Результат интеллектуальной деятельности: КОМПОЗИЦИИ АНТАГОНИСТОВ РЕЦЕПТОРОВ CGRP
Вид РИД
Изобретение
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к жидким фармацевтическим композициям антагонистов рецепторов CGRP.
CGRP является сильным нейромодулятором, который участвует в патологии цереброваскулярных расстройств, таких как мигрень и кластерная головная боль. В клинических исследованиях повышенный уровень CGRP в яремной вене был обнаружен во время приступов мигрени (Goadsby et al. (1990) Ann. Neurol. 28, 183-187), уровни CGRP в слюне повышаются у пациентов с мигренью между (Bellamy et al. (2006) Headache 46, 24-33) и во время атак (Cady et al. (2009) Headache 49, 1258-1266), и было показано, что CGRP, как таковой, запускает головную боль при мигрени (Lassen et al. (2002) Cephalalgia 22, 54-61). В клинических исследованиях было показано, что антагонист рецептора CGRP BIBN4096BS эффективен в лечении острого приступа мигрени (Olesen et al. (2004) New Engl. J. Med. 350, 1104-1110) и оказался способен предотвращать головную боль, индуцированную инфузией CGRP в контрольной группе (Petersen et al. (2005) Clin. Pharmacol. Ther. 77, 202-213). Перорально биодоступный антагонист рецептора телкагепант также продемонстрировал антимигренозную эффективность в клинических исследованиях III фазы (Ho et al. (2008) Lancet 372, 2115-2123; Connor et al. (2009) Neurology 73, 970-977).
Антагонисты рецептора CGRP могут быть использованы в качестве фармакологических агентов в случае расстройств, в которых участвует CGRP, у человека и животных, но особенно у человека. Такие заболевания включают мигрень и кластерную головную боль (Doods (2001) Curr. Opin. Invest. Drugs 2, 1261-1268; Edvinsson et al. (1994) Cephalalgia 14, 320-327); хроническую головную боль напряжения (Ashina et al. (2000) Neurology 14, 1335-1340); боль (Yu et al. (1998) Eur. J. Pharmacol. 347, 275-282); хроническую боль (Hulsebosch et al. (2000) Pain 86, 163-175); нейрогенное воспаление и воспалительную боль (Holzer (1988) Neuroscience 24, 739-768; Delay-Goyet et al. (1992) Acta Physiol. Scanda. 146, 537-538; Salmon et al. (2001) Nature Neurosci. 4, 357-358); глазную боль (May et al. (2002) Cephalalgia 22, 195-196), зубную боль (Awawdeh et al. (2002) Int. Endocrin. J. 35, 30-36), инсулиннезависимый сахарный диабет (Molina et al. (1990) Diabetes 39, 260-265); сосудистые заболевания; воспаление (Zhang et al. (2001) Pain 89, 265); артрит, бронхиальную гиперреактивность, астму, (Foster et al. (1992) Ann. NY Acad. Sci. 657, 397-404; Schini et al. (1994) Am. J. Physiol. 267, H2483-H2490; Zheng et al. (1993) J. Virol. 67, 5786-5791); шок, сепсис (Beer et al. (2002) Crit. Care Med. 30, 1794-1798); синдром отмены опиатов (Salmon et al. (2001) Nature Neurosci. 4, 357-358); устойчивость к морфину (Menard et al. (1996) J. Neurosci. 16, 2342-2351); приливы у мужчин и женщин (Chen et al. (1993) Lancet 342, 49; Spetz et al. (2001) J. Urology 166, 1720-1723); аллергический дерматит (Wallengren (2000) Contact Dermatitis 43, 137-143); псориаз; энцефалит, травму головного мозга, ишемию, инсульт, эпилепсию и нейродегенеративные заболевания (Rohrenbeck et al. (1999) Neurobiol. Dis. 6, 15-34); заболевания кожи (Geppetti and Holzer, Eds., Neurogenic Inflammation, 1996, CRC Press, Boca Raton, FL), нейрогенное кожное покраснение, розацеа и эритему кожи; шум в ушах (Herzog et al. (2002) J. Membr. Biol. 189, 225); ожирение (Walker et al. (2010) Endocrinology 151, 4257-4269); воспалительные заболевания кишечника, синдром раздраженной кишки, (Hoffman et al. (2002) Scand. J. Gastroenterol. 37, 414-422) и цистит. Особенно важным является острое или профилактическое лечение головной боли, включая мигрень или кластерную головную боль.
Характерные примеры антагонистов рецепторов CGRP включают таковые, описанные в международной публикации WO2012/064910, которая была опубликована 18 мая 2012, на имя Merck Sharp & Dohme Corp., которая таким образом полностью включена в виде ссылки.
Антагонисты рецептора CGRP могут быть составлены для перорального введения в виде таблеток, посредством использования различных методов, включая экструзию из расплава и распылительную сушку. Сходным образом, антагонисты рецепторов CGRP могут быть составлены для перорального введения в виде желатиновых капсул, в виде жидкости в мягкой капсуле или сухого порошка или полутвердого вещества в твердой капсуле. Кроме того, антагонисты рецептора CGRP могут быть составлены для внутривенного введения.
Жидкие фармацевтические композиции антагониста рецептора CGRP по настоящему изобретению не содержат спирта, являются жидкими композициями небольшого объема, которые можно принимать без воды для лечения головной боли при мигрени. Жидкие фармацевтические композиции по настоящему изобретению имеют преимущества над другими жидкими композициями антагонистов рецепторов CGRP в том, что активный ингредиент не осаждается при разведении слюной. Также жидкие фармацевтические композиции по настоящему изобретению имеют быстрое начало действия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к жидким фармацевтическим композициям, содержащим антагонисты рецепторов CGRP. Жидкие фармацевтические композиции антагонистов рецепторов CGRP по настоящему изобретению не содержат спирта, являются жидкими фармацевтическими композициями небольшого объема, которые можно принимать без воды для лечения головной боли при мигрени. Также описаны способы получения указанных фармацевтических композиций.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к жидким фармацевтическим композициям, содержащим антагонисты рецепторов CGRP. Жидкие фармацевтические композиции антагонистов рецепторов CGRP по настоящему изобретению включают антагонист рецепторов CGRP или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
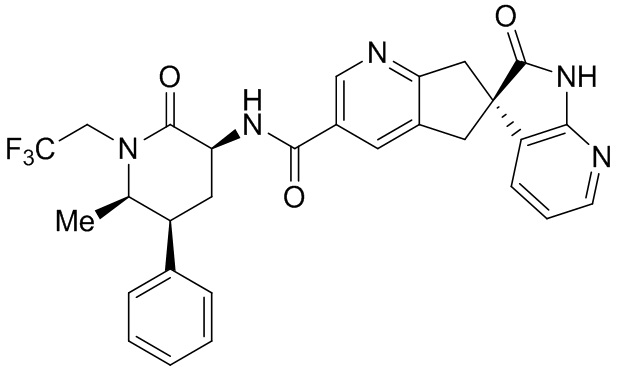
Особенно эффективным антагонистом рецепторов CGRP является (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида тригидрат,
 ,
,
который может быть получен методиками, описанными в: Международной публикации WO2012/064910, которая была опубликована 18 мая 2012, Merck Sharp & Dohme Corp., которое также называется в настоящем описании как “соединение I”. (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид также известен по его непатентованному наименованию, уброгепант. Соединение I представляет собой BCS соединение класса 4, которое имеет низкую растворимость и низкую проницаемость (16,6×10-6 см/с). В жидких фармацевтических композициях по настоящему изобретению соединение I остается в растворе и не осаждается немедленно при разведении слюной.
Жидкие фармацевтические композиции по настоящему изобретению также могут содержать один или более дополнительных рецептируемых ингредиентов, которые могут быть выбраны из широкого множества вспомогательных веществ, известных в области техники фармацевтики. В соответствии с желаемыми свойствами жидких фармацевтических композиций может быть выбрано любое количество ингредиентов, отдельно или в комбинации, на основании их известного применения в получении жидких фармацевтических композиций. Такие ингредиенты включают, без ограничения, ароматизаторы, усилители аромата, подсластители, консерванты и красители.
Термин “жидкие фармацевтические композиции”, как используется в настоящем описании, охватывает растворы, включающие антагонисты рецепторов CGRP.
Фармацевтические композиции по настоящему изобретению представляют собой жидкие фармацевтические растворы, которые включают антагонист рецепторов CGRP и фармацевтически приемлемый носитель.
Фармацевтические композиции по настоящему изобретению представляют собой жидкие фармацевтические растворы, которые включают (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, где объем носителя составляет менее чем 10 мл. В одном варианте осуществления изобретения жидкие фармацевтические растворы включают аморфную форму (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида. В другом варианте осуществления изобретения жидкие фармацевтические растворы включают безводную форму (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида. В другом варианте осуществления изобретения жидкие фармацевтические растворы включают гидратированную форму (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида. В одном классе изобретения фармацевтические композиции по настоящему изобретению представляют собой жидкие фармацевтические растворы, которые включают (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида тригидрат.
В одном варианте осуществления изобретения фармацевтически приемлемый носитель включает гидрофильный носитель и водорастворимое поверхностно-активное вещество или смесь водорастворимых поверхностно-активных веществ.
В одном варианте осуществления изобретения гидрофильный носитель включает воду, гликоли, гликольэфиры и их комбинации.
В одном варианте осуществления изобретения гликоль выбирают из группы, состоящей из пропиленгликоля, PEG и глицерина; сложный эфир гликоля выбирают из группы, состоящей из эфиров глицерина и эфиров пропиленгликоля и органических кислот, или их смесей. В одном классе изобретения гликоль выбирают из группы, состоящей из пропиленгликоля, PEG-400, глицерина или их смесей. В одном классе изобретения органические кислоты имеют два или три атома углерода.
В одном варианте осуществления изобретения эфиры гликоля включают триацетин, триэтилцитрат или их смеси.
В одном варианте осуществления изобретения водорастворимое поверхностно-активное вещество выбирают из группы, состоящей из VitE-TPGS, полоксамера, Tween 20, Tween 80, Span 20, и их комбинаций. В одном классе изобретения поверхностно-активным веществом является VitE-TPGS. В одном классе изобретения поверхностно-активным веществом является полоксамер. В другом классе изобретения поверхностно-активным веществом является полоксамер с Tween 20. В другом классе изобретения поверхностно-активным веществом является полоксамер с Tween 80. В другом классе изобретения поверхностно-активным веществом является полоксамер с Span 20. В одном подклассе изобретения полоксамером является полоксамер 407. В другом классе изобретения поверхностно-активным веществом является VitE-TPGS с Tween 20. В другом классе изобретения поверхностно-активным веществом является VitE-TPGS с Tween 80. В другом классе изобретения поверхностно-активным веществом является VitE-TPGS с Span 20.
В одном варианте осуществления изобретения водорастворимое поверхностно-активное вещество присутствует в количестве от около 0,1% до 15,0 масс.% композиции. В одном классе изобретения водорастворимое поверхностно-активное вещество присутствует в количестве от 2,5% до 10 масс.% композиции. Подходящим водорастворимым поверхностно-активным веществом является VitE-TPGS. Другим подходящим водорастворимым поверхностно-активным веществом является полоксамер 407.
В одном варианте осуществления изобретения антагонист рецептора CGRP присутствует в количестве от около 0,01% до 3,0 масс.% композиции. В одном классе изобретения антагонист рецептора CGRP присутствует в количестве от 0,25% до 2,0 масс.% композиции. В качестве примера изобретения антагонист рецептора CGRP представляет собой (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-yl)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида тригидрат или его соль.
В одном варианте осуществления изобретения объем носителя составляет менее чем 5 мл.
В одном варианте осуществления изобретение включает одно или более фармацевтически приемлемых вспомогательных веществ, выбираемых из антинуклеирующего полимера, антиоксиданта (такого как аскорбиновая кислота), комплексообразующего агента (такого как этилендиаминтетрауксусная кислота (EDTA)), окислителя, хлорида натрия, красителей (таких как водные и органические растворимые красители), подсластителей, ароматизаторов или их смесей.
В одном варианте осуществления изобретения антинуклеирующий полимер выбирают из группы, состоящей из повидона и коллидон-VA64.
В одном варианте осуществления изобретения окислитель выбирают из лимонной кислоты, яблочной кислоты, молочной кислоты, цитрата натрия и их комбинаций.
В одном варианте осуществления изобретения ароматизатор выбирают из группы, состоящей из ароматизаторов мяты, мяты перечной, ягод, вишни, ментола и хлорида натрия и их комбинаций.
В одном варианте осуществления изобретения подсластитель выбирают из группы, состоящей из сахара, сукралозы, аспартама, ацесульфама, неотама и их комбинаций. В одном классе изобретения подсластитель выбирают из группы, состоящей из сукралозы, аспартама, неотама и их комбинаций. В подклассе изобретения подсластителем является сукралоза.
Примером изобретения является жидкая фармацевтическая композиция, включающая (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид, пропиленгликоль, PEG-400, вода, VitE-TPGS, повидон, сукралоза, ментол, и ароматизатор мяты перечной. Дополнительным примером изобретения является жидкая фармацевтическая композиция, включающая (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамид, пропиленгликоль, PEG-400, воду, VitE-TPGS, повидон, сукралозу, ментол, ароматизатор мяты перечной или мяты, окисляющий агент и хлорид натрия.
Жидкая фармацевтическая композиция по настоящему изобретению является стабильной при комнатной температуре. Специфически, жидкие фармацевтические композиции имеют хорошую физическую и химическую стабильность при комнатной температуре, в диапазоне от около 25°C (±2°C) до 40°C (±2°C).
Жидкие фармацевтические композиции по настоящему изобретению имеют низкую вязкость (~0,065 Па⋅с) при комнатной температуре. Желательно иметь жидкую фармацевтическую композицию с низкой вязкостью, которая может быстро покидать контейнер. В одном варианте осуществления изобретения жидкая фармацевтическая композиция покидает контейнер в течение 1-10 секунд. В одном классе изобретения жидкая фармацевтическая композиция покидает контейнер в течение 1-5 секунд.
Жидкие фармацевтические композиции по настоящему изобретению включают количество вспомогательных веществ, которые подходит для ежедневного применения и доступно для разового повторного введения при необходимости.
Жидкие фармацевтические композиции по настоящему изобретению подходят для упаковки в многодозовые или однодозовые упаковки без изменения цвета или разрушения.
Настоящее изобретение включает способ получения жидкой фармацевтической композиции (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида тригидрата, включающий стадии:
(i) растворения водорастворимого поверхностно-активного вещества в гидрофильном носителе при комнатной температуре или при более высоких температурах (около 40°C), до образования гомогенного раствора посредством непрерывного перемешивания;
(ii) растворения дополнительных вспомогательных веществ, таких как ароматизатор, в растворе со стадии (i);
(iii) растворения водорастворимых вспомогательных веществ (таких как анти-нуклеирующий полимер, подсластители, ароматизаторы) в воде;
(iv) смешивания раствора стадии (iii) с раствором (ii) путем непрерывного перемешивания;
(v) растворения (S)-N-((3S,5S,6R)-6-метил-2-оксо-5-фенил-1-(2,2,2-трифторэтил)пиперидин-3-ил)-2'-оксо-1',2',5,7-тетрагидроспиро[циклопента[b]пиридин-6,3'-пирроло[2,3-b]пиридин]-3-карбоксамида тригидрата в растворе стадии (iv) путем непрерывного перемешивания при комнатной температуре или 40°C до образования гомогенного раствора;
(vi) растворения одного или более вспомогательных веществ в растворе стадии (v).
Жидкие фармацевтические композиции по настоящему изобретению могут быть применимыми в терапевтическом или профилактическом лечении заболеваний, ассоциированных с функцией CGRP. Такие заболевания включают: мигрень и кластерную головную боль; хроническую головную боль напряжения; хроническую боль; нейрогенное воспаление и воспалительную боль; глазную боль; зубную боль; инсулиннезависимый сахарный диабет; сосудистые заболевания; воспаление; артрит; бронхиальную гиперреактивность; астму; шок; сепсис; синдром отмены опиатов; непереносимость морфина; приливы у мужчин и женщин; аллергический дерматит; псориаз; энцефалит, травму головного мозга, ишемию, инсульт, эпилепсию, и нейродегенеративные заболевания; кожные заболевания; нейрогенное кожное покраснение, розацеа и покраснение кожи; шум в ушах; ожирение; воспалительные заболевания кишечника; синдром раздраженного кишечника; и цистит. В одном классе изобретения жидкие фармацевтические композиции по настоящему изобретению могут быть применимыми в терапевтическом лечении или профилактическом лечении головной боли, включая мигрень и кластерную головную боль.
Следующие примеры даны с целью иллюстрации настоящего изобретения и не должны расцениваться как ограничения рамок изобретения.
ПРИМЕР 1
ЖИДКИЕ ПЕРОРАЛЬНЫЕ КОМПОЗИЦИИ С (S)-N-((3S,5S,6R)-6-МЕТИЛ-2-ОКСО-5-ФЕНИЛ-1-(2,2,2-ТРИФТОРЭТИЛ)ПИПЕРИДИН-3-ИЛ)-2'-ОКСО-1',2',5,7-ТЕТРАГИДРОСПИРО[ЦИКЛОПЕНТА[B]ПИРИДИН-6,3'-ПИРРОЛО[2,3-B]ПИРИДИН]-3-КАРБОКСАМИДА ТРИГИДРАТОМ (СОЕДИНЕНИЕ I)
|
Пероральные жидкие композиции, представленные выше, получают, как указано далее:
1) добавить VitE-TPGS (в виде небольших кусочков <4 мм) к пропиленгликолю и нагреть до температуры около 40°C в стеклянной бутыли (с использованием мешалки и магнитной мешалки/нагревателя).
2) перемешать до того как VitE-TPGS растворится полностью, и получить прозрачный раствор (~<1 ч).
3) выключить нагрев.
4) добавить PEG-400 к раствору “VitE-TPGS-пропиленгликоля" и перемешивать для смешивания (раствор будет несколько мутным) (~5 мин).
5) растворить дополнительные вспомогательные вещества, такие как ментол, в растворе стадии (4).
6) добавить PVP к “воде” в смесителе и перемешать для растворения (~<30 мин).
7) добавить подсластитель, соль, окислитель и перемешать для растворения (~10 мин).
8) добавить “раствор PVP-подсластителя-соли-окислителя” к "раствору VitE-TPGS-PG-PEG-400” и перемешать для смешивания (~<10 мин).
9) добавить соединение I к вышеуказанному раствору (стадия 8) и перемешать для растворения (нагреть раствор до около ~40°C для более быстрого растворения) (~10 мин). Растворы должны быть прозрачными.
10) добавить ароматизатор и перемешать для смешивания (~5 мин).
ПРИМЕР 2
ФАРМАКОКИНЕТИКА ПЕРОРАЛЬНЫХ ЖИДКИХ КОМПОЗИЦИЙ (S)-N-((3S,5S,6R)-6-МЕТИЛ-2-ОКСО-5-ФЕНИЛ-1-(2,2,2-ТРИФТОРЭТИЛ)ПИПЕРИДИН-3-ИЛ)-2'-ОКСО-1',2',5,7-ТЕТРАГИДРОСПИРО[ЦИКЛОПЕНТА[B]ПИРИДИН-6,3'-ПИРРОЛО[2,3-B]ПИРИДИН]-3-КАРБОКСАМИДА ТРИГИДРАТА (СОЕДИНЕНИЕ I) У СОБАК
С целью оценки эффекта объема раствора при воздействии две композиции тестировали у собак; каждый раствор содержал ту же дозу соединения I, но объем раствора отличался. Композиции перорального раствора вводили собакам посредством шприца на заднюю стенку глотки (для стимуляции глотания небольшого объема жидкого раствора). С композициями пероральных растворов не давали промывки. Для растворов использовали 0,75 мл с высокой концентрацией и 1,5 мл с низкой концентрацией лекарственного средства. Для контрольного раствора PEG дозу 10 мг давали в 20 мл носителя с последующими 15 мл воды.
PK соединения I у собаки из низкого объема перорального раствора PVE у гончих собак натощак, после предварительного введения пентагастрина
|
У собак оба пероральных раствора имели немного лучшее воздействие, чем ранее создаваемый раствор PEG 400.
Пероральные растворы
|
Раствор PEG 400: PEG 400/Orasweet/вода 70%/15%/15% (доза 10 мг в 20 мл носителя с последующими 15 мл воды). Раствор PEG 400 не подходит для хронического применения из-за высокого количества PEG400. Он только подходит в виде разовой дозы в ранних клинических исследованиях.
ПРИМЕР 3
ОСАЖДЕНИЕ (S)-N-((3S,5S,6R)-6-МЕТИЛ-2-ОКСО-5-ФЕНИЛ-1-(2,2,2-ТРИФТОРЭТИЛ)ПИПЕРИДИН-3-ИЛ)-2'-ОКСО-1',2',5,7-ТЕТРАГИДРОСПИРО[ЦИКЛОПЕНТА[B]ПИРИДИН-6,3'-ПИРРОЛО[2,3-B]ПИРИДИН]-3-КАРБОКСАМИДА ТРИГИДРАТА (СОЕДИНЕНИЕ I) В ИСКУССТВЕННОЙ СЛЮНЕ ПРИ РАЗВЕДЕНИИ
Образцы пероральной жидкой композиции соединения I разводили в соотношениях 1:1 или 1:4 с pH 6,2 искусственной слюной. Искусственная слюна включает: KH2PO4 (12 мМ), NaCl (40 мМ), CaCl2 (1,5 мМ), и NaOH до pH 6,2 (ссылка: Ritschel and Thomson, Methods and findings in Experimental and Clinical Pharmacology, %, 511-525, 1983). Использовали магнитное перемешивание при 400 об/мин. Образцы забирали в разные временные точки для определения потенциальной кинетики осаждения при разведении. Центрифужную фильтрацию с фильтром 0,45 мкм использовали для 5 минутной временной точки, и 1 мкм фильтрацию и ультрацентрифугирование (80 k об/мин, 25°C, 15 минут, 9/9 акцелерации/децелерации) использовали для больших временных периодов. Образцы разводили 50/50 ACN/водой для соответствия аналитической стандартной концентрации (0,1 мг/мл) и анализировали ВЭЖХ. Используемые условия ЖХ были, как указано далее: 65% 0,1%H3PO4/35%ACN изократический метод, Chromolith SpeedROD RP-18e 50×4,6 мм колонка, УФ при 210 нм, 40°C температура колонки, 3 мл/мин скорость тока, и 10 мкл объем введения.
Резюме осаждения: концентрация лекарственного средства композиции A (описанной в ПРИМЕРЕ 1) после разведения 1:1 и 1:4 со слюной pH 6,2
|
Когда раствор A разводили 1:1, соединение I не осаждалось, и концентрация оставалась на ожидаемом уровне (почти ½ от исходной концентрации).
Когда раствор A разводили 1:4, концентрация лекарственного средства оставалась на ожидаемом уровне (около 1/5 исходной концентрации) в течение около 30 минут, и затем он медленно начинал осаждаться.
Полученные результаты демонстрируют, что раствор A противостоит осаждению при разведении в полости рта слюной.
ПРИМЕР 4
ВЯЗКОСТЬ ПЕРОРАЛЬНЫХ ЖИДКИХ КОМПОЗИЦИЙ (S)-N-((3S,5S,6R)-6-МЕТИЛ-2-ОКСО-5-ФЕНИЛ-1-(2,2,2-ТРИФТОРЭТИЛ)ПИПЕРИДИН-3-ИЛ)-2'-ОКСО-1',2',5,7-ТЕТРАГИДРОСПИРО[ЦИКЛОПЕНТА[B]ПИРИДИН-6,3'-ПИРРОЛО[2,3-B]ПИРИДИН]-3-КАРБОКСАМИДА ТРИГИДРАТА (СОЕДИНЕНИЕ I)
Для измерения вязкости использовали TA инструменты ARES G2 механически контролируемый реометр с программным обеспечением TRIOS. Двухстенную конфигурацию использовали из-за низкой вязкости образца. Все жидкости казались Ньютоновскими между 5-20 с-1. 5 минут выбирали для времени изотермического удержания, которое расценивали, достигая эквивалентности. Как показано ниже, все три тестируемые композиции продемонстрировали низкую вязкость (<0,065).
|
Вязкость жидких композиций при 25°C и 10°C.
|

