НОВАЯ БАКТЕРИЯ РОДА BACILLUS И ЕЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к новой бактерии, принадлежащей к семейству Bacillus, обозначаемой как Bacillus subtilis ssp. shriramensis, проявляющей противомикробную и/или противогрибковую и стимулирующую рост растений активность, к выделению и идентификации экстракта нового микроба, проявляющего противомикробную и/или противогрибковую, протеолитическую, амилолитическую активность, к композиции, включающей новую бактерию и/или экстракт, к способу ингибирования роста патогенных микробов и/или грибков путем контактирования патогенных микробов и/или грибков с эффективным количеством новой бактерии и/или к противомикробной и/или противогрибковой стимулирующей рост растений композиции и/или агенту и к их применению.
УРОВЕНЬ ТЕХНИКИ
Атмосфера Земли, как известно, взаимодействует с находящимися в воздухе микроорганизмами, несмотря на высокую интенсивность освещенности, резкие перепады температуры, низкие концентрации органических веществ и недостаток воды, делающими окружающую среду непригодной для размножения микробов. Биологический материал может составлять приблизительно 20%, 22% и 10% от общего количества содержащихся в воздухе частиц по объему в удаленных континентальных, заселенных континентальных и отдаленных морских условиях окружающей среды, соответственно. Большинство из них происходит из природных источников, таких как почва, озера, животные и человек. Кроме того, методы ведения сельского хозяйства, медицинские пункты и промышленные операции, такие как очистка сточных вод, выращивание животных, процессы ферментации и обработка растительных пищевых продуктов также являются источниками поступления жизнеспособных микроорганизмов в окружающую среду.
Бактерии составляют большую долю одноклеточных, прокариотных микроорганизмов. Как правило, составляя несколько микрометров в длину, бактерии имеют широкий диапазон форм, начиная от кокков до палочек и спиралей. Бактерии широко распространены на Земле, размножаясь в почве, кислых горячих источниках, радиоактивных отходах, воде и глубоко в земной коре, а также в органическом веществе и живых организмах растений и животных. Бациллы представляют собой грамположительные, спорулирующиеся, аэробные или факультативно анаэробные бактерии в форме палочек. Большинство бацилл являются сапрофитами. Каждая бактерия создает только одну спору, которая устойчива к нагреванию, охлаждению, радиации, высыханию и дезинфицирующим средствам. Бациллы проявляют множество физиологических характеристик, что позволяет им жить в широком диапазоне сред обитания, включая многие экстремальные места обитания, такие как пески пустыни, горячие источники и арктические почвы. Штаммы Bacillus могут быть термофильными, холодолюбивыми, ацидофильными, алкалифильными, солеустойчивыми или галофильными и способными к росту при различных значениях рН, температуры и концентрации солей.
Продукция противомикробных агентов, как представляется, является общим феноменом для большинства бактерий. Эти бактерии продуцируют превосходный набор микробных защитных систем, включая широкий спектр классических антибиотиков, метаболические побочные продукты, такие как органические кислоты, а также литические агенты, такие как лизоцим. Кроме того, продуцируется также несколько типов белковых экзотоксинов и бактериоцинов, которые представляют собой биологически активные пептидные фрагменты с бактерицидным механизмом действия. Биологический арсенал микробов примечателен своим разнообразием и природным изобилием.
Поиск новых противомикробных агентов является областью первостепенной важности. Развитие резистентности к антибактериальным агентам растет с угрожающей скоростью. Существующие решения включают разработку более рационального подхода к использованию антибиотиков и открытие новых противомикробных агентов.
Близкородственные патенты
1. Новые бактериальные штаммы и способы контроля над грибковыми патогенами (WO/2000/015761).
ЦЕЛИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление новой бактерии, проявляющей противомикробную и/или противогрибковую и стимулирующую рост растений активность.
Целью настоящего изобретения является выделение и идентификация экстракта новой бактерии, где экстракт проявляет противомикробную и/или противогрибковую, стимулирующую рост растений активность.
Целью настоящего изобретения является предоставление противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента, где композиция или агент включает новую бактерию и/или экстракт новой бактерии.
Целью настоящего изобретения также является предоставление способа ингибирования роста патогенных микробов и/или грибов путем контактирования патогенных микробов и/или грибков с эффективным количеством новой бактерии и/или противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента, где композиция или агент включает новую бактерию и/или экстракт новой бактерии, и/или смесь новой бактерии и ее экстракта.
Целью настоящего изобретения также является обеспечение применения новой бактерии, противомикробной и/или противогрибковой композиции или агента, где композиция или агент включает новую бактерию и/или экстракт новой бактерии, и/или смесь новой бактерии и ее экстракта, для подавления роста патогенных микробов и/или грибков.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов настоящего изобретения связан с предоставлением выделенной новой бактерию, которая пригодна для продукции противомикробных и/или противогрибковых метаболитов или агентов.
Один из аспектов настоящего изобретения связан с предоставлением новой формы бактерии, принадлежащей к виду Bacillus, которая обозначается как Bacillus subtilis ssp. shriramensis, номер поступления (MTCG-5674). В частности, новая бактерия, раскрытая в данной работе, способна проявлять отличные противомикробные и/или противогрибковые и стимулирующие рост растений свойства.
Еще один аспект настоящего изобретения состоит в создании способа получения противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента, где композиция или агент включает Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674).
Предлагается композиция Bacillus subtilis ssp. shriramensis (MTCC-5674). Композиция может дополнительно включать фармацевтически приемлемые наполнители, разбавители и/или носители.
Предлагается композиция, содержащая экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674). Предлагается также композиция, содержащая водный экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674). Композиция может дополнительно включать фармацевтически приемлемые наполнители, разбавители и/или носители.
Предлагается способ ингибирования роста патогенных микробов и/или грибков путем контактирования патогенных микробов и/или грибков с эффективным количеством Bacillus subtilis ssp. shriramensis (MTCC-5674) или экстракта Bacillus subtilis ssp. shriramensis (MTCC-5674). Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674) может необязательно содержать один или более дополнительных противомикробных и/или противогрибковых и стимулирующих рост растений агентов.
В настоящем изобретении предлагается Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674) для составления противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента для подавления роста патогенных микробов и/или грибов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагается новый микроорганизм, принадлежащий к семейству Bacillus, обозначаемый как Bacillus subtilis ssp. shriramensis и имеющий номер поступления (MTCC-5674) и способ получения противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента, где композиция или агент включает Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674).
В настоящем изобретении также предлагается способ ингибирования патогенных микробов и/или грибков путем контактирования микробов и/или грибков с эффективным количеством новой бактерии Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или композиции, включающей новую бактерию или ее экстракт.
В настоящем изобретении также предлагается применение Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или противомикробной и/или противогрибковой и стимулирующей рост растений композиции или агента, включающих новую бактерию Bacillus subtilis ssp. shriramensis (MTCC-5674) и/или экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674) для ингибирования патогенных микробов или грибков.
Новая Bacillus subtilis ssp. shriramensis (MTCC-5674) может быть использована для массированного получения противомикробной и/или противогрибковой и стимулирующей рост растений композиции/препарата/агента путем культивирования Bacillus subtilis ssp. shriramensis в подходящей ростовой среде в благоприятных условиях.
С помощью глубоких и тщательных исследований авторы изобретения неожиданно нашли, выделили и культивировали новую бактерию, которая может продуцировать новый агент. С помощью детально разработанных экспериментальных исследований авторы настоящего изобретения изобрели способ получения указанного нового агента из указанного нового микроорганизма.
КРАТКОЕ ОПИСАНИЕ СОПРОВОДИТЕЛЬНЫХ ЧЕРТЕЖЕЙ
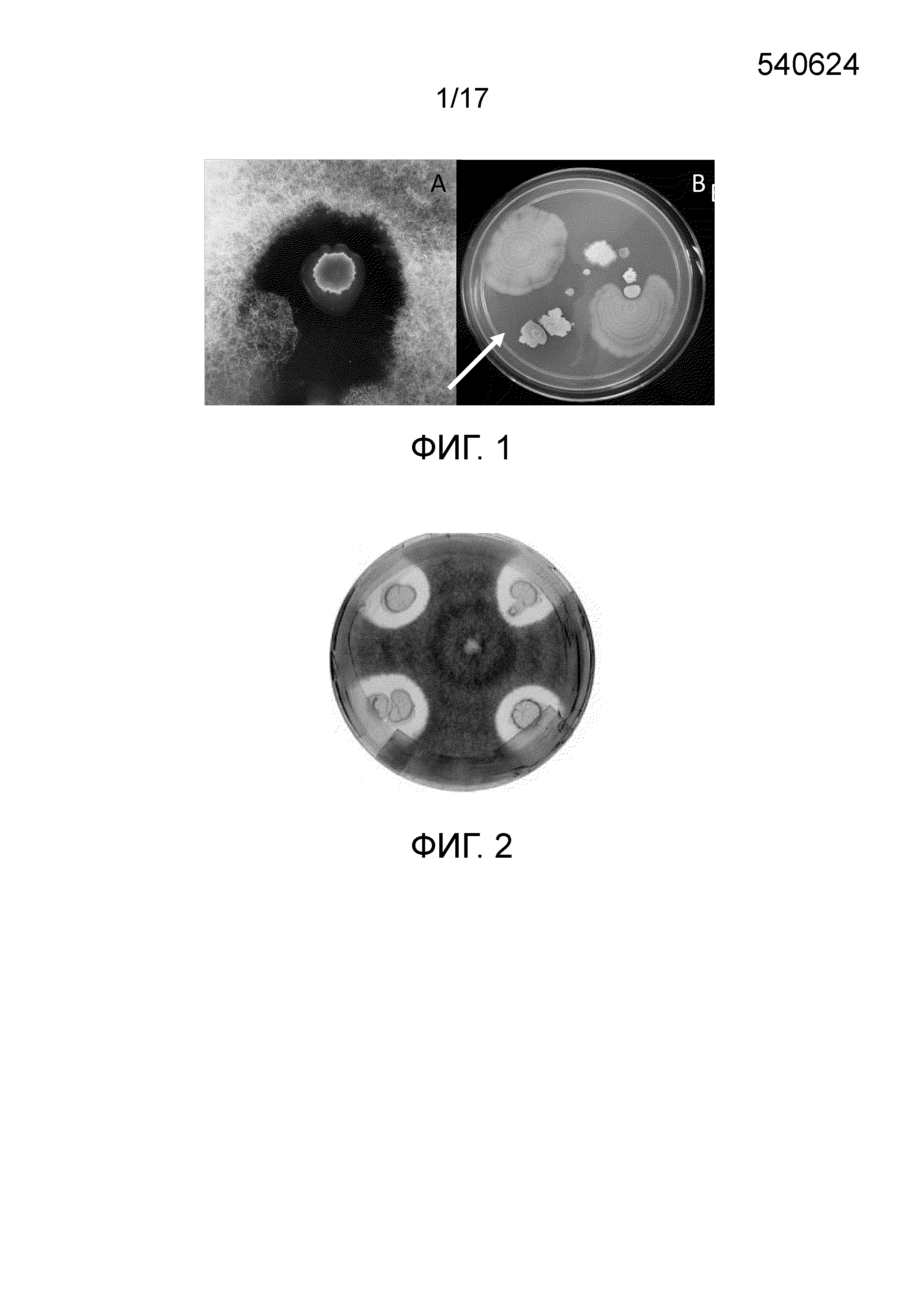
Фиг. 1 - Чашка, демонстрирующая выделение и очистку Bacillus subtilis ssp. shriramensis (MTCC-5674) (A) Чашка с материнской культурой, демонстрирующая рост бактерии совместно с мицелием гриба; (B) Очистка Bacillus subtilis ssp. shriramensis (MTCC-5674) из бактериальных колоний в (A). Стрелка указывает предполагаемую бактериальную колонию.
Фиг. 2 - Клон одной из очищенных колоний Bacillus subtilis ssp. shriramensis (MTCC-5674), демонстрирующий ингибирование роста мицелия Fusarium oxysporum.
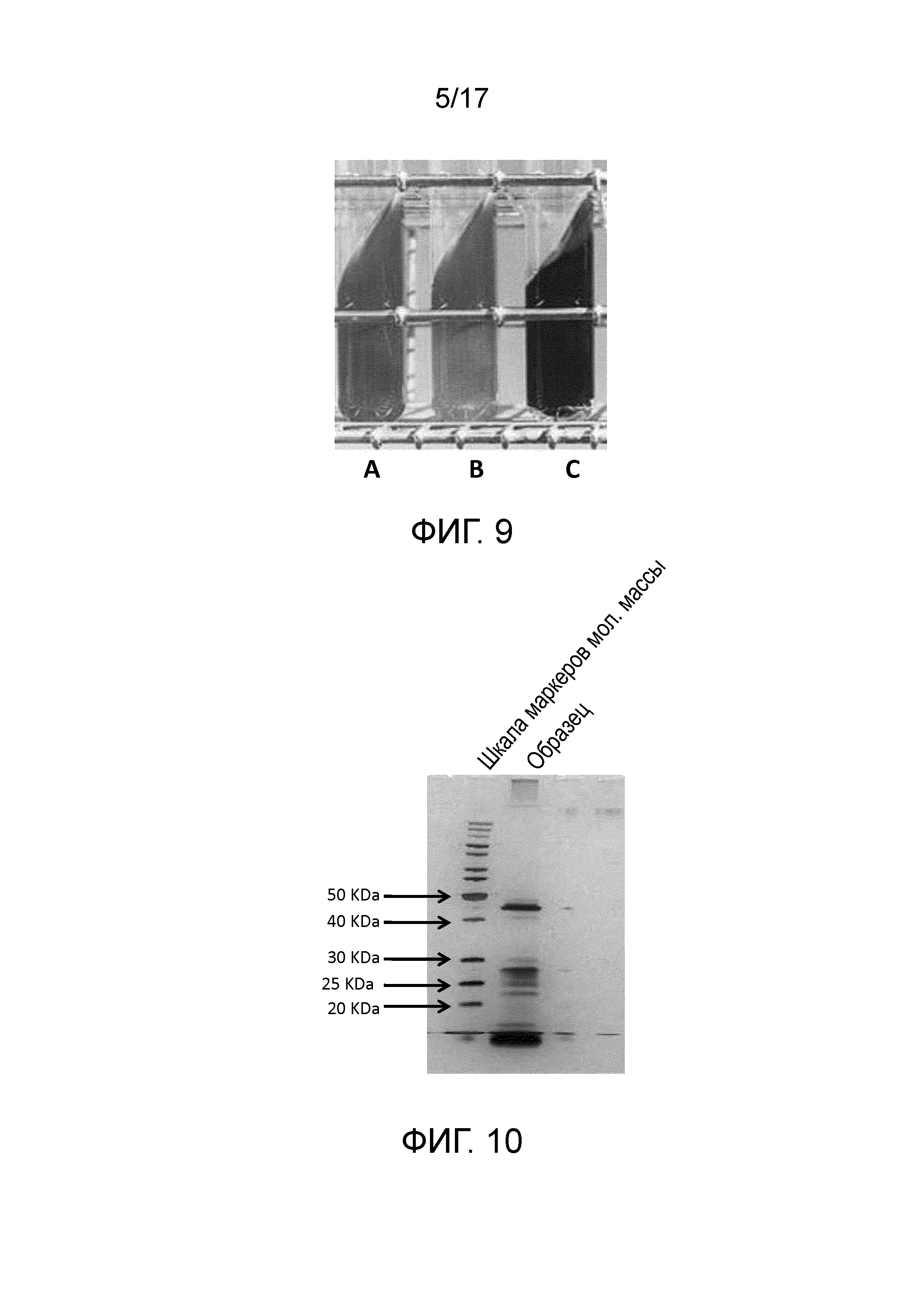
Фиг. 3 - Микроскопическое изображение вегетативных бактериальных клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) вместе со спорами.
Фиг. 4 - Чашка, демонстрирующая рост колоний Bacillus subtilis ssp. shriramensis (MTCC-5674).
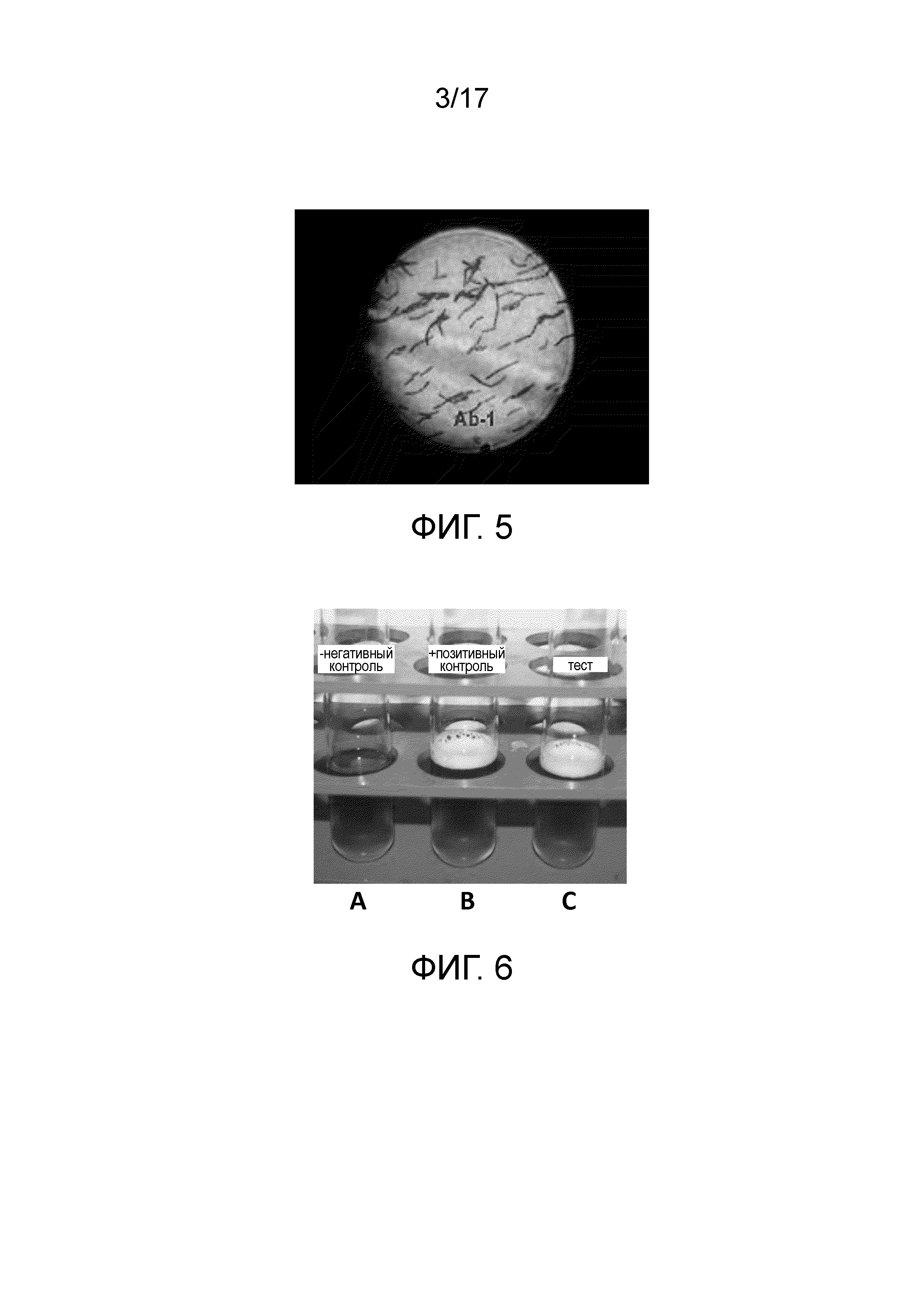
Фиг. 5 - Палочковидная Bacillus subtilis ssp. shriramensis (MTCC-5674) под световым микроскопом.
Фиг. 6 - Изображение, демонстрирующее результаты теста с каталазой: (A) негативный контроль; (B) позитивный контроль и (C) Bacillus subtilis ssp. shriramensis (MTCC-5674), демонстрирующая позитивные результаты в отношении активности каталазы.
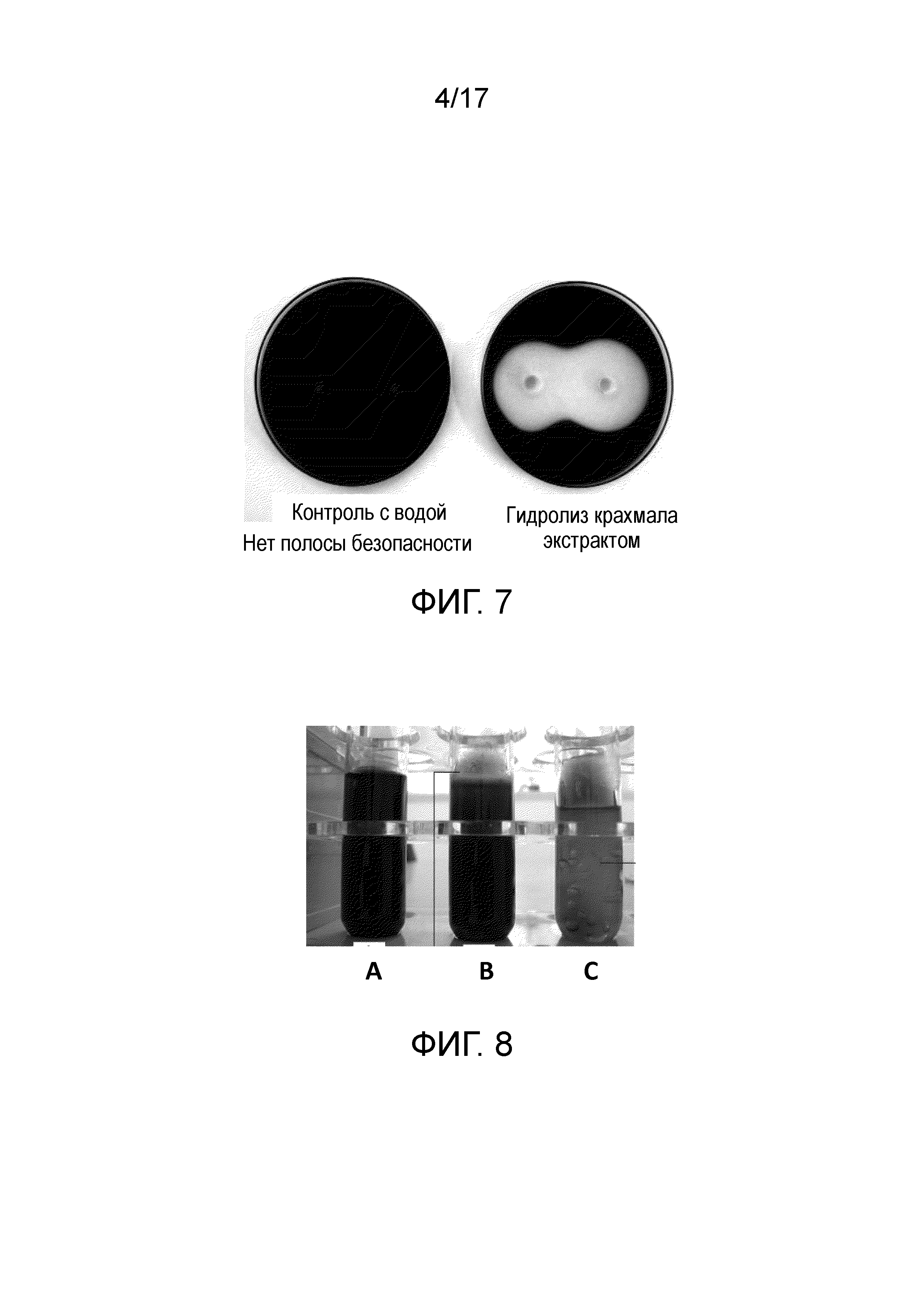
Фиг. 7 - Чашка, демонстрирующая амилолитическую активность культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 8 - Чашка, демонстрирующая результаты теста O/F (окисления-ферментации) (A) негативный контроль; (B) Bacillus subtilis ssp. shriramensis (MTCC-5674), демонстрирующая изменение цвета только в верхней части среды; (C) позитивный контроль.
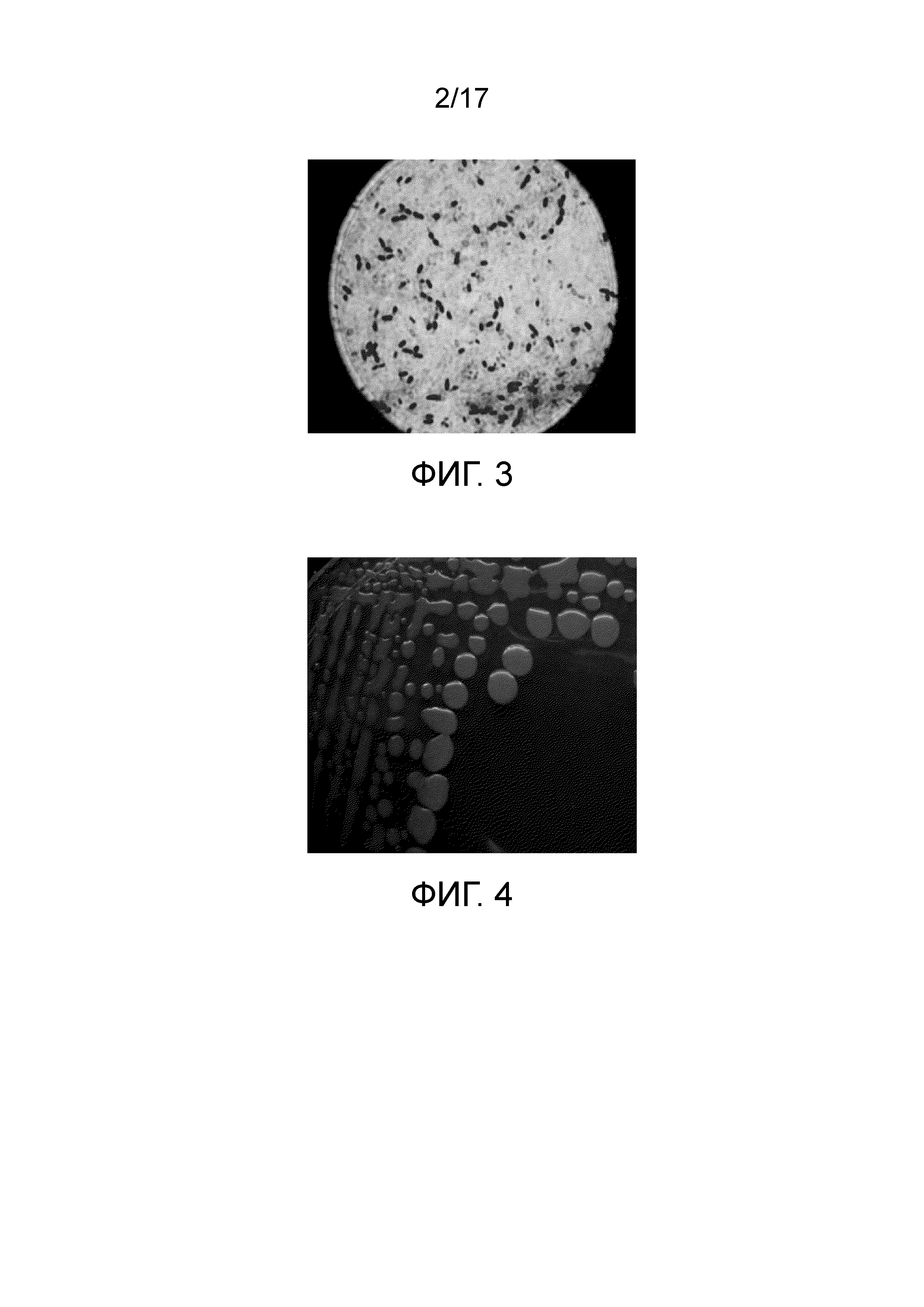
Фиг. 9 - Изображение, демонстрирующее результаты теста на продукцию сероводорода, (A) негативный контроль; (B) Bacillus subtilis ssp. shriramensis (MTCC-5674) и (C) позитивный контроль.
Фиг. 10 - Изображение, демонстрирующее результаты SDS-PAGE концентрированного культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674).
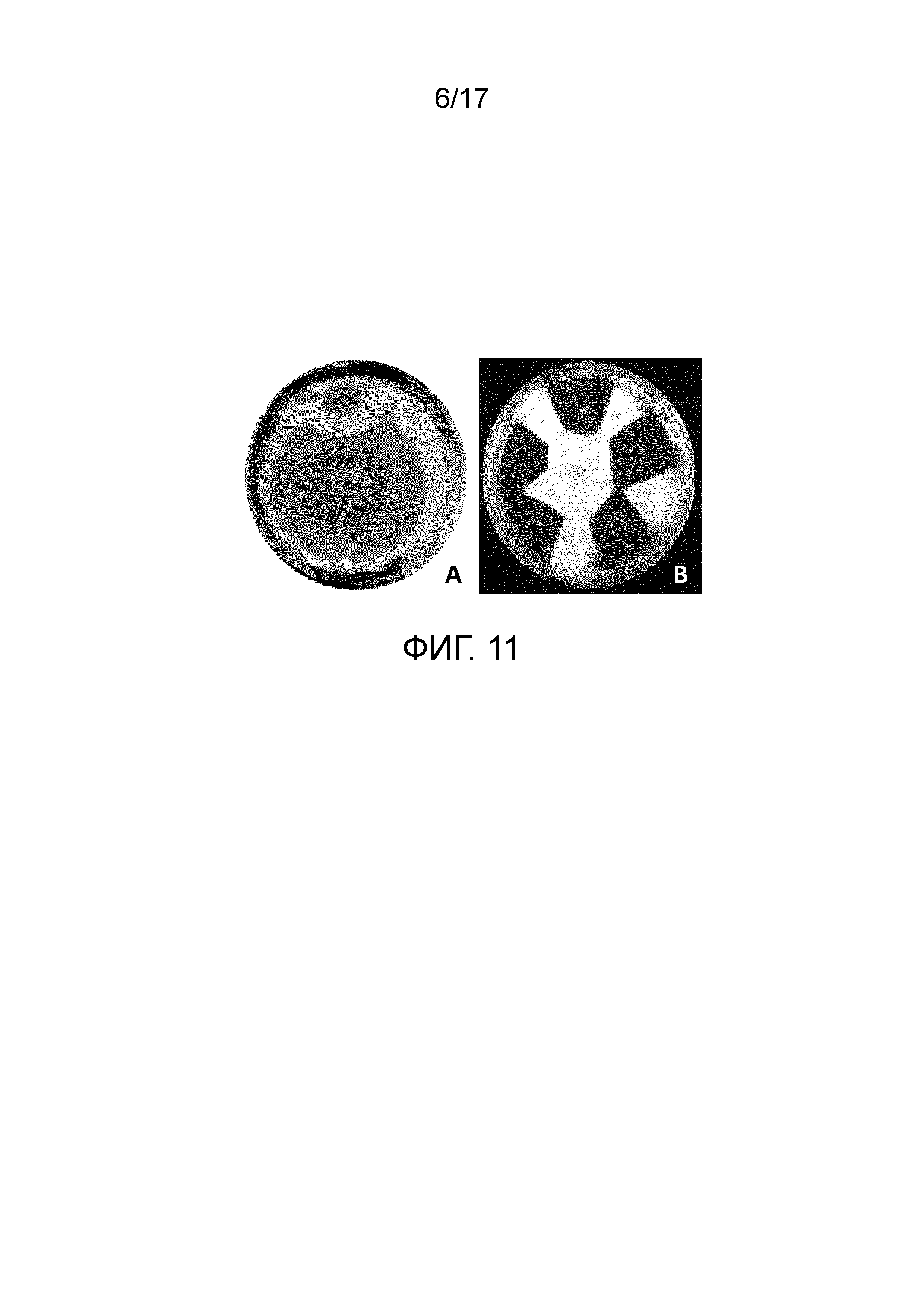
Фиг. 11 - Культуральные чашки, демонстрирующие противомикробную и/или противогрибковую активность, проявляемую (A) колонией Bacillus subtilis ssp. shriramensis (MTCC-5674) и (B) культуральным фильтратом Bacillus subtilis ssp. shriramensis (MTCC-5674). Культуру Fusarium oxysporum culture использовали в качестве тестируемого грибка.
Фиг. 12 - Изображение, демонстрирующее результаты определения MIC противомикробного и/или противогрибкового соединения с помощью метода разведения в пробирке. C 1 по C-2: изображения спор Fusarium oxysporum (наблюдаемых под световым микроскопом), после инкубации в PDB, содержащим различные концентрации противомикробного и/или противогрибкового агента. 1-18 (разведения с 1:1 до 1:100), C-1 - споры в противомикробном и/или противогрибковом агенте (неочищенные); C-2 - контроль (споры в бульоне без противомикробного и/или противогрибкового агента).
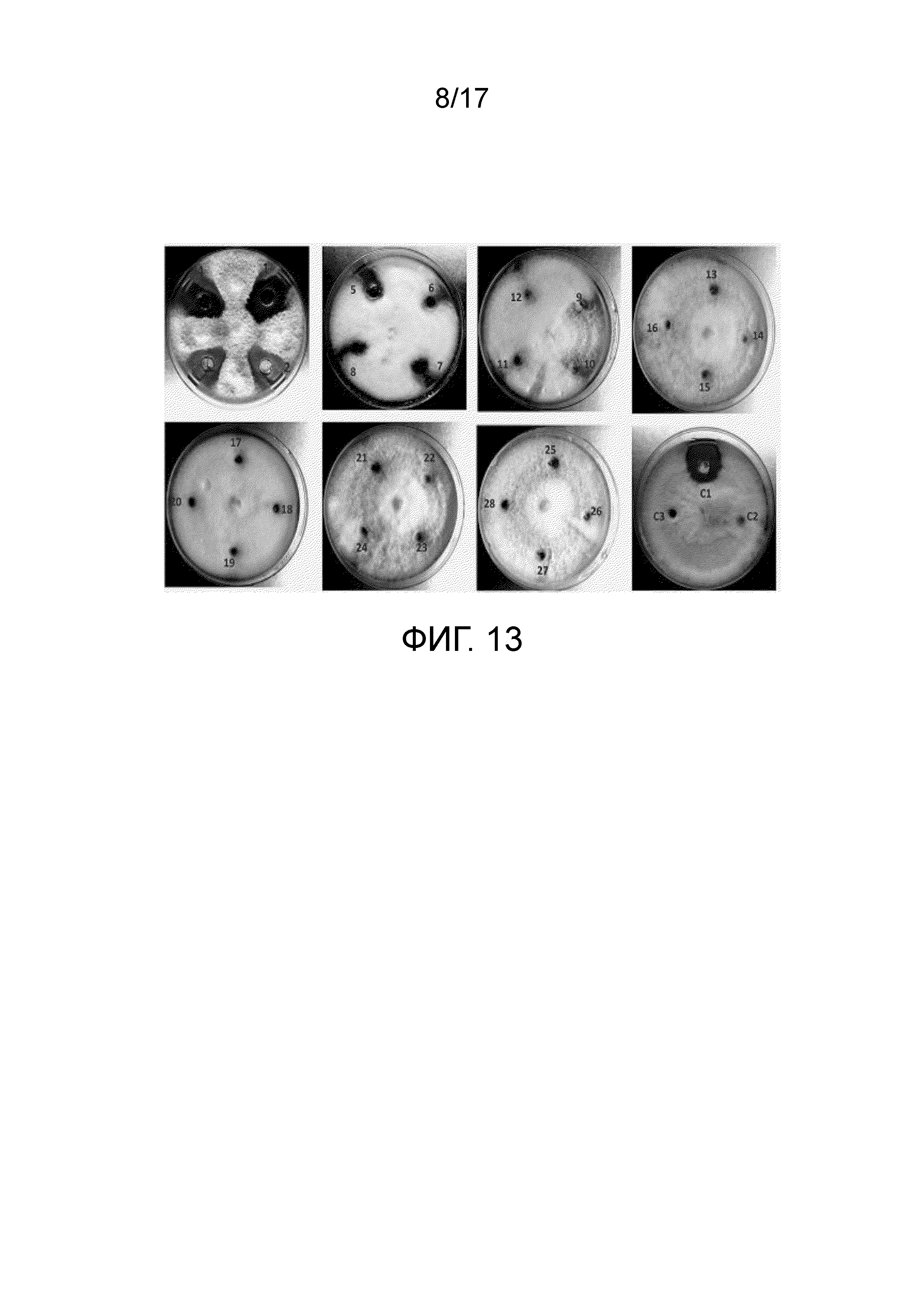
Фиг. 13 - Изображение, демонстрирующее результаты определения MIC противомикробного и/или противогрибкового агента методом диффузии в агаре. с 1 по С-2: изображения мицелия Fusarium oxysporum, растущего на чашках для тестирования. 1-28 Разведения противомикробного и/или противогрибкового агента от 1:1 до 1:100 (об./об.), C1 - лунка, содержащая противомикробный и/или противогрибковый агент (неочищенный); C2 - контрольная лунка, содержащая PDB; C3 - контрольная лунка, содержащая 70% насыщенный сульфат аммония.
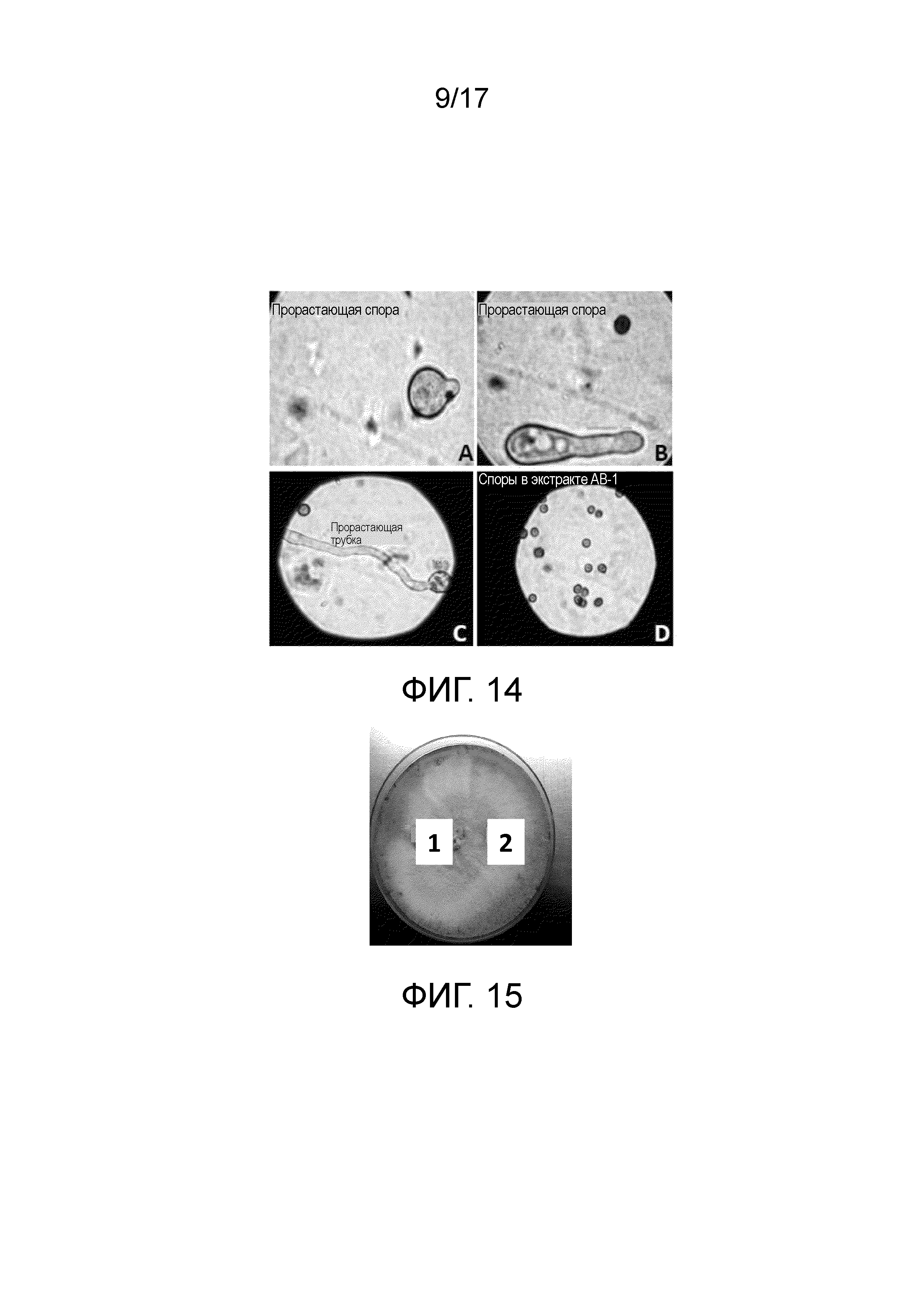
Фиг. 14 - Изображение, демонстрирующее действие противомикробного и/или противогрибкового агента на споры Aspergillus niger. (A, B и C) Споры Aspergillus niger, демонстрирующие нормальное прорастание в средах PDB; (D) споры Aspergillus niger, не способные прорастать в средах PDB, содержащих экстракт Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 15 - Чашка, демонстрирующая противомикробную и/или противогрибковую активность клеточного лизата в отношении Fusarium oxysporum; (1) лунка, содержащая только лизоцим (для проверки действия лизоцима на грибок Fusarium oxysporum) и (2) лунка, содержащая клеточный лизат Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 16 - Чашка, демонстрирующая противомикробную и/или противогрибковую активность клеток/экстракта Bacillus subtilis ssp. shriramensis (MTCC-5674) в отношении различных видов грибковых и бактериальных патогенов растений. A. Fusarium oxysporum, B. Sarocladium oryzae, C. Trichoderma viridae, D. Colletotrichum capsicii, E. Exerohilum turcicum, F. Rhizoctonia solani, G. Macrophomina phaseolina, H. Xanthomonas oryzae.
Фиг. 17 - Чашка, демонстрирующая результаты противомикробной и/или противогрибковой активности экстракта Bacillus subtilis ssp. shriramensis (MTCC-5674) в отношении прорастания семян риса в присутствии Fusarium oxysporum. (A) Семена риса, обработанные грибковыми спорами Fusarium oxysporum; (B и C) семена риса, обработанные грибком Fusarium Oxysporum и экстрактом Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 18 - Чашка, демонстрирующая результаты экспериментов по демонстрации отсутствия патогенности Bacillus subtilis ssp. shriramensis (MTCC-5674) в отношении различных видов растений. (А) рис, (B) хлопок, (С) табак, (D) кукуруза и (Е) томаты.
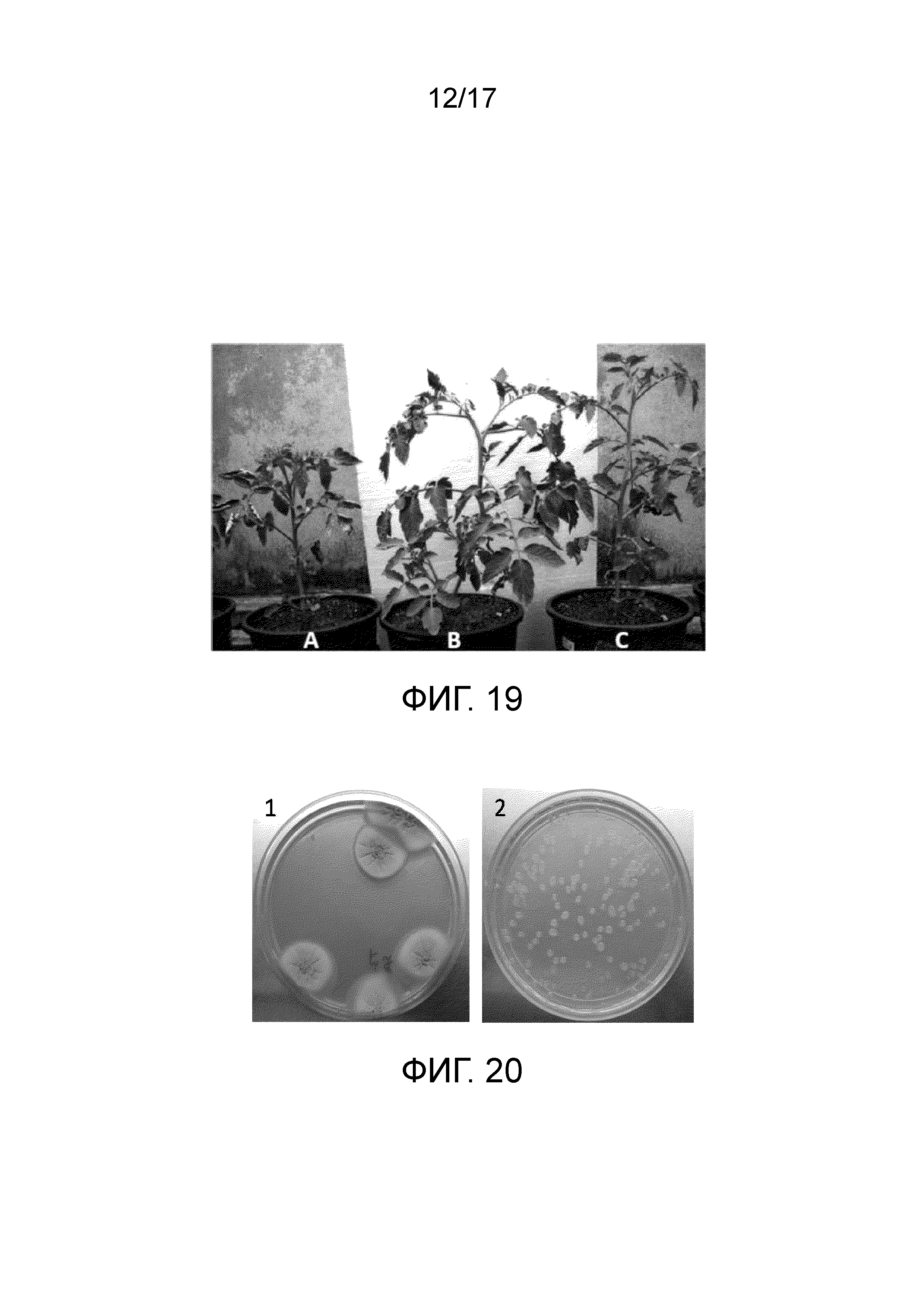
Фиг. 19 - Чашка, демонстрирующая результаты экспериментов по демонстрации действия Bacillus subtilis ssp. shriramensis (MTCC-5674) в качестве агента биологической защиты. (A) Растение томата инфицировали грибком Rhizoctonia solani (NFCCI-3194). (B) Растение томата с Rhizoctonia solani (NFCCI-3194) и Bacillus subtilis ssp. shriramensis (MTCC-5674) и (С) контрольное растение томата (без Rhizoctonia solani fungus и Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 20 - Чашки, демонстрирующие (1) колонии грибков Penicillium oxalicum (NFCCI-1997) и (2) чистые колонии Bacillus subtilis ssp. shriramensis (MTCC-5674).
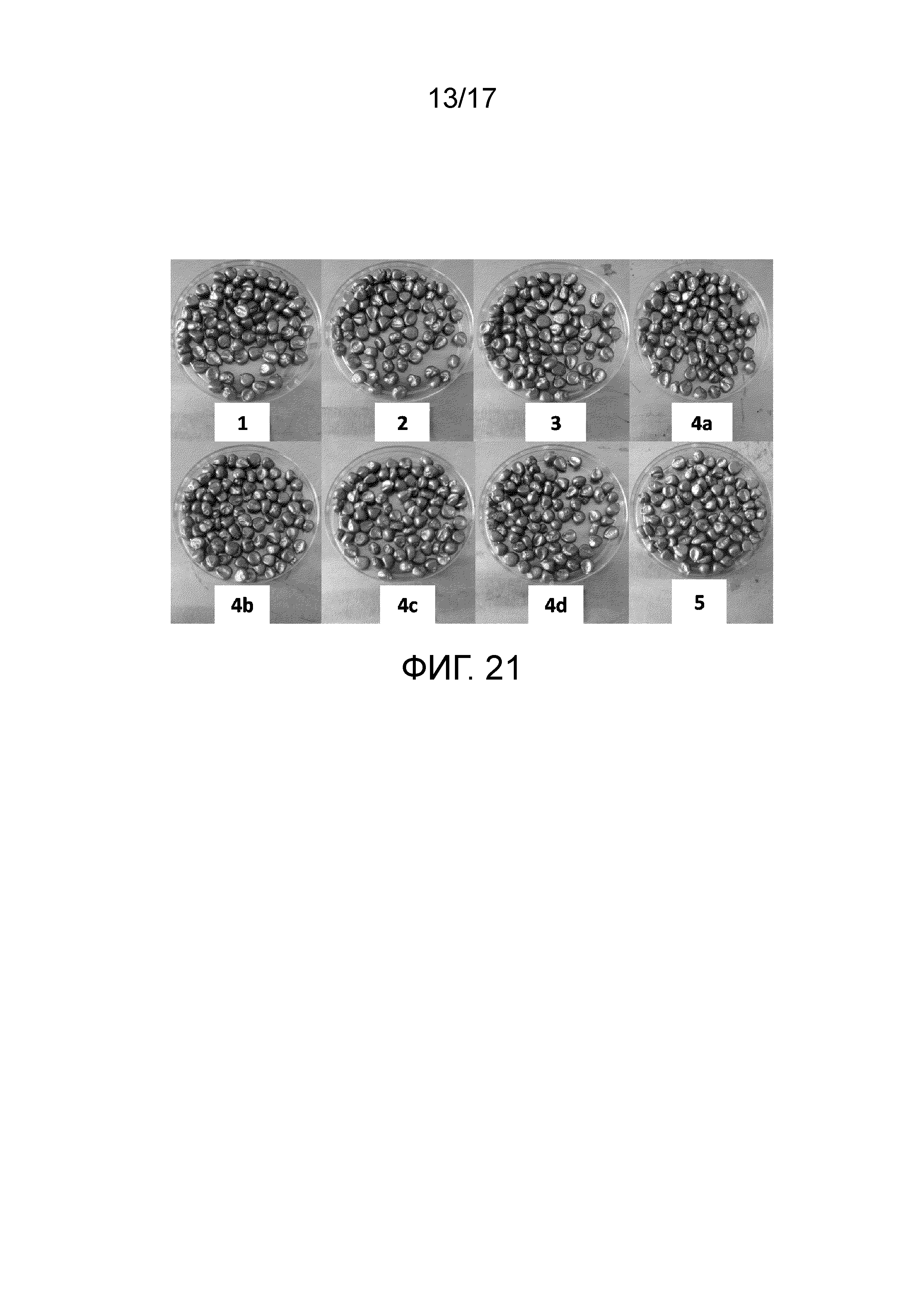
Фиг. 21 - Чашка, демонстрирующая зерна кукурузы, покрытые различными составами противомикробного/противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674). 1. (Контроль-1) Семена, обработанные составом, в котором не содержится грибкового патогена и агента биологической защиты; 2. (Контроль-2) Семена, обработанные составом, в котором не содержится агента биологической защиты; 3. (Контроль-3) Семена, обработанные составом, который содержит коммерческий фунгицид «карбендазим WP50»; 4a. Семена, обработанные составом, который содержит клетки Bacillus subtilis ssp. shriramensis (5×104 КОЕ); 4b. Семена, обработанные составом, который содержит клетки Bacillus subtilis ssp. shriramensis (5×105 КОЕ); 4c. Семена, обработанные составом, который содержит клетки Bacillus subtilis ssp. shriramensis (5×106 КОЕ); 4d. Семена, обработанные составом, который содержит клетки Bacillus subtilis ssp. shriramensis (5×107 КОЕ); и 5. Семена, обработанные составом, который содержит клетки только Bacillus subtilis ssp. shriramensis (5×107 КОЕ).
Фиг. 22 - Чашка, демонстрирующая результаты активности в отношении биологической защиты через 2 недели инкубации. 1. (Контроль-1) Семена, обработанные составом-1, в котором не содержится грибкового патогена и противогрибкового агента; 2. (Контроль-2) Семена, обработанные составом-2, в котором не содержится агента биологической защиты; 3. (Контроль-3) Семена, обработанные составом-3, который содержит коммерческий фунгицид «карбендазим WP50»; 4a. Семена, обработанные составом-4a, который содержит клетки Bacillus subtilis ssp. shriramensis (5×104 КОЕ); 4b. Семена, обработанные составом-4b, который содержит клетки Bacillus subtilis ssp. shriramensis (5×105 КОЕ); 4c. Семена, обработанные составом-4c, который содержит клетки Bacillus subtilis ssp. shriramensis (5×106 КОЕ); 4d. Семена, обработанные составом-4d, который содержит клетки Bacillus subtilis ssp. shriramensis (5×107 КОЕ); и 5. Семена, обработанные составом-5, который содержит клетки только Bacillus subtilis ssp. shriramensis (5×107 КОЕ).
Фиг. 23 - Чашка, демонстрирующая результаты активности агента биологической защиты через 4 недели инкубации. 1. (Контроль-1) Семена, обработанные составом-1, в котором не содержится грибкового патогена и противогрибкового агента; 2. (Контроль-2) Семена, обработанные составом-2, в котором не содержится агента биологической защиты; 3. (Контроль-3) Семена, обработанные составом-3, который содержит коммерческий фунгицид «карбендазим WP50»; 4a. Семена, обработанные составом-4a, который содержит клетки Bacillus subtilis ssp. shriramensis (5×104 КОЕ); 4b. Семена, обработанные составом-4b, который содержит клетки Bacillus subtilis ssp. shriramensis (5×105 КОЕ); 4c. Семена, обработанные составом-4c, который содержит клетки Bacillus subtilis ssp. shriramensis (5×106 КОЕ); 4d. Семена, обработанные составом-4d, который содержит клетки Bacillus subtilis ssp. shriramensis (5×107 КОЕ); и 5. Семена, обработанные составом-5, который содержит клетки только Bacillus subtilis ssp. shriramensis (5×107 КОЕ).
Фиг. 24 - Тест на противогрибковую и/или противомикробную активность против различных штаммов патогенных грибков человека. A, B и C - Тест на противогрибковую и/или противомикробную активность против Penicillium spp. (A) грибковые колонии Penicillium spp., (B) мицелий и (C) действие культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674). D, E и F - Тест на противогрибковую и/или противомикробную активность против Aspergillus flavus (D) грибковые колонии (E) мицелий и (F) действие культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674). G, H и I - Тест на противогрибковую и/или противомикробную активность против Aspergillus niger. (G) грибковые колонии (H) мицелий и (I) действие культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674. J, K и L - Тест на противогрибковую и/или противомикробную активность против неизвестного грибка, вызывающего инфекцию кожи. (J) грибковые колонии (K) конидии и (L) действие культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674).
Фиг. 25 - Действие состава Bacillus subtilis ssp. shriramensis (MTCC-5674) на рост и развитие кукурузы. Зерна кукурузы, обработанные составом, содержащим Bacillus subtilis ssp. shriramensis (MTCC-5674), характеризовались более высокой скоростью роста, биомассой и урожайностью зерна.
Выделение и идентификация новой бактерии
Авторы собрали образцы воздуха из 18 разных мест в Хайдарабаде и Патанчеру (Telangana, India) при проведении исследования флоры воздуха. Одноразовые чашки Петри, содержащие среду (T3 Medium, Travers, et al., 1987), готовили в лаборатории и подвергали воздействию воздуха в разных местоположениях. Экспонированные чашки герметизировали и инкубировали при 30°С в лабораторном инкубаторе. В одной из чашек, экспонированной с воздухом в области Патанчеру, наблюдалась колония бактерий, окруженная грибковым мицелием (фиг. 1A). Несмотря на продолжительную инкубацию, полоса безопасности поддерживалась, и рост мицелия грибов оставался ограниченным периферией полосы безопасности. Микроорганизмы из этой колонии были подвергнуты очистке с использованием стандартных методов микробиологии (фиг. 1B). Индивидуальные колонии тестировали против обычного грибка Fusarium oxysporum (фиг. 2).
Одна из колоний продемонстрировала ингибирование роста грибков, и была выявлена полоса безопасности (фиг. 2). Микроскопическое исследование бактерий из колонии выявило палочковидные подвижные бактерии (фиг. 5). Через шесть дней инкубации в культуральной среде бактерии продуцировали споры. Колонии бактерий были слизистыми, приподнятыми, круглыми, гладкими и от кремоватого до беловатого цвета (фиг. 4), и клетки показали вариабельную окраску по Граму (фиг. 5).
Проводили ряд биохимических тестов, включая сбраживание углеводов, активность каталазы, тест на окисление-ферментацию, гидролиз крахмала, тест на продукцию сероводорода, тест на активность оксидазы, тест на дезоксихолатном агаре. Результаты этих тестов подтвердили, что бактерия является позитивной в отношении каталазы, обладает активностью амилазы, сильно аэробна, не вырабатывает сероводород, позитивна в отношении оксидазы и вариабельна по окраске по Граму.
Для идентификации бактерии выполняли секвенирование 16S ДНК и анализ FAME. Результаты обоих исследований показали, что бактерия характеризуется 0,37% отличием в последовательности 16S ДНК и сходным показателем FAME 0,827 с Bacillus subtilis ssp. subtilis и 0,84% отличием в последовательности 16S ДНК и сходным показателем FAME 0,749 с Bacillus atrophaeus. Таким образом, эти результаты предполагают, что эта бактерия относится к Bacillus subtilis и Bacillus atrophaeus, но не идентична каким-либо штаммам бактерий, зарегистрированным в коллекции АТСС.
Результаты сравнения последовательностей 16S ДНК
|
Результаты сравнения с помощью анализа FAME
|
Выделенная бактерия является новым членом подвида рода Bacillus. В соответствии с бактериальной номенклатурной конвенцией новый бактериальный штамм был назван Bacillus subtilis ssp. shriramensis. Бактерия положена на хранение в коллекцию типов микробных культур (MTCC) в IMTECH, Chandigarh, India. Номером депозита этого нового штамма является (MTCC-5674).
Характерные свойства нового микроба, имеющего номер поступления/депозита (MTCC-5674), определенные с помощью настоящего изобретения
Бактерия является палочковидной с величиной 2,45×0,88 мкм, подвижной, спорообразующей, вариабельной при окраске по Граму; колонии являются гладкими, слизистыми, от беловатого до кремоватого цвета на ранних стадиях, но становятся морщинистыми при длительной инкубации. Бактерия превращается в спору при снижении питательных веществ в среде, как правило, процесс споруляции происходит при инкубации в течение 4 дней в 10 мл среды, содержащей 100 мкл 5×108 инокулированных клеток в культуральной пробирке 25×130 мм при 30°C и встряхивании при 200 об/мин.
Новая бактерия Bacillus subtilis ssp. shriramensis, имеющая номер поступления (MTCC-5674), обладает противомикробной и/или противогрибковой активностью. Экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), обладает противомикробной и/или противогрибковой активностью. Диапазон потенциального применения и использования бактерии обширен.
В настоящем изобретении предлагается способ получения противомикробного и/или противогрибкового экстракта из новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674).
Получение и выделение противомикробного и противогрибкового агента
Состав культуральной среды для роста Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), является следующим
|
pH=6,8
1. Среду получали согласно способу, представленному в приложении -I (I) и 100 мл аликвоты переносили в 500 мл конические колбы. Среду стерилизовали автоклавированием при 121°С в течение 15 минут.
2. В каждую колбу инокулировали единственную чистую колонию Bacillus subtilis ssp. shriramensis (MTCC-5674) и инкубировали при 30°С, 200 об/мин в течение 60 часов.
Выделение противомикробного и противогрибкового агента из культуральной среды
После выращивания бактерий в T3 бульоне в течение 60 часов культуру центрифугировали при 12000 об/мин в течение 10 мин при 4°С. Супернатант собирали и фильтровали с использованием 0,22 мкм фильтровальных дисков (Millipore/Sartorius). Фильтрат консервировали при подходящих условиях хранения для подробных экспериментов по изучению противомикробной и/или противогрибковой активности.
В настоящем изобретении конкретно предлагается новый микроорганизм Bacillus subtilis ssp. shriramensis, имеющий номер поступления (MTCC-5674), и способ получения противомикробной и/или противогрибковой композиции из новой бактерии и/или ее экстракта или из смеси новой бактерии и/или ее экстракта.
В одном из вариантов осуществления настоящего изобретения предлагается выделенная новая бактерия Bacillus subtilis ssp. shriramensis, имеющая номер поступления (MTCC-5674), проявляющая противомикробную и/или противогрибковую активность.
В одном из вариантов осуществления настоящего изобретения предлагается новая бактерия, обозначаемая как Bacillus subtilis ssp. shriramensis, имеющая номер поступления (MTCC-5674).
В другом варианте осуществления настоящего изобретения предлагается чистая культура новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674).
В одном из вариантов осуществления настоящего изобретения предлагается экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где экстракт проявляет противомикробную и/или противогрибковую активность.
В другом варианте осуществления настоящего изобретения предлагается экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где экстракт, проявляющий противомикробную и/или противогрибковую активность, представляет собой водный экстракт. В еще одном варианте осуществления настоящего изобретения предлагается способ получения экстракта новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где способ включает выращивание новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), в питательной среде и выделение экстракта, проявляющего противомикробную и/или противогрибковую активность.
В другом варианте осуществления настоящего изобретения предлагается способ получения экстракта новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где способ включает выращивание новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), в аэробных условиях.
В еще одном варианте осуществления настоящего изобретения предлагается способ получения экстракта новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где способ включает выращивание новой бактерии Bacillus subtilis ssp. shriramensis в питательной среде, выделение экстракта, проявляющего противомикробную и/или противогрибковую активность, и необязательно включает концентрирование экстракта с использованием традиционных методов.
В одном варианте осуществления настоящего изобретения предлагается композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674), где композиция проявляет противомикробную и/или противогрибковую активность.
В другом варианте осуществления настоящего изобретения предлагается композиция, включающая экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где композиция проявляет противомикробную и/или противогрибковую активность.
В одном варианте осуществления настоящего изобретения предлагается композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674), и экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), где композиция проявляет противомикробную и/или противогрибковую активность.
В одном варианте осуществления настоящего изобретения предлагается композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674), и/или экстракт указанной новой бактерии Bacillus subtilis ssp. shriramensis, или их сочетание, которая необязательно включает один или более противомикробных и/или противогрибковых агентов.
В другом варианте осуществления настоящего изобретения предлагается композиция, включающая экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), которая необязательно включает один или более противомикробных и/или противогрибковых агентов.
В еще одном варианте осуществления настоящего изобретения предлагается композиция, включающая сочетание новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), и ее экстракта, которая необязательно включает один или более противомикробных и/или противогрибковых агентов.
В одном варианте осуществления настоящего изобретения предлагается композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674), или экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), или их сочетание, которая необязательно включает сельскохозяйственно или фармацевтически приемлемый носитель.
В другом варианте осуществления настоящего изобретения предлагается композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674), которая необязательно включает сельскохозяйственно или фармацевтически приемлемый носитель.
В еще одном варианте осуществления настоящего изобретения предлагается композиция, содержащая экстракт новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), которая необязательно включает сельскохозяйственно или фармацевтически приемлемый носитель.
В еще одном варианте осуществления настоящего изобретения предлагается композиция, включающая сочетание новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), и экстракта указанной новой бактерии Bacillus subtilis ssp. shriramensis, которая необязательно включает сельскохозяйственно приемлемый носитель (смотри приложение III).
В одном варианте осуществления настоящего изобретения предлагается способ ингибирования роста патогенных грибков и/или бактерий, где указанный способ включает контактирование патогенных грибков и/или бактерий с эффективным количеством новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), или с композицией, включающей указанную новую бактерию или ее экстракт или их сочетание.
В одном варианте осуществления настоящего изобретения предлагается способ ингибирования роста патогенных грибков и/или бактерий, где указанный способ включает контактирование патогенных грибков и/или бактерий с эффективным количеством новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674).
В другом варианте осуществления настоящего изобретения предлагается способ ингибирования роста патогенных грибков и/или бактерий, где указанный способ включает контактирование патогенных грибков и/или бактерий с эффективным количеством композиции, включающей новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674).
В еще одном варианте осуществления настоящего изобретения предлагается способ ингибирования роста патогенных грибков и/или бактерий, где указанный способ включает контактирование патогенных грибков и/или бактерий с эффективным количеством композиции, включающей экстракт новой бактерии Bacillus subtilis ssp. shriramensis (MTCC-5674), где экстракт проявляет противомикробную и/или противогрибковую активность.
В еще одном варианте осуществления настоящего изобретения предлагается способ ингибирования роста патогенных грибков и/или бактерий, где указанный способ включает контактирование патогенных грибков и/или бактерий с эффективным количеством композиции, включающей новую бактерию Bacillus subtilis ssp. Shriramensis (MTCC-5674) и экстракт указанной новой бактерии Bacillus subtilis ssp. shriramensis, где экстракт проявляет противомикробную и/или противогрибковую активность.
В одном варианте осуществления настоящего изобретения предлагается применение новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), или композиции, включающей указанную новую бактерию, или ее экстракта или их сочетания для получения противомикробной и/или противогрибковой композиции для ингибирования роста патогенных грибков и/или бактерий.
В другом варианте осуществления настоящего изобретения предлагается применение новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674), для получения противомикробной и/или противогрибковой композиции для ингибирования роста патогенных грибков и/или бактерий.
В другом варианте осуществления настоящего изобретения предлагается применение композиции, включающей новую бактерию Bacillus subtilis ssp. shriramensis (MTCC-5674), для получения противомикробной и/или противогрибковой композиции для ингибирования роста патогенных грибков и/или бактерий.
В другом варианте осуществления настоящего изобретения предлагается применение композиции, включающей экстракт новой бактерии Bacillus subtilis ssp. shriramensis (MTCC-5674), для получения противомикробной и/или противогрибковой композиции для ингибирования роста патогенных грибков и/или бактерий.
В другом варианте осуществления настоящего изобретения предлагается применение композиции, включающей экстракт новой бактерии Bacillus subtilis ssp. shriramensis (MTCC-5674) и экстракт указанной новой бактерии Bacillus subtilis ssp. shriramensis, для получения противомикробной и/или противогрибковой композиции для ингибирования роста патогенных грибков и/или бактерий.
В другом варианте осуществления настоящего изобретения предлагается фармацевтически и сельскохозяйственно эффективная композиция, включающая новую бактерию Bacillus subtilis ssp. shriramensis, имеющую номер поступления (MTCC-5674).
В другом варианте осуществления настоящего изобретения предлагается фармацевтически и сельскохозяйственно эффективная композиция, включающая экстракт новой бактерии Bacillus subtilis ssp. shriramensis (MTCC-5674).
В еще одном варианте осуществления настоящего изобретения предлагается способ получения указанной эффективной композиции из новой бактерии Bacillus subtilis ssp. shriramensis, имеющей номер поступления (MTCC-5674).
В еще одном варианте осуществления настоящего изобретения стадии и время, требуемое для получения указанной композиции/экстракта, характеризуются минимальной продолжительностью, связанной с максимальным выходом соединения.
Другие достоинства и преимущества настоящего изобретения
Бактерия Bacillus subtilis ssp. shriramensis (MTCC-5674) вместе с противомикробным и/или противогрибковым агентом также продуцирует сильную термофильную протеазу и амилазу, которые активны даже после экспозиции при высокой температуре, т.е. 121°С в течение 15 мин.
Настоящее изобретение дополнительно объясняется с помощью последующих примеров. Однако настоящее изобретение не ограничивается этими примерами каким-либо образом. Последующие примеры предназначены для иллюстрации осуществления изобретения и не предназначены для узкого применения любых ограничений объема настоящего изобретения. Специалисты в данной области техники должны понимать, что эквивалентные замены описанных в настоящем документе конкретных веществ или соответствующие улучшения рассматриваются как входящие в объем изобретения.
Подробные методы объясняются в последующих примерах:
Методы, применяемые в настоящей работе, хорошо известны в микробиологии, причем соответствующие параметры варьируются и оптимизируются для настоящего исследования.
Пример 1
1.1 Сбор и предварительный скрининг образцов
Отбирали образцы воздуха из разных местах в Хайдарабаде и Патанчеру (Telangana, India). Одноразовые чашки Петри, содержащие среду T3, готовили в лаборатории и подвергали воздействию воздуха в разных местоположениях. Экспонированные чашки герметизировали и инкубировали при 30°С в лабораторном инкубаторе. В одной из чашек, экспонированной с воздухом в области Патанчеру, наблюдалась колония бактерий, окруженная мицелием грибка.
1.2 Предварительный скрининг образцов воздуха на противомикробную и/или противогрибковую активность
Несмотря на продолжительную инкубацию, полоса безопасности поддерживалась, и рост мицелия грибов оставался ограниченным периферией полосы безопасности. Микроорганизмы из этой колонии были подвергнуты очистке с использованием стандартных методов микробиологии (фиг. 1B). Индивидуальные колонии тестировали против обычного грибка Fusarium oxysporum (фиг. 2). Одна из колоний продемонстрировала ингибирование роста грибков, и была выявлена полоса безопасности (фиг. 2).
Скрининг нового изолята
Микроскопическая оценка бактерий выявила, что они представляют собой палочковидные подвижные бактерии (фиг. 5). Через шесть дней инкубации в культуральной среде бактерии продуцировали споры.
Колонии бактерий были слизистыми, приподнятыми, круглыми, гладкими и от кремоватого до беловатого цвета (фиг. 4), и клетки показали вариабельную окраску по Граму.
Пример 2
2.1 Характеристика и идентификация нового микроорганизма
2.1.1 Характеристика нового изолята Bacillus subtilis ssp. shriramensis, имеющего номер поступления (MTCC-5674)
Проводили ряд биохимических тестов, включая сбраживание углеводов, тест на активность каталазы, тест на окисление-ферментацию, гидролиз крахмала, тест на продукцию сероводорода, тест на активность оксидазы. Результаты этих тестов подтвердили, что бактерия является позитивной в отношении каталазы, позитивной в отношении амилазы, позитивной в отношении оксидазы и является сильно аэробной.
2.1.1.1 Морфология колонии Bacillus subtilis ssp. shriramensis (MTCC-5674)
Колонии Bacillus subtilis ssp. shriramensis (MTCC-5674) являются слизистыми, приподнятыми, круглыми, гладкими и от кремоватого до беловатого цвета (фиг. 4).
2.1.1.2 Характеристики культуры
Bacillus subtilis ssp. shriramensis (MTCC-5674) демонстрируют оптимальный рост при 30°С (могут расти при от 15°С до 55°С). Так как они являются аэробными бактериями, для их роста требуется адекватное снабжение кислородом, необходимо постоянное перемешивание для культивирования в бульоне.
2.1.1.3 Клеточная морфология
Клетки Bacillus subtilis ssp. shriramensis (MTCC-5674) являются палочкообразными, диплобацилльными и подвижными (фиг. 5).
2.1.1.3.1 Сравнение роста и морфологии колонии Bacillus subtilis ssp. shriramensis (MTCC-5674) с ростом и морфологией колоний Bacillus subtilis и Bacillus atrophaeus
|
2.1.1.4 Тест на каталазу
Материал
Культуральные пробирки Bacillus subtilis ssp. shriramensis (MTCC-5674)
Перекись водорода
Метод
Три пробирки, содержащие среду LB, были помечены как «тест», «позитивный контроль» и «негативный контроль», петли, заполненные Bacillus subtilis ssp. shriramensis (MTCC-5674), Escherichia coli и Streptococcus pneumonia, инокулировали в соответствующие пробирки. После инкубации при 30°С в течение 24 часов добавляли несколько капель перекиси водорода во все пробирки и наблюдали за образованием пузырьков.
Результат
Пузырьки газа образовывались как в «тесте» так и в «позитивном контроле», указывая на то, что Bacillus subtilis ssp. shriramensis (MTCC-5674) является положительной в отношении каталазы (фиг. 6).
2.1.1.5 Гидролиз крахмала
Материал
Культуральный фильтрат Bacillus subtilis ssp. shriramensis (MTCC-5674)
Чашки крахмала-агара
Йод
Инкубатор
Метод
Крахмал-агаровую среду готовили согласно методу, приведенному в приложении - I (VI). Две лунки создавали на равных расстояниях в чашке, содержащей крахмал-агаровую среду, и помечали как «тест» и «негативный контроль». Аликвоты по 500 мкл каждого из Bacillus subtilis ssp. shriramensis (MTCC-5674), культурального фильтрата и стерильной дистиллированной воды вносили в лунки с надписью «тест» и «негативный контроль». Чашку инкубировали при 50°С в течение 4-х часов.
Результат
После 4 часов инкубации синий цвет, окружающий тестируемую лунку исчезал, указывая на то, что культуральный фильтрат Bacillus subtilis ssp. shriramensis (MTCC-5674) имеет амилолитическую активность. Никаких изменений в синем цвете не наблюдалось в области, окружающей контрольную лунку (фиг. 7).
2.1.1.6 Тест O/F (оксиления-ферментации)
Материал
Окислительно-ферментативная(ОФ)базальная среда Хью и Лейфсона
Пробирки для тестирования
Культура E. coli
Bacillus subtilis ssp. shriramensis (MTCC-5674)
Инкубатор
Метод
Три пробирки, содержащие (ОФ)базальную среду Хью и Лейфсона (OFBM) (приложение - I (VII)), помечали как «негативный контроль», «позитивный контроль» и «тест», и петли, заполненные Alcaligenes faecalis, Escherichia coli и Bacillus subtilis ssp. shriramensis (MTCC-5674), инокулировали в соответствующие пробирки. Пробирки инкубировали при 30°С в течение 48 часов и наблюдали за изменением цвета.
Результат
Из наблюдений заключается, что тестируемый организм (Bacillus subtilis ssp. shriramensis (MTCC-5674)) строго аэробный, поскольку он не сбраживал углеводы (ни с образованием газа, ни с изменением цвета) глубоко внутри среды. Благодаря доступности кислорода, на поверхности среды наблюдалось некоторое изменение цвета. В то время как E. coli росла очень хорошо глубоко внутри среды и ферментировала углеводы (как с образованием газа, так и с изменением цвета среды), указывая на то, что она является факультативно анаэробной (фиг. 8). В негативном контроле не наблюдалось ни образования газа, ни изменения цвета.
2.1.1.7 Тест на продукцию сероводорода
Материал
Среда SIM (для определения сульфида, индола, подвижности)
Культуральные пробирки
Культура E. coli
Bacillus subtilis ssp. shriramensis (MTCC-5674)
Инкубатор
Метод
Пробирки, содержащие среду SIM [среду для определения сульфида, индола, подвижности, {приложение - I (VII)}], были помечены как «отрицательный контроль» и «тест», и петли, заполненные E. coli и Bacillus subtilis ssp. shriramensis (MTCC-5674), инокулировали в соответствующие пробирки и инкубировали при 30°С в течение 24 часов и наблюдали за изменением цвета.
Результат
Из наблюдений заключается, что тестируемый организм является негативным в отношении продукции H2S, так как среда не чернеет. Тот же результат наблюдался для негативного контроля (фиг. 9).
2.1.1.8 Влияние рН на рост Bacillus subtilis ssp. shriramensis (MTCC-5674)
Культуральные пробирки, содержащие стандартную культуральную среду (LB), доведенную до различных значений рН в пределах от 3,4 до 11,0 (от кислой к основной), использовали для выращивания Bacillus subtilis ssp. shriramensis (MTCC-5674) в стандартных условиях. Рост Bacillus subtilis ssp. shriramensis (MTCC-5674) наблюдался в диапазоне рН от 6,4 до 7,2 и оптимальный рН, как установлено, составлял 7,0.
2.1.1.9 Тест на чувствительность к антибиотикам Bacillus subtilis ssp. shriramensis (MTCC-5674)
24-часовую культуру Bacillus subtilis ssp. shriramensis (MTCC-5674) распределяли по всей поверхности агара T3. Диски с различными антибиотиками помещали на поверхности чашек с агаром Т3, меченных соответствующим антибиотиком. Чашки инкубировали при 30°С в течение 24 часов.
Таблица 1. Исследование чувствительности к антибиотикам Bacillus subtilis ssp. shriramensis (MTCC-5674) RES - устойчива, INT - промежуточная чувствительность, SEN - чувствительна
|
Результат
Из наблюдений заключается, что Bacillus subtilis ssp. shriramensis (MTCC-5674) устойчива к антибиотикам - ампициллину, карбенициллину, канамицину, энрофлоксацину, линкомицину, амоксициллину, клиндамицину, неомицину, азитромицину. Тестируемая бактерия чувствительна к гентамицину, тобрамицину, ванкомицину, новобиоцину, сульфизоксазолу, цефалотину, хлорамфениколу, цефтриаксону и бацитрацину и демонстрирует промежуточную устойчивость к оксациллину, амикацину, стрептомицину и эритромицину.
2.1.2 Идентификация нового изолята Bacillus subtilis ssp. shriramensis (MTCC-5674)
Для идентификации бактерии осуществляли секвенирование 16S ДНК и анализ FAME. Результаты обоих исследований показали, что бактерия характеризуется 0,37% отличием в последовательности 16S ДНК и сходным показателем FAME 0,827 с Bacillus subtilis ssp. subtilis и 0,84% отличием в последовательности 16S ДНК и сходным показателем FAME 0,749 с Bacillus atrophaeus. Таким образом, эти результаты предполагают, что эта бактерия относится к Bacillus subtilis и Bacillus atrophaeus, но не идентична каким-либо штаммам бактерий, зарегистрированным в коллекции АТСС.
2.1.2.1 Результаты сравнения последовательностей 16S ДНК
|
2.1.2.2 Результаты сравнения с помощью анализа FAME
|
Выделенная бактерия является новым членом рода Bacillus. В соответствии с бактериальной номенклатурной конвенцией новый бактериальный штамм был назван Bacillus subtilis ssp. shriramensis. Бактерия положена на хранение в коллекцию типов микробных культур (MTCC) в IMTECH, Chandigarh, India. Номером депозита этого нового штамма является (MTCC-5674).
Пример 3
3.1 Получение и скрининг противомикробного и/или противогрибкового агента
3.1.1 Получение противомикробного и/или противогрибкового агента
Материал
Бульон T3-1 л
Коническая колба - емкость 2 л
Канамицин (30 мкг/мл)
Инокулят Bacillus subtilis ssp. shriramensis (MTCC-5674)
Инкубатор-качалка (установленный на температуру 30°С и перемешивание при 200 об/мин)
Метод
Бульон T3 получали в соответствии с методом, описанным в приложении - I (1). 1 мл культуры Bacillus subtilis ssp. shriramensis (MTCC-5674) инокулировали в стерильный бульон T3 и инкубировали в инкубаторе-качалке при 30°С в течение 60 часов при перемешивании при 200 об/мин. После выращивания Bacillus subtilis ssp. shriramensis (MTCC-5674) в бульоне T3 в течение 60 часов культуральную среду отделяли центрифугированием при 12000 об/мин при 4°С в течение 10 мин. Супернатант собирали и пропускали через 0,22 мкм фильтры для отделения каких-либо оставшихся бактериальных клеток. Фильтрат хранили при 4°С.
3.1.2 Скрининг культурального фильтрата, собранного на стадии 3.1.1, представленной выше, на противомикробную и/или противогрибковую активность
Материал
Культуральный фильтрат Bacillus subtilis ssp. shriramensis (MTCC-5674), содержащий противомикробный и/или противогрибковый агент
Чашки PDA
Канамицин (30 мкг/мл)
Тестируемый гриб Fusarium oxysporum
Инкубатор
Метод
Для тестирования активности противомикробного и/или противогрибкового агента в фильтрате, делали лунку в одном углу чашки агара PDA, в лунку помещали 500 мкл фильтрата. Петлю, заполненную грибом Fusarium oxysporum, инокулировали в другой угол той же самой чашки агара PDA и инкубировали в течение 5 дней при комнатной температуре. Ингибирующую активность фильтрата против гриба Fusarium oxysporum регистрировали по зоне ингибирования вокруг лунки в миллиметрах.
Результат
Чистая зона ингибирования в 14 мм наблюдалась вокруг лунки, предполагая, что метод, используемый для получения противомикробного и/или противогрибкового агента, является оптимальным.
3.2 Характеристика противомикробного и/или противогрибкового агента
Противомикробную и/или противогрибковую активность, связанную с Bacillus subtilis ssp. shriramensis (MTCC-5674), исследовали для установления природы агента, определяющего противомикробную и/или противогрибковую активность.
Материал
Бульон T3-1 л
Коническая колба - емкость 2 л
Канамицин (30 мкг/мл)
Инокулят Bacillus subtilis ssp. shriramensis (MTCC-5674)
Инкубатор-качалка
Метод
Бульон T3 получали в соответствии с методом, описанным в приложении - I (1). 1 мл аликвоту 24-часовой культуры Bacillus subtilis ssp. shriramensis (MTCC-5674) инокулировали в стерильный бульон T3 и инкубировали в инкубаторе-качалке при 30°С в течение 60 часов при перемешивании при 200 об/мин. После выращивания Bacillus subtilis ssp. shriramensis (MTCC-5674) в бульоне T3 в течение 60 часов культуральную среду отделяли центрифугированием при 12000 об/мин при 4°С в течение 10 мин. Супернатант собирали и пропускали через 0,22 мкм фильтры для отделения каких-либо оставшихся бактериальных клеток.
3.2.1 Тестирование противомикробной и/или противогрибковой активности бактериальных клеток Bacillus subtilis ssp. shriramensis (MTCC-5674)
Для тестирования активности противомикробного и/или противогрибкового агента, продуцируемого клетками, петлю, заполненную Bacillus subtilis ssp. shriramensis (MTCC-5674), инокулировали в один угол чашки с агаром T3, а петлю, заполненную грибом Fusarium oxysporum, инокулировали в другом углу той же самой чашки с агаром T3 и инкубировали в течение 5 дней при комнатной температуре. Ингибирующую активность бактериальных клеток против гриба Fusarium oxysporum регистрировали по зоне ингибирования вокруг бактериальной колонии в миллиметрах.
Результат
Чистая зона ингибирования в 14 мм (фиг. 11A) наблюдалась вокруг бактериальной колонии, предполагая, что активное соединение, секретируемое бактериальными клетками, диффундирует в культуральную среду, что ведет к образованию полосы безопасности вокруг бактериальной колонии.
3.2.2 Тестирование противомикробной и/или противогрибковой активности культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674)
Для тестирования природы противомикробного и/или противогрибкового агента в фильтрате делали лунку в чашке агара PDA и в лунку помещали 500 мкл фильтрата. Петлю, заполненную грибом Fusarium oxysporum, инокулировали по диагонали в противоположный конец той же самой чашки агара PDA и инкубировали в течение 5 дней при комнатной температуре. Ингибирующую активность фильтрата против грибка Fusarium oxysporum регистрировали по зоне ингибирования вокруг лунки в миллиметрах.
Результат
Чистая зона ингибирования в 14 мм (фиг. 11B) наблюдалась вокруг лунки, предполагая, что фильтрат сохранял противомикробную и/или противогрибковую активность, указывая на то, что активное соединение секретируется из бактериальных клеток в культуральную среду.
3.3 Определение MIC противомикробного и/или противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674)
3.3.1 Лиофилизация противомикробного и/или противогрибкового агента
Материал
Культуральный фильтрат Bacillus subtilis ssp. shriramensis (MTCC-5674)
Сульфат аммония
Канамицин (30 мкг/мл)
Лиофильная сушка
Метод
Противомикробный и/или противогрибковый агент получали и очищали с помощью методов, представленных в 3.1.1. 800 мл аликвоту культурального фильтрата смешивали с 382,18 г сульфата аммония при 70% (масс./об.) насыщении (модифицированный протокол Jing et al., 2009), и раствор осторожно смешивали путем перемешивания в течение ночи при 4°С. Суспензию центрифугировали при 10000 об/мин в течение 10 мин при 4°С. Осадок, полученный таким образом, подвергали лиофилизации в течение 24 часов в лиофильной сушке, и высушенный осадок хранили при комнатной температуре.
3.3.2 MIC противомикробного и/или противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674)
Методы
3.3.2.1 Метод разведения в пробирке
3.3.2.2 Метод диффузии в агаре
Получение маточного раствора лиофилизованного противомикробного и/или противогрибкового агента
Маточный раствор получали путем растворения 1 г лиофилизованного порошка противомикробного и/или противогрибкового агента в 50 мл фосфатного буфера (рН 7,0). Конечную концентрацию маточного раствора доводили до 20 мкг/мкл. Маточный раствор использовали для получения разведений средой PDB в различных соотношениях, как представлено в таблице 1.
3.3.2.1 Метод разведения в пробирке
Материал
1,5 мл пробирки
Среда PDB
Маточный раствор противомикробного и/или противогрибкового агента
Суспензия спор Fusarium oxysporum
Метод
Определение MIC противомикробного и/или противогрибкового агента осуществляли в 1,5 мл пробирках. Различные разведения противомикробного и/или противогрибкового агента получали в среде PDB (таблица 2) в диапазоне от 10 мкг/мкл (1:1) до 198 нг/мкл (1:100). Определение MIC проводили против Fusarium oxysporum путем добавления 30 мкл (5×106 КОЕ/мл) суспензии спор во все пробирки и инкубации при 28°С в течение 2 дней при перемешивании при 180 об/мин.
Использовали три контроля, один с неразведенным маточным раствором противомикробного и/или противогрибкового агента, второй с 70% сульфатом аммония в PDB и третий только с PDB. Среду во всех трех пробирках инокулировали 30 мкл (5×106 КОЕ/мл) суспензией спор Fusarium oxysporum и инкубировали при 28°С в течение 2 дней при перемешивании при 180 об/мин.
3.3.2.2 Метод диффузии в агаре
Материал
Чашки PDA (картофельно-декстрозного агара)
Среда PDB (картофельно-декстрозного бульона)
Маточный раствор противомикробного и/или противогрибкового агента
Fusarium oxysporum
Метод
Определение MIC лиофилизованного противомикробного и/или противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674) также осуществляли методом диффузии в агаре. В чашках PDA делали четыре лунки диаметром 9 мм каждая на равном расстоянии. Различные разведения противомикробного и/или противогрибкового агента получали в среде PDB (таблица 3) в диапазоне от 10 мкг (1:1) до 198 нг (1:100). Аликвоту 200 мкл каждого разведения помещали в лунку, помеченную соответствующим разведением. Тестируемый грибок Fusarium oxysporum инокулировали в центр среды PDA, и чашки инкубировали при 28°С в течение 4 дней.
В качестве контроля использовали чашку с тремя контролями, один, содержащий неразведенный маточный раствор противомикробного и/или противогрибкового агента, второй, содержащий только бульон PDB, и третий, содержащий PDB с 70% сульфатом аммония. Активность измеряли по ингибиторной зоне вокруг лунки в миллиметрах.
Результат
Метод разведения в пробирке (фиг. 12)
Образцы исследовали на прорастание спор через 48 часов инкубации под световым микроскопом. Споры не прорастали в пробирках, содержащих противомикробный и/или противогрибковый агент, в отношениях 1:1, 1:2, 1:3 и 1:4. Умеренное прорастание спор наблюдалось в пробирках, содержащих противомикробный и/или противогрибковый агент, в отношениях разведений 1:5, 1:6, 1:7, 1:8 и 1:9, и нормальное прорастание спор и образование мицелия наблюдалось в оставшихся пробирках, содержащих противомикробный и/или противогрибковый агент, в отношениях от 1:10 до 1:100 (таблица 2).
Таблица 2. Определение MIC противомикробного и/или противогрибкового агента с помощью метода разведения в пробирках
|
Метод диффузии в агаре (фиг. 13)
Ингибирование роста мицелия грибка наблюдали вокруг лунок, содержащих противомикробный и/или противогрибковый агент, в отношениях 1:1, 1:2, 1:3 и 1:4 (таблица 3). Умеренное ингибирование наблюдали вокруг лунок, содержащих противомикробный и/или противогрибковый агент, в отношениях разведений 1:5, 1:6 и 1:7 и никакого ингибирования не наблюдали при оставшихся разведениях (от 1:8 до 1:100) (таблица 3).
Заключение
Из приведенного выше эксперимента заключается, что противомикробный и/или противогрибковый агент в виде порошка неочищенного экстракта ингибирует прорастание спор, а также рост мицелия до разведения 1:4 (об./об.) зависимым от концентрации образом.
Таблица 3. Определение MIC противомикробного и/или противогрибкового агента с помощью метода диффузии в агаре
|
3.4 Тестирование противомикробной и/или противогрибковой активности клеточного лизата нового изолята Bacillus subtilis ssp. shriramensis (MTCC-5674)
Материал
Чашки агара PDA
Бульон LB
Клетки Bacillus subtilis ssp. shriramensis (MTCC-5674)
Лизоцим
Инкубатор
Методы
3.4.1 Лизис клеток Bacillus subtilis ssp. shriramensis (MTCC-5674)
Бульон LB получали в соответствии с методом, описанным в приложении - I (3). Единичную колонию Bacillus subtilis ssp. shriramensis (MTCC-5674) инокулировали в стерильный бульон LB и инкубировали при 30°С в течение 24 часов. Через 24 часа инкубации вегетативные клетки собирали центрифугированием при 6500 об/мин, 4°С, клетки промывали три раза стерильной дистиллированной водой и индуцировали лизис клеток путем инкубации с лизоцимом при 37°С в течение 2 час. После лизиса суспензию центрифугировали при 10000 об/мин в течение 10 мин при 4°С для удаления разрушенных клеток. Супернатант собирали и пропускали через 0,22 мкм фильтр и хранили при 4°С.
3.4.2 Тестирование противомикробной и/или противогрибковой активности клеточного лизата
Две лунки пробивали на двух диагональных концах агара PDA в чашке Петри и их метили, одну как «тест» и другую как «контроль». Аликвоту 500 мкл лизата добавляли к тестируемой лунке и 500 мкл только лизоцима добавляли к контрольной лунке. Тестируемый грибок Fusarium oxysporum инокулировали в середину агара PDA и инкубировали в течение 5 дней при комнатной температуре.
Результат
Клеточный лизат не проявлял противомикробной и/или противогрибковой активности (фиг. 15) против грибка Fusarium oxysporum, предполагая, что противомикробный и/или противогрибковый агент в первую очередь секретируется в среду.
Пример 4
4.1 Тестирование противомикробной и/или противогрибковой активности против других патогенных грибков
Материал
Bacillus subtilis ssp. shriramensis (MTCC-5674)
Патогенные грибки растений
1. Rhizoctonia solani (вызывает заболевание эпидермиса у членов семейства пасленовых).
2. Sarocladium oryzae (вызывает гниль эпидермиса у риса).
3. Colletotrichum capsicii (вызывает антракноз у жгучего перца).
Exerohilum turcicum (вызывает фитофтороз turcicum).
Macrophomina phaseolina (вызывает угольную гниль).
Бульон T3
Чашки агара T3
Чашки агара PDA
Инкубатор
Метод
4.1.1 Тестирование противомикробной и/или противогрибковой активности клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) против различных патогенных грибков растений
Петлю, заполненную клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) и петлю, заполненную тестируемыми грибками, инокулировали в диагонально противоположные концы чашек T3, помеченных соответствующим грибком, и инкубировали при 28°С до наличия роста мицелия гриба поблизости от бактериальной колонии.
4.1.2 Тестирование противомикробной и/или противогрибковой активности фильтрата против различных патогенных грибков растений
Аликвоту 500 мкл культурального фильтрата, содержащего противомикробный и/или противогрибковый агент, добавляли к лункам, сделанным в агаре PDA, и петлю, заполненную тестируемыми грибками инокулировали в противоположном углу соответствующих чашек, меченных соответствующим грибком, и инкубировали при 28°С до наличия роста мицелия грибка поблизости от лунки, содержащей культуральный фильтрат.
Ингибиторную активность фильтрата против грибка-мишени регистрировали в миллиметрах в виде ингибиторной зоны, образуемой вокруг лунки.
Результат
Набор видов грибков, вызывающих заболевания растений, тестировали методом определения противомикробной и/или противогрибковой активности, и все они демонстрировали полное ингибирование роста в присутствии клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) и также их культурального фильтрата.
4.2 Эффективность противомикробного и/или противогрибкового агента в отношении защиты семян риса от поражения грибками
Семена риса обрабатывали спорами Fusarium oxysporum и культуральным фильтратом Bacillus subtilis ssp. shriramensis (MTCC-5674) и помещали в чашки Петри, содержащие простой агар, для проверки эффективности противомикробного и/или противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674) в отношении ингибирования поражения грибком прорастающих семян.
Контрольные семена обрабатывали только спорами Fusarium oxysporum.
Результат
В присутствии противомикробного и/или противогрибкового агента Bacillus subtilis ssp. shriramensis (MTCC-5674) грибок был не способен инфицировать семена, и семена риса прорастали нормально. Однако семена, обработанные только грибком, демонстрировали тяжелую инфекцию и были не способны прорастать (фиг. 17).
4.3 Тестирование патогенной природы Bacillus subtilis ssp. shriramensis (MTCC-5674) у растений
Материал
Bacillus subtilis ssp. shriramensis (MTCC-5674) в 1% КМЦ в распыляемой форме
Растения риса, хлопка, табака, кукурузы и томата
Распылитель
Метод
Культуру Bacillus subtilis ssp. shriramensis (MTCC-5674) тщательно тестировали на наличие патогенного воздействия, если таковое имеется, на ряд видов растений.
Bacillus subtilis ssp. shriramensis (MTCC-5674) высевали в 1 л стерильного бульона LB в 2 л конической колбе и инкубировали при 30°С в течение 24 часов, встряхивая при 200 об/мин. После роста бактерий клетки собирали центрифугированием при 6500 об/мин при 4°С в течение 10 мин. Осадок промывали дважды фосфатным буфером (рН 7,0) и доводили до суспензии в 1% КМЦ (карбоксиметилцеллюлозе) в фосфатном буфере (рН 7,0). Полученную суспензию использовали для распыления на сельскохозяйственные культуры, такие как рис, табак, кукуруза, томаты и хлопок.
Результат
Из наблюдений заключается, что все виды растений (рис, табак, кукуруза, томаты и хлопок), опрысканные Bacillus subtilis ssp. shriramensis (MTCC-5674), не проявляли каких-либо симптомов заболевания, и их рост и развитие были эквивалентны контрольным растениям, указывая на то, что Bacillus subtilis ssp. shriramensis (MTCC-5674) не является патогенной для видов растений (фиг. 18).
Пример 5
5.1 Составление противомикробных и/или противогрибковых композиций, содержащих клетки Bacillus subtilis ssp. shriramensis (MTCC-5674) в качестве агента биологической защиты.
Материал
Bacillus subtilis ssp. shriramensis (MTCC-5674)
Бульон LB
PDB (картофельно-декстрозный бульон)
Фосфатный буфер (рН 7,0)
КМЦ (карбоксиметилцеллюлоза)
Метод
5.1.1 Получение клеточной суспензии Bacillus subtilis ssp. shriramensis (MTCC-5674)
Bacillus subtilis ssp. shriramensis (MTCC-5674) инокулировали в 1 л стерильного бульона LB в 2 л конической колбе и инкубировали при 30°С в течение 24 часов, встряхивая при 200 об/мин. После роста Bacillus subtilis ssp. shriramensis (MTCC-5674) культуру центрифугировали при 6500 об/мин при 4°С в течение 10 мин. Осадок промывали дважды фосфатным буфером (рН 7,0) и смешивали с 1% КМЦ (карбоксиметилцеллюлозой) в фосфатном буфере (рН 7,0) для получения суспензии, содержащей 6×107 КОЕ/мл. Суспензию, содержащую Bacillus subtilis ssp. shriramensis (MTCC-5674), использовали для распыления на растения и обработки корней растений рассады путем погружения.
5.1.2 Тестирование эффективности состава, содержащего противомикробный и/или противогрибковый агент, в отношении ингибирования заражения Rhizoctonia solani (NFCCI-3194) корней томатов
Материал
Суспензия, содержащая Bacillus subtilis ssp. shriramensis (MTCC-5674)
Грибок Rhizoctonia solani (NFCCI-3194) (вызывает заболевание эпидермиса у членов семейства пасленовых).
Традиционная почва
Рассада томатов
5.1.3 Получение Rhizoctonia solani (NFCCI-3194)
Rhizoctonia solani (NFCCI-3194) выращивали в среде картофельно-декстрозного бульона (полученном согласно методу, представленному а приложении - I (V) в течение 6 дней. После роста Rhizoctonia solani (NFCCI-3194) его осторожно смешивали с традиционной почвой и инкубировали в течение 15 дней при комнатной температуре. Традиционную почву, содержащую грибок, смешивали с почвой в отношении 1:1.
Рассада томатов
В настоящем исследовании использовали рассаду томатов длиной 10 см.
Метод
Эксперимент осуществляли, как описано ниже.
A. Рассаду томатов высаживали в почву, содержащую Rhizoctonia solani (NFCCI-3194), но не обработанную Bacillus subtilis ssp. shriramensis (MTCC-5674).
B. Корни рассады томатов обрабатывали суспензией, содержащей Bacillus subtilis ssp. shriramensis (MTCC-5674), и высаживали в почву, содержащую Rhizoctonia solani (NFCCI-3194).
C. Рассада томатов без какой-либо обработки.
A. Обработка рассады клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) и грибком Rhizoctonia solani (NFCCI-3194)
Корни рассады томатов погружали в состав клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) на 30 мин. Обработанную рассаду высаживали в горшки, содержащие почву, смешанную с грибком Rhizoctonia solani (NFCCI-3194).
Контрольная рассада
Для индукции заболевания у рассады рассаду томатов (необработанную) высаживали в горшки, содержащие почву, смешанную с грибком Rhizoctonia solani (NFCCI-3194).
Для негативного контроля рассаду томатов (необработанную) высаживали в горшки, содержащие почву, не смешанную с грибком Rhizoctonia solani (NFCCI-3194).
Все горшки, содержащие рассаду томатов, переносили в теплицу и поддерживали до стадии плодоношения.
Результат
Из наблюдений заключается, что рассада, обработанная сочетанием Bacillus subtilis ssp. shriramensis (MTCC-5674) и грибка Rhizoctonia solani (NFCCI-3194), росла очень хорошо, эквивалентно контрольному растению, тогда как рассада (необработанная), высаженная в горшок, содержащий грибок Rhizoctonia solani (NFCCI-3194), показала задержку роста, бедное цветение и плодоношение по сравнению с контролем. Следовательно, можно заключить, что Bacillus subtilis ssp. shriramensis (MTCC-5674) ингибировала рост грибка Rhizoctonia solani (NFCCI-3194) в прикорневой зоне рассады томатов и защищала рассаду от заболевания, вызываемого грибком (фиг. 19).
Пример 6
6.1 Оценка in vitro минимального количества клеток Bacillus subtilis ssp. shriramensis (MTCC-5674), которое может контролировать инфицирование прорастающих зерен кукурузы почвенным и находящимся в зернах грибковым патогеном Penicillium oxalicum (NFCCI-1997).
6.1.1 Получение бактериальных и грибковых суспензионных культур
Материалы
a. Bacillus subtilis ssp. shriramensis (MTCC-5674)
b. Penicillium oxalicum (NFCCI-1997) -патогенный гриб растений
c. Карбендазим WP50 (коммерческий фунгицид)
d. Бульон Luria Bertani (LB)
Метод
6.1.1.1 Получение суспензионной культуры Bacillus subtilis ssp. shriramensis (MTCC-5674)
Чистую колонию Bacillus subtilis ssp. shriramensis (MTCC-5674) (фиг. 20-1) инокулировали в 10 мл бульона LB и инкубировали при 30°С в течение 24 час при 180 об/мин. Для получения состава биологической защиты 1 мл свежей культуры инокулировали в 100 мл бульона LB и инкубировали при 30°С в течение 24 час при 180 об/мин. Рост культуры отслеживали при периодическом измерении поглощения культуры при 625 нм. Бактериальные клетки собирали центрифугированием и промывали стерильным фосфатным буфером при центрифугировании при 5500 об/мин в течение 10 мин при 4°С. Затем клетки суспендировали в 5 мл стерильного фосфатного буфера. Эту концентрированную суспензию использовали для получения составов биологической защиты.
6.1.1.2 Получение суспензионной культуры Penicillium oxalicum (NFCCI-1997) (грибкового патогена)
Чистую колонию Penicillium oxalicum (NFCCI-1997) (фиг. 20-2) высевали на чашку PDA и инкубировали при 28°С до образования спор. Петлю, заполненную спорами грибка, инокулировали в 100 мл PDB и инкубировали при 28°С в течение 7 дней при 180 об/мин. Водную часть культуры, содержащей споры грибка, собирали в 50 мл полипропиленовые пробирки. Споры промывали стерильным фосфатным буфером с помощью центрифугирования при 8000 об/мин в течение 10 мин при 4°С. Споры суспендировали в необходимом объеме стерильного фосфатного буфера для получения КОЕ 6×104 мл-1.
6.1.2 Зараженность почвы Penicillium oxalicum (NFCCI-1997) (грибковым патогеном)
Для поддержания адекватной нагрузки спорами грибка почвенной среды 50 мл суспензией спор грибка (6×104 КОЕ/мл) смешивали с 1 кг автоклавированной традиционной почвой и инкубировали в течение 10 дней при 28°С. Традиционную почву, колонизированную грибком, равномерно смешивали с почвой в соотношении 1:1 и заполняли 96-чашечные лотки.
6.1.3 Получение состава Bacillus subtilis ssp. shriramensis (MTCC-5674) для биологической защиты от заболеваний растений, передающихся через почву
Материал
a. КМЦ (карбоксиметилцеллюлоза)
b. Сахароза
c. Красный полимер (без фунгицида)
d. Клеточная суспензия Bacillus subtilis ssp. shriramensis (MTCC-5674) (агент биологической защиты)
e. Карбендазим (коммерческий фунгицид)
Для оценки эффективной концентрации клеток Bacillus subtilis ssp. shriramensis (MTCC-5674), которая может подавлять рост и патогенность P. oxalicum (NFCCI-1997) на прорастающих зернах кукурузы, разработано четыре различных состава (подробности приведены в таблице ниже). Составы, содержащие только агент биологической защиты, только коммерческий фунгицид, и один состав без агента биологической защиты или фунгицида использовали в качестве контролей. Все составы содержат связующий материал - КМЦ (карбоксиметилцеллюлозу), источник углерода (сахарозу) и красный полимер (без фунгицида).
1. Контроль-1 (Состав без грибкового патогена и агента биологической защиты)
Этот состав состоит из 1% КМЦ, 2% сахарозы и красного полимера. В этом составе нет агента биологической защиты, агентов, вызывающих заболевание, и фунгицида. Семена, обработанные этим составом, использовали в качестве контрольных семян.
Состав
|
2. Контроль-2 (состав с грибковым патогеном, но без агента биологической защиты)
Этот состав состоит из 1% КМЦ, 2% сахарозы и красного полимера. Он не содержит агента биологической защиты/коммерческого фунгицида, но семена, обработанные таким составом, высеяны в почву с инокулированным грибком P. oxalicum (NFCCI-1997). Поскольку нет никакой биологической или химической защиты вокруг семян, грибок растет обильно, заражает семена, и у рассады развивается заболевание. Семена, обработанные этим составом, используются в качестве контролей с заболеванием.
Состав
|
Контроль-3 (состав с коммерческим фунгицидом «карбендазимом WP50»)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и коммерческого фунгицида карбендазима WP50 (торговое название Бавистин), который использовали в концентрации 500 мкг/мл (Mohiddin et al., 2013). Этот состав использовали для сравнения эффективности как агента биологической защиты, так и коммерческого фунгицида в отношении подавления роста грибка в непосредственной близости от прорастающих семян.
Состав
|
4а. Состав с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×104 КОЕ)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×104 КОЕ/мл. Этот состав имеет минимальное количество клеток Bacillus subtilis ssp. shriramensis (MTCC-5674).
Состав
|
4b. Состав с клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×105 КОЕ)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×105 КОЕ/мл.
Состав
|
4c. Состав с клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×106 КОЕ)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×106 КОЕ/мл.
Состав
|
4d. Состав с клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×107 КОЕ)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×107 КОЕ/мл. Этот состав имеет максимальное количество клеток Bacillus subtilis ssp. shriramensis (MTCC-5674).
Состав
|
5. Состав только с клетками Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×107 КОЕ)
Этот состав состоит из 1% КМЦ, 2% сахарозы, красного полимера и клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×107 КОЕ/мл. Этот состав имеет максимальное количество клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) и используется для исследования действия агента биологической защиты на прорастание семян и рост растения.
Состав
|
Таблица 4. Экспериментальный план в табличной форме
|
*1 (Контроль-1) - Состав без грибкового патогена и противогрибкового агента; *2 (Контроль-2) - состав с грибковым патогеном, но без агента биологической защиты; *3 (Контроль-3) - состав с коммерческим фунгицидом «карбендазимом WP50»; *4a - cостав с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×104 КОЕ); *4b - cостав с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×105 КОЕ); *4c- Состав с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×106 КОЕ); *4d- cостав с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×107 КОЕ); и *5- Состав только с Bacillus subtilis ssp. shriramensis (MTCC-5674) (5×104 КОЕ).
Покрытие семян
Составами биологической защиты в соответствии с композициями, приведенными выше, покрывают зерна кукурузы (фиг. 21). Двадцать зерен кукурузы в трехкратном повторе (всего 60 зерен) для каждой обработки стерилизовали с поверхности 0,1% HgCl2 в течение 10 мин и промывали 95% этанолом и каждый раз промывали стерильной водой в течение 10 минут. Сухие семена покрывали 171 мкл/60 семян различными составами и высушивали на воздухе в течение 2 час.
Посев семян
Все обработанные семена сажали в 96-чашечные лотки в трех повторах на обработку. Все лотки содержались в теплице и поддерживались при контролируемых условиях. Начиная от прорастания семян и далее, лотки контролировались до 5 недель.
Регистрация данных
Процент прорастания
Процент прорастания всех семян после обработки регистрировали через 1 неделю после посева семян.
Случаи заболевания
Случаи заболевания регистрировали как процент через 4 недели после посева семян. Формула, используемая для регистрации случаев заболевания (Hoffman et al., 2002), выглядит следующим образом:

Результаты
Прорастание семян и выживание рассады
Оптимальное прорастание семян, т.е., 93,33%, 96,66%, 100,00%, 100,00%, 100,00% и 100,00% было зафиксировано в семенах, обработанных составами - 3 (контроль-3), 4с, 1 (контроль-1), 4b, 4d и 5, соответственно, затем 83,33% 33,33% в семенах, обработанных составами - 4a и 2 (контроль-2). Показатель выживаемости рассады через 4 недели после посева регистрировали как 100,00% в семенах, обработанных всеми составами, указанными выше, за исключением семян, обработанных композицией-3 (которая содержала коммерческий фунгицид), это ясно указывает на то, что коммерческий фунгицид «карбендазим WP50», хотя он был эффективным в подавлении роста грибка, но не был 100,00% эффективным. Составы, содержащие различные концентрации (кроме состава 4a-, который имел наименьшее количество клеток) клеток Bacillus subtilis ssp. shriramensis (MTCC-5674), оказались 100,00% эффективными в защите семян от P. oxalicum (NFCCI-1997), присутствующего в почве.
Снижение скорости прорастания семян, обработанных составом - 4а (составом с наименьшей концентрацией бактериальных клеток, 50000 клеток/мл носителя), ясно указывает на то, что требуется базальная доза бактериальных клеток для придания защиты прорастающим семенам от P. oxalicum (NFCCI-1997), присутствующего в почве. Таким образом, состав-4b, который имеет концентрацию бактерий 5×105 КОЕ/мл (0,5 миллиона клеток/мл), придает хорошую защиту от P. oxalicum (NFCCI-1997) и дает 100% прорастание семян и показатель выживаемости всходов, такой же, как у контрольных семян.
Таблица 5. Определение эффективной концентрации (КОЕ/г носителя) клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) для подавления роста и патогенности P. oxalicum (NFCCI-1997).
|
*1- Зерна кукурузы+красный полимер+КМЦ+сахароза; *2- зерна кукурузы+красный полимер+КМЦ+сахароза+P. oxalicum (NFCCI-1997); *3- зерна кукурузы+красный полимер+КМЦ+сахароза+P. oxalicum (NFCCI-1997)+карбендазим; с *4а по 4d - зерна кукурузы+красный полимер+КМЦ+сахароза+P. oxalicum (NFCCI-1997)+разные концентрации клеток Bacillus subtilis ssp. shriramensis (MTCC-5674); *5- зерна кукурузы+красный полимер+КМЦ+сахароза+Bacillus subtilis ssp. shriramensis (MTCC-5674).
Случаи заболевания
Результаты исследования показали, что существуют значительные различия между обработками. Семена, обработанные составами 1, 4b, 4c, 4d и 5, не демонстрировали каких-либо симптомов заболевания и характеризовались здоровым ростом, сходным с контрольной рассадой, указывая на то, что агент биологической защиты Bacillus subtilis ssp. shriramensis (MTCC-5674), присутствующий в составах, существенно подавляет рост и патогенность грибка P. oxalicum (NFCCI-1997) и, таким образом, защищает семена от заражения грибком. Семена, обработанные с составом-3 (который содержит коммерческий фунгицид карбендазим 50WP), продемонстрировали уровень заболеваемости 3,57%, указывая на то, что хотя коммерческий фунгицид эффективен в отношении подавления роста грибка, но не так хорошо действует как агент биологической защиты, используемый в этом исследовании.
Таблица 6. Процент случаев заболевания рассады кукурузы, обработанной различными составами.
|
Заболеваемость 82% и 100% зарегистрирована для семян, обработанных составами 4а и 2, соответственно. Результаты показывают, что плотность клеток Bacillus subtilis ssp. shriramensis (MTCC-5674), присутствующих в составе 4а, не эффективна в подавлении роста грибка и, следовательно, прорастающие семена инфицируются грибком и погибают через 2 недели прорастания. Как и ожидалось, семена, обработанные составом 2, который не содержит ни агента биологической защиты, ни коммерческого фунгицида, продемонстрировали 100% случаев заболевания, указывая на то, что грибок инфицировал прорастающие семена и уничтожал рассаду в течение 2 недель прорастания.
Заключение
Приведенные выше результаты ясно показывают, что Bacillus subtilis ssp. shriramensis (MTCC-5674) в концентрации 5×105 КОЕ/мл (состав-4b) является эффективным в подавлении роста грибкового патогена и предоставляет 100% защиту прорастающей рассаде кукурузы. Следовательно, агент биологической защиты может быть с успехом использован для покрытия семян для эффективного контроля над находящимся в почве патогенным грибком P. oxalicum (NFCCI-1997).
Тестирование эффективности состава клеток Bacillus subtilis ssp. shriramensis (MTCC-5674) в отношении стимуляции роста и урожайности растений
Материалы и методы
Материалы
1. Семена кукурузы, томатов и баклажанов, обработанные составом, как указано в 6.1.3 (4b).
2. Контрольные семена кукурузы, томатов и баклажанов.
Методы
Покрытие семян
Семена кукурузы, томатов и баклажанов обрабатывали составом, как указано в 6.1.3 (4b), и сушили на воздухе.
Посев семян
Обработанные и необработанные (контрольные) семена кукурузы, томатов и баклажанов, каждые в трех повторах, и каждая повторность включает 23 семени, высевали в поле площадью 4 метра. Поддерживались стандартные измерения расстояний, такие как 20 см от растения к растению и 60 см от ряда к ряду. Следовали соответствующим методам агрономии для выращивания этих культур до созревания.
Результаты
Наблюдалось значительное увеличение показателей роста и урожайности растений в полевых условиях. Семена, покрытые составом, содержащим клетки Bacillus subtilis ssp. shriramensis (MTCC-5674), повышают урожайность кукурузы, баклажанов и томатов на 17,60, 37,15 и 1,58%, соответственно (таблица 7). Растения кукурузы, баклажанов и томатов продемонстрировали более высокие темпы роста, развития и накопления биомассы (репрезентативная картина различий обработанной и необработанной кукурузы приведена на фиг. 25). Более ранние сообщения о стимуляторах роста растений также доказали, что состав, содержащий Bacillus subtilis, усиливает рост растений и индуцирует системную устойчивость, защищающую от заболеваний, продуцируя 60 различных типов вторичных метаболитов (Compant et al., 2005 и Mohan Kumar et al., 2015).
Таблица 7. Влияние состава, включающего клетки Bacillus subtilis ssp. shriramensis (MTCC-5674), на урожайность кукурузы, помидоров и баклажанов.
|
Пример 7
7.1 Скрининг эффективности противогрибкового/противомикробного агента в отношении ингибирования роста патогенных грибков человека
Ряд штаммов грибков, вызывающих заболевания у человека, выделяли у людей, страдающих различными кожными и легочными инфекциями. Противогрибковую и/или противомикробную активность тестировали против всех выделенных патогенных грибков человека.
Материалы и методы
Материалы
1. Penicillium ssp.
2. Aspergillus flavus
3. Aspergillus niger
4. Aspergillus nidulans
5. Чашки PDA
6. Противогрибковый/противомикробный агент, выделенный из Bacillus subtilis ssp. shriramensis (MTCC-5674)
Метод
Аликвоту 500 мкл культурального фильтрата, содержащего противомикробный и/или противогрибковый агент, добавляли в лунки, сделанные в агаре PDA, и петлю, заполненную тестируемыми грибками, инокулировали в другой угол соответствующих чашек, помеченных соответствующим грибком, и инкубировали при 28°С до момента выявления роста грибного мицелия поблизости лунки, содержащей фильтрат культуры.
Ингибирующую активность фильтрата против целевого грибка регистрировали в миллиметрах как ингибирующую зону, образованную вокруг лунки.
Результат
Ряд штаммов грибков, вызывающих заболевания у человека, выделяли у людей, страдающих различными кожными и легочными инфекциями, тестировали методом анализа противомикробной и/или противогрибковой активности, и все они продемонстрировали полное ингибирование роста в присутствии культурального фильтрата Bacillus subtilis ssp. shriramensis (MTCC-5674) (фиг. 24).
Заключение
Из наблюдений заключается, что противогрибковый/противомикробный агент, выделенный из Bacillus subtilis ssp. shriramensis (MTCC-5674), может быть использован также в фармацевтических методах применения.
Ссылки
1. Compant, S., Duffy, B., Nowak, J., Clement, C. and Barka, E.A. (2005). Use of plants growth promoting bacteria for biocontrol of plant diseases: Principles, Mechanisms of action, and future prospects. Appl. Environ. Microbiol. 71:4951-4959. Sci. World J., Vol 2012, pp. 001-012.
2. Hoffmann, W.A. and Poorter, H. 2002. Avoiding Bias in Calculations of Relative Growth Rate. Ann. Bot., Vol.90 (1), pp. 37-42.
3. Li, J. Yang, Q. Zhao, L-H, Zhang, S.M., Wang, Y.X. Xiao-yu and Zhao, X.Y. 2009. Purification and characterization of a novel antifungal protein from Bacillus subtilis strain B29. J. Zhejiang Univ. Sci. B.,Vol.10 (4) pp. 264-272.
4. Malusá, E. Sas-Paszt, L. and Ciesielska, J. 2012. Technologies for Beneficial Microorganisms Inocula Used as Biofertilizers.
Mena-Violante, H.G. and Olalde-Portugal, V. 2007. Alteration of tomato fruit quality by root inoculation with plant growth-promoting rhizobacteria (PGPR): Bacillus subtilis BEB-13bs. Sci. Hort.,Vol.1 (113), pp. 103-106.
6. Mohan Kumar, S.P., Chowdappa, P. and Krishna, V. (2015). Development of seed coating formulation using consortium of Bacillus subtilis OTPB1 and Trichoderma harzianum OTPB3 for plant growth promotion and induction of systemic resistance in field and horticultural crops. Indian Phytopath. 68 (1):25-31.
7. Mohiddin, F. A. and Khan, M. R. 2013. Tolerance of fungal and bacterial bio-control agents to six pesticides commonly used in the control of soil borne plant pathogens. Global J. Pests, Dis. Crop Prot., Vol. 1 (1), pp. 001-004.
Родственные патенты
1. Новый штамм Bacillus для контроля над болезнями растений и блошкой длинноусой. (EP981540A1).
2. Штамм Bacillus subtilis для сельскохозяйственного применения. (WO2009031874A1).
3. Противогрибковая Bacillus subtilis и содержащий ее порошок, смоченный микроорганизмом (KR2011075132A).
Приложение 1
Состав используемых культуральных сред
Примечание: Общий метод получения сред представлен ниже. Составы всех сред, представленные ниже, даны на объем 100 мл. Композиции изменяются в зависимости от требуемого количества.
(I) Получение бульона T3 (рН - 6,8)
Состав среды T3
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Контейнер со средой автоклавировали при 121°С в течение 15 мин.
(II) Получение чашек агара T3 (рН - 6,8)
Состав среды T3
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Стеклянную колбу со средой автоклавировали при 121°С в течение 15 мин. После автоклавирования среду заливали в стерильные чашки Петри.
(III) Получение бульона LB (рН - 7,0)
Состав среды LB
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Контейнер со средой автоклавировали при 121°С в течение 15 мин.
(IV) Получение чашек с агаром LB (рН - 7,0)
Состав среды LB
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Стеклянную колбу со средой автоклавировали при 121°С в течение 15 мин. После автоклавирования среду заливали в стерильные чашки Петри.
(V) Получение бульона PDB (рН - 6,0)
Состав среды PDB
|
Метод
Порошок картофеля (2,0 г) взвешивали и помещали в 250 мл стеклянную колбу, содержащую 50 мл дистиллированной воды, и кипятили в течение 5 мин. Кипящую картофельную воду фильтровали с использованием муслиновой ткани. Фильтрат собирали в чистую 250 мл стеклянную колбу и в нее добавляли 2,0 г декстрозы. После доведения суммарного объема до 100 мл колбу со средой автоклавировали при 121°С в течение 15 мин.
(VI) Получение чашек с агаром PDB (рН - 6,0)
Состав среды PDB
|
Метод
Порошок картофеля (2,0 г) взвешивали и помещали в 250 мл стеклянную колбу, содержащую 50 мл дистиллированной воды, и кипятили в течение 5 мин. Кипящую картофельную воду фильтровали с использованием муслиновой ткани. Фильтрат собирали в чистую 250 мл стеклянную колбу и в нее добавляли 2,0 г декстрозы и 2,0 г агара. После доведения суммарного объема до 100 мл колбу со средой автоклавировали при 121°С в течение 15 мин. Расплавленную PDA вливали в стерильные чашки Петри.
(VII) Получение базальной среды OF Hugh и Leifson (OFBM) (pH - 7,1)
Состав среды OFBM
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Стеклянную колбу со средой автоклавировали при 121°С в течение 15 мин. После автоклавирования среду вливали в стерильные культуральные пробирки.
(VI) Получение среды SIM (для тестирования сульфида, индола, подвижности) (рН - 7,3)
Состав среды SIM
|
Метод
Все компоненты среды взвешивали и помещали в стеклянную колбу и растворяли в дистиллированной воде. Стеклянную колбу со средой автоклавировали при 121°С в течение 15 мин. После автоклавирования среду в расплавленном состоянии вливали в стерильные культуральные пробирки.
Приложение II
Получение фосфатного буфера
|
Метод
Обе фосфатные соли помещали в стеклянный стакан, к солям добавляли 50 мл дистиллированной воды и перемешивали на магнитной мешалке с помощью магнитного бруска. После проверки полного растворения фосфатных солей раствор доводили до 100 мл дистиллированной водой.
Приложение III
Носители и другие агенты, используемые в эксперименте
|
Сокращения
|