СТАБИЛЬНЫЕ БЕЛКОВЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ МОЛЯРНЫЙ ИЗБЫТОК СОРБИТОЛА
Вид РИД
Изобретение
Область изобретения
Предмет данного изобретения относится к белковым композициям, подходящим для введения субъекту, которые являются стабильными и содержат определенный молярный избыток сорбитола и полиэтиленгликоля в определенном количестве. Способ получения композиции и фармацевтический набор также включены в объем настоящего изобретения.
Предшествующий уровень техники
Белки представляют собой сложные молекулы с определенной первичной, вторичной, третичной и, в некоторых случаях, четвертичной структурой, все из которых играют определенную роль в придании специфической биологической функции. Различные белки, в частности антитела, доступны для фармацевтических применений. Однако эти большие, сложные молекулы более трудно включать в композиции для введения субъекту, чем традиционные органические и неорганические лекарства. Структурная сложность биологических лекарственных средств, таких как белки, делает их восприимчивыми к различным процессам, которые приводят к структурной и функциональной нестабильности, а также к потере безопасности. Для того, чтобы белок оставался биологически активным, композиция должна сохранять целостность конформации по меньшей мере основной аминокислотной последовательности белка, в то же время защищая множество функциональных групп белка от деградации. Что касается этих процессов дестабилизации или путей деградации, белок может подвергаться различным ковалентным и нековалентным реакциям или модификациям в растворе.
Пути деградации белков могут включать химическую нестабильность (т.е. любой процесс, который включает в себя модификацию белка путем образования связи или расщепления, приводящий к получению нового химического вещества) или физическую нестабильность (т.е. изменения структуры белка высшего порядка). Химическая нестабильность может возникнуть в результате дезаминирования, рацемизации, гидролиза, окисления, бета-элиминации или дисульфидного обмена. Физическая нестабильность может происходить, например, из-за денатурации, агрегации, осаждения или адсорбции. Три наиболее распространенные пути деградации белков представляют собой агрегацию, деамидирование и окисление.
Белковые лекарства чувствительны к физическому процессу деградации необратимой агрегации. Агрегация белков представляет особый интерес в производстве полипептидов, поскольку она часто приводит к уменьшению биологической активности, которая влияет на активность лекарственных средств, а также может вызвать серьезные иммунологические или антигенные реакции у пациентов. Химическая деградация белкового терапевтического средства, в том числе деградация химической структуры путем, например, химической модификации, также играет роль в увеличении его иммуногенного потенциала.
Долгосрочная стабильность терапевтического белка является особенно полезным критерием для безопасных, последовательных и эффективных методов лечения. Потеря функциональности терапевтического средства в препарате уменьшает его эффективную концентрацию для конкретного применения. Аналогичным образом, нежелательные изменения терапевтического средства могут влиять на активность и/или безопасность препарата, что приводит к потере эффективности и к риску нежелательных побочных эффектов. Таким образом, стабильные композиции белков требуют, чтобы были сведены к минимуму как физические, так и химические пути деградации.
Многие белковые препараты, предназначенные для применения у человека, требуют присутствия стабилизаторов для предотвращения денатурации, агрегации и других изменений белков перед применением препарата. Эта нестабильность проявляется в образовании растворимых и нерастворимых частиц, и часто возрастает, когда белковый препарат хранится в течение долгого времени и во время транспортировки. Одной из основных целей при разработке лекарственных форм белка является сохранение растворимости, стабильности и биологической активности белка.
Однако использование вспомогательных веществ для одной цели, такой как стабилизация, часто может привести к другим непредвиденным проблемам с совместимостью других компонентов, а также при изготовлении композиции. Нижеследующее раскрытие устраняет этот недостаток уровня техники.
Сущность изобретения
Раскрытый предмет изобретения направлен на стабильную композицию, содержащую белок, определенный молярный избыток сорбитола и полиэтиленгликоль (ПЭГ), способы получения этой композиции и способы введения этой композиции субъектам, нуждающимся в этом. В некоторых вариантах осуществления изобретения белок, присутствующий в композиции, представляет собой антитело, такое как антитело, которое специфически связывается с HER2. В некоторых из этих вариантов осуществления анти-HER2 антитело представляет собой трастузумаб.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к стабильной композиции, содержащей белок (например антитело), сорбитол и полиэтиленгликоль (ПЭГ), где сорбитол и белок присутствуют в молярном соотношении от 550 до 750 молей сорбитола на приблизительно 1 моль белка (например антитела).
В других вариантах осуществления описанный здесь предмет изобретения относится к стабильной восстановленной композиции, содержащей белок (например антитело) в количестве от приблизительно 5 мг/мл до приблизительно 50 мг/мл и разбавитель, где восстановленная композиция получена из лиофилизированной смеси, содержащей белок (например антитело), сорбитол и полиэтиленгликоль (ПЭГ), где в лиофилизированной смеси сорбитол присутствует в молярном соотношении от приблизительно 550 до приблизительно 750 молей сорбитола на 1 моль белка (например антитела) и молярное соотношение ПЭГ и белка (например антитела) составляет приблизительно от 2:1 до 50:1.
В другом варианте осуществления предмет изобретения, раскрытый в данном документе, относится к изделию или фармацевтическому набору, включающему в себя: (а) контейнер, который содержит лиофилизированную смесь, содержащую белок (например антитело), сорбитол, присутствующий в молярном соотношении от приблизительно 550 до приблизительно 750 моль сорбитола на 1 моль белка (например антитела); и полиэтиленгликоль (ПЭГ), присутствующий в молярном соотношении ПЭГ и белка (например антитела) приблизительно от 2:1 до 50:1; и (b) инструкции по восстановлению лиофилизированной смеси разбавителем. Изделие или фармацевтический набор может дополнительно включать второй контейнер, который содержит разбавитель (например, бактериостатическую воду для инъекций (BWFI)).
В другом варианте осуществления предмет изобретения, раскрытый в настоящем документе, также относится к способам введения терапевтически эффективных количеств композиций субъекту для лечения заболевания или расстройства.
В другом варианте осуществления предмет изобретения, раскрытый в данном документе, относится к способам получения лиофилизированных и жидких композиций, описанных в настоящем документе.
Краткое описание прилагаемых графических материалов
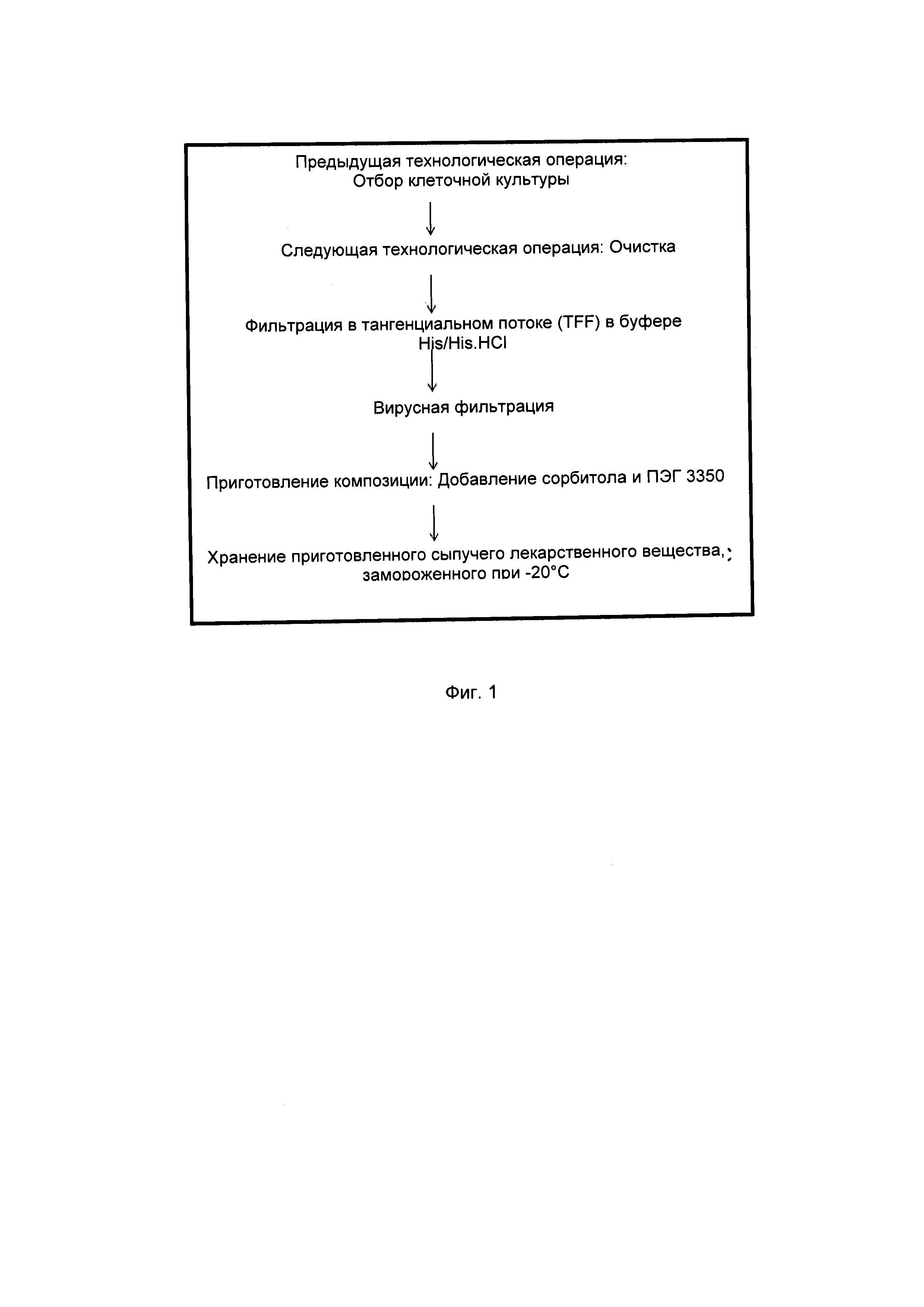
На фиг. 1 изображена блок-схема одного варианта осуществления способов получения фармацевтической композиции, описанной в данном документе.
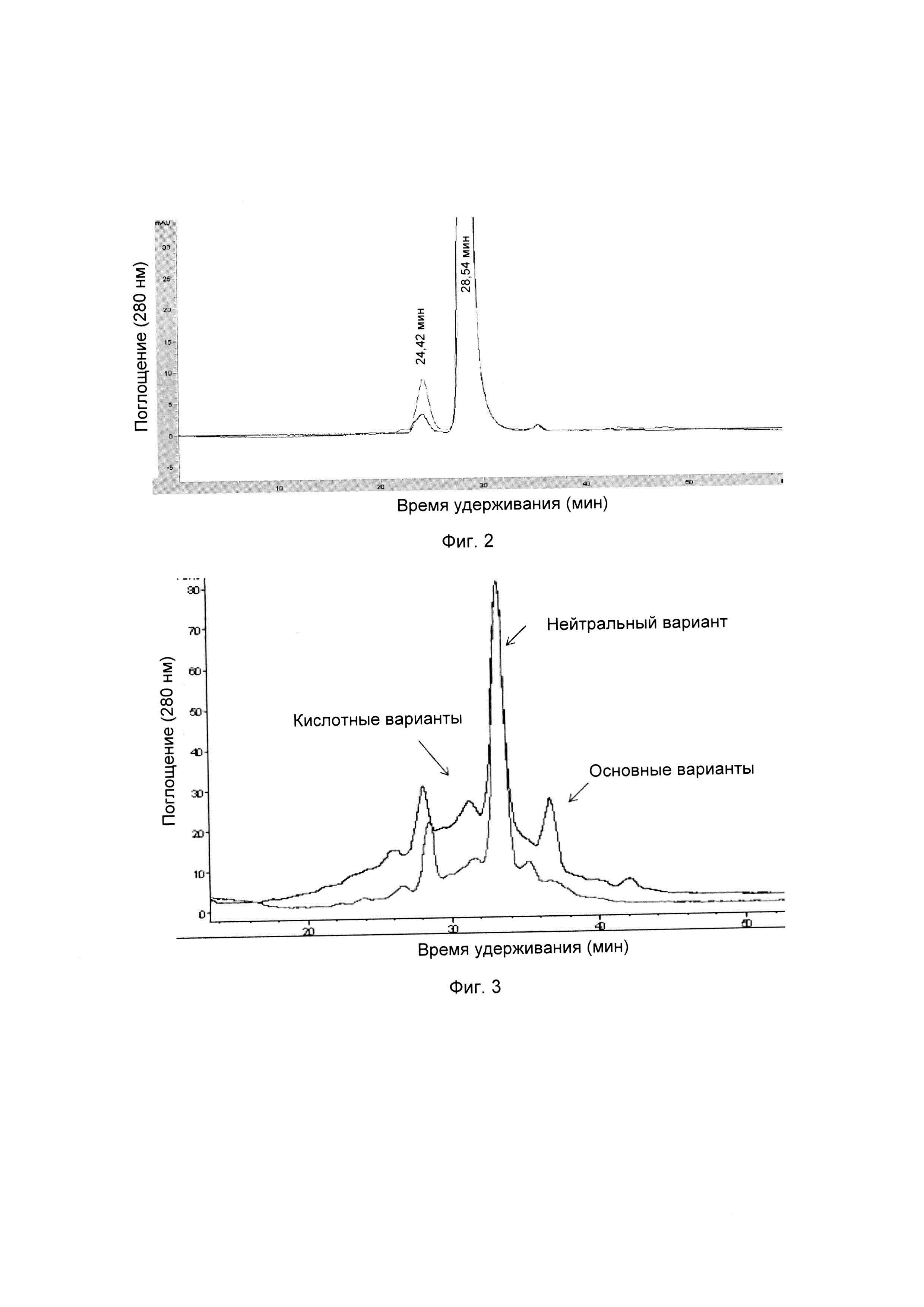
На фиг. 2 представлена хроматограмма гель-проникающей хроматографии (ГПХ) тестируемой композиции 6, как описано в настоящем документе. Фракция мономера элюируется при 28,54 мин, и агрегат элюируется при 24,42 мин. Увеличение содержания агрегата наблюдается в образце, который выдерживали при 40°С в течение 3-х недель (красная линия), по сравнению с образцом при начальном условии (синяя линия).
На фиг. 3 представлена хроматограмма ионообменной хроматографии (ИОХ) тестируемой композиции 6, как описано в настоящем документе. Главный пик нейтрального варианта элюируется при 32-33 мин, кислотный и основный варианты состоят из множества заряженных частиц, которые элюируются начиная с 20 минут и 34 минут, соответственно. Хроматограммы были нормализованы по отношению к главному пику. Увеличение содержания кислотного и основного вариантов наблюдают в образце, который выдерживали при 40°С в течение 3-х недель (верхняя хроматограмма), по сравнению с образцом при начальных условиях (нижняя хроматограмма).
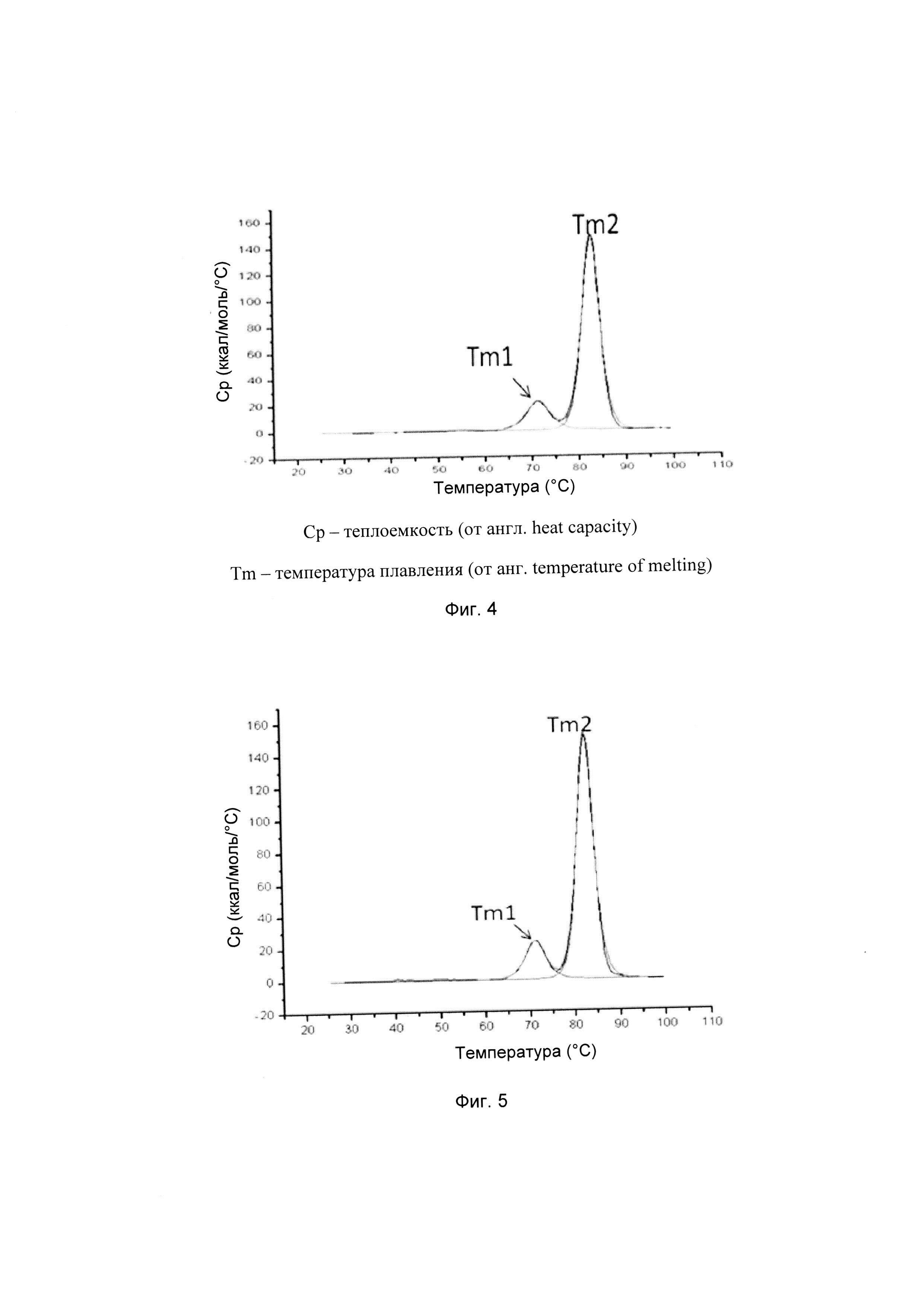
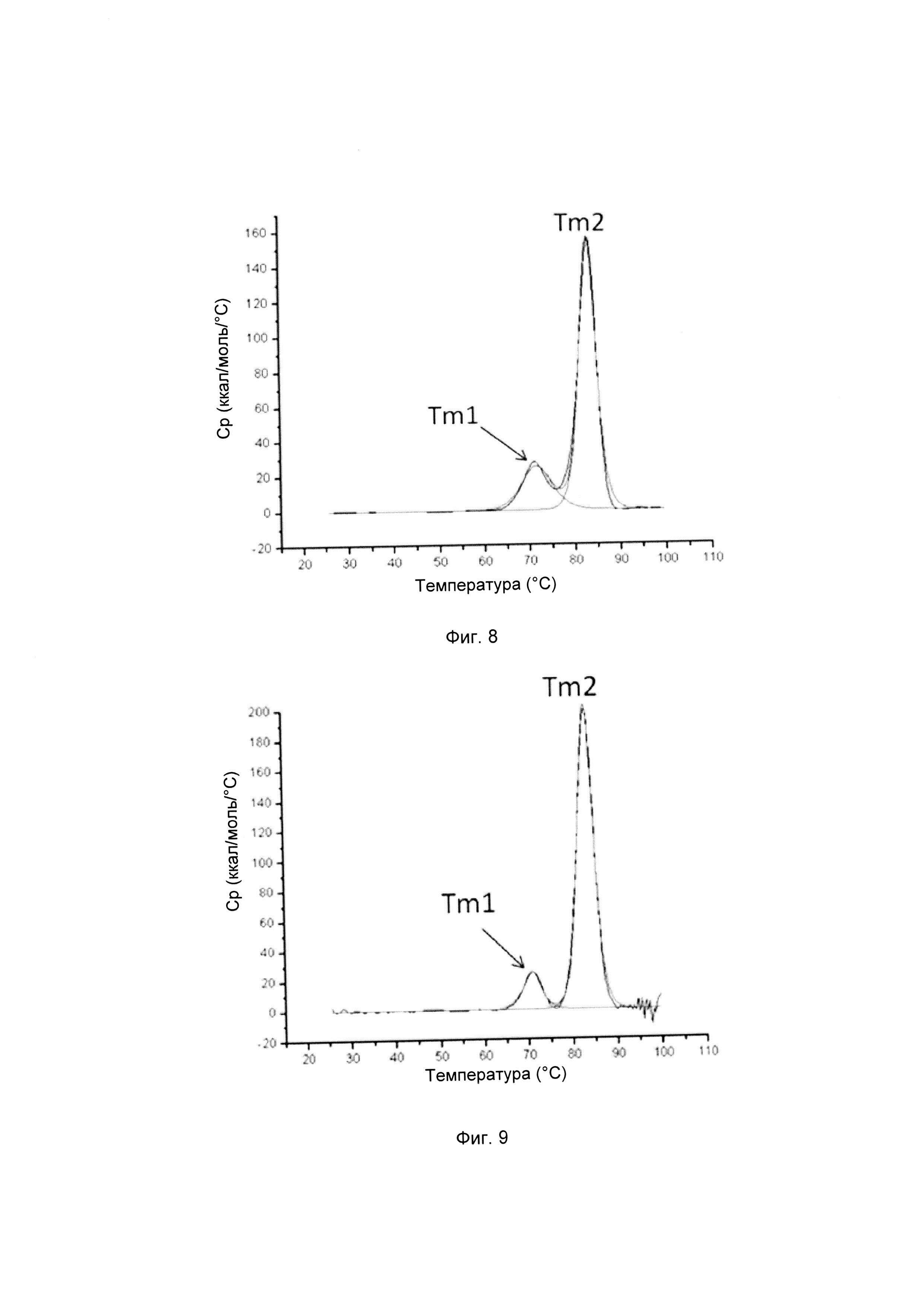
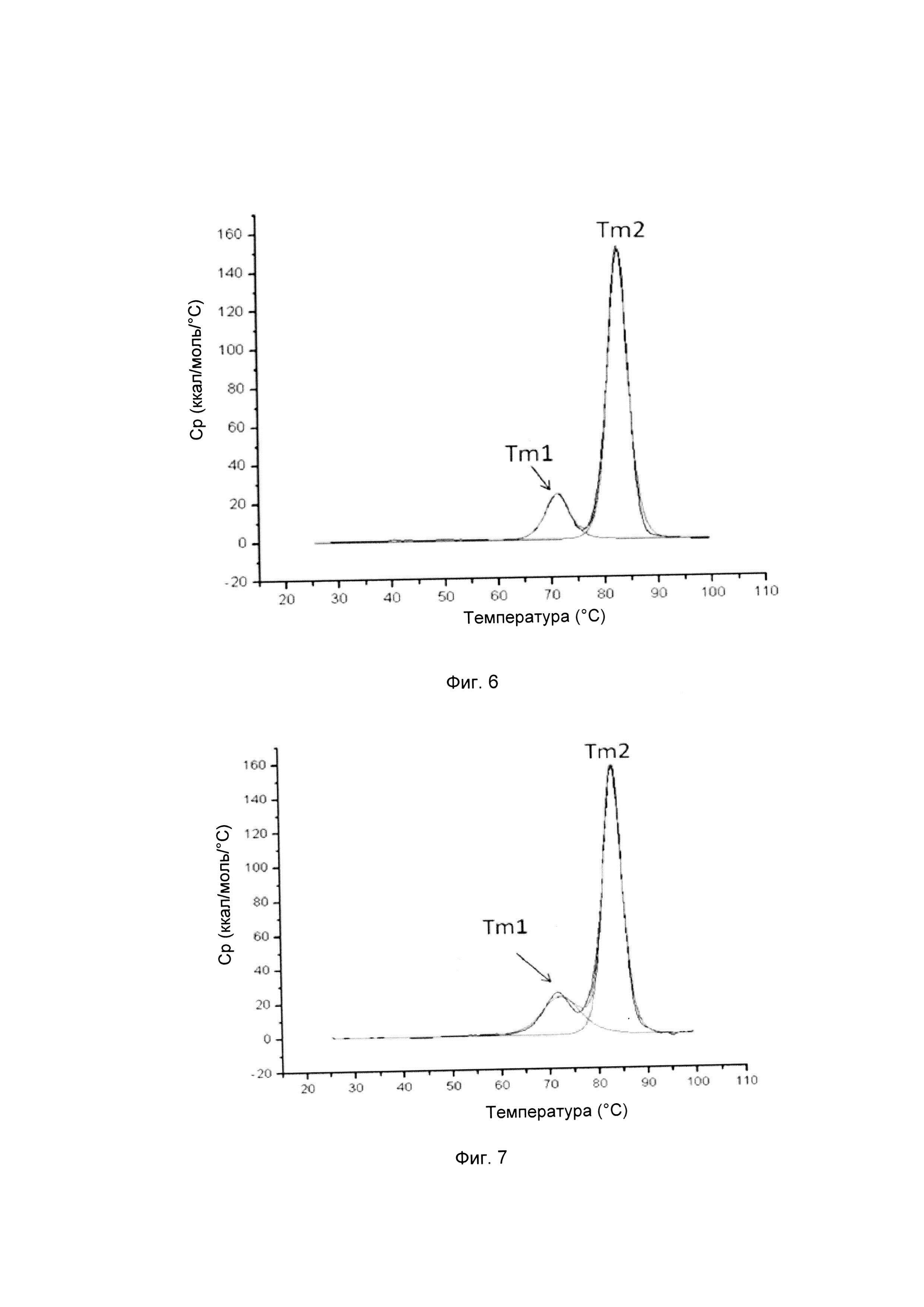
На фиг. 4-9 представлена термическая стабильность композиций, описанных в данном документе, как определено методом ДСК (дифференциальной сканирующей калориметрии).
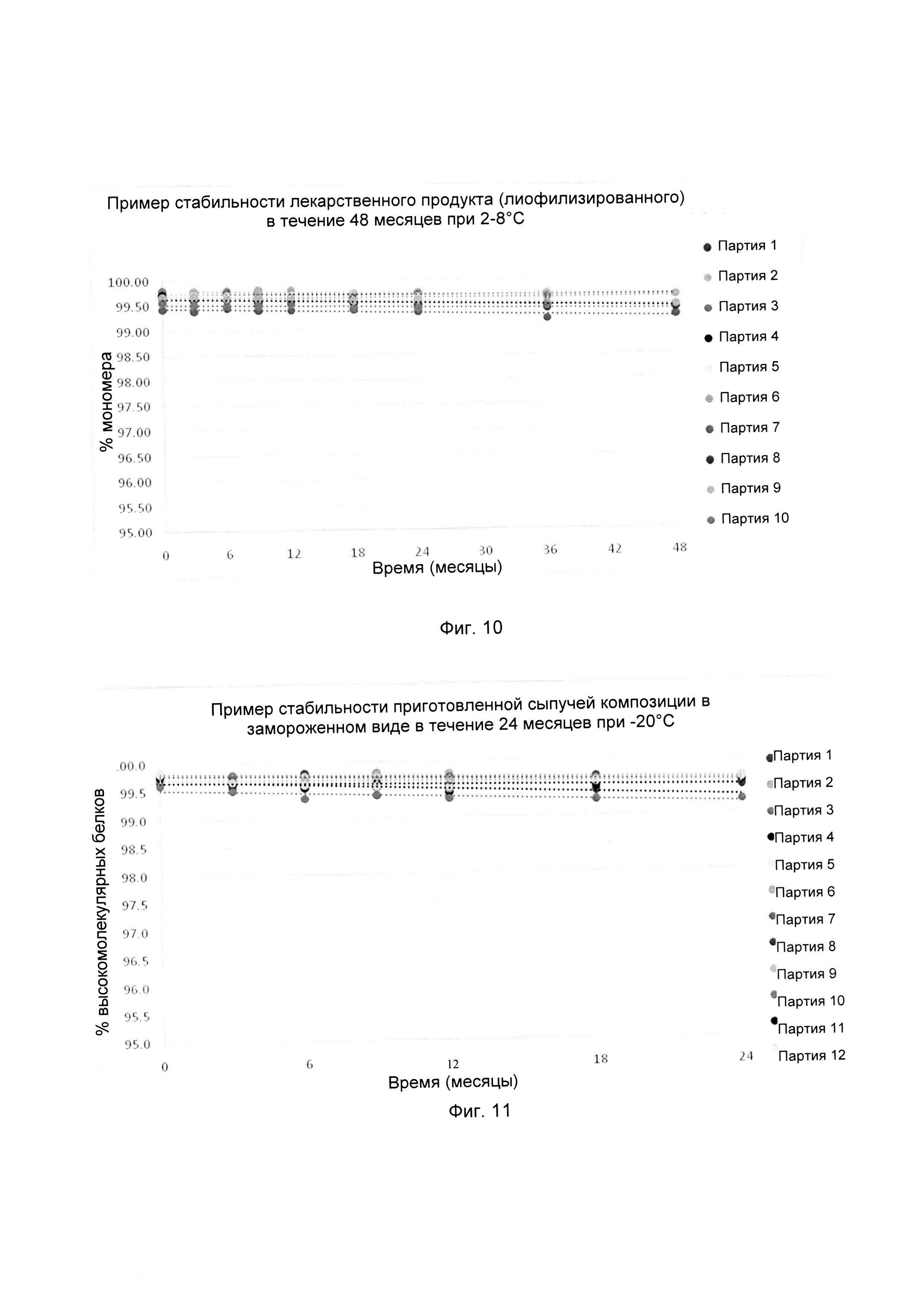
На фиг. 10 показаны сравнительные данные физической стабильности композиции, обозначенной как композиция 27, как описано в данном документе, и затем лиофилизированной, в партиях 1-10, при выдерживании при температуре 2-8°С в течение 4-х лет (48 месяцев).
На фиг. 11 показаны сравнительные данные физической стабильности композиции белкового лекарственного средства, как описано в данном документе, перед лиофилизацией в партиях 1-12, при выдерживании при температуре -20°С в течение 2-х лет (24 месяцев).
Подробное описание изобретения
Раскрытый выше предмет изобретения теперь будет более подробно описан ниже. Тем не менее, многие модификации и другие варианты осуществления раскрытого предмета изобретения, изложенного здесь, будут приходить на ум специалисту в данной области техники, к которой относится описанный предмет, имеющий преимущество принципов, представленных в приведенных выше описаниях. Поэтому следует понимать, что описанный предмет изобретения не должен быть ограничен конкретными раскрытыми вариантами осуществления, и что модификации и другие варианты осуществления предназначены для включения в объем прилагаемой формулы изобретения.
I. Фармацевтические композиции
Стабильные композиции, описанные здесь, содержат белок (например антитело) и определенный молярный избыток сорбитола вместе с полиэтиленгликолем (ПЭГ).
Белки
Используемые в настоящем описании термины "белок" и "полипептид" используются взаимозаменяемо и предполагается, что они охватывают "полипептид" в единственном числе, а также "полипептиды" во множественном числе, и относятся к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термины "белок" и "полипептид" относятся к любой цепи или цепям из двух или более аминокислот, и не относятся к какой-либо конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, цепь аминокислот или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "белка". Термины "белок" и "полипептид" также предназначены для обозначения продуктов посттрансляционных модификаций белка, в том числе, без ограничения, продуктов гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирующими группами и протеолитического расщепления. Полипептид может быть получен из природного биологического источника или получен с использованием рекомбинантной технологии, но не обязательно транслирован из указанной последовательности нуклеиновой кислоты. Он может быть получен любым способом, в том числе путем химического синтеза. Белок может включать природные аминокислоты, или одну или более неклассических аминокислот.
Полипептид может иметь размер приблизительно 3 или более, 5 или более, 10 или более, 20 или более, 25 или более, 50 или более, 75 или более, 100 или более, 200 или более, 500 или более, 1000 или более, или 2000 или более аминокислот. Полипептиды могут иметь определенную трехмерную структуру, хотя они не обязательно имеют такую структуру.
В некоторых вариантах осуществления изобретения белок является нестабильным. Например, белок склонен к агрегации, деамидированию (например Asn-деамидированию), окислению (например, Met-окислению), изомеризации (например Asp-изомеризации). В некоторых вариантах осуществления изобретения белок склонен к деамидированию.
Неограничивающий пример белка, который может быть включен в композицию, как описано в настоящем документе, представляет собой антитело. В некоторых из этих вариантов осуществления антитело представляет собой полноразмерное антитело. В некоторых вариантах осуществления изобретения антитело представляет собой моноклональное антитело. Моноклональное антитело может быть человеческим, гуманизированным или химерным. В некоторых из этих вариантов осуществления моноклональное антитело представляет собой антитело IgG1.
Термины "антитело" и "иммуноглобулин" используются в настоящем описании взаимозаменяемо и относятся к различным широким классам полипептидов, которые могут быть дифференцированы биохимически. Общая структура антител хорошо известна специалистам в данной области. См, например, Harlow et al. (1988) Antibodies: A Laboratory Manual (2nd ed.; Cold Spring Harbor Laboratory Press). Термины "антитело" и "антитела" в широком смысле охватывают природные формы антител и рекомбинантные антитела, такие как одноцепочечные антитела, химерные и гуманизированные антитела, и мультиспецифичные антитела, а также фрагменты и производные любого из вышеперечисленного, причем эти фрагменты и производные имеют по меньшей мере один антигенный сайт связывания. Производные антител могут содержать белок или химический фрагмент, конъюгированный с антителом. Термин "антитело" используют в самом широком смысле, и он охватывает полные антитела (например, поликлональные, моноклональные, мультиспецифичные, человеческие, гуманизированные, приматизированные, химерные антитела), фрагменты антител, которые могут связываться с антигеном (например, Fab', F(ab')2, Fv, одноцепочечные антитела, диатела), и рекомбинантные пептиды, содержащие вышеперечисленное.
В некоторых вариантах осуществления антитела, содержащиеся в композициях, описанных здесь, представляют собой моноклональные антитела. Термин "моноклональное антитело", используемый в данном описании, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельных антител, составляющих популяцию, которые являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Этот термин не ограничивается в отношении вида или источника антитела. Этот термин охватывает целые иммуноглобулины, а также фрагменты, такие как Fab, F(ab')2, Fv и другие, которые сохраняют функцию антитела связывания с антигеном. Моноклональные антитела являются высоко специфичными, направленными против одного сайта антигена. Кроме того, в отличие от традиционных препаратов (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональный" указывает на характер антитела, полученного, по существу, из гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с настоящим изобретением, могут быть получены способом гибридомы, впервые описанным Kohler и соавт. (1975) Nature 256:495, или могут быть получены с помощью методов рекомбинантной ДНК (см, например, патент США 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, Clackson и др. (1991) Nature 352:624-628; Marks et al. (1991) J. Mol. Biol. 222:581-597; и US 5514548.
В некоторых вариантах осуществления изобретения антитело раскрытой композиции представляет собой химерное антитело. Используемый в данном описании термин "химерное антитело" означает любое антитело, в котором иммунореактивная область или сайт получен или дериватизирован из одного (биологического) вида и константная область (которая может быть немодифицированной, частично или полностью модифицированной в соответствии с настоящим изобретением) получена из второго вида. В некоторых вариантах осуществления изобретения целевой участок связывания или сайт будет от источника, отличного от человека (например, от мыши или примата) и константная область будет от человека.
В некоторых из этих вариантов осуществления, где антитело раскрытой композиции представляет собой химерное антитело, химерное антитело представляет собой гуманизированное антитело. "Гуманизированное антитело" представляет собой специфический тип химерного антитела, которое содержит один или более каркасных участков, имеющих, по существу, аминокислотную последовательность иммуноглобулина человека, и один или несколько CDR (участков, определяющих комплементарность), имеющих, по существу, аминокислотную последовательность из нечеловеческого иммуноглобулина. Например, как описано в данном документе, антитело трастузумаб против HER2 представляет собой гуманизированный вариант мышиного 4D5 антитела.
Каркасные участки и CDR гуманизированного антитела не должны точно соответствовать исходным последовательностям. Например, один или более остатков донорских CDR, или консенсусной или зародышевой каркасной последовательности могут быть изменены (например, могут быть мутировавшими) путем замены, вставки или делеции, так что полученный аминокислотный остаток больше не идентичен исходному остатку в соответствующем положении в любой из родительских последовательностей, но антитела, тем не менее, сохраняют функцию связывания со своим антигеном. Такие изменения, как правило, не будут обширными и будут являться консервативными изменениями. Как правило, по меньшей мере 75% гуманизированных остатков антитела будут соответствовать таковым из родительских консенсусных или зародышевых каркасных и донорских CDR последовательностей, чаще по меньшей мере 90% и наиболее часто более 95% или более 98%, или более 99%.
На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые CDR остатки и, возможно, некоторые каркасные остатки заменены остатками из аналогичных участков антител грызунов. Смотрите, например, патенты США 5225539, 5585089, 5693761, 5693762, 5859205.
Смотрите также патент США 6180370 и международную публикацию WO 01/27160, где раскрыты гуманизированные антитела и способы получения гуманизированных антител, имеющих улучшенные сродство к заранее определенному антигену.
В других вариантах осуществления описанные здесь композиции содержат человеческое антитело. Используемый в данном описании термин "человеческие" антитела включает антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или более иммуноглобулинов человека, и которые не экспрессируют эндогенные иммуноглобулины, как описано ниже, и, например, в патенте США 5939598 на имя Kucherlapati с соавт.
Антитела описанных здесь композиций могут быть "мультиспецифичными", например, биспецифичными, триспецифичными или большей мультиспецифичности, а это означает, что они распознают и связываются с двумя или более различных эпитопов, присутствующих на одном или более различных антигенов {например, белков) одновременно. Таким образом, является ли антитело "моноспецифичным" или "мультиспецифичным", например "биспецифичным", относится к количеству различных эпитопов, с которыми взаимодействует связывающий полипептид. Мультиспецифичные антитела могут быть специфичными к различным эпитопам целевого полипептида или могут быть специфичными к целевому полипептиду, а также к гетерологичному эпитопу, такому как гетерологичный полипептид или твердый материал носителя.
Используемый в данном описании термин "валентность" относится к числу потенциальных связывающих доменов, например антигенсвязывающих доменов, присутствующих в антителе. Каждый связывающий домен специфически связывается с одним эпитопом. Когда антитело включает в себя более чем один связывающий домен, каждый связывающий домен может специфически связываться с тем же эпитопом. Антитело с двумя связывающими доменами, которое специфически связывается с тем же эпитопом, называется "двухвалентным моноспецифичным", в то время как антитело с двумя связывающими доменами, которые связываются с различными эпитопами, называется "двухвалентным биспецифичным". Антитела описанных здесь композиций также могут быть биспецифичными и двухвалентными для каждой специфичности (называются "биспецифичными четырехвалентными антителами").
Биспецифичные двухвалентные антитела и способы их получения описаны, например, в патентах США 5731168, 5807706, 5821333 и в опубликованных заявках на патент США 2003/020734 и 2002/0155537, все из которых включены в данное описание посредством ссылки. Биспецифичные четырехвалентные антитела и способы их получения описаны, например, в WO 02/096948 и WO 00/44788, обе из которых включены в данное описание посредством ссылки. См., в целом, публикации РСТ WO 93/17715, WO 92/08802, WO 91/00360, WO 92/05793, Tutt et al. (1991) J. Immunol. 147:60-69, US 4474893, 4714681, 4925648, 5573920, 5601819, Kostelny et al. (1992) J. Immunol. 148:1547-1553.
В некоторых вариантах осуществления изобретения антитело представляет собой природное антитело. «Природные антитела» и «природные иммуноглобулины», также называемые здесь «антителами полной длины», обычно представляют собой гетеротетрамерные гликопротеины приблизительно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь ковалентно связана с тяжелой цепью одной дисульфидной связью с образованием гетеродимера, и гетеротетрамерная молекула образована посредством ковалентных дисульфидных связей между двумя идентичными тяжелыми цепями гетеродимеров. Несмотря на то, что легкие и тяжелые цепи связаны между собой одной дисульфидной связью, количество дисульфидных связей между двумя тяжелыми цепями различается в зависимости от изотипа иммуноглобулина. Каждая тяжелая и легкая цепь также имеет регулярно расположенные внутрицепные дисульфидные мостики. Дисульфидные связи, как правило, соединяют четыре цепи в конфигурацию "Y", причем легкие цепи соединены с тяжелыми цепями, начиная с устья "Y" и продолжаясь через вариабельный участок. В тяжелой цепи последовательности аминокислот проходят от N-конца на разветвленных концах конфигурации Y до С-конца в нижней части каждой цепи.
Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце; причем константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что особые аминокислотные остатки образуют границу раздела между вариабельными доменами легкой и тяжелой цепи.
Термин «вариабельный» относится к тому, что некоторые части вариабельных доменов в значительной степени различаются последовательностями среди антител и используются в связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако вариабельность неравномерно распределена по вариабельным доменам антител. Она сконцентрирована в трех сегментах, называемых участками, определяющими комплементарность (CDR), или гипервариабельными участками в вариабельных доменах как легкой, так и тяжелой цепи. Более высоко консервативные части вариабельных доменов называются каркасными (FR) участками. Вариабельные домены природных тяжелой и легкой цепей содержат по четыре FR участка, в основном принимающих конфигурацию β-листа, соединенные тремя CDR, которые образуют петли, соединяющие структуру β-листа и, в некоторых случаях, образующие часть структуры β-листа. CDR в каждой цепи удерживаются вместе в непосредственной близости посредством FR участков и вносят вклад в образование антигенсвязывающего участка антител при участии CDR из другой цепи. Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной токсичности.
В некоторых вариантах осуществления изобретения белок в рамках описанных здесь композиций представляет собой фрагмент антитела. Например, фрагменты моноклональных антител могут быть включены в фармацевтические композиции, описанные здесь, причем эти фрагменты сохраняют некоторые или все желаемые функции антитела полной длины. Такие фрагменты характеризуются свойствами, аналогичными свойствам соответствующих антител полной длины.
"Фрагменты антитела" содержат часть исходного антитела, которая в некоторых вариантах осуществления является антигенсвязывающим или вариабельным участком исходного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv, димеры, линейные антитела (Zapata et al. (1995) Protein Eng. 8 (10): 1057-1062), молекулы одноцепочечных антител и мультиспецифичные антитела, образованные из фрагментов антител. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых фрагментами "Fab", каждый из которых с одним антигенсвязывающим сайтом, и остаточный фрагмент "Fc", чье название отражает его способность легко кристаллизоваться. Обработка антител пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и все еще способен к связыванию антигена.
Подходящие антигенсвязывающие фрагменты антитела для использования в описанных здесь композициях и способах содержат часть антитела полной длины, как правило, его антигенсвязывающий или вариабельный участок. Примеры фрагментов антител включают в себя, но не ограничиваются ими, фрагменты Fab, F(ab')2 и Fv, и молекулы одноцепочечных антител. Под термином "Fab" подразумевается одновалентный антигенсвязывающий фрагмент иммуноглобулина, который состоит из легкой цепи и части тяжелой цепи. Под термином "F(ab')2" подразумевается двухвалентный антигенсвязывающий фрагмент иммуноглобулина, который содержит легкие цепи и часть обеих тяжелых цепей. Под терминами фрагменты антител "одноцепочечный Fv", или "sFv", или "scFv" подразумеваются фрагменты, содержащие домены VH и VL антитела, причем эти домены присутствуют в одной полипептидной цепи. Смотрите, например, патенты США 4946778, 5260203, 5455030 и 5856456, которые включены в данное описание посредством ссылки. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет sFv образовать желаемую структуру для связывания антигена. Для обзора sFv смотрите Pluckthun (1994) в The Pharmacology of Monoclonal Antibodies, Vol. 113, ed. Rosenburg and Moore (Springer-Verlag, New York), pp. 269-315.
"Fv" представляет собой минимальный фрагмент антитела, который содержит сайт полного распознавания и связывания антигена. В двухцепочечных фрагментах Fv этот участок состоит из димера вариабельного домена с одной тяжелой и одной легкой цепью в тесной нековалентной ассоциации. В одноцепочечных фрагментах Fv вариабельный домен с одной тяжелой и одной легкой цепью может быть ковалентно связан посредством гибкого пептидного линкера таким образом, что легкие и тяжелые цепи могут быть связаны в "димерную" структуру, аналогичную двухцепочечным фрагментам Fv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть CDR обеспечивают специфичность связывания антитела. Однако, даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный сайт связывания.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab отличаются от фрагментов Fab' наличием нескольких остатков на карбокси-конце тяжелой цепи домена СН1, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH является здесь обозначением для Fab', в котором цистеиновый остаток (остатки) константных доменов несет свободную тиольную группу. Фрагменты F(ab')2 антитела первоначально были получены в виде пар фрагментов Fab', которые имеют шарнирные цистеины между ними.
Были разработаны различные методы для получения фрагментов антител. Традиционно эти фрагменты получали в результате протеолитического расщепления интактных антител (см, например, Morimoto et al. (1992) Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al. (1985) Science 229:81). Однако, эти фрагменты могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. В качестве альтернативы, фрагменты Fab'-SH можно непосредственно выделить из E. coli и химически связать с образованием фрагментов F(ab')2 (Carter et al. (1992) Bio/Technology 10:163-167). В соответствии с другим подходом фрагменты F(ab')2 можно выделить непосредственно из культуры рекомбинантных клеток-хозяев. Другие способы получения фрагментов антител будут очевидны специалисту в данной области.
В некоторых вариантах осуществления изобретения антитело раскрытых композиций согласно изобретению специфично или предпочтительно связывается с эпитопом.
Под термином "эпитоп" подразумевают часть молекулы антигена, к которой продуцируется антитело и с которой будет связываться антитело. Эпитопы могут включать линейные аминокислотные остатки (т.е. остатки внутри эпитопа расположены последовательно друг за другом линейно), нелинейные аминокислотные остатки (упоминаемые здесь как "нелинейные эпитопы" или "конформационные эпитопы"; эти эпитопы не расположены последовательно), или как линейные, так и нелинейные аминокислотные остатки. Нелинейные эпитопы или конформационные эпитопы могут также включать в себя аминокислотные остатки, которые вносят вклад в общую конформацию распознавающей структуры антитела, но не обязательно связывают антитело. Как правило, эпитопы представляют собой короткие аминокислотные последовательности, например, длиной около пяти аминокислот.
Систематические приемы для определения эпитопов известны в данной области техники и описаны, например, в патенте США 4708871, который включен в данное описание посредством ссылки во всей его полноте. Если коротко, то в одном из способов набор перекрывающихся олигопептидов, полученных из антигена, можно синтезировать и связать с твердофазной матрицей игл с уникальным олигопептидом на каждой игле. Матрица игл может содержать 96-луночный микротитровальный планшет, позволяющий анализировать все 96 олигопептидов одновременно, например, для связывания с биомаркер-специфичными моноклональными антителами. В качестве альтернативы, для картирования эпитопов в настоящее время коммерчески доступны наборы фаговых пептидных библиотек (New England Biolabs). С помощью этих методов можно определить аффинность связывания для каждого возможного подмножества последовательных аминокислот с целью идентификации эпитопа, который связывает данное антитело. Эпитопы могут быть также идентифицированы на основании предположений, когда для иммунизации животных, из которых получают антитела, используют пептидные последовательности с длиной эпитопа. Конформационные эпитопы могут быть идентифицированы с использованием способов пептидного сканирования и синтетических пептидов (см, например, Liang et al. (2005) Clinical Chemistry 51:1382-1396; Cochran et al. (2004) J. Immunol. Meth. 287:147-158; Teeling et al. (2006) J. Immunol. 177:362-371; Timmerman et al. (2004) Molecular Diversity 8:61-77; Lekcharoensuk et al. (2004) J. Virology 78:8135-8145; и Casadio et al. (2007) BMC Bioinformatics (Supp. 1): S1-6; все из которых включены в данное описание посредством ссылки во всей их полноте).
Под термином "специфически связывается", как правило, подразумевается, что антитело связывается с эпитопом посредством его антигенсвязывающего домена, и что связывание подразумевает некоторую комплементарность между антигенсвязывающим доменом и эпитопом. В соответствии с этим определением говорят, что антитело "специфически связывается" с эпитопом, когда оно связывается с этим эпитопом посредством его антигенсвязывающего домена более легко, чем оно бы связывалось с эпитопом, который является случайным, неродственным. Термин "специфичность" используется здесь, чтобы определить относительное сродство, посредством которого определенное антитело связывается с определенным эпитопом. Например, может считаться, что антитело "А" имеет более высокую специфичность для данного эпитопа, чем антитело "В", или можно сказать, что антитело "А" связывается с эпитопом "С" с более высокой специфичностью, чем с соответствующим эпитопом "D".
Под термином "преимущественно связывается" подразумевается, что антитело специфически связывается с эпитопом более легко, чем оно бы связывалось с эпитопом, который является родственным, подобным, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое "преимущественно связывается" с данным эпитопом будет более вероятно связываться с этим эпитопом, чем с родственным эпитопом, даже если такое антитело может перекрестно взаимодействовать с родственным эпитопом.
В неограничивающем примере можно считать, что антитело преимущественно связывается с первым эпитопом, если оно связывается с указанным первым эпитопом с константой диссоциации (KD), которая меньше, чем KD антитела для второго эпитопа. В другом неограничивающем примере можно считать, что антитело преимущественно связывается с первым антигеном, если оно связывается с первым эпитопом с аффинностью, которая по меньшей мере на один порядок меньше величины KD антитела для второго эпитопа. В другом неограничивающем примере можно считать, что антитело предпочтительно связывается с первым эпитопом, если оно связывается с первым эпитопом с аффинностью, которая по меньшей мере на два порядка меньше величины KD антитела для второго эпитопа.
В другом неограничивающем примере можно считать, что антитело преимущественно связывается с первым эпитопом, если оно связывается с указанным первым эпитопом со скоростью диссоциации (k(off)), которая меньше, чем k(off) антитела для второго эпитопа. В другом неограничивающем примере можно считать, что антитело преимущественно связывается с первым эпитопом, если оно связывается с указанным первым эпитопом с аффинностью, которая по меньшей мере на один порядок меньше величины k(off) антитела для второго эпитопа. В другом неограничивающем примере можно считать, что антитело преимущественно связывается с первым эпитопом, если оно связывается с указанным первым эпитопом с аффинностью, которая по меньшей мере на два порядка меньше величины k(off) для второго эпитопа.
В некоторых вариантах осуществления описанных здесь композиций и способов, антитело является таким, которое конкурентно ингибирует связывание референсного антитела (например, трастузумаба) с эпитопом на антигене-мишени. Говорят, что антитело конкурентно ингибирует связывание референсного антитела с конкретным эпитопом, если оно преимущественно связывается с этим эпитопом в той степени, что оно блокирует, до некоторой степени, связывание референсного антитела с эпитопом. Конкурентное ингибирование может быть определено любым способом, известным в данной области техники, например, конкурентным ИФА (иммуноферментным анализом). Можно сказать, что антитело конкурентно ингибирует связывание референсного антитела (например, трастузумаба) с конкретным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, или по меньшей мере на 50%.
В некоторых вариантах осуществления изобретения, где белок в описанных композициях представляет собой антитело, антитело связывается с его антигеном-мишенью с относительно высокой афинностью. Используемый в настоящем описании термин «афинность» является мерой прочности связывания отдельного эпитопа с CDR молекулы иммуноглобулина. См, например, Harlow et аl. (1988) Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed.), стр. 27-28. Используемый в данном описании термин "авидность" относится к общей стабильности комплекса между популяцией иммуноглобулинов и антигеном, то есть, к функциональной объединенной прочности смеси иммуноглобулинов с антигеном. См, например, Harlow на страницах 29-34. Авидность связана с афинностью отдельных молекул иммуноглобулина в популяции к определенным эпитопам, а также с валентностями иммуноглобулинов и антигена. Например, взаимодействие между двухвалентным моноклональным антителом и антигеном со структурой эпитопа, имеющей высокую повторяемость, такую как полимер, будет взаимодействием высокой авидности.
Антитела описанных здесь композиций и способов демонстрируют практически отсутствие перекрестной реактивности с другими родственными эпитопами.
В качестве не ограничивающего примера, в тех вариантах осуществления, где антитело в композиции представляет собой анти-HER2 антитело, анти-HER2 антитело демонстрирует практически отсутствие перекрестной реактивности с другими членами семейства HER (например, EGFR/HER1, HER3 и HER4). Используемый в данном описании термин "перекрестная реактивность" относится к способности антитела, специфичного для одного антигена, взаимодействовать со вторым антигеном; является мерой родства между двумя различными антигенными веществами. Таким образом, антитело является перекрестно-реактивным, если оно связывается с эпитопом, отличным от того, которое индуцировало его образование. Перекрестно-реактивный эпитоп в общем случае содержит многие из тех же самых комплементарных структурных признаков, как и индуцирующий эпитоп, а в некоторых случаях, может действительно лучше соответствовать, чем оригинал.
Например, некоторые антитела имеют некоторую степень перекрестной реактивности в том, что они связываются с родственными, но не идентичными эпитопами, например, с эпитопами, имеющими идентичность по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55% и по меньшей мере 50% (как рассчитано с использованием способов, известных в данной области техники и описанных здесь) относительно референсного эпитопа. Можно сказать, что антитело практически не имеет перекрестной реактивности, если оно не связывается с эпитопами, имеющими идентичность менее 95%, менее 90%, менее 85%, менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55% и менее 50% (как рассчитано с использованием способов, известных в данной области техники и описанных здесь) относительно референсного эпитопа. Антитело может считаться "высоко специфичным" для определенного эпитопа, если оно не связывается с любым другим аналогом, ортологом или гомологом этого эпитопа.
В некоторых вариантах осуществления изобретения антитело раскрытых композиций является таким антителом, которое направлено на белок, который способствует развитию и/или поддержанию болезненного состояния, и антагонизирует его. В некоторых из этих вариантов осуществления болезнь представляет собой рак и антитело направлено на белок, кодируемый онкогеном. Используемый в данном описании термин "онкоген" относится к гену, который кодирует генный продукт (например, белок), который вносит свой вклад в развитие и/или поддержание рака или трансформированного фенотипа. В некоторых из этих вариантов осуществления изобретения, где антитело в композиции направлено на белок, кодируемый онкогеном, белок-мишень представляет собой рецепторную тирозинкиназу (РТК) фактора роста.
Члены семейства HER рецепторных тирозинкиназ являются важными медиаторами роста, дифференцировки и выживания клеток. Потеря регуляции активации РТК фактора роста часто приводит к ненормальной клеточной пролиферации и онкогенезу. Это семейство рецепторов включает в себя четыре различных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2, Neu или p185neu), HER3 (ErbB3) и HER4 (ERBB4 или tyro2).
В некоторых вариантах осуществления изобретения белок раскрытых композиций представляет собой антитело против HER2 (анти-HER2 антитело). Последовательность гена erb-b2, который кодирует HER2, известна в данной области техники и обнаружена на полосе q21 хромосомы 17. Последовательности белка HER2 также известны в данной области и включают, но не ограничиваются этим, последовательности №№ NP_001005862, NP_004439, ААА75493 или ААА35978 из Банка генов (GenBank), каждая из которых включена в данное описание посредством ссылки. Белок HER2 имеет внеклеточный домен, трансмембранный домен, который включает в себя два повторяющихся кластера, богатых цистеином, и внутриклеточный домен киназы с сайтами автофосфорилирования. В последовательности из 1255 аминокислот изоформы 1 человеческого HER2, которая представлена как SEQ ID NO 11, внеклеточный домен состоит из аминокислотных остатков 23-652, трансмембранный домен включает остатки 653-675, и остатки 676-1255 образуют цитоплазматический домен. Как правило, анти-HER2 антитело направлено на внеклеточный домен HER2.
В некоторых вариантах осуществления настоящего изобретения белок описанных здесь композиций представляет собой моноклональное антитело трастузумаб (Герцептин®) (патент США №5821337, который включен в данное описание посредством ссылки во всей его полноте) или его активный вариант, способный связываться с HER2 и антагонизировать его. Трастузумаб является гуманизированным моноклональным антителом lgG1, содержащим легкую цепь каппа, которое селективно связывается с HER-2. Трастузумаб предотвращает димеризацию рецептора, существенную для внутриклеточной сигнализации, приводящую к ингибированию пролиферации клеток. Это приводит к ингибированию роста опухоли и метастазов. Кроме того, антитело-зависимая клеточно-опосредованная токсичность, а также интернализация и деградация HER2 также имеет место in vivo, тем самым дополнительно уменьшая потенциал пролиферации опухолевых клеток. Трастузумаб одобрен для внутривенного применения в сочетании с несколькими химиотерапевтическими агентами в качестве адъювантной терапии сверхэкспресирующего HER2 рака молочной железы, и метастатического сверхэкспресирующего HER2 рака молочной железы, а также сверхэкспресирующего HER2 метастатического рака желудка и гастроэзофагеального соединения. Следует понимать, что ссылка на трастузумаб должна включать биологически подобную форму трастузумаба. Следует понимать, что ссылка на трастузумаб включает антитело, содержащее или состоящее из аминокислотной последовательности тяжелой цепи и аминокислотной последовательности легкой цепи трастузумаба или его активного варианта.
Таким образом, в некоторых из этих вариантов осуществления, где белок раскрытых композиций включает анти-HER2 антитело, антитело содержит тяжелую цепь, имеющую последовательность, представленную SEQ ID NO 1, и легкую цепь, имеющую последовательность, представленную SEQ ID NO 2, или его активный вариант. Специалисту в данной области техники будет понятно, что константная область тяжелой цепи трастузумаба содержит аллель Glm-1(17) с лизином в положении 217 последовательности SEQ ID NO 1 и константная область легкой цепи включает аллель Km-3 с аланином в положении 153 и валином в положении 191 последовательности SEQ ID NO 2, или их активный вариант. В некоторых вариантах осуществления активный вариант трастузумаба содержится в описанных здесь композициях. Используемый здесь термин "активный вариант" применительно к трастузумабу означает полноразмерное антитело или его антигенсвязывающий фрагмент, который содержит по меньшей мере один CDR трастузумаба и способен связываться с HER2 и антагонизировать его активность, что может привести к какому-либо одному или более следующих событий: предотвращение димеризации рецептора, ингибирование пролиферации клеток, ингибирование роста опухоли, ингибирование метастазирования опухоли, антитело-зависимая клеточно-опосредованная токсичность, интернализация HER2, деградация HER2, снижение вероятности пролиферации опухолевых клеток, апоптоз сверхэкспрессирующих HER2 опухолевых клеток.
Таким образом, в некоторых вариантах осуществления описанные композиции содержат активный вариант трастузумаба, который конкурентно ингибирует связывание трастузумаба с HER2.
В других вариантах осуществления изобретения анти-HER2 антитело является антителом, которое связывается с тем же или аналогичным эпитопом, как трастузумаб. См. работу Cho et al. (2003) Nature 421(6924): 756-760, которая включена в данное описание посредством ссылки в полном объеме.
В других вариантах осуществления изобретения анти-HER2 антитело содержит тяжелую цепь, имеющую последовательность, представленную SEQ ID NO 1.
В других вариантах осуществления изобретения анти-HER2 антитело содержит легкую цепь, имеющую последовательность, представленную SEQ ID NO 2.
В других вариантах осуществления изобретения анти-HER2 антитело содержит вариабельный домен тяжелой цепи (VH), имеющий последовательность, представленную SEQ ID NO 3.
В других вариантах осуществления изобретения анти-HER2 антитело содержит вариабельный домен легкой цепи (VL), имеющий последовательность, представленную SEQ ID NO 4.
В некоторых из этих вариантов осуществления изобретения анти-HER2 антитело, пригодное для описанной здесь композиции, содержит домен VH, имеющий последовательность, представленную SEQ ID NO 3, и домен VL, имеющий последовательность, представленную SEQ ID NO 4.
В некоторых вариантах осуществления изобретения анти-HER2 антитело в композиции содержит по меньшей мере один CDR трастузумаба. Таким образом, анти-HER2 антитело может содержать по меньшей мере один из CDR, представленных SEQ ID NO 5, 6, 7, 8, 9 и 10 (CDR1, CDR2, CDR3 домена VH трастузумаба, и CDR1, CDR2 и CDR3 домена VL трастузумаба, соответственно). В некоторых из этих вариантов осуществления изобретения анти-HER2 антитело содержит VH CDR1, имеющий последовательность, представленную SEQ ID NO 5, VH CDR2, имеющий последовательность, представленную SEQ ID NO 6, VH CDR3, имеющий последовательность, представленную SEQ ID NO 7, VL CDR1, имеющий последовательность, представленную SEQ ID NO 8, VL CDR2, имеющий последовательность, представленную SEQ ID NO 9, и VL CDR3, имеющий последовательность, представленную SEQ ID NO 10.
Хотя широко признанным антителом к HER2 является трастузумаб, описанные здесь способы и композиции не ограничиваются использованием данного антитела, однако описанные здесь способы и композиции особенно подходят для этого антитела. Другие антитела к HER2 также пригодны для использования в описанных здесь способах и композициях. Примеры других таких антител к HER2 включают, но не ограничиваются ими, антитела 4D5 (описанные в патентах США 5677171 и 5772997), и антитело 520С9 и его функциональные эквиваленты, обозначенные 452F2, 736G9, 741F8, 758G5 и 761В10 (описанные в патенте США 6054561); rhuMAb 2С4 или Пертузумаб (Perjeta®) (описанный в патенте США 8372396.), включены в данное описание посредством ссылки. Другие антитела к HER2 с различными свойствами описаны в работах Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO 94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et al. Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); US 5,783,186; и Klapper et al. Oncogene 14:2099-2109 (1997); каждая из которых включена в данное описание посредством ссылки во всей ее полноте. Кроме того, новые антитела к HER2 могут быть получены с использованием способов, известных в данной области или описанных здесь.
В некоторых вариантах осуществления изобретения описанные композиции содержат более одного типа белка (например антитела). Например, было замечено, что с внеклеточно экспрессируемыми антигенами, такими как HER2, введение двух различных анти-HER2 антител, направленных на различные эпитопы белка, приводило к противоопухолевой активности in vivo and in vitro. Spiridon et al, Clin. Cancer Res. 8: 1720-30 (2002) (включено в данное описание посредством ссылки во всей его полноте). В самом деле, были продемонстрированы синергетические эффекты для введения двух различных анти-HER2 антител (Spiridon, 2002; Friedman et al. Proc. Natl. Acad. Sci USA 702: 1915-1920 (2005)); и комбинации одного анти-HER2 и одного анти-EGFR антитела (Larbouret et al., Clin. Cancer Res. 75:3356-3362 (2007)). Эти синергетические эффекты являются результатом гиперсшивания молекул клеточной поверхности путем смешивания высокоаффинных антител, направленных против различных эпитопов в той же молекуле (Spiridon, 2002). Одновременное участие более одного эпитопа вызывает образование крупных агрегатов комплексов антитело-рецептор. Эти крупные агрегаты эндоцитозируются быстрее, чем более мелкие комплексы антител, что приводит к ускоренному клиренсу рецепторов (Friedman, 2005). В качестве не ограничивающего примера описанная здесь композиция содержит трастузумаб или его активный вариант и пертузумаб или его активный вариант.
Сорбитол
Используемый в данном описании термин "сорбитол" относится к многоатомному спирту, имеющему молекулярную формулу С6Н14O6 и молекулярную массу 182,2. Он также известен как D-глюкоцитол. Он имеет следующую химическую структуру:
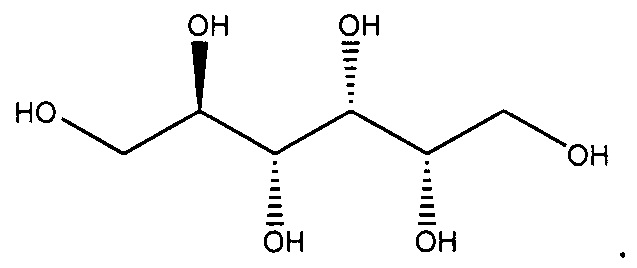
Сорбитол относится к категории эксципиентов и добавок, которые, в целом, считаются безопасными (GRAS, от англ. Generally Regarded As Safe).
В одном варианте осуществления изобретения описанный в данном документе объект изобретения относится к фармацевтической композиции, содержащей белок (например антитело) и сорбитол, где молярное соотношение сорбитола и белка (например антитела) составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль белка (например антитела). В некоторых вариантах осуществления указанное молярное соотношение составляет от приблизительно 600 до приблизительно 660 моль сорбитола : приблизительно 1 моль белка (например антитела). В некоторых из этих вариантов осуществления указанное молярное соотношение составляет от приблизительно 615 до приблизительно 655 моль сорбитола : приблизительно 1 моль белка (например антитела). В других вариантах осуществления указанное молярное соотношение составляет от приблизительно 620 до приблизительно 640 моль сорбитола : приблизительно 1 моль белка (например антитела). В других вариантах осуществления изобретения указанное молярное соотношение составляет приблизительно 631 моль сорбитола : приблизительно 1 моль белка (например антитела). В некоторых вариантах осуществления сорбитол присутствует в концентрации от приблизительно 90 мМ до приблизительно 120 мМ. В вариантах осуществления настоящего изобретения сорбитол присутствует в концентрации от приблизительно 100 мМ до приблизительно 110 мМ. В некоторых вариантах осуществления концентрация сорбитола составляет приблизительно 105,4 мМ.
В одном варианте осуществления изобретения описанный в данном документе объект изобретения относится к фармацевтической композиции, содержащей анти-HER2 антитело (например трастузумаб, как описано в настоящем документе) и сорбитол, где молярное соотношение сорбитола и антитела составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль антитела. В некоторых вариантах осуществления указанное молярное соотношение составляет от приблизительно 600 до приблизительно 660 моль сорбитола : приблизительно 1 моль антитела. В некоторых из этих вариантов осуществления указанное молярное соотношение составляет от приблизительно 615 до приблизительно 655 моль сорбитола : приблизительно 1 моль антитела. В других вариантах осуществления указанное молярное соотношение составляет от приблизительно 620 до приблизительно 640 моль сорбитола : приблизительно 1 моль антитела. В других вариантах осуществления изобретения указанное молярное соотношение составляет приблизительно 631 моль сорбитола : приблизительно 1 моль антитела. В некоторых вариантах осуществления сорбитол присутствует в концентрации от приблизительно 90 мМ до приблизительно 120 мМ. В некоторых вариантах осуществления изобретения сорбитол присутствует в концентрации от приблизительно 100 мМ до приблизительно 110 мМ. В некоторых вариантах осуществления концентрация сорбитола составляет приблизительно 105,4 мМ.
В одном варианте осуществления предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб и сорбитол, где молярное соотношение сорбитола и трастузумаба составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль трастузумаба. В некоторых вариантах осуществления указанное молярное соотношение составляет от приблизительно 600 до приблизительно 660 моль сорбитола : приблизительно 1 моль трастузумаба. В некоторых из этих вариантов осуществления указанное молярное соотношение составляет от приблизительно 615 до приблизительно 655 моль сорбитола : приблизительно 1 моль трастузумаба. В других вариантах осуществления указанное молярное соотношение составляет от приблизительно 620 до приблизительно 640 моль сорбитола : приблизительно 1 моль трастузумаба. В других вариантах осуществления настоящего изобретения указанное молярное соотношение составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба. В некоторых вариантах осуществления сорбитол присутствует в концентрации от приблизительно 90 мМ до приблизительно 120 мМ. В некоторых вариантах осуществления изобретения сорбитол присутствует в концентрации от приблизительно 100 мМ до приблизительно 110 мМ. В некоторых вариантах осуществления концентрация сорбитола составляет приблизительно 105,4 мМ.
В одном варианте осуществления предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб и сорбитол, где молярное соотношение сорбитола и трастузумаба составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба.
В одном варианте осуществления предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб и от приблизительно 100 мМ до приблизительно 110 мМ сорбитола.
В одном варианте осуществления предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб и приблизительно 105,4 мМ сорбитола.
Полиэтиленгликоль (ПЭГ)
Используемый в данном описании термин "полиэтиленгликоль" относится к соединению, состоящему из повторяющихся звеньев этиленгликоля: Н-(O-СН2-СН2)n-ОН; где n - среднее число оксиэтиленовых групп.
Очищенный ПЭГ является наиболее широко коммерчески доступным в виде смесей различных размеров олигомеров в широко или узко определенных диапазонах молекулярной массы (MW). Например, "ПЭГ 3350" обозначает, как правило, препарат, который включает в себя смесь молекул ПЭГ со средней MW 3350 г/моль.
Используемый в данном описании термин «ПЭГ» относится к биологически инертному, неиммуногенному химическому веществу, которое придает белкам большую растворимость в воде.
В одном варианте осуществления изобретения описанный в данном документе объект изобретения относится к фармацевтической композиции, содержащей белок (например антитело), сорбитол и полиэтиленгликоль (ПЭГ), где молярное соотношение сорбитола и белка (например антитела) составляет от приблизительно 550 до приблизительно 700 моль сорбитола : 1 моль белка (например антитела), и молярное соотношение полиэтиленгликоля (ПЭГ) и белка составляет приблизительно от 2:1 до 50:1. Было установлено, что присутствие полиэтиленгликоля в сочетании с сорбитолом в соотношениях, указанных здесь, обеспечивает композицию с желательной стабильностью. Полезные полиэтиленгликоли включают полиэтиленгликоли с молекулярной массой от приблизительно 2000 г/моль до приблизительно 5000 г/моль. В некоторых вариантах осуществления полиэтиленгликоли имеют молекулярную массу в диапазоне от приблизительно 3000 г/моль до приблизительно 4000 г/моль. В других вариантах осуществления изобретения полиэтиленгликоль представляет собой ПЭГ 3350, который является наиболее предпочтительным.
Не будучи связанными какой-либо теорией или механизмом действия, считают, что в конкретных вариантах осуществления изобретения сорбитол и полиэтиленгликоль могут функционировать в качестве лиопротекторов путем поддержания целостности структуры лиофилизированной лепешки, даже до такой степени, что предупреждают, ингибируют или минимизируют разрушение структуры лиофилизированной лепешки.
В конкретных вариантах осуществления изобретения композиции, содержащие сорбитол и ПЭГ, могут дополнительно содержать эксципиенты, но не содержат других лиопротекторов, например, трегалозы, сахарозы и/или маннита. Таким образом, в варианте осуществления изобретения композиции содержат антитело, как описано в настоящем документе, сорбитол в указанных соотношениях и количествах, как описано в настоящем документе, и ПЭГ в указанных соотношениях и количествах, как описано в настоящем документе, при условии, что композиции не содержат дополнительных нередуцирующих сахаров, таких как трегалоза, сахароза и/или маннит.
Приемлемые количества полиэтиленгликоля, присутствующие в композиции, включают молярное соотношение ПЭГ к белку (например антителу) по меньшей мере 2:1. В некоторых вариантах осуществления количество полиэтиленгликоля, присутствующее в композиции, включает молярное соотношение ПЭГ к белку (например антителу) от приблизительно 2:1 до приблизительно 50:1. В некоторых вариантах осуществления настоящего изобретения полиэтиленгликоль присутствует в композиции в молярном соотношении ПЭГ к белку (например антителу) от приблизительно 5:1 до приблизительно 40:1. В других вариантах осуществления изобретения полиэтиленгликоль присутствует в композиции в молярном соотношении ПЭГ к белку (например антителу) от приблизительно 5:1 до приблизительно 15:1. В еще другом варианте осуществления полиэтиленгликоль присутствует в композиции в молярном соотношении ПЭГ к белку (например антителу) приблизительно 10:1.
В некоторых вариантах осуществления изобретения ПЭГ присутствует в концентрации от приблизительно 1,0 мМ до приблизительно 2,5 мМ. В других вариантах осуществления изобретения ПЭГ присутствует в концентрации от приблизительно 1,5 мМ до приблизительно 1,9 мМ. В некоторых вариантах осуществления концентрация ПЭГ составляет приблизительно 1,67 мМ.
В некоторых вариантах осуществления изобретения композиция содержит белок (например антитело), сорбитол, где молярное соотношение сорбитола к белку (например антителу) составляет приблизительно 631 моль сорбитола : приблизительно 1 моль белка (например антитела); и ПЭГ 3350, где молярное соотношение ПЭГ 3350 к белку (например антителу) составляет приблизительно 10:1.
В некоторых вариантах осуществления изобретения композиция содержит анти-HER2 антитело; сорбитол, где молярное соотношение сорбитола к антителу составляет приблизительно 631 моль сорбитола : приблизительно 1 моль антитела; и ПЭГ 3350, где молярное соотношение ПЭГ 3350 к антителу составляет приблизительно 10:1.
В некоторых вариантах осуществления изобретения композиция содержит трастузумаб; сорбитол, где молярное соотношение сорбитола к трастузумабу составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба; и ПЭГ 3350, где молярное соотношение ПЭГ 3350 к трастузумабу составляет приблизительно 10:1.
Другие эксципиенты
Раскрытые в данной заявке композиции пригодны для лиофилизации. В этом аспекте композиция является твердой и может быть в виде порошка или лепешки. Лиофилизированная композиция является стабильной, как раскрыто в данном описании. Однако в некоторых вариантах осуществления композицию не обязательно лиофилизировать и жидкую композицию не обязательно восстанавливать из лиофилизированной формы. Лиофилизация белка (например антитела), как правило, требует присутствия лиопротектора в особом и адекватном соотношении к белку (например антителу), чтобы обеспечить защиту в процессе сублимации. «Лиопротектор» представляет собой молекулу, которая в сочетании с представляющим интерес белком существенно предотвращает или снижает химическую и/или физическую нестабильность белка при лиофилизации и последующем хранении. Лиопротектор добавляют к композиции перед лиофилизацией таким образом, что белок по существу сохраняет свою физическую и химическую стабильность и целостность при лиофилизации и хранении. В данной области характерно, что в композициях, как правило, используются нередуцирующие сахара, чтобы избежать нежелательных реакций Майяра, которые могут возникнуть из-за реакции между активной альдегидной группой с реакционноспособными аминокислотами белкового каркаса. Лиофилизированные композиции антител к HER2 описаны в патентах США 6267958 и 6685940, а также в международной заявке WO 97/04801, каждый из этих документов включен в данное описание посредством ссылки во всей их полноте.
В одном варианте осуществления описанный здесь предмет изобретения направлен на восстановленную композицию для введения. «Восстановленная» композиция является композицией, которую получают путем растворения лиофилизированной композиции белка в разбавителе такого, что белок является диспергированным в восстановленной композиции. Восстановленная композиция пригодна для введения (например, для парентерального введения) субъекту, подлежащему лечению требуемым белком, и, в некоторых вариантах осуществления изобретения, может быть такой, которая подходит для подкожного введения.
Восстановленная композиция содержит белок (например антитело) и сорбитол, причем молярное соотношение сорбитола и белка (например антитела) составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль белка (например антитела), и разбавитель. Понятие "разбавитель" относится к фармацевтически приемлемой (безопасной и нетоксичной для введения человеку) жидкости, которая подходит для приготовления восстановленной композиции.
Типичные разбавители включают стерильную воду, бактериостатическую воду для инъекций (BWFI), рН забуференный раствор (например, забуференный фосфатом физиологический раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. Композиции, как правило, являются стерильными, и это может быть достигнуто в соответствии с методами, известными специалистам в данной области для получения стерильных фармацевтических лекарственных форм, пригодных для введения человеку, включая фильтрацию через стерильные фильтрационные мембраны до или после получения композиции.
Разбавитель может содержать консерванты. "Консервант" представляет собой соединение, которое может быть добавлено к разбавителю, чтобы по существу уменьшить бактериальное воздействие в восстановленную композицию, облегчая тем самым, например, производство восстановленной композиции для многократного использования. Неограничивающие примеры консервантов включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, в которых алкильные группы представляют собой длинноцепочечные соединения) и хлорид бензетония, ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, аллилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. В некоторых из этих вариантов осуществления, где присутствует консервант, этот консервант представляет собой бензиловый спирт.
В одном варианте осуществления жидкая композиция содержит белок (например антитело) сорбитол, причем молярное соотношение сорбитола к белку (например антителу), составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль белка (например антитела), полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в диапазоне приблизительно от 2:1 до 50:1, и разбавитель.
В другом варианте осуществления жидкая композиция содержит анти-HER2 антитело и сорбитол, причем молярное соотношение сорбитола к антителу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль антитела, полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в диапазоне приблизительно от 2:1 до 50:1, и разбавитель.
В другом варианте осуществления жидкая композиция содержит трастузумаб и сорбитол, причем молярное соотношение сорбитола к трастузумабу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль трастузумаб, полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в интервале приблизительно от 2:1 до 50:1, и разбавитель.
В некоторых жидких композициях белок (например антитело) присутствует в концентрации от приблизительно 5 мг/мл до приблизительно 50 мг/мл. В некоторых из этих вариантов осуществления белок присутствует в концентрации от приблизительно 10 мг/мл до приблизительно 40 мг/мл. В других вариантах осуществления изобретения белок присутствует в концентрации от приблизительно 15 мг/мл до приблизительно 35 мг/мл. В некоторых вариантах осуществления настоящего изобретения белок присутствует в концентрации приблизительно 21 мг/мл.
В некоторых жидких композициях анти-HER2 антитело присутствует в концентрации приблизительно 21 мг/мл.
В некоторых жидких композициях трастузумаб присутствует в концентрации приблизительно 21 мг/мл.
Дополнительные пригодные концентрации белка также включают от приблизительно 0,10 мМ до приблизительно 0,25 мМ; от приблизительно 0,15 мм до приблизительно 0,18 мМ; и приблизительно 0,167 мМ.
Композиции, описанные здесь, могут дополнительно содержать эксципиенты. "Эксципиент" означает терапевтически неактивное вещество. Эксципиенты могут быть включены в композиции для самых разнообразных целей, в том числе, например, в качестве разбавителя, носителя, буфера, стабилизатора, агента тоничности, объемообразующего агента, поверхностно-активного вещества, криопротектора, лиопротектора, антиоксиданта, источника ионов металла, хелатирующего агента и/или консерванта. Эксципиенты хорошо известны в данной области, и их описание можно найти, например, в работах Wang W., Int. J. Pharm. 185:129-88 (1999) и Wang W., Int. J. Pharm. 203:1-60 (2000).
В некоторых вариантах осуществления описанные здесь композиции содержат буфер. Используемый в данном описании термин "буфер" означает вещество, которое стабилизирует рН жидкости, ее кислотность или щелочность. Другими словами, забуференный раствор сопротивляется изменению рН под действием его кислотно-основных сопряженных компонентов. Этот термин, как он используется в данном описании, предназначен для обозначения раствора, содержащего буферное вещество, такое как кислота, в равновесии с сопряженным с ней основанием. Буфер может обеспечить оптимальную буферную емкость в области его рКа, где буферная емкость означает устойчивость к изменению рН при добавлении к раствору кислоты или основания. В некоторых вариантах осуществления описанные здесь композиции имеют рН в диапазоне от приблизительно 5,0 до приблизительно 7,5, в некоторых из этих вариантов осуществления - от приблизительно 5,8 до приблизительно 6,8, например, от приблизительно 6,0 до приблизительно 6,4, а в некоторых вариантах осуществления имеют рН приблизительно 6,2. Неограничивающие примеры буферов, которые будут контролировать рН в этом интервале, включают ацетат, сукцинат, сукцинат, глюконат, гистидин, цитрат, глицилглицин и другие буферы органических кислот.
В некоторых вариантах осуществления буфером для раскрытых здесь композиций является гистидиновый буфер. Гистидиновый буфер представляет собой буфер, содержащий ионы гистидина. Неограничивающие примеры гистидиновых буферов включают L-гистидин и сопряженную с ним кислоту гидрохлорид L-гистидина, а также ацетат гистидина, фосфат гистидина, сульфат гистидина. В некоторых вариантах осуществления буфер представляет собой L-гистидин/гидрохлорид L-гистидина. В этих вариантах осуществления пригодные концентрации L-гистидина/ гидрохлорида L-гистидина составляют от приблизительно 1,0 мМ до приблизительно 3,0 мМ L-гистидина и от приблизительно 1,5 мМ до приблизительно 3,0 мМ гидрохлорида L-гистидина. В конкретных вариантах осуществления концентрация L-гистидина составляет от приблизительно 1,5 мМ до приблизительно 2,5 мМ и концентрация гидрохлорида L-гистидина составляет от приблизительно 2,0 мМ до приблизительно 2,5. В некоторых вариантах осуществления концентрация L-гистидина составляет приблизительно 1,93 мМ и концентрация гидрохлорида L-гистидина составляет приблизительно 2,23 мМ. Другие неограничивающие иллюстративные буферы включают уксусную кислоту или ацетатный буфер, глутаминовую кислоту или глутаматный буфер, янтарную кислоту или сукцинатный буфер, или пропионовую кислоту или пропионатный буфер.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб, сорбитол, L-гистидин, L-гистидин HCl и ПЭГ 3350, где молярное соотношение сорбитола к трастузумабу составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к фармацевтической композиции, содержащей трастузумаб, сорбитол, L-гистидин, L-гистидин HCl и ПЭГ 3350, где молярное соотношение сорбитола к трастузумабу составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба, и где молярное соотношение ПЭГ 3350 к антителу составляет приблизительно 10:1.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к фармацевтической композиции, содержащей сорбитол, ПЭГ 3350, белок и буфер, где сорбитол и белок находятся в молярном соотношении 631 моль : 1 моль, и ПЭГ 3350 и белок находятся в молярном соотношении 10 моль : 1 моль, причем лиофилизированная впоследствии композиция является стабильной при температуре 2-8 градусов Цельсия в течение по меньшей мере 4-х лет.
В особых вариантах осуществления описанный здесь предмет изобретения относится к фармацевтической композиции, содержащей приблизительно 150 мг анти-HER2 моноклональных антител, буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl, приблизительно 115,2 мг сорбитола, приблизительно 33,6 мг ПЭГ 3350 и приблизительно 7,2 мл стерильной воды для инъекций.
В другом варианте осуществления описанный здесь предмет изобретения относится к фармацевтической композиции (которая может быть лиофилизированной), содержащей приблизительно 150 мг анти-HER2 моноклональных антител, буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl, приблизительно 115,2 мг сорбитола и приблизительно 33,6 мг ПЭГ 3350.
В некоторых из этих вариантов осуществления анти-HER2 моноклональное антитело содержит домен VH, имеющий последовательность, представленную SEQ ID NO 3, и домен VL, имеющий последовательность, представленную SEQ ID NO 4. В конкретных вариантах осуществления анти-HER2 моноклональное антитело является трастузумабом и, таким образом, имеет последовательность тяжелой цепи, представленную SEQ ID NO 1, и последовательность легкой цепи, представленную SEQ ID NO 2.
В конкретных вариантах осуществления описанный здесь предмет изобретения относится к фармацевтической композиции, содержащей приблизительно 150 мг трастузумаба, буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl, приблизительно 115,2 мг сорбитола, приблизительно 33,6 мг ПЭГ 3350 и приблизительно 7,2 мл стерильной воды для инъекций.
В другом конкретном варианте осуществления описанный здесь предмет изобретения относится к фармацевтической композиции (которая может быть лиофилизированной), содержащей приблизительно 150 мг трастузумаба, буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl, приблизительно 115,2 мг сорбитола и приблизительно 33,6 мг ПЭГ 3350.
Другие эксципиенты, такие как объемообразующие агенты, также могут присутствовать, хотя в наиболее предпочтительных вариантах в качестве лиопротектора и объемообразующих агентов присутствует смесь сорбитол/ПЭГ. «Объемообразующий агент» представляет собой соединение, которое добавляет массу лиофилизированной смеси и вносит вклад в физическую структуру лиофилизированной лепешки (например, облегчает получение по существу однородной лиофилизированной лепешки, которая сохраняет открытую пористую структуру). Примеры объемообразующих агентов включают маннит и глицин. Сахарные спирты, известные также как полиолы, многоатомные спирты или полиспирты, являются гидрогенизированными формами углеводов, содержащих карбонильную группу, которая восстановлена до первичной или вторичной гидроксильной группы. Полиолы могут быть использованы в качестве стабилизирующих эксципиентов и/или агентов изотоничности в жидких и лиофилизированных композициях. Хотя описанные здесь композиции содержат сорбитол, дополнительные полиолы могут присутствовать в композиции и могут служить для защиты полипептидов от физического и химического разложения. Неограничивающие примеры других сахарных спиртов включают глицерин, маннит, ксилит, мальтит, лактит, эритрит и треит.
Другие наполнители включают, например, сахара, такие как сахароза, лактоза или декстроза; соли, такие как NaCl, KCl или фосфат кальция, аминокислоты, такие как глицин, метионин или глутаминовая кислота, поверхностно-активные вещества, ионы металлов, буферные соли, хлорид, пропионат, ацетат или сукцинат, консерванты и полипептиды, такие как человеческий сывороточный альбумин, а также физиологический раствор и воду. Как правило, жидкие композиции являются изотоническими. Под термином "изотонический" понимают, что композиция имеет по существу такое же осмотическое давление, как кровь человека. Изотоничность можно измерить, используя, например, осмометр давления пара или замораживания.
Раскрытые в данной заявке композиции являются стабильными. «Стабильная» композиция является такой, в которой белок по существу сохраняет свою физическую и химическую стабильность и целостность при хранении. Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга композицию можно выдерживать при температуре 40°С в течение от 2-х недель до 1 месяца, в течение этого времени измеряют стабильность. В случае, если композицию следует хранить при температуре 2-8°С, в некоторых вариантах осуществления изобретения композиция является стабильной в течение по меньшей мере шести месяцев. В других вариантах осуществления композиции стабильны в течение по меньшей мере 9 месяцев при хранении при температуре приблизительно от 2°С до 8°С. В некоторых вариантах осуществления композиции стабильны в течение по меньшей мере четырех лет при хранении при температуре приблизительно от 2°С до 8°С.
Степень агрегации после лиофилизации и хранения может быть использована в качестве индикатора стабильности белка. Например, «стабильная» композиция может быть такой, в которой менее приблизительно 10% и предпочтительно менее приблизительно 5% белка присутствует в виде агрегата. Увеличение образования агрегатов после лиофилизации и хранения лиофилизированной композиции можно определить. Например, «стабильная» лиофилизированная композиция может быть такой, где увеличение агрегатов в лиофилизированной композиции составляет менее приблизительно 5%, а в некоторых вариантах осуществления менее приблизительно 3%, когда лиофилизированная композиция хранится при температуре 2-8°С по меньшей мере четыре года. В других вариантах осуществления стабильность композиции белка может быть измерена с помощью анализа биологической активности.
Различные другие анализы стабильности для подтверждения стабильности композиции доступны квалифицированному специалисту и рассматриваются в работе Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно проверить путем оценки физической стабильности, химической стабильности и/или биологической активности антитела в композиции при ее приготовлении, а также после хранения при отмеченных температурах. Физическую и/или химическую стабильность можно оценивать качественно и/или количественно различными способами, включая оценку образования агрегатов (например, с использованием гель-проникающей хроматографии, путем измерения мутности и/или путем визуального осмотра); оценку гетерогенности заряда с использованием катионообменной хроматографии или капиллярного зонного электрофореза; амино-концевой или карбокси-концевой анализ последовательности; масс-спектрометрический анализ; анализ SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) для сравнения укороченного и интактного антитела; анализ пептидной карты (например, с трипсином или Lys-C); оценку биологической активности или антигенсвязывающей функции антитела; и т.п. Нестабильность может привести к агрегации, деамидированию (например Asn-деамидированию), окислению (например Met-окислению), изомеризации (например Asp-изомеризации), клиппингу/гидролизу/фрагментации (например фрагментации шарнирной области), образованию сукцинимида, непарным цистеинам, удлинению N-конца, обработке С-конца, различиям гликозилирования и т.д. Биологическую активность или функцию связывания антигена можно оценить с использованием различных методов, доступных квалифицированному специалисту. В настоящем документе специально рассматривается замораживание композиции. Следовательно, композицию можно проверить на стабильность при замораживании и оттаивании.
II. Способы получения фармацевтических композиций
Настоящее изобретение также относится к способу получения фармацевтической композиции, включающему приготовление композиции, как описано здесь, и, в некоторых вариантах осуществления, оценку физической стабильности, химической стабильности или биологической активности белка (например антитела) в композиции.
В одном варианте осуществления предложен способ получения стабильной композиции, включающий стадии, на которых:
a) смешивают белок, ПЭГ и сорбитол таким образом, что молярное соотношение сорбитол : белок находится диапазоне 550-700 моль сорбитола: 1 моль белка; и молярное соотношение ПЭГ: белок находится диапазоне 2-50 моль: 1 моль;
b) лиофилизируют эту смесь; и, возможно,
c) восстанавливают лиофилизированную смесь со стадии (b) в разбавителе таким образом, что концентрация белка составляет от 5 мг/мл до 50 мг/мл.
В описанном выше способе лиофилизированная смесь может дополнительно содержать объемообразующий агент.
В другом варианте осуществления предложен способ получения стабильной композиции, включающий стадии, на которых:
a) смешивают белок и сорбитол в молярном соотношении сорбитол : белок в диапазоне 550-700 моль сорбитола: 1 моль белка; и
b) добавляют ПЭГ к смеси со стадии (а) в молярном соотношении ПЭГ: белок в диапазоне от 2:1 до 50:1, предпочтительно 10:1;
c) разбавляют смесь с получением жидкой композиции.
В некоторых вариантах осуществления изобретения описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей белок (например антитело), сорбитол, где молярное соотношение сорбитола к белку (например антителу) составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль белка (например антитела); и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в диапазоне приблизительно от 2:1 до 50:1.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей белок (например антитело), сорбитол, где молярное соотношение сорбитола к белку (например антителу) составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль белка (например антитела); и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в диапазоне приблизительно от 2:1 до 50:1; и (b) восстановление лиофилизированной смеси со стадии (а) в растворителе таким образом что концентрация белка (например антитела) составляет от приблизительно 5 мг/мл до приблизительно 50 мг/мл. В некоторых вариантах осуществления изобретения белок (например антитело) присутствует в концентрации от приблизительно 10 мг/мл до приблизительно 40 мг/мл. В других вариантах осуществления изобретения белок (например антитело) присутствует в концентрации от приблизительно 15 мг/мл до приблизительно 35 мг/мл. В других вариантах осуществления изобретения белок (например антитело) присутствует в концентрации приблизительно 21 мг/мл. Пригодные концентрации белка (например антитела) также включают приблизительно от 0,10 мМ до 0,25 мМ; от приблизительно 0,15 мм до приблизительно 0,18 мМ; и приблизительно 0,167 мМ.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей анти-HER2 антитело; сорбитол, где молярное соотношение сорбитола к антителу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль антитела; и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например анти-HER2 антителу) находится в диапазоне приблизительно от 2:1 до 50:1.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей анти-HER2 антитело; сорбитол, где молярное соотношение сорбитола к антителу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль антитела; полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например антителу) находится в диапазоне приблизительно от 2:1 до 50:1; и (b) восстановление лиофилизированной смеси со стадии (а) растворителем таким образом, что концентрация антитела составляет от приблизительно 5 мг/мл до приблизительно 50 мг/мл. В некоторых вариантах осуществления изобретения антитело присутствует в концентрации от приблизительно 10 мг/мл до приблизительно 40 мг/мл. В других вариантах осуществления антитело присутствует в концентрации от приблизительно 15 мг/мл до приблизительно 35 мг/мл. В других вариантах осуществления изобретения антитело присутствует в концентрации приблизительно 21 мг/мл.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей трастузумаб, сорбитол, где молярное соотношение сорбитола к трастузумабу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль трастузумаба; и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например трастузумабу) находится в диапазоне приблизительно от 2:1 до 50:1.
В некоторых вариантах осуществления описанный здесь предмет изобретения относится к способам получения композиции, включающим следующие стадии: а) лиофилизацию смеси, содержащей трастузумаб, сорбитол, где молярное соотношение сорбитола к трастузумабу составляет от приблизительно 550 до приблизительно 700 моль сорбитола : приблизительно 1 моль трастузумаба; и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например трастузумабу) находится в диапазоне приблизительно от 2:1 до 50:1; и (b) восстановление лиофилизированной смеси со стадии (а) растворителем таким образом, что концентрация трастузумаба составляет от приблизительно 5 мг/мл до приблизительно 50 мг/мл. В некоторых вариантах осуществления трастузумаб присутствует в концентрации от приблизительно 10 мг/мл до приблизительно 40 мг/мл. В других вариантах осуществления трастузумаб присутствует в концентрации от приблизительно 15 мг/мл до приблизительно 35 мг/мл. В других вариантах осуществления трастузумаб присутствует в концентрации приблизительно 21 мг/мл.
В особых вариантах осуществления изобретения композиция содержит ПЭГ-3350, например, как описано в настоящем документе. Например, композиция содержит трастузумаб, сорбитол, L-гистидин, L-гистидин HCl и ПЭГ 3350, причем молярное соотношение сорбитола к трастузумабу составляет приблизительно 631 моль сорбитола : приблизительно 1 моль трастузумаба, и где молярное соотношение ПЭГ 3350 к антителу составляет приблизительно 10:1.
В некоторых вариантах осуществления изобретения композиция содержит буфер, например, гистидин и/или гистидин-HCl, например, как описано в настоящем документе.
В одном примере композиция содержит приблизительно 150 мг трастузумаба; буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl; приблизительно 115,2 мг сорбитола и приблизительно 33,6 мг ПЭГ 3350.
Для получения биологических лекарственных средств ингредиенты композиции обычно вводят с помощью фильтрации в тангенциальном потоке (TFF, от англ. tangential flow filtration). В этом способе лекарственное вещество (ЛВ) обменивается в буфер композиции, содержащий добавленные эксципиенты, но не содержащий поверхностно-активного вещества (например полиэтиленгликоля). ЛВ концентрируют до более высоких значений, чем целевая концентрация ЛВ. Затем выполняют разбавление, где добавляют поверхностно-активное вещество и доводят концентрацию до целевого значения.
Как известно специалистам в данной области техники, способ TFF включает в себя повторяющиеся циклы пропускания лекарственного вещества через мембрану много раз с использованием буфера с целевым основанием. Эти циклы пропускания потенциально могут привести к повреждению белков и их физической деградации, что приводит к высокому содержанию агрегатов. Как правило, сахара в композиции обеспечивают защиту, если такое повреждение должно было произойти. TFF с сахаром, однако, как правило, требует очень большого объема компонентов композиции.
Был разработан альтернативный способ, включающий прямое добавление эксципиентов с использованием буфера с общим основанием. Этот альтернативный способ включает прямое добавление эксципиентов для снижения потребления исходного материала путем долива эксципиента сорбитола вместо обмена мембранного раствора основания в массу ЛВ во время приготовления. В некоторых вариантах осуществления изобретения фармацевтическую композицию готовят, как показано на фиг. 1. Этот способ включает в себя ультрафильтрацию с последующей диафильтрацией (TFF) в буфер композиции His-His HCl при рН 6. Затем выполняют вирусную фильтрацию лекарственного вещества. Поскольку во время приготовления добавляют маточные жидкие растворы для предотвращения чрезмерного разжижения лекарственного вещества, необходимо, чтобы концентрация белка после вирусной фильтрации составляла не менее 32 мг/мл.
В одном варианте осуществления получение фармацевтической композиции включает в себя следующие стадии:
1. Приготовление гистидинового буфера
2. Приготовление 1 М сорбитола и 50 мМ ПЭГ 3350 в гистидиновом буфере.
3. Доведение рН маточных растворов сорбитола и ПЭГ до 6,0 с помощью 0,1 Н HCl или 0,1 Н NaOH
4. Добавление сорбитола до конечной концентрации 105,4 мМ
5. Добавление ПЭГ 3350 до конечной концентрации 1,67 мМ
6. Доведение концентрации белка до 25,00 мг/мл с помощью гистидинового буфера.
7. Доведение рН композиции до 6,00.
III. Способы лечения
В конкретных вариантах осуществления предмет изобретения, раскрытый в данном описании, относится к способу лечения HER2-гиперэкспрессирующего рака у субъекта, включающему введение субъекту композиции согласно изобретению, например, содержащей приблизительно 150 мг моноклонального анти-HER2 антитела; буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl; приблизительно 115,2 мг сорбитола; приблизительно 33,6 мг ПЭГ 3350 и приблизительно 7,2 мл стерильной воды. В одном примере композиция содержит приблизительно 150 мг трастузумаба; буфер, содержащий приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl; приблизительно 115,2 мг сорбитола; приблизительно 33,6 мг ПЭГ 3350 и приблизительно 7,2 мл стерильной воды. Этот способ особенно подходит для лечения рака, причем субъект может также принимать химиотерапевтическое средство и/или другое анти-HER2 антитело, например, пертузумаб. Примерами химиотерапевтических средств являются доксорубицин, циклофосфамид и либо паклитаксел, либо доцетаксел, либо доцетаксел и карбоплатин, либо антрациклин, либо паклитаксел, либо капецитабин и/или 5-фторурацил.
В одном примере рак представляет собой рак молочной железы. Например, рак представляет собой HER2-гиперэкспрессирующий рак молочной железы. Например, рак молочной железы является метастатическим раком молочной железы.
В одном примере способы предназначены для адъювантной терапии рака молочной железы.
В одном примере рак является раком желудка, например метастатическим раком желудка.
В зависимости от типа и тяжести заболевания, приблизительно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) белка является начальной потенциально возможной дозой для введения пациенту, например, либо посредством одного или более отдельных введений, либо посредством непрерывной инфузии. В некоторых вариантах осуществления изобретения доза белка будет находиться в диапазоне от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг. Таким образом, пациенту можно вводить одну или более доз приблизительно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любой их комбинации). Такие дозы можно вводить периодически, например, каждую неделю или один раз в три недели (например, таким образом, что пациент получает от приблизительно двух до приблизительно двадцати, например шести, доз белка). Можно вводить начальную более высокую дозу, за которой следуют одна или несколько более низких доз. В одном варианте осуществления изобретения белок вводят в виде нагрузочной дозы, составляющей приблизительно 840 мг, затем вводят приблизительно 420 мг приблизительно каждые 3 недели. В другом варианте осуществления изобретения белок вводят в дозе приблизительно 1050 мг, вводимой приблизительно каждые 3 недели. Например, белок (например анти-HER2 антитело, например трастузумаб) вводят в нагрузочной дозе приблизительно 4 мг/кг с последующей поддерживающей дозой каждую неделю приблизительно 2 мг/кг. Например, белок (например анти-HER2 антитело, например трастузумаб) вводят в нагрузочной дозе приблизительно 8 мг/кг с последующей поддерживающей дозой каждую неделю приблизительно 4 мг/кг.
В некоторых вариантах осуществления композицию белка вводят внутривенно, внутримышечно или подкожно, а в конкретных вариантах осуществления - внутривенно.
IV. Готовые изделия/Фармацевтический набор
В другом варианте осуществления изобретения предложено изделие или фармацевтический набор, который содержит фармацевтическую композицию, описанную здесь, в контейнере и, в некоторых вариантах осуществления, дополнительно содержит инструкции по ее применению. Подходящие контейнеры включают, например, бутылки, флаконы (например двухкамерные флаконы), шприцы (например двухкамерные шприцы) и тест-пробирки. Контейнер может быть выполнен из различных материалов, таких как стекло или пластик. В некоторых вариантах осуществления композиция предусмотрена внутри флакона с пробкой, прокалываемой шприцом, как правило, в водной форме. Флакон желательно хранить при температуре приблизительно 2-8°С до введения субъекту, нуждающемуся в этом. Сосуд может представлять собой, например, флакон на 10-15 куб. см. Контейнер содержит композицию, и этикетка на нем или прилагаемая к нему может содержать показания для применения. Контейнер с композицией может быть флаконом многоразового использования, который позволяет осуществлять повторное введение (например, 2-6 введений) восстановленной композиции. Изделие или фармацевтический набор может дополнительно содержать другие материалы, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению, как было отмечено в предыдущем разделе.
Композиции могут быть приготовлены в удобных дозировках, которые содержат определенные количества белка. В некоторых вариантах осуществления изобретения количество белка составляет от приблизительно 10 мг до приблизительно 500 мг; или от приблизительно 300 мг до приблизительно 500 мг; или от приблизительно 400 мг до приблизительно 480 мг; или приблизительно 440 мг. В некоторых вариантах осуществления изобретения количество белка составляет от приблизительно 50 мг до приблизительно 300 мг. В других вариантах осуществления изобретения количество белка составляет от 100 мг до приблизительно 200 мг. В других вариантах осуществления количество белка составляет от приблизительно 130 мг до приблизительно 170 мг. В некоторых вариантах осуществления количество белка составляет приблизительно 150 мг.
В некоторых вариантах осуществления восстановленная композиция или лиофилизированная композиция содержится в сосуде, таком как закупоренный флакон, для простоты использования. Таким образом, в одном из вариантов осуществления описанный здесь предмет изобретения относится к флакону, содержащему фармацевтическую композицию, причем указанная композиция содержит приблизительно 150 мг анти-HER2 моноклональных антител; буфер, содержащий, приблизительно 2,16 мг L-гистидина и 3,36 мг L-гистидина HCl; приблизительно 115,2 мг сорбитола и приблизительно 33,6 мг ПЭГ 3350. В этом варианте осуществления изобретения флакон может дополнительно содержать разбавитель. В некоторых вариантах осуществления разбавитель представляет собой стерильную воду, и в некоторых из этих вариантов осуществления - бактериостатическую воду для инъекций (BWFI). Объем стерильной воды предпочтительно составляет приблизительно 7,2 мл.
В другом варианте осуществления изделие или фармацевтический набор содержит:
(а) контейнер, который содержит лиофилизированную смесь, содержащую белок (например антитело), сорбитол, присутствующий в молярном соотношении от приблизительно 550 до приблизительно 750 моль сорбитола на приблизительно 1 моль белка (например антитела); и полиэтиленгликоль (ПЭГ), причем молярное соотношение ПЭГ к белку (например трастузумабу) находится в диапазоне приблизительно от 2:1 до 50:1;
и (b) инструкции по восстановлению лиофилизированной смеси разбавителем. Это изделие или фармацевтический набор может дополнительно включать второй контейнер, который содержит разбавитель (например, бактериостатическую воду для инъекций (BWFI)).
Далее изобретение дополнительно описано в данном документе с помощью следующих неограничивающих примеров, которые иллюстрируют изобретение и не предназначены для ограничения объема изобретения, и они не должны быть истолкованы, как ограничивающие объем изобретения.
ПРИМЕРЫ
1. Лиофилизация и анализ морфологии лепешки
i. Композиция ПЭГ
Композицию, содержащую только ПЭГ, получали в двух различных концентрациях в соответствии с таблицами 1А и 1В. ПЭГ-содержащую композицию лиофилизировали и исследовали морфологию и структуру лепешки после выдерживания в стрессовых условиях при 40°С плюс/минус 2°С (75% плюс/минус 5% отн. вл.). Оценка композиции включала лиофилизацию 150 мг композиции приготовленного сыпучего лекарственного вещества в соответствии с таблицами 1А и 1В во флаконах на 15 мл. Флаконы закупоривали наполовину с помощью покрытых хлорбутилом куполообразных пробок и лиофилизировали. Обе тестируемые композиции, содержащие 37,5-кратный и 100-кратный молярный избыток ПЭГ 3350 к антителу, были лиофилизованы без разрушения и образовали хорошо сформированную структуру лепешки. Полученные лиофилизированные лепешки помещали в камеру при 40°С плюс/минус 2°С (75% плюс/минус 5% отн. вл.) на 3 недели, после чего вновь исследовали морфологию лепешки. Анализировали внешний вид лепешки в начальный момент времени, а также через 3 недели при 40°С плюс/минус 2°С (75% плюс/минус 5% отн. вл.).
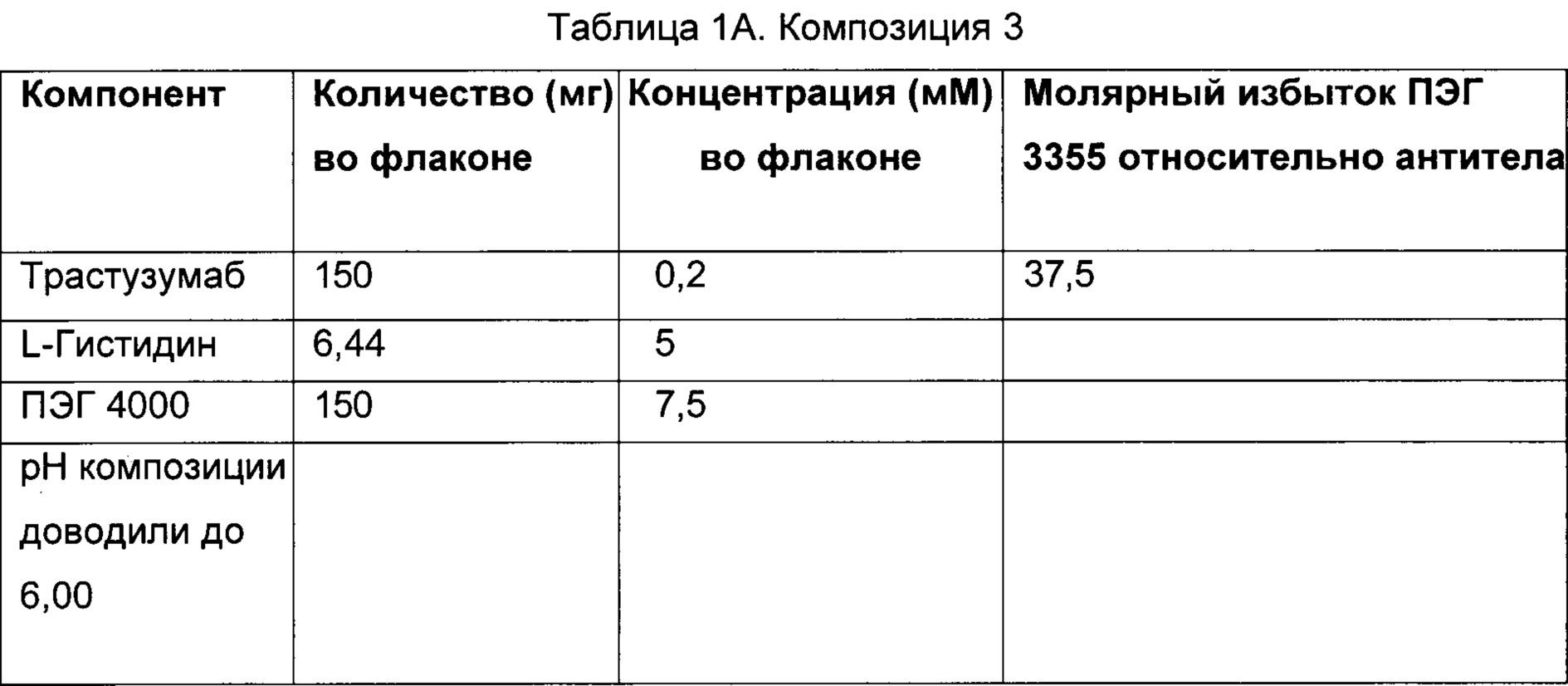
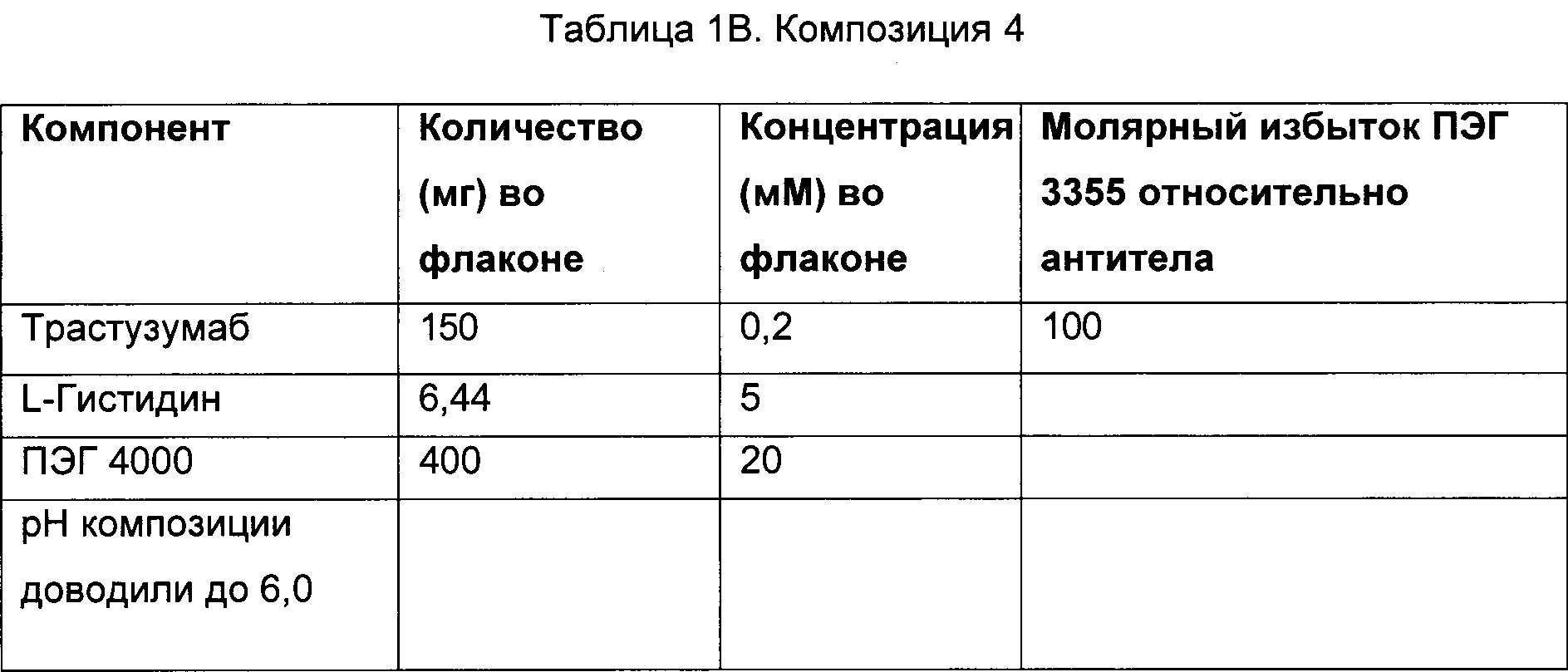
Лиофилизированную лепешку композиции 3 исследовали в начальный момент времени Т0 и после выдерживания при 40°С плюс/минус 2°С (75% плюс/минус 5% отн. вл.) в течение трех недель (T3W 40°С). Композиция 3 не может сохранять структуру лепешки при выдерживании при ускоренных условиях исследования стабильности 40°С плюс/минус 2°С (плюс/минус 5% отн. вл.) в течение 3-х недель, о чем свидетельствует разрушение структуры лепешки.
Лиофилизированную лепешку композиции 4 исследовали в начальный момент времени Т0 и после выдерживания при 40°С плюс/минус 2°С (75% плюс/минус 5% отн. вл.) в течение трех недель (T3W 40°С). Композиция 3 не может сохранять структуру лепешки при выдерживании при ускоренных условиях исследования стабильности 40°С плюс/минус 2°С (плюс/минус 5% отн. вл.) в течение 3-х недель, о чем свидетельствует разрушение структуры лепешки.
ii. Композиции ПЭГ/сорбитола
Оценивали композиции, содержащие комбинацию ПЭГ и сорбитола. Оценивали четыре различных молярных соотношения избытка ПЭГ и сорбитола относительно антитела: 36, 100, 310 и 667. В дополнение к мониторингу морфологии лепешки оценивали параметры качества продуктов, такие как физическая стабильность с помощью ГПХ, химическая стабильность с помощью ИОХ (ионообменной хроматографии), общее содержание белка с помощью УФ 280, значения рН и осмоляльность при выдерживании при температуре 40°С в течение 3-х недель.
5 мл приготовленного сыпучего лекарственного вещества в соответствии с таблицами 2А, 2В, 2С и 2D помещали во флакон на 15 мл. Флаконы закупоривали наполовину с помощью покрытых хлорбутилом куполообразных пробок и лиофилизировали. Полученные в результате лиофилизированные лепешки анализировали сразу же на параметры качества продукта в начальный момент времени Т0, а также после выдерживания в камере при 40°С плюс/минус 2°С (75% плюс/минус 5% относительной влажности) в течение 3-х недель.

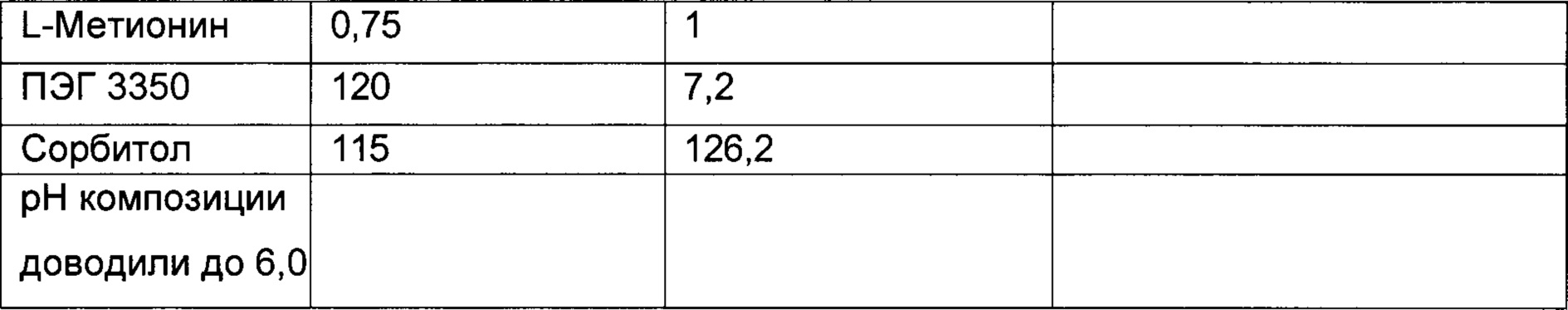
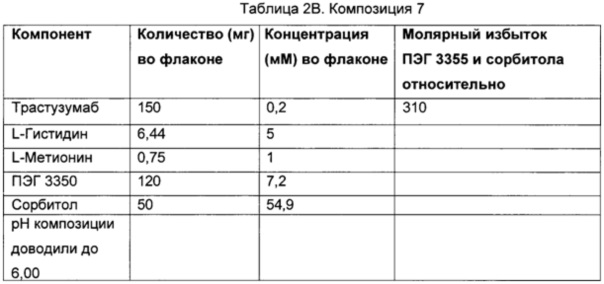
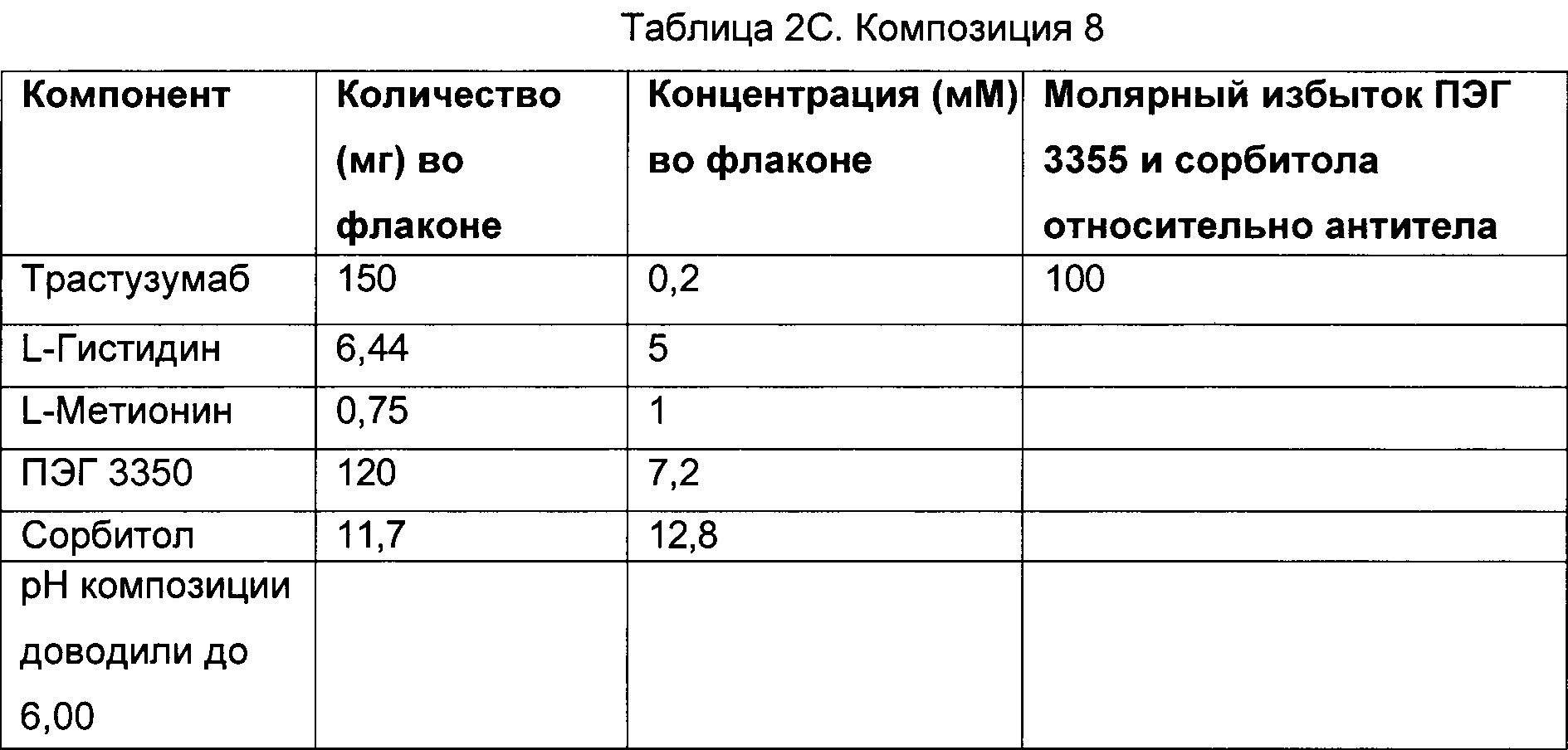
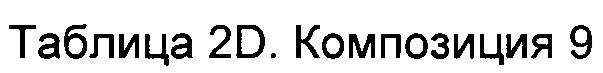
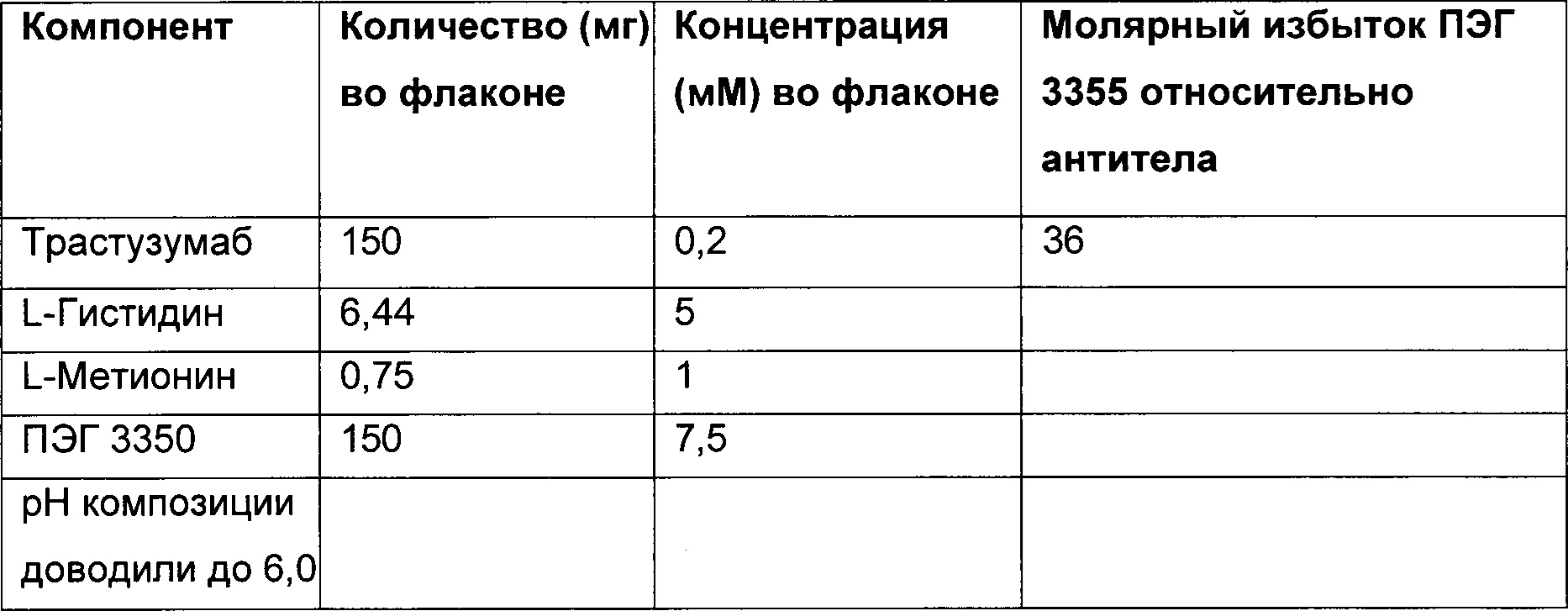
Все композиции, содержащие ПЭГ и сорбитол, обеспечивали улучшенную структуру лепешки и повышение физической стабильности при повышенных температурах по сравнению с композициями, содержащими только ПЭГ.
2. Стабильность композиций с ПЭГ и сорбитолом
Лиофилизированные лепешки лекарственного продукта восстанавливали с использованием 7,2 мл воды для инъекций и анализировали на рН композиции, распределение частиц по размерам с использованием ГПХ и распределение по зарядам с использованием ИОХ в начальный момент времени и после выдерживания в течение 3-х недель при 40°С. Данные, приведенные в таблице 3, показывают, что четыре тестируемых композиции имеют стабильное рН приблизительно 6,00 в момент времени Т0 и после выдерживания при 40°С в течение 3-х недель.
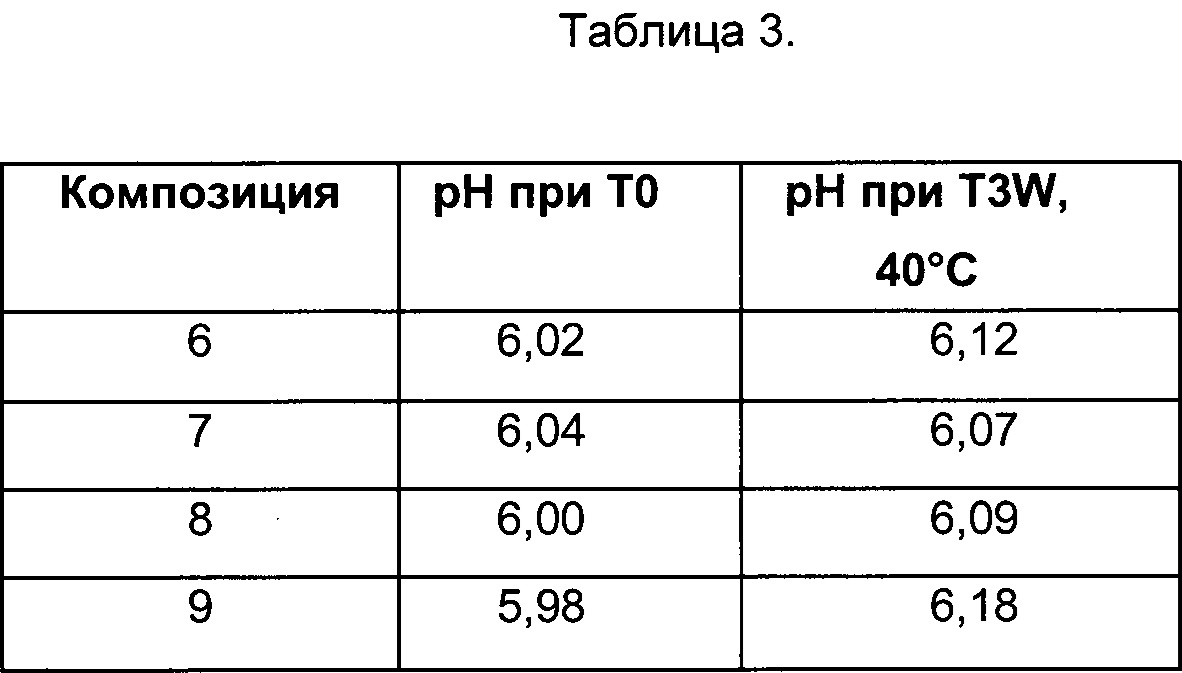
i. Физическая стабильность
На фиг. 2 представлена хроматограмма ГПХ тестируемой композиции 6. Фракция мономера элюируется при 28,54 мин, и агрегат элюируется при 24,42 мин. Увеличение содержания агрегата наблюдается в образце, который выдерживали при 40°С в течение 3-х недель (красная линия, стрелка), по сравнению с образцом при начальных условиях (синяя линия).
В таблице 4 приведены данные по физической стабильности тестируемых композиций при Т0 и после хранения при 40°С в течение трех недель после восстановления.
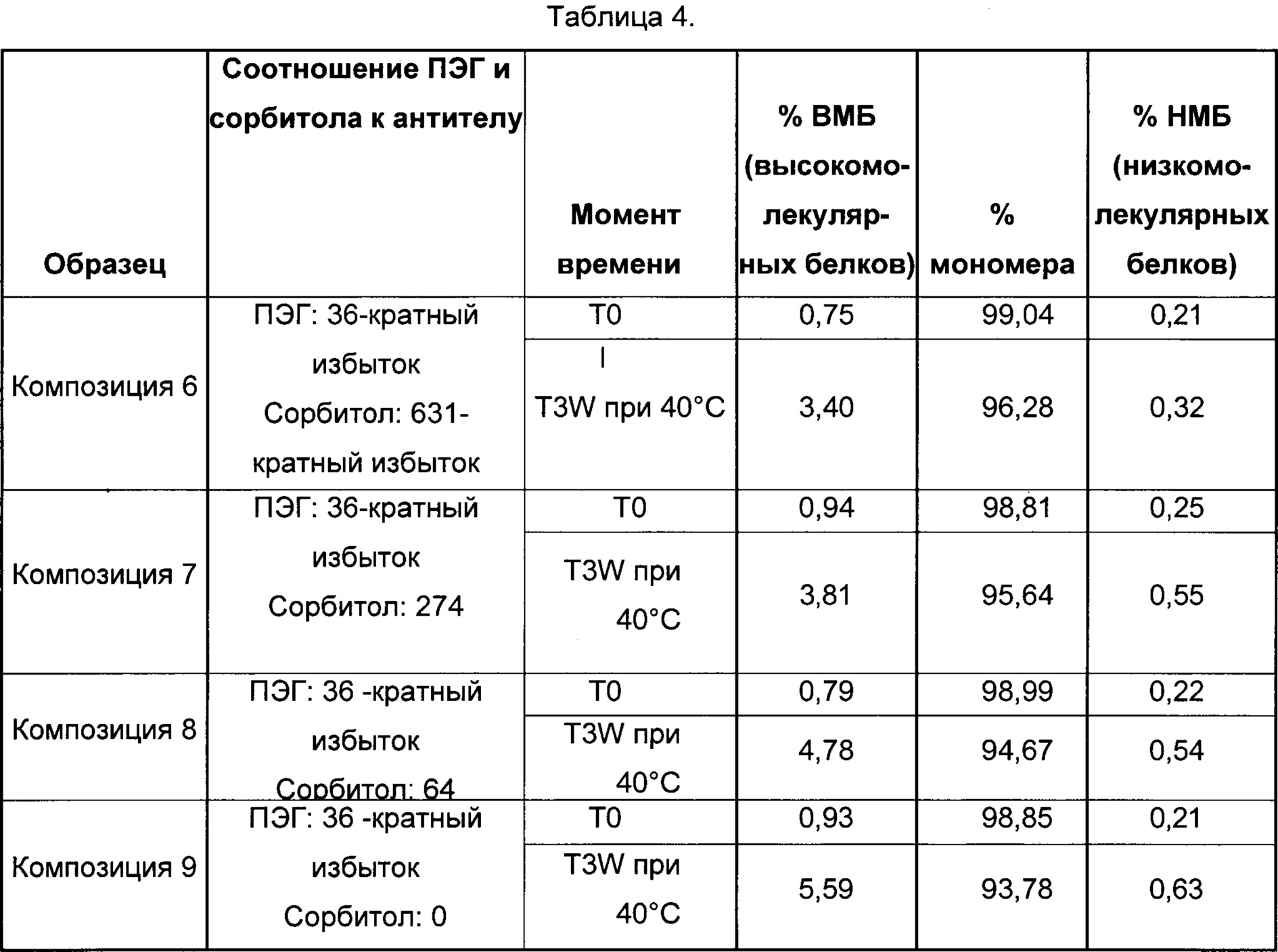
На фиг. 3 представлена хроматограмма ИОХ тестируемой композиции 6.
ii. Химическая стабильность
В таблице 5 приведены данные по химической стабильности тестируемых композиций при Т0 и после выдерживания при 40°С в течение трех недель после восстановления.
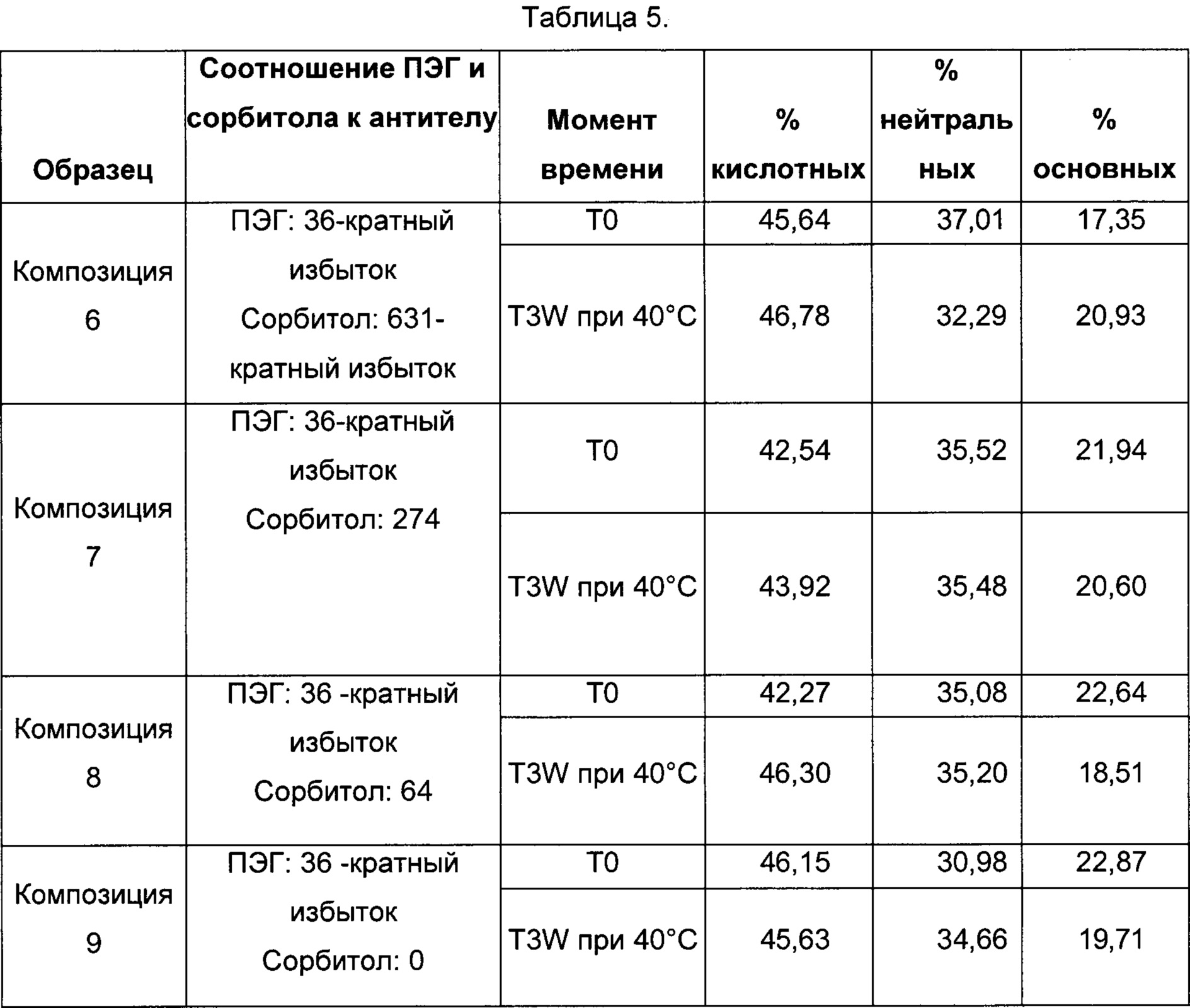
Четыре композиции были сопоставимы с точки зрения внешнего вида, рН и химической стабильности в начальный момент времени, а также после выдерживания при 40°С в течение трех недель. Однако можно наблюдать существенные различия в физической стабильности тестируемых композиций, как определено ГПХ. Данные анализа физической стабильности представлены в таблице 6, показывающие, что композиция 6 является лучшей. Корреляция между количеством сорбитола и физической стабильностью является очевидной, причем композиции с большей долей сорбитола имеют большую стабильность лекарственного продукта.

3. Исследования жидкого состояния
Влияние молярного избытка добавки ПЭГ/сорбитола оценивали по типу и степени деградации. Эксперимент проводили в жидком состоянии, так как в лиофилизированном состоянии можно было бы ожидать более сильную деградацию.
Жидкие композиции готовили в концентрации 25 мг/мл антитела (Ab) и с различными концентрациями добавки сорбитола/полимера, соответствующими 0,167 мМ белка.
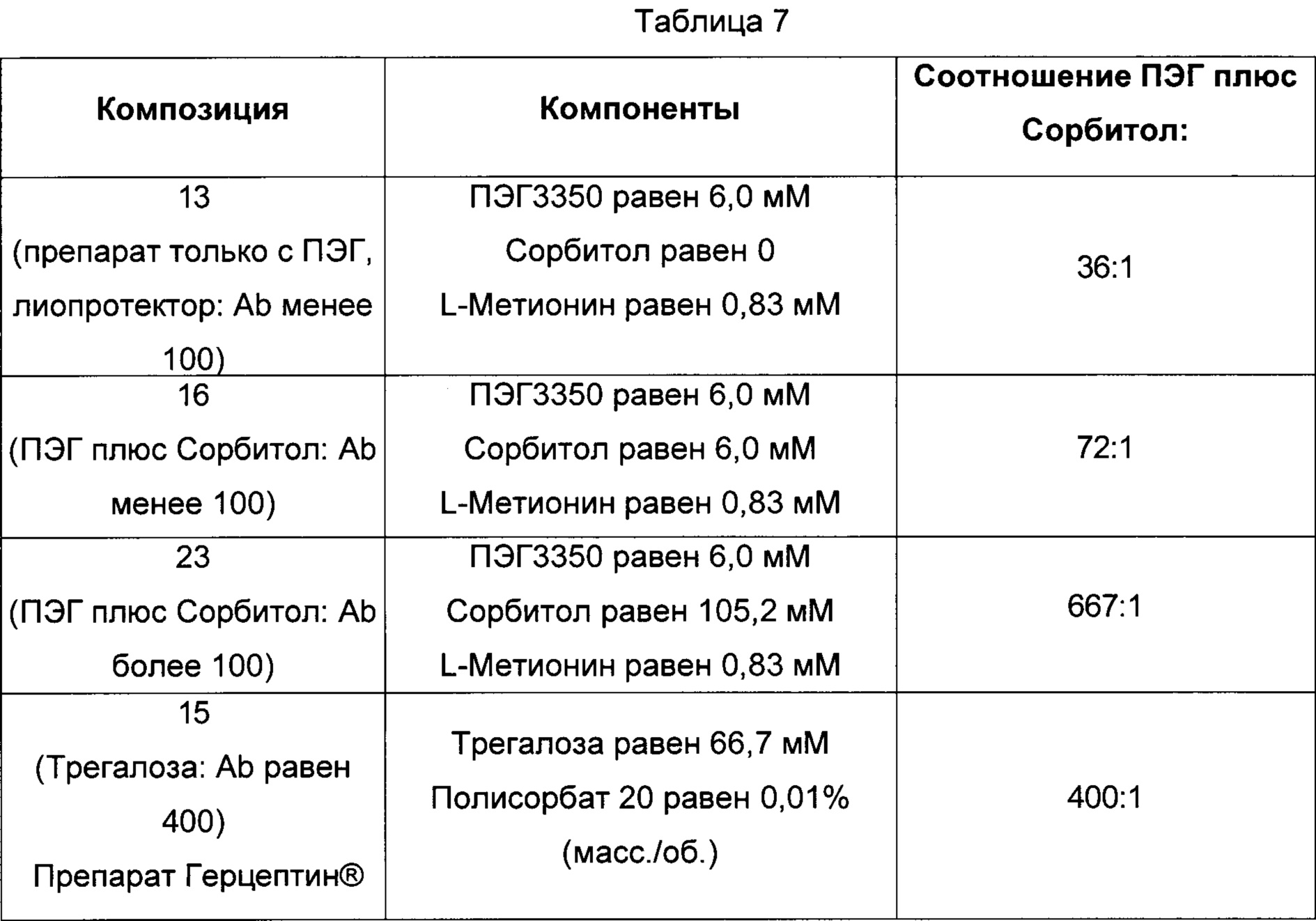
Композиции 13, 16, 23 содержали различные концентрации добавки ПЭГ/сорбитол. Композиция 15, содержащая трегалозу, является контролем. Во флаконы 2R добавляли 1 мл жидких композиций. Флаконы закрывали пробками, обжимали и выдерживали при 40°С в течение 4-х недель. Образцы отбирали через каждые 2 недели и анализировали на физическую стабильность методом ГПХ (таблица 8) и химическую стабильность методом ИОХ (таблица 10).
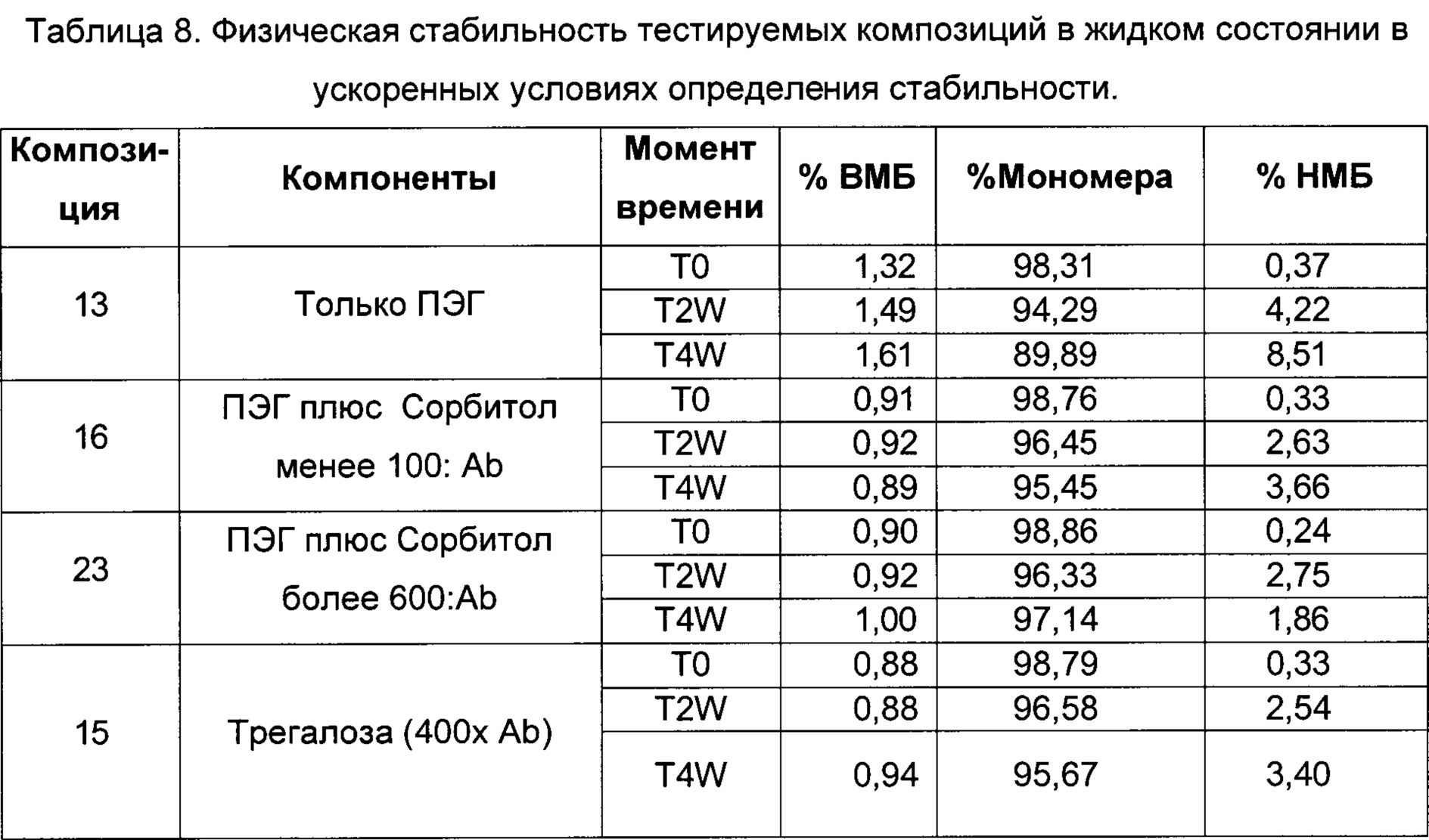
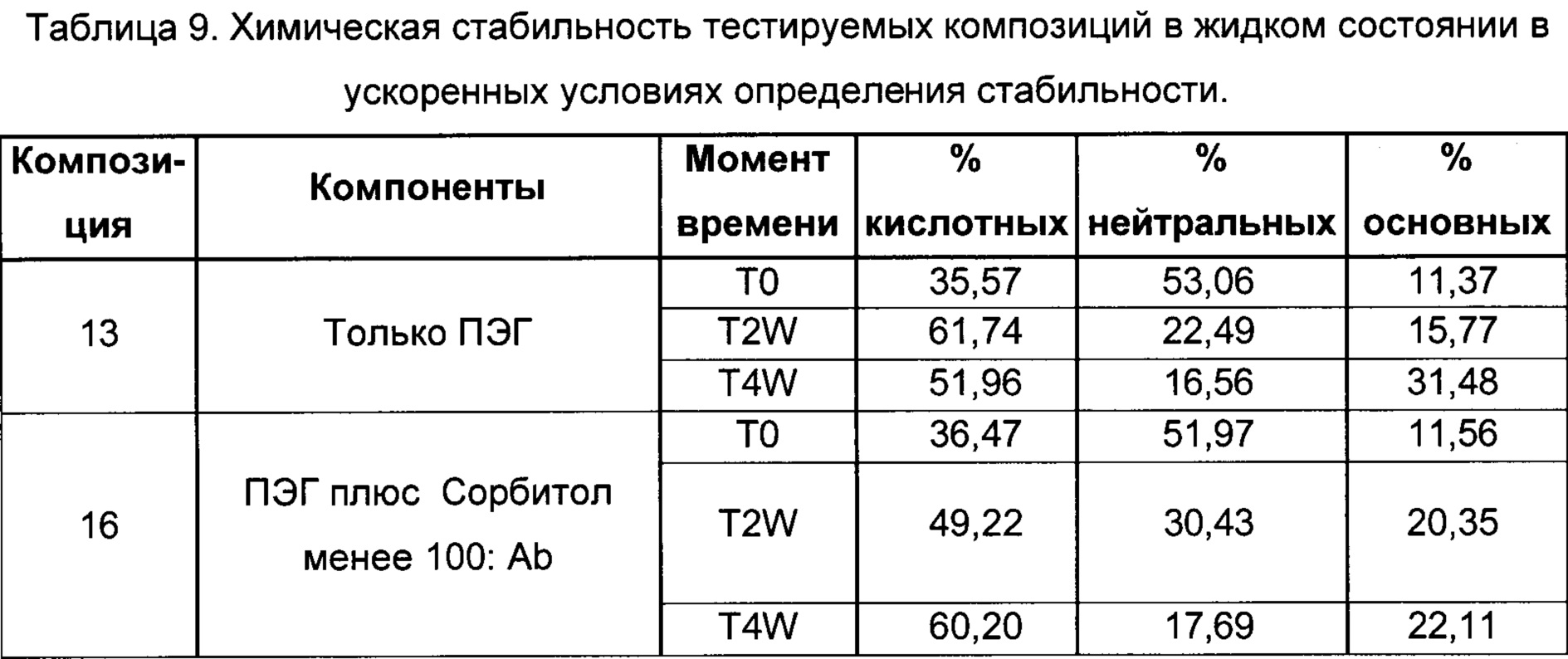
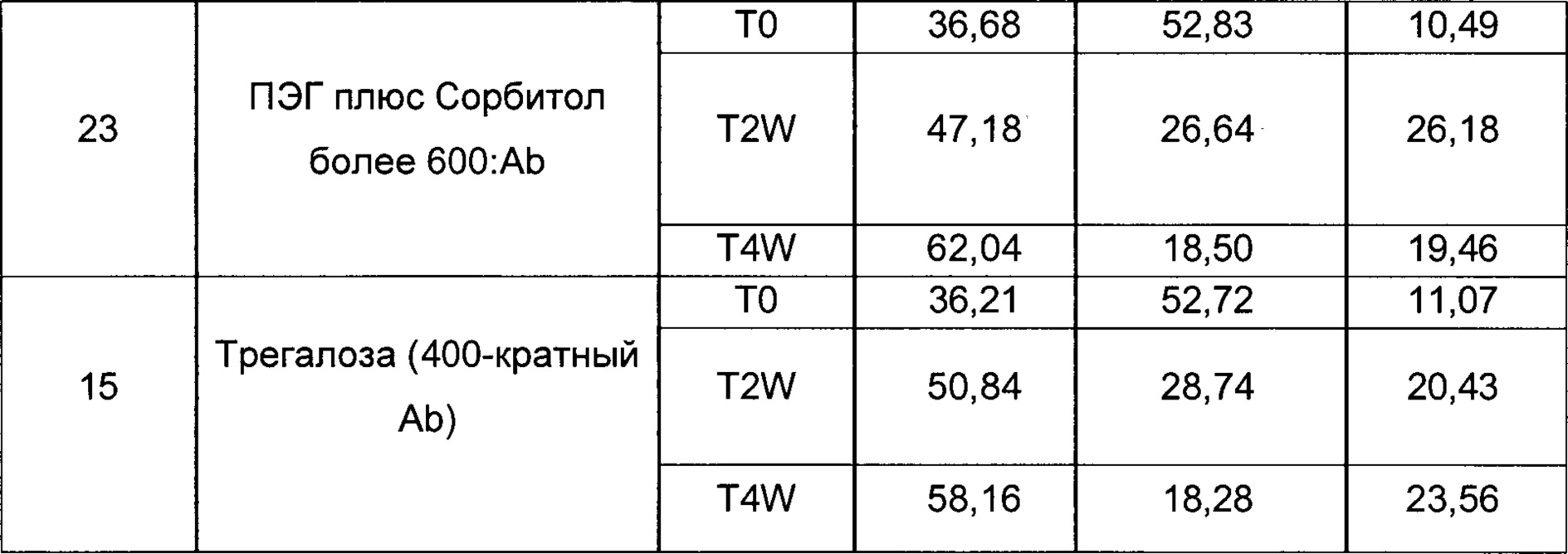
Физическая стабильность тестируемых композиций из экспериментов скрининга жидкостей показывает, что композиция 13, содержащая ПЭГ, была наименее стабильной, обнаруживая значительное увеличение фрагментации от 0,37% до 8,51% в течение 3-х недель при 40°С. Все другие тестируемые композиции, а именно 16 и 23, которые содержали различные количества сорбитола в дополнение к ПЭГ, имели сравнимую физическую стабильность.
Что касается химической стабильности, все композиции деградируют до некоторой степени, о чем свидетельствуют более высокие пропорции кислотных и основных вариантов при выдерживании при температуре 40°С в течение 3-х недель.
4. Анализ с помощью дифференциального сканирующего калориметра (ДСК)
Композиции содержали 150 мг трастузумаба в концентрации 25 мг/мл. 5 мл приготовленного сыпучего ЛВ помещали во флаконы на 15 мл, закупоривали наполовину с помощью покрытых хлорбутилом куполообразных пробок и лиофилизировали. Термическую стабильность композиции можно удобно контролировать с помощью ДСК. Повышение температуры плавления испытуемой композиции свидетельствует о повышенной стабильности. Поэтому лекарственный продукт от скрининга композиций анализировали с помощью ДСК. В таблице 10 показаны компоненты, присутствующие в композициях.

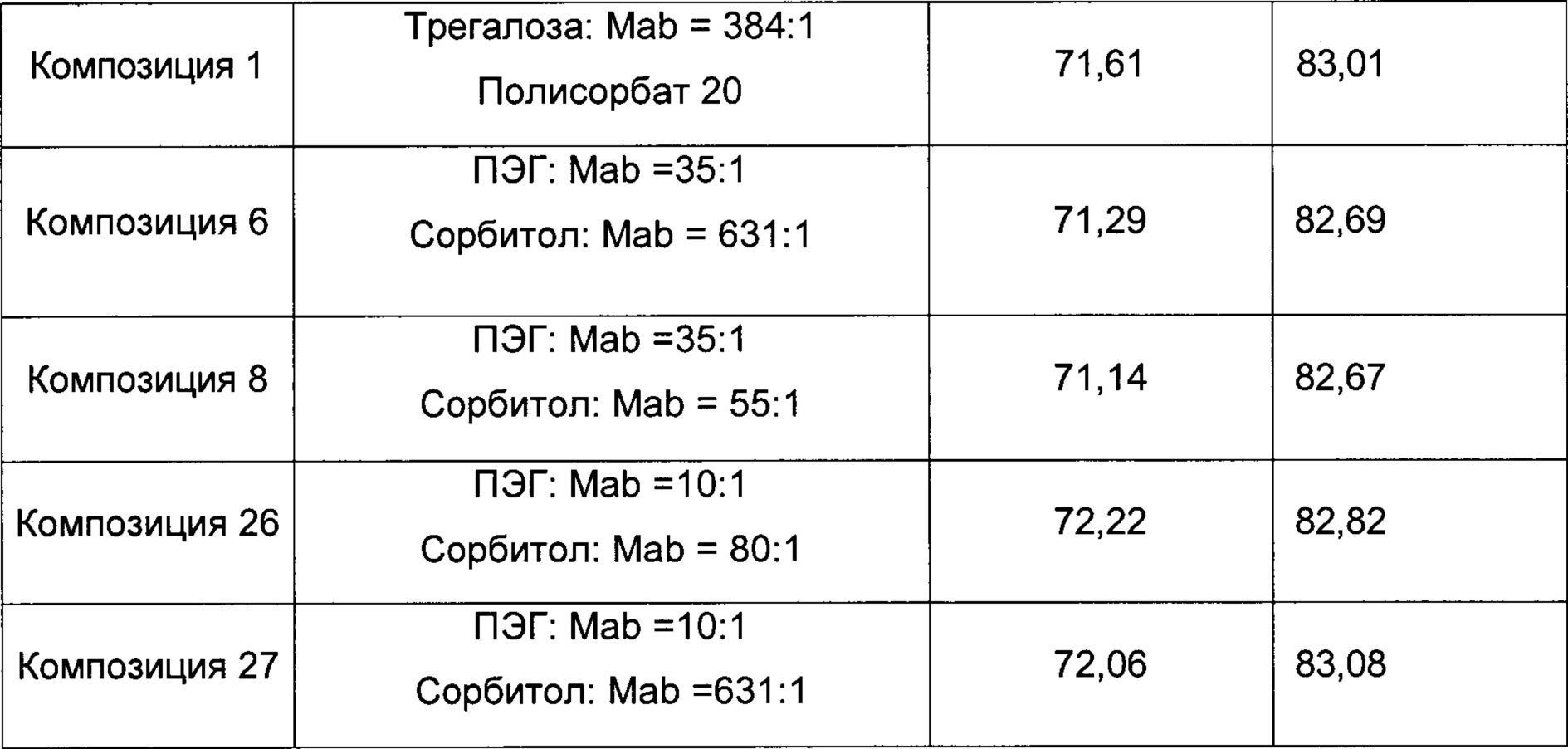
ДСК анализ лекарственного продукта из четырех тестируемых композиций (в концентрации 5 мг/мл, разбавленных соответствующим плацебо) показан на фиг. 4-9. Никаких существенных различий не наблюдалось между четырьмя тестируемыми композициями на основании температуры плавления для первого (Tm1) и второго перехода (Tm2). На фиг. 4 представлена ДСК композиции 6; на фиг. 5 представлена ДСК композиции 8; на фиг. 6 представлена ДСК композиции 26; на фиг. 7 представлена ДСК композиции 27; на фиг. 8 представлена ДСК композиции 1; и на фиг. 9 представлена ДСК герцептина.
5. Краткосрочные исследования физической и химической стабильности лиофилизированных композиций
Четыре тестируемые композиции подвергали краткосрочному анализу стабильности. Лиофилизированные композиции представлены в Таблице 11.

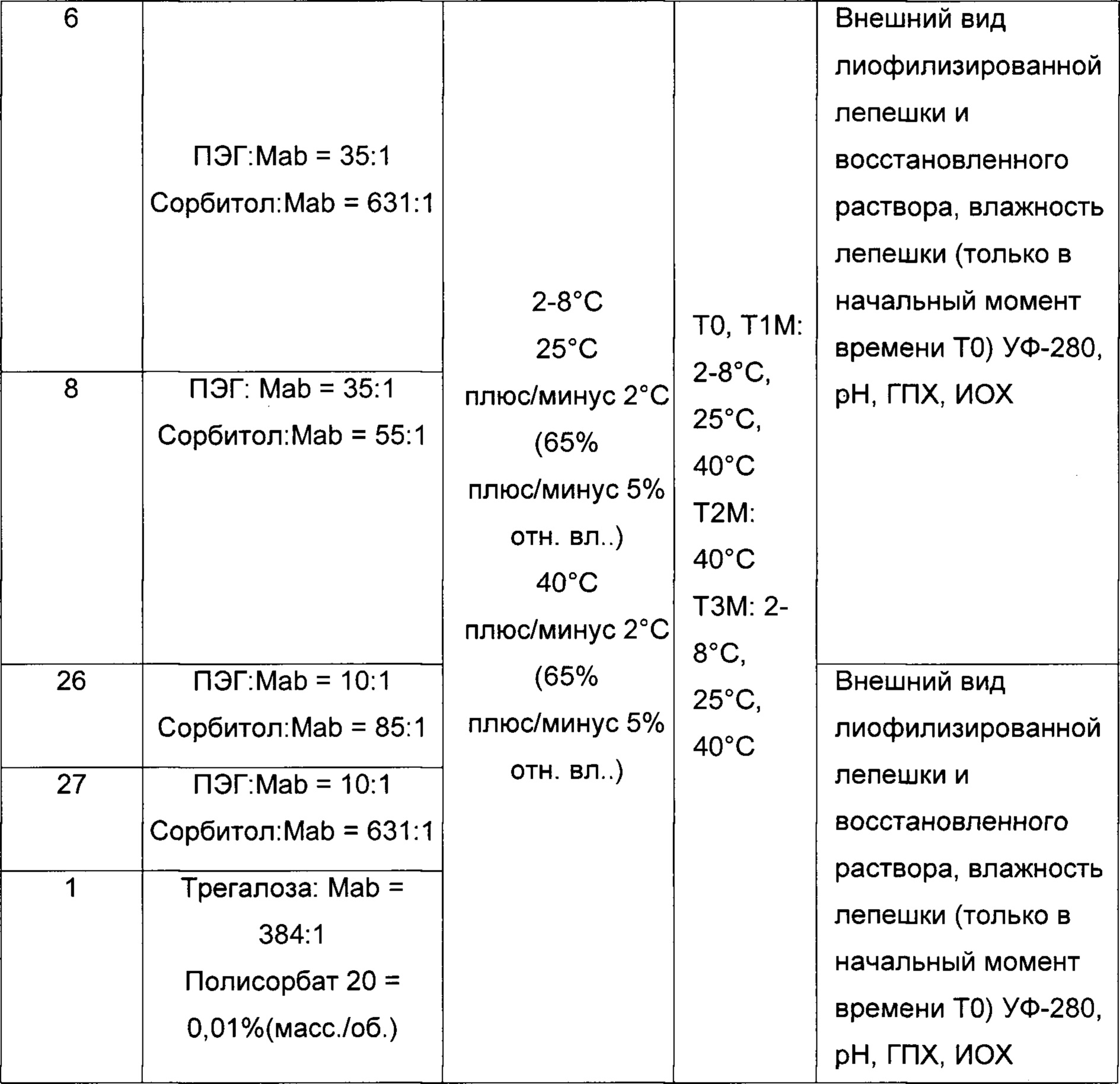
Проект программы стабильности подробно описан выше. В каждый момент времени лиофилизированную лепешку восстанавливали с использованием 7,2 мл воды для инъекций и анализировали параметры качества продукта (приведены в таблицах 12А-13Е).


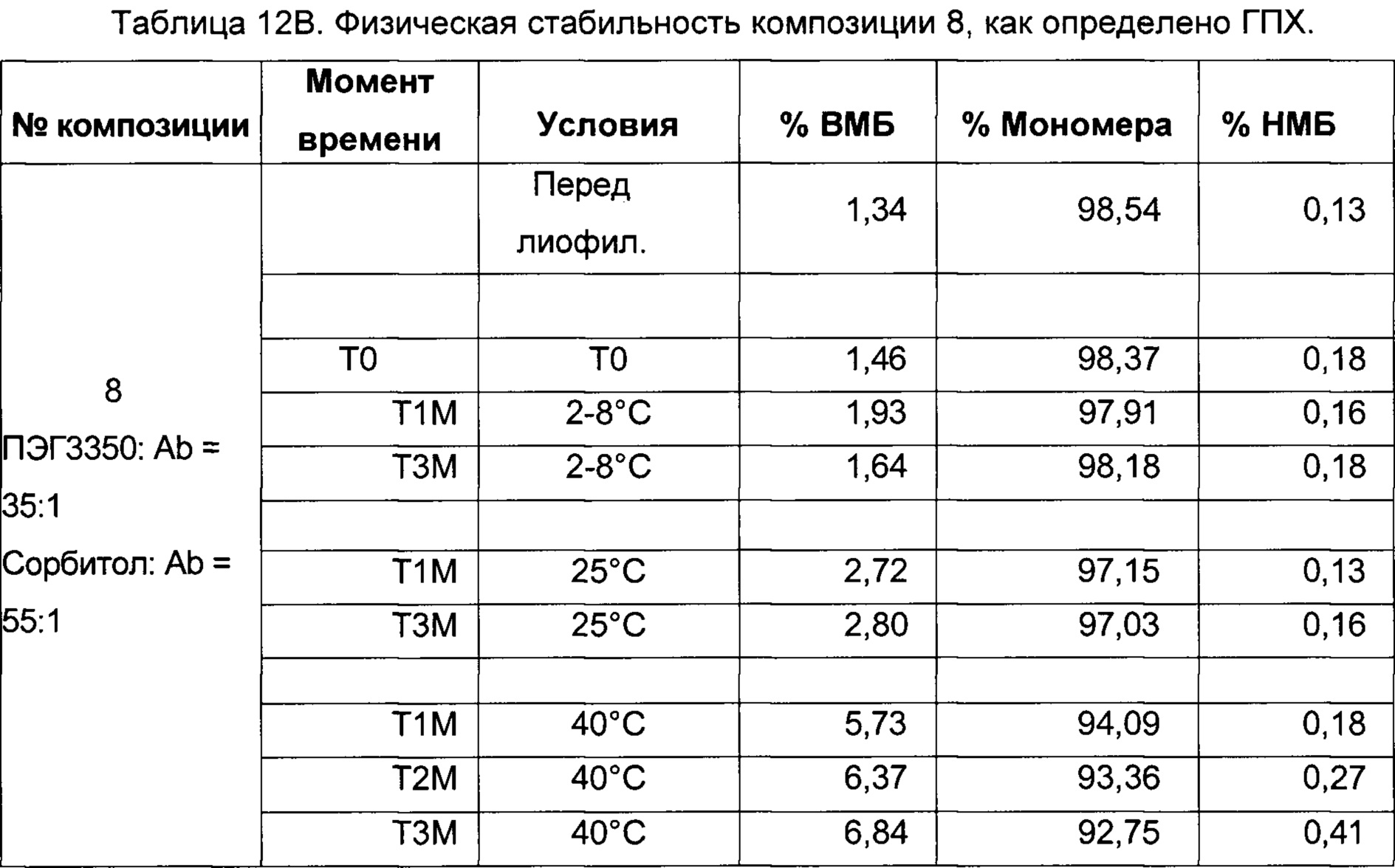
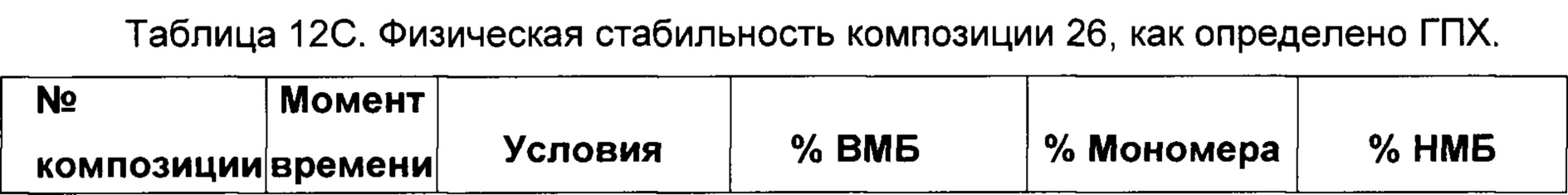
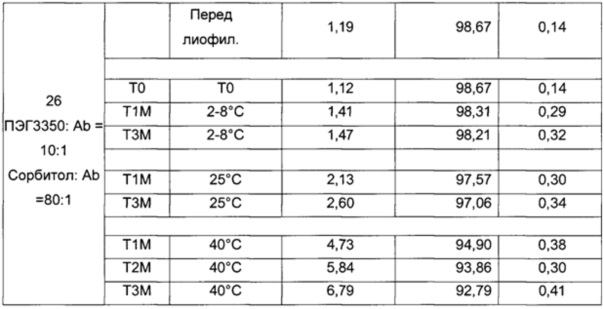
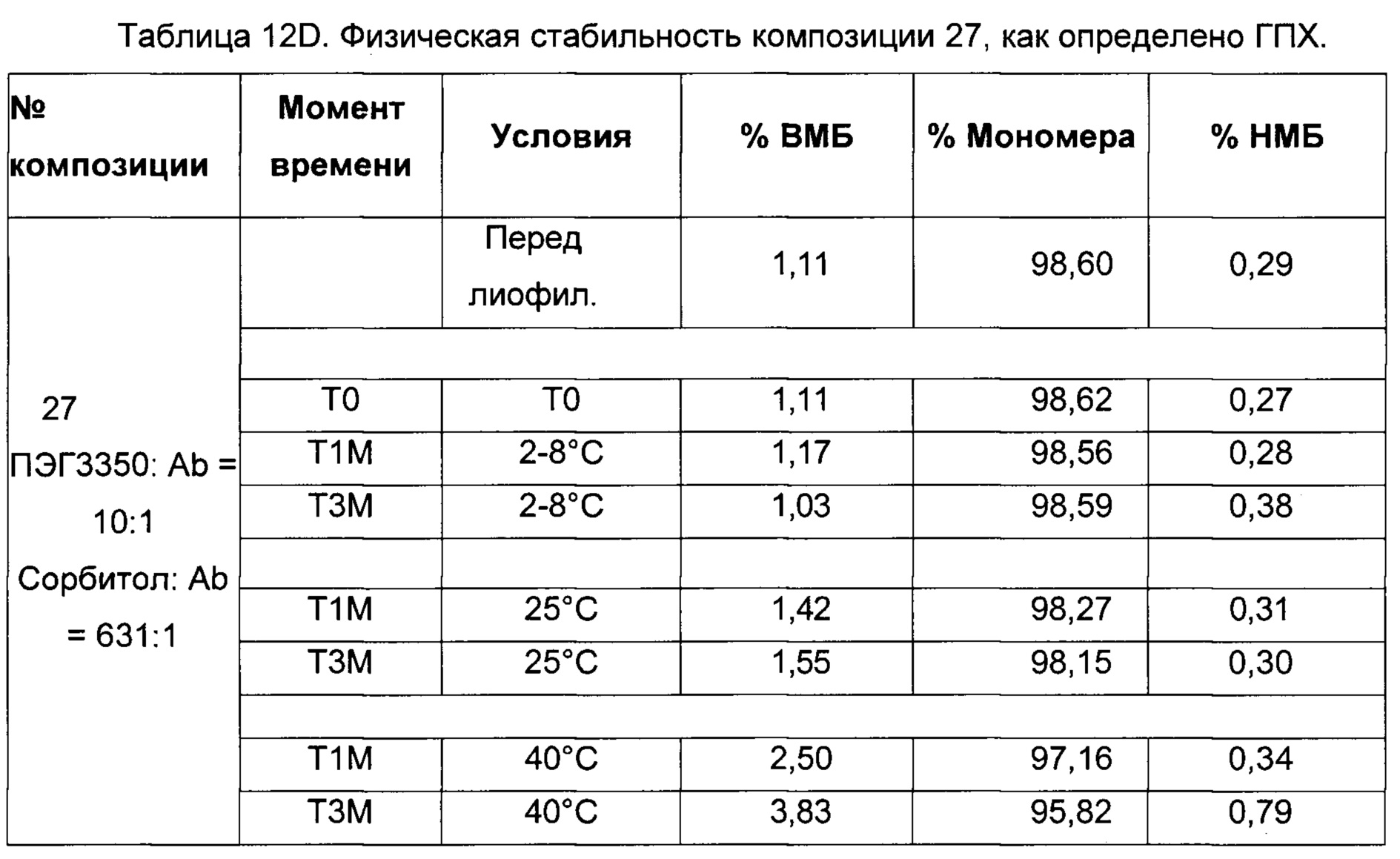

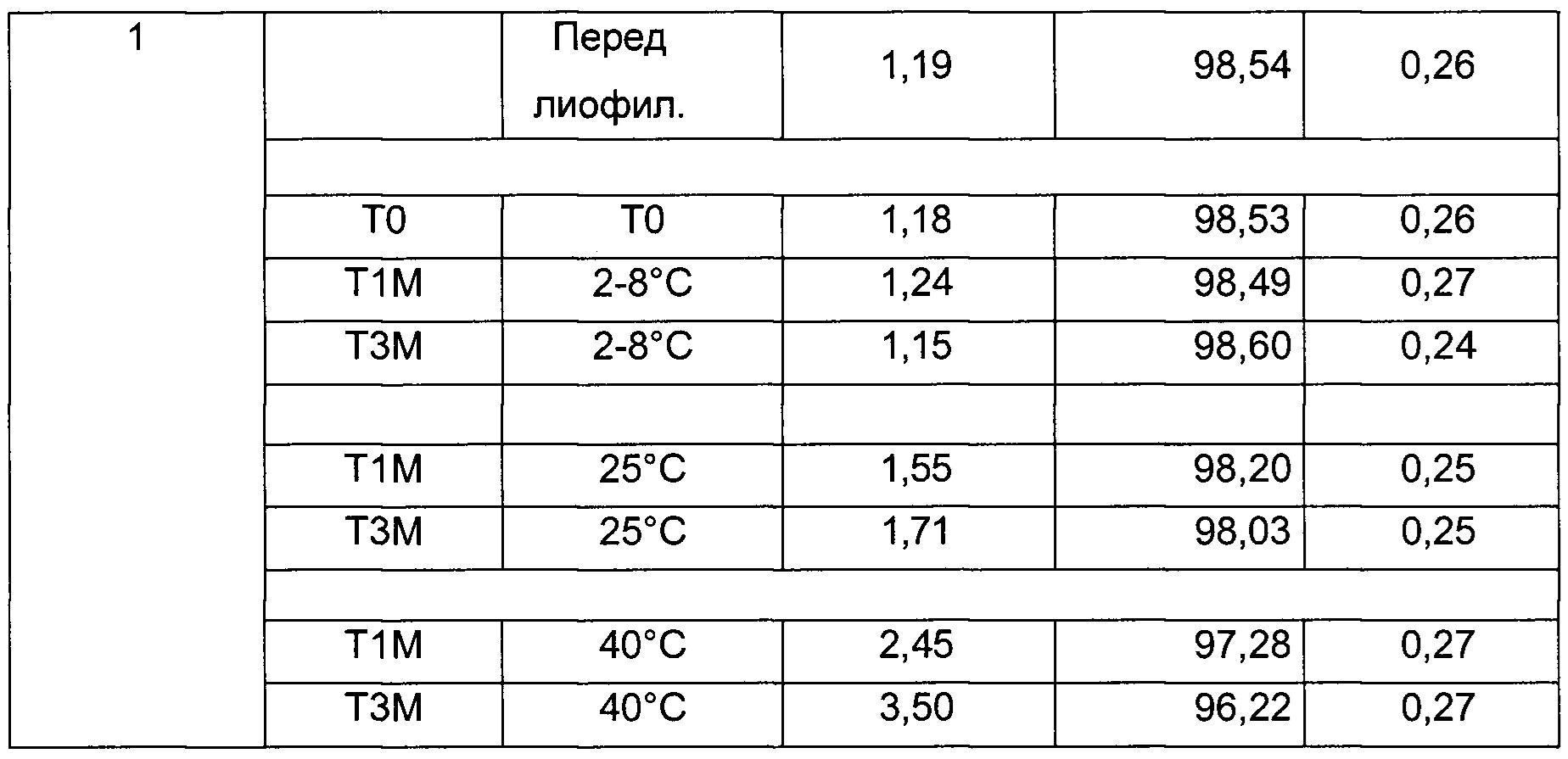
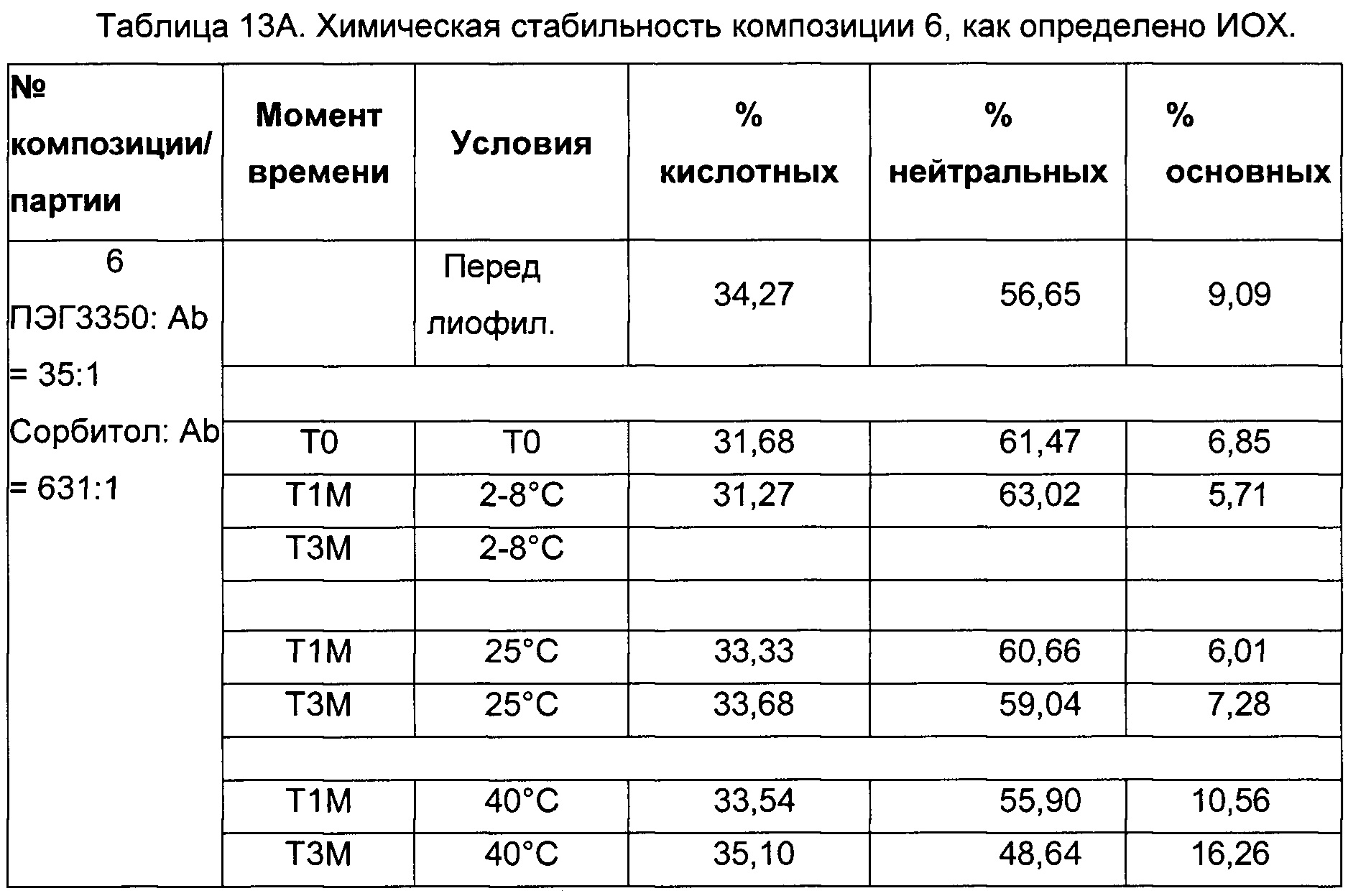

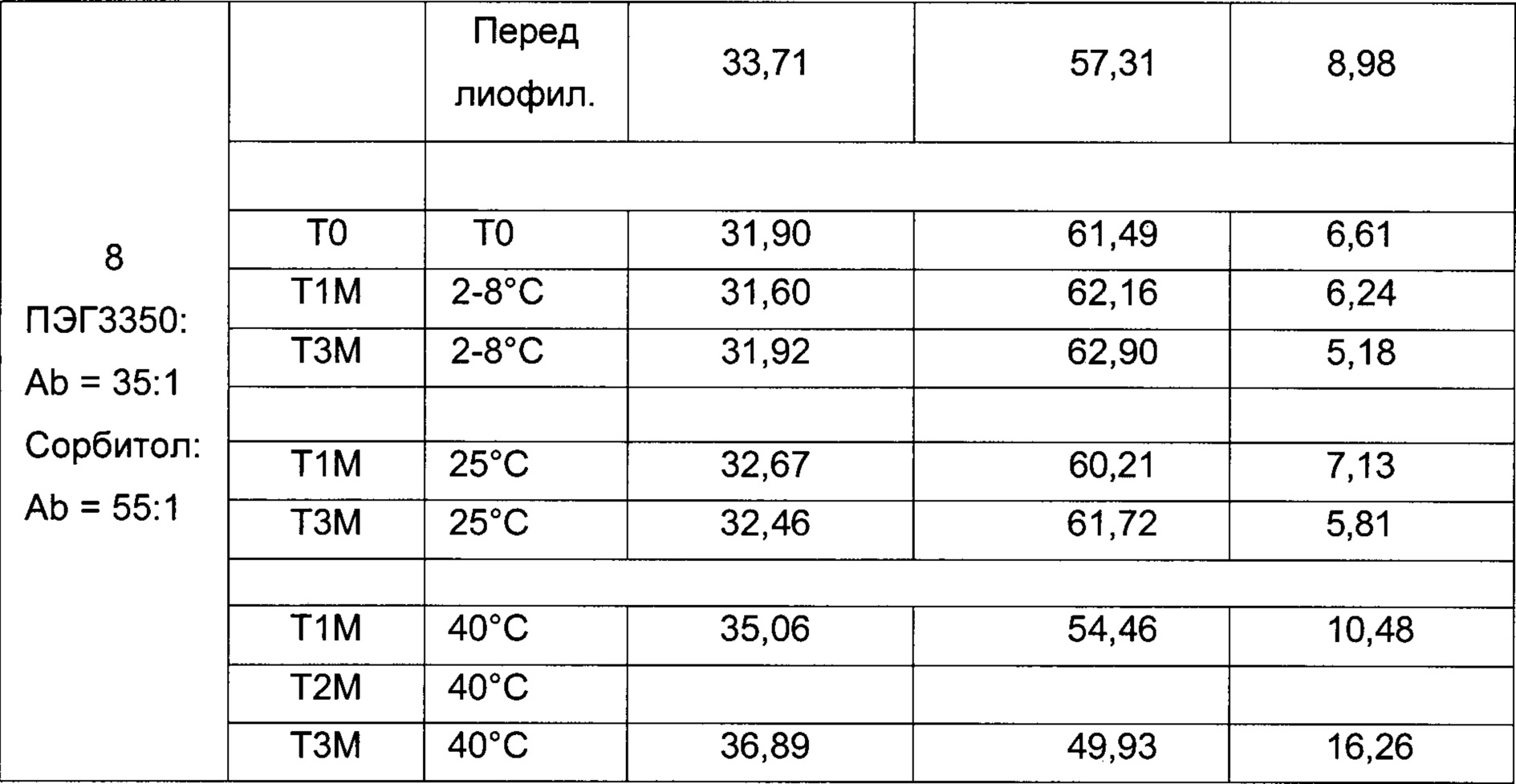
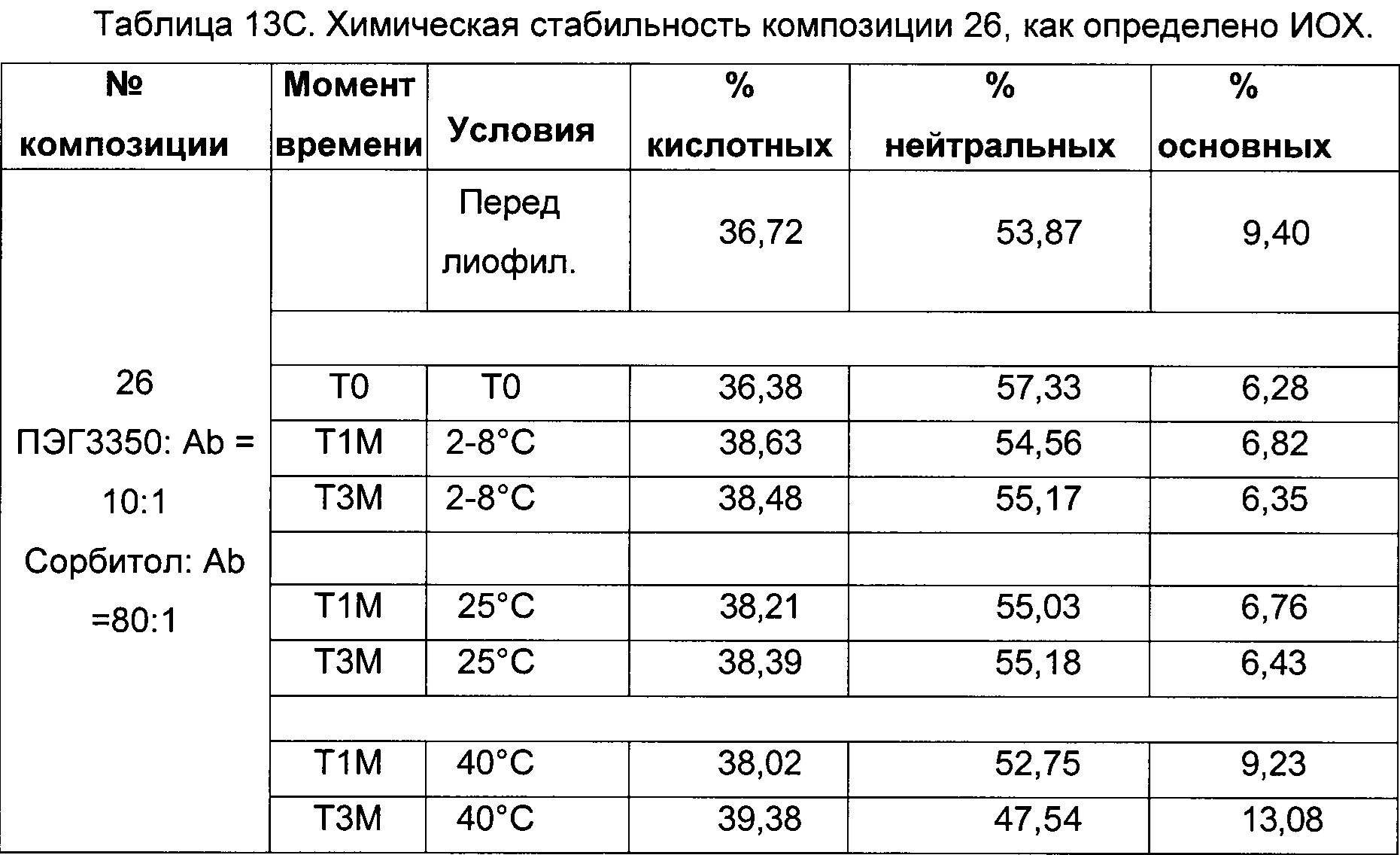

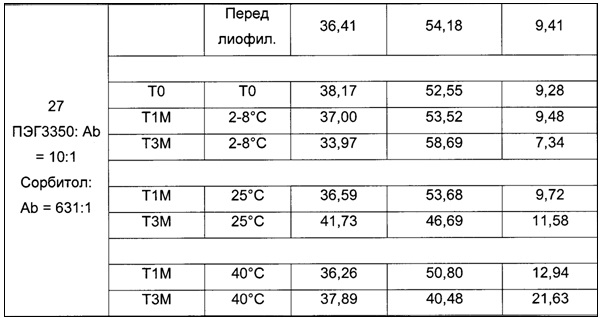
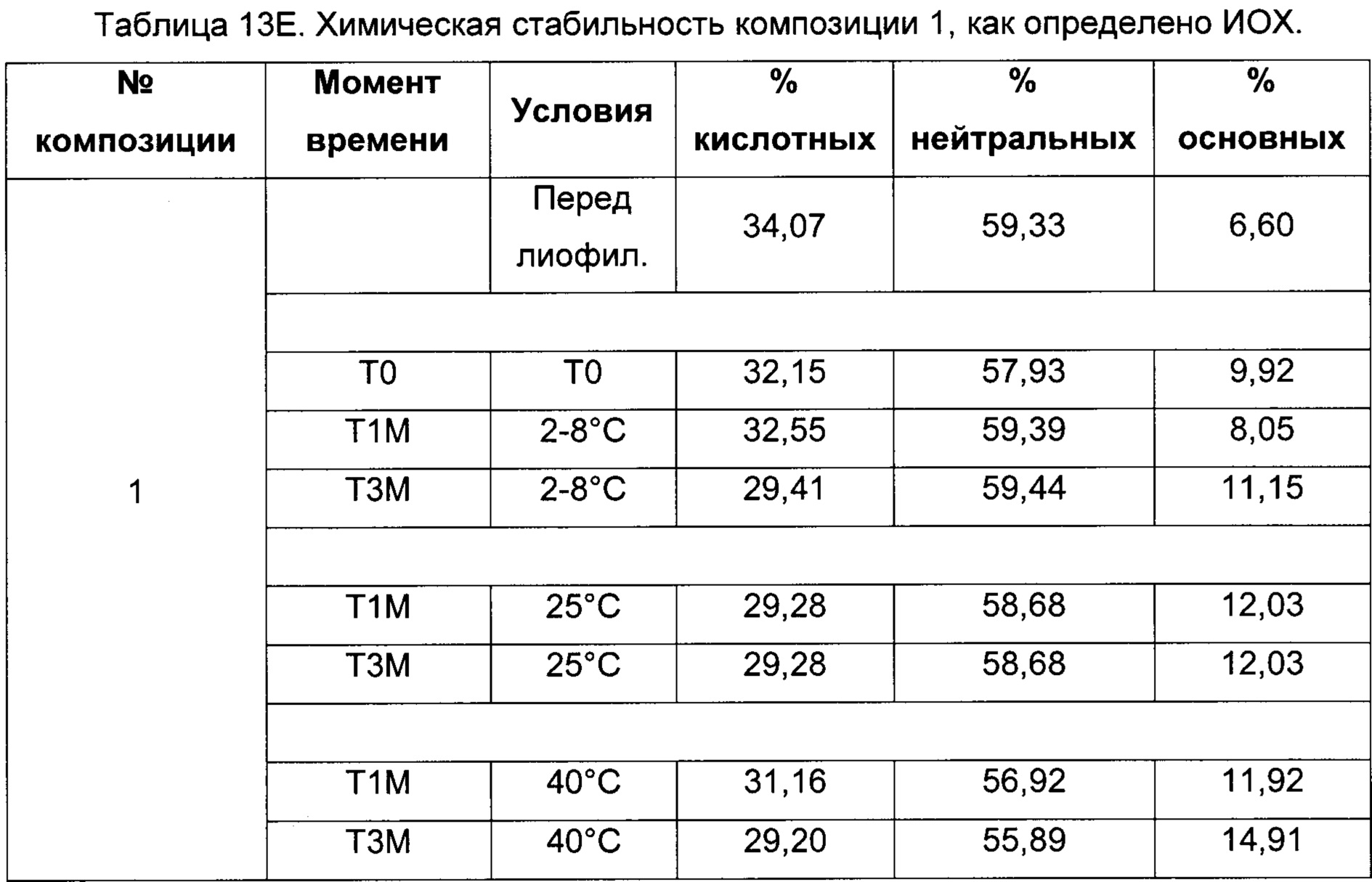
Лекарственный продукт, который лиофилизировали в 4-х тестируемых композициях, выдерживали при различных условиях, а именно при 2-8°С, 25°С плюс/минус 2°С (60% плюс/минус 5% относительной влажности) и 40°С плюс/минус 2°С (75% плюс/минус 5% относительной влажности) в течение от 3-х месяцев и сравнивали с лекарственным продуктом из контрольной композиции (композиция 1), который также выдерживали в таких же условиях. Контролировали физическую стабильность и химическую стабильность. Композиции, содержащие относительно высокое количество сорбитола, имели более высокую физическую стабильность, чем композиции с меньшим количеством сорбитола. В связи с этим, композиция 27 лучше, чем композиция 26, и композиция 6 лучше, чем композиция 8. Также относительно меньшая доля ПЭГ 3350 дает большую физическую стабильность лекарственного продукта. На основе физической стабильности качество композиций распределилось так: композиция 27> композиция 6> композиция 26 = композиция 8.
Фигуры 10-11 представляют сравнительные данные физической стабильности между лиофилизированной композицией и сыпучей лекарственной композицией.
В одном из примеров лиофилизированная композиция, обозначенная как композиция 27, была взята из 12 партий, а именно из партий 1-12, и выдерживалась при температуре 2-8°С в течение не менее 4-х лет. Было установлено, что эта композиция является стабильной в течение четырех лет (48 месяцев), как видно из фиг. 10.
В другом примере сыпучая лекарственная композиция перед лиофилизацией, обозначенная как композиция 27, также была взята из 12 партий, а именно из партий 1-12, и была определена стабильность при температуре -20°С в течение 2 лет. Все композиции показали стабильность в течение двух лет (24 месяцев) в экстремальных условиях.
Таким образом, было обнаружено, что сыпучее лекарство и лиофилизированная форма являются стабильными при хранении в течение по меньшей мере двух и четырех лет, соответственно, при выдерживании при указанных выше условиях.
6. Композиция сыпучего лекарственного вещества
Чтобы оценить, нужен ли сахар на стадии TFF, был приготовлен вирусный фильтрат в присутствии и в отсутствие сорбитола, и полученное лекарственное вещество проверяли с помощью гель-проникающей хроматографии (ГПХ) на предмет любых возможных изменений вариантов распределения по размерам.
Лекарственное вещество после TFF, помещенное в буфер His/His.HCl, подвергали вирусной фильтрации. Полученный вирусный фильтрат с концентрацией ~30 мг/мл готовили путем добавления жидких маточных растворов 1 М сорбитола и 50 мМ ПЭГ 3350, приготовленных в His/His.HCl буфере, до целевой конечной концентрации 105,4 мМ и 1,67 мМ соответственно. Конечную концентрацию сыпучего лекарственного вещества доводили до 25 мг/мл, используя буфер His/His.HCl, и рН доводили до 6,00 плюс/минус 0,50 с помощью 0,1 н NaOH или 0,1 н HCl, при необходимости.
Данные по размерам вариантов на каждой стадии показывают, что TFF лекарственного вещества в буфер, который не содержит сахара, не является разрушительной для белка.
Следует отметить, что объект с артиклем "а" или "an" означает один или несколько таких объектов; например, следует понимать, что понятие "анти-HER2 антитело" означает одно или несколько антител против HER2. Таким образом, термины "а" (или "an"), "один или более" и "по меньшей мере один" могут быть использованы здесь как взаимозаменяемые.
В описании и формуле изобретения слова "содержат", "содержит" и "содержащий" используются в неисключительном смысле, за исключением того, где контекст не требует иного.
Используемый в данном описании термин "приблизительно", когда речь идет о значении, охватывает отклонения в некоторых вариантах плюс/минус 20%, в некоторых вариантах плюс/минус 10%, в некоторых вариантах плюс/минус 5%, в некоторых вариантах плюс/минус 1%, в некоторых вариантах плюс/минус 0,5%, а в некоторых вариантах плюс/минус 0,1% от указанного значения, поскольку такие отклонения подходят для осуществления описанных способов или используются в описанных композициях.
Все публикации, заявки на патент, патенты и другие ссылки включены в данное описание посредством ссылки в той же степени, как если бы каждая отдельная публикация, заявка на патент, патент и другие ссылки были конкретно и индивидуально указаны как включенные посредством ссылки. Следует понимать, что, хотя ряд заявок на патент, патенты и другие ссылки упоминаются в настоящем документе, такие ссылки не являются признанием того, что любой из этих документов образует часть общеизвестных знаний в данной области.
Хотя вышеописанный предмет изобретения был описан довольно подробно путем иллюстрации и примера в целях ясности понимания, специалистам в данной области техники будет понятно, что можно выполнить определенные изменения и модификации в пределах объема прилагаемой формулы изобретения.
Имея, таким образом, подробно описанные предпочтительные варианты осуществления настоящего изобретения, следует понимать, что изобретение, определенное указанными выше параграфами, не должно быть ограничено конкретными деталями, изложенными в приведенном выше описании, поскольку возможно много очевидных их вариаций, не выходящих за пределы духа или объема настоящего изобретения.