ПИРАЗОЛОТИАЗОЛОВОЕ СОЕДИНЕНИЕ И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к фармацевтической композиции, содержащей новое пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват в качестве активного ингредиента.
Уровень техники
[0002]
Тирозинкиназы представляют собой группу ферментов, которые специфически фосфорилируют остаток тирозина в белках. Ферменты играют значительную роль во внутриклеточных путях передачи сигнала и связаны с широким спектром биологических функций, включая выживание, дифференцировку, пролиферацию и секрецию клеток. Семейство Janus киназы (также называемое JAK) известно как семейство внутриклеточных тирозинкиназ, связанное с цитокиновыми сигналами. Семейство JAK включает четыре типа ферментов: JAK1, JAK2, JAK3 и тирозинкиназа 2 (также называемая Tyk2). Как только цитокин связывается с его соответствующим цитокиновым рецептором, JAK фосфорилируется и затем фосфорилируется остаток тирозина рецептора. Затем, передатчик сигнала и активатор транскрипции (также называемый «STAT»), который существует в клетках, связывается с фосфорилированным тирозиновым остатком рецептора, и тирозиновый остаток STAT фосфорилируется JAK. Фосфорилированные STAT образуют димер, и димер транслоцируется в ядро и активирует транскрипцию гена-мишени, что приводит к активации клеток. Пути JAK/STAT являются ключевыми путями внутриклеточной передачи сигнала цитокинов в иммунокомпетентных клетках (непатентная литература 1). Около 40 типов передач сигнала цитокинами опосредуются комбинацией четырех JAK и семи STAT, и нарушения продукции цитокинов и цитокиновых сигналов, как полагают, имеют непосредственное участие не только в различных иммунных и воспалительных заболеваниях, таких как аутоиммунные заболевания и аллергические заболевания, а также заболеваний, имеющих различные патологии, такие как рак. Соединения, подавляющие активацию этих путей JAK/STAT, привлекают внимание как новые терапевтические средства для лечения этих заболеваний, и, фактически, ингибиторы JAK уже были одобрены в Соединенных Штатах и Японии в качестве терапевтического средства для лечения миелофиброза, истинной полицитемии и ревматоидного артрита. Кроме того, эффекты таких соединений ожидаются при лечении других аутоиммунных заболеваний (таких как псориатический артрит, ювенильный артрит, болезнь Кастлемана, системная красная волчанка, синдром Шегрена, рассеянный склероз, воспалительное заболевание кишечника, болезнь Бехчета, миастения гравис, сахарный диабет 1 типа, иммуноглобулин-связанная нефропатия, аутоиммунные заболевания щитовидной железы, псориаз, склеродермия, волчаночный нефрит, сухой глаз, васкулит (такой как артериит Такаясу, гигантоклеточный артериит, микроскопический полиангиит, гранулематоз с полиангиитом и эозинофильный гранулематоз с полиангиитом), дерматомиозит, полимиозит и нейромиелит зрительного нерва), воспалительных заболеваний (таких как атопический дерматит, контактный дерматит, экзема, зуд, пищевая аллергия, бронхиальная астма, эозинофильная пневмония, хроническое обструктивное заболевание легких, аллергический ринит, хронический синусит, эозинофильный синусит, носовой полип, аллергический конъюнктивит, остеоартрит, анкилозирующий спондилит, болезнь Кавасаки, болезнь Бюргера, узелковый полиартериит и IgA-васкулит), пролиферативных заболеваний (таких как солидные опухоли, рак крови, злокачественная опухоль лимфоузла, миелопролиферативные заболевания, множественная миелома, фиброз легких и эозинофилия), внезапной потери слуха, диабетической нефропатии, очаговой алопеции, отторжения трансплантата костного мозга или отторжения трансплантата органа. В настоящее время проводятся клинические исследования для некоторых заболеваний, перечисленных выше, в Японии, США и Европе.
[0003]
В частности, различные биологические исследования показали важную роль JAK1 в передачах сигнала многих цитокинов (см. непатентная литература 2, 3 и 4), что свидетельствует о том, что ингибиторы JAK1 полезны при лечении заболеваний, таких как аутоиммунные заболевания: псориатический артрит (см. непатентная литература 5), ювенильный артрит (см. непатентная литература 6), болезнь Кастлемана (см. непатентная литература 6), системная красная волчанка (см. непатентная литература 7), синдром Шегрена (см. непатентная литература 8), рассеянный склероз (см. непатентная литература 9), воспалительное заболевание кишечника (см. непатентная литература 10), болезнь Бехчета (см. непатентная литература 11), миастения гравис (см. непатентная литература 12), сахарный диабет 1 типа (см. непатентная литература 9), иммуноглобулин-связанная нефропатия (см. непатентная литература 13), аутоиммунные заболевания щитовидной железы (см. непатентная литература 14), псориаз (см. непатентная литература 15), склеродермия (см. непатентная литература 16), волчаночный нефрит (см. непатентная литература 17), сухой глаз (см. непатентная литература 18), васкулит (см. непатентная литература 19, 20, 21, 22 и 23), дерматомиозит (см. непатентная литература 24), полимиозит (см. непатентная литература 24), нейромиелит зрительного нерва (см. непатентная литература 25); воспалительные заболевания: атопический дерматит (см. непатентная литература 26), контактный дерматит (см. непатентная литература 27), экзема (см. непатентная литература 28), зуд (см. непатентная литература 29), пищевая аллергия (см. непатентная литература 30), бронхиальная астма (см. непатентная литература 31), эозинофильная пневмония (см. непатентная литература 32), хроническое обструктивное заболевание легких (см. непатентная литература 33), аллергический ринит (см. непатентная литература 31), хронический синусит (см. непатентная литература 34), эозинофильный синусит, носовой полип (см. непатентная литература 35), аллергический конъюнктивит (см. непатентная литература 36), остеоартрит (см. непатентная литература 37), анкилозирующий спондилит (см. непатентная литература 6), болезнь Кавасаки (см. непатентная литература 38), болезнь Бюргера (см. непатентная литература 39), узелковый полиартериит (см. непатентная литература 40), IgA-васкулит (см. непатентная литература 41); пролиферативные заболевания: солидные опухоли, рак крови, злокачественная опухоль лимфоузла, миелопролиферативные заболевания, множественная миелома (см. непатентная литература 42, 43 и 44), внезапная потеря слуха (см. непатентная литература 45), диабетическая нефропатия (см. непатентная литература 46), очаговая алопеция (см. непатентная литература 47), отторжение трансплантата костного мозга или отторжение трансплантата органа, и тому подобное. Например, проводятся следующие клинические исследования: ревматоидный артрит (https://clinicaltrials.gov/ NCT01888874 и NCT02049138), болезнь Крона (https://clinicaltrials.gov/ NCT02365649), немелкоклеточный рак легкого (https://clinicaltrials.gov/ NCT02257619), рак поджелудочной железы (https://clinicaltrials.gov/ NCT01858883), миелофиброз (https://clinicaltrials.gov/ NCT01633372) и псориаз (https://clinicaltrials.gov/ NCT02201524).
[0004]
Кроме того, среди цитокиновых сигналов, связанных с JAK1, ингибиторы для следующих цитокинов уже были открыты.
(1) IL-6 (также называемый интерлейкин-6): терапевтические средства для лечения ревматоидного артрита, ювенильного артрита и болезни Кастлемана (см. непатентная литература 48, 49 и 50).
(2) IL-2: терапевтическое средство для лечения острого отторжения после трансплантации почки (см. непатентная литература 51).
[0005]
Кроме того, в настоящее время ведутся клинические испытания следующих ингибиторов цитокина.
(3) IL-4 и IL-13: терапевтическое средство для лечения бронхиальной астмы, атопического дерматита, эозинофильного синусита, носового полипа и эозинофильного эзофагита (см. непатентная литература 31).
(4) IL-13: терапевтическое средство для лечения фиброза легких (см. https://clinicaltrials.gov/ NCT02036580).
(5) IL-5: терапевтическое средство для лечения бронхиальной астмы, хронического обструктивного заболевания легких, эозинофилии, эозинофильного гранулематоза с полиангиитом, эозинофильного эзофагита, эозинофильного синусита/носового полипа и атопического дерматита (см. непатентная литература 31 и непатентная литература 52).
(6) IFNα (также называемый интерферон-α): терапевтическое средство для лечения системной красной волчанки (см. непатентная литература 7).
(7) IL-31: терапевтическое средство для лечения атопического дерматита (https://clinicaltrials.gov/ NCT01986933).
(8) TSLP (также называемый тимусный стромальный лимфопоэтин): терапевтические средства для лечения бронхиальной астмы (https://clinicaltrials.gov/ NCT02054130) и атопического дерматита (https://clinicaltrials.gov/ NCT00757042).
[0006]
Таким образом, ингибирование передачи сигнала JAK1 является предпочтительным средством для профилактики или лечения заболеваний, вызванных нарушениями передачи сигнала JAK1, таких как аутоиммунные заболевания, воспалительные заболевания и пролиферативные заболевания.
[0007]
В качестве ингибитора JAK1, сообщалось о [1,2,4]триазоло[1,5-a]пиридинах (см. патентная литература 1 и 2), трициклических пиразинонах (см. патентная литература 3), пирролопиримидинах (см. патентная литература 4-7), фталазинах (см. патентная литература 8), имидазопирролопиридинах (см. патентная литература 9 и непатентная литература 53), диамино-1,2,4-триазолах (см. непатентная литература 54), пиразоло[1,5-a]пиридинах (см. патентная литература 10), имидазо[1,2-a]пиридинах (см. патентная литература 11 и 12), бензимидазолах (см. патентная литература 13), 7-азаиндолах (см. патентная литература 14). Однако ни один из упомянутых документов не раскрывает пиразоло[5,1-b][1,3]тиазоловых соединений.
Документы предшествующего уровня техники
Непатентная литература
[0008]
[Непатентная литература 1] O'Shea et al., Immunity, 2012, 36, 542-550.
[Непатентная литература 2] O'Sullivan et al., Mol. Immunol., 2007, 44, 2497-2506.
[Непатентная литература 3] Quintás-Cardama et al., Nat. Rev. Drug Discov., 2011, 10, 127-140.
[Непатентная литература 4] Haan et al., Chem. Biol., 2011, 18, 314-323.
[Непатентная литература 5] Gan et al., BioDrugs, 2013, 27, 359-373.
[Непатентная литература 6] Mihara et al., Clin. Sci. (Lond.), 2012, 122, 143-159.
[Непатентная литература 7] Wallace et al., 71st Ann. Meet. Am. Coll. Rheumatol., 2007, Abs. 1315.
[Непатентная литература 8] Gliozzi et al., J. Autoimmun., 2013, 40, 122-133.
[Непатентная литература 9] Neurath et al., Cytokine Growth Factor Rev., 2011, 22, 83-89.
[Непатентная литература 10] Vuitton et al., Curr. Drug Targets, 2013, 14, 1385-1391.
[Непатентная литература 11] Akdeniz et al., Ann. Acad. Med. Singapore, 2004, 33, 596-599.
[Непатентная литература 12] Dalakas, Ann. N.Y. Acad. Sci., 2012, 1274, 1-8.
[Непатентная литература 13] Goto et al., Clin. Immunol., 2008, 126, 260-269.
[Непатентная литература 14] Nanba et al., Thyroid, 2009, 19, 495-501.
[Непатентная литература 15] Strober et al., Br. J. Dermatol., 2013, 169, 992-999.
[Непатентная литература 16] Christner et al., Curr. Opin. Rheumatol., 2004, 16, 746-752.
[Непатентная литература 17] Dong et al., Lupus, 2007, 16, 101-109.
[Непатентная литература 18] Lim et al., Cornea, 2015, 34, 248-252.
[Непатентная литература 19] Saadoun et al., Arthritis Rheumatol., 2015, 67, 1353-1360.
[Непатентная литература 20] Kieffer et al., Rev. Med. Interne., 2014, 35, 56-59.
[Непатентная литература 21] Takenaka et al., Clin. Rheumatol., 2014, 33, 287-289.
[Непатентная литература 22] Kobold et al., Clin. Exp. Rheumatol., 1999, 17, 433-440.
[Непатентная литература 23] Vaglio et al., Allergy, 2013, 68, 261-273.
[Непатентная литература 24] Gono et al., Rheumatology, 2014, 53, 2196-2203.
[Непатентная литература 25] Araki et al., Neurology, 2014, 82, 1302-1306.
[Непатентная литература 26] Bao et al., JAKSTAT, 2013, 2, e24137.
[Непатентная литература 27] Takanami-Ohnishi et al., J. Biol. Chem., 2002, 277, 37896-37903.
[Непатентная литература 28] Antoniu, Curr. Opin. Investig. Drugs, 2010, 11, 1286-1294.
[Непатентная литература 29] Sokołowska-Wojdyło et al., J. Eur. Acad. Dermatol. Venereol., 2013, 27, 662-664.
[Непатентная литература 30] Brown et al., Eur. Food Res. Technol., 2012, 235, 971-980.
[Непатентная литература 31] Legrand et al., J. Allergy Clin. Immunol. Pract., 2015, 3, 167-174.
[Непатентная литература 32] Kita et al., Am. J. Respir. Crit. Care Med., 1996, 153, 1437-1441.
[Непатентная литература 33] Southworth et al., Br. J. Pharmacol., 2012, 166, 2070-2083.
[Непатентная литература 34] Van Zele et al., Allergy, 2006, 61, 1280-1289.
[Непатентная литература 35] Nabavi et al., Allergol. Immunopathol. (Madr.), 2014, 42, 465-471.
[Непатентная литература 36] Sakai et al., Curr. Eye Res., 2013, 38, 825-834.
[Непатентная литература 37] Beekhuizen et al., Eur. Cell Mater., 2013, 26, 80-90.
[Непатентная литература 38] Abe, Nihon Rinsho, 2014, 72, 1548-1553.
[Непатентная литература 39] Slavov et al., Clin. Exp. Rheumatol., 2005, 23, 219-226.
[Непатентная литература 40] Kawakami et al., Acta. Derm. Venereol. 2012, 92, 322-323.
[Непатентная литература 41] Gülhan et al., Pediatr. Nephrol., 2015, 30, 1269-1277.
[Непатентная литература 42] Costa-Pereira et al., Am. J. Cancer Res., 2011, 1, 806-816.
[Непатентная литература 43] Vainchenker et al., Semin. Cell Dev. Biol., 2008, 19, 385-393.
[Непатентная литература 44] Li et al., Neoplasia, 2010, 12, 28-38.
[Непатентная литература 45] Masuda et al., Otol. Neurotol., 2012, 33, 1142-1150.
[Непатентная литература 46] Donate-Correa et al., J. Diabetes Res., 2015, 948417.
[Непатентная литература 47] Zhang et al., Arch. Dermatol. Res., 2015, 307, 319-331.
[Непатентная литература 48] Nishimoto et al., J. Rheumatol., 2003, 30, 1426-1435.
[Непатентная литература 49] Yokota et al., LANCET, 2008, 371, 998-1006.
[Непатентная литература 50] Nishimoto et al., Blood, 2000, 95, 56-61.
[Непатентная литература 51] Nashan et al., LANCET, 1997, 350, 1193-1198.
[Непатентная литература 52] Kouro et al., Int. Immunol., 2009, 21, 1303-1309.
[Непатентная литература 53] Kulagowski et al., Journal of Medicinal Chemistry, 2012, 55, 5901-5921.
[Непатентная литература 54] Malerich et al., Bioorg. Med. Chem. Lett., 2010, 20, 7454-7457.
Патентная литература
[0009]
[Патентная литература 1] WO 2010/149769
[Патентная литература 2] WO 2010/010190
[Патентная литература 3] WO 2012/085176
[Патентная литература 4] WO 2009/114512
[Патентная литература 5] WO 2011/075334
[Патентная литература 6] WO 2012/022045
[Патентная литература 7] WO 2012/054364
[Патентная литература 8] WO 2012/037132
[Патентная литература 9] WO 2011/086053
[Патентная литература 10] WO 2011/101161
[Патентная литература 11] WO 2011/076419
[Патентная литература 12] JP 2011/136925
[Патентная литература 13] WO 2005/066156
[Патентная литература 14] WO 2007/084557
Сущность изобретения
Цель изобретения
[0010]
Целью настоящего изобретения является получение соединения с превосходной ингибирующей активностью в отношении JAK1.
Средства для достижения цели
[0011]
Настоящее изобретение основано на открытии авторов изобретения, что соединение, представленное следующей общей формулой [I], или его фармацевтически приемлемая соль или его сольват (далее называемое как «соединение по настоящему изобретению») обладает превосходной ингибирующей активностью в отношении JAK1.
[0012]
Таким образом, настоящее изобретение раскрыто в следующих пунктах (I)-(XVII).
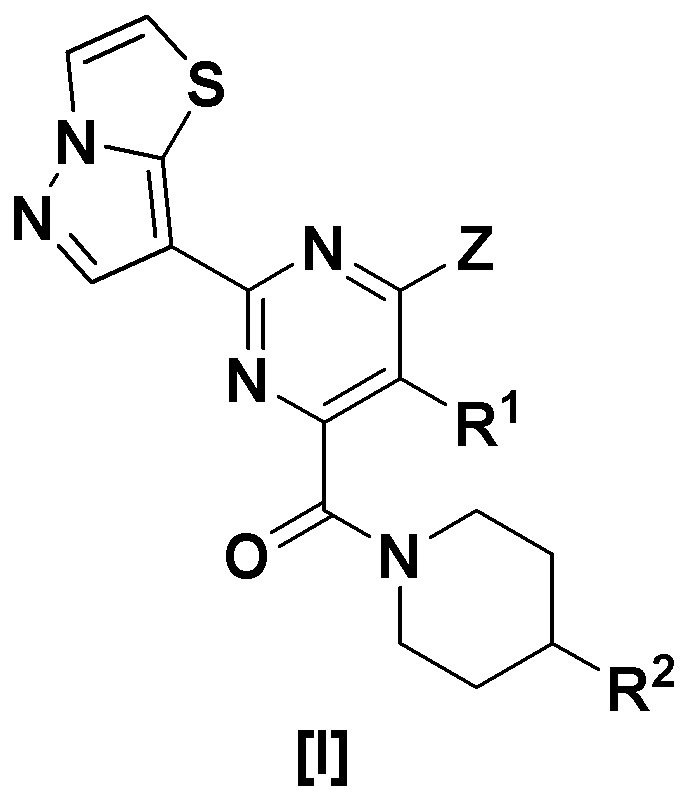
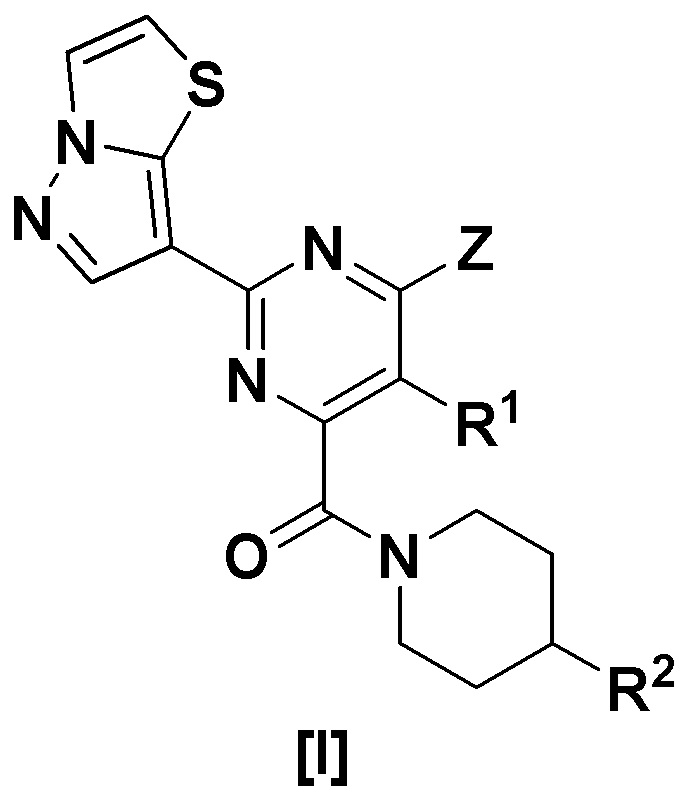
(I) Пиразолотиазоловое соединение, представленное формулой [I]:
[Формула 1]
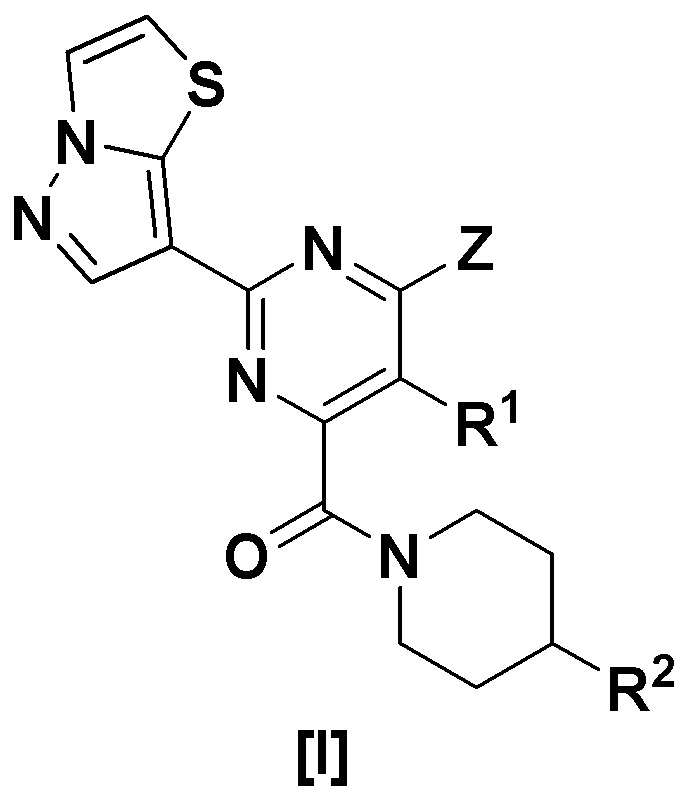
где,
R1 представляет собой водород, алкил или алкокси;
Z представляет собой -OR3 или -NR4R5;
где
R3 представляет собой алкил, алкил, замещенный циклоалкилом, циклоалкил, арил или гетероарил;
R4 представляет собой водород или алкил;
R5 представляет собой алкил, циклоалкил или насыщенную гетероциклическую группу,
указанный алкил и циклоалкил в R5 необязательно замещен одной или двумя группами, выбранными из группы, состоящей из следующих (1)-(6):
(1) гидрокси,
(2) алкокси и дифторалкокси,
(3) циклоалкил, циклоалкил, замещенный (дифторалкокси)алкилом, и циклоалкил, замещенный алкоксиалкилом,
(4) насыщенная гетероциклическая группа, необязательно замещенная (дифторалкокси)алкилом,
(5) арил, арил, замещенный галогеном, и арил, замещенный алкокси, и
(6) нитрил, и
указанная насыщенная гетероциклическая группа в R5 необязательно замещена одной или двумя группами, выбранными из группы, состоящей из следующих (1)-(3):
(1) алкил,
(2) алкилкарбонил, и
(3) алкоксикарбонил;
R2 представляет собой гидрокси или -NHR8,
где
R8 представляет собой гетероарил, гетероарил, замещенный галогеном, гетероарил, замещенный алкилом, -COL1, -COOL2 или -SO2L3,
указанный L1 представляет собой группу, выбранную из группы, состоящей из следующих (1)-(5):
(1) алкил, моногалогеналкил, дигалогеналкил, тригалогеналкил, и алкил, замещенный алкокси,
(2) циклоалкил,
(3) арил,
(4) гетероарил, и
(5) диалкиламино и циклоалкиламино,
указанный L2 представляет собой группу, выбранную из группы, состоящей из следующих (1)-(3):
(1) алкил, моногалогеналкил, дигалогеналкил, тригалогеналкил, и алкил, замещенный алкокси,
(2) циклоалкил, и
(3) диалкиламиноалкил, и
указанный L3 представляет собой алкил или циклоалкил,
или его фармацевтически приемлемая соль, или его сольват.
[0013]
(II) Пиразолотиазоловое соединение, описанное в пункте (I), или его фармацевтически приемлемая соль или его сольват, где R1 представляет собой водород.
[0014]
(III) Пиразолотиазоловое соединение, описанное в пункте (II), или его фармацевтически приемлемая соль или его сольват, где
Z представляет собой -NR4R5;
где
R4 представляет собой водород,
R5 представляет собой алкил или циклоалкил,
указанный алкил и циклоалкил в R5 необязательно замещены группой, выбранной из группы, состоящей из следующих (1)-(3):
(1) гидрокси,
(2) алкокси и
(3) циклоалкил,
R2 представляет собой гидрокси или -NHR8,
R8 представляет собой гетероарил, гетероарил, замещенный галогеном, гетероарил, замещенный алкилом, -COL1 или -COOL2,
указанный L1 представляет собой группу, выбранную из группы, состоящей из следующих (1)-(4):
(1) алкил, моногалогеналкил, дигалогеналкил, тригалогеналкил, и алкил, замещенный алкокси,
(2) циклоалкил,
(3) арил, и
(4) гетероарил, и
указанный L2 представляет собой алкил, моногалогеналкил, дигалогеналкил, тригалогеналкил, алкил, замещенный алкокси, или циклоалкил.
[0015]
(IV) Пиразолотиазоловое соединение, описанное в пункте (III), или его фармацевтически приемлемая соль или его сольват, где
R5 представляет собой алкил, алкил, замещенный гидрокси, алкил, замещенный циклопропилом, или алкил, замещенный алкокси, и
R2 представляет собой -NHR8.
[0016]
(V) Пиразолотиазоловое соединение, описанное в пункте (III), или его фармацевтически приемлемая соль или его сольват,
где
R5 представляет собой алкил, имеющий 2-6 атомов углерода, или алкил, замещенный циклопропилом,
R2 представляет собой -NHR8,
R8 представляет собой -COL1 или -COOL2,
указанный L1 представляет собой алкил, имеющий 2-6 атомов углерода, или циклопропил, и
указанный L2 представляет собой алкил или циклопропил.
[0017]
(VI) Пиразолотиазоловое соединение, описанное в пункте (I), которое представляет собой любое из следующих (1)-(135):
(1) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(2) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(3) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(4) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(5) N-(1-{[6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(6) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(7) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(8) N-[1-({6-[({1-[(дифторметокси)метил]циклопропил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(9) N-[1-({6-[({1-[(дифторметокси)метил]циклобутил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(10) N-[1-({6-[({1-[(дифторметокси)метил]циклопентил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(11) N-[1-({6-[({4-[(дифторметокси)метил]тетрагидро-2H-пиран-4-ил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(12) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(13) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(14) N-(1-{[6-{[(1S,2S)-2-(дифторметокси)циклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(15) N-[1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(16) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(17) N-(1-{[6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(18) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамид,
(19) N-(1-{[6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(20) [6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон,
(21) 1-фтор-2-метилпропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(22) метил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(23) [6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон,
(24) метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(25) метил (1-{[6-{[(2S)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(26) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(27) этил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(28) пропан-2-ил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(29) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид,
(30) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пиридин-3-карбоксамид,
(31) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)тиофен-2-карбоксамид,
(32) N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(33) 1-циклопропил-3-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)мочевина,
(34) [6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанон,
(35) N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(36) N-[1-({6-[(1-метилциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(37) N-[1-({6-[(1-метокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(38) метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(39) этил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(40) пропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(41) N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид,
(42) N-(1-{[6-(циклопропилметокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(43) N-[1-({6-[(3,3-диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(44) N-(1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(45) N-(1-{[6-(циклопентилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(46) N-(1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(47) N-[1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(48) [6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,2-оксазол-3-иламино)пиперидин-1-ил]метанон,
(49) [6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон,
(50) [6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-метил-1,2-оксазол-5-ил)амино]пиперидин-1-ил}метанон,
(51) N-(1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(52) [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон,
(53) метил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(54) пропан-2-ил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(55) метил [1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(56) [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон,
(57) метил (1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(58) метил [1-({6-[(3,3-диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(59) метил (1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(60) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)метансульфонамид,
(61) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропансульфонамид,
(62) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)этансульфонамид,
(63) N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамид,
(64) N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамид,
(65) этил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(66) [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанон,
(67) этил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(68) [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон,
(69) [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанон,
(70) метил [1-({6-[(2-метилбутан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(71) (4-гидроксипиперидин-1-ил)[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанон,
(72) пропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(73) пропил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(74) пропил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(75) пропил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(76) пропил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(77) метил [1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(78) 2-метоксиэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(79) 2-метоксиэтил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(80) 2-метоксиэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(81) 2-метоксиэтил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(82) N-(1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид,
(83) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид,
(84) метил [1-({6-[{[1-(метоксиметил)циклопропил]метил}(метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(85) 2,2-дифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(86) 2,2-дифторэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(87) 2,2-дифторэтил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(88) 2,2-дифторэтил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(89) трет-бутил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(90) 2-метоксиэтил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(91) 2-(диметиламино)этил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(92) 2,2,2-трифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(93) 2,2,2-трифторэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(94) 2-метокси-N-(1-{[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(95) N-(1-{[6-(2-этилбутокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(96) метил (1-{[6-(пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(97) метил (1-{[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(98) N-[1-({6-[(2-этилбутил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(99) N-(1-{[6-(пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(100) метил [1-({6-[метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(101) метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(102) N-(1-{[6-(2-этилбутокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид,
(103) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид,
(104) N-[1-({6-[метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(105) [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон,
(106) N-[1-({6-[(2-метокси-2-метилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(107) (4-гидроксипиперидин-1-ил){6-[метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}метанон,
(108) N-(1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид,
(109) N-(1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(110) N-(1-{[6-{[(2S)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(111) N-(1-{[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(112) метил [1-({6-[(2S)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(113) метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(114) N-[1-({6-[(1-метилциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(115) [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(5-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон,
(116) 2-метил-N-[1-({6-[(2-метилбутан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(117) N-[1-({6-[(2S)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(118) метил [1-({6-[трет-бутил(метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(119) циклопропил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(120) циклопропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(121) 2,2-дифтор-N-(1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид,
(122) 3-[1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]-1,1-диметилмочевина,
(123) 3-(1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-1,1-диметилмочевина,
(124) пропан-2-ил [1-({6-[(3-метилоксетан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(125) метил [1-({6-[(дициклопропилметил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(126) метил (1-{[6-фенокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(127) трет-бутил 4-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пиперидин-1-карбоксилат,
(128) метил (1-{[6-(пиперидин-4-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(129) метил [1-({6-[(1-цианоциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(130) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(131) метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(132) метил [1-({6-[(2S)-бутан-2-иламино]-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(133) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(134) метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат и
(135) метил (1-{[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-(пиридин-3-илокси)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
или его фармацевтически приемлемая соль или его сольват.
[0018]
(VII) Пиразолотиазоловое соединение, описанное в (I), которое представляет собой любое из следующих (1)-(58):
(1) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(2) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(3) N-(1-{[6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(4) N-(1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(5) N-[1-({6-[({1-[(дифторметокси)метил]циклопропил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(6) N-[1-({6-[({1-[(дифторметокси)метил]циклобутил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(7) N-[1-({6-[({1-[(дифторметокси)метил]циклопентил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(8) N-[1-({6-[({4-[(дифторметокси)метил]тетрагидро-2H-пиран-4-ил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(9) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(10) N-(1-{[6-{[(1S,2S)-2-(дифторметокси)циклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(11) N-[1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(12) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(13) N-(1-{[6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(14) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(15) этил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(16) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид,
(17) N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(18) пропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(19) N-(1-{[6-(циклопропилметокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(20) N-[1-({6-[(3,3-диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(21) N-(1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(22) N-[1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(23) [6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон,
(24) N-(1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(25) метил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(26) пропан-2-ил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(27) метил [1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(28) [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон,
(29) метил (1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(30) метил [1-({6-[(3,3-диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(31) метил (1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(32) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропансульфонамид,
(33) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)этансульфонамид,
(34) этил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(35) [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанон,
(36) пропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(37) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид,
(38) 2,2-дифторэтил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(39) 2,2-дифторэтил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(40) трет-бутил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(41) 2-метоксиэтил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(42) 2-(диметиламино)этил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(43) 2,2,2-трифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(44) 2,2,2-трифторэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(45) метил (1-{[6-(пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(46) N-[1-({6-[(2-этилбутил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид,
(47) N-(1-{[6-(пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(48) метил [1-({6-[(2S)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(49) метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(50) N-[1-({6-[(1-метилциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид,
(51) метил [1-({6-[трет-бутил(метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(52) циклопропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(53) пропан-2-ил [1-({6-[(3-метилоксетан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(54) метил [1-({6-[(1-цианоциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(55) метил [1-({6-[(2S)-бутан-2-иламино]-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
(56) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(57) метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат, и
(58) метил (1-{[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-(пиридин-3-илокси)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
или его фармацевтически приемлемая соль, или его сольват.
[0019]
(VIII) Пиразолотиазоловое соединение, описанное в (I), которое представляет собой любое из следующих (1)-(8):
(1) N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(2) N-(1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(3) метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(4) этил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(5) N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид,
(6) пропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат,
(7) метил [1-({6-[(2S)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат, и
(8) метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат,
или его фармацевтически приемлемая соль или его сольват.
[0020]
(IX) Фармацевтическая композиция, содержащая пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0021]
(X) Ингибитор JAK1, содержащий пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0022]
(XI) Терапевтическое средство для лечения воспалительного заболевания, содержащее пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0023]
(XII)
Терапевтическое средство по пункту (XI), где воспалительное заболевание представляет собой атопический дерматит, экзему, бронхиальную астму, эозинофильную пневмонию, хроническое обструктивное заболевание легких, аллергический ринит, эозинофильный синусит, носовой полип, анкилозирующий спондилит или эозинофильный эзофагит.
[0024]
(XIII)
Терапевтическое средство для лечения аутоиммунного заболевания, содержащее пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0025]
(XIV) Терапевтическое средство по пункту (XIII), где аутоиммунное заболевание представляет собой ревматоидный артрит, псориатический артрит, ювенильный артрит, болезнь Кастлемана, системную красную волчанку, синдром Шегрена, воспалительное заболевание кишечника, псориаз, склеродермию, сухой глаз, артериит Такаясу, гигантоклеточный артериит, микроскопический полиангиит, гранулематоз с полиангиитом, эозинофильный гранулематоз с полиангиитом или нейромиелит зрительного нерва.
[0026]
(XV) Терапевтическое средство для лечения пролиферативного заболевания, содержащее пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0027]
(XVI) Терапевтическое средство по пункту (XV), где пролиферативное заболевание представляют собой солидные опухоли, рак крови, злокачественную опухоль лимфоузла, миелопролиферативные заболевания, множественную миелому, фиброз легких или эозинофилию.
[0028]
(XVII) Терапевтическое средство для лечения диабетической нефропатии, очаговой алопеции, отторжения трансплантата костного мозга или отторжения трансплантата органа, содержащее пиразолотиазоловое соединение или его фармацевтически приемлемую соль или его сольват по любому из пунктов (I)-(VIII) в качестве активного ингредиента.
[0029]
Термины, используемые в настоящем описании, определены ниже.
Термин "галоген" означает фтор, хлор, бром или йода. В частности, атом фтора является предпочтительным.
[0030]
Термин "алкил" включает, например, алкил с прямой или разветвленной цепью, имеющей 1-10 атомов углерода, предпочтительно 1-8 атомов углерода, более предпочтительно 1-6 атомов углерода. В частности, термин может включать, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, втор-пентил, 1-этилпропил, 1,2-диметилпропил, трет-пентил, 2-метилбутил, изопентил, неопентил, н-гексил, втор-гексил, 1-этилбутил, изогексил, неогексил, 1,1-диметилбутил, тексил, 2-этилбутил, 1,2,2-триметилпропил, 2,2-диметилбутил, гептил, изогептил, октил и изооктил.
[0031]
Примеры алкильной группы в ʺ(дифторалкокси)алкилʺ, ʺалкоксиалкилʺ, ʺдиалкиламиноʺ, ʺдиалкиламиноалкилʺ, ʺалкилкарбонилʺ, ʺмоногалогеналкилʺ, ʺдигалогеналкилʺ, "тригалогеналкил" могут включать такие же, как описано выше для ʺалкилаʺ.
[0032]
Термин ʺмоногалогеналкилʺ относится к группе, где ʺалкилʺ, как определено выше, замещен ʺгалогеномʺ, как определено выше. В частности, термин может включать, например, монофторметил, монохлорметил и монофторэтил.
[0033]
Термин ʺдигалогеналкилʺ относится к группе, где ʺалкилʺ, как определено выше, замещен двумя ʺгалогенамиʺ, как определено выше. В частности, термин может включать, например, дифторметил, дифторэтил и 1,2-дифторпропил.
[0034]
Термин ʺтригалогеналкилʺ относится к группе, где ʺалкилʺ, как определено выше, замещен тремя ʺгалогенамиʺ, как определено выше. В частности, термин может включать, например, трифторметил, трихлорметил и трифторэтил.
[0035]
Термин "алкокси" может включать, например, алкоксигруппу с линейной или разветвленной цепью, имеющей 1-8 атомов углерода, предпочтительно 1-6 атомов углерода. В частности, термин может включать метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, н-гексилокси, н-гептилокси и н-октилокси.
[0036]
Примеры алкоксигруппы в ʺ(дифторалкокси)алкилʺ, ʺалкоксиалкилʺ могут включать такие же, как описано выше для ʺалкоксиʺ.
[0037]
Термин ʺциклоалкилʺ может включать, например, моно- - три-циклическую насыщенную углеводородную группу, имеющую 3-10 атомов углерода. Моноциклический циклоалкил, имеющий 3-6 атомов углерода является предпочтительным. В частности, термин может включать циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, бицикло[2.1.0]пентил, бицикло[2.2.1]гептил и бицикло[2.2.2]октил.
Для ʺциклоалкилаʺ, представленного L1, моноциклический циклоалкил, имеющий 3-6 атомов углерода является предпочтительным, и циклопропил является более предпочтительным.
Для ʺциклоалкильнойʺ группы в ʺциклоалкиламиноʺ, циклопропил является предпочтительным.
[0038]
Термин ʺарилʺ относится, например, к моно- - три-циклической ароматической углеводородной группе, имеющей 6-14 атомов углерода. В частности, термин может включать фенил, 1-нафтил, 2-нафтил, 1-антрил, 2-антрил, 9-антрил, 1-фенантрил, 2-фенантрил, 3-фенантрил, 4-фенантрил и 10-фенантрил. Особенно, фенил является предпочтительным.
[0039]
Термин ʺгетероарилʺ может включать, например, 5-10-членную моно- - бициклическую ароматическую гетероциклическую группу, имеющую 1-4 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода в кольце. В частности, термин может включать фурил (например, 2-фурил и 3-фурил), тиенил (например, 2-тиенил и 3-тиенил), пирролил (например, 2-пирролил и 3-пирролил), имидазолил (например, 2-имидазолил и 4-имидазолил), пиразолил (например, 3-пиразолил и 4-пиразолил), триазолил (например, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил и 1,2,3-триазол-4-ил), тетразолил (например, 5-тетразолил), оксазолил (например, 2-оксазолил, 4-оксазолил и 5-оксазолил), изоксазолил (например, 3-изоксазолил, 4-изоксазолил и 5-изоксазолил), оксадиазолил (например, 1,3,4-оксадиазол-2-ил), тиазолил (например, 2-тиазолил, 4-тиазолил и 5-тиазолил), тиадиазолил, изотиазолил (например, 3-изотиазолил, 4- изотиазолил и 5-изотиазолил), пиридил (например, 2-пиридил, 3-пиридил и 4-пиридил), пиридазинил (например, 3-пиридазинил и 4-пиридазинил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил и 5-пиримидинил), пиразинил (например, 2-пиразинил), бензимидазолил (например, 2-бензимидазолил, 4-бензимидазолил, 5-бензимидазолил, 6-бензимидазолил и 7-бензимидазолил), индазолил (например, 3-индазолил, 4-индазолил, 5-индазолил, 6-индазолил и 7-индазолил) и изохинолил (например, 1-изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 6-изохинолил, 7-изохинолил и 8-изохинолил). Предпочтительно, гетероарилом может быть фурил (например, 2-фурил и 3-фурил), имидазолил (например, 2-имидазолил и 4-имидазолил), тиазолил (например, 2-тиазолил, 4-тиазолил и 5-тиазолил), пиридил (например, 2-пиридил, 3-пиридил и 4-пиридил), пиридазинил (например, 3-пиридазинил и 4-пиридазинил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил и 5-пиримидинил) или пиразинил (например, 2-пиразинил).
Для ʺгетероарилаʺ, представленного R3, 3-пиридил является предпочтительным.
Для ʺгетероарилаʺ, представленного R8, изоксазолил (например, 3-изоксазолил, 4-изоксазолил и 5-изоксазолил), тиазолил (например, 2-тиазолил, 4-тиазолил и 5-тиазолил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил и 6-пиримидинил) и пиридил (2-пиридил, 3-пиридил и 4-пиридил) являются предпочтительными, и 3-изоксазолил, 5-изоксазолил, 2-тиазолил, 2-пиримидинил и 2-пиридил являются более предпочтительными.
Для ʺгетероарилаʺ, представленного L1, тиенил (например, 2-тиенил и 3-тиенил) и пиридил (например, 2-пиридил, 3-пиридил и 4-пиридил) являются более предпочтительными.
[0040]
Термин ʺнасыщенная гетероциклическая группаʺ может включать, например, 3-8-членную насыщенную гетероциклическую группу, имеющую 1-3 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода в кольце. В частности, термин может включать оксетанил (например, 2-оксетанил и 3-оксетанил), азетидинил (например, 2-азетидинил и 3-азетидинил), тетрагидропиранил (например, 2-тетрагидропиранил, 3-тетрагидропиранил и 4-тетрагидропиранил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), пиперидинил (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пиперазинил (например, 2-пиперазинил и 3-пиперазинил), морфолинил (например, 2-морфолинил и 3-морфолинил), тиоморфолинил (например, 2-тиоморфолинил и 3-тиоморфолинил) и тетрагидрофурил (2-тетрагидрофурил и 3-тетрагидрофурил). Более предпочтительно, термин может включать пиперидинил (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), тетрагидрофурил (2-тетрагидрофурил и 3-тетрагидрофурил) и тетрагидропиранил (2-тетрагидропиранил, 3-тетрагидропиранил и 4-тетрагидропиранил).
Способ осуществления изобретения
[0041]
Соединение по настоящему изобретению может быть получено согласно, например, следующим способам и примерам, как описано ниже, или способам, известным в данной области, с использованием соединения или промежуточного соединения, которое доступно или может быть получено легко. В том случае, когда исходный материал имеет функциональную группу, которая может влиять на реакцию в способе получения соединения по настоящему изобретению, исходное вещество следует предварительно защитить соответствующей защитной группой в соответствии с известным способом. Защитную группу можно удалить известным способом после реакции.
[0042]
Схема 1
[Формула 2]
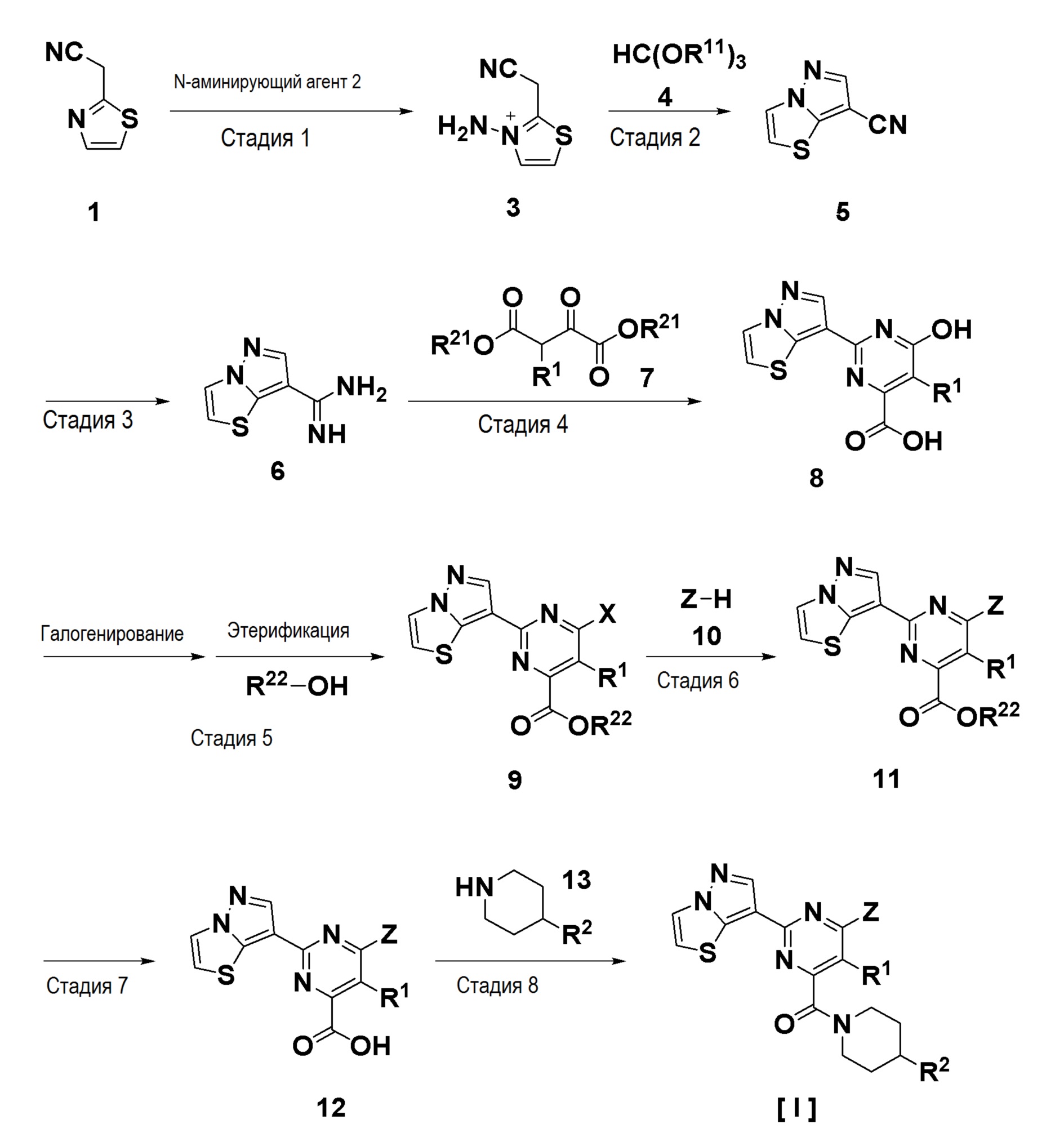
где, Z, R1 и R2 являются такими, как определено выше. R11 представляет собой алкил, R21 представляет собой водород или алкил, R22 представляет собой алкил и X представляет собой уходящую группу, такую как галоген.
[0043]
Стадия 1
Стадия представляет собой N-аминирование соединения 1 (которое может быть синтезировано с использованием способа, описанного, например, в Heterocycles, 2008, 75, 2005-2012) с использованием N-аминирующего агента 2 с получением N- аминотиазолиевой соли 3.
[0044]
Используемый N-аминирующий агент зависит от растворителя, используемого в реакции, и примеры включают, но ими не ограничиваются, O-(мезитиленсульфонил)гидроксиамин.
[0045]
N-аминирующий агент можно использовать в количестве 1-5 молярных эквивалента соединения 1.
[0046]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры могут включать, например, простые эфиры, такие как тетрагидрофуран (далее именуемый "THF"), диэтиловый эфир, 1,4-диоксан и диметоксиэтан (далее именуемый "DME"), нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, и их смешанные растворители.
[0047]
Температура реакции может быть от -78°C до 100°C, предпочтительно от -78°C до 50°C.
[0048]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 10 минут до 24 часов.
[0049]
Стадия 2
Стадия представляет собой взаимодействие N-аминотиазолиевой соли 3 с ортосложноэфирным соединением 4 в подходящем растворителе с получением соединения 5.
[0050]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры растворителя могут включать простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, и их смешанные растворители. Альтернативно, ортосложноэфирное соединение 4 само по себе может быть использовано в качестве растворителя в реакции.
[0051]
Температура реакции может быть от 0°C до 200°C, предпочтительно от 0°C до 150°C.
[0052]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 10 минут до 24 часов.
[0053]
Ортосложноэфирное соединение 4, предпочтительно, можно использовать в количестве 1-50 молярных эквивалента N-аминотиазолиевой соли 3.
[0054]
Стадия 3
Стадия представляет собой превращение нитрила в амидин, которое может быть проведено в соответствии со способом, описанным, например, в Slee et al., J. Med. Chem. 2008, 51, 1719-1729. То есть, соединение 5 перемешивают в присутствии основания, такого как алкоксид щелочного металла, в соответствующем растворителе с получением имидата, и полученный имидат подвергают взаимодействию с аммиаком или солью аммония с получением амидинового соединения 6.
[0055]
Примеры основания, используемого в реакции, могут включать алкоксиды, такие как метоксид натрия и этоксид натрия.
[0056]
Алкоксид, предпочтительно, можно использовать в количестве 1-5 молярных эквивалента соединения 5.
[0057]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и обычно можно использовать спирт, такой как метанол и этанол.
[0058]
При получении имидата, температура реакции может быть от 0°C до 150°C, предпочтительно от 0°C до 100°C.
[0059]
При получении имидата, время реакции может зависеть от температуры реакции и обычно оно составляет от 30 минут до 24 часов.
[0060]
При получении амидинового соединения 6, примеры соли аммония, использованной в реакции, могут включать хлорид аммония и ацетат аммония.
[0061]
Соль аммония или аммиак можно использовать в количестве 1-10 молярных эквивалента имидата.
[0062]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и обычно можно использовать спирт, такой как метанол и этанол.
[0063]
Температура реакции может быть от -78°C до 150°C, предпочтительно от 0°C до 150°C.
[0064]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 30 минут до 24 часов.
[0065]
Соль аммония может быть добавлена непосредственно в реакционную смесь, в которой был получен имидат.
[0066]
Стадия 4
Стадия представляет собой взаимодействие амидинового соединения 6 с соединением щавелевоуксусной кислоты 7 или его солью в присутствии основания, такого как гидроксид калия, в соответствующем растворителе, с получением пиримидинового соединения 8. Стадия может быть проведена в соответствии со способом, описанным, например, в WO 2009/138712.
[0067]
Примеры основания, используемого в реакции, могут включать неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид лития, гидрокарбонат натрия, карбонат натрия, карбонат калия и карбонат цезия, и алкоксиды, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия.
[0068]
Основание может быть использовано в количестве 1-50 молярных эквивалента амидинового соединения 6.
[0069]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры могут включать, например, простые эфиры, такие как THF, 1,4-диоксан и DME, спирты, такие как метанол и этанол, кетоны, такие как ацетон, воду, и их смешанные растворители.
[0070]
В этой реакции температура реакции может быть от 0°C до 200°C, предпочтительно от 0°C до 150°C.
[0071]
В этой реакции, время реакции может зависеть от температуры реакции и обычно оно составляет от 30 минут до 24 часов.
[0072]
Стадия 5
Стадия представляет собой способ получения соединения 9 путем галогенирования пиримидинового соединения 8 в присутствии галогенирующего агента в подходящем растворителе при температуре от 0°C до 180°C, с последующей этерификацией полученного галогенангидрида.
[0073]
В реакции галогенирования примеры галогенирующего агента могут включать оксихлорид фосфора, оксибромид фосфора и пентахлорид фосфора. Эти галогенирующие агенты могут быть использованы в реакции по отдельности или в их комбинации.
[0074]
В реакции галогенирования необязательно используют основание. Примеры используемого основания могут включать диэтиланилин, пиридин, 2,6-лутидин, N,N-диизопропилэтиламин (далее именуемый "DIPEA") и триэтиламин (далее именуемый "TEA").
[0075]
Галогенирующий агент и основание могут быть использованы в количестве 1-100 молярных эквивалента пиримидинового соединения 8.
[0076]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры могут включать простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, амиды, такие как N,N-диметилформамид (далее именуемый "DMF"), N,N-диметилацетамид, N-метилпирролидон (далее именуемый "NMP"), нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, сульфоксиды, такие как диметилсульфоксид (далее именуемый "ДМСО"), и их смешанные растворители.
[0077]
Температура реакции может быть от 0°C до 200°C, предпочтительно от 0°C до 150°C.
[0078]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 10 минут до 48 часов.
[0079]
Реакцию этерификации можно проводить в соответствии с обычным способом. Примеры спирта (R22-OH), используемого в реакции, могут включать метанол и этанол.
[0080]
В реакции этерификации необязательно используют основание. Примеры используемого основания могут включать органические основания, такие как диэтиланилин, пиридин, 2,6-лутидин, DIPEA и TEA, и неорганические основания, такие как гидрокарбонат натрия.
[0081]
Спирт и основание могут быть использованы в количестве 1-100 молярных эквивалента галоидангидрида.
[0082]
В реакции этерификации, растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры включают простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, амиды, такие как DMF и N,N-диметилацетамид, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, сульфоксиды, такие как ДМСО, и их смешанные растворители. Кроме того, в реакции можно использовать спирт в качестве растворителя.
[0083]
Температура реакции может быть от -78°C до 200°C, предпочтительно от 0°C до 50°C.
[0084]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 10 минут до 48 часов.
[0085]
Стадия 6
Стадия представляет собой взаимодействие соединения 9 с соединением 10 (спиртовое соединение R3OH или аминовое соединение NHR4R5) в подходящем растворителе с получением соединения 11.
[0086]
В реакции соединение 10 может быть использовано в количестве 1-10 молярных эквивалента соединения 9.
[0087]
При необходимости реакцию можно проводить в присутствии кислоты или основания. Примеры используемой кислоты могут включать неорганические кислоты, такие как хлористоводородная кислота и серная кислота. Примеры используемого основания могут включать органические основания, такие как TEA, DIPEA, N,N-диметиланилин, пиридин, DMAP и 1,8-диазабицикло[5.4.0]-7-ундецен, неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид лития, гидрокарбонат натрия, карбонат натрия, карбонат калия и карбонат цезия, алкоксиды, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия, и гидриды щелочных металлов, такие как гидрид натрия и гидрид калия.
[0088]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры включают простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, углеводороды, такие как толуол, бензол и циклогексан, спирты, такие как метанол, этанол, изопропиловый спирт и бутанол, амиды, такие как DMF, N,N-диметилацетамид, и NMP, сульфоксиды, такие как ДМСО, и их смешанные растворители.
[0089]
В этой реакции температура реакции может быть от 0°C до 200°C, предпочтительно от 0°C до 150°C. При необходимости реакцию можно проводить с использованием микроволновой печи или в закрытой системе.
[0090]
Время реакции может зависеть от типа исходных веществ и основания и температуры реакции, и обычно оно составляет от 30 минут до 48 часов.
[0091]
Стадия 7
Стадия представляет собой реакцию гидролиза сложноэфирного соединения 11 в присутствии подходящей кислоты или основания в подходящем растворителе с получением карбоновой кислоты 12.
[0092]
В реакции примеры используемой кислоты могут включать неорганические кислоты, такие как хлористоводородная кислота и серная кислота, и органические кислоты, такие как трифторуксусная кислота (далее именуемая "TFA"), метансульфоновая кислота и толуолсульфоновая кислота. Примеры основания могут включать неорганические основания, такие как гидроксид натрия, гидроксид калия и гидроксид лития.
[0093]
В реакции кислота или основание могут быть использованы в количестве 1-10 молярных эквивалента сложноэфирного соединения 11.
[0094]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры включают воду, спирты, такие как метанол, этанол и изопропанол, простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, и их смешанные растворители.
[0095]
В этой реакции температура реакции может быть от -78°C до 200°C, предпочтительно от 0°C до 100°C.
[0096]
Время реакции может зависеть от температуры реакции и обычно оно составляет от 30 минут до 48 часов.
[0097]
Стадия 8
Стадия представляет собой реакцию конденсации карбоновой кислоты 12 и соединения 13 в подходящем растворителе с получением соединения [I]. Соединение [I] может быть получено взаимодействием карбоновой кислоты 12 или ее реакционноспособного производного с соединением 13.
[0098]
Примеры реакционноспособных производных карбоновой кислоты 12 могут включать те, которые обычно используют в реакции амидной конденсации, такие как галоидангидриды (например, хлорангидрид и бромангидрид), смешанные ангидриды, имидазолиды и реакционноспособные амиды.
[0099]
При использовании карбоновой кислоты 12 можно использовать конденсирующий агент, такой как 1,1'-карбонилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид (далее именуемый "WSCD (водорастворимый карбодиимид)"), N,N'-дициклогексилкарбодиимид (далее именуемый "DCC"), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (далее именуемый "HATU"), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (далее именуемый "HBTU"), диэтил цианофосфонат, дифенилфосфорил азид, 2-хлор-1-метилпиридиний иодид, 1H-бензотриазол-1-илокситрипирролизинфосфоний гексафторфосфат или бензотриазол-1-илокситрис(диметиламино)фосфонияй гексафторфосфат).
[0100]
В реакции конденсирующий агент можно использовать в количестве 1-3 молярных эквивалента карбоновой кислоты 12.
[0101]
При необходимости реакцию можно проводить в присутствии основания. Примеры используемого основания могут включать, например, органические основания, такие как TEA, DIPEA, N,N-диметиланилин, пиридин, DMAP и 1,8-диазабицикло[5.4.0]-7-ундецен.
[0102]
Добавка, такая как 1-гидроксибензотриазол (именуемый далее "HOBt") и N-гидроксисукцинимид, может быть добавлена к реакции.
[0103]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры включают простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, амиды, такие как DMF и N,N-диметилацетамид, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ и дихлорметан, и их смешанные растворители.
[0104]
Температура реакции может быть от -78°C до 200°C, предпочтительно от -20°C до 50°C.
[0105]
Время реакции может зависеть от типа исходных веществ и конденсирующих агентов и от температуры реакции, и обычно оно составляет от 10 минут до 24 часов.
[0106]
Соединение [I] также может быть получено в соответствии со следующей схемой 2.
[0107]
Схема 2
[Формула 3]
где, Z, R1 и R2 являются такими, как определено выше. X представляет собой галоген.
[0108]
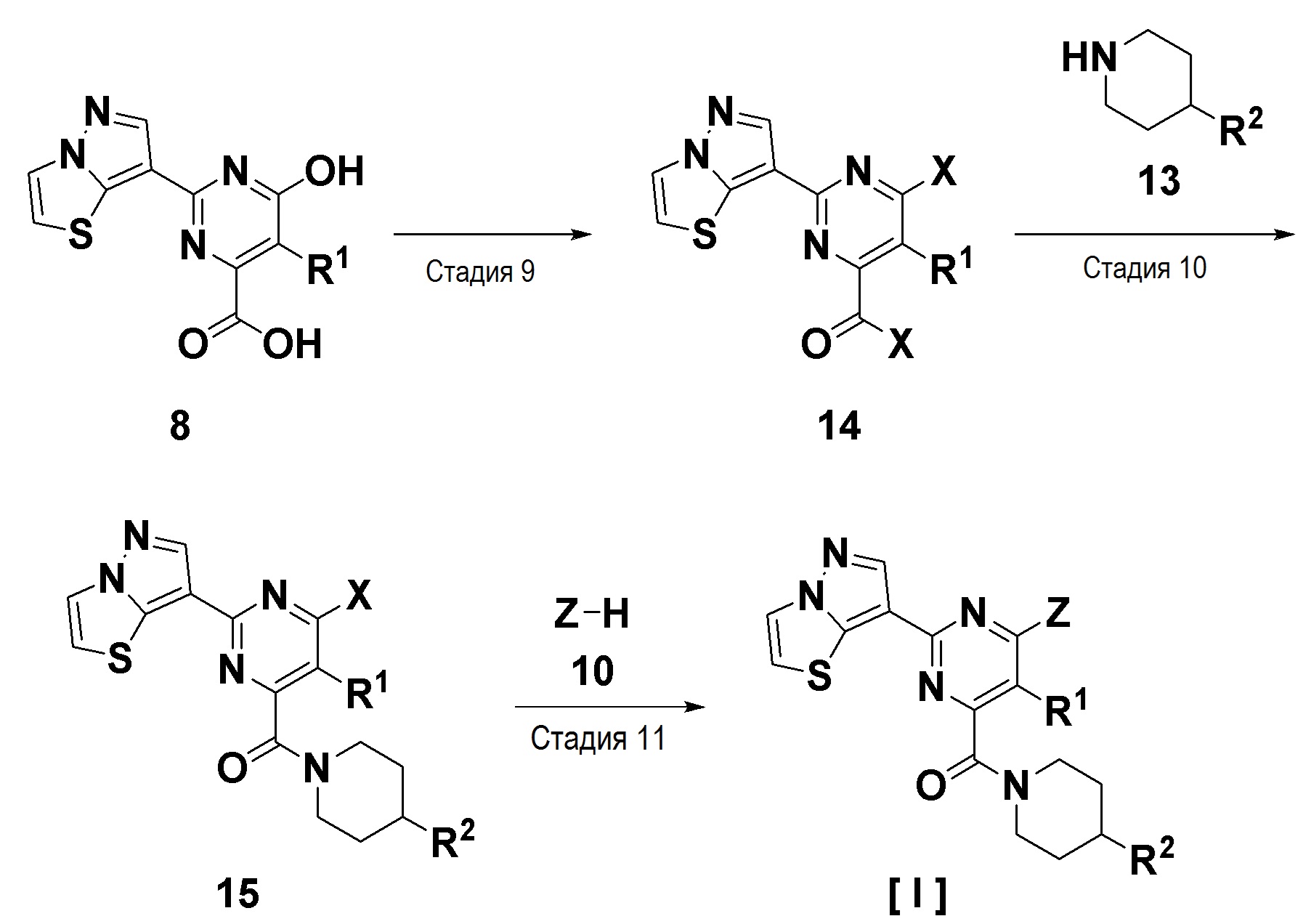
Стадия 9
Стадия представляет собой реакцию галогенирования гидроксидной группы соединения 8 с галогенирующим агентом, таким как оксихлорид фосфора в подходящем растворителе, с получением галоидангидрида 14. Стадия может быть проведена, как описано на стадии 5.
[0109]
Стадия 10
Стадия представляет собой взаимодействие галоидангидрида 14 с аминовым соединением 13 в подходящем растворителе с получением амидного соединения 15.
[0110]
В реакции соединение 13 может быть использовано в количестве 1-3 молярных эквивалента соединения 14.
[0111]
При необходимости реакцию можно проводить в присутствии основания. Примеры используемого основания могут включать органические основания, такие как TEA, DIPEA, N,N-диметиланилин, пиридин, DMAP и 1,8-диазабицикло[5.4.0]-7-ундецен, и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия и карбонат цезия.
[0112]
Растворитель, используемый в реакции, не ограничивают, при условии, что он не участвует в реакции, и примеры включают простые эфиры, такие как THF, диэтиловый эфир, 1,4-диоксан и DME, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, галогенированные углеводороды, такие как хлороформ, дихлорметан и 1,2-дихлорэтан, углеводороды, такие как толуол, бензол и циклогексан, амиды, такие как DMF и N,N-диметилацетамид, сульфоксиды, такие как ДМСО, и их смешанные растворители.
[0113]
В этой реакции температура реакции может быть от -50°C до 100°C, предпочтительно от 0°C до 50°C.
[0114]
Время реакции может зависеть от типа исходных материалов и оснований и от температуры реакции, и обычно оно составляет от 5 минут до 48 часов.
[0115]
Стадия 11
Стадия представляет собой взаимодействие соединения 15 с соединением 10 (спиртовое соединение R3OH или аминовое соединение R4R5NH) в подходящем растворителе с получением соединения [I]. Стадия может быть проведена, как описано выше на стадии 6.
[0116]
Пиразолотиазоловое соединение по настоящему изобретению можно использовать в виде лекарственного средства, как оно есть, и также можно модифицировать и использовать в форме фармацевтически приемлемой соли, сольвата или сольвата соли с использованием хорошо известного способа. Примеры фармацевтически приемлемой соли могут включать, например, соль с неорганической кислотой, такие как гидрохлорат, гидробромат, сульфат и фосфат, и соль с органической кислотой, такие как ацетат, цитрат, тартрат, малеат, сукцинат, фумарат, п-толуолсульфонат, бензолсульфонат и метансульфонат.
[0117]
Сольват включает сольват с органическим растворителем и гидратом. Примеры фармацевтически приемлемого сольвата могут включать, например, алкоголят (например, этанолят) и гидрат. Гидрат может включать, например, моногидрат и дигидрат. Сольват образуется путем координации с любым типом и количеством растворителей. Фармацевтически приемлемая соль может образовывать сольват.
[0118]
Например, хлористоводородную соль соединения можно получить путем растворения пиразолотиазолового соединения по настоящему изобретению в растворе хлористого водорода в спирте, растворе хлористого водорода в этилацетате, растворе хлористого водорода в 1,4-диоксане или растворе хлористого водорода в диэтиловом эфире.
[0119]
Некоторые из соединений по настоящему изобретению могут иметь асимметрический атом углерода, и соответствующие стереоизомеры и их смеси включены в настоящее изобретение. Стереоизомеры могут быть получены, например, посредством разделения оптических изомеров из их рацемата в соответствии с известным способом с использованием оптически активной кислоты (например, винной кислоты, дибензоилвинной кислоты, миндальной кислоты и 10-камфорсульфоновой кислоты и тому подобное), или с использованием оптически активного соединения, полученного заранее в качестве исходного материала. Кроме того, стереоизомеры могут быть получены путем разделения оптических изомеров с использованием хиральной колонки или с помощью асимметрического синтеза. Кроме того, некоторые соединения по настоящему изобретению могут образовывать таутомеры, и соответствующие таутомеры и их смеси также включены в настоящее изобретение.
[0120]
Соединение по настоящему изобретению имеет ингибирующую активность в отношении JAK1, как показано в следующих примерах испытаний. Кроме того, соединение по настоящему изобретению также обладает противовоспалительным, иммунодепрессивным и антипролиферативным эффектами и тому подобное, на основании их ингибирующей активности в отношении JAK1.
[0121]
Соответственно, соединение по настоящему изобретению можно использовать в качестве профилактического или терапевтического средства, например, для заболеваний, связанных с JAK1, и также заболеваний в отношение которых ожидается эффект от соединения, учитывая его противовоспалительный, иммунодепрессивный и антипролиферативный эффекты и тому подобное.
Примеры конкретных заболеваний, к которым соединения по настоящему изобретению могут быть применены, включают аутоиммунное заболевание (например, ревматоидный артрит, псориатический артрит, ювенильный артрит, болезнь Кастлемана, системная красная волчанка, синдром Шегрена, рассеянный склероз, воспалительное заболевание кишечника, болезнь Бехчета, миастения гравис, сахарный диабет 1 типа, иммуноглобулин-связанная нефропатия, аутоиммунные заболевания щитовидной железы, псориаз, склеродермия, волчаночный нефрит, сухой глаз, васкулит (например, артериит Такаясу, гигантоклеточный артериит, микроскопический полиангиит, гранулематоз с полиангиитом и эозинофильный гранулематоз с полиангиитом), дерматомиозит и полимиозит и нейромиелит зрительного нерва), воспалительные заболевания (например, атопический дерматит, контактный дерматит, экзема, зуд, пищевая аллергия, бронхиальная астма, эозинофильная пневмония, хроническое обструктивное заболевание легких, аллергический ринит, хронический синусит, эозинофильный синусит, носовой полип, аллергический конъюнктивит, остеоартрит, анкилозирующий спондилит, болезнь Кавасаки, болезнь Бюргера, узелковый полиартериит и IgA-васкулит), пролиферативные заболевания (например, солидные опухоли, рак крови, злокачественная опухоль лимфоузла, миелопролиферативные заболевания, множественная миелома, фиброз легких и эозинофилия), внезапную потерю слуха, диабетическую нефропатию, очаговую алопецию, отторжение трансплантата костного мозга или отторжение трансплантата органа.
[0122]
Соединение по настоящему изобретению можно вводить в качестве лекарственного средства млекопитающим, включая человека, как оно есть, или в виде фармацевтической композиции, содержащей его, в количестве, например, 0,001%-99,5%, предпочтительно 0,1%-90%, в комбинации с одним или несколькими фармацевтически приемлемыми нетоксичным и неактивным носителем(ями).
[0123]
В качестве носителя можно использовать один или несколько, выбранных из твердых, полутвердых или жидких разбавителей, наполнителей и других добавок для фармацевтического состава. Фармацевтическую композицию по настоящему изобретению может вводить в виде стандартной лекарственной формы. Фармацевтическую композицию можно вводить с помощью внутритканевого, перорального, внутривенного, местного (например, трансдермального, инстилляционного, внутрибрюшинного или внутригрудного введения) или трансректального введения. Композици следует вводить в лекарственной форме, подходящей для этих способов введения.
[0124]
Дозу соединения следует корректировать с учетом состояния пациента, такого как возраст, масса тела и заболевания, подлежащего лечению, и стадии заболевания, способа введения и вводимого соединения, типа соли в случае, когда соединение представляет собой соль и тому подобное. В случае перорального введения взрослым типичная суточная доза соединения по настоящему изобретению или его фармацевтически приемлемой соли может составлять от 0,01 мг до 5 г, и предпочтительно от 1 мг до 500 мг. В некоторых случаях может быть достаточна более низкая доза или, наоборот, может потребоваться более высокая доза. Обычно, доза вводится один раз в день или несколько раз в день в виде разделенных порций, или, в случае внутривенного введения, лекарство может быть болюсной инъекцией или непрерывно вводиться в течение 24 часов.
[0125]
Один или несколько из водорода, углерода и/или других атомов в соединении по настоящему изобретению могут быть заменены соответствующим изотопом водорода, углерода и/или других атомов. Примеры таких изотопов включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, йода и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, 123I и 36Cl. Соединение, замещенное таким изотопом, может быть использовано в качестве лекарственного средства, и все такие радиоактивно меченые формы соединения включены в настоящее изобретение.
ПРИМЕРЫ
[0126]
Настоящее изобретение описано более подробно со ссылкой на следующие примеры, тестовые примеры и примеры состава, которые не предназначены для ограничения объема настоящего изобретения.
[0127]
Аббревиатуры, используемые в примерах, являются следующими.
DMF: диметилформамид
ДМСО: диметилсульфоксид
DIPEA: N,N-диизопропилэтиламин
TEA: триэтиламин
THF: тетрагидрофуран
TFA: трифторуксусная кислота
NMP: N-метилпирролидон
HATU: O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат
CDCl3: дейтерохлороформ
ДМСО-d6: гексадейтеродиметил сульфоксид
МС: масс-спектрометрия
ЖХМС: жидкостная хроматография высокого давления с масс-спектрометрией
ESI: электрораспылительная ионизация
M: молярность
[0128]
МС определяли с использованием ЖХМС. В качестве способа ионизации использовали способ ESI. Измерения масс-спектрометрии показывали как m/z.
Условие измерения для ЖХМС заключается в следующем.
Анализатор: система ACQUITY UPLC MS/PDA (Waters)
Масс-спектрометр: МС детектор Waters 3100
Детектор с фотодиодной матрицей: детектор ACQUITY PDA (УФ-детектирование длина волны: 210-400 нм)
Колонка: Acquity BEH C18, 1,7 мкм, 2,1×50 мм
Скорость потока: 0,5 мл/мин
Температура колонки: 40°C
Растворитель;
Раствор A: 0,1% муравьиная кислота/H2O (об./об.; то же самое в дальнейшем)
Раствор B: 0,1% муравьиная кислота/ацетонитрил
[0129]
Микроволновый эксперимент проводили с использованием инициатора Biotage Initiator 60TM, который способен достигать температуры от 40 до 250°C и давления до 20 бар.
[0130]
Ссылочный пример 1: Пиразоло[5,1-b][1,3]тиазол-7-карбонитрил
[Стадия 1] Получение 2-(тиазол-2-ил)ацетонитрил
К раствору трет-бутил цианоацетата (28 г) в DMF (100 мл) добавляли 60% гидрид натрия (7,9 г) порциями при охлаждении льдом, и полученную смесь перемешивали в течение 10 минут. К смеси добавляли 2-бромтиазол (25 г), и смесь перемешивали при комнатной температуре в течение 15 минут, затем при 120°C в течение 2 часов. К реакционной смеси добавляли 1 M водного раствора хлористоводородной кислоты, и водный слой экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток промывали гексаном, полученное твердое вещество суспендировали в толуоле (200 мл), к суспензии добавляли моногидрат пара-толуолсульфоновой кислоты (2,0 г), и смесь перемешивали при 105°C в течение 2 часов. Реакционный раствор разбавляли этилацетатом, и разделение жидкости осуществляли добавлением насыщенного водного раствора бикарбоната натрия. Водный слой далее экстрагировали этилацетатом, и объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (7,0 г).
МС (m/z): 125 [M+H]+
[0131]
[Стадия 2] Получение пиразоло[5,1-b][1,3]тиазол-7-карбонитрила
К раствору 2-(тиазол-2-ил)ацетонитрила, полученного на стадии 1, (5 г) в дихлорметане (50 мл) добавляли раствор O- (мезитилсульфонил)гидроксиламина (который может быть получен в соответствии со способом, описанным, например, в Organic Process Research & Development, 2009, 13, 263-267) в дихлорметане (20 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 2 часов. При охлаждении льдом, к реакционной смеси добавляли диэтиловый эфир, и осажденное твердое вещество собирали на фильтре. Полученное твердое вещество суспендировали в триэтилортоформиате (35 мл), и смесь перемешивали при 120°C в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (2,5 г).
МС (m/z): 150 [M+H]+
[0132]
Ссылочный пример 2: 6-гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
К раствору пиразоло[5,1-b][1,3]тиазол-7-карбонитрила, полученного в ссылочном примере 1, (6 г) в метаноле (150 мл) добавляли раствор 28% метоксида натрия в метаноле (24,6 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. Затем, к ней добавляли хлорид аммония (12,9 г), и смесь перемешивали при 90°C в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли раствор диэтилоксалацетата натрия (33,8 г) в 5 M водном растворе гидроксида натрия (200 мл), и смесь перемешивали при 100°C в течение ночи. К реакционной смеси добавляли конц. хлористоводородную кислоту, чтобы сделать раствор кислым, и осажденное твердое вещество собирали на фильтре. Полученное твердое вещество растворяли в 5 М водном растворе гидроксида калия и промывали хлороформом. К водному слою добавляли конц. хлористоводородную кислоту, чтобы сделать раствор кислым, и осажденное твердое вещество собирали на фильтре, и сушили с получением указанного в заголовке соединения (10 г).
МС (m/z): 263 [M+H]+
[0133]
Ссылочный пример 3: метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилат
6-Гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновую кислоту, полученную в ссылочном примере 2, (1,4 г) суспендировали в оксихлориде фосфора (20 мл), к суспензии добавляли диэтиланилин (1,6 г), и смесь перемешивали при 130°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, к реакционной смеси добавляли метанол (100 мл) при охлаждении льдом, и полученную смесь перемешивали в течение 10 миут. Реакционный раствор разбавляли хлороформом, разделяли добавлением воды, и водный слой далее экстрагировали хлороформом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (910 мг).
МС (m/z): 297 [M+H]+
[0134]
Ссылочный пример 4: 6-гидрокси-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
К раствору пиразоло[5,1-b][1,3]тиазол-7-карбонитрила, полученного в ссылочном примере 1, (300 мг) в метаноле (6 мл) добавляли раствор 28% метоксида натрия в метаноле (0,41 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Затем, к ней добавляли хлорид аммония (215 мг), и смесь перемешивали при 70°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в 5 M водном растворе гидроксида натрия (1,2 мл) и воде (7 мл), к раствору добавляли диэтиловый эфир метилоксалуксусной кислоты (611 мг), и смесь перемешивали при 90°C в течение 45 минут. К реакционной смеси добавляли конц. хлористоводородную кислоту, чтобы сделать раствор кислым, и выпавшее в осадок твердое вещество собирали на фильтре и сушили с получением указанного в заголовке соединения (166 мг).
МС (m/z): 277 [M+H]+
[0135]
Ссылочный пример 5: метил 6-хлор-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилат
Аналогично способу в ссылочном примере 3, указанное в заголовке соединение, синтезировали с использованием 6-гидрокси-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 4, вместо 6-гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты.
МС (m/z): 311 [M+H]+
[0136]
Ссылочный пример 6: (2S)-1-(Дифторметокси)пропан-2-амин гидрохлорид
[Стадия 1] Получение бензил N-[(2S)-1-(дифторметокси)пропан-2-ил]карбамата
В атмосфере аргона, к раствору бензил [(1S)-1-(гидроксиметил)этил]карбамата (2 г) в ацетонитриле (40 мл) добавляли 2,2-дифтор-2-(фторсульфонил)уксусную кислоту (2,6 г) и йодид меди (364 мг), и смесь перемешивали при 50°C в течение 1 часа 30 мин. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (1,3 г).
1Н-ЯМР (CDCl3) δ: 1,23 (3H, д), 3,75-3,90 (2H, м), 4,00 (1H, ушир.с), 4,82 (1H, ушир.с), 5,11 (2H, с), 6,22 (1H, т), 7,30-7,40 (5H, м)
[0137]
[Стадия 2] Получение (2S)-1-(дифторметокси)пропан-2-амина гидрохлорида
К раствору бензил N-[(2S)-1-(дифторметокси)пропан-2-ил]карбамата, полученного на стадии 1, (1,3 г) в этаноле (40 мл) добавляли 20% гидроксид палладия (на активированном угле, 300 мг), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, затем к исходной жидкости добавляли 4 М раствор хлорида водорода-этилацетата (2 мл), и растворитель концентрировали при пониженном давлении с получением указанного в заголовке соединения (668 мг).
1Н-ЯМР (ДМСО-d6) δ: 1,19 (3H, д), 3,40-3,50 (1H, м), 3,86 (1H, дд), 3,97 (1H, дд), 6,77 (1H, т), 8,06 (3H, ушир.с)
[0138]
Ссылочный пример 7: (1S,2S)-2-(Дифторметокси)циклопентанамин гидрохлорид
[Стадия 1] Получение бензил N-[(1S,2S)-2-гидроксициклопентил]карбамата
К раствору (1S,2S)-2-бензилоксициклопентанамина (5,0 г) в этаноле (40 мл) добавляли 20% гидроксид палладия (на активированном угле, 1,0 г), и проводили каталитическое восстановление при среднем давлении. Палладий отфильтровывали и растворитель концентрировали при пониженном давлении. К полученному остатку добавляли воду (100 мл) и карбонат натрия (7,0 г), затем добавляли к этому бензилхлорформиат (6,7 г) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь экстрагировали хлороформом, и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (5,9 г).
МС (m/z): 236 [M+H]+
[0139]
[Стадия 2] Получение бензил N-[(1S,2S)-2-(дифторметокси)циклопентил]карбамата
Аналогично способу в ссылочном примере 6 стадия 1, указанное в заголовке соединение синтезировали с использованием бензил N-[(1S,2S)-2-гидроксициклопентил]карбамата, полученного на стадии 1, вместо бензил [(1S)-1-(гидроксиметил)этил]карбамата.
1Н-ЯМР (CDCl3) δ: 1,40-1,50 (1H, м), 1,62-1,88 (3H, м), 1,91-2,05 (1H, м), 2,10-2,25 (1H, м), 3,95-4,00 (1H, м), 4,40 (1H, ушир.с), 4,72 (1H, ушир.с), 5,10 (2H, дд), 6,33 (1H, т), 7,30-7,41 (5H, м)
[0140]
[Стадия 3] Получение (1S,2S)-2-(дифторметокси)циклопентанамина гидрохлорида
Аналогично способу в ссылочном примере 6 стадия 2, указанное в заголовке соединение синтезировали с использованием бензил N-[(1S,2S)-2-(дифторметокси)циклопентил]карбамата, полученного на стадии 2, вместо бензил N-[(2S)-1-(дифторметокси)пропан-2-ил]карбамата.
1Н-ЯМР (ДМСО-d6) δ: 1,50-1,78 (4H, м), 2,01-2,10 (2H, м), 3,48 (1H, ушир.с), 4,55 (1H, ушир.с), 6,78 (1H, т), 8,28 (3H, ушир.с)
[0141]
Ссылочный пример 8: {1-[(Дифторметокси)метил]циклопропил}метанамин
К раствору [1-(аминометил)циклопропил]метанола (720 мг) в дихлорметане (15 мл) добавляли DIPEA (2,5 мл), затем к этому добавляли бензилхлорформиат (1,46 г) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (348 мг). К раствору этого масла (348 мг) в ацетонитриле (10 мл) добавляли 2,2-дифтор-2-(фторсульфонил)уксусную кислоту (395 мг) и йодид меди (56 мг), и смесь перемешивали при 50°C в течение 1 часа. Реакционный раствор разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (129 мг). К раствору масла (129 мг) в метаноле (8,0 мл) добавляли 20% гидроксид палладия (на активированном угле, 43 мг), и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (68 мг).
1Н-ЯМР (CDCl3) δ: 0,51-0,52 (4H, м), 2,69 (2H, с), 3,79 (2H, с), 6,25 (1H, т)
[0142]
Ссылочный пример 9: {1-[(Дифторметокси)метил]циклобутил}метанамин
Аналогично способу в ссылочном примере 8, указанное в заголовке соединение синтезировали с использованием [1-(аминометил)циклобутил]метанола (который получали в соответствии со способом, описанным, например, в Journal of Medicinal Chemistry, 1972, 15, 1003-1006) вместо [1-(аминометил)циклопропил]метанола.
1Н-ЯМР (CDCl3) δ: 1,78-1,91 (6H, м), 2,78 (2H, с), 3,86 (2H, с), 6,23 (1H, т)
[0143]
Ссылочный пример 10: {1-[(Дифторметокси)метил]циклопентил}метанамин
Аналогично способу в ссылочном примере 8, указанное в заголовке соединение синтезировали с использованием [1-(аминометил)циклопентил]метанола (который получали в соответствии со способом, описанным, например, в Journal of Medicinal Chemistry, 1972, 15, 1003-1006) вместо [1-(аминометил)циклопропил]метанола.
1Н-ЯМР (CDCl3) δ: 1,42-1,46 (4H, м), 1,58-1,64 (4H, м), 2,69 (2H, с), 3,72 (2H, с), 6,24 (1H, т)
[0144]
Ссылочный пример 11: {4-[(Дифторметокси)метил]тетрагидро-2H-пиран-4-ил}метанамин
К раствору этил 4-{[(трет-бутоксикарбонил)амино]метил}тетрагидро-2H-пиран-4-карбоксилата (1,3 г) в дихлорметане (10 мл) добавляли TFA (5,0 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, к раствору полученного остатка в дихлорметане (10 мл) добавляли DIPEA (3,1 мл), затем к этому добавляли бензилхлорформиат (1,1 г) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (1,4 г). К раствору масла (1,3 г) в этаноле (20 мл) добавляли боргидрид натрия (382 мг) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 2,5 дней. Затем, к этому добавляли борогидрид натрия (382 мг), и смесь перемешивали при комнатной температуре в течение 4 часов, затем при температуре 50°C в течение 3 часов, и далее при комнатной температуре в течение ночи. К реакционному раствору добавляли воду при охлаждении на ледяной воде, и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (484 мг). К раствору масла (484 мг) в ацетонитриле (10 мл) добавляли 2,2-дифтор-2-(фторсульфонил)уксусную кислоту (463 мг) и йодид меди (66 мг), и смесь перемешивали при 50°C в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (209 мг). К раствору масла (200 мг) в метаноле (8,0 мл) добавляли 20% гидроксид палладия (на активированном угле, 80 мг), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (108 мг).
1Н-ЯМР (CDCl3) δ: 1,50-1,53 (4H, м), 2,76 (2H, с), 3,64-3,71 (4H, м), 3,84 (2H, с), 6,24 (1H, т)
[0145]
Ссылочный пример 12: (2R)-N,3,3-Триметилбутан-2-амин гидрохлорид
К раствору (2R)-3,3-диметилбутан-2-амина (5,0 г) в дихлорметане (100 мл) добавляли TEA (15 мл), бензилхлорформиат (9,3 г) добавляли к этому по каплям при охлаждении льдом, и смесь перемешивали в течение ночи. Реакционную смесь разбавляли хлороформом, раствор разделяли добавлением насыщенного водного раствора бикарбоната натрия, водный слой далее экстрагировали хлороформом, и объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением сырого продукта (4,0 г). К раствору полученного сырого продукта (4,0 г) в DMF (15 мл) добавляли йодметан (4,8 г), и 60% гидрид натрия (748 мг) добавляли к этому при охлаждении льдом. После смесь перемешивали при комнатной температуре в течение 1 часа, добавляли к этому ледяную воду и реакционный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением сырого продукта (4,2 г). К раствору полученного сырого продукта (4,2 г) в этаноле (20 мл) добавляли 20% гидроксид палладия (на активированном угле, 1,0 г), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, 2 M раствор хлористого водорода в этаноле (9,0 мл) добавляли к исходной жидкости, и растворитель концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,0 г).
МС (m/z): 116 [M-Cl]+
[0146]
Ссылочный пример 13: 1-[1-(Метоксиметил)циклопропил]-N-метилметанамин гидрохлорид
[Стадия 1] Получение бензил {[1-(гидроксиметил)циклопропил]метил}карбамата
К раствору [1-(аминометил)циклопропил]метанола (1,5 г) (который получали аналогично способу, описанному, например, в Journal of Medicinal Chemistry, 1972, 15, 1003-1006) в дихлорметане (30 мл) добавляли DIPEA (3,7 г), бензилхлорформиат (3,5 г) добавляли к этому при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (3,0 г).
1Н-ЯМР (CDCl3) δ: 0,46 (4H, с), 2,78 (1H, т), 3,20 (2H, д), 3,40 (2H, д), 5,12 (2H, с), 5,23 (1H, с), 7,35-7,37 (5H, м)
[0147]
[Стадия 2] Получение бензил {[1-(метоксиметил)циклопропил]метил}метилкарбамата
К раствору бензил {[1-(гидроксиметил)циклопропил]метил}карбамата, полученного на стадии 1, (350 мг) в DMF (3,0 мл) добавляли иодметан (1,0 г) и оксид серебра (1,7 г), и смесь перемешивали при комнатной температуре в течение ночи. При охлаждении льдом, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и смесь экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (189 мг).
1Н-ЯМР (CDCl3) δ: 0,46-0,60 (4H, м), 2,99 (3H, с), 3,15-3,36 (7H, м), 5,13 (2H, с), 7,28-7,39 (5H, м)
[0148]
[Стадия 3] Получение 1-[1-(метоксиметил)циклопропил]-N-метилметанамина гидрохлорида
К раствору бензил {[1-(метоксиметил)циклопропил]метил}метилкарбамата, полученного на стадии 2, (165 мг) в этаноле (6,0 мл) добавляли гидроксид палладия (на активированном угле, 80 мг), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, 2 М раствор хлористого водорода в этаноле (27 мкл) добавляли к исходной жидкости, и растворитель концентрировали при пониженном давлении с получением указанного в заголовке соединения (95 мг).
1Н-ЯМР (ДМСО-d6) δ: 0,53 (2H, т), 0,66 (2H, т), 2,51 (3H, с), 2,88 (2H, с), 3,26 (3H, с), 3,27 (2H, с), 8,52 (2H, ушир)
[0149]
Ссылочный пример 14: метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение метил пиперидин-4-илкарбамата
К раствору 1-бензилпиперидин-4-амина (5,0 г) в дихлорметане (100 мл) добавляли TEA (9,2 мл), метилхлорформиат (2,6 г) добавляли к этому по каплям при охлаждении льдом, и смесь перемешивали в течение 1 часа. Реакционный раствор разбавляли хлороформом, разделяли добавлением воды, и водный слой далее экстрагировали хлороформом. Объединенный органический слой сушили над безводным сульфатом магния и затем, концентрировали при пониженном давлении с получением масла (3,4 г). К раствору полученного масла (3,4 г) в этаноле (50 мл) добавляли 20% гидроксид палладия (на активированном угле, 1 г), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,9 г).
МС (m/z): 159 [M+H]+
[0150]
[Стадия 2] Получение метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
6-Гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновую кислоту, полученную в ссылочном примере 2, (700 мг) суспендировали в оксихлориде фосфора (5,0 мл), к суспензии добавляли диэтиланилин (0,4 г), и смесь перемешивали при 110°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, и растворяли в дихлорметане (40 мл) при охлаждении льдом. К полученному раствору добавляли DIPEA (2,3 мл) и метил пиперидин-4-илкарбамат, полученный на стадии 1 (443 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли хлороформом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (570 мг).
МС (m/z): 421, 423 [M+H]+
[0151]
Ссылочный пример 15: N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием N-(пиперидин-4-ил)циклопропанкарбоксамида (который получали аналогично способу, описанному, например, в Journal of Medicinal Chemistry, 2010, 53, 6386-6397) вместо метил пиперидин-4-илкарбамата.
МС (m/z): 431, 433 [M+H]+
[0152]
Ссылочный пример 16: N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамид
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 2-метил-N-(4-пиперидил)пропанамида (который получали аналогично способу, описанному, например, в Bioorganic & Medicinal Chemistry Letters, 2012, 22, 3157-3162) вместо метил пиперидин-4-илкарбамата.
МС (m/z): 433, 435 [M+H]+
[0153]
Ссылочный пример 17: трет-бутил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием трет-бутил N-(4-пиперидил)карбамата вместо метил пиперидин-4-илкарбамата.
МС (m/z): 463, 465 [M+H]+
[0154]
Ссылочный пример 18: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанон
В атмосфере аргона, к раствору 1-бензилпиперидин-4-амина (980 мг) и 2-фторпиридина (500 мг) в THF (3,0 мл) добавляли 1 M литий бис(триметилсилил)амид (раствор THF, 10,3 мл) при -78°C. Смесь перемешивали комнатной температуре в течение 1 часа, затем при 70°C в течение ночи. Реакционную смесь разбавляли хлороформом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (155 мг). К раствору полученного масла (150 мг) в этаноле (10 мл) добавляли 20% гидроксид палладия (на активированном угле, 50 мг) и TFA (1 капля), и проводили каталитическое восстановление при среднем давлении при 40°C. Реакционную смесь фильтровали для удаления палладия, и исходную жидкость концентрировали при пониженном давлении с получением твердого вещества (110 мг). 6-Гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновую кислоту, полученную в ссылочном примере 2, (150 мг) суспендировали в оксихлориде фосфора (1,1 мл), к суспензии добавляли диэтиланилин (85 мг), и смесь перемешивали при 110°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток растворяли в дихлорметане (10 мл) при охлаждении льдом, DIPEA (0,5 мл) и вышеуказанное твердое вещество (101 мг) добавляли к раствору, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли хлороформом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенные органические слои сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (36 мг).
МС (m/z): 400, 402 [M+H]+
[0155]
Ссылочный пример 19: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон
В атмосфере аргона, к раствору трет-бутил N-тиазол-2-илкарбамата (1,9 г) и трет-бутил 4-гидроксипиперидин-1-карбоксилата (1,8 г) в THF (20 мл) добавляли диэтил азодикарбоксилат (2,2 M толуольный раствор, 5,1 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 16 часов. Растворитель отгоняли, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества 1 (2,2 г). К раствору полученного твердого вещества 1 (2,2 г) в дихлорметане (5 мл) добавляли TFA (5 мл), и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества 2 (796 мг). 6-Гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновую кислоту, полученную в ссылочном примере 2, (100 мг) суспендировали в оксихлориде фосфора (1,1 мл), к суспензии добавляли диэтиланилин (57 мг), и смесь перемешивали при 110°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, концентрат растворяли в дихлорметане (10 мл) при охлаждении льдом, к раствору добавляли DIPEA (0,33 мл) и твердое вещество 2 (136 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли хлороформом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенные органические слои сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (70 мг).
МС (m/z): 446, 448 [M+H]+
[0156]
Ссылочный пример 20: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанон
К раствору трет-бутил 4-(пиримидин-2-иламино)пиперидин-1-карбоксилата (251 мг) в дихлорметане (3,0 мл) добавляли TFA (1,0 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (248 мг). 6-Гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновую кислоту, полученную в ссылочном примере 2, (100 мг) суспендировали в оксихлориде фосфора (1,1 мл), к суспензии добавляли диэтиланилин (57 мг), и смесь перемешивали при 110°C в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в дихлорметане (10 мл) при охлаждении льдом, DIPEA (0,33 мл) и твердое вещество (134 мг) добавляли к раствору, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли хлороформом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (104 мг).
МС (m/z): 441, 443 [M+H]+
[0157]
Ссылочный пример 21: Циклопропил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение бензил 4-(циклопропанкарбониламино)пиперидин-1-карбоксилата
К раствору 1-бензилоксикарбонилпиперидин-4-карбоновой кислоты (400 мг) в толуоле (3 мл) добавляли TEA (0,85 мл) и дифенилфосфорил азид (627 мг), и смесь перемешивали при 90°C в течение 3 часов. Затем, к этому добавляли циклопропанол (132 мг) (который получали аналогично способу, описанному, например, в US 2012/0010183), и смесь перемешивали при 80°C в течение ночи. Реакционную смесь разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (190 мг).
МС (m/z): 319 [M+H]+
[0158]
[Стадия 2] Получение циклопропил пиперидин-4-илкарбамата
К раствору бензил 4-(циклопропанкарбониламино)пиперидин-1-карбоксилата, полученного на стадии 1, (190 мг) в этаноле (10 мл) добавляли 20% гидроксид палладия (на активированном угле, 50 мг), и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (110 мг).
МС (m/z): 185 [M+H]+
[0159]
[Стадия 3] Получение циклопропил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием циклопропил пиперидин-4-илкарбамата, полученного в ссылочном примере 21 стадия 2, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 447, 449 [M+H]+
[0160]
Ссылочный пример 22: Пропан-2-ил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием пропан-2-ил пиперидин-4-илкарбамата (который получали аналогично способу, описанному, например, в US 5082847) вместо метил пиперидин-4-илкарбамата.
МС (m/z): 449, 451 [M+H]+
[0161]
Ссылочный пример 23: пропил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием пропил пиперидин-4-илкарбамата (который получали аналогично способу, описанному, например, в US 5082847) вместо метил пиперидин-4-илкарбамата.
МС (m/z): 449, 451 [M+H]+
[0162]
Ссылочный пример 24: 2-Метоксиэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение 2-метоксиэтил пиперидин-4-илкарбамата
К раствору 1-бензилоксикарбонилпиперидин-4-карбоновой кислоты (300 мг) в толуоле (2 мл) добавляли TEA (556 мкл), дифенилфосфорил азид (320 мкл) и 2-метоксиэтанол (2 мл), и смесь перемешивали при 100°C в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (189 мг). К раствору полученного масла (189 мг) в метаноле (10 мл) добавляли 5% палладий (на активированном угле, 30 мг), и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (111 мг).
1Н-ЯМР (CDCl3) δ: 1,32-1,37 (2H, м), 1,94-1,97 (2H, м), 2,60-2,74 (2H, т), 3,08 (2H, д), 3,40 (3H, с), 3,57-3,59 (3H, м), 4,20-4,22 (2H, м), 4,75-4,77 (1H, м)
[0163]
[Стадия 2] Получение 2-метоксиэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 2-метоксиэтил пиперидин-4-илкарбамата, полученного на стадии 1, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 465, 467 [M+H]+
[0164]
Ссылочный пример 25: 2,2-Дифторэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение 2,2-дифторэтил пиперидин-4-илкарбамата
К раствору 2,2-дифторэтанола (100 мг) в дихлорметане (1,0 мл) добавляли TEA (255 мкл) и трифосген (145 мг) при охлаждении льдом. После перемешивания смеси в течение 30 минут, к ней добавляли 4-амино-1-бензилпиперидин (497 мкл) и смесь дополнительно перемешивали в течение 30 минут. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (185 мг). К раствору полученного масла (185 мг) в метаноле (10 мл) добавляли 5% палладий (на активированном угле, 30 мг), и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (123 мг).
1Н-ЯМР (CDCl3) δ: 1,25-1,34 (2H, м), 1,94-1,97 (2H, м), 2,60-2,71 (2H, м), 3,04-3,08 (2H, м), 3,55-3,68 (1H, м), 4,20-4,35 (2H, м), 4,77 (1H, ушир), 5,78-6,08 (1H, м)
[0165]
[Стадия 2] Получение 2,2-дифторэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 2,2-дифторэтил пиперидин-4-илкарбамата, полученного на стадии 1, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 471, 473 [M+H]+
[0166]
Ссылочный пример 26: 2,2,2-Трифторэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в ссылочном примере 25, указанное в заголовке соединение синтезировали с использованием 2,2,2-трифторэтанола вместо 2,2-дифторэтанола.
МС (m/z): 489, 491 [M+H]+
[0167]
Ссылочный пример 27: N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид
[Стадия 1] Получение 2-метокси-N-(4-пиперидил)ацетамида
К раствору 1-бензилпиперидин-4-амина (10 г) и TEA (15,9 мл) в дихлорметане (200 мл) добавляли по каплям метоксиацетил хлорид (6,3 г) при охлаждении льдом, и смесь перемешивали в течение 3 часов. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и раствор экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении с получением масла. Полученное масло очищали с помощью колоночной хроматографии на силикагеле с получением масла (13,8 г). К раствору полученного масла в этаноле (100 мл) добавляли 20% гидроксид палладия (на активированном угле, 1,0 г), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (8,0 г).
МС (m/z): 173 [M+H]+
[0168]
[Стадия 2] Получение N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамида
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 2-метокси-N-(4-пиперидил)ацетамида, полученного на стадии 1, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 435, 437 [M+H]+
[0169]
Ссылочный пример 28: N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамид
[Стадия 1] Получение 2,2-дифтор-N-(4-пиперидил)ацетамида
К раствору дифторуксусной кислоты (2,3 г) в дихлорметане (100 мл) добавляли DMF (0,1 мл), добавляли к этому по каплям оксалилхлорид (2,6 г) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Затем, к этому добавляли 1-бензилпиперидин-4-амин (3,0 г), TEA (6,1 г) добавляли по каплям к смеси при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (500 мг). К раствору полученного масла в этаноле (5,0 мл) добавляли 20% гидроксид палладия (на активированном угле, 300 мг), и проводили каталитическое восстановление при среднем давлении. Реакционную смесь фильтровали для удаления палладия, исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (200 мг).
МС (m/z): 179 [M+H]+
[0170]
[Стадия 2] Получение N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамида
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 2,2-дифтор-N-(4-пиперидил)ацетамида, полученного на стадии 1, вместо метил пиперидин-4-илкарбамата.
1Н-ЯМР (CDCl3) δ: 1,55-1,65 (4H, м), 2,04-2,15 (2H, м), 3,03-3,06 (1H, м), 3,28-3,30 (1H, м), 4,72-4,75 (1H, м) 5,91 (1H, т), 6,22-6,24 (1H, м) 7,09 (1H, д), 7,30 (1H, с), 7,90 (1H, д), 8,50 (1H, с)
[0171]
Ссылочный пример 29: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием пиперидин-4-ола вместо метил пиперидин-4-илкарбамата.
МС (m/z): 364, 366 [M+H]+
[0172]
Ссылочный пример 30: (4-{[трет-бутил(диметил)силил]окси}пиперидин-1-ил)[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанон
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 4-{[трет-бутил(диметил)силил]окси}пиперидина (который получали аналогично способу, описанному, например, в WO 2004/006926) вместо метил пиперидин-4-илкарбамата.
1Н-ЯМР (CDCl3) δ: 0,07 (6H, д), 0,91 (9H, с), 1,56-1,75 (2H, м), 1,79-1,91 (2H, м), 3,40-3,50 (1H, м) 3,63―3,92 (3H, м), 4,02―4,11 (1H, м) 7,07 (1H, д), 7,26 (1H, с), 7,88 (1H, д), 8,51 (1H, с)
[0173]
Ссылочный пример 31: N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)пропанамида (который получали аналогично способу, описанному, например, в Bioorganic & Medicinal Chemistry Letters, 2003, 13, 2303-2306) вместо метил пиперидин-4-илкарбамата.
МС (m/z): 419, 421 [M+H]+
[0174]
Ссылочный пример 32: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон
[Стадия 1] Получение N-(1-бензилпиперидин-4-ил)-3-фторпиридин-2-амина
К раствору 1-бензилпиперидин-4-амина (100 мг) в ДМСО (2,0 мл) добавляли 2,3-дифторпиридин (25 мкл) и DIPEA (95 мкл), и смесь перемешивали с использованием микроволнового реактора при 130°C в течение 2 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (74 мг).
МС (m/z): 286 [M+H]+
[0175]
[Стадия 2] Получение 3-фтор-N-(пиперидин-4-ил)пиридин-2-амина
К раствору N-(1-бензилпиперидин-4-ил)-3-фторпиридин-2-амина, полученного на стадии 1, (970 мг) в этаноле (15 мл) добавляли 20% гидроксид палладия (на активированном угле, 300 мг) и каталитическое количество TFA, и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением указанного в заголовке соединения (770 мг).
МС (m/z): 196 [M+H]+
[0176]
[Стадия 3] Получение [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанона
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 3-фтор-N-(пиперидин-4-ил)пиридин-2-амина, полученного на стадии 2, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 458, 460 [M+H]+
[0177]
Ссылочный пример 33: 3-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-1,1-диметилмочевина
[Стадия 1] Получение 3-(1-бензилпиперидин-4-ил)-1,1-диметилмочевины
К раствору 1-бензилпиперидин-4-амина (2,0 г) в дихлорметане (50 мл) добавляли TEA (4,4 мл), затем, при охлаждении льдом, к этому медленно добавляли по каплям N,N-диметилкарбамоил хлорид (1,2 мл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученный раствор экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,7 г).
1Н-ЯМР (CDCl3) δ: 1,43 (2H, q), 1,94 (2H, д), 2,13 (2H, т), 2,80 (2H, д), 2,88 (6H, с), 3,50 (2H, с), 3,67 (1H, м), 4,17 (1H, д), 7,22-7,32 (5H, м)
[0178]
[Стадия 2] Получение 1,1-диметил-3-пиперидин-4-илмочевины
Аналогично способу в ссылочном примере 21 стадия 2, указанное в заголовке соединение синтезировали с использованием 3-(1-бензилпиперидин-4-ил)-1,1-диметилмочевины, полученной на стадии 1, вместо бензил 4-(циклопропанкарбониламино)пиперидин-1-карбоксилата.
МС (m/z): 172 [M+H]+
[0179]
[Стадия 3] Получение 3-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-1,1-диметилмочевины
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 1,1-диметил-3-пиперидин-4-илмочевины, полученной на стадии 2, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 434, 436 [M+H]+
[0180]
Ссылочный пример 34: [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(5-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон
[Стадия 1] Получение N-(1-бензилпиперидин-4-ил)-5-фторпиридин-2-амина
Аналогично способу в ссылочном примере 32 стадия 1, указанное в заголовке соединение синтезировали с использованием 2,5-дифторпиридина вместо 2,3-дифторпиридина.
МС (m/z): 286 [M+H]+
[0181]
[Стадия 2] Получение 5-фтор-N-(пиперидин-4-ил)пиридин-2-амина
Аналогично способу в ссылочном примере 32 стадия 2, указанное в заголовке соединение синтезировали с использованием N-(1-бензилпиперидин-4-ил)-5-фторпиридин-2-амина, полученного на стадии 1, вместо N-(1-бензилпиперидин-4-ил)-3-фторпиридин-2-амина.
1Н-ЯМР (CDCl3) δ: 1,75 (2H, д), 2,24 (2H, д), 2,99 (2H, т), 3,40 (2H, д), 3,97 (1H, с), 4,28 (2H, д), 6,36 (1H, д), 7,19 (1H, т), 7,93 (1H, д)
[0182]
[Стадия 3] Получение [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(5-фторпиридин-2-ил)амино]пиперидин-1-ил}метанона
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 5-фтор-N-(пиперидин-4-ил)пиридин-2-амина, полученного на стадии 2, вместо метил пиперидин-4-илкарбамата.
МС (m/z): 458, 460 [M+H]+
[0183]
Ссылочный пример 35: Метил (1-{[6-хлор-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение этил 6-гидрокси-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору метоксиуксусной кислоты (1,0 г) и диэтилоксалата (1,24 г) в THF (10 мл) добавляли 60% гидрид натрия (372 мг) и этанол (1 капля), и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционный раствор концентрировали при пониженном давлении с получением твердого вещества. С одной стороны, к раствору пиразоло[5,1-b][1,3]тиазол-7-карбонитрила, полученного в ссылочном примере 1, (10 г) в метаноле (300 мл) добавляли раствор 28% метоксида натрия в метаноле (41 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Затем, к ней добавляли хлорид аммония (21,5 г), и смесь перемешивали при 80°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растворяли в этаноле (5 мл), и раствор вышеуказанного твердого вещества в этаноле (5 мл) и этоксид натрия (576 мг) добавляли к раствору, и смесь перемешивали при 80°C на протяжении ночи. К реакционной смеси добавляли небольшое количество уксусной кислоты, смесь концентрировали при пониженном давлении, полученный остаток разбавляли этилацетатом, и жидкость отделяли добавлением насыщенного водного раствора бикарбоната натрия. Водный слой далее экстрагировали этилацетатом, и объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (119 мг).
МС (m/z): 321 [M+H]+
[0184]
[Стадия 2] Получение 6-гидрокси-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
К раствору этил 6-гидрокси-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1 (115 мг), в THF (2 мл) и воде (1 мл) добавляли моногидрат гидроксида лития (60 мг), и смесь перемешивали при 60°C в течение 6 часов. К реакционной смеси добавляли 1 M водного раствора хлористоводородной кислоты для нейтрализации смеси, которую концентрировали при пониженном давлении и полученный остаток промывали водой, собирали на фильтре и высушивали теплом при пониженном давлении с получением указанного в заголовке соединение (73 мг).
МС (m/z): 293 [M+H]+
[0185]
[Стадия 3] Получение метил (1-{[6-хлор-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 6-гидрокси-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной на стадии 2, вместо 6-гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты.
МС (m/z): 451, 453 [M+H]+
[0186]
Ссылочный пример 36: Метил (1-{[6-хлор-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
[Стадия 1] Получение 6-гидрокси-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
К раствору 2-этоксиэтилацетата (1 г) в THF (10 мл) добавляли диэтилоксалат (1,1 г) и 60% гидрид натрия (333 мг) с последующим добавлением каталитического количества этанола, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток суспендировали в гидроксиде натрия (762 мг) и воде (10 мл).
К раствору пиразоло[5,1-b][1,3]тиазол-7-карбонитрила, полученного в ссылочном примере 1, (406 мг) в метаноле (10 мл) добавляли раствор 28% метоксида натрия в метаноле (1,7 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Затем, к ней добавляли хлорид аммония (873 мг), и смесь перемешивали при 80°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли вышеуказанную суспензию, и смесь перемешивали при 100°C в течение 10 часов. К реакционной смеси добавляли конц. хлористоводородную кислоту, чтобы сделать раствор кислым, и выпавшее в осадок твердое вещество собирали на фильтре и сушили с получением указанного в заголовке соединения (217 мг).
МС (m/z): 307 [M+H]+
[0187]
[Стадия 2] Получение метил (1-{[6-хлор-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в ссылочном примере 14 стадия 2, указанное в заголовке соединение синтезировали с использованием 6-гидрокси-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной на стадии 1, вместо 6-гидрокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты.
МС (m/z): 465, 467 [M+H]+
[0188]
Ссылочный пример 37: 6-{[(2S)-1-(Дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
[Стадия 1] Получение метил 6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (30 мг) в DMF (0,5 мл) добавляли (2S)-1-(дифторметокси)пропан-2-амин гидрохлорид, полученный в ссылочном примере 6, (21 мг) и DIPEA (0,1 мл), и смесь перемешивали при 100°C в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (22 мг).
МС (m/z): 384 [M+H]+
[0189]
[Стадия 2] Получение 6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
К раствору метил 6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, (15 мг) в THF (3 мл) и воде (1 мл) добавляли моногидрат гидроксида лития (5 мг), и смесь перемешивали при 50°C в течение 2 часов. К реакционной смеси добавляли 1 M водного раствора хлористоводородной кислоты, чтобы сделать раствор кислым, водный слой экстрагировали смешанным растворителем из хлороформа и метанола, и органический слой сушили над безводным сульфатом магния, концентрировали при пониженном давлении с получением указанного в заголовке соединения (17 мг).
МС (m/z): 370 [M+H]+
[0190]
Ссылочный пример 38: 6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
[Стадия 1] Получение метил 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (50 мг) в DMF (2 мл) добавляли DIPEA (88 мкл) и (1S)-1-циклопропилэтанамин (16 мг), и смесь перемешивали при 80°C в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (40 мг).
МС (m/z): 344 [M+H]+
[0191]
[Стадия 2] Получение 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
К раствору метил 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, (40 мг) в THF (9 мл) и воде (3 мл) добавляли моногидрат гидроксида лития (10 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1 M водного раствора хлористоводородной кислоты, чтобы сделать раствор кислым, THF отгоняли при пониженном давлении и водный слой экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, концентрировали при пониженном давлении с получением указанного в заголовке соединения (36 мг).
МС (m/z): 330 [M+H]+
[0192]
Ссылочный пример 39: 6-{[(1R)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклопропилэтанамина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 330 [M+H]+
[0193]
Ссылочный пример 40: 6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (2S)-3,3-диметилбутан-2-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 346 [M+H]+
[0194]
Ссылочный пример 41: 6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 346 [M+H]+
[0195]
Ссылочный пример 42: 6-{[(1S,2S)-2-(дифторметокси)циклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (1S,2S)-2-(дифторметокси)циклопентанамина гидрохлорида, полученного в ссылочном примере 7, вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 396 [M+H]+
[0196]
Ссылочный пример 43: метил 6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилат
К раствору метил 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 38 стадия 1, (820 мг) в DMF (8,0 мл) добавляли 60% гидрид натрия (115 мг) при комнатной температуре, и смесь перемешивали в течение 3 минут. Затем, к этому добавляли йодметан (1,4 г) и смесь перемешивали в течение 5 минут. Далее, дополнительное количество 60% гидрида натрия (11 мг) добавляли к этому, и смесь перемешивали в течение 5 минут. Реакционный раствор разбавляли хлороформом, разделяли добавлением воды, водный слой далее экстрагировали хлороформом, и объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (665 мг).
МС (m/z): 358 [M+H]+
[0197]
Ссылочный пример 44: 6-{[(1R)-1-(4-метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (1R)-1-(4-метоксифенил)этанамина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 396 [M+H]+
[0198]
Ссылочный пример 45: 6-{[(1S,2S)-2-(Дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
[Стадия 1] Получение метил 6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору бензил [(1S,2S)-2-(дифторметокси)циклопентил]карбамата, полученного в ссылочном примере 7 стадия 2, (710 мг) в DMF (5 мл) добавляли 60% гидрид натрия (149 мг) порциями при комнатной температуре, и полученную смесь перемешивали в течение 10 минут. Затем, к этому добавляли йодметан (530 мг), и смесь перемешивали в течение 2 часов. Реакционную смесь разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (338 мг). К раствору полученного масла (300 мг) в этаноле (6 мл) добавляли 20% гидроксид палладия (на активированном угле, 100 мг), и проводили каталитическое восстановление при среднем давлении. К смеси добавляли 4 М хлористый водород-этилацетат, реакционный раствор фильтровали для удаления палладия и исходную жидкость концентрировали при пониженном давлении с получением твердого вещества (271 мг). К раствору полученного твердого вещества (75 мг) и метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (100 мг) в DMF (2 мл) добавляли DIPEA (0,18 мл), и смесь перемешивали при 100°C в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (102 мг).
МС (m/z): 424 [M+H]+
[0199]
[Стадия 2] Получение 6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
Аналогично способу в ссылочном примере 38 стадия 2, указанное в заголовке соединение синтезировали с использованием метил 6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, вместо метил 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата.
МС (m/z): 410 [M+H]+
[0200]
Ссылочный пример 46: 6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
[Стадия 1] Получение метил 6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору трет-бутил N-[(1S,2S)-2-гидроксициклопентил]карбамата (4,0 г) в DMF (20 мл) добавляли 60% гидрид натрия (870 мг) порциями при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 10 минут. Затем, к этому добавляли йодметан (3,1 г) при охлаждении льдом, и смесь перемешивали при комнатной температуре. Реакционную смесь разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества 1 (2,3 г). К раствору полученного твердого вещества 1 в дихлорметане (10 мл) добавляли 4 M раствор хлористого водорода в этилацетате (5,3 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель концентрировали при пониженном давлении с получением твердого вещества 2 (1,5 г). К раствору полученного твердого вещества 2 (93 мг) и метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (150 мг) в DMF (2,0 мл) добавляли DIPEA (0,26 мл), и смесь перемешивали при 100°C в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (112 мг).
МС (m/z): 374 [M+H]+
[0201]
[Стадия 2] Получение 6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
Аналогично способу в ссылочном примере 38 стадия 2, указанное в заголовке соединение синтезировали с использованием метил 6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, вместо метил 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата.
МС (m/z): 360 [M+H]+
[0202]
Ссылочный пример 47: 6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
[Стадия 1] Получение метил 6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору метил 6-хлор-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 5, (50 мг) в NMP (1 мл) добавляли (2S)-3,3-диметилбутан-2-амин (33 мг) и DIPEA (56 мкл), и смесь перемешивали при 110°C в течение 2 часов 30 минут. Смесь разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, водный слой далее экстрагировали этилацетатом, и объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (39 мг).
МС (m/z): 374 [M+H]+
[0203]
[Стадия 2] Получение 6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты
К раствору метил 6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, (35 мг) в THF (5,0 мл) и воде (2,0 мл) добавляли моногидрат гидроксида лития (12 мг), и смесь перемешивали при 50°C в течение 1 часа. К реакционной смеси добавляли 1 M водного раствора хлористоводородной кислоты, чтобы сделать раствор кислым, и водный слой экстрагировали смешанным растворителем из хлороформа и метанола. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении с получением указанного в заголовке соединения (35 мг).
МС (m/z): 360 [M+H]+
[0204]
Ссылочный пример 48: 6-{[(1S)-1-Циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 47 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо (2S)-3,3-диметилбутан-2-амина.
МС (m/z): 344 [M+H]+
[0205]
Ссылочный пример 49: 6-[(2,2-Диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновая кислота
Аналогично способу в ссылочном примере 38 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием 2,2-диметилпропан-1-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 332 [M+H]+
[0206]
Ссылочный пример 50: 1-циклопропил-3-пиперидин-4-илмочевина гидрохлорид
К раствору циклопропанкарбоновой кислоты (300 мг) в толуоле (3 мл) добавляли TEA (0,5 мл) и дифенилфосфорил азид (1,1 г), и смесь перемешивали при 80°C в течение 3 часов. Затем, к этому добавляли трет-бутил 4-аминопиперидин-1-карбоксилат (600 мг) при комнатной температуре, и смесь перемешивали в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (234 мг). К раствору полученного твердого вещества (230 мг) в дихлорметане (5 мл) добавляли 4 M раствор хлористого водорода в этилацетате (0,6 мл), и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (200 мг).
МС (m/z): 184 [M-Cl]+
[0207]
Ссылочный пример 51: 1-фтор-2-метилпропан-2-ил пиперидин-4-илкарбамат
К раствору 1-бензилпиперидин-4-амина (4,0 г) и 1-{[(1-фтор-2-метилпропан-2-ил)окси]карбонил}-3-метил-1H-имидазол-3-иум йодида (7,6 г) (который получали аналогично способу, описанному, например, в Bioorganic Medicinal Chemistry, 2011, 19, 1580-1593) в ацетонитриле (20 мл) добавляли TEA (5,9 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и полученный раствор экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (2,0 г). К раствору полученного твердого вещества (2,0 г) в этаноле (20 мл) добавляли 20% гидроксид палладия (на активированном угле, 1,0 г), и проводили каталитическое восстановление при среднем давлении. Реакционный раствор фильтровали для удаления палладия, исходную жидкость концентрировали при пониженном давлении и полученный остаток промывали этилацетатом с получением указанного в заголовке соединения (306 мг).
МС (m/z): 219 [M+H]+
[0208]
Ссылочный пример 52: 2-(Диметиламино)этил пиперидин-4-илкарбамат
Аналогично способу в ссылочном примере 25 стадия 1, указанное в заголовке соединение синтезировали с использованием 2-диметиламиноэтанола вместо 2,2-дифторэтанола.
1Н-ЯМР (CDCl3) δ: 1,21-1,35 (2H, м), 1,90-2,00 (2H, м), 2,28 (6H, с), 2,51-2,59 (2H, м), 2,62-2,70 (2H, м), 3,00-3,10 (2H, м), 3,52-3,64 (1H, м), 4,14 (2H, т), 4,74 (1H, ушир)
[0209]
Пример 1: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид гидрохлорид
[Стадия 1] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида
К раствору 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 38, (15 мг) в DMF (1,0 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (11 мг), DIPEA (24 мкл) и HATU (26 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (9 мг).
МС (m/z): 480 [M+H]+
[0210]
[Стадия 2] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида гидрохлорида
К раствору N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного на стадии 1, (540 мг) в дихлорметане добавляли 4 M раствор хлористого водорода в этилацетате (0,5 мл). Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (580 мг).
МС (m/z): 480 [M-Cl]+
Удельное вращение[α]D25=-45,2°(c=1,00,ДМСО)
[0211]
Пример 2: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
Аналогично способу в примере 1 стадия 1, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)ацетамида вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 454 [M+H]+
[0212]
Пример 3: N-(1-{[6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 40, (15 мг) в DMF (1,0 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (11 мг), DIPEA (23 мкл) и HATU (25 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (7 мг).
МС (m/z): 496 [M+H]+
[0213]
Пример 4: N-(1-{[6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
Аналогично способу в примере 3, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)ацетамида вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 470 [M+H]+
[0214]
Пример 5: N-(1-{[6-{[(1S,2S)-2-(Дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(1S,2S)-2-(дифторметокси)циклопентил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 45, (15 мг) в DMF (1,0 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (9,0 мг), DIPEA (19 мкл) и HATU (21 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (16 мг).
МС (m/z): 560 [M+H]+
[0215]
Пример 6: N-(1-{[6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
К раствору 6-{[(2S)-3,3-диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 47, (15 мг) и N-(4-пиперидил)ацетамида (9,0 мг) в DMF (1,0 мл) добавляли DIPEA (14 мкл) и HATU (24 мг), и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (15 мг).
МС (m/z): 484 [M+H]+
[0216]
Пример 7: N-(1-{[6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 6, указанное в заголовке соединение синтезировали с использованием N-(пиперидин-4-ил)циклопропанкарбоксамида вместо N-(4-пиперидил)ацетамида.
МС (m/z): 510 [M+H]+
[0217]
Пример 8: N-[1-({6-[({1-[(Дифторметокси)метил]циклопропил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
К раствору метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (200 мг) в DMF (1,5 мл) добавляли {1-[(дифторметокси)метил]циклопропил}метанамин, полученный в ссылочном примере 8, (113 мг) и DIPEA (236 мкл), и смесь перемешивали при 80°C в течение 1 часа 30 минут. К реакционному раствору добавляли воду, раствор экстрагировали этилацетатом, и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества 1 (233 мг). К раствору полученного твердого вещества 1 (210 мг) в THF (4,0 мл) и воде (1,0 мл) добавляли моногидрат гидроксида лития (32 мг), и смесь перемешивали при 40°C в течение 20 минут. Реакционный раствор нейтрализовали 1 М водным раствором хлористоводородной кислоты, и концентрировали при пониженном давлении с получением твердого вещества 2 (246 мг). К раствору полученного твердого вещества 2 (40 мг) в DMF (0,5 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (26 мг), DIPEA (35 мкл) и HATU (58 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (25 мг).
МС (m/z): 546 [M+H]+
[0218]
Пример 9: N-[1-({6-[({1-[(Дифторметокси)метил]циклобутил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 8, указанное в заголовке соединение синтезировали с использованием {1-[(дифторметокси)метил]циклобутил}метанамина, полученного в ссылочном примере 9, вместо {1-[(дифторметокси)метил]циклопропил}метанамина.
МС (m/z): 560 [M+H]+
[0219]
Пример 10: N-[1-({6-[({1-[(Дифторметокси)метил]циклопентил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 8, указанное в заголовке соединение синтезировали с использованием {1-[(дифторметокси)метил]циклопентил}метанамина, полученного в ссылочном примере 10, вместо {1-[(дифторметокси)метил]циклопропил}метанамина.
МС (m/z): 574 [M+H]+
[0220]
Пример 11: N-[1-({6-[({4-[(Дифторметокси)метил]тетрагидро-2H-пиран-4-ил}метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 8, указанное в заголовке соединение синтезировали с использованием {4-[(дифторметокси)метил]тетрагидро-2H-пиран-4-ил}метанамина, полученного в ссылочном примере 11, вместо {1-[(дифторметокси)метил]циклопропил}метанамина.
МС (m/z): 590 [M+H]+
[0221]
Пример 12: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(1S)-1-циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 48, (20 мг) в DMF (1 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (15 мг), DIPEA (20 мкл) и HATU (33 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (21 мг).
МС (m/z): 494 [M+H]+
[0222]
Пример 13: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
Аналогично способу в примере 12, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)ацетамида вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 468 [M+H]+
[0223]
Пример 14: N-(1-{[6-{[(1S,2S)-2-(Дифторметокси)циклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(1S,2S)-2-(дифторметокси)циклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 42, (20 мг) в DMF (1 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (13 мг), DIPEA (26 мкл) и HATU (29 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (7 мг).
МС (m/z): 546 [M+H]+
[0224]
Пример 15: N-[1-({6-[(2,2-Диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
К раствору метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (30 мг) в DMF (0,1 мл) добавляли 2,2-диметилпропан-1-амин (9,0 мг) и DIPEA (50 мкл), и смесь перемешивали при 100°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества 1 (28 мг). К раствору полученного твердого вещества 1 (28 мг) в диоксане (5,0 мл) и воде (1,0 мл) добавляли моногидрат гидроксида лития (7 мг), и смесь перемешивали при 50°C в течение 1 часа. Смесь нейтрализовали 2 М водным раствором хлористоводородной кислоты, и реакционный раствор концентрировали при пониженном давлении с получением твердого вещества 2. К раствору полученного твердого вещества 2 в DMF (1,5 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид, DIPEA (0,2 мл) и HATU (62 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (27 мг).
МС (m/z): 482 [M+H]+
[0225]
Пример 16: N-(1-{[6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
В атмосфере аргона, к раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (550 мг) в трет-бутаноле (20 мл) добавляли TEA (534 мкл) и (2R)-3,3-диметилбутан-2-амин (258 мг), и смесь перемешивали при 90°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (570 мг).
МС (m/z): 496 [M+H]+
Удельное вращение[α]D25=+14,0°(c=1,00,ДМСО)
[0226]
Пример 17: N-(1-{[6-{[(2S)-1-(Дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(2S)-1-(дифторметокси)пропан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 37, (20 мг) в DMF (0,5 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (11 мг), DIPEA (10 мкл) и HATU (40 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (13 мг).
МС (m/z): 520 [M+H]+
[0227]
Пример 18: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-5-метил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамид
Аналогично способу в примере 12, указанное в заголовке соединение синтезировали с использованием 2,2-дифтор-N-(4-пиперидил)ацетамида, полученного в ссылочном примере 28 стадия 1, вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 504 [M+H]+
[0228]
Пример 19: N-(1-{[6-{[(1S,2S)-2-Метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(1S,2S)-2-метоксициклопентил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 46, (20 мг) в DMF (1 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (14 мг), DIPEA (29 мкл) и HATU (32 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (13 мг).
МС (m/z): 510 [M+H]+
[0229]
Пример 20: [6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон гидрохлорид
К раствору 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 38, (420 мг) в DMF (5 мл) добавляли пиперидин-4-ол (194 мг), DIPEA (662 мкл) и HATU (727 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (530 мг). К раствору полученного твердого вещества в этилацетате добавляли 4 M раствор хлористого водорода в этилацетате (0,6 мл). Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (560 мг).
МС (m/z): 413 [M-Cl]+
Значение элементного анализа (для C19H24N6O2S HCl+0,3 H2O+0,2 CH3CO2C2H5)
Вычисленное значение (%) C: 52,93, H: 5,81, N: 17,81
Найденное значение (%) C: 52,68, H: 5,78, N: 17,78
[0230]
Пример 21: 1-фтор-2-метилпропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
Аналогично способу в примере 20, указанное в заголовке соединение синтезировали с использованием 1-фтор-2-метилпропан-2-ил пиперидин-4-илкарбамата, полученного в ссылочном примере 51, вместо пиперидин-4-ола.
МС (m/z): 530 [M-Cl]+
[0231]
Пример 22: метил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 3, указанное в заголовке соединение синтезировали с использованием метил пиперидин-4-илкарбамата, полученного в ссылочном примере 14 стадия 1, вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 486 [M+H]+
[0232]
Пример 23: [6-{[(2S)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон
Аналогично способу в примере 3, указанное в заголовке соединение синтезировали с использованием пиперидин-4-ола вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 429 [M+H]+
[0233]
Пример 24: метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
[Стадия 1] Получение метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
В атмосфере аргона, к раствору метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 14, (20 мг) в DMF (1 мл) добавляли DIPEA (16 мкл) и (2R)-3-метилбутан-2-амин (6 мг), и смесь перемешивали при 100°C в течение 3 часов 30 минут. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (19 мг).
МС (m/z): 472 [M+H]+
[Стадия 2] Получение метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата гидрохлорида
К раствору метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного на стадии 1, (56 мг) в этилацетате добавляли 4 M раствор хлористого водорода в этилацетате (0,1 мл). Реакционный раствор концентрировали при пониженном давлении, и полученный остаток промывали диэтиловым эфиром с получением указанного в заголовке соединения (50 мг).
МС (m/z): 472 [M-Cl]+
Значение элементного анализа (для C22H29N7O3S HCl+1,0 H2O)
Вычисленное значение (%) C: 50,23, H: 6,13, N: 18,64
Найденное значение (%) C: 50,47, H: 6,08, N: 18,52
[0234]
Пример 25: метил (1-{[6-{[(2S)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
Аналогично способу в примере 24 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (2S)-3-метилбутан-2-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 472 [M-Cl]+
Значение элементного анализа (для C22H29N7O3SH Cl+H2O)
Вычисленное значение (%) C: 50,23, H: 6,13, N: 18,64
Найденное значение (%) C: 50,50, H: 6,10, N: 18,27
[0235]
Пример 26: метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 470 [M+H]+
Удельное вращение[α]D25=-53,0°(c=1,00,ДМСО)
Пример 27: метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
К раствору метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в примере 26, (2,26 г) в этилацетате (100 мл) добавляли 4 M раствор хлористого водорода в этилацетате (2,4 мл). Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,35 г).
МС (m/z): 470 [M-Cl]+
Значение элементного анализа (для C22H27N7O3S HCl+H2O)
Вычисленное значение (%) C: 50,42, H: 5,77, N: 18,71
Найденное значение (%) C: 50,53, H: 5,66, N: 18,97
[0236]
Пример 28: этил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 1 стадия 1, указанное в заголовке соединение синтезировали с использованием этил пиперидин-4-илкарбамата (который получали аналогично способу, описанному, например, в US 1990/4918073) вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 484 [M+H]+
Удельное вращение[α]D25=-44,2°(c=1,00,ДМСО)
[0237]
Пример 29: Пропан-2-ил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору пропан-2-ил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 22, (200 мг) в DMF (3 мл) добавляли DIPEA (0,3 мл) и (2R)-3,3-диметилбутан-2-амин (90 мг), и смесь перемешивали при 120°C в течение 4 часов в запаянной трубке. Реакционный раствор разбавляли этилацетатом, разделяли с помощью насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (160 мг).
МС (m/z): 514 [M+H]+
[0238]
Пример 30: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид
[Стадия 1] Получение трет-бутил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в примере 1 стадия 1, указанное в заголовке соединение синтезировали с использованием трет-бутил N-(4-пиперидил)карбамата вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 512 [M+H]+
[Стадия 2] Получение (4-аминопиперидин-1-ил)[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона
К раствору трет-бутил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного на стадии 1, (75 мг) в дихлорметане (2 мл) добавляли TFA (0,5 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (65 мг).
МС (m/z): 412 [M+H]+
[Стадия 3] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамида
К раствору (4-аминопиперидин-1-ил)[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного на стадии 2, (20 мг) в дихлорметане (1 мл) добавляли DIPEA (25 мкл) и бензоилхлорид (10 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (18 мг).
МС (m/z): 516 [M+H]+
[0239]
Пример 31: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пиридин-3-карбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием пиридин-3-карбонилхлорида гидрохлорида вместо бензоилхлорида.
МС (m/z): 517 [M+H]+
[0240]
Пример 32: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)тиофен-2-карбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием тиофен-2-карбонил хлорида вместо бензоилхлорида.
МС (m/z): 522 [M+H]+
[0241]
Пример 33: N-(1-{[6-{[(1S)-1-Циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид гидрохлорид
[Стадия 1] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида
К раствору метил 6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 43, (25 мг) в THF (3 мл) и воде (1 мл) добавляли моногидрат гидроксида лития (9 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении, и к раствору полученного твердого вещества в DMF (2 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (18 мг), DIPEA (74 мкл) и HATU (40 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли хлороформом, разделяли добавлением воды, и водный слой далее экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (30 мг).
МС (m/z): 494 [M+H]+
[Стадия 2] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида гидрохлорида
Аналогично способу в примере 27, указанное в заголовке соединение синтезировали с использованием N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного на стадии 1.
МС (m/z): 494 [M-Cl]+
Удельное вращение[α]D25=-35,7°(c=0,42,ДМСО)
[0242]
Пример 34: 1-Циклопропил-3-(1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)мочевина
Аналогично способу в примере 1 стадия 1, указанное в заголовке соединение синтезировали с использованием 1-циклопропил-3-пиперидин-4-илмочевины гидрохлорида, полученной в ссылочном примере 50, вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 495 [M+H]+
[0243]
Пример 35: [6-{[(1S)-1-Циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанон
К раствору метил 6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 43, (665 мг) в THF (10 мл) и воде (5 мл) добавляли моногидрат гидроксида лития (234 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении, к полученному остатку добавляли 1 М водного раствора хлористоводородной кислоты, чтобы сделать раствор кислым, и водный слой экстрагировали смешанным растворителем из хлороформа и метанола. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении с получением твердого вещества (600 мг). К раствору полученного твердого вещества (15 мг) в DMF (1 мл) добавляли N-(4-пиперидил)пиримидин-2-амин (который получали аналогично способу, описанному, например, в WO 2005/105779) (12 мг), DIPEA (15 мкл), HATU (25 мг), и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (14 мг).
МС (m/z): 504 [M+H]+
[0244]
Пример 36: N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
[Стадия 1] Получение метил 6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата
К раствору метил 6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в ссылочном примере 3, (30 мг) в DMF (0,5 мл) добавляли DIPEA (50 мкл) и трет-бутиламин (7 мг), и смесь перемешивали при 100°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (15 мг).
МС (m/z): 332 [M+H]+
[Стадия 2] Получение N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида
К раствору метил 6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного на стадии 1, (15 мг) в THF (5 мл) и воде (1 мл) добавляли моногидрат гидроксида лития (6 мг), и смесь перемешивали при 40°C в течение 1 часа. Смесь нейтрализовали 2 М водным раствором хлористоводородной кислоты, и реакционный раствор концентрировали при пониженном давлении с получением твердого вещества. К раствору полученного твердого вещества в DMF (0,5 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (11 мг), DIPEA (16 мкл) и HATU (26 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (8 мг).
МС (m/z): 468 [M+H]+
[0245]
Пример 37: N-[1-({6-[(1-Метилциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 36 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием 1-метилциклопропанамина гидрохлорида вместо трет-бутиламина.
МС (m/z): 466 [M+H]+
[0246]
Пример 38: N-[1-({6-[(1-метокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 36 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием 1-метокси-2-метилпропан-2-амина гидрохлорида (который получали аналогично способу, описанному, например, в WO 2011/087837) вместо трет-бутиламина.
МС (m/z): 498 [M+H]+
[0247]
Пример 39: метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 486 [M+H]+
[0248]
Пример 40: этил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору 6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 41, (30 мг) в DMF (1 мл) добавляли этил пиперидин-4-илкарбамат (который получали аналогично способу, описанному в US 1990/4918073) (19 мг), DIPEA (34 мг) и HATU (50 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (41 мг).
МС (m/z): 500 [M+H]+
[0249]
Пример 41: Пропан-2-ил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 29, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 498 [M+H]+
Удельное вращение[α]D25=-35,4°(c=0,74,ДМСО)
[0250]
Пример 42: N-(1-{[6-{[(1S)-1-Циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид
[Стадия 1] Получение трет-бутил (1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
Аналогично способу в примере 35, указанное в заголовке соединение синтезировали с использованием трет-бутил N-(4-пиперидил)карбамата вместо N-(4-пиперидил)пиримидин-2-амина.
МС (m/z): 526 [M+H]+
[Стадия 2] Получение (4-аминопиперидин-1-ил)[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона
К раствору трет-бутил (1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного на стадии 1, (150 мг) в дихлорметане (2 мл) добавляли TFA (1 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (117 мг).
МС (m/z): 426 [M+H]+
[0251]
[Стадия 3] Получение N-(1-{[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамида
К раствору (4-аминопиперидин-1-ил)[6-{[(1S)-1-циклопропилэтил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного на стадии 2, (20 мг) в дихлорметане (1 мл) добавляли DIPEA (24 мкл) и бензоилхлорид (10 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (13 мг).
МС (m/z): 530 [M+H]+
[0252]
Пример 43: N-(1-{[6-(Циклопропилметокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (20 мг) и циклопропилметанола (33 мг) в THF (3,0 мл) добавляли 60% гидрид натрия (2 мг) при охлаждении льдом, и смесь перемешивали при 70°C в течение 1 часа. Реакционный раствор разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (15 мг).
МС (m/z): 467 [M+H]+
[0253]
Пример 44: N-[1-({6-[(3,3-Диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 43, указанное в заголовке соединение синтезировали с использованием 3,3-диметилбутан-2-ола вместо циклопропилметанола.
МС (m/z): 497 [M+H]+
[0254]
Пример 45: N-(1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 43, указанное в заголовке соединение синтезировали с использованием циклобутанола вместо циклопропилметанола.
МС (m/z): 467 [M+H]+
[0255]
Пример 46: N-(1-{[6-{[(1R)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклопропилэтанамина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 480 [M+H]+
[0256]
Пример 47: N-(1-{[6-{[(1R)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид гидрохлорид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (50 мг) в DMF (1 мл) добавляли DIPEA (60 мкл) и (1R)-1-циклопропилэтанамин (12 мг), и смесь перемешивали при 70°C в течение 1 часа 40 минут. Затем, (1R)-1-циклопропилэтанамин (11 мг) добавляли к этому, и смесь перемешивали при 70°C в течение 4 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (50 мг). К раствору полученного твердого вещества в этилацетате добавляли 4 M раствор хлористого водорода в этилацетате (52 мкл). Реакционный раствор концентрировали при пониженном давлении, и полученный остаток промывали диэтиловым эфиром с получением указанного в заголовке соединения (35 мг).
МС (m/z): 481 [M-Cl]+
[0257]
Пример 48: N-[1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (20 мг) в NMP (1 мл) добавляли DIPEA (16 мкл) и 2-амино-2-метилпропан-1-ол (6 мг), и смесь перемешивали при 100°C в течение 2 часов. Дополрительно к этому добавляли 2-амино-2-метилпропан-1-ол (6 мг), и смесь перемешивали при 110°C в течение 2 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (8 мг).
МС (m/z): 484 [M+H]+
[0258]
Пример 49: [6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,2-оксазол-3-иламино)пиперидин-1-ил]метанон
В атмосфере аргона, к раствору трет-бутил 4-оксопиперидин-1-карбоксилата (250 мг) и изоксазол-3-амина (106 мг) в метаноле (5 мл) добавляли уксусную кислоту (75 мг) и комплекс 2-пиколин боран (134 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, и раствор экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением масла (109 мг). Полученное масло растворяли в 2 М растворе хлористого водорода-метанола (5 мл), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток промывали диэтиловым эфиром и сушили с получением твердого вещества (90 мг). К раствору полученного твердого вещества (9 мг) и 6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 38, (10 мг) в DMF (1 мл) добавляли DIPEA (11 мкл) и HATU (17 мг), и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (14 мг).
МС (m/z): 479 [M+H]+
[0259]
Пример 50: [6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон
Аналогично способу в примере 49, указанное в заголовке соединение синтезировали с использованием тиазол-2-амина вместо изоксазол-3-амина.
МС (m/z): 495 [M+H]+
[0260]
Пример 51: [6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-метил-1,2-оксазол-5-ил)амино]пиперидин-1-ил}метанон
Аналогично способу в примере 49, указанное в заголовке соединение синтезировали с использованием 3-метилизоксазол-5-амина вместо изоксазол-3-амина.
МС (m/z): 493 [M+H]+
[0261]
Пример 52: N-(1-{[6-{[(1R)-1-(4-Метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору 6-{[(1R)-1-(4-метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 44, (20 мг) в DMF (1 мл) добавляли N-(пиперидин-4-ил)циклопропанкарбоксамид (12 мг), DIPEA (26 мкл) и HATU (29 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (16 мг).
МС (m/z): 546 [M+H]+
[0262]
Пример 53: метил (1-{[6-{[(1R)-1-(4-метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 52, указанное в заголовке соединение синтезировали с использованием метил пиперидин-4-илкарбамата, полученного в ссылочном примере 14 стадия 1, вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 536 [M+H]+
[0263]
Пример 54: N-(1-{[6-{[(1R)-1-(4-Метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)бензамид
Аналогично способу в примере 52, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)бензамида вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 582 [M+H]+
[0264]
Пример 55: N-(1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 48, указанное в заголовке соединение синтезировали с использованием (2S)-2-амино-3,3-диметилбутан-1-ола вместо 2-амино-2-метилпропан-1-ола.
МС (m/z): 512 [M+H]+
[0265]
Пример 56: (4-Гидроксипиперидин-1-ил)[6-{[(1R)-1-(4-метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанон
Аналогично способу в примере 52, указанное в заголовке соединение синтезировали с использованием пиперидин-4-ола вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 479 [M+H]+
[0266]
Пример 57: 1-фтор-2-метилпропан-2-ил (1-{[6-{[(1R)-1-(4-метоксифенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 52, указанное в заголовке соединение синтезировали с использованием 1-фтор-2-метилпропан-2-ил пиперидин-4-илкарбамата, полученного в ссылочном примере 51, вместо N-(пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 596 [M+H]+
[0267]
Пример 58: [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон
К раствору [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона, полученного в ссылочном примере 29, (2,2 г) в трет-бутаноле (10 мл) добавляли трет-бутиламин (1,3 г), и смесь перемешивали при 130°C в течение 10 часов в запаянной трубке. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (2,1 г).
МС (m/z): 401 [M+H]+
[0268]
Пример 59: метил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием трет-бутиламина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 458 [M+H]+
[0269]
Пример 60: Пропан-2-ил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 29, указанное в заголовке соединение синтезировали с использованием трет-бутиламина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 486 [M+H]+
[0270]
Пример 61: метил [1-({6-[(1-гидрокси-2-метилпропан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 2-амино-2-метилпропан-1-ола вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 474 [M+H]+
[0271]
Пример 62: [6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанон гидрохлорид
[Стадия 1] Получение [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона
К раствору [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона, полученного в ссылочном примере 29, (5 г) в 2-пропаноле (50 мл) добавляли DIPEA (9,5 мл) и (2R)-3,3-диметилбутан-2-амин (2,8 г), и смесь перемешивали при 100°C в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (6,0 г).
МС (m/z): 429 [M+H]+
[0272]
[Стадия 2] Получение [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона гидрохлорида
Аналогично способу в примере 27, указанное в заголовке соединение синтезировали с использованием [6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона, полученного на стадии 1.
МС (m/z): 429 [M-Cl]+
Значение элементного анализа (для C21H28N6O2S HCl+0,5 H2O)
Вычисленное значение (%) C: 52,22, H: 6,14, N: 18,27
Найденное значение (%) C: 52,09, H: 6,06, N: 18,26
[0273]
Пример 63: метил (1-{[6-{[(2S)-1-гидрокси-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием (2S)-2-амино-3,3-диметилбутан-1-ола вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 502 [M+H]+
[0274]
Пример 64: метил [1-({6-[(3,3-диметилбутан-2-ил)окси]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
К раствору метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 14, (25 мг) и 3,3-диметилбутан-2-ола (61 мг) в THF (2 мл) добавляли 60% гидрид натрия (4 мг) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли этилацетатом, разделяли добавлением воды, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (6 мг).
МС (m/z): 487 [M+H]+
[0275]
Пример 65: метил (1-{[6-(циклобутилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 64, указанное в заголовке соединение синтезировали с использованием циклобутанола вместо 3,3-диметилбутан-2-ола.
МС (m/z): 457 [M+H]+
[0276]
Пример 66: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)метансульфонамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием метансульфонилхлорида вместо бензоилхлорида.
МС (m/z): 490 [M+H]+
[0277]
Пример 67: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропансульфонамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием циклопропансульфонил хлорида вместо бензоилхлорида.
МС (m/z): 516 [M+H]+
[0278]
Пример 68: N-(1-{[6-{[(1S)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)этансульфонамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием этансульфонилхлорида вместо бензоилхлорида.
МС (m/z): 504 [M+H]+
[0279]
Пример 69: N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамид
К раствору метил 6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоксилата, полученного в примере 36 стадия 1, (280 мг) в 1,4-диоксане (3 мл) добвляли 2 M водный раствор гидроксида натрия (1,27 мл), и смесь перемешивали при 50°C в течение 1 часа. Смесь нейтрализовали 2 М водным раствором хлористоводородной кислоты, и реакционный раствор концентрировали при пониженном давлении с получением твердого вещества (50 мг). К раствору полученного твердого вещества в DMF (0,3 мл) добавляли DIPEA (41 мг), 2-метил-N-(4-пиперидил)пропанамид (который получали аналогично способу, описанному, например, в Bioorganic and Medicinal Chemistry Letters, 2012, 22, 3157-3162) (52 мг) и HATU (87 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и остаток разбавляли хлороформом и очищали колоночной хроматографией на силикагеле с получением указанного в заголовке соединения (28 мг).
МС (m/z): 470 [M+H]+
[0280]
Пример 70: N-(1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамид
Аналогично способу в примере 69, указанное в заголовке соединение синтезировали с использованием 2,2-дифтор-N-(4-пиперидил)ацетамида, полученного в примере 28 стадия 1, вместо 2-метил-N-(4-пиперидил)пропанамида.
МС (m/z): 478 [M+H]+
[0281]
Пример 71: этил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 69, указанное в заголовке соединение синтезировали с использованием этил пиперидин-4-илкарбамата (который получали аналогично способу, описанному, например, в US 19904918073) вместо 2-метил-N-(4-пиперидил)пропанамида.
МС (m/z): 472 [M+H]+
[0282]
Пример 72: [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанон
К раствору [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанона, полученного в ссылочном примере 18, (25 мг) в NMP (0,5 мл) добавляли DIPEA (20 мкл) и трет-бутиламин (8 мг), и смесь перемешивали при 120°C в течение 2 часов. Добавляли к этому дополнительное количество трет-бутиламина (8 мг), и смесь перемешивали при 120°C в течение дополнительного часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (8 мг).
МС (m/z): 477 [M+H]+
[0283]
Пример 73: этил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору 6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 39, (50 мг) в DMF (0,3 мл) добавляли этил пиперидин-4-илкарбамат (который получали аналогично способу, описанному, например, в US 1990/4918073) (52 мг), DIPEA (59 мг) и HATU (87 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (30 мг).
МС (m/z): 484 [M+H]+
[0284]
Пример 74: этил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
Аналогично способу в примере 27, указанное в заголовке соединение синтезировали с использованием этил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в примере 73.
МС (m/z): 484 [M-Cl]+
Значение элементного анализа (для C23H29N7O3S HCl+1,1H2O)
Вычисленное значение (%) C: 51,17, H: 6,01, N: 18,16
Найденное значение (%) C: 50,92, H: 6,12, N: 17,95
Пример 75: [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанон
Аналогично способу в примере 72, указанное в заголовке соединение синтезировали с использованием [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(1,3-тиазол-2-иламино)пиперидин-1-ил]метанона, полученного в ссылочном примере 19, вместо [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанона.
МС (m/z): 483 [M+H]+
[0285]
Пример 76: [6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанон
Аналогично способу в примере 72, указанное в заголовке соединение синтезировали с использованием [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиримидин-2-иламино)пиперидин-1-ил]метанона, полученного в ссылочном примере 20, вместо [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил][4-(пиридин-2-иламино)пиперидин-1-ил]метанона.
МС (m/z): 478 [M+H]+
[0286]
Пример 77: метил (1-{[6-{[(1R)-1-(4-фторфенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
В атмосфере аргона, к раствору метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 14, (20 мг) в DMF (1 мл) добавляли DIPEA (25 мкл) и (1R)-1-(4-фторфенил)этанамин (18 мкл), и смесь перемешивали при 80°C в течение 4 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (24 мг).
МС (m/z): 524 [M+H]+
[0287]
Пример 78: N-[1-({6-[(Азетидин-3-илметил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (30 мг) в DMF (1 мл) добавляли DIPEA (48 мкл) и 3-(аминометил)азетидин-1-карбоновую кислоту трет-бутил (19 мг), и смесь перемешивали при 120°C в течение 2 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (40 мг). К раствору полученного твердого вещества (35 мг) в дихлорметане (1 мл) добавляли TFA (1 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (29 мг).
МС (m/z): 481 [M+H]+
[0288]
Пример 79: N-(1-{[6-{[(1R)-1-(4-Фторфенил)этил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамид
Аналогично способу в примере 77, указанное в заголовке соединение синтезировали с использованием N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамида, полученного в ссылочном примере 16, вместо метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата.
МС (m/z): 536 [M+H]+
[0289]
Пример 80: метил [1-({6-[(2-метилбутан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 2-метилбутан-2-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 472 [M+H]+
[0290]
Пример 81: (4-Гидроксипиперидин-1-ил)[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанон гидрохлорид
[Стадия 1] Получение (4-гидроксипиперидин-1-ил)[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона
К раствору (4-{[трет-бутил(диметил)силил]окси}пиперидин-1-ил)[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного в ссылочном примере 30, (840 мг) в 1-бутаноле (10 мл) добавляли DIPEA (1,2 мл) и пентан-3-амин (459 мг), и смесь перемешивали при 80°C в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (792 мг). К раствору полученного твердого вещества (790 мг) в THF (5 мл) добавляли 1 M тетрабутиламмоний фторид (раствор THF, 6,0 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, раствор экстрагировали хлороформом, и органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (474 мг).
МС (m/z): 415 [M+H]+
[Стадия 2] Получение (4-гидроксипиперидин-1-ил)[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона гидрохлорида
К раствору (4-гидроксипиперидин-1-ил)[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного на стадии 1, (474 мг) в этилацетате (10 мл) добавляли 4 M раствор хлористого водорода в этилацетате (0,57 мл). Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения (517 мг).
МС (m/z): 415 [M-Cl]+
Значение элементного анализа (для C20H26N6O2S HCl+0,5 H2O)
Вычисленное значение (%) C: 52,22, H: 6,14, N: 18,27
Найденное значение (%) C: 52,09, H: 6,06, N: 18,26
[0291]
Пример 82: пропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Пропил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат, полученный в ссылочном примере 23, (30 мг) растворяли в NMP (0,5 мл), к смеси добавляли DIPEA (17 мг) и трет-бутиламин (14 мг), и смесь перемешивали при 130°C в течение 3 часов в запаянной трубке. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (25 мг).
МС (m/z): 486 [M+H]+
[0292]
Пример 83: пропил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 82, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклопропилэтанамина вместо трет-бутиламина.
МС (m/z): 498 [M+H]+
[0293]
Пример 84: пропил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 82, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо трет-бутиламина.
МС (m/z): 498 [M+H]+
[0294]
Пример 85: пропил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 82, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо трет-бутиламина.
МС (m/z): 514 [M+H]+
[0295]
Пример 86: пропил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 82, указанное в заголовке соединение синтезировали с использованием (2S)-3,3-диметилбутан-2-амина вместо трет-бутиламина.
МС (m/z): 514 [M+H]+
[0296]
Пример 87: метил [1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат гидрохлорид
[Стадия 1] Получение метил [1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 2,2-диметилпропан-1-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 472 [M+H]+
[Стадия 2] Получение метил [1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата гидрохлорида
К раствору метил [1-({6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата, полученного на стадии 1, (48 мг) в этилацетате (3 мл) добавляли 4 M раствор хлористого водорода в этилацетате (50 мкл). Реакционный раствор концентрировали при пониженном давлении, и сушили с получением указанного в заголовке соединения (51 мг).
МС (m/z): 472 [M-Cl]+
Значение элементного анализа (для C22H29N7O3S HCl+1,6 H2O)
Вычисленное значение (%) C: 49,22, H: 6,23, N: 18,26
Найденное значение (%) C: 49,03, H: 6,03, N: 18,35
[0297]
Пример 88: 2-Метоксиэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору 2-метоксиэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 24, (20 мг) в этаноле (1 мл) добавляли DIPEA (30 мкл) и (1R)-1-циклопропилэтанамин (14 мкл), и смесь перемешивали при 80°C в течение ночи. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (15 мг).
МС (m/z): 514 [M+H]+
[0298]
Пример 89: 2-Метоксиэтил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 88, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 514 [M+H]+
[0299]
Пример 90: 2-Метоксиэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 88, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 530 [M+H]+
[0300]
Пример 91: 2-Метоксиэтил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 88, указанное в заголовке соединение синтезировали с использованием (2S)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 530 [M+H]+
[0301]
Пример 92: N-(1-{[6-{[(1R)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамида, полученного в ссылочном примере 27, (50 мг) в 2-пропаноле (1 мл) добавляли DIPEA (60 мкл) и (1R)-1-циклопропилэтанамин (49 мг), и смесь перемешивали при 90°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (42 мг).
МС (m/z): 484 [M+H]+
[0302]
Пример 93: N-(1-{[6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метоксиацетамид
Аналогично способу в примере 92, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 500 [M+H]+
[0303]
Пример 94: {6-[(2,2-Диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}(4-гидроксипиперидин-1-ил)метанон
К раствору 6-[(2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбоновой кислоты, полученной в ссылочном примере 49, (27 мг) в DMF (0,5 мл) добавляли пиперидин-4-ол (16 мг), DIPEA (28 мкл) и HATU (62 мг), и смесь перемешивали при комнатной температуре в течение ночи. Затем, к этому добавляли HATU (15 мг), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (16 мг).
МС (m/z): 415 [M+H]+
[0304]
Пример 95: метил [1-({6-[{[1-(метоксиметил)циклопропил]метил}(метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 1-(1-(метоксиметил)циклопропил)-N-метилметанамина гидрохлорида, полученного в ссылочном примере 13, вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 514 [M+H]+
[0305]
Пример 96: 2,2-Дифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
[Стадия 1] Получение 2,2-дифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата
К раствору 2,2-дифторэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 25, (20 мг) в этаноле (1 мл) добавляли DIPEA (29 мкл) и (1R)-1-циклопропилэтанамин (14 мкл), и смесь перемешивали при 80°C в течение ночи. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (14 мг).
МС (m/z): 520 [M+H]+
[Стадия 2] Получение 2,2-дифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата гидрохлорида
К раствору 2,2-дифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного на стадии 1, (490 мг) в этилацетате добавляли 4 M раствор хлористого водорода в этилацетате (0,47 мл). Реакционный раствор концентрировали при пониженном давлении, и полученный остаток промывали диэтиловым эфиром с получением указанного в заголовке соединения (455 мг).
МС (m/z): 520 [M-Cl]+
Значение элементного анализа (для C23H27F2N7O3S HCl+2,5 H2O)
Вычисленное значение (%) C: 45,96, H: 5,53, N: 16,31
Найденное значение (%) C: 46,19, H: 5,34, N: 16,08
[0306]
Пример 97: 2,2-Дифторэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат гидрохлорид
Аналогично способу в примере 96 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 536 [M-Cl]+
Значение элементного анализа (для C24H31F2N7O3S HCl+1,1 H2O)
Вычисленное значение (%) C: 48,70, H: 5,82, N: 16,56
Найденное значение (%) C: 48,50, H: 5,69, N: 16,49
[0307]
Пример 98: 2,2-Дифторэтил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 96 стадия 1, указанное в заголовке соединение синтезировали с использованием (1S)-1-циклопропилэтанамина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 520 [M+H]+
[0308]
Пример 99: 2,2-Дифторэтил (1-{[6-{[(2S)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 96 стадия 1, указанное в заголовке соединение синтезировали с использованием (2S)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 536 [M+H]+
[0309]
Пример 100: трет-бутил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору трет-бутил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 17, (200 мг) в 1-бутаноле (1 мл) добавляли (2R)-3,3-диметилбутан-2-амин (131 мг) и DIPEA (0,3 мл), и смесь перемешивали при 80°C в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (183 мг).
МС (m/z): 528 [M+H]+
[0310]
Пример 101: 2-Метоксиэтил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору 2-метоксиэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 24, (20 мг) в этаноле (0,5 мл) добавляли DIPEA (45 мкл) и трет-бутиламин (23 мкл), и смесь перемешивали при 130°C в течение 4 часов в запаянной трубке. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (2,4 мг).
МС (m/z): 502 [M+H]+
[0311]
Пример 102: 2-(Диметиламино)этил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 40, указанное в заголовке соединение синтезировали с использованием 2-(диметиламино)этил пиперидин-4-илкарбамата, полученного в ссылочном примере 52, вместо этил пиперидин-4-илкарбамата.
МС (m/z): 543 [M+H]+
[0312]
Пример 103: 2,2,2-Трифторэтил (1-{[6-{[(1R)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору 2,2,2-трифторэтил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 26, (15 мг) в DMF (1 мл) добавляли DIPEA (21 мкл) и (1R)-1-циклопропилэтанамин (10 мкл), и смесь перемешивали при 90°C в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (5 мг).
МС (m/z): 538 [M+H]+
[0313]
Пример 104: 2,2,2-Трифторэтил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 103, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 554 [M+H]+
[0314]
Пример 105: N-(1-{[6-(Циклопентилокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 43, указанное в заголовке соединение синтезировали с использованием циклопентанола вместо циклопропилметанола.
МС (m/z): 481 [M+H]+
[0315]
Пример 106: 2-метокси-N-(1-{[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
Аналогично способу в примере 92, указанное в заголовке соединение синтезировали с использованием пентан-3-амина вместо (1R)-1-циклопропилэтанамина.
МС (m/z): 486 [M+H]+
[0316]
Пример 107: N-(1-{[6-(2-этилбутокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
В атмосфере аргона, к суспензии 60% гидрида натрия (4 мг) в THF (1,0 мл) добавляли 2-этилбутан-1-ол (29 мкл) и N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид, полученный в ссылочном примере 15, (20 мг) в этой последовательности, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, раствор экстрагировали этилацетатом, и органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (16 мг).
МС (m/z): 496 [M+H]+
[0317]
Пример 108: метил (1-{[6-(пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
В атмосфере аргона, к суспензии 60% гидрида натрия (4 мг) в THF (1 мл) добавляли пентан-3-ол (29 мкл) и метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат, полученный в ссылочном примере 14, (20 мг) в этой последовательности, и смесь перемешивали при комнатной температуре в течение 3 часов. Дополнительное количество 60% гидрида натрия (4 мг) добавляли к этому, и полученную смесь перемешивали далее при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (15 мг).
МС (m/z): 473 [M+H]+
[0318]
Пример 109: метил (1-{[6-(пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием пентан-3-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 472 [M+H]+
[0319]
Пример 110: N-[1-({6-[(2-этилбутил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием 2-этилбутан-1-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 496 [M+H]+
[0320]
Пример 111: N-(1-{[6-(Пентан-3-илокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 107, указанное в заголовке соединение синтезировали с использованием пентан-3-ола вместо 2-этилбутан-1-ола.
МС (m/z): 483 [M+H]+
[0321]
Пример 112: метил [1-({6-[метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием гидрохлорида N-метилпентан-3-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 486 [M+H]+
[0322]
Пример 113: метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 24, указанное в заголовке соединение синтезировали с использованием (2R)-N,3,3-триметилбутан-2-амина гидрохлорида, полученного в ссылочном примере 12, вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 500 [M+H]+
[0323]
Пример 114: N-(1-{[6-(2-этилбутокси)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид
В атмосфере аргона, к суспензии 60% гидрида натрия (8,0 мг) в THF (1,0 мл) добавляли 2-этилбутан-1-ол (49 мг) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 5 минут. Затем, N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид, полученный в ссылочном примере 31, (40 мг) добавляли к этому, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, и раствор отделяли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (33 мг).
МС (m/z): 485 [M+H]+
[0324]
Пример 115: N-(1-{[6-{[(2R)-3,3-Диметилбутан-2-ил](метил)амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамида, полученного в ссылочном примере 31, (20 мг) в 1-бутаноле (1 мл) добавляли DIPEA (50 мкл) и (2R)-N,3,3-триметилбутан-2-амин гидрохлорид, полученный в ссылочном примере 12, (14 мг) и смесь перемешивали при 80°C в течение 7 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (9 мг).
МС (m/z): 498 [M+H]+
[0325]
Пример 116: N-[1-({6-[Метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид
Аналогично способу в примере 115, указанное в заголовке соединение синтезировали с использованием N-метилпентан-3-амина гидрохлорида вместо (2R)-N,3,3-триметилбутан-2-амина гидрохлорида.
МС (m/z): 484 [M+H]+
[0326]
Пример 117: 1-({6-[(4-Гидроксипиперидин-1-ил)карбонил]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}амино)циклопропанкарбонитрил гидрохлорид
К раствору [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил](4-гидроксипиперидин-1-ил)метанона, полученного в ссылочном примере 29, (20 мг) в этаноле (0,2 мл) добавляли DIPEA (12 мкл) и 1-амино-циклопропанкарбонитрил гидрохлорид (65 мг), и смесь подвергали взаимодействию в микроволновом реакторе при температуре 130°C в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (16 мг). К раствору полученного твердого вещества (16 мг) в этилацетате (0,5 мл) добавляли 4 M раствор хлористого водорода в этилацетате (16 мкл), и растворитель отгоняли при пониженном давлении. Остаток растирали с этилацетатом и гексаном, и порошок собирали на фильтре, и сушили с получением указанного в заголовке соединения (12 мг).
МС (m/z): 410 [M-Cl]+
[0327]
Пример 118: [6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон
К раствору [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанона, полученного в ссылочном примере 32, (10 мг) в 1-бутаноле (1 мл) добавляли DIPEA (15 мкл) и (2R)-3,3-диметилбутан-2-амин (7 мг), и смесь перемешивали при 80°C в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (11 мг).
МС (m/z): 523 [M+H]+
[0328]
Пример 119: N-[1-({6-[(2-метокси-2-метилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид
Аналогично способу в примере 115, указанное в заголовке соединение синтезировали с использованием 2-метокси-2-метилпропан-1-амина вместо (2R)-N,3,3-триметилбутан-2-амина гидрохлорида.
МС (m/z): 486 [M+H]+
[0329]
Пример 120: (4-Гидроксипиперидин-1-ил){6-[метил(пентан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}метанон гидрохлорид
Аналогично способу в примере 117, указанное в заголовке соединение синтезировали с использованием N-метилпентан-3-амина гидрохлорида вместо 1-амино-циклопропанкарбонитрила гидрохлорида.
МС (m/z): 429 [M-Cl]+
[0330]
Пример 121: N-(1-{[6-{[(2R)-3-Метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамид
Аналогично способу в примере 115, указанное в заголовке соединение синтезировали с использованием (2R)-3-метилбутан-2-амина вместо (2R)-N,3,3-триметилбутан-2-амина гидрохлорида.
МС (m/z): 470 [M+H]+
[0331]
Пример 122: N-(1-{[6-{[(2R)-3-Метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием (2R)-3-метилбутан-2-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 482 [M+H]+
[0332]
Пример 123: N-(1-{[6-{[(2S)-3-Метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием (2S)-3-метилбутан-2-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 482 [M+H]+
[0333]
Пример 124: N-(1-{[6-(Пентан-3-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием пентан-3-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 482 [M+H]+
[0334]
Пример 125: метил [1-({6-[(2S)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат гидрохлорид
Аналогично способу в примере 24 стадии 1 и 2, указанное в заголовке соединение синтезировали с использованием (2S)-бутан-2-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 458 [M-Cl]+
Значение элементного анализа (для C21H27N7O3S HCl)
Вычисленное значение (%) C: 51,06, H: 5,71, N: 19,85
Найденное значение (%) C: 51,00, H: 5,73, N: 19,74
Удельное вращение[α]D25=2,2°(c=2,00,ДМСО)
[0335]
Пример 126: метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием (2R)-бутан-2-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 458 [M-H]+
Пример 127: метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат гидрохлорид
Аналогично способу в примере 24 стадия 2, указанное в заголовке соединение синтезировали с использованием метил [1-({6-[(2R)-бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата, полученного в примере 126, вместо метил (1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата.
МС (m/z): 458 [M-Cl]+
Значение элементного анализа (для C21H27N7O3S HCl+0,7 H2O)
Вычисленное значение (%) C: 49,79, H: 5,85, N: 19,35
Найденное значение (%) C: 49,73, H: 5,75, N: 19,44
Удельное вращение[α]D25=-1,8°(c=2,00,ДМСО)
[0336]
Пример 128: N-[1-({6-[(1-Метилциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид
Аналогично способу в примере 115, указанное в заголовке соединение синтезировали с использованием 1-метилциклопропанамина гидрохлорида (который получали аналогично способу, описанному, например, в Chemische Berichte, 1986, 119, 3672-3693) вместо (2R)-N,3,3-триметилбутан-2-амина гидрохлорида.
МС (m/z): 454 [M+H]+
[0337]
Пример 129: [6-{[(2R)-3,3-Диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(5-фторпиридин-2-ил)амино]пиперидин-1-ил}метанон
Аналогично способу в примере 118, указанное в заголовке соединение синтезировали с использованием [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(5-фторпиридин-2-ил)амино]пиперидин-1-ил}метанона, полученного в ссылочном примере 34, вместо [6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]{4-[(3-фторпиридин-2-ил)амино]пиперидин-1-ил}метанона.
МС (m/z): 523 [M+H]+
[0338]
Пример 130: 2-метил-N-[1-({6-[(2-метилбутан-2-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2-метилпропанамида, полученного в ссылочном примере 16, (25 мг) в DMF (1 мл) добавляли DIPEA (50 мкл) и 2-метилбутан-2-амин (25 мг), и смесь перемешивали при 120°C в течение 1 часа. Затем, к этому добавляли дополнительное количество 2-метилбутан-2-амина (25 мг), и смесь перемешивали при 120°C в течение 1 часа. К реакционному раствору добавляли воду, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (12 мг).
МС (m/z): 484 [M+H]+
[0339]
Пример 131: N-[1-({6-[(2S)-Бутан-2-иламино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]пропанамид
Аналогично способу в примере 115, указанное в заголовке соединение синтезировали с использованием (2S)-бутан-2-амина вместо (2R)-N,3,3-триметилбутан-2-амина гидрохлорида.
МС (m/z): 456 [M+H]+
[0340]
Пример 132: метил [1-({6-[трет-бутил(метил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат гидрохлорид
К раствору метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 14, (50 мг) в NMP (0,1 мл) добавляли DIPEA (103 мкл) и N,2-диметилпропан-2-амин (31 мг), и смесь перемешивали при 150°C в течение 2 часов в запаянной трубке. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (20 мг). К раствору полученного твердого вещества (20 мг) в этилацетате (2 мл) добавляли 4 M раствор хлористого водорода в этилацетате (15 мкл). Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (18 мг).
МС (m/z): 472 [M-Cl]+
[0341]
Пример 133: {6-[трет-бутил(этил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}(4-гидроксипиперидин-1-ил)метанон
[Стадия 1] Получение (4-{[трет-бутил(диметил)силил]окси}пиперидин-1-ил){6-[трет-бутил(этил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}метанона
К раствору (4-{[трет-бутил(диметил)силил]окси}пиперидин-1-ил)[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного в ссылочном примере 30, (150 мг) в этаноле (1 мл) добавляли DIPEA (706 мкл) и трет-бутиламин (333 мкл), и смесь перемешивали с использованием микроволнового реактора при 150°C в течение 1 часа. К этому добавляли дополнительное количество трет-бутиламина (333 мкл) и смесь затем перемешивали с использованием микроволнового реактора при 150°C в течение дополнительного часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением твердого вещества (111 мг). К раствору полученного твердого вещества (30 мг) в DMF (0,6 мл) добавляли 60% гидрид натрия (12 мг) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 15 минут. К смеси добавляли иодэтан (28 мкл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (28 мг).
1Н-ЯМР (CDCl3) δ: 0,06 (3H, с), 0,08 (3H, с), 0,90 (9H, с), 1,22-1,26 (4H, м), 1,57-1,63 (1H, м), 1,68 (9H, с), 1,82-1,90 (2H, м), 3,51-3,59 (1H, м), 3,63 (2H, q), 3,72-3,90 (3H, м), 4,01-4,09 (1H, м), 6,55 (1H, с), 6,97 (1H, с), 7,82 (1H, с), 8,41 (1H, с)
[Стадия 2] Получение {6-[трет-бутил(этил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}(4-гидроксипиперидин-1-ил)метанона
К раствору (4-{[трет-бутил(диметил)силил]окси}пиперидин-1-ил){6-[трет-бутил(этил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}метанона, полученного на стадии 1, (28 мг) в THF (0,5 мл) добавляли 1 M тетрабутиламмоний фторид (раствор THF, 152 мкл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, и водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (20 мг).
МС (m/z): 429 [M+H]+
[0342]
Пример 134: Циклопропил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору циклопропил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 21, (25 мг) в DMF (1 мл) добавляли DIPEA (19 мкл) и (1S)-1-циклопропилэтанамин (7 мг), и смесь перемешивали при 100°C в течение 1 часа. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, водный слой далее экстрагировали этилацетатом, и объединенный органический слой сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (23 мг).
МС (m/z): 496 [M+H]+
[0343]
Пример 135: Циклопропил (1-{[6-(трет-бутиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 134, указанное в заголовке соединение синтезировали с использованием трет-бутиламина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 484 [M+H]+
[0344]
Пример 136: 2,2-дифтор-N-(1-{[6-{[(2R)-3-метилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)ацетамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-2,2-дифторацетамида, полученного в ссылочном примере 28, (30 мг) в 2-пропаноле (2 мл) добавляли DIPEA (47 мкл) и (2R)-3-метилбутан-2-амин (18 мг), и смесь перемешивали при 80°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (32 мг).
МС (m/z): 492 [M+H]+
[0345]
Пример 137: 3-[1-({6-[(2,2-Диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]-1,1-диметилмочевина
К раствору 3-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-1,1-диметилмочевины, полученной в ссылочном примере 33, (20 мг) в DMF (1 мл) добавляли DIPEA (32 мкл) и 2,2-диметилпропан-1-амин (12 мг), и смесь перемешивали при 60°C в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (21 мг).
МС (m/z): 485 [M+H]+
[0346]
Пример 138: 3-(1-{[6-{[(1R)-1-Циклопропилэтил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)-1,1-диметилмочевина
Аналогично способу в примере 137, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклопропилэтанамина вместо 2,2-диметилпропан-1-амина.
МС (m/z): 483 [M+H]+
[0347]
Пример 139: Пропан-2-ил [1-({6-[(3-метилоксетан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 29, указанное в заголовке соединение синтезировали с использованием 3-метилоксетан-3-амина гидрохлорида вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 500 [M+H]+
[0348]
Пример 140: метил [1-({6-[(дициклопропилметил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием дициклопропилметанамина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 496 [M+H]+
[0349]
Пример 141: метил (1-{[6-фенокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору фенола (34 мг) в THF (3 мл) добавляли 60% гидрид натрия (6 мг) при охлаждении льдом, и смесь перемешивали в течение 5 минут. Затем, к этому добавляли метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат, полученный в ссылочном примере 14, (30 мг) и смесь перемешивали при 70°C в течение ночи. К реакционному раствору добавляли воду, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (19 мг).
МС (m/z): 479 [M+H]+
[0350]
Пример 142: трет-бутил 4-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пиперидин-1-карбоксилат
К раствору метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 14, (100 мг) в 2-пропаноле (2,0 мл) добавляли DIPEA (144 мкл) и трет-бутил 4-аминопиперидин-1-карбоксилат (143 мг), и смесь подвергали взаимодействию в микроволновом реакторе при температуре 150°C в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (105 мг).
МС (m/z): 585 [M+H]+
[0351]
Пример 143: метил (1-{[6-(пиперидин-4-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат дигидрохлорид
К трет-бутил 4-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пиперидин-1-карбоксилату, полученному в примере 142, (98 мг) добавляли 2 M раствор хлористого водорода-метанола, и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, полученный остаток растирали с этилацетатом и порошок собирали на фильтре, и сушили с получением указанного в заголовке соединения (91 мг).
МС (m/z): 485[M-2Cl-H]+
[0352]
Пример 144: метил [1-({6-[(1-цианоциклопропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 142, указанное в заголовке соединение синтезировали с использованием 1-аминоциклопропанкарбонитрила гидрохлорида вместо трет-бутил 4-аминопиперидин-1-карбоксилата.
МС (m/z): 467 [M+H]+
[0353]
Пример 145: метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
В атмосфере аргона, к раствору метил (1-{[6-хлор-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 35, (15 мг) в 2-пропаноле (1 мл) добавляли TEA (19 мкл) и (1S)-1-циклопропилэтанамин (6 мг), и смесь перемешивали при 100°C в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (16 мг).
МС (m/z): 500 [M+H]+
[0354]
Пример 146: метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 145, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 516 [M+H]+
[0355]
Пример 147: трет-бутил (3S)-3-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пирролидин-1-карбоксилат
Аналогично способу в примере 142, указанное в заголовке соединение синтезировали с использованием трет-бутил (S)-3-аминопирролидин-1-карбоновой кислоты вместо трет-бутил 4-аминопиперидин-1-карбоксилата.
МС (m/z): 571 [M+H]+
[0356]
Пример 148: трет-бутил (3R)-3-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пирролидин-1-карбоксилат
Аналогично способу в примере 142, указанное в заголовке соединение синтезировали с использованием трет-бутил (R)-3-аминопирролидин-1-карбоновой кислоты вместо трет-бутил 4-аминопиперидин-1-карбоксилата.
МС (m/z): 571 [M+H]+
[0357]
Пример 149: метил [1-({2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(3S)-пирролидин-3-иламино]пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат дигидрохлорид
Аналогично способу в примере 143, указанное в заголовке соединение синтезировали с использованием трет-бутил (3S)-3-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пирролидин-1-карбоксилата, полученного в примере 147.
МС (m/z): 471[M-2Cl-H]+
[0358]
Пример 150: метил [1-({2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(3R)-пирролидин-3-иламино]пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат дигидрохлорид
Аналогично способу в примере 143, указанное в заголовке соединение синтезировали с использованием трет-бутил (3R)-3-{[6-({4-[(метоксикарбонил)амино]пиперидин-1-ил}карбонил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]амино}пирролидин-1-карбоксилата, полученного в примере 148.
МС (m/z): 471[M-2Cl-H]+
[0359]
Пример 151: метил (1-{[6-{[(3R)-1-метилпирролидин-3-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору метил [1-({2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(3R)-пирролидин-3-иламино]пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата дигидрохлорида, полученного в примере 150, (20 мг) в метаноле (0,2 мл) добавляли комплекс 2-пиколин боран (40 мг), 37% водный раствор формальдегида (30 мкл) и уксусную кислоту (20 мкл), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (7 мг).
МС (m/z): 485 [M+H]+
[0360]
Пример 152: метил (1-{[6-{[(3R)-1-ацетилпирролидин-3-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору метил [1-({2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(3R)-пирролидин-3-иламино]пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамата дигидрохлорида, полученного в примере 150, (20 мг) в THF (0,5 мл) добавляли триэтиламин (51 мкл) и ацетилхлорид (26 мкл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (8 мг).
МС (m/z): 513 [M+H]+
[0361]
Пример 153: метил [1-({6-[(2S)-бутан-2-иламино]-5-метокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил}карбонил)пиперидин-4-ил]карбамат
Аналогично способу в примере 145, указанное в заголовке соединение синтезировали с использованием (2S)-бутан-2-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 488 [M+H]+
[0362]
Пример 154: метил (1-{[6-{[(1S)-1-циклопропилэтил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
В атмосфере аргона, к раствору метил (1-{[6-хлор-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в ссылочном примере 36, (10 мг) в 2-пропаноле (1 мл) добавляли TEA (12 мкл) и (1S)-1-циклопропилэтанамин (4 мг), и смесь перемешивали при 100°C в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (5 мг).
МС (m/z): 514 [M+H]+
[0363]
Пример 155: метил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-5-этокси-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
Аналогично способу в примере 154, указанное в заголовке соединение синтезировали с использованием (2R)-3,3-диметилбутан-2-амина вместо (1S)-1-циклопропилэтанамина.
МС (m/z): 530 [M+H]+
[0364]
Пример 156: метил (1-{[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-(пиридин-3-илокси)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору пиридин-3-ола (34 мг) в DMF (1,5 мл) добавляли 60% гидрид натрия (9,0 мг) при охлаждении льдом, и смесь перемешивали в течение 5 минут. Затем, к этому добавляли метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат, полученный в ссылочном примере 14, (30 мг) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (23 мг).
МС (m/z): 480 [M+H]+
[0365]
Пример 157: N-(1-{[6-(2-этилпиперидин-1-ил)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамид
К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (15 мг) в 1-бутаноле (1 мл) добавляли DIPEA (151 мкл) и 2-этилпиперидин (79 мг), и смесь подвергали взаимодействию в микроволновом реакторе при температуре 170°C в течение 1 часа. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (18 мг).
МС (m/z): 508 [M+H]+
[0366]
Пример 158: метил (1-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(2,2,2-трифторэтил)амино]пиримидин-4-карбонилпиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 2,2,2-трифторэтан-1-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 484 [M+H]+
[0367]
Пример 159: N-1-[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[(тиофен-2-ил)метил]аминопиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием тиофен-2-илметанамина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 508 [M+H]+
[0368]
Пример 160: N-1-[6-[(фуран-2-ил)метил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием фуран-2-илметанамина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 492 [M+H]+
[0369]
Пример 161: метил 1-[6-[(1R)-1-циклогексилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклогексилэтан-1-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 512 [M+H]+
[0370]
Пример 162: метил 1-[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[1-(пиридин-4-ил)этил]аминопиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 1-(пиридин-4-ил)этан-1-амина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 507 [M+H]+
[0371]
Пример 163: метил (1-6-[(2-циклопропилэтил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 2-циклопропилэтанамина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 470 [M+H]+
[0372]
Пример 164: Трет-бутил 3-([6-4-[(метоксикарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]оксиметил)азетидин-1-карбоксилат
Аналогично способу в примере 64, указанное в заголовке соединение синтезировали с использованием трет-бутил 3-(гидроксиметил)азетидин-1-карбоксилата вместо 3,3-диметилбутан-2-ола.
МС (m/z): 572 [M+H]+
[0373]
Пример 165: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-ил циклобутанкарбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием циклобутанкарбонил хлорида вместо бензоилхлорида.
МС (m/z): 494 [M+H]+
[0374]
Пример 166: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопентанкарбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием циклопентанкарбонил хлорида вместо бензоилхлорида.
МС (m/z): 508 [M+H]+
[0375]
Пример 167: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклогексанкарбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием циклогексанкарбонил хлорида вместо бензоилхлорида.
МС (m/z): 522 [M+H]+
[0376]
Пример 168: N-(1-6-[(транс-4-гидроксициклогексил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием транс-4-аминоциклогексан-1-ола вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 510 [M+H]+
[0377]
Пример 169: N-1-[6-[(1R)-1-циклогексилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием (1R)-1-циклогексилэтан-1-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 522 [M+H]+
[0378]
Пример 170: N-1-[2-(пиразоло[5,1-b][1,3]тиазол-7-ил)-6-[1-(пиридин-4-ил)этил]аминопиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием 1-(4-пиридил)этанамина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 517 [M+H]+
[0379]
Пример 171: Трет-бутил 4-[6-4-[(циклопропанкарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминопиперидин-1-карбоксилат
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием трет-бутил 4-аминопиперидин-1-карбоксилата вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 595 [M+H]+
[0380]
Пример 172: N-(1-6-[(оксан-4-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием тетрагидропиран-2-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 496 [M+H]+
[0381]
Пример 173: N-(1-6-[(оксетан-3-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием оксетан-3-амина вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 468 [M+H]+
[0382]
Пример 174: метил (1-6-[(3-циклопропил-2,2-диметилпропил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием 3-циклопропил-2,2-диметилпропан-1-амина гидрохлорида вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 512 [M+H]+
[0383]
Пример 175: метил 1-[6-([1-(метансульфонил)пиперидин-4-ил]метиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
[Стадия 1] Получение трет-бутил 4-([6-4-[(метоксикарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминометил)пиперидин-1-карбоксилата
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием трет-бутил 4-(аминометил)пиперидин-1-карбоксилата вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 599 [M+H]+
[Стадия 2] Получение метил 1-[6-([1-(метансульфонил)пиперидин-4-ил]метиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамата
К трет-бутил 4-([6-4-[(метоксикарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминометил)пиперидин-1-карбоксилату, полученному на стадии 1, (115 мг) добавляли 2 M раствор хлористого водорода-метанола (2 мл), и смесь перемешивали при 40°C в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток промывали простым эфиром, собирали на фильтре и сушили с получением твердого соединения (105 мг). Полученное твердое соединение (25 мг) суспендировали в дихлорметане, и добавляли DIPEA (38 мкл) и метансульфонилхлорид (8 мг), и смесь перемешивали при охлаждении льдом в течение 15 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (17 мг).
МС (m/z): 577 [M+H]+
[0384]
Пример 176: N-1-[6-[(1R)-бицикло[2.2.1]гептан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 16, указанное в заголовке соединение синтезировали с использованием норборнен-2-амина гидрохлорида вместо (2R)-3,3-диметилбутан-2-амина.
МС (m/z): 506 [M+H]+
[0385]
Пример 177: метил (1-6-[(цис-4-гидроксициклогексил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием цис-4-аминоциклогексанола вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 500 [M+H]+
[0386]
Пример 178: метил (1-6-[(транс-4-гидроксициклогексил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)карбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием транс-4-аминоциклогексанола вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 500 [M+H]+
[0387]
Пример 179: метил 1-[6-(циклопентиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием циклопентанамина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 470 [M+H]+
[0388]
Пример 180: метил 1-[6-(циклогексиламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 24 стадия 1, указанное в заголовке соединение синтезировали с использованием циклогексанамина вместо (2R)-3-метилбутан-2-амина.
МС (m/z): 584 [M+H]+
[0389]
Пример 181: N-(1-6-[(пиперидин-4-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид дигидрохлорид
К трет-бутил 4-[6-4-[(циклопропанкарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминопиперидин-1-карбоксилату, полученному в примере 171, (55 мг) добавляли 2 M раствор хлористого водорода-метанола (3 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток промывали простым эфиром, собирали на фильтре, и сушили с получением указанного в заголовке соединения (52 мг).
МС (m/z): 495[M-2Cl-H]+
[0390]
Пример 182: N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклогексанкарбоксамид
Аналогично способу в примере 40, указанное в заголовке соединение синтезировали с использованием N-(пиперидин-4-ил)циклогексанкарбоксамида гидрохлорида вместо этил пиперидин-4-илкарбамата.
МС (m/z): 538 [M+H]+
[0391]
Пример 183: N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илбензамид
Аналогично способу в примере 40, указанное в заголовке соединение синтезировали с использованием N-(4-пиперидил)бензамида гидрохлорида вместо этил пиперидин-4-илкарбамата.
МС (m/z): 532 [M+H]+
[0392]
Пример 184: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-ил-2-метилбензамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием 2-метилбензоилхлорида вместо бензоилхлорида.
МС (m/z): 530 [M+H]+
[0393]
Пример 185: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илпиридин-2-карбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием пиридин-2-карбонил хлорида гидрохлорида вместо бензоилхлорида.
МС (m/z): 517 [M+H]+
[0394]
Пример 186: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-ил-2-метоксибензамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием 2-метоксибензоил хлорида вместо бензоилхлорида.
МС (m/z): 546 [M+H]+
[0395]
Пример 187: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илпиридин-4-карбоксамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием пиридин-4-карбонил хлорида вместо бензоилхлорида.
МС (m/z): 517 [M+H]+
[0396]
Пример 188: N-(1-6-[(1-ацетилпиперидин-4-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид
В атмосфере аргона, к раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида (30 мг), полученного в ссылочном примере 15, в 2-пропаноле (2 мл) добавляли DIPEA (48 мкл) и 1-(4-амино-1-пиперидил)этанон (15 мг), и смесь перемешивали при 90°C в течение 1 часа. NMP (0,5 мл) дополнительно добавляли, и смесь перемешивали при 120°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (30 мг).
МС (m/z): 537 [M+H]+
[0397]
Пример 189: N-1-[6-[1-(метансульфонил)пиперидин-4-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
N-(1-6-[(пиперидин-4-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)циклопропанкарбоксамид дигидрохлорид (20 мг), полученный в примере 181, суспендировали в дихлорметане (2 мл), и добавляли DIPEA (30 мкл) и метансульфонилхлорид (6 мг), и смесь перемешивали при охлаждении льдом в течение 15 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (12 мг).
МС (m/z): 573 [M+H]+
[0398]
Пример 190: N-1-[6-[(1S)-1-циклопропилэтил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илпентанамид
Аналогично способу в примере 30 стадия 3, указанное в заголовке соединение синтезировали с использованием валероилхлорида вместо бензоилхлорида.
МС (m/z): 496 [M+H]+
[0399]
Пример 191: N-1-[6-[(3R)-1-(цианоацетил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
В атмосфере аргона, к раствору трет-бутил-[(3R)-пирролидин-3-ил]карбамата (500 мг) в THF (5 мл) добавляли этилцианоацетат (607 мг) и 1,8-диазабицикло[5.4.0]-7-ундецен (204 мг), и смесь перемешивали при 40°C в течение 2 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением твердого соединения 1 (530 мг). Полученное твердое соединение 1 (530 мг) растворяли в 2 M растворе хлористоводородная кислота-метанол (8 мл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли диэтиловый эфир, и полученный осадок собирали фильтрованием и сушили с получением твердого соединения 2 (331 мг). К раствору N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида, полученного в ссылочном примере 15, (30 мг) в NMP (1 мл) добавляли DIPEA (48 мкл) и вышеуказанное твердое вещество 2 (26 мг), и смесь перемешивали при 120°C в течение 3 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, промывали насыщенным солевым раствором, и водный слой экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (22 мг).
МС (m/z): 548 [M+H]+
[0400]
Пример 192: метил 4-([6-4-[(метоксикарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминометил)пиперидин-1-карбоксилат
Аналогично способу в примере 175 стадия 2, указанное в заголовке соединение синтезировали с использованием метилхлорформиата вместо метансульфонилхлорида.
МС (m/z): 557 [M+H]+
[0401]
Пример 193: N-1-[6-[1-(пропан-2-сульфонил)пиперидин-4-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 189, указанное в заголовке соединение синтезировали с использованием пропан-2-сульфонилхлорида вместо метансульфонилхлорида.
МС (m/z): 601 [M+H]+
[0402]
Пример 194: метил 4-[6-4-[(циклопропанкарбонил)амино]пиперидин-1-карбонил-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]аминопиперидин-1-карбоксилат
Аналогично способу в примере 189, указанное в заголовке соединение синтезировали с использованием метилхлорформиата вместо метансульфонилхлорида.
МС (m/z): 553 [M+H]+
[0403]
Пример 195: N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илгептанамид
[Стадия 1] Получение (4-аминопиперидин-1-ил)[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона
К раствору трет-бутил (1-{[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата, полученного в примере 100, (305 мг) в дихлорметане (1 мл) добавляли TFA (1 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли хлороформом, нейтрализовали насыщенным водным раствором бикарбоната натрия, и водный слой далее экстрагировали хлороформом. Объединенные органические слои промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (180 мг).
МС (m/z): 428 [M+H]+
[Стадия 2] Получение N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илгептанамида
К раствору (4-аминопиперидин-1-ил)[6-{[(2R)-3,3-диметилбутан-2-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]метанона, полученного на стадии 1, (10 мг) в дихлорметане (1 мл) добавляли DIPEA (16 мкл) и гептаноил хлорид (4 мг) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (18 мг).
МС (m/z): 540 [M+H]+
[0404]
Пример 196: 2-хлор-N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илбензамид
Аналогично способу в примере 195 стадия 2, указанное в заголовке соединение синтезировали с использованием 2-хлорбензоил хлорида вместо гептаноил хлорида.
МС (m/z): 566, 568 [M+H]+
[0405]
Пример 197: N-1-[6-[(2R)-3,3-диметилбутан-2-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-ил-4-фторбензамид
Аналогично способу в примере 195 стадия 2, указанное в заголовке соединение синтезировали с использованием 4-фторбензоил хлорида вместо гептаноил хлорида.
МС (m/z): 550 [M+H]+
[0406]
Пример 198: метил (1-6-[(1-пропаноилпиперидин-4-ил)амино]-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонилпиперидин-4-ил)карбамат
К раствору метил (1-{[6-(пиперидин-4-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата дигидрохлорида, полученного в примере 143, (15 мг) в THF (0,5 мл) добавляли TEA (38 мкл) и пропионил хлорид (17 мг), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (9 мг).
МС (m/z): 541 [M+H]+
[0407]
Пример 199: метил (1-{[6-{[1-(цианоацетил)пиперидин-4-ил]амино}-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамат
К раствору метил (1-{[6-(пиперидин-4-иламино)-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата дигидрохлорида, полученного в примере 143, (15 мг) в DMF (0,5 мл) добавляли цианоуксусную кислоту (5 мг), DIPEA (14 мкл) и HATU (15 мг), и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли этилацетатом, разделяли добавлением насыщенного водного раствора бикарбоната натрия, и водный слой далее экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (3 мг).
МС (m/z): 552 [M+H]+
[0408]
Пример 200: метил 1-[6-[1-(метансульфонил)пиперидин-4-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 198, указанное в заголовке соединение синтезировали с использованием метансульфонилхлорида вместо пропионилхлорида.
МС (m/z): 563 [M+H]+
[0409]
Пример 201: метил 1-[6-[(3R)-1-(цианоацетил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 191, указанное в заголовке соединение синтезировали с использованием метил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата вместо N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 538 [M+H]+
[0410]
Пример 202: N-1-[6-[(3R)-1-(цианоацетил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илпропанамид
Аналогично способу в примере 191, указанное в заголовке соединение синтезировали с использованием N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)пропанамида вместо N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 536 [M+H]+
[0411]
Пример 203: этил 1-[6-[(3R)-1-(цианоацетил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 191, указанное в заголовке соединение синтезировали с использованием этил (1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)карбамата вместо N-(1-{[6-хлор-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-ил]карбонил}пиперидин-4-ил)циклопропанкарбоксамида.
МС (m/z): 552 [M+H]+
[0412]
Пример 204: N-1-[6-[(3S)-1-(цианоацетил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илциклопропанкарбоксамид
Аналогично способу в примере 191, указанное в заголовке соединение синтезировали с использованием трет-бутил N-[(3S)-пирролидин-3-ил]карбамата вместо трет-бутил N-[(3R)-пирролидин-3-ил]карбамата.
МС (m/z): 548 [M+H]+
[0413]
Пример 205: метил 1-[6-[(3R)-1-(циклопропанкарбонил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 152, указанное в заголовке соединение синтезировали с использованием циклопропанкарбонил хлорида вместо ацетилхлорида.
МС (m/z): 539 [M+H]+
[0414]
Пример 206: метил 1-[6-[(3R)-1-(циклобутанкарбонил)пирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 152, указанное в заголовке соединение синтезировали с использованием циклобутанкарбонил хлорида вместо ацетилхлорида.
МС (m/z): 553 [M+H]+
[0415]
Пример 207: метил 1-[6-[(3R)-1-бутаноилпирролидин-3-ил]амино-2-(пиразоло[5,1-b][1,3]тиазол-7-ил)пиримидин-4-карбонил]пиперидин-4-илкарбамат
Аналогично способу в примере 152, указанное в заголовке соединение синтезировали с использованием бутирилхлорида вместо ацетилхлорида.
МС (m/z): 541 [M+H]+
Тестовый пример 1: Ингибирующее действие на тирозинкиназу JAK
1. Получение тестируемого соединения
Тестируемое соединение растворяли в диметилсульфоксиде (ДМСО) до 10 мМ и далее разбавляли ДМСО до концентраций 1000, 100, 10, 1, 0,1 и 0,01 мкМ, соответственно. Для JAK1 эти растворы тестируемого соединения использовали в шести концентрациях 10 мМ, 1000 мкМ, 100 мкМ, 10 мкМ, 1 мкМ и 0,1 мкМ. Для JAK2 и JAK3, эти растворы тестируемого соединения использовали в шести концентрациях 1000 мкМ, 100 мкМ, 10 мкМ, 1 мкМ, 0,1 мкМ и 0,01 мкМ. Растворы тестируемого соединения разбавляли далее в 20 раз аналитическим буфером для получения раствора образца. В качестве аналитического буфера использовали 15 мМ Tris-HCl (рН 7,5), 0,01 (об/об)% Tween-20 и 1 мМ дитиотреитола. ДМСО разбавляли в 20 раз аналитическим буфером и использовали в качестве отрицательного контроля.
[0416]
2. Ингибирующая активность в отношении тирозинкиназы JAK в присутствии 1 мМ АТФ
Активность определяли методом ELISA. Каждый из растворов образцов добавляли в 96-луночный планшет, покрытый стрептавидином (DELFIA Strip Plate 8×12 well, PerkinElmer) по 10 мкл/лунку (n=2). Раствор субстрата, содержащий биотинилированный пептидный субстрат (1250 нМ для JAK1, 625 нМ для JAK2 и JAK3), 2,5 мМ АТФ (конечная концентрация 1 мМ), 25 мМ MgCl2, 15 мМ Tris-HCl (pH 7,5), 0,01 (об/об) % Tween-20 и 1 мМ дитиотреитол, добавляли в планшет по 20 мкл/лунку. Наконец, тирозинкиназу JAK (Carna Biosciences, Inc.), которую предварительно разбавляли аналитическим буфером до 7,5 нМ для JAK1 и 0,75 нМ для JAK2 и JAK3, добавляли в планшет по 20 мкл/лунку, и планшет инкубировали при температуре 30°C в течение 1 часа. Планшет промывали четыре раза буфером (50 мМ Tris-HCl (pH 7,5), 150 мМ NaCl, 0,02 (об/об) % Tween-20). Блокирующий буфер (0,1% бычий сывороточный альбумин, 50 мМ Tris-HCl (pH 7,5), 150 мМ NaCl, 0,02 (об/об) % Tween-20) добавляли в планшет по 150 мкл/лунку и планшет блокировали при 30°C в течение 1 часа. Блокирующий буфер удаляли и меченое пероксидазой хрена антитело против фосфорилированного тирозина (BD Biosciences, Inc.) (разбавленный в 10000 раз блокирующим буфером) добавляли в планшет по 100 мкл/лунку, и планшет инкубировали при температуре 30°C в течение 30 минут. Планшет промывали четыре раза промывочным буфером и в планшет добавляли раствор 3,3',5,5'-тетраметилбензидина (Nacalai Tesque) по 100 мкл/лунку для проявления цвета в течение 10 минут. В планшет добавляли 0,1 М серную кислоту при 100 мкл/лунку, чтобы остановить реакцию. Поглощение при 450 нм измеряли с использованием микропланшет-ридера (BIO-RAD).
[0417]
3. Анализ результатов
Проводили нелинейный регрессионный анализ с использованием системы SAS (SAS Institute Inc.) для определения поглощения и рассчитывали концентрацию тестируемого соединения, которая приводила к 50% ингибированию соответствующей активности тирозинкиназы (IC50). Результаты показаны в следующих таблицах 1-6.
[0418]
[Таблица 1]
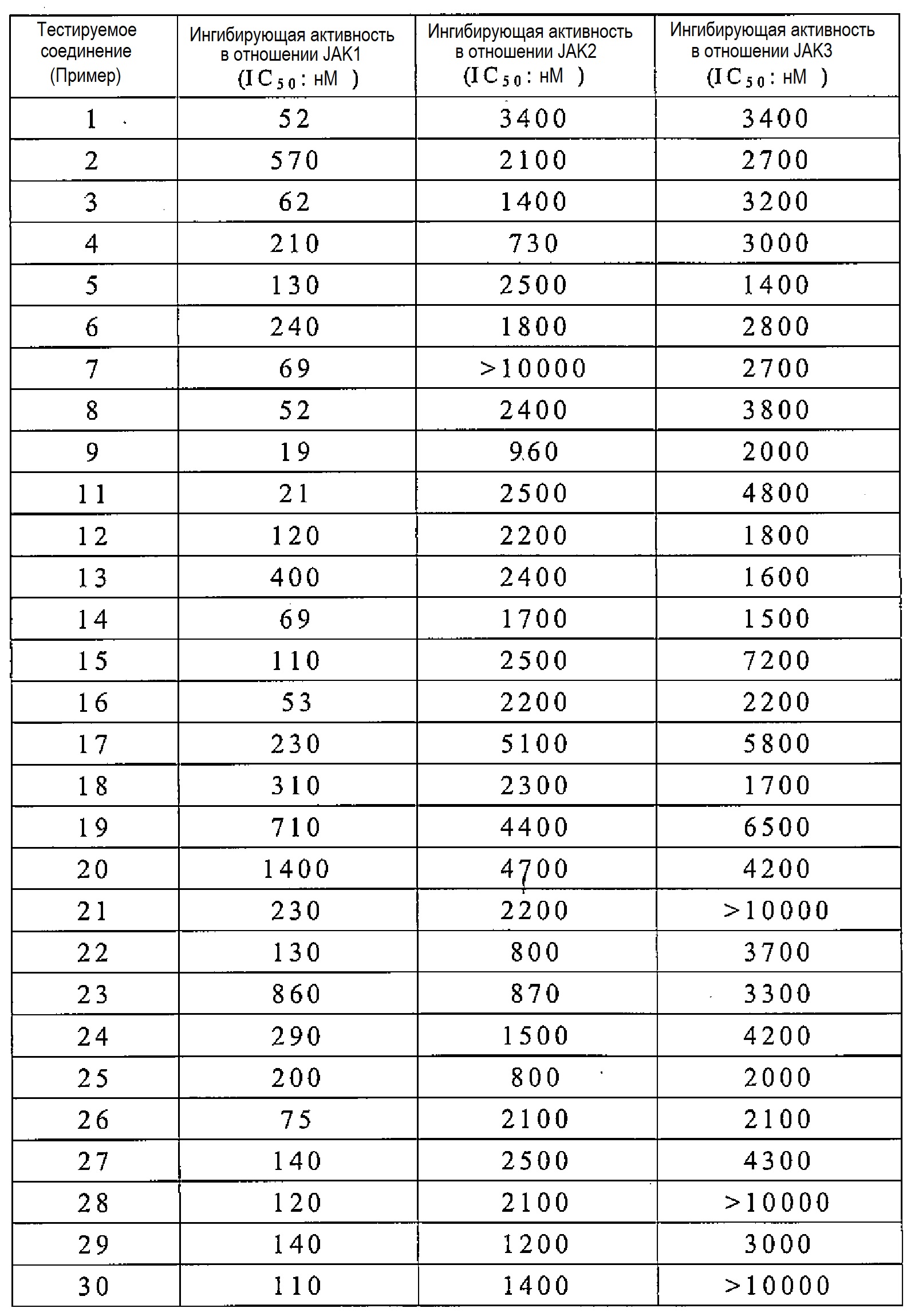
[0419]
[Таблица 2]
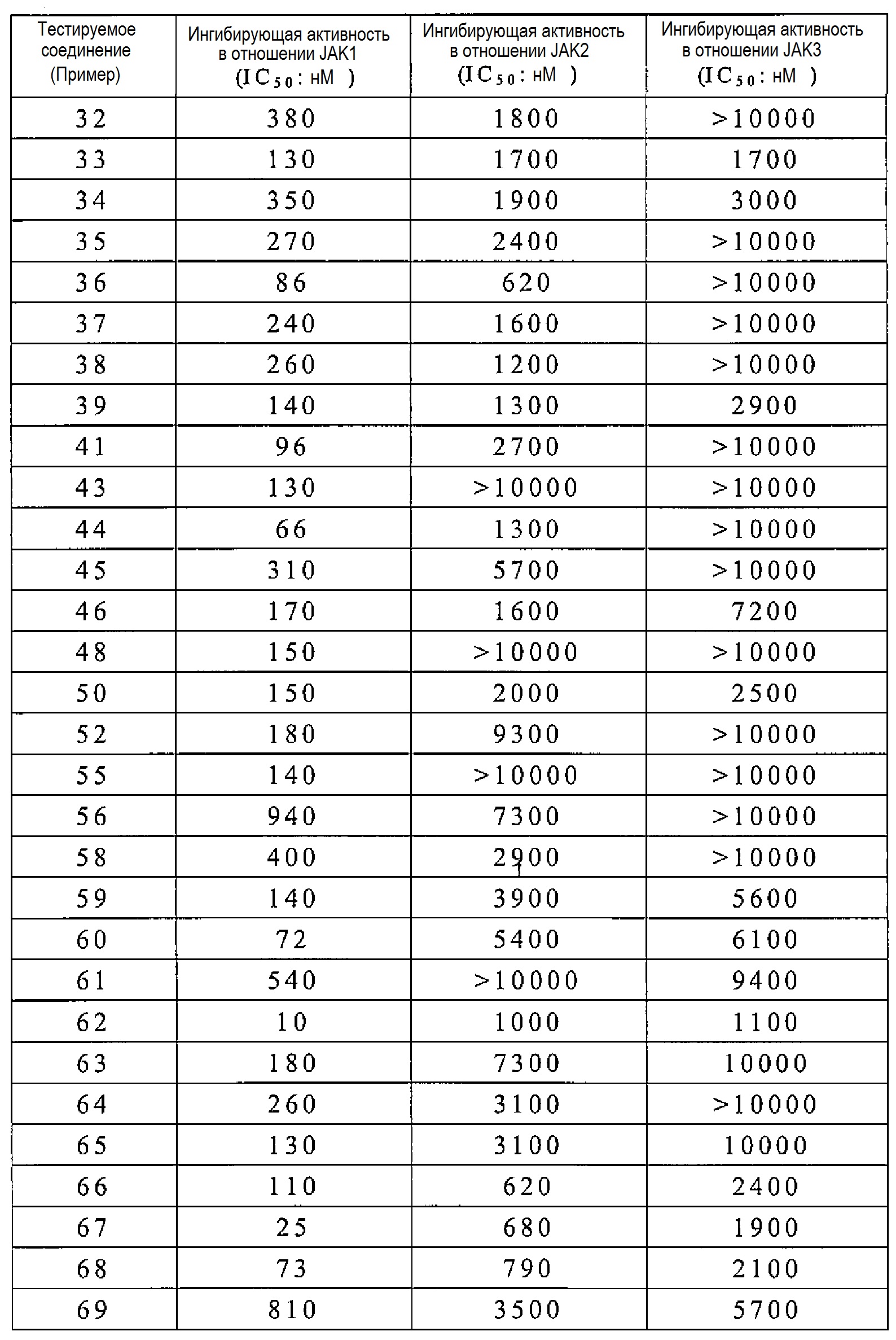
[0420]
[Таблица 3]
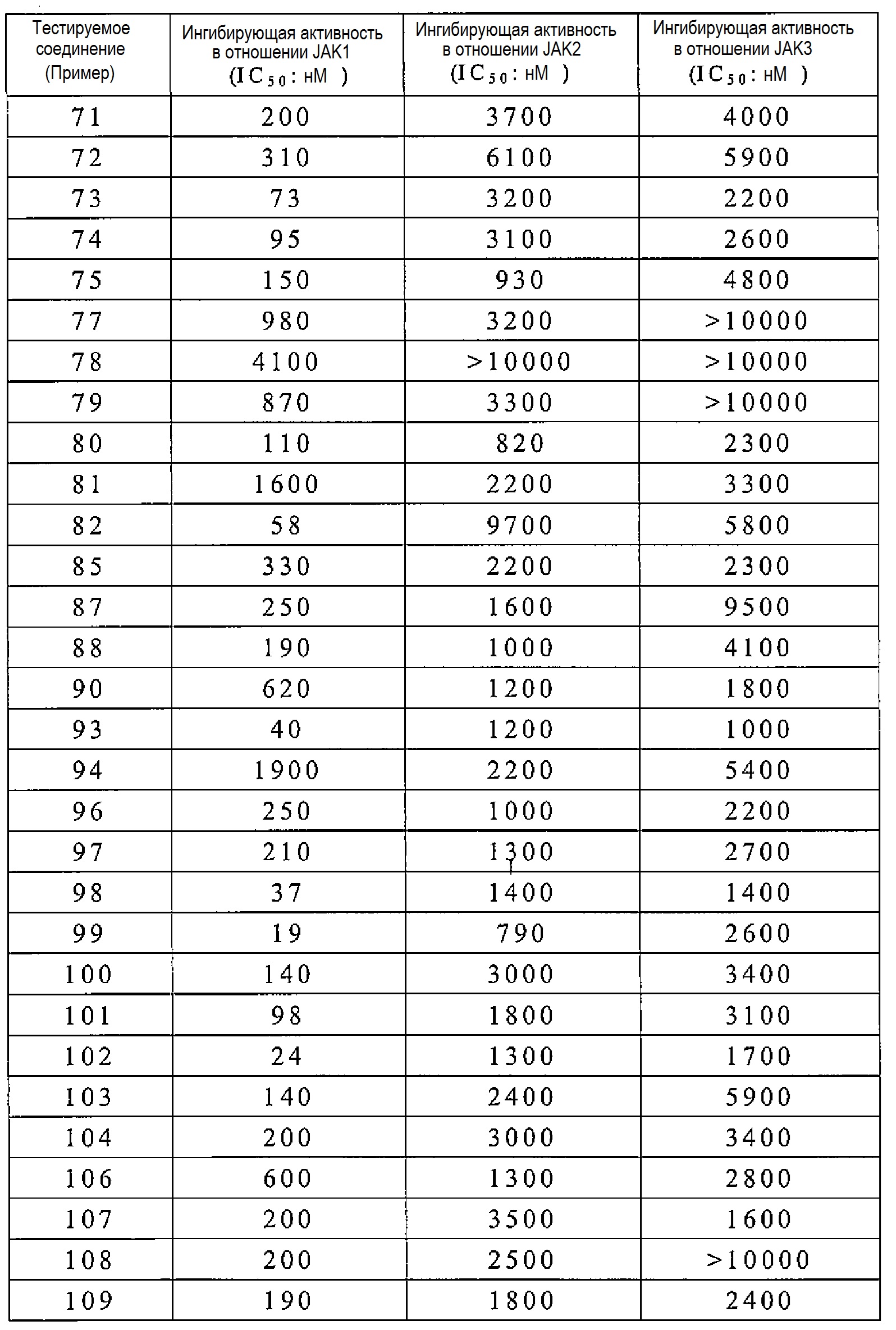
[0421]
[Таблица 4]
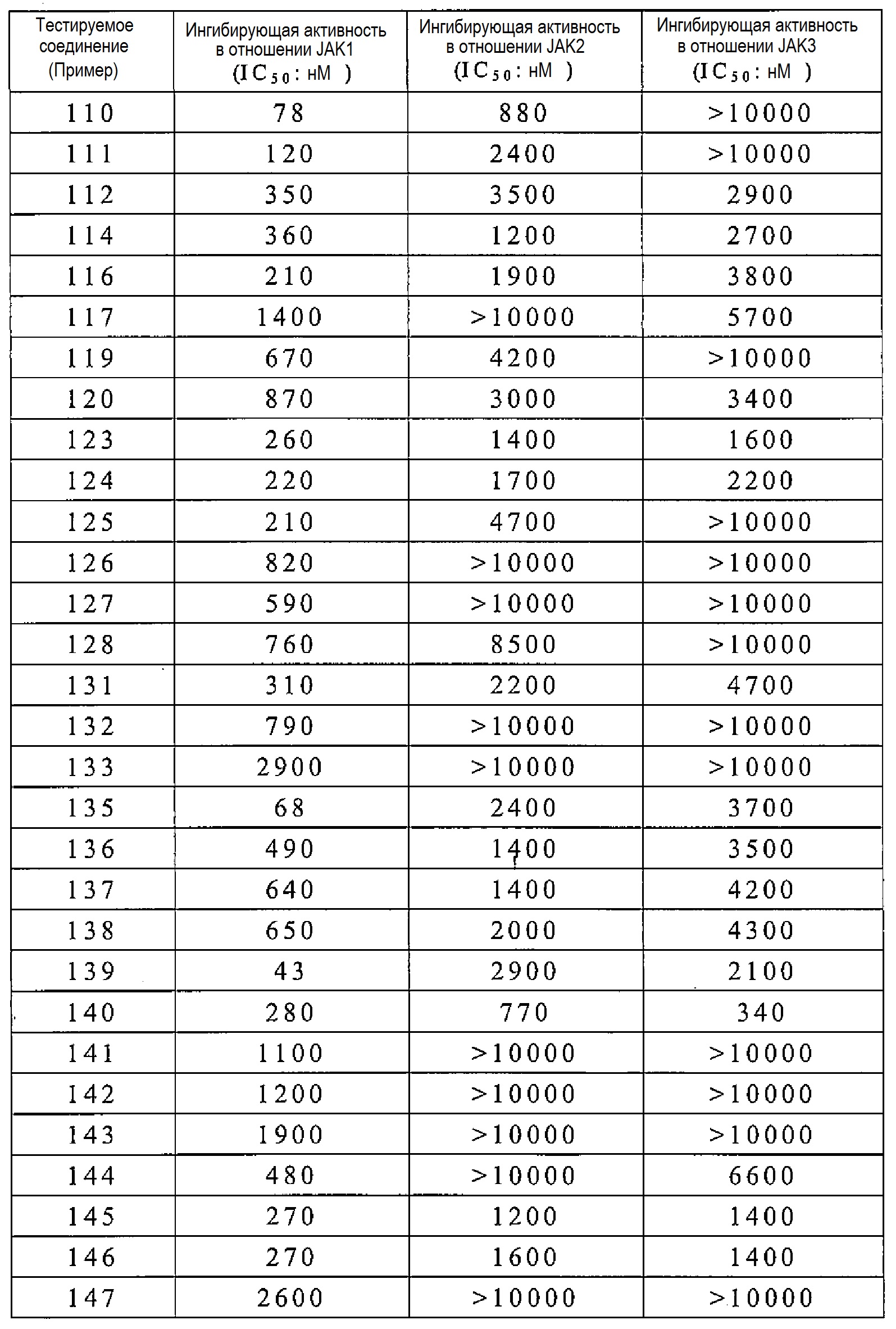
[0422]
[Таблица 5]
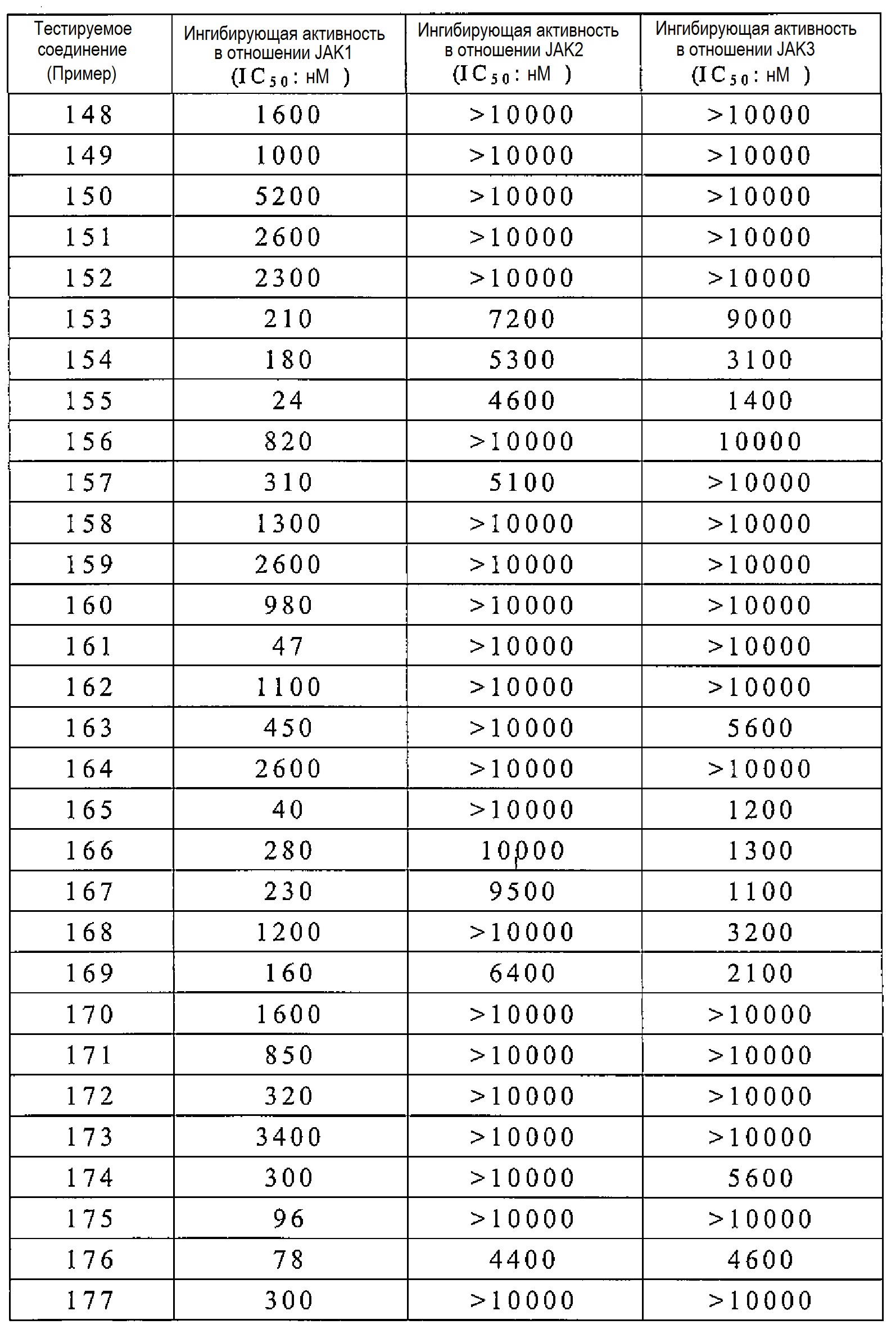
[0000]
[Таблица 6]
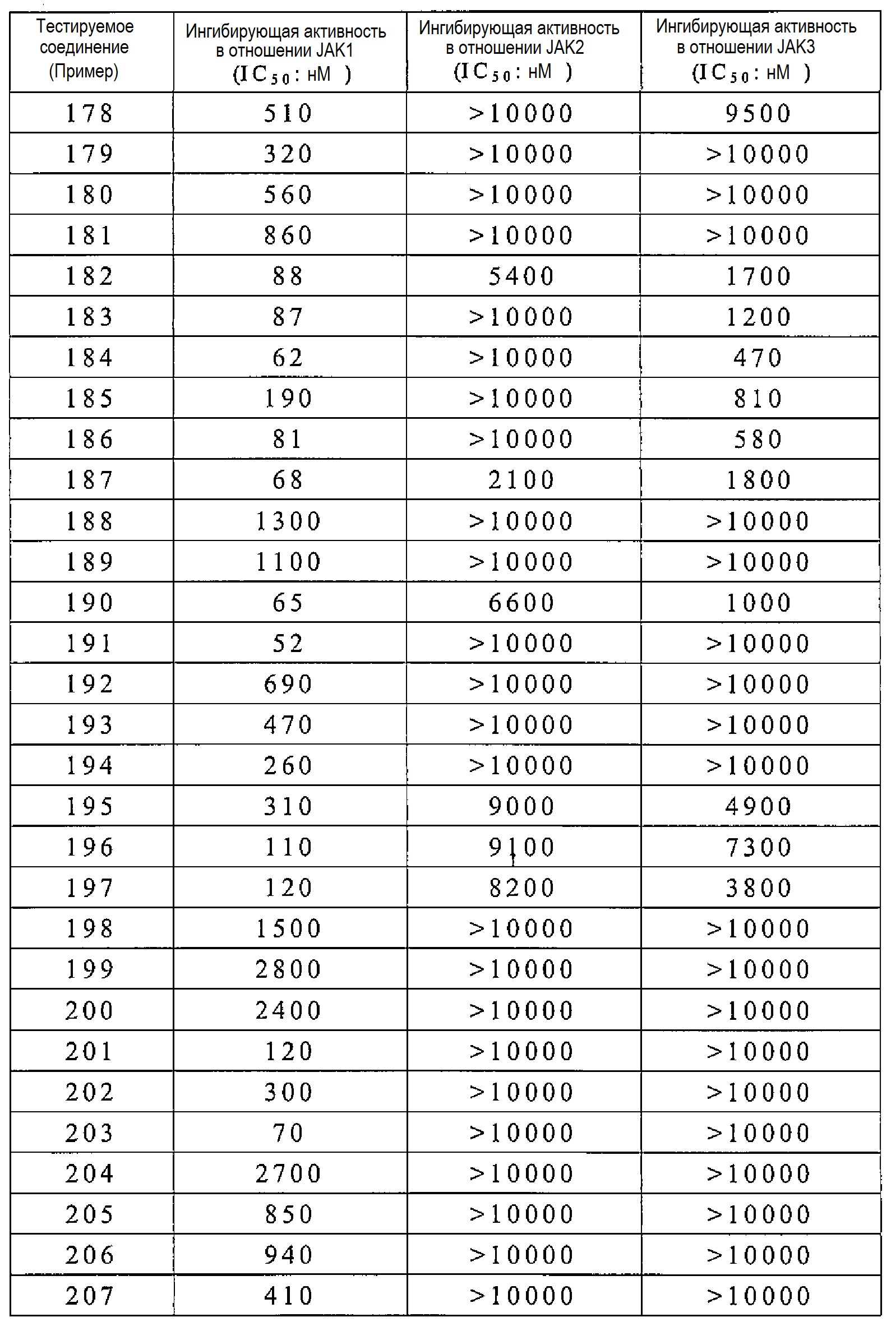
[0423]
Тестовый пример 2: Ингибирующее действие на модели воспаления дыхательных путей, вызываемого Aspergillus
Экстракты Aspergillus fumigatus (Greer laboratories, Inc.) доводили до 400 мкг/мл с помощью PBS. Полученные таким образом растворы Aspergillus fumigatus вводили мышам в виде капель для носа (50 мкл) в День 0, День 1, День 7 и День 8. Капли в нос вводили через час после введения тестируемых соединений утром. Тестируемое соединение вводили два раза в день утром и вечером в период с 0 по 9 день. Тестируемое соединение суспендировали в 0,5% метилцеллюлозе при 10 мг/мл и перорально вводили в дозе 10 мл/кг. Бронхоальвеолярную лаважную жидкость (BALF) собирали на 10-й день, и общее количество лейкоцитов в BALF измеряли с использованием Celltac (NIHON KOHDEN). Соотношение эозинофилов в общих белых клетках крови рассчитывали с использованием ADVIA 120 (Siemens Healthcare Diagnostics), и это отношение умножали на общее количество лейкоцитов для определения количества эозинофилов в BALF. Степень ингибирования тестируемого соединения определяли с учетом коэффициента ингибирования при обработке экстрактом Aspergillus fumigatus и 0,5% метилцеллюлозы как 0% и коэффициента ингибирования при обработке без экстракта Aspergillus fumigatus, но с 0,5% метилцеллюлозой как 100%. Результаты показаны в таблице 7.
[0424]
[Таблица 7]
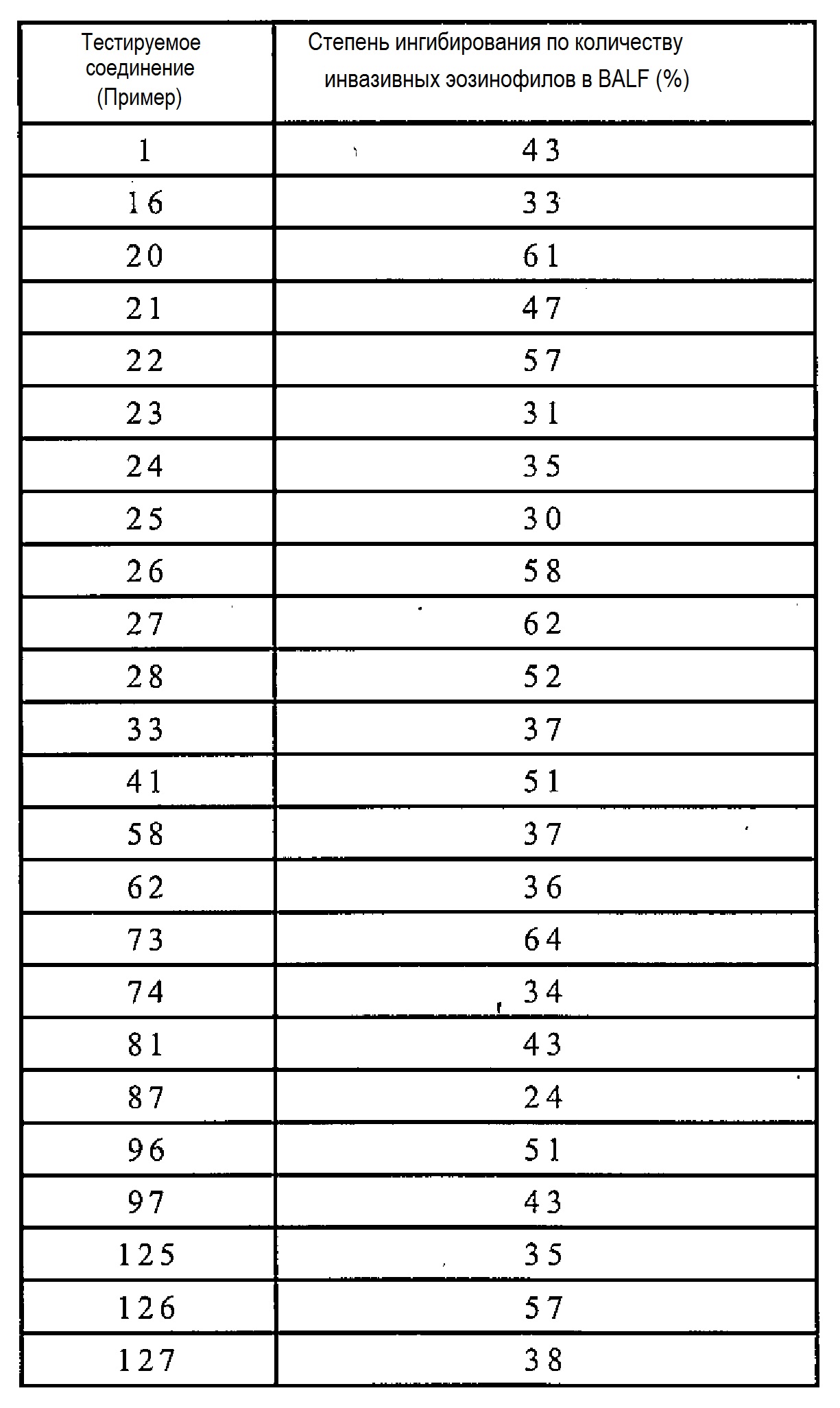
Как видно из таблицы 7, соединения по настоящему изобретению оказывают значительное влияние на эту модель воспаления in vivo.
[0425]
При использовании соединений, показанных выше в таблице 7, были проведены следующие испытания (тестовые примеры 3 и 4).
[0426]
Тестовый пример 3: Ингибирующее действие на индуцированное IL-4 фосфорилирование STAT6
1. Получение тестируемого соединения
Тестируемое соединение растворяли в диметилсульфоксиде (ДМСО) до 10 мМ и далее разбавляли ДМСО до концентраций 300 и 100 мкМ. Раствор далее разбавляли средой RPMI 1640 в 100 раз для получения раствора образца. Кроме того, ДМСО разбавляли в 100 раз средой RPMI 1640 и использовали в качестве отрицательного контроля.
[0427]
2. Активность фосфорилированного STAT6
Раствор образца или раствор отрицательного контроля (50 мкл) смешивали с раствором клетки DND39 (400 мкл) (количество клетки: 105 клеток) и встряхивали при 37°C в течение 30 минут. В качестве стимулятора добавляли 50 мкл интерлейкина-4 (10 нг/мл) и смесь встряхивали в течение 15 минут. К смеси добавляли 500 мкл буфера для фиксации (BD Biosciences, Inc.) и смесь встряхивали в течение 10 минут, чтобы остановить реакцию. После центрифугирования и удаления супернатанта, к осадку добавляли 500 мкл агента, повышающего проницаемость мембраны, Perm buffer III (BD Biosciences, Inc.), и инкубировали при 4°C в течение 30 минут. После двукратного промывания окрашивающим буфером (BD Biosciences, Inc.), добавляли Alexa Fluor 647 Mouse Anti-Stat6 (pY641) (BD Biosciences, Inc.) и инкубировали в прохладном темном месте в течение 30 минут. Полученный раствор клеток подвергали проточной цитометрии. Вычисляли ингибирующую активность тестируемого соединения, исходя из значения GEOMEAN (среднее геометрическое) интенсивности флуоресценции отрицательной контрольной группы, индуцированной интерлейкином-4, как коэффициент ингибирования 0% и значения GEOMEAN интенсивности флуоресценции нестимулированной отрицательной контрольной группы как коэффициент ингибирования 100%. Из полученных результатов было подтверждено, что тестируемые соединения подавляют передачу сигнала IL-4.
[0428]
Тестовый пример 4: Ингибирующее действие на индуцированное IL-7 фосфорилирование STAT5
1. Получение тестируемого соединения
Тестируемое соединение растворяли в диметилсульфоксиде (ДМСО) до 10 мМ и далее разбавляли средой RPMI 1640 в 100 раз для получения раствора образца. Кроме того, ДМСО разбавляли в 100 раз средой RPMI 1640 и использовали в качестве отрицательного контроля.
[0429]
2. Активность фосфорилированного STAT5
К 100 мкл свежей крови человека добавляли 10 мкл раствора образца или раствора отрицательного контроля и встряхивали при 37°C в течение 30 минут. В качестве стимулятора добавляли 10 мкл интерлейкина-7 (100 нг/мл) и смесь встряхивали в течение 15 минут. К реакционной системе добавляли 1,4 мл буфера Lyse/fix (BD Biosciences, Inc.), который разбавляли в 5 раз дистиллированной водой. Смесь встряхивали в течение 10 минут и центрифугировали для разделения клеток. После удаления супернатанта, в осадок добавляли 1 мл PBS. После центрифугирования для удаления PBS, добавляли 500 мкл Perm buffer III (BD Biosciences, Inc.), и инкубировали при 4°C в течение 30 минут. После двукратного промывания окрашивающим буфером (BD Biosciences, Inc.), добавляли антитело Alexa Fluor 647 Mouse Anti-Stat5 (pY694) (BD Biosciences, Inc.), и инкубировали в прохладном темном месте в течение 30 минут. Полученный раствор клеток подвергали проточной цитометрии. Вычисляли ингибирующую активность тестируемого соединения, исходя из значения GEOMEAN интенсивности флуоресценции отрицательной контрольной группы, индуцированной IL-7, как коэффициент ингибирования 0% и значения GEOMEAN интенсивности флуоресценции нестимулированной отрицательной контрольной группы, как коэффициент ингибирования 100%. Из полученных результатов было подтверждено, что тестируемые соединения подавляют передачу сигнала IL-7.
[0430]
Как показано в тестовых примерах 1-4, соединение по настоящему изобретению проявляет ингибирующую активность в отношении JAK1 и, таким образом, является эффективным в модели воспаления in vivo.
Промышленная применимость
[0431]
Принимая во внимание тот факт, что соединение по настоящему изобретению или его фармацевтически приемлемая соль проявляет ингибирующую активность в отношении JAK1, оно является полезным в качестве терапевтического средства для лечения аутоиммунного заболевания (например, ревматоидного артрита, псориатического артрита, ювенильного артрита, болезни Кастлемана, системной красной волчанки, синдрома Шегрена, рассеянного склероза, воспалительного заболевания кишечника, болезни Бехчета, миастении гравис, сахарного диабета 1 типа, иммуноглобулин-связанной нефропатии, аутоиммунных заболеваний щитовидной железы, псориаза, склеродермии, волчаночного нефрита, сухого глаза, васкулита (например, артериит Такаясу, гигантоклеточный артериит, микроскопический полиангиит, гранулематоз с полиангиитом и эозинофильный гранулематоз с полиангиитом), дерматомиозита, полимиозита и нейромиелита зрительного нерва)), воспалительных заболеваний (например, атопического дерматита, контактного дерматита, экземы, зуда, пищевой аллергии, бронхиальной астмы, эозинофильной пневмонии, хронического обструктивного заболевания легких, аллергического ринита, хронического синусита, эозинофильного синусита, носового полипа, аллергического конъюнктивита, остеоартрита, анкилозирующего спондилита, болезни Кавасаки, болезни Бюргера, узелкового полиартериита и IgA-васкулита), пролиферативных заболеваний (например, солидные опухоли, рак крови, злокачественная опухоль лимфоузла, миелопролиферативные заболевания, множественная миелома, фиброз легких и эозинофилия), внезапной потери слуха, диабетической нефропатии, очаговой алопеции, отторжения трансплантата костного мозга или отторжения трансплантата органа.
[0432]
Пример лекарственной формы 1
Таблетка (таблетка для перорального приема)
В 80 мг таблетки лекарственной формы:
Соединение примера - 15,0 мг
Кукурузный крахмал - 46,6 мг
Кристаллическая целлюлоза - 24,0 мг
Метилцеллюлоза - 4,0 мг
Стеарат магния - 0,4 мг
В соответствии с обычным способом, смешанный порошок из компонентов таблетировали с образованием таблетки для перорального введения.