УСТРОЙСТВО ДЛЯ ФИКСАЦИИ МЯГКОЙ БИОЛОГИЧЕСКОЙ ТКАНИ И СПОСОБ ЕГО ПРОИЗВОДСТВА
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к устройству для фиксации мягкой биологической ткани с использованием сплава на основе магния.
Описание уровня техники
В уровне техники в качестве устройства для фиксации мягкой биологической ткани например, в сосудистых клипсах для хирургии, были использованы материалы, которые являются стабильными in vivo, такие как титановые материалы, Устройства, использующие титановые материалы, не только становятся ненужными после наложения швов и заживления рассеченной ткани, но вызывают проблемы, такие как металлические артефакты (явление, в результате которого появляется искусственный шум на полученном изображении, когда материал с высокой плотностью и сильным поглощением, например, металл, который обладает сильным поглощением рентгеновского излучения, присутствует в измеряемой мишени) в ходе магниторезонансной томографии (МРТ) и компьютерной томографии (КТ) рентгеновского излучения, препятствуя прогнозированию, и тому подобному, поскольку материалы по существу постоянно остаются в организме.
С другой стороны, магний, который представляет собой по существу биологический элемент, привлекает внимание как конструкционный материал, поскольку с ним достигается высокая удельная прочность при малой массе. Кроме того, он обладает отличной биосовместимостью и поддается биологическому разложению, и следовательно, можно ожидать, что магний найдет применение в качестве материала в устройствах для фиксации мягкой биологической ткани. Однако чистый магний обладает низкой пластичностью, вызывая проблему разрушения устройства при фиксации мягкой биологической ткани.
Кроме того, в недавних исследованиях было разработано несколько сплавов на основе магния, в качестве материалов для устройств, которые разрушаются в организме. Однако эти материалы не пригодны для использования в устройствах для фиксации мягкой биологической ткани, таких как хирургические клипсы, скобы, или тому подобное, в связи с их деформируемостью.
Например, магниевый сплав Mg-Zn-РЗЭ, имеющий структуру пакетирования дальнего порядка с цинком и редкоземельным элементом (РЗЭ: один или несколько из Gd, Tb, и Tm), содержащимся в магнии, известен как традиционный сплав на основе магния (см. патентный документ 1). Однако проблема заключается в том, что редкоземельные элементы являются дорогими материалами и обладают неудовлетворительной деформируемостью для использования в устройствах для фиксации мягкой биологической ткани.
Тройной магниевый сплав Mg-Ca-Zn, который является недорогим, так как в нем не используются редкоземельные элементы и отсутствуют элементы, которые создают проблему биологической токсичности, также известен как традиционный сплав на основе магния (см. патентный документ 2). Однако существует проблема быстрого разложения in vivo, в связи с большим количеством добавленных элементов. Сплав на основе магния, описанный в патентном документе 2, имеет целью увеличение прочности магния, не обращая внимание на деформируемость, причем периодическая структура, которая является уникальной усиленной структурой, не образуется, если средний размер зерна составляет 1 мкм или меньше.
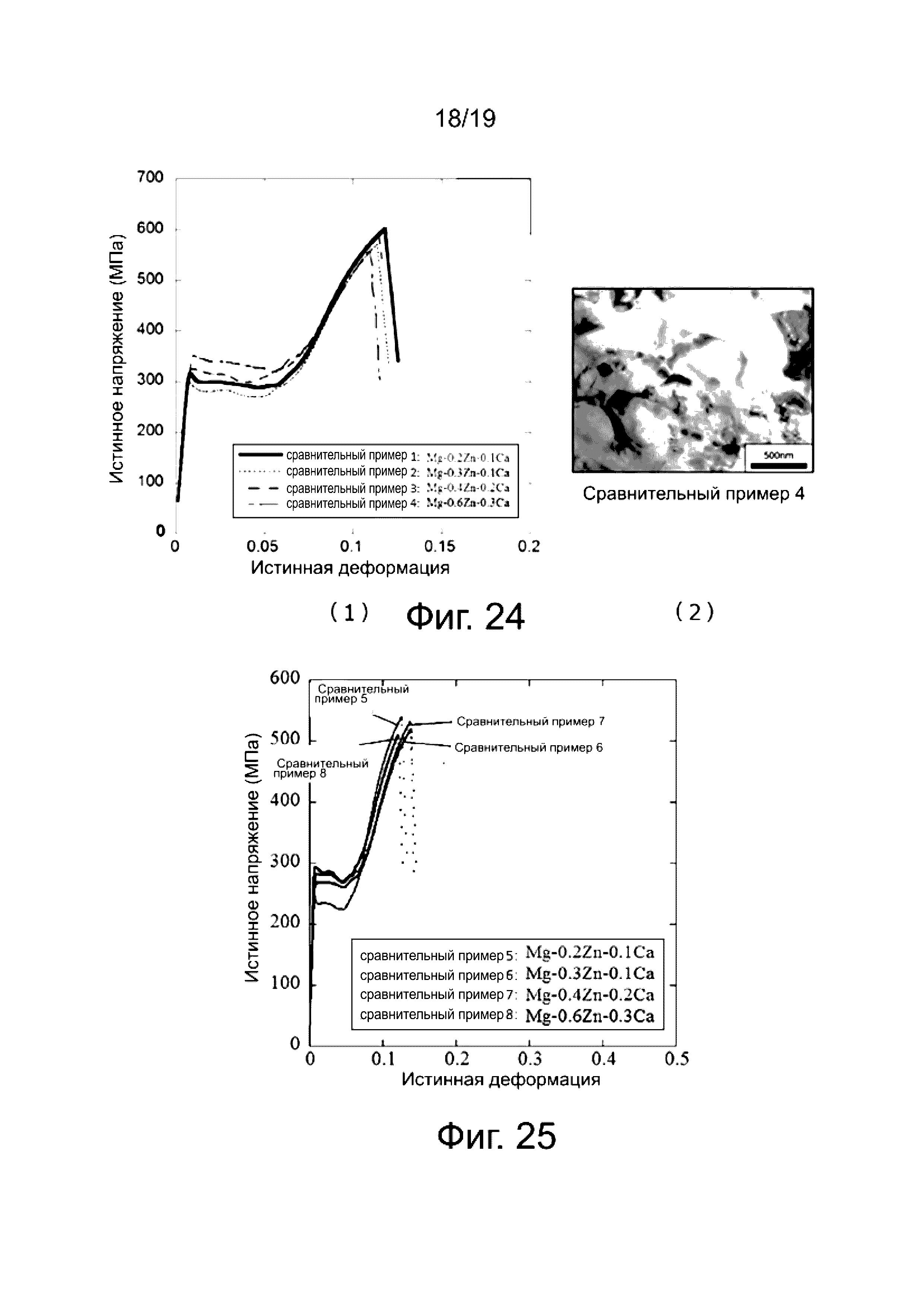
В изобретении описаны характеристики тройных магниевых сплавов Mg-Ca-Zn, имеющих структуру кристаллического зерна со средним размером зерна 0,3-2 мкм (магниевые сплавы, служащие сравнительными примерами) со ссылкой на фиг. 24 и фиг. 25. На фиг. 24 показана характерная диаграмма зависимости истинных напряжений от истинной деформации для материалов, которые подверглись только горячему прессованию, причем горячее прессование проведено при 250°C и без отжига. Диаграмма зависимости истинных напряжений от истинной деформации соответствует компрессионной деформации. Четыре типа магниевых сплавов выбраны в качестве сравнительных примеров, причем уровень содержания Ca и Zn (атом.%) в магниевых сплавах указан на кривых фиг. 24 (1). Можно утверждать, что магниевые сплавы Сравнительных примеров 1-4 обладают низкой деформируемостью, поскольку все эти сплавы разрушаются при истинной деформации равной 0,15 или меньше. На фиг. 24 (2) показано изображение, полученное методом трансмиссионной электронной микроскопии магниевого сплава из Сравнительного примера 4. На основании данных фиг. 24 (2) можно утверждать, что размер кристаллического зерна магниевого сплава из Сравнительного примера 4 составляет 1 мкм или меньше.
На фиг. 25 показана характерная диаграмма зависимости истинных напряжений от истинной деформации для материала, который подвергнут только горячему прессованию, причем горячее прессование проведено при 300°C и без отжига. Диаграмма зависимости истинных напряжений от истинной деформации соответствует компрессионной деформации. Уровень содержания Ca и Zn (атом.%) в магниевых сплавах является таким же, как на кривых фиг. 24(1). Можно утверждать, что магниевые сплавы Сравнительных примеров 5-8 обладают низкой деформируемостью, поскольку все эти сплавы разрушаются при истинной деформации равной 0,15 или меньше.
Кроме того, в других сплавах на основе магния, когда магний не является основным компонентом, при увеличении концентрации добавленных легирующих элементов, проблема заключается в том, что возникает токсичность, связанная с ионами или соединениями, выделяющимися при вымывании добавленных элементов. В связи с этим, известны материалы, которые обеспечивают функционирование, такое же как биологически разлагающийся металлический материал на основе магния, в котором в качестве металлического элемента второго компонента, добавленного к магнию, выбран только элемент с низкой биологической токсичностью, не увеличивают концентрацию элемента, добавленного в качестве второго компонента, более чем требуется, и не содержат выделившихся фаз и интерметаллических соединений (смотрите патентный документ 3). В сплавах на основе магния из патентного документа 3, токсичность для организма соединений элемента зависит от концентрации (количества) в организме, причем чем меньше количество добавленного элемента, тем ниже вероятность возникновения токсичности. Поэтому наиболее высокую концентрацию второго компонента устанавливают приблизительно равной 1/3 от предельной концентрации твёрдого раствора в магнии для любых остальных элементов, за исключением элементов с очевидной биологической токсичностью.
Затем, поскольку добавление Ca, Yb, Gd, In, и тому подобных, имеющих большой радиус металлической связи, уменьшает стационарную скорость разложения в большей степени, чем Au, Ag, Al, Zn, и тому подобных, имеющих небольшой радиус металлической связи, коррозионная стойкость материала сплава определяется типом и количеством второго элемента, добавленного в сплавы на основе магния.
Однако, когда вторым компонентом, добавленным к магнию, является Zn или Ca, которые является по существу биологическими элементами, их содержание можно не ограничивать на уровне приблизительно 1/3 от предельной концентрации твёрдого раствора в магнии. Кроме того, в патентном документе 3 вообще не упомянуты тройные магниевые сплавы Mg-Ca-Zn.
Документы уровня техники
Патентные документы
Патентный документ 1: Нерассмотренная патентная заявка Японии № 2009-221579
Патентный документ 2: Публикация Международной заявки WO 2013/069638
Патентный документ 3: Патент Японии № 5333886
Краткое изложение изобретения
Проблемы, решаемые изобретением
Как описано выше, некоторые сплавы на основе магния были разработаны как материалы для устройств, которые разрушаются in vivo. Однако проблема заключается в том, что деформируемость сплавов является неудовлетворительной для использования в устройствах для фиксации мягкой биологической ткани, таких как хирургические клипсы, скобы, или тому подобное.
Учитывая эту ситуацию, целью настоящего изобретения является разработка устройства для фиксации мягкой биологической ткани, причем это устройство содержит сплав на основе магния, и обладает прочностью и деформируемостью для того, чтобы использовать его в качестве устройства для закрепления мягкой биологической ткани (органы, кровеносные сосуды, и др.), которая была отрезана или отделена в результате рассечения или тому подобного в ходе хирургического вмешательства, и полностью разрушается in vivo и выводится из организма после наложения швов в мягкой ткани или заживления рассеченной ткани.
Средства для решения вышеупомянутых проблем
В результате углубленного изучения содержания добавок (количества) цинка и кальция, которые являются существенными биологическими элементами, добавленными к магнию, и способов получения сплавов на основе магния, авторы настоящего изобретения получили результаты, демонстрирующие, что устройство, содержащее тройной магниевый сплав Mg-Ca-Zn специального состава, является пригодным в качестве устройства для фиксации мягкой биологической ткани.
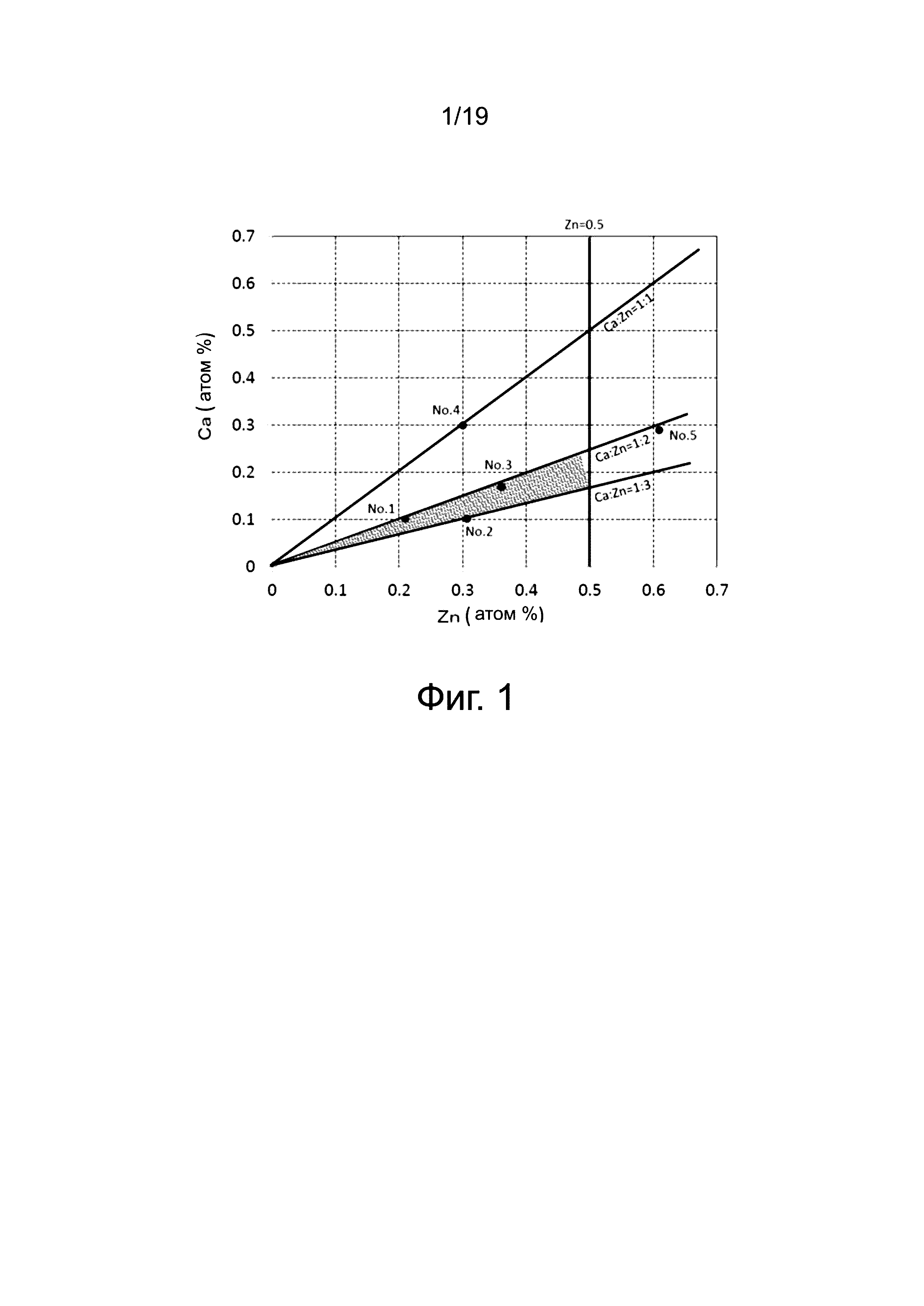
Конкретно, устройство настоящего изобретения для фиксации мягкой биологической ткани представляет собой устройство, содержащее тройной магниевый сплав Mg-Ca-Zn; этот магниевый сплав содержит Ca и Zn в пределах концентрации твёрдого раствора на основе магния, причем остальное приходится на Mg и неизбежные примеси, содержание Zn составляет 0,5 атом.% или меньше, уровень содержания Ca и Zn является таким, что атомное отношение Ca:Zn = 1:x (где х означает 1 - 3), и структура кристаллического зерна является равноосной, и имеет средний размер кристаллического зерна 20-250 мкм.
Указанная конфигурация обеспечивает прочность и деформируемость устройства для фиксации мягкой биологической ткани, а также полностью разлагается in vivo после наложения швов в мягкой ткани или после заживления рассеченной ткани.
Отмечается, что когда содержание Zn становится больше, чем 0,5 атом.%, скорость разложения in vivo возрастает, выделяется большое количество газа в связи с разложением после имплантации в организме. Известно, что это обусловлено замедленным восстановлением ткани. Поэтому содержание Zn регулируется до 0,5 атом.% или меньше. Кроме того, когда содержание Zn становится меньше, чем содержание Ca и содержание Zn в атомном отношении Ca:Zn = 1:1, то проблема состоит в том, что не достигается необходимая пластичность. С другой стороны, когда содержание Zn становится больше, чем Ca:Zn = 1:3, проявляется проблема высокой скорости разложения.
Устройство настоящего изобретения для фиксации мягкой биологической ткани содержит равноосную структуру кристаллического зерна, имеющую средний размер кристаллического зерна 20-250 мкм, причем путем осуществления отжига может быть улучшена не только прочность, но также и деформируемость. К тому же, средний размер кристаллического зерна измеряется методом линейной секущей от изображения структуры кристаллического зерна.
Кроме того, более предпочтительно, чтобы устройство настоящего изобретения для фиксации мягкой биологической ткани представляло собой устройство, содержащее тройной магниевый сплав Mg-Ca-Zn; этот магниевый сплав содержит Ca и Zn в пределах концентрации твёрдого раствора на основе магния, причем остальное приходится на Mg и неизбежные примеси, содержание Zn составляет от 0,2 атом.% до 0,4 атом.%, уровень содержания Ca и Zn является таким, что атомное отношение Ca:Zn = 1:x (где х означает 2 - 3) и структура кристаллического зерна является равноосной и имеет средний размер кристаллического зерна 20-250 мкм.
Наиболее предпочтительно, скорость разложения in vivo является такой, чтобы ткань соединялась и удерживалась в течение 2-8 недель, которые требуются для соединения мягкой биологической ткани, и затем устройство полностью разрушается приблизительно в течение одного года. Для достижения указанного выше эффекта, содержание Zn должно составлять от 0,2 атом.% до 0,4 атом.%, при соотношении Ca:Zn = 1:x (где x означает 2 - 3).
Устройство настоящего изобретения для фиксации мягкой биологической ткани включает в себя структуру равноосных кристаллических зерен, имеющих средний размер кристаллического зерна 20-250 мкм, причем путем осуществления отжига может быть улучшена не только прочность, но также и деформируемость. Средний размер кристаллического зерна может быть измерен методом линейной секущей от изображения структуры кристаллического зерна.
Поскольку требуется высокая способность к изменению формы при изгибе, устройство настоящего изобретения для фиксации мягкой биологической ткани должно содержать материал, в котором формируются границы кристаллических зерен, имеющие разориентацию кристаллов 15° или больше, или границы кристаллических субзерен, имеющих разориентацию кристаллов от 3° до меньше, чем 15°, причем эти границы существуют для разделения структуры кристаллических зерен в ходе деформации. Граница кристаллического зерна, имеющая разориентацию кристалла 15° или больше, является поверхностью раздела, названной высокоугловой границей зерна, и структура кристаллического зерна, очевидно, разделяется на части в ходе деформации. В качестве альтернативы, структура кристаллического зерна разделяется на части в ходе деформации, даже если разориентация кристаллов станет меньше, чем 15°, пока существует субграница кристаллического зерна. К тому же, причиной того, что нижний предел величины разориентации кристаллов кристаллической субграницы зерна установлен равным 3°, заключается в том, что нижний предел величины определяется как предельная величина разориентации кристаллов, которая может быть подтверждена путем исследования структуры, и она была установлена минимальной (=3°), что можно наблюдать с помощью электронного луча в сочетании со сканирующим электронным микроскопом (СЭМ) и с использованием характеристики EBSD (дифракции обратного рассеяния электронов), что дает возможность измерить ориентацию микрокристаллов и кристаллической системы.
Кроме того, необходимо проводить регулирование путем термической обработки с целью подтверждения, что равноосная структура кристаллического зерна, имеющего средний размер кристаллического зерна 20-250 мкм после отжига, находится внутри кристаллических зерен магниевого сплава. Это относится к предотвращению трещин из-за концентрирования напряжений и обеспечивает возможность повышения способности к изменению формы при изгибе при обычной температуре. Очистка кристаллической структуры также дает выгодное повышение прочности после формования.
Устройство настоящего изобретения для фиксации мягкой биологической ткани характеризуется отношением остаточного биологического разложения равным 50-92% через 4 недели после имплантации и количеством газа, выделенного в связи с разложением, не больше, чем двукратный объем пространства, образовавшегося в ходе биоимплантации.
Устройство настоящего изобретения для фиксации мягкой биологической ткани также характеризуется тем, что скорость биоразложения можно регулировать, используя уровень содержания Ca и Zn в качестве параметров.
Далее будет объяснен способ получения описанного выше устройства для фиксации мягкой биологической ткани.
Способ получения устройства для фиксации мягкой биологической ткани представляет собой способ получения устройства, содержащего тройной магниевый сплав Mg-Ca-Zn, в котором осуществляются следующие стадии 1) - 7) по порядку.
1) Стадия приготовления магниевого сплава путем добавления Ca и Zn в магний в пределах концентрации твёрдого раствора, так чтобы содержание Zn относительно Mg составляло 0,5 атом.% или меньше и уровень содержания Ca и Zn был установлен в атомном соотношении Ca:Zn=1:x (где x равен 1 - 3).
2) Стадия получения слитка путем плавления и разливки магниевого сплава.
3) Стадия гомогенизирующей термической обработки для гомогенизации слитка термической обработкой.
4) Стадия горячего прессования для осуществления, по меньшей мере, одного горячего прессования в диапазоне температур 250-450°C.
5) Стадия отжига для проведения отжига в диапазоне температур 350-450°C.
6) Стадия формования для получения требуемой формы устройства.
7) Стадия очистки поверхности для удаления примесей, в том числе оксидов на поверхности устройства.
На указанной выше стадии отжига 5) изобретения слиток может подвергаться воздействию высокой температуры в течение десятков секунд сразу после прессования путем повышения температуры горячего прессования и замедления скорости горячего прессованию на стадии горячего прессования.
Предпочтительно на стадии отжига 5), указанной выше, отжиг проводится в течение от одного до восьми часов при температуре, близкой к 400°C, когда содержание Zn относительно содержания магния составляет от 0,2 атом.% до 0,4 атом.%, и в магниевом сплаве устанавливается уровень содержания Ca и Zn в атомном соотношении Ca:Zn=1:x (где x равен 2 - 3).
Проведение горячего прессования в диапазоне температур 250-450°C обеспечивает возможность формирования равноосной структуры кристаллического зерна, имеющей размер зерна приблизительно от субмикронного до 10 мкм.
Кроме того, проведение отжига в диапазоне температур 350-450°C делает возможным формирование равноосной структуры кристаллического зерна, имеющей размер кристаллического зерна 20-250 мкм после отжига.
Отжиг является термической обработкой, при которой удаляется внутренняя деформация, вызванная деформационным упрочнением, разрастается структура кристаллического зерна и улучшается деформируемость, причем отжиг проводится, чтобы получить соответствующую прочность и пластичность для использования в качестве клипсы. Например, материал выдерживают на воздухе и охлаждают после нагревания до температуры 400°C и выдерживают в течение определенного времени приблизительно от одного до восьми часов. Размер кристаллического зерна измеряется методом линейной секущей от изображения структуры кристаллического зерна; однако могут быть использованы другие известные методы измерения.
Кроме того, первая стадия горячего прессования для осуществления горячего прессования в диапазоне температур 250-400°C и вторая стадия горячего прессования в диапазоне температур 350-450°C, но для осуществления горячего прессования при температуре выше, чем температура на первой стадии горячего прессования, может быть проведена вместо стадии горячего прессования в диапазоне температур 250-450°C и стадии отжига в диапазоне температур 350-450°C. Это связано с тем, что на второй стадии горячего прессования, проведенной при повышенной температуре, получаются такие же эффекты как при отжиге.
К тому же, многоступенчатая стадия горячего прессования также является более допустимой, чем две стадии, включающие первую стадию горячего прессования и вторую стадию горячего прессования. В этом случае, обработка проводится при более высокой температуре на стадии горячего прессования последней ступени, чем температура на стадиях горячего прессования предыдущих ступеней.
Скорость биоразложения можно регулировать, с использованием уровней содержания Ca и Zn в качестве параметров в способе получения устройства настоящего изобретения для фиксации мягкой биологической ткани.
Положительные эффекты изобретения
Устройство настоящего изобретения для фиксации мягкой биологической ткани гарантирует безопасность, даже после разложения в организме, так как оно состоит только из магния, в качестве основного компонента, и кальция и цинка, в качестве добавленных элементов, которые являются по существу биологическими элементами. Кроме того, устройство обладает прочностью и деформируемостью, чтобы фиксировать мягкую биологическую ткань, а также обеспечивает эффект, дающий возможность контролировать скорость разложения.
Краткое описание чертежей
На фиг. 1 показан график уровней содержания Ca и Zn для тройных магниевых сплавов Mg-Ca-Zn;
фиг. 2 представляет собой схему последовательности способа получения устройства для фиксации мягкой биологической ткани;
фиг. 3 представляет собой карту распределения напряжений для полученной клипсы;
на фиг. 4 показаны кривые (1) зависимости истинных напряжений от истинной деформации отожженных клипс;
на фиг. 5 показаны кривые (2) зависимости истинных напряжений от истинной деформации отожженных клипс;
на фиг. 6 показаны кривые (3) зависимости истинных напряжений от истинной деформации отожженных клипс;
на фиг. 7 показаны результаты анализа ориентации кристаллов в отожженных клипсах;
на фиг. 8 показана диаграмма способности к биологическому разложению отожженных клипс;
на фиг. 9 показана компьютерная томограмма КT (1) рентгеновского излучения после имплантирования отожженной клипсы in vivo;
на фиг. 10 показана компьютерная томограмма КT (2) рентгеновского излучения после имплантирования отожженной клипсы in vivo;
на фиг. 11 показана компьютерная томограмма КТ рентгеновского излучения после имплантирования титанового устройства (Сравнительный пример 1) in vivo;
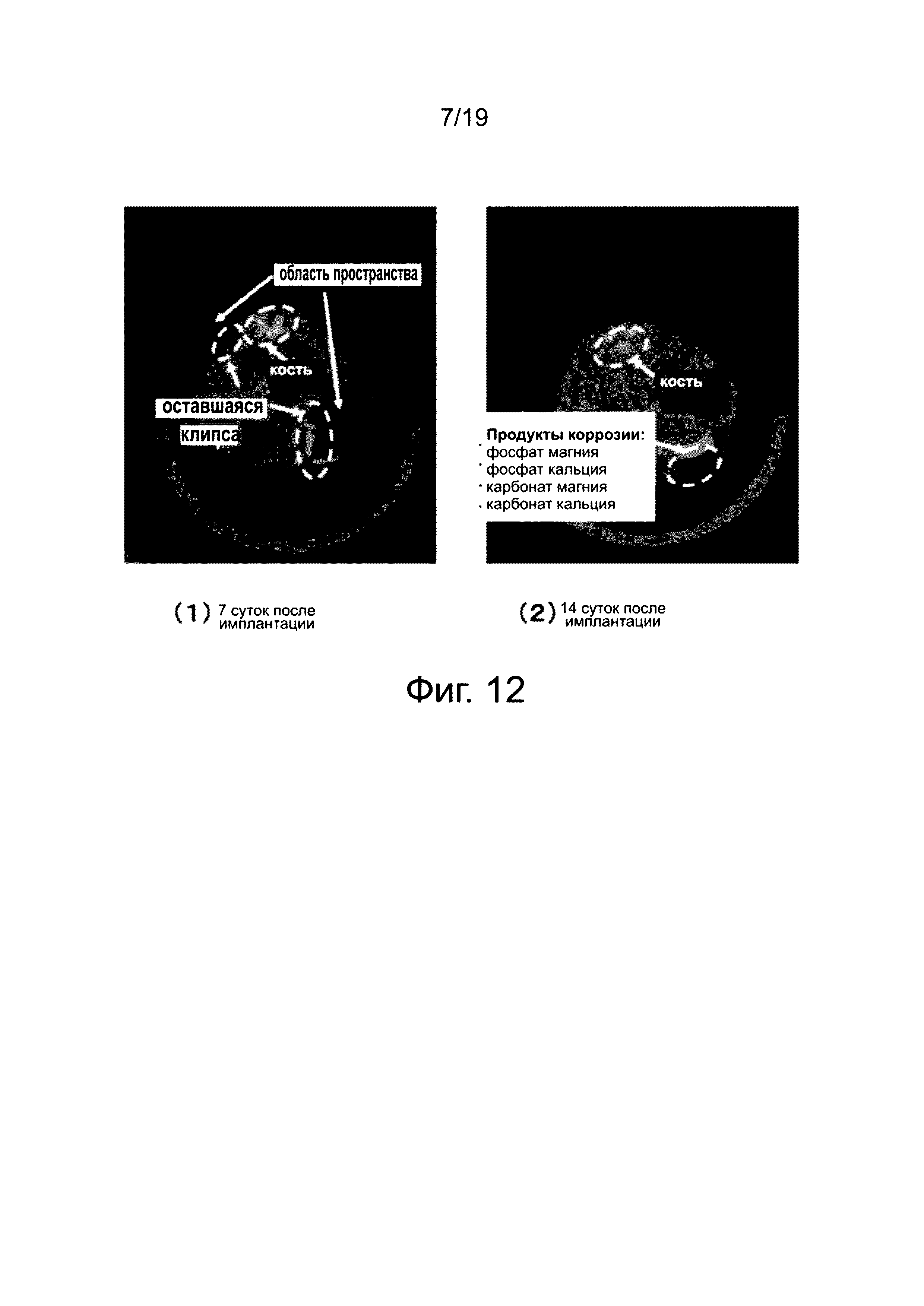
на фиг. 12 показана компьютерная томограмма КТ рентгеновского излучения после имплантирования устройства, имеющего высокое содержание Zn (Сравнительный пример 2) in vivo;
фиг. 13 демонстрирует микрофотографию структуры кристаллического зерна;
на фиг. 14 показано влияние времени имплантации на относительный остаточный объем (пример 3);
на фиг. 15 показаны реконструкции изображения компьютерной томограммы КТ рентгеновского излучения (пример 3);
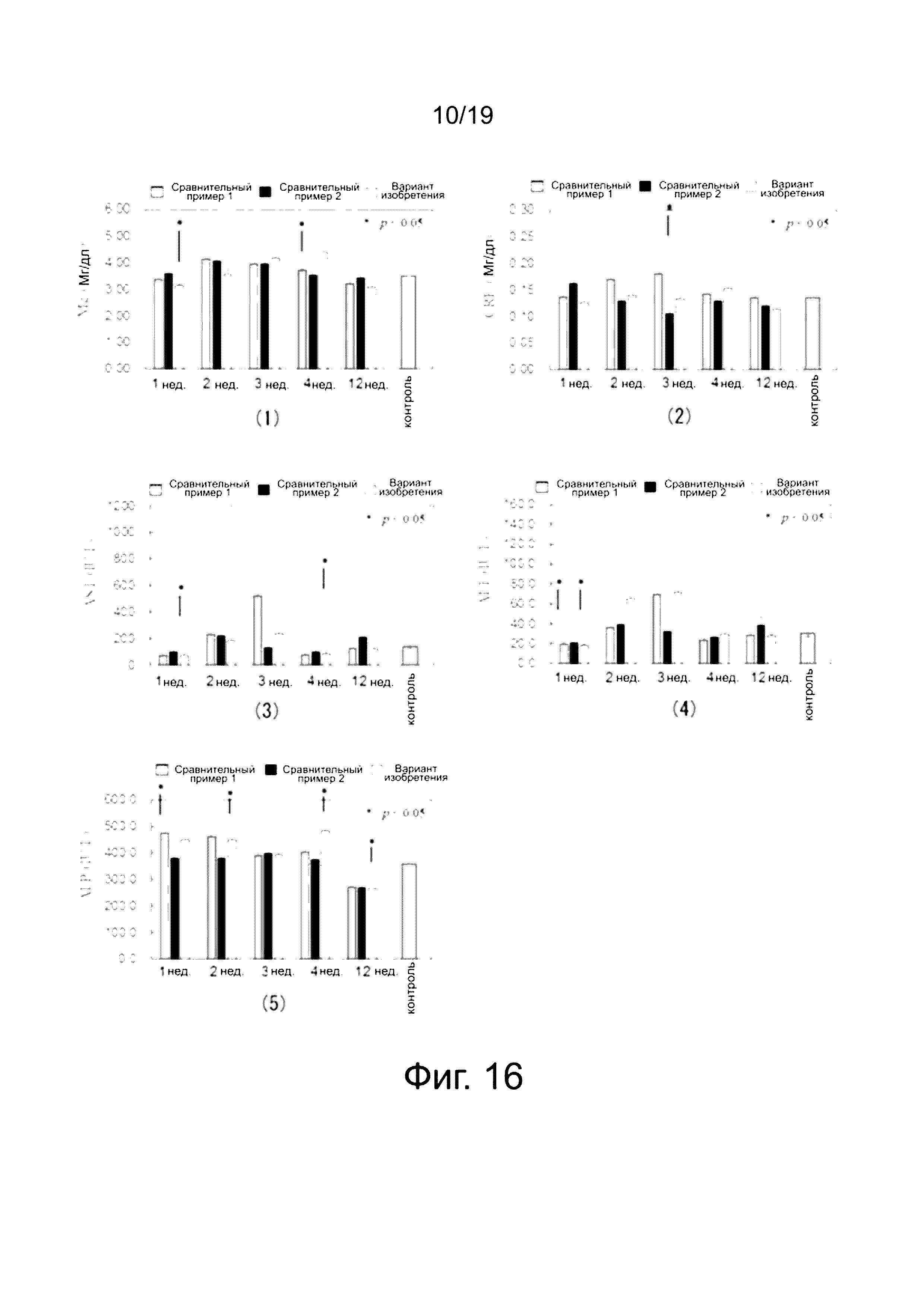
на фиг. 16 показаны данные измерения концентрации ионов Mg и т.д. в крови (пример 3);
на фиг. 17 показаны результаты обследования окружающих клеток и тканей (пример 3);
на фиг. 18 показаны результаты анализа ориентации кристаллов методом EBSD (пример 4);
фиг. 19 демонстрирует реконструкцию изображения 1 компьютерной томограммы КТ рентгеновского излучения крысы (пример 4);
на фиг. 20 показаны реконструкции изображения 2 компьютерной томограммы КТ рентгеновского излучения крысы (пример 4);
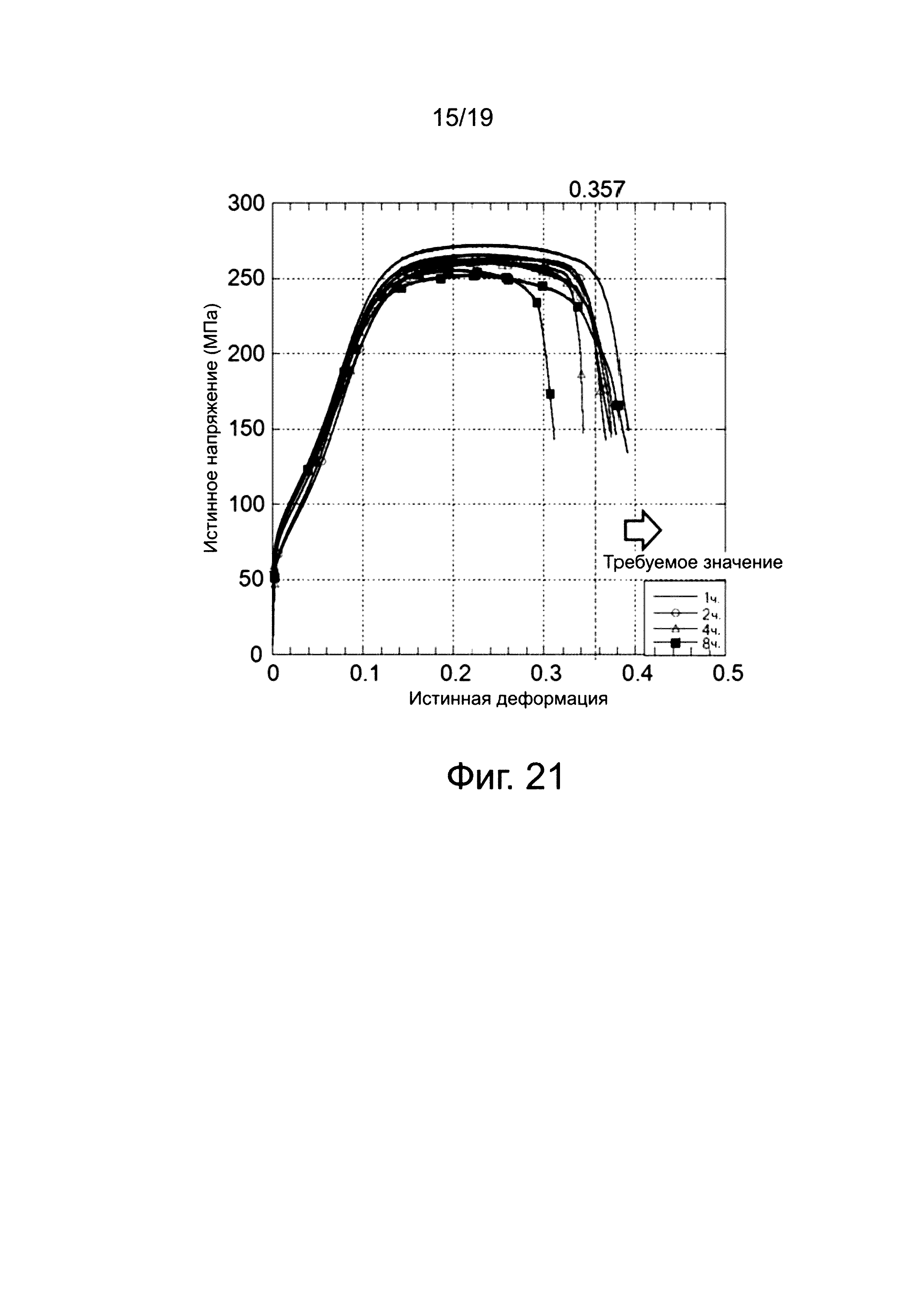
на фиг. 21 показана зависимость (4) истинных напряжений от истинной деформации отожженных клипс;
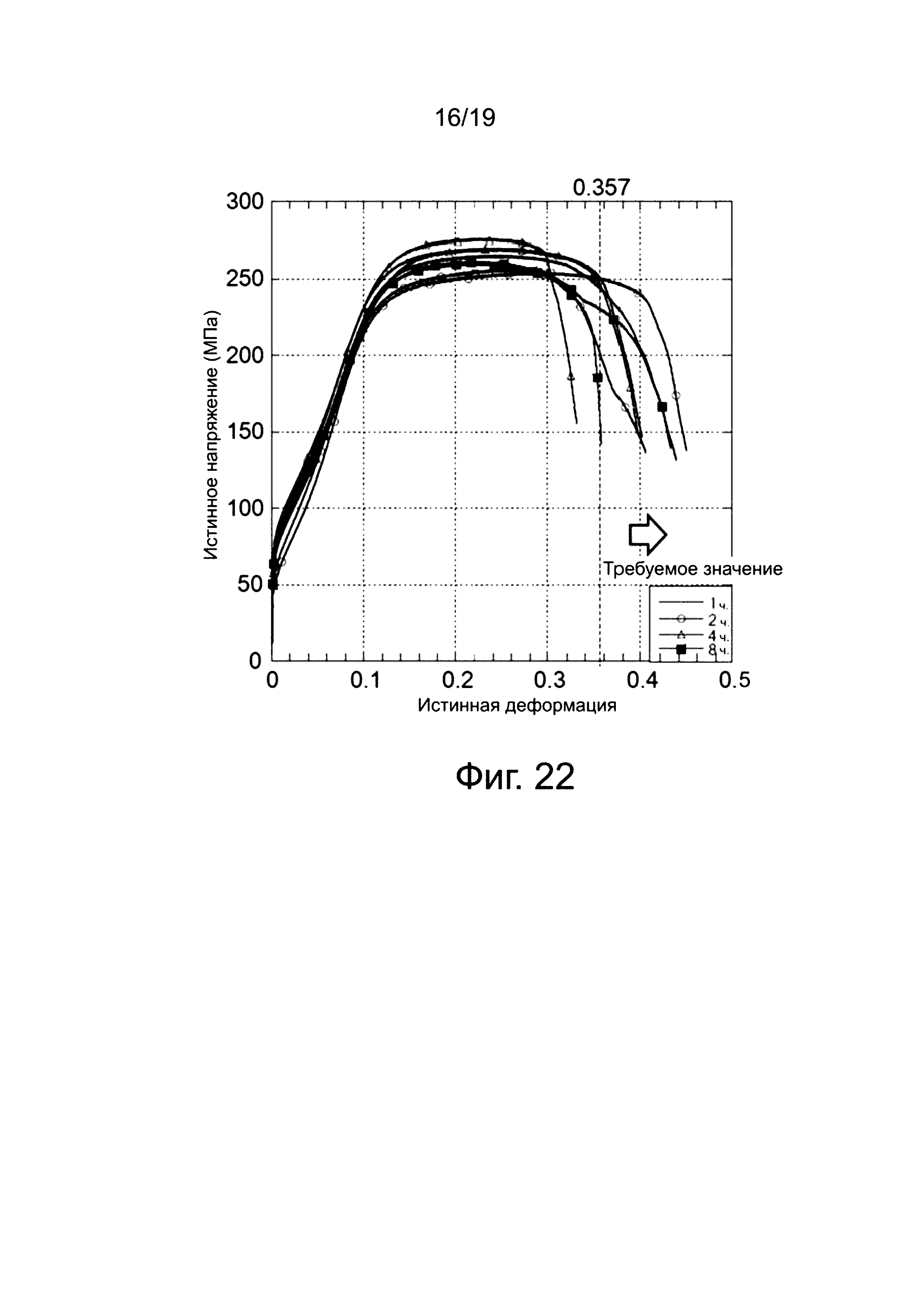
на фиг. 22 показана зависимость (5) истинных напряжений от истинной деформации отожженных клипс;
на фиг. 23 показана зависимость (6) истинных напряжений от истинной деформации отожженных клипс;
фиг. 24 представляет собой пояснительный чертеж (1) для традиционного мелкокристаллического зернистого материала;
фиг. 25 представляет собой пояснительный чертеж (2) для традиционного мелкокристаллического зернистого материала;
на фиг. 26 показана зависимость истинных напряжений от истинной деформации для чистого магния, используемого в расчете конечного элемента клипс варианта осуществления изобретения.
Описание предпочтительных вариантов осуществления изобретения
Ниже подробно объясняются примеры вариантов осуществления настоящего изобретения со ссылкой на прилагаемые чертежи. Кроме того, объем настоящего изобретения не ограничивается следующими примерами и иллюстрированными примерами; возможны многочисленные модификации и вариации.
Пример 1
На фиг. 1 показан график уровней содержания Ca и Zn для тройных магниевых сплавов Mg-Ca-Zn. Ниже объясняются результаты, полученные при оценке применимости пяти образцов (магниевые сплавы № 1 - 5), приведенных на фиг. 1 в качестве устройств для фиксации мягкой биологической ткани. Эти пять образцов (магниевые сплавы № 1 - 5) охарактеризованы ниже в Таблице 1.
Таблица 1
|
Получение пяти образцов (магниевые сплавы № 1-5) и способ получения устройств для фиксации мягкой биологической ткани с использованием указанных магниевых сплавов будут разъяснены со ссылкой на фиг. 2.
Сначала получают магниевый сплав путем добавления Ca и Zn на уровне содержания относительно Mg в количестве, указанном выше в Таблице 1, №№ 1-5, в атомном соотношении (стадия S01 приготовления магниевого сплава). Затем магниевый сплав расплавляется и отливается, чтобы получить слитки (стадия S02 получения слитков).
Затем слитки подвергаются гомогенизирующей термической обработке (стадия S03 гомогенизирующей термической обработки). Потом проводится горячее прессование в диапазоне температур 300°C (стадия S04 горячего прессования), и внутренняя часть структуры кристаллического зерна очищается путем обработки давлением. После этого проводится отжиг в диапазоне температур 400°C (S05: стадия отжига). Однородный материал может быть получен путем выдерживания в течение длительного времени после проведения горячего прессования (S04).
Затем материал формуют в требуемую форму клипсы (S06: стадия формования), и с поверхности клипсы удаляют примеси, включающие оксиды (S07: стадия очистки поверхности).
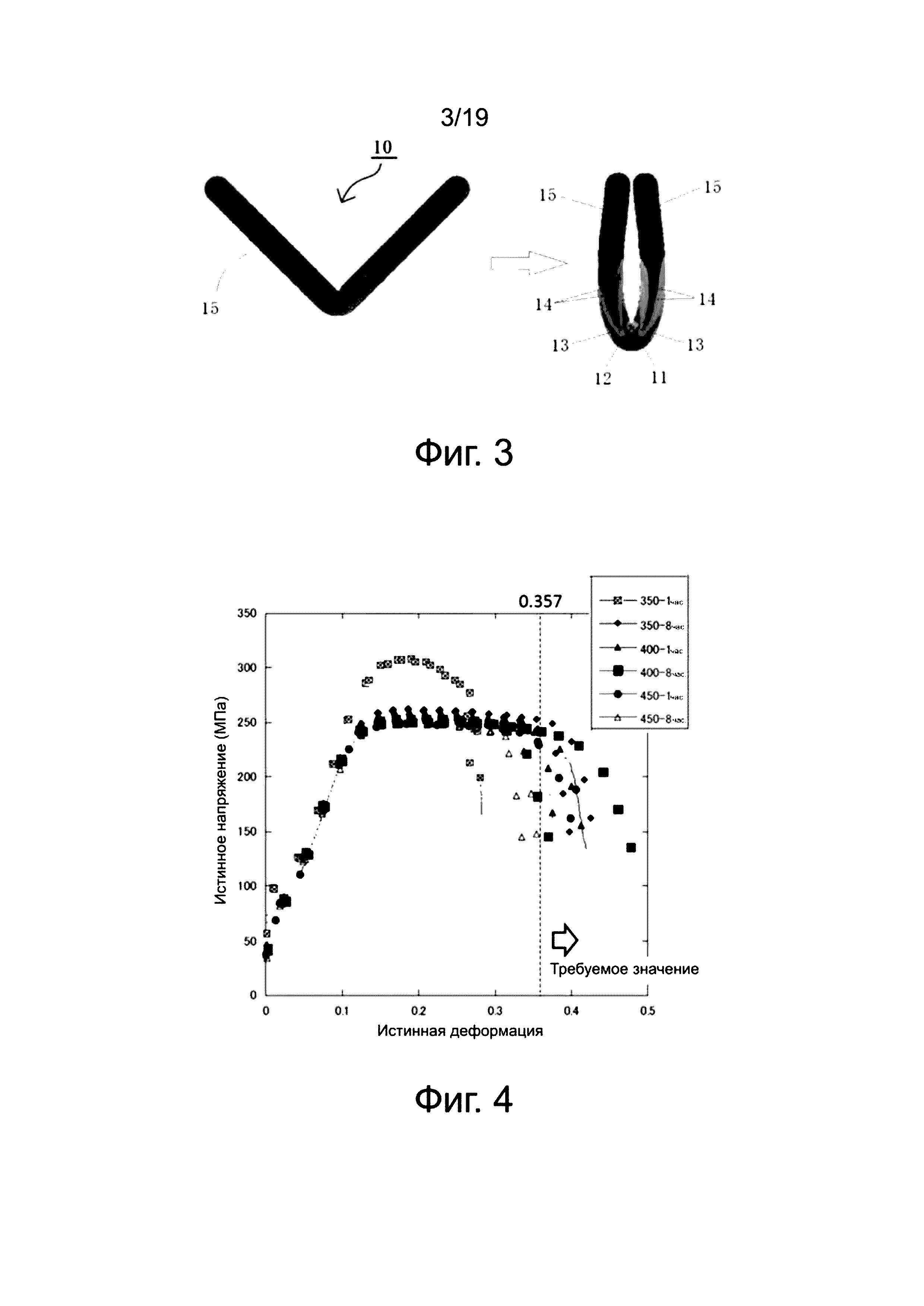
Анализ конечного элемента распределения деформаций, связанных с фиксацией клипсы, проводится на клипсах, выполненных из сетчатой модели. Фиг. 3 представляет собой эквивалент диаграммы распределения пластической деформации клипсы 10. Диаграмма распределения деформации, приведенная на фиг. 3, демонстрирует результаты, полученные с использованием анализа конечного элемента, на основе данных для материала - чистого магния (средний размер кристаллического зерна: 47 мкм). Зависимость истинных напряжений от истинной деформации для чистого магния, использованного при расчете конечного элемента клипсы 10, показана на фиг. 26. Пунктирная линия на графике фиг. 26, представляет собой диаграмму при допущении, что напряжение материала достигает постоянной величины без разрушения даже после достижения максимального напряжения. На чертеже слева фиг. 3 показана V-образная клипса (сетчатая модель до деформации, открытое состояние – до прищипывания); на чертеже справа показана клипса в закрытом состоянии. Положение каждой позиции 11-15 на фиг. 3 показывает части с различным затенением на изображении клипсы. Согнутая часть 11 клипсы в закрытом состоянии представляет собой часть с наибольшей деформацией, причем деформация снижается в ряду 12, 13, 14. Затененная часть, обозначенная как 15, является частью, в которой практически отсутствует деформация. Расчет дает максимальное значение относительной пластической деформации равное 0,357. Это значение 0,357 изменяется в зависимости от материала и формы клипсы, но не изменяется с размером клипсы. Анализ конечного элемента был проведен с параметрами материала - чистого магния и формами сетчатой модели клипсы, установленными и полученными в примерах. При деформации в форму, указанную на чертеже фиг. 3 справа, установлено, что предельное значение растяжения, необходимое для деформации, должно быть при использовании 0,357, максимального значения относительной пластической деформации в модели клипсы. Другими словами, значение 0,357 было установлено как целевой показатель. Следовательно, если изменяется материал, использованный в примере, то значение максимальной деформации, то есть, предельная величина, которая служит целевым показателем, также изменяется, поскольку, кроме того, изменяется распределение напряжений в ходе деформации. При условии, что форма и размер клипсы не ограничиваются, значение максимальной деформации клипсы с формой сетчатой модели, использованное в примере, служит критерием в настоящем изобретении.
Материал, который не разрушается при деформации 0,357 или больше, необходимо использовать в клипсе с формой сетчатой модели, использованной в примере. Ткань может быть зафиксирована без разрушения клипсы в позиции 11, где имеется наибольшая деформация клипсы. Как будет описано ниже, получены экспериментальные результаты, демонстрирующие, что магниевый сплав, полученный в этом примере, является материалом, который не разрушается при истинной деформации 0,357, вызванной сжатием. Таким образом, понятно, что мягкая биологическая ткань может быть зафиксирована с использованием клипсы, изготовленной из тройного магниевого сплава Mg-Ca-Zn, описанного в этом варианте осуществления.
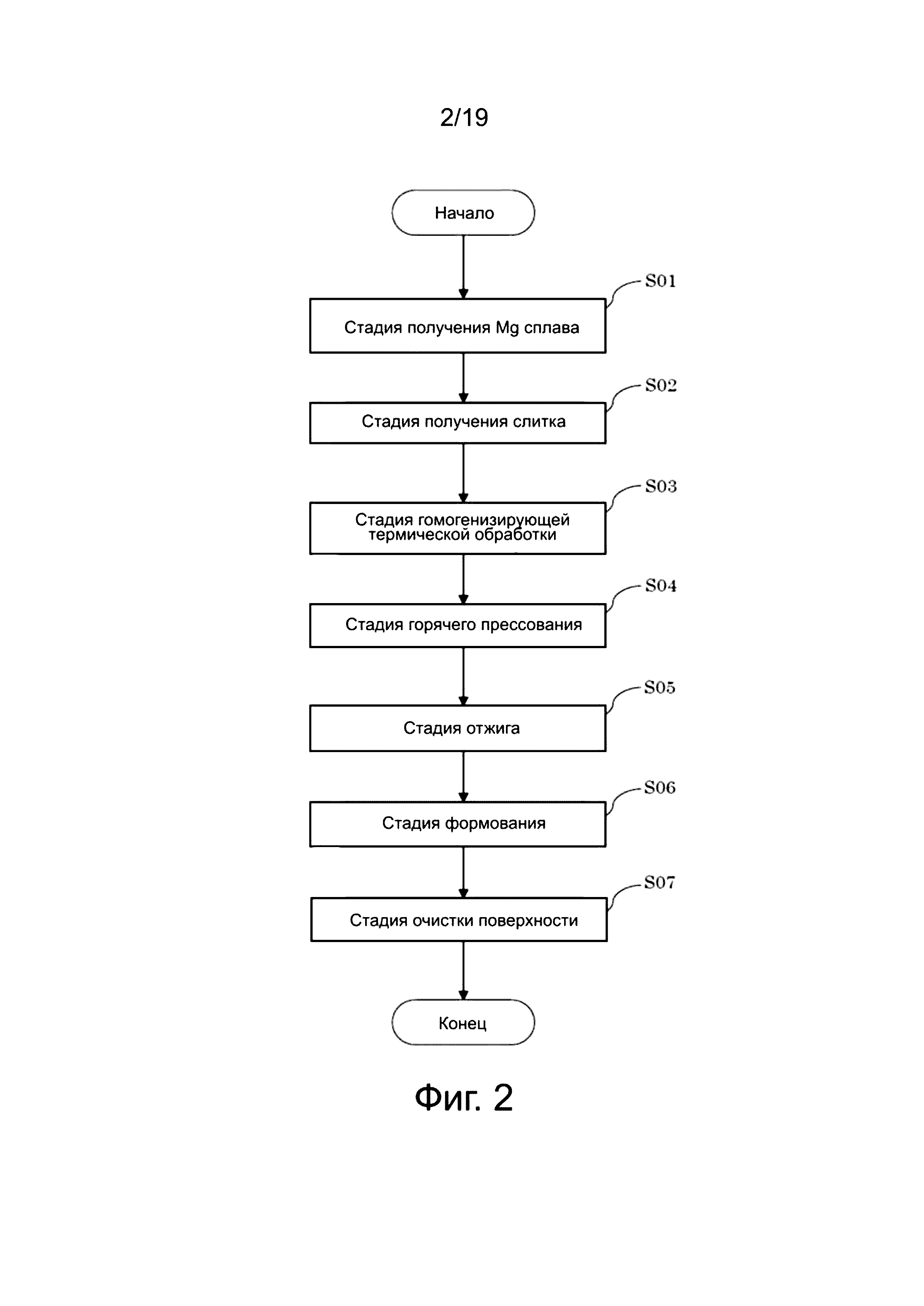
Фиг. 4 относится к магниевому сплаву № 1 (пример A), где показана зависимость истинных напряжений от истинной деформации для клипс, отожженных в течение одного часа или восьми часов при температурах 350°C, 400°C и 450°C. На графике фиг. 4 горизонтальная ось означает истинную деформацию, и вертикальная ось означает истинное напряжение. Из графика фиг. 4 ясно, что клипса, выполненная из магниевого сплава № 1 (пример A), не разрушается, даже когда возникает деформация 0,357 или больше, за исключением случаев обработки: один час при 350°C и восемь часов при 450°C. Другими словами, укрупнение кристаллических зерен является неудовлетворительным при термической обработке в течение одного часа, причем необходима термическая обработка в течение восьми часов при низкой температуре отжига, такой как 350°C. Кроме того, термическая обработка в течение одного часа является подходящей, и может быть получена кристаллическая структура, которая имеет деформацию, с необходимым значением 0,357 или больше, когда температура отжига является высокой, такой как 450°C. В отличие от этого, кристаллическая структура укрупняется больше, чем это необходимо при термической обработке в течение восьми часов, и поэтому необходимое значение деформации 0,357 или больше не может быть достигнуто. Это позволяет предположить, что существует оптимальный диапазон температуры отжига и времени выдержки.
Фиг. 5 относится к магниевому сплаву № 5 (Сравнительный пример) и показывает зависимость истинных напряжений от истинной деформации для клипс, отожженных в течение одного часа или восьми часов при температурах 350°C, 400°C и 450°C. Из графика фиг. 5 ясно, что для клипсы, выполненной из магниевого сплава № 5 (Сравнительный пример) отсутствует воспроизводимость данных для получения необходимого значения деформации 0,357 или больше.
На фиг. 6 показана зависимость истинных напряжений от истинной деформации для клипс, подвергнутых четырем типам отжига (один час, два часа, четыре часа или восемь часов) при 400°C, причем клипсы изготовлены из магниевого сплава № 1 (пример A). На основе кривых на фиг. 6 видно, что зависимости истинного напряжения от истинной деформации иногда улучшаются, а иногда ухудшаются, когда отжиг проводится в течение восьми часов в клипсе, приготовленной из магниевого сплава № 1 (пример A). Полагают, что закрепляющий эффект растворенных атомов на границы кристаллических зерен ухудшается, и кристаллическая структура имеет тенденцию к частичному укрупнению, когда время отжига составляет восемь часов, в связи с малой концентрацией основных растворенных атомов, которыми являются кальций и цинк, в материале магниевого сплава № 1. Это позволяет предположить, что имеется вероятность того, что необходимое значение не будет достигнуто при длительном времени отжига, когда мала концентрация растворенных атомов. В свою очередь, это подтверждает существование оптимального диапазона времени выдержки для отжига.
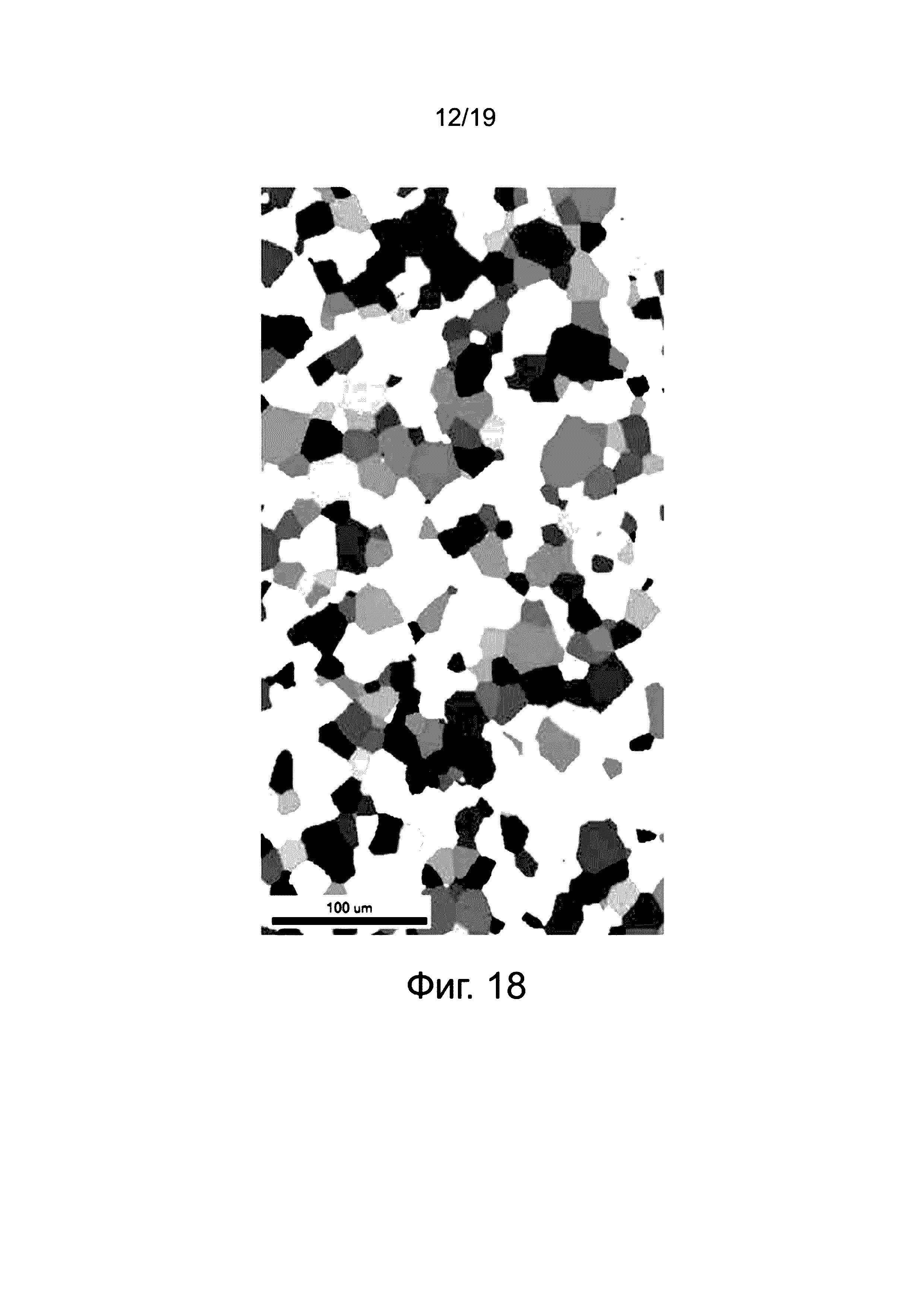
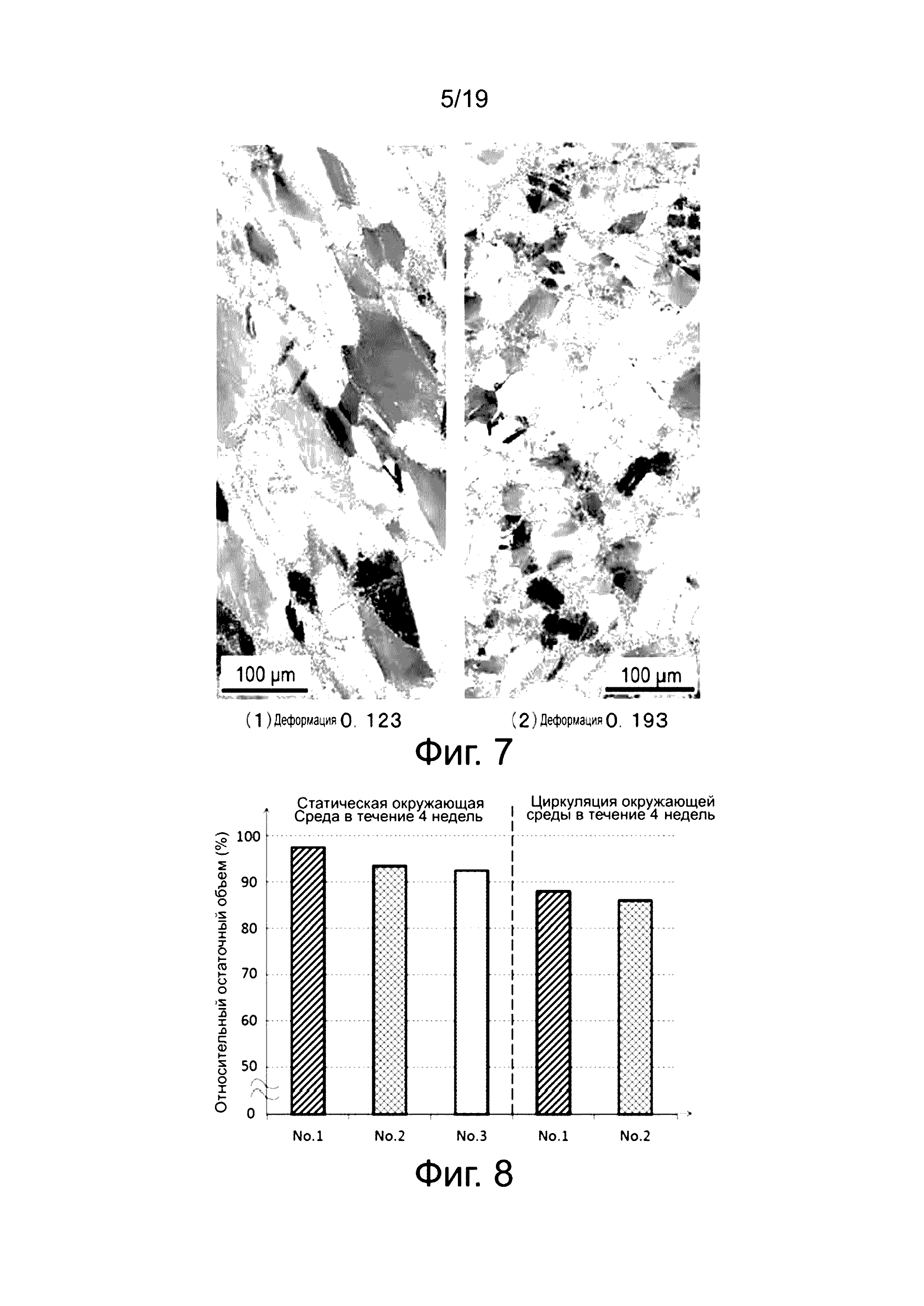
Здесь будет объяснена структура кристаллического зерна материала, который не разрушается, даже когда возникает деформация равная 0,357 или больше. Фиг. 13 (1)-(3), соответственно относятся к магниевому сплаву № 1 (пример A) и демонстрируют микрофотографии структуры кристаллического зерна для клипс, отожженных в течение восьми часов при температуре 350°C, два часа при 400°C, и один час при 450°C. Клипсы, отожженные в течение восьми часов при 350°C, два часа при 400°C, и один час при 450°C не разрушаются, даже когда возникает деформация равная 0,357 или больше, как показано на фиг. 4 и фиг. 6 (см. фиг. 4 для восьми часов при 350°C, фиг. 6 в течение двух часов при 400°C и фиг. 4 в течение одного часа при 450°C). Микрофотографии структуры кристаллического зерна на фиг. 13 (1)-(3) позволяют подтвердить, что размер кристаллического зерна в отожженных клипсах составляет около 20 мкм для небольших зерен и приблизительно 250 мкм для больших зерен.
На фиг. 21 показана зависимость истинных напряжений от истинной деформации для клипс, подвергнутых четырем типам отжига (один час, два часа, четыре часа, или восемь часов) при 400°C, причем клипсы содержат магниевый сплав № 2 (пример B). Кривые на фиг. 21 подтверждают, что характеристики «истинного напряжения - истинной деформации» иногда улучшаются, а иногда ухудшаются, когда отжиг проводится в течение четырех часов или восьми часов в клипсе, приготовленной из магниевого сплава № 2 (пример B), однако характеристики истинной деформации улучшаются, когда отжиг проводится в течение одного часа или двух часов. Это позволяет предположить, что имеется оптимальный диапазон времени выдержки для отжига клипс, содержащих магниевый сплав № 2 (пример B).
На фиг. 22 показана зависимость истинных напряжений от истинной деформации для клипс, подвергнутых четырем типам отжига (один час, два часа, четыре часа, или восемь часов) при 400°C, причем клипсы содержат магниевый сплав № 3 (пример C). Кривые на фиг. 22 подтверждают, что характеристики «истинного напряжения - истинной деформации» иногда улучшаются, а иногда ухудшаются, когда отжиг проводится в течение четырех часов и восьми часов для клипс, содержащих магниевый сплав № 3 (пример C), однако характеристики истинного напряжения-истинной деформации улучшаются, когда отжиг проводится в течение одного часа или двух часов. Это позволяет предположить, что имеется оптимальный диапазон времени выдержки для отжига клипс, содержащих магниевый сплав № 3 (пример C).
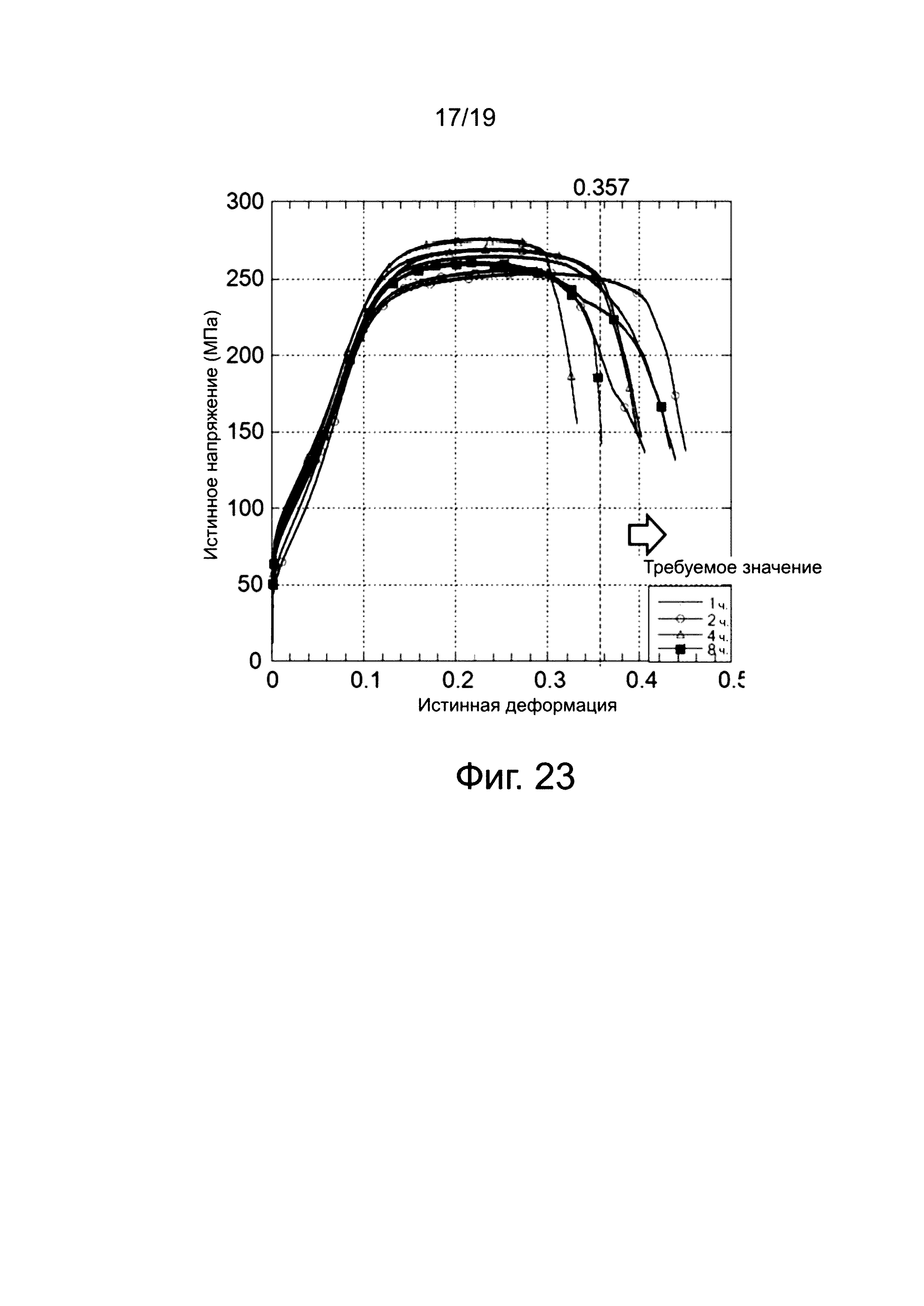
На фиг. 23 показана зависимость истинных напряжений от истинной деформации клипс, подвергнутых пяти типам отжига (один час, два часа, три часа, четыре часа, или восемь часов) при 400°C, причем клипсы содержат магниевый сплав № 4 (пример D). Кривые на фиг. 23 подтверждают, что характеристики «истинного напряжения - истинной деформации» улучшаются, когда отжиг проводится в течение трех часов для клипс, содержащих магниевый сплав № 4 (пример D). Кроме того, подтверждается, что характеристики «истинного напряжения - истинной деформации» иногда улучшаются, а иногда ухудшаются, когда отжиг проводится в течение четырех часов. Однако подтверждается, что для клипс, отожженных в течение одного часа, двух часов, и восьми часов, отсутствует воспроизводимость данных для получения необходимого значения деформации 0,357 или больше. Это позволяет предположить, что имеется оптимальный диапазон времени выдержки для отжига клипс, выполненных из магниевого сплава № 4 (пример D).
Далее будут объяснены результаты, полученные с использованием электронного луча в сочетании со сканирующим электронным микроскопом (СЭМ), при проведении анализа ориентации кристаллов с использованием метода EBSD, что позволяет определить ориентацию кристаллов и кристаллическую систему, и выяснить характеристики пластической деформации.
На фиг. 7 (1) и (2) показаны результаты анализа ориентации кристаллов в отожженных цилиндрических образцах для испытаний. На фиг. 7 (1) показана структура кристаллического зерна внутри регенерированного сжатого образца для испытаний, когда нагрузка удалена после сжатия магниевого сплава (№ 1: пример A) до истинной деформации 0,123. На фиг. 7 (2) показана структура кристаллического зерна внутри регенерированного сжатого образца для испытаний, когда нагрузка удалена после сжатия цилиндрического образца для испытаний, изготовленного из магниевого сплава (№ 1: пример A) до истинной деформации 0,193. "Характеристика (кривая) номинальное напряжение (σn)- номинальная деформация (εn)" определяется из зависимости (кривая) "нагрузка-перемещение", полученной путем испытания на сжатие цилиндрического образца для испытаний в соответствующих условиях, причем значение деформации структуры кристаллического зерна рассчитывается по "зависимости (кривой) истинное напряжение (σt=σn(1-εn)) - истинная деформация (εt=-ln(1-εn))". Здесь номинальное напряжение представляет собой нагрузку, отнесенную на исходную площадь поперечного сечения, и номинальная деформация означает (высоту исходного образца для испытаний - (минус) высота после деформации), разделенную на высоту исходного образца для испытаний.
Границы, имеющие разориентацию несколько градусов, подтверждаются через каждые несколько микрон внутри кристаллических зерен магниевого сплава в сжатом образце, соответствующем закрытому состоянию клипсы, показанному на фиг. 7 (2), то есть, во время деформации. Таким образом, понятно, что деформация, накопленная в связи с изменением формы, динамически восстанавливается, благодаря образованию субзерен, причем устраняется образование трещин (микроскопические трещины) из-за концентрации напряжения путем возникновения “динамического восстановления,” и это вносит вклад в улучшение пластичности.
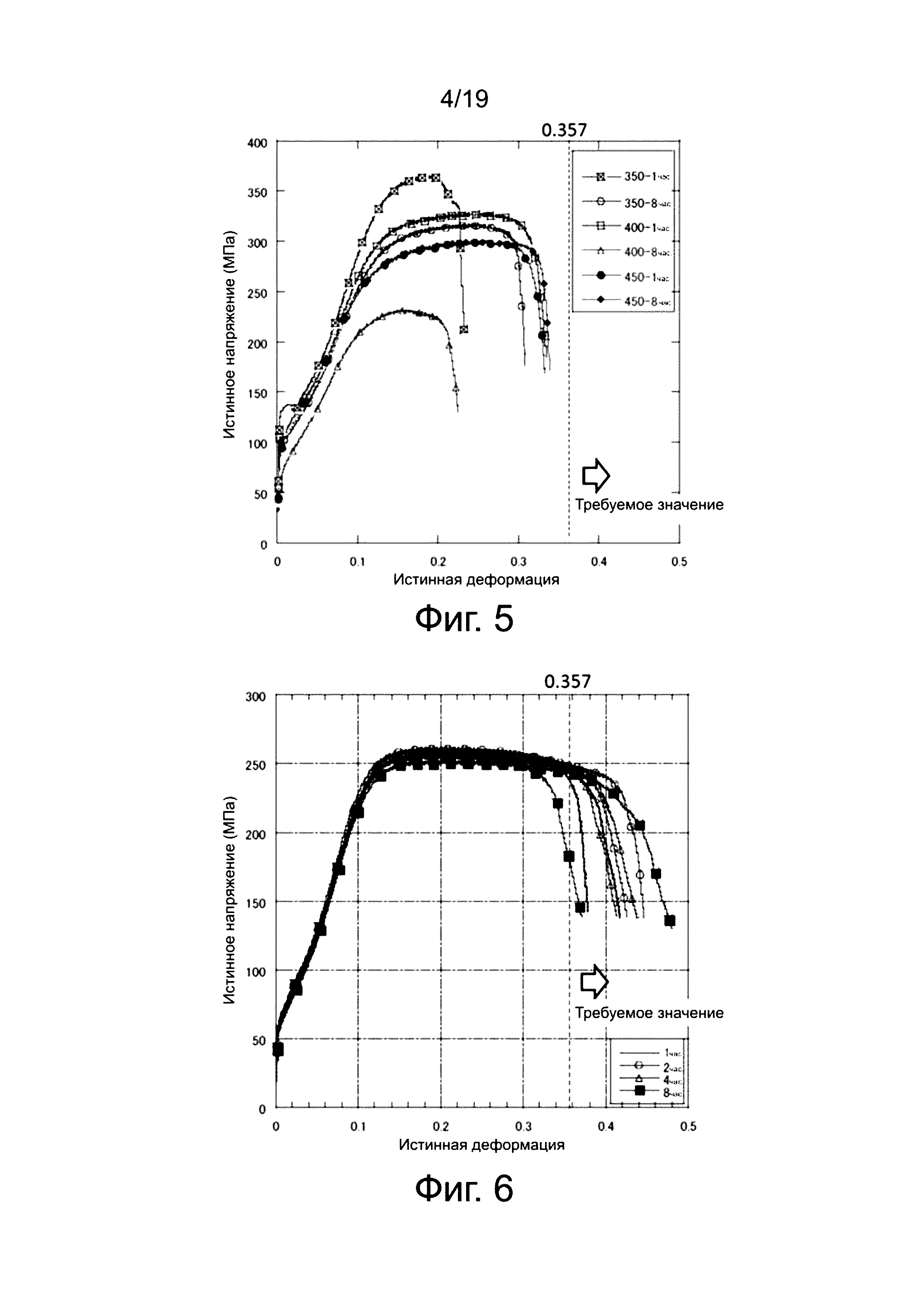
На фиг. 8 показана диаграмма способности к биологическому разложению отожженных клипс. Эти результаты получены в испытаниях in vitro, проведенных путем погружения на определенное время в раствор, моделирующий биологическую жидкость (E-MEM: 10% телячьей сыворотки крови, концентрация CO2: 5%, 37°C).
Левая сторона диаграммы на фиг. 8 относится к магниевым сплавам № 1 - № 3 и показывает относительный остаточный объем клипсы, когда создается окружающая среда, аналогичная среде в организме, и слева полученная клипса находится в статической окружающей среде в течение 4 недель. Правая сторона диаграммы относится к магниевым сплавам № 1 и № 2 и показывает относительный остаточный объем клипсы, когда создается флюид циркулирующей среды, аналогичной среде в организме, и полученную клипсу выдерживают в течение четырех недель в описанном выше слабом противоточном растворе, то есть дают выдержку в течение четырех недель в циркулирующей среде. В изобретении принимается, что относительный остаточный объем представляет собой отношение, определяемое как результат деления остаточного объема магниевого сплава, рассчитанный из изображений КT исследования, на объем до погружения.
Из диаграммы на фиг. 8 понятно, что все относительные остаточные объемы клипс после 4 недель в статической окружающей среде составляют 90% или больше, все относительные остаточные объемы клипс после 4 недель в циркулирующей среде составляют 85% или больше, причем степени биоразложения являются подходящими для устройств для фиксации мягкой биологической ткани. Кроме того, поскольку относительный остаточный объем возрастает в ряду: магниевый сплав № 1 (пример A), № 2 (пример B), № 3 (пример C), в соответствии с описанным выше методом испытания in vitro, с погружением на определенное время в раствор, моделирующий жидкость в организме, предполагается, что степень биоразложения уменьшается в указанной последовательности. Из этих данных также понятно, что степень биоразложения можно регулировать, варьируя концентрации Ca и Zn.
Как описано выше, устройства с использованием магниевых сплавов № 1 - № 3 были признаны пригодными в качестве устройств для фиксации мягкой биологической ткани.
Пример 2
Способность к биологическому разложению и безопасность полученных устройств для фиксации мягкой биологической ткани подтверждена в примере 2. Объяснение приведено ниже.
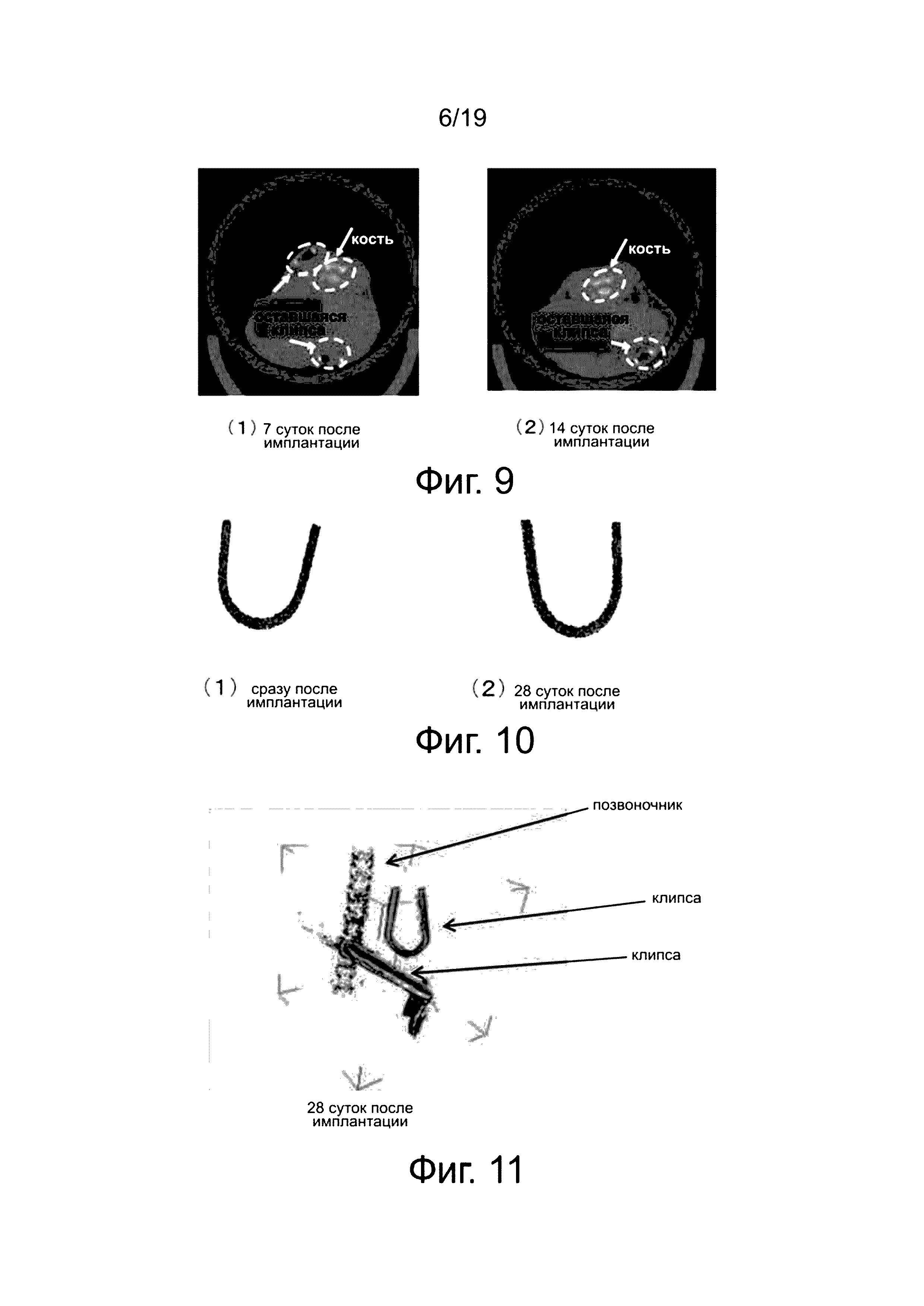
На фиг. 9 и фиг. 10 показаны компьютерные томограммы КТ рентгеновского излучения для U-образных устройств для фиксации мягкой биологической ткани, полученных таким же образом, как в примере 1, то есть, путем отжига, после имплантации в организм мыши.
Устройство для фиксации биологической ткани сохраняет свою U-форму через 7, 14 и 28 после имплантации, что подтверждается на основе данных компьютерной томограммы рентгеновского излучения.
На фиг. 9 (1) показано изображение через семь суток после имплантации в тело мыши. На фиг. 9 (2) показано изображение через 14 суток после имплантации. В обоих случаях изменения объема пространства сразу после имплантации были незначительными. Поэтому предполагается, что количество выделившегося газа будет малым, и не будет наблюдаться быстрое выделение газа.
Фиг. 10 (1) является реконструкцией изображения томограммы КТ рентгеновского излучения сразу после имплантации в тело мыши. Фиг. 10 (2) представляет собой реконструкцию изображения томограммы КТ рентгеновского излучения через 28 суток после имплантации мыши. Хотя уменьшение объема из-за равномерного разложения обнаружено спустя 28 суток, предполагается, что восстановленное устройство сохраняет U-образную форму. Таким образом, понятно, что устройство остается в закрепленном состоянии в течение указанного периода, без утраты каких-либо частей. К тому же, на основе КТ рентгеновского излучения или визуального обследования окружающих тканей подтверждается, что отсутствуют поражения тканей во время извлечения устройства.
Способность к биологическому разложению устройства, выполненного из титана (Сравнительный пример 1), и устройства, имеющего высокое содержание цинка (Сравнительный пример 2), будут описаны здесь в качестве сравнительных примеров.
На фиг. 11 показано изображение компьютерной томограммы рентгеновского излучения после имплантации титанового устройства (Сравнительный пример 1) в организме. На фиг. 12 показано изображение компьютерной томограммы рентгеновского излучения после имплантации устройства, имеющего содержание цинка in vivo 6 атом.% (Сравнительный пример 2) .
Предполагается, что титановое устройство (Сравнительный пример 1) сохраняет свою форму без разложения даже через 28 суток после имплантации в тело мыши (смотрите фиг. 11). Хотя на фиг. не показано, титановое устройство (Сравнительный пример 1) оказывает значительное влияние на изображение компьютерной томограммы рентгеновского излучения, и можно сказать, что это затрудняет исследование биологической ткани.
С другой стороны, магниевый сплав, включающий значительное количество (6 атом.%) цинка, выделяет большое количество газа (водород) в сочетании с биологическим разложением, через семь суток, из-за высокой степени биоразложения. На фиг. 12(1) показано изображение компьютерной томограммы рентгеновского излучения через семь суток после имплантации в тело мыши. На фиг. 12(1), имеется темная область пространства, иллюстрирующая очертание накопленного газа, оставшегося после исчезновения устройства, и имеется светлый участок на краях области пространства; что, возможно, подтверждает наличие металлической структуры, которая представляет собой оставшуюся клипсу и кость.
Кроме того, металлическая структура полностью разлагается через 14 суток, превращаясь в соединения, такие как фосфат кальция, фосфат магния, карбонат магния и карбонат кальция, и продукты коррозии устройства, оставшегося в организме мыши. На фиг. 12(2) показано изображение компьютерной томограммы рентгеновского излучения через 14 суток после имплантации в тело мыши. Продукты коррозии трудно распознать, когда они скрыты в мягкой ткани, поскольку их контраст меньше чем у кости, однако часть продуктов коррозии (фосфат кальция, фосфат магния, карбонат магния, карбонат кальция) может быть зарегистрирована на фиг. 12(2).
В отличие от изменений во времени материалов в двух указанных выше Сравнительных примерах 1 и 2, предполагается, что устройство настоящего изобретения для фиксации мягкой биологической ткани обладает характеристиками, которые дают возможность устранить замедленное восстановление ткани, связанное с выделением большого количества газа, обеспечивая закрепление и присоединение в течение требуемого промежутка времени в организме, и является минимально вредным для организма.
Пример 3
Испытание подкожной имплантации в брюшной полости мыши
Сначала будут объяснены результаты исследования, в котором клипсы, полученные таким же образом, как в примере 2 (в последующем называются клипсами настоящего примера), подкожно имплантированы в брюшную полость мыши. Титановые клипсы (Сравнительный пример 1) и клипсы, имеющие содержание цинка 6 атом.% (Сравнительный пример 2), были также испытаны путем подкожной имплантации в брюшную полость мыши, таким же образом, как в сравнительных примерах.
Хотя при внешнем обследовании клипс варианта осуществления или титановой клипсы (Сравнительный пример 1) через одну неделю после имплантации не наблюдается увеличение пространства, вызванного выделением газа, для клипсы Сравнительного примера 2, имеющего высокое содержание Zn, наблюдается значительное увеличение пространства. По-видимому, клипса Сравнительного примера 2, имеющая высокое содержание Zn, выделяет значительное количество газа (водород) в связи с биологическим разложением, спустя одну неделю, из-за высокой степени биоразложения.
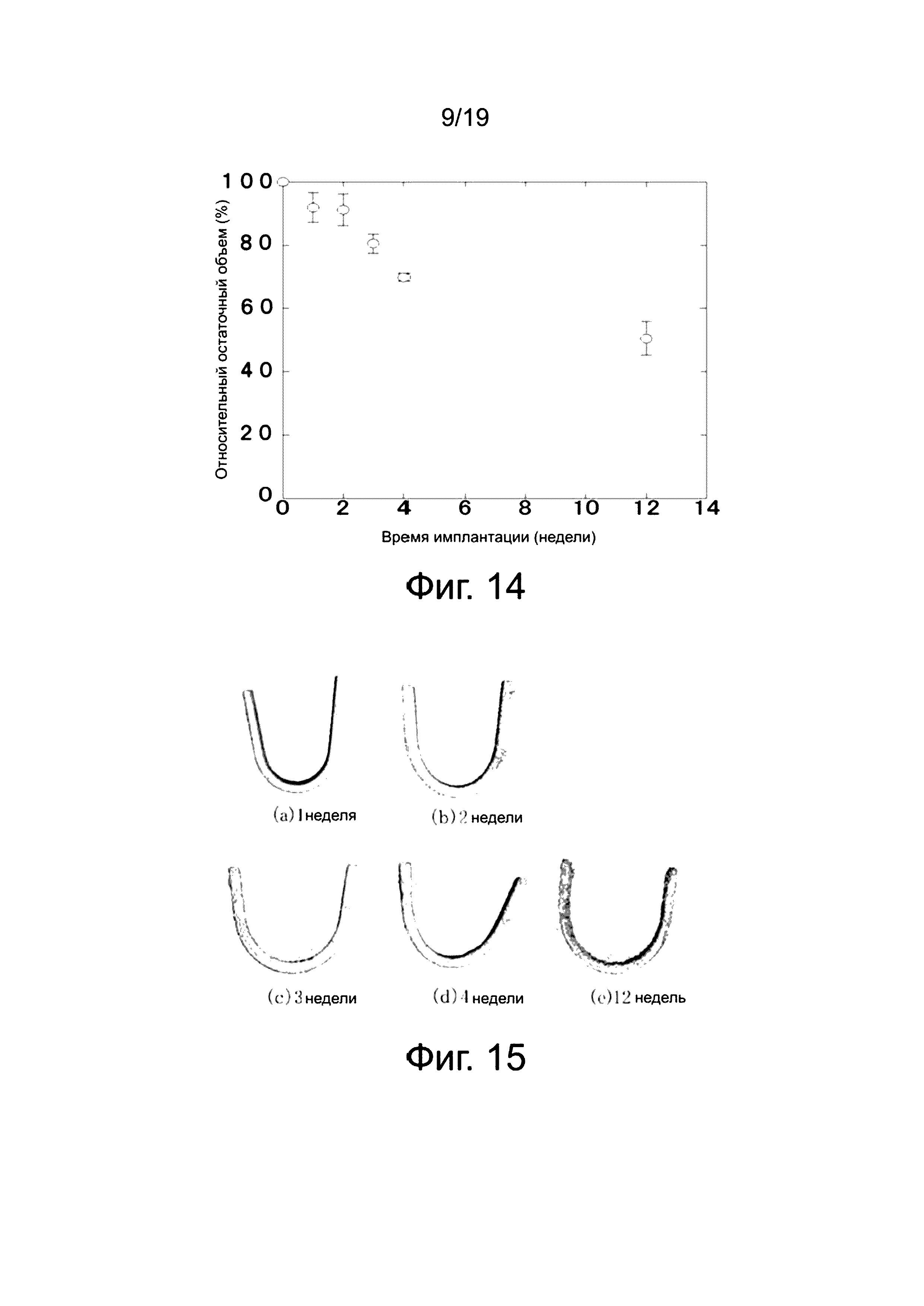
На фиг. 14 показано влияние времени имплантации на относительный остаточный объем клипс вариант осуществления изобретения. При построении графика были использованы средние значения объема для трех испытуемых мышей. Как показано на фиг. 14, объем клипс согласно изобретению уменьшается со временем нахождения в организме мыши, и достигает 70% за 1 месяц (четыре недели) после имплантации и 50% за 3 месяца (12 недель) после имплантации.
На фиг. 15 (a)-(e), соответственно, показаны реконструкции изображения компьютерной томограммы CT рентгеновского излучения клипс изобретения через одну неделю, две недели, три недели, четыре недели, и 12 недель после имплантации в тело мыши. Данные фиг. 15 подтверждают, что клипсы изобретения сохраняют свою форму во время имплантации после 12 недель.
Далее показаны результаты, полученные при измерении концентрации ионов Mg и тому подобных в организме через 12 недель после имплантации. Измеряемые показатели приведены ниже в Таблице 2. Данные сывороточной пробы также проанализированы статистически. К тому же, при статистическом анализе предположено, что данные имеют нормальное распределение, дисперсия подтверждена F-критерием, причем данные с равной дисперсией были последовательно проанализированы с использованием t-критерия Стьюдента, и данные с неодинаковой дисперсией были проанализированы с помощью t-критерия Уэлча. Уровень значимости во всех анализах установлен как p<0,05.
Таблица 2
|
* IU/L = Международная единица/л
На фиг. 16 показаны диаграммы результатов измерений концентрации ионов магния в крови и т.д. в организме вплоть до 12 недель после имплантации. На каждой диаграмме фиг. 16 (1)-(5) приведены численные значения концентраций Mg, CRE, AST, ALP и ALT через одну неделю, две недели, три недели, четыре недели и 12 недель для полученных клипс (согласно изобретению), титановых клипс (Сравнительный пример 1) и клипс, имеющих высокое содержание Zn (Сравнительный пример 2), соответственно. В диаграммах, данные после истечения заданного диапазона времени расположены в трех столбиках слева направо по порядку: Сравнительный пример 1, Сравнительный пример 2, вариант изобретения. В крайнем правом столбике на каждой диаграмме приведены численные значения, полученные спустя четыре недели для обычных мышей, не подвергнутых лапароскопии или имплантации, в качестве контроля. К тому же, данные на диаграммах являются средними значениями для трех мышей.
Тот факт, что в результатах, полученных путем измерения концентрации Mg в крови, вплоть до 12 недель после имплантации, не обнаружено значительное увеличение концентрации, дает возможность подтвердить, что элюируемые ионы выводятся из организма наружу.
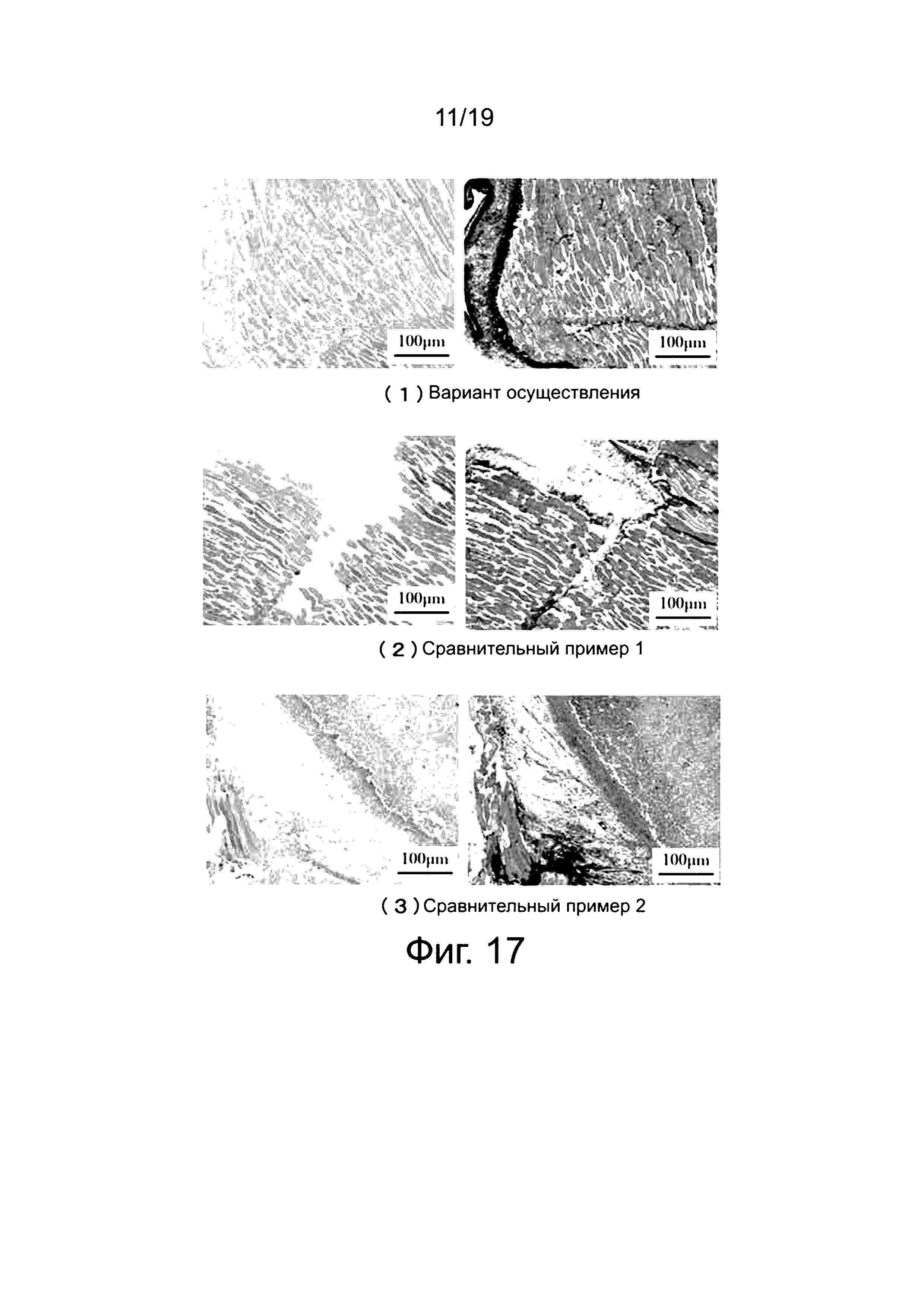
На фиг. 17 приведены результаты исследования окружающих клеток и тканей через две недели после имплантации. На фиг. 17 (1)-(3) показаны результаты, полученные путем окрашивания клеток и тканей, окружающих полученную имплантированную клипсу (согласно изобретению), титановую клипсу (Сравнительный пример 1) и клипсу, имеющую высокое содержание Zn (Сравнительный пример 2), с помощью гематоксилин-эозинового красителя (краситель HE) и SR красителя (Сириус красный) (изображения слева получены с HE красителем; изображения справа - с SR красителем).
Поскольку воспалительная реакция отсутствует, и окружающие клетки и ткани являются нормальными, на основе обследования клеток и тканей, окружающих полученную имплантированную клипсу (изобретения), и клеток и тканей, окружающих имплантированную титановую клипсу (Сравнительный пример 1), подтверждается, что клипса согласно изобретению является биологически безопасной. С другой стороны, не наблюдается волокнистая морфология, межклеточный субстрат (стенки клеток) разрушен, в клетках не образуются ядра, и ткань выглядит некротической при обследовании клеток и тканей, окружающих имплантированную клипсу, имеющую высокое содержание Zn (Сравнительный пример 2).
Пример 4
Испытание сосудистого анастомоза с использованием крыс
Пример 4 подтверждает способность к биологическому разложению и безопасность клипс, которые в отличие от клипс, полученных по способам примеров 2 и 3, получены путем повышения температуры горячего прессованию и замедления скорости горячего прессования на стадии горячего прессования, чтобы слиток подвергался воздействию высокотемпературной обработки в течение нескольких десятков секунд сразу после прессования и проведению отжига сразу после стадии горячего прессования. Ниже следует объяснение.
Клипсы примера 4 имеют содержание Zn и Ca в магниевом сплаве № 1, указанном выше в Таблице 1 примера 1. Конкретно, добавляют 0,1 атом.% Ca и 0,21 атом.% Zn относительно 99,69 атом.% магния, и получают слиток путем плавления и разливки, и слиток подвергают гомогенизирующей термической обработке. После термической обработки слитки подвергают на первом этапе горячему прессованию при 350°C, и из слитка диаметром 90 мм получают слиток диаметром 22 мм. Этот диаметр доводят до 20 мм путем обработки резанием слитка 22 мм. Слиток подвергают на втором этапе горячему прессованию при 410°C, и перерабатывают в V-форму в поперечном сечении. Отжиг путем выдерживания при 400-410°C проводится сразу после второго этапа горячего прессования. В последующем с поверхности клипсы удаляют примеси, включающие оксиды.
На фиг. 18 показаны результаты, полученные под действием электронного луча в сочетании со сканирующим электронным микроскопом (СЭМ) и осуществлении анализа ориентации кристаллов в клипсах, полученных с использованием метода EBSD, позволяющего определить микроориентацию кристаллов и кристаллическую систему. Результаты анализа ориентации кристаллов, приведенные на фиг. 18, подтверждают, что полученная кристаллическая структура клипсы является равноосной структурой кристаллических зерен. Кроме того, с использованием метода линейной секущей определен средний размер кристаллического зерна кристаллической структуры полученных кпипс, равный 28,8 (мкм) вблизи точки минимума V-формы клипсы и 31,5 (мкм) вблизи вершины V-формы.
Установлено, что полученные клипсы имеют равноосную структуру кристаллических зерен, имеющих средний размер кристаллического зерна приблизительно 30 (мкм). Эти клипсы обладают отличной деформируемостью в закрытой V-форме, поскольку, как разъясняется на фиг. 7, границы, имеющие разориентацию в несколько градусов, появляются внутри кристаллических зерен через каждые несколько микрон (образуются субзерна), динамически восстанавливается деформация, накопленная в связи с состоянием измененой формы, и предотвращается образование трещин из-за концентрации напряжения (релаксация концентрации напряжения).
Затем будут объяснены результаты, полученные путем анастомоза кровеносного сосуда, соединенного с участком печени крысы и желчным протоком с использованием полученных клипс. Брюшная полость крысы была вскрыта, кровеносные сосуды участка печени и желчного протока были расположены рядом и анастомозированы путем перекрывания клипсы V-формы. В последующем была проведена резекция печени.
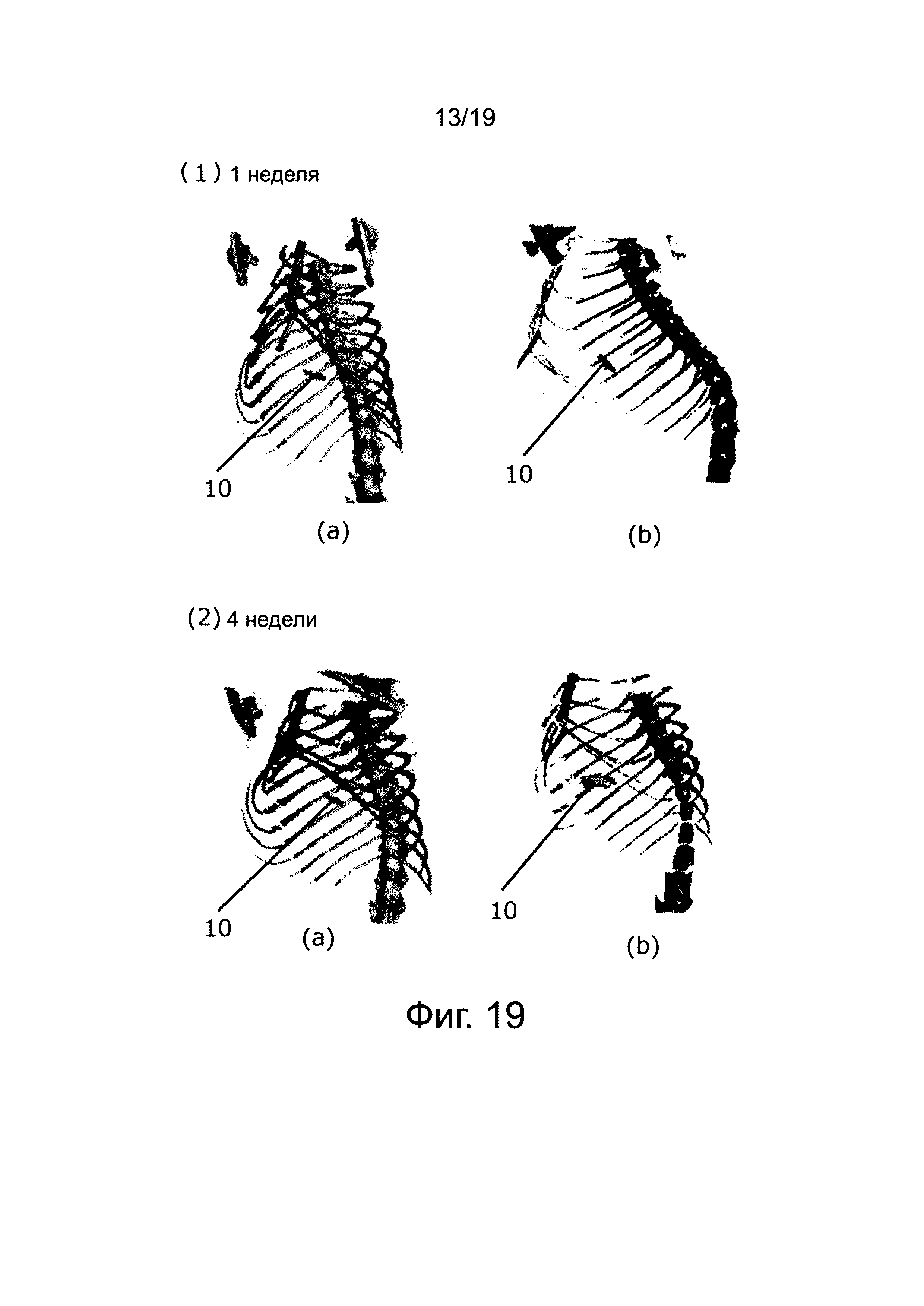
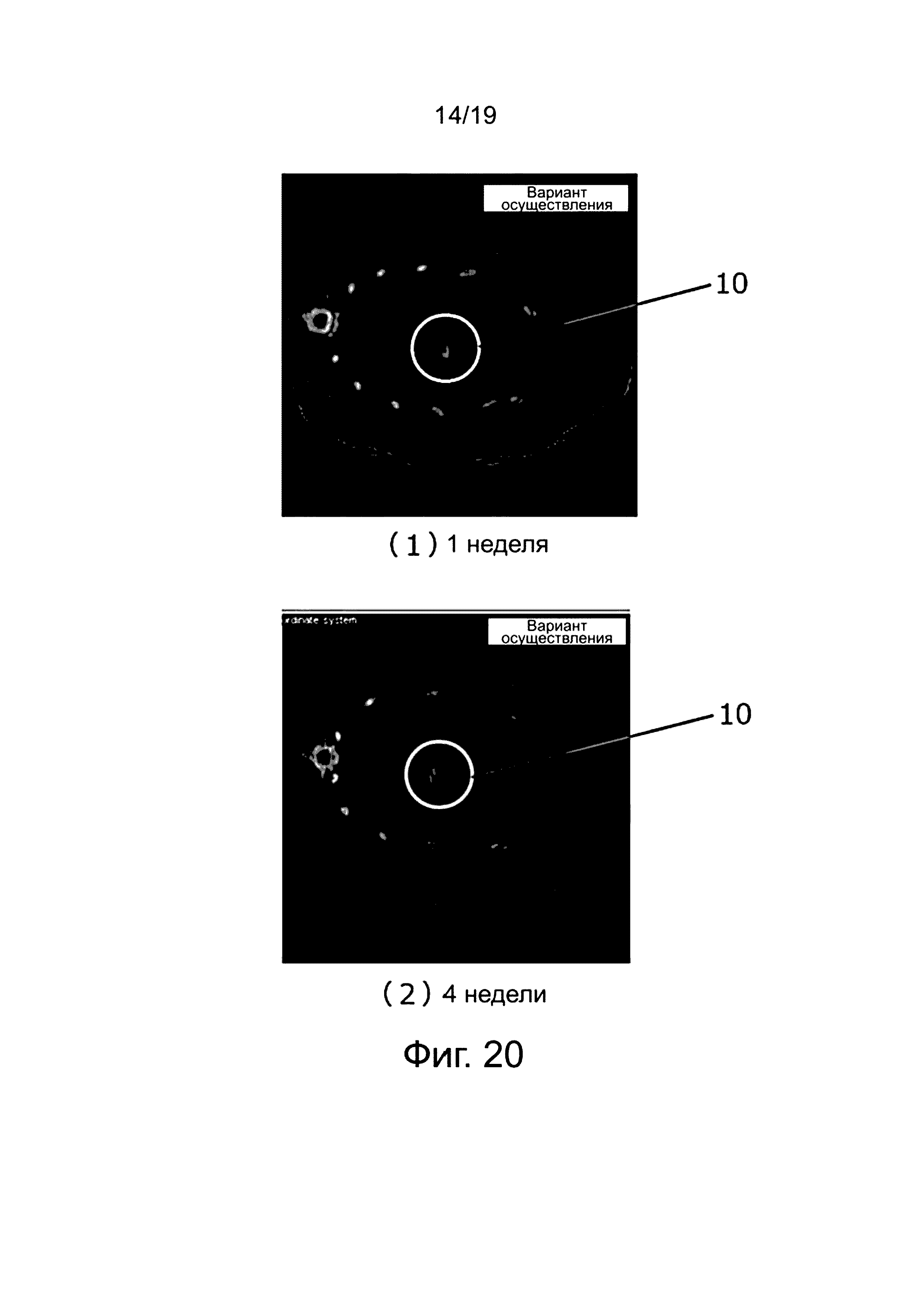
На фиг. 19 показаны реконструированные изображения компьютерной томограммы рентгеновского излучения грудной клетки крысы через одну неделю и четыре недели (один месяц) после резекции. На фиг. 19 (1) показаны реконструированные изображения через одну неделю после резекции и (2) через четыре недели (один месяц) после резекции. На фиг. 19 (1) и (2), (a) анастомоз осуществлен с помощью клипсы изобретения и (b) с помощью клипсы из Сравнительного примера 1.
Из фиг. 19 можно сделать вывод, что ожидаемое закрепление клипсы сохраняется, так как крысы продолжали жить даже через четыре недели после резекции печени, то есть после пересечения кровеносного сосуда и желчного протока, и на компьютерной томограмме рентгеновского излучения не обнаружено образование большого количества газа или открытие клипсы.
Кроме того, ожидается, что клипса окончательно разрушится и будет выводиться из организма после закрепления в течение определенного периода времени, поскольку разрушение происходит равномерно в организме крысы. Это подтверждает вероятность реализации безопасного биологического разложения клипсы.
На фиг. 20 показана компьютерная томограмма рентгеновского излучения крысы. Фиг. 20 (1) представляет собой изображение компьютерной томограммы рентгеновского излучения через одну неделю после резекции (2), через четыре недели (один месяц) после резекции. На обеих фиг. 20(1) и (2) показан анастомоз с использованием клипсы изобретения. Полагают, что для клипсы изобретения вероятность образования металлических артефактов во время компьютерной томограммы рентгеновского излучения, меньше, чем при использовании традиционной титановой клипсы, что позволяет ясно обследовать биологическую ткань без коррекции изображения.
Применимость в промышленности
Устройство настоящего изобретения для фиксации мягкой биологической ткани является пригодным для хирургических клипс, скоб и тому подобном, поскольку оно может поддерживать соединение тканей в течение 2-8 недель, позволяет сшивать мягкую биологическую ткань и выводится из организма после полного разрушения приблизительно в течение одного года.