Результат интеллектуальной деятельности: ИММУНОГЕННЫЕ КОМПОЗИЦИИ КОРОНАВИРУСА БЛИЖНЕВОСТОЧНОГО РЕСПИРАТОРНОГО СИНДРОМА (MERS-COV) И СПОСОБЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет преимущество на основании предварительной заявки США с регистрационным №61/880111, поданной 19 сентября 2013 года, которая включена в данный документ посредством ссылки во всей своей полноте для всех целей.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0002] Содержание текстового файла, поданного в электронном виде с данным документом, включено в данный документ посредством ссылки во всей полноте: Копия перечня последовательностей в машиночитаемом формате (имя файла: NOVV-056/01WO_Seqlist.txt, данные записаны: 18 сентября 2014 года, размер файла 17384 мегабайт).
УРОВЕНЬ ТЕХНИКИ
[0003] Коронавирусы могут вызывать заболевание у животных, например, у человека. SARS (тяжелый острый респираторный синдром) является одним из примеров такого заболевания. Не так давно появился новый коронавирус, коронавирус ближневосточного респираторного синдрома (MERS-CoV), который ассоциирован с летальными исходами у людей. MERS-CoV был идентифицирован Всемирной организацией здравоохранения (WHO) как "угроза для глобального здравоохранения", и он был зарегистрирован в 21 стране Ближнего Востока и Европы. MERS-CoV представляет собой высокопатогенный респираторный вирус, который вызывает тяжелый респираторный дистресс и, возможно, почечную недостаточность у инфицированных лиц [1, 2].
[0004] Коронавирусы прикрепляются к мембране клеток посредством взаимодействия гликопротеинов Spike (S), на поверхности вириона с родственным им рецептором на клетках-хозяевах (например, дипептидилпептидаза 4 (DPP4), обнаруженная на разных клетках человека, включая клетки легких и почек). Гликопротеин S состоит из N-концевого домена S1, который содержит рецептор-связывающий домен (RBD), и домена S2, ответственного за слияние вируса с клеткой. RBD MERS-CoV состоит из корового домена, который был совместно кристаллизован с белком DPP4 человека, демонстрируя, что тот взаимодействует с лопастями 4 и 5 из DPP4 [11]. В других коронавирусах, включая SARS-CoV, антитела к RBD способны нейтрализовывать и подавлять рост вируса in vitro [12-14]. На мышиных моделях SARS-CoV индуцированные вакциной и пассивно перенесенные нейтрализующие антитела оказались эффективными в отношении подавления патогенеза в легких и гибели [15]. Вместе с тем, об антителозависимом усилении (ADE) в иммунных клетках человека сообщали для SARS CoV in vitro, хотя его клиническая значимость in vivo неизвестна.
[0005] Плазму и/или иммуноглобулин людей-реконвалесцентов эффективно использовали для профилактики и лечения многих инфекций, вызываемых вирусами [16]. Система здравоохранения Великобритании и Международный консорциум тяжелых острых респираторных и острых инфекций (International Severe Acute Respiratory & Emerging Infection Consortium (ISARIC)) определили пассивную иммунотерапию нейтрализующими антителами (включая плазму реконвалесцентов) как подход к лечению MERS-CoV, который является приоритетным в исследовании. Однако получение больших количеств противопатогенной плазмы человека и/или иммуноглобулина с антителами с высокой аффинностью и авидностью в настоящее время требует пожертвований от выздоравливающих лиц, что может ограничить широкую доступность этих полученных от человека продуктов по ряду культурных, инфраструктурных и материально-технических причин. Необходимы альтернативные средства для быстрого получения специфического человеческого поликлонального иммуноглобулина для предупреждения и лечения заболеваний, вызываемых инфекционными агентами, в том числе MERS-CoV.
КРАТКОЕ ОПИСАНИЕ
[0006] В данном документе раскрыты композиции и способы для стимулирования иммунных ответов в отношении инфицирования коронавирусом (CoV), который вызывает ближневосточный респираторный синдром (MERS-CoV). Настоящее раскрытие предусматривает композиции, которые являются иммуногенными и обеспечивают защиту от инфекции, вызываемой MERS-CoV. Преимущественно композиции индуцируют выработку нейтрализующих антител к MERS-CoV и могут использоваться в качестве вакцин.
[0007] Настоящее раскрытие также предусматривает способ индуцирования устойчивого иммунитета к вирусной инфекции у животного, восприимчивого к MERS-CoV, включающий введение по меньшей мере одной эффективной дозы вакцины, содержащей наночастицу MERS-CoV. В одном варианте осуществления указанный способ включает введение животному указанной наночастицы перорально, внутрикожно, интраназально, внутримышечно, внутрибрюшинно, внутривенно или подкожно.
[0008] В различных аспектах наночастица содержит только один тип белка MERS-CoV. В конкретных аспектах этот единственный белок представляет собой белок Spike (S).
[0009] В одном из аспектов настоящее раскрытие предусматривает иммуногенную композицию, содержащую наночастицу MERS-CoV, где наночастица содержит по меньшей мере один тример полипептида Spike. В другом варианте осуществления наночастица содержит по меньшей мере от приблизительно пяти тримеров до приблизительно 30 тримеров полипептида шиловидного отростка. В другом варианте осуществления наночастица содержит по меньшей мере от приблизительно десяти тримеров до приблизительно 20 тримеров полипептида Spike. В одном варианте осуществления концентрация наночастицы составляет по меньшей мере от приблизительно 20 мкг/мл до приблизительно 60 мкг/мл. В другом варианте осуществления концентрация наночастицы составляет по меньшей мере от приблизительно 30 мкг/мл до приблизительно 50 мкг/мл. В еще одном варианте осуществления полипептид Spike содержит SEQ ID NO: 2. В еще одном дополнительном варианте осуществления полипептид Spike состоит из SEQ ID NO: 2.
[0010] В еще одном аспекте настоящее раскрытие предусматривает способ получения высокоаффинного антитела, включающий введение животному иммуногенной композиции, содержащей наночастицу MERS-CoV, где наночастица содержит по меньшей мере один тример полипептида Spike, отбор у животного сыворотки и/или плазмы и очистку антитела от сыворотки и/или плазмы. В одном варианте осуществления способ дополнительно включает введение адъюванта. В еще одном варианте осуществления адъювант выбран из группы, включающей Montanide ISA 206, Quil А, алюмокалиевые квасцы, адъювант Фрейнда, неполный адъювант Фрейнда и адъюванты на основе гидроксида алюминия. В одном варианте осуществления животное представляет собой корову или лошадь. В дополнительном варианте осуществления животное, представляющее собой корову или лошадь, является транс генным животным.
[0011] В одном варианте осуществления антитело, полученное путем иммунизации животного наночастицей, имеет KD от 10-8 до 10-15. В еще одном варианте осуществления антитело имеет KD от приблизительно 10-12 до приблизительно 10-14 или от приблизительно 10-13 до приблизительно 10-14.
[0012] В еще одном аспекте настоящее раскрытие включает дополнительное введение субъекту-человеку очищенного высокоаффинного антитела, полученного с помощью способа по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013] На фиг. 1 изображена структура коронавируса.
[0014] На фиг. 2 изображены частицы вакцины, полученные при помощи выполнения способов, раскрытых в данном документе.
[0015] На фиг. 3 изображено связывание антитела с VLP-наночастицами MERS CoV и VLP-наночастицами SARS CoV, раскрытых в данном документе, антитела к MERS и антитела к SARS, соответственно.
[0016] На фиг. 4 проиллюстрированы электронные микрофотографии VLP-наночастиц MERS CoV и VLP-наночастиц SARS CoV, раскрытых в данном документе.
[0017] На фиг. 5 проиллюстрирован протокол иммунизации для VLP-наночастиц MERS CoV и VLP-наночастиц SARS CoV, раскрытых в данном документе, в различные периоды времени, в различных дозах и с наличием или в отсутствие адъюванта.
[0018] На фиг. 6 проиллюстрированы частицы вакцины, полученные путем выполнения способов, раскрытых в данном документе. Белки Spike MERS показаны собранными в тример из белок-белковых мицелл размером 26 нм.
[0019] На фиг. 7 проиллюстрированы результаты нейтрализации после иммунизации мышей с использованием VLP MERS CoV и VLP-наночастиц SARS CoV, раскрытых в данном документе. Адъювант Matrix М является особенно эффективным.
[0020] На фиг. 8 проиллюстрирована кодон-оптимизированная нуклеотидная последовательность Spike MERS CoV.
[0021] На фиг. 9 проиллюстрирована аминокислотная последовательность Spike MERS CoV.
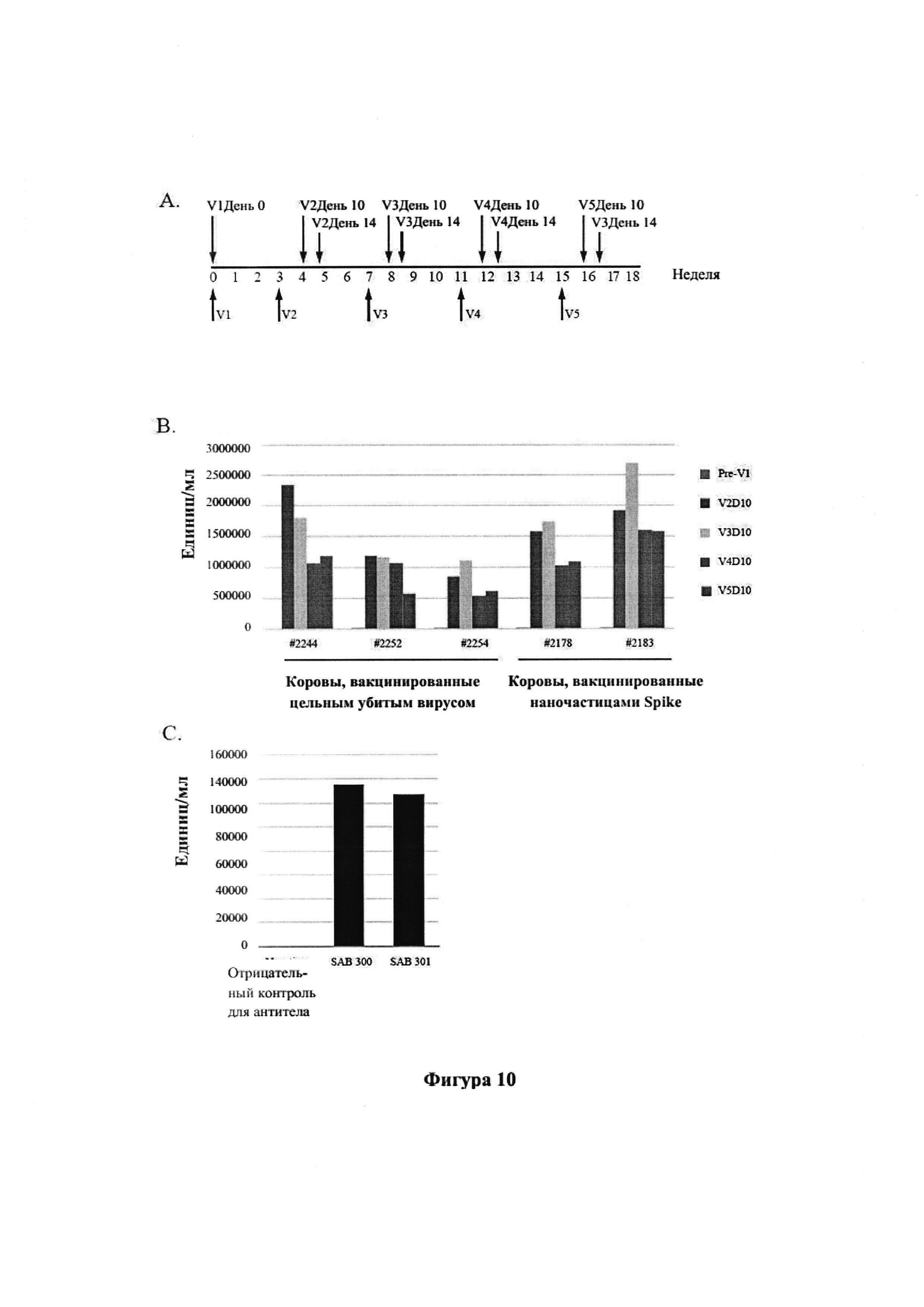
[0022] На фиг. 10А-С показано продуцирование антитела, специфического к Spike MERS, и титры ELISA. На панели А показана методика вакцинации (v означает номер вакцинации; например, v1 обозначает первую вакцинацию, v2 обозначает вторую вакцинацию и т.д.). На панели В показаны титры антител к рекомбинантному белку Spike MERS-CoV в образцах сыворотки отдельных Tc-животных на протяжении периода иммунизации, измеренные с помощью ELISA. Величина титра (единиц/мл) определяется как наибольшее разведение образца сыворотки, где показатель OD450 был в 2,5 раза выше, чем для пустого. На панели С показаны титры антител к рекомбинантному белку Spike MRS-CoV в SAB-300 и SAB-301. Величина активности титра (единиц/мг) определяется как наибольшее разведение 1 мг антитела, где показатель OD450 был в 2,5 раза выше, чем для пустого.
[0023] На фиг. 11А, В показаны результаты анализа нейтрализации со снижением флуоресценции. На панели А показана сыворотка вакцинированных коров, которую испытали в отношении нейтрализации при помощи анализа FRNT50. Масса (мкг) сыворотки, необходимая для 50% подавления обнаруженного MERS-CoV, графически представлена для каждого образца. Инфекцию количественно оценивали после предварительной обработки MERS-CoV разведением сывороток. После инфицирования клетки фиксировали и метили антителом к Spike для количественного определения уровня, при котором только 50% клеток было инфицировано по сравнению с контрольными сыворотками. На панели В показаны результаты анализа FRNT50 для SAB-300 и SAB-301, которые оценивали относительно их способности подавлять инфекцию MERS-CoV в клетках Vero. Аффинно очищенное антигеном кроличье антитело к Spike использовали в качестве положительного контроля в данных анализах FRNT50. Статистические показатели: критерий Стьюдента для одной выборки с коррекцией Уэлша, симулирующей распределение Гаусса. Значимости не обнаружили. Столбики представляют 95% доверительный интервал (CI).
[0024] На фиг. 12А, В показаны анализы нейтрализации MERS-CoV. На панели А показаны SAB-300 и SAB-301, которые тестировали в отношении их способности нейтрализовывать MERS-CoV с помощью анализа TCID50, графически представленного как процент титра вируса по сравнению с очищенным hIgG в качестве отрицательного контроля. Более высокий процент означает меньшее подавление инфекции. На панели В показано антителозависимое усиление для SAB-300 и SAB-301 относительно MERS-CoV. РНК из MERS-CoV, предварительно инкубированного с SAB-300 и SAB-301, в 48 часов после инфицирования оценивали в отношении количества MERS-CoV-специфического транскрипта, и графически представили как кратность изменения по сравнению с контрольными образцами, n.s. означает не значимо.
[0025] На фиг. 13А, В показано подавление репликации MERS-CoV in vivo. SAB-300 (А) или SAB-301 (В) вводили трансдуцированным Ad5-hDPP4 мышам BALB/c (6 недель, самки) внутрибрюшинно за 12 часов до инфицирования MERS-CoV. Затем мышей инфицировали интраназально с использованием 1×105 БОЕ MERS-CoV. Титры вируса в легких измеряли в указанные моменты времени. Титры выражали как БОЕ/г ткани, n=3 мыши/группа/момент времени. *Р<0,05 по сравнению с группой без обработки; Р<0,05 по сравнению с группой с контрольным антителом.
[0026] На фиг. 14 показана кинетика связывания белка S MERS-CoV с полученным от Tc-коров человеческим IgG.
ПОДРОБНОЕ ОПИСАНИЕ
[0027] Следует понимать, что формы единственного числа используются в данной заявке для удобства, однако за исключением того, где контекст или явное утверждение указывает иное, формы единственного числа предназначены для включения множественного числа. Кроме того, следует понимать, что каждая журнальная статья, патент, патентная заявка, публикация и подобные, которые упоминаются в данном документе, тем самым включены посредством ссылки во всей своей полноте и для всех целей. Все числовые диапазоны следует понимать с включением всех и каждой числовой точки в пределах числового диапазона, и их следует интерпретировать как перечисление всех и каждой числовой точки в индивидуальном порядке. Конечные точки всех диапазонов, направленные на один компонент или свойство, являются включающими в себя и предназначены для того, чтобы независимо комбинироваться.
[0028] "Приблизительно" включает в себя все значения, имеющие фактически такой же эффект или обеспечивающие фактически такой же результат, как и заданное значение. Таким образом, диапазон, охваченный выражением "приблизительно", будет варьировать в зависимости от контекста, в котором используется выражение, например, от параметра, с которым связано заданное значение. Таким образом, в зависимости от контекста "приблизительно" может означать, например, ±15%, ±10%, ±5%, ±4%, ±3%, ±2%, ±1% или ± менее 1%. Важно отметить, что все перечисления заданного значения, которым предшествует выражение "приблизительно", предназначены также для перечисления только одного заданного значения.
[0029] Используемый в данном документе термин "бакуловирус", известный также как baculoviridae, относится к семейству оболочечных ДНК-содержащих вирусов членистоногих, представителей которого можно использовать в качестве векторов экспрессии для продуцирования рекомбинантных белков при встраивании в культуры клеток. Вирион содержит один или несколько палочковидных нуклеокапсидов, содержащих молекулу кольцевой сверхспиральной двухцепочечной ДНК (молекулярная масса 54×106-154×106). Используемый в качестве вектора вирус обычно представляет собой вирус ядерного полиэдроза (NVP) Autographa californica. Экспрессия введенных генов контролируется сильным промотором, который обычно регулирует экспрессию полиэдрического белкового компонента в крупных ядерных включениях, в которые заключены вирусы в инфицированных клетках.
[0030] Используемое в данном документе выражение "полученный из" относится к происхождению или источнику и может включать природные, рекомбинантные, неочищенные или очищенные молекулы.
[0031] Используемый в данном документе термин "макромолекулярная структура белка" относится к конструкции или организации одного или нескольких белков.
[0032] Используемое в данном документе выражение "вакцина" относится к препарату из мертвых или ослабленных патогенов, или из полученных антигенных детерминант, который применяют для индуцирования формирования антител или иммунитета в отношении к патогену. Вакцину вводят для обеспечения иммунитета к заболеванию, например, MERS, который вызван вирусами MERS CoV, или SARS, который вызван вирусами SARS CoV. Настоящее раскрытие предусматривает вакцинные композиции, которые являются иммуногенными и обеспечивают защиту. Кроме того, термин "вакцина" также относится к суспензии или раствору иммуногена (например, VLP-наночастица) который вводят позвоночному для получения защитного иммунитета, т.е., иммунитета, который снижает тяжесть заболевания, связанного с инфекцией.
[0033] Используемое в данном документе выражение "устойчивый иммунитет" относится к иммунному ответу, при котором при введении позвоночному наночастиц происходит индукция иммунной системы указанного позвоночного, приводящая к предупреждению инфекции, облегчению тяжести инфекции или уменьшению у указанного позвоночного по меньшей мере одного симптома, связанного с вирусной инфекцией.
[0034] Используемый в данном документе термин "адъювант" относится к соединению, которое при использовании в комбинации со специфичным иммуногеном (например, VLP-наночастица) в составе усиливает, или иным образом изменяет, или модифицирует получаемый в результате иммунный ответ. Модификация иммунного ответа включает повышение эффективности или расширение спектра специфичности каждого из гуморального или клеточного иммунного ответа или обоих. Модификация иммунного ответа также может означать снижение или подавление определенных антиген-специфичных иммунных ответов.
[0035] Используемый в данном документе термин "иммуностимулятор" относится к соединению, которое повышает иммунный ответ посредством собственных химических мессенджеров организма (цитокинов). Эти молекулы включают в себя разные цитокины, лимфокины и хемокины с иммуностимулирующей, иммунопотенцирующей и провоспалительной активностью, такие как интерлейкины (например, IL-1, IL-2, IL-3, IL-4, IL-12, IL-13); факторы роста (например, гранулоцитарный-макрофагальный (GM)-колониестимулирующий фактор (CSF)) и другие иммуностимулирующие молекулы, такие как макрофагальный воспалительный фактор, лиганд Flt3, В7.1; В7.2 и т.д. Молекулы иммуностимуляторов можно вводить в том же составе, что и VLP-наночастицы, или можно вводить отдельно. Для получения иммуностимулирующего эффекта можно вводить либо белок, либо вектор экспрессии, кодирующий белок.
[0036] Используемая в данном документе "эффективная доза" в целом относится к такому количеству наночастицы, которое достаточно для индуцирования иммунитета, для предупреждения и/или облегчения тяжести вирусной инфекции, или для уменьшения по меньшей мере одного симптома инфекции, и/или для усиления эффективности другой дозы наночастицы. Эффективная доза может относиться к количеству наночастицы, достаточному для задержки или сведения к минимуму проявления инфекции. Эффективная доза может также относиться к количеству наночастицы, которое обеспечивает терапевтическое преимущество в лечении или контроле инфекции. Кроме того, эффективная доза представляет собой количество в отношении наночастиц отдельно, или в комбинации с другими видами терапии, которое обеспечивает терапевтическое преимущество в лечении или контроле вирусной инфекции. Эффективная доза также может представлять собой количество, достаточное для повышения у субъекта (например, у человека) собственного иммунного ответа на последующее воздействие вируса. Уровни иммунитета можно контролировать, например, путем измерения количеств нейтрализующих секреторных и/или сывороточных антител, например, с помощью анализа нейтрализации бляшкообразования, реакции связывания комплемента, твердофазного иммуноферментного анализа или реакции микронейтрализации. В случае вакцины "эффективная доза" представляет собой дозу, которая предупреждает заболевание или снижает тяжесть симптомов.
[0037] Используемое в данном документе выражение "фактически защитный гуморальный иммунный ответ" относится к иммунному ответу, опосредованному антителами, на вирус, проявляющийся у позвоночного (например, человека), который предупреждает инфекцию, или облегчает ее тяжесть, или уменьшает по меньшей мере один из ее симптомов. Наночастицы могут стимулировать выработку антител, которые, например, представляют собой нейтрализующие антитела, которые блокируют проникновение вирусов в клетки, блокируют репликацию указанного вируса путем связывания с вирусом и/или защищают клетки-хозяева от инфекции и разрушения.
[0038] Используемое в данном документе выражение "фактически защитный клеточный ответ" относится к иммунному ответу, опосредованному Т-лимфоцитами и/или другими лейкоцитами, на вирус, проявляющийся у позвоночного (например, человека), который предупреждает или облегчает тяжесть инфекции, или уменьшает по меньшей мере один из ее симптомов. Один из важных аспектов клеточного иммунитета включает антиген-специфический ответ цитолитических Т-клеток ("CTL"). CTL обладают специфичностью в отношении пептидных антигенов, которые представлены в ассоциации с белками, кодируемыми главным комплексом гистосовместимости (МНС) и экспрессируемыми на поверхности клеток. CTL помогают индуцировать и стимулировать разрушение внутриклеточных микробов или лизис клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфический ответ хелперных Т-клеток. Хелперные Т-клетки действуют с тем, чтобы оказать помошь в стимулировании функции и сфокусировать активность неспецифических эффекторных клеток против клеток, выставляющих пептидные антигены в ассоциации с молекулами МНС на своей поверхности. "Клеточный иммунный ответ" также относится к продукции цитокинов, хемокинов и других подобных молекул, продуцируемых активированными Т-клетками и/или другими лейкоцитами, в том числе тех, которые получены из CD4+ и CD8+ Т-клеток.
[0039] Используемое в данном документе выражение "устойчивый иммунитет на популяционной основе" относится к иммунитету в результате введения наночастиц индивидуумам в популяции. Результатом иммунитета у указанного индивидуума в указанной популяции является предупреждение, облегчение тяжести инфекции или уменьшение по меньшей мере одного из симптомов, связанных с вирусной инфекцией у указанного индивидуума, и предупреждение распространения указанного вируса среди индивидуумов в популяции. Термин популяция определен как группа индивидуумов (например, детей школьного возраста, пожилых, здоровых индивидуумов и т.д.) и может включать географическую область (например, конкретные города, школы, районы проживания, место работы, страну, штат и т.д.).
[0040] Используемый в данном документе термин "антигенный состав" или "антигенная композиция" относится к препарату, который при введении позвоночному, особенно млекопитающему, будет индуцировать иммунный ответ.
[0041] Используемый в данном документе термин "позвоночное", или "субъект", или "пациент" относится к любому представителю подтипа позвоночных, в том числе без ограничения к людям и другим приматам, в том числе приматам, за исключением человека, таким как шимпанзе и другие высшие приматы и виды обезьян. Сельскохозяйственные животные, такие как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние млекопитающие, такие как собаки и кошки; лабораторные животные, в том числе грызуны, такие как мыши, крысы и морские свинки; птицы, в том числе домашние, дикие и охотничье-промысловые птицы, такие как куры, индейки и другие куриные, утки, гуси и т.п., также представляют собой неограничивающие примеры. Термины "млекопитающие" и "животные" включены в это определение. Предусматривается, что охватываются как взрослые, так и новорожденные особи.
VLP-наночастицы
[0042] Одной из целей при разработке вакцин является получение вакцин, которые стимулируют иммунную систему против патогена, но сами по себе не являются инфекционными. Это уводит от применения цельных вирионов в вакцинах в сторону более минималистичных композиций. Однако эти минималистичные композиций обладают собственными лимитирующими факторами, и, в частности, часто демонстрируют пониженную иммуногенность, требующую применения адъювантов и систем, которые усиливают иммунный ответ. Наночастицы, содержащие нативные вирусные белки, предлагают средства иммунизации, которые используют естественную способность вирусов проникать в клетку и стимулировать иммунный ответ.
[0043] Наночастицы, как раскрыто в данном документе, представляют собой особый тип вирусоподобной частицы (VLP). Наночастицы содержат вирусные белки, но не содержат какого-либо вирусного генетического материала и, таким образом, сами по себе не являются инфекционными. Наночастицы образуются путем самосборки полученных рекомбинантным путем вирусных белков и стимулируют особенно полезные иммунные ответы. Не вдаваясь в теорию, полагают, что размер, повторяющаяся структура и корпускулярная природа способствуют мощным иммунным ответам. Следует отметить, что мощный иммунный ответ может быть получен даже при отсутствии адъюванта.
Структура наночастиц
[0044] Наночастицы содержат вирусные белки, такие как белки вирусного капсида или оболочки, организованные в полимерной форме. Как правило, полимер представляет собой по меньшей мере тример вирусных белков. В других аспектах полимер может содержать более трех мономеров вирусных белков. Например, полимер может содержать 4, 5, 6, 7, 8, 9 или 10 мономерных единиц (названный 4-мерный, 5-мерный, 6-мерный и так далее). В конкретных аспектах полимеры могут быть собраны в структуры более высокого порядка. Так, например, наночастицы могут содержать по меньшей мере приблизительно 3 полимера, по меньшей мере приблизительно 5 полимеров, по меньшей мере приблизительно 10 полимеров, по меньшей мере приблизительно 15 полимеров, по меньшей мере приблизительно 20 полимеров или по меньшей мере приблизительно 30 полимеров. В конкретных аспектах наночастица содержит от приблизительно 5 до приблизительно 15 полимеров, от приблизительно 5 до приблизительно 20 полимеров или от приблизительно 5 до приблизительно 30 полимеров. В других аспектах наночастица содержит от приблизительно 5 до приблизительно 200 полимеров, от приблизительно 10 до приблизительно 200 полимеров или от приблизительно 10 до приблизительно 50 полимеров. Таким образом, в конкретных примерах наночастицы могут содержать от приблизительно 5 до приблизительно 20 тримеров.
[0045] Как правило, более сложные структуры более высокого порядка могут быть получены за счет увеличения концентрации белка. В одном из примеров более низкие концентрации белка дают наночастицы, содержащие приблизительно 5 полимеров, в то время как более высокие концентрации белка (например, 30-50 мкг/мл) дают наночастицы, содержащие от приблизительно 10 до приблизительно 20 полимеров. В одном неограничивающем примере концентрация наночастиц составляет по меньшей мере приблизительно 10 мкг/мл, приблизительно 20 мкг/мл, приблизительно 30 мкг/мл, приблизительно 40 мкг/мл, приблизительно 50 мкг/мл, приблизительно 60 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл или приблизительно 500 мкг/мл. В частности, концентрация наночастиц может составлять от приблизительно 10 мкг/мл до приблизительно 1 мг/мл, или от приблизительно 20 мкг/мл до приблизительно 500 мкг/мл, или от приблизительно 30 мкг/мл до приблизительно 100 мкг/мл, или от приблизительно 30 мкг/мл до приблизительно 50 мкг/мл.
Наночастицы белков
[0046] Наночастицы, раскрытые в данном документе, могут содержать любой белок MERS-CoV, в том числе без ограничения, белок Spike (S), белок мембраны (М), белок нуклеокапсида (N) и белок оболочки (Е), или их комбинацию. Белки могут быть получены или извлечены из любого штамма, клады или вида MERS-CoV. Наночастицы могут содержать один или более белков из одного или более изолятов, штаммов, клад и/или видов MERS-CoV. В одном варианте осуществления белки получают или извлекают из штамма Jordan-N3/2012 (GenBank KC776174.1) MERS-CoV. В другом варианте осуществления белки получают или извлекают из штамма Munich_2013 MERS-CoV. В другом варианте осуществления белки получают или извлекают из штамма Al-Hasa_1_2013 MERS-CoV. Белки, содержащие наночастицы, также могут быть получены или извлечены из разных других источников, в том числе без ограничения из штамма Hafr-Al-batin_1_2013, штамма Bisha_1_2012, штамма Qatar_3_2013, штамма Camel_Egypt_2013, вирусов MERS-CoV клады А, вирусов MERS-CoV клады В, близкородственных штаммов HKU4 и HKU5 коронавируса летучих мышей и/или других близкородственных коронавирусов. Белки MERS-CoV можно также получить синтетическим или рекомбинантным путем in vitro. В одном варианте осуществления белки получают рекомбинантным путем в клетках насекомых, таких как клетки Sf9.
[0047] В одном варианте осуществления полимер может содержать один или более разных типов белков из MERS-CoV. В еще одном варианте осуществления полимер содержит единственный тип белка из MERS-CoV. В предпочтительном варианте осуществления полимер содержит только белок Spike. В еще одном варианте осуществления белок в полимере состоит из белка Spike. В еще одном варианте осуществления наночастица не содержит белки мембраны или нуклеокапсида. В еще одном дополнительном варианте осуществления наночастица не содержит каких-либо последовательностей вирусных нуклеиновых кислот.
[0048] В одном варианте осуществления наночастица содержит белок Spike или его фрагмент. В еще одном дополнительном варианте осуществления наночастица содержит тример из белков Spike или его фрагментов. В еще одном варианте осуществления наночастица содержит по меньшей мере один полимер белка Spike, кодируемого SEQ ID NO: 1. В еще одном варианте осуществления наночастица содержит по меньшей мере один полимер белка Spike, содержащего SEQ ID NO: 2. В еще одном варианте осуществления наночастица содержит по меньшей мере один полимер белка Spike, состоящего из SEQ ID NO: 2. В еще одном варианте осуществления наночастица содержит по меньшей мере один полимер рецептор-связывающего домена (RBD) белка Spike.
[0049] Наночастицы можно получить, как описано в данной области (например, как описано в патенте США №20100239617, опубликованном 23 сентября 2010 года и включенном в данный документ для всех целей). Общие руководства, описывающие молекулярно-биологические методики, которые применимы к настоящему раскрытию, такие как клонирование, мутации, культура клеток и им подобные, включают в себя Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. (Berger); Sambrook et al., Molecular Cloning-A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 2000 ("Sambrook") и Current Protocols in Molecular Biology, F.M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., ("Ausubel"). В этих руководствах описаны мутагенез, применение векторов, промоторов и многие другие актуальные темы, связанные с клонированием и мутацией белков. Так, настоящее раскрытие также охватывает применение известных способов белковой инженерии и технологии рекомбинантной ДНК для улучшения или изменения характеристик белков, экспрессированных на или в наночастицах. Они включают без ограничений сайт-направленный, случайный точковый мутагенез, гомологичную рекомбинацию (ДНК-шаффлинг), мутагенез с применением матриц, содержащих урацил, сайт-специфический мутагенез с применением олигонуклеотидов, мутагенез с использованием фосфоротиоат-модифицированной ДНК, мутагенез с применением дуплексов ДНК, содержащих разрывы, и т.п. Дополнительные подходящие способы включают репарацию точковых несовпадений, мутагенез с применением штаммов-хозяев, дефицитных по репарации, рестрикцию-отбор и рестрикцию-очистку, делеционный мутагенез, мутагенез путем синтеза полного гена, репарацию двухцепочечного разрыва и т.п. Мутагенез, например, вовлекающий гибридные конструкции, также включен в настоящее раскрытие. В одном варианте осуществления мутагенез можно направлять с помощью известной информации о молекулах, встречающихся в природе, или измененных или мутированных молекулах, встречающихся в природе, например, о последовательности, сравнении последовательностей, физических свойствах, кристаллической структуре и т.п.
Белки Spike MERS
[0050] Подходящие белки Spike или их фрагменты получают или извлекают из изолятов, штаммов, клад и/или последовательностей MERS-CoV. В качестве альтернативы, их можно получить рекомбинантным или синтетическим путем. Например, подходящая аминокислотная последовательность MERS-CoV раскрыта в Genbank с номером доступа AGN70962 (фиг. 9 (SEQ ID NO: 2)). В одном варианте осуществления белок Spike или его фрагмент получен из штамма Al-Hasa MERS-CoV.
[0051] Настоящее раскрытие предусматривает варианты белков MERS-CoV. Варианты могут содержать изменения в аминокислотных последовательностях составляющих белков. Выражение "вариант" относительно полипептида относится к аминокислотной последовательности, которую изменили по одной или более аминокислотам относительно референтной последовательности. Вариант может иметь "консервативные" замены, где замещенная аминокислота имеет подобные структурные или химические свойства, например, замещение лейцина изолейцином. В качестве альтернативы, вариант может иметь "неконсервативные" замены, например, замещение глицина триптофаном. Аналогичные незначительные вариации также могут включать делеции или вставки аминокислот, или и первые, и вторые. Руководство по определению, какие аминокислотные остатки можно замещать, вставлять или удалять без устранения биологической или иммунологической активности, можно найти в компьютерных программах, хорошо известных из уровня техники, например, программного обеспечения DNASTAR.
[0052] Естественные варианты могут возникать вследствие антигенного дрейфа. Антигенные дрейфы представляют собой небольшие изменения в вирусных белках, которые происходят непрерывно с течением времени. Таким образом, у человека, зараженного конкретным штаммом вируса MERS-CoV, образуются антитела к такому вирусу, хотя при появлении более новых штаммов вируса антитела к более старым штаммам уже не распознают более новый вирус, и может происходить повторное заражение. Природные белки MERS-CoV и варианты RBD можно использовать для получения наночастиц, как описано в данном документе.
[0053] В некоторых вариантах осуществления осуществляют мутации, в которые входят изменения, приводящие к молчащим заменам, добавлениям или делениям, но не изменяют свойства или активности кодируемого белка или структуры белков. Варианты нуклеотидов можно получать в силу разных соображений, например, для оптимизации кодонов для изменения экспрессии у определенного хозяина (замена кодонов в человеческой мРНК на кодоны, предпочтительные для клеток насекомых, таких как клетки Sf9). См. публикацию заявки на патент США 2005/0118191, включенную в данный документ посредством ссылки во всей своей полноте для всех целей. В конкретном аспекте предпочтительный белок кодируется кодон-оптимизированной нуклеотидной последовательностью, такой как показанная на фигуре 8 (SEQ ID NO: 1). Нуклеиновая кислота и полипептиды могут быть по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичны последовательностям, показанным на фигурах 8 и 9 (SEQ ID NO: 1 и 2).
[0054] Кроме того, последовательность нуклеотидов можно секвенировать, чтобы убедиться в том, что были клонированы правильные кодирующие участки, и они не содержат какие-либо нежелательные мутации. Нуклеотиды можно субклонировать в вектор экспрессии (например, бакуловирус) для экспрессии в любой клетке. Выше приведен только один пример того, как вирусные белки можно клонировать. Специалист в данной области понимает, что дополнительные способы доступны и являются возможными.
[0055] Настоящее раскрытие также предусматривает конструкции и способы, которые будут повышать эффективность получения наночастиц. Например, удаление сайтов расщепления из белков с целью повышения экспрессии белка. Другие способы включают в себя добавление лидерных последовательностей для более эффективной транспортировки. Например, гетерологичную сигнальную последовательность можно гибридизировать с белком MERS. В одном варианте осуществления сигнальную последовательность можно получить из гена клетки насекомого. В другом варианте осуществления сигнальный пептид представляет собой сигнальную последовательность хитиназы, которая эффективно работает в бакуловирусных системах экспрессии. В другом варианте осуществления обмен лидерными последовательностями между белками может обеспечить лучший транспорт белка.
[0056] Можно использовать подходящие векторы, кодирующие белки MERS-CoV или их фрагменты. Вектор может представлять собой, например, фаг, плазмиду, вирусный или ретровирусный вектор. В одном варианте осуществления вектор представляет собой рекомбинантный бакуловирусный вектор. Конструкции и/или векторы, которые кодируют гены, должны быть функционально сцеплены с подходящим промотором, например, промотор гена полиэдрина AcMNPV (или другого бакуловируса), промотор фага лямбда PL, промотор lac из Е. coli, промоторы phoA и tac, ранний и поздний промоторы SV40 и промоторы ретровирусных LTR являются неограничивающими примерами. Другие подходящие промоторы будут известны специалисту в данной области в зависимости от требуемых клетки-хозяина и/или скорости экспрессии. Конструкции для экспрессии будут дополнительно содержать сайты для инициации транскрипции, терминации транскрипции и, в транскрибированном участке, участок связывания рибосомы для трансляции. Кодирующая часть транскриптов, экспрессируемых с помощью конструкций, будет предпочтительно включать кодон инициации трансляции в начале и терминирующий кодон, соответственно расположенный на конце транслируемого полипептида.
[0057] Векторы экспрессии будут предпочтительно включать в себя по меньшей мере один селектируемый маркер. Такие маркеры включают дигидрофолатредуктазу, G418 или ген устойчивости к неомицину для эукариотической клеточной культуры и гены устойчивости к тетрациклину, канамицину или ампициллину для культивирования в E. coli и других бактериях. Среди векторов предпочтительными являются вирусные векторы, такие как бакуловирус, поксвирус (например, вирус коровьей оспы, вирус оспы птиц, вирус оспы канареек, вирус оспы кур, вирус оспы енотов, вирус оспы свиней и т.д.), аденовирус (например, аденовирус собак), герпесвирус и ретровирус. Бактериальные векторы также можно использовать. Примеры бактериальных векторов включают pQE70, pQE60 и pQE-9, векторы pBluescript, векторы Phagescript, pNH8A, pNH16a, pNH18A, pNH46A, ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5. Среди предпочтительных эукариотических векторов pFastBac1 pWINEO, pSV2CAT, pOG44, pXT1 и pSG, pSVK3, pBPV, pMSG и pSVL. Другие подходящие векторы будут очевидными для специалиста в данной области.
[0058] Векторы, например, векторы, содержащие полинуклеотиды MERS-CoV, можно трансфицировать в клетки-хозяева в соответствии со способами, хорошо известными из уровня техники. Например, введение нуклеиновых кислот в эукариотические клетки можно осуществлять посредством совместной преципитации с фосфатом кальция, электропорации, микроинъекции, липофекции и трансфекции с использованием полиаминных реагентов для трансфекции. В одном варианте осуществления указанный вектор представляет собой рекомбинантный бакуловирус.
[0059] Рекомбинантные векторы, такие как раскрытые выше, можно использовать для трансфекции, инфицирования или трансформации, и можно экспрессировать белки в эукариотических клетках и/или прокариотических клетках. Среди эукариотических клеток-хозяев можно использовать клетки-хозяева дрожжей, насекомых, птиц, растений, С. elegans (или нематоды) и млекопитающих. Неограничивающими примерами клеток насекомых являются клетки Spodoptera frugiperda (Sf), например, Sf9, Sf21, клетки Trichoplusia ni, например, клетки High Five, и клетки Drosophila S2. Примерами грибных (в том числе дрожжевых) клеток-хозяев являются S. cerevisiae, Kluyveromyces lactis (K. lactis), виды Candida, в том числе С. albicans и С. glabrata, Aspergillus nidulans, Schizosaccharomyces pombe (S. pombe), Pichia pastoris и Yarrowia lipolytica. Примерами клеток млекопитающих являются клетки COS, клетки почки детенышей хомяка, мышиные L-клетки, клетки LNCaP, клетки яичника китайского хомяка (СНО), клетки почки эмбриона человека (НЕК) и клетки африканской зеленой мартышки, клетки CV1, клетки HeLa, клетки MDCK, клетки Vero и Нер-2. Также можно использовать ооциты Xenopus laevis или другие клетки, происходящие от амфибий. Прокариотические клетки-хозяева включают бактериальные клетки, например, Е. coli, В. subtilis и микобактерии.
[0060] Способы выращивания клеток, разработанных для получения наночастиц, включают без ограничения техники периодических, периодических с подпиткой, непрерывных и перфузионных клеточных культур. Клеточная культура означает рост и размножение клеток в биореакторе (камере сбраживания), где клетки размножаются и экспрессируют белок (например, рекомбинантные белки) для очистки и выделения. Типично, культивирование клеток проводят в стерильных условиях с контролируемыми температурой и атмосферой в биореакторе. Биореактор представляет собой камеру, используемую для культивирования клеток, в которой условия окружающей среды, такие как температуру, атмосферу, перемешивание и/или pH, можно контролировать. В одном варианте осуществления указанный биореактор представляет собой камеру из нержавеющей стали. В другом варианте осуществления указанный биореактор представляет собой предварительно простерилизованный пластиковый пакет (например, Cellbag®, Wave Biotech, Бриджуотер, Нью-Джерси). В другом варианте осуществления указанные предварительно стерилизованные пластиковые пакеты представляют собой пакеты объемом от приблизительно 50 л до 1000 л.
[0061] Затем наночастицы можно выделять при помощи, которые сохраняют их целостность, например, путем центрифугирования в градиенте, например, хлорида цезия, сахарозы и иодиксанола, а также стандартных методик очистки, включая, например, ионообменную и гель-фильтрационную хроматографию.
[0062] Следующее представляет собой пример того, как наночастицы можно получить, выделить и очистить. Как правило, наночастицы получают из рекомбинантных клеточных линий, разработанных для создания наночастиц, где указанные клетки выращивают в клеточной культуре.
[0063] Например, получение наночастиц может начинаться с посева клеток Sf9 (неинфицированных) во встряхиваемые колбы, предоставления клеткам возможности развиваться и увеличиваться, поскольку клетки растут и размножаются (например, со 125-мл колбы до 50 л пакета фирмы Wave Biotech). Среду, используемую для выращивания клетки, составляют для обеспечения соответствующей клеточной линии (предпочтительно бессывороточная среда, например среда для клеток насекомых ExCell-420, JRH). Затем указанные клетки инфицируют рекомбинантным бакуловирусом при наиболее эффективной множественности заражения (например, от приблизительно 1 до приблизительно 3 бляшкообразующих единиц на клетку). После того, как произошло инфицирование, белки экспрессируются из генома вируса, самостоятельно собираются в VLP-наночастицы и секретируются из клетки в течение от приблизительно 24 до 72 часов после инфицирования. Как правило, инфицирование наиболее эффективно, когда клетки пребывают в средней лог-фазе роста (4-8×106 клеток/мл) и являются жизнеспособными по меньшей мере на приблизительно 90%.
[0064] В качестве альтернативы, наночастицы можно получать, например, путем инфицирования клеток-хозяев (например, клеток Sf9) рекомбинантным бакуловирусом, содержащим нуклеотидные последовательности, кодирующие белок MERS-CoV или представляющие интерес белки. Инфицированные клетки инкубируют и собирают. Белок MERS-CoV (например, белок Spike) экстрагируют из клеточной мембраны с помощью детергента. Затем белкам дают возможность естественным образом собраться с формированием структур (например, тримеров), которые затем очищают. Удаление детергента в ходе очистки позволяет белкам формировать структуры более высокого порядка, такие как наночастицы, содержащие множественные структуры (например, белок-белковые мицеллярные наночастицы, содержащие белковые тримеры). Как правило, на количество структур в наночастицах оказывает влияние концентрация белка, с более высокими концентрациями белка получают наночастицы, содержащие большее количество структур (например, тримеров).
[0065] Наночастицы можно собирать через примерно 48-96 часов после инфицирования, когда уровни VLP-наночастиц в среде клеточной культуры находятся вблизи максимума, но до обширного клеточного лизиса. Плотность и жизнеспособность клеток Sf9 во время сбора может составлять от приблизительно 0,5×106 клеток/мл до приблизительно 1,5×106 клеток/мл с жизнеспособностью по меньшей мере 20%, как показано в анализе с исключением красителя. Потом среду удаляют и очищают от примесей. Чтобы избежать нежелательной агрегации, в среду можно добавить NaCl в концентрации от приблизительно 0,4 до приблизительно 1,0 М, предпочтительно до приблизительно 0,5 М. Удаление клеток и клеточного дебриса из среды клеточной культуры, содержащей наночастицы, можно осуществлять с помощью тангенциальной поточной фильтрации (TFF) через предварительно простерилизованный половолоконный 0,5 или 1,00 мкм фильтровальный картридж одноразового применения или аналогичное устройство.
[0066] Затем наночастицы в очищенной культуральной среде можно концентрировать путем ультрафильтрации с использованием одноразового, предварительно стерилизованного половолоконного картриджа с отсечением по молекулярной массе 500000. Концентрированные наночастицы можно подвергнуть диафильтрации против 10 объемов фосфатно-солевого буфера (PBS), pH 7,0-8,0, содержащего 0,5 М NaCl, для удаления остаточных компонентов среды.
[0067] Концентрированные диафильтрованные наночастицы можно дополнительно очистить на ступенчатом с 20% до 60% градиенте сахарозы в буфере PBS при pH 7,2 с 0,5 М NaCl путем центрифугирования при 6500 g в течение 18 часов при температуре от приблизительно 4°C до приблизительно 10°C. Обычно VLP-наночастицы образуют характерную видимую полосу в области от приблизительно 30% до приблизительно 40% сахарозы или на границе раздела (в 20% и 60% ступенчатом градиенте), которую можно собрать из градиента и сохранить. Этот продукт можно развести, чтобы он содержал 200 мМ NaCl в препарате для следующей стадии процесса очистки. Этот продукт содержит VLP-наночастицы и может содержать интактные бакуловирусные частицы.
[0068] Дополнительной очистки наночастиц можно достичь путем анионной обменной хроматографии или изопикнического центрифугирования с использованием 44% сахарозной подушки. При анионообменной хроматографии образец из градиента сахарозы (см. выше) загружают в колонку, содержащую среду с анионом (например, Matrix Fractogel EMD ТМАЕ) и элюируют градиентом соли (от приблизительно 0,2 М до приблизительно 1,0 М NaCl), что может отделять наночастицу от других загрязнителей (например, бакуловируса и ДНК/РНК). В способе с сахарозной подушкой образец, содержащий наночастицы, добавляют к 44% сахарозной подушке и центрифугируют в течение приблизительно 18 часов при 30000 g. Наночастицы формируют полосу выше 44% сахарозы, тогда как бакуловирус выпадает в осадок на дне и другие загрязняющие белки остаются в слое с 0% сахарозы в верхней части. Собирают верхний слой или полосу наночастиц.
[0069] При необходимости интактный бакуловирус можно инактивировать. Инактивацию можно осуществлять химическими способами, например, с помощью формалина или β-пропиолактона (BPL). Удаление и/или инактивацию интактного бакуловируса также в значительной степени можно осуществлять с использованием селективного осаждения и хроматографических способов, известных из уровня техники, как поясняется примером выше. Способы инактивации включают инкубирование образца, содержащего наночастицы, в 0,2% BPL в течение 3 часов при температуре от приблизительно 25°C до приблизительно 27°C. Бакуловирус также можно инактивировать путем инкубирования образца, содержащего наночастицы, в 0,05% BPL при 4°C в течение 3 дней, затем при 37°C в течение одного часа.
[0070] После стадии инактивации/удаления продукт, содержащий наночастицы, можно провести через еще одну стадию диафильтрации для удаления любого реагента стадии инактивации и/или любой остаточной сахарозы и поместить наночастицы в требуемый буфер (например, PBS). Раствор, содержащий наночастицы, можно стерилизовать способами, известными в данной области (например, стерилизацией посредством фильтрации), и хранить в холодильнике или в морозильной камере.
[0071] Вышеописанные методики можно использовать на практике в различных масштабах. Например, Т-колбы, встряхиваемые колбы, роллерные бутыли, вплоть до биореакторов промышленных размеров. Биореакторы могут включать в себя либо бак из нержавеющей стали, либо предварительно простерилизованный пластиковый пакет (например, систему, продаваемую Wave Biotech, Бриджуотер, Нью-Джерси). Специалист в данной области будет знать, что является наиболее целесообразным для его целей.
Фармацевтические или вакцинные составы и введение
[0072] Фармацевтические композиции, применяемые в данного документе, содержат фармацевтически приемлемый носитель, в том числе любой подходящий разбавитель или наполнитель, который включает любое фармацевтическое средство, которое само по себе не индуцирует формирование иммунного ответа, причиняющего вред позвоночному, получающему композицию, и которое можно вводить без чрезмерной токсичности вместе с наночастицей. Используемое в данном документе выражение "фармацевтически приемлемый" означает, что он является одобренным регулирующим органом федерального правительства или правительства штата, или перечислен в Фармакопее США, Европейской фармакопее или в других общепризнанных фармакопеях для применения у позвоночных, и, более конкретно, у людей.
[0073] В целом, наночастицы вводят в эффективном количестве (как определено выше), достаточном для стимуляции иммунного ответа против одного или более штаммов вируса MERS CoV. Эти композиции можно использовать в качестве вакцины и/или антигенных композиций для индуцирования протективного иммунного ответа у позвоночного. Композиции могут содержать наночастицы, имеющие различные типы полимеров. Например, композиции могут содержать в основном тримеры с оставшейся частью, включающей различные полимеры. В одном из вариантов осуществления наночастицы, вводимые в эффективном количестве для стимуляции иммунного ответа против одного или более штаммов вируса MERS-CoV, содержат по меньшей мере приблизительно 5-100 тримеров, по меньшей мере приблизительно 10-90 тримеров, по меньшей мере приблизительно 20-50 тримеров, по меньшей мере приблизительно 10-30 тримеров или по меньшей мере приблизительно 10-20 тримеров белков MERS-CoV. В дополнительном варианте осуществления композиции вводимые наночастицы содержат по меньшей мере приблизительно 5-100 тримеров, по меньшей мере приблизительно 10-90 тримеров, по меньшей мере приблизительно 20-50 тримеров, по меньшей мере приблизительно 10-30 тримеров или по меньшей мере приблизительно 10-20 тримеров белка Spike или его фрагмента (такого как RBD).
[0074] В одном неограничивающем варианте осуществления концентрация наночастиц составляет по меньшей мере приблизительно 10 мкг/мл, приблизительно 20 мкг/мл, приблизительно 30 мкг/мл, приблизительно 40 мкг/мл, приблизительно 50 мкг/мл, приблизительно 60 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл или приблизительно 500 мкг/мл. В частности, концентрация наночастиц составляет от приблизительно 10 мкг/мл до приблизительно 1 мг/мл, или от приблизительно 20 мкг/мл до приблизительно 500 мкг/мл, или от приблизительно 30 мкг/мл до приблизительно 100 мкг/мл, или от приблизительно 30 мкг/мл до приблизительно 50 мкг/мл.
[0075] В других примерах композиции могут содержать наночастицы более высокого порядка, такие как от 5-мерные - 6-мерные. В конкретных аспектах композиции содержат по меньшей мере 70% 5-мерных - 6-мерных, по меньшей мере 80% 5-мерных - 6-мерных или по меньшей мере 90% 5-мерных - 6-мерных. В других аспектах композиция содержит по меньшей мере 70% 5-мерных - 6-мерных, по меньшей мере 80% 5-мерных - 6-мерных или по меньшей мере 90% 5-мерных - 6-мерных.
[0076] В одном варианте осуществления фармацевтические составы, раскрытые в данном документе, содержат наночастицы, содержащие белок MERS-CoV, часто белок Spike, и фармацевтически приемлемый носитель или наполнитель.
[0077] В других вариантах осуществления композиции могут содержать наночастицы, содержащие белки MERS-CoV или варианты, такие как вариант RBD, из разных штаммов MERS. Такие композиции можно вводить для обеспечения иммунитета к нескольким различным штаммам. В одном из аспектов композиция может содержать наночастицы для обеспечения иммунного ответа против первого штамма, второго штамма, третьего штамма. В другом аспекте наночастицы могут обеспечить иммунный ответ против четырех, пяти или шести штаммов. В еще одном варианте осуществления фармацевтические составы содержат очищенное высокоаффинное антитело, произведенное в организме животного, которому ввели наночастицы.
[0078] Фармацевтически приемлемые носители включают без ограничений физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, стерильный изотонический водный буфер и их комбинации. Подробное обсуждение фармацевтически приемлемых носителей, разбавителей и других наполнителей представлено в Remington's Pharmaceutical Sciences (Mack Pub. Co. N.J. последнее издание). Состав должен удовлетворять требованиям способа введения. В предпочтительном варианте осуществления состав, являющийся подходящим для введения человеку, предпочтительно является стерильным, не содержащим частиц и/или апирогенным.
[0079] Композиция, при необходимости, также может содержать небольшие количества увлажняющих или эмульгирующих средств, или забуферивающих pH средств. Композиция может представлять собой твердую форму, такую как лиофилизированный порошок, подходящий для восстановления, жидкий раствор, суспензию, эмульсию, таблетку, пилюлю, капсулу, состав с замедленным высвобождением или порошок. Состав для перорального введения может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, натриевая соль сахарина, целлюлоза, карбонат магния и т.д. со степенью чистоты для фармацевтической промышленности.
[0080] Настоящее раскрытие также предусматривает фармацевтический комплект или набор, содержащий один или более контейнеров, заполненных одним или более ингредиентами иммуногенных вакцинных составов. В предпочтительном варианте осуществления набор содержит два контейнера, один, содержащий наночастицы, и другой, содержащий адъювант. К таким контейнерам (контейнерами) может прилагаться информация в форме, предусмотренной правительственным учреждением, регулирующим производство, применение или продажу лекарственных препаратов или биологических продуктов, при этом в информации отражается одобрение учреждения относительно производства, применения или продажи для введения людям.
[0081] Составы могут быть упакованы в герметично укупоренном контейнере, таком как ампула или саше, с указанием количества композиции. В одном варианте осуществления композицию поставляют в виде жидкости, в другом варианте осуществления в виде сухого стерилизованного лиофилизированного порошка или безводного концентрата в герметично укупоренном контейнере, при этом она может быть восстановлена, например, водой или физиологическим раствором до соответствующей концентрации для введения субъекту. Предпочтительно, композицию поставляют в виде сухого стерильного лиофилизированного порошка в герметично укупоренном контейнере в дозированной форме, предпочтительно, приблизительно 1 мкг, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 50 мкг, приблизительно 100 мкг, приблизительно 125 мкг, приблизительно 150 мкг или приблизительно 200 мкг. В качестве альтернативы, дозированная форма композиции составляет менее приблизительно 1 мкг (например, приблизительно 0,08 мкг, приблизительно 0,04 мкг, приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,8 мкг, приблизительно 0,5 мкг или менее, приблизительно 0,25 мкг или менее или приблизительно 0,1 мкг или менее), или более приблизительно 125 мкг (например, приблизительно 150 мкг или более, приблизительно 250 мкг или более или приблизительно 500 мкг или более). Эти дозы можно измерить как общее количество наночастиц, или в виде мкг белка MERS-CoV (например, белка Spike или его фрагмента). Композицию с наночастицами следует вводить в течение приблизительно 12 часов, предпочтительно в течение приблизительно 6 часов, в течение приблизительно 5 часов, в течение приблизительно 3 часов или в течение приблизительно 1 часа после восстановления из лиофилизированного порошка.
[0082] В альтернативном варианте осуществления композиция с наночастицами поставляется в жидкой форме в герметично укупоренном контейнере с указанием количества и концентрации композиции с наночастицами. Предпочтительно, композиция с наночастицами в жидкой форме поставляется в герметично укупоренном контейнере в концентрации по меньшей мере приблизительно 50 мкг/мл, более предпочтительно по меньшей мере приблизительно 100 мкг/мл, по меньшей мере приблизительно 200 мкг/мл, по меньшей мере 500 мкг/мл или по меньшей мере 1 мг/мл.
[0083] Наночастицы можно вводить животному, чтобы вызвать иммунный ответ против MERS-CoV. В одном варианте осуществления животное восприимчиво к инфекции MERS-CoV. В одном варианте осуществления животное представляет собой человека. Предпочтительно, введение наночастиц вызывает устойчивый иммунитет против по меньшей мере одного штамма, изолята, клады и/или вида MERS-CoV. В одном варианте осуществления введение наночастиц вызывает устойчивый иммунитет против по меньшей мере 2 или более штаммов, изолятов, клад и/или видов MERS-CoV. В еще одном варианте осуществления введение наночастиц вызывает устойчивый иммунитет против другого коронавируса. Как правило, дозу можно подбирать в пределах этого диапазона на основе, например, возраста, физического состояния, массы тела, пола, питания, времени введения и других клинических факторов.
[0084] Кроме того, в данном документе раскрыты способы составления вакцины или антигенной композиции, которая индуцирует у субъекта устойчивый иммунитет к вирусной инфекции или по меньшей мере к одному из ее симптомов, включающие добавление к указанному составу эффективной дозы наночастиц.
[0085] Хотя предпочтительной является стимуляция устойчивого иммунитета однократной дозой, для достижения требуемого эффекта можно вводить дополнительные дозы с помощью такого же или отличающегося пути введения. Например, у новорожденных и младенцев для для достижения достаточных уровней иммунитета могут потребоваться множественные введения. Введение можно продолжать с определенными интервалами на протяжении всего детского возраста при необходимости поддержания достаточных уровней защиты против инфекции. Подобным образом, для взрослых, которые являются особенно восприимчивыми к повторным или тяжелым инфекциям, таких как, например, медицинские работники, работники детских садов, члены семей с маленькими детьми, пожилые люди и индивидуумы с нарушенной сердечно-легочной функцией, могут потребоваться множественные иммунизации для установления и/или поддержания защитных иммунных ответов. Уровни индуцированного иммунитета можно отслеживать, например, путем измерения количеств нейтрализующих секреторных и сывороточных антител, и при необходимости корригируют дозировки или повторяют вакцинации для вызова или поддержания требуемых уровней защиты.
[0086] Таким образом, в одном варианте осуществления способ индуцирования у субъекта устойчивого иммунитета против вирусной инфекции или по меньшей мере одного из ее симптомов включает введение по меньшей мере одной эффективной дозы наночастиц, где наночастица содержит по меньшей мере один тример, содержащий белок Spike MERS CoV или его фрагмент. В других аспектах наночастица содержит по меньшей мере один тример, состоящий фактически из белка Spike MERS CoV или его фрагмента. В действительности, белок Spike может являться единственным белком в тримере и/или наночастице.
[0087] Способы введения композиции, содержащей наночастицы (вакцины и/или антигенных составов), включают без ограничений парентеральное введение (например, внутрикожное, внутримышечное, внутривенное и подкожное), эпидуральное и чресслизистое (например, интраназальным и пероральным или пульмональным путем, или с помощью суппозиториев). В конкретном варианте осуществления композиции по настоящему раскрытию вводят внутримышечно, внутривенно, подкожно, трансдермально или внутрикожно. Композиции можно вводить с помощью любого удобного пути, например путем инфузии или болюсного введения, путем абсорбции через эпителиальные или слизисто-кожные выстилки (например, слизистую рта, толстой кишки, конъюнктивы, носоглотки, ротоглотки, влагалища, уретры, мочевого пузыря или кишечника и т.д.), и можно вводить вместе с другими биологически активными средствами. В некоторых вариантах осуществления интраназальный или другие чресслизистые пути введения композиции, содержащей наночастицы, могут индуцировать гуморальный или другой иммунный ответ, который в значительной степени выше, чем при других путях введения. В другом варианте осуществления интраназальный или другие чресслизистые пути введения композиции, содержащей наночастицы, может индуцировать гуморальный или другой иммунный ответ, который будет индуцировать перекрестную защиту против других штаммов вируса. Введение может быть системным или местным. Состав профилактической вакцины вводят системно, например, путем подкожной или внутримышечной инъекции с использованием иглы и шприца или безыгольного инъекционного устройства. В качестве альтернативы, вакцинный состав вводят интраназально, либо по каплям, в виде крупнодисперсного аэрозоля (более приблизительно 10 микрон), либо распыляют в верхних дыхательных путях. Хотя любой из вышеуказанных путей доставки приводит в результате к иммунному ответу, интраназальное введение предоставляет дополнительное преимущество в том, что вызывает мукозный иммунитет в месте проникновения вируса.
[0088] В еще одном варианте осуществления вакцину и/или антигенный состав вводят таким образом, чтобы целенаправленно воздействовать на слизистые ткани для вызова иммунного ответа в месте иммунизации. Например, на слизистые ткани, такие как лимфоидная ткань, ассоциированная с кишечником (GALT), можно целенаправленно воздействать для иммунизации путем перорального введения композиций, которые содержат адъюванты с определенными свойствами целенаправленного воздействия на слизистые. Также можно проводить целенаправленное воздействие на дополнительные слизистые ткани, такие как лимфоидная ткань носоглотки (NALT) и лимфоидная ткань бронхов (BALT).
[0089] Вакцины и/или антигенные составы также можно вводить на основе схемы дозирования, например, первичное введение вакцинной композиции с последующими бустерными введениями. В определенных вариантах осуществления вторую дозу композиции вводят в любое место в пределах от двух недель до одного года, предпочтительно от приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5 до приблизительно 6 месяцев после первичного введения. Кроме того, после второй дозы можно вводить третью дозу, и ее вводят от приблизительно трех месяцев до приблизительно двух лет, или даже более, предпочтительно через от приблизительно 4, приблизительно 5 или приблизительно 6 месяцев или приблизительно 7 месяцев до приблизительно одного года после первичного введения. Если после второй дозы в сыворотке и/или моче, или выделениях слизистых не выявлены уровни специфичных иммуноглобулинов, или они низкие, то введение третьей дозы является необязательным. В предпочтительном варианте осуществления вторую дозу вводят через приблизительно один месяц после первого введения, а третью дозу вводят через приблизительно шесть месяцев после первого введения. В другом варианте осуществления вторую дозу вводят через приблизительно шесть месяцев после первого введения.
[0090] В другом варианте осуществления наночастицу можно вводить как часть комбинированной терапии. Например, наночастицы можно составлять с другими иммуногенными композициями и/или противовирусными препаратами.
[0091] Дозировку фармацевтического состава может легко определить специалист в данной области, например, вначале определив дозы, эффективные для вызова профилактического или терапевтического иммунного ответа, например, путем измерения сывороточного титра иммуноглобулинов, специфичных в отношении вируса, или путем измерения коэффициента подавления антител в образцах сыворотки или образцах мочи, или секретах слизистых. Указанные дозировки можно определить по исследованиям на животных.
[0092] Кроме того, специалист в данной области может проводить клинические исследования на людях для определения предпочтительной эффективной дозы для людей. Такие клинические исследования являются принятыми и хорошо известными в данной области. Точная доза, подлежащая применению, также будет зависеть от пути введения. Эффективные дозы можно экстраполировать из кривых доза-ответ, полученных в in vitro тестовых системах или тестовых системах с животными.
[0093] Также, как хорошо известно из уровня техники, иммуногенность конкретной композиции можно повысить путем использования неспецифических стимуляторов иммунного ответа, известных как адъюванты. Адъюванты использовали в экспериментальных условиях для стимуляции общего повышения иммунитета против неизвестных антигенов (например, патент США №4877611). В протоколах иммунизации адъюванты для стимуляции ответов применялись в течение многих лет, и в таком качества адъюванты хорошо известны специалисту в данной области. Ряд адъювантов воздействет на путь, при котором происходит презентирование антигенов. Например, иммунный ответ повышается, когда белковые антигены осаждают с помощью алюмокалиевых квасцов. Эмульгирование антигенов также продлевает продолжительность презентирования антигена. Адъюванты могут быть включены. Подходящие адъюванты включают описанные в Vogel et al., "А Compendium of Vaccine Adjuvants and Excipients (2nd Edition)", включенную в данный документ посредством ссылки во всей своей полноте для всех целей.
[0094] Другие иллюстративные адъюванты включают полный адъювант Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитые Mycobacterium tuberculosis), неполные адъюванты Фрейнда и адъювант на основе гидроксид алюминия. Другие адъюванты включают GMCSP, BCG, гидроксид алюминия, соединения MDP, такие как thur-MDP и nor-MDP, CGP (МТР-РЕ), липид A, Montanide ISA 206 и монофосфориллипид A (MPL). Также предусмотрена система RIBI, которая содержит три компонента, выделенные из бактерий, MPL, трегалозы димиколат (TDM) и скелет клеточной стенки (CWS) в 2% эмульсии сквалена/Tween 80. Также можно применять MF-59, Novasomes®, антигены для МНС.
[0095] В одном из вариантов осуществления адъювант представляет собой олиголамеллярную липидную везикулу, содержащую от приблизительно двух до десяти бислоев, расположенных в форме фактически сферических оболочек, разделенных водными слоями, окружающими крупную аморфную центральную полость без липидных бислоев. Олиголамеллярные липидные везикулы могут проявлять действие в отношении стимуляции иммунного ответа посредством нескольких путей: в качестве неспецифических стимуляторов, в качестве носителей для антигена, в качестве носителей дополнительных адъювантов и их комбинаций. Олиголамеллярные липидные везикулы проявляют свое действие в качестве неспецифических иммуностимуляторов, например, если вакцину получают путем перемешивания антигена с предварительно сформированными везикулами таким образом, что антиген остается снаружи везикул. При инкапсуляции антигена в пределах центральной полости везикулы, везикула действует как иммуностимулятор, так и как носитель антигена. В другом варианте осуществления везикулы в основном получают из нефосфолипидных везикул. В других вариантах осуществления везикулы представляют собой Novasome®. Novasome® представляют собой олигослойные нефосфолипидные везикулы в диапазоне от приблизительно 100 нм до приблизительно 500 нм. Они содержат Brij 72, холестерин, олеиновую кислоту и сквален. Было показано, что Novasomes являются эффективным адъювантом для антигенов (см. патенты США №№5629021, 6387373 и 4911928, которые включены в данный документ посредством ссылки во всей своей полноте для всех целей).
[0096] В одном аспекте адъювантный эффект достигается путем применения использования такого средства, как алюмокалиевые квасцы, применяемого в от приблизительно 0,05 до приблизительно 0,1% растворе в фосфатно-солевом буферном растворе. В качестве альтернативы, наночастицы можно получить в виде смеси с синтетическими полимерами Сахаров (Carbopol®), используемых в виде приблизительно 0,25% раствора. Некоторые адъюванты, например, некоторые органические молекулы, полученные из бактерий, действуют на хозяина, а не на антиген. Примером может служить мурамилдипептид (N-ацетилмурамил-L-аланил-D-изоглутамин [MDP]), являющийся бактериальным пептидогликаном. В других вариантах осуществления также могут быть использованы гемоцианины и гемоэритрины. Использование гемоцианина из моллюсков семейства фиссурелловые (KLH) является предпочтительным в определенных вариантах осуществления, хотя можно использовать гемоцианины и гемоэритрины других моллюсков и членистоногих.
[0097] Разные полисахаридные адъюванты также можно использовать. Например, было описано применение различных пневмококковых полисахаридных адъювантов при гуморальном ответе у мышей (Yin et al., 1989). Дозы, которые вызывают оптимальные ответы, или которые по другим причинам не вызывают подавление, следует использовать как указано (Yin et al., 1989). Полиаминовые модификации полисахаридов являются особенно предпочтительными, такие как хитин и хитозан, в том числе деацетилированный хитин. В другом варианте осуществления липофильное дисахарид-трипептидное производное мурамилдипептида, которое описано для использования в искусственных липосомах, образованных фосфатидилхолином и фосфатидилглицеролом.
[0098] Другие подходящие адъюванты включают амфипатические и поверхностно-активные вещества, например, сапонин и производные, такие как QS21 (Cambridge Biotech). Адъюванты на основе сапонина включают содержащие Matrix А и Matrix С по отдельности и в комбинации. Иллюстративные подходящие адъюванты на основе сапонинов описаны в опубликованных заявках на патент США 20120107353 и 20110081378, которые включены в данный документ посредством ссылки для всех целей.
[0099] Также можно использовать неионогенные поверхностно-активные вещества из блок-сополимеров (Rabinovich et al., 1994). Олигонуклеотиды являются еще одной применимой группой адъювантов (Yamamoto et al., 1988). Quil А и lentinen представляют собой другие адъюванты, которые можно использовать в определенных вариантах осуществления.
[00100] Еще одну группу адъювантов составляют обезвреженные эндотоксины, такие как очищенный обезвреженный эндотоксин из патента США №4866034. Эти очищенные нейтрализованные эндотоксины эффективны в получении у позвоночных ответов на адъюванты. Естественно обезвреженные эндотоксины можно комбинировать с другими адъювантами для получения композиции из нескольких адъювантов. Например, конкретно предусматривается комбинация нейтрализованных эндотоксинов с трегалозы димиколатом, что описано в патенте США №4435386. Также предусматриваются как комбинации нейтрализованных эндотоксинов с трегалозы димиколатом и эндотоксическими гликолипидами (патент США №4505899), так и комбинация нейтрализованных эндотоксинов со скелетом клеточной стенки (CWS) или CWS и трегалозы димиколата, что описано в патентах США №№4436727, 4436728 и 4505900. Комбинации только CWS и трегалозы димиколата без нейтрилизованных эндотоксинов также предусматриваются как полезные, что описано в патенте США №4520019.
[00101] Специалистам в данной области известны различные типы адъювантов, которые можно конъюгировать с вакцинами, в том числе алкиллизофосфолипиды (ALP); BCG и биотин (включая биотинилированные производные) среди прочих. Конкретными адъювантами, особенно предпочтительными для использования, являются тейхоевые кислоты из грамотрицательных клеток. К ним относятся липотейхоевые кислоты (LTA), рибитолтейхоевые кислоты (RTA) и глицеролтейхоевая кислота (GTA). Активные формы их синтетических аналогов также можно использовать. (Takada et al., 1995).
[00102] Разные адъюванты, даже те, которые обычно не используют в организме человека, можно, тем не менее, использовать у других позвоночных, где, например, желательна выработка антитела или в дальнейшем получение активированных Т-клеток. Токсичность или другие побочные эффекты, которые могут возникнуть из-за адъюванта или клеток, что например, может происходить при использовании необлученных опухолевых клеток, в таких обстоятельствах не имеет какого-либо значения.
[00103] Еще один способ индуцирования иммунного ответа можно осуществлять путем составления наночастиц с "иммуностимуляторами". Такие иммуностимуляторы представляют собой собственные химические посредники организма (цитокины) для усиления ответа иммунной системы. Иммуностимуляторы включают без ограничения различные цитокины, лимфокины и хемокины с иммуностимулирующей, иммунопотенцирующей и провоспалительной активностью, такие как интерлейкины (например, IL-1, IL-2, IL-3, IL-4, IL-12, IL-13); факторы роста (например, гранулоцитарно-макрофагальный (GМ)-колониестимулирующий фактор (CSF)); и другие иммуностимулирующие молекулы, такие как макрофагальный воспалительный фактор, лиганд Flt3, В7.1; В7.2 и т.д. Иммуностимулирующие молекулы можно вводить в том же составе, что и наночастицы, или можно вводить отдельно. Для получения иммуностимулирующего эффекта можно вводить либо белок, либо вектор экспрессии, кодирующий белок.
[00104] Алюмокалиевые квасцы могут присутствовать в диапазоне с нижним пределом приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,6 мкг приблизительно 0,8 мкг, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 3 мкг, приблизительно 4 мкг, приблизительно 5 мкг, приблизительно 6 мкг, приблизительно 7 мкг, приблизительно 9 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 35 мкг, 40 мкг, приблизительно 45 мкг, приблизительно 50 мкг, приблизительно 60 мкг, приблизительно 70 мкг, приблизительно 80 мкг, приблизительно 90 мкг, приблизительно 100 мкг, приблизительно 110 мкг, приблизительно 120 мкг, приблизительно 130 мкг, приблизительно 140 мкг или приблизительно 150 мкг. Алюмокалиевые квасцы могут присутствовать в диапазоне с верхним пределом приблизительною мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 35 мкг, 40 мкг, приблизительно 45 мкг, приблизительно 50 мкг, приблизительно 60 мкг, приблизительно 70 мкг, приблизительно 80 мкг, приблизительно 90 мкг, приблизительно 100 мкг, приблизительно 110 мкг, приблизительно 120 мкг, приблизительно 130 мкг, приблизительно 140 мкг, приблизительно 150 мкг или приблизительно 200 мкг. В конкретных аспектах диапазон алюмокалиевых квасцов составляет от приблизительно 80 мкг до приблизительно 120 мкг или от приблизительно 100 мкг до приблизительно 120 мкг.
[00105] Адъювант на основе сапонина может присутствовать в диапазоне с нижним пределом приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,6 мкг, приблизительно 0,8 мкг, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 3 мкг, приблизительно 4 мкг, приблизительно 5 мкг, приблизительно 6 мкг, приблизительно 7 мкг, приблизительно 9 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг или приблизительно 30 мкг. Адъювант на основе сапонина может присутствовать в диапазоне с верхним пределом приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 35 мкг, 40 мкг, приблизительно 45 мкг, приблизительно 50 мкг, приблизительно 60 мкг, приблизительно 70 мкг, приблизительно 80 мкг, приблизительно 90 мкг, приблизительно 100 мкг, приблизительно 110 мкг, приблизительно 120 мкг, приблизительно 130 мкг, приблизительно 140 мкг, приблизительно 150 мкг или приблизительно 200 мкг. В конкретных аспектах диапазон адъюванта на основе сапонина составляет от приблизительно 5 мкг до приблизительно 20 мкг или от приблизительно 1 мкг до приблизительно 10 мкг.
[00106] Эти дозы являются особенно подходящими для мышей и их можно скорректировать для применения у человека, исходя из типичного веса мыши 20 г в сравнении с весом человека приблизительно 60 кг.
Способ стимуляции иммунного ответа против MERS CoV
[00107] Наночастицы являются пригодными для получения иммуногенных композиций для стимуляции иммунного ответа, который обеспечивает иммунитет или устойчивый иммунитет к вирусам MERS CoV. Как мукозальный, так и клеточный иммунитет могут вносить вклад в иммунитет к инфекции и заболеванию. Антитела, секретируемые местно в верхних дыхательных путях, представляют собой главный фактор устойчивости к естественным инфекциям. Секреторный иммуноглобулин A (sIgA) вовлечен в защиту верхних дыхательных путей, а сывороточный IgG в защиту нижних дыхательных путей. Иммунный ответ, индуцированный инфекцией, защищает от повторного заражения тем же вирусом или антигенно подобным штаммом вируса. Антитела, продуцированные в хозяине после иммунизации наночастицами, раскрытыми в данном документе, можно также вводить другим, тем самым обеспечивая пассивное введение субъекту.
[00108] Настоящее раскрытие обеспечивает способ получения высокоаффинных антител к MERS-CoV. Высокоаффинные антитела, полученные при иммунизации с наночастицами, раскрытыми в данном документе, получают путем введения животному иммуногенной композиции, содержащей наночастицу MERS-CoV, отбора у животного сыворотки и/или плазмы и очистки антитела от сыворотки и/или плазмы. В одном варианте осуществления животное представляет собой человека. В одном варианте осуществления животное представляет собой корову или лошадь. В другом варианте осуществления корова или лошадь является трансгенной. В еще одном варианте осуществления трансгенная корова или лошадь продуцирует человеческие антитела. В одном варианте осуществления способ дополнительно включает введение адъюванта или иммуностимулирующего соединения. В еще одном варианте осуществления очищенное высокоаффинное антитело вводят субъекту-человеку. В одном варианте осуществления субъект-человек подвержен риску инфекции MERS-CoV.
[00109] Наночастицы могут индуцировать устойчивый иммунитет у позвоночного (например, человека) при введении указанному позвоночному. Устойчивый иммунитет является результатом иммунного ответа против наночастиц, который защищает или облегчает тяжесть инфекции, или по меньшей мере уменьшает симптом вирусной инфекции у указанного позвоночного. В ряде случаев, если указанное позвоночное заражается, указанная инфекция будет бессимптомной. Ответ может представлять собой неполный защитный ответ. В этом случае, если указанное позвоночное инфицировано вирусом MERS CoV, позвоночное будет испытывать уменьшенные симптомы или симптомы более короткой продолжительности по сравнению с неиммунизированным позвоночным.
[00110] В одном варианте осуществления настоящее раскрытие обеспечивает способы индуцирования у субъекта устойчивого иммунитета к вирусной инфекции или по меньшей мере к одному ее симптому, включающие введение по меньшей мере одной эффективной дозы наночастицы. В одном варианте осуществления указанное индуцирование устойчивого иммунитета уменьшает продолжительность симптомов MERS. В еще одном варианте осуществления способ индуцирования у субъекта устойчивого иммунитета к вирусной инфекции или по меньшей мере к одному из ее симптомов включает введение по меньшей мере одной эффективной дозы наночастицы. В еще одном варианте осуществления указанный субъект является млекопитающим. В еще одном варианте осуществления указанное млекопитающее является человеком. В еще одном варианте осуществления указанная наночастица составлена с адъювантом или иммуностимулятором.
[00111] В вариантах осуществления доза каждого антигена, присутствующая в композиции, может составлять приблизительно 0,2 мкг, приблизительно 0,4 мкг, приблизительно 0,6 мкг, приблизительно 0,8 мкг, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 3 мкг, приблизительно 4 мкг, приблизительно 5 мкг, приблизительно 6 мкг, приблизительно 7 мкг, приблизительно 9 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 35 мкг, 40 мкг, приблизительно 45 мкг, приблизительно 50 мкг, приблизительно 60 мкг, приблизительно 70 мкг, приблизительно 80 мкг, приблизительно 90 мкг, приблизительно 100 мкг, приблизительно 110 мкг, приблизительно 120 мкг, приблизительно 130 мкг, приблизительно 140 мкг или приблизительно 150 мкг. Например, количество можно измерять в соответствии с содержанием белка Spike MERS. Например, 1 мкг наночастицы составляет приблизительно 1 мкг Spike MERS.
Антитела, получаемые при иммунизации наночастицами
[00112] Наночастицы, раскрытые в данном документе, индуцируют у хозяина продуцирование высокоаффинных антител к MERS-CoV. Эти высокоаффинные антитела к MERS-CoV демонстрируют более высокую аффинность, чем антитела к MERS-Co-V, полученные традиционными способами (например, с фаговым дисплеем; см. Zhang et al. 2014)).
[00113] Термин "аффинность" относится к силе взаимодействия между эпитопом и антигенсвязывающим сайтом антитела. Аффинность можно определить, например, с помощью уравнения:
 .
.
[00114] Где KA=константа аффинности; [Ab] = молярная концентрация незанятых сайтов связывания на антителе; [Ag] = молярная концентрация незанятых сайтов связывания на антигене и [Ab-Ag] = молярная концентрация комплекса антиген-антитело. KA описывает, сколько комплексов антиген-антитело существует в момент достижения равновесия. Время, необходимое для этого, зависит от скорости диффузии и одинаково для каждого антитела. Однако высокоаффинные антитела будут связывать большее количество антигена за более короткий период времени, чем низкоаффинные антитела. KA (константа аффинности) полученных антител может варьировать и находиться в диапазоне от приблизительно 105 моль-1 до приблизительно 1012 моль-1 или более. На KA могут влиять такие факторы, как pH, температура и буферная композиция.
[00115] Полученные антитела могут быть поликлональными антителами или моноклональными антителами. Аффинность моноклональных антител можно измерить точно, поскольку они являются однородными и селективными относительно одного эпитопа. Поликлональные антитела являются неоднородными и будут содержать смесь антител различной аффинности, распознающих несколько эпитопов - поэтому можно определить только среднюю аффинность.
[00116] Аффинность антител можно измерить с помощью любых средств, обычно используемых в данной области, включая без ограничения применение биосенсоров, таких как поверхностный плазмонный резонанс (например, Biacore). Единицы резонанса пропорциональны степени связывания растворимого лиганда с иммобилизированным рецептором (или растворимого антитела с иммобилизированным антигеном). Определение количества связывания при равновесии с различными известными концентрациями рецептора (антитела) и лиганда (белкового антигена) позволяет рассчитать константы равновесия (KA, KD) и скорости диссоциации и ассоциации (koff, kon).
[00117] Например, KD (равновесная константа диссоциации) представляет собой соотношение koff/kon антитела и его антигена. KD и аффинность имеют обратную зависимость. Более низкое значение KD (более низкая концентрация антитела), более высокая аффинность антитела. Большинство антител имеют значения KD в низком от микромолярного (10-6) до наномолярного (10-7 до 10-9) диапазона. Высокоаффинные антитела, как правило, рассматриваются как находящиеся в низком наномолярном диапазоне (10-9) с в значительной степени высокоаффинными антителами, находящимися в пикомолярном (10-12) диапазоне или ниже (например, диапазон от 10-13 до 10-14). В одном из вариантов осуществления антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют KD в диапазоне от приблизительно 10-6 до приблизительно 10-15, от приблизительно 10-7 до приблизительною 10-15, от приблизительно 10-8 до приблизительно 10-15 и от приблизительно 10-9 до приблизительно 10-15, от приблизительно 10-10 до приблизительно 10-15, от приблизительно 10-11 до приблизительно 10-15, от приблизительно 10-12 до приблизительно 10-15, от приблизительно 10-13 до приблизительно 10-14, от приблизительно 10-13 до приблизительно 10-15 и от приблизительно 10-14 до приблизительно 10-15. В предпочтительном варианте осуществления антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют KD в диапазоне от приблизительно 10-10 до приблизительно 10-14.
[00118] Антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют низкую степень диссоциации (Koff), что указывает на их тесную связь с антигеном. В одном из вариантов осуществления антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют Koff в диапазоне от приблизительно 10-3 М-1 до приблизительно 10-13 М-1, от приблизительно 10-5 М-1 до приблизительно 10-13 М-1, от приблизительно 10-6 М-1 до приблизительно 10-13 М-1, от приблизительно 10-7 М-1 до приблизительно 10-13 М-1, от приблизительно 10-8 М-1 до приблизительно 10-13 М-1, от приблизительно 10-9 М-1 до приблизительно 10-13 М-1, от приблизительно 10-10 М-1 до приблизительно 10-13 М-1, от приблизительно 10-11 М-1 до приблизительно 10-13 М-1 или от приблизительно 10-12 М-1 до приблизительно 10-13 М-1. В еще одном варианте осуществления антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют Koff в диапазоне от приблизительно 10-4 М-1 до приблизительно 10-10 М-1, от приблизительно 10-4 М-1 до приблизительно 10-9 М-1 или от приблизительно 10-4 М-1 до приблизительно 10-8 М-1.
[00119] Антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют высокую степень ассоциации (Kon), что указывает на их плотное связывание с антигеном. В одном из вариантов осуществления антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, имеют Kon в диапазоне от приблизительно 103 М до приблизительно 108 М, от приблизительно 104 М до приблизительно 107 М, от приблизительно 104 М до приблизительно 106 М, от приблизительно 104 М до приблизительно 105 М, от приблизительно 105 М до приблизительно 107 М или от приблизительно 105 М до приблизительно 106 М.
[00120] Антитела, полученные при иммунизации наночастицами, раскрытыми в данном документе, нейтрализуют вирус MERS-CoV. Антитела могут быть нейтрализующими антителами широкого спектра и нейтрализоввать один или более штаммов вируса MERS-CoV, клад или коронавирусов, или антитела могут нейтрализовать только один штамм вируса MERS-CoV. Нейтрализующую способность антител можно измерить с помощью любых средств, обычно используемых в данной области, включая без ограничения тест нейтрализации по снижению флуоресценции (FRNT50), клеточные анализы in vitro, в которых измеряют количество вирионов, высвободившихся из иммунизированных клеток, и анализы in vivo, в которых оценивают инфекцию у иммунизированного животного.
[00121] Настоящее раскрытие дополнительно проиллюстрировано следующими примерами, которые не должны толковаться как ограничивающие. Содержание всех ссылок, патентов и опубликованных заявок на патент, процитированных на протяжении настоящей заявки, а также фигуры включены посредством ссылки во всей своей полноте для всех целей.
Пример 1.
Получение наночастиц Spike MERS CoV
[00122] Наночастицы получали при помощи сверхэкспрессии белка Spike MERS CoV (фигуры 8 и 9) в бакуловирусе в клетках Sf9. После очистки белок Spike, входящий в состав VLP-наночастиц, извлекали преимущественно в форме тримера (фигуры 4 и 6).
Пример 2.
Индукция иммунного ответа при помощи наночастиц Spike MERS CoV
[00123] VLP вводили мышам, как показано на фигуре 5. В конце 45-дневного периода у мышей отбирали кровь для оценки иммунного ответа. На фигуре 7 проиллюстрированы титры нейтрализующих антител у мышей, которым вводили VLP-наночастицы Spike SARS CoV или VLP-наночастицы Spike MERS CoV. Наиболее высокий ответ получали при использовании адъюванта Matrix M1.
Пример 3.
Высокоактивный человеческий иммуноглобулин к MERS-CoV, полученный из трансхромосомных коров, ингибирует MERS-CoV In Vivo
[00124] Для того, чтобы продемонстрировать способность антител hIgG к MERS CoV и иммуноглобулина, полученного из Tc-коров после вакцинации, нейтрализовать MERS CoV in vitro и in vivo, вводили три экспериментальные вакцины против MERS CoV трем отдельным группам Tc-коров для индукции высоких титров нейтрализующих антител к MERS CoV. Первая протестированная вакцина представляла собой вакцину на основе цельного убитого вириона (WKV) MERS-CoV штамма Jordan (клады А), вторая представляла собой вакцину на основе наночастиц Spike (SN) MERS-CoV Al-Hasa (клады В), а третья представляла собой вакцину на основе пДНК, кодирующей белок Spike MERS-CoV Al-Hasa. В анализе in vitro было обнаружено, что вакцина на основе пДНК характеризуется слабой иммуногенностью, и ее в дальнейшем не оценивали (данные не представлены). Однако сыворотка реконвалесцентов и высокоочищенный иммуноглобулин hIgG от вакцинированных как с использованием WKV (названный SAB-300), так и с использованием SN (названный SAB-301) Tc-коров, были способны к перекрестной нейтрализации вируса in vitro, не вызывали антитело-зависимое проникновение вируса MERS-CoV в человеческие В-клетки Raji и быстро устраняли вирусную инфекцию (штамм Erasmus) в мышиной модели MERS-CoV с трансдукцией Ad5-hDPP4.
СПОСОБЫ И МАТЕРИАЛЫ
ИССЛЕДОВАНИЯ НА ЖИВОТНЫХ
Клонирование трансхромосомных (Тс) коров и получение антител
[00125] Tc-коров получали, как описано в Matsushita et al. PLoS One, 2014. 9(3): p. e90383, Sano et al. PLoS One, 2013. 8(10): p. e78119 и Kuroiwa, et al., Nat Biotechnol, 2009. 27(2): p. 173-81. Вкратце, Tc-коровы, использованные в данном исследовании, являются гомозиготными по тройному нокауту в генах эндогенных иммуноглобулинов коров (IGHM-/- IGHML1-/- IGL-/-) и несут человеческую искусственную хромосому (НАС), состоящую из фрагмента хромосомы 14 человека, который содержит полный локус тяжелой цепи иммуноглобулина человека, и фрагмента хромосомы 2 человека, который содержит полный локус легкой каппа-цепи иммуноглобулина человека.
Получение цельного инактивированного вириона
[00126] Цельные инактивированные вирионы MERS-CoV получали для вакцинации путем отбора среды из клеток Vero CCL-81, инфицированных штаммом Jordan-N3/2012 (GenBank KC776174.1). MERS-CoV, в количестве 4×108 БОЕ, облучали кобальтовым источником до достижения дозы 6 Мрад. Проводили испытание безопасности материала после инактивации. Каких-либо специфических сигнальных последовательностей MERS-CoV в облученном материале пассажей не обнаружили.
Получение наночастиц Spike MERS-CoV
[00127] Получали очищенные наночастицы белка Spike MERS-CoV штамма Al-Hasa, как описано в Coleman et al. 2014. Вкратце, клетки Sf9 при 2-3×106 клеток/мл инфицировали специфическим рекомбинантным бакуловирусом. Инфицированные клетки Sf9 инкубировали при непрерывном перемешивании при температуре 27±2°C и собирали в 68-72 часа после инфицирования путем центрифугирования при 4000 g в течение 15 минут. Белки Spike экстрагировали из клеточных мембран с помощью неионогенного детергента, и нерастворимый материал удаляли путем центрифугирования при 10000 g в течение 30 минут. Агрегаты белка Spike очищали с использованием комбинации анионообменной, аффинной и эксклюзионной хроматографии. Во время очистки большую часть детергентов удаляли, позволяя тримерам белка Spike сформировать белок-белковые мицеллярные наночастицы более высокого порядка. Очищенные наночастицы Spike профильтровывали через 0,2 мкм и хранили при -80°C.
Вакцинация Tc-коров
[00128] Как показано на фигуре 10А, трех Tc-коров в группе 1 (#2244; #2252 и #2254) иммунизировали цельным убитым вирусом (WKV) MERS-CoV при 1-2×108 PPF/доза, составленным с адъювантом Montanide ISA 25 (Seppic) в виде эмульсии типа "масло в воде" с добавлением извлеченного из сапонина иммуностимулятора Quil A (Accurate Chemicals). Двух Tc-коров в группе 2 (#2178 и #2183) иммунизировали наночастицей рекомбинантного белка (SN) MERS-CoV при 2 мг/доза, составленной с адъювантом Montanide ISA 206 в виде эмульсии типа "вода в масле в воде" с добавлением Quil А. Tc-коров в обеих группах иммунизировали 5 раз с интервалами от трех до четырех недель.
Провокационные испытания in vivo с MERS-CoV у мышей, трансдуцированных аденовирусом/hDPP4
[00129] Трансдуцированных hDPP4 мышей BALB/c инфицировали MERS-CoV, штамм Erasmus. Вкратце, BALB/c внутрибрюшинно вводили 100 или 500 мкг отрицательного контроля или тестируемого иммуноглобулина, собранного у коров (SAB-300 или SAB-301). Через двенадцать часов мышей инфицировали интраназально MERS-CoV (1×105 БОЕ) в общем объеме 50 мкл. Для получения титров вируса легкие отбирали и помещали в PBS и гомогенизировали с помощью ручного гомогенизатора. Вирус титровали на клетках Vero 81. Титры вируса выражали как БОЕ/г ткани для MERS-CoV.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка антиген-специфического hIgG, полученного от Tc-животных
[00130] Анализы ELISA, специфичные относительно белка Spike MERS-CoV, проводили для оценки специфического к антигену ответа hIgG у Tc-коров после иммунизации с использованием WKV или SN (фигура 10В), и SAB-300, и SAB-301 (фигура 10С). Результаты ELISA продемонстрировали надежный специфичный ответ hIgG на Spike MERS-CoV при второй вакцинации (V2) и сохраняющиеся высокие титры до последней иммунизации (V5) как для сыворотки, так и для SAB-300 и SAB-301 (фигура 10). Эти данные указывают, что hIgG-антитела с высоким титром, целенаправленно воздействующие на белки MERS-CoV, получены у Tc-коров, иммунизированных с использованием WKV или SN, и что оба иммуноглобулина сохраняют активность после очистки.
Нейтрализация MERS-CoV in vitro с использованием сывороток, SAB-300 и SAB-301
Реакция нейтрализации со снижением флуоресценции - 50% снижение (FRNT50)
[00131] Два анализа нейтрализации проводили для выявления потенциала нейтрализации у SAB-300 и SAB-301 in vitro. Исследовали способность сыворотки от вакцинированных коров, SAB-300 и SAB-301 ингибировать инфекцию MERS-CoV in vitro с использованием реакции нейтрализации со снижением флуоресценции (FRNT50) и анализа нейтрализации вирусной инфекции. Анализ FRNT с использованием флуоресценции характеризует инфекцию, а анализ нейтрализации вирусной инфекции характеризует жизнеспособность клеток.
[00132] Анализ FRNT50 проводили с сыворотками от вакцинированных коров (фигура 11А), и SAB-300, и SAB-301 (фигура 11В). Обнаружили, что корова #2244 в V2 продуцировала нейтрализующее антитело с высоким титром, как и в V2 от коров #2178 и #2183. По сравнению с равным количеством положительного контрольного кроличьего антитела к Spike, которое аффинно очищено антигеном, сыворотки крови Тс коров в V2 являются в значительной степени более нейтрализующими. Эти данные согласуются с результатами антиген-специфичного ELISA на фигуре 10В. Затем SAB-300, очищенный hIgG от коровы #2244 в V2, и SAB-301, очищенный hIgG из V2 от #2178 и #2183, тестировали на в отношении нейтрализации в таком же анализе FRNT50. Полученные данные показывают, что SAB-300 и SAB-301 генерируют аналогичные высокие уровни титров нейтрализующих антител (фигура 11С). По сравнению с равными количествами положительного контрольного аффинно очищенного антигеном кроличьего антитела к Spike оба очищенных препарата hIgG были высоко эффективными в отношении нейтрализации MERS-CoV, демонстрируя, что как SAB-300, так и SAB-301 были способны ингибировать инфекцию MERS-CoV in vitro.
[00133] Кроме того, SAB-300 и SAB-301 вызывали выраженную нейтрализацию MERS-CoV, выращенного в клетках Vero Е6, тогда как неспецифическая контрольная сыворотка не оказывала существенного влияния на инфекцию MERS-CoV клеток Vero Е6 (фигура 12А). Уровни инфекционного MERS-CoV, выделенного из клеток, инфицированных MERS-CoV, предварительно обработанного SAB-300, были ниже предела обнаружения анализа (158 TCID50/мл; фигура 12А), указывая на то, что SAB-300 является очень сильным нейтрализующим антителом. Уровни инфекционного MERS-CoV, выделенного из клеток, инфицированных MERS-CoV, предварительно обработанного SAB-301, были ниже предела обнаружения анализа (158 TCID50/мл; фигура 12А) при всех разведения, кроме 1:8000 и 1:16000, что свидетельствует о том, что сывороточное SAB-301 является высокоактивным нейтрализующим антителом, но не в такой степени ингибирующим, как SAB-300.
SAB-300 и SAB-301 не вызывают антителозависимогоусиления MERS-CoV
[00134] Для демонстрации того, что вирусы MERS-CoV, связанные с антителами, не создают возможность проникновения вириона в клетки, которые обычно не инфицируются, клетки Raji, иммортализированную линию В-клеток человека, которую, как правило, не инфицирует MERS-CoV, тестировали, чтобы выяснить, может ли присутствие антител к MERS приводить к транскрипции вирусной РНК и высвобождению живого вируса. Клетки Raji инфицировали MERS-CoV, предварительно инкубированным с SAB-300 и SAB-301 (фигура 12 В). ОТ-ПЦР для вирусной мРНК и анализы по TCID50 проводили на средах через 48 часов после инфицирования для исследования инфекции. Анализ TCID50 не выявил MERS-CoV, высвободившегося из клеток Raji, указывая, что они не были инфицированы MERS-CoV. И наоборот, в данном анализе было обнаружено, что обработанные аналогичным образом клетки Vero Е6, которые как правило инфицируются MERS-CoV, продуцируют высокие уровни вируса через 48 часов после инфицирования (данные не показаны). Для того, чтобы определить, обнаруживалась ли РНК MERS-CoV в клетках Raji, инфицированных MERS-CoV, после предварительной инкубации с SAB-300 и SAB-301, РНК экстрагировали из инфицированных клеток и анализировали с помощью ПЦР Taqman в режиме реального времени с праймерами, специфичными к вновь транскрибированной РНК MERS-CoV (лидерный праймер) (фигура 12В). Не выявили какого-либо значимого уровня вновь транскрибированной вирусной РНК MERS-CoV (набор лидерных праймеров) в клетках Raji, инфицированных только MERS-CoV, обработанных неспецифическим hIgG отрицательного контроля, выделенным из плазмы до вакцинации, или в клетках, инфицированных MERS-CoV, предварительно обработанных SAB-300 или SAB-301. Эти данные свидетельствуют о том, что антителозависимое усиление инфекции MERS-CoV, вызванное SAB-300 или SAB-301, отсутствует.
Ингибирование репликации MERS-CoV in vivo
[00135] Тестировали эффективность SAB-300 и SAB-301 на мышиной модели MERS-CoV. Мыши являются непермиссивными по отношению к MERS-CoV; однако при трансдукции с аденовирусом, экспрессирующим рецептор MERS-CoV, дипептидилпептидазу 4 человека (hDPP4), они становятся пермиссивными и в них происходит репликация вируса (Zhao, et al., Proc Natl Acad Sci USA, 2014. 111(13): p. 4970-5). Для тестирования противовирусной активности Tc-антител мышей BALB/c (6-8 недель) трансдуцировали интраназально с использованием 2,5×108 БОЕ Ad5-hDPP4 в 75 мкл PBS. Через 5 дней после трансдукции мышей обрабатывали путем внутрибрюшинного введения одной дозы 100 или 500 мкг контрольного hIgG, SAB-300 или SAB-301. Двенадцать часов спустя мышей инфицировали интраназально с использованием MERS-CoV (1×105 БОЕ) в общем объеме 50 мкл. Никаких дополнительных введений антитела не проводили на протяжении 5-дневного течения инфекции. На 1-й, 3-й и 5-й дни после инфицирования мышей умерщвляли и анализировали их легкие. Для получения титров вируса легкие гомогенизировали в PBS с помощью ручного гомогенизатора, осветляли путем центрифугирования и титровали на клетках Vero (фигура 13). Титры ~1×106 БОЕ/мг ткани легкого обнаруживали в легких группы без обработки и группы, получающей человеческий IgG отрицательного контроля, в 1-й и 3-й дни после инфицирования с падением титров до 1×105 на 5-й день после инфицирования. У мышей с введением 100 мкг или 500 мкг SAB-300 обнаруживали ~50-кратное или 500-кратное снижение, соответственно, титров вируса на 1-й день после инфицирования по сравнению с группой контрольного введения hIgG (фигура 13А). К 3-му дню после инфицирования снижение титра вируса для группы 100 мкг было ~5000-кратным, тогда как титры у мышей, получивших 500 мкг, были ниже уровня обнаружения. На 5-й день после инфицирования титры вируса в обеих обработанных группах были ниже уровня обнаружения (фигура 13А). Аналогичное снижение титра вируса установили для антитела SAB-301 за исключением того, что легочные титры были несколько выше в 1-й день после инфицирования по сравнению с мышами, обработанными SAB-300 (фигура 13В). К 5-му дню после инфицирования все мыши, обработанные SAB-301, имели титры вируса ниже уровня обнаружения (фигура 13В). Эти данные демонстрируют, что как SAB-300, так и SAB-301 были способны защитить мышей от инфекции MERS-CoV с помощью однократной профилактической инъекции.
Пример 4.
Анализ BIACORE антител у животных, иммунизированных наночастицами белка Spike (S) MERS-CoV
[00136] Авидность двух антител от двух Tc-коров (#2178 и 2183), иммунизированных вакциной на основе наночастиц S MERS-CoV, после серии иммунизаций, как показано на фигуре 10А и в примере 3, тестировали с использованием анализа аффинности к S (Biacore™). Тестировали авидность антител в сыворотке данных животных после 3-й вакцинации (v3), 4-й вакцинации (v4) и 5-й вакцинации (v5). Вкратце, посредством белка A/G, связанного через аминогруппу с чипом СМ5, сывороточный IgG от Tc-коров захватывался в проточной кювете. Антиген белка Spike MERS в концентрации 0, 20 и 40 нМ вводили в проточную кювету в течение 180 секунд с последующей диссоциацией в течение 600 секунд. Использовали модель сглаживания 1:1. Скорости ассоциации и диссоциации измеряли в зависимости от времени и наносили на сенсограмму, и рассчитывали константу диссоциации по скоростям ассоциации и диссоциации. Результаты показаны на фигуре 14 и в таблице 1.
[00137] В таблице 2 показана аффинность моноклональных антител (mAb) к S1, полученных с помощью фагового дисплея, как раскрыто в Ying et al. J. Virol. (2014). Сравнение данных этих двух таблиц демонстрирует, что заявленная KD и скорости Koff антитела для mAb к MERS-CoV, полученных с помощью фагового дисплея, на несколько порядков меньше, чем у поликлональных ответов к S, индуцированных у Tc-коровы.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[00138] Специалисты в данной области определят или будут способны установить с использованием всего лишь рутинных экспериментов множество эквивалентов специфических вариантов осуществления, описанных в данном документе. Такие эквиваленты охватываются формулой изобретения, представленной в данном документе.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00139] Данная заявка включает посредством ссылки все публикации или ссылки, раскрытые в данном документе, для всех целей во всей их полноте.
[00140] Данная заявка включает посредством ссылки для всех целей во всей полноте следующе документы: заявка на патент США с регистрационным №12/306965, поданная 27 июня 2007 года, заявка на патент США с регистрационным №61/015440, поданная 20 декабря 2007 года, заявка на патент США с регистрационным №11/582540, поданная 18 октября 2006 года, заявка на патент США с регистрационным №12/633995, поданная 18 октября 2006 года, заявки на патент США с регистрационным №60/727513, поданная 18 октября 2005 года; 60/780847, поданная 10 марта 2006 года; 60/800006, поданная 15 мая 2006 года; 60/831196, поданная 17 июля 2006 года; 60/832116, поданная 21 июля 2006 года, и 60/845495, поданная 19 сентября 2006 года, и 10/617569, поданная 11 июля 2003 года.
Ссылочные материалы
1. Berglund P., Fleeton M.N., Smerdou С. and Liljestrom, P. (1999). Immunization with recombinant Semliki Forest virus induces protection against influenza challenge in mice. Vaccine 17, 497-507.
2. Cox J.C. and Coulter A.R. (1997). Adjuvants--a classification and review of their modes of action. Vaccine 15, 248-256.
3. Crawford J., Wilkinson В., Vosnesensky A., Smith G., Garcia M., Stone H. and Perdue M. L. (1999). Baculovirus-derived hemagglutinin vaccines protect against lethal influenza infections by avian H5 and H7 subtypes. Vaccine 17, 2265-2274.
4. Crowther R.A., Kiselev N.A., Bottcher В., Berriman J.A., Borisova G.P., Ose V., Pumpens P. (1994). Three-dimensional structure of hepatitis В virus core particles determined by electron cryomicroscopy. Cell 17, 943-50.
5. Gomez-Puertas P., Mena I., Castillo M., Vivo A., Perez-Pastrana E. and Portela, A. (1999). Efficient formation of influenza virus-like particles: dependence on the expression levels of viral proteins. J. Gen. Virol. 80, 1635-1645.
6. Johansson В.E. (1999). Immunization with influenza A virus hemagglutinin and neuraminidase produced in recombinant baculovirus results in a balanced and broadened immune response superior to conventional vaccine. Vaccine 17, 2073-2080.
7. Lakey D.L., Treanor J.J., Betts B.F., Smith G.E., Thompson J., Sannella E., Reed G., Wilkinson В.E. and Wright P.E. (1996) Recombinant baculovirus influenza A hemagglutinin vaccines are well tolerated and immunogenic in healthy adults. J. Infect. Dis. 174, 838-841.
8. Latham T. and Galarza J.M. (2001). Formation of wild-type and chimeric influenza virus-like particles following simultaneous expression of only four structural proteins. J. Virol. 75, 6154-6165.
9. Mena I., Vivo A., Perez E. and Portela A. (1996). Rescue of a synthetic chloramphenicol acetyltransferase RNA into influenza-like particles obtained from recombinant plasmids. J. Virol. 70, 5016-5024.
10. Murphy B.R. and Webster R.G. (1996). Orthomyxoviruses. В "Virology" (D.M.K.B.N. Fields, P.M. Howley, Eds.) Vol. 1, pp. 1397-1445. Lippincott-Raven, Philadelphia.
11. Neumann G, Watanabe T. and Kawaoka Y. (2000). Plasmid-driven formation of influenza virus-like particles. J. Virol. 74, 547-551.
12. Olsen C.W., McGregor M.W., Dybdahl-Sissoko N., Schram B.R, Nelson K. M., Lunn D. P., Macklin M.D. and Swain W.F. (1997). Immunogenicity and efficacy of baculovirus-expressed and DNA-based equine influenza virus hemagglutinin vaccines in mice. Vaccine 15, 1149-1156.
13. Peiris J.S., Guan Y., Markwell D., Ghose P., Webster R.G. and Shortridge K.F. (2001). Cocirculation of avian H9N2 and contemporary "human" H3N2 influenza A viruses in pigs in southwestern China: potential for genetic reassortment? J. Virol. 75, 9679-9686.
14. Pumpens P. and Grens E. (2003). Artificial genes for chimeric virus-like particles. B: "Artificial DNA" (Khudyakov Y.E. и Fields H.A., Eds) pp. 249-327. CRC Press, New York.
15. Pushko P., Parker M., Ludwig G.V., Davis N.L., Johnston R.E. and Smith J.F. (1997). Replicon-helper systems from attenuated Venezuelan equine encephalitis virus: expression of heterologous genes in vitro and immunization against heterologous pathogens in vivo. Virology 239, 389-401.
16. Slepushkin V.A., Katz J.M., Black R.A., Gamble W.C, Rota P.A. and Cox N.J. (1995). Protection of mice against influenza A virus challenged by vaccination with baculovirus-expressed M2 protein. Vaccine 13, 1399-1402.
17. Treanor J.J., Betts R.F., Smith G.E., Anderson E.L., Hackett C.S., Wilkinson В.E., Belshe R.B. and Powers D.C. (1996). Evaluation of a recombinant hemagglutinin expressed in insect cells as an influenza vaccine in young and elderly adults. J. Infect. Dis. 173, 1467-1470.
18. Tsuji M., et al. (1998). Recombinant Sindbis viruses expressing a cytotoxic T-lymphocyte epitope of a malaria parasite or of influenza virus elicit protection against the corresponding pathogen in mice. J. Virol. 72, 6907-6910.
19. Ulmer, J.В., et al. (1993). Heterologous protection against influenza by injection of DNA encoding a viral protein. Science 259, 1745-1749.
20. Ulmer, J.В., et al. (1998). Protective CD4+ and CD8+ T cells against influenza virus induced by vaccination with nucleoprotein DNA. J. Virol. 72, 5648-5653.
21. Watanabe Т., Watanabe S., Neumann G. и Kawaoka Y. (2002) Immunogenicity and protective efficacy of replication-incompetent influenza virus-like particles. J. Virol. 76, 767-773.
22. Zhou, X., et al. (1995). Generation of cytotoxic and humoral immune responses by non-replicative recombinant Semliki Forest virus. Proc. Natl. Acad. Sci. USA 92, 3009-3013.
23. Zabel et al. (2014). Viral Particles Drive Rapid Differentiation of Memory В Cells into Secondary Plasma Cells Producing Increased Levels of Antibodies. J. Immunol. 192: 5499-5508.
24. Zhang et al. (2000). HPV6b virus like particles are potent immunogens without adjuvant in man. Vaccine. 18: 1051-8.