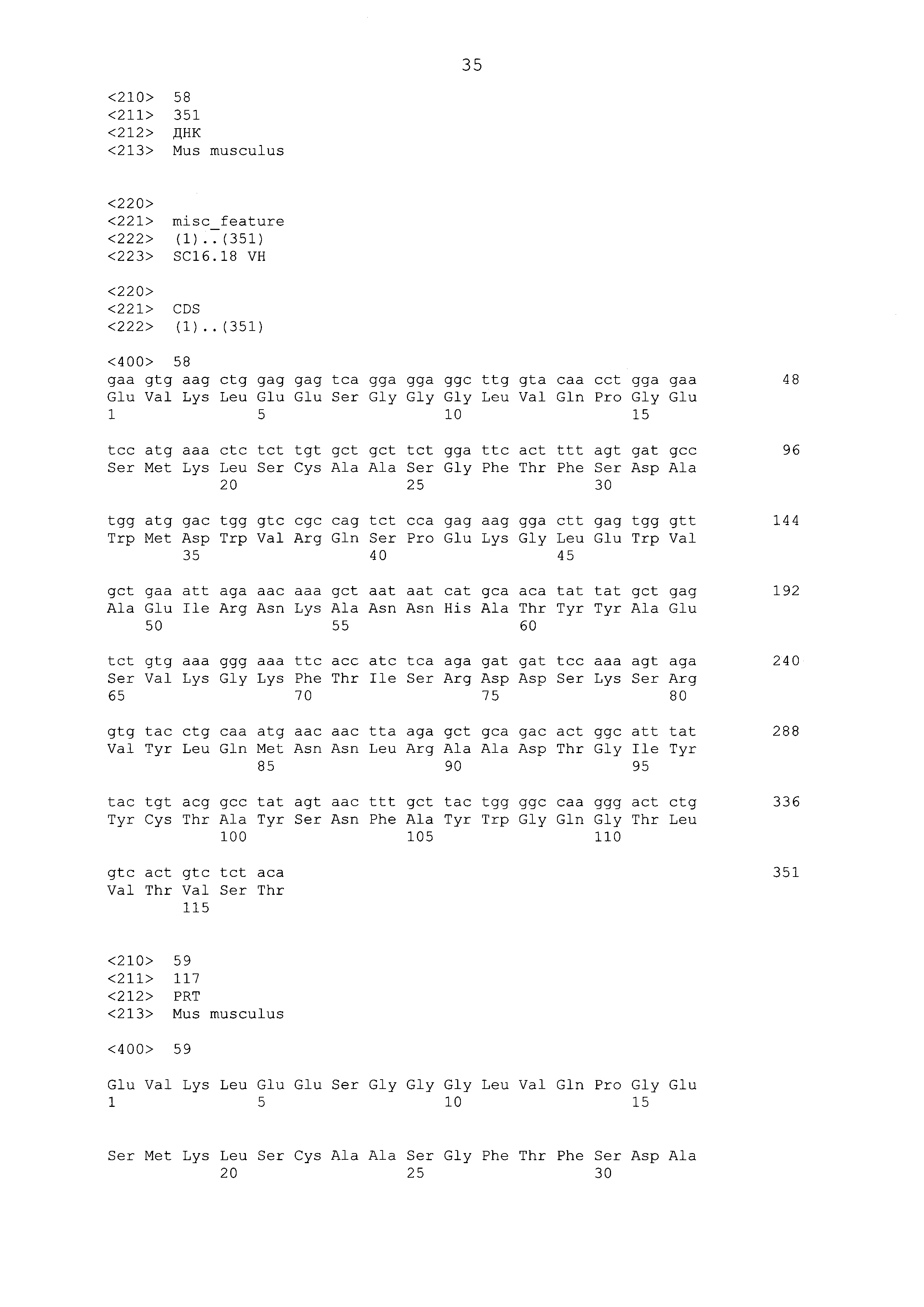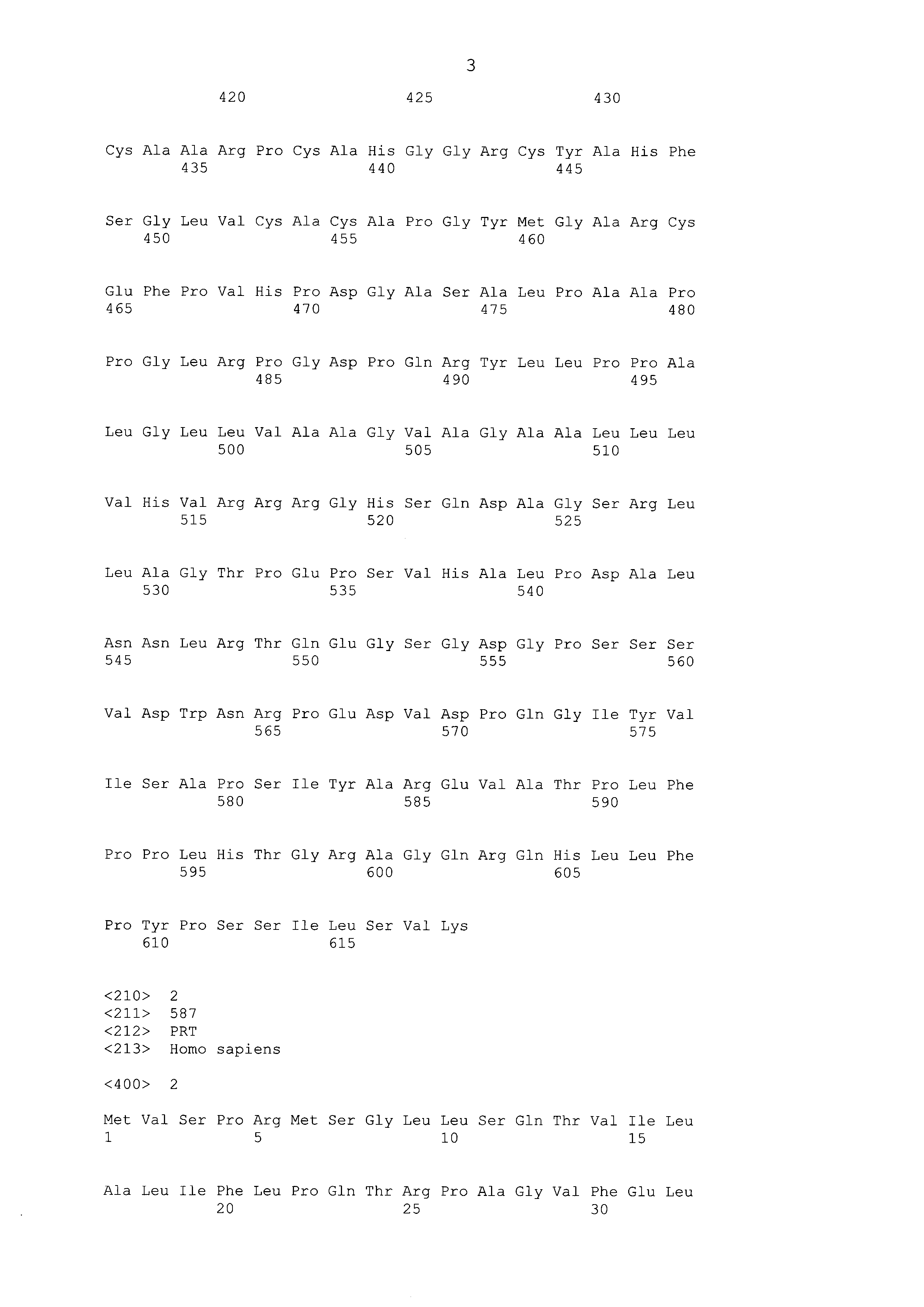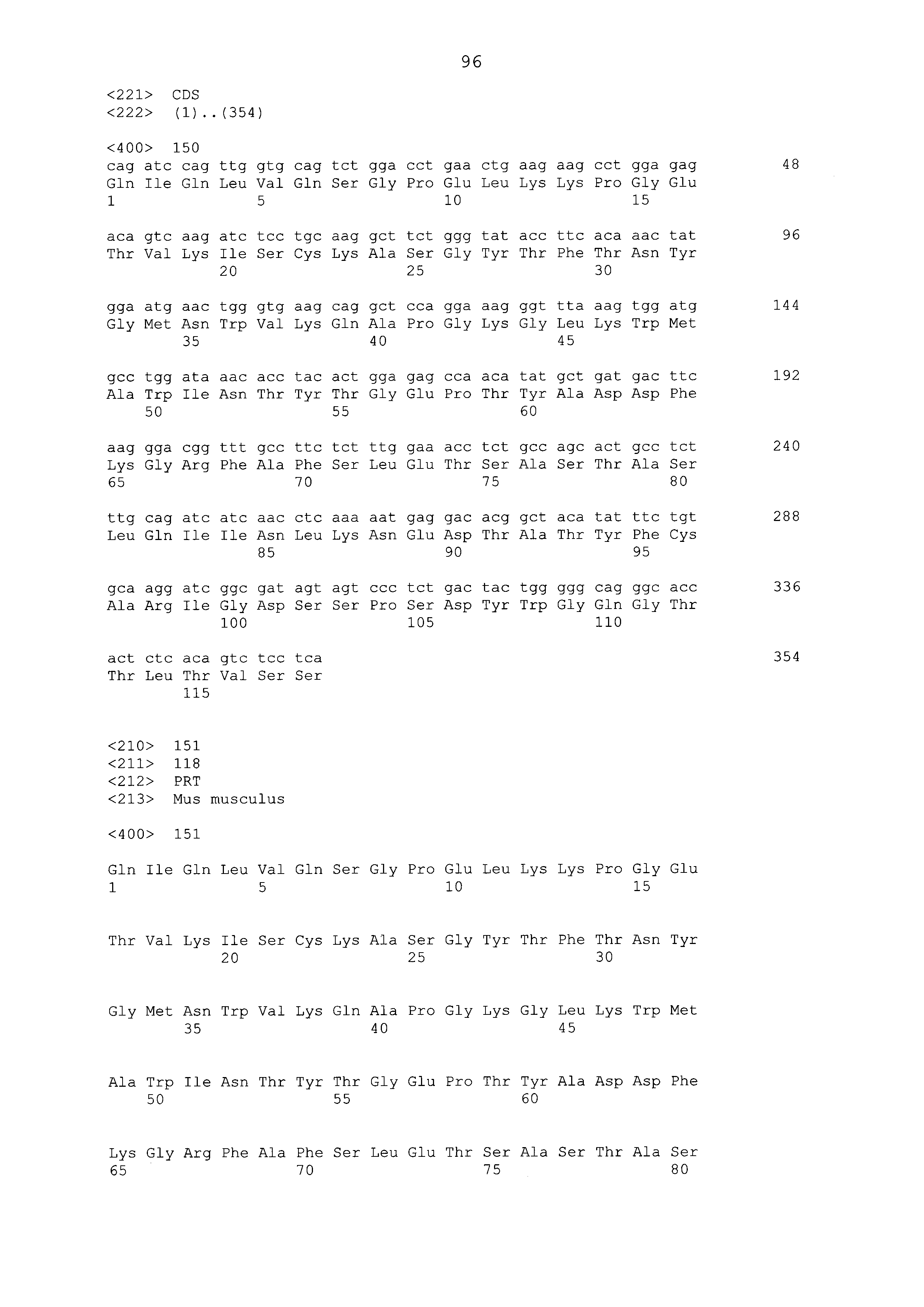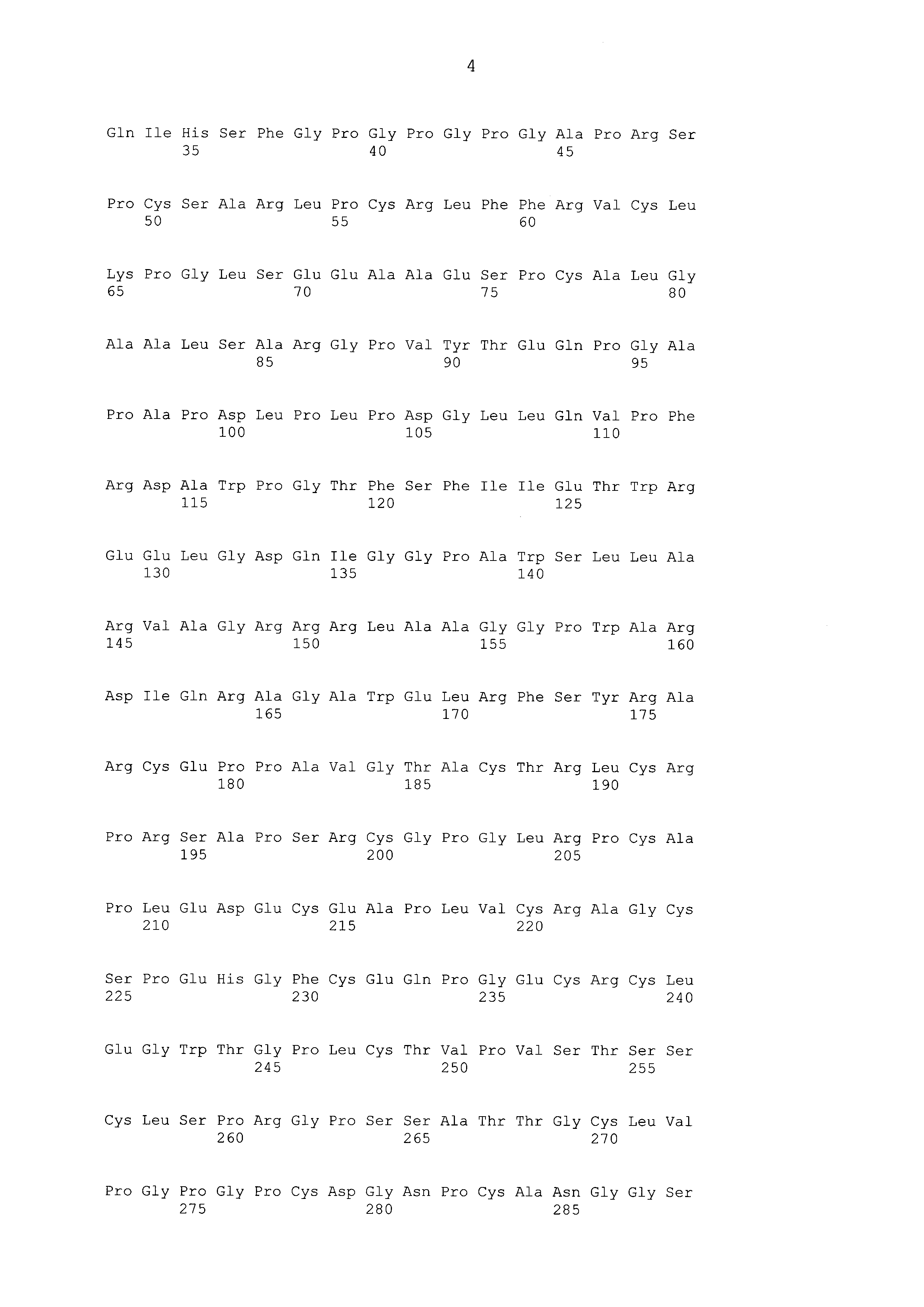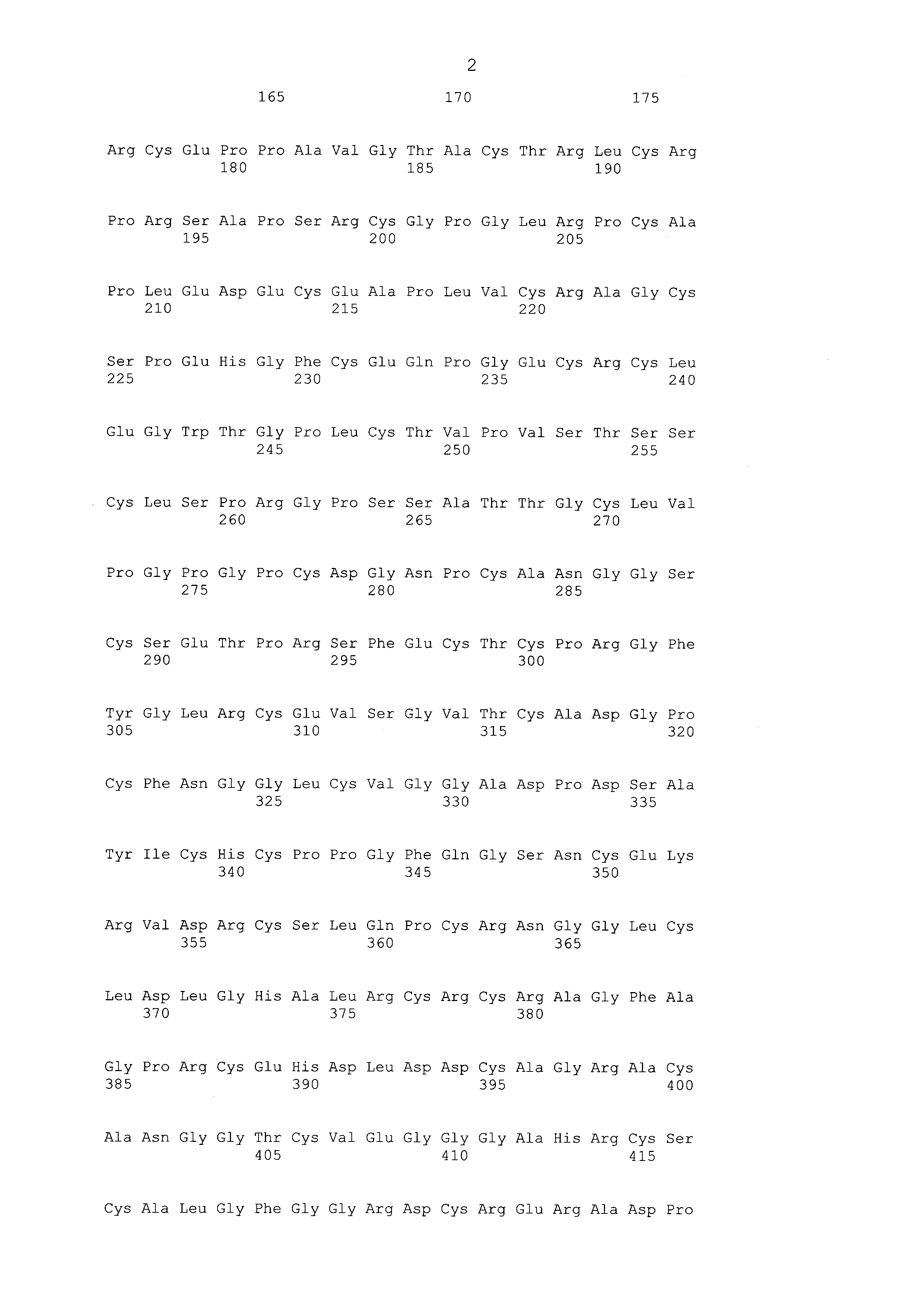Результат интеллектуальной деятельности: НОВЫЕ КОНЪЮГАТЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ЗАЯВКИ ПО ПЕРЕКРЕСТНЫМ ССЫЛКАМ
По данной заявке испрашивается приоритет по Предварительной Заявке США № 61/768368, поданной 22 февраля 2013 года, которая полностью включена в данный документ посредством ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Рассматриваемая заявка содержит список последовательностей, который был представлен в формате ASCII через EFS-Web, и, таким образом, полностью включен в данный документ посредством ссылки. Указанная ASCII копия, созданная 15 Февраля 2014 г, имеет название S69697_1110WO_ST25.txt и имеет размер 582 Кб (596345 байт).
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данная заявка, в целом, относится к новым соединениям, содержащим анти-DLL3 антитела или их иммунореактивные фрагменты, конъюгированные с пирролобензодиазепинами (ПБД), и применению таких новых соединений для лечения или профилактики злокачественного новообразования и любого его повторного проявления или метастазирования.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Дифференциация и пролиферация стволовых клеток и клеток-предшественников представляют собой нормальные перманентные процессы, которые действуют согласованно, чтобы поддержать тканевой рост во время органогенеза, восстановления клеток и замены клеток. Система является строго регулируемой, чтобы гарантировать то, что гененрируются только соответствующие сигналы на основании потребностей организма. Пролиферация и дифференциация клеток происходят нормально, только в объеме, необходимом для замены поврежденных или умирающих клеток или для роста. Однако, дестабилизация этих процессов может инициироваться множеством факторов, включающих недо- или сверхраспространенность различных сигнальных химических веществ, присутствие измененных микроокружений, генетические мутации или их комбинацию. Дестабилизация нормальной клеточной пролиферации и/или дифференциации может приводить к различным нарушениям, включающим пролиферативные заболевания, такие как злокачественное новообразование.
Общепринятые терапии злокачественного новообразования включают химиотерапию, лучевую терапию и иммунотерапию. Часто эти терапии являются неэффективными, а хирургическая резекция могут не обеспечивать жизнеспособную клиническую альтернативу. Ограничения современного стандарта клинической практики являются особенно очевидными в тех случаях, где пациенты проходят через терапию певой линии и в последующем рецидивируют. В таких случаях часто возникают рефрактерные опухоли, часто агрессивные и неизлечимые. Показатели общей выживаемости для многих солидных опухолей остаются в значительной степени неизменными в течение многих лет вследствие, по меньшей мере частично, невозможности существующих терапий предотвратить рецидив, повторное проявление опухоли и метастазирование. Терапевтические ограничения принятых в настоящее время доступных способов лечения выдвинули на первый план необходимость разрабатывать новые средства, которые эффективно целенаправленно действуют на онкогенные клетки и устраняют их с поддающимся коррекции побочным эффектом.
Одна перспективная область для разработки таких средств и относящихся к ним способам лечения включает в себя прицельные терапии с использованием антител. В данной связи терапия антителами была установлена для целенаправленного лечения пациентов со злокачественным новообразованием, иммунологическими и ангиогенными нарушениями (Carter, P. (2006) Nature Reviews Immunology 6:343-357). Более конкретно, было показано, что применение конъюгатов антитела с лекарственным средством (т.е., ADC или иммуноконъюгатов), содержащих компонент целенаправленного средства связывания с клеткой и компонент полезной нагрузки лекарственным средством для локализированной доставки цитотоксических или цитостатических средств, инициирует внутриклеточное накопление лекарственного внутри опухолевых клеток. Такая локализация обеспечивает относительно высокие концентрации лекарственного средства внутри опухоли, в то время как системное введение неконъюгированного (т.е., нецеленаправленного) лекарственного средства для достижения такой же концентрации в опухоли может приводить к неприемлемым уровням токсичности для нормальных клеток (Xie et al (2006) Expert. Opin. Biol. Ther. 6(3):281-291; Kovtun et al (2006) Cancer Res. 66(6):3214-3121; Law et al (2006) Cancer Res. 66(4):2328-2337; Wu et al (2005) Nature Biotech. 23(9):1137-1145; Lambert J. (2005) Current Opin. in Pharmacol. 5:543-549; Hamann P. (2005) Expert Opin. Ther. Patents 15(9):1087-1103; Payne, G. (2003) Cancer Cell 3:207-212; Trail et al (2003) Cancer Immunol. Immunother. 52:328-337; Syrigos and Epenetos (1999) Anticancer Research 19:605-614).
С клинической точки зрения такие конъюгаты антитела с лекарственным средством могут, таким образом, обеспечивать увеличенную эффективность действия вместе с соответствующим снижением токичности. Усилия по конструированию и очистке ADC были сконцентрированы на селективности моноклональных антитела (mAbs), а также на выяснении механизма действия лекарственных средств, технологиях конъюгирования и линкерах, отношении лекарственное средство/антитело (загрузке) и свойствах высвобождения лекарственного средства (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO2009/052249; McDonagh (2006) Белк Eng. Design & Sel. 19(7): 299-307; Doronina et al (2006) Bioconj. Chem. 17:114-124; Erickson et al (2006) Cancer Res. 66(8):1-8; Sanderson et al (2005) Clin. Cancer Res. 11:843-852; Jeffrey et al (2005) J. Med. Chem. 48:1344-1358; Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070). По отношению к селективности антитела и локализации опухоли многие известные опухолевые маркеры оказались неэффективными мишенями для ADC по ряду причин, включающих низкую экспрессию, отсутствие интернализации, шеддинг и т.д. Выбор подходящих составных частей ADC из лекарственных средств также в прошлом оказался проблематичным. Различные средства были предложены для применения в ADC, включающие фрагменты лекарственных средств, которые придают цитотоксические и цитотостатические эффекты посредством механизмов, включающих связывание тубулина, связывание ДНК, ингибирование протеасом и/или топоизомеразы. Несмотря на некоторый успех, некоторые цитотоксические лекарственные средства имеют тенденцию становиться неактивными или менее активными, когда их конъюгируют с крупными антителами или лигандами белковых рецепторов. Соответственно, выбор соответствующего целенаправленного или связывающегося с клеткой средства и эффективного лекарственного средства в виде полезной нагрузки в качестве составных частей ADC является важным для предоставления соединений, проявляющих желательный клинический профиль.
Один класс соединений, которые являются перспективным в качестве потенциальных полезных нагрузок ADC, представляет собой пирролобензодиазепины (ПБД). В этой связи ПБД обладают способностью распознавать специфичные последовательности ДНК, включающими предпочтительную последовательность PuGPu, и связываться с ними. Первый противоопухолевый антибиотик из ПБД, антрамицин, был обнаружен в 1965 г. (Leimgruber, et al., J. Am. Chem. Soc., 87, 5793-5795 (1965); Leimgruber, et al., J. Am. Chem. Soc., 87, 5791-5793 (1965)). С тех пор, сообщалось о ряде природных ПБД, и были разработаны свыше 10 синтетических путей до разнообразных аналогов (Thurston, et al., Chem. Rev.1994, 433-465 (1994); Antonow, D. and Thurston, D.E., Chem. Rev.2011 111 (4), 2815-2864). Члены семейства включают аббеймицин (Hochlowski, et al., J. Antibiotics, 40, 145-148 (1987)), чикамицин (Konishi, et al., J. Antibiotics, 37, 200-206 (1984)), DC-81 (Патент Японии 58-180 487; Thurston, et al., Chem. Brit., 26, 767-772 (1990); Bose, et al., Тетраhedron, 48, 751-758 (1992)), мазетрамицин (Kuminoto, et al., J. Antibiotics, 33, 665-667 (1980)), неотрамицины A и B (Takeuchi, et al., J. Antibiotics, 29, 93-96 (1976)), поротрамицин (Tsunakawa, et al., J. Antibiotics, 41, 1366-1373 (1988)), протракарцин (Shimizu, et al, J. Antibiotics, 29, 2492-2503 (1982); Langley and Thurston, J. Org. Chem., 52, 91-97 (1987)), сибаномицин (DC-102)(Hara, et al., J. Antibiotics, 41, 702-704 (1988); Itoh, et al., J. Antibiotics, 41, 1281-1284 (1988)), сибиромицин (Leber, et al., J. Am. Chem. Soc., 110, 2992-2993 (1988)) и томамицин (Arima, et al., J. Antibiotics, 25, 437-444 (1972)).
ПБД имеют общую структуру:

Они отличаются по числу, типу и положению заместителей, как в их ароматических кольцах A, так и пирроло-кольцах C, и по степени замещения C-кольца. В B-кольце присутствует либо имин (N=C), карбиноламин (NH-CH(OH)) или метиловый эфир карбиноламина (NH-CH(OMe)) в положении N10-C11, которое является электрофильным центром, ответственным за алкилирование ДНК. Все из известных природных продуктов имеют (S)-конфигурацию по хиральному положению C11a, которое обеспечивает их правосторонним поворотом при наблюдении от C-кольца в направлении A-кольца. Это придает им соответствующую трехмерную форму для структуры, изоспиральной малой бороздке B-формы ДНК, приводящей к точной подгонке на участке связывания (Kohn, In Antibiotics III. Springer-Verlag, New York, pp. 3-11 (1975); Hurley and Needham-VanDevanter, Acc. Chem. Res., 19, 230-237 (1986)). Их способность образовывать аддукт в малой бороздке, позволяет им препятствовать процессингу ДНК, следовательно, обеспечивает их применение противоопухолевых средств.
Особенно преимущественное пирролобензодиазепиновое соединение описано Gregson et al. (Chem. Commun. 1999, 797-798) как соединение 1, и Gregson et al. (J. Med. Chem. 2001, 44, 1161-1174) как соединение 4a. Данное соединение, также известное как SG2000, показано ниже:

WO 2007/085930 описывает получение димерных ПБД соединений, имеющих линкерные группы для соединения со средством связывания с клеткой, таким как антитело. Линкер присутствует в мостике, связывающем мономерные блоки ПБД димера.
WO 2011/130598 описывает димерные ПБД соединения, имеющие линкерные группы для соединения со средством связывания с клеткой, таким как антитело. Линкер в этих соединениях присоединен к одному из доступных положений N10 и предпочтительно расщепляется под действием фермента на линкерную группу.
В то время как различные ПБД ADC оказались перспективными для лечения некоторых пролиферативных нарушений, в данной области остается потребность в клинически эффективных целенаправленных соединениях и способах применения таких соединений для лечения пролиферативных нарушений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
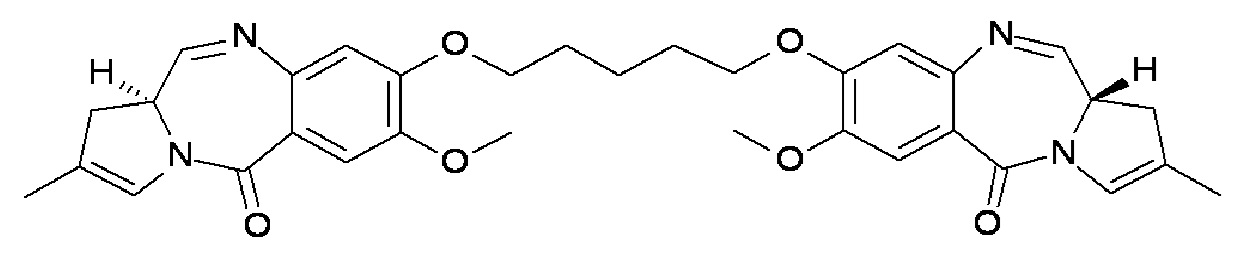
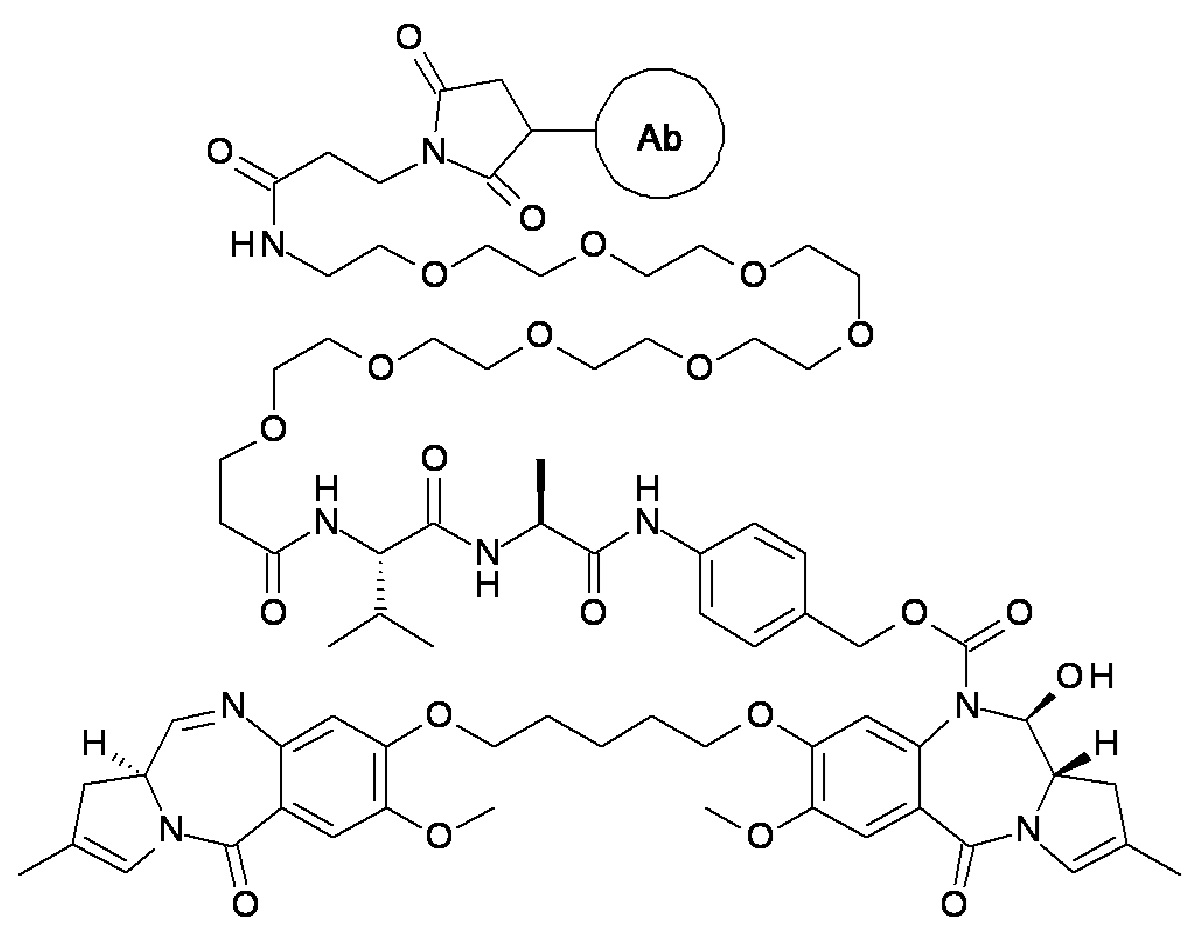
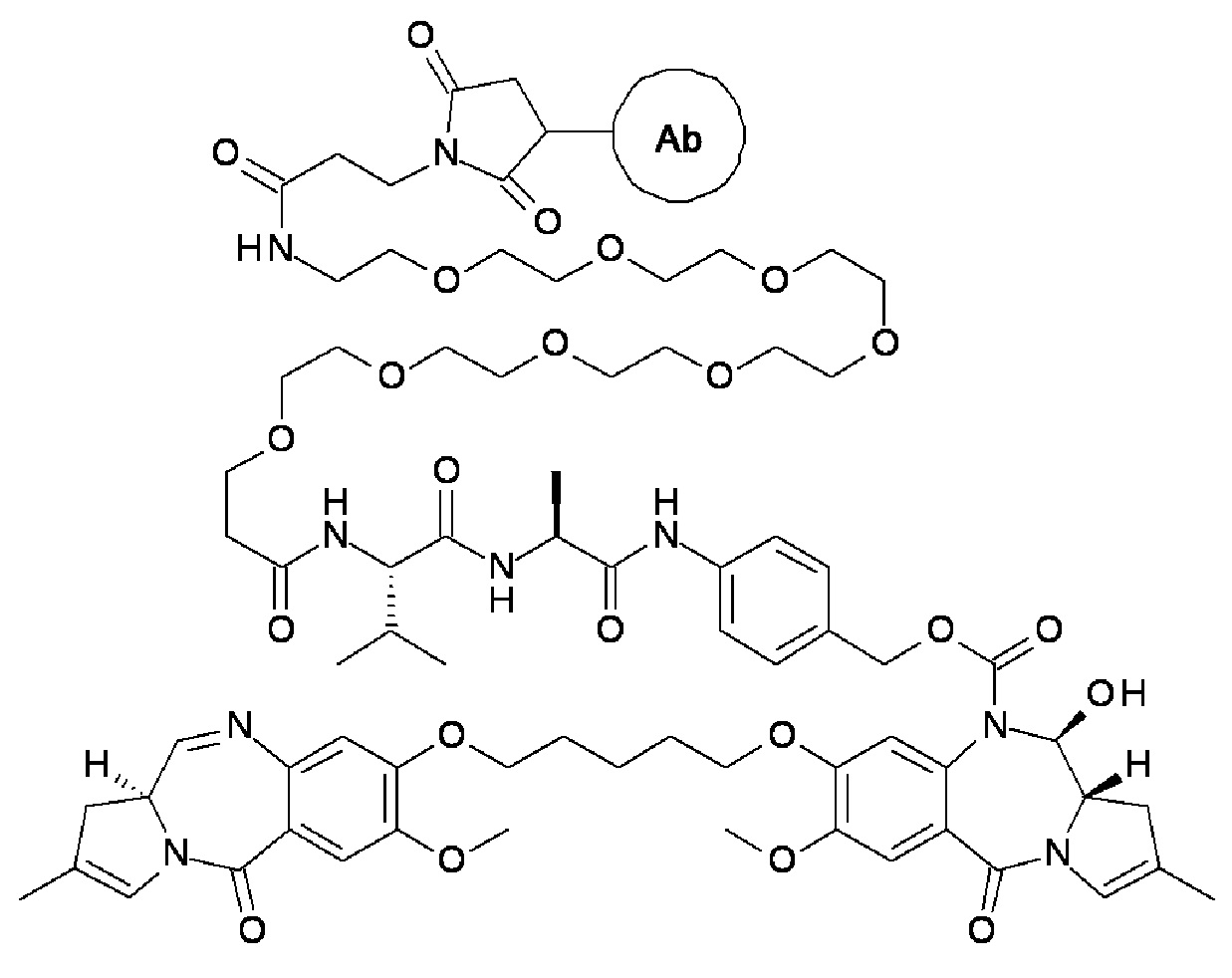
Эти и другие цели предусмотрены настоящим изобретением, которое, в широком смысле, направлено на способы, соединения, композиции и готовые изделия, содержащие некоторые конъюгаты антител с лекарственными средствами, содержащие выбранные ПБД, которые могут применяться при лечении нарушений, ассоциированных с DLL3 (например, пролиферативных нарушений или неопластических нарушений). В этой связи, настоящее изобретение предоставляет антитела с Дельта-подобным лигандом 3 (или DLL3), конъюгированные с выбранными ПБД, которые эффективно целенаправленно действуют на опухолевые клетки и/или раковые стволовые клетки, и могут применяться для лечения пациентов, страдающих от самых разных пролиферативных нарушений и любых их распространений, повторных проявлений, рецидивов или метастазов. В широком аспекте, настоящее изобретение относится к антителам с Дельта-подобным лигандом 3 (DLL3), конъюгированных с выбранными пирролобензодиазепинами, для обеспечения DLL3-иммуноконъюгатов, по существу приведенных в виде ADC1 - 5 непосредственно ниже. Соответственно, в одном аспекте изобретение направлено на конъюгат, выбранный из группы, состоящей из
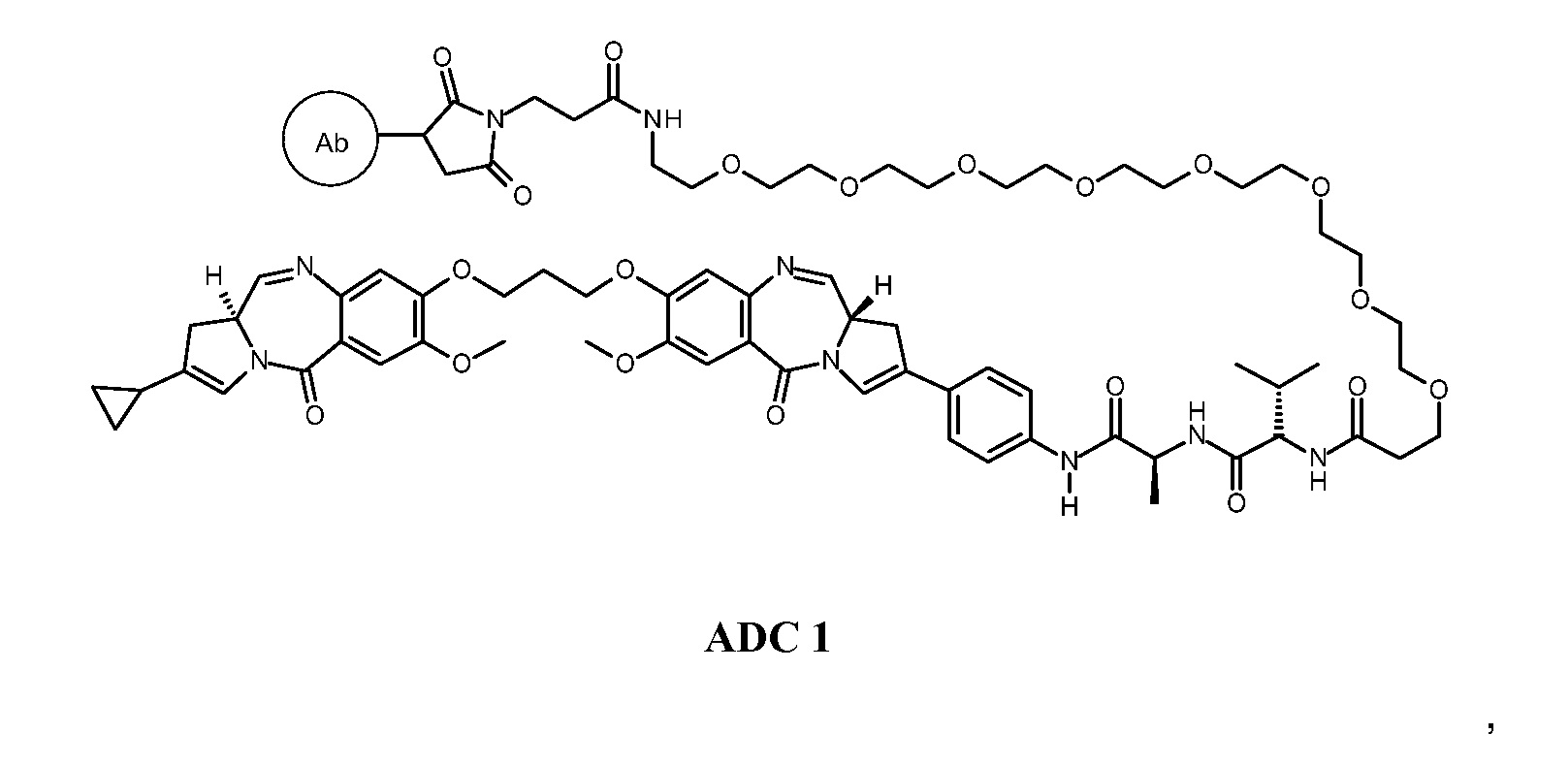
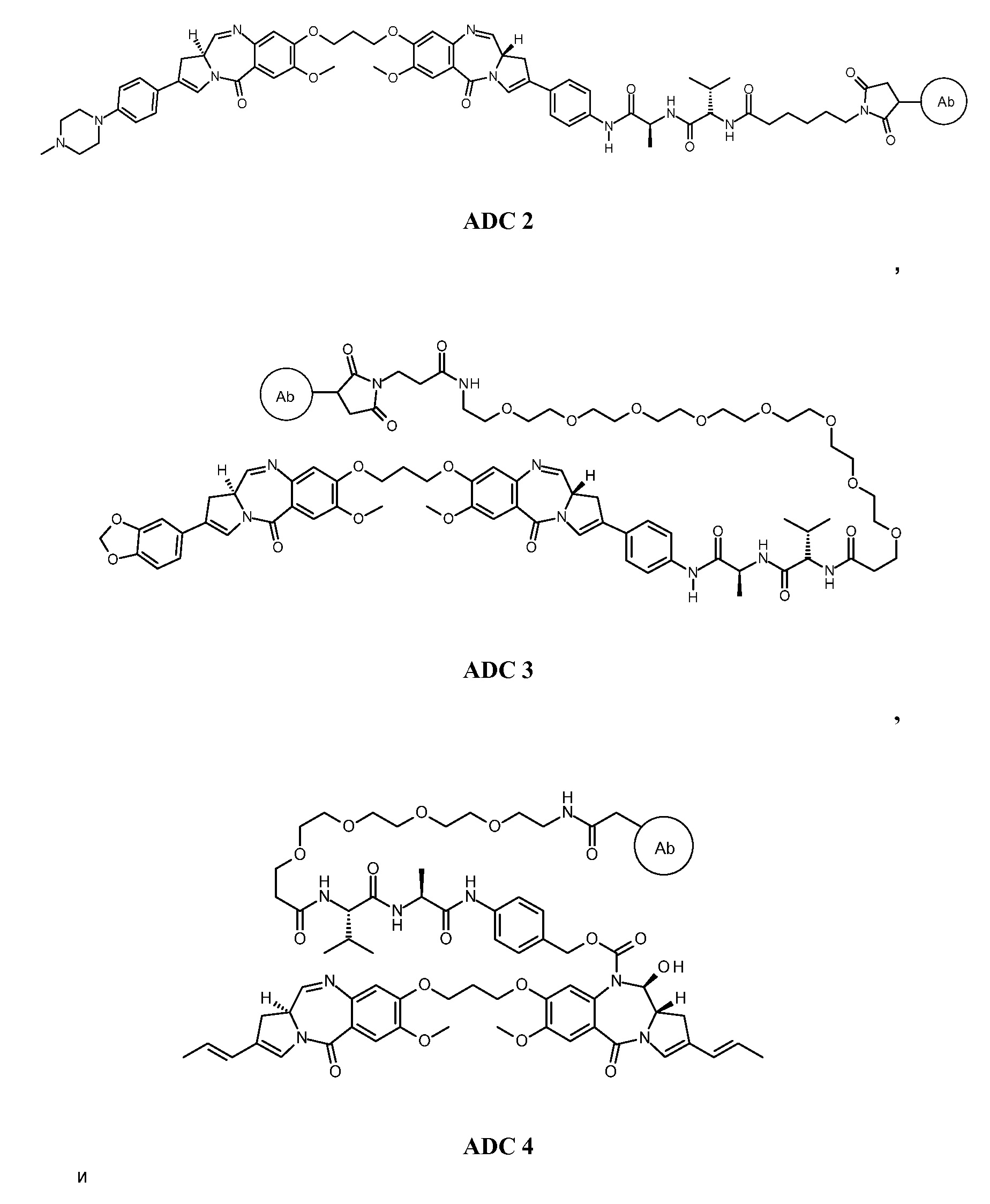

где Ab содержит анти-DLL3 антителоо или его иммунореактивный фрагмент. Конъюгирование с фрагментом линкерного лекарственного средства в каждом из конъюгатов происходит предпочтительно через свободный тиол в анти-DLL3 антителое.
В других аспектах настоящее изобретение включает в себя композицию, содержащую ADC 1, композицию, содержащую ADC 2, композицию, содержащую ADC 3, композицию, содержащую ADC 4 или композицию, содержащую ADC 5.
Как указано, такие конъюгаты могут применяться для лечения, контроля, устранения или профилактики пролиферативных нарушений или их повторных проявлений или прогрессирования. Выбранные варианты осуществления настоящего изобретения предоставляют применение таких Конъюгат DLL3ов, для иммунотерапевтического лечения злокачественных новообразований, предпочтительно включающего в себя уменьшение опухоли, инициирующей частоту распространения клеток. Раскрытые ADC могут применяться по отдельности или совместно с широким рядом противоопухолевых соединений, таких как химиотерапевтические или иммунотерпевтические средства (например, терапевтические антитела) или модификаторы биологического ответа. В других выбранных вариантах осуществления, два или более дискретных конъюгата DLL3 антитела с лекарственным средством могут применяться в комбинации, чтобы обеспечить усиленные антинеопластические эффекты.
В еще одном аспекте, приведенном в прилагаемых Примерах, изобретение предоставляет способ получения ADC1 - 5, включающий в себя конъюгирование соединения, выбранного из группы, состоящей из


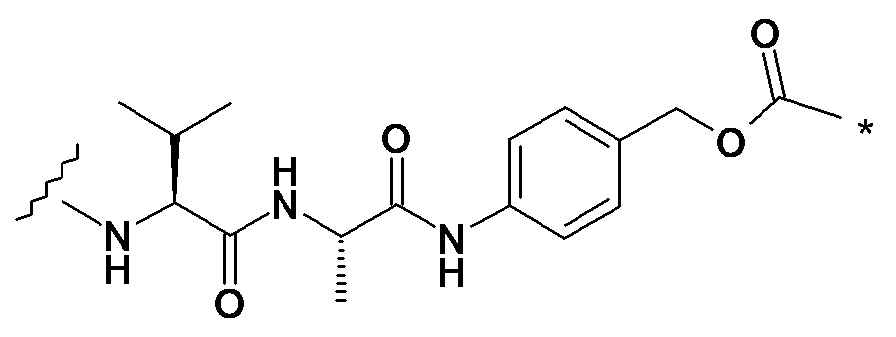
с анти-DLL3 антителоом или его иммунореактивным фрагментом. Для целей далее рассматриваемой заявки DL будет применяться как аббревиатура для “лекарственное средство-линкер” и будет содержать линкеры лекарственного средства 1-5 (т.е., DL1, DL2, DL3, DL4 и DL5), приведенные выше.
Следуеит принимать во внимание, что прилагаемый к линкеру концевой малеимидо-фрагмент (DL1-DL3 и DL5) или йодацетамидный фрагмент (DL4) могут быть конъюгированы со свободными сульфгидрилом(сульфгидрилами) в выбранном DLL3 антителе с использованием принятых в данной области методов В дополнение к более подробному обсуждению ниже, путь синтеза к каждому соединению из DL 1-5 предоставлен в Примере 1, прилагаемому к данному документу, в то время как специфичные способы конъюгирования таких соединений для предоставления ADC 1-5 приведены в Примере 7.
Отмечаем, что для целей рассматриваемой заявки следует принимать во внимание, что термины “модулятор” и “антитело” могут применяться взаимозаменяемо, если иное не предписано контекстом. Аналогично, все термины “анти-Конъюгат DLL3” и “Конъюгат DLL3”, или просто “конъюгат”, относятся к соединениям, приведенным в виде ADC 1-5, содержащих анти-DLL3 антителоо, и могут применяться взаимозаменяемо если иное не предписано контекстом.
При любых обстоятельствах эти и другие цели предусмотрены настоящим изобретением, которое, в широком смысле, направлено на вышеуказанные Конъюгат DLL3ы и ассоциированные способы, композиции и готовые изделия, которые могут применяться при лечении нарушений, ассоциированных с DLL3 (например, пролиферативных нарушений или неопластических нарушений). В этой связи, настоящее изобретение предоставляет конъюгаты антитела Дельта-подобного лиганда 3 (или DLL3), которые эффективно целенаправленно действуют на опухолевые клетки и/или раковые стволовые клетки и могут применяться для лечения пациентов, страдающих от самых различных злокачественных новообразований. Как будет обсуждаться более подробно в данном документе, существуют по меньшей мере две изоформы или два варианта DLL3 природного происхождения, и раскрытые модуляторы могут включать в себя или селективно ассоциироваться с одной или другой изоформой или с обеими. Более того, в некоторых вариантах осуществления раскрытые модуляторы DLL3 могут дополнительно взаимодействовать с одним или более членами семейства DLL (например, DLL1 или DLL4) или, в других вариантах осуществления, могут генерироваться и выбираться таким образом, чтобы ассоциироваться или взаимодействовать исключительно с одной или более изоформами DLL3.
Следует дополнительно принимать во внимание, что раскрытые конъюгаты антитела с лекарственным средством могут содержать любой модулятор, антитело или его иммунореактивный фрагмент, который распознает, конкурирует с, является агонистом, является антагонистом, взаимодействует, связывается или ассоциирует с детерминантой DLL3 (или ее фрагментом) и модулирует, настраивает, изменяет, регулирует, изменяет или модифицирует воздействие белка DLL3 на один или более физиологических путей и/или ингибирует или устраняет DLL3-ассоциированные клетки. Таким образом, в широком смысле, настоящее изобретение в целом направлено на Конъюгат DLL3ы и их применения. Кроме того, как всесторонне обсуждается ниже, такие конъюгаты антитела с лекарственным средством могут применяться для обеспечения фармацевтических композиций, применимых для профилактики, диагностики или лечения пролиферативных нарушений, включающих злокачественное новообразование.
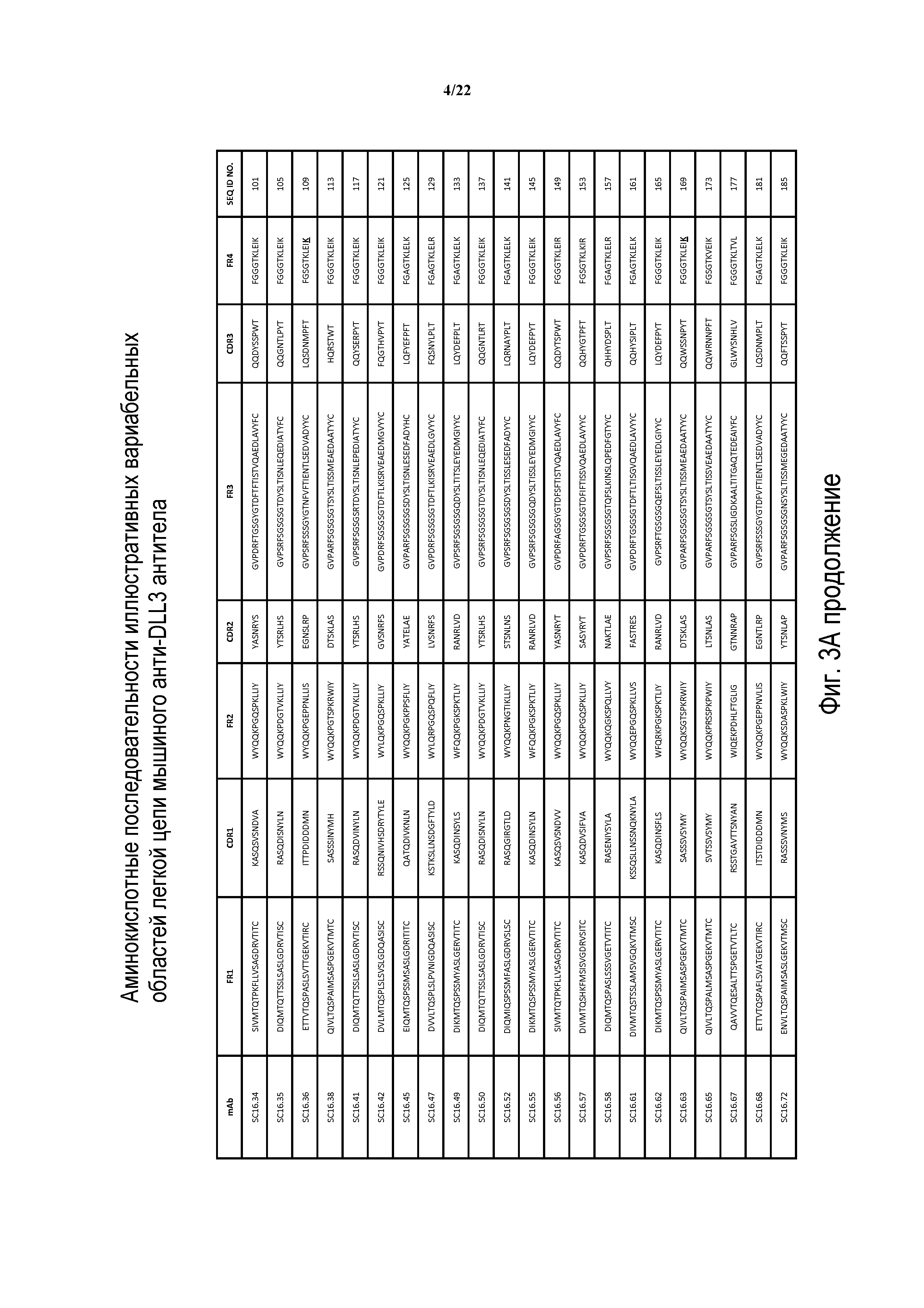
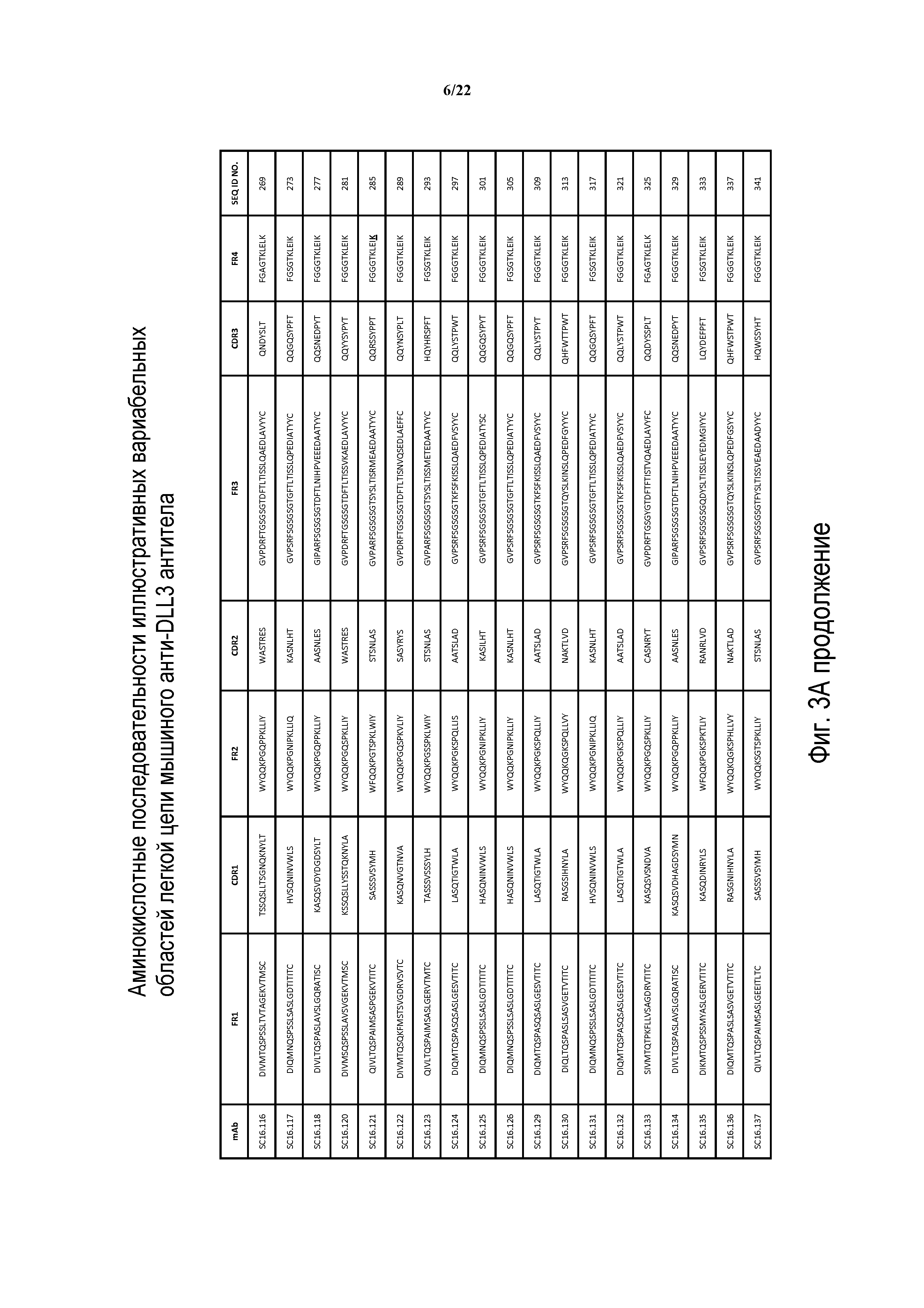
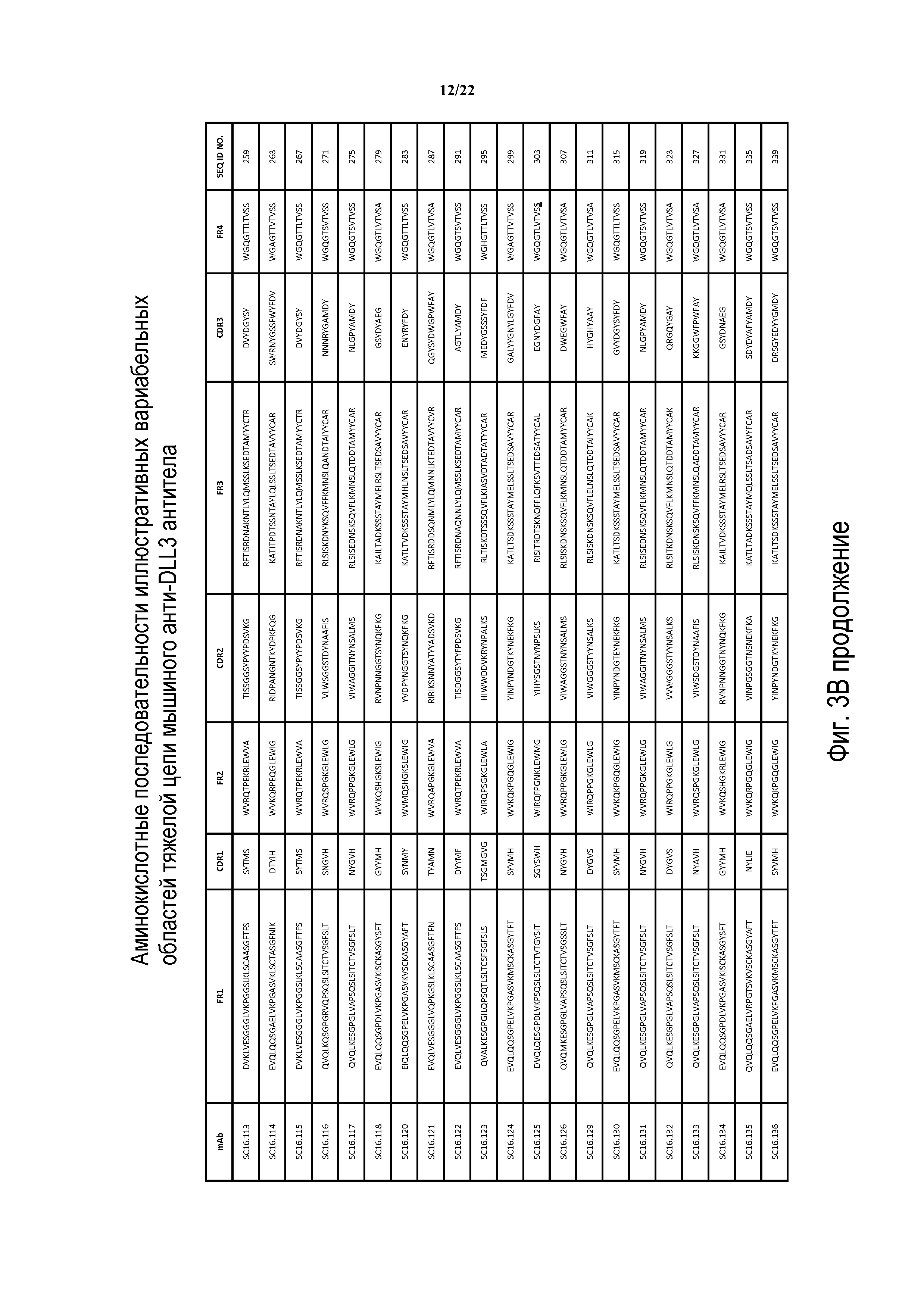
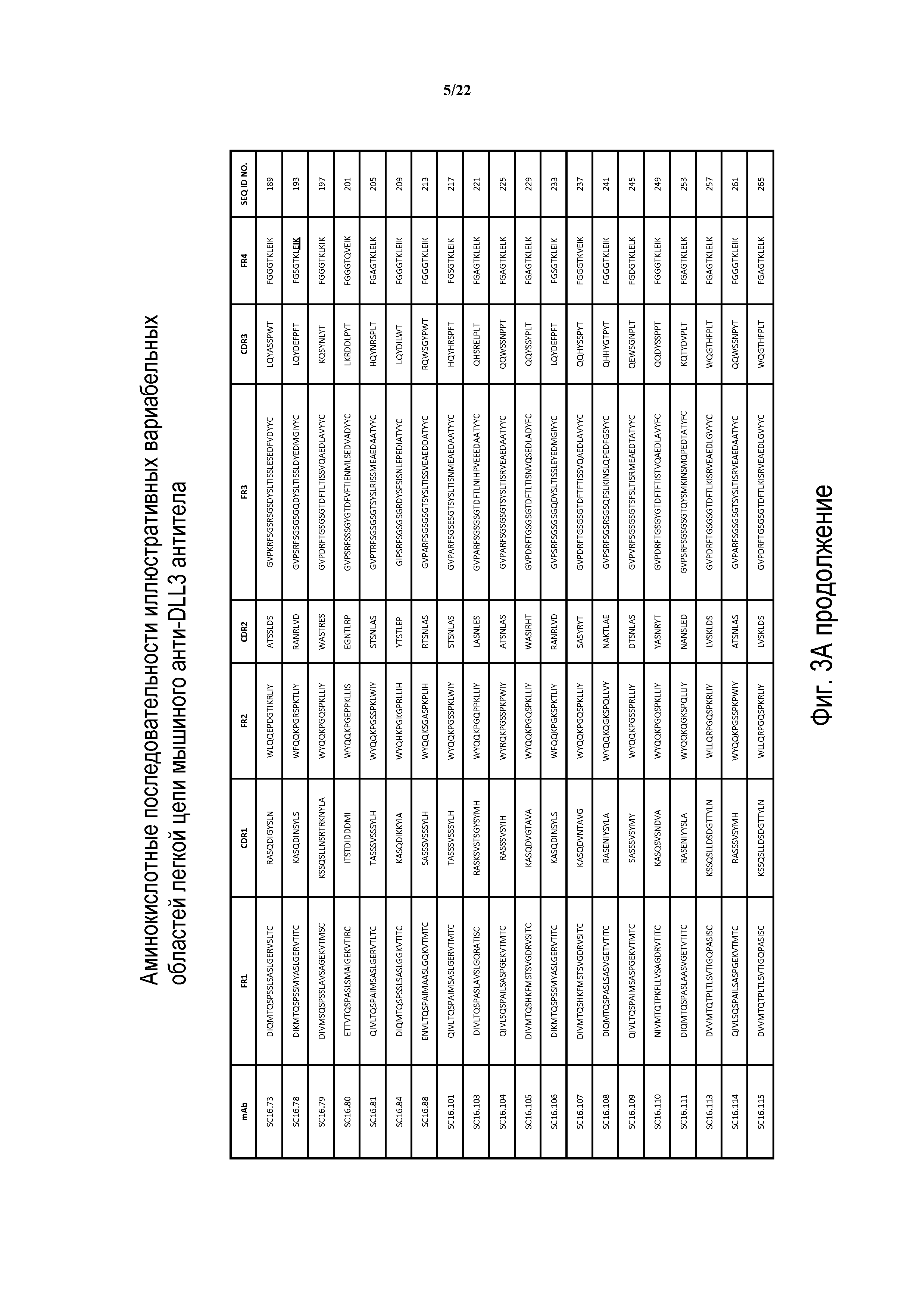
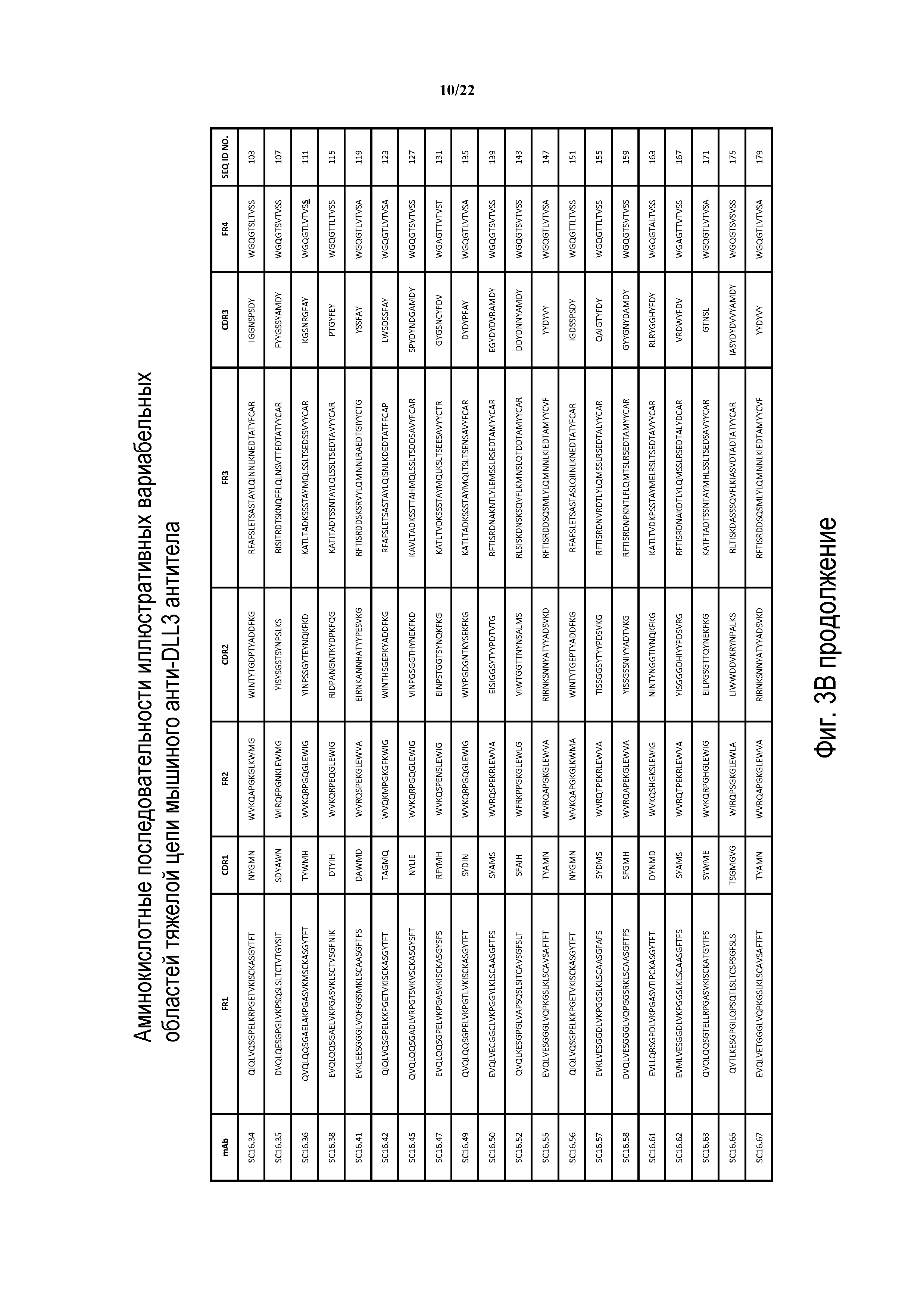
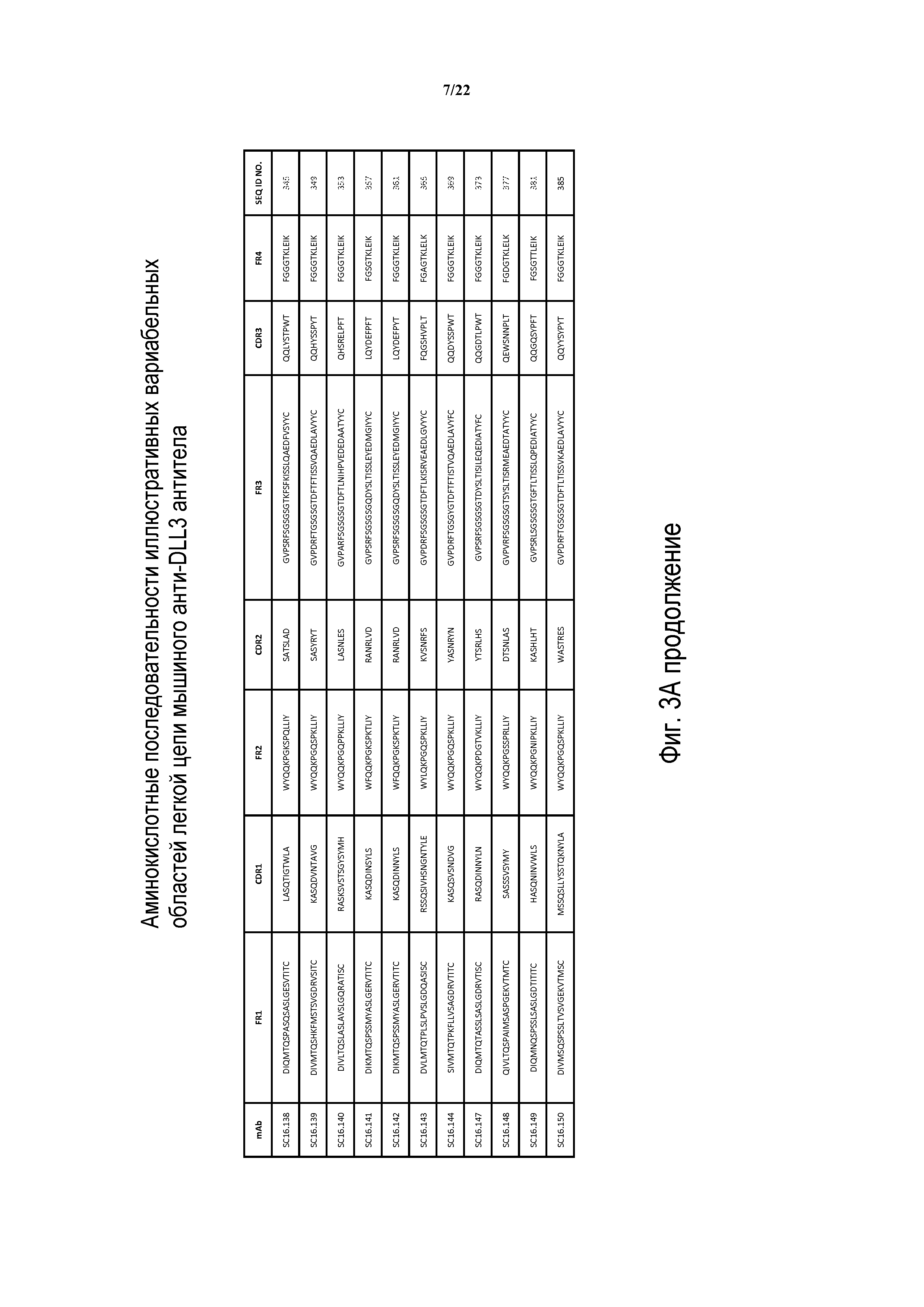
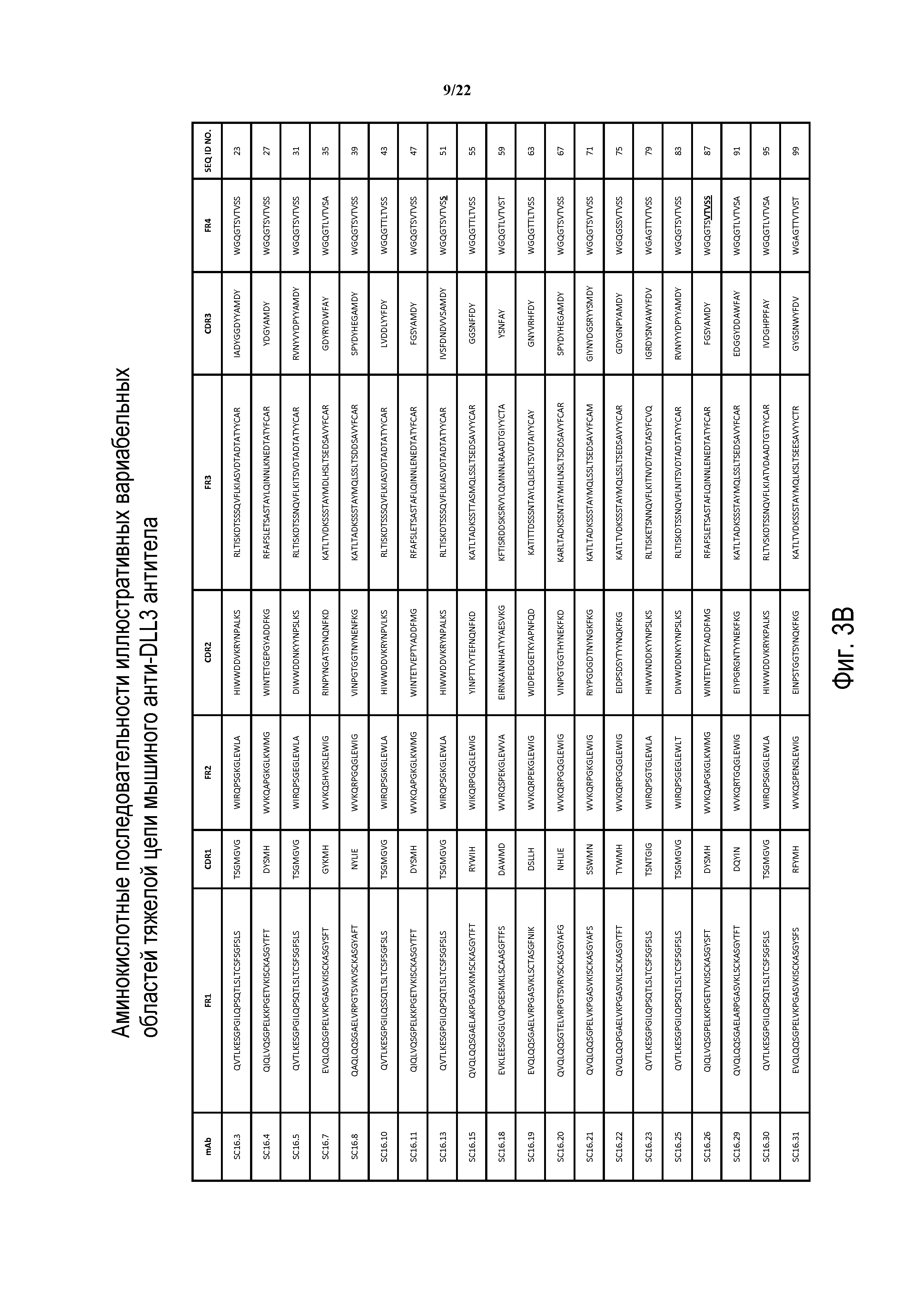
Что касается ADC 1-5, следует принимать во внимание, что совместимые антитела могут принимать любую одну из ряда форм, включающих, например, поликлональные и моноклональные антитела, химерные, CDR-привитые, гуманизированные и человеческие антитела и иммунореактивные фрагменты и/или варианты каждого из вышеуказанных. Предпочтительные варианты осуществления будут включать в себя антитела, которые являются относительно неиммуногенными, такие как гуманизированные или полностью человеческие конструкции. Несомненно, принимая во внимание рассматриваемое раскрытие, квалифицированные специалисты в данной области смогут легко идентифицировать одну или более областей, определяющих комплементарность, (CDR) ассоциированных с модуляторами вариабельных областей тяжелой и легкой цепи DLL3-антитела и применять эти CDR, чтобы конструировать или производить химерные, гуманизированные или CDR-привитые антитела без излишнего экспериментирования. Соответственно, в некоторых предпочтительных вариантах осуществления компонент DLL3-антитела раскрытых ADC содержит антитело, которое включает в себя одну или более областей, определяющих комплементарность (CDR), как определено на ФИГУРАХ 3A и 3B, и является производным иллюстративных смежных легкой (ФИГ. 3A) или тяжелой (ФИГ. 3B) цепи мышиных вариабельных областей (SEQ ID NO: 21-387, нечетные номера), приведенных в них. Также на ФИГ. 3 показаны иллюстративные гуманизированные (CDR привитые) последовательности вариабельной области легкой и тяжелой цепи, содержащие SEQ ID NO: 389-407. В предпочтительных вариантах осуществления антитела, содержащие CDR, приведенные на ФИГУРАХ 3A и 3B будут содержать моноклональные антитела и, даже в более предпочтительных вариантах осуществления, будут содержать химерные, CDR-привитые или гуманизированные антитела. Иллюстративные последовательности нуклеиновой кислоты, кодирующие каждую из аминокислотных последовательностей, приведенных на ФИГУРАХ 3A и 3B прилагаются в данном документе в списке последовательностей.
В еще одном варианте осуществления, антитело изобретения включает в себя вариабельные области тяжелой и легкой цепи, содержащие аминокислотные последовательности, которые являются гомологичными аминокислотным последовательностям иллюстративных антител, описанн в данном документе, и, где антитела сохраняют желательные функциональные свойства анти-DLL3 антитело изобретения.
Более конкретно, в избранных вариантах осуществления, антитела, включенные в любой из ADC 1-5, могут включать в себя антитело или его иммунореактивный фрагмент, имеющие вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 60% является гомологичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 53, SEQ ID NO: 57, SEQ ID NO: 61, SEQ ID NO: 65, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 97, SEQ ID NO: 101, SEQ ID NO: 105, SEQ ID NO: 109, SEQ ID NO: 113, SEQ ID NO: 117, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169, SEQ ID NO: 173, SEQ ID NO: 177, SEQ ID NO: 181, SEQ ID NO: 185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201, SEQ ID NO: 205, SEQ ID NO: 209, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 221, SEQ ID NO: 225, SEQ ID NO: 229, SEQ ID NO: 233, SEQ ID NO: 237, SEQ ID NO: 241, SEQ ID NO: 245, SEQ ID NO: 249, SEQ ID NO: 253, SEQ ID NO: 257, SEQ ID NO: 261, SEQ ID NO: 265, SEQ ID NO: 269, SEQ ID NO: 273, SEQ ID NO: 277, SEQ ID NO: 281, SEQ ID NO: 285, SEQ ID NO: 289, SEQ ID NO: 293, SEQ ID NO: 297, SEQ ID NO: 301, SEQ ID NO: 305, SEQ ID NO: 309, SEQ ID NO: 313, SEQ ID NO: 317, SEQ ID NO: 321, SEQ ID NO: 325, SEQ ID NO: 329, SEQ ID NO: 333, SEQ ID NO: 337, SEQ ID NO: 341, SEQ ID NO: 345, SEQ ID NO: 349, SEQ ID NO: 353, SEQ ID NO: 357, SEQ ID NO: 361, SEQ ID NO: 365, SEQ ID NO: 369, SEQ ID NO: 373, SEQ ID NO: 377, SEQ ID NO: 381 и SEQ ID NO: 385, и, где указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 60% является гомологичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 55, SEQ ID NO: 59, SEQ ID NO: 63, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 95, SEQ ID NO: 99, SEQ ID NO: 103, SEQ ID NO: 107, SEQ ID NO: 111, SEQ ID NO: 115, SEQ ID NO: 119, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139 SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171, SEQ ID NO: 175, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO: 195, SEQ ID NO: 199, SEQ ID NO: 203, SEQ ID NO: 207, SEQ ID NO: 211, SEQ ID NO: 215, SEQ ID NO: 219, SEQ ID NO: 223, SEQ ID NO: 227, SEQ ID NO: 231, SEQ ID NO: 235, SEQ ID NO: 239, SEQ ID NO: 243, SEQ ID NO: 247, SEQ ID NO: 251, SEQ ID NO: 255, SEQ ID NO: 259, SEQ ID NO: 263, SEQ ID NO: 267, SEQ ID NO: 271, SEQ ID NO: 275, SEQ ID NO: 279, SEQ ID NO: 283, SEQ ID NO: 287, SEQ ID NO: 291, SEQ ID NO: 295, SEQ ID NO: 299, SEQ ID NO: 303, SEQ ID NO: 307 SEQ ID NO: 311, SEQ ID NO: 315, SEQ ID NO: 319, SEQ ID NO: 323, SEQ ID NO: 327, SEQ ID NO: 331, SEQ ID NO: 335, SEQ ID NO: 339, SEQ ID NO: 343, SEQ ID NO: 347, SEQ ID NO: 351, SEQ ID NO: 355, SEQ ID NO: 359, SEQ ID NO: 363, SEQ ID NO: 367, SEQ ID NO: 371, SEQ ID NO: 375, SEQ ID NO: 379, SEQ ID NO: 383 и SEQ ID NO: 387. В других предпочтительных вариантах осуществления выбранные модуляторы будут содержать вариабельные области тяжелой и легкой цепи, которые на 65, 70, 75 или 80% являются гомологичными вышеуказанным мышиным последовательностям. В еще других вариантах осуществления модуляторы будут содержать аминокислотные последовательности вариабельной области тяжелой и легкой цепи, которые на 85, 90 или даже 95% являются гомологичными раскрытым мышиным последовательностям. В связи с эти, следует принимать во внимание, что гуманизированные антитела, полученные из антител мышиного происхождения обычно имеют вариабельные области тяжелой и легкой цепи, которые предпочтительно на от приблизительно 70% до приблизительно 85% являются гомологичными относительно исходных антител. Путем сравнения гуманизированные антитела будут обычно иметь вариабельные области тяжелой и легкой цепи, которые предпочтительно на от приблизительно 80% до приблизительно 95% являются гомологичными с такими же областями акцепторных человеческих антител.
В других предпочтительных вариантах осуществления выбранные антитела будут включать в себя одну или более CDR, полученные из любой из приведенных выше аминокислотных последовательностей вариабельной области легкой и тяжелой цепи. Соответственно, избранные варианты осуществления изобретения включают модулятор DLL3, содержащий одну или более CDR из любой одной из SEQ ID NO:21-387, нечетные номера. Предпочтительно, антитела будут содержать три CDR легкой цепи, полученные из единственной аминокислотной последовательности вариабельной области легкой цепи, приведенной на ФИГ. 3A, и три CDR тяжелой цепи, полученные из единственной аминокислотной последовательности вариабельной области тяжелой цепи, приведенной на ФИГ. 3B. Например, иллюстративные антитела могут содержать три CDR легкой цепи, полученные из единственной аминокислотной последовательности, вариабельной области легкой цепи, приведенной на ФИГ. 3A, и три CDR тяжелой цепи из единственной аминокислотной последовательности вариабельной области тяжелой цепи, приведенной на ФИГ. 3B, где вариабельные области легкой цепи и тяжелой цепи происходят из одного и того же клона. В еще других вариантах осуществления конъюгаты рассматриваемого изобретения будут содержать антитело или его иммунореактивный фрагмент, который конкурирует за связывание с любым из приведенных выше модуляторов.
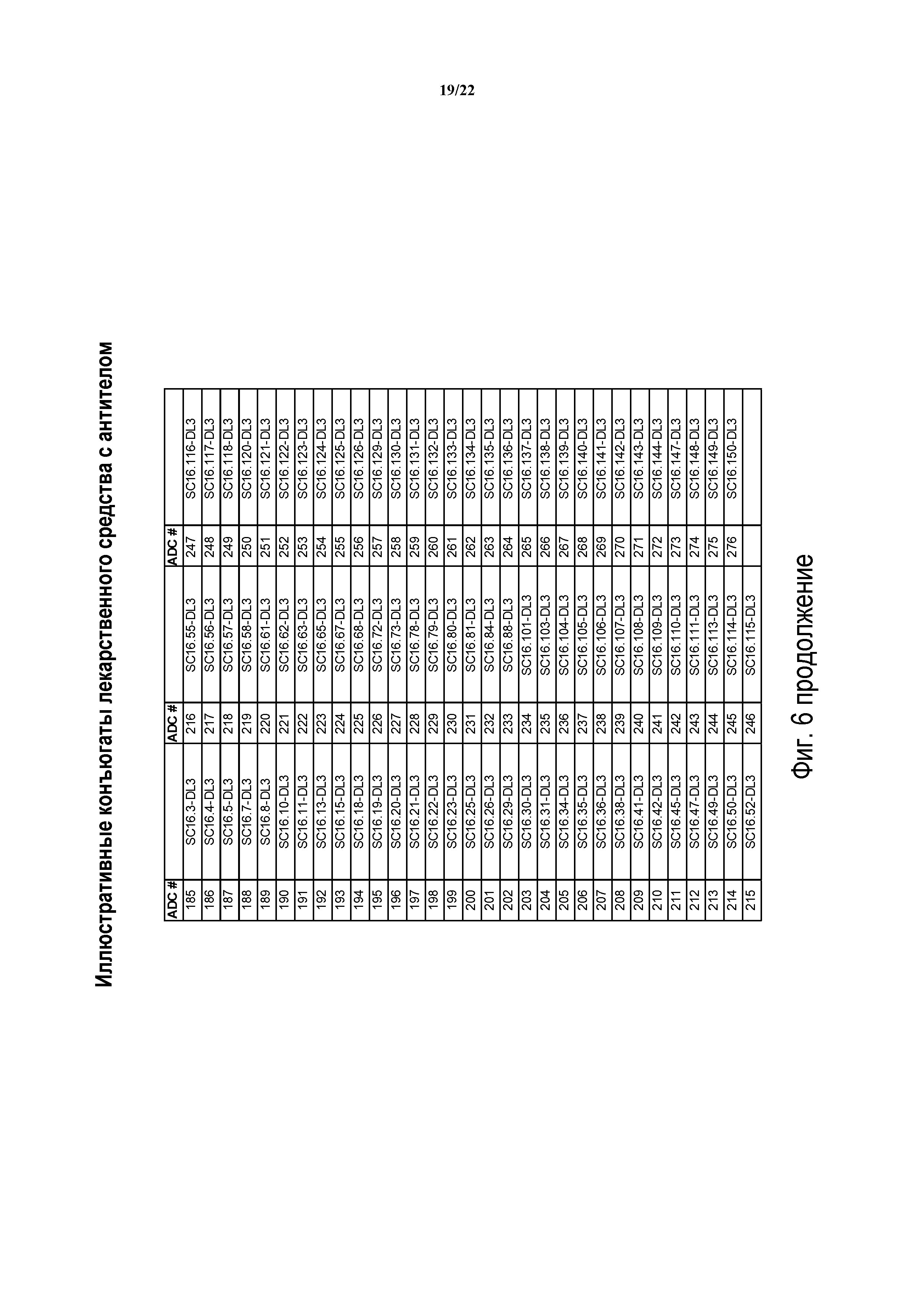
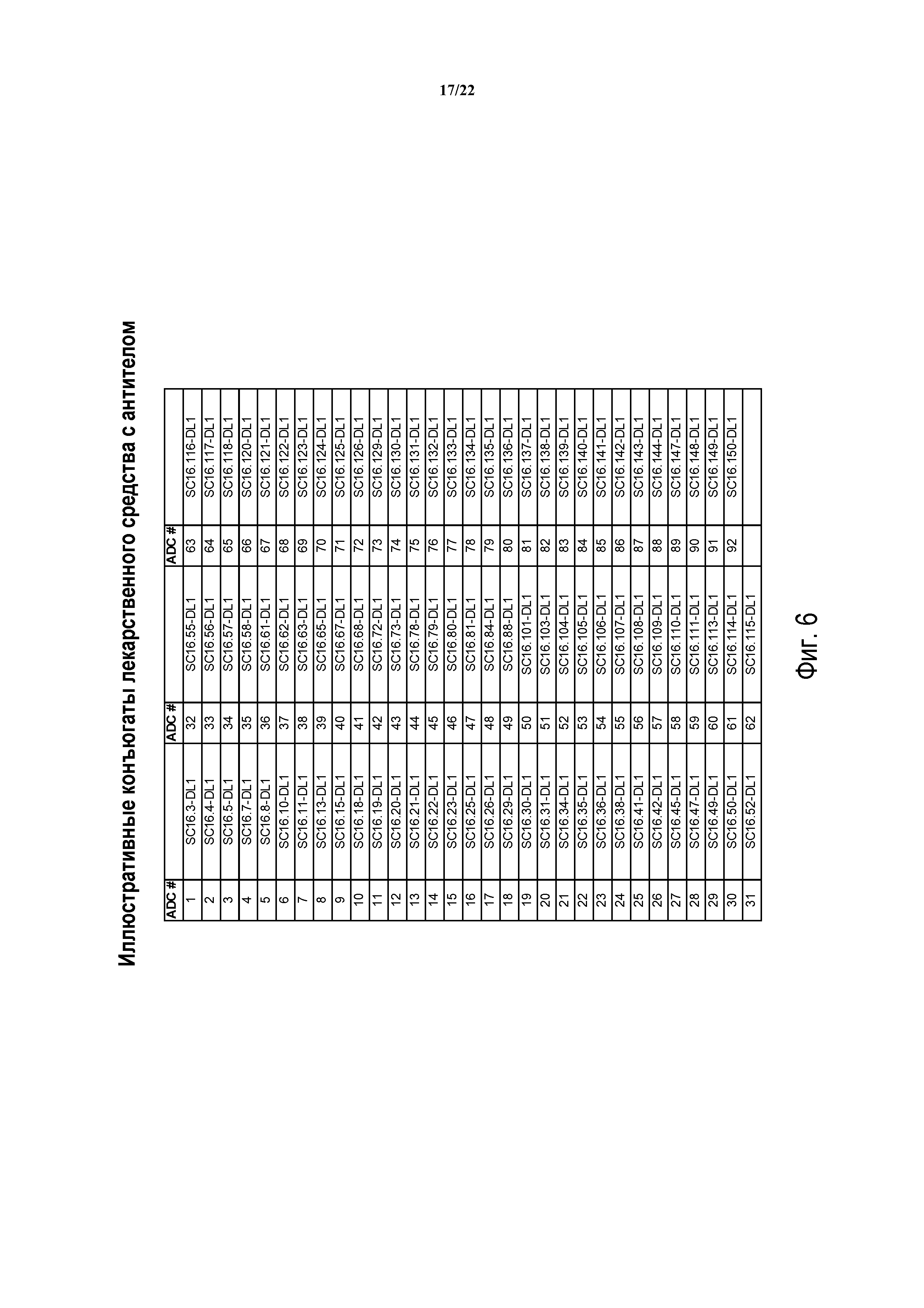
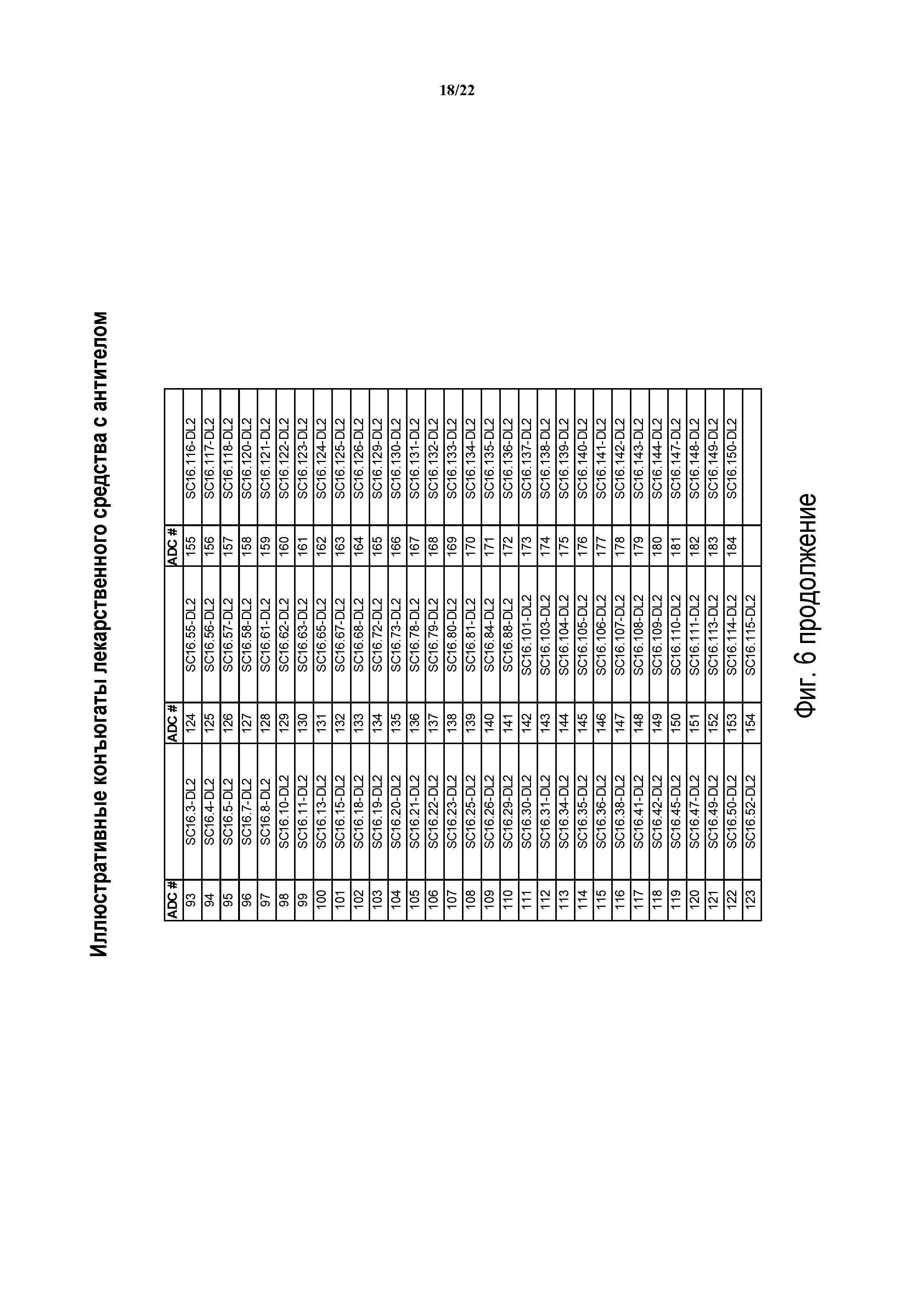
Таким образом, еще один аспект изобретения содержит ADC, включающий в себя антитела, полученные или произведенные из SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 и SC16.150; или любого из идентифицированных выше антител или их химерных или гуманизированных версий. В других вариантах осуществления ADC изобретения будут содержать DLL3-антитело, имеющее одно или более CDR, например, одно, два, три, четыре, пять или шесть CDR, из любого из вышеуказанных модуляторов.
В еще одном аспекте настоящее изобретение будет включать в себя конъюгат, где анти-DLL3 антителоо или его иммунореактивный фрагмент содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи содержит аминокислотную последовательность, произведенную из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 53, SEQ ID NO: 57, SEQ ID NO: 61, SEQ ID NO: 65, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 97, SEQ ID NO: 101, SEQ ID NO: 105, SEQ ID NO: 109, SEQ ID NO: 113, SEQ ID NO: 117, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169, SEQ ID NO: 173, SEQ ID NO: 177, SEQ ID NO: 181, SEQ ID NO: 185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201, SEQ ID NO: 205, SEQ ID NO: 209, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 221, SEQ ID NO: 225, SEQ ID NO: 229, SEQ ID NO: 233, SEQ ID NO: 237, SEQ ID NO: 241, SEQ ID NO: 245, SEQ ID NO: 249, SEQ ID NO: 253, SEQ ID NO: 257, SEQ ID NO: 261, SEQ ID NO: 265, SEQ ID NO: 269, SEQ ID NO: 273, SEQ ID NO: 277, SEQ ID NO: 281, SEQ ID NO: 285, SEQ ID NO: 289, SEQ ID NO: 293, SEQ ID NO: 297, SEQ ID NO: 301, SEQ ID NO: 305, SEQ ID NO: 309, SEQ ID NO: 313, SEQ ID NO: 317, SEQ ID NO: 321, SEQ ID NO: 325, SEQ ID NO: 329, SEQ ID NO: 333, SEQ ID NO: 337, SEQ ID NO: 341, SEQ ID NO: 345, SEQ ID NO: 349, SEQ ID NO: 353, SEQ ID NO: 357, SEQ ID NO: 361, SEQ ID NO: 365, SEQ ID NO: 369, SEQ ID NO: 373, SEQ ID NO: 377, SEQ ID NO: 381 и SEQ ID NO: 385, и, где указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, производную от аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 55, SEQ ID NO: 59, SEQ ID NO: 63, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 95, SEQ ID NO: 99, SEQ ID NO: 103, SEQ ID NO: 107, SEQ ID NO: 111, SEQ ID NO: 115, SEQ ID NO: 119, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139 SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171, SEQ ID NO: 175, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO: 195, SEQ ID NO: 199, SEQ ID NO: 203, SEQ ID NO: 207, SEQ ID NO: 211, SEQ ID NO: 215, SEQ ID NO: 219, SEQ ID NO: 223, SEQ ID NO: 227, SEQ ID NO: 231, SEQ ID NO: 235, SEQ ID NO: 239, SEQ ID NO: 243, SEQ ID NO: 247, SEQ ID NO: 251, SEQ ID NO: 255, SEQ ID NO: 259, SEQ ID NO: 263, SEQ ID NO: 267, SEQ ID NO: 271, SEQ ID NO: 275, SEQ ID NO: 279, SEQ ID NO: 283, SEQ ID NO: 287, SEQ ID NO: 291, SEQ ID NO: 295, SEQ ID NO: 299, SEQ ID NO: 303, SEQ ID NO: 307 SEQ ID NO: 311, SEQ ID NO: 315, SEQ ID NO: 319, SEQ ID NO: 323, SEQ ID NO: 327, SEQ ID NO: 331, SEQ ID NO: 335, SEQ ID NO: 339, SEQ ID NO: 343, SEQ ID NO: 347, SEQ ID NO: 351, SEQ ID NO: 355, SEQ ID NO: 359, SEQ ID NO: 363, SEQ ID NO: 367, SEQ ID NO: 371, SEQ ID NO: 375, SEQ ID NO: 379, SEQ ID NO: 383 и SEQ ID NO: 387. Например, такие антитела могут включать вариабельную область легкой цепи и вариабельную область тяжелой цепи одного и того же клона, идентифицированного на ФИГУРАХ 3A и 3B.
В еще других совместимых вариантах осуществления конъюгаты антитела с лекарственным средством рассматриваемого изобретения будут содержать одно из CDR-привитых или гуманизированных DLL3 антител hSC16.13, hSC16.15, hSC16.25, hSC16.34 и hSC16.56.
Другие варианты осуществления направлены на ADC, содержащие антитело, где указанное антитело содержит:
легкую цепь антитела, содержащую CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 408, CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 409 и CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 410; и
тяжелую цепь антитела, содержащую CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 411, CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 412 и CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 413.
В еще одном варианте осуществления изобретение направлено на ADC, содержащие антитело, где указанное антитело содержит:
легкую цепь антитела, содержащую CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 414, CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 415, и CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 416; и
тяжелую цепь антитела, содержащую CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 417, CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 418, и CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 419.
В еще одном варианте осуществления изобретение направлено на ADC, содержащие антитело, где указанное антитело содержит:
легкую цепь антитела, содержащую CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 420, CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 421, и CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 422; и
тяжелую цепь антитела, содержащую CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 423, CDR2 вариабельную область тяжелой цепи, содержащую SEQ ID NO: 424, и CDR3 вариабельную область тяжелой цепи, содержащую SEQ ID NO: 425.
В еще одном варианте осуществления изобретение направлено на ADC, содержащее антитело, где указанное антитело содержит:
легкую цепь антитела, содержащую CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 426, CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 427, и CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 428; и
тяжелую цепь антитела, содержащую CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 429, CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 430, и CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 431.
В еще одном варианте осуществления изобретение направлено на ADC, содержащие антитело, где указанное антитело содержит:
легкую цепь антитела, содержащую CDR1 вариабельной области легкой цепи, содержащую SEQ ID NO: 432, CDR2 вариабельной области легкой цепи, содержащую SEQ ID NO: 433, и CDR3 вариабельной области легкой цепи, содержащую SEQ ID NO: 434; и
тяжелую цепь антитела, содержащую CDR1 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 435, CDR2 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 436, и CDR3 вариабельной области тяжелой цепи, содержащую SEQ ID NO: 437.
В некоторых предпочтительных вариантах осуществления каждое из вышеуказанных антител содержит гуманизированные антитела. Более того, как описанл в данном документе, последовательности нуклеиновых кислот, кодирующие такие иллюстративные гуманизированные вариабельные области тяжелой и легкой цепи, приведены в прилагаемом списке последовательностей.
В дополнение, один аспект изобретения может содержать терапевтическую ассоциацию DLL3 полипептидов с раковыми стволовыми клетками. Таким образом, в некоторых других вариантах осуществления изобретение будет включать в себя Конъюгат DLL3 ADC 1-5, который уменьшает частоту распространения клеток, инициирующих опухоль, при введении субъекту. Предпочтительно, уменьшение частоты распространения будет определяться с использованием анализа методом серийных разведений in vitro или in vivo. В особенно предпочтительных вариантах осуществления такой анализ может проводиться с использованием анализа методом серийных разведений in vivo, включающим в себя пересадку живых человеческих опухолевых клеток в иммунодефицитным мышам. Альтернативно, анализ методом серийных разведений может проводиться с использованием анализа методом серийных разведений in vitro, включающего в себя депонирование серийных разведений живых человеческих опухолевых клетк при условиях поддержания колонии in vitro. В обоих случаях, анализ, вычисление или количественная оценка снижения частоты распостранения будут предпочтительно включать применение статистики распределения Пуассона для обеспечения точного учета. Следует принимать во внимание, что, в то время как такие методы количественной оценки являются предпочтительными, другие, менее трудоемкие методологии, такие как проточная цитометрия или иммуногистохимия также могут применяться для обеспечения желательных значений и, соответственно, явным образом рассматриваются, как включенные в объем рассматриваемого изобретения. В таких случаях уменьшение частоты распространения может также определяться с использованием проточного цитометрического анализа или иммуногистохимическог обнаружения поверхностных маркеров опухолевой клетки, известных как обогащающие клетки, инициирующие опухоли.
В этой связи, следует принимать во внимание, что настоящее изобретение основано, по меньшей мере, частично, на открытии того, что иммуногены DLL3 являются терапевтически ассоциированными с поддерживающими опухоль клетками (т.е., раковыми стволовыми клетками), которые вовлечены в этиологию различных пролиферативных нарушений, включающих неоплазию. Более конкретно, рассматриваемая заявка раскрывает, что введение раскрытых Конъюгат DLL3ов может опосредовать, уменьшать, истощать, ингибировать или устранять туморогенную передачу сигналов клетками, инициирующими опухоли (например, снижение частоты распространения клеток, инициирующих опухоли). Такая пониженная передача сигналов, либо посредством истощения, нейтрализации, уменьшения, устранения, перепрограммирования или сайленсинга клеток, инициирующих опухоли, или посредством модификации морфологии опухолевых клеток (например, индуцированной дифференциации, разрушения ниши), в свою очередь позволяет проводить более эффективное лечение нарушений, ассоциированных с DLL3, посредством ингибирования онкогенеза, поддержания опухоли, распространения и/или метастазирования и повторного проявления.
Помимо вышеуказанной ассоциации с раковыми стволовыми клетками, очевидно, что bзоформы DLL3 могут быть вовлечены в рост, повторное проявление или метастатический потенциал опухолей, содержащих или проявляющих нейроэндокринные признаки или фенотипические детерминанты. Для целей рассматриваемого изобретения такие опухоли будут включать нейроэндокринные опухоли и псевдонейроэндокринные опухоли. Вмешательство в пролиферацию таких онкогенных клеток с использованием новых Конъюгат DLL3ов, описанных в данном документе, могут, таким образом, уменьшать тяжесть или лечить расстройство посредством более чем одного механизма (например, инициирующего опухоль восстановления клеток и разрушения сигнального пути онкогенного пути), чтобы предоставить аддитивные или синергистические эффекты. Еще другие предпочтительные варианты осуществления могут воспользоваться преимуществами клеточной интернализации белка DLL3 клеточной повнрхности, чтобы доставить присоединенное противоопухолевое средство. В данной связи следует принимать во внимание, что настоящее изобретение не ограничивается каким-либо конкретным механизмом действия, но скорее охватывает широкое применение раскрытых модуляторов для лечения нарушений, ассоциированных с DLL3 (включающих различные неоплазии).
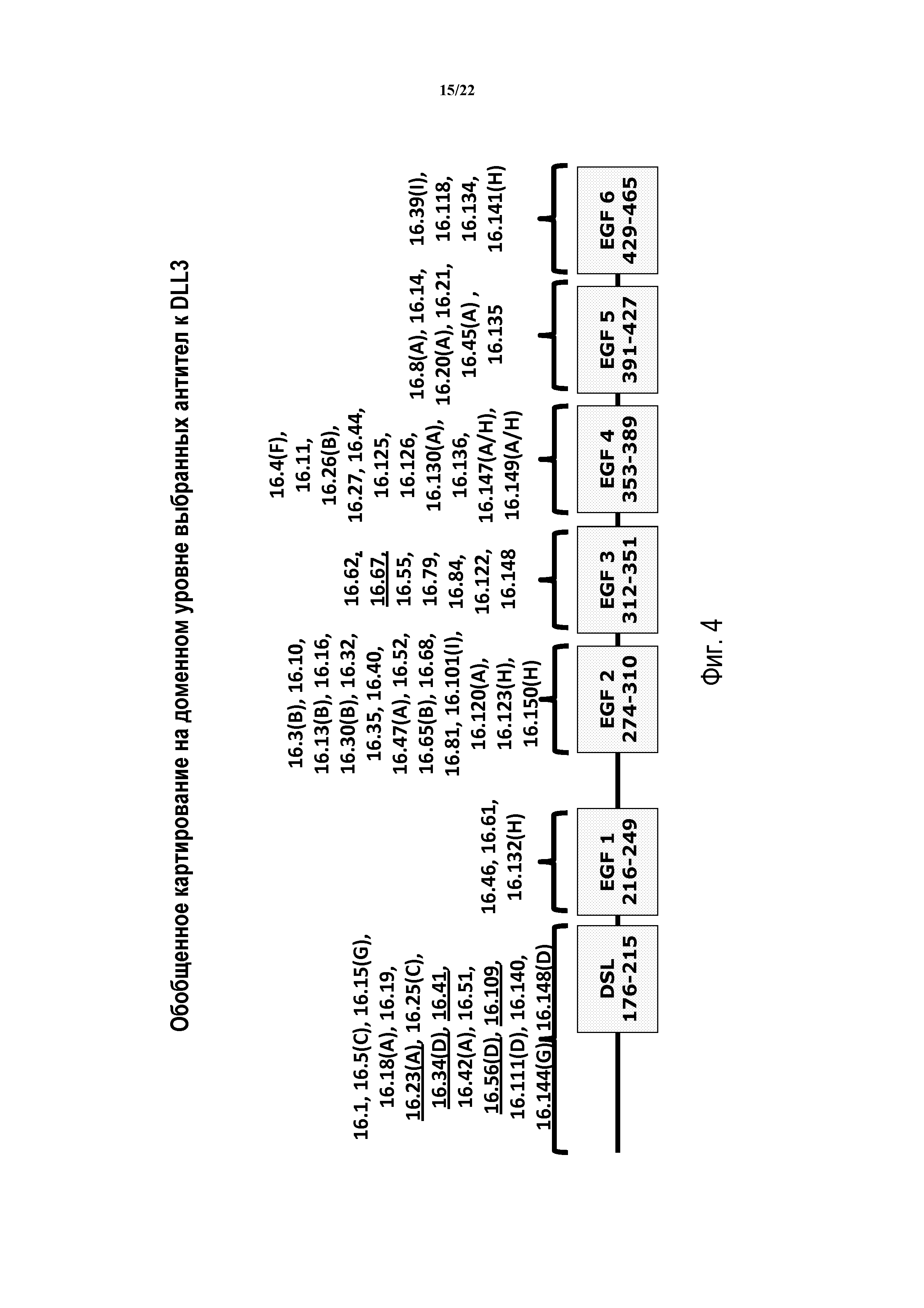
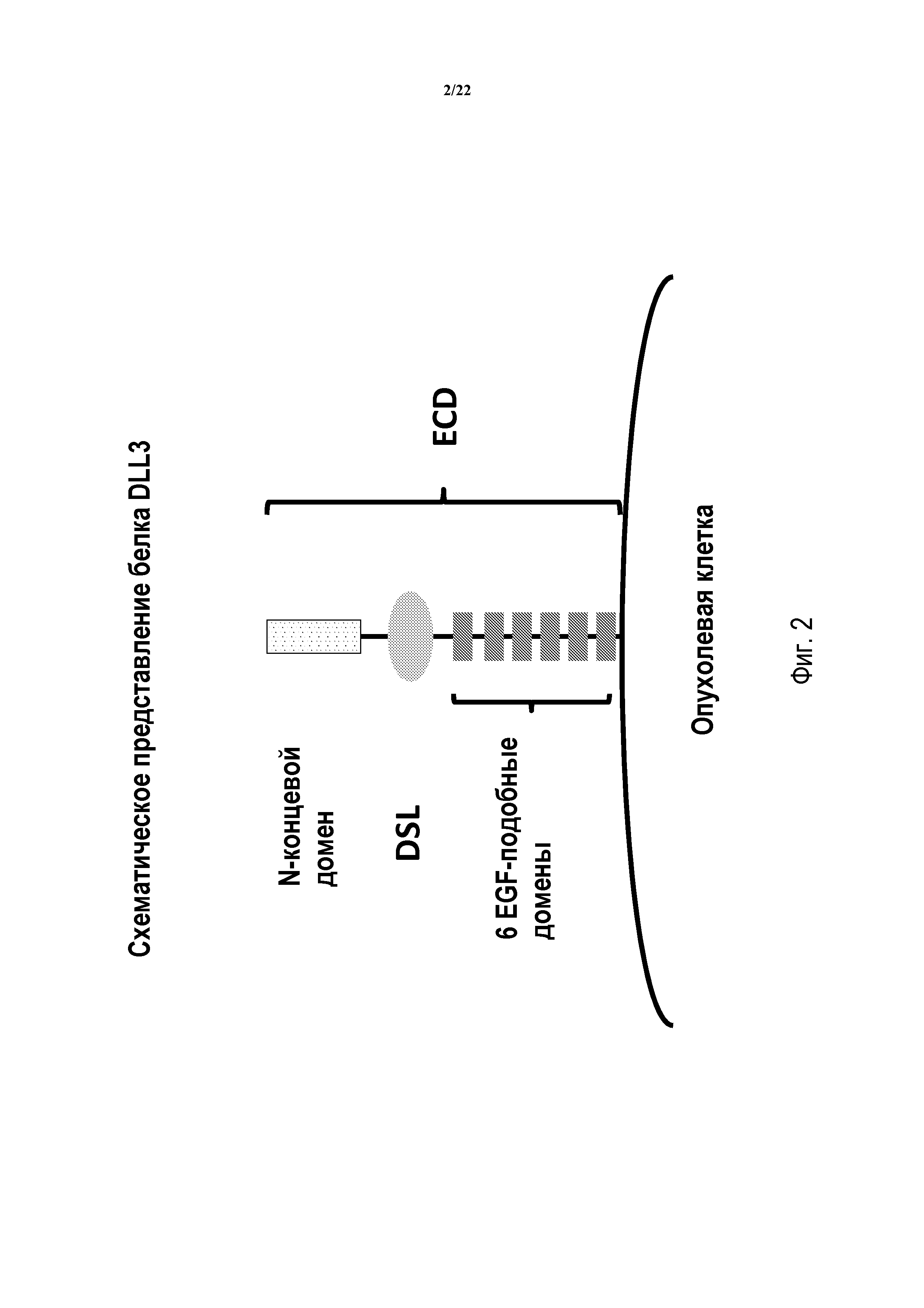
В еще других предпочтительных вариантах осуществления модуляторы будут ассоциироваться или связываться с специфичными эпитопом, частью, мотивом или доменом DLL3. Как будет обсуждаться довольно подробно ниже, обе изоформы DLL3 включают идентичную внеклеточную область (см. ФИГ. 2), содержащую по меньшей мере N-терминальный домен, DSL (Дельта/Пиловидный/лаг-2) домен и шесть EGF-подобных доменов (т.е., EGF1-EGF6). Соответственно, в некоторых вариантах осуществления модуляторы будут связываться или ассоциироваться с N-терминальным доменом DLL3 (т.е. аминокислотами 27-175 в зрелом белке), в то время как в других выбранных вариантах осуществления модуляторы будут ассоциироваться с доменом DSL (т.е. аминокислотами 176-215 DLL3) или эпитопом в этом месте. Другие аспекты рассматриваемого изобретения включают антитела, которые ассоциируются или связываются со специфичным эпитопом, расположенным в конкретном EGF-подобном домене DLL3. В данной связи конкретный модулятор может ассоциироваться или связываются с эпитопом, расположенном в EGF1 (аминокислоты 216-249), EGF2 (аминокислоты 274-310), EGF3 (аминокислоты 312-351), EGF4 (аминокислоты 353-389), EGF5 (аминокислоты 391-427) или EGF6 (аминокислоты 429-465). Конечно, следует принимать во внимание, что каждый из вышеуказанных доменов может содержать более одного эпитопа и/или более одного бина. В особенно предпочтительных вариантах осуществления изобретение будет включать антитело, которое связывается, взаимодействует или ассоциируется с доменом DSL или эпитопом в этом месте. В других предпочтительных вариантах осуществления изобретение будет включать антитела, которые связываются, взаимодействуют или ассоциируются с конкретным EGF-подобным доменом или эпитопом в этом месте. В еще других предпочтительных вариантах осуществления модуляторы будут связываться, взаимодействовать или ассоциировать с N-терминальным доменом или эпитопом в этом месте.
Что касается “бинов” модулятора или антитела, следует принимать во внимание, что антиген DLL3 может быть проанализирован или картирован посредством связывания конкурентных антител с использованием методов, принятых в данной области, для определения специфичных бинов, расположенных на белке или вдоль него. В то время, как обсуждается и показано в Примерах ниже, две антитела (одно из которых может называться “референтным антителом” “очерчивающим бин антителом” или “очерчивающим антителом”) могут считаться находящимися в одинаковом бине, если они конкурируют друг с другом за связывание с целевым антигеном. В таких случаях эпитопы субъектного антитела могут быть идентичными, по существу идентичными идентичн или достаточно близкими (либо в линейном смысле, где они разделены несколькими аминокислотами или конформационно), таким образом, что оба антитела стерически или элекростатически ингибируются или заранее исключаются из связывания с антигеном. Такие определенные бины могут быть, как правило, ассоциированы с некоторыми доменами DLL3 (например, референтное антитело будет связываться с эпитопом, содержащемся в специфичном домене), хотя корреляция не всегда бывает точной (например, может быть более одного бина в домене или бин может быть определен конформационно и содержать более одного домена). Следует принимать во внимание, что специалисты в данной области могут леко определить взаимосвязь между доменами DLL3 и эмпирически определенными бинами.
В отношении настоящего изобретения анализ конкурентного связывания с использованием методов, принятых в данной области, (например, ELISA, поверхностный плазмонный резонанс или интерферометрия биослоя) определил по меньшей мере девять различных бинов, каждый из которых, как было обнаружено, содержит ряд модуляторов антитела. Для целей рассматриваемого раскрытия девять бинов были проименованы от бина A до бина I. Таким образом, в избранных вариантах осуществления, настоящее изобретени будет содержать конъюгат антитела с лекарственным средством ADC 1-5, находящийся в бине, выбранном из группы, состоящей из бина A, бина B, бина C, бина D, бина E, бина F, бина G, бина H и бина I.
В других вариантах осуществления конъюгаты настоящего изобретения содержат антитело, находящееся в бине, определенном референтным антителом, выбранным из группы, состоящей из SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 и SC16.150. В еще других вариантах осуществления ADC изобретения будет включать антитела из бина A, антитела из бина B, антитела из бина C, антитела из бина D, антитела из бина E, антитела из бина F, антитела из бина G,антитела из бина H или антитела из бина I. Еще другие предпочтительные варианты осуществления будут включать модулятор референтного антитела и любое антитело, которое конкурирует с референтным антителом.
Термин “кокурирует” или “конкурирующее антитело”, когда используется в контексте раскрытых модуляторов, означает конкуренцию за связывание между антителами, как определяют посредством анализа, в котором референтное антитело или иммунологически функциональный фрагмент по существу предотвращает или ингибирует (например, боле чем на 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90%.) специфическое связывание тестируемого антитела с общим антигеном. Совместимые способы определения такой конкуренции включают известные методы, такие как, например, интерферометрия биослоя, поверхностный плазмонный резонанс, проточная цитометрия, конкурентный ELISA, и т.д.
Настоящее изобретение также предоставляет наборы или устройства и ассоциированные методы, в которых используют конъюгаты DLL3, раскрытые в данном документе, и фармацевтические композиции конъюгатов DLL3, раскрытых в данном документе, которые являются применимыми для лечения расстройств, ассоциированных с DLL3, таких как злокачественное новообразование. С этой целью, настоящее изобретение предпочтительно предоставляет готовое изделие, применимое для лечения расстройств, ассоциированных с DLL3, включающее емкость, содержащую конъюгат антитела с лекарственным средством из ADC1 - 5 и информационный обучающий материал по применению конъюгатов для лечения, облегчения протекания или предотвращения расстройства, ассоциированного с DLL3, или прогресстрования или повторного его проявления.
Вышеизложенное представляет собой краткое содержание сущности, и, таким образом, содержит, по необходимости, упрощения, обобщения, и пропуски подробностей; следовательно, специалисты в данной области смогут понять, краткое содержание сущности изобретения является только иллюстративным и не предназначено для ограничения никаким образом. Другие аспекты, признаки, и преимущества способов, композиций и/или устройств и/или другой субъектный материал, описанный в данном документе, станет очевидным из положений, изложенных в данном документе. Краткое содержание предоставлено, чтобы ввести в выбор концепций в упрощенной форме, которые дополнительно описаны ниже в Подробном Описании. Это краткое содержание не предназначено, ни для того, чтобы идентифицировать ключевый признаки или отличительные признаки заявленного предмета изобретения, ни для применения в качестве вспомогательного материала при определении объема заявленного предмета.
Краткое описание чертежей
ФИГ. 1 предоставляет выравнивание последовательностей двух изоформ белка DLL3 (SEQ ID NO: 1 и 2).
ФИГ. 2 предоставляет схематическое представление внеклеточной области белка DLL3, иллюстрирующее положения различных доменов.
ФИГ. 3A и 3B предоставляют, в табличной форме, смежные аминокислотные последовательности (SEQ ID NO: 21-407, с нечетными номерами) вариабельных областей легкой и тяжелой цепи ряда мышиных и гуманизированных иллюстративных антител к DLL3, совместимых с раскрытыми конъюгатами антител с лекарственным средством, выделенных, клонированных и сконструированных, как описано в Примерах в данном документе.
ФИГ. 4 отображает, в схематическом виде, результаты анализа на доменом уровне картирования иллюстративных модуляторов DLL3, выделенных, клонированных и сконструированных, как описано в Примерах в данном документе.
На ФИГ. 5 приведены биохимические и иммунологические свойства иллюстративных модуляторов DLL3, представленные в табличном формате.
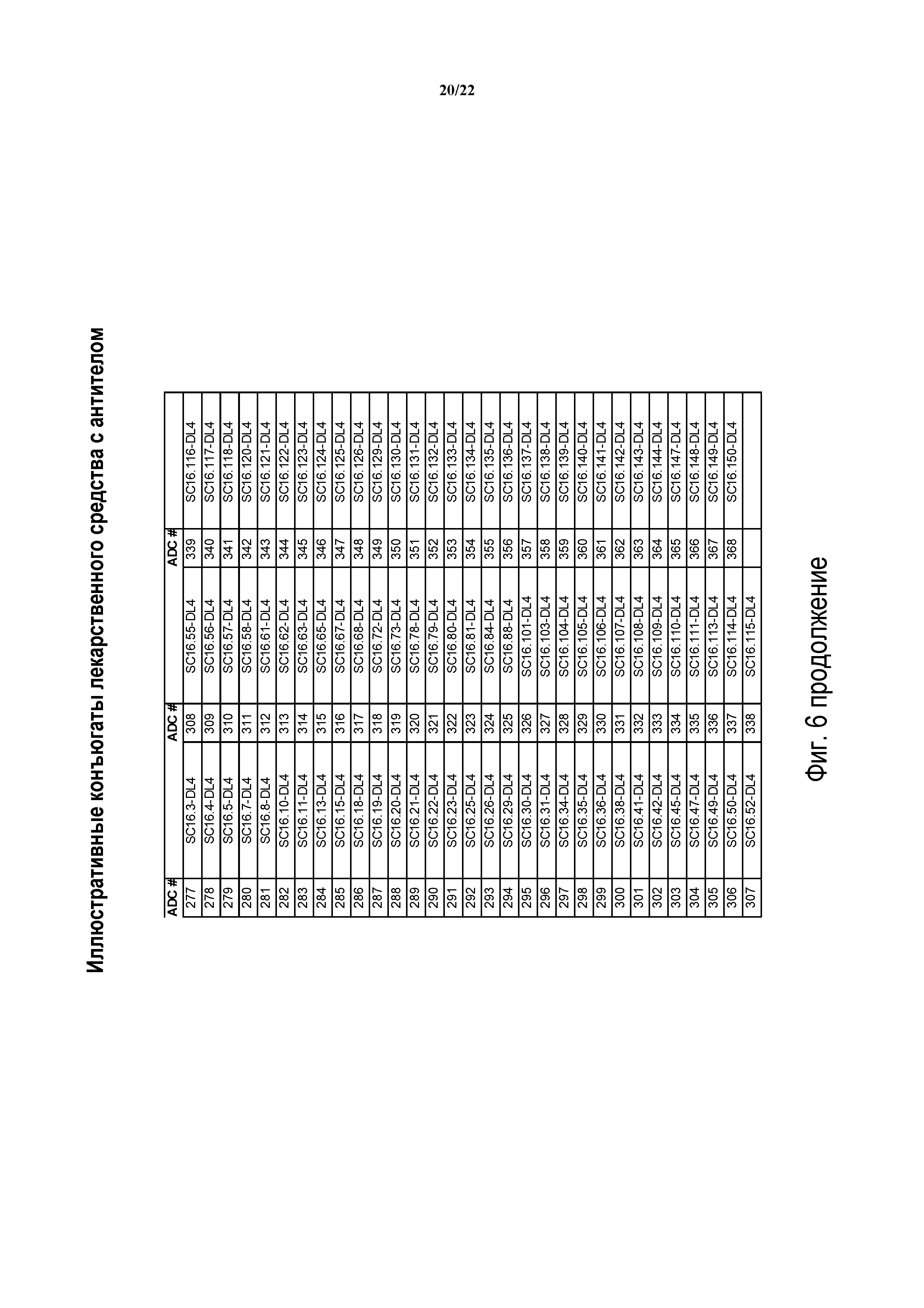
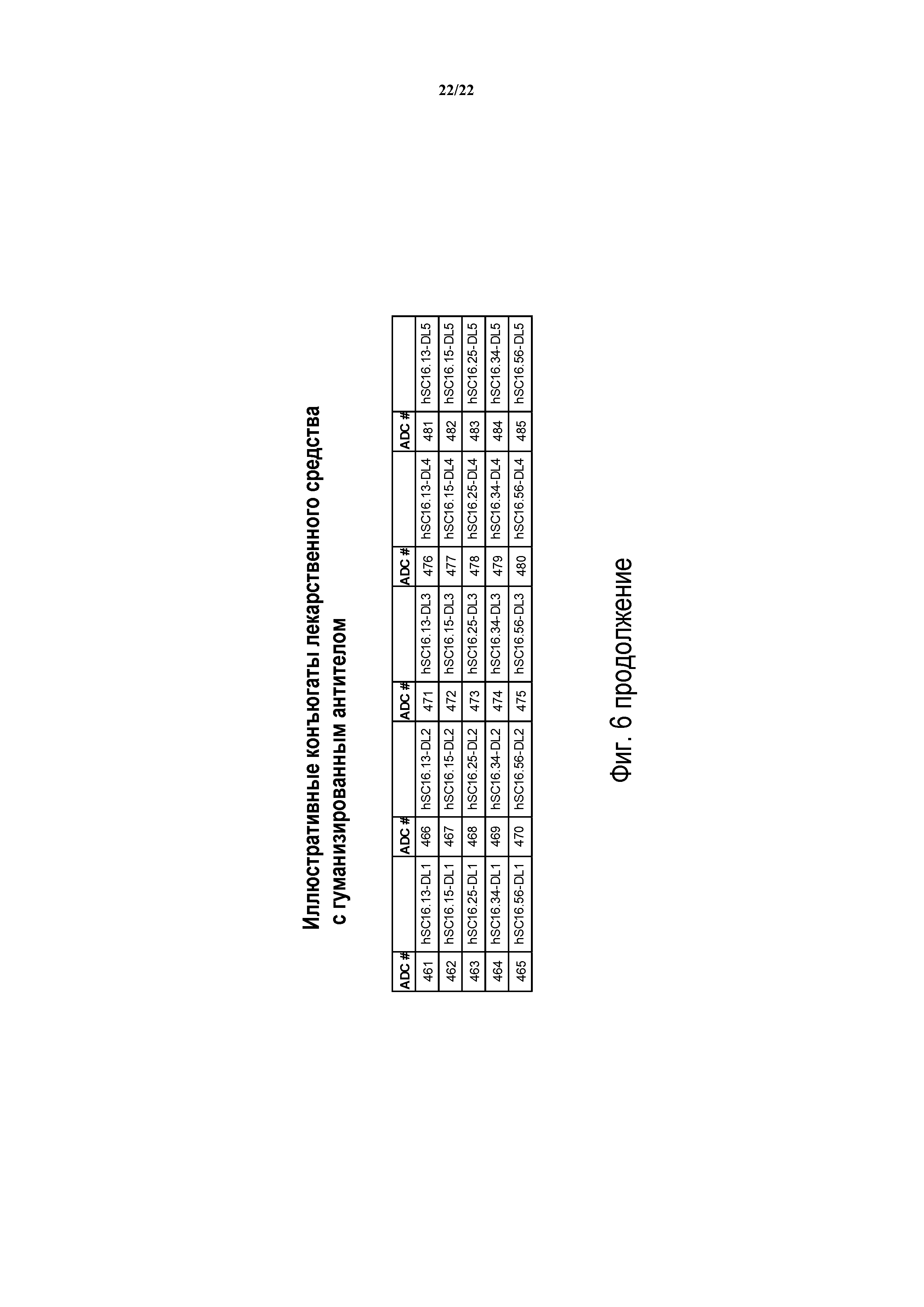
ФИГ. 6 предоставляет список иллюстративных конъюгатов антител с лекарственным средством, генерированных согласно рассматриваемому раскрытию.
Подробное описание изобретения
I. ВВЕДЕНИЕ
В то время как настоящее изобретение может воплощаться во многих различных формах, раскрытыми в данном документе являются их конкретные иллюстративные варианты осуществления, которые демонстрируют на примерах принципы изобретения. Ледует особенно отметить, что настоящее изобретени не ограничивается конкретными иллюстрированными вариантами осуществления. Более того, любые заголовки разделов, используемые в данном документе, приводятся только для организационных целей, и не рассматриваются как ограничивающие описанный предмет. Окончательно, для целей рассматриваемого раскрытия все идентифицирующие последовательности Инвентарные номера можно найти в базе данных NCBI референтных последовательностей (RefSeq) и/или в архивируемой базе данных последовательностей NCBI GenBank®, если не отмечено иначе.
Как обсуждается выше, было обнаружено, что фенотипические детерминанты DLL3 являются клинически ассоциированными с различными пролиферативными нарушениями, включающими неоплазию, проявляющую нейроэндокринные признаки, и, что белок DLL3 и его варианты или изоформы предоставляют применимые опухолевые маркеры, которые могут использоваться при лечении родственных заболеваний. В данной связи, настоящее изобретение предоставляет ряд конъюгатов антител с лекарственным средством, приведенных как ADC 1-5 выше, которые содержат целенаправленное средство анти-DLL3 антитело и ПБД полезную нагрузку. Как обсуждается более подробно ниже и приведено в прилагаемых Примерах, раскрытые DLL3 ADC являются особенно эффективными при устранении онкогенных клеток, и, следовательно, применимыми для лечения и профилактики некоторых пролиферативных нарушений или их прогрессирования или повторного проявления.
Более того, как показано в рассматриваемой заявке, было обнаружено, что маркеры DLL3 или детерминанты, такие как белок DLL3 клеточной поверхности являются терапевтически ассоциированными с раковыми стволовыми клетками (также известными, как опухолесохраняющие клетки) и могут эффективно использоваться для их устранения или подавления. Способность селективно снижать или устранять раковые стволовые клетки посредством применения конъюгированных модуляторов DLL3, раскрытых в данном документе, является удивительной в том, что такие клетки, как известно, в целом, являются резистентными ко многим общепринятым терапиям. Таким образом, эффективнность традиционных, а также более недавних способов целенаправленного лечения, часто ограничена существованием и/или возникновением резистентных раковых стволовых клеток, которые являются способными к сохранению роста опухоли, даже несмотря на эти разнообразные способы лечения. Дополнительно, детерминанты, ассоциированные с раковыми стволовыми клетками, часто создают слабые терапевтические мишени вследствие низкой или неустойчивой экспрессии, неспособности оставаться ассоциированными с опухолеобразующими клетками или неспособности присутствовать на клеточной поверхности. В резком противоречии с принципами предшествующего уровня, раскрытые сейчас конъюгаты антитела с лекарственным средством и способы эффективно преодолевают эту характерную резистентность и специфически устраняют, истощают, замедляют или инициируют дифференциацию таких раковых стволовых клеток, нейтрализуя посредством этого их способность поддерживать или реиндуцировать лежащий в основе рост опухоли. Более того, так как экспрессия белка DLL3 в значительной степени ассоциирована с внутриклеточными расположениями, такими как Гольджи, было неизвестно, что такие фенотипические детерминанты могут успешно использоваться в качестве терапевтической мишени для специфичных ADC, как изложено в данном документе.
Таким образом, особенно примечательно, что конъюгаты DLL3, такие как раскрытые в данном документе, могут преимущественно применяться при лечении и/или предотвращении выбранных пролиферативных (например, неопластических) растройств или их прогрессирования или повторного проявления. Следует принимать во внимание, что, в то время, как предпочтительные варианты осуществления изобретения будут широко обсуждаться ниже, в частности, в отношении конкретных доменов, областей или эпитопов или в контексте раковых стволовых клеткок или опухолей, содержащих нейроэндокринные признаки, и их взаимодействий с раскрытыми конъюгатами антител с лекарственным средством, специалисты в данной области смогут понять, что объем рассматриваемого изобретения не ограничивается такими иллюстративными вариантами осуществления. В большей степени, наиболее обширные варианты осуществления настоящего изобретения и прилагаемая формула изобретения широким образом и выраженно направлены на раскрытые конъюгаты DLL3 и их применение при лечении и/или предотвращении разнообразных ассоциированных с DLL3 или опосредованных им расстройств, включающих неопластические или клеточные пролиферативные нарушения, вне зависимости от какого-либо конкретного механизма действия или специфически целевой опухоли, клнточного или молекулярного компонента.
В этой связи, и как демонстрируется в рассматриваемой заявке, неожиданно было обнаружено, что раскрытые конъюгаты DLL3 могут эффективно применяться для устранения или иным образом обезвреживания пролиферативных или онкогенных клеток и целенаправленного действия на эти клетки и лечения расстройств, ассоциированных с DLL3 (например, неоплазии). Как используют в данном документе “расстройство, ассоциированное с DLL3”, будет означать любое расстройство или заболевание (включая пролиферативные нарушения), которое отмечают, диагностируют, обнаруживают или идентифицируют посредством фенотипической аберрации генетических компонентов DLL3 или его экспрессии (“детерминанта DLL3”) в процессе протекания или этиологии заболевания или расстройства. В данной связи, DLL3 фенотипическая аберрация или детерминанта могут, например, включать повышенные или подавленные уровни экспрессии белка DLL3, аномальную экспрессию белка DLL3 на некоторых определяемых клеточных популяциях или аномальную экспрессию белка DLL3 на несоответствующей фазе или стадии жизненного цикла клеток. Несомненно, следует принимать во внимание, что аналогичные схемы экспрессии генотипических детерминант (например, уровней транскрипции мРНК) DLL3 также могут применяться для классификации, обнаружения или лечения расстройств, связанных с DLL3.
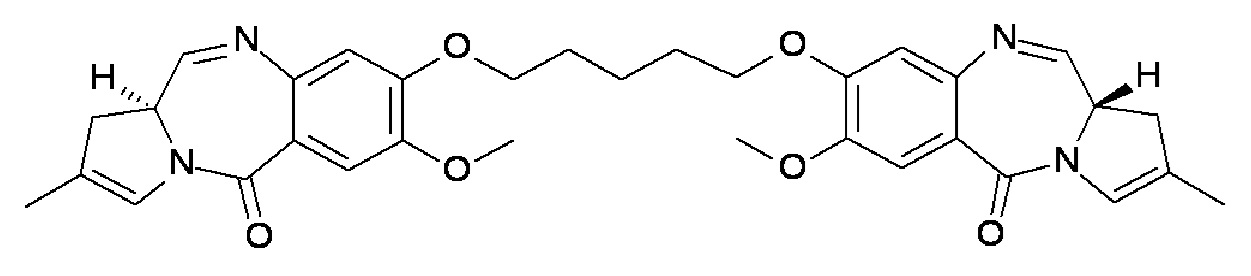
В отношении раскрытых конъюгатов, настоящее изобретение предоставляет димеры ПБД с линкером, соединенным с положением на одном из фрагментов ПБД и конъюгированные через линкер с модулятором антитела DLL3. Посредством этих тщательно сконструированных конфигураций конъюгат обеспечивает высвобождение активных ПБД соединений, которые, предпочтительно, не сохраняют какую-либо часть линкера. Таким образом, не присутствует никакого укороченного или линкерного остатка, который мог бы неблагоприятно воздействовать на реакционную способность ПБД полезнрй нагрузки. Таким образом, раскрытые конъюгаты DLL3 высвобождают следующие димерные ПБД соединения при расщеплении линкера.
Конъюгат ADC 1 высвобождает соединение ПБД 1:

Конъюгат ADC 2 высвобождает соединение ПБД 2:

Конъюгат ADC3 высвобождает соединение ПБД 3:

Конъюгат ADC4 высвобождает соединение PBD4:

Конъюгат ADC 5 высвобождает соединение ПБД 5:
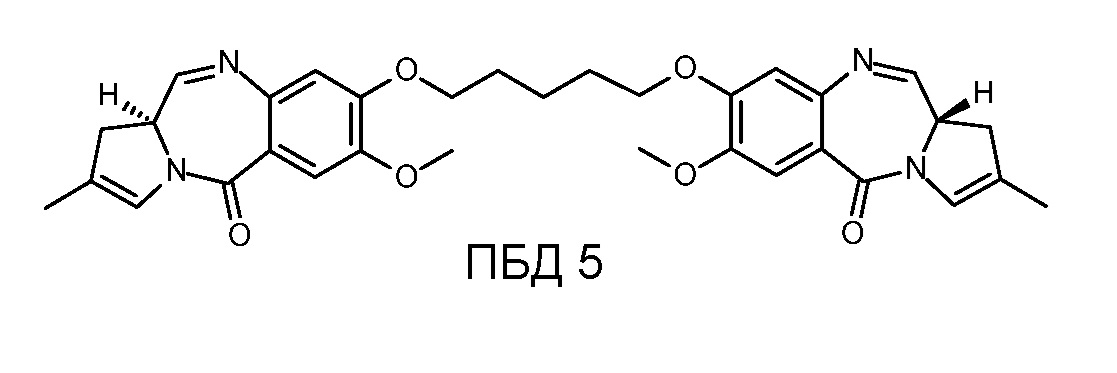
Соответственно, доставка токсичного соединения из ПБД 1, ПБД 2, ПБД 3, ПБД 4 или ПБД 5 достигается на желательном участке активации (т.е., внутри опухолеобразующей клетки) посредством ADC 1-5 через действие фермента, такого как катепсин, на соединяющую группу, и, в частности, на включенный дипептидный фрагмент валин-аланин. Как обсуждается более подробно ниже, локализованная доставка раскрытых ПБД цитотоксинов может обеспечить эффективное устранение нескольких типов онкогенных клеток со значительно меньшей токсичностью, чем при ассоциации с нецелевыми стандартными химиотерапиями.
В данной связи один аспект изобретения включает доставку соединения, выбранного из группы, состоящей из ПБД 1, ПБД 2, ПБД 3, ПБД 4 и ПБД 5, включающую стадию введения конъюгата DLL3.
II. ФИЗИОЛОГИЯ DLL3
Cигнальный путь Нотч, впервые идентифицированный у C. elegans и Drosophila, и, как показано впоследствии, являющийся эволюционно консервативным от беспозвоночных до позвоночных, участвует в ряде фундаментальных биологических процессов, включающих нормальное эмбриональное развитие, гомеостаз взрослых тканей, и поддержание стволовых клеток (D'Souza et al., 2010; Liu et al., 2010). Cигнальный путь Нотч является решающим для различных клеточных типов во время спецификации, формирования и морфогенеза. Часто, это происходит посредством механизма латерального ингибирования, при котором клетки экспрессирующие Нотч лиганд(ы) принимают предопределенную судьбу клеток, все еще подавляя эту судьбу у примыкающих клеток посредством стимуляции сигнального пути Нотч (Sternberg, 1988, Cabrera 1990). Обнаружено, что этот выбор бинарной судьбы клеток, опосредованный сигнальным путем Нотч играет важную роль в многочисленных тканях, включающую развитие нервной системы (de la Pompa et al., 1997), гематопоэтической и иммунной систем (Bigas и Espinosoa, 2012; Hoyne et al, 2011; Nagase et al., 2011), кишечника (Fre et al., 2005; Fre et al., 2009), эндокринной поджелудочной железы (Apelqvist et al., 1999; Jensen et al., 2000), гипофиза (Raetzman et al., 2004), и диффузной нейроэндокринной системы (Ito et al., 2000; Schonhoff et al, 2004). Генерализованный механизм осуществления этого бинарного включения, по-видимому, является консервативным, несмотря на широкий диапазон относящихся к развитию систем, в которых Нотч играет важную роль; например, в клетках, где выбор предопределенной судьбы клеток определяют по транскрипционным регуляторам, известным как основные белки спираль-петля-спираль (bHLH), сигнальный путь Нотч приводит к активации класса реагирующих на Нотч генов, которые, в свою очередь, подавляют активность белков bHLH (Ball, 2004). Эти бинарные решения происходят в широком контексте имеющих отношение к развитию и сигнальных команд, которые поволяют сигнальному пути Нотч оказывать воздействие на пролиферацию или ингибировать ее, и запускать самообновление или ингибировать его.
У Drosophila, сигнальный путь Нотч опосредован, в первую очередь, одним геном Нотч-рецептора и двумя лигандными генами, известными как Пилообразный (Serrate) и Дельта (Delta) (Wharton et al, 1985; Rebay et al., 1991). У людей, существуют четыре известных Нотч-рецептора и пять DSL (Delta-Serrate LAG2) лигандов - два гомолога Serrate, известных как Jagged 1 и Jagged 2, и три гомолога Delta, называемых дельта-подобные лиганды или DLL1, DLL3 и DLL4. В целом, Нотч-рецепторы на поверхности принимающей сигнал клетки активируются при взаимодействии с лигандами, экспрессируемыми на поверхности протвоположной, посылающей сигнал клетки (называемом транс-взаимодействием). Эти транс-взаимодействия приводят к последовательности опосредованных протеазой расщеплений Нотч-рецептора. Впоследствии, внутриклеточный домен Нотч-рецептора становится свободным, чтобы перемещаться от мембраны к ядру, где он объединяется с семейством CSL транскрипционных факторов (RBPJ у людей) и преобразует их из транскрипционных репрессоров в активаторы Нотч-чувствительных генов.
Из человеческих Нотч-лигандов, DLL3 отличается тем, что он, по-видимому, неспособен к активации Нотч-рецептора через транс-взаимодействия (Ladi et al., 2005). Нотч-лиганды могут также взаимодействовать с Нотч-рецепторами цис-образом (на той же клетке), что приводит к ингибированию Нотч-сигнала, хотя точные механизмы цис-ингибирования остаются неясными и могут варьировать в зависимости от лиганда (например, см. Klein et al., 1997; Ladi et al., 2005; Glittenberg et al., 2006). Два предполагаемых пути ингибирования включают модуляцию сигнального путь Нотч на клеточной поверхности посредством предотвращения транс-взаимодействий, или посредством снижения количества Нотч-рецептора на поверхности клетки посредством возмущения процессинга рецептора или физически вызывая удерживание рецептора в эндоплазматической сети или Гольджи (Sakamoto et al., 2002; Dunwoodie, 2009). Ясно, однако, что стохастические различия в экспрессии Нотч-рецепторов и лигандов на соседних клетках могут быть амплифицированы через как транскрипционные, так и нетранскрипционные процессы, и тонкие балансы цис- и транс-взаимодействий могут приводить к точной настройке Нотч-опосредованной трансдифференцировке дивергентных судеб клеток в соседних тканях (Sprinzak et al., 2010).
DLL3 (также известный как Дельта-подобный 3 или SCDO1) является членом Дельта-подобного семейства Нотч-лигандо DSL. Представительные ортологи белка DLL3 включают, но не ограничиваются перечисленным, человеческий (Учетный номер. NP_058637 и NP_982353), шимпанзе (Учетный номер. XP_003316395), мышиный (Учетный номер. NP_031892) и крысиный (Учетный номер. NP_446118). У людей, ген DLL3 состоит из 8 экзонов, охватывающих 9,5 kBp, расположенных на хромосоме 19q13. Чередующийся сплайсинг в последнем экзоне приводит к возникновению двух процессированных транскриптов, одного из 2389 оснований (Учетный номер. NM_016941), и одного из 2052 оснований (Учетный номер. NM_203486). Первый транскрипт кодирует белок из 618 аминокислот (Учетный номер. NP_058637; ФИГ. 1, SEQ ID NO: 1), в то время как последний кодирует белок из 587 аминокислот (Учетный номер. NP_982353; ФИГ. 1, SEQ ID NO: 2). Эти две белковые изоформы DLL3 имеют в целом 100% идентичности на протяжении их внеклеточных доменов и их трансмембранных доменов, отличаясь только тем, что более длинная изоформа содержит расширенный цитоплазматический хвост, содержащий 32 дополнительных остатка по карбокси-концу белка (ФИГ. 1). Биологическая уместность изоформ является неясной, несмотря на то, что обе изоформы могут быть обнаружены в опухолевой клетке.
В целом, DSL лиганды составлены из ряда структурных доменов: уникального N-терминального домена, сопровождаемого консервативным доменом DSL, множеством тандемных подобных эпидермальному фактору роста (EGF) повторов, трансмембранного домена, и цитоплазматического домена, не являющегося высококонсерватвным среди лигандов, но который содержит множество остатков лизина, которые являются потенциальными участками для убиквитинилирования по действием уникальных E3 убиквитинлигаз. Домен DSL является дегенеративным EGF-доменом, который является необходимым, но не достаточным для взаимодействий с Нотч-рецепторами (Shimizu et al., 1999). Дополнительно, первые два EGF-подобных повтора большинства DSL лигандов содержат более мелкий мотив последовательности белка, известный как DOS домен, который совместно взаимодействует с доменом DSL, при активации сигнального пути Нотч.
ФИГ. 2 предоставляет схематический чертеж внеклеточной области белка DLL3, иллюстрирующий общее соседнее положение шести EGF-подобных доменов, одиночного домена DSL и N-терминального домена. В целом, EGF домены распознают, как имеющие место при приблизительно аминокислотных остатках 216-249 (домен 1), 274-310 (домен 2), 312-351 (домен 3), 353-389 (домен 4), 391-427 (домен 5) и 429-465 (домен 6), с доменом DSL при приблизительно аминокислотных остатках 176-215 и N-терминальным доменом при приблизительно аминокислотных остатках 27-175 hDLL3 (SEQ ID NO: 1 и 2). Как обсуждается более подробно в данном документе, и показано в Примерах ниже, каждый из EGF-подобных доменов, домена DSL и N-терминального домена содержит часть белка DLL3, определенную отличающейся аминокислотной последовательностью. Следует отметить, что, для целей рассматриваемого раскрытия соответствующие EGF-подобные домены могут именоваться от EGF1 до EGF6, причем EGF1 является наиболее близким к N-терминальной части белка. По отношению к структурному составу белка, один существенный аспект рассматриваемого изобретения состоит в том, что раскрытые модуляторы DLL3 могут генерироваться, изготавливаться, конструироваться или выбираться таким образом, чтобы взаимодействовать с выбранным доменом, мотивов или эпитопом. В некоторых случаях такие сайт-специфичные модуляторы могут обеспечить увеличенную реакционную способность и/или эффективность действия в зависимости от их первичного образа действия.
Следует отметить, что, как используют в данном документе, термины “зрелый белок” или “зрелый полипептид”, относятся к форме(формам) белка, продуцируемого посредством экспрессии в клетке млекопитающих. В целом, гипотетически предполагают, что как только был инициирован экспорт растущей белковой цепи через грубую эндоплазматическую сеть, белки, секретируемые клетками млекопитающих, имеют последовательность сигнального пептида (SP), которая отщепляется от полного полипептида, чтобы продуцировать “зрелую” форму белка. В обеих изоформах зрелый белок DLL3 содержит сигнальный пептид из 26 аминокислот, который может быть зажат перед экспрессией клеточной поверхности. Таким образом, в зрелых белках N-терминальный домен будет располагаться от положения 27 в белке до начала домена DSL. Конечно, если белок не процессируется таким образом, N-терминальный домен будет удерживаться, чтобы достигать положения одной из SEQ ID NO: 1 и 2.
Из различных дельта-подобных лигандов, DLL3 является наиболее отличающимся от других в семействе, так как он содержит дегенеративный домен DSL, никаких DOS мотивов, и внутриклеточный домен, в котором отсутствуют остатки лизина. Дегенеративный DSL и отсутствие DOS мотивов согласуется с неспособностью DLL3 запускать сигнальный путь Нотч транс-путем (между клетками), с предположением, что DLL3, в отличие от DLL1 или DLL4, действует только как ингибитор сигнального пути Нотч (Ladi et al., 2005). Исследования показали, что DLL3 может располагаться первично в цис-Гольджи (Geffers et al., 2007), что согласовывалось бы с предполагаемой способностью удерживать Нотч-рецептор внутриклеточно, или препятствовать процессингу Нотч-рецепторов, предотвращая экспорт к клеточной поверхности, и, вместо этого перенацеливая его к лизосоме (Chapman et al., 2011). Некоторая часть белка DLL3 может появляться на клеточной поверхности, однако, когда белок искусственно сверхэкспрессируется в модельных системах (Ladi et al., 2005), но не очевидно, что это будет происходить ни при нормальных биологических контекстах, ни в опухолях, в которых повышается транскрипт мРНК DLL3; в некоторой степени удивительно, что уровни белка, обнаруживаемые в типах опухолей, раскрытых в данном документе, указывают на то, что значительная часть белка DLL3 уходит к поверхности клеток различных опухолей.
Дополнительно, как обсуждается выше, сигнальный путь Нотч играет роль в развитии и поддержании нейроэндокринных клеток и опухолей, проявляющих нейроэндокринные признаки. В данной связи сигнальный путь Нотч вовлечен в широкий диапазон решений судьбы клеток в нормальных эндокринных органах и в диффузной нейроэндокринной смстеме. Например, в поджелудочной железе, сигнальный путь Нотч требуется для подавления развития по умолчанию эндокринного фенотипа, опосредованного bHLH фактором транскрипции NGN3 (Habener et al, 2005). Аналогичное Нотч-опосредованное подавление судьбы эндокринных клеток происходит в энтероэндокринных клетках (Schonhoff et al., 2004), парафолликулярных клетках щитовидной железы (Cook et al., 2010), при установлении относительных соотношений нейроэндокринных клеточных типов в гипофизе (Dutta et al., 2011), и, вероятно, вовлечен в решение судьбы клеток внутри легкого, чтобы принять нейроэндокринный или не-нейроэндокринный фенотип (Chen et al., 1997; Ito et al., 2000; Sriuranpong et al., 2002). Следовательно, ясно, что во многих тканях подавление сигнального пути Нотч связано с нейроэндокринными фенотипами.
Несоответствующая реактивация сигнальных путей, имеющих отношение к развитию, или дисрегуляция нормальных сигальных путей обычно наблюдается в опухолях, и, в случае сигнального пути Нотч, была ассоциирована с многочисленными опухолевыми типами (Koch и Radtke, 2010; Harris et al., 2012). Путь-Нотч исследовали в качестве онкогена в лимфомах, при колоректальном раке, раке поджелудочной железы, и в некоторых типах немелкоклеточного рака легких (см. Zarenczan and Chen, 2010 и приведенные в них ссылки). Напротив, сообщается, что Нотч действует в качестве супрессора опухоли в опухолях с нейроэндокринными признаками (см. Zarenczan and Chen, 2010 выше). Опухоли с нейроэндокринными признаками возникают нечасто в широком ряде первичных участков, и, в то время, как их исчерпывающая классификация остается проблематичной (Yao et al., 2008; Klimstra et al., 2010; Klöppel, 2011), они могут быть классифицированы на четыре основных типа: низкой степени доброкачественные карциноиды, низкой степени хорошо дифференцируемые нейроэндокринные опухоли со злокачественным поведением, опухоли со смешанными нейроэндокринными и эпителиальными признаками, и высокой степени слабо дифференцируемые нейроэндокринные карциномы. Из этих классификаций, слабо диффернцируемые нейроэндокринные карциномы, которые включают мелкоклеточный рак легких (SCLC) и подтипы немелкоклеточного рака легких (NSCLC), представляют собой типы злокачественных новообразований с неблагоприятным прогнозом. Было постулировано, что SCLC является бронхогенным по происхождению, возникающим отчасти из легочных нейроэндокринных клеток (Galluzzo и Bocchetta, 2011). Какой бы ни был специфичный клеточный источник происхождения для каждой из этих опухолей, обладающей нейроэндокринным фенотипом, можно ожидать, что подавление сигнального пути Нотч, либо посредством прямых повреждений самих генов пути Нотч, или посредством активации других генов, которые подавляют сигнальный путь Нотч, может приводить к приобретению нейроэндокринного фенотипа этих опухолей. При расширении, гены, которые приводят к возмущению пути Нотч, могут представить терапевтические мишени для лечения опухолей с нейроэндокринными фенотипами, особенно для показаний, которые в настоящее время имеют плохие клинические исходы.
ASCL1 является одним таким геном, который, по-видимому, взаимодействует с сигнальным путем Нотч через DLL3. Ясно, что многие нейроэндокринные опухоли показывают слабо дифференцируемый (т.е. частично полный) эндокринный фенотип; например, отмеченные повышение или экспрессию различных эндокринных белков и полипептидов (например, хромогранина A, CHGA; кальцитонина, CALCA; пропиомеланокорина, POMC; соматостатина, SST), белков, ассоциированных с секреторными везикулами (например, синаптофизина, SYP), и генов, вовлеченных в биохимические пути, отвечающие за синтез биоактивных аминов (например, допа-декарбоксилазы, DDC). Вероятно неудивительно, что эти опухоли часто сверхэкспрессируют ASCL1 (также известный как mASH1 у мышей, или hASH1 у людей), фактор транскрипции, известный, как играющий роль в слаженной работе генных каскадов, ведущих к невральному и нейроэндокринному фенотипам. Несмотря на специфические молекулярные детали, каскад остается слабовыраженным, и становится ясно, что для некоторых клеточных типов, особенно парафолликулярных клеток щитовидной железы (Kameda et al., 2007), хромаффинных клеток мозгового слоя надпочечников (Huber et al., 2002) и клеток, обнаруживаемых в диффузной нейроэндокринной системе легкого (Chen et al., 1997; Ito et al., 2000; Sriuranpong et al., 2002), ASCL1 является частью точно настроенной регуляиорной петли развития, в которой выборы судьбы клеток опосредованы балансом ASCL1-опосредованных и Нотч-опосредованных каскадов экспрессии генов. Например, было обнаружено, что ASCL1 экспрессируется в нормальных мышиных легочных нейроэндокринных клетках, в то время как эффектор сигнального пути Нотч, HES1, экспрессировался в легочных ненейроэндокринных клетках (Ito et al., 2000). Особенно надо учитывать, что эти два каскада находятся в тонком балансе с потенциальной перекрестной регуляцией. Было показано, что эффектор Нотч HES1 регулирует с понижением экспрессию ASCL1 (Chen et al., 1997; Sriuranpong et al., 2002). Эти результаты ясно демонстрируют, что сигнальный путь Нотч может подавлять нейроэндокринную дифференциацию. Однако, демонстрация связывания ASCL1 с промотором DLL3 активирует экспрессию DLL3 (Henke et al., 2009), и наблюдение того, что DLL3 ослабляет сигнальный путь Нотч (Ladi et al., 2005), закрывает генетический контур для выборов судьбы клеток между нейроэндокринными и ненейроэндокринными фенотипами.
Принимая во внимание, что сигнальный путь Нотч, по-видимому, возник для амплификации тонких различий между соседними клетками, чтобы позволить появиться резко ограниченным тканевым доменам с дивергентными путями дифференциации (например, “латерального ингибирования”, как описано выше), эти данные вместе позволяют предположить, что точно настроенная регуляторная петля для развития стала реактивированной и дисрегулированной у злокачественных новообразований с нейроэндокринными фенотипами. В то время, как неочевидно, что DLL3 смог бы обеспечить подходящую мишень клеточной поверхности для разработки терапевтических антител с учетом его нормального расположения внутри мебранных компартментов клетки (Geffers et al., 2007) и его предполагаемых там взаимодействий с Нотч, возможно, что полученная в результате экспресси DLL3 в нейроэндокринных опухолях может предложить уникальную терапевтическую мишень для опухолей с нейроэндокринным фенотипом (например, NET и pNET). Обычно наблюдают, что обширная сверхэкспрессия белков в лабораторных системах может вызывать отклонение от локализации сверхэкспрессированного белка внутри клетки. Следовательно, выдвигается обоснованная гипотеза, еще не являющаяся очевидной без экспериментальной верификации, что сверхэкспрессия DLL3 в опухоли может приводить к некоторой экспрессии белка на клеточной поверхности, и, таким образом, представлять мишень для раскрытых ADC настоящего изобретения.
III. Раковые стволовые клетки
Как упоминалось выше, неожиданно было обнаружено, что аберрантная экспрессия DLL3 (генотипическая и/или фенотипическая) ассоциирована с субпопуляциями различных опухолеобразующих клеток. В данном отношении, настоящее изобретение предоставляет конъюгаты антитела к DLL3 с лекарственным средством, которые могут быть особенно применимыми для целенаправленного действия на такие клетки (например, раковые стволовые клетки), способствуя, таким образом, лечению, контролю или предотвращения неопластических расстройств. Таким образом, в предпочтительных вариантах осуществления, раскрытые DLL3 ADC могут преимущественно применяться для снижения частоты клеток, инициирующих опухоль, в соответствии с представленными принципами, и, таким образом, способствовать лечению или контролю пролиферативных нарушений.
Для целей рассматриваемой заявки термин “клетка, инициирующая опухоль” (TIC) охватывает как “поддерживающие опухоль клетки” (TPC; т.е., раковые стволовые клетки или CSC) и в высокой степени пролиферативные “клетки-предшественники опухоли” (называемые TProg), которые вместе содержат уникальную субпопуляцию (т.е. 0,1-40%) объема или массы опухоли. Для целей рассматриваемого раскрытия термины “поддерживающие опухоль клетки” и “раковые стволовые клетки” или “неопластические стволовые клетки” являются эквивалентными и могут применяться взаимозаменяемо в данном документе. TPC отличаются от TProg в том, что TPC могут полностью повторять состав опухолевых клеток, существующих внутри опухоли, и имеют неограниченную способность к самообновлению, как продемонстрировано посредством серийной трансплантации (два или более пассажей через мышей) низкого количества выделенных клеток, в то время как TProg не будут проявлять неограниченную способность к самообновлению.
Специалисты в данной области смогут понять, что сортировка флуоресцентно-активированных клеток (FACS) с использованием соответствующих маркеров клеточной поверхности является надежным методом для выделения высоко обогащенных субпопуляций раковых стволовых клеток (например, >99,5% чистоты) вследствие, по меньшей мере, частично, его способности проводить различие между одиночными клетками и скоплениями клеток (т.е. дублетами и т.д.). С использованием таких методов было показано, что, когда низкие количества высокоочищенных клеток TProg пересаживают иммунодефицитным мышам, они могут подпитывать опухолевый рост в первичном трансплантате. Однако, в отличие от субпопуляций очищенных TPC, опухоли, генерируемые TProg, не полностью отражают родительскую опухоль по гетерогенности фенотипических клеток, и очевидно являются неэффективными при повторной инициации серийного онкогенеза в последующих трансплантатах. Напротив, субпопуляции раковых стволовых клеток полностью восстанавливают клеточную гетерогенность родительской опухоли и могут эффективно инициировать опухоли, когда их серийно выделяют и трансплантируют. Таким образом, специалисты в области смогут понять, что определенное различие между TPC и TProg, хотя оба типа могут являться генерирующими опухоль в первичных трансплантатах, представляет собой уникальную способность TPC бесконечно подпитывать гетерогенный опухолевый рост при серийной трансплантации с низкими количествами клеток. Другие общие подходы для характеризации TPC включают морфологию и исследование маркеров поверхности клетки, транскрипционного профиля, и ответа на лекарственное средство, несмотря на то, что маркер экспресси может изменяться вместе с условиями культивирования и с пассажем клеточной линии in vitro.
Соответственно, для целей рассматриваемого изобретения поддерживающие опухоль клетки, подобно нормальным стволовым клеткам, которые поддерживают клеточные иерархии в нормальной ткани, предпочтительно определяют по их способности к самообновлению неопределенным образом, при поддержании в то же время способности к дифференциации смешанного типа. Поддерживающие опухоль клетки, таким образом, являются способными к генерации как туморогенного потомства (т.е., клеток, инициирующих опухоли: TPC и TProg), так и нетуморогенного (NTG) потомства. Как используют в данном документе “неопухолеобразующая клетка” (NTG) относится к опухолевой клетке, которая возникает из клеток, инициирующих опухоль, но сама по себе не имеет способности к самообновлению или генерации гетерогенных рядов поколений опухолевых клеток, котрые составляют опухоль. Экспериментально, клетки NTG неспособны к репродуцируемому образованию опухоли у мышей, даже когда их персаживают при избытке количества клеток.
Как указано, TProg также категоризуют как клетки, инициирующие опухоли (или TIC), вследствие их ограниченной способности генерировать опухоли у мышей. TProg являются потомками TPC, и обычно способны к конечному числу делений несамообновляющихся клеток. Более того, клетки TProg могут дополнительно подразделяться на ранних предшественников опухолевых клеток - (ETP) и поздних предшественников опухолевых клеток (LTP), каждые из которых могут различаться по фенотипу (например, маркерам клеточной поверхности) и различным способностям повторять архитектуру опухолевой клетки. Несмотря на такие технические различия, как ETP, так и LTP отличаются функционально от TPC тем, что они, как правило, менее способны к серийному восстановлению опухоли, когда их пересаживают при небольшом числе клеток, и обычно не отражают гетерогенность родительской опухоли. Вопреки приведенным выше различиям, также было показано, что различные популяции TProg могут, в редком случае, приобретать способности к самообновлению, обычно присущие стволовым клеткам, и сами становятся TPC (или CSC). В любом случае, оба типа клеток, инициирующих опухоль, вероятно, представлены в типичной массе опухоли единичного пациента и являются предметом лечения с использованием модуляторов, раскрытых в данном документе. Таким образом, раскрытые композиции в целом являются эффективными при снижении частоты или изменении хемочувствительности таких DLL3-положительных клеток, инициирующих опухоли, независимо от конкретного варианта осуществления или смеси, представленной в опухоли.
В контексте рассматриваемого изобретения, TPC являются более туморогенными, относительно более спокойными и часто более химиорезистентными, чем TProg (как ETP, так и LTP), клетки NTG и инфильтративные через опухоль, не-TPC производные клетки (например, фибробласты/строма, эндотелиальные и гематопоэтические клетки), которые составляют основную массу опухоли. С учетом того, что общепринятые терапии и режимы лечения были, в основном, разработаны, чтобы, как сокращать массу опухоли, так и атаковать быстро пролиферирующие клетки, TPC, вероятно, являются более резистентными к общепринятым терапиям и режимам, чем более быстро пролиферирующие TProg и другие клеточные популяции основной массы опухоли. Дополнительно, TPC часто экспрессируют другие характеристики, которые делают их относительно химиорезистентными к общепринятым терапиям, такие как увеличенная экспрессия транспортеров резистентности к мультилекарственным средствам, усиленный механизм репарации ДНК и анти-апоптотические белки. Эти свойства, каждое из которых способствует перносимости лекарственного средства у TPC, оставляют главную причину неудач стандартных режимов онкологического лечения для обеспечения долговременного благоприятного эффекта для большинства пациентов с прогрессирующей стадией неоплазии; т.е. неспособность адекватно целенаправленно действовать и уничтожать эти клетки, которые подпитывают продолжающийся опухолевый рост и повторное проявление (т.е. TPC или CSC).
В отличие от многих терапий предшествующего уровня, новые конъюгаты антител с лекарственным средством настоящего изобретения предпочтительно снижают частоту клеток, инициирующих опухоли, при введении ADC субъекту. Как отмечалось выше, снижение частоты клеток, инициирующих опухоль, может происходить в результате a) устранения, истощения, сенсибилизации, сайленсинга или ингибирования клеток, инициирующих опухоли; b) управления ростом, экспансией или повторным проявлением клеток, инициирующих опухоли; c) прерывания инициации, распространения, поддержания или пролиферации клеток, инициирующих опухоли; или d) посредством иного затруднения выживания, регенерации и/или метастазирования онкогенных клеток. В некоторых вариантах осуществления, снижение частоты клеток, инициирующих опухоли, происходит в результате изменения в одном или нескольких физиологических путях. Изменение в пути, либо посредством уменьшения или устранения клеток, инициирующих опухоли или посредством модификации их потенциала (например, индуцированной дифференциации, разрушения ниши) или иного противодействия их способности влиять на окружение опухоли или другие клетки, что, в свою очередь обеспечивает более эффективное лечение нарушений, ассоциированных с DLL3, посредством ингибирования онкогенеза, поддержания опухоли и/или метастазирования и повторного проявления.
Среди признанных в области методов, которые могут применяться для оценки такого снижения частоты клеток, инициирующих опухоли, находится анализ методом серийных разведений либо in vitro или in vivo, предпочтительно с последующим перчислением с использованием статистики распределения Пуассона или оценки частоты предварительно заданных определенных событий, таких как способность или неспособность генерировать опухоли in vivo. В то время, как такой анализ методом серийных разведений включает предпочтительные методы расчета снижения частоты клеток, инициирующих опухоли, менее востребованные методы, также могут применяться, чтобы эффективно определять желательные значения, хотя и немного менее точно, и являются полностью совместимыми с принципами данного документа. Таким образом, как смогут оценить специалисты в области, также является возможным определить снижение значений частоты посредством хорошо известных проточной цитометрии или иммуногистохимических средств. По всем вышеуказанным методам см., например, Dylla et al. 2008, PMID: 18560594 & Hoey et al. 2009, PMID: 19664991; каждая из которых полностью включена в данный документ посредством ссылки и, в частности, для раскрытых методов.
Что касается анализа методом серийных разведений in vitro, то учет частоты клеток, инициирующих опухоль, может осуществляться посредством осаждения либо фракционированных или нефракционированных человеческих опухолевых клеток (например, из подвергаемых лечению и неподвергаемых лечению опухолей, соответственно) в условия роста in vitro, которые благоприятствуют образованию колонии. Таким образом, колониеобразующие клетки могут быть учтены посредством простого подсчета и характеризации колоний или посредством анализа состоящего из, например, осаждения человеческих опухолевых клеток в планшеты при серийных разведениях и оценки каждой лунки либо как положительной или отрицыательной для образования колонии по меньшей мере через 10 дней после внесения в планшеты. Эксперименты in vivo с ограничивающим разведением или анализы, которые, обычно, являются более точными по их способности определять инициирующую опухоль частоту клеток, охватывают трансплантацию человеческих опухолевых клеток, либо из необработанных контрольных или обработанных популяций, например, иммунодефицитным мышам при серийных разведениях и, в последующем, оценку каждой мыши, либо как положительную или отрицательную для образования опухоли по меньшей мере через 60 дней после пересадки. Вывод значений частоты клеток посредством анализа методом серийных разведений in vitro или in vivo предпочтительно проводят посредством применения статистического распределения Пуассона к известной частоте положительных и отрицательных событий, таким образом, обеспечивая частоту событий, выполняя определение положительного события; в данном случае, образования колонии или опухоли, соответственно.
Что касается других методов, совместимых с рассматриваемым изобретением, которые могут применяться для расчета частоты клеток, инициирующих опухоль, то они наиболее часто включаеют поддающиеся количественному измерению методы проточной цитометрии и методики иммуногистохимического окрашивания. Хотя и не являясь настолько точными, как методы анализа методом серийных разведений, описанным непосредственно выше, эти методики являются намного менее трудозатратными и обеспечивают приемлемые в относительно коротком формате времени. Таким образом, следует принимать во внимание, что квалифицированный специалист может применять проточное цитометрическое определение профиля маркеров клеточной поверхности с использованием одного или более антител или реагентов, которые связываются с принятыми в данной области белков клеточной поверхности, которые как известно, обогащают клетки, инициирующие опухоли (например, потенциально совместимые маркеры, приведенные в заявке PCT 2012/031280, которая полностью включена в данный документ), и, таким образом, измерить уровни TIC из различных образцов. В еще одном совместимом методе специалист в области сможет учесть частоту TIC in situ (например, в тканевом срезе) посредством иммуногистохимии с использованием одного или более антител или реагентов, способных связываться с белками клеточной поверхности, которые, как полагают, разграничивают эти клетки.
Общепризнанно, что многочисленные маркеры (или их отсутствие) были ассоциированы с различными популяциями раковых стволовых клеток, и их приеняли для выделения или характеризации субпопуляций опухолевых клеток. В данном отношении, иллюстративные маркеры раковых стволовых клеток включают OCT4, Nanog, STAT3, EPCAM, CD24, CD34, NB84, TrkA, GD2, CD133, CD20, CD56, CD29, B7H3, CD46, рецептор трансферрина, JAM3, карбоксипептидазу M, ADAM9, онкостатин M, Lgr5, Lgr6, CD324, CD325, нестин, Sox1, Bmi-1, eed, easyh1, easyh2, mf2, yy1, smarcA3, smarckA5, smarcD3, smarcE1, mllt3, FZD1, FZD2, FZD3, FZD4, FZD6, FZD7, FZD8, FZD9, FZD10, WNT2, WNT2B, WNT3, WNT5A, WNT10B, WNT16, AXIN1, BCL9, MYC, (TCF4) SLC7A8, IL1RAP, TEM8, TMPRSS4, MUC16, GPRC5B, SLC6A14, SLC4A11, PPAP2C, CAV1, CAV2, PTPN3, EPHA1, EPHA2, SLC1A1, CX3CL1, ADORA2A, MPZL1, FLJ10052, C4,4A, EDG3, RARRES1, TMEPAI, PTS, CEACAM6, NID2, STEAP, ABCA3, CRIM1, IL1R1, OPN3, DAF, MUC1, MCP, CPD, NMA, ADAM9, GJA1, SLC19A2, ABCA1, PCDH7, ADCY9, SLC39A1, NPC1, ENPP1, N33, GPNMB, LY6E, CELSR1, LRP3, C20orf52, TMEPAI, FLVCR, PCDHA10, GPR54, TGFBR3, SEMA4B, PCDHB2, ABCG2, CD166, AFP, BMP-4, β-катенин, CD2, CD3, CD9, CD14, CD31, CD38, CD44, CD45, CD74, CD90, CXCR4, декорин, EGFR, CD105, CD64, CD16, CD16a, CD16b, GLI1, GLI2, CD49b, и CD49f. См., например, Schulenburg et al., 2010, PMID: 20185329, ПАТЕНТЕ США № 7,632,678 и В патентах США №№ 2007/0292414, 2008/0175870, 2010/0275280, 2010/0162416 и 2011/0020221, каждый из которых включен в данный документ посредством ссылки. Следует дополнительно принимать во внимание, что каждый из вышеуказанных маркеров также может применяться в качестве вторичного антигена-мишени в контексте биспецифических или мультиспецифических антител рассматриваемого изобретения.
Аналогично, неограничивающие примеры фенотипов клеточной поверхности, ассоциированных с раковыми стволовыми клетками некоторых опухолевых типов, включают CD44hiCD24low, ALDH+, CD133+, CD123+, CD34+CD38-, CD44+CD24-, CD46hiCD324+CD66c-, CD133+CD34+CD10-CD19-, CD138-CD34-CD19+, CD133+RC2+, CD44+α2 β1hiCD133+, CD44+CD24+ESA+, CD271+, ABCB5+ а также другие фенотипы клеточной поверхности раковых стволовых клеток, которые известны в области. См., например, Schulenburg et al., 2010, выше, Visvader et al., 2008, PMID: 18784658 и ПАТЕНТЕ США № 2008/0138313, каждая из которых полностью включена в данный документ посредством ссылки. Специалисты в данной области смогут понять, что фенотипы маркеров, такие как приведенные в виде примера непосредственно выше, могут применяться в сочетании со стандартным проточным цитометрическим анализом и методами сортировки клеток для характеризации, выделения, очистки или обогащения клеток TIC и/или TPC или клеточных популяций для дополнительного анализа. По отношению к рассматриваемому изобретению, интерес представляют CD46, CD324 и, необязательно, CD66c, которые либо в высокой степени или гетерогенно экспрессируются на поверхности многих человеческих опухолевых клеток колоректального рака (“CR”), рака молочной железы (“BR”), немелкоклеточного рака легкого (NSCLC), мелкоклеточного рака легкого (SCLC), рака поджелудочной железы (“PA”), меланомы (“Mel”), рака яичника (“OV”), и рака головы и шеи (“HN”), независимо от того, являются ли анализируемые образцы опухоли образцами опухоли от пациента с первичной опухолью или образцами полученной от пациента нетрадиционной кснотрансплантатной (NTX) опухоли.
Применяя любой из указанных выше методов, и выбранные маркеры, известные в данной области, затем является возможным количественно оценить снижение частоты TIC (или TPC в данном документе), предоставляемое раскрытыми модуляторами DLL3 (включая модуляторы, конъюгированные с цитотоксическими средствами) в соответствии с принципами данного документа. В некоторых случаях, соединения рассматриваемого изобретения могут снижать частоту TIC или TPC (посредством различных механизмов, отмеченных выше, включающих устранение, индуцированную дифференциацию, разрушение ниши, сайленсинг, и т.д.) на 10%, 15%, 20%, 25%, 30% или даже на 35%. В других вариантах осуществления, снижение частоты TIC или TPC может иметь порядок 40%, 45%, 50%, 55%, 60% или 65%. В некоторых вариантах осуществления, раскрытые соединения могут снижать частоту TIC или TPC на 70%, 75%, 80%, 85%, 90% или даже 95%. Несомненно, следует принимать во внимание, что любое снижение частоты TIC или TPC вероятно приводит к соответствующему снижению туморогенности, жизнестойкости, повторного проявления и агрессивности неоплазии.
IV. Средства связывания с клеткой
1. Структура антитела
Как указано выше, особенно предпочтительные варианты осуществления рассматриваемого изобретения включают раскрытые конъюгаты DLL3 со средством связывания с клеткой в форме антитела, или его иммунореактивного фрагмента, которое преимущественно ассоциируется с одним или более доменами изоформы белка DLL3 и, необязательно, другими членами семейства DLL. В данной связи антитела, и их варианты и производные, включая принятую номенклатуру и системы нумерации, были всесторонне описанн, например, в Abbas et al. (2010), Cellular and Molecular Immunology (6th Ed.), W.B. Saunders Company; или Murphey et al. (2011), Janeway's Immunobiology (8th Ed.), Garland Science.
“Антитело” или “интактное антитело” обычно относится к Y-образному тетрамерному белку, содержащему две тяжелые (H) и две легкие (L) полипептидные цепи, удерживаемые вместе посредством ковалентных дисульфидных связей и нековалентных взаимодействий. Человеческие легкие цепи содержат вариабельный домен (VL) и константный домен (CL), где константный домен может быть легко классифицирован как каппа или лямбда на основании аминокислотной последовательности и генных локусов. Каждая тяжелая цепь содержит один вариабельный домен (VH) и константную область, которая в случае IgG, IgA, и IgD, содержит три домена, именуемые CH1, CH2, и CH3 (IgM и IgE имеют четвертый домен, CH4). В IgG, IgA, и IgD классы CH1 и CH2 доменов разделены гибкой шарнироной областью, которая представляет собой сегмент, обогащенный пролином и цистеином, с вариабельной длиной (обычно от приблизительно 10 до приблизительно 60 аминокислот в IgG). Вариабельные домены, как в легкой, так и тяжелой цепях объединены с константными доменами посредством “J” области из приблизительно 12 или более аминокислот, и тяжелая цепь также имеет “D” область из приблизительно 10 дополнительных аминокислот. Каждый класс антител дополнительно содержит межцепочечные и внутрицепочечные дисульфидные связи, образованные спаренными цистеиновыми остатками.
Как используют в данном документе, термин ''антитело'' может толковаться в широком смысле, и включает поликлональные антитела, мультиклональные антитела, моноклональные антитела, химерные антитела, гуманизированные и приматизированные антитела, CDR привитые антитела, человеческие антитела, рекомбинантно продуцированные антитела, интраантитела, мультиспецифические антитела, биспецифические антитела, моновалентные антитела, мультивалентные антитела, анти-идиотипические антитела, синтетические антитела, включая мутеины и их варианты, фрагменты иммуноспецифических антител, такие как Fd, Fab, F(ab')2, фрагменты F(ab'), одноцепочечные фрагменты (например, ScFv и ScFvFc); и их производные, включая Fc гибриды и другие модификации, и любую другую иммунореактивную молекулу, при условии, что она проявляет преимущественную ассоциацию или связывание с DLL3 детерминантой. Более того, если не следует иначе по ограничениям контекста, термин дополнительно содержит все классы антител (т.е. IgA, IgD, IgE, IgG, и IgM) и все изотипы (т.е., IgG1, IgG2, IgG3, IgG4, IgA1, и IgA2). Константные домены тяжелой цепи, которые соответствуют различным классам антител обычно обозначают соответствующей малой буквой греческого алфавита α, δ, ε, γ и μ, соответственно. Легкие цепи антител из любых видов позвоночных могут быть отнесены к одному из двух четко отличающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
В избранных вариантах осуществления и, как показано в прилагаемых Примерах, CL домен может содержать каппа CL домен. В других вариантах осуществления источник антитела может содержать лямбда CL домен. Так как последовательности всех человеческих IgG CL доменов являются хорошо известными, специалист в данной области может легко анализировать как лямбда, так и каппа последовательности в соответствии с настоящим раскрытием и использовать их для обеспечения совместимых конструкций антител. Аналогично, с целью объяснения и демонстрации последующее обсуждение и прилагаемые Примеры, в первую очередь, будут выделять IgG1 (мышиный или человеческий) тип антител. Как и для константной области легкой цепи, последовательности константных доменов тяжелой цепи из различных изотипов (IgM, IgD, IgE, IgA) и подклассы (IgG1, IgG2, IgG3, IgG4, IgA1, IgA2) являются хорошо известными и охарактеризованными. Соответственно, специалист в данной области может легко использовать анти-DLL3 антитела, содержащие любой изотип или подкласс, и конъюгат каждого из них с раскрытым ПБД, как изложено в данном документе для обеспечения конъюгатов антител с лекарственным средством настоящего изобретения.
Вариабельные домены антител показывают значительную изменчивость в аминокислотном составе от одного антитела к другому, и, являются, в первую очередь, ответственными за распознавание и связывание антигена. Вариабельные области каждой пары легкая/тяжелая цепь образуют участок связывания антитела, таким образом, что интактное IgG антитело имеет два участка связывания (т.е. оно является бивалентным). VH и VL домены содержат три области с крайне высокой вариабельностью, которые называют гипервариабельными областями, или, в большинстве случаев, областями, определяющими комплементарность (CDR), ограниченных и разделенных четырьмя менее вариабельными областями, известными как каркасные области (FRs). Нековалентная ассоциация между VH и VL областями образует Fv фрагмент (т.е. ''фрагмент вариабельный''), который содержит два антиген связывающих участка антитела. ScFv фрагменты (для одноцепочечного вариабельного фрагмента), который может быть получен посредством гентической инженерии, ассоциируются в единственную полипептид цепь, причем VH и VL области антитела разделяются пептидным линкером.
Как используют в данном документе, отнесение аминокислот к каждому домену, каркасной области и CDR может быть проведено в соответствии с обной из схем нумерации, предложенных Kabat et al. (1991) Sequences of proteins of Immunological Interest (5th Ed.), US Dept. of Health and Human Services, PHS, NIH, NIH Publication no. 91-3242;Chothia et al., 1987, PMID: 3681981; Chothia et al., 1989, PMID: 2687698; MacCallum et al.,1996, PMID: 8876650; или Dubel, Ed. (2007) Handbook of Therapeutical Antibodies, 3rd Ed., Wily-VCH Verlag GmbH and Co., если не отмечено иначе. Аминокислотные остатки, которые содержат CDR, как определено Кабат, Чотиа и Маккаллум, полученные из базы данных с вебсайта Abysis (выше), приведены ниже
|
|
Вариабельная область и CDR в последовательности антитела может быть идентифицирована в соответствии с общими правилами, которые были разработаны в данной области (как приведено выше, такими как, например, Система нумерации Кабат) или посредством выравнивания последовательностей против базы данных известной вариабельной области. Методы идентификации этих областей описаны у Kontermann and Dubel, eds., Antibody Engineering, Springer, New York, NY, 2001 and Dinarello et al., Current Protocols in Immunology, John Wiley и Sons Inc., Hoboken, NJ, 2000. Иллюстративные базы данных последовательностей антител описаны в, и могут быть оценены посредством вебсайта “Abysis'' на сайте www.bioinf.org.uk/abs (поддерживаемого посредством A.C. Martin in Department of Biochemistry & Molecular Biology University College London, London, England) и вебсайта VBASE2 на сайте www.vbase2.org, как описано у Retter et al., Nucl. Acids Res., 33 (Выпуск базы данных): D671-D674 (2005). Предпочтительно, последовательности анализируют, используя базу данных Abysis, которая интегрирует данные последовательностей из Kabat, IMGT and Protein Data Bank (PDB) со структурными данными для ПДБ. См. главу книги Dr. Andrew C. R. Martin's Protein Sequence and Structure Analysis Antibody Variable Domains. В: Antibody Engineering Lab Manual (Ed.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg, ISBN-13: 978-3540413547, также доступную на вебсайте bioinforg.uk/abs). Вебсайт с базой данных Abysis дополнительно включает общие правила, которые были разработаны для идентификации CDR, которые могут использоваться в соответствии с принципами данного документа. Если не указано иначе, все CDR, приведенные в данном документе, получают в соответствии с вебсайтом базы данных Abysis как по Кабат.
Для положений аминокислот константных областей тяжелой цепи, обсуждаемых в изобретении, нумерацию проводят в соответствии с индексом Eu, впервые описанным у Edelman et al., 1969, Proc, Natl. Acad. Sci. USA 63(1): 78-85, при описании аминокислотной последовательности белка миеломы Eu, который по имеющимся данным был первым человеческим секвенированным IgG1. Индекс Eu Эдельмана также приведен в Kabat et al., 1991 (выше.). Таким образом, термины “индекс EU, приведенный в Кабат” или “индекс EU по Кабат” в контексте тяжелой цепи относится к системе нумерации остатков, основанной на человеческом IgG1 Eu антителе из Edelman et al. приведенной в Kabat et al., 1991 (выше.). Система нумерации, используемая для аминокислотных последовательностей константной области легкой цепи аналогично приводится в Kabat et al., 1991. Иллюстративные каппа аминокислотные последовательности константной области тяжелой цепи CL и IgG1, совместимые с рассматриваемым изобретением, приведены в виде SEQ ID NO: 5 и 6 в прилагаемом списке последовательностей. Специалисты в данной области смогут понять, что раскрытые последовательности константных областей могут быть объединены с раскрытыми вариабельными областями тяжелой и легкой цепи с использованием стандартных методов молекулярной биологии для предоставления непроцессированного антитела, которое может быть включено в конъюгаты DLL3 рассматриваемого изобретения.
Антитела или иммуноглобулины изобретения могут содержать любые антитела или быть производными любых антител, которые специфически распознают любую детерминанту DLL3 или ассоциируются с ней. Как используют в данном документе “детерминанта” или “мишень” означает любые обнаруживаемые свойство, маркер или фактор, которые идентифицируемым образом ассоциированы с, или специфически обнаруживаются в или на конкретной клетке, клеточной популяции или ткани. Детерминанты или мишени могут быть морфологическими, функциональными или биохимическими по природе и, предпочтительно, являюся фенотипическими. В некоторых предпочтительных вариантах осуществления, детерминанта представляет собой белок, который дифференцированно экспрессируется (сверх- или недоэкспрессируется) конкретными клеточными типами или клетками при некоторых условиях (например, во время конкретных фаз клеточного цикла или клеток в конкретной нише). Для целей рассматриваемого изобретения, детерминанта, предпочтительно, дифференцированно экспрессируется на аберрантных раковых клетках и может содержать белок DLL3, или любой из его сплайс-вариантов, изоформ или членов семейства, или его специфичных доменов, областей или эпитопов. “Антиген”, “иммуногенная детерминанта”, “антигенная детерминанта” или “иммуноген” означает любой белок (включая DLL3) или любые его фрагмент, область, домен или эпитоп, которые могут стимулировать иммунный ответ при введении в иммунокомпетентное животное, и распознаются антителами, продуцируемыми в результате иммунного ответа животного. Наличие или отсутствие детерминант, предусмотренных в данном документе, может применяться для идентификации клетки, субпопуляции клетки или ткани (например, опухоли, онкогенных клеток или CSC).
Как приведено ниже в Примерах, выбранные варианты осуществления изобретения содержат мышиные антитела, которые иммуноспецифически связываются с DLL3, который может считаться “источником” антитела. В других вариантах осуществления, антитела предусмотренные изобретением, могут являться производными из такого “источника” антител посредством необязательной модификации константной области или связывающихся с эпитопом аминокислотных последовательностей источника антитела. В одном варианте осуществления антитело “является производным” от источника антител, если выбранные аминокислоты в источнике антител изменяются посредством делеции, мутации, замены, интеграци или комбинаци. В еще одном варианте осуществления, “являющееся производным” антитело представляет собой антитело, в котором фрагменты источника антитела (например, одна или более CDR или полная вариабельная область) комбинируются с последовательностью акцепторного антитела или включаются в нее для предоставления производных антител (например, химерных, CDR привитых или гуманизированных антител). Эти “являющиеся производными” (например, гуманизированные или CDR-привитые) антитела могут генерироваться с использованием стандартных методов молекулярной биологии по различным причинам, таким как, например, для улучшения аффинности для детерминанты; для улучшения продуцирования и выхода в клеточной культуре; для снижения иммуногенности in vivo; для снижения токсичности; для облегчения конъюгирования активного фрагмента; или для создания мультиспецифического антитела. Такие антитела могут также являться производными из источника антитела посредством модификации зрелой молекулы (например, схем гликозилирования или пегилирования), химических средств или посттрансляционной модификации.
В контексте рассматриваемого изобретения следует принимать во внимание, что любая из раскрытых CDR легкой и тяжелой цепи, являющаяся производной от аминокислотных последовательностей мышиной вариабельной области, приведенной на ФИГ. 3A или ФИГ. 3B, может комбинироваться с акцепторными антителами или перегруппировываться для предоставления оптимизированных антител против человеческого DLL3 (например, гуманизированных или химерных анти-hDLL3) в соответствии с рассматриваемыми принципами. Таким образом, одна или более из CDR, являющихся производными или полученными из смежных аминокислотных последовательностей вариабельной области легкой цепи, приведенных на ФИГ. 3A или смежных аминокислотных последовательностей вариабельной области тяжелой цепи, приведенных на ФИГ. 3B (вместе SEQ ID NO: 21-387, с нечетными номерами) могут быть включены в модулятор DLL3, и, в особенно предпочтительных вариантах осуществления, в CDR привитые или гуманизированные антитела, которые иммуноспецифически ассоциируются с одной или более изоформами DLL3. Примеры “являющихся производными” аминокислотных последовательностей вариабельных областей легкой и тяжелой цепей таких гуманизированных модуляторов также приведены на ФИГУРАХ. 3A и 3B (SEQ ID NO: 389-407, с нечетными номерами).
На ФИГ. 3A и 3B сокращенные CDR и каркасные последовательности определены по системе Кабат с использованием зарегистрированную базу данных Abysis. Однако, как обсуждается в данном документе, специалист в данной области сможет легко определить, идентифицировать, получить в виде производной и/или пронумеровать CDR, как определено по Kabat et al., Chothia et al. или MacCallum et al. для каждой соответствующей последовательности тяжелой и легкой цепи, приведенной на ФИГ. 3A или ФИГ. 3B. Соответственно, каждое из субъектных CDR и антител, содержащих CDR, посредством всей такой номенклатуры, однозначно включено в объем рассматриваемого изобретения. В более широком смысле, термины “аминокислотный остаток CDR вариабельной области” или упрощенно, “CDR”, включают аминокислоты в CDR, идентифицированные с использованием любого способа на основе последовательности или структуры, приведенных выше. В пределах данного контекста Кабат CDR для иллюстративных гуманизированных антител на ФИГ. 3A и 3B представлены в прилагаемом списке последовательностей как SEQ ID NO: 408-437.
В еще других вариантах осуществления, совместимые DLL3 антитело содержит вариабельные области тяжелой и легкой цепи, содержащие аминокислотные последовательности, которые являются гомологичными аминокислотным последовательностям иллюстративных антител, описанных в данном документе (как гуманизированных, так и мышиных), и, где антитела сохраняют желательные функциональные свойства анти-DLL3 антитела изобретения.
Например совместимые DLL3 антитела могут содержать антитело или его иммунореактивный фрагмент, имеющие вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 60% является гомологичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 53, SEQ ID NO: 57, SEQ ID NO: 61, SEQ ID NO: 65, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 97, SEQ ID NO: 101, SEQ ID NO: 105, SEQ ID NO: 109, SEQ ID NO: 113, SEQ ID NO: 117, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169, SEQ ID NO: 173, SEQ ID NO: 177, SEQ ID NO: 181, SEQ ID NO: 185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201, SEQ ID NO: 205, SEQ ID NO: 209, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 221, SEQ ID NO: 225, SEQ ID NO: 229, SEQ ID NO: 233, SEQ ID NO: 237, SEQ ID NO: 241, SEQ ID NO: 245, SEQ ID NO: 249, SEQ ID NO: 253, SEQ ID NO: 257, SEQ ID NO: 261, SEQ ID NO: 265, SEQ ID NO: 269, SEQ ID NO: 273, SEQ ID NO: 277, SEQ ID NO: 281, SEQ ID NO: 285, SEQ ID NO: 289, SEQ ID NO: 293, SEQ ID NO: 297, SEQ ID NO: 301, SEQ ID NO: 305, SEQ ID NO: 309, SEQ ID NO: 313, SEQ ID NO: 317, SEQ ID NO: 321, SEQ ID NO: 325, SEQ ID NO: 329, SEQ ID NO: 333, SEQ ID NO: 337, SEQ ID NO: 341, SEQ ID NO: 345, SEQ ID NO: 349, SEQ ID NO: 353, SEQ ID NO: 357, SEQ ID NO: 361, SEQ ID NO: 365, SEQ ID NO: 369, SEQ ID NO: 373, SEQ ID NO: 377, SEQ ID NO: 381 и SEQ ID NO: 385, и, где указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 60% является гомологичной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 55, SEQ ID NO: 59, SEQ ID NO: 63, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 95, SEQ ID NO: 99, SEQ ID NO: 103, SEQ ID NO: 107, SEQ ID NO: 111, SEQ ID NO: 115, SEQ ID NO: 119, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139 SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171, SEQ ID NO: 175, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO: 195, SEQ ID NO: 199, SEQ ID NO: 203, SEQ ID NO: 207, SEQ ID NO: 211, SEQ ID NO: 215, SEQ ID NO: 219, SEQ ID NO: 223, SEQ ID NO: 227, SEQ ID NO: 231, SEQ ID NO: 235, SEQ ID NO: 239, SEQ ID NO: 243, SEQ ID NO: 247, SEQ ID NO: 251, SEQ ID NO: 255, SEQ ID NO: 259, SEQ ID NO: 263, SEQ ID NO: 267, SEQ ID NO: 271, SEQ ID NO: 275, SEQ ID NO: 279, SEQ ID NO: 283, SEQ ID NO: 287, SEQ ID NO: 291, SEQ ID NO: 295, SEQ ID NO: 299, SEQ ID NO: 303, SEQ ID NO: 307 SEQ ID NO: 311, SEQ ID NO: 315, SEQ ID NO: 319, SEQ ID NO: 323, SEQ ID NO: 327, SEQ ID NO: 331, SEQ ID NO: 335, SEQ ID NO: 339, SEQ ID NO: 343, SEQ ID NO: 347, SEQ ID NO: 351, SEQ ID NO: 355, SEQ ID NO: 359, SEQ ID NO: 363, SEQ ID NO: 367, SEQ ID NO: 371, SEQ ID NO: 375, SEQ ID NO: 379, SEQ ID NO: 383 и SEQ ID NO: 387.
В других вариантах осуществления, аминокислотные последовательности VH и/или VL могут быть на 65%, 70%, 75%, 80%, 85%, 90% или 95% гомологичными с последовательностям, приведенным выше. Антитело, имеющее VH и VL области, имеющие высокую (т.е., 80% или выше) гомологию с VH и VL областями последовательностей, приведенных выше, могут быть получены или произведены использованием стандартных методов молекулярной биологии. Например, как показано в ТАБЛИЦЕ 4 ниже, гуманизированные антитела, полученные, как приведено в Примере 4 из мышиного источника антител, будут содержать вариабельные области тяжелой и легкой цепи, которые приблизительно на 75% - 85% являются гомологичными таких областей источника антител.
Как используют в данном документе, процент гомологии между двумя аминокислотными последовательностями является эквивалентным проценту идентичности между двумя последовательностями. Процент идентичности между двумя последовательностям является функцией числа идентичных положений, являющихся общими для последовательностей (т.е., % гомологии = # идентичных положений/общее # положений × 100), с учетом числа пропусков, и длины каждого пропуска, который необходимо ввести для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процента идентичности между двумя последовательностями может выполняться с использованием математического алгоритма, описанного в неограничивающих примерах ниже.
Процент идентичности между двумя аминокислотными последовательностями может быть определен с использованием алгоритма E. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), который был включен в программу ALIGN (версия 2,0), с использованием таблицы массы PAM120 остатка, штрафа за удлинение пропуска, равного 12, и штрафа за пропуск в последовательности, равного 4. В дополнение, процент идентичности между двумя аминокислотными последовательностями может быть определен с использованием алгоритма Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970)), который был включен в программу GAP в пакете программного обеспечения GCG (доступном на www.gcg.com), исполязуя либо матрицу Blossum 62 или матрицу PAM250, и штраф за делецию, равный 16, 14, 12, 10, 8, 6 или 4, и штраф за продолжение делеции, равный 1, 2, 3, 4, 5 или 6.
Дополнительно или альтернативно, последовательности белков настоящего изобретения могут дополнительно применяться в качестве “запрашиваемых последовательностей” для выполнения поиска в общедоступных базах данных, чтобы, например, идентифицировать родственные последовательности. Такие поиски могут выполняться с использованием программы XBLAST (версия 2.0) Altschul, et al. (1990) J. Mol. Biol. 215:403-10. Поиски белка по BLAST могут выполняться с помощью программы XBLAST, балльная оценка = 50, длина слова = 3, чтобы получить аминокислотные последовательности, гомологичные молекулам антитела изобретения. Чтобы получить содержащие пробелы выравнивания для целей сравнения, может использоваться Gapped BLAST, как описано в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При использовании программ BLAST и Gapped BLAST, могут применяться параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST).
2. Генерация антител
a. Поликлональные антитела
Продуцирование поликлональных антител у различных животных-хозяев, включающих кроликов, мышей, крыс и т.д. является хорошо известным в области. В некоторых вариантах осуществления, сыворотку, содержащую поликлональные анти-DLL3 антитела, получают посредством кровоизвлечения или умерщвления животного. Сыворотка может применяться в исследовательских целях в форме, полученной из животного или, альтернативно, анти-DLL3 антитела могут быть частично или полностью очищаться для получения иммуноглобулиновых фракций или гомогенных препаратов антител.
Вкратце, выбранное животное иммунизируют иммуногеном DLL3 (например, растворимым DLL3 или sDLL3), который может, например, содержать выбранные изоформы, домены и/или пептиды, или живые клетки или препараты клеток, экспрессирующих DLL3 или его иммунореактивные фрагменты. Известные в данной области адъюванты, которые могут применяться для увеличения иммунного ответа, в зависимости от инокулируемого вида, включают, но не ограничиваются перечисленным, адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианины лимфы улитки, динитрофенол, и потенциальноприменимые человеческие адъюванты, такие как БЦЖ (бацилла Кальмета-Герена) и парвум коринебактерий. Такие адъюванты могут защищать антиген от быстрого всасывания посредством изолирования его в местном отложении, или они могут содержать вещества, которые стимулируют хозяина секретировать факторы, которые являются хемотаксическими для макрофагов и других компонентов иммунной системы. Предпочтительно протокол иммунизации будет включать два или более введений выбранного иммуногена, распределяемых в течение заданного периода времени.
Аминокислотная последовательность белка DLL3, как показано на ФИГ. 1, может быть проанализирована, чтобы выбрать специфичные области белка DLL3 для генерации антител. Например, анализы гидрофобности и гидрофильности аминокислотной последовательности DLL3 применяют для идентификации гидрофильных областей в структуре DLL3. Области белка DLL3, которые показывают иммуногенную структуру, а также другие области и домены, могут быть легко идентифицированы с использованием различных других методов, известных в данной области, таких как анализ Чоу-Фасмана, Гарнье-Робсона, Кайт-Дулитла, Эйзенберга, Карплуса-Шульца или Джеймсона-Вольфа. Профмли средней эластичности могут быть генерированы, с использованием метода Bhaskaran R., Ponnuswamy P. K., 1988, Int. J. Pept. Protein Res. 32:242-255. Профили бета-изгиба могут генерироваться с использованием метода Deleage, G., Roux B., 1987, Protein Engineering 1:289-294. Таким образом, каждая область DLL3, каждый домен или мотив, идентифицированный посредством любой из этих программ или любого из этих методов, находится в пределах объема настоящего изобретения, и могут быть выделены или сконструированы для обеспечения иммуногенов, приводящих к образованию модуляторов, содержащих желательные свойства. Предпочтительные методы генерации антител к DLL3 дополнительно иллюстрируются путем Примеров, предоставленных в данном документе. Методы получения белка или полипептида для применения в качестве иммуногена являются хорошо известными в данной области. Также хорошо известны в области методы получения иммуногенных конъюгатов белка с носителем, таким как BSA, KLH или другой белок-носитель. При некоторых обстоятельствах, применяют прямое конъюгирование с использованием, например, карбодиимидных реагентов; в других случаях являются эффективными связующие реагенты. Введение иммуногена DLL3 часто проводят посредством инъекции в течение подходящего периода времени и с применением подходящего адъюванта, как понимают в данной области. Во время протокола иммунизации, могут быть взяты титры антител, как описано в Примерах ниже, для определения соответствия образования антитела.
b. Моноклональные антитела
В дополнение, изобретение предусматривает применение моноклональных антител. Как известно в данной области, термин ''моноклональное антитело'' (или mAb) относится к антителу, полученному из популяции по существу гомогенных антител, т.е., индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных мутаций (например, природных мутаций), которые могут присутствовать в минорных количествах. В некоторых вариантах осуществления, такое моноклональное антитело включает антитело, содержащее полипептидную последовательность, которая связывается или ассоциируется с антигеном, где антиген-связывающая полипептидная последовательность была получена посредством процесса, который включает выбор единственной мишени, связывающей полипептидную последовательность из множества полипептидных последовательностей.
В более общем виде, и в приведенных в Примерах в данном документе, моноклональные антитела могут быть получены с использованием самых различных методов, известных в области, включающих методы получения гибридом, рекомбинантные методы, технологии фагового отображения, трансгенных животных (например, XenoMouse®) или их некоторых комбинаций. Например, моноклональные антитела могут продуцироваться с использованием гибридомных методов и признанных биохимических методов и методов и генетической инженерии, таких как описаны более подробно в An, Zhigiang (ed.) Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley и Sons, 1st ed. 2009; Shire et. al. (eds.) Current Trends Monoclonal Antibody Development and Manufacturing, Springer Science+Business Media LLC, 1st ed. 2010; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. 1988; Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), каждая из которых полностью включены в данный документ посредством ссылки. Следует понимать, что выбранная связывающая последовательность может быть дополнительно изменена, например, чтобы улучшить аффинность к мишени, для гуманизации целевой связывающей последовательности, чтобы улучшить ее продуцирование в клеточной культуре, чтобы снизить ее иммуногенность in vivo, для создания мультиспецифического антитела и т.д., и то, что антитело, содержащее измененную целевую связывающую последовательность также является антителом данного изобретения.
c. Химерные и гуманизированные антитела
В еще одном варианте осуществления, антитела изобретения может содержать химерные антитела, полученные из ковалентно соединенных белковых сегментов из по меньшей мере двух различных видов или классов антител. Термин ''химерные'' антитела направлен на конструкции, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученным из конкретного вида, или принадлежащих к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из еще одного вида или принадлежащих к еще одному классу или подклассу антител, а также фрагментам таких антител (патент США № 4,816,567; Morrison et al., 1984, PMID: 6436822).
В одном варианте осуществления, химерное антитело может содержать мышиные VH и VL аминокислотные последовательности и константные области, полученные их человеческих источников, например, гуманизированные антитела, как описано ниже. В некоторых вариантах осуществления, антитела могут являться ''CDR-привитыми'', где антитело содержит одну или более CDR из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из еще одного вида или принадлежащих к еще одному классу или подклассу антител. Для применения у людей, выбранные CDR грызунов, например, мышиные CDR могут быть привиты к человеческому антителу, заменяя одну или более природных CDR человеческого антитела. Эти конструкции обычно имеют преимущества предоставления в полном объеме функций антитела, например, комплементзависимую цитотоксичность (CDC) и антителозависимую клеточно-опосредованную цитотоксичность (ADCC), в то же время, снижая нежелательные иммунные ответы на антитело у субъекта.
Аналогичным CDR-привитому антителу является “гуманизированное” антитело. Как используют в данном документе, “гуманизированные” формы нечеловеческих (например, мышиных) антител являются химерными антителами, которые содержат аминокислотные последовательности, полученные из одного или более нечеловеческих иммуноглобулинов. В одном варианте осуществления, гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное или акцепторное антитело), в котором остатки из одной или более CDR реципиента заменены остатками из одной или нескольких CDR вида, не принадлежащего к человеку (донорное антитело), такого как мышь, крыса, кролик или примат, не являющийся человеком. В некоторых предпочтительных вариантах осуществления, остатки одной или более FR в вариабельном домене человеческого иммуноглобулина заменяются соответствующими нечеловеческими остатками из донорного антитела, чтобы помочь поддержанию соответствующей трехмерной конфигурации привитых CDR и, посредством этого, улучшить аффинность. Это может относиться к введению “обратных мутаций”. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются у реципиентного антитела или в донорном антителе, чтобы, например, дополнительно улучшить характеристики антитела.
Можно использовать различные источники, чтобы определить какие человеческие последовательности применять в гуманизированных антителах. Такие источники включают человеческие последовательности эмбрионального типа, которые раскрыты, например, в Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today 16: 237-242; Chothia, D. et al. (1992) J. Mol. Biol. 227:799-817; и Tomlinson et al. (1995) EMBO J 14:4628-4638; V-BASE directory (VBASE2 - Retter et al., Nucleic Acid Res. 33; 671-674, 2005), которые предоставляют всестороннее руководство по человеческим последовательностям вариабельных областей иммуноглобулинов (составлено Tomlinson, I. A. et al. MRC Centre for Protein Engineering, Cambridge, UK); или консенсусные человеческие FR, описанные, например, в патенте США № 6,300,064.
Прививка CDR и гуманизированные антитела описаны, например, в патентах США №№. 6,180,370 и 5,693,762. Дополнительные подробности, см., например, в Jones et al., 1986, PMID: 3713831); и в патентах США №№ 6,982,321 и 7,087,409.
Еще один способ имеет название “гуманиринг”, который описан, например, в патентной заявке США № 2005/0008625. В еще одном варианте осуществления нечеловеческое антитело может быть модифицировано посредством специфической делеции человеческих T-клеточных эпитопов или “деиммунизации” методами, раскрытыми в WO 98/52976 и WO 00/34317.
Как обсуждается выше в избранных вариантах осуществления, по меньшей мере 60%, 65%, 70%, 75% или 80% аминокислотных остатков вариабельной области тяжелой или легкой цепи гуманизированного или CDR привитого антитела будут соответствовать аминокислотным остаткам реципиентных человеческих последовательностей. В других вариантах осуществления по меньшей мере 83%, 85%, 87% или 90% остатков вариабельной области гуманизированного антитела будут соответствовать аминокислотным остаткам реципиентных человеческих последовательностей. В дополнительном предпочтительном варианте осуществления, более 95% каждой из вариабельной области гуманизированного антитела будет соответствовать реципиентным человеческим последовательностям.
Идентичность или гомология последовательности вариабельной области гуманизированного антитела с человеческой акцепторной вариабельной областью могут быть определены, как обсуждается ранее и, при измерении как таковом, будут предпочтительно иметь по меньшей мере 60% или 65% идентичности последовательности, более предпочтительно, по меньшей мере 70%, 75%, 80%, 85% или 90% идентичности последовательности, даже более предпочтительно, по меньшей мере 93%, 95%, 98% или 99% идентичности последовательности. Предпочтительно, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. “Консервативная аминокислотная замена” представляет собой замену, при которой аминокислотный остаток заменяется еще одним другим аминокислотным остатком, имеющим боковую цепь (R группу) с аналогичными химическими свойствами (например, зарядом или гидрофобностью). В целом, консервативная аминокислотная замена не будет по существу изменять функциональные свойства белка. В случаях, где две или более аминокислотные последовательности отличаются друг от друга консервативными заменами, процент идентичности последовательности или степень сходства могут регулироваться по восходящей для коррекции консервативной природы замены.
d. Человеческие антитела
В еще одном варианте осуществления, антитела могут содержать полностью человеческие антитела. Термин ''человеческое антитело'' относится к антителу, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком, и/или было получено с использованием любого из методов получения человеческих антител.
Человеческие антитела могут продуцироваться с использованием различных методов, известных в данной области. Одним методом является фаговое отображение, при котором библиотека (предпочтительно, человеческих) антител синтезируется на фагах, библиотеку подвергают скринингу с использованием интересующего антигена или его связывающей антитело части, и фаг, который связывает антиген, выделяют, и из него можно получить иммунореактивные фрагменты. Способы получения и скрининга таких библиотек являются хорошо известными в области, и наборы для генерации библиотек фагового отображения являются доступными для приобретения (например, Pharmacia Recombinant Phage Antibody System, номер по каталогу 27-9400-01; и Stratagene SurfZAP™ набор фагового отображения, номер по каталогу 240612). Существуют также другие способы и реагенты, которые могут применяться при генерации и скрининге библиотек отображения антител (см., например, патент США № 5,223,409; Публикацию PCT № WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; и Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982 (1991)).
В одном варианте осуществления, рекомбинантные человеческие антитела могут быть выделены посредством скрининга библиотеки рекомбинантных комбинаторных антител, полученных как описано выше. В одном варианте осуществления, библиотека представляет собой биьлиотеку фагового отображения scFv, генерируемую с использованием человеческих VL и VH кДНК, полученных из мРНК, выделенных из B-клеток.
Антитела, продуцируемые посредством интактных библиотек (либо природные или синтетические) могут иметь умеренную аффинность (Ka равно приблизительно 106-107 M-1), но созревание аффинности можно также имитировать in vitro посредством построения и повторной селекции из вторичных библиотек, как описано в данной области. Например, мутация может вводиться статистическим образом in vitro посредством использования ошибающейся полимеразы (сообщается у Leung et al., Technique, 1: 11-15 (1989)). Дополнительно, созревание аффинности может выполняться посредством статистического мутирования одной или более CDR, например, с использованием ПЦР с праймерами, несущими случайную последовательность, охватывающую CDR, представляющую интерес, у выбранных индивидуальных Fv клонов, и скрининга клонов с более высокой аффинностью. В WO 9607754 описан способ индуцирования мутагенеза в CDR легкой цепи иммуноглобулина для создания библиотеки генов легкой цепи. Еще один другой эффективный подход состоит в рекомбинации VH или VL доменов, выбранных посредством фагового отображения с наборами природных вариантов V домена, полученных от неиммунизированных доноров и для скрининга на более высокую аффинность при нескольких циклах перетасовки цепи, как описано у Marks et al., Biotechnol., 10: 779-783 (1992). Данный метод обеспечивает продукцирование антител и фрагментов антител с константой диссоциации KD (koff/kon), равной приблизительно 10-9M или менее.
В других вариантах осуществления, могут применяться аналогичные методики с использованием библиотек, содержащих эукариотные клетки (например, дрожжей), которые экспрессируют пары связывания на их поверхности. См., например, патент США № 7,700,302 и патентную заявку США 12/404,059. В одном варианте осуществления, человеческое антитело выбирают из библиотеки фагов, где такая библиотека фагов экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. Proc. Natl. Acad. Sci. USA 95:6157-6162 (1998). В других вариантах осуществления, человеческие пары связывания могут быть выделены из библиотек комбнаторных антител, генерируемых в эукариотных клетках, таких как дрожжи. См., например, патент США № 7,700,302. Такие методы преимущественно обеспечивают скрининг большого числа кандидатных модуляторов и предоставляют относительно простое манипулирование кандидатными последовательностями (например, посредством созревания аффинности или рекомбинантной тасовки).
Человеческие антитела могут также быть получены посредством введения локусов человеческих иммуноглобулинов трансгенным животным, например, мышам, у которых гены эндогенных иммуноглобулинов были частично или полностью инактивированы, и которым были введены гены человеческих иммуноглобулинов. При стимуляции, наблюдали продуцирование человеческих антител, которое явлется очень сходным с наблюдаемым у людей во всех отношениях, включающих перегруппировку генов, сборку и набор антител. Данный подход описан, например, в патентах США №№. 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,661,016, и в патентах США №№ 6,075,181 и 6,150,584, касающихся технологии XenoMouse®; и Lonberg и Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно, человеческие антитела могут быть получены посредством иммортализации человеческих B-лимфоцитов, продуцирующих антитела, направленные против целевого антигена, (такие B-лимфоциты могут быть извлечены из индивидуума, страдающего от неопластического нарушения, или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol, 147 (l):86-95 (1991); и патент США № 5,750,373.
3. Рекомбинантное получение антител
Антитела и их фрагменты могут быть получены или модифицированы с использованием генетического материала, полученного из клеток, продуцирующих антитела, и рекомбинантной технологии (см., например, Berger и Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology vol. 152 Academic Press, Inc., San Diego, CA; Sambrook и Russell (Eds.) (2000) Molecular Cloning: A Laboratory Manual (3rd Ed.), NY, Cold Spring Harbor Laboratory Press; Ausubel et al. (2002) Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (дополненноео в 2006); и патент США № 7,709,611).
Более конкретно, еще один другой аспект изобретения относится к молекулам нуклеиновых кислот, которые кодируют антитела изобретения. Нуклеиновые кислоты могут присутствовать в цельных клетках, в клеточном лизате, или в частично очищенной или по существу чистой форме. Нуклеиновая кислота является “выделенной” или “полученной по существу чистой”, когда ее очищают от других клеточных компонентов или других посторонних веществ, например, других клеточных нуклеиновых кислот или белков, посредством стандартных методов, включающих щелочную/SDS обработку, окрашивание с CsCl, колоночную хроматографию, элекрофорез на агарозном геле и другие, хорошо известные в области. Нуклеиновая кислота изобретения может представлять собой, например, ДНК или РНК и может содержать или может не содержать интронные последовательности. В более общем значении термин “нуклеиновая кислота”, как используют в данном документе, включает геномные ДНК, кДНК, РНК и их искусственные варианты (например, пептиднуклеиновые кислоты), либо одноцепочечные или двухцепочечные. В предпочтительном варианте осуществления, нуклеиновая кислота представляет собой молекулу кДНК.
Нуклеиновые кислоты изобретения могут быть получены с использованием стандартных методов молекулярной биологии. Для антител, экспрессируемых гибридомами (например, гибридомами, полученными из трансгенных мышей, несущих гены человеческих иммуноглобулинов, как дополнительно описано ниже), кДНК, кодирующие легкие и тяжелые цепи антитела, полученного посредством гибридомы, могут быть получены стандартной амплификацией ПЦР или методами клонирования кДНК. Для антител, полученных из библиотеки генов иммуноглобулинов (например, с использованием методов фагового отображения), нуклеиновая кислота, кодирующая антитело, может быть извлечена из библиотеки.
Как только получают фрагменты ДНК, кодирующие VH и VL сегменты, с этими фрагментами ДНК можно дополнительно проводить манипуляции посредством стандартных методов рекомбинантных ДНК, например, чтобы преобразовать гены вариабельной области в гены цепи непроцессированного антитела, в гены Fab фрагмента или в ген scFv. При этих манипуляциях, VL- или VH-кодирующий фрагмент ДНК является функционально связанным с еще одним фрагментом ДНК, кодирующим еше один белок, такой как константная область антитела или гибкий линкер. Термин “функционально связанный”, как применяют в данном контексте, предназначен для обозначения того, что два фрагмента ДНК соединены таким образом, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК остаются внутри рамки.
Выделенная ДНК, кодирующая VH область, может быть пробразована в ген непроцессированной тяжелой цепи посредством функционального связывания VH-кодирующей ДНК с еще одной молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности человеческих генов константной области тяжелой цепи являются известными в данной области (см. например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и ДНК фрагменты, охватывающие данные области, могут быть получены посредством стандартной амплификации ПЦР. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно является константной областью IgG1 или IgG4. Как обсуждается более подробно ниже, иллюстративная константная область IgG1, которая является совместимой с принципами данного документа, приводится как SEQ ID NO: 6 в прилагаемом списке последовательностей. Для гена тяжелой цепи фрагмента Fab, VH-кодирующая ДНК может быть функционально связана с еще одной молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Выделенная ДНК, кодирующая VL область, может быть преобразована в ген непрцессированной легкой цепи (а также ген легкой цепи Fab) посредством функционального связывания VL-кодирующей ДНК с еще одной молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности человеческих генов константной области легкой цепи известны в данной области (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие эти области могут быть получены посредством стандартной амплификации ПЦР. Константная область легкой цепи может представлять собой каппа или лямбда константную область, но, наиболее предпочтительно, представляет собй каппа константную область. В данном отношении, иллюстративная совместимая каппа константная область легкой цепи приводится в виде SEQ ID NO: 5 в прилагаемом списке последовательностей.
Рассматриваем изобретение также предоставляет векторы, содержащие такие нуклеиновые кислоты, описанные выше, которые могут быть функционально связаны с промотором (см., например, WO 86/05807; WO 89/01036; и патент США № 5,122,464); и другие транскрипционные регуляторные и управляющие процессингом элементы эукариотного секреторного пути. Изобретение также предоставляет клетки-хозяева, укрывающие эти векторы и системы экспрессии хозяина.
Как используют в данном документе, термин “система экспрессии хозяина” включает любой тип клеточной системы, которая может быть сконструирована, чтобы генерировать либо нуклеиновые кислоты или полипептиды и антитела изобретения. Такие системы экспрессии хозяина включают, но не ограничиваются перечисленным, микроорганизмы (например, E. coli или B. subtilis), трансформированные или трансфицированные рекомбинантной ДНК бактериофага или плазмидную ДНК; дрожжи (например, Saccharomyces), трансфицированные рекомбинантными дрожжевыми векторами экспрессии; или клетки млекопитающих (клетки например, COS, CHO-S, HEK-293T, 3T3), укрывающие рекомбинантные конструкции экспрессии, содержащие промоторы, являющиеся производными генома клеток млекопитающих или вирусов (например, аленовирусный поздний промотор). Клетка-хозяин может быть со-трансфицирована двумя векторами экспрессии, например, первым вектором, кодирующим полипептид, производный от тяжелой цепи, и вторым вектором кодирующим полипептид, производный от легкой цепи.
Способы трансформации клеток млекопитающих хорошо известны в области. См., например, патенты США №№ 4,399,216, 4,912,040, 4,740,461 и 4,959,455. Клетка-хозяин также может быть сконструирована, чтобы обеспечить продуцирование антигенсвязывающей молекулы с различными характеристиками (например, модифицированных гликоформ или белков, имеющих активность GnTIII).
Для продолжительного продуцирования рекомбинантных белков с высоким выходом стабильная экспрессия является предпочтительной. Соответственно, клеточные линии, которые стабильно экспрессируют выбранное антитело, могут быть сконструированы с использованием стандартных признанных в области методов, и образуют часть изобретения. В большей степени чем с использованием векторов экспрессии, которые содержат вирусные точки начала репликации, клетки-хозяева могут быть трансформированы с помощью ДНК, управляемой соответствующими контрольными элементами экспрессии (например, промоторными или энхансерными последовательностями, терминаторами транскрипции, сайтами полиаденилирования, и т.д.), и селектируемым маркером. Могут применяться любые из систем селекции, хорошо известных в области, включая систему экспрессии гена глутаминсинтетазы (систему GS), которая предоставляет эффективный подход для усиления экспрессии при некоторых условиях. Система GS обсуждается полностью или частично в связи с EP 0 216 846, EP 0 256 055, EP 0 323 997 и EP 0 338 841 и патентами США №№ 5,591,639 и 5,879,936. Еще одной предпочтительной системой экспрессии для разработки стабильных клеточных линий является набор Freedom™ CHO-S (Life Technologies).
Как только антитело изобретения было продуцировано посредством рекомбинантной экспрессии или любого другого из раскрытых методов, оно может быть очищено или выделено посредством методов, известных в данной области, что означает его идентификацию и отделение и/или извлечение из его природного окружения и отделение от посторонних веществ, которые могли бы препятствовать диагностическим или терапевтическим применениям для антитела. Выделенные антитела включают антитела in situ внутри рекомбинантных клеток.
Эти выделенные препараты могут быть очищены с использованием различных признанных в области методов, таких как, например, ионообменная и гель-проникающая хроматография, диализ, диафильтрация и аффинная хроматография, в частности, аффинная хроматография с Белком A или Белком G.
4. Селекция после продуцирования
Независимо от того, как они получены, продуцирующие антитела клетки (например, гибридомы, дрожжевые колонии, и т.д.) могут быть выбраны, клонированы и дополнительно скринированы по желательным характеристикам, включающим, например, устойчивый рост, высокое продуцирование антител и желательные характеристики антител, такие как высокая аффинность к антигену, представляющему интерес. Гибридомы могут быть распространены in vitro в культуре клеток или in vivo в сингенных иммунодефицитных животных. Способы селекции, клонирования и распростанения гибридом и/или колоний являются хорошо известными рядовым специалистам в области. Как только желательные антитела идентифицируют, относящийся к ним генетический материал может быть выделен, обработан и экспрессирован с использованием обычных, принятых в данной области методов молекулярной биологии и биохимических методов.
Антитела, продуцируемые посредством интактных библиотек, (либо природные или синтетические) могут иметь умеренную аффинность (Ka равно приблизительно 106-107 M-1). Чтобы увеличить аффинность, созревание аффинности может быть имитировано in vitro посредством построения библиотек антител (например, посредством введения случайных мутаций in vitro с использованием ошибающейся полимеразы) и реселекции антител с высокой аффинностью к антигену из этих вторичных библиотек (например, посредством применения фагового или дрожжевого отображения). WO 9607754 описывает способ индуцирования мутагенеза в CDR легкой цепи иммуноглобулина для создания библиотеки генов легкой цепи.
Для селекции антител могут применяться различные методы, включающие, но не ограниченные перечисленным, фаговое или дрожжевое отображение, при котором библиотеку человеческих комбинаторных антител или фрагментов scFv синтезируют на фагах или дрожжах, библиотеку скринируют с антигеном, представляющим интерес, или его частью, связывающей антитело, и выделяют фаг или дрожжи, которые связывают антиген, из которых можно получать антитела или иммунореактивные фрагменты (Vaughan et al., 1996, PMID: 9630891; Sheets et al., 1998, PMID: 9600934; Boder et al., 1997, PMID: 9181578; Pepper et al., 2008, PMID: 18336206). Наборы для генерации библиотек фагового или дрожжевого отбражения являются доступными для приобретения. Существуют также другие методы и реагенты, которые могут применяться при генерации и скрининге библиотек отображения антител (см. патент США № 5,223,409; WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; и Barbas et al., 1991, PMID: 1896445). Такие методы преимущественно обеспечивают скрининг большого числа кандидатных антител и предоставляют относительно простое манипулирование с последовательностями (например, посредством рекомбинантной тасовки).
5. Фрагменты и производные антитела
a. Фрагменты
Независимо от того, какая форма модулятора (например, химерная, гуманизированная и т.д.) выбрана для практического осуществления изобретения, следует принимать во внимание, что иммунореактивные фрагменты модулятора могут применяться в соответствии с принципами данного документа. “Фрагмент антитела'' содержит по меньшей мере часть интактного антитела. Как используют в данном документе, термин ''фрагмент'' молекулы антитела включает антигенсвязывающие фрагменты антител, и термин “антигенсвязывающий фрагмент” относится к полипептидному фрагменту иммуноглобулина или антитела, который иммуноспецифически связывается или взаимодействует с выбранным антигеном или его иммуногенной детерминантой, или конкурирует с интактным антителом из которого были получены фрагменты для специфического связывания антигена.
Иллюстративные фрагменты включают: VL, VH, scFv, F(ab')2 фрагмент, Fab фрагмент, Fd фрагмент, Fv фрагмент, фрагменты одиночного домена антитела, диатела, линейные антитела, молекулы одноцепочечного антитела и мультиспецифические антитела, образованные из фрагментов антитела. В дополнение, активный фрагмент содержит часть антитела, которая сохраняет свою способность взаимодействовать с антигеном/субстратами или рецепторами и модифицировать их образом, аналогичным обрзу действию интактного антитела (несмотря на возможную в некоторой степени меньшую эффективность).
В других вариантах осуществления, фрагмент антитела представляет собой фрагмент, который содержит Fc область, и, который сохраняет по меньшей мере одну из биологических функций, обычно ассоциированных с Fc областью, когда он присутствует в интактном антителе, такую как связывание FcRn, модуляцию периода времени полужизни антитела, функцию ADCC и связывание комплемента. В одном варианте осуществления, фрагмент антитела представляет собой моновалентное антитело, которое имеет время полужизни in vivo, по существу аналогичное времени полужизни интактного антитела. Например, такой фрагмент антитела может содержать плечо связывания антигена, связанное с Fc последовательностью, способной придавать фрагменту стабильность in vivo.
Как признают квалифицированные специалисты в области, фрагменты могут быть получены посредством химической или ферментативной обработки (такой как папаином или пепсином) интактного или полного антитела или цепи антитела или рекомбинантными средствами. См., например, Fundamental Immunology, W. E. Paul, ed., Raven Press, N.Y. (1999), на предмет более подробного описания фрагментов антител.
b. Мультивалентные антитела
В одном варианте осуществления, модуляторы изобретения могут быть моновалентными или мультивалентными (например, бивалентными, тривалентными, и т.д.). Как используют в данном документе, термин ''валентность'' относится к числу потенциальных участков целенаправленного связывания, ассоциированных с антителом. Каждый участок целенаправленного связывания специфически связывается с одной целевой молекулой или специфическим положением или локусом на целевой молекуле. Когда антитело является моновалентным, каждый участок связывания молекулы будет специфически связываться с единственным положением антигена или эпитопа. Когда антитело содержит более одного участка целевого связывания, (является мультивалентным), каждый участок целевого связывания может специфически связываться с одинаковыми или различными молекулами (например, может связываться с различными лигандами или различными антигенами, или различными эпитопами или положениями на одном и том же антигене). См., например, патент США № 2009/0130105. В каждом случае по меньшей мере один из участков связывания будет содержать эпитоп, мотив или домен, ассоциированный с изоформой DLL3.
В одном варианте осуществления, модуляторы представляют собой биспецифические антитела, в которых две цепи имеют различные специфичности, как описано в Millstein et al., 1983, Nature, 305:537-539. Другие варианты осуществления включают антитела с дополнительными специфичностями, такие как триспецифические антитела. Другие более усложненные совместимые мультиспецифическин конструкции и методы их изготовления приведены в патенте США № 2009/0155255, а также WO 94/04690; Suresh et al., 1986, Methods in Enzymology, 121:210; и WO96/27011.
Как упоминается выше, мультивалентн антитела могут иммуноспецифически связываться с различными эпитопами желательной молекулы-мишени или могут иммуноспецифически связываться с молекулой-мишенью, а также с гетерологичным эпитопом, таким как гетерологичный полипептид или вещество твердой подложки. В то время как предпочтительные варианты осуществления анти-DLL3 антитела только связывают два антигена, (т.е. биспецифические антитела), антитела с дополнительными специфичностями, такие как триспецифические антитела, также охватываются рассматриваемым изобретением. Биспецифические антитела также включают сшитые или ''гетероконъюгатные'' антитела. Например, одно из антител в гетероконъюгате может сочетаться с авидином, другое - с биотином. Такие антитела были предложены, например, ждя нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4,676,980), и для лечения инфекции ВИЧ (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгатные антитела могут быть получены с использованием любых удобных методов сшивки. Подходящие сшивающие средства являются хорошо известными в области, и раскрыты в патенте США № 4,676,980, вместе с рядом технологий сшивки.
В еще других вариантах осуществления, вариабельные домены антитела с желательными специфичностями связывания (антитело-антиген комбинирующими участками) гибридизируют с последовательностями константных доменов иммуноглобулинов, такими как последовательность константного домена тяжелой цепи иммуноглобулина, содержащая по меньшей мере часть шарнирной области, CH2, и/или CH3 областей, с использованием методов, хорошо известных рядовым специалистам в области.
c. Модификации Fc области
В дополнение к различным модификациям, заменам, присоединениям или делециям в вариабельной или связывающей области раскрытых антител, приведенных выше, специалисты в данной области смогут понять, что выбранные варианты осуществления настоящего изобретения могут также содержать замены или модификации константной области (т.е. Fc области). Более конкретно, предусматривают, что DLL3 модуляторы изобретения могут содержать помимо прочего одну или более дополнительных замен, мутаций и/или модификаций аминокислотных остатков, что приводит в результате к соединению с предпочтительными характеристиками, включающими, но не ограниченными перечисленным: измененную фармакокинетику, увеличенное время полужизни в сыворотке, увеличенную аффинность связывания, сниженную иммуногенность, увеличенное продуцирование, измененное связывание Fc лиганда с Fc рецептором (FcR), увеличенную или сниженную “ADCC” (антителозависимую клеточно опосредованную цитотоксичность) или активность “CDC” (комплемент-зависимую цитотоксичность), измененные гликозилирование и/или дисульфидные связи и модифицированнцю специфичность связывания. В данной связи следует принимать во внимание, что эти Fc варианты могут преимущественно применяться для увеличения эффективных анти-неопластических свойств раскрытых модуляторов.
С этой целью некоторые варианты осуществления изобретения может содержать замены или модификации Fc области, например добавление одного или нескольких аминокислотных остатков, замены, мутации и/или модификации для получения соединения с увеличенными или предпочтительными Fc-эффекторными функциями. Например, изменения в аминокислотных остатках, вовлеченных во взаимодействие между Fc доменом и Fc рецептором (например, FcγRI, FcγRIIA и B, FcγRIII и FcRn) могут приводить к увеличенной цитотоксичности и/или измененной фармакокинетике, такой как увеличенное время полужизни в сыворотке (см., например, Rav and etc and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995), каждая из которых включена в данный документ посредством ссылки).
В избранных вариантах осуществления, антитела с увеличенными значениями времени полужизни in vivo могут генерироваться посредством модифицирования (например, замещения, делеции или добавления) аминокислотных остатков, идентифицированных как вовлеченных во взаимодействие между Fc доменом и FcRn рецептором (см., например, International Publication NO. WO 97/34631; WO 04/029207; патент США № 6,737,056 и патент США № 2003/0190311. По отношению к таким вариантам осуществления, Fc варианты могут обеспечивать значения времени полужизни у млекопитающего, предпочтительно, человека, большие, чем 5 дней, большие, чем 10 дней, большие, чем 15 дней, предпочтительно, большие, чем 20 дней, большие, чем 25 дней, большие, чем 30 дней, большие, чем 35 дней, большие, чем 40 дней, большие, чем 45 дней, большие, чем 2 месяца, большие, чем 3 месяца, большие, чем 4 месяца или большие, чем 5 месяцев. Увеличенное время полужизни приводит к более высокому сывороточному титру, что, таким образом, снижает частоту введения антител и/или снижает концентрацию антител, подлежащих введению. Связывание с человеческим FcRn in vivo и время полужизни в сыворотке человеческих полипептидов, связывающих FcRn с высокой аффинностью, можно проанализировать, например, у трансгенных мышей или трансфицированных человеческих клеточных линий, экспрессирующих человеческий FcRn, или у приматов, которым вводят полипептиды с вариантной Fc областью. WO 2000/42072 описывает варианты антитела с улучшенным или уменьшенным связыванием с FcRn. См., также, например, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001).
В других вариантах осуществления, изменения Fc могут приводить к увеличенной или сниженной активности ADCC или CDC. Как известно в области, CDC относится к лизису клетки-мишени в присутствии комплемента, а ADCC относится к форме цитотоксичности, при которой секретируемый Ig, связанный на FcR, присутствующий на некоторых цитотоксических клетках (например, клетках естественных киллеров, нейтрофилах и макрофагов), позволяет этим цитотоксическим эффекторным клеткам связываться специфически с антиген-несущей клеткой-мишенью и впоследствии уничтожать клетку-мишень с помощью цитотоксинов. В контексте рассматриваемого изобретения предоставлены варианты антитела с ''измененной'' аффинностью связывания с FcR, которая либо увеличивает или уменьшает связывание в сравнении с родительским или немодифицированным антителом или с антителом, содержащим нативную последовательность FcR. Такие варианты, которые проявляют сниженное связывание, могут обладать небольшим учитываемым связыванием или не обладать им, например, 0-20% связывания с FcR в сравнении с нативной последовательностью, например, определенным методами, хорошо известными в области. В других вариантах осуществления вариант будет проявлять увеличенное связывание по сравнению с Fc доменом нативного иммуноглобулина. Следует принимать во внимание, что эти типы Fc вариантов могут преимущественно применяться для увеличения эффективных анти-неопластических свойств раскрытых антител. В еще других вариантах осуществления, такие изменения приводят к увеличенной аффинности связывания, сниженной иммуногенности, увеличенному продуцированию, измененному гликозилированию и/или дисульфидным связям (например, для участков конъюгирования), модифицированной специфичности связывания, увеличенному фагоцитозу; и/или нисходящей регуляции рецепторов клеточной поверхности (например, B-клеточного рецептора; BCR), и т.д.
d. Измененное гликозилирование
Еще другие варианты осуществления содержат одну или несколько сконструированных гликоформ, т.е., модулятор DLL3, содержащий измененную схему гликозилирования или измененный углеводный состав, который ковалентно присоединен к белку (например, в Fc домене). См., например, Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740. Сконструированные гликоформы могут быть применимыми для различных целей, включающих, но не ограниченных перечисленным усиление или ослабление эффекторной функции, увеличение аффинности модулятора к мишени или облегчение продуцирования модулятора. В некоторых вариантах осуществления, где ослабленная эффекторная функция является желательной, молекула может быть сконструирована для экспрессии агликозилированной формы. Замены, которые могут приводить к устранению одного или более участков гликозилирования каркаса вариабельной области, чтобы, таким образом, исключить гликозилирование на этом участке, являются хорошо известными (см., например, патенты США №№ 5,714,350 и 6,350,861). Напротив, усиленные эффекторные функции или улучшенное связывание могут придаваться Fc-содержащей молекуле посредством конструирования в одном или нескольких дополнительных участков гликозилирования.
Другие варианты осуществления включают вариант Fc, который имеет измененный состав гликозилирования, такой как гипофукозилированное антитело, имеющее уменьшенное количество фукозильных остатков, или антитело, имеющее увеличенные раздвоенные структуры GlcNAc. Было продемонстрировано, что такие измененные схемы гликозилирования увеличивают ADCC способность антител. Сконструированные гликоформы могут генерироваться любым способом, известным специалисту в данной области, например, посредством использования сконструированных или вариантных экспрессионных штаммов, посредством со-экспрессии с помощью одного или более ферментов (например N-ацетилглюкозоаминилтрансферазы III (GnTI11)), посредством экспрессирования молекулы, содержащей Fc-область, в различных организмах или клеточных линиях от различных организмов, или посредством модификации углевода(углеводов) после того, как молекула, содержащая Fc-область была экспрессирована (см., например, WO 2012/117002).
e. Дополнительный процессинг
Модуляторы могут быть различным образом модифицированы во время или после получения, например, посредством гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирующими группами, протерлитического расщепления, связывания с молекулой антитела или другого клеточного лиганда и т.д. Любые из многочисленных химических модификаций могут выполняться известными методами, включающими, но не ограниченными перечисленным, специфичное химическое расщепление цианогенбромидом, трипсином, химотрипсином, папаином, протеазой V8, NaBH4, ацетилированием, формилирование, окисление, восстановление, метаболический синтез в присутствии туникaмицина и т.д.
Различные посттрансляционные модификации, также охватываемые изобретением, включают например, N-связанные или O-связанные углеводные цепи, процессинг N-терминальных или C-терминальных концов, присоединение химических фрагментов к аминокислотному скелету, химические модификации N-связанных или O-связанных углеводных цепей, и присоединение или делецию N-терминального метионинового остатка в результате экспрессии прокариотной клетки-хозяина. Более того, модуляторы могут также быть модифицированы обнаруживаемой меткой, такой как ферментативная, флуоресцентная, радиоизотопная или аффинная метка, чтобы обеспечить обнаружение и выделение модулятора.
6. Характеристики антитела
Независимо от того, как модулятор получен, или какие из вышеуказанных форм он принимает, различные варианты осуществления раскрытых модуляторов могут проявлять некоторые характеристики. В избранных вариантах осуществления, клетки, пролуцирующие антитела (например, гибридомы или колонии дрожжей), могут быть выбраны, клонированы и дополнительно подвергнуты скринингу на благоприятные свойства, включающие, например, устойчивый рост, высокое продуцирование модулятора и, как обсуждается более подробно ниже, желательные характеристики модулятора. В других случаях характеристики модулятора могут придаваться или на них можно влиять посредством выбора конкретного антигена (например, специфичной изоформы DLL3) или иммунореактивного фрагмента целевого антигена для инокуляции животного. В еще других вариантах осуществления выбранные модуляторы могут быть сконструированы, как описано выше, для усиления или усовершенствования иммунохимических характеристик, таких как аффинность или фармакокинетика.
a. Нейтрализующие антитела
В некоторых вариантах осуществления, конъюгаты будут содержать “нейтрализующие” антитела или их производные или фрагменты. Таким образом, настоящее изобретение может включать молекулы антитела, которые связывают специфичные домены, мотивы или эпитопы, и способны к блокированию, снижению или ингибированию биологической активности DLL3. В более общем смысле, термин “нейтрализующее антитело” относится к антителу, которое связывается или взаимодействует с молекулой-мишенью или лигандом и предотвращает связывание или ассоциацию молекулы-мишени с партнером связывания, таким как рецептор или субстрат, посредством этого прерывая биологический ответ, который иначе являлся бы результатом взаимодействия молекул.
Следует принимать во внимание, что аналитические тесты на конкурентное связывание, известные в данной области, могут применяться для оценки связывания и специфичности антитела или его иммунологически функционального фрагмента или производного. По отношению к рассматриваемому изобретению, антитело или фрагмент будут удерживаться, чтобы ингибировать или снижать связывание DLL3 с партнером связывания или субстратом, когда избыток антитела уменьшает количество партнера связывания, связанного с DLL3, на по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более, как измеряют, например, посредством активности Нотч-рецептора или в аналитическом тесте на конкурентное связывание in vitro. В случае антител к DLL3, например, нейтрализующее антитело или антагонист будут предпочтительно изменять активность Нотч-рецептора на по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более. Следует принимать во внимание, что эта модифицированная активность может быть измерена непосредственно с использованием методов, принятых в данной области, или может быть измерена под воздействием, приводящим к изменению активности с понижением (например, онкогенез, выживаемость клеток или активация или подавление Нотч-реагирующих генов). Предпочтительно, способность антитела нейтрализовать активность DLL3 оценивают по ингибированию связывания DLL3 с Нотч-рецептором или посредством оценки его способности смягчать опосредованную DLL3 репрессию сигнального пути Нотч.
b. Интернализированные антитела
Существуют очевидные доказательства того, что значительная часть экспрессированного белка DLL3 остается ассоциированной с поверхностью опухолеобразующей клетки, таким образом, обеспечивая локализацию и интернализацию раскрытых модуляторов. В предпочтительных вариантах осуществления такие модуляторы могут быть ассоциированы или конъюгированны с противоопухолевым средством, таким как цитотоксические фрагменты, которые уничтожают клетку при интернализации. В особенно предпочтительных вариантах осуществления модулятор будет содержать конъюгат интернализированного антитела с лекарственным средством.
Как используют в данном документе, модулятор, который “интернализует”, является модулятором, который захватывается клеткой (наряду с любой полезной нагрузкой) при связывании с ассоциированным антигеном или рецептором. Как следует понимать, интернализированный модулятор может, в предпочтительных вариантах осуществления, содержать антитело, включая фрагмент антитела и их производные, а также конъюгаты антитела. Интернализация может происходить in vitro или in vivo. Для терапевтических применений, интернализация будет предпочтительно происходить in vivo у субъекта, нуждающегося в этом. Число интернализованных молекул антитела может быть достаточным или соответствующим, чтобы уничтожить антиген-экспрессирующую клетку, особенно, антиген-экспрессирующую раковую стволовую клетку. В зависимости от активности антитела или конъюгата антитела, в некоторых случаях, захват единственной молекулы антитела в клетку является достаточным для уничтожения клетки-мишени, с которой антитело связывается. Например, некоторые токсины являются настолько высокоактивными, что интернализация нескольких молекул токсина, конъюгированного с антителом, является достаточной для уничтожения опухолевой клетки. Интернализируется ли антитело при связывании с клеткой млекопитающего, может быть определено различнвми признанными в области аналитическими тестами, включающими описанные в Примерах ниже. Методы обнаружения того, интернализуется ли антитело в клетку также описаны в патенте США № 7,619,068, который полностью включен в данный документ посредством ссылки.
c. Истощающие антитела
В других вариантах осуществления антитела будут содержать истощающие антитела или их производные или фрагменты. Термин “истощающее” антитело относится к антителу, которое предпочтительно связывается или ассоциируется с антигеном на поверхности клетки или рядом с ней и индуцирует, инициирует или вызывает смерть или устранение клетки (например, посредством CDC, ADCC или введения цитотоксического средства). В некоторых вариантах осуществления, выбранные истощающие антитела будут ассоциированы или конъюгированы с цитотоксическим средством.
Предпочтительно, истощающее антитело будет обладать способностью к удалению, ограничению дееспособности, устранению или уничтожению, по меньшей мере, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, или 99% DLL3 онкогенных клеток в определенной клеточной популяции. В некоторых вариантах осуществления клеточная популяция может содержать обогащенные, секционированные, очищенные или выделенные поддерживающие опухоль клетки. В других вариантах осуществления клеточная популяция может содержать образцы цельной опухоли или гетерогенные опухолевые экстракты, которые содержат поддерживающие опухоль клетки. Специалисты в области смогут понять, что стандартные биохимические методы, описанные в Примерах ниже (например, Примерах 8 - 10), могут применяться для непрерывной регистрации и количественной оценки истощения онкогенных клеток или поддерживающих опухоль клеток в соответствии с принципами данного документа.
d. Биннинг и картирование эпитопов
Следует дополнительно учитывать, что раскрытые модуляторы анти-DLL3 антитела будут ассоциироваться, или связываться с дискретными эпитопами или иммуногенными детерминантами, представленными выбранной мишенью или ее фрагментом. В некоторых вариантах осуществления, эпитоп или иммуногенные детерминанты включают химически активные поверхностные группировки молекул, таких как аминокислоты, сахарные боковые цепи, фосфорильные группы или сульфонильные группы, и, в некоторых вариантах осуществления, могут иметь специфичные характеристики трехмерной структуры и/или специфичные характеристики заряда. Таким образом, как используют в данном документе, термин “эпитоп” включает любую белковую детерминанту, способную к специфическому связыванию с иммуноглобулином или T-клеточным рецептором или иным образом взаимодействующую с молекулой. В некоторых вариантах осуществления, утверждают, что антитело специфически связывается (или иммуноспецифически связывается или взаимодействует) с антигеном, когда оно преимущественно распознает его целевой антиген в сложной смеси белков и/или макромолекул. В предпочтительных вариантах осуществления, утверждают, что антитело специфически связывается с антигеном когда равновесная константа диссоциации (KD) составляеи меньше, чем или равна 10-6M, или меньше, чем или равна 10-7M, более предпочтительно, когда равновесная константа диссоциации составляет меньше, чем или равна 10-8M, и, даже более предпочтительно, когда константа диссоциации составляет меньше, чем или равна 10-9M.
Более направленно, термин “эпитоп” применяют в его общепринятом биохимическом смысле, и он относится к той части целевого антигена, которая может распознаваться и быть специфически связанной конкретным модулятором антитела. Когда антиген представляет собой полипептид, такой как DLL3, эпитопы могут обычно образовываться как из смежных аминокислот, так и несмежных аминокислот находящихся рядом при образовании третичной складчатой структуры белка (“конформационные эпитопы”). В таких конформационных эпитопах точки взаимодействия находятся на протяжении аминокислотных остатков в белке, которые линейно разделены друг с другом. Эпитопы, образованные из смежных аминокислот (иногда называемых “линейными” или “непрерывными” эпитопами), обычно сохраняются при денатурации белка, в то время, как эпитопы, образованные посредством образования третичной складчатой структуры, обычно утрачиваются при денатурации белка. При любом событии эпитоп антитела обычно включает по меньшей мере 3, и более обычно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
В данном отношении следует принимать во внимание, что, в некоторых вариантах осуществления, эпитоп может располагаться в одной или нескольких областях, одном или нескольких доменах или мотивах белка DLL3 (например, аминокислоты 1-618 изоформы 1) или ассоциирован с ними. Как обсуждается более подробно в данном документе, внеклеточная область белка DLL3 содержит ряд общепризнанных доменов, включающих шесть EGF-подобных доменов и домен DSL. В целях рассматриваемого раскрытия, термин “домен” будет применяться в соответствии с его общепринятым значением, и будет сохраняться для обозначения идентифицируемого или определяемого консервативного структурного объекта в белке, который проявляет отличительное содержание вторичной структуры. Во многих случаях, гомологичные домены с общими функциями будут обычно показывать сходства последовательностей и обнаруживаться в ряде несравнимых белков (например, EGF-подобные домены, как сообщается, обнаружены в по меньшей мере 471 различном белке). Аналогично, принятый в области термин “мотив” будет применяться в соответствии с его общим значением, и будет, как правило, относиться к короткой, консервативной области белка, которая состоит обычно из десяти - двадцати смежных аминокислотных остатоков. Как обсуждается на протяжении всей заявки, выбранные варианты осуществления включают модуляторы, которые ассоциируются или связываются с эпитопом внутри специфичных областей, доменов или мотивов DLL3.
При любом событии, как только определяют желательный эпитоп на антигене, является возможным генерировать антитела к этому эпитопу, например, посредством иммунизации эпитопом, содержащим пептид, с использованием методов, описанных в настоящем изобретении. Альтернативно, во время процесса обнаружения, генерация и характеризация антител может дать иноформацию о желательных эпитопах, расположенных в специфичных доменах или мотивах. На основании этой информации, затем возможно проводить конкурентный скрининг антител на предмет связывания с одиним и тем же эпитопом. Подход для достижения этого результата, заключается в проведении кокурентных исследований, чтобы найти антитела, которые конкурентно связываются друг с другом, т.е. антитела, конкурирующие за связывание с антигеном. Высокопроизводительный процесс биннинга антител, основанный на их перекрестной конкуренции описан в WO 03/48731. Другие методы биннинга на доменном уровне или картирования эпитопов, включающие конкуренцию модуляторов или экспрессию фрагмента антигена на дрожжах, приведены в Примерах ниже.
Как используют в данном документе, термин “биннинг” относится к методам, применяемым для группирования или классификации антител на основании их антигенсвязывающих характеристик и конкуренции. В то время как эти методы являются применимыми для определения и категоризации модуляторов рассматриваемого изобретения, бины не всегда непосредственно коррелируют с эпитопами, и такие первоначальные определения связывания эпитопа могут дополнительно уточняться и подтверждаться другой принятой в области методологией, описанной в данном документе. Однако, как обсуждается и показано в Примерах ниже, эмпирическое отнесение модуляторов антитела к индивидуальным бинам обеспечивает информацией, которая может указывать на терапевтический потенциал раскрытых модуляторов.
Более конкретно, можно определить связывается ли выбранное референтное антитело (или его фрагмент) с одинаковым эпитопом или перекрестно конкурирует за связывание со вторым тестируемым антителом (т.е., находтится в том же бине), используя методы, известные в области и приведенные в Примерах в данном документе. В одном варианте осуществления, модулятор референтного антитела ассоциируют с антигеном DLL3 в условиях насыщения, а затем определяют способность модулятора вторичного или тестируемого антитела к связыванию с DLL3, используя стандартные иммунохимические сетоды. Если тестируемое антитело способно по существу связываться с DLL3 в одно и то же время с референтным анти-DLL3 антителом, тогда вторичное или тестируемое антитело связывается с различным эпитопом, чем первичное или референтное антитело. Однако, если тестируемое антитело неспособно связываться по существу с DLL3 в одно и то же время, тогда тестируемое антитело связывается с тем же самым эпитопом, перекрывающим эпитопом, или эпитопом, который находится в тесной близости (по меньшей мере стерически) с эпитопом, связанным первичным антителом. Таким образом, тестируемое антитело конкурирует за связывание с антигеном и находится в том же самом бине, что и референтное антитело.
Термин “конкурировать” или “конкурирующее антитело”, когда его применяют в контексте раскрытых модуляторов, означает соревнование между антителами, определяемое посредством аналитического теста, в котором тестируемое антитело или его иммунологически функциональный фрагмент в условиях тестирования предотвращает или ингибирует специфическое связывание референтного антитела с общим антигеном. Обычно, такой аналитический тест включает в себя применение очищенного антигена (например, DLL3 или его домена или фрагмента), связанного с твердой поверхностью или клетками, несущими любой из немеченого тестируемого иммуноглобулина или меченого референтного иммуноглобулина. Конкурентн ингибирование измеряют посредством определения количества метки, связанного с твердой поверхностью или клетками в присутствии тестируемого иммуноглобулина. Обычно, тестируемый иммуноглобулин присутствует в избытке и/или ему первоначально обеспечивают связывание. Антитела, идентифицируемые посредством конкурентного аналитического теста (конкурирующие антитела), включают антитела, связывающиеся с тем же самым эпитопом, как и референтное антитело, и антитела, связывающиеся с соседним эпитопом, достаточно приближенным к эпитопу, связанным референтным антителом, из-за имеющего место стерического затруднения. Дополнительные подробности, касающихся методов определения конкурентного связывания предоставлены в Примерах данного описания. Обычно, когда конкурирующее антитело присутствует в избытке, оно будет ингибировать специфическое связывание референтного антитела с общим антигеном на по меньшей мере 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. В некоторых случаях, связывание ингибируется на по меньшей мере 80%, 85%, 90%, 95% или 97% или более.
Напротив, когда референтное антитело является связанным, оно будет предпочтительно ингибировать связывание впоследствии добавленного тестируемого антитела (т.е., модулятора DLL3) на по меньшей мере 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. В некоторых случаях, связывание тестируемого антитела ингибируется на по меньшей мере 80%, 85%, 90%, 95% или 97% или более.
В отношении к рассматриваемому изобретению и изложенного в Примерах ниже, было определено (посредством поверхностного плазмонного резонанса или интерферометрии биослоя), что внеклеточный домен DLL3 определяет по меньшей мере девять бинов посредством конкурентного связывания, называемых “бин A” до “бина I” в данном документе. С учетом разделения, обеспечиваемого методами биннинга модулятора, полагают, что эти девять бинов включают большинство бинов, которые присутствуют во внеклеточной области белка DLL3.
В данном отношении, и как известно в данной области и подробно описано в Примерах ниже, желательные данные биннинга или конкурентного связывания могут быть получены с использованием твердофазного прямого или косвенного радиоиммунологического анализа (RIA), твердофазного прямого или косвенного ферментного иммунологического анализа (EIA или ELISA), сэндвич-конкурентного анализа, системы Biacore™ 2000 (т.е., поверхностного плазмонного резонанса - GE Healthcare), анализатора ForteBio® (т.е., интерферометрии биослоя - ForteBio, Inc.) или методологии проточной цитометрии. Термин “поверхностный плазмонный резонанс”, как используют в данном документе, относится к оптическому явлению, которое позволяет проводить в режиме реального времени анализ специфических взаимодействий посредством обнаружения изменений концентрации белка внутри биосенсорной матрицы. Термин “интерферометрия биослоя” относится к методу оптического анализа, который анализирует схему интерференции белого света, отражаемого от двух поверхностей: слоя иммобилизованного белка на биосенсорном наконечнике, и внутреннего референтного слоя. Любое изменение числа молекул, связанных с биосенсорным наконечником вызывает сдвиг схемы интерференции, который может быть измерен в режиме реального времени. В особенно предпочтительных вариантах осуществления анализ (либо поверхностный плазмонный резонанс, интерферометрия биослоя или проточн цитометрия) проводят, используя прибор Biacore или ForteBio или проточный цитометр (например, FACSAria II), как демонстрируется в Примерах ниже.
Чтобы дополнительно характеризовать эпитопы, с которыми ассоциируются или связываются раскрытые модуляторы DLL3 антител, выполняли картирование эпитопов на доменном уровне с использованием модификации протокола, описанного Cochran et al. (J Immunol Methods. 287 (1-2):147-158 (2004), который включен в данный документ посредством ссылки). Вкратце, индивидуальные домены DLL3, содержащие специфичные аминокислотные последовательности экспрессировали на поверхности дрожжей, и связывание посредством каждого антитела к DLL3 определяли посредством проточной цитометрии. Результаты обсуждаются ниже в Примере 6 и показаны на ФИГ. 4.
Другие совместимые методы картирования эпитопов включают аланиновые мутанты сканирования, пептидные блоттинги (Reineke (2004) Methods Mol Biol 248:443-63) (в данный документ особым образом полностью включено посредством ссылки), или анализ пептидного расщепления. В дополнение, могут использоваться методы, такие как рассечение эпитопа, экстракция эпитопа и химическая модификация антигенов (Tomer (2000) Protein Science 9: 487-496) (в данный документ особым образом полностью включено посредством ссылки). В других вариантах осуществления Профилирование с помощью модификации (MAP), также известное как Основанное на структуре антигена профилирование антител (ASAP), предоставляет метод, который категоризует большие количества моноклональных антител (mAbs), направленных против одного и того же антигена в соответствии со сходством профиля связывания каждого антитела с химически или ферментативно модифицированными поверхностями антигена (патент США № 2004/0101920, особым образом полностью включенный в данный документ посредством ссылки). Каждая категория может отражать уникальный эпитоп, либо четко отличающийся от эпитопа, представленного еще одной категорией, или частично перекрывающийся с ним. Данная техгология обеспечивает быструю фильтрацию генетически идентичных антител, таким образом, что характеризация может быть сфокусирована на генетически отличимых антителах. Следует принимать во внимание, что MAP может применяться для сортировки модуляторов hDLL3 антител изобретения в группы антител, связывающих различные эпитопы.
Средства, применимые для изменения структуры иммобилизованного антигена включают ферменты, такие как протеолитические ферменты (например, трипсин, эндопротеаза Glu-C, эндопротеаза Asp-N, химотрипсин и т.д.). Средства, применимые для изменения структуры иммобилизованного антигена, могут также представлять собой химические средства, такие как, сукцинимидиловые сложные эфиры и их производные, соединения, содержащие первичные амины, гидразины и карбогидразины, свободные аминокислоты и т.д.
Белок антигена может быть иммобилизован либо на поверхностях биосенсорного чипа или полистирольных гранулах. Последние могут быть обработаны с использованием, например, аналитическог теста, такого как анализ мультиплексного обнаружения LUMINEX™ (Luminex Corp.). Вследствие способности LUMINEX проводить манипуляции с мультиплексным анализом с использованием до 100 различных типов гранул, LUMINEX предоставляет почти неограниченные антигенные поверхности с различными модификациями, приводящими в результате к улучшенному разрешению при профилировании эпитопов антитела во время биосенсорного анализа.
e. Аффинность связывания
Помимо специфичности к эпитопам раскрытые антитела могут характеризоваться с использованием физических характеристик, таких как, например, аффинность связывания. В данной связи настоящее изобретение дополнительно охватывает применение антител, которые имеют высокую аффинность связывания для одной или более изоформ DLL3 или, в случае пэннинг-антител, более одного члена семейства DLL. Как используют в данном документе, термин “высокая аффинность” для IgG антитела относится к антителу, имеющему KD, равную 10-8M или менее, более предпочтительно, 10-9M или менее, и даже более предпочтительно, 10-10M или менее для целевого антигена. Однако, “высокая аффинность” связывания может варьировать для других изотипов антитела. Например, “высокая аффинность” связывания для изотипа IgM относится к антителу, имеющему KD, равную 10-7M или менее, более предпочтительно 10-8M или менее, даже более предпочтительно, 10-9M или менее.
Термин “KD”, как используют в данном документе, предназначен для обозначения константы диссоциации конкретного взаимодействия антитело-антиген. Утверждают, что антитело изобретения иммуноспецифически связывается со своим целевым антигеном, когда константа диссоциации KD (koff/kon) составляет ≤ 10-7M. Антитело специфически связывает антиген с высокой аффинностью, когда KD составляет ≤ 5×10-9M, и с очень высокой аффинностью, когда KD составляет ≤ 5×10-10M. В одном варианте осуществления изобретения, антитело имеет KD≤10-9M и скорость диссоциации, равную приблизительно 1×10-4/сек. В одном варианте осуществления изобретения, константа скорости диссоциации равна < 1×10-5/сек. В других вариантах осуществления изобретения, антитело будет связываться с DLL3 с KD, равной между приблизительно 10-7M и 10-10M, и в еще одном варианте осуществления оно будет связываться с KD≤2×10-10M. Еще другие выбранные варианты осуществления настоящего изобретения включают антитела, которые имеют константу диссоциации или KD (koff/kon) меньше, чем 10-2M, меньше, чем 5×10-2M, меньше, чем 10-3M, меньше, чем 5×10-3M, меньше, чем 10-4M, меньше, чем 5×10-4M, меньше, чем 10-5M, меньше, чем 5×10-5M, меньше, чем 10-6M, меньше, чем 5×10-6M, меньше, чем 10-7M, меньше, чем 5×10-7M, меньше, чем 10-8M, меньше, чем 5×10-8M, меньше, чем 10-9M, меньше, чем 5×10-9M, меньше, чем 10-10M, меньше, чем 5×10-10M, меньше, чем 10-11M, меньше, чем 5×10-11M, меньше, чем 10-12M, меньше, чем 5×10-12M, меньше, чем 10-13M, меньше, чем 5×10-13M, меньше, чем 10-14M, меньше, чем 5×10-14M, меньше, чем 10-15M или меньше, чем 5×10-15M.
В конкретных вариантах осуществления, антитело изобретения, которое иммуноспецифически связывается с DLL3, имеет константу скорости ассоциации или kon (или ka) (DLL3 (Ab)+антиген (Ag)kon←Ab-Ag), равную по меньшей мере 105M-1с-1, по меньшей мере 2×105M-1с-1, по меньшей мере 5×105M-1с-1, по меньшей мере 106M-1с-1, по меньшей мере 5×106M-1с-1, по меньшей мере 107M-1с-1, по меньшей мере 5×107M-1с-1, или по меньшей мере 108M-1с-1.
В еще одном варианте осуществления, антитело изобретения которое иммуноспецифически связывается с DLL3, имеет константу скорости диссоциации или koff (или kd) (DLL3 (Ab)+антиген (Ag)koff←Ab-Ag), меньше, чем 10-1с-1, меньше, чем 5×10-1с-1, меньше, чем 10-2с-1, меньше, чем 5×10-2с-1, меньше, чем 10-3с-1, меньше, чем 5×10-3с-1, меньше, чем 10-4с-1, меньше, чем 5×10-4с-1, меньше, чем 10-5с-1, меньше, чем 5×10-5с-1, меньше, чем 10-6с-1, меньше, чем 5×10-6с-1, меньше, чем 10-7с-1, меньше, чем 5×10-7с-1, меньше, чем 10-8с-1, меньше, чем 5×10-8с-1, меньше, чем 10-9с-1, меньше, чем 5×10-9с-1 или меньше, чем 10-10с-1.
В других выбранных вариантах осуществления настоящего изобретения анти-DLL3 антитела будут иметь константу аффинности или Ka (kon/koff), равную по меньшей мере 102M-1, по меньшей мере 5×102M-1, по меньшей мере 103M-1, по меньшей мере 5×103M-1, по меньшей мере 104M-1, по меньшей мере 5×104M-1, по меньшей мере 105M-1, по меньшей мере 5×105M-1, по меньшей мере 106M-1, по меньшей мере 5×106M-1, по меньшей мере 107M-1, по меньшей мере 5×107M-1, по меньшей мере 108M-1, по меньшей мере 5×108M-1, по меньшей мере 109M-1, по меньшей мере 5×109M-1, по меньшей мере 1010M-1, по меньшей мере 5×1010M-1, по меньшей мере 1011M-1, по меньшей мере 5×1011M-1, по меньшей мере 1012M-1, по меньшей мере 5×1012M-1, по меньшей мере 1013M-1, по меньшей мере 5×1013M-1, по меньшей мере 1014M-1, по меньшей мере 5×1014M-1, по меньшей мере 1015M-1 или по меньшей мере 5×1015M-1.
Помимо вышеуказанных модуляторных характеристик, антитела рассматриваемого изобретения могут дополнительно характеризоваться с использованием дополнительных физических характеристик, включающих, например, термическую стабильность (т.е., температуру плавления; Tm), и изоэлектрические точки. (См., например, Bjellqvist et al., 1993, Electrophoresis 14:1023; Vermeer et al., 2000, Biophys. J. 78:394-404; Vermeer et al., 2000, Biophys. J. 79: 2150-2154, каждая из которых включена в данный документ посредством ссылки).
V. Конъюгаты антитела с лекарственным средством и фрагменты лекарственное средство-линкер
Следует принимать во внимание, что конъюгаты DLL3 рассматриваемого изобретения содержат связующее средство клетки DLL3, ковалентно связанное через линкерный фрагмент с полезной нагрузкой в виде ПБД лекарственного средства. Как обсуждается в данном документе, конъюгаты DLL3 рассматриваемого изобретения могут применяться для предоставления любого из ПБД 1, ПБД 2, ПБД 3, ПБД 4 или ПБД 5 к месту расположения мишени (например, онкогенных клеток). Данное преимущественным образом достигается посредством раскрытых ADC, которые направляют связанную полезную нагрузку лекарственного средства к целевому участку в относительно нереакционноспособном, нетоксичном состоянии перед высвобождением и активацией полезной нагрузки лекарственного средства. Данное целенаправленное высвобождение токсичной полезной нагрузки в-основном достигается посредством линкеров, включенных в соединения лекарственное средство-линкер DL 1-5, которые изготавливают, так, чтобы не происходило расщепление и высвобождение цитотоксического димерного ПБД, пока ADC не достигнет опухолеобразующой клетки. Это преимущественным образом обеспечивает относительно высокие уровни активного ПБД лекарственн средств на участке локализации опухоли, в то же время минимизируя воздействие на нецелевые клетки и ткань.
1. Линкерные соединения
Более конкретно, линкеры, включенные в раскрытые ADC, предпочтительно являются стабильными вне клеток, препятствуют агрегации молекул ADC и поддерживают ADC в свободном растворимом виде в водных средах и в мономерном состоянии. Перед транспортировкой или доставеой в клетку, конъюгат антитело-лекарственное средство (ADC) является предпочтительно стабильным и остается интактным, т.е. антитело остается связанным с фрагментом лекарственного средства. В то время как линкеры являются стабильными вне клетки-мишени, их разрабатывают так, чтобы они расщеплялись при некоторой эффективной скорости внутри клетки. Соответственно, эффективный линкер будет: (i) поддерживать специфические связывающие средства антитела; (ii) обеспечивать внутриклеточную доставку конъюгата или фрагмента лекарственного средства; (iii) оставаться стабильным и интактным, т.е. нерасщепленным, пока конъюгат не будет доставлен или транспортирован к его намеченному участку; и (iv) поддерживать цитотоксический, уничтожающий клетки эффект или цитотостатический эффект фрагмента ПБД лекарственного средства. Стабильность ADC может быть измерена стандартными аналитическими методами, такими как масс-спектроскопия, ВЭЖХ, и метод разделения/анализа ЖХ/МС. Ковалентное присоединение антитела и фрагмента лекарственного средства требует от линкера наличия двух реакционноспособных функциональных групп, т.е. бивалентности в смысле реакционной способности. Бивалентные линкерные реагенты, которые являются применимыми для присоединения двух или более функциональных или биологически активных фрагментов, таких как пептиды, нуклеиновые кислоты, лекарственные средства, токсины, антитела, гаптены и репортерные группы, являются описаны известны, и были описаны способы получения на их основе конъюгатов (Hermanson, G.T. (1996) Bioconjugate Techniques; Academic Press: New York, p 234-242).
В связи с этим, DLL3 ADC изобретения содержат линкеры, которые являются расщепляемыми по действием расщепляющего средства, которое присутствует во внутриклеточном окружении (например, внутри лизосомы или эндосомы или кавеолы). В случае ADC 1 - 5 линкер содержит пептидильный линкер, который расщепляется внутриклеточным пептидазным или протеазным ферментом, включающим, но не ограниченным перечисленным, лизосомальную или эндосомальную протеазу. В некоторых вариантах осуществления, пептидильный линкер имеет предпочтительно по меньшей мере две аминокислоты по длине или в других вариантах осуществления по меньшей мере три аминокислоты по длине. Расщепляющие средства могут включать катепсины B и D и плазмин, каждый из которых, как известно, гидролизует дипептидные производные лекарственного средства, приводя в результате к высвобождению активного лекарственного средства внутри клеток-мишеней. В раскрытых фрагментах лекарственное средство-линкер DL1-DL5 пептидильный линкер, расщепляемый внутриклеточной протеазой, представляет собой дипептидный фрагмент валин-аланин. Одно преимущество использования внутриклеточного протеолитического высвобождения терапевтического средства состоит в том, что средство обычно ослабляется при конъюгации и стабильности конъюгатов в сыворотке являются обычно высокими.
Кроме расщепляемого ферментом дипептидного блока, каждый из раскрытых линкеров, обнаруживаемых в ADC 1-5 (или DL1-DL5) включает спэйсерный блок, связывающий фрагмент для соединения лекарственное средство-линкер со средством связывания с клеткой, и, по меньшей мере в случае DL4 и DL5, саморасщепляющийся фрагмент, который обеспечивет чистое отсоединение ПБД лекарственного средства при расщеплении линкера. По отношению к саморасщепляющейся группы как DL4, так и DL5 включают одинаковый фрагмент. В этой связи саморасщепляющийся линкер и дипептид вместе образуют группу -NH-Val-Ala-CO-NH-PABC-, которая иллюстрируется ниже:

где звездочка указывает место присоединения к выбранному ПБД цитотоксическому фрагменту, а волнистая линия указывает место присоединения к оставшейся части линкера (например, сегменты, связывания спэйсер-антитело), которые могут быть конъюгированны с антителом. При ферментативном расщеплении дипептида саморасщепляющийся линкер будет обеспечивать чистое высвобождение защищенного соединения (т.е., токсичного ПБД димера), когда удаленный участок активируется, которое протекает вдоль линий, показанных ниже:

где L* является активированной формой оставшейся части линкера, содержащей теперь расщепленный пептидильный блок. Чистое высвобождение ПБД 4 и ПБД 5 гарантирует то, что они будут поддерживать желательную токсическую активность.
Как будет обсуждаться более подробно ниже, и приведено в Примере 7, линкеры лекарственных средств рассматриваемого изобретения будут связаны с реакционноспособными тиольными нуклеофилами. Антитела могут быть получены в реакционноспособном виде для конъюгирования с линкерными реагентами посредством обработки восстановителем, таким как DTT (дитиотреитол). Каждый цистеиновый мостик будет, таким образом, образовывать, теоретически, два реакционноспособных тиольных нуклеофила. В ПАТЕНТЕ США № 7,521,541 изложено конструирование антител посредством введения реакционноспособных цистеиновых аминокислот.
В DL 1, DL 2, DL 3 и DL 5 соединение между средством связывания с клеткой и фрагментом лекарственное средство-линкер происходит посредством тиольного остатка средства связывания с клеткой и терминальной малеимидной группы, присутствующей на линкере. В таких вариантах осуществления, соединение между средством связывания с клеткой и лекарственное средство-линкер представляет собой:

где звездочка указывает место присоединения к оставшейся части фрагмента лекарственное средство-линкер, а волнистая линия указывает место присоединения к оставшейся части средства связывания с клеткой. В данном варианте осуществления, атом S обычно присходит из DLL3 антитела.
По отношению к DL4, связывающий фрагмент содержит терминальный йодацетамид, который может взаимодействовать с активированными тиолами для предоставления желательного ADC 4. Как приведено в Примере 7 ниже, предпочтительная методика конъюгирования для DL4 слегка отличается от предпочтительной методики конъюгирования для малеимидной связывающей группы, обнаруживаемой в других вариантах осуществления. При любом событии квалифицированный специалист в области сможет легко конъюгировать каждое из раскрытых соединений лекарственное средство-линкер с совместимым модулятором DLL3 с учетом данного раскрытия.
2. ПБД соединения
Как обсуждается выше и представлено в Примерах ниже, каждое из раскрытых ПБД соединений (изображенных непосредственно ниже) проявляет цитотоксические свойства, которые делают его потенциальным кандидатом для включения в ADC рассматриваемого изобретения. Синтез каждого из ПБД 1-5 в качестве компонента каждого из DL 1-5, представлен очень подробно в Примере 1 ниже. С учетом настоящего раскрытия токсичные соединения, которые содержат полезные нагрузки в виде ADC настоящего изобретения, могут легко генерироваться и использоваться, как приведено в настоящем документе. ПБД соединения, которые высвобождаются из ADC 1-5 при расщеплении линкера приведены непосредственно ниже:
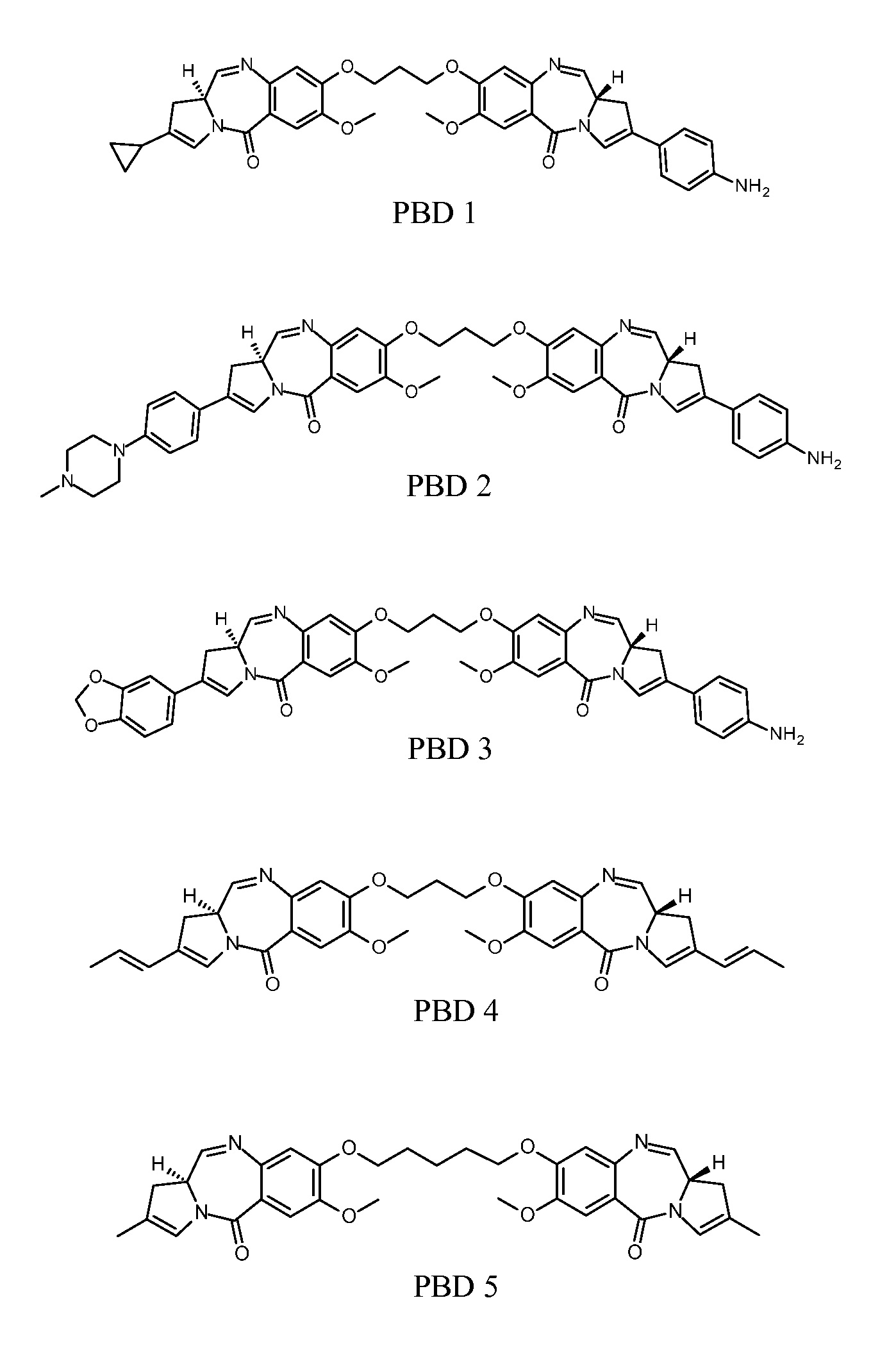
Доставка и высвобождение таких соединений на участке(участках) локализации опухоли могут оказаться клинически эффективными при лечении или пролиферативных нарушений или их управлением в соответствии с настоящим раскрытием. В отношении соединений следует принимать во внимание, что каждый из раскрытых ПБД имеет два sp2 центра в каждом C-кольце, которые могут обеспечить более сильное связывание в малой бороздке ДНК (и, следовательно, более высокую токсичность), чем для соединений только с одним sp2 центром в каждом C-кольце. Таким образом, при использовании в DLL3 ADC, как приведено в данном документе, раскрытые ПБД могут оказаться особенно эффективными для лечения пролиферативных нарушений.
3. Фрагменты лекарственное средство-линкер
В соответствии с изложенным в данном документе, раскрытые ПБД будут комбинироваться с линкерами, как приведено выше, для предоставления соединений типа лекарственное средство-линкер, DL1-DL5, приведенных непосредственно ниже. Подробные протоколы синтеза каждого из раскрытых соединений типа лекарственное средство-линкер приводится в Примере 1 ниже.


В отношении соединений типа лекарственное средство-линкер DL 1-5 следует принимать во внимание, что каждый из DL 1, DL 2, DL 3 и DL 5 содержит терминальную малеимидную группу, которая может применяться для конъюгирования соединений с выбранными DLL3 антителами. Напротив, DL 4 содержит терминальную йодацетамидную группу, которая применяется для конъюгирования полезной нагрузки в виде ПБД для нацеливания антител. Может быть так, что при некоторых условиях применение йодацетамидного фрагмента поможет избежать некоторых нежелательных побочных реакций и обеспечить увеличенную стабильность ADC. Более того, следует принимать во внимание, что DL 4 и DL 5 содержат ПБД, которые связаны с модулятором DLL3 через положение N10 в B-кольце, в то время как DL1, DL2 и DL3 связаны с выбранным антителом через положение C2 в C-кольце. По отношению к соединениям, которые связываются через положение N10, следует дополнительно отметить, что линкеры содержат саморасщепляющийся фрагмент PABC для обеспечения чистого отделения полезной нагрузки. С учетом настоящего изложенного материала, специалист в области сможет легко определить, какое DL (и ассоциированный ADC) мог бы оказаться эффективным для лечения выбранных пролиферативных нарушений.
4. Характеристики соединений
Следующие варианты осуществления и вариации, приведенные непосредственно ниже, являются применимыми к раскрытым ADC, линкерам лекарственных средств и/или ПБД, и явным образом рассматриваются как находящиеся в пределах объема рассматриваемого изобретения.
a. Сольваты
Может оказаться удобным или желательным получать, очищать и/или обрабатывать вручную соответствующий сольват линкера лекарственного средства, ADC или PBD. Термин “сольват” применяют в данном документе в общепринятом смысле для обозначения комплекса растворенного вещества (например, активного соединения, соли активного соединени) и растворителя. Если растворитель является водой, сольват может удобным образом именоваться гидратом, например, моно-гидратом, ди-гидратом, три-гидратом, и т.д.
Изобретение включает соединения, где растворитель присоединяется через иминную связь ПБД фрагмента, что иллюстрируется ниже, где растворитель является водой или спиртом (RAOH, где RA представляет собой C1-4 алкил):

Эти формы могут называться карбиноламинными и карбиноламинэфирными формами ПБД (как описано в разделе, относящемся к R10 выше). Баланс этих равновесий зависит от условий, в которых соединения обнаруживаются, а также от природы самого фрагмент.
b. Изомеры
Нкоторые соединения изобретения могут существовать в одной или более конкретных геометрических, оптических, энаньтиомерных, диастереомерных, эпимерных, атропичных, стереоизомерных, таутомерных, конформационных или аномерных формах, включающих, но не ограничиваясь перечисленным, цис- и транс-формы; E- и Z-формы; c-, t-, и r-формы; эндо- и экзо-формы; R-, S-, и мезо-формы; D- и L-формы; d- и l-формы; (+) и (-) формы; кето-, енол-, и енолят-формы; син- и анти- формы; синклинальные- и антиклинальные-формы; α- и β-формы; аксиальные и экваториальные формы; формы лодки-, кресла-, закрутки, конверта и полукресла; и их комбинации, далее в данном документе обобщенно именуемые как “изомеры” (или “изомерные формы”).
Термин “хиральные” относится к молекулам, которые имеют свойство не совпадать при наложении на партнера зеркального изображения, в то время термин “ахиральный” относится к молекулам, которые являются совпадающими при наложении на их партнера зеркального изображения.
Термин “стереоизомеры” относится к соединениям, которые имеют идентичный химический состав, но различаются по отношению к расположению атомов или групп в пространстве.
“Диастереомер” относится к стереоизомерам с двумя или более центрами хиральности, и молекулы которых не являются зеркальными изображениями друг друга. Диастереомеры имеют различные физические свойства, например, температуры плавления, температуры кипения, спектральные свойства и реакционные способности. Смеси диастереомеров могут быть разделены в условиях аналитических методик с высоким разрешением, таких как электрофорез и хроматография.
“Энантиомеры” относится к двум стереоизомерам соединения, которые являются несовпадающими зеркальными изображениями друг друга.
Стереохимические определения и договоренности, используемые в данном документе, как правило, следуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. и Wilen, S., “Stereochemistry of Organic Compounds”, John Wiley & Sons, Inc., New York, 1994. Соединения изобретения могут содержать асимметрические или хиральные центры, и, следовательно, существовать в различных стереоизомерных формах. Подразумевают, что все стереоизомерные формы соединений изобретения, включающие, но не ограниченные перечисленным, диастереомеры, энантиомеры и атропизомеры, а также их смеси, таки как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способность вращать плоскость плоскополяризованного света. При описании оптически активных соединений, приставки D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы около ее хирального центра(центров). Приставки d и l или (+) и (-) используют для обозначения признака вращения плоскополяризованного света соединением, причем (-) или l означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для данной химической структуры, эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными изображениями друг друга. Специфичный стереоизомер может также именоваться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь 50:50 энантиомеров называют рацемической смесью или рацематом, которая может иметь место там, где в химических реакции или процессе не было стереоселективности или стереоспецифичности. Термины “рацемическая смесь” и “рацемат” относятся к эквамолярной смеси двух энантиомерных видов, лишенных оптической активности.
Следует отметить, что, за исключением обсуждаемых ниже таутомерных форм, специфически исключенными из термина “изомеры”, используемого в данном документе, являются структурные (или составные) изомеры (т.е. изомеры, которые различаются по связям между атомами, а не просто по положению атомов в пространстве). Например, ссылка на метокси-группу, -OCH3, не должна интерпретироваться как ссылка на ее структурный изомер, гидроксиметильную группу, -CH2OH. Аналогично, ссылка на орто-хлорфенил не должна интерпретироваться как ссылка на его структурный изомер, мета-хлорфенил. Однако, ссылка на класс структур может в полной мере включать структурно изомерные формы, попадающие в предел этого класса (например, C1-7 алкил включает н-пропил и изо-пропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и пара-метоксифенил).
Приведенное выше исключение не относится к таутомерным формам, например, кето-, енольным- и енолятным-формам, как, например, в следующих таутомерных парах: кето/енол (иллюстрируется ниже), имин/енамин, амид/имино спирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/аци-нитро.

Термин “таутомер” или “таутомерная форма” относится к структурным изомерам с различными энергиями, которые являются взаимопревращаемыми через низкоэнергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимные превращения посредством миграции протона, такие как кето-енольная и имин-енаминовая изомеризации. Валентные таутомеры включают взаимные превращения посредством реорганизации некоторых из связывающих электронов.
Следует отметить, что особенным образом включенными в термин “изомер” являются соединения с одной или более изотопных замен. Например, H может находиться в любой изотопной форме, включая 1H, 2H (D) и 3H (T); C может находиться в любой изотопной форме, включая 12C, 13C, и 14C; O может находиться в любой изотопной форме, включая 16O и 18O; и т.п.
Примеры изотопов, которые могут быть включены в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как, но не ограниченные перечисленным 2H (дейтерий, D), 3H (тритий), 11C, 13C, 14C, 15N, 18F, 31P, 32P, 35S, 36Cl и 125I. Различными изотопно мечеными соединениями настоящего изобретения, являются, например, те соединения, в которые вводят радиоактивные изотопы, такие как 3H, 13C, и 14C. Такие изотопно меченые соединения могут быть применимыми в метаболических исследованиях, исследованиях кинетики реакций, методах обнаружения или визуализации, таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая аналитические тесты на распределение лекарственных средств или субстрата в тканях, или при лечении пациентов радиоактивными изотопами. Меченые или замещенные дейтерием терапевтические соединения изобретения могут иметь улучшенные свойства DMPK (метаболизма и фармакокинетики лекарственного средства), относящиеся к распределению, метаболизму и выделению (ADME). Замещение более тяжелыми изотопами, такими как дейтерий, могут дать некоторые терпевтические преимущества, являющиеся результатом более высокой метаболической стабильностью, например увеличенным временем полужизни in vivo или сниженными требованиями к дозировке. 18F-меченые соединени могут быть применимыми для исследований методами ПЭТ или ОФЭКТ. Изотопно меченые соединения данного изобретения и их пролекарства обычно могут быть получены посредством выполнения методик, раскрытых в схемах или в примерах и методиках, описанных ниже, при замене легкодоступным изотопно меченым реагентом неизотопно меченого реагента. Дополнительно, замещение более тяжелыми изотопами, в частности, дейтерием (т.е., 2H или D) могуть дать некоторые терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например, увеличенного времени полужизни in vivo или сниженных требований к дозировке или улучшения терапевтического индекса. Понимают, что такой дейтерий в данном контексте считается заместителем. Концентрация такого более тяжелого изотопа, особенно дейтерия, может быть определена посредством фактора изотопного обогащения. В соединениях данного изобретения любой атом, особым образом не обозначенный как конкретный изотоп означает представление любого стабильного изотопа данного атома.
Если не указано иначе, ссылка на конкретное соединение включает все такие изомерные формы, включающие (полностью или частично) их рацемические и другие смеси. Способы получения (например, асимметрический синтез) и разделения (например, фракционная кристаллизация и хроматографические средства) таких изомерных форм являются либо известными в области или легко получают посредством адаптации способов изложенных в данном документе, или известных способов известным образом.
5. Конъюгаты и загрузка лекарственного средства
Как обсуждается выше, следующие конъюгаты антител с лекарственными средствами предоставлены рассматриваемым изобретением:
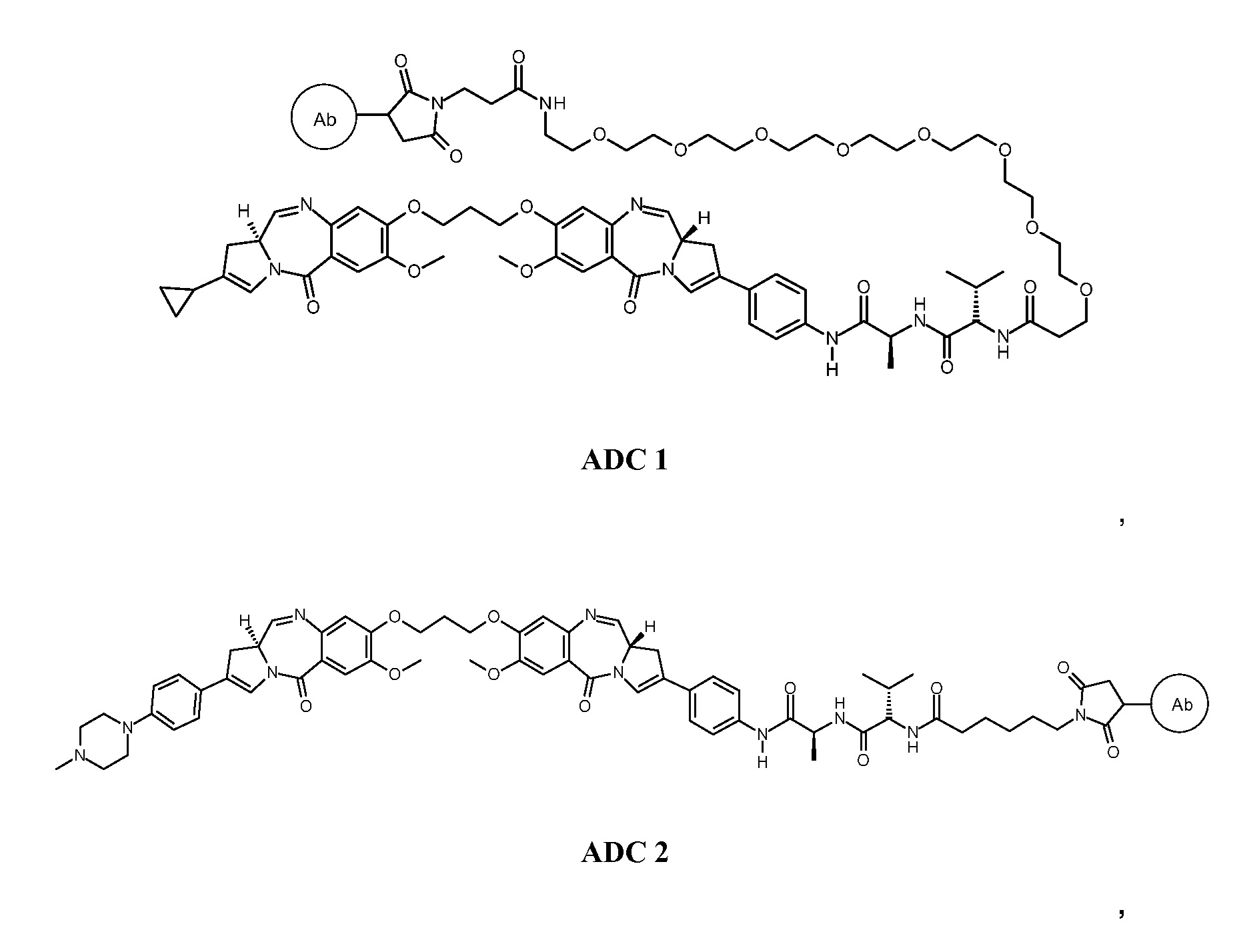


Как только модуляторы и соединения лекарственное средство-линкер изобретения генерируют и/или изготавливают и отбирают в соответвии с изложенным в данном документе, они могут быть связаны или конъюгированы для предоставления раскрытых ADC. Как используют в данном описании, термины “конъюгат” или “модуляторный конъюгат” или “конъюгат антитела” или “Конъюгат DLL3” или “ADC” будут применяться взаимозаменяемо и поддерживать значение любого из ADC 1, ADC 2, ADC 3, ADC 4 или ADC 5. Методы, принятые в данной области, могут применяться для конъюгирования выбранных антител и соединений лекарственное средство-линкер для предоставления желательного ADC. Предпочтительные способы конъюгирования приведены в Примере 7 ниже. Более того, посредством варьирования условий конъюгирования, известных в области или выбора конкретных конструкций антител, ADC, проявляющие различные стехиометрические молярные отношения лекарственного средства к антителу, могут генерироваться и очевидно находиться в пределах рассматриваемого изобретения.
В более общем случае специалисты в данной области смогут оценть, что ряд различных реакций является доступным для присоединения или ассоциации раскрытых соединений лекарственное средство-линкер к DLL3-связывающим средствам. Посредством Примера, нуклеофильные группы на антителах включают, но не ограничиваются перечисленным, боковую цепь тиольной группы, например, цистеин. Тиольные группы являются нуклеофильными и способны к взаимодействию с образованием ковалентных связей с электрофильными группами на линкерных фрагментах, таких как линкерные фрагменты настоящего изобретения. Предпочтительные антитела рассматриваемого изобретения будут иметь восстанавливаемые межцепные дисульфиды, т.е. цистеиновые мостики, обеспечивающие такие нуклеофильные группы. Таким образом, в некоторых вариантах осуществления реакция свободной сульфгидрильной группы модуляторных цистеинов и терминальной малеимидо или йодацетамидгруппы раскрытых соединений лекарственное средство-линкер будет обеспечивать желательное конъюгирование. В таких случаях антитела могут быть получены в реакционноспособном виде для конъюгирования с линкерными реагентами посредством обработки восстановителем, таким как дитиотреитол (DTT) или (трис-(2-карбоксиэтил)фосфин (TCEP). Каждый цистеиновый дисульфидный мостик, будет, таким образом, образовывать, теоретически, два реакционноспосбных тиольных нуклеофила. В других вариантах осуществления дополнительные нуклеофильные группы могут быть введены в антитела через реакцию лизинов с реагентами, включающими, но не ограниченными перечисленными, 2-иминотиолан (реагент Траута), SATA, SATP или SAT(PEG)4, приводящую в результате к превращению амина в тиол. В то время, как такие реагенты являются предпочтительными, следует принимать во внимание, что на конъюгирование раскрытых соединений лекарственное средство-линкер и DLL3 модуляторов могут оказывать воздействие различные реакции, условия и реагенты, известные специалистам в данной области, которые обеспечивают ковалентное связывание нуклеофильной группы антитела или средства связывания с клеткой с реагентом лекарственное средство-линкер. Как указано, особенно предпочтительные способы приведены более подробно в Примере 7 ниже.
ADC и композиции ADC изобретения могут содержать фрагменты лекарственного средства и антитела в рзличных стехиометрических молярных отношениях, зависящих, по меньшей мере частично, от метода, применяемого для воздействия на конъюгирование. Как используют в данном документе стехиометрические молярные отношения определяют с позиций “Отношения лекарственного средства к антителу,” “DAR” или “нагрузка лекарственным средством.” Другими словами, нагрузка лекарственным средством или DAR представляет собой средневзвешенное значение ПБД лекарственных средств на средство связывания с клеткой, например, антитело в композиции. Там, где ПБД соединения изобретения являются конъюгированными с природными цистеинами в IgG1, нагрузка лекарственным средством может находиться в интервале от 1 до 8 лекарственных средств на средство связывания с клеткой, т.е., где 1, 2, 3, 4, 5, 6, 7, или 8 фрагментов лекарственного средства ковалентно присоединены к каждому средству связывания с клеткой. Предпочтительно DAR композиций рассматриваемого изобретения будет равно приблизительно 2, 4 или 6 и, в особенно предпочтительных вариантах осуществления, DAR будет равно приблизительно 2.
Более конкретно, конъюгат композиции настоящего изобретения содержит средства связывания с клеткой, например, антитела, конъюгированные с рядом ПБД соединений, от 1 до 8 (в случае IgG1). Сами по себе, раскрытые композиции конъюгатов антител с лекарственными средствами включают смеси соединений конъюгатов антител с лекарственными средствами, где большинство составляющих антител являются ковалентно связанными с одним или более фрагментами ПБД лекарственных средств, и, где фрагменты лекарственных средств могут присоединяться к антителам по различным аминокислотным остаткам. Таким образом, после конъюгирования ADC композиции изобретения будут содержать смесь Конъюгат DLL3ов с различными нагрузками лекарственных средств (например, от 1 до 8 лекарственных средств на IgG1 антитело) при различных концентрациях. Применяя селективные условия конъюгирования и методы очистки композиции конъюгатов могут быть направлены к точке, где они, в основном, содержат единственный преобладающий желательный вид ADC (например, с нагрузкой лекарственным средством, равной 2) с относительно низкими уровнями других видов ADC (например, с нагрузкой лекарственным средством, равной 1, 4, 6, и т.д.). Значение DAR представляет спедневзвешенное значение нагрузки лекарственным средством для композиции в целом, (т.е., всех видов ADC, взятых вместе). Вследствие присущей неопределенности используемой методологии количественной оценки и трудности при полном удалении непреобладающих видов ADC в промышленном масштабе, приемлемые значения DAR или спецификации часто представляют в виде интервала или распределения (т.е., DAR равно 2 +/- 0,5). Предпочтительно, композиции, содержащие измеренное DAR в пределах интервала (т.е., от 1,5 до 2,5) будут применяться в фармацевтической установке.
Таким образом, в некоторых предпочтительных вариантах осуществления настоящее изобретение будет включать композиции, имеющие DAR, равное 1, 2, 3, 4, 5, 6, 7 или 8, каждое +/- 0,4. В других предпочтительных вариантах осуществления настоящее изобретение будет включать DAR, равное 2, 4, 6 или 8 +/- 0,4. Окончательно, в выбранных предпочтительных вариантах осуществления настоящее изобретение будет включать DAR, равное 2 +/- 0,4. Следует принимать во внимание, что интервал или отклонение могут быть меньше, чем 0,4 в некоторых предпочтительных вариантах осуществления. Таким образом, в других вариантах осуществления композиции будут включать DAR, равное 1, 2, 3, 4, 5, 6, 7 или 8, каждое +/- 0,3, DAR, равное 2, 4, 6 или 8 +/- 0,3 или, даже более предпочтительно, DAR, равное 2 +/- 0,3. В других вариантах осуществления композиции конъюгатов IgG1 будут предпочтительно содержать композицию с DAR, равным 1, 2, 3, 4, 5, 6, 7 или 8, каждое +/- 0,4 и относительно низкими уровнями (т.е., меньше, чем 30%) непреобладающих видов ADC. В других предпочтительных вариантах осуществления композиция ADC будет иметь DAR, равное 2, 4, 6 или 8, каждое +/- 0,4, с относительно низкими уровнями (<30%) непреобладающих видов ADC. В особенно предпочтительных вариантах осуществления композиция ADC будет иметь DAR, равное 2 +/- 0,4 с относительно низкими уровнями (<30%) непреобладающих видов ADC.
Распределение лекарственных средств на антителах в препаратах ADC от реакций конъюгирования может характеризоваться общепринятыми средствами, такими как УФ, обращено-фазовая ВЭЖХ, ГВХ, масс-спектроскопия, анализ ELISA и электрофорез. Количественное распределение ADC с позиций лекарственных средств на антитело может также быть определено. Посредством ELISA, может быть определено усредненное значение лекарственных средств на антитело в конкретном прпарате ADC (Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070; Sanderson et al (2005) Clin. Cancer Res. 11:843-852). Однако, значения распределения лекарственного средства на антителе не являются различимыми посредством связывания антитело-антиген и ограничением обнаружения ELISA. Анализ ELISA для обнаружения конъюгатов антитело-лекарственное средство также не определяет участки, где фрагменты лекарственного средств присоединяются к антителу, такие как, фрагменты тяжелой цепи или легкой цепи, или конкретные аминокислотные остатки. В некоторых случаях, разделение, очистка и характеризация гомогенных ADC, где DAR имеет некоторое хорошо определенное значение от ADC с другими нагрузками лекарственным средством, могут достигаться средствами, такими как обращено-фазовая ВЭЖХ или элекрофорез. Такие методы также применимы к другим типам конъюгатов.
Там, где более одной нуклеофильных или электрофильных групп антитела взаимодействует с промежуточным соединением лекарственное средство-линкер, или линкерным реагентом с последующим реагентом фрагмента лекарственного средства, полученный затем в результате продукт представляет собой смесь соединений ADC с распределением фрагментов лекарственного средства, присоединенных к антителу, например, 1, 2, 3, и т.д. Методы жидкостной хроматографии, таки как хроматография с полимерной обращенной фазой (PLRP) и хроматография гидрофобного взаимодействия (ГВХ) могут разделять соединения в смеси по значению нагрузки лекарственным средством. Препараты ADC со значением нагрузки единственным лекарственным средством могут быть выделены, однако, эти ADC с единичным значением нагрузки могут все еще содержать гетерогенные смеси, вследствие того, что фрагменты лекарственного средства могут быть присоединены, через линкер, к различным участкам на антителе.
Для некоторых конъюгатов антитело-лекарственное средство, число нагрузок лекарственным средством может ограничиваться числом участков присоединения на антителе. Например, антитело может иметь только одну или несколько цистеиновых тиольных групп, или может иметь только одну или несколько достаточно реакционноспособных тиольных групп, через которые линкер может присоединяться. Более высокая нагрузка лекарственным средством, например, >5, может вызвать агрегацию, нерастворимость, токсичность или потерю клеточной проницаемости у некоторых конъюгатов антитело-лекарственное средство.
Обычно, менее теоретического максимума фрагментов лекарственного средства конъюгируются с антителами во время реакции конъюгирования. Антитела могут содержать, например, много остатков лизина, которые не взаимодействуют с промежуточным соединением лекарственное средство-линкер или линкерным реагентом. Только наиболее реакционноспособные лизиновые группы могут взаимодействовать с амин-реакционноспособным линкерным реагентом. Также, только наиболее реакционноспособные цистеиновые тиольные группы могут взаимодействовать с тиол-реакционноспособным линкерным реагентом. Как правило, антитела не содержат много, если вообще содержат, свободных и реакционноспособных цистеиновых тиольных групп, которые могут быть связаны с фрагментом лекарственного средства. Большинство цистеиновых тиольных остатков в соединениях антител существуют в виде дисульфидных мостиков, и должны быть восстановлены восстановителем, таким как дитиотреитол (DTT) или TCEP, в условиях частичного или полного восстановления. Нагрузка (отношение лекарственное средство/антитело) в ADC может контролироваться несколькими различными способами, включающими: (i) ограничение молярного избытка промежуточного соединения лекарственное средство-линкер или линкерного реагента относительно антитела, (ii) ограничение времени или температуры реакции конъюгирования, и (iii) частичные или ограничивающие восстановительные условия для модификации цистеинового тиола.
Следует дополнительно принимать во внимание, что реакционноспособные тиольные группы могут быть введены в антитело (или его фрагмент) посредством конструирования одного, двух, трех, четырех или более цистеиновых остатков (например, получения мутантных антител, содержащих один или более ненативных цистеиновых аминокислотных остатков). Таким образом, цистеиновые аминокислоты могут быть сконструированы на реакционноспособных участках в антителе, и они не образуют внутрицепных или межмолекулярных дисульфидных связей (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO2009/052249). Сконструированные цистеиновые тиолы могут реагировать с линкерными реагентами или реагентами типа лекарственное средство-линкер настоящего изобретения, которые имеют тиол-реакционноспособные, электрофильные группы, такие как малеимид или альфа-йодамиды, с образованием ADC с антителами с конструированным цистеином и фрагментами ПБД лекарственного средства. Расположение фрагмента лекарственного средства может, таким образом, проектироваться, управляться и быть известным. Нагрузка лекарственным средством может управляться, так как сконструированные цистеиновые тиольные группы обычно взаимодействуют с тиол-реакционноспособными линкерными реагентами или реагентами типа лекарственное средство-линкер с высоким выходом. Конструирование IgG антитела для введения цистеиновой аминокислоты посредством замены на единственном участке на тяжелой или легкой цепи дает два новых цистеина на симметричном антителе. Нагрузка лекарственным средством около 2 может достигаться почти с гомогенностью продукта конъюгирования ADC.
VI. Фармацевтические препараты и терапевтические применения
1. Лекарственные формы и пути введения
В зависимости от формы выбранного конъюгата, способа предполагаемой доставки, заболевания, подвергаемого лечению или реистрируемого, и многочисленных других переменных, композиции изобретения могут быть составлены желательным образом с использованием методов, признанных в данной области. В некоторых вариантах осуществления, терапевтические композиции изобретения могут вводиться в чистом виде или с минимальным количеством дополнительных компонентов, в то время как другие композиции могут необязательно составляться, чтобы содержать подходящие фармацевтически приемлемые носители, содержащие эксципиенты и вспомогательные вещества, которые являются хорошо известными в области (см., например, Gennaro, Remington: Science and Practice of Pharmacy with Facts и Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Доставк Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Различные фармацевтически приемлемые носители, которые включают основы, адъюванты и разбавители, являются легко доступными из многочисленных промышленных источников. Более того, ассортимент фармацевтически приемлемых вспомогательных веществ, таких как регулирующие pH и буферные средства, регулирующие тоничность средства, стабилизаторы, увлажняющие средства и т.п., также являются доступными. Некоторые неограничивающие иллюстративные носители включают физраствор, забуференный физраствор, декстрозу, воду, глицерин, этанол и их комбинации.
Более конкретно, следует принимать во внимание, что, в некоторых вариантах осуществления, терапевтические композиции изобретения могут вводиться в чистом виде или с минимальным количеством дополнительных компонентов. Напротив, DLL3 ADC настоящего изобретения могут необязательно составляться, чтобы содержать подходящие фармацевтически приемлемые носители, содержащие эксципиенты и вспомогательные вещества, которые являются хорошо известными в данной области и являются относительно инертными веществами, которые облегчают введение конъюгата, или которые способствуют переработке активных соединений в препараты, которые фармацевтически оптимизируют для доставки к участку действия. Например, эксципиент может придавать форму или консистенцию или действовать в качестве разбавителя для улучшения фармакокинетики или стабильности ADC. Подходящие эксципиенты или добавки включают, но не ограничиваются перечисленным, стабилизирующие средства, увлажняющие и эмульгирующие средства, соли для изменения осмолярности, инкапсулирующие средства, буферы, и средства, облегчающие проникновение через кожу. В некоторых предпочтительных вариантах осуществления фармацевтические композиции могут быть предоставлены в лиофилизированной форме и восстановлены, например, в забуференном физрастворе перед введеним. Такие восстановленные композиции предпочтительно вводят внутривенно.
Раскрытые ADC для системного введения могут быть составлены для энтерального, парентерального или местного введения. Несомненно, все три типа лекарственной формы могут применяться одновременно для достижения системного введения активного ингредиента. Эксципиенты, а также лекарственные формы для парентеральной и непарентеральной доставки лекарственного средства приведены in Remington, Science и Practice of Pharmacy 20th Ed. Mack Publishing (2000). Подходящие лекарственные формы для парентерального введения включают водные растворы активного соединения в водорастворимой форме, например, водорастворимых солей. В дополнение, могут вводиться суспензии активных соединений по необходимости для масляных инъекционных суспензий. Подходящие липофильные растворители или основы включают жирные масла, например, гексилзамещенный поли(лактид), кунжутное масло или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, и включают, например, натриевую карбоксиметилцеллюлозу, сорбит и/или декстран. Необязательно, суспензия может также содержать стабилизаторы. Липосомы также могут применяться для инкапсулирования средства для доставки в клетку.
Подходящие лекарственные формы для энтерального введения включают твердые или мягкие желатиновые капсулы, пилюли, таблетки, включая покрытые таблетки, эликсиры, суспензии, сиропы или ингаляции и их формы с управляемым высвобождением.
Лекарственные формы, подходящие для парентерального введения (например, посредством инъекции), включают водные или неводные, изотоничные, апирогенные, стерильные жидкости (например, растворы, суспензии), в которых активный ингредиент растворен, суспендирован или предоставлен иным образом (например, в липосоме или другой форме микрочастиц). Такие жидкости могут дополнительно содержать другие фармацевтически приемлемые ингредиенты, таки как антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатики, суспендирующие средства, загущающие средства, и растворимые вещества, которые придают лекарственной форме изотоничность с кровью (или другой уместной жидкой средой организма) предназначенного реципиента. Примеры эксципиентов включают, например, воду, спирты, полиолы, глицерин, растительные масла и т.п. Примеры подходящих изотоничных носителей для применения в таких лекарственных формах включают инъекционный раствор хлорида натрия, раствор Рингера или инъекционный раствор Рингера с лактатом.
Совместимые лекарственные формы для парентерального введения (например, внутривенной инъекции) будут содержать концентрации ADC от приблизительно 10 мкг/мл до приблизительно 100 мг/мл. В ненкоторых избранных вариантах осуществления концентрации ADC будут составлять 20 мкг/мл, 40 мкг/мл, 60 мкг/мл, 80 мкг/мл, 100 мкг/мл, 200 мкг/мл, 300, мкг/мл, 400 мкг/мл, 500 мкг/мл, 600 мкг/мл, 700 мкг/мл, 800 мкг/мл, 900 мкг/мл или 1 мг/мл. В других предпочтительных вариантах осуществления концентрации ADC будут составлять 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 8 мг/мл, 10 мг/мл, 12 мг/мл, 14 мг/мл, 16 мг/мл, 18 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл или 100 мг/мл.
Как правило, соединения и композиции изобретения, содержащие DLL3 ADC, могут вводиться in vivo субъекту, нуждающемуся в таком лечении, посредством различных путей, включающих, но не ограниченных перечисленным, пероральный, внутривенный, внутриартериальный, подкожный, парентеральный, интраназальный, внутримышечный, внутричерепной, внутрисердечный, внутрижелудочковый, внутритрахеальный, буккальный, ректальный, внутрибрюшинный, внутрикожный, местный, чрескожный и интратекальный, или иным образом посредством имплантации или ингаляции. Субъектные композиции могут быть составлены в препараты в твердой, полутвердой, жидкой или газообразной формах; включающих, но не ограниченных перечисленным, таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, клизмы, инъекции, средства для ингаляции и аэрозоли. Соответствующая лекарственная форма и путь введения могут быть выбраны согласно предполагаемому применению и терапевтическому режиму. В особенно предпочтительных вариантах осуществления соединения рассматриваемого изобретения будут доставляться внутривенно.
2. Дозировки
Аналогично, конкретный режим дозирования, т.е., доза, временная последовательность и повтор, будет зависеть от конкретного индивидуума и его индивидуальной истории болезни, а также эмпирических учитываемых факторов, таких как фармакокинетика (например, время полужизни, скорость выведения, и т.д.). Частота введения может быть определена и регулирована в течение курса терапии, и основана на снижении числа пролиферативных или онкогенных клеток, поддерживающих снижение таких неопластических клеток, снижая пролиферацию неопластических клеток, или задерживая развитие метастазирования. В других вариантах осуществления вводимая дозировка может регулироваться или ослабляться для контроля потенциальных побочных эффектов и/или токсичности. Альтернативно, могут подходить лекарственные формы с пролонгированным непрерывным высвобождением субъектной терапевтической композиции.
Специалист в данной области сможет понять, что соответствующие дозировки конъюгатных соединений, и композиций, содержащих конъюгатные соединение, могут варьировать от пациента к пациенту. Определение оптимальной дозировки будет, как правило, включать в себя уравновешивание уровня терапевтического благоприятного эффекта против любого риска или вредных побочных эффектов. Выбранный уровень дозировки будет зависеть от различных факторов, включающих, но не ограниченных перечисленным, активность конкретного соединения, путь введения, время введения, скорость выведения соединения, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, используемые в комбинации, тяжесть состояния, и принадлежность, пол, возраст, масса тела, состояние, общее здоровье, и предшествующая история болезни пациента. Количество соединения и путь введения будут, в конечном счете, приняты по усмотрению терапевта, ветеринара или клинициста, несмотря на то, что, в целом, дозировка будет выбрана, чтобы достигнуть местной концентрации на месте действия, которая достигает желательного эффекта, не вызывая значительных вредных или неблагоприятных побочных эффектов.
В общем случае, ADC изобретения могут вводиться в различных интервалах. Интервалы включают приблизительно от 5 мкг/кг массы тела до приблизительно 100 мг/кг массы тела на дозу; приблизительно от 50 мкг/кг массы тела до приблизительно 5 мг/кг массы тела на дозу; приблизительно от 100 мкг/кг массы тела до приблизительно 10 мг/кг массы тела на дозу. Другие интервалы включают приблизительно от 100 мкг/кг массы тела до приблизительно 20 мг/кг массы тела на дозу и приблизительно от 0,5 мг/кг массы тела до приблизительно 20 мг/кг массы тела на дозу. В некоторых вариантах осуществления, дозировка составляет по меньшей мере приблизительно 100 мкг/кг массы тела, по меньшей мере приблизительно 250 мкг/кг массы тела, по меньшей мере приблизительно 750 мкг/кг массы тела, по меньшей мере приблизительно 3 мг/кг массы тела, по меньшей мере приблизительно 5 мг/кг массы тела, по меньшей мере приблизительно 10 мг/кг массы тела.
В избранных вариантах осуществления ADC будут вводиться (предпочтительно, внутривенно) при приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мкг/кг массы тела на дозу. Другие варианты осуществления будут включать введение ADC при приблизительно 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 мкг/кг массы тела на дозу. В других предпочтительных вариантах осуществления раскрытые конъюгаты будут вводиться при 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,58, 9 или 10 мг/кг. В еще других вариантах осуществления конъюгаты могут вводиться при 12, 14, 16, 18 или 20 мг/кг массы тела на дозу. В еще других вариантах осуществления конъюгаты могут вводиться при 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90 или 100 мг/кг массы тела на дозу. Применяя основные положения данного описания, специалист в данной области сможет легко определить соответствующие дозировки для различных ADC, на основе доклинических исследованиях на животных, клинических наблюдений и стандартных медицинских и биохимических методов и измерениях. В особенно предпочтительных вариантах осуществления такие дозировки Конъюгат DLL3а будут вводиться внутривенно в течение периода времени. Более того, такие дозировки могут вводиться множество раз в течение заданного курса лечения.
Другие режимы дозирования могут быть основаны на расчетах Площади Поверхности Тела (BSA), как раскрыто в ПАТЕНТЕ США № 7,744,877. Хорошо известно, что BSA рассчитывают, используя рост и массу тела пациента, и это прараметр предоставляет меру размера субъекта, представленную площадью поверхности его или ее или тела. В некоторых вариантах осуществления, конъюгаты могут вводиться при дозировках от 1 мг/м2 до 800 мг/м2, от 50 мг/м2 до 500 мг/м2 и при дозировках, равных 100 мг/м2, 150 мг/м2, 200 мг/м2, 250 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2 или 450 мг/м2. Следует также учитывать, что признанные в области и эмпирические методы могут применяться для определения соответствующей дозировки.
При любом событии, DLL3 ADC предпочтительно вводят по необходимости субъектам, нуждающимся в таком введении. Определение частоты введения может быть проведено специалистами в данной области, такими как лечащий врач, на основе параметров состояния, подвергаемого лечению, возраста субъекта, подвергаемого лечению, тяжести состояния, подвергаемого лечению, общего состояния здоровья субъекта, подвергаемого лечению, и т.п. В целом, эффективная доза Конъюгат DLL3а вводится субъекту один или более раз. Более конкретно, эффективную дозу ADC вводят субъекту один раз в месяц, более одного раза в месяц, или менее одного раза в месяц. В некоторых вариантах осуществления, эффективная доза DLL3 ADC может вводиться множество раз, включая периоды, составляющие по меньшей мере месяц, по меньшей мере шесть месяцев, по меньшей мере год, по меньшей мере два года или период в несколько лет. В еще других вариантах осуществления, несколько дней (2, 3, 4, 5, 6 или 7), несколько недель (1, 2, 3, 4, 5, 6, 7 или 8) или несколько месяцев (1, 2, 3, 4, 5, 6, 7 или 8) или даже год или несколько лет могут проходить между введением раскрытых модуляторов.
В некоторых предпочтительных вариантах осуществления курс лечения, включающий конъюгированные модуляторы будет включать множество доз, выбранного продукта лекарственного средства в течение периода, равного неделям или месяцам. Более конкретно, конъюгированные модуляторы рассматриваемого изобретения могут водиться один раз каждый день, каждые два дня, каждые четыре дня, каждую неделю, каждые десять дней, каждые две недели, каждые три недели, каждый месяц, каждые шесть недель, каждые два месяца, каждые десять недель или каждые три месяца. В данной связи следует принимать во внимание, что дозировки могут изменяться или интервал может регулироваться на основании ответной реакции пациента и клинической практики.
Дозировки и режимы могут также определяться эмпирически для раскрытых терапевтических композиций у индивидуумов, которые получали одно или более введений. Например, индивидуумы могут получать инкрементные дозировки терапевтической композиции, полученной, как описано в данном документе. В избранных вариантах осуществления дозировка может постепенно увеличиваться или снижаться или ослабляться, на основе, соответственно, эмпирически определяемых или наблюдемых побочных эффектов или токсичности. Чтобы оценить эффективность действия выбранной композиции, можно использовать маркер конкретного заболевания, расстройства или состояния, как описано ранее. Для злокачественного новообразования, такие действия включают непосредственные измерения размера опухоли пальпацией или визуальным наблюдением, косвенные измерения размера опухоли при рентгеновском исследовании или другими методами визуализации; улучшение по оценке прямой биопсией опухоли и микроскопическим исследованием образца опухоли; измерение косвенного опухолевого маркера (например, PSA для рака простаты) или туморогенного антигена, идентифицированного согласно способам, описанным в данном документе, уменьшение боли или паралича; улучшенная речь, зрение, дыхание или другого ограничения жизнедеятельности, ассоциированного с опухолью; увеличенный аппетит; или улучшения качества жизни, по измерениям посредством принятых тестов, или продолжительности выживаемости. Для специалиста в области будет очевидным, что такая дозировка будет изменяться в зависимости от индивидуума, типа неопластического состояния, стадии неопластического состояния, в случае, если неопластическое состояние начало метастазировать к другому участку организма у индивидуума, и применялись прошедшие и одновременные курсы лечения.
3. Комбинированные терапии
В соответствии с рассматриваемым изобретением комбинированные терапии могут быть особенно применимыми при снижении или ингибировании пролиферации нежелательных неопластических клеток, снижении частоты наступления злокачественного новообразования, уменьшении вероятности или предотвращении повторного проявления злокачественного новообразования, или уменьшении вероятности или предотвращении распространения или метастазирования злокачественного новообразования. В таких случаях ADC рассматриваемого изобретения может функционировать в качестве сенсибилизирующих или химиосенсибилизирующих средств посредством удаления CSC, которые иначе смогли бы поддерживать и сохранять массу опухоли, и таким образом, обеспечивать более эффективное применение современного стандарта терапии с использованием циторедуктивной операции или противоопухолевого средства. То есть, раскрытые ADC могут, в некоторых вариантах осуществления обеспечить усиленное воздействие (например, аддитивное или синергистическое по природе), которое потенцирует способ действия еще одного введенного терпевтического средства. В контексте рассматриваемого изобретения “комбинированная терапия” должна широко интерпретироваться, и просто относится к введению DLL3 ADC и одного или более противоопухолевых средств, которые включают, но не ограничиваются перечисленным, цитотоксические средства, цитотостатические средства, анти-ангиогенные средства, циторедуктивные средства, химиотерапевтические средства, лучевую терапию и радиотерапевтические средства, противоопухолевые средства целевого назначения (включающие как моноклональные антитела, так и низкомолекулярные объекты), BRM, терапевтические антитела, противораковые вакцины, цитокины, гормональные терапии, лучевую терапию и анти-метастатические средства и иммунотерапевтические средства, включая как специфические, так и неспецифические подходы.
Для комбинированных результатов не существует требований к аддитивности наблюдаемых эффектов, когда каждый вид лечения (например, ADC и противоопухолевые средств) проводится отдельно. Несмотря на то, что по меньшей мере аддитивные эффекты, в целом, являются желательными любой увеличенный противоопухолевый эффект, превосходящий эффект одной из одиночных терапий, является благоприятным. Кроме того, по изобретению не требуется комбинированного лечения для проявления синергистических эффектов. Однако, специалисты в данной области смогут оценить, что с некоторыми выбранными комбинациями, которые включают предпочтительные варианты осуществления, может наблюдаться синергизм.
При практической реализации комбинированной терапии, Конъюгат DLL3 и противоопухолевое средство могут вводиться субъекту одновременно, либо в виде единственной композиции, или в виде двух или более различных композиций, с использованием одинаковых или различных путей введения. Альтернативно, ADC могут предшествовать лечению или следовать за лечением противоопухолевым средством, например, с интервалами в интервале от минут до недель. Период времени между каждой доставкой является таким, что противоопухолевое средство и конъюгат способны проявлять комбинированное воздействие на опухоль. В по меньшей мере одном варианте осуществления, как противоопухолевое средство, так и ADC вводят в пределах от приблизительно 5 минут до приблизительно двух недель друг от друга. В еще других вариантах осуществления, несколько дней (2, 3, 4, 5, 6 или 7), несколько недель (1, 2, 3, 4, 5, 6, 7 или 8) или несколько месяцев (1, 2, 3, 4, 5, 6, 7 или 8) может проходить между введением DLL3 ADC и противоопухолевым средством.
Комбинированная терапия может вводиться однократно, дважды или по меньшей мере в течение периода времени, достаточного для лечения, облегчения или излечения состояния. В некоторых вариантах осуществления, комбинированная терапия вводится множество раз, например, от трех раз ежедневно до одного раза каждые шесть месяцев. Введение может проводиться в режиме, таком как три раза ежедневно, дважды ежедневно, один раз ежедневно, один раз каждые два дня, один раз каждые три дня, один раз еженедельно, один раз каждые две недели, один раз каждый месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые шесть месяцев или может проводиться непрерывно посредством мининасоса. Комбинированная терапия может вводиться посредством любого пути, как отмечалось ранее. Комбинированная терапия может вводиться на участке, удаленном от участка локализации опухоли.
В одном варианте осуществления ADC вводят в комбинации с одним или более противоопухолевыми средствами в течение короткого цикла лечения субъекту, нуждающемуся в таком лечении. Изобретение также предусматривает периодическое введение или ежедневными дозами, разделенными на несколько частичных введений. Конъюгат и противоопухолевое средство могут вводиться взаимозаменяемо, по чредующимся дням или неделям; или может предоставляться последовательность лечения антителами, сопровождаемых одним или более курсами лечения с использованием терапии противоопухолевым средством. При любом событии, как будет понятно рядовым специалистам в области, соответствующие дозы химиотерапевтических средств и раскрытых конъюгатов будут, как правило, приблизительно равны дозам, уже используемым в клинических терапиях, где химиотерапевтические средства вводят по отдельности или в комбинации с другими химиотерапевтическими средствами.
В еще одном другом предпочтительном варианте осуществления Конъюгат DLL3ы рассматриваемого изобретения могут применяться при поддерживающей терапии, чтобы уменьшить или исключить вероятность повторного проявления опухоли после первоначального проявления заболевания. Предпочтительно, расстройство будет подвергаться лечению, и первоначальная масса опухоли будет устраняться, снижаться или иным образом уменьшаться, так, чтобы пациент был асимптоматичен или находился в ремиссии. В такое время субъекту могут вводиться фармацевтически эффективные количества раскрытых Конъюгат DLL3ов один или более раз, даже, несмотря на то, что существует небольшое или не существует вообще указание на заболевание, с использованием стандартных диагностических процедур. В некоторых вариантах осуществления, ADC будут вводиться при регулярном режиме в течение периода времени, такого как еженедельно, каждые две недели, ежемесячно, каждые шесть недель, каждые два месяца, каждые три месяца, каждые шесть месяцев или ежегодно. С учетом изложенного материала в данном документе, специалист в области смог бы легко определить благоприятные дозировки и режимы дозирования для снижения потенциала повторного проявления заболевания. Более того, такие курсы лечения могли бы продолжаться в течение периода, равного неделям, месяцам, годам или даже неопределенно долго, в зависимости от ответной реакции пациента, клинических и диагностических параметров.
В еще одном другом предпочтительном варианте осуществления ADC настоящего изобретения могут применяться профилактически или в качестве вспомогательной терапии, чтобы предотвратить или снизить возможность метастазирования опухоли после циторедуктивной операции. Как используют в рассматриваемом раскрытии термин “циторедуктивная операция” определяется в широком смысле и будет означать любую процедуру, метод или способ, которые устраняют, снижают, лечат или амелиорируют опухоль или пролиферацию опухоли. Иллюстративные циторедуктивные операции включают но не ограничиваются перечисленным, хирургическое вмешательство, лучевые терапии (т.е., направленное излучение), химиотерапию, иммунотерапию или абляцию. В соответствующее время, легко определяемое квалифицированным специалистом в области с учетом рассматриваемого раскрытия, ADC могут вводиться, как предлагают клинические, диагностические или лечебно-диагностические методики для уменьшения метастазирования опухоли. Конъюгаты могут вводиться один или более раз при фармацевтически эффективных дозировках, определенных с использованием стандартных методов. Предпочтительно режим дозирования будет сопровождаться соответствующими методами диагностики или регистрации, которые позволяют проводить его модификацию.
Еще другие варианты осуществления изобретения включают в себя введение раскрытых Конъюгат DLL3ов субъектам, которые являются бессимптомными, но имеют риск развития пролиферативного расстройства. Имеется в виду, что конъюгаты рассматриваемого изобретения могут применяться в истинно профилактическом смысле, и предоставляться пациентам, которые были обследованы или протестированы и имеют один или более отмеченных факторов риска (например, геномные показания, семейный анамнез, результаты тестирования in vivo или in vitro и т.д.), но у которых не развивается неоплазия. В таких случаях, специалисты в данной области смогут определить эффективный режим дозирования посредством эмпирического наблюдения или посредством принятых клинических практик.
4. Противоопухолевые стредства
Как обсуждается по всему объему рассматриваемой заявки Конъюгат DLL3ы рассматриваемого изобретения могут применяться в комбинации с противоопухолевыми средствами. Термин “противоопухолевое средство” или “антипролиферативное средство” означает любое средство, которое может применяться для лечения клеточного пролиферативного расстройства, такого как злокачественное новообразование, и включает, но не ограничено перечисленным, цитотоксические средства, цитотостатические средства, анти-ангиогеннык средства, циторедуктивные средства, химиотерапевтические средства, радиотерапию и радиотерапевтические средства, целенаправленные противоопухолевые средства, BRM, терапевтические антитела, противораковые вакцины, цитокины, гормональные терапии, лучевую терапию и анти-метастатические средства и иммунотерапевтические средства.
Как используют в данном документе, термин “цитотоксическое средство” означает вещество, которое является токсичным по отношению к клеткам и снижает или ингибирует функцию клеток и/или вызывает деструкцию клеток. В некоторых вариантах осуществления вещество является природного происхождения молекулой природного происхождения, производной от живого оганизма. Примеры цитотоксических средств включают, но не ограничиваются перечисленным, низкомолекулярные токсины или ферментативно активные токсины бактерий (например, дифтерийный токсин, эндотоксин Pseudomonas и экзотоксин, стафилококковый энтеротоксин A), токсины грибков (например, α-сарцин, рестриктоцин), растительные токсины (например, абрин, рицин, модессин, вискумин, протвовирусный белок лаконоса, сапорин, гелонин, моморидин, трихосантин, токсин ячменя, белки Aleurites fordii, диантиновые белки, белки Phytolacca mericana (PAPI, PAPII, и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор saponaria officinalis, гелонин, митегелин, рестриктоцин, феномицин, неомицин и трихотецены) или токсины животных, (например, цитотоксические РНКазы, такие как внеклеточные панкреатические РНКазы; ДНКаза I, включая их фрагменты и/или варианты).
Для целей рассматриваемого изобретения “химиотерапевтическое средство” содержит химическое соединение, которое неспецифически снижает или ингибирует рост, пролиферацию и/или выживание опухолевых клеток (например, цитотоксические или цитотостатические средства). Такие химические средства часто направлены на внутриклеточные процессы, неоьходимые для роста или деления клеток, и, таким образом, являются особенно эффективными против злокачественных клеток, которые обычно быстро растут делятся. Например, винкристин депроимеризует микротрубочки, и, таким образом, ингибирует клетки от вхождения в митоз. В целом, химиотерапевтические средства могут включать любое химическое средство, которое ингибирует, или разработано для ингибирования злокачественных клеток или клеток, которые, вероятно, станут злокачественными, или генераци туморогенных потомков (например, TIC). Такие средства часто вводят, и они часто являются наиболее эффективными, в комбинации, например, с курсами терапии, такими как CHOP или FOLFIRI.
Примеры противоопухолевых средств, которые могут применяться в комбинации с DLL3 ADC настоящего изобретения, включают но не ограничиваются перечисленным, алкилирующие средства, алкилсульфонаты, азиридины, этилениминыимины и метилмеламины, ацетогенины, камптотецин, бриостатин, каллистатин, CC-1065, криптофицины, доластатин, дуокармицин, элеуторобин, панкратистатин, саркодиктиин, спонгистатин, азотистые мустарды, антибиотики, энедииновые антибиотики, динемицин, бисфосфонаты эсперамицин, хромопротеиновые энедииновые антибиотические хромофоры, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицинис, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, АДРИАМИЦИН® доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зинотатин, зорубицин; антиметаболиты, эрлотиниб, вемурафениб, кризотиниб, сорафениб, ибрутиниб, энзалутамид, аналог фолиевой кислоты, аналоги пуринов, андрогены, антиадреналин, компенсатор фолиевой кислоты, такой как фолиниевая кислота, ацеглатон, альдофосфамидный гликозид, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазиквон, элфорнитин, ацетат эллиптиния, эпотилон, этоглюцид, нитрат галлия, гидроксимочевина, лентинан, лониданин, майтансиноиды, митогуазон, митоксантрон, мопиданмол, нитраэрин, пентостатин, фенамет, пирарубицин, лосоксантрон, подофиллиновая кислота, 2-этилгидразид, прокарбазин, PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR), разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин A и ангвидин); уретан; виндесин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабиноид (''Ara-C''); циклофосфамид; тиотепа; таксоиды, хлоранбуцил; гемцитабин GEMZAR®; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® винорелбин; новантрон; тенипозид; эдптрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (Камптосар, CPT-11), ингибитор топоизомеразы RFS 2000; дифторметилорнитин; ретиноиды; капецитабин; комбретастатин; лейковорин; оксалиплатин; ингибиторы PKC-альфа, Raf, H-Ras, EGFR и VEGF-A, которые снижают пролиферацию клеток, и фармацевтически приемлемые соли, кислоты или производные любых из приведенных выше. Также в это определение включают антигормональные средства, которые действуют, чтобы регулировать или ингибировать действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенов, ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогенов в надпочечниках, и антиандрогены; а также троксацитабин (1,3-диоксолановый аналого нуклеозида цитозина); антисмысловые олигонуклеотиды, рибозимы, такие как ингибитор экспрессии VEGF и ингибитор экспрессии HER2; вакцины, PROLEUKIN® rIL-2; топоизомеразы 1 ингибитор LURTOTECAN®; ABARELIX® rmRH; Винорелбин и Эсперамицины и фармацевтически приемлемые соли, кислоты или производные любых из приведенных выше.
Особенно предпочтительные противоопухолевые средства включают доступные для приобретения или доступные клинически соединения, такие как эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), доцетаксел (TAXOTERE®, Sanofi-Aventis), 5-ФУ (фторурацил, 5-фторурацил, CAS No. 51-21-8), гемцитабин (GEMZAR®, Lilly), PD-0325901 (CAS No. 391210-10-9, Pfizer), цисплатин (цис-диамин, дихлорплатина(II), CAS No. 15663-27-1), карбоплатин (CAS No. 41575-94-4), паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, N.J.), трастузумаб (HERCEPTIN®, Genentech), темозоломид (4-метил-5-оксо-2,3,4,6,8-пентазабицикло[4.3,0]нона-2,7,9-триен-9-карбоксамид, CAS No. 85622-93-1, TEMODAR®, TEMODAL®, Schering Plough), тамоксифен ((Z)-2-[4-(1,2-дифенилбут-1-енил)фенокси]-N,N-диметилэтанамин, NOLVADEX®, ISTUBAL®, VALODEX®), и доксорубицин (АДРИАМИЦИН®). Дополнительные доступные для приобретения или клинически доступные противоопухолевые средства включают оксалиплатин (ELOXATIN®, Sanofi), бортезомиб (VELCADE®, Millennium Pharm.), сутент (SUNITINIB®, SU11248, Pfizer), летрозол (FEMARA®, Novartis), иматиниба мезилат (GLEEVEC®, Novartis), XL-518 (ингибитор Mek, Exelixis, WO 2007/044515), ARRY-886 (ингибитор Mek, AZD6244, Array BioPharma, Astra Zeneca), SF-1126 (ингибитор PI3K, Semafore Pharmaceuticals), BEZ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis), PTK787/ZK 222584 (Novartis), фулвестрант (FASLODEX®, AstraZeneca), лейковорин (фолиниевая кислота), рапамицин (сиролимус, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафарниб (SARASAR™, SCH 66336, Schering Plough), сорафениб (NEXAVAR®, BAY43-9006, Bayer Labs), гефетиниб (IRESSA®, AstraZeneca), иринотекан (CAMPTOSAR®, CPT-11, Pfizer), типифарниб (ZARNESTRA™, Johnson & Johnson), АБРАКСАН™ (Cremophor-free), сконструированные с альбумином лекарственные формы паклитаксела в виде наночастиц (American Pharmaceutical Partners, Schaumberg, Il), вандетаниб (rINN, ZD6474, ZACTIMA®, AstraZeneca), хлорамбуцил, AG1478, AG1571 (SU 5271; Sugen), темсиролимус (TORISEL®, Wyeth), пазопаниб (GlaxoSmithKline), канфосфамид (TELCYTA®, Telik), тиотепа и циклофосфамид (CYTОКСАN®, NEOSAR®); винорелбин (NAVELBINE®); капецитабин (XELODA®, Roche), тамоксифен (включая NOLVADEX®; тамоксифена цитрат, FARESTON® (торемифина цитрат) MEGASE® (мегэстрола ацетат), AROMASIN® (эксеместан; Pfizer), форместанин, фадразол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis), и ARIMIDEX® (анастрозол; AstraZeneca).
В других вариантах осуществления Конъюгат DLL3ы рассматриваемого изобретения могут применяться в комбинации с каким-либо антителом из ряда антител (или иммунотерапевтических средств), проходящих в настоящее время клинические испытания или доступных для приобретения. С этой целью, раскрытые Конъюгат DLL3ы могут применяться в комбинации с антителами, выбранными из группы, состоящей из абаговомаб, адекатумумаб, афутузумаб, алемтузумаб, альтумомаб, аматуксимаб, анатумомаб, арцитумомаб, бавитуксимаб, бектумомаб, бевацизумаб, биватузумаб, блинатумомаб, брентуксимаб, кантузумаб, катумаксомаб, цетуксимаб, цитатузумаб, циксутумумаб, кливатузумаб, конатумумаб, даратумумаб, дрозитумаб, дулиготумаб, дузигитумаб, детумомаб, дацетузумаб, далотузумаб, экромексимаб, элотузумаб, энситуксимаб, эртумаксомаб, этарацизумаб, фарлетузумаб, фиклатузумаб, фигитумумаб, фланвотумаб, футуксимаб, гантитумаб, гемтузумаб, гирентуксимаб, глембатумумаб, ибритумомаб, иговомаб, имгатузумаб, индатуксимаб, инотузумаб, интетумумаб, ипилимумаб, иратумумаб, лабетузумаб, лексатумумаб, линтузумаб, лорвотузумаб, лукатумумаб, мапатумумаб, матузумаб, милатузумаб, минретумомаб, митумомаб, моксетумомаб, нарнатумаб, наптумомаб, нецитумумаб, нимотузумаб, нофетумомаб, окаратузумаб, офатумумаб, оларатумаб, онартузумаб, опортузумаб, ореговомаб, панитумумаб, парсатузумаб, патритумаб, пемтумомаб, пертузумаб, пинтумомаб, притумумаб, ракотумомаб, рамуцирумаб, радретумаб, рилотумумаб, ритуксимаб, робатумумаб, сатумомаб, сибротузумаб, силтуксимаб, симтузумаб, солитомаб, такатузумаб, таплитумомаб, тенатумомаб, тепротумумаб, тигатузумаб, тоситумомаб, трастузумаб, тукотузумаб, ублитуксимаб, велтузумаб, ворсетузумаб, вотумумаб, залутумумаб, CC49, 3F8 и их комбинации.
Еще другие особенно предпочтительные варианты осуществления будут включать применение антител при тестировании или применение разрешенных антител при терапии рака, включающих, но не ограниченных перечисленным, ритуксимаб, трастузумаб, гемтузумаб озогамцин, алемтузумаб, ибритумомаб тиуксетан, тоситумомаб, бевацизумаб, цетуксимаб, панитумумаб, рамуцирумаб, офатумумаб, ипилимумаб и брентуксимаб ведотин. Специалисты в данной области смогут легко идентифицировать дополнительные противоопухолевые средства, которые являются совместимыми с основными положениями данного документа.
5. Радиотерапия
Настоящее изобретение также предоставляет комбинацию Конъюгат DLL3ов с радиотерапией (т.е., любым механизмом для индуцирования повреждения ДНК локально внутри опухолевых клеток, таким как гамма-облучение, рентгеновское облучение, УФ-облучение, микроволны, электронные эмиссии и т.п.). Также предусматривают комбинированную терапию с использованием направленной доставки радиоизотопов к опухолевым клеткам, и раскрытые конъюгаты могут применяться в связи с нацеленным противоопухолевым средством или другим средством целенаправленного действия. Обычно, лучевую терапию вводят импульсами в течение периода времени от приблизительно 1 до приблизительно 2 недель. Лучевая терапия может вводиться субъектам, имеющ рак головы и шеи в течение приблизительно 6-7 недель. Необязательно, лучевая терапия может вводиться в виде однократной дозы или в виде множественных, последовательных доз.
VII. Показания к применению
Следует принимать во внимание, что ADC рассматриваемого изобретения могут применяться для лечения, предотвращения, контроля или ингибирования появления или повторного проявления любого ассоциированного с DLL3 расстройства. Соответственно, либо вводимые отдельно или в комбинации с противоопухолевым средством или радиотерапией, ADC изобретения являются особенно применимыми для лечения в принципе неопластических состояний у пациентов или субъектов, которые могут включать доброкачественные или злокачественные опухоли (например, карциномы надпочечников, печени, почки, мочевого пузыря, молочной железы, желудка, яичника, толстой кишки, простаты, поджелудочной железы, легкого, щитовидной железы, печени, шейки матки, эндометрия, пищевода и матки; саркомы; глиобластомы; и различные опухоли головы и шеи); лейкемии и лимфоидные злокачественные новообразования; другие расстройства, такие как нейрональные, глиальные, астроцитальные, гипоталамические и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцельные растройства; и воспалительные, ангиогенные, иммунологические расстройства и расстройства, вызванные патогенами. В частности, основными мишенями для лечения являются неопластические состояния, включающие твердые опухоли, несмотря на то, что гематологические злокачественные новообразования находятся в пределах объема изобретения.
Термин “лечение”, как используют в данном документе в контексте лечения состояния, относится, в целом к лечению и терапии, либо человека или животного (например, в ветеринарных применениях), в которых достигается некоторый желательный терапевтический эффект, например, ингибирование прогрессирования состояния, и включает снижение скорости прогрессирования, остановку скорости прогресирования, регрессию состояния, улучшение состояния, и излечение состояния. Также включено лечение в виде профилактической меры (т.е., профилактики, предотвращения).
Термин “терапевтически эффективное количество”, как используют в данном документе, относится к тому количеству активного соединения или вещества, композиции или дозированной формы, содержащему активное соединение, которое является эффективным для продуцирования некоторого желательного терапевтического эффекта, соразмерного с рациональным отношением благоприятный эффект/риск, при введении в соответствии с желательным режимом лечения.
Аналогично, термин “профилактически эффективное количество”, как используют в данном документе, относится к тому количеству активного соединения или вещества, композиции или дозированной формы, содержащему активное соединение, которое является эффективным для продуцирования некоторого желательного профилактического эффекта, соразмерного с рациональным отношением благоприятный эффект/риск, при введении в соответствии с желательным режимом лечения.
Более конкретно, неопластические состояния субъекта для лечения в соответствии с рассматриваемым изобретением, могут быть выбраны из группы, включающей, но не ограниченной перечисленным, опухоли надпочечников, СПИД-ассоциированные злокачественные новообразования, альвеолярную саркому мягких тканей, астроцитарные опухоли, рак мочевого пузыря (карцинома сквамозных клеток и переходно-клеточная карцинома), рак костных тканей (адамантиному, аневризматические костные кисты, остеохондрому, остеосаркому), злокачественные новообразования головного и спинного мозга, метастатические опухоли головного мозга, рак молочной железы, опухоли каротидного гломуса, рак шейки матки, хондросаркому, хордому, карциному хромофобных клеток почки, светлоклеточную карциному, рак толстой кишки, колоректальный рак, кожные доброкачественные фиброзные гистиоцитомы, десмопластические мелкокруглоклеточные опухоли, эпендимомы, опухоли Юинга, внескелетную миксоидную хондросаркому, несовершенный костный фиброгенез, фиброзную дисплазию костей, злокачественные новообразования желчного пузыря и желчных протоков, гестационную трофобластическую болезнь, опухоли зародышевых клеток, злокачественные новообразования головы и клеток, опухоли островковых клеток, саркому Капошт, рак почки (нефробластому, папиллярный тип почечно-клеточного рака почек), лейкемии, липому/добракачествнные липоматозные опухоли, липосапкому/злокачественные липоматозные опухоли, рак печени (гепатобластому, гепатоцеллюлярную карциному), лимфомы, злокачественные образования легкого (мелкоклеточную карциному, аденокарциному, сквамозно-клеточную карциному, крупноклеточную карциному и т.д.), медуллобластому, меланому, менингиомы, множественные эндокринные неоплазии, множественную мелому, миелодиспластический синдром, нейробластому, нейроэндокринные опухоли, рак яичника, злокачественные новообразования поджелудочной железы, папиллярные тиреоидные карциномы, паратиреоидные опухоли, детские злокачественные новообразования, злокачественную опухоль периферических нервных стволов, феохромоцитому, опухоли гипофиза, рак простаты, последующую увеальную меланому, редкие гематологические расстройства, почечный метастатический рак, рабдоидную опухоль, рабдомиосаркому, саркомы, рак кожи, саркомы мягких тканей, сквамозно-клеточный рак, рак желудка, синовиальную саркому, рак яичка, карцинома тимуса, тимому, тиреоидный метастатический рак, и злокачественные новообразования матки (карцинома шейки матки, карцинома эндометрия и лейомиома).
В некоторых предпочтительных вариантах осуществления пролиферативное расстройство будет включать солидные опухоли, включающие, но не ограниченные перечисленным опухоли надпочечников, печени, почки, мочевого пузыря, молочной железы, желудка, яичника, шейки матки, матки, пищевода, толстой кишки, простаты, поджелудочной железы, легкого (как мелкоклеточные, так и немелкоклеточные), щитовидной железы, карциномы, спркомы, глиобластомы и различные опухоли головы и шеи. В других предпочтительных вариантах осуществления, и, как показано в Примерах ниже, раскрытые ADC являются особенно эффективными при лечении мелкоклеточного рака легких (SCLC) и немелкоклеточного рака легких (NSCLC) (например, немелкоклеточный рак легкого сквамозных клеток или мелкоклеточный рак легкого сквамозных клеток). В одном варианте осуществления, рак легкого является рефрактерным, рецидивирующим или резистентным к средствам на основе платины (например, карбоплатину, цисплатину, оксалиплатину, топотекану) и/или таксану (например, доцетакселу, паклитакселу, ларотакселу или кабазитакселу).
В особенно предпочтительных вариантах осуществления раскрытые ADC могут применяться для лечения мелкоклеточного рака легких. Что касается таких вариантов осуществления конъюгированные модуляторы могут вводиться пациентам, проявляющим ограниченную стадию заболевания. В других вариантах осуществления раскрытые ADC будут вводиться пациентам, проявляющим экстенсивную стадию заболевания. В других предпочтительных вариантах осуществления раскрытые ADC будут вводиться рефрактерным пациентам (т.е., тем, которые рецидивируют во время курса первоначальной терапии или через небольшое время после его завершения) или пациентам с рецидивирующим мелкоклеточным раком легких. Еще другие варианты осуществления включают введение раскрытых ADC чувствительным пациентам (т.е., тем, которые рецидивируют более, чем через 2-3 месяца после первичной терапии. В каждом случае следует принимать во внимание, что совместимые ADC могут применяться в комбинации с другими противоопухолевыми средствами, в зависимости от выбранного режима дозирования и клинического диагноза.
Как обсуждается выше, раскрытые ADC могут дополнительно применяться для предотвращения, лечения или диагностики опухолей с нейроэндокринными признаками или фенотипами, включающими нейроэндокринные опухоли. Истинные или канонические нейроэндокринные опухоли (NET), возникающие из диффузной эндокринной системы, являются относительно редкими, при заболеваемости 2-5 случая на 100000 человек, но высокоагрессивными. Нейроэндокринные опухоли возникают в почке, мочеполовом тракте (мочевом пузыре, простате, яичнике, шейке матки и эндометрии), желудочно-кишечном тракте (толстой кишке, желудке), щитовидной железе (медуллярный рак щитовидной железы), и легком (мелкоклеточная карцинома легкого и крупноклеточная нейроэндокринная карцинома). Эти опухоли могут секретировать некоторые гормоны, включая серотонин и/или хромогранин A, которые могут вызывать симптомы истощения, известные как карциноидный синдром. Такие опухоли могут обозначаться посредством положительных иммуногистохимических маркеров, таких как нейрон-специфическая енолаза (NSE, также известная как гамма-енолаза, символ гена = ENO2), CD56 (или NCAM1), хромогранин A (CHGA), и синаптофизин (SYP) или посредством генов, известных как проявляющих повышенную экспрессию, таких как ASCL1. К сожалению, традиционные химиотерапии не были особенно эффективными при лечении NET и метастазы в печени являются обычным конечным результатом.
В то время как раскрытые ADC могут примущественно применяться для лечения нейроэндокринных опухолей, они также могут применяться для лечения, прдотвращения или диагностики псевдонейроэндокринных опухолей (pNETs), которые генотипически или фенотипически имитируют, напоминают канонические нейроэндокринные опухоли, или проявляют общие характерные черты с ними. Псевдонейроэндокринные опухоли или опухоли с нейроэндокринными признаками представляют собой опухоли, которые возникают из клеток диффузной нейроэндокринной системы или из клеток, в которых каскад нейроэндокринной дифференциации ошибочно реактивировался во время онкогенного процесса. Такие pNET обычно имеют некоторые общие фенотипические или биохимические характеристики с традиционно определяемыми нейроэндокринными опухолями, включая способность продуцировать подклассы биологически активных аминов, нейротрансмиттеров и пептидных гормонов. Гистологически, такие опухоли (NET и pNET) имеют общий внешний вид, часто показывающий плотно соединенные небольшие клетки с минимальной цитоплазмой умеренной цитопатологии и покрытыми вкраплениями ядрами от круглых до овальных. Для целей рассматриваемого изобретения обычно экспрессируемые гистологические маркеры или генетические маркеры, которые могут применяться для определения нейроэндокринных и псевдонейроэндокриных опухолей, включают, но не ограничиваются перечисленным, хромогранин A, CD56, синаптофизин, PGP9,5, ASCL1 и нейрон-специфическую енолазу (NSE).
Соответственно ADC рассматриваемого изобретения могут благоприятным образом применяться для лечения как псевдонейроэндокринных опухолей, так и канонических нейроэндокринных опухолей. В данной связи ADC могут применяться, как описано в данном документе, для лечения нейроэндокринных опухолей (как NET, так и pNET) возникающих в почке, мочеполовом тракте (мочевом пузыре, простате, яичнике, шейке матки и эндометрии), желудочно-кишечном тракте (толстой кишке, желудке), щитовидной железе (медуллярный рак щитовидной железы), и легких (мелкоклеточная карцинома легкого и крупноклеточная нейроэндокринная карцинома). Более того, ADC рассматриваемого изобретения могут применяться для лечения опухолей, экспрессирующих один или более маркеров, выбранных из группы, состоящей из NSE, CD56, синаптофизина, хромогранина A, ASCL1 и PGP9,5 (UCHL1). Таким образом, настоящее изобретение может применяться для лечения субъекта, страдающего от опухоли, которая является NSE+ или CD56+ или PGP9,5+ или ASCL1+ или SYP+ или CHGA+ или их некоторой комбинации.
В отношении гематологических злокачественных новообразований следует дополнительно учитывать, что соединения и способы настоящего изобретения могут быть особенно эффективными при лечении различных B-клеточных лимфом, включающих низклй степени/NHL фолликулярную клеточную лимфому (FCC), мантийноклеточную лимфому (MCL), диффузную крупноклеточную лимфому (DLCL), мелкоклеточную лимфоцитарную лимфому (SL) NHL, промежуточной степени/фолликулярную NHL, промежуточной степени диффузную NHL, высокой степени иммунобластную NHL, высокой степени лимфобластную NHL, высокой степени мелкоклеточную лимфому с нерассеченными ядрами, NHL, массивную лимфоаденопатию NHL, макроглобулинемию Вальденстрема, лимфоплазмоцитарную лимфому (LPL), мантийноклеточную лимфому (MCL), фолликулярную лимфому (FL), диффузную крупноклеточную лимфому (DLCL), лимфому Беркита (BL), лимфомы, относящиеся к СПИД, моноцитарную В-клеточную лимфому, ангиоиммунобластную лимфоаденопатию, мелкоклеточную лимфоцитарную, фолликулярную, диффузную крупноклеточную, диффузную мелкоклеточную с нерасщепленными ядрами, крупноклеточную иммунобластную лимфобластому, мелкоклеточную, с нерасщепленными ядрами, Беркита и не-Беркита, фолликулярную, в основном крупноклеточную; фолликулярную, в основном мелкоклеточную с нерасщепленными ядрами; и фолликулярную, смешанную мелкоклеточную и крупноклеточную лимфомы. См, Gaidono et al., ''Lymphomas'', IN CANCER: PRINCIPLES & PRACTICE OF ONCOLOGY, Vol. 2: 2131-2145 (DeVita et al., eds., 5.sup.th ed. 1997). Специалистам в области должно быть понятно, что эти лимфомы будут часто иметь различные названия вследствие меняющихся систем классификации, и, что пациенты, имеющие лимфомы, классифицируемые под различными названиями могут также получать благоприятное воздействие от комбинированных терапевтических режимов настоящего изобретения.
Настоящее изобретение также предоставляет предупреждающее или профилактическое лечение субъектов с наличием доброкачественных или преканцерогенных опухолей. Вне списка DLL3-ассоциированных расстройств полагают, что любой конкретный тип опухоли или пролиферативного расстройства не должен исключаться из лечения с использованием настоящего изобретения. Однако, тип опухолевых клеток может соответствовать применению изобретения в комбинации со вторичными терапевтическими средствами, в частности, химиотерапевтическими средствами и противоопухолевыми средствами целенаправленного действия.
Предпочтительно “субъект” или “пациент”, подлежащий лечению будет являться человеком, хотя, как применяют в данном документе, термины в явно выраженной форме выдержаны, чтобы включать в себя любые виды, включающие всех млекопитающих. Соответственно, субъект/пациент может представлять собой животное, млекопитающее, плацентарное млекопитающее, сумчатое (например, кенгуру, вомбат), однопроходное животное (например, утконос), грызуна (например, морскую свинку, хомяка, крысу, мышь), мышиное животное (например, мышь), зайцобразное (например, кролик), пернатое (например, птицу), собачье (например, собаку), кошачье (например, кошку), конское (например, лошадь, свиное (например, свинью), овечье (например, овцу), крупный рогатый скот (например, корову), примата, обезьянье (например, обезьяну или человекообразную обезьяну), обезьяну (например, мартышку, бабуина), человекообразную обезьяну (например, гориллу, шимпанзе, орангутанга, гиббона) или человека.
VIII. Готовые изделия
Также предоставлены фармацевтические упаковки и наборы, содержащие один или более контейнеров, содержащих одну или более доз DLL3 ADC. В некоторых вариантах осуществления, предоставлена стандартная дозировка, где стандартная дозировка содержит заданное количество композиции, содержащей, например, анти-Конъюгат DLL3, с одним или более дополнительных средств или без них. Для других вариантов осуществления, такая стандартная дозировка поставляется в одноразовом предварительно заполненном щприце для инъекции. В еще других вариантах осуществления, композиция, содержащаяся в стандартной дозировке, может содержать физраствор, сахарозу, или т.п.; буфер, такой как фосфат или т.п.; и/или быть составлена в пределах устойчивого и эффективного интервала pH. Альтернативно, в некоторых вариантах осуществления, композиция конъюгата может быть предоставлена в виде лиофилизированного порошка, который может быть восстановлен при добавлении соответствующей жидкости, например, стерильной воды или физраствора. В некоторых предпочтительных вариантах осуществления, композиция содержит одно или более веществ, которые ингибируют агрегацию белка, включающие, но не ограниченные перечисленным, сахарозу и аргинин. Любая метка на контейнере(контейнерах), или ассоциированная сними, указывает, что содержащаяся композиция конъюгата применяется для лечения выбранного состояния неопластического заболевания.
Настоящее изобретение также предоставляет наборы для получения однодозовых или многодозовых единиц введения конъюгатов DLL3 и, необязательно, одно или более противоопухолевых средств. Набор содержит контейнер и метку или вкладыш в упаковку на контейнере или ассоциированные с контейнером. Подходящие контейнеры включают, например, бутыли, пузырьки, шприцы и т.д. Контейнеры могут быть образованы из разнообразных материалов, таких как стекло или пластик и содержать фармацевтически эффективное количество раскрытых Конъюгат DLL3ов в конъюгированной или неконъюгированной форме. В других предпочтительных вариантах осуществления контейнер(ы) содержат стерильный порт доступа (например, контейнер может представлять собой мешок с внутривенным раствором или пузырек, имеющий пробку, прокалываемую иглой для подкожных инъекций). Такие наборы, будут, как правило, содержать в подходящем контейнере фармацевтически приемлемую лекарственную форму Конъюгат DLL3а и, необязательно, одно или более противоопухолевых средств в тех же самых или различных контейнерах. Наборы могут также содержать другие фармацевтически приемлемые лекарственные формы, либо для диагностики или комбинированной терапии. Например, в дополнение к Конъюгат DLL3ам изобретения, такие наборы могут содержать любые одно или более из диапазона противоопухолевых средств, таких как химиотерапевтические или радиотерапевтические лекарственные средства; анти-ангиогенные средства; анти-метастатические средства; противоопухолевые средства целенаправленного действия; цитотоксические средства; и/или другие противоопухолевые средства.
Более конкретно, в наборах может иметься одиночный контейнер, который содержит DLL3 ADC, с дополнительными компонентами или без них, или они могут иметь различные контейнеры для каждого желательного средства. Там, где комбинированные терапевтические средства предоставлены для конъюгирования, одиночный раствор может быть предварительно смешан, либо в сочетании молярных эквивалентов или с одним компонентом в избытке по отношению к другому. Альтернативно, Конъюгат DLL3ы и любое противораковое средство по выбору из набора могут поддерживаться раздельно в различных контейнерах перед введением пациенту. Наборы могут также содержать второе/третье контейнерное средство для содержания стерильного, фармацевтически приемлемого буфера или другого разбавителя, такого как бактериостатическая вода для инъекции (BWFI), забуференный фосфатом физраствор (PBS), раствор Рингера и раствор декстрозы.
Когда компоненты набора предоставлены в одном или более жидких растворах, жидкий раствор является предпочтительно водным раствором, причем стерильный водный или физиологический раствор являются особенно предпочтительными. Однако, компоненты набора могут быть предоставлены в виде высушенных порошка(порошков). Когда реагенты или компоненты предоставлены в виде сухого порошка, порошок может быть восстановлен посредством добавления подходящего растворителя. Предусмотрено, что растворитель может также быть предоставлен в еще одном другом контейнере.
Как указано вкратце выше, наборы могут также содержать средство, посредством которого вводят конъюгат антител и любые компоненты по выбору животному или пациенту, например, одну или более игл, В.В. мешки или шприцы, или даже дозатор капель для глаз, пипетку или другое такое устройство, из которого лекарственная форма может инъицироваться или вводиться животному или применяться на пораженной области организма. Наборы настоящего изобретения будут также обычно включать средства для содержания пузырьков, или подобные им, и другой компонент в тесном ограничении для промышленной продажи, такие как, например, полученные инжекционным литьем или формованные пластиковые контейнеры, в которых желательные пузырьки и другие устройства помещают и содержат. Любая метка или упаковочный вкладыш указывает, что композицию конъюгата DLL3 применяют для лечения злокачественного новообразования, например мелкоклеточного рака легких.
В других предпочтительных вариантах осуществления конъюгаты рассматриваемого изобретения могут применяться в сочетании с диагностическими или терапевтическими устройствами или содержать такие устройства, применимые при профилактике или лечении пролиферативных нарушений. Например, в предпочтительном варианте осуществления, соединения и композиции рассматриваемого изобретения могут комбинироваться с некоторыми диагностическими устройствами или приборами, которые могут применяться для обнаружения, регистрации, количественной оценки или профилирования клеток или маркерных соединений вовлеченных в этиологию или проявление пролиферативных нарушений. Для выбранных вариантов осуществления маркерные соединения могут содержать NSE, CD56, синаптофизин, хромогранин A и PGP9,5.
В особенно предпочтительных вариантах осуществления устройства могут применяться для обнаружения, регистрации и/или количественной оценки циркулирующих опухолевых клеток либо in vivo или in vitro (см., например, WO 2012/0128801 которая включена в данное описание посредством ссылки). В еще других предпочтительных вариантах осуществления, и, как обсуждается выше, циркулирующие опухолевые клетки могут содержать раковые стволовые клетки.
IX. Краткое описание списка последовательностей
К рассматриваемой заявке прилагается список последовательностей, содержащий ряд последовательностей нуклеиновых кислот и аминокислотных последовательностей. Следующая ТАБЛИЦА 2 предоставляет краткое описание включенных последовательностей.
|
|
X. Разное
Если в данном описании не определено иначе, научные и технические термины, применяемые в связи с настоящим изобретеним, будут иметь значения, которые являются общепонятными для рядовых специалистов в области. Дополнительно, если не требуеися иначе по контексту, термины в единственном числе будут включать множества, а термины во множественном числе будут включать единственное число. Более конкретно, как используют в данном описании и прилагаемой формуле изобретения, формы единственного числа ''a'' ''an'' и ''the'' включают ссылки на множественное число, если контекст явным образом не предписывает иначе. Таким образом, например, ссылка на ''белок'' включает множество белков; ссылка на ''клетку'' включает смеси клеток и т.п. В дополнение, интервалы, предоставленные в описании и прилагаемой формуле изобретения, включают как начальную, так и конечную точку, и все точки между начальной и конечной точками. Следовательно, интервал от 2,0 до 3,0 включает 2,0, 3,0, и все точки между 2,0 и 3,0.
В целом, методы культивирования клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики и химии белков и нуклеиновых кислот и гибридизации, описанные в данном документе, и номенклатура, используемая в связи с ними, являются хорошо известными и общепринятыми в данной области. Способы и методы настоящего изобретения, как правило, выполняют в соответствии с общепринятыми способами, хорошо известными в области, и описанными в различных общих и более специфических ссылках, которые цитируют и обсуждают на протяжении всего настоящего описания, если не указано иначе. См., например, Abbas et al., Cellular and Molecular Immunology, 6th ed., W.B. Saunders Company (2010); Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow и Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и методы очистки выполняют в соответствии со спецификациями изготовителя, как обычно выполняют в данной области или как описано в данном документе. Лабораторные методики и методы и номенклатура, используемая в связи с ними, для аналитической химии, синтетической органической химии, и медицинской и фармацевтической химии, описанные в данном документе, являются хорошо известно и общепринятыми в области. Более того, заголовки разделов, применяемые в данном документе, используют только для организационных целей и не должны рассматриваться как ограничивающие описанный объект.
Некоторые сокращения, используемые в настоящем описании:
|
|
Примеры
Настоящее изобретение, таким образом, в целом, описанное выше, будет более легко понято со ссылкой на следующие примеры, которые предоставлены путем иллюстрации и не подразумеваются как ограничивающие рассматриваемое изобретение. Примеры не предназначены представлять то, что эксперименты, описанные ниже, представляют собой все или единственные проводимые эксперименты. Если не указано иначе, части представляют собой массовые части, молеклярная масса представляет собой среднемассовую молекулярную массу, температура представлена в градусах по шкале Цельсия, и давление является атмосферным или или близким к атмосферному.
Пример 1
Получение соединений ПБД лекарственное средство-Линкер
Соединения ПБД лекарственное средство-линкер DL1-DL5 были синтезированы следующим образом:
A. Обшие экспериментальные методы
Значения оптического вращения измеряли на поляриметре ADP 220 (Bellingham Stanley Ltd.) и концентрации (c) приведены в г/100 мл. Температуры плавления измеряли с использованием цифрового прибора для измерения температуры плавления (Electrothermal). ИК спектры записывали на ФП-ИК Спектрометре Perkin-Elmer Spectrum 1000. 1H и 13C ЯМР спектры снимали при 300 K, используя ЯМР-спектрометр Bruker Avance при 400 и 100 МГц, соответственно. Химические сдвиги приведены относительно ТМС (δ=0,0 мд), и сигналы обозначают как с (синглет), д (дублет), т (триплет), дт (двойной триплет), дд (дублет дублетов), ддд (двойной дублет дублетов) или м (мультиплет), причем константы спин-спинового взаимодействия приведены в Герцах (Гц). Данные масс-спектроскопии (МС) регистрировали, применяя прибор Waters Micromass ZQ, сочетанный с Waters 2695 ВЭЖХ с Waters 2996 PDA. Применяемые параметры Waters Micromass ZQ были следующими: Капилляр (кВ), 3,38; Конус (В), 35; Экстрактор (В), 3,0; Температура источника (°C), 100; Температура десольватации (°C), 200; Скорость потока конуса (л/ч), 50; Скорость потока десольватации (л/ч), 250. Данные масс-спектроскопии высокого разрешения (ВРМС) регистрировали на Waters Micromass QTOF Global в положительном W-режиме, используя наконечники из боросиликатного стекла с металлическим покрытием для введения образцов в прибор. Тонкослойную хроматографию (ТСХ) проводили на алюминиевых пластинах с силикагелем (Merck 60, F254), и для флэш-хроматографии применяли силикагель (Merck 60, 230-400 меш ASTM). За исключением HOBt (NovaBiochem) и реагентов на твердой подложке (Argonaut), все другие химикаты и растворители приобретали у Sigma-Aldrich и применяли в поставляемом виде без дополнительной очистки. Безводные растворители получали посредством перегонки в атмосфере сухого азота в присутствии соответствующего осушителя, и хранили над молекулярными ситами 4Å или натриевой проволокой. Петролейный эфир относится к фракции, кипящей при 40-60°C.
При генерации раскрытых соединений ЖХ/МС проводили с использованием двух немного различающихся методик. Методика по умолчанию представляла собой первый описанный метод, который применяли, если не указано иначе.
Метод 1 (метод по умолчанию, применяемый, если не указано иначе) - ВЭЖХ (Waters Alliance 2695) проводили, используя подвижную фазу из воды (A) (муравьиная кислота 0,1%) и ацетонитрила (B) (муравьиная кислота 0,1%). Градиент: первоначальный состав 5% B выдерживание в течение 1,0 мин, затем увеличение от 5% B до 95% B в течение 3-минутного периода. Состав выдерживали в течение 0,1 мин при 95% B, затем возвращались к 5% B за 0,03 минуты и выдерживали его в течение 0,87 мин. Общее время прохождения градиента равно 5 минутам.
Метод 2 - ВЭЖХ (Waters Alliance 2695) проводили, используя подвижную фазу из воды (A) (муравьиная кислота 0,1%) и ацетонитрил (B) (муравьиная кислота 0,1%). Градиент: первоначальный состав 5% B выдерживание в течение 1,0 минуты, затем увеличение от 5% B до 95% B в течение периода в 2,5 минуты. Состав выдерживали в течение 0,5 минут при 95% B, затем возвращались к 5% B за 0,1 минуты и выдерживали его в течение 0,9 мин. Общее время прохождения градиента равно 5 минутам.
Для обоих методов скорость потока была равна 3,0 мл/мин, 400 мкл отделяли через тройник с нулевым мертвым объемом, который проходит внутрь масс-спектрометра. Интервал длин волн детектирования: 220-400 нм. Тип функции: диодная матрица (535 сканов). Колонка: Phenomenex Onyx Monolithic C18 50 × 4,60 мм.
Условия флэш-очиски на обращенной фазе были следующими: Система флэш-очистки (Varian 971-Fp) эксплуатировали, используя подвижную фазу из воды (A) и ацетонитрила (B). Градиент: первоначальный состав 5% B в течение прохождения 20 О.К. (Объемов Колонки) затем от 5% B до 70% B в пределах 60 О.К. Состав выдерживали в течение 15 О.К. при 95% B, и затем возвращались к 5% B в течение 5 О.К. и выдерживали 5% B в течение 10 О.К. Общее время прохождения градиента было равно 120 О.К. Скорость потока 6,0 мл/мин. Интервал длин волн детектирования: 254 нм. Колонка: Agilent AX1372-1 SF10-5,5gC8.
Препаративную ВЭЖХ проводили следующим образом: Ультравысокоэффективную жидкостную хроматографию на обращенной фазе (УВЭЖХ) проводили на колонках Phenomenex Gemini NX 5мкм C-18 следующих размеров: 150×4,6 мм для анализа, и 150×21,20 мм для прпаративной работы. Все эксперименты УВЭЖХ проводили при условиях градиента. Используемые элюенты представляли собой растворитель A (H2O с 0,1% Муравьиной кислотой) и растворитель B (CH3CN с 0,1% Муравьиной кислотой). Применяемые скорости потока составляли 1,0 мл/мин для аналитической и 20,0 мл/мин для препаративной ВЭЖХ. Детектирование проводили при 254 и 280 нм.
B. Синтез Лекарственное средство-Линкер DL1 (Путь 1)

(a) 1',3'-Бис[2-метокси-4-(метоксикарбонил)фенокси]пропан (3)
Диизопропилазодикарбоксилат (71,3 мл, 73,2 г, 362 ммоль) добавляли по каплям в течение 60-минутного периода к перемешиваемому в верхней части реактора раствору метилванилината 2 (60,0 г, 329 ммоль) и Ph3P (129,4 г, 494 ммоль) в безводном ТГФ (800 мл) при 0-5°C (лед/ацетон) в атмосфере азота. Реакционная смесь перемешивалась при 0-5°C в течение дополнительного 1 часа, после которого раствор 1,3-пропандиола (11,4 мл, 12,0 г, 158 ммоль) в ТГФ (12 мл) добавляли по каплям в течение 20-минутного периода. Реакционная смесь нагревалась до комнатной температуры и ее перемешивали в течение 5 дней. Полученный в результате осадок белого цвета 3 собирали посредством фильтрации в вакууме, промывали ТГФ и сушили в вакуумном эксикаторе до постоянной массы. Выход = 54,7 г (84% в расчете от 1,3-пропандиола). Чистота удовлетворительная по ЖХ/МС (3,20 мин (ЭР+) m/z (относительная интенсивность) 427 ([M+Na]+, 10); 1H ЯМР (400 МГц, CDCl3) δ 7,64 (дд, 2H, J=1,8, 8,3 Гц), 7,54 (д, 2H, J=1,8 Гц), 6,93 (д, 2H, J=8,5 Гц), 4,30 (т, 4H, J=6,1 Гц), 3,90 (с, 6H), 3,89 (с, 6H), 2,40 (п, 2H, J=6,0 Гц).
(b) 1',3'-Бис[2-метокси-4-(метоксикарбонил)-5-нитрофенокси]пропан (4)
Твердый Cu(NO3)2.3H2O (81,5 г, 337,5 ммоль) медленно добавляли к перемешиваемой в верхней части реактора взвеси бис-сложного эфира 3 (54,7 г, 135 ммоль) в уксусном ангидриде(650 мл) при 0-5°C (лед/ацетон). Реакционная смесь перемешивалась в течение 1 часа при 0-5°C и затем нагревалась до комнатной температуре. На этой стадии наблюдали слабую экзотермическую реакцию (прибл. 40-50°C), сопровождаемую загущением и выделением NO2. Добавляли дополнительный уксусный ангидрид (300 мл) и реакционная смесь перемешивалась в течение 16 часов при комнатной температуре. Реакционную смесь выливыали на лед (~1,5 л), перемешивали и возвращали к комнатной температуре. Полученный в результате осадок желього цвета собирали посредством фильтрации в вакууме и сушили в эксикаторе с получением желательного бис-нитро соединения 4 в виде твердого вещества желтого цвета. Выход = 66,7 г (100%). Чистота удовлетворительная по ЖХ/МС (3,25 мин (ЭР+) m/z (относительная интенсивность) 517 ([M+Na]+., 40); 1H ЯМР (400 МГц, CDCl3) δ 7,49 (с, 2H), 7,06 (с, 2H), 4,32 (т, 4H, J=6,0 Гц), 3,95 (с, 6H), 3,90 (с, 6H), 2,45-2,40 (м, 2H).
(c) 1',3'-Бис(4-карбокси-2-метокси-5-нитрофенокси)пропан (5)
Взвесь метилового эфира 4 (66,7 г, 135 ммоль) в ТГФ (700 мл) обрабатывали 1N NaOH (700 мл) и реакционная смесь перемешивалась интенсивно при комнатной температуре. Через 4 дня перемешивания, взвесь становилась раствором темной окраски, который подвергали роторному испарению при пониженном давлении для удаления ТГФ. Полученный в результате водянистый остаток подкисляли до pH 1 концентрированной HCl, и бесцветный осадок 5 собирали и тщательно сушили в вакуум-сушильном шкафе (50°C). Выход=54,5 г (87%). Чистота удовлетворительная по ЖХ/МС (2,65 мин (ЭР+) m/z (относительная интенсивность) 489 ([M+Na]+., 30)); 1H ЯМР (400 МГц, ДМСО-d6) δ 7,62 (с, 2H), 7,30 (с, 2H), 4,29 (т, 4H, J=6,0 Гц), 3,85 (с, 6H), 2,30-2,26 (м, 2H).
(d) 1,1'-[[(Пропан-1,3-диил)диокси]бис[(5-метокси-2-нитро-1,4-фенилен)карбонил]]бис[(2S,4R)-метил-4-гидроксипирролидин-2-карбоксилат] (6)
Оксалилхлорид (24,5 мл, 35,6 г, 281 ммоль) добавляли к перемешиваемой суспензии нитробензойной кислоты 5 (43 г, 92,3 ммоль) и ДМФА (6 мл) в безводном ДХМ (600 мл). После первоначального вспенивания реакционная суспензия становилась раствором и смесь перемешивалась при комнатной температуре в течение 16 часов. Превращение в хлорангидрид кислоты подтверждали посредством обработки образца реакционной смеси MeOH, и полученный в результате бис-метиловый эфир наблюдали посредством ЖХ/МС. Основную часть растворителя удаляли упариванием при пониженном давлении; полученный в результате концентрированный раствор перерастворяли в минимальном количестве безводного ДХМ и растирали с диэтиловым эфиром. Полученн в результате осадок желтого цвета собирали фильтрацией, промывали холодным диэтиловым эфиром и сушили в течение 1 часа в вакуум-сушильном шкафе при 40°C. Твердый хлорангидрид кислоты добавляли по частям в течение 25-минутного периода к перемешиваемой суспензии гидрохлорида (2S,4R)-метил-4-гидроксипирролидин-2-карбоксилата (38,1 г, 210 ммоль) и ТЭА (64,5 мл, г, 463 ммоль) в ДХМ (400 мл) при -40°C (сухой лед/CH3CN). Непосредственно сразу же, реакция проходила полностью, по результату ЖХ/МС (2,47 мин (ЭР+) m/z (относительная интенсивность) 721 ([M+H]+, 100). Смесь разбавляли ДХМ (200 мл) и промывали 1N HCl (300 мл), насыщенным NaHCO3 (300 мл), насыщенным раствором хлорида натрия (400 мл), сушили (MgSO4), отфильтровывали, и растворитель упаривали in vacuo с получением чистого продукта 6 в виде твердого вещества оранжевого цвета (66,7 г, 100%). [α]22D=-46,1° (c=0,47, CHCl3); 1H ЯМР (400 МГц, CDCl3) (ротамеры) δ 7,63 (с, 2H), 6,82 (с, 2H), 4,79-4,72 (м, 2H), 4,49-4,28 (м, 6H), 3,96 (с, 6H), 3,79 (с, 6H), 3,46-3,38 (м, 2H), 3,02 (д, 2H, J=11,1 Гц), 2,48-2,30 (м, 4H), 2,29-2,04 (м, 4H); 13C ЯМР (100 МГц, CDCl3) (ротамеры) δ 172,4, 166,7, 154,6, 148,4, 137,2, 127,0, 109,7, 108,2, 69,7, 65,1, 57,4, 57,0, 56,7, 52,4, 37,8, 29,0; ИК (ATR, CHCl3) 3410 (шир), 3010, 2953, 1741, 1622, 1577, 1519, 1455, 1429, 1334, 1274, 1211, 1177, 1072, 1050, 1008, 871 cm-1; МС (ЭР+) m/z (относительная интенсивность) 721 ([M+H]+., 47), 388 (80); МСВР [M+H]+.теоретический C31H36N4O16m/z 721,2199, обнаруженный (ЭР+) m/z 721,2227.
(e) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS,2R)-2-(гидрокси)-7-метокси-1,2,3,10,11,11a-гексагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (7)
Способ A: Раствор нитро-сложного эфира 6 (44 г, 61,1 ммоль) в MeOH (2,8 л) добавляли к свежеполученному никелю Рэнея® (~50 г ~50% взвеси в H2O) и гранулам против вскипания в 5л 3х-горлую круглодонную колбу. смесь нагревали при кипячении с обратным холодильником и затем обрабатывали по каплям раствором гидразингидрата (21,6 мл, 22,2 г, 693 ммоль) в MeOH (200 мл), причем при этом наблюдали интенсивное вспенивание наблюдали. По завершении добавления (~45 мин) осторожно добавляли дополнительный никель Рэнея®, до прекращения вспенивания и исчезновения первоначального желтого цвета реакционной смеси. Смесь нагревали при кипячении с обратным холодильником в течение дополнительных 5 мин, и после этого реакцию считали прошедшей полностью по результатам ТСХ (90:10 об/об CHCl3/MeOH) и ЖХ/МС (2,12 мин (ЭР+) m/z (относительная интенсивность) 597 ([M+H]+, 100)). Реакционную смесь сразу же отфильтровывали в горячем состоянии через воронку из спеченного стекла, содержащую целит с помощью вакуум-отсоса. Объем фильтрата уменьшали упариванием in vacuo, при этом образовывался бесцветный осадок, который собирали фильтрацией и сушили в вакуумном эксикаторе для предоставления 7 (31 г, 85%). [α]27D=+404° (c=0,10, ДМФА); 1H ЯМР (400 МГц, ДМСО-d6) δ 10,2 (с, 2H, NH), 7,26 (с, 2H), 6,73 (с, 2H), 5,11 (д, 2H, J=3,98 Гц, OH), 4,32-4,27 (м, 2H), 4,19-4,07 (м, 6H), 3,78 (с, 6H), 3,62 (дд, 2H, J=12,1, 3,60 Гц), 3,43 (дд, 2H, J=12,0, 4,72 Гц), 2,67-2,57 (м, 2H), 2,26 (п, 2H, J=5,90 Гц), 1,99-1,89 (м, 2H); 13C ЯМР (100 МГц, ДМСО-d6) δ 169,1, 164,0, 149,9, 144,5, 129,8, 117,1, 111,3, 104,5, 54,8, 54,4, 53,1, 33,5, 27,5; ИК (ATR, чистый) 3438, 1680, 1654, 1610, 1605, 1516, 1490, 1434, 1379, 1263, 1234, 1216, 1177, 1156, 1115, 1089, 1038, 1018, 952, 870 см-1; МС (ЭР+) m/z (относительная интенсивность) 619 ([M+Na]+, 10), 597 ([M+H]+, 52), 445 (12), 326 (11); МСВР [M+H]+ теоретический C29H32N4O10m/z 597,2191, обнаруженный (ЭР+) m/z 597,2205.
Способ B: Суспензию 10% Pd/C (7,5 г, 10% м/м) в ДМФА (40 мл) добавляли к раствору нитро-сложного эфира 6 (75 г, 104 ммоль) в ДМФА (360 мл). Суспензию гидрировали в устройстве для гидрирования Парра в течение 8 часов. Протекание реакции регистрировали с поиощью ЖХ/МС после прекращения поглощения водорода. Твердый Pd/C удаляли фильтрацией, и фильтрат концентрировали посредством роторного испарения в вакууме (ниже 10 мбар) при 40°C с получением масла темного цвета, содержащего следы ДМФА и остаточный древесный уголь. Остаток обрабатывали в EtOH (500 мл) при 40°C на водяной бане (бане роторного испарителя), и полученную в результате суспензию отфильтровывали через целит и промывали этанолом (500 мл) с получением прозрачного фильтрата. Гидразингидрат (10 мл, 321 ммоль) добавляли к раствору, и реакционную смесь нагревали при кипячении с обратным холодильником. Через 20 минут наблюдали образование осадка белого цвета и обеспечивали продолжение кипячения с обратным холодильником в течение дополнительных 30 минут. Смеси давали охладиться до комнатной температуры и осадок извлекали фильтрацией, промывали диэтиловым эфиром (2:1 объем осадка) и сушили в вакуумном эксикаторе с получением 7 (50 г, 81%). Данные анализа для способа B: Идентичны данным, полученным для Способа A (оптическое вращение, 1H ЯМР, ЖХ/МС и ТСХ).
(f) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS,2R)-2-(трет-бутилдиметилсилилокси)-7-метокси-1,2,3,10,11,11a-гексагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (8)
TBSCl (27,6 г, 182,9 ммоль) и имидазол (29,9 г, 438,8 ммоль) добавляли к мутному раствору тетралактама 7 (21,8 г, 36,6 ммоль) в безводном ДМФА (400 мл) при 0°C (лед/ацетон). Смесь перемешивалась в атмосфере азота в течение 3 часов, и после этого периода времени репкцию считали прошедшей полностью по данным ЖХ/МС (3,90 мин (ЭР+) m/z (относительная интенсивность) 825 ([M+H]+, 100). Реакционную смесь выливали на лед (~1,75 л) и она нагревалась до комнатной температуры при перемешивании. Полученный в результате осадок белого цвета собирали посредством фильтрации в вакууме, промывали H2O, диэтиловым эфиром и сушили в вакуумном эксикаторе с получением чистого 8 (30,1 г, 99%). [α]23D=+234° (c=0,41, CHCl3); 1H ЯМР (400 МГц, CDCl3) δ 8,65 (с, 2H, NH), 7,44 (с, 2H), 6,54 (с, 2H), 4,50 (п, 2H, J=5,38 Гц), 4,21-4,10 (м, 6H), 3,87 (с, 6H), 3,73-3,63 (м, 4H), 2,85-2,79 (м, 2H), 2,36-2,29 (м, 2H), 2,07-1,99 (м, 2H), 0,86 (с, 18H), 0,08 (с, 12H); 13C ЯМР (100 МГц, CDCl3) δ 170,4, 165,7, 151,4, 146,6, 129,7, 118,9, 112,8, 105,3, 69,2, 65,4, 56,3, 55,7, 54,2, 35,2, 28,7, 25,7, 18,0, -4,82 и -4,86; ИК (ATR, CHCl3) 3235, 2955, 2926, 2855, 1698, 1695, 1603, 1518, 1491, 1446, 1380, 1356, 1251, 1220, 1120, 1099, 1033 см-1; МС (ЭР+) m/z (относительная интенсивность) 825 ([M+H]+, 62), 721 (14), 440 (38); МСВР [M+H]+ теоретический C41H60N4O10Si2m/z 825,3921, найденный (ЭР+) m/z 825,3948.
(g) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS,2R)-2-(трет-бутилдиметилсилилокси)-7-метокси-10-((2-(триметилсилил)этокси)метил)-1,2,3,10,11,11a-гексагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (9)
Раствор н-BuLi (68,3 мл 1,6M раствора в гексане, 109 ммоль) добавляли по каплям к перемешиваемой суспензии тетралактама 8 (30,08 г, 36,4 ммоль) в безводном ТГФ (600 мл) при -30°C (сухой лед/этиленгликоль) в атмосфере азота. Реакционная смесь перемешивалась при данной темературе в течение 1 часа (до приобретения красновато-оранжевого цвета), и с этого времени раствор SEMCl (19,3 мл, 18,2 г, 109 ммоль) в безводном ТГФ (120 мл) добавляли по каплям. Реакционная смесь медленно нагревалась до комнатной температуры и перемешивалась в течение 16 часов в атмосфере азота. Реакцию считали прошедшей полностью по данным ТСХ (EtOAc) и ЖХ/МС (4,77 мин (ЭР+) m/z (относительная интенсивность) 1085 ([M+H]+, 100). ТГФ удаляли упариванием in vacuo, и полученный в результате остаток растворяли в EtOAc (750 мл), промывали H2O (250 мл), насыщенным раствором хлорида натрия (250 мл), сушили (MgSO4) отфильтровывали и упаривали in vacuo с получением неочищенного N10-SEM-защищенного тетралактама 9 в виде масла (максm 39,5 г, 100%). Продукт переносили на следующкю стадию без очистки. [α]23D=+163° (c=0,41, CHCl3); 1H ЯМР (400 МГц, CDCl3) δ 7,33 (с, 2H), 7,22 (с, 2H), 5,47 (д, 2H, J=9,98 Гц), 4,68 (д, 2H, J=9,99 Гц), 4,57 (п, 2H, J=5,77 Гц), 4,29-4,19 (м, 6H), 3,89 (с, 6H), 3,79-3,51 (м, 8H), 2,87-2,81 (м, 2H), 2,41 (п, 2H, J=5,81 Гц), 2,03-1,90 (м, 2H), 1,02-0,81 (м, 22H), 0,09 (с, 12H), 0,01 (с, 18H); 13C ЯМР (100 МГц, CDCl3) δ 170,0, 165,7, 151,2, 147,5, 133,8, 121,8, 111,6, 106,9, 78,1, 69,6, 67,1, 65,5, 56,6, 56,3, 53,7, 35,6, 30,0, 25,8, 18,4, 18,1, -1,24, -4,73; ИК (ATR, CHCl3) 2951, 1685, 1640, 1606, 1517, 1462, 1433, 1360, 1247, 1127, 1065 см-1; МС (ЭР+) m/z (относительная интенсивность) 1113 ([M+Na]+, 48), 1085 ([M+H]+, 100), 1009 (5), 813 (6); МСВР [M+H]+.теоретическая C53H88N4O12Si4 m/z 1085,5548, найденная (ЭР+) m/z 1085,5542.
(h) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS,2R)-2-гидрокси-7-метокси-10-((2-(триметилсилил)этокси)метил)-1,2,3,10,11,11a-гексагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (10)
Раствор TBAF (150 мл 1,0M раствора в ТГФ, 150 ммоль) добавляли к перемешиваемому раствору неочищенного бис-силилового эфира 9 [84,0 г (максm 56,8 г), 52,4 ммоль] в ТГФ (800 мл) при комнатной температуре. После перемешивания в течение 1 часа, анализ реакционной смеси посредством ТСХ (95:5 об/об CHCl3/MeOH) показал завершение реакции. ТГФ удаляли упариванием при пониженном давлении при комнатной температуре, и полученный в результате остаток растворяли в EtOAc (500 мл) и промывали NH4Cl (300 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия (60 мл), сушили (MgSO4), отфильтровывали и упаривали при пониженном давлении с получением неочищенного продукта. Очисткой посредством флэш-хроматографии (градиентное элюирование: 100% CHCl3 до 96:4 об/об CHCl3/MeOH) получали чистый тетралактам 10 в виде белой пены (36,0 г, 79%). ЖХ/МС 3,33 мин (ЭР+) m/z (относительная интенсивность) 879 ([M+Na]+, 100), 857 ([M+H]+., 40); [α]23D=+202° (c=0,34, CHCl3); 1H ЯМР (400 МГц, CDCl3) δ 7,28 (с, 2H), 7,20 (с, 2H), 5,44 (д, 2H, J=10,0 Гц), 4,72 (д, 2H, J=10,0 Гц), 4,61-4,58 (м, 2H), 4,25 (т, 4H, J=5,83 Гц), 4,20-4,16 (м, 2H), 3,91-3,85 (м, 8H), 3,77-3,54 (м, 6H), 3,01 (шир с, 2H, OH), 2,96-2,90 (м, 2H), 2,38 (п, 2H, J=5,77 Гц), 2,11-2,05 (м, 2H), 1,00-0,91 (м, 4H), 0,00 (с, 18H); 13C ЯМР (100 МГц, CDCl3) δ 169,5, 165,9, 151,3, 147,4, 133,7, 121,5, 111,6, 106,9, 79,4, 69,3, 67,2, 65,2, 56,5, 56,2, 54,1, 35,2, 29,1, 18,4, -1,23; ИК (ATR, CHCl3) 2956, 1684, 1625, 1604, 1518, 1464, 1434, 1361, 1238, 1058, 1021 см-1; МС (ЭР+) m/z (относительная интенсивность) 885 ([M+29]+, 70), 857 ([M+H]+., 100), 711 (8), 448 (17); МСВР [M+H]+ теоретическое C41H60N4O12Si2 m/z 857,3819, найденное (ЭР+) m/z 857,3826.
(i) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS)-7-метокси-2-оксо-10-((2-(триметилсилил)этокси)метил)-1,2,3,10,11,11a-гексагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (11)
Диол 10 (25,6 г, 30 ммоль, 1 экв.), NaOAc (6,9 г, 84 ммоль, 2,8 экв.) и TEMPO (188 мг, 1,2 ммоль, 0,04 экв.) растворяли в ДХМ (326 мл) под Ar. Смесь охлаждали до -8°C (внутренняя температура) и TCCA (9,7 г, 42 ммоль, 1,4 экв.) добавляли частями в течение 15 минут. ТСХ (EtOAc) и ЖХ/МС [3,60 мин. (ЭР+) m/z (относительная интенсивность) 854,21 ([M+H]+, 40), (ЭР-) m/z (относительная интенсивность) 887,07 ([M-H+Cl]-, 10)] через 30 минут указывали на завершение реакции. Добавляли холодный ДХМ (200 мл) и смесь отфильтровывали через слой Целита перед промывкой раствором насыщенного гидрокарбоната натрия/тиосульфата натрия (1:1 об/об; 200 мл × 2). Органический слой сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo с получением губки желто/оранжевого цвета (25,4 г, 99%). ЖХ/МС [3,60 мин. (ЭР+) m/z (относительная интенсивность) 854,21 ([M+H]+, 40); [α]20D=+291° (c=0,26, CHCl3); 1H ЯМР (400 МГц, CDCl3) δ 7,32 (с, 2H), 7,25 (с, 2H), 5,50 (д, 2H, J=10,1 Гц), 4,75 (д, 2H, J=10,1 Гц), 4,60 (дд, 2H, J=9,85, 3,07 Гц), 4,31-4,18 (м, 6H), 3,89-3,84 (м, 8H), 3,78-3,62 (м, 4H), 3,55 (дд, 2H, J=19,2, 2,85 Гц), 2,76 (дд, 2H, J=19,2, 9,90 Гц), 2,42 (п, 2H, J=5,77 Гц), 0,98-0,91 (м, 4H), 0,00 (с, 18H); 13C ЯМР (100 МГц, CDCl3) δ 206,8, 168,8, 165,9, 151,8, 148,0, 133,9, 120,9, 111,6, 107,2, 78,2, 67,3, 65,6, 56,3, 54,9, 52,4, 37,4, 29,0, 18,4, -1,24; ИК (ATR, CHCl3) 2957, 1763, 1685, 1644, 1606, 1516, 1457, 1434, 1360, 1247, 1209, 1098, 1066, 1023 см-1; МС (ЭР+) m/z (относительная интенсивность) 881 ([M+29]+, 38), 853 ([M+H]+, 100), 707 (8), 542 (12); МСВР [M+H]+ теоретическая C41H56N4O12Si2m/z 853,3506, найденная (ЭР+) m/z 853,3502.
(j) 1,1'-[[(Пропан-1,3-диил)диокси]бис(11aS)-7-метокси-2-[[(трифторметил)сульфонил]окси]-10-((2-(триметилсилил)этокси)метил)-1,10,11,11a-тетрагидро-5H-пирроло[2,1-c][1,4]-бензодиазепин-5,11-дион] (12)
Безводный 2,6-лутидин (5,15 мл, 4,74 г, 44,2 ммоль) инъкционно вводили одной частью в интенсивно перемешиваемый раствор бис-кетона 11 (6,08 г, 7,1 ммоль) в безводном ДХМ (180 мл) при -45°C (сухой лед/ацетонитрил) в атмосфере азота. Безводный трифторметансульфоновый ангидрид, взятый из только что открытой ампулы (7,2 мл, 12,08 г, 42,8 ммоль), быстро инъекционно вводили по каплям, в то же время поддерживая температуру при -40°C или ниже. Реакционная смесь перемешивалась при -45°C в течение 1 часа, после чего ТСХ (50/50 об/об н-гексан/EtOAc) показала полное потребление исходного вещества. Холодную реакционную смесь сразу же разбавляли ДХМ (200 мл) и, при интенсивном встряхивании, промывали водой (1×100 мл), 5% раствором лимонной кислоты (1×200 мл), насыщенным NaHCO3 (200 мл), насыщенным раствором хлорида натрия (100 мл) и сушили (MgSO4). Фильтрацией и упариванием растворителя при пониженном давлении получали неочищенный продукт, который очищали посредством флэш-колоночной хроматографии (градиентное элюирование: 90:10 об/об н-гексан/EtOAc до 70:30 об/об н-гексан/EtOAc) с получением бис-енольного трифлата 12 в виде пены желтого цвета (5,5 г, 70%). ЖХ/МС 4,32 мин (ЭР+) m/z (относительная интенсивность) 1139 ([M+Na]+., 20); [α]24D=+271° (c=0,18, CHCl3); 1H ЯМР (400 МГц, CDCl3) δ 7,33 (с, 2H), 7,26 (с, 2H), 7,14 (т, 2H, J=1,97 Гц), 5,51 (д, 2H, J=10,1 Гц), 4,76 (д, 2H, J=10,1 Гц), 4,62 (дд, 2H, J=11,0, 3,69 Гц), 4,32-4,23 (м, 4H), 3,94-3,90 (м, 8H), 3,81-3,64 (м, 4H), 3,16 (ддд, 2H, J=16,3, 11,0, 2,36 Гц), 2,43 (п, 2H, J=5,85 Гц), 1,23-0,92 (м, 4H), 0,02 (с, 18H); 13C ЯМР (100 МГц, CDCl3) δ 167,1, 162,7, 151,9, 148,0, 138,4, 133,6, 120,2, 118,8, 111,9, 107,4, 78,6, 67,5, 65,6, 56,7, 56,3, 30,8, 29,0, 18,4, -1,25; ИК (ATR, CHCl3) 2958, 1690, 1646, 1605, 1517, 1456, 1428, 1360, 1327, 1207, 1136, 1096, 1060, 1022, 938, 913 см-1; МС (ЭР+) m/z (относительная интенсивность) 1144 ([M+28]+., 100), 1117 ([M+H]+., 48), 1041 (40), 578 (8); МСВР [M+H]+.теоретическое C43H54N4O16Si2S2F6 m/z 1117,2491, обнаруженное (ЭР+) m/z 1117,2465.
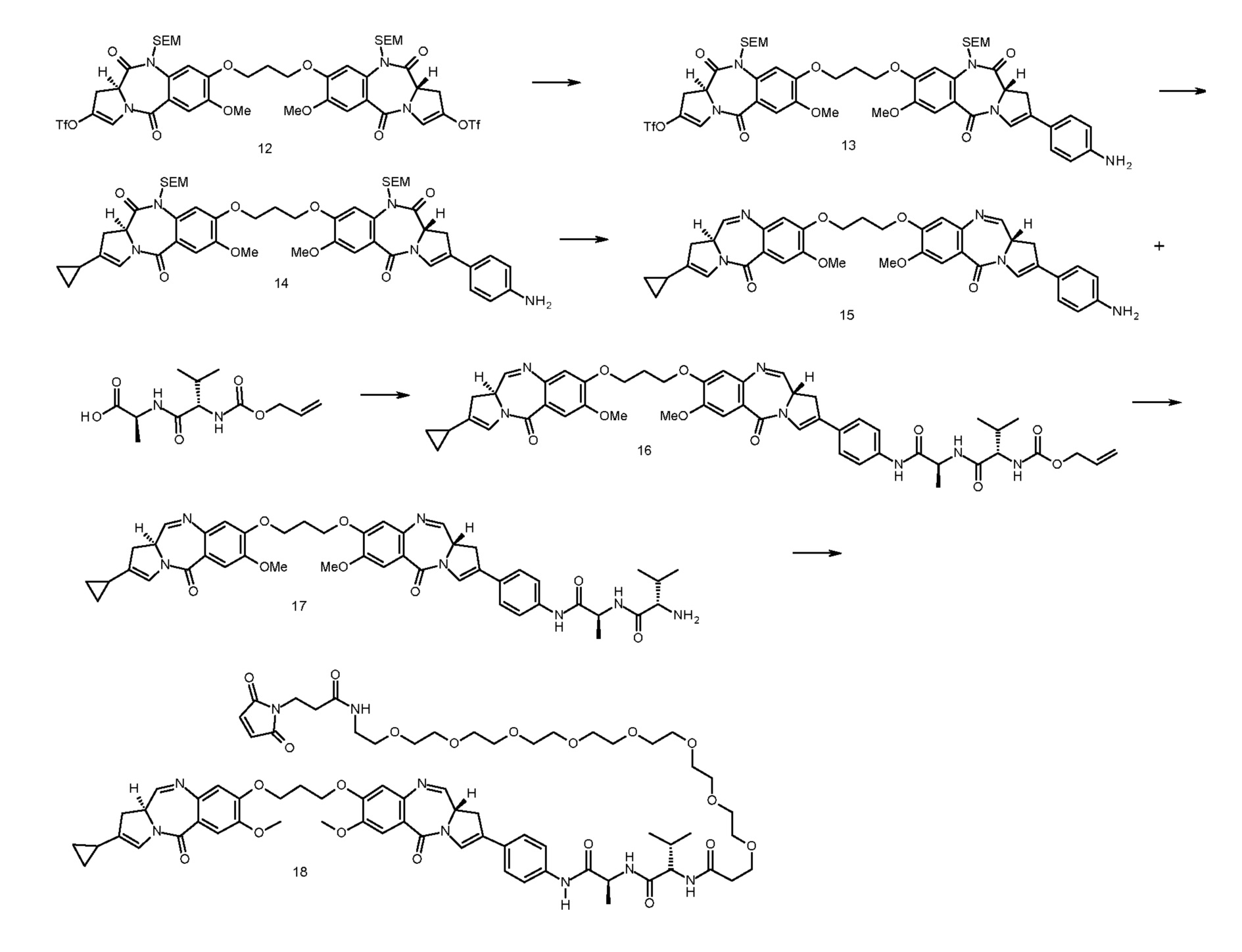
(a) (S)-8-(3-(((S)-2-(4-аминофенил)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил трифторметансульфонат (13)
Pd(PPh3)4 (116,9 мг, 0,101 ммоль) добавляли к перемешиваемой смеси бис-енольного трифлата 12 (5,65 г, 5,06 ммоль), пинаколинового сложного эфира 4-аминофенилбороновой кислоты (1 г, 4,56 ммоль), Na2CO3 (2,46 г, 23,2 ммоль), MeOH (37 мл), толуола (74 мл) и воды (37 мл). Реакционная смесь перемешивалась при 30°C в атмосфере азота в течение 24 часов, после чего весь бороновый сложный эфир потреблялся. Реакционную смесь затем упаривали досуха, перед тем как остаток переносили в EtOAc (150 мл) и промывали H2O (2×100 мл), насыщенным раствором хлорида натрия (150 мл), сушили (MgSO4), отфильтровывали и упаривали при пониженном давлении с получением неочищенного продукта. Очисткой посредством флэш-хроматографии (градиентное элюирование: 80:20 об/об Гексан/EtOAc до 60:40 об/об Гексан/EtOAc) получали продукт 13 в виде желтоватой пены (2,4 г, 45%). ЖХ/МС 4,02 мин (ЭР+) m/z (относительная интенсивность) 1060,21 ([M+H]+., 100); 1H-ЯМР: (CDCl3, 400 МГц) δ 7,40 (с, 1H), 7,33 (с, 1H), 7,27 (шс, 3H), 7,24 (д, 2H, J=8,5 Гц), 7,15 (т, 1H, J=2,0 Гц), 6,66 (д, 2H, J=8,5 Гц), 5,52 (д, 2H, J=10,0 Гц), 4,77 (д, 1H, J=10,0 Гц), 4,76 (д, 1H, J=10,0 Гц), 4,62 (дд, 1H, J=3,7, 11,0 Гц), 4,58 (дд, 1H, J=3,4, 10,6 Гц), 4,29 (т, 4H, J=5,6 Гц), 4,00-3,85 (м, 8H), 3,80-3,60 (м, 4H), 3,16 (ддд, 1H, J=2,4, 11,0, 16,3 Гц), 3,11 (ддд, 1H, J=2,2, 10,5, 16,1 Гц), 2,43 (п, 2H, J=5,9 Гц), 1,1-0,9 (м, 4H), 0,2 (с, 18H). 13C-ЯМР: (CDCl3, 100 МГц) δ 169,8, 168,3, 164,0, 162,7, 153,3, 152,6, 149,28, 149,0, 147,6, 139,6, 134,8, 134,5, 127,9, 127,5, 125,1, 123,21, 121,5, 120,5, 120,1, 116,4, 113,2, 108,7, 79,8, 79,6, 68,7, 68,5, 67,0, 66,8, 58,8, 58,0, 57,6, 32,8, 32,0, 30,3, 19,7, 0,25.
(b) (S)-2-(4-Аминофенил)-8-(3-(((S)-2-циклопропил-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-10-((2-(триметилсилил)этокси)метил)-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-5,11(10H,11aH)-дион (14)
Трифениларсин (0,24 г, 0,8 ммоль), оксид серебра (I) (1,02 г, 4,4 ммоль), циклопропилбороновая кислота (0,47 г, 5,5 ммоль) и исходное вещество 13 (1,15 г, 1,1 ммоль) растворяли в диоксане (30 мл) в атмосфере аргона. Ортофосфат калия (2,8 г, 13,2 ммоль) измельчали с помощью пестика и ступки и быстро добавляли к реакционной смеси. Реакционную смесь вакуумировали и продували аргоном 3 раза и нагревали до 71°C. Добавляли бис-(бензонитрилхлорид) палладия (II) (84 мг, 0,22 ммоль) и реакционный сосуд вакуумировали и продували аргоном 3 раза. Через 10 минут небольшой образц отбирали для анализа посредством ТСХ (80:20 об/об этилацетат/гексан) и ЖХ/МС. Через 30 минут реакция протекала до завершения (ЖХ/МС анализ показал полное потребление исходного вещества) и реакционную смесь отфильтровывали через целит и набивку фильтра промывали этилацетатом (400 мл). Фильтрат промывали водой (2×200 мл) и насыщенным раствором хлорида натрия (2×200 мл). Органический слой сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии на силикагеле (30:70 об/об Гексан/Этилацетат) получали продукт 14 в виде оранжево/желтого твердого вещества (0,66 г, 63%). Способ 1, ЖХ/МС (3,85 мин (ЭР+) m/z (относительная интенсивность) 952,17 ([M+H]+, 100). 1H ЯМР (400 МГц, CDCl3) δ 7,36 (д, 2H, J=8,4 Гц), 7,30 (с, 1H), 7,25-7,19 (м, 4H), 6,68 (с, 1H), 6,62 (д, 2H, J=8,4 Гц), 5,49 (дд, 2H, J=5,6, 10,0 Гц), 4,73 (каж. т, 2H, J=10,8 Гц), 4,54 (дд, 1H, J=3,2, 10,4 Гц), 4,40 (дд,1H, J=3,2, 10,4 Гц), 4,29-4,23 (м, 4H), 3,91-3,85 (м, 7H), 3,80-3,71 (м, 2H), 3,70-3,61 (м, 2H), 3,38-3,32 (м, 1H), 3,12-3,01 (м, 1H), 2,50-2,69 (м, 1H), 2,40 (кв., 2H, J=5,6 Гц), 1,50-1,43 (м, 1H), 0,99-0,71 (м, 6H), 0,54-0,59 (м, 2H), 0,00 (с, 18H) мд.
(c) (S)-2-(4-Аминофенил)-8-(3-(((S)-2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-5(11aH)-он (15)
SEM дилактам 14 (0,66 г, 0,69 ммоль) растворяли в ТГФ (23 мл) и охлаждали до -78°C в атмосфере аргона. Раствор Супер-Гидрида® (1,7 мл, 1M в ТГФ) добавляли по каплям в течение 5 минут, в то же время регистрируя температуру. Через 20 минут отбирали небольшой образец и промывали водой для ЖХ/МС анализа. Добавляли воду (50 мл) и холодную баню удаляли. Органический слой экстрагировали, и промывали насыщенным раствором хлорида натрия (60 мл). Объединенные водные слои промывали CH2Cl2/MeOH (90/10 об/об) (2×50 мл). Объединенные органические слои сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo. Неочищенный продукт растворяли в MeOH (48 мл), CH2Cl2 (18 мл) и воде (6 мл) и добавляли достаточное количество силикагеля с получением густой суспензии. Через 5 дней перемешивания, суспензию отфильтровывали через воронку из спеченного стекла и промывали CH2Cl2/MeOH (9:1) (~ 200 мл) до прекращения элюирования продукта. Органический слой промывали насыщенным раствором хлорида натрия (2×70 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии на силикагеле (100% CHCl3 до 96/4 об/об CHCl3/MeOH) получали продукт 15 в виде твердого вещества желтого цвета (302 мг, 66%). Способ 1, ЖХ/МС (2,42 мин (ЭР+) m/z (относительная интенсивность) 660,74 ([M+H]+, 30). 1H ЯМР (400 МГц, CDCl3) δ 7,86 (д, 1H, J=3,6 Гц), 7,78 (д, 1H, J=3,6 Гц), 7,58-7,44 (м, 3H), 7,34-7,20 (м, 3H), 6,88-6,66 (м, 4H), 4,35-4,15 (м, 6H), 3,95-3,75 (м, 7H), 3,39-3,22 (м, 1H), 3,14-3,04 (м, 1H), 2,93-2,85 (м, 1H), 2,46-2,36 (м, 2H), 1,49-1,41 (м, 1H), 0,80-0,72 (м, 2H), 0,58-0,51 (каж. с, 2H) мд.
(d) Аллил-((2S)-1-(((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (16)
В дегазируемой круглодонной колбе, заполненной аргоном, HO-Ala-Val-alloc (149,6 мг, 0,549 ммоль) и EEDQ (135,8 мг, 0,549 ммоль) растворяли в смеси 9:1 безводный CH2Cl2/MeOH (5 мл). Колбу обертывали алюминиевой фольгой и реакционная смесь перемешивалась при комнатной температуре в течение 1 часа перед добавлением исходного вещества 15 (302 мг, 0,457 ммоль). Реакционную смесь оставляли перемешиваться в течение дополнительных 40 часов при комнатной температуре перед удалением летучих веществ удаляли посредством роторного испарения при пониженном давлении (реакция сопровождалась ЖХ/МС, ВУ исходного вещества 2,32 мин, (ЭР+ 660,29 ([M+H]+, 100)). Неочищенный продукт непосредственно очищали посредством колоночной хроматографии на силикагеле (100% CHCl3 до 90/10 об/об CHCl3/MeOH) с получением чистого продукта (16) с 42% выходом (174 мг). Сапособ 2 ЖХ/МС (2,70 мин (ЭР+) m/z (относительная интенсивность) 914,73 ([M+H]+, 60), 660,43 (60), 184,31 (100)).
(e) (2S)-2-амино-N-((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)-3-метилбутанамид(17)
Исходное вещество 16 (170 мг, 0,185 ммоль) растворяли в безводном CH2Cl2 (5 мл) в круглодонной колбе, заполненной аргоном, перед добавлением пирролидина (41 мкл, 0,21 ммоль). Колбу продували/перезаполняли три раза аргоном перед добавлением Pd(PPh3)4 (14 мг, 0,084 ммоль) и операцию продувки повторяли. Через 1 час, наблюдали полное потебление исходного вещества (реакция сопровождалась ЖХ/МС) и Et2O (50 мл) добавляли к реакционной смеси, перемешивание которой обеспечивали до высвобождения всего продукта из раствора. Твердое вещество отфильтровывали через воронку из спеченного стекла и дважды промывали Et2O (2×25 мл). Сборную колбу заменяли и выделенное твердое вещество растворяли в CHCl3 (100 мл или до тех пор, пока весь продукт не проходил через воронку из спеченного стекла). Летучие вещества затем удаляли посредством роторного испарения при пониженном давлении с получением неочищенного продукта 17, который непосредственно использовали на следующей стадии (168 мг). ЖХ/МС метод 2 (2,70 мин (ЭР+) m/z (относительная интенсивность) 830,27 ([M+H]+, 50), 660,13 (80), 171,15 (100)).
(f) N-((R)-1-(((S)-1-((4-((S)-8-(3-(((S)-2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)-1-(3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропанамидо)-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амид(18 или DL1)
Исходное вещество 17 (154 мг, 0,185 ммоль) и EDCI.HCl (110 мг, 0,185 ммоль) солюбилизировали в безводном CH2Cl2 (5 мл) в круглодонной колбе, продутой и заполненной аргоном. Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа перед добавлением PEG8-малеимида (35,6 мг, 0,185 ммоль), и реакционную смесь перемешивали в течение дополнительных 16 часов (или до завершения реакции, с регистрацией по ЖХ/МС). Реакционный раствор разбавляли CH2Cl2 (50 мл) и органические вещества промывали H2O (50 мл) и насыщенным раствором хлорида натрия (50 мл) перед осушкой MgSO4, отфильтровывали и растворитель удаляли посредством роторного испарения при пониженном давлении с получением неочищенного продукта. Очистка хроматографией на колонке с силикагелем (100% CHCl3 до 85/15 об/об CHCl3/MeOH) давала желательный продукт (135 мг), однако наблюдали оставшиеся следы непрореагировавшего PEG8-малеимида (посредством ЖХ/МС, 2,21 мин, метод 2). С помощью автоматизированной обращено-фазовой хроматографии на силикагеле (H2O/CH3CN) (см. общую информацию по условиям) успешно удаляли примесь, получая чистый конечный продукт (18, 37 мг чистого продукта, исходя из 110 мг, 33%). Суммарный выход = 17%. Метод 2 ЖХ/МС (2,58 мин (ЭР+) m/z (относительная интенсивность) 1404,03 ([M+H]+, 20), 702,63 (100)). 1H ЯМР (400 МГц, CDCl3) δ 7,91 (т, J=3,5 Гц, 1H), 7,80 (д, J=4,0 Гц, 1H), 7,75 (д, J=8,8 Гц, 1H), 7,69 (д, J=8,7 Гц, 1H), 7,54-7,50 (м, 2H), 7,45 (с, 1H), 7,39-7,31 (м, 2H), 6,87 (д, J=10,5 Гц, 2H), 6,76 (с, 1H), 6,72-6,68 (м, 2H), 4,74-4,62 (м, 1H), 4,45-4,17 (м, 7H), 3,95 (с, 3H), 3,94 (с, 3H), 3,67-3,58 (м, 34H), 3,54 (м, 2H), 3,42 (дд, J=10,2, 5,2 Гц, 2H), 3,16-3,07 (м, 1H), 2,92 (дд, J=16,1, 4,1 Гц, 1H), 2,62-2,49 (м, 4H), 2,48-2,39 (м, 2H), 2,37-2,25 (м, 1H), 1,92 (с, 1H), 1,52-1,44 (м, 3H), 1,10-0,93 (м, 6H), 0,79 (дд, J=9,2, 5,3 Гц, 2H), 0,57 (дд, J=9,2, 5,3 Гц, 2H), NH не наблюдали.
C. Синтез Лекарственное средство-Линкер DL1 (Путь 2)

(a) (R)-2-((R)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропановая кислота (20b)
HO-Ala-Val-H 20a (350 мг, 1,86 ммоль) и Na2CO3 (493 мг, 4,65 ммоль) растворяли в дистиллированной H2O (15 мл) и смесь охлаждали до 0°C перед добавлением диоксана (15 мл) (происходило частичное осаждение соли аминокислоты). Раствор Fmoc-Cl (504 мг, 1,95 ммоль) в диоксане (15 мл) добавляли по каплям при интенсивном перемешивании в течение 10 минут. Полученную в результате смесь перемешивали при 0°C в течение 2 часов перед удалением бани со льдом, и перемешивание поддерживали в течение 16 часов. Растворитель удаляли посредством роторного испарения при пониженном давлении, и остаток растворяли в воде (150 мл). pH доводили от 9 до 2 1N HCl и водный слой впоследствии экстрагировали EtOAc (3×100 мл). Объединенные органические вещества промывали насыщенным раствором хлорида натрия (100 мл), сушили MgSO4, отфильтровывали и летучие вещества удаляли посредством роторного испарения при пониженном давлении с получением чистого HO-Ala-Val-Fmoc 20b (746 мг, 97% выход). ЖХ/МС 2,85 мин (ЭР+) m/z (относительная интенсивность) 410,60; 1H-ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=7,77 Гц, 2H), 7,60(д, J=7,77 Гц, 2H), 7,43(д, J=7,5 Гц, 2H), 7,34 (д, J=7,5 Гц, 2H), 6,30 (шс, 1H), 5,30 (шс, 1H), 4,71-7,56 (м, 1H), 4,54-4,36 (м, 2H), 4,08-3,91 (м, 1H), 2,21-2,07 (м, 1H), 1,50 (д, J=7,1 Гц, 3H), 1,06-0,90 (м, 6H).
(b) (9H-флуорен-9-ил)метил ((S)-3-метил-1-оксо-1-(((S)-1-оксо-1-((4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)амино)пропан-2-ил)амино)бутан-2-ил)карбамат (20)
Пинаколиновый сложный эфир 4-Аминофенилбороновой кислоты (146,9 мг, 0,67 ммоль) добавляли к раствору HO-Ala-Val-Fmoc 20b (330 мг, 0,8 ммоль), DCC (166 мг, 0,8 ммоль) и DMAP (5 мг, кат.) в безводном ДХМ (8 мл), предварительно перемешиваемому в течение 30 минут при комнатной температуре в колбе, продутой аргоном. Реакционная смесь затем перемешивалась при комнатной температуре в течение ночи. Реакция сопровождалась ЖХМС и ТСХ. Реакционную смес разбавляли CH2Cl2 и органические вещества промывали H2O и насыщенным раствором хлорида натрия перед осушкой MgSO4, отфильтровывали, и растворитель удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт was dryloaded on a silicagel chromatography column (Гексан/EtOAc, 6:4), и чистый продукт 20 выделяли в виде твердого вещества белого цвета с 88% выходом (360 мг).
(c) 8-(3-((2-(4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)фенил)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил трифторметансульфонат (21)
Бис-трифлат 12 (2,03 г, 1,81 ммоль), пинаколиновый сложный эфир бороновой кислоты (1 г, 1,63 ммоль) и Na2CO3 (881 мг, 8,31 ммоль) растворяли в смеси толуол/MeOH/H2O, 2:1:1 (40 мл). Реакционную колбу продували и заполняли аргоном три раза перед добавлением тетракис(трифенилфосфин)палладия(0) (41 мг, 0,035 ммоль), и реакционную смесь нагревали при 30°C в течение ночи. Растворители удаляли при пониженном давлении, и остаток отбирали в H2O (100 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические фракции промывали насыщенным раствором хлорида натрия (100 мл), сушили MgSO4, отфильтровывали, и летучие вещества удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (Гексан/EtOAc, 8:2 to 25:75) с получением чистого 21 с 33% выходом (885 мг). ЖХ/МС 3,85 мин (ЭР+) m/z (относительная интенсивность) 1452,90; 1H ЯМР (400 МГц, CDCl3) δ 7,78-7,16 (м, 17H), 7,13 (с, 1H), 6,51-6,24 (м, 1H), 5,51 (дд, J=10,0, 5,1 Гц, 2H), 5,36-5,11 (м, 1H), 4,74 (дд,J=10,1, 4,4 Гц, 2H), 4,70-4,53 (м, 2H), 4,47 (д, J=6,4 Гц, 1H), 4,37 (д, J=7,2 Гц, 1H), 4,27 (м, 4H), 4,20-4,14 (м, 1H), 3,90 (с, 3H), 3,89 (с, 3H), 3,77 (ддд, J=16,7, 9,0, 6,4 Гц, 3H), 3,71-3,61 (м, 2H), 3,24-2,91 (м, 3H), 2,55-2,33 (м, 2H), 2,22-2,07 (м, 1H), 1,52-1,37 (м, 3H), 1,04-0,86 (м, 10H), 0,00 (с, 18H).
(d) (9H-флуорен-9-ил)метил((2S)-1-(((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (22)
Трифениларсин (42 мг, 0,137 ммоль) добавляли к смеси PBD-трифлата 21 (250 мг, 0,172 ммоль), циклопропилбороновой кислоты (73,9 мг, 0,86 ммоль), оксида серебра (159 мг, 0,688 ммоль) и ортофосфата калия (438 мг, 2,06 ммоль) в безводном диоксане (10 мл) в атмосфере аргона. Реакционную смесь продували аргоном 3 раза и добавляли хлорид бис(бензонитрил)палладия(II) (13,2 мг, 0,034 ммоль). Реакционную смесь продували аргоном еще 3 раза перед нагревом до 75°C и перемешиванием в течение 10 минут. Реакционную смесь отфильтровывали через подложку с целитом, которую впоследствии промывали этилацетатом. Растворитель удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; 1% метанол/хлороформ). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением желательного продукта 22 (132 мг, 50% выход). ЖХ/МС 3,83 мин (ЭР+) m/z (относительная интенсивность) 1345,91; 1H ЯМР (400 МГц, CDCl3) δ 7,88-7,14 (м, 17H), 6,69 (с, 1H), 6,45-6,25 (м, 1H), 5,57-5,41 (м, 2H), 5,34-5,14 (м, 1H), 4,78-4,67 (м, 2H), 4,62-4,55 (м, 1H), 4,50-4,45 (м, 2H), 4,51-4,44 (м, 1H), 4,31-4,21 (м, 4H), 4,16 (м, 1H), 3,92 (с, 3H), 3,86 (с, 3H), 3,82-3,71 (м, 2H), 3,66 (м, 3H), 3,40-3,28 (м, 1H), 3,07 (м, 1H), 2,70-2,57 (м, 1H), 2,47-2,36 (м, 2H), 2,15 (м, 1H), 1,51-1,40 (м, 3H), 1,03-0,87 (м, 11H), 0,77-0,71 (м, 2H), 0,60-0,54 (м, 2H), 0,00 (т, J=3,0 Гц, 18H).
(e) (9H-флуорен-9-ил)метил((2S)-1-(((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (23)
Раствор Супер-Гидрида® (0,5 мл, 1M в ТГФ) добавляли по каплям к раствору SEM дилактама 22 (265 мг, 0,19 ммоль) в ТГФ (10 мл) при -78°C в атмосфере аргона. Добавление завершали через 5 минут, чтобы поддерживать постоянную внутреннюю температуру реакционной смеси. Через 20 минут, аликвоту гасили водой вод для ЖХ/МС анализа, который показал, что реакция завершилась. Воду (20 мл) добавляли к реакционной смеси, и холодную баню удаляли. Органический слой экстрагировали EtOAc (3×30 мл), и объединенные органические фракции промывали насыщенным раствором хлорида натрия (50 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт растворяли в MeOH (12 мл), CH2Cl2 (6 мл), воде (2 мл) и добавляли достаточное количество силикагеля для образования густой перемешиваемой суспензии. Через 5 дней, суспензию отфильтровывали через воронку из спеченного стекла и промывали CH2Cl2/MeOH (9:1) (200 мл) до завершения элюирования продукта. Органический слой промывали насыщенным раствором хлорида натрия (2×70 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли посредством роторного испарения при пониженном давлении. Очисткой посредством колоночной хроматографии на силикагеле (100% CHCl3 до 96% CHCl3/4% MeOH) получали продукт 23 в виде твердого вещества желтого цвета (162 мг, 78%). ЖХ/МС 3,02 мин (ЭР+) m/z (относительная интенсивность) 1052,37.
(f) (2S)-2-амино-N-((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)-3-метилбутанамид (17)
Добавляли избыточный пиперидин (0,2 мл, 2 ммоль) к раствору SEM-дилактама 23 (76 мг, 0,073 ммоль) в ДМФА (1 мл). Смесь перемешивалась при комнатной температуре в течение 20 мин, после чего реакция проходила полностью (по данным регистрации посредством ЖХ/МС). Реакционную смесь разбавляли CH2Cl2 (75 мл) и органическую фазу промывали H2O (3×75 мл) до полного удаления пиперидина. Органическую фазу сушили над MgSO4, отфильтровывали и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении с получением неочищенного продукта 17, который использовали без дополнительной очистки на следующей стадии. ЖХ/МС 2,32 мин (ЭР+) m/z (относительная интенсивность) 830,00.
(g) N-((2S)-1-(((2S)-1-((4-(8-(3-((2-циклопропил-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)-1-(3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропанамидо)-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амид (18 или DL 1)
EDCI гидрохлорид (14 мг, 0,0732 ммоль) добавляли к суспензии Малеимид-PEG8-кислоты (43,4 мг, 0,0732 ммоль) в безводном CH2Cl2 (5 мл) в атмосфере аргона. Смесь перемешивали в течение 1 часа при комнатной температуре перед добавлением ПБД 17 (60,7 мг, 0,0732 ммоль). Перемешивание поддерживали до полного завершения реакции (обычно 5 часов). Реакционную смесь разбавляли CH2Cl2 и органическую фазу промывали H2O и насыщенным раствором хлорида натрия перед осушкой над MgSO4, отфильтровывали и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении. Продукт очищали посредством тщательной хроматографии на силикагеле (медленное элюирование, начиная с 100% CHCl3 до 9:1 CHCl3/MeOH) с последующей обращено-фазовой хроматографии для удаления непрореагировавшей малеимид-PEG8-кислоты. Продукт 18(DL1) выделяли с выходом 17,6% (21,8 мг). ЖХ/МС 2,57 мин (ЭР+) m/z (относительная интенсивность) 1405,30; 1H ЯМР (400 МГц, CDCl3) δ 7,91 (т, J=3,5 Гц, 1H), 7,80 (д, J=4,0 Гц, 1H), 7,75 (д, J=8,8 Гц, 1H), 7,69 (д, J=8,7 Гц, 1H), 7,54-7,50 (м, 2H), 7,45 (с, 1H), 7,39-7,31 (м, 2H), 6,87 (д, J=10,5 Гц, 2H), 6,76 (с, 1H), 6,72-6,68 (м, 2H), 4,74-4,62 (м, 1H), 4,45-4,17 (м, 7H), 3,95 (с, 3H), 3,94 (с, 3H), 3,67-3,58 (м, 34H), 3,54 (м, 2H), 3,42 (дд, J=10,2, 5,2 Гц, 2H), 3,16-3,07 (м, 1H), 2,92 (дд, J=16,1, 4,1 Гц, 1H), 2,62-2,49 (м, 4H), 2,48-2,39 (м, 2H), 2,37-2,25 (м, 1H), 1,92 (с, 1H), 1,52-1,44 (м, 3H), 1,10-0,93 (м, 6H), 0,79 (дд,J=9,2, 5,3 Гц, 2H), 0,57 (дд, J=9,2, 5,3 Гц, 2H), NH не наблюдали.
D. Синтез Лекарственное средство-Линкер DL2 (Путь 1)

(a) (S)-7-метокси-8-(3-(((S)-7-метокси-2-(4-(4-метилпиперазин-1-ил)фенил)-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил трифторметансульфонат (24)
Pd(PPh3)4 (20,6 мг, 0,018 ммоль) добавляли к перемешиваемой смеси бис-енольного трифлата 12 (500 мг, 0,44 ммоль), N-метилпиперазинборонового сложного эфира (100 мг, 0,4 ммоль), Na2CO3 (218 мг, 2,05 ммоль), MeOH (2,5 мл), толуола (5 мл) и воды (2,5 мл). Реакционная смесь перемешивалась при 30°C в атмосфере азота в течение 24 часов, после чего весь бороновый сложный эфир потреблялся. Реакционную смесь затем упаривали досуха перед тем, как остаток отбирали в EtOAc (100 мл) и промывали H2O (2×50 мл), насыщенным раствором хлорида натрия (50 мл), сушили (MgSO4), отфильтровывали и упаривали при пониженном давлении с получением неочищенного продукта. Очисткой посредством флэш-хроматографии (градиентное элюирование: 80:20 об/об Гексан/EtOAc до 60:40 об/об Гексан/EtOAc) получали продукт 24 в виде желтоватой пены (122,6 мг, 25%).
ЖХ/МС 3,15 мин (ЭР+) m/z (относительная интенсивность) 1144 ([M+H]+, 20%).
(b) (9H-флуорен-9-ил)метил ((S)-1-(((S)-1-((4-((S)-7-метокси-8-(3-(((S)-7-метокси-2-(4-(4-метилпиперазин-1-ил)фенил)-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (25)
PBD-трифлат 24 (359 мг, 0,314 ммоль), пинаколиновый сложный эфир бороновой кислоты 20 (250 мг, 0,408 ммоль) и триэтиламин (0,35 мл, 2,51 ммоль) растворяли в смеси толуол/MeOH/H2O, 2:1:1 (3 мл). Реактор для микроволновой обработки продували и заполненн аргоном три раза перед добавлением тетракис(трифенилфосфин)палладия(0) (21,7 мг, 0,018 ммоль), и реакционную смесь помещали в микроволновую печь при 80°C на 10 минут. Далее, добавляли CH2Cl2 (100 мл) и органические фракции промывали водой (2×50 мл) и насыщенным раствором хлорида натрия (50 мл) перед осушкой над MgSO4, отфильтровывали, и летучие вещества удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (CHCl3/MeOH, 100% до 9:1) с получением чистого 25 (200 мг, 43% выход). ЖХ/МС 3,27 мин (ЭР+) m/z (относительная интенсивность) 1478 ([M+H]+, 100%).
(c) (9H-флуорен-9-ил)метил-((S)-1-(((S)-1-((4-((S)-7-метокси-8-(3-(((S)-7-метокси-2-(4-(4-метилпиперазин-1-ил)фенил)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (26)
Раствор Супер-Гидрида® (0,34 мл, 1M в ТГФ) добавляли по каплям к раствору SEM-дилактама 25 (200 мг, 0,135 ммоль) в ТГФ (5 мл) при -78°C в атмосфере аргона. Добавление проводили в течение 5 минут, чтобы поддерживать постоянной внутреннюю температуру реакционной смеси. Через 20 минут, аликвоту гасили водой для ЖХ/МС анализа, который показал завершение реакции. Воду (20 мл) добавляли к реакционной смеси и холодную баню удаляли. Органический слой экстрагировали with EtOAc (3×30 мл) и объединенные органические вещества промывали насыщенн раствор хлорида натрия (50 мл), сушили MgSO4, отфильтровывали и растворител удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт растворяли в MeOH (6 мл), CH2Cl2 (3 мл), воде (1 мл), и добавляли достаточное количество силикагеля для образования густой перемешиваемой суспензии. Через 5 дней, суспензию отфильтровывали через воронку из спеченного стекла и промывали CH2Cl2/MeOH (9:1) (100 мл) до полного элюирования продукта. Органический слой промывали насыщенным раствором хлорида натрия (2×50 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли посредством роторного испарения при пониженном давлении. Очисткой посредством колоночной хроматографии на силикагеле (100% CHCl3 до 96% CHCl3/ 4% MeOH) получали продукт 26 в виде твердого вещества желтого цвета (100 мг, 63%). ЖХ/МС 2,67 мин (ЭР+) m/z (относительная интенсивность) 1186 ([M+H]+, 5%).
(d) (S)-2-амино-N-((S)-1-((4-((R)-7-метокси-8-(3-(((R)-7-метокси-2-(4-(4-метилпиперазин-1-ил)фенил)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)-3-метилбутанамид (27)
Избыточный пиперидин добавляли (0,1 мл, 1 ммоль) к раствору ПБД 26 (36,4 мг, 0,03 ммоль) в ДМФА (0,9 мл). Смесь перемешивалась при комнатной температуре в течение 20 мин, после чего реакция проходила полностью (по данным регистрации ЖХ/МС). Реакционную смесь разбавляли CH2Cl2 (50 мл), и органическую фазу промывали H2O (3×50 мл) до полного удаления пиперидина. Органическую фазу сушили над MgSO4, отфильтровывали, и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении с получением неочищенного продукта 27, который использовали без дополнительной очистки на следующей стадии. ЖХ/МС 2,20 мин (ЭР+) m/z (относительная интенсивность) 964 ([M+H]+, 5%).
(e) 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-N-((S)-1-(((S)-1-((4-((S)-7-метокси-8-(3-(((S)-7-метокси-2-(4-(4-метилпиперазин-1-ил)фенил)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)гексанамид (28 или DL 2).
EDCI гидрохлорид (4,7 мг, 0,03 ммоль) добавляли к суспензии 6-малеимидогексановой кислоты (6,5 мг, 0,03 ммоль) в безводном CH2Cl2 (3 мл) в атмосфере аргона. Смесь перемешивали в течение 1 часа при комнатной температуре перед добавлением ПБД 27 (34 мг, неочищенного). Перемешивание поддерживали до полного завершения реакции (6 часов). Реакционную смесь разбавляли CH2Cl2 и органическую фазу промывали H2O и насыщенным раствором хлорида натрия перед осушкой над MgSO4, отфильтровывали, и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении. Продукт очищали посреством тщательной хроматографии на силикагеле (медленное элюирование, начиная с 100% CHCl3 до 9:1 CHCl3/MeOH) с последующей обращенно-фазовой хроматографией для удаления непрореагировавшей малеимид-PEG8-кислоты. Продукт 28 выделяли с выходом 41% в две стадии (14,6 мг). ЖХ/МС 2,40 мин (ЭР+) m/z (относительная интенсивность) 1157 ([M+H]+, 5%)
E. Синтез Лекарственное средство-Линкер DL2 (Путь 2)
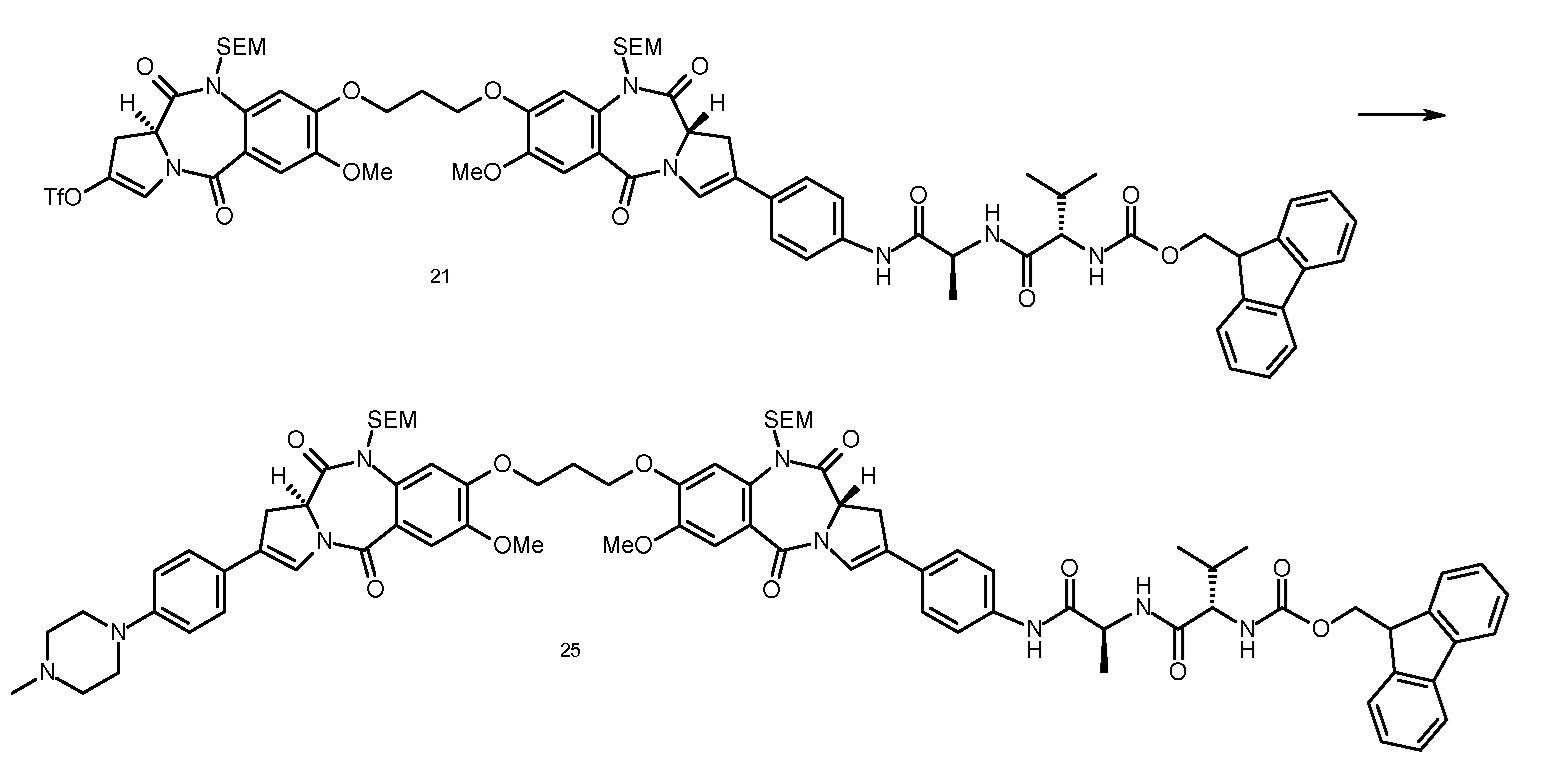
PBD-трифлат 21 (469 мг, 0,323 ммоль), пинаколиновый сложный эфир бороновой кислоты (146,5 мг, 0,484 ммоль) и Na2CO3 (157 мг, 1,48 ммоль) растворяли в смеси толуол/MeOH/H2O, 2:1:1 (10 мл). Реакционную колбу продували аргоном три раза перед добавлением тетракис(трифенилфосфин)палладия(0) (7,41 мг, 0,0064 ммоль), и реакционную смесь нагревали при 30°C в течение ночи. Растворители удаляли при пониженном давлении и остаток отбирали в H2O (50 мл) и экстрагировали EtOAc (3×50 мл). Объединенные органические фракции промывали насыщенным раствором хлорида натрия (100 мл), сушили MgSO4, отфильтровывали, и летучие вещества удаляли посредством роторного испарения при пониженном давлении. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (CHCl3 100% до CHCl3/MeOH 95%:5%) с получением чистого 25 с 33% выходом (885 мг). ЖХ/МС 3,27 мин (ЭР+) m/z (относительная интенсивность) 1478 ([M+H]+, 100%).
F. Синтез Лекарственное средство-Линкер DL3(Путь 1)
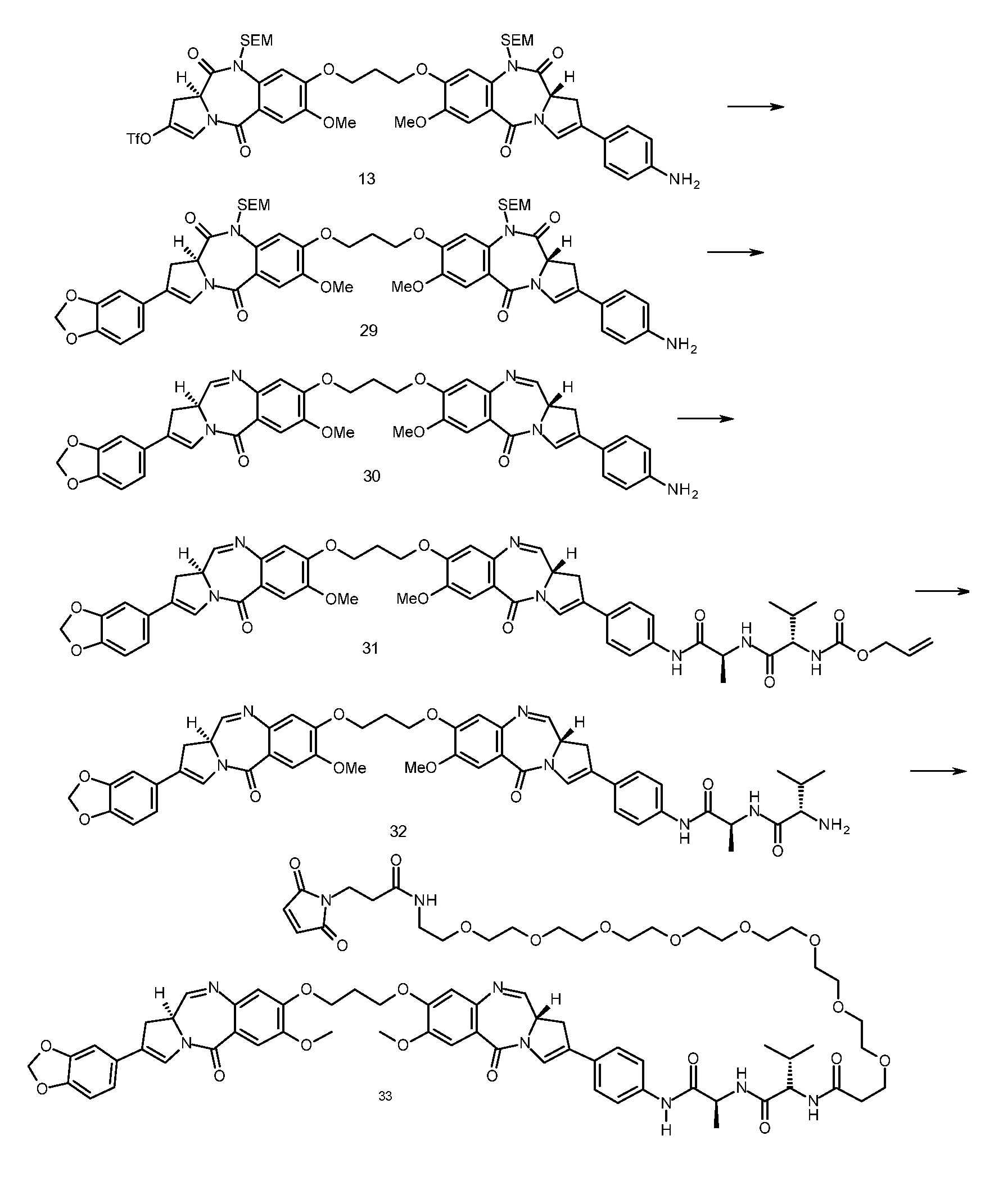
(a) (S)-2-(4-Аминофенил)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-10-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,1-c][1,4]бензодиазепин-5,11(10H,11aH)-дион (29)
3,4-(Метилендиокси)фенилбороновую кислоту (356 мг, 2,1 ммоль, 1,3 эквив.), ТЭА (1,8 мл, 12,9 ммоль, 8 эквив.) и трифлат/анилин 13 (1,75 г, 1,7 ммоль, 1 эквив.) растворяли в смеси этанола (7 мл), толуола (13 мл) и воды (2 мл) под атмосферой Ar. Реакционную смесь вакуумировали и продували Ar 3 раза, перед добавлением тетракис(трифенилфосфин)палладия(0) (114 мг, 0,1 ммоль, 0,06 эквив.). Колбу снова вакуумировали и продували Ar 3 раза и нагревали в микроволновой печи при 80°C в течение 8 минут с 30 секундным времением предварительного перемешивания. Анализ посредством ТСХ (80:20 об/об этилацетат/гексан) показал полное потребление исходного вещества. Реакционную смесь разбавляли дихлорметаном (50 мл) и промывали водой (50 мл). Органический слой сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии на силикагеле (60:40 до 20:80 об/об гексан/этилацетат) получали продукт 29 в виде твердого вещества желтого цвета (1,21 г, 71%). ЖХ/МС (3,92 мин (ЭР+) m/z (относительная интенсивность) 1032,44 ([M+H]+, 100).
(b) (S)-2-(4-Аминофенил)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-1H-пирроло[2,1-c][1,4]бензодиазепин-5(11aH)-он (30)
SEM дилактам 29 (0,25 г, 0,24 ммоль, 1 эквив.) растворяли в ТГФ (8 мл) и охлаждали до -78°C под атмосферой Ar. Супер-Гидрид® (0,6 мл, 1M в ТГФ, 2,5 эквив.) добавляли по каплям в течение 5 минут при регистрации температуры. Через 20 минут отбирали небольшой образец и обрабатывали для ЖХМС-анализа. Добавляли воду (50 мл), холодную баню удаляли, и раствор промывали этилацетатом (50 мл). Органический слой экстрагировали и промывали насыщенным раствором хлорида натрия (60 мл), сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo. Неочищенный продукт растворяли в EtOH (15 мл), CH2Cl2 (7,5 мл) и воде (2,5 мл) и добавляли достаточное количество силикагеля, до образования густой суспензии. Через 5 дней перемешивания, ее отфильтровывали через воронку из спеченного стекла и промывали CH2Cl2/MeOH (9:1) (100 мл) до прекращения элюирования продукта. Органический слой промывали насыщенным раствором хлорида натрия (2×50 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии на силикагеле (CHCl3 с градиентом от 1% до 4% MeOH) получали продукт 30 в виде твердого вещества желтого цвета (94 мг, 53%). ЖХ/МС (2,53 мин (ЭР+) m/z (относительная интенсивность) 739,64 ([M ]+, 70).
(c) Аллил ((S)-1-(((S)-1-((4-((S)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (31)
Под атмосферой Ar, Аланин-Валин-Alloc (180 мг, 0,66 ммоль, 1,2 эквив.) перемешивали с EEDQ (163 мг, 0,66 ммоль, 1,2 эквив.) в безводном CH2Cl2 (21 мл) и метаноле (1 мл) в течение 1 часа. ПБД 30 (407 мг, 0,55 ммоль, 1 эквив.) растворяли в безводном CH2Cl2 (21 мл) и метаноле (1 мл) и добавляли к реакционной смеси. ЖХ/МС через 5 дней перемешивания при комнатной температуре показала образование основного количества продукта. Растворитель удаляли in vacuo перед очисткой посредством колоночной хроматографии (CH2Cl2 с градиентом от 1% до 6% MeOH) с получением продукта 31 в виде твердого вещества желтого цвета (184 мг, 34%). ЖХ/МС (2,95 мин (ЭР+) m/z (относительная интенсивность) 994,95 ([M+H]+, 60).
(d) (S)-2-Амино-N-((S)-1-((4-((S)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)-3-метилбутанамид (32)
Имин 31 (100 мг, 0,1 ммоль, 1 эквив.) растворяли в безводном ДХМ (10 мл) (с помощью одной капли метанола, чтобы помочь растворению) под атмосферой Ar. Пирролидин (30 мкл, 0,15 ммоль, 1,5 эквив.) добавляли по каплям перед вакуумированием колбы, и продували Ar три раза. Pd(PPh3)4 (7 мг, 6 мкмоль, 0,06 эквив.) добавляли, и колбу вакуумировали и продували Ar три раза. ЖХ/МС анализ через 1 час показал образование продукта и полное отсутствие исходного вещества. Et2O (60 мл) добавляли к реакционной смеси, и ее оставляли перемешиваться до выхода всего продукта из раствора. Осадок отфильтровывали через воронку из спеченного стекла и дважды промывали Et2O (2×20 мл). Приемную колбу заменяли и выделеное твердое вещество растворяли и промывали через пористый фильтр с использованием CHCl3 (100 мл). Растворитель удаляли in vacuo с получением неочищенного продукта 32 в виде твердого вещества желтого цвета, которое непосредственно использовали на следующей стадии. ЖХ/МС (1,14 мин (ЭР+) m/z (относительная интенсивность) 910,40 ([M+H]+, 67).
(e) N-((S)-1-(((S)-1-((4-((S)-8-(3-(((S)-2-(Бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)-1-(3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропанамидо)-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амид (33 или DL 3)
Имин 32 (92 мг, 0,1 ммоль, 1,1 эквив.) растворяли в CHCl3 (6 мл) с одной каплей безводного MeOH, чтобы помочь растворению. Добавляли малеимид-PEG8-кислоту (53 мг, 0,09 ммоль, 1 эквив.) с последующим добавлением EEDQ (33 мг, 0,14 ммоль, 1,5 эквив.). Смесь оставляли интенсивно перемешиваться при комнатной температуре под Ar в течение 4 дней пока ЖХ/МС анализ не показал образование основного количества продукта. Растворитель удаляли in vacuo, и неочищенный продукт частично очищали посредством колоночной хроматографии на силикагеле (CHCl3 с градиентом от 1% до 10% MeOH г), получая на выходе 33 (81 мг). Вещество дополнительно очищали посредством прпаративной ВЭЖХ с получением 33 в виде твердого вещества желтого цвета (26,3 мг, 18%). Быстрый анализ с муравьиной кислотой: ЖХ/МС (1,39 мин (ЭР+) m/z (относительная интенсивность) 1485,00 ([M+H]+, 64).
G. Синтез Лекарственное средство-Линкер DL3 (Путь 2)

(a) 9H-Флуорен-9-ил)метил ((S)-1-(((S)-1-((4-((S)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5,11-диоксо-10-((2-(триметилсилил)этокси)метил)-5,10,11,11a-тетрагидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (34)
Трифлат 21 (0,5 г, 0,35 ммоль, 1 эквив.), 3,4-(метилендиокси)фенилбороновую кислоту (75 мг, 0,45 ммоль, 1,3 эквив.) и Na2CO3 (0,17 г, 1,6 ммоль, 4,5 эквив.) растворяли в толуоле (11 мл), EtOH (5,5 мл) и воде (5,5 мл) под атмосферой Ar. Колбу вакуумировали и продували Ar три раза. Добавляли Pd(PPh3)4 (24 мг, 0,02 ммоль, 0,06 эквив.) и колбу снова вакуумировали и продували Ar три раза. Реакционную смесь нагревали до 30oC и оставляли перемешиваться в течение ночи. Анализ посредством ЖХ/МС показал полное отсутствие исходного вещества. Растворитель удаляли in vacuo, и остаток растворяли в воде (60 мл) перед промывкой этилацетатом (60 мл × 3). Объединенные органические слои промывали насыщенным раствором хлорида натрия (50 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии (50:50 до 25:75 об/об гексан/ этилацетат) получали продукт 34 в виде твердого вещества желтого цвета (310 мг, 64%). ЖХ/МС (1,44 мин (ЭР-) m/z (относительная интенсивность) 1423,35 ([M-H]-, 79).
(b) (9H-Флуорен-9-ил)метил ((S)-1-(((S)-1-((4-((S)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (35)
SEM дилактам 34 (0,31 г, 0,22 ммоль, 1 эквив.) растворяли в ТГФ (10 мл) и охлаждали до -78°C под атмосферой Ar. Супер-Гидрид® (0,5 мл, 1M в ТГФ, 2,5 эквив.) добавляли по каплям в течение 5 минут с регистрацией температуры. Через 30 минут отбирали небольшой образец и обрабатывали для ЖХ/МС анализа. Добавляли воду (50 мл), холодную баню удаляли, и раствор промывали этилацетатом (50 мл). Органический слой экстрагировали и промывали насыщенным раствором хлорида натрия (60 мл), сушили MgSO4, отфильтровывали и растворитель удаляли in vacuo. Неочищенный продукт растворяли в EtOH (13,2 мл), CH2Cl2 (6,6 мл) и воде (2,2 мл), и добавляли достаточное количество силикагеля до образования густой суспензии. Через 5 дней перемешивания, ее отфильтровывали через воронку из спеченного стекла и промывали CH2Cl2/MeOH (9:1) (100 мл) до прекращения элюирования продукта. Органический слой промывали насыщенным раствором хлорида натрия (2×50 мл), сушили MgSO4, отфильтровывали, и растворитель удаляли in vacuo. Очисткой посредством колоночной хроматографии на силикагеле (CHCl3 с градиентом от 1% до 4% MeOH) получали чистый продукт 35 в виде твердого вещества желтого цвета (185 мг, 75%). ЖХ/МС (1,70 мин (ЭР+) m/z (относительная интенсивность) 1132,85 ([M+H]+, 60).
(c) (S)-2-Амино-N-((S)-1-((4-((S)-8-(3-(((S)-2-(бензо[d][1,3]диоксол-5-ил)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-8-ил)окси)пропокси)-7-метокси-5-оксо-5,11a-дигидро-1H-пирроло[2,1-c][1,4]бензодиазепин-2-ил)фенил)амино)-1-оксопропан-2-ил)-3-метилбутанамид (32)
Имин 35 (82 мг, 0,07 ммоль, 1 эквив.) растворяли в ДМФА (1 мл) перед медленным добавлением пиперидина (0,2 мл, 2 ммоль, избыток). Этот раствор оставляли перемешиваться при комнатной температуре в течение 20 минут пока ЖХ/МС анализ не показал полное потребление исходного вещества. Реакционную смесь разбавляли CH2Cl2 (50 мл), промывали водой (50 мл × 4), сушили MgSO4, отфильтровывали, и растворитель удаляли in vacuo. Продукт 33 использовали без дополнительной очистки на следующей стадии. ЖХ/МС (1,15 мин (ЭР+) m/z (относительная интенсивность) 910,60 ([M+H]+, 58).
H. Синтез Лекарственное средство-Линкер DL5
(i) (S)-(2-амино-5-метокси-4-((триизопропилсилилсилил)окси)фенил)(2-(((трет-бутилдиметилсилил)окси)метил)-4-метил-2,3-дигидро-1H-пиррол-1-ил)метанон (49)

(a) 5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)бензальдегид (42)
Чистый триизопропилсилилсилилхлорид (56,4 мл, 262 ммоль) добавляли к смеси имидазола (48,7 г, 715,23 ммоль) и 4-гидрокси-5-метокси-2-нитробензальдегида 41 (47 г, 238 ммоль) (измельченным вместе). Смесь нагревали до расплавления фенола и имидазола и их перехода в раствор (100°C). Реакционная смесь перемешивалась в течение 15 минут и затем охлаждалась, при этом наблюдали образование твердого вещества на дне колбы (хлорид имидазола). Реакционную смесь разбавляли смесью 5% EtOAc/гексаны и загружали непосредственно на силикагель, и слой элюировали смесью 5% EtOAc/гексаны, с последующим элюированием смесью 10% EtOAc/гексаны (вследствие низкого избытка, очень немного непрореагировавшего TIPSCl было обнаружено в продукте). Желательный продукт элюировали 5% этилацетата в гексане. Избыточный элюент удаляли посредством роторного испарения при пониженном давлении, с последующей сушкой в условиях высокого вакуума с получением кристаллического чувствительного к свету твердого вещества (74,4 г, 88%). Чистота удовлетворительная по ЖХ/МС (4,22 мин (ЭР+) m/z (относительная интенсивность) 353,88 ([M+H]+, 100)); 1H ЯМР (400 МГц, CDCl3) δ 10,43 (с, 1H), 7,60 (с, 1H), 7,40 (с, 1H), 3,96 (с, 3H), 1,35-1,24 (м, 3H), 1,10 (м, 18H).
(b) 5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)бензойная кислота (43)
Раствор хлорита натрия (47,3 г, 523 ммоль, 80% технически чистый) и одноосновного дигидрофосфата натрия (35,2 г, 293 ммоль) (NaH2PO4) в воде (800 мл) добавляли к раствору соединения 2 (74 г, 209 ммоль) в тетрагидрофуране (500 мл) при комнатной температуре. Пероксид водорода (60% м/м, 140 мл, 2,93 моль) сразу же добавляли к интенсивно перемешиваемой двухфазной смеси. Реакционная смесь выделяла газ (кислород), исходное вещество растворялось, и температура реакционной смеси поднималась до 45°C. Через 30 минут ЖХ/МС показал, что реакция завершилась. Реакционную смесь охлаждали в бане со льдом, и хлористоводородную кислоту (1 M) добавляли, чтобы понизить pH до 3 (было обнаружено, что данная стадия является ненужной во многих случаях, так как pH в конце реакции уже является кислым; рекомендовано проверять pH перед экстракцией). Реакционную смесь затем экстрагировали этилацетатом (1 л), и органические фазы промывали насыщенным раствором хлорида натрия (2×100 мл) и сушили над сульфатом магния. Органическую фазу отфильтровывали, и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении с получением продукта 43 с количественным выходом в виде твердого вещества желтого цвета. ЖХ/МС (3,93 мин (ЭР-) m/z (относительная интенсивность) 367,74 ([M-H]-, 100)); 1H ЯМР (400 МГц, CDCl3) δ 7,36 (с, 1H), 7,24 (с, 1H), 3,93 (с, 3H), 1,34-1,22 (м, 3H), 1,10 (м, 18H).
(c) ((2S,4R)-2-(((трет-бутилдиметилсилил)окси)метил)-4-гидроксипирролидин-1-ил)(5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)фенил)метанон (45)
DCC (29,2 г, 141 ммоль, 1,2 экв) добавляли к раствору кислоты 3 (43,5 г, 117,8 ммоль, 1 экв), и гидрата гидроксибензотриазола (19,8 г, 129,6 ммоль, 1,1 экв) в дихлорметане (200 мл) при 0°C. Холодную баню удаляли и реакция протекала в течение 30 минут при комнатной температуре, после чего быстро добавляли раствор (2S,4R)-2-трет-бутилдиметилсилилоксиметил-4-гидроксипирролидина 44 (30 г, 129,6 ммоль, 1,1 экв) и триэтиламина (24,66 мл, 176 ммоль, 1,5 экв) в дихлорметане (100 мл) при -10°C под аргоном (в большом масштабе, время добавления может быть сокращено посредством даже более дополнительного охлаждения реакционной смеси. Реакционная смесь перемешивалась при комнатной температуре в течение от 40 минут до 1 часа при регистрации ЖХ/МС и ТСХ (EtOAc). Твердые вещества удаляли фильтрацией через целит, и органическую фазу промывали холодным водным 0,1M HCl, пока измеренное значение pH не стаеовилось равным 4 или 5. Органическую фазу затем промывали водой, с последующей промывкой насыщенным водным раствором бикарбонатом натрия и насыщенным раствором хлорида натрия. Органический слой сушили над сульфатом магния, отфильтровывали и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии (силикагель; градиент от 40/60 этилацетат/гексан до 80/20 этилацетат/гексан). Избыток растворителяя удаляли посредством роторного испарения при пониженном давлении с получением чистого продукта 45, (45,5 г чистого продукта 66%, и 17 г слегка загрязненного продукта, всего 90%).ЖХ/МС 4,43 мин (ЭР+) m/z (относительная интенсивность) 582,92 ([M+H]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 7,66 (с, 1H), 6,74 (с, 1H), 4,54 (с, 1H), 4,40 (с, 1H), 4,13 (с, 1H), 3,86 (с, 3H), 3,77 (д, J=9,2 Гц, 1H), 3,36 (дд, J=11,3, 4,5 Гц, 1H), 3,14-3,02 (м, 1H), 2,38-2,28 (м, 1H), 2,10 (ддд, J=13,3, 8,4, 2,2 Гц, 1H), 1,36-1,19 (м, 3H), 1,15-1,05 (м, 18H), 0,91 (с, 9H), 0,17-0,05 (м, 6H), (наличие ротамеров).
(d) (S)-5-(((трет-бутилдиметилсилил)окси)метил)-1-(5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)бензоил)пирролидин-3-он (46)
TCCA (8,82 г, 40 ммоль, 0,7 экв) добавляли к перемешиваемому раствору 45 (31,7 г, 54 ммоль, 1 экв) и TEMPO (0,85 г, 5,4 ммоль, 0,1 экв) в безводном дихлорметане (250 мл) при 0°C. Реакционную смесь интенсивно перемешивали в течение 20 минут, после чего ТСХ (50/50 этилацетат/гексан) показала полное потребление исходного вещества. Реакционную смесь отфильтровывали через целит, и фильтрат промывали водным насыщенным раствором бикарбоната натрия (100 мл), тиосульфатом натрия (9 г в 300 мл), насыщенным раствором хлорида натрия (100 мл) и сушили над сульфатом магния. Роторным испарением при пониженном давлении получали продукт 46 с количественным выходом. ЖХ/МС 4,52 мин (ЭР+) m/z (относительная интенсивность) 581,08 ([M+H]+, 100);
1H ЯМР (400 МГц, CDCl3) δ 7,78-7,60 (м, 1H), 6,85-6,62 (м, 1H), 4,94 (дд, J=30,8, 7,8 Гц, 1H), 4,50-4,16 (м, 1H), 3,99-3,82 (м, 3H), 3,80-3,34 (м, 3H), 2,92-2,17 (м, 2H), 1,40-1,18 (м, 3H), 1,11 (т, J=6,2 Гц, 18H), 0,97-0,75 (м, 9H), 0,15-0,06 (м, 6H), (наличие ротамеров).
(e) (S)-5-(((трет-бутилдиметилсилил)окси)метил)-1-(5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)бензоил)-4,5-дигидро-1H-пиррол-3-ил трифторметансульфонат (47)
Трифторметансульфоновый ангидрид (27,7 мл, 46,4 г, 165 ммоль, 3 экв) инъекционно вводили (при контролируемой температуре) в интенсивно перемешиваемую суспензию кетона 46 (31,9 г, 55 ммоль, 1 экв) в безводном дихлорметане (900 мл) в присутствии 2,6-лутидина (25,6 мл, 23,5 г, 220 ммоль, 4 экв, сушили над ситами) при -50°C (баня ацетон/сухой лед). Реакционная смесь перемешивалась в течение 1,5 часов до того, как ЖХ/МС, после минимальной обработки (вода/дихлорметан), показала завершение реакции. Воду добавляли к еще холодной реакционной смеси, и органический слой отделяли и промывали насыщенным бикарбонатом натрия, насыщенным раствором хлорида натрия и сульфатом магния. Органическую фаз отфильтровывали и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении. Остаток подвергали колоночной флэш-хроматографи (силикагель; 10/90 об/об этилацетат/гексан), удалением избыточного элюента получали продукт 47 (37,6 г, 96%) ЖХ/МС, метод 2, 4,32 мин (ЭР+) m/z (относительная интенсивность) 712,89 ([M+H]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 7,71 (с, 1H), 6,75 (с, 1H), 6,05 (д, J=1,8 Гц, 1H), 4,78 (дд, J=9,8, 5,5 Гц, 1H), 4,15-3,75 (м, 5H), 3,17 (ддд, J=16,2, 10,4, 2,3 Гц, 1H), 2,99 (ддд, J=16,3, 4,0, 1,6 Гц, 1H), 1,45-1,19 (м, 3H), 1,15-1,08 (м, 18H), 1,05 (с, 6H), 0,95-0,87 (м, 9H), 0,15-0,08 (м, 6H).
(f) (S)-(2-(((трет-бутилдиметилсилил)окси)метил)-4-метил-2,3-дигидро-1H-пиррол-1-ил)(5-метокси-2-нитро-4-((триизопропилсилилсилил)окси)фенил)метанон (48)
Трифениларсин (1,71 г, 5,60 ммоль, 0,4 экв) добавляли к смеси трифлата 47 (10,00 г, 14 ммоль, 1 экв), метилбороновой кислоты (2,94 г, 49,1 ммоль, 3,5 экв), оксида серебра (13 г, 56 ммоль, 4 экв) и ортофосфата калия (17,8 г, 84 ммоль, 6 экв) в безводном диоксане (80 мл) в атмосфере аргона. Реакционную смесь продували аргоном 3 раза и добавляли бис(бензонитрил)палладия(II) хлорид (540 мг, 1,40 ммоль, 0,1 экв). Реакционную смесь продували аргоном еще 3 раза перед немедленно проводимым нагревом до 110°C (блок нагрева предварительно нагревали до 110°C перед добавлением колбы). Через 10 минут реакционную смесь охлаждали до комнатной температуры и отфильтровывали через слой целита. Растворитель удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали колоночной флэш-хроматографи (силикагель; 10% этилацетат/гексан). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 48 (4,5 г, 55%). ЖХ/МС, 4,27 мин (ЭР+) m/z (относительная интенсивность) 579,18 ([M+H]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 7,70 (с, 1H), 6,77 (с, 1H), 5,51 (д, J=1,7 Гц, 1H), 4,77-4,59 (м, 1H), 3,89 (с, 3H), 2,92-2,65 (м, 1H), 2,55 (д, J=14,8 Гц, 1H), 1,62 (д, J=1,1 Гц, 3H), 1,40-1,18 (м, 3H), 1,11 (с, 9H), 1,10 (с, 9H), 0,90 (с, 9H), 0,11 (д, J=2,3 Гц, 6H).
(g) (S)-(2-амино-5-метокси-4-((триизопропилсилилсилил)окси)фенил)(2-(((трет-бутилдиметилсилил)окси)метил)-4-метил-2,3-дигидро-1H-пиррол-1-ил)метанон (49)
Порошок цинка (28 г, 430 ммоль, 37 экв) добавляли к раствору соединения 48 (6,7 г, 11,58 ммоль) в 5% муравьиной кислоте в этаноле об/об (70 мл) при приблизительно 15°C. Полученную в результате экзотермическую реакцию контролировали, используя баню со льдом для поддержания температуры реакционной смеси ниже 30°C. Через 30 минут реакционную смесь отфильтровывали через подложку с целитом. Фильтрат разбавляли этилацетатом, и органическую фазу промывали водой, насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; 10% этилацетат в гексане). Чистые фракции собирали и объединяли, и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении с получением продукта 49 (5,1 г, 80%). ЖХ/МС, 4,23 мин (ЭР+) m/z (относительная интенсивность) 550,21 ([M+H]+., 100); 1H ЯМР (400 МГц, CDCl3) δ 7,28 (с, 1H), 6,67 (с, 1H), 6,19 (с, 1H), 4,64-4,53 (м, J=4,1 Гц, 1H), 4,17 (с, 1H), 3,87 (с, 1H), 3,77-3,69 (м, 1H), 3,66 (с, 3H), 2,71-2,60 (м, 1H), 2,53-2,43 (м, 1H), 2,04-1,97 (м, J=11,9 Гц, 1H), 1,62 (с, 3H), 1,26-1,13 (м, 3H), 1,08-0,99 (м, 18H), 0,82 (с, 9H), 0,03-0,03 (м, J=6,2 Гц, 6H).
(ii) (11S,11aS)-аллил-11-((трет-бутилдиметилсилил)окси)-8-((5-йодопентил)окси)-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат
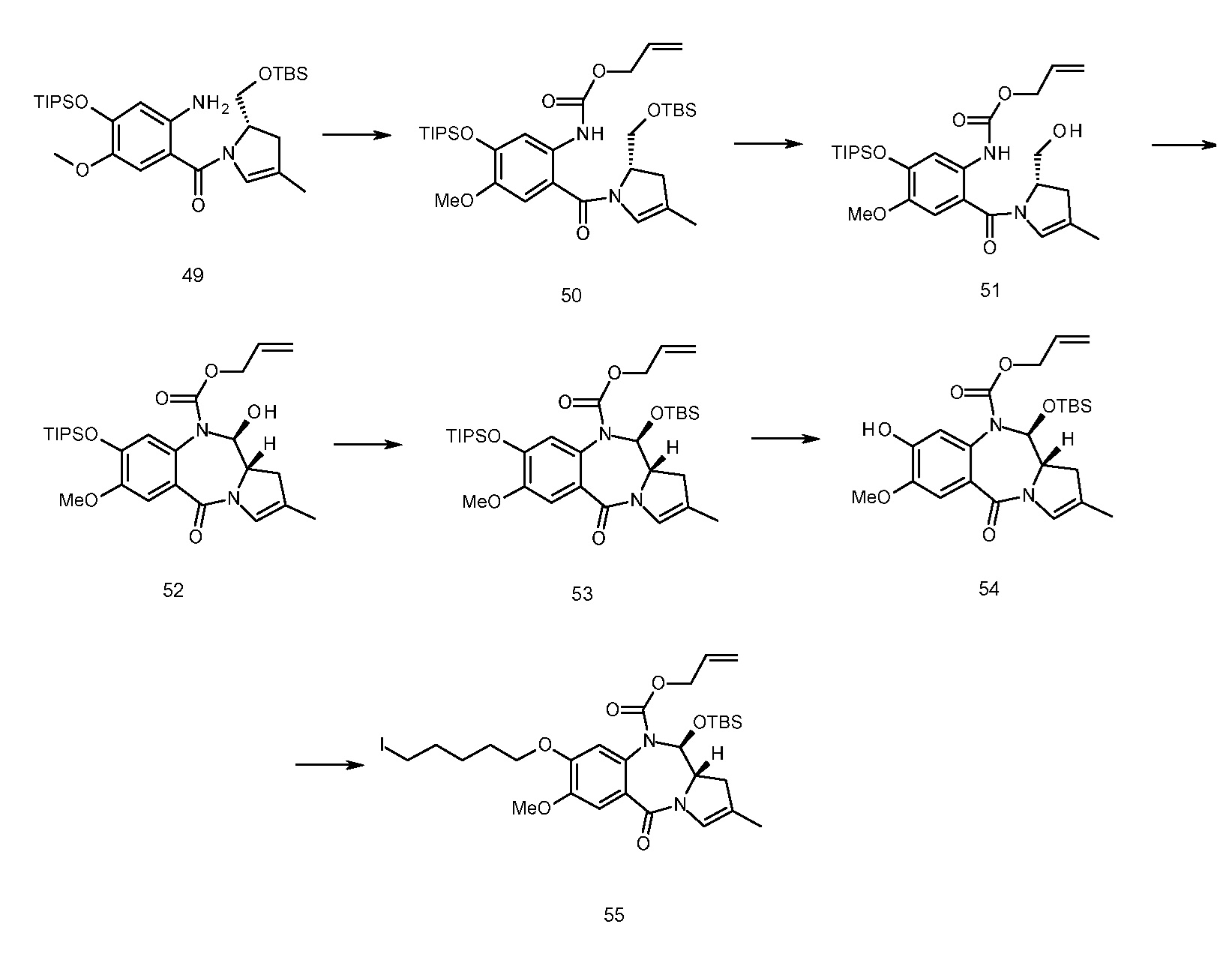
(a) (S)-аллил (2-(2-(((трет-бутилдиметилсилил)окси)метил)-4-метил-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамат (50)
Аллилхлорформиат (0,30 мл, 3,00 ммоль, 1,1 экв) добавляли к раствору амина 49 (1,5 г, 2,73 ммоль) в присутствии безводного пиридина (0,48 мл, 6,00 ммоль, 2,2 экв) в безводном дихлорметане (20 мл) при -78°C (баня ацетон/сухой лед). Через 30 минут, баню удаляли, и реакционную смесь нагревали до комнатной температуры. Реакционную смес разбавляли дихлорметаном и добавляли насыщенный водный сульфат меди. Органический слой затем последовательно промывали насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыточный растворитель удаляли посредством роторного испарения при пониженном давлении с получением продукта 50, который непосредственно использовали в следующей реакции. ЖХ/МС, 4,45 мин (ЭР+) m/z (относительная интенсивность) 632,91 ([M+H]+, 100)
(b) (S)-аллил (2-(2-(гидроксиметил)-4-метил-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамат (51)
Неочищенный 50 растворяли в 7:1:1:2 смеси из уксусной кислоты/метанола/тетрагидрофурана/воды (28:4:4:8 мл) и перемешивали при комнатной температуре. Через 3 часов, полное исчезновение исходного вещества наблюдали посредством ЖХ/МС. Реакционную смесь разбавляли этилацетатом и последовательно промывали водой (2×500 мл), насыщенным водным бикарбонатом натрия (200 мл) и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали и избыточный этилацетат удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель, 25% этилацетат в гексане). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением желательного продукта 51 (1 г, 71%). ЖХ/МС, 3,70 мин (ЭР+) m/z (относительная интенсивность) 519,13 ([M+H]+, 95); 1H ЯМР (400 МГц, CDCl3) δ 8,34 (с, 1H), 7,69 (с, 1H), 6,78 (с, 1H), 6,15 (с, 1H), 5,95 (ддт, J=17,2, 10,5, 5,7 Гц, 1H), 5,33 (дкв, J=17,2, 1,5 Гц, 1H), 5,23 (ддд, J=10,4, 2,6, 1,3 Гц, 1H), 4,73 (тт, J=7,8, 4,8 Гц, 1H), 4,63 (дт, J=5,7, 1,4 Гц, 2H), 4,54 (с, 1H), 3,89-3,70 (м, 5H), 2,87 (дд, J=16,5, 10,5 Гц, 1H), 2,19 (дд, J=16,8, 4,6 Гц, 1H), 1,70 (д, J=1,3 Гц, 3H), 1,38-1,23 (м, 3H), 1,12 (с, 10H), 1,10 (с, 8H).
(c) (11S,11aS)-аллил 11-гидрокси-7-метокси-2-метил-5-оксо-8-((триизопропилсилилсилил)окси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (52)
Диметилсульфоксид (0,35 мл, 4,83 ммоль, 2,5 экв) добавляли по каплям к раствору оксалилхлорида (0,2 мл, 2,32 ммоль, 1,2 экв) в безводном дихлорметане (10 мл) при -78°C (баня сухой лед/ацетон) в атмосфере аргона. Через 10 минут раствор 51 (1 г, 1,93 ммоль) в безводном дихлорметане (8 мл) медленно добавляли при температуре, находящейся еще при -78°C. Через 15 мин добавляли по каплям триэтиламин (1,35 мл, высушенный над молекулярными ситами 4Å, 9,65 ммоль, 5 экв) и баню сухой лед/ацетон. Реакционная смесь достигала комнатной температуры и ее экстрагировали холодной хлористоводородной кислотой (0,1 M), насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали и избыточный дихлорметан удаляли посредством роторного испарения при пониженном давлении с получением продукта 52 (658 мг, 66%). ЖХ/МС, 3,52 мин (ЭР+) m/z (относительная интенсивность) 517,14 ([M+H]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 7,20 (с, 1H), 6,75-6,63 (м, J=8,8, 4,0 Гц, 2H), 5,89-5,64 (м, J=9,6, 4,1 Гц, 2H), 5,23-5,03 (м, 2H), 4,68-4,38 (м, 2H), 3,84 (с, 3H), 3,83-3,77 (м, 1H), 3,40 (с, 1H), 3,05-2,83 (м, 1H), 2,59 (д, J=17,1 Гц, 1H), 1,78 (д, J=1,3 Гц, 3H), 1,33-1,16 (м, 3H), 1,09 (д, J=2,2 Гц, 9H), 1,07 (д, J=2,1 Гц, 9H).
(d) (11S, 11aS)-аллил-11-((трет-бутилдиметилсилил)окси)-7-метокси-2-метил-5-оксо-8-((триизопропилсилилсилил)окси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (53)
Трет-бутилдиметилсилилтрифлат (0,70 мл, 3,00 ммоль, 3 экв) добавляли к раствору соединения 52 (520 мг, 1,00 ммоль) и 2,6-лутидина (0,46 мл, 4,00 ммоль, 4 экв) в безводном дихлорметане (40 мл) при 0°C под аргоном. Через 10 мин, холодную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали водой, насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали и, избыток удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; градиент, 10% этилацетат в гексане до 20% этилацетата в гексане). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 53 (540 мг, 85%). ЖХ/МС, 4,42 мин (ЭР+) m/z (относительная интенсивность) 653,14 ([M+Na]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 7,20 (с, 1H), 6,71-6,64 (м, J=5,5 Гц, 2H), 5,83 (д, J=9,0 Гц, 1H), 5,80-5,68 (м, J=5,9 Гц, 1H), 5,14-5,06 (м, 2H), 4,58 (дд, J=13,2, 5,2 Гц, 1H), 4,36 (дд, J=13,3, 5,5 Гц, 1H), 3,84 (с, 3H), 3,71 (тд, J=10,1, 3,8 Гц, 1H), 2,91 (дд, J=16,9, 10,3 Гц, 1H), 2,36 (д, J=16,8 Гц, 1H), 1,75 (с, 3H), 1,31-1,16 (м, 3H), 1,12-1,01 (м, J=7,4, 2,1 Гц, 18H), 0,89-0,81 (м, 9H), 0,25 (с, 3H), 0,19 (с, 3H).
(e) (11S,11aS)-аллил-11-((трет-бутилдиметилсилил)окси)-8-гидрокси-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (54)
Ацетат лития (87 мг, 0,85 ммоль) добавляли к раствору соединения 53 (540 мг, 0,85 ммоль) во влажном диметилформамиде (6 мл, 50:1 ДМФА/вод). Через 4 часов, реакция проходила полностью, и реакционную смесь разбавляли этилацетатом (25 мл) и промывали водным раствором лимонной кислоты (pH~3), водой и насыщенным раствором хлорида натрия. Органический слой сушили над сульфатом магния отфильтровывали, и избыток этилацетата удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; градиент, 25% до 75% этилацетата в гексане). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 54 (400 мг, количественный выход). ЖХ/МС, (3,33 мин (ЭР+) m/z (относительная интенсивность)475,26 ([M+H]+, 100).
(f) (11S,11aS)-аллил-11-((трет-бутилдиметилсилил)окси)-8-((5-йодопентил)окси)-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (55)
Дийодопентан (0,63 мл, 4,21 ммоль, 5 экв) и карбонат калия (116 мг, 0,84 ммоль, 1 экв) добавляли к раствору фенола 54 (400 мг, 0,84 ммоль) в ацетоне (4 мл, высушенному над молекулярными ситами). Реакционную смесь затем нагревали до 60°C и перемешивали в течение 6 часов. Ацетон удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; 50/50, об/об, гексан/этилацетат). Чистые фракции собирали и объединяли, и избыточный элюент удаляли с получением 55 с 90% выходом. ЖХ/МС, 3,90 мин (ЭР+) m/z (относительная интенсивность) 670,91 ([M]+, 100). 1H ЯМР (400 МГц, CDCl3) δ 7,23 (с, 1H), 6,69 (с, 1H), 6,60 (с, 1H), 5,87 (д, J=8,8 Гц, 1H), 5,83-5,68 (м, J=5,6 Гц, 1H), 5,15-5,01 (м, 2H), 4,67-4,58 (м, 1H), 4,45-4,35 (м, 1H), 4,04-3,93 (м, 2H), 3,91 (с, 3H), 3,73 (тд, J=10,0, 3,8 Гц, 1H), 3,25-3,14 (м, J=8,5, 7,0 Гц, 2H), 2,92 (дд, J=16,8, 10,3 Гц, 1H), 2,38 (д, J=16,8 Гц, 1H), 1,95-1,81 (м, 4H), 1,77 (с, 3H), 1,64-1,49 (м, 2H), 0,88 (с, 9H), 0,25 (с, 3H), 0,23 (с, 3H).
(iii) (11S,11aS)-4-(2-(1-((1-(аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил 11-((трет-бутилдиметилсилил)окси)-8-гидрокси-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (70)

(a) Аллил 3-(2-(2-(4-((((2-((S)-2-(((трет-бутилдиметилсилил)окси)метил)-4-метил-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамоил)окси)метил)фенил)гидразинил)пропанамидо)-4-метил-2-оксопентаноат (56)
Триэтиламин (2,23 мл, 18,04 ммоль, 2,2 экв) добавляли к перемешиваемому раствору амина 49 (4 г, 8,20 ммоль) и трифосгена (778 мг, 2,95 ммоль, 0,36 экв) в безводном тетрагидрофуране (40 мл) при 5°C (баня со льдом). Протекание изоцтанатной реакции регистрировали, посредством периодического удаления аликвот из реакционн смеси и гашением метанолом с проведением ЖХ/МС анализа. Как только образование цианата полностью завершалось, раствор alloc-Val-Ala-PABOH (4,12 г, 12,30 ммоль, 1,5 экв) и триэтиламина (1,52 мл, 12,30 ммоль, 1,5 экв) в безводном тетрагидрофуране (40 мл) быстро добавляли посредством инъекции к свежеполученному изоцианату. Реакционная смесь перемешивалась при 40°C в течение 4 часов. Избыток растворителяя удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; градиент, 1% метанола до 5% метанола в дихлорметане). (Альтернативные условия хроматографии с использованием EtOAc и Гексана также были удачными). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 56 (3,9 г, 50%). ЖХ/МС, 4,23 мин (ЭР+) m/z (относительная интенсивность) 952,36 ([M+H]+, 100); 1H ЯМР (400 МГц, CDCl3) δ 8,62 (шир с, 1H), 8,46 (с, 1H), 7,77 (шир с, 1H), 7,53 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,5 Гц, 2H), 6,76 (с, 1H), 6,57 (д, J=7,6 Гц, 1H), 6,17 (с, 1H), 6,03-5,83 (м, 1H), 5,26 (дд, J=33,8, 13,5 Гц, 3H), 5,10 (с, 2H), 4,70-4,60 (м, 2H), 4,58 (дд, J=5,7, 1,3 Гц, 2H), 4,06-3,99 (м, 1H), 3,92 (с, 1H), 3,82-3,71 (м, 1H), 3,75 (с, 3H), 2,79-2,64 (м, 1H), 2,54 (д, J=12,9 Гц, 1H), 2,16 (дкв, J=13,5, 6,7 Гц, 1H), 1,67 (с, 3H), 1,46 (д, J=7,0 Гц, 3H), 1,35-1,24 (м, 3H), 1,12 (с, 9H), 1,10 (с, 9H), 0,97 (д, J=6,8 Гц, 3H), 0,94 (д, J=6,8 Гц, 3H), 0,87 (с, 9H), 0,07--0,02 (м, 6H).
(b) Аллил 3-(2-(2-(4-((((2-((S)-2-(гидроксиметил)-4-метил-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамоил)окси)метил)фенил)гидразинил)пропанамидо)-4-метил-2-оксопентаноат (57)
TBS-эфир 56 (1,32 г, 1,38 ммоль) растворяли в 7:1:1:2 смеси из уксусной кислоты/метанола/тетрагидрофурана/воды (14:2:2:4 мл) и перемешивали при комнатной температуре. Через 3 часа никакого исходного вещества не наблюдали посредством ЖХ/МС. Реакционную смесь разбавляли этилацетатом (25 мл) и последовательно промывали водой, насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыток этилацетата удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель, 2% метанол в дихлорметане). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением желательного продукта 57 (920 мг, 80%). ЖХ/МС, 3,60 мин (ЭР+) m/z (относительная интенсивность)838,18 ([M+H]+, 100), 1H ЯМР (400 МГц, CDCl3) δ 8,55 (с, 1H), 8,35 (с, 1H), 7,68 (с, 1H), 7,52 (д, J=8,1 Гц, 2H), 7,31 (д, J=8,4 Гц, 2H), 6,77 (с, 1H), 6,71 (д, J=7,5 Гц, 1H), 6,13 (с, 1H), 5,97-5,82 (м, J=5,7 Гц, 1H), 5,41-5,15 (м, 3H), 5,10 (д, J=3,5 Гц, 2H), 4,76-4,42 (м, 5H), 4,03 (т, J=6,6 Гц, 1H), 3,77 (с, 5H), 2,84 (дд, J=16,7, 10,4 Гц, 1H), 2,26-2,08 (м, 2H), 1,68 (с, 3H), 1,44 (д, J=7,0 Гц, 3H), 1,30 (дт, J=14,7, 7,4 Гц, 3H), 1,12 (с, 9H), 1,10 (с, 9H), 0,96 (д, J=6,8 Гц, 3H), 0,93 (д, J=6,8 Гц, 3H).
(c) (11S,11aS)-4-(2-(1-((1-(аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил-11-гидрокси-7-метокси-2-метил-5-оксо-8-((триизопропилсилилсилил)окси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (58)
Диметилсульфоксид (0,2 мл, 2,75 ммоль, 2,5 экв) добавляли по каплям к раствору оксалилхлорида (0,11 мл, 1,32 ммоль, 1,2 экв) в безводном дихлорметане (7 мл) при -78°C (баня сухой лед/ацетон) под атмосферой аргона. Через 10 минут раствор 57 (920 мг, 1,10 ммоль) в безводном дихлорметане (5 мл) медленно добавляли при температуре, все еще при -78°C. Через 15 мин триэтиламин (0,77 мл, высушенный над молекулярными ситами 4Å, 5,50 ммоль, 5 экв) добавляли по каплям и баню сухой лед/ацетон удаляли. Реакционная смесь достигала комнатной температуры, и ее экстрагировали холодной хлористоводородной кислотой (0,1 M), насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали и избыток дихлорметана удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали колоночной флэш-хроматографи (силикагель; градиент 2% метанола до 5% метанола в дихлорметане). Чистые фракции собирали и объединяли и при удалении избыточного элюента посредством роторного испарения при пониженном давлении получали продукт 58 (550 мг, 60%). ЖХ/МС, 3,43 мин (ЭР+) m/z (относительная интенсивность)836,01 ([M]+, 100). 1H ЯМР (400 МГц, CDCl3) δ 8,39 (с, 1H), 7,52-7,40 (м, 2H), 7,21-7,08 (м, J=11,5 Гц, 2H), 6,67 (с, 1H), 6,60-6,47 (м, J=7,4 Гц, 1H), 5,97-5,83 (м, 1H), 5,79-5,66 (м, 1H), 5,38-4,90 (м, 6H), 4,68-4,52 (м, J=18,4, 5,5 Гц, 4H), 4,04-3,94 (м, J=6,5 Гц, 1H), 3,87-3,76 (м, 5H), 3,00-2,88 (м, 1H), 2,66-2,49 (м, 2H), 2,21-2,08 (м, 2H), 1,76 (с, 3H), 1,45 (д, J=7,0 Гц, 3H), 1,09-0,98 (м, J=8,9 Гц, 18H), 0,96 (д, J=6,7 Гц, 3H), 0,93 (д, J=6,9 Гц, 3H).
(d) (11S,11aS)-4-(2-(1-((1-(Аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил-11-((трет-бутилдиметилсилил)окси)-7-метокси-2-метил-5-оксо-8-((триизопропилсилилсилил)окси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (59)
Трет-бутилдиметилсилилтрифлат (0,38 мл, 1,62 ммоль, 3 экв) добавляли к раствору соединения 58 (450 мг, 0,54 ммоль) и 2,6-лутидина (0,25 мл, 2,16 ммоль, 4 экв) в безводном дихлорметане (5 мл) при 0°C под аргоном. Через 10 мин, холодную баню удаляли, и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали водой, насыщенным водным бикарбонатом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыток растворителя удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали колоночной флэш-хроматографи (силикагель; 50/50 об/об гексан/этилацетат). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 59 (334 мг, 65%). ЖХ/МС, 4,18 мин (ЭР+) m/z (относительная интенсивность)950,50 ([M]+, 100). 1H ЯМР (400 МГц, CDCl3) δ 8,53 (с, 1H), 8,02 (с, 1H), 7,44 (д, J=7,6 Гц, 2H), 7,21 (с, 1H), 7,08 (д, J=8,2 Гц, 2H), 6,72-6,61 (м, J=8,9 Гц, 2H), 6,16 (с, 1H), 5,97-5,79 (м, J=24,4, 7,5 Гц, 2H), 5,41-5,08 (м, 5H), 4,86 (д, J=12,5 Гц, 1H), 4,69-4,60 (м, 1H), 4,57 (с, 1H), 4,03 (т, J=6,7 Гц, 1H), 3,87 (с, 3H), 3,74 (тд, J=9,6, 3,6 Гц, 1H), 2,43-2,09 (м, J=34,8, 19,4, 11,7 Гц, 3H), 1,76 (с, 3H), 1,43 (д, J=6,9 Гц, 3H), 1,30-1,21 (м, 3H), 0,97 (д, J=6,7 Гц, 3H), 0,92 (т, J=8,4 Гц, 3H), 0,84 (с, 9H), 0,23 (с, 3H), 0,12 (с, 3H).
(e) (11S,11aS)-4-(2-(1-((1-(Аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил 11-((трет-бутилдиметилсилил)окси)-8-гидрокси-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (60)
Ацетат лития (50 мг, 0,49 ммоль) добавляли к раствору соединения 59 (470 мг, 0,49 ммоль) во влажном диметилформамиде (4 мл, 50:1 ДМФА/вода). Через 4 часа, реакция проходила полностью, и реакционную смесь разбавляли этилацетатом и промывали лимонной кислотой (pH~3), водой и насыщенным раствором хлорида натрия. Органический слой сушили над сульфатом магния, отфильтровывали, и избыток этилацетата удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали колоночной флэш-хроматографи (силикагель; градиент, 50/50 до 25/75 об/об гексан/этилацетат). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 60 (400 мг, количественный выход). ЖХ/МС, 3,32 мин (ЭР+) m/z (относительная интенсивность)794,18 ([M+H]+, 100). 1H ЯМР (400 МГц, CDCl3) δ 8,53 (с, 1H), 8,02 (с, 1H), 7,44 (д, J=7,6 Гц, 2H), 7,21 (с, 1H), 7,08 (д, J=8,2 Гц, 2H), 6,72-6,61 (м, J=8,9 Гц, 2H), 6,16 (с, 1H), 5,97-5,79 (м, J=24,4, 7,5 Гц, 2H), 5,41-5,08 (м, 5H), 4,86 (д, J=12,5 Гц, 1H), 4,69-4,60 (м, 1H), 4,57 (с, 1H), 4,03 (т, J=6,7 Гц, 1H), 3,87 (с, 3H), 3,74 (тд, J=9,6, 3,6 Гц, 1H), 2,43-2,09 (м, J=34,8, 19,4, 11,7 Гц, 3H), 1,76 (с, 3H), 1,43 (д, J=6,9 Гц, 3H), 1,30-1,21 (м, 3H), 0,97 (д, J=6,7 Гц, 3H), 0,92 (т, J=8,4 Гц, 3H), 0,84 (с, 9H), 0,23 (с, 3H), 0,12 (с, 3H).
(iv) (11S,11aS)-4-((2S,5S)-37-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-5-изопропил-2-метил-4,7,35-триоксо-10,13,16,19,22,25,28,31-октаокса-3,6,34-триазагептатриаконтанамидо)бензил-11-гидрокси-7-метокси-8-((5-(((S)-7-метокси-2-метил-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пентил)окси)-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (64)

(a) (11S)-аллил 8-((5-(((11S)-10-(((4-(2-(1-((1-(аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил)окси)карбонил)-11-((трет-бутилдиметилсилил)окси)-7-метокси-2-метил-5-оксо-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пентил)окси)-11-((трет-бутилдиметилсилил)окси)-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (61)
Карбонат калия (70 мг, 0,504 ммоль, 1 экв) добавляли к раствору 55 (370 мг, 0,552 ммоль, 1,2 экв) и фенола 60 (400 мг, 0,504 ммоль) в безводном ацетоне (25 мл). Реакционную смесь перемешивали 8 часов при 70°C. ЖХ/МС показала, что исходное вещество не было израсходовано, так, что обеспечивали перемешивание реакционной смеси в течение ночи при комнатной температуре и перемешивание продолжали в течение дополнительных 2 часов на следующий день. Ацетон удаляли посредством роторного испарения при пониженном давлении. полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; 80% этилацетат в гексане до 100% этилацетата). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением продукта 61 (385 мг, 57%). ЖХ/МС, 4,07 мин (ЭР+) m/z (относительная интенсивность)1336,55 ([M+H]+, 50).
(b) (11S)-аллил-8-((5-(((11S)-10-(((4-(2-(1-((1-(аллилокси)-4-метил-1,2-диоксопентан-3-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил)окси)карбонил)-11-гидрокси-7-метокси-2-метил-5-оксо-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пентил)окси)-11-гидрокси-7-метокси-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (62)
Фторид тетра-н-бутиламмония (1M, 0,34 мл, 0,34 ммоль, 2 экв) добавляли к раствору 61 (230 мг, 0,172 ммоль) в безводном тетрагидрофуране (3 мл). Исходное вещество полностью потреблялось через 10 минут. Реакционную смесь разбавляли этилацетатом (30 мл) и последовательно промывали водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыток этилацетата удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток 62 использовали в виде неочищенной смеси для следующей реакции. ЖХ/МС, 2,87 мин (ЭР+) m/z (относительная интенсивность) 1108,11 ([M+H]+, 100).
(c) (11S)-4-(2-(1-((1-амино-3-метил-1-оксобутан-2-ил)амино)-1-оксопропан-2-ил)гидразинил)бензил 11-гидрокси-7-метокси-8-((5-((7-метокси-2-метил-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пентил)окси)-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (63)
Тетракис(трифенилфосфин)палладий(0) (12 мг, 0,01 ммоль, 0,06 экв) добавляли к раствору неочищенного 62 (0,172 ммоль) и пирролидина (36 мкл, 0,43 ммоль, 2,5 экв) в безводном дихлорметане (10 мл). Реакционную смесь перемешивали 20 минут и разбавляли дихлорметаном и последовательно промывали насыщенным водным хлоридом аммония и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыток дихлорметана удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток 63 использовали в виде неочищенной смеси для следующей реакции. ЖХ/МС, 2,38 мин (ЭР+) m/z (относительная интенсивность)922,16 ([M+H]+, 40).
(d) (11S,11aS)-4-((2S,5S)-37-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-5-изопропил-2-метил-4,7,35-триоксо-10,13,16,19,22,25,28,31-октаокса-3,6,34-триазагептатриаконтанамидо)бензил-11-гидрокси-7-метокси-8-((5-(((S)-7-метокси-2-метил-5-оксо-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пентил)окси)-2-метил-5-оксо-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (64 или DL5)
1-этил-3-(3'-диметиламинопропил)карбодиимид (EDCI, 33 мг, 0,172 ммоль) добавляли к раствору неочищенного 63 (0,172 ммоль) и Mal-(PEG)8-кислоты (100 мг, 0,172 ммоль) в безводном дихлорметане (10 мл). Реакционную смесь перемешивали в течение 2 часов и наличие исходного вещества не наблюдали больше посредством ЖХ/МС. Реакционную смесь разбавляли дихлорметаном и последовательно промывали водой и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, отфильтровывали, и избыток дихлорметана удаляли посредством роторного испарения при пониженном давлении. Полученный в результате остаток подвергали флэш-колоночной хроматографии (силикагель; 100% хлороформ до 10% метанола в хлороформе). Чистые фракции собирали и объединяли, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением 64 или DL5(60 мг, 25% за 3 стадии).
I. Синтез Лекарственное средство-Линкер DL4(Путь 1)

Соединение 65 представляет собой соединение 79 из WO 2011/130598
(11S)-4-(1-йод-20-изопропил-23-метил-2,18,21-триоксо-6,9,12,15-тетраокса-3,19,22-триазатетракозанамидо)бензил-11-гидрокси-7-метокси-8-(3-((7-метокси-5-оксо-2-((E)-проп-1-ен-1-ил)-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-ил)окси)пропокси)-5-оксо-2-((E)-проп-1-ен-1-ил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (66 или DL4)
N,N′-диизопропилкарбодиимид (DIC, 4,71 мкл, 0,0304 ммоль) добавляли к раствору амина 65 (0,0276 ммоль) и Йод-(PEG)4-кислоты (13,1 мг, 0,0304 ммоль) в безводном дихлорметане (0,8 мл). Реакционную смесь перемешивали в течение 3 часов и наличие исходного вещества более не наблюдали посредством ЖХ/МС. Реакционную смесь непосредственно загружали на пластину для тонко-слойной хроматографии (ТСХ) и очищали посредством препаративной ТСХ (10% метанола в хлороформе). Чистые полосы соскребали с пластины ТСХ, переносили в 10% метанол в хлороформе, отфильтровывали, и избыточный элюент удаляли посредством роторного испарения при пониженном давлении с получением 66 (D) (20,9 мг, 56%). ЖХ/МС, метод 2, 3,08 мин (ЭР+) m/z (относительная интенсивность) 1361,16 ([M+H]+, 100).
J. Синтез Лекарственное средство-Линкер DL4 (Путь 2)
Следующие методы были использованы в данном Примере J.
Данные ЖХМС получали с использованием ЖХ/МС серии Agilent 1200 с квадрупольным МС Agilent 6110, с электрораспылительной ионизацией. Подвижная фаза A - 0,1% Уксусная кислота в воде. Подвижная фаза B - 0,1% в ацетонитриле. Скорость потока была равна 1,00 мл/мин. Градиент от 5% B с повышением до 95% B в течение 3 минут, с остающимся 95% B в течение 1 минуты и затем обратным снижением до 5% B в течение 6 секунд. Общее время прохождения составляло 5 минут. Колонка: Phenomenex Gemini-NX 3 мкм C18, 30×2,00 мм. Хроматограммы основаны на УФ-детектировании при 254 нм. Масс-спектры получали, используя МС в положительном режиме. Значения химических сдвигов протонного ЯМР измеряли по дельта шкале при 400 МГц, используя Bruker AV400. Применяли следующие сокращения с, синглет; д, дублет; т, триплет; кв, квадруплет; м, мультиплет; шир, широкий. Константы взаимодействия приведены в Гц. Если не утверждается иначе, колоночную хроматогрфию (посредством флэш-методики) проводили на оксиде кремния Merck Kieselgel (Арт. 9385). Данные масс-спектроскопии (МС) получали, используя прибор Waters Micromass LCT, соединенный с модулем Waters 2795 для ВЭЖХ разделения. Тонкослойную хроматографию (ТСХ) проводили на алюминиевых пластинах, покрытых силикагелем (Merck 60, F254). Все другие химикаты и растворители приобретали от Sigma-Aldrich или Fisher Scientific и использовали в поставляемом виде без дополнительной очистки.
Оптические вращения измеряли на поляриметре ADP 220 (Bellingham Stanley Ltd.) и концентрации (c) приводятся в г/100 мл. Значения температур плавления измеряли, используя цифровое устройство для измерения температуры плавления (Electrothermal). ИК-спектры записывали на ФП-ИК Спектрометре Perkin-Elmer Spectrum 1000. 1H и 13C ЯМР-спектры снимали при 300 K, применяя ЯМР-спектрометр Bruker Avance при 400 и 100 МГц, соответственно. Химические сдвиги приводятся относительно ТМС (δ=0,0 мд), и сигналы обознчали как с (синглет), д (дублет), т (триплет), дт (двойной триплет), дд (дублет дублетов), ддд (двойной дублет дублетов) или м (мультиплет), причем константы взаимодействия приведены в Герцах (Гц). Данные масс-спектроскопии (МС) получали, используя инструмент Waters Micromass ZQ, соединенный с ВЭЖХ Waters 2695 с Waters 2996 PDA. Используемые параметры Waters Micromass ZQ: Капилляр (кВ), 3,38; Конус (В), 35; Экстрактор (В), 3,0; Температура источника (°C), 100; Температура десольватации (°C), 200; Скорость потока конуса (л/ч), 50; Скорость потока десольватации (л/ч), 250. Данные масс-спектроскопии высокого разрешения (МСВР) записывали на Waters Micromass QTOF Global при положительном W-режиме, используя покрытые металлом наконечники из боросиликатного стекла для введения образцов в прибор. Тонкослойную хроматографию (ТСХ) проводили на покрытых силикагелем алюминиевых пластинах (Merck 60, F254), и при флэш-хроматографии использовали силикагель (Merck 60, 230-400 меш ASTM). За исключением HOBt (NovaBiochem) и реагентов на твердой подложке (Argonaut), все другие химикаты и растворители приобретали от Sigma-Aldrich и применяли в поставляемом виде без дополнительной очистки. Безводные растворители получали перегонкой в атмосфере сухого азота в присутствии соответствующего осушителя, и хранили над молекулярными ситами 4Å или натриевой проволокой. Петролейный эфир относится к фракции, кипящей при 40-60°C.
Общие условия ЖХ/МС: ВЭЖХ (Waters Alliance 2695) проводили, используя подвижную фазу из воды (A) (муравьиная кислота 0,1%) и ацетонитрила (B) (муравьиная кислота 0,1%). Градиент: первоначальный состав 5% B в течение 1,0 мин, затем 5% B до 95% B в пределах 3 мин. Состав выдерживали в течение 0,5 мин при 95% B, и затем возвращали до 5% B за 0,3 минуты. Обшее время прохождения градиента составляло 5 мин. Скорость потока 3,0 мл/мин, 400 мкл разделяли через нулевой мертвый объем тройника, который проходил в масс-спектрометр. Интервал детектирования длин волн: от 220 до 400 нм. Тип функции: диодная матрица (535 сканов). Колонка: Phenomenex® Onyx Monolithic C18 50×4,60 мм
Первоначально получали следующие промежуточные соединения.

(a-i) (S)-2-(аллилоксикарбониламино)-3-метилбутановая кислота (I2)
Аллилхлорформиат (36,2 мл, 340,59 ммоль, 1,2 экв) добавляли по каплям к перемешиваемому раствору L-валина (I1) (33,25 г, 283,82 ммоль, 1,0 экв) и карбоната калия (59,27 г, 425,74 ммоль, 1,5 экв) в воде (650 мл) и ТГФ (650 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем растворитель концентрировали при пониженном давлении и оставшийся раствор экстрагировали диэтиловым эфиром (3×100 мл). Водную часть подкисляли до pH 2 конц. HCl и экстрагировали ДХМ (3×100 мл). Объединенные органические вещества промывали насыщенным раствором хлорида натрия, сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением продукта в виде бесцветного масла (57,1 г, допускаемый 100% выход). ЖХ/МС (1,966 мин (ЭР+)), m/z: 202,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 12,57 (шир с, 1H), 7,43 (д, 1H, J=8,6 Гц), 5,96-5,86 (м, 1H), 5,30 (ддд, 1H, J=17,2, 3,4, 1,7 Гц), 5,18 (ддд, 1H, J=10,4, 2,9, 1,6 Гц), 4,48 (дт, 2H, J=5,3, 1,5 Гц), 3,85 (дд,1H, J=8,6, 6,0 Гц), 2,03 (окт, 1H, J=6,6 Гц), 0,89 (д, 3H, J=6,4 Гц), 0,87 (д, 3H, J=6,5 Гц).
(a-ii) (S)-2,5-диоксопирролидин-1-ил-2-(аллилоксикарбониламино)-3-метилбутаноат (I3)
К перемешиваемому раствору защищенной кислоты I2 (60,6 г, 301,16 ммоль, 1,0 экв) и N-гидроксисукцинимида (34,66 г, 301,16 ммоль, 1,0 экв) в безводном ТГФ (800 мл) добавляли дициклогексилкарбодиимид (62,14 г, 301,16 ммоль, 1 экв). Реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь затем отфильтровывали, твердое вещество промывали ТГФ и объединенный фильтрат концентрировали при пониженном давлении. Остаток перерастворяли в ДХМ и оставляли отстаиваться при 0°C в течение 30 минут. Суспензию отфильтровывали и промывали холодным ДХМ. Концентрированием фильтрата при пониженном давлении получали продукт в виде вязкого бесцветного масла (84,7 г, допустимый 100% выход), которое использовали на следующей стадии без дополнительной очистки. ЖХ/МС (2,194 мин (ЭР+)), m/z: 321,0 [M+Na]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,0 (д, 1H, J=8,3 Гц), 5,97-5,87 (м, 1H), 5,30 (ддд, 1H, J=17,2, 3,0, 1,7 Гц), 5,19 (ддд, 1H, J=10,4, 2,7, 1,4 Гц), 4,52 (дт, 2H, J=5,3, 1,4 Гц), 4,32 (дд,1H, J=8,3, 6,6 Гц), 2,81 (м, 4H), 2,18 (окт, 1H, J=6,7 Гц), 1,00 (д, 6H, J=6,8 Гц)
(a-iii) (S)-2-((S)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропановая кислота (I4)
Раствор сукцинимидного сложного эфира I3(12,99 г, 43,55 ммоль, 1,0 экв) в ТГФ (50 мл) добавляли к раствору L-аланина (4,07 г, 45,73 ммоль, 1,05 экв) и NaHCO3 (4,02 г, 47,90 ммоль, 1,1 экв) в ТГФ (100 мл) и H2O (100 мл). Смесь перемешивали при комнатной температуре в течение 72 часов, и тогда ТГФ удаляли при пониженном давлении. pH доводили до 3-4 лимонной кислоты для осаждения камеди белого цвета. После экстракции этилацетатом (6×150 мл), объединенные органические вещества промывали H2O (200 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Растиранием с диэтиловым эфиром получали продукт в виде порошка белого цвета, который собирали фильтрацией и промывали диэтиловым эфиром (5,78 г, 49%). ЖХ/МС (1,925 мин (ЭР+)), m/z: 273,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 12,47 (шир с, 1H), 8,17 (д, 1H, J=6,8 Гц), 7,16 (д, 1H, J=9,0 Гц), 5,95-5,85 (м, 1H), 5,29 (дд, 1H, J=17,2, 1,7 Гц), 5,17 (дд, 1H, J=10,4, 1,5 Гц), 4,46 (м, 2H), 4,18 (quin, 1H, J=7,2 Гц), 3,87 (дд, 1H, J=9,0, 7,1 Гц), 1,95 (окт, 1H, J=6,8 Гц), 1,26 (д, 3H, J=7,3 Гц), 0,88 (д, 3H, J=6,8 Гц), 0,83 (д, 3H, J=6,8 Гц).
(a-iv) Аллил-(S)-1-((S)-1-(4-(гидроксиметил)фениламино)-1-оксопропан-2-иламино)-3-метил-1-оксобутан-2-илкарбамат (I5)
EEDQ (5,51 г, 22,29 ммоль, 1,05 экв) добавляли к раствору п-аминобензилового спирта (2,74 г, 22,29 ммоль, 1,05 экв) и кислоты I4 (5,78 г, 21,23 ммоль, 1 экв) в безводном ТГФ (100 мл) и перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь затем концентрировали при пониженном давлении, и полученное в результате твердое вещество коричневого цвета растирали с диэтиловым эфиром и отфильтровывали с последующей промывкой избытком диэтилового эфира с получением продукта в виде грязно-белого твердого вещесттва (7,1 г, 88%). ЖХ/МС (1,980 мин (ЭР+)), m/z: 378,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,89 (шир с, 1H), 8,13 (д, 1H, J=7,0 Гц), 7,52 (д, 2H, J=8,5 Гц), 7,26 (м, 1H), 7,23 (д, 2H, J=8,5 Гц), 5,91 (м, 1H), 5,30 (м, 1H), 5,17 (м, 1H), 4,46 (м, 2H), 5,09 (т, 1H, J=5,6 Гц), 4,48 (м, 2H), 4,42 (м, 3H), 3,89 (дд,1H, J=8,6, 6,8 Гц), 1,97 (м, 1H), 1,30 (д, 3H, J=7,1 Гц), 0,88 (д, 3H, J=6,8 Гц), 0,83 (д, 3H, J=6,7 Гц).

1-йод-2-оксо-6,9,12,15-тетраокса-3-азаоктадекан-18-овая кислота (I7)
Раствор йодуксусного ангидрида (0,250 г, 0,706 ммоль, 1,1 экв) в безводном ДХМ (1 мл) добавляли к амино-PEG(4)-кислоте I6 (0,170 г, 0,642 ммоль, 1,0 экв) в ДХМ (1 мл). Смесь перемешивали в темноте при комнатной температуре в течение ночи. Реакционную смесь промывали 0,1M HCl, водой, сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 3% MeOH и 0,1% муравьиная кислота в хлороформе до 10% MeOH и 0,1% муравьиная кислота в хлороформе) с получением продукта в виде масла оранжевого цвета (0,118 г, 42%). ЖХ/МС (1,623 мин (ЭР+)), m/z: 433.,98 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,069 (с, 1H), 7,22 (шир с, 1H), 3,79 (т, 2H, J=5,8 Гц), 3,74 (с, 2H), 3,72-3,58 (м, 14H), 3,50-3,46 (м, 2H), 2,62 (т, 2H, J=5,8 Гц).
(ii) (11S,11aS)-аллил-11-(трет-бутилдиметилсилилокси)-8-(3-йодпропокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (74)
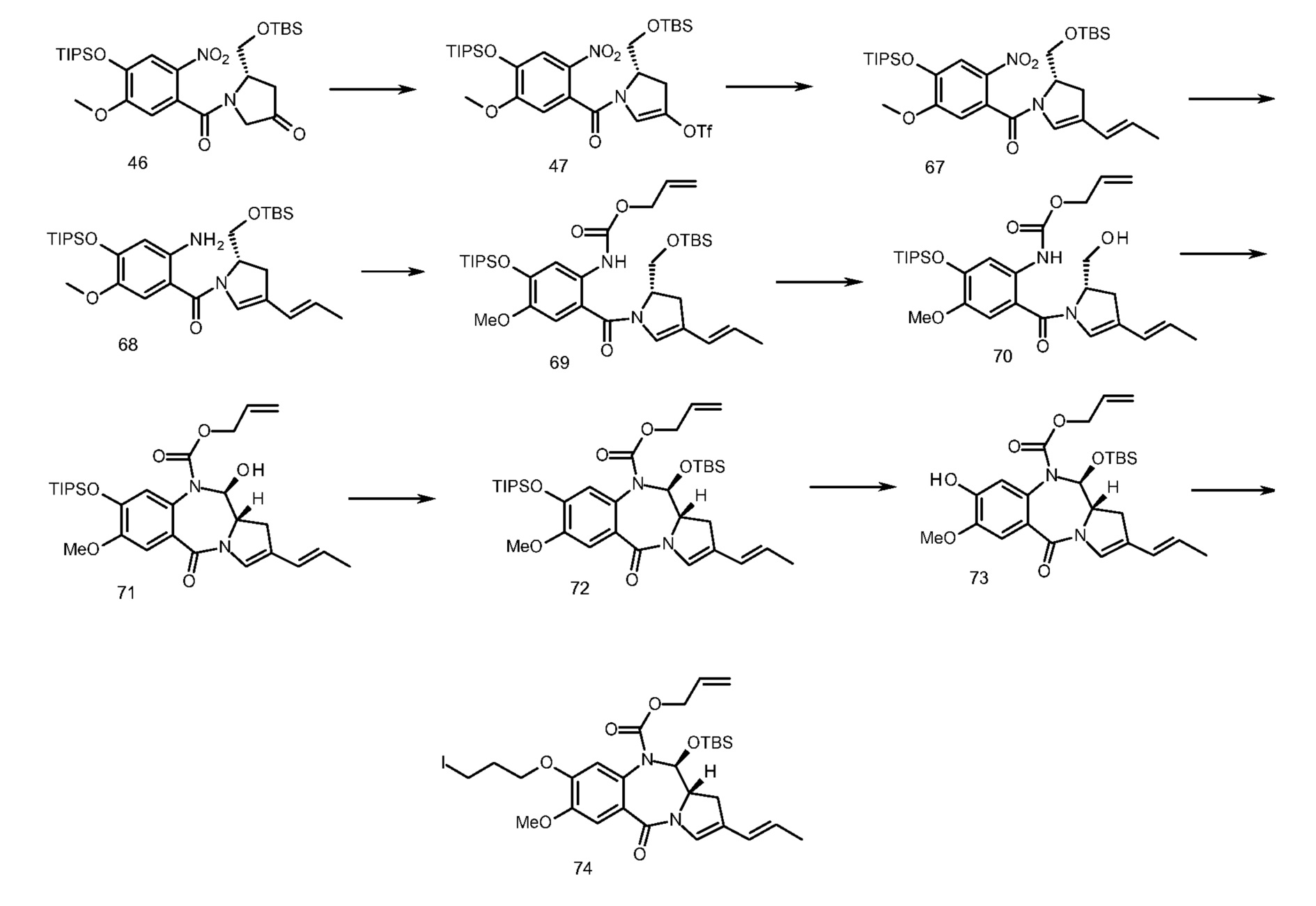
(a) (S)-5-((трет-бутилдиметилсилилокси)метил)-1-(5-метокси-2-нитро-4-(триизопропилсилилсилилокси)бензоил)-4,5-дигидро-1H-пиррол-3-ил трифторметансульфонат (47)
Трифторметансульфоновый ангидрид (28,4 г, 100,0 ммоль, 3,0 экв) добавляли по каплям, в течение 25 минут, к интенсивно перемешиваемому раствору кетона 46 (19,5 г, 30,0 ммоль, 1,0 экв) в ДХМ (550 мл), содержащему 2,6-лутидин (14,4 г, 130,0 ммоль, 4,0 экв) при -50°C. Реакционную смесь перемешивали в течение 1,5 часов, когда ЖХ/МС показала полное протекание реакции. Органическую фазу промывали последовательно водой (100 мл), насыщенным бикарбонатом натрия (150 мл), насыщенным раствором хлорида натрия (50 мл), и органическую фазу сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 90/10 об/об н-гексан/EtOAc) с получением продукта в виде масла бледно-желтого цвета (19,5 г, 82%). ЖХ/МС (4,391 мин (ЭР+)), m/z: 713,25 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,68 (с, 1H), 6,72 (с, 1H), 6,02 (т, 1H, J=1,9 Гц), 4,75 (м, 1H), 4,05 (м, 2H), 3,87 (с, 3H), 3,15 (ддд, 1H, J=16,2, 10,3, 2,3 Гц), 2,96 (ддд, 1H, J=16,2, 4,0, 1,6 Гц), 1,28-1,21 (м, 3H), 1,07 (д, 18H, J=7,2 Гц), 0,88 (с, 9H), 0,09 (с, 3H), 0,08 (с, 3H).
(b) (S,E)-(2-((трет-бутилдиметилсилилокси)метил)-4-(проп-1-енил)-2,3-дигидро-1H-пиррол-1-ил)(5-метокси-2-нитро-4-(триизопропилсилилсилилокси)фенил)метанон (67)
Тетракис(трифенилфосфин)палладия(0) (0,41 г, 0,35 ммоль, 0,03 экв) добавляли к смеси трифлата 47 (8,4 г, 11,8 ммоль, 1,0 экв), E-1-пропен-1-илбороновой кислоты (1,42 г, 16,5 ммоль, 1,4 экв) и фосфата калия (5,0 г, 23,6 ммоль, 2,0 экв) в безводном диоксане (60 мл) в атмосфере азота. Смесь перемешивали при 25°C в течение 120 минут, когда ЖХ/МС показала завершение реакции. Добавляли этилацетат (120 мл) и воду (120 мл), органическую фазу удаляли, промывали насыщенным раствором хлорида натрия (20 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 95/5 об/об н-гексан/EtOAc до 90/10 об/об н-гексан/EtOAc) с получением продукта в виде пены желтого цвета (4,96 г, 70%). ЖХ/МС (4,477 мин (ЭР+)), m/z: 605,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,67 (с, 1H), 6,74 (с, 1H), 5,93 (д, 1H, J=15,4 Гц), 5,67 (с, 1H), 4,65 (м, 1H), 4,04 (м, 2H), 3,86 (с, 3H), 2,85 (м, 1H), 2,71 (м, 1H), 1,72 (дд,3H, J=6,8, 1,0 Гц), 1,30-1,22 (м, 3H), 1,07 (д, 18H, J=7,2 Гц), 0,87 (с, 9H), 0,08 (с, 3H), 0,07 (с, 3H).
(c) (S,E)-(2-амино-5-метокси-4-(триизопропилсилилсилилокси)фенил)(2-((трет-бутилдиметилсилилокси)метил)-4-(проп-1-енил)-2,3-дигидро-1H-пиррол-1-ил)метанон (68)
Цинковую пыль (22,0 г, 0,33 моль, 37 экв) добавляли, частями в течение 20 минут, к раствору пропенильного промежуточного соединения 67 (5,5 г, 9,1 ммоль, 1,0 экв) в 5% об/об муравьиная кислота/этанол (55 мл), применяя баню со льдом для поддержания температуры между 25-30oC. Через 30 минут, реакционную смесь отфильтровывали через тонкий слой целита®. Целит® промывали этилацетатом (65 мл), и объединенные органические вещества промывали последовательно водой (35 мл), насыщенным бикарбонатом натрия (35 мл) и насыщенным раствором хлорида натрия (10 мл). Органическую фазу сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 90/10 об/об н-гексан/EtOAc) с получением продукта в виде масла бледно-желтого цвета (3,6 г, 69,0%). ЖХ/МС (4,439 мин (ЭР+)), m/z: 575,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 6,75 (м, 1H), 6,40 (шир с, 1H), 6,28 (м, 1H), 6,11 (д, 1H, J=15,4 Гц), 5,53 (м, 1H), 4,67 (м, 1H), 4,36 (м, 2H), 3,93 (шир с, 1H), 3,84 (шир с, 1H), 3,73 (с, 3H), 2,86 (дд, 1H, J=15,7, 10,4 Гц), 2,73 (дд,1H, J=15,9, 4,5 Гц), 1,80 (дд, 3H, J=6,8, 1,3 Гц), 1,35-1,23 (м, 3H), 1,12 (д, 18H, J=7,3 Гц), 0,89 (с, 9H), 0,08 (с, 3H), 0,07 (с, 3H).
(d) (S,E)-аллил 2-(2-((трет-бутилдиметилсилилокси)метил)-4-(проп-1-енил)-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-(триизопропилсилилсилилокси)фенилкарбамат (69)
Аллилхлорформиат (0,83 г, 6,88 ммоль, 1,1 экв) добавляли к раствору амина 68 (3,6 г, 6,26 ммоль, 1,0 экв) в безводном ДХМ (80 мл), содержащем безводный пиридин (1,09 г, 13,77 ммоль, 2,2 экв) при -78°C. Сухой лед удаляли, и реакционная смесь нагревалась до комнатной температуры. После перемешивания в течение дополнительных 15 минут, ЖХ/МС показала завершение реакции. Органическую фазу последовательно промывали 0,01N HCl (50 мл), насыщенным бикарбонатом натрия (50 мл), насыщенным раствором хлорида натрия (10 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении, получая в остатке бледно-желтое масло, которое использовали на следующей стадии без дополнительной очистки (4,12 г, допустимый 100% выход). ЖХ/МС (4,862 мин (ЭР+)), m/z: 659,2 [M+H]+.
(e) (S,E)-аллил 2-(2-(гидроксиметил)-4-(проп-1-енил)-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-(триизопропилсилилсилилокси)фенилкарбамат (70)
Неочищенное промежуточное соединение 69 (допустимый 100% выход, 4,12 г, 6,25 ммоль, 1,0 экв) растворяли в смеси уксусной кислоты (70 мл), метанола (10 мл), ТГФ (10 мл) и воды (20 мл) и перемешивали при комнатной температуре. Через 6 часов реакционную смесь разбавляли этилацетатом (500 мл) и последовательно промывали водой (2×500 мл), насыщенным бикарбонатом натрия (300 мл) и насыщенным раствором хлорида натрия (50 мл). Органическую фазу сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 1/99 об/об метанол/ДХМ до 5/95 об/об метанол/ДХМ) с получением продукта в виде желтого масла и дополнительно извлекали 1 г непрореагировавшего исходного вещества. Данное вещество подвергали таким же условиям реакции, как описано выше, но оставляли перемешиваться в течение 16 ч. Посредством обработки и очистки, выделяли дополнительный продукт (2,7 г, 79%, 2 стадии) ЖХ/МС (3,742 мин (ЭР+)), m/z: 545,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,38 (м, 1H), 7,72 (м, 1H), 6,81 (с, 1H), 6,37 (м, 1H), 6,10 (д, 1H, J=15,8 Гц), 5,97 (м, 1H), 5,53 (м, 1H), 5,36 (ддд, 1H, J=17,2, 3,1, 1,5 Гц), 5,25 (ддд, 1H, J=10,4, 2,5, 1,3 Гц), 4,78 (м, 1H), 4,65 (дт, 2H, J=5,7, 1,3 Гц), 3,84 (м, 3H), 3,79 (с, 3H), 3,04 (дд, 1H, J=16,7, 10,5 Гц), 2,40 (дд,1H, J=16,0, 4,5 Гц), 1,82 (дд, 3H, J=6,8, 1,0 Гц), 1,36-1,26 (м, 3H), 1,14 (д, 18H, J=7,3 Гц).
(f) (11S,11aS)-аллил-11-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-8-(триизопропилсилилсилилокси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (71)
Безводный диметилсульфоксид (1,16 г, 14,87 ммоль, 3,0 экв) добавляли по каплям к раствору оксалилхлорида (0,94 г, 7,43 ммоль, 1,5 экв) в ДХМ (25 мл) при -78°C в атмосфере азота. Поддерживая температуру при -78°C, через 10 минут добавляли по каплям раствор первичного спирта 70 (2,7 г, 4,96 ммоль, 1,0 экв) в ДХМ (20 мл). Через дополнительные 15 минут, добавляли безводный триэтиламин (2,5 г, 24,78 ммоль, 5,0 экв), и реакционная смесь нагревалась до комнатной температуры. Реакционную смесь последовательно промывали холодной 0,1N HCl (50 мл), насыщенным гидрокарбонатом натрия (50 мл) и насыщенным раствором хлорида натрия (10 мл), и органический слой сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением продукта в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки (2,68 г, допустимый 100% выход). ЖХ/МС (3,548 мин (ЭР+)), m/z: 543,2 [M+H]+.
(g) (11S,11aS)-аллил 11-(трет-бутилдиметилсилилокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-8-(триизопропилсилилсилилокси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (72)
Трет-бутилдиметилсилилтрифторметансульфонат (3,93 г, 14,87 ммоль, 3,0 экв) добавляли к раствору карбиноламина 71 (допустимый 100% выход, 2,68 г, 4,96 ммоль, 1,0 экв) и 2,6-лутидина (2,12 г, 19,83 ммоль, 4,0 экв) в безводном ДХМ (40 мл) при 0°C в атмосфере азота. Через 10 минут, реакционную смесь нагревалась до комнатной температуры и ее перемешивали в течение дополнительных 60 минут. Органическую фазу последовательно промывали водой (10 мл), насыщенным бикарбонатом натрия (10 мл) и насыщенным раствором хлорида натрия (5 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, хлороформ до 2/98 об/об Метанол/хлороформ) с получением продукта в виде желтого масла (2,0 г, 63%, 2 стадии). ЖХ/МС (4,748 мин (ЭР+)), m/z: 657,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,19 (с, 1H), 6,86 (м, 1H), 6,66 (с, 1H), 6,22 (д, 1H, J=15,4 Гц), 5,81 (д, 1H, J=8,8 Гц), 5,78 (м, 1H), 5,48 (м, 1H), 5,11 (д, 1H, J=5,0 Гц), 5,08 (м, 1H), 4,58 (дд, 1H, J=13,4, 5,4 Гц), 4,35 (дд, 1H, J=13,2, 5,7 Гц), 3,83 (с, 3H), 3,76 (с, 1H), 3,00 (дд, 1H, J=15,6, 11,0 Гц), 2,53 (м, 1H), 1,81 (дд, 3H, J=6,8, 0,9 Гц), 1,30-1,18 (м, 3H), 1,08 (д, 9H, J=2,3 Гц), 1,06 (д, 9H, J=2,3 Гц), 0,86 (с, 9H), 0,25 (с, 3H), 0,18 (с, 3H).
(h) (11S,11aS)-аллил-11-(трет-бутилдиметилсилилокси)-8-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (73)
Дигидрат ацетата лития (0,31 г, 3,04 ммоль, 1,0 экв) добавляли к раствору диазепина 72 (2,0 г, 3,04 ммоль, 1,0 экв) во влажном ДМФА (20 мл) при 25°C и перемешивали в течение 4 часов. Реакционную смесь разбавляли этилацетатом (200 мл) и последовательно промывали 0,1M лимонной кислотой (50 мл, pH 3), водой (50 мл) и насыщенным раствором хлорида натрия (10 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 50/50 об/об н-гексан/EtOAc до 25/75 об/об н-гексан/EtOAc) с получением продукта в виде твердого вещества бледно-желтого цвета(0,68 г, 45%). ЖХ/МС (3,352 мин (ЭР+)), m/z: 501,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,02 (с, 1H), 6,66 (м, 1H), 6,53 (с, 1H), 6,03 (д, 1H, J=15,5 Гц), 5,80 (с, 1H), 5,63 (д, 1H, J=8,9 Гц), 5,55 (м, 1H), 5,29 (м, 1H), 4,87 (м, 2H), 4,39 (дд, 1H, J=13,5, 4,2 Гц), 4,20 (дд, 1H, J=13,2, 5,7 Гц), 3,73 (с, 3H), 3,59 (м, 1H), 2,81 (дд, 1H, J=16,1, 10,5 Гц), 2,35 (д, 1H, J=15,7 Гц), 1,61 (д, 3H, J=6,4 Гц), 0,67 (с, 9H), 0,05 (с, 3H), 0,00 (с, 3H).
(i) (11S,11aS)-аллил-11-(трет-бутилдиметилсилилокси)-8-(3-йодпропокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (74)
Дийодпропан (0,295 г, 1,00 ммоль, 5,0 экв) и карбонат калия (0,028 г, 0,20 ммоль, 1,0 экв) добавляли к раствору фенола 33 (0,100 г, 0,020 ммоль, 1,0 экв) в безводном ацетоне (5 мл). Реакционную смес нагревали при 60°C в течение 6 часов, пока ЖХ/МС не показала завершение реакции. Реакционную смесь концентрировали досуха при пониженном давлении, и остаток очищали посредством флэш-хроматографии (силикагель, 75/25 об/об н-гексан/EtOAc до 50/50 об/об н-гексан/EtOAc) с получением продукта в виде бесцветного масла (0,074 г, 56%). ЖХ/МС (3,853 мин (ЭР+)), m/z: 669,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,26 (с, 1H), 6,90 (с, 1H), 6,68 (с, 1H), 6,24 (д, 1H, J=15,3 Гц), 5,87 (д, 1H, J=8,9 Гц), 5,78 (м, 1H), 5,53 (м, 1H), 5,12 (м, 2H), 4,65 (м, 2H), 4,41 (м, 1H), 4,11 (м, 1H), 3,93 (с, 3H), 3,81 (м, 1H), 3,40 (т, 2H, J=6,7 Гц), 3,05 (дд, 1H, J=16,3, 10,1 Гц), 2,57 (м, 1H), 2,34 (м, 2H), 1,84 (д, 3H, J=6,6 Гц), 0,92 (с, 9H), 0,28 (с, 3H), 0,26 (с, 3H).
(iii) (11S,11aS)-4-((S)-2-((S)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензил 11-(трет-бутилдиметилсилилокси)-8-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат 79)

(a) Аллил-((S)-1-(((S)-1-((4-((((2-((S)-2-(((трет-бутилдиметилсилил)окси)метил)-4-((E)-проп-1-ен-1-ил)-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамоил)окси)метил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (75)
Триэтиламин (0,256 мл, 1,84 ммоль, 2,2 экв) добавляли к перемешиваемому раствору амина 68 (0,480 г, 0,835 ммоль, 1,0 экв) и трифосгена (0,089 г, 0,301 ммоль, 0,36 экв) в безводном ТГФ (15 мл) при 5°C (баня со льдом). Протекание изоцианатной реакции регистрировали посредством периодического удаления аликвот из реакционной смеси и гашения метанолом, и проводя ЖХМС анализ. Как только изоцианатная реакция проходила полностью раствор Alloc-Val-Ala-PABOH I5 (0,473 г, 1,25 ммоль, 1,5 экв) и триэтиламина (0,174 мл, 1,25 ммоль, 1,5 экв) в безводном ТГФ (10 мл) быстро добавляли посредством инъекции к свежеполученному изоцианату. Реакционная смесь перемешивалась при 40°C в течение 4 часов с последующим перемешиванием при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении и очищали посредством флэш-хроматографии (силикагель, 20/80 об/об н-гексан/EtOAc до 50/50 об/об н-гексан/EtOAc, затем 1/99 об/об ДХМ/MeOH до 5/95 об/об ДХМ/MeOH) с получением продукта в виде твердого вещества желтого цвета (0,579 г, 71%). ЖХ/МС (4,468 мин (ЭР+)), m/z: 978,55 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,63 (шир с, 1H), 8,42 (с, 1H), 7,78 (шир с, 1H), 7,53 (д, 2H, J=8,1 Гц), 7,31 (д, 2H, J=8,6 Гц), 6,76 (с, 1H), 6,59 (д, 1H, J=7,6 Гц), 6,36 (шир с, 1H), 6,04 (д, 1H, J=15,9 Гц), 5,90 (м, 1H), 5,55 (м, 1H), 5,33-5,21 (м, 3H), 5,10 (с, 2H), 4,66 (м, 2H), 4,57 (дд, 2H, J=5,6, 1,0 Гц), 3,98 (дд, 1H, J=7,3, 6,8 Гц), 3,90 (м, 1H), 3,81 (м, 1H), 3,78 (с, 3H), 2,82 (дд,1H, J=15,4, 9,6 Гц), 2,72 (дд, 1H, J=15,9, 3,5 Гц), 2,17 (м, 1H), 1,78 (дд, 3H, J=6,5, 0,8 Гц), 1,46 (д, 3H, J=7,1 Гц), 1,29 (м, 3H), 1,11 (д, 18H, J=7,1 Гц), 0,97 (д, 3H, J=6,8 Гц), 0,92 (д, 3H, J=6,8 Гц), 0,83 (с, 9H), 0,04 (с, 3H), 0,01 (с, 3H).
(b) Аллил-((S)-1-(((S)-1-((4-((((2-((S)-2-(гидроксиметил)-4-((E)-проп-1-ен-1-ил)-2,3-дигидро-1H-пиррол-1-карбонил)-4-метокси-5-((триизопропилсилилсилил)окси)фенил)карбамоил)окси)метил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (76)
Силиловый эфир 75 (1,49 г, 1,52 ммоль, 1,0 экв) растворяли в 7:1:1:2 смеси из уксусной кислоты/метанола/тетрагидрофурана/воды (14:2:2:4 мл) и перемешивали при комнатной температуре. Через 2 часа реакционную смесь разбавляли EtOAc (100 мл), последовательно промывали водой, водн. бикарбонатом натрия, затем насыщенным раствором хлорида натрия. Органическую фазу затем сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 100/0 затем 99/1 до 92/8 об/об ДХМ/ MeOH) с получением продукта в виде твердого вещества оранжевого цвета (1,2 г, 92%). ЖХ/МС (3,649 мин (ЭР+)), m/z: 865,44 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,44 (с, 1H), 8,35 (с, 1H), 7,69 (шир с, 1H), 7,53 (д, 2H, J=8,7 Гц), 7,32 (д, 2H, J=8,3 Гц), 6,78 (с, 1H), 6,56 (м, 2H), 6,32 (шир с, 1H), 6,05 (д, 1H, J=14,9 Гц), 5,90 (м, 1H), 5,56 (м, 1H), 5,30 (м, 2H), 5,22 (м, 1H), 5,10 (д, 2H, J=3,1 Гц), 4,73 (м, 1H), 4,64 (м, 1H), 4,57 (д, 2H, J=5,8 Гц), 4,01 (м, 1H), 3,79 (м, 2H), 3,76 (с, 3H), 2,98 (дд, 1H, J=16,3, 10,2 Гц), 2,38 (дд, 1H, J=16,6, 4,1 Гц), 2,16 (м, 1H), 1,78 (дд,3H, J=6,8, 0,9 Гц), 1,46 (д, 3H, J=7,1 Гц), 1,29 (м, 3H), 1,11 (д, 18H, J=7,4 Гц), 0,97 (д, 3H, J=6,7 Гц), 0,92 (д, 3H, J=6,8 Гц).
(c) (11S,11aS)-4-((S)-2-((S)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензил-11-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-8-(триизопропилсилилсилилокси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (77)
Безводный диметилсульфоксид (0,180 г, 2,3 ммоль, 3,0 экв) добавляли по каплям к раствору оксалилхлорида (0,147 г, 1,1 ммоль, 1,5 экв) в ДХМ (10 мл) при -78°C в атмосфере азота. Поддерживая температуру при -78°C, через 20 минут, раствор первичного спирта 76 (0,666 г, 0,77 ммоль, 1,0 экв) в ДХМ (10 мл) добавляли по каплям. Через дополнительные 15 минут, добавляли безводный триэтиламин (0,390 г, 3,85 ммоль, 5,0 экв), и реакционная смесь нагревалась до комнатной температуры. Реакционную смесь последовательно промывали холодной 0,1N HCl (10 мл), насыщенным гидрокарбонатом натрия (10 мл) и насыщенным раствором хлорида натрия (5 мл). Органический слой затем сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток затем очищали посредством флэш-хроматографии (силикагель, 50/50 об/об н-гексан/EtOAc до 25/75 об/об н-гексан/EtOAc) с получением продукта в виде твердого вещества белого цвета (0,356 г, 54%). ЖХ/МС (3,487 мин (ЭР+)), m/z: 862,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,34 (шир с, 1H), 7,47 (д, 2H, J=7,6 Гц), 7,17 (с, 1H), 7,14 (д, 2H, J=7,5 Гц), 6,86 (шир с, 1H), 6,65 (шир с, 1H), 6,42 (д, 1H, J=7,6 Гц), 6,22 (д, 1H, J=14,4 Гц), 5,80 (м, 1H), 5,40 (м, 1H), 5,53 (м, 1H), 5,32 (м, 1H), 5,21 (д, 2H, J=9,6 Гц), 5,06 (д, 1H, J=12,3 Гц), 4,90 (м, 1H), 4,58 (м, 3H), 3,98 (м, 1H), 3,84 (м, 1H), 3,81 (с, 3H), 3,50 (м, 1H), 3,05 (дд, 1H, J=16,0, 10,3 Гц), 2,76 (м, 1H), 2,15 (м, 1H), 1,80 (дд, 3H, J=6,7, 0,8 Гц), 1,44 (д, 3H, J=7,1 Гц), 1,16 (м, 3H), 1,01 (д, 18H, J=6,6 Гц), 0,96 (д, 3H, J=6,8 Гц), 0,92 (д, 3H, J=6,8 Гц).
(d) (11S,11aS)-4-((S)-2-((S)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензил-11-(трет-бутилдиметилсилилокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-8-(триизопропилсилилсилилокси)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (78)
Трет-бутилдиметилсилилтрифторметансульфонат (0,46 г, 1,74 ммоль, 3,0 экв) добавляли к раствору вторичного спирта 77 (0,5 г, 0,58 ммоль, 1,0 экв) и 2,6-лутидина (0,25 г, 2,32 ммоль, 4,0 экв) в безводном ДХМ (10 мл) при 0°C в атмосфере азота. Через 10 минут, реакционную смесь нагревали до комнатной температуры и перемешивали в течение дополнительных 120 минут. Органическую фазу затем последовательно промывали водой (10 мл), насыщенным бикарбонатом натрия (10 мл) и насыщенным раствором хлорида натрия (5 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 50/50 об/об н-гексан/EtOAc) с получением продукта в виде твердого вещества белого цвета (0,320 г, 57%). ЖХ/МС (4,415 мин (ЭР+)), m/z: 976,52 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,31 (шир с, 1H), 7,48 (д, 2H, J=8,0 Гц), 7,21 (с, 1H), 7,14 (д, 2H, J=8,3 Гц), 6,89 (с, 1H), 6,65 (с, 1H), 6,38 (д, 1H, J=7,3 Гц), 6,25 (д, 1H, J=14,6 Гц), 5,93 (м, 1H), 5,85 (д, 1H, J=8,8 Гц), 5,50 (м, 1H), 5,34 (м, 1H), 5,24 (м, 2H), 5,15 (д, 1H, J=12,5 Гц), 4,86 (д, 1H, J=12,2 Гц), 4,62 (м, 3H), 4,01 (м, 1H), 3,86 (с, 3H), 3,78 (м, 1H), 3,04 (м, 1H), 2,56 (м, 1H), 2,20 (м, 1H), 1,84 (дд,3H, J=6,6, 0,7 Гц), 1,48 (д, 3H, J=6,8 Гц), 1,20 (м, 3H), 1,05 (д, 9H, J=2,9 Гц), 1,03 (д, 9H, J=2,9 Гц), 0,99 (д, 3H, J=6,8 Гц), 0,95 (д, 3H, J=6,8 Гц), 0,88 (с, 9H), 0,27 (с, 3H), 0,14 (с, 3H).
(e) (11S,11aS)-4-((S)-2-((S)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензил 11-(трет-бутилдиметилсилилокси)-8-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (79)
Дигидрат ацетата лития (0,010 г, 0,10 ммоль, 1,0 экв) добавляли к раствору силилого эфира 78 (0,100 г, 0,10 ммоль, 1,0 экв) во влажном ДМФА (2 мл) при 25°C в течение 3 часов. Реакционную смес затем разбавляли этилацетатом (20 мл) и последовательно промывали 0,1M лимонной кислотой (20 мл, pH 3), водой (20 мл) и насыщенным раствором хлорида натрия (5 мл), сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии (силикагель, 5/95 об/об метанол/ДХМ) с получением продукта в виде масла бледно-желтого цвета (0,070 г, 83%). ЖХ/МС (3,362 мин (ЭР+)), m/z: 820,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,39 (с, 1H), 7,48 (д, 2H, J=8,2 Гц), 7,25 (с, 1H), 7,12 (д, 2H, J=8,1 Гц), 6,88 (с, 1H), 6,68 (с, 1H), 6,47 (д, 1H, J=7,6 Гц), 6,24 (д, 1H, J=15,2 Гц), 6,03 (с, 1H), 5,92 (м, 1H), 5,84 (д, 1H, J=8,9 Гц), 5,50 (м, 1H), 5,34 (м, 1H), 5,26 (м, 2H), 5,18 (д, 1H, J=12,3 Гц), 4,80 (д, 1H, J=12,4 Гц), 4,66-4,60 (м, 3H), 4,02 (м, 1H), 3,95 (с, 3H), 3,81 (м, 1H), 3,03 (м, 1H), 2,57 (м, 1H), 2,19 (м, 1H), 1,84 (дд, 3H, J=6,8, 0,8 Гц), 1,48 (д, 3H, J=7,1 Гц), 1,00 (д, 3H, J=6,8 Гц), 0,95 (д, 3H, J=6,8 Гц), 0,87 (с, 9H), 0,26 (с, 3H), 0,12 (с, 3H).
(iv)(11S,11aS)-4-((20S,23S)-1-йод-20-изопропил-23-метил-2,18,21-триоксо-6,9,12,15-тетраокса-3,19,22-триазатетракозанамидо)бензил-11-гидрокси-7-метокси-8-(3-((S)-7-метокси-5-оксо-2-((E)-проп-1-енил)-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-илокси)пропокси)-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (66 или DL4)

(a) (11S,11aS)-аллил-8-(3-((11S,11aS)-10-((4-((R)-2-((R)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензилокси)карбонил)-11-(трет-бутилдиметилсилилокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-илокси)пропокси)-11-(трет-бутилдиметилсилилокси)-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (80)
Карбонат калия (0,030 г, 0,21 ммоль, 1,0 экв) добавляли к раствору фенола 79 (0,175 г, 0,21 ммоль, 1,0 экв) и йодистого линкера 74 (0,214 г, 0,32 ммоль, 1,5 экв) в ацетоне (10 мл). Реакционную смесь нагревали в атмосфере азота при 75°C в герметично закрытой колбе в течение 17 часов. Реакционную смесь концентрировали досуха при пониженном давлении и очищали посредством флэш-хроматографии (силикагель, 2/98 об/об метанол/ДХМ до 5/95 об/об метанол/ДХМ) с получением продукта в виде твердого вещества бледно-желтого цвета (0,100 г, 35%). ЖХ/МС (4,293 мин (ЭР+)), m/z: 1359,13 [M]+.
(b) (11S,11aS)-аллил-8-(3-((11S,11aS)-10-((4-((R)-2-((R)-2-(аллилоксикарбониламино)-3-метилбутанамидо)пропанамидо)бензилокси)карбонил)-11-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-5,10,11,11a-тетрагидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-илокси)пропокси)-11-гидрокси-7-метокси-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (81)
Фторид тетра-н-бутиламмония (1M, 0,22 мл, 0,22 ммоль, 2,0 экв) добавляли к раствору силилового эфира 80 (0,150 г, 0,11 ммоль, 1,0 экв) в безводном ТГФ (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут, после которых ЖХ/МС показала завершение реакции. Реакционную смесь разбавляли этилацетатом (10 мл) и последовательно промывали водой (5 мл) и насыщенным раствором хлорида натрия (5 мл). Органическую фазу сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении, получая в остатке твердое вещество желтого цвета. Очисткой посредством флэш-хроматографии (силикагель, 6/94 об/об метанол/ДХМ до 10/90 об/об метанол/ДХМ) получали продукт в виде твердого вещества бледно-желтого цвета (0,090 г, 73%). ЖХ/МС (2,947 мин (ЭР+)), m/z: 1154,0 [M+Na]+. 1H ЯМР (400 МГц, CDCl3) δ 8,39 (шир с, 1H), 7,39 (д, 2H, J=7,6 Гц), 7,18 (д, 2H, J=10,6 Гц), 7,10 (м, 3H), 6,86 (д, 2H, J=10,0 Гц), 6,74 (с, 1H), 6,55 (с, 1H), 6,22 (дд, 2H, J=15,3, 6,6 Гц), 5,85 (м, 2H), 5,74 (м, 3H), 5,52 (м, 2H), 5,22 (м, 1H), 5,00 (м, 2H), 4,57 (м, 6H), 4,41 (м, 2H), 4,09 (м, 4H), 3,85 (м, 11H), 3,06 (м, 2H), 2,76 (м, 2H), 2,20 (м, 2H), 2,08 (м, 1H), 1,79 (д, 6H, J=6,4 Гц), 1,40 (д, 3H, J=6,1 Гц), 0,90 (м, 6H).
(c) (11S,11aS)-4-((R)-2-((R)-2-амино-3-метилбутанамидо)пропанамидо)бензил-11-гидрокси-7-метокси-8-(3-((S)-7-метокси-5-оксо-2-((E)-проп-1-енил)-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-илокси)пропокси)-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (65)
Тетракис(трифенилфосфин)палладия(0) (0,005 г, 0,005 ммоль, 0,06 экв) добавляли к раствору бис-карбиноламина 81 (0,090 г, 0,08 ммоль, 1,0 экв) и пирролидина (16 мкл, 0,20 ммоль, 2,5 экв) в безводном ДХМ (5 мл). Через 20 минут, реакционную смесь разбавляли ДХМ (10 мл) и последовательно промывали насыщенным хлоридом аммония (5 мл) и насыщенным раствором хлорида натрия (5 мл), сушили над MgSO4, отфильтровывали, и растворитель удаляли при пониженном давлении, поучая в остатке неочищенный продукт в виде твердого вещества бледно-желтого цвета, которое использовали на следующей стадии без дополнительной очистки (0,075 г, допустимый 100% выход). ЖХ/МС (2,060 мин (ЭР+)), m/z: 947,2 [M+H]+.
(d) (11S,11aS)-4-((20S,23S)-1-йод-20-изопропил-23-метил-2,18,21-триоксо-6,9,12,15-тетраокса-3,19,22-триазатетракозанамидо)бензил 11-гидрокси-7-метокси-8-(3-((S)-7-метокси-5-оксо-2-((E)-проп-1-енил)-5,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-8-илокси)пропокси)-5-оксо-2-((E)-проп-1-енил)-11,11a-дигидро-1H-бензо[e]пирроло[1,2-a][1,4]диазепин-10(5H)-карбоксилат (66 или DL4)
EDCI (0,015 г, 0,08 ммоль, 1,0 экв) добавляли к раствору амина 65 (допустимый 100% выход 0,075 г, 0,08 ммоль, 1,0 экв) и йодацетамид-PEG4-кислоты I7 (0,034 г, 0,08 ммоль, 1,0 экв) в безводном дихлорметане (5 мл) и реакционную смесь перемешивали в темноте. Через 50 минут, дополнительное количество йодацетамид-PEG4-кислоты I7 (0,007 г, 0,016 ммоль, 0,2 экв) добавляли наряду с дополнительным количеством EDCI (0,003 г, 0,016 ммоль, 0,2 экв). Через всего 2,5 часа, реакционную смесь разбавляли дихлорметаном (15 мл) и последовательно промывали водой (10 мл) и насыщенным раствором хлорида натрия (10 мл). Органическую фазу сушили над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Полученный в результате остаток очищали посредством флэш-хроматографии (силикагель, Хлороформ 100% до 90:10 об/об Хлороформ:Метанол). Чистые фракции объединяли с получением продукта (0,0254 г, 23%, 2 стадии). Неочищенные фракции собирали и очищали посредством препаративной ТСХ (силикагель, 90:10 об/об Хлороформ:Метанол) с получением второй загрузки продукта (0,0036 г, 3%, 2 стадии). ЖХ/МС (2,689 мин (ЭР+)), m/z: 681,0 1/2[M+2H]+.
Следует принимать во внимание, что соединения, синтезированные в данном Примере 1, могут быть конъюгированы с анти-DLL3 антителоами, как раскрыто в данном документе для предоставления раскрытых ADC 1-5.
Пример 2
Генерация Анти-DLL3 антитело
Анти-DLL3 мышиные антитела получали следующим образом. При первой кампании иммунизации, троих мышей (по одной от каждого из следующих штаммов: Balb/c, CD-1, FVB) инокулировали человеческим DLL3-fc белком (hDLL3-Fc), эмульгированным с равным объемом TiterMax® или адъювантом из квасцов. hDLL3-Fc гибридную конструкцию приобретали от Adipogen International (Каталог №. AG-40A-0113). Первоначальную иммунизацию проводили эмульсией 10 мкг hDLL3-Fc на мышь в TiterMax. Мышей затем иммунизировали один раз в две недели 5 мкг hDLL3-Fc на мышь в адъюванте из квасцов. Окончательная инъекция перед гибридизацией составляла 5 мкг hDLL3-Fc на мышь в PBS.
При проведении второй кампании иммунизации шесть мышей (по две от каждого из следующих штаммов: Balb/c, CD-1, FVB), инокулировали человеческим DLL3-His белком (hDLL3-His), эмульгированным с равным объемом TiterMax® или адъювант из квасцов. Рекомбинантный hDLL3-His белок очищали из супернатантов клеток CHO-S, сконструированных для сверхэкспрессии hDLL3-His. Первоначальную иммунизацию проводили с эмульсией 10 мкг hDLL3-His на мышь в TiterMax. Мышей затем иммунизировали один раз в две недели 5 мкг hDLL3-His на мышь в адъюванте из квасцов. Последнюю инъекцию проводили с клетками 2×105 HEK-293T, сконструированн для сверхэкспрессии hDLL3.
Аналитические тесты методом твердофазного ELISA применяли для скрининга мышиных сывороток на мышиные IgG антитела, специфичные для человеческого DLL3. Положительный сигнал свыше фон указывал на антитела, специфичные для DLL3. Вкратце, 96-луночные планшеты (VWR International, Кат. #610744) покрывали рекомбинантными DLL3-His при 0,5 мкг/мл в покрывающем буфере для ELISA в течение ночи. Посредством промывки с использованием PBS, содержащего0,02% (об/об) Tween 20, лунки блокировали 3% (м/о) БСА в PBS, 200 мкл/лунку в течение 1 часа при комнатной температуре (КТ). Мышиную сыворотку титровали (1:100, 1:200, 1:400, и 1:800) и добавляли в DLL3-покрытые планшеты при 50 мкл/лунку и инкубировали при КТ в течение 1 часа. Планшеты промывали и затем инкубировали с 50 мкл/лунку HRP-меченых козьих анти-мышиных IgG, разбавленных 1:10,000 в 3% BSA-PBS или 2% FCS в PBS в течение 1 часа при КТ. Планшеты снова промывали и 40 мкл/лунку раствора TMB-субстрата (Thermo Scientific 34028) добавляли в течение 15 минут при КТ. После проявления, равный объем 2N H2SO4 добавляли, чтобы остановить проявление субстрата, и планшеты анализировали на спектрофотометре при OD 450.
Сероположительных иммунизированных мышей умерщвляли и дренирующие лимфатические узлы (подколенные, паховые и медиальные подвздошные) вскрывали и использовали в качестве источника клеток, пролуцирующих антитела. Клеточные суспензии B-клеток (приблизительно 229×106 клеток от hDLL3-Fc-иммунизированных мышей, и 510×106 клеток от hDLL3-His-иммунизированных мышей) гибридизировали с несекретирующими P3x63Ag8.653 клетками миеломы при отношении 1:1 посредством клеточной электрогибридизации, используя модель BTX Hybrimmune System (BTX Harvard Apparatus). Клетки ресуспендировали в среде для селекции гибридом, состоящей из DMEM-среды, дополненной азасерином, 15% сывороткой зародышевого клона I, 10% BM Condimed (Roche Applied Sciences), 1 мМ заменимых аминокислот, 1 мМ HEPES, 100 МЕ пенициллин-стрептомицин и 50 мкМ 2-меркаптоэтанолом, и культивировали в четырех колбах T225 в 100 мл селекционной среды на колбу. Колбы помещали в увлажняемый при 37°C инкубатор, содержащий 5% CO2 и 95% воздух на шесть - семь дней.
На шестой или седьмой день после гибридизаций клетки из библиотеки гибридом собирали из колб и помещали в планшеты по одной клетке на лунку (используя сортировщик клеток FACSAria I) в 200 мкл дополненной селекционной среды для гибридом (как описано выше) в 64 Falcon 96-луночных планшетов, и 48 96-луночных планшетов для проведения кампании иммунизации hDLL3-His. Оставшуюся часть библиотеки хранили в жидком азоте.
Гибридомы культивировали в течение 10 дней, и супернатанты подвергали скринингу на антитела, специфичные к hDLL3, используя проточную цитометрию, проводимую следующим образом. 1×105 на лунку клеток HEK-293T, сконструированных для сверхэкспрессии человеческого DLL3, мышиного DLL3 (предварительно окрашенного красителем), или обезьяньего DLL3 (предварительно окрашенного Dylight800) инкубировали в течение 30 минут с 25 мкл гибридомного супернатанта. Клетки промывали PBS/2% FCS, и затем инкубировали с использованием 25 мкл на образец DyeLight 649-меченых козьих-анти-мышиных IgG, специфичного Fc фрагмента, вторично разбавленного 1:300 в PBS/2%FCS. После 15-минутной инкубации клетки дважды промывали PBS/2%FCS и ресуспендировали в PBS/2%FCS с DAPI и анализировали посредством проточной цитометрии для флуоресцентного превышения клеток, окрашенных изотипным контрольным антителом. Оставшиеся неиспользованные клетки библиотеки гибридом замораживали в жидком азоте для будущего тестирования и скрининга библиотеки.
Кампания иммунизации hDLL3-His давала на выходе приблизительно 50 мышиных анти-hDLL3 антител, а кампания иммунизации hDLL3-Fc давала на выходе приблизительно 90 мышиных анти-hDLL3 антител.
Пример 3
Секвенирование Анти-DLL3 антитело
На основании приведенного выше, несколько иллюстративных различающихся моноклональных антител, которые связывают иммобилизованный человеческий DLL3 или клетки h293-hDLL3 с явно высокой аффинностью, были выбраны для секвенирования и дальнешего анализа. Как показано в табличном виде на ФИГ. 3A и 3B, анализ последовательностей вариабельных областей легкой цепи (ФИГ. 3A) и вариабельных областей тяжелой цепи (ФИГ. 3B) из отобранных моноклональных антител, генерируемых в Примере 2, подтвердил, что многие из них имели новые области, определяющие комплементарность, и часто проявляли новые расположения VDJ. Следует отметить, что области, определяющие комплементарность, и каркасные области, приведенные на ФИГУРАХ. 3A и 3B, определены по Kabat et al. (выше), с использованием патентованной версии базы данных Abysis.
Первоначально отобранные гибридомные клетки, экспрессирующие желательные антитела лизировали в реагенте Trizol® (Trizol® Plus RNA Purification System, Life Technologies) для получения РНК, кодирующих антитела. Между 104 и 105 клеток ресуспендировали в 1 мл Trizol и встряхивали интенсивно после добавления 200 мкл хлороформа. Образцы затем центрифугировали при 4°C в течение 10 минут, и водную фазу переносили в свежую микроцентрифужную пробирку и добавляли равный объем 70% этанола. Образец загружали на колонку RNeasy Mini spin, помещали в 2 мл пробирку-сборник и обрабатывали в соответствии с инструкциями изготовителя. Общую РНК экстрагировали элюированием, непосредственно на мембрану спин-колонки 100 мкл воды, не содержащей РНК-азы. Качество прпаратов РНК определяли посредством фракционирования 3 мкл в 1% агарозном геле перед хранением при - 80°C до использования.
Вариабельную область тяжелой цепи Ig каждой гибридомы амплифицировали, используя смесь 5'-праймеров, содержащую 32 мышиных специфичных лидерных последовательностей праймеров, разработанных для целенаправленного действия на полный мышиный набор VH в комбинации с 3' мышиным Cγ праймером, специфичным для всех мышиных изотипов Ig. Аналогично, смесь праймеров, содержащая 32 5' Vκ лидерных послеовательностей разработанных для амплификации каждой из мышиных семейств Vκ, применяли в комбинации с единственным обратным праймером, специфичным к мышиной каппа константной области, чтобы амплифицировать и секвенировать каппа легкую цепь. Для антител, содержащих лямбда легкую цепь, амплификацию проводили, используя три 5' VL лидерных последовательности в комбинации с одним обратным праймером, специфичным к мышиной лямбда константной области. VH и VL транскрипты амплифицировали из 100 нг общей РНК, используя набор Qiagen One Step RT-ПЦР следующим образом. Всего восемь реакций ОТ-ПЦР проводили для каждой гибридомы, четыре для Vκ легкой цепи и четыре для Vγ тяжелой цепи. Реакционные смеси для ПЦР включали 3 мкл РНК, 0,5 мкл 100 мкМ праймеров либо тяжелой цепи или каппа легкой цепи (синтезированных по заказу Integrated Data Technologies), 5 мкл 5× буфера ОТ-ПЦР буфер, 1 мкл dNTP, 1 мкл смеси ферментов, содержащей обратную транскриптазу и ДНК-полимеразу, и 0,4 мкл ингибитора рибонуклеазы RNasin (1 единица). Программой термоциклера являлась стадия ОТ 50°C в течение 30 минут, 95°C в течение 15 минут с последующими 30 циклами из (95°C в течение 30 секунд, 48°C в течение 30 секунд, 72°C в течение 1 минуты). Затем проводили конечную инкубацию при 72°C в течение 10 минут.
Экстрагированные продукты ПЦР секвенировали, используя такие же специфичные праймеры вариабельной цепи, как описано выше, для амплификации вариабельных областей. Чтобы получить продукты ПЦР для прямого секвенирования ДНК, их очищали, используя набор для очистки ПЦР QIAquick™ (Qiagen), в соответствии с протоколом изготовителя. ДНК элюировали из спин-колонки, используя 50 мкл стерильной воды, и затем секвенировали непосредственно из обоих цепей. Нуклеотидные последовательности анализировали, используя программный инструмент IMGT для анализа последовательностей (http://www.imgt.org/IMGTmedical/последовательност_анализ.html), чтобы идентифицировать зародышевые генные элементы V, D и J с наивысшей гомологией последовательностей. Полученные последовательности сравнивали с известными последовательностями зародышевых ДНК Ig V- и J-областей посредством выравнивания генов VH и VL с базой данных для мышиной зародышевой линии, применяя патентованную базу данных антител.
Более конкретно, ФИГ. 3A отображает смежные аминокислотные последовательности многочисленных новых мышиных вариабельных областей легкой цепи из анти-DLL3 антитело и иллюстративные гуманизированные вариабельные области легкой цепи, полученные из представительных мышиных легких цепей. Аналогично, ФИГ. 3B отображает смежные аминокислотные последовательности многочисленных новых мышиных вариабельных областей тяжелой цепи из таких же анти-DLL3 антитело и иллюстративные гуманизированные вариабельные области тяжелой цепи, производные от таких же мышиных антител, предоставляющих гуманизированные легкие цепи. Мышиные аминокислотные последовательности вариабельной области легкой и тяжелой цепи предоставлены в SEQ ID NO: 21-387, нечетные номера, в то время как гуманизированные аминокислотные последовательности вариабельной области легкой и тяжелой цепи предоставлены в SEQ ID NO: 389-407, нечетные номера.
Таким образом, взятые вместе ФИГ. 3A и 3B предоставляют снабженные аннотациями последовательности ряда функциональных мышиных анти-DLL3 антитело (называемые SC16.3, SC16.4, SC16,5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16,50, SC16,52, SC16,55, SC16,56, SC16,57, SC16,58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 и SC16.150) и иллюстративных гуманизированных антител (называемые hSC16.13, hSC16.15, hSC16.25, hSC16.34 и hSC16,56). Следует отметить, что эти же самые обозначения могут относиться к клону, который продуцирует субъектное антитело и, собственно, применение любого конкретного обозначения должно интерпретироваться в контексте окружающего описания.
Для целей рассматриваемой заявки SEQ ID NO каждого конкретного антитела представляют собой последовательные нечетные номера. Таким образом mAb SC16.3 содержит аминокислотные SEQ ID NO: 21 и 23 для вариабельных областей легкой и тяжелой цепи, соответственно. В данной связи SC16.4 содержит SEQ ID NO: 25 и 27, SC16,5 содержит SEQ ID NO: 29 и 31 и т.д. Соответствующая последовательность нуклеиновой кислоты для каждой аминокислотной последовательности антитела включена в прилагаемый список последовательностей и имеет SEQ ID NO, непосредственно предшествующий соответствующему аминокислотному SEQ ID NO. Таким образом, например, SEQ ID NO VL и VH антитела SC16.3 представляют собой 21 и 23, соответственно, и SEQ ID NO последовательностей нуклеиновых кислот VL и VH антитела SC16.3 представляют собой SEQ ID NO: 20 и 22, соответственно.
В отношении приведенных последовательностей, следует отметить, что, вследствие аномалий при секвенировании, некоторые последовательности вариабельной области тяжелой и легкой цепи были преждевременно процессированы во время проведения методики. Это привело к пропуску одной или более аминокислот в приведенной каркасной 4 последовательности. В таких случаях совместимые аминокислоты (определенные посредством обзора соответствующих последовательностей от других клонов) доставляли к полной по существу субъектной последовательности вариабельной области. Например, остатки “IK” добавляли к терминальному концу последовательности легкой цепи SC16.22 последовательност на ФИГ. 3A (SEQ ID NO: 73) для обеспечения функциональной вариабельной области легкой цепи с полным каркасом 4. Основания, кодирующие добавленные аминокислоты аналогично добавляли к соответствующей последовательности нуклеиновой кислоты (SEQ ID NO: 72) для гарантии согласованности. В каждом таком случае на ФИГ 3A и 3B, (но не в прилагаемом списке последовательностей) добавленные аминокислоты являются подчеркнутыми и выделенными жирным шрифтом, чтобы, таким образом, быть легко идентифицируемыми.
Пример 4
Генерация химерных и гуманизированных анти-DLL3 антител
Как упоминается выше, указанные некоторые мышиные антитела из Примера 2 (SC16.13, SC16.15, SC16.25, SC16.34 и SC16.56) применялись для получения из них химерных антител, содержащих человеческие константные области с мышиными вариабельными областями, и гуманизированных антител, содержащих мышиные CDR, привитые к человеческому акцепторному антителу. В предпочтительных вариантах осуществления эти полученные антитела (химерные или гуманизированные) могут быть включены в раскрытые конъюгаты DLL3.
Более конкретно, химерные анти-DLL3 антитела генерировали с использованием методов, принятых в данной области, следующим образом. Общую РНК экстрагировали из гибридом и амплифицировали, как приведено в Примере 3. Данные, касающиеся генных сегментов V, D и J VH и VL цепей мышиных антител, получали из производных последовательностей нуклеиновых кислот. Наборы праймеров, специфичных к лидерной последовательности VH и VL цепи антитела, создавали, используя следующие сайты рестрикции: AgeI и XhoI для VH фрагментов, и XmaI и DraIII для VL фрагментов. Продукты ПЦР очищали с использованием набора Qiaquick для очистки продуктов ПЦР (Qiagen), с последующей обработкой рестрикционными ферментами AgeI и XhoI для VH фрагментов и XmaI и DraIII для VL фрагментов. VH и VL обработанные ПЦР продукты очищали и лигировали, соответственно, в вектор экспрессии константной области тяжелой цепи человеческого IgG1 (SEQ ID NO. 6) или вектор экспрессии константной области легкой цепи человеческой каппа CL (SEQ ID NO. 5).
Реакции лигирования проводили следующим образом: в общем объеме 10 мкл с использованием 200Ед T4-ДНК Лигазы (New England Biolabs), 7,5 мкл обработанного и очищенного ген-специфичного продукта ПЦР и 25 нг линеаризованного вектора ДНК. Компетентные бактерии E. coli DH10B (Life Technologies) трансформировали посредством теплового шока при 42°C с использованием 3 мкл продукта лигирования и помещали в планшеты с ампициллином при концентрации 100 мкг/мл. После очистки и обработки амплифицированных продуктов лигирования, VH фрагмент клонировали в сайты рестрикции AgeI-XhoI вектора экспрессии pEE6.4HuIgG1 (Lonza), а VL фрагмент клонировали в сайты рестрикции XmaI-DraIII вектора экспрессии pEE12.4Hu-Каппа (Lonza).
Химерные антитела экспрессировали посредством со-трансфекции клеток HEK-293T с использованием векторов экспрессии pEE6.4HuIgG1 и pEE12.4Hu-Каппа. Перед трансфекцией клетки HEK-293T культивировали в 150 мМ планшетах при стандартных условиях в модифицированной Дульбекко среде Игла (DMEM), дополненной 10% инактивированным теплом FCS, 100 мкг/мл стрептомицина и 100 Ед/мл пенициллина G. Для преходящих трансфекций клетки выращивали до 80% конфлюентности. 12,5 мкг каждого из ДНК векторов pEE6.4HuIgG1 и pEE12.4Hu-Каппа добавляли к 50 мкл реагента трансфекции HEK-293T в 1,5 мл Opti-MEM. Смесь инкубировали в течение 30 минут при комнатной температуре и помещали в планшеты. Супернатанты собирали через три - шесть дней после трансфекции. Супернатанты культур, содержащие рекомбинантные химерные антитела, осветляли от клеточного дебриса центрифугированием при 800×g в течение 10 минут и хранили при 4°C. Рекомбинантные химерные антитела очищали посредством аффинной хроматографии с Белком A.
Те же самые мышиные анти-DLL3 антитела (например, SC16.13, SC16.15, SC16.25, SC16.34 и SC16.56) также получали для получения производных CDR-привитых или гуманизированных антител. В этой связи, мышиные антитела гуманизировали с использованием патентованного осуществляемого компьютером метода CDR-прививки (Abysis Database, UCL Business) и стандартных методов молекулярного конструирования следующим образом. Человеческие вариабельные области каркасных областей были разработаны на основании наивысшей гомологии между каркасными последовательностями и последовательностями канонических структур CDR антител человеческого эмбрионального типа, и каркасными последовательностями и CDR соответствующих мышиных антител. С целью анализа отнесение аминокислот к каждому из доменов CDR было сделано в соответствии с нумерацией Kabat et al.. Как только вариабельные области были выбраны, их генерировали из синтетических генных сегментов (Integrated DNA Technologies). Гуманизированные антитела клонировали и экспрессировали с использованием молекулярных методов, описанных выше для химерных антител.
Генетические композиции для выбранных человеческих акцепторных вариабельных областей показаны в ТАБЛИЦЕ 3 непосредственно ниже для каждого из гуманизированных антител. Последовательности, отображенные в ТАБЛИЦЕ 3, соответствуют аннотированным последовательностям тяжелой и легкой цепи, приведенных на ФИГУРАХ. 3A и 3B для рассматриваемых клонов. Более конкретно, данные, приведенные в ТАБЛИЦЕ 3 ниже, соответствуют последовательностям смежных вариабельных областей, приведенным как SEQ ID NO: 389 и 391 (hSC16.13), SEQ ID NO: 393 и 395 (hSC16.15), SEQ ID NO: 397 и 399 (hSC16.25), SEQ ID NO: 401 и 403 (hSC16.34) и SEQ ID NO: 405 и 407 (hSC16.56). Кроме генетической композиции, ТАБЛИЦА 3 показывает, что в этих выбранных вариантах осуществления, никакие каркасные изменения или обратными мутации не были необходимыми для поддержания благоприятных свойств связывания выбранных антител. Конечно, в других CDR привитых конструкциях следует принимать во внимание, что такие каркасные изменения или обратные мутации могут быть желательными и, как таковые, явным образом рассматриваются в пределах объема рассматриваемого изобретения.
|
Несмотря на то, что никакие остатки не были изменены в каркасных областях, в один из гуманизированных клонов (hSC16.13) были введены мутации CDR2 тяжелой цепи для решения проблем стабильности. Аффинность связывания антитела с модифицированной CDR проверяли, чтобы гарантировать ее эквивалентность с соответствующим либо химерным или мышиным антителом.
После гуманизации всех выбранных антител посредством прививки CDR, полученные в результате аминокислотные последовательности вариабельной области легкой и тяжелой цепи анализировали, чтобы определить их гомологию по отношению к мышиной донорной и человеческой акцепторной вариабельных областей легкой и тяжелой цепи. Результаты, показанные в ТАБЛИЦЕ 4 непосредственно ниже, отображают, что гуманизированные конструкции сопоставимо проявляли более высокую гомологию по отношению к человеческим акцепторным последовательностям, чем к мышиным донорным последовательностям. Более конкретно, мышиные вариабельные области тяжелой и легкой цепи показывают аналогичный общий процент гомологии с наиболее близким совпадением с генами человеческого эмбрионального типа (85%-93%) по сравнению с гомологией гуманизированных антител и белковых последовательностей донорной гибридомы (74%-83%).
|
При тестировании, и, как будет обсуждаться более подробно ниже, каждая из полученных гуманизированных конструкций проявляла благоприятные характеристики связывания, приблизительно сопоставимые с характеристиками, показанными мышиными родительскими антителами.
Пример 5
Характеристики анти-DLL3 антител
Применяли различные методы, чтобы проанализировать характеристики связывания и иммунохимические характеристики выбранных модуляторов DLL3 антител, генерируемых, как приведено выше. Конкретно, ряд модуляторов антител были охарактеризованы по аффинности, кинетике, биннингу, расположению связывания и перекрестной реактивности по отношению к распознаванию человеческих, обезьяньих, крысиных и мышиных антигенов (т.е., с использованием клеток и конструкций белка DLL3) посредством принятых в данной области методов, включающих проточную цитометрию. Константу аффинности и кинетические константы kon и koff выбранных модуляторов измеряли, используя анализ интерферометрии биослоя на ForteBio RED (ForteBio, Inc.) или поверхностный плазмонный резонанс с использованием Biacore 2000, каждый в соответствии с инструкциями изготовителя.
Результаты характеризации приведены в табличной форме на ФИГ. 5, где можно видеть, что выбранные модуляторы в целом проявляли относительно высокие аффинности в наномолярном диапазоне и, во многих случаях, имели перекрестную реактивность. На ФИГ. 5 дополнительно приведены эмпирически определяемые бины антител, а также домен DLL3, связанный рассматриваемый антителом, как определяют, используя опосредованную дрожжами экспрессию фрагмента антигена, таким образом, как описано более подробно в Примере 6 непосредственно ниже.
Что касается биннинга антител, ForteBio RED применяли в соответствии с инструкциями изготовителя, чтобы идентифицировать конкурирующие антитела, которые связаны с одинаковыми или различными бинами. Вкратце, референтное антитело (Ab1) захватывалось на анти-мышином чипе захвата, затем высокую концентрацию несвязывающего антитела применяли для блокирования чипа и отмечали исходный уровень. Мономерное, рекомбинантное человеческое DLL3-Flag (Adipogen International) затем захватывали специфичным антителом (Ab1), и наконечник погружали в лунку либо с таким же антителом (Ab1) в качестве контроля или в лунку с отличающимся тестируемым антителом (Ab2). Если с новым антителом наблюдали дополнительное связывание, тогда определяли, что Ab1 и Ab2 находятся в различных бинах. Если не происходит дополнительного связывания, как определяют посредством сравнения уровней связывания с контрольным Ab1, тогда определяют, что Ab2 находится в том же самом бине. Как известно в данной области, данный процесс может распространяться на скрининг крупных библиотек уникальных антител с использованием полного ряда антител, представляющих уникальные бины в 96-луночном планшете. В рассматриваемом случае, данный процесс биннинга показал, что скринируемые антитела связаны с по меньшей мере девятью различными бинами (обозначаемыми как Бины A - I на ФИГ. 5) на белке DLL3. На основании кажущегося размера антигена DLL3 (где ECD равен приблизительно 56 кД) и разрешения используемой методологии биннинга, полагают, что девять идентифицированных бинов представляют большинство бинов, присутствующих на внеклеточном антигене DLL3.
В дополнение к оценке иллюстративных модуляторов, как приведено выше, проводили проточную цитометрию, для подтверждения того, что выбранные SC16 модуляторы антитела могут иммуноспецифически ассоциироваться с человеческим DLL3, и, чтобы определить происходит ли перекрестное взаимодействие таких же антител с обезьяньим, крысиным и/или мышиным DLL3. Более конкретно, иллюстративные мышиные антитела анализировали посредством проточной цитометрии, используя FACSCanto II и клетки 293, сверхэкспрессирующие мышиный, крысиный, обезьяний или человеческий DLL3. В некоторых случаях, иллюстративные мышиные модуляторы анализировали посредством проточной цитометрии, используя FACSCanto II и дрожжевые клетки, проявляющие обезьяний DLL3, используя методы, описанные Cochran et al. (J Immunol Methods. 287 (1-2):147-158 (2004).
На основании проточной цитометрии было обнаружено, что все выбранные модуляторы антител связываются с человеческим DLL3, сверхэкспрессируемым на клетках 293 (данные не показаны), в то время, как было обнаружено, что ряд тестируемых антител перекрестно взаимодействуют с обезьяньим и/или мышиным DLL3 (все антитела, взаимодействующие с мышиным, также взаимодействовали с крысиным). В данной связи, и как приведено на ФИГ. 5, было обнаружено, что восемь из тринадцати модуляторов, которые иммуноспецифически взаимодействуют с человеческим DLL3, также взаимодействуют с мышиным (или крысиным) DLL3. Было обнаружено, что, конкретно, mAbs SC16.4, SC16.8, SC16.15, SC16.34, SC16.39, SC16.46, SC16.51 и SC16.56 перекрестно взаимодействуют с мышиным DLL3 в большей или меньшей степени, в то время как mAbs SC16.7, SC16.10, SC16.13, SC16.25 и SC16.65 заметно не ассоциировались с мышиным DLL3. Такие результаты не являются неожиданными с учетом того, что мышиный DLL3 является приблизительно на 83% гомологичным с изоформой 2 человеческого DLL3. Следует принимать во внимание, что эта кросс-реактивность может преимущественно использоваться в контексте рассматриваемого изобретения посредством применения животных моделей при открытии и разработке лекарственных средств.
Кроме проведения вышеуказанных аналитических тестов, гуманизированные конструкции hSC16.13, hSC16.15, hSC16.25, hSC16.34 и hSC16.56 из Примера 4 анализировали, чтобы определить, изменил ли заметно процесс прививки CDR их характеристики связывания. В этой связи, гуманизированные конструкции (CDR привитые) сравнивали с “традиционными” химерными антителами, содержащими вариабельные домены тяжелой и легкой цепи мышиного родительского (или донорного) антитела и человеческую константную область, по существу эквивалентную области, используемой в гуманизированных конструкциях. С использованием этих конструкций проводили поверхностный плазмонный резонанс (SPR), используя Biacore 2000 (GE Healthcare) для идентификации каких-либо малозаметных изменений констант скорости, привнесенных процессом гуманизации.
На основании концентрационных рядов по 25 и 12,5 нМ человеческого антигена DLL3, и, используя модель связывания Лэнгмюра 1:1, оценивали, что KD связывания антитела SC16.15 с человеческим антигеном DLL3 равна 0,2 нМ. Аналогичные эксперименты затем проводили с другими гуманизированными конструкциями и химерными конструкциями, для демонстрации того, что они сохраняют терапевтические значения аффинности (данные не показаны). Такие результаты демонстрируют, что процесс гуманизации не оказывал существенного воздействия на аффинность модуляторов и показали, что они являются жизнеспособными кандидатами для применения в раскрытых DLL3 ADC.
Пример 6
Картирование доменов и эпитопов анти-DLL3 антител
Чтобы охарактеризовать и позиционировать эпитопы, с которыми раскрытые конъюгаты антитела DLL3 с лекарственным средством ассоциируются или связывается, выполняли картирование эпитопов на доменном уровне на многочисленных иллюстративных антителах, используя модификацию протокола, описанного Cochran et al., 2004 (выше). Вкратце, индивидуальные домены DLL3, содержащие специфичные аминокислотные последовательности, экспрессировали на поверхности дрожжей, и связывание выбранными DLL3 антителами определяли посредством проточной цитометрии.
Более конкретно, плазмидные конструкции дрожжевого фенотипа создавали для экспрессии следующих конструкций: внеклеточного домена DLL3 (аминокислоты 27-466); химеры DLL1-DLL3, которая состоит из N-терминальной области и домена DSL DLL1 (аминокислоты 22-225), гибридизированного с EGF-подобными доменами 1-6 DLL3 (аминокислоты 220-466); химеры DLL3-DLL1, которая состоит из N-терминальной области и домена DSL DLL3, (аминокислоты 27-214), гибридизированного с EGF-подобными доменами 1-8 DLL1 (аминокислоты 222-518); EGF-подобного домена #1 (аминокислоты 215-249); EGF-подобного домена #2 (аминокислоты 274-310); EGF-подобных доменов #1 и #2 (аминокислоты 215-310); EGF-подобного домена #3 (аминокислоты 312-351); EGF-подобного домена #4 (аминокислоты 353-389); EGF-подобного домена #5 (аминокислоты 391-427); и EGF-подобного домена #6 (аминокислоты 429-465). (Информацию по доменам см., в целом, в базе данных UniProtKB/Swiss-Prot вход Q9NYJ7, которая включена в данный документ посредством ссылки. Следует отметить, что нумерацию аминокислот проводят посредством ссылки на непроцессированный белок DLL3 с лидерной последовательностью, такой как приведенная в SEQ ID NO. 1). Для анализа N-терминальной области или EGF доменов в целом, применяли химеры с членом семейства DLL1 (DLL1-DLL3 и DLL3-DLL1), а не фрагментами, чтобы минимизировать потенциальные проблемы со складчатостью белка. Ранее было показано, что домен-картированные антитела не взаимодействуют перекрестно с DLL1, что указывает на то, что какое-либо связывание с этими конструкциями происходило посредством ассоциации с DLL3 частью конструкции. Эти плазмиды трансформировали в дрожжи, которые затем выращивали и индуцировали, как описано в Cochran et al.
Для тестирования связывания с конкретной конструкцией, 200000 индуцированных дрожжевых клеток, экспрессирующих желательную конструкцию, промывали дважды в PBS+1 мг/мл BSA (PBSA), и инкубировали в 50 мкл PBSA с биотинилированным анти-HA клоном 3F10 (Roche Diagnostics) при 0,1 мкг/мл и либо 50 нМ очищенного антитела или разведением 1:2 неочищенного супернатанта от гибридом, культивируемых в течение 7 дней. Клетки инкубировали в течение 90 минут на льду, с последующими 2 промывками в PBSA. Клетки затем инкубировали в 50 мкл PBSA с соответствующими вторичными антителами: для мышиных антител, конъюгированный с Alexa 488 стрептавидин, и конъюгированные с Alexa 647 козьи антитела против мышиных антител (оба от Life Technologies) добавляли при 1 мкг/мл каждый, а для гуманизированных или химерных антител, конъюгированный с Alexa 647 стрептавидин (Life Technologies), и конъюгированные с R-фикоэритрином козьи антитела против человеческих антител (Jackson Immunoresearch) добавляли при 1 мкг/мл каждый. После двадцатиминутной инкубации на льду, клетки дважды промывали PBSA и анализировали на FACS Canto II. Антитела, которые связывались с химерой DLL3-DLL1, обозначали, как связывающиеся с N-терминальной областью+DSL. Антитела, которые связывались специфически с эпитопом, присутствующим на конкретном EGF-подобном домене, обозначали, как связывающиеся с его соответствующим доменом.
Чтобы классифицировать эпитоп как конформационный (например, прерывистый) или линейный, дрожжи, проявляющие внеклеточный домен DLL3, подвергали тепловой обработке в течение 30 минут при 80°C, затем промывали дважды в ледяном PBSA. Дрожжи, проявляющие денатурированный антиген (денатурированные дрожжи), затем подвергали такому же протоколу окрашивания и анализу методом проточной цитометрии, как описано выше. Антитела, которые связывались как денатурированными, так и нативными дрожжами, классифицировали, как связывающиеся с линейным эпитопом, в то время как антитела, которые связывались с нативными дрожжами, но не с денатурированными дрожжами, классифицировали как конформационно специфичные.
Схематическое обобщение данных картирования эпитопов на доменном уровне для тестируемых антител, представлено на ФИГ. 4, причем антитела, связывающиеся с линейным эпитопом подчеркнуты, а, где определено, соответствующий бин указан в скобках. Обзор ФИГ. 4 показывает, что большинство модуляторов имеют тенденцию картироваться до эпитопов, обнаруженных либо в N-терминальной/DSL области DLL3 или во втором EGF-подобном домене. Как упоминалось прежде, ФИГ. 5 представляет аналогичные данные, касающиеся определения бина и доменного картирования для ряда выбранных модуляторов, в табличной форме.
Точное картирование эпитопов проводили дополнительно на выбранных антителах с использованием одного из двух методов. В первом методе использовали набор пептидных библиотек фагового отображения Ph.D.-12 (New England Biolabs E8110S), который применяли в соответствии с инструкциями изготовителя. Вкратце, антитела для картирования эпитопов покрывали в течение ночи при 50 мкг/мл в 3 мл 0,1M раствора бикарбоната натрия, pH 8, на пробирке Nunc MaxiSorp (Nunc). Пробирку блокировали раствором 3% BSA в растворе бикарбоната. Затем, обеспечивали связывание 1011 вводимого фага в PBS+0,1% Твин-20, сопровождаемое десятью последовательными промывками при 0,1% Твин-20, чтобы отмыть несвязывающийся фаг. Оставшийся фаг элюировали 1 мл 0,2M глицина в течение 10 минут при комнатной температуре при осторожном встряхивании, с последующей нейтрализацией с 150 мкл 1M Tris-HCl pH 9. Элюированный фаг амплифицировали и снова подвергали пэннингу с 1011 вводимого фага, используя 0,5% Твин-20 во время стадии промывки, чтобы увеличить строгость селекции. ДНК из 24 сгустков элюированного фага из второго цикла выделяли, используя набор Qiaprep M13 Spin (Qiagen), и секвенировали. Связывание клонального фага подтверждали, используя аналитическую систему ELISA, где картированное антитело или контрольное антитело покрывали на планшете для ELISA, блокировали, и подвергали воздействию каждого клона фага. Связывание фагов обнаруживали, используя пероксидазу хрена, конъюгированную с анти-M13 антителом (GE Healthcare), и раствор 1-Step Turbo TMB ELISA (Pierce). Пептидные последовательности фагов от специфически связывающегося фага выравнивали, используя Вектор NTI (Life Technologies) против пептидной последовательности антигена ECD, чтобы определить эпитоп связывания.
Альтернативно, метод дрожжевого отображения (Chao et al., Nat Protoc. 1(2): 755-768, 2007) применяли для эпитопного картирования выбранных антител. Вкратце, библиотеки DLL3 ECD мутантов генерировали с помощью ПЦР с ошибающейся полимеразой, применяя нуклеотидные аналоги 8-оксо-2'-дезоксигуанин-5'-трифосфат и 2'-дезокси-п-нуклеозид-5'-трифосфат (оба от TriLink Bio) для целевой степени мутагенеза, равной одной аминокислотной мутации на клон. Их трансформировали в формат дрожжевого фенотипа. Используя метод, описанный выше для картирования на доменном уровне, библиотеку окрашивали на HA и проводили связывание антител при 50 нМ. С использованием FACS Aria (BD), клоны, которые проявляли потерю связывания в сравнении с DLL3 ECD дикого типа, отсортировывали. Эти клоны повторно выращивали, и подвергали еще одному циклу сортировки FACS для потери связывания с целевым антителом. С использованием набор Zymoprep Yeast Plasmid Miniprep (Zymo Research), выделяли и секвенировали индивидуальные клоны ECD. Там, где необходимо, мутации переформатировали в виде одиночно-мутантных клонов ECD, используя набор Quikchange для сайт-направленного мутагенеза (Agilent).
Индивидуальные клоны ECD затем подвергали скринингу, чтобы определить происходит ли потеря связывания вследствие мутации в эпитопе, или мутации, которая вызвала неправильную укладку. Мутации, которые включали цистеин, пролин и стоп-кодоны, автоматически исключали, вследствие высокой вероятности мутации с неправильной укладкой. Оставшиеся клоны ECD затем скринировали на предмет связывания с неконкурентным, конформационно специфичным антителом. Был сделан вывод, что клоны ECD, которые потеряли связывание с неконкурентными, конформационно специфичными антителами, содержат мутации с неправильной укладкой, в то время как для клонов ECD, которые сохраняли эквивалентное связывание с DLL3 ECD дикого типа, делали вывод о правильной укладке. Делали вывод, что мутации в клонах ECD в последней группе находятся в эпитопе. Результаты приведены в ТАБЛИЦЕ 5 непосредственно ниже.
|
Более конкретно, обобщение выбранных антител с производными из них эпитопами, содержащими аминокислотные остатки, которые вовлечены в связывание с антителом, приведены в ТАБЛИЦЕ 5. В этой связи антитела SC16.34 и SC16.56 явным образом взаимодействуют с общими аминокислотными остатками, что согласуется с информацией по биннингу, и результатами картирования доменов, показанными на ФИГ. 4. Более того, было обнаружено, что SC16.23 взаимодействует с отличающимся смежным эпитопом и не входит в бин с SC16.34 или SC16.56.
Пример 7
Получение конъюгатов DLL3 антитела с лекарственным средством
Чтобы дополнительно продемонстрировать разносторонность рассматриваемого изобретения, конъюгаты анти-DLL3 антитела с лекарственным средством, по существу приведенные в ADC 1-5, получали посредством конъюгирования соединений DL1-DL5 с DLL3-антителами, такими, как раскрытые в данном документе. В этой связи следует принимать во внимание, что, вследствие линкера, выбранного для DL4, две немного отличающихся методики конъюгирования используют для предоставления раскрытых конъюгатов. Более конкретно, ADC 1-3 и 5 предпочтительно получают, используя первую методику конъюгирования ниже, а ADC 4 предпочтительно получают, используя вторую методику под ней.
(a) Малеимидное конъюгирование
Более конкретно, получают конъюгаты DLL3-антитела с лекарственным средством, содержащие линкер и димеры пирролобензодиазепина (ПБД), приведенные в DL1-DL3, а DL5 ковалентно присоединяют к раскрытым антителам (см., в целом, в патентных заявках США №№ 2011/0256157 и 2012/0078028 и патенте США № 6,214,345, каждая из которых полностью включена в данный документ посредством ссылки).
Комбинации лекарственное средство-линкер DL1-DL3 и DL5 синтезируют и очищают по существу, как описано в Примере 1 выше, и используя методы, принятые в данной области. После получения, структурную единицу лекарственное средство-линкер, содержащую a терминальный малеимидо фрагмент, конъюгируют со свободным сульфгидрилом на выбранном DLL3 антителе. В данной связи, конъюгаты DLL3 получают посредством частичного восстановления выбранного DLL3 антитела с помощью трис-(2-карбоксиэтил)-фосфина (TCEP) с последующей реакцией восстановленных Cys остатков с полезной нагрузкой малеимидо-линкер.
Более конкретно, выбранный модулятор DLL3 антитела восстанавливают 1,3 молями трис(2-карбоксиэтил)-фосфина (TCEP) на моль mAb в течение 90 минут при 20°C в 200 мМ Tris, pH 7,5 и 32 мМ EDTA буфере. Реакционная смесь охлаждалась до 15°C и линкерную полезную нагрузку, растворенную в DMA, затем добавляли при отношении 3,2 моль/моль mAb с предварительным добавлением дополнительного количества DMA до конечной концентрации, равной 6% (об/об). Реакция протекает в течение 30 минут. Непрореагировавшее соединение лекарственное средство-линкер блокируют добавлением эквивалентного молярного избытка N-ацетилцистеина. Конъюгаты, по существу приведенные в ADC 1-3 и 5 затем очищают на ионо-обменной колонке, используя систему AKTA Explorer FPLC (G.E. Healthcare) для удаления агрегированных высокомолекулярных антител, co-растворителя и небольших молекул. Элюированный конъюгат затем подвергают замене буфера посредством тангенциальной поточной фильтрации (TFF) в буфер для лекарственной формы с последующим доведением концентрации и добавлением детергента. Конечный конъюгат анализируют на концентрацию белка (измеряя УФ), агрегацию (SEC), отношение лекарственного средства к антителу (DAR) посредством обращенно-фазовой (ОФ) ВЭЖХ, присутствие неконъюгированных антител посредством хроматографии с гидрофобным взаимодействием (ГВХ) ВЭЖХ, небелковые вещества посредством ОФ ВЭЖХ и цитотоксичность in vitro, используя клеточную линию, экспрессирующую DLL3.
(b) Йодацетамидное конъюгирование
ADC 4 получают по существу следующим образом. DL4 синтезируют и предоставляют, как приведено в Примере 1. После получения, блок цитотоксин-линкер, содержащий терминальный йодацетамидный фрагмент конъюгируют со свободным сульфгидрилом на выбранном DLL3 антителе. В данной связи, конъюгаты DLL3 получают посредством частичного восстановления выбранного DLL3 антитела с помощью трис-(2-карбоксиэтил)-фосфина (TCEP) с последующей реакцией восстановленных Cys остатков с полезной нагрузкой йодацетамид-линкер.
Более конкретно, выбранный модулятор DLL3 антитела восстанавливают 1,8 моля TCEP на моль mAb в течение 90 минут при 20°C в PBS pH 7,2 и 5 мМ EDTA буфере. Раствор восстановленного антитела затем доводят до pH 8,5 с помощью 100 мМ бората натрия и добавляют полезную нагрузку линкера в ДМСО при отношении, равном по меньшей мере 5 моль/моль mAb с предварительным добавлением дополнительного количества ДМСО до конечной концентрации, равной 6% (об/об). Реакция затем протекает в течение ночи при 20oC. Конъюгат затем подвергают замене буфера посредством тангенциальной поточной фильтрации (TFF) в диафильтрационный буфер с последующим доведением концентрации и добавлением детергента. Конечный конъюгат затем анализируют на концентрацию белка (измеряя УФ), агрегацию (SEC), отношение лекарственного средства к антителу (DAR) посредством обращенно-фазовой (ОФ) ВЭЖХ, и цитотоксичность in vitro, используя клеточную линию, экспрессирующую DLL3.
Используя вышеуказанные методики, или по существу аналогичную методологию, известную в данной области, ряд конъюгатов, содержащих комбинации различных модуляторов DLL3 антител и DL фрагментов, генерируют и характеризуют, как описано в данном документе. В данной связи ФИГ. 6 предоставляет обобщение ADC, которые могут генерироваться в соответствии с настоящим раскрытием посредством конъюгирования специфичного антитела (например, SC16.3) с выбранным соединением лекарственное средство-линкер (например, DL1) для предоставления соответствующего ADC (т.е., SC16.3-DL1 или SC16.3-ADC1). Специалисты в данной области смогут понять, что каждое из обозначений антитела в иллюстративных конструкциях ФИГ. 6, за исключением идентифицированных как гуманизированные (например, hSC16.34-DL4), может представлять любой тип антитела (химерное, гуманизированное, человеческое, IgG1, IgG3, и т.д., версии идентифицированных мышиных клонов) или его иммунореактивный фрагмент. Более того, следует принимать во внимание, что иллюстративные соединения ADC 1, ADC 2, ADC 3 и ADC5 конъюгируют, используя протокол, приведенный в Примере 7(a), в то время как иллюстративные соединения ADC 4 конъюгируют, используя протокол, приведенный в Примере 7(b). Следует принимать во внимание, что в выбранных аспектах настоящее изобретение содержит конъюгаты, приведенные на ФИГ. 6.
Пример 8
Аналитический тест на уничтожение опухолевых клеток In Vitro
Применение конъюгатов DLL3 антитела с лекарственным средством
Для демонстрации того, что DLL3 ADC рассматриваемого изобретения обладают способностью опосредовать доставку цитотоксического средства к живым клеткам, выполняют аналитические тесты на уничтожение клеток in vitro, используя выбранные конъюгаты DLL3, полученные, как в предыдущих Примерах.
DLL3-нацеленные ADC, нагруженные одной из нескольких ПБД полезных нагрузок (т.е., ПБД1 - ПБД5), оценивают in vitro и связывают, с наномолярной аффинностью, специфически с DLL3 на человеческих клетках 293, сконструированных для сверхэкспрессии человеческого DLL3, но не на интактных родительских клетках 293. Для исследования цитотоксического потенциала выбранных ADC 1-5 in vitro, оценивают их способность уничтожать клетки 293, сверхэкспрессирующие человеческий DLL3. Конкретно, родительские клетки 293T или клетки 293T, сконструированные для экспрессии DLL3, инкубируют с разведениями выбранных ADC 1-5 в течение периода, равного 48-72 часам перед оценкой жизнеспособности клеток, используя Cell Titer Glo® (Promega) в соответствии с инструкциями производителя. ADC, которые уничтожают клетки 293, сверхэкспрессирующие DLL3 с IC50, равной 0,1-100 пМ, но которые демонстрируют от небольшой до отсутствия способности уничтожать интактные родительские клетки 293, выбирают в качестве кандидатов на доклинические исследования.
На основании аналитических тестов с 293 на цитотоксичность, выбирают конъюгаты для дополнительного исследования с опухолевыми клетками. Первоначально, 2500 клеток/лунку человеческих KDY66, почечных NET NTX, экспрессирующих эндогенный DLL3, диссоциируют в суспензии одиночных клеток и помещают на планшеты BD PrimariaTM (BD Biosciences) в дополненную фактором роста безсывороточную среду, известную в области. Через период, равный 24 часам, различные концентрации (0,1-100 пМ) очищенных конъюгатов DLL3 антител, например, SC16.26-DL1, SC16.81-DL2, SC16.118-DL4 и SC16.67-DL5, наряду с соответствующими контролями (например, несвязывающими конъюгатами IgG1-DL) добавляют к культурам. Через семидневный период планшеты исследуют, чтобы определить воздействие конъюгатов DLL3 антитела на жизнеспособность клеток. Способность конъюгатов антитела с лекарственным средством интернализоваться и уничтожать опухолевые клетки определяют посредством подсчета числа жизнеспособных клеток с использованием Cell Titer Glo® в соответствии с инструкциями производителя. Грубые оценки люминесценции с использованием культур, содержащих клетки, подвергнутых воздействию контрольного конъюгата изотипного антитела, устанавливаются как 100% референтные значения, и все другие оценки рассчитывают соответственно. Предполагается, что некоторые или все из конъюгатов DLL3 уничтожают опухолевые клетки KDY66 с IC50, равной между 0,1 пМ и 100 пМ, и, что контроли изотипного конъюгата проявляют крайне высокие значения IC50.
Активные конъюгаты DLL3 антитела тестируют в тесте с лимитирующими разведениями, чтобы определить значения EC50 для активности. Используя такой же аналитический тест, описанный непосредственно выше, выбранные конъюгаты антитела и соответствующие контроли конъюгатов инкубируют с помещенными в планшет опухолевыми клетками яичника (например, OV26, опухоли яичника NET NTX). Предполагают, что некоторые из всех конъюгатов показывают эффективное уничтожение опухолевых клеток яичника с измеренными значениями EC50 в пикомолярном или надпикомолярном диапазоне. Напротив, предполагают, что контрольные ADC проявляют относительно высокие значения EC, что указывает на то, что они неэффективно интернализованы, и конъюгированное лекарственное средство остается в неактивном состоянии.
Чтобы дополнительно продемонстрировать разносторонность раскрытого изобретения, опухолевые клетки, полученные из крупноклеточной нейроэндокринной карциномы легкого (LU37) подвергают воздействию выбранных конъюгатов (например, SC16.26-DL1, SC16.81-DL2 и SC16.67-DL5) в соответствии с принципами данного документа. Более конкретно, 2500 клеток LU37 NTX на лунку помещают в планшеты (планшеты BD Primaria™) в дополненную фактором роста безсывороточную среду за один день перед добавлением конъюгированного DLL3 антитела и конъюгированных изотипных контролей. Клетки в планшетах подвергают воздействию различных концентраций конъюгатов DLL3 и контрольных конъюгатов в течение семи дней. После воздействия, жизнеспособность клеток определяют посредством подсчета числа жизнеспособных клеток с использованием Cell Titer Glo®, как описано выше. Предполагают, что конъюгаты DLL3 эффективно устраняют опухолевые клетки при клинически приемлемых концентрациях. Например, предполагают, что конъюгаты DLL3 обладают способностью уничтожать 50% клеток LU37 in vitro при концентрациях меньших, чем приблизительно 100 пМ, в то время как для контрольных конъюгатов изотипов требуются концентрации >1 нМ для уничтожения 50% опухолевых клеток.
Такие результаты могли бы служить указанием на то, что раскрытые конъюгаты являются применимыми для лечения различных неопластических нарушений.
Пример 9
Анализ подавления роста опухоли In Vivo
Применение конъюгатов DLL3 антитела с лекарственным средством
С учетом приведенных выше результатов in vitro, проводят эксперименты, чтобы оценить способность раскрытых DLL3 ADC вызывать регресс и подавлять рост DLL3-экспрессирующих человеческих опухолей in vivo. Более конкретно, выбранные конъюгаты DLL3, содержащие как мышиные, так и гуманизированные модуляторы, тестируют, чтобы продемонстрировать их способность подавлять рост опухоли NTX человека у иммунодефицитных мышей.
Для подготовки к экспериментам полученные от пациента опухоли NTX (LU37, LU73, и OV26) выращивают подкожно в боковых областях самок NOD/SCID реципиентных мышей с использованием методов, принятых в данной области. Объемы опухолей и массы мышей регистрируют дважды еженедельно. Когда объемы опухолей достигают 150-250 мм3, мышей статистически распределяют по группам обработки и вводят инъекции с различными дозами конъюгатов DLL3, например, SC16.21-DL2, SC16.144-DL4, hSC16.34-DL5, hSC16.56-DL1, или изотипных контролей, содержащих такие же DL (каждый из которых получен по существу, как описано в Примере 7 выше) посредством внутрибрюшинной инъекции. Мыши получают три равных инъекции ADC при 0,1 - 1 мг/кг, равномерно разделенных на протяжении семи дней. После обработки, объемы опухолей и массы мышей регистрируют, пока опухоли не превышали 800 мм3 или мыши не заболевали.
Предполагают, что в большей или меньшей степени выбранные конъюгаты DLL3 показывают способность уменьшать объем опухоли или подавлять рост опухоли. В некоторых случаях, предполагают, что подавление роста опухоли является продолжительным, например, с продолжительностью 30 дней, 40 дней, 50 дней, 60 дней или более по отношению к каждой из трех различных опухолевых клеточных линий. Способность ряда конъюгированных модуляторов, включающих гуманизированные конъюгаты, замедлять или подавлять рост опухоли in vivo в течение длительных периодов будет дополнительно подтверждать применение раскрытых конъюгатов DLL3 в качестве терапевтических средств для лечения пролиферативных нарушений.
Пример 10
Анализ снижения частоты раковых стволовых клеток
Применение конъюгатов DLL3 антитела с лекарственным средством
Предполагают, что, как приведено в предшествующих Примерах, раскрытые конъюгаты DLL3 являются эффективными при подавлении роста опухоли. Более того, как обсуждается выше, экспрессия DLL3 ассоциирована с раковыми стволовыми клетками, которые как общеизвестно, являются резистентными к лекарственным средствам и являются источником повторного проявления и метастазирования опухолей. Соответственно, чтобы продемонстрировать, что лечение с использованием DLL3-ADC снижает потенциальный рецидив линий NTX, выполняют анализы с ограниченными разведениями (LDA) in vivo, чтобы определить частоту раковых стволовых клеток в опухоли мелкоклеточного рака легких после обработки конъюгатами DLL3, например, hSC16.13-DL2 или hSC16.34-DL5.
Полученный от пациента трансплантат опухоли мелкоклеточного рака легких (LU95) и полученный от пациента трансплантат из папиллярно-клеточного типа карциномы почек (KDY66) выращивают подкожно у иммунодефицитных мышей-хозяев. Когда объемы опухолей достигают в среднем 150 мм3 - 250 мм3, мышей статистически разделяют на две группы по семь мышей Посредством внутрибрюшинной инъекции, мышам инъекционно вводят в дни 0, 4 и 7, либо человеческий IgG1-DL2 или человеческий IgG1-DL5 (1 мг/кг; n=7 мышей каждая) в качестве отрицательных контролей или конъюгаты DLL3, например, hSC16.13-DL2 или hSC16.34-DL5 (1 мг/кг; n=7 мышей каждая). В день 8, двух представительных мышей из каждой группы (всего четыре) подвергали эвтаназии и их опухоли собирают и диспергируют до суспензий одиночных клеток. Предполагают, что опухоли, обработанные контрольными конъюгатами изотипов, продолжают расти у пяти оставшихся мышей, в то время, как объемы опухолей, обработанных конъюгатами DLL3, снижаются до нуля или почти до нуля у пяти оставшихся мышей.
Используя стандартные методы проточной цитометрии и меченые анти-DLL3 антитела, оценивают собранные опухоли от каждой из четырех групп обработки, чтобы подтвердить положительную экспрессию DLL3. Опухолевые клетки от каждой соответствующей группы обработки затем объединяют, и живые человеческие клетки выделяют посредством FACS с использованием FACSAria III (Becton Dickinson) в соответствии с инструкциями изготовителя и методами, принятыми в данной области. Вкратце, клетки метят FITC-конъюгированными анти-мышиными H2Kd и анти-мышиными CD45 антителами (оба от BioLegend, Inc.) и затем ресуспендируют в 1 мкг/мл DAPI. Полученную в результате суспензию затем сортируют при стандартных условиях с использованием собираемых человеческих клеток DAPI-, mH2Kd- и mCD45-, а мышиные клетки утилизируют.
Группам из пяти реципиентных мышей затем пересаживают либо 2000, 500, 120 или 30 отсортированных живых человеческих клеток из опухолей, обработанных конъюгатами DLL3. Для сравнения, группам из пяти реципиентных мышей пересаживают либо 1000, 250, 60 или 15 отсортированных живых человеческих клеток из опухолей, обработанных соответствующими контрольными конъюгатами изотипов. Опухоли у реципиентных мышнй измеряют еженедельно, и индивидуальных мышей подвергают эвтаназии перед тем, как опухоли достигают 1500 мм3. После начала роста опухоли, исследование завершали через четыре последующих недели без новых опухолей, появляющихся у какой-либо дополнительной мыши. В это время, реципиентным мышам присваивают положительную или отрицательную оценку роста опухоли, причем положительный рост имел объемы, превышающие 100 мм3. Предполагают, что реципиенты клеток LU95 или KDY66, обработанные конъюгатами DLL3, продуцируют меньшие опухоли по сравнению с реципиентами клеток LU95 или KDY66, обработанными контрольным изотипом DL2.
Применяя статистическое распределение Пуассона (программное обеспечение L-Calc, Stemcell Technologies), инъекционно вводимые дозы клеток реципиентов с опухолями и без них на неделе 18 после пересадки, применяют для расчета частот инициирующих опухоль клеток в каждой популяции. Предполагают, что число TIC на 10000 живых человеческих клеток в образцах LU95 и KDY66 значительно снижается у животных, обработанных конъюгатами DLL3, например, имеется, по меньшей мере, приблизительно 10-кратное снижение, или 20-кратное снижение, или 50-кратное снижение, или 100-кратное снижение. Значительное снижение частоты раковых стволовых клеток позволяет предположить, что модуляторы рассматриваемого изобретения могут значительно и специфически уменьшать популяции раковых стволовых клеток и, разумеется, снижать вероятность рецидивирования, метастазирования или повторного роста потенциальной опухоли.
Полное раскрытие всех патентов, патентных заявок и публикаций, и материалов, доступных в электронном виде (включающих, например, представления нуклеотидных последовательностей в, например, GenBank и RefSeq, и представления аминокислотных последовательностей в, например, SwissProt, PIR, PRF, ПБД, и трансляции из аннотированных кодирующих областей в GenBank и RefSeq, цитируемых в данном документе, включено посредством ссылки. Предшествующее подробное описание и примеры приведены только для ясности понимания. Их не следует понимать в качестве нецелесообразных ограничений. Изобретение не ограничивается показанными и описанными точными подробностями, так как вариации, очевидные для специалистов в данной области, будут включены в изобретение, определяемое формулой изобретения.