Результат интеллектуальной деятельности: КОМПОЗИЦИЯ И СПОСОБЫ ВЫСОКОЭФФЕКТИВНОГО ПЕРЕНОСА ГЕНОВ С ПОМОЩЬЮ ВАРИАНТОВ КАПСИДА AAV
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет предварительных заявок США №№ 61/635273 и 61/794995, поданных 18 апреля 2012 года и 15 марта 2013 года, соответственно, и полное содержание каждой из указанных заявок включено в настоящее изобретение путем ссылки, как если бы они были изложены в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области генной терапии и молекулярной биологии. Более конкретно, настоящее изобретение относится к аденоассоциированным вирусным векторам, содержащим варианты капсидных белков, которые повышают эффективность трансдукции AAV векторов, содержащих терапевтически полезные трансгены.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
В настоящем документе упомянуты ряд публикаций и патентных документов для описания состояния области техники, к которой относится настоящее изобретение. Каждое из этих упоминаний включено в настоящее описание посредством ссылки, как изложенное в полном объеме.
Аденоассоциированный вирус (AAV) представляет собой небольшой (20 нм), дефектный по репликации, безоболочечный вирус. У человека и приматов описано множество различных серотипов AAV. Геном AAV состоит из одноцепочечной ДНК, имеющей 145 пар оснований (п.о.), с инвертированными концевыми повторами (ИКП) на обоих концах. Имеются две открытые рамки считывания (ОРС), rep и cap. Продукты rep имеют важное значение для репликации AAV, при этом от гена cap экспрессируются 3 капсидных белка (VP1, VP2 и VP3). Белки VP1, VP2 и VP3 находятся в соотношении 1:1:10, образуя икосаэдрический капсид (Xie Q et al., 2002). При образовании рекомбинантного вектора AAV (rAAV) кассета экспрессии, фланкированная ИКП, упаковывается в капсид AAV. Гены, необходимые для репликации AAV, не входят в кассету. Рекомбинантный AAV считается самым безопасным и одним из наиболее широко используемых вирусных векторов для переноса генов in vivo. Векторы могут инфицировать клетки из тканей множества типов, обеспечивая мощную и устойчивую трансгенную экспрессию. Они также являются непатогенными и имеют низкий профиль иммуногенности (High KA, 2011).
Одной из насущных целей для генно-терапевтических исследований является оптимизация векторов для максимальной тканевой трансдукции при минимизации дозы вектора. После внедрения в клетку капсидные белки AAV подвергаются протеасомно-опосредованному расщеплению. Фосфорилирование экспонированных на поверхности остатков тирозина в капсиде AAV является одним из первых этапов, которые ведут к разрушению вируса посредством убиквитин-протеасомного пути (Zhong L. et al., 2007). Регулируемый протеолиз в клетке происходит в основном посредством этого пути. Убиквитин представляет собой небольшой белок (примерно 8,5 кДа), который можно обнаружить во всех эукариотических клетках. Убиквитин присоединен к боковой цепи аминокислот в белковом субстрате. После присоединения дополнительных убиквитиновых белков к матрице с помощью изначально присоединенного убиквитина образуется полиубиквитиновая цепь, и матрица получает метку для расщепления (Thrower J.S. et al. 2000, Peng J. et al. 2003, Bedford L. et al. 2011). Было показано, что мутации экспонированных на поверхности остатков тирозина приводят к повышению эффективности трансдукции векторов AAV2 (Zhong L. et al., 2008). В последнее время некоторые исследователи показали, что эта стратегия также эффективна во многих тканях в отношении других серотипов AAV, включающих в себя AAV-серотипы 6 и 8.
Очевидно, что в данной области техники существует потребность в композициях и способах, которые улучшают трансдукцию AAV, несущих клинически важные трансгены, у нуждающихся в этом пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении рассмотрены новые варианты AAV, проявляющие повышенную эффективность трансдукции по сравнению с серотипами AAV (например, AAV1, AAV2, AAV8, AAV-rh74), которые не имеют модификаций, описанных в настоящем изобретении. Такие улучшенные векторы являются полезными для трансдукции в различных тканях, в том числе в печени, мышцах, мозге и сетчатке.
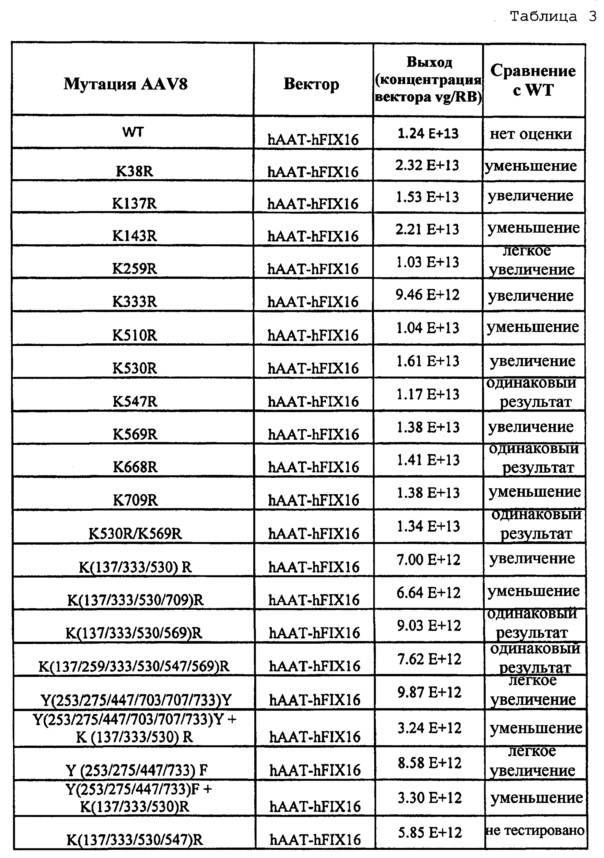
В одном варианте осуществления рассмотрен вектор на основе аденоассоциированного вируса (AAV), содержащий измененный капсидный белок VP1, и упомянутый измененный капсидный белок содержит замену остатка лизина, тем самым снижая убиквитинирование капсида и повышая эффективность трансдукции вариантного AAV в целевых тканях и клетках. В одном варианте осуществления вектор дополнительно содержит гетерологичную нуклеиновую кислоту (например, миниген, содержащий инвертированные концевые повторы AAV и гетерологичную последовательность нуклеиновой кислоты), функционально связанную с регуляторными последовательностями, которые направляют экспрессию продукта из гетерологичной последовательности нуклеиновой кислоты в клетку-хозяина. В предпочтительном варианте осуществления вектор AAV содержит одну или несколько замен лизина в VP1, что показано в таблицах настоящего описания. В другом варианте осуществления вектор AAV имеет серотип AAV8 и содержит альтерацию, указанную в таблице 3.
В предпочтительном варианте осуществления векторы AAV по изобретению, содержащие вариантные капсидные белки, являются полезными для экспрессии терапевтических пептидов или терапевтических нуклеиновых кислот. Такие пептиды включают в себя без ограничения противовирусную молекулу иРНК, фактор VIII, фактор IX или их функциональный фрагмент. Дополнительные продукты экспрессии включают в себя, например, IgG, IgM, IgA, IgD, IgE, химерные иммуноглобулины, гуманизированные антитела или одноцепочечные антитела. В одном аспекте продуктом экспрессии является ингибирующая РНК (РНКи), которая полезна для ингибирования инфекции и репликации вируса гепатита С (HCV). В другом варианте осуществления продуктом экспрессии является антисмысловая нуклеиновая кислота, полезная для понижающей регуляции рассматриваемой клетки-мишени.
В другом варианте осуществления настоящего изобретения рассмотрена фармацевтическая композиция, содержащая вариантные векторы AAV по изобретению в биологически совместимом носителе. В объем настоящего изобретения также входят клеточные культуры, содержащие описанные в изобретении векторы.
Изобретение также охватывает способ доставки трансгена в клетку субъекта, при этом указанный способ содержит этап контактирования клетки с вектором AAV по изобретению, и упомянутый вектор AAV содержит трансген, при этом присутствие замены лизина в последовательности VP1 капсида в указанном векторе связано со снижением убиквитинирования и повышением эффективности трансдукции.
В конечном аспекте настоящее изобретение относится к вирусным вариантам-ловушкам, которые неэффективны при инфицировании клетки, но при этом эффективно блокируют нейтрализацию антителами вариантов вирусов, несущих полезные трансгены, которая обусловлена структурным сходством двух вариантов вируса. Примерные варианты капсидов для этой цели включают в себя, например, K38R, K143R, K510R и K709R.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
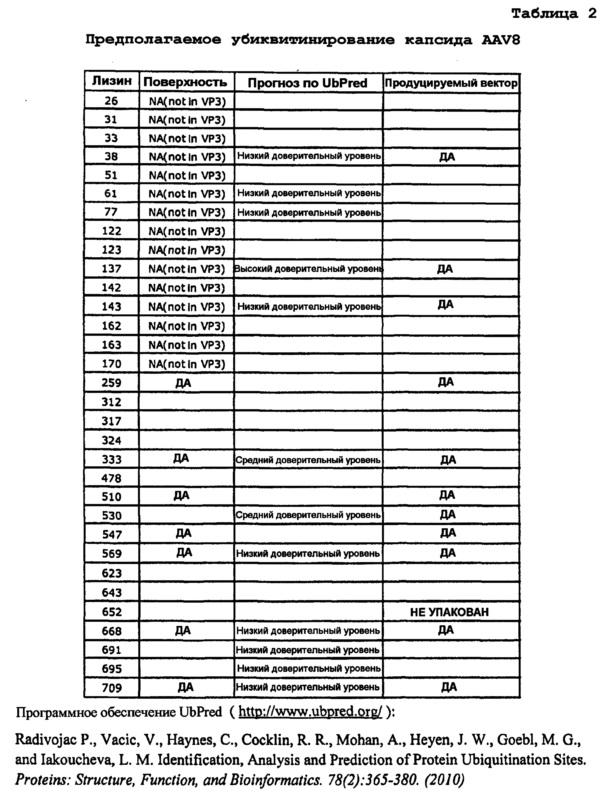
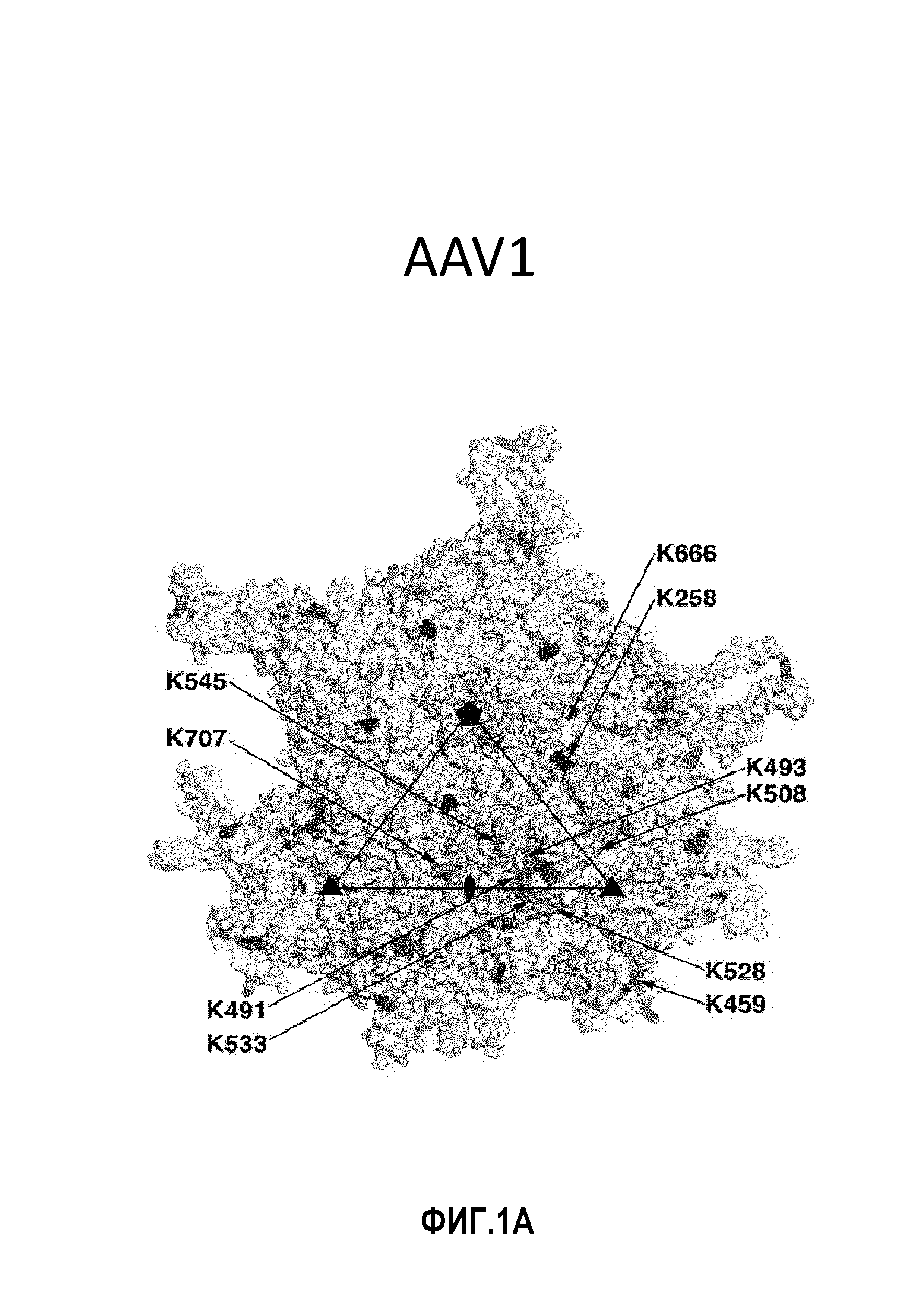
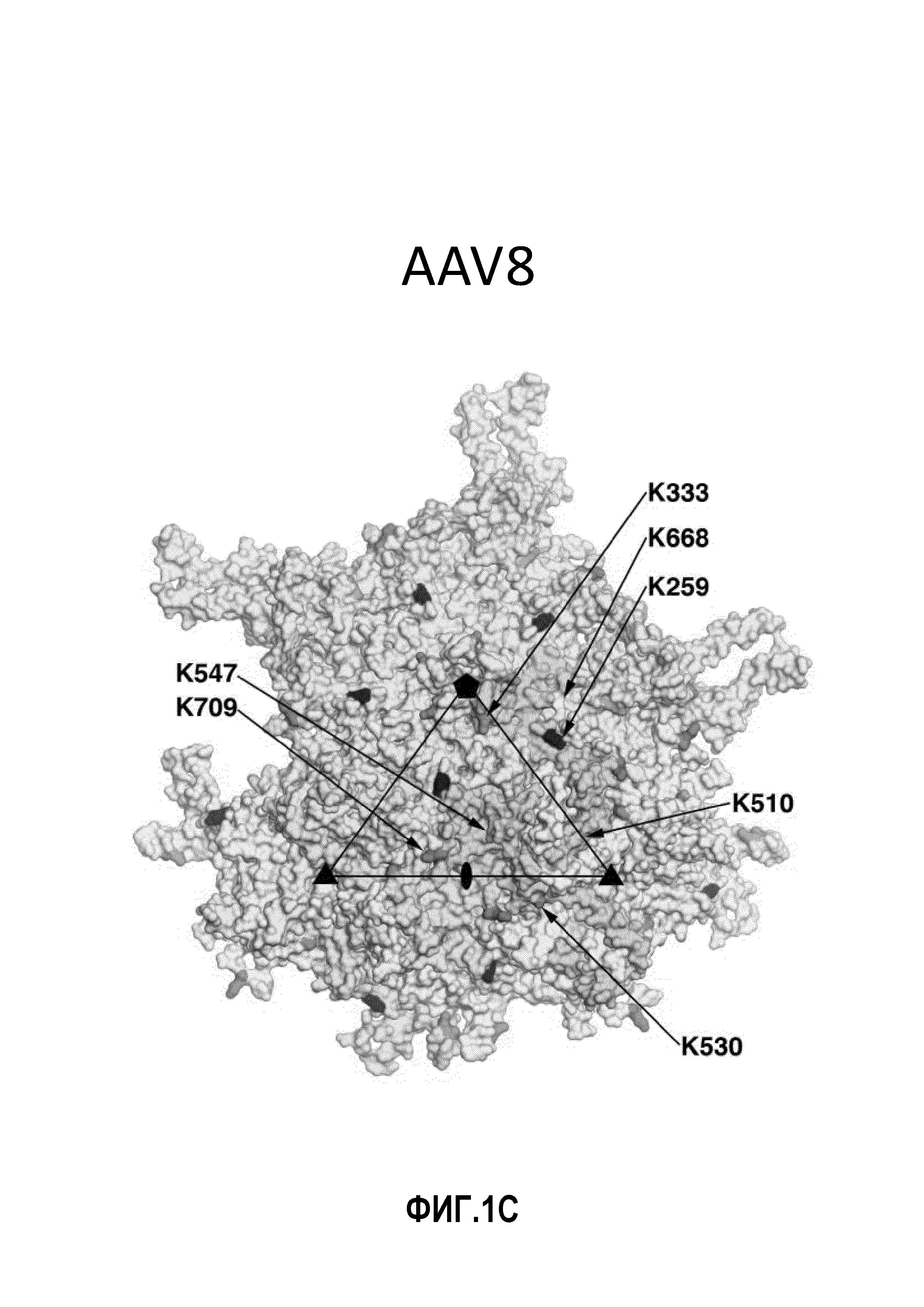
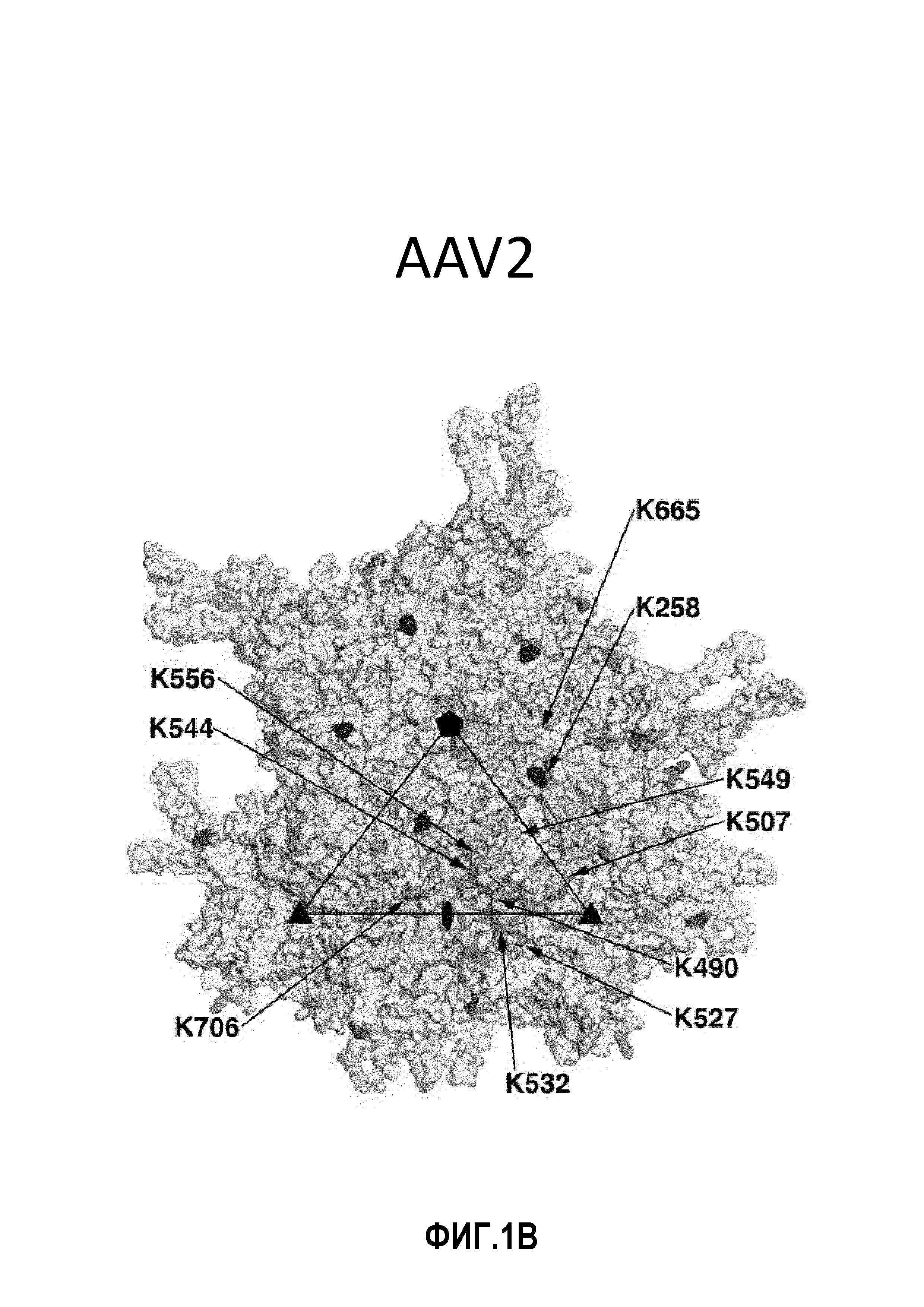
Фиг.1: остатки лизина на поверхности AAV1, AAV2 и AAV8: в изобретении используются серотипы AAV под следующими номерами по базе данных PDB: AAV1: 3NG9, AAV2: 1LP3 и AAV8: 2QA0. Стрелками указаны соответствующие остатки лизина. (А) Имеется 11 остатков лизина на поверхности AAV1 VP3. Остатки обозначены следующим цветом: K258 - красный, K459 - синий, K491 - желтый, K493 - пурпурный, K508 - голубой, K528 - темный оранжево-розовый, K533 - светло-зеленый, K545 - светло-голубой (синевато-серый), K567 - темный оранжево-розовый, K666 - светло-голубой, K707 - серый. (В) Имеются 10 остатков лизина на поверхности AAV2 VP3. Остатки обозначены следующим цветом: K258 - красный, K490 - желтый, K507 - голубой, K527 - темный оранжево-розовый, K532 - светло-зеленый, K544 - светло-голубой (синевато-серый), K549 - светло-желтый, K556 - светло-пурпурный, K665 - светло-голубой, K706 - серый. (C) Имеются 8 остатков лизина на поверхности AAV8 VP3. Остатки обозначены следующим цветом: K259 - красный, K333 - зеленый, K510 - голубой, K530 - темный оранжево-розовый, K547 - светло-голубой (синевато-серый), K569 - темный оранжево-розовый, K668 светло-голубой, K709 - серый. Следует отметить, что остатки K528 и K567 из AAV1 и остатки K530 и K569 из AAV8 структурно примыкают друг к другу и показаны одним и тем же цветом.
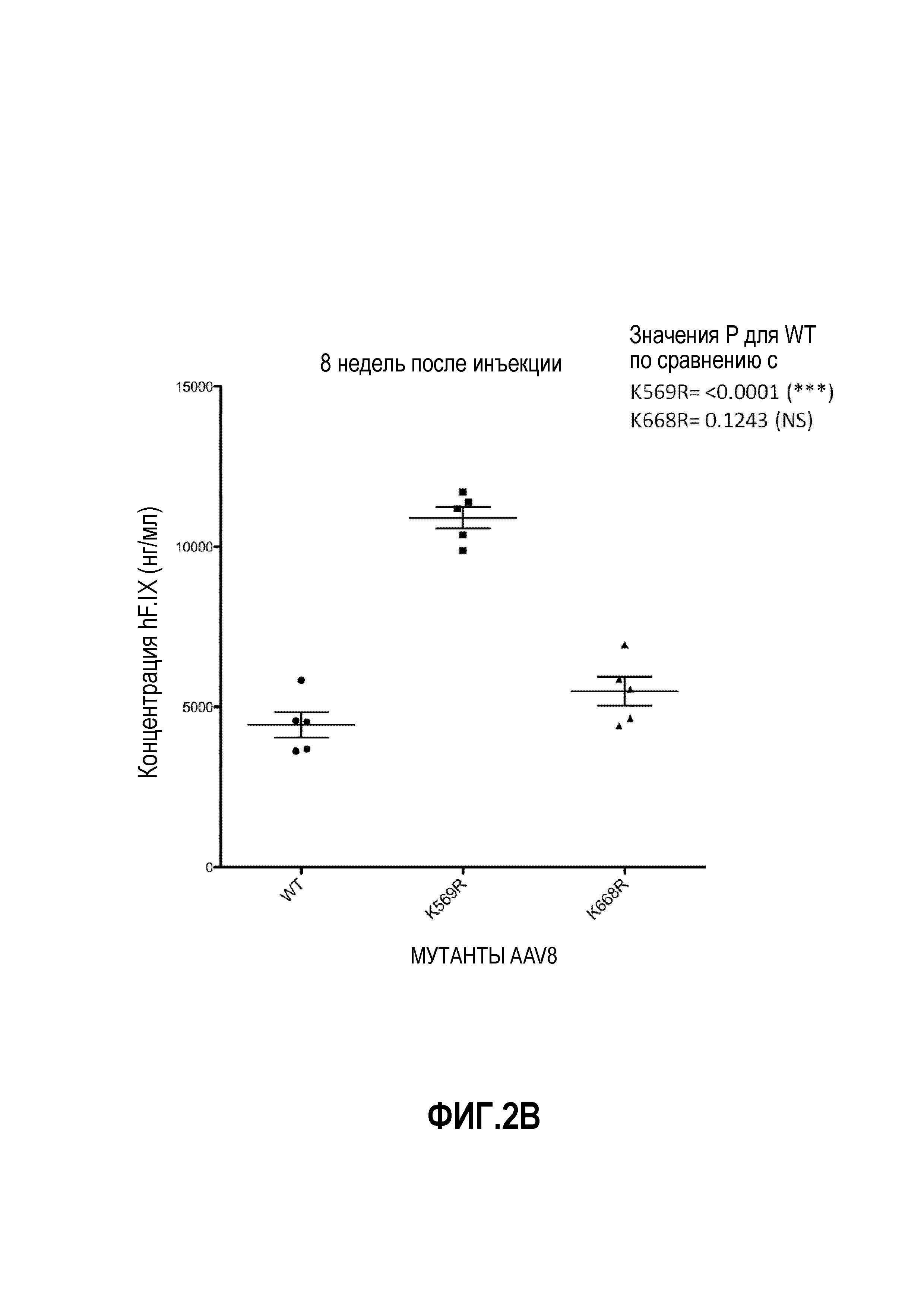
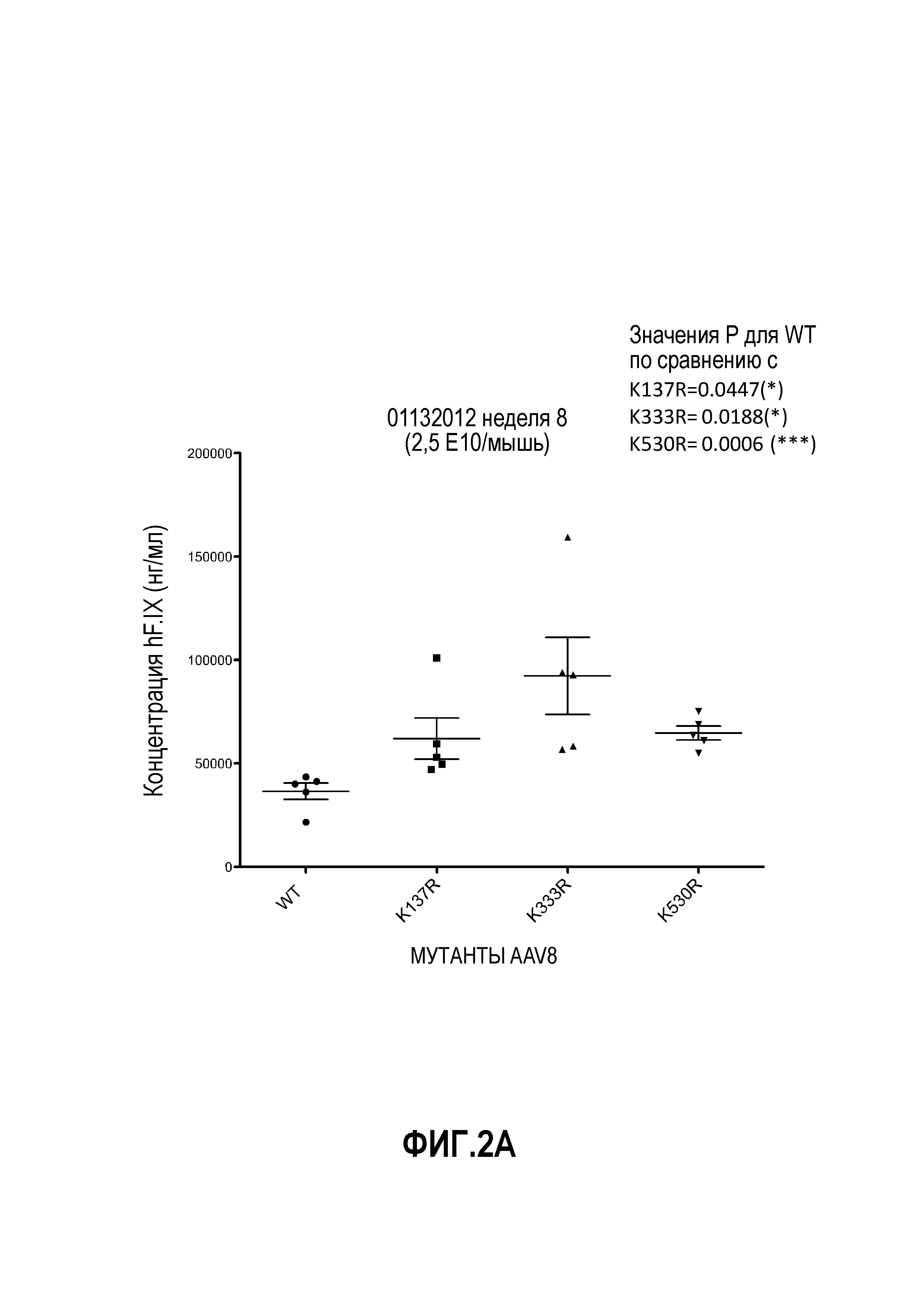
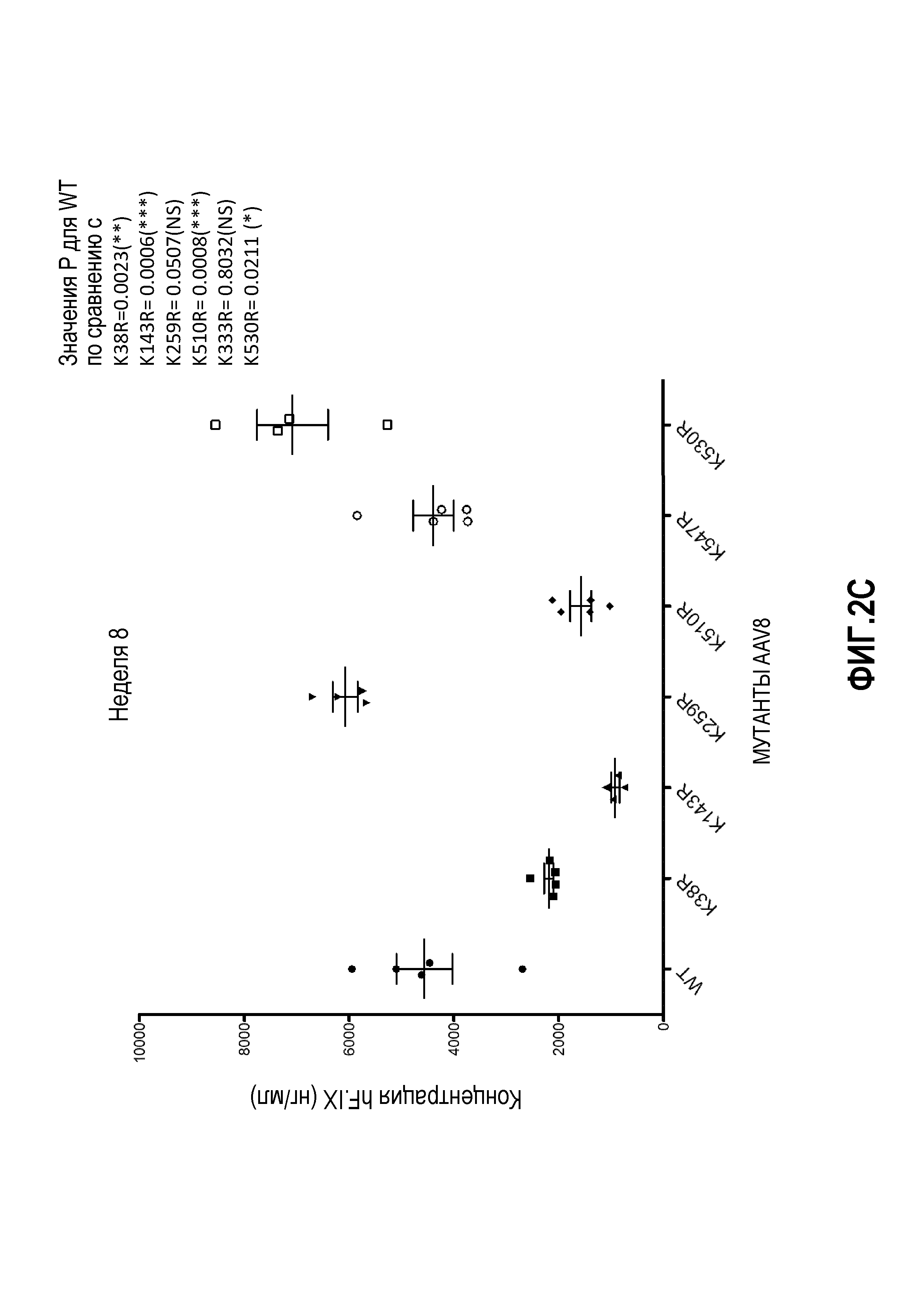
Фиг.2: несколько остатков лизина в капсиде AAV8 были заменены на аргинин. У животных отбирали кровь через 8 недель после инъекции вируса через хвостовую вену. Уровни hF.IX определяли с помощью анализа ELISA. (А) Выполняли замену на аргинин остатков с предполагаемым убиквитинированием, определенным с помощью программного обеспечения с высоким и средним доверительным уровнем. Вирусные частицы в количестве 2,5×1010 на мышь вводили через хвостовую вену. (B, C) Остатки с предполагаемым убиквитинированием, но с низким доверительным уровнем, определенным с помощью программного обеспечения, были заменены на аргинин. Вирусные частицы в количестве 2,5×109 на мышь вводили через хвостовую вену. (B) Мутации капсида K569R и K668R. (C) Влияние капсидных мутаций K38R, K143R, K259R, K510R и K547R по сравнению с влиянием мутации K530R.
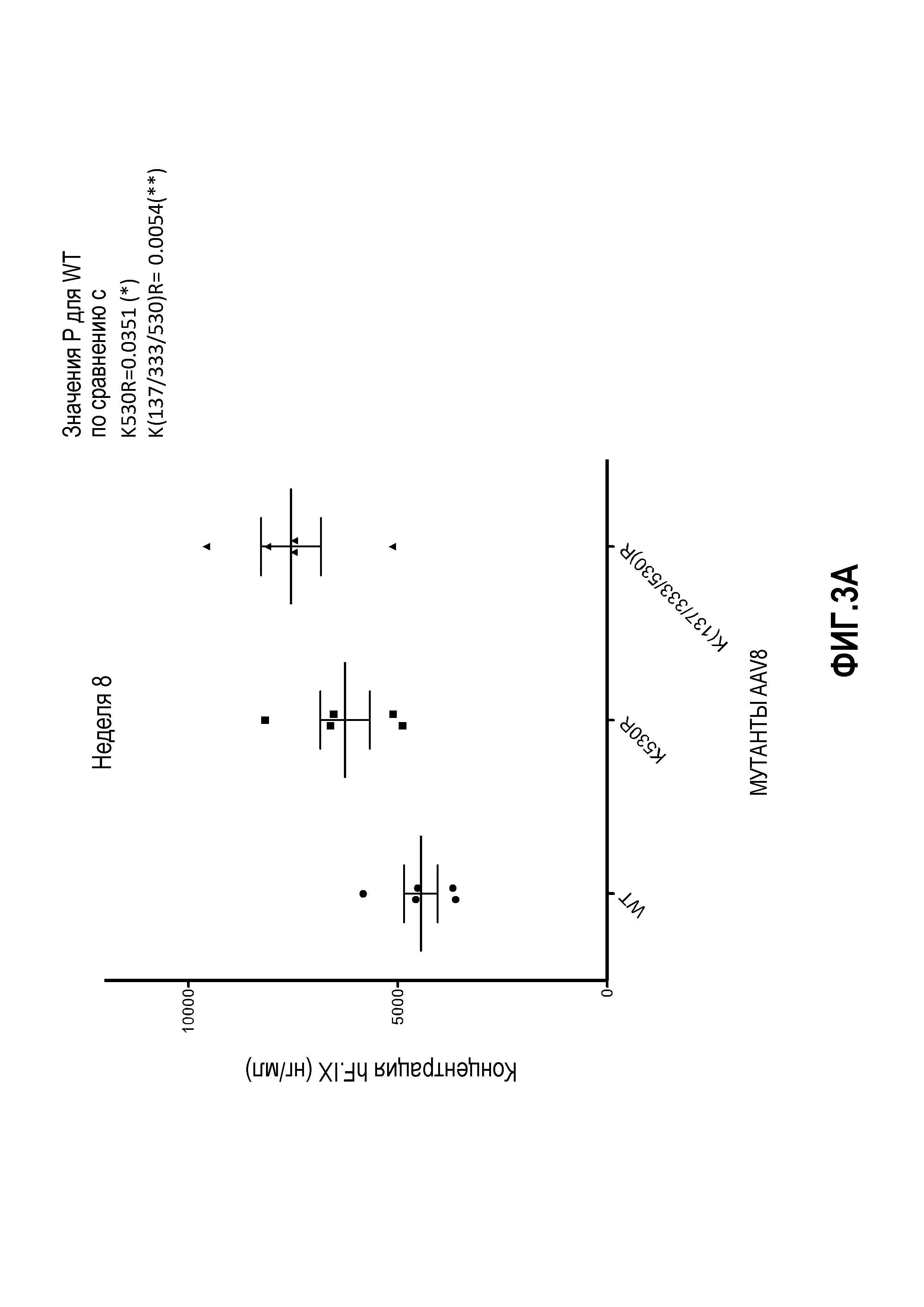
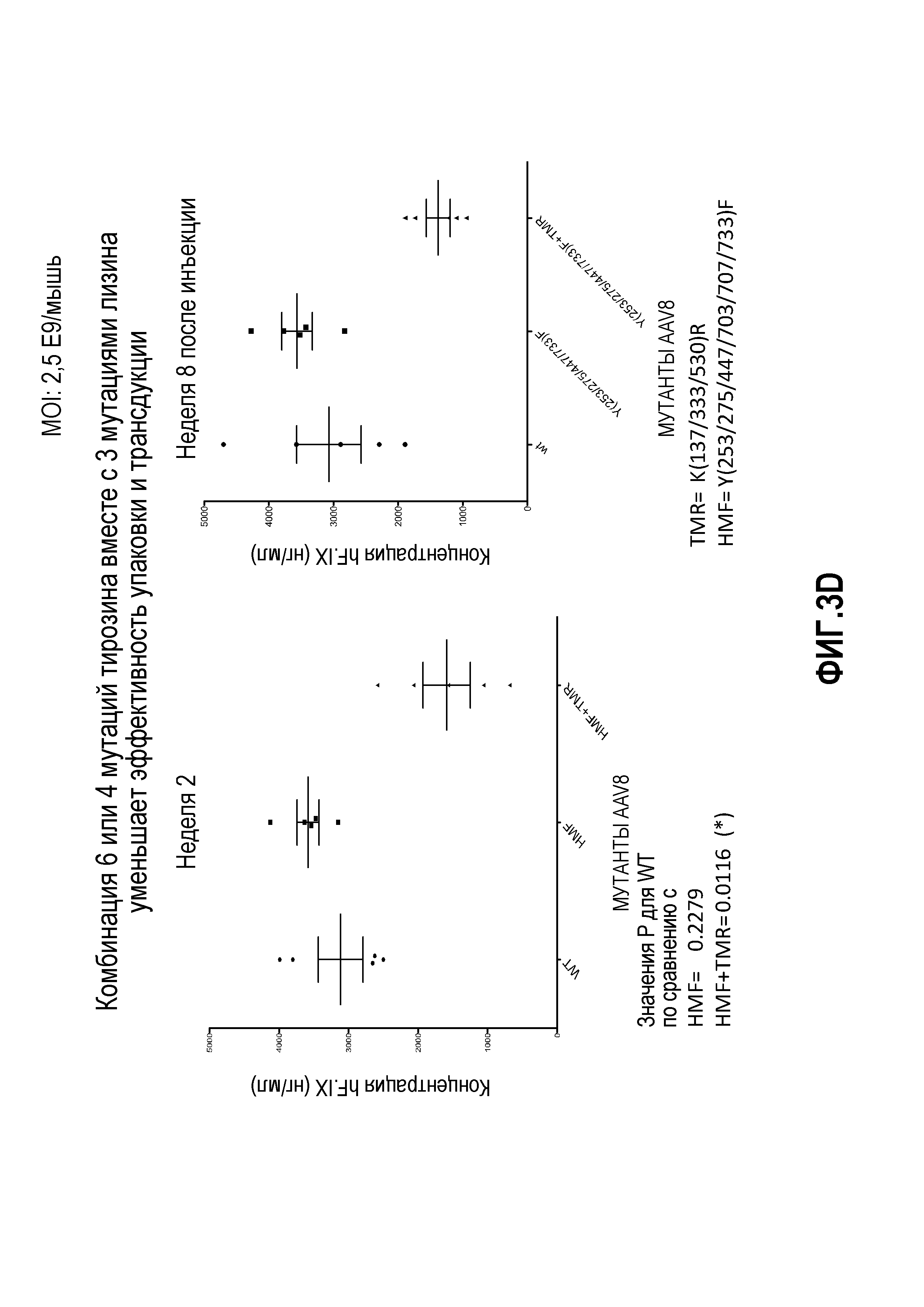
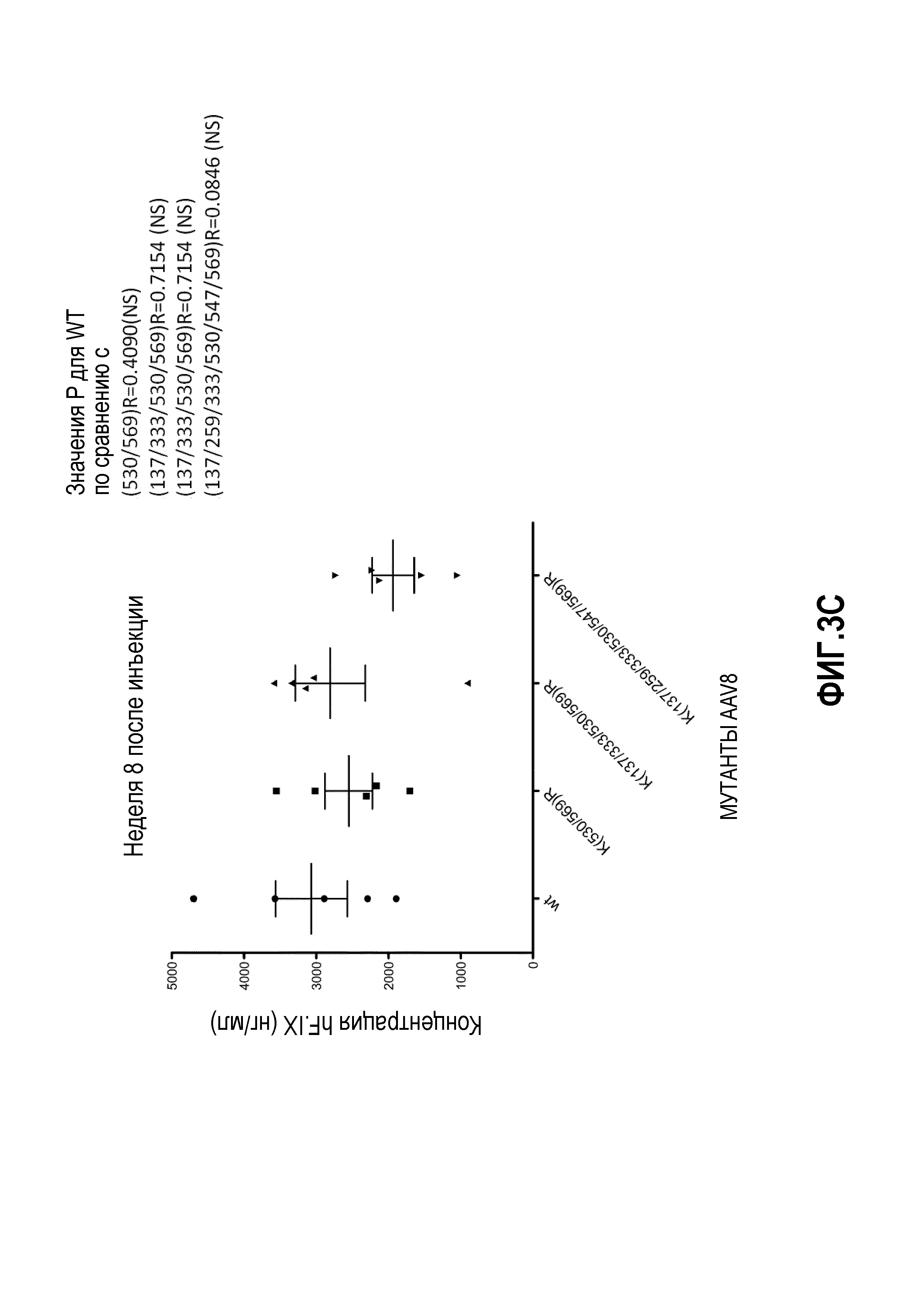
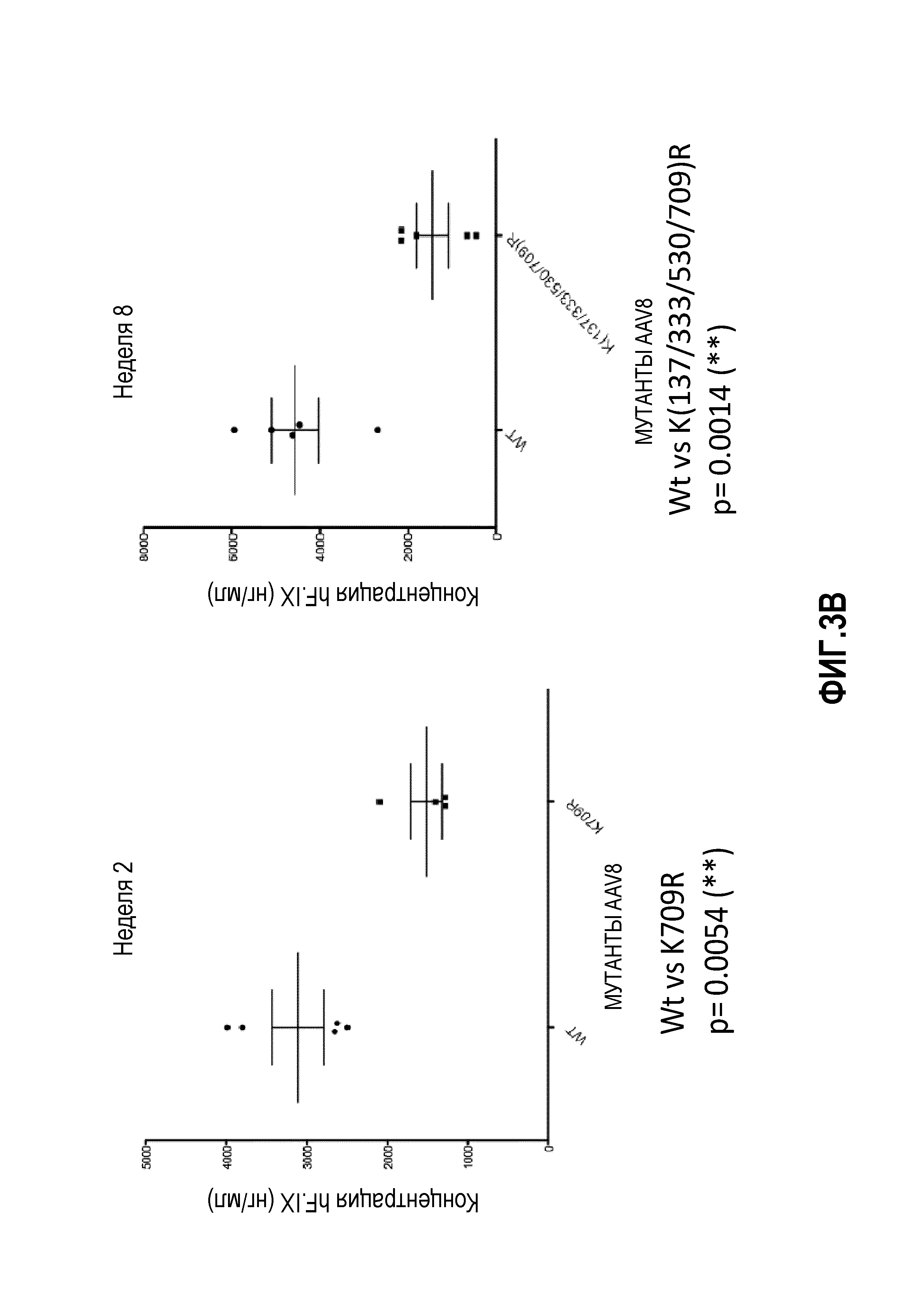
Фиг.3: комбинация капсидных мутаций K на R. (А) Комбинация мутаций K137R, K33R и K530R, тем не менее, выше, чем у дикого типа, но статистически не отличается от K530R. (В) Мутация K709R негативно влияет на трансдукцию AAV8; добавление мутации K709R в мутантный K(137/333/530)R также уменьшает трансдукцию вируса. (С) Комбинация множественных мутаций лизина на аргинин не увеличивает частоту трансдукции. (D) Комбинация трех остатков от лизина до аргинина с четырьмя или шестью остатками от тирозина до фенилаланина снижает скорость трансдукции.
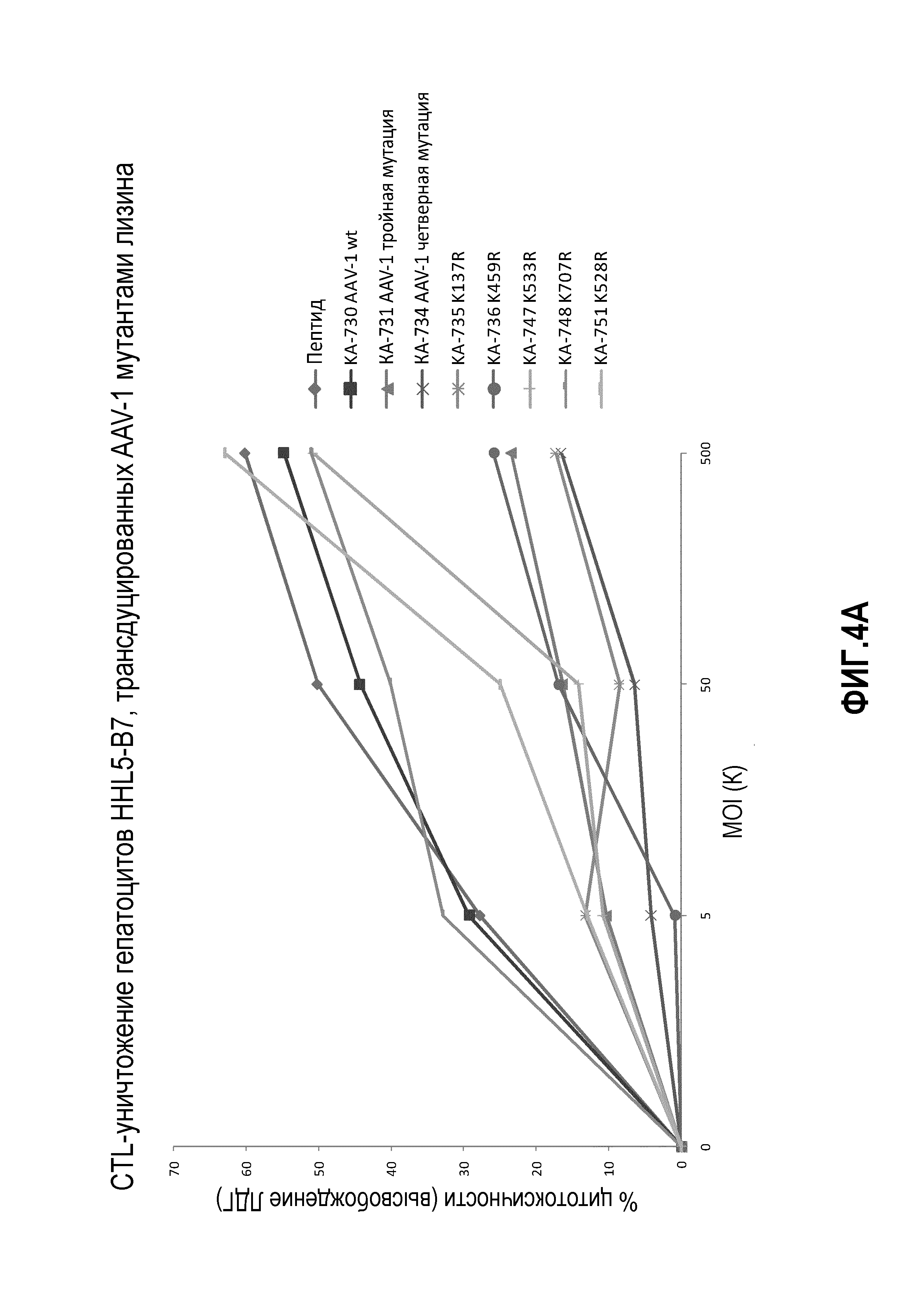
Фиг.4: трансдукция AAV1: (А) уничтожение посредством CTL гепатоцитов HHL5-В7, трансдуцированных мутантными AAV-1 лизинами при трех разных значениях множественности инфекции (MOI): 5K, 50K и 500K. В качестве положительного контроля использовали пептид (IPQYGYLTL для AAV1; VPQYGYLTL для AAV2). Высвобождение липопротеинов высокой плотности (ЛВП) коррелирует с гибелью клеток. (B) Общее количество GFP-положительных клеток и экспрессию зеленого флуоресцирующего белка (GFP) сравнивали в разных конструкциях с показателями MOI 50K и 500K.
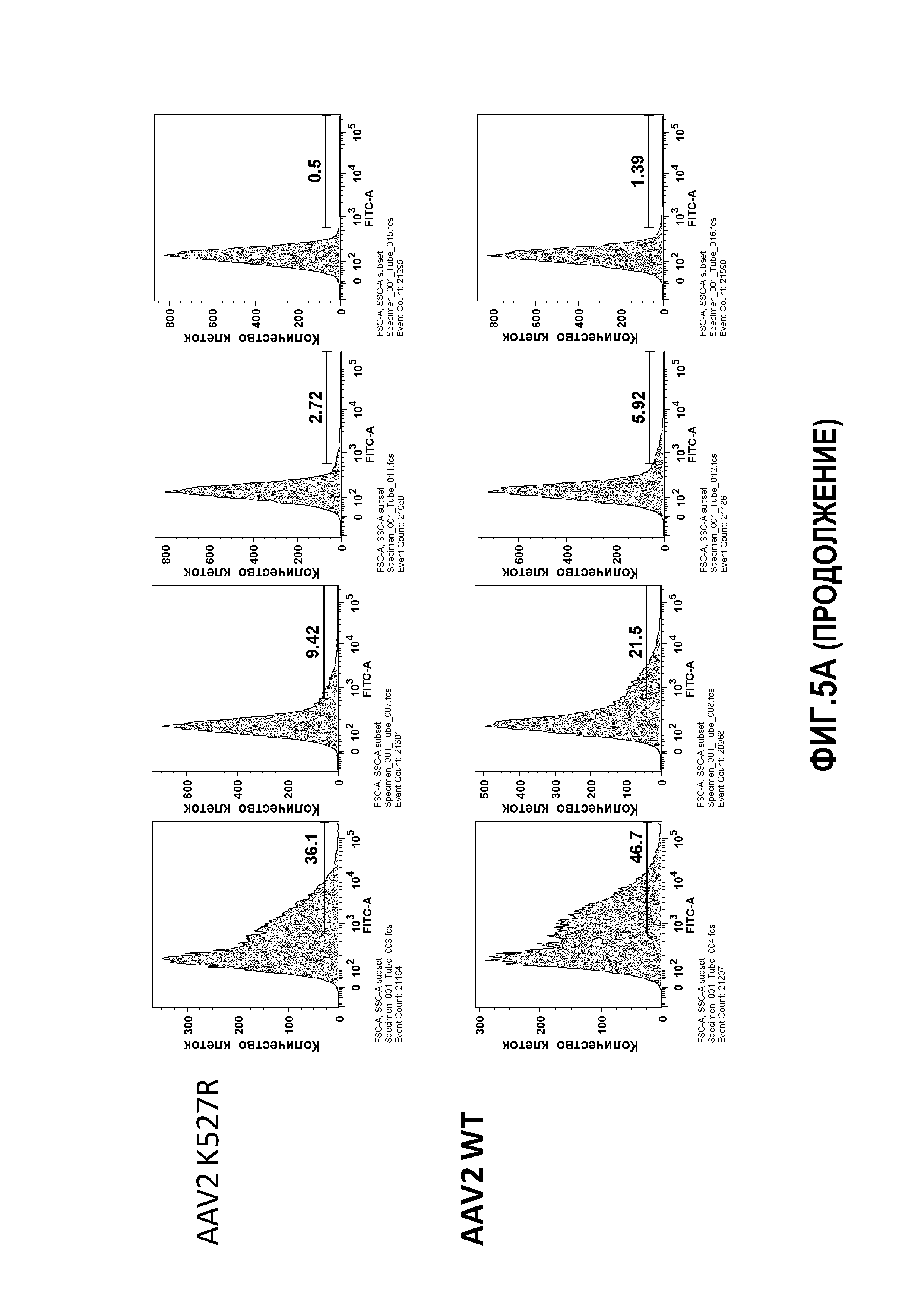
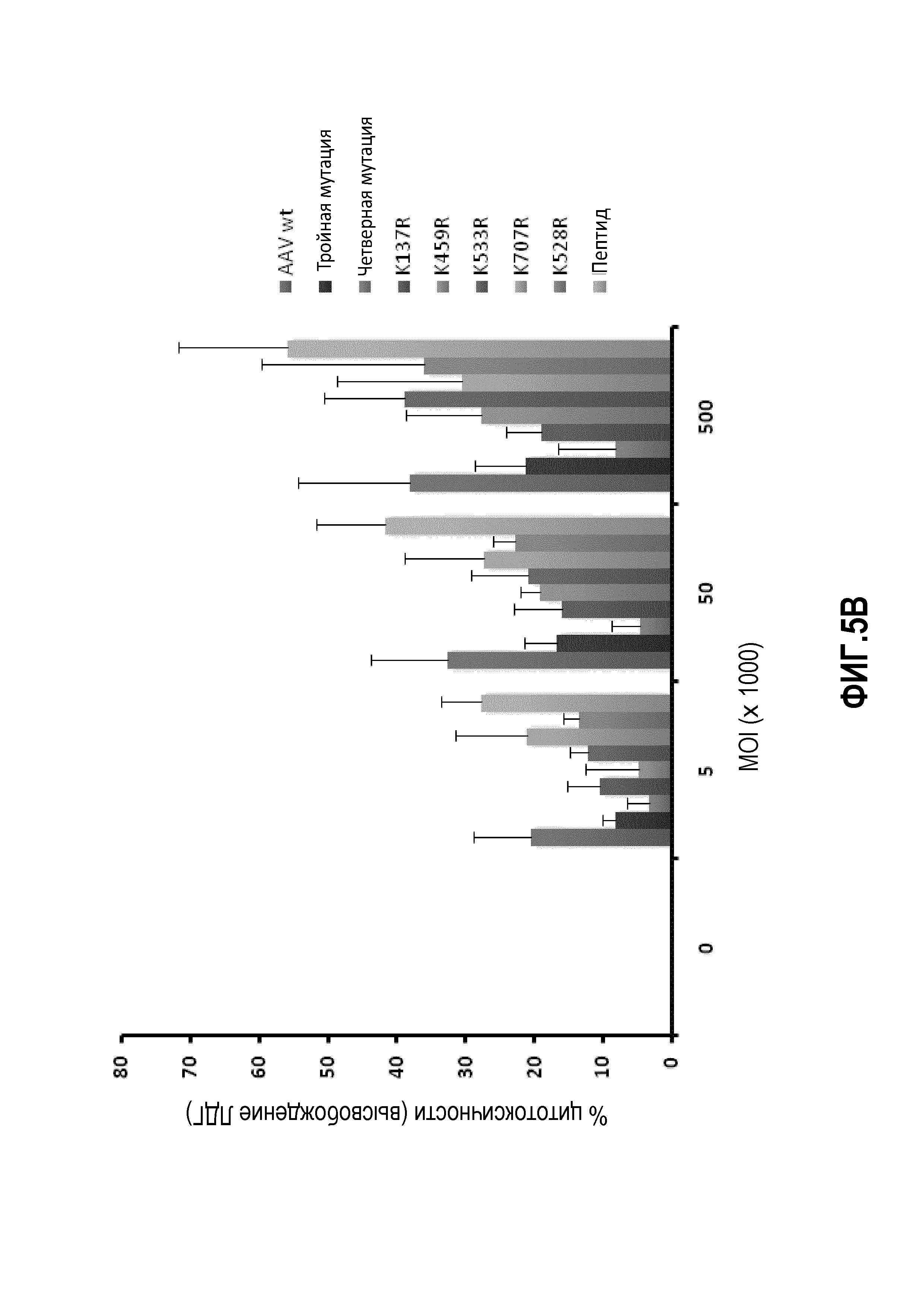
Фиг.5: трансдукция AAV2: (А) мутантные AAV2 K137R, K527R или K532R сравнивали с WT AAV2 в отношении скорости трансдукции клеточной линии HHL5. Клетки трансфецировали с MOI 10K, 50K, 100K и 500K и проверяли через 24 часа на экспрессию GFP. (В) график, показывающий цитотоксичность, которую измеряли по высвобождению липопротеинов низкой плотности (ЛНП) тестируемых вариантов.
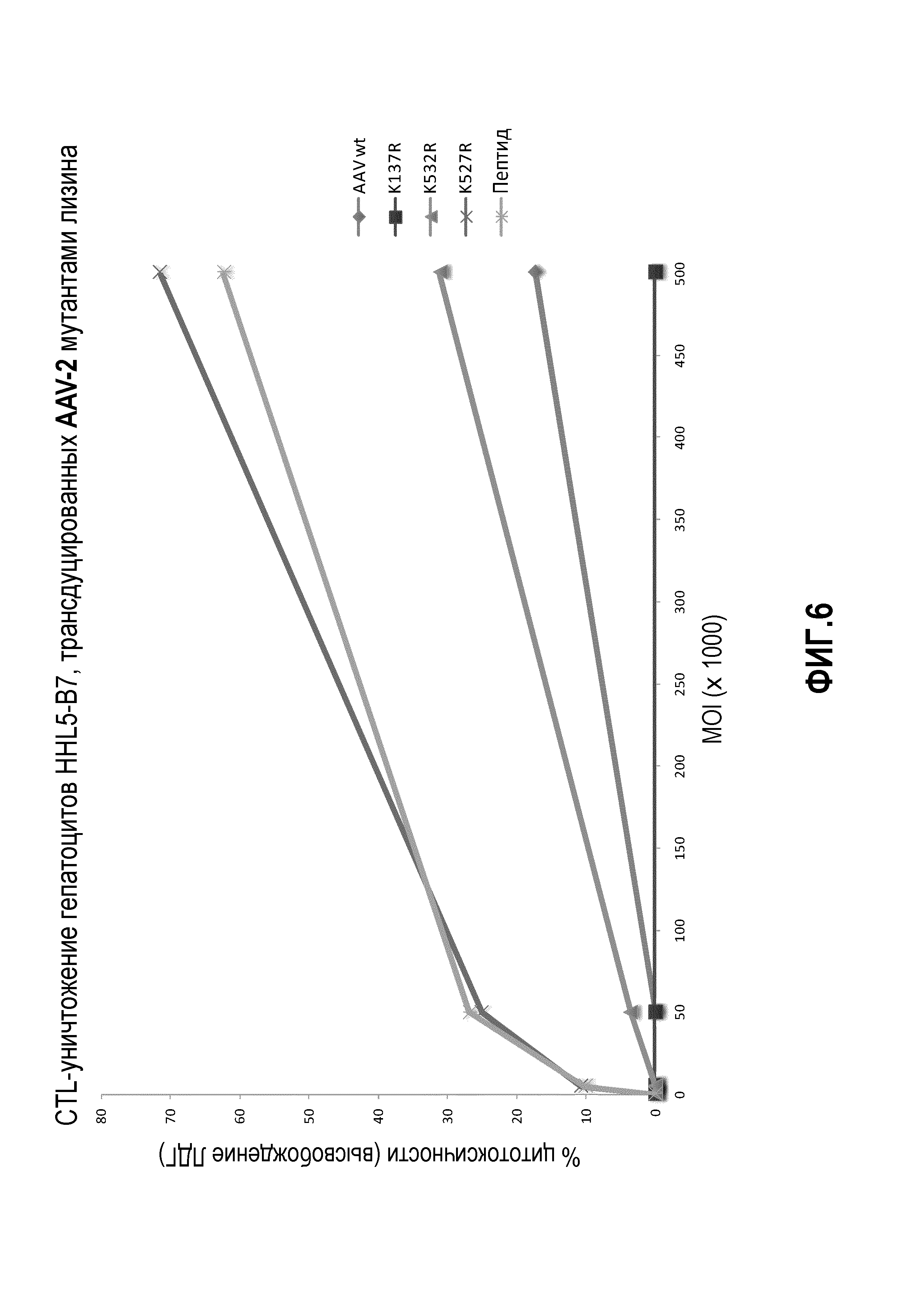
Фиг.6: анализ цитотоксических Т-лимфоцитов (CTL), в котором целевые клетки-гепатоциты трансдуцировали вектором AAV2 с повышением концентраций, а затем инкубировали с эффекторными клетками, подобранными по HLA. Векторы AAV кодировали AAV-2 капсид дикого типа или одиночные мутации лизина, как указано. Эффекторы получали из мононуклеарных клеток периферической крови (РВМС), выращенных in vitro, против AAV-2 главного комплекса гистосовместимости (МНС) класса I эпитопа VPQYGYLTL, при соотношении эффектор-мишень 10:1. Результаты выражены в процентах от активности CTL (% цитотоксичности по сравнению с клетками, обработанными 10% SDS в качестве максимального контроля цитотоксичности после вычитания фоновых значений) по отношению к вектору дикого типа.
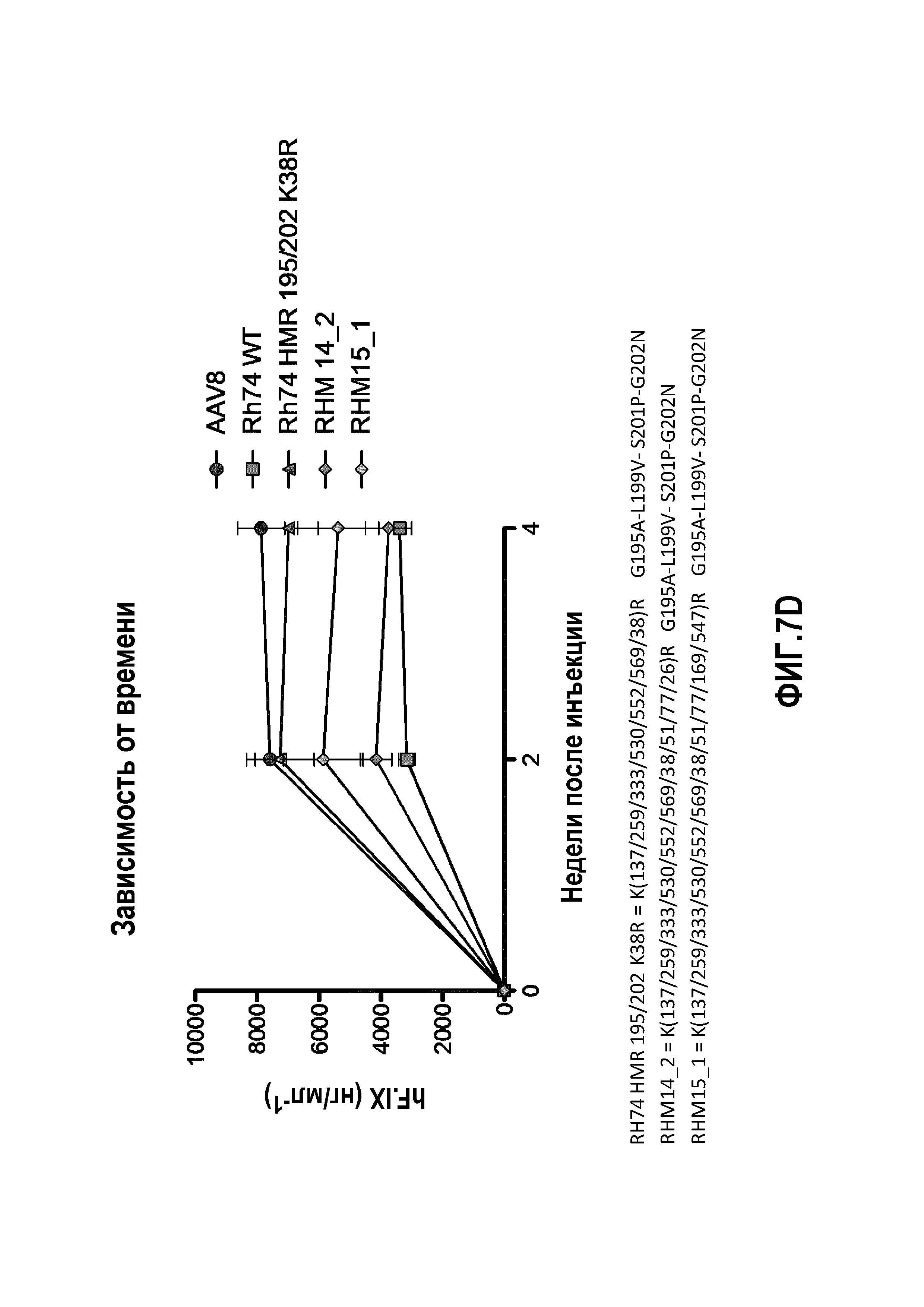
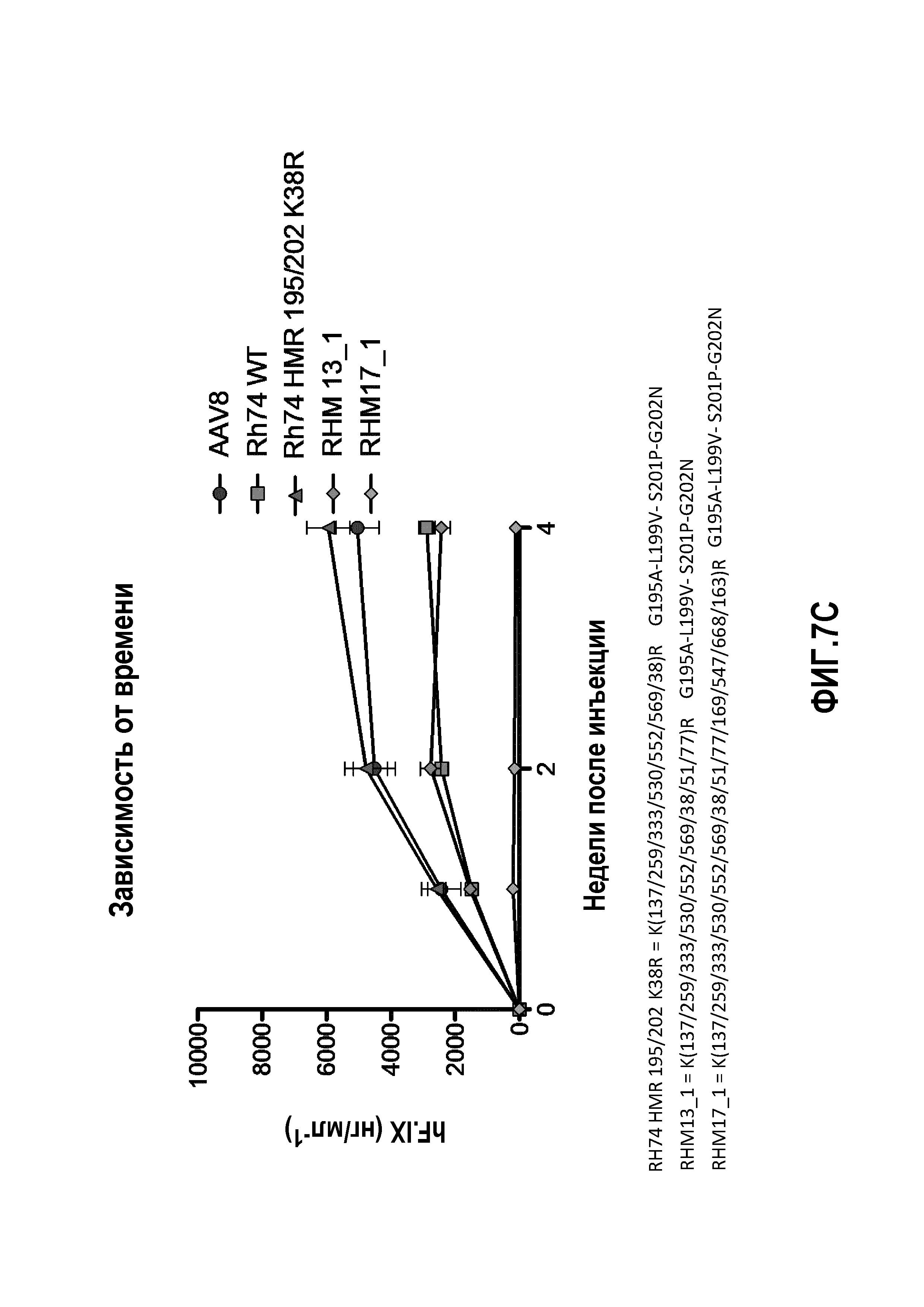
Фиг.7: данные RH74: уровни экспрессии человеческого трансгена F.IX в плазме, измеренные с помощью ELISA, являются специфичными для человеческого F.IX. (А) Определение TMR=K(137/333/530)R, определение HMF=Y(253/275/447/703/707/733)F. (В) Определение HMR: K(137/259/333/530/552/569)R, определение 195/202: G195A+L199V+S201P+G202N. После инъекции мышам HMR+195/202, HMR+195/202+K(38)R, HMR+195/202+K(51)R, HMR+195/202+K(61)R и HMR+195/202+K(77)R продуцируются на более высоком уровне, чем продукция hFIX, тогда как инъекции HMR+195/202+K(122/123)R или HMR+195/202+K(142/413)R вообще не вызывают какой-либо определяемой продукции hFIX. (C): мутантный RHM13_1 продуцировал аналогичные уровни hFIX по сравнению с Rh74 WT, тогда как уровни hFIX, полученные у мышей после введения RHM17_1, только слегка превышали фоновый уровень. (D) мутантный RHM14_2 продуцировал аналогичные уровни hFIX по сравнению с Rh74 WT; показатели у RHM15_1 имеют промежуточное значение между показателями AAV8 и AAVrh74 WT.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению, авторы обнаружили, что замена остатков лизина на капсиде AAV на остатки аргинина увеличивает эффективность трансдукции AAV. Начальные эксперименты авторов привели к предположению, что одиночная замена остатка лизина будет мишенью для убиквитинирования и даст в результате более высокий уровень экспрессии трансгена человеческого фактора IX (FIX) у мышей по сравнению с животными, получающими немодифицированные векторы AAV. Описанные в изобретении мутанты можно выгодно использовать в AAV-лизиновых остатках для создания векторов, которые с более высокой эффективностью нацелены на печень, ЦНС, мышцы и другие органы, по сравнению с капсидом AAV дикого типа. Таким образом, настоящее открытие может быть использовано для разработки лекарственных препаратов для лечения гемофилии А, В, болезни Хантингтона и практически любого другого заболевания, при котором требуется повышенный уровень трансдукции желательных трансгенов в ткани-мишени, представляющей интерес.
Следующие определения приведены для облегчения понимания настоящего изобретения.
I. ОПРЕДЕЛЕНИЯ:
"Генная терапия" представляет собой вставку генов в клетки и/или тканей субъекта для лечения заболевания, обычно, наследственных заболеваний, при этом дефектный мутантный аллель заменяется или дополняется функциональным аллелем.
"Аденоассоциированные вирусы" относятся к семейству парвовирусов и представляют собой небольшие вирусы с геномом одноцепочечной ДНК. Эти вирусы могут встраивать генетический материал в конкретный сайт на хромосоме 19 и являются предпочтительными, поскольку не связаны с инфекционными заболеваниями человека.
"Терапевтический" пептид или белок представляет собой пептид или белок, который может облегчить или уменьшить симптомы, возникающие в результате отсутствия белка или дефекта в белке в клетке или у субъекта. С другой стороны, "терапевтическим" пептидом или белком является пептид или белок, который иным образом приносит полезный эффект для субъекта, например, обладает противораковыми эффектами. Терапевтические пептиды и белки включают в себя без ограничения CFTR (ген трансмембранного регуляторного белка кистозного фиброза), дистрофин (в том числе белковый продукт минигенов дистрофина, см., например, Vincent et al., (1993) Nature Genetics 5:130), утрофин (Tinsley et al, (1996). Nature 384:349), факторы свертывания (фактор XIII, фактор IX, фактор X и т.д.), моноклональные антитела (Lewis et al., 2002), эритропоэтин, рецептор ЛНП, липопротеинлипазы, орнитин транскарбамилазу, β-глобин, α-глобин, спектрин, α-антитрипсин, аденозиндезаминазу, гипоксантин-гуанин фосфорибозилтрансферазу, β-глюкоцереброзидазу, сфингомиелиназу, лизосомальную гексозаминидазу, дегидрогеназу кетокислот с разветвленной цепью, гормоны, факторы роста (например, инсулиноподобные факторы роста 1 и 2, тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста нервов, нейротрофический фактор -3 и -4, мозговой нейротрофический фактор, глиальный фактор роста, трансформирующий фактор роста α и β и тому подобное), цитокины (например, α-интерферон, β-интерферон, γ-интерферон, интерлейкин-2, интерлейкин-4, интерлейкин-12, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин), продукты гена самоубийства (например, тимидинкиназа вируса простого герпеса, цитозиндезаминаза, дифтерийный токсин, цитохром Р450, дезоксицитидинкиназа и фактор некроза опухоли), белки, придающие устойчивость к лекарственному средству, применяемому в противораковой терапии, продукты гена-супрессора опухоли (например, р53, Rb, Wt-1, NF1, VHL, APC и т.п.) и любой другой пептид или белок, который обладает терапевтическим эффектом у нуждающегося в этом субъекта.
Дополнительные примеры терапевтических пептидов или белков включают в себя пептиды или белки, которые можно применять для лечения заболевания, включающего в себя без ограничения кистозный фиброз (и другие заболевания легких), гемофилию А, гемофилию В, талассемию, анемии и другие заболевания крови, СПИД, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, эпилепсию и другие неврологические расстройства, рак, сахарный диабет, мышечную дистрофию (например, Дюшенна, Беккера), болезнь Гоше, болезнь Херлера, дефицит аденозиндеаминазы, болезни накопления гликогена и другие метаболические дефекты, дегенеративные заболевания сетчатки (и другие заболевания глаз), а также заболевания солидных органов (например, головного мозга, печени, почек, сердца).
Термин "промоторы" или "промотор", используемый в изобретении, может относиться к последовательности ДНК, которая расположена как смежная с последовательностью ДНК, кодирующей рекомбинантный продукт. Промотор предпочтительно функционально связан со смежной последовательностью ДНК. Промотор обычно увеличивает количество экспрессируемого рекомбинантного продукта от последовательности ДНК по сравнению с количеством экспрессируемого рекомбинантного продукта в отсутствие промотора. Промотор из одного организма может быть использован для усиления экспрессии рекомбинантного продукта из последовательности ДНК, которая происходит из другого организма. Например, промотор от позвоночных можно использовать для экспрессии GFP медузы у позвоночных. Дополнительно, один промоторный элемент может увеличивать количество экспрессируемых рекомбинантных продуктов для нескольких попарно присоединенных последовательностей ДНК. Следовательно, один промоторный элемент может усиливать экспрессию одного или нескольких рекомбинантных продуктов. Множество промоторных элементов хорошо известны специалистам в данной области техники.
В одном варианте осуществления будет желательным высокий уровень конститутивной экспрессии. Примеры таких промоторов включают в себя без ограничения промотор/энхансер LTR вируса ретровирусной саркомы Рауса (RSV), немедленно-ранний промотор/энхансер цитомегаловируса (CMV) (см., например, Boshart et al., Cell, 41: 521-530 (1985)), промотор SV40, промотор дигидрофолатредуктазы, промотор цитоплазматического β-актина и промотора фосфоглицеролкиназы (PGK).
В другом варианте осуществления могут быть желательными индуцируемые промоторы. Индуцируемые промоторы представляют собой промоторы, которые регулируются экзогенно поступающими соединениями как в цис-, так и в транс-форме, включая в себя без ограничений индуцируемый цинком промотор металлотионеина (MT) овцы; индуцируемый дексаметазоном (Dex) промотер вируса опухоли молочной железы мыши (MMTV); промотерную систему T7-полимеразы (WO 98/10088); тетрациклин-репрессируемую систему (Gossen et al., Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)); тетрациклин-индуцируемую систему (Gossen et al., Science, 268:1766-1769 (1995); также см. Harvey et al. Curr. Opin. Chem. Biol., 2:512-518 (1998)); RU486 - индуцируемую систему (Wang et al., Nat. Biotech, 15:239-243 (1997) и Wang et al., Gene Ther., 4:432-441 (1997)); и рапамицин-индуцируемую систему (Magari et al., J. Clin. Invest., 100:2865-2872 (1997); Rivera et al., Nat. Medicine 2:1028-1032 (1996)). Другие типы индуцируемых промоторов, которые могут быть полезны в этом плане, представляют собой промоторы, которые регулируются определенным физиологическим состоянием, например, исключительно температурой, острой фазой заболевания или при репликации клеток.
В другом варианте осуществления используется природный промотор для рассматриваемого трансгена или последовательности нуклеиновой кислоты. Природный промотор может быть предпочтительным, если желательно, чтобы экспрессия трансгена или последовательности нуклеиновой кислоты имитировала нативную экспрессию. Можно использовать природный промотор, если экспрессия трансгена или другой последовательности нуклеиновой кислоты должна регулироваться по времени, или по мере развития, или тканеспецифичным образом, или в ответ на конкретные транскрипционные раздражители. В дополнительном варианте осуществления для имитации нативной экспрессии также можно использовать другие элементы контроля нативной экспрессии, такие как энхансерные элементы, сайты полиаденилирования или консенсусные последовательности Козака.
В одном варианте осуществления рекомбинантный вирусный геном содержит трансген, функционально связанный с тканеспецифичным промотором. Например, если желательно получить экспрессию в скелетных мышцах, можно использовать промотор, действующий в мышцах. В число таких промоторов входят промоторы из генов, кодирующих скелетный α-актин, легкую цепь 2А миозина, дистрофин, мышечную креатинкиназу, а также синтетические мышечные промоторы, активность которых превышает активность промоторов природного происхождения. См. Li et al., Nat. Biotech., 17:241-245 (1999). Примеры промоторов, которые являются тканеспецифичными, известны для альбумина печени, Miyatake et al., J. Virol., 71:5124-32 (1997); также, среди прочих, известны: коровый промотор вируса гепатита В, Sandig et al., Gene Ther. 3:1002-9 (1996); альфа-фетопротеина (АФП), Arbuthnot et al., Hum. Gene Ther., 7:1503-14 (1996), кости (остеокальцин, Stein et al., Mol. Biol. Rep., 24:185-96 (1997)); костного сиалопротеина, Chen et al., J. Bone Miner. Res. 11:654-64 (1996), лимфоцитов (CD2, Hansal et al., J. Immunol., 161:1063-8 (1998)); тяжелой цепи иммуноглобулина; Т-клеточный рецептор α-цепи, нейрональный промотор (нейрон-специфичная энолаза (NSE), Andersen et al., Cell. Mol. Neurobiol., 13:503-15 (1993); ген нейрофиламентов легкой цепи, Piccioli et al., Proc. Natl. Acad. Sci. USA, 88:5611-5 (1991); нейрон-специфичный ген vgf, Piccioli et al., Neuron, 15:373-84 (1995).
Термины "энхансеры" или "энхансер", используемые в изобретении, могут относиться к последовательности ДНК, которая расположена как смежная с последовательностью ДНК, кодирующей рекомбинантный продукт. Энхансерные элементы обычно расположены в 3'-5' направлении от промоторного элемента или могут быть расположены ниже или в пределах кодирующей последовательности ДНК (например, последовательности ДНК, транскрибированной или транслированной в рекомбинантный продукт или продукты). Таким образом, энхансерный элемент может быть расположен на расстоянии 100 пар оснований, 200 пар оснований или 300 или больше пар оснований перед последовательностью ДНК, которая кодирует рекомбинантный продукт, или после этой последовательности. Энхансерные элементы могут увеличивать количество экспрессируемого рекомбинантного продукта от последовательности ДНК, превышая повышенную экспрессию, обусловленную промоторным элементом. Специалистам в данной области техники доступно множество энхансерных элементов.
Термины "нуклеиновая кислота" или "молекула нуклеиновой кислоты", используемые в изобретении, относятся к любой и одноцепочечной и двухцепочечной молекуле ДНК или РНК и, в случае одноцепочечной молекулы, к ее комплементарной последовательности в линейной или циркулярной форме. При описании молекул нуклеиновых кислот в настоящем изобретении последовательность или структура конкретной молекулы нуклеиновой кислоты может быть описана в соответствии с общепринятой конвенцией, рассматривая последовательность в направлении от 5' к 3'. В отношении нуклеиновых кислот по изобретению иногда используется понятие "выделенная нуклеиновая кислота". Это понятие, в отношении ДНК, относится к молекуле ДНК, которая отделена от последовательностей, с которыми она непосредственно граничит в природном геноме организма, из которого эта молекула происходит. Например, "выделенная нуклеиновая кислота" может содержать молекулу ДНК, встроенную в вектор, такой как плазмида или вирусный вектор, или быть интегрированной в геномную ДНК в прокариотических или эукариотических клетках или в организме-хозяине.
"Вектор" представляет собой репликон, такой как плазмида, космида, бакмида, фаг или вирус, к которому может присоединяться другая генетическая последовательность или элемент (или ДНК, или РНК) таким образом, чтобы вызвать репликацию присоединенной последовательности или элемента.
"Оперон экспрессии" относится к сегменту нуклеиновой кислоты, которая может иметь последовательности контроля транскрипции и трансляции, такие как промоторы, энхансеры, старт-сигналы трансляции (например, кодоны ATG или AUG), сигналы полиаденилирования, терминаторы и т.п., которые способствуют экспрессии кодирующей последовательности полипептида в клетке-хозяине или организме-хозяине.
Термины "трасформация", "трансфекция", "трансдукция" относятся к любому способу или средствам, с помощью которых нуклеиновая кислота вводится в клетку или организм-хозяин, и могут быть использованы взаимозаменяемо для передачи аналогичного значения. Такие способы включают в себя без ограничения трансфекцию, электропорацию, микроинъекции, инфицирование, ПЭГ-сплавление и тому подобное.
Встраиваемая нуклеиновая кислота может быть не интегрирована или интегрирована (ковалентно связана) в нуклеиновую кислоту клетки-реципиента или организма. В клетках бактерий, дрожжей, растений и млекопитающих встраиваемая нуклеиновая кислота может, например, сохраняться в качестве эписомального элемента или независимого репликона, например, в виде плазмиды. С другой стороны, встраиваемая нуклеиновая кислота может становиться интегрированной в нуклеиновую кислоту клетки-реципиента или организма и находиться в стабильном состоянии в этой клетке или организме, и далее передаваться или наследоваться потомством клеток или организмов упомянутой клетки-реципиента или организма. Наконец, встраиваемая нуклеиновая кислота может только временно находиться в клетке-реципиенте или в организме-хозяине.
Термин "селектируемый маркерный ген" относится к гену, который при экспрессии придает трансформированной клетке или растению селектируемый фенотип, например, устойчивость к антибиотикам.
Термин "функционально связанный" означает, что регуляторные последовательности, необходимые для экспрессии кодирующей последовательности, расположены в молекуле ДНК в соответствующих позициях по отношению к кодирующей последовательности таким образом, чтобы осуществлялась экспрессия кодирующей последовательности. Это же определение иногда применяется к расположению в векторе экспрессии единиц транскрипции и других элементов контроля транскрипции (например, энхансеров).
Термин "олигонуклеотид", используемый в изобретении, относится к последовательностям, праймерам и зондам, согласно настоящему изобретению, и определяется как молекула нуклеиновой кислоты, состоящая из двух или нескольких, предпочтительно более чем из трех рибонуклеотидов или дезоксирибонуклеотидов. Точный размер олигонуклеотида будет зависеть от различных факторов и от конкретного применения и использования олигонуклеотида.
Понятие "специфичная гибридизация" относится к связи между двумя молекулами одноцепочечных нуклеиновых кислот с достаточной степенью комплементарности последовательностей (иногда их называют "практически комплементарными"), которая позволит осуществление такой гибридизации при заранее определенных условиях, обычно используемых в данной области техники. В частности, это понятие относится к гибридизации олигонуклеотида по существу с комплементарной последовательностью, содержащейся в одноцепочечной молекуле ДНК или РНК по изобретению, за существенным исключением гибридизации олигонуклеотида с одноцепочечными нуклеиновыми кислотами с некомплементарными последовательностями.
Термин "праймер", используемый в изобретении, относится к ДНК-олигонуклеотиду, и к одноцепочечному и к двухцепочечному, или полученному из биологической системы, который создан путем расщепления ферментами рестрикции или получен синтетическим путем, при этом праймер при попадании в соответствующую среду способен функционально действовать в качестве инициатора матрично-зависимого синтеза нуклеиновых кислот. Если имеется соответствующая матрица нуклеиновой кислоты, подходящие трифосфатные нуклеозиды - предшественники нуклеиновых кислот, полимеразный фермент, подходящие кофакторы и условия, такие как подходящая температура и уровень рН, можно удлинять праймер на его 3'-конце путем добавления нуклеотидов посредством активности полимеразы или сходного действия, с получением продукта удлинения праймера. Праймер может иметь вариабельную длину в зависимости от конкретных условий и требований применения. Например, олигонуклеотидный праймер для диагностических применений обычно имеет длину от 15 до 25 или больше нуклеотидов. Праймер должен иметь достаточную степень комплементарности к желательной матрице, чтобы запускать синтез желательного продукта удлинения, то есть, чтобы была возможность для отжига с желательной матричной цепью таким способом, который будет достаточным для получения 3'-гидроксильной группы праймера в соответствующей юкстапозиции, для использования при инициации синтеза посредством полимеразы или подобного фермента. Не требуется полная комплементарность праймерной последовательности к желательной матрице. Например, можно присоединять некомплементарную нуклеотидную последовательность к 5'-концу праймера, который в остальном является комплементарным. Альтернативно, в последовательность олигонуклеотидного праймера можно вкраплять некомплементарные основания при условии, что последовательность праймера имеет достаточную степень комплементарности с последовательностью желательной матричной цепи, чтобы функционально получить матрично-праймерный комплекс для синтеза продукта удлинения.
Полимеразная цепная реакция (ПЦР) была описана в патентах США №№ 4683195, 4800195 и 4965188, полное раскрытие которых включено в настоящее изобретение путем ссылки.
Термин "выделенный" может относиться к соединению или комплексу, который был в достаточной степени отделен от других соединений, с которыми он был бы связан в природном виде. Термин "выделенный" не предназначен для исключения искусственных или синтетических смесей с другими соединениями или материалами, или наличия примесей, которые не нарушают основополагающего действия или последующих анализов и которые могут присутствовать, например, из-за неполной очистки или добавления стабилизаторов.
Термин "иммунный ответ" предназначен для обозначения любого ответа на антиген или антигенную детерминанту со стороны иммунной системы позвоночного субъекта. Примеры иммунных ответов включают в себя гуморальные иммунные ответы (например, выработку антиген-специфичных антител) и клеточно-опосредованные иммунные ответы (например, пролиферацию лимфоцитов), что описано в настоящем изобретении ниже.
II. СПОСОБЫ ИСПОЛЬЗОВАНИЯ И СПОСОБЫ ВВЕДЕНИЯ ВАРИАНТНЫХ АДЕНОАССОЦИИРОВАННЫХ ВИРУСНЫХ ВЕКТОРОВ ПО ИЗОБРЕТЕНИЮ
Способы по настоящему изобретению относятся к средствам для доставки гетерологичных последовательностей нуклеиновых кислот в разнообразные клетки-хозяева, в том числе и в делящиеся и в непролиферирующие клетки. Векторы и другие реагенты, способы и фармацевтические композиции по настоящему изобретению являются дополнительно полезными в способе введения белка или пептида субъекту, нуждающемуся в этом, в качестве способа лечения или с другой целью. Таким образом, белок или пептид могут быть получены в субъекте in vivo. Субъект может иметь потребность в белке или пептиде, потому что у этого субъекта имеется дефицит белка или пептида, или потому, что выработка белка или пептида в субъекте может давать некоторый терапевтический эффект, в качестве способа лечения или с другой целью, что описано ниже.
В общем, настоящее изобретение можно использовать для доставки любой чужеродной нуклеиновой кислоты с биологическим эффектом для лечения или ослабления симптомов, связанных с каким-либо расстройством, обусловленным генной экспрессией. Примеры патологических состояний включают в себя без ограничения кистозный фиброз (и другие заболевания легких), гемофилию А, гемофилию В, талассемию, анемии и другие нарушения свертываемости крови, СПИД, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, эпилепсию и другие неврологические расстройства, рак, сахарный диабет, мышечные дистрофии (например, Дюшенна, Беккера), болезнь Гоше, болезнь Херлера, дефицит аденозиндеаминазы, болезни накопления гликогена и другие метаболические дефекты, дегенеративные заболевания сетчатки (и другие заболевания глаз), заболевания солидных органов (например, мозга, печени, почек, сердца) и тому подобное.
Дополнительно, настоящее изобретение можно использовать для доставки нуклеиновых кислот, кодирующих моноклональные антитела или их фрагменты, которые, как известно, обеспечивают полезные биологические эффекты для лечения или ослабления симптомов, связанных с раком, инфекционными заболеваниями и аутоиммунными заболеваниями, такими как ревматоидный артрит. Другие последовательности могут кодировать, например, цитокины, такие как интерферон-альфа, которые могут модулировать течение болезни.
Перенос генов обладает значительным потенциалом применения для понимания и создания способов лечения патологических состояний. Существует ряд наследственных заболеваний, для которых были изучены и клонированы дефектные гены. В некоторых случаях известна функция этих клонированных генов. В целом, упомянутые выше патологические состояния делятся на два класса: дефицитные состояния, как правило, дефицит ферментов, которые обычно наследуются рецессивным образом, и состояния нарушения баланса, иногда с вовлечением по меньшей мере регуляторных или структурных белков, которые наследуются доминантным образом. При дефицитных заболеваниях можно использовать перенос генов, чтобы внести нормальный ген в пораженные ткани для заместительной терапии, а также для создания животных моделей этого заболевания с помощью антисмысловых мутаций. При патологических состояниях нарушения баланса перенос генов можно использовать для создания патологического состояния в смоделированной системе, которую затем можно использовать для разработки мер против этого патологического состояния. Таким образом, способы по настоящему изобретению позволяют лечить генетические заболевания. Согласно изобретению, патологическое состояние лечится путем частичного или полного устранения дефекта или дисбаланса, который вызывает заболевание или усугубляет степень его тяжести. Также возможно использование сайт-специфичной интеграции нуклеиновых последовательностей для запуска мутаций или исправления дефектов.
Наконец, настоящее изобретение находит дополнительное использование в способах диагностики и скрининга, где вызывающий интерес ген транзиторно или стабильно экспрессируется в клеточной культуральной системе или, альтернативно, в трансгенной животной модели.
III. СУБЪЕКТЫ, ФАРМАЦЕВТИЧЕСКИЕ РЕЦЕПТУРЫ, ВАКЦИНЫ И СПОСОБЫ ВВЕДЕНИЯ
Настоящее изобретение находит применение в областях ветеринарии и медицины. Подходящие субъекты включают в себя и птиц и млекопитающих, при этом предпочтительными являются млекопитающие. Термин "птицы", используемый в изобретении, включает в себя без ограничения кур, уток, гусей, перепелов, фазанов и индеек. Термин "млекопитающее", используемый в изобретении, включает в себя без ограничения людей, представителей крупного рогатого скота, овец, коз, лошадей, кошачьих, собачьих, зайцеобразных и тому подобное. Человеческие субъекты являются наиболее предпочтительными. Человеческие субъекты включают в себя плодные субъекты, новорожденных, младенцев, несовершеннолетних и взрослых людей.
В конкретных вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей вирусную частицу по изобретению в фармацевтически приемлемом носителе или в других лекарственных соединениях, фармацевтические агенты, носители, адъюванты, разбавители и т.д. Носитель для инъекций обычно является жидким. Носитель для других способов введения может быть или твердым, или жидким, таким как стерильная апирогенная вода или стерильный апирогенный фосфатно-солевой буферный раствор. Для введения путем ингаляции носитель является вдыхаемым и предпочтительно находится в твердой или жидкой дисперсной форме. В качестве инъекционной среды предпочтительно использовать воду, содержащую добавки, общепринятые для инъекционных растворов, такие как стабилизирующие агенты, соли или солевые растворы и/или буферы.
В других вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей клетку, в которой провирус AAV интегрирован в геном, в фармацевтически приемлемом носителе или других лекарственных соединениях, фармацевтических агентах, носителях, адъювантах, разбавителях и т.д.
"Фармацевтически приемлемым" считается материал, который не имеет биологических или других противопоказаний, например, материал можно вводить субъекту без каких-либо нежелательных биологических эффектов. Таким образом, такие фармацевтические композиции можно использовать, например, для трансфекции клетки ex vivo или для введения in vivo вирусной частицы или клетки непосредственно субъекту.
Настоящее изобретение дополнительно относится к способу доставки нуклеиновой кислоты в клетку. В способах in vitro вирус можно вводить в клетку с помощью стандартных способов вирусной трансдукции, известных в данной области техники. Предпочтительно, чтобы вирусные частицы добавлялись в клетки при соответствующем показателе множественности инфекции в соответствии со стандартными способами трансдукции, подходящими для конкретных клеток-мишеней. Титры вводимого вируса могут варьироваться в зависимости от типа клетки-мишени и конкретного вирусного вектора и могут быть определены специалистами в данной области техники без излишнего экспериментирования. С другой стороны, введение парвовирусного вектора по настоящему изобретению можно осуществлять с помощью любых других способов, известных в данной области техники.
Рекомбинантные вирусные векторы предпочтительно вводят в клетку в биологически эффективном количестве. "Биологически эффективное" количество вирусного вектора представляет собой количество, которое достаточно, чтобы вызвать инфекцию (или трансдукцию) и экспрессию гетерологичной последовательности нуклеиновой кислоты в клетке. Если вирус вводят в клетку in vivo (например, вирус вводят субъекту, как описано ниже), "биологически эффективное" количество вирусного вектора представляет собой количество, которое достаточно, чтобы вызвать трансдукцию и экспрессию гетерологичной последовательности нуклеиновой кислоты в клетке-мишени.
Клетка для введения вирусного вектора по изобретению может быть клеткой любого типа, включая в себя без ограничения нервные клетки (включающие в себя клетки периферической и центральной нервной системы, в частности, клетки головного мозга), легочные клетки, клетки сетчатки, эпителиальные клетки (например, эпителиальные клетки кишечника и дыхательных путей), мышечные клетки, клетки поджелудочной железы (в том числе островковые клетки), печеночные клетки, клетки миокарда, костные клетки (например, стволовые клетки костного мозга), гемопоэтические стволовые клетки, клетки селезенки, кератиноциты, фибробласты, эндотелиальные клетки, клетки предстательной железы, половые клетки и тому подобное. Альтернативно, клетка может быть любой клеткой-предшественником. В качестве дополнительной альтернативы, клетки могут представлять собой стволовые клетки (например, нервные стволовые клетки, стволовые клетки печени). Кроме того, клетки могут происходить от любых видов, как указано выше.
В конкретных вариантах осуществления настоящего изобретения клетки забирают из субъекта, в эти клетки вводят парвовирусный вектор и затем клетки возвращают в субъект. Способы забора клеток от субъекта для обработки ex vivo с последующим введением обратно субъекту известны в данной области техники. Альтернативно, вектор rAAV вводят в клетки от другого субъекта, в культивируемые клетки или в клетки из любого другого подходящего источника, и затем клетки вводят нуждающемуся в этом субъекту.
Подходящие клетки для генной терапии ex vivo включают в себя без ограничения клетки печени, нервные клетки (включающие в себя клетки центральной и периферической нервной системы, в частности, клетки головного мозга), клетки поджелудочной железы, клетки селезенки, фибробласты (например, фибробласты кожи), кератиноциты, эндотелиальные клетки, эпителиальные клетки, миобласты, гемопоэтические клетки, стромальные клетки костного мозга, клетки-предшественники и стволовые клетки.
Дозировки клеток для введения субъекту будут варьироваться в зависимости от возраста, состояния и вида субъекта, типа клеток, нуклеиновой кислоты, экспрессируемой этими клетками, от способа введения и тому подобного. Обычно в одной дозе можно вводить по меньшей мере приблизительно от 102 приблизительно до 108, предпочтительно приблизительно от 103 приблизительно до 106 клеток. Предпочтительно, клетки вводятся в "терапевтически эффективном количестве".
Термин "терапевтически эффективное" количество, используемый в изобретении, представляет собой количество, которое достаточно для облегчения (например, для смягчения, уменьшения, снижения) по меньшей мере одного из симптомов, связанных с патологическим состоянием. Другими словами, "терапевтически эффективное" количество представляет собой количество, которое достаточно для обеспечения некоторого улучшения состояния субъекта.
Еще в одном аспекте изобретение относится к способу лечения субъектов in vivo вирусными частицами по изобретению. Введение парвовирусных частиц по настоящему изобретению субъекту-человеку или животному, нуждающемуся в этом, можно проводить любым известным в данной области способом для введения вирусных векторов.
Примеры способов введения включают в себя местное применение, пероральное, ректальное, чрезслизистое, трансдермальное, ингаляционное, парентеральное введение (например, внутривенное, подкожное, внутрикожное, внутримышечное и внутрисуставное) и т.п., а также инъекции непосредственно в ткань или в орган и, альтернативно, интратекальные, непосредственно внутримышечные, внутрижелудочковые, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции. Инъекционные препараты могут быть приготовлены в общепринятых лекарственных формах: в виде жидких растворов или суспензий, твердых форм, подходящих для приготовления растворов или суспензий в жидкости перед инъекцией, или в виде эмульсий. Альтернативно, можно вводить вирус локально, а не системно, например, в виде депо или в композиции с замедленным высвобождением.
В конкретных предварительно оформленных вариантах осуществления настоящего изобретения рассматриваемая нуклеотидная последовательность доставляется в печень субъекта. Введение в печень можно осуществлять любым способом, известным в данной области и включающим в себя без ограничения внутривенное введение, внутрипортальное введение, интрабилиарное введение, внутриартериальное введение и непосредственную инъекцию в паренхиму печени.
Предпочтительно клетки (например, клетки печени) инфицируются рекомбинантным парвовирусным вектором, кодирующим пептид или белок, эти клетки экспрессируют кодированный пептид или белок и выделяют его в кровеносную систему в терапевтически эффективном количестве (как описано выше). Альтернативно, доставка и экспрессия вектора происходит в другой клетке или ткани, включающей в себя без ограничения головной мозг, поджелудочную железу, селезенку или мышцы.
В других предпочтительных вариантах осуществления парвовирусные частицы по изобретению вводят внутримышечно, более предпочтительно, путем внутримышечной инъекции или путем местного применения (как описано выше). В других предпочтительных вариантах осуществления парвовирусные частицы по настоящему изобретению вводят в легкие.
Парвовирусный вектор, раскрытый в изобретении, можно вводить в легкие субъекта с помощью любых подходящих способов, но предпочтительным является введение в форме аэрозольной суспензии вдыхаемых частиц, состоящих из парвовирусного вектора по изобретению, который вдыхается субъектом. Вдыхаемые частицы могут быть жидкими или твердыми. Аэрозоли из жидких частиц, содержащих парвовирусные векторы по изобретению, можно делать любыми подходящими способами, например, в виде аэрозольного ингалятора под давлением или ультразвукового распылителя, которые известны специалистам в данной области техники. См., например, патент США № 4501729. Также можно делать аэрозоли твердых частиц, содержащие вирусные векторы по изобретению, с любым генератором твердых лекарственных аэрозольных частиц с помощью известных в фармацевтической области технологий.
Дозировки парвовирусных частиц по изобретению будут зависеть от способа введения, заболевания или состояния, подлежащего лечению, от состояния субъекта, конкретного вирусного вектора и доставляемого гена, и их можно определять рутинными способами. Примерными дозами для достижения терапевтического эффекта являются вирусные титры, составляющие по меньшей мере примерно 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015, 1016 трансдуцирующих единиц или больше, предпочтительно приблизительно от 108 до 1013 трансдуцирующих единиц, еще более предпочтительно 1012 трансдуцирующих единиц.
Таким образом, парвовирусные векторы, реагенты и способы по настоящему изобретению можно использовать для направления нуклеиновой кислоты в делящиеся или неделящиеся клетки и для стабильной экспрессии в этих клетках гетерологичной нуклеиновой кислоты. С использованием этой векторной системы стало возможно вводить в клетки в условиях in vitro или in vivo гены, которые кодируют белки, влияющие на физиологию клеток. Таким образом, векторы по настоящему изобретению могут быть полезными в генной терапии при патологических состояниях или для экспериментальной модификации клеточной физиологии.
Следующий пример приведен для иллюстрации некоторых вариантов осуществления настоящего изобретения. Пример не предназначен для какого-либо ограничения объема изобретения.
ПРИМЕР I
Замены лизина на аргинин влияют на скорость трансдукции AAV и доставки МНС
Идентификация остатков лизина, нацеливаемых на векторы AAV1 и AAV8
Авторы использовали программное обеспечение UbPred для прогнозирования возможных сайтов убиквитинирования на капсидных белках AAV1, AAV2, AAV8 и Rh74 (Radivojac P. et al., 2010). Программное обеспечение UbPred доступно в Интернете по адресу http://www.ubpred.org/index.html. Результатом анализа является прогнозирование в отношении важных для убиквитинирования остатков лизина в указанной последовательности капсида серотипа AAV. Данные приведены в фиг.1 и таблице 1. К ним относятся следующие последовательности:
Последовательность AAV1 капсидного белка VP1:




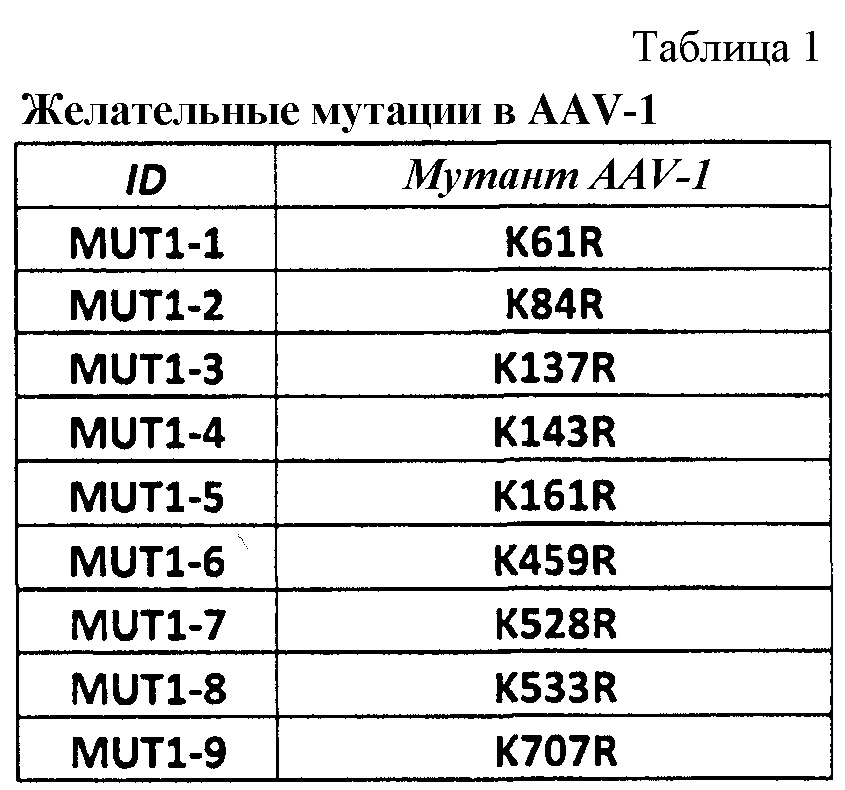
Последовательность AAV8 капсидного белка VP1:



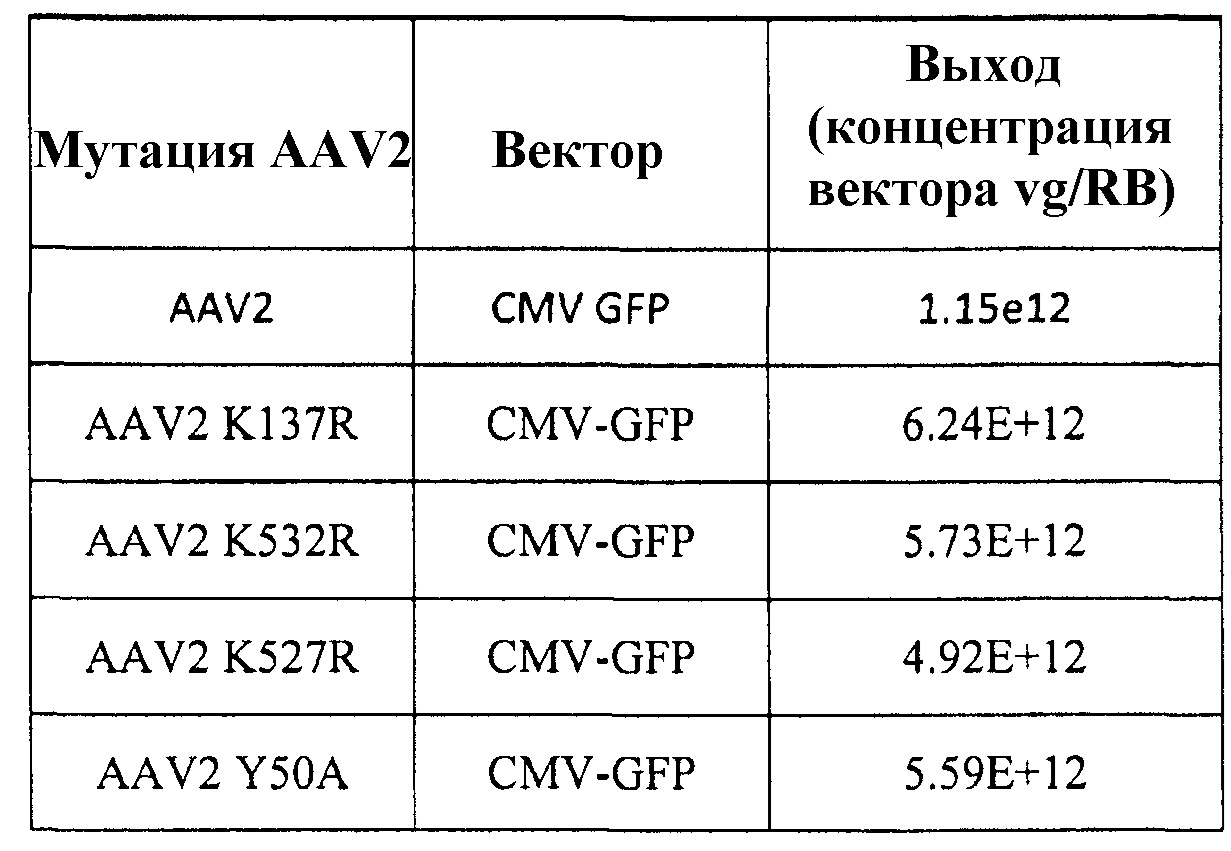
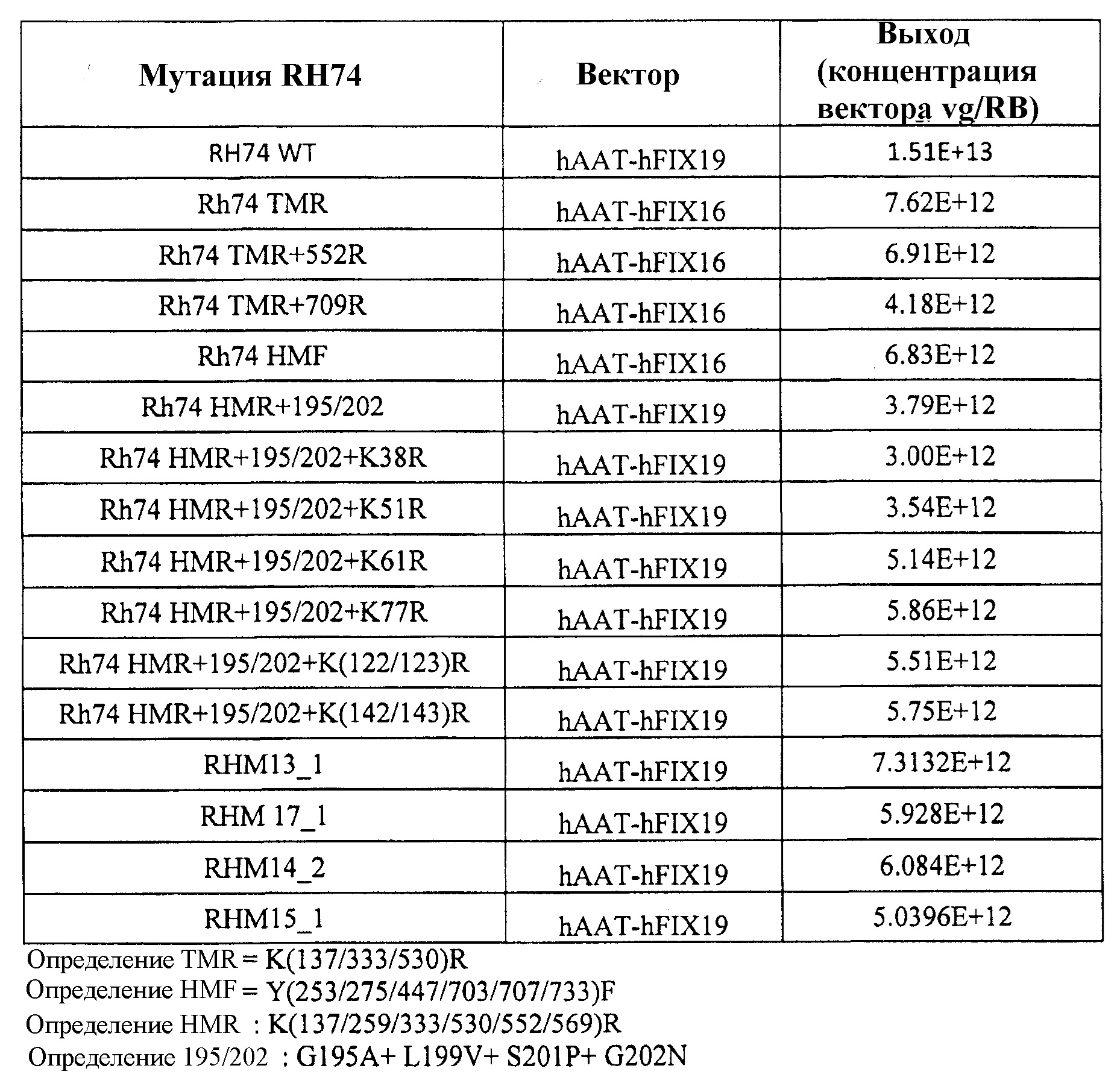
Таблица 3, приведенная в настоящем описании, показывает выход вектора, полученного с использованием различных капсидных мутаций, включающих в себя AAV8 по изобретению. В таблице также указан результат мутации, а именно увеличение, уменьшение или сравнимая эффективность трансдукции по сравнению с векторами дикого типа этого же серотипа.
Последовательность AAV2 капсидного белка VP1:

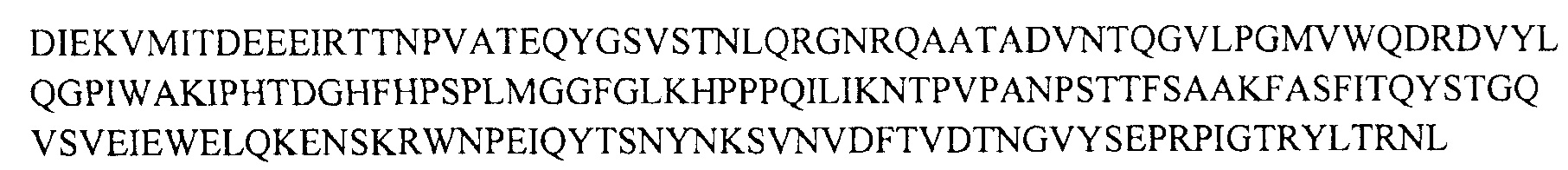

Последовательность AAV-Rh74 капсидного белка VP1:
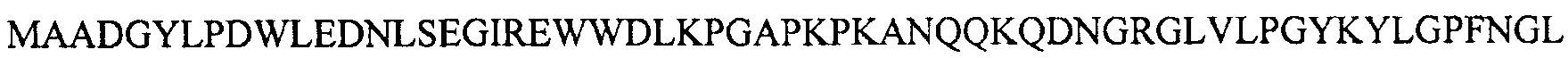



Желательные мутанты в AAV-rh74 (также см. таблицу 3)
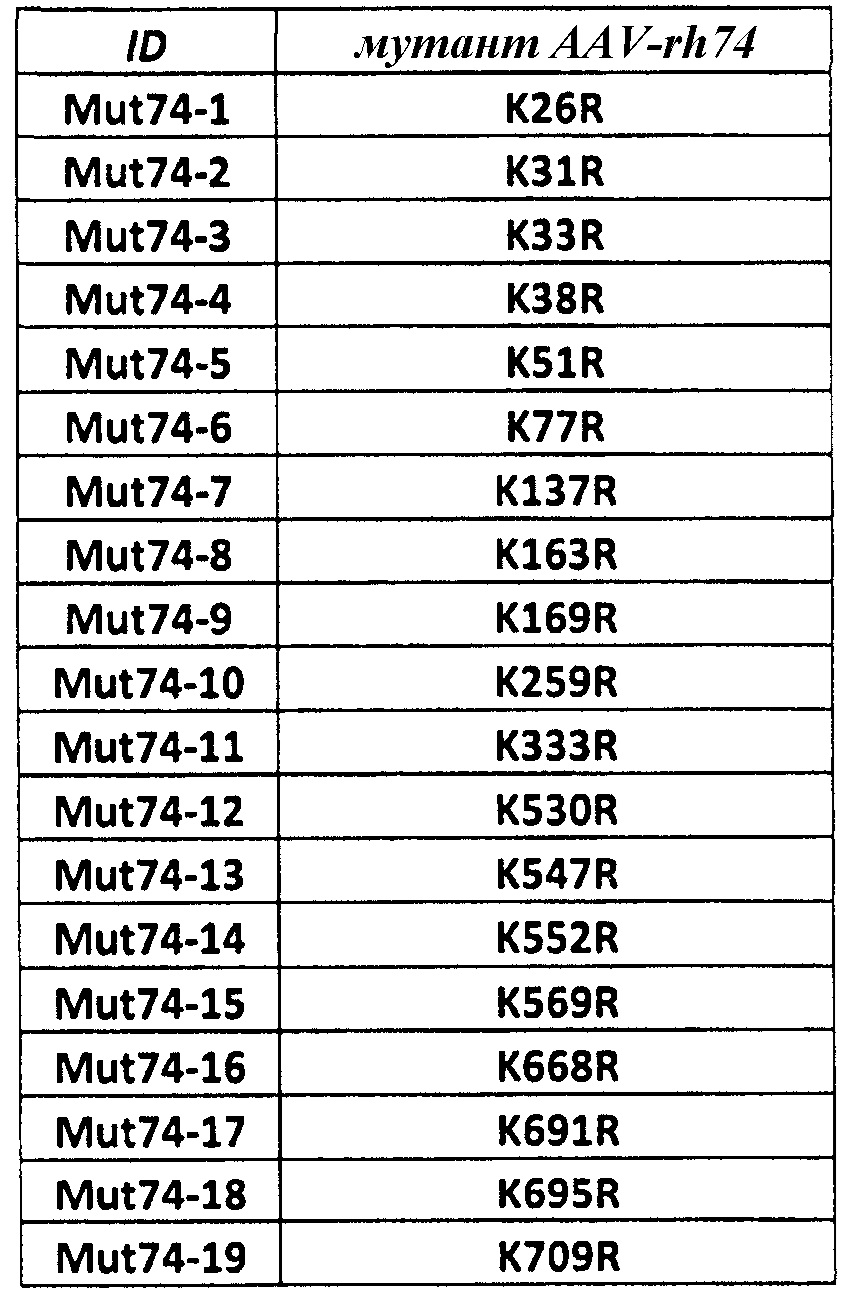
Следующие наборы праймеров были использованы для создания лизина, содержащего варианты капсида согласно изобретению:
Праймеры, используемые для мутагенеза:
- AAV1 праймеры:


- Праймеры AAV8
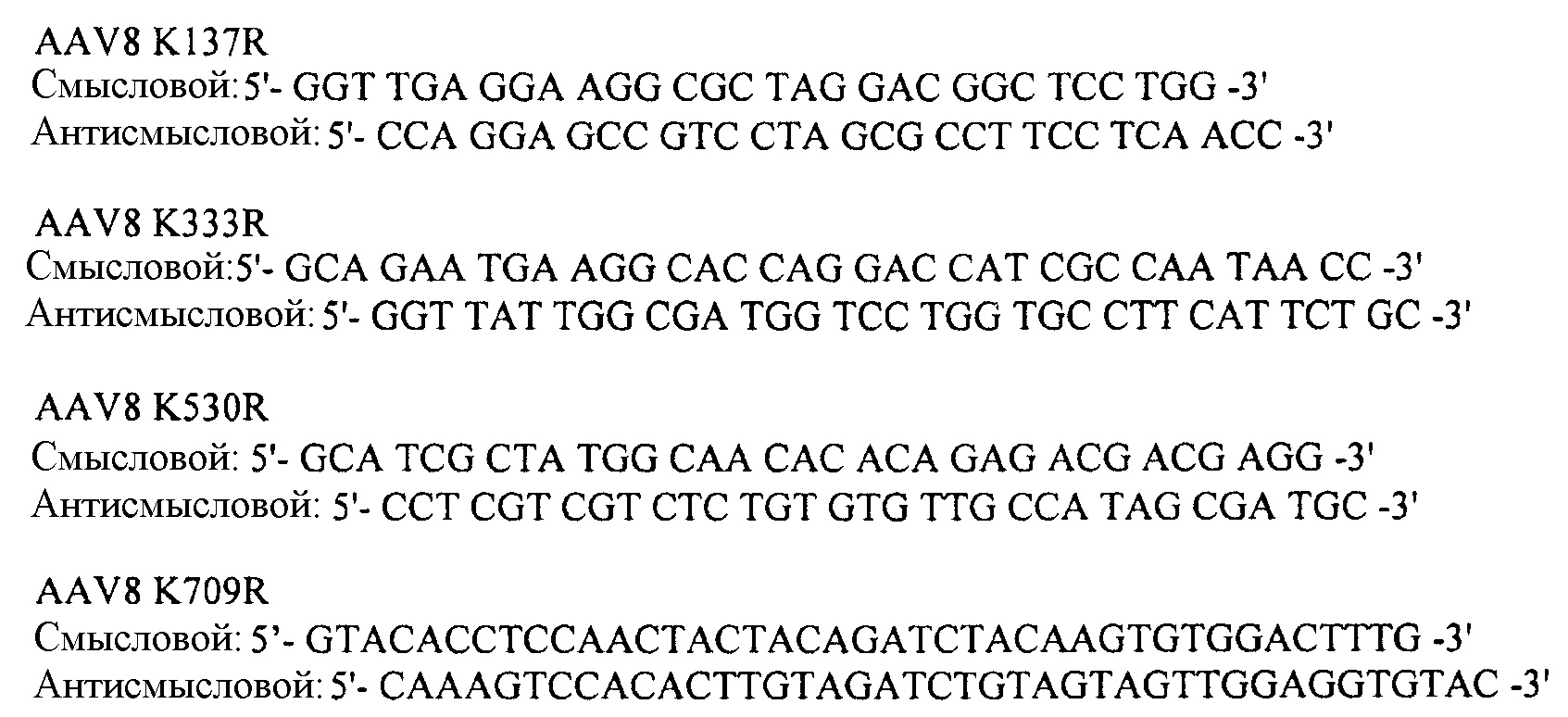
- Праймеры AAV2
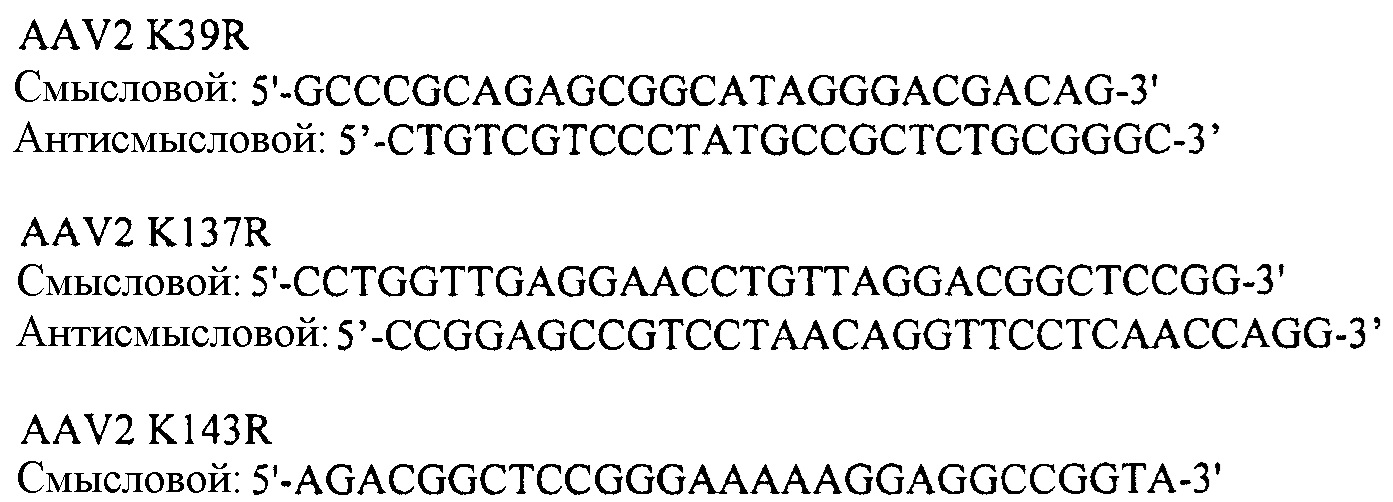
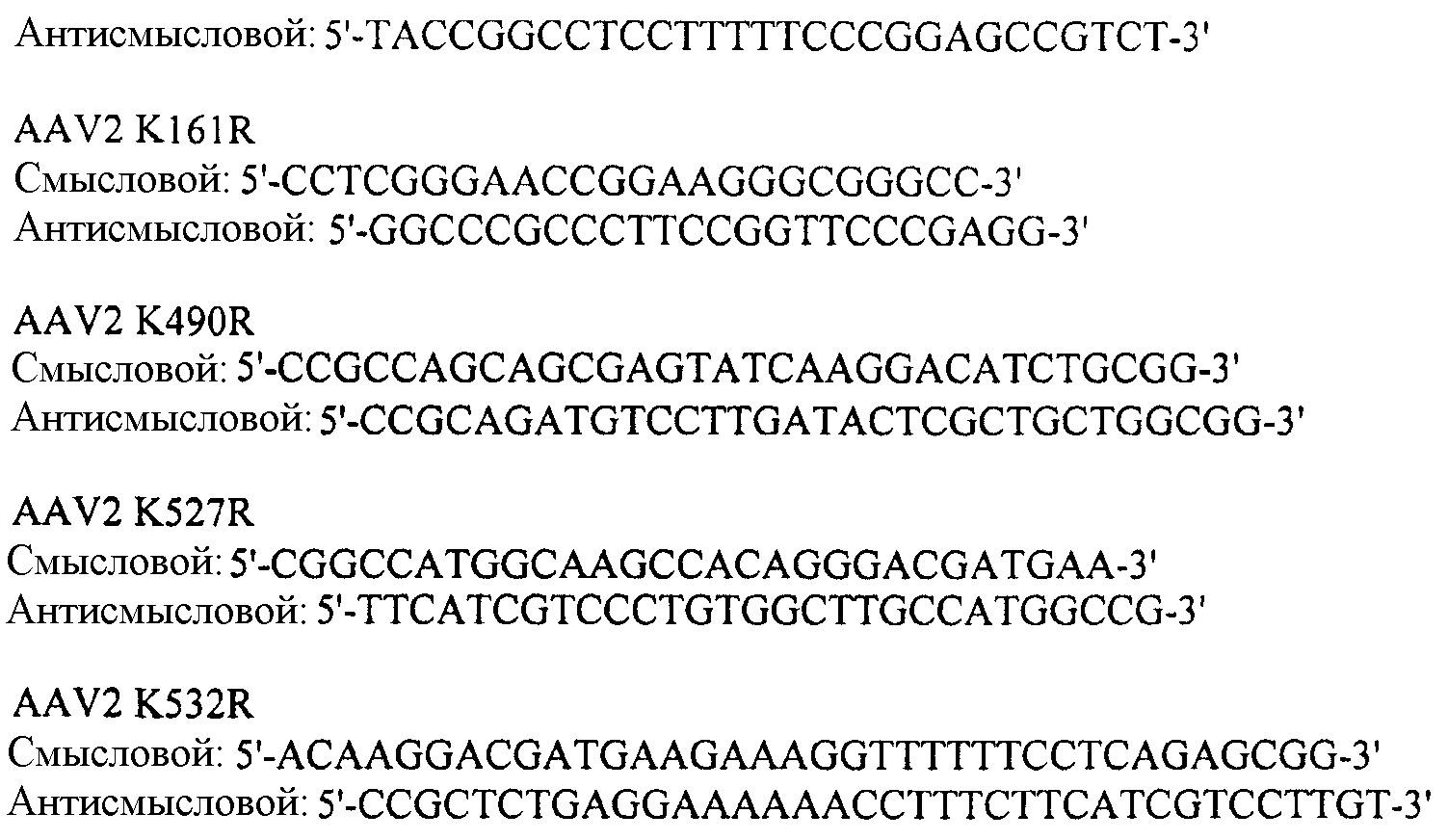
- Праймеры AAV-rh74

Таблица 5 представляет серию векторов AAV, полученных посредством мутагенеза, которые были использованы для упаковки специфичных для печени AAV трансгенных кассет экспрессии для FIX. Эффективность упаковки была неотличимой от эффективности, наблюдаемой у немодифицированных векторов AAV8 дикого типа.
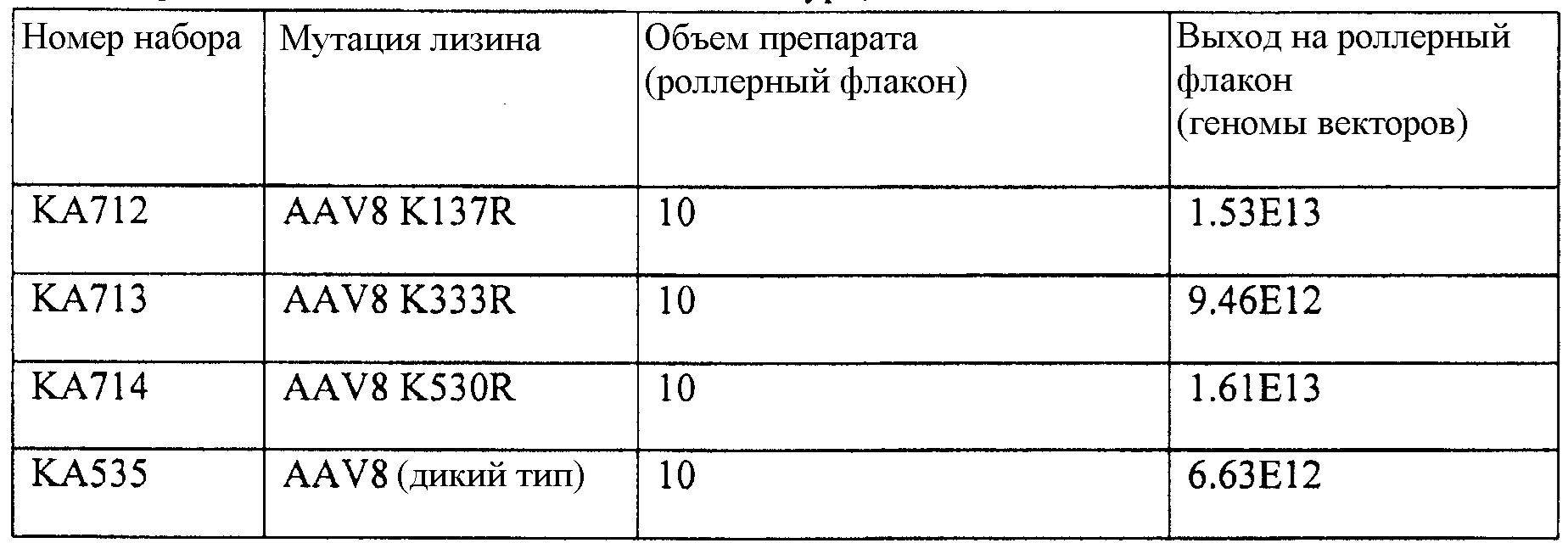
В объем настоящего изобретения также входят капсидные мутанты, которые содержат 2, 3, 4, 5, 6, 7 или больше измененных остатков лизина в любом из капсидных белков, описанных в изобретении, для дополнительного повышения эффективности трансдукции. Данные также показывают, что определенные мутации приводят к вариантам, которые проявляют значительно сниженную эффективность трансдукции. Такие варианты можно использовать в сочетании с вариантами, которые обладают повышенной эффективностью трансдукции, чтобы действовать в качестве ловушек для нейтрализации или насыщения антитела, направляющего иммунный ответ на вставляемые вектора, тем самым позволяя несущим желательные трансгены векторам с большей эффективностью проникать в клетки.
На фиг.1 схематично показана поверхность капсида. Данные, представленные на фиг.2А, 2В и 2С, показывают, что замена остатков лизина в капсиде VP1 на AAV8 изменяет уровень продуцируемого трансгена по причине изменения уровня трансдукции. Фиг.3А, 3В и 3С показывают эффекты одиночной и множественных мутаций на продукцию HF.IX в трансдуцированных клетках. Фиг.3D показывает, что комбинированные мутации, например, замена трех остатков лизина на аргинин вместе с заменой четырех или шести остатков тирозина на фенилаланин, снижают скорость трансдукции.
Уничтожение цитотоксическими T-лимфоцитами (CTL) HHL5-B7 гепатоцитов с помощью AAV-мутантов лизина
Авторы оценивали CTL-уничтожение гепатоцитов, трансдуцированных некоторыми AAV-мутантами лизина, раскрытыми в изобретении. Для оценки CTL-уничтожения трансдуцированных гепатоцитов использовали следующие материалы и способы.
Создание вектора
AAV векторы получали из клеток НЕК-293 с использованием технологии тройной трансфекции, как описано ранее (Matsushita, 1998) и очищали с градиентом хлорида цезия с помощью центрифугирования (Ayuso, 2010). Пептиды с AAV-эпитопами были синтезированы в компании Genemed Synthesis и ресуспендированы в 100% ДМСО с концентрацией 5 мг/мл.
Размножение Т-клеток in vitro
Человеческие РВМС (Cellular Technology LTD) оттаивали, промывали, подсчитывали и ресуспендировали при концентрации 2×106 клеток/мл в среде для лимфоцитов AIM-V (Gibco), содержащей 3% человеческой сыворотки (Bioreclamation), 1% L-глутамина (Gibco) и 1% пенициллина/стрептомицина (Gibco). Для каждого условия размножения добавляли 1×106 (500 мкл) клеток в каждую лунку в 24-луночном планшете (BD Falcon) в объеме 500 мкл. Дополнительно в качестве питающих клеток в каждую лунку добавляли 1×106 (500 мкл) аутологичных облученных спленоцитов (3000 рад) вместе с 2,5 мкг/мл человеческого β-2-микроглобулина (Lee BioSolutions) и 10 нг/мл человеческого рекомбинантного ИЛ-7 (R & D Systems). Клетки размножались в присутствии пептида AAV в конечной концентрации 10 мкг/мл при 37°С в 5% CО2. По истечении первых 24 часов к культуре клеток добавляли человеческий ИЛ-2 (Roche) в концентрации 10 нг/мл и после этого пополняли каждые 48 часов. По мере необходимости клетки распределяли по новым лункам и повторяли антигенную стимуляцию (антиген и фидерные клетки) каждые 7-10 дней до 3-х циклов рестимуляции.
АНАЛИЗ CTL
Анализ CTL проводили, как описано ранее (Pien, 2009). Коротко, измеряли высвобождение лактатдегидрогеназы (ЛДГ) после CTL-опосредованного направленного лизиса с помощью анализа нерадиоактивной цитотоксичности CytoTox 96 (Promega). Четыре тысячи клеток-мишеней HHL5 гепатоцитов высевали в каждую лунку в плоскодонный 96-луночный планшет Microtest Primaria (BD Falcon) в среде DMEM, не содержащей сыворотки. Клетки-мишени трансдуцировали с MOI 5000, 50000 и 500000 из капсида AAV и инкубировали в течение 18 часов при 37°С 5% CО2. После обработки и инкубации культивируемые клетки-мишени промывали средой однократно перед добавлением эпитоп-специфичных цитотоксических Т-лимфоцитов и оставляли для размножения, как описано выше. Клетки CTL добавляли при соотношении эффектор:клетка-мишень 10:1 в течение 4 часов при 37°С, 5% СО2 и измеряли уровень ЛДГ после 30-минутной инкубации при комнатной температуре с ферментной матрицей, считываемой при 490 нм с использованием спектрофотометра (Spectramax).
Проточная цитометрия
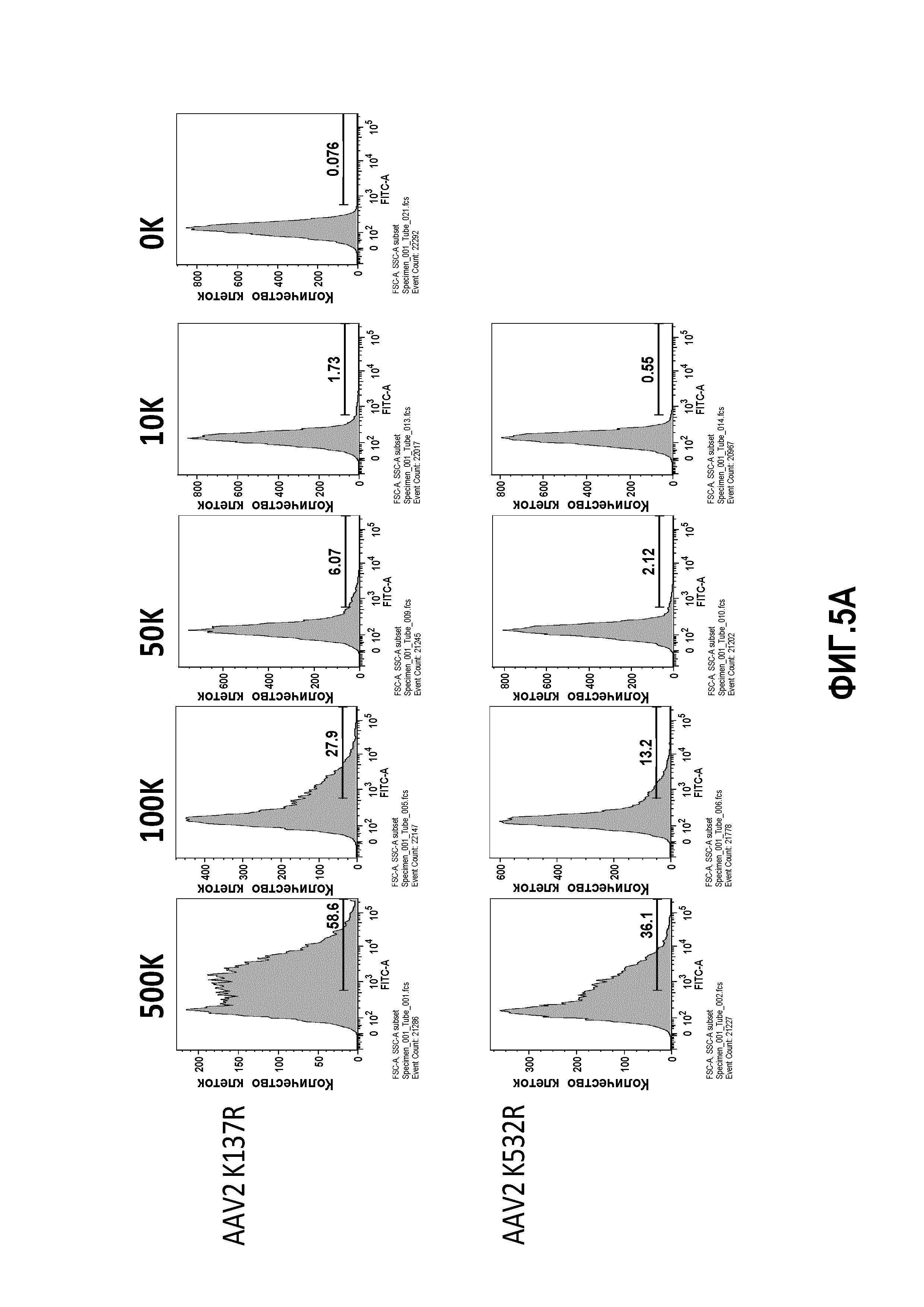
Экспрессии GFP после трансдукции AAV измеряли с помощью проточной цитометрии. Гепатоциты человека из клеточных линий HHL5 или Huh7 высевали в среду DMEM, содержащую 10% фетальной бычьей сыворотки, 1% L-глутамина (Gibco) и 1% пенициллина/стрептомицина (Gibco) при плотности 250000 клеток/лунку в 24-луночный планшет Primaria (BD Falcon). Клетки трансдуцировали вектором AAV с MOI 5000, 50000 или 5000000 и инкубировали в течение 18 часов при 37°С 5% CО2. После инкубации клетки обрабатывали трипсином, дважды промывали фосфатно-буферным раствором (ФБР) с 2% FBS и фиксировали 2% параформальдегидом. Образцы исследовали на проточном цитометре FACS Canto II с помощью FACSDiva® (BD Biosciences) и проводили дальнейший анализ с использованием программного обеспечения Flowjo® (Treestar).
РЕЗУЛЬТАТЫ АНАЛИЗА CTL
Для дальнейшего исследования эффекта мутаций лизина на вирусную трансдукцию авторы применяли анализ CTL-опосредованной цитотоксичности in vitro, ранее разработанный в лаборатории авторов, для тестирования функциональности векторов AAV (Pien et al.). Результаты трансдукции AAV1 и AAV2 показаны на фиг.4, 5 и 6. На фиг.4 показано, что все мутации лизина в капсиде AAV-1 вызывали уменьшение CTL-опосредованного уничтожения клеток-мишеней, что свидетельствует о том, что мутации лизина приводили к уменьшению эффективности процессинга и представления поверхностного антигена при трансдукции. Кроме того, эффект мутаций лизина, по-видимому, является аддитивным, а именно, тройные и четверные мутации лизина показывают наибольшее уменьшение CTL-опосредованного уничтожения (фиг.4A, B). Мутации в AAV-2 капсиде показали аналогичный эффект. См. фиг.5 и 6. На фиг.7 показаны результаты трансдукции, полученные при изучении вариантов Rh74.
Таким образом, авторы обнаружили, что замена остатков лизина в капсидах AAV на остатки аргинина повышает эффективность трансдукции AAV. В этих экспериментах было выявлено несколько вариантов, которые при трансдукции вызывали более выраженную экспрессию трансгена человеческого фактора IX (FIX) у мышей по сравнению с животными, получавшими немодифицированные векторы AAV.
ССЫЛКИ
Xie Q, Bu W, Bhatia S, Hare J, Somasundaram T, Azzi A, et al. The atomic structure of adeno-associated virus (AAV-2), a vector for human gene therapy. Proc Natl Acad Sci USA, 2002; 99:10405-10410.
High KA, Aubourg P «rAAV human trial experience» Methods Mol Biol. 2011; 807:429-57. Zhong L, Zhao W, Wu J, Li B, Zolotukhin S, Govindasamy L, Agbandje-McKenna M, Srivastava A. «A dual role of EGFR protein tyrosine kinase signaling in ubiquitination of AAV2 capsids and viral second-strand DNA synthesis», Mol Ther. 2007 Jul; 15(7):1323-30. Epub 2007 Apr 17.
Zhong L, Li B, Mah CS, Govindasamy L, Agbandje-McKenna M, Cooper M, Herzog RW, Zolotukhin I, Warrington KH Jr, Weigel-Van Aken KA, Hobbs JA, Zolotukhin S, Muzyczka N, Srivastava A. «Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses», Proc Natl Acad Sci USA. 2008 Jun 3; 105(22):7827-32.
Thrower JS, Hoffman L, Rechsteiner M, and Pickart С M «Recognition of the polyubiquitin proteolytic signal», EMBO J. 2000 January 4; 19(1):94-102.
Bedford L, Lowe J, Dick LR, Mayer RJ, Brownell JE. «Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets» Nat Rev Drug Discov. 2011 Jan; 10(l):29-46.
Peng, J; Schwartz; Elias; Thoreen; Cheng; Marsischky; Roelofs; Finley et al (Aug 2003). «A proteomics approach to understanding protein ubiquitination». Nature biotechnology 21 (8):921-6.
Radivojac, P., Vacic, V., Haynes, C., Cocklin, R. R., Mohan, A., Heyen, J. W., Goebl, M. G., and Iakoucheva, L. M. Identification, Analysis and Prediction of Protein Ubiquitination Sites. Proteins: Structure, Function, and Bioinformatics. 78(2):365-380. (2010).
Описаны и приведены в качестве примера выше некоторые из предпочтительных вариантов осуществления настоящего изобретения, вместе с тем, это не означает, что изобретение ограничено такими вариантами осуществления. Можно делать различные модификации без отклонения от объема и сущности настоящего изобретения, изложенной в формуле изобретения ниже.