Результат интеллектуальной деятельности: Полиэтиленгликоль-содержащий липид, композиция на его основе с катионным амфифилом и нейтральным фосфолипидом и способ ее получения для доставки нуклеиновых кислот in vivo
Вид РИД
Изобретение
Изобретение относится к области химии, биотехнологии, медицины и химико-фармацевтической промышленности, и описывает синтез, состав, способ получения новой композиции для транспорта нуклеиновых кислот в клетки в присутствии сыворотки в ростовой среде. Композиция включает поликатионный амфифил, нейтральный фосфолипид и полиэтиленгликоль (ПЭГ)-содержащий липид, и образует комплекс с нуклеиновой кислотой. Предлагаемая композиция способна в виде водных дисперсий доставлять нуклеиновые кислоты в клетки млекопитающих как in vitro, так и in vivo.
Среди разработанных на сегодняшний день систем доставки нуклеиновых кислот наиболее широко распространены катионные липосомы, благодаря таким преимуществам, как неиммуногенность, низкая токсичность, возможность крупномасштабного производства [Madeira С. et al. Fluorescence methods for lipoplex characterization / Biochim. Biophys. Acta, 2011, V. 1808, pp. 2694-2705; Noble G.T. et al. Ligand-targeted liposome design: challenges and fundamental considerations / Trends in Biotechnology, 2014, V. 32, pp. 32-45]. Комплексы катионных липосом с нуклеиновыми кислотами получили название - липоплексы. Однако главным недостатком липосом является их низкая эффективность трансфекции эукариотических клеток. Катионные липосомы 2X3-DOPE, состоящие из поликатионного амфифила 1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорида [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine / Russ. Chem. Bull., 2010, V. 59, pp. 260-268] и цвиттер-ионного липида 1,2-ди-О-олеоилфосфатидилэтаноламина (DOPE), оказались способны эффективно переносить короткие и протяженные нуклеиновые кислоты [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA / J. Control. Release, 2012, V. 160, pp. 182-193; Markov O.O. et al. Novel cationic liposomes provide highly efficient delivery of DNA and RNA into dendritic cell progenitors and their immature offsets / J. Control. Release, 2012, V. 160, pp. 200-210].
Известно, что использование полиэтиленгликоль (ПЭГ)-содержащих липидов в составе катионных липосом приводит к созданию стерического барьера, предотвращающего адсорбцию белков плазмы крови (опсонинов) на поверхности липосом [Yingchoncharoen P. et al. Lipid-Based Drug Delivery Systems in Cancer Therapy: What Is Available and What Is Yet to Come / Pharmacol. Rev., 2016, V. 68, pp. 701-787]. ПЭГилирование позволяет увеличивать время циркуляции катионных липосом в кровотоке и защищает их от поглощения клетками ретикулоэндотелиальной системы [Suk J.S. et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery / Adv. Drug Deliv. Rev., 2016, V. 99, 28-51]. В некоторых случая использование ПЭГ уменьшает агрегацию эритроцитов и/или гемолиз [Eliyahu Н. et al. Lipoplex-induced hemagglutination: potential involvement in intravenous gene delivery / Gene Therapy, 2002, V. 9, pp. 850-858].
На физико-химические характеристики и биологические свойства ПЭГ-модифицированных катионных липосом влияют такие параметры, как структура ПЭГ-содержащего липида и его молекулярная масса [Xia Y. et al. Effect of surface properties on liposomal siRNA delivery / Biomaterials, 2016, V. 79, pp. 56-68], а также его количественное содержание в составе липосом [Suk J.S. et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery / Adv. Drug Deliv. Rev., 2016, V. 99, pp. 28-51].
Молекулярная масса остатков ПЭГ, используемых для модификации систем доставки нуклеиновых кислот, варьируется от 350 Да до 40 кДа [Mosqueira V.C. et al. Interactions between a macrophage cell line (J774A1) and surface-modified poly (D,L-lactide) nanocapsules bearing poly(ethylene glycol) / J. Drug Target., 1999, V. 7, pp. 65-78; Cui J. et al. Engineering poly (ethylene glycol) particles for improved biodistribution / ACS Nano, 2015, V. 9, pp. 1571-1580], в частности, в составе катионных липосом наиболее часто используется липид с ПЭГ молекулярной массы 2 кДа [Xia Y. et al. Effect of surface properties on liposomal siRNA delivery / Biomaterials, 2016, V. 79, pp. 56-68; Chan C.L. et al. Endosomal escape and transfection efficiency of PEGylated cationic liposome-DNA complexes prepared with an acid-labile PEG-lipid / Biomaterials. 2012, V. 33, pp. 4928-4935; Tagami T. et al. Anti-angiogenic therapy via cationic liposome-mediated systemic siRNA delivery / Int. J. Pharm., 2012, V. 422, pp. 280-289].
Количественное содержание ПЭГ-содержащего липида в составе систем доставки нуклеиновых кислот варьируется от 0,5 до 30% [Gref R. et al. "Stealth" corona-core nanoparticles surface modified by polyethylene glycol (PEG): Influences of the corona (PEG chain length and surface density) and of the core composition on phagocytic uptake and plasma protein adsorption / Colloids and Surfaces, 2000, V. 18, pp. 301-313; Chan C.L. et al. Endosomal escape and transfection efficiency of PEGylated cationic liposome-DNA complexes prepared with an acid-labile PEG-lipid / Biomaterials, 2012, V. 33, pp. 4928-4935; Palchetti S. et al. The protein corona of circulating PEGylated liposomes / Biochim. Biophys. Acta, 2016, V. 1858, pp. 189-196; Mosqueira V.C. et al. Interactions between a macrophage cell line (J774A1) and surface-modified poly (D,L-lactide) nanocapsules bearing poly(ethylene glycol) / J. Drug Target., 1999, V. 7, рр. 65-78]. Для обеспечения наиболее эффективной защиты от взаимодействия с белками сыворотки крови оптимальным является содержание ПЭГ-липида в количестве от 2 до 5% [Gref R. et al. "Stealth " corona-core nanoparticles surface modified by polyethylene glycol (PEG): Influences of the corona (PEG chain length and surface density) and of the core composition on phagocytic uptake and plasma protein adsorption / Colloids and Surfaces, 2000, V. 18, pp. 301-313].
Техническим результатом заявленного изобретения является расширение арсенала средств, способных эффективно доставлять нуклеиновые кислоты в опухолевые клетки in vitro в присутствии сыворотки крови в ростовой среде, а также в клетки мишени in vivo при внутривенном введении в организм животного.
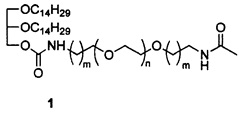
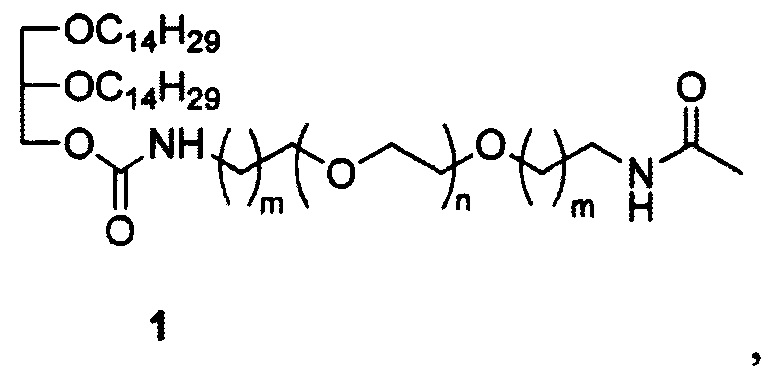
Технический результат достигается ПЭГ-содержащим липидом структуры (1):

где: если m=1, то n=18 или n=32-52, а если m=2, то n=20-46.
Структура ПЭГ-содержащего липида (1) включает дитетрадецилглицерин, необходимый для встраивания в липидный бислой катионных липосом, и остаток полиэтиленгликоля различной молекулярной массы (например, ~750 Да, ~1,5 кДа и ~2,0 кДа), необходимой для защиты липосом от воздействия сыворотки крови и увеличения времени циркуляции в кровотоке. В качестве терминальной группы полиэтиленгликоля выбрана ацетамидная группа. Для присоединения ПЭГ к дитетрадецилглицерину используют биодеградируемый линкер карбамоильного типа.
Технический результат также достигается предлагаемой композицией, которая включает: 1) поликатионный амфифил 1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид (соединение 2X3) в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту, 2) нейтральный фосфолипид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE) в качестве структурообразующего и промотирующего компонента (для структуризации комплексов) и 3) ПЭГ-содержащий липид (1), обеспечивающий защитную функцию.
В одном из вариантов осуществления изобретения композиция содержит: поликатионный амфифил в количестве 25-50 мольных процентов от общего количества липидов в композиции, нейтральный фосфолипид в количестве 25-49,5 мольных процентов от общего количества липидов в композиции и ПЭГ-содержащий липид (1) в количестве 0,5-10 мольных процентов от общего количества липидов композиции.
Технический результат также достигается способом получения предлагаемой композиции для доставки коротких и протяженных нуклеиновых кислот, согласно которому гидратируют в воде липидную пленку, содержащую поликатионный амфифил, нейтральный фосфолипид и ПЭГ-содержащий липид (1), и затем полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке или экструзии.
Исходным соединением в синтезе ПЭГ-содержащего липида (1) являлся 1,2-ди-О-тетрадецил-rac-глицерин (2), из которого было получено его активированное производное - rac-1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерин (3) согласно описанному ранее методу [Shmendel' Е. V. et al. Synthesis of neoglycolipids for the development of non-viral gene delivery systems / Russian Chemical Bulletin, 2010, V. 59, pp. 2281-2289]. Активированный диглицерид (3) вводили во взаимодействие с избытком диаминов - O,O'-бис(2-аминоэтил)октадекаэтиленгликолем, бис(3-аминопропил)полиэтиленгликолем с молекулярной массой ~1500 Да и бис(амино)полиэтиленгликолем с молекулярной массой ~2000 Да - в условиях реакции конденсации в присутствии триэтиламина [Шменделъ Е.В. и др. Синтез фолатсодержащих липоконъюгатов с гидрофобными спейсерными группами / Вестник МИТХТ, 2013, Т. 8, с. 111-113], получая соединение (4). Ацилирование свободной терминальной аминогруппы соединения (4) приводило к целевому соединению (1).
Соединения (2), (3) были получены ранее [Shmendel' Е. V. et al. Synthesis of neoglycolipids for the development of non-viral gene delivery systems / Russian Chemical Bulletin, 2010, V. 59, pp. 2281-2289]. O,O'-Бис(2-аминоэтил)октадекаэтиленгликоль, бис(3-аминопропил)полиэтиленгликоль с молекулярной массой ~1500 Да, бис(амино)полиэтиленгликоль с молекулярной массой -2000 Да были получены от Aldrich. Остальные растворители и реагенты были отечественного производства. Хлористый метилен и триэтиламин кипятили над гидридом кальция и перегоняли перед реакцией. Пиридин кипятили над гидроксидом калия и перегоняли перед реакцией.
Тонкослойную хроматографию проводили на пластинках Kieselgel 60 F254 (Merck). Обнаружение пятен на хроматограммах проводили раствором фосформолибденовая кислота - церий (IV) сульфат с последующим прогреванием и с помощью УФ-лампы (254 нм). Колоночную хроматографию осуществляли на силикагеле Kieselgel 60 (0,040-0,063 мм и 0,063-0,200 мм, Merck). Ионообменную колоночную хроматографию проводили на смоле Dowex Н+.
Спектры ЯМР 1Н и 13С регистрировали на приборах Bruker DPX 300 и Bruker DRX 500 с использованием CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги ЯМР 1Н приведены относительно остаточного сигнала CHCl3 (δH 7.26 м.д.). Химические сдвиги ЯМР 13С приведены относительно центрального сигнала растворителя (δC 77.0 м.д. для растворов в CDCl3). Масс-спектры получали на времяпролетном масс-спектрометре «Bruker Ultraflex» (Германия) методом матриксной лазерно-десорбционной ионизации на матрице с использованием в качестве матрицы 2,5-дигидроксибензойной кислоты, если не указано иное.
Для формирования композиций использовали гидратирование липидной пленки, состоящей из поликатионного амфифила, нейтрального фосфолипида (например, DOPE) и ПЭГ-содержащего липида (1), с последующей ультразвуковой обработкой или экструзией.
Для изучения способности предлагаемой композиции доставлять нуклеиновые кислоты в клетки млекопитающих in vitro использовали протяженную плазмидную ДНК (pEGFP-C2, «Clontech» (Германия)) или короткую 21-звенную двуцепочечную РНК (siPHК, ИХБФМ СО РАН) (последовательность смысловой цепи 5'-GCGCCGAGGUGAAGUUCGATT-3', антисмысловой цепи - 5'-UCGAACUUCACCUCGGCGCGG-3'). Для исследования способности композиции доставлять нуклеиновые кислоты в клетки-мишени in vivo использовали 19-звенную двуцепочечную иммуностимулирующую РНК (исРНК, ИХБФМ СО РАН) с 3-х нуклеотидными выступающими 3'-концами [патент RU 2391405 С1, опубл. 10.06.2010] (последовательность цепи 1: 5'-GUGUCAGGCUUUCAGAUUUUUU-3'; цепи 2: 5'-AAAUCUGAAAGCCUGACACUUA-3').
Для формирования комплексов нуклеиновых кислот с предлагаемой композицией инкубировали аликвоты растворов нуклеиновых кислот и композиции, рассчитанные в соответствии с соотношением положительных зарядов аминогрупп поликатионного амфифила (N) к отрицательным зарядам фосфатных групп (Р) нуклеиновых кислот (соотношения N/P=4/1-8/1).
Эффективность проникновения нуклеиновых кислот с использованием липосомальной композиции в клетки млекопитающих in vitro была исследована в экспериментах по трансфекции клеток HEK293 плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (EGFP), а также по трансфекции трансгенных клеток BHK IR780, стабильно экспрессирующих EGFP, siPHК, направленной на подавление синтеза EGFP. Эффективность доставки иммуностимулирующей РНК с использованием липосомальной композиции в клетки-мишени in vivo была исследована в экспериментах по определению уровня интерферона-α (ИФН-α) и цитокинов воспаления интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α) в сыворотке крови мышей через 6 ч после внутривенного введения.
Сопоставительный анализ заявляемой липосомальной композиции с известными и широко используемыми трансфектантами, такими как Lipofectamine®2000 и композицией 2X3:DOPE [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA / J. Control. Release, 2012, V. 160, pp. 182-193] показал, что ПЭГ-содержащий липид (1) и липосомальная композиция на его основе обладают следующими преимуществами:
1) Заявляемая композиция с высокой эффективностью доставляет как in vitro, так и in vivo в клетки млекопитающих протяженные и короткие нуклеиновые кислоты, что позволяет рассматривать ее в качестве перспективного средства доставки терапевтических нуклеиновых кислот в эукариотические клетки.
2) Заявляемая композиция не требуют сложной процедуры приготовления, для получения рабочего раствора достаточно подвергнуть ультразвуковой обработке или экструзии гидратированную липидную пленку, состоящую из поликатионного амфифила, нейтрального фосфолипида (например, DOPE) и ПЭГ-содержащего липида (1).
3) Заявляемая композиция стабильна при хранении, как в сухом виде, так и в виде водных формуляций.
4) Заявляемая композиция превосходит известные аналоги по эффективности трансфекции в эукариотические клетки.
Поиск по источникам научно-технической и патентной литературы показал, что заявляемое соединение, композиция на его основе и способ ее получения в известных из уровня техники источниках не описаны.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез ПЭГ-содержащего липида (1).
К раствору 1,2-ди-О-тетрадецил-rac-глицерина (2) (2,42 г, 4,99 ммоль) в безводном хлористом метилене (20 мл) добавили по каплям безводный триэтиламин (1,4 мл) и раствор 4-нитрофенилхлорформиата (1,55 г, 7,69 ммоль) в безводном хлористом метилене (20 мл). Реакционную смесь перемешивали 11 ч при 24°C, промывали 3% водн. хлористоводородной кислоты (20 мл), насыщенным раствором хлорида натрия (3×20 мл) до рН=7. Органический слой сушили сульфатом натрия, фильтровали, упаривали в вакууме. Продукт выделяли колоночной хроматографией, элюируя толуолом. Получили 3,11 г (96%) rac-1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерина (3) в виде кристаллизующегося масла.
К раствору rac-1-O-(4-нитрофенилоксикарбонил)-2,3-ди-O-тетрадецилглицерина (3) (0,171 ммоль) в безводном хлористом метилене (3 мл) был добавлен раствор диамина (0,343 ммоль) - O,O'-бис(2-аминоэтил)октадекаэтиленгликоля или бис(3-аминопропил)полиэтиленгликоля с молекулярной массой ~1500 Да или бис(амино)полиэтиленгликоля с молекулярной массой ~2000 Да - в безводном хлористом метилене (4 мл) и безводном триэтиламине (96 мкл). Реакционную смесь перемешивали 1 ч при 24°C, затем промывали 3% водн. хлористоводородной кислоты (до рН=4), водой до рН=7. Органический слой сушили сульфатом натрия, фильтровали, растворители удалили в вакууме. Продукт (4) выделяли колоночной хроматографией, элюируя смесью хлороформ-метанол 15:1, с увеличением полярности до 10:1. Получили от 20 до 51% соединения (4) в виде кристаллизующегося масла.
Безводный пиридин (50 мкл) и уксусный ангидрид (50 мкл) были добавлены к раствору соединения (4) в безводном хлористом метилене (2 мл). Реакционную смесь перемешивали 6 ч при 24°C, растворители удалили в вакууме. Продукт выделили с помощью ионообменной колоночной хроматографии, элюируя метанолом, с увеличением полярности метанол-водный раствор аммиака 5:1. Соединение (1) было получено с выходом 77-88% в виде белого кристаллизующегося масла.
Соединение (1), где n=18: 1H ЯМР (300 МГц, CDCl3, δ): 0.81 (т, J=6.7 Гц, 6Н, 2(СН2)11Ме); 1.10-1.29 (м, 44Н, 2(CH2)11Ме); 1.44-1.57 (м, 4Н, 2OCH2CH2); 1-91 (с, 3H, CH3COO); 3.25-3.68 (м, 86Н, 2NHCH2, CH2(OCH2CH2)18OCH2, 2OCH2CH2, ОСН2СНО); 3.68-3.77 (м, 1Н, OCH2CHO); 4.02 (дд, J=5.4 Гц, J=11.4 Гц, 1H) и 4.07-4.15 (м, 1Н, СН2ОС(O)); 5.21-5.30 (м, 1H, NHCH2); 6.46-6.56 (м, 1Н, NH). 13С ЯМР (125 МГц, CDCl3, δ): 14.04, 22.61, 25.99, 26.04, 29.28, 29.43, 29.58, 29.61, 29.98, 31.85, 39.26, 40.82, 69.80, 70.02, 70.14, 70.27, 70.51, 71.71, 170.28. Масс-спектр MALDI, m/z: [М]+ вычислено для C74H148N2O24, 1449.042; найдено: 1449.781.
Соединение 1, где n=20-46: 1Н ЯМР (300 МГц, CDCl3, δ): 0.81 (т, J=6.7 Гц, 6Н, 2(СН2)11Ме,); 1.13-1.29 (м, 44Н, 2(СН2)11Ме); 1.43-1.52 (м, 4Н, 2OCH2CH2); 1.66-1.75 (м, 4Н, 2NHCH2CH2); 1.88 (с, 3Н, СН3СОО); 3.17-3.25 (м, 2Н, NHCH2); 3.26-3.32 (м, 2Н, NHCH2); 3.33-3.63 (м, 142Н, СН2(ОСН2СН2)33ОСН2, 2OCH2CH2, ОСН2СНО); 3.69-3.73 (м, 1Н, ОСН2СНО); 4.01 (дд, J=5.2, J=11.5, 1 Н) и 4.06-4.14 (м, 1 Н, СН2ОС(O)); 5.07-5.14 (м, 1H, NHCH2); 6.26-6.35 (м, 1H, NHCH2). Масс-спектр MALDI, m/z: [М+Н]+ вычислено для C106H213N2O39, 2138.475; найдено: 2138.272.
Соединение 1, где n=32-52: 1Н ЯМР (300 МГц, CDCl3:CD3OD, 6:1, δ): 0.81 (т, J=6.7 Гц, 6Н, 2(СН2)11Ме,); 1.12-1.32 (м, 44Н, 2(СН2)11Ме); 1.44-1.55 (м, 4Н, 2OCH2CH2); 1.91 (с, 3Н, CH3COO); 3.21-3.68 (м, 182Н, 2NHCH2, СН2(ОСН2СН2)42ОСН2, 2OCH2CH2, ОСН2СНО); 3.68-3.74 (м, 1Н, ОСН2СНО); 4.01 (дд, J=5.4, J=11.6, 1 Н) и 4.06-4.13 (м, 1 Н, СН2ОС(О)). 13С ЯМР (125 МГц, CDCl3): 13.84, 22.36, 22.52, 25.94, 29.20, 29.35, 29.50, 29.54, 31.78, 39.20, 69.53, 69.93, 70.33, 71.71, 109.20, 160.10. Масс-спектр MALDI, m/z: [М+Н]+ вычислено для C122H245N2O48, 2506.679; найдено: 2506.662.
Пример 2. Получение композиции Р800, Р1500, Р2000.
Катионный амфифил 2X3 [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine / Russ. Chem. Bull., 2010, V. 59, pp. 260-268], нейтральный фосфолипид DOPE и ПЭГ-содержащий липид (1) в подходящем органическом растворителе упаривали в вакууме до образования липидной пленки. Полученную липидную пленку гидратировали в необходимом количестве автоклавированной деионизированной воды в течение 5 часов, а затем озвучивали на ультразвуковой бане до получения однородной композиции. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор 50-200 нм. Были получены композиции Р800 (когда в ПЭГ-содержащем липиде (1) n=18), Р1500 (когда в ПЭГ-содержащем липиде (1) n=20-46) и Р2000 (когда в ПЭГ-содержащем липиде (1) n=32-52).
Пример 3. Трансфекция клеток HEK 293 плазмидной ДНК с использованием композиций Р800, Р1500, Р2000.
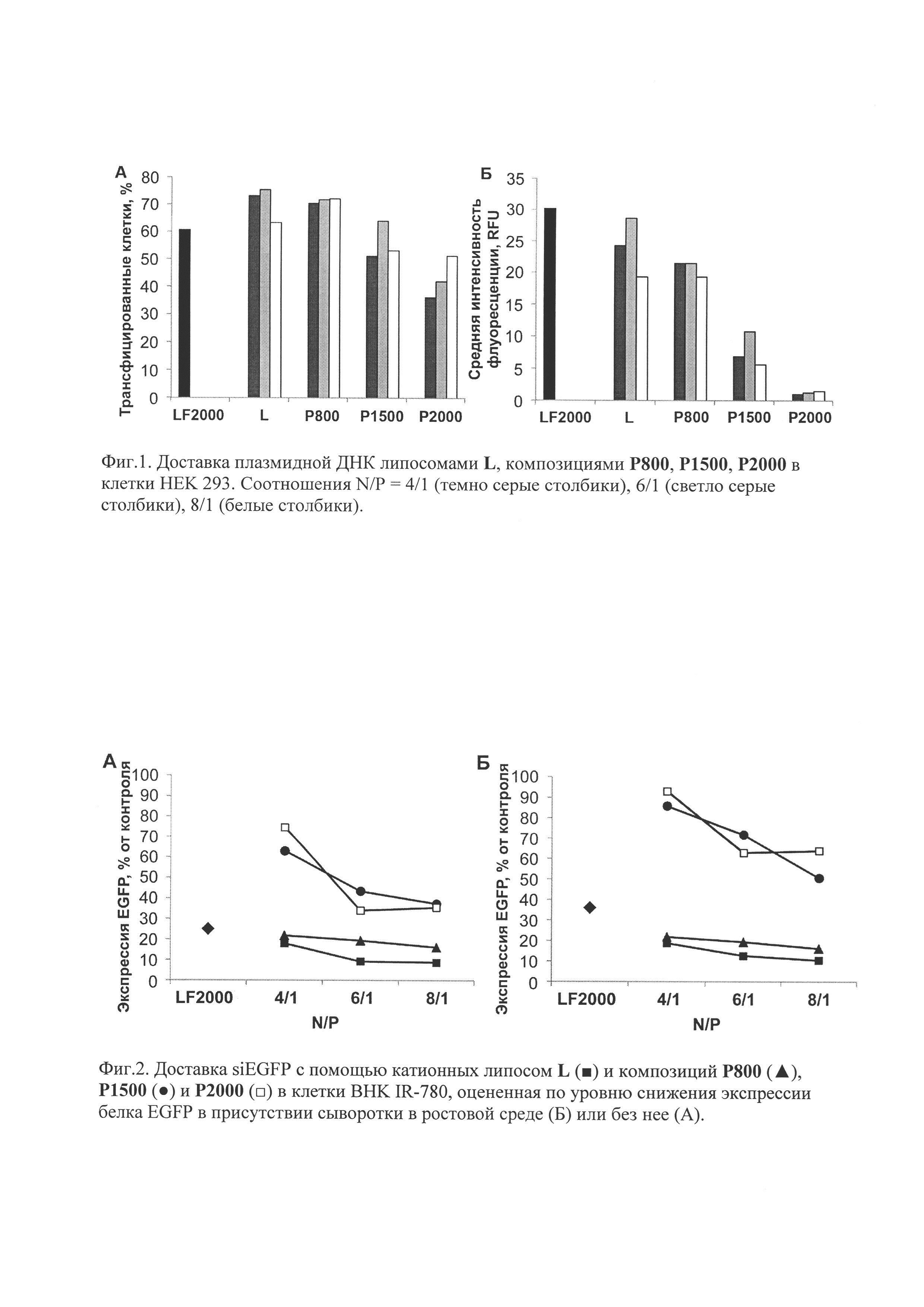
Исследование доставки плазмидной ДНК в клетки HEK 293 проводили с помощью проточной цитофлуориметрии. Эффективность трансфекции оценивали по количеству клеток, содержащих зеленый флуоресцентный белок (EGFP) от общего количества клеток в образце. Клетки HEK 293 высаживали в 24-луночные планшеты (1×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой (FBS)) и культивировали в течение суток при 37°C в атмосфере, содержащей 5% CO2. Перед проведением трансфекции среду в лунках заменяли на 200 мкл среды DMEM с 10% FBS. Композицию Р800, или Р1500, или Р2000 в 25 мкл среды OptiMEM смешивали с раствором pEGFP-C2 (0,5 мкг на лунку) в 25 мкл этой же среды при соотношении N/P=4/1 (темно серые столбики), 6/1 (светло серые столбики) или 8/1 (белые столбики) и инкубировали 20 мин при 25°C. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°C в атмосфере, содержащей 5% CO2, затем заменяли среду на 500 мкл DMEM с 10% FBS. Через 48 ч клетки промывали фосфатно-солевым буфером (PBS) (300 мкл), добавляли 40 мкл раствора трипсина и инкубировали 2 мин (37°C, 5% CO2). По окончании инкубации в лунки добавляли 400 мкл DMEM с 10% FBS, клетки суспендировали и переносили в пробирки. Полученную клеточную суспензию центрифугировали при 1200 об/мин в течение 10 мин, отбирали среду и промывали 500 мкл PBS. Затем клетки фиксировали в 600 мкл 2% раствора формальдегида в PBS. Анализ уровня трансфекции клеток проводили на флуоцитометре ACEA NovoCyte™ 3000 (Bioscience Inc., USA). В этих экспериментах определяли количество клеток (фиг. 1А), экспрессирующих белок EGFP, и средний уровень флуоресценции клеток (фиг. 1Б), при длине волны возбуждения 488 нм. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 (Invitrogene) и липосомы 2X3-DOPE (L) [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA / J. Control. Release, 2012, V. 160, pp. 182-193].
Результаты трансфекции клеток плазмидной ДНК pEGFP-C2 в присутствии FBS в ростовой среде представлены на фиг. 1.
Пример 4. Трансфекция клеток BHK IR-780 короткой интерферирующей РНК с использованием предлагаемых композиций.
Исследование проникновения siPHК, направленной на подавление синтеза зеленого флуоресцирующего белка EGFP, проводили на клетках линии BHK IR-780, стабильно экспрессирующих данный белок. В качестве мишени была выбрана мРНК EGFP, таким образом по уменьшению флуоресценции клеток, определяемой этим белком, можно судить об эффективности доставки siPHК в цитоплазму клетки.
Клетки BHK IR-780 высаживали в 24-луночные планшеты (0,13×105 клеток на лунку в 500 мкл среды DMEM с 10% FBS) и культивировали в течение суток при 37°C в атмосфере, содержащей 5% CO2. Перед проведением трансфекции для экспериментов в присутствии сыворотки (фиг. 2Б) или в отсутствии сыворотки (фиг. 2А) среду в лунках заменяли на 200 мкл среды DMEM с 10% FBS или без нее, соответственно. Композиции Р800 (фиг. 2, ( )), Р1500 (фиг. 2, (
)), Р1500 (фиг. 2, ( )) или Р2000 (фиг. 2, (
)) или Р2000 (фиг. 2, ( )) в 25 мкл среды OptiMEM смешивали с раствором siPHК (конечная концентрация siPHК 50 нМ) в 25 мкл этой же среды при соотношениях N/P=4/1, 6/1 или 8/1 и инкубировали 20 мин при 25°C. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°C в атмосфере, содержащей 5% CO2, затем заменяли среду на 500 мкл DMEM с 10% FBS. Через 72 ч клетки обрабатывали, как описано в примере 5. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 (фиг. 2, (
)) в 25 мкл среды OptiMEM смешивали с раствором siPHК (конечная концентрация siPHК 50 нМ) в 25 мкл этой же среды при соотношениях N/P=4/1, 6/1 или 8/1 и инкубировали 20 мин при 25°C. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°C в атмосфере, содержащей 5% CO2, затем заменяли среду на 500 мкл DMEM с 10% FBS. Через 72 ч клетки обрабатывали, как описано в примере 5. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 (фиг. 2, ( )) и липосомы 2X3:DOPE (L - фиг. 2, (
)) и липосомы 2X3:DOPE (L - фиг. 2, ( )). Результаты по трансфекции клеток короткой интерферирующей РНК с липосомальными композициями в присутствии сыворотки в ростовой среде (Б) или без нее (А), определенные по уровню снижения экспрессии белка EGFP представлены на фиг. 2.
)). Результаты по трансфекции клеток короткой интерферирующей РНК с липосомальными композициями в присутствии сыворотки в ростовой среде (Б) или без нее (А), определенные по уровню снижения экспрессии белка EGFP представлены на фиг. 2.
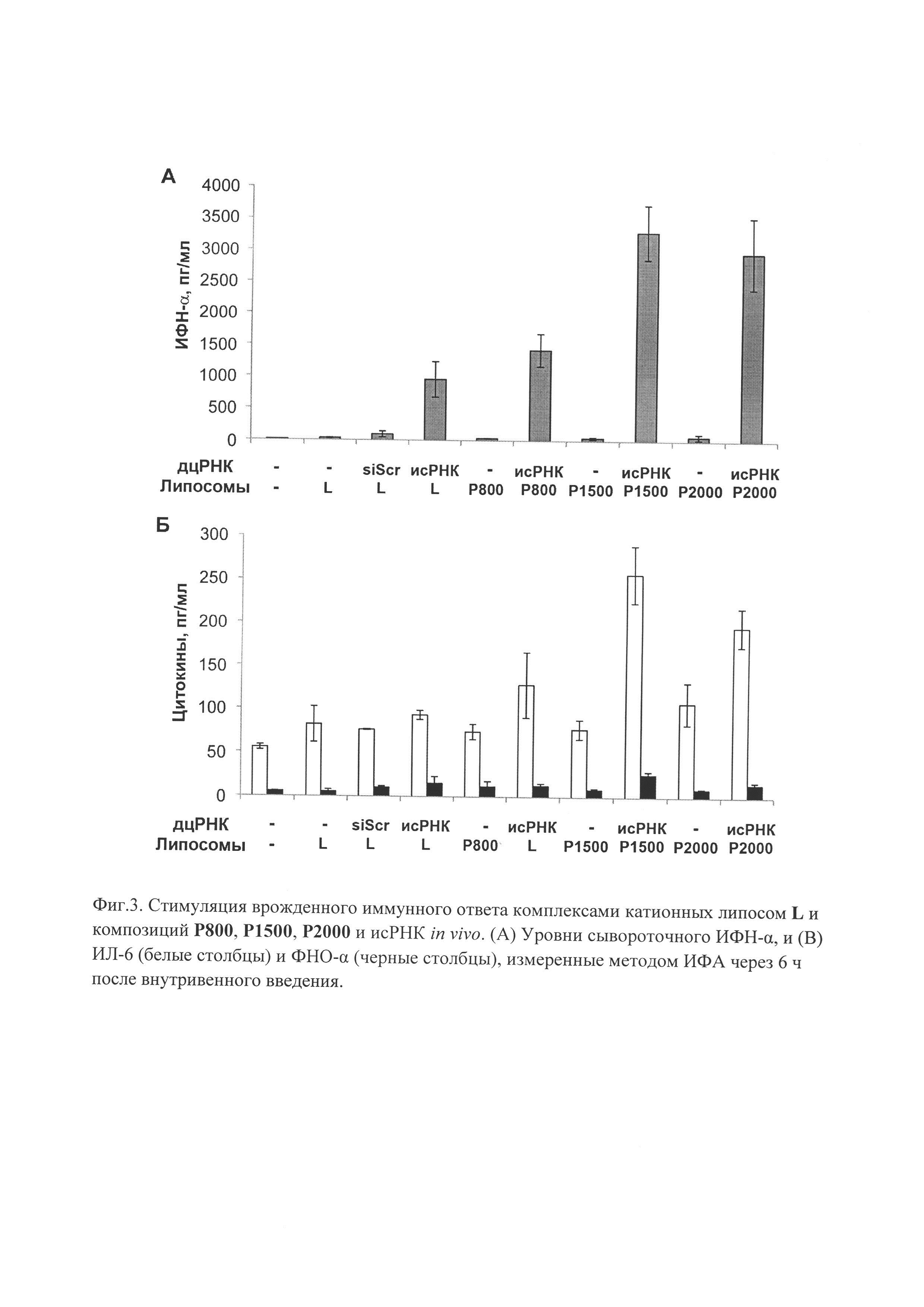
Пример 5. Анализ уровня цитокинов в сыворотке крови мышей.
Все процедуры на животных проводили в соответствии с протоколами, утвержденными Биоэтическим комитетом СО РАН, и рекомендациями по правильному использованию и уходу за лабораторными животными (European Communities Council Directive 86/609/CEE). В работе использовали 10-14-недельных самцов мышей линии CBA/LacSto со средним весом 23-27 г разведения вивария ИЦиГ СО РАН. Животных содержали по 8-10 особей в клетке при естественном освещении. Мыши имели свободный доступ к еде и воде. Мышам внутривенно вводили препараты исРНК в количестве 0,5 мкг/г в комплексе с липосомами L или композицией Р800, Р1500 или Р2000 при соотношении N/P=4/1 в 200 мкл OptiMEM. Через 6 часов осуществляли забор крови у мышей путем декапитации. Для получения сыворотки пробирки с кровью инкубировали при 37°C в течение 30 мин для образования сгустка крови. Сгусток отделяли от стенок пробирки и удаляли. Сыворотку центрифугировали при 300 G, супернатант переносили в лунки 96-луночного планшета. Концентрации ИФН-α (фиг. 3А), ФНО-α (фиг. 3Б, черные столбцы) и ИЛ-6 (фиг. 3Б, белые столбцы) в сыворотке крови мышей определяли с помощью иммуноферментного анализа как описано в протоколе производителя («BD Biosciences», США). Было проведено три независимых эксперимента, образцы измерялись в дубликатах. В качестве контроля специфичности использовали РНК сходную по структуре с исРНК, но случайной последовательности (siScr).
Результаты уровня цитокинов в сыворотке крови мышей представлены на фиг. 3.
Таким образом, приведенные примеры однозначно указывают на способность предлагаемой липосомальной композиции, состоящей из поликатионного амфифила, нейтрального фосфолипида и ПЭГ-содержащего липида (1), способствовать эффективному проникновению коротких и протяженных нуклеиновых кислот в клетки млекопитающих в присутствии сыворотки крови in vitro, а также усиливать интерфероногенную активность исРНК при ее доставке in vivo, что позволяет использовать их в качестве агентов для доставки нуклеиновых кислот в клетки млекопитающих в условиях как in vitro, так и in vivo.