Результат интеллектуальной деятельности: СПОСОБ ОТДЕЛЕНИЯ ТРИТИЕВОЙ ВОДЫ ОТ ЛЕГКОЙ ВОДЫ
Вид РИД
Изобретение
Область изобретения
[0001] Настоящее изобретение относится к способу отделения тритиевой воды от легкой воды.
Предпосылки изобретения
[0002] Большинство радиоактивных нуклидов в загрязненной воде, хранящейся на атомной электростанции Фукусима Дайичи компании Tokyo Electric Power Company, удаляются обработкой в системе ALPS и соосаждением с соединениями железа, и поэтому радиоактивным нуклидом, который остается в загрязненной воде с концентрацией выше регламентированной концентрации, когда загрязненную воду выпускают в систему коммунального водоснабжения, является только тритий, который присутствует в виде тритиевой воды (HTO).
[0003] Концентрация трития в загрязненной воде составляет от 0,6 до 5×106 Бк/л, а объем загрязненной воды каждый день возрастает на 400 м3/день. Таким образом, существует потребность в разработке технологии удаления трития, которая может снижать концентрацию трития в загрязненной воде по меньшей мере до допустимой для выпуска в окружающую среду концентрации 6×104 Бк/л или менее (концентрация трития в морской воде составляет от 1 до 3 Бк/л) и имеет производительность обработки более 400 м3/день.
[0004] Поскольку удельная активность трития (Т) составляет 3,59×1014 Бк/г, концентрация тритиевой воды в загрязненной воде является крайне низкой из расчета от 1,86 до 9,29×10-8 г/л, но желательно удалить приблизительно 99% или более тритиевой воды.
[0005] Концепция отделения тяжелой воды от легкой воды с использованием разности в температурах кристаллизации газогидратов между тяжелой водой и легкой водой уже известна (патентный документ 1). Однако концентрация тритиевой воды в загрязненной воде является крайне низкой, как описано выше, и когда желательно кристаллизовать газогидрат, содержащий тритиевую воду, но не содержащий легкую воду, концентрация является слишком низкой для формирования критических зародышей, даже если может быть сформирован их прекурсор, и тем самым невозможно на практике закристаллизовать тритиевую воду.
[0006] Хотя существуют многочисленные предложения по отделению газогидрата от жидкой фазы флотационным или седиментационным разделением с использованием различия в их удельной плотности для разделения жидкой фазы и кристаллов газогидрата (непатентные документы 1 и 2), в случае отделения тритиевой воды от легкой воды невозможно в достаточной мере разделить их только посредством гравитационных сил вследствие очень малой разницы в удельной плотности, хотя эффективность разделения может зависеть от используемого газа и от типа формируемой структуры гидрата.
[0007] Хотя может быть применен способ разделения центрифугированием, это непрактично, так как требует высокоскоростной и длительной операции разделения вследствие малого диаметра частиц кристаллов газогидрата.
[0008] В вышеуказанных обстоятельствах в настоящее время нет выполнимого в промышленном масштабе способа отделения тритиевой воды от легкой воды.
Список цитированной литературы
[0009] Патентная литература
[Патентный документ 1] JP-A № 2005-139015
[0010] Непатентная литература
[Непатентный документ 1] Susumu Saito, "Gas hydrate method", Bulletin of the Society of Sea Water Science, Japan, том 22, № 1 (1968), стр. 114-124
[Непатентный документ 2] Toshio Nishimoto, Toshio Hashimoto, и Nobuo Okabayashi, "Concentration of sea water and brine by gas hydrate method", № 17, Scientific papers of Hofu Salt Experiment Station, Japan Monopoly Corporation, 22 (1969), стр. 71-78
Сущность изобретения
Техническая проблема
[0011] Задача настоящего изобретения состоит в создании выполнимого в промышленном масштабе способа отделения тритиевой воды от легкой воды.
Решение проблемы
[0012] Настоящее изобретение относится к способу отделения тритиевой воды от легкой воды, включающему в себя:
этап удаления тритиевой воды и тяжелой воды из легкой воды посредством добавления тяжелой воды к жидкостной смеси, содержащей тритиевую воду и легкую воду,
посредством преобразования в газогидрат, состоящий по существу из тритиевой воды и тяжелой воды как кристаллической структуры, при условии преобразования в газогидрат по меньшей мере одной из тяжелой воды и тритиевой воды, и в то же время удерживания легкой воды в жидком состоянии, и
этап, отделения тритиевой воды от тяжелой воды
посредством разрушения структуры газогидрата, содержащего тритиевую воду и тяжелую воду, так чтобы получить жидкостную смесь,
посредством преобразования жидкостной смеси, содержащей тритиевую воду и тяжелую воду, в газогидрат, содержащий тритиевую воду в кристаллической структуре, при условии преобразования в газогидрат, содержащий тритиевую воду в кристаллической структуре, и в то же время удерживания тяжелой воды в жидком состоянии, а затем
посредством разрушения структуры газогидрата тритиевой воды, так чтобы собрать тритиевую воду, в этом порядке.
[0013] В способе отделения тритиевой воды от легкой воды согласно настоящему изобретению жидкостная смесь, содержащая тритиевую воду и тяжелую воду, полученная разрушением газогидрата, содержащего тритиевую воду и тяжелую воду в кристаллической структуре, может быть многократно перекристаллизована для удаления или уменьшения количества легкой воды, содержащейся в газогидрате, а затем жидкостная смесь, содержащая тритиевую воду и тяжелую воду, может быть преобразована в газогидрат тритиевой воды при условии преобразования в газогидрат тритиевой воды и вместе с тем удерживания тяжелой воды в жидком состоянии.
Выгодные эффекты изобретения
[0014] Согласно настоящему изобретению возможно многократное применение тяжелой воды и промышленное отделение тритиевой воды от легкой воды. Выделенный из воды тритий может быть использован в сверхмалом реакторе, разработанном фирмой Lockheed Martin Corporation, который, как утверждается, генерирует энергии приблизительно в 10000000 раз больше, чем было бы получено из такого же количества ископаемого топлива, с использованием реакции ядерного синтеза с тяжелой водой.
Краткое описание чертежей
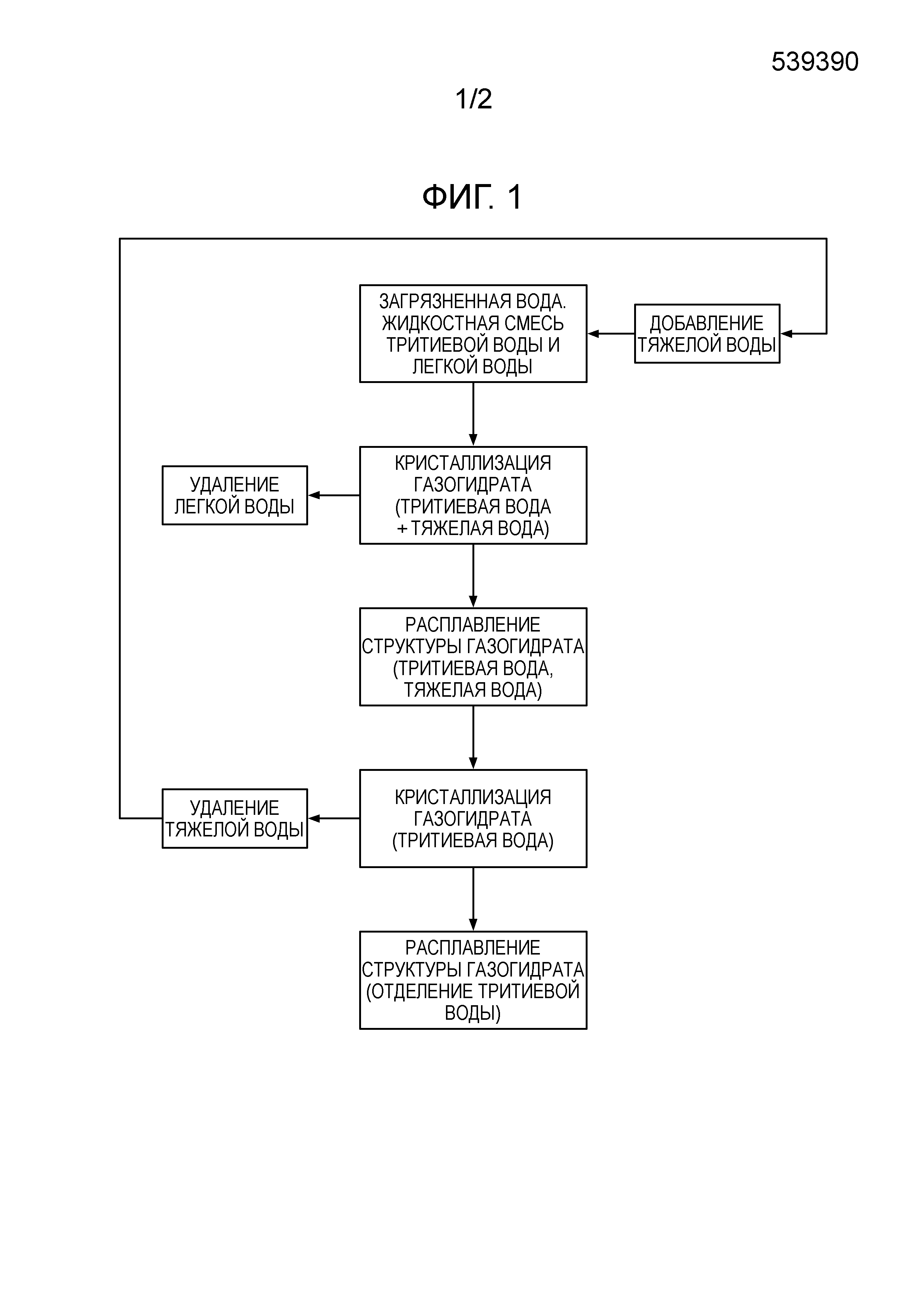
[0015] Фигура 1 представляет собой схему, показывающую последовательность операций способа согласно настоящему изобретению.
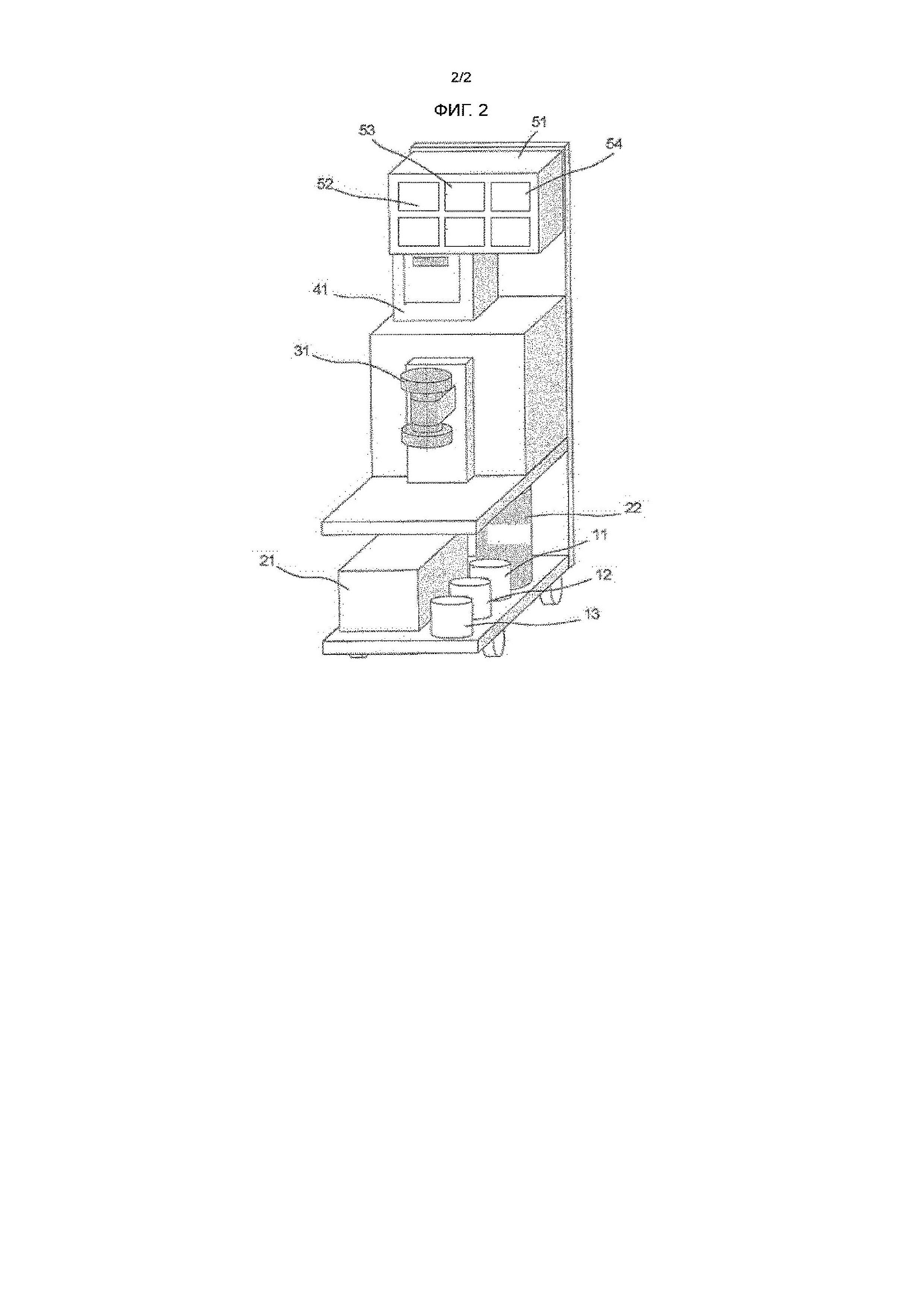
Фигура 2 представляет схематический вид устройства в варианте осуществления настоящего изобретения.
Описание вариантов осуществления изобретения
<1. Способ отделения тритиевой воды от легкой воды>
[0016] Способ отделения тритиевой воды от загрязненной воды согласно настоящему изобретению показан на Фигуре 1.
[0017] Сначала к жидкостной смеси, содержащей тритиевую воду и легкую воду, добавляют тяжелую воду. Таким образом, смешивают тритиевую воду, легкую воду и тяжелую воду.
Жидкостная смесь, содержащая тритиевую воду и легкую воду, представляет собой, так называемую загрязненную воду, которая может содержать дополнительные компоненты, иные, нежели тритиевая вода и легкая вода. Тяжелая вода представляет собой по меньшей мере одну из D2O и DOH.
Поскольку газогидрат тяжелой воды подобен газогидрату тритиевой воды по структуре, количество тяжелой воды, добавляемой к загрязненной воде, представляет собой количество, при котором газогидрат тяжелой воды действует как затравочный кристалл, и газогидрат тритиевой воды кристаллизуется в виде смеси с газогидратом тяжелой воды. Например, оно составляет величину приблизительно в 104 раз большую, чем концентрация трития в загрязненной воде. В этом случае, поскольку концентрация трития в загрязненной воде составляет от 1,86 до 9,29×10-8 г/л, как было описано выше, количество добавляемой тяжелой воды составляет приблизительно от 0,01 до 50 мас.% от количества загрязненной воды.
[0018] После добавления тяжелой воды тритиевую воду и тяжелую воду в загрязненной воде преобразуют в газогидрат при условии, где обе или одна из тяжелой воды и тритиевой воды преобразуется в газогидрат, а легкая вода все еще остается в жидком состоянии.
[0019] Условие, где по меньшей мере одна из тяжелой воды и тритиевой воды преобразуется в газогидрат, варьируют согласно типу используемой молекулы-гостя, а также кристаллической структуры образующегося газогидрата. Например, в случае, где структура газогидрата тяжелой воды включает типы I и II, условие устанавливают на температуру и давление между квадрупольной точкой (Q1) гидратной фазы, фазы льда, водной фазы тяжелой воды и газовой фазы молекулы-гостя и квадрупольной точкой (Q2) гидратной фазы и водной фазы, и газовой фазы, и жидкой фазы молекулы-гостя.
[0020] Молекула-гость газогидрата отдельно не ограничивается и может быть обычно применяемой молекулой. Ее примеры включают CH2F2 (HFC-32), Ar, Kr, N2, O2, Xe, H2S, CH4, CO2, C2H4, C2H6, C3H6, C3H8, C4H10, газообразные фреоны, тетрагидрофуран (THF), ацетон и тому подобные.
[0021] В частности, предпочтительным является CH2F2 (дифторметан), газ, называемый HFC-32, который будет описан ниже в Примерах. Также предпочтителен пропан.
[0022] Существенным отличием от общепринятых способов преобразования в газогидрат является то, что при преобразовании смеси в газогидрат в переохлажденном состоянии ниже точки Q1, как в распространенном преобразовании газогидрата, легкая вода также может быть закристаллизована в процессе преобразования тяжелой воды в газогидрат, поскольку условие преобразования в газогидрат тяжелой воды подобны условию для легкой воды. Однако значение Q1 для легкой воды составляет 0°С при атмосферном давлении, тогда как для тяжелой воды составляет 3,82°С. Разница приблизительно в 4°С делает возможным преобразование тяжелой воды в газогидрат, в то же время удерживая легкую воду в жидком состоянии.
[0023] Чтобы сократить число молекул газов за исключением молекулы-гостя, перед преобразованием в газогидрат необходимо удалять газы, содержащиеся в легкой воде и в тяжелой воде, такие как воздух, кислород, газообразный диоксид углерода. Средство удаления отдельно не ограничивается , и обычно используют вакуумный насос. Затем смешивают молекулу-гость с легкой водой и тяжелой водой. Средство смешения отдельно не ограничивается , и обычно применяют способ барботирования газа. Затем, после этих обработок смесь преобразуют в газогидрат. Кроме того, HFC-32, используемый в качестве молекулы-гостя, который более растворим в воде, может ускорять преобразование в газогидрат.
[0024] Однако, если смесь преобразуют в газогидрат в переохлажденном состоянии ниже Q1, как в обычном процессе преобразования в газогидрат, легкая вода тоже преобразуется в газогидрат. Поэтому применяется процесс описанный ниже. Когда повышают давление газа, в то время как температуру поддерживают в диапазоне, в котором легкая вода не переходит в твердое состояние, то в момент времени, когда по меньшей мере одна из тяжелой воды и тритиевой воды кристаллизуется, по меньшей мере одна из тяжелой воды и тритиевой воды начинает преобразовываться в газогидрат в тот же момент времени, приводя к снижению давления газа. Затем, используется способ повышения давления газа, так что газ может быть восполнен. Само собой разумеется, что необходимо регулировать температуру в диапазоне между Q1 и Q2, поскольку во время преобразования в газогидрат выделяется тепло.
[0025] Полученный таким образом газогидрат, что включает в себя случай, когда газогидрат получается в условии преобразования в газогидрат тяжелой воды, содержит твердое вещество, преобразованное в газогидрат как тритиевой воды, так и тяжелой воды. В этом случае кристаллическая структура газогидрата состоит по существу из тритиевой воды и тяжелой воды, и кристаллический газогидрат дополнительно включает небольшое количество легкой воды, но он может быть легко отделен от легкой воды, которая присутствует в основном в жидком состоянии, известными методами разделения твердой и жидкой фаз, такими как фильтрование или центрифугирование. Подобным образом, когда первоначально в газогидрат преобразуется тритиевая вода, в газогидрат преобразуется и тяжелая вода. В случае загрязненной воды кристаллическая структура закристаллизованного таким образом газогидрата содержит закристаллизованную тритиевую воду в количестве приблизительно 0,01 мас.% в расчете на кристаллическую структуру тяжелой воды. Хотя кристаллический газогидрат отделяют от большого объема легкой воды, он все еще содержит легкую воду, включенную в кристалл.
[0026] Затем разрушают кристаллическую структуру газогидрата, состоящую по существу из тритиевой воды и тяжелой воды. Он может быть расплавлен в результате изменения по меньшей мере одного из температуры или давления в кристалле газогидрата от условия преобразования в газогидрат в направлении ослабления сил связывания гидрата. Более конкретно, кристаллический газогидрат расплавляют при по меньшей мере одном из нагревания или пониженного давления. Этим путем можно отделить как тритиевую воду, так и тяжелую воду от жидкости из большого объема легкой воды. В результате этого получается жидкостная смесь, содержащая тяжелую воду и тритиевую воду, и дополнительно небольшое количество легкой воды.
[0027] Небольшое количество легкой воды, содержащееся в газогидрате, может быть оставлено как есть, но предпочтительно может быть сокращено. В качестве способа для этого предпочтительна перекристаллизация. В этом способе используется тот факт, что, когда многократно повторяют этот процесс перекристаллизации содержащей тритиевую воду и тяжелую воду жидкостной смеси, полученной разрушением газогидрата, содержащего как тритиевую воду, так и тяжелую воду в кристаллической структуре, газогидраты, выросшие до определенного размера, остаются без разрушения, но те из них, которые являются меньшими по размеру, разрушаются и перекристаллизовываются в процессе, легкая вода, которая почти не кристаллизуется, остается в жидком состоянии, но при этом тритиевая вода и тяжелая вода, которые легко кристаллизуются, преобразуются в газогидрат. Условием преобразования в газогидрат во время перекристаллизации может быть состояние переохлаждения, более холодное, чем условие преобразования в газогидрат между Q1 и Q2. Подробности будут описаны ниже.
[0028] Полученную таким образом жидкостную смесь, включающую тритиевую воду и тяжелую воду, преобразуют в газогидрат в условиях преобразования тритиевой воды в газогидрат, но при этом оставляя тяжелую воду в жидком состоянии. Базовая концепция этого процесса преобразования газогидрата является такой же, как для описанного выше фазового превращения газогидрата. Q1 тяжелой воды составляет 3,82°С, тогда как Q1 тритиевой воды составляет 4,49°С при атмосферном давлении. Хотя разница не столь велика, можно стимулировать преобразование тритиевой воды в газогидрат, оставляя при этом тяжелую воду в жидком состоянии, если надлежащим образом регулировать температуру. Таким образом, тритиевая вода также может быть отделена от тяжелой воды. Тяжелая вода может быть использована многократно.
<2. Устройство для отделения тритиевой воды от легкой воды>
[0029] В качестве устройства для кристаллизации газогидрата как тяжелой воды, так и тритиевой воды или тритиевой воды способом согласно настоящему изобретению применяется известное устройство. Например, применяется устройство, имеющее реакционный резервуар для кристаллизации, циркуляционный трубопровод, размещенный снаружи реакционного резервуара и соединяющий верхнюю часть с днищем реакционного резервуара, и насос, подающий содержимое реакционного резервуара вверх от днища к верхней части и размещенный в промежуточном участке трубопровода. Температура в трубопроводе отдельно не ограничивается , если она выше, чем температура кристаллизации, но обычно ее устанавливают незначительно выше, чем температура в реакционном резервуаре. Кристаллы газогидрата в реакционном резервуаре задерживаются, когда они вырастают до более крупного размера, чем величина пор фильтра, а кристаллы меньше, чем поры фильтра возвращаются в реакционный резервуар, поскольку они расплавляются во время циркуляции в трубопроводе, и перекристаллизовываются в нем. Кристаллы газогидрата удерживаются в процессе роста механически в реакционном резервуаре. После того, как кристаллы вырастают до определенного размера, циркуляция жидкой фазы затрудняется, и возрастает перепад давлений на насосе. Возможно отделение кристаллов гидрата от жидкой фазы удалением жидкой фазы в реакционном резервуаре на этой стадии.
[0030] Пример применяемого в настоящем изобретении разделительного устройства показан в Фигуре 2.
[0031] Оно имеет резервуар 11 для загрязненной воды, содержащий загрязненную воду, подлежащую обработке, резервуар 12 для тяжелой воды и резервуар 13 для легкой воды. Хотя это не показано на Фигуре, с каждым из резервуара 11 для загрязненной воды и резервуара 12 для тяжелой воды соединен вакуумный насос для удаления растворенных газов. Резервуар 12 для тяжелой воды содержит тяжелую воду, добавляемую к загрязненной воде, но может быть использован для хранения тяжелой воды, выделенной способом разделения согласно настоящему изобретению. Резервуар 13 для легкой воды представляет собой резервуар для хранения легкой воды, отделенной и выделенной из тритиевой воды способом разделения согласно настоящему изобретению.
[0032] Циркуляционный насос 21 представляет собой насос для циркуляции загрязненной воды и тяжелой воды в реакционный резервуар 31, а газовый баллон 22 заполнен веществом для преобразования в газогидрат, таким как газообразный пропан.
[0033] Как будет подробно описано ниже, реакционный резервуар 31 представляет собой устройство для преобразования в газогидраты как тяжелой воды, так и тритиевой воды и для преобразования в газогидрат тритиевой воды.
[0034] Термостатированный водяной резервуар 41 представляет собой устройство, которое содержит загрязненную воду, подаваемую из резервуара 11 для загрязненной воды циркуляционным насосом 21, и тяжелую воду, подаваемую из резервуара 12 для тяжелой воды циркуляционным насосом 21, и осуществляет регулирование температуры этих вод при условии преобразования в газогидрат с помощью блока 51 измерительных приборов.
[0035] Блок 51 измерительных приборов имеет расходомер 52, термометр 53 и блок 54 регулирования давления, корректирующий давление от газового баллона 22 до давления преобразования в газогидрат.
[0036] Реакционный резервуар 31 принимает как загрязненную воду, так и тяжелую воду, регулируемые при температуре преобразования в газогидрат с помощью термостата водяного резервуара 41 и подаваемые циркуляционным насосом 21. Кроме того, реакционный резервуар 31 принимает газ из газового баллона 22 после того, как он подвергнут сжатию до условия преобразования в газогидрат с помощью блока 51 измерительных приборов. Как загрязненная вода, так и тяжелая вода смешиваются барботированием в реакционном резервуаре 31, и тем самым преобразуются в газогидрат.
[0037] Хотя это не показано на фигуре, циркуляционный трубопровод для соединения реакционного резервуара 31 с циркуляционным насосом 21 содержит фильтр, и, как было описано выше, кристаллы газогидрата, выросшие до большего размера, чем размер пор фильтра в реакционном резервуаре 31, задерживаются, тогда как кристаллы меньшего размера, нежели размер пор фильтра, расплавляются во время циркуляции в трубопроводе, возвращаются обратно в реакционный резервуар 31 и перекристаллизовываются в нем. Когда кристаллы газогидрата в реакционном резервуаре 31 вырастают до такого размера, что циркуляция жидкой фазы механически затрудняется, возрастает разность давлений на насосе. Когда на этой стадии из реакционного резервуара удаляется жидкая фаза, кристаллический гидрат и жидкая фаза отделяются друг от друга.
Пример 1
[0038] Коммерчески доступную в качестве реагента тритиевую воду разбавили особо чистой водой до концентрации трития 5×105 Бк/л для получения контрольного образца воды. После того, как образец воды поместили в реакционный резервуар, к нему добавили такое же количество тяжелой воды. Образец воды, содержащий добавленную тяжелую воду, подвергли деаэрации при пониженном давлении с помощью вакуумного насоса. Операцию проводили при температуре 19,0°С.
[0039] В реакционный резервуар с постоянной скоростью подавали газообразный HFC-32, в то время как температуру в реакционном резервуаре поддерживали при 19,0°С. Газообразный HFC-32 растворяли в воде до насыщения, и затем, как только было достигнуто насыщение, увеличивалась скорость повышения давления. Когда давление увеличивалось и достигало условий преобразования в газогидрат, выпадали в осадок кристаллы газогидрата. Поскольку давление быстро снижалось, когда газ расходовался для преобразования в газогидрат, вводили в резервуар газообразный HFC-32 в необходимом количестве для компенсации падения давления. Выделившаяся в осадок вода в виде гидрата при этом условии температуры/давления включает легкую воду, тяжелую воду и тритиевую воду. Она растворялась, так что газогидраты, имеющие низкую степень кристалличности, проходили через внешний циркуляционный блок так, что температура воды, проходящей через внешний циркуляционный блок, повышалась до температуры, значительно более высокой, чем температура Q2 (20,0°С) легкой воды.
[0040] Температуру в реакционном резервуаре также постепенно повышали от 19,0°С. Температуру повышали до 22,5°С, при которой легкая вода давала гидрат в нестабильной фазе, тогда как и тяжелая вода, и тритиевая вода давали гидраты в стабильной фазе. Реакцию продолжали при этом условии, а жидкую фазу в реакционном резервуаре выводили, когда сокращался расход во внешнем циркуляционном блоке. Выведенная жидкая фаза дегазировалась, когда ее нагревали при пониженном давлении. Дегазированный образец жидкости представлял собой легкую воду, и определяли концентрацию содержащейся в ней тритиевой воды. Измерение выполняли жидкостно-сцинтилляционным методом. Результаты обобщены в Таблице 1.
[0041] Кристаллы гидрата, оставшиеся в реакционном резервуаре, расплавились в ходе дегазации нагреванием при пониженном давлении. Образец дегазированной жидкости представлял собой более концентрированную смесь тяжелой воды и тритиевой воды. Вместо описанной выше операции кристаллы гидрата, оставшиеся в реакционном резервуаре, переводили в жидкое состояние при пониженном давлении и помещали в еще один реакционный резервуар как образец воды для применения в операции отделения тяжелой воды от тритиевой воды.
[0042] В реакционный резервуар с постоянной скоростью подавали газообразный HFC-32, в то время как температуру в реакционном резервуаре поддерживали при 19,0°С. Газообразный HFC-32 растворяли в воде до насыщения, а затем, как только было достигнуто насыщение, увеличивали скорость повышения давления. Когда давление достигало условий преобразования в газогидрат, выпадали в осадок кристаллы газогидрата. Поскольку давление быстро снижалось, когда газ расходовался для преобразования в газогидрат, вводили газообразный HFC-32 в резервуар в необходимом количестве для компенсации падения давления.
[0043] Происходило повторное растворение, когда газогидрат, имеющий низкую степень кристалличности, проходил через внешний циркуляционный блок, посредством установления температуры его нагрева в достаточной мере превышающей температуру Q2 (приблизительно 23°С) тяжелой воды. Температуру в реакционном резервуаре также постепенно повышали от 19,0°С. Температуру повышали до 24°С, при этом тяжелая вода давала гидрат в нестабильной фазе, тогда как тритиевая вода давала гидрат в стабильной фазе.
[0044] Реакцию продолжали в этих условиях, а жидкую фазу выводили из реакционного резервуара, когда сокращался расход во внешнем циркуляционном блоке. Выведенная жидкая фаза дегазировалась, когда ее нагревали при пониженном давлении. Дегазированный образец жидкости представлял собой тяжелую воду.
[0045] Оставшиеся в реакционном резервуаре кристаллы гидрата расплавляли при дегазации с нагреванием при пониженном давлении. Образец дегазированной жидкости представлял собой смесь тяжелой воды и тритиевой воды, и определяли в нем концентрацию тритиевой воды. Результаты обобщены в Таблице 1.
Пример 2
[0046] Коммерчески доступную в качестве реагента тритиевую воду смешали с особо чистой водой до концентрации трития 5×105 Бк/л для получения контрольного образца воды. Использованное устройство было таким же, как устройство в примере 1. После того, как образец воды поместили в реакционный резервуар, к нему добавили такое же количество тяжелой воды. Образец воды, содержащий добавленную тяжелую воду, подвергли дегазации при пониженном давлении с помощью вакуумного насоса. Операцию проводили при температуре 19,0°С.
[0047] В реакционный резервуар с постоянной скоростью подавали газообразный HFC-32, в то время как температуру в реакционном резервуаре поддерживали при 22,5°С. Газообразный HFC-32 растворяли в воде до насыщения, и как только было достигнуто насыщение, увеличивалась скорость повышения давления. Когда давление увеличивалось и достигало условий преобразования в газогидрат, выпадали в осадок кристаллы газогидрата. Поскольку давление быстро снижалось, когда газ расходовался для преобразования в газогидрат, вводили в резервуар газообразный HFC-32 в необходимом количестве для компенсации падения давления. Выделившаяся в осадок вода в виде гидрата при условии температуры/давления включает тяжелую воду и тритиевую воду. Газогидраты, имеющие низкую степень кристалличности, растворялись, проходя через блок внешней циркуляции, таким что температура воды, проходящей через блок внешней циркуляции, повышалась до температуры, незначительно выше температуры Q2 (приблизительно 23°С) легкой воды.
[0048] Температуру в реакционном резервуаре также постепенно повышали от 22,5°С до 23,5°С, при которой каждая из тяжелой воды и тритиевой воды давали гидраты в стабильной фазе, в то время как гидрат легкой воды, который кристаллизовался в виде термодинамически метастабильной фазы, расплавлялся. Реакцию продолжали при этом условии, а жидкую фазу из реакционного резервуара выводили, когда сокращался расход во блоке внешней циркуляции. Выведенная жидкая фаза дегазировалась, когда ее нагревали при пониженном давлении. Дегазированный образец жидкости представлял собой легкую воду, концентрацию содержащейся в ней тритиевой воды определяли. Результаты обобщены в Таблице 1.
[0049] Кристаллы гидрата, оставшиеся в реакционном резервуаре, расплавились в ходе дегазации нагреванием при пониженном давлении. Образец дегазированной жидкости представлял собой смесь тяжелой воды и тритиевой воды. Кристаллы гидрата, оставшиеся в реакционном резервуаре, переводили в жидкое состояние при пониженном давлении как образец воды для операции отделения тяжелой воды от тритиевой воды.
[0050] В реакционный резервуар с постоянной скоростью подавали газообразный HFC-32, в то время как температуру в реакционном резервуаре поддерживали при 22,5°С. Газообразный HFC-32 растворяли в воде до насыщения, а затем, как только было достигнуто насыщение, увеличивали скорость повышения давления. Когда давление достигало условий преобразования в газогидрат, выпадали в осадок кристаллы газогидрата. Поскольку давление быстро снижалось, когда газ расходовался для преобразования в газогидрат, вводили газообразный HFC-32 в резервуар в необходимом количестве для компенсации падения давления.
[0051] Происходило повторное растворение, когда газогидрат, имеющий низкую степень кристалличности, проходил через внешний циркуляционный блок, так что температура воды, проходящей через внешний циркуляционный блок, повышалась до температуры, незначительно выше температуры Q2 (приблизительно 23°С) тяжелой воды. Температуру в реакционном резервуаре также постепенно повышали от 19,0°С до 24°С, при которой тяжелая вода давала гидрат в нестабильной фазе, тогда как тритиевая вода давала гидрат в стабильной фазе. Реакцию продолжали при этом условии, а жидкую фазу из реакционного резервуара выводили, когда расход во внешнем циркуляционном блоке сокращался до значения, меньшего, чем предварительно заданное значение. Выведенная жидкая фаза дегазировалась, когда ее нагревали при пониженном давлении. Дегазированный образец жидкости представлял собой тяжелую воду.
[0052] Оставшиеся в реакционном резервуаре кристаллы гидрата расплавляли при дегазации с нагреванием при пониженном давлении. Образец дегазированной жидкости представлял собой смесь тяжелой воды и тритиевой воды, и определяли в нем концентрацию тритиевой воды. Результаты обобщены в Таблице 1.
[0053] Концентрации трития в жидкостях после первой стадии отделения кристаллов газогидрата от жидкости и в концентрированной тритиевой воде в реакционном резервуаре на второй стадии
|
Список условных обозначений
[0054]
11: Резервуар для загрязненной воды
12: Резервуар для тяжелой воды
13: Резервуар для легкой воды
21: Циркуляционный насос
22: Газовый баллон
31: Реакционный резервуар
41: Термостатированный водяной резервуар
51: Блок измерительных приборов
52: Блок регулирования температуры
53: Термометр
54: Расходомер.