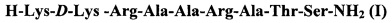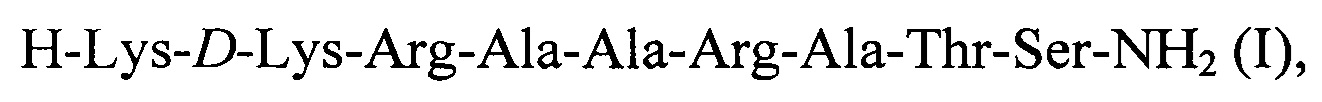Результат интеллектуальной деятельности: Протеолитически устойчивый нонапептид, обладающий способностью предотвращать повышение гиперпроницаемости сосудистого эндотелия
Вид РИД
Изобретение
Предлагаемое изобретение относится к биологически активному пептиду, обладающему способностью предотвращать развитие сосудистой гиперпроницаемости в стрессовых ситуациях. Благодаря этому свойству заявляемый пептид может найти применение в медицине в качестве противоотечного средства.
Резкие изменения сосудистой проницаемости опосредуются эндотелиальной выстилкой микрососудов. Эндотелий играет роль селективного барьера между кровью и тканями организма, через который осуществляется транспорт питательных веществ, выведение продуктов метаболизма и передача гуморальных сигналов к клеткам. Различные стрессорные агенты, такие как бактериальные эндотоксины, ишемия, некротоксины, активные формы кислорода, нитрозильные соединения, механическая травма и др. приводят к нарушению контактов между эндотелиальными клетками и их сокращению. В результате барьерная функция эндотелия нарушается, и в ткань беспрепятственно поступают белковые и клеточные компоненты крови, развивается острый отек и провоцируется локальная активация иммунокомпетентных клеток. Если такие события развиваются в сосудистой системе легких и мозга, то последствия могут быть катастрофическими. При ишемии и последующей реперфузии миокарда и других органов также возрастает локальная сосудистая проницаемость, что приводит к развитию постишемического отека и способствует инфильтрации и повреждению ткани нейтрофилами. Дополнительно, в части микрососудов сердца не восстанавливается кровоток (синдром "no reflow"), и это состояние также связывают с дисфункцией эндотелия, в частности, с сокращением эндотелия капилляров и сужением просвета микрососудов.
Известно, что одним из важнейших белковых активаторов гиперпроницаемости эндотелия является фермент киназа легких цепей миозина (КЛЦМ). В эндотелии присутствует ее высокомолекулярная изоформа КЛЦМ210. Многие стресс-агенты активируют эндотелиальную КЛЦМ и вызывают разборку межэндотелиальных контактов и ретракцию эндотелиальных клеток. Известно, что мыши с генетическим нокаутом КЛЦМ210 более устойчивы к повреждению легких и сердца в экспериментальных моделях сепсиса за счет сохранения барьерной функции эндотелия микрососудов. Введение мышам дикого типа ингибиторов КЛЦМ защищает их легкие от повреждения в модели сепсиса так же, как и генетическая инактивация КЛЦМ. Эти данные дают основание полагать, что фармакологическая инактивация КЛЦМ в эндотелии микрососудов может затормозить развитие отека ткани и ее повреждение.
Большинство ингибиторов КЛЦМ, используемых в эксперименте и созданных на основе малых органических молекул, не подходит для медицинского применения из-за многочисленных побочных эффектов. В связи с этим возникает необходимость в разработке фармакологически привилегированных соединений, которые можно будет применять у человека в качестве противоотечных препаратов. К таким классам соединений относятся, в частности, пептиды.
Известен синтетический пептидный ингибитор КЛЦМ формулы H-Lys-Lys-Arg-Ala-Ala-Arg-Ala-Thr-Ser-NH2 (MLC11-19), соответствующий аминокислотной последовательности 11-19 регуляторной легкой цепи (РЛЦ) миозина (Pearson et al., 1986). В экспериментах на очищенных белках in vitro он являлся наилучшим конкурентным ингибитором гладкомышечной КЛЦМ из набора пептидных молекул, соответствующих фрагментам РЛЦ миозина. Показано, что добавленный к нейтрофилам пептид MLC11-19 подавляет в них фосфорилирование РЛЦ миозина, т.е. он способен проникать внутрь клеток (Chilcoat et al., 2008). Этот пептид является структурным аналогом заявляемого соединения. В силу особенностей химической структуры этот пептид чрезвычайно чувствителен к действию протеолитических ферментов, поэтому вряд ли может найти применение в практической медицине.
Известны также пептиды семейства ПИК (Пептидные Ингибиторы Киназы), представляющие собой модификацию автоингибиторной последовательности КЛЦМ. Так, нонапептид H-Arg-Lys-Lys-Tyr-Lys-Tyr-Arg-Arg-Lys-NH2 (L-ПИК) (Lukas et al., 1999) проникает через плазматическую мембрану и влияет на эпителиальную проницаемость in vitro и in vivo (Clayburgh et al., 2005). L-ПИК так же, как и MLC11-19, имеет низкую протеолитическую стабильность (Owens et al., 2005). Это также ставит под сомнение возможность его применения в практической медицине. Модификация пептида L-ПИК путем замены входящих в его состав L-аминокислот на D-конфигурацию, как и следовало ожидать, приводила к повышению устойчивости пептида к протеолитической деградации (Clayburgh et al., 2005). Однако ингибиторная активность D-ПИК значительно уступала таковой для L-ПИК, по-видимому, из-за того, что D-ПИК, являясь полным энантиомером L-ПИК, обладает иной пространственной структурой (Секридова et al., 2010). При сравнении пептидныхингибиторов КЛЦМ с различными вариантами модификации структуры исходного L-ПИК, а именно, D-ПИК, [NαМе-Аrg1]-ПИК, [εАса1]-ПИК, [Сit1]-ПИК, [Cit1,Orn3]-ПИК) было показано, что активностью in vitro, сопоставимой с исходным L-ПИК, обладает только пептид H-MeArg1-Lys-Lys-Tyr-Lys-Tyr-Arg-Arg-Lys-NH2 [NαМе-Аrg1]-ПИК (ПИК1) с модификацией N-концевой аминокислоты исходного пептида L-ПИК (Патент РФ №2402565, МПК С07К 7/00, опубл. 27.10.2010 г.). Время жизни ПИК1 в плазме крови in vitro почти в 3 раза превышало время жизни L-ПИК, и в концентрации 100 мкМ ПИК1 в 1.6 раза снижал индуцированное тромбином повышение проницаемости монослоя эндотелиальных клеток.
Относительно высокие рабочие концентрации ПИК1 снижали его привлекательность для применения in vivo. В дальнейшем на основе ПИК1 был создан новый пептидный ингибитор КЛЦМ H-MeArg1-Lys-Lys-Tyr-Lys-Tyr-Arg-D-Arg8-Lys-NH2 (ПИК2), в котором помимо модификации [NαМе-Аrg1] была реализована замена L-Arg8 на D-Arg8 (Патент РФ 2493164, МПК С07К 7/06, опубл. 20.09.2013 г.). Стабильность ПИК2 превышала стабильность ПИК1 в 4 и более раз, в то же время внесенные модификации не повлияли на ингибиторные свойства ПИК2 в отношении КЛЦМ. ПИК2 подавлял тромбин-индуцируемую гиперпроницаемость эндотелиального монослоя in vitro до уровня контроля, действуя в концентрации 20 мкМ, т.е. в 5 раз более низкой, чем ПИК1. Таким образом, по стабильности и биологической активности ПИК2 существенно превосходил ПИК1. ПИК2 рассматривается в качестве прототипа заявляемого соединения. Однако, показатели переносимости ПИК2 при однократном внутривенном введении лабораторным животным были не высокими. Так, ЛД50 ПИК2 при введении мышам составляла около 18 мг/кг, а для кроликов Шиншилла не превышала 5 мг/кг, что делало терапевтическое окно для этого пептида узким и перспективы его медицинского применения неочевидными, несмотря на достижение целевого эффекта - подавление гиперпроницаемости эндотелия и отека легких у крыс. Таким образом, высокая токсичность ПИК2 является наиболее существенным его недостатком.
Задачей изобретения является разработка протеолитически устойчивого нонапептид, обладающего способностью предотвращать повышение гиперпроницаемости сосудистого эндотелия для использования его в составе пептидного препарата, сочетающего высокую устойчивость к биодеградации с низкой токсичностью, что позволяет обеспечить широкое терапевтическое окно при его планируемом медицинском применении.
Актуальность этой задачи обусловлена необходимостью обеспечения медицины неотложных состояний эффективными и нетоксичными противоотечными и эндотелиопротективными препаратами, недостаток которых очевиден в соответствующем сегменте фармацевтического рынка.
Технический результат заключается в получении пептида формулы (I), обладающего высокой активностью в плане подавления гиперпроницаемости эндотелия сосудов, низкой токсичностью и длительным временем жизни в плазме крови человека.
Технический результат достигается путем синтеза амида нонапептида формулы

или [D-Lys12]-MLC11-19, (I), далее ПИК7, в молекуле которого остаток Lys12 природной L-конфигурации заменен на D-Lys12.
Заявляемый пептид ПИК7, и контрольные пептиды - фрагмент MLC11-19 (структурный аналог) и ПИК2 (функциональный аналог, взятый в качестве прототипа) - получали твердофазным методом пептидного синтеза с использованием Fmoc-технологии, описанным ниже в примере 1.
Неочевидность изобретения обусловлена тем, что любой дизайн пептидных молекул является чисто теоретическим подходом, так как каждый модифицированный пептид является уникальным химическим соединением, его биологическая активность не является очевидной и требует экспериментального подтверждения.
Так, при замене природной L-конфигурации α-углеродного атома остатка Lys12 на D-конфигурацию следовало ожидать увеличения времени жизни пептида ПИК7 в плазме крови, поскольку известно, что пептидные связи, образованные D-аминокислотами более устойчивы, чем связи L-аминокислотных аналогов, так как не распознаются протеолитическими ферментами (Hruby and Qian, 1994). Однако, наряду с увеличением времени жизни, внесение модификаций может отрицательно сказаться на ингибиторной активности заявляемого пептида, поскольку в ряду пептидных аналогов не существует четкой взаимосвязи между структурой и биологической активностью. Даже небольшие модификации пептида (а именно, замена природной L-конфигурации α-углеродного атома остатка Lys12 на D-конфигурацию) могут кардинально сказаться на его ингибиторных свойствах. Подтверждением этого может служить известный факт, когда замена N-концевого остатка L-лизина на остаток D-лизина в гексапептиде, соответствующем последовательности 11-16 РЛЦ, приводила к резкому ухудшению его ингибиторных свойств: для H-L-Lys-Lys-Arg-Ala-Ala-Arg-NH2 IC50=22 μМ, а для H-D-Lys-Lys-Arg-Ala-Ala-Arg-NH2 IC50=180 μM (Hunt et al., 1989).
Изобретение поясняется чертежами.
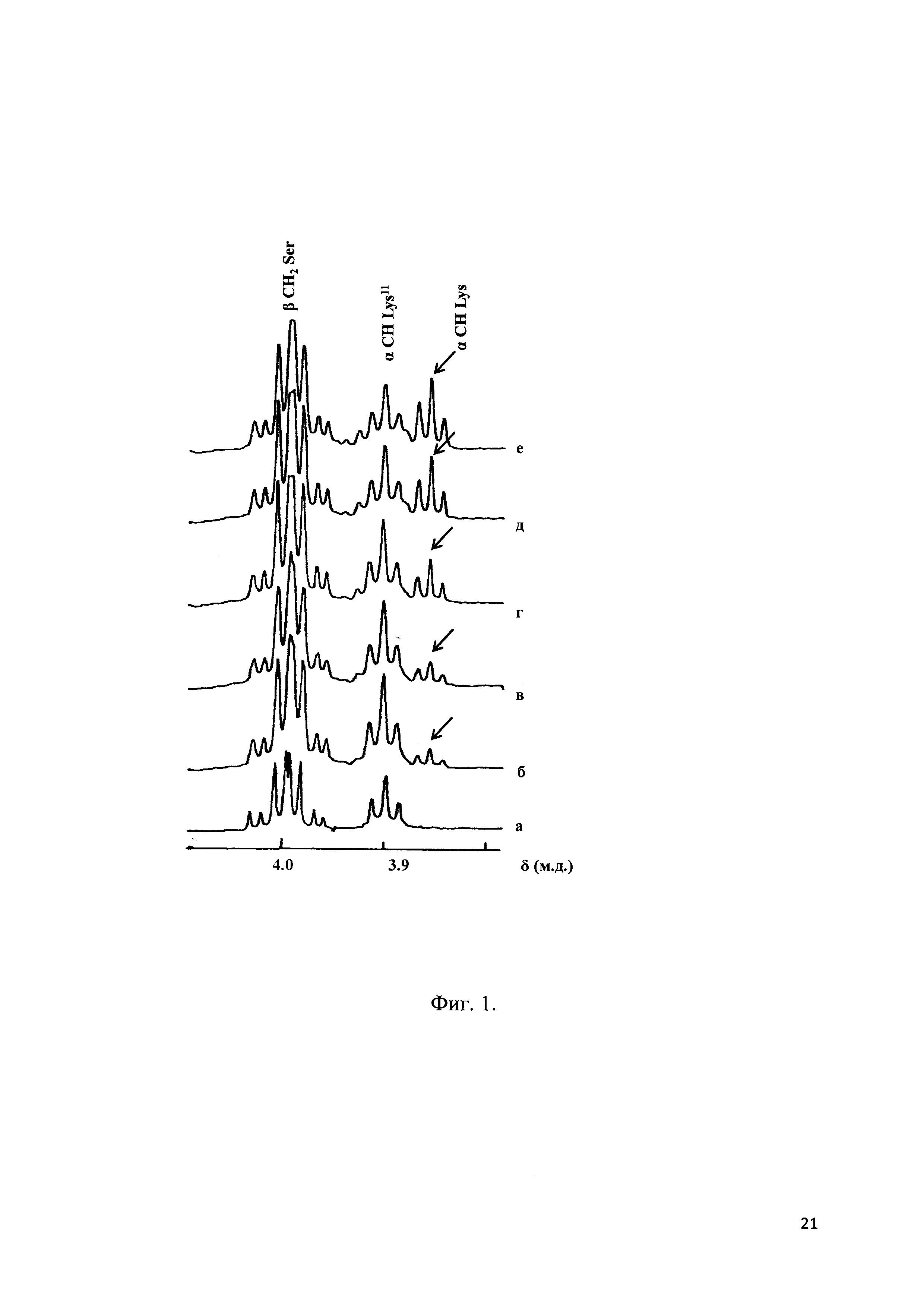
Фиг. 1 - Фрагменты спектров 1Н-ЯМР (500 МГц) пептида MLC11-19 (после вычитания спектра плазмы крови), полученные через 18 (б), 25(в), 36 (г), 50 (д), 65 (е) мин после добавления пептида в плазму; (а) - спектр пептида в фосфатном буфере рН 7.4, D2O.
Фиг. 2 - Фрагменты спектров 1Н-ЯМР (500 МГц) заявляемого пептида ПИК7 (после вычитания спектра плазмы крови), полученные через 140 (б), 200(в), 330 (г) мин после добавления пептида в плазму; (а) - спектр пептида в фосфатном буфере рН 7.4, D2O.
Эти спектры показывают относительную устойчивость аналога и заявляемого пептида к действию протеолитических ферментов плазмы крови, как описано в примере 2.
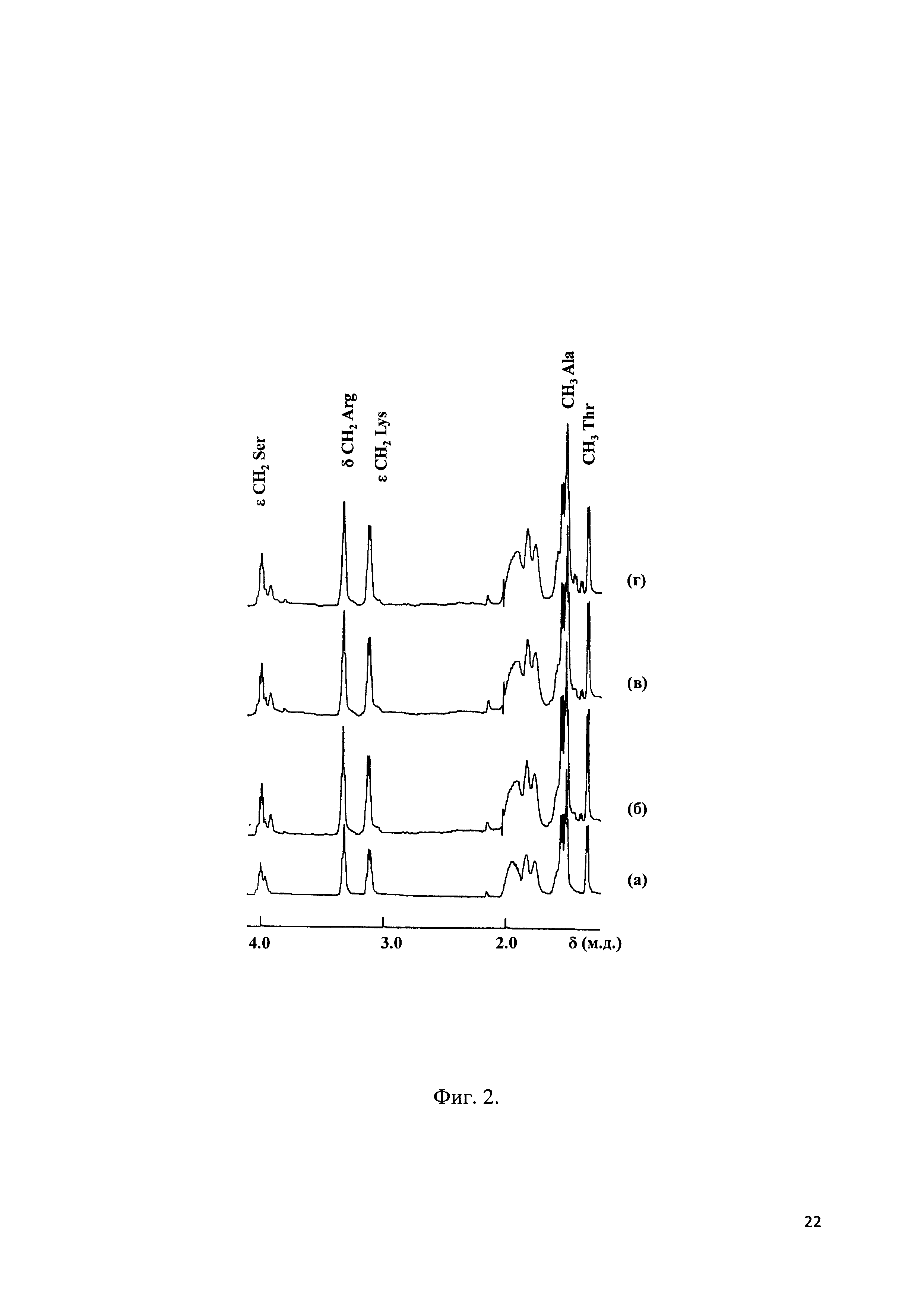
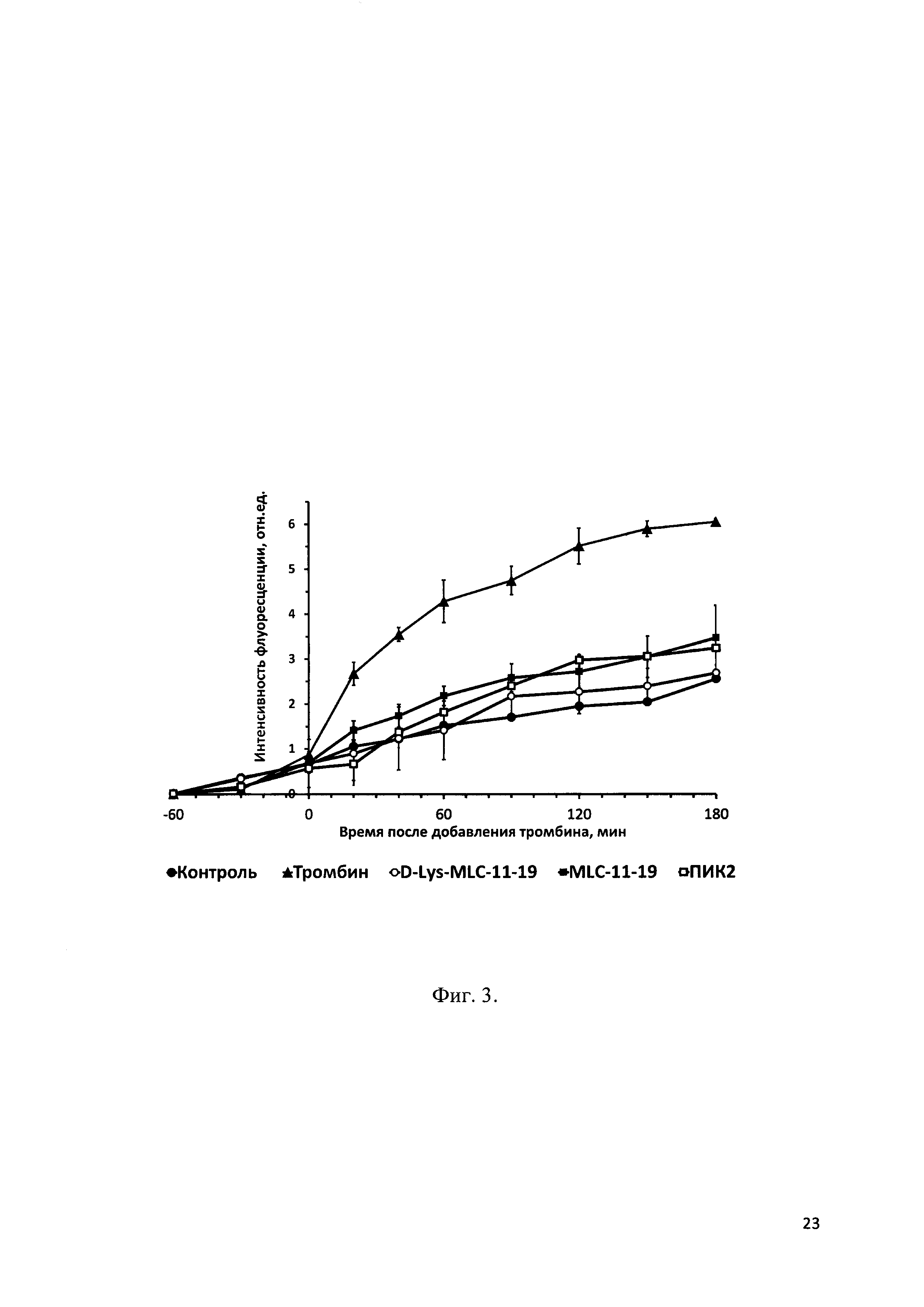
Фиг. 3 - Проницаемость ФИТЦ-декстрана через монослой эндотелиальных клеток линии EA.hy926 под воздействием тромбина в присутствии пептидных ингибиторов киназы легких цепей миозина.
Тромбин 100 нМ, добавлен в 0 мин, клетки преинкубировали с 100 микроМ пептидными ингибиторами КЛЦМ 60 мин. Среднее± ст. откл. n=5. р<0.05 для всех значений в диапазоне 20-180 мин по сравнению с +тромбин в контроле.
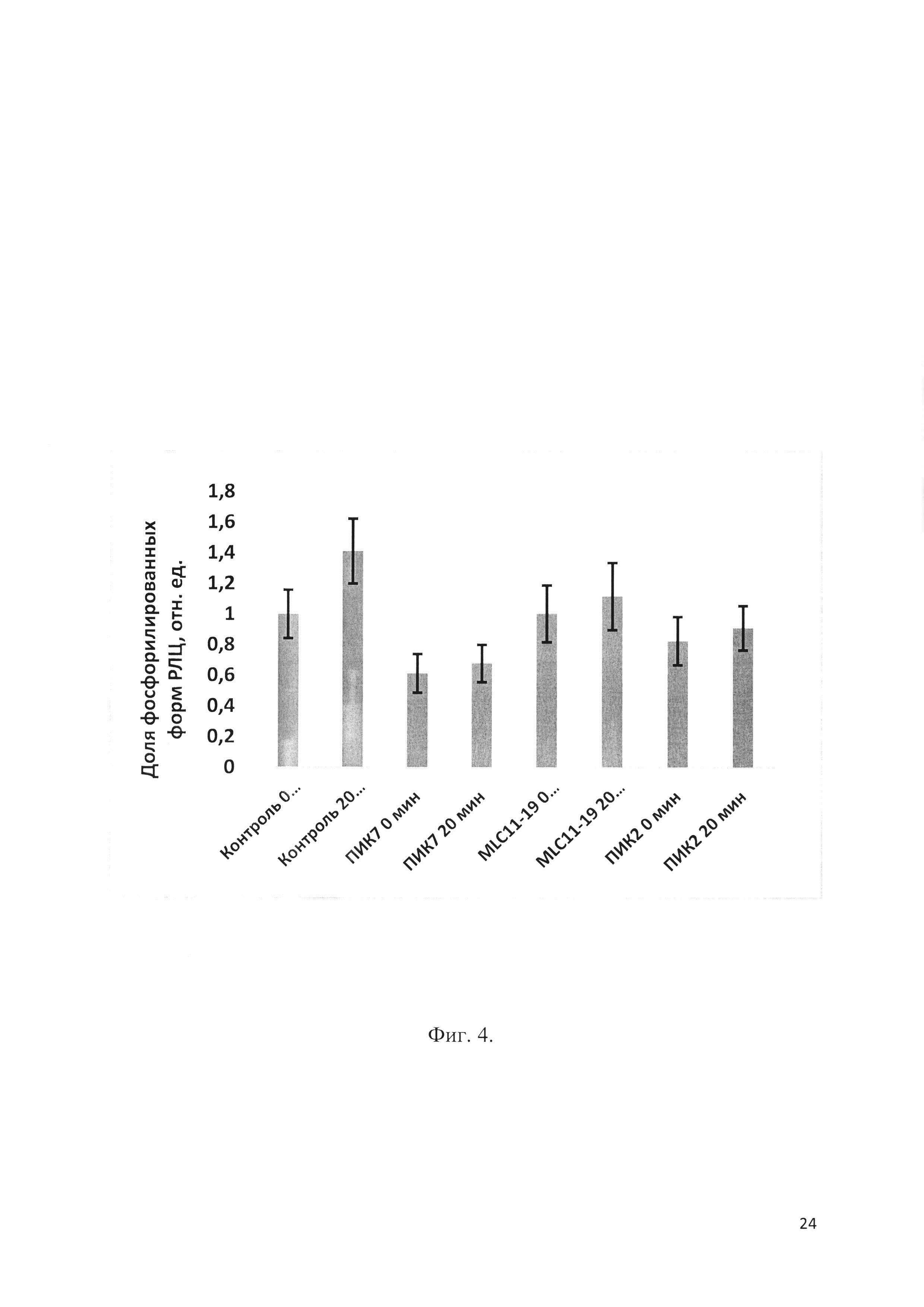
Фиг. 4 - Ингибирование тромбин-индуцированного фосфорилирования РЛЦ миозина в эндотелиальных клетках EA.hy926 пептидными ингибиторами КЛЦМ: ПИК2, ПИК7 ([D-Lys12]-MLC11-19) и MLC11-19.
Ингибиторы добавляли в концентрации 100 мкМ. n=3-5. р<0.05 для ПИК2, ПИК7 vs контроль (0, 20 мин). р<0.05 для ПИК2 vs ПИК7 (0, 20 мин).
Влияние заявляемого пептида (ПИК7), прототипа (ПИК2) и структурного аналога (MLC11-19) на проницаемость эндотелия оценивали по скорости диффузии ФИТЦ-декстрана через монослой эндотелиалных клеток, как описанано в примере 3. На Фиг. 3 представлена проницаемость ФИТЦ-декстрана через монослой эндотелиальных клеток линии EA.hy926 под воздействием тромбина в присутствии пептидных ингибиторов киназы легких цепей миозина ПИК2, ПИК7и MLC11-19; все использованные ингибиторы полностью подавляли гиперпроницаемость для ФИТЦ-декстрана в этих условиях и _заявляемый пептид ПИК7 не уступал пептиду-аналогу и пептиду-прототипу ПИК2 в эффективности действия.
Ингибиторную активность заявляемого пептида ПИК7 и прототипа/аналога (ПИК2 / MLC11-19) сравнивали по их влиянию на фосфорилирование регуляторных легких цепей миозина (РЛЦ) in vitro, как описано в примере 4. На Фиг. 4 представлены данные по ингибированию тромбин-индуцированного фосфорилирования РЛЦ миозина в эндотелиальных клетках EA.hy926 пептидными ингибиторами КЛЦМ ПИК2, ПИК7 и MLC11-19. Показано, что заявляемый пептид ПИК7 обладает способностью ингибировать фосфорилирование РЛЦ миозина в эндотелии, и его эффективность превышает таковую для прототипа ПИК2 и аналога MLC11-19.
Сравнительное изучение острой токсичности и переносимости ПИК7 и ПИК2 было проведено на мышах и кроликах, как описано в примере 5.
Результаты исследования острой токсичности и переносимости ПИК2 и ПИК7 при введении лабораторным животным однозначно свидетельствуют о том, что ПИК7 демонстрирует более чем на порядок лучшую переносимость, меньшую острую токсичность и, следовательно, имеет более широкое терапевтическое окно, чем ПИК2, см. табл. 3.
Таким образом, проведенная сравнительная оценка протеолитической устойчивости, биологической активности и токсичности (переносимости) заявляемого пептида ПИК7 и пептидов, выбранных в качестве аналога и прототипа, показала, что ПИК7 не уступает структурному аналогу MLC11-19 и пептиду-прототипу ПИК2 в эффективности действия: обладает высокой активностью в плане подавления гиперпроницаемости эндотелия сосудов, превосходит MLC11-19 и ПИК2 по способности ингибировать фосфорилирование РЛЦ миозина в эндотелии; обладает повышенной протеолитической устойчивостью (на порядок превосходящей таковую у структурного аналога) и существенно более низкой токсичностью, чем прототип ПИК2.
Изобретение описано 5 пятью примерами.
Пример 1. Синтез заявляемого пептида ПИК7

Список сокращений:
АА - аминокислота;
Вос - трет-бутилоксикарбонил;
But - трет-бутил;
DCM - дихлорметан;
DMSO-d6 - дейтерированный диметилсульфоксид;
DMF - N,N- диметилформамид;
Fmoc - 9-флуоренилметоксикарбонил;
НОВТ - 1-гидроксибензотриазол;
MALDI - матрично-активированная лазерная десорбция/ионизация;
NMM - N-метилморфолин;
4-MePip - 4-метилпиперидин;
Pbf-2,2,4,6,7-пeнтaмeтилдигидpoбeнзoфypaн-5-cyльфoнил;
TBTU - N,N,N',N'-тетраметил-O-(бензотриазол-1-ил)урония тетрафторборат;
TIBS - триизобутилсилан;
TFA - трифторуксусная кислота;
ВЭЖХ - высокоэффективная жидкостная хроматография;
В работе использовали производные аминокислот и TBTU (NovaBiochem, Швейцария), NMM, HOBt, TIBS, (Fluka, Швейцария), 4-метилпиперидин (Fluka, Швейцария). Для синтеза применяли DMF, дихлорметан и TFA (Fluka, Швейцария), для хроматографии - ацетонитрил (Раnrеас, Испания). Аналитическую ВЭЖХ проводили на хроматографе (Gilson, Франция), использовали колонку Nucleosil 100 С18, 5 мкм, (4.6×250 мм) (Sigma, США) в качестве элюентов использовали буфер А - 0.1% TFA, буфер Б - 80% ацетонитрила в буфере А, элюция градиентом концентрации буфера Б в буфере А от 0% до 60% за 30 мин. Скорость потока 1 мл/мин, детекция при 220 нм. Препаративную ВЭЖХ проводили на приборе Knauer (Германия) на колонке Диасорб С16 130Т (25×250 мм), размер частиц сорбента 10 мкм. В качестве элюентов использовали буфер А -- 0.1%) ТФА, буфер Б - 80% ацетонитрила в буфере А. Элюцию проводили градиентом 0.5% в минуту буфера Б в буфере А от 100% буфера А со скоростью 10 мл/мин. Пептиды детектировали при длине волны 220 нм. Структура полученных пептидов доказана спектрами 1Н-ЯМР и данными масс-спектрометрии. 1Н-ЯМР-спектры снимали на спектрометре WM-500 (Bruker) 500 МГц (ФРГ) в DMSO-d6 при 300 K, концентрация пептидов составляла 2-3 мг/мл. Химические сдвиги измерялись относительно тетраметилсилана. Масс-спектры регистрировали на приборе Ultraflex TOF/TOF (Bruker Daltonics, ФРГ) с ионизацией методом MALDI и времяпролетной базой.
Для твердофазного синтеза использовали сополимер стирола с 1% дивинилбензола с 4-(2,4-диметоксифенил)-Fmoc-аминометилфенокси - якорной группой (Rink-amide-полимер) фирмы Nova BioChem, Швейцария, предназначенный для получения амидов пептидов, содержащий 0.64 ммоль/г аминогрупп. Синтез амида нонапептида проводили с С-конца, ступенчато (присоединяя по одной аминокислоте), исходя из 0.60 г (0.38 ммоль) Rink-amide-полимера в автоматическом режиме на пептидном синтезаторе Tribute UV Protein Technologies Inc. (США) по стандартной программе для однократной конденсации Fmoc-аминокислот. (См. протокол твердофазного синтеза, табл. 1). Для блокирования гуанидиновых групп остатков Arg использовали Pbf-защиту, для ε-аминогрупп Lys - Вос-защиту, для гидроксильных групп Ser и Thr - Вut-защиту. По окончании синтеза отщепление пептида от полимера с одновременным деблокированием боковых функциональных групп проводили путем обработки пептидилполимера смесью 95% трифторуксусной кислоты с добавками 2.5% деионизованной воды и 2.5% триизобутилсилана в течение 1,5 ч. Затем полимер отфильтровывали, промывали 2×2 мл деблокирующей смеси, фильтрат концентрировали в вакууме, пептид осаждали сухим диэтиловым эфиром. Осадок отфильтровывали, промывали на фильтре DCM (2×5 мл), диэтиловым эфиром (3×5 мл), сушили в вакуум-эксикаторе. Сырой продукт в количестве 0.76 г, содержащий 52% основного вещества по данным ВЭЖХ, очищали методом препаративной ВЭЖХ. После лиофилизации был получено 0.23 г пептида с 97.2%-й чистотой по данным ВЭЖХ. Выход - 38.8% в расчете на стартовую аминокислоту. Аналогично синтезировали структурный аналог MLC11-19 и прототип ПИК2. Структуру заявляемого пептида ПИК7, прототипа ПИК2 и структурного аналога MLC11-19 подтверждали методами масс-спектрометрии и 1Н-ядерного магнитного резонанса см. табл. 2, а чистоту - аналитической ВЭЖХ (см. табл. 2, 3).



Пример 2. Время жизни пептидов в плазме крови in vitro (по данным 1Н-ЯМР-спектроскопии).
В асептических условиях у здоровых доноров забирали по 100 мл цельной крови в 50-мл пробирки с 5 мл консерванта (130 мМ цитрат на фосфатно-солевом буфере (ФСБ), рН 7,4). Кровь выдерживали 15-20 мин при комнатной температуре и центрифугировали при 1500g в течение 15 мин при 18°С. Надосадочную жидкость переносили в новые пробирки и центрифугировали повторно в тех же условиях. Измеряли объем плазмы крови и добавляли сухой NaBr из расчета 280 мг NaBr на 1 мл плазмы. После растворения NaBr плазму (приблизительно по 30 мл) разливали по центрифужным стаканам (для ротора Type 45Ti, Beckman, США) и наслаивали сверху по 20 мл раствора с плотностью 1,216 г/л следующего состава: 11,42 г NaCl и 100 мг этилендиаминтетрауксусной кислоты (ЭДТА) растворяли в 1 л дистиллированной воды, рН 7,4, затем добавляли 281,44 г NaBr. Центрифугировали при 40000 об/мин в течение 48 ч. После центрифугирования отбирали верхний темно-желтый слой жидкости, содержащий липопротеиды, и бесцветный слой буфера, оставляя буфер на высоту приблизительно 1 см до видимой границы плазмы. Плазму, полученную от одного донора, объединяли и диализовали в течение 36 ч против 4 л ФСБ, свободного от ионов Ca2+ и Mg2+ (MP Biomedicals, США) в диализных мешках с размером пор 12-14 кДа (Medicell, Великобритания). Процедуру диализа повторяли два раза по 24 ч против свежего буфера. После диализа плазму подвергали центрифугированию при 25000 об/мин в роторе Type 45Ti (Beckman, США) в течение 15 мин при 4°С. Надосадочную жидкость отбирали и лиофилизовали. Сухой остаток растворяли в D2O (в объеме, равном объему плазмы до внесения NaBr) и снова лиофилизовали. Затем растворяли в таком же объеме и до использования хранили аликвотами по 1 мл при - 20°С.
С помощью 1Н-ЯМР-спектроскопии была проведена сравнительная оценка устойчивости пептидов ПИК7 (заявляемого пептида) и MLC11-19 (структурного аналога) в плазме крови человека. 1Н-ЯМР-спектроскопия позволяет непосредственно в ходе ферментативного гидролиза регистрировать сигналы и оценивать количества как исходного пептида, так и продуктов его распада (Исакова et al., 1986). Сравнение спектров, полученных через различные промежутки времени после добавления того или иного пептида в плазму крови, дает информацию об устойчивости пептида, путях его распада и позволяет оценить время полураспада (полужизни) этого пептида. Спектры 1Н-ЯМР были получены на спектрометре WM-500 (Bruker, США) при 37°С. Химические сдвиги сигналов в спектрах измеряли относительно внутреннего стандарта - натриевой соли 2,2-диметил-2-силапентан-5-сульфаната. Отнесение сигналов выполняли с помощью метода двойного резонанса. Для выделения сигналов, принадлежащих протонам пептида, применяли разностную спектроскопию: из каждого спектра, полученного после добавления пептида в плазму крови, вычитали спектр свободной плазмы. Концентрация пептида в образце составляла 3 мг/мл. Хотя значения времени полужизни пептидов, полученные в экспериментах in vitro, не соответствуют реальной стабильности этих пептидов в кровотоке (так как в этих экспериментах концентрации пептидов существенно выше, а активность ферментов плазмы крови ниже, чем в физиологических условиях), проведенные эксперименты позволяют сделать выводы об относительной устойчивости пептидов к протеолитической деградации и показывают, что время полужизни заявляемого пептида ПИК7 существенно выше, чем у ближайшего структурного аналога MLC11-19. Если время полужизни MLC11-19 составляет 32 мин (Фиг. 1), то для заявляемого пептида эта величина более 7 часов (Фиг. 2).
Как видно из Фиг. 1, в случае пептида MLC11-19 через 25 мин инкубации в плазме крови человека in vitro, наряду с сигналами протонов N-концевого Lys11 хорошо выражены сигналы (показанные стрелками), соответствующие СαН-группам свободного лизина. Это указывает на деградацию N-концевой части пептида. В то же время, в случае заявляемого пептида ПИК7 (Фиг. 2) исходный спектр не претерпевает существенных изменений даже через 320 мин инкубации, указывая на его высокую стабильность в плазме крови с временем полужизни > 320 мин. Таким образом, заявляемый пептид характеризуется повышенным временем жизни в плазме крови. Это позволяет продолжительное время поддерживать его эффективную концентрацию, необходимую для снижения гиперпроницаемости сосудистого эндотелия в критических состояниях. Повышенное время жизни пептида позволяет также использовать более низкие, при сравнении с гомологами, концентрации при сохранении терапевтического эффекта.
Пример 3. Проницаемость эндотелиального монослоя in vitro
Исследование проводили следующим образом. Клетки выращивали в специальных вставках фирмы Grenier BioOne (Австрия) на пористых мембранах с диаметром пор 0,4 мкм и плотностью пор 108/см2 в 24-луночных планшетах в среде ДМЕМ до формирования монослоя (3-4 дня). Наличие сформированного монослоя проверяли путем сравнения пропускания ФИТЦ-декстрана за 1 час во вставках с клетками и во вставках без них («пустые» вставки). Эксперимент проводили после формирования плотного монослоя. Клетки инкубировали в депривационной среде ДМЕМ с ингибиторами КЛЦМ либо без них (контрольные вставки). После депривации в верхнюю камеру добавляли ФИТЦ-декстран до конечной концентрации 0,05 мг/мл. Затем через 30 и 60 мин отбирали по 10 мкл из нижней камеры и добавляли в 100 мкл фосфатно-солевого буфера рН 7,3 в лунку 96-луночного планшета для иммуноферментного анализа. Так определяли «базовое протекание» мембран. Затем в верхнюю камеру добавляли 100 нМ тромбин, и из нижней камеры каждые 30 минут в течение 3 часов отбирали пробы. Эксперименты проводили в трипликатах. Флуоресценцию ФИТЦ-декстрана в пробах измеряли с помощью планшетного анализатора Victor Х3 фирмы Perkin Elmer (США). По полученным значениям строили графики изменения флуоресценции во времени.
Видно, что под действием 100 нМ тромбина развивается гиперпроницаемость эндотелия по сравнению с контролем без добавления веществ, что выражается в повышении диффузии 70 кДа ФИТЦ-декстрана через эндотелиальный монослой и, соответственно, в возрастании флуоресценции в нижней части диффузионной камеры. После иреинкубации эндотелиальных клеток с пептидными ингибиторами КЛЦМ в концентрации 100 мкМ тромбин-индуцированная гиперпроницаемость эндотелия не развивается. Все использованные ингибиторы полностью подавляли гиперпроницаемость для ФИТЦ-декстрана в этих условиях. Таким образом, заявляемый пептид ПИК7 не уступает пептиду-аналогу MLC11-19 и пептиду-прототипу ПИК2 в эффективности действия.
Пример 4. Оценка ингибиторной активности заявляемого пептида ПИК7, прототипа ПИК2 и аналога MLC11-19.
Способность пептидных ингибиторов КЛЦМ ингибировать тромбин-индуцированное фосфорилирование РЛЦ миозина в эндотелиальных клетках EA.hy926 определяли следующим образом. Клетки линии EA.hy926 инкубировали в чашках Петри диаметром 35 мм до образования монослоя в питательной в среде ДМЕМ при 37°С в атмосфере 5% СО2. После того, как клетки образовывали плотный монослой, меняли питательную среду на бессывороточную и добавляли ингибиторы КЛЦМ до конечной концентрации 100 мкМ, инкубировали 1 час при 37°С, 5% СО2 и отбирали пробу до добавления тромбина (0 минут). Затем добавляли 100 нМ раствор тромбина в среде ДМЕМ и отбирали пробы через 20 минут после добавления тромбина (для отбора проб чашки помещали на лед, удаляли питательную среду, промывали клетки холодным ФСБ, лизировали клетки в 100 мкл буфера для электрофореза в денатурирующих условиях). Затем полученные пробы разделяли электрофорезом в полиакриламидном геле по Лэммли и анализировали методом иммуноблоттинга с антителами против РЛЦ, дифосфорилированных РЛЦ и монофосфорилированных РЛЦ. Мембраны проявляли с помощью набора ECL от фирмы Thermo. Для детекции использовали гель- и хеми-документирующую систему Fusion SL4 фирмы Vilber Lourmat (Франция). Полученные снимки обрабатывали в программе Image J, которая позволяет оценить яркость полос на электрофорезе в относительных единицах. Уровни фосфорилирования / дифосфорилирования РЛЦ нормировали на общий уровень РЛЦ. Затем объединяли данные по моно- и дифосфорилированию для каждого образца и представляли как общий уровень фосфорилированных форм РЛЦ миозина в эндотелиальных клетках.
Показано (см. Фиг. 4), что заявляемый пептид ПИК7 обладает способностью ингибировать фосфорилирование РЛЦ миозина в эндотелии, и его эффективность превышает таковую для прототипа ПИК2 и аналога MLC11-19.
Пример 5. Исследование острой токсичности и переносимости ПИК2 и ПИК7 при введении лабораторным животным
Исследования проведены на 82 мышах линии BALB/c (самцы и самки, масса тела 18-24 г). Животных получали из питомника лабораторных животных ФГБУ НЦБМТ ФМБА России. Они были здоровы, имели ветеринарный сертификат качества и состояния здоровья. Животных содержали в клетках Т-3 5-10 особей в условиях искусственного освещения (по 12 часов светлого и темного времени) с принудительной 16-кратной в час вентиляцией, при температуре 20-22 С° и относительной влажности 50-65% на подстилке из древесных стружек, простерилизованных в сухожаровом шкафу. Животные имели свободный доступ к питьевой водопроводной воде и брикетированному корму ПК-120-1, ГОСТ Р50258-92 (ООО «Лабораторснаб»).
Препараты ПИК2 и ПИК7 вводили однократно внутрибрюшинно мышам в виде водных растворов. Длительность наблюдения за подопытными животными после введения препаратов составляла 14 дней. Использовали шкалу доз, в которой каждая последующая испытуемая доза выше предыдущей на 50%. Определяли первую дозу действующего вещества, при которой наблюдается гибель животного. В случае ПИК2 такая доза составляла 27 мг/кг. В случае ПИК7 она соответствовала 1274 мг/кг, т.е. превышала таковую для ПИК2 в 47 раз.
Проведенные исследования показали, что однократное внутрибрюшинное введение ПИК2 и ПИК7 в токсических дозах сопровождается заторможенностью мышей, после чего мыши погибали в течение 24 часов.
Исследована переносимость препаратов ПИК2 и ПИК7 при однократном внутривенном введении кроликам Шиншилла. Исследования ПИК2 проводили на 4 кроликах Шиншилла (самцы, масса тела 3.43-3.82 кг). Исследования ПИК7 проводили на 4 кроликах Шиншилла (самцы, масса тела 2.69-2.89 кг).
Испытанная доза препарата ПИК2 - 5 мг/кг в 5 раз превышала высшую предполагаемую терапевтическую дозу для человека (1 мг/кг). Изучаемую субстанцию ПИК2 в исследуемой дозе 5 мг/кг, рассчитанной индивидуально для каждого животного, вводили в краевую вену уха кроликам в объеме 1,7-1,9 мл в стерильном физрастворе. Концентрация изучаемого препарата составляла 10 мг/мл. В случае ПИК7 испытывали дозу 10 мг/кг, в 10 раз превышающую предполагаемую терапевтическую дозу для человека. Препарат ПИК7 в концентрации 11.1 мг/мл вводили кроликам в объеме 2.4-2.6 мл.
Животные содержались в стандартных условиях вивария, имели свободный доступ к брикетированному корму К-122 и водопроводной питьевой воде. На протяжении опытных суток отмечали общее состояние и поведение животных (аппетит, двигательная активность, состояние шерстного покрова).
До введения препаратов (фон), а также через 4 и 24 часа в цельной венозной крови исследовали следующие гематологические показатели: количество эритроцитов, гематокрит, уровень гемоглобина, средний объем эритроцитов, среднее содержание гемоглобина в эритроците, общее количество лейкоцитов, лимфоцитов, гранулоцитов и их процентное содержание, количество тромбоцитов, средний объем тромбоцитов. В сыворотке крови в эти же сроки определяли следующие биохимические показатели: общий белок, билирубин, мочевина, креатинин, глюкоза, общий холестерин, триглицериды, а также активность щелочной фосфатазы, лактатдегидрогеназы, аспартат- и аланинаминотрансфераз. Для определения указанных показателей кровь брали из краевой вены уха кролика в объеме 3,0-3,5 мл. Подсчет форменных элементов крови производили на гематологическом анализаторе Abacus junior vet (Австрия), биохимические исследования были выполнены на анализаторе Targa-2000 (Италия).
Проведенные исследования показали, что на второй минуте после внутривенного введения препарата ПИК2 в дозе 5 мг/кг у кроликов наблюдались прерывистое дыхание, одышка, мышечная ригидность, положение на животе с вытянутыми конечностями. Два кролика из 4-х через 30 мин после введения препарата приняли свое обычное положение, существенных изменений в общем состоянии и поведении этих подопытных животных замечено не было. Два других кролика погибли на 7-ой и 10-ой минутах после введения препарата.
После внутривенного введения препарата ПИК7 в дозе 10 мг/кг не было выявлено существенных изменений в общем состоянии и поведении кроликов, они сохраняли обычную двигательную активность и аппетит, имели неизмененный гладкий шерстный покров, гибели животных не отмечалось. Через 24 часа после введения ПИК7 у кроликов наблюдалось небольшое, но достоверное снижение уровня гемоглобина (131+5 г/л против 120+7 г/л), гематокрита (38.81+1.49% против 35.90+0.18%) и общего белка сыворотки крови (73.6+2.58 г/л против 69.2+0.47 г/л), а уровень триглицеридов превышал фоновые значения (1.63 ммоль/л против 2.79 ммоль/л). На другие стандартные гематологические и биохимические показатели препарат ПИК7 влияния не оказал. Таким образом, ПИК7 значительно превосходит ПИК2 по переносимости кроликами и не вызывает их гибель в дозах на порядок превышающих максимальную предполагаемую терапевтическую дозу для человека (1 мг/кг).
Литература.
Chilcoat, C.D., Y. Sharief, and S.L. Jones. 2008. Tonic protein kinase A activity maintains inactive beta2 integrins in unstimulated neutrophils by reducing myosin light-chain phosphorylation: role of myosin light-chain kinase and Rho kinase. J Leukoc Biol. 83:964-971.
Clayburgh, D.R., T.A. Barrett, Y. Tang, J.B. Meddings, L.J. Van Eldik, D.M. Watterson, L.L. Clarke, R.J. Mrsny, and J.R. Turner. 2005. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. The Journal of clinical investigation. 115:2702-2715.
Glyn, M.C., and B.J. Ward. 2000. Contraction in cardiac endothelial cells contributes to changes in capillary dimensions following ischaemia and reperfusion. Cardiovasc Res. 48:346-356.
Hruby, V.J., and X. Qian. 1994. Approaches to the asymmetric synthesis of unusual amino acids. Methods Mol Biol. 35:249-286.
Hunt, J.T., D.M. Floyd, V.G. Lee, D.K. Little, and S. Moreland. 1989. Minimum requirements for inhibition of smooth-muscle myosin light-chain kinase by synthetic peptides. Biochem J. 257:73-78.
Khapchaev, A.Y., O.A. Kazakova, M.V. Samsonov, M.V. Sidorova, V.N. Bushuev, E.L. Vilitkevich, A.A. Az'muko, A.S. Molokoedov, Z.D. Bespalova, and V.P. Shirinsky. 2016. Design of peptidase-resistant peptide inhibitors of myosin light chain kinase. J Pept Sci. 22:673-681.
Khapchaev, A.Y., and V.P. Shirinsky. 2016. Myosin Light Chain Kinase MYLK1: Anatomy, Interactions, Functions, and Regulation. Biochemistry (Mosc). 81:1676-1697.
Lukas, T.J., S. Mirzoeva, U. Slomczynska, and D.M. Watterson. 1999. Identification of novel classes of protein kinase inhibitors using combinatorial peptide chemistry based on functional genomics knowledge. Journal of medicinal chemistry. 42:910-919.
Owens, S.E., W.V. Graham, D. Siccardi, J.R. Turner, and R.J. Mrsny. 2005. A strategy to identify stable membrane-permeant peptide inhibitors of myosin light chain kinase. Pharm Res. 22:703-709.
Pearson, R.B., L.Y. Misconi, and B.E. Kemp.1986. Smooth muscle myosin kinase requires residues on the COOH-terminal side of the phosphorylation site. Peptide inhibitors. J Biol Chem. 261:25-27.
Wainwright, M.S., J. Rossi, J. Schavocky, S. Crawford, D. Steinhorn, A.V. Velentza, M. Zasadzki, V. Shirinsky, Y. Jia, J. Haiech, L.J. Van Eldik, and D.M. Watterson. 2003. Protein kinase involved in lung injury susceptibility: evidence from enzyme isoform genetic knockout and in vivo inhibitor treatment. Proceedings of the National Academy of Sciences of the United States of America. 100:6233-6238.
Хапчаев, А.Ю., M.B. Самсонов, O.A. Казакова, Е.Л. Вилиткевич, M.B. Сидорова, A.A. Азьмуко, А.С. Молокоедов, Ж.Д. Беспалова, and В.П. Ширинский. 2012. Подавление гиперпроницаемости сосудистого эндотелия с помощью проникающих пептидных ингибиторов киназы легких цепей миозина. Биофизика. 57:764-770.
Абрамов, А.А., А.А. Азьмуко, Ж.Д. Беспалова, В.Н. Бушуев, Е.Л. Вилиткевич, О.А. Казакова, В.И. Капелько, В.Л. Лакомкин, А.С. Молокоедов, М.В. Самсонов, М.В. Сидорова, А.Ю. Хапчаев, and В.П. Ширинский. 2012. Амид нонапептида, препятствующий повышению гиперпроницаемости сосудистого эндотелия, п.и.т.з. Федеральная служба по интеллектуальной собственности, editor, Российская Федерация.
Беспалова, Ж.Д., В.Н. Бушуев, Т.Г. Куликова, А.В. Марченко, А.С. Молокоедов, А.В. Секридова, М.В. Сидорова, О.В. Степанова, and В.П. Ширинский. 2009. Амид нонапептида, обладающий способностью предотвращать повышение проницаемости эндотелия сосудов, п.и.т.з. Федеральная служба по интеллектуальной собственности, editor, Российская Федерация. 8.
Исакова, О.Л., Н.Ф. Сепетов, В.Н. Бушуев, Ж.Д. Беспалова, В.А. Виноградов, Э.К. Рууге, and М.И. Титов. 1986. Исследование деградации пептидов в сыворотке крови методом 1Н-ЯМР. Биоорганическая химия. 12:106-111.
Марченко, А.В., Е.О. Степанова, А.В. Секридова, М.В. Сидорова, В.Н. Бушуев, Ж.Д. Беспалова, and В.П. Ширинский. 2010. Новые пептидные ингибиторы киназы легких цепей миозина подавляют гиперпроницаемость эндотелия сосудов. Биофизика. 55:1008-1013.
Секридова, А.В., М.В. Сидорова, А.А. Азьмуко, А.С. Молокоедов, В.Н. Бушуев, А.В. Марченко, О.В. Щербакова, В.П. Ширинский, and Ж.Д. Беспалова. 2010. Пептидные ингибиторы киназы легких цепей миозина. Разработка аналогов, устойчивых к действию пептидаз. Биоорганическая химия. 36:498-504.
Ширинский, В.П. 2011. Молекулярная физиология эндотелия и механизмы проницаемости сосудов. Успехи физиологических наук. 42:18-32.