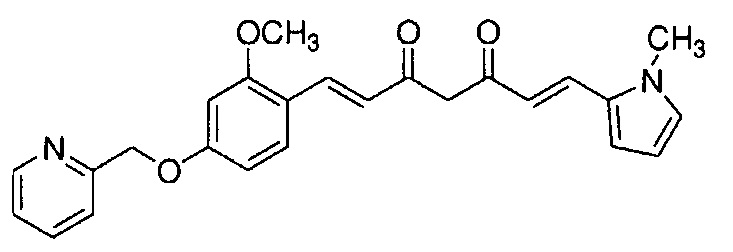
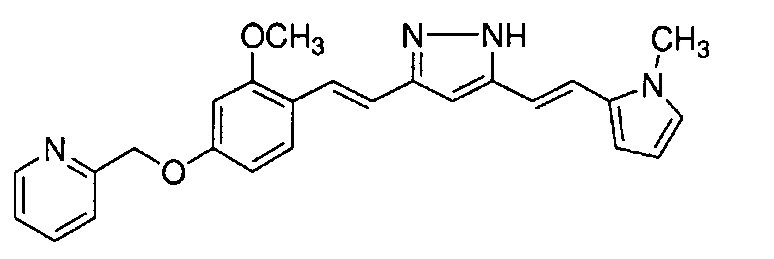
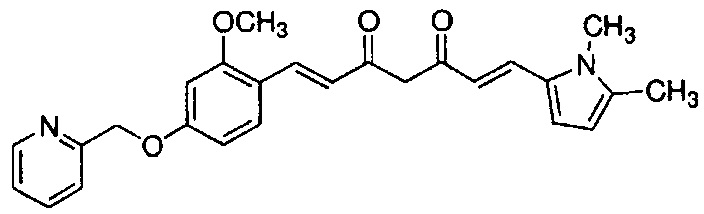
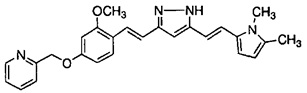
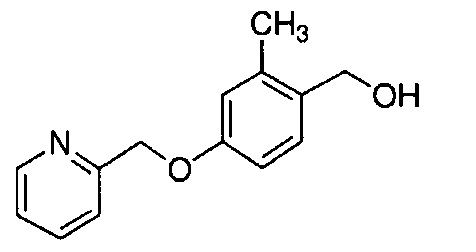
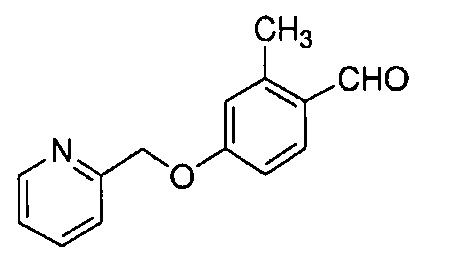
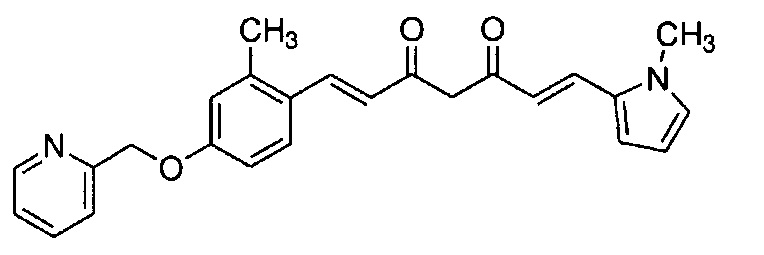
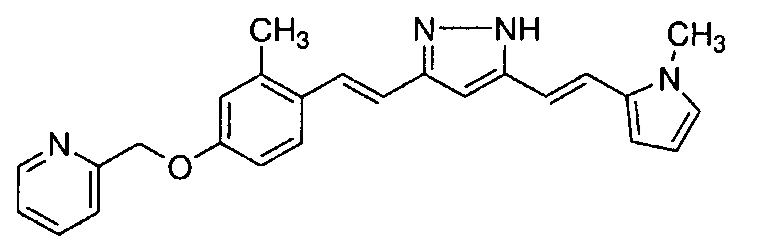
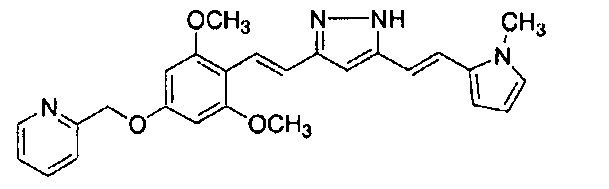
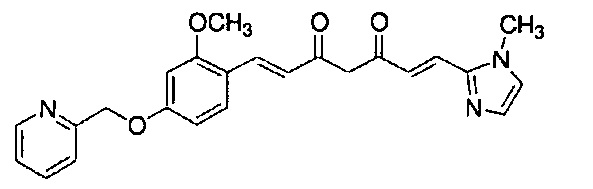
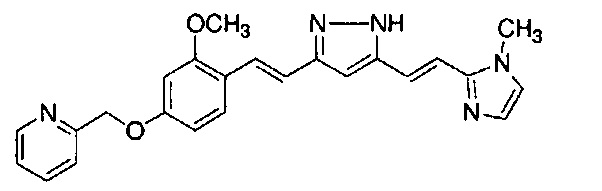
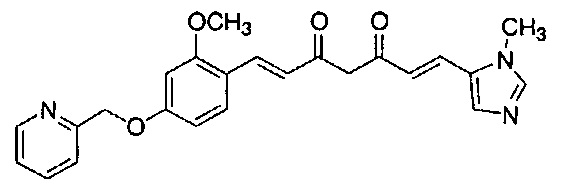
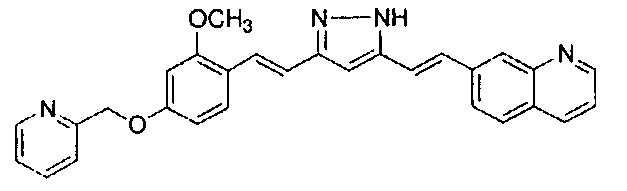
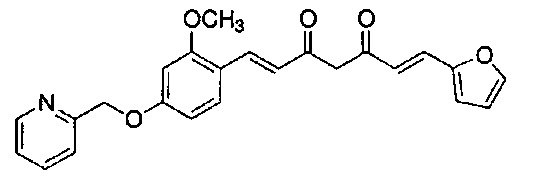
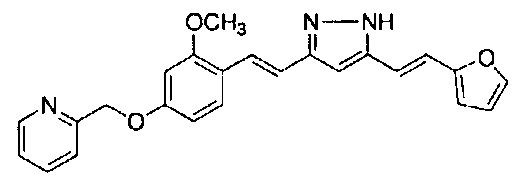
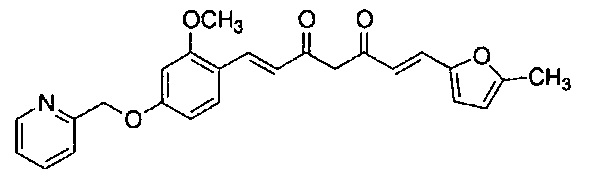
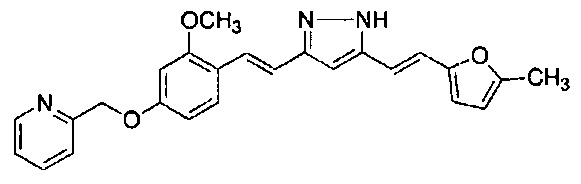
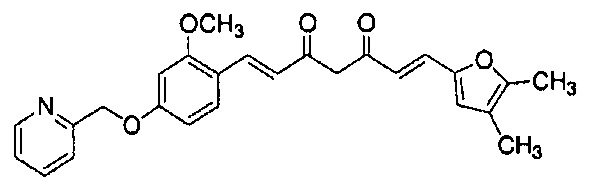
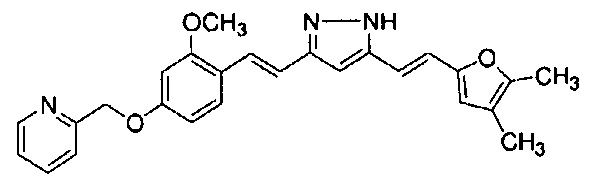
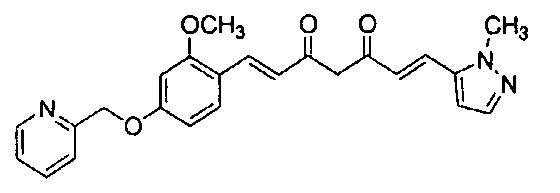
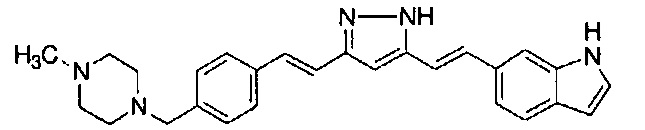
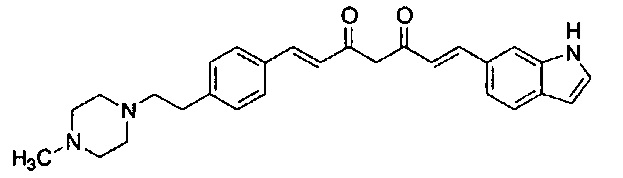
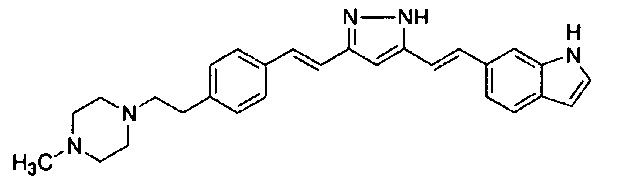
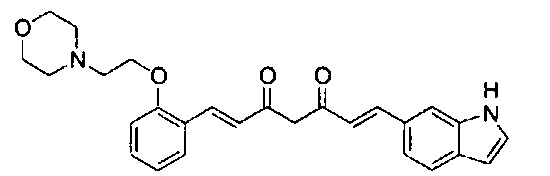
Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому соединению; ингибитору агрегации тау-белка (здесь и далее именуемого просто как тау), ингибитору β-секретазы и ингибитору агрегации β-амилоидного белка (здесь и далее также именуемого как Aβ), к его применению; и к новому производному пиразола, которое можно использовать для предотвращения или лечения заболеваний, таких как деменция и болезнь Альцгеймера, и к фармацевтической композиции его содержащей.
Известный уровень техники
Старческая деменция стала серьезной медицинской проблемой наряду с быстрым старением общества в последние годы, и поэтому весьма желательно создание эффективных лекарственных средств для лечения деменции. Уже существует множество исследований, касающихся болезни Альцгеймера, но до сих пор четко не определена причина этой болезни. Такие лекарственные средства, как ингибиторы ацетилхолинэстеразы, включающие донепезил (Aricept (зарегистрированная торговая марка)), галантамин (Reminyl) и ривастигмин (Exelon/Rivastach) и антагонисты рецептора NMDA, включая мемантингидрохлорид (Memary), использовались в качестве терапевтических средств для лечения болезни Альцгеймера. Указанные лекарственные средства весьма полезны в симптоматической терапии, но не являются лекарственными средствами для фундаментального лечения.
Считают, что болезнь Альцгеймера вызывается агрегацией Aβ, агрегацией тау и т.п. Поэтому вещество, которое ингибирует агрегацию указанных белков, можно использовать в качестве фундаментального терапевтического лекарственного средства против болезни Альцгеймера.
Yang et al. сообщали, что куркумин обладает ингибирующей активностью в отношении агрегации Aβ, дисагрегационной активностью в отношении Aβ агрегатов и т.п. (непатентная литература 1). Авторы настоящего изобретения обнаружили, что куркумин и его производные обладают ингибирующей активностью в отношении секретазы, которая участвует в образовании Aβ (патентная литература 1 и 2). Narlawar et al. синтезировали производные куркумина, заменяя 1,3-дикарбонильный фрагмент на пиразольное кольцо, и сообщили, что полученные соединения обладают ингибирующей активностью в отношении агрегации тау (непатентная литература 2).
Список цитированной патентной литературы
Патентная литература 1: WО 2008/066151,
Патентная литература 2: WО 2009/145219
Непатентная литература
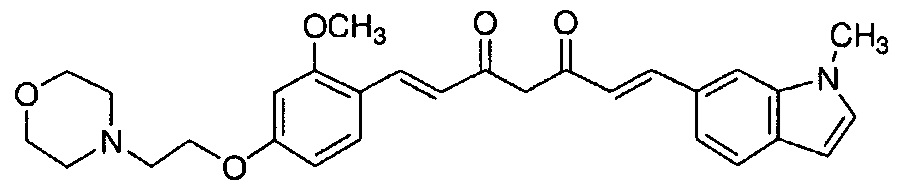
Непатентная литература 1: Fusheng Yang et al., J. Biol. Chem. 2005, Feb 18; 280 (7) 5892-5901
Непатентная литература 2: Rajeshwar Narlawar et al., ChemMedChem 2008, 3, 165-172
Сущность изобретения
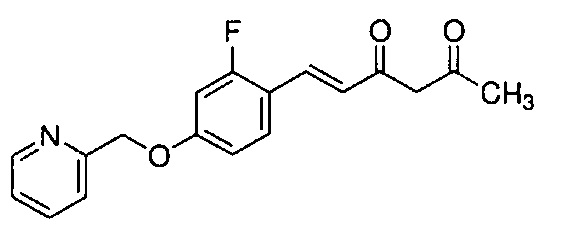
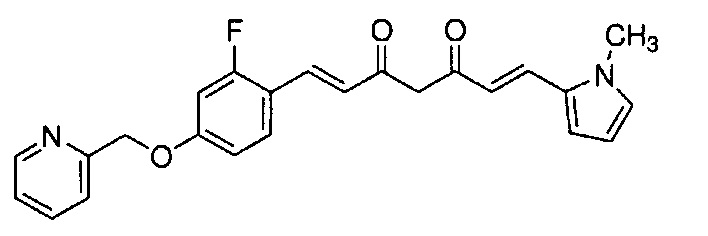
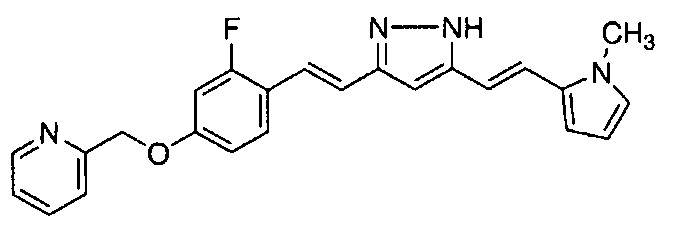
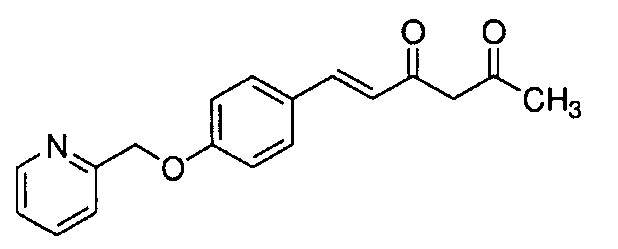
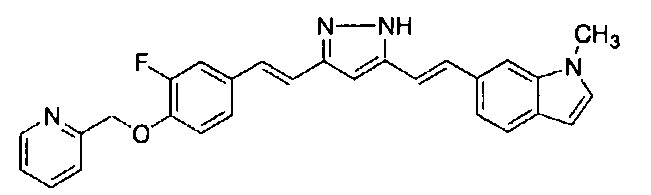
Техническая проблема
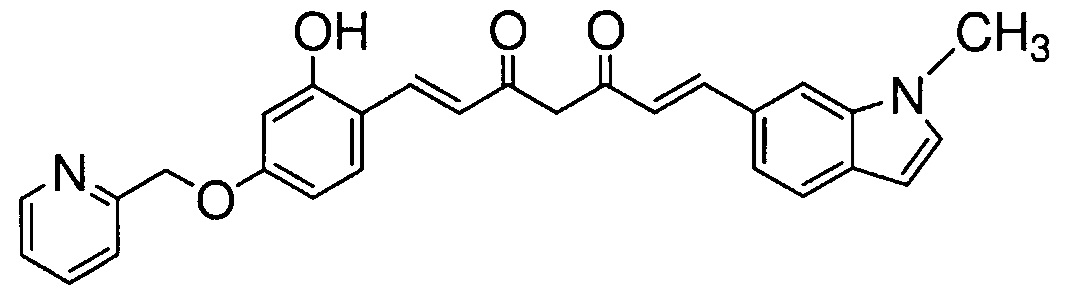
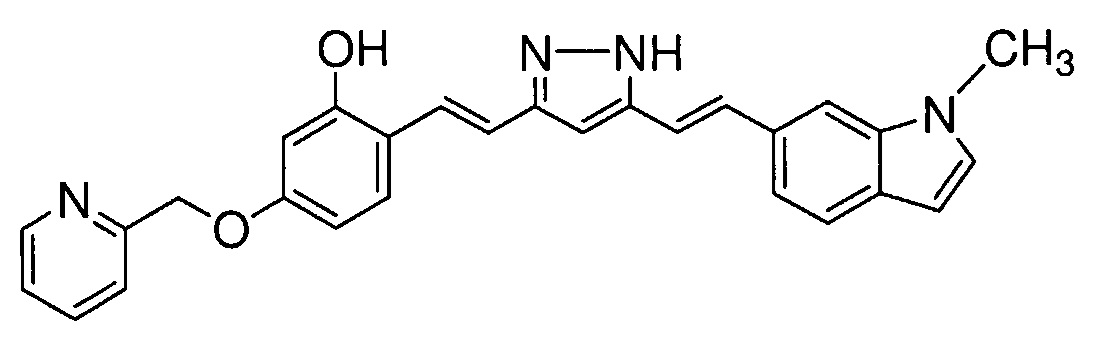
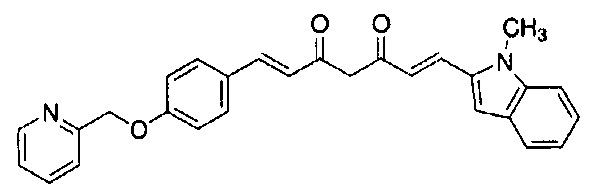
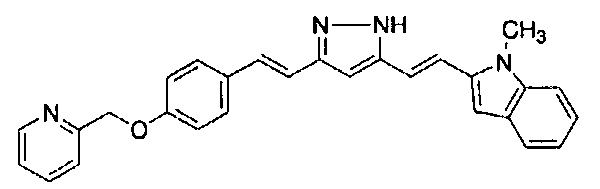
Как раскрыто в вышеуказанной литературе, производное куркумина может быть обещающим кандидатом для фундаментального терапевтического лекарственного средства для лечения болезни Альцгеймера. Учитывая существующие технические предпосылки, целью настоящего изобретения является создание новых терапевтических средств для лечения болезни Альцгеймера.
Решение проблемы
Авторам удалось получить новое соединение на основании технических идей, которые отличаются от тех, которые составляют основу известных соединений, и обнаружили, что такое соединение обладает превосходной фармакологической активностью. Затем авторы предприняли интенсивные исследования для завершения настоящего изобретения.
В результате интенсивных исследований с целью решения вышеуказанных проблем, авторы синтезировали производное куркумина, заменяя 1,3-дикарбонильный фрагмент куркумина на пиразольное кольцо, и заменяя по меньшей мере одну из 4-гидрокси-3-метоксифенильных групп с обоих концов заместителем, и обнаружили, что такое новое соединение обладает эффективной ингибирующей агрегацию тау активностью. Авторы также обнаружили, что указанное производное обладает высокой способностью проникновения в мозг и также обладает ингибирующей β-секретазу активностью и активностью ингибирования агрегации Aβ.
Производное куркумина, в котором 1,3-дикарбонильный фрагмент куркумина заменен пиразольным кольцом, описано в непатентной литературе 2 и т.д. Производное куркумина, в котором одна из 4-гидрокси-3-метоксифенильных групп с обоих концов куркумина заменена заместителем, раскрыто в патентной литературе 1 и 2, и т.д. Однако, производное настоящего изобретения, которое содержит пиразольное кольцо, и в котором по меньшей мере одна из 4-гидрокси-3-метоксифенильных групп с обоих концов заменена заместителем, представляет собой новое соединение с химической структурой, которая является уникальной для настоящего изобретения и отличается от структур соединений, раскрытых в известной литературе.
Активность ингибирования агрегации тау производными куркумина раскрыта в непатентной литературе 2. В указанной литературе атом азота в положении 1 пиразольного кольца заменяют различными группами, и активности ингибирования агрегации тау указанными производными существенно варьируется в зависимости от групп, введенных в кольцо. Однако, не были осуществлены никакие модификации с обоих концов бензольных колец и, таким образом, все синтезированные производные содержат 4-гидрокси-3-метоксифенильные группы, как и куркумин. Поэтому предполагается, что специалист, прочитавший непатентную литературу 2, придет к выводу, что группа, введенная в пиразольное кольцо, играет важную роль в активности ингибирования агрегации тау, и что 4-гидрокси-3-метоксифенильные группы с обоих концов не имеют отношения к активности ингибирования агрегации тау. Поэтому специалист в данной области не предпримет попыток заменить 4-гидрокси-3-метоксифенильные группы заместителем.
Таким образом, настоящее изобретение относится к следующему.
[1] Соединение, представленное следующей общей формулой (I):
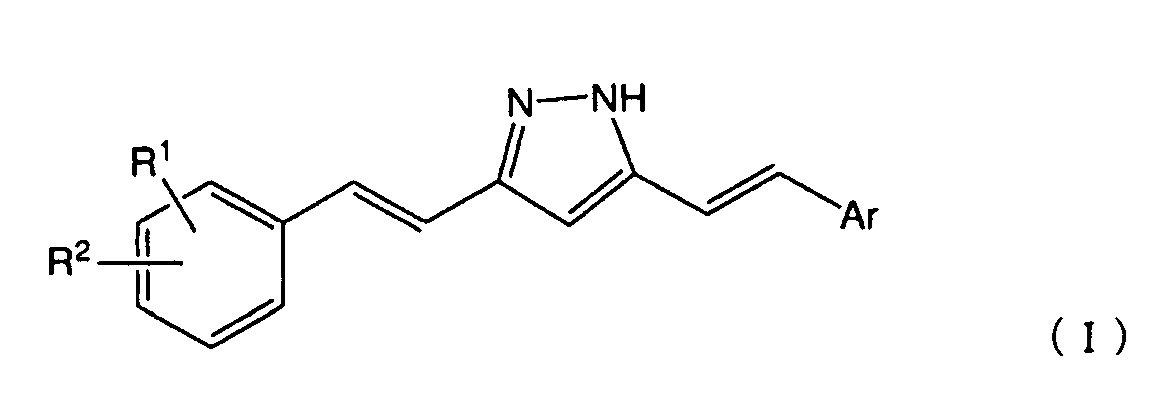
[где
R1 представляет собой атом водорода, атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, цианогруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, C1-6 алкилтиогруппу, необязательно содержащую один или более заместителей, C1-6 алкилсульфонильную группу, необязательно содержащую один или более заместителей, C1-6 ацильную группу, необязательно содержащую один или более заместителей, C1-6 ациламиногруппу, необязательно содержащую один или более заместителей, C2-6 алкенильную группу, необязательно содержащую один или более заместителей, C2-6 алкенилоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, C2-6 алкенилтиогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей;
R2 представляет собой группу, представленную следующей общей формулой (II):
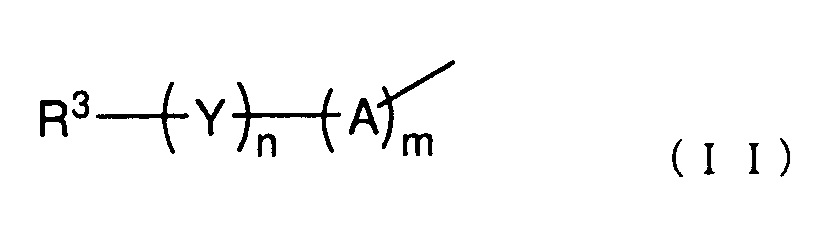
(где каждый m и n представляет собой целое число 0 или 1,
A представляет собой -O-, -NH-, -S-, -SO- или -SO2-,
Y представляет собой C1-6 алкиленовую группу, C2-6 алкениленовую группу или C2-6 алкиниленовую группу, и
R3 представляет собой азотсодержащую гетероциклическую группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, моно- или ди (C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей);
R1 и R2 могут быть соединены с образованием кольца вместе с бензольным кольцом; и
Ar представляет собой гомоциклическую или гетероциклическую группу, необязательно содержащую один или более заместителей],
или его соль.
[2] Соединение по п. [1] или его соль, где m представляет собой 1, и A представляет собой -O-.
[3] Соединение по п. [2] или его соль, где R2 представляет собой морфолинометоксигруппу, морфолиноэтоксигруппу, пиридилметоксигруппу, пиридилэтоксигруппу, 2-пирролидиноэтоксигруппу, 2-пиперидиноэтоксигруппу, 2-(4-(замещенный)пиперазино)этоксигруппу или 2-(1,1-диоксо-1,4-тиазинан-4-ил)этоксигруппу.
[4] Соединение по п. [3] или его соль, где R2 представляет собой морфолиноэтоксигруппу.
[5] Соединение по п. [1] или его соль, где R2 представляет собой морфолинометильную группу, (4-(замещенный)пиперазино)метильную группу, (1,1-диоксо-1,4-тиазинан-4-ил)метильную группу, пиперидинометильную группу, пирролидинометильную группу, 2-морфолиноэтильную группу, 2-(4-(замещенный)пиперазино)этильную группу, 2-(1,1-диоксо-1,4-тиазинан-4-ил)этильную группу, 2-пиперидиноэтильную группу, 2-пирролидиноэтильную группу или 2-морфолиноэтансульфонильную группу.
[6] Соединение по п. [1] или его соль, где R2 представляет собой 4-(замещенный)пиперазинoгруппу или 4-(замещенный)-1,4-диазепанoгруппу, за исключением случаев, когда Ar представляет собой гомоциклическую группу, необязательно содержащую заместитель.
[7] Соединение по любому одному из пп. [1]-[6] или его соль, где Ar представляет собой бициклическую группу, содержащую бензольный скелет и необязательно содержащую один или более заместителей.
[8] Соединения по п. [7] или его соль, где бициклическая группа, содержащая бензольный скелет, представляет собой группу 1,3-бензодиоксола, группу 1,4-бензодиоксан-5-ила, группу 1,4-бензодиоксан-6-ила, группу 1,4-бензодиоксин-2-ила, хинолиногруппу или индолильную группу.
[9] Соединение по любому одному из пп. [1]-[5] или его соль, где Ar представляет собой фенильную группу, необязательно содержащую один или более заместителей, пирролильную группу, необязательно содержащую один или более заместителей, пиридильную группу, необязательно содержащую один или более заместителей, пиразильную группу, необязательно содержащую один или более заместителей, имидазолильную группу, необязательно содержащую один или более заместителей, или фурильную группу, необязательно содержащую один или более заместителей.
[10] Соединение по п.[6] или его соль, где Ar представляет собой пирролильную группу, необязательно содержащую один или более заместителей, пиридильную группу, необязательно содержащую один или более заместителей, пиразильную группу, необязательно содержащую один или более заместителей, имидазолильную группу, необязательно содержащую один или более заместителей, или фурильную группу, необязательно содержащую один или более заместителей.
[11] Соединение по п. [1] или его соль, где Ar представлен следующей общей формулой (III):
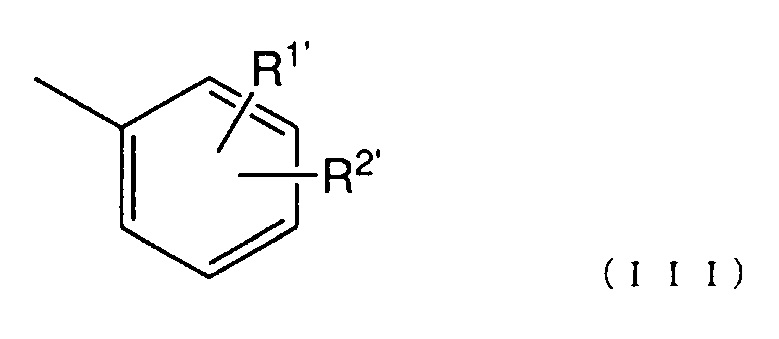
(где
R1' представляет собой атом водорода, атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, цианогруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди (C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, C1-6 алкилтиогруппу, необязательно содержащую один или более заместителей, C1-6 алкилсульфонильную группу, необязательно содержащую один или более заместителей, C1-6 ацильную группу, необязательно содержащую один или более заместителей, C1-6 ациламиногруппу, необязательно содержащую один или более заместителей, C2-6 алкенильную группу, необязательно содержащую один или более заместителей, C2-6 алкенилоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, C2-6 алкенилтиогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей;
R2' представляет собой группу, представленную следующей общей формулой (IV):
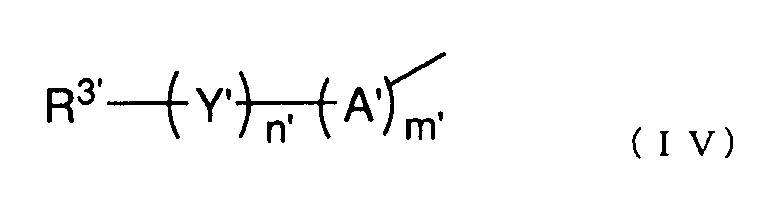
(где каждый m' и n' представляет собой целое число 0 или 1,
A' представляет собой -O-, -NH-, -S-, -SO- или -SO2-,
Y' представляет собой C1-6 алкиленовую группу, C2-6 алкениленовую группу или C2-6 алкиниленовую группу, и
R3' представляет собой азотсодержащую гетероциклическую группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей), и
R1' и R2' могут образовывать кольцо вместе с бензольным кольцом).
[12] Ингибитор агрегации тау, содержащий соединение по любому одному из пп. [1]-[11] или его соль, в качестве активного ингредиента.
[13] Ингибитор β-секретазы, включающий соединение по любому одному из пп. [1]-[11] или его соль, в качестве активного ингредиента.
[14] Ингибитор агрегации Aβ, включающий соединения по любому одному из пп. [1]-[11] или его соль, в качестве активного ингредиента.
[15] Фармацевтическая композиция, включающая соединение по любому одному из пп. [1]-[11] или его соль, в качестве активного ингредиента.
[16] Фармацевтическая композиция по п. [15], предназначенная для предотвращения или лечения заболеваний, в которых участвуют тау, β-секретаза или Aβ.
[17] Применение соединения по п. 1 или его соли при получении профилактического или терапевтического лекарственного средства для лечения заболеваний, в которых участвуют тау, β-секретаза или Aβ.
[18] Соединение по любому одному из пп. [1]-[11] или его соль, предназначенное для предотвращения или лечения заболеваний, в которых участвуют тау, β-секретаза или Aβ.
[19] Способ предотвращения или лечения заболеваний, в которых участвуют тау, β-секретаза или Aβ, включающий стадию введения пациенту соединения по п. [1].
[20] Фармацевтическая композиция по п. [15], предназначенная для предотвращения или лечения болезни Альцгеймера.
[21] Применение соединения по п. [1] или его соли при производстве профилактического или терапевтического лекарственного средства для лечения болезни Альцгеймера.
[22] Соединение по любому одному из пп. [1]-[11] или его соль, предназначенное для предотвращения или лечения болезни Альцгеймера.
[23] Способ предотвращения или лечения болезни Альцгеймера, включающий введение пациенту соединения по п. [1].
[24] Лекарственное средство для перорального или парентерального введения, включающее соединение по любому одному из пп. [1]-[11] или его соль и один или более фармакологически приемлемых носителей.
Благоприятные эффекты настоящего изобретения
Соединение настоящего изобретения особенно превосходно в отношении активности ингибирования агрегации тау, активности ингибирования β-секретазы, активности ингибирования агрегации Aβ и/или т.п., и поэтому полезно в качестве терапевтического лекарственного средства для лечения болезни Альцгеймера и т.п. Соединение настоящего изобретения также обладает высокой проникающей способностью в мозг, и поэтому может представлять собой высокоэффективное терапевтическое лекарственное средство.
Предпочтительные варианты осуществления настоящего изобретения
Настоящее изобретение более подробно раскрыто далее.
В настоящем изобретении термин "атом галогена" означает атом фтора, атом хлора, атом брома и атом йода. Термин "C1-6 алкильная группа" означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и примеры таких групп включают метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, втор-бутильную, трет-бутильную, н-пентильную, неопентильную и н-гексильную группы. Термин "гало C1-6 алкильная группа" означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную одним или более атомами галогенов, которые могут быть однаковыми или различными, и примеры таких групп включают трифторметильную, дифторметильную, перфторэтильную, гексафторизопропильную, перфторизопропильную, хлорметильную, бромметильную, 1-бромэтильную и 2,3-дибромпропильную группы.
Термин "C1-6 алкоксигруппа" означает неразветвленную или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода, и примеры таких групп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, неопентилокси и н-гексилоксигруппы. Термин "гало C1-6 алкоксигруппа" означает неразветвленную или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода, замещенную одним или более из атомов галогенов, которые могут быть одинаковыми или различными, и примеры таких групп включают трифторметокси, дифторметокси, перфторэтокси, перфторизопропокси, хлорметокси, бромметокси, 1-бромэтокси и 2,3-дибромпропокси группы.
Термин "C1-6 ацильная группа" означает неразветвленную или разветвленную ацильную группу, содержащую от 1 до 6 атомов углерода, и примеры таких групп включают формильную, ацетильную, пропионильную, бутирильную, 2-метилпропионильную, пивалоильную, пентаноильную, 3-метилбутирильную и гексаноильную группы. Термин "гало C1-6 ацильная группа" означает неразветвленную или разветвленную ацильную группу, содержащую от 1 до 6 атомов углерода, замещенную одним или более атомами галогенов, которые могут быть одинаковыми или различными, и примеры таких групп включают хлорформильную, бромформильную, дихлорацетильную, дибромацетильную и трифторацетильную группы.
Термин "C1-6 алкилсульфонильная группа" означает неразветвленную или разветвленную алкилсульфонильную группу, содержащую от 1 до 6 атомов углерода, и примеры таких групп включают метилсульфонильную, этилсульфонильную, н-пропилсульфонильную, изопропилсульфонильную, н-бутилсульфонильную, втор-бутилсульфонильную, трет-бутилсульфонильную, н-пентилсульфонильную, изопентилсульфонильную и н-гексилсульфонильную группы. Термин "гало C1-6 алкилсульфонильная группа" означает неразветвленную или разветвленную алкилсульфонильную группу, содержащую от 1 до 6 атомов углерода, замещенную одним или более атомами галогенов, которые могут быть одинаковыми или различными, и примеры таких групп включают трифторметилсульфонильную, дифторметилсульфонильную, перфторэтилсульфонильную, перфторизопропилсульфонильную, хлорметилсульфонильную, бромметилсульфонильную, 1-бромэтилсульфонильную и 2,3-дибромпропилсульфонильную группы.
Термин "моно- или ди(C1-6 алкил)аминогруппа" означает аминогруппу, моно- или ди-замещенную вышеуказанной C1-6 алкильной группой, и примеры таких групп включают метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино, трет-бутиламино, диметиламино, диэтиламино, этилметиламино, дипропиламино, метилпропиламино и диизопропиламиногруппы. Термин "C1-6 алкилтиогруппа" означает неразветвленную или разветвленную алкилтиогруппу, содержащую от 1 до 6 атомов углерода, и примеры таких групп включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, трет-бутилтио, н-пентилтио, изопентилтио и н-гексилтио группы. Термин "C1-6 ациламиногруппа" означает аминогруппу, замещенную вышеуказанной C1-6 ацильной группой, и примеры таких групп включают ацетиламино и пропиониламиногруппы.
Термин "C2-6 алкенильная группа" означает неразветвленную или разветвленную алкенильную группу, содержащую от 2 до 6 атомов углерода, и примеры таких групп включают винильную, пропенильную и бутенильную группы. Термин "C2-6 алкенилоксигруппа" означает неразветвленную или разветвленную алкенилоксигруппу, содержащую от 2 до 6 атомов углерода, и примеры таких групп включают пропенилокси, бутенилокси и пентенилокси группы. Термин "моно- или ди(C2-6 алкенил)аминогруппа" означает алкениламиногруппу, моно- или ди-замещенную вышеуказанной C2-6 алкенильной группой, и примеры таких групп включают виниламино, пропениламино, бутениламино и дивиниламиногруппы.
Термин "C2-6 алкенилтиогруппа" означает неразветвленную или разветвленную алкенилтиогруппу, содержащую от 2 до 6 атомов углерода, и примеры таких групп включают винилтио, 1-пропенилтио, изопропенилтио, 1-бутенилтио, 2-бутенилтио и 2-метилаллилтиогруппы. Термин "азотсодержащая гетероциклическая группа" означает насыщенную или ненасыщенную гетероциклическую группу, содержащую один или более атомов азота, и необязательно содержащую один или более атомов кислорода и/или серы, и примеры таких групп включают пиридильную, пиримидильную, пиразильную, морфолино, 4-(замещенный)пиперазино (например, 4-метилпиперазино и т.д.), 1,1-диоксо-1,4-тиазинан-4-ильную, пиперидино, пирролидино, тиазолильную, азепан-1-ильную и 4-(замещенный)-1,4-диазепано (например, 4-метил-1,4-диазепано) группы.
Настоящее изобретение относится к соединению, представленному следующей общей формулой (I):
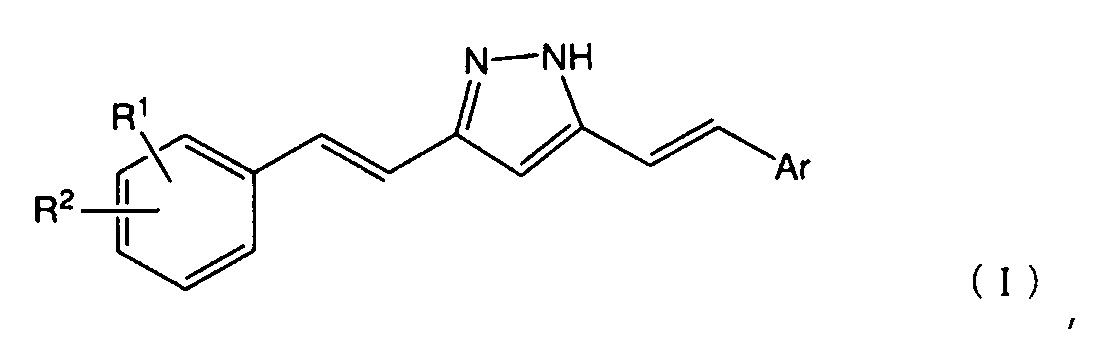
и к его соли.
В вышеуказанной общей формуле (I), R1 представляет собой атом водорода, атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, цианогруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, C1-6 алкилтиогруппу, необязательно содержащую один или более заместителей, C1-6 алкилсульфонильную группу, необязательно содержащую один или более заместителей, C1-6 ацильную группу, необязательно содержащую один или более заместителей, C1-6 ациламиногруппу, необязательно содержащую один или более заместителей, C2-6 алкенильную группу, необязательно содержащую один или более заместителей, C2-6 алкенилоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, C2-6 алкенилтиогруппу, необязательно содержащую один или более заместителей, карбамоильную группу, необязательно содержащую один или более заместителей, или т.п.
Заместители в R1 конкретно не ограничены до тех пор, пока эффекты настоящего изобретения не нарушаются, и примеры таких групп включают атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, морфолиногруппу и группу пиридила. R1 предпочтительно представляет собой гидроксигруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, или т.п., и более предпочтительно представляет собой гидрокси, метокси, этокси, морфолинометокси, морфолиноэтокси, пиридилметокси или пиридилэтоксигруппу или т.п. Положение R1 на бензольном кольце конкретно не ограничено до тех пор, пока эффекты настоящего изобретения не нарушаются, но если положение атома углерода, связанного с пиразольным кольцом через винильную группу, соответствует положению 1, тогда поожение R1 на бензольном кольце, предпочтительно представляет собой положение 2 или 3, более предпочтительно положение 2. В вышеуказанной общей формуле (I) R2 представляет собой группу, представленную следующей общей формулой (II):
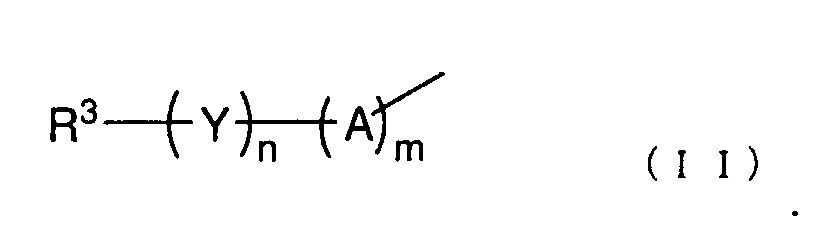
В вышеуказанной общей формуле (II), каждый m и n представляет собой целое число 0 или 1. A представляет собой -O-, -NH-, -S-, -SO-, -SO2- или т.п., и предпочтительно представляет собой -O-, -SO2- или т.п. Y представляет собой C1-6 алкиленовую группу, C2-6 алкениленовую группу, C2-6 алкиниленовую группу или т.п., и предпочтительно представляет собой метиленовую группу, этиленовую группу или т.п. R3 представляет собой азотсодержащую гетероциклическую группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей.
Заместители в R3 в вышеуказанной общей формуле (II) конкретно не ограничены до тех пор, пока эффекты настоящего изобретения не нарушаются. В тех случаях, когда R3 представляет собой азотсодержащую гетероциклическую группу, заместители предпочтительно представляют собой атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, C1-6 алкильную группу, гало C1-6 алкильную группу, C1-6 алкоксигруппу, гало C1-6 алкоксигруппу, C1-6 ацильную группу, гало C1-6 ацильную группу, C1-6 алкилсульфонильную группу, гало C1-6 алкилсульфонильную группу или т.п. В тех случаях, когда R3 представляет собой C1-6 алкоксигруппу, заместители предпочтительно представляют собой метоксигруппу, этоксигруппу, 2-метоксиэтоксигруппу или т.п. В тех случаях, когда R3 представляет собой моно- или ди(C1-6 алкил)аминогруппу или моно- или ди(алкенил)аминогруппу, заместители предпочтительно представляют собой C1-6 алкоксигруппу, гало C1-6 алкоксигруппу, C1-6 алкилсульфонильную группу, гало C1-6 алкилсульфонильную группу или т.п. В тех случаях, когда R3 представляет собой карбамоильную группу, заместители предпочтительно представляют собой C1-6 алкильную группу, C1-6 алкоксигруппу или т.п.
Предпочтительные конкретные примеры групп, представляющих R3, включают пиридильную, пиримидильную, пиразильную, морфолино, 4-(замещенный)пиперазино (например, 4-метилпиперазино), 4-(замещенный)-1,4-диазепано (например, 4-метил-1,4-диазепано), 1,1-диоксо-1,4-тиазинан-4-ильную, пиперидино, пирролидино, тиазолильную, метокси, этокси, пропокси, диметиламино, диэтиламино, изопропиламино, N,N-бис(2-метоксиэтил)амино, N-2-метоксиэтил-N-метиламино, N,N-бис(2-метилсульфонилэтил)амино, N-метил-N-(2-метилсульфонилэтил)амино и диметилкарбамоильную группы.
Наиболее предпочтительные конкретные примеры групп, представляющих R2, включают морфолиноэтокси, морфолинометокси, пиридилметокси, пиридилэтокси, 2-пирролидиноэтокси, 2-пиперидиноэтокси, 2-(4-(замещенный)пиперазино)этокси, 2-(1,1-диоксо-1,4-тиазинан-4-ил)этокси, морфолинометильную, (4-(замещенный)пиперазино)метильную, (1,1-диоксо-1,4-тиазинан-4-ил)метильную, пиперидинометильную, пирролидинометильную, 2-морфолиноэтильную, 2-(4-(замещенный)пиперазино)этильную, 2-(1,1-диоксо-1,4-тиазинан-4-ил)этильную, 2-пиперидиноэтильную, 2-пирролидиноэтильную, 2-морфолиноэтансульфонильную, метоксиметокси, метоксиэтокси, метоксиметильную, метоксиэтильную, диметиламино, диэтиламино, изопропиламино, N,N-бис(2-метоксиэтил)амино, N-2-метоксиэтил-N-метиламино, N,N-бис(2-метилсульфонилэтил)амино, N-метил-N-(2-метилсульфонилэтил)амино, диметиламинометил, диэтиламинометильную, N,N-бис(2-метоксиэтил)аминометильную, диметиламиноэтокси, 4-(замещенный)пиперазино, 4-(замещенный)-1,4-диазепано и диметилкарбамоилэтокси группы. Заместители, определяемые термином "замещенный", и заключенные в скобки, конкретно не ограничены до тех пор, пока не нарушаются эффекты настоящего изобретения, но предпочтительно представляют собой атом водорода, C1-6 алкильную группу или т.п., и особенно предпочтительно атом водорода, метильную группу, этильную группу, изопропильную группу или т.п. Положение R2 на бензольном кольце конкретно не ограничено до тех пор, пока эффекты настоящего изобретения не нарушаются, но если положение атома углерода, связанного с пиразольным кольцом через винильную группу, соответствует положению 1, тогда положение R2 на бензольном кольце предпочтительно представляет собой положение 3 или 4, более предпочтительно положение 4.
В вышеуказанной общей формуле (I), R1 и R2 могут быть соединены вместе с образованием кольца. В таком случае, R1 и R2 образуют конденсированное кольцо или т.п. вместе с бензольным кольцом, к которому присоединены R1 и R2. Примеры конденсированных колец включают 1,3-бензодиоксольную группу, необязательно содержащую один или более заместителей, 1,4-бензодиоксан-5-ильную группу, необязательно содержащую один или более заместителей, 1,4-бензодиоксан-6-ильную группу, необязательно содержащую один или более заместителей, 1,4-бензодиоксин-6-ильную группу, необязательно содержащую один или более заместителей, 1,4-бензодиоксин-2-ильную группу, необязательно содержащую один или более заместителей, хинолиногруппу, необязательно содержащую один или более заместителей, изохинолиногруппу, необязательно содержащую один или более заместителей, хиноксалиногруппу, необязательно содержащую один или более заместителей, и индолильную группу, необязательно содержащую один или более заместителей.
Заместители в вышеуказанных конденсированных кольцах конкретно не ограничены, и примеры таких групп включают те, которые приведены в качестве примеров для R1, R2 и R3.
В вышеуказанной общей формуле (I), Ar представляет собой гомоциклическую или гетероциклическую группу, необязательно содержащую один или более заместителей. Заместители конкретно не ограничены, пока эффекты настоящего изобретения не нарушаются. Предпочтительные примеры таких групп включают атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, C1-6 алкильную группу, гало C1-6 алкильную группу, C1-6 алкоксигруппу, гало C1-6 алкоксигруппу, C1-6 ацильную группу, гало C1-6 ацильную группу, C1-6 алкилсульфонильную группу и гало C1-6 алкилсульфонильную группу, и особенно предпочтительные примеры таких групп включают амино, гидрокси, метильную, этильную, метокси и этокси группы. Предпочтительные примеры гомоциклических или гетероциклических групп включают моноциклические группы, такие как фенильная, пирролильная, имидазолильная, фурильная, пиридильная и пиразильная группы, и бициклические группы с бензольным скелетом.
Предпочтительные примеры бициклических групп с бензольным скелетом включают 1,3-бензодиоксольную, 1,4-бензодиоксан-5-ильную, 1,4-бензодиоксан-6-ильную, 1,4-бензодиоксин-6-ильную, 1,4-бензодиоксин-2-ильную, хинолино, изохинолино, хиноксалино и индолильную группы. Особенно предпочтительные примеры индолильных групп, необязательно содержащих один или более заместителей, включают 1-метилиндолильную группу.
В тех случаях, когда Ar представляет собой фенильную группу, необязательно содержащую один или более заместителей, Ar предпочтительно представляет собой заместитель, представленный, например, следующуей общей формулой (III):
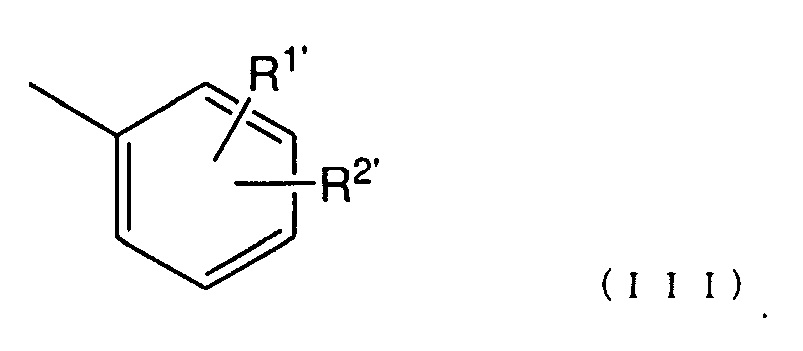
В вышеуказанной общей формуле (I), R1' представляет собой атом водорода, атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, цианогруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, C1-6 алкилтиогруппу, необязательно содержащую один или более заместителей, C1-6 алкилсульфонильную группу, необязательно содержащую один или более заместителей, C1-6 ацильную группу, необязательно содержащую один или более заместителей, C1-6 ациламиногруппу, необязательно содержащую один или более заместителей, C2-6 алкенильную группу, необязательно содержащую один или более заместителей, C2-6 алкенилоксигруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, C2-6 алкенилтиогруппу, необязательно содержащую один или более заместителей, карбамоильную группу, необязательно содержащую один или более заместителей, или т.п.
Заместители в R1' конкретно не ограничены до тех пор, пока эффекты настоящего изобретения не нарушаются, и примеры таких групп включают атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, морфолиногруппу, и пиридильную группу. R1' предпочтительно представляет собой гидроксигруппу, C1-6 алкильную группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, или т.п., и более предпочтительно гидрокси, метокси, этокси, морфолинометокси, морфолиноэтокси, пиридилметокси или пиридилэтоксигруппу, или т.п. Положение R1' на бензольном кольце конкретно не ограничено до тех пор, пока эффекты настоящего изобретения не нарушаются, но в тех случаях, когда положение атома углерода, связанного с пиразольным кольцом через винильную группу, определено как положение 1, тогда положение R1' на бензольном кольце предпочтительно представляет собой положение 2 или 3, более предпочтительно положение 2.
В вышеуказанной общей формуле (III) R2' представляет собой группу, представленную следующей общей формулой (IV):
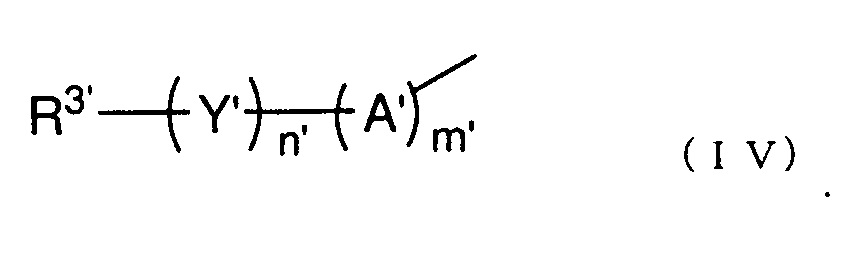
В вышеуказанной общей формуле (IV), каждый m' и n' представляет собой целое число 0 или 1. A' представляет собой -O-, -NH-, -S-, -SO-, -SO2-, или т.п., и предпочтительно представляет собой -O-, -SO2- или т.п. Y' представляет собой C1-6 алкиленовую группу, C2-6 алкениленовую группу, C2-6 алкиниленовую группу или т.п., и предпочтительно представляет собой метиленовую группу, этиленовую группу, или т.п. R3' представляет собой азотсодержащую гетероциклическую группу, необязательно содержащую один или более заместителей, C1-6 алкоксигруппу, необязательно содержащую один или более заместителей, моно- или ди (C1-6 алкил)аминогруппу, необязательно содержащую один или более заместителей, моно- или ди(C2-6 алкенил)аминогруппу, необязательно содержащую один или более заместителей, или карбамоильную группу, необязательно содержащую один или более заместителей.
Заместители в R3' в вышеуказанной общей формуле (IV) конкретно не ограничены до тех пор, пока эффекты настоящего изобретения не нарушаются. В тех случаях, когда R3' представляет собой азотсодержащую гетероциклическую группу, заместители предпочтительно представляют собой атом галогена, гидроксигруппу, нитрогруппу, аминогруппу, C1-6 алкильную группу, гало C1-6 алкильную группу, C1-6 алкоксигруппу, гало C1-6 алкоксигруппу, C1-6 ацильную группу, гало C1-6 ацильную группу, C1-6 алкилсульфонильную группу, гало C1-6 алкилсульфонильную группу или т.п. В тех случаях, когда R3' представляет собой C1-6 алкоксигруппу, заместители предпочтительно представляют собой метоксигруппу, этоксигруппу, 2-метоксиэтоксигруппу или т.п. В тех случаях, когда R3' представляет собой моно- или ди(C1-6 алкил)аминогруппу или моно- или ди(алкенил)аминогруппу, заместители предпочтительно представляют собой C1-6 алкоксигруппу, гало C1-6 алкоксигруппу, C1-6 алкилсульфонильную группу, гало C1-6 алкилсульфонильную группу или т.п. В тех случаях, когда R3' представляет собой карбамоильную группу, заместители предпочтительно представляют собой C1-6 алкильную группу, C1-6 алкоксигруппу или т.п.
Предпочтительные конкретные примеры групп, представленных R3', включают пиридильную, пиримидильную, пиразильную, морфолино, 4-(замещенный)пиперазино (например, 4-метилпиперазино), 1,1-диоксо-1,4-тиазинан-4-ильную, пиперидино, пирролидино, тиазолильную, метокси, этокси, пропокси, диметиламино, диэтиламино, изопропиламино, N,N-бис(2-метоксиэтил)амино, N-2-метоксиэтил-N-метиламино, N,N-бис(2-метилсульфонилэтил)амино, N-метил-N-(2-метилсульфонилэтил)амино и диметилкарбамоильную группы.
Наиболее предпочтительные конкретные примеры групп, представленных R2', включают морфолиноэтокси, морфолинометокси, пиридилметокси, пиридилэтокси, 2-пирролидиноэтокси, 2-пиперидиноэтокси, 2-(4-(замещенный)пиперазино)этокси, 2-(1,1-диоксо-1,4-тиазинан-4-ил)этокси, морфолинометильную, (4-(замещенный)пиперазино)метильную, (1,1-диоксо-1,4-тиазинан-4-ил)метильную, пиперидинометильную, пирролидинометильную, 2-морфолиноэтильную, 2-(4-(замещенный)пиперазино)этильную, 2-(1,1-диоксо-1,4-тиазинан-4-ил)этильную, 2-пиперидиноэтильную, 2-пирролидиноэтильную, 2-морфолиноэтансульфонильную, метоксиметокси, метоксиэтокси, метоксиметильную, метоксиэтильную, диметиламино, диэтиламино, изопропиламино, N,N-бис(2-метоксиэтил)амино, N-2-метоксиэтил-N-метиламино, N,N-бис(2-метилсульфонилэтил)амино, N-метил-N-(2-метилсульфонилэтил)амино, диметиламинометильную, диэтиламинометильную, N,N-бис(2-метоксиэтил)аминометильную, диметиламиноэтокси и диметилкарбамоилэтокси группы. Заместители, представленные термином "замещенный", заключенные в скобки, конкретно не ограничены до тех пор, пока настоящее изобретение не нарушено, но предпочтительно представляют собой атом водорода, C1-6 алкильную группу или т.п., и особенно предпочтительно представляют собой атом водорода, метильную группу, этильную группу, изопропильную группу или т.п. Положение R2' на бензольном кольце конкретно не ограничено до тех пор, пока эффекты настоящего изобретения не нарушаются, но в тех случаях, когда положение атома углерода, связанного с пиразольным кольцом через винильную группу, определено как положение 1, тогда положение R2' на бензольном кольце предпочтительно представляет собой положение 3 или 4, более предпочтительно положение 4.
В вышеуказанной общей формуле (III), R1' и R2' могут быть соединены вместе с образованием кольца. В таком случае R1' и R2' образуют конденсированное кольцо или т.п. вместе с бензольным кольцом, к которому R1' и R2' присоединены. Примеры конденсированных колец включают те, которые представлены выше для бициклических групп с бензольным скелетом.
Заместители, представленные общей формулой (III), могут быть такими же или могут отличаться от фенильной группы, замещенной R1 и R2 в общей формуле (I). В тех случаях, когда они одинаковы, соединение или его соль легче синтезировать, и поэтому промышленно предпочтительны.
В общей формуле (I), в тех случаях, когда R2 представляет собой морфолинометокси, морфолиноэтокси или пиридилметокси группы, Ar особенно предпочтительно представляет собой, например, фенильную группу, необязательно содержащую один или более заместителей (например, морфолинометоксифенильную группу, диметилкарбамоилметоксифенильную группу, диметоксифенильную группу или т.п.), пирролильную группу, необязательно содержащую один или более заместителей, или бициклическую группу, имеющую бензольный скелет и необязательно содержащую один или более заместителей (например, 1,3-бензодиоксольную группу, 1,4-бензодиоксан-6-ильную группу, индолильную группу, 1-метилиндолильную группу или т.п.). В тех случаях, когда R2 представляет собой пиридилметоксигруппу, Ar особенно предпочтительно представляет собой, например, пирролильную группу, необязательно содержащую один или более заместителей, или бициклическую группу с бензольным скелетом (например, 1-метилиндолильную группу или т.п.). Предпочтительно, R1, R2 и/или Ar представляют собой основные группы, так что соединения или их соли прекрасно растворяются в воде и поэтому могут легко абсорбироваться во рту и т.п.
Соль соединения, представленного общей формулой (I), также включена в настоящее изобретение. Такая соль предпочтительно представляет собой фармакологически приемлемую соль, и ее примеры включают соли галогенводородных кислот, такие гидрофторид, гидрохлорид, гидробромид и гидроиодид; соли неорганических кислот, такие как сульфат, нитрат, перхлорат, фосфат, карбонат и бикарбонат; соли органических карбоновых кислот, такие как ацетат, оксалат, малеат, тартрат и фумарат; соли органических сульфоновых кислот, такие как метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат и камфорсульфонат, соли аминокислот, такие как аспартат и глутамат; соли амина, такие как соль триметиламина, соль триэтиламина, соль прокаина, соль пиридина, и соль фенэтилбензиламина; соль щелочных металлов, такие как соли натрия и соли калия; соли щелочноземельных металлов, такие как соли магния и соли кальция; и т.д. С учетом растворимости в воде, пероральной абсорбционной способности, эффективности и т.п., предпочтительными являются гидрохлорид и оксалат.
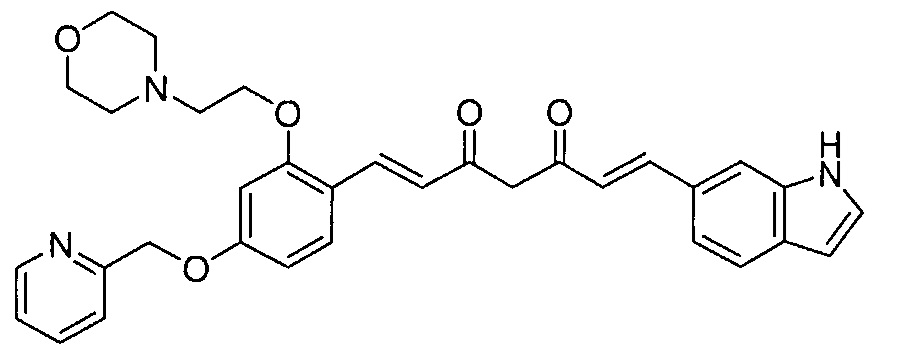
Соединение, представленное общей формулой (I), можно получить известными способами, раскрытыми, например, в Rajeshwar Narlawar et al., ChemMedChem 2008, 3, 165-172, WО 2008/066151, WО 2009/145219, или т.п., или используя любую из комбинаций способов, известных из литературы, или способами, известными per se, или эквивалентными им способами. Более конкретно, соединение можно получить, например, используя следующие стадии 1 и 2, но способы получения ими не ограничиваются.
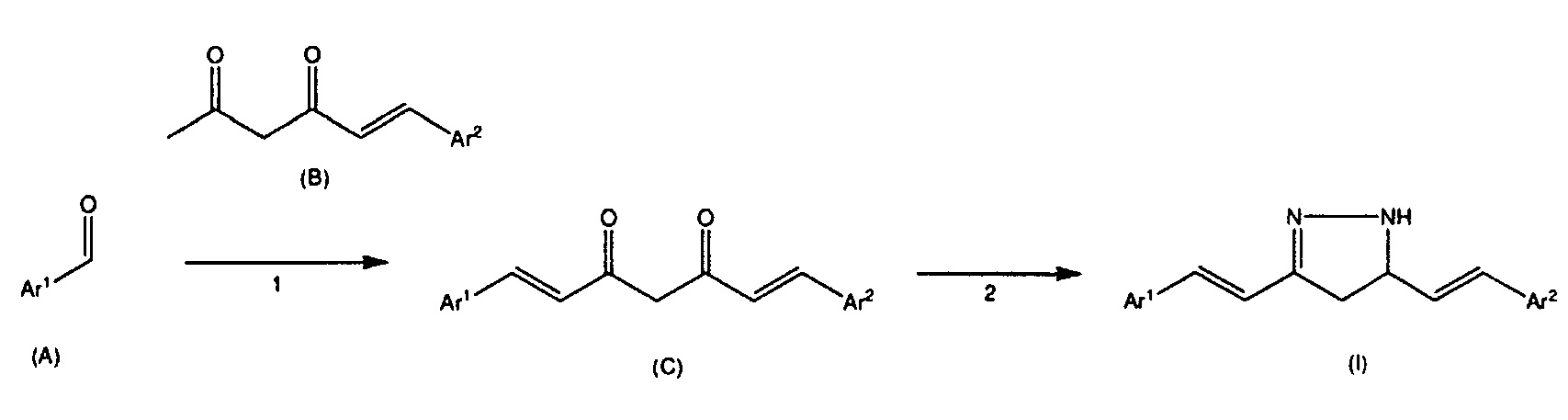
Ar1 в вышеприведенной формуле представляет собой или фенильное кольцо, замещенное R1 и R2, или кольцо, представленное как Ar в соединениях, представленных общей формулой (I) настоящего изобретения, и Ar2 отличается от Ar. На стадии 1, альдегид, представленный общей формулой (A), подвергают взаимодействию с соединением, представленным общей формулой (B), в присутствии растворителя и катализатора, получая дикетон, представленный общей формулой (C).
Растворитель, используемый в указанной реакции, конкретно не ограничен до тех пор, пока он не ингибируют реакцию, и его примеры включают этилацетат, N,N-диметилацетамид, N,N-диметилформамид, l-метил-2-пирролидон, диметилсульфоксид, тетрагидрофуран, ацетонитрил и т.д. Указанные растворители можно использовать отдельно или в комбинации двух или более их типов в смеси в указанном соотношении.
Катализатор, используемый в реакции, также конкретно не ограничен. Его примеры включают основания, такие как первичные амины и вторичные амины, и конкретные примеры катализатора включают н-бутиламин, этаноламин, пиперидин, морфолин, и т.д.
На стадии 1 можно добавить поглотитель воды, чтобы удалить воду, образующуюся в реакции. Примеры поглотителя воды включают алкилбораты, алкилфосфаты, сложные ортоэфиры и т.д., и его конкретные примеры включают триметилортоформиат и три-н-бутилборат.
На стадии 1 количественное отношение альдегида, представленного общей формулой (A), и соединения, представленного общей формулой (B), конкретно не ограничено до тех пор, пока реакция происходит. Однако, с учетом эффективности реакции и т.п., количество соединения предпочтительно составляет от 0,5 до 10 молей, более предпочтительно от 0,5 до 2 молей, в расчете на 1 моль альдегида.
На стадии 1 температура реакции конкретно не ограничена до тех пор, пока реакция происходит. Однако, с учетом эффективности реакции и т.п., температура реакции предпочтительно составляет от 0 до 200°C, более предпочтительно от 50 до 100°C.
На стадии 1, длительность реакции конкретно не ограничена до тех пор, пока реакция происходит. Однако, с учетом эффективности получения и т.п., длительность реакции предпочтительно составляет от 0,5 до 48 часов, более предпочтительно от 1 до 24 часов.
Альдегид, представленный общей формулой (A), и соединение представленное общей формулой (B), которые используют на стадии 1, могут быть коммерчески доступными продуктами или могут быть синтезированы известными способами (например, способом, раскрытым в WО 2008/066151 или WО 2009/145219) или другими способами.
На стадии 2 дикетон, представленный общей формулой (C), оставляют реагировать с гидразином в присутствии растворителя, получая соединение, представленное общей формулой (I).
Гидразин, используемый в реакции, конкретно не ограничен, и его примеры включают моногидрат гидразина, водный раствор гидразина, безводный гидразин, ацетат гидразина, моногидрохлорид гидразина, дигидрохлорид гидразина и их производные и т.д.
Растворитель, используемый в реакции, конкретно не ограничен до тех пор, пока он не ингибируют реакцию, и его примеры включают протонные растворители, такие как уксусная кислота, метанол, этанол и вода; апротонные растворители, такие как этилацетат, толуол, тетрагидрофуран, метиленхлорид, хлороформ и т.д. Указанные растворители можно использовать отдельно или, при желании, в комбинации двух или более их типов в смеси в указанном соотношении.
На стадии 2 количественное отношение дикетона, представленного общей формулой (C), и гидразина конкретно не ограничено до тех пор, пока реакция происходит. Однако, с учетом эффективности реакции и т.п., количество гидразина предпочтительно составляет от 1 до 50 молей, более предпочтительно от 2 до 10 молей, в расчете на 1 моль дикетона.
На стадии 2 температура реакции конкретно не ограничена до тех пор, пока реакция происходит. Однако, с учетом эффективности реакции и т.п., температура реакции предпочтительно составляет от 20 до 120°C, более предпочтительно от 50 до 80°C.
На стадии 2 длительность реакции конкретно не ограничена до тех пор, пока реакция происходит. Однако, с учетом эффективности получения и т.п., длительность реакции предпочтительно составляет от 0,2 до 24 часов, более предпочтительно от 0,5 до 6 часов.
Соединение настоящего изобретения можно вводить субъекту отдельно или в комбинации с одним или более другими соединениями настоящего изобретения, или с одним или более соединениями, отличными от соединений настоящего изобретения. Соединение настоящего изобретения можно вводить в виде препарата или в виде фармацевтической композиции, включающей один или более фармакологически приемлемых носителей. Эффективная доза соединения настоящего изобретения в качестве активного ингредиента и частота введения могут меняться в зависимости от лекарственной формы, возраста, массы тела, симптомов и т.д. пациента и т.п., но дневная доза обычно составляет от около 0,01 до 100 мг/кг, более предпочтительно от около 1 до 50 мг/кг.
Субъект конкретно не ограничен, и его примеры включают млекопитающих, таких как человек, обезьяна, гамадрил, бабуин, шимпанзе, мышь, крыса, морская свинка, хомяк, кролик, кошка, собака, овца, коза, свинья и рогатый скот.
Способы введения препарата или фармацевтической композиции, включающей соединение настоящего изобретения в качестве активного ингредиента, конкретно не ограничены, и такой препарат или фармацевтическую композицию можно вводить перорально или парентерально обычными способами. Примеры парентерального введения включают ректальное введение, назальное введение, транспульмонарное введение, дермальное введение и введение с помощью инъекций (например, внутривенное введение, интраспинальное введение, эпидуральное введение, внутримышечное введение, подкожное введение, внутрибрюшинное введение, внутриартериальное введение, внутрисуставное введение, внутрисердечное введение, внутрикистозное введение, внутрикожное введение, внутриочаговое введение, интраокулярное введение, интраторакальное введение, субарахноидальное введение, внутриматочное введение, интравентрикулярное введение и т.д.).
Форма препарата или фармацевтической композиции, включающей соединение настоящего изобретения в качестве активного ингредиента, конкретно не ограничена, и примеры таких форм включают пероральные или парэнтеральные препараты, такие как таблетки, порошки, гранулы, капсулы, пероральные растворы, эмульсии, эликсиры, лимонады, суспензии, сиропы, оромукозальные таблетки, желе для перорального приема, препараты для ингаляций, суппозитории, препараты для инъекций, мази, глазные мази, глазные препараты, назальные препараты, ушные препараты, пластыри, растворы для наружного применения.
Дозу препарата или фармацевтической композиции настоящего изобретения можно определить соответствующим образом в зависимости от тяжести симптомов, возраста, пола и массы тела пациента, способа введения, типа соли, конкретного заболевания и т.д.
Так как соединение настоящего изобретения обладает ингибирующей активностью в отношении агрегации тау, ингибирующей активностью в отношении β-секретазы и/или ингибирующей активностью в отношении агрегации Aβ, соединение настоящего изобретения является эффективным при предотвращении и лечении заболеваний, в которых участвуют тау, β-секретаза или Aβ, таких как болезнь Альцгеймера (семейная болезнь Альцгеймера и спорадическая болезнь Альцгеймера), старческая деменция, синдром Дауна, болезнь Паркинсона, болезнь Крейтцфельдта-Якоба, амиотрофический латеральный склероз, диабетическая нейропатия, хорея Хантингтона, рассеянный склероз и т.д. Среди указанных нервных заболеваний, соединение настоящего изобретения особенно эффективно для предотвращения или лечения болезни Альцгеймера.
Соединение настоящего изобретения может быть составлено обычно используемыми способами в лекарственные формы, такие как таблетки, порошки, гранулы, капсулы, пероральные растворы, эмульсии, эликсиры, лимонады, суспензии, сиропы, оромукозальные таблетки, пероральные желе, препараты для ингаляций, суппозитории, препараты для инъекций, мази, глазные мази, глазные препараты, назальные препараты, ушные препараты, пластыри, растворы для наружного использования и т.д. Для составления в такие лекарственные формы можно использовать эксципиенты, связующие, смазывающие вещества, красители и модифицирующие вкус и аромат вещества, которые обычно используют для составления лекарственных средств, и при необходимости также можно использовать стабилизаторы, эмульгаторы, усилители абсорбции, поверхностно-активные вещества, регуляторы величины pH, консерванты, антиоксиданты и/или т.п. Таким образом, ингредиенты, которые обычно используют в качестве сырых материалов для фармацевтических препаратов можно смешивать с соединением и составлять в лекарственные формы обычным способом.
Например, при производстве пероральных препаратов, кристаллические или аморфные соединения настоящего изобретения смешивают с эксципиентами, и при необходимости с такими добавками, как связующие, разрыхлители, смазывающие вещества, красители, модификаторы вкуса и т.д., и приготавливают в форме порошков, тонких гранул, гранул, таблеток, таблеток в оболочке, капсул, и т.д. обычными способами. Примеры добавок включают животные и растительные жиры и масла, такие как соевое масло, топленое сало, и синтетические глицериды; углеводороды, такие как жидкий парафин, сквалан и твердый парафин; сложноэфирные масла, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бегениловый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как полиоксиэтиленовые эфиры жирных кислот, сорбитановые эфиры жирных кислот, глицериновые эфиры жирных кислот, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтиленовое отвержденное касторовое масло и блок-сополимеры полиоксиэтилен-полиоксипропилена; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, полиакрилат, карбоксивиниловый полимер, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; полиспирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и сахароза; неорганические порошки, такие как безводная кремниевая кислота, алюмосиликат магния и силикат алюминия; очищенная вода; и т.д.
Примеры эксципиентов включают лактозу, кукурузный крахмал, сахарозу, глюкозу, маннит, сорбит, кристаллическую целлюлозу, диоксид кремния и т.д. Примеры связующих включают поливиниловый спирт, поливиниловый простой эфир, метилцеллюлозу, этилцеллюлозу, гуммиарабик, трагакант, желатин, шеллак, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон, блок-полимер полипропиленгликоль-полиоксиэтилена, меглумин и т.д. Примеры разрыхлителей включают крахмалы, агар, порошок желатина, кристаллическую целлюлозу, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин, кальцийкарбоксиметилцеллюлозу и т.д. Примеры смазывающих веществ включают стеарат магния, тальк, полиэтиленгликоль, двуокись кремния, гидрированное растительное масло и т.д. Примеры красителей включают красители, которые разрешены как добавки к лекарственным средствам и т.д. Примеры модификаторов вкуса и аромата включают порошок какао, ментол, порошок-ароматизатор, ментоловое масло, борнеол, порошок корицы и т.д.
Нет необходимости указывать, что при производстве таблеток или гранул при необходимости можно осуществлять покрытие таблеток или гранул сахаром или т.п. При приготовлении растворов, таких как сиропы, эмульсии, эликсиры, лимонады, суспензии и препараты для инъекций, соединение настоящего изобретения можно смешивать при необходимости с дополнительными добавками, такими как регуляторы pH, солюбилизаторы, эмульгаторы, разрыхлители, изотонические вещества, вещества, способствующие растворению, стабилизаторы и т.п., и приготавливать в виде таких растворов обычными способами.
При производстве лекарственных средств для местного применения способ получения не ограничен, и получение можно осуществлять обычными способами. Так, для составления лекарственных средств для местного применения можно использовать различные типы исходных материалов, которые обычно используют для лекарственных средств, квази-лекарственных средств, косметических средств или т.п. в качестве основных ингредиентов. Конкретные примеры основных ингредиентов, которые можно использовать, включают животные и растительные масла, минеральные масла, сложноэфирные масла, воски, высшие спирты, жирные кислоты, силиконовые масла, поверхностно-активные вещества, фосфолипиды, спирты, полиспирты, водорастворимые полимеры, глинистые минералы, нерастворимые в воде природные или синтетические полимеры, такие как смолы, пластики и каучуки, очищенная вода, и т.д. Кроме того, при необходимости можно добавлять, регуляторы pH, антиоксиданты, хелатирующие вещества, антибактериальные и противогрибковые агенты, красители, модификаторы вкуса и/или т.п. Основные ингредиенты лекарственных средств для местного применения не ограничены вышеперечисленными ингредиентами. При необходимости добавляют другие ингредиенты, и их примеры включают ингредиенты, обладающие диференциальной стимулирующей активностью, агенты, усиливающие кровоток, бактерициды, противовоспалительные лекарственные средства, клеточные активаторы, витамины, аминокислоты, увлажнители, кератолитические агенты и т.д. Количество добавляемых основных ингредиенов определяют таким образом, чтобы их концентрация соответствовала обычной концентрации основных ингредиентов, используемой при производстве лекарственных средств для местного применения.
Соединения настоящего изобретения могут быть как в виде пищевых продуктов или напитков, так и в виде добавок к пищевым продуктам.
Продукты питания или напитки по изобретению могут содержать один или более типов пищевых добавок, которые обычно используют для продуктов питания или напитков, и примеры пищевых добавок включают подсластители, красители, консерванты, загустители, стабилизаторы, антиоксиданты, фиксаторы окраски, отбеливатели, противогрибковые агенты, смолистые основания, горечи, ферменты, оптические отбеливатели, подкислители, приправы, эмульгаторы, усилители вкуса, вещества, облегчающие обработку, отдушки и экстракты пряностей. Пищевые продукты или напитки настоящего изобретения включают продукты здорового питания, функциональные продукты, продукты для использования при конкретном состоянии здоровья, продукты для младенцев, продукты детского питания, продукты для беременных женщин и кормящих матерей, продукты для пожилых и продукты для больных.
Форма пищевых продуктов или напитков по изобретению конкретно не ограничена. Конкретные примеры таких продуктов включают так называемые диетические добавки в форме таблеток, гранул, порошков, энергетических напитков или т.п. Другие примеры таких форм включают напитки, такие как чаи, освежающие напитки, шипучие напитки, питательные напитки, фруктовые соки и молочные напитки; макаронные изделия, такие как гречневая лапша, пшеничная лапша, китайская лапша и макаронные изделия быстрого приготовления; сладости и хлебобулочные изделия, такие как драже, леденцы, жевательные конфеты, шоколад, снэки, бисквиты, желе, джемы, кремы, печенье и хлеб; рыбные или мясные продукты, такие как рыбные сосиски, ветчина и сосики; молочные продукты, такие как переработанное молоко и ферментированное молоко; жиры, масла и продукты их переработки, такие как растительные масла, масла для жарки при высоких температурах, маргарины, майонезы, шортенинги, взбитые сливки и подливки; заправки, такие как соусы и острые соусы; пищевые продукты в термостойкой упаковке, такие как карри, рагу, пловы, каши и рисовые супы; и замороженные десерты, такие как морженое, щербеты и кубики льда.
Количество потребляемых пищевых продуктов или напитков по изобретению конкретно не ограничено, и его можно определить в зависимости от формы пищевых продуктов или напитков, возраста, пола, состояния здоровья и т.п. субъекта, который потребляет указанную пищу или напитки, и от других условий.
Соединение настоящего изобретения или его соль можно использовать для способа лечения такого заболевания, в котором участвует тау, β-секретаза или Aβ. Конкретные примеры такого способа включают следующие (a)-(c):
(a) терапевтический способ лечения заболевания, в котором участвует тау, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли пациенту, в заболевании которого участвует тау;
(b) терапевтический способ лечения заболевания, в котором участвует β-секретаза, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли пациенту, в заболевании которого участвует β-секретаза; и
(c) терапевтический способ лечения зоболевания, в котором участвует Aβ, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли пациенту, в зоболевании которого участвует Aβ.
Заболевания, в которых принимают участие тау, β-секретаза или Aβ, предпочтительно включают зоболевания, механизм возникновения которых включает участие тау, β-секретазы или Aβ. Конкретные примеры таких заболеваний включают болезнь Альцгеймера (семейная болезнь Альцгеймера и спорадическая болезнь Альцгеймера), старческую деменцию, синдром Дауна, болезнь Паркинсона, болезнь Крейтцфельда-Якоба, амиотрофический латеральный склероз, диабетическую нефропатию, хорею Хантингтона, рассеянный склероз и т.д. Среди них предпочтительна болезнь Альцгеймера.
Способ введения, лекарственная форма и доза соединения настоящего изобретения, и субъект, которому необходимо вводить указанное соединение, могут быть теми же, что раскрыты выше для получения препарата, включающего соединение настоящего изобретения.
Соединение настоящего изобретения можно также использовать в способе ингибирования агрегации тау, в способе ингибирования β-секретазы и в способе ингибирования агрегации Aβ. Конкретные примеры такого способа включают следующие (d)-(i):
d) способ ингибирования агрегации тау, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли млекопитающему, включая человека, тем самым ингибируя агрегацию тау в организме млекопитающего, включая человека;
(e) способ ингибирования агрегации тау, причем указанный способ включает стадию осуществления контактирования соединения, представленного общей формулой (I), или его соли с тау;
(f) способ ингибирования β-секретазы, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли млекопитающему, включая человека, тем самым ингибируя β-секретазу в организме живого человека;
g) способ ингибирования β-секретазы, причем указанный способ включает стадию осуществления контактирования соединения, представленного общей формулой (I), или его соли с β-секретазой;
(h) способ ингибирования агрегации Aβ, причем указанный способ включает стадию введения соединения, представленного общей формулой (I), или его соли млекопитающему, включая человека, тем самым ингибируя агрегацию Aβ в организме млекопитающего, включая человека; и
(i) способ ингибирования агрегации Aβ, причем указанный способ включает стадию осуществления контактирования соединения, представленного общей формулой (I), или его соли с Aβ;
Солью в вышеуказанных способах может быть фармакологически приемлемая соль.
Настоящее изобретение также включает, в качестве одного из вариантов, применение соединения настоящего изобретения или его соли в производстве профилактических или терапевтических лекарственных средств для лечения заболеваний, в которых принимают участие тау, β-секретаза или Aβ. Заболевания, в которых принимают участие тау, β-секретаза или Aβ, могут быть раскрытыми выше заболеваниями, и предпочтительно болезнью Альцгеймера.
Настоящее изобретение также включает, в качестве другого варианта, соединение настоящего изобретения или его соль, предназаначенное для предотвращения или лечения заболеваний, в которых участвуют тау, β-секретаза или Aβ. Заболевания, в которых принимают участие тау, β-секретаза или Aβ, могут быть раскрытыми выше заболеваниями, и предпочтительно болезнью Альцгеймера.
Примеры
Далее настоящее изобретение будет раскрыто более подробно со ссылкой на примеры и т.д., но настоящее изобретение ими не ограничивается. Специалисты в данной области могут осуществить различные модификации изобретения, не выходя за рамки объема технической идеи настоящего изобретения.
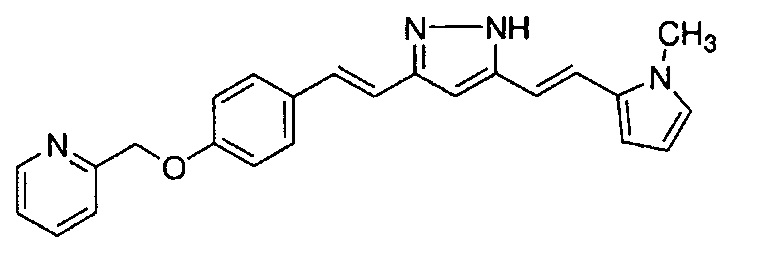
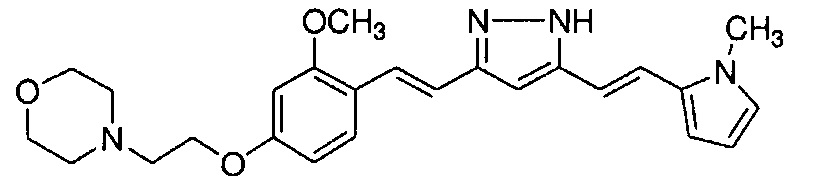
В примерах соединение общей формулой (I) определено как смесь двух таутомеров, представленных далее общими формулами (I) и (I'), в зависимости от условий измерения 1H-ЯМР. Указанные два таутомера представляют собой изомеры одного вещества. Поэтому, синтетические соединения в примерах можно именовать или на основании общей формулы (I), или общей формулы (I').
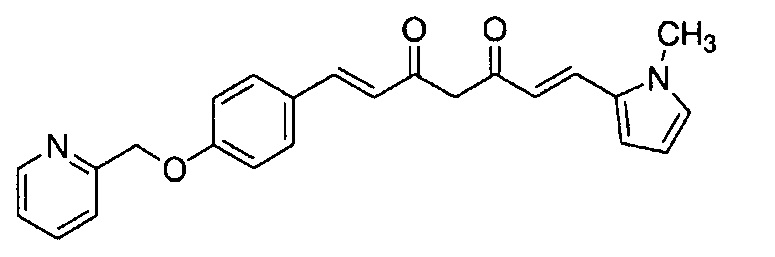
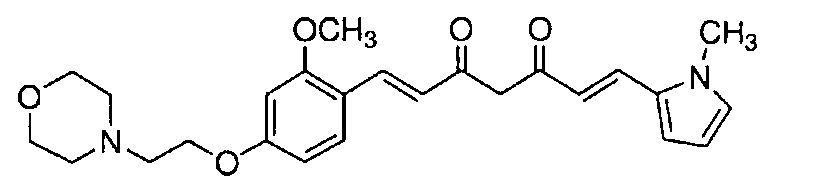
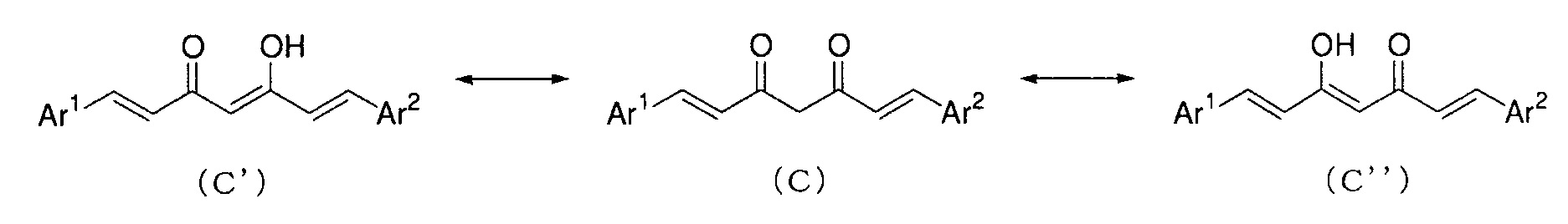
Соединение, представленное выше общей формулой (C), является важным промежуточным соединением настоящего изобретения. Соединение общей формулой (C) может существовать в таутомерных формах, включая кетоформу и енольную форму, и указанные таутомерные формы представляют собой одно и то же вещество. Поэтому, такое промежуточное соединение можно именовать на основании любой из общей формулы (C), общей формулы (C') и общей формулы (C'').
В описании использованы следующие сокращения.
|
|
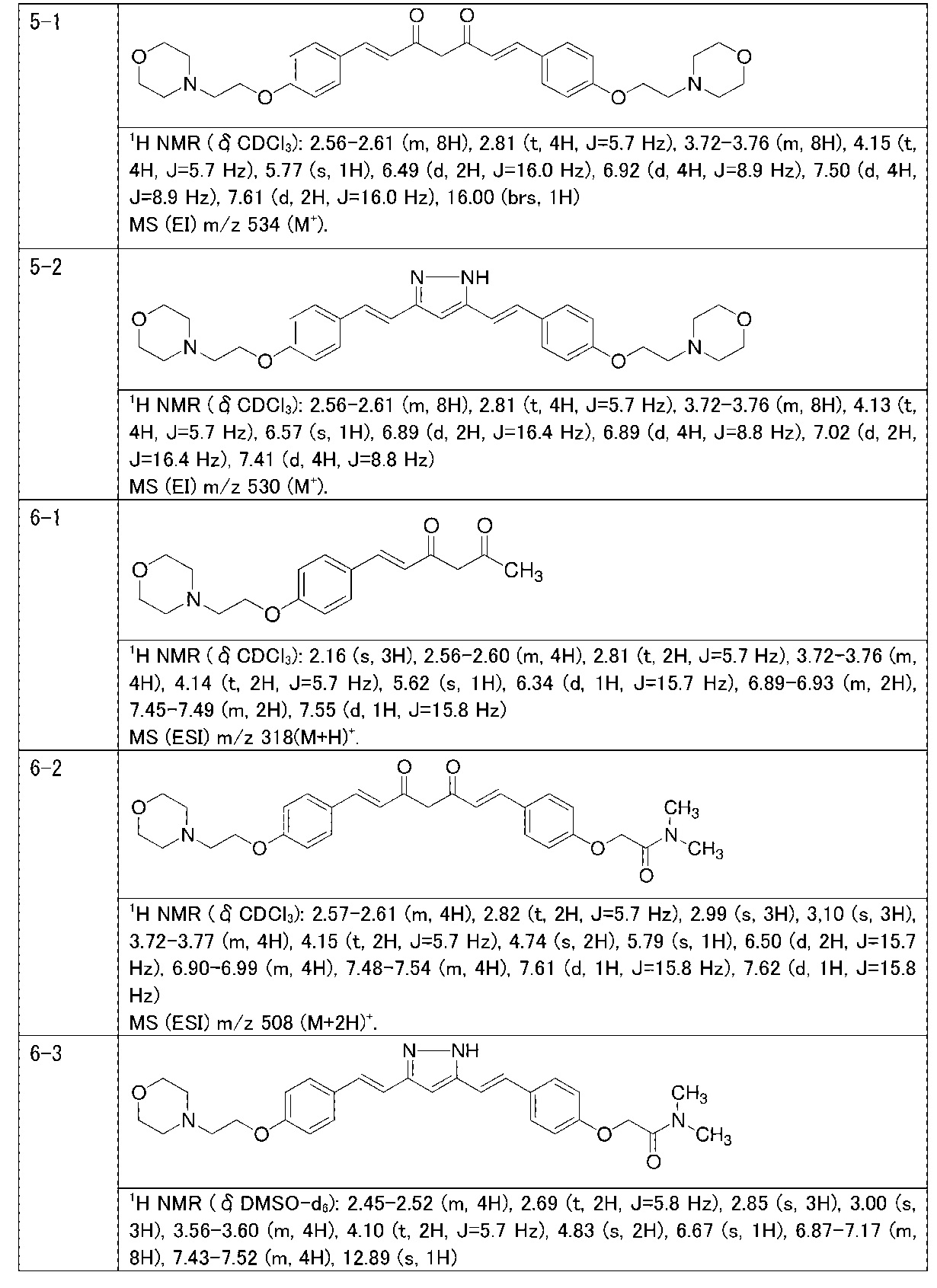
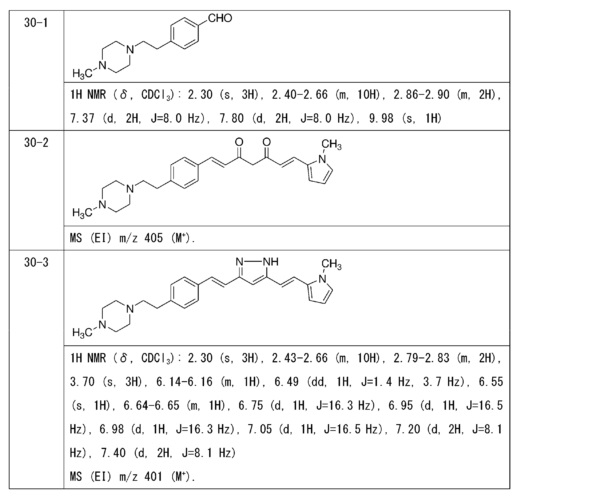
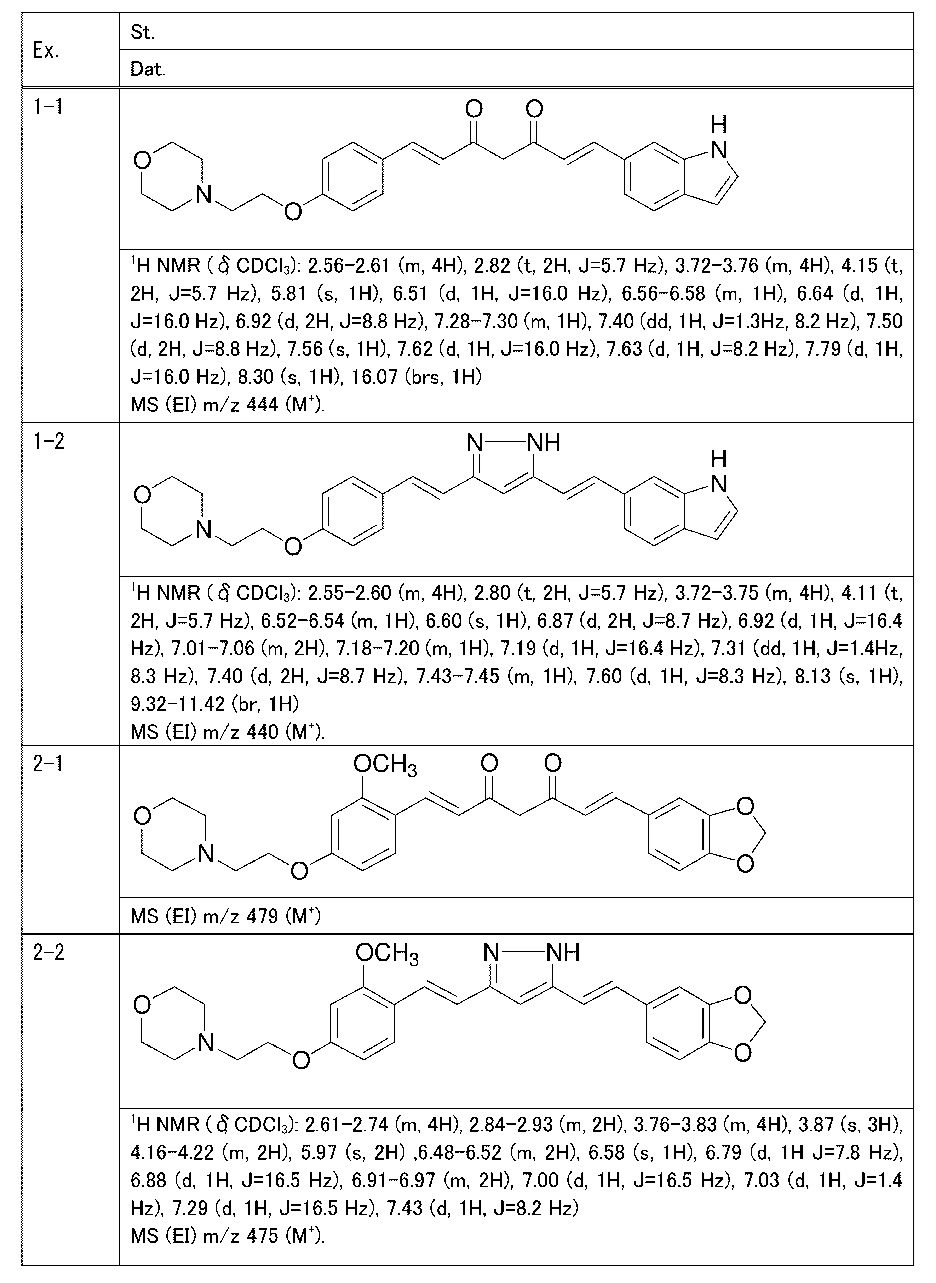
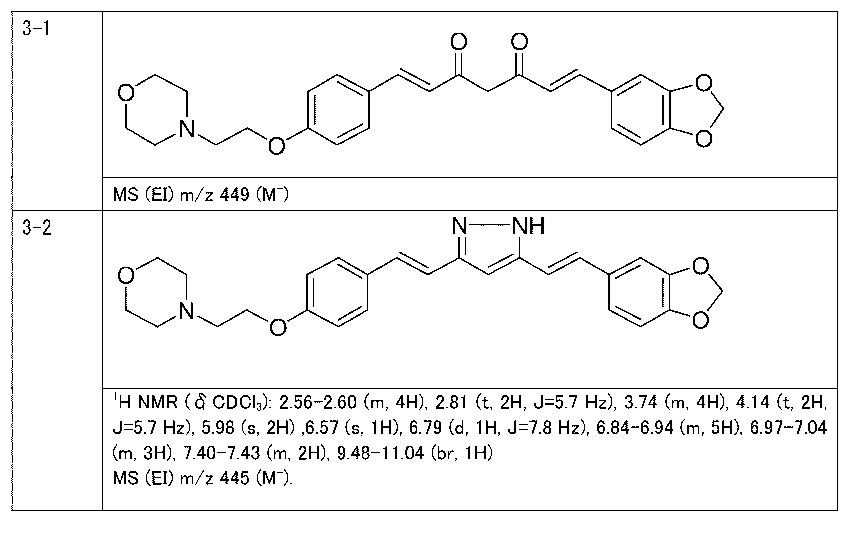
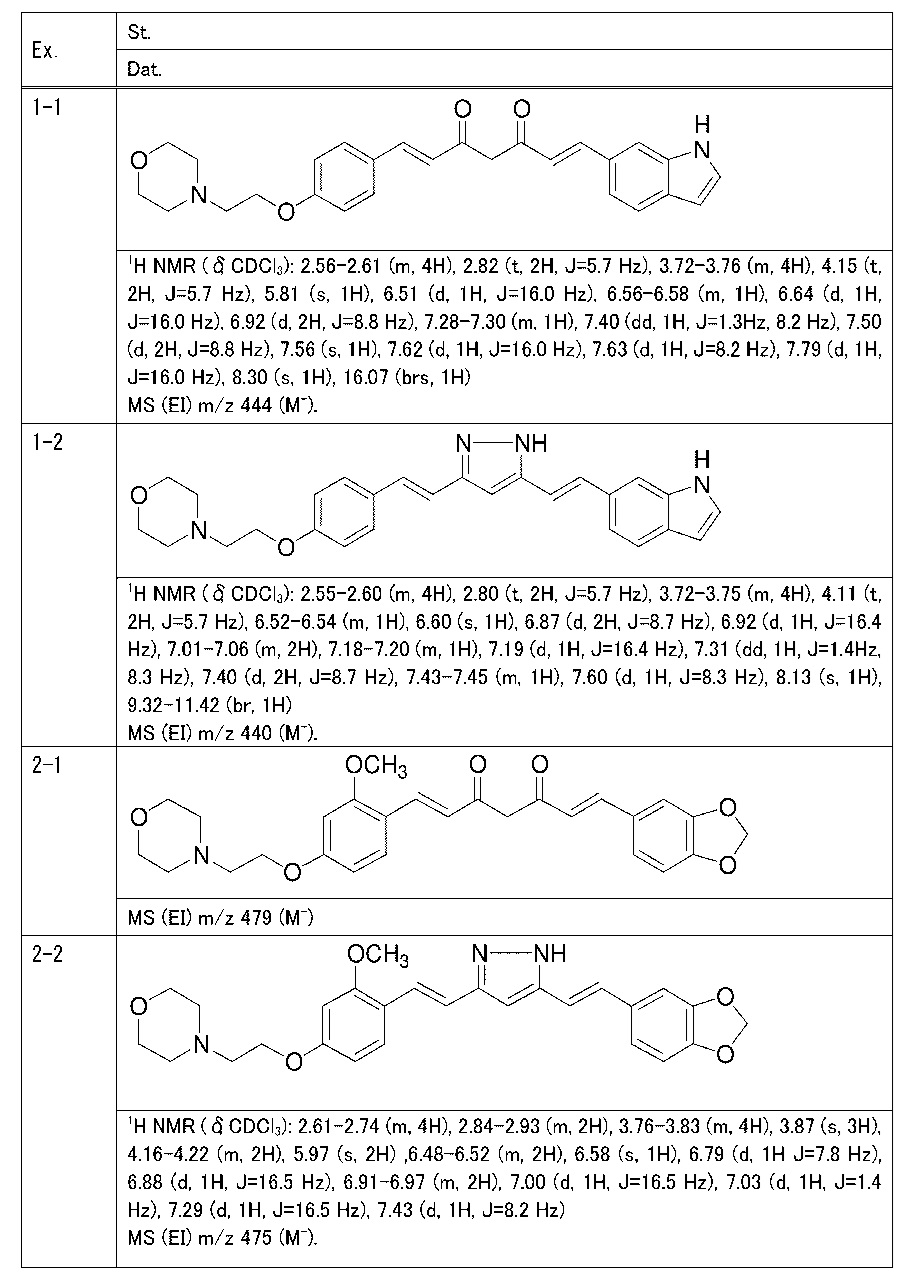
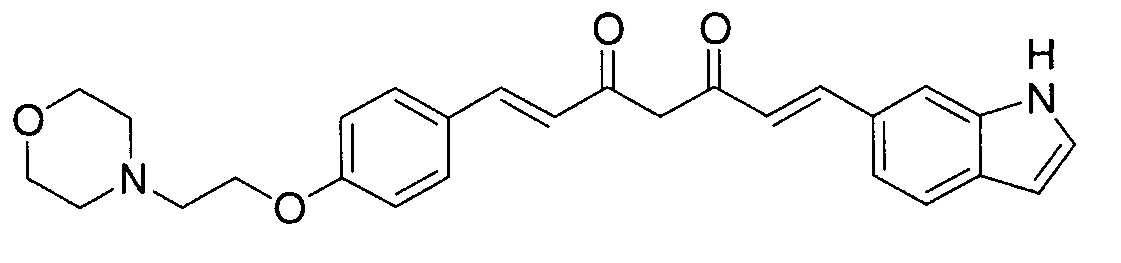
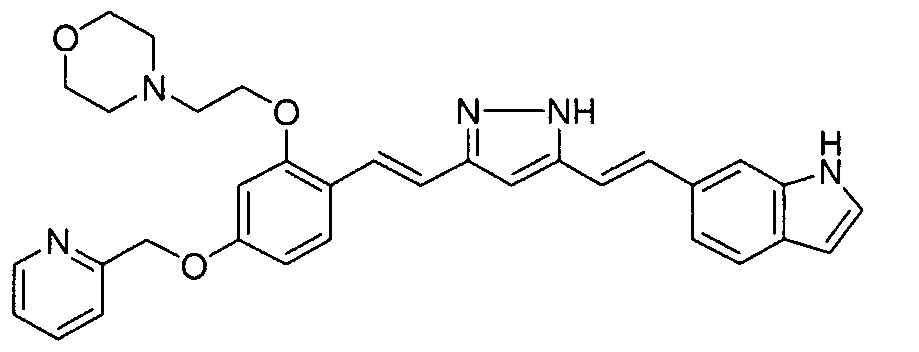
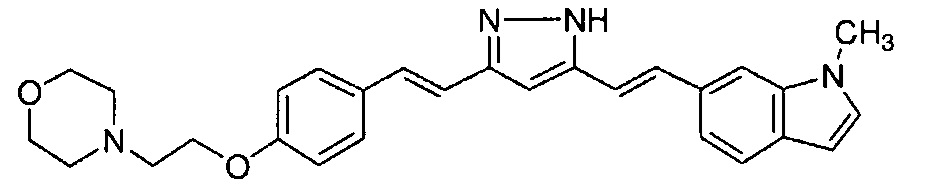
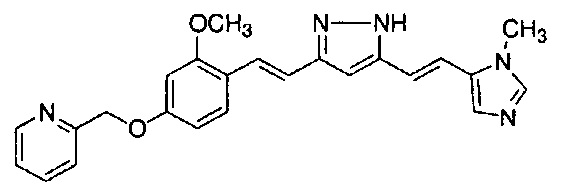
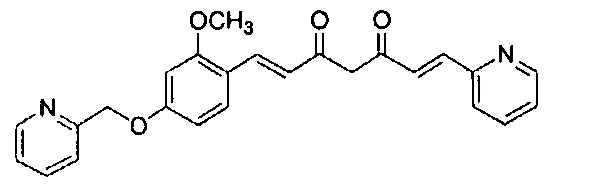
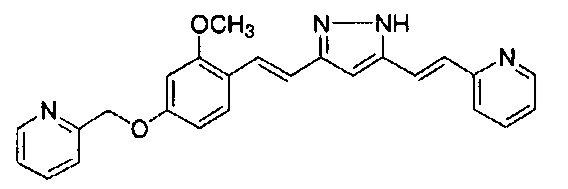
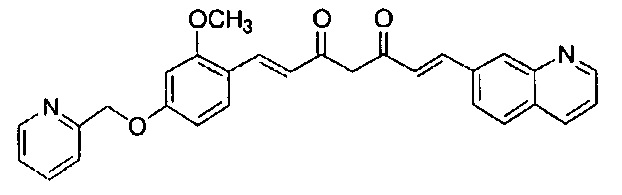
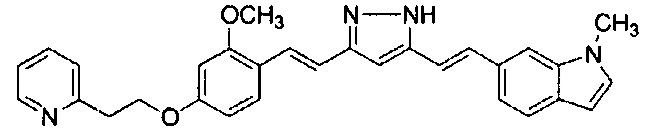
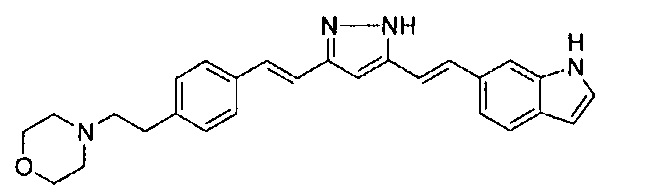
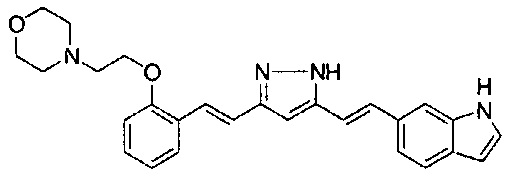
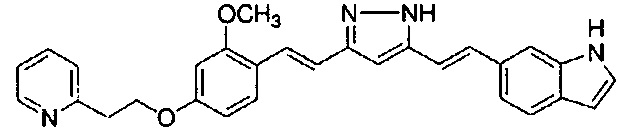
Пример 1: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
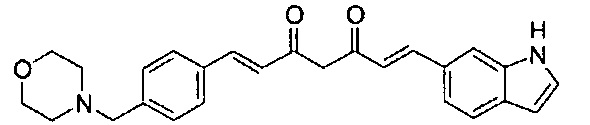
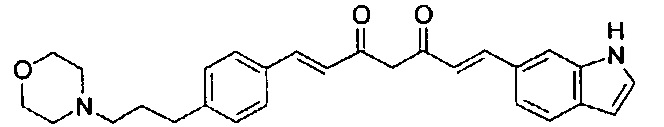
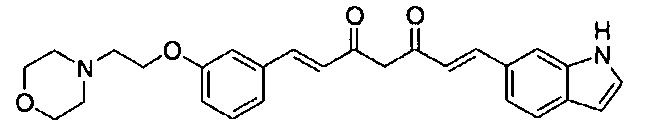
Пример 1-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
К 2,5 г (E)-6-(1H-индол-6-ил)гекс-5-ен-2,4-диона добавляют 44 мл AcOEt и 1,07 г оксида бора, и полученную смесь перемешивают при 70°C в течение 40 минут. К смеси последовательно добавляют 2,27 г 4-(2-морфолиноэтокси)бензальдегида и 7,07 мл трибутилбората, и полученную смесь перемешивают при той же самой температуре в течение 40 минут. Затем добавляют 0,11 мл пиперидина, и полученную смесь перемешивают при 70°C в течение 1,5 часа и оставляют охлаждаться снова до комнатной температуры. К полученной реакционной смеси добавляют 22 мл 20% водного раствора K2CO3 и 20 мл ТГФ, и полученную смесь перемешивают при комнатной температуре в течение 10 минут. Органический слой выделяют, промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система CHCl3/ацетон или CHCl3/метанол), получая 1,62 г указанного в заголовке соединения (33% выход).
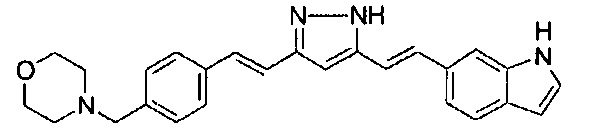
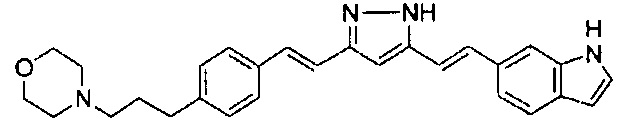
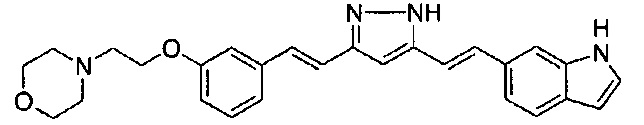
Пример 1-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
К 1,5 г (1E,6E)-1-(1H-индол-6-ил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона добавляют 13,5 мл AcOH и 1,31 мл гидразинмоногидрата, и полученную смесь перемешивают при 60°C в течение 3 часов. Полученную реакционную смесь снова оставляют охлаждаться до комнатной температуры, и в перемешиваемую смесь выливают 18,7 г K2CO3, 95 мл холодной воды, 30 мл AcOEt и 20 мл ТГФ. Органический слой выделяют, промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система CHCl3/ацетон или CHCl3/метанол), получая 0,62 г указанного в заголовке соединения (42% выход).
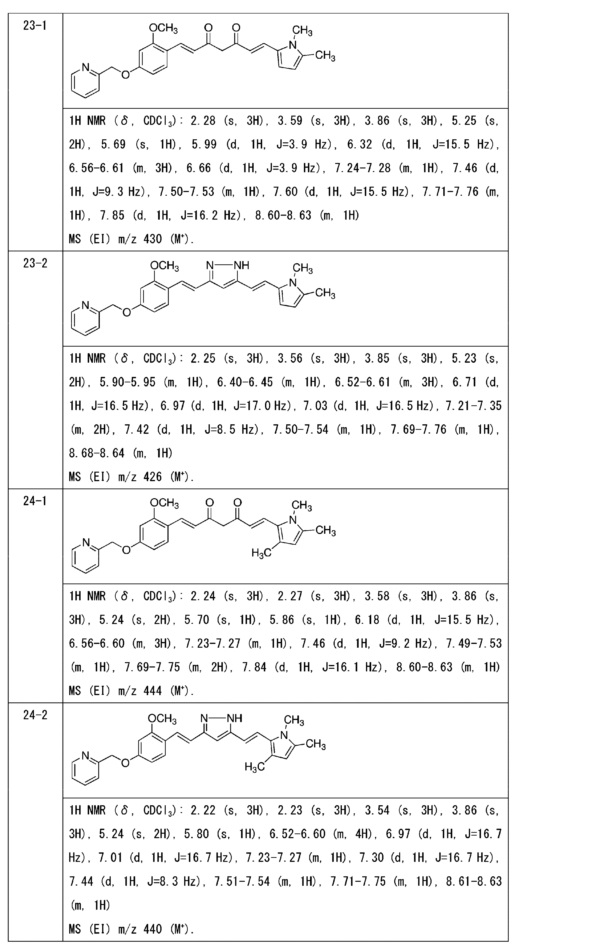
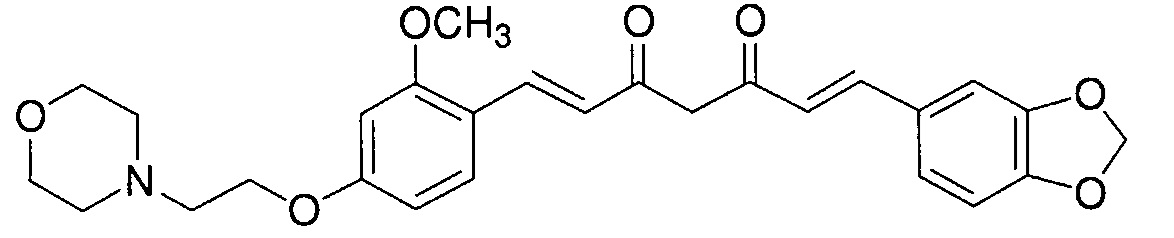
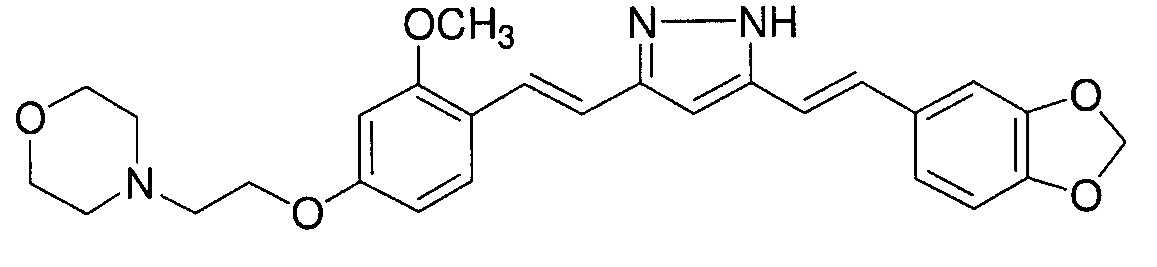
Пример 2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1,3- бензодиоксол-5-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]этил]морфолина
Пример 2-1: Получение (1E,6E)-1-(1,3-бензодиоксол-5-ил)-7-[2-метокси-4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 2-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1,3- бензодиоксол-5-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
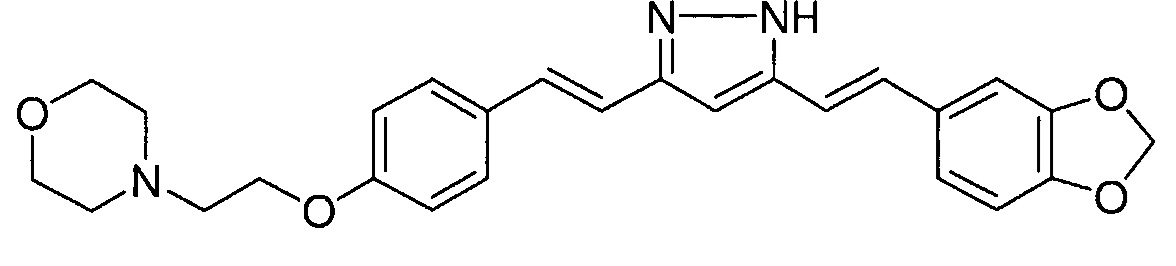
Пример 3: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1,3-бензодиоксол-5-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
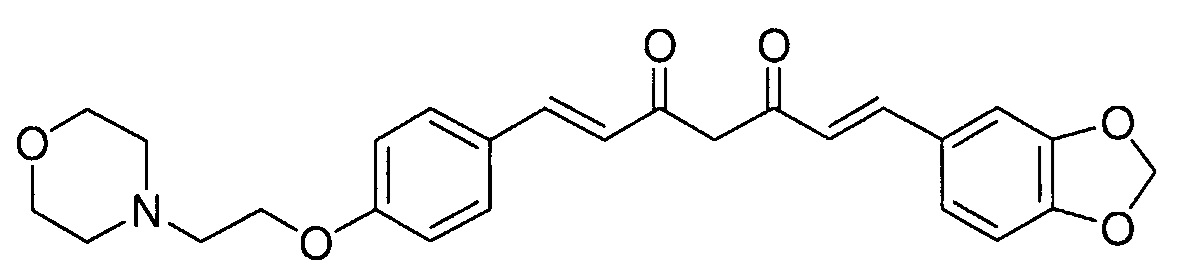
Пример 3-1: Получение (1E,6E)-1-(1,3-бензодиоксол-5-ил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 3-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1,3-бензодиоксол-5-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
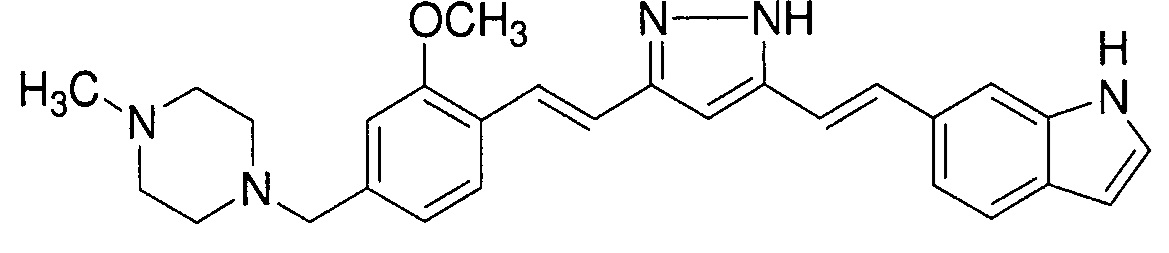
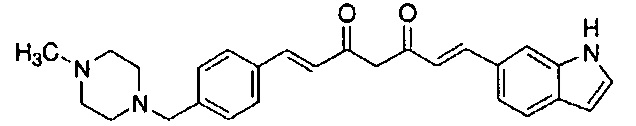
Пример 4: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
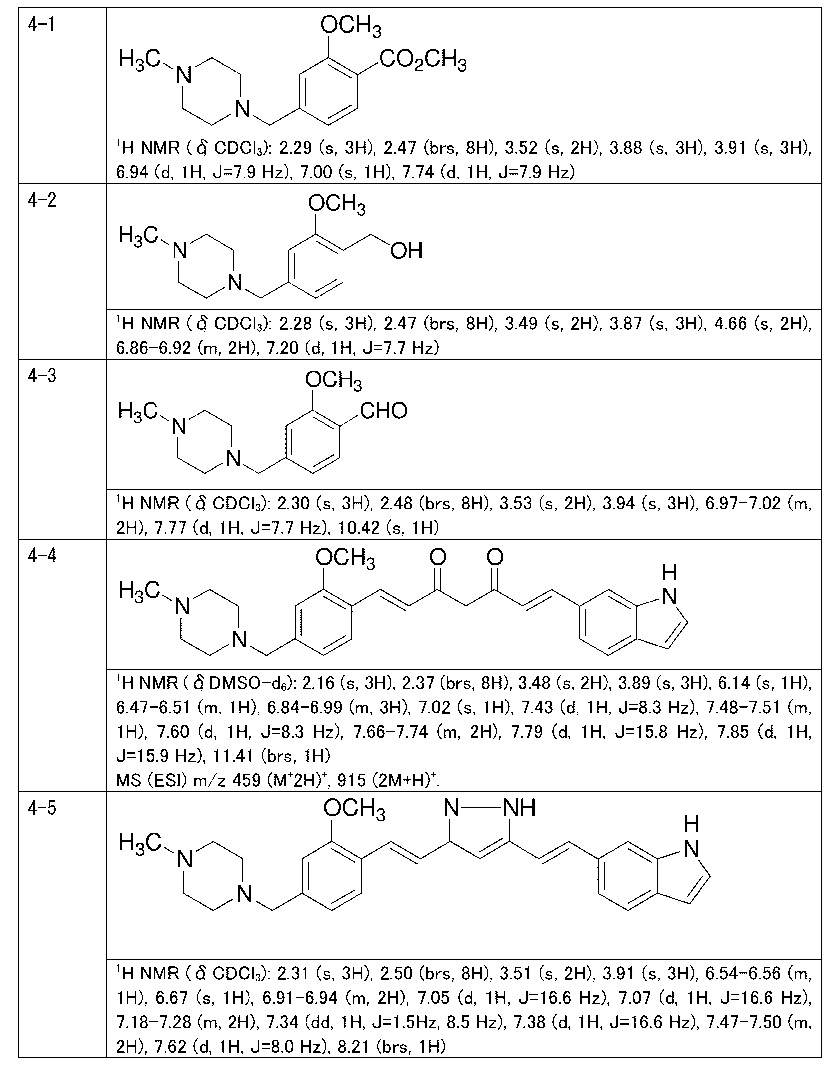
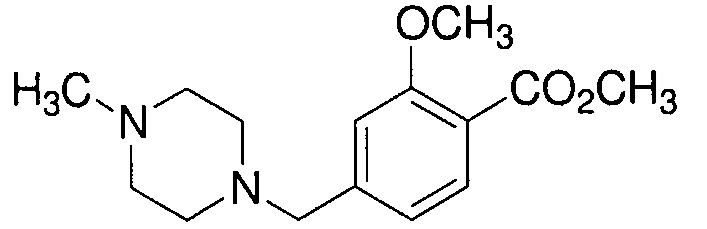
Пример 4-1: Получение метилового эфира 2-метокси-4-[(4-метилпиперазин-1-ил)метил]бензойной кислоты
К 100 мл этанола добавляют 10,0 г 1-метилпиперазина и 20,2 г триэтиламина. К смеси, охлажденной льдом, по каплям добавляют 25 мл раствора 24,6 г метилового эфира 4-(бромметил)-2-метоксибензойной кислоты в этаноле. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Полученную реакционную смесь концентрируют. К остатку добавляют 75 мл воды и 250 мл метиленхлорида, и органический слой выделяют. Полученный органический слой сушат и концентрируют. Полученный остаток очищают, используя хроматографическую колонку с амино-силикагелем (система гептан /AcOEt), получая 22,4 г указанного в заголовке соединения (85% выход).
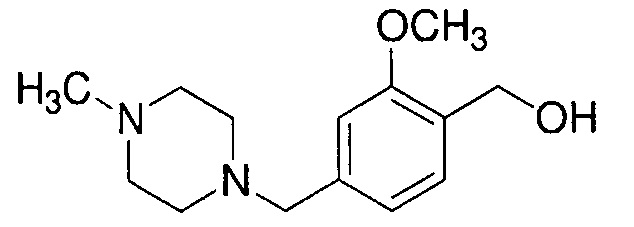
Пример 4-2: Получение [2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил]метанола
К 200 мл суспензии 5,21 г LAH в ТГФ, охлажденной льдом, по каплям добавляют, в потоке аргона, 50 мл раствора 25,5 г метилового эфира 2-метокси-4-[(4-метилпиперазин-1-ил)метил]бензойной кислоты в ТГФ. Полученную смесь перемешивают при охлаждении льдом в течение 1 часа и затем перемешивают при комнатной температуре в течение 22 часов. К реакционной смеси, охлаждаемой льдом, по каплям добавляют 25 мл 10% водной NaOH. После 30-минутного перемешивания полученную смесь фильтруют через целит. Полученный фильтрат промывают 150 мл ТГФ и затем концентрируют. К остатку добавляют 50 мл насыщенного солевого раствора и 300 мл дихлорметана, и органический слой выделяют. Органический слой концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система CHCl3/метанол), получая 22,4 г указанного в заголовке соединения (98% выход).
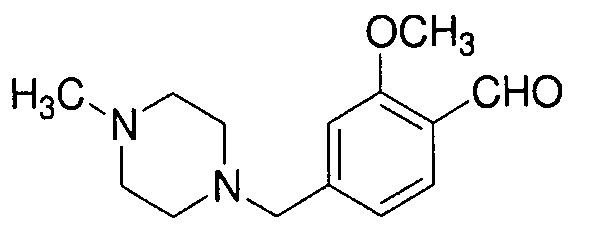
Пример 4-3: Получение 2-метокси-4-[(4-метилпиперазин-1-ил)метил]бензальдегида
К 220 мл раствора 22,2 г [2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил]метанола в CHCl3 добавляют 61,8 г диоксида марганца, и полученную смесь перемешивают при 55°C в течение 13 часов. Полученную реакционную смесь оставляют охлаждаться. Нерастворимый материал отфильтровывают, маточный раствор концентрируют, получая 21,8 г указанного в заголовке соединения (99% выход).
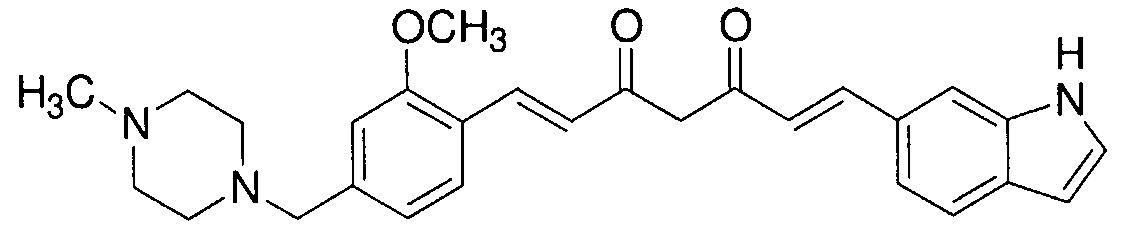
Пример 4-4: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил]гепта-1,6-диен-3,5-диона
К 200 мл раствора 7,56 г (E)-6-(1H-индол-6-ил)гекс-5-ен-2,4-диона в AcOEt добавляют 3,24 г оксида бора, и полученную смесь перемешивают при 70°C в течение 1 часа. К смеси последовательно добавляют 15 мл раствора 8,68 г 2-метокси-4-[(4-метилпиперазин-1-ил)метил]бензальдегида в AcOEt и 18,3 мл триизопропилбората, и смесь перемешивают при той же самой температуре в течение 40 минут. Затем добавляют 10 мл раствора 0,35 мл пиперидина в AcOEt. Полученную смесь перемешивают при 70°C в течение 3 часов и оставляют охлаждаться снова до комнатной температуры. К полученной реакционной смеси добавляют 100 мл 10% водного раствора K2CО3, и полученную смесь перемешивают в течение 1 часа. Органический слой выделяют и концентрируют. Полученный остаток очищают, используя хроматографическую колонку с амино-силикагелем (система гептан /AcOEt), получая 7,14 г указанного в заголовке соединения (47% выход).
Пример 4-5: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Указанное в заголовке соединение получают тем же способом, что 20 и в примере 1-2.
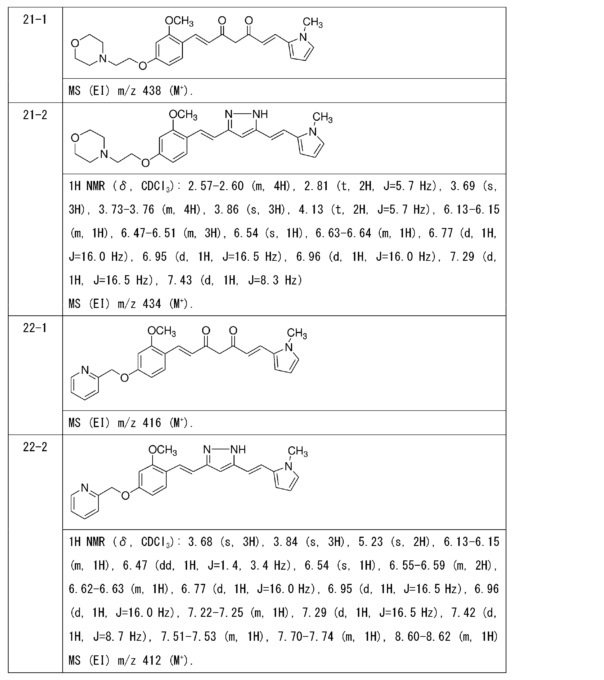
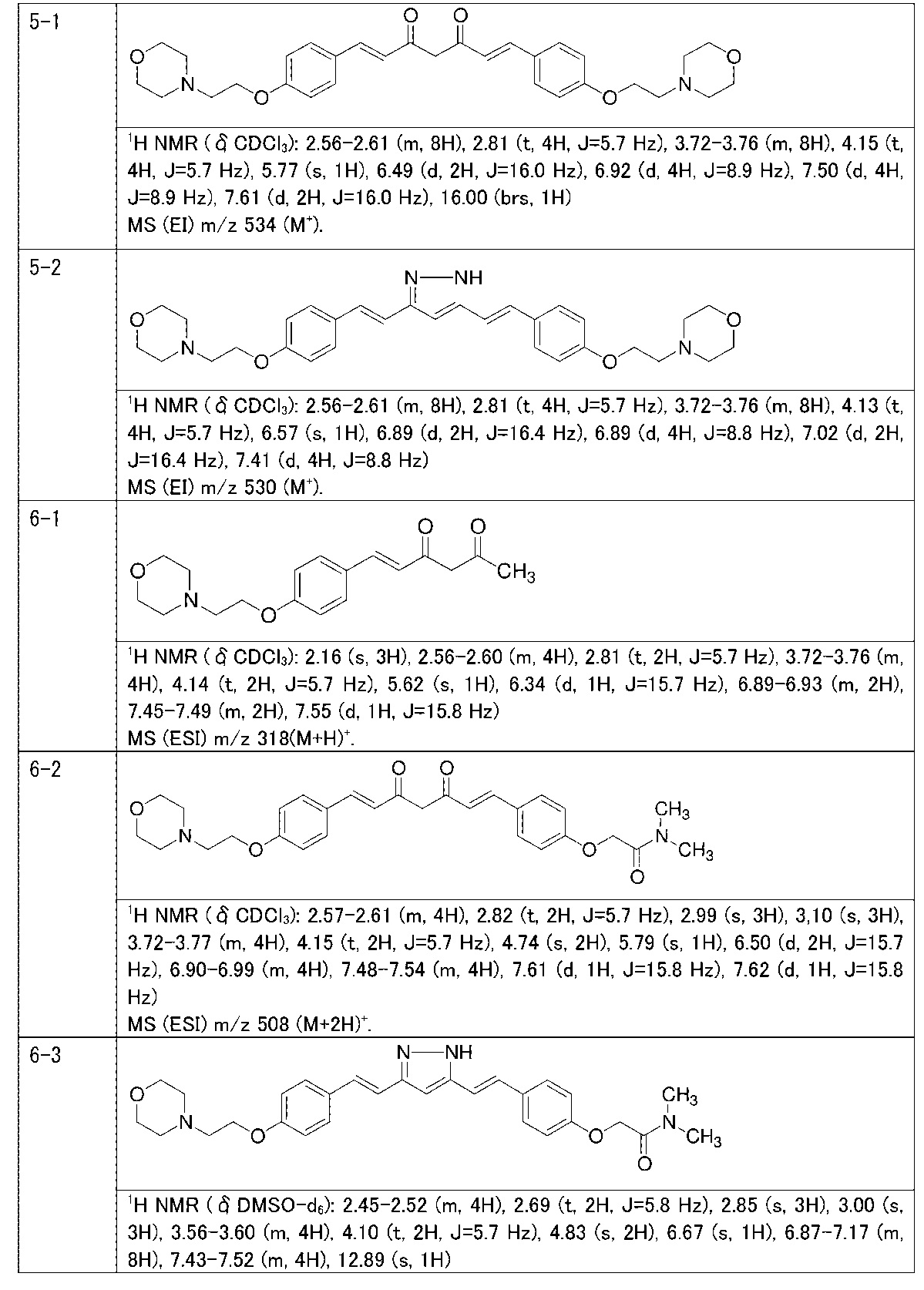
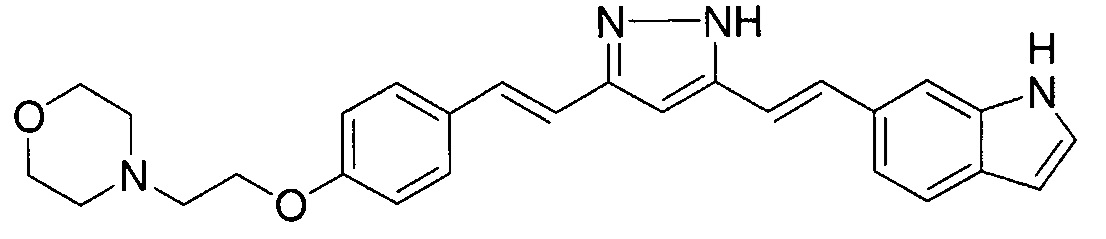
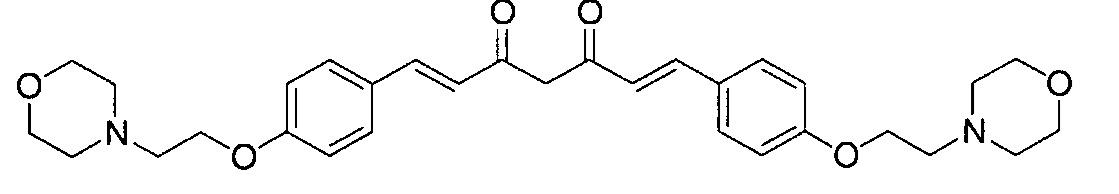
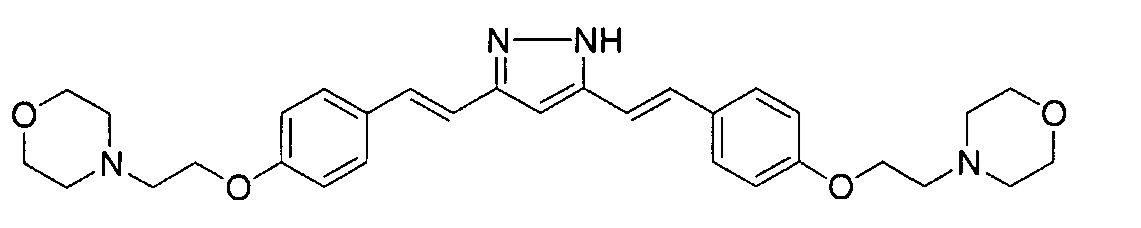
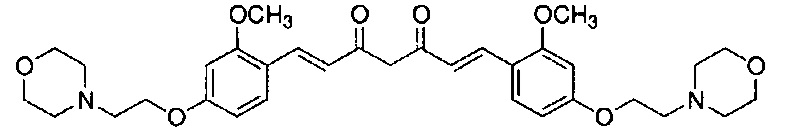
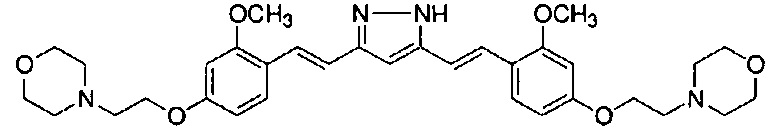
Пример 5: Получение 3,5-бис[(E)-2-[4-(2-морфолиноэтокси)фенил]винил]-1H-пиразола
Пример 5-1: Получение (1E,6E)-1,7-бис[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
К 2,0 г пентан-2,4-диона добавляют 10,0 мл AcOEt и 0,70 г оксида бора, и полученную смесь перемешивают при 70°C в течение 1 часа. К полученной реакционной смеси последовательно добавляют 30 мл раствора 9,4 г 4-(2-морфолиноэтокси)бензальдегида в AcOEt и 10,7 мл трибутилбората, и полученную смесь перемешивают при той же температуре в течение 1 часа. Добавляют 0,4 мл 1-бутиламина, и полученную смесь перемешивают при 70°C в течение 2,5 часа, и оставляют охлаждаться снова до комнатной температуры. К полученной реакционной смеси добавляют 50 мл 10% водного раствора K2CO3 и 30 мл ТГФ, и полученную смесь перемешивают при комнатной температуре в течение 10 минут. Органический слой выделяют, промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Полученный остаток обрабатывают 100 мл диэтилового эфира, получая 2,51 г указанного в заголовке соединения в виде порошка (24% выход).
Пример 5-2: Получение 3,5-бис[(E)-2-[4-(2-морфолиноэтокси)фенил]винил]-1H-пиразола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
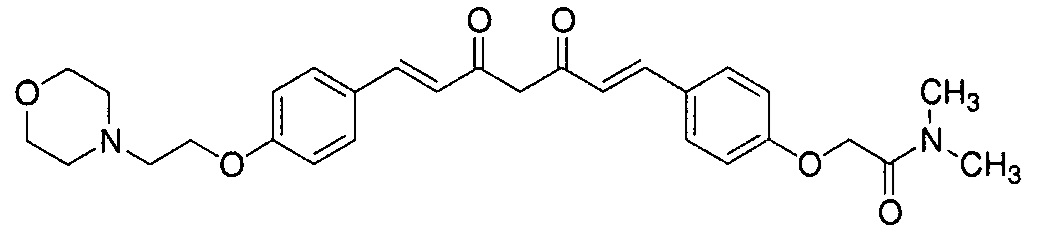
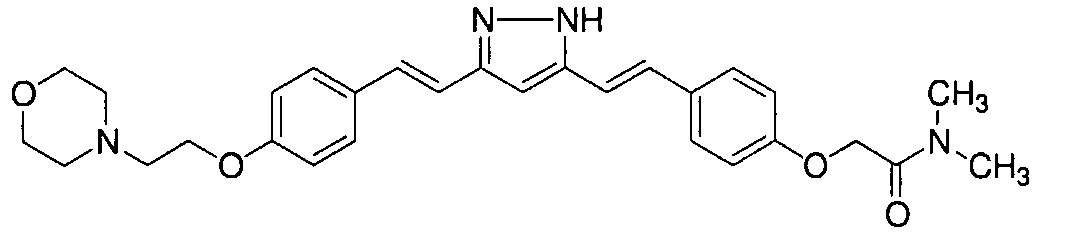
Пример 6: Получение N,N-диметил-2-[4-[(E)-2-[3-[(E)-2-[4-(2-морфолиноэтокси)фенил]винил]-1H-пиразол-5-ил]винил]фенокси]ацетамида
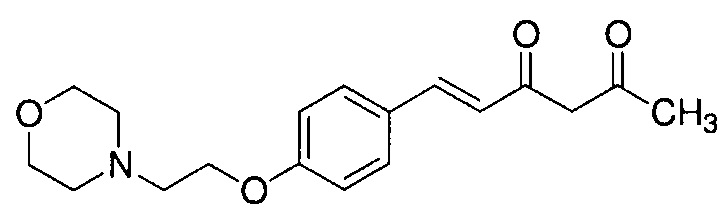
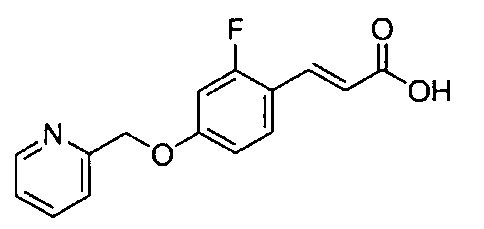
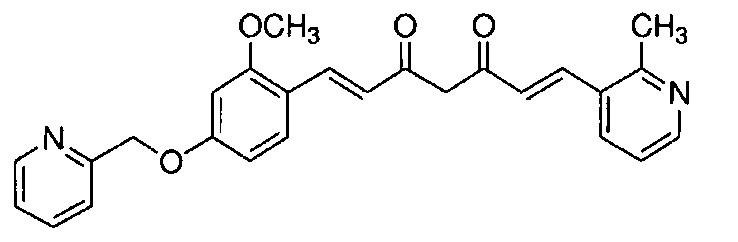
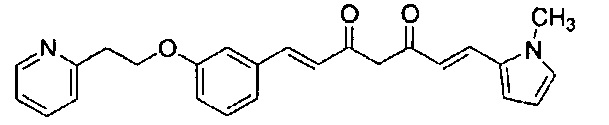
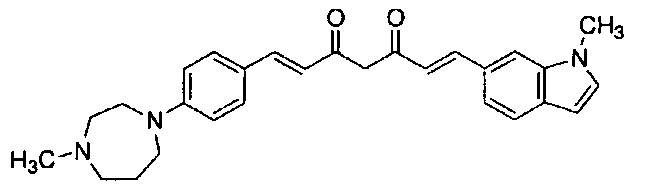
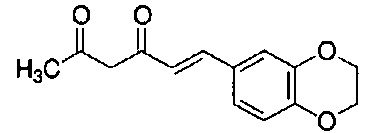
Пример 6-1: Получение (E)-6-[4-(2-морфолиноэтокси)фенил]гекс-5-ен-2,4-диона
К 30,0 г (E)-3-[4-(2-морфолиноэтокси)фенил]-2-пропеновой кислоты добавляют 600 мл ТГФ в потоке аргона. К полученной смеси, охлаждаемой льдом, последовательно по каплям добавляют 12,1 г триэтиламина и 15,5 г IBCF. Полученную смесь перемешивают при комнатной температуре в течение 2 часов до получения ангидрида кислоты. В отдельном контейнере в потоке аргона к 200 мл ТГФ и 16,3 г ацетилацетона добавляют к 15,5 г хлорида марганца. К полученной смеси, охлаждаемой льдом, по каплям добавляют 17,5 мл пиридина за 25 минут. Полученную смесь перемешивают при комнатной температуре в течение 2 часов. К полученной реакционной смеси, охлаждаемой льдом, по каплям добавляют в течение 45 минут полученный выше ангидрид кислоты, охлаждаемый льдом. Полученную смесь перемешивают при комнатной температуре в течение ночи. Полученную реакционную смесь добавляют к 2 л насыщенного водного раствора аммонийхлорида и 2 л CHCl3, и органический слой выделяют. Полученный органический слой сушат над Na2SO4 и концентрируют.
Полученный остаток растворяют в 100 мл ТГФ. Пока полученную смесь перемешивают при охлаждении льдом, по каплям добавляют 40 мл 28% аммиачной воды. Полученную смесь перемешивают при той же температуре в течение 1 часа. Полученную реакционную смесь добавляют к 1 л CHCl3 и 1 л насыщенного солевого раствора, и органический слой выделяют. Полученный органический слой сушат над Na2SO4 и концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система CHCl3/метанол), получая 26,5 г указанного в заголовке соединения (77% выход).
Пример 6-2: Получение N,N-диметил-2-[4-[(1E,6E)-7-[4-(2-морфолиноэтокси)фенил]-3,5-диоксогепта-1,6-
диенил]фенокси]ацетамида
Указанное в заголовке соединение получают тем же способом, что и в примере 4-4.
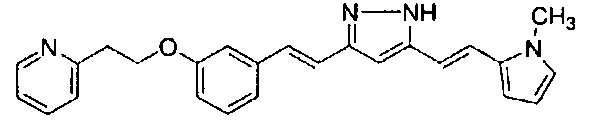
Пример 6-3: Получение N,N-диметил-2-[4-[(E)-2-[3-[(E)-2-[4-(2-морфолиноэтокси)фенил]винил]-1H-пиразол-5-ил]винил]фенокси]ацетамида
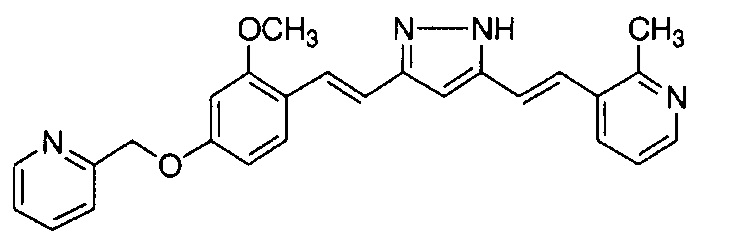
К 2,70 г N,N-диметил-2-[4-[(1E,6E)-7-[4-(2-морфолиноэтокси)фенил]-3,5-диоксо-гепта-1,6-диенил]фенокси]ацетамида добавляют 2,80 г гидразиндигидрохлорида и 54 мл метанола, и полученную смесь перемешивают при 40°C в течение ночи. Полученную реакционную смесь оставляют охлаждаться и выливают в 200 мл насыщенного водного раствора NaHCO3. К смеси добавляют 600 мл AcOEt, и органический слой выделяют. Полученный органический слой промывают насыщенным солевым раствором, сушат над Na2SO4 и концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система CHCl3/метанол), получая 1,76 г указанного в заголовке соединения (66% выход).
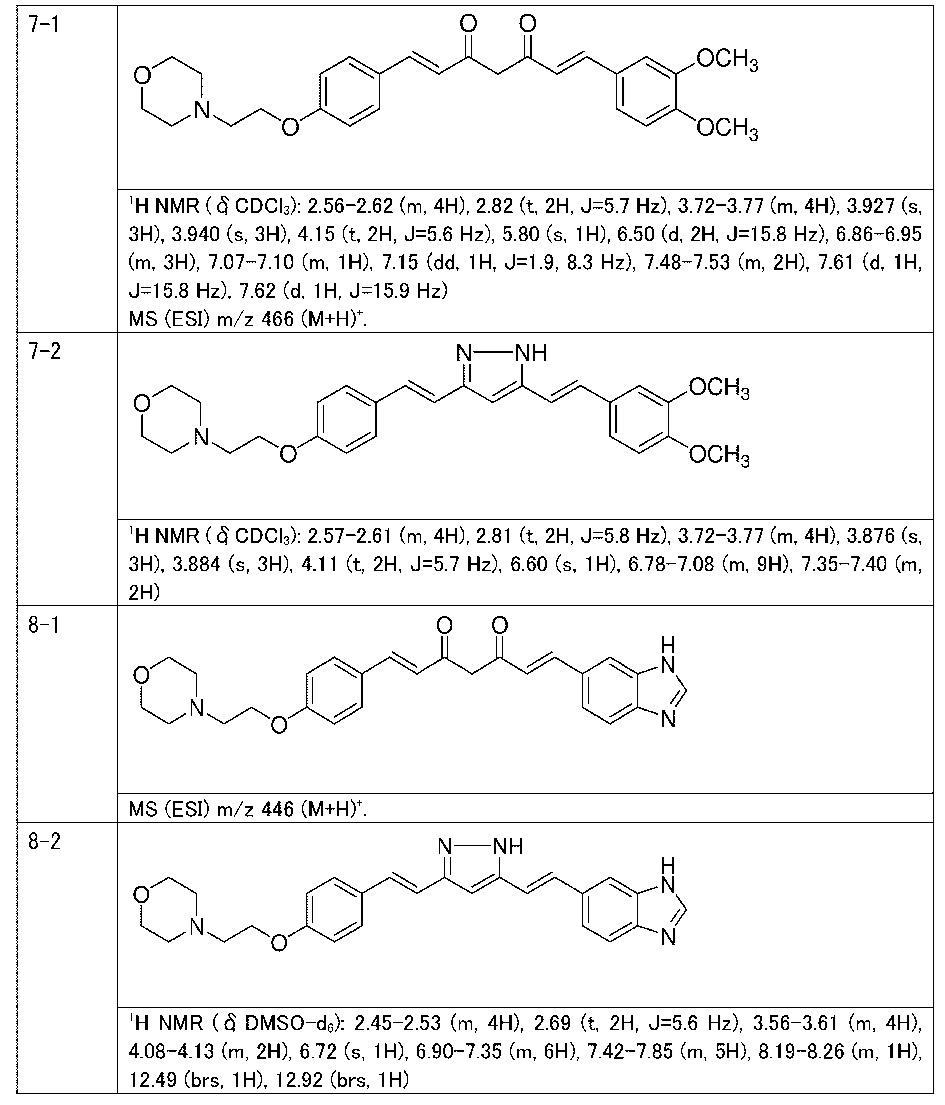
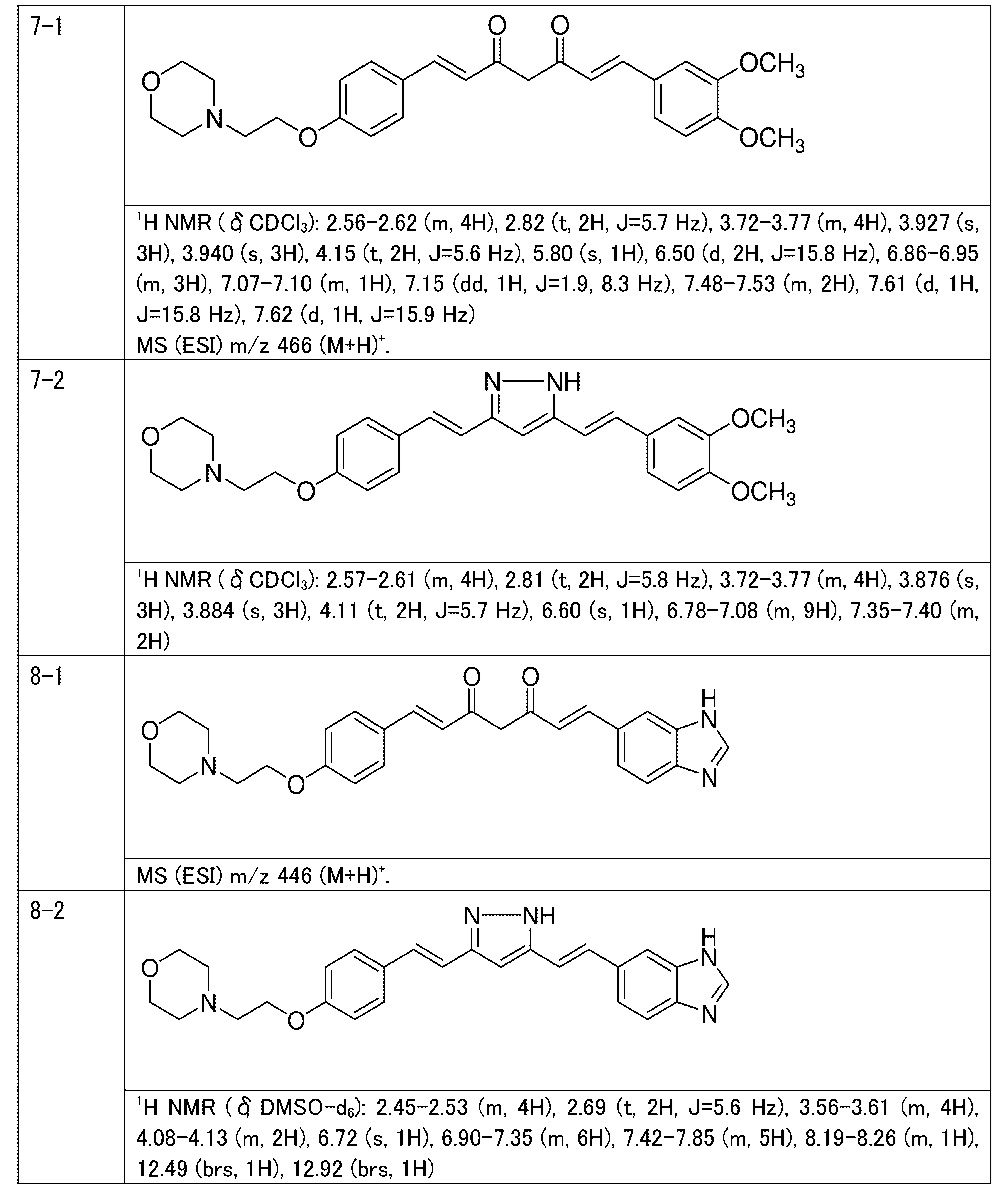
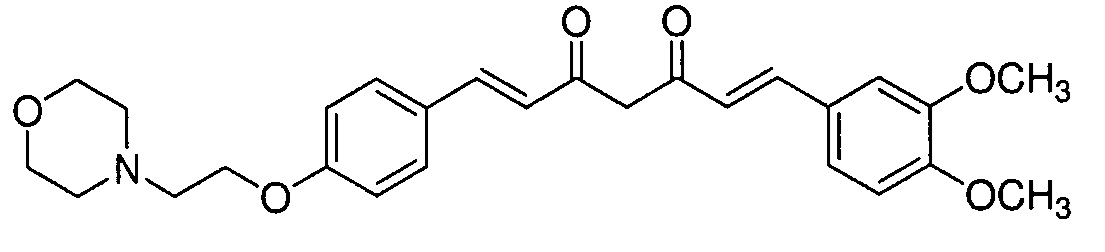
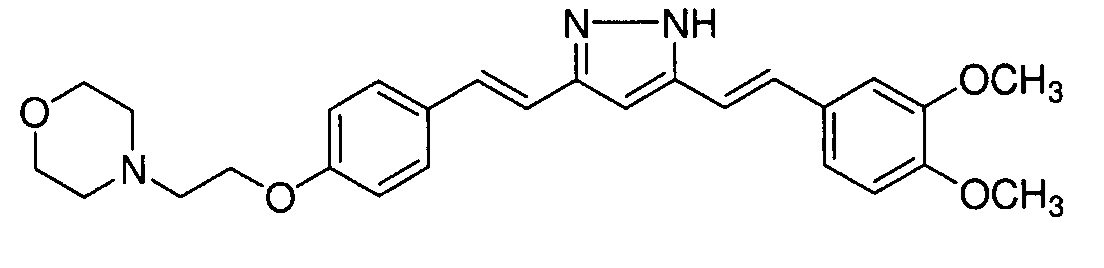
Пример 7: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(3,4-диметоксифенил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 7-1: Получение (1E,6E)-1-(3,4-диметоксифенил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 4-4.
Пример 7-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(3,4-диметоксифенил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают таким же способом, что и в примере 6-3.
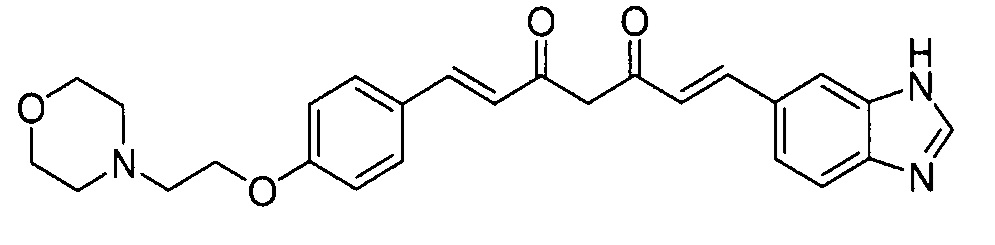
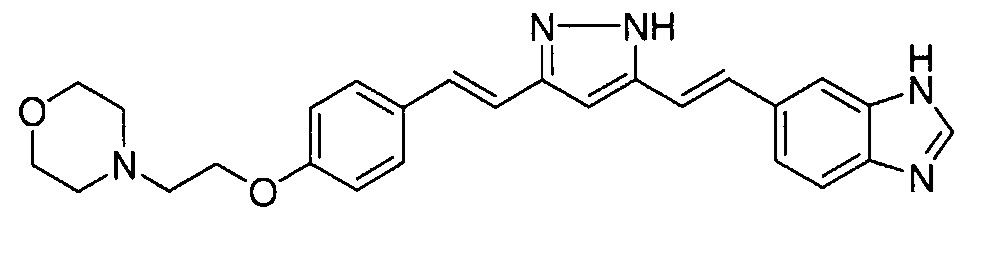
Пример 8: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(3H-бензимидазол-5-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 8-1: Получение (1E,6E)-1-(3H-бензимидазол-5-ил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 4-4.
Пример 8-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(3H-бензимидазол-5-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 6-3.
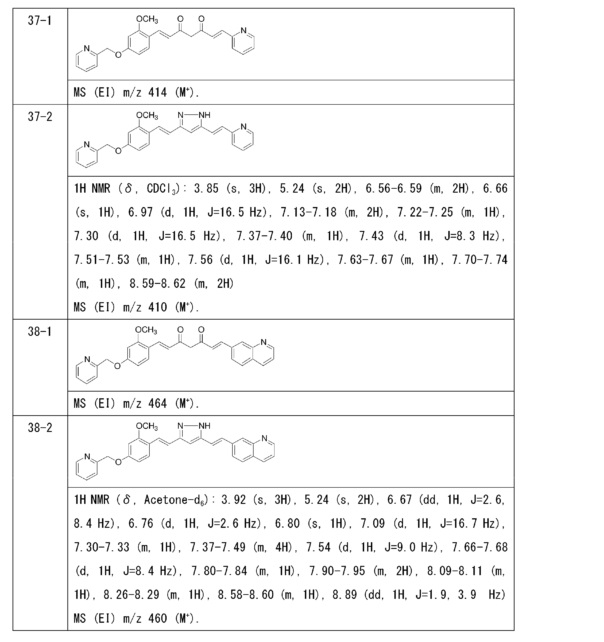
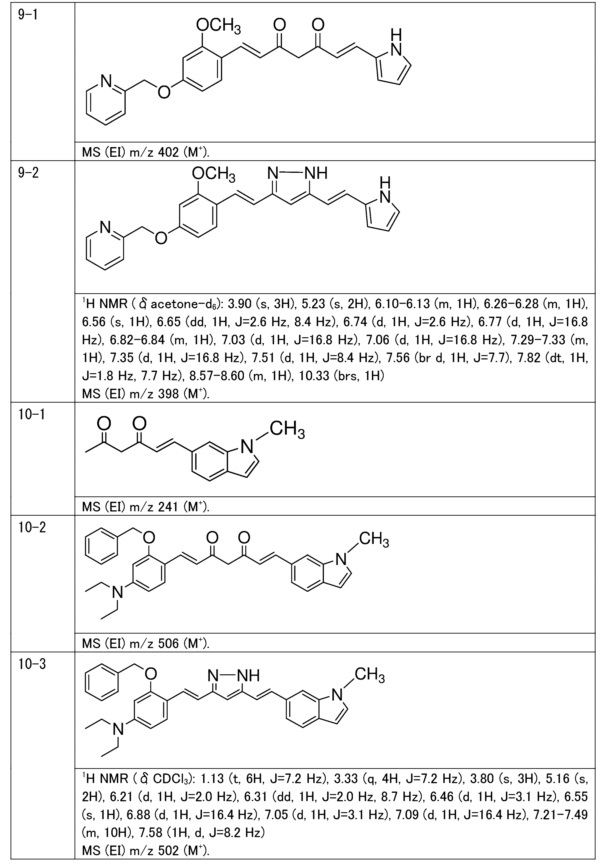
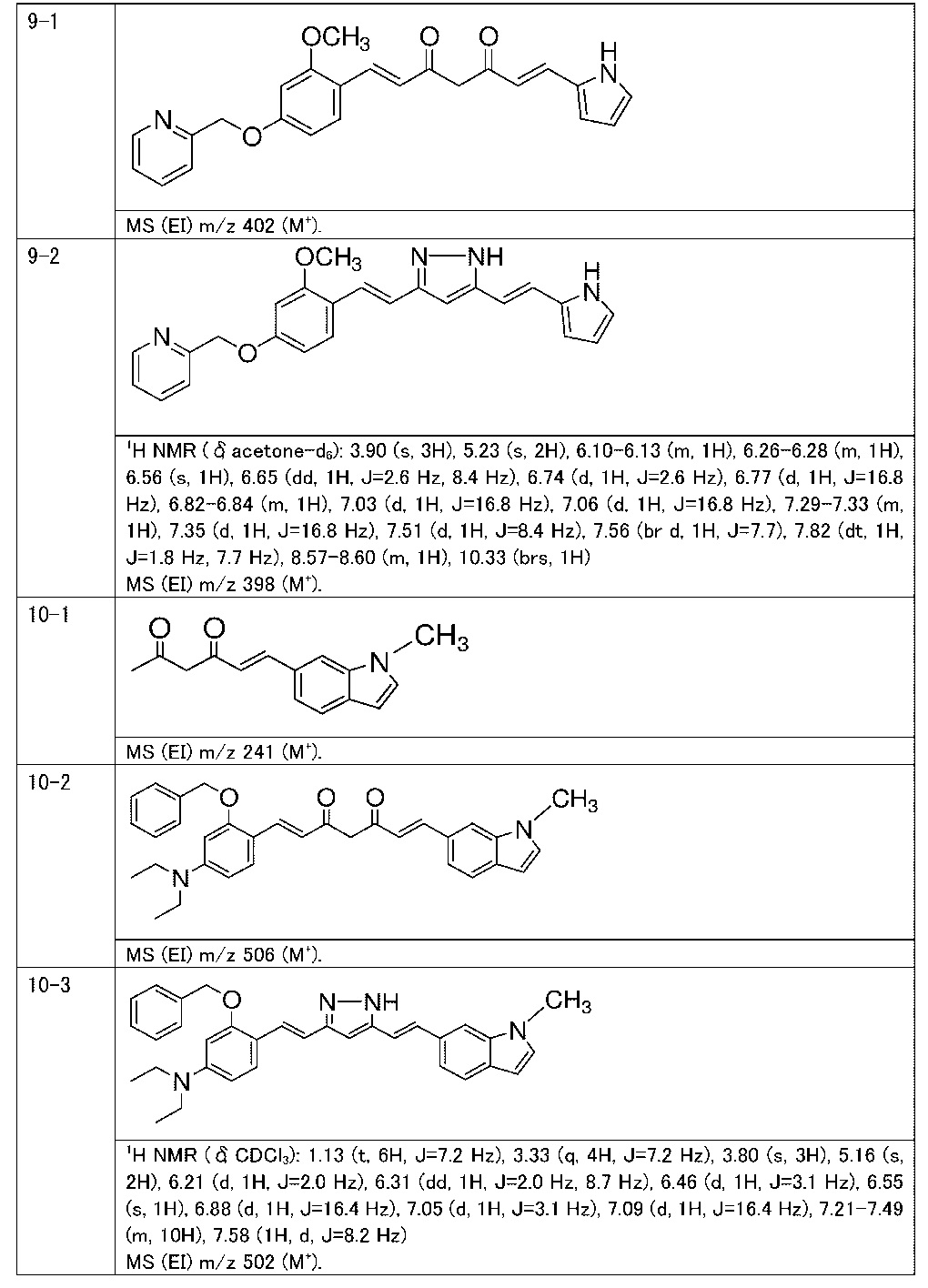
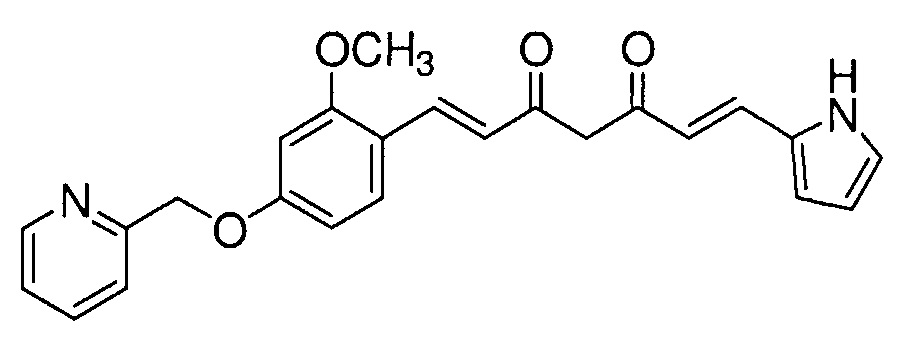
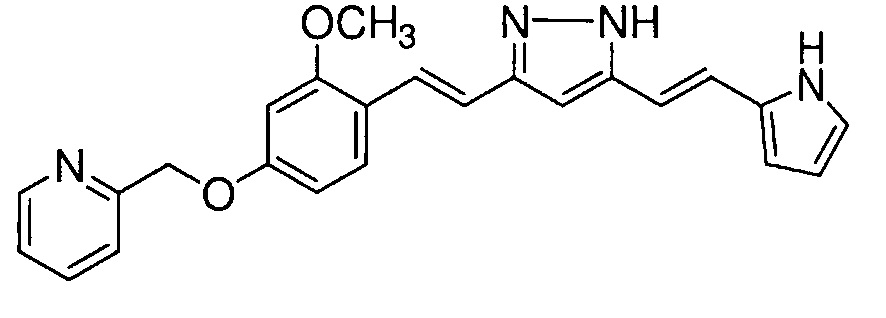
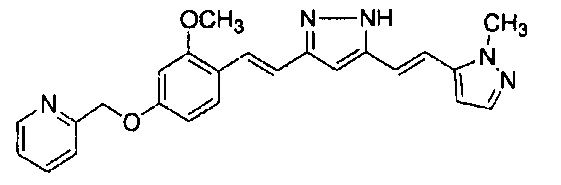
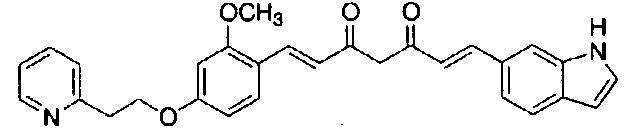
Пример 9: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1H-пиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 9-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1H-пиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 9-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1H-пиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
К 30 мг (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1H-пиррол-2-ил)гепта-1,6-диен-3,5-диона добавляют 1 мл ТГФ, 3 мкл AcOH и 4 мкл моногидрата гидразина, и полученную смесь перемешивают при 60°C в течение 4 часов. К смеси добавляют 500 мкл AcOH, и полученную смесь перемешивают при 80°C в течение 1 часа. К смеси добавляют 4 мкл моногидрата гидразина, и полученную смесь перемешивают при 80°C в течение 1 часа. Полученную реакционную смесь оставляют охлаждаться снова до комнатной температуры, и добавляют насыщеннымй водный раствор NaHCO3. После экстрагирования AcOEt органический слой выделяют. Полученный органический слой промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Полученный остаток очищают, используя PTLC (система CHCl3/метанол или AcOEt), получая 8 мг указанного в заголовке соединения (27% выход).
Пример 10: Получение 3-бензилокси-N,N-диэтил-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]анилина
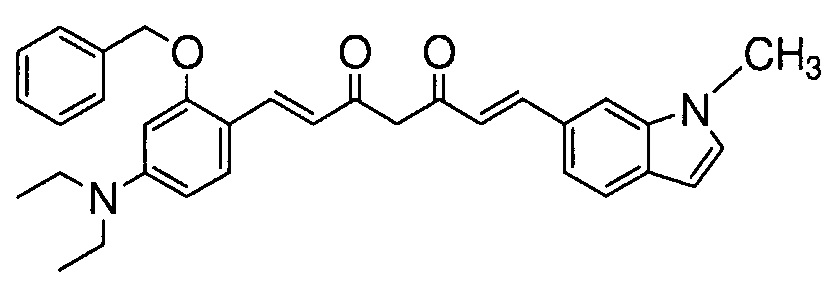
Пример 10-1: Получение (E)-6-(1-метилиндол-6-ил)гекс-5-ен-2,4-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 6-1.
Пример 10-2: Получение (1E,6E)-1-[2-бензилокси-4-(диэтиламино)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
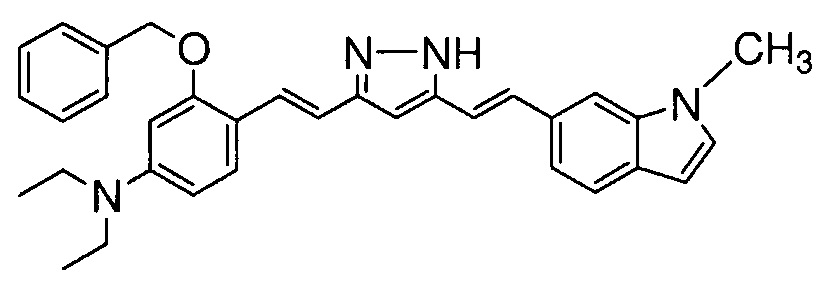
Пример 10-3: Получение 3-бензилокси-N,N-диэтил-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]анилина
Указанное в заголовке соединение получают тем же способом, что и в примере 9-2.
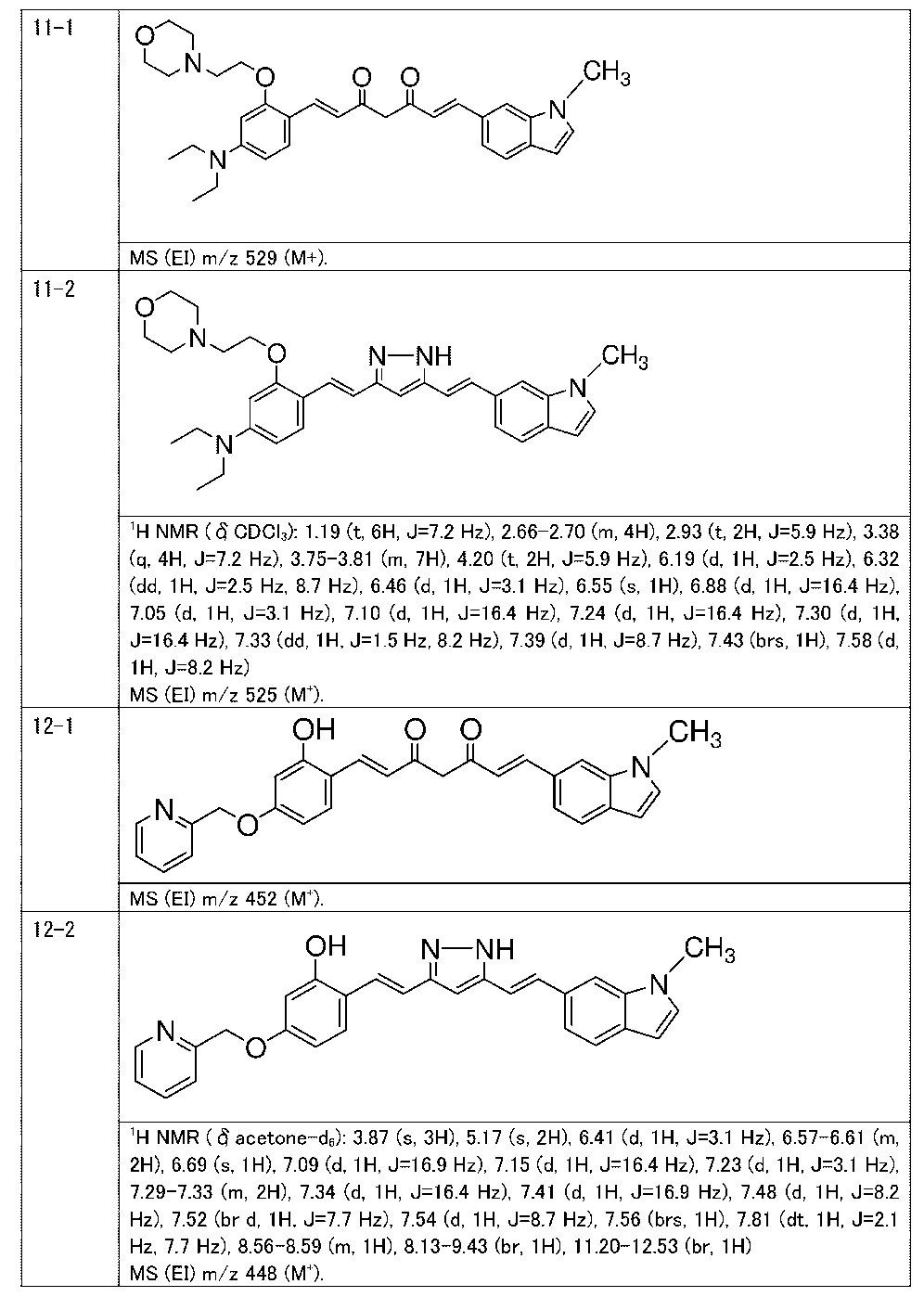
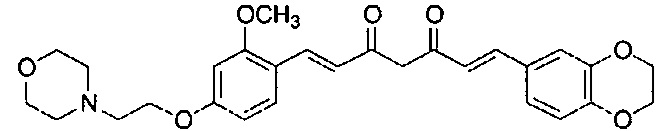
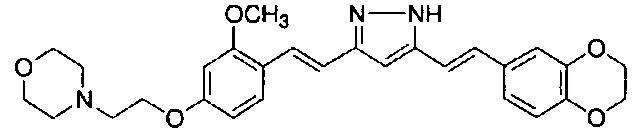
Пример 11: Получение N,N-диэтил-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]-3-(2-морфолиноэтокси)анилина
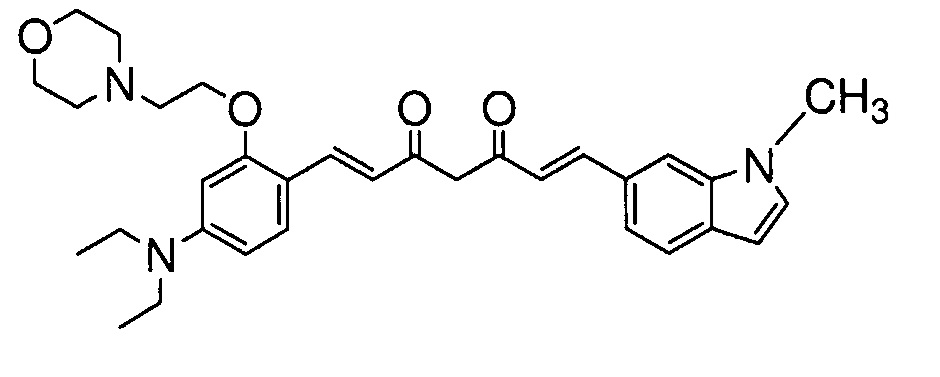
Пример 11-1: Получение (1E,6E)-1-[4-(диэтиламино)-2-(2-морфолиноэтокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
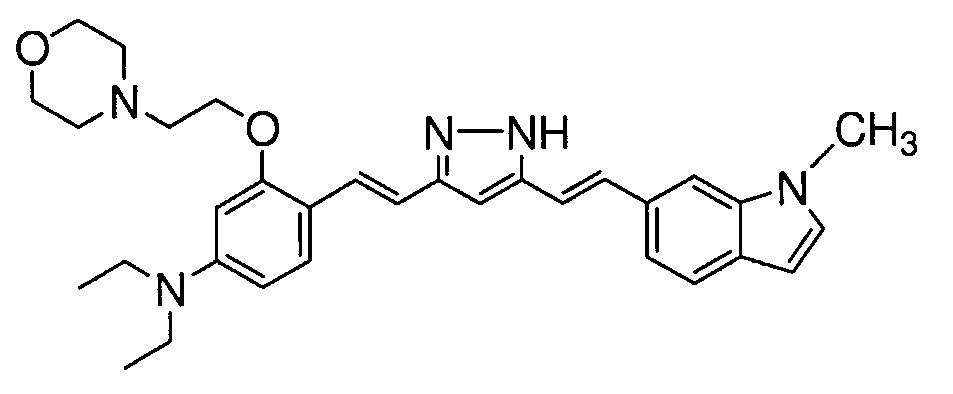
Пример 11-2: Получение N,N-диэтил-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]-3-(2-морфолиноэтокси)анилина
Указанное в заголовке соединение получают тем же способом, что и в примере 9-2.
Пример 12: Получение 2-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]-5-(2-пиридилметокси)фенола
Пример 12-1: Получение (1E,6E)-1-[2-гидрокси-4-(2-пиридилметокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 12-2: Получение 2-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]-5-(2-пиридилметокси)фенола
Указанное в заголовке соединение получают тем же способом, что и в примере 9-2.
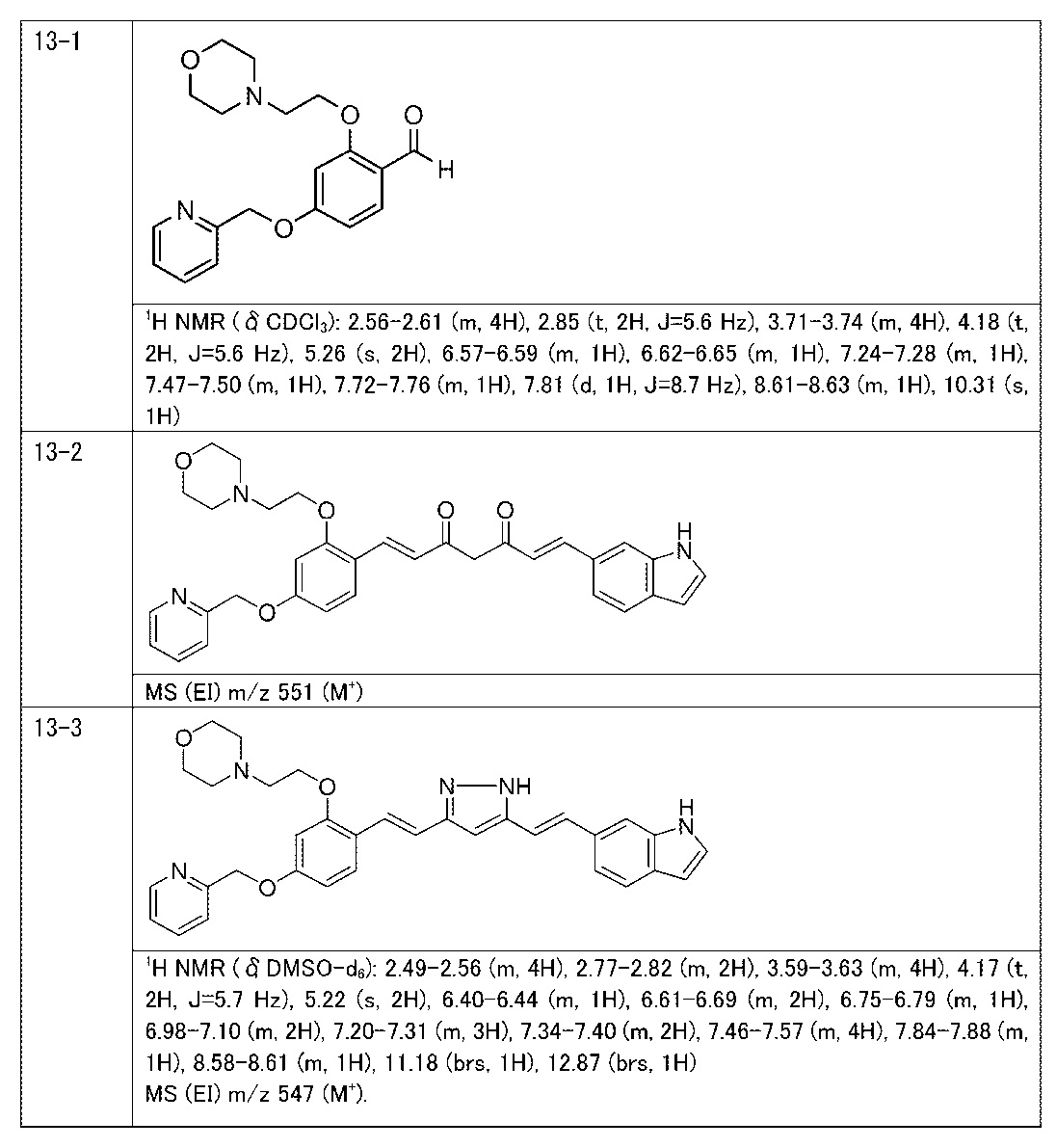
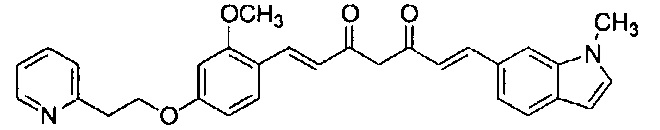
Пример 13: Получение 4-[2-[2-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]-5-(2-пиридилметокси)фенокси]этил]морфолина
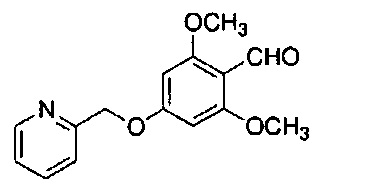
Пример 13-1: Получение 2-(2-морфолиноэтокси)-4-(2-пиридилметокси)бензальдегида
К 1,0 г 2-гидрокси-4-(2-пиридилметокси)бензальдегида последовательно добавляют 30 мл ацетонитрила, 4,26 г карбоната цезия и 0,85 г 4-(2-хлорэтил)морфолингидрохлорида. Полученную смесь перемешивают при 90°C в течение 2 часов. К полученной реакционной смеси добавляют 50 мл воды и 150 мл AcOEt, и органический слой выделяют. Полученный органический слой сушат над Na2SO4 и концентрируют, получая 1,56 г указанного в заголовке соединения с количественным выходом.
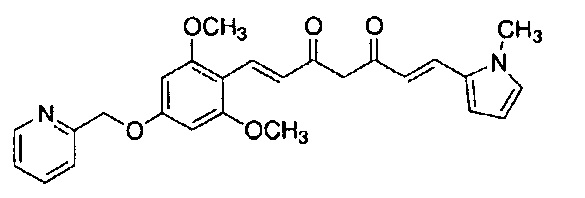
Пример 13-2: (1E,6E)-1-(1H-индол-6-ил)-7-[2-(2-морфолиноэтокси)-4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 13-3: Получение 4-[2-[2-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]-5-(2-пиридилметокси)фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 9-2.
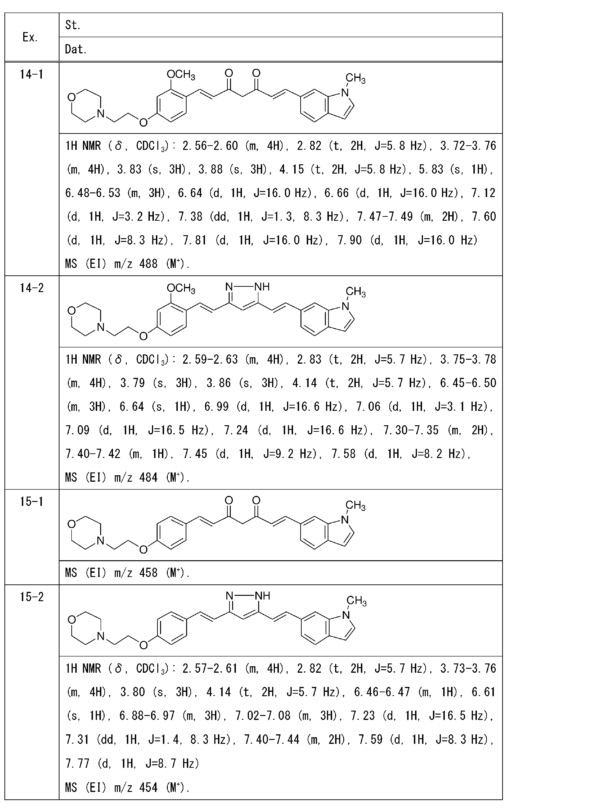
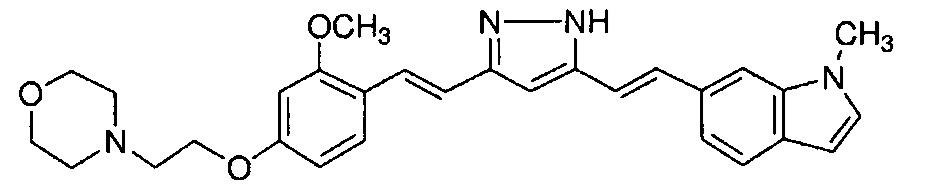
Пример 14: Получение 4-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 14-1: Получение (1E,6E)-1-[2-метокси-4-(2-морфолиноэтокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 14-2: Получение 4-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают получают тем же способом, что и в примере 1-2.
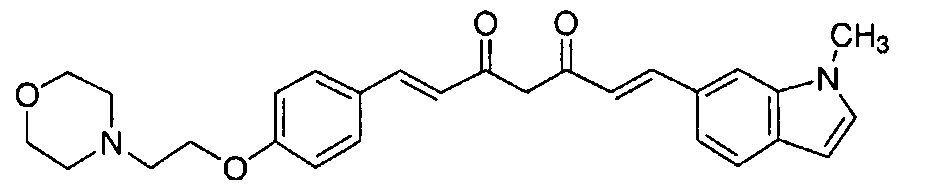
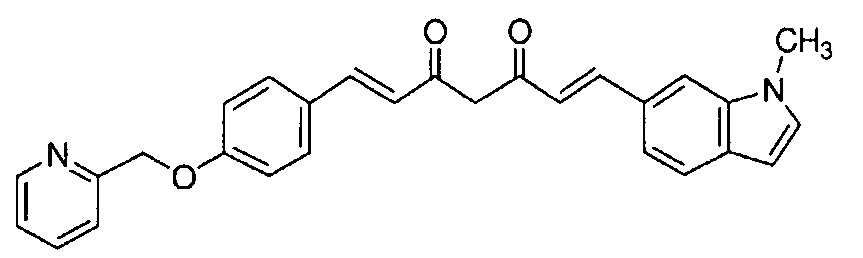
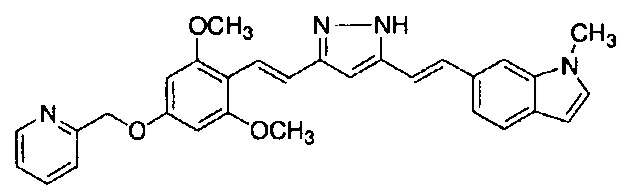
Пример 15: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
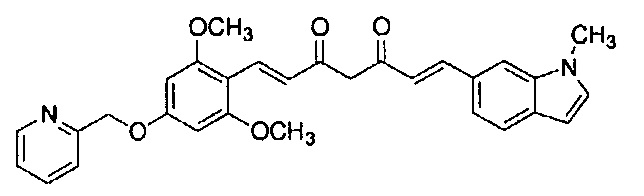
Пример 15-1: Получение (1E,6E)-1-(1-метилиндол-6-ил)-7-[4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 15-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1-метилиндол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
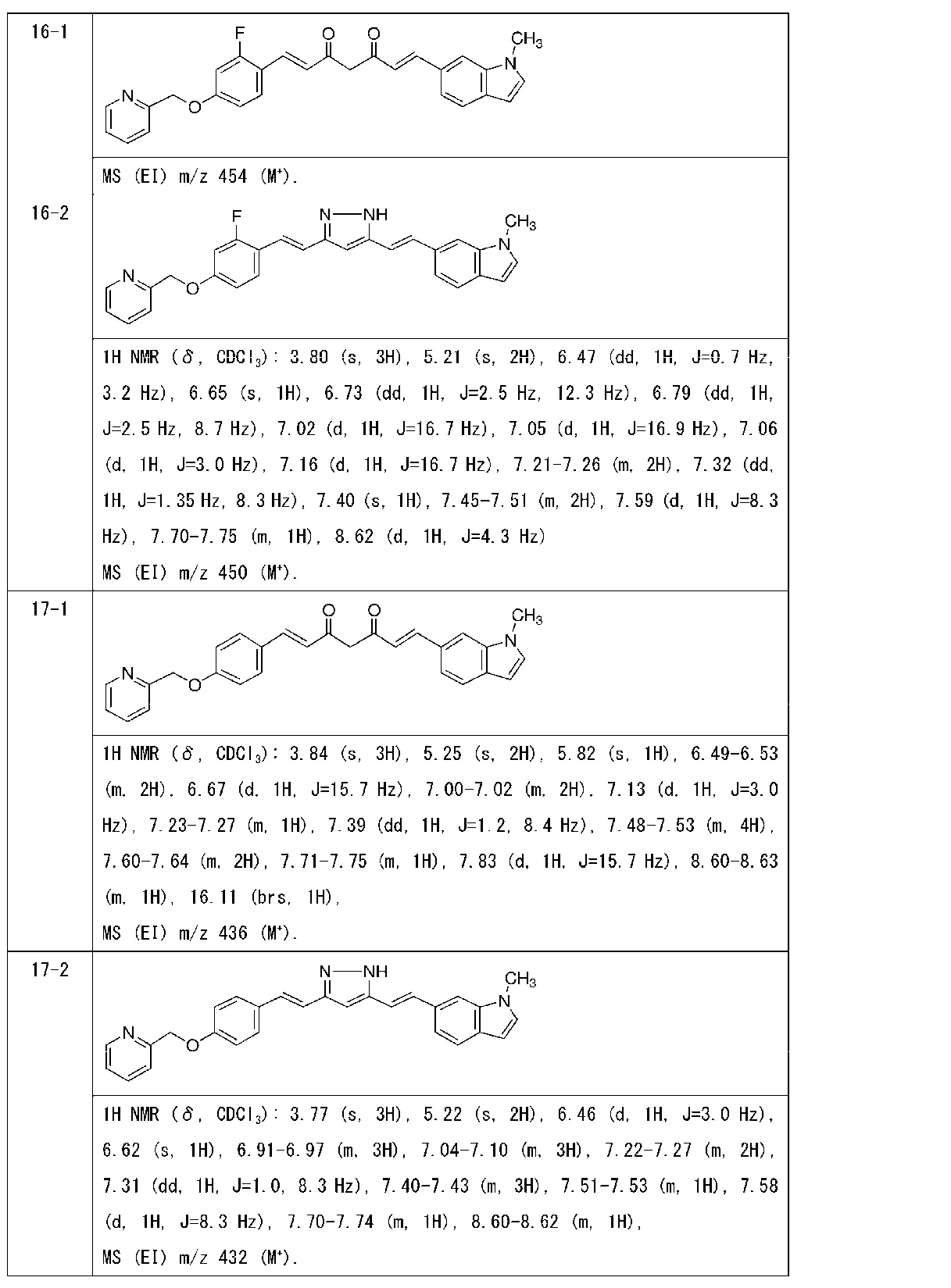
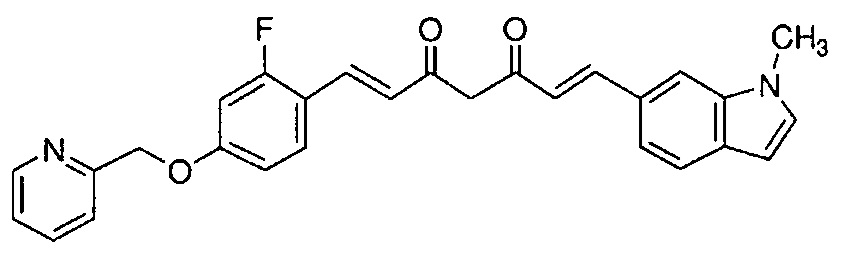
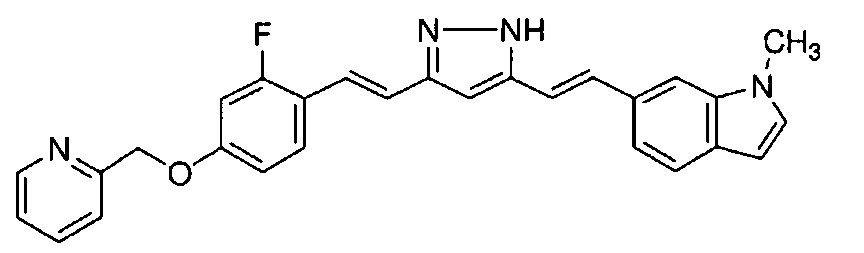
Пример 16: Получение 6-[(E)-2-[3-[(E)-2-[2-фтор-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
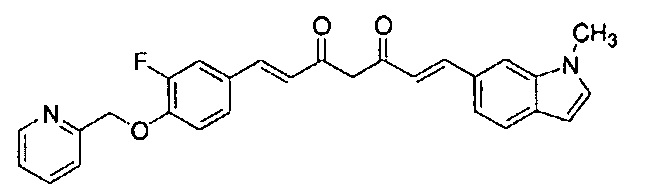
Пример 16-1: Получение (1E,6E)-1-[2-фтор-4-(2-пиридилметокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 16-2: Получение 6-[(E)-2-[3-[(E)-2-[2-фтор-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
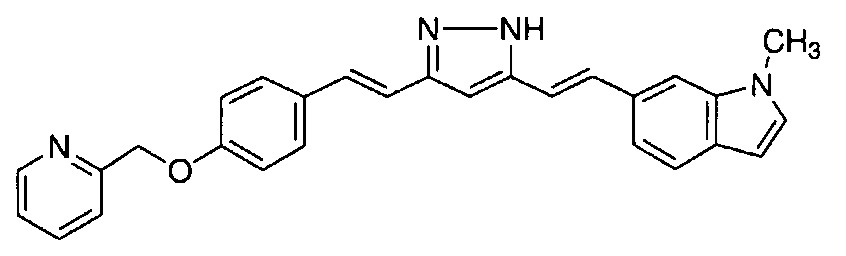
Пример 17: Получение l-метил-6-[(E)-2-[3-[(E)-2-[4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
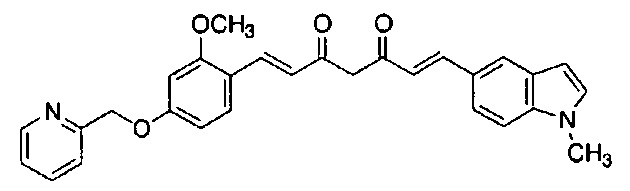
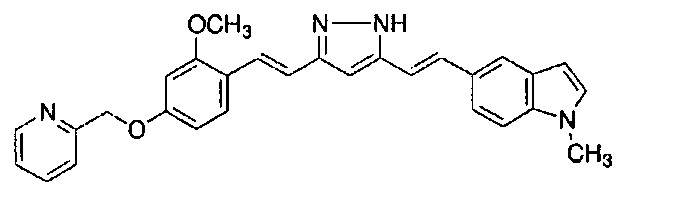
Пример 17-1: Получение (1E,6E)-1-(1-метилиндол-6-ил)-7-[4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 17-2: Получение l-метил-6-[(E)-2-[3-[(E)-2-[4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
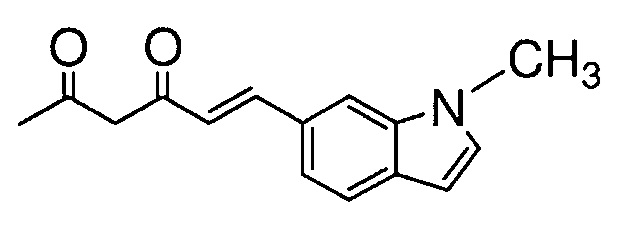
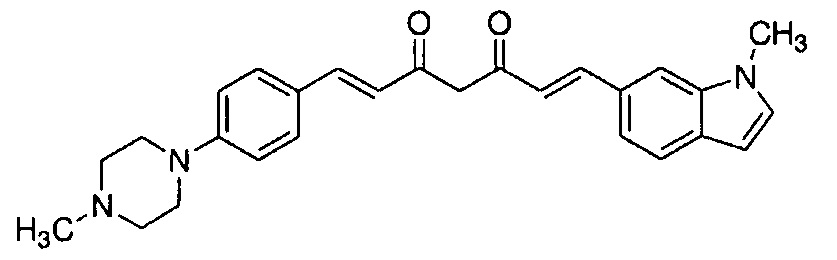
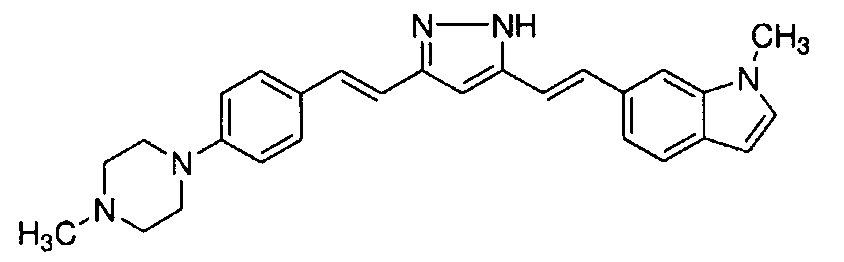
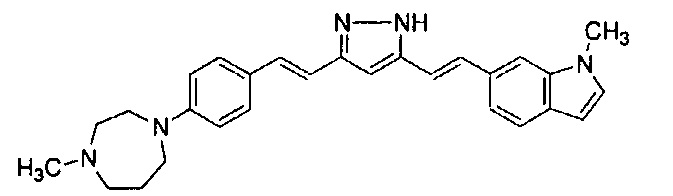
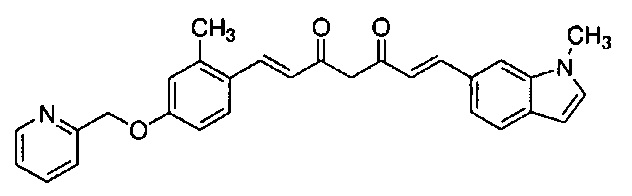
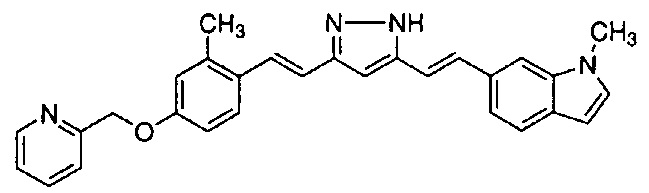
Пример 18: Получение l-метил-6-[(E)-2-[3-[(E)-2-[4-(4-метилпиперазин-1-ил)фенил]винил]-1H-пиразол-5-ил]винил]индола
Пример 18-1: Получение (1E,6E)-1-(1-метилиндол-6-ил)-7-[4-(4-метилпиперазин-1-ил)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 18-2: Получение l-метил-6-[(E)-2-[3-[(E)-2-[4-(4-метилпиперазин-1-ил)фенил]винил]-1H-пиразол-5-ил]винил]индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 19: Получение 2-[[3-фтор-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 19-1: Получение (E)-3-[2-фтор-4-(2-пиридилметокси)фенил]-2-пропеновой кислоты
К 1,8 г малоновой кислоты добавляют 18 мл пиридина, 2,0 г 2-фтор-4-(2-пиридилметокси)бензальдегида и 0,21 мл пиперидина. Полученную смесь перемешивают при 75°C в течение 1,5 часа и затем перемешивают при 95°C в течение 1 часа. Полученную реакционную смесь охлаждают льдом, добавляют воду, и добавляют 10% хлористоводородную кислоту, чтобы довести значение pH до 4. Образовавшийся осадок выделяют фильтрованием, получая 2,0 г указанного в заголовке соединения (85% выход).
Пример 19-2: Получение (E)-6-[2-фтор-4-(2-пиридилметокси)фенил]гекс-5-ен-2,4-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 6-1.
Пример 19-3: Получение (1E,6E)-1-[2-фтор-4-(2- пиридилметокси)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 19-4: Получение 2-[[3-фтор-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 20: Получение 2-[[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 20-1: Получение (E)-6-[4-(2-пиридилметокси)фенил]гекс-5-ен-2,4-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 6-1.
Пример 20-2: Получение (1E,6E)-1-(1-метилпиррол-2-ил)-7-[4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 20-3: Получение 2-[[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 21: Получение 4-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 21-1: Получение (1E,6E)-1-[2-метокси-4-(2-морфолиноэтокси)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что 15 и в примере 1-1.
Пример 21-2: Получение 4-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 22: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 22-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 22-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 23: Получение 2-[[4-[(E)-2-[5-[(E)-2-(1,5-диметилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Пример 23-1: Получение (1E,6E)-1-(1,5-диметилпиррол-2-ил)-7-[2-метокси-4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 23-2: Получение 2-[[4-[(E)-2-[5-[(E)-2-(1,5-диметилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 24: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1,3,5-триметилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 24-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1,3,5-триметилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 24-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1,3,5-триметилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 25: Получение 2-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-6-метилпиридина
Пример 25-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(6-метил-2-пиридил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 25-2: Получение 2-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-6-метилпиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 26: Получение 3-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-2-метилпиридина
Пример 26-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(2-метил-3-пиридил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 26-2: Получение 3-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-2-метилпиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 27: Получение l-метил-4-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]пиперазина
Пример 27-1: Получение (E)-6-(1-метилпиррол-2-ил)гекс-5-ен-2,4-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 6-1.
Пример 27-2: Получение (1E,6E)-1-[4-(4-метилпиперазин-1-ил)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 27-3: Получение l-метил-4-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]пиперазина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 28: Получение l-метил-4-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]-1,4-диазепана
Пример 28-1: Получение (1E,6E)-1-[4-(4-метил-1,4-диазепан-1-ил)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 28-2: Получение l-метил-4-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]-1,4-диазепана
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 29: Получение 3-[(E)-2-(4-изопропокси-2-метоксифенил)винил]-5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразола
Пример 29-1: Получение (1E,6E)-1-(4-изопропокси-2-метоксифенил)-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 29-2: Получение 3-[(E)-2-(4-изопропокси-2-метоксифенил)винил]-5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 30: Получение l-метил-4-[2-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]этил]пиперазина
Пример 30-1: Получение 4-[2-(4-метилпиперазин-1-ил)этил]бензальдегида
К 87 мл раствора 8,7 г l-[2-(4-бромфенил)этил]-4-метилпиперазина в ТГФ, охлажденного до -70°C, по каплям добавляют 21,1 мл раствора н-бутиллития (1,6 моль/л) в гексане, и полученную смесь перемешивают при той же самой температуре в течение 30 минут. В то время как полученную реакционную смесь перемешивают при той же температуре, по каплям добавляют 3,6 мл N,N-диметилформамида. Смесь перемешивают при той же самой температуре в течение 30 минут. Охлаждающую баню удаляют, и полученную смесь оставляют нагреваться до -10°C, выливают в смесь 12 мл 1 н. хлористоводородной кислоты и 100 мл холодной воды, и экстрагируют CHCl3. Полученный экстракт сушат над MgSO4 и концентрируют, получая 7,04 г указанного в заголовке соединения (98%).
Пример 30-2: Получение (1E,6E)-1-[4-[2-(4-метилпиперазин-1-ил)этил]фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 30-3: Получение l-метил-4-[2-[4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенил]этил]пиперазина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 31: Получение 2-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]пиридина
Пример 31-1: Получение 2-метокси-4-[2-(2-пиридил)этокси]бензальдегида
К перемешиваемой, охлаждаемой льдом смеси 5,0 г 4-гидрокси-2-метоксибензальдегида, 4,5 г 2-(2-пиридил)этанола и 10,3 г трифенилфосфина по каплям добавляют 15,8 г 40% раствора диэтилазодикарбоксилата в толуоле. Смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь концентрируют, очищают, используя колоночную хроматографию на силикагеле (система гексан/ацетон), и дополнительно очищают, используя колоночную хроматографию на силикагеле (система гексан/AcOEt), получая 5,84 г указанного в заголовке соединения (69% выход).
Пример 31-2: Получение (1E,6E)-1-[2-метокси-4-[2-(2-пиридил)этокси]фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 31-3; Получение 2-[2-[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 32: Получение 2-[[3-метил-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 32-1: Получение метилового эфира 2-метил-4-(2-пиридилметокси)бензойной кислоты
К 0,85 г метилового эфира 4-гидрокси-2-метилбензойной кислоты добавляют 12 мл ацетонитрила, 2,12 г K2CO3 и 0,84 г 2-хлорметил)пиридингидрохлорида, и полученную смесь перемешивают при 90°C в течение 4 часов. Реакционную смесь оставляют снова охлаждаться до комнатной температуры и нейтрализуют, добавляя 5% хлористоводородную кислоту. Добавляют 150 мл AcOEt, и органический слой выделяют. Полученный органический слой промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Полученный остаток очищают, используя колоночную хроматографию на силикагеле (система гексан/AcOEt), получая 1,18 г указанного в заголовке соединения (89% выход).
Пример 32-2: Получение [2-метил-4-(2-пиридилметокси)фенил]метанола
К 1,0 г метилового эфира 2-метил-4-(2-пиридилметокси)бензойной кислоты добавляют 8 мл толуола в атмосфере аргона. К полученной смеси, охлажденной до -78°C, по каплям добавляют 8,7 мл раствора диизобутилалюминийгидрида (1,0 моль/л) в толуоле. Полученную смесь перемешивают при той же самой температуре в течение 6 часов и затем перемешивают при -35°C в течение 1 часа. К полученной реакционной смеси добавляют насыщенный водный раствор соли Рочелла, и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К смеси добавляют 150 мл диэтилового эфира, и органический слой выделяют. Полученный органический слой сушат над Na2SO4 и концентрируют, получая 0,83 г указанного в заголовке соединения (93% выход).
Пример 32-3: Получение 2-метил-4-(2-пиридилметокси)бензальдегида
К 0,72 г [2-метил-4-(2-пиридилметокси)фенил]метанола добавляют 30 мл CHCl3 и 7,2 г диоксида марганца, и полученную смесь перемешивают при комнатной температуре в течение 2 часов. Нерастворимое вещество отфильтровывают из реакционной смеси, и маточный раствор концентрируют, получая 0,70 г указанного в заголовке соединения (99% выход).
Пример 32-4: Получение (1E,6E)-1-[2-метил-4-(2-пиридилметокси)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 32-5: Получение 2-[[3-метил-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 33: Получение 2-[2-[3-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]пиридина
Пример 33-1: Получение (1E,6E)-1-(1-метилпиррол-2-ил)-7-{3-[2-(2-пиридил)этокси]фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 33-2: Получение 2-[2-[3-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 34: Получение 2-[[3,5-диметокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 34-1: Получение 2,6-диметокси-4-(2-пиридилметокси)бензальдегида
Указанное в заголовке соединение получают тем же способом, что и в примере 32-1.
Пример 34-2: Получение (1E,6E)-1-[2,6-диметокси-4-(2-пиридилметокси)фенил]-7-(1-метилпиррол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 34-3: Получение 2-[[3,5-диметокси-4-[(E)-2-[5-[(E)-2-(1-метилпиррол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 35: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилимидазол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 35-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1-метилимидазол-2-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 35-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(1-метилимидазол-2-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 36: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(3-метилимидазол-4-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 36-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(3-метилимидазол-4-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 36-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(3-метилимидазол-4-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 37: Получение 2-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]пиридина
Пример 37-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(2-пиридил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 37-2: Получение 2-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 38: Получение 7-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]хинолина
Пример 38-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(7-хинолил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 38-2: Получение 7-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]хинолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 39: Получение 2-[[4-[(E)-2-[5-[(E)-2-(2-фурил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Пример 39-1: Получение (1E,6E)-1-(2-фурил)-7-[2-метокси-4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 39-2: Получение 2-[[4-[(E)-2-[5-[(E)-2-(2-фурил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 40: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(5-метил-2-фурил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 40-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(5-метил-2-фурил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 40-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(5-метил-2-фурил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 41: Получение 2-[[4-[(E)-2-[5-[(E)-2-(4,5-диметил-2-фурил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Пример 41-1: Получение (1E,6E)-1-(4,5-диметил-2-фурил)-7-[2-метокси-4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 41-2: Получение 2-[[4-[(E)-2-[5-[(E)-2-(4,5-диметил-2-фурил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 42: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(2-метилпиразол-3-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Пример 42-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(2-метилпиразол-3-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 42-2: Получение 2-[[3-метокси-4-[(E)-2-[5-[(E)-2-(2-метилпиразол-3-ил)винил]-1H-пиразол-3-ил]винил]фенокси]метил]пиридина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 43: Получение l-метил-6-[(E)-2-[3-[(B)-2-[4-(4-метил-1,4-диазепан-1-ил)фенил]винил]-1H-пиразол-5-ил]винил]индола
Пример 43-1: Получение (1E,6E)-1-[4-(4-метил-1,4-диазепан-1-ил)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 43-2: Получение l-метил-6-[(E)-2-[3-[(E)-2-[4-(4-метил-1,4-диазепан-1-ил)фенил]винил]-1H-пиразол-5-ил]винил]индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 44: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[2-(2-пиридил)этокси]фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Пример 44-1: Получение (1E,6E)-1-[2-метокси-4-[2-(2-пиридил)этокси]фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 44-2: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[2-(2-пиридил)этокси]фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 45: Получение 6-[(E)-2-[3-[(E)-2-[2,6-диметокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Пример 45-1: Получение (1E,6E)-1-[2,6-диметокси-4-(2-пиридилметокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 45-2: Получение 6-[(E)-2-[3-[(E)-2-[2,6-диметокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 46: Получение 6-[(E)-2-[3-[(E)-2-[3-фтор-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Пример 46-1: Получение (1E,6E)-1-[3-фтор-4-(2-пиридилметокси)фенил]-7-(1-метилиндол-6-ил)гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 46-2: Получение 6-[(E)-2-[3-[(E)-2-[3-фтор-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 47: Получение 4-[[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]метил]морфолина
Пример 47-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-(морфолинометил)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 47-2: Получение 4-[[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]метил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 48: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]этил]морфолина
Пример 48-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-(2-морфолиноэтил)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 48-2: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 49: Получение 4-[3-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]пропил]морфолина
Пример 49-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-(3-морфолинопропил)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 49-2: Получение 4-[3-[4-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенил]пропил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 50: Получение 6-[(E)-2-[3-[(E)-2-[4-[(4-метилпиперазин-1-ил)метил]фенил]винил]-1H-пиразол-5-ил]винил]-IH-индола
Пример 50-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-[(4-метилпиперазин-1-ил)метил]фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 50-2: Получение 6-[(E)-2-[3-[(E)-2-[4-[(4-метилпиперазин-1-ил)метил]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 51: Получение 6-[(E)-2-[3-[(E)-2-[4-[2-(4-метилпиперазин-1-ил)этил]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Пример 51-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[4-[2-(4-метилпиперазин-1-ил)этил]фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 51-2: Получение 6-[(E)-2-[3-[(E)-2-[4-[2-(4-метилпиперазин-1-ил)этил]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 52: Получение 4-[2-[2-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 52-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[2-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 52-2: Получение 4-[2-[2-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 53: Получение 4-[2-[3-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Пример 53-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[3-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 53-2: Получение 4-[2-[3-[(E)-2-[5-[(E)-2-(1H-индол-6-ил)винил]-1H-пиразол-3-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 54: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[2-(2-пиридил)этокси]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Пример 54-1: Получение (1E,6E)-1-(1H-индол-6-ил)-7-[2-метокси-4-[2-(2-пиридил)этокси]фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 54-2: Получение 6-[(E)-2-[3-[(E)-2-[2-метокси-4-[2-(2-пиридил)этокси]фенил]винил]-1H-пиразол-5-ил]винил]-1H-индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 55: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]этил]морфолина
Пример 55-1: Получение (E)-6-(2,3-дигидро-1,4-бензодиоксин-6-ил)гекс-5-ен-2,4-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 6-1.
Пример 55-2: Получение (1E,6E)-1-(2,3-дигидро-1,4-бензодиоксин-6-ил)-7-[2-метокси-4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 55-3: Получение 4-[2-[4-[(E)-2-[5-[(E)-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)винил]-1H-пиразол-3-ил]винил]-3-метоксифенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 56: Получение 4-[2-[3-метокси-4-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-морфолиноэтокси)фенил]винил]-1H-пиразол-5-ил]винил]фенокси]этил]морфолина
Пример 56-1: Получение (1E,6E)-1,7-бис[2-метокси-4-(2-морфолиноэтокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 5-1.
Пример 56-2: Получение 4-[2-[3-метокси-4-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-морфолиноэтокси)фенил]винил]-1H-пиразол-5-ил]винил]фенокси]этил]морфолина
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 57: Получение l-метил-2-[(E)-2-[3-[(E)-2-[4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
Пример 57-1: Получение (1E,6E)-1-(1-метилиндол-2-ил)-7-[4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 57-2: Получение l-метил-2-[(E)-2-[3-[(E)-2-[4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 58: Получение 5-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Пример 58-1: Получение (1E,6E)-1-[2-метокси-4-(2-пиридилметокси)фенил]-7-(1-метилиндол-5-ил)гепта-1,6-диен)-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 58-2: Получение 5-[(E)-2-[3-[(E)-2-[2-метокси-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]-1-метилиндола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Пример 59: Получение l-метил-6-[(E)-2-[3-[(E)-2-[2-метил-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
Пример 59-1: Получение (1E,6E)-1-(1-метилиндол-6-ил)-7-[2-метил-4-(2-пиридилметокси)фенил]гепта-1,6-диен-3,5-диона
Указанное в заголовке соединение получают тем же способом, что и в примере 1-1.
Пример 59-2: Получение l-метил-6-[(E)-2-[3-[(E)-2-[2-метил-4-(2-пиридилметокси)фенил]винил]-1H-пиразол-5-ил]винил]индола
Указанное в заголовке соединение получают тем же способом, что и в примере 1-2.
Структурные формулы и аналитические данные, полученные в приведенных выше примерах, представлены далее в таблицах.
В таблицах: Ex.: пример; St.: химическая структура; Dat.: аналитические данные.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фармакологический тестовый пример 1: Определение ингибирующей активности в отношении агрегации тау
Рекомбинантный трех-повторный, связывающий микроканальцы домен (3R-MBD) тау-белка экспрессируют в E. coli, очищают и используют в экспериментах. Очищенный тау раствор разбавляют 50 мМ трис-HCl буфера (pH 7,6) до конечной концентрации 10 мкМ. Тестируемые соединения получают, используя диметилсульфоксид (здесь и далее называемый как ДМСО), при их 20-кратных конечных концентрациях, и добавляют к тау раствору, с тем, чтобы концентрация ДМСО составила 5%. К полученному раствору, добавляют гепарин, с тем, чтобы конечная концентрация составила 10 мкМ, и планшет оставляют выстаиваться при 37°C в течение 16 часов. В планшет добавляют тиофлавин T так, чтобы концентрация составила 10 мкМ, и измеряют интенсивность флуоресценции, используя устройство, считывающее данные с флуоресцентного планшета (PerkinElmer, Inc.) (длина волны возбуждения: 440 нм; флуоресценция на длине волны: 486 нм).
Конечная концентрация каждого из соединений к моменту измерения составляет 0,1, 0,3, 1, 3 и 10 мкМ. Образец, в который добавляют только ДМСО, используют в качестве негативного контроля, и интенсивность его флуоресценции принимают за 0% ингибирующей активности для определения 50% ингибирующей концентрации (IC50) каждого из соединений. Результаты представлены в таблице 39. В таблице 39 также представлено рассчитанное максимальное ингибирование (%) для соединений, демонстрирующих особенно высокое максимальное ингибирование (%) при концентрациях, использованных для определения ингибирующей активности агрегации тау.
|
Как следует из таблицы 39, некоторые из соединений настоящего изобретения демонстрируют особенно высокую ингибирующую активность в отношении агрегации тау. Ожидают, что соединения, которые демонстрируют максимально высокую способность ингибирования, обладают повышенным терапевтическим эффектом и поэтому наиболее предпочтительны.
Фармакологический тестовый пример 2: Определение ингибирующей активности в отношении β-секретазы
Активность ингибирования β-секретазы измеряют, используя аналитический набор BACE-1 FRET (Invitrogen). Тестируемые соединения получают, используя ДМСО, при их 30-кратных конечных концентрациях, и добавляют к аналитическому буферу таким образом, чтобы концентрация ДМСО составляла 10%. К каждому раствору добавляют равные объемы человеческой рекомбинантной β-секретазы (1 ед/мл) и флуоресцентный пептидный субстрат (750 нМ), каждый растворенный в аналитическом буфере, и полученные растворы оставляют выстаиваться в течение 1 часа. Интенсивность флуоресценции измеряют, используя устройство, считывающее данные с флуоресцентного планшета (длина волны возбуждения: 545 нм; длина волны флуоресценции: 590 нм).
Конечная концентрация каждого из соединений в момент измерения составляет 0,1, 0,3, 1, 3 и 10 мкМ, и 0,3, 1, 3, 10 и 30 мкМ, или 1, 3, 10, 30 и 100 мкМ. Образец, к которому добавлен только ДМСО, используют в качестве негативного контроля, и его интенсивность флуоресценции принимают за 0% ингибирующей активности для определения 50% ингибирyющей концентрации (IC50) каждого из соединений в отношении β-секретазы. Аминокислотная последовательность флуоресцентного пептидного субстрата соответствует Ser-Glu-Val-Asn-Leu-Asp-Ala-Glu-Lys-Arg, в которой Ser остаток в положении 1 помечен флуоресцентным донором (Cy3), и Lys в положении 9 помечен гасителем флуоресценции (Cy5Q).
Соединения настоящего изобретения демонстрируют высокие ингибирующие активности в отношении β-секретазы.
Фармакологический тестовый пример 3: Определение ингибирующей активности в отношении агрегации Aβ
Aβ 1-42 (Peptide Institute, Inc.) растворяют в 0,1% аммиачной воде таким образом, что концентрация составляет 0,5 мМ, и затем разбавляют PBS до 20 мкМ. Тестируемые соединения получают в ДМСО при их 100-кратных конечных концентрациях, и затем разбавляют PBS таким образом, чтобы концентрация ДМСО составляла 2%. Раствор Aβ и растворы каждого из тестируемых соединений смешивают в эквивалентном отношении, и полученные смеси оставляют выстаиваться при 37°C в течение 24 часов. К каждой из смесей добавляют равные объемы раствора тиофлавина T, концентрации которых доведены до 6 мкМ с помощью 100 мМ трис-глицинового буфера (pH 8,5). Интенсивность флуоресценции измеряют, используя устройство, считывающее данные с флуоресцентного планшета (длина волны возбуждения: 440 нм; длина волны флуоресценции: 486 нм).
Конечные концентрации каждого из соединений в момент измерения составляют 0,1, 0,3, 1, 3, и 10 мкМ или 2, 4, 8 и 16 мкМ. Образец, к которому добавлен только ДМСО, используют в качестве негативного контроля, и его интенсивность флуоресценции принимают за 0% ингибирующей активности. Используя интенсивность флуоресценции контрольного образца, принятую за 0%, рассчитывают 50% ингибирующую концентрацию (IC50) каждого из соединений для оценки ингибирующей активности агрегации Aβ каждого из соединений.
Соединения настоящего изобретения демонстрируют высокие ингибирующие активности в отношении агрегации Аβ.
Фармакологический тестовый пример 4: Измерение концентрации в мозге после перорального введения
Каждое из соединений настоящего изобретения, представленных в таблицах 40 и 41, и соединение примера 2 в JP 2012-229208 A вводят перорально ICR мышам (самцы, возраст 7 недель) в единичной дозе 5 мг/кг. Через 3, 6 и 9 часов после введения, через 1, 3, 6 и 9 часов после введения или 1, 3, 6, 9 и 24 часа после введения мышам вводят физиологический раствор в сердце при ингаляционной анестезии изофураном, и извлекают полный мозг. Физиологический раствор добавляют к собранному мозгу в количестве, соответствующем двойной влажной массе мозга, и мозг гомогенизируют. Затем добавляют равные объемы метанола, и полученную смесь депротеинизируют. Концентрацию каждого из соединений в образце измеряют, используя ЖХ/МС/МС. Результаты тестов представлены в таблицах 40 и 41.
|
|
Промышленная применимость
Соединение настоящего изобретения можно использовать в качестве профилактического лекарственного средства, терапевтического лекарственного средства и т.п. для лечения болезни Альцгеймера, и поэтому настоящее изобретение можно применять в промышленных областях, таких как фармацевтическая индустрия.