Результат интеллектуальной деятельности: ЛЕЧЕНИЕ ВИРУСА ГРИППА А H7N9
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет согласно предварительной заявке на патент США 61/931949, поданной 27 января 2014, которая полностью включена здесь для ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Рассматриваемая в данный момент заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и полностью включен здесь для ссылки. Указанная копия в формате ASCII, созданная 13 января 2015 года, имеет имя P5782R1-WO_SL.txt и размер 51,106 байтов.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам против вируса гриппа A H7N9, являющимся эффективными в плане связывания, нейтрализации и лечения вируса гриппа A H7N9, композициям, включающим данные антитела, и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Вирус гриппа A H7N9 представляет собой одну подгруппу вирусов гриппа, которая обычно распространена среди птиц и является эндемической среди домашних кур в Азии. До недавнего времени данный вирус гриппа не встречался у людей. Новый реассортантный вирус птичьего гриппа A H7N9, ассоциируемый с тяжелой инфекцией человека, был впервые отмечен в начале 2013 в Китае, (см., например, Gao et al. (2013) NEJM 368: 1888-1897). Первоначальная вспышка данной инфекции, связанной с вирусом птичьего гриппа у людей, в течение весны 2013 года привела к 132 зарегистрированным случаям заражения и 44 смертям. Считается, что большинство инфицированных лиц заразилось вирусом путем непосредственного контакта с зараженной домашней птицей. На сегодняшний день устойчивая передача вируса птичьего гриппа A H7N9 от человека к человеку не наблюдалась. Тем не менее, исследования на хорьках, которые, подобно людям, заражают друг друга через кашель и чихание, показали, что один штамм вируса гриппа A H7N9, выделенный от человека, может переноситься от хорька к хорьку воздушно-капельным путем.
Пандемический потенциал данного вируса вызывает значительные опасения. Поскольку вирусы гриппа чрезвычайно изменчивы, вероятность того, что вирус птичьего гриппа H7N9 станет переносимым от человека к человеку и что такой перенос сможет привести к глобальной пандемии, не может исключаться. Если вирусы гриппа H7N9 приобретут способность эффективно переноситься от человека к человеку, может произойти глобальная вспышка заболевания, поскольку люди не обладают защитными иммунными реакциями на данные типы вирусов. Таким образом, существует потребность в новых способах лечения, являющихся эффективными в плане лечения и профилактики инфекций, связанных с вирусом гриппа A H7N9, у людей.
Настоящее изобретение удовлетворяет данную потребность и обеспечивает иные преимущества в плане лечения инфекции, связанной с вирусом гриппа A H7N9.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против гемагглютинина (анти-НА), композициям, включающим антитела против гемагглютинина, и способам их применения. Антитела против гемагглютинина по настоящему изобретению являются эффективными в плане нейтрализации вируса гриппа A H7N9; антитела против гемагглютинина по настоящему изобретению представляют собой антитела против вируса гриппа A H7N9, в частности антитела против гемагглютинина Н7.
Изобретатели открыли обеспечивающие широкую нейтрализацию антитела человека, которые связываются с белком НА Н7 и являются эффективными в плане нейтрализации вирусов гриппа A H7N9. Антитела против вируса гриппа A H7N9 по настоящему изобретению являются эффективными в плане связывания Н7НА из, например, изолятов вируса гриппа A H7N9 A/Shanghai/1/2013 и А/Anhui/1/2013. Кроме того, антитела против вируса гриппа A H7N9 по настоящему изобретению являются эффективными в плане нейтрализации штамма реассортантного вируса гриппа A H7N9, A/Shanghai/2/2013 IDCDC RG32A.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; a
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две, три, четыре, пять и/или шесть последовательностей гипервариабельного участка (HVR), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9) включающему три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и LVR-L3), при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9) включающему три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-Н3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9) включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) легкой цепи, при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; и
(с) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9) включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) тяжелой цепи, при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 74, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 74.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 76, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 76.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 74, и при этом вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 76, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь состоит из аминокислотной последовательности SEQ ID NO: 76, а легкая цепь состоит из аминокислотной последовательности SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две, три, четыре, пять и/или шесть последовательностей гипервариабельного участка (HVR), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и LVR-L3), при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(с) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-Н3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO:63; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) легкой цепи, при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) тяжелой цепи, при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 78, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 79.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 79.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 78.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 80, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 81.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 81.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 80.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 78, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 79.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 80, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 81.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь состоит из аминокислотной последовательности SEQ ID NO: 80, а легкая цепь состоит из аминокислотной последовательности SEQ ID NO: 81.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 68;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 69;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 70;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 71;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 72; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 73.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две, три, четыре, пять и/или шесть последовательностей гипервариабельного участка (HVR), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 68;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 69;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 70;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 71;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 72; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 73.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и LVR-L3), при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 71;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 72; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 73.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-Н3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 68;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 69; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 70.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) легкой цепи, при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 71;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 72; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 73.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) тяжелой цепи, при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 68;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 69; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 70.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 82, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 83.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 83.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 82.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 84, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 85.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 85.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 84.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 68;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 69;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 70;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 71;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 72; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 73.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 82, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 83.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 84, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 85.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики, лечения или нейтрализации инфекции, связанной с вирусом гриппа А H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь состоит из аминокислотной последовательности SEQ ID NO: 84, а легкая цепь состоит из аминокислотной последовательности SEQ ID NO: 85.
Изобретение также относится к выделенным нуклеиновым кислотам, кодирующим антитело против вируса гриппа A H7N9 по настоящему изобретению. Изобретение также относится к векторам, включающим нуклеиновую кислоту, кодирующую антитело против вируса гриппа A H7N9 по настоящему изобретению. Изобретение также относится к клеткам-хозяевам, включающим нуклеиновую кислоту или вектор по настоящему изобретению. Вектор может быть любого типа, например рекомбинантный вектор, такой как вектор экспрессии. Могут применяться любые из множества клеток-хозяев. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку, например, E. coli. В другом варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, например клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО).
Изобретение также относится к способу получения антитела против вируса гриппа А H7N9 по настоящему изобретению. Например, изобретение относится к способам получения антитела против вируса гриппа A H7N9 (которое, как определено здесь, включает полноразмерное антитело и его фрагменты), при этом данный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора по изобретению, кодирующего антитело против вируса гриппа A H7N9 или его фрагменты, таким образом что обеспечивается получение данного антитела или его фрагментов. В некоторых вариантах осуществления данный способ включает культивирование клетки-хозяина, включающей нуклеиновую кислоту, кодирующую антитело против вируса гриппа A H7N9 по настоящему изобретению (или его фрагмент), таким образом что обеспечивается экспрессия данной нуклеиновой кислоты. Способ также может включать выделение антитела против вируса гриппа A H7N9 или его фрагментов из культуры клеток-хозяев или культуральной среды клеток-хозяев.
Изобретение также относится к фармацевтическим составам, включающим антитело против вируса гриппа A H7N9 по настоящему изобретению и фармацевтически приемлемый носитель. Фармацевтический состав может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
Изобретение также относится к композициям, включающим антитело против вируса гриппа A H7N9 по настоящему изобретению. Композиция может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
Изобретение также относится к композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях профилактики инфекции, связанной с вирусом гриппа A H7N9. В некоторых вариантах осуществления изобретение относится к фармацевтической композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях профилактики инфекции, связанной с вирусом гриппа A H7N9. Изобретение также относится к композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях лечения инфекции, связанной с вирусом гриппа A H7N9. В некоторых вариантах осуществления изобретение относится к фармацевтической композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях лечения инфекции, связанной с вирусом гриппа А H7N9. Изобретение также относится к композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях ингибирования инфекции, связанной с вирусом гриппа A H7N9. В некоторых вариантах осуществления изобретение относится к фармацевтической композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, для применения в целях ингибирования или нейтрализации инфекции, связанной с вирусом гриппа A H7N9.
Композиции, включающие антитело против вируса гриппа A H7N9 по настоящему изобретению, также могут применяться при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа А H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
Изобретение также относится к способу ингибирования инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение нуждающемуся в этом пациенту эффективного количества композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, что обеспечивает ингибирование инфекции, связанной с вирусом гриппа A H7N9. Изобретение также относится к способу лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение нуждающемуся в этом пациенту эффективного количества композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, что обеспечивает лечение инфекции, связанной с вирусом гриппа A H7N9. Изобретение также относится к способу профилактики инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение нуждающемуся в этом пациенту эффективного количества композиции, включающей антитело против вируса гриппа А H7N9 по настоящему изобретению, что обеспечивает профилактику инфекции, связанной с вирусом гриппа A H7N9. Изобретение также относится к способу нейтрализации вируса гриппа A H7N9, при этом данный способ включает применение эффективного количества композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, что обеспечивает нейтрализацию инфекции, связанной с вирусом гриппа А H7N9.
Изобретение также относится к способу ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение нуждающемуся в этом пациенту эффективного количества композиции, включающей антитело против вируса гриппа A H7N9 по настоящему изобретению, и введение пациенту эффективного количества дополнительного терапевтического агента, что обеспечивает ингибирование, лечение или профилактику инфекции, связанной с вирусом гриппа A H7N9. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир. В других вариантах осуществления дополнительный терапевтический агент представляет собой другое антитело против вируса гриппа A H7N9. В других вариантах осуществления дополнительный терапевтический агент представляет собой другое антитело против гемагглютинина. В других вариантах осуществления дополнительный терапевтический агент представляет собой антитело против М2. В рамках различных аспектов данных комбинированных видов лечения терапевтические агенты вводят примерно в одинаковое время, вводят совместно или вводят последовательно или непрерывно. В конкретных вариантах осуществления ингибитор нейраминидазы вводят перед введением антитела против вируса гриппа A H7N9 по настоящему изобретению.
В другом аспекте изобретение относится к применению антитела против вируса гриппа А H7N9 по настоящему изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа А H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В другом аспекте изобретение относится к применению нуклеиновой кислоты по изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9. Лекарственное средство может быть также предназначено для применения в целях нейтрализации инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В другом аспекте изобретение относится к применению вектора экспрессии по изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9. Лекарственное средство может быть также предназначено для применения в целях нейтрализации инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В другом аспекте изобретение относится к применению клетки-хозяина по изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9. Лекарственное средство может быть также предназначено для применения в целях нейтрализации инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В другом аспекте изобретение относится к применению промышленного изделия по изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9. Лекарственное средство может быть также предназначено для применения в целях нейтрализации инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В другом аспекте изобретение относится к применению набора по изобретению при производстве лекарственного средства. Лекарственное средство может быть предназначено для применения в целях ингибирования, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9. Лекарственное средство может быть также предназначено для применения в целях нейтрализации инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления лекарственное средство может также включать дополнительный терапевтический агент (например, ингибитор нейраминидазы, такой как оселтамивир, занамивир или перамивир; другое антитело, такое как другое антитело против вируса гриппа A H7N9, другое антитело против гемагглютинина или антитело против М2; и так далее).
В рамках различных аспектов антитело против вируса гриппа A H7N9 по настоящему изобретению связывает гемагглютинин Н7. В рамках некоторых аспектов антитело против вируса гриппа A H7N9 по настоящему изобретению связывает гемагглютинин Н7 вируса гриппа A H7N9. В рамках других аспектов антитело против вируса гриппа А H7N9 по настоящему изобретению связывает гемагглютинин Н7 и нейтрализует вирус гриппа A H7N9. В некоторых вариантах осуществления антитело против вируса гриппа А H7N9 по настоящему изобретению нейтрализует вирус гриппа A H7N9 in vitro, in vivo или in vitro и in vivo.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1А, 1В и 1С приведены данные, иллюстрирующие связывание mAb1, mAb2 и mAb3 с гемагглютинином Н7 в рамках ELISA, соответственно.
На Фиг. 2А, 2В и 2С приведены данные, иллюстрирующие in vitro нейтрализацию штамма A/Shanghai/2/2013 IDCDC RG32A вируса гриппа A H7N9 посредством mAb1, mAb2 и антитела для отрицательного контроля, соответственно.
На Фиг. 3А и 3В показана аминокислотная последовательность тяжелой цепи, легкой цепи, вариабельного участка тяжелой цепи и вариабельного участка легкой цепи mAb1.
На Фиг. 4А и 4В показана аминокислотная последовательность тяжелой цепи, легкой цепи, вариабельного участка тяжелой цепи и вариабельного участка легкой цепи mAb2.
На Фиг. 5А и 5В показана аминокислотная последовательность тяжелой цепи, легкой цепи, вариабельного участка тяжелой цепи и вариабельного участка легкой цепи mAb3.
На Фиг. 6 показана аминокислотная последовательность гипервариабельных участков тяжелой цепи и легкой цепи (т.е. CDR) mAb1, mAb2 и mAb3.
На Фиг. 7 показана последовательность нуклеиновой кислоты гемагглютинина Н7 вируса гриппа A H7N9 A/Anhui/1/2013.
На Фиг. 8 показана последовательность нуклеиновой кислоты гемагглютинина Н7 вируса гриппа A H7N9 A/Shanghai/1/2013.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
"Акцепторный каркасный участок человека" в соответствии с настоящим описанием представляет собой каркасный участок, включающий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), полученный из каркасного участка иммуноглобулина человека или консенсусного каркасного участка человека, как указано ниже. Акцепторный каркасный участок человека, "полученный из" каркасного участка иммуноглобулина человека или консенсусного каркасного участка человека, может включать их интактную аминокислотную последовательность, или он может содержать изменения в такой аминокислотной последовательности. В некоторых вариантах осуществления количество аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах осуществления акцепторный каркасный участок человека VL идентичен последовательности каркасного участка иммуноглобулина человека VL или последовательности консенсусного каркасного участка человека.
Термин "аффинность" означает интенсивность суммарных общих нековалентных взаимодействий между отдельным участком связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, в соответствии с используемым здесь значением термин "аффинность связывания" означает собственную аффинность связывания, которая соответствует взаимодействию 1:1 между членами связывающейся пары (например, антителом и антигеном). Сродство молекулы X к ее партнеру Y, как правило, можно представить в виде константы диссоциации (Kd). Аффинность может быть измерена с помощью стандартных способов, известных в данной области, включая описанные здесь. Конкретные иллюстративные и примерные варианты осуществления, связанные с измерением аффинности связывания, описаны ниже.
Термин "аффинно-зрелый" означает антитело, содержащее одно или несколько изменений в одном или нескольких гипервариабельных участках (HVR) по сравнению с исходным антителом, которое не обладает данными изменениями, при этом данные изменения приводят к повышению аффинности антитела к антигену.
Термины "антитело против гемагглютинина" и "антитело, которое связывается с гемагглютинином" означают антитело, которое связывает гемагглютинин с достаточной аффинностью, таким образом что данное антитело может применяться в качестве диагностического и/или терапевтического агента при использовании гемагглютинина в качестве мишени, включая использование в качестве мишени гемагглютинина вируса гриппа. В одном варианте осуществления степень связывания антитела против гемагглютинина с неродственным, не являющимся гемагглютинином белком составляет менее чем около 10% от степени связывания антитела с гемагглютинина при измерении, например, с помощью радиоиммуноанализа (RIA). В определенных вариантах осуществления антитело, которое связывается с гемагглютинином обладает величиной константы диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например от 10-8 М до 10-13 М, например от 10-9 М до 10-13 М). В определенных вариантах осуществления антитело против гемагглютинина связывается с эпитопом гемагглютинина, который сохраняется среди гемагглютинина различных штаммов, подтипов и изолятов вирусов гриппа А.
Термин "антитело", используется здесь в самом широком смысле и охватывает различные типы антител, включая, без ограничения, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, если они обладают требуемой антиген-связывающей активностью.
Термин "фрагмент антитела" означает молекулу, отличную от интактного антитела, которая включает часть интактного антитела, связывающуюся с тем же антигеном, что и интактное антитело. Термин "фрагмент антитела" также означает молекулу, отличную от интактного антитела, которая включает часть интактного антитела, связывающуюся с гемагглютинином и нейтрализующую вирус гриппа А. Примеры фрагментов антител включают, без ограничения, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител (например, svFv); и мультиспецифические антитела, образованные из фрагментов антител.
Термин "антитело, которое связывается с тем же эпитопом", что и указанное антитело, означает антитело, которое блокирует связывание указанного антитела с его антигеном по данным конкурентного анализа на 50% или более, и наоборот, указанное антитело блокирует связывание антитела с его антигеном по данным конкурентного анализа на 50% или более. Пример конкурентного анализа описан здесь.
Термин "химерное" антитело означает антитело, в котором одна часть тяжелой и/или легкой цепи получена из определенного источника, или от определенных видов, а другая часть тяжелой и/или легкой цепи получена из другого источника, или от других видов.
Термин "класс" антитела означает тип константного домена или константного участка тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, при этом некоторые из них могут быть также разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно.
Термин "цитотоксический агент" в соответствии с используемым здесь значением означает вещество, которое ингибирует или предотвращает проявление клеточной функции и/или вызывает гибель или разрушение клетки. Цитотоксические агенты включают, без ограничения, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические средства или лекарства (такие как метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства); ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, в том числе их фрагменты и/или варианты; и разные противоопухолевые или противораковые средства, описанные ниже.
Термин "эффекторные функции" означает виды биологической активности, присущие Fc-участку антитела, которые варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1qи комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; анти тело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора); и активацию В-клеток.
Термин "эффективное количество" агента, такого как фармацевтическая композиция, означает количество, являющееся эффективным в рамках применяемых дозировок и периодов времени для достижения требуемого терапевтического или профилактического результата.
Термин " Fc-участок" используется здесь для обозначения C-терминального участка тяжелой цепи иммуноглобулина, который содержит, по меньшей мере, часть константного участка. Термин включает Fc-участки с нативными последовательностями и вариантные Fc-участки. В одном варианте осуществления Fc-участок тяжелой цепи IgG человека расположен от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Тем не менее, C-терминальный лизин (Lys447) Fc-участка может присутствовать или отсутствовать. Если здесь не указано иное, нумерация аминокислотных остатков в Fc-участке или константном участке приведена в соответствии с системой нумерации ЕС, также называемой ЕС указателем, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Термин "каркасный участок" или "FR" означает остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена в целом состоят из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR в целом присутствуют в VH (или VL) в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "полноразмерное антитело", "интактное антитело" и "цельное антитело" используются здесь в качестве взаимозаменяемых и означают антитело, обладающее по существу такой же структурой, что и нативное антитело, или имеющее тяжелые цепи, которые содержат определенный здесь Fc-участок.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются в качестве взаимозаменяемых и означают клетки, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", в том числе первично трансформированные клетки и полученное из них потомство, независимо от количества пассажей. Потомство может не являться полностью идентичным в плане содержания нуклеиновых кислот относительно исходной летки вследствие мутаций. В объем изобретения входит мутантное потомство, которое обладает той же функцией или биологической активностью, скрининг или отбор на основе которой осуществляли в рамках исходных трансформированных клеток.
"Антитело человека" представляет собой антитело, которое обладает аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого человеком или клеткой человека, или полученного из не являющегося человеком источника, в котором используются репертуары антител человека или другие последовательности, кодирующие антитела человека. Данное определение антитела человека в частности не включает гуманизированное антитело, включающее антиген-связывающие остатки не являющихся человеком источников.
"Консенсусный каркасный участок человека" представляет собой каркасный участок, который соответствует аминокислотным остаткам, наиболее часто встречающимся в наборе последовательностей каркасных участков VL или VH иммуноглобулина человека. Как правило, набор последовательностей VL или VH иммуноглобулина человека относится к подгруппе последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, соответствующую описанной в Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд., NIH Publication 91-3242, Bethesda MD (1991), т. 1-3. В одном варианте осуществления VL данная подгруппа представляет собой подгруппу каппа I как в Kabat et al., выше. В одном варианте осуществления VH данная подгруппа представляет собой подгруппу III как в Kabat et al., выше.
Термин "гуманизированное" антитело означает химерное антитело, включающее аминокислотные остатки из HVR не являющегося человеком вида и аминокислотные остатки из FR человека. В определенных вариантах осуществления гуманизированное антитело включает, по существу, все из, по меньшей мере, одного и, как правило, двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют антителу не являющегося человеком вида, и все или по существу все FR соответствуют антителу человека. Гуманизированное антитело необязательно может включать, по меньшей мере, часть константного участка антитела, полученного из антитела человека. Термин "гуманизированная форма" антитела, например антитела не являющегося человеком вида, означает антитело, которое было подвергнуто гуманизации. Термин "гипервариабельный участок" или "HVR" в соответствии с используемым здесь значением означает каждый из участков вариабельного домена антитела, которые являются гипервариабельными в плане последовательности ("участки, определяющие комплементарность" или "CDR") и/или образуют петли с определенной структурой ("гипервариабельные петли") и/или содержат антиген-контактирующие остатки ("антигенные остатки"). Как правило, антитела включают шесть HVR: три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Примеры HVR включают здесь:
(a) гипервариабельные петли, расположенные на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987));
(b) CDR, расположенные на аминокислотных остатках 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (Н3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(c) антигенные контакты, расположенные на аминокислотных остатках 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(d) комбинации (a), (b) и/или (с), включая аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы здесь по Kabat et al., выше.
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или несколькими гетерологичными молекулами, включающими, без ограничения, цитотоксическое средство.
"Лицо" или "субъект" представляет собой млекопитающее. Млекопитающие включают, без ограничения, домашних животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, люди и отличные от человека приматы, например, мартышки), кроликов и грызунов (например, мыши и крысы). В определенных вариантах осуществления особь или субъект представляет собой человека.
"Выделенное" антитело представляет собой антитело, которое было отделено от компонента его естественной среды. В некоторых вариантах осуществления антитело очищают до степени более чем 95% или 99%, которую определяют, например, с помощью электрофореза (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографии (такой как ионообменная ВЭЖХ или ВЭЖХ на обращенной фазе). Обзор способов анализа чистоты антител см., например, у Flatman et al., J. Chromatogr. В 848: 79-87 (2007).
Термин "выделенная" нуклеиновая кислота означает молекулу нуклеиновой кислоты, которая была отделена от компонента ее естественной среды. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат такую молекулу нуклеиновой кислоты, однако указанная молекула нуклеиновой кислоты присутствует вне хромосомы или в участке хромосомы, который отличается от природного местонахождения данной молекулы в хромосоме. Термин "выделенная нуклеиновая кислота, кодирующая антитело против гемагглютинина" означает одну или несколько молекул нуклеиновой кислоты, кодирующих тяжелую и легкую цепи антитела (или их фрагменты), включая такую молекулу(ы) нуклеиновой кислоты в одном векторе или отдельных векторах, и такую молекулу(ы) нуклеиновой кислоты, которые присутствуют в одном или нескольких положениях в клетке-хозяине.
Термин "моноклональные антитело" в соответствии с используемым здесь значением означает антитело, полученное из по существу гомогенной популяции антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например содержащих встречающиеся в природе мутации или образующихся при процессе получения препарата моноклональных антител, при этом такие варианты обычно присутствуют в малых количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), все моноклональные антитела из препарата моноклональных антител направлены против одной детерминанты антигена. Таким образом, определение "моноклональный" указывает на свойство антитела, заключающееся в том, что антитело получено из практически гомогенной популяции антител и не должно рассматриваться в качестве требующего получения данного антитела каким-либо конкретным способом. Например, моноклональные антитела для применения в соответствии с настоящим изобретением могут быть получены с помощью множества способов, включая, без ограничения, гибридомный способ, способы на основе рекомбинантных ДНК, способы на основе фагового дисплея и способы, в рамках которых применяют трансгенных животных, содержащих все или часть локусов иммуноглобулина человека, при этом здесь описаны данные способы и другие приводимые в качестве примеров способы получения моноклональных антител.
Термин "голое антитело" означает антитело, которое не конъюгировано с гетерологичным фрагментом (таким как цитотоксический фрагмент) или радиоизотопной меткой. Голое антитело может входить в присутствовать в фармацевтическом составе.
Термин "нативные антитела" означает встречающиеся в природе молекулы иммуноглобулина, имеющие различные структуры. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. От N- до C-конца каждая тяжелая цепь обладает вариабельным участком (VH), также называемым вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, и далее тремя константными доменами (CH1, СН2 и СН3). Аналогично, от N- до C-конца каждая легкая цепь обладает вариабельным участком (VL), также называемым вариабельным легким доменом или вариабельным доменом легкой цепи, и далее константным легким (CL) доменом. В зависимости от аминокислотной последовательности константного домена, легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ).
Термин "вкладыш в упаковку" используется для обозначения инструкций, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов и которые содержат информацию по показаниям, применению, дозировке, способу введения, сочетанной терапии, противопоказаниям и/или предупреждения, касающиеся применения таких терапевтических продуктов.
"Степень идентичности аминокислотной последовательности в процентах (%)" в отношении указанной полипептидной последовательности представляет собой долю аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в указанной полипептидной последовательности после выравнивания последовательностей и внесения промежутков, если это необходимо, для достижения максимальной степени идентичности последовательностей без учета каких-либо консервативных замещений в качестве части степени идентичности последовательностей. Выравнивание с целью определения степени идентичности аминокислотных последовательностей может быть осуществлено разными способами, известными специалистам в данной области, например с помощью доступного компьютерного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить параметры, подходящие для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых последовательностей по всей длине. Однако для целей настоящего описания значения % идентичности аминокислотных последовательностей получены с помощью компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана компанией Genentech, Inc., при этом исходный код был зарегистрирована наряду с информацией для пользователя в Бюро регистрации авторских прав США, Washington D.C., 20559, под номером регистрации авторского права США TXU510087. Программа ALIGN-2 находится в свободном доступе от Genentech, Inc., South San Francisco, California, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для использования на операционной системе UNIX, включая UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и являются неизменными.
Если ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности некоторой аминокислотной последовательности А и некоторой аминокислотной последовательности В (или, другими словами, конкретная аминокислотная последовательность А обладает или характеризуется определенным % идентичности последовательности по отношению к конкретной аминокислотной последовательности В) рассчитывают следующим образом:
100×X/Y
где X представляет собой количество аминокислотных остатков, рассчитанное как идентичные совпадения, определенные с помощью программы для выравнивания ALIGN-2, при выравнивании А и В с применением данной программы, и где Y представляет собой общее количество аминокислотных остатков в В. Следует понимать, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности по аминокислотной последовательности А к В не будет равен % идентичности по аминокислотной последовательности В к А. Если не указано иное, все используемые здесь значения % идентичности по аминокислотной последовательности получены в соответствии с описанием в предыдущем абзаце с применением компьютерной программы ALIGN-2.
Термин "фармацевтический состав" означает препарат, который находится в виде формы, обеспечивающей эффективную биологическую активность содержащегося в нем активного ингредиента, и не содержит других компонентов, обладающих неприемлемой токсичностью для субъекта, которому вводят состав.
Термин "фармацевтически приемлемый носитель" означает ингредиент в фармацевтическом составе, отличный от активного ингредиента, который является нетоксичным по отношению к субъекту. Фармацевтически приемлемый носитель включает, без ограничения, буфер, вспомогательное вещество, стабилизатор или консервант.
Термин "гемагглютинин" в соответствии с используемым здесь значением означает любой нативный гемагглютинин из любого источника в виде вируса гриппа, если не указано иное. Данный термин охватывает "полноразмерный" не подвергавшийся обработке гемагглютинин, а также любую форму гемагглютинина, которая получена в результате обработки вируса гриппа или клетки, инфицированной вирусом гриппа. Данный термин также охватывает встречающиеся в природе варианты гемагглютинина, например варианты, образованные в результате сплайсинга, или аллельные варианты. Термин "гемагглютинин" в соответствии с используемым здесь значением включает гемагглютинин Н7.
В соответствии с используемым здесь значением термин "лечение" (а также его грамматические производные, такие как "лечить" или "лечение") означает клиническое вмешательство с целью изменения естественного состояния подвергаемого лечению субъекта, которое может быть проведено для профилактики или в рамках течения клинической патологии. Желательные эффекты лечения включают, без ограничения, предотвращение появления или повторного возникновения заболевания (например, предотвращение появления или повторного возникновения инфекции, связанной с вирусом гриппа A H7N9), снижение (например, уменьшение) или облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, понижение скорости прогрессирования заболевания, улучшение или временное улучшение состояния заболевания и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела по изобретению применяют для задержки развития заболевания или замедления прогрессирования заболевания.
Термин "вариабельный участок" или "вариабельный домен" означает домен тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, имеют схожие структуры, при этом каждый домен включает четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt et al. Kuby Immunology, 6-е изд., W.H. Freeman and Co., стр. 91 (2007).) Один VH или VL домен может являться достаточным для придания антиген-связывающей специфичности. Более того, антитела, способные связываться с конкретным антигеном, могут быть выделены с применением VH или VL домена антитела, связывающегося с антигеном, для скрининга библиотеки последовательностей, комплементарных VL или VH доменам, соответственно. См., например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991). Термин "вектор" в соответствии с используемым здесь значением означает молекулу нуклеиновой кислоты, способную обеспечивать репродукцию другой нуклеиновой кислоты, с которой она связана. Данный термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую она введена. Определенные векторы способны управлять экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы в называются здесь "векторами экспрессии".
II. КОМПОЗИЦИИ И СПОСОБЫ
В одном аспекте изобретение частично основано на антителах против вируса гриппа А H7N9 и их применении. В определенных вариантах осуществления изобретение относится к антителам, которые связываются с гемагглютинином Н7. Антитела по изобретению могут применяться, например, для диагностики, лечения или профилактики инфекции, связанной с вирусом гриппа A H7N9.
А. Примеры антител против вируса птичьего гриппа A H7N9
В одном аспекте изобретение относится к выделенным антителам, которые связывают гемагглютинин Н7. В определенных вариантах осуществления антитело против вируса гриппа A H7N9 по настоящему изобретению связывает гемагглютинин Н7. В других вариантах осуществления антитело против вируса гриппа A H7N9 по настоящему изобретению нейтрализует вирус гриппа A H7N9 in vitro. В других вариантах осуществления антитело против вируса гриппа A H7N9 по настоящему изобретению нейтрализует вирус гриппа A H7N9 in vivo. В других вариантах осуществления антитело против вируса гриппа A H7N9 по настоящему изобретению уменьшает инфекцию, связанную с вирусом гриппа A H7N9, предотвращает инфекцию, связанную с вирусом гриппа A H7N9, ингибирует инфекцию, связанную с вирусом гриппа A H7N9, или обеспечивает лечение инфекции, связанной с вирусом гриппа A H7N9. В некоторых вариантах осуществления антитело против вируса гриппа A H7N9 по настоящему изобретению предотвращает, ингибирует или снижает опосредуемое гемагглютинином связывание мембраны вируса гриппа и эндосомальных мембран инфицированной клетки (обеспечивая, таким образом, ингибирование или снижение степени проникновения вирусной РНК в цитоплазму инфицированной клетки, что обеспечивает предотвращение, ингибирование или уменьшение дальнейшего распространения инфекции, связанной с вирусом гриппа).
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две, три, четыре, пять и/или шесть последовательностей гипервариабельного участка (HVR), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO:57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и LVR-L3), при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-Н3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) легкой цепи, при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: а по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) тяжелой цепи, при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 74, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 74.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 76, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 76.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 56;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 57;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 58;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 59;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 60; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 61.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 74, и при этом вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 75.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 76, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две, три, четыре, пять и/или шесть последовательностей гипервариабельного участка (HVR), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и LVR-L3), при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-Н3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) легкой цепи, при этом:
(a) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(b) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(c) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления изобретение относится к выделенному антителу против гемагглютинина (выделенному антителу против вируса гриппа A H7N9), включающему: по меньшей мере, одну, две и/или три последовательности гипервариабельного участка (HVR) тяжелой цепи, при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63; а
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 78, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 79.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 79.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 78.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 80, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 81.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 81.
В некоторых вариантах осуществления выделенное антитело против гемагглютинина (выделенное антитело против вируса гриппа A H7N9) по настоящему изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 80.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает три гипервариабельных участка тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3) и три гипервариабельных участка легкой цепи (HVR-L1, HVR-L2 и HVR-L3), при этом:
(a) HVR-H1 включает аминокислотную последовательность SEQ ID NO: 62;
(b) HVR-H2 включает аминокислотную последовательность SEQ ID NO: 63;
(c) HVR-H3 включает аминокислотную последовательность SEQ ID NO: 64;
(d) HVR-L1 включает аминокислотную последовательность SEQ ID NO: 65;
(e) HVR-L2 включает аминокислотную последовательность SEQ ID NO: 66; а
(f) HVR-L3 включает аминокислотную последовательность SEQ ID NO: 67.
В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи включает аминокислотную последовательность SEQ ID NO: 78, а вариабельный участок легкой цепи включает аминокислотную последовательность SEQ ID NO: 79. В некоторых вариантах осуществления настоящее изобретение относится к способу профилактики или лечения инфекции, связанной с вирусом гриппа A H7N9, при этом данный способ включает введение субъекту, имеющему или обладающему риском наличия инфекции, связанной с вирусом гриппа A H7N9, терапевтически эффективного количества антитела, при этом антитело включает тяжелую цепь и легкую цепь, при этом тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 80, а легкая цепь включает аминокислотную последовательность SEQ ID NO: 81.
В любом из указанных выше вариантов осуществления антитело против вируса гриппа А H7N9 по настоящему изобретению является гуманизированным. В одном варианте осуществления антитело против вируса гриппа A H7N9 включает HVR, описанные в любом из указанных выше вариантов осуществления, а также включает акцепторный каркасный участок человека, например каркасный участок иммуноглобулина человека или консенсусный каркасный участок человека.
В другом аспекте антитело против вируса гриппа A H7N9 по настоящему изобретению включает последовательность вариабельного домена тяжелой цепи (VH), имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности относительно аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 74 и 78. В определенных вариантах осуществления последовательность VH, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замещения (например, консервативные замещения), инсерции или делеции по сравнению с исходной последовательностью,. однако антитело против вируса гриппа A H7N9, включающее такую последовательность, сохраняет способность связывать гемагглютинин Н7. В определенных вариантах осуществления общее количество замещенных, подвергнутых инсерции и/или делеции аминокислот в SEQ ID NO: 74 или 78 составляет 1 из 10. В определенных вариантах осуществления замещения, инсерции или делеции расположены в участках вне HVR (то есть в FR). Необязательно, антитело против гемагглютинина (антитело против вируса гриппа A H7N9) включает последовательность VH в SEQ ID NO: 74 или 78, включая посттрансляционные модификации данной последовательности.
В другом аспекте предусмотрено антитело против вируса гриппа A H7N9, при этом антитело включает последовательность вариабельного домена легкой цепи (VL), имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности относительно аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 75 и 79. В определенных вариантах осуществления последовательность VL, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замещения (например, консервативные замещения), инсерции или делеции по сравнению с исходной последовательностью, однако антитело против вируса гриппа A H7N9, включающее такую последовательность, сохраняет способность связывать гемагглютинин Н7. В определенных вариантах осуществления общее количество замещенных, подвергнутых инсерции и/или делеции аминокислот в SEQ ID NO: 75 или 79 составляет 1 из 10. В определенных вариантах осуществления замещения, инсерции или делеции расположены в участках вне HVR (то есть в FR).. Необязательно, антитело против гемагглютинина (антитело против вируса гриппа A H7N9) включает последовательность VL в SEQ ID NO: 75 или 79, включая посттрансляционные модификации данной последовательности.
В другом аспекте изобретение относится к антителу против вируса гриппа A H7N9, при этом данное включает VH, как и в любом из описанных выше вариантов осуществления, и VL, как и в любом из описанных выше вариантов осуществления. В одном варианте осуществления антитело включает последовательности VH и VL, представленные в SEQ ID NO: 74 или 78, и SEQ ID NO: 75 или 79, соответственно, включая посттрансляционные модификации данных последовательностей.
В другом аспекте изобретение относится к антителу, которое связывается с тем же эпитопом, что и указанное здесь антитело против вируса гриппа A H7N9. Например, в некоторых вариантах осуществления предусмотрено антитело, которое связывается с тем же эпитопом, что и антитело против вируса гриппа A H7N9, включающее последовательность VH SEQ ID NO: 75 и последовательность VL SEQ ID NO: 75; или последовательность VH SEQ ID NO: 78 и последовательность VL SEQ ID NO: 79.
В другом аспекте изобретения антитело против вируса гриппа A H7N9 в соответствии с любым из описанных выше вариантов осуществления представляет собой моноклональное антитело, включая химерное, гуманизированное антитело или антитело человека. В одном варианте осуществления антитело против вируса гриппа A H7N9 представляет собой фрагмент антитела, например Fv, Fab, Fab', scFv, диатело или фрагмент F(ab')2. В другом варианте осуществления антитело представляет собой полноразмерное антитело, например интактное антитело IgG1 или относящееся к другому классу или изотипу антител, как указано здесь.
В другом аспекте антитело против вируса гриппа A H7N9 в соответствии с любым из описанных выше вариантов осуществления может иметь любые из признаков, самостоятельно или в комбинации, описанные в приведенных ниже Разделах 1-7.
1. Аффинность антител
В определенных вариантах осуществления указанное здесь антитело имеет значение константы диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например от 10-8 М до 10-13 М, например от 10-9 М до 10-13 М).
В одном варианте осуществления Kd измеряют с помощью анализа связывания антигена, меченного радиоактивным изотопом (RIA). В одном варианте осуществления RIA осуществляют с применением Fab версии представляющего интерес антитела и его антигена. Например, аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии ряда титровочных концентраций немеченого антигена с последующим улавливанием связанного антигена на планшете, покрытом антителом против Fab (см., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999)). Чтобы определить условия анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл улавливающим антителом против Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (pH 9,6) и затем блокируют 2% (масс/об) раствором бычьего сывороточного альбумина в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°C). В планшете, не содержащем адсорбента (Nunc #269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с анализом антитела против VEGF, Fab-12, описанным в Presta et al, Cancer Res. 57: 4593-4599 (1997)). Затем представляющий интерес Fab культивируют в течение ночи; однако культивирование можно продолжать в течение более длительного периода (например, в течение приблизительно 65 часов), чтобы гарантировать достижение равновесия. Затем смеси переносят в планшет для улавливания и культивируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и промывают планшет восемь раз 0,1% раствором полисорбата 20 (TWEEN-20®) в PBS. После просушки планшетов добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20 ТМ; Packard) и считают на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, обеспечивающие связывание, составляющее 20% или меньше от максимального, выбирают для применения в анализе конкурентного связывания.
В соответствии с другим вариантом осуществления Kd измеряют с применением анализа на основе поверхностного плазмонного резонанса BIACORE®. Например, анализ с применением BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) проводят при 25°C с использованием чипов СМ5 с иммобилизованным антигеном при ~10 единиц ответа (RU). В одном варианте осуществления биосенсорные чипы из карбоксиметилированного декстрана (СМ5, BIACORE, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для достижения приблизительно 10 единиц ответа (RU) связанного белка. После антигена вводят 1 М этаноламин, чтобы блокировать непрореагировавшие группы. Для измерений кинетических показателей двукратные последовательные разведения Fab (от 0,78 нМ до 500 нМ) впрыскивают в PBS с 0,05% раствором поверхностно-активного вещества полисорбат 20 (TWEEN-20™) (PBST) при температуре 25°C и скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют с применением простой модели связывания Лангмюра один к одному (BIAcore Evaluation Software version 3.2) посредством одновременной аппроксимации сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде соотношения koff/kon. См., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если скорость ассоциации превышает 106 M-1/c-1 на основе указанного выше анализа поверхностного плазмонного резонанса, то скорость ассоциации можно определить способом на основе гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (длина волны возбуждения = 295 нМ; длина волны испускания = 340 нМ, полоса пропускания 16 нМ) при 25°C в присутствии 20 нМ комплекса антиген-антитело (форма Fab) в PBS, pH 7,2, и повышающихся концентраций антигена, определяемых с помощью спектрометра, например спектрофотометра остановленного потока (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) с перемешиваемой кюветой.
2. Фрагменты антител
В определенных вариантах осуществления предусмотренное здесь антитело представляет собой фрагмент антитела. Фрагменты антител включают, без ограничения, фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, а также другие фрагменты, описанные ниже. Обзор определенных фрагментов антител см. в Hudson et al., Nat. Med. 9: 129-134 (2003). Обзор фрагментов scFv см., например, в  , в The Pharmacology of Monoclonal Antibodies, т. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), стр. 269-315 (1994); также см. WO 93/16185; и патенты США 5571894 и 5587458. Описание фрагментов Fab и F(ab')2, включающих остатки, связывающие эпитоп реутилизационного рецептора, и имеющих повышенный период полужизни in vivo, см. в патенте США 5869046.
, в The Pharmacology of Monoclonal Antibodies, т. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), стр. 269-315 (1994); также см. WO 93/16185; и патенты США 5571894 и 5587458. Описание фрагментов Fab и F(ab')2, включающих остатки, связывающие эпитоп реутилизационного рецептора, и имеющих повышенный период полужизни in vivo, см. в патенте США 5869046.
Диатела представляют собой фрагменты антител, содержащие два антиген-связывающих участка, и могут быть бивалентными или биспецифическими. См., например, европейский патент 404097; WO 1993/01161; Hudson et al., Nat. Med. 9: 129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). В Hudson et al., Nat. Med. 9: 129-134 (2003) также описаны триатела и тетратела.
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В определенных вариантах осуществления однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc., Waltham, MA; см., например, патент США 6248516 В1).
Фрагменты антител могут быть получены с помощью различных способов, включая, без ограничения, протеолитическое расщепление интактного антитела, а также получение с применением рекомбинантных клеток-хозяев (таких как Е. coli или фаг), как описано здесь.
3. Химерные и гуманизированные антитела
В определенных вариантах осуществления предусмотренное здесь антитело представляет собой химерное антитело. Определенные химерные антитела описаны, например, в патенте США 4816567; и в Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). В одном примере химерное антитело включает вариабельный участок не являющегося человеком вида (например, вариабельный участок, полученный от мыши, крысы, хомяка, кролика или отличного от человека примата, такого как мартышка) и константный участок человека. В другом примере химерное антитело представляет собой антитело "переключенного класса", полученное в результате изменения класса или подкласса исходного антитела. Термин "химерные антитела" включает их антиген-связывающие фрагменты.
В определенных вариантах осуществления химерное антитело представляет собой гуманизированное антитело. Как правило, антитело не являющегося человеком вида подвергают гуманизации, чтобы уменьшить иммуногенность для человека и сохранить при этом специфичность и аффинность исходного антитела не являющегося человеком вида. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их фрагменты), являются полученными из антитела не являющегося человеком вида, a FR (или их фрагменты) являются полученными из последовательностей антител человека. Гуманизированное антитело также необязательно включает, по меньшей мере, часть константного участка человека. В некоторых вариантах осуществления некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками из антитела не являющегося человеком вида (например, антитела, из которого получены остатки HVR), например, для восстановления или увеличения специфичности или аффинности антитела. Гуманизированные антитела и способы их получения рассматриваются, например, в Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008), и также описаны, например, в Riechmann et al., Nature 332: 323-329 (1988); Queen et al., Proc. Nat’I Acad. Sci. USA 86: 10029-10033 (1989); патентах США 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36: 25-34 (2005) (описан перенос определяющего специфичность участка (SDR); Padlan, Mol. Immunol. 28: 489-498 (1991) (описано "повторное покрывание"); Dall’Acqua et al., Methods 36: 43-60 (2005) (описано "тасование FR"); и в Osbourn et al., Methods 36: 61-68 (2005) и Klimka et al., Br. J. Cancer, 83: 252-260 (2000) (описан подход к тасованию FR на основе "направленного отбора").
Каркасные участки человека, которые могут применяться для гуманизации, включают, без ограничения: каркасные участки, выбранные с применением способа "наилучшего соответствия" (см., например, Sims et al. J. Immunol. 151:2296 (1993)); каркасные участки, полученные из консенсусных последовательностей антител человека определенной подгруппы вариабельных участков легкой и тяжелой цепи (см., например Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al. J. Immunol., 151:2623 (1993)); зрелые каркасные участки человека (подвергнутые соматической мутации) или зародышевые каркасные участков человека (см.., например, Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008)); и каркасные участки, полученные из скрининговых библиотек FR (см., например, Baca et al., J. Biol. Chem. 272: 10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271: 22611-22618 (1996)).
4. Антитела человека
В определенных вариантах осуществления предусмотренное здесь антитело представляет собой антитело человека. Антитело человека может быть получено с помощью различных способов, известных в данной области, или с помощью описанных здесь способов. Антитела человека в целом описаны в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20: 450-459 (2008).
Антитела человека могут быть получены путем введения иммуногена трансгенному животному, модифицированному с целью придания ему способности продуцировать интактные антитела человека или интактные антитела, содержащие вариабельные участки человека, в ответ на введение антигена. Такие животные обычно содержат весь локус человеческих иммуноглобулинов или его часть, который заменяет эндогенный локус иммуноглобулинов, или который присутствует вне хромосом, или интегрируется случайным образом в хромосомы животного. У таких трансгенных мышей эндогенный локус иммуноглобулинов обычно инактивируют. Обзор способов получения антител человека в трансгенных животных см. в Lonberg, Nat. Biotech. 23: 1117-1125 (2005). См. также, например, патенты США 6075181 и 6150584, описывающие технологию XENOMOUSE™; патент США №5770429, описывающий технологию HUMAB®; патент США 7041870, описывающий технологию K-М MOUSE®, и публикацию патентной заявки США 2007/0061900, описывающую технологию VelociMouse®). Вариабельные участки интактных антител человека, полученные с применением таких животных, могут быть подвергнуты дополнительной модификации, например, путем объединения с другим константным участком человека.
Антитела человека также могут быть получены с помощью способов на основе гибридом. Были описаны линии клеток миеломы человека и гетеромиеломы мыши-человека для продуцирования моноклональных антител человека. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, стр. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).) Антитела человека, полученные с помощью гибридомной технологии на основе В-клеток человека, также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103: 3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США 7189826 (описано получение моноклональных антител IgM человека из линий гибридомных клеток) и Ni, Xiandai Mianyixue, 26(4): 265-268 (2006) (описаны гибридомы типа человек-человек). Технология гибридом человека (технология Trioma) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3): 927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Антитела человека также могут быть получены путем выделения последовательностей вариабельного домена клона Fv, выбранных из полученных от человека библиотек фаговых дисплеев. Такие последовательности вариабельного домена могут быть затем объединены с требуемым константным доменом человека. Методы отбора антител человека из библиотек антител описаны ниже.
5. Антитела, получаемые из библиотек
Антитела по изобретению могут быть выделены путем скрининга комбинаторных библиотек на антитела, обладающие требуемой активностью или активностями. Например, в данной области известен ряд способов получения библиотек фаговых дисплеев и скрининга таких библиотек на антитела, обладающие требуемыми характеристиками связывания. Данные способы рассматриваются, например, у Hoogenboom et al. в Methods in Molecular Biology 178: 1-37 (O’Brien et al., ed., Human Press, Totowa, NJ, 2001) и также описаны, например, в McCafferty et al., Nature 348: 552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, в Methods in Molecular Biology 248: 161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284 (1-2): 119-132 (2004).
В рамках определенных способов на основе фаговых дисплеев репертуары генов VH и VL отдельно клонируют с помощью полимеразной цепной реакции (PCR) и воссоединяют случайным образом в фаговых библиотеках, которые затем могут быть подвергнуты скринингу на антиген-связывающие фаги, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как правило, фаг демонстрирует фрагменты антител, либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки, полученные из иммунизированных источников, содержат антитела с высокой аффинностью по отношению к иммуногену без необходимости конструирования гибридом. Альтернативно можно клонировать наивный репертуар (например, полученный от человека) с получением одного источника антител против широкого ряда не собственных и собственных антигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также могут быть получены синтетически путем клонирования не подвергавшихся реаранжировке сегментов V-гена из стволовых клеток и с использованием праймеров ПЦР, содержащих случайную последовательность, для кодирования высоковариабельных участков CDR3 и с проведением реаранжировки in vitro, как описано Hoogenboom и Winter, J. Mol. Biol., 227: 381-388 (1992). Патентные публикации, описывающие фаговые библиотеки антител человека включают, например: патент США 5750373 и публикации патентов США 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек антител человека, рассматривают здесь в качестве антител человека или фрагментов антител человека.
6. Мультиспецифические антитела
В определенных вариантах осуществления предусмотренное здесь антитело представляет собой мультиспецифическое антитело, например биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания, по меньшей мере, двух различных участков. В определенных вариантах осуществления одна специфичность связывания относится к гемагглютинину, а другая - к любому другому антигену. В определенных вариантах осуществления биспецифические антитела могут связываться с двумя различными эпитопами гемагглютинина. Биспецифические антитела также могут применяться для локализации цитотоксических агентов в клетках, экспрессирующих гемагглютинин. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Способы получения мультиспецифических антител включают, без ограничения, рекомбинантную коэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, обладающих разными специфичностями (см. Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10: 3655 (1991)), и технологию "выступ-во-впадину" (см., например, патент США 5731168). Мультиспецифические антитела также могут быть получены посредством создания эффектов электростатического наведения для получения Fc-гетеродимерных молекул антител (WO 2009/089004 А1); перекрестного сшивания двух или более антител или фрагментов (см., например, патент США 4676980 и Brennan et al., Science, 229: 81 (1985)); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)); использования технологии получения "диател" для создания фрагментов биспецифических антител (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)); и использования димеров одноцепочечных Fv (sFv) (см., например, Gruber et al., J. Immunol, 152: 5368 (1994)); и получения триспецифических антител, как описано, например, в Tutt et al. J. Immunol. 147: 60 (1991).
Сконструированные антитела, содержащие три или более функциональных антиген-связывающих участка, в том числе "антитела Octopus", также входят в объем настоящего изобретения (см., например, заявку на патент США 2006/0025576 А1).
Антитело или его фрагмент также включает здесь "Fab двойного действия" или "DAF", включающий антиген-связывающий участок, который связывается с гемагглютинином, а также с другим, отличным от него антигеном (см., например, заявку на патент США 2008/0069820).
7. Варианты антител
В определенных вариантах осуществления включены варианты аминокислотных последовательностей антител, предлагаемых в настоящем описании. Например, может возникнуть необходимость в улучшении аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антител могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции и/или замещения остатков в аминокислотной последовательности антитела. Для получения конечного конструкта может быть осуществлено любое сочетание делеций, инсерций и замещений при условии, что конечный конструкт обладает требуемыми характеристиками, такими как способность связывать антиген.
а) Варианты на основе замещений, инсерций и делеций
В определенных вариантах осуществления предусмотрены варианты антител, содержащие одну или несколько аминокислотных замещений. Участки, представляющие интерес с точки зрения заместительного мутагенеза, включают HVR и FR. Консервативные замещения представлены в Таблице 1 под заголовком "предпочтительные замещения". Более конкретные замещения приведены в Таблице 1 под заголовком "примеры замещений" и соответствуют более приведенному ниже более подробному описанию с учетом классов боковых цепей аминокислот. Аминокислотные замещения могут быть введены в представляющее интерес антитело, после чего полученные продукты подвергают скринингу на требуемую активность, например сохранение/улучшение связывания антигена, пониженную иммуногенность или улучшенную ADCC или CDC.

Аминокислоты могут быть сгруппированы в соответствии со стандартными свойствами боковых цепей::
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепей: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замещения будут выражаться в замещении представителя одного из данных классов представителем другого класса.
Один тип заместительного варианта включает замещение одного или нескольких остатков гипервариабельного участка исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант (варианты), выбранные для дальнейшего исследования, характеризуются изменением (например, улучшениями) в плане некоторых биологических свойств (таких как повышенная аффинность, пониженная иммуногенность) по сравнению с исходным антителом и/или по существу сохраняют определенные биологические свойства исходного антитела. Пример заместительного варианта представляет собой аффинно зрелое антитело, которое может быть получено удобным образом, например, с помощью способов с использованием аффинного созревания на основе фаговых дисплеев, таких как описанные здесь. Кратко, один или несколько остатков HVR подвергаются мутации, при этом варианты антител экспонируют на фаге и подвергают скринингу на предмет определенной биологической активности (например, аффинности связывания).
В HVR могут быть осуществлены изменения (например, замены), например с целью улучшения аффинности антитела. Такие изменения могут быть осуществлены в "горячих точках" HVR, т.е. в остатках, кодируемых кодонами, которые в процессе соматического созревания подвергаются мутациям с высокой частотой (см., например, Chowdhury, Methods Mol Biol. 207: 179-196 (2008)), и/или остатках, которые контактируют с антигеном, при этом полученный VH или VL вариант подвергают исследованию на аффинность связывания. Аффинное созревание, осуществляемое путем модификации и повторного отбора из вторичных библиотек, было описано, например, в Hoogenboom et al., in Methods in Molecular Biology 178: 1-37 (O’Brien et al., ed., Human Press, Totowa, NJ, (2001).). В некоторых вариантах осуществления аффинного созревания в гены вариабельных участков, выбранных для созревания, вводят разнообразие с помощью одного из ряда способов (например, ПЦР с внесением ошибок, перетасовки цепей или олигонуклеотид-направленного мутагенеза). Затем создают вторичную библиотеку. Затем данную библиотеку подвергают скринингу для идентификации любых вариантов антител, обладающих требуемой аффинностью. Другой способ введения разнообразия включает HVR-направленные подходы, в рамках которых осуществляют рандомизацию нескольких остатков HVR (например, 4-6 остатков одновременно). Является возможной точная идентификация остатков HVR, принимающих участие в связывании антигена, например с применением сканирующего аланином мутагенеза или моделирования. При этом мишенями часто являются CDR-H3 и CDR-L3.
В определенных вариантах осуществления замещения, инсерции или делеции могут располагаться в одном или нескольких HVR, при условии, что такие изменения по существу не снижают способность антитела связывать антиген. Например, в HVR могут быть осуществлены консервативные изменения (например, указанные здесь консервативные замещения), которые по существу не снижают аффинность связывания. Данные изменения могут быть расположены, например, вне остатков HVR, контактирующих с антигеном. В некоторых вариантах осуществления описанных выше вариантов последовательностей VH и VL каждый HVR либо остается неизменным, либо содержит не более одной, двух или трех аминокислотных замещений.
Способ, который может применяться для идентификации остатков или участков антитела, которые могут являться мишенями для мутагенеза, называется "сканирующий аланином мутагенез", описанный Cunningham and Wells (1989) Science, 244: 1081-1085. В рамках данного способа идентифицируют остаток или группу остатков-мишеней (например, заряженных остатков, таких как arg, asp, his, lys и glu) и заменяют их нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином), чтобы определить, влияют ли они на взаимодействие антитела с антигеном. В аминокислотные положения, характеризующиеся функциональной чувствительностью к исходным заменам, могут быть введены дополнительные замещения. Альтернативно или дополнительно, точки контакта между антителом и антигеном идентифицируют с использованием кристаллической структуры комплекса антиген-антитело. Такие контактные остатки и соседние с ними остатки могут применяться в качестве мишеней или быть устранены в качестве кандидатов для замены. Варианты могут быть подвергнуты скринингу для определения того, обладают ли они требуемыми свойствами. Инсерции в аминокислотных последовательностях включают амино- и/или карбокси-терминальные присоединения размером от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции в центральной части последовательности одного или нескольких аминокислотных остатков. Примеры терминальных инсерций включают антитело с N-терминальным метионильным остатком. Другие варианты молекулы антитела с инсерциями включают соединения на N- или C-конце антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает период полураспада антитела в сыворотке.
b) Варианты на основе гликозилирования
В определенных вариантах осуществления предлагаемое здесь антитело изменяют с целью увеличения или уменьшения степени его гликозилирования. Добавление к антителу сайтов гликозилирования или их исключение может быть легко осуществлено путем изменения аминокислотной последовательности таким образом, что создается или исключается один или несколько сайтов гликозилирования.
Если антитело включает Fc-участок, присоединенный к нему углевод может быть подвергнут изменению. Нативные антитела, продуцируемые клетками млекопитающих, как правило, включают разветвленный, биантеннарный олигосахарид, обычно присоединенный N-связью к Asn297 домена СН2 Fc-участка. См., например, Wright et al., TIBTECH 15: 26-32 (1997). Олигосахарид может включать различные углеводы, например маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в "стволовой" части биантеннарной структуры олигосахарида. В некоторых вариантах осуществления могут быть осуществлены модификации олигосахарида, входящего в состав антитела по изобретению, с целью создания вариантов антител, обладающих определенными улучшенными свойствами.
В одном варианте осуществления предусмотрены варианты антител с углеводной структурой без фукозы, присоединенной (непосредственно или косвенно) к Fc-участку. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%). Количество фукозы определяют путем расчета отношения среднего количества фукозы в цепи сахара, присоединенного к Asn297, к сумме всех углеводных структур, присоединенных к Asn297 (например, комплексных структур, гибридных структур и структур с высоким содержанием маннозы), с применением способа на основе масс-спектрометрии MALDI-TOF, описанного, например, в WO 2008/077546. Asn297 обозначает аспарагиновый остаток, расположенный в положении приблизительно 297 Fc-участка (Eu-нумерация остатков Fc-участка); однако Asn297 также может быть расположен на расстоянии примерно ±3 аминокислот выше или ниже положения 297, т.е. между положениями 294 и 300, вследствие небольших вариаций последовательности антител. Такие варианты на основе фукозилирования могут обладать улучшенной ADCC функцией. См., например, патентные публикации США US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, описывающих "дефукозилированные" или "фукоза-дефицитные" варианты антител, включают: заявку на патент 2003/0157108; WO 2000/61739; WO 2001/29246; заявку на патент 2003/0115614; заявку на патент 2002/0164328; заявку на патент 2004/0093621; заявку на патент 2004/0132140; заявку на патент 2004/0110704; заявку на патент 2004/0110282; заявку на патент 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al., J. Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 СНО, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на патент США 2003/0157108 A1, Presta, L.; и WO 2004/056312 A1, Adams et al., особенно Пример 11), и линии нокаутных клеток, такие как ген альфа-1,6-фукозилтрансферазы, FUT8, нокаутные клетки СНО (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94 (4): 680-688 (2006); и WO 2003/085107).
Также предлагаются варианты антител, содержащие бисектированные олигосахариды, например в которых разветвление биантеннарного олигосахарида, присоединенного к Fc-участку антитела, осуществляется по GlcNAc. Такие варианты антител могут характеризоваться пониженным фукозилированием и/или улучшенной ADCC функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США 6602684 (Umana et al.) и заявке на патент США 2005/0123546 (Umana et al.). Также предусмотрены варианты антител, содержащие, по меньшей мере, один галактозный остаток в олигосахариде, присоединенном к Fc-участку. Такие варианты антител могут характеризоваться улучшенной CDC функцией. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
с) Варианты на основе Fc-участка
В некоторых воплощениях одна или несколько аминокислотных модификаций могут быть введены в Fc-участок указанного здесь антитела с получением варианта на основе Fc-участка. Вариант на основе Fc-участка может включать последовательность Fc-участка человека (например, Fc-участок IgG1, IgG2, IgG3 или IgG4 человека), включающий модификацию аминокислоты (например, замещение) в одном или нескольких аминокислотных положениях.
В определенных вариантах осуществления изобретение включает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для вариантов применения, в рамках которых важное значение имеет период полужизни антитела in vivo, хотя отдельные эффекторные функции (такие как комплемент и ADCC) не являются необходимыми, или являются вредными. Для подтверждения уменьшения/истощения активности CDC и/или ADCC могут быть проведены анализы цитотоксичности in vitro и/или in vivo. Например, для подтверждения отсутствия у антитела связывания FcγR (и, таким образом, вероятного отсутствия ADCC активности), но сохранения способности связывать FcRn, могут быть проведены анализы связывания Fc рецептора (FcR). Первичные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках обобщена в Таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-492 (1991). Неограничивающие примеры in vitro анализов для оценки активности ADCC представляющей интерес молекулы описаны в патенте США 5500362 (см., например, Hellstrom, I. et al. Proc. Nat’I Acad. Sci. USA 83: 7059-7063 (1986)) и Hellstrom, I. et al., Proc. Nat’I Acad. Sci. USA 82: 1499-1502 (1985); 5821337 (cm. Bruggemann, M. et al., J. Exp. Med. 166: 1351-1361 (1987)). Альтернативно могут применяться нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности методом проточной цитометрии ACTI™ (CellTechnology, Inc. Mountain View, CA) и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). В качестве эффекторных клеток в таких анализах могут применяться мононуклеарные клетки периферической крови (РВМС) и естественные киллерные (NK) клетки. Альтернативно или дополнительно, ADCC активность представляющей интерес молекулы может быть оценена in vivo, например в рамках модели на животных, такой как описана в Clynes et al. Proc. Nat’I Acad. Sci. USA 95: 652-656 (1998). Также могут быть проведены анализы связывания C1q, чтобы подтвердить, что антитело неспособно связывать C1q и, таким образом, не имеет CDC активность. См., например, анализ связывания C1q и С3с в рамках ELISA, описанный в WO 2006/029879 и WO 2005/100402. Активацию комплемента можно определить с помощью анализа CDC (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101: 1045-1052 (2003); и Cragg, M.S. and M.J. Glennie, Blood 103: 2738-2743 (2004)). Определение связывания FcRn и in vivo клиренса/периода полужизни может быть также осуществлено с помощью способов, известных в данной области (см., например, Petkova, S.B. et al., Int’l. Immunol. 18(12): 1759-1769 (2006)).
Антитела с пониженной эффекторной функцией включают антитела с замещением одного или нескольких остатков Fc-участка 238, 265, 269, 270, 297, 327 и 329 (патент США 6737056). Такие Fc-мутанты включают Fc-мутанты с замещениями в одном или нескольких аминокислотных положениях 265, 269, 270, 297 и 327, включая так называемый Fc-мутант "DANA" с заменой остатков в положениях 265 и 297 на аланин (патент США 7332581).
Описаны определенные варианты антител с улучшенным или сниженным связыванием с FcR (см., например, патент США 6737056; WO 2004/056312 и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).
В определенных вариантах осуществления вариант антитела включает Fc-участок с одной или несколькими аминокислотными замещениями, приводящими к улучшению ADCC, например с замещениями в положениях 298, 333 и/или 334 Fc-участка (EU-нумерация остатков).
В некоторых вариантах осуществления в Fc-участке присутствуют изменения, которые приводят к изменению (т.е. к улучшению или ухудшению) связывания C1q и/или комплемент-зависимой цитотоксичности (CDC), например как описано в патенте США 6194551, WO 99/51642 и Idusogie et al. J. Immunol. 164: 4178-4184 (2000). Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в заявке на патент США 2005/0014934 A1 (Hinton et al.). Данные антитела включают Fc-участок с одним или несколькими замещениями, которые улучшают связывание Fc-участка с FcRn. Такие Fc-варианты включают варианты с замещениями в одном или нескольких из следующих остатков Fc-участка: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замещение остатка 434 Fc-участка (патент США №7371826).
См. также Duncan & Winter, Nature 322: 738-40 (1988); патент США 5648260; патент США 5624821; и WO 94/29351, описывающие другие примеры вариантов Fc-участка.
d) Варианты антител, модифицированные цистеином
В некоторых вариантах осуществления может являться желательным создание модифицированных цистеином антител, таких как "thioMAb", в которых один или несколько остатков антитела замещены цистеиновыми остатками. В конкретных вариантах осуществления замещаемые остатки расположены в доступных участках антитела. Путем замещения указанных остатков цистеином в доступных участках антитела появляются реакционноспособные тиольные группы, которые могут применяться для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, с получением иммуноконъюгата, как описано в настоящем документе. В определенных вариантах осуществления любой один или несколько из следующих остатков могут быть замещены цистеином: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc-участка тяжелой цепи. Модифицированные цистеином антитела могут быть получены как описано, например, в патенте США 7521541.
е) Производные антител
В определенных вариантах осуществления предлагаемое здесь антитело может быть также модифицировано путем введения дополнительных небелковых фрагментов, которые известны в данной области и являются легкодоступными. Фрагменты, которые являются подходящими для дериватизации антитела, включают, без ограничения, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, без ограничения, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (или гомополимеры или статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоль пропионового альдегида может обладать преимуществами в плане промышленного производства вследствие его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединяемых к антителу, может варьироваться, при этом если присоединяется больше одного полимера, они могут представлять собой одинаковые или различные молекулы. Как правило, число и/или тип полимеров, используемых для дериватизации, можно определить с учетом факторов, включающих, без ограничения, конкретные свойства или функции антитела, подлежащие улучшению, независимо от того, будет ли производное антитела использоваться в терапии при определенных условиях, и так далее.
В другом варианте осуществления предлагаются конъюгаты антитела с небелковым фрагментом, который можно избирательно нагревать под действием облучения. В одном варианте осуществления небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Облучение может иметь любую длину волны, включая, без ограничения, длины волн, которые не приносят вреда обычным клеткам, но нагревают небелковый фрагмент до температуры, при которой клетки, находящиеся по соседству с конъюгатом антитело-небелковый фрагмент, погибают.
В. Рекомбинантные способы и композиции
Антитела могут быть получены с помощью рекомбинантных способов и композиций, например, описанных в патенте США 4816567. В одном варианте осуществления предусмотрена описанная здесь выделенная нуклеиновая кислота, кодирующая антитело против гемагглютинина. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, включающую VL, и/или аминокислотную последовательность, включающую VH антитела (например, легкую и/или тяжелую цепи антитела). В следующем варианте осуществления предусмотрен один или несколько векторов (например, векторов экспрессии), включающих такую нуклеиновую кислоту. В другом варианте осуществления предусмотрена клетка-хозяин, включающая такую нуклеиновую кислоту. В одном подобном варианте осуществления клетка-хозяин включает (например, была трансформирована с помощью): (1) вектора, включающего нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и аминокислотную последовательность, включающую VH антитела, или (2) первого вектора, включающего нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и второго вектора, включающего нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VH антитела. В одном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, например клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0, NS0, Sp20 клетку). В одном варианте осуществления предусмотрен способ получения антитела против гемагглютинина, при этом данный способ включает культивирование клетки-хозяина, включающей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, подходящих для экспрессии антитела, и, необязательно, выделение антитела из клетки-хозяина (или среды, в которой культивируют клетку-хозяина).
Для рекомбинантного получения антитела против гемагглютинина нуклеиновую кислоту, кодирующую антитело, например, описанную выше, выделяют и инсертируют в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделить и секвенировать с помощью традиционных методов (например, с применением олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Клетки-хозяева, подходящие для клонирования или экспрессии векторов, кодирующих антитело, включают описанные здесь прокариотические или эукариотические клетки. Например, антитела могут быть получены в бактериях, в частности если гликозилирование и эффекторная функция Fc не являются необходимыми. Для экспрессии фрагментов антител и полипептидов в бактериях см., например, патенты США 5648237, 5789199 и 5840523. (См. также Charlton, Methods in Molecular Biology, Т. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), стр. 245-254, где описана экспрессия фрагментов антител в Е. coli.) После экспрессии антитело может быть выделено из массы бактериальных клеток в растворимую фракцию и затем очищено.
Помимо прокариотов в качестве хозяев, подходящих для клонирования или экспрессии антитело-кодирующих векторов, могут применяться эукариотические микроорганизмы, такие как гифомицеты или дрожжи, включающие штаммы грибков и дрожжей с "гуманизированными" путями гликозилирования, которые обеспечивают получение антитела с частично или полностью относящимся к человеку паттерном гликозилирования. См. Gerngross, Nat. Biotech. 22: 1409-1414 (2004) и Li et al., Nat. Biotech. 24: 210-215 (2006).
Клетки-хозяева, подходящие для экспрессии гликозилированного антитела, также могут быть получены из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут применяться в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также могут применяться культуры клеток растений. См., например, патенты США 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев также могут применяться клетки позвоночных. Например, могут применяться клеточные линии млекопитающих, адаптированные для роста в суспензии. Другие примеры подходящих линий клеток-хозяев млекопитающих включают линию клеток почки мартышки CV1, трансформированных SV40 (COS-7); линию клеток почки эмбриона человека (клетки 293 или 293, описанную, например, в Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомяка (BHK); клетки мыши Sertoli (клетки ТМ4, описанные, например, в Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки мартышки (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы buffalo (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, в Mather et al., Annals NY. Acad. Sci. 383: 44-68 (1982); клетки MRC 5; и клетки FS4. Другие подходящие линии клеток-хозяев млекопитающих включают клетки яичника китайского хомячка (СНО), в том числе клетки DHFR-CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев млекопитающих, подходящих для получения антител, см., например, в Yazaki и Wu, Methods in Molecular Biology, m. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), стр. 255-268 (2003).
С. Анализы
Указанные здесь антитела против гемагглютинина могут быть идентифицированы, подвергнуты скринингу или охарактеризованы в отношении их физических/химических свойств и/или биологических активностей с помощью различных анализов, известных в данной области.
1. Анализы связывания и другие анализы
В одном аспекте антитело по изобретению тестируют на антиген-связывающую активность, например с помощью известных способов, таких как ELISA, вестерн-блоттинг и др.
В другом аспекте для идентификации антитела, которое конкурирует за связывание гемагглютинина Н7 с описанным здесь антителом против вируса гриппа A H7N9 (против гемагглютинина Н7) могут применяться конкурентные анализы. В определенных вариантах осуществления такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), который связан описанным здесь антителом против вируса гриппа A H7N9 (например, антителом против вируса гриппа A H7N9, включающим VH последовательность SEQ ID NO: 74 и VL последовательность SEQ ID NO: 74; или VH последовательность SEQ ID NO: 78 и VL последовательность SEQ ID NO: 79. Подробные примеры способов картирования эпитопа, с которым связывается антитело, приведены у Morris (1996) "Epitope Mapping Protocols," в Methods in Molecular Biology т. 66 (Humana Press, Totowa, NJ).
В примере конкурентного анализа иммобилизованный периостин культивируют в растворе, включающем первое меченое антитело, которое связывается с гемагглютинином, и второе немеченое антитело, подлежащее тестированию на способность конкурировать с первым антителом за связывание с гемагглютинином. Второе антитело может присутствовать в гибридомном супернатанте. В качестве контроля иммобилизованный гемагглютинин культивируют в растворе, включающем первое меченое антитело, но не второе немеченое антитело. После культивирования в условиях, позволяющих связывание первого антитела с гемагглютинином, избыток несвязанного антитела удаляют и измеряют количество метки, связанной с иммобилизованным гемагглютинином. Если количество метки, связанной с иммобилизованным гемагглютинином, является существенно сниженным в тестируемом образце относительно контрольного образца, то это свидетельствует о том, что второе антитело конкурирует с первым антителом за связывание с гемагглютинином. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual гл. 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
2. Анализы активности
В одном аспекте предлагаются анализы для идентификации антитела против вируса гриппа A H7N9 и его фрагментов, обладающих биологической активностью. Биологическая активность может включать, например, специфичное связывание с гемагглютинином вируса гриппа A H7N9, нейтрализацию вируса гриппа A H7N9, и так далее. Также предусмотрены антитела и композиции, включающие антитела или их фрагменты, обладающие указанной биологической активностью in vivo и/или in vitro.
В определенных вариантах осуществления антитело по изобретению тестируют на указанную биологическую активность. См. описание данных анализов в Примерах 4, 5, 6, 7, 8 и 9.
D. Иммуноконъюгаты
Изобретение также предусматривает иммуноконъюгаты, включающие описанное здесь антитело против вируса гриппа A H7N9, конъюгированное с одним или несколькими цитотоксическими средствами, такими как химиотерапевтические средства или лекарства, ингибиторы роста, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты) или радиоактивные изотопы.
В одном варианте осуществления иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или несколькими лекарственными средствами, включающими, без ограничения, майтансиноид (см. патенты США 5208020, 5416064 и Европейский патент ЕР 0425235 В1); ауристатин, такой как монометилауристатиновые лекарственные фрагменты DE и DF (ММАЕ и MMAF) (см. патенты США 5635483 и 5780588, и 7498298); доластатин; калихеамицин или его производные (см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; Hinman et al., Cancer Res. 53: 3336-3342 (1993); и Lode et al., Cancer Res. 58: 2925-2928 (1998)); антрациклин, такой как дауномицин или доксорубицин (см. Kratz et al., Current Med. Chem. 13 :477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16: 358-362 (2006); Torgov et al., Bioconj. Chem. 16: 717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97: 829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12: 1529-1532 (2002); King et al., J. Med. Chem. 45: 4336-4343 (2002); и патент США 6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тесетаксел и ортотаксел; трихотецен; и СС1065.
В другом варианте осуществления иммуноконъюгат включает описанное здесь антитело, конъюгированное с ферментативно активным токсином или его фрагментом, включая, без ограничения, А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модекцина, альфа-сарцин, белки Aleurites fordii, белки dianthin, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
В другом варианте осуществления иммуноконъюгат включает описанное здесь антитело, конъюгированное с радиоактивным атомом с получением радиоконъюгата. Для получения радиоконъюгатов может применяться множество радиоактивных изотопов. Их примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При применении радиоконъюгата для детектирования он может включать радиоактивный атом в случае сцинтиграфических исследований, например tc99m или 1123, или спин-метку в случае ядерного магнитного резонанса (ЯМР) (также известного как отображение магнитного резонанса, ОМР), такую как снова иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитостатического агента могут быть получены с помощью различных связывающих белки бифункциональных агентов, таких как N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметилдиадипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил) гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные фторсодержащие соединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен как описано в публикации Vitetta et al. Science, 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTP А) является примером хелатообразующего агента для конъюгирования радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", обеспечивающий высвобождение цитотоксического лекарственного средства в клетке. Например, могут применяться кислотолабильный линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США 5208020).
Описанные здесь иммуноконъюгаты или ADC в явной форме включают, без ограничения, конъюгаты, полученные с применением перекрестно-сшивающих реагентов, включая, без ограничения, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A).
E. Способы и композиции для диагностики и детектирования
В определенных вариантах осуществления любое из указанных здесь антител против вируса гриппа A H7N9 может применяться для детектирования присутствия гемагглютинина Н7 или вируса гриппа A H7N9 в биологическом образце. Термин "детектирование" в соответствии с используемым здесь значением охватывает количественное или качественное детектирование. В определенных вариантах осуществления биологический образец включает клетку или ткань, такую как, например, легкое, верхние дыхательные пути, носослезный канал, кровь, мокроту, или включает биологический образец, полученный путем взятия мазка из носа или горла.
В одном варианте осуществления предусмотрено антитело против вируса гриппа A H7N9 для применения в рамках способа диагностики или детектирования. В другом аспекте предусмотрен способ детектирования присутствия гемагглютинина Н7 или вируса гриппа A H7N9 в биологическом образце. В определенных вариантах осуществления способ включает контактирование биологического образца с описанным здесь антителом против вируса гриппа A H7N9 в условиях, позволяющих связывание антитела против гриппа А H7N9 с гемагглютинином Н7, и детектирование образования комплекса между антителом против вируса гриппа A H7N9 и гемагглютинином Н7. Данный способ может представлять собой in vitro или in vivo способ. В одном варианте осуществления антитело против вируса гриппа A H7N9 применяют для отбора субъектов, которые являются подходящими для терапии с применением антитела против вируса гриппа A H7N9, например если гемагглютинин Н7 является биомаркером для отбора пациентов.
Примеры заболеваний, которые могут быть диагностированы с применением антитела по изобретению, включают инфекцию, связанную с вирусом гриппа A H7N9, включая инфекцию, связанную с вирусом гриппа A H7N9, у детей, подростков, взрослых и пожилых, а также у птиц.
В определенных вариантах осуществления изобретения предусмотрены меченые антитела против вируса гриппа A H7N9. Метки включают, без ограничения, метки или фрагменты, которые можно детектировать непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые можно детектировать косвенно, например с помощью ферментативной реакции или молекулярного взаимодействия. Примеры меток включают, без ограничения, радиоактивные изотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люциферазу святляка и бактериальную люциферазу (патент США 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахарид оксидазы, например, глюкозооксидазу, галактозооксидазу и глюкоза-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, связанная с ферментом, который использует перекись водорода для окисления предшественника красителя, таким как HRP, лактопероксидазу, или микропероксидазу, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и им подобные.
F. Фармацевтические составы
Фармацевтические составы на основе описанного здесь антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) получают путем смешивания данного антитела, имеющего требуемую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16-е изд., Osol, A. Ed. (1980)) в форме лиофилизированных составов или водных растворов. Фармацевтически приемлемые носители в целом являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают, без ограничения: буферы, такие как фосфатный, цитратный, или на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил-или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем около 10 аминокислотных остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннитол, трегалоза или сорбитол; солеобразующие противоионы, такие как натрий; металлокомплексы (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Примеры фармацевтически приемлемых носителей в соответствии включают здесь средства, обеспечивающие внутритканевое распределение лекарства, такие как растворимые нейтрально-активные гликобелки, содержащие гиалуронидазу (sHASEGP), например, человеческие растворимые гликобелки РН-20, содержащие гиалуронидазу, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Определенные примеры sHASEGP и способы их применения, включая rHuPH20, описаны в патентных публикациях США 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP соединяют с одной или несколькими дополнительными глюкозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в патенте США 6267958. Водные композиции антител включают композиции, описанные в патенте США 6171586 и WO 2006/044908, причем последние композиции включают гистидин-ацетатный буфер. Указанная здесь композиция также может содержать более одного активного ингредиента, если это необходимо для конкретного показания для лечения, предпочтительно ингредиенты с комплементарными активностями, которые не оказывают неблагоприятного влияния друг на друга. Например, может являться желательным дополнительно включить ингибитор нейраминидазы, антитело против гемагглютинина, антитело против М2, и так далее. Такие активные ингредиенты присутствуют в комбинации в количествах, эффективных для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, с помощью способов на основе коацервации или межповерхностной полимеризации, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидную систему доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 16-е изд., Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с продолжительным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем такие матрицы находятся в виде формованных изделий, например пленок или микрокапсул.
Составы для введения in vivo как правило являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрационные мембраны.
G. Терапевтические способы и композиции
В рамках терапевтических способов могут применяться любые из описанных здесь антител против гемагглютинина (например, антитело против гемагглютинина Н7, антитело против вируса гриппа A H7N9).
В одном аспекте предусмотрено применение антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) в качестве лекарственного средства. В других аспектах предусмотрено применение антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) для лечения, профилактики или ингибирования инфекции, связанной с вирусом гриппа A H7N9. В определенных вариантах осуществления предусмотрено применение антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) в рамках способа лечения.. В определенных вариантах осуществления изобретение относится к антителу против гемагглютинина (например, антителу против гемагглютинину Н7, антителу против вируса гриппа A H7N9) для применения в рамках способа лечения субъекта, имеющего инфекцию, связанную с вирусом гриппа A H7N9, включающего введение субъекту эффективного количества антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9). В одном подобном варианте осуществления способ также включает введение субъекту эффективного количества, по меньшей мере, одного дополнительного терапевтического агента, например такого, как описан ниже. В других вариантах осуществления изобретение относится к антителу против гемагглютинина (например, антителу против гемагглютинина Н7, антителу против вируса гриппа A H7N9) для применения для профилактики, ингибирования или снижения опосредованного гемагглютинином связывания между вирусной мембраной вируса гриппа A H7N9 и эндосомальными мембранами инфицированной клетки, что обеспечивает предотвращение попадания вирусной РНК в цитоплазму инфицированной клетки и предотвращение дальнейшего распространения инфекции. В определенных вариантах осуществления изобретение относится к антителу против гемагглютинина (например, антителу против гемагглютинину Н7, антителу против вируса гриппа A H7N9) для применения в рамках способа профилактики, ингибирования или лечения инфекции, связанной с вирусом гриппа A H7N9, у субъекта, включающего введение субъекту эффективного количества антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) для профилактики, ингибирования или лечения инфекции, связанной с вирусом гриппа A H7N9. "Субъект" в соответствии с любым из описанных выше вариантов осуществления предпочтительно представляет собой человека.
В другом аспекте изобретение относится к применению антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9) в рамках производства или получения лекарственного средства. В одном варианте осуществления лекарственное средство предназначено для лечения инфекции, связанной с вирусом гриппа A H7N9. В другом варианте осуществления лекарственное средство предназначено для применения в рамках способа лечения инфекции, связанной с вирусом гриппа A H7N9, включающего введение субъекту, имеющему инфекцию, связанную с вирусом гриппа A H7N9, эффективного количества лекарственного средства. В одном подобном варианте осуществления способ также включает введение субъекту эффективного количества, по меньшей мере, одного дополнительного терапевтического агента, например такого, как описан ниже. В другом варианте осуществления лекарственное средство предназначено для профилактики, ингибирования или снижения опосредованного гемагглютинином связывания между вирусной мембраной вируса гриппа A H7N9 и эндосомальными мембранами инфицированной клетки, что обеспечивает предотвращение попадания вирусной РНК в цитоплазму инфицированной клетки и предотвращение дальнейшего распространения инфекции. В другом варианте осуществления лекарственное средство предназначено для применения в рамках способа профилактики, ингибирования или лечения инфекции, связанной с вирусом гриппа А H7N9, у субъекта, включающего введение субъекту эффективного количества лекарственного средства для профилактики, ингибирования или уменьшения инфекции, связанной с вирусом гриппа A H7N9. "Субъект" в соответствии с любым из описанных выше вариантов осуществления может представлять собой человека.
В другом аспекте изобретение относится к способу лечения инфекции, связанной с вирусом гриппа A H7N9. В одном варианте осуществления способ включает введение субъекту, имеющему такую инфекцию, связанную с вирусом гриппа A H7N9, эффективного количества антитела против гемагглютинина (например, антитела против гемагглютинина Н7, антитела против вируса гриппа A H7N9). В одном подобном варианте осуществления способ также включает введение субъекту эффективного количества, по меньшей мере, одного дополнительного терапевтического агента, например такого, как описан здесь. "Субъект" в соответствии с любым из описанных выше вариантов осуществления может представлять собой человека.
Настоящее изобретение относится к антителам против гемагглютинина (например, антителам против гемагглютинина Н7, антителам против вируса гриппа A H7N9), которые являются эффективными в плане ингибирования, профилактики или лечения инфекции, связанной с вирусом гриппа, у субъекта (например, пациента). В некоторых аспектах антитело против гемагглютинина (например, антитело против гемагглютинина Н7, антитело против вируса гриппа A H7N9) по настоящему изобретению является эффективным при профилактическом лечении субъекта в целях профилактики инфекции, связанной с вирусом гриппа A H7N9, у субъекта.
В некоторых аспектах субъект, являющийся подходящим для лечения антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа A H7N9) по настоящему изобретению, представляет собой субъекта, имеющего или вероятно имеющего инфекцию, связанную с вирусом гриппа A H7N9. В некоторых вариантах осуществления такие субъекты включают новорожденных, детей, взрослых и пожилых. В некоторых вариантах осуществления субъект является госпитализированным вследствие инфекции, связанной с вирусом гриппа A H7N9. В других вариантах осуществления субъект, имеющий инфекцию, связанную с вирусом гриппа A H7N9, имеет одно или несколько сопутствующих болезненных состояний, таких как иммунодефицит, беременность, заболевание легких, заболевание сердца, почечное заболевание или сопутствующую инфекцию (например, бактериальную инфекцию или вирусную инфекцию, такую как бактериальная или вирусная пневмония).
В некоторых аспектах лечение субъекта антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа A H7N9) по настоящему изобретению снижает тяжесть инфекции, связанной с вирусом гриппа А H7N9, снижает продолжительность инфекции, связанной с вирусом гриппа A H7N9, или снижает инфективность вируса гриппа A H7N9. В других аспектах лечение инфекции, связанной с вирусом гриппа A H7N9, антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа A H7N9) по настоящему изобретению обеспечивает дополнительную пользу, включая снижение продолжительности госпитализации, снижение или предотвращение потребности в использовании отделения интенсивной терапии (ОИТ), снижение или предотвращение потребности в искусственной или механической вентиляции легких, снижение или предотвращение потребности в подаче дополнительного кислорода и снижение смертности. В некоторых аспектах снижение продолжительности госпитализации составляет 1 день, 2 дня, 3 дня, 4 дня, 5 дней или более 5 дней. В некоторых аспектах снижение потребности в использовании отделения интенсивной терапии составляет 1 день, 2 дня, 3 дня, 4 дня, 5 дней или более 5 дней. В некоторых аспектах снижение потребности в искусственной или механической вентиляции легких составляет 1 день, 2 дня, 3 дня, 4 дня, 5 дней или более 5 дней. В некоторых аспектах снижение потребности в подаче дополнительного кислорода составляет 1 день, 2 дня, 3 дня, 4 дня, 5 дней или более 5 дней. В некоторых аспектах лечение субъекта антителом против гемагглютинина по настоящему изобретению снижает симптомы заболевания, вызванного инфекцией, связанной с вирусом гриппа A H7N9, такие как, например, жар, насморк, озноб, боль в горле, мышечная боль, боли в теле, головная боль, кашель, заложенность носа, слабость или усталость, раздражение или выделение слез из глаз, и общий дискомфорт.
В некоторых аспектах лечение субъекта антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа A H7N9) по настоящему изобретению уменьшает время, необходимое для нормализации респираторной функции, например уменьшает время, необходимое для нормализации частоты дыхания, или время, необходимое для нормализации кислородного насыщения. В некоторых аспектах лечение субъекта антителом против гемагглютинина по настоящему изобретению уменьшает время, необходимое для возращения к нормальному кислородному насыщению, например кислородному насыщению приблизительно 92% или более при измерении в течение 24-часового периода без введения дополнительного кислорода. В других аспектах лечение субъекта антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа А H7N9) по настоящему изобретению уменьшает время, необходимое для нормализации основных показателей состояния организма, таких как частота сердцебиения, кровяное давление, частота дыхания и температура.
В некоторых аспектах лечение субъекта антителом против гемагглютинина (например, антителом против гемагглютинина Н7, антителом против вируса гриппа A H7N9) по настоящему изобретению улучшает вирусологические показатели, такие как, например, титр вируса гриппа A H7N9. Титр вируса может быть определен с помощью различных способов, известных специалисту в данной области, таких как, например, площадь под кривой (AUC) при измерении с помощью, например, кПЦР, или инфекционной дозы в тканевой культуре (TCID50). В некоторых аспектах лечение приводит к превышающему или равному 50% снижению вирусной AUC при измерении с помощью кПЦР или TCID50.
В различных аспектах настоящего изобретения указанное здесь антитело против гемагглютинина (например, антитело против гемагглютинина Н7, антитело против вируса гриппа A H7N9) является эффективным в плане лечения инфекции, связанной с вирусом гриппа A H7N9, при введении спустя около 12 часов, около 24 часов, около 36 часов, около 48 часов, около 60 часов, около 72 часов, около 84 часов и около 96 часов после возникновения симптомов (например, после возникновения заболевания). В других аспектах указанное здесь антитело против гемагглютинина (например, антитело против гемагглютинина Н7, антитело против вируса гриппа A H7N9) является эффективным в плане лечения инфекции, связанной с вирусом гриппа A H7N9, при введении спустя от около 24 часов до около 48 часов после возникновения симптомов (например, если субъект имел симптомы в течение от 24 до 48 часов), при введении спустя от около 48 часов до около 2 часов после возникновения симптомов или при введении спустя от около 72 часов до около 96 часов после возникновения симптомов. В определенных вариантах осуществления настоящего изобретения антитело против гемагглютинина (например, антитело против гемагглютинина Н7, антитело против вируса гриппа A H7N9) по настоящему изобретению является эффективным в плане лечения или уменьшения инфекции, связанной с вирусом гриппа A H7N9 и расширяет окно лечения современного лечебного стандарта (например, оселтамивира) сверх 48 часов после развития симптомов. В дополнительном аспекте изобретение относится к фармацевтическим составам, включающим любое из описанных здесь антител против гемагглютинина, например для применения в рамках любого из описанных выше терапевтических способов. В одном варианте осуществления фармацевтический состав включает любое из описанных здесь антител против гемагглютинина и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтический состав включает любое из указанных здесь антител против гемагглютинина и, по меньшей мере, один дополнительный терапевтический агент, например такой, как описан ниже.
При терапии антитела по изобретению могут применяться самостоятельно или в комбинации с другими агентами. Например, антитело по изобретению может быть введено совместно с, по меньшей мере, одним дополнительным терапевтическим агентом. В определенных вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор нейраминидазы (например, занамивир, оселтамивирфосфат, перамивир, амантадин, римантадин), антитело против М2, антитело против гемагглютинина и так далее. В некоторых аспектах лечение субъекта, имеющего инфекцию, связанную с вирусом гриппа A H7N9, антителом против гемагглютинина по настоящему изобретению, которое вводят совместно с ингибитором нейраминидазы, обеспечивает синергетический терапевтический эффект по сравнению с лечением любым одним из данных агентов.
Такие описанные выше способы комбинированного лечения включают комбинированное введение (когда два или более терапевтических средства включены в один состав или разные составы) и раздельное введение, при котором введение антитела или иммуноконъюгата по изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического средства или средств. В одном варианте осуществления введения антитела против гемагглютинина и введение дополнительного терапевтического агента осуществляется в течение приблизительно одного месяца или в течение приблизительно одной, двух или трех недель, в течение приблизительно одного, двух, трех, четырех, пяти или шести дней или в течение приблизительно одного, двух, трех, четырех, пяти, шести, восьми, десяти, двенадцати, шестнадцати, двадцати или двадцати четырех часов между ними.
Антитело по изобретению (и любой дополнительный терапевтический агент) может быть введено любым подходящим способом, включая парентеральное, внутрилегочное и интраназальное введение и, если это необходимо для местного лечения, внутриочаговое введение. Парентеральное введение включает внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение может осуществляться любым подходящим способом, например с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или постоянным. Здесь предусмотрены различные схемы введения, включая, без ограничения, однократное или многократное введение в течение разных периодов времени, болюсное введение и импульсную инфузию.
Антитела по данному изобретению могут быть включены в состав композиции, подвергнуты определению дозировки и введены с помощью способов, согласующихся с хорошей медицинской практикой. Факторы, учитываемые в данном контексте, включают конкретное подлежащее лечению заболевание, вид конкретного подлежащего лечению млекопитающего, клиническое состояние пациента, причину заболевания, участок доставки средства, способ введения, схему введения и другие факторы, известные лечащим врачам. Антитело необязательно может входить в состав состава вместе с одним или несколькими средствами, используемыми в настоящее время для профилактики или лечения указанного заболевания. Эффективное количество таких других средств зависит от количества антитела, присутствующего в составе, типа расстройства или лечения и других описанных выше факторов. Как правило, их применяют в соответствии с указанными здесь дозировками и способами введения, или в диапазоне от около 1 до около 99% указанных здесь дозировок, или в любой дозировке и с помощью любого способа, эмпирически/клинически определенных в качестве подходящих.
Дозировка антитела по настоящему изобретению (применяемого самостоятельно или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), подходящая для профилактики или лечения заболевания, зависит от типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, цели (профилактической или терапевтической) введения антитела, предшествующей терапии, клинической истории пациента, чувствительности к антителу и предписания лечащего врача. Антитело может быть введено пациенту однократно или в несколько приемов. В зависимости от типа и тяжести заболевания, исходная кандидатная дозировка для введения пациенту может составлять от около 1 мкг/кг до около 45 мг/кг (например, от около 1,0 мг/кг до около 15 мг/кг) антитела, вводимого, например, один или несколько раз, или путем непрерывной инфузии. Одна стандартная ежедневная дозировка может варьироваться от около 1 мкг/кг до около 100 мг/кг или более, в зависимости от указанных выше факторов. В случае многократного введения в течение нескольких дней или дольше, в зависимости от состояния, лечение, как правило, проводят до достижения желательной степени подавления симптомов заболевания. Примеры дозировок антитела будут в диапазоне от около 1,0 мг/кг до около 45 мг/кг, от около 1,0 мг/кг до около 30 мг/кг, от около 1,0 мг/кг до около 15 мг/кг, от около 1,0 мг/кг до около 10 мг/кг или от около 1,0 мг/кг до около 5 мг/кг. Таким образом, пациенту может быть введена одна или несколько доз приблизительно по 1,0 мг/кг, 2,5 мг/кг, 5,0 мг/кг, 10 мг/кг, 15 мг/кг, 30 мг/кг или 45 мг/кг (или любая их комбинация). Такие дозы могут быть вводиться с перерывами, например каждый день, каждые два дня, каждые три дня и так далее. Может быть введена начальная более высокая доза с последующими одной или несколькими более низкими дозами. Дозировка также может представлять собой фиксированную дозировку, например 200 мг, 400 мг, 600 мг, 800 мг, 1000 мг, 1200 мг, 1400 мг, 1500 мг, 1600 мг, 1800 мг, 2000 мг, 2200 мг, 2400 мг, 2500 мг, 2600 мг, 2800 мг, 3000 мг, 3200 мг, 3400 мг, 3600 мг и так далее. Результаты данной терапии можно легко отслеживать с помощью стандартных способов и анализов.
Следует понимать, что любые вышеописанные составы или терапевтические способы могут быть реализованы с применением иммуноконъюгата по изобретению вместо или помимо антитела против гемагглютинина.
Н. Промышленные изделия
В другом аспекте настоящее изобретение относится к промышленному изделию, содержащему вещества, которые могут применяться для лечения, профилактики и/или диагностики описанных выше заболеваний. Промышленное изделие включает контейнер и этикетку или вкладыш в упаковку, вложенный в контейнер или присоединенный к контейнеру. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для в/в инъекций и так далее. Контейнеры могут состоять из различных материалов, таких как стекло или пластик. Контейнер содержит композицию саму по себе или в сочетании с другой композицией, эффективной для лечения, профилактики и/или диагностики состояния, кроме того, он может содержать стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон, имеющий пробку, которую можно проткнуть иглой для подкожных инъекций). По меньшей мере, одно активное средство, входящее в состав композиции, представляет собой антитело по изобретению. Этикетка или вкладыш в упаковку указывает на то, что композицию следует использовать для лечения определенного заболевания. Более того, промышленное изделие может включать (а) первый контейнер, содержащий композицию, включающую антитело по изобретению; и (b) второй контейнер, содержащий композицию, включающую другое средство, являющееся цитотоксическим или иным образом терапевтическим. Промышленное изделие в данном варианте осуществления изобретения может также включать вкладыш в упаковку, указывающий на то, что композиции можно использовать для лечения конкретного заболевания. Альтернативно или дополнительно, промышленное изделие может также включать второй (или третий) контейнер, включающий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно содержать другие вещества, являющиеся желательными с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Следует понимать, что любое из описанных выше промышленных изделий может включать иммуноконъюгат по изобретению вместо или помимо антитела против гемагглютинина.
III. ПРИМЕРЫ
Далее приведены примеры способов и композиций по изобретению. Следует понимать, что на практике могут быть реализованы различные иные варианты осуществления с учетом общего описания, которое приведено выше.
Пример 1. Идентификация антител против гемагглютинина с помощью фагового дисплея
Описанное здесь антитело против вируса гриппа mAb3 идентифицировали с помощью фагового дисплея с применением библиотеки фагового дисплея, сконструированной из клеток периферической крови (РВМС), полученных от представляющих собой людей доноров, подвергнутых вакцинации с применением вакцины против сезонного гриппа, как было описано ранее. (См. заявку на патент США 14/077414, которая полностью приведена здесь в качестве ссылки).
Пример 2. Обогащение и экспансия плазмобластов
Описанные здесь антитела mAb1 против вируса гриппа A H7N9 и антитела mAb2 против вируса гриппа A H7N9 идентифицировали с применением ранее описанного способа на основе обогащения и экспансии плазмобластов. (См. Nakamura et al. (2013) Cell Host & Microbe 14: 93-103 и заявку на патент США 14/077414, каждая из которых полностью приведена здесь в качестве ссылки).
Антикоагулированную цитратом кровь нормальных представляющих собой людей доноров, которые получали вакцину Fluvirin® против сезонного гриппа (Novartis Lot #111796Р1) за 7 дней до сдачи крови, получали от Blood Centers of the Pacific (San Francisco, CA). Мононуклеарные клетки периферической крови (РВМС) выделяли из антикоагулированной цитратом крови с помощью стандартных способов. Самок SCID мышей/мышей без NK-клеток возрастом от шести до восьми недель приобретали у Charles River Laboratories (Hollister, CA) и содержали в Genentech в соответствии с директивами American Association of Laboratory Animal Care. Все экспериментальные исследования проводили с одобрения Институциональных комитетов по содержанию и использованию животных (Institutional Animal Care and Use Committees) Genentech Lab Animal Research в аккредитованном AAALACi учреждении в соответствии с Руководством по содержанию и применению лабораторных животных (Guide for the Care and Use of Laboratory Animals) и соответствующими законами и правилами. Антикоагулированную цитратом кровь или кровь от здоровых представляющих собой людей доноров получали после письменного согласия и согласования с Western Institutional Review Board.
In vivo антиген-опосредованное обогащение и экспансию плазмобластов осуществляли с применением трансплантации РВМС в селезенку следующим образом. Выделенные РВМС ресуспендировали с антигенами на основе гемагглютинина (0,1-2 мкг на каждый миллион В-клеток) и культивировали в течение 30 минут при 37°C (премикс РВМС/антиген). После данного культивирования РВМС промывали для удаления несвязанных антигенов. Для обогащения плазмобластами, которые продуцировали кросс-реактивные антитела против гемагглютинина, были выбраны варианты антигенов на основе гемагглютинина, применяемые для премикса РВМС/антиген, и сортинг отдельных клеток для отличия от вариантов антигенов на основе гемагглютинина, содержащихся в вакцине Fluvirin® против гриппа. Антигены на основе гемагглютинина, применяемые в данном исследовании, таким образом, включали гемагглютинин H1 из изолята вируса гриппа A A/NWS/1933, гемагглютинин Н3 из изолята вируса гриппа A A/Hong Kong/8/1968 и гемагглютинин Н7 из изолята вируса гриппа A A/Netherlands/219/2003. Антигены на основе гемагглютинина получали в Genentech с применением стандартных способов молекулярной биологии.
Самок SCID мышей/мышей без NK-клеток возрастом 6-8 недель (Charles River Laboratories, Hollister, CA) подвергали нелетальному облучению при 350 рад с применением источника цезия-137. В питьевую воду добавляли полимиксин В (110 мг/л) и неомицин (1,1 г/л) в течение 7 дней после облучения. Спустя четыре часа после облучения левую боковую поверхность каждой мыши брили и обрабатывали Betadine® (Purdue Pharma, Stamford, CT) и 70% спиртом. Хирургические процедуры проводили при анестезии с применением асептических хирургических процедур. Делали надрез кожи размером 1 см чуть ниже линии ребер каждой мыши и далее надрез брюшной стенки и брюшины. Селезенку каждой мыши осторожно извлекали и инъецировали 50×106 РВМС человека, ресуспендированных в 30 мкл PBS. Надрезы закрывали в районе мышечного слоя и кожи с помощью 5-O Vicryl® нитей (Ethicon, Somerville, NJ) и хирургических скобок, соответственно. Для оценки сортинга антиген-специфичных клеток мышей умерщвляли спустя 8 дней после трансплантации и собирали их селезенки.
Суспензии отдельных клеток селезенки, полученных от мышей, окрашивали коктейлем моноклональных антител против антигенов человека CD38 РЕСу7 (BD Biosciences, San Jose, С А) и IgG Dylight (Jackson ImmunoResearch Laboratories, Inc., West Grove, PA), что позволяло определить IgG+ плазмобласты человека в виде экспрессии CD38high/IgG+. Для идентификации плазмобластов в суспензии выделенных клеток селезенки, обладающих кросс-реактивностью в отношении гемагглютинина, клетки окрашивали гемагглютинином H1 из изолята вируса гриппа A A/NWS/1933 и гемагглютинином Н3 из изолята вируса гриппа A A/Hong Kong/8/1968, которые предварительно конъюгировали с FITC или РЕ, соответственно, с применением наборов для окрашивания Lightning-Link® (Innova Biosciences, Cambridge, UK).
Затем образцы анализировали в присутствии йодистого пропидия для эксклюзии мертвых клеток на высокоскоростном сортировщике клеток Aria (BD Biosciences, San Jose, CA) и отсортировывали специфичные в отношении гемагглютинина плазмобласты по одной клетке в 96-луночные планшеты для культивирования ткани, содержащие 50 мкл культуральной среды RPMI с добавлением 5% эмбриональной коровьей сыворотки с низким содержанием IgG. (Gibco, Grand Island, NY).
Пример 3. Клонирование IgG из отдельных плазмобластов
Плазмобласты человека, обладающие кросс-реактивностью в отношении гемагглютинина H1 и Н3 (описаны выше), подвергали сортингу отдельных клеток. Отдельные плазмобласты подвергали сортингу непосредственно в 96-луночные микротитровальные планшеты с U-образными донышками, содержащие 50 мкл RPMI, содержащей 5% эмбриональную коровью сыворотку с низким содержанием IgG. Планшеты центрифугировали в течение 5 минут при 600×g (Beckman Coulter, Brea, CA) и осторожно удаляли культуральную среду с помощью аспирации. Клетки ресуспендировали и дважды промывали в 90 мкл PBS по той же процедуре.
Для получения кДНК, кодирующей вариабельные тяжелые цепи и легкие цепи, каждую клетку ресуспендировали в 6 мкл реакционной смеси на основе обратной транскриптазы (RT), содержащей 2 единицы RNaseout (Invitrogen, Grand Island, NY), 0,5 мМ 4dNTP (Perkin Elmer, Waltham, MA), 1,5 мМ MgCl2, 37,5 мМ KCl, 10 мМ DTT (дитиотреитол), 0,25% Nonidet P40 (US Biological, Marblehead, MA), 0,1 мг/мл альбумина коровьей сыворотки (Sigma-Aldrich), 25 мМ Tris pH 8,3, 0,25 пмоль олигонуклеотидов, специфичных в отношении константного участка IgG1-4, константного участка каппа цепи и константного участка лямбда цепи (показаны ниже) и 40 U Superscript III (Invitrogen, Grand Island, NY).
константный участок IgG1-4:  (SEQ ID NO: 1)
(SEQ ID NO: 1)
константный участок каппа цепи:  (SEQ ID NO: 2)
(SEQ ID NO: 2)
константный участок лямбда цепи:  (SEQ ID NO: 3)
(SEQ ID NO: 3)
Реакцию проводили в течение 3×30-минутных интервалов при 45°C, 50°C и 55°C. После проведения реакции реакционную смесь разбавляли до 15 мкл ТЕ буфером (10 мМ трис HCl, 1 мМ ЭДТА). Первоначальные полимеразные цепные реакции (ПЦР) проводили для амплификации тяжелых цепей IgG, каппа цепей и лямбда цепей с применением разбавленного до 2 мкл RT коктейля, как указано выше, и полимеразной смеси Advantage-GC 2 (Clontech, Mountain View, CA) в соответствии с протоколами, предоставленными производителями. ПЦР амплификации проводили с применением дегенеративных олигонуклеотидов на основе зародышевой линии с вариабельной тяжелой цепью и легкой цепью и последовательностями константного участка, показанными ниже.

константный участок НС 301.5  (SEQ ID NO: 27)
(SEQ ID NO: 27)
константный участок каппа 102  (SEQ ID NO: 28)
(SEQ ID NO: 28)
константный участок лямбда 202  (SEQ ID NO: 29)
(SEQ ID NO: 29)
Каждая реакция ПЦР амплификации с тяжелой и легкой цепью разделялась на две реакции следующим образом: семейства VH. 1, 2, 3 (праймеры IGVH1a, IGVH1b, IGVH2, IGVH3) и VH. 4, 5, 6, 7 (праймеры IGVH4, IGVH5, IGVH6 и IGVH7) тяжелой цепи; семейства VK. 1, 2, 3 (праймеры IGKV1, IGKV2 и IGKV3) и VK. 4, 5, 6 (праймеры IGVK4, IGVK5 и IGVK6) каппа цепи; и семейства VL. 1, 2, 3, 4, 5 (IGLV1, IGLV2, IGLV3, IGLV4 и IGLV5) и VL. 6, 7, 8, 9 (праймеры IGLV6, IGLV7, IGLV8 и IGLV9) лямбда цепи. Д Для температурного циклирования применяли протокол амплификации на основе ступенчатой ПЦР.
После реакции продукты ПЦР амплификации обрабатывали экзонуклеазой 1 (Ехо) и щелочной фосфатазой креветки (SAP) для удаления избытка нуклеотидов и праймеров из каждой реакции ПЦР амплификации (U.S. Biologicals, Marblehead, MA). Продукты первоначальной ПЦР амплификации подвергали прямому секвенированию для определения вариабельных последовательностей тяжелых цепей и легких цепей с применением секвенирования по Сэнгеру. Вторые гнездовые ПЦР амплификации проводили с применением совпадающих с зародышевой линией вариабельных нуклеотидов с тяжелой цепью и легкой цепью для инсерции сигнала млекопитающего и клонирующих последовательностей константного участка с применением следующих олигонуклеотидных праймеров:



Константный участок тяжелой цепи:  (SEQ ID NO: 53)
(SEQ ID NO: 53)
Константный участок каппа цепи:
Константный участок лямбда цепи:  (SEQ ID NO: 55)
(SEQ ID NO: 55)
Реакции ПЦР амплификации подготавливали с применением PrimeStar HS ДНК полимеразы с GC (Takara Bio, Shiga, Japan) в соответствии с рекомендациями производителя. После реакций ПЦР амплификации продукты амплификации обрабатывали Exo/SAP, как описано выше. Продукты ПЦР амплификации, кодирующие тяжелую вариабельную цепь и легкую вариабельную цепь, инсертировали в вектор экспрессии млекопитающего с применением процедур без использования рестриктазы. 20 мкл продуктов ПЦР амплификации отжигали на однонитевых ДНК-матрицах человека для IgG1, каппа и лямбда цепи с применением протокола мутагенеза по Кункелю. (См. Kunkel (1985) PNAS 82: 488-492.) Наличие правильно инсертированных конструктов определяли с помощью секвенирования ДНК. Плазмиды, содержащие нуклеиновые кислоты, кодирующие тяжелые цепи и легкие цепи, подвергали совместной трансфекции в эмбриональные клетки почки человека 293Т с применением трансфекционного реагента Fugene (Roche Diagnostic, Indianapolis, IN) для транзиентной экспрессии и анализировали на экспрессию и связывание как описано ниже в Примере 4.
Пример 4. Анализ на основе ELISA скрининга гемагглютинина Н7
Для анализа способности антитела mAb1 против вируса гриппа, антитела mAb2 против вируса гриппа и антитела mAb3 против вируса гриппа связывать Н7 НА проводили следующие исследования.
Нуклеиновую кислоту, кодирующую Н7 НА из A/Shanghai/1/2013 (Фиг. 7; SEQ ID NO: 86)) и из A/Anhui/1/2013 (Фиг. 8; SEQ ID NO: 87), синтезировала компания Blue Heron Biotech, входящая в группу OriGene из Bothell, Washington. Нуклеиновую кислоту, кодирующую белок Н7 НА, субклонировали в вектор экспрессии млекопитающего pRK.sm (Genentech Inc) перед трансфекцией и экспрессией. Белки Н7 НА экспрессировали в виде полноразмерных белков на поверхности клеток 293Т перед проведением детектирования с применением связанного ферментами иммуносорбента.
Для получения полноразмерных лизатов НА клетки 293Т в 10 см культуральных чашках (Corning Cat# 430167) трансфицировали плазмидами, экспрессирующими Н7 НА, с применением способа на основе фосфата кальция. Спустя 48 часов клетки обрабатывали 1 мл лизисного буфера (50 мМ трис, pH 8, 5 мМ ЭДТА pH 8, 150 мМ NaCl, 1% Triton X-100 (EMD, каталожный номер 9410) и коктейлем ингибиторов протеазы в виде таблеток (Roche, Cat# 11836153001) в течение 20 минут при комнатной температуре. Лизаты центрифугировали при 14000 об/мин в течение 10 минут. Супернатанты хранили при -80°C и применяли в рамках исследований ELISA.
Для исследований ELISA 96-луночные планшеты Nunc Maxisorp (каталожный номер 439454) покрывали 5 мкг/мл лектина Galanthus nivalis (Sigma, каталожный номер L-8275) в PBS в течение 6 часов при комнатной температуре. Затем планшеты промывали промывочным буфером (PBS, pH 7,4,+0,05% Tween-20 (EMD, каталожный номер 1296)) и подвергали культивированию в блокирующем буфере (PBS, pH 7,4,+0,5% BSA (альбумин коровьей сыворотки, Gibco, каталожный номер 15260)). Затем планшеты промывали и культивировали с лизатами клеток 293Т (1:300) в аналитическом разбавителе (PBS, pH 7,4, +0,5% BSA +0,05% Tween-20) в течение ночи при 4°C. Затем планшеты промывали и культивировали с разбавленными несколько раз антителами в аналитическом разбавителе в течение 1,5 часов при комнатной температуре.
После последующего этапа промывки планшеты культивировали с антителами козы против IgG-HRP человека (Jackson ImmunoResearch, каталожный номер 109-036-098) при концентрации 1:30000 или антителами козы против IgG-HRP мыши (Jackson ImmunoResearch, каталожный номер 115-035-071) при концентрации 1:20000 в аналитическом разбавителе в течение 1 часа при комнатной температуре. Планшеты промывали и культивировали с субстратом ТМВ (KPL, каталожный номер 50-65-00) в течение 5-10 минут при комнатной температуре; затем добавляли 1М фосфорную кислоту для остановки реакции. Абсорбцию при 450 нМ измеряли на сканере для планшетов BioTek Synergy2 с программным обеспечением Gen5. Анализ данных и графическое построение связывания антител с Н7 НА получали с помощью программного обеспечения Prism.
Анализы ELISA проводили для всех трех антител для тестирования связывания с белками Н7 НА из A/Shanghai/1/2013 and А/Anhui/1/2013. В качестве отрицательного контроля все три антитела тестировали с применением ELISA на связывание с лизатом, который не содержал белка Н7 НА. Антитело mAb1 против гриппа (Фиг. 1A), антитело mAb2 против гриппа (Фиг. 1В) и антитело mAb3 против гриппа (Фиг. 1С) демонстрировали специфичное связывания с обоими протестированными белками Н7 НА. Для всех трех антител наблюдали очень малую активность связывания с лизатом, представляющим собой отрицательный контроль, даже при самой высокой протестированной концентрации антител (25000 нг/мл). (См. Фиг. 1А, 1В и 1С). Характеризующие связывание данные, полученные с помощью ELISA, подвергали аппроксимации в виде сигмоидной кривой доза-реакция для подсчета IC50 значения связывания и 95% доверительного интервала для каждого антитела. (См. Таблицу 2 ниже.)
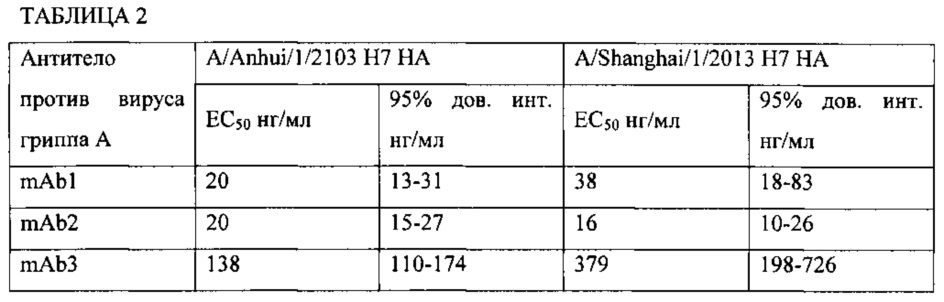
Данные результаты показали, что все три протестированных в рамках данного анализа антитела могут специфично связываться с белками Н7 НА из A/Shanghai/1/2013 и A/Anhui/1/2013, двумя из первых штаммов вируса человека A H7N9, выделенными в рамках вспышки вируса птичьего гриппа A H7N9 В Китае в 2013 году.
Пример 5. In vitro нейтрализация вируса гриппа A H7N9
Способность антител против вируса гриппа A H7N9 по настоящему изобретению нейтрализовывать вирус гриппа A H7N9 in vitro анализировали следующим образом. Исследования нейтрализации in vitro проводили в BSL3 учреждении в Virapur LLC, San Diego, CA. В рамках исследований in vitro нейтрализации применяли штамм A/Shanghai/2/2013 IDCDC RG32A вируса гриппа A H7N9. Для анализа нейтрализации приблизительно 100 инфекционных единиц вируса смешивали с каждым антителом при концентрации в диапазоне от 200 до 1,56 мкг/мл и оставляли для культивирования в течение 1 часа. Затем смеси вирус/антитела помещали в слившийся монослой клеток MDCK, которые культивировали в прозрачных 96-луночных планшетах с плоским дном. Каждую концентрацию антител тестировали трижды. Вирусу в присутствии антитела позволяли инфицировать клетки MDCK в течение от 68 до 72 часов при 37°C. После инфицирования раствор антитело-вирус удаляли и фиксировали и окрашивали клетки MDCK кристаллвиолетом для визуализации инфицированных и неинфицированных монослоев MDCK. Лунки, которые содержали интактные неинфицированные монослои клеток MDCK, окрашивались кристаллвиолетом в темно-синий цвет; лунки, которые содержали инфицированные монослои MDCK, не окрашивались кристаллвиолетом в темно-синий цвет.
Антитело mAb1 против вируса гриппа А и антитело mAb2 против вируса гриппа А, которые демонстрировали наибольшую способность связывать Н7 НА, были способны полностью блокировать инфекцию, связанную с вирусом гриппа A H7N9, при концентрации антител 200 на 25 мкг/мл (Фиг. 2А и 2В). Антитело против гемагглютинина (mAb 81.39, содержащее остаток Trp вместо остатка Tyr в положении 6 в HVR-L3), эффективность которого в плане нейтрализации вируса гриппа A Grp2 была ранее подтверждена (см. заявку на патент США 14/077414, которая полностью приведена здесь в качестве ссылки), не было эффективным в плане нейтрализации вируса гриппа A H7N9 в рамках данного исследования (данные не показаны), что свидетельствует о том, что антитела против вируса гриппа A H7N9 по настоящему изобретению имеют неожиданное преимущество, связанное с эффективной нейтрализацией вируса гриппа A H7N9. В качестве отрицательного контроля на способность блокировать инфективность вируса гриппа A H7N9 также тестировали антитело, которое не связывается с Н7 НА. Данное антитело, применяемое в качестве отрицательного контроля, показало отсутствие способности обеспечивать in vitro нейтрализацию даже при более высокой протестированной концентрации антител (200 мкг/мл) (Фиг. 2С). Минимальные обеспечивающие ингибирование значения концентрации (MIC) для mAb1 (анти-Flu1) и mAb2 (анти-Flu2) в рамках данного анализа составляли 25 мкг/мл, в то время как MIC для антитела, применяемого в качестве отрицательного контроля, не может быть определено (Таблица 3).

Данные результаты показали, что моноклональные антитела по настоящему изобретению были способны обеспечивать нейтрализацию вируса гриппа A H7N9 in vitro в зависимости от дозировки. Данные результаты свидетельствовали, что антитела по настоящему изобретению являются эффективными в плане лечения и профилактики инфекции, связанной с вирусом гриппа A H7N9.
Пример 6. In vivo эффективность антитела против вируса гриппа A H7N9 у мышей и хорьков
Модели на основе инфекции, связанной с вирусом гриппа А у мышей и хорьков, часто применяют для оценки профилактической и терапевтической эффективности способов лечения гриппа. Хорьки рассматриваются в качестве клинически родственной модели с использованием животных для инфекции, связанной с вирусом гриппа у человека. (См. Matsuoka et al., (2009) Current Protocols in Microbiology, гл. 15, раздел 15G 12.)
Анализ in vivo эффективности антител против вируса гриппа A H7N9 у мышей и хорьков проводили следующим образом. DBA/2J мышей (Jackson Lab, Bar Harbor, ME) или самцов хорьков (Mustela putorius furo) интраназально инфицировали 50 мкл кладами различных штаммов вируса гриппа A H7N9, разбавленными в среде для гриппа (DMEM, 0,2% BSA, 2 мкг/мл обработанного ТРСК трипсина) при минимальной LD100 дозе. Инфекции, связанной с вирусом гриппа, позволяли прогрессировать в течение 24-72 часов перед внутривенным введением антитела.
Спустя 72 часа после заражения вирусом гриппа A H7N9 мышам и хорькам внутривенно вводили различные количества антитела при различных дозировках (например, 45 мг/кг, 15 мг/кг, 5 мг/кг, 1,5 мг/кг и 0,6 мг/кг) в 200 мкл PBS. Мышей и хорьков наблюдали ежедневно на предмет состояния организма и выживаемости, а также ежедневно взвешивали в течение 21 дней после инфицирования.
Определяли долю выживаемости (с течением времени, сут.) мышей и хорьков, которым вводили различные количества антитела спустя 24, 48 и 72 часа после инфицирования вирусом гриппа A H7N9. Результаты показывают, что моноклональные антитела по настоящему изобретению являются эффективными в плане лечения различных инфекций, связанных с вирусом гриппа A H7N9. Кроме того, эти данные показывают, что моноклональные антитела по настоящему изобретению являются эффективными в плане лечения инфекции, связанной с вирусом гриппа A H7N9, при введении в течение, по меньшей мере, до 72 часов после инфицирования вирусом гриппа A H7N9.
Пример 7. In vivo эффективность антитела против вируса гриппа A H7N9 и оселтамивира у мышей и хорьков
Для сравнения эффективности антител против вируса гриппа A H7N9 и эффективности фосфата оселтамивира (Tamiflu®) у мышей и хорьков проводили следующие исследования. Balb/c мышей (Charles River Laboratories, Hollister, CA) в возрасте 6 недель подвергали интраназальному инфицированию 50 мкл вируса гриппа A H7N9 при 100х летальной дозе. Самцам хорьков (Mustela putorius furo) интраназально вводили дозу вируса гриппа A H7N9, соответствующую, например, 1×103 БОЕ. Спустя 48 часов после инфицирования вводили антитела против вируса гриппа A H7N9 в виде одной дозы (например, приблизительно 45 мг/кг, 15 мг/кг, 5 мг/кг, 1,5 мг/кг или 0,6 мг/кг) или контрольный IgG в 200 мкл PBS внутривенно. В рамках данных экспериментов схему приема оселтамивира, состоящую из 2 мг, вводимых два раза в день (BID) в течение пяти дней, сравнивали со схемой приема антитела против вируса гриппа A H7N9 в виде однократной дозы.
Определяли долю смертности в каждой подвергавшейся лечению группе. Результаты показывают что антитела против вируса гриппа A H7N9 по изобретению являются более эффективными в плане лечения инфекции, связанной с вирусом гриппа A H7N9, у мышей и хорьков по сравнению с оселтамивиром.
Пример 8. In vivo эффективность антитела против вируса гриппа A H7N9 у мышей и хорьков с/без совместного введения оселтамивира
Введение оселтамивира является эффективным в плане уменьшения инфекции, связанной с вирусом гриппа А человека, если оно осуществляется в течение 48 часов после возникновения симптомов. К сожалению, оселтамивир демонстрирует минимальную эффективность у пациентов, которые имели симптомы в течение более чем 48 часов. Таким образом, описанные ниже эксперименты проводили для анализа того, демонстрирует ли совместное введение антитела против вируса гриппа A H7N9 и оселтамивира повышенную эффективность по сравнению с лечением только одним из них. Данные эксперименты проводили с применением модели на основе инфекции, связанной с гриппом, у мышей или хорьков, такой как описанная выше в Примере 7. Кратко, самок Balb/C мышей (Charles River Laboratories) инфицировали 100х летальной дозой вируса гриппа A H7N9, самцам хорьков (Mustela putorius furo) интраназально вводили дозу вируса гриппа A H7N9, соответствующую, например 1×103 БОЕ, за 72 часа до в/в введения одной субэффективной дозы антитела против вируса гриппа A H7N9, контрольного IgG, 2 мг оселтамивира BID или комбинации из одной дозы антитела против вируса гриппа A H7N9 и лечения оселтамивиром в течение 5 дней.
Определяли процентную долю смертности в каждой подвергавшейся лечению группе. Осуществляли сравнение для определения возникновения синергетического эффекта в рамках комбинированной терапии с применением антитела против вируса гриппа А H7N9, применяемого в комбинации с оселтамивиром, являющимся ингибитором нейраминидазы.
Данные результаты показали, что обеспечивающие широкую нейтрализацию антитела против гемагглютинина по настоящему изобретению обеспечивали высокую степень защиты при лечении инфекции, связанной с вирусом гриппа A H7N9 у хорьков, и являлись более эффективными, чем оселтамивир, при введении спустя 24, 48 и 72 часа после инфицирования вирусом гриппа A H7N9.
Пример 9. Профилактическое лечение
Антитела по настоящему изобретению могут применяться в рамках профилактического лечения инфекции, связанной с вирусом гриппа A H7N9. Такое лечение обеспечивает профилактическую терапию для субъектов с риском заражения или инфицирования вирусом гриппа A H7N9. Антитела против вируса гриппа A H7N9 проанализировали в рамках профилактических in vivo моделей с применением животных для анализа их способности обеспечивать профилактическое лечение в ответ на вспышку вируса гриппа A H7N9 у людей. При использовании мышей и хорьков доступны несколько in vivo моделей H7N9 с применением животных с диапазоном клинических исходов от умеренного заболевания до смерти. Внутривенная доставка данных антител при концентрации от 5 до 50 мг/мл данным животным перед инфицированием применяется для анализа их профилактической активности в плане уменьшения инфекции и степени тяжести заболевания, связанного с вирусом гриппа A H7N9.
Статистические анализы
Статистические показатели рассчитывали с применением программного обеспечения JMP версии 9.0.2 (SAS Institute). Результаты экспериментов, связанных с выживаемостью, сравнивали с применением критерия Мантела-Кокса. Р значения <0,05 рассматривали в качестве значимых. Кривые и значения IC50 наносили и рассчитывали с применением программного обеспечения Graphpad Prism версии 5.0.
Несмотря на то, что приведенное выше описание изобретения содержит в качестве иллюстрации некоторые подробности и примеры для облегчения понимания, описания и примеры не следует рассматривать в качестве ограничивающих объема данного изобретения. Описание всей упомянутой здесь патентной и научной литературы полностью включено здесь в качестве ссылок.