Результат интеллектуальной деятельности: Пептид, обладающий противоопухолевой и антиметастатической активностью, и готовая лекарственная форма на его основе
Вид РИД
Изобретение
Область техники. Изобретение относится к биологически активным соединениям, в частности к пептидам, обладающим противоопухолевой и антиметастатической активностью. Предложен шестичленный пептид в ацетил-амидной форме Ac-Thr-Gly-Glu-Asn-His-Arg-NH2 в качестве противоопухолевого средства и готовая лекарственная форма на его основе для лечения онкологических заболеваний. Готовая лекарственная форма на основе пептида содержит в качестве активного вещества пептид в ацетил-амидной форме, водный раствор которого в концентрации 1 мг/мл стерильно расфасован в ампулы с последующей лиофилизацией.
Уровень техники. В качестве изобретения заявляется биологически активное соединение, конкретно, пептид формулы Ac-Thr-Gly-Glu-Asn-His-Arg-NH2 (далее Ас-TGENHR-NH2), который подавляет пролиферацию раковых клеток, оказывает антиметастатическое действие, а также готовая лекарственная форма на его основе, которые могут найти применение в медицине.
Известен целый ряд природных соединений, останавливающих рост и метастазирование злокачественных опухолей. Однако все эти соединения труднодоступны и дороги, поскольку их выделяют из природных источников. Кроме того, существует большое количество опухолей, препараты для лечения которых пока не созданы.
Анализ мировых и российских тенденций диагностики и лечения показывает, что перспективы преодоления неблагоприятной ситуации в онкологии связаны, в частности, с решением одной из основных задач биомедицинского профиля: разработкой и внедрением в медицинскую практику новых отечественных эффективных и безопасных препаратов для лечения социально значимых онкологических заболеваний на основе критических биомедицинских технологий. Использование заявленного препарата позволит излечивать некоторые виды рака при минимальном вреде для организма больного. Внедрение в медицинскую практику позволит осуществлять принципиально новое качество иммунологического сопровождения противоопухолевой химиотерапии при всех стадиях опухолевого процесса, а также улучшать качество жизни онкобольных, получающих стандартную химиотерапию.
Актуальность разработки препарата определяется тем, что злокачественные новообразования устойчиво занимают второе место среди причин смертности населения России. Их удельный вес в общей структуре смертности составляет около 14%. По данным главного онколога Минздрава России В.И. Чиссова 2.8 млн россиян живут с диагнозом рак. Каждый год в России выявляется более 500 тысяч онкобольных. Судя по большинству источников, ежегодно такие диагнозы ставятся около 10 млн. людей со всего мира, т.е. около 27.000 людей за 1 сутки получают диагноз рак, из них около 1500 только в России. Ежегодный прирост новых пациентов онкологических клиник и отделений за последние годы, составил около 2-3%, причем цифра эта ежегодно растет.
В подавляющем большинстве в качестве противоопухолевой терапии используется комплексное лечение, включающее химио-, радиотерапию. Одним из главных препятствий в достижении желаемого эффекта является высокая токсичность этих воздействий, нередко ограничивающая проведение интенсивной противоопухолевой терапии. Особенно страдают системы, функционирование которых связано с высокой пролиферативной активностью клеток - костного мозга, иммунной системы, слизистых оболочек, а также центральной нервной системы. Одним из специфических осложнений противоопухолевой терапии является нейротоксичность. Достижение максимальной терапевтической эффективности цитостатических методов лечения злокачественных опухолей может быть связано с использованием новых средств, блокирующих или замедляющих развитие токсических повреждений, но не снижающих противоопухолевых свойств цитостатиков. Все это делает актуальным разработку средств и способов снижения токсического действия специфического противоопухолевого лечения и защиты жизненно важных органов и тканей, способствующих высокой эффективности цитостатической терапии.
Одним из современных подходов к повышению эффективности лечения злокачественных новообразований является использование биотерапевтических воздействий в сочетании с классическими методами (химио-, лучевая терапия, операционное вмешательство). Преимущество такого комплексного подхода заключается в одновременном повреждающем действии на опухолевые клетки и активизации защитных механизмов организма, оказывающих, в свою очередь, противоопухолевый эффект.
Предлагаемый пептид способен не только оказывать противоопухолевое действие, но и оказывать влияние на противоопухолевую эффективность цитостатической терапии и процесс метастазирования.
Внимание многих исследователей сосредоточено сейчас на препаратах, вызывающих дифференцировку клеток, поскольку патогенез многих злокачественных опухолей связан с отклонениями в нормальной клеточной дифференцировке. Белковые факторы дифференцировки и их биологически активные пептидные фрагменты представляются чрезвычайно перспективными в терапии опухолей в качестве независимых лекарственных средств, либо как препараты сопровождения противоопухолевой терапии. Достоинством данного подхода является то, что эти вещества способны вызывать регрессию опухоли через активацию естественного механизма ингибирования роста клеток в результате индукции их дифференцировки.
Перспективность применения и дальнейшего развития методов биологической (в том числе пептидной) терапии онкологических заболеваний в свете новых научных знаний уже не вызывает сомнения. Клинический опыт позволяет утверждать, что применение пептидов больным независимо от стадии онкологического заболевания и проводимого лечения не только усиливает его эффективность, но и существенно повышает качество жизни этой категории больных.
Известен 8-членный пептид на основе микробного белка CAGE, интерферирующий с клеточными сигнальными путями. Пептид блокирует связывание с GSK3β, и тем самым блокирует пролиферативный сигнал от Wnt-путей в лекарственно-резистентных раковых клетках (Doo II Jeoung, Young Mi Kim, Hyun A Kim, 2018).
Известны некоторые противомикробные пептиды, подавляющие развитие опухолей, отличительной особенностью которых является их низкая токсичность в отношении здоровых клеток (Zhou Lihong, 2017).
Известен 7-членный циклический пептид, выделенный из стеблей растения Maytenus variabilis, обладающий противораковыми свойствами. Этот циклический пептид эффективно ингибирует рост широкого спектра опухолевых клеток, в частности, рака толстого кишечника, рака молочных желез, рака простаты, рака легких, меланомы, лейкемии, рака головного мозга, рака почек и рака яичников в наномолярном диапазоне концентраций (Hongjie Zhang, 2017).
Известен 15-членный пептид, выделенный из природного источника, который ингибирует пролиферацию раковых стволовых клеток. Механизм его действия состоит в ингибировании ядерной транслокации фактора NF-κВ. Препятствуя попаданию NF-κВ в ядро, этот пептид блокирует трансактивацию множества пролиферативных и противовоспалительных генов и таким образом подавляет пролиферацию и метастазирование опухолевых стволовых клеток (Yoon Jeong Park, Chong-Pyoung Chung, Jue-Yeon Lee, Jin Sook Suh, 2017).
Известен пептид GK-1 из ленточного червя Т. crassiceps, обладающий противоопухолевыми и антиметастатическими свойствами. Пептид активен в отношении базальноклеточного рака, сквамозноклеточного рака, переходноклеточной карциномы и аденокарциномы, и, в частности, он был эффективен для лечения рака молочных желез (Sciutto Conde Edda Lydia, Fragoso 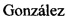 Gladis Del Carmen, Torres
Gladis Del Carmen, Torres  Diana, Cervantes Torres Jacquelynne Brenda, Segura
Diana, Cervantes Torres Jacquelynne Brenda, Segura  Alvaro,
Alvaro,  Torres Armando, Manucharyan Karen, 2017).
Torres Armando, Manucharyan Karen, 2017).
Недостатками вышеописанных аналогов являются неудовлетворительное время нахождения в кровотоке (что ограничивает их биодоступность и увеличивает нагрузку и стоимость терапии вследствие быстрой деградации или выведения), иммуногенность (особенно, если они получены из других биологических видов, кроме человека) или недостаточно высокая активность.
Известен гексапептид формулы (Thr-Gly-Glu-Asn-His-Arg), наиболее близкий к предлагаемому, обладающий противоопухолевой, протекторной и нормализующей активностью (Патент Российской Федерации на изобретение №2213747). Однако возможность использовать его в качестве лекарственного препарата ограничивается его быстрой биодеградацией в тканях организма.
Раскрытие изобретения. Заявляемое изобретение решает задачу расширения арсенала лекарственных препаратов для лечения некоторых онкологических заболеваний. Поставленная задача решается за счет пептида формулы Ac-Thr-Gly-Glu-Asn-His-Arg-NH2, обладающего лечебным действием при онкологических заболеваниях и лекарственной формы на его основе.
Техническим результатом, достигаемым при реализации изобретения, является наличие широкого спектра лечебного действия ацетил-амидной формы пептида, что определяет возможность его использования в низких дозах в качестве противоопухолевого и антиметастатического средства. Пептид отличается хорошей переносимостью, отсутствием токсичности и нежелательных побочных эффектов, характерных для известных препаратов для лечения онкологических заболеваний.
Выраженность противоопухолевого и антиметастатического действия этого нового лекарственного препарата в дозе 25 мг/кг сопоставима с действием таких известных цитостатиков как цисплатин, гемцитар. При этом очень важно, что пептид проявляет свое действие в гораздо меньших дозах, чем препараты сравнения (120 мг/кг).
Основанием для решения задачи и получения технического результата, достигаемого при реализации изобретения, является наличие противоопухолевого и антиметастатического лечебного действия ацетил-амидной формы пептида, что определяет возможность его использования в низких дозах в качестве лечебного средства.
Готовая лекарственная форма на основе пептида представляет собой стерильно расфасованный в ампулы с последующей лиофилизацией водный раствор пептида в концентрации 1 мг/мл. Готовая лекарственная форма на основе заявляемого пептида отличается хорошей переносимостью, отсутствием нежелательных побочных эффектов и токсичности, характерных для известных препаратов для лечения раковых заболеваний.
Пептид получают с помощью классического пептидного синтеза, затем очищают и выделяют в гомогенном состоянии. Пептид имеет следующие свойства: мол. масса 753 Да, рН стабильность в интервале рН 2,0-9,0, термостабильность в интервале температур от 0°С до +60°С, гомогенность 99,7%, хорошая растворимость в воде и физиологическом растворе, неиммуногенный, нетоксичный.
Изобретение иллюстрируют следующие графические материалы:
Фиг. 1 Биодеградация пептида [3H-G]Ac-TGENHR-NH2 в плазме крови крысы в течение 8 (a) and 32 (b) минут. Радиохроматография в градиенте метанола (10-40%) в 0.1% TFA на колонке Kromasil С18 (8×150 mm).
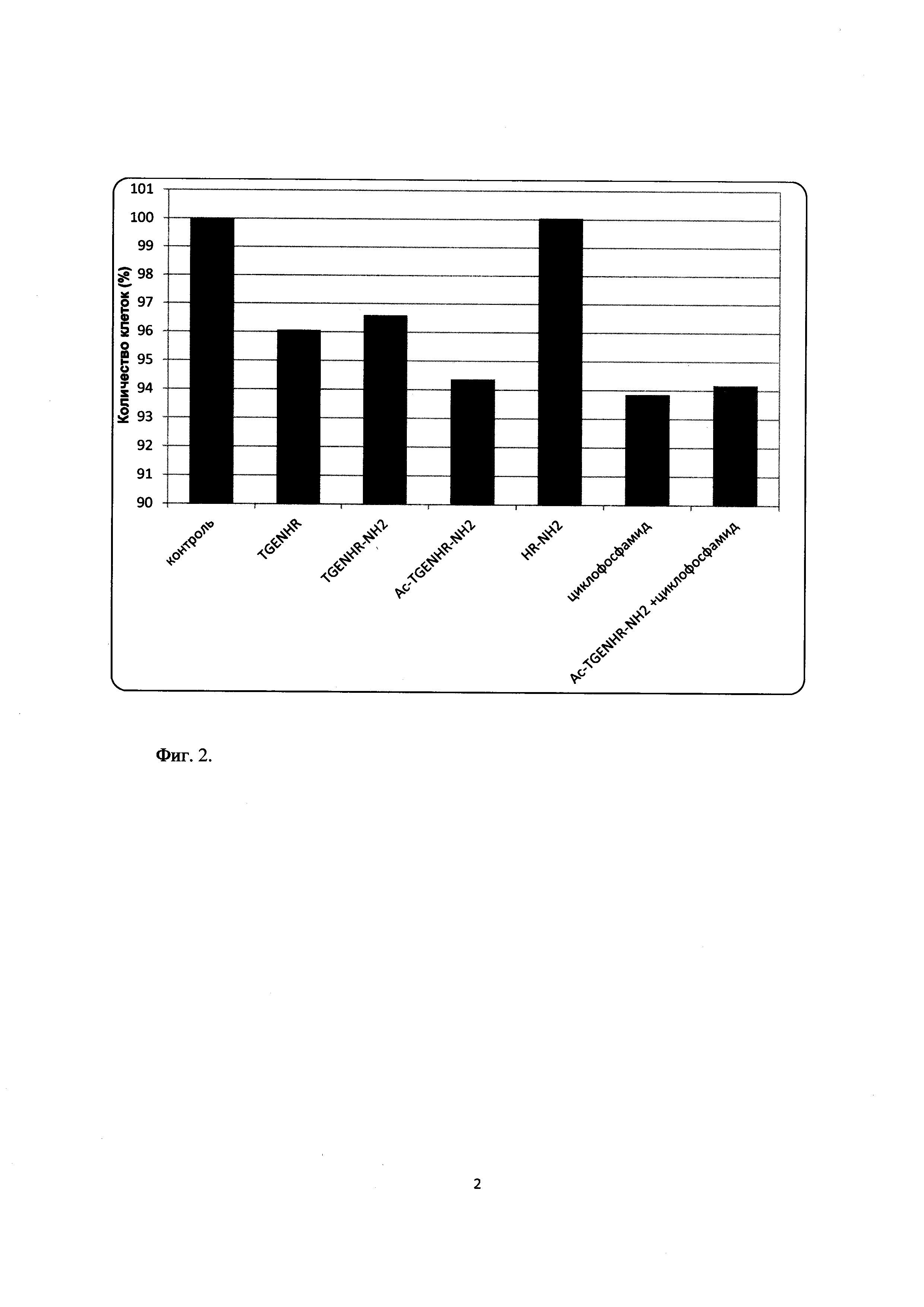
Фиг. 2. Влияние пептида на пролиферацию клеток миеломы
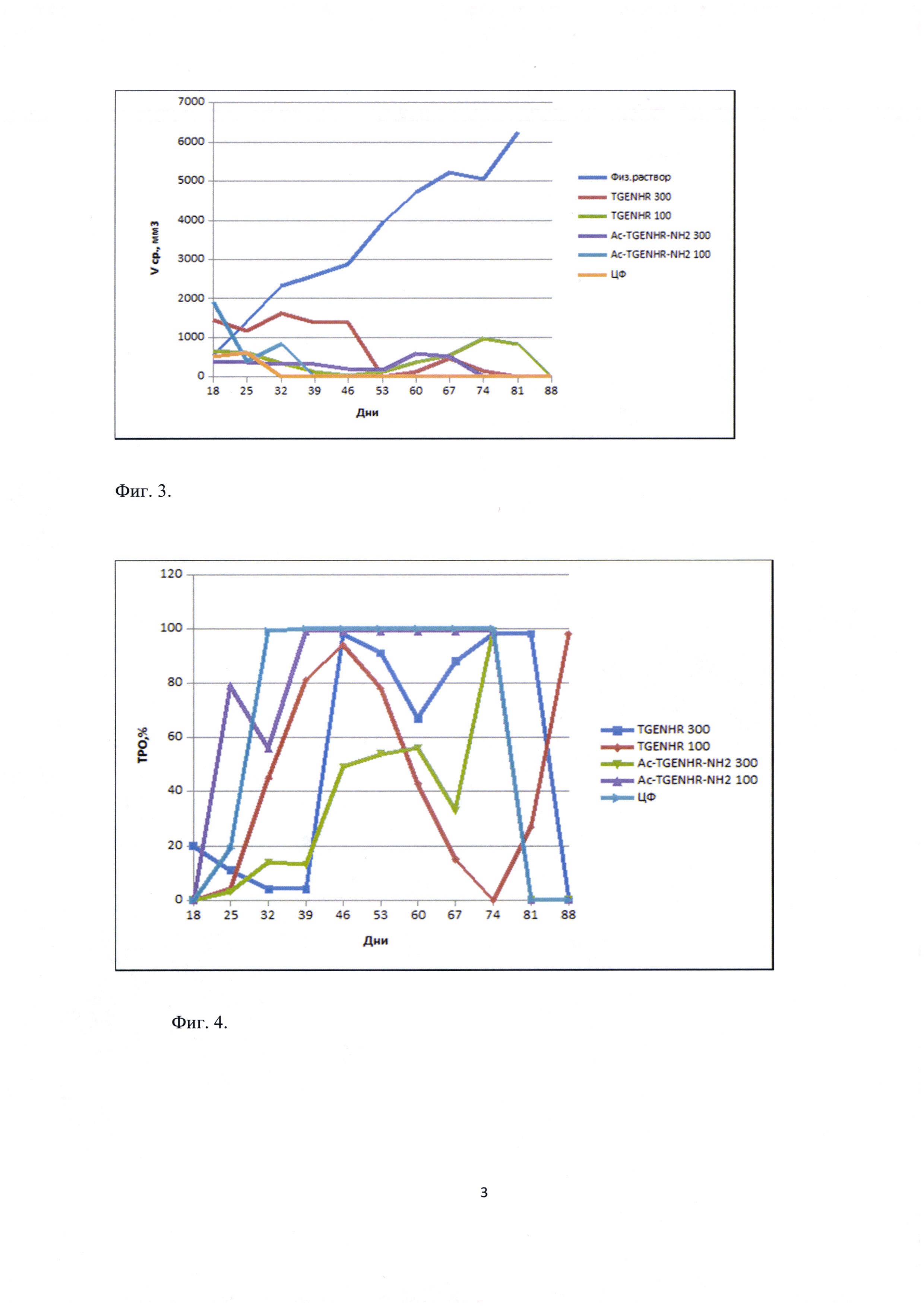
Фиг. 3. - Изменение объема опухоли у экспериментальных животных.
Фиг. 4. Торможение роста опухоли (ТРО) у экспериментальных животных
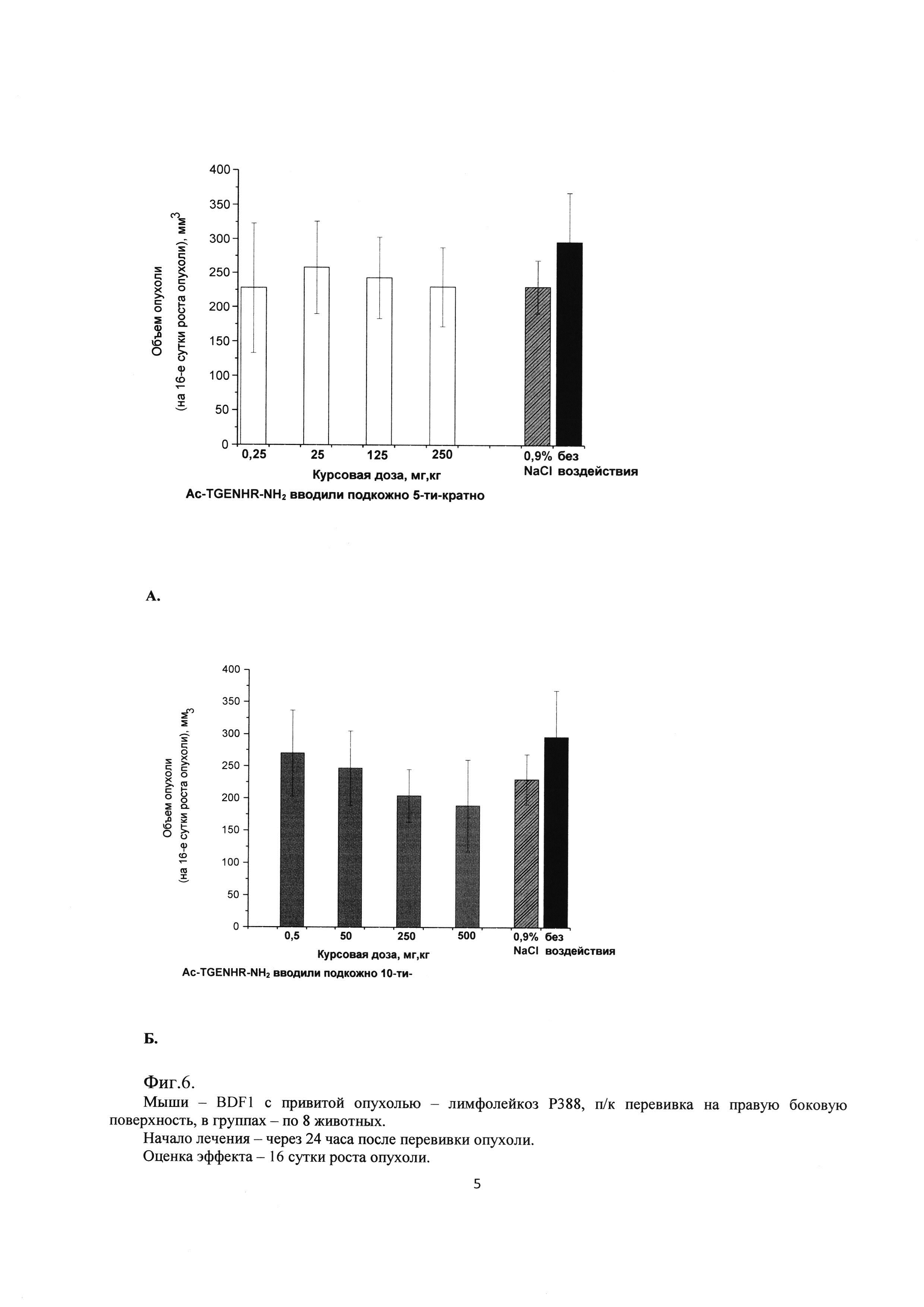
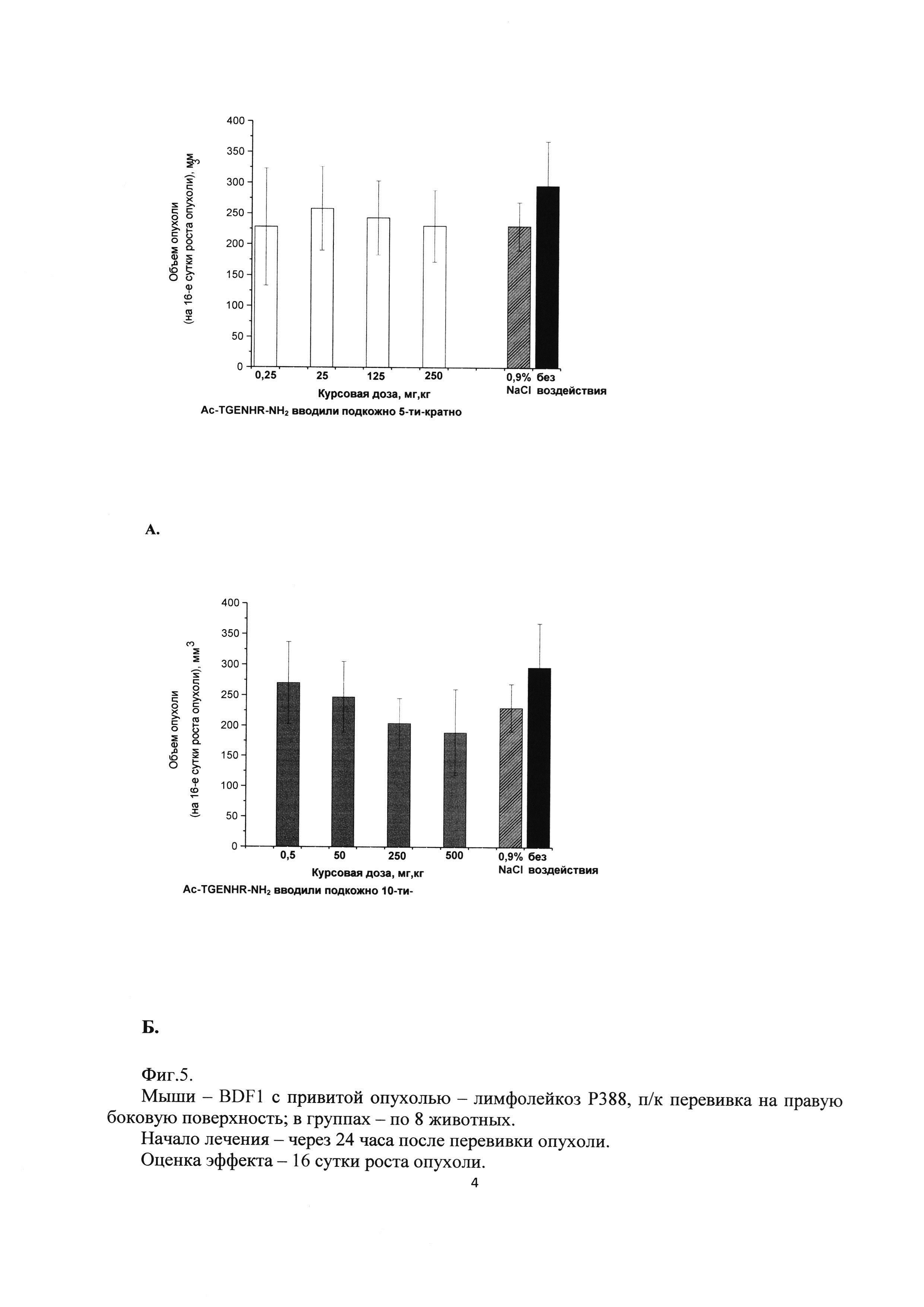
Фиг. 5. Влияние гексапептида Ac-TGENHR-NH2 на рост первичного очага опухоли лимфолейкоза Р388 при подкожном введении.
А - 5-и кратное введение в разовых дозах 0,05 мг/кг, 5 мг/кг, 25 мг/кг, 50 мг/кг.
Б - 10-и кратное введение в разовых дозах 0,05 мг/кг, 5 мг/кг, 25 мг/кг, 50 мг/кг
Фиг. 6. Влияние гексапептида Ac-TGENHR-NH2 на рост первичного очага опухоли лимфолейкоза Р388 при внутривенном введении.
А - 5-и кратное введение в разовых дозах 0,05 мг/кг, 5 мг/кг, 25 мг/кг, 50 мг/кг.
Б - 10-и кратное введение в разовых дозах 0,05 мг/кг, 5 мг/кг, 25 мг/кг, 50 мг/кг.
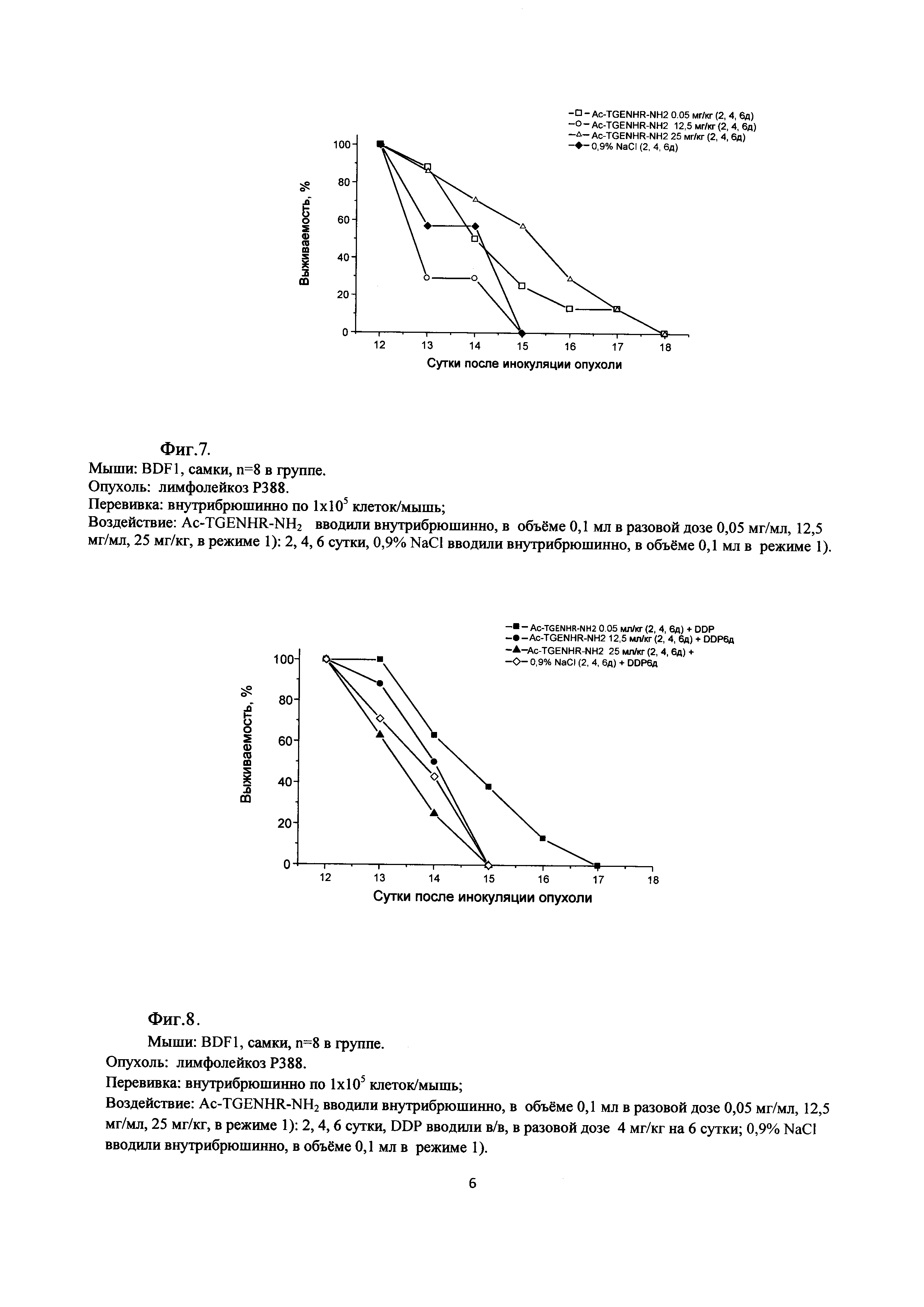
Фиг. 7. Динамика выживаемости животных с асцитным вариантом лимфолейкоза Р388 при монотерапии пептидом Ac-TGENHR-NH2 в различных дозах
Фиг. 8 - Динамика выживаемости животных с асцитным вариантом лимфолейкоза Р388 при сочетанной терапии пептидом Ac-TGENHR-NH2 в различных дозах и цисплатином в дозе 4 мг/кг.
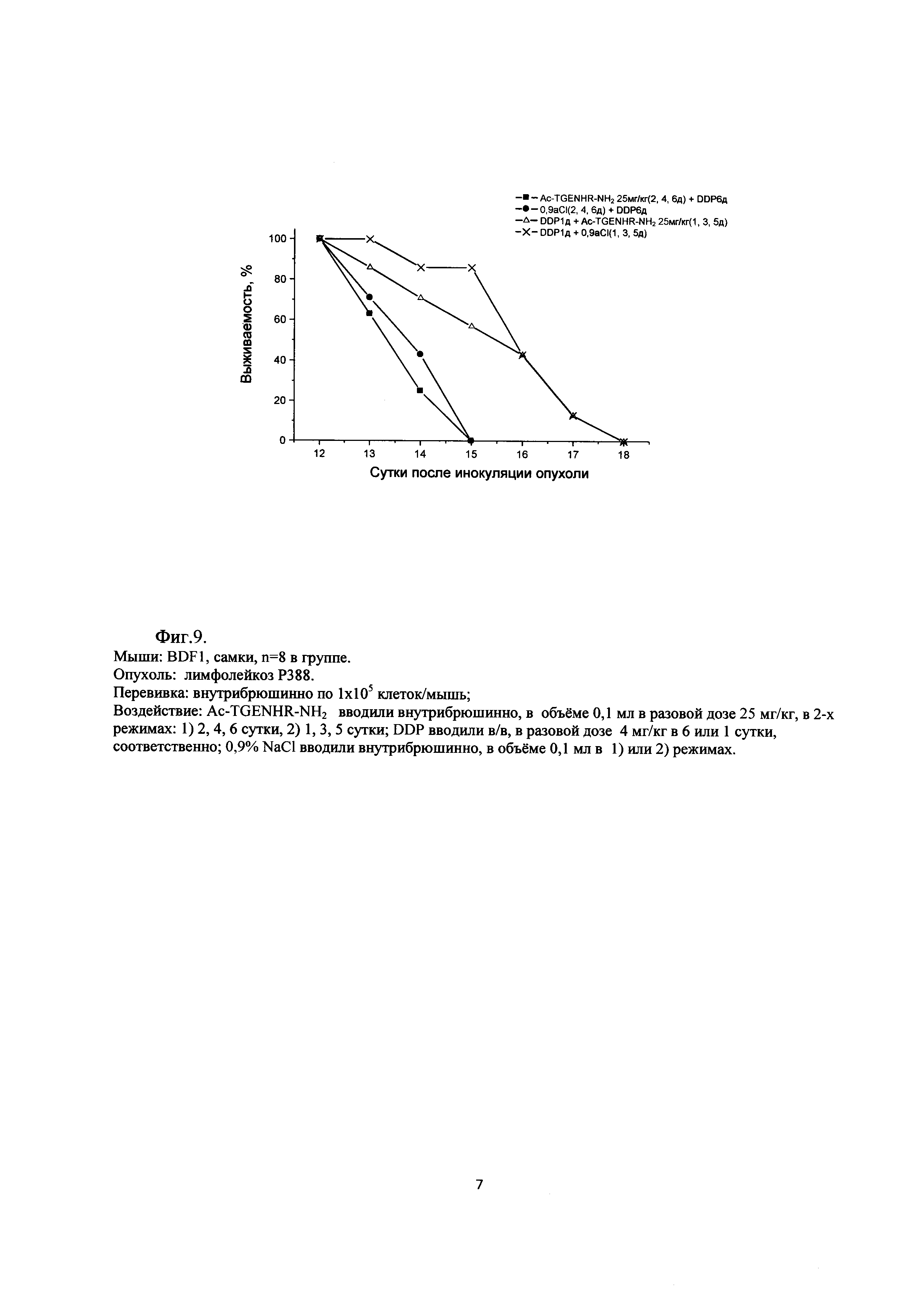
Фиг. 9. Сравнение различных схем терапии: «Ac-TGENHR-NH2 (2, 4 и 6 дни после перевивки) + DDP (6 сутки)» и «DDP (1 сутки) + Ac-TGENHR-NH2 (1, 3 и 5 дни после перевивки)» на модели асцитного варианта роста лимфолейкоза Р388
Фиг. 10. Химическая формула и масс-спектр конъюгата FITC и пептида Ас-TGENHR-NH2
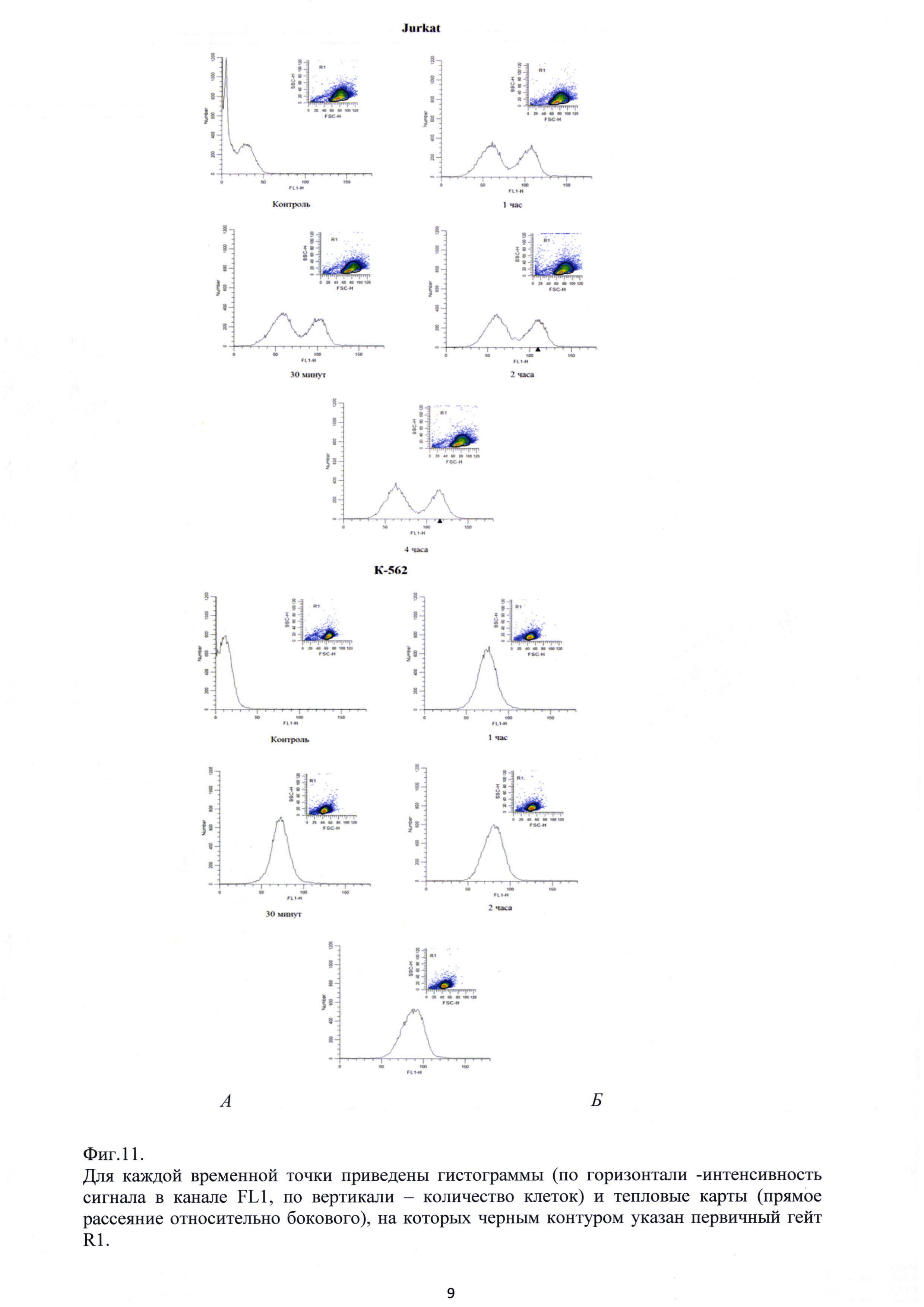
Фиг. 11. Результаты исследования с помощью проточной цитометрии динамики связывания 100 мкМ FITC- Ac-TGENHR-NH2 с клетками Jurkat (А) и К562 (Б).
Фиг. 12. Взаимодействие клеток линии U87MG и 100 мкМ FITC- AcTGENHRa
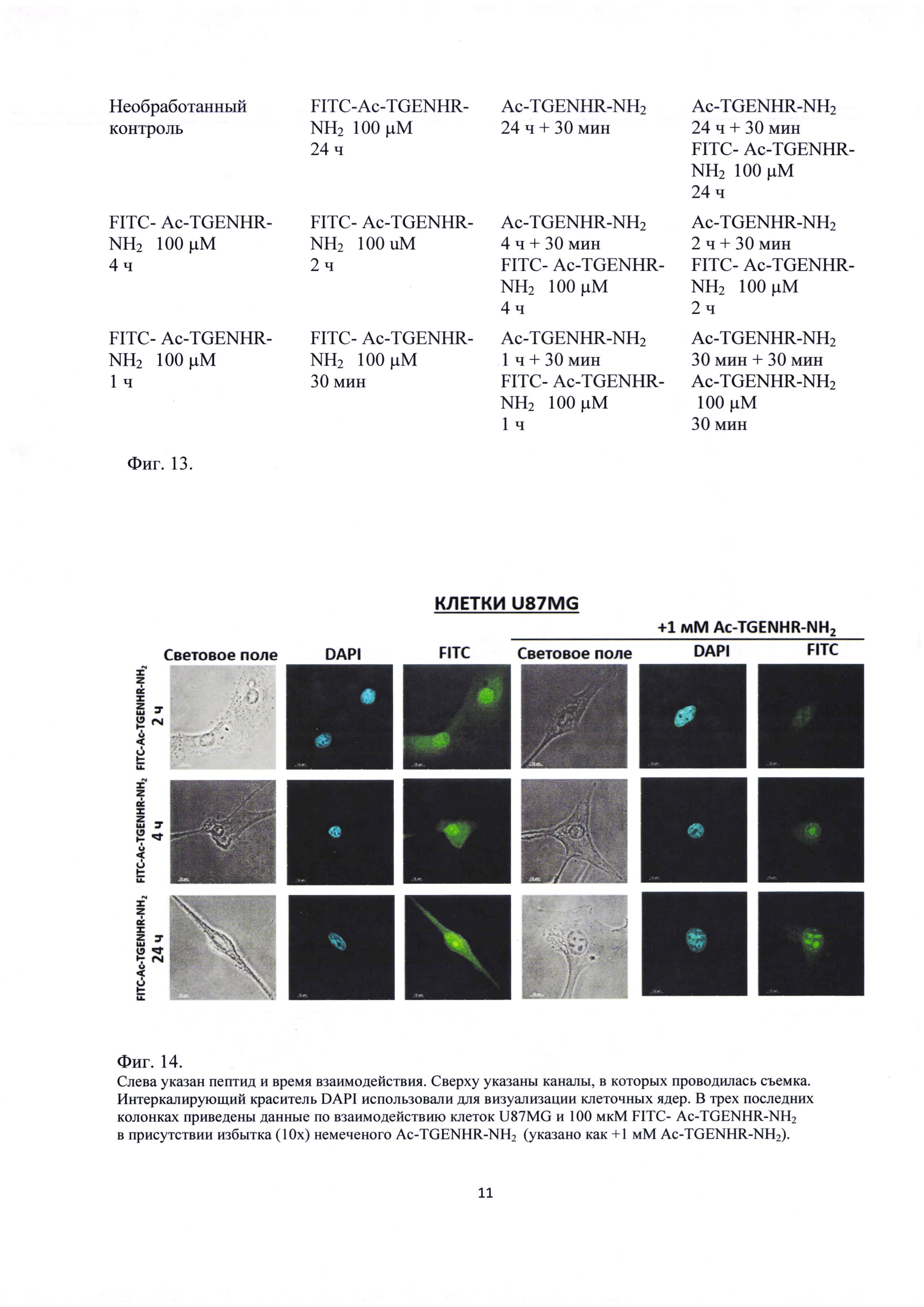
Фиг. 13. Схема обработки клеток линии U87MG пептидом FITC- Ac-TGENHR-NH2 (Каждая ячейка схемы соответствует лунке в 12-луночной плашке)
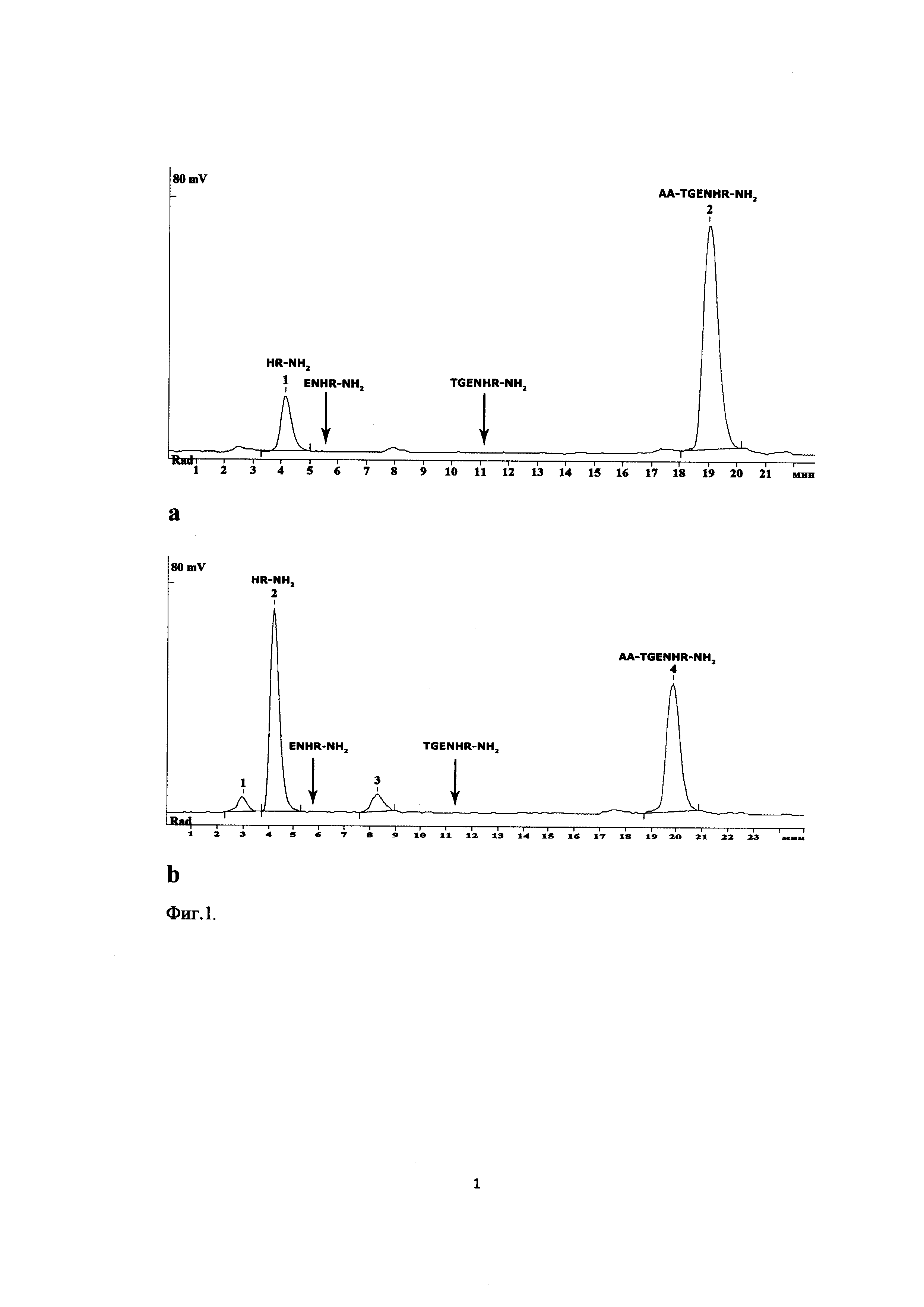
Фиг. 14. Исследование динамики взаимодействия клеток линии U87MG и 100 мкМ FITC- Ac-TGENHR-NH2
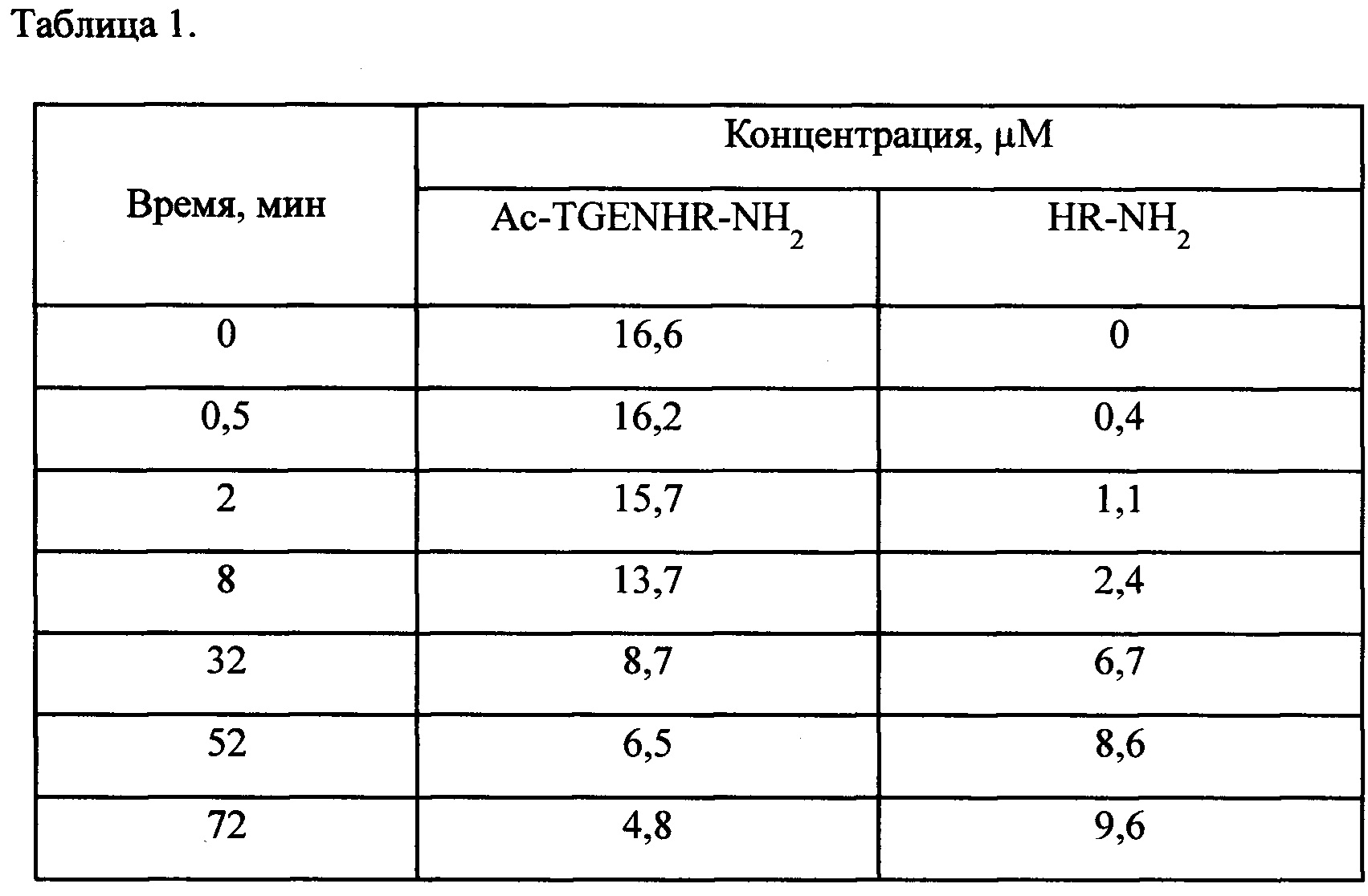
Таблица 1 - Биодеградация пептида [3H-G] Ac-TGENHR-NH2 в плазме крови крысы.
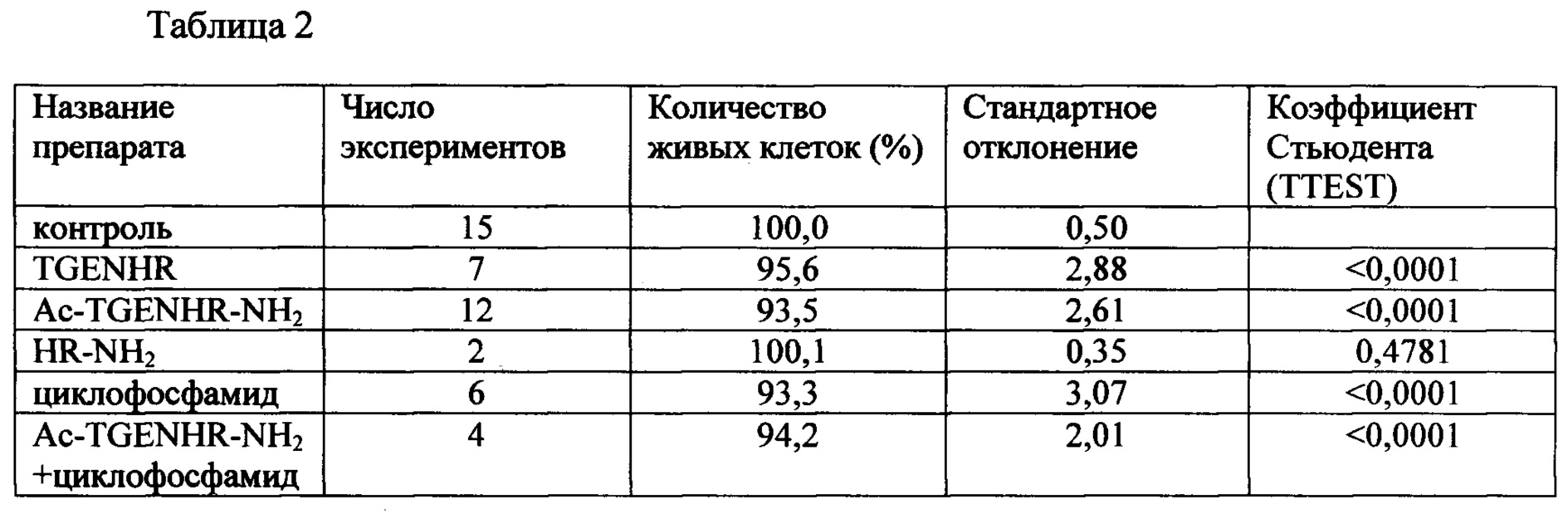
Таблица 2 - Противоопухолевое действие пептида TGENHR и его аналогов на клетки миеломы
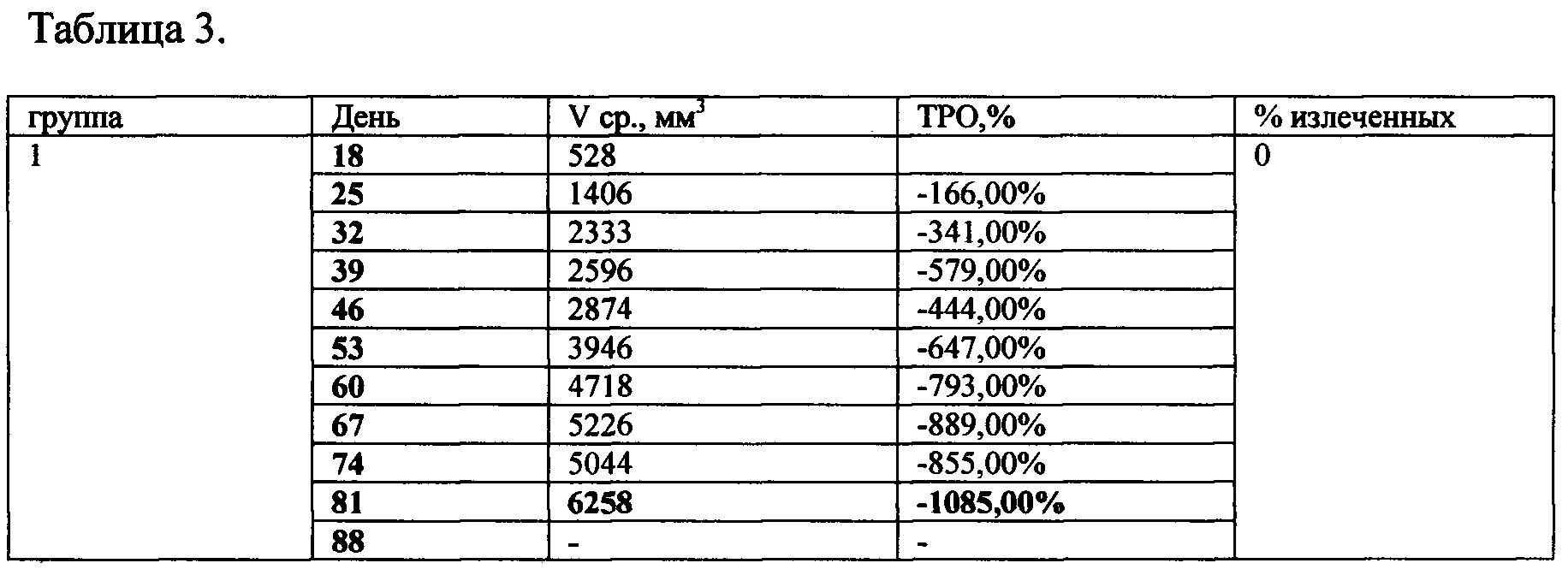
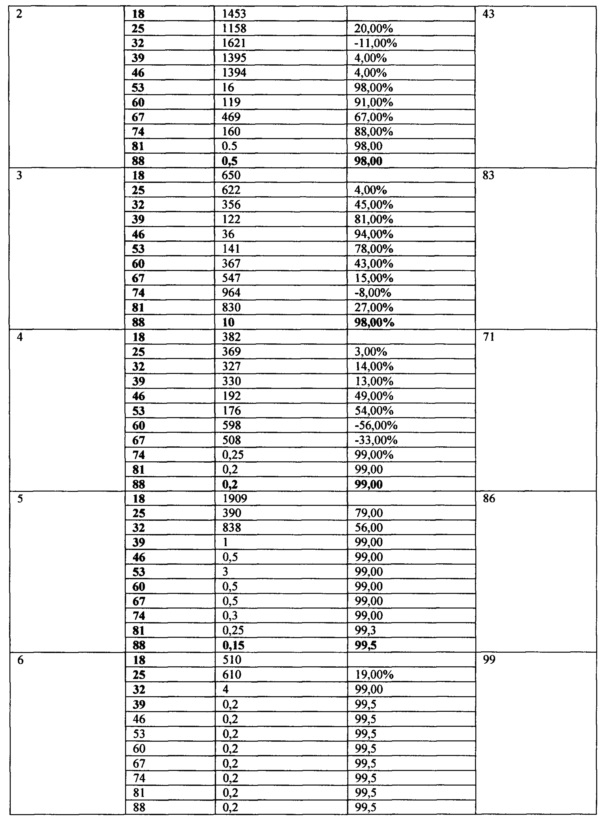
Таблица 3. Противоопухолевая активность TGENHR и Ac-TGENHR-NH2
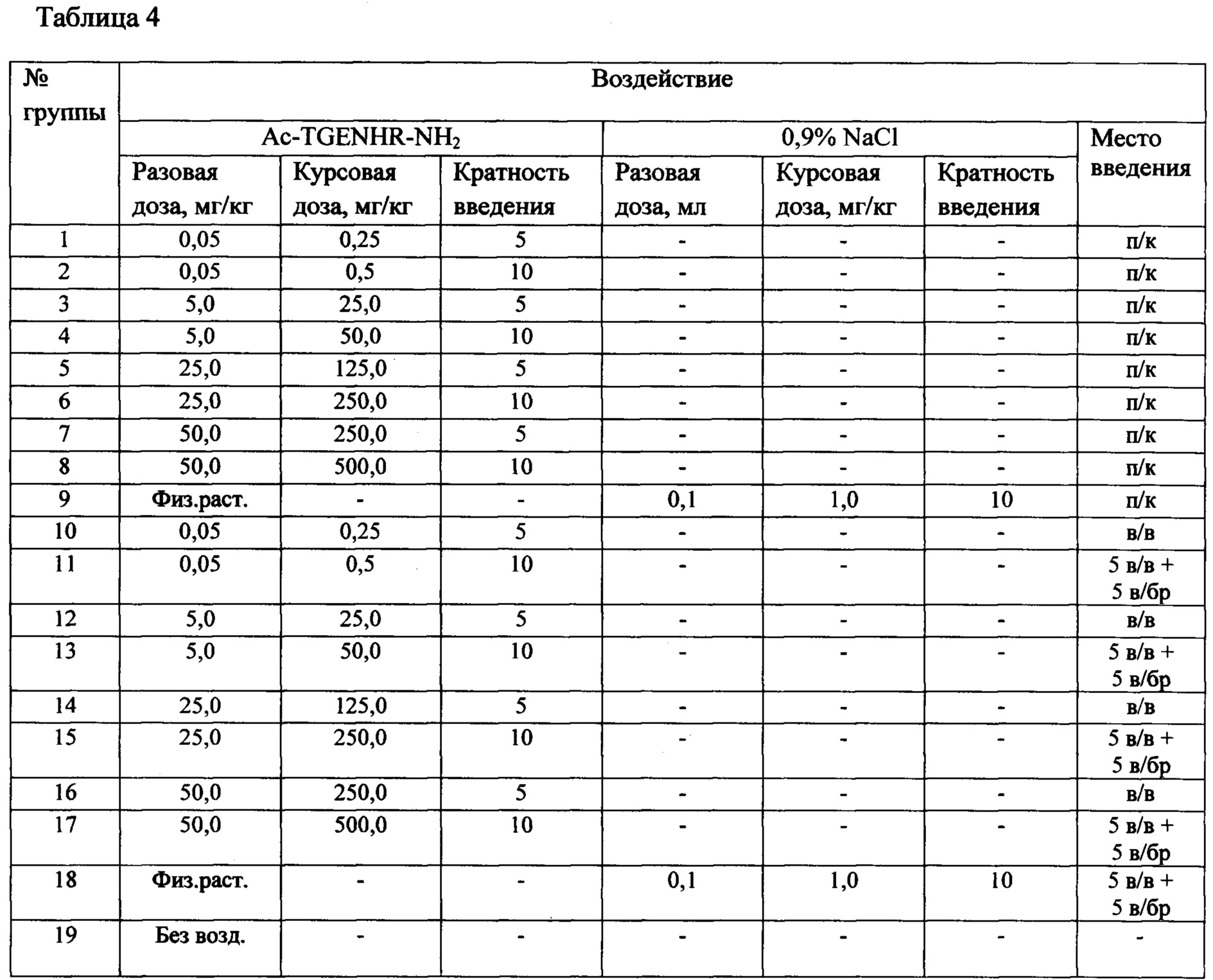
Таблица 4 - Группы, режимы введения, однократные и курсовые дозы субстанции Ac-TGENHR-NH2 у мышей с лимфолейкозом Р388
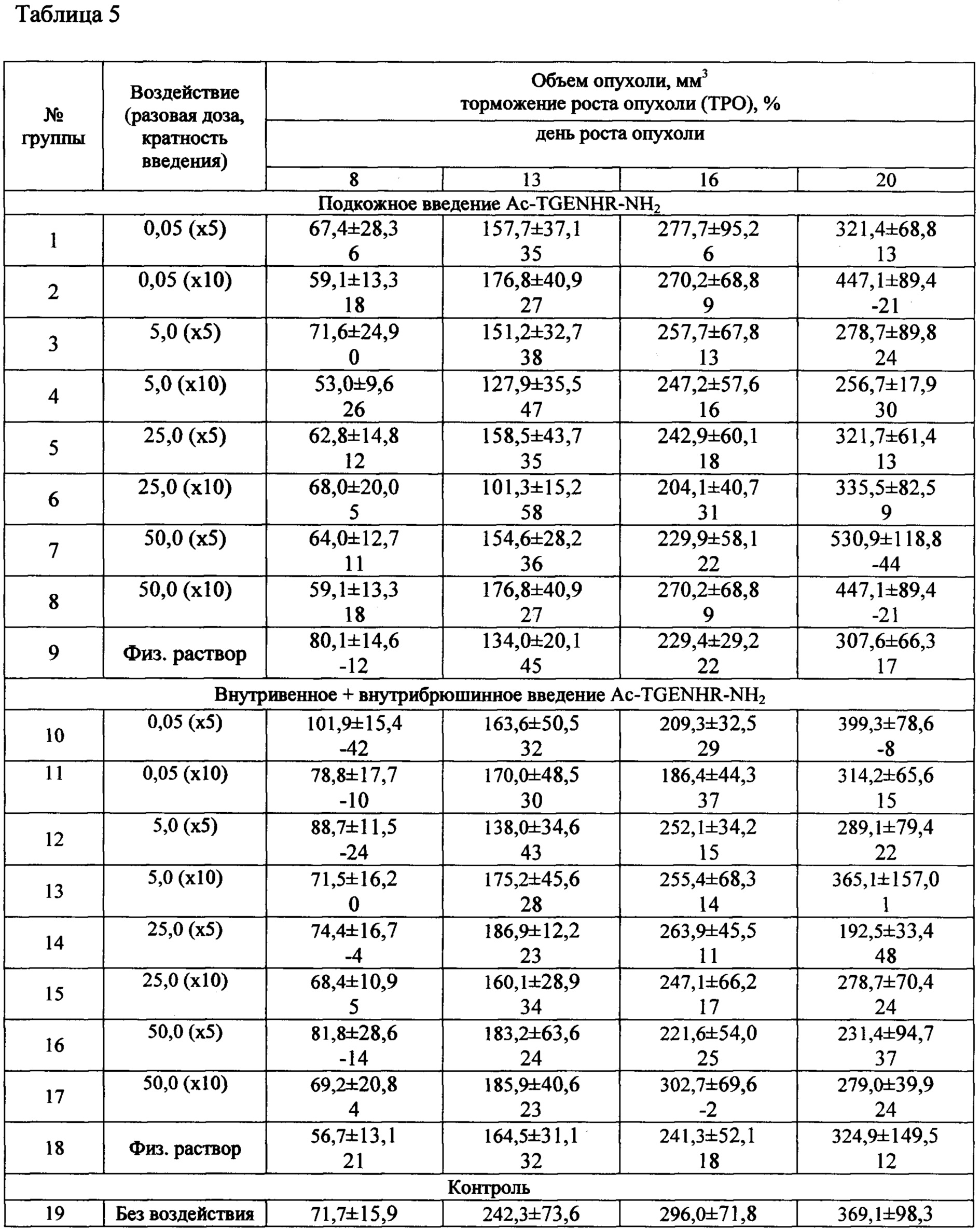
Таблица 5 - Влияние Ac-TGENHR-NH2 на рост первичной опухоли - лимфолейкоза Р388 у мышей
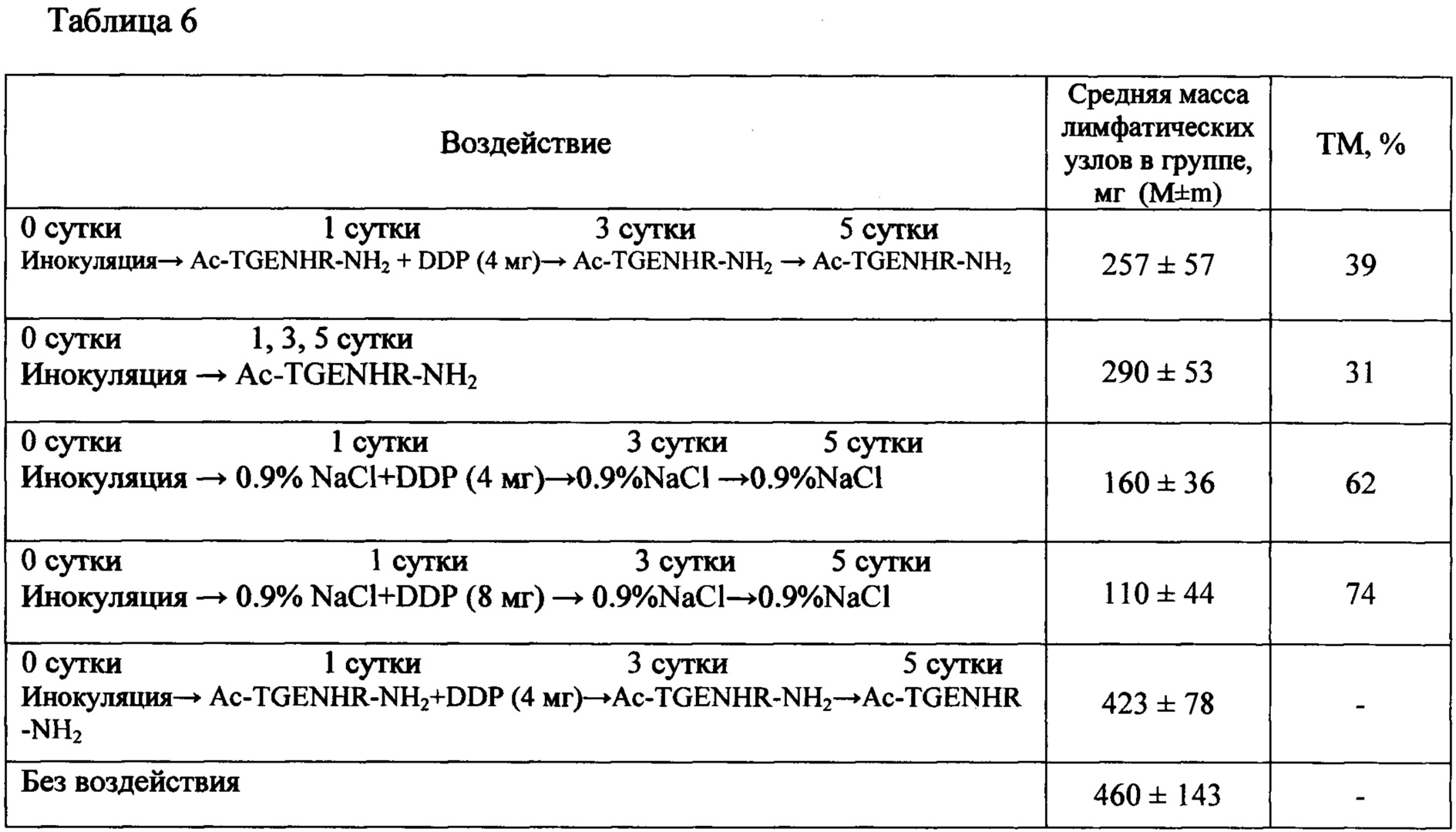
Таблица 6 - Оценка метастазирования рака шейки матки РШМ5 (солидная форма) при различных видах воздействия
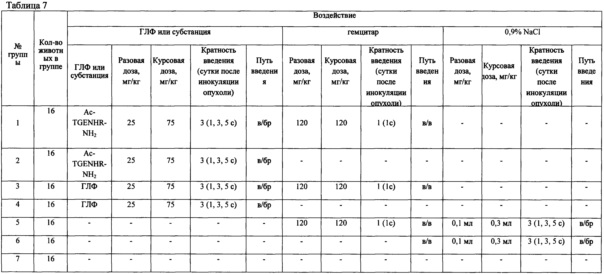
Таблица 7 - Сравнение влияния ГЛФ и субстанции пептида Ac-TGENHR-NH2 в монотерапии и в сочетании с гемцитаром на рост первичной опухоли и метастазирование саркомы мыши S37 при внутрибрюшинной инокуляции опухолевого материала. Группы, дозы, схемы воздействия
Таблица 8 - Результаты вскрытия животных с саркомой S37 (асцитный вариант) после воздействия Ac-TGENHR-NH2 (субстанции и ГЛФ) в монотерапии и в сочетании с гемцитаром
Таблица 9 - Продолжительность жизни животных с саркомой S37 (асцитный вариант) после воздействия Ac-TGENHR-NH2 (субстанции и ГЛФ) в монотерапии и в сочетании с гемцитаром
Осуществление изобретения. Предлагаемое изобретение иллюстрируют следующие примеры:
Пример 1. Пептид обладает высокой устойчивостью к гидролизу в плазме крови (Фиг. 1). Период его полудеградации равен 32 мин.
Биотрансформацию пептида Ac-TGENHR-NH2 и его фрагментов изучают в плазме крови крысы. Для анализа биотрансформации пептида Ac-TGENHR-NH2 используют ВЭЖХ продуктов взаимодействия [3Н] Ac-TGENHR-NH2 с гепариновой плазмой крови. Для этого исследования был использован равномерно меченный тритием исходный пептид [3Н] Ac-TGENHR-NH2 с молярной радиоактивностью 50 Ки/ммоль, полученный в ИМГ РАН. Для хроматографии используют последовательно соединенные УФ-детектор и проточный детектор радиоактивности. Для идентификации пептидных фрагментов, образующихся при биотрансформации пептида [3H]Ac-TGENHR-NH2 в плазме крови крысы, в качестве маркеров были синтезированы 2-5-членные пептидные фрагменты. Образование таких пептидных фрагментов возможно при последовательно проходящем протеолитическом гидролизе с N- или С-конца пептидной цепи. С использованием меченного тритием пептида [3H]Ac-TGENHR-NH2 проводят in vitro количественный анализ протеолитического гидролизата пептида Ac-TGENHR-NH2 и образующихся из него фрагментов.
Пептидные фрагменты, образовавшиеся при протеолитическом гидролизе пептида Ac-TGENHR-NH2, определяют методом радиохроматографии, используя данные о распределении изотопной метки в этом пептиде. Пример радиохроматографического ВЭЖХ-анализа продуктов биодеградации пептида Ac-TGENHR-NH2 с исходной концентрацией 2.5 мкМ в плазме крови крысы приведен на Фиг. 1. Отнесение хроматографических пиков на радиохроматограмме выполняют с использованием УФ-детектора и маркерных пептидов.
Данные радиохроматографии продуктов гидролиза in vitro пептида Ac-TGENHR-NH2 указывают на то, что основным путем биодеградации этого пептида в плазме крови крысы является отщепление дипептида HR-NH2 с защищенного С-конца пептида.
Для расчета молярной радиоактивности пептидных фрагментов, образующихся при биодеградации меченного тритием пептида [3H]Ac-TGENHR-NH2, используют ранее найденную зависимость о том, что дейтерий и тритий в реакции ВТКИО взаимодействуют с органическими соединениями с близкими скоростями и одинаковой селективностью. С учетом данных по распределению дейтериевой изотопной метки в пептиде [2Н]Ас-TGENHR-NH2 рассчитывают включение дейтерия в пептидные фрагмент HR-NH2 Среднее количество атомов дейтерия в пептидах [2H]Ac-TGENHR-NH2 и [2H]HR-NH2 составило 2.90 и 1.72 на молекулу, соответственно. После чего, принимая одинаковым распределение дейтерия и трития в этих пептидах и используя данные по молярной радиоактивности меченного тритием пептида [3H]Ac-TGENHR-NH2, рассчитывают величины молярной радиоактивности образующегося из него пептидного фрагмента [3H]HR-NH2. Для фрагментов пептида [3H]Ac-TGENHR-NH2 с молярной радиоактивностью 50 Ки/ммоль, была рассчитана величина молярной радиоактивности пептида [3H]HR-NH2, которая составляла 29 Ки/ммоль. Используя эти значения молярной радиоактивности и численные значения радиоактивности ВЭЖХ-фракций, содержащих эти пептиды, проводят количественный анализ состава пептидов, образовавшихся при биодеградации [3Н]Ac-TGENHR-NH2 в плазме крови (Табл. 1.).
В результате проведенного анализа было найдено, что исследуемый пептид обладает высокой устойчивостью к гидролизу в плазме крови (Фиг. 1). Период его полудеградации равен 32 мин. В результате проведенного исследования по превращению пептида Ас-TGENHR-NH2 в плазме крови, определен дипептид HR-NH2 как основной продукт его ферментативного гидролиза.
Пример 2. Противоопухолевое действие исходного пептида TGENHR и его аналогов (амидной формулы TGENHR-NH2, ацетил-амидной формы Ac-TGENHR-NH2 и дипептида) в отношении клеток миеломы линии SP2/0 in vitro.
Миелома - злокачественная опухоль из плазматических клеток (дифференцированных В-лимфоцитов, продуцирующих антитела). Заболевание системы крови, относящееся к парапротеинемическим лейкозам.
Было проведено сравнительное тестирование противоопухолевой активности заявляемого пептида Ac-TGENHR-NH2, его аналогов, а также циклофосфамида в качестве положительного контроля. Клетки линии SP2/0 используют в логарифмической фазе роста. Готовят суспензию клеток с концентрацией ~200000 кл/мл. К этой суспензии добавляют исследуемые вещества в концентрации 5 мкг/мл среды. Клетки инкубируют сутки или двое при температуре 37°С, в атмосфере 5%-ого углекислого газа. По окончании инкубации оценивают количество клеток в суспензии, используя метод МТТ, широко применяемый для определения количества живых клеток в культуре. МТТ-колориметрический тест, который является стандартным методом проверки цитотоксичности различных соединений, а также для определения лекарственной чувствительности опухолей.
Полученные данные представлены в Таблице 2 и на диаграмме (Фиг. 2).
Полученные результаты свидетельствуют о том, что наибольшей способностью тормозить пролиферацию клеток обладает ацетил-амидная форма пептида TGENHR-NH2, причем с высокой степенью достоверности, о чем свидетельствуют значения TTEST, приведенные в таблице 2. В отличие от аналогов способность пептида тормозить рост злокачественных клеток сопоставима по активности с таким известным цитостатиком как циклофосфамид, используемым в проведенном эксперименте в качестве положительного контроля.
Пример 3. Противоопухолевая активность пептида Ac-TGENHR-NH2 на модельной опухоли миеломы линии.
Противоопухолевую активность ацетил-амидной формы пептида Ac-TGENHR-NH2 проверяют in vivo на модельной опухоли миеломы линии SP2/0. В эксперименте также изучали активность исходного (немодифицированного) TGENHR пептида. Опухоль была привита мышам-самцам линии Balb/c. В эксперименте участвовали 6 групп животных:
Группа 1 - отрицательный контроль (инъекции физ. раствора)
Группа 2 (инъекции пептида TGENHR в дозе 300 мкг)
Группа 3 (инъекции пептида TGENHR в дозе 100 мкг)
Группа 4 (инъекции Ac-TGENHR-NH2 пептида в дозе 300 мкг)
Группа 5 (инъекции Ac-TGENHR-NH2 пептида в дозе 100 мкг)
Группа 6 - положительный контроль (инъекции аптечного препарата циклофосфана в дозе 10 мг/кг)
Опухолевые клетки в количестве 104 в 0,5 мл инокулируют экспериментальным животным подкожно под правую переднюю лапу. На 17 день после прививания опухоли начинают инъекции контрольных и опытных препаратов. Пептиды растворяют в физиологическом растворе. Всего было сделано 10 инъекций с интервалом в 2 суток (с 17 по 35 день). Животных еженедельно взвешивают и измеряют объемы опухолей на протяжении 102 дней со дня прививки опухоли. Лучшие результаты были показаны в группе 5. У животных этой группы средний объем опухоли снизился с 1909 до 0,15 мм3, показатель ТРО (торможение роста опухоли) составил 99% к 37 дню и оставался неизменным на всем протяжении эксперимента. У групп, получавших немодифицированный пептид и Ac-TGENHR-NH2 пептида в дозе 300 мкг, показатели были хуже (См. таблицу 3 и Фиг. 3, 4). У животных, получавших инъекции физ. раствора, средний объем опухоли увеличился с 528 до 6258 мм3, а к 90 дню проведения эксперимента в живых осталась только одна мышь с привившейся изначально опухолью, рассосавшейся в процессе эксперимента. В группе, получавшей инъекции циклофосфана, показатель ТРО составил 99% к 34 дню и далее не изменялся. Таким образом наиболее эффективным оказался препарат Ac-TGENHR-NH2 пептида в дозе 100 мкг, причем эффект сохранялся в течение 77 дней после прекращения инъекций.
Пример 4. Изучение терапевтической эффективности субстанции пептида Ас-TGENHR-NH2 в монотерапии у мышей с лимфолейкозом Р388 при различных режимах (4 разовые дозы, 5-и и 10-кратное введение), 2 пути введения - подкожный и внутривенный.
Исследования проводят на мышах BDF1, самок, с опухолью: лимфолейкоз Р388 (солидный вариант) при подкожной перевивке на бок. Тестируемую субстанцию Ас-TGENHR-NH2 вводят ежедневно в 2-х режимах: 5-ти и 10-ти кратно подкожно (п/к) в зону, близкую к опухоли, и внутривенно (в/в), варьируя разовую дозу: 0,05 мг/кг, 5 мг/кг, 25 мг/кг и 50 мг/кг. При 10-и кратном введении Ac-TGENHR-NH2 5 раз вводят в/в, последующие 5 раз - внутрибрюшинно (в/бр), поскольку после 5 внутривенных введений хвостовая вена, как правило, тромбируется. Лечение начинают через 24 часа после перевивки опухоли. Контрольным животным вводят растворитель (физиологический раствор), соблюдая путь введения. Одна группа животных (№19) с привитой опухолью служит контролем роста опухоли и не подвергалась воздействию.
Наблюдение за животными проводят в течение 20 суток после инокуляции опухоли; регистрируют общее состояние животных, фиксируют размеры опухоли и гибель животных. Затем оставшихся животных наблюдают до их гибели, регистрируя продолжительность жизни каждого животного.
Группы, режимы введения, суммарные и однократные дозы препарата у мышей с лимфолейкозом Р388 представлены в таблице 4.
Результаты исследований по изучению влияния Ac-TGENHR-NH2 на рост первичной опухоли Р388 представлены в таблице 5.
В ходе эксперимента варьировали разовую дозу пептида в широком диапазоне (0,05 мг/кг-50 мг/кг), кратность введения (5-и и 10-и кратное введение) и путь введения - подкожно, в зону, близкую к опухоли, и внутривенно (в случае 10-и кратного введения 5 раз вводили в хвостовую вену и 5 раз - внутрибрюшинно).
В таблице 5 представлены объемы опухолей, полученные при динамическом наблюдении, и торможение роста опухолей, рассчитанное относительно значений в группе животных без воздействия.
Как видно из полученных результатов наблюдается влияние исследуемого лекарственного средства на рост первичного узла лимфолейкоза Р388. (Фиг. 5, 6).
На рисунке 5 представлены результаты при подкожном введении пептида (оценка на 16 сутки роста опухоли). Можно отметить, что при 5-и кратном введении пептида не происходит торможения роста опухоли ни при одной дозе Ac-TGENHR-NH2. Однако при 10-и кратном введении наблюдается дозозависимое снижение средних по группе объемов опухолевых узлов, хотя статистическая достоверность различий с контрольными группами не достигается.
При внутривенном введении (Фиг. 6) также наблюдается тенденция к дозозависимости эффекта, но при 5-и кратном введении. Статистическая достоверность не достигается.
Противоопухолевую эффективность пептида в монотерапии и его влияние на терапевтический эффект цисплатина оценивали по выживаемости животных.
Результаты представлены на Фиг. 7.
Как видно из представленных на Фиг. 7 данных, эффективность введения пептида в режиме «2, 4 и 6 дни роста опухоли» нелинейно зависит от разовой дозы пептида. При введении пептида в разовой дозе 25 мг/кг окончательная гибель животных наступила на 18 сутки после перевивки опухолевого материала. К этому эффекту приближается продолжительность жизни животных в группе «Ac-TGENHR-NH2, 0,05 мг/кг»: последнее животное также пало на 18 сутки, хотя гибель происходила с несколько большей скоростью. В то же время гибель в группе «Ac-TGENHR-NH2, 12,5 мг/кг» была наиболее интенсивной и даже превышала таковую в контрольной гуппе
Пример 5. Противоопухолевая активность пептида при сочетанной терапии с цитостатиками.
Проводят оценку эффективности субстанции гексапептида Ac-TGENHR-NH2 в комбинации с известными противоопухолевыми препаратами. На моделях асцитных вариантов роста опухолей - лимфолейкоза Р388 и саркомы S37 проводят исследования при внутрибрюшинном введении пептида Ac-TGENHR-NH2 в дозах 0,05 мг/кг, 12,5 мг/кг и 25 мг/кг и внутривенном введении цисплатина в дозе 4 мг/кг (1/2 ТД) в режиме: пептид - во 2, 4, 6 сутки и DDP в 6 сутки (1-ый режим), а также в режиме: DDP в 1 сутки, пептид (25 мг/кг) в 1, 3, 5 сутки (2-ой режим). Получено улучшение результатов лечения при оценке по продолжительности жизни животных с опухолями (по сравнению с контролем - 0,9% NaCl) при введении пептида Ac-TGENHR-NH2 в сочетании с цисплатином:
Применение пептида в сочетании с цитостатическим препаратом - цисплатином-ТЕВА приводит к увеличению терапевтического действия цитостатика при использовании пептида в минимальной разовой дозе - 0,05 мг/кг и режиме «2, 4 и 6 дни + DDP, 6 сутки». Интересно отметить, что при сочетанном лечении наблюдается обратная зависимость влияния Ac-TGENHR-NH2 на терапевтический эффект цисплатина от дозы пептида: наиболее интенсивная гибель животных отмечена в группе «Ac-TGENHR-NH2 (25 мг/кг) + DDP», гибель при введении пептида в разовой дозе 12,5 мг/кг занимает промежуточное положение по интенсивности, хотя последнее животное, также как в группе «Ас-TGENHR-NH2 (25 мг/кг) + DDP» пало к 15 суткам роста опухоли. Наилучший результат отмечен в группе «Ac-TGENHR-NH2 (0,05 мг/кг) + DDP»: срок окончательной гибели животных - 17 сутки и наиболее пологая кривая гибели (Фиг. 8).
Эффективность терапии зависит от срока введения цисплатина: схема с ранним введением цитостатика (1 сутки после перевивки) в обоих случаях - с лечением пептидом (1, 3 и 5 дни) и без него (0,9% NaCl в 1, 3 и 5 дни) существенно эффективнее схемы «Ас-TGENHR-NH2 (2, 4 и 6 дни после перевивки) + DDP (6 сутки)» по срокам гибели животных: 18 сутки и 15 сутки, соответственно (Фиг. 9). Этот результат подтверждает общую закономерность экспериментальной химиотерапии - эффективность лечения при раннем начале, как правило, превышает таковую при позднем начале (на выросшей опухоли).
Таким образом, на модели асцитной формы лимфолейкоза Р388 у мышей получено улучшение результатов лечения при оценке по продолжительности жизни животных с опухолями (по сравнению с контролем - 0,9% NaCl) как при введении одного пептида Ас-TGENHR-NH2, так и в сочетании с цисплатином. Эффект по интегральной шкале можно оценить как «+».
Пример 6. Торможение метастазирования на модели солидной опухоли РШМ5.
Изучалось влияние пептида на метастазирование опухоли рака шейки матки как при монотерапии, так и в сочетании с цитостатиком цисплатином.
Торможение метастазирования было максимальным (74%) в группе с цисплатином в ТД (8 мг/кг), что нашло отражение в наибольшей продолжительности жизни животных этой группы: УПЖ составило 53,0% (табл. 6). Значения ТМ в группе с цисплатином в 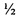 ТД (4 мг/кг) в сочетании с Ac-TGENHR-NH2 составляет 39%. УПЖ составляет 36,4% в группе «Ac-TGENHR-NH2 + DDP (4 мг/кг)». Наблюдается торможение роста метастатических очагов в лимфатические узлы - на 31% при монотерапии пептидом HLDF6.
ТД (4 мг/кг) в сочетании с Ac-TGENHR-NH2 составляет 39%. УПЖ составляет 36,4% в группе «Ac-TGENHR-NH2 + DDP (4 мг/кг)». Наблюдается торможение роста метастатических очагов в лимфатические узлы - на 31% при монотерапии пептидом HLDF6.
Пример 7. Связывание пептида Ac-TGENHR-NH2 с клетками и определение его внутриклеточной локализации.
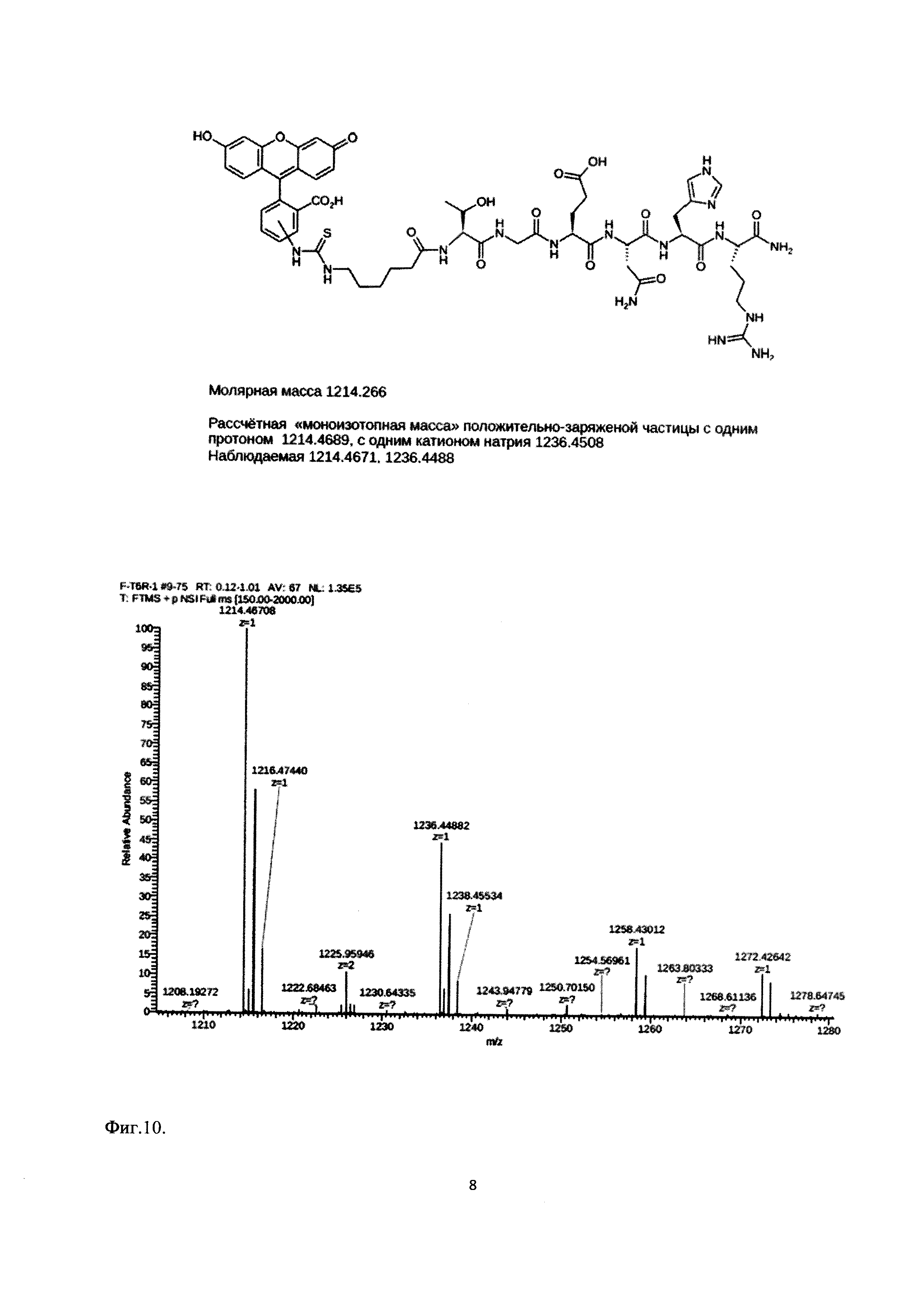
С целью изучения связывания пептида Ac-TGENHR-NH2 с клетками и его внутриклеточной локализации проводят мечение пептида Ac-TGENHR-NH2 с использованием визуализирующих агентов. В качестве контроля используют 6-членный пептид, содержащий аминокислоты пептида Ac-TGENHR-NH2 в произвольном порядке. Полученный продукт и его соответствие ожидаемому оценивают масс-спектрометрически. Масс-спектр и формула использованного меченого пептида представлены на Фиг. 10.
Изучение связывания Ac-TGENHR-NH2 с клетками первоначально проводят с помощью проточной цитометрии на клетках миелоидного лейкоза человека К562 и Т-клеточного лейкоза Jurkat, а также микроскопически на клетках карциномы шейки матки HeLa. В качестве контроля используют меченный тем же красителем 6-членный пептид, аналогичный по аминокислотному составу Ac-TGENHR-NH2. На гистограммах Фиг. 11 представлены профили связывания меченого FITC пептида Ac-TGENHR-NH2 с клетками линий Jurkat (Фиг. 11А) и К562 (Фиг. 11Б).
Интенсивность свечения клеток в канале FL1 (FITC) свидетельствует о связывании пептида с клетками. Как видно из Фиг. 11, на приведенных гистограммах для обоих типов клеток уже через 30 мин наблюдается сдвиг профилей вправо, что свидетельствует о связывании пептида с клетками, которое усиливается со временем, достигая плато уже через 2 часа.
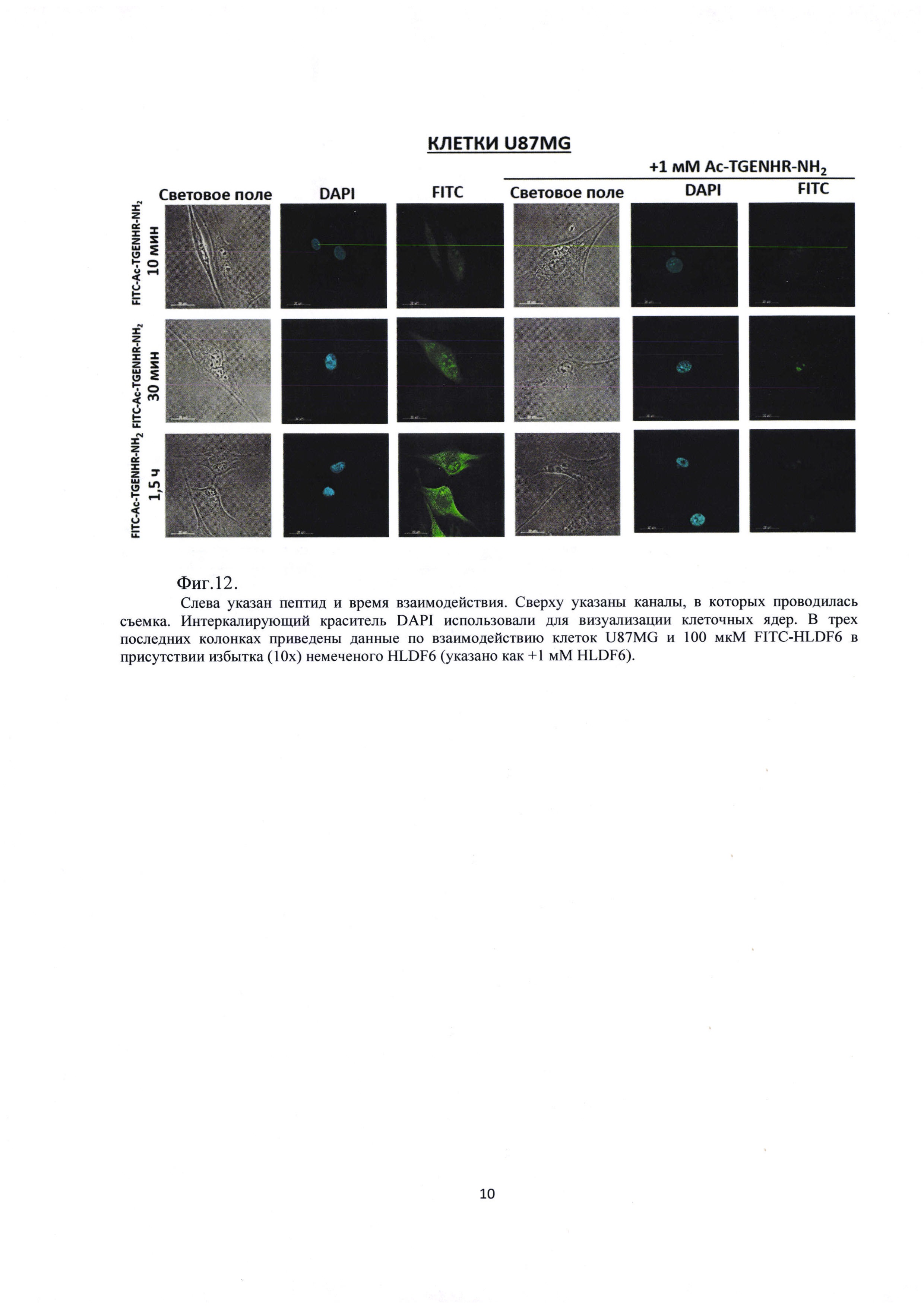
Было проведено исследование взаимодействия FITC- Ac-TGENHR-NH2 с глиальной клеточной линией U87MG. Анализ взаимодействия проводят с помощью конфокальной микроскопии, используют временные точки 10, 30 и 90 мин, а также используют 10-кратный избыток немеченого пептида Ac-TGENHR-NH2 (1 мМ), добавляемый за 30 мин до добавления 100 мкМ FITC- Ac-TGENHR-NH2, для конкурентного анализа связывания. Результаты эксперимента представлены на Фиг. 12.
Из рисунка видно, что в клетках U87MG наблюдается усиливающееся со временем накопление зеленой флуоресценции, которое блокируется избытком немеченого пептида, что свидетельствует о специфичном накоплении FITC-Ac-TGENHR-NH2 в клетках U87MG.
Далее была исследована динамика накопления и выведения FITC- Ac-TGENHR-NH2 в клетках U87MG. 100 мкМ FITC-Ac-TGENHR-NH2 добавляют к клеткам U87MG и инкубируют в течение 2-24 ч отдельно и в присутствии 10-кратного избытка немеченого Ac-TGENHR-NH2 согласно приведенной на Фиг. 13 схеме.
Результаты конфокальной микроскопии приведены на Фиг. 14. Видно, что пептид постепенно накапливается в ядре клеток, достигая плато в области 4 ч после добавления пептида. Следует отметить, что через 24 часа в клетках все еще можно наблюдать зеленую флуоресценцию, что может свидетельствовать о том, что пептид стабилен в клетках. Также следует отметить, что через 24 часа наблюдается некоторое накопление пептида FITC- Ac-TGENHR-NH2 в ядрах клеток даже в присутствии 10-кратного избытка немеченого пептида. Это может быть следствием большей стабильности меченого пептида относительно немеченого или же введение метки на N-конце пептида каким-либо образом блокирует его выведение из клетки.
Таким образом, пептид FITC- Ac-TGENHR-NH2 специфично взаимодействует с клетками глиобластомы U87MG, накапливаясь при этом в ядре клетки.
Изучение белковых комплексов с участием Ac-TGENHR-NH2 в клетках глиобластомы U87MG
Поиск партнеров, взаимодействующих с Ac-TGENHR-NH2, осуществляют с помощью метода лимитированной кросс-сшивки с использованием формальдегида. Известно, что при кросс-сшивке в условиях недостаточного содержания формальдегида преимущественно сшиваются молекулы, находящиеся в непосредственной близости друг от друга, что таким образом позволяет идентифицировать взаимодействующие молекулы. В качестве «якоря» для поиска партнеров Ac-TGENHR-NH2 используют меченый пептид FITC- Ac-TGENHR-NH2, эффективно связывающийся с клетками глиобластомы U87MG. Полученные методом лимитированной кросс-сшивки данные о том, что пептид Ас-TGENHR-NH2 в клетках ассоциирован с ДНК или с белками, связанными с ДНК, коррелируют с ранее показанными локализацией и накоплением пептида Ac-TGENHR-NH2 в ядре клеток линии U87MG.
Анализ данных, полученных с использованием различных моделей показывает, что противоопухолевая и антиметастатическая активности Ac-TGENHR-NH2 в моделях различных онкологических заболеваний, оцениваемая по степени увеличения продолжительности жизни, торможения роста опухоли и уменьшения метастазирования достоверна. При этом очень важно, что пептид проявляет свое действие в гораздо меньших дозах, чем препараты сравнения. По совокупности полученных данных можно сделать вывод о том, что пептид Ac-Thr-Gly-Glu-Asn-His-Arg-NH2 эффективен при монотерапии опухолей лимфолейкоз Р388 и саркома S37 при асцитном варианте роста и внутрибрюшинном введении пептида.
При изучении химиомодифицирующего действия пептида Ac-TGENHR-NH2 выявлено, что его модифицирующее действие проявляется на модели саркомы S37 при асцитном варианте роста, внутрибрюшинном введении пептида и внутривенном - цисплатина.
Готовая лекарственная форма на основе пептида Ac-TGENHR-NH2 представляет собой запаянный в ампулы белый порошок, полученный путем лиофилизации стерильно расфасованного водного раствора пептида в концентрации 1 мг/мл.
Пример 8. Сравнение влияния субстанции и готовой лекарственной формы на основе пептида Ac-TGENHR-NH2 при монотерапии и в сочетании с противоопухолевыми препаратами
Исследования на широком спектре опухолей, привитых внутрибрюшинно (Р388 и S37, асцитный вариант роста), подкожно (Р388, S37, B16F1, РШМ5, LLC, С26, солидный вариант роста) и внутримышечно (LLC, солидный вариант роста), показали, что наиболее чувствительной к воздействию пептида Ac-TGENHR-NH2 в монотерапии является саркома S37 при асцитном варианте роста. Эта же опухоль чувствительна к сочетанной терапии Ac-TGENHR-NH2 (25 мг/кг) и гемцитаром (120 мг/кг) в режиме: ГЗ - 1 сутки после инокуляции опухолевого материала, пептид - 1, 3, 5 сутки роста опухоли.
С учетом этих результатов сравнение субстанции Ac-TGENHR-NH2 и готовой лекарственной формы (ГЛФ) проводят у мышей с опухолью S37, привитой внутрибрюшинно, как наиболее чувствительной к Ac-TGENHR-NH2. Лечение начинают через 24 часа после инокуляции опухоли. Группам контрольных животных вводят 0,9% раствор NaCl. Дизайн исследования представлен в таблице 7.
Субстанцию и ГЛФ Ac-TGENHR-NH2 вводят мышам внутрибрюшинно в дозах, указанных в дизайне исследования. У мышей с S37 оценивают диссеминацию опухолевого процесса по брюшине при вскрытии - у половины животных из каждой группы (табл. 8); у другой половины животных оценивают продолжительность жизни (табл. 9).
Представленные в таблицах 8 и 9 данные свидетельствуют об отсутствии достоверных различий в наличии опухолевых диссеминатов в брюшной полости и в объеме асцитической жидкости в этих группах, а также в продолжительности жизни животных, получивших сочетанную терапию гемцитаром и субстанцией или ГЛФ пептида HLDF6.
Таким образом, не отмечено значимой разницы в терапевтической активности субстанции и ГЛФ пептида Ac-TGENHR-NH2.
Терапевтическое действие субстанции и ГЛФ пептида Ac-TGENHR-NH2 на модели саркомы S37 при асцитном варианте роста сходно как в монотерапии, так и при их сочетании с гемцитаром. Это означает, что выбранный вариант получения ГЛФ пептида - стерильный розлив водного раствора пептида Ac-TGENHR-NH2 в концентрации 1 мг/мл с последующей лиофилизацией не приводит к изменению физиологической активности пептида и может быть использован для получения ГЛФ.
Существенные преимущества использования пептида заключаются в том, что он эффективен, состоит из природных, встречающихся в организме аминокислот и быстро метаболизируется. При метаболизме пептидов в организме не образуются токсические продукты. Для пептида Ac-Thr-Gly-Glu-Asn-His-Arg-NH2 не удалось обнаружить каких-либо нарушений в состоянии животных при увеличении действующей дозы в 200-500 раз. Пептид не только сам обладает противоопухолевой активностью, но и способен усиливать противоопухолевое действие стандартной химиотерапии, а также снижать ее негативное воздействие на организм больного.
Мыши - BDF1; в группах - по 8 животных
Опухоль - лимфолейкоз Р388,
Перевивка - правый бок, п/к, 1×106 кл/мышь
Начало лечения - через 24 часа после перевивки
П/к субстанцию Ac-TGENHR-NH2 вводили в зону, близкую к опухоли.
Мыши BDF1, самки, с опухолью Р-388, в группах - по 8 животных
Мыши: F1, самки, n=8 в группе
Опухоль: рак шейки матки РШМ5.
Перевивка: п/к на правый бок по 20 мг на мышь;
Воздействие: Ac-TGENHR-NH2 вводили п/к близко к первичной опухоли, в разовой дозе 25 мг/кг в объеме 0,1 мл в 1, 3, 5 сутки;
DDP вводили в/в, в разовой дозе 4 и 8 мг/кг в 1 сутки;
0,9% NaCl вводили п/к близко к первичной опухоли, в объеме 0,1 мл в 1, 3, 5 сутки.
Исследовали паховые и подлопаточные лимфатические узлы с обеих сторон.
Средняя масса лимфатических узлов у интактных животных - 74 мг
М - среднее значение по группе
m - стандартное отклонение
Мыши-гибриды F1, самки.
Саркому S37 инокулировали мышам внутрибрюшинно по 1×106 клеток/мышь
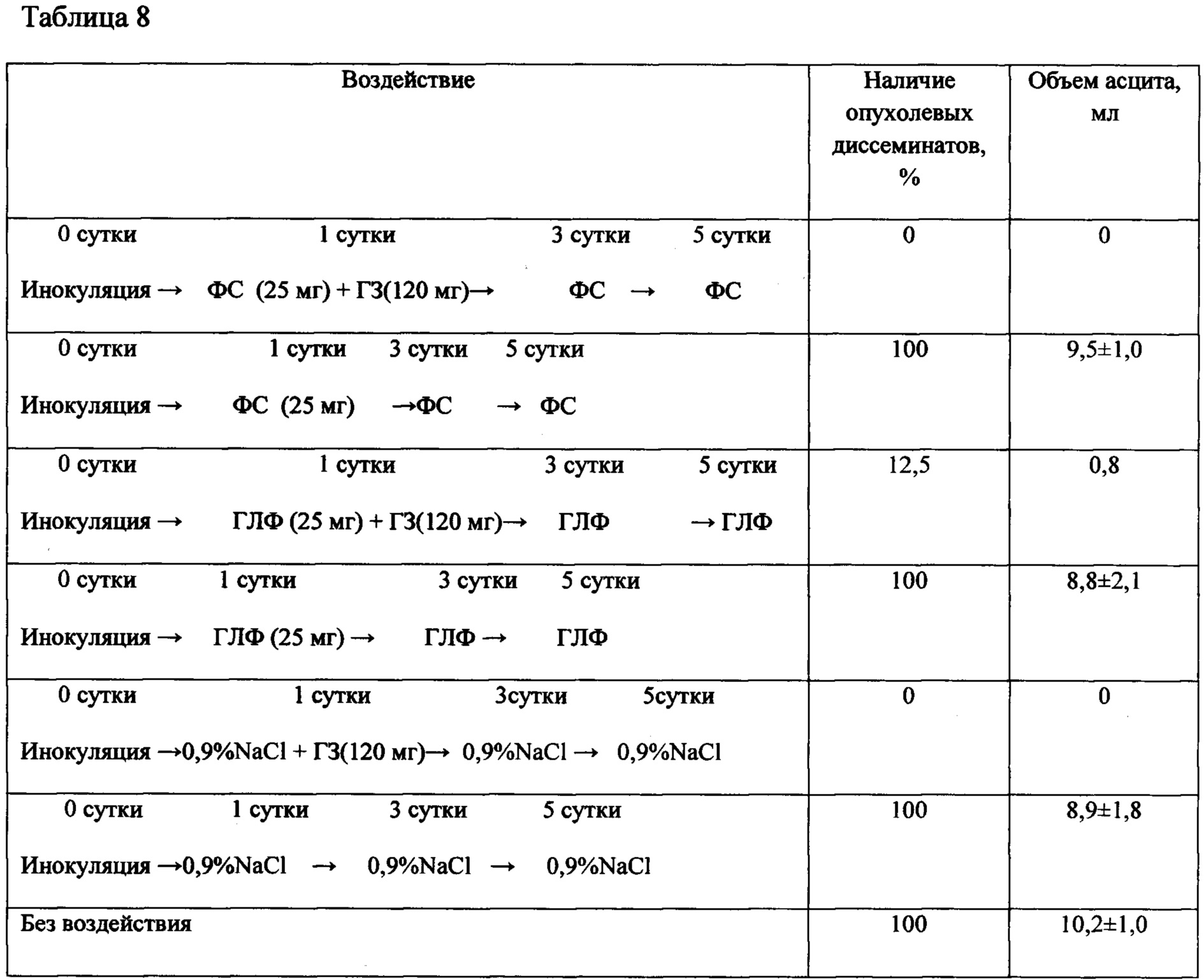
Мыши: F1, самки, n=8 в группе. ФС - фармацевтическая субстанция Ac-TGENHR-NH2, ГЛФ - готовая лекарственная форма на основе пептида Ac-TGENHR-NH2
Опухоль: саркома S37.
Перевивка: внутрибрюшинно по 1×106 клеток/мышь;
Воздействие: Ac-TGENHR-NH2 вводили внутрибрюшинно, в объеме 0,1 мл в разовой дозе 25 мг/кг, в режиме: 1, 3, 5 сутки; ГЗ вводили в/в, в разовой дозе 120 мг/кг в 1 сутки; 0,9% NaCl вводили внутрибрюшинно, в объеме 0,1 мл в указанном режиме.
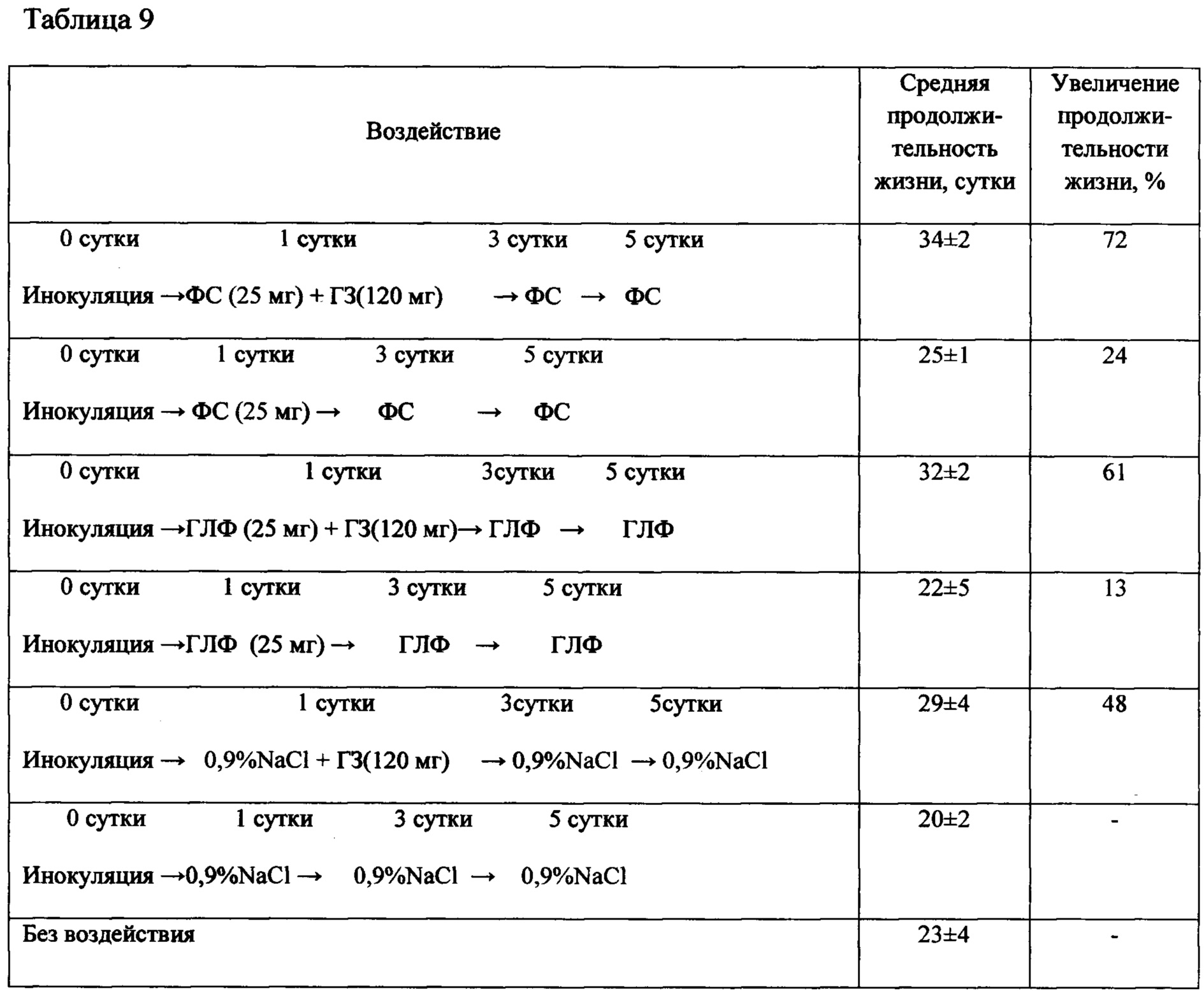
Мыши: F1, самки, n=8 в группе. ФС - фармацевтическая субстанция Ac-TGENHR-NH2, ГЛФ - готовая лекарственная форма на основе пептида Ac-TGENHR-NH2
Опухоль: саркома S37.
Перевивка: внутрибрюшинно по 1×106 клеток/мышь;
Воздействие: Ac-TGENHR-NH2 вводили внутрибрюшинно, в объеме 0,1 мл в разовой дозе 25 мг/кг, в режиме: 1, 3, 5 сутки; ГЗ вводили в/в, в разовой дозе 120 мг/кг в 1 сутки; 0,9% NaCl вводили внутрибрюшинно, в объеме 0,1 мл в указанном режиме.