Результат интеллектуальной деятельности: Штамм бактерии Komagataeibacter hansenii - продуцент бактериальной целлюлозы
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и может быть использовано в медицине как биоматериал для тканевой инженерии, создания раневых покрытий и трансдермальных терапевтических систем, в пищевой промышленности, в технике, для получения нанокристаллической целлюлозы и биокомпозиционных материалов для аэрокосмической и авиационной промышленности.
Бактериальная целлюлоза обладает уникальными свойствами: высокой механической прочностью, сорбционной способностью, биологической совместимостью и т.д. В отличие от растительной целлюлозы она представляет собой химически чистый внеклеточный продукт. Молекулы бактериальной целлюлозы образуют микрофибриллы в 100 раз тоньше микрофибрилл растительной целлюлозы, то есть это структурные элементы наноуровневого размера. За счет правильного расположения волокон степень кристалличности бактериальной целлюлозы достигает 70 – 89 %. Благодаря своим уникальным свойствам бактериальная целлюлоза является перспективным материалом для промышленности и техники, открывая новые горизонты для нанотехнологии. Она имеет большой потенциал использования в медицине как биоматериал для тканевой инженерии, создания раневых покрытий и трансдермальных терапевтических систем, в пищевой, фармацевтической промышленности, в технике, в промышленной электронике для получения оптически прозрачных соединений с ультранизким коэффициентом теплового расширения, для изготовления акустических диафрагм, способна служить заменой растительной целлюлозы в производстве бумаги, для получения нанокристаллической целлюлозы и биокомпозиционных материалов (Lee K.Y. More than meets the eye in bacterial cellulose: biosynthesis, bioprocessing, and applications in advanced fiber composites / K.Y. Lee, G. Buldum, A. Mantalaris, A. Bismarck // Macromolecular bioscience. – 2014. – № 14. – P. 10-32).
Несмотря на указанные преимущества, производство бактериальной целлюлозы является довольно дорогостоящим процессом. Это связано, прежде всего, с невысокой продуктивностью известных штаммов и использованием дорогих питательных сред (Ревин В.В. Получение бактериальной целлюлозы и нанокомпозиционных материалов : монография / В.В. Ревин, Е.В. Лияськина, Н.А. Пестов. – Саранск : Издательство Мордов. ун-та, 2014. – 128 с.).
В качестве продуцента бактериальной целлюлозы известен штамм бактерии Gluconacetobacter hansenii GH-1/2008, полученный путем многоступенчатого скрининга из культуры «чайного кваса». Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ В-10547. При культивировании в статических условиях в течение 7 сут на среде Hestrin-Schramm (HS) выход бактериальной целлюлозы составляет 2,17 г/л, на селективных средах – 4,73-6,67 г/л (RU 2464307, МПК C12N 1/20, С12Р 19/04, С12R 1/01, опубл. 20.10.2012).
Недостатком известного решения является длительное время культивирования (7 сут) и использование в качестве питательных сред для получения бактериальной целлюлозы сахаросодержащих сред сложного состава.
Известен штамм бактерии Komagataeibacter xylinus В-12068 – продуцент бактериальной целлюлозы, который был выделен из природной ассоциации Medusomyces gisevii J. Lindau (чайный гриб) селекционным путем на стандартной среде HS. Штамм бактерии Komagataeibacter xylinus позволяет получать бактериальную целлюлозу с высокими выходами до 200-350 г/л (во влажном состоянии), при поверхностном и глубинном культивировании на жидкой питательной среде HS с глюкозой со степенью кристалличности 60-67 и 30 %, соответственно (RU 2568605, МПК C12N 1/20, С12Р 19/04, С12R 1/00, опубл. 20.11.2015).
Недостатком известного решения является использование дорогих питательных сред, длительное время культивирования (7 сут) и низкая степень кристалличности полимера, полученного в динамических условиях (30 %).
Технический результат заключается в создании нового штамма бактерии Komagataeibacter hansenii B-12950, используемого для получения бактериальной целлюлозы.
Для достижения указанного технического результата предложено использовать штамм бактерии Komagataeibacter hansenii B-12950 – продуцент бактериальной целлюлозы.
Штамм бактерии Komagataeibacter hansenii B-12950 депонирован во ВКПМ под регистрационным номером ВКПМ В-12950.
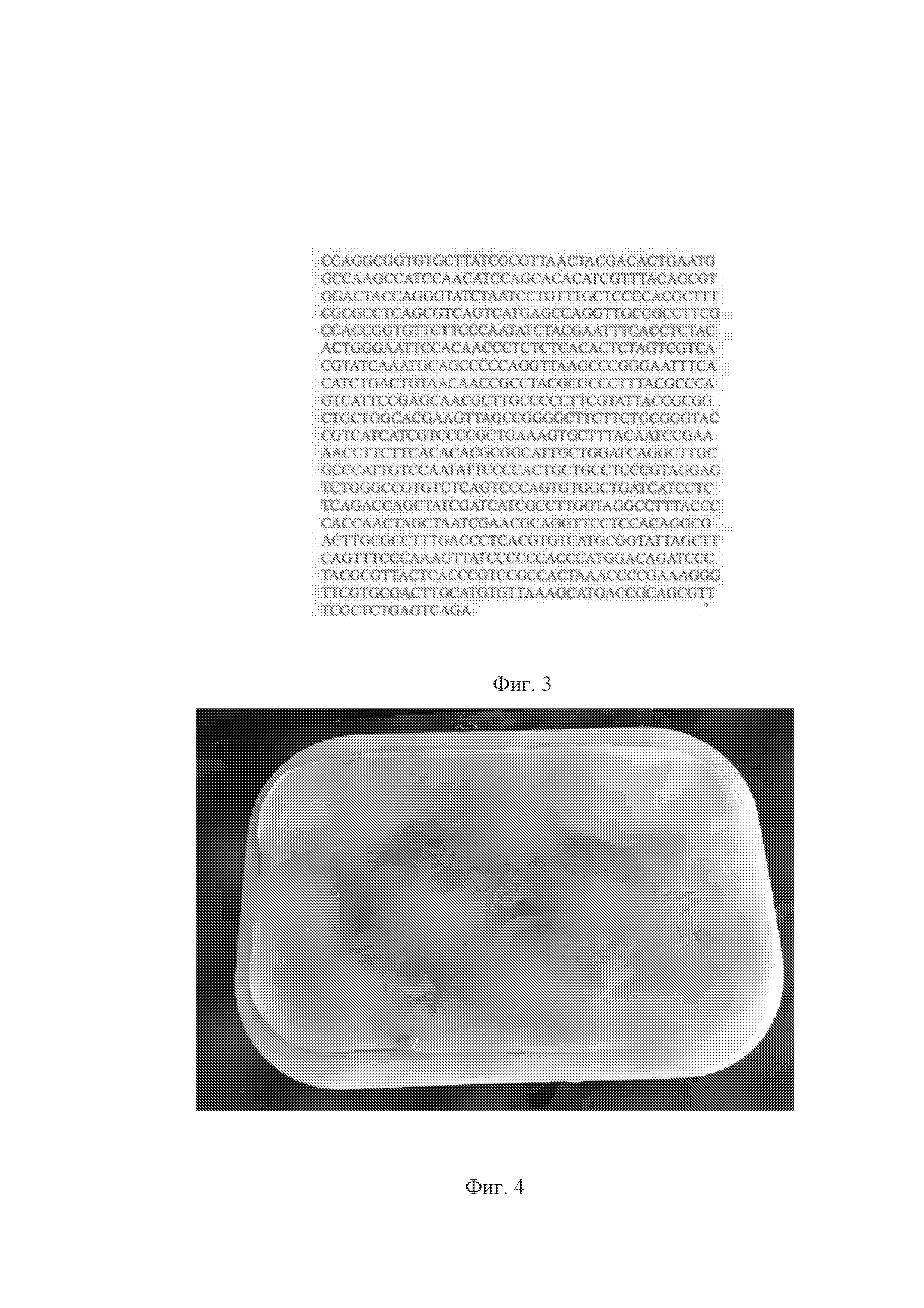
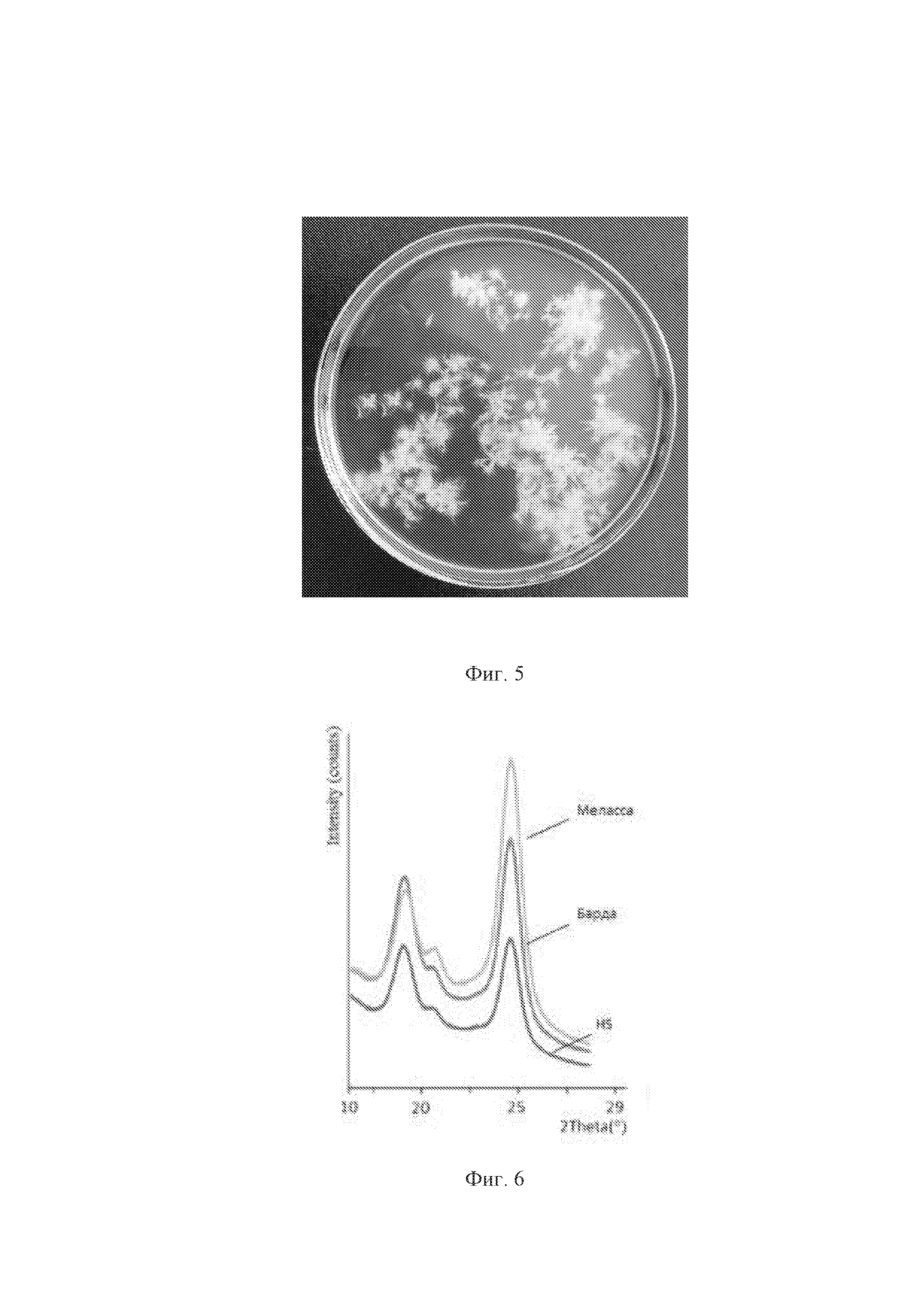
На фиг. 1 представлены клетки бактерии Komagataeibacter hansenii B-12950; на фиг. 2 изображено филогенетическое дерево Komagataeibacter hansenii B-12950 с гомологичными штаммами бактерии; на фиг. 3 – результаты проведенного анализа секвенсов вариабельных участков генов, кодирующих 16S рРНК; на фиг. 4 показана гель-пленка бактериальной целлюлозы, образованная в статических условиях; на фиг. 5 показаны хлопьевидные структуры, образованные в динамических условия; на фиг. 6 представлен график получения бактериальной целлюлозы в статических и динамических условиях.
Заявляемый штамм выделен из природной ассоциации индийского риса с последующей селекцией на основе естественного отбора. Индийский рис наряду с чайным и молочным грибом принадлежит к группе зооглей. Индийский рис (индийский морской рис, тиби) представляет собой ассоциацию микроорганизмов, включающую молочнокислые бактерии родов Lactobacillus, Leuconostoc, уксуснокислые бактерии, дрожжи родов Kluyveromyces, Pichia, Saccharomyces и д.р. (Fiorda F.A. Microbiological, biochemical, and functional aspects of sugary kefir fermentation - A review /F.A .Fiorda, G.V. de Melo Pereira, V. Thomaz-Soccol [et al.] // Food Microbiol. – 2017. – Vol. 66. – P.86-95).
Штамм бактерии Komagataeibacter hansenii B-12950 идентифицирован по культурально-морфологическим и физиолого-биохимическим свойствам и генетическим характеристикам и имеет следующие признаки.
Штамм бактерии – облигатный аэроб, клетки цилиндрические с закругленными концами размерами 0,6-1,2×1-3 мкм, некоторые слегка изогнуты, расположены одиночно, попарно и в коротких цепочках; спор не образуют; грамотрицательные, подвижные (фиг. 1).
Штамм бактерии идентифицирован до вида с помощью анализа 16S РНК.
При секвенировании вариабельных участков генов, кодирующих 16S рРНК, получена собранная нуклеотидная последовательность для штамма бактерии. Последовательности были выровнены с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank. По данным анализа генов, кодирующих 16S рРНК, построено филогенетическое дерево Komagataeibacter hansenii B-12950 с гомологичными штаммами бактерии, представленное на фиг. 2. По результатам проведенного анализа секвенсов вариабельных участков генов, кодирующих 16S рРНК, штамм бактерии наиболее близок к виду Komagataeibacter hansenii (фиг. 3).
Штамм бактерии хорошо растет на агаризованных средах. На агаризованной среде с глюкозой (состав (г/л): глюкоза – 10,0; дрожжевой экстракт – 10,0; пептон – 7,0; лимонная кислота – 0,2; уксусная кислота – 1,5 мл; агар – 15,0; мел – 0,5; этанол – 10,0 мл. pH среды 5,0-6,0) и среде YE (состав (г/л): дрожжевой экстракт – 30,0; этанол – 20,0, агар – 20,0. pH среды 5,0-6,0) на третьи сутки роста колонии мелкие круглые диаметром 1 мм светло-бежевого цвета. На пятые сутки культивирования диаметр колоний увеличивается до 2-4 мм. На агаризованной среде с мелом колонии круглые, диаметром 1 мм, белого цвета, окруженные прозрачным ореолом. На жидких питательных средах с сахарозой и глюкозой в статических условиях образуется гель-пленка бактериальной целлюлозы (фиг. 4), в динамических условиях – хлопьевидные структуры (фиг. 5).
Штамм бактерии культивируют в статических и динамических условиях на качалке при 250 об/мин и температуре 30 °C в среде HS (Hestrin, Schramm, 1954) следующего состава, г/л: D-глюкоза – 20,0; дрожжевой экстракт – 5,0; пептон – 5,0; Na2PHO4 – 2,7; лимонная кислота – 1,15. pH среды – 6,0. Режим стерилизации 121 °C в течение 20 мин. Количество бактериальной целлюлозы, образующееся на среде HS в статических условиях, составляет 1,02 г/л на пятые сутки культивирования, в динамических условиях – 1,5 г/л на третьи сутки культивирования со степенью кристалличности 57,9 % (фиг. 6). На среде с мелассой в статических условиях образуется 2,8 г/л бактериальной целлюлозы на пятые сутки культивирования, в динамических условиях 3,5 г/л бактериальной целлюлозы на третьи сутки культивирования со степенью кристалличности 72,4 % (фиг. 5). На фильтрате нативной барды в статических условиях образуется 2,1 г/л бактериальной целлюлозы на пятые сутки культивирования, в динамических условиях 2,8 г/л бактериальной целлюлозы на третьи сутки культивирования со степенью кристалличности 62,45 % (фиг. 6).
Штамм бактерии Komagataeibacter hansenii B-12950 может расти без добавления уксусной кислоты. Штамм бактерии растет при pH от 2,5 до 6,5, оптимальным pH является интервал от 4,0 до 6,0.
Пример 1. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3-5 сут в статических условиях в открытых емкостях на среде HS (Hestrin, Schramm, 1954) следующего состава, г/л: D-глюкоза – 20,0; дрожжевой экстракт – 5,0; пептон – 5,0; Na2PHO4 – 2,7; лимонная кислота – 1,15. pH среды – 6,0. Режим стерилизации 121 °C в течение 20 мин. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 мин для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывали дистиллированной водой, 0,5 %-ным водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивают при 80 °C до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. Масса сухой бактериальной целлюлозы составляет 1,02 г/л.
Пример 2. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3-5 сут в статических условиях на среде с мелассой в концентрации 55 г/л. pH среды – 4,5. Режим стерилизации 121 °C в течение 20 мин. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 минут для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывают дистиллированной водой, 0,5 %-ным водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивают при 80 °C до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. После удаления клеток и компонентов среды масса сухой бактериальной целлюлозы составляет 2,8 г/л.
Пример 3. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3-5 сут в статических условиях открытых емкостях на фильтрате послеспиртовой барды. pH среды – 4,4. Режим стерилизации 121 °C в течение 20 мин. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 мин для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывают дистиллированной водой, 0,5 %-ным водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивали при 80 °C до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. После удаления клеток и компонентов среды масса сухой бактериальной целлюлозы составляет 2,1 г/л.
Пример 4. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3 сут в динамических условиях на шейкере-инкубаторе при 250 об/мин и температуре 30 °C в колбах на 250 мл, содержащих 100 мл среды HS следующего состава, г/л: D-глюкоза – 20,0; дрожжевой экстракт – 5,0; пептон – 5,0; Na2PHO4 – 2,7; лимонная кислота – 1,15. pH среды – 6,0. Режим стерилизации 121 °C в течение 20 мин. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 мин для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывают дистиллированной водой, 0,5 %-ным водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивают при 80 °С до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. После удаления клеток и компонентов среды масса сухой бактериальной целлюлозы составляет 1,5 г/л.
Пример 5. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3 сут в динамических условиях на шейкере-инкубаторе при 250 об/мин и температуре 30 °С в колбах на 250 мл, содержащих 100 мл среды с мелассой в концентрации 55 г/л. pH среды – 4,5. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 мин для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывали дистиллированной водой, 0,5 % водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивают при 80 °C до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. После удаления клеток и культуральной среды масса сухой бактериальной целлюлозы составляет 3,5 г/л.
Пример 6. Культуру штамма бактерии Komagataeibacter hansenii B-12950 выращивают в течение 3 сут в динамических условиях на шейкере-инкубаторе при 250 об/мин и температуре 30 °C в колбах на 250 мл, содержащих 100 мл фильтрата послеспиртовой барды. pH среды – 4,4. Бактериальную целлюлозу, полученную при культивировании бактерий, обрабатывают 0,1 Н раствором NaOH при 80 °C в течение 30 мин для удаления клеток и компонентов культуральной среды. От раствора щелочи бактериальную целлюлозу отмывают дистиллированной водой, 0,5 %-ным водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяют 3 раза. Далее целлюлозу высушивают при 80 °C до постоянной массы. Количество бактериальной целлюлозы определяют весовым методом. После удаления клеток и культуральной среды масса сухой бактериальной целлюлозы составляет 2,8 г/л.
По сравнению с известным решением предлагаемое обеспечивает образование бактериальной целлюлозы в количестве 2,8 – 3,5 г/л со степенью кристалличности 62,45 – 72,5 % при динамическом культивировании в течение 3 сут на средах с отходами биотехнологических производств за счет использования штамма бактерии Komagataeibacter hansenii B-12950.
Штамм бактерии Komagataeibacter hansenii ВКПМ В-12950 – продуцент бактериальной целлюлозы.