КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
Эта заявка с частичным продолжением испрашивает приоритет в соответствии с параграфом 120 раздела 35 Свода законов США патентной заявки США 13/365824, поданной 3-го февраля 2012 г., заявки с частичным продолжением, которая испрашивает приоритет патентной заявки PCT/GB2011/052115, поданной 31-го октября 2011 г., международной патентной заявки, которая испрашивает приоритет GB 1018289.7, поданной 29-го октября 2010 г., и испрашивает приоритет патентной заявки US 13/365828, поданной 3-го февраля 2012 г., и испрашивает приоритет GB 1113730.4, поданной 10-го августа 2011 г., GB 1113729.6,поданной 10-го августа 2011 г., GB 1113728.8, поданной 10-го августа 2011 г., и GB 1101937.9, поданной 4-го февраля 2011 г., полное содержание которых таким образом включено путем ссылки.
Воспаление включает в себя активацию иммунной системы в ответ на вредоносные стимулы, такие как, например, патоген, инфекция, раздражающее вещество или повреждение клеток. В качестве стандартной реакции воспаление представляет собой механизм врожденного иммунитета в отличие приобретенного иммунитета, который является специфичным к каждому патогену. Воспаление можно классифицировать на острое или хроническое. В общем, острое воспаление опосредовано гранулоцитами, а хроническое воспаление опосредовано мононуклеарными клетками, такими как моноциты и лимфоциты.
Острое воспаление является первоначальной защитной реакцией организма с целью удаления повреждающего стимула путем поддержания целостности тканей и содействия репарации тканей. Оно является частью естественной защитной системы организма против травм и болезней, и при отсутствии острого воспаления раны и инфекции никогда бы не зажили, а нарастающее разрушение ткани могло бы поставить под угрозу выживание организма. Процесс острого воспаления инициируется клетками, уже присутствующими во всех тканях, в основном резидентными макрофагами, дендритными клетками, гистиоцитами, клетками Купфера, мастоцитами, сосудистыми эндотелиальными клетками и гладкомышечными клетками сосудов. В начале вредноносного стимула эти клетки активируются и высвобождают воспалительные опосредующие и сенсибилизирующие молекулы, такие как, например, провоспалительные цитокины, провоспалительные простагландины, лейкотриены, гистамин, серотонин, нейтральные протеазы, брадикинин и оксид азота. Эти воспалительные молекулы модулируют сложный ряд биологических событий, включающих клеточные и внеклеточные компоненты местной сосудистой системы, иммунной системы и поврежденного участка ткани для усиления и формирования воспалительной реакции. Эти события отвечают за инициацию острой воспалительной реакции, как правило, характеризующейся: 1) вазодилатацией, увеличивающей приток крови в ткань, из-за чего возникает эритема (покраснение и повышение температуры), которая может выходить за пределы этого участка (обострение реакции); 2) проницаемостью кровеносных сосудов, которая увеличивает утечку плазмы в ткань, тем самым вызывая эдему (отек); 3) изменением возбудимости некоторых сенсорных нейронов, вызывающих повышенную чувствительность и боль; 4) стимуляцией высвобождения индуцирующих воспаление молекул, таких как, например, нейропептиды, такие как вещество Р (SP) и пептид, связанный с геном кальцитонина (CGRP), простагландины, и аминокислоты, такие как глутамат, из периферических нервных окончаний; и 5) увеличением миграции лейкоцитов, в основном гранулоцитов, из кровеносных сосудов в ткани. Острая воспалительная реакция требует постоянной стимуляции для поддержания и должна быть быстро остановлена при исчезновении необходимости. Следовательно, острое воспаление прекращается после удаления вредоносного стимула.
Однако сильная или продолжительная вредоносная стимуляция дает в результате хроническую воспалительную реакцию, которая приводит к возрастающему сдвигу в типе клеток, присутствующих в месте повреждения ткани. Хроническое воспаление может быть охарактеризовано как одновременное разрушение и заживление ткани в результате воспалительного процесса, с конечным результатом вызывающим повреждение, а не опосредующим заживление. Фактически, хроническое воспаление представляет собой заболевание. Поскольку воспалительная реакция может случиться в любой части тела, хроническое воспаление играет роль в патофизиологии широкого спектра, казалось бы, не связанных расстройств, которые лежат в основе большой и разнообразной группы заболеваний человека. Например, хроническое воспаление связано с заболеваниями, такими разными, как сердечно-сосудистые заболевания, раковые заболевания, аллергические заболевания, ожирение, сахарный диабет, заболевания пищеварительной системы, дегенеративные заболевания, аутоиммунные заболевания и болезнь Альцгеймера.
Попытки лечения хронического воспаления имеют ограниченный успех. Это обусловлено, в частности, тем, что этиология хронического воспаления является комплексной реакций, основанной частично на различных индуцирующих воспаление молекулах и множестве опосредующих воспаление и сенсибилизирующих молекулах, которые, по-видимому, вызывают воспаление с помощью дублирующихся механизмов. Кроме того, помимо блокирования провоспалительных молекул многие противовоспалительные препараты также ингибируют регулирующие циклы, которые высвобождают эндогенные противовоспалительные молекулы. Например, NSAID уменьшают воспаление, блокируя ферментативную активность циклооксигеназы, ключевого фермента, который катализирует превращение арахидоновой кислоты в простагландины и лейкотриены. Таким образом, NSAID уменьшают воспаление, предотвращая синтез всех простагландинов. Однако NSAID не только предотвращает синтез провоспалительных простагландинов, эти соединения также предотвращают синтез противовоспалительных простагландинов. Следовательно, NSAID имеют ограниченный успех, поскольку они блокируют эндогенную противовоспалительную реакцию, что в некоторых случаях может продлить хроническое воспаление. Таким образом, соединения, композиции, варианты применения и способы, преимущественно ингибирующие провоспалительные реакции, были бы весьма желательны для лечения хронического воспаления.
В настоящем описании раскрыты фармацевтические композиции и способы лечения индивидуума, страдающего от хронического воспаления. Фармацевтические композиции, раскрытые в данном документе, по существу являются липидной системой доставки, которая обеспечивает возможность доставки терапевтического соединения, обладающего противовоспалительным действием, таким способом, который более эффективно ингибирует провоспалительную реакцию. Конечным результатом является улучшение лечения хронического воспаления.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В аспектах настоящего описания раскрыта фармацевтическая композиция, содержащая терапевтическое соединение и фармацевтически приемлемый адъювант. Терапевтическое соединение может иметь противовоспалительное действие. В других аспектах настоящего описания раскрыта фармацевтическая композиция, содержащая терапевтическое соединение, раскрытое в данном документе, фармацевтически приемлемый растворитель и фармацевтически приемлемый адъювант. В других аспектах, фармацевтические композиции, раскрытые в данном документе, дополнительно содержат фармацевтически приемлемый стабилизирующий агент.
В других аспектах настоящего описания раскрыт способ получения фармацевтической композиции, где способ включает стадию контактирования терапевтического соединения с фармацевтически приемлемым адъювантом в условиях, которые позволяют образование фармацевтической композиции. В других аспектах настоящего описания раскрыт способ получения фармацевтической композиции, где способ включает следующие стадии: а) контактирование фармацевтически приемлемого растворителя с терапевтическим соединением в условиях, которые позволяют терапевтическому соединению растворяться в фармацевтически приемлемом растворителе, таким образом образуя раствор, где терапевтическое соединение обладает противовоспалительным действием, и b) контактирование раствора, полученного на стадии (а) с фармацевтически приемлемым адъювантом в условиях, позволяющих образование фармацевтической композиции. В других аспектах способ получения, раскрытый в данном документе, дополнительно включает с) удаление фармацевтически приемлемого растворителя из фармацевтической композиции.
В других аспектах настоящего описания раскрыта фармацевтическая композиция, где фармацевтическая композиция изготовлена в соответствии со способом, включающим стадию контактирования терапевтического соединения с фармацевтически приемлемым адъювантом в условиях, которые позволяют образование фармацевтической композиции. В других аспектах настоящего описания раскрыта фармацевтическая композиция, где фармацевтическая композицию изготовлена в соответствии со способом, включающим стадии: а) контактирование фармацевтически приемлемого растворителя с терапевтическим соединением в условиях, которые позволяют терапевтическому соединению растворяться в фармацевтически приемлемом растворителе, таким образом образуя раствор, где терапевтическое соединение обладает противовоспалительным действием, и b) контактирование раствора, полученного на стадии (а) с фармацевтически приемлемым адъювантом в условиях, позволяющих образование фармацевтической композиции. В других аспектах способ изготовления фармацевтической композиции, раскрытой в данном документе, дополнительно включает с) удаление фармацевтически приемлемого растворителя из фармацевтической композиции.
В других аспектах настоящего описания раскрыт способ лечения индивидуума с хроническим воспалением, где способ включает стадию введения индивидууму, нуждающемуся в этом, фармацевтической композиции, описанной в данном документе, где введение приводит к снижению симптома, ассоциированного с хроническим воспалением, тем самым обеспечивая лечение индивидуума.
В других аспектах настоящего описания раскрыто применение фармацевтической композиции, раскрытой в данном документе, в производстве лекарственного препарата для лечения хронического воспаления.
В других аспектах настоящего описания раскрыто применение фармацевтической композиции, описанной в данном документе, для лечения хронического воспаления.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показаны эффекты фармацевтической композиции, раскрытой в данном документе, на выживаемость при введении летальной дозы вируса гриппа A/PR/8/34. Ибупрофен 335 мкг = группа A, контроль перорального введения = группа B и ибупрофен 335 мкг масло/этанол перорально (BC1054) = группа C.
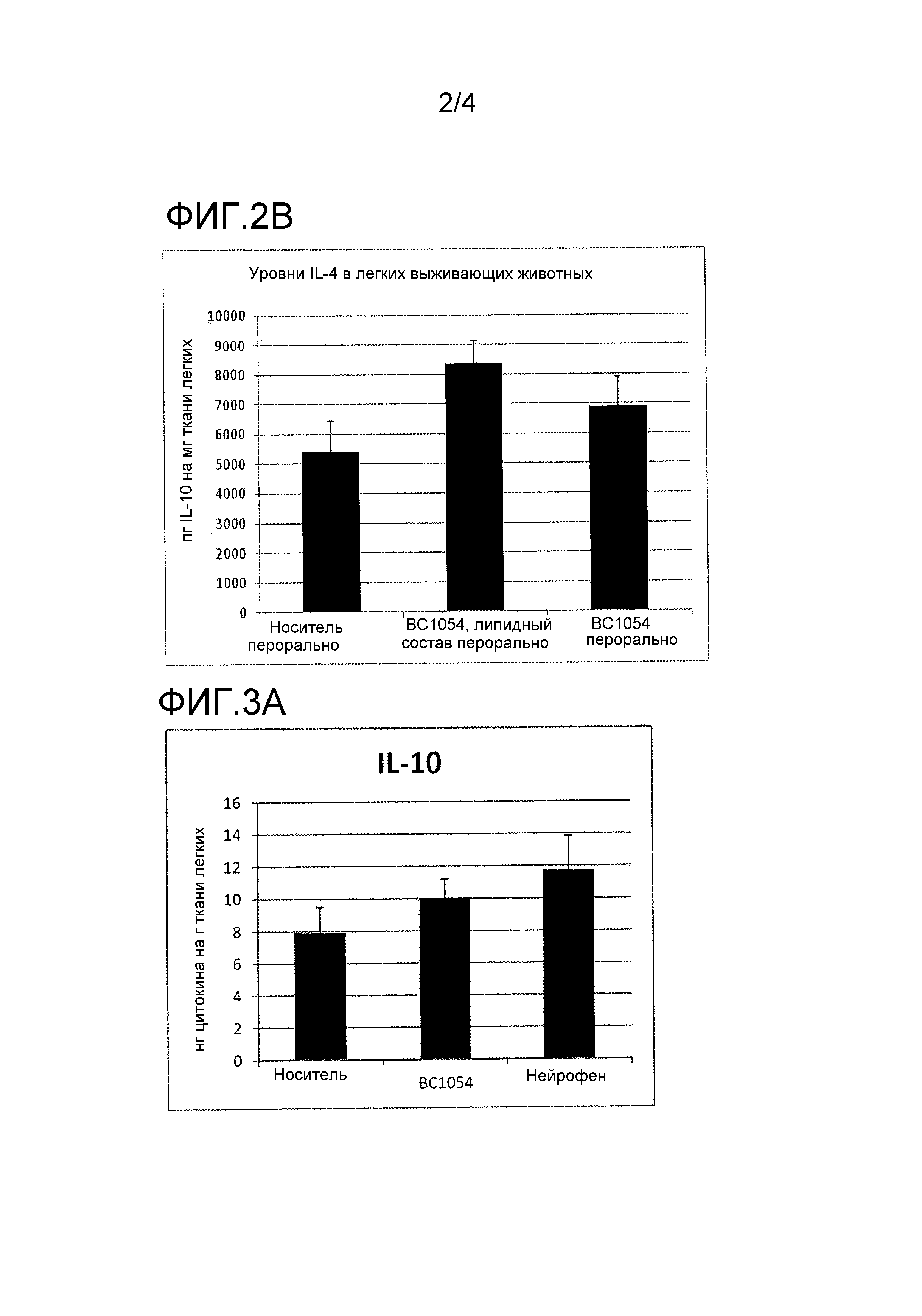
На фиг. 2 показаны эффекты фармацевтической композиции, раскрытой в данном документе, на in vivo уровни Th2-цитокинов в легких выживших мышей. На фиг. 2А показана диаграмма эффектов фармацевтической композиции, раскрытой в данном документе, на in vivo уровни IL-10, тогда как на фиг. 2B показана диаграмма эффектов фармацевтической композиции, раскрытой в данном документе, на in vivo уровни IL-4. BC1054 перорально = группа A, носитель перорально = группа B и BC1054 в липидном составе перорально = группа C.
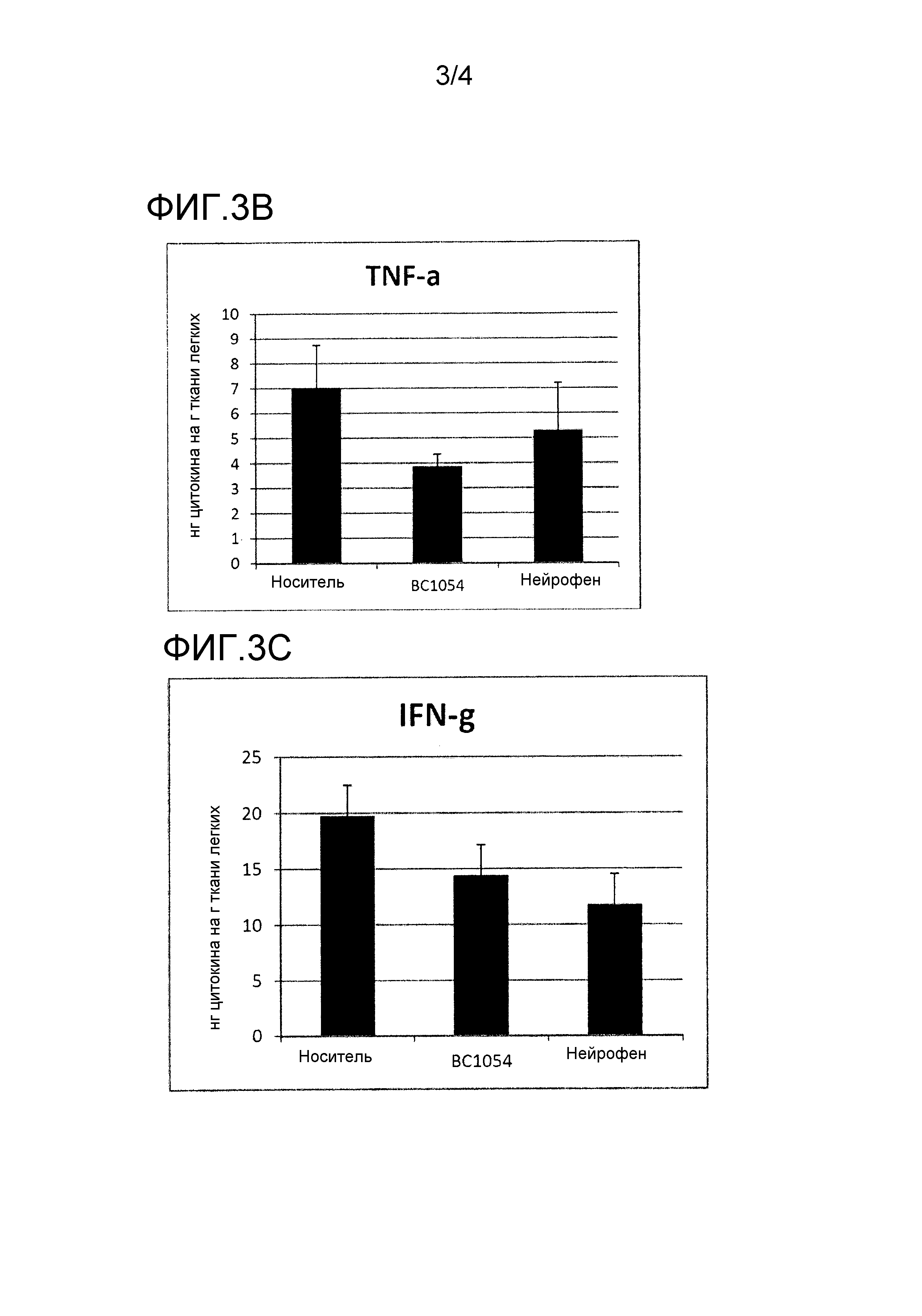
На фиг. 3 показаны эффекты фармацевтической композиции, раскрытой в данном документе, на in vivo уровни Th2-цитокинов в легких выживших мышей. На фиг. 3А показана диаграмма эффектов фармацевтической композиции, раскрытой в данном документе, на in vivo уровни IL-10, на фиг. 3В показана диаграмма эффектов фармацевтической композиции, раскрытой в данном документе, на in vivo уровни TNF-α; и на фиг. 3С показана диаграмма эффектов фармацевтической композиции, раскрытой в данном документе, на in vivo уровни IFN-γ. BC1054 перорально = группа A, носитель перорально = группа B и BC1054 в липидном составе перорально = группа C.
На фиг. 4 показаны эффекты фармацевтической композиции, раскрытой в данном документе, на артрит с использованием мышиной модели артрита, индуцированного анти-коллагеновыми антителами (ACAIA). PBS = группа A, Энбрел = группа B, носитель метилцеллюлоза = группа C, исходное лекарственное соединение, 40 мг/кг = группа D, носитель для BC1054 = группа E; BC1054, 20 мг/кг = группа F и BC1054, 30 мг/кг = группа G.
ОПИСАНИЕ
В аспектах настоящего описания раскрыта, в частности, композиция. Композицию, раскрытую в данном документе, обычно вводят в виде фармацевтически приемлемой композиции. Используемый в данном документе термин «фармацевтически приемлемый» относится любой молекулярной единице или композиции, которая не дает побочной, аллергической или другой неблагоприятной или нежелательной реакции при введении в организм человека. Используемый в данном документе термин «фармацевтически приемлемая композиция» является синонимом «фармацевтической композиции» и означает терапевтически эффективную концентрацию действующего ингредиента, такого как, например, любое из терапевтических соединений, раскрытых в данном документе. Фармацевтическая композиция, раскрытая в данном документе, походит для медицинского и ветеринарного применения. Фармацевтическая композиция может быть введена индивидууму отдельно или в сочетании с другими дополнительными действующими ингредиентами, агентами, лекарственными средствами или гормонами.
Фармацевтическая композиция, раскрытая в данном документе, может, необязательно, включать фармацевтически приемлемый носитель, который облегчает введение действующего ингредиента в фармацевтически приемлемые композиции. Используемый в данном документе термин «фармацевтически приемлемый носитель» является синонимом «фармакологического носителя» и означает любой носитель, который по существу не имеет длительного или постоянного вредного воздействия при приеме и охватывает такие термины, как «фармакологически приемлемый носитель, стабилизатор, разбавитель, добавка, вспомогательное вещество или наполнитель». Такой носитель, как правило, смешивают с действующим соединением или позволяют разбавлять или заключить в нем действующее соединение, и он может быть твердым, полутвердым или жидким веществом. Понятно, что действующие ингредиенты могут быть растворимыми или могут быть доставлены в виде суспензии в требуемом носителе или разбавителе. Может использоваться любой из множества фармацевтически приемлемых носителей, включая, без ограничения, водные среды, такие как, например, вода, физиологический раствор, глицин, гиалуроновая кислота и т. п.; твердые носители, такие как, например, маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, тальк, целлюлоза, глюкоза, сахароза, карбонат магния и т. п.; растворители; дисперсионные среды; покрытия; антибактериальные и противогрибковые агенты; изотонические и замедляющие всасывание агенты; или любой другой неактивный ингредиент. Выбор фармацевтически приемлемого носителя может зависеть от способа введения. За исключением случаев, когда любой фармакологически приемлемый носитель несовместим с действующим ингредиентом, предусмотрено их применение в фармацевтически приемлемых композициях. Неограничивающие примеры конкретных вариантов применения таких фармацевтических носителей можно найти в Pharmaceutical Dosage Forms and Drug Delivery Systems (Howard C. Ansel et al., eds., Lippincott Williams & Wilkins Publishers, 7th ed. 1999); REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (Alfonso R. Gennaro ed., Lippincott, Williams & Wilkins, 20th ed. 2000); Goodman & Gilman's The Pharmacological Basis of Therapeutics (Joel G. Hardman et al., eds., McGraw-Hill Professional, 10th ed. 2001 ); и Handbook of Pharmaceutical Excipients (Raymond C. Rowe et al., APhA Publications, 4th edition 2003). Эти протоколы представляют собой обычные процедуры и любые модификации входят в пределы компетенции специалиста в данной области и исходят от идеи данного документа.
Фармацевтическая композиция, раскрытая в данном документе, может дополнительно включать, без ограничения, другие фармацевтически приемлемые компоненты (или фармацевтические компоненты), включая, без ограничения, буферы, консерванты, регуляторы тоничности, соли, антиоксиданты, агенты, регулирующие осмотическое давление, физиологические вещества, фармакологические вещества, наполнители, эмульгаторы, смачивающие агенты, подсластители или вкусо-ароматические агенты, и т.п. Различные буферы и средства для подведения рН могут использоваться для получения фармацевтической композиции, раскрытой в данном документе, при условии, что в результате препарат будет фармацевтически приемлемым. Такие буферы включают, без ограничения, ацетатные буферы, цитратные буферы, фосфатные буферы, нейтральный буферный солевой раствор, фосфатно-солевой буфер и боратные буферы. Понятно, что кислоты или основания могут использоваться для подведения рН композиции по мере необходимости. Фармацевтически приемлемые антиоксиданты включают, без ограничения, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол. Подходящие консерванты включают, без ограничения, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенилртути, нитрат фенилртути, композицию стабилизированного диокисида хлора и хелатообразователи, такие как, например, DTPA или DTPA-бисамид, DTPA-кальций и CaNaDTPA-бисамид. Регуляторы тоничности, используемые в фармацевтической композиции, включают, без ограничения, соли, такие как, например, хлорид натрия, хлорид калия, маннит или глицерин, и другие фармацевтически приемлемые регуляторы тоничности. Фармацевтическая композиция может быть представлена в виде соли, которая может быть образована со многими кислотами, включая, но не ограничиваясь ими, соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.п. Соли, как правило, лучше растворяются в водных или других протонных растворителях, чем соответствующие свободные основания. Понятно, что эти и другие вещества, известные в данной области фармакологии, могут быть включены в фармацевтическую композицию.
В одном варианте осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, включает терапевтическое соединение, имеющее противовоспалительное действие и фармацевтически приемлемый адъювант. В другом варианте осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, включает терапевтическое соединение, имеющее противовоспалительное действие, фармацевтически приемлемый растворитель и фармацевтически приемлемый адъювант. В аспектах этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, может дополнительно содержать фармацевтически приемлемый стабилизирующий агент. В других аспектах этого варианта осуществления, фармацевтическая композиция, раскрытая в данном документе, может дополнительно содержать фармацевтически приемлемый носитель, фармацевтически приемлемый компонент или оба фармацевтически приемлемый носитель и фармацевтически приемлемый компонент.
В аспектах настоящего описания раскрыто, в частности, терапевтическое соединение. Терапевтическое соединение является соединением, которое обеспечивает фармакологическую активность или другой прямой эффект в диагностике, излечении, смягчении, лечении или профилактике заболеваний, или влияет на структуру или любую функцию тела человека или животных. Терапевтическое соединение, раскрытое в данном документе, может использоваться в форме фармацевтически приемлемой соли, сольвата или сольвата соли, например гидрохлорида. Кроме того, терапевтическое соединение, раскрытое в данном документе, может быть предложено в виде рацематов, или в виде отдельных энантиомеров, включая в R- или S-энантиомер. Таким образом, терапевтическое соединение, раскрытое в данном документе, может содержать только R-энантиомер, только S-энантиомер, или комбинацию обоих R- и S-энантиомеров терапевтического соединения. Терапевтическое соединение, раскрытое в данном документе, может иметь противовоспалительное действие.
В варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни индуцирующей воспаление молекулы. В аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни вещества P (SP), пептида, связанного с геном кальцитонина (CGRP), глутамата или их комбинации. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни SP, CGRP, глутамата или их комбинации, высвобождаемых из сенсорных нейронов, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни SP, CGRP, глутамата или их комбинации, высвобождаемых из сенсорных нейронов, в диапазоне, например, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70% или от примерно 50% до примерно 70%.
Простагландины (PG) опосредуют местную воспалительную реакцию и участвуют во всех воспалительных функциях путем воздействия на простагландиновые рецепторы, а также опосредуют воспалительные сигналы, включая хемотаксис (у макрофагов, нейтрофилов и эозинофилов), вазодилатацию и алгезию. Однако PG-опосредованная воспалительная реакция является самозатухающей (саморазрешающейся). Основным фактором такой отрицательной регуляции является простагландин, называемый 15dPGJ2, который представляет собой эндогенный агонист сигнального пути гамма-рецептора, активируемого пролифераторами пероксисом (PPAR-γ). Сигнальный путь PPARγ (1) индуцирует апоптоз клеток макрофагов М1, тем самым снижая уровень Th1-провоспалительных цитокинов и (2) усиливает дифференцировку моноцитов в клетки макрофагов М2. Клетки макрофагов M2 продуцируют и высвобождают Th2-противовоспалительные цитокины.
В варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни индуцирующего воспаление простагландина. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни индуцирующего воспаление простагландина, высвобождаемого из сенсорных нейронов, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни индуцирующего воспаление простагландина, высвобождаемого из сенсорных нейронов, в диапазоне, например, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70% или от примерно 50% до примерно 70%.
В другом варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие по существу аналогичное действию 15dPGJ2. В аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, которое составляет, например, по меньшей мере 5%, по меньшей мере 15%, по меньшей мере 25%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% от действия, наблюдаемого для 15dPGJ2. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, которое находится в диапазоне, например, от примерно 5% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 25% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 80% до примерно 90%, от примерно 25% до примерно 80%, от примерно 50% до примерно 80%, от примерно 60% до примерно 80%, от примерно 70% до примерно 80%, от примерно 25% до примерно 70%, от примерно 50% до примерно 70%, от примерно 25% до примерно 60%, от примерно 50% до примерно 60% или от примерно 25% до примерно 50% от действия, наблюдаемого для 15dPGJ2.
Рецепторы, активируемые пролифераторами пероксисом (PPAR), представляют собой группу ядерных рецепторов, которые функционируют в качестве транскрипционных факторов, регулирующих экспрессию генов. Известно, что все PPAR гетеродимеризуются с ретиноид-Х-рецептором (RXR) и связываются с определенными областями на ДНК генов-мишеней, называемых элементами, отвечающими на гормональные пролифераторы пероксисом (PPRE). PPAR играют существенную роль в регуляции клеточной дифференцировки, развития и метаболизма (углеводов, липидов, белков), а также онкогенеза у высших организмов. Семейство включает в себя три члена, PPAR-α, PPAR-γ, и PPAR-δ (также известный как PPAR-β). PPAR-α экспрессируется в печени, почках, сердце, мышцах, жировой ткани, а также в других тканях. PPAR-δ экспрессируется во многих тканях, но особенно в мозге, жировой ткани и коже. PPAR-γ включает три альтернативно сплайсированных формы, имеющих разные картины экспрессии. PPAR-γ1 экспрессируется практически во всех тканях, включая сердце, мышцы, кишечник, почки, поджелудочную железу и селезенку. PPAR-γ2 экспрессируется в основном в жировой ткани. PPAR-γ3 экспрессируется в макрофагах, толстом кишечнике и белой жировой ткани. Эндогенные лиганды для рецепторов PPAR включают свободные жирные кислоты и эйкозаноиды. PPAR-γ активируется PGJ2 (простагландинами), тогда как PPAR-α активируется лейкотриеном В4.
В варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное стимулировать все PPAR-сигнальные пути. Такое терапевтическое соединение включает пан-агонист PPAR. В других вариантах осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное стимулировать один или два PPAR-сигнальных пути. Такое терапевтическое соединение включает избирательный агонист PPAR.
В другом варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное стимулировать сигнальный путь PPAR-α. В аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPAR-α, например, по меньшей мере на 5%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPAR-α в диапазоне, например, от примерно 5% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 25% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 80% до примерно 90%, от примерно 25% до примерно 80%, от примерно 50% до примерно 80%, от примерно 60% до примерно 80%, от примерно 70% до примерно 80%, от примерно 25% до примерно 70%, от примерно 50% до примерно 70%, от примерно 25% до примерно 60%, от примерно 50% до примерно 60% или от примерно 25% до примерно 50%.
В другом варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное стимулировать сигнальный путь PPAR-δ. В аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPAR-δ, например, по меньшей мере на 5%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPAR-δ в диапазоне, например, от примерно 5% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 25% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 80% до примерно 90%, от примерно 25% до примерно 80%, от примерно 50% до примерно 80%, от примерно 60% до примерно 80%, от примерно 70% до примерно 80%, от примерно 25% до примерно 70%, от примерно 50% до примерно 70%, от примерно 25% до примерно 60%, от примерно 50% до примерно 60% или от примерно 25% до примерно 50%.
В другом варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное стимулировать сигнальный путь PPARγ. Терапевтическое соединение, раскрытое в данном документе, может быть способно связывать все изоформы PPAR-γ или может быть способно избирательно связывать любой из PPAR-γ1, PPAR-γ2 или PPAR-γ3, либо любую комбинацию двух из них. В аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPARγ, например, по меньшей мере на 5%, по меньшей мере на 15%, по меньшей мере на 25%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, стимулирует сигнальный путь PPARγ в диапазоне, например, от примерно 5% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 25% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 80% до примерно 90%, от примерно 25% до примерно 80%, от примерно 50% до примерно 80%, от примерно 60% до примерно 80%, от примерно 70% до примерно 80%, от примерно 25% до примерно 70%, от примерно 50% до примерно 70%, от примерно 25% до примерно 60%, от примерно 50% до примерно 60% или от примерно 25% до примерно 50%.
Макрофаги активируются и поляризуются в различных фенотипы, экспрессирующие уникальные молекулы на клеточной поверхности и секретирующие различные наборы цитокинов и хемокинов. Классический фенотип М1 поддерживает Th1-провоспалительные реакции, опосредованные цитокинами, такими как, например, интерлейкин-6 (IL-6), IL-12 и IL-23, тогда как альтернативный фенотип М2 в общем поддерживает противовоспалительные процессы, контролируемые IL-10. M2-клетки могут быть дополнительно разделены на подгруппы, М2a, M2b и M2с, в зависимости от типа стимуляции и последующей экспрессии поверхностных молекул и цитокинов.
В еще одном варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное усиливать фенотипический переход от М1 до М2, снижающий воспалительную реакцию. В аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное индуцировать апоптоз клеток макрофагов М1. В другом аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное усиливать дифференцировку клеток макрофагов М2. В еще одном аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное индуцировать апоптоз клеток макрофагов М1 и усиливать дифференцировку клеток макрофагов М2.
В третьем варианте осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное модулировать Th1- и Th2-цитокины. В аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни гамма-интерферона (IFNγ), фактора некроза опухолей-альфа (TNF-α), интерлейкина-12 (IL-12) или их комбинации, высвобождаемых из Th1-клеток. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, например, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70 или от примерно 50% до примерно 70%.
В другом аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, обладает противовоспалительным действием, способным повышать уровни IL-10, высвобождаемого из Th2-клеток. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, обладает противовоспалительным действием, способным повышать уровни IL-10, высвобождаемого из Th2-клеток, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, обладает противовоспалительным действием, способным повышать уровни IL-10, высвобождаемого из Th2-клеток, в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70 или от примерно 50% до примерно 70%.
В другом аспекте этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, обладает противовоспалительным действием, способным понижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, и повышать уровни IL-10, высвобождаемого из Th2-клеток. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%, и способное повышать уровни IL-10, высвобождаемого из Th2-клеток, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%. В других аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, имеет противовоспалительное действие, способное понижать уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70% или от примерно 50% до примерно 70%, и способное повышать уровни IL-10, высвобождаемого из Th2-клеток, в диапазоне, например, от примерно 10% до примерно 100%, от примерно 20% до примерно 100%, от примерно 30% до примерно 100%, от примерно 40% до примерно 100%, от примерно 50% до примерно 100%, от примерно 60% до примерно 100%, от примерно 70% до примерно 100%, от примерно 80% до примерно 100%, от примерно 10% до примерно 90%, от примерно 20% до примерно 90%, от примерно 30% до примерно 90%, от примерно 40% до примерно 90%, от примерно 50% до примерно 90%, от примерно 60% до примерно 90%, от примерно 70% до примерно 90%, от примерно 10% до примерно 80%, от примерно 20% до примерно 80%, от примерно 30% до примерно 80%, от примерно 40% до примерно 80%, от примерно 50% до примерно 80% или от примерно 60% до примерно 80%, от примерно 10% до примерно 70%, от примерно 20% до примерно 70%, от примерно 30% до примерно 70%, от примерно 40% до примерно 70% или от примерно 50% до примерно 70%.
Терапевтическое соединение, раскрытое в данном документе, может иметь величину логарифма коэффициента распределения (log P), указывающую, что соединение растворимо в органическом растворителе. Используемый в данном документе, термин «величина log Р» относится к десятичному логарифму коэффициента распределения (P) для соединения и является мерой липофильности. Как правило, Р определяется как соотношение концентраций неионизированного соединения в двух фазах смеси двух несмешивающихся растворителей при равновесии. Таким образом, log Р=Log10 (P), где Р=[растворенное вещество в несмешивающемся растворителе 1]/[растворенное вещество в несмешивающемся растворителе 2]. Что касается органической и водной фаз, величина log P соединения является постоянной для любой пары водных и органических растворителей, и эта величина может быть определена эмпирически одним из нескольких способов разделения фаз, известных специалисту в данной области, включая, например, анализ во встряхиваемой колбе, ВЭЖХ-анализ и анализ на поверхности раздела между двумя несмешивающимися растворами электролитов (ITIES).
В аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь величину log P, указывающую, что соединение по существу растворимо в органическом растворителе. В аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь величину log P, указывающую, что соединение, например, по меньшей мере на 50% растворимо в органическом растворителе, по меньшей мере на 60% растворимо в органическом растворителе, по меньшей мере на 70% растворимо в органическом растворителе, по меньшей мере на 80% растворимо в органическом растворителе или по меньшей мере на 90% растворимо в органическом растворителе. В аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь величину log P, указывающую, что от примерно 50% до примерно 100% соединения растворимо в органическом растворителе, от примерно 60% до примерно 100% растворимо в органическом растворителе, от примерно 70% до примерно 100% растворимо в органическом растворителе, от примерно 80% до примерно 100% растворимо в органическом растворителе или от примерно 90% до примерно 100% растворимо в органическом растворителе.
В аспектах этого варианта осуществления изобретения терапевтическое соединение, раскрытое в данном документе, может иметь величину log P, например, выше 1,1, выше 1,2, выше 1,4, выше 1,6, выше 1,8, выше 2,0, выше 2,2, выше 2,4, выше 2,6, выше 2,8, выше 3,0, выше 3,2, выше 3,4 или выше 3,6. В других аспектах этого варианта осуществления терапевтическое соединение, раскрытое в данном документе, может иметь величину log P в диапазоне, например, между 1,8 и 4,0, между 2,0 и 4,0, между 2,1 и 4,0, между 2,2 и 4,0 или между 2,3 и 4,0, между 2,4 и 4,0, между 2,5 и 4,0, между 2,6 и 4,0 или между 2,8 и 4,0. В других аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь величину log P в диапазоне, например, между 3,0 и 4,0 или между 3,1 и 4,0, между 3,2 и 4,0, между 3,3 и 4,0, между 3,4 и 4,0, между 3,5 и 4,0 или между 3,6 и 4,0. В дополнительных аспектах этого варианта осуществления терапевтическое соединение, раскрытое в данном документе, может иметь величину log P в диапазоне, например, между 2,0 и 2,5, между 2,0 и 2,7, между 2,0 и 3,0 или между 2,2 и 2,5.
Терапевтическое соединение, раскрытое в данном документе, может иметь площадь полярной поверхности, которая является гидрофобной. Используемый в данном документе термин «площадь полярной поверхности» относится к сумме поверхностей для всех полярных атомов в структуре соединения и является мерой гидрофобности. Как правило, эти полярные атомы включают, например, кислород, азот и присоединенные к ним атомы водорода. В аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь площадь полярной поверхности, составляющую, например, меньше 8,0 нм2, меньше 7,0 нм2, меньше 6,0 нм2, меньше 5,0 нм2, меньше 4,0 нм2 или меньше 3,0 нм2. В других аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь площадь полярной поверхности в диапазоне, например, между 3,0 нм2 и 6,5 нм2, между 3,0 нм2 и 6,0 нм2, между 3,0 нм2 и 5,5 нм2, между 3,0 нм2 и 5,0 нм2, между 3,0 нм2 и 4,5 нм2, между 3,5 нм2 и 6,5 нм2, между 3,5 нм2 и 6,0 нм2, между 3,5 нм2 и 5,5 нм2, между 3,5 нм2 и 5,0 нм2, между 3,5 нм2 и 4,5 нм2, между 4,0 нм2 и 6,5 нм2, между 4,0 нм2 и 6,0 нм2, между 4,0 нм2 и 5,5 нм2 или между 4,0 нм2 и 5,0 нм2, между 4,0 нм2 и 4,5 нм2 или между 4,5 нм2 и 5,5 нм2. В дополнительных аспектах этого варианта осуществления, терапевтическое соединение, раскрытое в данном документе, может иметь площадь полярной поверхности в диапазоне, например, между 2,0 нм2 и 6,5 нм2, между 2,0 нм2 и 6,0 нм2, между 2,0 нм2 и 5,5 нм2, между 2,0 нм2 и 5,0 нм2, между 2,0 нм2 и 4,5 нм2, между 2,5 нм2 и 6,5 нм2, между 2,5 нм2 и 6,0 нм2, между 2,5 нм2 и 5,5 нм2, между 2,5 нм2 и 5,0 нм2 или между 2,5 нм2 и 4,5 нм2.
Терапевтическим соединением, раскрытым в данном документе, могут являться нестероидные противовоспалительные препараты (NSAID). NSAID представляет собой большую группу терапевтических соединений с анальгетическим, противовоспалительным и жаропонижающим свойствами. NSAID снижают воспаление путем блокирования циклооксигеназ. NSAID включают, без ограничения, Ацеклофенак, Ацеметацин, Актарит, Алкофенак, Альминопрофен, Амфенак, Алоксипирин, Аминофеназон, Антрафенин, Аспирин, Азапропазон, Бенорилат, Беноксапрофен, Бензидамин, Бутибуфен, Целекоксиб, Хлортеноксацин, холина салицилат, Клометацин, Декскетопрофен, Диклофенак, Дифлунизал, Эморфазон, Эпиризол, Этодолак, Эторикоксиб, Феклобузон, Фелбинак, Фенбуфен, Фенклофенак, Флурбипрофен, Глафенин, гидроксиэтилсалицилат, Ибупрофен, Индометацин, Индопрофен, Кетопрофен, Кеторолак, Лактил-фенетидин, Локсопрофен, Лумиракоксиб, мефенамовую кислоту, Мелоксикам, Метамизол, метиазиновую кислоту, Мофебутазон, Мофезолак, Набуметон, Напроксен, Нифеназон, нифлумовую кислоту, Оксаметацин, Фенацетин, Пипебузон, Пранопрофен, Пропифеназон, Проквазон, протизиновую кислоту, Рофекоксиб, салициламид, Салсалат, Сулиндак, Супрофен, Тиарамид, Тиноридин, толфенамовую кислоту, Вальдекоксиб и Зомепирак.
NSAID могут быть классифицированы на основе своей химической структуры или механизма действия. Неограничивающие примеры NSAID включают NSAID, являющиеся салицилатными производными, NSAID, являющиеся п-аминофенольными производными, NSAID, являющиеся производными пропионовой кислоты, NSAID, являющиеся производными уксусной кислоты, NSAID, являющиеся производными енольной кислоты, NSAID, являющиеся производными фенамовой кислоты, неселективные ингибиторы циклооксигеназы (СОХ), селективные ингибиторы циклооксигеназы 1 (СОХ-1) и селективные ингибиторы циклооксигеназы 2 (СОХ-2). NSAID может представлять собой профен. Примеры подходящих NSAID, являющихся салицилатными производными, включают, без ограничения, ацетилсалициловую кислоту (Аспирин), Дифлунизал и Салсалат. Примеры подходящих NSAID, являющихся п-аминофенольными производными, включают, без ограничения, Парацетамол и Фенацетин. Примеры подходящих NSAID, являющихся производными пропионовой кислоты, включают, без ограничения, Альминопрофен, Беноксапрофен, Декскетопрофен, Фенопрофен, Флурбипрофен, Ибупрофен, Индопрофен, Кетопрофен, Локсопрофен, Напроксен, Оксапрозин, Пранопрофен и Супрофен. Примеры подходящих NSAID, являющихся производными уксусной кислоты, включают, без ограничения, Ацеклофенак, Ацеметацин, Актарит, Алкофенак, Амфенак, Клометацин, Диклофенак, Этодолак, Фелбинак, Фенклофенак, Индометацин, Кеторолак, Метиазиновую кислоту, Мофезолак, Набуметон, Напроксен, Оксаметацн, Сулиндак и Зомепирак. Примеры подходящих NSAID, являющихся производными енольной кислоты (оксикамов), включают, без ограничения, Дроксикам, Изоксикам, Лорноксикам, Мелоксикам, Пироксикам и Теноксикам. Примеры подходящих NSAID, являющихся производными фенамовой кислоты, включают, без ограничения, флуфенаминовую кислоту, мефенамовую кислоту, меклофенамовую кислоту и толфенамовую кислоту. Примеры подходящих селективных ингибиторов СОХ-2 включают, без ограничения, Целекоксиб, Эторикоксиб, Фирококсиб, Лумиракоксиб, Мелоксикам, Парекоксиб, Рофекоксиб и Вальдекоксиб.
Терапевтическим соединением, раскрытым в данном документе, может являться агонист PPARγ. Примеры подходящих агонистов PPARγ включают, без ограничения, Бензбромарон, каннабидиол, Цилостазол Куркумин, дельта-(9)-тетрагидроканнабинол, глицирретиновую кислоту, Индометацин, Ирбесартан, Монасцин, микофеноловую кислоту, Ресвератрол, 6-шогаол, Телмисартан, тиазолидиндион, такой как Розиглитазон, Пиоглитазон и Троглитазон, NSAID и фибрат. Другие подходящие агонисты PPARγ описаны в Masson and Caumont-Bertrand, PPAR Agonist Compounds, Preparation and Uses, US 2011/0195993, который включен путем ссылки в полном объеме.
Терапевтическим соединением, раскрытым в данном документе, может являться агент, связывающий ядерные рецепторы. Примеры подходящего агента, связывающего ядерные рецепторы, включают, без ограничения, агент, связывающий рецептор ретиноевой кислоты (RAR), агент, связывающий ретиноид-Х-рецептор (RXR), агент, связывающий печеночный Х-рецептор (LXR), и агент, связывающий витамин D.
Терапевтическим соединением, раскрытым в данном документе, может являться анти-гиперлипидемический агент. Существует несколько классов анти-гиперлипидемических агентов (также известных как гиполипидемические агенты). Они могут отличаться как по своему влиянию на профиль холестерина, так и побочными эффектами. Например, некоторые из них могут снижать уровень липопротеинов низкой плотности (LDL), в то время как другие могут преимущественно повышать уровень липопротеинов высокой плотности (HDL). В клиническом применении, выбор агента будет зависеть от профиля холестерина, риска сердечно-сосудистых осложнений и/или функции печени и почек индивидуума. Примеры подходящего анти-гиперлипидемического агента включают, без ограничения, фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот (смолы), ингибитор всасывания холестерина, ингибитор панкреатической липазы и симпатомиметический амин.
Терапевтическим соединением, раскрытым в данном документе, может являться фибрат. Фибраты представляют собой класс амфипатических карбоновых кислот, способных изменять уровень содержания липидов. Эти терапевтические соединения используются при ряде метаболических нарушений. Одним неограничивающим вариантом применения является применение в качестве анти-гиперлипидемического агента, где он может снижать уровень, например, триглицеридов и LDL, а также увеличивать уровень HDL. Примеры подходящих фибратов включают, без ограничения, Безафибрат, Ципрофибрат, Клофибрат, Гемфиброзил и Фенофибрат.
Терапевтическим соединением, раскрытым в данном документе, может являться статин. Статины (или ингибиторы HMG-CoA-редуктазы) представляют собой класс терапевтических соединений, используемых для снижения уровня LDL и/или холестерина путем ингибирования фермента HMG-CoA-редуктазы, которая играет ключевую роль в производстве холестерина в печени. Чтобы скомпенсировать снижение доступности холестерина, увеличивается синтез печеночных LDL-рецепторов, что приводит к увеличению клиренса частиц LDL из крови. Примеры подходящих статинов включают, без ограничения, Аторвастатин, Флувастатин, Ловастатин, Питавастатин, Правастатин, Розувастатин и Симвастатин.
Терапевтическим соединением, раскрытым в данном документе, могут являться токотриенолы. Токотриенолы представляют собой другой класс ингибиторов HMG-CoA-редуктазы и могут использоваться для снижения уровня LDL и/или холестерина в крови за счет повышения уровня печеночных LDL-рецепторов и/или снижения уровня LDL в плазме. Примеры подходящих токотриенолов включают, без ограничения, γ-токотриенол и δ-токотриенол.
Терапевтическим соединением, раскрытым в данном документе, может являться ниацин. Ниацины представляют собой класс терапевтических соединений, способных изменять уровень содержания липидов. Например, ниацин может снижать уровень LDL путем селективного ингибирования печеночной диацилглицерин-ацилтрансферазы 2, снижать синтез триглицеридов и секрецию VLDL через рецептор HM74 и HM74A или GPR109A. Эти терапевтические соединения используются при ряде метаболических нарушений. Одним неограничивающим вариантом применения является применение в качестве анти-гиперлипидемического агента, где он может ингибировать расщепление жиров в жировой ткани. Поскольку ниацин блокирует расщепление жиров, это приводит к снижению содержания свободных жирных кислот в крови и, как следствие, снижает секрецию липопротеинов очень низкой плотности (VLDL) и холестерина печенью. Путем снижения уровня VLDL ниацин может также повышать уровень HDL в крови. Примеры подходящих ниацинов включают, без ограничения, аципимокс, ниацин, никотинамид и витамин В3.
Терапевтическим соединением, раскрытым в данном документе, может являться секвестрант желчных кислот. Секвестранты желчных кислот (также известные как смолы) представляют собой класс терапевтических соединений, используемых для связывания определенных компонентов желчи в желудочно-кишечном тракте. Они нарушают энтерогепатическую циркуляцию желчных кислот путем их секвестрации и предупреждения их реабсорбции в кишечнике. Секвестранты желчных кислот являются особенно эффективными для снижения LDL и холестерина путем секвестрирования холестерин-содержащих желчных кислот, высвобождаемых в кишечник и предупреждения их реабсорбции из кишечника. Кроме того, секвестранты желчных кислот могут также повышать уровень HDL. Примеры подходящих секвестрантов желчных кислот включают, без ограничения, Холестирамин, Колесевелам и Колестипол.
Терапевтическим соединением, раскрытым в данном документе, может являться ингибитор абсорбции холестерина. Ингибиторы абсорбции холестерина представляют собой класс терапевтических соединений, которые ингибируют абсорбцию холестерина из кишечника. Снижение абсорбции холестерина приводит к повышению количества LDL-рецепторов на поверхности клеток и повышенной абсорбции LDL-холестерина в этих клетках, что приводит к снижению уровня LDL в плазме крови. Примеры подходящих ингибиторов абсорбции холестерина включают, без ограничения, Эзетимиб, фитостерин, стерин и станол.
Терапевтическим соединением, раскрытым в данном документе, может являться ингибитор абсорбции жиров. Ингибиторы абсорбции жиров представляют собой класс терапевтических соединений, которые ингибируют абсорбцию жиров из кишечника. Снижение абсорбции жиров снижает потребление калорий. В одном аспекте, ингибитор абсорбции жиров ингибирует панкреатическую липазу, фермент, который разрушает триглицериды в кишечнике. Примеры подходящего ингибитора абсорбции жиров включают, без ограничения, Орлистат.
Терапевтическим соединением, раскрытым в данном документе, может являться симпатомиметический амин. Симпатомиметические амины представляют собой класс терапевтических соединений, которые имитируют эффекты трансмиттерных веществ симпатической нервной системы, таких как катехоламины, эпинефрин (адреналин), норэпинефрин (норадреналин) и/или дофамин. Симпатомиметический амин может действовать в качестве α-адренергического агониста, β-адренергического агониста, дофаминергического агониста, ингибитора моноаминоксидазы (МАО) и ингибитора СОМТ. Такие терапевтические соединения, среди прочего, используются для лечения при остановке сердца, низком кровяном давлении или даже для задержки преждевременной родовой деятельности. Примеры подходящих симпатомиметических аминов включают, без ограничения, Кленбутерол, Сальбутамол, эфедрин, псевдоэфедрин, метамфетамин, амфетамин, фенилэфрин, изопротеренол, добутамин, метилфенидат, лисдексамфетамин, катин, катинон, меткатинон, кокаин, бензилпиперазин (BZP), метилендиоксипировалерон (MDPV), 4-метиламинорекс, пемолин, фенметразин и пропилгекседрин.
Терапевтическим соединением, раскрытым в данном документе, может являться сложный эфир терапевтического соединения. Сложный эфир терапевтического соединения увеличивает величину logP относительно этого же терапевтического соединения, но без сложноэфирной модификации. Сложноэфирная группа может быть присоединена к терапевтическому соединению, например, через карбоксильную или гидроксильную функциональные группы, присутствующие в терапевтическом соединении. Сложный эфир терапевтического соединения может иметь повышенную гидрофобность, и, таким образом, может быть растворен в меньшем объеме растворителя, раскрытого в данном документе. В некоторых случаях, сложный эфир терапевтического соединения может быть объединен напрямую с адъювантом, раскрытым в данном документе, тем самым устраняя необходимость в растворителе. Сложный эфир терапевтического соединения может обеспечивать возможность изготовления фармацевтической композиции, раскрытой в данном документе, в ситуациях, когда неэтерифицированная форма того же терапевтического соединения в противном случае не смешивается с растворителем, раскрытым в данном документе. Сложный эфир терапевтического соединения может, кроме того, доставляться таким способом, который более эффективно ингибирует провоспалительную реакцию, при условии что соединение объединено с адъювантом, раскрытым в данном документе. В одном варианте осуществления изобретения терапевтическое соединение может вступать в реакцию с этиловым сложным эфиром с образованием этилового эфира терапевтического соединения.
В другом варианте осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, не содержит фармацевтически приемлемый растворитель, раскрытый в данном документе. В одном аспекте этого варианта осуществления фармацевтическая композиция включает терапевтическое соединение и фармацевтически приемлемый адъювант, но не содержат фармацевтически приемлемый растворитель, раскрытый в данном документе.
Фармацевтическая композиция, раскрытая в данном документе, может содержать терапевтическое соединение в количестве, достаточном, чтобы обеспечить стандартное введение индивидууму. В аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может включать, например, по меньшей мере 5 мг, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 80 мг, по меньшей мере 85 мг, по меньшей мере 90 мг, по меньшей мере 95 мг или по меньшей мере 100 мг терапевтического соединения. В других аспектах этого варианта осуществления, фармацевтическая композиция, раскрытая в данном документе, может включать, например, по меньшей мере 5 мг, по меньшей мере 10 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 50 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 200 мг, по меньшей мере 300 мг, по меньшей мере 400 мг, по меньшей мере 500 мг, по меньшей мере 600 мг, по меньшей мере 700 мг, по меньшей мере 800 мг, по меньшей мере 900 мг, по меньшей мере 1000 мг, по меньшей мере 1100 мг, по меньшей мере 1200 мг, по меньшей мере 1300 мг, по меньшей мере 1400 мг или по меньшей мере 1500 мг терапевтического соединения. В дополнительных аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может находится в диапазоне, например, от примерно 5 мг до примерно 100 мг, от примерно 10 мг до примерно 100 мг, от примерно 50 мг до примерно 150 мг, от примерно 100 мг до примерно 250 мг, от примерно 150 мг до примерно 350 мг, от примерно 250 мг до примерно 500 мг, от примерно 350 мг до примерно 600 мг, от примерно 500 мг до примерно 750 мг, от примерно 600 мг до примерно 900 мг, от примерно 750 мг до примерно 1000 мг, от примерно 850 мг до примерно 1200 мг или от примерно 1000 мг до примерно 1500 мг. В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может находится в диапазоне, например, от примерно 10 мг до примерно 250 мг, от примерно 10 мг до примерно 500 мг, от примерно 10 мг до примерно 750 мг, от примерно 10 мг до примерно 1000 мг, от примерно 10 мг до примерно 1500 мг, от примерно 50 мг до примерно 250 мг, от примерно 50 мг до примерно 500 мг, от примерно 50 мг до примерно 750 мг, от примерно 50 мг до примерно 1000 мг, от примерно 50 мг до примерно 1500 мг, от примерно 100 мг до примерно 250 мг, от примерно 100 мг до примерно 500 мг, от примерно 100 мг до примерно 750 мг, от примерно 100 мг до примерно 1000 мг, от примерно 100 мг до примерно 1500 мг, от примерно 200 мг до примерно 500 мг, от примерно 200 мг до примерно 750 мг, от примерно 200 мг до примерно 1000 мг, от примерно 200 мг до примерно 1500 мг, от примерно 5 мг до примерно 1500 мг, от примерно 5 мг до примерно 1000 мг или от примерно 5 мг до примерно 250 мг.
В аспектах настоящего описания раскрыт, в частности, фармацевтически приемлемый растворитель. Растворитель представляет собой жидкость, твердое вещество или газ, в котором растворяется другое твердое, жидкое, или газообразное вещество (растворяемое вещество), давая раствор. Растворители, используемые в фармацевтических композициях, раскрытых в данном документе, включают, без ограничения, фармацевтически приемлемый полярный апротонный растворитель, фармацевтически приемлемый полярной протонный растворитель и фармацевтически приемлемый неполярный растворитель. Фармацевтически приемлемые полярные апротонные растворители включают, без ограничения, дихлорметан (DCM), тетрагидрофуран (THF), этилацетат, ацетон, диметилформамид (DMF), ацетонитрил (MeCN), диметилсульфоксид (DMSO). Фармацевтически приемлемые полярные протонные растворители включают, без ограничения, уксусную кислоту, муравьиную кислоту, этанол, н-бутанол, 1-бутанол, 2-бутанол, изобутанол, втор-бутанол, трет-бутанол, н-пропанол, изопропанол, 1,2-пропандиол, метанол, глицерин и воду. Фармацевтически приемлемые неполярные растворители включают, без ограничения, пентан, циклопентан, гексан, циклогексан, бензол, толуол, 1,4-диоксан, хлороформ, N-метил-пирролидон (NMP) и диэтиловый эфир.
Фармацевтическая композиция, раскрытая в данном документе, может содержать растворитель в количестве, достаточном для растворения терапевтического соединения, раскрытого в данном документе. В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может содержать растворитель в количестве, например, меньше примерно 90% (об./об.), меньше примерно 80% (об./об.), меньше примерно 70% (об./об.), меньше примерно 65% (об./об.), меньше примерно 60% (об./об.), меньше примерно 55% (об./об.), меньше примерно 50% (об./об.), меньше примерно 45% (об./об.), меньше примерно 40% (об./об.), меньше примерно 35% (об./об.), меньше примерно 30% (об./об.), меньше примерно 25% (об./об.), меньше примерно 20% (об./об.), меньше примерно 15% (об./об.), меньше примерно 10% (об./об.), меньше примерно 5% (об./об.) или меньше примерно 1% (об./об.). В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может содержать растворитель в количестве, находящемся в диапазоне, например, примерно от 1% (об./об.) до 90% (об./об.), примерно от 1% (об./об.) до 70% (об./об.), примерно от 1% (об./об.) до 60% (об./об.), примерно от 1% (об./об.) до 50% (об./об.), примерно от 1% (об./об.) до 40% (об./об.), примерно от 1% (об./об.) до 30% (об./об.), примерно от 1% (об./об.) до 20% (об./об.), примерно от 1% (об./об.) до 10% (об./об.), примерно от 2% (об./об.) до 50% (об./об.), примерно от 2% (об./об.) до 40% (об./об.), примерно от 2% (об./об.) до 30% (об./об.), примерно от 2% (об./об.) до 20% (об./об.), примерно от 2% (об./об.) до 10% (об./об.), примерно от 4% (об./об.) до 50% (об./об.), примерно от 4% (об./об.) до 40% (об./об.), примерно от 4% (об./об.) до 30% (об./об.), примерно от 4% (об./об.) до 20% (об./об.), примерно от 4% (об./об.) до 10% (об./об.), примерно от 6% (об./об.) до 50% (об./об.), примерно от 6% (об./об.) до 40% (об./об.), примерно от 6% (об./об.) до 30% (об./об.), примерно от 6% (об./об.) до 20% (об./об.), примерно от 6% (об./об.) до 10% (об./об.), примерно от 8% (об./об.) до 50% (об./об.), примерно от 8% (об./об.) до 40% (об./об.), примерно от 8% (об./об.) до 30% (об./об.), примерно от 8% (об./об.) до 20% (об./об.), примерно от 8% (об./об.) до 15% (об./об.) или примерно от 8% (об./об.) до 12% (об./об.).
В одном варианте осуществления изобретения растворитель может содержать фармацевтически приемлемый спирт. Используемый в данном документе термин «спирт» относится к органической молекуле, содержащей гидроксильную функциональную группу (-ОН), связанную с атомом углерода, где атом углерода является насыщенным. В аспектах этого варианта осуществления, спирт может являться, например, C2-4-спиртом, С1-4-спиртом, С1-5-спиртом, С1-7-спиртом, С1-10-спиртом, C1-15-спиртом или С1-20-спиртом. В других аспектах этого варианта осуществления, спирт может представлять собой, например, первичный спирт, вторичный спирт или третичный спирт. В других аспектах этого варианта осуществления, спирт может представлять собой, например, ациклический спирт, одноатомный спирт, многоатомный спирт (известный также как полиол или сахарный спирт), ненасыщенный алифатический спирт, алициклический спирт или их комбинацию. Примеры одноатомного спирта включают, без ограничения, метанол, этанол, пропанол, бутанол, пентанол и 1-гексадеканол. Примеры многоатомного спирта включают, без ограничения, гликоль, глицерин, эритрит, арабит, ксилит, мальтит, сорбит (глюцит), маннит, инозит, лактит, галактит (идит) и изомальт. Примеры ненасыщенных алифатических спиртов включают, без ограничения, проп-2-ен-1-ол, 3,7-диметилокта-2,6-диен-1-ол, и проп-2-ин-1-ол. Примеры алициклических спиртов включают, без ограничения, циклогексан-1, 2,3,4,5,6-гексол и 2-(2-пропил)-5-метил-циклогексан-1-ол.
В другом варианте осуществления изобретения растворитель может содержать сложный эфир фармацевтически приемлемого спирта и кислоты. Подходящие фармацевтически приемлемые спирты включают описанные в данном документе. Подходящие кислоты включают, без ограничения, уксусную кислоту, масляную кислоту и муравьиную кислоту. Сложные эфиры спирта и кислоты включают, без ограничения, метилацетат, метилбутират, метилформиат, этилацетат, этилбутират, этилформиат, пропилацетат, пропилбутират, пропилформиат, бутилацетат, бутилбутират, бутилформиат, изобутилацетат, изобутилбутират, изобутилформиат, пентилацетат, пентилбутират, пентилформиат и 1-гексадецилацетат, 1-гексадецилбутират и 1-гексадецилформиат.
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый гликолевый эфир. Гликолевые эфиры представляют собой группу растворителей на основе простых алкиловых эфиров этиленгликоля. Неограничивающие примеры включают монометиловый эфир диэтиленгликоля (2-(2-метоксиэтокси)этанол), моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси) этанол), монопропиловый эфир диэтиленгликоля (2- (2-пропоксиэтокси)этанол), моноизопропиловый эфир диэтиленгликоля (2-(2-изопропоксиэтокси)этанол) и моно-н-бутиловый эфир диэтиленгликоля (2-(2-бутоксиэтокси)этанол). Моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси)этанол) является коммерчески доступным под названием TRANSCUTOL®.
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый диол. Диол или двухатомный спирт представляет собой химическое соединение, содержащее две гидроксильные группы (-ОН группы).
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый пропиленгликоль. Пропиленгликоль, также называемый 1,2-пропандиол или пропан-1,2-диол, представляет собой органическое соединение с формулой С3Η8Ο2 или HO-CH2-CHOH-CH3.
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый дипропиленгликоль. Дипропиленгликоль представляет собой смесь трех изомеров химического соединения, 4-окса-2,6-гептандиола, 2-(2-гидрокси-пропокси)пропан-1-ола и 2-(2-гидрокси-1-метил-этокси)пропан-1-ола.
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый пропиленгликолевый (PPG) полимер. PPG-полимеры, также известные как полипропиленоксидные (PPO) полимеры или полиоксипропиленовые (POP) полимеры, получают полимеризацией пропиленоксида и коммерчески доступны в широком диапазоне молярных масс от 100 г/моль до 10000000 г/моль. PPG-полимеры с низкой молекулярной массой являются жидкостями или легкоплавкими твердыми веществами, тогда как PPG-полимеры с более высокой молекулярной массой являются твердыми веществами. PPG-полимеры включают, без ограничения, PPG 100, PPG 200, PPG 300, PPG 400, PPG 500, PPG 600, PPG 700, PPG 800, PPG 900, PPG 1000, PPG 1100, PPG 1200, PPG 1300, PPG 1400, PPG 1500, PPG 1600, PPG 1700, PPG 1800, PPG 1900, PPG 2000, PPG 2100, PPG 2200, PPG 2300, PPG 2400, PPG 2500, PPG 2600, PPG 2700, PPG 2800, PPG 2900, PPG 3000, PPG 3250, PPG 3350, PPG 3500, PPG 3750, PPG 4000, PPG 4250, PPG 4500, PPG 4750, PPG 5000, PPG 5500, PPG 6000, PPG 6500, PPG 7000, PPG 7500, PPG 8000, PPG 8500, PPG 9000, PPG 9500, PPG 10000, PPG 11000, PPG 12000, PPG 13000, PPG 14000, PPG 15000, PPG 16000, PPG 17000, PPG 18000, PPG 19000 или PPG 20000.
В другом варианте осуществления изобретения растворитель может включать фармацевтически приемлемый полиэтиленгликолевый (PEG) полимер. PEG-полимеры, также известные как полиэтиленоксидные (PEO) полимеры или полиоксиэтиленовые (POE) полимеры, получают полимеризацией этиленоксида и коммерчески доступны в широком диапазоне молярных масс от 100 г/моль до 10000000 г/моль. PEG-полимеры с низкой молекулярной массой являются жидкостями или легкоплавкими твердыми веществами, тогда как PEG-полимеры с более высокой молекулярной массой являются твердыми веществами. PEG-полимеры включают, без ограничения, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600, PEG 700, PEG 800, PEG 900, PEG 1000, PEG 1100, PEG 1200, PEG 1300, PEG 1400, PEG 1500, PEG 1600, PEG 1700, PEG 1800, PEG 1900, PEG 2000, PEG 2100, PEG 2200, PEG 2300, PEG 2400, PEG 2500, PEG 2600, PEG 2700, PEG 2800, PEG 2900, PEG 3000, PEG 3250, PEG 3350, PEG 3500, PEG 3750, PEG 4000, PEG 4250, PEG 4500, PEG 4750, PEG 5000, PEG 5500, PEG 6000, PEG 6500, PEG 7000, PEG 7500, PEG 8000, PEG 8500, PEG 9000, PEG 9500, PEG 10000, PEG 11000, PEG 12000, PEG 13000, PEG 14000, PEG 15000, PEG 16000, PEG 17000, PEG 18000, PEG 19000 или PEG 20000.
В другом варианте осуществления изобретения растворитель может содержать фармацевтически приемлемый глицерид. Глицериды включают замещенный глицерин, где одна, две или все три гидроксильные группы глицерина этерифицированы жирной кислотой с образованием моноглицеридов, диглицеридов и триглицеридов, соответственно. В этих соединениях каждая гидроксильная группа глицерина может быть этерифицирована различными жирными кислотами. Кроме того, глицериды могут быть ацетилированы с образованием ацетилированных моноглицеридов, ацетилированных диглицеридов и ацетилированных триглицеридов.
В другом варианте осуществления изобретения растворитель может содержать фармацевтически приемлемый твердый растворитель. Твердые растворители могут быть полезны при изготовлении твердой лекарственной формы фармацевтической композиции, раскрытой в данном документе. Как правило, твердый растворитель расплавляют, чтобы растворить терапевтическое соединение. Фармацевтически приемлемые твердые растворители включают, без ограничения, ментол и PEG-полимеры с молекулярной массой выше примерно 20000 г/моль.
В аспектах настоящего описания раскрыт, в частности, фармацевтически приемлемый адъювант. Адъювант представляет собой фармакологический агент, который модифицирует действие других агентов, таких как, например, терапевтическое соединение, раскрытое в данном документе. Кроме того, адъювант, раскрытый в данном описании, может использоваться в качестве растворителя, который растворяет терапевтическое соединение, раскрытое в данном документе, с образованием раствора в адъюванте. Адъювант, раскрытый в данном документе, облегчает доставку терапевтического соединения таким образом, что оно более эффективно ингибирует провоспалительную реакцию. В одном варианте осуществления изобретения адъювант, раскрытый в данном документе, облегчает доставку терапевтического соединения, раскрытого в данном документе, в макрофаги.
Фармацевтическая композиция, раскрытая в данном документе, может содержать фармацевтически приемлемый адъювант в количестве, достаточном, чтобы смешиваться с раствором, раскрытым в данном документе, или эмульсией, раскрытой в данном документе. В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может содержать адъювант в количестве, например, по меньшей мере 10% (об./об.), по меньшей мере 20% (об./об.), по меньшей мере 30% (об./об.), по меньшей мере 35% (об./об.), по меньшей мере 40% (об./об.), по меньшей мере 45% (об./об.), по меньшей мере 50% (об./об.), по меньшей мере 55% (об./об.), по меньшей мере 60% (об./об.), по меньшей мере 65% (об./об.), по меньшей мере 70% (об./об.), по меньшей мере 75% (об./об.), по меньшей мере 80% (об./об.), по меньшей мере 85% (об./об.), по меньшей мере 90% (об./об.), по меньшей мере 95% (об./об.) или по меньшей мере 99% (об./об.). В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может содержать адъювант в количестве, находящемся в диапазоне, например, от примерно 30% (об./об.) до примерно 99% (об./об.), от примерно 35% (об./об.) до примерно 99% (об./об.), от примерно 40% (об./об.) до примерно 99% (об./об.), от примерно 45% (об./об.) до примерно 99% (об./об.), от примерно 50% (об./об.) до примерно 99% (об./об.), от примерно 30% (об./об.) до примерно 98% (об./об.), от примерно 35% (об./об.) до примерно 98% (об./об.), от примерно 40% (об./об.) до примерно 98% (об./об.), от примерно 45% (об./об.) до примерно 98% (об./об.), от примерно 50% (об./об.) до примерно 98% (об./об.), от примерно 30% (об./об.) до примерно 95% (об./об.), от примерно 35% (об./об.) до примерно 95% (об./об.), от примерно 40% (об./об.) до примерно 95% (об./об.), от примерно 45% (об./об.) до примерно 95% (об./об.) или от примерно 50% (об./об.) до примерно 95% (об./об.). В других аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может содержать адъювант в количестве, находящемся в диапазоне, например, от примерно 70% (об./об.) до примерно 97% (об./об.), от примерно 75% (об./об.) до примерно 97% (об./об.), от примерно 80% (об./об.) до примерно 97% (об./об.), от примерно 85% (об./об.) до примерно 97% (об./об.), от примерно 88% (об./об.) до примерно 97% (об./об.), от примерно 89% (об./об.) до примерно 97% (об./об.), от примерно 90% (об./об.) до примерно 97% (об./об.), от примерно 75% (об./об.) до примерно 96% (об./об.), от примерно 80% (об./об.) до примерно 96% (об./об.), от примерно 85% (об./об.) до примерно 96% (об./об.), от примерно 88% (об./об.) до примерно 96% (об./об.), от примерно 89% (об./об.) до примерно 96% (об./об.), от примерно 90% (об./об.) до примерно 96% (об./об.), от примерно 75% (об./об.) до примерно 93% (об./об.), от примерно 80% (об./об.) до примерно 93% (об./об.), от примерно 85% (об./об.) до примерно 93% (об./об.), от примерно 88% (об./об.) до примерно 93% (об./об.), от примерно 89% (об./об.) до примерно 93% (об./об.) или от примерно 90% (об./об.) до примерно 93% (об./об.).
В одном варианте осуществления изобретения адъювант может представлять собой фармацевтически приемлемый липид. Липид в общем можно описать как гидрофобное или амфифильное низкомолекулярное вещество. Амфифильный характер некоторых липидов позволяет им образовывать структуры, такие как везикулы, липосомы или мембраны в водной среде. Неограничивающие примеры липидов включают жирные кислоты, глицеролипиды (например, моноглицериды, диглицериды и триглицериды), фосфолипиды, сфинголипиды, стериновые липиды, пренольные липиды, сахаролипиды и поликетиды. Фармацевтическая композиция, раскрытая в данном документе, может содержать липид, такой как, например, масло, жидкость на масляной основе, жир, жирная кислота, воск, сложный эфир жирной кислоты, соль жирной кислоты, жирный спирт, глицерид (моно-, ди- или триглицерид), частично гидролизованный глицеролипид, фосфолипиды, гликолевый эфир, эфир сахарозы, производное глицероолеата, триглицерид со средней длиной цепи или их смесь. Другие примеры фармацевтически приемлемых липидов, подходящих в качестве адъювантов, описаны, например, в US 6923988, US 6451339, US 6383471, US 6294192 и US 6267985, полное содержание которых включено в данное описание путем ссылки.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемая жирная кислота. Жирная кислота включает карбоновую кислоту с длинной неразветвленной углеводородной цепью, которая может быть либо насыщенной, либо ненасыщенной. Такая структура обеспечивает жирной кислоте полярный, гидрофильный конец и неполярный гидрофобный конец, который является нерастворимым в воде. Большинство природных жирных кислот имеют углеводородную цепь с четным числом атомов углерода, как правило, от 4 до 24 атомов углерода, и могут быть соединены с функциональными группами содержащими кислород, галогены, азот и серу. Синтетические или неприродные жирные кислоты могут иметь углеводородную цепь из любого числа атомов углерода от от 3 до 40. При наличии двойной связи, существует возможность цис или транс геометрической изомерии, которая значительно влияет на конфигурацию молекулы. Цис-двойные связи вызывают изгиб жирной кислоты, эффект, который тем более выражен, чем больше двойных связей присутствует в цепи. Большинство природных жирных кислот имеют цис-конфигурацию, хотя транс-форма присутствует в некоторых природных и частично гидрированных жирах и маслах. Примеры жирных кислот включают, без ограничения, каприловую кислоту (8:0), пеларгоновую кислоту (9:0), каприновую кислоту (10:0), ундециловую кислоту (11:0), лауриновоую кислоту (12:0), тридециловую кислоту (13:0), миристиновую кислоту (14:0), миристолеиновую кислоту (14:1), пентадециловую кислоту (15:0), пальмитиновую кислоту (16:0), пальмитолеиновую кислоту (16:1), сапиеновую кислоту (16:1), маргариновую кислоту (17:0), стеариновую кислоту (18:0), олеиновую кислоту (18:1), элаидиновую кислоту (18:1), вакценовую кислоту (18:1), линолевую кислоту (18:2), линоэлаидиновую кислоту (18: 2), линоленовую кислоту (18:3), γ-линоленовую кислоту (18:3), стеаридоновую кислоту (18:4), нонадециловую кислоту (19:0), арахидоновую кислоту (20:0), эйкозеновую кислоту (20:1), дигомо-γ-линоленовую кислоту (20:3), мидовую кислоту (20:3), арахидоновую кислоту (20:4), эйкозапентаеновую кислоту (20:5), генэйкозановую кислоту (21:0), бегеновую кислоту (22:0), эруковую кислоту (22:1), докозагексаеновую кислоту (22:6), трикозановую кислоту (23:0), лигноцериновую кислоту (24:0), ацетэруковую кислоту (24:1), пентакозановую кислоту (25:0), церотиновую кислоту (26:0), гептакозановую кислоту (27:0), монтановую кислоту (28:0), нонакозановую кислоту (29:0), мелиссовую кислоту (30:0), гентриаконтановую кислоту (31:0), лацериновую кислоту (32:0), псилластеариновую кислоту (33:0), геддовую кислоту (34:0), церопластовую кислоту (35:0) и гексатриаконтиловую кислоту (36:0).
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый частично гидрированный липид. Процесс гидрогенизации добавляет атомы водорода к ненасыщенному липиду, устраняя двойные связи и превращая его в частично или полностью насыщенный липид. Частичное гидрирование является химическим, а не ферментативным процессом, который преобразует часть цис-изомеров в транс-ненасыщенные липиды вместо полного их гидрирования. На первой стадии реакции добавляется один водород, с другим координационно-ненасыщенным углеродом, присоединяющимся к катализатору. Второй этап состоит в добавлении водорода к оставшемуся атому углерода, давая в результате насыщенную жирную кислоту. Первая стадия является обратимой, так что водород повторно адсорбируется на катализаторе, и двойная связь образуется вновь. Промежуточное соединение только с одним добавленным атомом водорода не содержит двойную связь и может свободно вращаться. Таким образом, двойная связь может повторно образоваться либо в цис-, либо транс-форме, из которых транс-форма является преимущественной вне зависимости от исходного вещества.
В варианте осуществления изобретения адъювантом может быть фармацевтически приемлемая насыщенная или ненасыщенная жирная кислота. В аспектах этого варианта осуществления насыщенная или ненасыщенная жирная кислота содержит, например, по меньшей мере 8, по меньшей мере 10, по меньшей мере 12, по меньшей мере 14, по меньшей мере 16, по меньшей мере 18, по меньшей мере 20, по меньшей мере 22, по меньшей мере 24, по меньшей мере 26, по меньшей мере 28 или по меньшей мере 30 атомов углерода. В других аспектах этого варианта осуществления насыщенная или ненасыщенная жирная кислота содержит, например, от 4 до 24 атомов углерода, от 6 до 24 атомов углерода, от 8 до 24 атомов углерода, от 10 до 24 атомов углерода, от 12 до 24 атомов углерода, от 14 до 24 атомов углерода или от 16 до 24 атомов углерода, от 4 до 22 атомов углерода, от 6 до 22 атомов углерода, от 8 до 22 атомов углерода, от 10 до 22 атомов углерода, от 12 до 22 атомов углерода, от 14 до 22 атомов углерода или от 16 до 22 атомов углерода, от 4 до 20 атомов углерода, от 6 до 20 атомов углерода, от 8 до 20 атомов углерода, от 10 до 20 атомов углерода, от 12 до 20 атомов углерода, от 14 до 20 атомов углерода или от 16 до 20 атомов углерода. Будучи ненасыщенной, жирная кислота может иметь, например, 1 или больше, 2 или больше, 3 или больше, 4 или больше, 5 или больше или 6 или больше двойных связей.
В аспектах этого варианта осуществления фармацевтически приемлемая насыщенная или ненасыщенная жирная кислота является жидкой при комнатной температуре. Температура плавления жирной кислоты в значительной степени определяется степенью насыщенности/ненасыщенности углеводородной цепи. В аспектах этого варианта осуществления насыщенная или ненасыщенная жирная кислота имеет температуру плавления, например, 20°C или ниже, 15°C или ниже, 10°C или ниже, 5°C или ниже, 0°C или ниже, -5°C или ниже, -10°C или ниже, -15°C или ниже или -20°C или ниже. В других аспектах этого варианта осуществления, насыщенная или ненасыщенная жирная кислота имеет температуру плавления в диапазоне, например, от примерно -20°C до примерно 20°C, от примерно -20°C до примерно 18°C, от примерно -20°C до примерно 16°C, от примерно -20°C до примерно 12°C, от примерно -20°C до примерно 8°C, от примерно -20°C до примерно 4°C, от примерно -20°C до примерно 0°C, от примерно -15°C до примерно 20°C, от примерно -15°C до примерно 18°C, от примерно -15°C до примерно 16°C, от примерно -15°C до примерно 12°C, от примерно -15°C до примерно 8°C, от примерно -15°C до примерно 4°C, от примерно -15°C до примерно 0°C.
В другом варианте осуществления изобретения адъювант может содержать один вид фармацевтически приемлемой жирной кислоты. В аспектах этого варианта осуществления, адъювант может содержать только пальмитиновую кислоту, только стеариновую кислоту, только олеиновую кислоту, только линолевую кислоту или только линоленовую кислоту.
В другом варианте осуществления изобретения адъювант может содержать множество различных фармацевтически приемлемых жирных кислот. В аспектах этого варианта осуществления, адъювант может содержать, например, две или несколько различных жирных кислот, три или несколько различных жирных кислот, четыре или несколько различных жирных кислот, пять или несколько различных жирных кислот или шесть или несколько различных жирных кислот.
В других аспектах этого варианта осуществления изобретения адъювант может содержать две или несколько различных фармацевтически приемлемых жирных кислот, включающих по меньшей мере пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту и/или линоленовую кислоту, и любую их комбинацию. В других аспектах этого варианта осуществления, адъювант может содержать соотношение (пальмитиновой кислоты и/или стеариновой кислоты и/или олеиновой кислоты):(линоленовой кислоты и/или линолевой кислоты), например, по меньшей мере 2:1, по меньшей мере 3:1, по меньшей мере 4:1, по меньшей мере 5:1, по меньшей мере 6:1, по меньшей мере 7:1, по меньшей мере 8:1, по меньшей мере 9:1, по меньшей мере 10:1, по меньшей мере 15:1 или по меньшей мере 20:1. В других аспектах этого варианта осуществления, адъювант может содержать соотношение (пальмитиновой кислоты и/или стеариновой кислоты и/или олеиновой кислоты):(линоленовой кислоты и/или линолевой кислоты) в диапазоне, например, от примерно 1:1 до примерно 20:1, от примерно 2:1 до примерно 15:1, от примерно 4:1 до примерно 12:1 или от примерно 6:1 до примерно 10:1.
В других аспектах этого варианта осуществления изобретения адъювант может содержать четыре или несколько различных фармацевтически приемлемых жирных кислот, включающих по меньшей мере пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту и/или линоленовую кислоту, и любую их комбинацию. В других аспектах этого варианта осуществления, адъювант может содержать соотношение пальмитиновой кислоты:стеариновой кислоты:линоленовой кислоты:линолевой кислоты, например, 10:10:1:1, 9:9:1:1, 8:8:1:1, 7:7:1:1, 6:6:1:1, 5:5:1:1, 4:4:1:1, 3:3:1:1, 2:2:1:1 или 1:1:1:1. В других аспектах этого варианта осуществления изобретения адъювант может содержать соотношение пальмитиновой кислоты:стеариновой кислоты:линоленовой кислоты:линолевой кислоты в диапазоне, например, от примерно 10:10:1:1 до примерно 6:6:1:1, от примерно 8:8:1:1 до примерно 4:4:1:1 или от примерно 5:5:1:1 до примерно 1:1:1:1.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемая омега-жирная кислота. Неограничивающие примеры омега-жирных кислот включают омега-3, омега-6, омега-7 и омега-9. Омега-3 жирные кислоты (также известные как n-3 жирные кислоты или ω-3 жирные кислоты) представляют собой семейство незаменимых жирных ненасыщенных кислот, которые имеют общую концевую двойную углерод-углеродную связь в положении n-3, то есть третью связь, считая от концевой метильной группы жирной кислоты. Омега-3 жирные кислоты являются «незаменимыми» жирными кислотами, потому что они имеют жизненно важное значение для нормального обмена веществ и не могут синтезироваться в организме человека. Омега-3 жирные кислоты включают, без ограничения, гексадекатриеновую кислоту (16:3), линоленовую кислоту (18:3), стеаридоновую кислоту (18:4), эйкозатриеновую кислоту (20:3), эйкозатетраеновую кислоту (20:4), эйкозапентаеновую кислоту (20:5), генэйкозапентаеновую кислоту (21:5), докозапентаеновую кислоту (клупанодоновую кислоту) (22:5), докозагексаеновую кислоту (22:6), тетракозапентаеновую кислоту (24:5), тетракозагексаеновую кислоту (низиновую кислоту) (24:6).
Омега-6 жирные кислоты (также известные как n-6 жирные кислоты или ω-6 жирные кислоты) представляют собой семейство ненасыщенных жирных кислот, которые имеют общую концевую двойную углерод-углеродную связь в положении n-6, то есть шестую связь, считая от концевой метильной группы жирной кислоты. Омега-6 жирные кислоты включают, без ограничения, линолевую кислоту (18:2), γ-линоленовую кислоту (18: 3), календовую кислоту (18:3), эйкозадиеновую кислоту (20:2), дигомо-γ-линоленовую кислоту (20:3), арахидоновую кислоту (20:4), докозадиеновую кислоту (22:2), адреновую кислоту (22:4), докозапентаеновую кислоту (22:5), тетракозатетраеновую кислоту (24:4) и тетракозапентаеновую кислоту (24:5).
Омега-7 жирные кислоты (также известные как n-7 жирные кислоты или ω-7 жирные кислоты) представляют собой семейство ненасыщенных жирных кислот, которые имеют общую концевую двойную углерод-углеродную связь в положении n-7, то есть седьмую связь, считая от концевой метильной группы жирной кислоты. Омега-7 жирные кислоты включают, без ограничения, 5-додеценовую кислоту (12:1), 7-тетрадеценовую кислоту (14:1), 9-гексадеценовую кислоту (пальмитолеиновую кислоту) (16:1), 11-деценовую кислоту (вакценовую кислоту) (18:1), 9Z,11Е-конъюгированную линолевую кислоту (руменовую кислоту) (18:2), 13-эйкозеновую кислоту (полиновую кислоту) (20:1), 15-докозеновую кислоту (22:1) и 17-тетракозеновую кислоту (24:1).
Омега-9 жирные кислоты (также известные как n-9 жирные кислоты или ω-9 жирные кислоты) представляют собой семейство ненасыщенных жирных кислот, которые имеют общую концевую двойную углерод-углеродную связь в положении n-9, то есть девятую связь, считая от концевой метильной группы жирной кислоты. Омега-7 жирные кислоты включают, без ограничения, олеиновую кислоту (18:1), элаидиновую кислоту (18:1), эйкозеновую кислоту (20:1), мидовую кислоту (20:3), эруковую кислоту (22:1), ацетэруковую кислоту (24:1) и рицинолеиновую кислоту.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый жир. Также известен как высокоплавкий жир или твердый жир, жир включает в себя любую жирную кислоту, которая является твердой при обычной комнатной температуре, такой как, например, около 20°C. Жиры состоят из широкой группы соединений, которые обычно растворимы в органических растворителях и обычно нерастворимы в воде. Жиром, подходящим в качестве липида, подходящего для фармацевтических композиций, раскрытых в данном документе, может являться триглицерид, триэфир глицерина или любая из нескольких жирных кислот.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемое масло. Масло, также известное как жидкий жир, включает любую жирную кислоту, которая является жидкостью при обычной комнатной температуре, такой как, например, около 20°C. Маслом, подходящим в качестве липида, подходящего для фармацевтических композиций, раскрытых в данном документе, может являться природное масло, растительное масло или любое вещество, которое не смешивается с водой и дает ощущение жирности. Примеры подходящих природных масел включают, без ограничения, минеральное масло, триацетин, этилолеат, гидрированное природное масло или их смеси. Примеры подходящих растительных масел включают, без ограничения, миндальное масло, арахисовое масло, масло авокадо, рапсовое масло, касторовое масло, кокосовое масло, кукурузное масло, масло хлопчатника, масло виноградных косточек, масло лесного ореха, конопляное масло, льняное масло (масло из льняного семени), оливковое масло, пальмовое масло, арахисовое масло, масло из рапсовых семян, масло из рисовых отрубей, сафлоровое масло, кунжутное масло, масло из соевых бобов, соевое масло, подсолнечное масло, масло из какао-бобов (какао-масло), масло грецкого ореха, масло из зародышей пшеницы или их смесь. Каждое из этих масел является коммерчески доступным из различных источников, хорошо известных специалистам в данной области.
Масло, как правило, представляет собой смесь различных жирных кислот. Например, рапсовое масло, получаемое из семян Brassica napus, включает в себя обе омега-6 и омега-3 жирные кислоты в соотношении примерно 2:1. В качестве другого примера, льняное масло, получаемое из семян Linum usitatissimum, включает в себя примерно 7% пальмитиновой кислоты, примерно 3,4-4,6% стеариновой кислоты, примерно 18,5-22,6% олеиновой кислоты, примерно 14,2-17% линолевой кислоты и примерно 51,9-55,2% линоленовой кислоты. В качестве другого примера, какао-масло, получаемое из какао-бобов, включает глицериды, полученные из пальмитиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты и арахиновой кислоты, с температурой плавления 34-38°С. В аспектах этого варианта осуществления изобретения фармацевтическая композиция содержит масло, включающее по меньшей мере две различных жирных кислоты, по меньшей мере три различных жирных кислоты, по меньшей мере четыре различных жирных кислоты, по меньшей мере пять различных жирных кислот или по меньшей мере шесть различных жирных кислот.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый глицеролипид. Глицеролипиды состоят в основном из моно-, ди- и три-замещенных глицеринов. Одна группа глицеролипидов представляет собой глицериды, где одна, две или все три гидроксильные группы глицерина этерифицированы с использованием жирной кислоты, раскрытой в данном документе, с образованием моноглицеридов, диглицеридов и триглицеридов, соответственно. В этих соединениях каждая гидроксильная группа глицерина может быть этерифицирована с использованием различных жирных кислот. Кроме того, глицериды могут быть ацетилированы с образованием ацетилированных моноглицеридов, ацетилированных диглицеридов и ацетилированных триглицеридов. Одна группа глицеролипидов представляет собой глицериды, где одна, две или все три гидроксильные группы глицерина имеют остатки сахаров, присоединенных через гликозидную связь.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый частично гидролизованный глицеролипид. В аспекте этого варианта осуществления изобретения фармацевтически приемлемый частично гидролизованный глицеролипид является триглицеридом, частично гидролизированным в смесь моно-, ди- и триглицеридов.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый гликолевый эфир жирной кислоты. Фармацевтически приемлемый гликолевый эфир жирной кислоты может представлять собой моноэфир гликоля, диэфир гликоля или триэфир гликоля. Гликолевые эфиры жирных кислот включают, без ограничения, этиленгликолевый эфир жирной кислоты, диэтиленгликолевый эфир жирной кислоты, пропиленгликолевый эфир жирной кислоты, дипропиленовый эфир жирной кислоты. Неограничивающие примеры гликолевых эфиров жирных кислот включают, например, этиленгликоля каприлат, этиленгликоля пеларгонат, этиленгликоля капрат, этиленгликоля ундецилат, этиленгликоля лаурат, этиленгликоля тридецилат, этиленгликоля миристат, этиленгликоля миристолат, этиленгликоля пентадециклат, этиленгликоля пальмитат, этиленгликоля пальмитолеат, этиленгликоля сапиенат, этиленгликоля маргарат, этиленгликоля стеарат, этиленгликоля пальмитостеарат, этиленгликоля олеат, этиленгликоля элаидат, этиленгликоля вакценат, этиленгликоля линолеат, этиленгликоля линоэлаидат, этиленгликоля α-линоленат, этиленгликоля γ-линоленат, этиленгликоля стеаридонат, этиленгликоля каприлокапрат, этиленгликоля дикаприлокапрат, диэтиленгликоля каприлат, диэтиленгликоля пеларгонат, диэтиленгликоля капрат, диэтиленгликоля ундецилат, диэтиленгликоля лаурат, диэтиленгликоля тридецилат, диэтиленгликоля миристат, диэтиленгликоля миристолат, диэтиленгликоля пентадециклат, диэтиленгликоля пальмитат, диэтиленгликоля пальмитолеат, диэтиленгликоля сапиенат, диэтиленгликоля маргарат, диэтиленгликоля стеарат, диэтиленгликоля пальмитостеарат, диэтиленгликоля олеат, диэтиленгликоля элаидат, диэтиленгликоля вакценат, диэтиленгликоля линолеат, диэтиленгликоля линоэлаидат, диэтиленгликоля α-линоленат, диэтиленгликоля γ-линоленат, диэтиленгликоля стеаридонат, диэтиленгликоля каприлокапрат, диэтиленгликоля дикаприлокапрат, пропиленгликоля каприлат, пропиленгликоля пеларгонат, пропиленгликоля капрат, пропиленгликоля ундецилат, пропиленгликоля лаурат, пропиленгликоля тридецилат, пропиленгликоля миристат, пропиленгликоля миристолат, пропиленгликоля пентадециклат, пропиленгликоля пальмитат, пропиленгликоля пальмитолеат, пропиленгликоля сапиенат, пропиленгликоля маргарат, пропилена стеарат, пропиленгликоля пальмитостеарат, пропиленгликоля олеат, пропиленгликоля элаидат, пропиленгликоля вакценат, пропиленгликоля линолеат, пропиленгликоля линоэлаидат, пропиленгликоля α-линоленат, пропиленгликоля γ-линоленат, пропиленгликоля стеаридонат, пропиленгликоля каприлокапрат, пропиленгликоля дикаприлокапрат, дипропиленгликоля каприлат, дипропиленгликоля пеларгонат, дипропиленгликоля капрат, дипропиленгликоля ундецилат, дипропиленгликоля лаурат, дипропиленгликоля тридецилат, дипропиленгликоля миристат, дипропиленгликоля миристолат, дипропиленгликоля пентадециклат, дипропиленгликоля пальмитат, дипропиленгликоля пальмитолеат, дипропиленгликоля сапиенат, дипропиленгликоля маргарат, дипропиленгликоля стеарат, дипропиленгликоля пальмитостеарат, дипропиленгликоля олеат, дипропиленгликоля элаидат, дипропиленгликоля вакценат, дипропиленгликоля линолеат, дипропиленгликоля линоэлаидат, дипропиленгликоля α-линоленат, дипропиленгликоля γ-линоленат, дипропиленгликоля стеаридонат, дипропиленгликоля каприлокапрат, дипропиленгликоля дикаприлокапрат или любую их комбинацию.
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться фармацевтически приемлемый сложный эфир простого полиэфира и жирной кислоты. Фармацевтически приемлемый сложный эфир простого полиэфира и жирной кислоты может представлять собой моноэфир жирной кислоты и простого полиэфира, диэфир жирной кислоты и простого полиэфира или триэфир жирной кислоты и простого полиэфира. Сложный эфир простого полиэфира и жирной кислоты включает, без ограничения, сложный эфир PEG и жирной кислоты, PEG-глицерил жирной кислоты, глицерид сложного эфира PEG и жирной кислоты, сложный эфир PPG и жирной кислоты, PPG-глицерил жирной кислоты, глицерид сложного эфира PPG и жирной кислоты. PEG или PPG могут иметь молекулярную массу, составляющую например, 5-20000 Да. Неограничивающие примеры сложных эфиров простых полиэфиров и жирных кислот включают, например, PEG каприлат, PEG пеларгонат, PEG капрат, PEG ундецилат, PEG лаурат, PEG тридецилат, PEG миристат, PEG миристолат, PEG пентадециклат, PEG пальмитат, PEG пальмитолеат, PEG сапиенат, PEG маргарат, PEG стеарат, PEG пальмитостеарат, PEG олеат, PEG элаидат, PEG вакценат, PEG линолеат, PEG линоэлаидат, PEG α-линоленат, PEG γ-линоленат, PEG стеаридонат PEG каприлокапрат, PEG дикаприлокапрат, PEG-глицерил каприлат, PEG-глицерил пеларгонат, PEG-глицерил капрат, PEG-глицерил ундецилат, PEG-глицерил лаурат, PEG-глицерил тридецилат, PEG-глицерил миристат, PEG-глицерил миристолат, PEG-глицерил пентадециклат, PEG-глицерил пальмитат, PEG-глицерил пальмитолеат, PEG-глицерил сапиенат, PEG-глицерил маргарат, PEG-глицерил стеарат, PEG-глицерил пальмитостеарат, PEG-глицерил олеат, PEG-глицерил элаидат, PEG-глицерил вакценат, PEG-глицерил линолеат, PEG-глицерил линоэлаидат, PEG-глицерил α-линоленат, PEG-глицерил γ-линоленат, PEG-глицерил стеаридонат, PEG-глицерил каприлокапрат, PEG-глицерил дикаприлокапрат, каприлоил-PEG глицерид, пеларгоноил-PEG глицерид, капроил-PEG глицерид, ундецилоил-PEG глицерид, лауроил-PEG глицерид, тридецилоил-PEG глицерид, миристоил-PEG глицерид, миристолоил-PEG глицерид, пентадециклоил-PEG глицерид, пальмитоил-PEG глицерид, пальмитолеоил-PEG глицерид, сапиеноил-PEG глицерид, маргароил-PEG глицерид, стеароил-PEG глицерид, пальмитостеароил-PEG глицерид, олеоил-PEG глицерид, элаидоил-PEG глицерид, вакценоил-PEG глицерид, линолеоил-PEG глицерид, линоэлаидоил-PEG глицерид, α-линоленоил-PEG глицерид, γ-линоленоил-PEG глицерид, стеаридоноил-PEG глицерид, каприлкапроил-PEG глицерид, дикаприлкапроил-PEG глицерид, PPG каприлат, PPG пеларгонат, PPG капрат, PPG ундецилат, PPG лаурат, PPG тридецилат, PPG миристат, PPG миристолат, PPG пентадециклат, PPG пальмитат, PPG пальмитолеат, PPG сапиенат, PPG маргарат, PPG стеарат, PPG пальмитостеарат, PPG олеат, PPG элаидат, PPG вакценат, PPG линолеат, PPG линоэлаидат, PPG α-линоленат, PPG γ-линоленат, стеаридонат PPG, каприлокапрат PPG, дикаприлокапрат PPG, PPG-глицерил каприлат, PPG-глицерил пеларгонат, PPG-глицерил капрат, PPG-глицерил ундецилат, PPG-глицерил лаурат, PPG-глицерил тридецилат, PPG-глицерил миристат, PPG-глицерил миристолат, PPG-глицерил пентадециклат, PPG-глицерил пальмитат, PPG-глицерил пальмитолеат, PPG-глицерил сапиенат, PPG-глицерил маргарат, PPG-глицерил стеарат, PPG-глицерил пальмитостеарат, PPG-глицерил олеат, PPG-глицерил элаидат, PPG-глицерил вакценат, PPG-глицерил линолеат, PPG-глицерил линоэлаидат, PPG-глицерил α-линоленат, PPG-глицерил γ-линоленат, PPG-глицерил стеаридонат, PPG-глицерил каприлокапрат, PPG-глицерил дикаприлокапрат, каприлоил-PPG глицерид, пеларгоноил-PPG глицерид, капроил-PPG глицерид, ундецилоил-PPG глицерид, лауроил-PPG глицерид, тридецилоил-PPG глицерид, миристоил-PPG глицерид, миристолоил-PPG глицерид, пентадециклоил-PPG глицерид, пальмитоил-PPG глицерид, пальмитолеоил-PPG глицерид, сапиеноил-PPG глицерид, маргароил-PPG глицерид, стеароил-PPG глицерид, пальмитостеароил-PPG глицерид, олеоил-PPG глицерид, элаидоил-PPG глицерид, вакценоил-PPG глицерид, линолеоил-PPG глицерид, линоэлаидоил-PPG глицерид, α-линоленоил-PPG глицерид, γ-линоленоил-PPG глицерид, стеаридоноил-PPG глицерид, каприлкапроил-PPG глицерид, дикаприлкапроил-PPG глицерид или любую их комбинацию.
Коммерчески доступные фармацевтически приемлемые сложные эфиры простых полиэфиров и жирных кислот включают, без ограничения, каприлкапроил-макрогол-8 глицериды (LABRASOL®), пропиленгликоля монопальмитостеарат (MONOSTEOL®), глицерилдибегенат (COMPRITOL® 888), бегенат глицерина (COMPRITOL® Е АТО), бегеноил-полиоксил-8 глицериды (COMPRITOL® HD5 ATO), диизостеарат триглицерина (PLUROL® Diisostearique), PEG-8 пчелиный воск (APIFIL®), лауроил-макрогол-32 глицериды (GELUCIRE 44/14), стеароил макрогол-32 глицериды (GELUCIRE 50,13), пропиленгликоля дикаприлокапрат (LABRAFAC® PG), полиглицерина-3 диолеат (PLUROL® Oleique CC 497), пропиленгликоля монолаурат (тип I), (LAUROGLYCOL® FCC), пропиленгликоля монолаурат (тип II), (LAUROGLYCOL® 90), пропиленгликоля монокаприлат (тип I) (CAPRYOL® PGMC), пропиленгликоля монокаприлат (тип II) (CAPRYOL® 90), линолеоил-макрогол-6 глицериды (LABRAFIL® M2125CS), олеоил-макрогол-6 глицериды (LABRAFIL® M1944CS), лауроил-макрогол-6 глицериды (LABRAFIL® M2130CS), дипальмитостеарат глицерина (Biogapress Vegetal BM297ATO), дистеарат глицерина (тип I) (PRECIROL® ATO 5) и монолинолеат глицерина (MAISINE™ 35-1).
Липидом, подходящим для фармацевтических композиций, раскрытых в данном документе, может являться смесь фармацевтически приемлемых липидов. Примеры смесей фармацевтически приемлемых липидов включают, без ограничения, смесь одного или нескольких глицеролипидов, раскрытых в данном документе, смесь одного или нескольких гликолевых эфиров жирных кислот раскрытых в данном документе, смесь нескольких эфиров простых полиэфиров и жирных кислот, раскрытых в данном документе, смесь нескольких глицеридов, раскрытых в данном документе.
В аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов, имеющую температуру плавления, например, примерно 33°C, примерно 34°C, примерно 35°C, примерно 36°C, примерно 37°C, примерно 38°C, примерно 39°C, примерно 40°C, примерно 41°C, примерно 43°C, примерно 43°C, примерно 44°C, примерно 45°C, примерно 45°C, примерно 47°C, примерно 48°C, примерно 49°C, примерно 50°C. В аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов, имеющую температуру плавления, например, от примерно 30°C до примерно 44°C, от примерно 30°C до примерно 45°C, от примерно 30°C до примерно 46°C, от примерно 30°C до примерно 47°C, от примерно 30°C до примерно 48°C, от примерно 30°C до примерно 49°C, от примерно 30°C до примерно 50°C, от примерно 32°C до примерно 44°C, от примерно 32°C до примерно 45°C, от примерно 32°C до примерно 46°C, от примерно 32°C до примерно 47°C, от примерно 32°C до примерно 48°C, от примерно 32°C до примерно 49°C, от примерно 32°C до примерно 50°C, от примерно 34°C до примерно 44°C, от примерно 34°C до примерно 45°C, от примерно 34°C до примерно 46°C, от примерно 34°C до примерно 47°C, от примерно 34°C до примерно 48°C, от примерно 34°C до примерно 49°C, от примерно 34°C до примерно 50°C, от примерно 36°C до примерно 44°C, от примерно 36°C до примерно 45°C, от примерно 36°C до примерно 46°C, от примерно 36°C до примерно 47°C, от примерно 36°C до примерно 48°C, от примерно 36°C до примерно 49°C, от примерно 36°C до примерно 50°C, от примерно 38°C до примерно 44°C, от примерно 38°C до примерно 45°C, от примерно 38°C до примерно 46°C, от примерно 38°C до примерно 47°C, от примерно 38°C до примерно 48°C, от примерно 38°C до примерно 49°C, от примерно 38°C до примерно 50°C, от примерно 40°C до примерно 44°C, от примерно 40°C до примерно 45°C, от примерно 40°C до примерно 46°C, от примерно 40°C до примерно 47°C, от примерно 40°C до примерно 48°C, от примерно 40°C до примерно 49°C, от примерно 40°C до примерно 50°C, от примерно 42°C до примерно 44°C, от примерно 42°C до примерно 45°C, от примерно 42°C до примерно 46°C, от примерно 42°C до примерно 47°C, от примерно 42°C до примерно 48°C, от примерно 42°C до примерно 49°C или от примерно 42°C до примерно 50°C.
В других аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь сложных эфиров PEG и жирных кислот, имеющую температуру плавления, например, примерно 33°C, примерно 34°C, примерно 35°C, примерно 36°C, примерно 37°C, примерно 38°C, примерно 39°C, примерно 40°C, примерно 41°C, примерно 43°C, примерно 43°C, примерно 44°C, примерно 45°C, примерно 45°C, примерно 47°C, примерно 48°C, примерно 49°C, примерно 50°C. В аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь сложных эфиров PEG и жирных кислот, имеющую температуру плавления, например, от примерно 30°C до примерно 44°C, от примерно 30°C до примерно 45°C, от примерно 30°C до примерно 46°C, от примерно 30°C до примерно 47°C, от примерно 30°C до примерно 48°C, от примерно 30°C до примерно 49°C, от примерно 30°C до примерно 50°C, от примерно 32°C до примерно 44°C, от примерно 32°C до примерно 45°C, от примерно 32°C до примерно 46°C, от примерно 32°C до примерно 47°C, от примерно 32°C до примерно 48°C, от примерно 32°C до примерно 49°C, от примерно 32°C до примерно 50°C, от примерно 34°C до примерно 44°C, от примерно 34°C до примерно 45°C, от примерно 34°C до примерно 46°C, от примерно 34°C до примерно 47°C, от примерно 34°C до примерно 48°C, от примерно 34°C до примерно 49°C, от примерно 34°C до примерно 50°C, от примерно 36°C до примерно 44°C, от примерно 36°C до примерно 45°C, от примерно 36°C до примерно 46°C, от примерно 36°C до примерно 47°C, от примерно 36°C до примерно 48°C, от примерно 36°C до примерно 49°C, от примерно 36°C до примерно 50°C, от примерно 38°C до примерно 44°C, от примерно 38°C до примерно 45°C, от примерно 38°C до примерно 46°C, от примерно 38°C до примерно 47°C, от примерно 38°C до примерно 48°C, от примерно 38°C до примерно 49°C, от примерно 38°C до примерно 50°C, от примерно 40°C до примерно 44°C, от примерно 40°C до примерно 45°C, от примерно 40°C до примерно 46°C, от примерно 40°C до примерно 47°C, от примерно 40°C до примерно 48°C, от примерно 40°C до примерно 49°C, от примерно 40°C до примерно 50°C, от примерно 42°C до примерно 44°C, от примерно 42°C до примерно 45°C, от примерно 42°C до примерно 46°C, от примерно 42°C до примерно 47°C, от примерно 42°C до примерно 48°C, от примерно 42°C до примерно 49°C или от примерно 42°C до примерно 50°C.
В других аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов и сложных эфиров PEG и жирных кислот, имеющую температуру плавления, например, примерно 33°C, примерно 34°C, примерно 35°C, примерно 36°C, примерно 37°C, примерно 38°C, примерно 39°C, примерно 40°C, примерно 41°C, примерно 43°C, примерно 43°C, примерно 44°C, примерно 45°C, примерно 45°C, примерно 47°C, примерно 48°C, примерно 49°C, примерно 50°C. В аспектах этого варианта осуществления изобретения смесь фармацевтически приемлемых липидов включает смесь моно-, ди- и/или триглицеридов и сложных эфиров PEG и жирных кислот, имеющую температуру плавления, например, от примерно 30°C до примерно 44°C, от примерно 30°C до примерно 45°C, от примерно 30°C до примерно 46°C, от примерно 30°C до примерно 47°C, от примерно 30°C до примерно 48°C, от примерно 30°C до примерно 49°C, от примерно 30°C до примерно 50°C, от примерно 32°C до примерно 44°C, от примерно 32°C до примерно 45°C, от примерно 32°C до примерно 46°C, от примерно 32°C до примерно 47°C, от примерно 32°C до примерно 48°C, от примерно 32°C до примерно 49°C, от примерно 32°C до примерно 50°C, от примерно 34°C до примерно 44°C, от примерно 34°C до примерно 45°C, от примерно 34°C до примерно 46°C, от примерно 34°C до примерно 47°C, от примерно 34°C до примерно 48°C, от примерно 34°C до примерно 49°C, от примерно 34°C до примерно 50°C, от примерно 36°C до примерно 44°C, от примерно 36°C до примерно 45°C, от примерно 36°C до примерно 46°C, от примерно 36°C до примерно 47°C, от примерно 36°C до примерно 48°C, от примерно 36°C до примерно 49°C, от примерно 36°C до примерно 50°C, от примерно 38°C до примерно 44°C, от примерно 38°C до примерно 45°C, от примерно 38°C до примерно 46°C, от примерно 38°C до примерно 47°C, от примерно 38°C до примерно 48°C, от примерно 38°C до примерно 49°C, от примерно 38°C до примерно 50°C, от примерно 40°C до примерно 44°C, от примерно 40°C до примерно 45°C, от примерно 40°C до примерно 46°C, от примерно 40°C до примерно 47°C, от примерно 40°C до примерно 48°C, от примерно 40°C до примерно 49°C, от примерно 40°C до примерно 50°C, от примерно 42°C до примерно 44°C, от примерно 42°C до примерно 45°C, от примерно 42°C до примерно 46°C, от примерно 42°C до примерно 47°C, от примерно 42°C до примерно 48°C, от примерно 42°C до примерно 49°C или от примерно 42°C до примерно 50°C.
Коммерчески доступные смеси фармацевтически приемлемых липидов включают, без ограничения, смеси PEG-6 стеарата и этиленгликоля пальмитостеарата и PEG-32 стеарата (TEFOSE® 1500; TEFOSE® 63), смеси трицетеарет-4 фосфата и этиленгликоля пальмитостеарата и диэтиленгликоля пальмитостеарата (SEDEFOS® 75), смеси глицерина моностеарата и PEG-75 стеарата (GELOT®), смеси цетилового спирта и этоксилированных жирных спиртов (сетет-2, стеарет-20) (EMULCIRE®), смеси насыщенных C10-C18 триглицеридов, имеющие температуру плавления около 33°С (GELUCIRE® 33/01), смеси насыщенных триглицеридов С10-С18, имеющие температуру плавления около 39°С (GELUCIRE® 39/01), смеси насыщенных триглицеридов С10-С18, имеющие температуру плавления около 43°С (GELUCIRE® 43/01), смеси моностеарата глицерина 40-55 (тип I) и диглицеридов (GELEOL® Моно и Диглицериды), а также смеси триглицеридов со средней длиной цепи (LABRAFAC® Lipophile WL 1349).
В аспектах настоящего описания раскрывается, в частности, фармацевтически приемлемый стабилизирующий агент. Стабилизирующий агент снижает или исключает образование сложных эфиров терапевтического соединения, которые могут быть результатом нежелательного взаимодействия с конкретным используемым растворителем. Стабилизирующий агент включает, без ограничения, воду, протекторную кислоту, содержащую жирнокислотный компонент и уксусную кислоту, этилацетат, ацетат натрия/уксусную кислоту (E262), моноглицерид, ацетилированный моноглицерид, диглицерид, ацетилированный моноглицерид, ацетилированный диглицерид, жирную кислоту и соль жирной кислоты.
В одном варианте осуществления изобретения фармацевтически приемлемый стабилизирующий агент может включать фармацевтически приемлемый эмульгатор. Эмульгатор (также известный как эмульгент) представляет собой вещество, которое стабилизирует эмульсию, содержащую жидкую дисперсную фазу и жидкую дисперсионную фазу, повышая ее кинетическую стабильность. Таким образом, в ситуации, когда растворитель и адъювант, используемые для создания фармацевтической композиции, раскрытой в данном документе, обычно не смешиваются, для создания однородной и стабильной эмульсии используется эмульгатор, раскрытый в данном документе. Эмульгатор включает в себя, без ограничения, поверхностно-активное вещество, полисахарид, лектин и фосфолипид.
В одном аспекте этого варианта осуществления изобретения эмульгатор может включать поверхностно-активное вещество. Используемый в данном документе термин «поверхностно-активное вещество» относится к природному или синтетическому амфифильному соединению. Поверхностно-активное вещество может быть неионным, цвиттер-ионным или ионным. Неограничивающие примеры поверхностно-активных веществ включают полисорбаты, такие как полисорбат 20 (TWEEN® 20), полисорбат 40 (TWEEN® 40), полисорбат 60 (TWEEN® 60), полисорбат 61 (TWEEN® 61), полисорбат 65 (TWEEN® 65), полисорбат 80 (TWEEN® 80) и полисорбат 81 (TWEEN® 81); полоксамеры (полиэтилен-полипропиленовые сополимеры), такие как Полоксамер 124 (PLURONIC® L44), Полоксамер 181 (PLURONIC® L61), Полоксамер 182 (PLURONIC® L62), Полоксамер 184 (PLURONIC® L64), Полоксамер 188 (PLURONIC® F68), Полоксамер 237 (PLURONIC ® F87), Полоксамер 338 (PLURONIC® L108), Полоксамер 407 (PLURONIC® F127), полиоксиэтиленгликоль-додецильные эфиры, такие как BRIJ® 30 и BRIJ® 35; 2-додекоксиэтанол (LUBROL®-PX); полиоксиэтиленоктилфениловый эфир (TRITON® X-100); додецилсульфат натрия (SDS); 3-[(3-холамидопропил)диметиламмоний]-1-пропансульфонат (CHAPS); 3-[(3-холамидопропил)диметиламмоний]-2-гидрокси-1-пропансульфонат (CHAPSO); монолаурат сахарозы; и холат натрия. Другие не ограничивающие примеры вспомогательных поверхностно-активных веществ можно найти, например, в Ansel, supra, (1999); Gennaro, supra, (2000); Hardman, supra, (2001); и Rowe, supra, (2003), которые полностью включены в данный документ путем ссылки.
В аспекте этого варианта осуществления изобретения эмульгатор может включать полисахарид. Неограничивающие примеры полисахаридов включают гуаровую камедь, агар, альгинат, Calgene, декстран (например, декстран 1К, декстран 4K, декстран 40K, декстран 60K и декстран 70K), декстрин, гликоген, инулин, крахмал, производное крахмала (например, гидроксиметилированный крахмал, гидроксиэтилированный крахмал, гидроксипропилированный крахмал, гидроксибутилированный крахмал и гидроксипентилированный крахмал), гетакрахмал, целлюлозу, FICOLL, метилцеллюлозу (MC), карбоксиметилцеллюлозу (CMC), гидроксиэтилцеллюлозу (НЕС), гидроксипропилцеллюлозу (HPC), гидроксиэтилметилцеллюлозу (HEMC), гидроксипропилметилцеллюлозу (HPMC); поливинилацетаты (PVA); поливинилпирролидоны (PVP), также известные как повидоны, имеющие К-значение меньше или равное 18, К-значение выше 18 или меньше или равное 95, или К-значение выше 95, как PVP 12 (KOLLIDON® 12), PVP 17 (KOLLIDON® 17), PVP 25 (KOLLIDON® 25), PVP 30 (KOLLIDON® 30), PVP 90 (KOLLIDON® 90); и полиэтиленимины (PEI).
В аспекте этого варианта осуществления изобретения эмульгатор может включать лектин. Лектины представляют собой связывающие сахара белки, которые являются высокоспецифичными к своим молекулам сахаров. Лектины могут классифицироваться по молекулам сахаров, с которыми они связываются, и включают, без ограничения, маннозосвязывающие лектины, галактозо/N-ацетилгалактозамин-связывающие лектины, N-ацетилглюкозамин-связывающие лектины, N-ацетилнейрамин-связывающие лектины, N- ацетилнейраминовую кислоту связывающие лектины и фукозосвязывающие лектины. Неограничивающие примеры поверхностно-активных веществ включают конканавалин А, лектин из чечевицы, лектин из подснежников, Roin, арахисовый агглютинин, jacain, лектин из вики мохнатой, агглютинин из зародышей пшеницы, лектин из бузины, лейкоагглютинин из Maackia anurensis, гемагглютинин из Maackia anurensis, агглютинин из Ulex europaeus и лектин из Aleuria aurantia.
В аспекте этого варианта осуществления изобретения эмульгатор может включать фосфолипид. Структура фосфолипида обычно содержит гидрофобный хвост и гидрофильную головку и носит амфипатический характер. Большинство фосфолипидов содержат диглицерид, фосфатную группу и простые органические молекулы, такие как холин; единственным исключением из этого правила является сфингомиелин, который является производным сфингозина вместо глицерина. Фосфолипиды включают, без ограничения, диацилглицериды и фосфосфинголипиды. Неограничивающие примеры диацилглицеридов включают фосфатидную кислоту (фосфатидат) (PA) фосфатидилэтаноламин (цефалин) (PE), фосфатидилхолин (лецитин) (PC), а фосфатидилсерин (PS), и фосфоинозитиды, включающие фосфатидилинозитол (PI), фосфатидилинозитол фосфат (PIP), фосфатидилинозитол бисфосфат (PIP2), и фосфатидилинозитол трифосфат (PIP3). Неограничивающие примеры фосфосфинголипидов включают в себя церамидфосфорилхолин (сфингомиелин) (SPH), церамидфосфорилэтаноламин (сфингомиелин) (Cer-PE) и церамидфосфорилглицерин.
В одном варианте осуществления изобретения фармацевтически приемлемый стабилизирующий агент не содержит фармацевтически приемлемый эмульгатор.
В другом варианте осуществления изобретения фармацевтическая композиция не содержит фармацевтически приемлемый эмульгатор.
Фармацевтические композиции, раскрытые в данном документе, действуют в качестве системы доставки, которая обеспечивает возможность более эффективной доставки или направленного переноса терапевтического соединения, раскрытого в данном документе, в определенный тип клеток, ткань, орган или область тела таким образом, чтобы более эффективно ингибировать провоспалительную реакцию. Это ингибирование приводит к увеличению эффективности лечения хронического воспаления. Например, фармацевтическая композиция, раскрытая в данном документе, может облегчить доставку терапевтического соединения, раскрытого в данном документе, в макрофаги. Одним из возможных механизмов для достижения этого селективного биораспределения, является создание фармацевтических композиций, раскрытых в данном документе, где используются преимущества функций хиломикронов. Хиломикроны представляют собой относительно большие липопротеиновые частицы, имеющие диаметр от 75 нм до 1200 нм. Содержащие триглицериды (85-92%), фосфолипиды (6-12%), холестерин (1-3%) и аполипопротеины (1-2%), хиломикроны переносят пищевые липиды из кишечника в другие места в организме. Хиломикроны являются одной из пяти основных групп липопротеинов, другие представляют собой VLDL, IDL, липопротеины низкой плотности (LDL), липопротеины высокой плотности (HDL), которые позволяют жирам и холестерину передвигаться в кровотоке, являющимся водным раствором.
Во время пищеварения, жирные кислоты и холестерин процессируются в желудочно-кишечном тракте под действием панкреатических соков, включающих липазы, и эмульгируются желчными солями с образованием мицелл. Эти мицеллы позволяют поглощение липидов в качестве свободных жирных кислот поглощающими клетками тонкого кишечника, известными как энтероциты. После вхождения в энтероциты триглицериды и холестерин собираются в незрелые хиломикроны. Незрелые хиломикроны в основном состоит из триглицеридов (85%) и содержат некоторое количество холестерина и эфиров холестерина. Основным аполипопротеиновым компонентом является аполипопротеин В-48 (APOB48). Эти незрелые хиломикроны высвобождаются из энтероцитов путем экзоцитоза в млечные сосуды, лимфатические сосуды, берущие начало в ворсинках тонкой кишки, а затем секретируются в кровоток в месте соединения грудного протока с левой подключичной веной.
Во время циркуляции в лимфе и крови хиломикроны обмениваются компонентамии с HDL. HDL отдает аполипопротеин C-II (APOC2) и аполипопротеин Е (APOE) незрелому хиломикрону и, таким образом, превращает его в зрелый хиломикрон (часто называемый просто «хиломикроном»). APOC2 является кофактором активности липопротеин-липазы (LPL). После распределения триглицеридов по хранилищам, хиломикрон возвращает APOC2 в HDL (но сохраняет APOE) и, таким образом, становится остаточным хиломикроном, теперь имеющим размер только 30-50 нм. APOB48 и АРОЕ важны для идентификации остаточного хиломикрона в печени для эндоцитоза и расщепления на липопротеины (VLDL, LDL и HDL). Эти липопротеины процессируются и хранятся в компетентных клетках, включая, например, гепатоциты, адипоциты и макрофаги. Таким образом, не ограничиваясь какой-либо конкретной теорией, авторы предполагают, что при пероральном введении фармацевтическая композиция, раскрытая в данном документе, может процессироваться в мицеллы, находясь в желудочно-кишечном тракте, абсорбироваться энтероцитами и собираться в незрелые хиломикроны, оставаясь ассоциированной с остаточными хиломикронами, поглощаемыми печенью и, наконец, попадая в макрофаги, которые присутствуют в воспаленных тканях.
В качестве другого примера, фармацевтическая композиция раскрытая в данном документе, может облегчить доставку терапевтического соединения, раскрытого в данном документе, в дендритные клетки. Одним из возможных механизмов для достижения этого селективного биораспределения, является создание фармацевтических композиций, раскрытых в данном документе, где используются преимущества эндоцитозной/фагоцитарной активности дендритных клеток. Дендритные клетки представляют собой иммунные клетки, образующие часть иммунной системы млекопитающих. Основная функция дендритных клеток состоит в процессинге антигенного материала и представлении его на поверхности другим клеткам иммунной системы. Таким образом, дендритные клетки функционируют в качестве антиген-представляющих клеток, которые действуют в качестве мессенджеров между системой врожденного и приобретенного иммунитета. Дендритные клетки присутствуют в тканях, находящихся в контакте с внешней средой, таких как, например, кожа (где присутствуют специализированный тип дендритных клеток, называемых клетками Лангерганса) и внутренняя выстилка носа, легких, желудка и кишечника. Эти клетки также могут быть найдены в незрелом состоянии в крови. После активации они мигрируют в лимфатические узлы, где взаимодействуют с Т- и В-клетками, чтобы инициировать и специализировать адаптивный иммунный ответ. Дендритные клетки, как известно, эндоцитируют и фагоцитируют липидные частицы, в качестве часть своих процессов мониторинга окружающей среды и представления антигена. Не желая ограничиваться какой-либо конкретной теорией, авторы предполагают, что при местном или ингаляционном введении фармацевтическая композиция, раскрытая в данном документе, может проникать в кожу или внутреннюю выстилку носа, легких, желудка и кишечника, эндоцитироваться/фагоцитироваться дендритными клетками, и в итоге попадать в Т-клетки и/или В-клетки, которые присутствуют в воспаленных тканях.
В аспектах настоящего описания раскрыт, в частности, способ получения фармацевтической композиции, раскрытой в данном документе. Способ, раскрытый в данном документе, включает в себя стадию контактирования фармацевтически приемлемого адъюванта, раскрытого в данном документе, с терапевтическим соединением, раскрытым в данном документе, в условиях, позволяющих терапевтическому соединению растворяться в фармацевтически приемлемом адъюванте, таким образом образуя фармацевтическую композицию, раскрытую в данном документе.
В аспектах настоящего описания раскрыт, в частности, способ получения фармацевтической композиции, раскрытой в данном документе. Способ, раскрытый в данном документе, включает в себя стадии а) контактирования фармацевтически приемлемого растворителя, раскрытого в данном документе, с терапевтическим соединением, раскрытым в данном документе, в условиях, позволяющих терапевтическому соединению растворяться в фармацевтически приемлемом растворителе, тем самым образуя раствор; и b) контактирования раствора, полученного на стадии (а) с фармацевтически приемлемым адъювантом, раскрытым в данном документе, в условиях, позволяющих образование фармацевтической композиции. Способы получения, раскрытые в данном документе, могут дополнительно включать стадию (с) удаления фармацевтически приемлемого растворителя из фармацевтической композиции.
Количество терапевтического соединения, которые вводят в контакт с фармацевтически приемлемым растворителем на стадии (а) способа может составлять любое требуемое количество. Факторы, используемые для определения используемого количества терапевтического соединения, включают, без ограничения, окончательное количество терапевтического соединения, желаемого в фармацевтической композиции, желаемую концентрацию терапевтического соединения в растворе, гидрофобность терапевтического соединения, липофобность терапевтического соединения, температуру, при которой осуществляется стадия контактирования (а), и время, за которое осуществляется стадия контактирования (а).
Объем фармацевтически приемлемого растворителя, используемого на стадии (а) способа, может составлять любой желаемый объем. Факторы, используемые для определения объема используемого фармацевтически приемлемого растворителя включают, без ограничения, желаемое конечное количество фармацевтической композиции, желаемую концентрацию терапевтического соединения в растворе, гидрофобность терапевтического соединения и липофобность терапевтического соединения.
В аспектах этого варианта осуществления изобретения количество терапевтического соединения, которое контактирует с растворителем на стадии (а), может составлять, например, по меньшей мере 10 мг, по меньшей мере 20 мг, по меньшей мере 30 мг, по меньшей мере 40 мг, по меньшей мере 50 мг, по меньшей мере 60 мг, по меньшей мере 70 мг, по меньшей мере 80 мг, по меньшей мере 90 мг, по меньшей мере 100 мг, по меньшей мере 200 мг, по меньшей мере 300 мг, по меньшей мере 400 мг, по меньшей мере 500 мг, по меньшей мере 600 мг, по меньшей мере 700 мг, по меньшей мере 800 мг, по меньшей мере 900 мг, по меньшей мере 1000 мг, по меньшей мере 1100 мг, по меньшей мере 1200 мг, по меньшей мере 1300 мг, по меньшей мере 1400 мг или по меньшей мере 1500 мг. В других аспектах этого варианта осуществления изобретения количество терапевтического соединения, которое контактирует с растворителем на стадии (а), может находиться в диапазоне, например, от примерно 10 мг до примерно 100 мг, от примерно 50 мг до примерно 150 мг, от примерно 100 мг до примерно 250 мг, от примерно 150 мг до примерно 350 мг, от примерно 250 мг до примерно 500 мг, от примерно 350 мг до примерно 600 мг, от примерно 500 мг до примерно 750 мг, от примерно 600 мг до примерно 900 мг, от примерно 750 мг до примерно 1000 мг, от примерно 850 мг до примерно 1200 мг или от примерно 1000 мг до примерно 1500 мг. В других аспектах этого варианта осуществления изобретения количество терапевтического соединения, которое растворяется в растворителе на стадии (а), может находиться в диапазоне, например, от примерно 10 мг до примерно 250 мг, от примерно 10 мг до примерно 500 мг, от примерно 10 мг до примерно 750 мг, от примерно 10 мг до примерно 1000 мг, от примерно 10 мг до примерно 1500 мг, от примерно 50 мг до примерно 250 мг, от примерно 50 мг до примерно 500 мг, от примерно 50 мг до примерно 750 мг, от примерно 50 мг до примерно 1000 мг, от примерно 50 мг до примерно 1500 мг, от примерно 100 мг до примерно 250 мг, от примерно 100 мг до примерно 500 мг, от примерно 100 мг до примерно 750 мг, от примерно 100 мг до примерно 1000 мг, от примерно 100 мг до примерно 1500 мг, от примерно 200 мг до примерно 500 мг, от примерно 200 мг до примерно 750 мг, от примерно 200 мг до примерно 1000 мг или от примерно 200 мг до примерно 1500 мг.
Стадию (а) можно проводить при комнатной температуре, для того чтобы позволить терапевтическому соединению полностью раствориться в фармацевтически приемлемом растворителе. Однако в других вариантах осуществления способа стадию (а) можно проводить при температуре выше комнатной. В аспектах этого варианта осуществления изобретения стадию (а) можно проводить при температуре, например, выше 21°C, выше 25°C, выше 30°C, выше 35°C или выше 37°C, выше 40°C, выше 42°C, выше 45°C, выше 50°C, выше 55°C или выше 60°C. В аспектах этого варианта осуществления изобретения стадию (а) можно проводить при температуре, например, от примерно 20°C до примерно 30°C, от примерно 25°C до примерно 35°C, от примерно 30°C до примерно 40°C, от примерно 35°C до примерно 45°C, от примерно 40°C до примерно 50°C, от примерно 45°C до примерно 55°C или от примерно 50°C до примерно 60°C. В некоторых случаях стадию (а) можно проводить при температуре ниже комнатной, для того чтобы позволить терапевтическому соединению полностью раствориться в растворителе. Однако в других вариантах осуществления способа стадию (а) можно проводить при температуре ниже комнатной, например, ниже 10°C, выше 5°C, выше 0°C, выше -10°C или выше -20°C. Контактирование на стадии (а) может включать смешивание терапевтического соединения и фармацевтически приемлемого растворителя, например, посредством перемешивания, переворачивания, озвучивания или встряхивания. Смешивание можно проводить в течение, например, по меньшей мере 1 секунды, по меньшей мере 5 секунд, по меньшей мере 10 секунд, по меньшей мере 20 секунд, по меньшей мере 30 секунд, по меньшей мере 45 секунд, по меньшей мере 60 секунд или большего времени до полного растворения терапевтического соединения в растворителе.
После контактирования концентрация терапевтического соединения, раскрытого в данном документе, в растворе может составлять любую желаемую концентрацию. В аспектах этого варианта осуществления изобретения концентрация терапевтического соединения, раскрытого в данном документе, в растворе может составлять, например, по меньшей мере 0,00001 мг/мл, по меньшей мере 0,0001 мг/мл, по меньшей мере 0,001 мг/мл, по меньшей мере 0,01 мг/мл, по меньшей мере 0,1 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 100 мг/мл, по меньшей мере 200 мг/мл, по меньшей мере 500 мг/мл, по меньшей мере 700 мг/мл, по меньшей мере 1000 мг/мл или по меньшей мере 1200 мг/мл. В других аспектах этого варианта осуществления изобретения концентрация терапевтического соединения, раскрытого в данном документе, в растворе может составлять, например, самое большее 1000 мг/мл, самое большее 1100 мг/мл, самое большее 1200 мг/мл, самое большее 1300 мг/мл, самое большее 1400 мг/мл, самое большее 1500 мг/мл, самое большее 2000 мг/мл, самое большее 2000 мг/мл или самое большее 3000 мг/мл. В других аспектах этого варианта осуществления изобретения концентрация терапевтического соединения, раскрытого в данном документе, в растворе может находиться в диапазоне, например, от примерно 0,00001 мг/мл до примерно 3000 мг/мл, от примерно 0,0001 мг/мл до примерно 3000 мг/мл, от примерно 0,01 мг/мл до примерно 3000 мг/мл, от примерно 0,1 мг/мл до примерно 3000 мг/мл, от примерно 1 мг/мл до примерно 3000 мг/мл, от примерно 250 мг/мл до примерно 3000 мг/мл, от примерно 500 мг/мл до примерно 3000 мг/мл, от примерно 750 мг/мл до примерно 3000 мг/мл, от примерно 1000 мг/мл до примерно 3000 мг/мл, от примерно 100 мг/мл до примерно 2000 мг/мл, от примерно 250 мг/мл до примерно 2000 мг/мл, от примерно 500 мг/мл до примерно 2000 мг/мл, от примерно 750 мг/мл до примерно 2000 мг/мл, от примерно 1000 мг/мл до примерно 2000 мг/мл, от примерно 100 мг/мл до примерно 1500 мг/мл, от примерно 250 мг/мл до примерно 1500 мг/мл, от примерно 500 мг/мл до примерно 1500 мг/мл, от примерно 750 мг/мл до примерно 1500 мг/мл, от примерно 1000 мг/мл до примерно 1500 мг/мл, от примерно 100 мг/мл до примерно 1200 мг/мл, от примерно 250 мг/мл до примерно 1200 мг/мл, от примерно 500 мг/мл до примерно 1200 мг/мл, от примерно 750 мг/мл до примерно 1200 мг/мл, от примерно 1000 мг/мл до примерно 1200 мг/мл, от примерно 100 мг/мл до примерно 1000 мг/мл, от примерно 250 мг/мл до примерно 1000 мг/мл, от примерно 500 мг/мл до примерно 1000 мг/мл, от примерно 750 мг/мл до примерно 1000 мг/мл, от примерно 100 мг/мл до примерно 750 мг/мл, от примерно 250 мг/мл до примерно 750 мг/мл, от примерно 500 мг/мл до примерно 750 мг/мл, от примерно 100 мг/мл до примерно 500 мг/мл, от примерно 250 мг/мл до примерно 500 мг/мл, от примерно 0,00001 мг/мл до примерно 0,0001 мг/мл, от примерно 0,00001 мг/мл до примерно 0,001 мг/мл, от примерно 0,00001 мг/мл до примерно 0,01 мг/мл, от примерно 0,00001 мг/мл до примерно 0,1 мг/мл, от примерно 0,00001 мг/мл до примерно 1 мг/мл, от примерно 0,001 мг/мл до примерно 0,01 мг/мл, от примерно 0,001 мг/мл до примерно 0,1 мг/мл, от примерно 0,001 мг/мл до примерно 1 мг/мл, от примерно 0,001 мг/мл до примерно 10 мг/мл или от примерно 0,001 мг/мл до примерно 100 мг/мл.
Объем фармацевтически приемлемого адъюванта, используемого на стадии (b) способа, может составлять любой желаемый объем. Факторы, используемые для определения объема используемого фармацевтически приемлемого адъюванта включают, без ограничения, желаемое конечное количество фармацевтической композиции, желаемую концентрацию терапевтического соединения в фармацевтической композиции, используемое соотношение растворителя и адъюванта и смешиваемость растворителя и адъюванта.
В аспектах этого варианта осуществления изобретения соотношение растворителя и адъюванта может составлять, например, по меньшей мере 5:1, по меньшей мере 4:1, по меньшей мере 3:1, по меньшей мере 2:1, по меньшей мере 0:1, по меньшей мере 1:1, по меньшей мере 1:2, по меньшей мере 1:3, по меньшей мере 1:4, по меньшей мере 1:5, по меньшей мере 1:6, по меньшей мере 1:7, по меньшей мере 1:8, по меньшей мере 1:9, по меньшей мере 1:10, по меньшей мере 1:15, по меньшей мере 1:20 или по меньшей мере 1:25. В других аспектах этого варианта осуществления изобретения соотношение растворителя и адъюванта может находиться в диапазоне, например, от примерно 5:1 до примерно 1:25, от примерно 4:1 до примерно 1:25, от примерно 3:1 до примерно 1:25, от примерно 2:1 до примерно 1:25, от примерно 0:1 до примерно 1:25, от примерно 1:1 до примерно 1:25, от примерно 1:2 до примерно 1:25, от примерно 1:3 до примерно 1:25, от примерно 1:4 до примерно 1:25, от примерно 1:5 до примерно 1:25, от примерно 5:1 до примерно 1:20, от примерно 4:1 до примерно 1:20, от примерно 3:1 до примерно 1:20, от примерно 2:1 до примерно 1:20, от примерно 0:1 до примерно 1:20, от примерно 1:1 до примерно 1:20, от примерно 1:2 до примерно 1:20, от примерно 1:3 до примерно 1:20, от примерно 1:4 до примерно 1:20, от примерно 1:5 до примерно 1:20, от примерно 5:1 до примерно 1:15, от примерно 4:1 до примерно 1:15, от примерно 3:1 до примерно 1:15, от примерно 0:1 до примерно 1:15, от примерно 2:1 до примерно 1:15, от примерно 1:1 до примерно 1:15, от примерно 1:2 до примерно 1:15, от примерно 1:3 до примерно 1:15, от примерно 1:4 до примерно 1:15, от примерно 1:5 до примерно 1:15, от примерно 5:1 до примерно 1:12, от примерно 4:1 до примерно 1:12, от примерно 3:1 до примерно 1:12, от примерно 2:1 до примерно 1:12, от примерно 0:1 до примерно 1:12, от примерно 1:1 до примерно 1:12, от примерно 1:2 до примерно 1:12, от примерно 1:3 до примерно 1:12, от примерно 1:4 до примерно 1:12, от примерно 1:5 до примерно 1:12, от примерно 1:6 до примерно 1:12, от примерно 1:7 до примерно 1:12, от примерно 1:8 до примерно 1:12, от примерно 5:1 до примерно 1:10, от примерно 4:1 до примерно 1:10, от примерно 3:1 до примерно 1:10, от примерно 2:1 до примерно 1:10, от примерно 0:1 до примерно 1:10, от примерно 1:1 до примерно 1:10, от примерно 1:2 до примерно 1:10, от примерно 1:3 до примерно 1:10, от примерно 1:4 до примерно 1:10, от примерно 1:5 до примерно 1:10, от примерно 1:6 до примерно 1:10, от примерно 1:7 до примерно 1:10 или от примерно 1:8 до примерно 1:10.
Стадию (b) можно проводить при комнатной температуре, для того чтобы позволить раствору, содержащему терапевтическое соединение, образовать фармацевтическую композицию. Однако в других вариантах осуществления способа стадию (b) можно проводить при температуре выше комнатной. В аспектах этого варианта осуществления изобретения стадию (b) можно проводить при температуре, например, выше 21°C, выше 25°C, выше 30°C, выше 35°C или выше 37°C, выше 40°C, выше 42°C, выше 45°C, выше 50°C, выше 55°C или выше 60°C. В аспектах этого варианта осуществления изобретения стадию (а) можно проводить при температуре в диапазоне, например, от примерно 20°C до примерно 30°C, от примерно 25°C до примерно 35°C, от примерно 30°C до примерно 40°C, от примерно 35°C до примерно 45°C, от примерно 40°C до примерно 50°C, от примерно 45°C до примерно 55°C или от примерно 50°C до примерно 60°C. В некоторых случаях стадию (b) можно проводить при температуре ниже комнатной, для того чтобы позволить терапевтическому соединению полностью раствориться в фармацевтически приемлемом растворителе. Однако в других вариантах осуществления способа стадию (b) можно проводить при температуре ниже комнатной, например, ниже 10°C, выше 5°C, выше 0°C, выше -10°C или выше -20°C. Контактирование на стадии (b) может включать смешивание раствора и фармацевтически приемлемого адъюванта, например, посредством перемешивания, переворачивания, озвучивания или встряхивания. Смешивание можно проводить в течение, например, по меньшей мере 1 секунды, по меньшей мере 5 секунд, по меньшей мере 10 секунд, по меньшей мере 20 секунд, по меньшей мере 30 секунд, по меньшей мере 45 секунд, по меньшей мере 60 секунд или большего времени до образования фармацевтической композиции.
В некоторых вариантах осуществления изобретения может использоваться стадия быстрого охлаждения для снижения температуры фармацевтической композиции, раскрытой в данном документе, после ее образования. Например, стадия быстрого охлаждения может использоваться в процедурах, где используются температуры выше комнатной, для того чтобы позволить терапевтическому соединению полностью раствориться в фармацевтически приемлемом растворителе, и/или для того чтобы позволить образоваться фармацевтической композиции из раствора, содержащего терапевтическое соединение. В аспектах этого варианта осуществления изобретения стадия быстрого охлаждения приводит к снижению температуры, например, на примерно 30°C за 20 минут, на примерно 25°C за 20 минут, на примерно 20°C за 20 минут, на примерно 15°C за 20 минут, на примерно 30°C за 15 минут, на примерно 25°C за 15 минут, на примерно 20°C за 15 минут, на примерно 15°C за 15 минут, на примерно 30°C за 10 минут, на примерно 25°C за 10 минут, на примерно 20°C за 10 минут, на примерно 15°C за 10 минут, на примерно 30°C за 5 минут, на примерно 25°C за 5 минут, на примерно 20°C за 5 минут, на примерно 15°C за 5 минут. В других аспектах этого варианта осуществления изобретения стадия быстрого охлаждения приводит к снижению температуры, например, от примерно 20°C до примерно 30°C за 20 минут, от примерно 20°C до примерно 30°C за 15 минут, от примерно 20°C до примерно 30°C за 10 минут, от примерно 20°C до примерно 30°C за 5 минут, от примерно 15°C до примерно 25°C за 20 минут, от примерно 15°C до примерно 25°C за 15 минут, от примерно 15°C до примерно 25°C за 10 минут, от примерно 15°C до примерно 25°C за 5 минут, от примерно 10°C до примерно 20°C за 20 минут, от примерно 10°C до примерно 20°C за 15 минут, от примерно 10°C до примерно 20°C за 10 минут или от примерно 10°C до примерно 20°C за 5 минут.
В других аспектах этого варианта осуществления изобретения стадия быстрого охлаждения приводит к снижению температуры, составляющему, например, примерно 2,0°C/минуту, примерно 1,9°C/минуту, примерно 1,3°C/минуту, примерно 1,7°C/минуту, примерно 1,6°C/минуту, примерно 1,5°C/минуту, примерно 1,4°C/минуту, примерно 1,3°C/минуту, примерно 1,2°C/минуту, примерно 1,1°C/минуту, примерно 1,0°C/минуту, примерно 0,9°C/минуту, примерно 0,8°C/минуту, примерно 0,7°C/минуту, примерно 0,6°C/минуту, примерно 0,5°C/минуту, примерно 0,4°C/минуту, примерно 0,3°C/минуту, примерно 0,2°C/минуту или примерно 0,1°C/минуту. В других аспектах этого варианта осуществления изобретения стадия быстрого охлаждения приводит к снижению температуры, составляющему, например, от примерно 0,1°C до примерно 0,4°C/минуту, от примерно 0,2°C до примерно 0,6°C/минуту, от примерно 0,4°C до примерно 0,8°C/минуту, от примерно 0,6°C до примерно 1,0°C/минуту, от примерно 0,8°C до примерно 1,2°C/минуту, от примерно 1,0°C до примерно 1,4°C/минуту, от примерно 1,2°C до примерно 1,6°C/минуту, от примерно 1,4°C до примерно 1,8°C/минуту, от примерно 1,6°C до примерно 2,0°C/минуту, от примерно 0,1°C до примерно 0,5°C/минуту, от примерно 0,5°C до примерно 1,0°C/минуту, от примерно 1,0°C до примерно 1,5°C/минуту, от примерно 1,5°C до примерно 2,0°C/минуту, от примерно 0,5°C до примерно 1,5°C/минуту или от примерно 1,0°C до примерно 2,0°C/минуту.
В некоторых вариантах осуществления изобретения может использоваться температура выше комнатной, применяемая либо на стадии (а), либо на стадии (b), либо на обеих стадиях, для удаления растворителя из фармацевтической композиции. В другом варианте осуществления изобретения удаление растворителя из фармацевтической композиции требует отдельной стадии (с). На стадии (с) удаление растворителя из фармацевтической композиции может быть выполнено с использованием одной из множества процедур, известных в данной области, включая, без ограничений, выпаривание, диализ, испарение, лиофилизацию и фильтрацию. Эти процедуры удаления растворителя могут осуществляться при атмосферном давлении, при пониженном давлении или в вакууме, и либо при комнатной температуре, либо при температурах, требующих нагрева.
В одном варианте осуществления изобретения стадия (с) может обеспечить полное удаление фармацевтически приемлемого растворителя из фармацевтической композиции, раскрытой в данном документе. В аспектах этого варианта осуществления стадия (c) может обеспечить удаление, например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% фармацевтически приемлемого растворителя из фармацевтической композиции, раскрытой в данном документе.
Стадию (с) проводят при температуре, которая позволяет испарение фармацевтически приемлемого растворителя, раскрытого в данном документе, и таким образом, температура зависит от растворителя. Факторы, которые влияют на температуру испарения растворителя, раскрытого в данном документе, включают, без ограничения, конкретный используемый растворитель, количество присутствующего растворителя, конкретное присутствующее терапевтическое соединение, конкретный присутствующий адъювант, стабильность присутствующего терапевтического соединения, реакционную способность присутствующего терапевтического соединения, конкретное используемое атмосферное давление, заданное время полного испарения. В общем, фармацевтическая композиция будет требовать нагрева, если стадию испарения проводят при атмосферном давлении, например, 1 атм. Однако в условиях глубокого вакуума стадию испарения можно проводить при температуре ниже комнатной, например, ниже 22°C.
В одном варианте осуществления изобретения удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить при текущем атмосферном давлении и при температуре выше комнатной. В аспектах этого варианта осуществления удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить при текущем атмосферном давлении и при температуре, например, выше 25°C, выше 30°C, выше 35°C, выше 40°C, выше 45°C, выше 50°C, выше 55°C, выше 60°C, выше 65°C, выше 70°C, выше 80°C или выше 25°C. В других аспектах этого варианта осуществления удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить при текущем атмосферном давлении и при температуре, находящейся в диапазоне, например, от примерно 25°C до примерно 100°C, от примерно 25°C до примерно 95°C, от примерно 25°C до примерно 90°C, от примерно 25°C до примерно 85°C, от примерно 25°C до примерно 80°C, от примерно 25°C до примерно 75°C, от примерно 25°C до примерно 70°C, от примерно 25°C до примерно 65°C или от примерно 25°C до примерно 60°C.
В другом варианте осуществления изобретения удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить под вакуумом и при температуре ниже комнатной. В аспектах этого варианта осуществления изобретения удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить под вакуумом и при температуре, например, ниже 20°C, ниже 18°C, ниже 16°C, ниже 14°C, ниже 12°C, ниже 10°C, ниже 8°C, ниже 6°C, ниже 4°C, ниже 2°C или ниже 0°C. В других аспектах этого варианта осуществления изобретения удаление растворителя из фармацевтической композиции, раскрытой в данном документе, можно проводить под вакуумом и при температуре в диапазоне, например, от примерно -20°C до примерно 20°C, от примерно -20°C до примерно 18°C, от примерно -20°C до примерно 16°C, от примерно -20°C до примерно 14°C, от примерно -20°C до примерно 12°C, от примерно -20°C до примерно 10°C, от примерно -20°C до примерно 8°C, от примерно -20°C до примерно 6°C, от примерно -20°C до примерно 4°C, от примерно -20°C до примерно 2°C, от примерно -20°C до примерно 0°C, от примерно -15°C до примерно 20°C, от примерно -10°C до примерно 20°C, от примерно -5°C до примерно 20°C, от примерно 0°C до примерно 20°C, от примерно -10°C до примерно 20°C, от примерно -10°C до примерно 18°C, от примерно -10°C до примерно 16°C, от примерно -10°C до примерно 14°C, от примерно -10°C до примерно 12°C, от примерно -10°C до примерно 10°C, от примерно -10°C до примерно 8°C, от примерно -10°C до примерно 6°C, от примерно -10°C до примерно 4°C, от примерно -10°C до примерно 2°C или от примерно -10°C до примерно 0°C.
Конечная концентрация терапевтического соединения, раскрытого в данном документе, в фармацевтической композиции, раскрытой в данном документе, может составлять любую желаемую концентрацию. В аспекте этого варианта осуществления конечная концентрация терапевтического соединения в фармацевтической композиции может представлять собой терапевтически эффективное количество. В других аспектах этого варианта осуществления конечная концентрация терапевтического соединения в фармацевтической композиции может составлять, например, по меньшей мере 0,00001 мг/мл, по меньшей мере 0,0001 мг/мл, по меньшей мере 0,001 мг/мл, по меньшей мере 0,01 мг/мл, по меньшей мере 0,1 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 100 мг/мл, по меньшей мере 200 мг/мл, по меньшей мере 500 мг/мл, по меньшей мере 700 мг/мл, по меньшей мере 1000 мг/мл или по меньшей мере 1200 мг/мл. В других аспектах этого варианта осуществления конечная концентрация терапевтического соединения в фармацевтической композиции может составлять, например, самое большее 1000 мг/мл, самое большее 1100 мг/мл, самое большее 1200 мг/мл, самое большее 1300 мг/мл, самое большее 1400 мг/мл, самое большее 1500 мг/мл, самое большее 2000 мг/мл, самое большее 2000 мг/мл или самое большее 3000 мг/мл. В других аспектах этого варианта осуществления конечная концентрация терапевтического соединения в фармацевтической композиции может находиться в диапазоне, например, от примерно 0,00001 мг/мл до примерно 3000 мг/мл, от примерно 0,0001 мг/мл до примерно 3000 мг/мл, от примерно 0,01 мг/мл до примерно 3000 мг/мл, от примерно 0,1 мг/мл до примерно 3000 мг/мл, от примерно 1 мг/мл до примерно 3000 мг/мл, от примерно 250 мг/мл до примерно 3000 мг/мл, от примерно 500 мг/мл до примерно 3000 мг/мл, от примерно 750 мг/мл до примерно 3000 мг/мл, от примерно 1000 мг/мл до примерно 3000 мг/мл, от примерно 100 мг/мл до примерно 2000 мг/мл, от примерно 250 мг/мл до примерно 2000 мг/мл, от примерно 500 мг/мл до примерно 2000 мг/мл, от примерно 750 мг/мл до примерно 2000 мг/мл, от примерно 1000 мг/мл до примерно 2000 мг/мл, от примерно 100 мг/мл до примерно 1500 мг/мл, от примерно 250 мг/мл до примерно 1500 мг/мл, от примерно 500 мг/мл до примерно 1500 мг/мл, от примерно 750 мг/мл до примерно 1500 мг/мл, от примерно 1000 мг/мл до примерно 1500 мг/мл, от примерно 100 мг/мл до примерно 1200 мг/мл, от примерно 250 мг/мл до примерно 1200 мг/мл, от примерно 500 мг/мл до примерно 1200 мг/мл, от примерно 750 мг/мл до примерно 1200 мг/мл, от примерно 1000 мг/мл до примерно 1200 мг/мл, от примерно 100 мг/мл до примерно 1000 мг/мл, от примерно 250 мг/мл до примерно 1000 мг/мл, от примерно 500 мг/мл до примерно 1000 мг/мл, от примерно 750 мг/мл до примерно 1000 мг/мл, от примерно 100 мг/мл до примерно 750 мг/мл, от примерно 250 мг/мл до примерно 750 мг/мл, от примерно 500 мг/мл до примерно 750 мг/мл, от примерно 100 мг/мл до примерно 500 мг/мл, от примерно 250 мг/мл до примерно 500 мг/мл, от примерно 0,00001 мг/мл до примерно 0,0001 мг/мл, от примерно 0,00001 мг/мл до примерно 0,001 мг/мл, от примерно 0,00001 мг/мл до примерно 0,01 мг/мл, от примерно 0,00001 мг/мл до примерно 0,1 мг/мл, от примерно 0,00001 мг/мл до примерно 1 мг/мл, от примерно 0,001 мг/мл до примерно 0,01 мг/мл, от примерно 0,001 мг/мл до примерно 0,1 мг/мл, от примерно 0,001 мг/мл до примерно 1 мг/мл, от примерно 0,001 мг/мл до примерно 10 мг/мл или от примерно 0,001 мг/мл до примерно 100 мг/мл.
Фармацевтическая композиция, полученная с использованием способов, раскрытых в данном документе, может быть составлена для местной или системной доставки с использованием местных, энтеральных или парентеральных путей введения. Кроме того, терапевтическое соединение, раскрытое в данном документе, может быть введено в состав фармацевтической композиции индивидуально, или может быть введено в состав одной фармацевтической композиции совместно с одним или несколькими другими терапевтическими соединениями, раскрытыми в данном документе.
Фармацевтическая композиция, полученная с использованием способов, раскрытых в данном документе, может представлять собой жидкий состав, полутвердый состав или твердый состав. Состав, раскрытый в данном документе, может быть изготовлен таким образом, чтобы получить одну фазу, такую как, например, масло или твердое вещество. В альтернативном варианте, состав, раскрытый в данном документе, может быть изготовлен таким образом, чтобы получить две фазы, такие как, например, эмульсия. Раскрытая в данном документе фармацевтическая композиция, предназначенная для такого введения, может быть получена в соответствии с любым способом, известным в данной области для изготовления фармацевтических композиций. Полутвердые составы, подходящие для местного введения включают, без ограничения, мази, кремы, бальзамы и гели.
Жидкий состав может быть получен с использованием различных липидов, таких как масла других жирных кислот, которые остаются жидкими в заданном температурном диапазоне. В варианте осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, является жидкой при комнатной температуре. В аспектах этого варианта осуществления фармацевтическая композиция, раскрытая в данном документе, может быть составлена таким образом, чтобы представлять собой жидкость при температуре, например, составляющей примерно 25°C или выше, примерно 23°C или выше, примерно 2°C или выше, примерно 19°C или выше, примерно 17°C или выше, примерно 15°C или выше, примерно 12°C или выше, примерно 10°C или выше, примерно 8°C или выше, примерно 6°C или выше, примерно 4°C или выше или примерно 0°C или выше.
В жидких и полутвердых составах концентрация терапевтического соединения, раскрытого в данном документе, как правило, может составлять от примерно 50 мг/мл до примерно 1000 мг/мл. В аспектах этого варианта осуществления терапевтически эффективное количество терапевтического соединения, раскрытого в данном документе, может составлять, например, от примерно 50 мг/мл до примерно 100 мг/мл, от примерно 50 мг/мл до примерно 200 мг/мл, от примерно 50 мг/мл до примерно 300 мг/мл, от примерно 50 мг/мл до примерно 400 мг/мл, от примерно 50 мг/мл до примерно 500 мг/мл, от примерно 50 мг/мл до примерно 600 мг/мл, от примерно 50 мг/мл до примерно 700 мг/мл, от примерно 50 мг/мл до примерно 800 мг/мл, от примерно 50 мг/мл до примерно 900 мг/мл, от примерно 50 мг/мл до примерно 1000 мг/мл, от примерно 100 мг/мл до примерно 200 мг/мл, от примерно 100 мг/мл до примерно 300 мг/мл, от примерно 100 мг/мл до примерно 400 мг/мл, от примерно 100 мг/мл до примерно 500 мг/мл, от примерно 100 мг/мл до примерно 600 мг/мл, от примерно 100 мг/мл до примерно 700 мг/мл, от примерно 100 мг/мл до примерно 800 мг/мл, от примерно 100 мг/мл до примерно 900 мг/мл, от примерно 100 мг/мл до примерно 1000 мг/мл, от примерно 200 мг/мл до примерно 300 мг/мл, от примерно 200 мг/мл до примерно 400 мг/мл, от примерно 200 мг/мл до примерно 500 мг/мл, от примерно 200 мг/мл до примерно 600 мг/мл, от примерно 200 мг/мл до примерно 700 мг/мл, от примерно 200 мг/мл до примерно 800 мг/мл, от примерно 200 мг/мл до примерно 900 мг/мл, от примерно 200 мг/мл до примерно 1000 мг/мл, от примерно 300 мг/мл до примерно 400 мг/мл, от примерно 300 мг/мл до примерно 500 мг/мл, от примерно 300 мг/мл до примерно 600 мг/мл, от примерно 300 мг/мл до примерно 700 мг/мл, от примерно 300 мг/мл до примерно 800 мг/мл, от примерно 300 мг/мл до примерно 900 мг/мл, от примерно 300 мг/мл до примерно 1000 мг/мл, от примерно 400 мг/мл до примерно 500 мг/мл, от примерно 400 мг/мл до примерно 600 мг/мл, от примерно 400 мг/мл до примерно 700 мг/мл, от примерно 400 мг/мл до примерно 800 мг/мл, от примерно 400 мг/мл до примерно 900 мг/мл, от примерно 400 мг/мл до примерно 1000 мг/мл, от примерно 500 мг/мл до примерно 600 мг/мл, от примерно 500 мг/мл до примерно 700 мг/мл, от примерно 500 мг/мл до примерно 800 мг/мл, от примерно 500 мг/мл до примерно 900 мг/мл, от примерно 500 мг/мл до примерно 1000 мг/мл, от примерно 600 мг/мл до примерно 700 мг/мл, от примерно 600 мг/мл до примерно 800 мг/мл, от примерно 600 мг/мл до примерно 900 мг/мл или от примерно 600 мг/мл до примерно 1000 мг/мл.
В полутвердых и твердых составах количество терапевтического соединения, раскрытого в данном документе, как правило, может составлять от примерно 0,01% до примерно 45% по массе. В аспектах этого варианта осуществления количество терапевтического соединения, раскрытого в данном документе может составлять, например, от примерно 0,1% до примерно 45% по массе, от примерно 0,1% до примерно 40% по массе, от примерно 0,1% до примерно 35% по массе, от примерно 0,1% до примерно 30% по массе, от примерно 0,1% до примерно 25% по массе, от примерно 0,1% до примерно 20% по массе, от примерно 0,1% до примерно 15% по массе, от примерно 0,1% до примерно 10% по массе, от примерно 0,1% до примерно 5% по массе, от примерно 1% до примерно 45% по массе, от примерно 1% до примерно 40% по массе, от примерно 1% до примерно 35% по массе, от примерно 1% до примерно 30% по массе, от примерно 1% до примерно 25% по массе, от примерно 1% до примерно 20% по массе, от примерно 1% до примерно 15% по массе, от примерно 1% до примерно 10% по массе, от примерно 1% до примерно 5% по массе, от примерно 5% до примерно 45% по массе, от примерно 5% до примерно 40% по массе, от примерно 5% до примерно 35% по массе, от примерно 5% до примерно 30% по массе, от примерно 5% до примерно 25% по массе, от примерно 5% до примерно 20% по массе, от примерно 5% до примерно 15% по массе, от примерно 5% до примерно 10% по массе, от примерно 10% до примерно 45% по массе, от примерно 10% до примерно 40% по массе, от примерно 10% до примерно 35% по массе, от примерно 10% до примерно 30% по массе, от примерно 10% до примерно 25% по массе, от примерно 10% до примерно 20% по массе, от примерно 10% до примерно 15% по массе, от примерно 15% до примерно 45% по массе, от примерно 15% до примерно 40% по массе, от примерно 15% до примерно 35% по массе, от примерно 15% до примерно 30% по массе, от примерно 15% до примерно 25% по массе, от примерно 15% до примерно 20% по массе, от примерно 20% до примерно 45% по массе, от примерно 20% до примерно 40% по массе, от примерно 20% до примерно 35% по массе, от примерно 20% до примерно 30% по массе, от примерно 20% до примерно 25% по массе, от примерно 25% до примерно 45% по массе, от примерно 25% до примерно 40% по массе, от примерно 25% до примерно 35% по массе или от примерно 25% до примерно 30% по массе.
В одном варианте осуществления изобретения жидкий состав содержит терапевтическое соединение, гликолевый эфир, частично гидрированный жир, масло и спирт. В аспекте этого варианта осуществления жидкий состав содержит от примерно 15% до примерно 35% по массе терапевтического соединения, от примерно 5% до примерно 25% по массе гликолевого эфира, от примерно 15% до примерно 40% по массе частично гидрированного жира, от примерно 15% до примерно 40% масла и от примерно 1% до примерно 15% спирта. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 10% до примерно 20% по массе гликолевого эфира, от примерно 20% до примерно 35% по массе частично гидрированного жира, от примерно 20% до примерно 35% масла и от примерно 2% до примерно 10% спирта. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 13% до примерно 17% по массе гликолевого эфира, от примерно 25% до примерно 30% по массе частично гидрированного жира, от примерно 25% до примерно 30% масла и от примерно 4% до примерно 8% спирта. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 24% до примерно 26% по массе терапевтического соединения, от примерно 14% до примерно 16% по массе гликолевого эфира, от примерно 26% до примерно 28% по массе частично гидрированного жира, от примерно 26% до примерно 28% масла и от примерно 5% до примерно 7% спирта. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В другом варианте осуществления изобретения жидкий состав содержит терапевтическое соединение, гликолевый эфир, глицерилмонолинолеат, масло и спирт. В аспекте этого варианта осуществления изобретения жидкий состав содержит от примерно 15% до примерно 35% по массе терапевтического соединения, от примерно 5% до примерно 25% по массе гликолевого эфира, от примерно 15% до примерно 40% по массе глицерилмонолинолеата, от примерно 15% до примерно 40% масла и от примерно 1% до примерно 15% спирта. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 10% до примерно 20% по массе гликолевого эфира, от примерно 20% до примерно 35% по массе глицерилмонолинолеата, от примерно 20% до примерно 35% масла и от примерно 2% до примерно 10% спирта. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 13% до примерно 17% по массе гликолевого эфира, от примерно 25% до примерно 30% по массе глицерилмонолинолеата, от примерно 25% до примерно 30% масла и от примерно 4% до примерно 8% спирта. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 24% до примерно 26% по массе терапевтического соединения, от примерно 14% до примерно 16% по массе гликолевого эфира, от примерно 26% до примерно 28% по массе глицерилмонолинолеата, от примерно 26% до примерно 28% масла и от примерно 5% до примерно 7% спирта. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В другом варианте осуществления изобретения жидкий состав содержит ибупрофен, моноэтиловый эфир диэтиленгликоля, глицерилмонолинолеат, масло и спирт. В аспекте этого варианта осуществления изобретения жидкий состав содержит от примерно 15% до примерно 35% по массе ибупрофена, от примерно 5% до примерно 25% по массе моноэтилового эфира диэтиленгликоля, от примерно 15% до примерно 40% по массе глицерилмонолинолеата, от примерно 15% до примерно 40% масла и от примерно 1% до примерно 15% спирта. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 20% до примерно 30% по массе ибупрофена, от примерно 10% до примерно 20% по массе моноэтилового эфира диэтиленгликоля, от примерно 20% до примерно 35% по массе глицерилмонолинолеата, от примерно 20% до примерно 35% масла и от примерно 2% до примерно 10% спирта. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 23% до примерно 27% по массе ибупрофена, от примерно 13% до примерно 17% по массе моноэтилового эфира диэтиленгликоля, от примерно 25% до примерно 30% по массе глицерилмонолинолеата, от примерно 25% до примерно 30% масла и от примерно 4% до примерно 8% спирта. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 24% до примерно 26% по массе ибупрофена, от примерно 14% до примерно 16% по массе моноэтилового эфира диэтиленгликоля, от примерно 26% до примерно 28% по массе глицерилмонолинолеата, от примерно 26% до примерно 28% масла и от примерно 5% до примерно 7% спирта. В других аспектах этого варианта осуществления ибупрофен может являться свободной кислотой или солью ибупрофена. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В одном варианте осуществления изобретения жидкий состав содержит терапевтическое соединение, сложный эфир спирта и масло. В аспекте этого варианта осуществления изобретения жидкий состав содержит от примерно 1% до примерно 10% по массе терапевтического соединения, от примерно 1% до примерно 10% по массе сложного эфира спирта и от примерно 80% до примерно 98% масла. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 2% до примерно 8% по массе терапевтического соединения, от примерно 1% до примерно 7% по массе сложного эфира спирта и от примерно 85% до примерно 97% масла. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 3% до примерно 7% по массе терапевтического соединения, от примерно 2% до примерно 6% по массе сложного эфира спирта и от примерно 87% до примерно 95% масла. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 4% до примерно 6% по массе терапевтического соединения, от примерно 3% до примерно 5% по массе сложного эфира спирта и от примерно 90% до примерно 92% масла. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В другом варианте осуществления изобретения жидкий состав содержит терапевтическое соединение, этилацетат и масло. В аспекте этого варианта осуществления изобретения жидкий состав содержит от примерно 1% до примерно 10% по массе терапевтического соединения, от примерно 1% до примерно 10% по массе этилацетата и от примерно 80% до примерно 98% масла. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 2% до примерно 8% по массе терапевтического соединения, от примерно 1% до примерно 7% по массе этилацетата и от примерно 85% до примерно 97% масла. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 3% до примерно 7% по массе терапевтического соединения, от примерно 2% до примерно 6% по массе этилацетата и от примерно 87% до примерно 95% масла. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 4% до примерно 6% по массе терапевтического соединения, от примерно 3% до примерно 5% по массе этилацетата и от примерно 90% до примерно 92% масла. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В другом варианте осуществления изобретения жидкий состав содержит ибупрофен, этилацетат и масло. В аспекте этого варианта осуществления изобретения жидкий состав содержит от примерно 1% до примерно 10% по массе ибупрофена, от примерно 1% до примерно 10% по массе этилацетата и от примерно 80% до примерно 98% масла. В другом аспекте этого варианта осуществления жидкий состав содержит от примерно 2% до примерно 8% по массе ибупрофена, от примерно 1% до примерно 7% по массе этилацетата и от примерно 85% до примерно 97% масла. В еще одном аспекте этого варианта осуществления жидкий состав содержит от примерно 3% до примерно 7% по массе ибупрофена, от примерно 2% до примерно 6% по массе этилацетата и от примерно 87% до примерно 95% масла. В третьем аспекте этого варианта осуществления жидкий состав содержит от примерно 4% до примерно 6% по массе ибупрофена, от примерно 3% до примерно 5% по массе этилацетата и от примерно 90% до примерно 92% масла. В других аспектах этого варианта осуществления ибупрофен может являться свободной кислотой или солью ибупрофена. В других аспектах этого варианта осуществления маслом является рапсовое масло или какао-масло.
В одном варианте осуществления изобретения твердый или полутвердый состав, раскрытый в данном документе, изготавливают без гидрофильного растворителя, такого как вода. Такие составы приводят к образованию сокристаллов липидов и терапевтического соединения. Иначе говоря, такие композиции не образуют липосомальные эмульсии и/или мицеллярные частицы, которые требуют гидрофильного растворителя.
В одном варианте осуществления изобретения твердый состав содержит терапевтическое соединение, твердый жир, частично гидрированный жир и полиэтиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе терапевтического соединения, от примерно 8% до примерно 70% по массе твердого жира, от примерно 2% до примерно 65% по массе частично гидрированного жира и от примерно 1% до примерно 15% полиэтиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе терапевтического соединения, от примерно 20% до примерно 50% по массе твердого жира, от примерно 10% до примерно 30% по массе частично гидрированного жира и от примерно 5% до примерно 15% полиэтиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 30% до примерно 50% по массе твердого жира, от примерно 10% до примерно 30% по массе частично гидрированного жира и от примерно 7% до примерно 13% полиэтиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 35% до примерно 50% по массе твердого жира, от примерно 15% до примерно 25% по массе частично гидрированного жира и от примерно 7% до примерно 13% полиэтиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 41% до примерно 47% по массе твердого жира, от примерно 18% до примерно 22% по массе частично гидрированного жира и от примерно 9% до примерно 11% полиэтиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения твердый состав содержит терапевтическое соединение, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат и полиэтиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе терапевтического соединения, от примерно 8% до примерно 70% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 2% до примерно 65% по массе глицерилмонолинолеата и от примерно 1% до примерно 15% полиэтиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе терапевтического соединения, от примерно 20% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата и от примерно 5% до примерно 15% полиэтиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 30% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата и от примерно 7% до примерно 13% полиэтиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 35% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 5% до примерно 25% по массе глицерилмонолинолеата и от примерно 7% до примерно 13% полиэтиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 41% до примерно 47% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 18% до примерно 22% по массе глицерилмонолинолеата и от примерно 9% до примерно 11% полиэтиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения твердый состав содержит ибупрофен, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат и полиэтиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе ибупрофена, от примерно 8% до примерно 70% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 2% до примерно 65% по массе глицерилмонолинолеата и от примерно 1% до примерно 15% полиэтиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе ибупрофена, от примерно 20% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата и от примерно 5% до примерно 15% полиэтиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе ибупрофена, от примерно 30% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата и от примерно 7% до примерно 13% полиэтиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе ибупрофена, от примерно 35% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 15% до примерно 25% по массе глицерилмонолинолеата и от примерно 7% до примерно 13% полиэтиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе ибупрофена, от примерно 41% до примерно 47% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 18% до примерно 22% по массе глицерилмонолинолеата и от примерно 9% до примерно 11% полиэтиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения твердый состав содержит терапевтическое соединение, твердый жир, частично гидрированный жир, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе терапевтического соединения, от примерно 8% до примерно 70% по массе твердого жира, от примерно 2% до примерно 65% по массе частично гидрированного жира, от примерно 1% до примерно 15% полиэтиленгликоля и от примерно 1% до примерно 15% пропиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе терапевтического соединения, от примерно 20% до примерно 50% по массе твердого жира, от примерно 10% до примерно 30% по массе частично гидрированного жира, от примерно 5% до примерно 15% полиэтиленгликоля и от примерно 5% до примерно 15% пропиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 30% до примерно 50% по массе твердого жира, от примерно 10% до примерно 30% по массе частично гидрированного жира, от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 35% до примерно 50% по массе твердого жира, от примерно 15% до примерно 25% по массе частично гидрированного жира, от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 41% до примерно 47% по массе твердого жира, от примерно 18% до примерно 22% по массе частично гидрированного жира, от примерно 9% до примерно 11% полиэтиленгликоля и от примерно 9% до примерно 11% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения твердый состав содержит терапевтическое соединение, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе терапевтического соединения, от примерно 8% до примерно 70% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 2% до примерно 65% по массе глицерилмонолинолеата, от примерно 1% до примерно 15% полиэтиленгликоля и от примерно 1% до примерно 15% пропиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе терапевтического соединения, от примерно 20% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата, от примерно 5% до примерно 15% полиэтиленгликоля и от примерно 5% до примерно 15% пропиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 30% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата, от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе терапевтического соединения, от примерно 35% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 15% до примерно 25% по массе глицерилмонолинолеата, от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе терапевтического соединения, от примерно 41% до примерно 47% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 18% до примерно 22% по массе глицерилмонолинолеата, от примерно 9% до примерно 11% полиэтиленгликоля и от примерно 9% до примерно 11% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения твердый состав содержит ибупрофен, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 1% до примерно 30% по массе ибупрофена, от примерно 8% до примерно 70% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 2% до примерно 65% по массе глицерилмонолинолеата, от примерно 1% до примерно 15% полиэтиленгликоля и от примерно 1% до примерно 15% пропиленгликоля. В другом аспекте этого варианта осуществления твердый состав содержит от примерно 10% до примерно 30% по массе ибупрофена, от примерно 20% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата, от примерно 5% до примерно 15% полиэтиленгликоля и от примерно 5% до примерно 15% пропиленгликоля. В еще одном аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе ибупрофена, от примерно 30% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 10% до примерно 30% по массе глицерилмонолинолеата и от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В третьем аспекте этого варианта осуществления твердый состав содержит от примерно 20% до примерно 30% по массе ибупрофена, от примерно 35% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 15% до примерно 25% по массе глицерилмонолинолеата, от примерно 7% до примерно 13% полиэтиленгликоля и от примерно 7% до примерно 13% пропиленгликоля. В дополнительном аспекте этого варианта осуществления изобретения твердый состав содержит от примерно 23% до примерно 27% по массе ибупрофена, от примерно 41% до примерно 47% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 18% до примерно 22% по массе глицерилмонолинолеата, от примерно 9% до примерно 11% полиэтиленгликоля и от примерно 9% до примерно 11% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит терапевтическое соединение, твердый жир, частично гидрированный жир, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 15% до примерно 55% по массе терапевтического соединения, от примерно 7% до примерно 20% по массе твердого жира, от примерно 20% до примерно 50% по массе частично гидрированного жира, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 8% до примерно 18% по массе твердого жира, от примерно 25% до примерно 45% по массе частично гидрированного жира, от примерно 8% до примерно 18% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 10% до примерно 16% по массе твердого жира, от примерно 25% до примерно 45% по массе частично гидрированного жира, от примерно 10% до примерно 16% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 11% до примерно 15% по массе твердого жира, от примерно 30% до примерно 40% по массе частично гидрированного жира, от примерно 11% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 25% до примерно 44% по массе терапевтического соединения, от примерно 12% до примерно 14% по массе твердого жира, от примерно 32% до примерно 39% по массе частично гидрированного жира, от примерно 12% до примерно 14% полиэтиленгликоля и от примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит терапевтическое соединение, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 15% до примерно 55% по массе терапевтического соединения, от примерно 7% до примерно 20% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 20% до примерно 50% по массе глицерилмонолинолеата, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 8% до примерно 18% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 8% до примерно 18% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 10% до примерно 16% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 10% до примерно 16%o полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе терапевтического соединения, от примерно 11% до примерно 15% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 30% до примерно 40% по массе глицерилмонолинолеата и от примерно 11% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 25% до примерно 44% по массе терапевтического соединения, от примерно 12% до примерно 14% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 32% до примерно 39% по массе глицерилмонолинолеата, от примерно 12% до примерно 14% полиэтиленгликоля и от примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит ибупрофен, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 15% до примерно 55% по массе ибупрофена, от примерно 7% до примерно 20% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 20% до примерно 50% по массе глицерилмонолинолеата, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе ибупрофена, от примерно 8% до примерно 18% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 8% до примерно 18% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе ибупрофена, от примерно 10% до примерно 16% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 10% до примерно 16% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 50% по массе ибупрофена, от примерно 11% до примерно 15% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 30% до примерно 40% по массе глицерилмонолинолеата и от примерно 1% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 25% до примерно 44% по массе ибупрофена, от примерно 12% до примерно 14% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 32% до примерно 39% по массе глицерилмонолинолеата, от примерно 12% до примерно 14% полиэтиленгликоля и примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит терапевтическое соединение, твердый жир, частично гидрированный жир, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 10% до примерно 35% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 30% по массе соли терапевтического соединения, от примерно 7% до примерно 20% по массе твердого жира, от примерно 20% до примерно 50% по массе частично гидрированного жира, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли терапевтического соединения, от примерно 10% до примерно 16% по массе твердого жира, от примерно 25% до примерно 45% по массе частично гидрированного жира, от примерно 10% до примерно 16% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли терапевтического соединения, от примерно 11% до примерно 15% по массе твердого жира, от примерно 30% до примерно 40% по массе частично гидрированного жира, от примерно 11% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 24% по массе терапевтического соединения в виде свободной кислоты, от примерно 5% до примерно 20% по массе соли терапевтического соединения, от примерно 12% до примерно 14% по массе твердого жира, от примерно 32% до примерно 39% по массе частично гидрированного жира, от примерно 12% до примерно 14% полиэтиленгликоля и примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит терапевтическое соединение, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 10% до примерно 35% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 30% по массе соли терапевтического соединения, от примерно 7% до примерно 20% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 20% до примерно 50% по массе глицерилмонолинолеата, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли терапевтического соединения, от примерно 10% до примерно 16% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 10% до примерно 16% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе терапевтического соединения в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли терапевтического соединения, от примерно 11% до примерно 15% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 30% до примерно 40% по массе глицерилмонолинолеата и от примерно 11% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 24% по массе терапевтического соединения в виде свободной кислоты, от примерно 5% до примерно 20% по массе соли терапевтического соединения, от примерно 12% до примерно 14% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 32% до примерно 39% по массе глицерилмонолинолеата, от примерно 12% до примерно 14% полиэтиленгликоля и примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В другом варианте осуществления изобретения полутвердый состав содержит ибупрофен, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, глицерилмонолинолеат, полиэтиленгликоль и пропиленгликоль. В аспекте этого варианта осуществления изобретения полутвердый состав содержит от примерно 10% до примерно 35% по массе ибупрофена в виде свободной кислоты, от примерно 1% до примерно 30% по массе соли ибупрофена, от примерно 7% до примерно 20% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 20% до примерно 50% по массе глицерилмонолинолеата, от примерно 7% до примерно 20% полиэтиленгликоля и от примерно 1% до примерно 8% пропиленгликоля. В другом аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе ибупрофена в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли ибупрофена, от примерно 10% до примерно 16% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 25% до примерно 45% по массе глицерилмонолинолеата, от примерно 10% до примерно 16% полиэтиленгликоля и от примерно 2% до примерно 6% пропиленгликоля. В еще одном аспекте этого варианта осуществления полутвердый состав содержит от примерно 15% до примерно 30% по массе ибупрофена в виде свободной кислоты, от примерно 1% до примерно 25% по массе соли ибупрофена, от примерно 11% до примерно 15% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 30% до примерно 40% по массе глицерилмонолинолеата и от примерно 11% до примерно 15% полиэтиленгликоля и от примерно 3% до примерно 5% пропиленгликоля. В третьем аспекте этого варианта осуществления полутвердый состав содержит от примерно 20% до примерно 24% по массе ибупрофена в виде свободной кислоты, от примерно 5% до примерно 20% по массе соли ибупрофена, от примерно 12% до примерно 14% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, от примерно 32% до примерно 39% по массе глицерилмонолинолеата, от примерно 12% до примерно 14% полиэтиленгликоля и примерно 4% пропиленгликоля. В других аспектах этого варианта осуществления полиэтиленгликоль представляет собой, например, PEG 100, PEG 200, PEG 300, PEG 400, PEG 500, PEG 600 или PEG 700.
В твердом или полутвердом составе, раскрытом в данном документе, используется преимущество отличающихся температур плавления различных адъювантов, таких как жирные кислоты. Образование твердой или полутвердой лекарственной формы может быть осуществлено путем изменения соответствующих концентраций жирных кислот, содержащих фармацевтическую композицию, раскрытую в данном документе. Например, линоленовая кислота имеет температуру плавления (Tm) примерно -11°C, линолевая кислота имеет Tm примерно -5°C, олеиновая кислота имеет Tm примерно 16°C, пальмитиновая кислота имеет Tm примерно 61-62°C и стеариновая кислота имеет Tm примерно 67-72°C. Увеличение доли(ей) пальмитиновой, стеариновой или олеиновой кислот повышает общую температуру плавления композиции, тогда как, наоборот, увеличение доли(ей) линолевой и линоленовой кислот снизило бы температуру плавления композиции. Таким образом, путем контроля типов и количества добавляемых адъювантных компонентов раскрытая в данном документе композиция может быть изготовлена так, чтобы она была по существу твердой или полутвердой при комнатной температуре, но плавилась при приеме внутрь и достижении температуры тела. Получающаяся расплавленная композиция легко образует мицеллы, которые абсорбируются кишечником, собираются в хиломикроны и в итоге поглощаются макрофагами. Твердая лекарственная форма может представлять собой порошок, гранулу, таблетку, капсулу или суппозиторий.
В варианте осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, является твердой при комнатной температуре. В аспектах этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, может быть составлена таким образом, чтобы быть твердой при температуре, например, примерно 35°C или ниже, примерно 33°C или ниже, примерно 31°C или ниже, примерно 29°C или ниже, примерно 27°C или ниже, примерно 25°C или ниже, примерно 23°C или ниже, примерно 21°C или ниже, примерно 19°C или ниже, примерно 17°C или ниже, примерно 15°C или ниже, примерно 12°C или ниже, примерно 10°C или ниже, примерно 8°C или ниже, примерно 6°C или ниже, примерно 4°C или ниже или примерно 0°C или ниже.
В других аспектах этого варианта осуществления раскрытая фармацевтическая композиция имеет температуру плавления, например, 5°C или выше, 10°C или выше, 15°C или выше, 22°C или выше, 23°C или выше, 24°C или выше, 25°C или выше, 26°C или выше, 27°C или выше, 28°C или выше, 29°C или выше, 30°C или выше, 31°C или выше, 32°C или выше, 33°C или выше, 34°C или выше или 35°C или выше. В других аспектах этого варианта осуществления раскрытая фармацевтическая композиция имеет температуру плавления в диапазоне, например, от примерно 5°C до примерно 24°C, от примерно 10°C до примерно 24°C, от примерно 22°C до примерно 24°C, от примерно 23°C до примерно 25°C, от примерно 24°C до примерно 26°C, от примерно 25°C до примерно 27°C, от примерно 26°C до примерно 28°C, от примерно 27°C до примерно 29°C, от примерно 28°C до примерно 30°C, от примерно 29°C до примерно 31°C, от примерно 30°C до примерно 32°C, от примерно 31°C до примерно 33°C, от примерно 32°C до примерно 34°C или от примерно 33°C до примерно 35°C. В других аспектах этого варианта осуществления раскрытая фармацевтическая композиция имеет температуру плавления в диапазоне, например, от примерно 22°C до примерно 26°C, от примерно 24°C до примерно 28°C, от примерно 26°C до примерно 30°C, от примерно 28°C до примерно 32°C или от примерно 30°C до примерно 34°C.
В аспектах настоящего описания раскрыт, в частности, способ лечения индивидуума с хроническим воспалением. В одном варианте осуществления изобретения способ включают в себя стадию введения индивидууму, нуждающемуся в этом, фармацевтической композиции, раскрытой в данном документе, где введение уменьшает симптом, ассоциированный с хроническим воспалением, таким образом обеспечивая лечение индивидуума.
В аспектах настоящего описания раскрыто, в частности, лечение индивидуума, страдающего от хронического воспаления. Используемый в данном документе, термин «лечение» относится к уменьшению или устранению у индивидуума клинического симптома хронического воспаления; или к задержке или предупреждению у индивидуума появления клинического симптома хронического воспаления. Например, термин «лечение» может означать уменьшение симптома состояния, характеризующегося хроническим воспалением, например, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% по меньшей мере на 95% или по меньшей мере на 100%. Фактические симптомы, ассоциированные с хроническим воспалением, хорошо известны и могут быть определены обычным специалистом в данной области техники с учетом факторов, включающих, без ограничения, расположение хронического воспаления, причину хронического воспаления, тяжесть хронического воспаления и/или ткань или орган, затронутые хроническим воспалением. Специалисты в данной области будут знать соответствующие симптомы или признаки, ассоциированные с конкретным типом хронического воспаления, и будут знать, как определить, является ли человек кандидатом для лечения, раскрытого в данном документе.
Симптомы хронического воспаления включают, без ограничения, отек, гиперемию, эритему, кровоподтеки, болезненность, скованность, отечность, лихорадку, озноб, заложенность носа, ощущение тяжести в голове, проблемы с дыханием, задержку жидкости, образование тромбов, потерю аппетита, учащенное сердцебиение, образование гранулемы, фибринозные явления, гной, невязкую серозную жидкость или язвы и боль. Фактические симптомы, ассоциированные с хроническим воспалением, хорошо известны и могут быть определены обычным специалистом в данной области техники с учетом факторов, включающих, без ограничения, местоположение воспаления, причину воспаления, тяжесть воспаления, затронутые ткань или орган и ассоциированное заболевание.
Конкретные модели хронического воспаления наблюдаются во время определенных ситуаций, возникающих в организме, например, при возникновении воспаления на поверхности эпителия или при участии гнойных бактерий. Например, гранулематозное воспаление представляет собой воспаление, возникающее в результате образование гранулем, появляющихся при ограниченном, но разнообразном, наборе заболеваний, включающих, без ограничения, туберкулез, лепру, саркоидоз и сифилис. Гнойное воспаление представляет собой воспаление, возникающее в результате образования большого количества гноя, который состоит из нейтрофилов, погибших клеток и жидкости. Заражение гнойными бактериями, такими как стафилококки, характерно для воспаления такого рода. Серозное воспаление представляет собой воспаление, возникающее в результате обильного выпота невязкой серозной жидкости, которая обычно продуцируется мезотелиальными клетками серозных оболочек, но также может накапливаться из плазмы крови. Волдыри являются примером этой модели воспаления. Язвенное воспаление представляет собой воспаление, возникающее в результате некротической потери ткани на поверхности эпителия, обнажающей нижние слои и образующей язву.
Симптом хронического воспаления может быть ассоциирован с большой группой несвязанных между собой расстройств, которые лежат в основе различных заболеваний и нарушений. Иммунная система часто связана с хроническими воспалительными заболеваниями, что продемонстрировано как аллергическими реакциями, так и некоторыми миопатиями, где многие нарушения иммунной системы приводят к аномальному воспалению. Неиммунные заболевания с этиологическим происхождением из хронических воспалительных процессов включают рак, атеросклероз и ишемическую болезнь сердца. Неограничивающие примеры заболеваний, имеющих хроническое воспаление в качестве симптома, включают, без ограничения, угри, кислотный рефлюкс/изжогу, возрастную макулярную дегенерацию (AMD), аллергию, аллергический ринит, болезнь Альцгеймера, латеральный амиотрофический склероз, анемию, аппендицит, артериит, артрит, астму, атеросклероз, аутоиммунные заболевания, баланит, блефарит, бронхиолит, бронхит, буллезный пемфигоид, ожог, бурсит, рак, остановку сердца, кардит, целиакию, целлюлит, цервицит, холангит, холецистит, хориоамнионит, хроническую обструктивную болезнь легких (COPD), цирроз печени, колит, застойную сердечную недостаточность, конъюнктивит, циклофосфамид-индуцированной цистит, кистозный фиброз, цистит, простуду, дакриоаденит, деменцию, дерматит, дерматомиозит, диабет, диабетическую невропатию, диабетическую ретинопатию, диабетическую нефропатию, диабетическую язву, заболевание пищеварительной системы, экзему, эмфизему, энцефалит, эндокардит, эндометрит, энтерит, энтероколит, эпиконделит, эпидидимит, фасциит, фибромиалгию, фиброз, фиброзит, гастрит, гастроэнтерит, гингивит, гломерулонефрит, глоссит, болезнь сердца, дисфункцию клапана сердца, гепатит, гнойный гидраденит, болезнь Хантингтона, гиперлипидемический панкреатит, гипертонию, илеит, инфекцию, воспалительное заболевание кишечника, воспалительную кардиомегалию, воспалительную невропатию, инсулинорезистентность, интерстициальный цистит, интерстициальный нефрит, ирит, ишемию, ишемическую болезнь сердца, кератит, кератоконъюнктивит, ларингит, волчаночный нефрит, мастит, мастоидит, менингит, метаболический синдром (синдром X), мигрень, рассеянный склероз, миелит, миокардит, миозит, нефрит, неалкогольный стеатогепатит, ожирение, омфалит, оофорит, орхит, остеохондрит, остеопению, остеомиелит, остеопороз, остеит, отит, панкреатит, болезнь Паркинсона, паротит, воспалительное заболевание органов таза, пузырчатку обыкновенную, перикардит, перитонит, фарингит, флебит, плеврит, пневмонию, поликистозный нефрит, проктит, простатит, псориаз, пульпит, пиелонефрит, пилефлебит, почечную недостаточность, реперфузионное повреждение, ретинит, ревматическую лихорадку, ринит, сальпингит, саркоидоз, сиаладенит, синусит, спастическую толстую кишку, стеноз, стоматит, инсульт, осложнение после хирургического вмешательства, синовит, тендинит, тендиноз, теносиновит, тромбофлебит, тонзиллит, травму, черепно-мозговую травму, отторжение трансплантата, тригонит, туберкулез, опухоль, уретрит, урсит, увеит, вагинит, васкулит и вульвит. См. также Eric R. First, Application of Botulinum Toxin to the Management of Neurogenic Inflammatory Disorders, патент США № 6063768, полное содержание которого включено в данный документ путем ссылки.
В одном варианте осуществления изобретения хроническое воспаление представляет собой воспаление тканей. Воспалением тканей является хроническое воспаление, которое ограничивается конкретной тканью или органом. В аспекте этого варианта осуществления изобретения воспаление тканей включает, например, воспаление кожи, воспаление мышц, воспаление сухожилий, воспаление связок, воспаление кости, воспаление хряща, воспаление легких, воспаление сердца, воспаление печени, воспаление поджелудочной железы, воспаление почек, воспаление мочевого пузыря, воспаление желудка, воспаление кишечника, воспаление нейронов и воспаление мозга.
В другом варианте осуществления изобретения хроническое воспаление представляет собой системное воспаление. Хотя связанные с ним процессы идентичны таковым при воспалении тканей, системное воспаление не ограничено конкретной тканью, а фактически распространяется на все тело, включая эндотелий и другие системы органов. Если это является следствием инфекции, то применяется термин сепсис, где при бактериемии применяется термин бактериальный сепсис, а при виримии применяется термин вирусный сепсис. Вазодилатация и органная дисфункция являются серьезными проблемами, ассоциированными с широким распространением инфекции, которые могут привести к септическому шоку и смерти.
В другом варианте осуществления изобретения хроническое воспаление включает артрит. Артрит включает в себя группу патологических состояний, связанных с повреждением суставов тела из-за воспаления синовиальной оболочки, включая, без ограничения, остеоартрит, ревматоидный артрит, ювенильный идиопатический артрит, спондилоартропатии, такие как анкилозирующий спондилит, реактивный артрит (синдром Рейтера), псориатический артрит, связанный с воспалительным заболеванием кишечника энтеропатический артрит, болезнь Уиппла и болезнь Бехчета, септический артрит, подагру (также известную как подагрический артрит, кристаллический синовит, метаболический артрит), псевдоподагру (заболевание, возникающее вследствие отложения кристаллов пирофосфата кальция) и болезнь Стилла. Артрит может затрагивать один сустав (моноартрит), от двух до четырех суставов (олигоартрит) или пять или большее количество суставов (полиартрит), и может либо являться аутоиммунным заболеванием, либо не являться аутоиммунным заболеванием.
В другом варианте осуществления изобретения хроническое воспаление включает аутоиммунное заболевание. Аутоиммунные заболевания можно в целом разделить на системные и орган-специфичные аутоиммунные заболевания в зависимости от основных клинико-патологических признаков каждого заболевания. Системные аутоиммунные заболевания включают, без ограничения, системную красную волчанку (SLE), синдром Шегрена, склеродермию, ревматоидный артрит и полимиозит. Местные аутоиммунные заболевания могут быть эндокринологическим (сахарный диабет I типа, тиреоидит Хашимото, болезнь Аддисона т.д.), дерматологическими (пузырчатка обыкновенная), гематологическими (аутоиммунная гемолитическая анемия), нервными (рассеянный склероз) или могут включать практически любую ограниченную массу тела ткани. Типы аутоиммунных заболеваний включают, без ограничения, острый рассеянный энцефаломиелит (ADEM), болезнь Аддисона, аллергию или гиперчувствительность, боковой амиотрофический склероз, синдром антифосфолипидного антитела (APS), артрит, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный панкреатит, буллезный пемфигоид, целиакию, болезнь Шагаса, хроническую обструктивную болезнь легких (COPD), сахарный диабет I типа (IDDM), эндометриоз, фибромиалгию, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре (GBS), тиреоидит Хашимото, гидраденит гнойный, идиопатическую тромбоцитопеническую пурпуру, воспалительное заболевание кишечника, интерстициальный цистит, волчанку (включая дискоидную красную волчанку, медикаментозную красную волчанку, волчаночный нефрит, неонатальную волчанку, подострую кожную красную волчанку и системную красную волчанку), морфею, рассеянный склероз (MS), миастению, миопатии, нарколепсию, нейромиотонию, пузырчатку обыкновенную, пернициознную анемию, первичный билиарный цирроз печени, рецидивирующий диссеминированный энцефаломиелит (мультифазный диссеминированный энцефаломиелит), ревматизм, шизофрению, склеродермию, синдром Шегрена, теносиновит, васкулит и витилиго. См. Pamela D. Van Schaack & Kenneth L. Tong, Treatment of Autoimmune Disorder with a Neurotoxin, патентная публикация США 2006/138059, полное содержание которой таким образом включено путем ссылки.
В другом варианте осуществления изобретения хроническое воспаление включает миопатию. Миопатии возникают, когда иммунная система ошибочно атакует компоненты мышцы, что приводит к воспалению в мышцах. Миопатия включает воспалительную миопатию и аутоиммунную миопатию. Миопатии включают, без ограничения, дерматомиозит, миозит с тельцами включения и полимиозит.
В другом варианте осуществления изобретения хроническое воспаление представляет собой васкулит. Васкулит представляет собой разнообразную группу заболеваний, характеризующихся воспалением сосудистой стенки, включая лимфатические сосуды и кровеносные сосуды, такие как вены (флебит), артерии (артериит) и капилляры, являющегося следствием миграции лейкоцитов и связанного с повреждением. Воспаление может затронуть кровеносный сосуд любого размера в любой части тела. Оно может затрагивать артерии и/или вены. Воспаление может быть очаговым, это означает, что оно затрагивает одном место в сосуде, или оно может быть распространенным, с участками воспаления, разбросанными по конкретному органу или ткани, или даже может затрагивать более одной системы органов в организме. Васкулит включает, без ограничения, болезнь Бюргера (облитерирующий тромбангиит), церебральный васкулит (васкулит центральной нервной системы), артериит Чарга-Стросса, криоглобулинемию, эссенциальный криоглобулинемический васкулит, гигантоклеточный (временной) артериит, васкулит игрока в гольф, пурпуру Геноха-Шенлейна, васкулит гиперчувствительности (аллергический васкулит), болезнь Кавасаки, микроскопический полиартериит/полиангиит, узелковый полиартериит, ревматическую полимиалгию (PMR), ревматоидный васкулит, артериит Такаясу, гранулематоз Вегенера, и васкулит, вторичный при заболеваниях соединительной ткани, таких как системная красная волчанка (SLE), ревматоидный артрит (RA), рецидивирующий полихондрит, болезнь Бехчета или другие заболевания соединительной ткани, васкулит, вторичный по отношению к вирусной инфекции.
В другом варианте осуществления изобретения хроническое воспаление представляет собой заболевание кожи. Кожные заболевания включают, без ограничения, угри, включая угри обыкновенные, буллезной пемфигоид, дерматит, включая атопический дерматит и хронической актинический дерматит, экзему, такую как атопическая экзема, контактная экзема, ксеротическая экзема, себорейный дерматит, дисгидроз, дискоидная экзема, венозная экзема, дерматит герпетиформный, нейродермит и аутоэкематизация, и стазисный дерматит, гидраденит гнойный, красный плоский лишай, псориаз, включая бляшечный псориаз, псориаз ногтей, каплевидный псориаз, псориаз волосистой части головы, обратный псориаз, пустулезный псориаз, эритродермический псориаз и псориатический артрит, розацею и склеродермию, включая морфею.
В другом варианте осуществления изобретения хроническое воспаление представляет собой желудочно-кишечное расстройство. Желудочно-кишечные расстройства включают в себя, без ограничения, синдром раздраженной толстой кишки, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, такой как язвенный проктит, левосторонний колит, панколит и молниеносный колит.
В другом варианте осуществления изобретения хроническое воспаление представляет собой сердечно-сосудистое заболевание. Когда LDL-холестерин встраивается в стенки артерий, он может вызвать иммунный ответ. Хроническое воспаление может в конечном итоге повредить артерии, что может привести к образованию трещин. Сердечно-сосудистым заболеванием является любое из ряда определенных заболеваний, которые затрагивают само сердце и/или систему кровеносных сосудов, особенно вены и артерии, ведущие к сердцу и от него. Существует более 60 видов сердечно-сосудистых заболеваний, включая, без ограничения, гипертонию, эндокардит, миокардит, дисфункцию клапанов сердца, застойную сердечную недостаточность, инфаркт миокарда, связанные с диабетом сердечно-сосудистые заболевания, воспаление кровеносных сосудов, такое как артериит, флебит, васкулит, артериальная окклюзионная болезнь, такая как атеросклероз и стеноз, воспалительную кардиомегалию, заболевание периферических артерий, аневризму, эмболию, расслоение сосудов, псевдоаневризму, сосудистую мальформацию, сосудистый невус, тромбоз, тромбофлебит, варикозное расширение вен, инсульт. Симптомы сердечно-сосудистого заболевания, влияющие на сердце, включают, без ограничения, боль в груди или дискомфорт в груди (стенокардию), боль в одной или обеих руках, левом плече, шее, челюсти или спине, одышку, головокружение, частое сердцебиение, тошноту, аномальное сердцебиение, чувство усталости. Симптомы сердечно-сосудистого заболевания, влияющие на мозг, включают, без ограничения, внезапное онемение или слабость лица, руки или ноги, особенно, на одной стороне тела, внезапное замешательство или проблемы с речью или пониманием речи, внезапные проблемы со зрением в одном или обоих глазах, внезапное головокружение, затруднение при ходьбы или потеря равновесия или координации, внезапная сильная головная боль с неизвестной причиной. Симптомы сердечно-сосудистого заболевания, влияющего на ноги, таз и/или руки включают, без ограничения, хромоту, которая является следствием боли или судороги в мышцах, и холод или чувство онемения в ногах или пальцах ног, особенно ночью.
В другом варианте осуществления изобретения хроническое воспаление представляет собой рак. Воспаление контролирует микросреду вокруг опухоли, способствуя ее пролиферации, выживанию и миграции. Например, фибринозное воспаление является результатом значительного увеличения проницаемости сосудов, что позволяет фибрину пройти через кровеносные сосуды. Если присутствует соответствующий прокоагуляционный стимул, например, раковые клетки, то происходит осаждение фибринозного экссудата. Это часто наблюдается в серозных полостях, где превращение фибринозного экссудата в шрам может произойти между серозными оболочками, ограничивая их функции. В другом примере, раком является воспалительный рак, такой как опосредуемый NF-κB воспалительный рак.
В другом варианте осуществления изобретения хроническое воспаление включает фармакологически индуцированное воспаление. Некоторые лекарственные препараты или экзогенные химические соединения, как известно, влияют на воспаление. Например, дефицит витамина А вызывает увеличение воспалительной реакции. Некоторые виды пагубного воздействия некоторых запрещенных наркотических препаратов, таких как кокаин и экстази, могут быть следствием активации ими транскрипционных факторов, тесно связанных с воспалением (например, NF-κB).
В другом варианте осуществления изобретения хроническое воспаление включает инфекцию. Инфекционный организм может выйти за пределы непосредственной ткани через систему кровообращения или лимфатическую систему, с помощью которых он может распространиться на другие части тела. Если организм не сдерживается в результате действия острого воспаления, он может получить доступ к лимфатической системе через близлежащие лимфатические сосуды. Инфекция лимфатических сосудов известна как лимфангит, а инфекция лимфатических узлов называется лимфаденит. Патоген может получить доступ к кровоток через лимфатический дренаж в системе кровообращения. Инфекции включают, без ограничения, бактериальной цистит, бактериальный энцефалит, пандемический грипп, вирусный энцефалит и вирусный гепатит (A, B и C).
В другом варианте осуществления изобретения хроническое воспаление представляет собой травму ткани или органа. Травмы ткани или органа включают, без ограничения, ожог, резанную рану, ранение, колотую рану или травму.
В другом варианте осуществления изобретения хроническое воспаление представляет собой отторжение трансплантата. Отторжение трансплантата возникает, когда трансплантированные орган или ткань не принимаются организмом реципиента, потому что иммунная система реципиента атакует трансплантированные орган или ткань. Адаптивный иммунный ответ, отторжение трансплантата опосредованы как Т-клеточным, так и гуморальным иммунным (через антитела) механизмами. Отторжение трансплантата можно классифицировать как сверхострое отторжение, острое отторжение или хроническое отторжение. Хроническое отторжение пересаженного органа или ткани представляет собой отторжение, которое происходит вследствие плохо понимаемого хронического воспалительного и иммунного ответа против трансплантированной ткани. Также в термин «отторжение трансплантата» включен синдром трансплантат-против-хозяина (GVDH). GVDH является распространенным осложнением аллогенной трансплантации костного мозга, при котором функциональные иммунные клетки в пересаженном мозге распознают реципиента как чужеродного и организуют иммунологическую атаку. Это также может происходить при переливании крови при определенных обстоятельствах. GVDH делится на острую и хроническую формы. Острая и хроническая формы GVDH, по-видимому, включают различные подтипы иммунных клеток, различные наборы цитокинов, несколько разные мишени и отличающуюся реакцию на лечение.
В другом варианте осуществления изобретения хроническое воспаление представляет собой Th1-опосредованное воспалительное заболевание. В хорошо функционирующей иммунной системе иммунный ответ должен включать хорошо сбалансированные провоспалительный Th1-ответ и противовоспалительный Th2-ответ, которые могут справиться с иммунологическим стимулом. В общем, после инициации провоспалительного Th1-ответа, организм полагается на противовоспалительную реакцию, вызываемую Th2-ответом, чтобы противодействовать данной Th1-реакции. Этот противодействующий ответ включает высвобождение цитокинов Th2-типа, таких как, например, IL-4, IL-5 и IL-13, которые связаны с усилением IgE- и эозинофильных ответов при атопии, а также IL-10, который имеет противовоспалительное действие. Th1-опосредованное воспалительное заболевание включает избыточную провоспалительную реакцию, обеспечиваемую Th1-клетками, которая приводит к хроническому воспалению. Th1-опосредованное заболевание может индуцироваться вирусами, бактериями или химическими соединениями (например, факторами окружающей среды). Например, вирус, вызывающий Th1-опосредованное заболевание, может вызывать хроническую или острую инфекцию, которая может быть причиной респираторного расстройства или гриппа.
В другом варианте осуществления изобретения хроническое воспаление представляет собой хроническое нейрогенное воспаление. Хроническое нейрогенное воспаление относится к воспалительной реакции, инициированной и/или поддерживаемой посредством высвобождения воспалительных молекул, подобно SP или CGRP, которые высвобождаются из периферических сенсорных нервных окончаний (т. е., эфферентной функции в отличие от нормального афферентного сигнального пути в спинной мозг в этих нервах). Хроническое нейрогенное воспаление включает в себя как первичное, так и вторичное нейрогенное воспаление. Используемый в данном документе термин «первичное» нейрогенное воспаление относится к воспалению ткани (воспалительным симптомам), которое инициируется или является результатом высвобождения веществ из первичных сенсорных нервных окончаний (например, C и А-дельта волокон). Используемый в данном документе термин «вторичное» нейрогенное воспаление относится к воспалению ткани, инициированному не-нейрональными источниками (например, просачивающимися из сосудистого русла или получаемыми из интерстиция ткани, например, из тучных клеток или иммунных клеток) воспалительных медиаторов, таких как пептиды или цитокины, стимулирующие сенсорные нервные окончания и вызывающие высвобождение воспалительных медиаторов из нервов. Конечным эффектом обоих форм (первичной и вторичной) хронического нейрогенного воспаления является наличие воспалительного состояния, которое поддерживается сенсибилизацией периферических сенсорных нервных волокон. Физиологические последствия хронического нейрогенного воспаления зависят от затронутой ткани, включая, например, кожную боль (аллодинию, гипералгезию), боль в суставах и/или артрит, висцеральную боль и дисфункцию, легочную дисфункцию (астму, COPD) и дисфункцию мочевого пузыря (боль, гиперактивный мочевой пузырь).
Композицию или соединение вводят индивидууму. Индивидуум, как правило, является человеком. Как правило, любой индивидуум, который является кандидатом для обычного лечения хронического воспаления, является кандидатом для лечения хронического воспаления, раскрытого в данном документе. Предоперационное освидетельствование обычно включает в себя рутинное изучение истории болезни и физический осмотр в дополнение к подробно информированному согласию, раскрывающему все существенные риски и выгоды от процедуры.
Фармацевтическая композиция, раскрытая в данном документе, может содержать терапевтическое соединение в терапевтически эффективном количестве. Используемый в данном документе термин «эффективное количество» является синонимом «терапевтически эффективного количества», «эффективной дозы» или «терапевтически эффективной дозы», и при использовании в отношении лечения хронического воспаления относится к минимальной дозе терапевтического соединения, раскрытого в данном документе, необходимой для достижения желаемого терапевтического эффекта, и включает дозу, достаточную для уменьшения симптомов, ассоциированных с хроническим воспалением. Эффективность терапевтического соединения, раскрытого в данном документе, при лечении хронического воспаления может быть определена путем наблюдения за улучшением состояния индивидуума исходя из одного или нескольких клинических симптомов и/или физиологических показателей, ассоциированных с состоянием. На улучшение при состоянии сильной боли также может указывать снижение потребности в сопутствующей терапии.
Подходящее эффективное количество терапевтического соединения, раскрытого в данном документе, для введения индивидууму при конкретном хроническом воспалении может определить обычный специалист в данной области техники с учетом факторов, включающих, без ограничения, тип хронического воспаления, местоположение хронического воспаления, причину хронического воспаления, тяжесть хронического воспаления, желаемую степень облегчения хронического воспаления, желаемую продолжительность облегчения хронического воспаления, конкретное используемое терапевтическое соединение, скорость экскреции используемого терапевтического соединения, фармакодинамику используемого терапевтического соединения, природу других соединений, которые будут включены в композицию, конкретный состав, конкретный способ введения, конкретные характеристики, историю болезни и факторы риска пациента, такие, как, например, возраст, вес, общее состояние здоровья и т.п., или любую комбинацию вышеперечисленного. Кроме того, когда используют повторное введение терапевтического соединения, эффективное количество терапевтического соединения будет также зависеть от факторов, включающих, без ограничения, частоту введения, время полужизни терапевтического соединения или любую их комбинацию. Среднему специалисту в данной области известно, что эффективное количество терапевтического соединения, раскрытого в данном документе, могут быть экстраполировано из in vitro анализов и in vivo исследований введения с использованием животных моделей до введения человеку.
В аспектах этого варианта осуществления изобретения терапевтически эффективное количество терапевтического соединения, раскрытого в данном документе, уменьшает симптом, ассоциированный с хроническим воспалением, например, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. В других аспектах этого варианта осуществления изобретения терапевтически эффективное количество терапевтического соединения, раскрытого в данном документе, уменьшает симптом, ассоциированный с хроническим воспалением, например, самое большее на 10%, самое большее на 15%, самое большее на 20%, самое большее на 25%, самое большее на 30%, самое большее на 35%, самое большее на 40%, самое большее на 45%, самое большее на 50%, самое большее на 55%, самое большее на 60%, самое большее на 65%, самое большее на 70%, самое большее на 75%, самое большее на 80%, самое большее на 85%, самое большее на 90%, самое большее на 95% или самое большее на 100%. В других аспектах этого варианта осуществления изобретения терапевтически эффективное количество терапевтического соединения, раскрытого в данном документе, уменьшает симптом, ассоциированный с хроническим воспалением, например, от примерно 10% до примерно 100%, от примерно 10% до примерно 90%, от примерно 10% до примерно 80%, от примерно 10% до примерно 70%, от примерно 10% до примерно 60%, от примерно 10% до примерно 50%, от примерно 10% до примерно 40%, от примерно 20% до примерно 100%, от примерно 20% до примерно 90%, от примерно 20% до примерно 80%, от примерно 20% до примерно 20%, от примерно 20% до примерно 60%, от примерно 20% до примерно 50%, от примерно 20% до примерно 40%, от примерно 30% до примерно 100%, от примерно 30% до примерно 90%, от примерно 30% до примерно 80%, от примерно 30% до примерно 70%, от примерно 30% до примерно 60% или от примерно 30% до примерно 50%.
В других аспектах этого варианта осуществления изобретения терапевтически эффективное количество терапевтического соединения, раскрытого в данном документе, обычно находится в диапазоне от примерно 0,001 мг/кг/день до примерно 100 мг/кг/день. В аспектах этого варианта осуществления изобретения эффективное количество терапевтического соединения, раскрытого в данном документе, может составлять, например, по меньшей мере 0,001 мг/кг/день, по меньшей мере 0,01 мг/кг/день, по меньшей мере 0,1 мг/кг/день, по меньшей мере 1.0 мг/кг/день, по меньшей мере 5.0 мг/кг/день, по меньшей мере 10 мг/кг/день, по меньшей мере 15 мг/кг/день, по меньшей мере 20 мг/кг/день, по меньшей мере 25 мг/кг/день, по меньшей мере 30 мг/кг/день, по меньшей мере 35 мг/кг/день, по меньшей мере 40 мг/кг/день, по меньшей мере 45 мг/кг/день или по меньшей мере 50 мг/кг/день. В других аспектах этого варианта осуществления, эффективное количество терапевтического соединения, раскрытого в данном документе, может находиться в диапазоне, например, от примерно 0,001 мг/кг/день до примерно 10 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 15 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 20 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 25 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 30 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 35 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 40 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 45 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 50 мг/кг/день, от примерно 0,001 мг/кг/день до примерно 75 мг/кг/день или от примерно 0,001 мг/кг/день до примерно 100 мг/кг/день. В других аспектах этого варианта осуществления изобретения эффективное количество терапевтического соединения, раскрытого в данном документе, может находиться в диапазоне, например, от примерно 0,01 мг/кг/день до примерно 10 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 15 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 20 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 25 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 30 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 35 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 40 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 45 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 50 мг/кг/день, от примерно 0,01 мг/кг/день до примерно 75 мг/кг/день или от примерно 0,01 мг/кг/день до примерно 100 мг/кг/день. В других аспектах этого варианта осуществления изобретения эффективное количество терапевтического соединения, раскрытого в данном документе, может находиться в диапазоне, например, от примерно 0,1 мг/кг/день до примерно 10 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 15 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 20 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 25 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 30 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 35 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 40 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 45 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 50 мг/кг/день, от примерно 0,1 мг/кг/день до примерно 75 мг/кг/день или от примерно 0,1 мг/кг/день до примерно 100 мг/кг/день.
В других аспектах этого варианта осуществления изобретения эффективное количество терапевтического соединения, раскрытого в данном документе, может находиться в диапазоне, например, от примерно 1 мг/кг/день до примерно 10 мг/кг/день, от примерно 1 мг/кг/день до примерно 15 мг/кг/день, от примерно 1 мг/кг/день до примерно 20 мг/кг/день, от примерно 1 мг/кг/день до примерно 25 мг/кг/день, от примерно 1 мг/кг/день до примерно 30 мг/кг/день, от примерно 1 мг/кг/день до примерно 35 мг/кг/день, от примерно 1 мг/кг/день до примерно 40 мг/кг/день, от примерно 1 мг/кг/день до примерно 45 мг/кг/день, от примерно 1 мг/кг/день до примерно 50 мг/кг/день, от примерно 1 мг/кг/день до примерно 75 мг/кг/день или от примерно 1 мг/кг/день до примерно 100 мг/кг/день. В других аспектах этого варианта осуществления изобретения эффективное количество терапевтического соединения, раскрытого в данном документе, может находиться в диапазоне, например, от примерно 5 мг/кг/день до примерно 10 мг/кг/день, от примерно 5 мг/кг/день до примерно 15 мг/кг/день, от примерно 5 мг/кг/день до примерно 20 мг/кг/день, от примерно 5 мг/кг/день до примерно 25 мг/кг/день, от примерно 5 мг/кг/день до примерно 30 мг/кг/день, от примерно 5 мг/кг/день до примерно 35 мг/кг/день, от примерно 5 мг/кг/день до примерно 40 мг/кг/день, от примерно 5 мг/кг/день до примерно 45 мг/кг/день, от примерно 5 мг/кг/день до примерно 50 мг/кг/день, от примерно 5 мг/кг/день до примерно 75 мг/кг/день или от примерно 5 мг/кг/день до примерно 100 мг/кг/день.
Дозировка может представлять собой разовую дозу или кумулятивную дозу (при многократном введении) и может быть легко определена специалистом в данной области. Например, лечение хронического воспаления может включать разовое введение эффективной дозы фармацевтической композиции, раскрытой в данном документе. В альтернативном варианте лечение хронического воспаления может включать многократное введение эффективной дозы фармацевтической композиции, осуществляемое в диапазоне временных интервалов, таких как, например, один раз в день, два раза в день, трижды в день, один раз в несколько дней или один раз в неделю. Время введения может варьировать для каждого отдельного индивидуума в зависимости от таких факторов, как тяжесть симптомов у индивидуума. Например, эффективная доза фармацевтической композиции, раскрытой в данном документе, может вводиться индивидууму один раз в день в течение неопределенного периода времени, или до тех пор, пока ему больше не будет требоваться лечение. Специалисту в данной области будет понятно, что состояние индивидуума можно контролировать в течение всего курса лечения, а эффективное количество вводимой фармацевтической композиции, которая раскрыта в данном документе, может быть соответственно скорректировано.
Для введения терапевтического соединения, раскрытого в данном документе, могут подходить различные пути введения в соответствии со способом лечения хронического воспаления, раскрытым в данном документе. Фармацевтическая композиция может быть введена индивидууму с помощью любого из множества средств в зависимости, например, от типа хронического воспаления, подлежащего лечению, локализации хронического воспаления, подлежащего лечению, конкретного используемого терапевтического соединения или композиции, или другого соединения, которое должно быть включено в композицию, и истории болезни, факторов риска и симптомов индивидуума. По существу, топические, энтеральные или парентеральные пути введения могут подходить для лечения хронического воспаления, раскрытого в данном документе, и такие пути включают как местную, так и системную доставку терапевтического соединения или композиции, раскрытых в данном документе. Композиции, содержащие либо одно терапевтическое соединение, раскрытое в данном документе, либо два или несколько терапевтических соединений, раскрытых в данном документе, предназначены для ингаляционного, местного, интраназального, сублингвального, инъекционного, инфузионного, инстилляционного, ректального и/или вагинального применения и могут быть получены в соответствии с любым способом, известным в данной области для изготовления фармацевтических композиций.
В одном варианте осуществления изобретения, при введении индивидууму фармацевтическая композиция, содержащая терапевтическое соединение, раскрытое в данном документе, приводит в результате к биораспределению терапевтического соединения, отличающемуся от биораспределения терапевтического соединения, включенного в такую же фармацевтическую композицию за исключением адъюванта, раскрытого в данном документе.
В другом варианте осуществления изобретения при введении индивидууму, терапевтическое соединение в фармацевтической композиции, раскрытой в данном документе, доставляется в макрофаги. Макрофаги являются одним из ключевых типов клеток, которые, как полагают, участвуют в контроле реакции воспаления. Полученный высокий уровень терапевтического соединения, имеющего противовоспалительное действие, присутствующий в макрофагах, приводит в результате к клинически эффективному лечению хронического воспаления. В аспекте этого варианта осуществления, при введении индивидууму терапевтически эффективное количество терапевтического соединения в фармацевтической композиции, раскрытой в данном документе, предпочтительно, доставляется в макрофаги. В другом аспекте этого варианта осуществления изобретения, при введении индивидууму терапевтическое соединение в фармацевтической композиции, раскрытой в данном описании, по существу, доставляется в макрофаги. В еще одном аспекте этого варианта осуществления изобретения при введении индивидууму количество терапевтического соединения в фармацевтической композиции, раскрытой в данном описании, которое доставляется в макрофаги, составляет, например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% от общего количества терапевтического соединения, содержащегося во введенной фармацевтической композиции. В дополнительных аспектах этого варианта осуществления изобретения, при введении индивидууму количество терапевтического соединения в фармацевтической композиции, раскрытой в данном описании, которое доставляется в макрофаги, находится в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 15% до примерно 100%, от примерно 20% до примерно 100%, от примерно 25% до примерно 100%, от примерно 30% до примерно 100%, от примерно 35% до примерно 100%, от примерно 40% до примерно 100%, от примерно 45% до примерно 100%, от примерно 50% до примерно 100%, от примерно 5% до примерно 90%, от примерно 10% до примерно 90%, от примерно 15% до примерно 90%, от примерно 20% до примерно 90%, от примерно 25% до примерно 90%, от примерно 30% до примерно 90%, от примерно 35% до примерно 90%, от примерно 40% до примерно 90%, от примерно 45% до примерно 90%, от примерно 50% до примерно 90%, от примерно 5% до примерно 80%, от примерно 10% до примерно 80%, от примерно 15% до примерно 80%, от примерно 20% до примерно 80%, от примерно 25% до примерно 80%, от примерно 30% до примерно 80%, от примерно 35% до примерно 80%, от примерно 40% до примерно 80%, от примерно 45% до примерно 80%, от примерно 50% до примерно 80%, от примерно 5% до примерно 70%, от примерно 10% до примерно 70%, от примерно 15% до примерно 70%, от примерно 20% до примерно 70%, от примерно 25% до примерно 70%, от примерно 30% до примерно 70%, от примерно 35% до примерно 70%, от примерно 40% до примерно 70%, от примерно 45% до примерно 70% или от примерно 50% до примерно 70% от общего количества терапевтического соединения, содержащегося во введенной фармацевтической композиции.
В другом варианте осуществления изобретения при введении индивидууму, терапевтическое соединение в фармацевтической композиции, раскрытой в данном документе, доставляется в дендритные клетки. Дендритные клетки являются одним из ключевых типов клеток, которые, как полагают, координируют взаимодействие между врожденным и приобретенным иммунитетом. Полученный высокий уровень терапевтического соединения, имеющего обезболивающее действие, присутствующий в дендритных клетках, приводит в результате к клинически эффективному лечению хронического воспаления. В аспекте этого варианта осуществления, при введении индивидууму терапевтически эффективное количество терапевтического соединения в фармацевтической композиции, раскрытой в данном документе, предпочтительно, доставляется в дендритные клетки. В другом аспекте этого варианта осуществления изобретения, при введении индивидууму терапевтическое соединение в фармацевтической композиции, раскрытой в данном описании, по существу, доставляется в дендритные клетки. В еще одном аспекте этого варианта осуществления изобретения при введении индивидууму количество терапевтического соединения в фармацевтической композиции, раскрытой в данном описании, которое доставляется в дендритные клетки, составляет, например, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% от общего количества терапевтического соединения, содержащегося во введенной фармацевтической композиции. В дополнительных аспектах этого варианта осуществления изобретения, при введении индивидууму количество терапевтического соединения в фармацевтической композиции, раскрытой в данном описании, которое доставляется в дендритные клетки, находится в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 15% до примерно 100%, от примерно 20% до примерно 100%, от примерно 25% до примерно 100%, от примерно 30% до примерно 100%, от примерно 35% до примерно 100%, от примерно 40% до примерно 100%, от примерно 45% до примерно 100%, от примерно 50% до примерно 100%, от примерно 5% до примерно 90%, от примерно 10% до примерно 90%, от примерно 15% до примерно 90%, от примерно 20% до примерно 90%, от примерно 25% до примерно 90%, от примерно 30% до примерно 90%, от примерно 35% до примерно 90%, от примерно 40% до примерно 90%, от примерно 45% до примерно 90%, от примерно 50% до примерно 90%, от примерно 5% до примерно 80%, от примерно 10% до примерно 80%, от примерно 15% до примерно 80%, от примерно 20% до примерно 80%, от примерно 25% до примерно 80%, от примерно 30% до примерно 80%, от примерно 35% до примерно 80%, от примерно 40% до примерно 80%, от примерно 45% до примерно 80%, от примерно 50% до примерно 80%, от примерно 5% до примерно 70%, от примерно 10% до примерно 70%, от примерно 15% до примерно 70%, от примерно 20% до примерно 70%, от примерно 25% до примерно 70%, от примерно 30% до примерно 70%, от примерно 35% до примерно 70%, от примерно 40% до примерно 70%, от примерно 45% до примерно 70% или от примерно 50% до примерно 70% от общего количества терапевтического соединения, содержащегося во введенной фармацевтической композиции.
В другом варианте осуществления изобретения при введении индивидууму фармацевтическая композиция, раскрытая в данном документе, снижает раздражение желудка. В аспекте этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, по существу снижает раздражение желудка. В еще одном варианте осуществления изобретения при введении индивидууму фармацевтическая композиция, раскрытая в данном документе, снижает раздражение желудка при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта. В аспекте этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, по существу снижает раздражение желудка при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта. В других аспектах этого варианта осуществления, фармацевтическая композиция, раскрытая в данном документе, снижает раздражение желудка, например, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. В других аспектах этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, снижает раздражение желудка в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 15% до примерно 100%, от примерно 20% до примерно 100%, от примерно 25% до примерно 100%, от примерно 30% до примерно 100%, от примерно 35% до примерно 100%, от примерно 40% до примерно 100%, от примерно 45% до примерно 100%, от примерно 50% до примерно 100%, от примерно 5% до примерно 90%, от примерно 10% до примерно 90%, от примерно 15% до примерно 90%, от примерно 20% до примерно 90%, от примерно 25% до примерно 90%, от примерно 30% до примерно 90%, от примерно 35% до примерно 90%, от примерно 40% до примерно 90%, от примерно 45% до примерно 90%, от примерно 50% до примерно 90%, от примерно 5% до примерно 80%, от примерно 10% до примерно 80%, от примерно 15% до примерно 80%, от примерно 20% до примерно 80%, от примерно 25% до примерно 80%, от примерно 30% до примерно 80%, от примерно 35% до примерно 80%, от примерно 40% до примерно 80%, от примерно 45% до примерно 80%, от примерно 50% до примерно 80%, от примерно 5% до примерно 70%, от примерно 10% до примерно 70%, от примерно 15% до примерно 70%, от примерно 20% до примерно 70%, от примерно 25% до примерно 70%, от примерно 30% до примерно 70%, от примерно 35% до примерно 70%, от примерно 40% до примерно 70%, от примерно 45% до примерно 70% или от примерно 50% до примерно 70%.
В другом варианте осуществления изобретения при введении индивидууму фармацевтическая композиция, раскрытая в данном документе, снижает раздражение кишечника. В аспекте этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, по существу снижает раздражение кишечника. В еще одном варианте осуществления изобретения при введении индивидууму фармацевтическая композиция, раскрытая в данном документе, снижает раздражение кишечника при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта. В аспекте этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, по существу снижает раздражение кишечника при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта. В других аспектах этого варианта осуществления, фармацевтическая композиция, раскрытая в данном документе, снижает раздражение кишечника, например, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100% при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта. В других аспектах этого варианта осуществления изобретения фармацевтическая композиция, раскрытая в данном документе, снижает раздражение кишечника в диапазоне, например, от примерно 5% до примерно 100%, от примерно 10% до примерно 100%, от примерно 15% до примерно 100%, от примерно 20% до примерно 100%, от примерно 25% до примерно 100%, от примерно 30% до примерно 100%, от примерно 35% до примерно 100%, от примерно 40% до примерно 100%, от примерно 45% до примерно 100%, от примерно 50% до примерно 100%, от примерно 5% до примерно 90%, от примерно 10% до примерно 90%, от примерно 15% до примерно 90%, от примерно 20% до примерно 90%, от примерно 25% до примерно 90%, от примерно 30% до примерно 90%, от примерно 35% до примерно 90%, от примерно 40% до примерно 90%, от примерно 45% до примерно 90%, от примерно 50% до примерно 90%, от примерно 5% до примерно 80%, от примерно 10% до примерно 80%, от примерно 15% до примерно 80%, от примерно 20% до примерно 80%, от примерно 25% до примерно 80%, от примерно 30% до примерно 80%, от примерно 35% до примерно 80%, от примерно 40% до примерно 80%, от примерно 45% до примерно 80%, от примерно 50% до примерно 80%, от примерно 5% до примерно 70%, от примерно 10% до примерно 70%, от примерно 15% до примерно 70%, от примерно 20% до примерно 70%, от примерно 25% до примерно 70%, от примерно 30% до примерно 70%, от примерно 35% до примерно 70%, от примерно 40% до примерно 70%, от примерно 45% до примерно 70% или от примерно 50% до примерно 70% при сравнении с такой же фармацевтической композицией, как раскрытая в данном документе, за исключением отсутствия фармацевтически приемлемого адъюванта.
Фармацевтическую композицию, раскрытую в данном документе, можно также вводить индивидууму в комбинации с другими терапевтическими соединениями для увеличения общего терапевтического эффекта лечения. Применение нескольких соединений для лечения заболевания может увеличить полезные эффекты, одновременно снижая побочные эффекты.
Аспекты настоящего изобретения могут также быть описаны следующим образом:
1. Фармацевтическая композиция, содержащая: а) терапевтическое соединение, где терапевтическое соединение обладает противовоспалительным действием; и b) фармацевтически приемлемый адъювант.
2. Фармацевтическая композиция по варианту 1, в которой композиция дополнительно содержит фармацевтически приемлемый растворитель.
3. Фармацевтическая композиция, содержащая: а) терапевтическое соединение, где терапевтическое соединение обладает противовоспалительным действием; b) фармацевтически приемлемый растворитель; и c) фармацевтически-приемлемый адъювант.
4. Фармацевтическая композиция, содержащая: а) терапевтическое соединение, где терапевтическое соединение обладает противовоспалительным действием; b) фармацевтически приемлемый растворитель; и c) фармацевтически приемлемый адъювант, где соотношение фармацевтически приемлемого растворителя и фармацевтически приемлемого адъюванта, находится в диапазоне примерно от 0:1 до примерно 1:25.
5. Фармацевтическая композиция по варианту 2 или 3, в которой соотношение фармацевтически приемлемого растворителя и фармацевтически приемлемого адъюванта находится в диапазоне примерно от 0:1 до примерно 1:25.
6. Фармацевтическая композиция по вариантам 1-5, в которой противовоспалительное действие снижает уровень вызывающей воспаление молекулы.
7. Фармацевтическая композиция по варианту 6, в которой вызывающая воспаление молекула включает вещество Р (SP), пептид, связанный с геном кальцитонина (CGRP), глутамат или их комбинацию.
8. Фармацевтическая композиция по варианту 7, в которой противовоспалительное действие снижает уровень SP, CGRP, глутамата или их комбинации по меньшей мере на 10%.
9. Фармацевтическая композиция по вариантам 1-8, в которой противовоспалительное действие снижает уровень вызывающего воспаление простагландина.
10. Фармацевтическая композиция по варианту 9, в которой уровень вызывающего воспаление простагландина снижается по меньшей мере на 10%.
11. Фармацевтическая композиция по вариантам 1-10, в которой противовоспалительное действие стимулирует PPAR-сигнальный путь.
12. Фармацевтическая композиция по варианту 1, в которой PPAR-сигнальный путь стимулируется по меньшей мере на 10%.
13. Фармацевтическая композиция по вариантам 1-12, в которой противовоспалительное действие вызывает апоптоз клеток макрофагов М1, способствует дифференцировке клеток макрофагов М2 или выполняет оба действия.
14. Фармацевтическая композиция по вариантам 1-13, в которой противовоспалительное действие, снижая уровни гамма-интерферона (IFNγ), фактора некроза опухоли альфа (TNF-α), интерлейкина-12 (IL-12) или их комбинации, высвобождаемых из Th1-клеток, повышает уровень IL-10, высвобождаемого из Th2-клеток, или или выполняет оба действия.
15. Фармацевтическая композиция по варианту 14, в которой уровни IFNγ, TNF-α, IL-12 или их комбинации, высвобождаемых из Th1-клеток, снижаются по меньшей мере на 10%.
16. Фармацевтическая композиция по варианту 14, в которой уровень IL-10, высвобождаемого из Th2-клеток, повышается по меньшей мере на 10%.
17. Фармацевтическая композиция по вариантам 1-16, в которой терапевтическое соединение имеет величину logP, указывающую, что соединение растворимо в органическом растворителе.
18. Фармацевтическая композиция по вариантам 1-17, в которой терапевтическое соединение имеет величину logP выше 1,0.
19. Фармацевтическая композиция по вариантам 1-17, в которой терапевтическое соединение имеет величину logP выше 2,0.
20. Фармацевтическая композиция по вариантам 1-19, в которой терапевтическое соединение имеет площадь полярной поверхности, которая является гидрофобной.
21. Фармацевтическая композиция по вариантам 1-20, в которой терапевтическое соединение имеет площадь полярной поверхности, которая меньше 8,0 нм2.
22. Фармацевтическая композиция по вариантам 1-20, в которой терапевтическое соединение имеет площадь полярной поверхности, которая меньше 6,0 нм2.
23. Фармацевтическая композиция по вариантам 1-22, в которой терапевтическое соединение включает нестероидное обезболивающее средство (NSAID).
24. Фармацевтическая композиция по варианту 23, в которой NSAID включает NSAID - салицилатное производное, NSAID-п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или их комбинацию.
25. Фармацевтическая композиция по вариантам 1-24, в которой терапевтическое соединение включает агониста PPARγ.
26. Фармацевтическая композиция по варианту 25, в которой агонист PPARγ включает Монасцин, Ирбесартан, Телмисартан, микофеноловую кислоту, Ресвератрол, дельта(9)-тетрагидроканнабинол, каннабидиол, Куркумин, Цилостазол, Бензбромарон, 6-шогаол, глицирретиновую кислоту, тиазолидиндион, NSAID, фибрат или их комбинацию.
27. Фармацевтическая композиция по вариантам 1-26, в которой терапевтическое соединение включает агент, связывающий ядерные рецепторы.
28. Фармацевтическая композиция по варианту 27, в которой агент, связывающий ядерные рецепторы включает агент, связывающий рецептор ретиноевой кислоты (RAR), агент, связывающий ретиноид-Х-рецептор (RXR), агент, связывающий печеночный Х-рецептор (LXR), агент, связывающий витамин D и их комбинацию.
29. Фармацевтическая композиция по вариантам 1-28, в которой терапевтическое соединение содержит анти-гиперлипидемический агент.
30. Фармацевтическая композиция по варианту 29, в которой анти-гиперлипидемический агент включает фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот (смолы), ингибитор всасывания холестерина, ингибитор панкреатической липазы, симпатомиметический амин или их комбинацию.
31. Фармацевтическая композиция по варианту 29, в которой фибрат включает Безафибрат, Ципрофибрат, Клофибрат, Гемфиброзил, Фенофибрат или их комбинацию.
32. Фармацевтическая композиция по варианту 29, в которой статин включает Аторвастатин, Флувастатин, Ловастатин, Питавастатин, Правастатин, Розувастатин, Симвастатин или их комбинацию.
33. Фармацевтическая композиция по варианту 29, в которой ниацин включает аципимокс, ниацин, никотинамид, витамин В3 или их комбинацию.
34. Фармацевтическая композиция по варианту 29, в которой секвестрант желчных кислот включает Холестирамин, Колестипол, Колесевелам или их комбинацию.
35. Фармацевтическая композиция по варианту 29, в которой ингибитор всасывания холестерина включает Эзетимиб, фитостерин, стерин, станол или их комбинацию.
36. Фармацевтическая композиция по варианту 29, в которой ингибитор всасывания жиров включает Орлистат.
37. Фармацевтическая композиция по варианту 29, в которой симпатомиметический амин включает Кленбутерол, Сальбутамол, эфедрин, псевдоэфедрин, метамфетамин, амфетамин, фенилэфрин, изопротеренол, добутамин, метилфенидат, лисдексамфетамин, катин, катинон, меткатинон, кокаин, бензилпиперазин (BZP), метилендиоксипировалерон (MDPV), 4-метиламинорекс, пемолин, фенметразин, пропилгекседрин или их комбинацию.
38. Фармацевтическая композиция по вариантам 1-37, в которой терапевтическое соединение содержит содержит сложный эфир терапевтического соединения.
39. Фармацевтическая композиция по вариантам 1-38, в которой терапевтическое соединение содержит сложный эфир терапевтического соединения по вариантам 23-37.
40. Фармацевтическая композиция по вариантам 1-39, в которой фармацевтически приемлемый растворитель составляет менее примерно 20% (об./об.).
41. Фармацевтическая композиция по вариантам 1-40, в которой фармацевтически приемлемый растворитель содержит фармацевтически приемлемый полярный апротонный растворитель, фармацевтически приемлемый полярный протонный растворитель, фармацевтически приемлемый неполярный растворитель или их комбинацию.
42. Фармацевтическая композиция по вариантам 1-41, в которой фармацевтически приемлемый растворитель включает фармацевтически приемлемый спирт.
43. Фармацевтическая композиция по варианту 42, в которой фармацевтически приемлемый спирт включает ациклический спирт, одноатомный спирт, многоатомный спирт, ненасыщенный алифатический спирт, алициклический спирт или их комбинацию.
44. Фармацевтическая композиция по варианту 42, в которой фармацевтически приемлемый спирт включает С1-20-спирт.
45. Фармацевтическая композиция по варианту 42, в которой фармацевтически приемлемый спирт включает метанол, этанол, пропанол, бутанол, пентанол, 1-гексадеканол или их комбинацию.
46. Фармацевтическая композиция по вариантам 1-45, в которой фармацевтически приемлемый растворитель включает фармацевтически приемлемый сложный эфир фармацевтически приемлемого спирта и кислоты.
47. Фармацевтическая композиция по варианту 46, в которой фармацевтически приемлемый сложный эфир включает метилацетат, метилбутират, метилформиат, этилацетат, этилбутират, этилформиат, пропилацетат, пропилбутират, пропилформиат, бутилацетат, бутилбутират, бутилформиат, изобутилацетат, изобутилбутират, изобутилформиат, пентилацетат, пентилбутират, пентилформиат и 1-гексадецилацетат, 1-гексадецилбутират и 1-гексадецилформиат или их комбинацию.
48. Фармацевтическая композиция по вариантам 1-47, в которой фармацевтически приемлемый растворитель включает фармацевтически приемлемый гликолевый эфир, фармацевтически приемлемый двухатомный спирт, фармацевтически приемлемый пропиленгликоль, фармацевтически приемлемый дипропиленгликоль, фармацевтически приемлемый полипропиленгликолевый (PPG) полимер, фармацевтически приемлемый полиэтиленгликолевый (PEG) полимер или любую их комбинацию.
49. Фармацевтическая композиция по варианту 48, в которой фармацевтически приемлемый гликолевый эфир включает монометиловый эфир диэтиленгликоля (2-(2-метоксиэтокси)этанол), моноэтиловый эфир диэтиленгликоля (2-(2-этоксиэтокси) этанол), монопропиловый эфир диэтиленгликоля (2-(2-пропоксиэтокси)этанол), моноизопропиловый эфир диэтиленгликоля (2-(2-изопропоксиэтокси)этанол) и моно-н-бутиловый эфир диэтиленгликоля (2-(2-бутоксиэтокси)этанол) или любую их комбинацию.
50. Фармацевтическая композиция по варианту 48, в которой молярная масса фармацевтически приемлемого полипропиленгликолевого (PPG) полимера или фармацевтически приемлемого полиэтиленгликолевого (PEG) полимера меньше примерно 2000 г/моль.
51. Фармацевтическая композиция по варианту 48, в которой молярная масса фармацевтически приемлемого полипропиленгликолевого (PPG) полимера или фармацевтически приемлемого полиэтиленгликолевого (PEG) полимера больше примерно 2000 г/моль.
52. Фармацевтическая композиция по вариантам 1-51, в которой фармацевтически приемлемый растворитель включает фармацевтически приемлемый глицерид.
53. Фармацевтическая композиция по варианту 52, в которой фармацевтически приемлемый глицерид включает моноглицерид, диглицерид, триглицерид, ацетилированный моноглицерид, ацетилированный диглицерид, ацетилированный триглицерид или их комбинацию.
54. Фармацевтическая композиция по вариантам 1-53, в которой фармацевтически приемлемый растворитель представляет собой жидкость при 20°С, или в которой фармацевтически приемлемый растворитель представляет собой твердое вещество при 20°С.
55. Фармацевтическая композиция по варианту 54, в которой фармацевтически приемлемый твердый растворитель содержит ментол.
56. Фармацевтическая композиция по вариантам 1-55, в которой адъювант составляет по меньшей мере 80% (об./об.).
57. Фармацевтическая композиция по вариантам 1-56, в которой фармацевтически приемлемый адъювант представляет собой жидкость при 20°С.
58. Фармацевтическая композиция по вариантам 1-56, в которой фармацевтически приемлемый адъювант представляет собой твердое вещество при 20°C.
59. Фармацевтическая композиция по вариантам 1-58, в которой фармацевтически приемлемый адъювант содержит фармацевтически приемлемый липид.
60. Фармацевтическая композиция по варианту 59, в которой фармацевтически приемлемый липид включает насыщенную жирную кислоту, ненасыщенную жирную кислоту или их комбинацию.
61. Фармацевтическая композиция по варианту 59 или 60, в которой фармацевтически приемлемый липид включает две или несколько насыщенных или ненасыщенных жирных кислот.
62. Фармацевтическая композиция по варианту 61, в которой две или несколько насыщенных или ненасыщенных жирных кислот включают пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту, линоленовую кислоту или их комбинацию.
63. Фармацевтическая композиция по вариантам 60-62, в которой ненасыщенная жирная кислота имеет температуру плавления 20°С или ниже, или ненасыщенная жирная кислота является твердой при 20°C.
64. Фармацевтическая композиция по вариантам 60-62, в которой ненасыщенная жирная кислота содержит омега-жирную кислоту.
65. Фармацевтическая композиция по варианту 59, в которой фармацевтически приемлемый липид включает фармацевтически приемлемое масло.
66. Фармацевтическая композиция по варианту 65, в которой фармацевтически приемлемое масло включает миндальное масло, арахисовое масло, масло авокадо, рапсовое масло, касторовое масло, кокосовое масло, кукурузное масло, масло хлопчатника, масло из виноградных косточек, масло лесного ореха, конопляное масло, льняное масло, оливковое масло, пальмовое масло, арахисовое масло, масло из рапсовых семян, масло из рисовых отрубей, сафлоровое масло, кунжутное масло, масло из соевых бобов, соевое масло, подсолнечное масло, масло из какао-бобов, масло из грецкого ореха, масло из зародышей пшеницы или их комбинацию.
67. Фармацевтическая композиция по варианту 59, в которой фармацевтически приемлемый липид включает фармацевтически приемлемый глицеролипид, фармацевтически приемлемый гликолевый эфир жирной кислоты, фармацевтически приемлемый сложный эфир полиэфира и жирной кислоты, смесь фармацевтически приемлемых липидов или любую их комбинацию.
68. Фармацевтическая композиция по вариантам 1-67, в которой фармацевтическая композиция дополнительно содержит фармацевтически приемлемый стабилизирующий агент.
69. Фармацевтическая композиция по варианту 68, в которой фармацевтически приемлемый стабилизирующий агент включает воду, протекторную кислоту, содержащую жирнокислотный компонент и уксусную кислоту, этилацетат, ацетат натрия/уксусную кислоту, моноглицерид, ацетилированный моноглицерид, диглицерид, ацетилированный моноглицерид, ацетилированный диглицерид, жирную кислоту, соль жирной кислоты или их комбинацию.
70. Фармацевтическая композиция по варианту 68, в которой фармацевтически приемлемый стабилизирующий агент включает фармацевтически приемлемый эмульгатор.
71. Фармацевтическая композиция по варианту 70, в которой фармацевтически приемлемый эмульгатор включает поверхностно-активное вещество, полисахарид, лектин, фосфолипид или их комбинацию.
72. Фармацевтическая композиция по вариантам 1-69, в которой фармацевтическая композиция не содержит фармацевтически приемлемый эмульгатор.
73. Способ получения фармацевтической композиции, включающий стадию контактирования терапевтического соединения с фармацевтически приемлемым адъювантом в условиях, позволяющих образование фармацевтической композиции.
74. Способ получения фармацевтической композиции, включающий следующие стадии: а) контактирование фармацевтически приемлемого растворителя с терапевтическим соединением в условиях, позволяющих терапевтическому соединению растворяться в фармацевтически приемлемом растворителе, тем самым образуя раствор, где терапевтическое соединение обладает противовоспалительным действием, и b) контактирование раствора, полученного на стадии (а) с фармацевтически приемлемым адъювантом в условиях, позволяющих образование фармацевтической композиции.
75. Способ получения фармацевтической композиции, включающий следующие стадии: а) контактирование фармацевтически приемлемого растворителя с терапевтическим соединением в условиях, позволяющих терапевтическому соединению растворяться в фармацевтически приемлемом растворителе, тем самым образуя раствор, где терапевтическое соединение обладает противовоспалительным действием, и b) контактирование раствора, полученного на стадии (а) с фармацевтически приемлемым адъювантом в условиях, позволяющих образование фармацевтической композиции, где соотношение фармацевтически приемлемого растворителя и фармацевтически приемлемого адъюванта находится в диапазоне от примерно 0:1 до примерно 1:25.
76. Способ по вариантам 73-75, в котором терапевтическое соединение имеет величину logP, указывающую, что соединение растворимо в органическом растворителе.
77. Способ по вариантам 73-76, в котором терапевтическое соединение имеет величину logP выше 1,0.
78. Способ по вариантам 73-76, в котором терапевтическое соединение имеет величину logP выше 2,0.
79. Способ по вариантам 73-78, в котором терапевтическое соединение имеет площадь полярной поверхности, которая является гидрофобной.
80. Способ по вариантам 73-79, в котором терапевтическое соединение имеет площадь полярной поверхности, которая меньше 8,0 нм2.
81. Способ по вариантам 73-79, в котором терапевтическое соединение имеет площадь полярной поверхности, которая меньше 6,0 нм2.
82. Способ по вариантам 73-81, в котором терапевтическое соединение включает нестероидное противовоспалительное средство (NSAID).
83. Способ по варианту 82, в котором NSAID включает NSAID- салицилатное производное, NSAID-п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID- производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или их комбинацию.
84. Способ по вариантам 73-83, в котором терапевтическое соединение включает агониста PPARγ.
85. Способ по варианту 84, в котором агонист PPARγ включает Монасцин, Ирбесартан, Телмисартан, микофеноловую кислоту, Ресвератрол, дельта(9)-тетрагидроканнабинол, каннабидиол, Куркумин, Цилостазол, Бензбромарон, 6-шогаол, глицирретиновую кислоту, тиазолидиндион, NSAID, фибрат или их комбинацию.
86. Способ по вариантам 73-85, в котором терапевтическое соединение включает агент, связывающий ядерные рецепторы.
87. Способ по варианту 86, в котором агент, связывающий ядерные рецепторы включает агент, связывающий рецептор ретиноевой кислоты (RAR), агент, связывающий ретиноид-Х-рецептор (RXR), агент, связывающий печеночный Х-рецептор (LXR), агент, связывающий витамин D и их комбинацию.
88. Способ по вариантам 73-87, в котором терапевтическое соединение содержит анти-гиперлипидемический агент.
89. Способ по варианту 88, в котором анти-гиперлипидемический агент включает фибрат, статин, токотриенол, ниацин, секвестранты желчных кислот (смолы), ингибитор всасывания холестерина, ингибитор панкреатической липазы, симпатомиметический амин или их комбинацию.
90. Способ по варианту 89, в котором фибрат включает Безафибрат, Ципрофибрат, Клофибрат, Гемфиброзил, Фенофибрат или их комбинацию.
91. Способ по варианту 89, в котором статин включает Аторвастатин, Флувастатин, Ловастатин, Питавастатин, Правастатин, Розувастатин, Симвастатин или их комбинацию.
92. Способ по варианту 89, в котором ниацин включает аципимокс, ниацин, никотинамид, витамин В3 или их комбинацию.
93. Способ по варианту 89, в котором секвестрант желчных кислот включает Холестирамин, Колестипол, Колесевелам или их комбинацию.
94. Способ по варианту 89, в котором ингибитор всасывания холестерина включает Эзетимиб, фитостерин, стерин, станол или их комбинацию.
95. Способ по варианту 89, где ингибитор всасывания жиров включает Орлистат.
96. Способ по варианту 89, в котором симпатомиметический амин включает Кленбутерол, Сальбутамол, эфедрин, псевдоэфедрин, метамфетамин, амфетамин, фенилэфрин, изопротеренол, добутамин, метилфенидат, лисдексамфетамин, катин, катинон, меткатинон, кокаин, бензилпиперазин (BZP), метилендиоксипировалерон (MDPV), 4-метиламинорекс, пемолин, фенметразин, пропилгекседрин или их комбинацию.
97. Способ по вариантам 73-96, в котором терапевтическое соединение содержит сложный эфир терапевтического соединения.
98. Способ по вариантам 73-97, в котором терапевтическое соединение содержит эфир терапевтического соединения по вариантам 111-126.
99. Способ по вариантам 74-98, в котором фармацевтически приемлемый растворитель составляет менее примерно 20% (об./об.).
100. Способ по вариантам 74-99, в котором фармацевтически приемлемый растворитель содержит фармацевтически приемлемый полярный апротонный растворитель, фармацевтически приемлемый полярный протонный растворитель, фармацевтически приемлемый неполярный растворитель или их комбинацию.
101. Способ по вариантам 74-100, в котором фармацевтически приемлемый растворитель включает фармацевтически приемлемый спирт.
102. Способ по варианту 101, в котором фармацевтически приемлемый спирт включает ациклический спирт, одноатомный спирт, многоатомный спирт, ненасыщенный алифатический спирт, алициклический спирт или их комбинацию.
103. Способ по варианту 101, в котором фармацевтически приемлемый спирт включает С1-20-спирт.
104. Способ по варианту 101, в котором фармацевтически приемлемый спирт включает метанол, этанол, пропанол, бутанол, пентанол, 1-гексадеканол или их комбинацию.
105. Способ по варианту 101, в котором фармацевтически приемлемый растворитель включает фармацевтически приемлемый сложный эфир фармацевтически приемлемого спирта и кислоты.
106. Способ по варианту 105, в котором фармацевтически приемлемый сложный эфир включает метилацетат, метилбутират, метилформиат, этилацетат, этилбутират, этилформиат, пропилацетат, пропилбутират, пропилформиат, бутилацетат, бутилбутират, бутилформиат, изобутилацетат, изобутилбутират, изобутилформиат, пентилацетат, пентилбутират, пентилформиат и 1-гексадецилацетат, 1-гексадецилбутират и 1-гексадецилформиат или их комбинацию.
107. Способ по вариантам 74-106, в котором фармацевтически приемлемый растворитель представляет собой фармацевтически приемлемый полиэтиленгликолевый (PEG) полимер.
108. Способ по варианту 107, в котором молярная масса фармацевтически приемлемого полиэтиленгликолевого (PEG) полимера меньше примерно 2000 г/моль.
109. Способ по варианту 107, в котором молярная масса фармацевтически приемлемого полиэтиленгликолевого (PEG) полимера выше примерно 2000 г/моль.
110. Способ по вариантам 74-109, в котором фармацевтически приемлемый растворитель включает фармацевтически приемлемый глицерид.
111. Способ по варианту 110, в котором фармацевтически приемлемый глицерид включает моноглицерид, диглицерид, триглицерид, ацетилированный моноглицерид, ацетилированный диглицерид, ацетилированный триглицерид или их комбинацию.
112. Способ по вариантам 74-111, в котором фармацевтически приемлемый растворитель представляет собой жидкость при 20°С.
113. Способ по вариантам 74-111, в котором фармацевтически приемлемый растворитель представляет собой твердое вещество при 20°C.
114. Способ по варианту 113, в котором фармацевтически приемлемый твердый растворитель содержит ментол.
115. Способ по вариантам 73-114, в котором адъювант составляет по меньшей мере 80% (об./об.).
116. Способ по вариантам 73-115, в котором фармацевтически приемлемый адъювант представляет собой жидкость при 20°С.
117. Способ по вариантам 73-115, в котором фармацевтически приемлемый адъювант представляет собой твердое вещество при 20°C.
118. Способ по вариантам 73-117, в котором фармацевтически приемлемый адъювант содержит фармацевтически приемлемый липид.
119. Способ по варианту 118, в котором фармацевтически приемлемый липид включает насыщенную жирную кислоту, ненасыщенную жирную кислоту или их комбинацию.
120. Способ по варианту 118 или 119, в котором фармацевтически приемлемый липид включает две или несколько насыщенных или ненасыщенных жирных кислот.
121. Способ по варианту 120, в котором две или несколько насыщенных или ненасыщенных жирных кислот включают пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту, линолевую кислоту, линоленовую кислоту или их комбинацию.
122. Способ по вариантам 119-121, в котором фармацевтически приемлемая ненасыщенная жирная кислота имеет температуру плавления 20°С или ниже.
123. Способ по вариантам 119-121, в котором фармацевтически приемлемая ненасыщенная жирная кислота представляет собой твердое вещество при 20°C.
124. Способ по вариантам 119-123, в котором фармацевтически приемлемая ненасыщенная жирная кислота содержит омега-жирную кислоту.
125. Способ по вариантам 118-124, в котором фармацевтически приемлемый липид включает фармацевтически приемлемое масло.
126. Способ по варианту 125, в котором фармацевтически приемлемое масло включает миндальное масло, арахисовое масло, масло авокадо, рапсовое масло, касторовое масло, кокосовое масло, кукурузное масло, масло хлопчатника, масло из виноградных косточек, масло лесного ореха, конопляное масло, льняное масло, оливковое масло, пальмовое масло, арахисовое масло, масло из рапсовых семян, масло из рисовых отрубей, сафлоровое масло, кунжутное масло, соевое масло, соевое масло, подсолнечное масло, масло из грецкого ореха, масло из зародышей пшеницы или их комбинацию.
127. Способ по вариантам 74 или 76-126, в котором на стадии (b) соотношение фармацевтически приемлемого растворителя и фармацевтически приемлемого адъюванта находится в диапазоне от примерно 0:1 до примерно 1:25.
128. Способ по вариантам 73-127, в котором стадия (а) дополнительно включает контактирование фармацевтически приемлемого стабилизирующего агента с фармацевтически приемлемым растворителем и терапевтическим соединением.
129. Способ по варианту 128, в котором фармацевтически приемлемый стабилизирующий агент включает воду, протекторную кислоту, содержащую жирнокислотный компонент и уксусную кислоту, этилацетат, ацетат натрия/уксусную кислоту, моноглицерид, ацетилированный моноглицерид, ацетилированный моноглицерид, диглицерид, ацетилированный диглицерид, жирную кислоту, соль жирной кислоты или их комбинацию.
130. Способ по варианту 128 или 129, в которой фармацевтически приемлемый стабилизирующий агент содержит фармацевтически приемлемый эмульгатор.
131. Способ по варианту 130, в котором фармацевтически приемлемый эмульгатор содержит поверхностно-активное вещество, полисахарид, лектин, фосфолипид или их комбинацию.
132. Способ по вариантам 73-129, в котором фармацевтическая композиция не содержит фармацевтически приемлемый эмульгатор.
133. Способ по вариантам 74-132, в котором способ дополнительно включает удаление фармацевтически приемлемого растворителя из фармацевтической композиции.
134. Способ по варианту 133, в котором по меньшей мере, 5% фармацевтически приемлемого растворителя удаляют из фармацевтической композиции.
135. Способ по варианту 133 или 134, в котором удаление растворителя из фармацевтической композиции, раскрытой в данном документе, проводят при температуре ниже 20°С.
136. Способ по вариантам 73-135, в котором фармацевтическая композиция изготовлена по вариантам 1-72.
137. Способ лечения индивидуума с хроническим воспалением, где способ включает в себя стадию введения индивидууму, нуждающемуся в этом, фармацевтической композиции по вариантам 1-72, где введение приводит к снижению симптома, ассоциированного с хроническим воспалением, таким образом обеспечивая лечение индивидуума.
138. Применение фармацевтической композиции по вариантам 1-72 в производстве лекарственного средства для лечения хронического воспаления.
139. Применение фармацевтической композиции по вариантам 1-72 для лечения хронического воспаления.
140. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с угрями, кислотным рефлюксом/изжогой, возрастной макулярной дегенерацией (AMD), аллергией, аллергическим ринитом, болезнью Альцгеймера, латеральным амиотрофическим склерозом, анемией, аппендицитом, артериитом, артритом, астмой, атеросклерозом, аутоиммунными заболеваниями, баланитом, блефаритом, бронхиолитом, бронхитом, буллезным пемфигоидом, ожогом, бурситом, раком, остановкой сердца, кардитом, целиакией, целлюлитом, цервицитом, холангитом, холециститом, хориоамнионитом, хронической обструктивной болезнью легких (COPD), циррозом, колитом, застойной сердечной недостаточностью, конъюнктивитом, циклофосфамид-индуцированным циститом, кистозным фиброзом, циститом, простудой, дакриоаденитом, деменцией, дерматитом, дерматомиозитом, диабетом, диабетической невропатией, диабетической ретинопатией, диабетической нефропатией, диабетической язвой, заболеванием пищеварительной системы, экземой, эмфиземой, энцефалитом, эндокардитом эндометритом, энтеритом, энтероколитом, эпиконделитом, эпидидимитом, фасциитом, фибромиалгией, фиброзом, фиброзитом, гастритом, гастроэнтеритом, гингивитом, гломерулонефритом, глосситом, болезнью сердца, дисфункцией клапана сердца, гепатитом, гнойным гидраденитом, болезнью Хантингтона, гиперлипидемическим панкреатитом, гипертонией, илеитом, инфекцией, воспалительным заболеванием кишечника, воспалительной кардиомегалией, воспалительной невропатией, инсулинорезистентностью, интерстициальным циститом, интерстициальным нефритом, иритом, ишемией, ишемической болезнью сердца, кератитом, кератоконъюнктивитом, ларингитом, волчаночным нефритом, маститом, мастоидитом, менингитом, метаболическим синдромом (синдромом X), мигренью, рассеянным склерозом, миелитом, миокардитом, миозитом, нефритом, неалкогольным стеатогепатитом, ожирением, омфалитом, оофоритом, орхитом, остеохондритом, остеопенией, остеомиелитом, остеопорозом, остеитом, отитом, панкреатитом, болезнью Паркинсона, паротитом, воспалительным заболеванием органов таза, пузырчаткой обыкновенной, перикардитом, перитонитом, фарингитом, флебитом, плевритом, пневмонией, поликистозным нефритом, проктитом, простатитом, псориазом, пульпитом, пиелонефритом, пилефлебитом, почечной недостаточностью, реперфузионным повреждением, ретинитом, ревматической лихорадкой, ринитом, сальпингитом, саркоидозом, сиаладенитом, синуситом, спастической толстой кишкой, стенозом, стоматитом, инсультом, осложнением после хирургического вмешательства, синовитом, тендинитом, тендинозом, теносиновитом, тромбофлебитом, тонзиллитом, травмой, черепно-мозговой травмой, отторжением трансплантата, тригонитом, туберкулезом, опухолью, уретритом, урситом, увеитом, вагинитом, васкулитом или вульвитом.
141. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой воспаление ткани.
142. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой системное воспаление.
143. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой артрит.
144. Способ или применение по варианту 140 или 143, в котором артрит представляет собой моноартрит, олигоартрит или полиартрит.
145. Способ или применение по воплощению 140 или 143, в котором артрит может являться аутоиммунным заболеванием или неаутоиммунным заболеванием.
146. Способ или применение по варианту 140 или 143, в котором артрит представляет собой остеоартрит, ревматоидный артрит, ювенильный идиопатический артрит, септический артрит, спондилоартропатию, подагру, псевдоподагру или болезнь Стилла.
147. Способ или применение по воплощению 146, в котором спондилоартропатия представляет собой анкилозирующий спондилит, реактивный артрит (синдром Рейтера), псориатический артрит, связанный с воспалительным заболеванием кишечника энтеропатический артрит, болезнь Уиппла и болезнь Бехчета.
148. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой аутоиммунное заболевание.
149. Способ или применение по варианту 140 или 148, в котором аутоиммунное заболевание представляет собой системное аутоиммунное заболевание или органоспецифическое аутоиммунное заболевание.
150. Способ или применение по варианту 140 или 148, в котором аутоиммунное заболевание представляет собой острый рассеянный энцефаломиелит (ADEM), болезнь Аддисона, аллергию или гиперчувствительность, боковой амиотрофический склероз, синдром антифосфолипидного антитела (APS), артрит, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный панкреатит, буллезный пемфигоид, целиакию, болезнь Шагаса, хроническую обструктивную болезнь легких (COPD), сахарный диабет I типа 1 (IDDM), эндометриоз, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре (GBS), тиреоидит Хашимото, гидраденит гнойный, идиопатическую тромбоцитопеническую пурпуру, воспалительные заболевания кишечника, интерстициальный цистит, волчанку (включая дискоидную красную волчанку, медикаментозную красную волчанку, волчаночный нефрит, неонатальную волчанку, подострую кожную красную волчанку и системную красную волчанку), морфею, рассеянный склероз (MS), миастению, миопатию, нарколепсию, нейромиотонию, пузырчатку обыкновенную, пернициознную анемию, первичный билиарный цирроз печени, рецидивирующий диссеминированный энцефаломиелит, ревматизм, шизофрению, склеродермию, синдром Шегрена, теносиновит, васкулит или витилиго.
151. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой миопатию.
152. Способ или применение по варианту 137 или 148, в котором миопатия представляет собой дерматомиозит, миозит телец включения или полимиозит.
153. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление представляет собой васкулит.
154. Способ или применение по варианту 140 или 153, в котором васкулит представляет собой болезнь Бюргера, артериит, церебральный васкулит, артериит Чарга-Стросса, криоглобулинемию, эссенциальный криоглобулинемический васкулит, гигантоклеточный артериит, васкулит игрока в гольф, пурпуру Геноха-Шенлейна, васкулит гиперчувствительности, болезнь Кавасаки, флебит, микроскопический полиартериит/полиангиит, узелковый полиартериит, ревматическую полимиалгию (PMR), ревматоидный васкулит, артериит Такаясу, тромбофлебит, гранулематоз Вегенера или васкулит, вторичный при заболеваниях соединительной ткани, или васкулит, вторичный по отношению к вирусной инфекции.
155. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с заболеванием кожи.
156. Способ или применение по варианту 140 или 155, в котором заболевание кожи представляет собой дерматит, экзему, стазисный дерматит, гидраденит гнойный, псориаз, угри или склеродермии.
157. Способ или применение по варианту 156, в котором экзема представляет собой атопическую экзему, контактную экзему, ксеротическую экзему, себорейный дерматит, дисгидроз, дискоидную экзему, венозную экзему, герпетиформный дерматит, нейродермит или аутоэкзематизацию.
158. Способ или применение по варианту 156, в котором псориаз является представляет собой бляшечный псориаз, псориаз ногтей, каплевидный псориаз, псориаз волосистой части головы, обратный псориаз, пустулезный псориаз или эритродермический псориаз.
159. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с желудочно-кишечным расстройством.
160. Способ или применение по варианту 140 или 159, в котором желудочно-кишечное расстройство представляет собой синдром раздраженного кишечника или воспалительное заболевание кишечника.
161. Способ или применение по варианту 160, в котором воспалительное заболевание кишечника представляет собой болезнь Крона или язвенный колит.
162. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с сердечно-сосудистым заболеванием.
163. Способ или применение по варианту 140 или 162, в котором сердечно-сосудистое заболевание представляет собой гипертонию, дисфункцию клапана сердца, застойную сердечную недостаточность, инфаркт миокарда, диабетические сердечные заболевания, воспаление кровеносных сосудов, артериальную окклюзионную болезнь, заболевание периферических артерий, аневризму, эмболию, расслоение сосудов, псевдоаневризму, сосудистую мальформацию, сосудистый невус, тромбоз, тромбофлебит, варикозное расширение вен или инсульт.
164. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с раком.
165. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с фармакологически индуцированным воспалением.
166. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с инфекцией.
167. Способ или применение по варианту 140 или 166, в котором инфекция представляет собой бактериальной цистит, бактериальный энцефалит, пандемический грипп, вирусный энцефалит, вирусный гепатит А, вирусный гепатит В или вирусный гепатит С.
168. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с травмой ткани или органа.
169. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с отторжением трансплантата или синдромом трансплантат-против-хозяина.
170. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с Th1-опосредованным воспалительным заболеванием.
171. Способ по варианту 137 или применение по варианту 138 или 139, в котором хроническое воспаление ассоциировано с хроническим нейрогенным воспалением.
172. Способ по вариантам 137 или 140-171 или применение по вариантам 138-171, в котором при введении индивидууму фармацевтическая композиция, содержащая терапевтическое соединение по вариантам 1-72, приводит в результате к биораспределению терапевтического соединения, отличающемуся от биораспределения терапевтического соединения, включенного в такую же фармацевтическую композицию за исключением адъюванта, раскрытого в данном документе.
173. Способ по вариантам 137 или 140-172 или применение по вариантам 138-172, в котором при введении индивидууму, количество терапевтического соединения в фармацевтической композиции в соответствии с вариантами осуществления 1-72, доставленное в макрофаги, составляет по меньшей мере 5% от общего количества терапевтического соединения, содержащегося в введенной фармацевтической композиции.
174. Способ по вариантам 137 или 140-173 или применение по вариантам 138-173, в котором при введении индивидууму фармацевтическая композиция по вариантам 1-72 снижает раздражение кишечника по меньшей мере на 5% по сравнению с фармацевтической композицией по вариантам 1-72 за исключением отсутствия фармацевтически приемлемого адъюванта.
175. Способ по вариантам 137 или 140-171 или применение по вариантам 138-174, в котором при введении индивидууму, фармацевтическая композиция по вариантам 1-72 снижает раздражение желудка по меньшей мере на 5% по сравнению с фармацевтической композицией по вариантам 1-72 за исключением отсутствия фармацевтически приемлемого адъюванта.
176. Твердая фармацевтическая композиция, содержащая: а) примерно 10%-30% по массе нестероидного противовоспалительного средства (NSAID), где NSAID имеет противовоспалительное действие, b) от примерно 20% до примерно 50% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, с) от примерно 10% до примерно 30% по массе глицерилмонолинолеата, и d) от примерно 5% до примерно 15% PEG.
177. Твердая фармацевтическая композиция по варианту 176, в которой NSAID составляет от примерно 20% до примерно 30% по массе фармацевтической композиции.
178. Твердая фармацевтическая композиция по варианту 176 или 177, в которой смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот составляет от примерно 35% до примерно 45% по массе фармацевтической композиции.
179. Твердая фармацевтическая композиция по любому одному из вариантов 176-178, в которой глицерилмонолинолеат составляет от примерно 15% до примерно 25% по массе фармацевтической композиции.
180. Твердая фармацевтическая композиция по любому одному из вариантов 176-179, в которой PEG составляет от примерно 7% до примерно 13% по массе фармацевтической композиции.
181. Твердая фармацевтическая композиция по любому одному из вариантов 176-180, в которой NSAID составляет от примерно 23% до примерно 27% по массе фармацевтической композиции, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот составляет от примерно 41% до примерно 47% по массе фармацевтической композиции, глицерилмонолинолеат составляет от примерно 18% до примерно 22% по массе фармацевтической композиции, а PEG составляет от примерно 9% до примерно 11% по массе фармацевтической композиции.
182. Твердая фармацевтическая композиция по любому одному из вариантов 176-181, в которой твердая фармацевтическая композиция дополнительно содержит от примерно 5% до примерно 15% пропиленгликоля.
183. Твердая фармацевтическая композиция по любому одному из вариантов 176-182, в которой NSAID составляет от примерно 23% до примерно 27% по массе фармацевтической композиции, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот составляет от примерно 41% до примерно 47% по массе фармацевтической композиции, глицерилмонолинолеат составляет от примерно 18% до примерно 22% по массе фармацевтической композиции, PEG составляет от примерно 9% до примерно 11% по массе фармацевтической композиции, а пропиленгликоль составляет от примерно 9% до примерно 11% по массе фармацевтической композиции.
184. Жидкая фармацевтическая композиция, содержащая: а) от примерно 15% до примерно 35% по массе нестероидного противовоспалительного лекарственного средства (NSAID), где NSAID имеет противовоспалительное действие; b) от примерно 5% до примерно 25% по массе моноэтилового эфира диэтиленгликоля; с) от примерно 15% до примерно 40% по массе глицерилмонолинолеата; и d) от примерно 15% до примерно 40% масла.
185. Жидкая фармацевтическая композиция по варианту 184, в которой NSAID составляет от примерно 20% до примерно 30% по массе фармацевтической композиции.
186. Жидкая фармацевтическая композиция по варианту 184 или 185, в которой моноэтиловый эфир диэтиленгликоля составляет от примерно 10% до примерно 20% по массе фармацевтической композиции.
187. Жидкая фармацевтическая композиция по любому одному из вариантов 184-186, в которой глицерилмонолинолеат составляет от примерно 20% до примерно 35% по массе фармацевтической композиции.
188. Жидкая фармацевтическая композиция по любому одному из вариантов 184-187, в которой масло составляет от примерно 20% до примерно 35% по массе фармацевтической композиции.
189. Жидкая фармацевтическая композиция по любому одному из вариантов 184-188, в которой NSAID составляет от примерно 23% до примерно 27% по массе фармацевтической композиции, моноэтиловый эфир диэтиленгликоля составляет от примерно 13% до примерно 17% по массе фармацевтической композиции, глицерилмонолинолеат составляет от примерно 25% до примерно 30% по массе фармацевтической композиции, а масло составляет от примерно 25% до примерно 30% по массе фармацевтической композиции.
190. Жидкая фармацевтическая композиция по любому одному из вариантов 184-189, в которой жидкая фармацевтическая композиция дополнительно содержит около 2% до примерно 10% спирта.
191. Жидкая фармацевтическая композиция по варианту 190, в которой спирт представляет собой этанол, н-бутанол, 1-бутанол, 2-бутанол, изобутанол, втор-бутанол, трет-бутанол, н-пропанол, изопропанол, 1,2-пропандиол или метанол.
192. Жидкая фармацевтическая композиция по любому одному из вариантов 184-191, в которой NSAID составляет от примерно 23% до примерно 27% по массе фармацевтической композиции, моноэтиловый эфир диэтиленгликоля составляет от примерно 13% до примерно 17% по массе фармацевтической композиции, глицерилмонолинолеат составляет от примерно 25% до примерно 30% по массе фармацевтической композиции, масло составляет от примерно 25% до примерно 30% по массе фармацевтической композиции, а спирт составляет от примерно 4% до примерно 8% по массе фармацевтической композиции.
193. Полутвердая фармацевтическая композиция, содержащая: а) от примерно 20% до примерно 50% по массе нестероидного противовоспалительного лекарственного средства (NSAID), где NSAID имеет противовоспалительное действие, b) от примерно 8% до примерно 18% по массе смеси моно-, ди- и триглицеридов и сложных PEG и эфиров жирных кислот, c) от примерно 25% до примерно 45% по массе глицерилмонолинолеата, d) от примерно 8% до примерно 18% PEG; и е) от примерно 2% до примерно 6% пропиленгликоля.
194. Полутвердая фармацевтическая композиция по варианту 193, в которой смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот составляет от примерно 10% до примерно 16% по массе фармацевтической композиции.
195. Полутвердая фармацевтическая композиция по варианту 193 или 194, в которой PEG составляет от примерно 10% до примерно 16% по массе фармацевтической композиции.
196. Полутвердая фармацевтическая композиция по любому одному из вариантов 193-195, в которой NSAID составляет от примерно 25% до примерно 44% по массе фармацевтической композиции, смесь моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот составляет от примерно 12% до примерно 14% по массе фармацевтической композиции, глицерилмонолинолеат составляет от примерно 32% до примерно 39% по массе фармацевтической композиции, PEG составляет от примерно 12% до примерно 14% по массе от фармацевтической композиции, а пропиленгликоль составляет от примерно 3% до примерно 5% по массе фармацевтической композиции.
197. Полутвердая фармацевтическая композиция, содержащая: а) от примерно 15% до примерно 30% по массе свободной кислоты нестероидного противовоспалительного лекарственного средства (NSAID), где NSAID имеет противовоспалительное действие, b) от примерно 1% до примерно 25% по массе соли NSAID, где NSAID имеет противовоспалительное действие, c) от примерно 8% до примерно 18% по массе смеси моно-, ди- и триглицеридов и сложных эфиров PEG и жирных кислот, d) от примерно 25% до примерно 45% по массе глицерилмонолинолеата, e) от примерно 8% до примерно 18% PEG; и f) от примерно 2% до примерно 6% пропиленгликоля.
ПРИМЕРЫ
Следующие неограничивающие примеры приведены для иллюстративных целей, только для того чтобы облегчить более полное понимание предусмотренных типичных вариантов осуществления изобретения. Эти примеры не следует рассматривать как ограничивающие любой из вариантов осуществления, раскрытых в настоящем описании, включая те, которые относятся к соединениям, спиртам, липидам, фармацевтическим композициям, способам получения фармацевтических композиций или способам или применению для лечения хронического воспаления или заболевания, ассоциированного с хроническим воспалением.
Пример 1
Жидкие составы фармацевтической композиции
Этот пример иллюстрирует, как изготовить фармацевтическую композицию, раскрытую в данном документе, в виде жидкого состава.
Сначала вносили напрямую 2400 мг ибупрофена в 2,0 мл рапсового масла в попытке растворить терапевтическое соединение напрямую в адъюванте до концентрации 1,200 мг/мл. Однако ибупрофен оставался нерастворимым в масле и по существу заметно не растворялся. Ибупрофен оставался нерастворимым, даже если смесь перемешивали на вортексе в течение 20 секунд, проводили контактирование при 20°С или 37°С, и/или смесь инкубировали в течение 24 часов при 20°С или 37°С. Нерастворимость ибупрофена в рапсовом масле оказалась неожиданной, учитывая то, что ибупрофен имеет величину logP, составляющую 3,6; столь высокая величина logP свидетельствует о том, что соединение будет легко растворяться в адъюванте, таком как масло.
Поскольку не было возможности растворить ибупрофен непосредственно в масле, несмотря на высокую величину logP, в следующий раз попытались растворить терапевтическое средство в растворителе, чтобы сначала получить раствор, содержащий соединение. В качестве первого шага были проведены эксперименты по смешиваемости растворителя и адъюванта, такого как масло, в отсутствие терапевтического соединения. В этих экспериментах 0,5 мл этанола смешивали с десятью различными объемами рапсового масла (таблица 1). Каждую смесь тестировали при 22°С и при 37°С, когда этанол и масло первоначально нагревали на водяной бане, а затем смешивали вместе. Смешивание осуществляли на вортексе в течение 20 секунд, а содержимому в емкостях позволяли осесть до проведения визуальной оценки, либо немедленно, либо через 24 часа. Каждую смесь оценивали, чтобы определить, образуют или нет этанол и рапсовое масло несмешивающиеся слои или однородную смесь. Результаты суммированы в таблице 1. Смеси, содержащие растворитель:адъювант в соотношении 1:1, 1:2, 1:3, 1:4, 1:5 и 1:6 образовывали несмешивающиеся слои при 22°С или при 37°С, сразу или через 24 часа инкубации, указывая на то, что этанол и масло не смешиваются хорошо в этих соотношениях. Однако при соотношениях растворитель:адъювант выше 1:7 гомогенная смесь образуется при всех тестируемых условиях.
|
|
После того, как были определены соответствующие соотношения спирта и липида, необходимые для образования гомогенной смеси, далее определяли, будет ли контактирование терапевтического соединения с растворителем до контактирования с адъювантом приводить к растворению соединения в растворителях. Для проведения этих экспериментов либо 1000 мг, либо 1200 мг ибупрофена растворяли в 0,5 мл этанола. Полученный спиртовой раствор затем смешивали с рапсовым маслом при двух различных соотношениях растворитель:адъювант (1:2 и 1:9). Каждую смесь тестировали при 20°С и при 37°С, когда раствор этанола и масла первоначально нагревали на водяной бане, а затем смешивали вместе. Смешивание осуществляли на вортексе в течение 20 секунд, а содержимому в емкостях позволяли осесть до проведения визуальной оценки, либо немедленно, либо через 24 часа. Каждую смесь оценивали, чтобы определить, образуют или нет этанольный раствор и рапсовое масло несмешивающиеся слои или однородную смесь. Результаты суммированы в таблице 2. В отличие от ситуации в отсутствие терапевтического соединения, если ибупрофен присутствует в этаноле, то это приводит к получению однородной смеси этанола и масла в любых протестированных условиях при соотношениях растворитель:адъювант выше 1:2. Это наблюдение было весьма неожиданным, поэтому, хотя и не желая быть связанными какой-либо теорией, авторы изобретения предполагают, что терапевтическое соединение может оказывать определенное влияние на то, каким образом адъювант и растворитель взаимодействуют друг с другом, что образуется гомогенная смесь, которая не возникает при отсутствии терапевтического соединения. Кроме того, результаты указывают на то, что терапевтическое соединение может быть введено в состав в клинически пригодных концентрациях.
|
Пример 2
Жидкие составы фармацевтической композиции
Этот пример иллюстрирует, как изготовить фармацевтическую композицию, раскрытую в данном документе, в виде жидкого состава.
Для получения фармацевтической композиции, раскрытой в данном документе, с использованием гемфиброзила, исследовали следующие составы. В этих экспериментах 600 мг гемфиброзила смешивали с различными объемами этанола в качестве растворителя, нагретого до 37°С, и полученный раствор затем смешивали с различными объемами льняного масла в качестве адъюванта, нагретого до 37°С (таблица 3). Каждый состав оценивали, чтобы определить, будут ли этанол и льняное масло образовывать несмешивающиеся слои или прозрачную однородную смесь, а также будет ли гемфиброзил кристаллизоваться из раствора. Результаты суммированы в таблице 3.
Подобно ибупрофену в примере 1, в одиночку гемфиброзил оставался нерастворимым в масле и по существу заметно не растворялся. Состав, содержащий 0,2 мл этанола, не мог полностью растворить гемфиброзил. Кроме того, хотя состав, содержащий 0,3 мл этанола, был способен растворять гемфиброзил, терапевтическое соединение начинало кристаллизоваться из раствора через 3 часа, и полная кристаллизация происходила за 48 часов. Все другие протестированные составы были способны растворять гемфиброзил и образовать фармацевтическую композицию, раскрытую в данном документе. Однако только состав, содержащий 0,5 мл этанола, по-видимому, был необходим для стабильной фармацевтической композиции, в которой гемфиброзил оставался полностью растворенным через три недели.
|
Пример 3
Жидкие составы фармацевтических композиций
Этот пример иллюстрирует, как изготовить фармацевтическую композицию, раскрытую в данном документе, в виде жидкого состава.
Для получения жидкой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Около 4 г ибупрофена смешивали с 3,6 мл этилацетата в качестве растворителя, и полученный раствор затем смешивали с 76,4 мл рапсового масла в качестве адъюванта. Полученная фармацевтическая композиция имела соотношение растворитель:адъювант примерно 1:21. Эту фармацевтическую композицию затем помещали в круглодонную колбу и оставляли при низком давлении на роторном испарителе. Температуру поддерживали низкой, а испарение продолжали до достижения постоянного веса. Потерянный общий объем составлял 3,65% от общей массы. Полученная жидкость больше не сохраняла характерный запах/привкус этилацетата, что указывало на практическое удаление этилацетата из фармацевтической композиции.
Для получения жидкой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена выполняли следующий способ. Около 2 г ибупрофена смешивали с 1,2 мл моноэтилового эфира диэтиленгликоля (2-(2-этоксиэтокси)этанола) в качестве растворителя, 2,2 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse) и 2,2 мл рапсового масла в качестве адъюванта, и полученную смесь затем смешивали с 0,46 мл изопропанола. Смесь добавляли в сосуд, нагревали от примерно 40°С до примерно 50°С и перемешивали до полного растворения всех компонентов смеси, а затем охлаждали до температуры примерно 30°C. Полученная фармацевтическая композиция имела соотношение растворитель:адъювант примерно 1:3,67. Эту фармацевтическую композицию затем аликвотили, получая 10 жидких капсул, каждая из которых содержала примерно 200 мг ибупрофена.
Пример 4
Твердый состав фармацевтической композиции
Этот пример иллюстрирует, как изготовить фармацевтическую композицию, раскрытую в данном документе, в виде твердого состава.
Так как некоторые жирные кислоты являются жидкими при комнатной температуре, тогда как другие являются твердыми, было проведено изучение различных жирных кислот в попытке оценить возможность использования каждой жирной кислоты для изготовления твердого состава. Эти данные будут способствовать разработке широкого спектра твердых составов путем регулирования относительного содержания каждой жирной кислоты. В качестве первого эксперимента была проведена оценка линоленовой кислоты, линолевой кислоты, пальмитиновой кислоты и стеариновой кислоты, чтобы определить, возможно ли получение фармацевтической композиции, раскрытой в данном документе, которая могла бы быть составлена с использованием только одной из этих жирных кислот, чтобы быть твердой или полутвердой при 22°С (темпепратуре, имитирующей условия комнатной температуры), но расплавляющейсф в жидкость при 37°C (температуре, имитирующей условия внутренней температуры тела после приема).
Были приготовлены четыре различных тестируемых состава и оценены по своей способности образовывать твердый лекарственный состав при 22°С и плавиться до гомогенного раствора при 37°С без образования суспензии (таблица 4). Состав 1 был приготовлен путем растворения 200 мг ибупрофена в 400 мг ментола, и полученный раствор смешивали с 200 мг стеариновой кислоты (Тm примерно 67-72°С) и нагревали при 60°С в течение от 30 минут до образования гомогенного раствора. Состав 1 затвердевал сразу после охлаждения до 22°С. Состав 1 оставался твердым даже после инкубации при 37°С в течение ночи. Состав 2 приготавливали растворением 200 мг ибупрофена в 400 мг ментола, и полученный раствор смешивали с 200 мг пальмитиновой кислоты (Тm примерно 61-62°С) и нагревали при 60°С в течение от 30 минут до образования гомогенного раствора. Состав 2 затвердевал в течение примерно 1 часа после охлаждения до 22°С. Инкубация при температуре 37°С в течение ночи вызывала полное расплавление композиции 2 до прозрачной гомогенной жидкости. Однако состав 2 снова затвердевал в течение примерно 1 часа после охлаждения до 22°С. Состав 3 приготавливали путем растворения 200 мг ибупрофена в 400 мг ментола, и полученный раствор смешивали с 200 мг линолевой кислоты (Тm примерно -5°С) и нагревали при 37°С в течение 2 часов, чтобы образовался гомогенный раствор. Состав 3 оставался жидким даже после охлаждения до 22°С в течение 72 часов. Состав 4 приготавливали путем растворения 200 мг ибупрофена в 400 мг ментола, и полученный раствор смешивали с 200 мг линоленовой кислоты (Тm примерно -11°C) и нагревали при 37°С в течение 2 часов, чтобы образовался гомогенный раствор. Состав 4 оставался жидким даже после охлаждения до 22°С в течение 72 часов.
|
Исходя из этих данных, может быть изготовлена твердая лекарственная форма фармацевтической композиции, раскрытой в данном документе. Например, фармацевтическая композиция будет составлена таким образом, чтобы быть твердой или полутвердой при 22°С, но расплавляться в правильный прозрачный раствор (а не суспензию) при 37°С (таблица 5).
|
Для получения твердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Около 15 г ибупрофена смешивали примерно с 9,0 мл моноэтилового эфира диэтиленгликоля (2-(2-этоксиэтокси)этанола) в качестве растворителя, примерно 33 г GELUCIRE® 39/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 37°С до 41°С и содержащего смесь насыщенных C10-C18 триглицеридов, в качестве адъюванта и 3,6 мл изопропанола. Смесь добавляли в сосуд, нагревали от примерно 40°С до примерно 50°С и перемешивали до растворения всех компонентов смеси, охлаждали примерно до 30°С, а затем аликвотили, разливая по формам, и охлаждали до комнатной температуры. Полученная фармацевтическая композиция имела соотношение растворитель:адъювант примерно 1:3,67. Эта фармацевтическая композиция давала 75 твердых таблеток, где каждая содержала по 200 мг ибупрофена.
Для получения твердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 20 г ибупрофена смешивали примерно с 12,0 мл моноэтилового эфира диэтиленгликоля (2-(2-этоксиэтокси)этанола) в качестве растворителя, примерно 16 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, и примерно 16 г MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse) в качестве адъюванта и примерно 3,6 мл изопропанола. Смесь добавляли в сосуд, нагревали от примерно 40°С до примерно 50°С и перемешивали до растворения всех компонентов смеси, охлаждали примерно до 30°С, а затем аликвотили, разливая по формам, и охлаждали до комнатной температуры. Полученная фармацевтическая композиция имела соотношение растворитель:адъювант примерно 1:2,67. Эта фармацевтическая композиция давала 100 твердых таблеток, где каждая содержала по 200 мг ибупрофена.
Для получения твердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 80 г ибупрофена, примерно 152 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, примерно 72 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse) и примерно 32 мл PEG400 добавляли в сосуд, нагревали от примерно 50°С до примерно 60°С и перемешивали до растворения всех компонентов смеси. Горячую смесь охлаждали примерно до 40°С, а затем аликвотили, разливая по формам, и охлаждали до комнатной температуры. Эта фармацевтическая композиция давала 400 твердых таблеток, где каждая содержала по 200 мг ибупрофена.
Для получения твердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 1,1 г натриевой соли ибупрофена, примерно 1,9 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, примерно 0,9 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse), примерно 0,4 мл PEG 400 и примерно 0,3 мл пропиленгликоля добавляли в сосуд, нагревали от примерно 50°С до примерно 60°С и перемешивали до растворения всех компонентов смеси. Горячую смесь охлаждали примерно до 40°С, а затем аликвотили, разливая по формам, и охлаждали до комнатной температуры. Эта фармацевтическая композиция давала 5 твердых таблеток, где каждая содержала по 200 мг ибупрофена.
Для получения твердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 5 г ибупрофена в форме свободной кислоты, примерно 5 г натриевой соли ибупрофена, примерно 3 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, примерно 8 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse), примерно 3 мл PEG 400 и примерно 1 мл пропиленгликоля добавляли в сосуд, нагревали от примерно 50°С до примерно 60°С и перемешивали до растворения всех компонентов смеси. Горячую смесь охлаждали примерно до 40°С, а затем аликвотили, разливая по формам, и охлаждали до комнатной температуры. Эта фармацевтическая композиция давала 50 твердых таблеток, где каждая содержала по 200 мг ибупрофена.
Пример 5
Полутвердый состав фармацевтической композиции
Этот пример иллюстрирует, как изготовить фармацевтическую композицию, раскрытую в данном документе, в виде полутвердого состава, пригодного для местного введения.
Для получения полутвердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 1 г ибупрофена в форме свободной кислоты, примерно 0,2 г натриевой соли ибупрофена, примерно 0,6 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, примерно 1,6 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse), примерно 0,6 мл PEG 400 и примерно 0,15 мл пропиленгликоля добавляли в сосуд, нагревали от примерно 50°С до примерно 60°С и перемешивали до растворения всех компонентов смеси. Горячую смесь охлаждали до комнатной температуры и аликвотили по соответствующим емкостям. Эта фармацевтическая композиция давала полутвердую мазь, имеющую концентрацию ибупрофена примерно 400 мг/мл.
Для получения полутвердой фармацевтической композиции, раскрытой в данном документе, с использованием ибупрофена осуществляли следующий способ. Примерно 5 г ибупрофена в форме свободной кислоты, примерно 5 г натриевой соли ибупрофена, примерно 3 г GELUCIRE® 43/01 (Gattefosse), воскообразного твердого вещества, имеющего температуру плавления от 41°С до 45°С и содержащего смесь насыщенных C10-C18 триглицеридов, примерно 8 мл MAISINE® 35-1 (глицерилмонолинолеат, Gattefosse), примерно 3 мл PEG 400 и примерно 1 мл пропиленгликоля добавляли в сосуд, нагревали от примерно 50°С до примерно 60°С и перемешивали до растворения всех компонентов смеси. Горячую смесь охлаждали до комнатной температуры и аликвотили по соответствующим емкостям. Эта фармацевтическая композиция давала полутвердую мазь, имеющую концентрацию ибупрофена примерно 650 мг/мл.
Пример 6
Животная модель эрозии кишечника
Чтобы оценить, снижает ли раздражение желудка фармацевтическая композиция, раскрытая в настоящем документе, были проведены эксперименты с использованием мышиной модели кишечной эрозии.
Крыс Sprague-Dawley разделяли на семь экспериментальных групп, содержащих по пять животных в каждой. После голодания в течение ночи животные получали одно из семи различных воздействий. Группа А была контрольной, в которой каждой мыши перорально вводили только носитель (1%-ю метилцеллюлозу/0,5%-й полисорбат 80). Группа B была контрольной, в которой каждой мыши перорально вводили только растворитель/адъювант (через желудочный зонд - 10% этанола и 90% льняного масла). Группа C была контрольной, в которой каждой мыши перорально вводили 150 мг/кг аспирина. Группа D была контрольной, в которой каждой мыши перорально вводили 100 мг/кг ибупрофена, ресуспендированного в 1%-й метилцеллюлозе/0,5%-м полисорбате 80. Группа Е была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054-100), содержащую 100 мг/кг ибупрофена, 10% этанола и 90% льняного масла. Группа F была контрольной, в которой каждой мыши перорально вводили 100 мг/кг ибупрофена, ресуспендированного в 1%-й метилцеллюлозе/0,5%-м полисорбате 80. Группа G была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054-200), содержащую 200 мг/кг ибупрофена, 10% этанола и 90% льняного масла. Животных умерщвляли через 4 часа после введения соединений, и желудки были исследовали для определения степени кровоизлияния и тяжести эрозионных повреждений слизистой. Раздражение желудка оценивали следующим образом: 0, отсутствие повреждений; 1, гиперемия; 2, одно или два небольших повреждения; 3, более двух небольших повреждений или тяжелых повреждений; и 4, очень тяжелые повреждения. Оценка, составляющая 50% или более относительно группы С (контрольная группа с введением аспирина), которую принимали за 100%, считалась положительной оценкой раздражения желудка.
Результаты приведены в таблице 6. В группе D (контрольной группе, получавшей 100 мг/кг ибупрофена) и группе F (контрольной группе, получавшей 200 мг/кг ибупрофена) наблюдались повреждения желудка, которые составляли 75% и 95%, соответственно, по тяжести относительно повреждений, индуцированных в группе С (контрольной группе, получавшей аспирин). Однако в группе E (экспериментальной группе, получавшей BC1054-100) и группе G (экспериментальной группе, получавшей BC1054-200) наблюдались повреждения желудка, которые составляли 20% и 40%, соответственно, по тяжести относительно повреждений, наблюдаемых в группе C (контрольной группе, получавшей аспирин). Эти результаты показывают, что фармацевтическая композиция, раскрытая в данном документе, снижает степень, до которой терапевтическое соединение может вызвать повреждения слизистой и раздражение желудка.
|
Пример 7
Животная модель респираторного воспаления
Чтобы оценить эффективность фармацевтической композиции, раскрытой в данной документе, при лечении респираторного воспаления были проведены эксперименты с использованием мышиной модели вирусного гриппа.
6-7-недельных самок мышей C57BLK разделяли на три экспериментальные группы, содержащие по 10 животных в каждой. В 1-й день животные получали интраназальную летальную дозу (по 25 мкл/носовое отверстие, всего 50 мкл) штамма гриппа A/PR/8/34 под галотановой анестезией. На 3-й день, после заражения вирусом животные получали один из трех вариантов лечения. Группа А была контрольной, в которой каждой мыши перорально вводили 335,6 мкг ибупрофена, растворенного в 10 мкл DMSO (без адъюванта). Группа В была контрольной, в которой каждой мыши перорально вводили только растворитель/адъювант (через зонд - 10% этанола и 90% льняного масла). Группа С была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054), содержащую 335,6 мкг ибупрофена, 10% этанола и 90% льняного масла. Дозировка 335,6 мкг у мыши эквивалентна 20 мг/кг/день или 1200 мг/день у человека (максимальная стандартная доза для ибупрофена). Животных ежедневно взвешивали и наблюдали за признаками инфекции до 6-го дня, когда животных забивали. На фигуре 1 ясно показано, что пероральное введение только растворителя/адъюванта (группа В) давало уровень смертности 80%, а пероральное введение только ибупрофена (группа А) давало уровень смертности 60%. Однако однократное пероральное введение BC1054 снижало уровень смертности до всего 20%.
Для определения уровней IL-10 и IL-4 проводили твердофазный иммуноферментный анализ (ELISA) с использованием 96-луночного планшета, покрытого захватывающим антителом к IL-10 или IL-4. У забитых мышей собирали легкие и гомогенизировали при 4°C, собирали супернатант и хранили при -70°C до анализа. Размороженные образцы встряхивали на вортексе в течение 30 сек. непосредственно перед добавлением в планшет для проведения ELISA. Серийные разведения проводили в каждом планшете, как для образца, так и для стандартов, путем пипетирования 60 мкл аналитического буфера для разбавления в каждую лунку. Планшет запечатывали и инкубировали в течение 2 часов при комнатной температуре. Для IL-4 в каждую лунку добавляли по 60 мкл рабочей детектирующей смеси (детектирующее антитело + реагент SAv-HRP). Планшет запечатывали и инкубировали в течение 1 ч. при комнатной температуре. Для IL-10, в каждую лунку добавляли по 60 мкл детектирующего антитела, разведенного в аналитическом буфере для разбавления. Планшеты промывали и добавляли по 60 мкл фермента Sav-HRP, разведенного в аналитическом буфере для разбавления. Планшет запечатывали и инкубировали 20 мин. при комнатной температуре. Планшеты затем промывали 10 раз. Добавляли по 60 мкл раствора субстрата в каждую лунку, и планшет инкубировали в течение 30 мин. при комнатной температуре в темноте. Добавляли по 60 мкл стоп-раствора в каждую лунку и измеряли поглощение при 450 нм. Концентрации IL-10 и IL-4 выражали в пг/мг ткани легких. Эти результаты указывают, что фармацевтическая композиция, раскрытая в данном документе, была эффективна для лечения респираторного воспаления.
Результаты показывают, что животные из группы А (получавшей ибупрофен контрольной группы) и группы В (получавшей растворитель/адъювант контрольной группы) имели содержание IL-10, составляющее 2600 г/мг и 2000 пг/мл, соответственно (фиг. 2А). Однако в группе С (получавшей ВС1054 экспериментальной группе) была выявлена концентрация IL-10, составляющая 6000 пг/мл, в три раза выше, чем наблюдаемые у контрольных животных. Эти результаты также показали, что животные из группы А (получавшей ибупрофен контрольной группы) и группы В (получавшей растворитель/адъювант контрольной группы) имели 6900 пг/мг и 5400 пг/мл IL-4, соответственно, тогда как в группе C (получавшей ВС1054 экспериментальной группе) концентрация IL-4 составляла 8300 pg/mg (фиг. 2B). В совокупности, синергетическое повышение уровней IL-10 и/или IL-4 позволяет предположить, что по меньшей мере часть действия, наблюдаемого для BC1054, вызвана переключением ответа с Th1 на Th2.
Были проведены дополнительные эксперименты, чтобы определить, какие типы клеток были простимулированы для высвобождения цитокинов при введении BC1054. 6-7-недельных самок мышей C57BLK разделяли на три экспериментальные группы, содержащие по 10 животных в каждой. В 1-й день животные получали интраназальную летальную дозу (по 25 мкл/носовое отверстие, всего 50 мкл) штамма гриппа H1/N1 под галотановой анестезией. На 3-й день после заражения вирусом животные получали один из трех вариантов лечения. Группа А была контрольной, в которой каждой мыши перорально вводили 335,6 мкг ибупрофена, растворенного в 10 мкл DMSO (без адъюванта). Группа В была контрольной, в которой каждой мыши перорально вводили только растворитель/адъювант (через зонд - 10% этанола и 90% льняного масла). Группа С была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054), содержащую 335,6 мкг ибупрофена, 10% этанола и 90% льняного масла. Легкие, собранные от смертельно инфицированных мышей гомогенизировали при 4°C, супернанат собирали, хранили, и уровни IL-10, TNF-α и IFNγ измеряли, используя метод ELISA.
Результаты показывают, что животные из группы А (получавшей ибупрофен контрольной группы) и группы С (получавшей BC1054 экспериментальной группы) имели повышенный уровень IL-10 (фиг. 3A). Однако это увеличение IL-10 было ассоциировано с очень отличающимися фармакодинамическими эффектами, а картина снижения провоспалительных цитокинов подчеркивает источник IL-10 и его отношение к влиянию на выживание. Например, TNF-α (который является связанным с макрофагами цитокином) заметно не ингибировался (фиг. 3В) у животных из группы А (получавшей ибупрофен контрольной группы), тогда как уровни IFNγ (который является лимфоцитарным цитокином) были заметно снижены в этой группе по сравнению с животными из группы С (получавшей BC1054 экспериментальной группы) (фиг. 3С). Эта модель высвобождения цитокинов ассоциируется с плохим прогнозом. Однако у животных из группы С (получавшей BC1054 экспериментальной группы) уровни TNF-α были заметно снижены (фиг. 3В), тогда как уровни IFNγ практически не менялись (фиг. 3С). Этот эксперимент демонстрирует, что фармацевтическая композиция, раскрытая в данном документе, обеспечивает защитный эффект в отношении индуцированной H1N1 смертности посредством, в частности, повышения уровней макрофагального IL-10, а не лимфоцитарного IL-10.
Пример 8
Животная модель воспалительного заболевания кишечника
Для оценки эффективности фармацевтической композиции, раскрытой в данном документе при лечении воспалительного заболевания кишечника проводили эксперименты с использованием мышиной модели колита, индуцированного TBS.
6-7-недельных самцов мышей C57Bl/6 разделяли на семь экспериментальных групп, содержащих по меньшей мере по десять животных каждая. В 0-й день индуцировали колит у мышей из групп B-G путем интраректального введения 100 мкл TNBS (4 мг) в 50%-м этаноле под изофурановой анестезией. Начиная с дня -1 и до 5-го дня животные получали один или три раза в день одно из семи различных воздействий. Группа А была контрольной группой, в которой каждой мыши перорально вводили только носитель этанол. Группа В была контрольной группой, в которой каждой мыши перорально вводили носитель 1%-ю метилцеллюлозу. Группа С была контрольной группой, в которой каждой мыши вводили только растворитель/адъювант (через зонд 10% этанола и 90% льняного масла). Группа D была контрольной группой, в которой каждой мыши перорально вводили 3 мг/кг преднизолона. Группа Е была контрольной группой, в которой каждой мыши перорально вводили по 20 мг/кг ибупрофена, ресуспендированного в 1%-й метилцеллюлозе (1 мг/кг) (без адъюванта). Группа F была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054-20), содержащую 20 мг/кг ибупрофена, 10% этанола и 90% льняного масла. Группа G была экспериментальной группой, в которой каждой мыши вводили фармацевтическую композицию, раскрытую в данном документе (BC1054-20), содержащую 30 мг/кг ибупрофена, 10% этанола и 90% льняного масла. Всех животных ежедневно взвешивали и оценивали визуально на наличие диареи и/или кровавого стула. На 3-й и на 5-й день тяжесть колита оценивали у всех животных, используя видео-эндоскопию, с помощью которой были получены изображения, и тяжесть колита визуально оценивалась наблюдателем «вслепую» по шкале от 0 до 4 следующим образом: 0, норма; 1, потеря васкуляризации; 2, потеря васкуляризации и рыхлость; 3, рыхлость и эрозии; и 4, изъязвления и кровотечение. После эндоскопии на 5-й день животных умерщвляли, изымали толстую кишку и измеряли ее длину и вес. Отбирали образцы сыворотки, и толстую кишку фиксировали в 10%-м формалине. Дополнительный кусок ткани толстой кишки собирали, взвешивали и замораживали в жидком азоте.
Результаты этих экспериментов представлены в таблице 7. Группа B (получавшая TNBS контрольная группа) показывала статистически значимое различие в среднем изменении веса по сравнению с группой А (контрольной группой, получавшей этанол), все остальные группы сравнения не показали никакой разницы в среднем изменении веса. Группа B (получавшая TNBS контрольная группа) показала статистически значимое уменьшение средней длины ободочной кишки по сравнению с группой А (контрольной группой, получавшей этанол). Кроме того, группа D (получавшая преднизолон контрольная группа), группа F (получавшая BC1054-20 экспериментальная группа) и группа G (получавшая BC1054-30 экспериментальная группа), все показали статистически значимое увеличение средней длины толстой кишки по сравнению с группой В (получавшей TNBS контрольной группой). Хотя Группа B (получавшая TNBS контрольная группа) показала статистически значимое увеличение среднего веса толстой кишки по сравнению с группой А (контрольной группой, получавшей этанол), все остальные группы сравнения не показали никакой разницы в средней массе толстой кишки. Что касается эндоскопической оценки колита, группа D (получавшая преднизолон контрольная группа) показала статистически значимое уменьшение средней оценки колита как на 3-й день, так и на 5-й день по сравнению с группой B (получавшей TNBS контрольной группой). Аналогичным образом, как группа F (получавшая BC1054-20 экспериментальная группа), так и группа G (получавшая BC1054-30 экспериментальная группа), показали статистически значимое снижение средней оценки колита на 5-й день по сравнению с группой B (получавшей TNBS контрольной группой). Эти результаты показывают, что фармацевтическая композиция, раскрытая в данном документе, эффективна при лечении воспалительного заболевания кишечника.
|
|
Пример 9
Животная модель системного артрита
Для оценки эффективности фармацевтической композиции, раскрытой в данном документе, при лечении артрита были проведены эксперименты с использованием мышиной модели артрита, индуцированного антителами к коллагену (ACAIA), которая имитирует системный артрит, такой как ревматоидный артрит.
Самцов мышей линии BALB/с разделяли на восемь групп, каждая из которых включала по 10 животных. Для индукции симптомов артрита, мышам из всех восьми групп внутривенно вводили по 200 мкл раствора, содержащего 2 мг коктейля из четырех моноклональных антител к коллагену II (ARTHRITOMAB™, MD Biosciences) в 0-й день исследования (начало исследования), с последующим введением с помощью внутрибрюшинной инъекции по 200 мкл раствора, содержащего 50 мкг липополисахарида (LPS) в день 3. Начиная с 3-го дня и ежедневно до 8-го дня, а затем в дни 10 и 12, регистрировали толщину лап (с помощью плетизмографии) и оценку артрита по шкале. Те же животные также получали лечение ежедневно с 0-го по 11-й день, где животные получали один из шести вариантов лечения (воздействия). Группа А была контрольной, в которой каждой мыши перорально вводили только носитель, фосфорно-солевой буфер (PBS). Группа B была контрольной, в которой каждой мыши внутрибрюшинно вводили по 10 мг/кг в этанерцепта (ENBREL®, Wyeth) в PBS. Группа C была контрольной, в которой каждой мыши вводили перорально только 1%-ю метилцеллюлозу. Группа D была контрольной, в которой каждой мыши перорально вводили по 40 мг/кг ибупрофена, ресуспендированного в 1%-й метилцеллюлозе (1 мл/кг) (без адъюванта). Группа E была контрольной, в которой каждой мыши перорально вводили только растворитель/адъювант (через желудочный зонд, 10% этанола и 90% льняного масла). Группа F была экспериментальной группой, в которой каждой мыши вводили перорально фармацевтическую композицию, раскрытую в данном документе (BC1054-20), содержащую 20 мг/кг ибупрофена, 10% этанола и 90% льняного масла. Группа G был экспериментальной группой, в которой каждой мыши вводили перорально фармацевтическую композицию, раскрытую в данном документе (BC1054-30), содержащую 30 мг/кг ибупрофена, 10% этанола и 90% льняного масла. На протяжении всего эксперимента (12 дней) у животных ежедневно проверяли клинические признаки (общее наблюдение за здоровьем животного) и массу тела. Общую оценку артрита определяют путем суммирования оценки артрита для отдельных лап с использованием следующей шкалы: 0 = нет признаков артрита, 1 = небольшое, но определенное покраснение и отек лодыжки/запястья или видимое покраснение или отек, ограничивающиеся отдельными пальцами, независимо от числа затронутых пальцев, 2 = покраснение и отек лодыжки/запястья от умеренного до тяжелого, 3 = покраснение и отек всей лапы, включая пальцы, 4 = максимально воспаленная конечность с участием нескольких суставов.
Результаты этого эксперимента показаны на фиг. 4. Как и ожидалось, животные из группы B (получавшей этанерцепт контрольной группы) показали лучшие результаты, с самыми низкой толщиной лап около 1,6 мм на 12-й день. Для двух фармацевтических композиций, животные из группы F (получавшей BC1054-20 экспериментальной группы) и группа G (получавшей BC1054-30 экспериментальной группы) показывали практически аналогичные результаты, где мыши из группы G имели толщину лапы только 1,7 мм, а мыши из группы F имели толщину лапы примерно 1,73 мм. Животные из группы отрицательного контроля (получавшей носитель (PBS) контрольной группы), группы C (получавшей метилцеллюлозный носитель контрольной группы) и группы Е (получавшей растворитель/адъювант контрольной группы), а также из группы D (получавшей ибупрофен контрольной группы) имели значительно худшие показатели с толщиной лапы 1,9 мм и более по сравнению с животными из групп F и G. Эти результаты показывают, что фармацевтическая композиция, раскрытая в данном документе, эффективна для лечения артрита.
Пример 10
Животная модель системного артрита
Для оценки эффективности фармацевтической композиции, раскрытой в данном документе, при лечении артрита были проведены эксперименты с использованием мышиной модели артрита, индуцированного антителами к коллагену (ACAIA), которая имитирует системный артрит, такой как ревматоидный артрит.
Самцов мышей линии BALB/с разделяли на восемь групп, каждая из которых содержала по 10 животных. Для индукции симптомов артрита, мышам из всех восьми групп внутривенно вводили по 200 мкл раствора, содержащего 2 мг коктейля из четырех моноклональных антител к коллагену II (ARTHRITOMAB™, MD Biosciences) в 0-й день исследования (начало исследования), с последующим введением с помощью внутрибрюшинной инъекции по 200 мкл раствора, содержащего 50 мкг липополисахарида (LPS) в день 3. Каждая группа ежедневно получала контрольное или тестируемое лечение (воздействие), осуществляемое в дни 0-11, следующим образом: мышам из группы 1 (1М) трижды в день вводили перорально препарат носителя, содержащего 1%-ю метилцеллюлозу; мышам из группы 2 (2М) один раз в день вводили внутрибрюшинно препарат положительного контроля содержащий 10 мг/кг этанерцепта (ENBREL®, Wyeth); мышам из группы 3 (3M) один раз в день вводили перорально по 20 мг/кг тестируемого жидкого состава, содержащего ибупрофен и рапсовое масло (BC1054 LF-RO); мышам из группы 4 (4М) трижды в день вводили перорально по 20 мг/кг тестируемого жидкого состава, содержащего ибупрофен и рапсовое масло (BC1054 LF-RO); мышам из группы 5 (5М) трижды в день вводили перорально по 20 мг/кг тестируемого жидкого состава, содержащего ибупрофен и глицерилмонолинолеат (MAISINE® 35-1, Gattefosse) (BC1054 LF-МА); мышам из группы 6 (6M) трижды в день вводили перорально по 20 мг/кг тестируемого жидкого состава, содержащего ибупрофен и какао-масло (BC1054 LF-ТО); мышам из группы 7 (7M) трижды в день вводили перорально контрольный препарат 1, содержащий 20 мг/кг ибупрофена; и мышам из группы 8 (8M) трижды в день вводили перорально по 20 мг/кг тестируемого твердого состава, содержащего ибупрофен и воскообразное твердого вещество, имеющее температуру плавления в диапазоне от 37°С до 41°С и содержащее смесь насыщенных C10-C18 триглицеридов (GELUCIRE® 39/01, Gattefosse) (BC1054 LF-GE) (таблица 8). Вводимая доза была рассчитана на основе предположения, что каждое животное весит в среднем 20 г. Каждой мыши вводили фиксированный объем 100 мкл, за исключением животных, получающих положительный контроль (2М), которым вводили по 200 мкл.
|
|
Контроль развития артрита и клинические осмотры проводились у всех мышей в 0-й день исследования незадолго до индукции артрита и затем в дни исследования 3-7, 9, 10 и 12 (завершение исследования). Для оценки развития артрита проводили как оценку артрита по шкале, так и измерение толщины лап (плетизмографию). Оценка артрита была основана на визуальном определении признаков артрита с использованием шкалы 0-4 в порядке возрастания тяжести с оценкой 0, указывающей на отсутствие артритических признаков; оценкой 1, указывающей на небольшое, но определенное покраснение и отек лодыжки/запястья или видимое покраснение или отек, ограничивающиеся отдельными пальцами, независимо от числа затронутых пальцев; оценкой 2, указывающей на покраснение и отек лодыжки/запястья от умеренного до тяжелого; оценкой 3, указывающей на покраснение и отек всей лапы, включая пальцы; и оценкой 4, указывающей на максимально воспаленную конечность с участием нескольких суставов. Толщину лап измеряли для обеих задних лап прямо над подушечкой лапы и ниже пяточной кости с использованием цифрового штангенциркуля (Kroeplin, Мюнхен, Германия). Определяли средние значения измерений толщины лап, и, при необходимости, использовали анализ данных с помощью ANOVA с ретроспективным анализом Тьюки для определения достоверности эффектов лечения.
Клинический осмотр включал оценку изменений массы тела, состояния кожи, меха, глаз, слизистых оболочек, появление выделений и продуктов жизнедеятельности (например, диареи), и вегетативной активности (например, слезотечения, слюнотечения, пилоэрекции, размера зрачка, необычного дыхания). Также отмечались изменения в походке, осанке и ответе на манипуляции, а также присутствие странного поведения, тремора, судорог, комы и сна. Сыворотку собирали при прекращении исследования.
Частота артрита увеличилась во всех группах, начиная с 3-го дня. В группе 1М заболеваемость животных достигла пика на 7-й день, когда 9 из 10 животных показали признаки артрита, которые оставались относительно постоянными до конца исследования. У мышей из группы 2М, получавших этанерцепт, пик заболеваемости пришелся на 6-й день, когда у 9 из 10 животных наблюдались признаки заболевания, но снизилась до 1 из 10 животных на 12-й день. Пик заболеваемости артрита у животных из групп 3М и 4М, получавших BC1054 LS-RO один раз или три раза в день, пришелся на 7-й день (9/10 и 7/10 животных, соответственно), и эта частота сократилась до 4/10 мышей в обеих группах на 12-й день. Заболеваемость артритом достигла максимума на 6-й день у животных из группы 5M, получавших BC1054 LS-МА, когда заболели 8/10 животных, и заболеваемость колебалась с 6 до 8 животных (из 10) до конца исследования. На 6-й день, 9 из 10 животных демонстрировали артрит в группе 6М, получавшей BC1054 SF-ТО, но это соотношение также менялось и пришло к 7/10 на 12-й день. В получавшей ибупрофен группе 7М, пик заболеваемости артритом был зафиксирован на 6-й день с 8 заболевшими из 10 животных, и это соотношение оставалось относительно постоянным до окончания исследования. У мышей из группы 8M, получавших BC1054 LS-GE, пик заболеваемости приходился на 6-й день с 9 животными из 10, показывающими признаки артрита, но это соотношение сократилось до 4/10 на 12-й день.
Клинические признаки, ассоциированные с введением LPS, появились во всех группах после введения LPS на 3-й день. Они исчезли во всех группах на 12-й день. В ходе этого исследования не была зарегистрирована смертность животных или не отмечались существенные различия в массе тела между группой, получавшей носитель, и группами, получавшими исследуемые продукты.
Результаты по средней толщине лап приведены в таблице 9. Средняя толщина задних лап у животных из группы 1М (получавших носитель) составляла 1,72±0,01 в день 0. Толщина увеличивалась и достигала максимума 2,33±0,15 на 9-й день и составляла 2,17±0,11 на 12-й день. У мышей из группы 2М, получавших Этанерцепт, средняя толщина задних лап составляла 1,70±0,02 в день 0. Она увеличивалась, достигнув пика 1,96±0,05 на 6-й день, перед уменьшением обратно до 1,77±0,02 на 12-й день. Лечение Этанерцептом привело к значительному уменьшению объема лапы по сравнению с мышами из группы положительного контроля в дни 9, 10 и 12. В группе 3М, которая получила BC1054 LS-RO один раз в день, толщина задних лап составляла 1,71±0,02 в день 0. На 7-й день отек в этой группе достигал пика 1,96±0,05, и после этого он оставался относительно постоянным. Наблюдалось значительное уменьшение среднего значения отека лапы в дни 6 и 9 после введения BC1054 LS-RO. Средняя толщина задних лап в группе 4М, которая получала BC1054 LS-RO трижды в день, увеличилась до 1,97±0,08 на 10-й день (с 1,70±0,03 в день 0), с 10-го дня объем лап оставался относительно постоянным до конца исследования. Введение BC1054 LS-RO трижды в день привело к значительному уменьшению средней толщины лап по сравнению с мышами, получавшими носитель (группа 1М) в дни 6, 7 и 9. Мыши из группы 5М, получавшие BC1054 LS-МА, имели пиковый объем лап на 7-й день (1,97±0,05 относительно 1,69±0,02 в день 0), в этой группе наблюдалось значительное снижение этого показателя на 6-й и на 9-й день, по сравнению с животными из группы 1М, получавшими носитель. У животных из группы 6М, получавших BC1054 LS-ТО, средняя толщина задних лап составляла 1,74±0,01 в день 0. Она увеличивалась до пикового значения 2,05±0,10 на 7-й день перед обратным снижением до 1,94±0,06 на 12-й день. Никаких существенных различий не было замечено между животными, получавшими BC1054 LS-ТО (группа 6M), и животными, получавшими носитель (группа 1М). В группе, которая получала ибупрофен (группа 7М), толщина задних лап составляла 1,71±0,02 в день 0. На 7-й день опухоль в этой группе достигала своего пика в 2,15±0,10, прежде чем снизиться до 2,02±0,08 на 12-й день. Никаких существенных различий не наблюдалось при сравнении этой группы с контрольной группой 1М. Животные из группы 8М, которым вводили BC1054 LS-GE, продемонстрировали незначительное увеличение толщины задних лап с 1,72±0,02 в день 0 до 1,85±0,06 на 7-й день, которая оставалась относительно постоянной, составляя 1,77±0,03 на 12-й день. Введение BC1054 LS-GE приводило к значительному уменьшению отека лап у животных (группа 8М) по сравнению с контрольной группой, которой вводили носитель (группа 1М) в дни 6, 7, 9, 10 и 12.
|
Учитывая приведенные выше данные, значительная противоартритическое действие наблюдалось в группе животных 3М, получавших один раз в день BC1054 LS-RO, группе животных 4M, получавших трижды в день BC1054 LS-RO, группе животных 5M, получавших трижды в день BC1054 LS-MA, и группе животных 8М, получавших трижды в день BC1054SF-GE.
Пример 11
Примеры случаев лечения хронического воспаления
47-летняя женщина, которой был поставлен диагноз реактивный артрит в одном колене, получала лечение фармацевтической композицией, раскрытой в настоящем описании (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (1200 мг, один раз в день), в течение 3-дневного периода, и было найдено, что отек и боль начали исчезать через 1 день и полностью исчезли через 3 дня. Неэффективное стандартное лечение ибупрофеном было впоследствии прекращено. За 3 месяца наблюдения никаких признаков реактивного артрита не наблюдалось.
50-летнему мужчине был поставлен диагноз перелома Мезоннева в лодыжке. Пациент принимал 30 мг кодеина с 500 мг парацетамола дважды в день, наряду с 10 мг диклофенака три раза в день в течение 8 месяцев, чтобы контролировать сильную боль. Пациент прошел 5-дневный курс фармацевтической композиции, раскрытой в настоящем описании (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (600 мг дважды в день), через 2 дня сообщил о значительном ослаблении своей боли, а затем через 3 дня он сообщил, что боль полностью находится под контролем. Впоследствии он перестал принимать кодеин, парацетамол и диклофенак, и через 2 месяца наблюдений пациент все еще не испытывал боли.
У 33-летней женщины с диагнозом обусловленная стрессом экзема наблюдалась обострение экземы на руках и груди. Фармацевтическую композицию, раскрытую в данном документе (BC1054), содержащую 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (1200 мг, один раз в день), вводили в течение 7 дней. Через пару часов прекратился зуд в пораженном месте, через 1 день было сообщено о заметном уменьшении отека в месте поражения. Через 2-3 дня исчезла эритема в пораженных экземой участках, а через 7 дней поражения полностью исчезли. В прошлом пациентка использовала смягчающие кремы и содержащие гидрокортизон кремы, которые ухудшали состояние кожи и часто приводили к курсу антибиотиков. Пациентка отметила, что ее реакция на лечение BC1054 была быстрой и полной, и наблюдалось заметное улучшение относительно используемых ранее фармакологических методов лечения.
У 85-летнего мужчины был диагностирован реактивный остеоартрит с выраженным отеком и сильной болью в обоих коленях. В течение 1 года пациенту был прописан преднизолон и NSAID для контроля артрита, которые не дали эффекта. Кроме того, пациент ежедневно принимал глюкозамин. Несмотря на значительное фармакологическое вмешательство, у пациента регулярно наблюдались рецидивы, приводящие в результате к значительному ограничению в подвижности. Пациент прошел 10-дневный курс лечения фармацевтической композицией, раскрытой в данном документе (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (400 мг, трижды в день), и испытывал заметное улучшение на 3-й день и полное улучшение после завершения курса. Пациент сообщил, что его подвижность вернулась к норме, и он оставался в стадии ремиссии при осмотре через 1 месяц.
38-летний мужчина с реактивным остеоартритом в 1 колене в течение 6 месяцев (боль и отек). За этот период пациент перепробовал широкий спектр фармакологических методов лечения: преднизолон, Хумиру и сульфасалазин, наряду с NSAID для контроля боли. Только сульфасалазин оказал заметное влияние, однако пациенту не понравились побочные эффекты, поэтому он попросил отменить сульфасалазин. Через 2 недели после отмены сульфасалазина у пациента случился рецидив реактивного артрита, и он начал 4-дневный курс фармацевтической композиции, раскрытой в данном документе (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (600 мг дважы в день), после чего наступила полная ремиссия артрита. Через 2 недели после прекращения лечения наступил рецидив артрита, и пациент прошел еще один 4-дневный курс лечения BC1054, снова достигнув полной ремиссии. На этот раз артрит повторно рецидивировал через 1 неделю. С учетом этого пациент получил окончательный 10-дневный курс BC1054. Впоследствии, артрит оставался на стадии ремиссии в течение 11 месяцев (на момент последнего осмотра).
49-летний мужчина с диагнозом гиперхолестеринемии (LDL 4,35 ммоль/л) получил курс фармацевтической композиции, раскрытой в данном документе (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла, (600 мг дважды в день) в течение 7 дней. Через 5 дней лечения уровни LDL у пациента нормализовались до 3,89 ммоль/л. Нормализация уровня LDL сохранялась в течение 2 месяцев после прекращения введения BC1054, как было установлено при последнем осмотре.
60-летний мужчина с недавно диагностированной гиперхолестеринемией (LDL 4,31 ммоль/л) получил курс фармацевтической композиции, раскрытой в данном документе (BC1054), содержащей 20 мг/кг ибупрофена, 10% этанола и 90% рапсового масла (1200 мг один раз в день), чтобы снизить уровень LDL до нормального диапазона. Через 5 дней лечения уровни LDL у пациента снизились до 3,36 ммоль/л. Пациент находился под наблюдением в течение 1 месяца, и его уровень LDL оставался в пределах нормы, несмотря на отсутствие дополнительного введения ВС1054.
Пример 12
Лечение хронического воспаления
62-летняя женщина жалуется на плохую подвижность и отек в суставах и получает диагноз ревматоидный артрит. Врач определяет, что плохая подвижность и отек суставов являются следствием хронического воспаления. Женщина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием женщины ведется наблюдение, и примерно через 3 дня лечения женщина указывает, что подвижность суставов повышается, а отек уменьшается. На контрольных приемах через один и три месяца женщина указывает, что у нее по-прежнему повышена подвижность суставов и снижен отек в области лечения. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в настоящем документе, будет использоваться для лечения пациента, страдающего от хронического воспаления, ассоциированного с любым моноартритом, олигоартритом или полиартритом, таким как, например, остеоартрит, ювенильный идиопатический артрит, септический артрит, спондилоартропатия (включая анкилозирующий спондилит, реактивный артрит (синдром Рейтера), псориатический артрит, энтеропатический артрит, связанный с воспалительным заболеванием кишечника, болезнь Уиппла или болезнь Бехчета), синовит, подагра, псевдоподагра или болезнь Стилла, а также бурсит, ревматизм или теносиновит. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
58-летний мужчина жалуется на затрудненное дыхание, и ему поставлен диагноз хроническая обструктивная болезнь легких (COPD). Врач определяет, что затрудненное дыхание является следствием хронического воспаления. Мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием мужчины ведется наблюдение, и примерно через 3 дня лечения мужчина указывает, что наблюдается улучшение в его способности дышать. На контрольных приемах через один и три месяца мужчина указывает, что у него по-прежнему наблюдается улучшение дыхания. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в данном документе, будет использоваться для лечения пациентов, страдающих от хронического воспаления, ассоциированного с астмой, бронхиолитом, бронхитом, эмфиземой, ларингитом, фарингитом, плевритом, пневмонией, ринитом, синуситом или любым другим типом хронического респираторного заболевания. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
67-летний мужчина жалуется на боль в мышцах, и ему поставлен диагноз дерматомиозит. Врач определяет, что болезненность является следствием хронического воспаления. Мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием мужчины ведется наблюдение, и примерно через 3 дня лечения мужчина указывает, что боль уменьшилась. На контрольных приемах через один и три месяца мужчина указывает, что у него продолжается увеличение подвижности мышц и уменьшение боли. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в данном документе, будет использоваться для лечения пациентов, страдающих от хронического воспаления, ассоциированного с миозитом телец включения, миастенией, полимиозитом или любым другим типом воспалительной миопатией, а также с фасциитом, фиброзом, миозитом, нейромиотонией, тендинозом или тендинитом. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
73-летняя женщина жалуется на хрипы при дыхании, и ей поставлен диагноз артериит Чарга-Стросса. Врач определяет, что хрипы являются следствием хронического воспаления. Женщина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием женщины ведется наблюдение, и примерно через 3 дня лечения женщина указывает, что хрипы исчезли. На контрольных приемах через один и три месяца женщина указывает, что у нее не наблюдаются хрипы при дыхании. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в настоящем документе, будет использоваться для лечения пациента, страдающего от хронического воспаления, связанного с любым васкулитом, таким как, например, болезнь Бюргера, церебральный васкулит, криоглобулинемия, эссенциальный криоглобулинемический васкулит, гигантоклеточный артериит, васкулит игрока в гольф, пурпура Геноха-Шенлейна, васкулит гиперчувствительности, болезнь Кавасаки, флебит, микроскопический полиартериит/полиангиит, узелковый полиартериит, ревматическая полимиалгия (PMR), ревматоидный васкулит, артериит Такаясу или гранулематоз Вегенера, а также артериит, кардит, эндокардит, болезнь сердца, высокое кровяное давление, воспалительная кардиомегалия, ишемическая болезнь сердца, миокардит, перикардит, флебит, пилефлебит или тромбофлебит. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
37-летний мужчина жалуется на покраснение кожи и диагноз розацеа. Врач определяет, что покраснение является следствием хронического воспаления. Мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием мужчины ведется наблюдение, и примерно через 3 дня лечения мужчина указывает, что покраснение уменьшилось. На контрольных приемах через один и три месяца мужчина указывает, что у него продолжает оставаться улучшенный цвет кожи и уменьшенное покраснение. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в данном документе, будет использоваться для лечения пациентов, страдающих от хронического воспаления, ассоциированного с акне, цервицитом, дерматитом, экземой (включая атопический дерматит, контактную экзему, ксеротическую экзему, себорейный дерматит, дисгидроз, дискоидную экзему, венозную экзему, герпетиформный дерматит, нейродермит или аутоэкзематизацию), эндометритом, гингивитом, глосситом, гнойным гидраденитом, кератитом, кератоконъюнктивитом, маститом, псориазом (включая бляшечный псориаз, ногтевой псориаз, каплевидный псориаз, псориаз волосистой части головы, обратный псориаз, пустулезный псориаз или эритродермический псориаз), склеродермией, стазисным дерматитом, стоматитом, тонзиллитом, вагинитом, витилиго или вульвитом. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
33-летняя женщина жалуется на боль в животе и диарею, и ей поставлен диагноз болезнь Крона. Врач определяет, что боль в животе и диарея являются следствием хронического воспаления. Женщина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием женщины ведется наблюдение, и примерно через 3 дня лечения женщина указывает, что боль в животе уменьшается, а диарея исчезла. На контрольных приемах через один и три месяца женщина указывает, что у нее по-прежнему уменьшаются боль и диарея. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в настоящем документе, будет использоваться для лечения пациента, страдающего от нейрогенного воспаления, ассоциированного с любым воспалительным заболеванием кишечника, таким как, например, язвенный колит (включая язвенный проктит, левосторонний колит, панколит и молниеносный колит), любым синдромом раздраженного кишечника, а также колитом, энтеритом, энтероколитом, гастритом, гастроэнтеритом, метаболическим синдромом (синдромом X), спастической толстой кишкой или любым другим желудочно-кишечным заболеванием. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
46-летний мужчина жалуется на лихорадку, боль в суставах и усталость, и ему поставлен диагноз системная красная волчанка. Врач определяет, что эти симптомы обусловлены хроническим воспалением. Мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием мужчины ведется наблюдение, и примерно через 3 дня лечения мужчина указывает, что его здоровье улучшилось, лихорадка прошла, боль в суставах уменьшилась, и он не устает. На контрольных приемах через один и три месяца мужчина указывает, что у него по-прежнему меньшая боль в суставах, и он не страдает от лихорадки или усталости. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в данном документе, будет использоваться для лечения пациентов, страдающих от хронического воспаления, ассоциированного с любым другим системным аутоиммунным заболеванием, включая, без ограничения, синдром антифосфолипидных антител (APS), буллезный пемфигоид, болезнь Шагаса, дискоидную красную волчанку, медикаментозную системную красную волчанку, синдром Гудпасчера, синдром Гийена-Барре, идиопатическую тромбоцитопеническую пурпуру, миастению, волчанку новорожденных, пернициозную анемию, ревматическую полимиалгию, ревматоидный артрит, склеродермию, синдром Шегрена, подострую кожную красную волчанку или гранулематоз Вегенера. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
58-летний мужчина жалуется на депрессию, чувствительность к холоду, увеличение веса, забывчивость, запоры, и ему поставлен диагноз тиреоидит Хашимото. Врач определяет, что эти симптомы обусловлены хроническим воспалением. Мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте мужчина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием мужчины ведется наблюдение, и примерно через 3 дня лечения мужчина указывает, что у него уменьшились все симптомы, на которые он жаловался. На контрольных приемах через один и три месяца мужчина указывает, что не испытывает депрессию, чувствительность к холоду, увеличение веса, забывчивость и запоры. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в данном документе, будет использоваться для лечения пациентов, страдающих от хронического воспаления, ассоциированного с любым другим местным аутоиммунным заболеванием, включая, без ограничения, острый рассеянный энцефаломиелит (ADEM), болезнь Аддисона, аутоиммунную гемолитическую анемию, аутоиммунный гепатит (включая первичный билиарный цирроз), аутоиммунное заболевание внутреннего уха, целиакию, болезнь Крона, сахарный диабет I типа, эндометриоз, гигантоклеточный артериит, болезнь Грейвса, интерстициальный цистит, волчаночный нефрит, рассеянный склероз, морфею, пузырчатку обыкновенная, рецидивирующий рассеянный энцефаломиелит, склерозирующий холангит, язвенный колит или витилиго. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
59-летняя женщина жалуется на плохую подвижность и отек в суставах и получает диагноз реактивный артрит. Врач определяет, что плохая подвижность суставов и отек являются следствием хронического воспаления. Женщина получает лечение путем перорального введения фармацевтической композиции, содержащей ибупрофен, раскрытой в данном документе, принимаемой дважды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей аспирин, раскрытой в данном документе, принимаемой трижды в день. В альтернативном варианте женщина получает лечение путем перорального введения фармацевтической композиции, содержащей напроксен, раскрытой в данном документе, принимаемой дважды в день. За состоянием женщины ведется наблюдение, и примерно через 3 дня лечения женщина указывает, что подвижность суставов увеличилась, а отек уменьшился. На контрольных приемах через один и три месяца женщина указывает, что у нее по-прежнему повышена подвижность суставов и снижен отек в больной области. Это уменьшение симптома хронического воспаления указывает на успешное лечение с использованием фармацевтической композиции, раскрытой в данном документе. Аналогичный тип перорального введения фармацевтической композиции, раскрытой в настоящем документе, будет использоваться для лечения пациента, страдающего от хронического воспаления, ассоциированного с любым моноартритом, олигоартритом или полиартритом, таким как, например, остеоартрит, ювенильный идиопатический артрит, септический артрит, спондилоартропатия (включая анкилозирующий спондилит, реактивный артрит (синдром Рейтера), псориатический артрит, энтеропатический артрит, связанный с воспалительным заболеванием кишечника, болезнь Уиппла или болезнь Бехчета), синовит, подагра, псевдоподагра или болезнь Стилла, а также бурсит, ревматизм или теносиновит. Аналогичным образом, любое из терапевтических соединений, таких как, например, NSAID - салицилатное производное, NSAID - п-аминофенольное производное, NSAID - производное пропионовой кислоты, NSAID - производное уксусной кислоты, NSAID - производное енольной кислоты, NSAID - производное фенамовой кислоты, неселективный ингибитор циклооксигеназы (СОХ), селективный ингибитор циклооксигеназы 1 (СОХ 1), селективный ингибитор циклооксигеназы 2 (СОХ 2) или фибрат, будут введены в состав фармацевтической композиции и введены пациенту как описано выше.
В заключение следует понимать, что хотя аспекты настоящего описания освещены путем ссылки на конкретные варианты осуществления, специалист в данной области техники легко поймет, что эти раскрытые варианты осуществления являются только иллюстрацией принципов объекта изобретения, раскрытого в данном документе. Поэтому, следует понимать, что раскрытый объект изобретения никоим образом не ограничен конкретной методикой, протоколом и/или реагентом и т.д., описанными в данном документе. По существу, различные модификации или изменения или альтернативные конфигурации раскрытого объекта изобретения могут быть осуществлены в соответствии с идеями данного описания без отступления от сущности настоящего описания. И наконец, используемая в данном документе терминология предназначена для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который определен исключительно формулой изобретения. Соответственно, настоящее изобретение не ограничено тем, что точно соответствует показанному и описанному.
Некоторые варианты осуществления настоящего изобретения описаны в данном документе, включая лучший способ, известный изобретателям для осуществления изобретения. Конечно, вариации этих описанных вариантов будут очевидны специалистам в данной области техники после прочтения приведенного выше описания. Изобретатель ожидает, что квалифицированные специалисты используют такие варианты при необходимости, и изобретатели предполагают, что настоящее изобретение будет осуществляться на практике иначе, чем конкретно описано в данном документе. Соответственно, данное изобретение включает все модификации и эквиваленты объекта изобретения, изложенного в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Более того, любая комбинация вышеописанных вариантов осуществления во всех возможных вариантах охватывается изобретением, если иное не указано в данном документе или явно не противоречит контексту.
Разделение на группы альтернативных вариантов, элементов или стадий настоящего изобретения не должно истолковываться как ограничение. Каждый член группы может указываться и заявляться по отдельности или в любой комбинации с другими членами группы, раскрытыми в данном документе. Предполагается, что один или несколько членов группы могут быть включены в группу или удалены из нее по причинам удобства и/или патентуемости. Когда происходит такое включение или удаление, считается, что описание содержит группу, измененную таким образом, что соблюдается письменное описание всех групп Маркуша, используемых в приложенной формуле изобретения.
Если не указано иное, все числа, выражающие характеристику, предмет, количество, параметр, свойство, термин, и т.д., используемые в настоящем описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином «примерно». Используемый в данном документе, термин «примерно» означает, что характеристика, предмет, количество, параметр, свойство или термин, таким образом описанные, охватывают диапазон плюс или минус десять процентов выше и ниже значения, указанного характеристикой, предметом, количеством, параметром, свойством или термином. Соответственно, если не указано иное, числовые параметры, изложенные в описании и прилагаемой формуле изобретения, являются приблизительными значениями, которые могут изменяться. По крайней мере и не в качестве попытки ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый числовой показатель следует воспринимать в свете количества указанных значащих цифр и с применением обычных методов округления. Несмотря на то, что численные диапазоны и значения, устанавливающие широкий объем изобретения, являются приближениями, численные диапазоны и значения, изложенные в конкретных примерах, указаны настолько точно, насколько это возможно. Любой численный диапазон или значение однако по своей природе содержит некоторые ошибки, неизбежно вытекающие из стандартного отклонения, обнаруживаемого в их соответствующих тестовых измерениях. Перечисление числовых диапазонов величин в данном документе служит только в качестве краткого способа индивидуальной ссылки на каждую отдельную численную величину, находящуюся в пределах диапазона. Если не указано иное, каждая отдельная величина числового диапазона включена в настоящее описание, как если бы она была индивидуально указана в данном документе.
Формы в единственного числа и аналогичные указания, используемые в контексте описания настоящего изобретения (особенно в контексте нижеследующей формулы изобретения) следует истолковывать, как охватывающие как единственное, так и множественное число, если иное не указано в данном документе или явно не противоречит контексту. Все описанные в данном документе способы могут быть выполнены в любом подходящем порядке, если не указано иное или явно не противоречит контексту. Использование любых и всех примеров или типовой терминологии (например, «такой как») в данном документе предназначено только для лучшего освещения настоящего изобретения и не накладывает ограничения на объем изобретения, заявленный иным образом. Никакую терминологию в настоящем описании не следует истолковывать, как указание на любой незаявленный элемент, необходимой для практического осуществления изобретения.
Конкретные варианты осуществления, раскрытые в данном документе, могут быть дополнительно ограничены в формуле изобретения с использованием формулировок «состоящий из» или «состоящий по существу из». При использовании в поданной формуле изобретения или во внесенных поправках, переносящийся термин «состоящий из» исключает любой элемент, стадию или ингредиент, не указанные в формуле изобретения. Переносящийся термин «состоящий по существу из» ограничивает объем изобретения указанными материалами или стадиями и теми, которые не оказывают существенного влияния на основные и новые характеристики. Варианты осуществления настоящего изобретения, заявленного таким образом, по своей природе или прямо описаны и доступны в данном документе.
Все патенты, патентные публикации и другие публикации, указанные и определенные в данном описании, индивидуально и прямо полностью включены в данный документ путем ссылки с целью описания и раскрытия, например, композиции и методики, описанные в таких публикациях, которые могут быть использованы в настоящем изобретении. Эти публикации приведены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этом отношении не должно быть истолковано как допущение, что изобретатели не имеют права датировать задним числом такое раскрытие на основании предшествующего изобретения или по любой другой причине. Все утверждения на сегодняшний момент или представление относительно содержания этих документов основаны на информации, имеющейся в распоряжении заявителей, и не предполагают никакого допущения относительно правильности дат или содержания этих документов.