ОЛИГОПЕПТИДЫ МЕТАЛЛОПРОТЕИНАЗ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Отсылки к родственным заявкам
Настоящая заявка является частично продолжающей заявкой и испрашивает приоритет по находящейся на рассмотрении заявке на патент США 13/012796, поданной 24 января 2011 г.Раскрытие указанной заявки целиком включается в данную заявку путем отсылки. Настоящая заявка содержит перечень последовательностей, представленный в виде файла ASCII, именуемого RIPLLC018003CIP1sequence_ST25, дата создания 7/5/2011, размер текстового файла ASCII 6 кБ.
Область техники, к которой относится данное изобретение
Настоящее описание относится в основном к конструированию и синтезу новых последовательностей олигопептидов металлопротеиназ, предназначенных для применения в качестве терапевтических агентов для лечения заболеваний, затрагивающих межклеточный матрикс. Более конкретно, настоящее описание относится к применению олигопептидов металлопротеиназ из живых организмов различных видов в качестве вакцины, фармацевтической композиции, терапевтической дозы и диагностического средства при лечении рака.
Уровень техники
Матриксные металлопротеиназы - это семейство нейтральных цинк-зависимых эндопептидаз, играющих важную роль в ангиогенезе опухолей, перестройке тканей и миграции клеток. При раке уровень некоторых из этих ферментов аномально повышен, что позволяет раковым клеткам разрушать межклеточный матрикс, проникать через базальную мембрану сосудов и перемещаться, образуя удаленные метастазы. С повышенной активностью металлопротеиназ, в частности ферментов, обозначаемых ММР-2 и ММР-9, связаны различные патологические состояния. Эти протеазы способны расщеплять коллаген и другие белки межклеточного матрикса, что создает условия для распространения заболевания. Таким образом, существует нужда в терапевтическом агенте, эффективно блокирующем разрушение межклеточного матрикса этими металлопротеиназами и тем самым препятствующем распространению по организму рака и других заболеваний.
В лечении рака чрезвычайно важно предотвращать и прекращать метастазирование злокачественных клеток; на сегодняшний день это главная проблема. Существующие методы ее решения токсичны, неспецифичны и эффект их применения при болезнях, затрагивающих белки межклеточного матрикса, непредсказуем. Поэтому существует потребность в терапевтических агентах, эффективно блокирующих расщепление компонентов межклеточного матрикса металлопротеиназами и тем самым предотвращающие его разрушение и распространение заболевания в организме.
Раскрытие изобретения
В настоящем документе описываются последовательности и состав олигопептидов металлопротеиназ и способ их применения в качестве вакцины, фармацевтической композиции, терапевтической дозы и диагностического средства при лечении заболеваний, затрагивающих межклеточный матрикс.
В одном из воплощений данного изобретения сконструированы и синтезированы олигопептидные аналогии последовательностей металлопротеиназ ММР-9 и ММР-2. В другом воплощении данного изобретения проверялась способность этих олигопептидов подавлять инвазию раковых клеток in vitro с использованием определенных линий клеток.
В другом воплощении данного изобретения проверялась способность олигопептидных аналогов ММР-9 и ММР-2 подавлять рост опухолей in vivo у мышей.
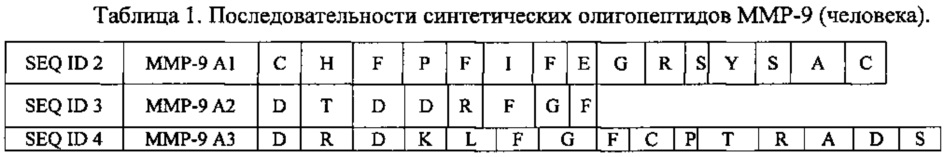
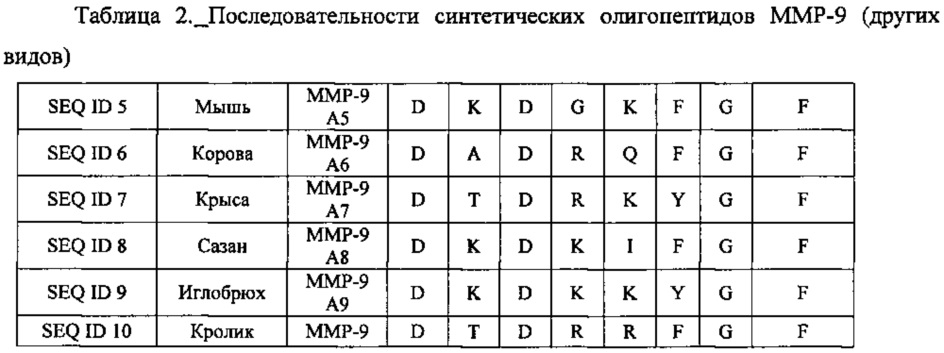
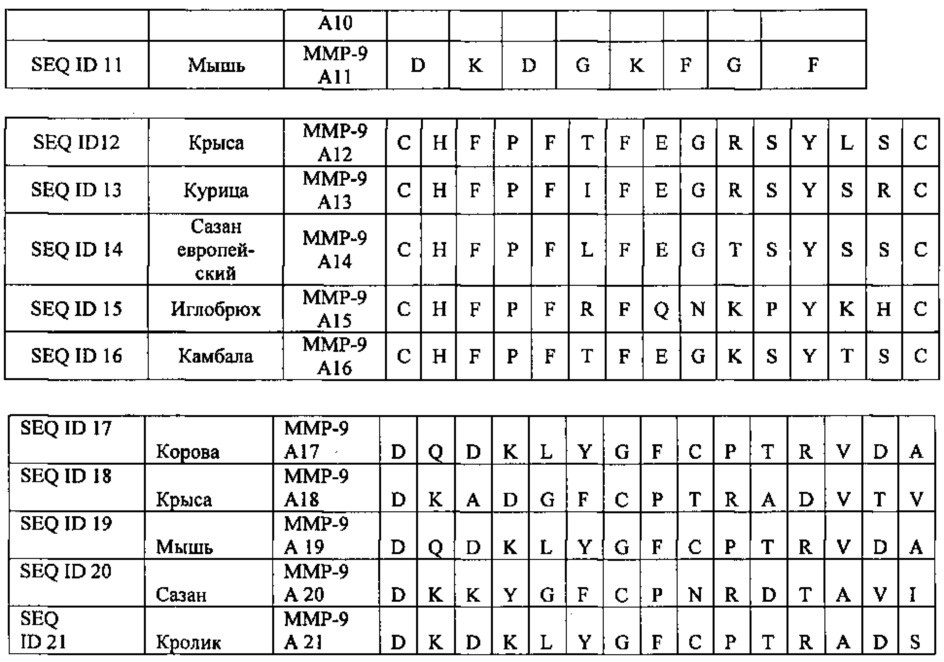
В одном из воплощений данного изобретения приведенные ниже олигопептидные последовательности использовались для получения вакцины. В другом воплощении данного изобретения определяли лечебную дозу, содержащую синтетические аналоги олигопептидов с последовательностями SEQ ID 1-21, для больного раком.

В одном из воплощений данного изобретения в последовательности олигопептида могут быть мутации, делеции и замены (изменения последовательности не ограничиваются перечисленным).
В одном из воплощений данного изобретения олигопептиды ММР-2 могут применяться в качестве вакцины, фармацевтической композиции, терапевтической дозы и диагностического средства. В другом воплощении данного изобретения олигопептиды ММР-2 могут использоваться в сочетании с каким-либо из олигопептидов ММР-9 в качестве вакцины. В другом воплощении данного изобретения все двадцать один олигопептид могут вместе использоваться для получения вакцины.
В одном из воплощений данного изобретения последовательности олигопептидов могут быть линейными или кольцевыми. В другом воплощении данного изобретения в олигопептиде последовательность может повторяться.
В другом воплощении данного изобретения к олигопептиду могут быть присоединены гаптены или полигликаны для более эффективной доставки.
В другом воплощении данного изобретения раскрывается способ иммунизации млекопитающего, например мыши, для образования у него антител к определенной металлопротеиназе. В одном из воплощений данного изобретения раскрывается процедура выбора олигопептида, подходящего для индукции иммунного ответа. В другом воплощении данного изобретения осуществляется in vitro подавление инвазии раковых клеток антителами, индуцированными олигопептидом по данному изобретению.
В другом воплощении данного изобретения млекопитающих, например мышей, иммунизировали олигопептидами по данному изобретения, после чего вводили им клетки меланомы мыши В16F0, чтобы проверить подавление опухолевого роста.
В одном из воплощений данного изобретения применение указанной иммунизации не ограничивается лечением рака, но включает также применение при всех заболеваниях, связанных с разрушением межклеточного матрикса. В другом воплощении данного изобретения вакцинация проводится однократно или повторно в зависимости от уровня антител, специфичных к введенному олигопептиду. В одном из воплощений данного изобретения вид животного, которому вводится олигопептид по данному изобретению, может относиться к млекопитающим и/или нет.
В одном из воплощений данного изобретения композиция для использования олигопептида по данному изобретению в качестве вакцины или терапевтической дозы включает какой-либо из олигопептидов с последовательностями SEQ ID 1-21 в отдельности или комбинацию таких олигопептидов.
В одном из воплощений данного изобретения терапевтически эффективное количество олигопептида вводится животному путем инъекции (но этим способом введения не ограничивается). В других воплощениях используются композиции для перорального введения, местного применения, введения через слизистые, путем вдыхания, прицельной доставки или пролонгированного высвобождения. Лечебная доза может включать терапевтически эффективные и фармацевтически приемлемые комбинации.
Описываемые в настоящем документе композиция, способ и лечение могут осуществляться любыми средствами для достижения различных целей и могут быть выполнены в форме, подходящей для данного млекопитающего. Другие признаки настоящего изобретения будут ясны из прилагаемых иллюстраций и нижеследующего описания осуществления изобретения.
Краткое описание иллюстраций
Примерные воплощения настоящего изобретения иллюстрируются в качестве примера прилагаемыми фигурами, на которых сходные элементы обозначены одинаково.
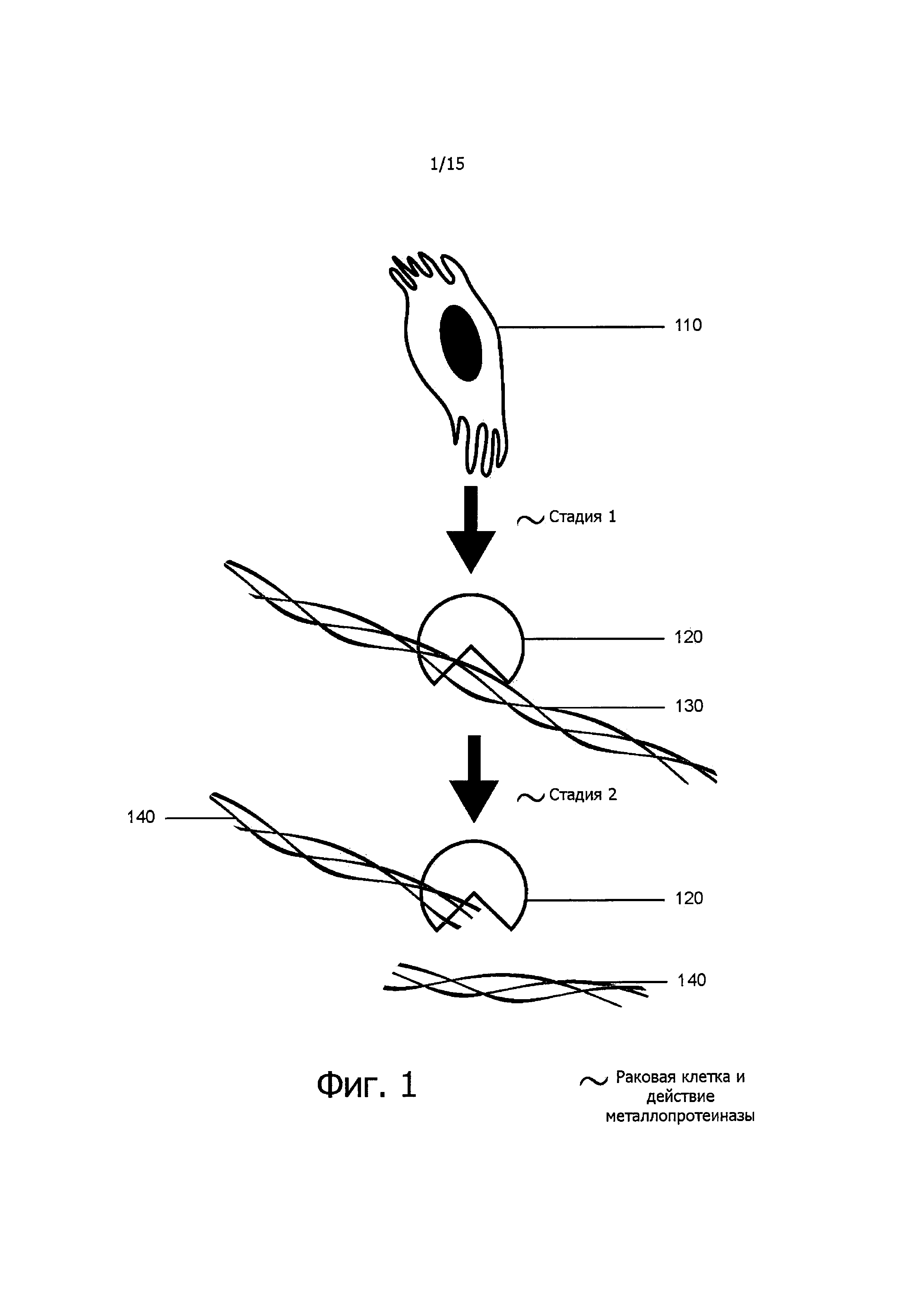
Фигура 1 изображает, соответственно современным представлениям, разрушение межклеточного матрикса путем расщепления его компонентов под действием металлопротеиназ в процессе заболевания.
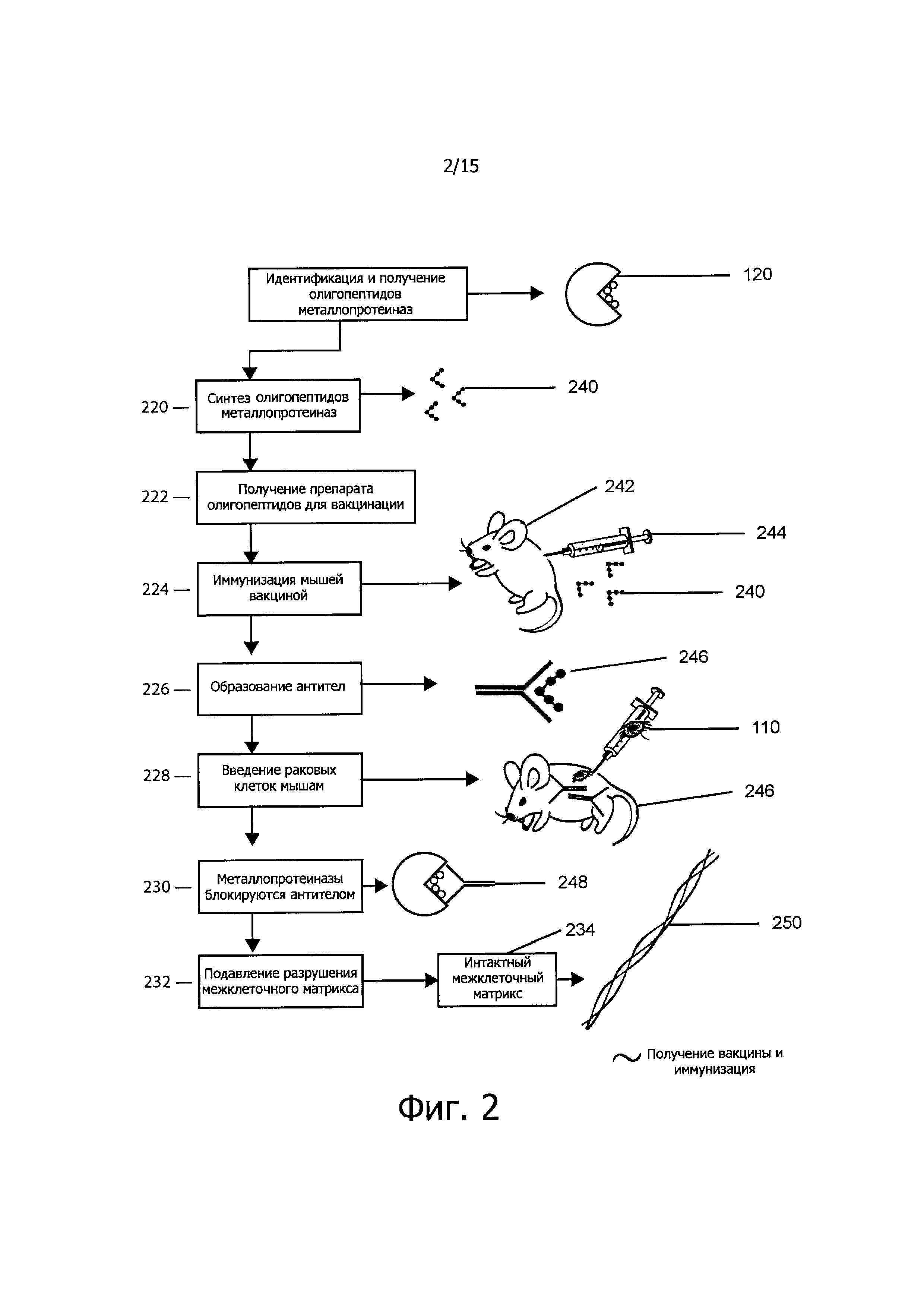
Фигура 2 представляет схему воздействия на организм млекопитающего с использованием вакцины.
Фигура 3(A-D) - фотографии клеток HeLa (контрольных и при обработке олигопептидами), сделанные в ходе эксперимента по инвазии и демонстрирующие эффект иммунной сыворотки с олигопептидами металлопротеиназ ММР-9 А1-3 и ММР-2 А4.
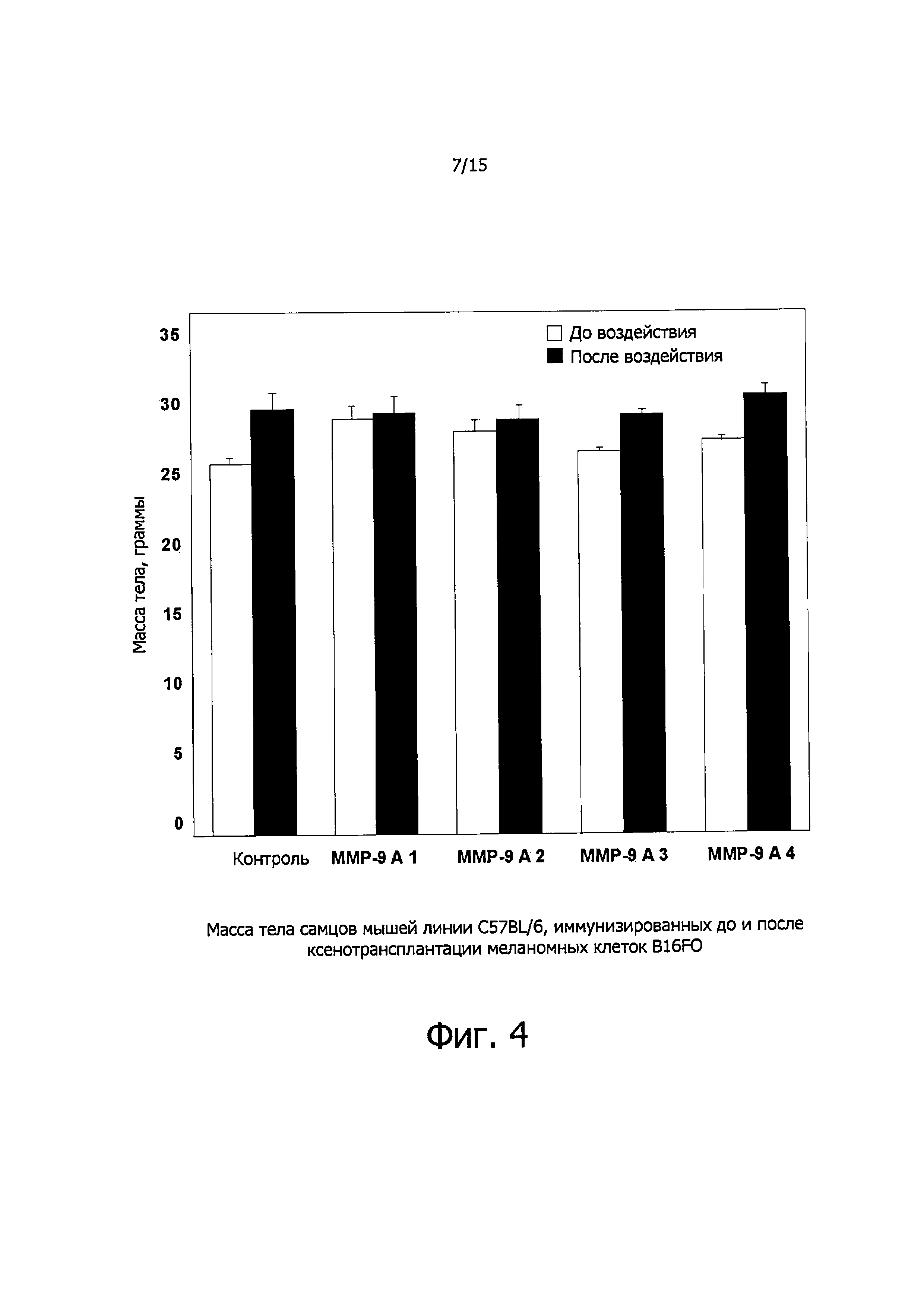
Фигура 4 представляет данные по массе тела мышей до и после воздействия.
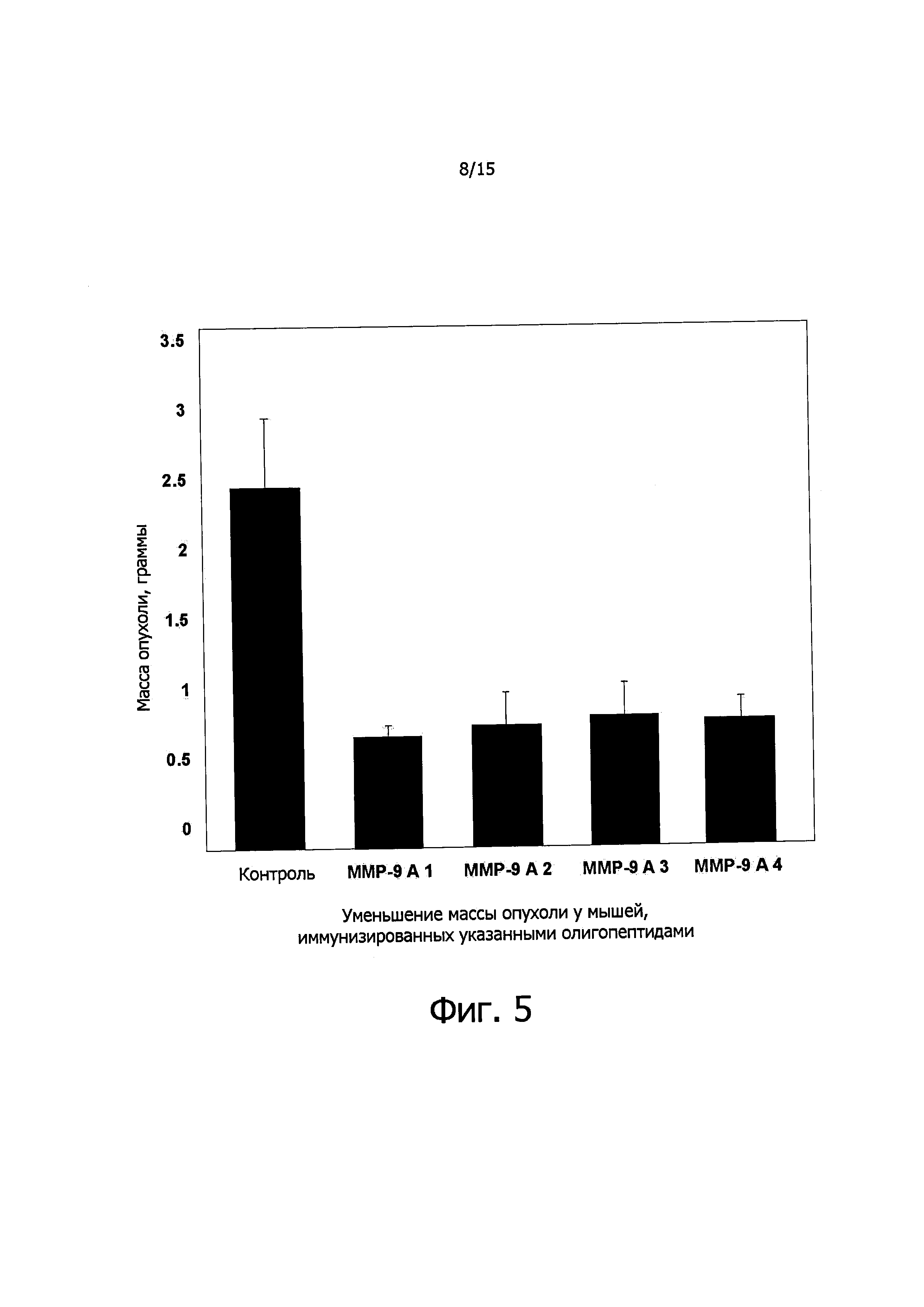
Фигура 5 демонстрирует эффект иммунизации с использованием матриксной металлопептидазы ММР-9 А1-3 и ММР-2 А4 на подавление роста опухоли из ксенотрансплантата меланомных клеток линии B16FO у самцов мышей линии C57BL/6.
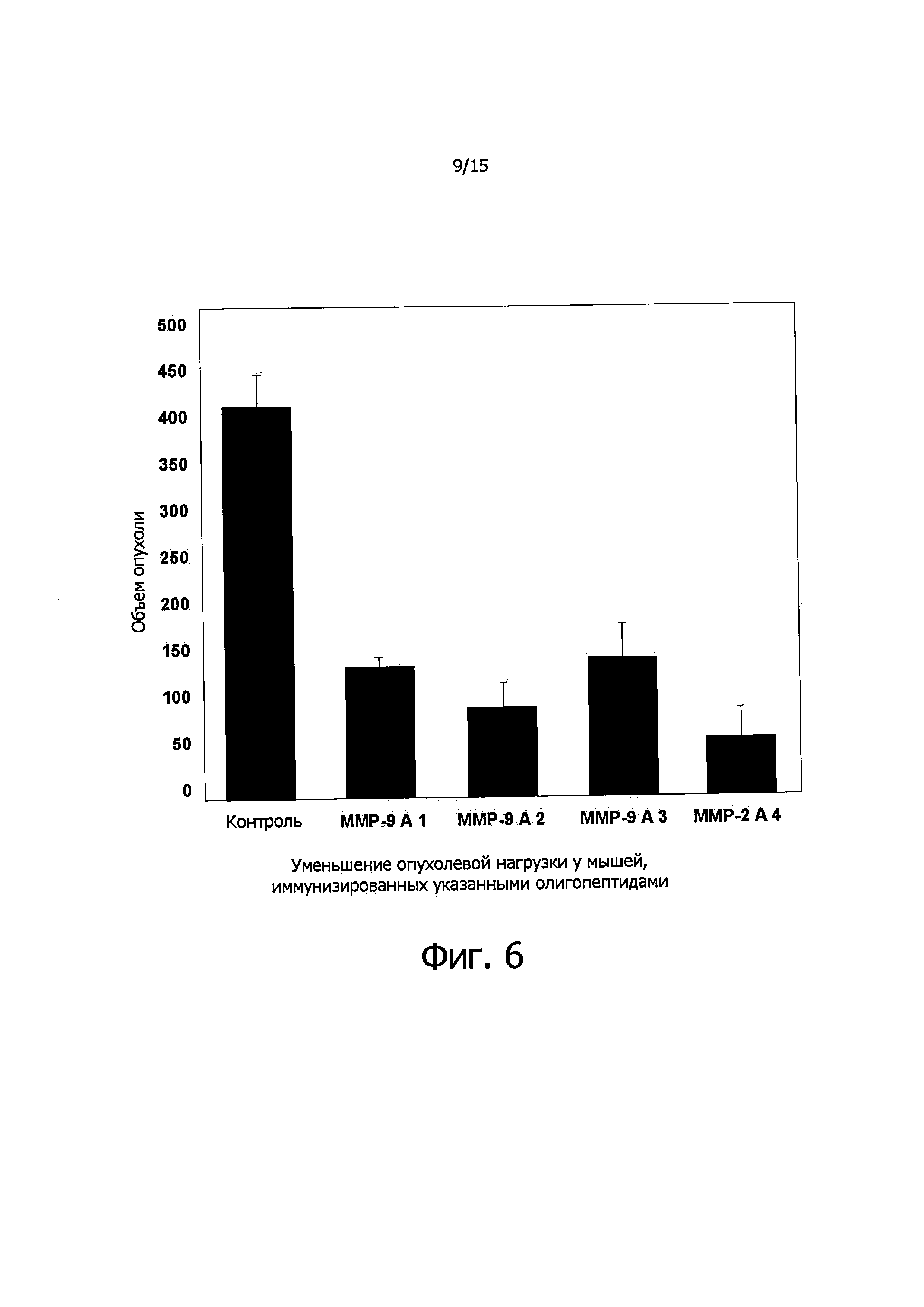
Фигура 6 демонстрирует опухолевую нагрузку (по длине и ширине опухолей), полученных у самцов мышей линии C57BL/6 до и после обработки меланомного ксенотрансплантата.
Фигура 7А-Е демонстрирует опухолевый рост у контрольных мышей и его подавление у иммунизированных особей.
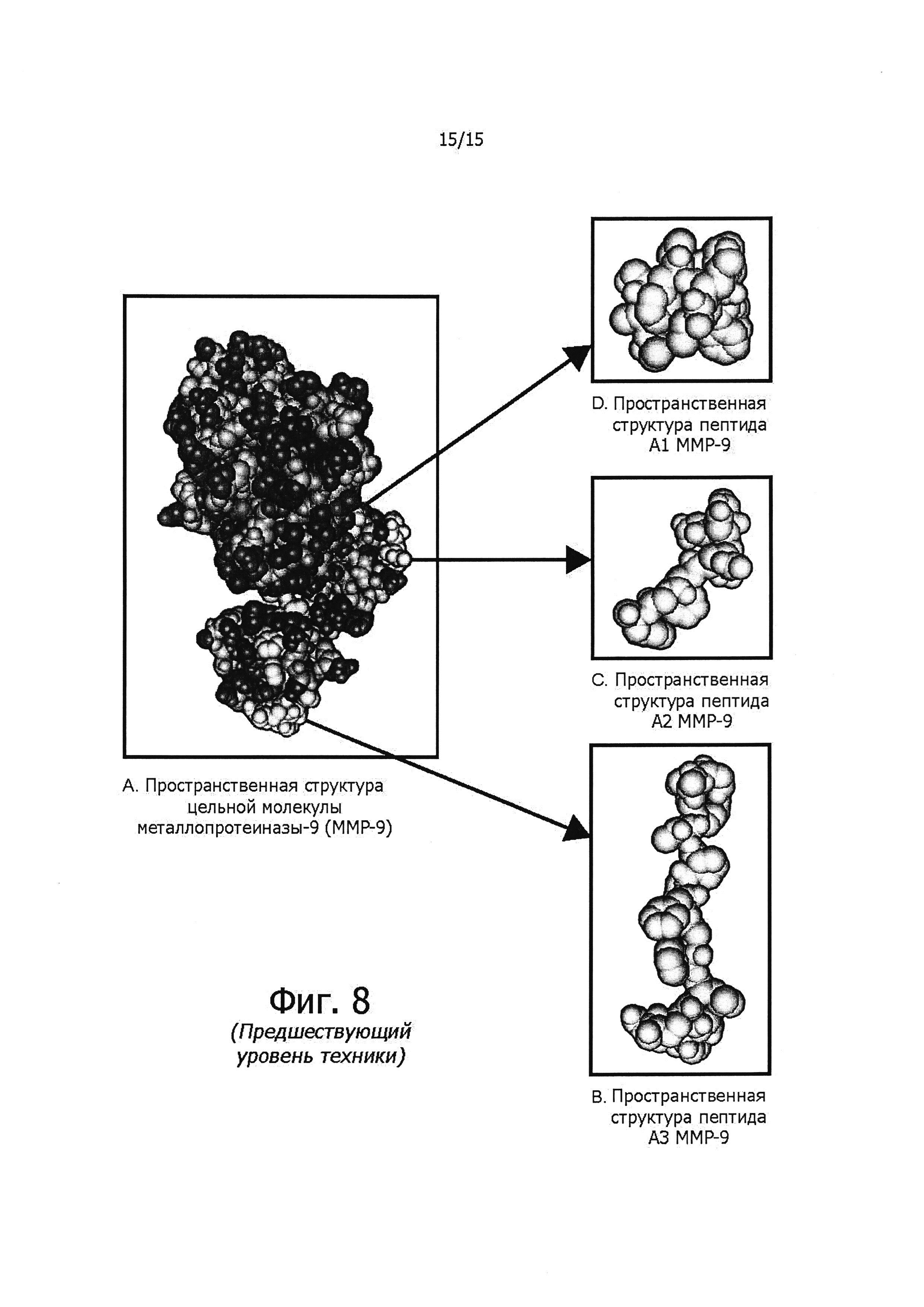
Фигура 8 показывает участки связывания, соответствующие различным пептидомиметикам, в молекуле металлопротеиназы.
Другие признаки представленных здесь воплощений настоящего изобретения станут ясны из соответствующих иллюстраций и приведенного ниже подробного описания осуществления изобретения.
Осуществление изобретения
Здесь описываются несколько последовательностей и способов для иммунизации, лечения рака и сокращения размеров опухолей с использованием олигопептидов матриксных металлопротеиназ в качестве вакцины.
Хотя представленные здесь различные воплощения настоящего изобретения описаны на конкретных примерах, будет очевидно, что возможны различные модификации и изменения этих воплощений, не отступающие от их сущности и объема.
Раковые клетки производят матриксные металлопротеиназы, в частности ММР-2 и ММР-9 в повышенных количествах. Эти ферменты способны разрушать межклеточный матрикс соединительной ткани, окружающей раковые клетки. Металлопротеиназы связываются с межклеточным матриксом посредством специфических связывающих участков. Блокирование таких связывающих участков в молекулах металлопротеиназ предотвращает связывание этих ферментов с межклеточным матриксом. Подавление разрушения межклеточного матрикса предотвращает распространение рака и сокращает размер опухоли. В настоящем изобретении идентифицированы несколько потенциальных связывающих участков в молекулах ММР-9 и ММР-2. На фигуре 1 изображено, что раковые клетки (110) производят металлопротеиназы (120) (стадия 1). Металлопротеиназы (120) связываются посредством специфических связывающих участков с межклеточным матриксом (130) (стадия 2). Металлопротеиназы (120) разрушают межклеточный матрикс (140) (стадия 3).
На фигуре 2 настоящее изобретение представлено поэтапно, включая получение вакцины и иммунизацию животного (222-224). Идентификация и конструирование олигопептидов металлопротеиназ осуществляется с использованием последовательностей этих белков. Синтезируют олигопептиды (220), получая синтетические олигопептиды (240). Препараты олигопептидов, предназначенные для вакцинации, обозначены 222. В ответ на них образуются антитела (226). Мышей (242) иммунизируют (224) вакциной путем инъекции (244). Олигопептиды могут быть определенной длины. Были испробованы несколько сочетаний и комбинаций последовательностей. Последовательности по данному изобретению представлены выше и обозначены ММР-9 А1-3 и 5-21 и ММР-2 А4. Прежде чем отобрать эти двадцать одну последовательность как потенциальные олигопептиды, были идентифицированы несколько потенциальных связывающих участков в белках ММР-9 и ММР-2. Используя фибросаркомные клетки линии НТ-1080 и клетки опухоли шейки матки линии DoTC-2, мы синтезировали и испытали в общей сложности восемь олигопептидов. Для дальнейших экспериментов были взяты только отобранные последовательности. Олигопептиды ММР-9 А1-3 и 5-21 и ММР-2 А4 были синтезированы как в линейной, так и в кольцевой форме. В одном из воплощений данного изобретения были также получены различные модификации этих последовательностей. Модификации заключались в замене одного или более аминокислотных остатков на N-конце, С-конце или на обоих концах полипептидной цепи, причем замены производились исходя из сходства заряда и полярности, без учета заряда и полярности; в делеции аминокислотных остатков на С- и N-конце полипептидной цепи, только на С-конце и только на N-конце.
В другом воплощении данного изобретения замены и делеции аминокислотных остатков могли осуществляться одновременно. Олигопептиды далее могли быть модифицированы путем повторения последовательностей; кроме того, для создания вакцины мы брали более чем одну последовательность из числа SEQ ID 1-3, 5-21 ММР-9 А1-3 и 5-21 и SEQ ID 1, ММР-2 А4. Пептидомиметики металлопротеиназ можно использовать для блокирования связывающих участков металлопротеиназ, которые сверхэкспрессируются при определенных заболеваниях.
В одном из воплощений настоящего изобретения предлагаемые олигопептиды можно использовать в качестве регуляторов по принципу обратной связи для того, чтобы на клеточном уровне специфически предотвращать образование ММР-9 и ММР-2 или снижать скорость их синтеза. В одном из воплощений настоящего изобретения блокирование и подавление разрушения межклеточного матрикса у мышей достигалось благодаря антителам, образовавшимся в результате вакцинации олигопептидами.
В другом воплощении настоящего изобретения к N-концу синтезированных олигопептидов присоединяли биотин, используя спейсеры, содержащие 21 атом углерода (производство компании Genscript, Пискатауэй, шт. Нью-Джерси 08554, США), и конъюгировали с белком KLH. Эффективность лечения путем иммунотерапии с олигопептидами по данному изобретению изучали в экспериментах на мышах, в которых проводили иммунизацию животных и индукцию у них опухолей.
Для инъекций брали 100 мкл конъюгатов KLH и биотинилированных пептидов и 100 мкл полного адъюванта Фрейнда (производство Sigma, Сент-Луис, шт. Миссури, США).
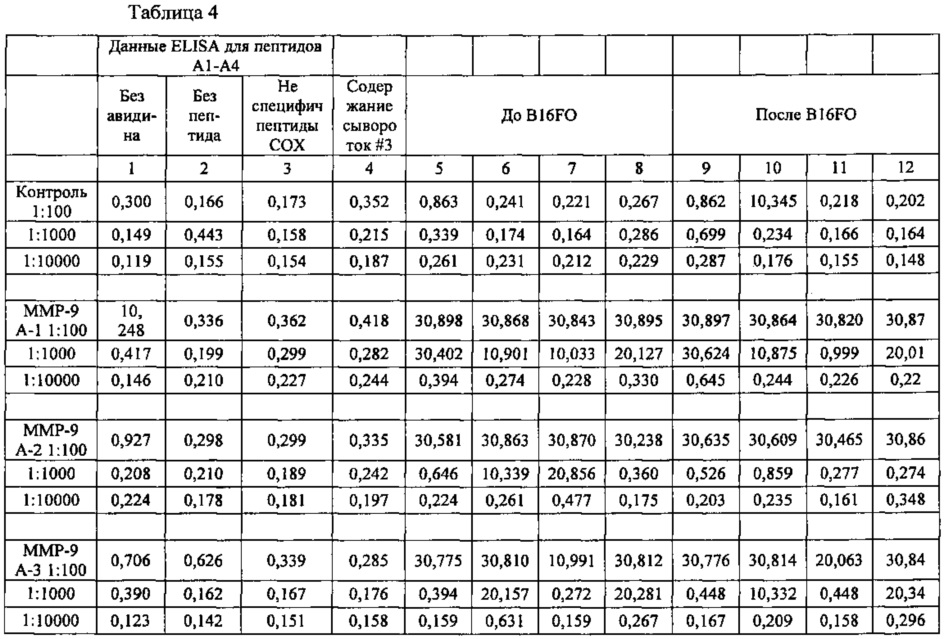
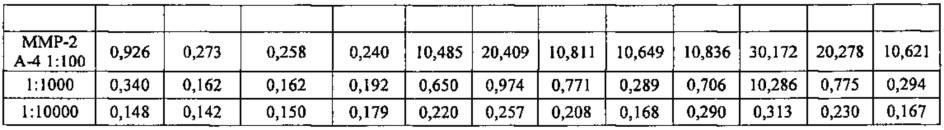
Подопытных животных - самцов мышей линии C57BL/6 в возрасте 6 недель (на момент прибытия в лабораторию авторов), предоставленных компанией Simonsen Laboratories (Гилрой, шт. Калифорния, США), содержали в микроизоляторной системе в безпатогенных условиях в течение недели до начала эксперимента при режиме освещения 12 часов свет/12 часов темнота. Всем особям был обеспечен уход, соответствующий общепринятым установлениям относительно содержания лабораторных животных. По окончании этой недели животных (группы по 5 особей) иммунизировали путем внутрибрюшинной инъекции (этот день обозначен «День 0») и затем в дни 7, 14 и 28 им тем же путем вводили неполный адъювант Фрейнда (Sigma). В образцах крови определяли иммунный ответ путем стандартного твердофазного иммуноферментного анализа (ELISA), используя планшеты для микротитрования. Повторные инъекции синтетических пептидов вызывали у мышей пептидоспецифичный иммунный ответ. Были испробованы различные разведения, например 1:100, 1:1000 и 1:10000.
Конъюгирование пептидов
Все пептиды SEQ ID 1-4 ковалентно конъюгировали с гемоцианином фиссуреллы (белком KLH). В типичном опыте 1 мг пептида и 4 мг KLH растворяли в 5 мл 0,01 М NaНСО3 с 2 мкл глутарового альдегида и перемешивали в течение ночи, после чего прибавляли 100 мкл глицинэтилового эфира (1М) до конченой концентрации 0,1 М и оставляли на 30 минут при комнатной температуре. Затем для осаждения прибавляли 4-5 объемов холодного ацетона и держали 30 минут при -70°С. Быстро нагревали до комнатной температуры и отделяли осадок путем центрифугирования при 10000 g в течение 10 минут. Полученный осадок растворяли в 1 мл 0,1 М NaHCO3 и хранили при -20°С.
Определение иммунного ответа на пептиды
В лунки планшета для микротитрования наносили тот или иной пептид по данному изобретению в количестве 5 мкг в объеме 100 мкл в карбонатном буферном растворе (рН 9,5). Через 20 часов при 20°С лунки промывали и инкубировали с серийными разведениями мышиной сыворотки в растворе PBS/0,5% BSA, Tween 20 (буферный раствор для связывания, ВВ). После промывания инкубировали со 100 мкл на лунку кроличьих антимышиных поликлональных антител IgG, конъюгированных с пероксидазой хрена (HRP), в растворе ВВ в течение 30 минут при 37°С. После промывания определяли титр мышиных антипептидных IgG с помощью цветной реакции с раствором тетраметилбензидина (ТМВ) в качестве субстрата пероксидазы (при 450 нм).
При разведении 1:100 интенсивность иммунного ответа была выше в случае SEQ ID 2-4 ММР-9 А1-3 и несколько меньше в случае SEQ ID 1, ММР-2 А21, как показано в приведенной ниже таблице 4.
Терапевтически эффективное количество олигопептида по настоящему изобретению может быть введено в организм млекопитающего многими различными способами, не ограничивающимися инъекциями. Различные способы введения хорошо известны в данной области техники, и некоторые из них описаны ниже.
Под «определенным видом животных», подлежащем воздействию заявленным здесь способом, подразумевается человек или иное животное, например мышь, сельскохозяйственные животные, приматы, позвоночные.
Под определенными заболеваниями, подлежащими лечению с использованием олигопептидов металлопротеиназ и/или соответствующих пептидомиметиков, подразумеваются неопластические заболевания, воспалительные заболевания, ишемическая болезнь сердца и другие поражения коронарных артерий, окклюзионные сердечно-сосудистые заболевания, дегенеративные заболевания и инфекционные заболевания. Некоторые примеры неопластических заболеваний включают (но не ограничиваются перечисленным здесь) рак, лимфому, лейкоз и опухоли мозга. Некоторые примеры воспалительных заболеваний включают (но не ограничиваются перечисленным здесь) артрит, астму, атеросклероз, болезнь Крона, колит, дерматит, красную волчанку и др. Некоторые примеры инфекционных заболеваний включают (но не ограничиваются перечисленным здесь) бактериальные, вирусные, грибковые, микоплазменные и другие инфекции, а также инфекции, часто возникающие при наличии некоторых генетических заболеваний. В настоящей заявке идентифицированы сигнальные олигопептиды в выбранной металлопротеиназе, опосредующие ключевую функцию этого белка в патологическом процессе, а именно в разрушении соединительной ткани, что является предпосылкой для миграции раковых клеток и образования метастазов. Эти олигопептиды были синтезированы, и у животных, которым их вводили, образовывались антитела. Такая вакцинация приводила к существенному уменьшению размеров опухолей. Степень эффективности демонстрируется уровнем титра антител, индуцируемых вакциной на основе олигопептидов металлопротеиназы, что доказывает высокую эффективность этих вакцин.
Для увеличения природной антигенности олигопептида обычно несколько изменяют его аминокислотную последовательность, например путем замены, делеции, вставки и проч. отдельных аминокислот. Олигопептиды SEQ ID 5-21 были идентифицированы и сконструированы таким образом, чтобы соответствовать по гидрофобности, гидрофильности и электрическому заряду аминокислотным последовательностям олигопептидов SEQ ID 1-3 (ММР). Они также содержат сигнальные и функциональные участки для узнавания антителами. Поскольку эти олигопептиды очень сходны с SEQ ID 1-3 (ММР), их можно использовать в качестве вакцины для сокращения опухолевого роста. В настоящей заявке эти последовательности предлагается использовать в разработке вакцины для лечения рака. Олигопептиды SEQ ID 5-21 могут усиливать терапевтическую эффективность при межвидовой иммунизации путем увеличения природной антигенности независимо от использования адъювантов.
В состав препаратов, пригодных для указанных путей введения в организм, включают помимо активного ингредиента один или более фармацевтически приемлемых носителей, после чего смесь подвергается обычным в данной области техники манипуляциям. Способы введения препарата в организм включают (но не ограничиваются перечисленным здесь) неинвазивное пероральное, местное (например, чрескожное), энтеральное введение, введение через слизистые, прицельную доставку, пролонгированное высвобождение, отсроченное высвобождение, прерывистое высвобождение, парентеральное введение. Для перорального введения могут быть использованы как жидкие, так и сухие формы препарата.
Препараты, пригодные для перорального введения, могут быть в форме капсул, крахмальных капсул, пилюль, таблеток, леденцов или пастилок для рассасывания (с использованием ароматизированной основы, обычно сахарозы и аравийской или трагакантовой камеди), порошков, гранул либо водных или неводньгх растворов или суспензий, либо прямых («масло в воде») или же обратных («вода в масле») эмульсий, в форме эликсиров или сиропов, или пастилок (с использованием инертной основы, например желатина, глицерина или сахарозы и аравийской камеди), причем каждая из этих форм содержит заранее определенное количество заявленной в настоящем документе композиции в качестве активного ингредиента. Заявленные здесь композиции могут вводиться в организм также в форме шариков, электуариев (кашек) или паст.
При изготовлении твердого лекарственного продукта для перорального применения олигопептиды металлопротеиназ и/или металлопротеиназные пептидомиметики смешивают с эксципиентом (и при необходимости с одним или несколькими дополнительными компонентами, например связующим агентом, дезинтегрирующим агентом, агентом, улучшающим скольжение, красителем, подсластителем, ароматизатором), после чего смесь подвергается обычным в данной области техники манипуляциям и в результате получают твердый лекарственный продукт для перорального применения, например таблетки, таблетки в оболочке, гранулы, порошок или капсулы. В качестве дополнительных компонентов берутся обычно используемые в данной области техники добавки. Примеры этих эксципиентов включают лактат, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу и кремниевую кислоту; примеры связующего агента включают воду, этиловый спирт, пропиловый спирт, сахарный сироп, раствор глюкозы, раствор крахмала, расплавленный желатин, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидрокиспропилкрахмал, метилцеллюлозу. этилцеллюлозу, шеллак, фосфат кальция и поливинилпирролидон; примеры дезинтегрирующего агента включают высушенный крахмал, аргинат натрия, порошок агара, однозамещенный карбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерилстеарат и лактозу; примеры агента, улучшающего скольжение, включают очищенный тальк, соли стеариновой кислоты, буру и полиэтиленгликоль; примеры подсластителей включают сахарозу, апельсиновую корку, лимонную кислоту и виннокаменную кислоту.
При получении жидкого лекарственного продукта для перорального применения олигипептиды металлопротеиназ и/или пептидомиметики металлопротеиназных последовательностей смешивают с такими дополнительными ингредиентами, как подсластители, забуферивающие агенты, стабилизирующие агенты или ароматизаторы, и полученную смесь обрабатывают обычно применяемыми в данной области техники методами; в результате получают предназначенный для перорального введения в организм жидкий лекарственный продукт, например раствор, сироп или эликсир. Примеры подсластителей включают ванилин; примеры забуферивающих агентов включают цитрат натрия; примеры стабилизирующих агентов включают трагакантовую камедь, аравийскую камедь и желатин.
Для чрескожного (например, местного) введения можно готовить разбавленные стерильные водные или частично водные растворы (обычно концентрацией около 0,1-5%) или же использовать препараты, сходные с описанными выше растворами для парентерального введения.
Препараты для ректального или интравагинального введения могут быть представлены суппозиториями, которые получают путем смешивания предлагаемой в настоящем документе композиции с одним или более пригодными не вызывающими раздражения носителями, включая, например, масло какао, полиэтиленгликоль и медицинский воск или салицилат; эти препараты при комнатной температуре твердые, а при температуре тела жидкие, то есть в полости тела они расплавляются, высвобождая заключенные в них вещества и композицию (композиции). Препараты для интравагинального введения также включают пессарии, тампоны, кремы, гели, пасты, пены или распыляемые составы, содержащие пригодные для таких препаратов носители, известные в данной области техники.
Компоненты препарата, предназначенные для обеспечения прицельной доставки, могут включаться в систему для пролонгированного высвобождения путем нанесения сразу высвобождающегося слоя поверх ядра с пролонгированным высвобождением; путем формирования оболочки или прессования или путем создания полифункциональной системы, например капсул, содержащих частицы как с пролонгированным, так и с немедленным высвобождением.
Термин «пролонгированное высвобождение» применительно к фармацевтической композиции или другому материалу, употребляется в известном в данной области технике смысле. Например, лечебная композиция, высвобождающая данное вещество на протяжении некоторого времени, может обладать свойствами пролонгированного высвобождения - в отличие от, например, болюсного (струйного внутривенного) введения, когда все введенное в организм количество активного вещества оказывается биологически доступным одновременно. Например, в некоторых конкретных воплощениях данного изобретения один или более фармацевтически приемлемых эксципиентов при контакте с жидкостями тела, включая кровь, спинномозговую жидкость, секреты слизистых, лимфу или т.п., могут постепенно или через некоторое время разрушаться (например, путем гидролиза) с выделением - постепенным или продолжительным (по сравнению с разовым высвобождением) - входивших в их состав компонентов, например терапевтически и/или биологически активных солей и/или композиций. Результатом такого высвобождения может быть увеличение времени доставки терапевтически эффективных количеств любого из описываемых в настоящем документе терапевтических агентов.
В настоящее время в области систем доставки лечебных агентов в организм усилия сосредоточены на разработке прицельной доставки, при которой лекарственное вещество проявляет свою активность только в области желаемой мишени (например, в опухолевой ткани), и препаратов с пролонгированным высвобождением активных ингредиентов, из которых лекарственное вещество высвобождается контролируемым образом на протяжении некоторого времени. К числу систем пролонгированного высвобождения относятся липосомы, биоразлагаемые микросферы, нагруженные лекарственным веществом, и конъюгаты полимеров с лекарственными веществами.
Препараты с задержанным высвобождением лекарственного вещества получают путем покрывания твердой лекарственной формы пленкой полимера, нерастворимой в кислой среде содержимого желудка, но растворяющейся в нейтральной среде содержимого тонкого кишечника. Препараты с задержанным высвобождением могут быть получены, например, путем покрывания лекарственного вещества или содержащей лекарственное вещество композиции оболочкой из выбранного материала. Композиция, содержащая лекарственное вещество, может быть в форме таблетки, предназначенной для заключения в капсулу, в форме таблетки, служащей ядром формы с оболочкой, или в форме множества шариков, частиц или гранул, предназначенных для заключения в капсулу или включения в состав таблетки. Предпочтительные материалы для оболочки включают биологически разрушаемые, постепенно гидролизуемые, постепенно растворяющиеся в воде и/или ферментативно расщепляемые полимеры; ими могут служить обычно используемые растворимые в кишечнике полимеры. Как известно специалистам в данной области техники, полимеры, растворимые в кишечнике, становятся растворимыми при более высоких значениях рН среды, свойственных содержимому нижних отделов желудочно-кишечного тракта, или медленно разрушаются по мере продвижения лекарственной формы по желудочно-кишечному тракту; ферментативно расщепляемые полимеры разрушаются ферментами бактерий, присутствующих в нижних отделах желудочно-кишечного тракта, в частности в толстой кишке. Или же таблетки с задержанным высвобождением могут быть получены путем распределения лекарственного вещества в матриксе из подходящего материала, например в гидрофильном полимере или жировом веществе. Пригодные для этой цели гидрофильные полимеры включают (но не ограничиваются перечисленным здесь) полимеры и сополимеры целлюлозы, эфиры целлюлозы, акриловую кислоту, метакриловую кислоту, метилакрилат, этилакрилат и винил или ферментативно расщепляемые полимеры и сополимеры, описанные выше. Эти гидрофильные полимеры особенно ценны для создания матрикса для задержанного высвобождения. Жировые вещества, которые могут служить матриксом, обеспечивающим задержанное/замедленное высвобождение лекарственного агента, включают (но не ограничиваются перечисленным здесь) воска (например, карнаубский воск) и глицерилтристеарат. После того как активный ингредиент смешан с матриксным материалом, из этой смеси можно путем прессования изготовить таблетки.
Системы прерывистого высвобождения лекарственного вещества обеспечивают многократное поступление лечебного агента без его повторного введения в организм; обычно они позволяют по меньшей мере вдвое снизить частоту приема по сравнению с обычными лекарственными формами (например, раствором или твердой формой с немедленным высвобождением активного ингредиента). Прерывистое высвобождение характеризуется наличием вначале периода, когда активное вещество не высвобождается или высвобождается незначительно, после чего следует период быстрого высвобождения.
Словосочетания «парентеральное введение» и «вводят парентерально» в настоящем документе употребляются в отношении способов введения помимо пищеварительного тракта и местного применения; парентеральное введение достигается, например, путем инъекций, включая (но не ограничиваясь перечисленным здесь) внутривенное, внутримышечное, интраплевральное, внутрисосудистое, интраперикардиальное, интраартериальное, внутриоболочечное, интракапсулярное, внутриглазничное, внутрисердечное, интрадермальное, внутрибрюшинное, транстрахеальное, подкожное, субкутикулярное, внутрисуставное, субкапсулярное, субарахноидальное, интраспинальное и внутригрудинное введение путем инъекций и инфузий.
Некоторые из описываемых в настоящем документе фармацевтических композиций, подходящих для парентерального введения, содержат одну или более предлагаемых данным изобретением композиций в сочетании с одним или более фармацевтически приемлемым стерильным изотоническим водным или неводным раствором, дисперсией, суспензией или эмульсией или стерильным порошком, которые могут быть непосредственно перед применением разведены в стерильных растворах или дисперсиях для инъекций, содержащих антиоксиданты, забуферивающие агенты, вещества с бактериостатическим действием, растворимые вещества для обеспечения изотоничности относительно крови предполагаемого пациента или суспендирующие агенты или загустители.
При изготовлении продукта для инъекций олигопептид металлопротеиназы и/или соответствующий пепидомиметик смешивают с дополнительными ингредиентами, как, например, вещества, регулирующие pH, забуферивающие агенты, стабилизирующие агенты, вещества, обеспечивающие нужное осмотическое давление, или анестезирующие вещества местного действия; полученную смесь обрабатывают обычными в данной области техники методами, в результате получая препарат для подкожных, внутримышечных или внутривенных инъекций. Примеры веществ, регулирующих pH, и забуферивающих агентов включают лимоннокислый натрий, уксуснокислый натрий и фосфат натрия; примеры стабилизирующих агентов включают пиросульфит натрия, этилендиаминтетраацетат, тиогликолевую кислоту и тиомолочную кислоту; примеры анестезирующих агентов местного действия включают прокаина гидрохлорид и лидокаина гидрохлорид; примеры веществ, обеспечивающих нужное осмотическое давление, включают хлористый натрий и глюкозу.
Для усиления иммунного ответа используются адъюванты. Существуют различные типы адъювантов. В настоящей работе в качестве адъювантов используются гаптены. При получении иммуногенсодержащих прямых («вода в масле») эмульсий можно использовать адъювант Фрейнда и его варианты. Антигены в составе прямых («вода в масле») эмульсий вызывают интенсивный и длительный антительный ответ, что можно связать с медленным высвобождением антигена. Обычно антигены (предпочтительно в солевом растворе) смешивают с равным объемом адъюванта, получая эмульсию.
Выражение «фармацевтически приемлемый» общепринято в данной области техники. В некоторых воплощениях настоящего изобретения этот термин подразумевает композиции, полимеры и другие материалы и/или лекарственные формы, которые удовлетворяют медицинским требованиям, пригодны для применения в контакте с тканями организма млекопитающих, включая человека, не обладают чрезмерной токсичностью, не вызывают раздражения, аллергических реакций или других расстройств и осложнений, отвечают разумному соотношению риск/польза.
Выражение «фармацевтически приемлемый носитель» общепринято в данной области техники и включает, например, фармацевтически приемлемые материалы, композиции или средства доставки, например жидкие или твердые наполнители, разбавители, растворители или материалы для изготовления капсул или оболочек, участвующие в переносе или транспортировке любой композиции по данному изобретению от одного органа или части тела к другому органу или части тела. Всякий носитель должен быть приемлемым в том смысле, что он должен быть совместим с другими ингредиентами композиции по данному изобретению и не должен причинять вред организму пациента. В некоторых воплощениях настоящего изобретения фармацевтически приемлемый носитель является апирогенным. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают: (1) сахара, например лактозу, глюкозу и сахарозу; (2) крахмал, например кукурузный и картофельный; (3) целлюлозу и ее производные, например натриевую соль карбоксиметилцеллюлозы, этилцеллюлозу и ацетат целлюлозы; (4) порошок трагакантовой камеды; (5) солод; (6) желатин; (7) тальк; (8) масло какао и медицинский воск; (9) масла, например арахисовое, хлопковое, подсолнечное, кунжутное, оливковое, кукурузное и соевое; (10) гликоли, например пропиленгликоль; (11) многоатомные спирты, например глицерин, сорбит, маннит и полиэтиленгликоль; (12) эфиры, например этиловый эфир олеиновой кислоты и этиловый эфир лауриловой кислоты; (13) агар; (14) забуферивающие агенты, например гидроокись магния и гидроокись алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатсодержащие буферные растворы; (21) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях.
В некоторых воплощениях данного изобретения описанные в настоящем документе фармацевтические композиции составлены таким образом, что указанные композиции можно вводить млекопитающим в терапевтически эффективном количестве для профилактики, превентивного лечения и терапии.
В некоторых воплощениях данного изобретения дозировка олигопептидных композиций, которые можно назвать предлагаемыми по данному изобретению терапевтическими композициями, определяется в зависимости от концентрации указанной терапевтической композиции или иного материала, заключенного в капсулы или оболочку, в плазме крови. Например, можно определять иммунный ответ на соответствующие олигопептиды в образцах крови.
Терапевтические композиции, предлагаемые в данной заявке, могут вводиться нуждающемуся в том индивиду различными путями, обычно используемыми для введения в организм лекарственных препаратов, включая местное применение, пероральное и парентеральное введение, например внутривенное, подкожное или интрамедуллярное введение. Также терапевтические композиции по данному изобретению могут быть введены интраназально, ректально (суппозитории) или в форме быстрорастворимого препарата, т.е. продукта, помещаемого в ротовую полость, где он растворяется без запивания водой. Кроме того, терапевтические композиции по данному изобретению могут быть введены нуждающемуся в таком лечении индивиду в форме с контролируемым высвобождением активного ингредиента, с помощью систем прицельной мишень-специфичной доставки, систем чрескожной доставки, пластырных форм (с активным либо пассивным высвобождением активного вещества), путем стереотаксической инъекции или же в виде наночастиц.
При должной концентрации активного ингредиента в терапевтических композициях по данному изобретению они могут применяться местно для обработки кожи, носовой полости, глотки и гортани, бронхов, влагалища, прямой кишки и глаз.
Для применения в аэрозольной форме активные ингредиенты по данному изобретению могут быть помещены в находящуюся под давлением аэрозольную емкость вместе с газообразным иди жидким пропеллентом, например дихлордифторметаном, диоксидом углерода, азотом, пропаном и т.п. веществами, а также обычно используемыми в таких системах вспомогательными компонентами, например совместными растворителями и увлажняющими агентами, если это необходимо или желательно.
Наиболее часто используемые пути введения также включают предпочтительное введение через слизистые носовой полости, ротовой полости (буккально и подъязычно), влагалища, глаза и прямой кишки и вдыхание.
В некоторых воплощениях данного изобретения предлагаемые в настоящей заявке композиции могут быть лиофилизованы или высушены иным подходящим способом, например распылением. Композиции по данному изобретению могут вводиться однократно или в несколько приемов в меньшей дозе через различные промежутки времени, отчасти в зависимости от скорости высвобождения указанных композиций и желаемой дозировки.
Препараты, которые можно использовать в предлагаемых здесь способах, включают такие, которые пригодны для перорального, местного (включая буккальное и подъязычное), ректального, влагалищного и/или парентерального введения, а также введения путем вдыхания. Эти препараты, обычно представленные единичными лекарственными формами, могут быть получены любыми способами, известными в области изготовления лекарственных препаратов. Количество композиции по данному изобретению, объединяемое с носителем, в единичной дозе может варьировать в зависимости от индивидуальных особенностей пациента и способа введения препарата в его организм.
Приводимое в настоящем документе терапевтически приемлемое количество препарата может вводиться в организм пациента в форме для ингаляции или в аэрозольной форме. Средства для ингаляции или аэрозольные препараты могут содержать один или более таких агентов, как адъюванты, диагностические агенты, визуализирующие агенты или терапевтические агенты, используемые при лечении путем вдыхания лекарства. В конечной форме аэрозольный препарат может, например, содержать лекарственное вещество в количестве 0,005-90% (масса/масса), например 0,005-50%, 0,005-5% или 0,01-1,0% от общей массы препарата.
Примеры водных и неводных носителей, пригодных для использования в фармацевтических композициях по данному изобретению, включают воду, этиловый спирт, многоатомные спирты (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их смеси, растительные масла (например, оливковое масло) и приемлемые для инъекций органические эфиры, например этиловый эфир олеиновой кислоты. Должная текучесть препарата обеспечивается, например, использованием поверхностно-активных агентов, образующих покров, например лецитина, а также в случае дисперсий определенным размером частиц.
Терапевтически приемлемая дозировка композиций по данному изобретению может достигаться в комбинации их с другими препаратами или в форме комбинированного препарата.
На фигуре 2 образующиеся антитела (246) определяют путем твердофазного иммуноферментного анализа (ELISA). Мышам вводили (228) путем инъекции раковые клетки (ПО). Наблюдалось блокирование металлопротеиназы (230) антилом (246). В результате подавления разрушения межклеточного матрикса (232) он оставался интактным (234), что демонстрировалось экспериментами in vivo и in vitro, как описано ниже и выше.
Линии и культуры раковых клеток
Раковые клетки шейки матки человека (HeLa) и меланомные клетки мыши B16FO из Американской коллекции типовых культур (АТСС, Роквилл, шт. Мэриленд, США) культивировали в модифицированной по Дульбекко среде Игла, содержащей 10% эмбриональной сыворотки крупного рогатого скота и антибиотики. Среды и сыворотки получали в АТСС, антибиотики (пенициллин и стрептомицин) - в компании Gibco BRL (Лонг-Айленд, шт. Нью-Йорк, США).
Изучение инвазии клеток
Для изучения инвазии клеток использовали 24-луночный планшет с матригелем (Becton Dickinson). Раковые клетки шейки матки человека HeLa, суспендированные в среде, содержащей антисыворотку от подопытных иммунизированных мышей в разведении 1:100, высевали в лунки с матригелем. Каждая лунка содержала среду с активными фибробластами кожи для хемотаксиса. Заполненные таким образом планшеты помещали в инкубатор (5% СО2, 95% воздух) на 24 часа. После инкубации из лунок удаляли среду. С поверхности матригеля осторожно собирали клетки с помощью ватного тампона. Клетки, которые проникли через матригель, окрашивали гематоксилином и эозином (Н&Е) и подсчитывали их количество визуально под микроскопом.
Подавление инвазии сравнивали с контролем. Фигуры 3A-3D демонстрируют эффект различных олигопептидов матриксных металлопротеиназ. По сравнению с клетками после обработки ММР-9 А1-3 и ММР-2 А4 многие клетки проникают через матригель. Например, по сравнению с клетками 1004А-1005А после обработки ММР-9 А1 клеток 1001 А-1003А больше. Сходные результат получены для ММР-9 2-3 и ММР-2 А4 (см. последующие рисунки).
Описанные выше эксперименты in vivo дали интересные результаты в отношении массы тела мышей, массы опухолей, опухолевой нагрузки и эффективности различных олигопептидов, применявшихся в терапевтически эффективном количестве для подавления разрушения межклеточного матрикса.
У мышей, получавших олигопептиды, на 45-е сутки брали кровь из ретроорбитального венозного сплетения. Образцы крови помещали в 2-миллилитровые центрифужные пробирки. После определения иммунного ответа на отдельные пептиды, животным каждой группы вводили подкожно 0,5×106 клеток в 0,2 мл PBS. После инъекции их сажали обратно в клетки и давали обычный корм для мышей (Purina). Через 21 неделю животных умерщвляли и извлекали у них опухоли. Определяли линейные размеры (длину и ширину) опухолей с помощью штангенциркуля с цифровой индикацией и рассчитывали опухолевую нагрузку по формуле: 0,5× длина × ширина.
Масса тела у подопытных животных до обработки и после обработки существенно не различалась (см. фиг. 4). А вот на массу опухолей иммунизация олигопептидами матриксных металлопротеиназ заметно влияла, как демонстрирует фиг. 5. Объем опухолей тоже значительно уменьшался по сравнению с контролем (см. фиг. 6), что также доказывает эффективность предлагаемого способа лечения. На фиг. 7А-Е представлены фотографии некоторых опухолей, вырезанных у контрольных и иммунизированных мышей. В случае одного из пептидов ММР-9 A3 одна из опухолей совершенно исчезла. На фиг. 8 показана пространственная структура молекулы металлопротеиназы и тех ее участков, которые соответствуют ММР-9 А1, ММР-9 А2 и ММР-9 A3. На основании этих структур могут быть сконструированы соответствующие пептидомиметики для подавления экспрессии ММР и предотвращения метастазирования.
Кроме того, следует отметить, что различные последовательности, процедуры иммунизации и способы лечения, описанные в настоящем документе, могут быть осуществлены с использованием средств для создания различных комбинаций дозировки лечебного агента и способов его доставки для лечения конкретного заболевания. Соответственно, настоящее описание и фигуры должны рассматриваться как иллюстративные и не ограничивающие объем изобретения.