ЛИПОСОМАЛЬНЫЕ ПРЕПАРАТЫ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет предварительных заявок на патенты US 61/691455, 61/791693 и 61/862300, поданных 21 августа 2012; 15 марта 2013 и 5 августа 2013 соответственно, где все эти документы полностью включены в данное изобретение посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ Настоящее изобретение относится к фармацевтическим препаратам, содержащим офтальмологическое лекарственное средство, в характерном случае применяемое путем интравитреальной инъекции в глаз, и липосомальное средство доставки, дающее возможность местного введения в глаз данного интравитреального лекарственного средства. Настоящее изобретение также относится к антиангиогенному соединению, такому как моноклональное антитело или его фрагмент, выбранное из, например, ранибизумаба, представляющего собой связывающий агент фактора роста эндотелия сосудов (VEGF; от англ. "vascular endothelial growth factor"), ингибирующий действие VEGF, и/или ингибитора мультикиназы, представляющей собой рецептор фактора роста эндотелия сосудов (VEGFR; от англ. "vascular endothelial growth factor receptor") и рецептор тромбоцитарного фактора роста (PDGFR; от англ. "platelet-derived growth factor receptor"), например, сунитиниба, и к средству доставки, выбранному из фармацевтически приемлемой липосомы. Эти препараты полезны при лечении различных ангиогенных расстройств и заболеваний у животных и людей, и предпочтительно при глазных расстройствах, выбранных из возрастной макулярной дегенерации, диабетического отека макулы и неоваскуляризации роговицы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Для лечения глазных заболеваний в характерном случае требуется либо местное введение, либо интравитреальная инъекция конкретного лекарственного средства в глаз в зависимости от конкретного заболевания или состояния и от эффективности пути введения по отношению к конкретному лекарственному средству и заболеванию. При определенных заболеваниях или состояниях глаза эффективное лечение может быть достигнуто только в том случае, когда лекарственное средство вводят путем интравитреальной инъекции. Существует длинный перечень заболеваний и состояний глаза, которые эффективно лечат путем интравитреальной инъекции. В то же время, эти инъекции могут вызвать серьезные побочные эффекты и/или сопровождаться этими эффектами, включающими глазные инфекции (эндофтальмит), воспаление глаза, отслоения сетчатки и повышения внутриглазного давления. В связи с этими эффектами или их рисками местное лечение глаза стало как предпочтительным путем введения лекарственных средств для лечения глазных состояний, так и недостижимой задачей, поскольку почти во всех случаях местное введение лекарственного средства не лечит эффективно определенные глазные состояния, в частности, те состояния, которые возникают в задней части глаза. Следовательно, существует необходимость в разработке препаратов, которые эффективно лечат эти состояния, и которые устраняют необходимость в интравитреальных инъекциях. Авторы настоящего изобретения считают, что они обнаружили такой носитель. В патенте US №6884879 раскрыты различные антитела против фактора роста эндотелия сосудов (VEGF; от англ. "vascular endothelial growth factor"). В этом патенте конкретно раскрыто и заявлено моноклональное антитело ранибизумаб, одобренное и имеющееся в продаже под торговой маркой Луцентис®. Антитела, раскрытые в этом патенте, описаны как обладающие способностью к предупреждению, обратному развитию и/или ослаблению симптомов различных заболеваний, а также описаны как обладающие способностью к ингибированию VEGF-индуцированной пролиферации эндотелиальных клеток и способностью к ингибированию VEGF-индуцированного ангиогенеза. Луцентис® одобрен для лечения неоваскулярной (влажной) возрастной макулярной дегенерации (ВМД) при дозировке 0,5 мг (0,05 мл) путем интравитреальной инъекции один раз в месяц, и, хотя это менее эффективно, это одобренное терапевтическое средство можно вводить путем инъекции каждые три месяца после первоначальной схемы один раз в месяц в течение по меньшей мере четырех месяцев. Луцентис® также одобрен в США для лечения отека макулы после окклюзии вены сетчатки (ОВС) с применением 0,5 мг (0,05 мл) при интравитреальной схеме один раз в месяц. Кроме того, Луцентис® одобрен в Европе и в США для лечения диабетического отека макулы в инъекционном препарате.
Сунитиниб (SU-11248, Сутент) одобрен в январе 2006 Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA; от англ. "Food and Drug Administration") в качестве монотерапии для лечения метастатического почечно-клеточного рака и желудочно-кишечных стромальных опухолей. Сунитиниб ингибирует по меньшей мере восемь рецепторных протеинтирозинкиназ, включая рецепторы фактора роста эндотелия сосудов 1-3 (VEGFR1-VEGFR3), рецепторы тромбоцитарного фактора роста (PDGFR; от англ. "platelet-derived growth factor receptor" α и PDGFRβ). Данное соединение ингибирует ангиогенез путем уменьшения передачи сигнала через VEGFR1, VEGFR2, и PDGFRβ. PDGFRβ обнаружен в перицитах, окружающих капиллярные эндотелиальные клетки1 (Roskoski, 2007, документ PDF прилагается). Имеются данные, что комбинированное применение антитела против PDGF обладает преимуществом перед монотерапией ранибизумабом при лечении некоторых заболеваний, обусловленных VEGF.
С интравитреальной инъекцией антител против VEGF и других глазных лекарственных средств связано множество побочных эффектов или потенциальных побочных эффектов, включающих дискомфорт для пациента. Для процедуры интравитреальной инъекции необходимо специализированное стерильное помещение с соблюдением обычных правил асептики; должны быть немедленно доступна реанимационная аппаратура. Осложнения этой процедуры включают инфекционный эндофтальмит; отслоение сетчатки и травматическую катаракту. Другие возможные осложнения интравитреальной инъекции включают изменения внутриглазного давления, в частности, повышения внутриглазного давления. Повышения внутриглазного давления, обусловленные инъекцией, которые могут встречаться сразу после инъекции любого вида лекарственного средства, и изменения внутриглазного давления, обусловленные конкретным лекарственным средством, которые могут быть обнаружены через сутки или даже месяцы после инъекции. См. Semin. Ophthamol. 2009 Mar-Apr; 24(2): 100-5.
В медицине существует крайне неотложная потребность в новых схемах местной терапии такими антителами против VEGF и другими эффективными глазными лекарственными средствами, как антибактериальные средства, противовирусные средства, кортикостероиды и средства против фактора роста эндотелия сосудов, которые являются основными классами лекарственных средств, вводимых путем интравитреальных инъекций. Настоящее изобретение включает комбинацию липосом и любого из указанных лекарственных средств в пределах данных классов лекарственных средств в местном препарате. Хотя в патенте US №6884879 в общем раскрыты различные возможные способы или реагенты для доставки, включающие липосомы, и различные пути введения, включающие местное введение таких моноклональных антител к VEGF, где единственной одобренной формой ранибизумаба является интравитреальная форма в жидком препарате, существует необходимость в местных препаратах ранибизумаба, эффективных при лечении людей, страдающих расстройствами, обусловленными VEGF, включая глазные расстройства.
Авторы изобретения столкнулись с данной неотложной потребностью и неожиданно обнаружили, что определенные липосомальные препараты, содержащие такие моноклональные антитела к VEGF и определенные липосомы, обеспечивают эффективное облегчение у пациентов, страдающих диабетическим отеком макулы. Эти препараты можно эффективно вводить местным путем в пораженный глаз, и это введение более эффективно, чем местное введение интравитреального препарата. В патенте US №6958160 раскрыты и заявлены самоформирующиеся, термодинамически стабильные липосомы. В публикации патента US №2010/0076209, включенной в настоящее изобретение посредством ссылки, раскрыты полиэтиленгликоль (ПЭГ)-липидные конъюгаты для липосом и доставки лекарственных средств. Различные препараты на основе липидов, включающие такие самоформирующиеся термодинамически стабильные липосомы, имеющиеся в продаже под торговой маркой Qsomes™ (далее в данном описании Qsome), продаются Biozone Laboratories для многочисленных терапевтических применений посредством различных путей введения, включающих местное введение на кожу. Авторы изобретения обнаружили, что фармацевтическая композиция, содержащая ранибизумаб и такие самоформирующиеся термодинамически стабильные липосомы и/или ПЭГ-липидные конъюгаты могут быть доставлены местным путем в глаз пациента, нуждающегося в лечении обусловленных VEGF глазных заболеваний и состояний. Настоящее изобретение дополнительно включает местный препарат, содержащий Qsome, как описано в данном изобретении (самоформирующуюся термодинамически стабильную липосому) и лекарственное средство, где данный препарат подходит для лечения глазного заболевания заднего сегмента глаза и/или заболевания, представляющего собой заболевание переднего сегмента/заднего сегмента глаза. Заявленные препараты подходят для местного введения и особенно полезны при лечении глазных заболеваний и состояний, которые в характерном случае лечат периокулярным путем или посредством интравитреального введения (внутриглазной доставки). Периокулярное введение включает субконъюнктивальное, субтеноновое, ретробульбарное и перибульбарное введение. Существует несколько лекарственных средств, раскрытых как обладающие способностью к доставке в задний сегмент путем местного введения, и включающих следующие лекарственные средства: ESBA105, одноцепочечное антитело против фактора некроза опухоли альфа (TNF; от англ. "tumor necrosis factor"); дексаметазон; непафенак; мемантин HCl; дорзоламин; бримонидин и бетаксолол. Считают, что местное введение этих лекарственные средств в препарате Qsome приведет в результате к более эффективной местной доставке путем эффективной доставки в задний сегмент. Тем не менее, предпочтительно заявленное изобретение включает местный препарат, включающий липосому Qsome, как раскрыто в данном изобретении, и лекарственные средства, которые до сих пор не доставляли эффективно посредством местного введения.
Лекарственные средства, в характерном случае вводимые путем интравитреальной инъекции, включают антибактериальные средства, противовирусные средства, кортикостероиды и средства против фактора роста эндотелия сосудов. Настоящее изобретение включает липосомальный препарат, содержащий самоформирующуюся термодинамически стабильную липосому и активный фармацевтический агент, выбранный из любого или из комбинации антибактериальных средств, противовирусных средств, кортикостероидов и средств против фактора роста эндотелия сосудов, где данный препарат подходит для местной доставки в глаз пациента для лечения глазного заболевания или состояния. Диклофенак, гатифлоксацин, спарфлоксацин лактат, GCV, демеклоциклин, флубипрофен, доксорубицин, целекоксиб, будесонид и цисплатин включают в коллоидные дозируемые формы для транскорнеальной или транссклеральной доставки. Катионные липосомы, содержащие пенициллин G, тропикамид и ацетазоламид, применены для обеспечения максимального транспорта лекарственного средства через роговицу относительно анионных и нейтральных липосом. См. статьи: Schaeffer et al. Liposomes in topical drug deliver. Invest. Ophthalmol. Vis Sci. 1982: 22(2): 220-7; Nagarsenker et al. Preparation and evaluation of liposomal formulations of tropicamide for ocular delivery. Int J Pharma. 1999: 190(1): 63-71 и Hathout et al. Liposome as an ocular delivery system for acetazolamide: in vitro and in vivo studies. AAPS PharmaSciTech. 2007; 8(1): 1.
Диабетическая ретинопатия (ДР) является наиболее распространенным микрососудистым осложнением диабета2 (Fong, 2004) и является ведущей причиной новых случаев потери зрения среди взрослого населения трудоспособного возраста. Диабетический отек макулы (ДОМ) является наиболее распространенной причиной потери зрения у пациентов, страдающих ДР. Распространенность ДОМ составляет 3% последних диагнозов при примерно 75000 новых случаев ДОМ ежегодно (США). Число пациентов во всем мире, страдающих диабетом, колеблется вокруг 285 млн. ДОМ является результатом серии биохимических и клеточных изменений, которые, в конечном счете, вызывают прогрессирующее истечение и экссудацию, что приводит к утолщению сетчатки и плотным экссудатам в пределах 1 диаметра диска центра макулы. ДОМ является одной из наиболее распространенных причин ухудшения зрения у пациентов с диабетом3 (Bhagat, 2009). Приблизительно 50% пациентов испытывает потерю не менее 2 линий наилучшей корригированной остроты зрения (BCVA; от англ. "Best corrected visual acuity") после двух лет наблюдения4 (Meyer, 2007).
При ДОМ поврежденные кровеносные сосуды пропускают жидкость в центральную часть сетчатки (макулу), что приводит к набуханию. Макула вовлечена в остроту центрального зрения. Фовеа (ямка) находится в центре макулы. ДОМ может встречаться у пациентов, имеющих диабет типа 1 или типа 2. Приблизительно 26 млн. человек в США страдает диабетом, и 1,9 млн. новых случаев диагностируют у людей в возрасте 20 лет и старше ежегодно. По оценкам ежегодно развивается вплоть до 75000 новых случаев ДОМ. ДОМ является ведущей причиной слепоты среди населения трудоспособного возраста в большинстве развитых стран. Терапией первой линии при ДОМ является лазерная операция, которая запаивает протекающие кровеносные сосуды, уменьшая вытекание жидкости и снижая количество жидкости в сетчатке. Таким образом, существует значительная потребность в создании новых препаратов, обеспечивающих терапевтическое облегчение у этих пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой фармацевтический препарат, содержащий антиангиогенное соединение или другой глазной активный ингредиент и липосому. Предпочтительными антиангиогенными соединениями являются антитела против VEGF. Этот фармацевтический препарат предпочтительно вводят в виде местного препарата в глаз пациента, нуждающегося в лечении. Этот фармацевтический препарат полезен при лечении глазных расстройств, обусловленных VEGF, включающих, например, возрастную макулярную дегенерацию и диабетический отек макулы. Настоящее изобретение также направлено на препараты, подходящие для местного введения, и препараты, эффективные при лечении заболевания, обусловленного неоваскуляризацией роговицы.
Предпочтительное антитело против VEGF выбрано из ранибизумаба (Луцентис®) и может быть получено, как раскрыто в патенте US №6884879, включенном в данное описание посредством ссылки. Данный препарат имеется в продаже как утвержденный интравитреальный жидкий препарат. Ранибизумаб представляет собой фрагмент рекомбинантного гуманизированного моноклонального антитела IgG1 каппа-изотипа. Данное антитело связывается с VEGF-A и ингибирует его, и имеет молекулярную массу приблизительно 48 килодальтон. Это препарат продуцируют в экспрессионной системе Е.coli в питательной среде, содержащей тетрациклин. Утвержденный препарат поставляют в стеклянном флаконе однократного применения, содержащем 0,05 мл 10 мг/мл ранибизумаба. Другие антитела против VEGF, такие как бевацизумаб, можно также применять для лечения определенных заболеваний и состояний, таких как заболевание, обусловленное неоваскуляризацией роговицы. Местный липосомальный препарат, раскрытый в данном изобретении, способствует проникновению полноразмерных антител, таких как бевацизумаб, в глаза, имеющие аномальные новообразованные сосуды.
Липосомы, полезные в настоящем изобретении, предпочтительно включают липосомы, раскрытые в патенте US №6958160, полностью включенном в данное описание посредством ссылки. Как раскрыто в этом патенте, липосомы представляют собой самозамкнутые коллоидные частицы, мембраны которых состоят из одного или более липидных бислоев, заключающих фракцию водного раствора, в котором они суспендированы. Как также изложено в патенте '160, не все липосомы являются одинаковыми, и действительно липосомы могут иметь проблемы, включающие коллоидную нестабильность, и проблемы их получения, связанные с экстремальными условиями, такими как повышенные давления и температуры, а также условия высокого сдвига, где все эти условия могут разрушать компоненты липосомы. Другие проблемы, связанные с липосомами в целом, могут включать гетерогенные распределения размеров и количеств бислоев, что может вызывать или обострять проблемы масштабирования. Кроме того, условия стерилизации также могут создавать проблемы для липосом. Липосомы могут также обладать коллоидной нестабильностью вследствие агрегации при нахождении в суспензии. Это приводит к проблемам слияния, и решение данной проблемы в характерном случае состоит в лиофилизации, являющейся дорогостоящей дополнительной стадией. Липосомы, раскрытые в патенте '160, позволили преодолеть эти проблемы, и неожиданно обнаружено, что эти конкретные липосомы эффективны при объединении с антителами против VEGF, такими как ранибизумаб.
В частности, препарат, содержащий самоформирующиеся термодинамически стабильные липосомы и антитело против VEGF, особенно подходит для местного введения при лечении глазных заболеваний и состояний, обусловленных VEGF.
Липосомы, полезные в настоящем препарате, содержат соединения диацилглицерин-ПЭГ. Температура плавления этих соединений ниже приблизительно 40°С, и длина ацильных цепей является большей или равной 14 атомам углерода. Эти соединения получают, как изложено в патенте '160. Предпочтительным жидким конъюгатом ПЭГ является полиэтиленгликоль 12-глицериндимиристат (PEG-12-GDM; от англ. "Polyethylene glycol 12-Glycerol Dimyristate"). ПЭГ стабилизирует липосомы за счет создания стерического барьера на наружной поверхности липосом, где цепь ПЭГ имеет молекулярную массу, составляющую приблизительно от 300 Дальтон до 5000 Дальтон. Получение липосомы ограничено исключительно смешиванием липида с водным раствором. Эти виды липосом существуют в состоянии самой низкой энергии, в котором может существовать липид, находясь в водном растворе, и воспроизводимость этого липосомального препарата не составляет проблем.
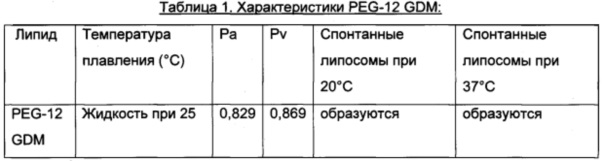
Определенный липид, смесь липидов или смесь липид/соединение образует подобные липосомы каждый раз при смешивании с одним и тем же водным раствором. Выше критических концентраций (около 20% масс/об) в водном растворе начнут образовываться нелипосомальные структуры. Эти липосомы существуют в их состоянии самой низкой энергии и представляют собой термодинамически стабильные, самоформирующиеся липосомы. PEG-12 GDM образует очень мелкие везикулы, так что их можно стерильно фильтровать. Кинетическая энергия, такая как встряхивание или перемешивание на вортексе, может быть применена к липидному раствору и к водному раствору. В настоящем препарате можно также использовать другие конъюгаты липид-ПЭГ, как в общем или конкретно раскрыто в патенте 6958160. Кроме того, можно также использовать другие самоформирующиеся, термодинамически стабильные конъюгаты липид-ПЭГ, включающие соединения, раскрытые в публикации патента US №2010/0076209. В таблице 1 ниже описаны некоторые характеристики PEG-12 GDM.
Молекулярная масса: 1068 г/моль
Оптимум рН: 5-7
Растворимость: Растворяется в органических растворителях
В местном препарате ранибизумаба по настоящему изобретению использовали 1% масс./об. PEG-12 GDM на основе конечного объема раствора, и этот препарат имел рН местного раствора 5,5, находящийся в подходящем диапазоне для работы с липосомой.
В дополнение к антиангиогенному соединению (например, антителу против VEGF) и термодинамически стабильной самоформирующейся липосоме этот препарат может дополнительно содержать дополнительные фармацевтически приемлемые эксципиенты. Предпочтительные эксципиенты выбраны из группы, состоящей из эксципиентов, подходящих для местного введения в глаз. Эти эксципиенты включают поверхностно-активные вещества, буферные реагенты, модификаторы рН, соли и другие такие ингредиенты.
Эти препараты полезны при лечении заболеваний и состояний, обусловленных VEGF, и/или других ангиогенных состояний. Настоящее изобретение, таким образом, включает применение таких препаратов для лечения возрастной макулярной дегенерации, диабетических заболеваний сетчатки, включающих диабетический отек макулы и неоваскуляризацию роговицы. В предпочтительном воплощении изобретения изобретение включает местный препарат и охватывает способ лечения таких заболеваний и состояний, обусловленных VEGF, путем местного введения таких препаратов в глаз пациента, нуждающегося в его лечении.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
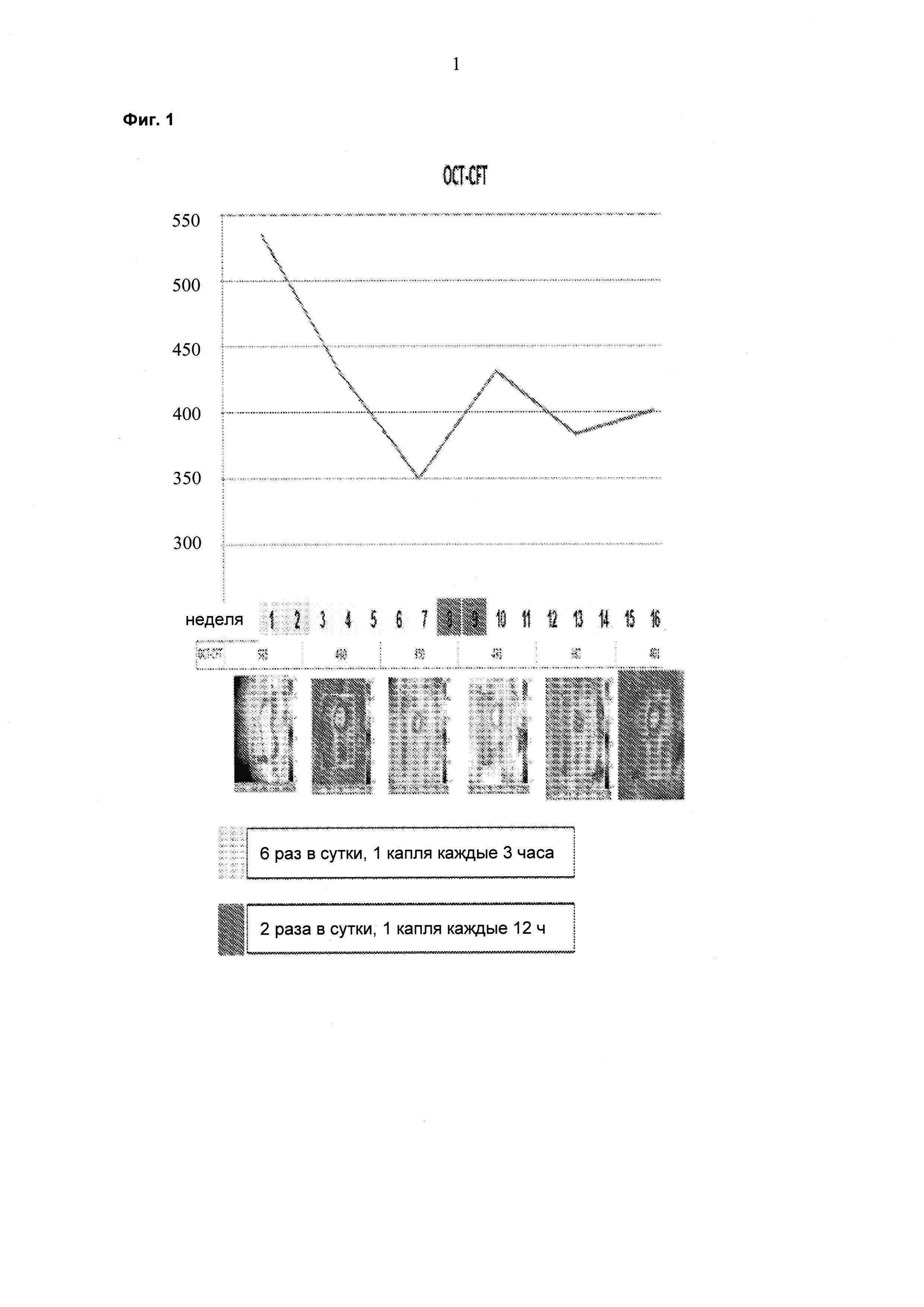
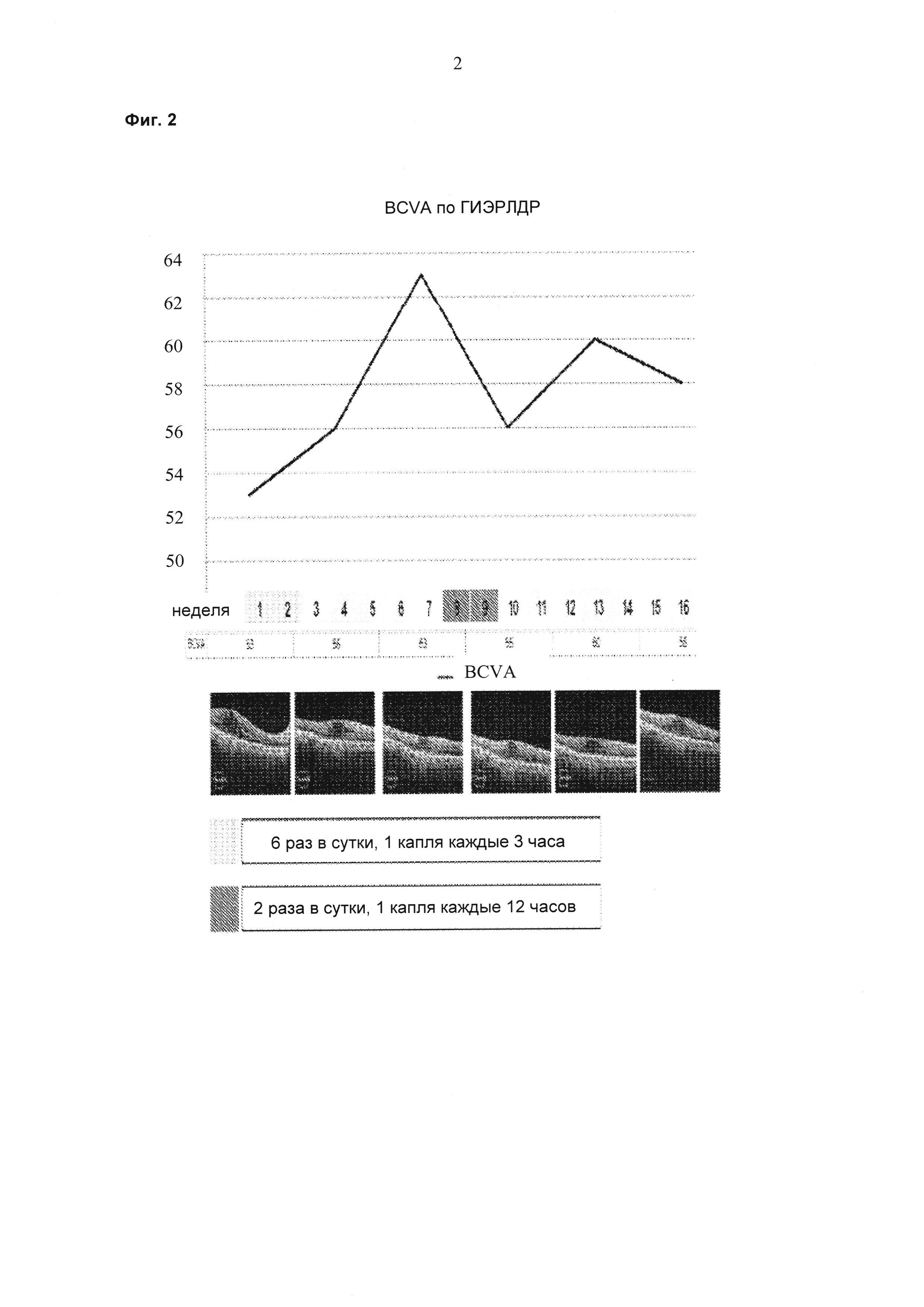
Далее изобретение описано в следующих графических материалах. На фиг. 1 представлены данные от одного пациента, которого лечили липосомальным препаратом ранибизумаба, имеющего улучшенные измерения толщины сетчатки в области центральной ямки с использованием оптической когерентной томографии (OCT-CFT; от англ. "optical coherence tomography of central foveal thickness") в течение восьминедельного периода после дозирования шести капель в сутки в течение двух недель. Не восьмой неделе у пациента показано улучшение CFT, и лечение снова начинали на 10-й неделе при суточной дозе 2 капли в сутки. На фиг. 1 показано улучшение CFT, снова появляющееся с 12-недельного до 14-недельного периода.
На фиг. 2 показан тот же клинический пациент, которого лечили липосомальным препаратом ранибизумаба, имеющий улучшенные измерения остроты зрения (BCVA ГИЭРЛДР (Группы по изучению эффективности раннего лечения диабетической ретинопатии)) в течение восьминедельного периода после дозирования шести капель в сутки в течение двух недель. На восьмой неделе у пациента показано снижение остроты зрения (VA), и лечение снова начинали на 10-й неделе при суточной дозе 2 капли в сутки. На фиг. 2 показано улучшение VA, снова появляющееся с 12-недельного до 14-недельного периода.
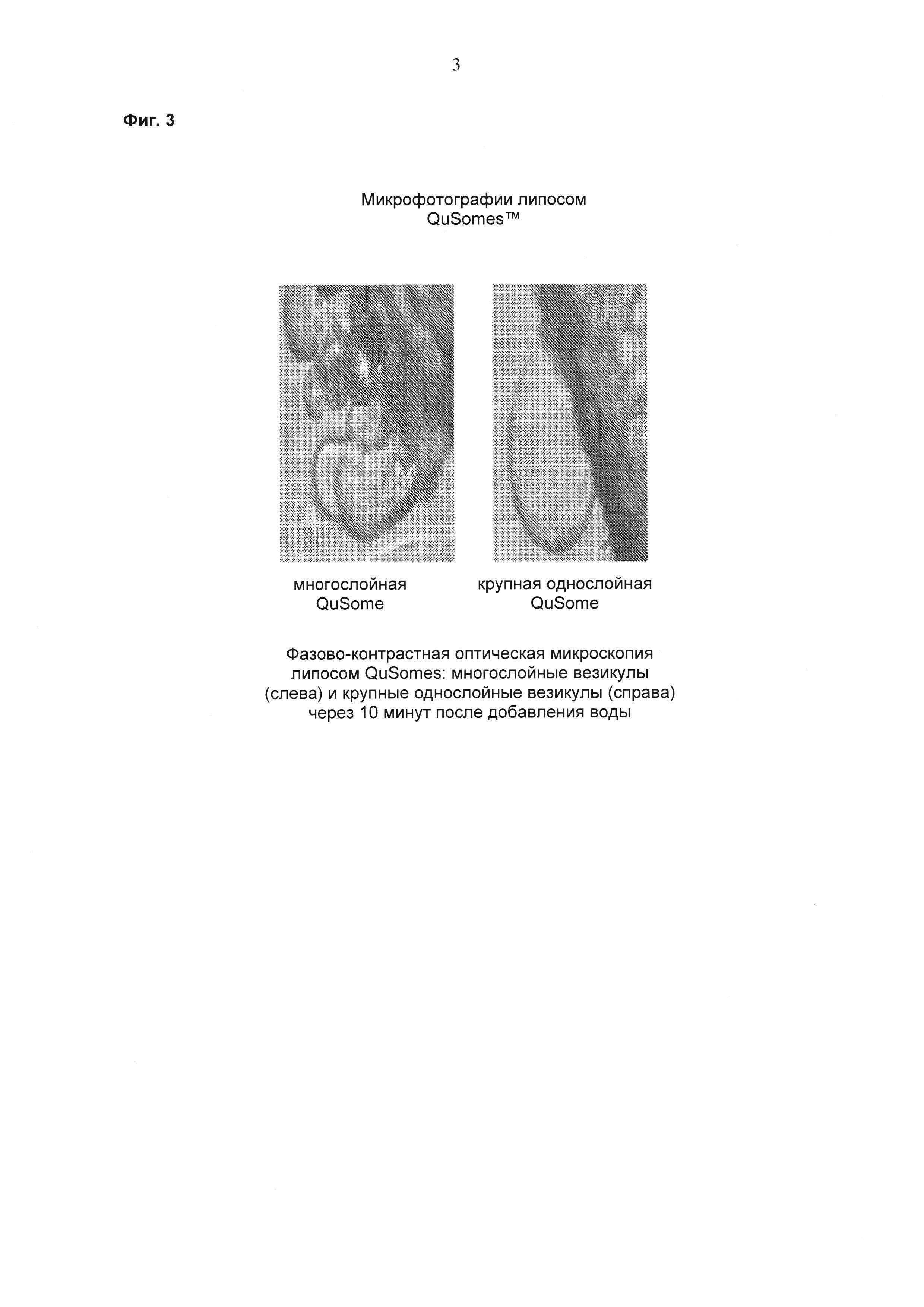
На фиг. 3 показаны микроскопические фотографии многослойных липосом и однослойных липосом.
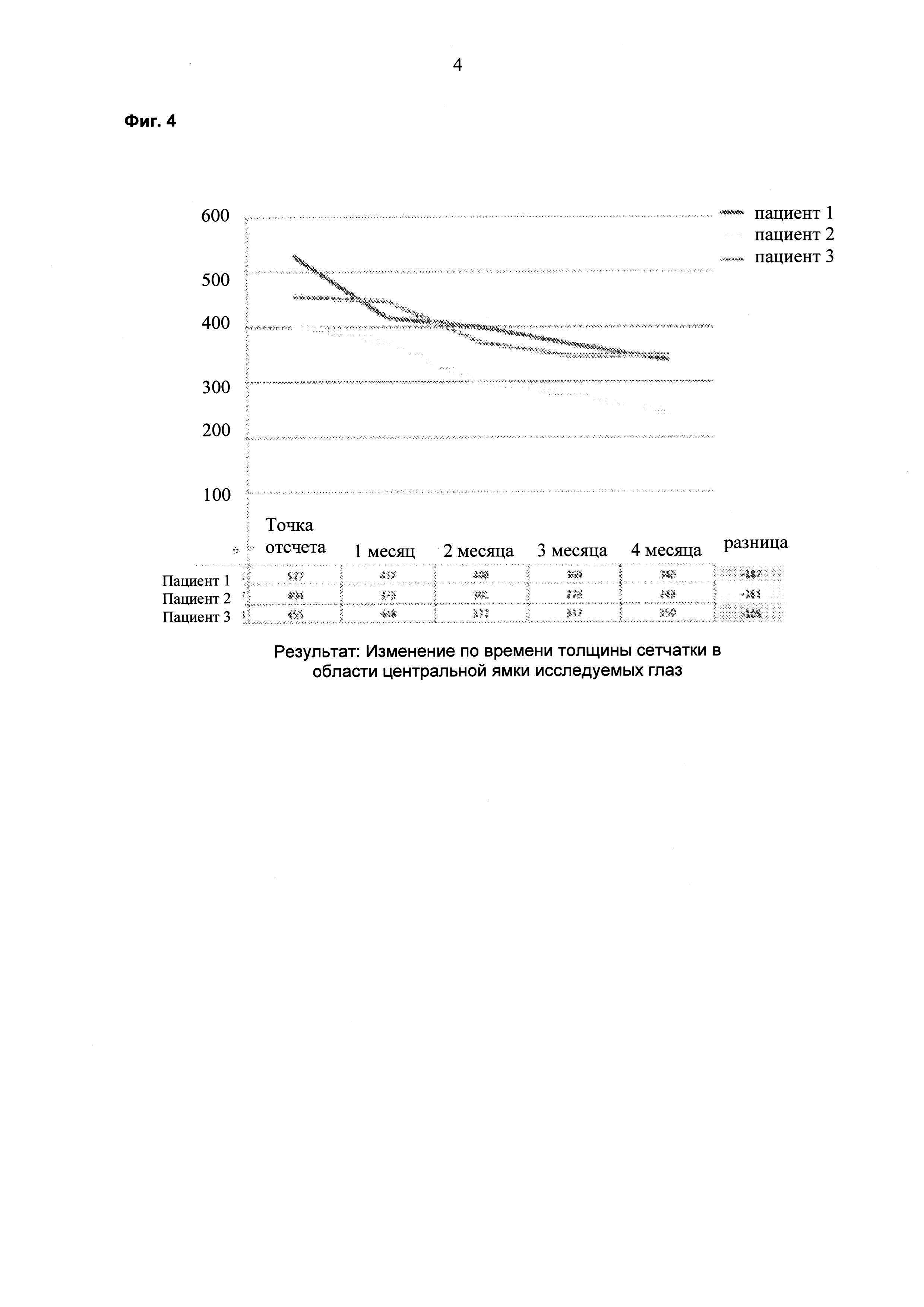
На фиг. 4 показаны результаты ОСТ толщины сетчатки в области центральной ямки пациентов, которых лечили липосомальным препаратом ранибизумаба, по времени.
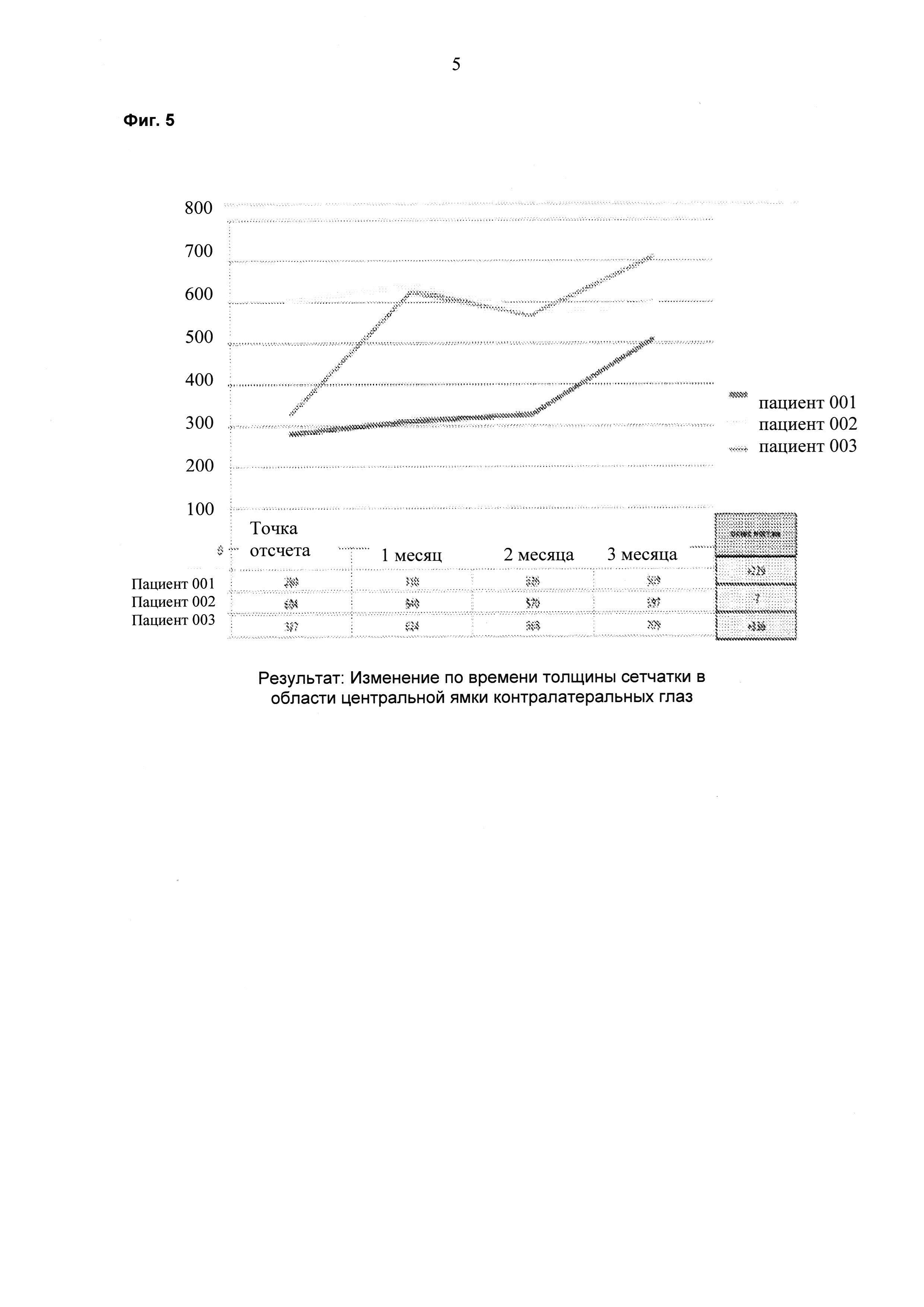
На фиг. 5 показаны результаты ОСТ толщины сетчатки в области центральной ямки контралатеральных глаз пациентов по времени.
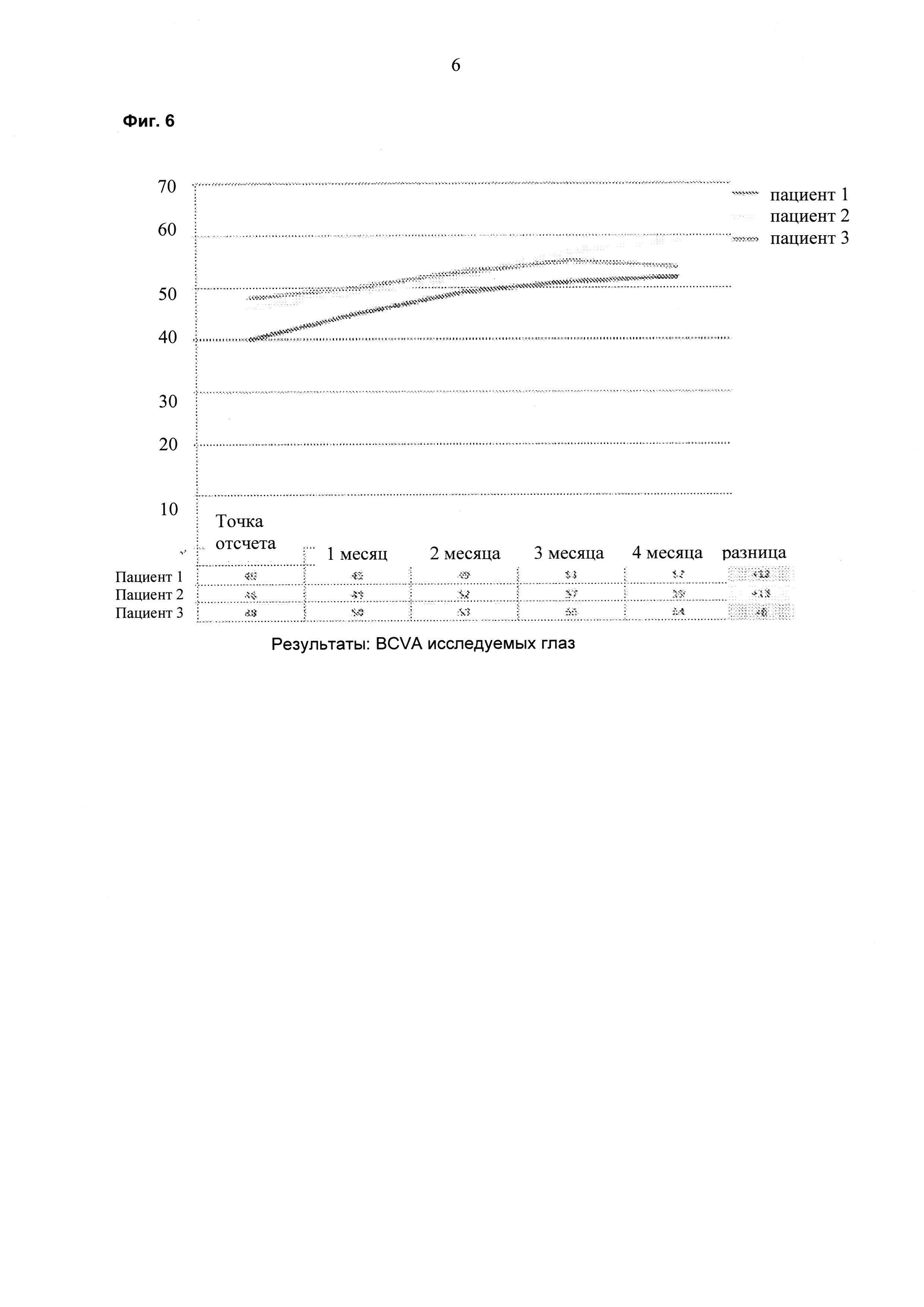
На фиг. 6 показаны результаты BCVA по времени для исследуемых глаз у трех пациентов.
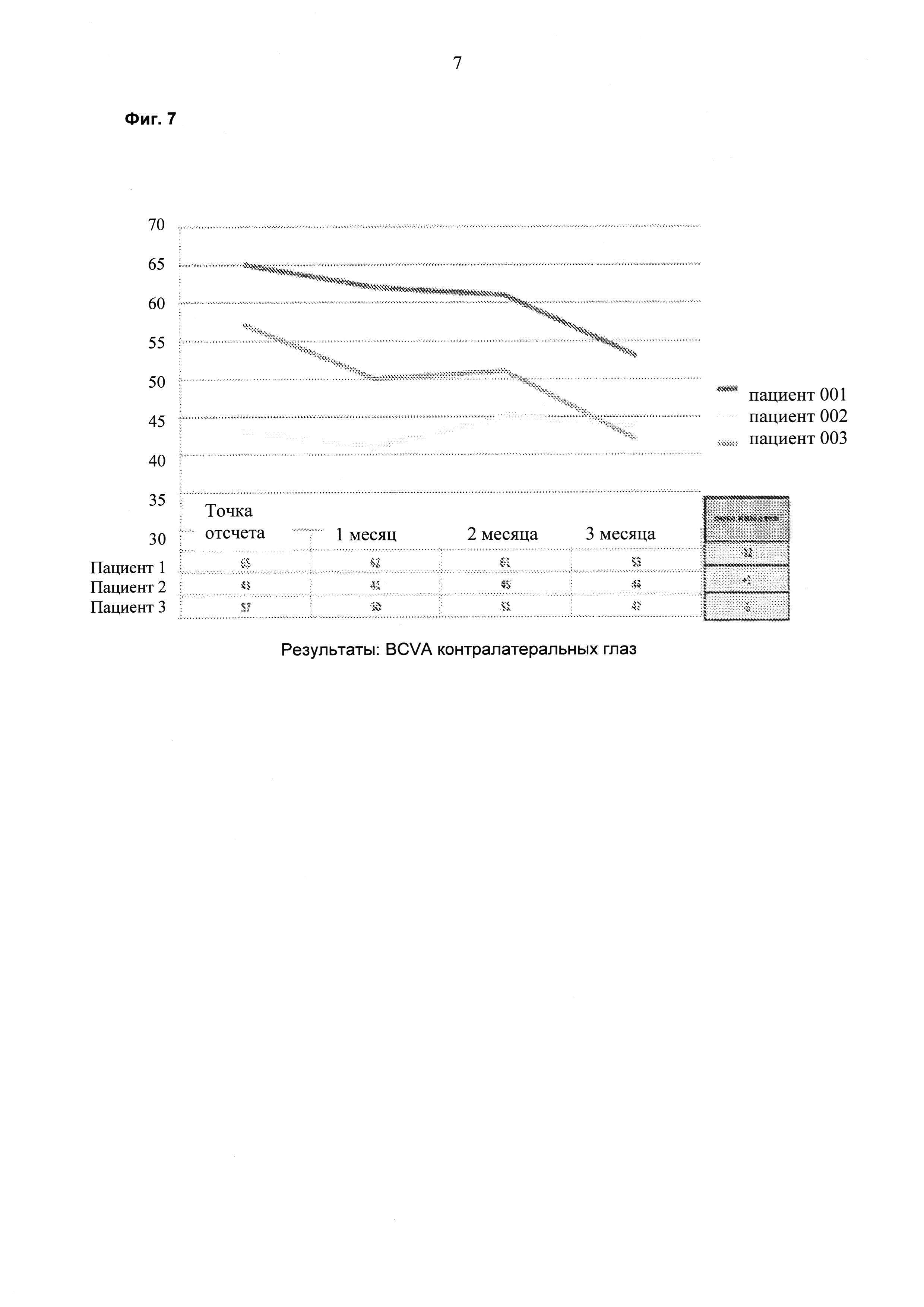
На фиг. 7 показаны результаты BCVA по времени для контралатеральных глаз.
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим препаратам и их применениям, где предпочтительный препарат содержит антитело против VEGF и самоформирующуюся термодинамически стабильную липосому. Настоящее изобретение также относится к местному препарату, содержащему антитело против VEGF и самоформирующуюся термодинамически стабильную липосому. Изобретение, кроме того, включает способ лечения заболевания или состояния, обусловленного VEGF, включающий введение препарата, содержащего антитело против VEGF и самоформирующуюся термодинамически стабильную липосому, пациенту, нуждающемуся в его лечении. В предпочтительном воплощении изобретения заболевание или состояние, обусловленное VEGF, выбрано из диабетической ретинопатии (ДР).
Хотя липосомы "в целом" раскрыты в связи с доставкой различных активных ингредиентов, на уровне техники не раскрыта или не предложена комбинация самоформирующихся термодинамически стабильных липосом в сочетании с антителами против VEGF. Липосомы препараты особенно подходят для доставки антител против VEGF пациенту, нуждающемуся в лечении заболевания или состояния, обусловленного VEGF, и, в частности, глазных заболеваний или состояний. Липосомальные препараты по настоящему изобретению особенно подходят для местного введения в глаз пациента, нуждающегося в лечении, например, диабетического отека макулы, либо возрастной макулярной дегенерации, либо неоваскуляризации роговицы. Липосомы по настоящему изобретению обладают желаемыми фундаментальными свойствами, делающими их особенно подходящими для этих местных препаратов. Суспензии липосом термодинамически стабильны при температуре приготовления препарата. Композиции липидов, составляющих липосому, обладают несколькими фундаментальными свойствами. Эти липиды имеют параметры упаковки, дающие возможность образования липосом. Эти липиды включают в качестве части концевой группы полиэтиленгликоль (ПЭГ) или полимер с подобными свойствами, стерически стабилизирующий липосомы в суспензии. Кроме того, липосомы имеют температуру плавления, дающую им возможность находиться в жидкой форме при смешивании с водой или водным раствором.
Как раскрыто в патенте 6610322, при формировании липосомальных суспензий в водном растворе не требуется или требуется небольшая дополнительная энергия. В настоящем изобретении предпочтительный способ включает формирование липосомальной суспензии в присутствии водного раствора, содержащего активный ингредиент, представляющий собой антитело против VEGF. Самосборка, таким образом, предпочтительно вероятнее происходит с активным ингредиентом, чем перед добавлением активного ингредиента к суспензии. Молекулы липидов претерпевают диспергирование и самосборку в естественном состоянии низкой энергии. Липосомы образуют крупные или малые моноламеллярные (однослойные) везикулы (SUV; от англ. "small unilamellar vesicles") или мультиламеллярные (многослойные) везикулы (MLV; от англ. "multilamellar vesicles") (см. фиг. 3), как раскрыто на вебсайте Biozone Laboratories для Qusomes™.
Цепь ПЭГ предпочтительно имеет молекулярную массу от приблизительно 300 дальтон до 5000 Дальтон. Примеры подходящих липидов включают PEG-12 GDO (глицериндиолеат; от англ. "glycerol dioleate") и PEG-12 GDM (глицериндимиристат; от англ. "glycerol dimyristate"). PEG-12 GDM представляет собой жидкость при 25°С и имеет параметры упаковки Ра и Pv 0,853 и 0,889 соответственно. Каждый из этих липидов образует спонтанные липосомы при 20°С, 37°С и 60°С. Ра может находиться в диапазоне от 0,84 до 0,88, а Pv от приблизительно 0,88 до 0,93. Предпочтительно подходящие соединения образуют липосомы вместо, например, мицелл. Кроме того, липидная композиция должна иметь температуру фазового перехода от приблизительно 0°С до 100°С, то есть липидная композиция имеет температуру плавления, дающую возможность композиции находиться в жидкой форме при смешивании с водным раствором. Также модуль упругости при изгибе композиции должен быть таким, чтобы липидная композиция могла образовать липосомы в водной среде без необходимости в какой-либо или какой-либо значительной подаче энергии. К раствору может быть применена кинетическая энергия. Предпочтительный модуль упругости при изгибе составляет от приблизительно 0 kt до 15 kt. Модуль упругости при изгибе в значительной степени определяется каркасом, и глицерин является предпочтительным каркасом по настоящему изобретению, хотя можно также использовать любой эквивалентный каркас в отношении модуля упругости при изгибе и подходящей функциональности. Относительный процент по массе липида в конечном растворе может находиться в диапазоне от более 0 до приблизительно 20 процентов по массе (масс/масс). Этот диапазон может составлять от приблизительно 1% до 15 масс. %, либо от приблизительно 1% до 10%, от приблизительно 1% до 5 масс. %, либо от более 0% до 4 масс. %.
Смеси других молекул и липидов, имеющих цепи ПЭГ длиннее, чем 12, можно также использовать в настоящем изобретении при условии, что они образуют липосомы. Например, смесь PEG-45 GDS (глицериндистеарат) и холестерина образует липосомы. Как раскрыто в патенте '322, обычный специалист в данной области техники может варьировать переменные, включающие длину цепи ПЭГ и компоненты, для получения термодинамически стабильной, свободно образующейся липосомы, и такие липосомы включены в объем настоящего изобретения как таковые и при объединении с антителом против VEGF. Количество холестерина, добавляемое к липиду перед образованием липосом, составляет вплоть до приблизительно 10 масс. %.
В дополнение к липидам, раскрытым в патенте '322, в настоящем изобретении можно также использовать другие липиды. В публикации патента US №2010/0076209 раскрыты некоторые ПЭГ-липидные конъюгаты, образующие липосомы, подходящие для доставки лекарственного средства из конкретно раскрытых активных ингредиентов. В данной ссылке отсутствует предложение доставки антител против VEGF или ссылка на них. В частности, соединение диацилглицерин-полиэтиленгликоль, как раскрыто в публикации '209, можно использовать в комбинации с антителами против VEGF в препаратах по настоящему изобретению. Общая структура липидных соединений представлена в публикации '209 и включает соединения, имеющие формулу (R2)(R1)Глицерин-Х-ПЭГ-R1 и/или R1-ПЭГ-Х-Глицерин(R2)(R1), где R1 предпочтительно представляет собой либо -ОН, либо -ОСН3; R2 и R3 представляют собой жирные кислоты, включающие и не ограниченные ими, лаурат, олеат, миристат, пальмитат, стеарат и линолеат; и X представляет собой одиночный линкер или повторяющиеся линкеры, либо комбинацию двух или более линкеров между липидом и ПЭГ. R2 и R3 могут быть одинаковыми или разными. Если R2 находится в положении С1 глицерина, R3 может быть расположен либо в С2, либо в С3. Общая структура включает все рацематы и структурные изомеры и/или их функциональные эквиваленты.
R1 может быть также выбран, например, из -NH2, -СООН, -ОСН2СН3, -ОСН2СН2СН3, -ОСН2СН2ОН, -СОСН=СН2, -OCH2CH2NH2, -OS02CH3, -ОСН2С6Н6, -OCH2COCH2CH2COONC4H4O2, -СН2СН2=СН2 и -ОС6Н6. Также R1 может представлять собой функциональную группу, способствующую связыванию или связывающую терапевтические или нацеливающие агенты с поверхностью липосомы. Они могут включать аминоалкиловые эфиры, малеимид, диглицидиловый эфир, малеимидопропионат, метилкарбамат, соли тозилгидразона, азид, пропаргиламин, пропаргиловый спирт, сложные эфиры N-гидроксисукцинимида (NHS; от англ. "N-hydroxy-succinimide"), гидразид, сукцинимидиловый эфир, соли сукцинимидилтартрат, сукцинимидилсукцинат и толуолсульфонат. Настоящее изобретение включает липосомальные препараты, имеющие антитела против VEGF внутри липосомальной композиции, и может дополнительно включать любое другое терапевтическое соединение, включающее антитела против VEGF, ковалентно связанные или сшитые с липосомой посредством функциональной группы R1. В таком случае изобретение должно включать или представлять собой комбинированный препарат или препарат, имеющие оба активных ингредиента: нековалентно связанный активный ингредиент и ковалентно связанный активный ингредиент, где эти активные ингредиенты могут быть одинаковыми или разными.
Линкеры, полезные или подходящие в данном типе липосомального препарата, включают линкеры, раскрытые в публикации '209, и включены в настоящее изобретение посредством ссылки. В таблице 1 этой публикации описаны или перечислены такие подходящие линкеры, включающие амино, сукциниламиноацетамидо, 2-аминопентанамидо, 2(2')-R'-аминоацетил и т.д. В каждом случае липиды образуют спонтанные липосомы при 20 и 37°С, как показано в таблице 4 публикации '209. Настоящее изобретение, таким образом, включает липиды, раскрытые как PEG-12-N1-GDO; PEG-23-N2-GDO; PEG-18-N3-GDO; PEG-23-N4-GDO; PEG-8-S1-GDO; PEG-18-S2-GDO; PEG-12-S3-GDO; PEG-18-Ad-GDO; PEG-12-Ac2-GDO; PEG-12-N1-GDM; PEG-12-N1-GDLO; PEG-12-S3-GDM; PeG-12-S3-GDLO; PEG-12-Ac2-GDM; PEG-12-Ac2-GDLO; PEG-23-N1-GDL; PEG-12kN1-GDP; PEG-23-Ac2-GDL and PEG-12-Ac2-GDP. GDLO означает глицериндилинолеат, a GDP означает глицериндипальмитат. Каждое из этих соединений представляет собой жидкость при 25°С и имеет параметры упаковки Ра в диапазоне от 0,830 до 0,869 и Pv в диапазоне от 0,872 до 0,924.
Настоящее изобретение дополнительно включает известные липиды, соответствующие физическим требованиям, изложенным в данном изобретении, и которые, например, находятся в жидком состоянии при 25°С и являются самоформирующимися как при 20°С, так и при 37°С, а также имеют функционально эквивалентные или эквивалентные параметры упаковки и образуют термодинамически стабильные липосомы без подачи энергии или с небольшой подачей энергии при объединении с водным раствором.
Антитела против VEGF, полезные в настоящем препарате, включают любое известное антитело против VEGF. Эти антитела включают полноразмерные антитела или фрагменты антител при условии, что они обладают необходимыми биологическими свойствами против VEGF. В предпочтительном воплощении изобретения антитело представляет собой фрагмент антитела, обладающий необходимыми биологическими и фармакологическими свойствами против VEGF. В патенте US №6884879 раскрыты антитела против VEGF, полезные в настоящем изобретении. Такие антитела включают гуманизированные антитела против VEGF и варианты антител против VEGF, обладающие свойствами, которые включают сильное сродство связывания с VEGF; способность к ингибированию VEGF-стимулируемой пролиферации эндотелиальных клеток и способность к ингибированию VEGF-индуцированного ангиогенеза. Предпочтительное сродство связывания (Kd) составляет не более чем приблизительно 5×10-9 М при значении ED50 ингибирования VEGF-индуцированной пролиферации эндотелиальных клеток in vitro, составляющем не более чем приблизительно 5 нМ. Антитела включают антитела, ингибирующие по меньшей мере приблизительно 50% опухолевого роста в модели опухоли А673 in vivo при дозе антитела 5 мг/кг. Наиболее предпочтительное антитело имеется в продаже под торговой маркой Луцентис® (ранибизумаб) и одобрено для лечения возрастной макулярной дегенерации и различных форм отека макулы в качестве интравитреального препарата. Термин "антитело против VEGF" включает как полноразмерные антитела, так и фрагменты антител. Ряд заболеваний, которые можно лечить антителами против VEGF, включают заболевания или состояния, обусловленные ангиогенезом, или состояния патологического ангиогенеза. Эти состояния включают рак, а также глазные неоваскулярные синдромы, такие как возрастные ретинопатии или возрастная макулярная дегенерация (ВМД), ревматоидный артрит и псориаз. Хотя предпочтительным путем введения является местное введение в глаз, а предпочтительной модальностью заболевания является диабетический отек макулы, препарат, описанный в данном изобретении, может быть также полезен при других способах доставки (то есть при инъекционном способе; при внутривенной инфузии) и при лечении длинного перечня VEGF-обусловленных заболеваний и состояний.
Антитела против VEGF включают антитела, продуцируемые с изолированной нуклеиновой кислоты, кодирующей гуманизированный вариант родительского антитела против VEGF, где родительское антитело включает вариабельные домены, отличающиеся от человеческих, где гуманизированный вариант связывает VEGF человека и имеет аминокислотные последовательности участков, определяющих комплементарность (CDR; от англ. "complementarity-determining region"), тяжелой цепи, как описано и заявлено в патенте 6884879, включенном в данное описание посредством ссылки. Антитела против VEGF включают антитела, которые можно продуцировать с использованием векторов, имеющих нуклеиновую кислоту, кодирующую аминокислотные последовательности CDR, и изолированных клеток-хозяев, содержащих такие векторы. Клетки-хозяева можно культивировать для продуцирования таких последовательностей, и гуманизированные антитела против VEGF могут быть выделены из таких культур клеток-хозяев. Изолированная нуклеиновая кислота, описанная выше, может дополнительно кодировать гуманизированный вариант, имеющий участок, определяющий комплементарность (CDR), легкой цепи с последовательностями, раскрытыми в патенте '879. Такой гуманизированный вариант может включать вариабельный домен тяжелой цепи, имеющий последовательность, представленную как SEQ ID NO: 7, и вариабельный домен легкой цепи, имеющий последовательность, представленную как SEQ ID NO: 8 в патенте '879. Такой гуманизированный вариант может также включать последовательность вариабельного домена тяжелой цепи SEQ ID NO: 116 и последовательность вариабельного домена легкой цепи SEQ ID NO: 115, как показано в патенте '879.
Патент US №7060269 также включен в данное описание посредством ссылки. В данном патенте заявлен и раскрыт ранибизумаб. В пункте 1 формулы изобретения патента '269 заявлен способ ингибирования VEGF-индуцированного ангиогенеза у субъекта, включающий введение этому субъекту эффективного количества гуманизированного антитела против VEGF, связывающего VEGF человека со значением Kd не более чем приблизительно 1×10-8, где данное гуманизированное антитело против VEGF включает последовательность вариабельного домена тяжелой цепи SEQ ID NO: 116 и последовательность вариабельного домена легкой цепи SEQ ID NO: 115. Ранибизумаб представляет собой фрагмент рекомбинантного гуманизированного моноклонального антитела IgG1 каппа-изотипа, предназначенный для внутриглазного применения. Данное моноклональное антитело связывается с фактором роста эндотелия сосудов A (VEGF-A) человека и ингибирует его. Ранибизумаб имеет молекулярную массу приблизительно 48000 Дальтон и продуцируется в экспрессионной системе Е.coli в питательной среде, содержащей тетрациклин. Этот препарат имеется в продаже под торговой маркой Луцентис® и поставляется в виде стерильного раствора, не содержащего консерванты, в стеклянном флаконе однократного применения, который может доставлять 0,05 мл водного раствора 10 мг/мл ранибизумаба, содержащего 10 мМ гистидин-HCl, 10% альфа, альфа-трегалозы дегидрата, 0,01% полисорбата 20 и имеющего рН 5,5.
Ранибизумаб описан в научном журнале, опубликованном в 1999 г., в журнале Journal of Molecular Biology (JMB) в статье Chen et al., озаглавленной "Selection and Analysis of an Optimized anti-VEGF Antibody: Crystal Structure of an Affinity-matured Fab in complex with Antigen"5 (Chen et al. JMB, 293: 865-881 (1999). В данной статье последовательности тяжелой цепи и легкой цепи ранибизумаба обозначены как Y0317 и представлены на фиг. 1 этой статьи. В дополнение к данному описанию, в этой статье также приведены данные, касающиеся сродства связывания этого фрагмента антитела с VEGF (таблица 6 на с. 870 этого журнала). Известно, что ранибизумаб связывается с VEGF-A и ингибирует его биологическую активность, вызывающую неоваскуляризацию и протекание в моделях глазного ангиогенеза. Ранибизумаб связывается с VEGF-A и ингибирует его, а также предотвращает взаимодействие VEGF-A с рецепторами VEGF на поверхности эндотелиальных клеток и, таким образом, уменьшает образование новых кровеносных сосудов (ангиогенез); протекание кровеносных сосудов и пролиферацию эндотелиальных клеток. Введение фармацевтически эффективного количества ранибизумаба ингибирует VEGF-индуцированный ангиогенез. Термин антитело против VEGF охватывает полноразмерные антитела и фрагменты антител, такие как Fab, Fab', F(ab)2 и Fv, при условии, что эти фрагменты проявляют желаемую фармакологическую активность посредством связывания с VEGF человека. Ранибизумаб имеет сродство связывания к VEGF (Kd) не более чем приблизительно 1×10-8 М, то есть приблизительно 1,4×10-10 (см. Chen et al. на с. 870). На фиг. 10А и 10В патента '269 приведены последовательности вариабельных доменов легкой цепи и вариабельных доменов тяжелой цепи ранибизумаба (Fab Y0317, как показано в статье Chen et al.). Эти последовательности идентичны SEQ ID NO: 115 и SEQ ID NO: 116 патента '269.
В дополнение к ранибизумабу и другим ингибиторам, направленным против VEGF, или лекарственным средствам, раскрытым в приведенных выше статьях и патентах, в настоящем препарате можно использовать дополнительные лекарственные средства против VEGF или антиангиогенные лекарственные средства. Хотя авторы изобретения обнаружили, что антитела против VEGF, представляющие собой фрагменты антител, предпочтительны в липосомальных препаратах для лечения заболеваний и состояний, в которое вовлечено местное применение на глазах пациентов, имеющих здоровую роговицу или минимальную неоваскуляризацию роговицы, при некоторых других глазных состояниях (например, при возрастной макулярной дегенерации или диабетическом отеке макулы) препараты, содержащие полноразмерные антитела против VEGF и самоформирующиеся термодинамически стабильные липосомы, также полезны при лечении неоваскуляризации роговицы и этих других глазных состояний (у пациентов, имеющих оба заболевания) при условии, что неоваскуляризация роговицы позволяет или способствует поступлению полноразмерного антитела большого размера и его препаратов. Пример интактного или полноразмерного антитела против VEGF продается фирмой Genentech под торговой маркой Авастин® (бевацизумаб). Данное антитело представляет собой рекомбинантное гуманизированное антитело IgG1, ингибирующее биологическую активность VEGF. Оно содержит каркасные участки человека и участки, определяющие комплементарность, мышиного антитела, связывающегося с VEGF, и имеет приблизительную молекулярную массу 149 кД. Это антитело продуцируют в экспрессионной системе клеток млекопитающих (яичника китайского хомячка) в питательной среде, содержащей гентамицин. В патенте US №6054297 (полностью включенном в данное описание посредством ссылки) заявлен и раскрыт бевацизумаб или способ получения бевацизумаба (см. пункты формулы изобретения 1, 6, 7, 8, 9, 10, 12, 29 и 30 этого патента).
Как описано в инструкции по применению одобренного препарата, бевацизумаб представляет собой рекомбинантное гуманизированное моноклональное антитело IgG1, связывающееся с фактором роста эндотелия сосудов человека и ингибирующее его биологическую активность в системах анализа in vitro и in vivo. Данное антитело содержит каркасные участки человека мышиного антитела, связывающегося с VEGF6 (см. L.G. Presta et al. (1997) Cancer Res. 57: 4593-99). Молекулярная масса бевацизумаба составляет приблизительно 149 килодальтон. В данной статье раскрыто взаимодействие вариабельных доменов фрагмента F(ab) гуманизированного антитела, "F(ab)1-12." Бевацизумаб имеет участки CDR, отличающиеся от человеческих, имеющие происхождение от последовательности мышиного антитела, а также каркасные замены в вариабельных доменах в положении 46 легкой цепи (VL) и в положениях 49, 69, 71, 73, 78 и 94 тяжелой цепи (VH), которые аналогичны заменам, показанным в соответствующих положениях F(ab)-12, как показано на фиг. 1 статьи Presta et al. В статье Presta et al. имеется информация о молекулярных признаках и характеристиках связывания бевацизумаба.
Как указано выше, в дополнение к ранибизумабу и бевацизумабу в настоящем изобретении можно также использовать другие антитела против VEGF или антиангиогенные лекарственные средства. Антитела против VEGF по изобретению получают, как раскрыто в патентных ссылках, цитируемых выше, касающихся этих антител. Как правило, изолированная нуклеиновая кислота, кодирующая антитело; векторы, содержащие эту нуклеиновую кислоту, функционально связанную с контрольными последовательностями, распознаваемыми клетками-хозяевами, трансформированными этим вектором; клетки-хозяева, имеющие этот вектор, все вместе используют в способе получения представляющего интерес антитела путем культивирования этих клеток и сбора и очистки антитела. К антителу может быть добавлен любой подходящий фармацевтический эксципиент, и антитело при желании может быть также лиофилизировано. "Антитела против VEGF" включают различные формы и могут быть полноразмерными, имеющими интактный участок Fc человека, или представлять собой фрагменты антител, например, Fab, Fab' или F(ab')2. Другие антиангиогенные лекарственные средства, подходящие для объединения с липидами, раскрытыми в данном изобретении, с образованием липосомальных препаратов включают пегаптаниб или этанерцепт (ингибитор фактора некроза опухоли (TNF; от англ. "tumor necrosis factor")). В последнем случае этот препарат можно применять для лечения различных аутоиммунных заболеваний или состояний. Этанерцепт имеется в продаже под торговой маркой Энбрел®, применяемый для лечения ревматоидного, ювенильного ревматоидного и псориатического артрита, пятнистого псориаза и анкилозирующего спондилоартрита. Другие подходящие лекарственные средства включают сунитиниб, представляющий собой ингибитор рецепторной протеинкиназы VEGF и PDGF и ангиогенеза (2-оксиндол, имеющийся в продаже под названием Сутент®), раскрытый и заявленный в патенте US №6573293, включенном в данное описание посредством ссылки), или FOVISTA™ (ранее известный как Е10030), представляющий собой регулятор тромбоцитарного фактора роста В (PDGF-B) (1,5 мг/0,5 мг ранибизумаба). Другие подходящие лекарственные средства, применяемые в комбинации, включают интерферон-альфа-2а, или темсиролимус, или другие ингибиторы mTOR, такие как рапамицин. Классы лекарственных средств для глазных заболеваний, которые можно применять в комбинации, также включают ингибиторы протеосом, ингибиторы аутофагии, ретиноиды, лизосомальные ингибиторы, активаторы ответа теплового шока, ингибиторы шаперона Hsp90, ингибиторы транспорта белка, ингибиторы гликозидазы, ингибиторы тирозинкиназы и ингибиторы деацетилазы гистонов. Эти лекарственные средства можно применять отдельно в лизосомальном препарате, либо их можно применять в комбинированном препарате с соединением или антителом против VEGF, либо их можно применять в последовательной комбинации, и предпочтительно в местном препарате. Предпочтительным показанием при комбинировании FOVISTA™ (0,03-3,0 мг/глаз в комбинации с 0,5 мг ранибизумаба или другого соединения против VEGF) (и/или другого лекарственного средства, обладающего ингибиторной активностью в отношении PDGF) и ранибизумаба является лечение возрастной макулярной дегенерации. Афлиберцепт (2,0 мг/0,05 мл) (Эйлеа™) можно также применять в липосомальном препарате отдельно или в комбинации с ранибизумабом или другими активными ингредиентами. Настоящее изобретение дополнительно включает местный липосомальный препарат, как описано выше, содержащий FOVISTA и афлиберцепт и/или любое другое антиангиогенное лекарственное средство при условии, что по меньшей мере один из активных ингредиентов смешан/объединен с термодинамически стабильными, самоформирующиеся липосомы по изобретению. FOVISTA (аптамер, направленный против PDGF-B), также известен и описан как "Антагонист А" в публикации патента US №2012/0100136, полностью включенной в данное описание посредством ссылки. Синтез Антагониста А раскрыт в Примере 4 в публикации '136 (см. также фиг. 7 данного документа). Каждый из отдельных антагонистов VEGF и антагонистов PDGF, раскрытых в этом документе, также включен в объем настоящего изобретения, когда по меньшей мере один агент включают в препарат с липидом, раскрытым в данном изобретении, образующим термодинамически стабильную самоформирующуюся липосому. Местный препарат, содержащий любой из активных ингредиентов, описанных в данном изобретении, или любую их комбинацию, обладает преимуществом по сравнению с лекарственными средствами или их комбинациями, которые вводят путем интравитреальной инъекции. Кроме того, местное введение в глаз для глазного заболевания предпочтительно по сравнению с системным пероральным введением. Композиции, полезные в настоящем изобретении, включают в виде липосомальных препаратов или комбинации липосомальных препаратов и/или любого другого препарата следующие препараты: (а) (ингибиторы PDGF) ARC-127, Антагонист А, Антагонист В, Антагонист С, Антагонист D, антитело 1В3, CDP860, IMC-3G3, иматиниб, антитело 162.62, антитело 163.31, антитело 169.14, антитело 169.31, антитело αR1, антитело 2А1Е2, антитело M4TS.11, антитело M4TS.22, А10, брефелдин А, сунитиниб, антитело Hyb 120.1.2.1.2, антитело Hyb 121.6.1.1.1, антитело Hyb 127.5.7.3.1, антитело Hyb 127.8.2.2.2, антитело Hyb 1.6.1, антитело Hyb 1.11.1, антитело Hyb 1.17.1, антитело Hyb 1.18.1, антитело Hyb 1.19.1, антитело Hyb 1.23.1, антитело Hyb 1.24, антитело Hyb 1.25, антитело Hyb 1.29, антитело Hyb 1.33, антитело Hyb 1.38, антитело Hyb 1.39, антитело Hyb 1.40, антитело Hyb 1.45, антитело Hyb 1.46, антитело Hyb 1.48, антитело Hyb 1.49, антитело Hyb 1.51, антитело Hyb 6.4.1, антитело F3, гуманизированное антитело F3, антитело С1, гуманизированное антитело С1, антитело 6.4, антитело IgG козы против mPGDF-C, антитело С3.1, 5-метил-7-диэтиламино-s-триазоло(1,5-а)пиримидин, интерферон, протамин, моноклональное антитело к PDGFR-B1, моноклональное антитело к PDGFR-B2, моноклональное антитело 6D11, моноклональное антитело S равно 1, моноклональное антитело PR7212, моноклональное антитело PR292, моноклональное антитело HYB9610, моноклональное антитело HYB 9611, моноклональное антитело HYB 9612, моноклональное антитело HYB 9613, 4-(2-(N-(2-карбоксамидо-индол)аминоэтил)-бензолсульфонат, 4-(2-(N-(-2-карбоксамидоиндол)аминоэтил)-сульфонилмочевину, CGP 53716, антитело g162 человека, пиразоло[3,4-g]хиноксалин, 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]-индазол, 1-{2-[5-(2-метокси-этокси)-бензоимидазол-1-ил]-хинолин-8-ил}-пиперидин-4-иламин, 4-{4-[N-(4-нитрофенил)карбамоил]-1-пиперазинил]-6,7-диметоксихиназолин, 4-амино-5-фтор-3-(6-(4-метил-пиперазин-1-ил)-1Н-бензимидазол-2-ил)1Н-хинолин-2-он, (4-трет-бутилфенил){4-[(6,7-диметокси-4-хинолил)окси]фенил}метанон, 5-метил-N-[4-(трифторметил)фенил]-4-изоксазолкарбоксамид, транс-4-[(6,7-диметоксихиноксалин-2-ил)амино]циклогексанол, (Z)-3-[(2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил)-пропионовую кислоту, 5-(5-фтор-2-оксо-1,2-дигидроиндол-3-илиденметил)-2,4-диметил-1Н-пиррол-3-карбоновую кислоту, 1-(4-хлоранилино)-4-(4-пиридилметил)фталазин, N-{4-(3-амино-1Н-индазол-4-ил)фенил-N''-(2-фтор-5-метилфенил)мочевину, 1,2-диметил-7-(2-тиофен)имидазол[5,4-g]хиноксалин, 1,2-диметил-6-фенил-имидазоло[5,4-g]хиноксалин, 1,2-диметил-6-(2-тиофен)имидазоло[5,4-g]хиноксалин, AG1295, AG1296, 3-арилхинолин, 4-пиридил-2-арилпиримидин, сорафениб, MLN518, PKC412, AMN107, сурамин, неомицин или его фармацевтически приемлемую соль и (b) (ингибиторы VEGF) ранибизумаб, бевацизумаб, афлиберцепт, слитый белок, представляющий собой рецептор VEGF KH902, слитый с Fe, антитело 2С3, ORA102, пегаптаниб, бевасираниб, бевасираниб с тупыми концами, SIRNA-027, декурсин, декурсинол, пикроподофиллин, гуггулстерон, PLG101, эйкозанид LXA4, PTK787, пазопаниб, акситиниб, CDDO-Me, CDDO-Imm, шиконин, бета-гидроксиизовалерилшиконин, ганглиозид GM3, антитело DC101, антитело Mab25, антитело Mab73, антитело 4А5, антитело 4Е10, антитело 5F12, антитело VA01, антитело BL2, BECG-родственный белок, sFLTOI, SFLT02, пептид В3, TG100801, сорафениб, антитело G6-31 или другие соединения, ингибирующие VEGF-обусловленный ангиогенез. В дополнение к антителам другие активные ингредиенты на основе белков, подходящие для лечения глазных заболеваний или состояний, включающих заболевания передней части глаза, такие как заболевания роговицы или заживление, необходимое вследствие хирургических вмешательств; травмы или язвы, включают, например, гормоны роста человека или другие известные гормональные пептиды или их варианты.
Липосомальный препарат получают путем выполнения следующих общих стадий в любом порядке: (1) приготовление водного раствора, содержащего антитело против VEGF и/или другого активного вещества или активных веществ, как раскрыто выше; (2) добавление термодинамически стабильного, самоформирующегося липида, способного к образованию липосомы, к водному раствору стадии (1) и (3) необязательное добавление фармацевтически приемлемых эксципиентов. Можно использовать любую вариацию способа получения препарата в виде суспензии липосом, включая объединение антитела против VEGF (или ингибитора VEGF, или ингибитора PDGF) и липида, а затем добавление водного раствора, либо добавление каждого ингредиента по отдельности к водному раствору. Суспензию получают на основании ожидаемого пути доставки (например, местного и т.д.), и дополнительные эксципиенты также выбирают на основании такого пути. Носители, стабилизаторы и/или эксципиенты включают буферы, такие как фосфат, цитрат или другие неорганические кислоты; антиоксиданты, такие как аскорбиновая кислота и/или метионин; консерванты; низкомолекулярные полипептиды; белки, такие как желатин, сывороточный альбумин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон (ПВП); аминокислоты; моносахариды или дисахариды или другие углеводы; хелатирующие агенты; сахара; солеобразующие противоионы; неионные поверхностно-активные вещества и тому подобное. Липосомальный препарат может также находиться в форме раствора.
Эти препараты полезны при лечении VEGF-обусловленных заболеваний и расстройств. Предпочтительными заболеваниями или состояниями, подлежащими лечению препаратом, раскрытым в данном изобретении, являются глазные заболевания. Как раскрыто выше, предпочтительным заболеванием или состоянием для настоящего изобретения является лечение диабетического отека макулы. Как описано выше, ДОМ является результатом серии биохимических и клеточных событий, которые в конечном счете вызывают прогрессирующее протекание и экссудацию, приводя к утолщению сетчатки и к образованию плотных экссудатов внутри одного диаметра диска центра макулы. Лазерная фотокоагуляция является основой лечения и эффективна для предупреждения риска умеренной потери зрения приблизительно на 50% [ETDRSRG, 1985]. Лазерная фотокоагуляция приводит к улучшению баллов чтения строк, но имеет сопутствующие осложнения, такие как прогрессирующее расширение рубцов, центроцекальные скотомы, сниженная контрастная чувствительность и ухудшение цветового зрения.
Липосомальный препарат может обширно лечить опухоли или ретинальные расстройства, обусловленные VEGF и/или PDGF, или любое другое глазное заболевание или состояние в зависимости от конкретного активного ингредиента. Антитела против VEGF ингибируют одну или более биологических активностей, вызываемых VEGF. Терапевтические применения включают фармацевтически приемлемую дозируемую форму, вводимую пациенту, нуждающемуся в лечении конкретного заболевания или состояния. Подходящие дозируемые формы, хотя предпочтительно являются местными, могут также включать введение внутривенными путями в виде болюса или путем непрерывной инфузии; внутримышечным, интраперитонеальным, интрацереброспинальным, подкожным, внутрисуставным, интрасиновиальным, подоболочечным, пероральным путем или путем ингаляции. Кроме того, такие препараты антител можно также вводить внутриопухолевым, перитуморальным, внутриочаговым путем или по периферии пораженного очага. Неопластические заболевания, поддающиеся лечению препаратами антитела, включают различные карциномы, включающие карциному молочной железы, карциному легкого, карциному желудка, пищевода, колоректальную карциному, карциному печени, яичника, арренобластомы шейки матки, эндометрия, гиперплазию эндометрия, эндометриоз, фибросаркомы, хориокарциному, рак головы и шеи, носоглоточную карциному, карциномы гортани, гепатобластому, саркому Капоши, меланому, карциномы кожи, гемангиому, кавернозную гемангиому, гемангиобластому, карциномы поджелудочной железы и другие типы рака. Неопухолевые состояния, обусловленные VEGF, включают ревматоидный артрит, псориаз, атеросклероз, диабетические и другие пролиферативные ретинопатии, включающие ретинопатию недоношенности, ретролентальные фиброплазии, неоваскулярную глаукому, возрастную макулярную дегенерацию, диабетический отек макулы и другие формы отека макулы, гиперплазии щитовидной железы, включающие диффузный токсический зоб, трансплантацию роговицы и другой ткани, хроническое воспаление, воспаление легкого, нефритический синдром, преэклампсию, асциты, перикардиальные выпоты и плевральный выпот. Предпочтительным состоянием или заболеванием, которое лечат предпочтительным местным препаратом, является диабетический отек макулы. Вводимая доза и частота введения зависит от типа и тяжести заболевания и от состояния конкретного пациента. Например, антитела против VEGF можно вводить в диапазоне дозы от 1 мкг/кг до приблизительно 50 мг/кг или приблизительно 0,1-20 мг/кг пациенту, нуждающемуся в его лечении. Предпочтительная схема дозирования для лечения ДОМ в отношении местного препарата ранибизумаба описана в Примере 3 данного изобретения. Концентрацию и количество активного ингредиента можно варьировать в зависимости от конкретного пациента и числа суток лечения, и количество, вводимое в сутки, либо в неделю, либо в месяц можно также варьировать в зависимости от ответа пациента и признаков улучшения, как остроты зрения, так и утолщения сетчатки.
Идеальным терапевтическим методом для целей лечения ДОМ или другого VEGF-обусловленного глазного состояния является метод, приводящий к быстрому и долго длящемуся улучшению зрения. Другие терапевтические методы, применяемые в настоящее время для лечения ДОМ, включают селективные ингибиторы PKCβ (рубоксистаурин); стероиды (триамцинолон ацетонид, флуоцинолон ацетонид); ингибиторы VEGF (инъекционные препараты бевацизумаба; ранибизумаба и пегаптиниба) и витрэктомию. Настоящий липосомальный препарат обеспечивает схему местного лечения, что является значительным усовершенствованием, например, по сравнению с интравитреальными препаратами, имеющимися в настоящее время в продаже. Настоящий препарат можно применять в комбинации с другими известными терапевтическими средствами для глазных или VEGF-обусловленных заболеваний или состояний, описанных в данном изобретении, и/или как раскрыто выше, при условии отсутствия противопоказаний. Такие схемы лечения или терапевтические методы включают, например, молекулы малых ингибиторных РНК (миРНК), такие как бевасираниб, с подходящими носителями доставки, включающими термодинамически стабильные, самоформирующиеся липосомы, применяемые в настоящем изобретении.
Глазные стероиды, которые можно применять в липосомальном препарате отдельно или в комбинации с любым другим активным ингредиентом, включают дексаметазон, флуоцинолон, лотепреднол, дифлупреднат, фторметолон, преднизолон, медризон, триамцинолон ацетонид, римексолон и их различные солевые формы. Другие глазные противовоспалительные средства (например, нестероидные противовоспалительные препараты (НСПВП)) можно также применять в липосомальном препарате. В зависимости от активного ингредиента можно применять другие липосомы в дополнение к термодинамически стабильным самоформирующимся липосомам или в качестве альтернативы им.
Приведенные ниже примеры предназначены для дополнительной иллюстрации некоторых воплощений изобретения и являются неограничивающими:
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1-А. Раствор липосом и ранибизумаба
Был получен флакон, содержащий 0,5 мг ранибизумаба при концентрации 10 мг/мл (0,05 мл). К этому раствору добавляли 0,015 грамма ПЭГ-12 глицериндимиристата (PEG-12 GDM) Qsomes™ (число после ПЭГ указывает число субъединиц C2H4O в цепи ПЭГ). Объем этой суспензии липосом был разведен до конечного объема 1,5 мл, используя 1,45 мл буферного раствора, состоящего из фосфатов, хлорида натрия и полиоксил 40 стеарата с получением концентрации ранибизумаба 0,333 мг/мл в суспензии липосом и процента липида приблизительно 1% (10 мг/мл). Добавляли перборат натрия (0,28 мг/мл) в качестве консерванта. 1 мл этой суспензии эквивалентен 20 каплям. Каждая капля содержит приблизительно 17 мкг ранибизумаба.
Буферный раствор готовили путем объединения 15 мл раствора полиоксил 40 стеарата, хлорида натрия, одноосновного фосфата натрия и двухосновного фосфата натрия с 5 мл раствора пербората натрия (V=20 мл, рН 5,5). Затем 1,45 мл этого раствора использовали, как описано непосредственно выше. Концентрации каждого из эксципиентов в офтальмологическом липосомальном суспензионном препарате были следующими: 0,142 мг/мл (двухосновный фосфат натрия); 6,7 мг/мл (одноосновный фосфат натрия); 50 мг/мл (полиоксил 40 стеарат); 5,1 мг/мл (хлорид натрия); 0,333 мг/мл (ранибизумаб); 10 мг/мл (PEG-12 GDM) и 2,8 мг/мл (перборат натрия). рН можно доводить с помощью HCl или NaOH, а также можно использовать низкомолекулярные аминокислоты или органические кислоты. На фиг. 3 показано по меньшей мере два типа липосом (Qusomes®), которые образуются, когда липид смешивают с водным раствором (с вебсайта Biozone Laboratories).
Пример 2. Исследование на роговицах кроликов в диффузионной камере
Данные диффузионной камеры липосомального препарата, наносимого на роговицы кроликов, были получены, используя описанные выше способы. В кратком изложении, образцы брали через 10, 20 и 30 минут и через 1, 2, 3, 4, 5, 6 и 24 часа. Данные показали значительную степень проникновения во внутриглазную жидкость роговицы кролика при 34 градусах Цельсия для липосомального препарата ранибизумаба, нанесенного местным путем. В липосомальном препарате ранибизумаб был идентифицирован, начиная с 3 часов, и продолжал присутствовать в течение 24 часов после введения по сравнению с 7 и 14 сутками, ранее сообщаемыми для нелипосомального препарата у кролика (данные не представлены; см. Chen et al., Eye London 2011 Nov; 25(11): 1504-11). Эксперименты проводили в стеклянных камерах Valia-Chen с горизонтальным потоком. Вода рециркулирует при температуре 34°С. мембрану помещали между стыками камер, и в данном примере в качестве мембраны использовали роговицы кроликов. Рецепторную камеру заполняли 3,2 мл физиологического раствора, чтобы имитировать содержание внутриглазной жидкости в передней части глаза. В донорную камеру помещали 3 мл офтальмологического препарата, содержащего ранибизумаб и термодинамически стабильный самоформирующийся липид. Диффузионные камеры постоянно перемешивали. Образцы отбирали из рецепторной камеры в различные моменты времени; каждый раз брали 400 мкл образцов и заменяли 400 мкл физиологического раствора. Образцы брали в следующие моменты времени: 10 мин; 20 мин; 30 мин; 1 ч; 2 ч; 3 ч; 4 ч; 5 ч; 6 ч и 24 ч. Ранибизумаб определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) начиная с 3го часа. Луцентис® использовали в качестве контрольного раствора для стандарта ВЭЖХ. Электрофорез также использовали для оценки прохождения липосомального препарата через мембрану роговицы кролика, и его результаты согласовывались сданными ВЭЖХ.
Пример 3. Пробное клиническое исследование на пациентах с ДОМ
Пациента, страдающего ДОМ, лечили 6 раз в сутки 1 каплей каждые три часа препаратом на ежесуточной основе (6 раз в сутки) в течение двух недель. Суммарная суточная доза ранибизумаба составляла 6×17 мкг или 102 мкг. Улучшения, состоящие в снижении средней толщины сетчатки в области центральной ямки (CFT; от англ. "central foveal thickness") и в повышении остроты зрения, наблюдали через шесть недель после данного двухнедельного периода (см. фиг. 1 и фиг. 2). На восьмой неделе происходило увеличение толщины сетчатки и снижение остроты зрения, и на неделе 10 лечение начинали повторно двумя каплями в сутки (34 мкг/сутки). На неделе 14 наблюдали явную тенденцию в направлении улучшения в ОСТ и BCVA (см. фиг. 1 и 2). Двух дополнительных пациентов также лечили, используя тот же протокол. Результаты для всех трех пациентов представлены на фиг. 4-7 и показывают улучшение CFT и остроты зрения (VA; от англ. "vision acuity") относительно контроля.
Пример 4. Пробное клиническое исследование на пациентах с ДОМ с использование триамцинолона ацетонида
Пациенты, подходящие для участия в исследовании, страдающие ДОМ, получали местный препарат, содержащий триамцинолон (ТА), в одноцентровом открытом пробном исследовании. Суммарно 3 глаза 3 пациентов (средний возраст 58 лет, интервал 53-64) с ДОМ, включая центр макулы и наилучшую корригированную остроту зрения (BCVA; от англ. "best-corrected visual acuity") в исследуемом глазу от 65 до 40 букв при использовании тестирования Группы по изучению эффективности раннего лечения диабетической ретинопатии (ГИЭРЛДР). Пациентов инструктировали, чтобы они наносили одну каплю, содержащую 133 мкг (микрограмма) ТА каждые два часа в исследуемый глаз с момента их пробуждения (шесть раз) в течение контролируемого периода лечения, составляющего двенадцать (12) недель. Основные измерения результатов включали первичные результаты через три месяца, такие как частота и тяжесть глазных и системных побочных эффектов и изменение по времени по сравнению с базовым уровнем толщины сетчатки в области центральной ямки (CFT), измеряемой с помощью оптической когерентной томографии (ОСТ; от англ. "optical coherence tomography"). Вторичные результаты представляли собой изменение по времени по сравнению с базовым уровнем балла BCVA, долю пациентов с прогрессированием тяжести ретинопатии на фотографиях глазного дна (FP; от англ. "fundus photographs") более 3 стадии по сравнению с базовым уровнем по ГИЭРЛДР, долю пациентов с ослаблением протекания на флуоресцеиновой ангиографии (FA; от англ. "fluorescein angiography") и необходимость в лазерном лечении макулы со временем. Препарат ТА готовили аналогично препарату ранибизумаба из имеющихся в продаже исходных веществ.
Офтальмологическая суспензия Триамцинолон + 1% липосомы
Конечный препарат представляет собой стерильную водную суспензию. Его содержание является следующим:
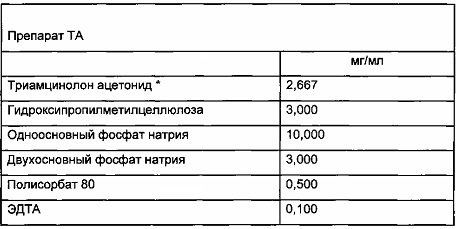
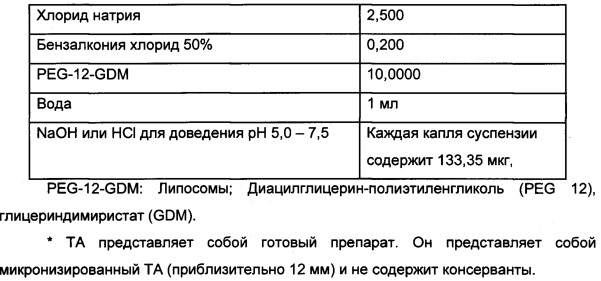
Протокол получения офтальмологической суспензии Триамцинолон + 1% липосомы
1. Помещают 40% конечного объема дистиллированной воды в химический стакан и нагревают до 70-80°С.
2. Добавляют гидроксипропилметилцеллюлозу и прекращают перемешивание до достижения комнатной температуры, и смесь становится прозрачной и гомогенной.
3. Автоклавируют смесь, и, как только она становится стерильной, дают ей достичь комнатной температуры при перемешивании.
4. Помещают в другой химический стакан 40% конечного объема дистиллированной воды. Добавляют и перемешивают до полного растворения один за другим следующие реагенты:
a) одноосновный фосфат натрия
b) двуходноосновный фосфат натрия
c) Этилендиаминтетрауксусная кислота (ЭДТА)
d) хлорид натрия
e) Полисорбат 80
5. В 10% остаточного объема воды добавляют бензалкония хлорид в концентрации 50% и смешивают до полного включения. Как только он растворяется, добавляют этот новый раствор к полученному выше раствору, содержащему фосфаты, ЭДТА, хлорид натрия и Полисорбат 80. Для стерилизации фильтруют через мембрану 0,22 мкм.
6. Смешивают стерильный раствор гидроксипропилметилцеллюлозы с другим стерильным раствором, содержащим соли и консервант бензалкония хлорид и смешивают до получения прозрачной гомогенной смеси.
7. Добавляют триамцинолона ацетат к раствору с буферами и бензалкония хлоридом и перемешивают до полного включения.
8. К этой смеси добавляют липосомы и перемешивают в течение 15 минут магнитной мешалкой с получением конечной суспензии.
9. Упаковывают эту суспензию в стерильные глазные флаконы-капельницы. Каждый флакон-капельница содержала 1,5 мл данной офтальмологической суспензии триамцинолона.
Результаты: применение местного препарата, содержащего ТА в липосомальном препарате у пациентов с клинически значимым диабетическим отеком макулы (ДОМ) с вовлечением центральной ямки хорошо переносилось. Ни глазные, ни системные нежелательные эффекты не описаны. На 2 месяце CFT всех трех пациентов была уменьшена относительно базального уровня. У двух из трех пациентов снижение CFT составляло по меньшей мере 100 мкм. На третьем месяце у всех трех пациентов показано улучшение остроты зрения. Один из пациентов набрал более 15 букв.
Хотя заявленное изобретение подробно раскрыто со ссылкой на его конкретные воплощения, обычному специалисту в данной области техники очевидно, что могут быть выполнены различные изменения и модификации заявленного изобретения без отклонения от его сущности и объема. Так, например, специалисты в данной области техники понимают или способны подтвердить без применения не более чем рутинного экспериментирования различные воплощения заявленного изобретения, не раскрытые явным образом. Такие воплощения находятся в пределах объема изобретения.
ССЫЛКИ
Roskoski Jr, Sunitinib: A VEGF and PDGF receptor protein kinase and angiogenesis inhibitor. BBRC, 2007.
Fong D, Diabetic Retinopathy. Diabetes Care, 2004.
Bhagat N, Diabetic Macular Edema: Pathogenesis and Treatment. Survey of Ophthalmology 2009.
Meyer C, Current Treatment Approaches in Diabetic Macular Edema, Ophthalmologica, 2007.
Chen Y, Selection and analysis of an optimized anti-VEGF Antibody: Crystal structure of an affinity-matured Fab in complex with antigen, JMB, 1999.
Presta L, Humanization of an Anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders.
ETDRSR, Photocoagulation for macular edema, Report 1, 1985.