Результат интеллектуальной деятельности: СПОСОБ ПРИГОТОВЛЕНИЯ ТРОМБОФИБРИНОВОГО СГУСТКА, ОБЛАДАЮЩЕГО РОСТСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно регенеративной медицины, и может быть использовано для стимуляции репаративных процессов в поврежденных тканях.
Уровень техники
Из уровня техники известен метод получения тромбоцитарного геля из богатой тромбоцитами плазмы с использованием хлорида кальция и тромбина [Amable P.R., Carias R.B., Teixeira M.V., da Cruz Pacheco I.,  do Amaral R.J., Granjeiro J.M., Borojevic R. Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther. 2013. 4 (3):67].
do Amaral R.J., Granjeiro J.M., Borojevic R. Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther. 2013. 4 (3):67].
Однако известный метод требует длительной оптимизации процедур центрифугирования, не позволяет после ретракции тромбофибринового сгустка сохранить в составе геля биологически активные вещества, секретируемые тромбоцитами, не содержит данных о влиянии полученного геля на жизнеспособность диплоидных клеток человека,
Наиболее близким к заявляемому является способ получения тромбоцитарного геля на основе богатой тромбоцитами аутоплазмы [Применение аппликаций богатой тромбоцитами аутоплазмы в лечении больных с хроническими ранами различной этиологии. Методические рекомендации, авт.Оболенский В.Н., Ермолова Д.А, Макаров М.С., Конюшко О.И., Сторожева М.В., Лаберко Л.А., Боровкова Н.В. - М., Департамент здравоохранения города Москвы, 2013. -16 с.]. В состав тромбоцитарного геля входит богатая тромбоцитами плазма (БоТП), выделенная из крови пациента, и 10% раствор хлорида кальция; 1 мл препарата содержит 934-952 мкл БоТП и 48-66 мкл 10% раствора хлорида кальция. У пациента осуществляют забор крови в стерильные одноразовые вакутейнеры с 3,8% цитратом натрия. Для выделения БоТП исходную кровь центрифугируют в течение 8 мин при 460 g. Затем с помощью дозатора в асептичных условиях отбирают нижнюю фракцию плазмы, наиболее богатую тромбоцитами. Для получения тромбоцитарного геля в плазму с тромбоцитами вводят 10% раствор хлорида кальция из расчета 50-70 мкл на 1 мл БоТП и инкубируют БоТП при 37°С в течение 20-30 мин. Инкубация может производиться как в стерильных одноразовых пробирках, так и в стерильных стеклянных чашках. Биологическую эффективность БоТП пациента оценивают in vitro на примере культуры фибробластов человека линии М-22. Экспериментально установлено, что адекватно подобранная доза БоТП в 1,5-2,5 раза увеличивает пролиферативную активность клеток М-22 без нарушения их жизнеспособности. Применение тромбоцитарного геля в виде сгустка при лечении больных с длительно незаживающими ранами различной этиологии позволило значительно ускорить процесс заживления ран, сократить время пребывания в стационаре, сократить стоимость лечения более чем в 2 раза, улучшить качество жизни больного (Оболенский В.Н. и др. Стимуляция регенераторных процессов в хронических ранах с помощью богатой тромбоцитами аутоплазмы: клинико-экспериментальное исследование. Клиническая и экспериментальная хирургия, Журнал имени академика Б.В.Петровского, 2016, Т. 4, №1, с. 38-43).
Однако данный метод не включает оценку качества тромбоцитов пациента в клинической практике, что создает риск получения геля с низким уровнем ростовых факторов, не позволяет получить тромбоцитарный гель в отсутствие термостата, не позволяет выделить из тромбоцитарного геля тромбофибриновый сгусток, обладающий выраженными рост-стимулирующими свойствами.
Раскрытие изобретения
Задачей изобретения является усовершенствование способа получения тромбоцитарного геля и тромбофибринового сгустка на его основе, для использования в лечении больных с длительно незаживающими ранами различной этиологии.
Техническим результатом, на достижение которого направлено заявленное изобретение, является получение тромбофибринового сгустка, обладающего рост-стимулирующими свойствами, за счет активации тромбоцитов человека и использовании температурного режима, позволяющего провести активацию тромбоцитов без их полной дегрануляции.
Технический результат достигается при осуществлении способа получения тромбофибринового сгустка, включающего забор венозной крови пациента в стандартную пробирку с антикоагулянтом, выделение богатой тромбоцитами плазмы (БоТП), введение в БоТП раствора 10% хлорида кальция и инкубацию БоТП, оценку содержания в БоТП биологически полноценных тромбоцитов (тромбоцитов с гранулами), при этом дополнительно к раствору 10% хлорида кальция вводят в БоТП препарат для инъекций «Адреналина гидрохлорид-Виал» из расчета 5-7 мкл 10%-го раствора хлорида кальция и 20-25 мкл препарата «Адреналина гидрохлорид-Виал» на 100 мкл БоТП, содержащей не менее 100 тыс. тромбоцитов с гранулами на 1 мкл, инкубацию БоТП осуществляют при температуре 20-22°С для образования тромбоцитарного геля, при этом время инкубации БоТП составляет 20-30 мин при содержании тромбоцитов с гранулами свыше 35%, 30-50 мин при содержании тромбоцитов с гранулами 10-35%, после чего осуществляют дополнительную инкубацию образованного геля в течение 10-20 мин для образования тромбофибринового сгустка и отбор тромбофибринового сгустка.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фиг. 1 представлена фотография витально окрашенных (трипафлавином и акридиновым оранжевым) мезенхимальных мультипотентных стромальных клеток человека через 3 суток культивирования без ТФ и в присутствии ТФ, полученных двумя разными методами (метод-прототип и заявляемый метод). Увеличение ×40; а - без ТФ (контроль); б - ТФ, полученный методом-прототипом; в - ТФ, полученный заявляемым методом.
Осуществление изобретения
Заявляемый способ приготовления тромбофибринового сгустка включает следующие этапы:
1. Забор венозной крови пациента в стандартную пробирку с антикоагулянтом CPD (цитрат) или ЭДТА.
2. Выделение богатой тромбоцитами плазмы (БоТП), для получения которой образцы крови пациента центрифугируют при 300-400 g в течение 4-5 минут, после чего отбирают супернатант.
3. Приготовление витального красителя с использованием, например, трипафлавина и акридинового оранжевого.
4. Оценка содержания в БоТП биологически полноценных тромбоцитов (тромбоцитов с гранулами), %.
5. Введение в БоТП раствора 10% хлорида кальция и препарата «Адреналин-Виал» из расчета 5-7 мкл 10% хлорида кальция и 20-25 мкл препарата для инъекций «Адреналина гидрохлорид-Виал» на 100 мкл БоТП.
6. Инкубация активированной БоТП при комнатной температуре (20-22°С) в пробирке, эппендорфе или емкости с плоским дном для получения тромбоцитарного геля, при этом время инкубации БоТП составляет 20-30 мин при содержании тромбоцитов с гранулами свыше 35 (предпочтительно до 75%), при содержании тромбоцитов с гранулами от 10 до 35% (включительно) время инкубации БоТП составляет 30-50 мин.
7. Выделение тромбофибринового сгустка. Для выделения тромбофибринового сгустка образованный гель дополнительно инкубируют в тех же условиях (20-22°С) в течение 10-20 мин, после чего в стерильных условиях пинцетом отбирают тромбофибриновый сгусток.
На первом этапе решения поставленной задачи был осуществлен подбор оптимального индуктора активации тромбоцитов для получения тромбоцитарного геля. Способность к активации имеют только биологически полноценные тромбоциты (клетки с гранулами). В физиологических условиях воздействие стандартных/канонических индукторов активации (коллаген, АДФ, тромбин и др.) вызывает быстрый и необратимый выброс гранул за пределы тромбоцита, также тотальная дегрануляция тромбоцитов происходит при внесении в плазму хлорида кальция (стандартный способ получения тромбоцитарного геля). В обоих случаях тромбоцитарный материал находится при температуре 37°С, оптимальной для дегрануляции; из-за этого основной объем тромбоцитарных гранул выходит за пределы тромбоцитов и практически не фиксируются в составе тромбофибриновых сгустков. С другой стороны, существуют различные неканонические пути активации тромбоцитов, которые позволяют активировать тромбоциты даже при 20-22°С.Стоит особо подчеркнуть, что в процессе неканонической активации тромбоцитов при 20-22°С формирование тромбоцитарных агрегатов не сопровождается быстрой и тотальной дегрануляцией, т.е. по крайней мере, часть гранул сохраняется в активированных тромбоцитах при 20-22°С в течение нескольких часов [Макаров М.С. Неканонические способы активации тромбоцитов человека // Медицинский алфавит. Современная лаборатория. - 2015. - Т. 3, №11. - С. 30-35.]. Таким образом, необходимо было подобрать индуктор активации, позволяющий получать тромбоцитарный гель в условиях 20-22°С.
Среди известных препаратов, потенциально способных активировать тромбоциты, был выбран препарат для инъекций «Адреналина гидрохлорид-Виал». В состав препарата входит эпинефрин (адреналин) в концентрации 1 мг/мл, натрия дисульфит, натрия хлорид, эдетовая кислота (ЭДТА, этилендиаминтетрауксусная кислота), хлористоводородная кислота, вода для инъекций. Адреналин вызывает активацию тромбоцитов in vivo и in vitro путем воздействия на специфические адреналин-зависимые рецепторы. Дисульфит натрия и хлористоводородная кислота обладают выраженными восстановительными (электрон-донорскими) свойствами, что также может способствовать активации тромбоцитов. В среде с высоким восстановительным редокс-потенциалом происходит активация рецепторов на поверхности тромбоцитарных мембран, которые запускают каскад внутриклеточных сигналов и в результате стимулируют адгезию и агрегацию тромбоцитов [Murphy D.D., Reddy Е.С., Moran N., O'Neill S. Regulation of platelet activity in a changing redox environment. // Antioxid Redox Signal. - 2014. - Vol. 20, №13. - P. 2074-2089.]. Таким образом, препарат «Адреналина гидрохлорид-Виал» потенциально способен запускать активацию тромбоцитов разными путями, причем совмещение этих путей может оказывать синергетический эффект и усиливать образование тромбоцитарного геля.
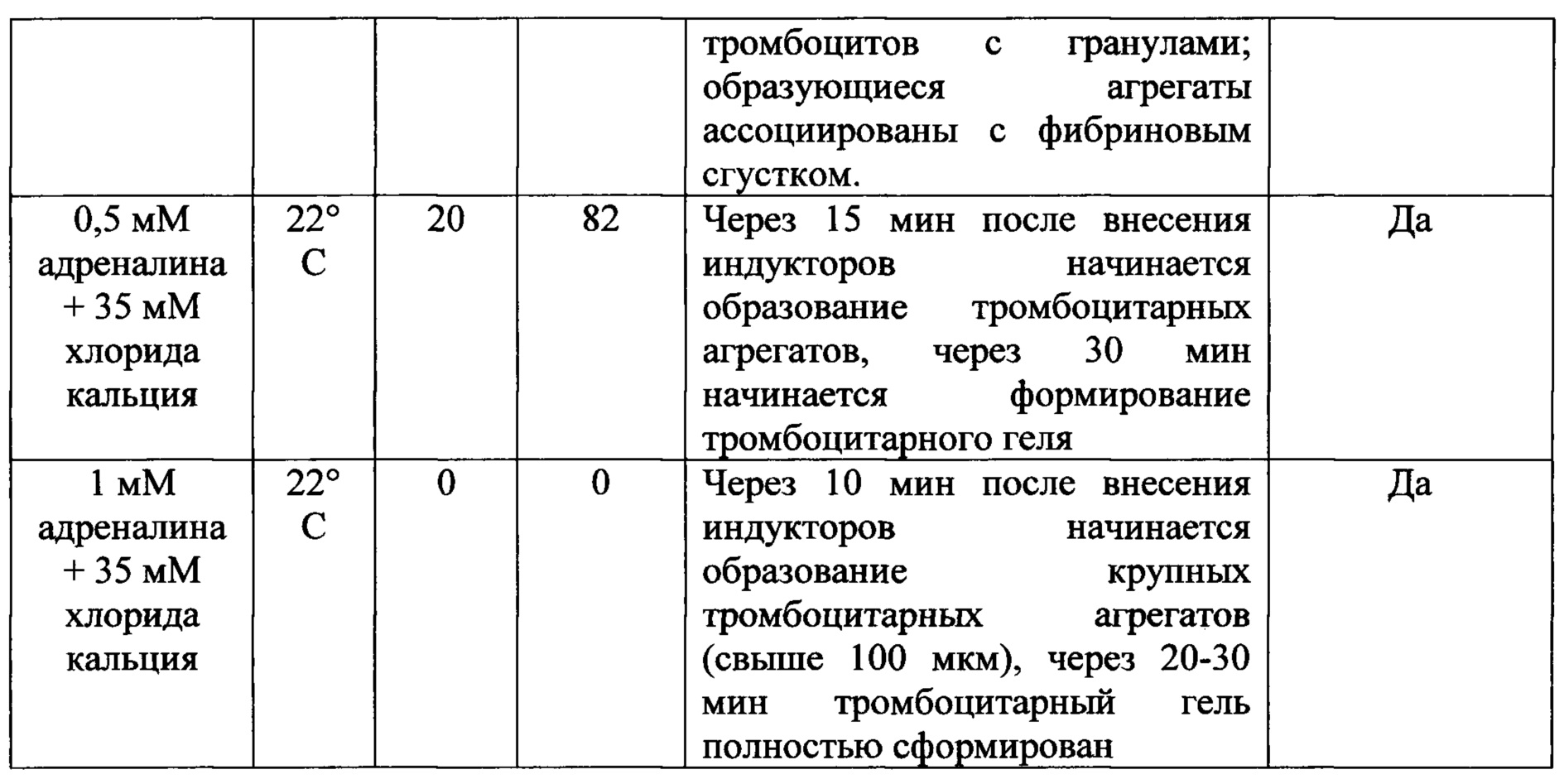
Для оценки эффективности данного препарата был проведен ряд экспериментов. Морфофункциональный анализ тромбоцитов проводили с помощью метода, основанного на витальном окрашивании тромбоцитов с последующим их анализом с помощью флуоресцентной микроскопии [Патент РФ на изобретение №2485502 «Способ оценки морфофункционального статуса тромбоцитов человека», авторы Хубутия М.Ш., Макаров М.С., Хватов В.Б., Высочин И.В., Кобзева Е.Н., Боровкова Н.В., Конюшко О.И., 20.06.2013]. По данным литературы, массовая активация тромбоцитов происходит при концентрации адреналина 1 мМ (1*10-3 М) и выше [Michelson A.D. Platelets. 3rd ed. - Amsterdam: Academic Press, 2013, 1351 р.]. При добавлении препарата «Адреналина гидрохлорид-Виал» в плазму с тромбоцитами до концентрации 1 мМ при 22°С выраженной активации тромбоцитов не происходит, при 37°С формируются многочисленные тромбоцитарные агрегаты, одновременно с этим происходит дегрануляция большинства биологически полноценных тромбоцитов. Стоит особо отметить, что при более низких концентрациях адреналина формирование агрегатов в условиях 37°С не сопровождается тотальной активацией тромбоцитов, часть клеток остается неактивированной (табл. 1). При использовании 1 мМ адреналина через 30 мин активируется 64-65% тромбоцитов с гранулами, через 1 час - 100%. Однако тромбоцитарный гель при этом не формируется. Препарат «Адреналина гидрохлорид-Виал» содержит ЭДТА, который обладает хелатерирующим действием и блокирует свободный кальций, необходимый для активации плазменного звена гемостаза. В стандартном способе получения тромбоцитарного геля в плазму с тромбоцитами добавляют 10% раствор хлорида кальция до конечной концентрации 30-40 мМ и экспонируют при 37°С. Это позволяет получить тромбоцитарный гель из плазмы при 37°С, но не при 22°С. Если же препарат «Адреналина гидрохлорид-Виал» внести в плазму вместе с хлоридом кальция, то уже через 10-15 мин в плазме наблюдается интенсивная агрегация тромбоцитов, которое приводит к образованию тромбоцитарного геля даже при 22°С (табл. 1). В плазме с нормальным уровнем тромбоцитов с гранулами (35-75%) тромбоцитарный гель под действием 1 мМ адреналина и 35 мМ хлорида кальция формируется через 20-30 мин. Если уровень тромбоцитов с гранулами снижен (10-35%), время образования геля увеличивается до 50 мин. Если содержание тромбоцитов с гранулами в плазме составляет менее 10%, тромбоцитарный гель не формируется даже при очень длительной экспозиции. Таким образом, для получения тромбоцитарного геля наиболее пригодна плазма, полученная из крови с нормальным уровнем биологически полноценных тромбоцитов. Для формирования тромбоцитарного геля в образце БоТП общее содержание тромбоцитов с гранулами должно составлять не менее 100 тыс/мкл. Исследования показли, что для достижения эффективной концентрации адреналина и хлорида кальция в конечном растворе на 100 мкл исходной плазмы с тромбоцитами необходимо внести 20-25 мкл препарата «Адреналина гидрохлорид-Виал» и 5-7 мкл 10% раствора хлорида кальция (табл. 2). В зависимости от требуемого объема тромбоцитарного геля указанные объемы плазмы, препарата «Адреналина гидрохлорид-Виал» и хлорида кальция следует кратно уменьшать или увеличивать.


In vitro в тромбоцитарном геле сразу после его формирования начинается процесс ретракции (сжатия) тромбофибринового сгустка в его составе, в результате чего уже через 30-50 мин тромбоцитарный гель распадается на 2 фракции: нерастворимый гелеобразный тромбофибриновый сгусток и жидкую сыворотку, в которую выходит основная часть ростовых факторов и других биологически активных веществ, секретируемых тромбоцитами. Это процесс особенно выражен при получении тромбоцитарного геля в узких сосудах - пробирках, вакутейнерах и т.п. Таким образом, если тромбоцитарный гель не используется непосредственно после изготовления, то даже при коротком хранении лишь небольшой его объем сохраняет гелевую консистенцию - тромбофибриновый сгусток (ТФ).
Гелевые препараты считаются гораздо более предпочтительными по сравнению с жидкими препаратами, поскольку они лучше фиксируются на ране или раневом покрытии, отсутствует риск вымывания или быстрой деградации растворенных факторов. Однако при использовании стандартных методик получения тромбоцитарного геля основная часть биологических веществ остается в жидкой фракции и не фиксируется в составе ТФ. На примере культуры мезенхимальных мультипотентных стромальных клеток человека (ММСК) нами установлено, что ТФ, полученные стандартным способом (метод-прототип), in vitro увеличивают рост клеток лишь в 1,1 раза (рис. 1а, б). В то же время, ТФ, полученные из БоТП с использованием оригинальной методики, увеличивают пролиферативную активность диплоидных клеток человека в 1,5-1,8 раза без видимого нарушения жизнеспособности клеток (рис. 1в, табл. 2). Также оценивали насыщенность образцов ТФ ростовыми факторами, в частности тромбоцитарным фактором роста (PDGF). PDGF обладает выраженными рост-стимулирующими свойствами in vivo и in vitro, создание эффективных раневых покрытий, насыщенных БоТП представляет актуальную задачу регенеративной медицины [Nurden А.Т., Nurden P., Sanchez M., Andia I., Anitua E. Platelets and wound healing. Frontiers in Bioscience, 2008; vol. 13, no. 9, pp. 3532-3548]. Установлено, что уровень тромбоцитарного фактора роста в ТФ, изготовленном оригинальным способом, был в 3-5 раз выше, чем в ТФ, полученном из той же БоТП с использованием стандартной методики. Если при стандартной методике получения тромбоцитарного геля в составе ТФ сохранялось менее 12% от всего объема PDGF исходной БоТП, то при использовании оригинальной методики сохранность PDGF в ТФ превышала 50% (табл. 3).
Таким образом, предложенная методика приготовления тромбоцитарного геля позволяет получать тромбофибриновые сгустки, обладающие выраженным рост-стимулирующим эффектом.


В конкретном примере реализации изобретения был получен тромбоцитарный гель, который включал (на 1000 мкл препарата): 770 мкл БоТП пациента с желательным уровнем тромбоцитов с гранулами 35-75%; 192 мкл препарата для инъекций «Адреналина гидрохлорид-Виал»; 38 мкл раствора 10% хлорида кальция.
Приготовление тромбофибринового сгустка состояла из следующих этапов:
1. Забор 5 мл венозной крови пациента в стандартную пробирку с антикоагулянтом CPD (цитрат) или ЭДТА в соотношении 7:1. Для получения больших объемов геля общий объем забранной крови может быть кратно увеличен.
2. Выделение богатой тромбоцитами плазмы (БоТП), для получения которой образцы крови пациента центрифугируют при 300-400 g в течение 4-5 минут, после чего отбирают супернатант.
3. Приготовление витального красителя путем разведения 10 мг трипафлавина и 20 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера (рН - 7,2-7,4).
4. Оценка содержания в БоТП биологически полноценных тромбоцитов (тромбоцитов с гранулами), %. БоТП и витальный краситель смешивают в отношении 1:1, окрашивание проводят в микропробирке в течение 2-5 мин при комнатной температуре, после чего 5 мкл пробы с окрашенными тромбоцитами переносят на предметное стекло и накрывают покровным стеклом, в люминисцентном микроскопе оценивают долю тромбоцитов с гранулами (%) в расчете на 150-200 клеток.
5. Введение в БоТП раствора 10% хлорида кальция и препарата «Адреналин-Виал» из расчета 5-7 мкл 10% хлорида кальция и 20-25 мкл препарата для инъекций «Адреналина гидрохлорид-Виал» на 100 мкл БоТП. В конкретном примере реализации изобретения для приготовления 1 мл тромбоцитарного геля смешивали 770 мкл БоТП, 192 мкл препарата для инъекций «Адреналина гидрохлорид-Виал» и 38 мкл раствора 10% хлорида кальция.
6. Инкубация активированной БоТП при комнатной температуре (20-22°С) в пробирке, эппендорфе или емкости с плоским дном. Для получения тромбоцитарного геля время инкубации БоТП составляет 20-30 мин при содержании тромбоцитов с гранулами свыше 35, при содержании тромбоцитов с гранулами от 10 до 35% (включительно) время инкубации БоТП составляет 30-50 мин.
7. Выделение тромбофибринового сгустка. Для выделения тромбофибринового сгустка образованный гель дополнительно инкубируют в тех же условиях (20-22°С) в течение 10-20 мин, после чего в стерильных условиях пинцетом отбирают тромбофибриновый сгусток.
Был получен тромбофибриновый сгусток, обладающий рост-стимулирующими свойствами, продемонстрированными на фиг. 1.
Способ получения тромбофибринового сгустка, включающий забор венозной крови пациента, выделение богатой тромбоцитами плазмы (БоТП), введение в БоТП раствора 10%-ного хлорида кальция и инкубацию БоТП, отличающийся тем, что дополнительно к раствору 10%-ного хлорида кальция в БоТП вводят препарат для инъекций «Адреналин гидрохлорид-Виал» из расчета 5-7 мкл 10%-ного раствора хлорида кальция и 20-25 мкл препарата «Адреналин гидрохлорид-Виал» на 100 мкл БоТП, содержащей не менее 100 тыс. тромбоцитов с гранулами на 1 мкл, осуществляют инкубацию БоТП при температуре 20-22°С для образования тромбоцитарного геля, при этом время инкубации БоТП составляет 20-30 мин при содержании тромбоцитов с гранулами свыше 35%, 30-50 мин - при содержании тромбоцитов с гранулами 10-35%, после чего осуществляют дополнительную инкубацию образованного геля до образования тромбофибринового сгустка с его последующим отбором.

