Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
Вид РИД
Изобретение
Настоящее изобретение относится к медицине, а именно к способам лечения синдрома диабетической стопы.
Синдром диабетической стопы (СДС) является тяжелым осложнением сахарного диабета,проявляющимся в виде гнойно-некротических язв, а также повреждением костей и суставов стопы.
Число больных сахарным диабетом в России составляет 10 млн. человек и, по оценкам, к 2030 году достигнет 14 млн. человек. Осложнение СДС встречается у 4-10% больных диабетом.
Различают три основные формы СДС, нейропатическая форма (70%), нейро-ишемическая форма (15-20%) и ишемическая форма (5-7%).
СДС характеризуется очень медленным заживлением или даже потерей способности к заживлению.По имеющимся данным, полной эпителизации язв при СДС за 20 недель удается достигнуть только в 31% случаев.Около 15-20% язв у пациентов с СДС никогда не заживают и требуют хирургического вмешательства. Около 60%всех ампутаций нижних конечностей нетравматического характера приходится на больных с СДС.Таким образом, существует огромная потребность в эффективных способах лечения СДС.
Известны способы лечения СДС с использованием клеточных технологий.Для лечения СДС у пациентов с незаживающими >6 недель язвами использовались криоконсервированные аллогенные фибробласты из кожи крайней плоти новорожденных, выращенные на биосорбирующем скаффолде из полиглактина (Dermagraft).Williametal., DiabetesCare, 2003, 26(6): 1701-5.Для лечения СДС применялся двухслойный искусственный эквивалент кожи, состоящий из слоя аллогенных фибробластов дермы на коллагеновом гелевом матриксе и слоя эпидермальных кератиноцитов (Apligraf).Vevesetal., DiabetesCare, 2001, 24(2):290–295;Edmondsetal., IntJLowExtremWounds. 2009, 8(1):11-18. Двухслойный искусственный эквивалент кожи, состоящий изпористого слоя заполненного аллогенными дермальными фибробластами и непористого слоя,в котором культивируются аллогенные эпидермальные кератиноциты (OrCel) применялся для лечения пациентов с незаживающими язвами при СДС.Lipkinetal., Wounds. 2003, 15(7).Криконсервированный аллотрансплантат кожи человека, состоящий из фибробластов и кератиноцитов (TheraSkin), использовался для лечения пациентов с незаживающими язвами при СДС.DiDomenicaetal., Wounds 2011, 23(7): 184-189. Двухкомпонентное средство, состоящее из аутодермотрансплантата c включенными в него фибробластами и кератиноцитами (Hyalograft 3D/ Laserskin Autograft) использовалось для лечения пациентов с незаживающими язвами при СДС.Ucciolietal., Int J Low Extrem Wounds. 2011, 10(2):80-5. Общим недостатком всех указанных средствявляется недостаточная клиническая эффективность. Ни одно из средств не обеспечило заживления язв у всех пациентов.
Патент RU 2446811 раскрывает способ лечения СДС нейропатической формы, при котором на раневую поверхность однократно проводят трансплантацию аутологичных клеточных культур фибробластов пациента, обогащенных мультипотентными мезенхимальными стволовыми клетками (МСК). Однако, недостатком способа является то, что для лечения применяется гетерогенный и неопределенный по клеточным характеристикам материал, так как хорошо известно, что культура МСКчрезвычайно гетерогенна. Федеральный закон РФ от 23 июня 2016 г. N 180-ФЗ "О биомедицинских клеточных продуктах" разрешает использование для лечения только «стандартизованной популяции клеток одного типа с воспроизводимым клеточным составом», так как гетерогенные и неопределенные по составу клеточные линии не могут обеспечить воспроизводимость результатов лечения и делают невозможным оптимизацию лечения.
Клеточные продукты не ускоряют заживление при диабетических язвах, если клетки вводятся в дозе менее одного миллиона клеток на один см2 площади кожи. Falangaet al., Tissueengineering2007, 13(6):1299-1312.Минимальная доза клеток для ускорения диабетических язв составляла 5 миллионов клеток на один см2 площади кожи. Dashet al., RejuvenationResearch2009,12(5):359-366.Еще в одном исследовании,минимальная доза клеток для ускорения диабетических язв составляла около 4 миллионов клеток на один см2 площади кожи.Luetal., DiabetesResearchandClinicalPractice 2011, 92(1):26–36. Еще в одном исследовании, минимальная доза клеток для ускорения диабетических язв составляла около 3 миллионов клеток на один см2 площади кожи.Dubskyetal., DiabetesMetabResRev. 2013 29(5):369-76.Таким образом, из уровня техники неизвестны биомедицинские клеточные продукты для лечения СДС, которые позволяли бы ускорить заживление при введении в дозе менее одного миллиона клеток на один см2 площади кожи. В то же время, существует необходимость в снижении дозы клеток при СДС для улучшения безопасности и экономичности клеточных технологий. Необходимость производства клеток в больших количествах увеличивает время, необходимое для создания клеточного продукта и таким образом увеличивает сроки заживления диабетических язв.
Задачей настоящего изобретения является повышение эффективности лечения СДС биомедицинскими клеточными продуктами, содержащими стандартизованную популяцию клеток одного типа с воспроизводимым клеточным составом, охарактеризованным точной маркерной верификацией.
Еще одной задачей настоящего изобретения является повышение эффективности лечения СДС биомедицинскими клеточными продуктами с использованием низких доз клеток, не превышающих один миллион клеток на один см2 площади кожи.
CD-маркеры являются молекулярными структурами клеток, которые определяются рутинной проточной цитометрией.Существующая CD-номенклатура позволяет однозначно охарактеризовать принадлежность клеток к определенной клеточной линии истандартизовать популяцию клеток одного типа с воспроизводимым клеточным составом для использования в составе биомедицинского клеточного продукта. Мы обнаружили, что введение клеток имеющих определенные CD-маркеры позволяют достичь воспроизводимого эффекта при лечении СДС.
Настоящее изобретение раскрывает способ лечения синдрома диабетической стопы путем введения биомедицинского клеточного продукта, характеризующийся тем, что клеточная линия в составе указанного продукта имеет CD-маркер выбранный из группы, состоящей из CD73, CD106, CD146, CD200, CD271 и клетки в составе указанного продукта вводятся в дозе от 10 до 50 тысяч клеток/см2 кожи. Технический результат состоит в снижении дозы клеток до при одновременном повышении скорости заживления язв у лиц с синдромом диабетической стопы, что достигается использованием клеток определенного фенотипа, верифицированного по наличию специфических клеточных маркеров CD73, CD106, CD146, CD200, CD271.
Далее, настоящее изобретение раскрывает способ лечения синдрома диабетической стопы путем введения биомедицинского клеточного продукта, характеризующийся тем, что клетки в составе указанного продукта вводятся в дозе от 10 до 990 тысяч клеток/см2 кожи.
Указанный биомедицинский клеточный продукт может быть введен в виде комплекса, состоящего из клеточной линии (клеточных линий) и вспомогательных веществ либо из клеточной линии (клеточных линий) и вспомогательных веществ в сочетании с прошедшими государственную регистрацию лекарственными препаратами для медицинского применения и (или) медицинскими изделиями.
Указанный биомедицинский клеточный продукт может быть аутологичным, аллогенным, или комбинированным. Предпочтительно, указанный продукт является аутологичным.
Термин «биомедицинский клеточный продукт» означает комплекс, состоящий из клеточной линии (клеточных линий) и вспомогательных веществ либо из клеточной линии (клеточных линий) и вспомогательных веществ в сочетании с прошедшими государственную регистрацию лекарственными препаратами для медицинского применения (далее - лекарственные препараты) и (или) медицинскими изделиями.
Термин «аутологичный биомедицинский клеточный продукт»означает биомедицинский клеточный продукт, содержащий в своем составе клеточную линию (клеточные линии), полученную из биологического материала определенного человека, и предназначенный для применения этому же человеку.
Термин «аллогенный биомедицинский клеточный продукт» означает биомедицинский клеточный продукт, содержащий в своем составе клеточную линию (клеточные линии), полученную из биологического материала определенного человека, и предназначенный для применения другим людям.
Термин «комбинированный биомедицинский клеточный продукт» означает биомедицинский клеточный продукт, содержащий в своем составе клеточные линии, полученные из биологического материала нескольких людей, и предназначенный для применения одному из них.
Термин «клеточная линия» означает стандартизованная популяция клеток одного типа с воспроизводимым клеточным составом, полученная путем изъятия из организма человека биологического материала с последующим культивированием клеток вне организма человека.
Термин «вспомогательные вещества» означает вещества неорганического или органического происхождения, используемые при разработке и производстве биомедицинского клеточного продукта.
Термин «CD-маркер» означает молекулярную структуру, указанную в явном виде в CD-номенклатуре, например, в CD-номенклатуре 2015. EngelPetal. JImmunol 2015, 195:4555-4563.Примерами CD-маркеров являются CD73, CD90, CD105, CD29, CD44, CD106, CD146, CD166, CD200, CD271.
В практике настоящего изобретения, CD-маркеры клеточной линии могут быть определены проточной цитометрией или другими коммерчески доступными системами высокоинформативного скрининга.
Клеточная линия настоящего изобретения может быть получена путем изъятия биологического материала из организма человека, неэксклюзивно включаякожу, мочу, костный мозг, периферическую кровь, жировую ткань, плаценту, пуповину, пульпу зуба, ткань десны, илюбые другие ткани или жидкости человека, содержащие клетки.
Согласно настоящему изобретению, введение биомедицинского клеточного продукта вспособе лечения СДС может быть частью комплексного лечения, наряду со стадиями хирургической обработки, медикаментозной терапии, перевязки и разгрузки или любой другой процедуры, направленной на улучшение эффективности лечения.
Согласно настоящему изобретению, введение биомедицинского клеточного продукта в способе лечения СДС может быть однократным или многократным. Указанный биомедицинский клеточный продукт может быть введен любым известным способом, в том числе наружно или парентерально. Предпочтительно, указанный продукт вводится наружно.
Согласно настоящему изобретению, указанный способ лечения применим ко всем трем формам СДС, нейропатической, ишемической, и нейро-ишемической.
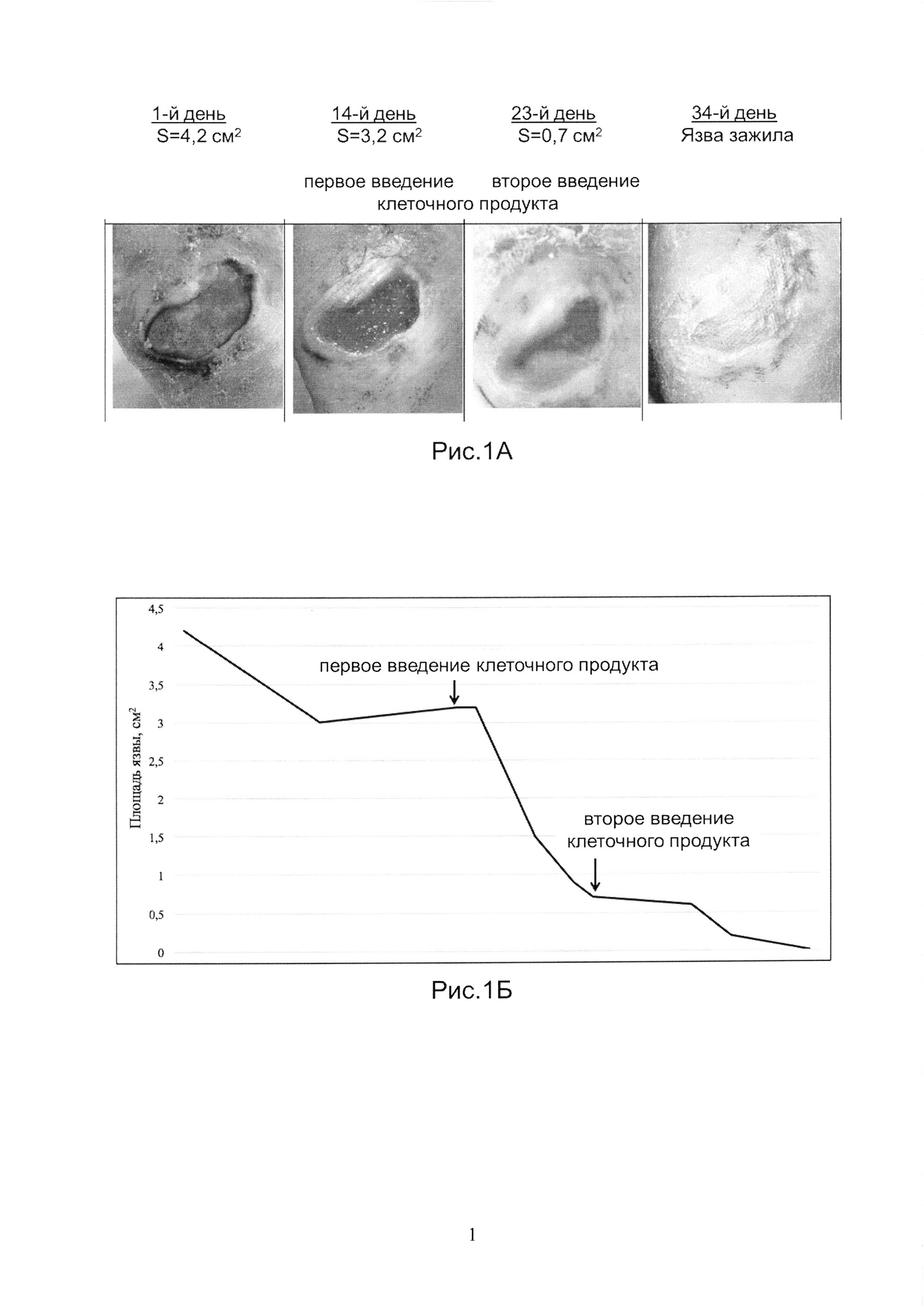
Рис.1А и 1Б показывает динамику заживления язвы у Пациента 1.
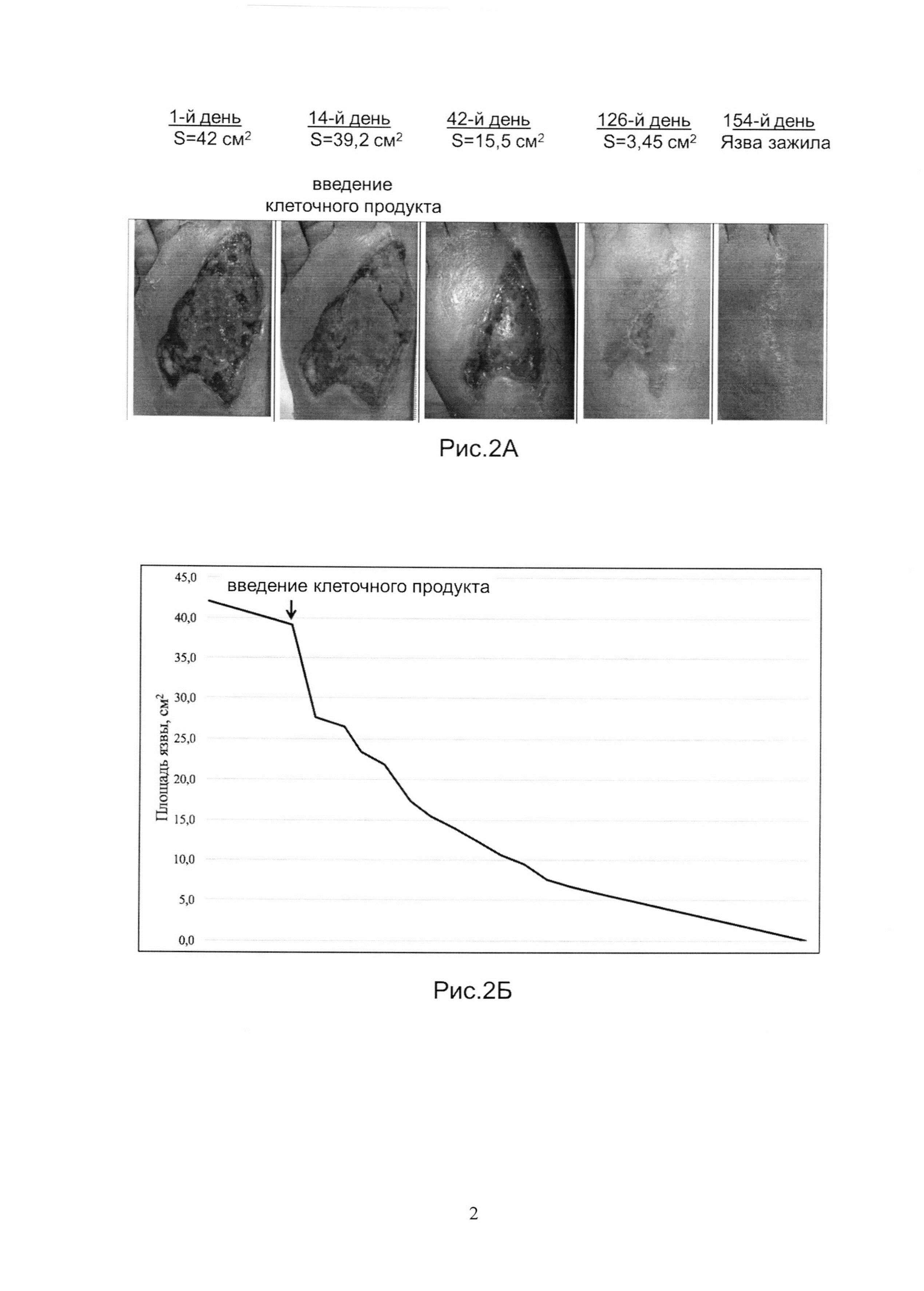
Рис.2А и 2Б показывает динамику заживления язвы у Пациента 2.
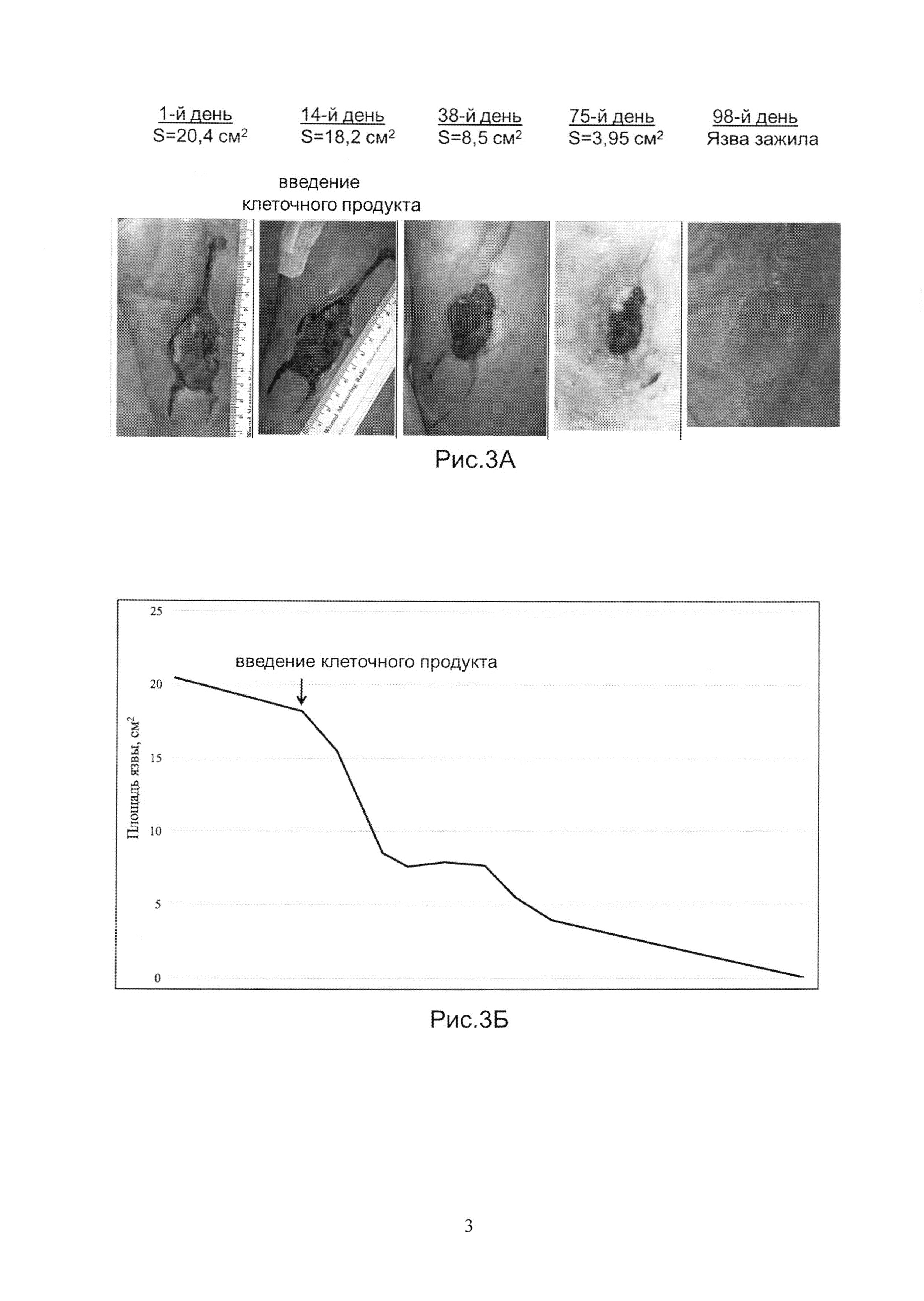
Рис.3А и 3Б показывает динамику заживления язвы у Пациента 3.
Настоящее изобретение иллюстрируется примерами. Примеры являются иллюстративными и ни в коем случае не сужают пределы изобретения.
Пример 1.
Настоящий пример иллюстрирует получение биомедицинского клеточного продукта для лечения СДС.
Аспират костного мозга был получен в результате пункции крыла подвздошной кости пациентов 1-3 с СДС для создания аутологичного биомедицинского клеточного продукта, предназначенного для лечения СДС у этих же пациентов. Аспират фракционировали и выделили фракцию клеток, содержащих хотя бы один CD-маркер, выбранный из группы, состоящей из CD73, CD106, CD146, CD200, CD271. Маркирование проводили с использованием проточного цитофлуориметра. Выход клеточной линии составил примерно 0,5% от общего состава аспирата. Клетки культивировали в подходящей среде в течение 3 недель. Среду удалили. Клетки ресуспендировали в физиологическом растворе. Полученная суспензия представляет собой аутологичный биомедицинский клеточный продуктдля лечения СДС.
Пример 2.
Настоящий пример иллюстрирует способ лечения СДС.
В предварительных тестах на диабетических животных(db/dbмыши) было установлено, что полученный биомедицинский клеточный продукт для лечения СДС эффективен в дозах от 10 до 990 тысяч клеток на один см2 площади кожи. Доза 50 тысяч клеток на один см2 площади кожи была выбрана в качестве стандартной дозы для лечения СДС у пациентов с нейропатической формой СДС.
Пример 3.
Настоящий пример иллюстрирует способ лечения СДС у пациента 1 путем введения биомедицинского клеточного продукта настоящего изобретения.
Пациент 1 в возрасте 65 лет с СД 2 типа и СДС нейропатической формы и язвой в средней части подошвенной поверхности правой стопы площадью 4,2 см2, 2А стадии (Texas University classification), незаживающей в течение 8 месяцев.
В соответствии с протоколом исследований, СДС лечили стандартными методами в течение 14 дней. Былоотмечено сокращение размеров язвы на 23% (при норме 30%), что подтвердило замедленный характер заживления.
Аутологичный биомедицинский клеточный продукт был получен, как указано в Примере 1. Продукт вводили наружно, двукратно, на14-й и 23-й день наблюдений, в дозе 50 тысяч клеток/см2 язвы. На Рис.1А показаны фотографии язвы на 1-й, 14-й (первое введение клеточного продукта), 23-й (второе введение клеточного продукта), и 34-й день наблюдений. На Рис.1Б показана динамика изменения размера язвы в течение всего срока наблюдений. Площадь язвы после первого введенияпродукта сократилась на 78% за первые 7 дней. Полное заживление язвы произошло через 18 дней с момента первого введения клеточного продукта. Через 1 и 2 недели после лечения кожные покровы в проекции зажившей язвы оставались неповрежденными, нормального цвета и влажности.
Пример 4.
Настоящий пример иллюстрирует способ лечения СДС у пациента 2 путем введения биомедицинского клеточного продукта настоящего изобретения.Пациент в возрасте 40 лет с СД 2 типа и СДС нейропатической формы и язвой на тыльной поверхности левой стопы площадью 42 см2, 2А стадии (TexasUniversityclassification), незаживающей в течение 3 месяцев.
В соответствии с протоколом исследований, СДС лечили стандартными методами в течение 14 дней. Было отмечено сокращение размеров язвы на 7% (при норме 30%), что подтвердило замедленный характер заживления.
Аутологичный биомедицинский клеточный продукт был получен, как указано в Примере 1. Продукт вводили наружно, однократно, на 14-й день наблюдений, в дозе 50 тысяч клеток/см2 язвы. На Рис.2А показаны фотографии язвы на 1-й, 14-й (введение клеточного продукта), 42-й, 126-й, и 154-й день наблюдений. На Рис.2Б показана динамика изменения размера язвы в течение всего срока наблюдений. Площадь язвы после введения клеточного продукта сократилась на29% за первые 7 дней. Полное заживление язвы произошло через 154 дня с момента введения клеточного продукта.
Пример 5.
Настоящий пример иллюстрирует способ лечения СДС у пациента 3 путем введения биомедицинского клеточного продукта настоящего изобретения.
Пациент в возрасте 48 лет с СД 2 типа и СДС нейропатической формы и язвой на подошвенной поверхности левой стопы площадью 20,4 см2, 2А стадии (TexasUniversityclassification), незаживающей в течение 6 месяцев.
В соответствии с протоколом исследований, СДС лечили стандартными методами в течение 14 дней. Было отмечено сокращение размеров язвы на 11% (при норме 30%), что подтвердило замедленный характер заживления.
Аутологичный биомедицинский клеточный продукт был получен, как указано в Примере 1. Продукт вводили наружно, однократно, на 14-й день наблюдений, в дозе 50 тысяч клеток/см2 язвы. На Рис.3А показаны фотографии язвы на 1-й, 14-й (введение клеточного продукта), 38-й, 75-й, и 98-й день наблюдений. На Рис.3Б показана динамика изменения размера язвы в течение всего срока наблюдений. Площадь язвы после введения клеточного продукта сократилась на 15% за первые 7 дней. Полное заживление язвы произошло через 98 дней с момента введения клеточного продукта.
Пример 6.
Настоящий пример иллюстрирует способ лечения СДС у пациентов 1-3 путем введения биомедицинского клеточного продукта настоящего изобретения.
Таблица 1 показывает среднюю суточную скорость заживления язвы у пациентов 1-3 в течение двухнедель либо стандартной терапии (контроль) или после введения аутологичного биомедицинского клеточного продукта настоящего изобретения, в дозе 50 тысяч клеток/см2 язвы.
Таблица 1
|
Таблица 1 показывает, что введение клеточного продукта достоверно повышает среднюю суточную скорость заживления язвы по сравнению с контролем (*p<0.02; t=7.37; ratiot-test).