Результат интеллектуальной деятельности: СОЕДИНЕНИЯ ДИГИДРОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ПРИМЕНЕНИЯ
[0001] В настоящей заявке изложены приоритеты и преимущества Заявок на патент в Китае №201310590683.6 и 201410108925.8, поданных в государственную службу по защите прав интеллектуальной собственности Китая соответственно 19 ноября 2013 г. и 23 марта 2014 г., которые включены в настоящее описание посредством ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ
[0002] Изобретение касается соединений дигидропиримидина и их фармацевтических соединений, и также касается использования соединений или фармацевтических составов в изготовлении лекарственных средств, в частности для использования при профилактике, контроле, лечении или уменьшении вирусного заболевания или вируса гепатита В.
УРОВЕНЬ ТЕХНИКИ
[0003] Вирус гепатита В принадлежит семье гепаднавирусов. Он может вызвать острые и/или постоянные или прогрессивные хронические заболевания. Многие другие клинические проявления в патологической морфологии также могут быть вызваны ВГВ (HBV) - в частности, хронический гепатит, цирроз и гепатоцеллюлярный рак. Кроме того, совместное инфицирование вирусом гепатита D может оказывать неблагоприятные эффекты на прогрессирование заболевания.
[0004] Стандартными медикаментами, одобренными для лечения хронического гепатита, являются интерферон и ламивудин. Однако интерферон оказывает просто умеренное действие, но имеет неблагоприятные побочные реакции. Несмотря на то, что ламивудин оказывает хорошее действие, устойчивость к препарату развивается быстро во время лечения, и эффекты рецидива часто наблюдаются после прекращения лечения. Значение IC50 (3-ТС) ламивудина составляет 300 нм (Science, 2003, 299, 893-896).
[0005] Deres и др., сообщают о соединениях дигидропиримидина с замещенным гетероарилом (НАР), представленных Bay41-4109 и Bay39-5493, и эти соединения играют роль в блокировании репликации ВГВ путем предотвращения формирования вирусных коровых частиц (нуклеокапсиды). Bay41-4109 продемонстрировал лучшие метаболические параметры препарата в клиническом исследовании (Science, 2003, 299, 893-896). Исследование механизма действия этих соединения указало, что посредством реакции с 113-143 остатками аминокислоты корового белка, соединения дигидропиримидина с замещенным гетероарилом изменили угол между димерами, которые могут формировать нуклеокапсиды, и привели к формированию нестабильно расширенных нуклеокапсидов, ускоряющих распад корового белка (Biochem. Pharmacol., 2003, 66, 2273-2279).
[0006] Новые и эффективные антивирусные соединения срочно необходимы, в частности для лечения и/или профилактики инфекции ВГВ.
РЕЗЮМЕ
[0007] Изобретение касается новых соединений дигидропиримидина и фармацевтических соединений и их использования при изготовлении лекарственных средств для профилактики, контроля, лечения или уменьшения вирусного заболевания, в частности инфекции или заболевания гепатита В (ВГВ), вызванного инфекцией гепатита В.
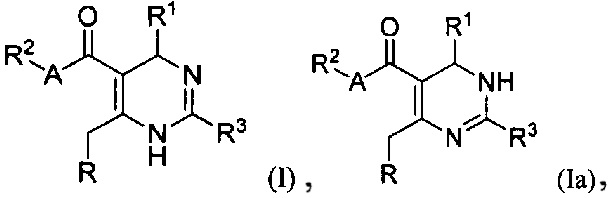
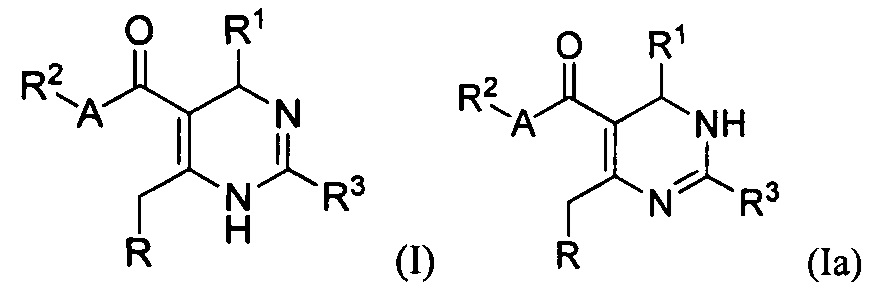
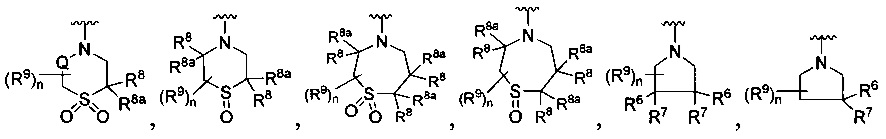
[0008] В одном аспекте в настоящем документе описаны соединения, имеющие Формулу (I) или (Ia), или их энантиомер, диастереоизомер, таутомер, гидрат, сольват, пролекарство, стереоизомер, N-оксид или их фармацевтически приемлемая соль, 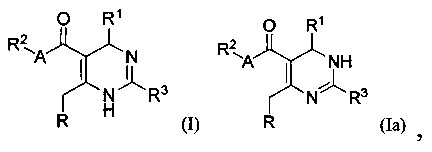
где R1 является С6-10 арилом или C1-9 гетероарилом;
R3 является 5-членной гетероарильной группой;
А является звеном, -О-, -S- или -NR5-;
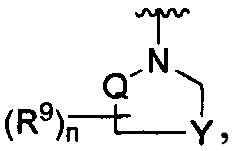
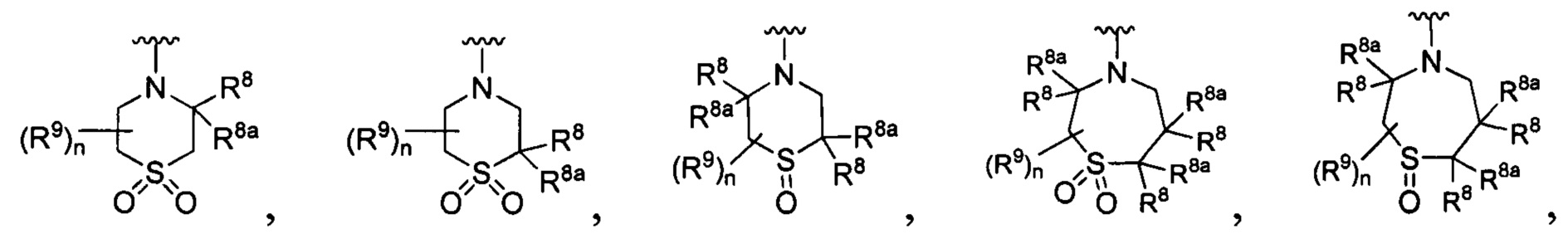
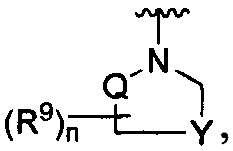
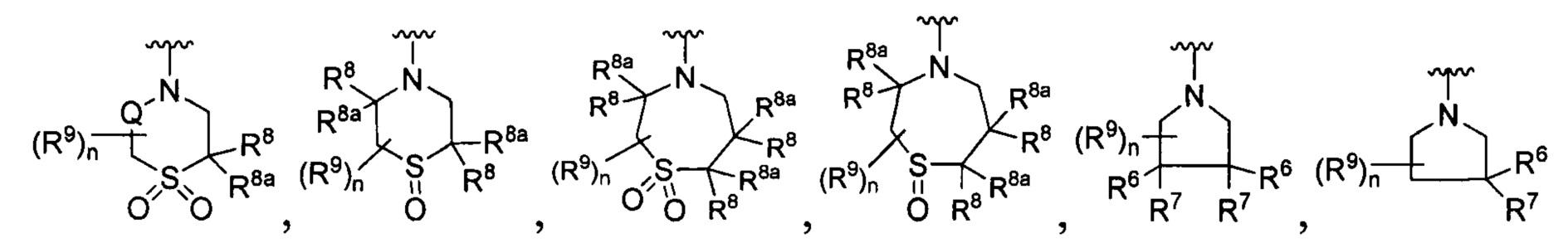
R является
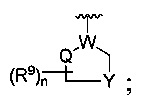
где W является CR4 или N;
каждый из R2, R4 и R5 является независимо водородом или С1-4 алкилом;
Y является -(CR8R8a)k-S(=O)q- или -(CR7R6)n-;
Q является -(CR8R8a)k-;
каждый R7 является независимо водородом, F или алкилом;
каждый R6 является независимо F или алкилом;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом, цианистым или алкильным;
каждый R9 независимо является -(CR10R10a)t-OH, триазолилом, тетразолилом, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(-O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, (CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, галогеном, галоалкилом или алкилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют циклоалкил, гетероциклил или -С(=O)-;
каждый R11 представляет собой независимо водород, алкил, алкокси, гидрокси, алкил-S(=O)q-, арил, гетероарил, циклоалкил, гетероциклил, арилалкил, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- или арил-S(=O)q-;
R11a является алкилом, алкокси, гидрокси, алкил-S(=O)q-, арилом, гетероарилом, циклоалкилом, гетероциклилом, арилалкилом, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- или арил-S(=O)q-;
каждый n равняется независимо 1, 2 или 3;
каждый t и m равняются независимо 1, 2, 3 или 4;
каждый q равняется независимо 1 или 2; и
каждый k независимо 0, 1, 2, 3 или 4;
где каждый алкокси, алкил-S(=O)q-, арил, гетероарил, арилалкил, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- и арил-S(=O)q-, описанный в R11 и R11a, алкил, описанный в R6, R7, R8, R8a, R10, R10a, R11a и R11, галоалкил, описанный в R10 и R10a, гетероциклил и циклоалкил, описанный в R10, R10a, R11a и R11, триазолил и тетразолил, описанный в R9, 5-членная гетероарильная группа, описанная в R3, С1-4 алкил, описанный в R1, R4 и R5, и С6-10 арил и C1-9 гетероарил, описанный в R1, произвольно и независимо замещаются одним или несколькими заместителями, независимо выбранными из водорода, фторо-, хлоро-, бромо-, йодо-, оксо- (=O), метилен (=CH2), алкил, алкокси, циано, гидрокси, нитро, алкиламино, амино, арил, гетероарил, гетероциклил, циклоалкил, трифторометил, трифторометокси, галоалкил-замещенный арил, галоген-замещенный арил или трифторометилсульфонил.
[0009] В некоторых воплощениях,
R является 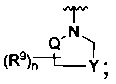
Где Y -(CR8R8a)k-S(=O)q- или -(CR7R6)n-;
Q является -(CR8R8a)k-;
каждый R7 является независимо водородом, С1-4 алкилом или F;
каждый R6 является независимо F или С1-4 алкилом;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом или С1-4 алкилом;
каждый R9 является независимо -(CR10R10a)t-OH, триазолилом, тетразолилом, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a является независимо водородом, галогеном, С1-4 галоалкилом или С1-4 алкилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют С3-6 циклоалкил, С2-9 гетероциклил или -С(=O)-;
каждый R11 является независимо водородом, C1-6 алкилом, С1-6 алкокси, С1-6 алкил-S(=O)q-, арил С6-10, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-6-алкилом, С2-9 гетероциклил-S(=O)q-, С1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-; и
R11a является С1-6 алкилом, С1-6 алкокси, С1-6 алкил -S(=O)q-, С6-10 арилом, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-6-алкилом, С2-9 гетероциклил-S(=O)q-, C1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-.
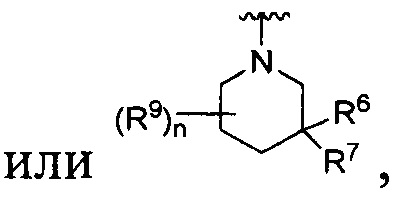
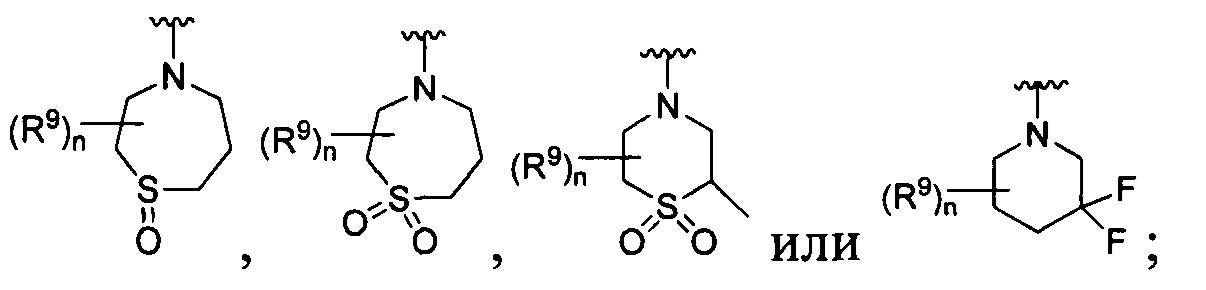
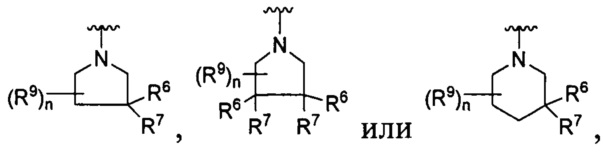
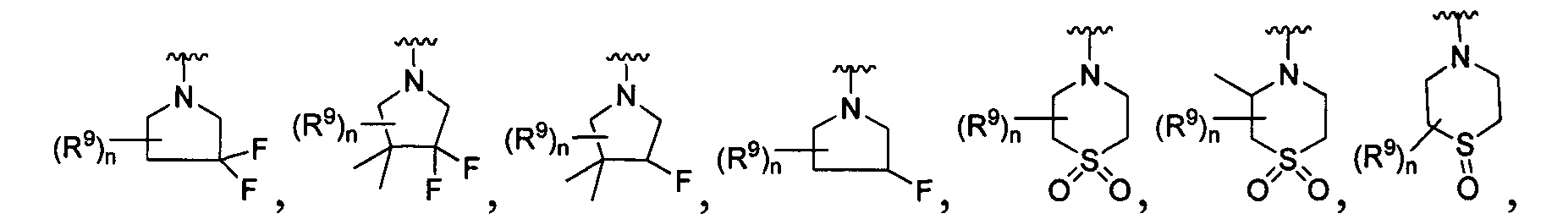
[0010] В других воплощениях R является
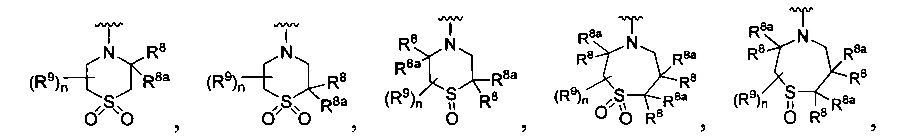
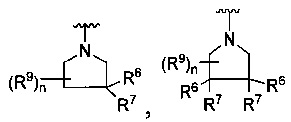 или
или 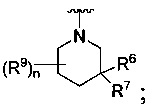
где каждый R7 является независимо водородом, метилом, этилом или F;
каждый R6 является независимо F, метилом или этилом;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом, метилом, этилом или пропилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолилом, тетразолилом, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фторо-, хлоро-, бромо-, йодо-, трифторометилом, метилом, этилом, пропилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют циклопропил, циклобутил, циклопентил, циклогексил или -С(=O)-;
каждый R11 является независимо водородом, C1-4 алкилом, С1-4 алкокси, C1-4 алкил-S(=O)2-, фенилом, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-; и
R11a является С1-4 алкилом, С1-4 алкокси, C1-4 алкил-S(=O)2-, фенилом, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-.
[0011] В некоторых воплощениях,
R1 является фенилом;
R3 является тиазолилом или 1-метил-1H-имидазолилом; и
каждый из R2, R4 и R5 является независимо водородом, метилом или этилом;
где каждый тиазолил и 1-метил-1H-имидазолил, описанный в R3, фенил, описанный в R1, и метил и этил, описанный в R2, R4 и R5, произвольно и независимо замещены одним или несколькими заместителями, независимо выбранными из водорода, С1-4 алкила, фторо, хлоро- или бромо.
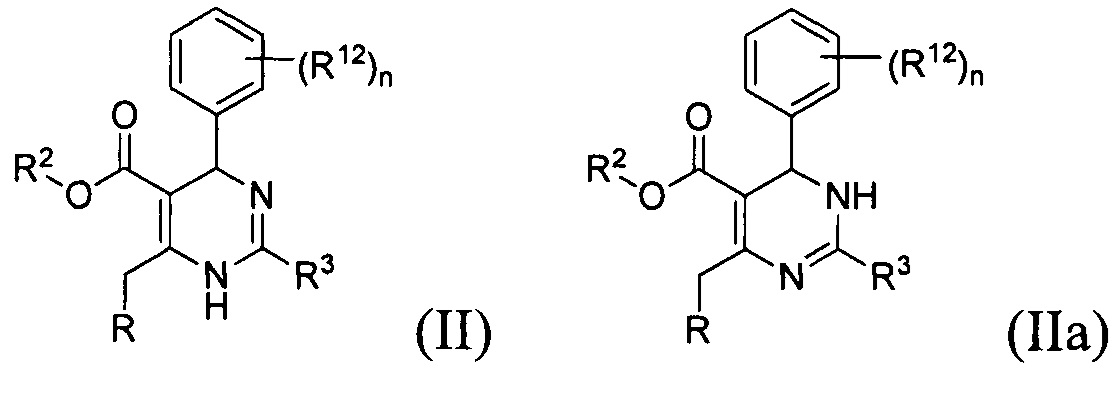
[0012] Некоторые воплощения, приведенные здесь, представляют соединения, имеющие Формулу (II) или (IIa), или их энантиомер, диастереоизомер, таутомер, гидрат, сольват, пролекарство, стереоизомер, N-оксид или фармацевтически приемлемую соль, 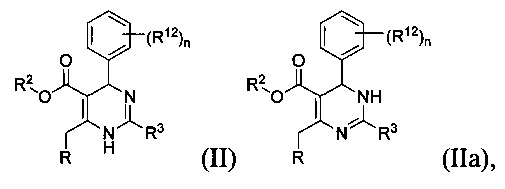
где
R2 является водородом или С1-4 алкилом;
R3 представляет собой тиазолил или 1-метил-1H-имидазолил;
R представляет собой
или 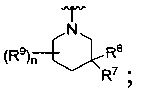
где каждый R7 является независимо водородом, C1-4 алкилом или F;
каждый R6 независимо F или С1-4 алкил;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
Q является -(CR8R8a)k-;
каждый R8 и R8a являются независимо водородом или С1-4 алкилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(-O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фторо-, хлоро-, бромо-, йодо-, С1-4 галоалкилом или С1-4 алкил, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, образуют С3-6 циклоалкил или -С(=O)-;
каждый R11 является независимо водородом, С1-4 алкилом, С1-4 алкокси, гидрокси, С1-4 алкил-S(=O)q-, С6-10 арилом, C1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-4 алкилом, С2-9 гетероциклил-S(=O)q-, C1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-;
R11a является С1-4 алкилом, С1-4 алкокси, гидрокси, С1-4 алкил-S(=O)q-, С6-10 арилом, C1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-4 алкилом, С2-9 гетероциклил-S(=O)q-, С1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-;
каждый R12 является независимо водородом, фторо-, хлоро- или бромо-;
каждый n равняется независимо 1, 2 или 3;
каждый t и m равняются независимо 1, 2, 3 или 4;
каждый q равняется независимо 1 или 2; и
каждый k независимо 0, 1, 2, 3 или 4.
[0013] Другие воплощения, где R
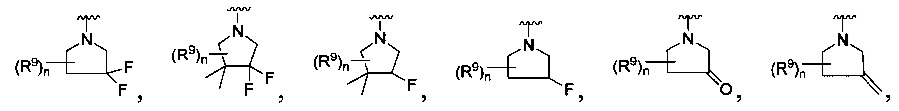
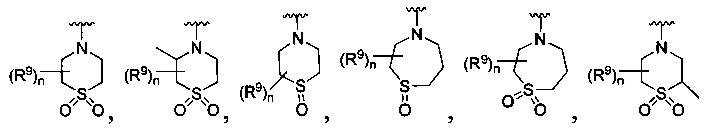 или
или 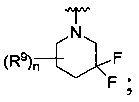
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил,
-(CR10R10a)m-C(=O)O-R11,-(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11,
-S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2,
-(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11,
-(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11,
-(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или
-(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фтοрο-, хлоро-, трифторометилом, метилом, этилом, пропилом, изопропилом, n-бутилбутилом или n-бутилом, или R10 и R10a вместе с атомом углерода, к которому они присоединены, формируют циклопропил, циклобутил, циклопентил, циклогексил или -С(=O)-;
каждый R11 является независимо водородом, метилом, этилом, пропилом, изопропилом, трет-бутилом, n-бутилом; метоксилом, этокси, пропокси, изопропокси, терт-бутокси, n-бутокси, метил-S(=O)2-, этил-S(=O)2-, пропил-S(=O)2-, изопропил-S(=O)2-, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-; и
R11a является метилом, этилом, пропилом, изопропилом, трет-бутилом, n-бутилом; метоксилом, этокси, пропокси, изопропокси, терт-бутокси, n-бутокси, метил-S(=O)2-, этил-S(=O)2-, пропил-S(=O)2-, изопропил-S(=O)2-, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-.
[0014] В одном аспекте, приведенном в настоящем документе, фармацевтическая композиция, включает соединение, раскрытое в настоящем документе, и фармацевтически приемлемый носитель, наполнитель, разжижитель, вспомогательное вещество, несущую среду или их комбинацию.
[0015] В некоторых воплощениях фармацевтическая композиция далее содержит агент анти-ВГВ.
[0016] В других воплощениях агент анти-ВГВ является ингибитором полимеразы ВГВ, иммуномодулятором или интерфероном.
[0017] В других воплощениях агент анти-ВГВ включает, по крайней мере, одно из веществ, выбранных из группы, состоящей из ламивудина, тельбивудина, тенофовира, энтекавира, адефовира, альфаферона, аллоферона, цельмолейкина, клевудина, эмтрицитабина, фамцикловира, интерферона, гепатекта CP, интефена, интерферона α-1b, интерферона α, интерферона α-2а, интерферона β-1а, интерферон аα-2, интерлейкина 2, мивотилата, нитазоксанида, пегинтерферона альфа-2а, рибавирина, роферон-А, сизофирана, евфоравака, амплигена, фосфазида, геплисава, интерферона α-2b, левамизола и проапгермания.
[0018] В другом аспекте, приведенном в настоящем документе, описано использование соединения или фармацевтической композиции при изготовлении лекарственного средства для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ.
[0019] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[0020] В других воплощениях заболеванием, вызванным инфекцией гепатита В, является цирроз или гепатоцеллюлярный рак.
[0021] В другом аспекте, приведенном в настоящем документе, описано соединение или фармацевтическая композиция для изготовления лекарственного средства для использования в профилактике, контроле, лечении или уменьшении вирусного заболевания или заболевания ВГВ.
[0022] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[0023] В других воплощениях заболевание, вызванное инфекцией гепатита В, является циррозом или гепатоцеллюлярным раком.
[0024] В другом аспекте, приведенном в настоящем документе, описан способ для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, включающий введение пациенту терапевтически эффективного объема соединения или фармацевтической композиции.
[0025] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[0026] В других воплощениях заболевание, вызванное инфекцией гепатита В, является циррозом или гепатоцеллюлярным раком.
[0027] В другом аспекте, приведенном в настоящем документе, описано использование соединения или фармацевтической композиции при изготовлении лекарственного средства для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ у пациента, включая введение пациенту терапевтически эффективного объема соединения или состава, раскрытого в настоящем документе.
[0028] В другом аспекте, приведенном в настоящем документе, описаны способы для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, включающие введение пациенту фармацевтически эффективного объема соединения, раскрытого в настоящем документе.
[0029] В другом аспекте, приведенном в настоящем документе, описаны способы профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, включающие введение пациенту фармацевтически эффективного объема фармацевтической композиции, раскрытой в настоящем документе.
[0030] В другом аспекте, приведенном в настоящем документе, описано использование соединения, раскрытого в настоящем документе, при изготовлении лекарственного средства для профилактики, контроля или лечения вирусного заболевания или заболевания ВГВ и уменьшения степени тяжести вирусного заболевания или заболевания ВГВ.
[0031] В другом аспекте, приведенном в настоящем документе, описано использование фармацевтической композиции, включающей соединение, раскрытое в настоящем документе, при изготовлении лекарственного средства для профилактики, контроля или лечения вирусного заболевания или заболевания ВГВ и уменьшения степени тяжести вирусного заболевания или заболевания ВГВ у пациента.
[0032] В некоторых воплощениях организм является млекопитающим; в других воплощениях организм является человеком. В других воплощениях способ далее включает контакт киназы с терапевтическим агентом против ВГВ.
[0033] В другом аспекте, приведенном в настоящем документе, описан способ ингибирования инфекции ВГВ, включая контакт клетки с эффективным объемом соединения для ингибирования ВГВ, раскрытого в настоящем документе, или его состава. В других воплощениях способ далее включает контакт клетки с терапевтическим агентом против ВГВ.
[0034] В другом аспекте, приведенном в настоящем документе, описан способ лечения заболевания ВГВ, причем способ включает введение нуждающемуся пациенту терапевтически эффективного объема соединения, раскрытого в настоящем документе, или его состава. В других воплощениях способ далее включает введение терапевтического агента против ВГВ.
[0035] В другом аспекте, приведенном в настоящем документе, описан способ ингибирования инфекции ВГВ, причем способ включает введение нуждающемуся пациенту терапевтически эффективного объема соединения, раскрытого в настоящем документе, или его состава. В других воплощениях способ далее включает введение терапевтического агента против ВГВ.
[0036] В другом аспекте, приведенном в настоящем документе, включены способы подготовки, способы отделения и способы очищения соединений по Формуле (I) или (Ia) и определенных соединений изобретения.
[0037] Предшествующие параграфы только суммируют определенные аспекты, раскрытые в настоящем документе, и не имеют ограничивающего характера. Эти аспекты и другие аспекты и воплощения описаны более детально далее.
ПОДРОБНОЕ ОПИСАНИЕ, ОПРЕДЕЛЕНИЯ И ОБЩАЯ ТЕРМИНОЛОГИЯ
[0038] Ниже дана детальная ссылка на определенные воплощения, раскрытые в настоящем документе, примеры которых проиллюстрированы в сопровождающих структурах и формулах. Изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем применения, раскрытый в настоящем документе, как определено формулой изобретения. Специалисту в области известны многие способы и материалы, подобные или эквивалентные описанным в настоящем документе, которые могут использоваться в практике, раскрытой в настоящем документе. Настоящее описание никоим образом не ограничивается способами и материалами. Если один или несколько источников литературы, патентов и подобных материалов отличаются или противоречат настоящей заявке, включая, без ограничений, определенные термины, использование терминов, описанные способы, и т.п., настоящая заявка является определяющей.
[0039] Далее очевидно, что определенные признаки изобретения, которые, для ясности, описаны в контексте отдельных воплощений, могут также представляться в комбинации в единственном воплощении. С другой стороны различные признаки изобретения, которые, для краткости, описаны в контексте единственного воплощения, могут также представляться отдельно или в любой подходящей под комбинации.
[0040] Если не определено иначе, все технические и научные термины, использованные в настоящем документе, имеют то же значение, которое обычно подразумевается специалистом в области, которой принадлежит настоящее изобретение. Все патенты и публикации, упомянутые в настоящем документе, полностью включены посредством ссылок.
[0041] Как используется в настоящем документе, применяются следующие определения, если не указано иначе. В целях, раскрытых в настоящем документе, химические элементы идентифицируются в соответствии с Периодической таблицей элементов, по версии CAS, и Руководства по химии и физике, 75 изд. 1994 год. Кроме того, общие принципы органической химии описаны в Sorrell и др., «Organic Chemistry», University Science Books, Саусалито: 1999 и Smith и др., "March's Advanced Organic Chemistry", John Wiley & Sons, Нью-Йорк: 2007, все из которых полностью включены в настоящий документ ссылкой.
[0042] Грамматические артикли означают «по крайней мере, один» или «один или несколько», если иначе не обозначено в настоящем документе, или ясно не вытекает из контекста. Таким образом, артикли используются для описания одного или несколько (т.е. по крайней мере, одного) грамматических объектов. Например, «компонент» означает один или несколько компонентов, и таким образом, больше чем один компонент может рассматриваться и использоваться, или использоваться в осуществлении описанных воплощений.
[0043] Как используется в настоящем документе, «пациент» относится к человеку (включая взрослых и детей) или животному. В одном воплощении «пациент» относится к человеку.
[0044] Термин «включая» означает открытое окончание, включая обозначенный компонент, но не, исключая другие элементы.
[0045] Термин «стереоизомеры» относится к составам, имеющим идентичную химическую структуру, но отличающимся относительно устройства атомов или групп в пространстве. Стереоизомеры включают энантиомер, диастереомеры, конформеры (ротамеры), геометрические (цис/транс) изомеры, атропизомеры, и т.д.
[0046] Термин «хиральный» относится к молекулам, имеющим свойство неналагающегося зеркального изображения, в то время как термин «ахиральный» относится к молекулам, которые имеют свойства налагающегося зеркального изображения.
[0047] Термин «энантиомеры» относится к двум стереоизомерам соединения, которые являются неналагающимися зеркальными изображениями друг друга.
[0048] Термин «диастереомер» относится к стереоизомеру с двумя или большим количеством центров хиральности, и молекулы которого не являются зеркальными отображениями друг друга. Диастереомеры имеют различные физические свойства, например, температуру плавления, точки кипения, спектральные свойства или биологические действия. Смесь диастереомеров может разделяться в соответствии с аналитическими процедурами с высоким разрешением, такими как электрофорез и хроматография, например, ВЭЖХ.
[0049] Как описано в настоящем документе, соединения, раскрытые в настоящем документе, могут быть произвольно замещены одним или несколькими заместителями, которые проиллюстрированы выше, определенными соединениями, или, как иллюстрируется определенными классами, подклассами и разновидностями, раскрытыми в настоящем документе. Очевидно, что фраза «произвольно замещены» используется наравне с фразой «замещенный или незамещенный». В целом термин «замещенный» относится к замещению одного или нескольких водородных радикалов в данной структуре радикалом указанного заместителя. Если иначе не указано, группа, замещенная произвольно, может иметь заместитель в каждом замещаемом положении группы. Когда больше чем одно положение в данной структуре может быть замещено больше чем одним заместителем, выбранным из указанной группы, заместитель может быть тем же или различным в каждом положении. Причем заместители включают, без ограничения, водород, фторо-, хлоро-, бромо-, йодо-, оксо- (=O), метилен (=CH2), алкил, алкокси, циано, гидрокси, тио, нитро, алкиламино, амино, арил, арилалкил, гетероарил, гетероарилалкил, гетероциклил, гетероциклилалкил, циклоалкил, циклоалкилалкил, трифторометил, трифторметокси, галоалкил замещенный арил, галоген замещенный арил или трифторометилсульфонил, и т.п.
[0050] В различных местах в настоящей спецификации заместители соединений, раскрытых в настоящем документе, раскрыты в группах или в диапазонах. В частности предполагается, что изобретение включает каждую отдельную подкомбинацию членов таких групп и диапазонов. Например, термин «C1-6 алкильная группа» относится, соответственно, к метилу, этилу, С3 алкилу, С4 алкилу, С5 алкилу, С6 алкилу.
[0051] В различных местах в настоящей спецификации описаны связывающие заместители. Если структура ясно требует связывающей группы, переменные Маркуша, перечисленные для такой группы считаются связывающими группами. Например, если структура требует связывающей группы, и определение группы Маркуша для той переменной включает «алкил» или «арил» тогда, очивидно, что «алкил» или «арил» представляют связывающую алкиленовую группу или ариленовую группу, соответственно.
[0052] Термин «алкил» или «алкильная группа» относится к насыщенной нормальной или разветвленной цепи моновалентного радикала углеводорода из 1-20 атомов углерода, где алкильный радикал может быть произвольно заменен независимо одним или несколькими заместителями, описанными в настоящем документе. Если иначе не определено, алкильные группы содержат 1-20 атомов углерода. В некоторых воплощениях алкильные группы содержат 1-10 атомов углерода. В других воплощениях алкильные группы содержат 1-8 атомов углерода. В других воплощениях алкильные группы содержат 1-6 атомов углерода, и в еще других воплощениях, алкильные группы содержат 1-4 атома углерода. В других воплощениях алкильные группы содержат 1-3 атома углерода. Некоторые неограничивающие примеры алкильной группы включают, без ограничений, метил (Ме, -CH3), этил (Et, -CH2CH3), 1-пропил (n-Pr, -CH2CH2CH3), 2-пропил (i-Pr, -СН(CH3)2), 1-бутил (n-Bu, -CH2CH2CH2CH3), 2-метил-1-пропил или изобутил (i-Bu, -CH2CH(CH3)2), 1-метилпропил или sec-бутил (s-Bu, -CH(CH3)CH2CH3), трет-бутил (t-Bu, -C(CH3)3), 1-пентил (-CH2CH2CH2CH2CH3),
2-пентил (-СН(CH3)CH2CH2CH3), 3-пентил (-СН(CH2CH3)2), 2-метил-2-бутил (-С(CH3)2CH2CH3), 3-метил-2-бутил (-СН(CH3)СН(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-СН(CH3)CH2CH2CH2CH3), 3-гексил (-СН(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-С(CH3)2CH2CH2CH3), 3-метил-2-пентил (-СН(CH3)СН(CH3)CH2CH3), 4-метил-2-пентил (-СН(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-С(CH3)(CH2CH3)2), 2-метил-3-пентил (-СН(CH2CH3)СН(CH3)2), 2,3-этан-2-бутил (-С(CH3)2СН(CH3)2), 3,3-этан-2-бутил (-СН(CH3)С(CH3)3, 1-гептил, 1-октил, и т.п.
[0053] Термин «галоалкил» или «галоалкокси» относится к алкильному радикалу или алкокси радикалу, замещенный одним или несколькими атомами галогена (т.е. F, Cl, Br или I), который может быть тем же или различным. Причем алкильная группа и алкокси группа как определяются в настоящем документе. Некоторые неограничивающие примеры таких радикалов включают трифторометил, трифтороэтил, трифторометокси, и т.п.
[0054] Термин «алкенил» относится к линейной или разветвленной цепи моновалентного радикала углеводорода из двух - двенадцати атомов углерода, по крайней мере, с одним местом ненасыщенности, т.е. углерод-углерод, двойная связь sp2, где алкенильный радикал может быть произвольно замещен одним или несколькими заместителями, описанными в настоящем документе, и включает радикалы, имеющие ориентации «цис» и «транс», или альтернативно, ориентации «Е» и «Z». В некоторых воплощениях, алкенильные группы содержат 2-8 атомов углерода. В других воплощениях, алкенильные группы содержат 2-6 атомов углерода. В других воплощениях, алкенильные группы включают, содержат 2-4 атома углерода. Примеры включают, без ограничения, этенил или винил (-СН=CH2), аллил (-CH2CH=CH2), и т.п.
[0055] Термин «циклоалкил» или относится к моновалентному или многовалентному, неароматическому, насыщенному или частично ненасыщенному кольцу, имеющему 3-12 атомов углерода как моноциклическая, бициклическая система, или трициклическое кольцо, где циклоалкильный радикал может быть произвольно замещен одним или несколькими заместителями, описанными в настоящем документе. В некоторых воплощениях циклоалкил содержит 3-12 атомов углерода. В других воплощениях циклоалкил содержит 3-8 атомов углерода, и в еще других воплощениях, циклоалкил содержит 3-6 атомов углерода. Примеры включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, суберил, и т.п.
[0056] Термин «циклоалкилалкил» относится к алкильному радикалу, замещенным одной или несколькими циклоалкильными группами, где алкильные и циклоалкильные группы как определяются в настоящем документе. Некоторые неограничивающие примеры таких радикалов включают циклопропилметил, циклопропилэтил, циклопропилпропил, циклобутилметил, циклобутилэтил, циклобутилпропил, циклопентилметил, циклопентилэтил, циклопентилпропил, и т.п.
[0057] Термин «гетероцикл», «гетероциклил» или «гетероциклическое ядро», как используется взаимозаменяемо в настоящем документе, относится к насыщенному или частично ненасыщенному моноциклическому, бициклическому или трициклическому кольцу, содержащему 3-12 кольцевых атома, из которых, по крайней мере, один кольцевой атом выбран из азота, серы и кислорода. Причем, радикальный гетероцикл может быть произвольно замещен одним или несколькими заместителями, описанными в настоящем документе. Если иначе не определено, гетероцикл может быть связан углеродом или азотом, и где -CH2- группа может произвольно быть замещена группой -С(=O)-. Кольцевые атомы серы могут быть произвольно окислены для формирования S-оксидов. Кольцевые атомы азота в гетероцикле могут быть произвольно окислены для формирования N-оксидов. В некоторых воплощениях гетероциклил может быть С2-10 гетероциклилом, который содержит 2-10 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В других воплощениях гетероциклил может быть С2-9 гетероциклилом, который содержит 2-9 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В других воплощениях гетероциклил может быть С2-7 гетероциклилом, который содержит 2-7 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В еще другом воплощении гетероциклил может быть С2-5 гетероциклилом, который содержит 2-5 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. Некоторые неограничивающие примеры гетероциклических ядер включают пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиримидинил, тетрагидропиранил, пиперидил, морфолинил, тиоморфолинил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, глицид, 2-пирролинил, дигидроиндолинил, пиразолинил,
1,1-диоксотиоморфолинил, и т.п. Некоторые неограниченные примеры гетероциклила, где -CH2-группа замещается фрагментом -С(О)- это 2-оксипирролидинил, 2-пиперидинонил, 3-морфинонил, 3-тиоморфолинонил, окситетрагидропиримидинил, и т.п.
[0058] Термин «гетероциклилалкил» или «гетероциклоалкил» относится к гетероциклилу, присоединенному к остальной части молекулы через алкил, где алкильная и гетероциклильная группа как определяются в настоящем документе. Гетероциклилалкил произвольно замещается одним или несколькими заместителями, описанными в настоящем документе. Некоторые неограничивающие примеры гетероциклилалкила включают пиррол-2-илметил, морфолин-4-илметил, пирролидинилметил, пиперидилметил, пиперидилэтил, морфолинилметил, морфолинилэтил, и т.п.
[0059] Термин «галоген» относится к F, Cl, Br или I.
[0060] Термин «алкокси» относится к алкильной группе, как ранее определено, присоединенной к остальной части молекулы через атом кислорода. Некоторые неограничивающие примеры включают метокси (МеО, -OCH3), этиокси (EtO, -OCH2CH3), 1-пропокси (n-PrO, n-пропокси, -OCH2CH2CH3), 2-пропокси (i-PrO, i-пропокси, -ОСН(CH3)2), 1-бутокси (n-BuO, n-бутокси, -OCH2CH2CH2CH3), 2-метил-1-пропокси (i-BuO, i-бутокси, -OCH2CH(CH3)2), 2-бутокси (s-BuO, s-бутокси, -ОСН(CH3)CH2CH3), 2-метил-2-пропокси (i-BuO, t-бутокси, -OC(CH3)3), 1-пентокси (n-пентокси, -OCH2CH2CH2CH2CH3), 2-пентокси (-ОСН(CH3)CH2CH2CH3), 3-пентокси (-ОСН(CH2CH3)2), 2-метил-2-бутокси (-ОС(CH3)2CH2CH3), 3-метил-2-бутокси (-ОСН(CH3)СН(CH3)2), 3-метил-1-бутокси (-OCH2CH2CH(CH3)2), 2-метил-1-бутокси (-OCH2CH(CH3)CH2CH3), и т.п.
[0061] Термин «арил» относится к моноциклическим, бициклическим и трициклическим карбоциклическим кольцевым системам, имеющим в общей сложности шесть - четырнадцать членов кольца, или шесть - двенадцать членов кольца, или шесть - десять членов кольца. Причем, по крайней мере, одно кольцо в системе является ароматическим, где каждое кольцо в системе, содержит 3-7 членов кольца, и имеет одну или несколько точек крепления к остальной части молекулы. Термин «арил» может быть использован наравне с термином «арилзамещенное кольцо». Некоторые неограничивающие примеры арилзамещенных колец включают фенил, 2,3 дигидро 1H инденил, нафтил, антрил, и т.п. Арил произвольно может быть замещен одним или несколькими заместителями, описанными здесь.
[0062] Термин «арилалкил» относится к арилу, присоединенному к остальной части молекулы через алкил, где алкильные и арилзамещенные группы как определяются здесь. Арилалкил произвольно замещен одним или несколькими заместителями, описанными здесь. Некоторые неограничивающие примеры арилалкила включают бензил, фенилэтил, нафтилметил, и т.п.
[0063] Термин «гетероарил» относится к моноциклическим, бициклическим и трициклическим кольцевым системам, имеющим в общей сложности 5-14 членов кольца, или 5-12 членов кольца, или 5-10 членов кольца или 5-6 членов кольца, причем, по крайней мере, одно кольцо в системе является ароматическим, и, по крайней мере, одно кольцо в системе содержит один или несколько гетероатомов, выбранных из азота, серы и кислорода, причем каждое кольцо в системе, содержит 5-7 членов кольца, и имеет одну или несколько точек крепления к остальной части молекулы. Термин «гетероарил» может быть использован наравне с термином «гетероарильное кольцо» или «гетероароматическое соединение». В некоторых воплощениях гетероарилом может быть C1-9 гетероарил, содержащим 1-9 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В других воплощениях гетероарилом может быть C1-7 гетероарил, содержащим 1-7 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В других воплощениях гетероарилом может быть С1-6 гетероарил, содержащим 1-6 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. Во все еще другом воплощении гетероарилом может быть С1-5 гетероарил, содержащим 1-5 атомов углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. Во все же другом воплощении гетероарилом может быть C1-4 гетероарил, содержащий 1-4 атома углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. В другом воплощении гетероарилом может быть С1-3 гетероарил, содержащий 1-3 атома углерода и, по крайней мере, один гетероатом, выбранный из азота, серы и кислорода. Некоторые неограничивающие примеры подходящих колец гетероарила включают следующие моноциклы: фуранил (например, 2-фуранил, 3-фуранил), имидазолил (например. N-имидазолил, 1-метил-1H-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил), 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, N-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, пиридазинил (например, 3-пиридазинил), тиазолил (например, 2-тиазолил, 4-тиазолил, 5-тиазолил), тетразолил (например, 5-тетразолил), триазолил (например, 2-триазолил и 5-триазолил), 2-тиенил, 3-тиенил, пиранил, пиразолил (например, 2-пиразолил), изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пиразинил, 1,3,5-триазинил, диазолил, тиадиазолил, триазинил; и некоторые следующие примеры бициклов включают, без ограничений, бензотиазолил, бензимидазолил, бензофурил, бензотиофенил, индолил (например, 2-индолил), пуринил, квинолинил (например, 2-квинолинил, 3-квинолинил, 4-квинолинил), или изоквинолинил (например, 1-изоквинолинил, 3-изоквинолинил или 4-изоквинолинил), и т.п.
[0064] Термин «гетероарилалкил» относится к гетероарилу, присоединенному к остальной части молекулы через алкил, причем алкильные и гетероарильные группы как определяются здесь. Гетероарилалкильный радикал произвольно замещен одним или несколькими заместителями, описанными здесь. Некоторые неограничивающие примеры таких радикалов включают пиридин-2-илэтил, тиазол-2-илметил, имидазол-2-илэтил, пиримидин-2-илпропил, и т.п.
[0065] Термин "алкил-S(=O)q-", "гетероциклил-S(=O)q-", "гетероарил-S(=O)q-", "циклоалкил-S(=O)q-" и "арил-S(=O)q-" относится к алкилу, гетероциклилу, гетероарилу, циклоалкилу и арилу, присоединенному к остальной части молекулы через тионил (-S(=O)-) или сульфонил (-S(=O)2-), где q, и алкильные, гетероциклильные, гетероарильные, циклоалкильные и арильные группы как определяются здесь. Некоторые неограничивающие примеры таких радикалов включают метилсульфонил (-S(=O)CH3), циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2-, фенил-S(=O)2-, метилсульфонил (-S(=O)2CH3), и т.п.
[0066] Термин «алкиламино» относится к «N-алкиламино» и "N,N-диалкиламино", где аминогруппы независимо замещены одним алкильным радикалом или двумя алкильными радикалами, соответственно, причем алкильная группа как определяется здесь. Некоторые неограничивающие примеры подходящих алкиламино радикалов включают моно или диалкиламино, например, N-метиламино, N-этиламино, изопропиламино, пропиламино, i-бутиламино, n-бутиламино, 1-метилпропиламино, n-пентиламино, n-гексиламино, N,N-диметиламино, N,N-диэтиламино, и т.п.
[0067] Термин «галоалкил-замещенный арил» относится к арильному радикалу, замещенному одним или несколькими галоалкильными радикалами, причем галоалкильные и арильные группы как определяются в настоящем документе. Некоторые неограничивающие примеры таких радикалов включают 2-трифторометил фенил, 3,5-bis(трифторометил) фенил, 3-трифторометилфенил, 4-трифторометилфенил, 2,6-bis(трифторометил)фенил, и т.п.
[0068] Термин «галоген-замещенный арил» относится к арилу, замещенному одним или несколькими атомами галогена, причем атомы галогена (галоген) и арильные группы как определяются здесь. Некоторые неограничивающие примеры таких радикалов включают фторофенил, дифторофенил, трифторофенил, хлорофенил, дихлорофенил, трихлорофенил, бромофенил, трибромофенил, дибромофенил, фторохлорофенил, фторобромофенил, хлоробромофенил, и т.п.
[0069] Как описано здесь, звено, оттянутое от заместителя до центра одного кольца в кольцевой системе (как показано ниже), представляет замещение заместителя в любом замещаемом положении на кольцах. Например, иллюстрация а представляет возможную замену в любом из положений на кольцо А и кольцо В, как показано на ФИГ. b; ФИГ. с, ФИГ. d, ФИГ. е; ФИГ. f, ФИГ. g и ФИГ. h.
[0070] Кроме того, необходимо объяснить, что фразы «каждый… и… независимо», «каждый из… и… независимо» используются взаимозаменяемо. Нужно понимать, что определенные варианты, выраженные тем же символом, независимо взаимозаменяемы в различных группах; или определенные варианты, выраженные тем же символом, независимо взаимозаменяемы в тех же группах. Например, рисунок р, определенные варианты нескольких n являются независимо взаимозаменяемыми, и определенные варианты нескольких R9 являются независимо взаимозаменяемыми.
[0071] Как описано в настоящем документе, есть две точки крепления в системе для соединения с остальной частью молекулы. Например, Е или Е', как показано в Формуле q, могут крепиться к остальной части молекулы, т.е. если молекулярная структура является обоснованной, Е и Е' могут использоваться наравне друг с другом.
[0072] Как описано здесь, двойное звено, присоединенное к остальной части молекулы связью (как показано на рисунке k), относится к (Z) изомерам двойной связи или (Е) изомерам двойной связи или смеси (Z) изомеров двойной связи и (Е) изомерам двойной связи.
[0073] Если не указано иное, структуры, изображенные здесь, также включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационныйе)) формы структуры; например, конфигурации R и S для каждого центра асимметрии, (Z) и (E) изомеры двойной связи, и (Z) и (Е) конформационные изомеры. Поэтому единственные стереохимические изомеры, а также энантиомерные, диастереомерные или геометрические (или конформационные) смеси существующих соединений входят в объем, раскрытый здесь.
[0074] Термин «пролекарство» относится к соединению, преобразованному in vivo в соединение по Формуле (I) или (Ia). На такое преобразование может повлиять, например, гидролиз в крови или ферментативное преобразование формы пролекарства в родительскую форму в крови или ткани. Пролекарства соединений, раскрытых здесь, могут быть, например, сложными эфирами. Сложные эфиры, которые могут быть использованы как пролекарства в данном изобретении, являются сложными фениловыми эфирами, алифатическими эфирами (С1-24), ацилоксиметиловыми эфирами, карбонатами, карбаматами и эфирами аминокислот. Например, соединение, раскрытое здесь, содержит группу ОН, может быть ацилирован в этом положении в форме пролекарства. Другие формы пролекарства включают фосфаты, например, фосфаты, полученные из фосфинирования группы ОН на родительском соединении. Полное обсуждение пролекарств приведено в Higuchi и др., Pro-drugs as Novel Delivery Systems, Издание 14 A.C.S. Simposium Series; Roche и др., Bioreversible Carriers in Drug Design, Американская Фармацевтическая Ассоциация и Pergamon Press, 1987; Rautio и др., Prodrugs: Design and Clinical Applications, Nature Review, Drug Discovery 2008, 7, 255-270, и Hecker и др., Prodrugs of Phosphates and Phosphonates, J Med. Chem., 2008, 51, 2328-2345, все из которых включены здесь ссылкой.
[0075] Если не указано иное, все таутомерные формы соединений, раскрытых здесь, находятся в рамках изобретения. Кроме того, если не указано иное, структуры, изображенные в настоящем, также включают составы, отличающиеся только присутствием одного или нескольких изотопически обогащенных атомов.
[0076] «Метаболит» является продуктом, произведенным через метаболизм указанного соединения или его соли в организме. Метаболиты соединения могут быть идентифицированы с помощью обычных способов, известных в области, и их действия определяются с помощью анализов, как описано в настоящем документе. Такие продукты могут быть получены, например, в результате окисления, восстановления, гидролиза, амидирования, дезамидирования, эстерификации, деэстерификации, ферментного распада и т.п. вводимого соединения. Соответственно, изобретение включает метаболиты соединений, раскрытых здесь, включая соединения, произведенные процессом, включающим контакт соединения, раскрытого здесь с млекопитающим, в течение времени, достаточного для получения метаболического продукта.
[0077] Стереохимические определения и обозначения, используемые в настоящем документе, обычно, следуют из Parker, и др., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, Нью-Йорк и Eliel, и др., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., Нью-Йорк, 1994.
[0078] Любой асимметричный атом (например, углерод и т.п.) соединения, раскрытого в настоящем документе, может присутствовать в рацемическом или энантиомерно обогащенном состоянии, например, конфигурации (R)-, (S)- или (R, S)-. В определенных воплощениях каждый асимметричный атом имеет, по крайней мере, 50%-й энантиомерный избыток, по крайней мере 60%-й энантиомерный избыток, по крайней мере 70%-й энантиомерный избыток, по крайней мере 80%-й энантиомерный избыток, по крайней мере 90%-й энантиомерный избыток, по крайней мере 95%-й энантиомерный избыток или по крайней мере 99%-й энантиомерный избыток в конфигурации (R)- или (S)-. Предполагается, что все стереоизомерные формы соединений, раскрытых здесь, включая, без ограничений, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, являются частью данного изобретения. Многие органические соединения существуют в оптически активных формах, т.е. имеют способность вращать плоскость плоскополяризованного света. В описании оптически активного соединения префиксы D и L, или R и S используются для обозначения абсолютной конфигурации молекулы об ее хиральном центре. Префиксы d и l или (+) и (-) используются для обозначения признака вращения плоскополяризованного света соединения, причем (-) или l подразумевают, что соединение является левовращающим. Соединение, обозначаемое префиксом (+) или d, является правовращающим. Для данной химической структуры эти стереоизомеры идентичны за исключением того, что они являются зеркальными отображениями друг друга. Определенный стереоизомер может также упоминаться как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 упоминается как рацемическая смесь или рацемат, который может быть образован в случае отсутствия стереовыбора или стереоспецифичности в химической реакции или процессе. Термин "рацемическая смесь" или «рацемат» относится к эквимолекулярной смеси двух энантиомерных разновидностей, лишенных оптической активности.
[0079] Термин «таутомер» или «таутомерная форма» относится к структурным изомерам различных энергий, которые равноценны через низкоэнергетический барьер. Если таутомеризация возможна (например, в растворе), может быть достигнуто химическое равновесие таутомеров. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимные преобразования через миграцию протона, такие как изомеризации имина-энамина и кето-энола. Таутомеры валентности включают взаимные преобразования перестройкой некоторых электронов связи. Определенным примером кето-энольной таутомеризации является взаимное преобразование таутомеров пентан-2,4-дион и 4-гидроксипент-3-ен-2-он. Другим примером таутомеризации является таутомеризация фенола-кето. Определенным примером таутомеризации фенола-кето является взаимное преобразование таутомеров пиридин-4-ол и пиридин-4(1H)-он. Если не указано иное, все таутомерные формы составов, раскрытых в настоящем изобретении, находятся в рамках изобретения.
[0080] "Фармацевтически приемлемые соли" относится к органическим или неорганическим солям соединения, раскрытого в настоящем документе.
Фармацевтически приемлемые соли известны в области. Например, Berge и др., описывает фармацевтически приемлемые соли подробно в журнале J. Pharmacol Sci, 1977, 66, 1-19, который включен ссылкой. Некоторые неограничивающие примеры фармацевтически приемлемых солей включают соли аминогруппы, сформированные неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота; или органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота; или при помощи других способов, используемых в области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, соль яблочной кислоты, 2-гидракриловую кислую соль, альгинат, аскорбат, аспартат, бензенсульфонат, бензоат, бисульфат, борат, бутират, камфановую кислую соль, сатрпогсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, йодгидрат, 2-гидрокси этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малонат, тэтансульфонат, 2-нафталенсульфонат, никотинат, нитрат, олеат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, стеарат, роданид, р-толуолсульфонат, ундеканоат, соли валерата, и т.п. Соли, полученные из надлежащих основ, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4 алкил)4 соли.
Настоящее изобретение также предполагает образование четвертичного основания любых основных содержащих азот групп соединений, раскрытых в настоящем документе. Продукты, растворимые или дисперсные в воде или масле, могут быть получены таким образованием четвертичного основания.
Примеры солей щелочи или щелочноземельного металла включают натрий, литий, калий, кальций, магний, и т.п. роме того, фармацевтически приемлемые соли включают, в надлежащих случаях, нетоксичный аммоний, четвертичный аммоний и катионы амина, сформированные с помощью противоионов, таких как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, C1-8 сульфонат или арильный сульфонат.
[0081] «Сольват» относится к ассоциации или комплексу одной или нескольких растворяющих молекул и соединения, раскрытого в настоящем документе. Некоторые неограничивающие примеры растворителей, формирующих сольваты, включают воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, где растворяющая молекула является водой.
[0082] Термин «блокирующая группа» или «Pg» относится к заместителю, обычно использующемуся, чтобы заблокировать или защитить определенную функциональность при реакции с другими функциональными группами в соединении. Например, «блокирующая группа амина» является заместителем, присоединенным к аминогруппе, блокирующей или защищающей функциональность амино в соединении. Некоторые неограничивающие примеры подходящих блокирующих групп амино включают ацетил, трифтороацетил, t-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz) и 9-фторенилметиленоксикарбонил (Fmoc). Точно так же «блокирующая группа гидрокси» относится к заместителю гидроксильной группы, блокирующей или защищающей функциональность гидрокси. Некоторые неограничивающие примеры подходящих блокирующих групп гидрокси включают ацетил и силил. «Блокирующая группа карбокси» относится к заместителю карбоксильной группы, блокирующей или защищающей функциональность карбокси. Некоторые неограничивающие примеры общих блокирующих групп карбокси включают -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(р-толуолсульфонил)этил, 2-(р-нитрофенилсульфонил)этил, 2-(дифенилфосфино) этил, нитроэтил, и т.п. Для общего описания блокирующих групп и их использования, см. Greene и др., Protective Groups in Organic Synthesis, John Wiley & Sons, Нью-Йорк, 1991 и Kocienski и др., Protecting Groups, Thieme, Штутгарт, 2005.
[0083] Кроме того, соединения, раскрытые в настоящем документе, включая их соли, могут также быть получены в форме гидратов, или включать другие растворители, такие как этанол, DMSO, и т.п., используемые для их кристаллизации. Соединения данного изобретения могут по своей природе или согласно замыслу формировать сольваты с фармацевтически приемлемыми растворителями (включая воду); поэтому, предполагается, что изобретение охватывает сольватированные и несольватированные формы.
[0084] Любая формула, данная в настоящем приложении, также представляет собой изотопически необогащенные формы, а также изотопически обогащенные формы соединений. Изотопически обогащенные соединений имеют структуры, изображенные формулами, данными здесь за исключением того, что один или несколько атомов замещены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые могут быть включены в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например, 2H (дейтерий, D), 3Н, 11С, 13С, 14С, 15Н, 17O, 18O, 18F, 31Р, 32Р, 35S, 36Cl, 125I.
[0085] В другом аспекте соединения изобретения включают изотопически обогащенные соединения, определенные в настоящем документе, например те, в которых присутствуют радиоактивные изотопы, такие как 3Н, 14С и 18F, или те, в которых присутствуют нерадиоактивные изотопы, такие как 2Н и 3С. Такие изотопически обогащенные соединения полезны в метаболических исследованиях (с 14С), исследованиях кинетической реакции (с, например, 2Н или 3Н), для обнаружения или способов отображения, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включая количественное содержание лекарственного средства или распределения ткани субстрата, или при радиоактивной терапии пациентов. В частности, 18F-обогащенное соединение может быть особенно желательным для исследований SPECT или PET. Изотопически обогащенные соединения по Формуле (I) могут быть обычно подготовлены стандартными способами или процессами, известными специалистам в области, аналогично описанным в сопровождающих Примерах и Препаратах с помощью надлежащего изотопически маркированного реактива, вместо немаркированного реактива, используемого ранее.
[0086] Кроме того, замена более тяжелыми изотопами, особенно дейтерия (т.е. 2Н или D) может дать определенные терапевтические преимущества, вытекающие из большей метаболической стабильности, например, увеличенный период полураспада in vivo, уменьшенные требования дозировки или усиление терапевтического индекса. Очевидно, что дейтерий в этом контексте расценивается как заместитель соединения по формуле (I). Концентрация более тяжелого изотопа, в частности, дейтерия, может быть определена фактором изотопного обогащения. Термин «фактор изотопного обогащения», как используется в настоящем документе, означает отношение между изотопным изобилием и естественным изобилием указанного изотопа. Если заместитель в соединении настоящего изобретения является дейтерием, такое соединение имеет фактор изотопного обогащения для каждого определяемого атома дейтерия, по крайней мере, 3500 (инкорпорация дейтерия на 52,5% в каждом определяемом атоме дейтерия), по крайней мере, 4000 (60% инкорпорация дейтерия), по крайней мере, 4500 (инкорпорация дейтерия на 67,5%), по крайней мере, 5000 (75% инкорпорация дейтерия), по крайней мере, 5500 (инкорпорация дейтерия на 82,5%), по крайней мере, 6000 (90% инкорпорация дейтерия), по крайней мере, 6333,3 (95% инкорпорация дейтерия), по крайней мере, 6466,7 (97% инкорпорация дейтерия), по крайней мере, 6600 (99% инкорпорация дейтерия), или, по крайней мере, 6633,3 (инкорпорация дейтерия на 99,5%). Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, где растворитель кристаллизации может быть изотопически замещен, например, D2O, d6-ацетон, DMSO-d6.
ОПИСАНИЕ СОЕДИНЕНИЙ
[0087] Изобретение касается новых соединений дигидропиримидина и фармацевтических составов и их применения в изготовлении лекарственных средствлекарственных средств для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, в частности, инфекции гепатита В (ВГВ) или заболевания, вызванного инфекцией гепатита В.
[0088] В одном аспекте, приведенном в настоящем документе, соединения, имеющие Формулу (I) или (Ia), или их энантиомер, диастереоизомер, таутомер, гидрат, сольват, пролекарство, стереоизомер, N-оксид или фармацевтически приемлемая соль,
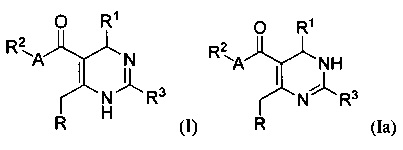
где
R1 является С6-10 арилом или С1-9 гетероарилом;
R3 является 5-членной гетероарильной группой;
А является звеном, -О-, -S- или -NR5-;
R является
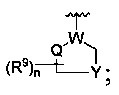
где W является CR4 или N;
каждый из R2, R4 и R5 является независимо водородом или C1-4 алкилом;
Y является -(CR8R8a)k-S(=O)q- или -(CR7R6)n-;
Q является -(CR8R8a)k-;
каждый R7 является независимо водородом, F или алкилом;
каждый R6 независимо F или алкил;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом, циано или алкилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11,
-(CR10R10a)k-C(-O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2,
-(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, галогеном, галоалкилом или алкилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют циклоалкил, гетероциклил или -С(=O)-;
каждый R11 представляет собой независимо водород, алкил, алкокси, гидрокси, алкил -S(=O)q-, арил, гетероарил, циклоалкил, гетероциклил, арилалкил, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- или арил-S(=O)q-;
R11a является алкилом, алкокси, гидрокси, алкил-S(=O)q-, арилом, гетероарилом, циклоал килом, гетероциклилом, арил ал килом, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- или арил-S(=O)q-;
каждый n равняется независимо 1, 2 или 3;
каждый t и m равняются независимо 1, 2, 3 или 4;
каждый q равняется независимо 1 или 2; и
каждый k независимо 0, 1, 2, 3 или 4;
где каждый алкокси, алкил-S(=O)q-, арил, гетероарил, арилалкил, гетероциклил-S(=O)q-, гетероарил-S(=O)q-, циклоалкил-S(=O)q- и арил-S(=O)q-, описанный в R11 и R11a, алкил, описанный в R6, R7, R8, R8a, R10, R10a, R11a и R11, галоалкил описанный в R10 и R10a, гетероциклил и циклоалкил, описанный в R10, R10a, R11a и R11, триазолил и тетразолил, описанный в R9, 5-членная гетероарильная группа, описанная в R3, С1-4 алкил, описанный в R1, R4 и R5, и С6-10 арил и С1-9 гетероарил, описанный в R1, произвольно и независимо замещены одним или несколькими заместителями, независимо выбранными из водорода, фторо-, хлоро-, бромо-, йодо, оксо (=O), метилена (=CH2), алкила, алкокси, циано, гидрокси, нитро, алкиламино, амино, арила, гетероарила, гетероциклила, циклоалкила, трифторометила, трифторометокси, галоалкил замещенного арила, галоген замещенного арила или трифторометилсульфонила.
[0089] В некоторых воплощениях,
R является 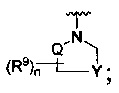
где Y является -(CR8R8a)k-S(=O)q- или -(CR7R6)n-;
Q является -(CR8R8a)k-;
каждый R7 является независимо водородом, C1-4 алкилом или F;
каждый R6 независимо F или C1-4 алкил;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом или С1-4 алкилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)OR11, (CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a является независимо водородом, галогеном, C1-4 галоалкилом или С1-4 алкилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют С3-6 циклоалкил, С2-9 гетероциклил или -С(=O)-;
каждый R11 является независимо водородом, С1-6 алкилом, C1-6 алкокси, C1-6 алкил-S(=O)q-, С6-10 арилом, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-6 алкилом, С2-9 гетероциклил-S(=O)q-, C1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-; и
R11a является С1-6 алкилом, C1-6 алкокси, C1-6 алкил-S(=O)q-, С6-10 арилом, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил-С1-6 алкилом, С2-9 гетероциклил-S(=O)q-, C1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-.
[0090] В других воплощениях, где
R является
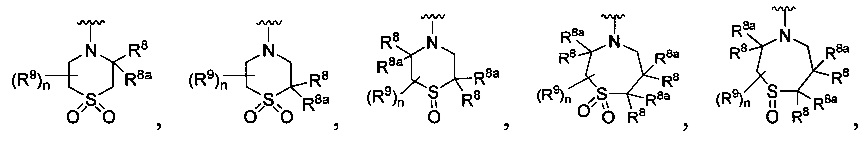
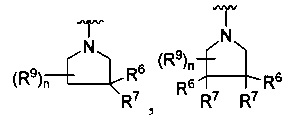 или
или 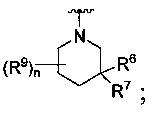
где каждый R7 является независимо водородом, метилом, этилом или F;
каждый R6 независимо F, метил или этил;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
каждый R8 и R8a являются независимо водородом, метилом, этилом или пропилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фторо-, хлоро-, бромо-, йодо-, трифторометилом, метилом, этилом, пропилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют циклопропил, циклобутил, циклопентил, циклогексил или -С(=O)-;
каждый R11 является независимо водородом, С1-4 алкилом, С1-4 алкокси, С1-4 алкил-S(=O)2-, фенилом, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-; и
R11a является С1-4 алкилом, С1-4 алкокси, С1-4 алкил-S(=O)2-, фенилом, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-.
[0091] В определенных воплощениях, где
R1 является фенилом;
R3 является тиазолилом или 1-метил-1Н-имидазолилом; и
каждый из R2, R4 и R5 является независимо водородом, метилом или этилом;
где каждый тиазолил и - метил-1Н-имидазолил, описанный в R3, фенил, описанный в R1, и метил и этил, описанный в R2, R4 и R5, произвольно и независимо замещены одним или несколькими заместителями, независимо выбранными из водорода, C1-4 алкила, фторо-, хлоро- или бромо-.
[0092] В определенных воплощениях, данных в настоящем документе, соединения, имеющие Формулу (II) или (IIa) или их энантиомер, диастереоизомер, таутомер, гидрат, сольват, пролекарство, стереоизомер, N-оксид или фармацевтически приемлемая соль,
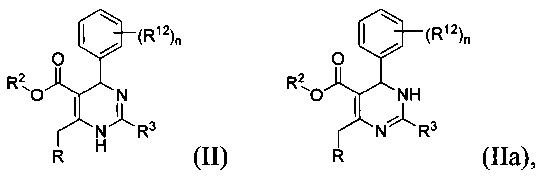
где
R2 является водородом или С1-4 алкилом;
R3 является тиазолилом или 1-метил-1Н-имидазолилом;
R является
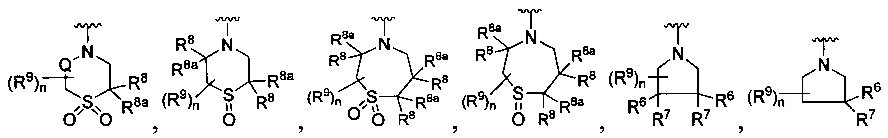
или 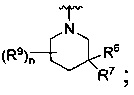
где каждый R7 является независимо водородом, C1-4 алкилом или F;
каждый R6 независимо F или С1-4 алкил;
или R6 и R7, вместе с атомом углерода, к которому они присоединены, формируют -С(=CH2)- или -С(=O)-;
Q является -(CR8R8a)k-;
каждый R8 и R8a являются независимо водородом или С1-4 алкилом;
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, (CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фторо-, хлоро-, бромо-, йодо-, C1-4 галоалкилом или C1-4 алкилом, или R10 и R10a, вместе с атомом углерода, к которому они присоединены, формируют С3-6 циклоалкил или -С(=O)-;
каждый R11 является независимо водородом, C1-4 алкилом, C1-4 алкокси, гидрокси, С1-4 алкил-S(=O)q-, С6-10 арилом, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил С1-4 алкилом, С2-9 гетероциклил-S(=O)q-, С1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-;
R11a является С1-4 алкилом, С1-4 алкокси, гидрокси, C1-4 алкил-S(=O)q-, С6-10 арилом, С1-9 гетероарилом, С3-6 циклоалкилом, С2-9 гетероциклилом, С6-10 арил С1-4 алкилом, С2-9 гетероциклил-S(=O)q-, С1-9 гетероарил-S(=O)q-, С3-6 циклоалкил-S(=O)q- или С6-10 арил-S(=O)q-;
каждый R12 является независимо водородом, фторо-, хлоро- или бромо-;
каждый n равняется независимо 1, 2 или 3;
каждый t и m равняются независимо 1, 2, 3 или 4;
каждый q равняется независимо 1 или 2; и
каждый k независимо 0, 1, 2, 3 или 4.
[0093] В других воплощениях, где R является
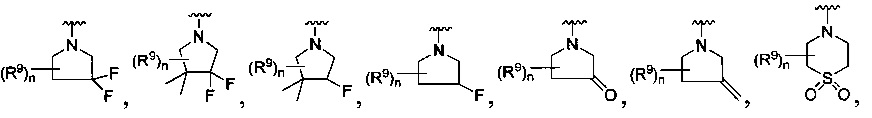
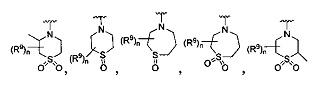 или
или 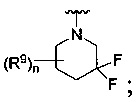
каждый R9 независимо -(CR10R10a)t-OH, триазолил, тетразолил, -(CR10R10a)m-C(=O)O-R11, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)O-R11, -S(=O)qOR11, -(CR10R10a)k-S(=O)qN(R11)2, -(CR10R10a)k-C(=O)O-(CR10R10a)k-OC(=O)-R11, (CR10R10a)k-C(=O)O-(CR10R10a)k-C(=O)O-R11, -(CR10R10a)t-N(R11)2, -(CR10R10a)t-OC(=O)-R11, -C(=O)O-R11a или -(CR10R10a)k-C(=O)N(R11)2;
каждый R10 и R10a являются независимо водородом, фторо-, хлоро-, трифторометилом, метилом, этилом, пропилом, изопропилом, трет-бутилом или n-бутилом, или R10 и R10a вместе с атомом углерода, к которому они присоединены, формируют циклопропил, циклобутил, циклопентил, циклогексил или -С(=O)-;
каждый R11 является независимо водородом, метилом, этилом, пропилом, изопропилом, трет-бутилом, n-бутилом; метокси, этокси, пропокси, изопропокси, терт-бутокси, n-бутокси, метил-S(=O)2-, этил-S(=O)2-, пропил-S(=O)2-, изопропил-S(=O)2-, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, пиразолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-; и
R11a является метилом, этилом, пропилом, изопропилом, трет-бутилом, n-бутилом; метокси, этокси, пропокси, изопропокси, терт-бутокси, n-бутокси, метил-S(=O)2-, этил-S(=O)2-, пропил-S(=O)2-, изопропил-S(=O)2-, пиридилом, тиазолилом, фурилом, имидазолилом, изоксазолилом, оксазолилом, пирролилом, пиримидинилом, пиридазинилом, диазолилом, триазолилом, тетразолилом, тиенилом, шфазолилом, изотиазолилом, оксадиазолилом, тиадиазолилом, пиразинилом, пиранилом, триазинилом, циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклопропил-S(=O)2-, циклобутил-S(=O)2-, циклопентил-S(=O)2-, циклогексил-S(=O)2-, нафтил-S(=O)2- или фенил-S(=O)2-.
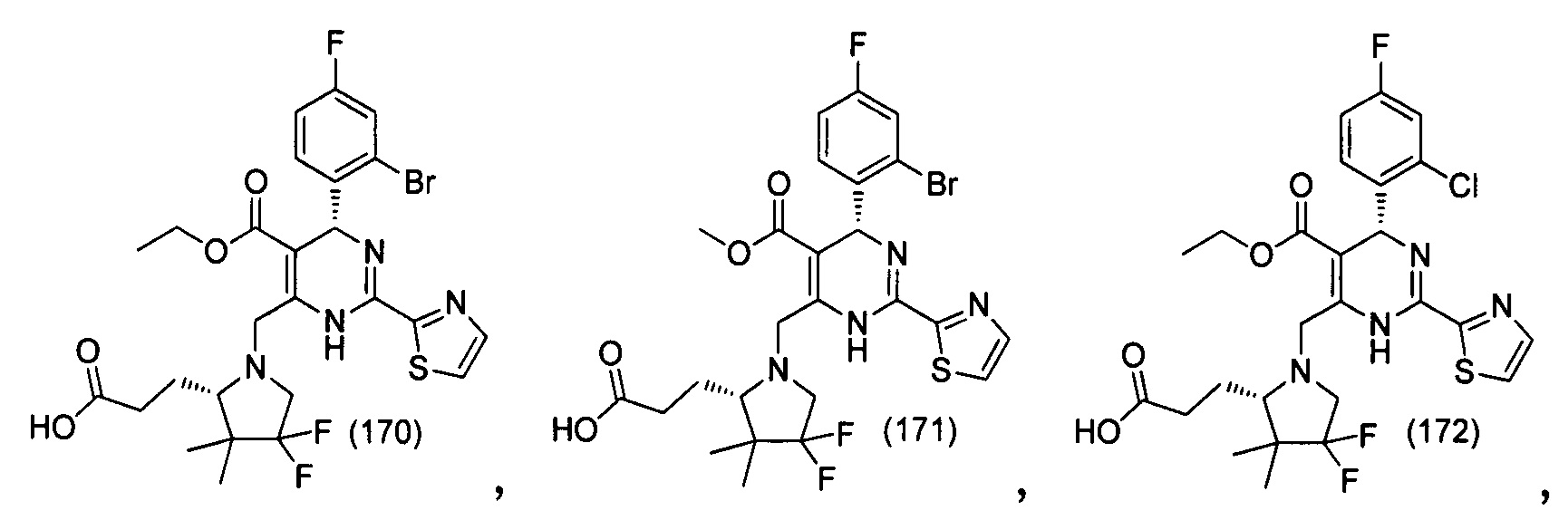
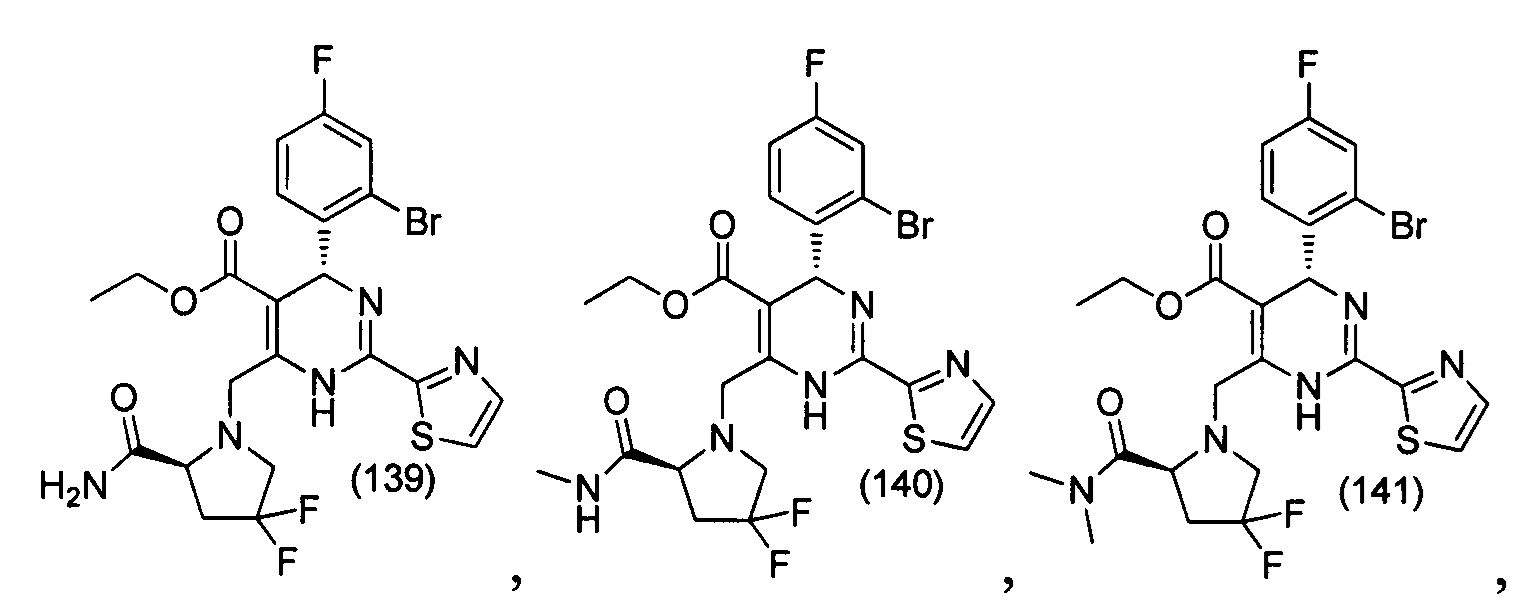
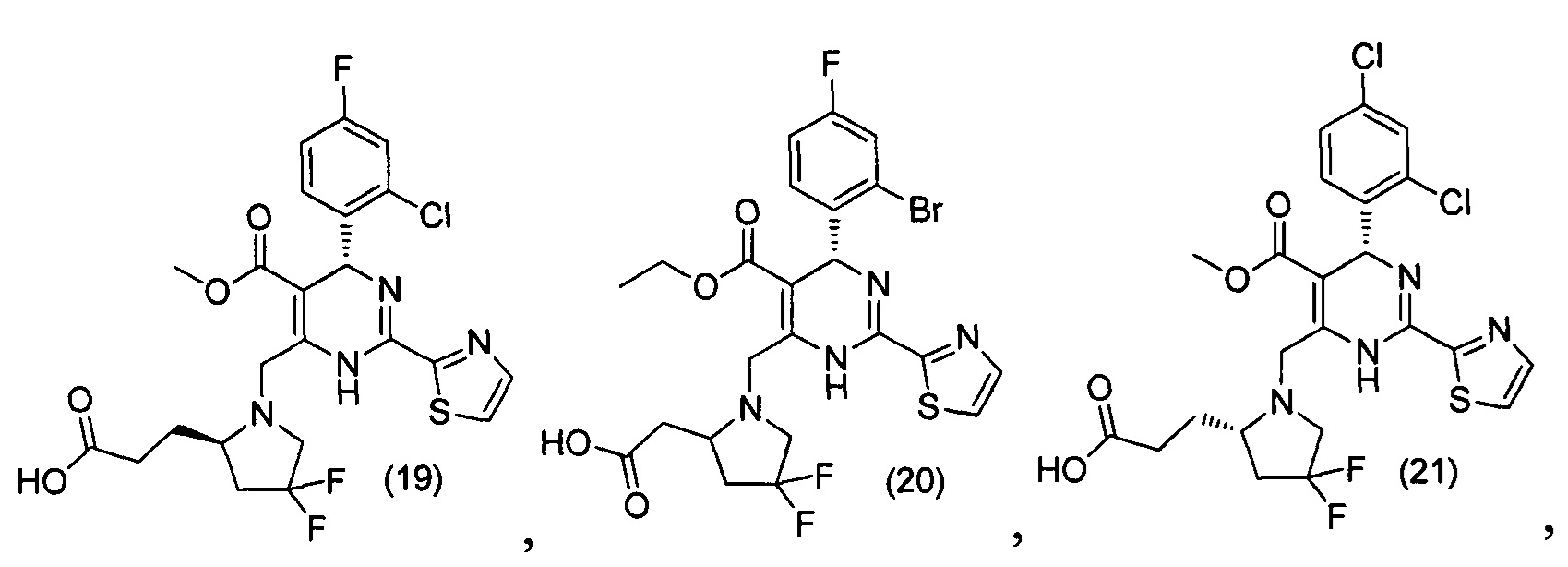
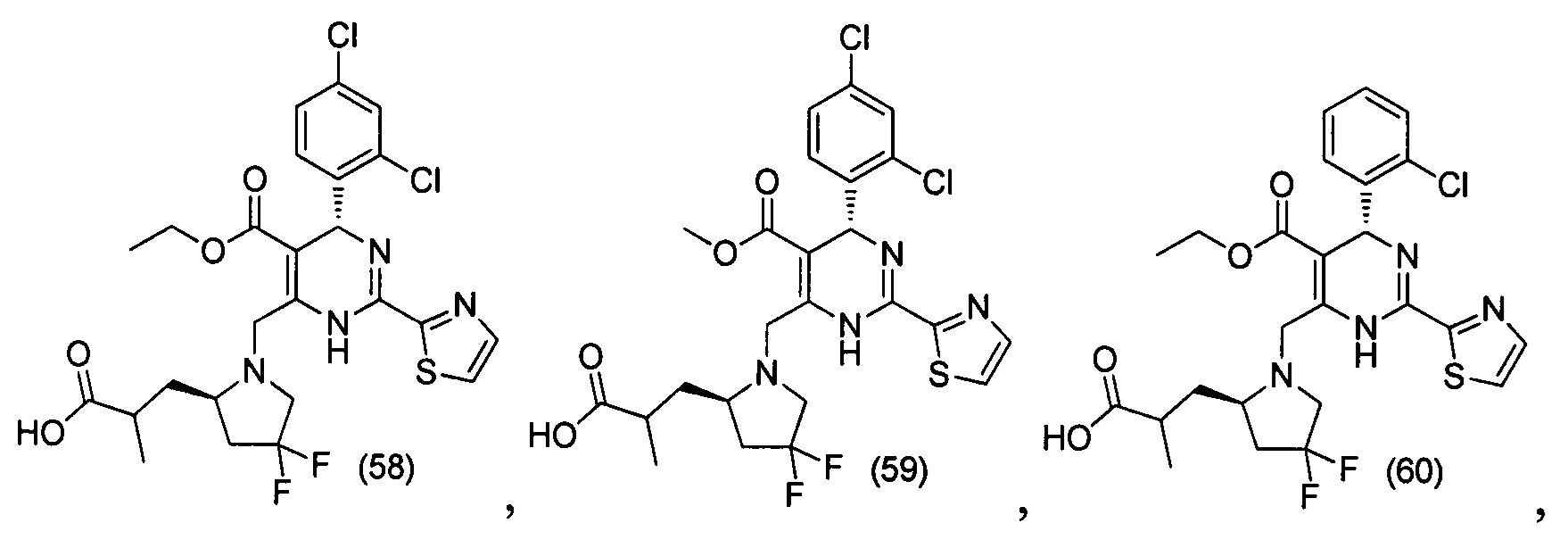
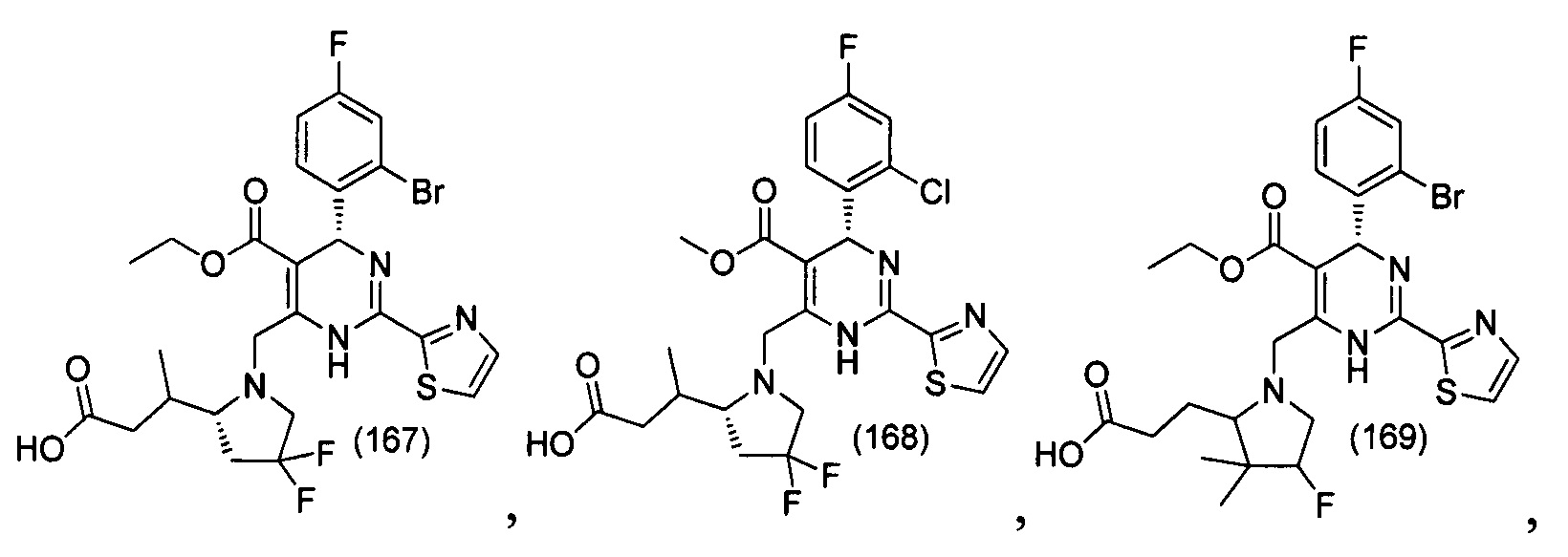
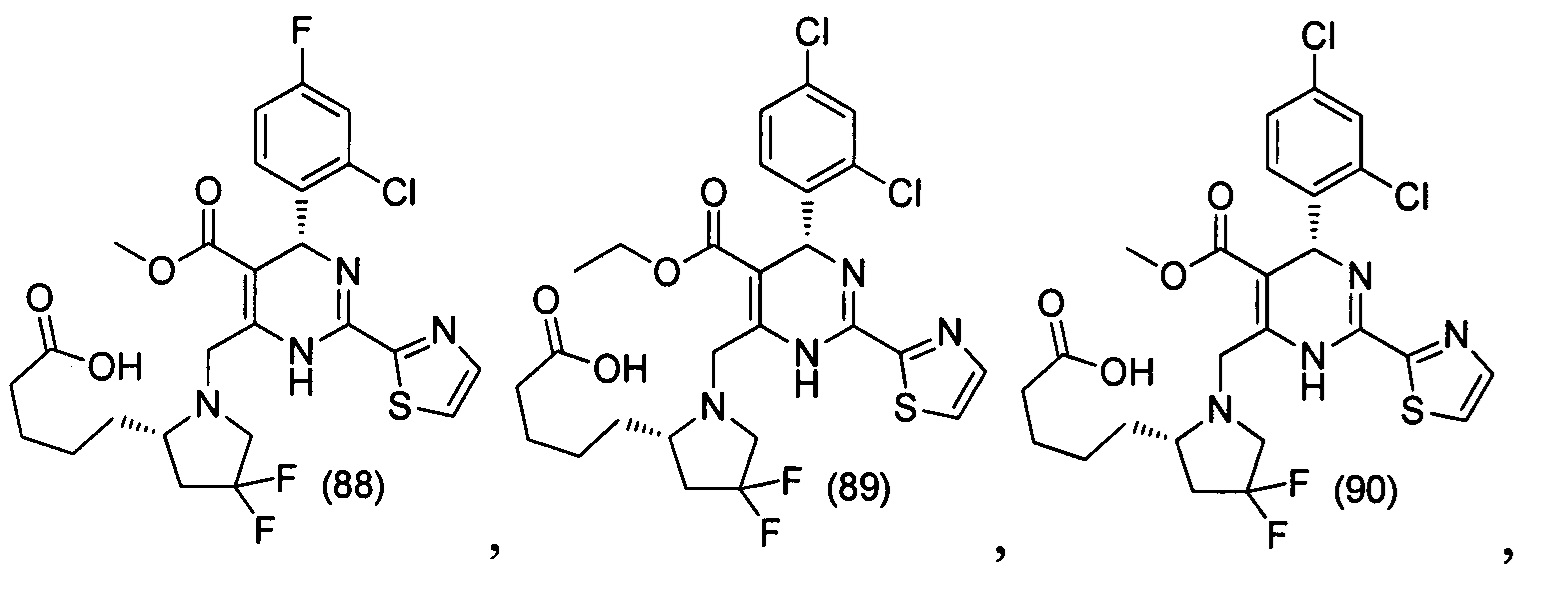
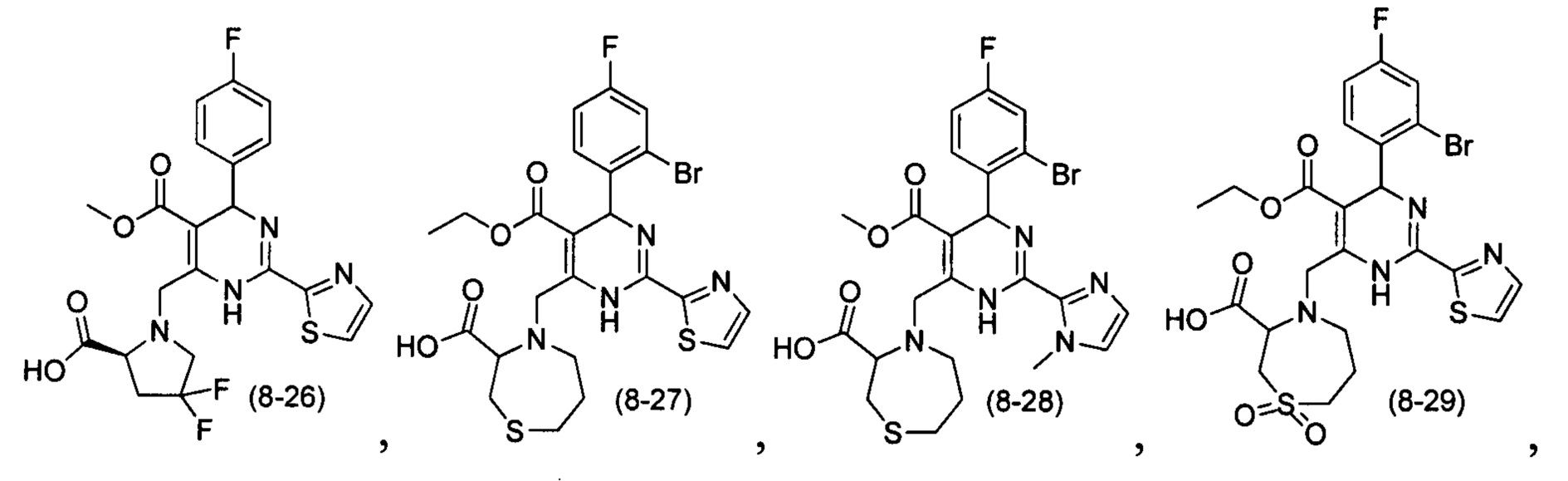
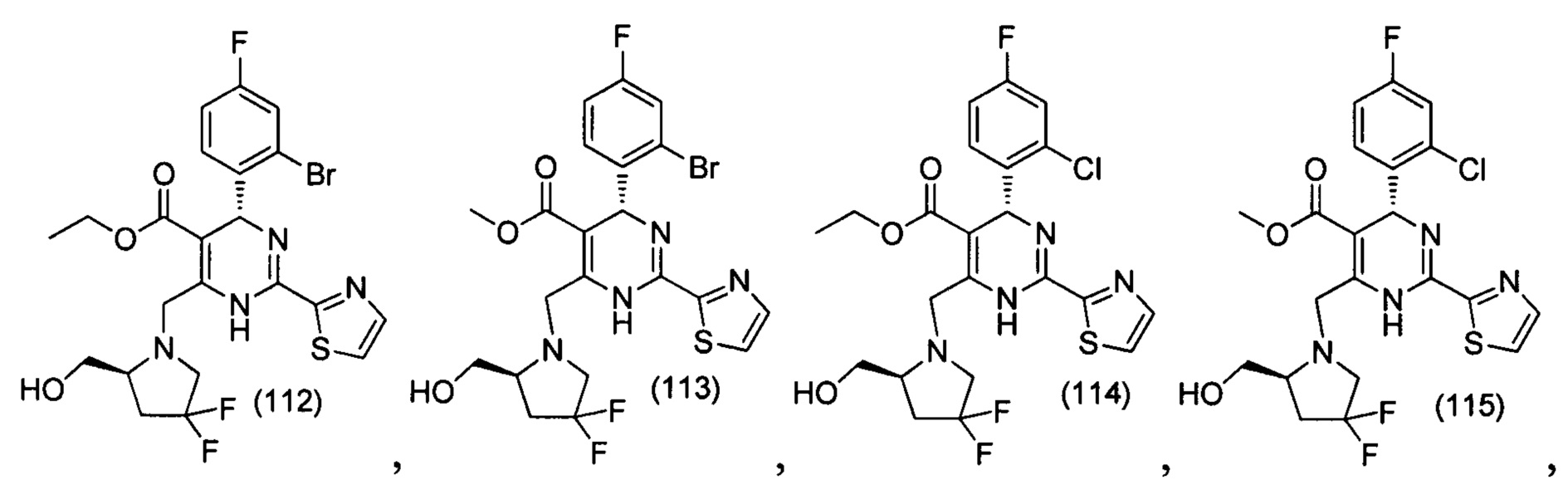
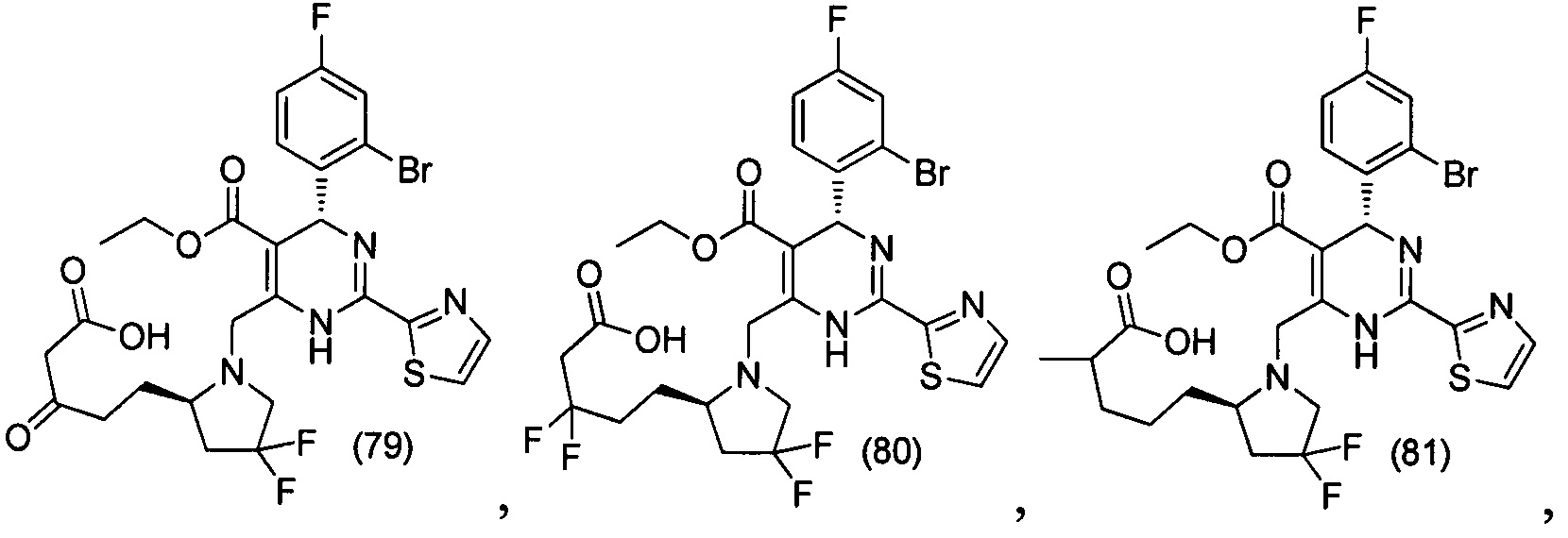
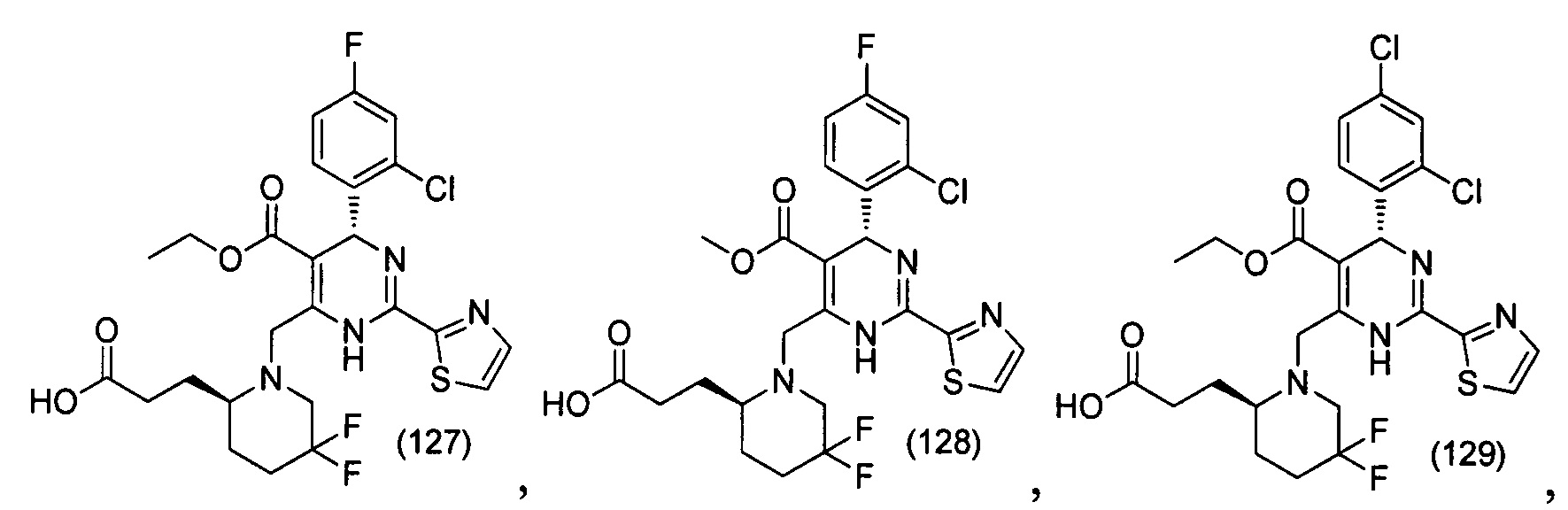
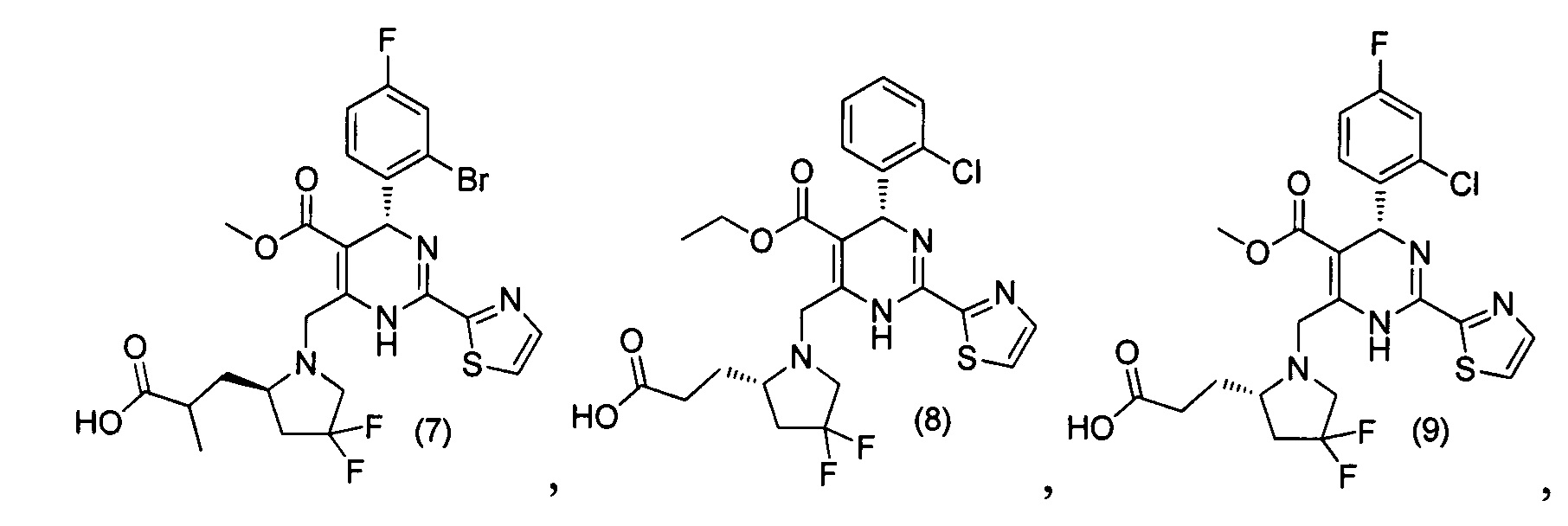
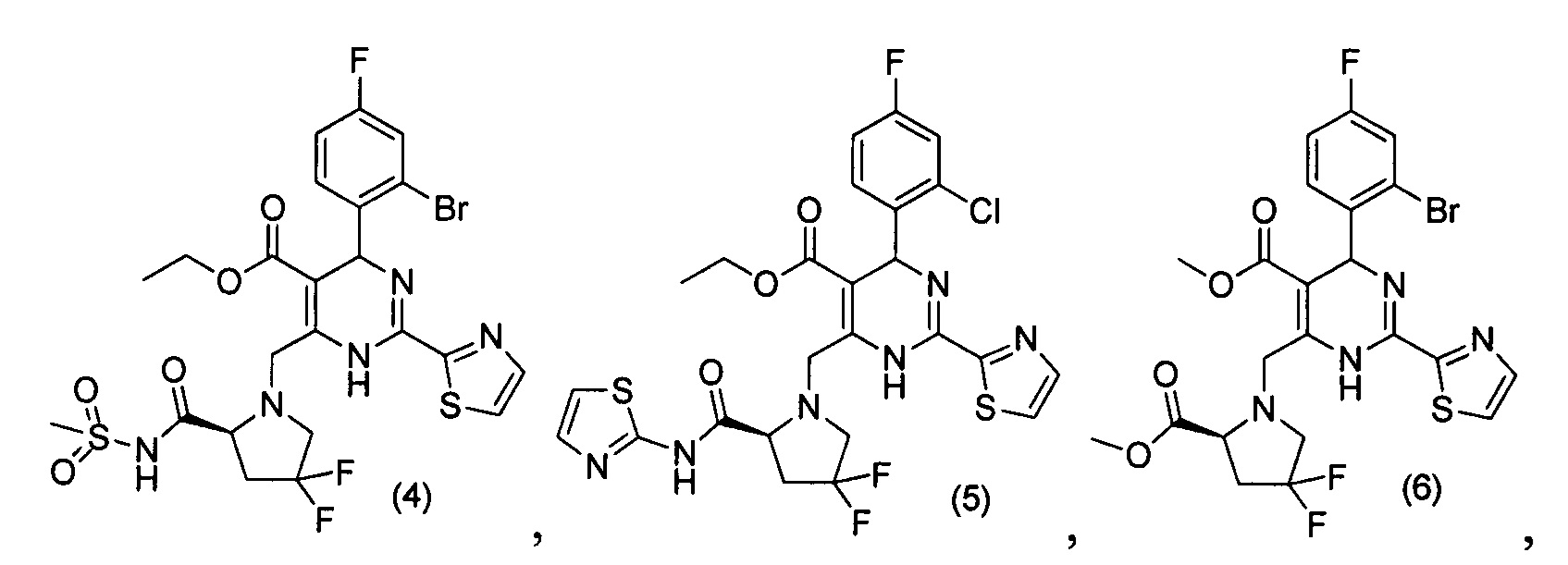
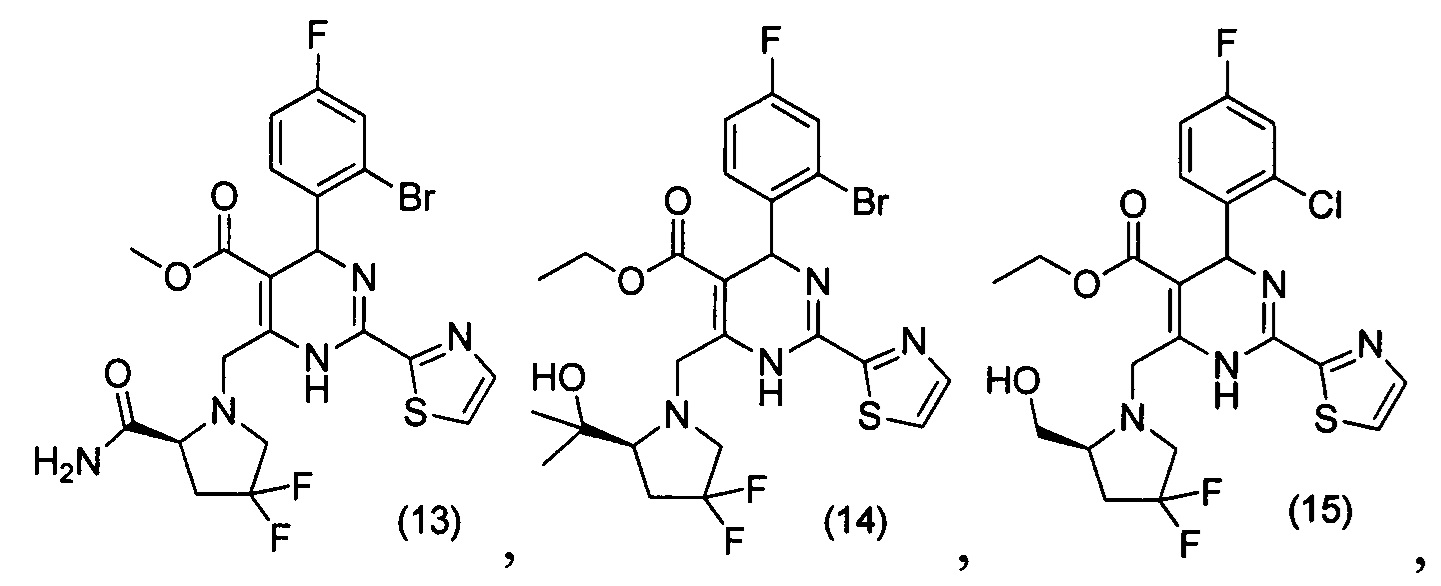
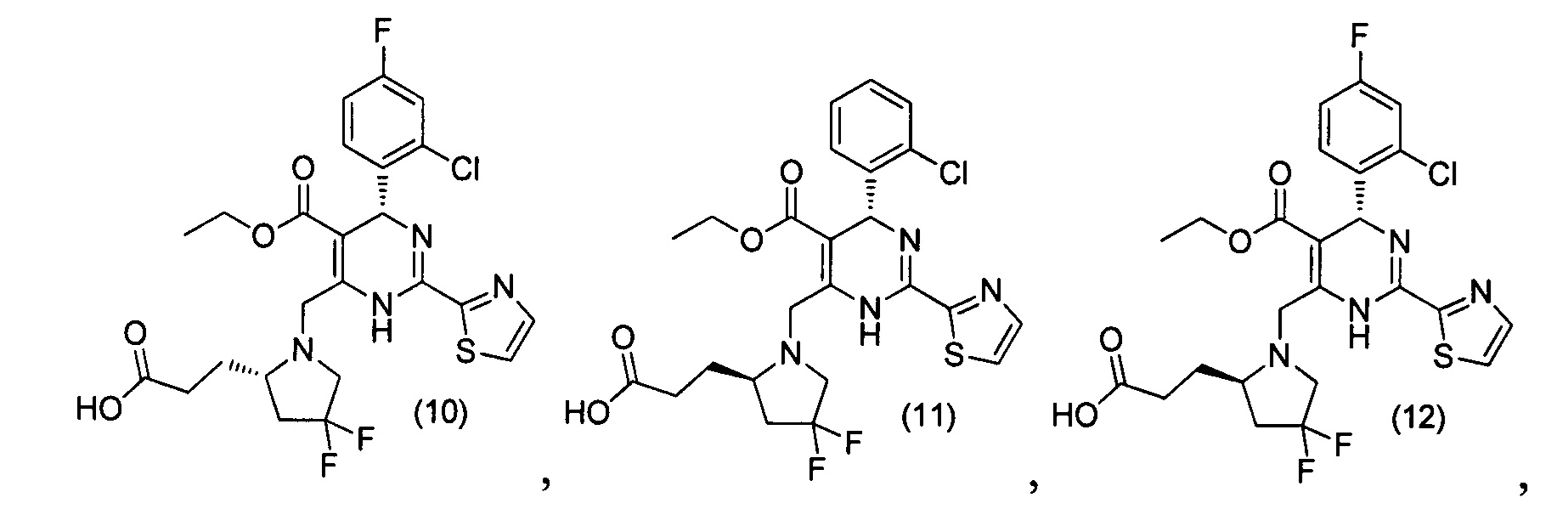
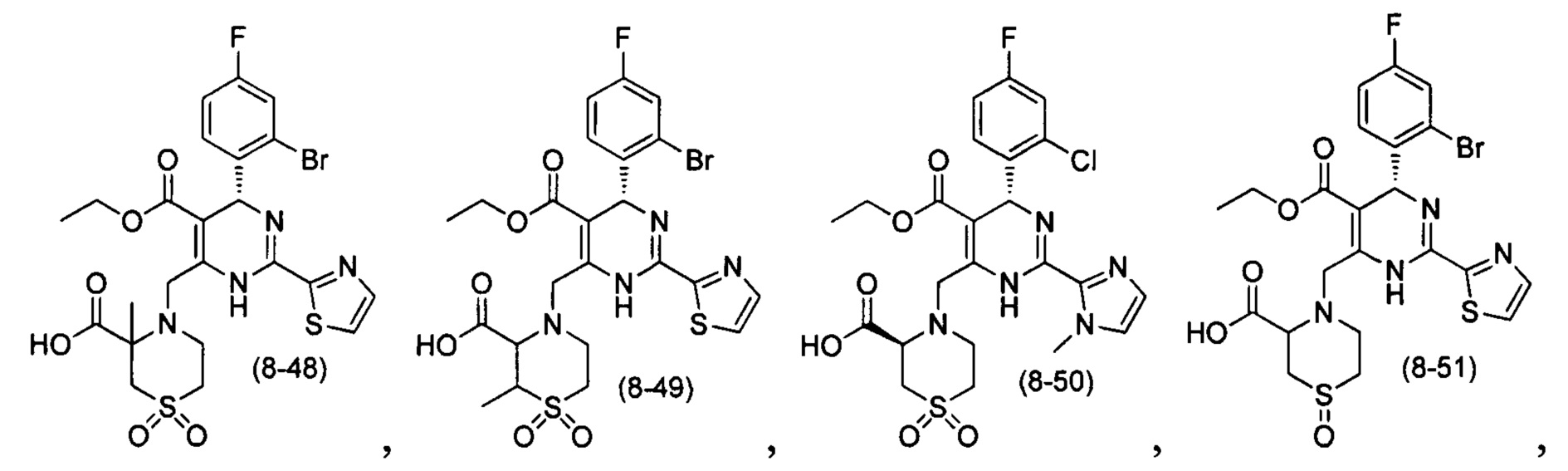
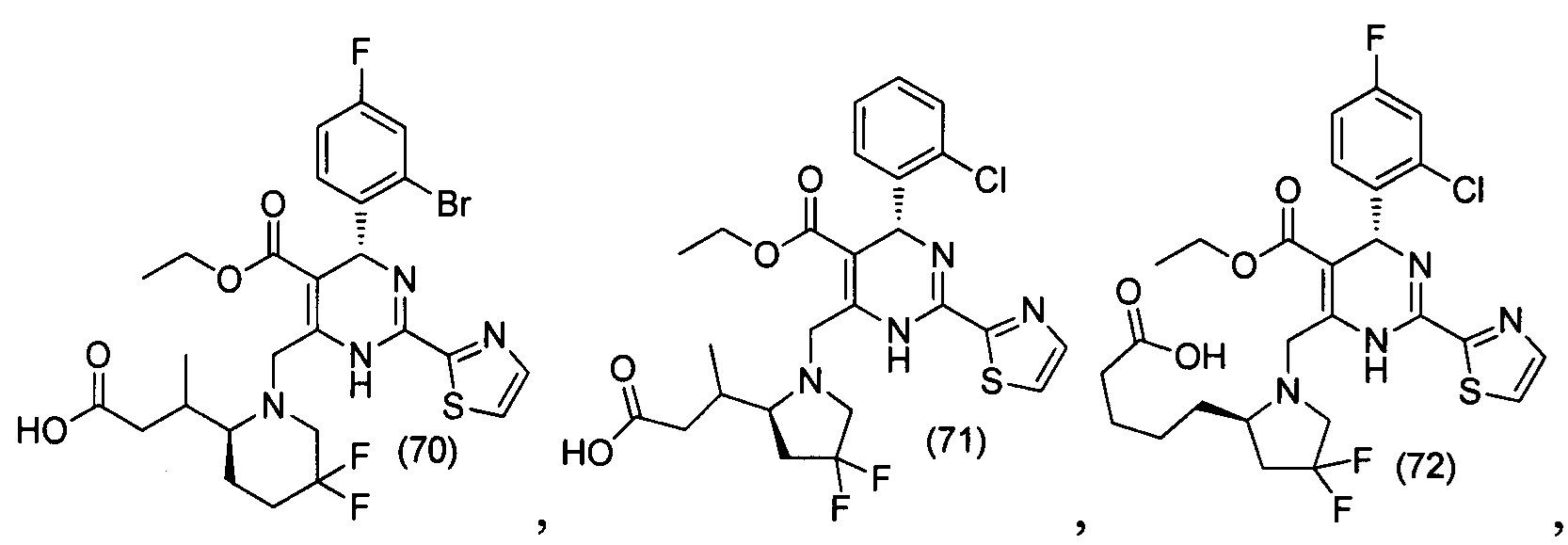
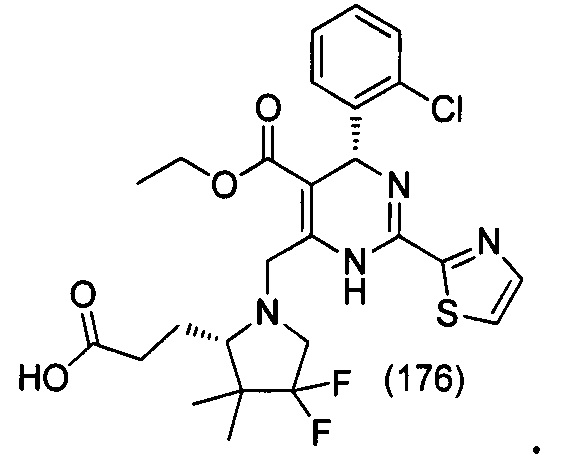
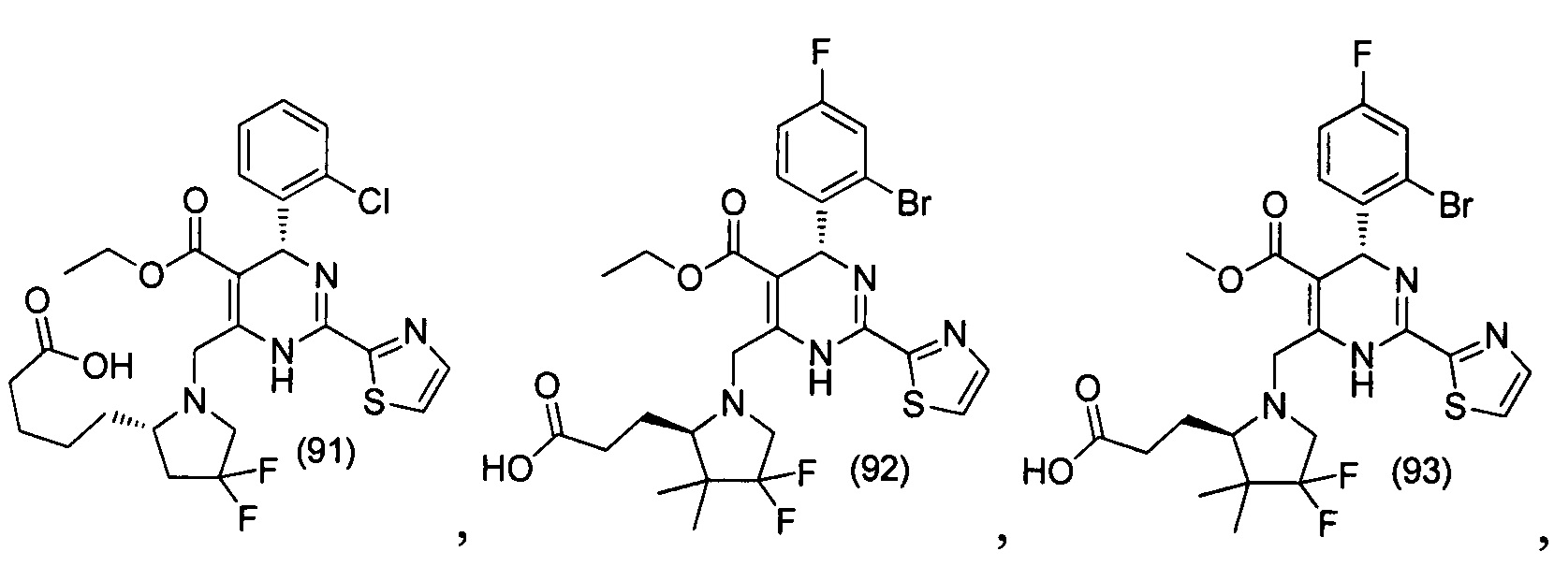
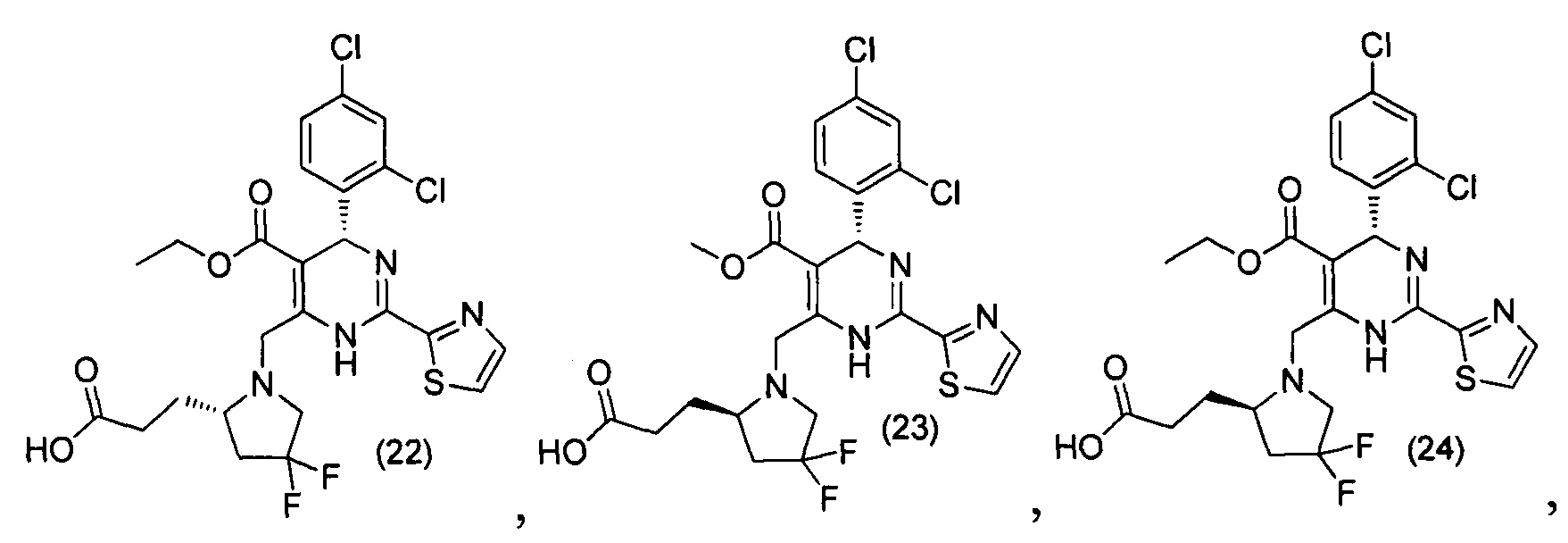
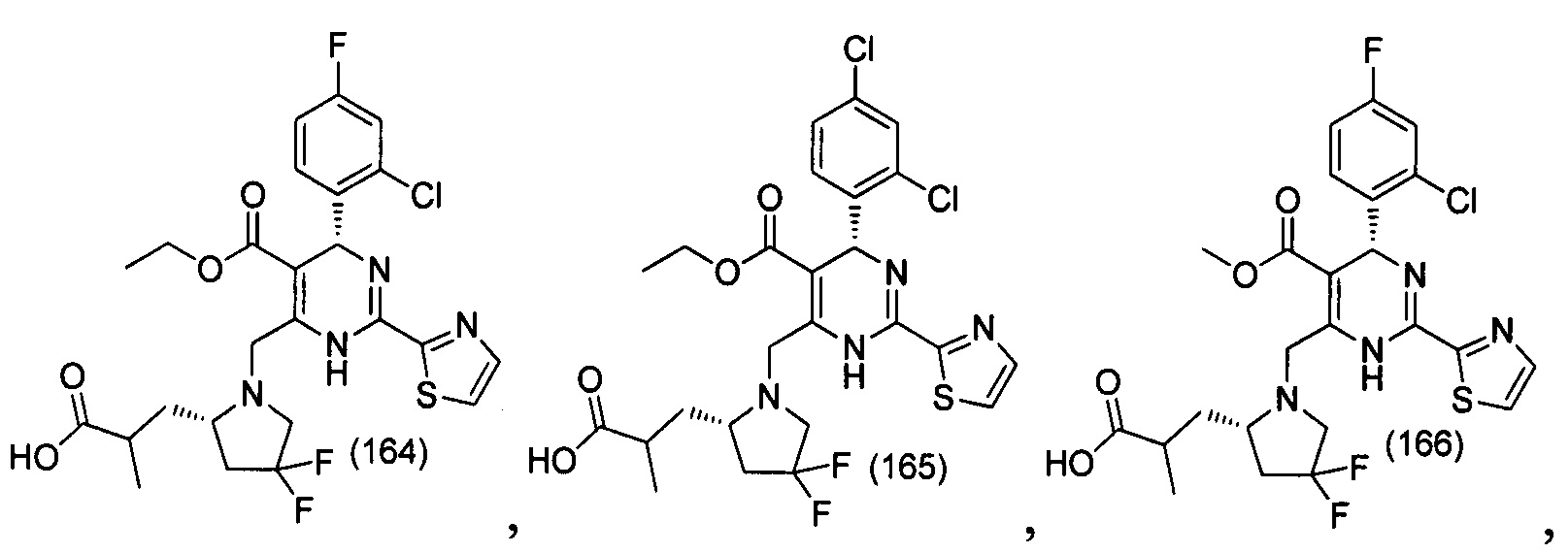
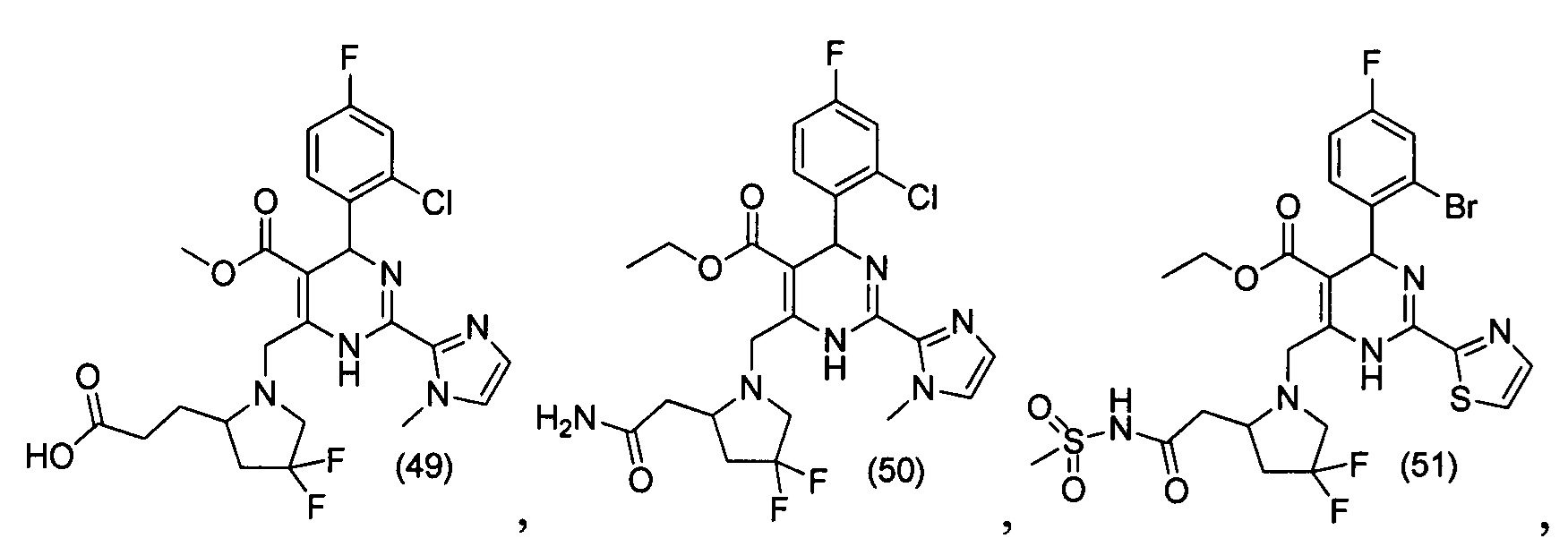
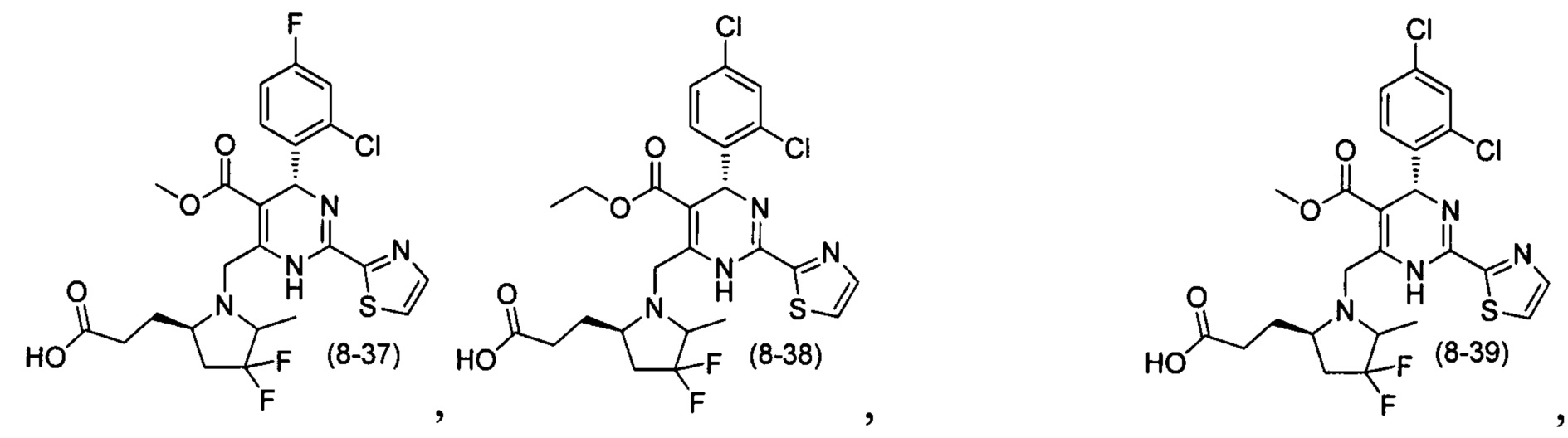
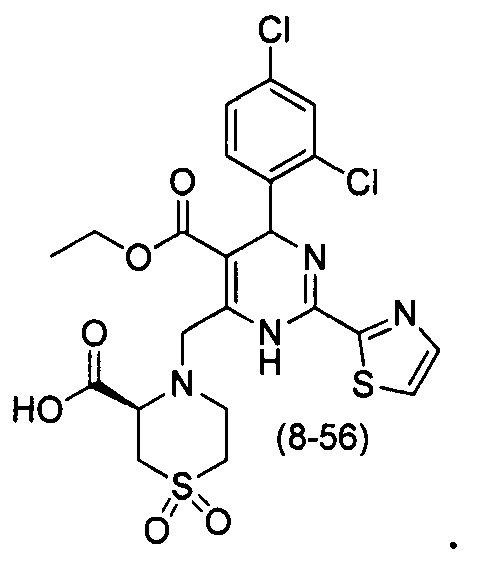
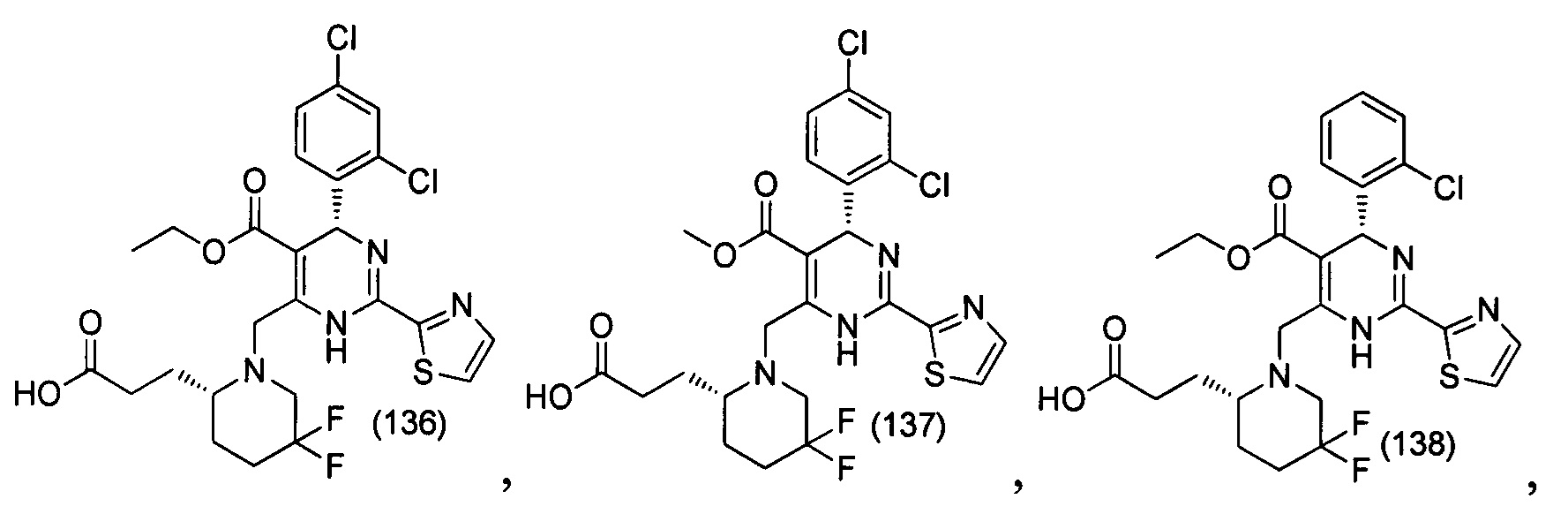
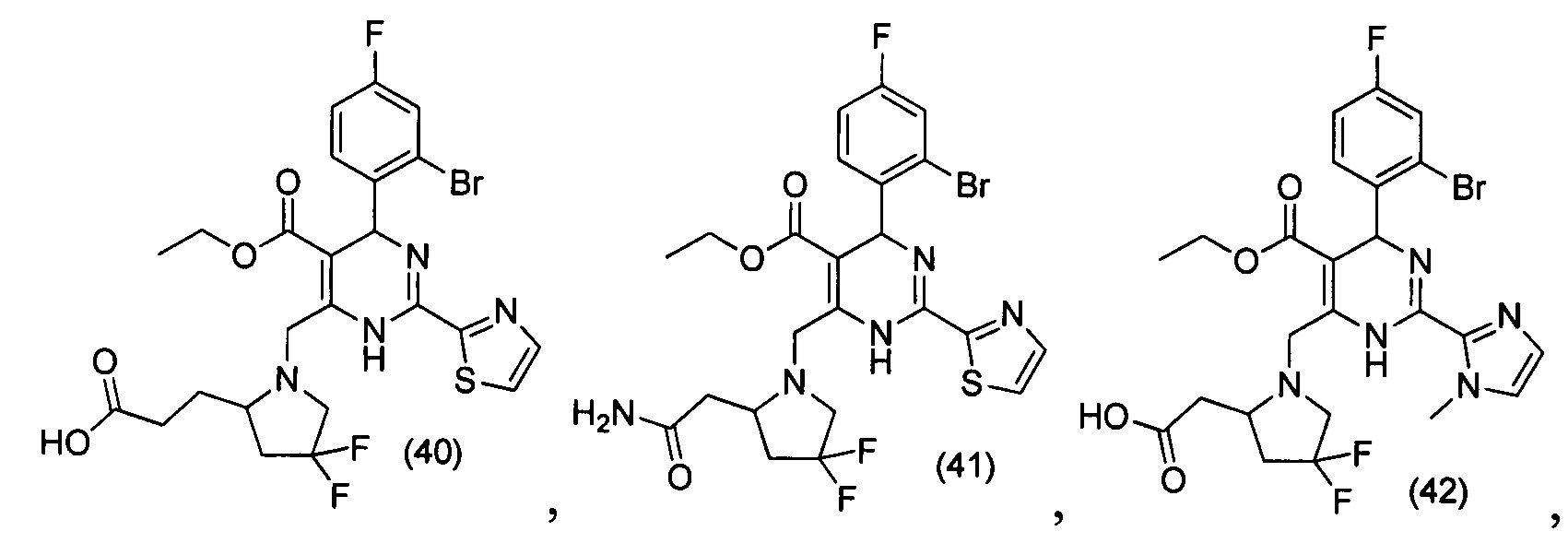
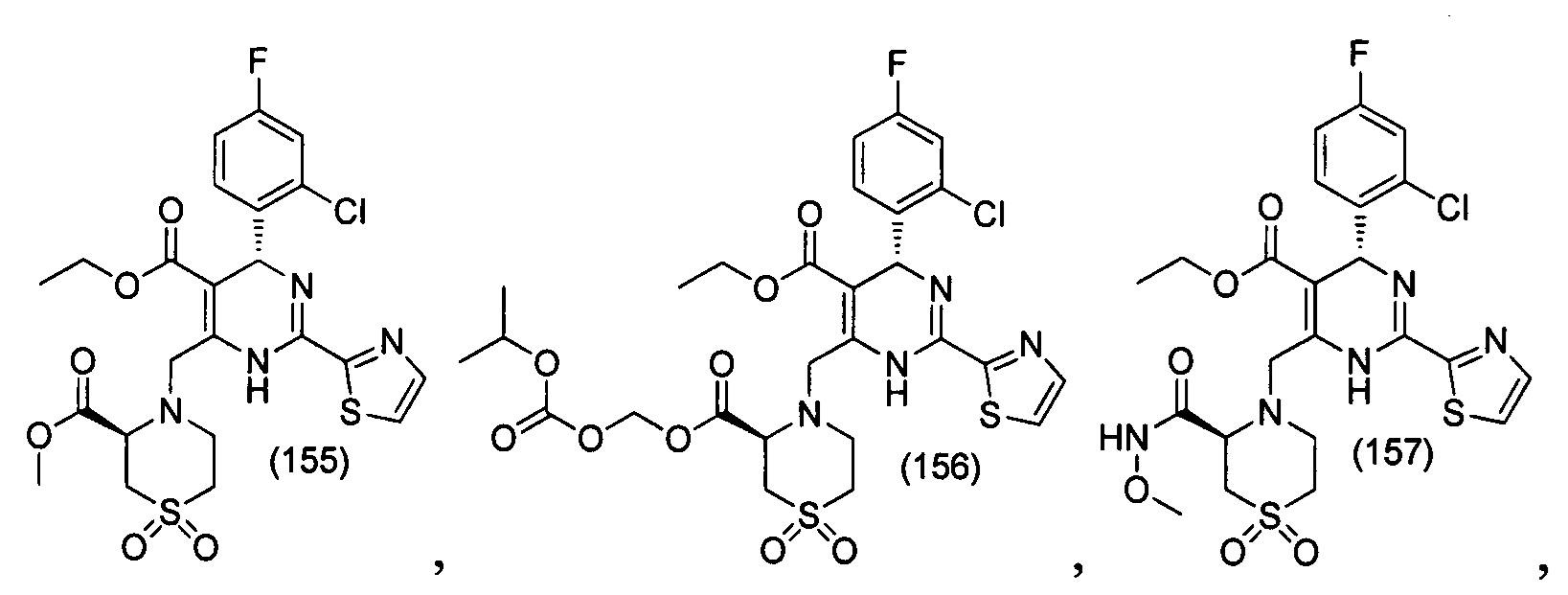
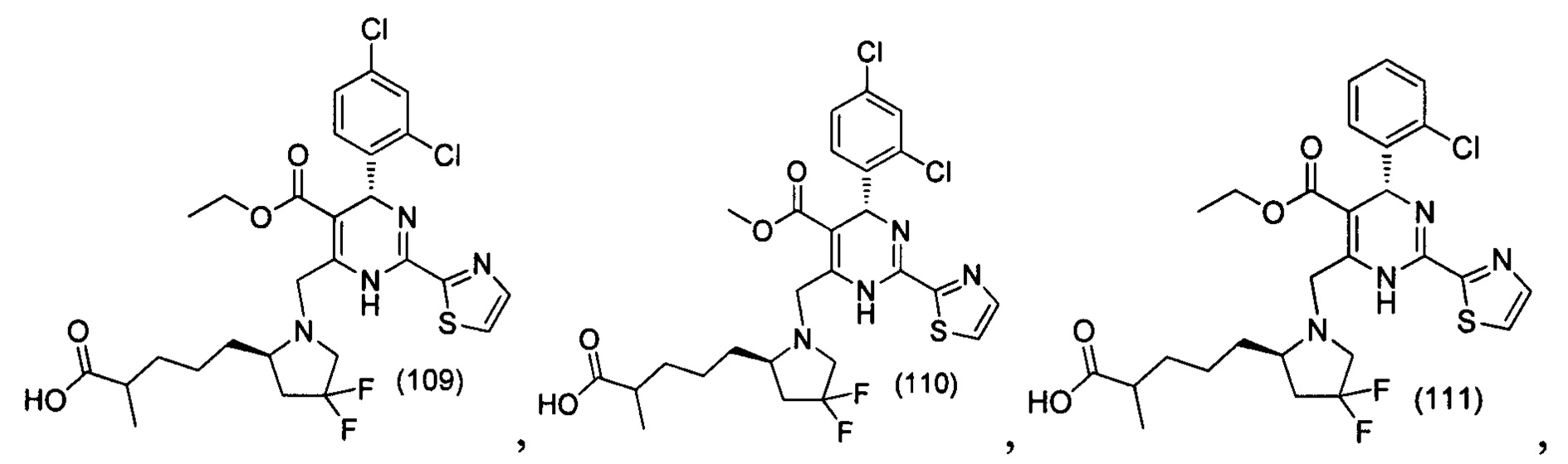
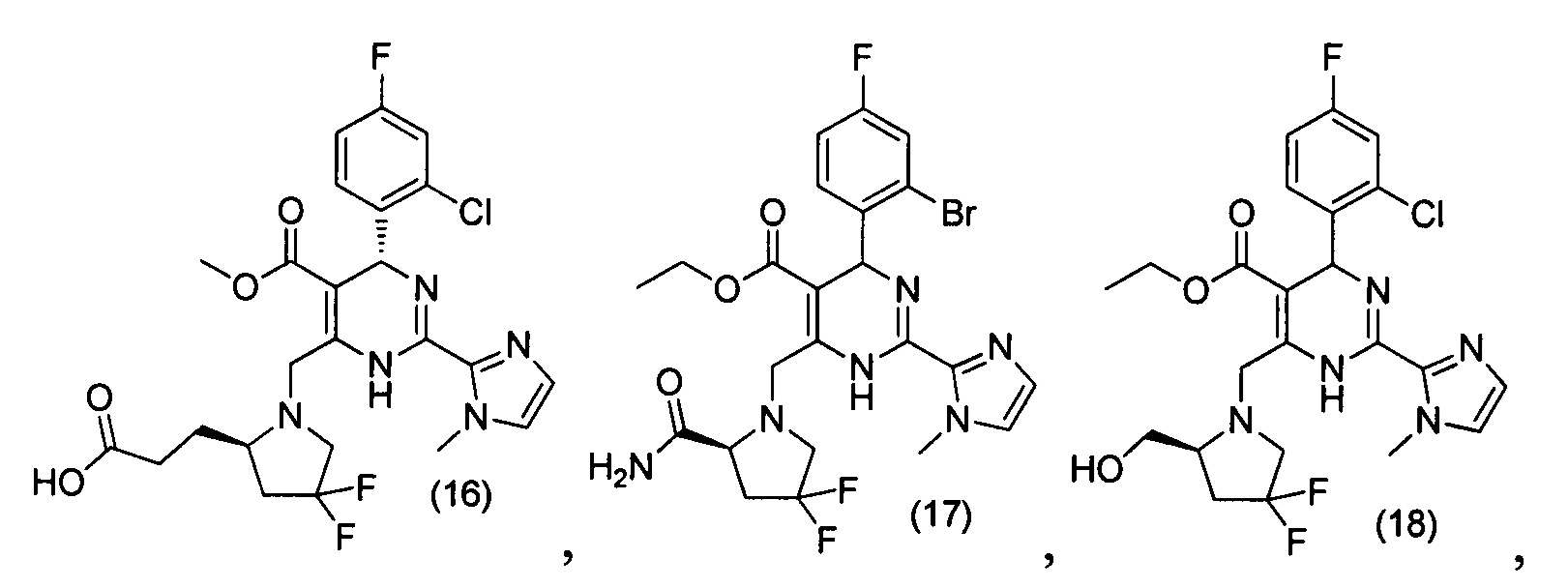
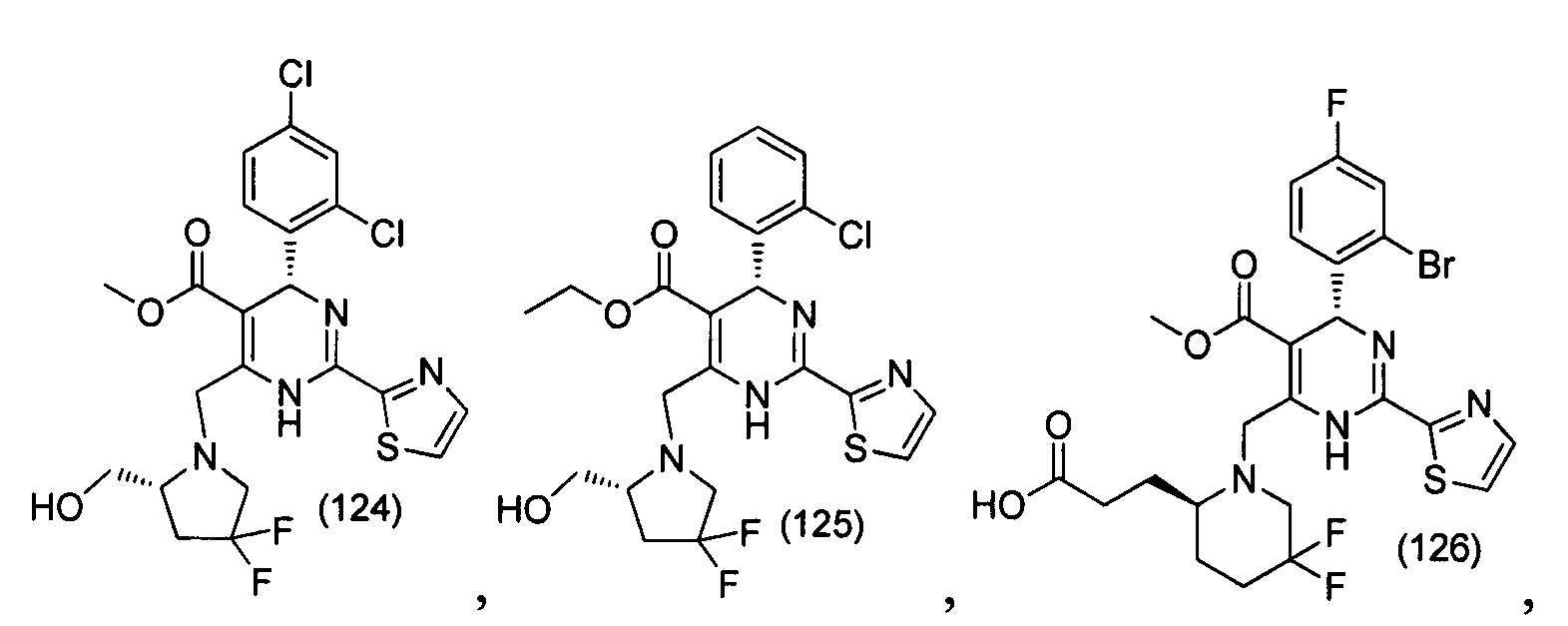
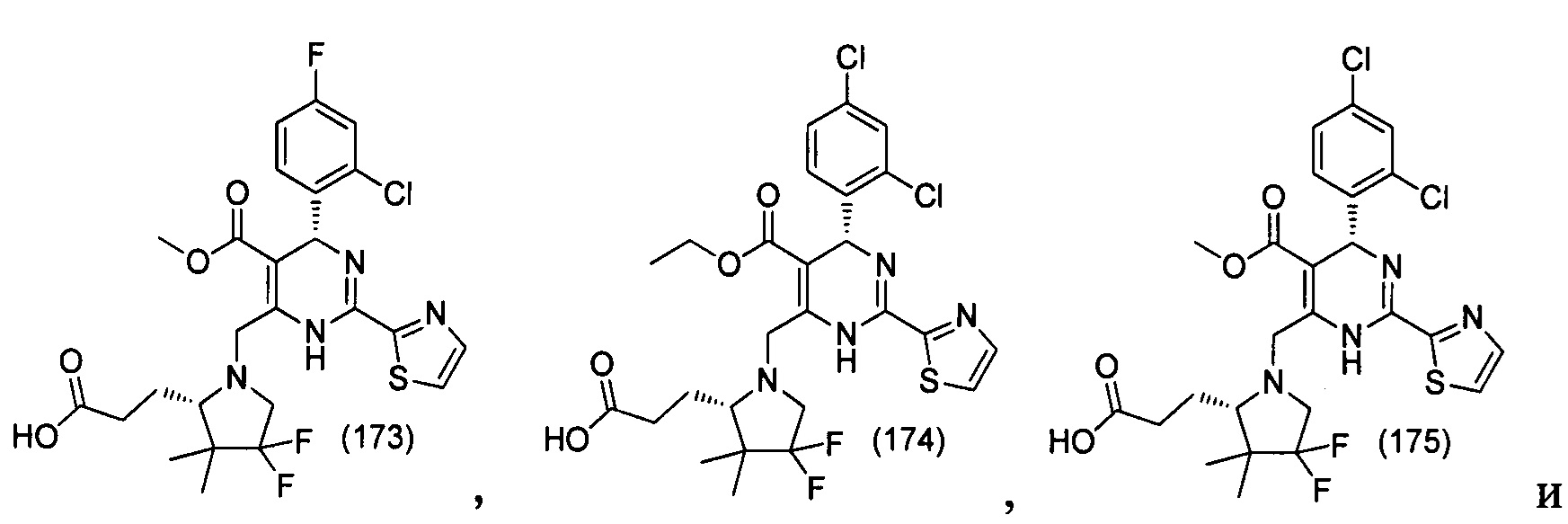
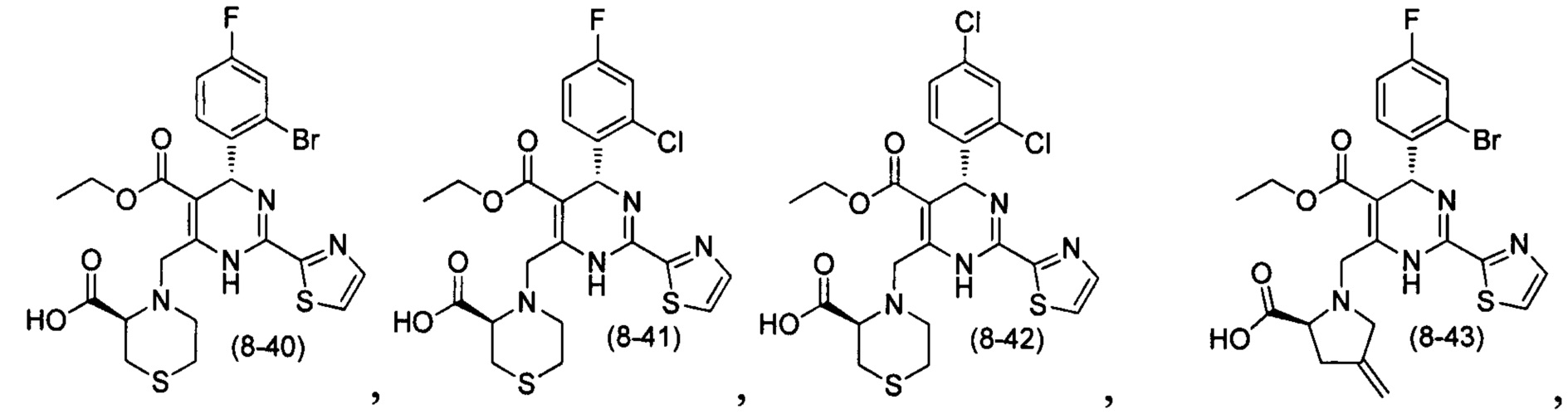
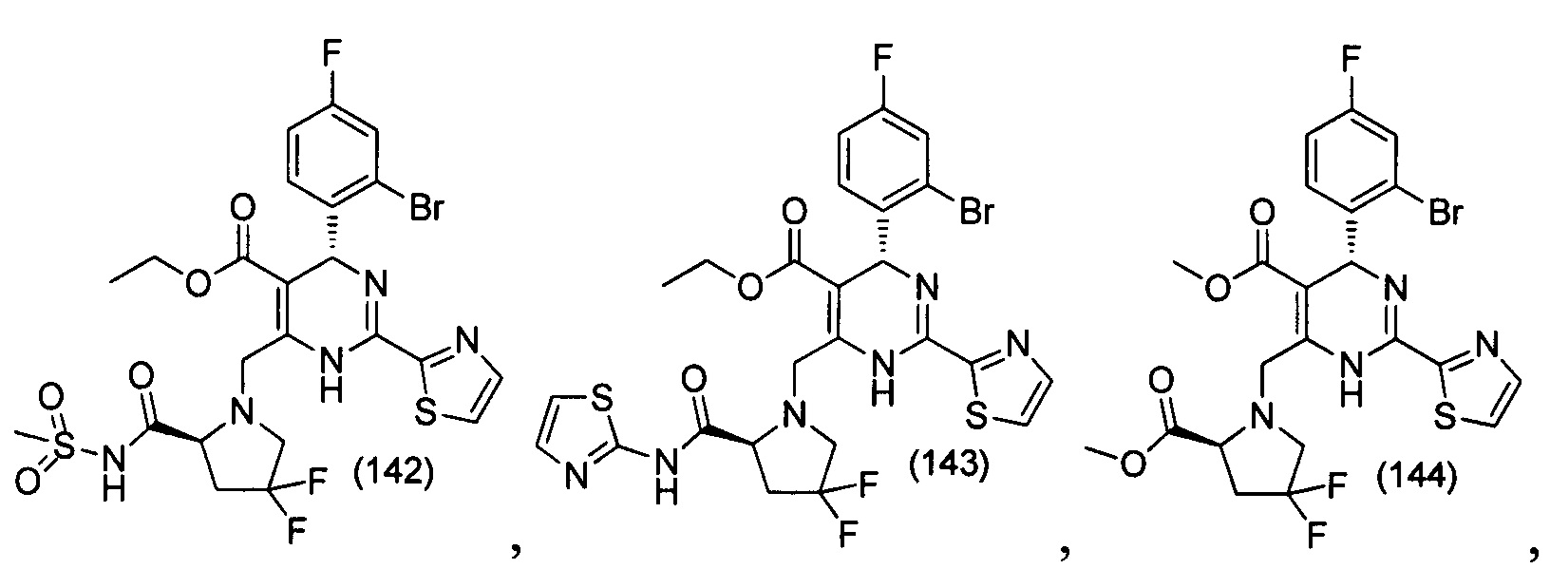
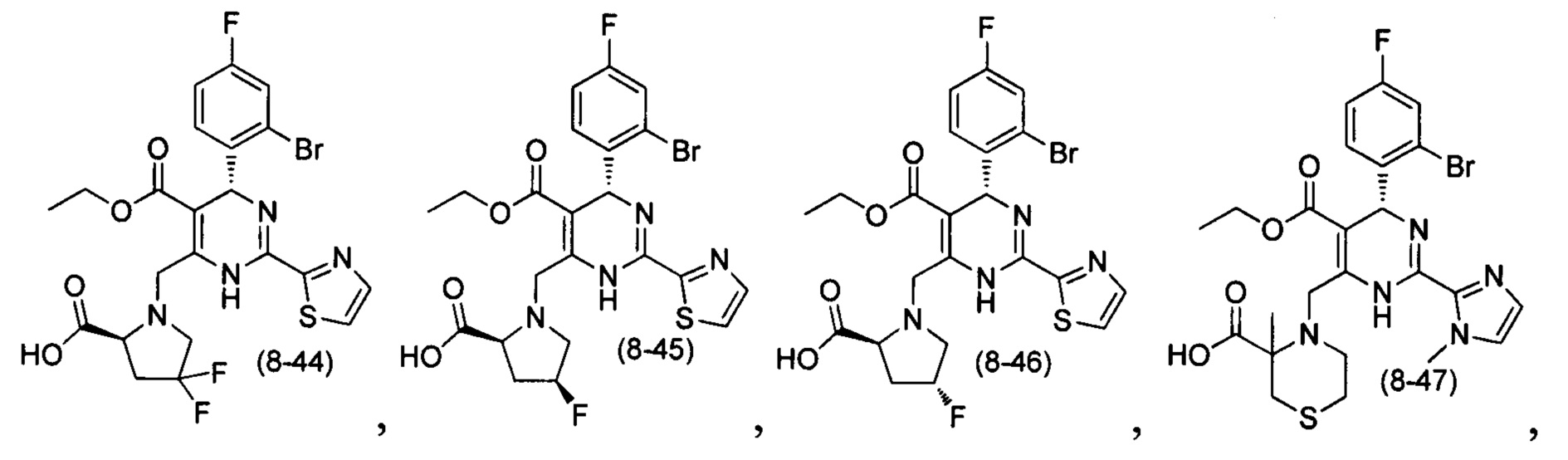
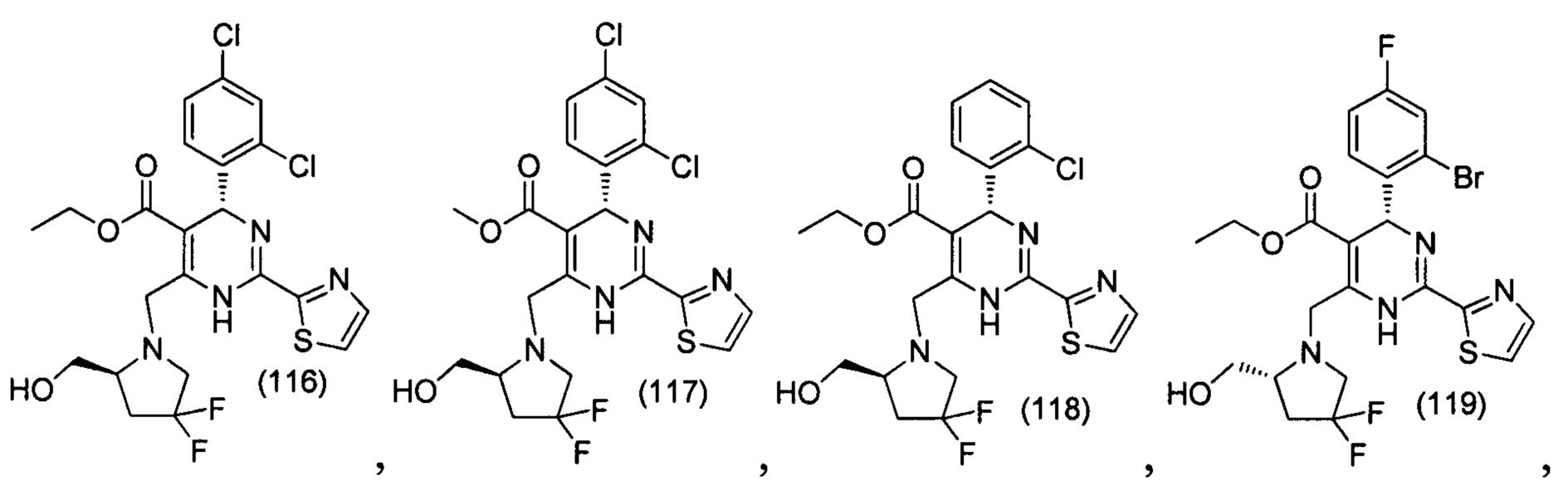
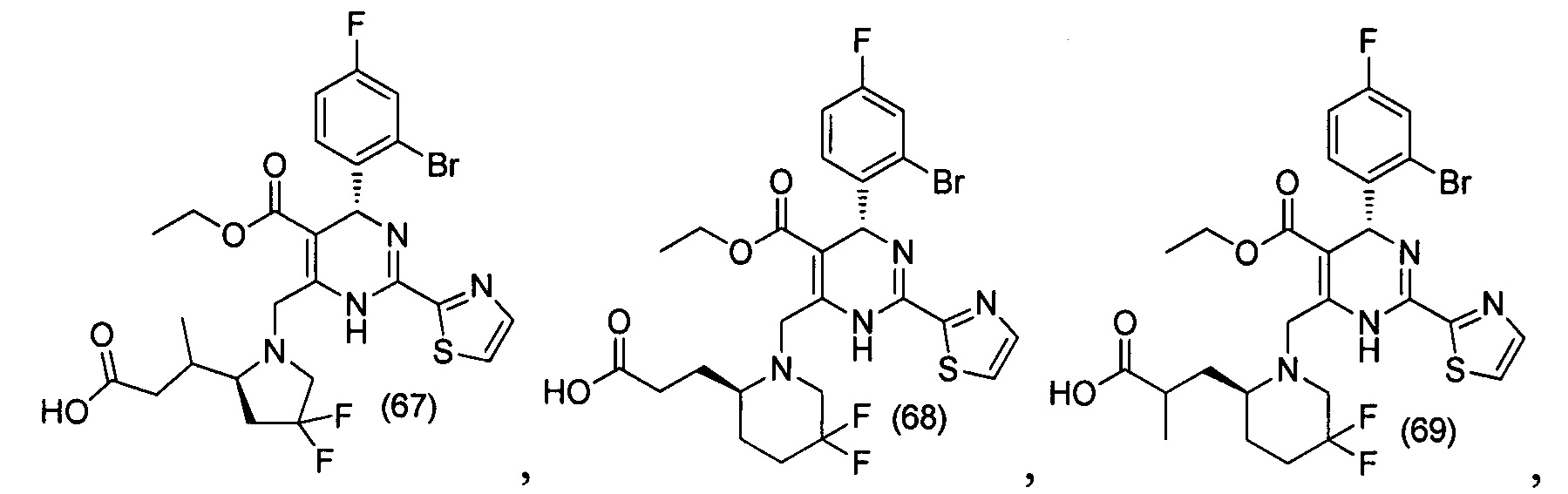
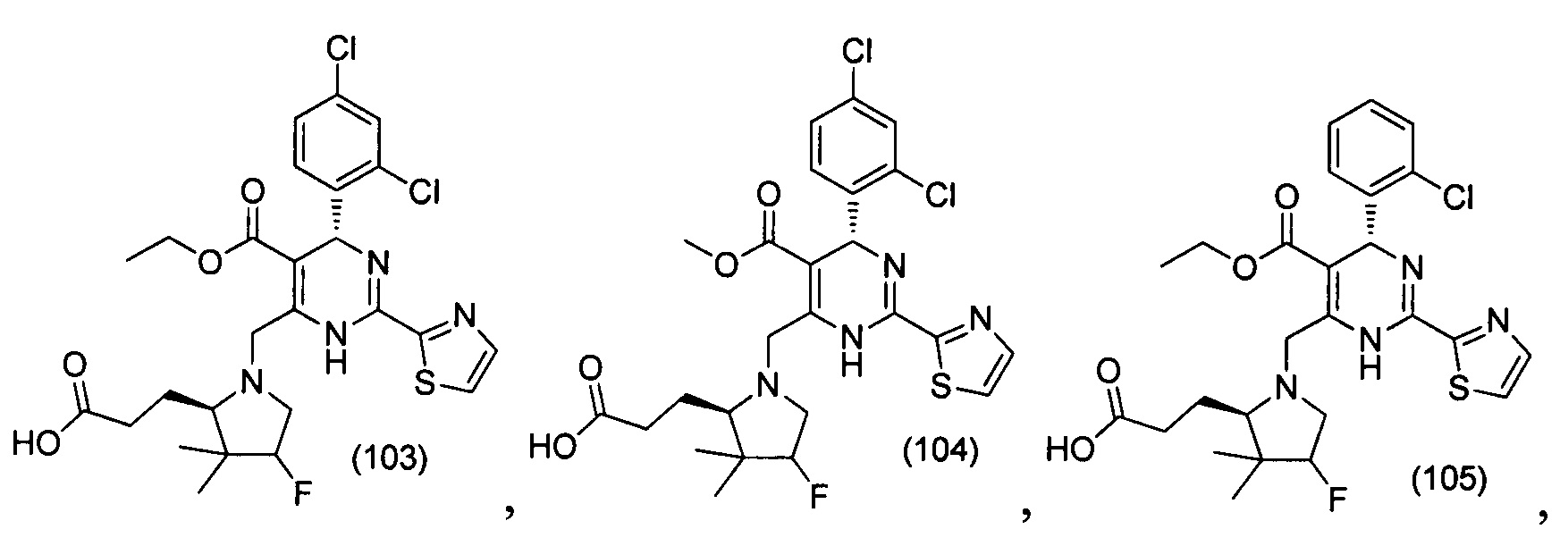
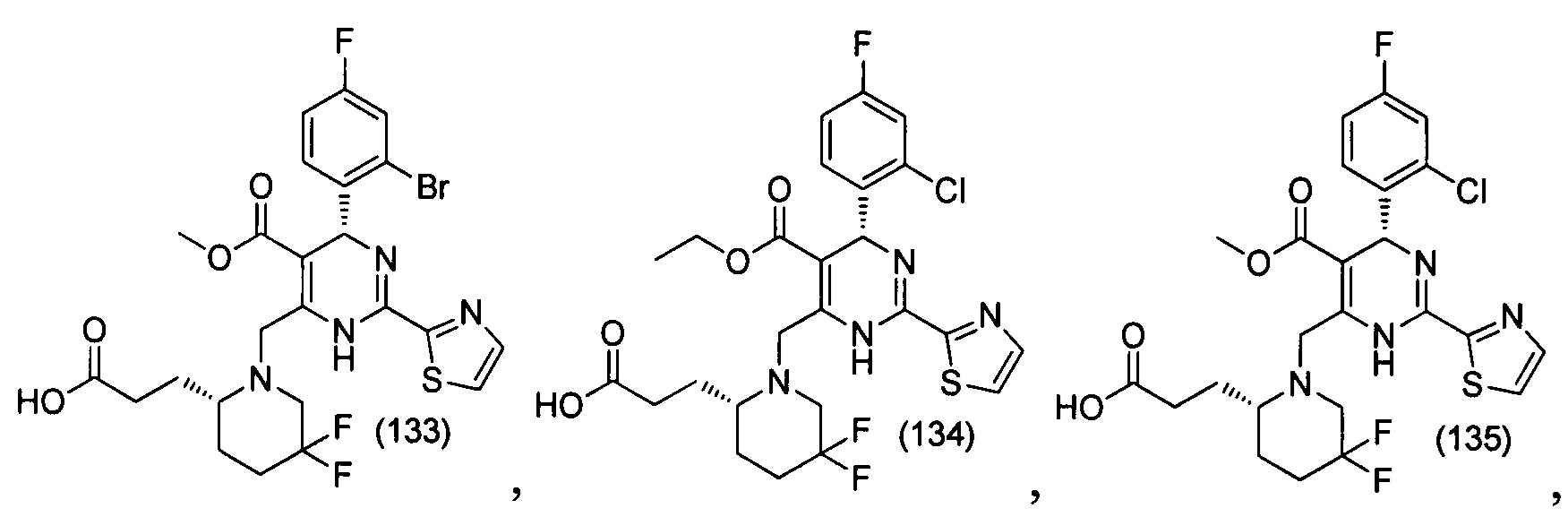
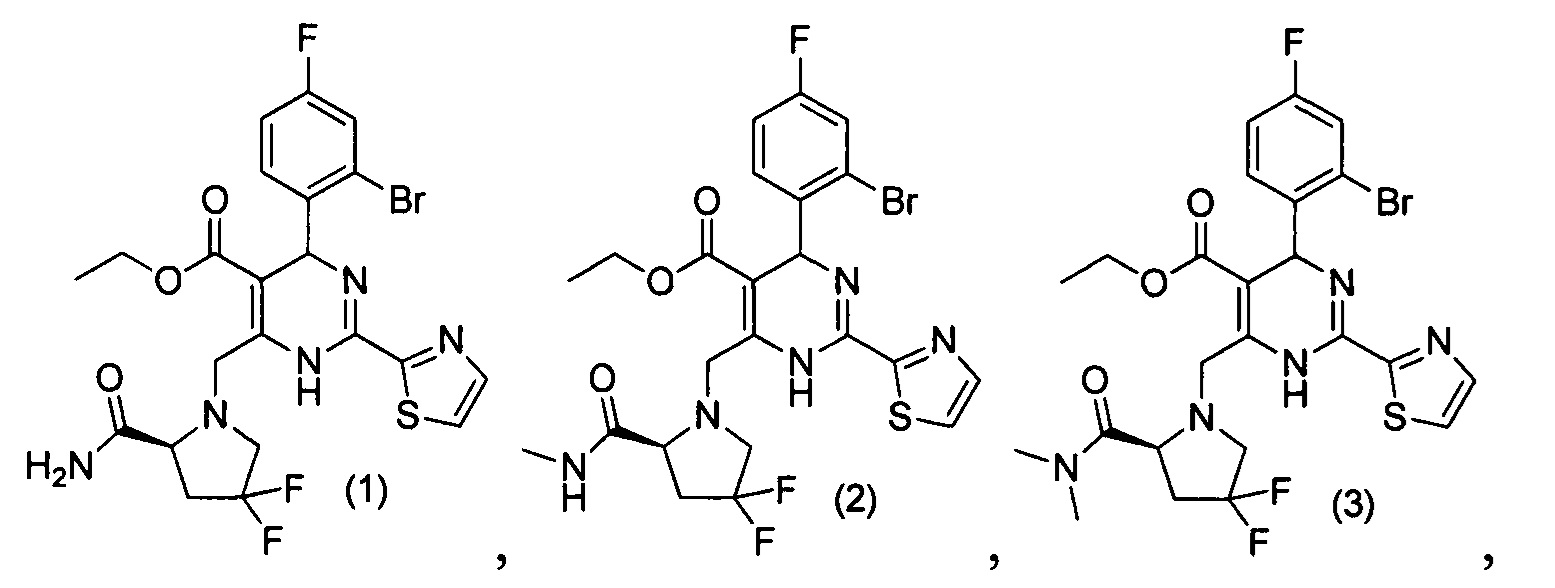
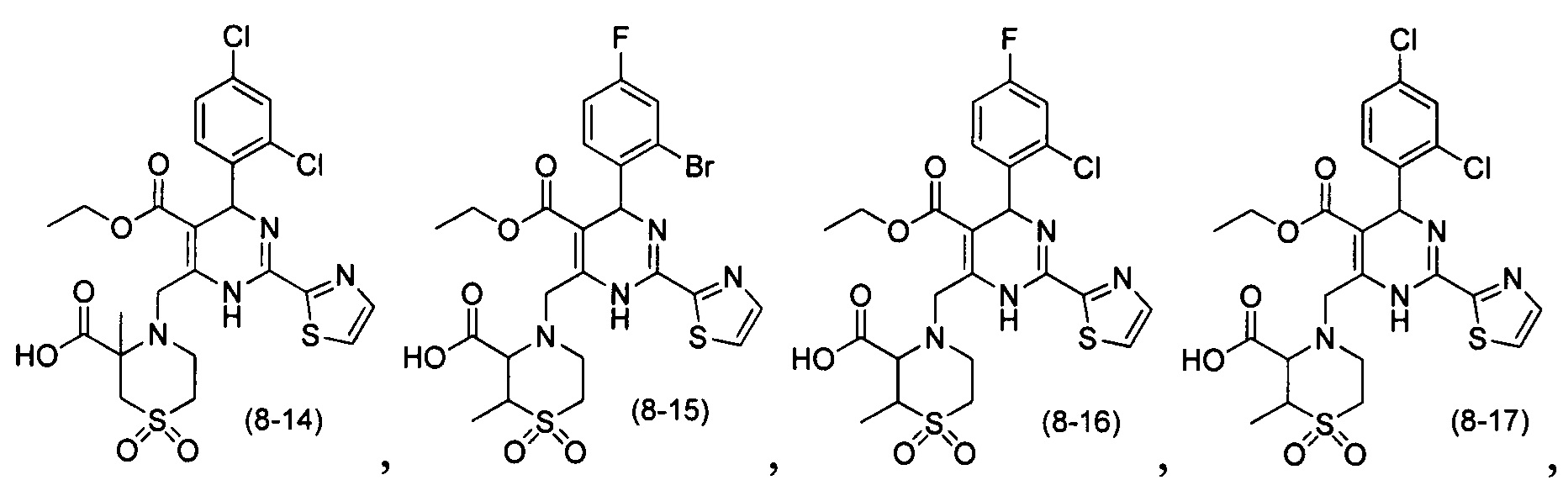
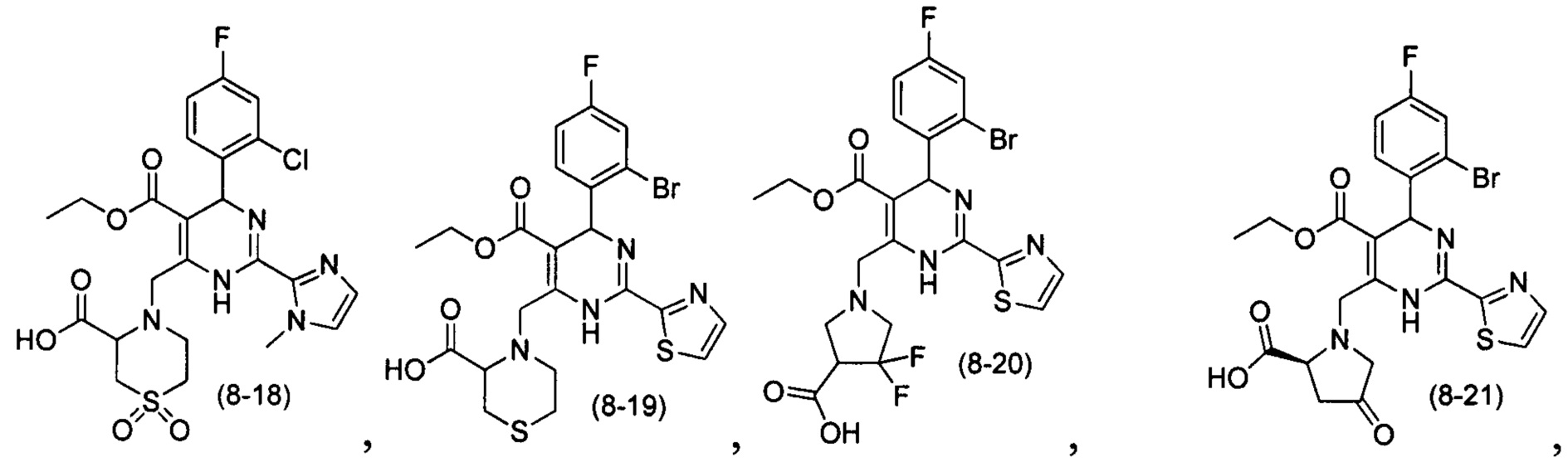
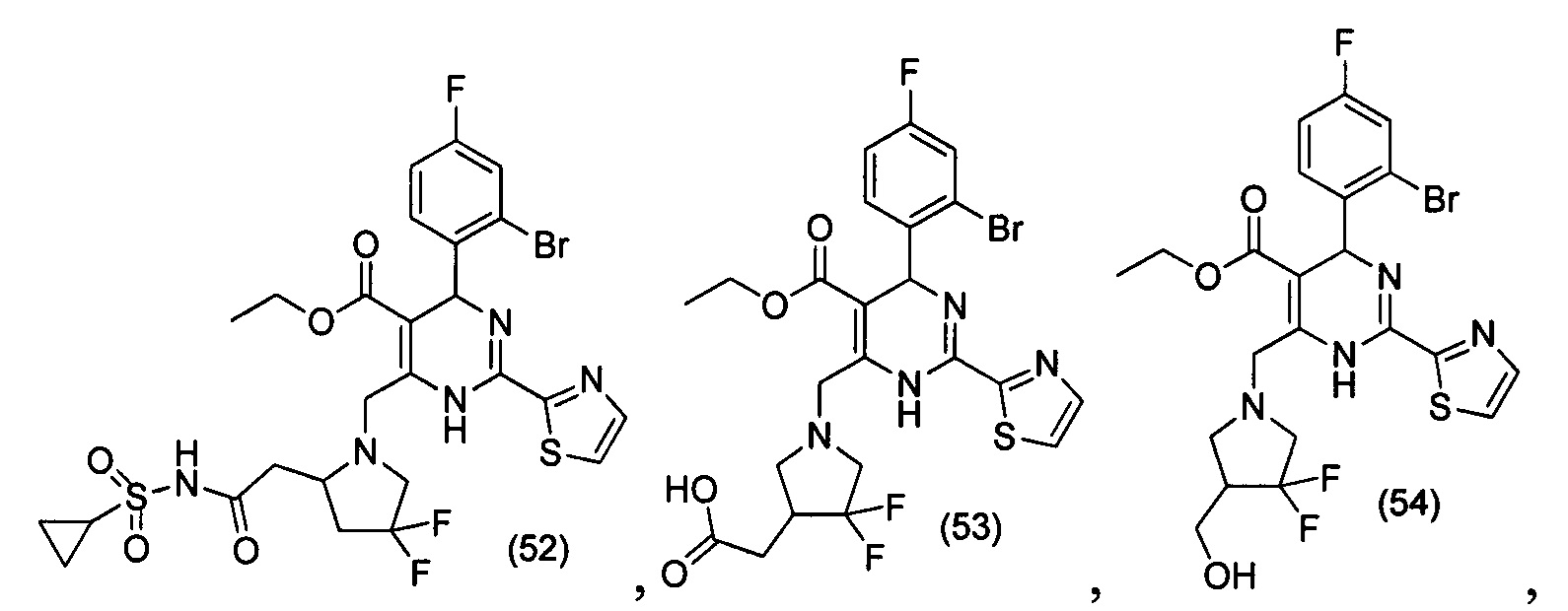
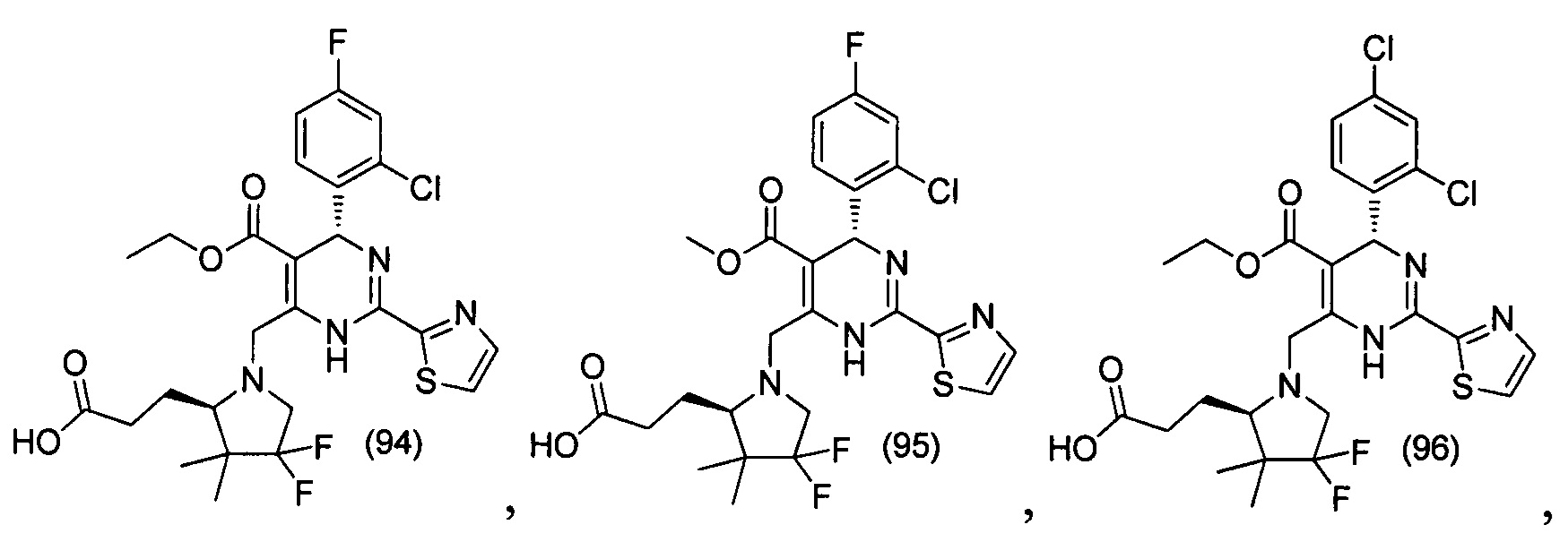
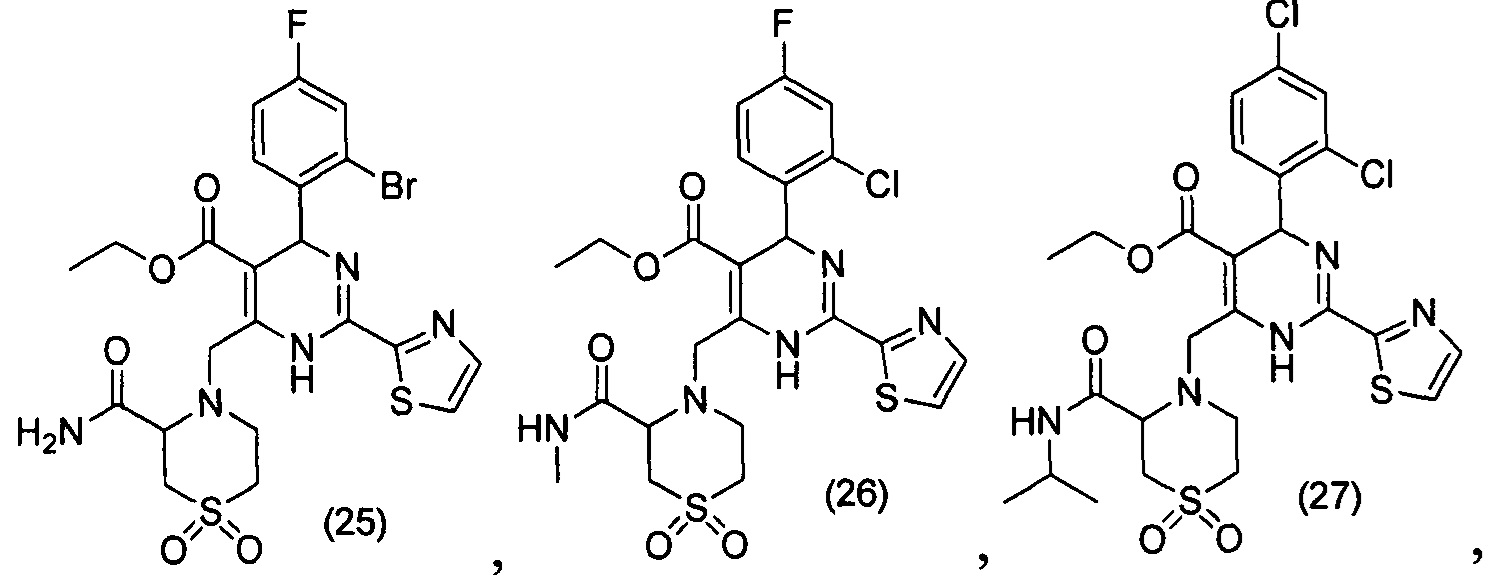
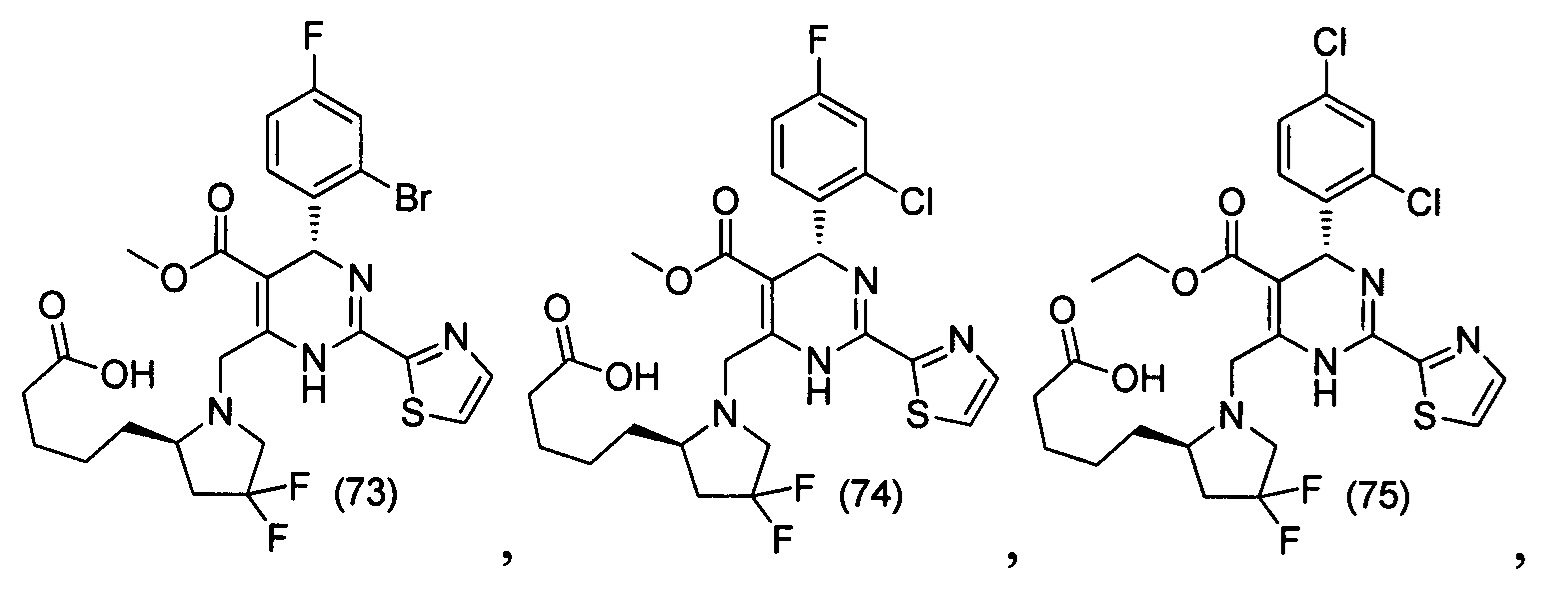
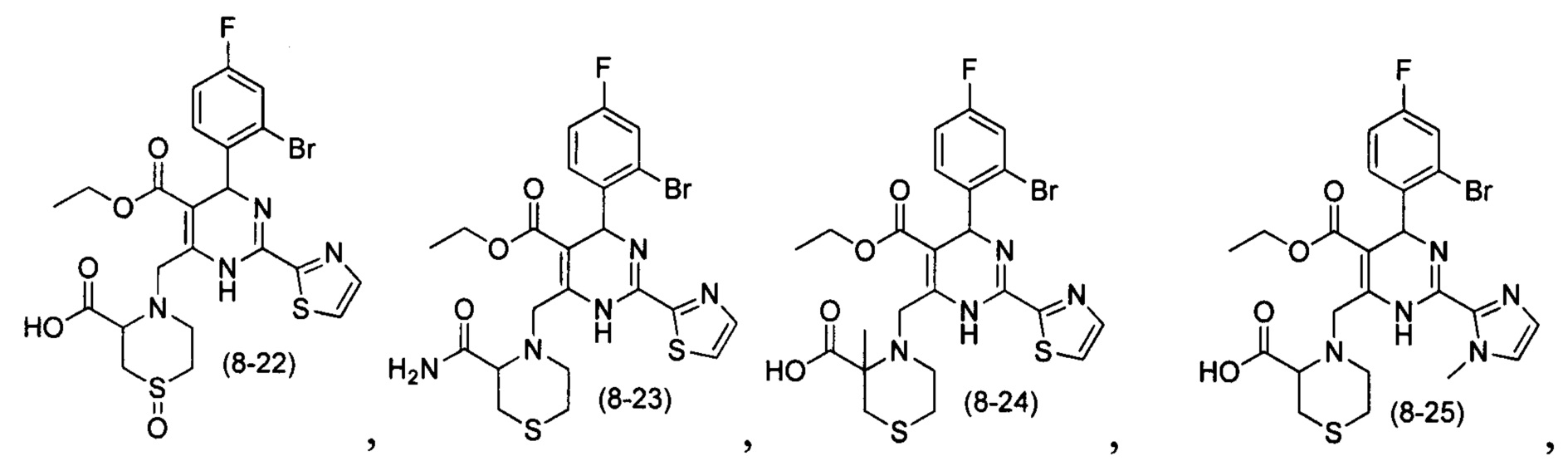
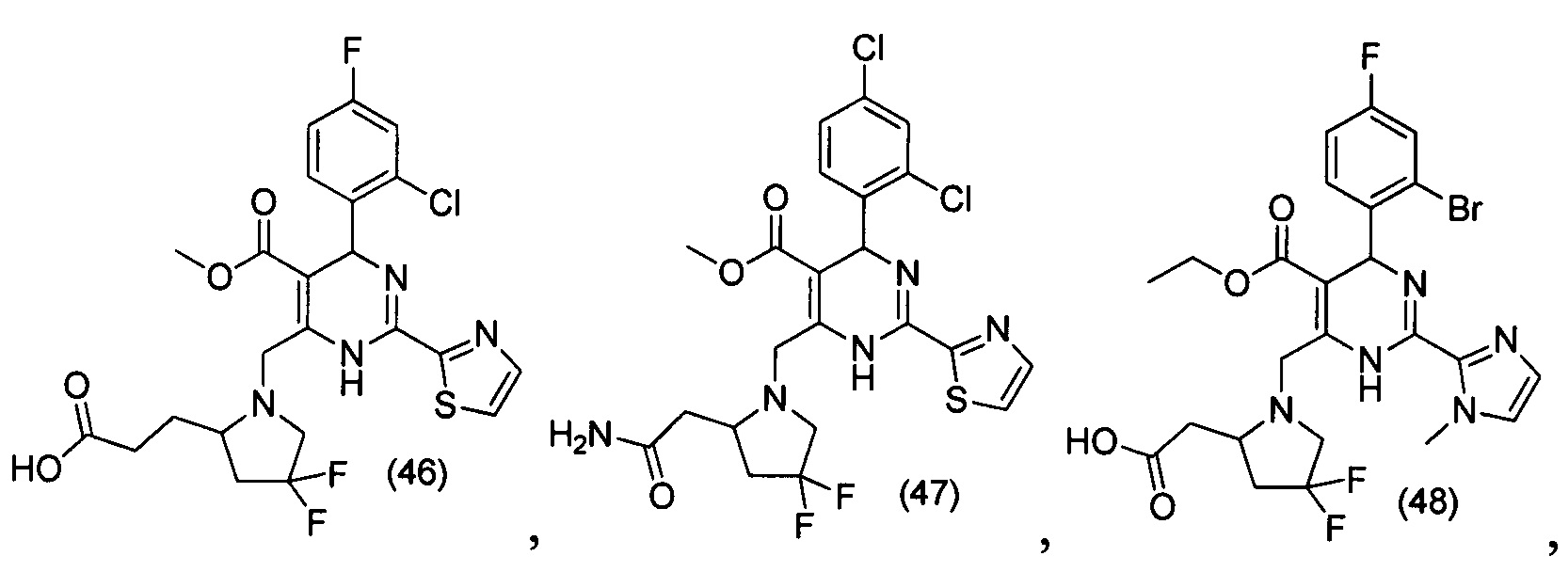
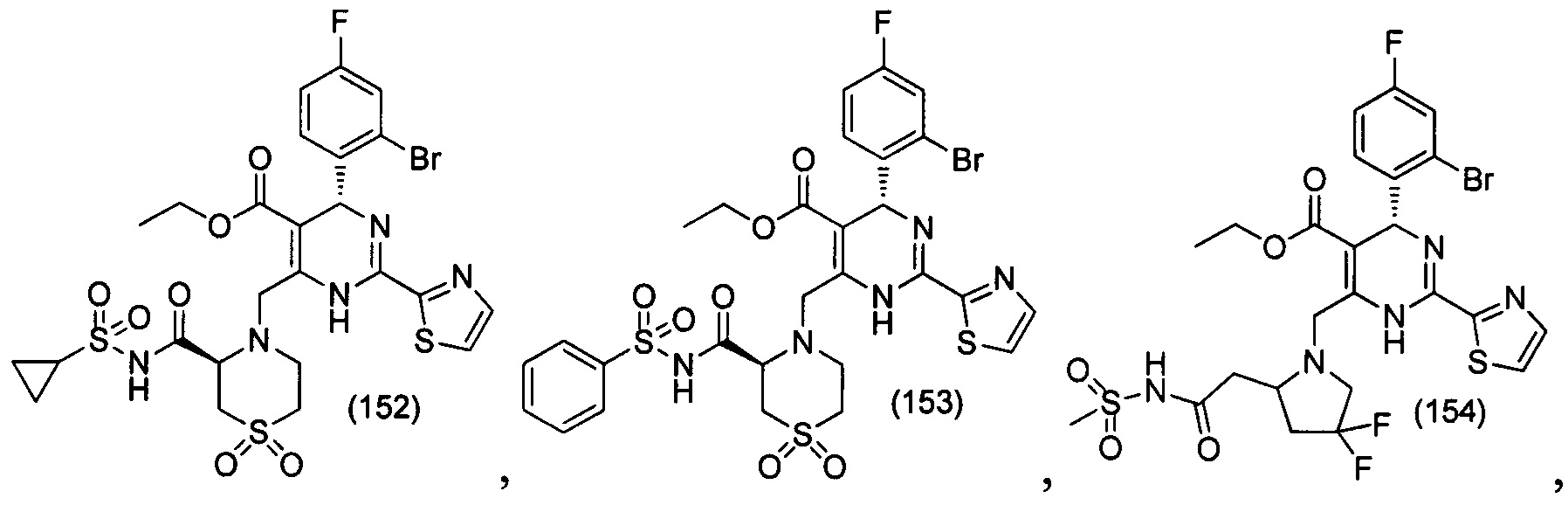
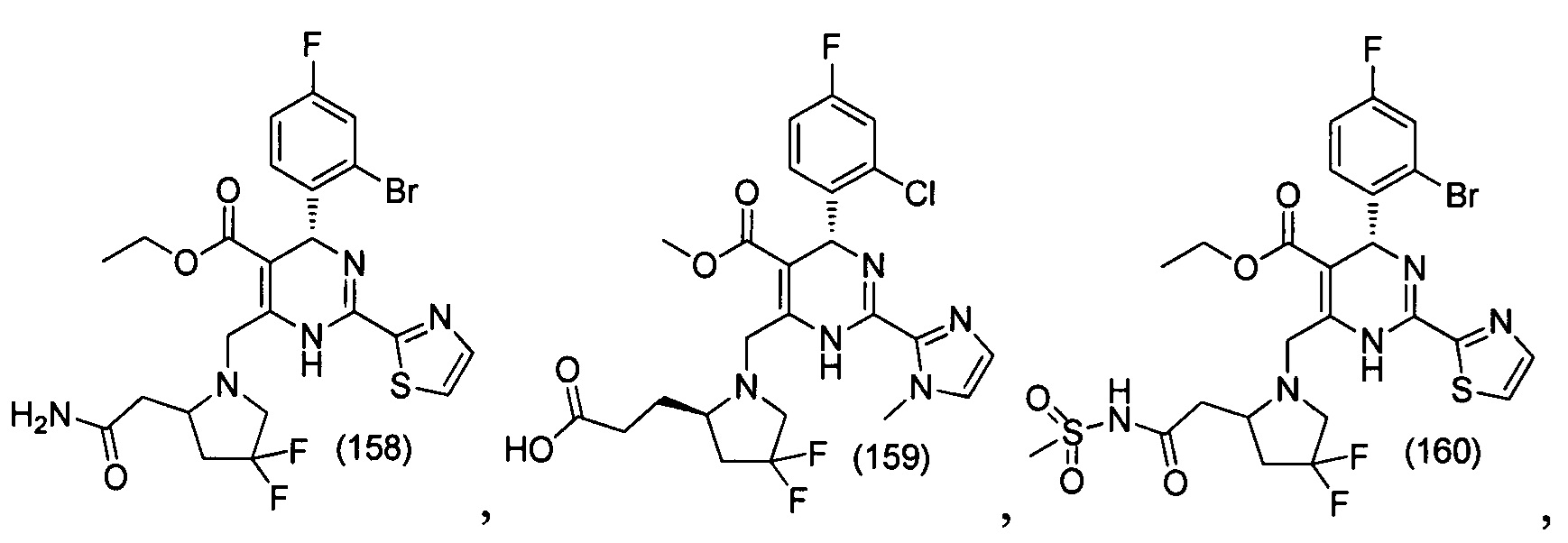
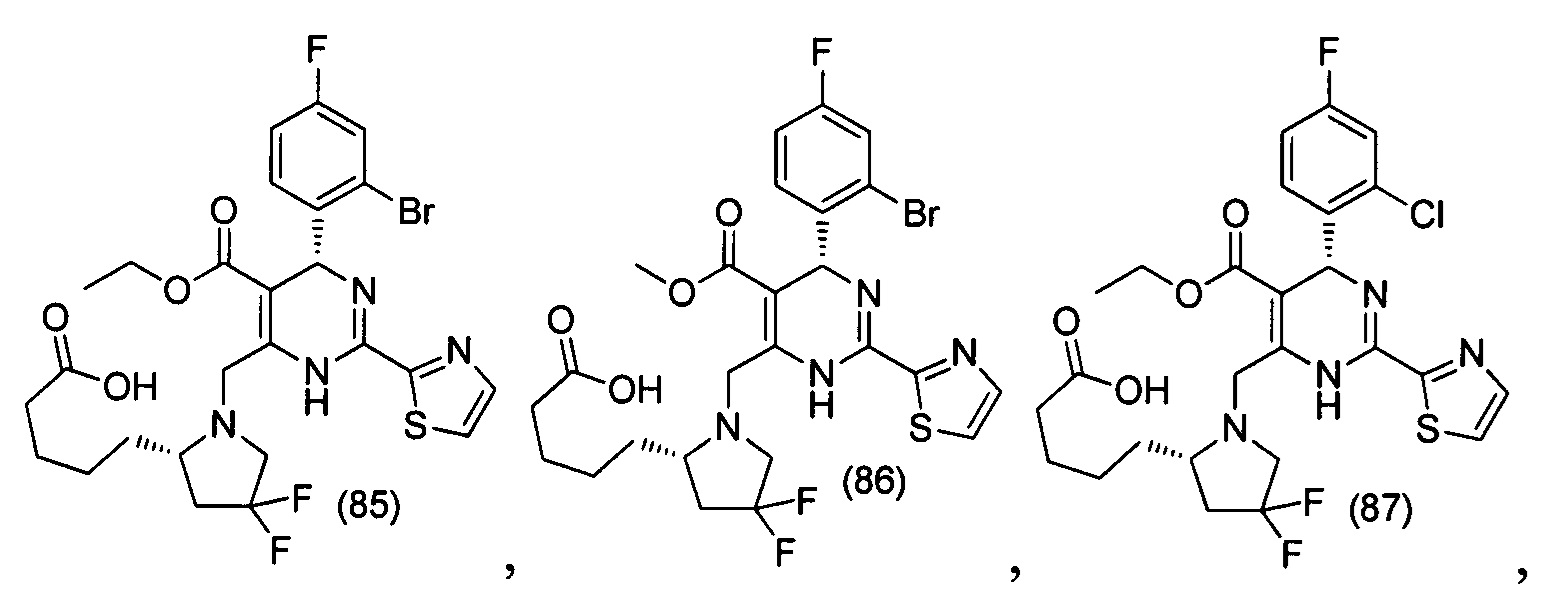
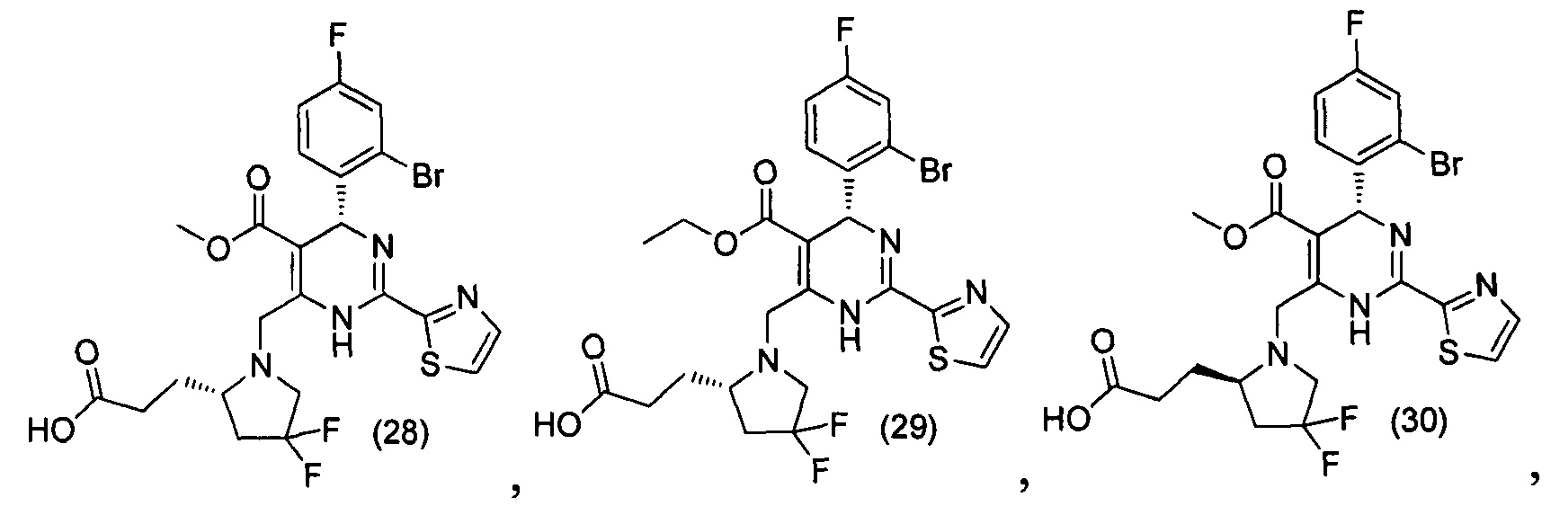
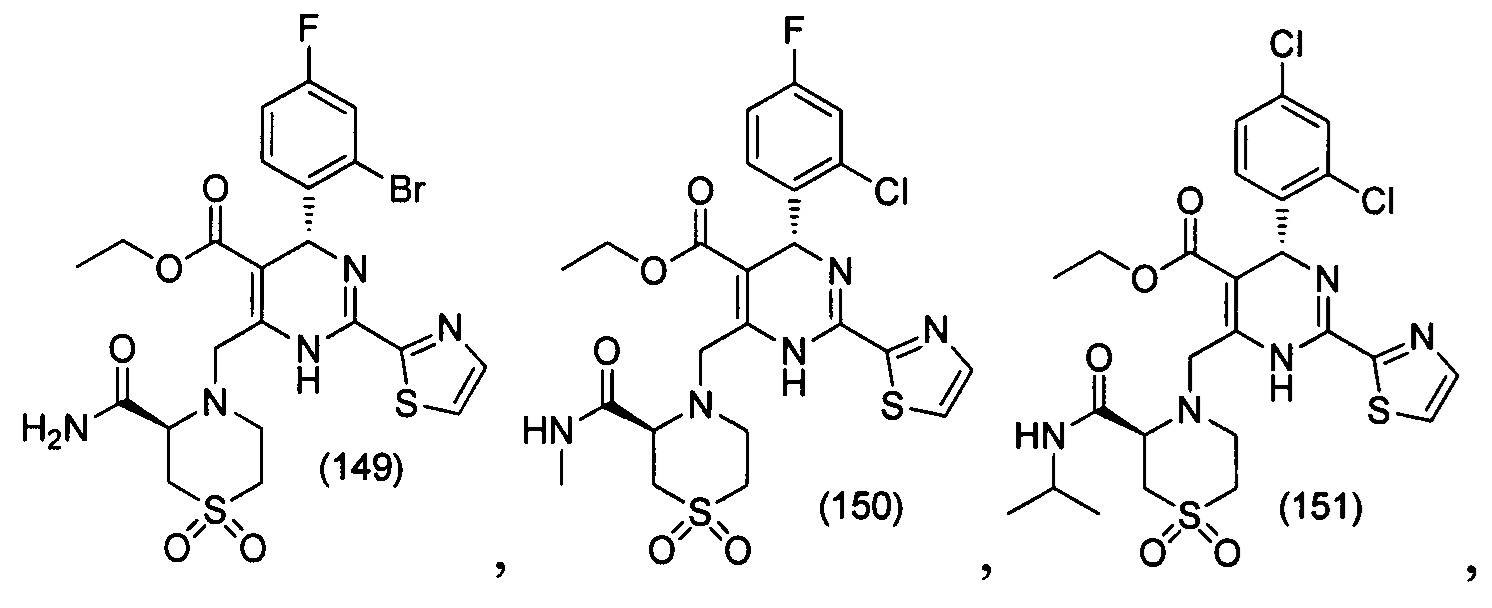
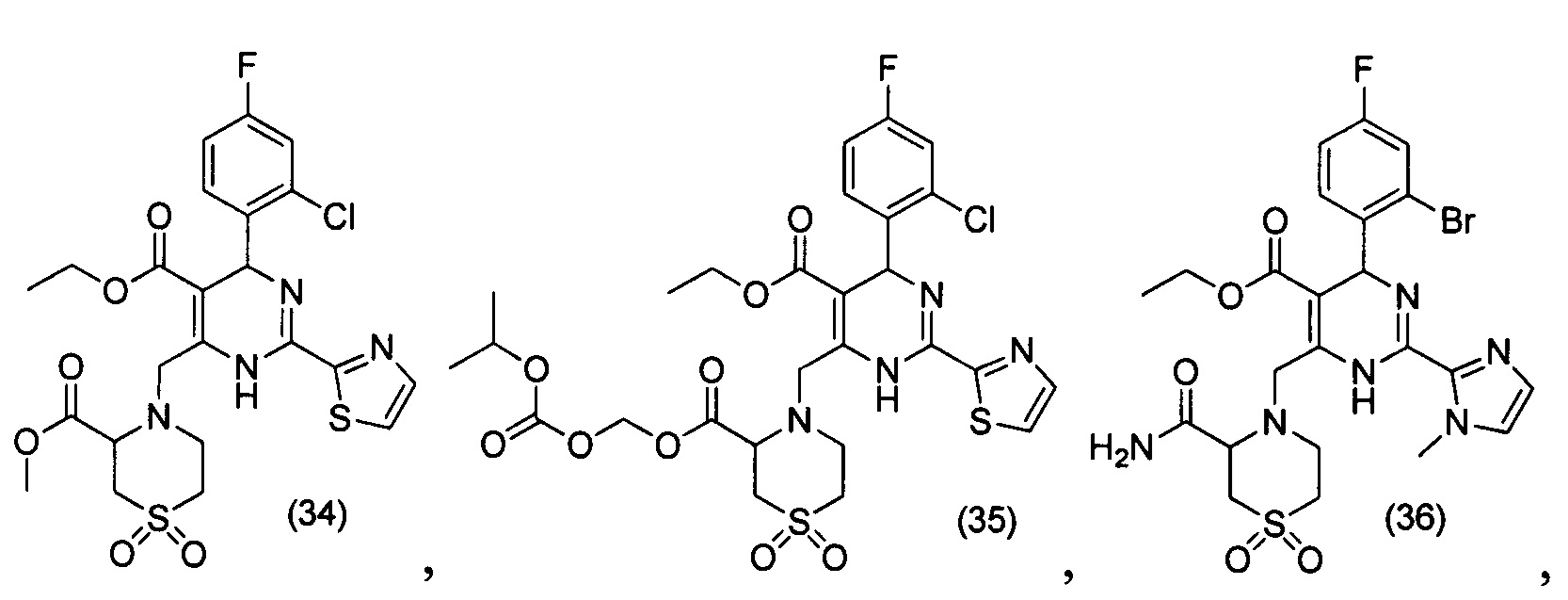
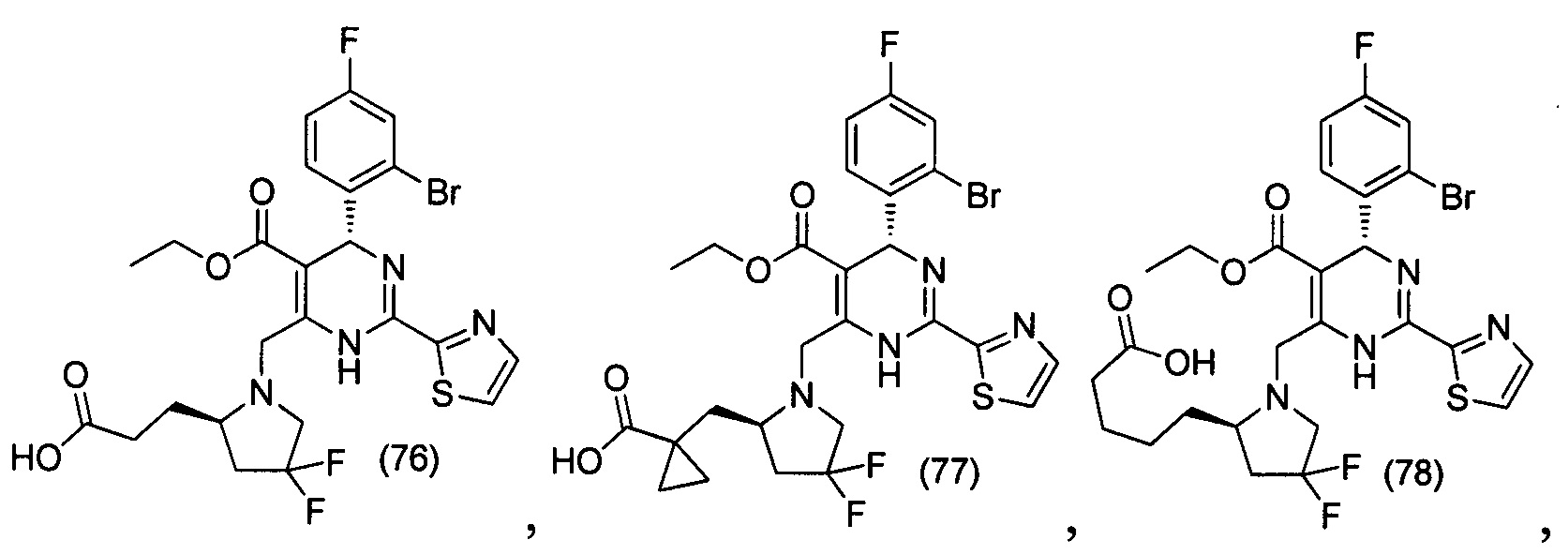
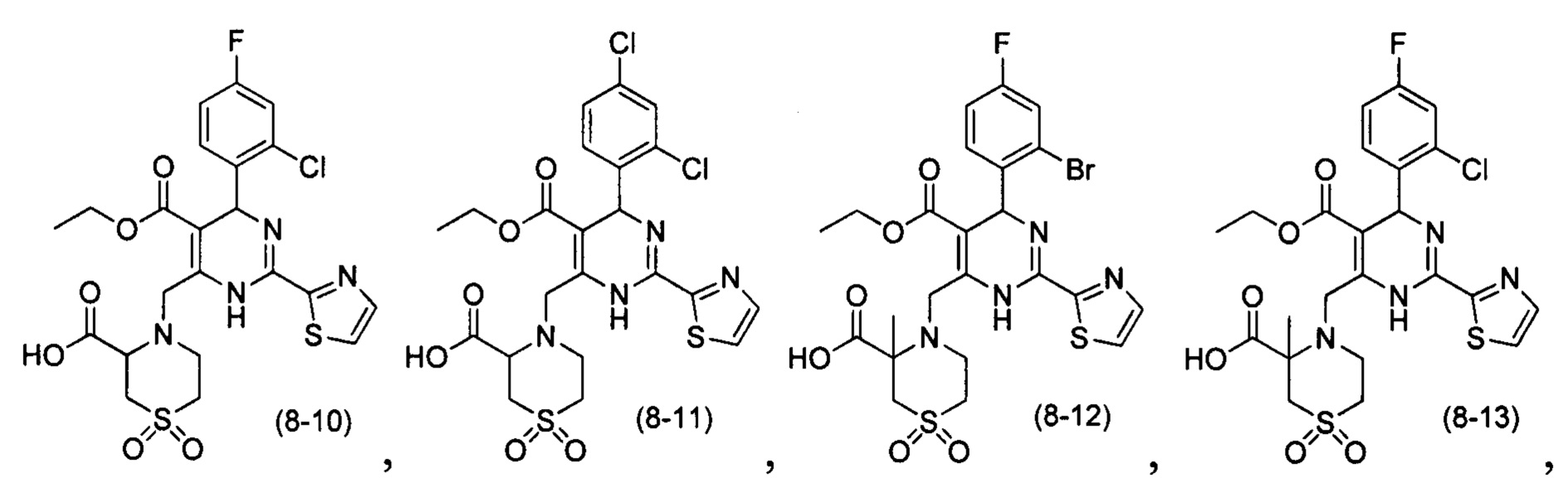
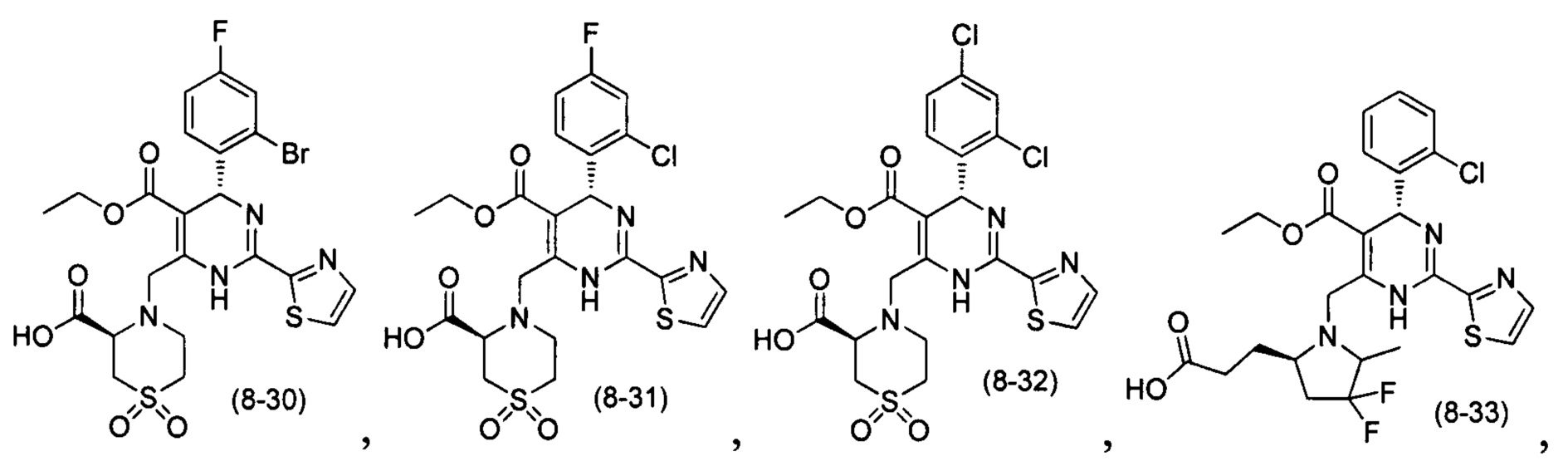
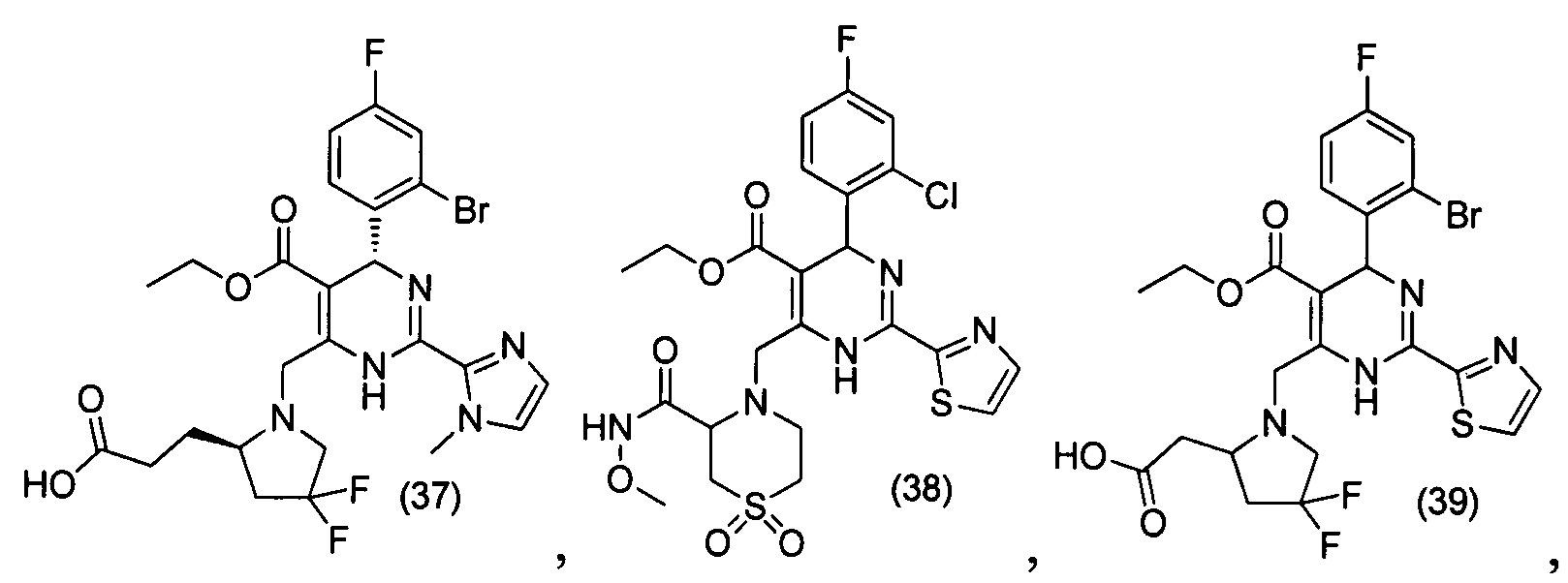
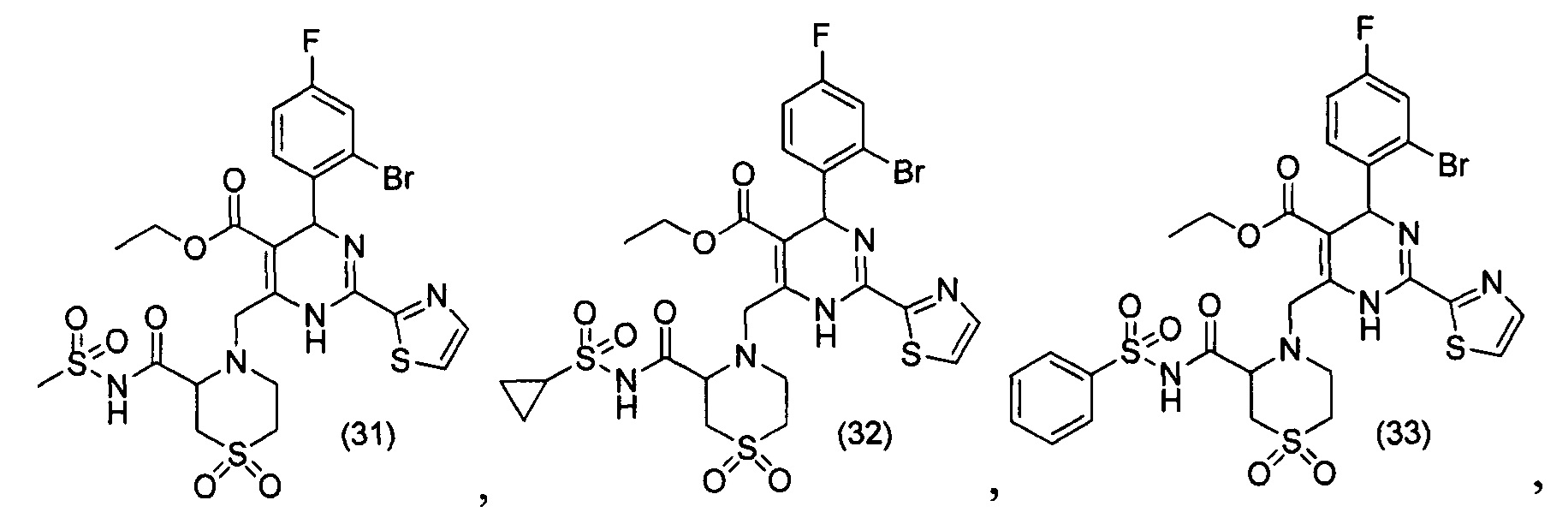
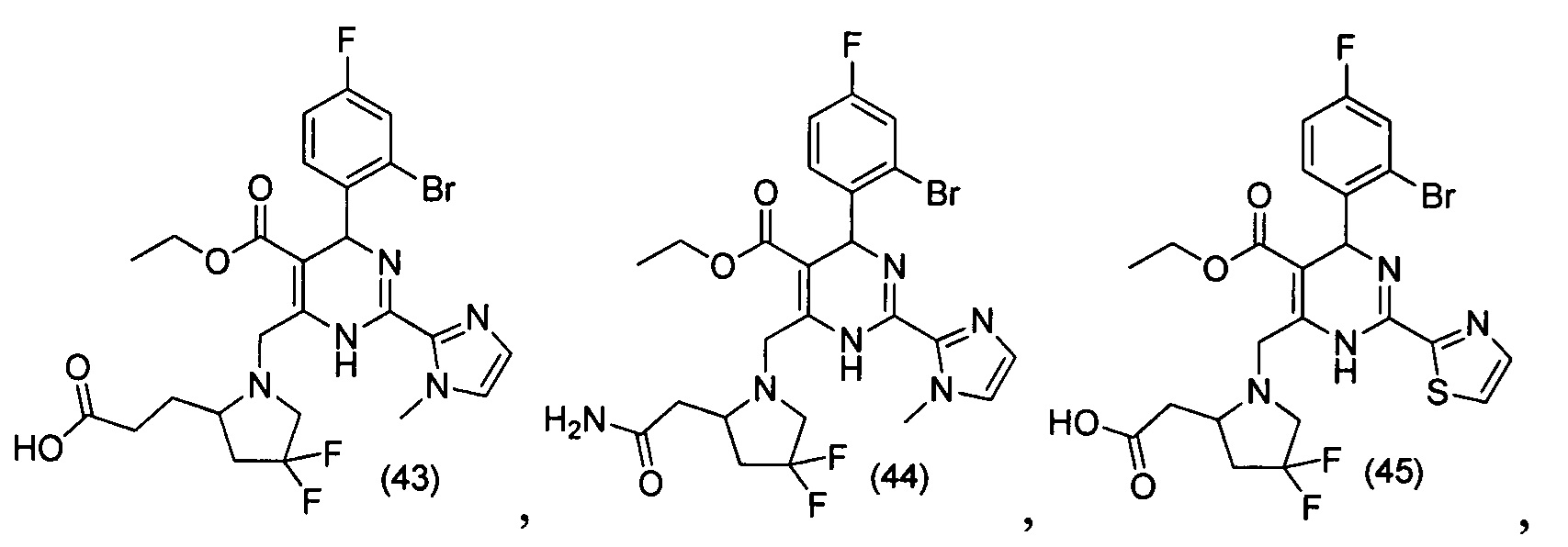
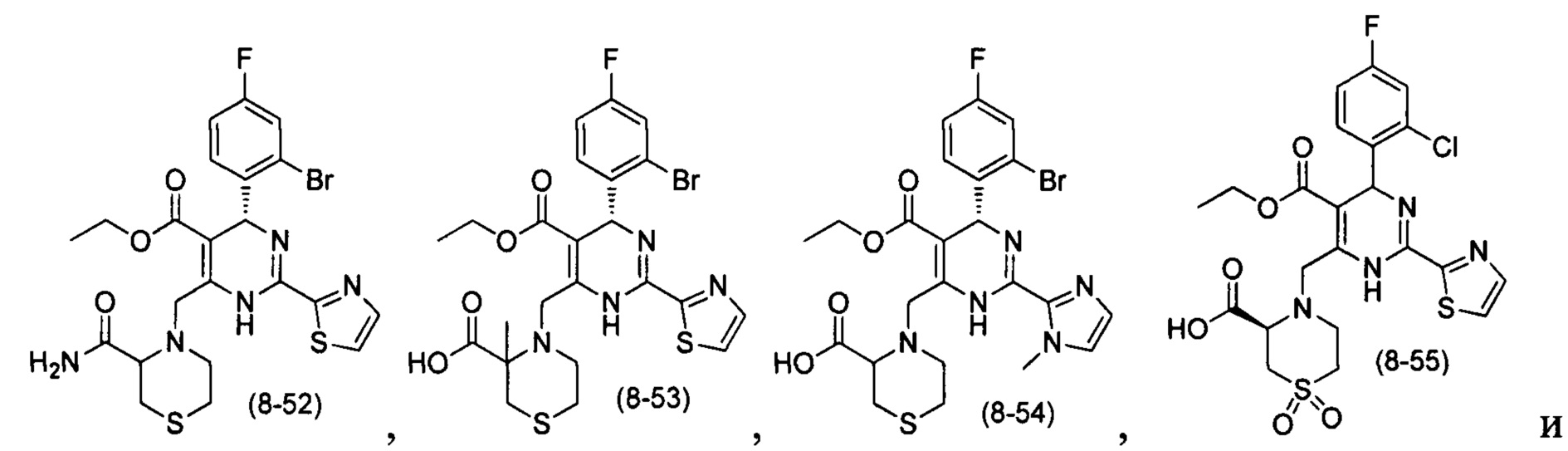
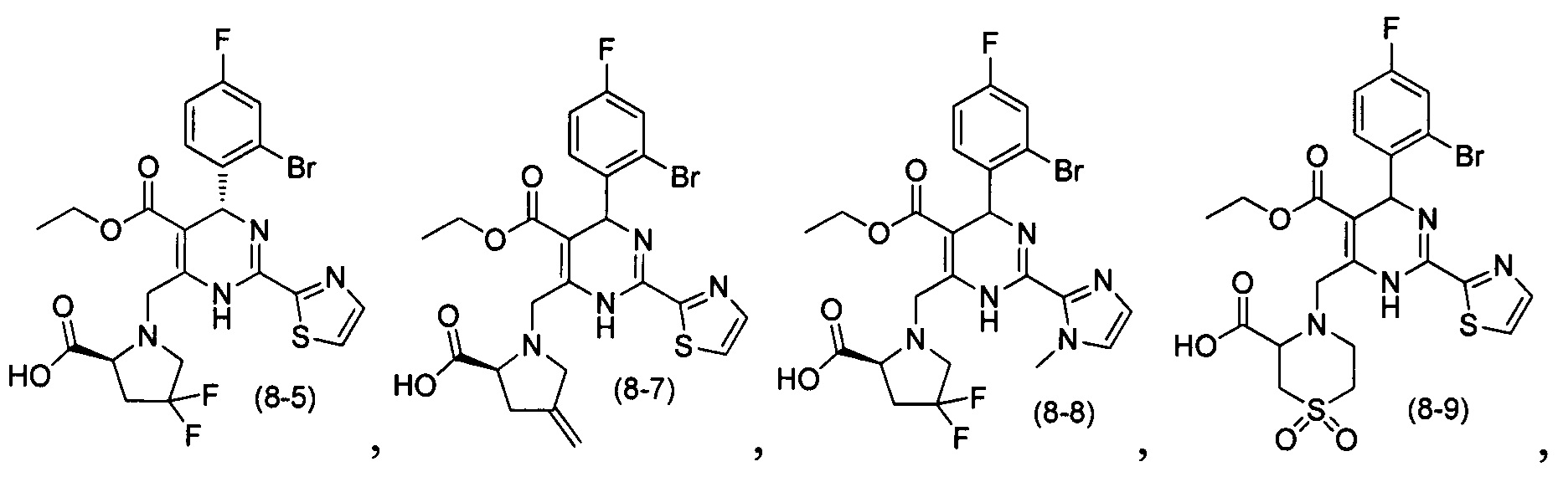
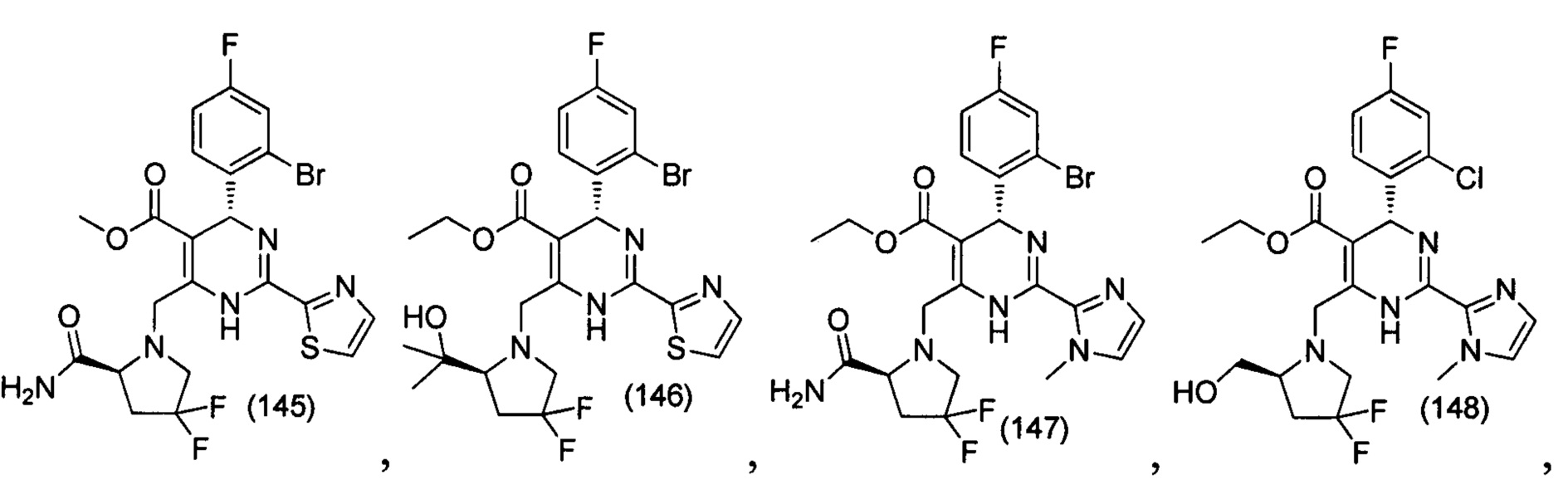
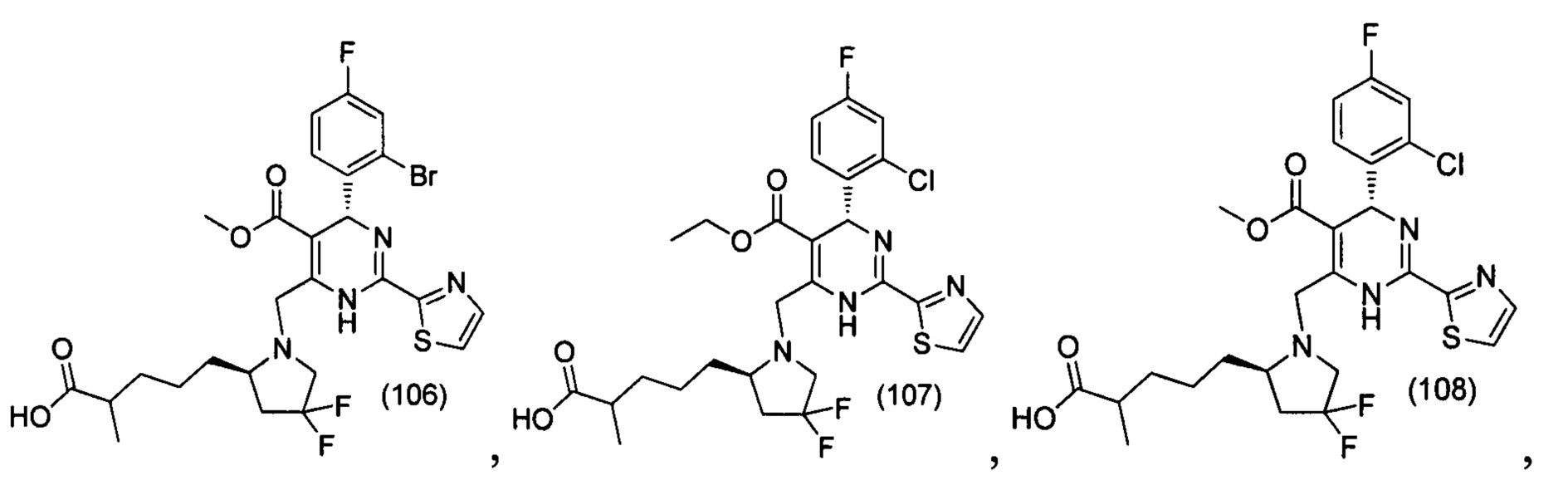
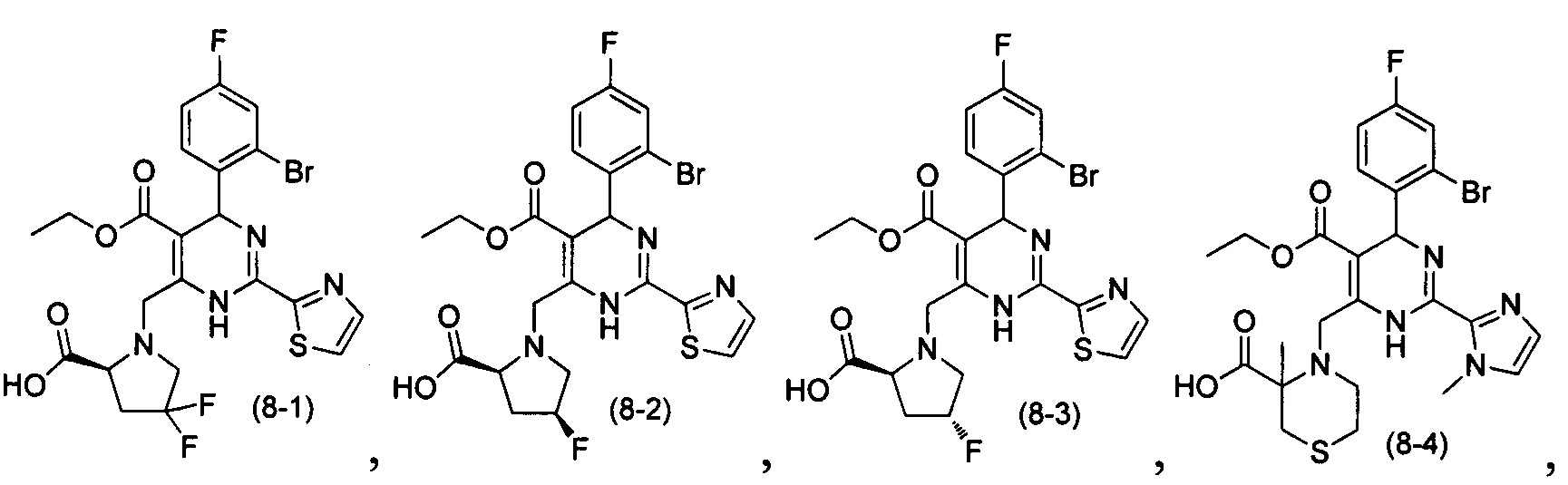
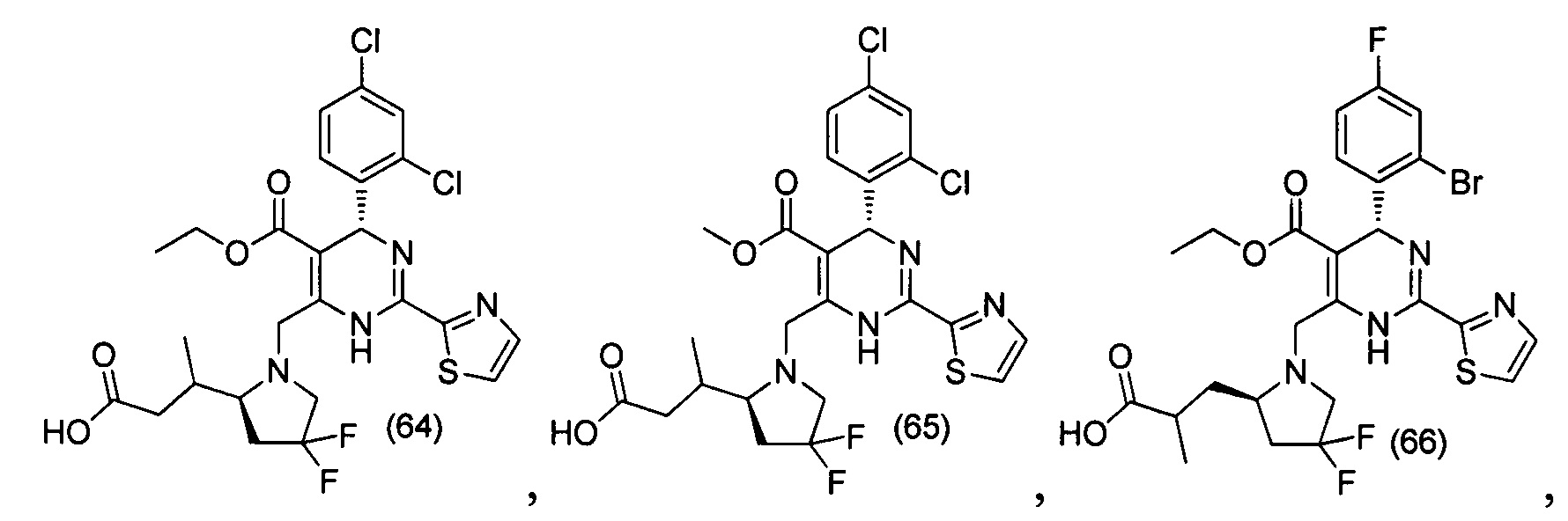
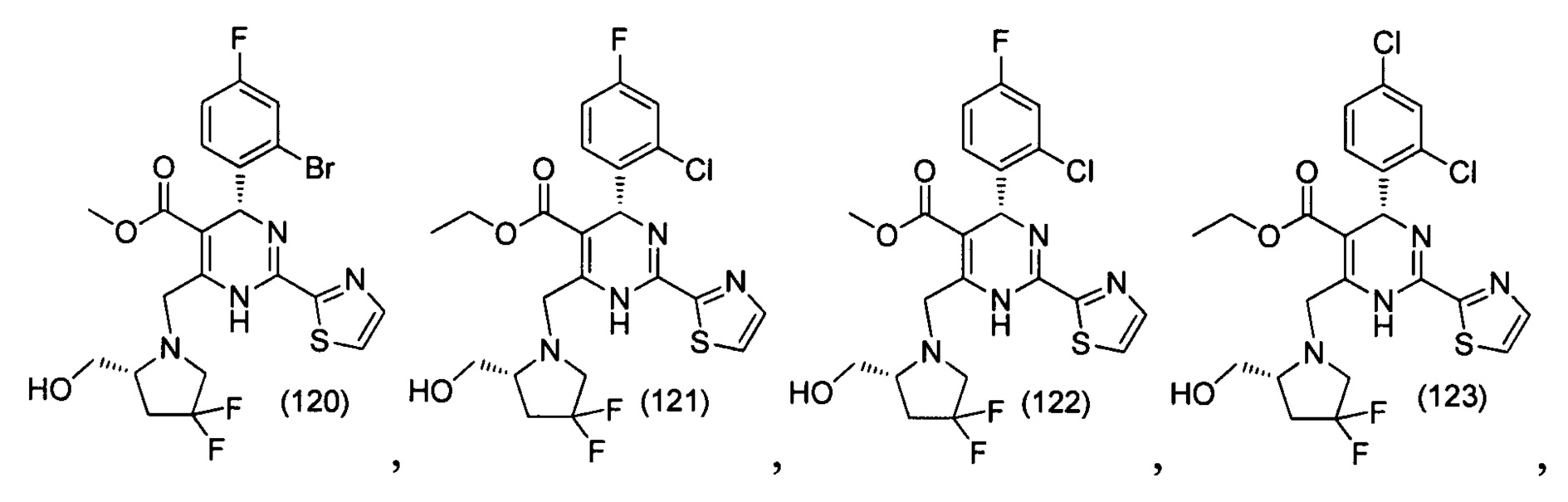
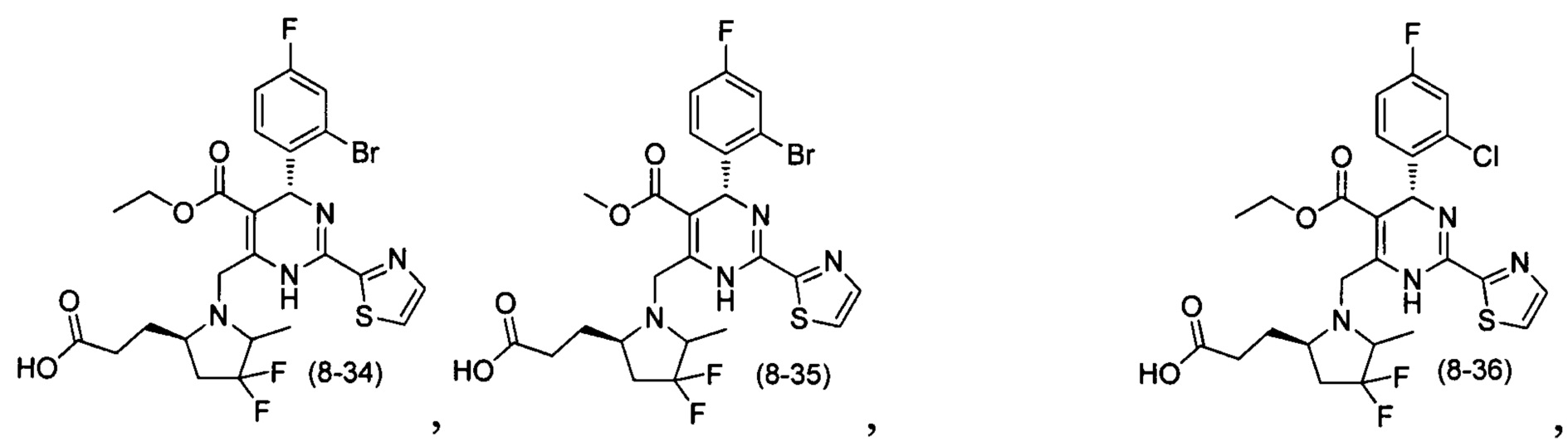
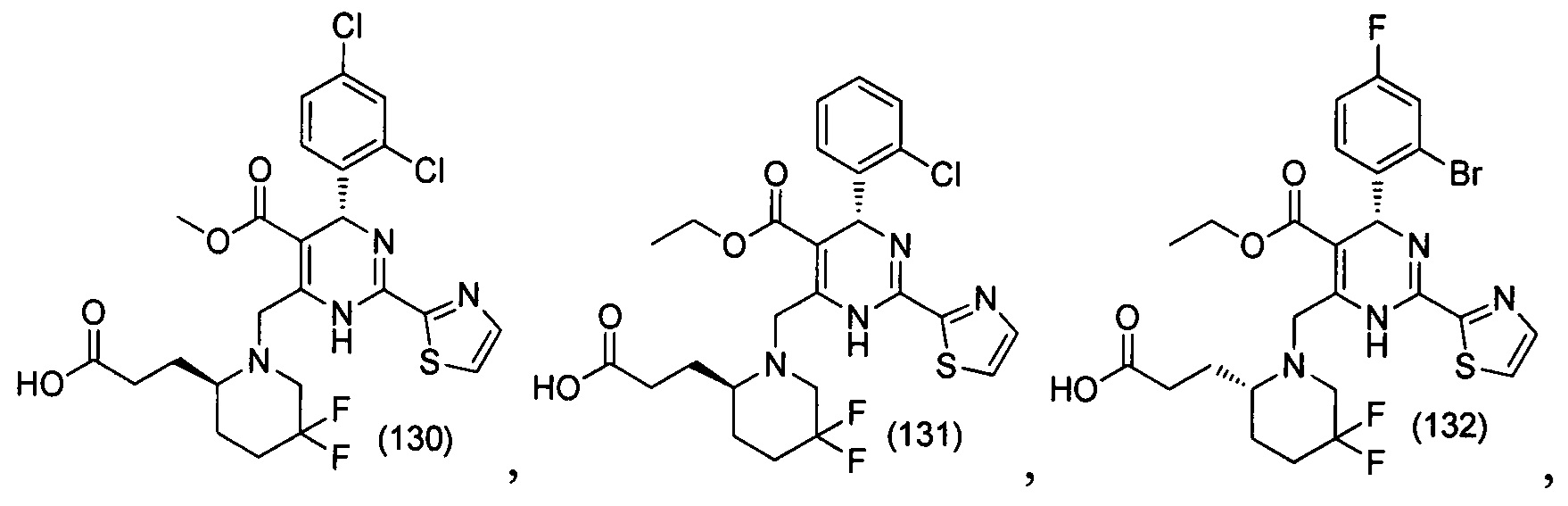
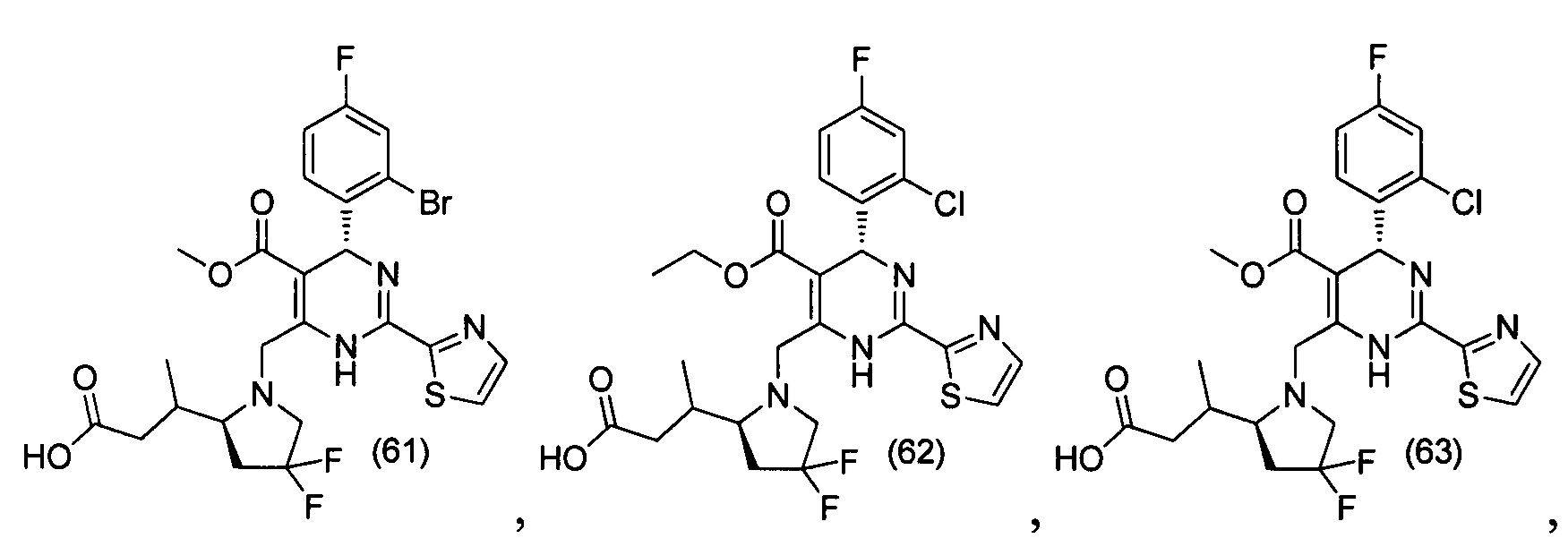
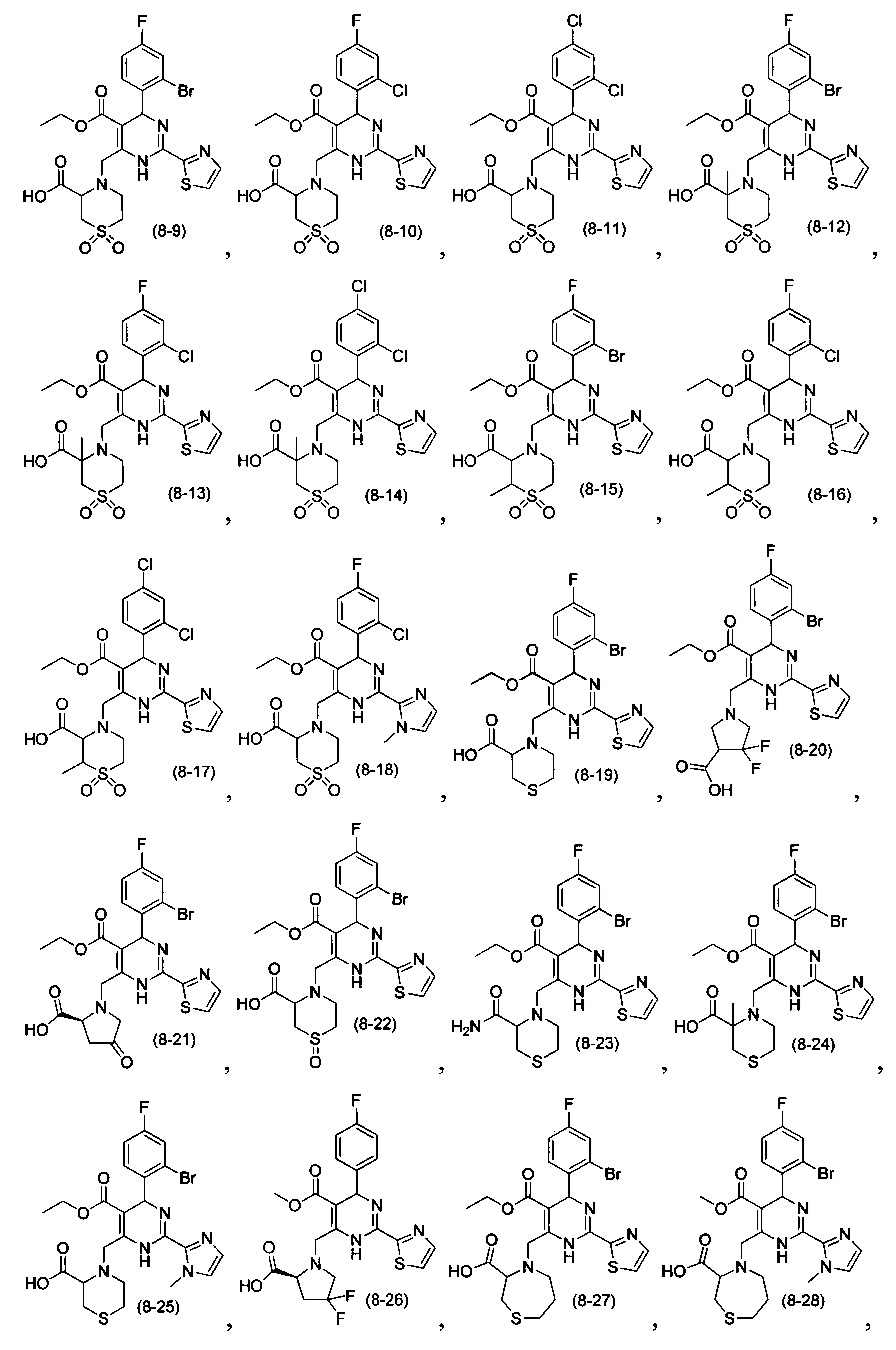
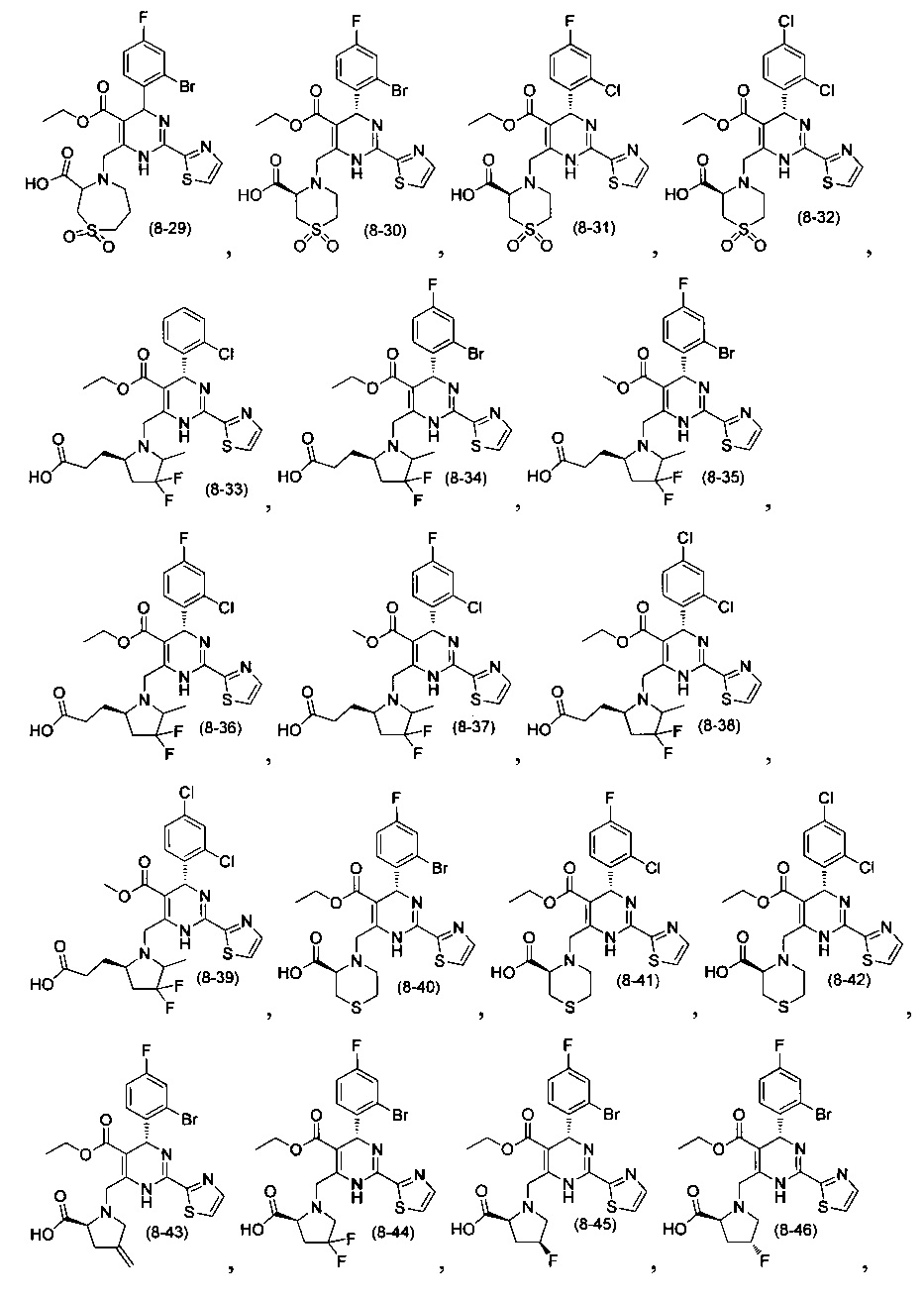
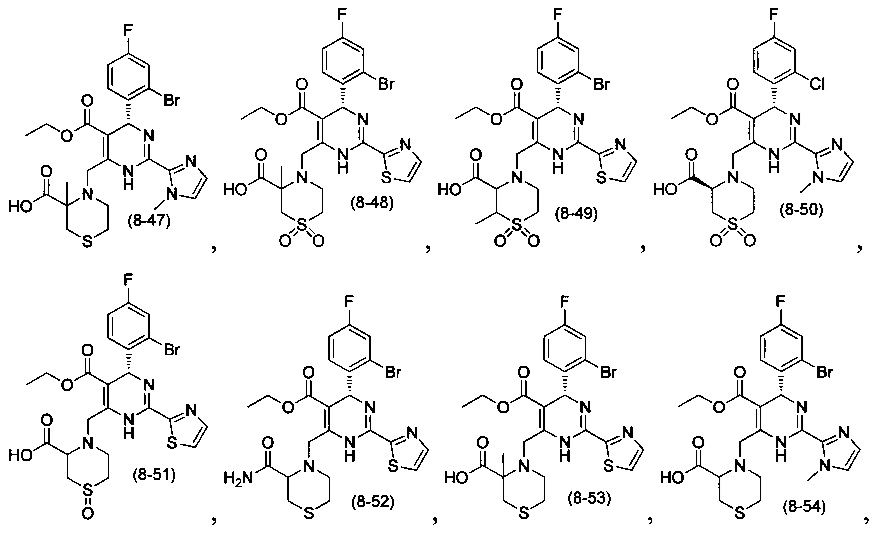
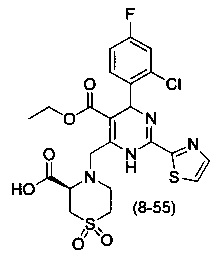
[0094] В других воплощениях, данных в настоящем документе, одно из соединений следующим образом, или его энантиомер, диастереоизомер, таутомер, гидрат, сольват или фармацевтически приемлемая соль, и без ограничений:
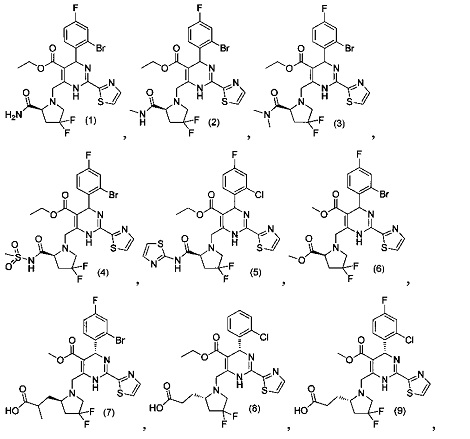
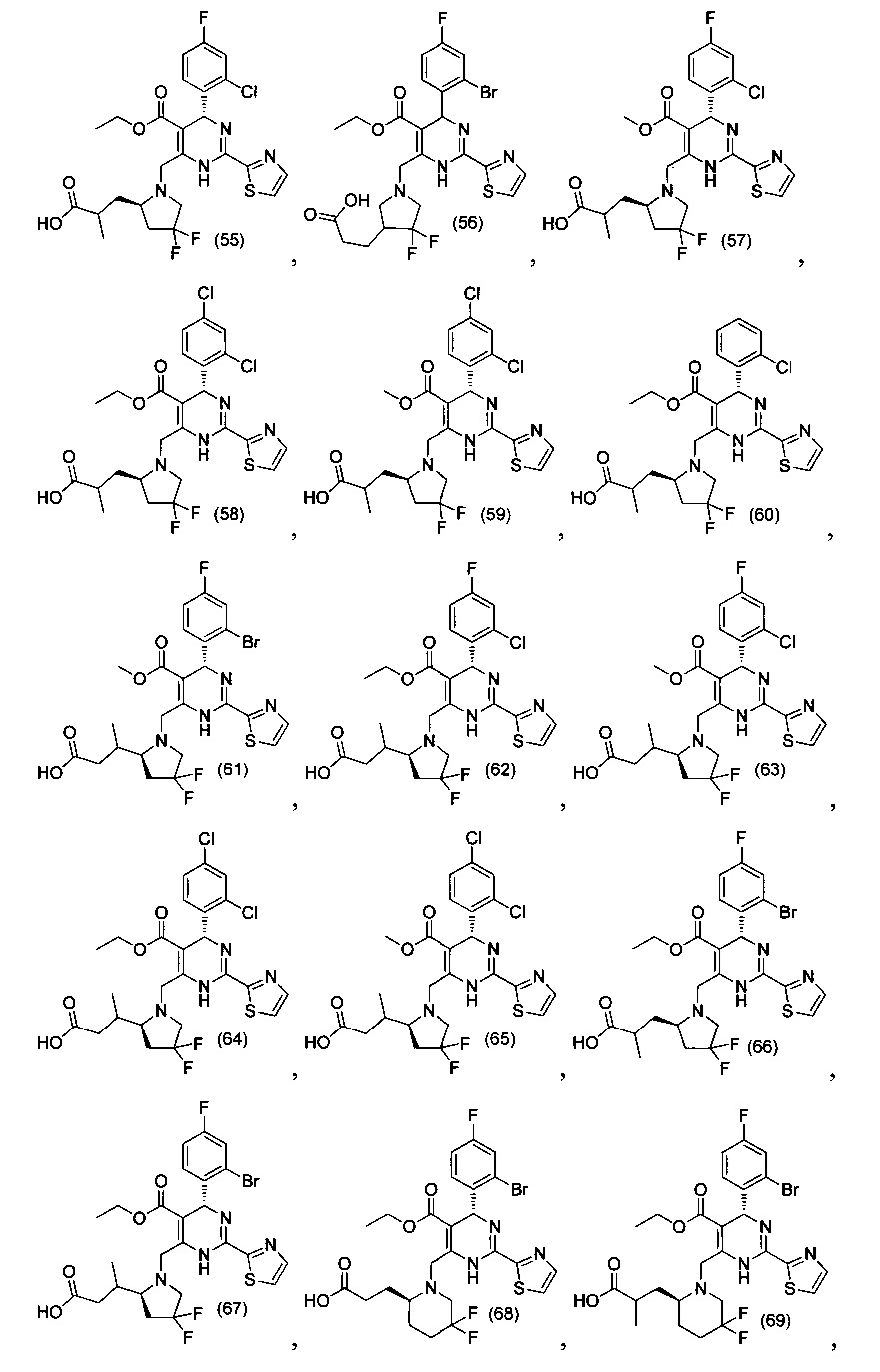
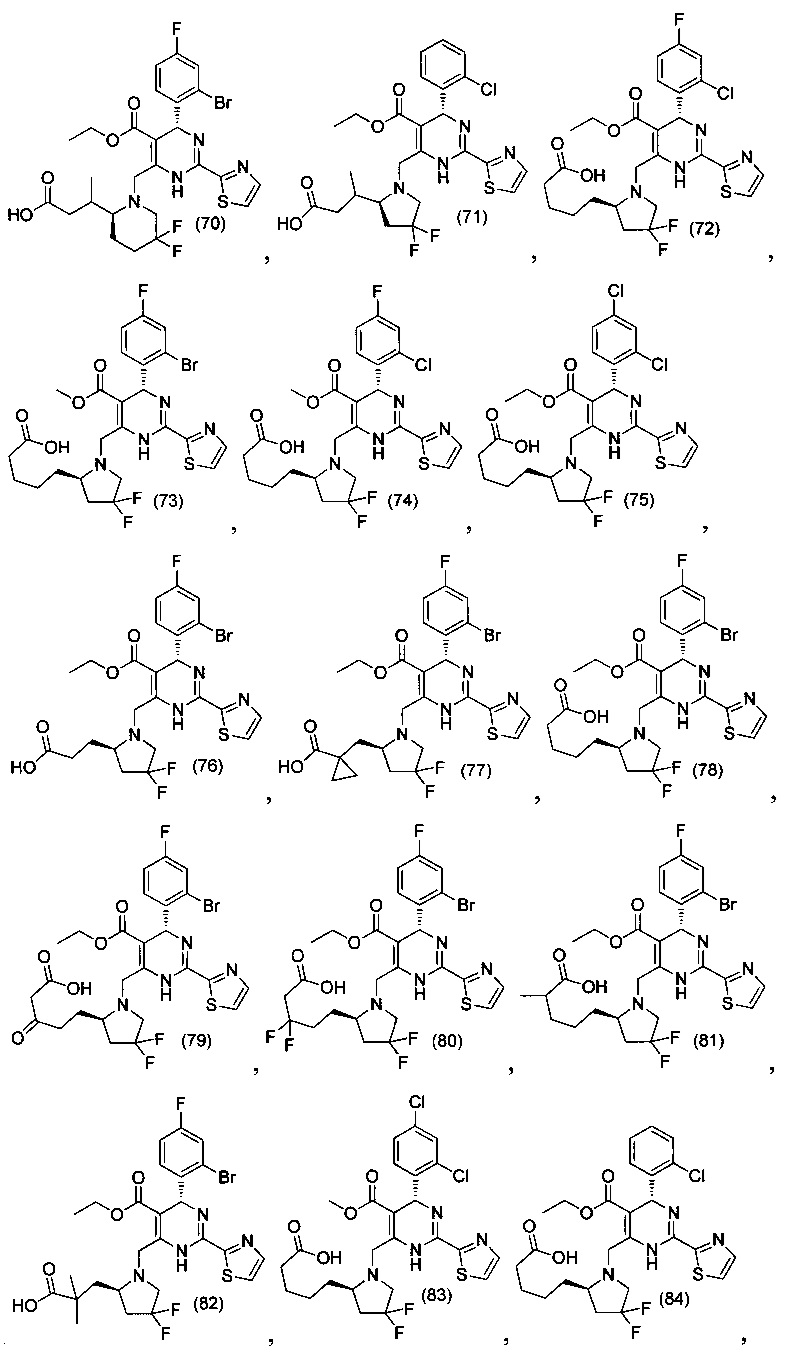
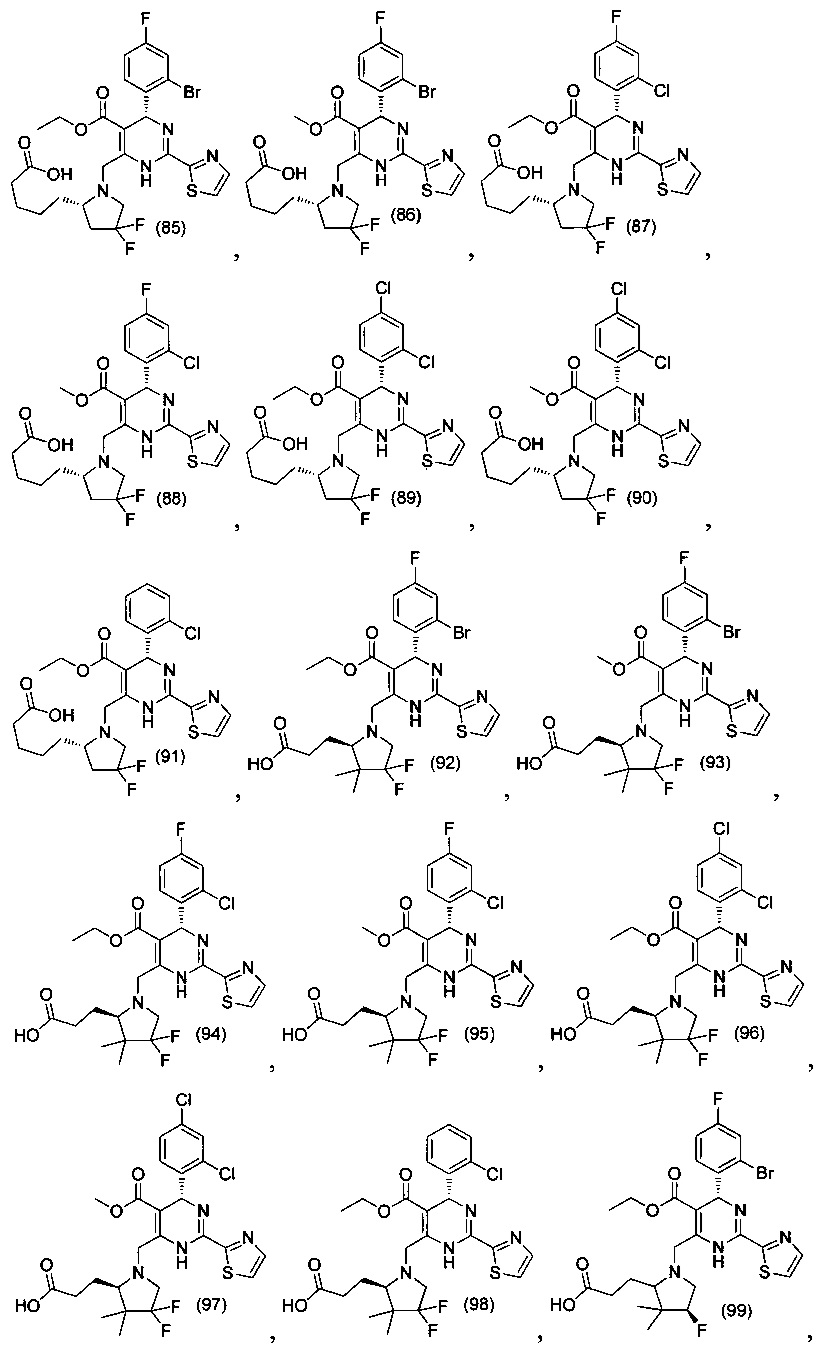
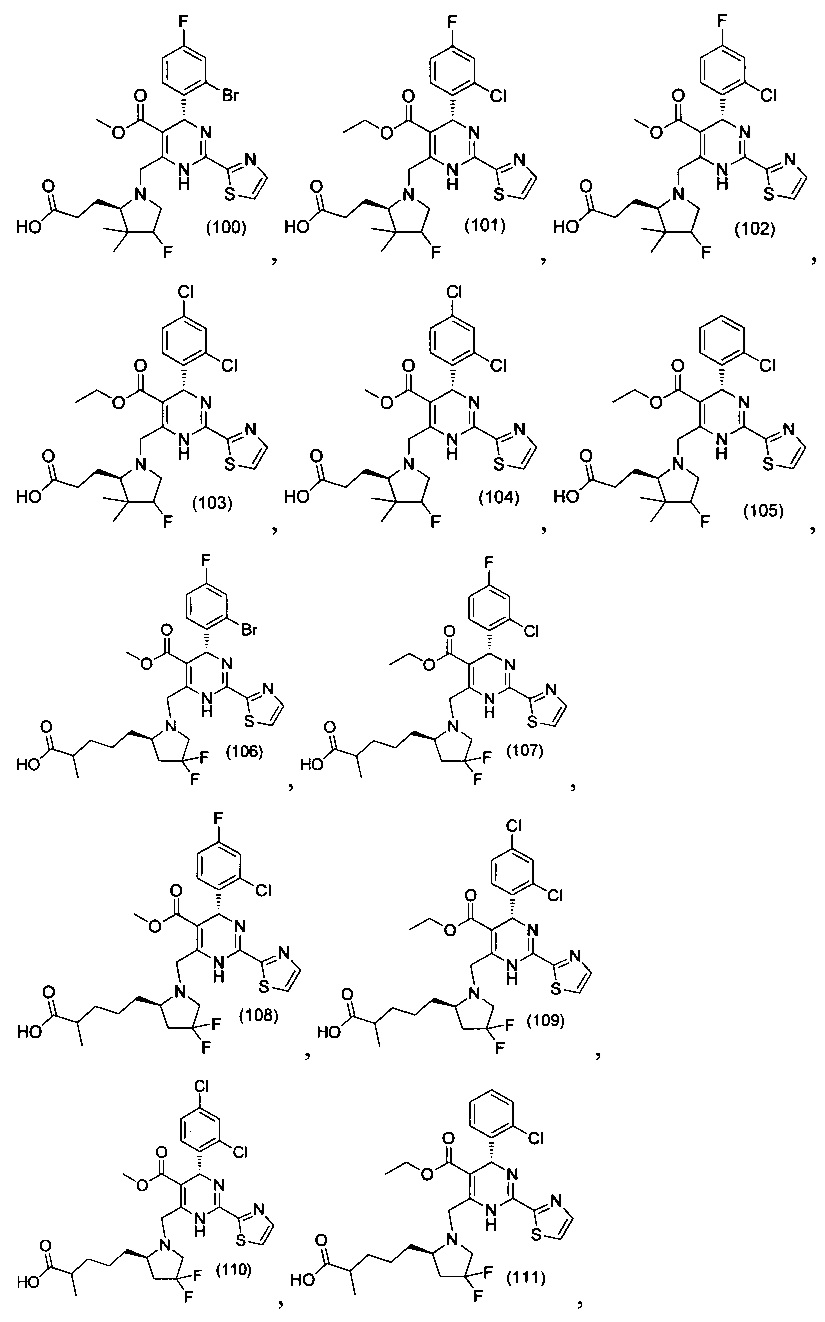
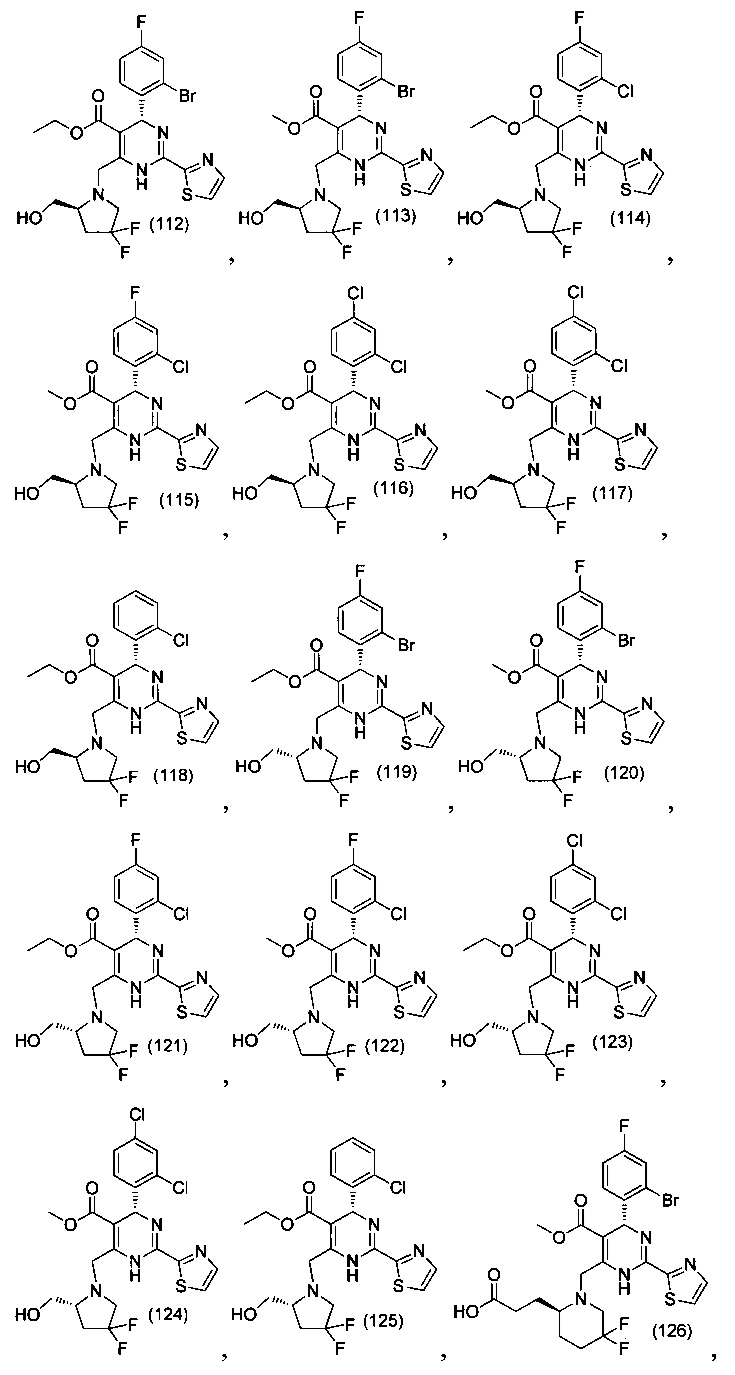
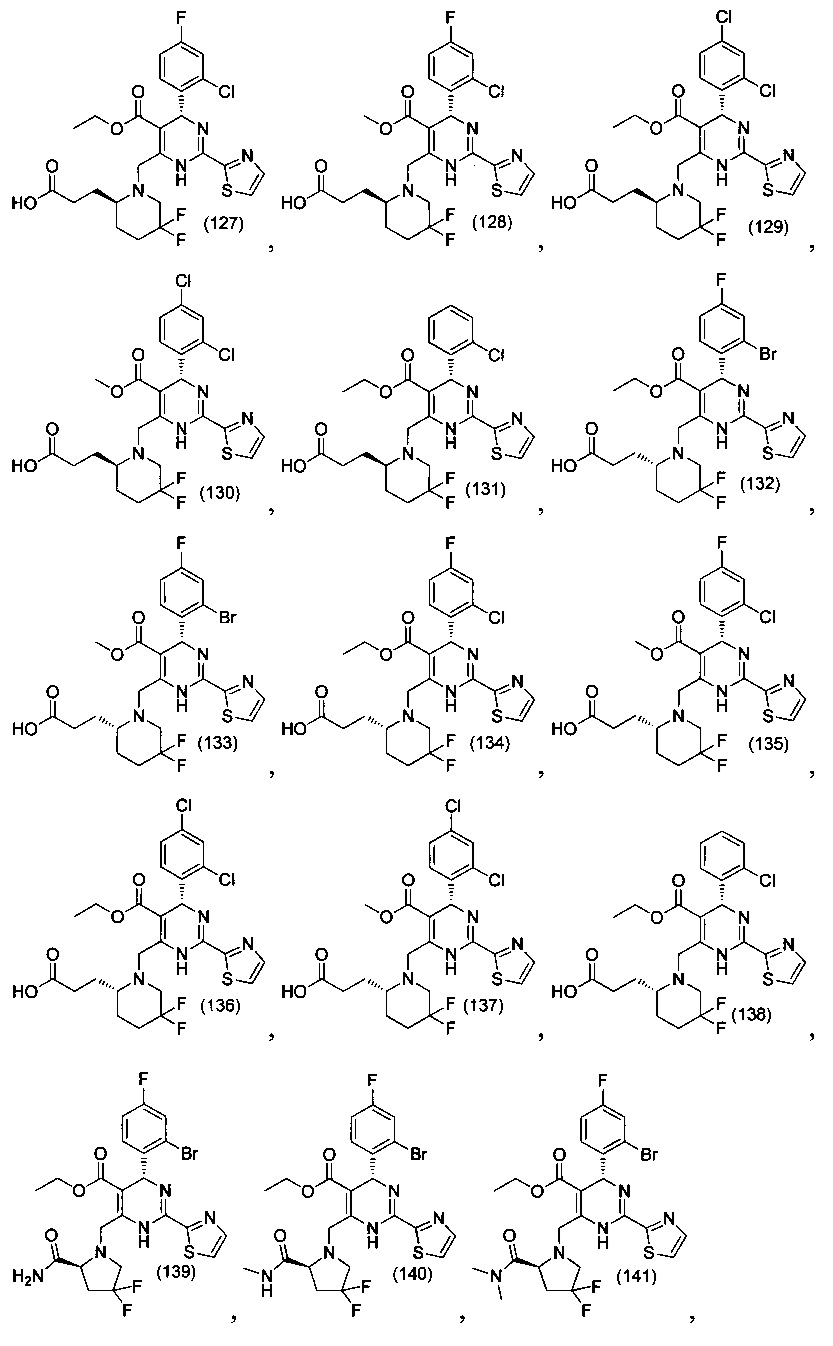
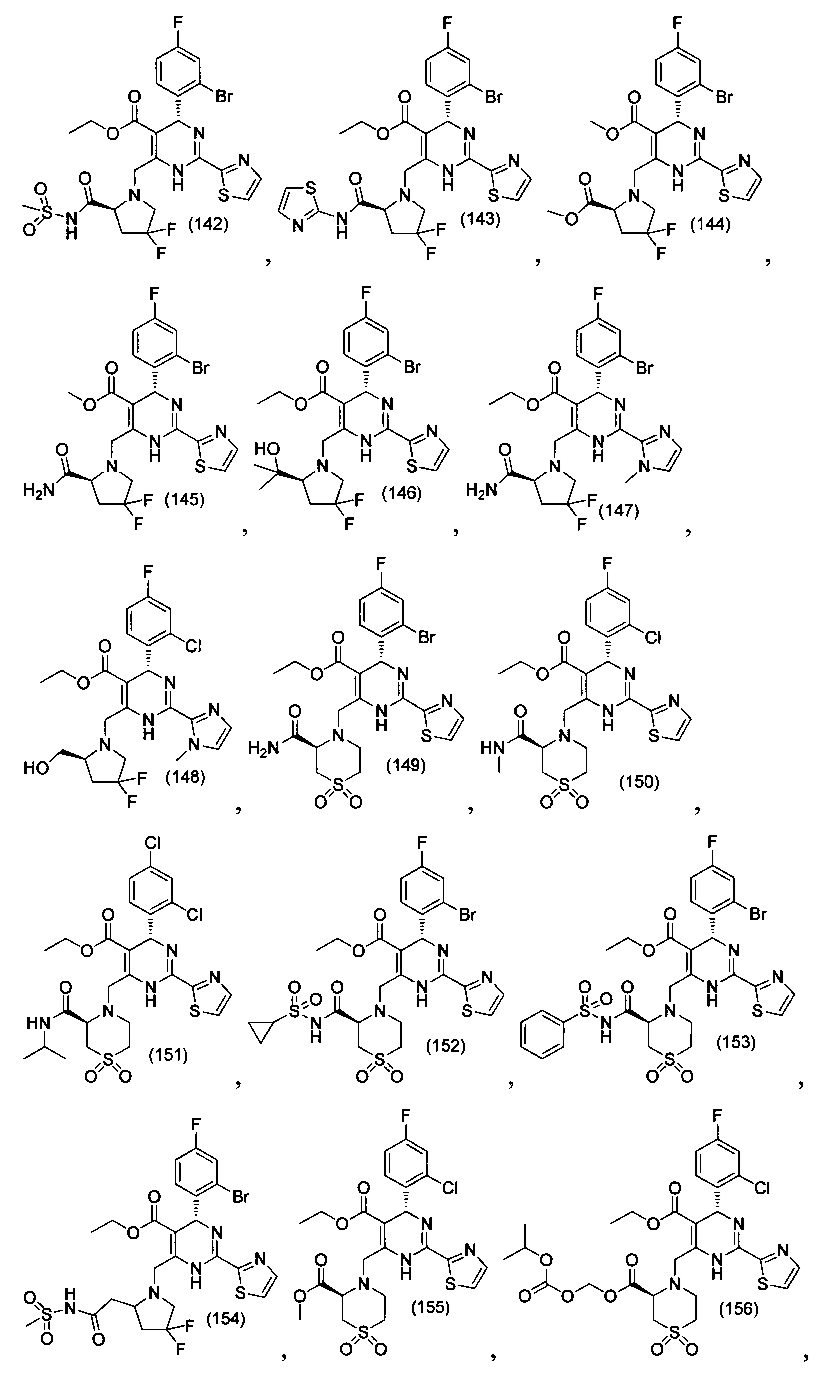
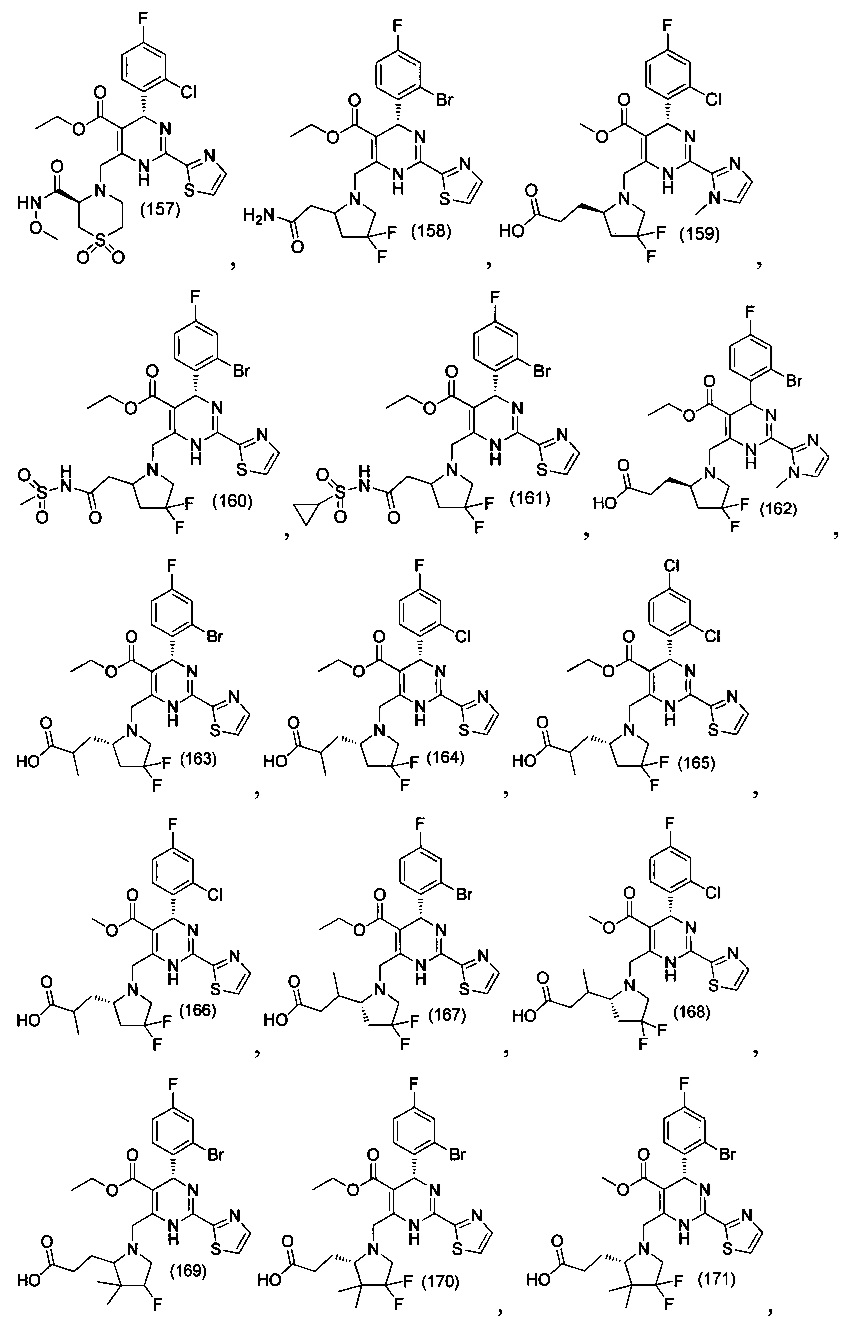
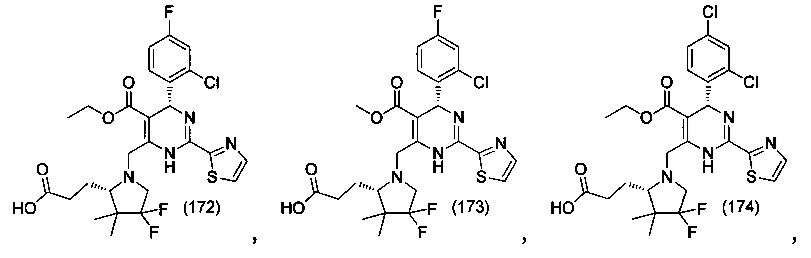
 и
и 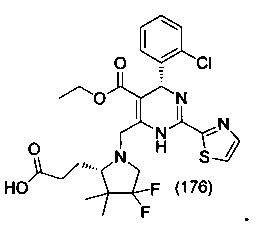
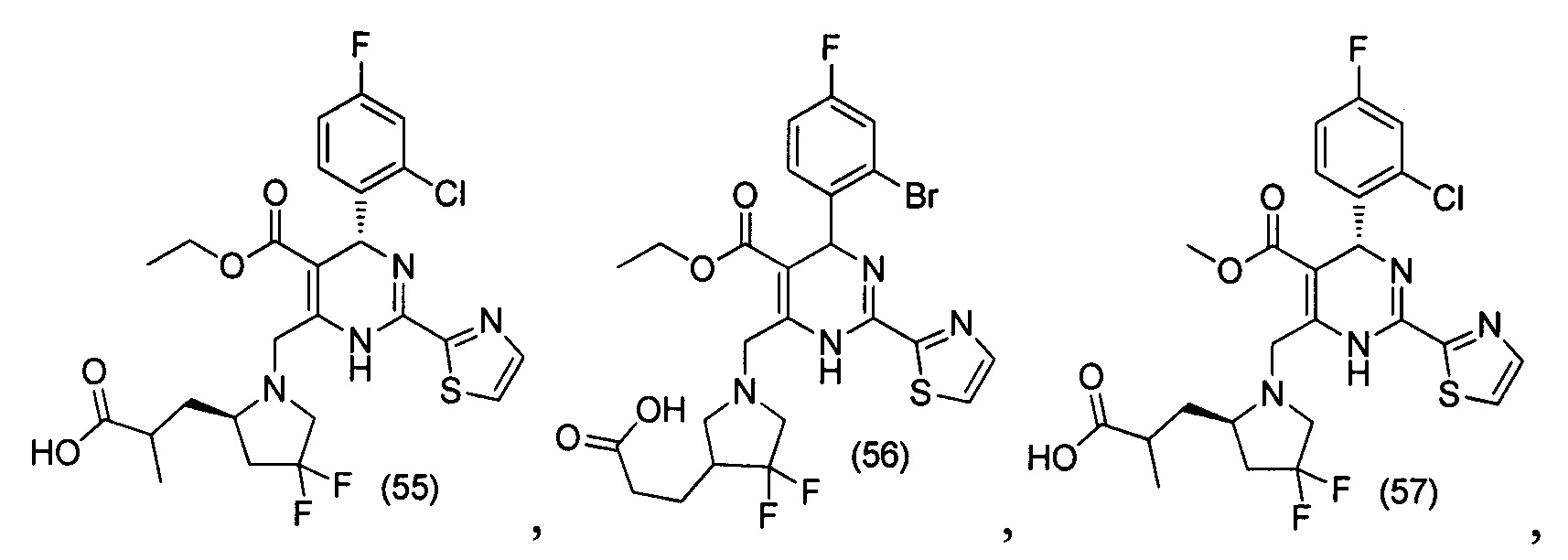
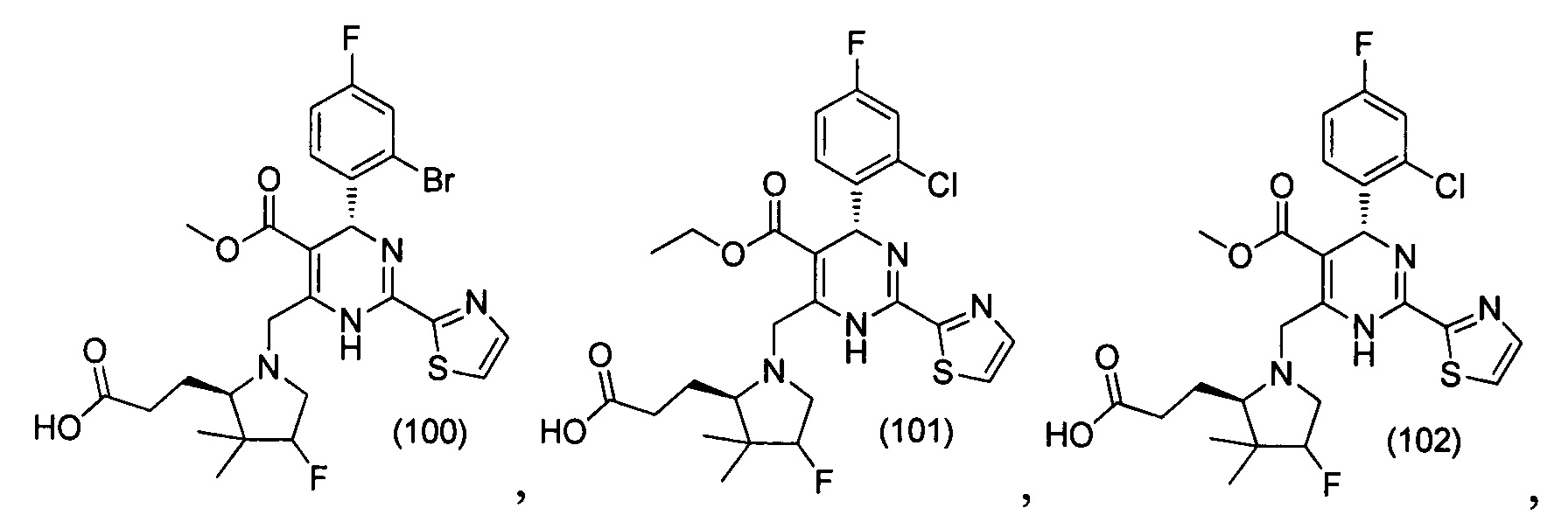
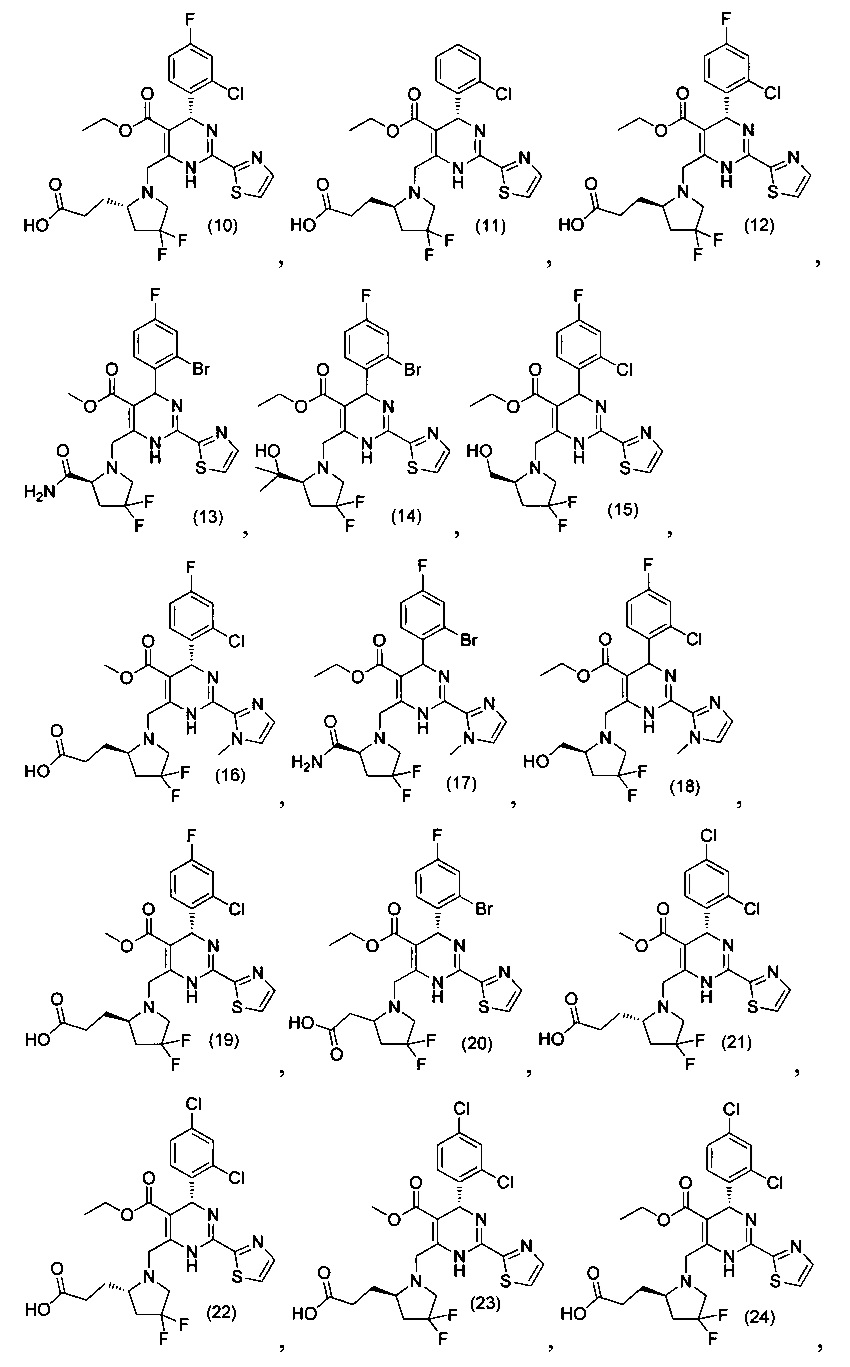
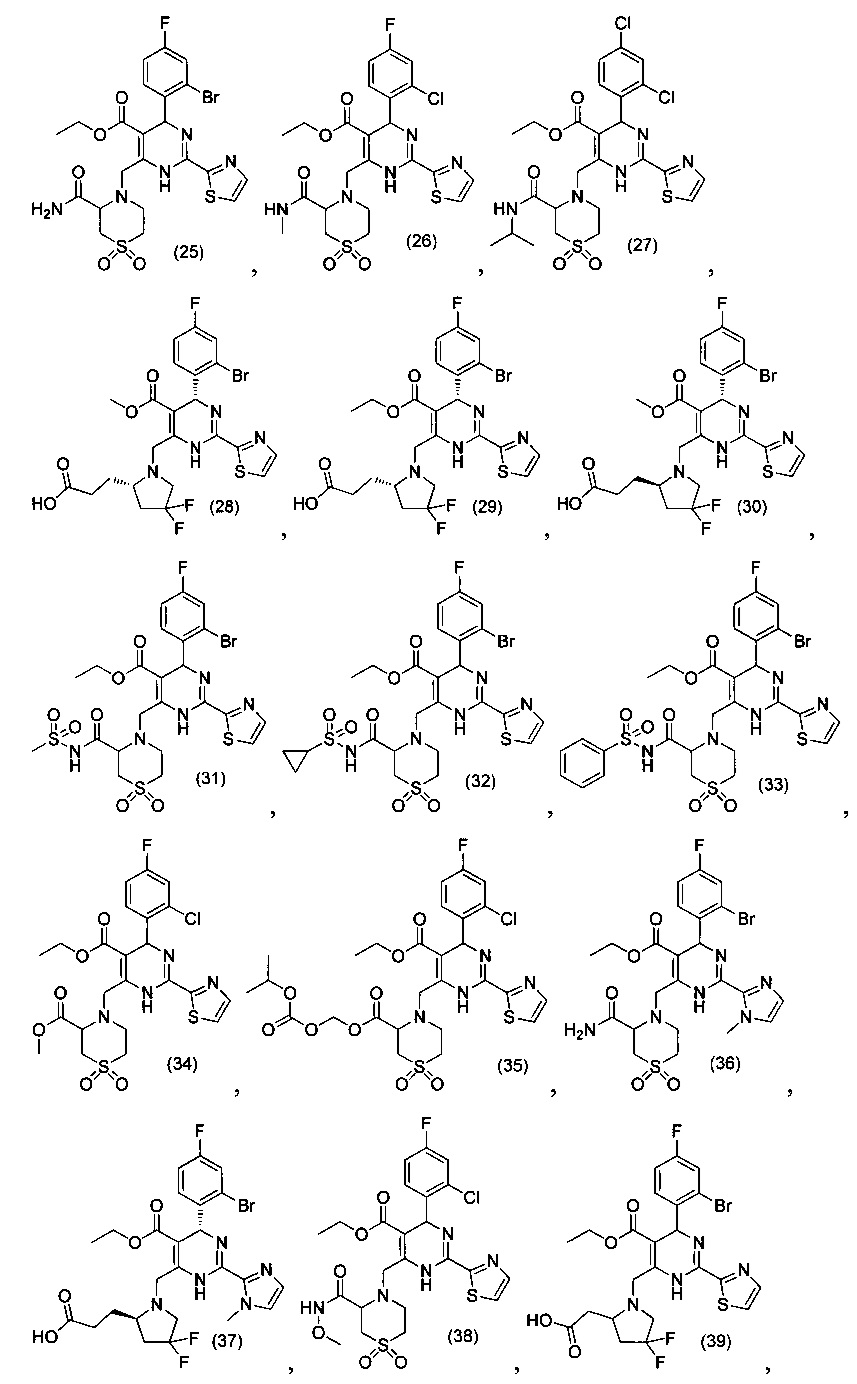
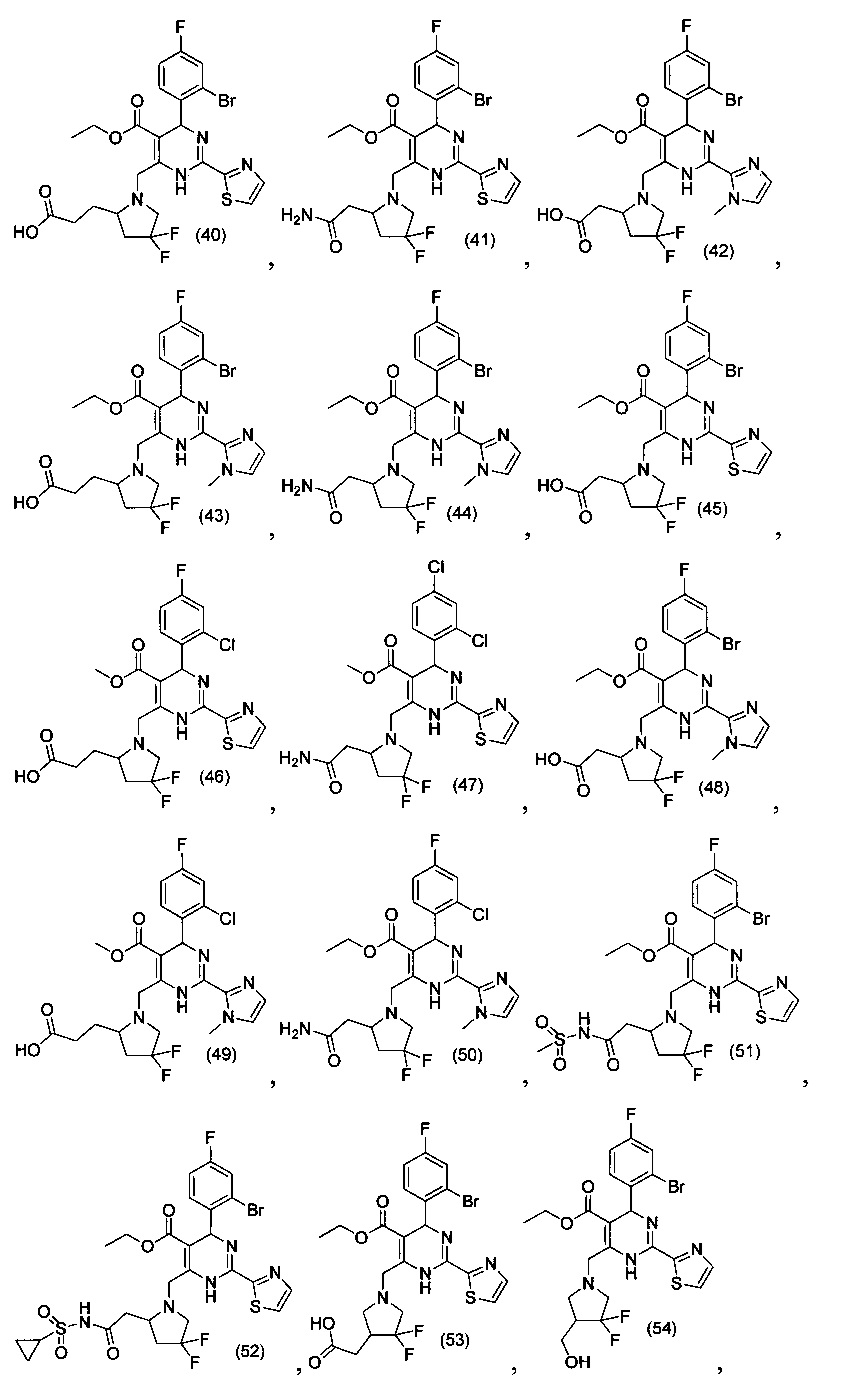
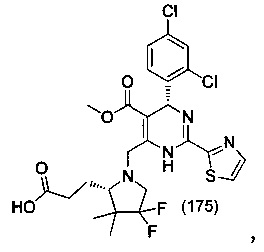
[0095] В другом аспекте, приведенном в настоящем документе, одно из соединений следующим образом, или его энантиомер, диастереоизомер, таутомер, гидрат, сольват или фармацевтически приемлемая соль, и без ограничений:
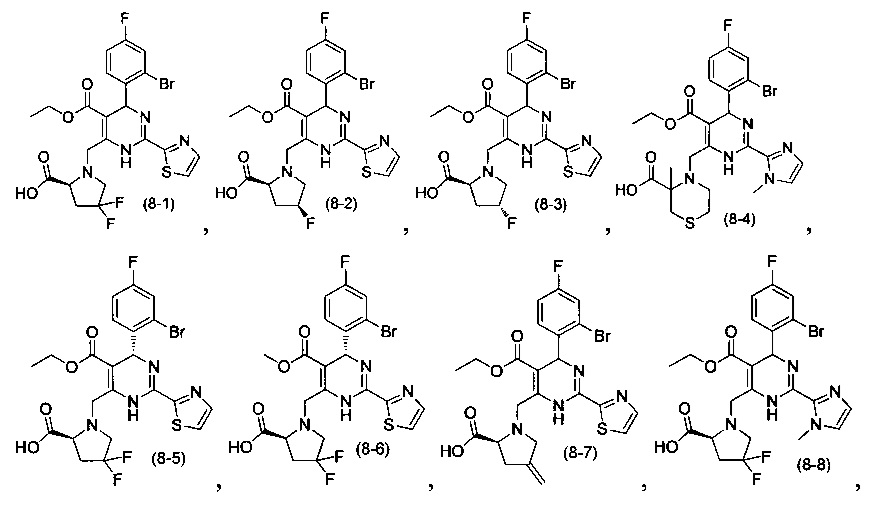
 и
и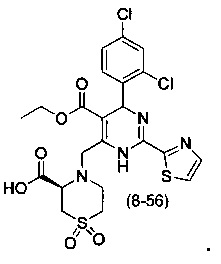
[0096] В одном аспекте, приведенном в настоящем документе, фармацевтическая композиция, содержит соединение, раскрытое здесь, и фармацевтически приемлемый носитель, наполнитель, разжижитель, вспомогательное вещество, несущую среду или их комбинацию.
[0097] В определенных воплощениях фармацевтическая композиция далее включает агента анти-ВГВ.
[0098] В определенных воплощениях агент анти-ВГВ является ингибитором полимеразы ВГВ, иммуномодулятором или интерфероном.
[0099] В определенных воплощениях агент анти-ВГВ включает, по крайней мере, одно вещество, выбранное из группы, состоящей из ламивудина, тельбивудина, тенофовира, энтекавира, адефовира, дипивоксила, альфаферона, аллоферона, цельмолейкина, клевудина, эмтрицитабина, фамцикловира, ферона, фепатекта CP, интефена, интерферона α-1b, интерферона α, интерферона α-2, интерферона α-2а, интерферона α-2b, интерферона β-1а, интерлейкина 2, мивотилата, нитазоксанида, пегинтерферона альфа-2а, рибавирина, роферон-А, сизофирана, евфоравака, ринтатолимода, фосфазида, геплисава, левамизола и проапгермания.
[00100] В другом аспекте, приведенном в настоящем документе, использование соединения или фармацевтической композициипри изготовлении лекарственных средств для профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ.
[00101] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[00102] В других воплощениях заболевание, вызванное инфекцией гепатита В, является циррозом или гепатоцеллюлярным раком.
[00103] В другом аспекте, приведенном в настоящем документе, соединение или фармацевтическая композиция при изготовлении лекарственных средств для использования при профилактике, контроле, лечении или уменьшении вирусного заболевания или заболевания ВГВ.
[00104] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[00105] В других воплощениях заболевание, вызванное инфекцией гепатита В, является циррозом или гепатоцеллюлярным раком.
[00106] В другом аспекте, приведенном в настоящем документе, способ профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, включающий введение пациенту терапевтически эффективного объема соединения или фармацевтической композиции.
[00107] В некоторых воплощениях, вирусным заболеванием или заболеванием ВГВ является инфекция гепатита В или заболевание, вызванное инфекцией гепатита В.
[00108] В других воплощениях заболевание, вызванное инфекцией гепатита В, является циррозом или гепатоцеллюлярным раком.
[00109] В другом аспекте, приведенном в настоящем документе, способы профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ, включающие введение пациенту фармацевтически эффективного объема соединения, раскрытого здесь, или фармацевтической композиции, раскрытой здесь.
[00110] В другом аспекте, приведенном в настоящем документе, способы профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ у пациента, включающие введение фармацевтически эффективного объема соединения, раскрытого здесь, пациенту.
[00111] В другом аспекте, приведенном в настоящем документе, способы профилактики, контроля, лечения или уменьшения вирусного заболевания или заболевания ВГВ у пациента, включающие введение фармацевтически эффективного объема фармацевтических составов, раскрытых здесь, пациенту.
[00112] В другом аспекте, приведенном в настоящем документе, использование соединения, раскрытого здесь при изготовлении лекарственного средства для профилактики, контроля или лечения вирусного заболевания или заболевания ВГВ и уменьшения степени тяжести вирусного заболевания или заболевания ВГВ.
[00113] В другом аспекте, приведенном в настоящем документе, использование фармацевтической композиции, раскрытой здесь при изготовлении лекарственного средства для профилактики, контроля или лечения вирусного заболевания или заболевания ВГВ и уменьшения степени тяжести вирусного заболевания или заболевания ВГВ у пациента.
[00114] В некоторых воплощениях, организм или пациент является млекопитающим; в других воплощениях, организм или пациент является человеком. В других воплощениях способ далее включает контакт киназы или организма с терапевтическим агентом против ВГВ.
[00115] В другом аспекте, приведенном в настоящем документе, способ ингибирования инфекции ВГВ, включая контакт клетки или множества клеток с эффективным объемом соединения для ингибирования ВГВ, раскрытого здесь, или его состав. В других воплощениях способ далее включает контакт клеток с терапевтическим агентом против ВГВ.
[00116] В другом аспекте, приведенном в настоящем документе, способ лечения заболевания ВГВ, причем способ включает введение нуждающемуся пациенту эффективный терапевтический объем соединения, раскрытого здесь, или его состава. В других воплощениях способ далее включает введение пациенту терапевтического агента против ВГВ.
[00117] В другом аспекте, приведенном в настоящем документе, способ ингибирования инфекции ВГВ, причем способ включает введение нуждающемуся пациенту эффективный терапевтический объем соединения, раскрытого здесь, или состав, раскрытый здесь. В других воплощениях способ далее включает введение пациенту терапевтического агента против ВГВ.
[00118] В другом аспекте, приведенном в настоящем документе, включают способы подготовки, способы отделения и способы очищения соединений по Формуле (I) или (Ia) и определенного состава.
[00119] Описание в настоящем документе включает использование соединения, раскрытого здесь, или его фармацевтически приемлемой соли, при изготовлении лекарственного средства для эффективного ингибирования инфекции ВГВ, включая описание в настоящем документе. Соединения, раскрытые в настоящем документе, используются при изготовлении лекарственных средств для ингибирования инфекции ВГВ. Соединения, раскрытые здесь, также используются при изготовлении лекарственных средств, чтобы уменьшить, предотвратить, вылечить или контролировать нарушения через ингибирование ВГВ. Также здесь описывается фармацевтическая композиция, включающая терапевтически эффективный объем соединения по Формуле (I) или (Ia) и определенного соединения в сочетании, по крайней мере, с одним фармацевтически приемлемым носителем, вспомогательным веществом или разжижителем.
[00120] Также здесь описан способ ингибирования нарушений ВГВ у пациента, имеющего или склонного к такому нарушению, причем способ включает лечение пациента терапевтически эффективным объемом соединения по Формуле (I) или (Ia) и определенного состава.
[00121] Если не указано иное, все стереоизомеры, геометрические изомеры, таутомеры, N-оксиды, гидраты, сольваты, метаболиты, соли и фармацевтически приемлемые пролекарства соединений, раскрытых здесь, находятся в рамках изобретения.
[00122] В определенных воплощениях соль является фармацевтически приемлемой солью. Фраза "фармацевтически приемлемая" относится к тому факту, что вещество или состав должны быть совместимыми химическим и/или токсикологическим образом с другими компонентами, включающими препарат и/или млекопитающее, которому он вводится.
[00123] Соединения, раскрытые здесь также, включают соли таких соединений, которые не обязательно являются фармацевтически приемлемыми солями, и которые могут быть использованы как промежуточные звенья для подготовки и/или очищения соединений по Формуле (I) или (Ia) и/или для отделения энантиомеров соединений по Формуле (I) или (Ia) или/и определенных соединений.
[00124] Если соединение, раскрытое в настоящем документе, является основой, желаемая соль может быть подготовлена любым подходящим способом, доступным в области, например, обработкой свободной основы неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и т.п. Или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, яблочная кислота, 2-гидрокси акриловая кислота, молочная кислота, лимонная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота; пираносидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота; альфа-оксикислота, такая как лимонная кислота или винная кислота; аминокислота, такая как аспарагиновая кислота или глутаминовая кислота; ароматическая кислота, такая как бензойная кислота или коричная кислота; сульфокислота, такая как кислота р-толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота или трифторометансульфоновая кислота, и т.п.
[00125] Если соединение, раскрытое в настоящем документе, является кислотой, желаемая соль может быть подготовлена любым подходящим способом, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (основной, вторичный или третичный), гидроокись щелочного металла, аммоний, соль N + (R14)4 или гидроокись щелочноземельного металла, и т.п. Некоторые неограничивающие примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиак (первичные, вторичные, и третичные амины), соли N+ (R14)4, такие как R14 - H, С1-4 алкил, С6-10 арил или С6-10 арил-С1-4 алкил и циклические амины, такие как пиперидин, тетрагидрооксазин и пиперазин и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия, лития, и т.п. Дальнейшие соли включают, в надлежащих случаях, нетоксичный аммоний, четвертичный аммоний и катионы амина, сформированные с помощью противоионов, таких как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, сульфонат С1-8 или арилзамещенный сульфонат.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕПАРАТЫ, ИСПОЛЬЗОВАНИЕ И ВВЕДЕНИЕ СОЕДИНЕНИЙ И ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ
[00126] Изобретение описывает фармацевтические композиции, включающие соединение по Формуле (I) или (Ia), соединение, указанное в настоящем документе, или соединение, определенное в Примерах 1-44, и фармацевтически приемлемый носитель, вспомогательное вещество или наполнитель. Соединение, раскрытое здесь, может эффективно ингибировать ВГВ и подходит для использования при лечении или уменьшении заболеваний, вызванных вирусами, в частности, острыми и хроническими постоянными инфекциями ВГВ. Хронические вирусные заболевания, вызванные ВГВ, могут ухудшить состояние, и хроническая инфекция ВГВ может вызвать цирроз печени и/или гепатоцеллюлярный рак во многих случаях.
[00127] Соединения, раскрытые в настоящем документе, подходят для лечения острых и хронических вирусных инфекций, особенно подходят для эффективного ингибирования ВГВ. Соединения, раскрытые в настоящем документе, подходят для использования в лечении или уменьшении заболеваний, вызванных вирусами, в частности острыми и хроническими постоянными инфекциями ВГВ. Хронические вирусные заболевания, вызванные ВГВ, могут ухудшить состояние, и хроническая инфекция ВГВ может вызвать цирроз печени и/или гепатоцеллюлярный рак во многих случаях.
[00128] Настоящее изобретение включает фармацевтические препараты, помимо нетоксичных, инертных фармацевтически подходящих носителей, включающие один или несколько соединений, раскрытых в настоящем документе, или их комбинацию, или состоящие из одного или нескольких активных ингредиентов, раскрытых в настоящем документе, или их комбинации.
[00129] Фармацевтические препараты, упомянутые выше, также включают другие активные фармацевтические ингредиенты, кроме соединений, раскрытых в настоящем документе.
[00130] Также очевидно, что определенные соединения, раскрытые в настоящем документе, могут существовать в свободной форме для лечения, или, где это необходимо, как фармацевтически приемлемая производная. Некоторые неограничивающие примеры фармацевтически приемлемой производной включают фармацевтически приемлемые пролекарства, соли, эфиры, соли таких эфиров, или любые другие аддукты или производные, которые после введения нуждающемуся пациенту способны обеспечить, прямо или косвенно, соединение, как описано здесь, или его метаболит или остаток.
[00131] Как описано выше, фармацевтически приемлемые соединения, раскрытые в настоящем документе, дополнительно, включают фармацевтически приемлемый носитель, вспомогательное вещество или несущую среду, как используется здесь, включая все растворители, разжижители, или другие несущие среды, дисперсии или суспензии, поверхностно-активные вещества, изотонические вещества, сгущающие или эмульгирующие вещества, консерванты, твердые связующие вещества, смазки и т.п., подходящие для определенной желаемой формы дозировки. Troy и др., Remington: The Science and Practice of Pharmacy, 21 изд., 2005, Lippincott Williams & Wilkins, Филадельфия, и Swarbrick и др., Encyclopedia of Pharmaceutical Technology, изд. 1988-1999, Marcel Dekker, Нью-Йорк, все из которых включены ссылкой, раскрывают различные носители, используемые в подготовке фармацевтически приемлемых составов и известных способов их изготовления. До степени, в которой любая стандартная питательная среда носителя несовместима с соединениями, раскрытыми здесь, например, ввиду любого нежелательного биологического влияния или иного взаимодействия вредным способом с любым другим компонентом фармацевтически приемлемого состава, его использование находится в рамках настоящего изобретения.
[00132] Некоторые неограничивающие примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают иониты, алюминий, глинозем, стеарат алюминия, лецитин, серологические протеины, такие как человеческий сывороточный альбумин, буферизирующие вещества, такие как фосфаты, глицин, сорбиновая кислота, или калиевый сорбат, смеси неполного глицерида насыщенных растительных жирных кислот, воды, солей или электролитов, таких как сульфат протамина, вторичный кислый фосфорнокислый натрий, вторичный кислый фосфорнокислый калий, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинил пирролидон, полиакрилаты, воски, полиэтилен-полиоксипропиленовый блок, шерстяной жир, сахар, такой как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски суппозитория; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и лаурат этила; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт, и буферные растворы фосфата, а также другие нетоксичные совместимые смазки, такие как сульфат лаурила натрия и стеарат магния, а также красители, разделители, покрывающие вещества, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты. Для удобства местные обезболивающие, консерванты, буферные вещества и т.д., могут быть растворены в носителях непосредственно.
[00133] Фармацевтическая композиция, включает соединение, раскрытое в настоящем документе, может быть введена любым из следующих путей: перорально, при вдыхании распылением, ректально, через нос, локально, во влагалище, парентерально, например, подкожной, внутривенной, внутримышечной, интраперитонеальной, интратекальной, интравентрикулярной, интрастернальной или внутричерепной инъекцией или вливанием, или введен при помощи эксплантированного резервуара, причем пути введения перорально, внутримышечно, интраперитонеально или внутривенной инъекцией являются предпочтительными.
[00134] Соединение или приемлемая фармацевтическая композиция, содержащая соединение, раскрытое в настоящем документе, могут вводиться в форме однократной дозировки. Форма дозировки может быть жидкой или твердой. Жидкая форма включает истинный раствор, коллоиды, макрочастицы, эмульсии, суспензии. Другие формы дозировки включают таблетки, капсулы, драже, аэрозоли, таблетки, порошок, растворы, суспензии, эмульсии, гранулы, суппозитории, лиофилизированный порошок для инъекции, клатраты, имплантаты, пластыри, линименты, и т.п.
[00135] Пероральные таблетки и капсулы могут включать наполнители, например, связующие вещества, такие как сироп, гуммиарабик, сорбитол, трагакант или поливинилпирролидон; наполнители, такие как лактоза, сахароза, кукурузный крахмал, фосфат кальция, сорбитол, аминоуксусная кислота; смазки, такие как стеарат магния, сапионит, полиэтиленгликоль, кварц, разрыхлители, такие как картофельный крахмал или приемлемые увлажняющие компоненты, такие как сульфат лаурила натрия. Таблетки могут быть покрыты при помощи способов, известных в фармацевтике.
[00136] Пероральный раствор может быть выполнен в виде суспензии из воды и масла, раствора, эмульсии, сиропа или эликсира, или как высушенный продукт, к которому вода или другая питательная среда добавляются перед использованием. Эта жидкая форма может включать стандартные добавки, например, суспендирующие вещества, такие как сорбитол, метиловый эфир целлюлозы, сироп глюкозы, желатин, оксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия, гидрогенизировала съедобный жир; эмульгирующие вещества, такие как лецитин, моноолеат сорбитана, гуммиарабик; или неводные носители (возможно включая пищевое масло), такие как миндальное масло, жир, такие как глицерин, этиленгликоль или этанол; антисептики, такие как метил или пропил р-гидроксибензоат, сорбиновая кислота. При желании добавляется ароматизирующее вещество или краситель.
[00137] Суппозиторий может включить стандартный субстрат суппозитория, такой как масло какао или другой глицерид.
[00138] Для введения не через желудок жидкая форма дозировки обычно производится из соединения и стерилизованного носителя. Предпочтительным носителем является вода. Согласно выбранному носителю и концентрации лекарственного средства, соединение может быть растворено в носителе или преобразовано в суспензию. При создании раствора для инъекции состав, во-первых, растворяется в воде, и затем фильтруется и стерилизуется до расфасовки по флаконам или ампулам.
[00139] Для местного применения на коже соединение, раскрытое в настоящем документе, может быть преобразован в подходящую форму мази, лосьона или крема, где активный ингредиент суспендирован или растворен в одном или нескольких носителях. Некоторые неограничивающие примеры носителей, используемых для мази, включают масло, жидкий вазелин, алболен, пропиленгликоль, полиэтиленоксид, полиоксипропилен, эмульгированный воск, воду, и т.п. Некоторые неограничивающие примеры носителей, используемых для лосьона и крема, включают масло, сорбитан, моностеариновый эфир, твин 60, цетиловый воск сложных эфиров, гексадецилен ароматический спирт, лауриновый альдегид 2-октил, бензиловый спирт, вода, и т.п.
[00140] В целом было доказано, что будь то в медицине или в ветеринарии, обеспечено преимущество того, что суммарная доза активного соединения, раскрытого в настоящем документе, приблизительно 0,5-500 мг каждые 24 часа, предпочтительно 1-100 мг на килограмм массы тела. При необходимости лекарственное средство вводится однократно несколько раз, чтобы, таким образом, достигнуть желаемого эффекта. Объем активного соединения в однократной дозе предпочтительно приблизительно 1-80 мг, более предпочтительно 1-50 мг на килограмм массы тела. Тем не менее, доза может также отличаться согласно типу и массе тела объекта, который получает лечение, вид и степень тяжести заболевания, тип препарата и способа введения лекарственного средства, и периода введения или временного интервала.
[00141] В одном аспекте, приведенном в настоящем документе, фармацевтическая композиция, далее включает агент анти-ВГВ. И агент анти-ВГВ является ингибитором полимеразы ВГВ, иммуномодулятором или интерфероном.
[00142] Агент ВГВ является ламивудином, тельбивудином, тенофовиром, энтекавиром, адефовиром, дипивоксилом, альфафероном, аллофероном, цельмолейкином, клевудином, эмтрицитабином, фамцикловиром, ферономом, гепатектом CP, интефеном, интерфероном α-1b, интерфероном α, интерфероном α-2а, интерфероном β-1а, интерфероном α-2, интерлейкином 2, мивотилатом, нитазоксанидом, пегинтерфероном альфа-2а, рибавирином, роферон-А, сизофираном, евфораваком, велдоной, ринтатолимодом, фосфазидом, геплисавом, интерфероном α-2b, левамизолом или проапгерманием и т.д.
[00143] В другом аспекте, приведенном в настоящем документе, использование соединения и фармацевтической композиции при изготовлении лекарственных средств для профилактики, контроля, лечения или уменьшения заболевания ВГВ у пациента, включая введение фармацевтически эффективного объема пациенту. Заболевание ВГВ является печеночной болезнью, вызванной инфекцией гепатита В или вирусом гепатита В, включая острый гепатит, хронический гепатит, цирроз и гепатоцеллюлярный рак. Симптомы острой инфекции вируса гепатита В могут отсутствовать или могут совпасть с симптомами острого гепатита. Пациент с хронической вирусной инфекцией может заболеть активной формой заболевания, которая может прогрессировать до рака печени и цирроза.
[00144] Такие дополнительные агенты могут быть введены отдельно от содержащего соединение состава как часть режима многократной дозировки. Также такие агенты могут быть частью формы однократной дозировки, смешанной вместе с соединением, раскрытым в настоящем документе, в одном составе. При введении как часть многократного режима дозировки, эти два активных вещества могут быть введены одновременно, последовательно или в течение промежутка времени, что привело бы к желаемому действию агентов.
[00145] Объем и соединения, и дополнительного терапевтического агента (в составах, включающих дополнительный терапевтический агент, как описано выше), который может быть объединен с материалами носителя для производства формы однократной дозировки, зависит от субъекта и определенного способа введения. Обычно, объем дополнительного терапевтического агента, присутствующего в соединениях, раскрытых в настоящем документе, не превышает объем, который обычно используется в составе, включающем терапевтический агент как единственное активное вещество. В другом воплощении, объем дополнительного терапевтического агента в раскрытых составах составляет приблизительно от 50% до 100% от объема, обычно присутствующем в составе, включающем такой агент как единственное терапевтически активное вещество. В составах, включающих дополнительный терапевтический агент, такой дополнительный терапевтический агент и соединение, раскрытое в настоящем документе, могут действовать синергично.
[00146] Соединение, раскрытое в настоящем документе, демонстрирует относительно сильный антивирусный эффект. Этот вид соединения имеет неожиданную антивирусную активность в отношении ВГВ, и таким образом адаптируется для лечения различных вызванных вирусом заболеваний, при определенных острых и хронических вирусных заболеваниях, вызванных ВГВ, может привести к различным синдромам, имеющим различные степени тяжести. Как известно, хроническая инфекция ВГВ может привести к печеночному циррозу и/или раку клеток печени.
[00147] Примеры признаков, подлежащих лечению соединением, раскрытым в настоящем документе, включают: острые и хронические вирусные инфекции, которые могут привести к инфекционному гепатиту, такие как инфекция ВГВ, и в частности хроническая инфекция ВГВ и острая инфекция ВГВ.
[00148] Изобретение далее касается использования соединений и составов, определенных выше, для производства лекарственных средств для лечения и профилактики заболеваний, описанных выше, предпочтительно вирусных заболеваний, в частности, гепатита В.
ОБЩИЕ ПРОЦЕДУРЫ СИНТЕЗА
[00149] В случае каких-либо различий между химическим названием и химической структурой в спецификации, химическая структура является преобладающей.
[00150] Обычно соединения, раскрытые в настоящем документе, могут быть подготовлены способами, описанными здесь, где заместители как определяются для Формул (I) или (Ia), выше, если не указано иное. Следующие неограничивающие схемы и примеры представлены для дальнейшей иллюстрации изобретения.
[00151] Для специалистов в области очевидно, что описанные химические реакции могут быть легко адаптированы для приготовления других соединений, раскрытых в настоящем документе, и альтернативные способы для подготовки соединений, раскрытых в настоящем документе, находится в объеме настоящего изобретения. Например, синтез неиллюстрируемых соединений согласно изобретению может быть успешно выполнен модификациями, очевидными для специалистов в области, например, путем надлежащей защиты вмешивающихся групп, путем использования других подходящих реактивов, известных в области, кроме описанных, и/или путем обычных модификаций условий реакции. Также другие реакции, раскрытые здесь или известные в области, будут признаны приемлемыми для приготовления других соединений, раскрытых в настоящем документе.
[00152] В примерах, описанных ниже, если иначе не обозначено, все температуры обозначены в градусах Цельсия (°С). Реактивы были приобретены у коммерческих поставщиков, таких как Aldrich Chemical Company, Arco Chemical Company и Alpha Chemical Company, и использовались без дальнейшей очистки, если не указано иное. Общие растворители были приобретены у коммерческих поставщиков, таких как Shantou XiLong Chemical Factory, Guangdong Guanghua Reagent Chemical Factory Co. Ltd., Guangzhou Reagent Chemical Factory, Tianjin YuYu Fine Chemical Ltd., Qingdao Tenglong Reagent Chemical Ltd., и Qingdao Ocean Chemical Factory.
[00153] Безводный THF, диоксан, толуол и эфир были получены путем флегмирования растворителя с натрием. Безводный CH2Cl2 и CHCl3 были получены путем флегмирования растворителя с СаН2. EtOAc, РЕ, гексан, DMAC и DMF обработаны безводной Na2SO4 до использования.
[00154] Реакции, сформулированные ниже, обычно проводились под положительным давлением азота или аргона или с сушильной трубой (если не указано иное), в безводных растворителях, и лабораторные колбы были, как правило, оснащены резиновыми септами для введения субстратов и реактивов через шприц. Стеклянная посуда была высушена в термостате и/или под источником тепла.
[00155] Хроматография на колонке проводилась с помощью колонки из геля кварца. Гель кварца (200-300 меш) был приобретен у Qingdao Ocean Chemical Factory. Спектры 1H NMR были зарегистрированы на спектрометре Bruker на 600 МГц или на 400 МГц с помощью CDCl3, d6-DMSO, CD3OD или d6-ацетон как раствора (обозначение в ppm), и с помощью TMS (0 ppm) или хлороформа (7,25 ppm) как справочный стандарт. При определении пиковых разнообразий, следующие используются сокращения: s (синглет), s, s (синглет, синглет), d (дуплет), t (триплет), m (мультиплет), br (расширенный), dd (дуплет дуплетов), ddd (дуплет дуплета дуплетов), dt (дуплет триплетов), br.s (расширенный синглет), ddt (дуплет дуплета триплетов), dddd (дуплет дуплета дуплетов дуплета), td (триплет дуплетов) и brs (расширенный синглет). Соединенные константы, при наличии, обозначаются в герцах (Гц).
[00156] Данные о масс-спектре (MS) низкого разрешения были определены на спектрометре Agilent 6320 серии LCMS, оборудованного двойными насосами G1312A и G1316A ТСС (температурный контроль колонки, поддерживаемой при 30°С). Автоматическая пипетка G1329A и датчик G1315B DAD использовались в анализе, и источник ЭРИ использовался на спектрометре LCMS.
[00157] Данные о масс-спектре (MS) низкого разрешения были определены на спектрометре Agilent 6120 серии LCMS, оборудованного насосами для четырехкомпонентных смесей G1311A и G1316A ТСС (температурный контроль колонки, поддерживаемой при 30°С). Автоматическая пипетка G1329A и датчик G1315D DAD использовались в анализе, и источник ЭРИ использовался на спектрометре LCMS.
[00158] Оба спектрографа были оборудованы SB-C18 Agilent Zorbax (2.1 × 30 мм, 5 μт). Объем инъекции определялся типовой концентрацией. Скорость потока составляла 0,6 мл/мин; пик ВЭЖХ был зарегистрирован с обнаружением UV-Vis при 210/254 нм. Подвижные фазы состояли из комбинации А (муравьиная кислота 0,1% в CH3CN) и В (муравьиная кислота 0,1% в H2O). Условия элюции градиента описаны в Таблице 1:
[00159] Чистота составов оценивалась высокоэффективной жидкостной хроматографией (ВЭЖХ) на аппарате Agilent 1100 с обнаружением УФ при 210 нм и 254 нм (SB-C18 Zorbax, 2.1 × 30 мм, 4 μм), 10 минут, скорость потока 0,6 мл/мин, комбинация А (муравьиная кислота 0,1% в CH3CN) и В (муравьиная кислота 0,1% в H2O) в режиме градиента (5-95%). Колонка использовалась при 40°С.
[00160] Очистка соединений подготовительной хроматографией была осуществлена путем высокоэффективной жидкостной хроматографии (ВЭЖХ) на аппарате Agilent 1260 с обнаружением УФ при 278 нм (Daicel CHIRALPAK IC, 10.0 × 250 мм, 5 μм), 40 минут, скорость потока 2,0 мл/мин, n-гексан / этанол (97/3 об. %). Колонка использовалась при 30°С.
[00161] Следующие сокращения используются в настоящей спецификации:
|
СПОСОБЫ СИНТЕЗА
Схема 1
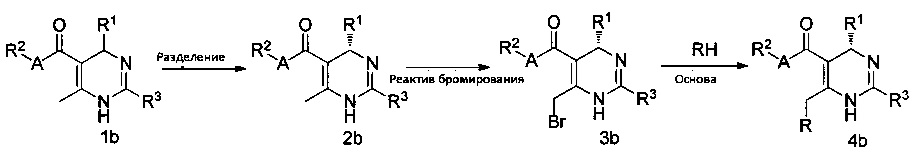
[00162] Целевое соединение 4b может быть подготовлено процессом, проиллюстрированным в схеме 1, где каждый R1, R2, R3, А и R как определяются в настоящем документе. Соединение 2b может быть подготовлено путем разделения соединения 1b, и затем реакцией бромирования соединения 2b с реактивом бромирования для получения соединения 3b. Впоследствии, состав 3b может вступать в реакцию с RH под щелочной средой для получения целевого соединения 4b.
Схема 2
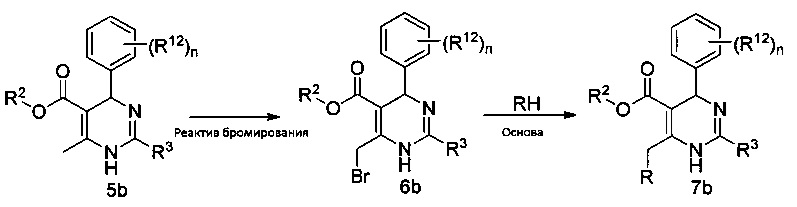
[00163] Целевое соединение 7b может быть подготовлено процессом, проиллюстрированным в схеме 2, где каждый R12, R2, R3 и R как определяются в настоящем документе. Реакция бромирования соединения 5b с реактивом бромирования для получения соединения 6b. Впоследствии, соединение 6b может вступать в реакцию с RH под щелочной средой для получения целевого соединения 7b.
Схема 3
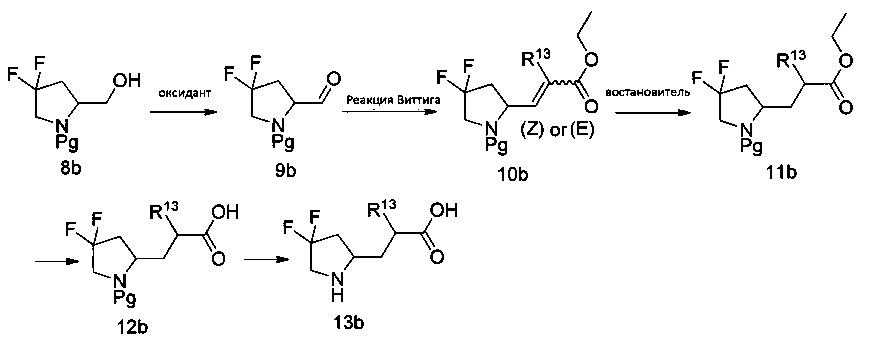
[00164] Целевое соединение 13b может быть подготовлено процессом, проиллюстрированным в схеме 3, где R13 является водородом или метилом. Pg является блокирующей группой амино, такой как Boc, Fmoc, Cbz, и т.п. Соединение 8b может быть преобразовано в соединение 9b в присутствии оксиданта (например, Десс-Мартин периодинан). Реакция Виттига соединения 9b с реактивом Виттига для получения соединения 10b. Соединение 10b может быть восстановлено для получения соединения 11b в присутствии восстановителя, и затем соединение 11b может быть преобразовано в соединение 12b гидролизом. Впоследствии, блокирующая группа Pg соединения 12b может быть удалена для получения соединения 13b.
Схема 4
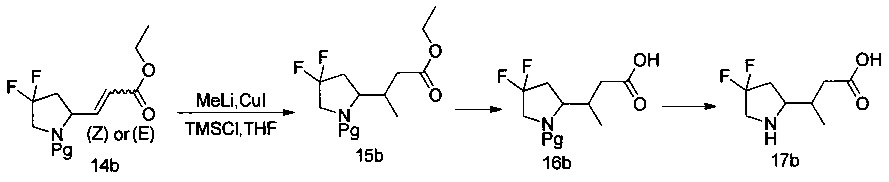
[00165] Целевое соединение 17b может быть подготовлено процессом, проиллюстрированным в схеме 4, где Pg является блокирующей группой амино, такой как Boc, Fmoc, Cbz, и т.п. Соединение 14b может быть преобразовано в соединение 15b в присутствии CuI, MeLi и TMSCl, и затем соединение 15b, может быть преобразовано в соединение 16b гидролизом. Впоследствии, блокирующая группа Pg соединения 16b может быть удалена для получения соединения 17b.
Схема 5
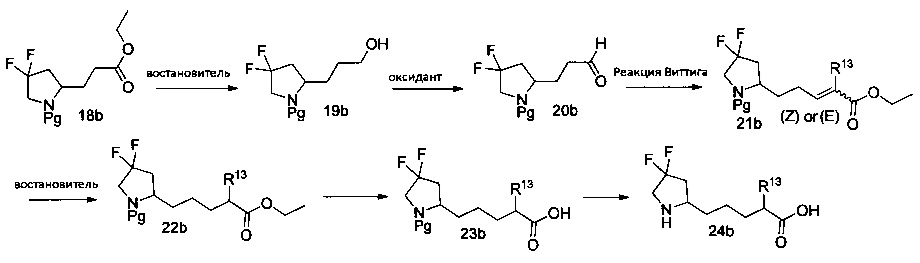
[00166] Целевое соединение 24b может быть подготовлено процессом, проиллюстрированным в схеме 5, где R13 является водородом или метилом. Pg является блокирующей группой амино, такой как Boc, Fmoc, Cbz, и т.п. Соединение 18b может быть преобразовано в соединение 19b в присутствии восстановителя. Соединение 19b может быть преобразовано в соединение 20b в присутствии оксиданта (например, Десс-Мартин периодинан). Реакция Виттига соединения 20b с реактивом Виттига для получения соединения 21b. Соединение 21b может быть восстановлено для получения соединения 22b, и затем соединение 22b может быть преобразовано в соединение 23b гидролизом. Впоследствии, блокирующая группа Pg соединения 23b может быть удалена для получения соединения 24b.
Схема 6
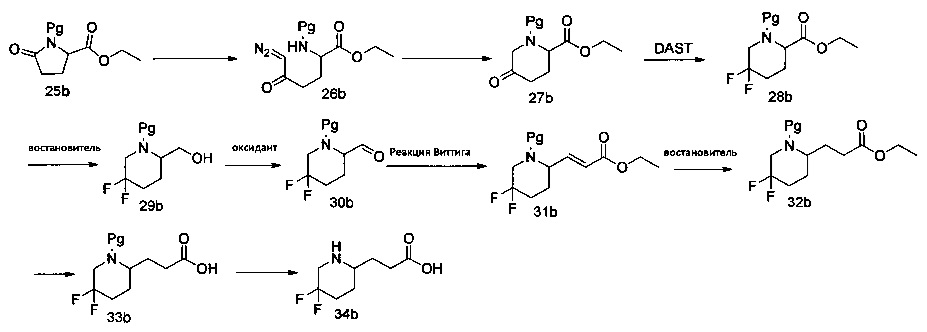
[00167] Целевое соединение 34b может быть подготовлено процессом, проиллюстрированным в схеме 6, где Pg является блокирующей группой амино, такой как Boc, Fmoc, Cbz, и т.п. Соединение 25b может быть преобразовано в соединение 26b в присутствии (триметилсилил) диазометана и n-бутиллития. Содинение 26b может быть преобразовано в соединение 27b в присутствии родиевого ацетата. Соединение 27b может вступать в реакцию с DAST для получения соединения 28b. Соединение 28b может быть уменьшено для получения соединения 29b в присутствии восстановителя. Соединение 29b может быть преобразовано в соединение 30b в присутствии оксиданта (например, Десс-Мартин периодинан). Соединение 30b может вступать в реакцию с реактивом Виттига для получения соединения 31b. Соединение 31b может быть восстановлено для получения соединения 32b, и затем соединение 32b может быть преобразовано в состав 33b гидролизом. Впоследствии, блокирующая группа Pg соединения 33b может быть удалена для получения соединения 34b.
Схема 7
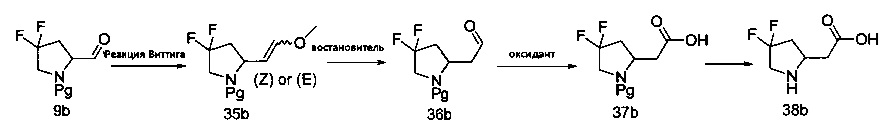
[00168] Целевое соединение 38b может быть подготовлено процессом, проиллюстрированным в схеме 7, где Pg является блокирующей группой амино, такой как Boc, Fmoc, Cbz, и т.п. Реакция Виттига соединения 9b с реактивом Виттига для получения соединения 35b. Соединение 35b может быть восстановлено для получения соединения 36b в присутствии восстановителя, и затем соединение 36b может быть преобразовано в соединение 37b в присутствии оксиданта. Впоследствии, блокирующая группа Pg соединения 37b может быть удалена для получения соединения 38b.
ПРИМЕРЫ
[00169] Изобретение проиллюстрировано далее следующими примерами, которые не являются ограничивающими изобретения в его объеме.
Пример 1: (S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-карбоксиловая кислота
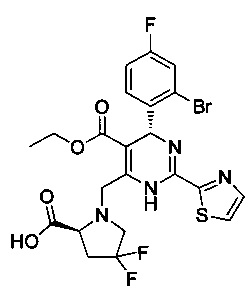
Шаг 1) (R)-этил 4-(2-бромо-4 фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
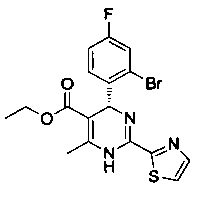
[00170] Раствор этила 4-(2-бромо-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (5 г, 11,8 ммоль, см. процедуру синтеза: WO 2010069147 A) в смеси МеОН и DCM (об. % = 1/1, 20 мл) был отделен подготовительной хроматографией для получения титульного соединения в виде желтой твердой фазы (2 г, 40%).
Соединение характеризовалось следующими спектральными данными:
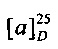 = -80.71 (с=0.3023 г/100 мл, МеОН);
= -80.71 (с=0.3023 г/100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 424.0 [М+1]+; и
1Н NMR (400 МГц, DMSO-d6): δ 9.88 (s, 1Н), 7.97 (d, 1H), 7.89 (d, 1H), 7.54 (dd, 1H), 7.35 (dd, 1H), 7.23 (td, 1H), 5.96 (s, 1H), 3.93 (q, 2H), 2.46 (s, 3H), 1.03 (t, 3H).
Шаг 2) (R)-этил 4-(2-бромо-4 фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
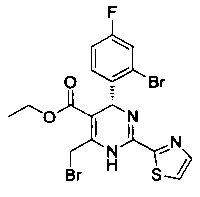
[00171] К смеси (R)-этил 4-(2-бромо-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (1 г, 2,4 ммоль) и CCl4 (20 мл) добавили NBS (0,47 г, 2,64 ммоль) при 76°С. Реакционную смесь размешивали при 76°С в течение 30 минут. После того, как реакция была закончена, смесь была охлаждена и сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 5/1) для получения титульного соединения в виде желтой твердой фазы (0,85 г, 70%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 503.9 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 10.23 (s, 1Н), 8.01 (d, 1H), 7.98 (d, 1H), 7.62 (dd, 1H), 7.42 (dd, 1H), 7.29 (td, 1H), 6.01 (s, 1H), 4.79 (br, 2H), 4.01 (q, 2H), 1.08 (t, 3H).
Шаг 3) (S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-карбоксиловая кислота
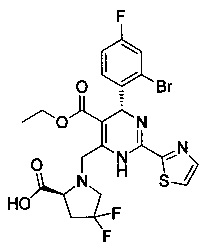
[00172] В колбу добавили (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (0,56 г, 1,1 ммоль), (S)-4,4-дифторопирролидин-2-карбоксиловую кислоту, соль трифторуксусной кислоты (0,58 г, 2,2 ммоль, см. процедуру синтеза: Tetrahedron letters, 1998, 39 (10), 1169-1172), карбонат калия (0,3 г, 2,2 ммоль) и безводный этиловый спирт (20 мл). Смесь размешивали при 30°С в течение 24 часов под N2, и затем отфильтровали. Фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 15/1) для получения титульного соединения в виде светло-желтой твердой фазы (0,15 г, 24%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 573.0 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 9.98 (br, 1H), 8.03 (d, 1H), 8.00 (d, 1H), 7.61 (dd, 1H), 7.48 (dd, 1H), 7.28 (td, 1H), 6.02 (s, 1H), 4.35 (d, 1H), 4.13 (d, 1H), 4.01-3.94 (m, 3Н), 3.61-3.51 (m, 1H), 3.25-3.19 (m, 1H), 3.10-3.04 (m, 1H), 2.86-2.68 (m, 1H), 1.20 (t, 3H).
Пример 2: (R)-4-(((R)-6-(2-бромо-4 фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
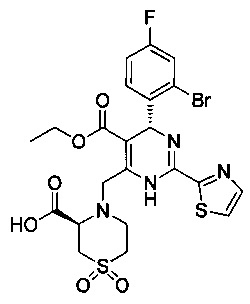
[00173] В колбу добавили (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (0,56 г, 1,1 ммоль), (R)-тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид (0,4 г, 2,2 ммоль, см. процедуру синтеза: Acta Chemica Scandinavica, 1994: 48: 517-525), карбонат калия (0,3 г, 2,2 ммоль) и безводный этиловый спирт (20 мл). Смесь размешивали при 30°С в течение 24 часов под N2. После того, как реакция была закончена, реакция была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 10/1) для получения титульного соединения в виде светло-желтой твердой фазы (0,2 г, 30%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 601.0 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 11.07 (br, 1H), 10.19 (br, 1H), 8.00 (d, 1H), 7.92 (d, 1H), 7.56 (dd, 1H), 7.41 (dd, 1H), 7.21 (td, 1H), 6.01 (s, 1H), 4.55 (dd, 1H), 4.11 (br, 1H), 3.99-3.89 (m, 3H), 3.55-3.35 (m, 3H), 3.23-2.97 (m, 3H), 1.06 (t, 3H).
Пример 3: (3R)-4-((6-(2-хлоро-4 фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
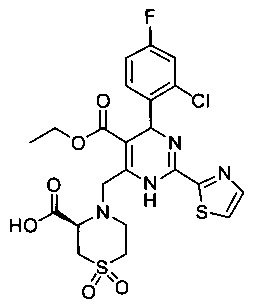
[00174] Смесь этила 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (1,24 г, 2,7 ммоль, см. процедуру синтеза: WO 2010069147 A), K2CO3 (0,66 г, 4,8 ммоль), безводный этанол (60 мл) и (R)-тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид (0,43 г, 2,4 ммоль) размешивали при 25°С в течение 24 часов. После того, как реакция была закончена, реакционная смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 15/1) для получения титульного соединения в виде желтой твердой фазы (0,16 г, 12%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 557.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 13.03 (br, 1Н), 9.73 (br, 1H), 8.03 (d, 1H), 7.97 (d, 1H), 7.47-7.43 (m, 2H), 7.19 (td, 1H), 6.05 (s, 1H), 4.55 (dd, 1H), 4.40-4.24 (m, 2H), 4.11-3.93 (m, 3H), 3.65-3.40 (m, 3H), 3.25-3.15 (m, 2H), 1.06 (t, 3H).
Пример 4: (3R)-4-((6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
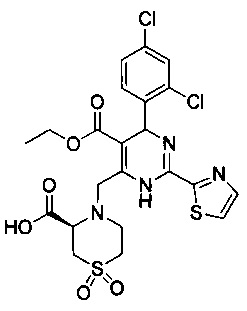
[00175] Смесь этила 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат (1,35 г, 3,4 ммоль, см. процедуру синтеза: WO 2010069147 A), K2CO3 (0,88 г, 6,2 ммоль), (R)-тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид (0,55 г, 3,1 ммоль) и безводный этанол (60 мл) размешивали при 35°С в течение 24 часов. После того, как реакция была закончена, реакционная смесь была отфильтрована, и фильтрат был сконцентрирован. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 50/1) для получения титульного соединения в виде желтой твердой фазы (0,15 г, 8,4%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 573.1 [М+Н]+;
1Н NMR (600 МГц, DMSO-d6): δ 10.49 (br, 1Н), 7.99 (br, 1H), 7.92 (d, 1H), 7.73-7.60 (m, 2H), 7.42-7.40 (m, 1H), 6.05 (s, 1H), 4.52 (d, 1H), 4.38 (d, 1H), 4.18-4.13 (m, 1H), 3.99-3.93 (m, 3H), 3.55-3.40 (m, 3H), 3.20-3.05 (m, 2H), 1.05 (t, 3H).
Пример 5: 2-(1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)уксусная кислота
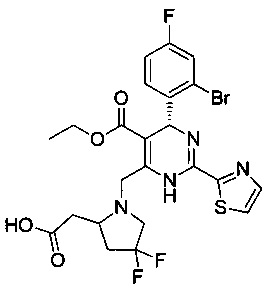
Шаг 1) (S)-терт-бутил 4,4-дифторо-2-формилпирролидин-1-карбоксилат
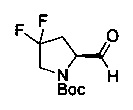
[00176] К решению (S)-терт-бутил 4,4-дифторо-2-формилпирролидин-1-карбоксилата (10 г, 42,2 ммоль) в DCM (200 мл) добавили Десс-Мартин периодинан (21,5 г, 50,6 ммоль) при 0°С. После дополнения реакционная смесь размешивали при 0°С в течение 3 часов. После того, как реакция была закончена, реакция была подавлена насыщенным водным раствором NaHCO3 (200 мл). Отделенная органическая фаза была промыта насыщенным водным раствором NaHCO3 (200 мл) и насыщенным солевым раствором (200 мл), высушена безводным Na2SO4 и сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 2/1) для получения титульного соединения в виде светло-желтого масла (5,6 г, 56%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 180.1 [М+Н-56]+.
Шаг 2) трет-бутил 4,4-дифторо-2-(2-метоксивинил) пирролидин-1-карбоксилат
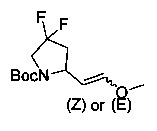
[00177] Смесь (метоксиметил) трифенилфосфония хлорида (19,0 г, 55,4 ммоль), безводным THF (200 мл) и калиевого терт-бутоксида (7,4 г, 60,94 ммоль) размешивали при 50°С под N2 в течение 2 часов. Смесь была охлаждена до 25°С и затем раствор (S)-терт-бутил 4,4-дифторо-2-формилпирролидин-1-карбоксилата (4,5 г, 19,14 ммоль) в безводном THF (15 мл) были добавлены по капле. После дополнения полученную смесь размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, реакция была подавлена водой (200 мл) и затем экстрагирована EtOAc (300 мл×2). Объединенные органические фазы были промыты солевым раствором (300 мл×2), высушены над безводной Na2SO4, отфильтрованы, и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 8/1) для получения титульного соединения в виде светло-желтого масла (3,0 г, 59,64%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 164.1 [М+Н-100]+; и
1H NMR (400 МГц, CDCl3): δ 6.55-5.92 (m, 1H), 4.96-4.68 (m, 1Н), 4.55-4.36 (m, 1Н), 3.85-3.66 (m, 2Н),-3.63-3.55 (s, s, 3Н), 2.70-2.44 (m, 1Н), 2.27-2.08 (m, 1Н), 1.47 (s, 9Н).
Шаг 3) трет-бутл 4,4-дифторо-2-(2-оксоэтил)пирролидин-1-карбоксилат
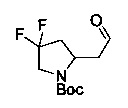
[00178] Смесь трет-бутил 4,4-дифторо-2-(2-метоксивинил) пирролидин-1-карбоксилата (1,0 г, 3,8 ммоль), ацетонитрила (40 мл) и водного раствора TFA (5%, 8 мл) размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, реакция была подавлена насыщенным водным раствором бикарбоната натрия (100 мл), и смесь была экстрагирована EtOAc (150 мл×2). Объединенные органические фазы были вымыты насыщенным водным раствором бикарбоната натрия (100 мл×2) и насыщенным солевым раствором (100 мл×2), далее высушили над безводной Na2SO4, отфильтровали и сконцентрировали в вакууме для получения титульного соединения в виде коричневого масла (1,0 г), которое использовалось непосредственно для следующего шага без дальнейшей очистки. Соединение характеризовалось следующими спектральными данными:
1Н NMR (400 МГц, CDCl3): δ 9.78 (s, 1Н), 4.46 (s, 1Н), 3.90-3.64 (m, 2Н), 3.23-2.91 (m, 1Н), 2.80-2.54 (m, 2Н), 2.27-2.08 (m, 1Н), 1.47 (s, 9Н).
Шаг 4) 2-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)уксусная кислота
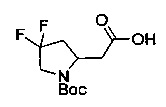
[00179] К смеси трет-бутила 4,4-дифторо-2-(2-оксоэтил) пирролидин-1-карбоксилата (1,0 г, 4,02 ммоль), ацетона (2 мл) был добавлен водный раствор KMnO4 (1 моль/л, 10 мл) при 0°С. Реакционную смесь размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, реакция была подавлена насыщенным водным раствором NaHSO3 (50 мл). Полученная смесь была экстрагирована EtOAc (100 мл×2). Объединенные органические фазы были высушены над безводной Na2SO4, отфильтрованы и сконцентрированы в вакууме для получения титульного соединения в виде коричневого масла (0,8 г, 75,5%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 166.1 [М+Н-100]+.
Шаг 5) 2-(4,4 дифторопирролидин-2-ил)гидрохлорид уксусной кислоты
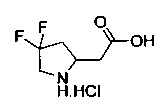
[00180] Смесь 2-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)уксусной кислоты (0,2 г, 0,75 ммоль) и HCl в EtOAc (4 моль/л, 20 мл) размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь была сконцентрирована в вакууме для получения титульного соединения в виде красновато-коричневого масла (0,15 г, 99%), которое использовалось непосредственно для следующего шага без дальнейшей очистки. Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 166.1 [М+Н]+.
Шаг 6) 2-(1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)уксусная кислота
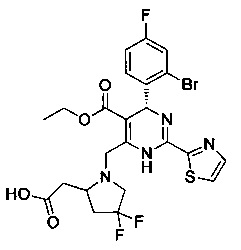
[00181] Смесь 2-(4,4 дифторопирролидин-2-ил)уксусной кислоты гидрохлорида (0,15 г, 0,74 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,46 г, 0,92 ммоль), K2CO3 (0,47 г, 3,36 ммоль) и безводного этанола (10 мл) размешивали при 25°С под N2 в течение 12 часов. После того, как реакция была закончена, реакционная смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 10/1) для получения титульного соединения в виде желтой твердой фазы (0,15 г, 34,24%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 587.0 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.46 (s, 1Н), 9.63 (s, 1H), 8.09-7.87 (m, 2Н), 7.58 (d, 1Н), 7.50-7.34 (m, 1Н), 7.23 (d, 1Н), 6.02 (s, 1Н), 4.40-4.10 (m, 2Н), 4.02-3.95 (m, 2Н), 3.57 (d, 2Н), 3.19 (s, 1Н), 3.00-2.78 (m, 1Н), 2.70 (d, 1Н), 2.42 (dd, 1Н), 2.20 (s, 1Н), 1.06 (t, 3Н).
Пример 6: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
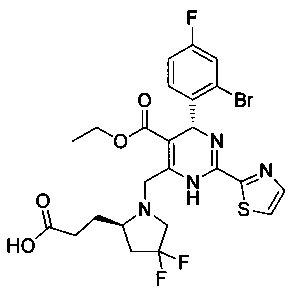
Шаг 1) (S)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилат
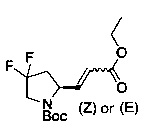
[00182] Смесь (S)-терт-бутил 4,4-дифторо-2-формилпирролидон-1-карбоксилата (4,84 г, 20,57 ммоль), DCM (120 мл) и этила (трифенилфосфоранилдиен) ацетата (8,59 г, 24,69 ммоль) размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, реакционная смесь была сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (ОБ. %) = 3/1) для получения титульного соединения в виде светло-желтого масла (3,96 г, 63,1%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 206 [М+Н-100]+; 250 [М+Н-56]+; и
1H NMR (600 МГц, CDCl3): δ 6.83 (m, 1Н), 5.91 (d, 1H), 4.65 (d, 1H), 4.22 (d, 2Н), 3.86 (s, 1H), 3.73 (m, 1H), 2.66 (d, 1Н), 2.26 (dd, 1Н), 1.45 (d, 9Н), 1.31 (t, 3Н).
Шаг 2) (R)-терт-бутил-2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилат
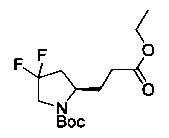
[00183] Смесь (S)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилата (0,5 г, 1,8 ммоль), этанола (10 мл) и Pd/C (10%, 60 мг) размешивали под Н2 при 25°С в течение 12 часов. После того, как реакция была закончена, реакционная смесь была отфильтрована. Фильтрат был сконцентрирован в вакууме для получения титульного соединения в виде бесцветного масла (0,45 г, 89,5%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (600 МГц, CDCl3): δ 4.15 (dd, 2Н), 3.98-3.82 (m, 1H), 3.77 (t, 1H), 3.62 (dd, 1H), 2.61-2.43 (m, 1H), 2.40-2.26 (m, 2H), 2.19-2.07 (m, 2H), 1.91-1.83 (m, 1H), 1.49 (s, 9H), 1.28 (t, 3H).
Шаг 3) (R)-3-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)пропановая кислота
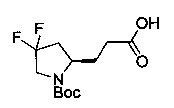
[00184] Смесь (R)-терт-бутил 2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилата (0,45 г, 1,46 ммоль) в этаноле (10 мл) добавили в водный раствор LiOH.H2O (LiOH.H2O (0,62 г, 14,7 ммоль) в 10 мл воды), размешивали при 25°С в течение 1 часа и сконцентрировали в вакууме. Далее к остатку добавили воду (15 мл). Полученная смесь была экстрагирована EtOAc (25 мл×2). Органическую фазу отбросили. К водной фазе добавили EtOAc (50 мл), и полученную смесь довели до рН фактора 4-6 концентрированной соляной кислотой, далее отделенную органическую фазу промыли насыщенным солевым раствором (×2 на 25 мл), высушили над безводной Na2SO4, отфильтровали и сконцентрировали в вакууме для получения титульного соединения в виде светло-желтого масла (0,25 г, 61,1%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 180 [М+Н-100]+; 224 [М+Н-56]+; и
1Н NMR (600 МГц, CDCl3): δ 4.30-4.09 (m, 1Н), 4.02-3.78 (m, 1Н), 3.69-3.56 (m, 1Н), 2.61-2.48 (m, 1Н), 2.47-2.35 (m, 1Н), 2.22-2.09 (m, 1Н), 1.92-1.79 (m, 1H), 1.49 (s, 9Н).
Шаг 4) (R)-3-(4,4-дифторопирролидин-2-ил)пропановой кислоты гидрохлорид
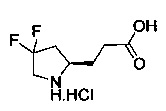
[00185] Смесь (R)-3-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)пропановая кислота (0,25 г, 0,90 ммоль) и раствор HCl в EtOAc (4 моль/л, 5 мл) размешивали при 25°С в течение 2 часов. Реакционная смесь была сконцентрирована в вакууме для получения титульного соединения в виде белого порошка (0,15 г, 77,9%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 180.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 10.21 (br, 1H), 3.80-3.73 (m, 2Н), 3.66-3.59 (m, 1H), 2.74-2.67 (m, 1H), 2.43-2.40 (m, 2H), 2.33-2.23 (m, 1H), 2.05-1.95 (m, 2H).
Шаг 5) 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
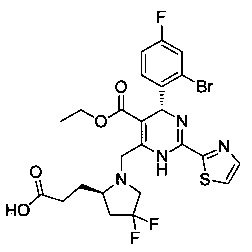
[00186] Смесь (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорид (0,18 г, 0,84 ммоль), (R)-этил4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,47 г, 0,92 ммоль), K2CO3 (0,46 г, 3,36 ммоль) и безводного этанола (10 мл) размешивали при 25°С в течение 12 часов в условиях азота. После того, как реакция была закончена, реакционная смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 25/1) для получения титульного соединения в виде желтой твердой фазы (0,4 г, 79,2%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 601.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 12.08 (s, 1H), 9.51 (s, 1Н), 8.01 (d, 1H), 7.93 (d, 1H), 7.57 (dd, 1H), 7.41 (dd, 1H), 7.24 (td, 1H), 6.01 (s, 1H), 4.12 (dd, 2H), 3.97 (q, 2H), 3.61-3.52 (m, 1H), 3.04-2.96 (m, 2H), 2.58-2.56 (m, 1H), 2.35-2.20 (m, 2H), 2.12-1.98 (m, 1H), 1.93-1.90 (m, 1H), 1.56-1.48 (m, 1H), 1.06 (t, 3H).
Пример 7: 3-(2R)-1-((6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(1 метил 1H имидазол 2 ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
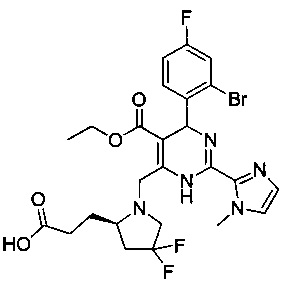
[00187] Смесь (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,1 г, 0,46 ммоль), этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(1 метил-1Н-имидазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,26 г, 0,51 ммоль), K2CO3 (0,13 г, 0,94 ммоль), этанол (3 мл) и DMF (1,5 мл) размешивали при 25°С в среде азота в течение 12 часов. После того, как реакция была закончена, реакционная смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (ОБ. %) = 15/1) для получения титульного соединения в виде желтой твердой фазы (0,15 г, 56%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 598.0 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.18 (s, 1Н), 9.54 (s, s, 1Н), 7.59-7.56 (m, 1H), 7.37-7.26 (m, 2H), 7.25-7.14 (m, 1H), 7.02 (s, 1H), 6.01 (s, s, 1H), 4.21-4.09 (m, 2H), 4.04-3.92 (m, 2H), 3.89-3.88 (s, s, 3H), 3.58-3.37 (m, 1H), 3.07-2.78 (m, 2H), 2.56-2.51 (m, 1H), 2.38-2.12 (m, 2H), 2.15-1.85 (m, 2H), 1.66-1.44 (m, 1H), 1.09-1.05 (m, 3H).
Пример 8: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
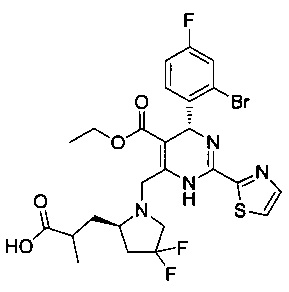
Шаг 1) (S)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилат
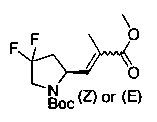
[00188] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 1 с использованием (S)-терт-бутил 4,4-дифторо-2-формилпирролидон-1-карбоксилата (2,6 г, 11,06 ммоль), DCM (120 мл) и метил 2-(трифенилфосфоранилдиен) пропаноата (4,24 г, 12,17 ммоль) для получения титульного соединения в виде светло-желтого масла (1,6 г, 47,3%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 250.1 [М+Н-56]+.
Шаг 2) (2R)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопропил)пирролидин-1-карбоксилат
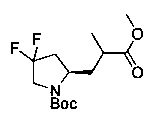
[00189] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 2 с использованием (S)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилата (1,6 г, 5,24 ммоль), метанола (10 мл) и Pd/C (10%, 0,2 г) для получения титульного соединения в виде бесцветного масла (1,4 г, 87,5%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208 [М+Н-100]+; 252 [М+Н-56]+.
Шаг 3) 3-(R)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
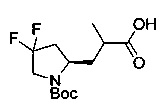
[00190] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (2R)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопропил)пирролидин-1-карбоксилата (1,4 г, 4,55 ммоль), этанола (50 мл) и водного раствора LiOH.H2O (LiOH.H2O (1,9 г, 45.3 ммоль) в 50 мл воды для получения титульного соединения в виде светло-желтого масла (1,1 г, 82,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194 [М+Н-100]+; 238 [М+Н-56]+.
Шаг 4) 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорид
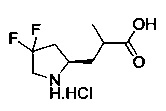
[00191] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 с использованием 3-(R)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты (1,1 г, 3,75 ммоль) и раствора HCl в EtOAc (4 моль/л, 80 мл) для получения титульного соединения в виде светло-коричневой вязкой фазы (0,69 г, 80%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.2 [М+Н]+.
Шаг 5) 3-(1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
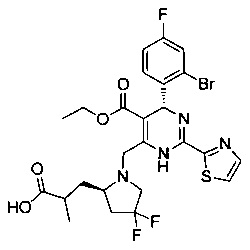
[00192] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,81 г, 3,75 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (2,07 г, 4,12 ммоль), K2CO3 (1,54 г, 11,19 ммоль) и безводного этанола (40 мл) для получения титульного соединения в виде желтой твердой фазы (1,63 г, 70,6%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 616 [М+Н]+;
1Н NMR (400 МГц, DMSO-d6): δ 8.05-8.01 (m, 2Н), 7.58 (dd, 1Н), 7.47 (dd, 1H), 7.26 (td, 1H), 6.01 (s, 1H), 4.51 (d, 1H), 4.22 (t, 1H), 4.00 (q, 2H), 3.89 (br, 1H), 3.55-3.42 (m, 2H), 2.79-2.69 (m, 1H), 2.47-2.36 (m, 1H), 2.30-2.14 (m, 1H), 2.02-1.86 (m, 1H), 1.55-1.45 (m, 1H), 1.15-1.09 (m, 6H).
Пример 9: 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
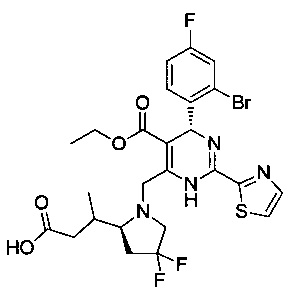
Шаг 1) (2S)-терт-бутил 2-(4-этокси-4-оксобутан-2-ил)-4,4-дифторопирролидин-1-карбоксилат
[00193] К смеси CuI (960 мг, 5,05 ммоль) и безводного THF (100 мл) добавили раствор MeLi в THF (1,6 моль/л, 6,3 мл) при 0°С под азотом. Реакционную смесь размешивали при этой температуре в течение 1 часа. Далее смесь была охлаждена до -78°С и TMSCl (283 мг, 2,62 ммоль) и (S)-терт-бутил 2-(3 этокси 3 оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилат был добавлен поочередно при -78°С. Полученную смесь размешивали при -78°С в течение 2 часов и затем размешивали при 25°С в течение 1 часа. После того, как реакция была закончена, реакция была подавлена насыщенным хлоридом аммония (50 мл). Полученная смесь была экстрагирована EtOAc (×2 на 50 мл). Объединенные органические фазы были промыты насыщенным солевым раствором (×2 на 30 мл), высушены над безводной Na2SO4 и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (ОБ. %) = 8/1) для получения титульного соединения в виде светло-желтого масла (500 мг, 59,4%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 222 [М+Н-100]+.
Шаг 2) 3-(S)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
[00194] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 6 с использованием (2S)-терт-бутил 2-(4-этокси-4-оксобутан-2-ил)-4,4-дифторопирролидин-1-карбоксилата (500 мг, 1,55 ммоль), этанола (10 мл) и водного раствора LiOH.H2O (LiOH.H2O (0,65 г) в 10 мл воды) для получения титульного соединения в виде светло-желтого масла (320 мг, 70,1%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194 [М+Н-100]+; 238 [М+Н-56]+.
Шаг 3) 3-(S)-4,4-дифторопирролидин-2-ил)бутеновой кислоты гидрохлорид
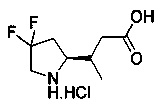
[00195] Титульное соединение было подготовлено процедурой, описанной в шаге 4 Примера 6 с использованием 3-(S)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)бутеновой кислоты (320 мг, 1,09 ммоль) и HCl в EtOAc (4 моль/л, 2 мл) для получения титульного соединения в виде светло-коричневого масла (0,19 г, 76%), Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н]+.
Шаг 4) 3-(5)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
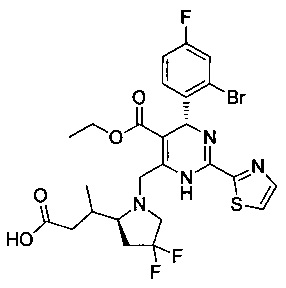
[00196] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил)бутеновой кислоты гидрохлорида (250 мг, 1,09 ммоль), (R)-этил4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,66 г, 1,31 ммоль), K2CO3 (0,45 г, 3,27 ммоль) и безводного этанола (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,1 г, 14,6%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 615.0 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 11.97 (s, 1H), 9.47 (s, 1H), 8.11-7.82 (m, 2Н), 7.58 (dd, 1Н), 7.42 (dd, 1H), 7.24 (td, 1H), 6.00 (s, 1H), 4.20-4.10 (m, 2H), 3.96 (q, 2H), 3.75-3.65 (m, 1H), 3.13-3.01 (m, 2H), 2.67 (d, 1H), 2.37-2.25 (m, 2H), 2.11-2.06 (m, 1H), 2.00-1.95 (m, 1H), 1.06 (t, 3H), 0.89 (d, 3H).
Пример 10: (R)-4-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
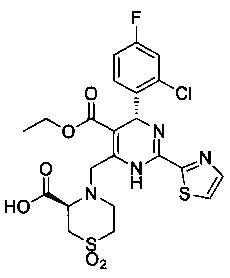
Шаг 1) (R)-этил 4-(2-хлоро-4 фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
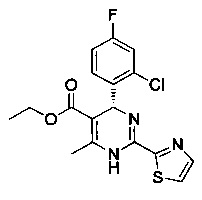
[00197] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 1 с использованием этил 4-(2-хлоро-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (5 г, 13,2 ммоль) для получения титульного соединения в виде желтой твердой фазы (2,1 г, 42%). Соединение характеризовалось следующими спектральными данными:
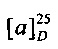 = -59.6 (с = 0.3020 г/100 мл, МеОН);
= -59.6 (с = 0.3020 г/100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 380.2 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 9.92 (s, 1H), 7.97 (d, 1Н), 7.90 (d, 1Н), 7.41 (dd, 1Н), 7.37 (dd, 1Н), 7.19 (td, 1Н), 6.00 (s, 1H), 3.93 (q, 2Н), 2.46 (s, 3Н), 1.03 (t, 3Н).
Шаг 2) (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
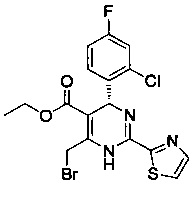
[00198] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 1 с использованием (R)-этил 4-(2-хлоро-4 фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,91 г, 2,4 ммоль), CCl4 (20 мл) и NBS (0,47 г, 2,64 ммоль) для получения титульного соединения в виде желтой твердой фазы (0,8 г, 73%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 457.9 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 9.67 (s, 1Н), 8.01 (d, 1H), 7.97 (br, 1H), 7.44-7.41 (m, 2H), 7.22 (td, 1H), 5.99 (s, 1H), 4.83 (br, 2H), 4.02 (q, 2H), 1.07 (t, 3H).
Шаг 3) (R)-4-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
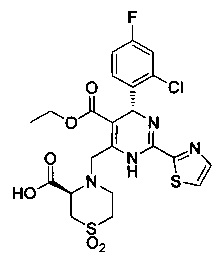
[00199] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (1,24 г, 2,7 ммоль), (R)-тиоморфолин-3-карбоксиловой кислоты 1,1-диоксида (0,43 г, 2,4 ммоль), K2CO3 (0,75 г, 5,4 ммоль) и безводного этанола (25 мл) для получения титульного соединения в виде желтой твердой фазы (0,16 г, 12%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 557.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 13.03 (br, 1H), 9.73 (br, 1H), 8.03 (d, 1H), 7.97 (d, 1H), 7.47-7.43 (m, 2H), 7.19 (td, 1H), 6.05 (s, 1H), 4.55 (dd, 1H), 4.40-4.24 (m, 2H), 4.11-3.93 (m, 3H), 3.65-3.40 (m, 3H), 3.25-3.15 (m, 2H), 1.06 (t, 3H).
Пример 11: (R)-4-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
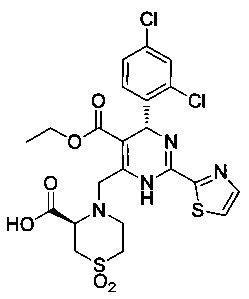
Шаг 1) (R)-этил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
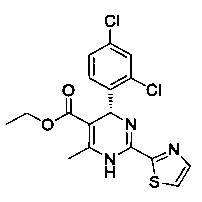
[00200] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 1 с использованием этил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (5 г, 12,6 ммоль) для получения титульного соединения в виде желтой твердой фазы (1,9 г, 38%). Соединение характеризовалось следующими спектральными данными:
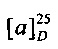 = -39.07 (с = 0.3032 г/100 мл, МеОН);
= -39.07 (с = 0.3032 г/100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 396.1 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 9.93 (s, 1Н), 7.97 (d, 1H), 7.90 (d, 1H), 7.58 (d, 1H), 7.41 (dd, 1H), 7.35 (d, 1H), 6.00 (s, 1H), 3.93 (q, 2H), 2.46 (s, 3H), 1.03 (t, 3H).
Шаг 2) (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
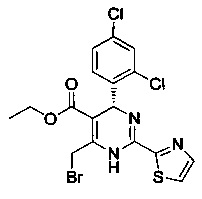
[00201] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 1 с использованием (R)-этил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,95 г, 2,4 ммоль), CCl4 (20 мл) и NBS (0,47 г, 2,64 ммоль) для получения титульного соединения в виде желтой твердой фазы (0,74 г, 65%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 475.6 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 8.03 (d, 1Н), 7.98 (d, 1H), 7.66-7.62 (m, 1H), 7.47-7.35 (m, 2H), 5.99 (s, 1H), 4.82 (br, 2H), 4.02 (q, 2H), 1.09 (t, 3H).
Шаг 3) (R)-4-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)тиоморфолин-3-карбоксиловой кислоты 1,1-диоксид
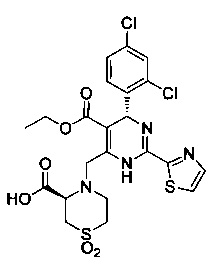
[00202] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (1,35 г, 3.4 ммоль), (R)-тиоморфолин-3-карбоксиловой кислоты 1,1-диоксида (0,55 г, 3,1 ммоль), K2CO3 (0,94 г, 6,8 ммоль) и безводного этанола (25 мл) для получения титульного соединения в виде желтой твердой фазы (0,15 г, 8,4%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 573.1 [М+Н]+; и
1H NMR (600 МГц, DMSO-d6): δ 10.49 (br, 1H), 7.99 (br, 1H), 7.92 (d, 1H), 7.73-7.60 (m, 2H), 7.42-7.40 (m, 1H), 6.05 (s, 1H), 4.52 (d, 1H), 4.38 (d, 1H), 4.18-4.13 (m, 1H), 3.99-3.93 (m, 3H), 3.55-3.40 (m, 3H), 3.20-3.05 (m, 2H), 1.05 (t, 3H).
Пример 12: 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
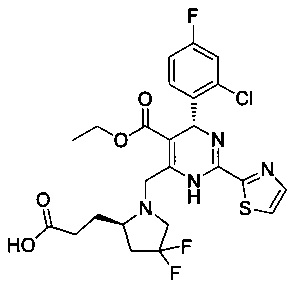
[00203] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,11 г, 0,51 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,21 г, 0,46 ммоль), карбоната калия (0,13 г, 0,94 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,13 г, 50%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 556.9 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 12.08 (s, 1H), 9.52 (s, 1Н), 7.99 (d, 1H), 7.92 (d, 1H), 7.44-7.40 (m, 2H), 7.19 (td, 1H), 6.03 (s, 1H), 4.13 (dd, 2H), 3.97 (q, 2H), 3.60-3.52 (m, 1H), 3.06-2.96 (m, 2H), 2.59-2.56 (m, 1H), 2.36-2.20 (m, 2H), 2.13-1.99 (m, 1H), 1.93-1.88 (m, 1H), 1.57-1.44 (m, 1H), 1.05 (t, 3H).
Пример 13: 3-(R)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
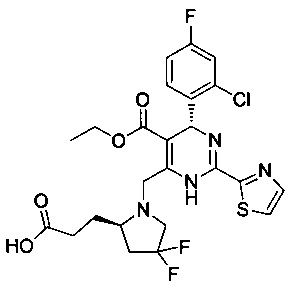
[00204] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,12 г, 0,56 ммоль), (R)-метил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,21 г, 0,44 ммоль), карбоната калия (0,12 г, 0,87 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,18 г, 72%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 573.3 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.05 (s, 1Н), 9.52 (s, 1H), 8.00 (d, 1H), 7.94 (d, 1H), 7.60 (br, 1H), 7.41 (br, 2H), 6.04 (s, 1H), 4.14 (dd, 2H), 3.97 (q, 2H), 3.57-3.49 (m, 1H), 3.07-2.97 (m, 2H), 2.58-2.54 (m, 1H), 2.34-2.21 (m, 2H), 2.18-2.03 (m, 1H), 1.95-1.91 (m, 1H), 1.60-1.49 (m, 1H), 1.06 (t, 3H).
Пример 14: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
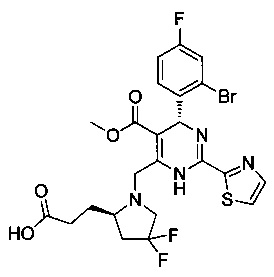
Шаг 1) (R)-метил 4-(2-бромо-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
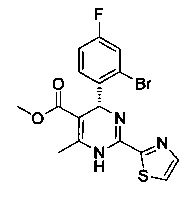
[00205] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 1 метил с использованием 4-(2-бромо-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (5 г, 12,2 ммоль, см. процедуру синтеза: WO 2008154817 A) для получения титульного соединения в виде желтой твердой фазы (2 г, 40%). Соединение характеризовалось следующими спектральными данными:
=-86.04 (с = 0,3022 г /100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 410.0 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 7.79 (d, 1H), 7.67 (d, 1H), 7.42 (dd, 1H), 7.36 (dd, 1H), 7.15 (td, 1H), 5.85 (s, 1H), 3.40 (s, 3H), 2.33 (s, 3H).
Шаг 2) (R)-метил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
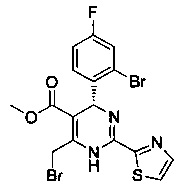
[00206] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 1 с использованием (R)-метил 4-(2-бромо-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,98 г, 2,4 ммоль), CCl4 (20 мл) и NBS (0,47 г, 2,64 ммоль) для получения титульного соединения в виде желтой твердой фазы (0,8 г, 68%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 489.9 [М+Н]+; и
1Н NMR (400 МГц, CDCl3): δ 7.87 (d, 1H), 7.54 (d, 1Н), 7.40 (dd, 1H), 7.35 (dd, 1H), 7.03 (td, 1Н), 6.11 (s, 1Н), 4.97 (d, 1Н), 4.64 (d, 1Н), 3.69 (s, 3Н).
Шаг 3) 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
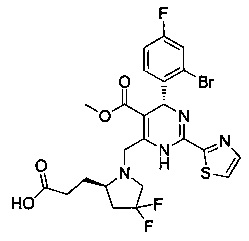
[00207] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,1 г, 0,46 ммоль), (R)-метил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,2 г, 0,41 ммоль), карбоната калия (0,06 г, 0,4 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,1 г, 40%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 587.2 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 11.03 (s, 1H), 9.57 (s, 1Н), 7.99 (d, 1H), 7.92 (d, 1H), 7.55 (dd, 1H), 7.39 (dd, 1H), 7.23 (td, 1H), 6.00 (s, 1H), 4.14 (dd, 2H), 3.62-3.54 (m, 1H), 3.53 (s, 3H), 3.05-2.96 (m, 2H), 2.57-2.56 (m, 1H), 2.36-2.20 (m, 2H), 2.13-1.98 (m, 1H), 1.95-1.90 (m, 1H), 1.56-1.46 (m, 1H).
Пример 15: 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
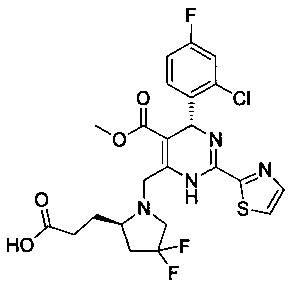
Шаг 1) (R)-метил 4-(2-хлоро-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
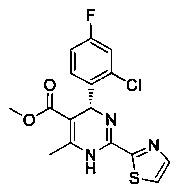
[00208] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 1 с использованием метил 4-(2-хлоро-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (5 г, 13,7 ммоль, см. процедуру синтеза: WO 2008154818 A) для получения титульного соединения в виде желтой твердой фазы (2,1 г, 42%). Соединение характеризовалось следующими спектральными данными:
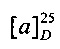 = -81.49 (с = 0.5031 г/100 мл, МеОН);
= -81.49 (с = 0.5031 г/100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 366.1 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 7.81 (d, 1Н), 7.68 (d, 1H), 7.36 (dd, 1H), 7.29 (dd, 1H), 7.11 (td, 1H), 5.90 (s, 1H), 3.41 (s, 3H), 2.34 (s, 3H).
Шаг 2) (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
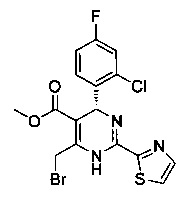
[00209] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 1 с использованием (R)-метил 4-(2-хлоро-4-фторофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,88 г, 2,4 ммоль), CCl4 (20 мл) и NBS (0,47 г, 2,64 ммоль) для получения титульного соединения в виде желтой твердой фазы (0,78 г, 73%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 445.6 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 8.02 (d, 1Н), 7.96 (br, 1H), 7.46-7.40 (m, 2H), 7.22 (td, 1H), 5.98 (s, 1H), 4.83 (br, 2H), 3.57 (s, 3H).
Шаг 3) 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
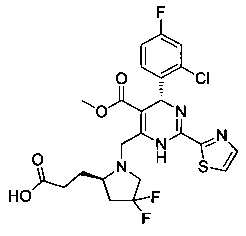
[00210] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,15 г, 0,72 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,31 г, 0,63 ммоль), карбоната калия (0,1 г, 0,7 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,26 г, 75%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 543.0 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 12.07 (br, 1Н), 9.55 (s, 1H), 7.99 (d, 1H), 7.92 (d, 1H), 7.43-7.39 (m, 2H), 7.18 (td, 1H), 6.03 (s, 1H), 4.15 (d, 1H), 4.09 (d, 1H), 3.56-3.54 (m, 1H), 3.53 (s, 3H), 3.05-2.95 (m, 2H), 2.48-2.46 (m, 1H), 2.36-2.17 (m, 2H), 2.15-2.02 (m, 1H), 1.97-1.85 (m, 1H), 1.59-1.50 (m, 1H).
Пример 16: 3-(R)-1-(((R)-6-(2,4-дихлорофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
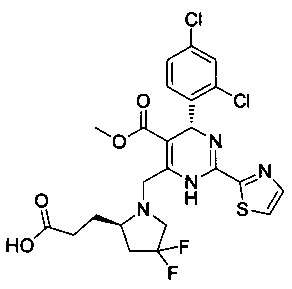
Шаг 1) (R)-метил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
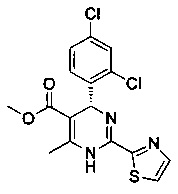
[00211] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 1 с использованием этил метил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (5 г, 13,1 ммоль, см. процедуру синтеза: WO 2008154820 A) для получения титульного соединения в виде желтой твердой фазы (1,9 г, 38%). Соединение характеризовалось следующими спектральными данными:
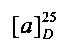 = -46.08 (с = 0.3038 г/100 мл, МеОН);
= -46.08 (с = 0.3038 г/100 мл, МеОН);
MS (ЭРИ, пол.ион) уд.з.: 382.1 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 9.99 (s, 1H), 7.98 (d, 1H), 7.90 (d, 1H), 7.59 (d, 1H), 7.40 (dd, 1H), 7.33 (d, 1H), 5.98 (s, 1H), 3.49 (s, 3H), 2.47 (s, 3H).
Шаг 2) (R)-метил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
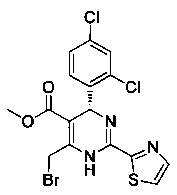
[00212] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 1 с использованием (R)-метил 4-(2,4-дихлорофенил)-6-метил-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,92 г, 2,4 ммоль), CCl4 (20 мл) и NBS (0,47 г, 2,64 ммоль) для получения титульного соединения в виде желтой твердой фазы (0,72 г, 65%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 459.9 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 9.91 (s, 1H), 8.01 (d, 1H), 7.96 (d, 1H), 7.62 (br, 1H), 7.40 (br, 2H), 6.01 (s, 1H), 4.86 (br, 2H), 3.56 (s, 3H).
Шаг 3) 3-(R)-1-(((R)-6-(2,4-дихлорофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
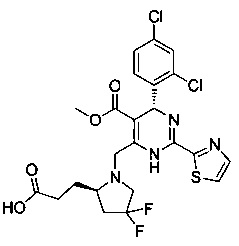
[00213] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,13 г, 0,6 ммоль), (R)-метил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,25 г, 0,54 ммоль), карбоната калия (0,1 г, 0,7 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,11 г, 38%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 559.0 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 11.07 (br, 1Н), 9.56 (s, 1H), 7.99 (d, 1H), 7.92 (d, 1H), 7.60 (br, 1H), 7.39 (br, 2H), 6.02 (s, 1H), 4.14 (dd, 2H), 3.52 (s, 3H), 3.08-2.94 (m, 3H), 2.55-2.53 (m, 1H), 2.30-2.19 (m, 2H), 2.12-1.99 (m, 1H), 1.95-1.84 (m, 1H), 1.60-1.46 (m, 1H).
Пример 17: 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
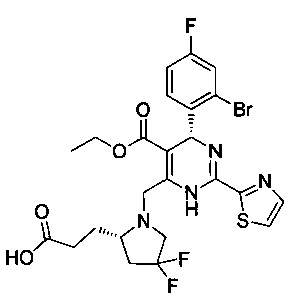
Шаг 1) (R)-терт-бутил 4,4-дифторо-2-формилпирролидон-1-карбоксилат
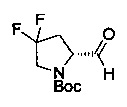
[00214] Титульное соединение было подготовлено процедурой, описанной в шаге 5 Примера 1 с использованием (R)-терт-бутил 4,4-дифторо-2-(гидроксиметил)пирролидин-1-карбоксилата (10 г, 42,2 ммоль), DCM (200 мл) и Десс-Мартин периодинана (21,5 г, 50,6 ммоль) для получения титульного соединения в виде светло-желтого масла (4,8 г, 48%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 180.1 [М+Н-56]+.
Шаг 2) (R)-терт-бутил 2-(3 этокси 3 оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилат
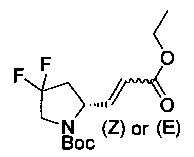
[00215] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 1 с использованием (R)-терт-бутил 4,4-дифторо-2-формилпирролидон-1-карбоксилата (4,84 г, 20,57 ммоль), DCM (120 мл) и этил (трифенилфосфоранилдиен) ацетата (8,59 г, 24,69 ммоль) для получения титульного соединения в виде светло-желтого масла (3,83 г, 61%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 206.0 [М+Н]+.
Шаг 3) (S)-терт-бутил-2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилат
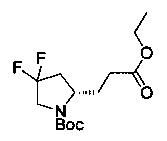
[00216] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 2 с использованием (R)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилата (3,8 г, 12,4 ммоль), метанола (80 мл) и Pd/C (10%, 0,38 г) для получения титульного соединения в виде бесцветного масла (3,3 г, 86%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н-100]+.
Шаг 4) (S)-3-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)пропановая кислота
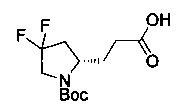
[00217] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (S)-терт-бутил-2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилата (3,2 г, 10,4 ммоль), этанола (32 мл) и водного раствора LiOH.H2O (LiOH.H2O (2,2 г, 52,1 ммоль) в 32 мл воды для получения титульного соединения в виде песчано-бежевого масла (2,53 г, 87%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 224.1 [М+Н-56]+.
Шаг 5) (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорид
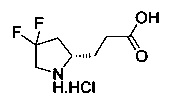
[00218] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 с использованием (S)-3-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)пропановой кислоты (2,5 г, 9 ммоль) и HCl в EtOAc (4 моль/л, 50 мл) для получения титульного соединения в виде белой твердой фазы (1,6 г, 83%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 180.2 [М+Н]+; и
1Н NMR (600 МГц, D2O): δ 4.00-3.94 (m, 1Н), 3.82 (dd, 1H), 3.72 (dd, 1H), 2.83-2.76 (m, 1H), 2.57-2.47 (m, 2H), 2.39-2.32 (m, 1H), 2.16-2.03 (m, 2H).
Шаг 6) 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
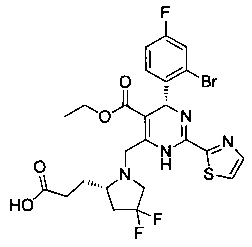
[00219] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,18 г, 0,84 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,47 г, 0,92 ммоль), карбоната калия (0,46 г, 3,36 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,28 г, 55%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 601.2 [М+Н]+; и
1Н NMR (400 МГц, CDCl3): δ 12.19 (br, 1H), 9.46 (s, 1Н), 7.86 (d, 1H), 7.50 (d, 1H), 7.37-7.33 (m, 2Н), 7.00 (td, 1Н), 6.19 (s, 1Н), 4.52 (d, 1H), 4.14-4.03 (m, 2Н), 3.65 (d, 1Н), 3.31-3.23 (m, 2Н), 3.02-2.91 (m, 1Н), 2.57-2.25 (m, 5Н), 1.79-1.74 (m, 1Н), 1.16 (t, 3Н).
Пример 18: 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
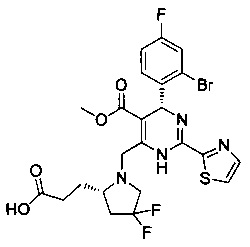
[00220] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,22 г, 1 ммоль), (R)-метил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,49 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,29 г, 49%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 587.2 [М+Н]+; и
1Н NMR (400 МГц, CDCl3): δ 12.15 (br, 1H), 9.47 (s, 1H), 7.85 (d, 1Н), 7.51 (d, 1Н), 7.38-7.33 (m, 2Н), 7.01 (td, 1Н), 6.17 (s, 1Н), 4.50 (d, 1Н), 3.66 (d, 1Н), 3.55 (s, 3Н), 3.33-3.23 (ш, 2Н), 3.04-2.92 (m, 1Н), 2.58-2.25 (m, 5Н), 1.78-1.74 (m, 1Н).
Пример 19: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
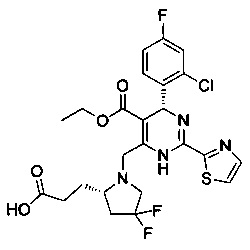
[00221] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,22 г, 1 ммоль), (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0.46 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,31 г, 56%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 557.2 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.16 (br, 1H), 9.45 (s, 1Н), 8.00 (d, 1H), 7.94 (d, 1H), 7.47-7.41 (m, 2H), 7.18 (td, 1H), 6.06 (s, 1H), 4.12 (dd, 2H), 4.00-3.93 (m, 2H), 3.46-3.38 (m, 1H), 3.01-2.85 (m, 2H), 2.60-2.53 (m, 1H), 2.40-2.23 (m, 2H), 2.15-1.99 (m, 2H), 1.66-1.56 (m, 1H), 1.05 (t, 3H).
Пример 20: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
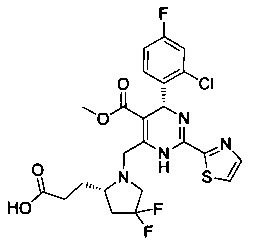
[00222] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,22 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,45 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,23 г, 43%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 543.0 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.06 (br, 1H), 9.56 (s, 1H), 8.01 (d, 1H), 7.94 (d, 1H), 7.44-7.40 (m, 2H), 7.16 (td, 1H), 6.05 (s, 1H), 4.13 (d, 1H), 4.09 (d, 1H), 3.57-3.54 (m, 1H), 3.52 (s, 3H), 3.06-2.96 (m, 2H).2.47-2.45 (m, 1H), 2.37-2.17 (m, 2H), 2.16-2.02 (m, 1H), 1.98-1.85 (m, 1H), 1.60-1.51 (m, 1H).
Пример 21: 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
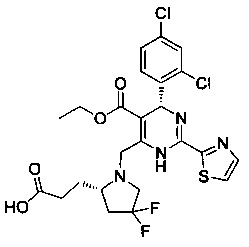
[00223] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,22 г, 1 ммоль), (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,48 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,35 г, 62%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 573.2 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.17 (s, 1Н), 9.47 (s, 1H), 8.00 (d, 1H), 7.94 (d, 1H), 7.60 (br, 1H), 7.45-7.37 (m, 2H), 6.06 (s, 1H), 4.15 (dd, 2H), 3.96 (q, 2H), 3.47-3.39 (m, 1H), 3.01-2.86 (m, 2H), 2.59-2.53 (m, 1H), 2.38-2.25 (m, 2H), 2.15-2.01 (m, 2H), 1.65-1.55 (m, 1H), 1.05 (t, 3H).
Пример 22: 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)пропановая кислота
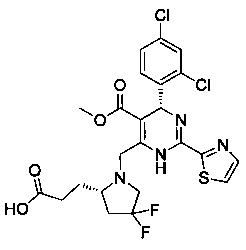
[00224] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(4,4 дифторопирролидин-2-ил)пропановой кислоты гидрохлорида (0,22 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,46 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,26 г, 47%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 558.6 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.15 (s, 1H), 9.52 (s, 1H), 8.00 (d, 1H), 7.94 (d, 1H), 7.60 (s, 1H), 7.41 (br, 2H), 6.05 (s, 1H), 4.13 (dd, 2H), 3.52 (s, 3H), 3.47-3.39 (m, 1H), 3.01-2.87 (m, 2H), 2.59-2.53 (m, 1H), 2.37-2.25 (m, 2H), 2.15-2.02 (m, 2H), 1.64-1.55 (m, 1H).
Пример 23: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
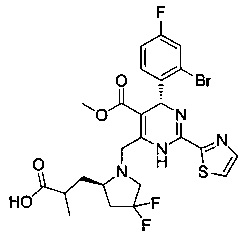
[00225] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-метил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,49 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,23 г, 39%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 600.7 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 8.01 (d, 1H), 7.93 (d, 1H), 7.56 (dd, 1H), 7.44 (dd, 1H), 7.24 (td, 1H), 6.02 (s, 1H), 4.49 (d, 1H), 4.20 (t, 1H), 3.90 (br, 1H), 3.59 (s, 3H), 3.56-3.43 (m, 2H), 2.80-2.70 (m, 1H), 2.46-2.35 (m, 1H), 2.31-2.14 (m, 1H), 2.03-1.87 (m, 1H), 1.57-1.46 (m, 1H), 1.13 (d, 3H).
Пример 24: 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
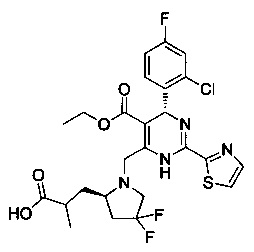
[00226] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,1 г, 0,44 ммоль), (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,31 г, 0,68 ммоль), карбоната калия (0,12 г, 0,87 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,11 г, 45%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 571.2 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 9.49 (s, 1Н), 8.00 (d, 1H), 7.92 (d, 1H), 7.48-7.38 (m, 2H), 7.18 (td, 1H), 6.04 (s, 1H), 4.53 (d, 1H), 4.19 (t, 1H), 4.02 (q, 2H), 3.90 (br, 1H), 3.52-3.42 (m, 2H), 2.77-2.68 (m, 1H), 2.48-2.36 (m, 1H), 2.31-2.14 (m, 1H), 2.04-1.87 (m, 1H), 1.54-1.45 (m, 1H), 1.16-1.09 (m, 6H).
Пример 25: 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
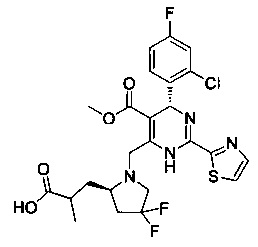
[00227] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 mmo), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,44 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,23 г, 41%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 556.7 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 9.54 (s, 1Н), 7.99 (d, 1Н), 7.91 (d, 1Н), 7.43-7.35 (m, 2Н), 7.17 (td, 1Н), 6.02 (s, 1H), 4.47 (d, 1Н), 4.21 (t, 1Н), 3.92 (br, 1Н), 3.52 (s, 3Н), 3.50-3.40 (m, 2Н), 2.81-2.71 (m, 1H), 2.49-2.37 (m, 1Н), 2.33-2.17 (m, 1Н), 2.03-1.85 (m, 1Н), 1.58-1.46 (m, 1H), 1.12 (d, 3Н).
Пример 26: 3-(R)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
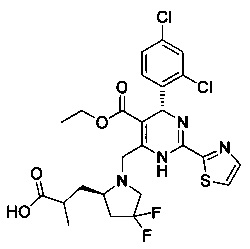
[00228] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 mmo), (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,48 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,31 г, 53%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 587.2 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 9.50 (s, 1Н), 8.01 (d, 1H), 7.93 (d, 1H), 7.60 (br, 1H), 7.40 (br, 2H), 6.03 (s, 1H), 4.17-4.01 (m, 3H), 3.97 (q, 2H), 3.20-2.95 (m, 2H), 2.65-2.59 (m, 1H), 2.39-2.29 (m, 1H), 2.08-2.02 (m, 1H), 1.75-1.60 (m, 1H), 1.55-1.45 (m, 1H), 1.10-0.95 (m, 6H).
Пример 27: 3-(R)-1-(((R)-6-(2,4-дихлорофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
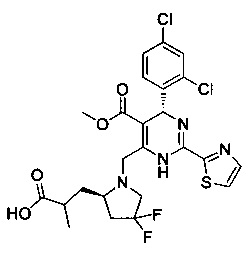
[00229] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,46 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,25 г, 44%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 572.6 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 9.55 (s, 1Н), 8.00 (d, 1H), 7.92 (d, 1H), 7.58 (br, 1H), 7.38 (br, 2H), 6.02 (s, 1H), 4.15-4.05 (m, 3H), 3.52 (s, 3H), 3.21-2.98 (m, 2H), 2.63-2.58 (m, 1H), 2.37-2.29 (m, 1H), 2.09-2.02 (m, 1H), 1.77-1.62 (m, 1H), 1.56-1.46 (m, 1H), 1.13 (d, 3H).
Пример 28: 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
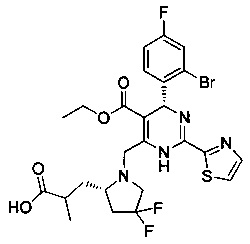
Шаг 1) (R)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилат
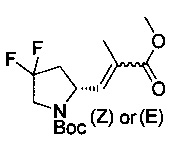
[00230] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 1 с использованием (R)-терт-бутил 4,4-дифторо-2-формилпирролидон-1-карбоксилата (2,6 г, 11,06 ммоль), DCM (120 мл) и метил 2-(трифенилфосфоранилдиен) пропаноата (4,24 г, 12,17 ммоль) для получения титульного соединения в виде желтого масла (1,9 г, 56%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 206.1 [М+Н-100]+.
Шаг 2) (2S)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопропил)пирролидин-1-карбоксилат
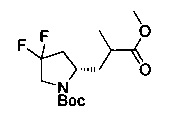
[00231] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 2 с использованием (R)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилата (1,6 г, 5,24 ммоль), метанола (10 мл) и Pd/C (10%, 0,2 г) для получения титульного соединения в виде бесцветного масла (1,38 г, 85,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 252.2 [М+Н-56]+.
Шаг 3) 3-(S)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
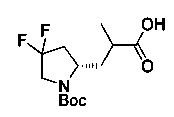
[00232] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (2S)-терт-бутил 4,4-дифторо-2-(3-метокси-2-метил-3-оксопропил)пирролидин-1-карбоксилата (1,4 г, 4,55 ммоль), этанола (50 мл) и водного раствора LiOH.H2O (LiOH.H2O (1,9 г, 45,3 ммоль) в 50 мл воды) для получения титульного соединения в виде светло-желтого масла (1,2 г, 90%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н-100]+.
Шаг 4) 3-(S)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорид
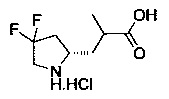
[00233] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 с использованием 3-(S)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты (1,1 г, 3,75 ммоль) и HCl в EtOAc (4 моль/л, 10 мл) для получения титульного соединения в виде светло-коричневой вязкой фазы (0,71 г, 83%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.2 [М+Н]+.
Шаг 5) 3-(S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
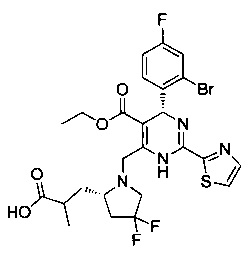
[00234] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,86 г, 3,75 ммоль), ((R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (2,07 г, 4,12 ммоль), карбоната калия (1,54 г, 11,19 ммоль) и безводного этилового спирта (40 мл) для получения титульного соединения в виде желтой твердой фазы (1,36 г, 59%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 615.1 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 8.04 (d, 1H), 7.96 (d, 1H), 7.60 (dd, 1H), 7.51 (dd, 1H), 7.20 (td, 1H), 6.02 (s, 1H), 4.48 (d, 1H), 4.20 (t, 1H), 3.98 (q, 2H), 3.88 (br, 1H), 3.56-3.43 (m, 2H), 2.82-2.71 (m, 1H), 2.48-2.37 (m, 1H), 2.31-2.13 (m, 1H), 2.05-1.88 (m, 1H), 1.57-1.46 (m, 1H), 1.13-1.09 (m, 6H).
Пример 29: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
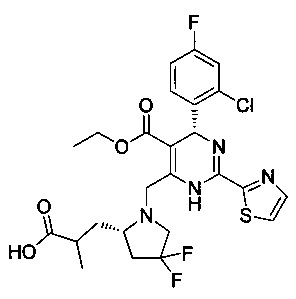
[00235] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,2 г, 0,87 ммоль), (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,4 г, 0,87 ммоль), карбоната калия (0,24 г, 1,74 ммоль) и безводного этилового спирта (8 мл) для получения титульного соединения в виде желтой твердой фазы (0,23 г, 47%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 571.1 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 8.03 (d, 1H), 7.94 (d, 1H), 7.46-7.39 (m, 2H), 7.19 (td, 1H), 6.02 (s, 1H), 4.51 (d, 1H), 4.18 (t, 1H), 4.01 (q, 2H), 3.92 (br, 1H), 3.54-3.41 (m, 2H), 2.79-2.69 (m, 1H), 2.48-2.36 (m, 1H), 2.33-2.15 (m, 1H), 2.07-1.85 (m, 1H), 1.56-1.45 (m, 1H), 1.18-1.09 (m, 6H).
Пример 30: 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
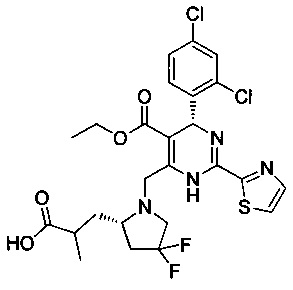
[00236] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,48 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,33 г, 57%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 586.7 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 8.03 (d, 1Н), 7.94 (d, 1H), 7.61 (br, 1H), 7.39 (br, 2H), 6.01 (s, 1H), 4.18-4.03 (m, 3H), 3.98 (q, 2H), 3.22-2.96 (m, 2H), 2.68-2.59 (m, 1H), 2.39-2.27 (m, 1H), 2.06-2.02 (m, 1H), 1.79-1.60 (m, 1H), 1.58-1.45 (m, 1H), 1.13-0.97 (m, 6H).
Пример 31: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)-2-метилпропановая кислота
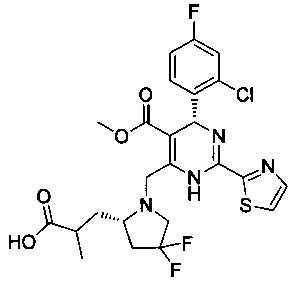
[00237] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил)-2-метилпропановой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,44 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (9 мл) для получения титульного соединения в виде желтой твердой фазы (0,21 г, 37%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 556.7 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 8.01 (d, 1Н), 7.92 (d, 1H), 7.45-7.38 (m, 2H), 7.18 (td, 1H), 6.01 (s, 1H), 4.48 (d, 1H), 4.20 (t, 1H), 3.94 (br, 1H), 3.53 (s, 3H), 3.49-3.41 (m, 2H), 2.82-2.71 (m, 1H), 2.47-2.37 (m, 1H), 2.35-2.18 (m, 1H), 2.05-1.87 (m, 1H), 1.58-1.45 (m, 1H), 1.11 (d, 3H).
Пример 32: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
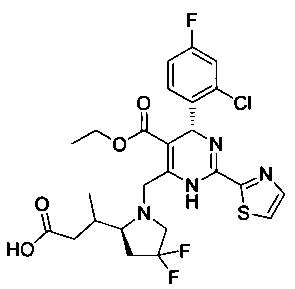
[00238] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил), бутеновой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-этил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,46 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,12 г, 21%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 571.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 7.98 (d, 1H), 7.91 (d, 1H), 7.53-7.38 (m, 2H), 7.20 (td, 1H), 6.01 (s, 1H), 4.22-4.12 (m, 2H), 3.99 (q, 2H), 3.77-3.66 (m, 1H), 3.15-3.05 (m, 2H), 2.69 (d, 1H), 2.35-2.25 (m, 2H), 2.10-2.06 (m, 1H), 2.01-1.96 (m, 1H), 1.07 (t, 3H),0.91 (d, 3H).
Пример 33: 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
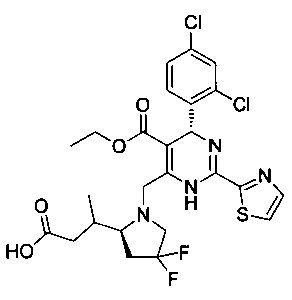
[00239] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил), бутеновой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,48 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,15 г, 25%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.:587.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 11.93 (s, 1Н), 9.51 (s, 1H), 8.00 (d, 1H), 7.92 (d, 1H), 7.58 (br, 1H), 7.41 (br, 2H), 6.02 (s, 1H), 4.21-4.13 (m, 2H), 3.98 (q, 2H), 3.77-3.65 (m, 1H), 3.15-3.04 (m, 2H), 2.68 (d, 1H), 2.36-2.27 (m, 2H), 2.13-2.07 (m, 1H), 2.01-1.95 (m, 1H), 1.07 (t, 3H), 0.91 (d, 3H).
Пример 34: 3-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
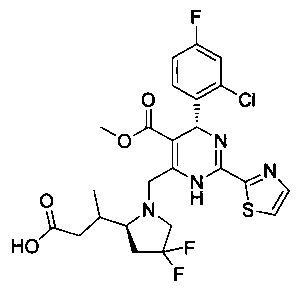
[00240] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(S)-4,4-дифторопирролидин-2-ил), бутеновой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,44 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,1 г, 18%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 557.1 [М+Н]+; и
1H NMR (600 МГц, DMSO-d6): δ 8.02 (d, 2Н), 7.96 (d, 1Н), 7.55-7.39 (m, 2H), 7.21 (td, 1H), 5.99 (s, 1H), 4.22-4.12 (m, 2H), 3.74-3.66 (m, 1H), 3.51 (s, 3H), 3.18-3.07 (m, 2H), 2.67 (d, 1H), 2.33-2.25 (m, 2H), 2.12-2.08 (m, 1H), 2.01-1.94 (m, 1H),0.91 (d, 3H).
Пример 35: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
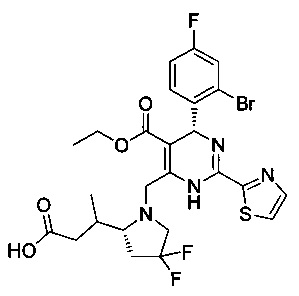
Шаг 1) (2R)-терт-бутил 2-(4-этокси-4-оксобутан-2-ил)-4,4-дифторопирролидин-1-карбоксилат
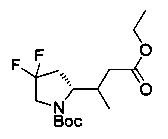
[00241] Титульное соединение было подготовлено процедурой, описанной в Примере шага 19 с использованием CuI (0,96 г, 5,05 ммоль), безводного THF (100 мл), раствора MeLi в THF (1,6 моль/л, 6,3 мл) и (R)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилата (0,8 г, 2,62 ммоль) в THF (8 мл) для получения титульного соединения в виде светло-желтого масла (0,45 г, 54%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 222.1 [М+Н-100]+.
Шаг 2) 3-(R)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
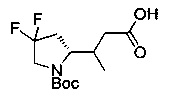
[00242] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (2R)-терт-бутил 2-(4-этокси-4-оксобутан-2-ил)-4,4-дифторопирролидин-1-карбоксилата (0,5 г, 1,55 ммоль), этанола (10 мл) и водного раствора LiOH.H2O (LiOH.H2O (0,65 г) в 10 мл воды) для получения титульного соединения в виде светло-желтого масла (0,38 г, 84%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.2 [М+Н-100]+.
Шаг 3) 3-(R)-4,4-дифторопирролидин-2-ил)бутеновой кислоты гидрохлорид
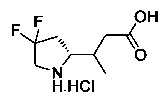
[00243] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 использования 3-(R)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил), бутеновая кислота (0,35 г, 1,2 ммоль) и HCl в EtOAc (4 моль/л, 2,5 мл) для получения титульного соединения в виде светло-коричневой вязкой фазы (0,23 г, 82%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н]+.
Шаг 4) 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
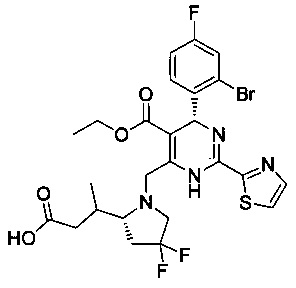
[00244] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)бутеновой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,5 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,14 г, 22%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 614.7 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 8.03 (d, 1H), 7.92 (d, 1Н), 7.60 (dd, 1Н), 7.41 (dd, 1Н), 7.22 (td, 1Н), 6.02 (s, 1Н), 4.18-4.10 (m, 2Н), 3.98 (q, 2Н), 3.74-3.63 (m, 1H), 3.15-3.01 (m, 2Н), 2.69 (d, 1H), 2.35-2.25 (m, 2Н), 2.12-2.06 (m, 1H), 2.03-1.92 (m, 1Н), 1.08 (t, 3Н), 0.87 (d, 3Н).
Пример 36: 3-(R)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)бутеновая кислота
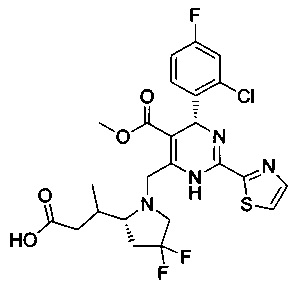
[00245] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(R)-4,4-дифторопирролидин-2-ил)бутеновой кислоты гидрохлорида (0,23 г, 1 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,44 г, 1 ммоль), карбоната калия (0,14 г, 1 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (0,1 г, 18%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 557.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 8.01 (d, 2Н), 7.94 (d, 1Н), 7.56-7.38 (m, 2H), 7.18 (td, 1H), 6.03 (s, 1H), 4.19-4.11 (m, 2H), 3.75-3.67 (m, 1H), 3.50 (s, 3H), 3.15-3.04 (m, 2H), 2.66 (d, 1H), 2.35-2.25 (m, 2H), 2.12-2.08 (m, 1H), 2.04-1.96 (m, 1H), 0.92 (d, 3H).
Пример 37: 5-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)валериановая кислота
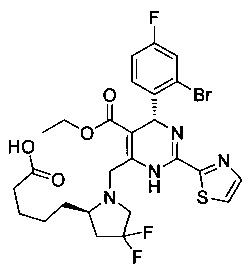
Шаг 1) (R)-терт-бутил 4,4-дифторо-2-(3-гидроксипропил)пирролидин-1-карбоксилат
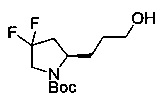
[00246] К смеси (R)-терт-бутил 2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилата (1,0 г, 3,25 ммоль) и безводного THF (150 мл) добавили LiAlH4 (0,14 г, 3,58 ммоль) при 0°С. После дополнения реакционную смесь размешивали в течение 30 минут. После того, как реакция была закончена, к смеси был добавлен насыщенный водный раствор NaHSO4 (20 мл). Полученная смесь была отфильтрована, и фильтрат был экстрагирован EtOAc (100 мл×2). Объединенные органические фазы были высушены над безводной Na2SO4 и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (PE/EtOAc (ОБ. %) = 3/1) для получения титульного соединения в виде светло-желтого масла (0,86 г, 99,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 210.2 [М+Н-56]+.
Шаг 2) (R)-терт-бутил 4,4-дифторо-2-(3-оксопропил)пирролидин-1-карбоксилат
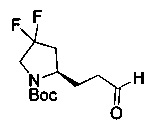
[00247] Титульное соединение было подготовлено процедурой, описанной в шаге 5 Примера 1 с использованием (R)-терт-бутил 4,4-дифторо-2-(3-гидроксипропил)пирролидин-1-карбоксилата (3 г, 11,3 ммоль), Десс-Мартин периодинана (5,75 г, 13,56 ммоль) и DCM (60 мл) в качестве исходных материалов для получения титульного соединения в виде желтого масла (2.32 г, 78%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н-56]+.
Шаг 3) (R)-терт-бутил 2-(5-этокси-5-оксопент-3-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилат
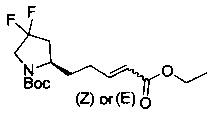
[00248] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 1 с использованием (R)-терт-бутил 4,4-дифторо-2-(3-оксопропил)пирролидин-1-карбоксилата (2,98 г, 11,3 ммоль), этил(трифенилфосфоранилдиен)ацетата (3,94 г, 11,3 ммоль) и DCM (60 мл) для получения титульного соединения в виде бесцветного масла (2,64 г, 70%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 234.1 [М+Н-100]+.
Шаг 4) (R)-терт-бутил 2-(5-этокси-5-оксопентил)-4,4-дифторопирролидин-1-карбоксилат
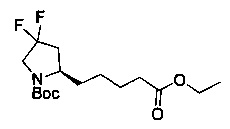
[00249] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 2 с использованием (R)-терт-бутил 2-(5-этокси-5-оксопент-3-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилата (2,64 г, 7,92 ммоль), Pd/C (10%, 0,5 г) и этанол (60 мл) в качестве исходных материалов для получения титульного соединения в виде бесцветного масла (2,4 г, 90%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 236.3 [М+Н-100]+.
Шаг 5) (R)-5-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)валериановая кислота
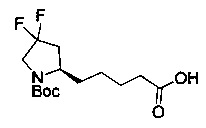
[00250] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (R)-терт-бутил 2-(5-этокси-5-оксопентил)-4,4-дифторопирролидин-1-карбоксилата (2,4 г, 7,2 ммоль), этанола (24 мл) и раствора LiOH.H2O (3,02 г, 72 ммоль) в воде (24 мл) в качестве исходных материалов для получения титульного соединения в виде светлого бесцветного масла (2,08 г, 94%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н-100]+.
Шаг 6) (R)-5-(4,4 дифторопирролидин-2-ил)валериановой кислоты гидрохлорид
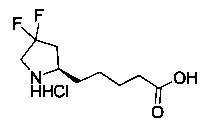
[00251] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 с использованием (R)-5-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)валериановой кислоты (2,08 г, 6,77 ммоль) и HCl в EtOAc (4 моль/л, 20 мл) для получения титульного соединения в виде белой твердой фазы (1,44 г, 87%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н]+.
Шаг 7) 5-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)валериановая кислота
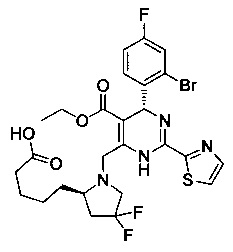
[00252] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-5-(4,4 дифторопирролидин-2-ил)валериановой кислоты гидрохлорида (0,56 г, 2,17 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (1,2 г, 2,39 ммоль) и K2CO3 (0,6 г, 4,34 ммоль) и безводного этанола (12 мл) для получения титульного соединения в виде желтой твердой фазы (0,53 г, 39%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 629.0 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.21 (s, 1H), 9.51 (s, 1H), 8.01 (d, 1H), 7.94 (d, 1H), 7.57 (dd, 1H), 7.41 (dd, 1H), 7.24 (td, 1H), 6.02 (s, 1H), 4.19-4.04 (m, 2H), 3.96 (q, 2H), 3.59-3.48 (m, 1H), 3.03-2.91 (m, 2H), 2.61-2.52 (m, 1H), 2.13-2.05 (m, 2H), 2.03-1.96 (m, 1H), 1.70-1.60 (m, 1H), 1.50-1.40 (m, 2H), 1.33-1.25 (m, 3H), 1.06 (t, 3H).
Пример 38: 5-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)валериановая кислота
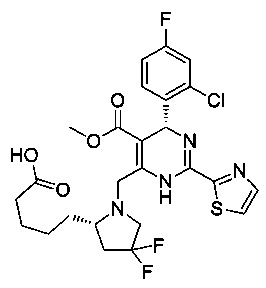
Шаг 1) (S)-терт-бутил 4,4-дифторо-2-(3-гидроксипропил)пирролидин-1-карбоксилат
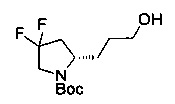
[00253] Титульное соединение было подготовлено процедурой, описанной в шаге 37 Примера 1 с использованием (S)-терт-бутил 2-(3-этокси-3-оксопропил)-4,4-дифторопирролидин-1-карбоксилата (3 г, 9,8 ммоль), безводного THF (80 мл) и LiAlH4 (0,41 г, 10,74 ммоль) для получения титульного соединения в виде бесцветного масла (2,37 г, 91%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 210.1 [М+Н-56]+.
Шаг 2) (S)-терт-бутил 4,4-дифторо-2-(3-оксопропил)пирролидин-1-карбоксилат
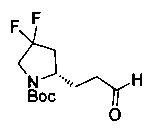
[00254] Титульное соединение было подготовлено процедурой, описанной в шаге 5 Примера 1 с использованием (S)-терт-бутил 4,4-дифторо-2-(3-гидроксипропил)пирролидин-1-карбоксилата (2,3 г, 8,7 ммоль), Десс-Мартин периодинана (4,4 г, 10,4 ммоль) и DCM (45 мл) в качестве исходных материалов для получения титульного соединения в виде бесцветного масла (1,58 г, 69%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н-56]+.
Шаг 3) (S)-терт-бутил 2-(5 этокси 5 оксопент-3-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилат
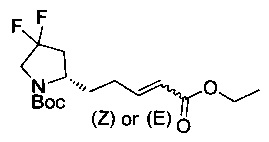
[00255] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 1 с использованием (S)-терт-бутил 4,4-дифторо-2-(3-оксопропил)пирролидин-1-карбоксилата (1,5 г, 5,7 ммоль), этил (трифенилфосфоранилдиен) ацетата (1,99 г, 5,7 ммоль) и DCM (30 мл) для получения титульного соединения в виде бесцветного масла (1,24 г, 65%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 234.1 [М+Н-100]+.
Шаг 4) (S)-терт-бутил 2-(5-этокси-5-оксопентил)-4,4-дифторопирролидин-1-карбоксилат
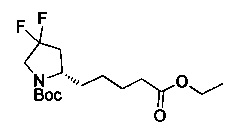
[00256] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 2 с использованием (S)-терт-бутил 2-(5-этокси-5-оксопент-3-ен-1-ил)-4,4-дифторопирролидин-1-карбоксилата (1,2 г, 3,6 ммоль), Pd/C (10%, 0,5 г) и этанола (24 мл) в качестве исходных материалов для получения титульного соединения в виде бесцветного масла (1,1 г, 93%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 236.3 [М+Н-100]+.
Шаг 5) (S)-5-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-ил)валериановая кислота
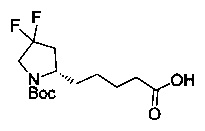
[00257] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 3 с использованием (S)-терт-бутил 2-(5-этокси-5-оксопентил)-4,4-дифторопирролидин-1-карбоксилата (1 г, 3 ммоль), этанола (20 мл) и раствора LiOH.H2O (1,26 г, 30 ммоль) в воде (25 мл) для получения титульного соединения в виде бесцветного масла (0,83 г, 90%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н-100]+.
Шаг 6) (S)-5-(4,4 дифторопирролидин-2-ил)валериановой кислоты гидрохлорид
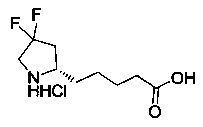
[00258] Титульное соединение было подготовлено процедурой, описанной в шаге 6 Примера 4 с использованием (S)-5-(1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2- ил) валериановой кислоты (0,8 г, 2,6 ммоль) и HCl в EtOAc (4 моль/л, 4 мл) для получения титульного соединения в виде светло-желтой вязкой фазы (0,54 г, 86%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 208.1 [М+Н]+.
Шаг 7) 5-(S)-1-(((R)-6-(2-хлоро-4-фторофенил)-5-(метоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4,4-дифторопирролидин-2-ил)валериановая кислота
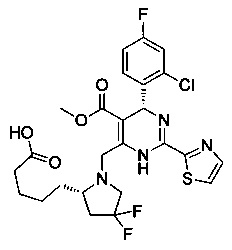
[00259] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-5-(4,4 дифторопирролидин-2-ил)валериановой кислоты гидрохлорида (0,5 г, 2,1 ммоль), (R)-метил 6-(бромометил)-4-(2-хлоро-4-фторофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,93 г, 2,1 ммоль) и карбоната калия (0,29 г, 2,1 ммоль) и этанола (20 мл) для получения титульного соединения в виде желтой твердой фазы (0,5 г, 42%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.:571.0 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 8.03 (d, 1H), 7.96 (d, 1Н), 7.51-7.40 (m, 2H), 7.19 (td, 1H), 5.99 (s, 1H), 4.16-4.04 (m, 2H), 3.61-3.53 (m, 1H), 3.49 (s, 3H), 3.05-2.93 (m, 2H), 2.62-2.52 (m, 1H), 2.14-2.05 (m, 2H), 2.03-1.94 (m, 1H), 1.72-1.60 (m, 1H), 1.52-1.41 (m, 2H), 1.35-1.25 (m, 3H).
Пример 39: 3-(1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4-фторо-3,3-диметилпирролидин-2-ил)пропановая кислота
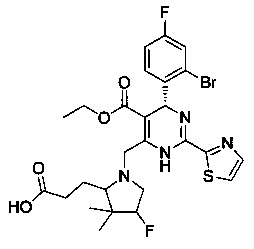
Шаг 1) 3-метилбут-2-ен-1-ил 2-(терт-бутоксикарбонил)амино)ацетат
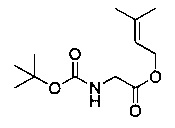
[00260] К смеси 3-метилбут-2-ен-1-ола (10 г, 116,1 ммоль), 2-(терт-бутоксикарбонил) амино), уксусной кислоты (24,2 г, 138,1 ммоль), DMAP (2,83 г, 23,2 ммоль) и DCM (400 мл) добавили раствор DCC (35,9 г, 174,1 ммоль) в DCM (200 мл) при -5°С. После дополнения реакцию размешивали при 25°С в течение 8 часов. После того, как реакция была закончена, смесь была отфильтрована и сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об.%) = 3/1) для получения титульного соединения в виде бесцветного масла (28 г, 99,15%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (400 МГц, CDCl3): δ 5.35 (t, 1Н), 5.04 (s, 1Н), 4.66 (d, 2Н), 3.92 (d, 2Н), 1.75 (d, 6Н), 1.46 (s, 9Н).
Шаг 2) 2-(терт-бутоксикарбонил)амино)-3,3-Диметилпент-4-еновая кислота
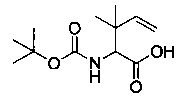
[00261] К смеси 3-метилбут-2-ен-1-ил 2-(терт-бутоксикарбонил)амино) ацетата (8,0 г, 32,8 ммоль), хлорида цинка (5,35 г, 39,3 ммоль) и безводного THF (200 мл) добавили раствор LDA в THF (2 моль/л, 41 мл, 82,0 ммоль) при -75°С. После дополнения реакцию размешивали при -75°С в течение 2 часов и затем при 25°С в течение 12 часов. После того, как реакция была закончена, смесь была подавлена насыщенным водным раствором хлорида аммония (100 мл), затем добавили насыщенный солевой раствор (100 мл). Смесь была экстрагирована EtOAc (100 мл×3). Объединенные органические фазы промыли насыщенным солевым раствором (100 мл×2) и сконцентрировали в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 1/1) для получения титульного соединения в виде бесцветного масла (6,0 г, 75%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 188.2 [М+Н-56]+.
Шаг 3) трет-бутил (5-(йодометил)-4,4-диметил-2-охотетрагидрофуран-3-ил)карбамат
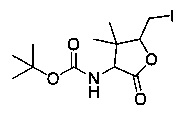
[00262] К смеси 2-(терт-бутоксикарбонил)амино)-3,3-диметилпент-4-еновой кислоты (6,0 г, 24,6 моль), безводного THF (120 мл) и воды (40 мл) добавили раствор йода (18,7 г, 73,8 ммоль) в THF (80 мл) при -5°С. После дополнения реакцию размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь была подавлена насыщенным водным раствором NaHCO3 (60 мл). Полученную смесь размешивали в течение 30 минут, и затем влили избыточный водный раствор №28203 (10%, 60 мл). Смесь была экстрагирована EtOAc (150 мл×3). Объединенные органические фазы были сконцентрированы в вакууме для получения титульного соединения в виде коричневого масла (8 г, 88%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (400 МГц, CDCl3): δ 4.87 (br, 1Н), 4.54-4.39 (m, 2Н), 3.34-3.14 (m, 2Н), 1.48 (s, 9Н), 1.33 (s, 3Н), 0.86 (s, 3Н).
Шаг 4) 3-амино-5-(йодометил)-4,4-диметилдигидрофуран-2(3Н)-он трифторуксусная кислота
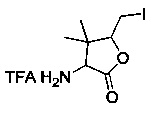
[00263] Смесь трет-бутила (5-(йодометил)-4,4-диметил-2-охотетрагидрофуран-3-ил) карбамата (4,0 г, 10,8 ммоль), DCM (40 мл) и трифторуксусной кислоты (12,3 г, 108 ммоль) размешивали при 40°С в течение 3 часов. После того, как реакция была закончена, смесь была сконцентрирована в вакууме для получения сырого продукта, использованного непосредственно для следующего шага.
Шаг 5) 1-(терт-бутоксикарбонил)-4-гидрокси-3,3-диметилпирролидин-2-карбоксиловая кислота
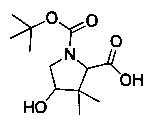
[00264] Смесь 3-амино-5-(йодометил)-4,4-диметилдигидрофуран-2(3Н)-он трифторуксусной кислоты (4,14 г, 10,8 ммоль) и THF (40 мл) довели до рН фактору 9 водным раствором гидроксида калия (0,5 моль/л). Полученную смесь размешивали при 25°С в течение 4 часов. Далее к смеси добавили ди-трет-бутиловый бикарбонат (2,35 г, 10,8 ммоль) и водный раствор гидроксида натрия (1 моль/л, 10,8 мл). Смесь размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, смесь довели до рН фактора 4 1 моль/л соляной кислотой, и затем сконцентрировали в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/MeOH (об. %) = 10/1) для получения титульного соединения в виде бесцветной твердой фазы (2,5 г, 89,3%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 204.1 [М+Н-56]+.
Шаг 6) 1-терт-бутил 2-метил 4 гидрокси-3,3-диметилпирролидон-1,2-дикарбоксилат
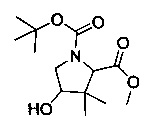
[00265] К смеси 1-(терт-бутоксикарбонил)-4-гидрокси-3,3-диметилпирролидин-2-карбоксиловой кислоты (4,0 г, 15,4 ммоль), цезиевого карбоната (15,0 г, 46,2 ммоль) и DMF (150 мл) добавили метилйодид (4,37 г, 30,8 ммоль) по капле при 25°С. Реакционную смесь размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, смесь погасили водой. Смесь была экстрагирована EtOAc (150 мл×3). Объединенные органические фазы промыли насыщенным солевым раствором (100 мл×3) и сконцентрировали в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (PE/EtOAc (об.%) = 5/1) для получения титульного соединения в виде бесцветного масла (3,5 г, 83,1%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 174.1 [М+Н-100]+.
Шаг 7) 1-терт-бутил 2-метил 4-фторо-3,3-диметилпирролидин-1,2-дикарбоксилат
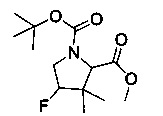
[00266] К смеси 1-терт-бутил 2-метил 4-гидрокси-3,3-диметилпирролидон-1,2-дикарбоксилата (0,64 г, 2,34 ммоль) и DCM (100 мл) добавили DAST (1,13 г, 7,02 ммоль) при 25°С. После дополнения реакционную смесь размешивали при 50°С в течение 12 часов. После того, как реакция была закончена, смесь погасили насыщенным водным раствором NaHCO3 (50 мл). Смесь была экстрагирована DCM (60 мл×3). Объединенные органические фазы были сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об.%) = 5/1) для получения титульного соединения в виде светло-желтого масла (0,51 г, 80%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 176.1 [М+Н-100]+.
Шаг 8) 1-(терт-бутоксикарбонил)-4-фторо-2-(гидроксиметил)-3,3-диметилпирролидин
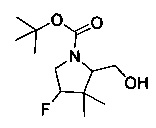
[00267] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 37 с использованием 1 трет-бутил 2-метил 4-фторо-3,3-диметилпирролидин-1,2-дикарбоксилата (0,51 г, 1,85 ммоль), THF (150 мл) и LiAlH4 (77,4 мг, 2,04 ммоль) для получения титульного соединения в виде светло-желтого масла (0,45 г, 98,2%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 192.1 [М+Н-56]+.
Шаг 9) 1-(терт-бутоксикарбонил)-4-фторо-2-формил-3,3-диметилпирролидин
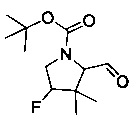
[00268] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 5 с использованием (1-(терт-бутоксикарбонил)-4-фторо-2-(гидроксиметил)-3,3-диметилпирролидина (0,45 г, 1,81 ммоль), DCM (80 мл) и Десс-Мартин периодинана (0,93 г, 2,18 ммоль) для получения титульного соединения в виде светло-желтого масла (0,4 г, 89,6%).
Шаг 10) 1-(терт-бутоксикарбонил)-2-(3-этокси-3-оксопроп-1-ен-1-ил)-4-фторо-3,3-диметилпирролидин
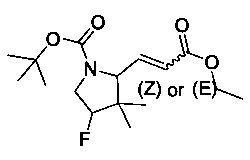
[00269] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 6 с использованием 1-(терт-бутоксикарбонил)-4-фторо-2-формил-3,3-диметилпирролидина (0,4 г, 1,63 ммоль), DCM (80 мл) и этил (трифенилфосфоранилдиен) ацетата (0,68 г, 1,95 ммоль) для получения титульного соединения в виде светло-желтого масла (0,4 г, 77,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 216.3 [М+Н-100]+.
Шаг 11) 1-(терт-бутоксикарбонил)-2-(3-этокси-3-оксопропил)-4-фторо-3,3-диметилпирролидин
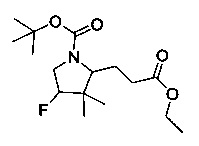
[00270] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 6 с использованием 1-(терт-бутоксикарбонил)-2-(3 этокси 3 оксопроп-1-ен-1-ил)-4-фторо-3,3-диметилпирролидина (0,4 г, 1,27 ммоль), метанола (50 мл) и Pd/C (10%, 0.1 г) для получения титульного соединения в виде бесцветного масла (0,4 г, 99,4%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 262.2 [М+Н-56]+.
Шаг 12) 3-(1-(терт-бутоксикарбонил)-4-фторо-3,3-диметилпирролидин-2-ил)пропановая кислота
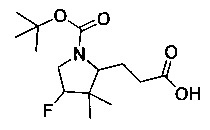
[00271] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 6 с использованием 1-(терт-бутоксикарбонил)-2-(3-этокси-3-оксопропил)-4-фторо-3,3-диметилпирролидина (0,4 г, 1.26 mmol), этанола (10 мл) и водного раствора LiOH.H2O (LiOH.H2O (0,53 г, 12,6 ммоль) в 10 мл воды) для получения титульного соединения в виде светло-желтого масла (0,36 г, 98,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 234.2 [М+Н-56]+.
Шаг 13) 3-(4-фторо-3,3-диметилпирролидин-2-ил)пропановой кислоты гидрохлорид
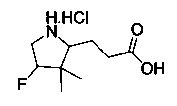
[00272] Титульное соединение было подготовлено процедурой, описанной в шаге 4 Примера 6 с использованием 3-(1-(терт-бутоксикарбонил)-4-фторо-3,3-диметилпирролидин-2-ил)пропановой кислоты (0,36 г, 1,24 ммоль) и раствора HCl в EtOAc (4 моль/л, 2 мл) для получения титульного соединения в виде песчано-бежевой твердой фазы (0,28 г, 99,7%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 189.2 [М+Н]+.
Шаг 14) 3-(1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4-фторо-3,3-диметилпирролидин-2-ил)пропановая кислота
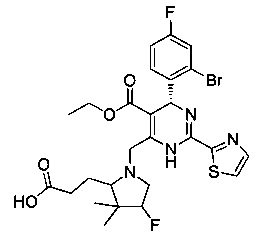
[00273] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием 3-(4-фторо-3,3-диметилпирролидин-2-ил) пропановой кислоты гидрохлорида (0,3 г, 1,33 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,81 г, 1,6 ммоль), карбоната калия (0,55 г, 4 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (53 мг, 6,5%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 611.3 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 12.13 (br, 1Н), 9.72 (s, s, 1H), 8.01-7.90 (m, 2H), 7.59-7.53 (m, 1H), 7.44-7.33 (m, 1H), 7.26-7.15 (m, 1H), 6.06 (s, s, 1H), 4.35-4.18 (m, 1H), 4.15-4.02 (m, 1H), 4.02-3.90 (m, 2H), 3.33-3.25 (m, 1H), 3.18-2.92 (m, 2H), 2.46-2.30 (m, 2H), 2.18-2.01 (m, 1H), 1.84-1.64 (m, 1H), 1.62-1.44 (m, 1H), 1.41-1.31 (m, 3H), 1.07-0.93 (m, 6H).
Пример 40: 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-5,5-дифторопиперидин-2-ил)пропановая кислота
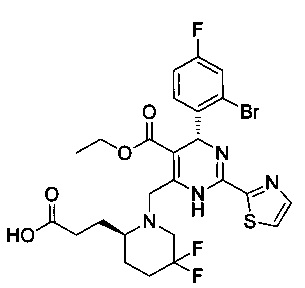
Шаг 1) (S)-этил 2-(терт-бутоксикарбонил)амино)-6-диазо-5-оксогексаноат
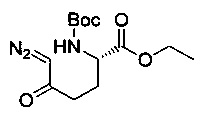
[00274] К смеси раствора (триметилсилила) диазометана в n-гексане (2 моль/л, 10,68 мл) и безводного THF (50 мл) был добавлен раствор n-бутиллития в n-гексане (2,5 моль/л, 9,32 мл, 23,3 ммоль) при -78°С под азотом. Реакционную смесь размешивали при -78°С в течение 30 минут, и затем раствор (S)-1-терт-бутил 2-этил 5-оксопирролидин-1,2-дикарбоксилата (5 г, 19,43 моль) в THF (100 мл) добавили по капле. После дополнения реакционную смесь размешивали при -78°С в течение следующих 45 минут. После того, как реакция была закончена, реакция была подавлена насыщенным водным раствором хлорида аммония (50 мл). Смесь была экстрагирована EtOAc (100 мл×2). Объединенные органические фазы были промыты насыщенным солевым раствором (100 мл×2), высушены над безводной Na2SO4 и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 3/1) для получения титульного соединения в виде светло-желтого масла (3,1 г, 53%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 200.1 [М+Н-100]+.
Шаг 2) (S)-1-терт-бутил 2-этил 5-оксопиперидин-1,2-дикарбоксилат
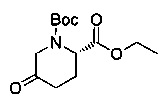
[00275] К смеси (S)-этил 2-(терт-бутоксикарбонил)амино)-6-диазо-5-оксогексаноата (3,1 г, 10,4 ммоль) и DCM (150 мл) добавили родиевый ацетат (30 мг, 0,07 ммоль) при 0°С. После дополнения реакцию размешивали при 0°С в течение 1 часа, и затем при 25°С в течение 12 часов. После того, как реакция была закончена, реакционная смесь была сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (PE/EtOAc (об. %) = 3/1) для получения титульного соединения в виде светло-желтого масла (1,25 г, 46%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 172.1 [М+Н-100]+.
Шаг 3) (S)-1-терт-бутил 2-этил 5,5-дифторопиперидин-1,2-дикарбоксилат
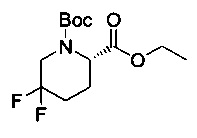
[00276] К смеси (S)--1-терт-бутил 2-этил 5-оксопиперидин-1,2-дикарбоксилата (0,9 г, 3,3 ммоль) и безводного DCM (90 мл) добавили DAST (4,36 мл, 10 ммоль) по капле при 25°С. После дополнения реакцию размешивали при 25°С в течение 12 часов. После того, как реакция была закончена, смесь погасили насыщенным водным раствором бикарбоната натрия (30 мл). Поулченная смесь была экстрагирована DCM (50 мл×2). Органические фазы были высушены над безводной Na2SO4, отфильтрованы и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 4/1) для получения титульного соединения в виде светло-желтого масла (0,75 г, 77%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (600 МГц, DMSO-d6): δ 4.77 (d, 1Н), 4.23-4.12 (m, 2H), 4.11-3.98 (m, 1H), 3.30-3.03 (m, 1H), 2.20-2.08 (m, 2H), 1.96-1.71 (m, 2H), 1.44-1.35 (m, 9H), 1.21 (t, 3H).
Шаг 4) (S)-терт-бутил 5,5-дифторо-2-(гидроксиметил)пиперидин-1-карбоксилат
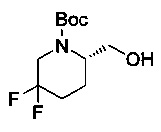
[00277] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 37 с использованием (S)-1-терт-бутил 2-этил 5,5-дифторопиперидин-1,2-дикарбоксилата (0,9 г, 3,1 ммоль), безводного THF (80 мл) и LiAlH4 (0,12 г, 3,1 ммоль) для получения титульного соединения в виде бесцветного масла (0,71 г, 91%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 152.1 [М+Н-100]+.
Шаг 5) (S)-терт-бутил 5,5-дифторо~2-формилпиперидин-1-карбоксилат
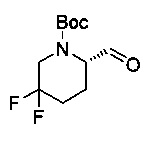
[00278] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 5 с использованием (S)-терт-бутил 5,5-дифторо-2-(гидроксиметил)пиперидин-1-карбоксилата (0,7 г, 2,8 ммоль), DCM (100 мл) и Десс-Мартин периодинана (1,3 г, 3,06 ммоль) для получения титульного соединения в виде светло-желтого масла (0,6 г, 86%).
Шаг 6) (S)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-5,5-дифторопиперидин-1-карбоксилат
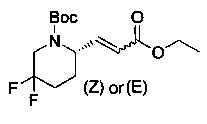
[00279] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 6 с использованием (S)-терт-бутил 5,5-дифторо--2-формилпиперидин-1-карбоксилата (0,7 г, 2,81 ммоль), DCM (30 мл) и этил (трифенилфосфоранилдиен) ацетата (1,1 г, 3,1 ммоль) для получения титульного соединения в виде бесцветного масла (0,7 г, 78,1%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (400 МГц, CDCl3): δ 6.84 (dd, 1Н), 5.89 (dd, 1H), 5.08 (s, 1H), 4.36-4.15 (m, 3H), 3.16-2.93 (m, 1H), 2.37-2.20 (m, 2H), 2.15-2.08 (m, 1H), 1.96-1.87 (m, 1Н), 1.50 (s, 9H), 1.33 (t, 3H).
Шаг 7) (R)-терт-бутил 2-(3-этокси-3-оксопропил)-5,5-дифторопиперидин-1-карбоксилат
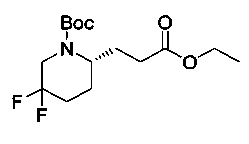
[00280] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 6 с использованием (S)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-5,5-дифторопиперидин-1-карбоксилата (0,7 г, 2,2 ммоль), метанола (40 мл) и Pd/C (10%, 0,1 г) для получения титульного соединения в виде бесцветного масла (0,7 г, 99%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 222.1 [М+Н-100]+.
Шаг 8) (R)-3-(1-(терт-бутоксикарбонил)-5,5-дифторопиперидин-2-ил)пропановая кислота
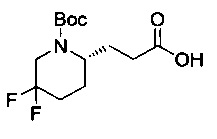
[00281] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 6 с использованием (R)-терт-бутил 2-(3-этокси-3-оксопропил)-5,5-дифторопиперидин-1-карбоксилата (0,7 г, 2,2 ммоль), этанола (50 мл) и водного раствора LiOH.H2O (LiOH.H2O (0,73 г, 17,42 ммоль) в 50 мл воды) для получения титульного соединения в виде бесцветного масла (0,5 г, 78,3%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н-100]+.
Шаг 9) (R)-3-(5,5-дифторопиперидин-2-ил)пропановой кислоты гидрохлорид
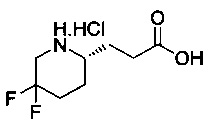
[00282] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 6 с использованием (R)-3-(1-(терт-бутоксикарбонил)-5,5-дифторопиперидин-2-ил)пропановой кислоты (0,5 г, 1,71 ммоль) и раствора HCl в EtOAc (4 моль/л, 5 мл) для получения титульного соединения в виде белого порошка (0,4 г, 100%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н]+.
Шаг 10) 3-(R)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-5,5-дифторопиперидин-2-ил)пропановая кислота
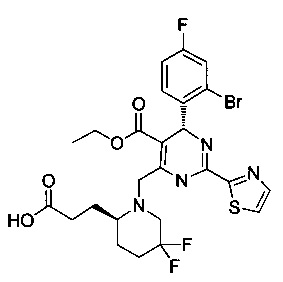
[00283] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (R)-3-(5,5-дифторопиперидин-2-ил)пропановой кислоты гидрохлорида (0,36 г, 1,57 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,86 г, 1,71 ммоль), карбоната калия (0,43 г, 3,1 ммоль) и безводного этилового спирта (30 мл) для получения титульного соединения в виде желтой твердой фазы (0,1 г, 10,5%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 615.2 [М+Н]+; и
1H NMR (400 МГц, DMSO-d6): δ 12.03 (s, 1H), 9.58 (s, 1H), 8.04-7.88 (m, 2H), 7.60-7.51 (m, 1H), 7.45-7.37 (m, 1H), 7.27-7.18 (m, 1H), 6.02 (s, 1H), 4.36 (d, 1H), 4.03-3.91 (m, 3H), 3.21-3.10 (m, 1H), 3.02-2.86 (m, 1H), 2.76-2.62 (m, 1H), 2.30-2.19 (m, 2H), 2.13-2.02 (m, 1H), 1.98-1.81 (m, 3H), 1.68-1.50 (m, 2H), 1.05 (t, 3H).
Пример 41: 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-5,5-дифторопиперидин-2-ил)пропановая кислота
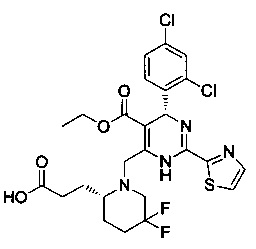
Шаг 1) (R)-этил 2-(терт-бутоксикарбонил)амино)-6-диазо-5-оксогексаноат
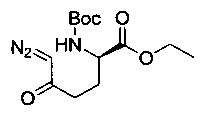
[00284] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 40 с использованием раствора (триметилсилил) диазометана в n-гексане (2 моль/л, 10,68 мл), безводного THF (50 мл), раствора n-бутиллития в n-гексане (2,5 моль/л, 9,32 мл, 23,3 ммоль) и раствора (R)-1-терт-бутил 2-этил 5-оксопирролидин-1,2-дикарбоксилата (5,0 г, 19,43 моль) в THF (100 мл) для получения титульного соединения в виде светло-желтого масла (2,73 г, 47%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 200.2 [М+Н-100]+.
Шаг 2) (R)-1-терт-бутил 2-этил 5-оксопиперидин-1,2-дикарбоксилат
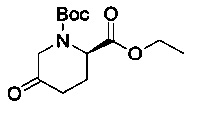
[00285] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 40 с использованием (R)-этил 2-(терт-бутоксикарбонил)амино)-6-диазо-5-оксогексаноата (3,1 г, 10,4 ммоль), DCM (150 мл) и родиевого ацетата (30 мг, 0,07 ммоль) для получения титульного соединения в виде светло-желтого масла (1,41 г, 52%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 172.2 [М+Н-100]+.
Шаг 3) (R)-1-терт-бутил 2-этил 5,5-дифторопиперидин-1,2-дикарбоксилат
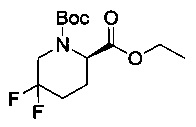
[00286] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 40 с использованием (R)-1-терт-бутил 2-этил 5-оксопиперидин-1,2-дикарбоксилата (0,9 г, 3,3 ммоль), безводного DCM (90 мл) и DAST (4,36 мл, 10 ммоль) для получения титульного соединения в виде бесцветного масла (0,59 г, 61%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.:238.1 [М+Н-56]+.
Шаг 4) (R)-терт-бутил 5,5-дифторо-2-(гидроксиметил)пиперидин-1-карбоксилат
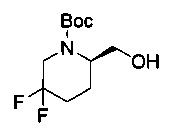
[00287] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 37 с использованием (R)-1-терт-бутил 2-этил 5,5-дифторопиперидин-1,2-дикарбоксилата (0,45 г, 1,55 ммоль), безводного THF (40 мл) и LiAlH4 (60 мг, 1,55 ммоль) для получения титульного соединения в виде бесцветного масла (0,34 г, 88%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 196.1 [М+Н-56]+.
Шаг 5) (R)-терт-бутил 5,5-дифторо--2-формилпиперидин-1-карбоксилат
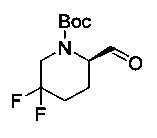
[00288] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 5 с использованием (R)-терт-бутил 5,5-дифторо-2-(гидроксиметил)пиперидин-1-карбоксилата (0,35 г, 1,4 ммоль), DCM (50 мл) и Десс-Мартин периодинана (0,71 г, 1,68 ммоль) для получения титульного соединения в виде светло-желтого масла (0,26 г, 76%).
Шаг 6) (R)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-5,5-дифторопиперидин-1-карбоксилат
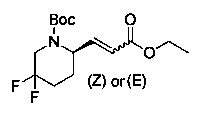
[00289] Титульное соединение было подготовлено процедурой, описанной в шаге 1 Примера 6 с использованием (R)-терт-бутил 5,5-дифторо-2-формилпиперидин-1-карбоксилата (0,27 г, 1,1 ммоль), DCM (30 мл) и этил (трифенилфосфоранилдиен) ацетата (0,38 г, 1,1 ммоль) для получения титульного соединения в виде бесцветного масла (0,31 г, 88%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 220.2 [М+Н-100]+.
Шаг 7) (S)-терт-бутил 2-(3-этокси-3-оксопропил)-5,5-дифторопиперидин-1-карбоксилат
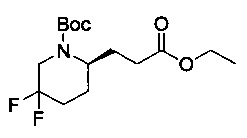
[00290] Титульное соединение было подготовлено процедурой, описанной в шаге 2 Примера 6 с использованием (R)-терт-бутил 2-(3-этокси-3-оксопроп-1-ен-1-ил)-5,5-дифторопиперидин-1-карбоксилата (0,31 г, 1 ммоль), метанола (10 мл) и Pd/C (10%, 0,1 г) для получения титульного соединения в виде бесцветного масла (0,31 г, 95%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.:266.2 [М+Н-56]+.
Шаг 8) (S)-3-(1-(терт-бутоксикарбонил)-5,5-дифторопиперидин-2-ил)пропановая кислота
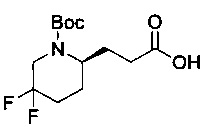
[00291] Титульное соединение было подготовлено процедурой, описанной в шаге 3 Примера 6 с использованием (S)-терт-бутил 2-(3-этокси-3-оксопропил)-5,5-дифторопиперидин-1-карбоксилата (0,31 г, 1 ммоль), этанола (10 мл) и водного раствора LiOH.H2O (LiOH.H2O (0,42 г, 10 ммоль) в 10 мл воды) для получения титульного соединения в виде окрашенного масла (0,28 г, 94%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н-100]+.
Шаг 9) (S)-3-(5,5-дифторопиперидин-2-ил)пропановой кислоты гидрохлорид
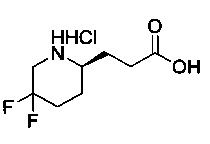
[00292] Титульное соединение было подготовлено процедурой, описанной в шаге 4 Примера 6 с использованием (S)-3-(1-(терт-бутоксикарбонил)-5,5-дифторопиперидин-2-ил)пропановой кислоты (0,28 г, 1 ммоль) и раствора HCl в EtOAc (4 моль/л, 3 мл) для получения титульного соединения в виде белого порошка (0,18 г, 78%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 194.1 [М+Н]+.
Шаг 10) 3-(S)-1-(((R)-6-(2,4-дихлорофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-5,5-дифторопиперидин-2-ил)пропановая кислота
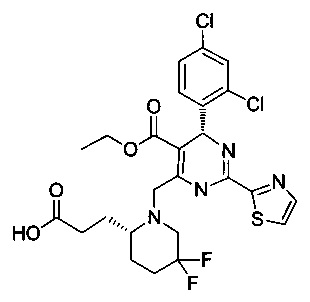
[00293] Титульное соединение было подготовлено процедурой, описанной в Примере 2 с использованием (S)-3-(5,5-дифторопиперидин-2-ил)пропановой кислоты гидрохлорида (0,21 г, 0,56 ммоль), (R)-этил 6-(бромометил)-4-(2,4-дихлорофенил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,37 г, 0,78 ммоль), карбоната калия (0,22 г, 1,56 ммоль) и безводного этилового спирта (10 мл) для получения титульного соединения в виде желтой твердой фазы (69 мг, 15%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 587.1 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 8.01 (d, 1H), 7.94 (d, 1H), 7.56 (br, 1H), 7.40 (br, 2H), 6.01 (s, 1H), 4.34 (d, 1H), 4.01-3.91 (m, 3H), 3.22-3.10 (m, 1H), 3.05-2.87 (m, 1H), 2.74-2.62 (m, 1H), 2.29-2.18 (m, 2H), 2.11-2.02 (m, 1H), 1.99-1.81 (m, 3H), 1.68-1.52 (m, 2H), 1.06 (t, 3H).
Пример 42: (R)-этил 4-(2-бромо-4-фторофенил)-6-(((S)-2-карбамоил-4,4-дифторопирролидин-1-ил)метил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
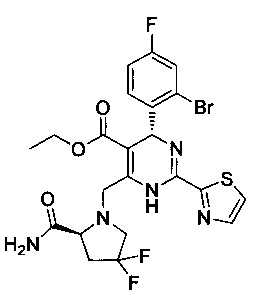
Шаг 1) (S)-терт-бутил 2-карбамоил-4,4-дифторопирролидин-1-карбоксилат
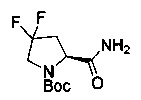
[00294] Смесь раствора NH3-метанола (7 моль/л, 30 мл) и (S)-1-терт-бутил 2-метил 4,4-дифторопирролидин-1,2 дикарбоксилата (3,5 г, 13,2 ммоль) размешивали при 25°С в течение 12 часов в герметичной пробирке. После того, как реакция была закончена, смесь была сконцентрирована в вакууме для получения титульного соединения в виде белой твердой фазы (1,8 г, 54,3%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 195.1 [М+Н-56]+.
Шаг 2) (S)-4,4-дифторопирролидин-2-карбоксамида гидрохлорид
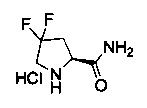
[00295] Смесь (S)-терт-бутил 2 карбамоил 4,4-дифторопирролидин-1-карбоксилата (0,8 г, 3,2 ммоль) и раствора HCl в EtOAc (4 моль/л, 10 мл) размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь отфильтровали для получения титульного соединения в виде белой твердой фазы (0,54 г, 90%). Соединение характеризовалось следующими спектральными данными:
1Н NMR (400 МГц, DMSO-d6): δ 10.25 (s, 1Н), 8.19 (s, 1H), 7.82 (s, 1H), 4.47 (t, 1H), 3.84-3.57 (m, 2H), 3.06-2.83 (m, 1H), 2.61-2.50 (m, 1H).
Шаг 3) (R)-этил 4-(2-бромо-4-фторофенил)-6-(((S)-2-карбамоил-4,4-дифторопирролидин-1-ил)метил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
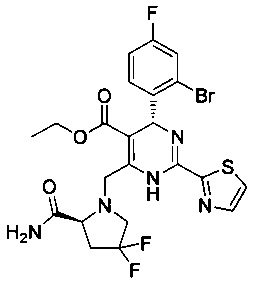
[00296] Смесь (S)-4,4-дифторопирролидин-2-карбоксамида гидрохлорида (0,2 г, 1,1 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,55 г, 1,1 ммоль), карбоната калия (0,3 г, 2,2 ммоль) и этилового спирта (15 мл) размешивали при 25°С в течение 10 часов. После того, как реакция была закончена, смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (об. %) = 25/1) для получения титульного соединения в виде желтого масла (0,2 г, 35%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 572.1 [М+Н]+; и
1Н NMR (600 МГц, DMSO-d6): δ 8.17 (br, 1H), 8.12 (br, 1H), 8.05 (br, 1H), 7.72 (br, 1H), 7.61 (d, 1H), 7.58-7.49 (m, 1H), 7.34-7.24 (m, 1H), 6.04 (s, 1H), 4.49 (d, 2H), 4.26 (d, 2H), 3.65-3.53 (m, 3H), 2.96 (br, 2H), 1.07 (t, 3H).
Пример 43: (S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримидин-4-ил)метил)-4-метиленпирролидин-2-карбоксиловая кислота
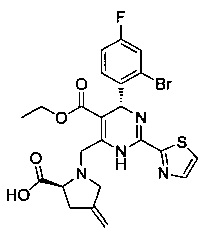
Шаг 1) (S)-1 трет-бутил 2-метил 4-метиленпирролидин-1,2-дикарбоксилат
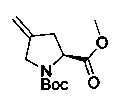
[00297] К суспензии метилтрифенилфосфония бромида калия (5,9 г, 16,4 ммоль) в безводном THF (30 мл) добавили терт-бутоксид калия (1,8 г, 16,4 ммоль) при -10°С. После дополнения смесь размешивали при -10°С в течение 15 минут, и затем размешивали при 25°С в течение 3 часов. Далее смесь была охлаждена до 0°С и медленно добавили раствор (S) 1 трет-бутил 2-метил 4-оксопирролидин-1,2-дикарбоксилата (2 г, 8,2 ммоль) в THF (10 мл). После дополнения полученную смесь размешивали при 25°С в течение 1 часа, охладили до 0°С, и затем нейтрализовали соляной кислотой (2 моль/л). Смесь была экстрагирована EtOAc (50 мл×2). Объединенные органические фазы были высушены над безводноц Na2SO4 и сконцентрированы в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 10/1) для получения титульного соединения в виде желтого масла (0,25 г, 12,6%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 142.2 [М+Н-100]+; и
1Н NMR (400 МГц, CDCl3): δ 5.11-4.92 (m, 2Н), 4.60-4.37 (m, 1Н), 4.16, 4.04 (s, s, 2Н), 3.81, 3.63 (s, s, 3Н), 3.11-2.85 (m, 1Н), 2.78-2.42 (m, 1H), 1.53, 1.44 (s, s, 9Н).
Шаг 2) (S)-1-(терт-бутоксикарбонил)-4-метиленпирролидин-2-карбоксиловая кислота
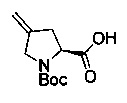
[00298] Смесь (S)-1 трет-бутил 2-метил 4-метиленпирролидин-1,2-дикарбоксилата (0,5 г, 2.1 ммоль), этанола (5 мл) и раствора LiOH.H2O (0,44 г, 10,5 ммоль) в воде (5 мл) размешивали при 25°С в течение 3 часов. После того, как реакция была завершена, смесь была разбавлена водой (40 мл) и экстрагирована EtOAc (50 мл×3). Органические фазы отбросили. Водная фаза была доведена до рН фактора 4-5, затем экстрагирована EtOAc (50 мл×3), и объединенные органические фазы были промыты насыщенным солевым раствором (80 мл), высушены над безводной Na2SO4 и сконцентрированы в вакууме для получения титульного соединения в виде белой твердой фазы (0,2 г, 85%).
MS (ЭРИ, пол.ион) уд.з.: 128.4 [М+Н-100]+; и
1Н NMR (400 МГц, CDCl3): δ 9.08 (br, 1Н), 5.00 (s, 2Н), 4.58-4.46 (m, 1Н), 4.08-3.90 (m, 2Н), 2.99-2.87 (m, 1Н), 2.74-2.60 (m, 1Н), 1.41 (s, 9Н).
Шаг 3) (S)-4-метиленпирролидин-2-карбоксиловой кислоты гидрохлорид
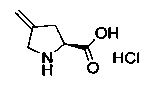
[00299] Смесь (S)-1-(терт-бутоксикарбонил)-4-метиленпирролидин-2-карбоксиловой кислоты (0,45 г, 2 ммоль) и раствора HCl в EtOAc (4 моль/л, 5 мл) размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь отфильтровали для получения титульного соединения в виде белой твердой фазы (0.27 г, 81%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 128.1 [М+Н-100]+.
Шаг 4) (S)-1-(((R)-6-(2-бромо-4-фторофенил)-5-(этоксикарбонил)-2-(тиазол-2-ил)-3,6-дигидропиримвдин-4-ил)метил)-4-метиленпирролидин-2-карбоксиловая кислота
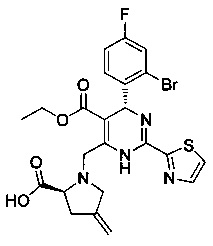
[00300] Смесь (S)-4-метиленпирролидин-2-карбоксиловой кислоты гидрохлорида (0,16 г, 1 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,5 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) размешивали при 25°С в течение 10 часов. После того, как реакция была закончена, смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (об. %) = 25/1) для получения титульного соединения в виде желтого масла (0,31 г, 56,3%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 549.1 [М+Н]+; и
1H-NMR (400 МГц, DMSO-d6): δ 9.72 (s, 1Н), 7.96-7.90 (m, 2H), 7.57-7.55 (m, 1H), 7.44-7.35 (m, 1H), 7.27-7.23 (m, 1H), 6.00 (s, 1H), 4.97 (s, 2H), 4.25 (d, 1H), 4.02 (d, 1H), 3.96-3.92 (m, 2H), 3.84-3.69 (m, 3H), 2.94-2.80 (m, 1H), 2.62-2.56 (m, 1H), 1.07-0.99 (m, 3H).
Пример 44: (R)-этил-4-(2-бромо-4-фторофенил)-6-(((S)-4,4-дифторо-2-(метилкарбамоил)пирролидин-1-ил)метил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
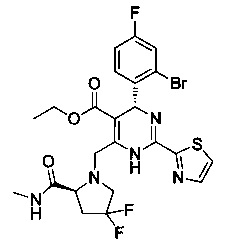
Шаг 1) (S)-терт-бутил 4,4-дифторо-2-(метилкарбомоил)пирролидин-1-карбоксилат
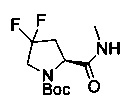
[00301] Смесь (S)-1-(терт-бутоксикарбонил)-4,4-дифторопирролидин-2-карбоксиловой кислоты (0,4 г, 1,6 ммоль), метиламина гидрохлорида (0,26 г, 4 ммоль), EDCI (0,61 г, 3,2 ммоль), НОАТ (0,1 г, 0,7 ммоль) и DCM (15 мл) размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь была сконцентрирована в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (РЕ/EtOAc (об. %) = 10/1) для получения титульного соединения в виде бесцветного масла (0,25 г, 58%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 165.1 [М+Н-100]+.
Шаг 2) (S)-4,4-дифторо-2-(метилкарбамоил)пирролидина гидрохлорид
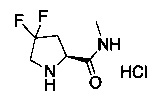
[00302] Смесь (S)-терт-бутил 4,4-дифторо-2-(метилкарбамоил) пирролидин-1-карбоксилата (0,47 г, 1,8 ммоль) и раствора HCl в EtOAc (4 моль/л, 5 мл) размешивали при 25°С в течение 2 часов. После того, как реакция была закончена, смесь была отфильтрована для получения титульного соединения в виде белой твердой фазы (0.27 г, 75%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 165.1 [М+Н]+.
Шаг 3) (R)-этил-4-(2-бромо-4-фторофенил)-6-(((S)-4,4-дифторо-2-(метилкарбамоил)пирролидин-1-ил)метил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилат
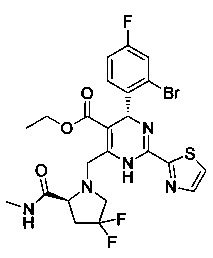
[00303] Смесь (S)-4,4-дифторо-2-(метилкарбамоил) пирролидина гидрохлорида (0,2 г, 1 ммоль), (R)-этил 4-(2-бромо-4-фторофенил)-6-(бромометил)-2-(тиазол-2-ил)-1,4-дигидропиримидин-5-карбоксилата (0,5 г, 1 ммоль), карбоната калия (0,28 г, 2 ммоль) и безводного этилового спирта (10 мл) размешивали при 25°С в течение 10 часов. После того, как реакция была закончена, смесь была отфильтрована, и фильтрат был сконцентрирован в вакууме. Остаток был очищен колоночной хроматографией с силикагелем (DCM/CH3OH (об. %) = 100/1) для получения титульного соединения в виде желтого масла (0,24 г, 41%). Соединение характеризовалось следующими спектральными данными:
MS (ЭРИ, пол.ион) уд.з.: 586.1 [М+Н]+; и
1Н NMR (400 МГц, DMSO-d6): δ 8.17 (s, 1H), 8.02 (d, 2H), 7.57 (d, 1H), 7.43 (d, 1H), 7.26 (s, 1H), 6.00 (s, 1H), 4.18 (d, 2H), 4.07 (s, 1H), 4.03 (d, 1H), 4.00-3.93 (m, 2H), 3.79 (s, 2H), 2.69 (s, 2H), 2.60 (d, 3H), 2.36 (dd, 1H), 1.05 (t, 3H).
Пример 45: Действие анти-ВГВ соединений in-vitro в стабильной клеточной линии, производящей ВГВ (HepG2.2.15)
1. Способ количественного определения
[00304] Содержание ДНК ВГВ в жидкости клеточной культуры было обнаружено способом количественной ПЦР, и были рассчитаны значения 50% эффективной концентрации (ЕС50). Конкретные процедуры были следующими:
[00305] Клетки HepG2.2.15 были засеяны в каждую лунку 96-луночного планшета, 40000 клеток на лунку. Клетки обрабатывали питательной средой клеточной культуры, содержащей соединения в различной концентрации, спустя 24 часа после иннокулирования клетки. Заключительная концентрация каждого соединения составила 16,4 цм в каждой лунке, и каждое соединение было разбавлено до желаемой концентрации с помощью протокола 3-кратного разбавления, 9 точек разбавления в двойном экземпляре. Питательные среды, содержащие составы, обновлялись в день 4 после иннокулирвоания клетки. Питательные среды были собраны с планшетов HepG2.2.15 в день 7 после иннокулирования клетки, с последующим извлечением ДНК ВГВ.
[00306] Извлечение ДНК ВГВ: Извлечение ДНК ВГВ выполнялся с помощью набора для забора крови QIAamp 96 DNA (QIAGEN 51161).
[00307] ПЦР для определения количества: смесь ПЦР была подготовлена согласно системе ПЦР. Смесь ПЦР была распределено по 96-луночному планшету для оптических реакций (специально для определения количества). Был добавлен стандарт, разбавленный пропорционально. Далее был добавлен образец; планшеты были изолированы оптической адгезивной пленкой; система ПНР была выполнена согласно программам.
[00308] Процент ингибирования репликации ДНК ВГВ соединением был вычислен с помощью следующего уравнения:
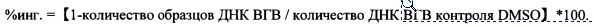
[00309] Расчитанное значение ЕС50 соединений на репликации ВГВ: значения ЕС50 были рассчитаны на основе «логистического уравнения с четырьмя параметрами» и с использованием аналитического программного обеспечения GraphPad Prism 5.
2. Результаты количественного определения
[00310] Анти-ВГВ действие соединений, раскрытых в настоящем документе, в клеточных линиях ВГВ HepG2.2.15, было обнаружено способами, описанными выше. Результаты показаны в Таблице 2:
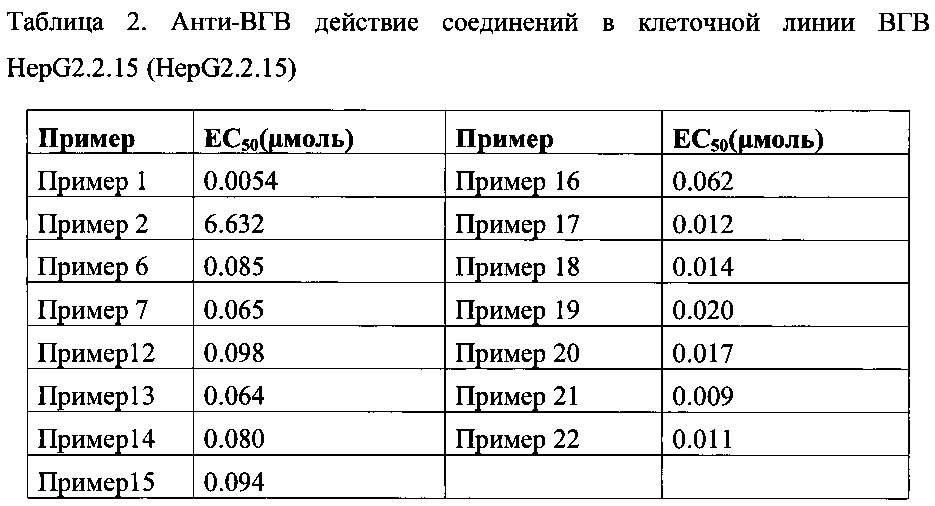
3. Заключения
[00311] Соединения, раскрытые в настоящем документе, продемонстрировали мощное ингибирующее действие на ВГВ. Такие соединения имеют удивительное антивирусное действие и могут применяться в лечении различных видов нарушений, вызванных инфекцией ВГВ
[00312] Пример 46:
Количественное определение исследуемых соединений у мышей ICR
I. Способ количественного определения
[00313] Исследуемые соединения были влиты желудок мышей ICR через рот в объеме 10 мг/кг или 5 мг/кг, или введены в объеме 2 мг/кг мышам ICR внутривенной инъекцией через хвост. Образец крови орбитальной вены был взят спустя 0,083, 0.25, 0.5, 1, 2, 4, 6, 8 и 24 часа после введения, и собран в антикоагуляционной пробирке, в которую добавили EDTA-K2. Исследуемые соединения были экстрагированы из образцов плазмы и хроматографированы на тандемном масс-спектрометре. Количественная оценка выполнялась с помощью многократного контроля реакции (МКР). Фармакокинетические параметры были рассчитаны с помощью программного обеспечения WinNonlin 6.3 по внеблоковой модели.
II. Результаты количественного определения
[00314] Исследуемые соединения были проверены способами, описанными выше. Результаты приведены в Таблице 3:
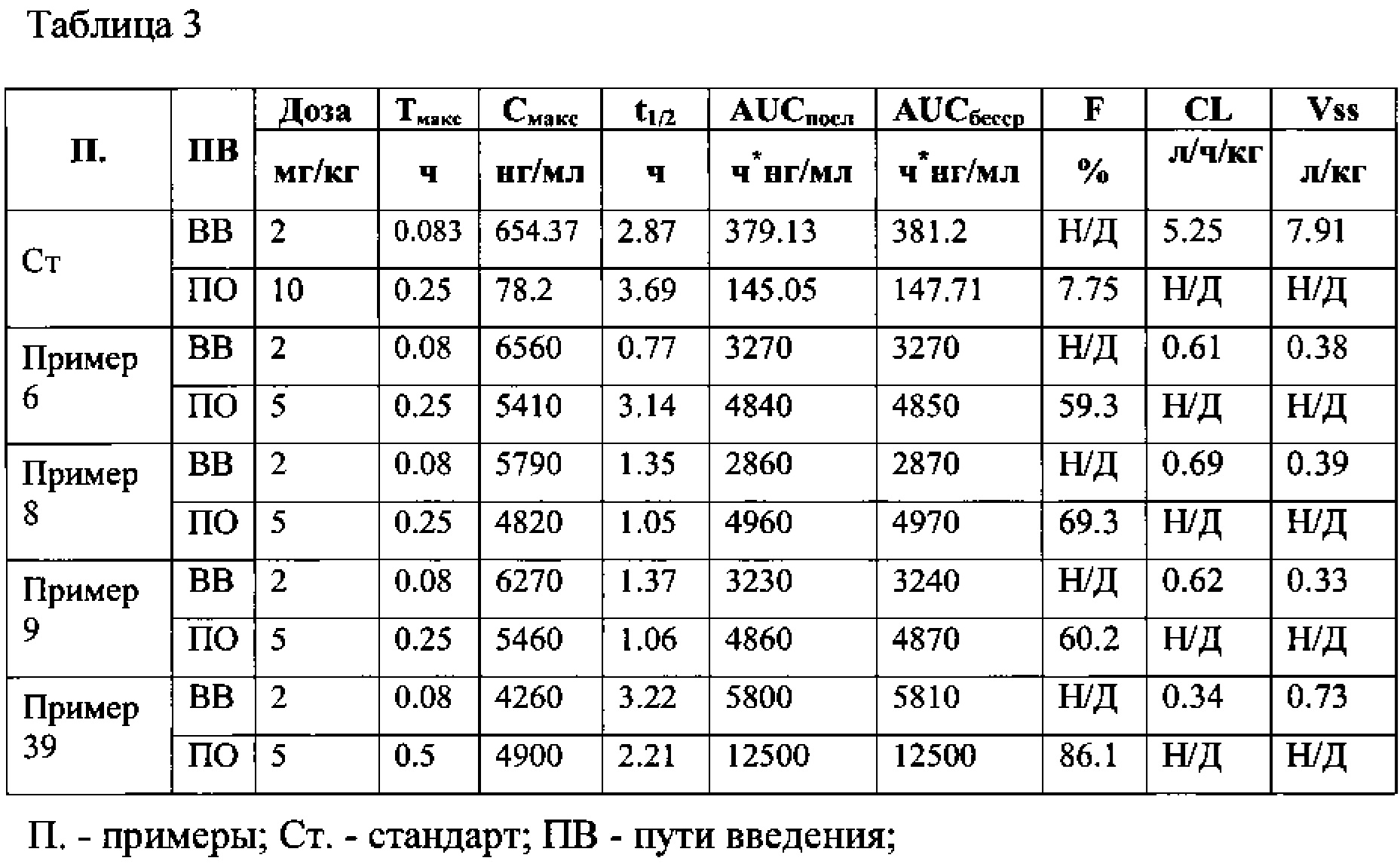
Стандарт - этил 4-(2-бромо-4-фторофенил)-2-(тиазол-2-ил)-6-(4-морфолино)метил)-1,4-дигидропиримидин-5-карбоксилат (Соединение синтезировано согласно процедуре, как описано в WO 2008154817);
Н/Д - обнаружения нет;
AUCпосл - AUC за 0-24 часа;
AUCбeccp - AUC за 0 часов до бессрочного периода
III. Заключения
[00315] После внутрижелудочного введения препаратов мышам ICR, соединение Примера 6, Примера 8, Примера 9 и соединение Примера 39 были быстро поглощены, и пиковое время в плазме составило 0,25 часа, 0,25 часа, 0,25 часа и 0,5 часа, соответственно. AUCпосл соединения Примера 6 составило 4840 ч*нг/мл, AUCпосл соединения Примера 8 составило 4960 ч*нг/мл, AUCпосл соединения Примера 9 составило 4860 ч*нг/мл, и AUCпосл соединения Примера 39 составило 12500 ч*нг/мл. Соединения имеют лучшее врмя выдержки, которое очевидно выше, чем у стандарта. Это показало, что соединения были хорошо поглощены у мышей ICR. После введения внутривенной инъекцией, CL соединения Примера 6, Примера 8, Примера 9 и соединения Примера 39 составило 0.61 л/ч/кг, 0.69 л/ч/кг, 0.62 л/ч/кг и 0.34 л/ч/кг, соответственно, и Vss соединения Примера 6, Примера 8, Примера 9 и соединения Примера 39 составило 0.38 л/кг, 0.39 л/кгч 0.33 л/кг и 0.73 л/кг, соответственно. Расчитанное значение AUCпосл соединения Примера 6, Примера 8, Примера 9 и соединения Примера 39, F составило 59,3%, 69,3%, 60,2% и 96,1%, соответственно, когда исследуемые соединения были влиты желудок мышей ICR через рот в объеме 5 мг/кг. Соединения имеют лучшую биопригодность, которая намного выше, чем у стандарта (7,75%).
[00316] Сравнение данных о действии показало, что действие большинства соединений, раскрытых в настоящем документе, было выше, чем у стандарта, и, таким образом, демонстрируется хорошая перспектива анти-ВГВ действии.
[00317] Несмотря на то, что данное изобретение было описано в виде подробного описания, в котором было дано общее описание, примеры и количественные определения, специалисту в области очевидно, что могут быть внесены определенные изменения и модификации, не отступая от изобретения, и поэтому все такие изменения и модификации находятся в рамках изобретения.