Результат интеллектуальной деятельности: ГОРМОНСОДЕРЖАЩАЯ ЭМУЛЬСИЯ
Вид РИД
Изобретение
Изобретение относится к гормонсодержащей эмульсии типа масло-в-воде для парентерального введения, включающей прогестоген и/или эстроген; и триглицериды рыбьего жира, так же как к фармацевтической композиции, включающей или состоящей из указанной эмульсии типа масло-в-воде. Фармацевтическая композиция предназначена для применения в лечении или профилактике неврологического повреждения после ударов и/или травмы и/или для применения в лечении или профилактике неврологического повреждения после сотрясения и/или травматического повреждения в центральной нервной системе.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Черепно-мозговая травма (ЧМТ) является недегенеративным, ненаследственным кровоизлиянием в головной мозг под действием внешней механической силы, способным приводить к постоянному или временному нарушению когнитивных, физических и психосоциологических функций, связанных со снижением или изменением состояния сознания. В результате ЧМТ некоторым пациентам требуется длительная или пожизненная помощь для осуществления ежедневной активности.
Несмотря на чудовищность проблемы, вызываемой ЧМТ, в настоящее время нет никаких одобренных лекарств, эффективность которых для снижения летальности или улучшения результатов после ЧМТ была бы доказана. Однако, два недавних клинических испытания продемонстрировали успешное лечение ЧМТ при помощи стероидного гормона прогестерона (Xiao et al, 2008, Crit. Care, 12: R61; Wright et al Ann. Emerg. Med. 2007, 49: 391-402). Оба исследования показали, что прогестерон является безопасным и хорошо переносится пациентами с ЧМТ, и что введение прогестерона пациентам с ЧМТ приводит к снижению летальности. Кроме того, патентные заявки WO2006/102644, WO2006102596, WO2008/039898, US 2011/0262494 и US 2011/0262495 обрисовывают в общих чертах способы лечения ЧМТ посредством парентерального введения прогестогена.
Кроме того, Alkayed с соавторами в Stroke 31, 161 (2003) описывают положительное влияние подкожно вводимых эстрогенов и прогестеронов на состояние пациентов, перенесших инсульт.
Инсульт, также известный как острое нарушение мозгового кровообращения (CVA), представляет собой быструю потерю мозговой функции(й) в результате нарушения кровоснабжения головного мозга. Это может происходить из-за ишемии (нехватка кровотока), вызываемой закупоркой (тромбоз, артериальная эмболия), или кровотечения (утечка крови). В результате пораженная зона мозга не может функционировать, что может приводить к неспособности двигать одной или более конечностями на одной стороне тела, неспособности понимать или формулировать речь или неспособности видеть одну сторону поля зрения.
Инсульт является тяжелым медицинским состоянием и может вызывать постоянное неврологическое повреждение, осложнения и смерть. Он является главной причиной инвалидности у взрослых людей в Соединенных Штатах и Европе и второй главной причиной смертности во всем мире. Факторы риска для инсульта включают старость, артериальную гипертензию (высокое кровяное давление), инсульт в прошлом или переходящее ишемическое нарушение (TIA), диабет, высокий холестерин, курение сигарет и фибрилляцию предсердий. Высокое кровяное давление является наиболее важным поддающимся изменению фактором риска для инсульта.
Самым эффективным путем введения прогестогенов, таких как прогестерон, и/или эстрогена, такого как эстрадиол, является перентеральный путь, такой как внутривенное введение. Однако, гидрофобность прогестерона и/или молекул эстрадиола, и следовательно, его плохая растворимость в воде, ограничивают его использование для составления в композиции. Водные растворы представляют лекарственные формы, способные доставить терапевтически эффективные дозы прогестерона пациентам. Однако, прогестерон и/или эстрадиол являются достаточно липофильными для получения терапевтически эффективных концентраций в гидрофобных растворителях, таких как растворители на основе триглицерида.
Доставка гидрофобных препаратов посредством внутривенного вливания эмульсий типа масло-в-воде известно в области техники. В публикации Wright с соавторами, Ann. Emerg. Med. 2007, 49: 391-402, применяется 2-компонентная система, в которой сначала прогестерон растворяют в спиртовом растворе (первый компонент), и затем этот спиртовой раствор прогестерона вводят в коммерчески доступную липидную эмульсию Intralipid® 20% (Fresenius Kabi, Швеция) (второй компонент), и вручную смешивают (например, встряхиванием) незадолго до внутривенного введения смеси спиртовой раствор/эмульсия. В применении этого способа получения есть множество недостатков:
во-первых, введение спиртовых растворов пациентам с ЧМТ не желательно. Во-вторых, при том, что наличие спирта способствует растворению прогестерона и/или эстрадиола, слабое ручное смешивание не позволяет всему прогестерону/эстрадиолу войти в масляную фазу. Следовательно, такие эмульсии способны растворять только ограниченное количество прогестерона или эстрадиола, и для достижения желаемых уровней прогестерона и/или эстрогена в сыворотке крови необходимо введение большого количества липида. Однако, введение больших объемов эмульсии и/или большого количества липида пациенту может иметь серьезные последствия, такие как начало гиперлипидемии или отека. Пациент, в результате подвергается воздействию нежелательной нагрузки от липидов и/или жидкости и подвергается риску появления побочных реакций.
Кроме того, нерастворенный прогестоген и/или эстроген склонны к кристаллизации и последующему окислению в водной фазе, таким образом, приводя не только к повышенному уровню скопления частиц в композиции, но также и высоким уровням продуктов распада активного ингредиента. Действительно, показано, что когда спиртовой раствор прогестерона вводят в коммерческую композицию липидной эмульсии (такую как Intralipid® 20%), фракцию гормона скорее обнаруживают в кристаллической форме, чем в растворенной в эмульсии. Сообщается, что этот нерастворимый прогестерон адсорбируется на поверхности инфузионных мешков и трубок подачи. Наблюдение того, что не весь прогестерон переходит в масляную фазу этих 2-компонентных эмульсий приводит к неопределенности относительно концентрации прогестерона, достигаемой в итоговой композиции, и биодоступности гормона.
Наконец, из-за проблем устойчивости, смесь липида и прогестерона в 2-компонентной системе должна быть получена только за несколько часов перед введением (т.е. первую компоненту добавляют ко второй компоненте и смешивают в течение часов применения), поскольку итоговую смесь нельзя хранить при комнатной температуре. Это и времязатратно, и неудобно для врачей получать такие смеси по необходимости, и особенно неудовлетворительно в контексте терапии ЧМТ, когда быстрое лечение может быть важно для состояния пациента.
Альтернативные способы получения гормонсодержащих эмульсий описывают включение гормона непосредственно в масло во время получения липидной эмульсии (WO 2004/110402).
CN 101152186 описывает применение поверхностно-активных веществ Solutol S15 или poloxamer 188 для получения впрыскиваемых композиций прогестерона. При том, что применение этих поверхностно-активных веществ может приводить к высокой растворимости прогестерона, внутривенное введение высоких концентраций этих поверхностно-активных веществ связано с нежелательными побочными эффектами, включая умеренное повышение в выбросе гистамина, крапивницу и анафилактические реакции (прурит, эритема).
Один способ увеличения растворимости прогестерона и/или эстрадиола в липидных эмульсиях, известный в области техники, представляет собой применение органических растворителей. Прогестерон высоко растворим в бензойной кислоте или ее производных соединениях. Например, JP 60-258110 описывает применение бензилбензоата для увеличения растворимости прогестерона в липидной эмульсии. Однако, поскольку бензиловые спирты и бензилбензоат обычно являются токсичными и, как известно, вызывают аллергии, их включение в композиции для парентерального введения считают серьезной опасностью.
Независимо от проблем, связанных с растворимостью и устойчивостью эмульсий, остается проблема улучшения эффективности гормонов в лечении или профилактике неврологических повреждений.
Неожиданно обнаружено, что проблемы, связанные с предшествующей областью техники, могут быть решены посредством гормонсодержащей эмульсии типа масло-в-воде для парентерального введения, включающей прогестоген и/или эстроген; и рыбий жир, обогащенный омега-3-жирными кислотами, и/или фосфолипиды, включающие один или более фрагментов омега-3-жирных кислот.
ОПРЕДЕЛЕНИЯ
Термин «масло» легко взаимозаменяется с «липид» и «жир», и относится к липофильным высококипящим органическим соединениям, которые являются жидкими при температуре тела человека (например, приблизительно 37°C) и фармакологически приемлемыми во вливаемых композициях. Масла по настоящему изобретению охватывают и глицериды, неполные глицериды, остатки жирных кислот и неглицериды, так же как и их смеси. Фосфолипиды, если иначе не указано, не охватываются термином «масло», как применено в настоящем описании.
Термин «эмульсия типа масло-в-воде» относится к коллоидной дисперсионной системе, в которой жидкое масло диспергировано в виде небольших капелек (дисперсная фаза) в водной среде (дисперсионная фаза).
Термин «фосфолипид» относится к сложному эфиру глицерина с одной или двумя жирными кислотами и одной фосфатной группой. В дополнение к фосфолипидам, получаемым из глицерина, термин «фосфолипид», как применено в настоящем описании, также охватывает сфингомиэлин.
Термин «водная среда» относится к водосодержащей жидкости.
Формы единственного числа обозначают и единственное и множественное число, если явно не указано обозначение только единственного числа.
Как применено в настоящем описании, фраза «терапевтически эффективное количество» обозначает дозировку лекарственного средства, которая обеспечивает определенный фармакологический ответ, для достижения которого лекарственное средство вводят пациенту, нуждающемуся в таком лечении. Подчеркивается, что терапевтически эффективное количество или терапевтический уровень лекарственного средства не всегда будут эффективными при лечении состояний/заболеваний, описанных в настоящей заявке, даже при том, что такая дозировка считается специалистом в области техники терапевтически эффективным количеством. Типовые дозировки, количества доставки лекарственных средств, терапевтически эффективные количества и терапевтические уровни приведены ниже для взрослых людей-пациентов только для удобства. Специалисты в области техники могут регулировать такие количества в соответствии с общепринятой практикой по необходимости для лечения определенного пациента и/или состояния/заболевания.
Если не указано иначе, всякий раз, когда дается ссылка в настоящем описании на «процентный вес к объему» или «% вес/объем» эти термины описывают массу компонента в г на 100 мл композиции, в которой она содержится. Если не указано иначе, всякий раз, когда приводится ссылка в настоящем описании на «процентный вес к весу» или «% вес/вес» эти термины обозначают массу компонента как процент от массы композиции, в которой содержится компонент.
Ссылка на «PCS» или «фотонно-корреляционную спектроскопию» означает PCS с измерением согласно способу, описанному в USP, глава <729>, Способ I, с применением Zetasizer 1000 HSA (Malvern Instruments).
Ссылка на d(0,5) (среднеобъемный диаметр) означает d(0,5), измеряемый согласно способу, описанному в USP <429> (Измерение размера частиц при помощи дифракции света) с применением прибора Mastersizer 2000 с дисперсионным блоком Hydro S (Malvern Instruments).
В настоящем описании ссылка на «дзета-потенциал» подразумевает электрокинетический потенциал в коллоидных системах, определяемый экспериментально с применением прибора Zetasizer 1000 HAS (Malvern Instruments).
В настоящем описании термин «несодержащий кристаллическое твердое вещество» означает, что эмульсии по настоящему изобретению соответствуют стандартам по размеру и числу частиц в жидкостях для вливаний (USP 788, Method 2-Microscopic Particle count test).
ПОДРОБНОЕ ОПИСАНИЕ
Первый вариант осуществления настоящего изобретения представляет собой гормонсодержащую эмульсию типа масло-в-воде для парентерального введения, включающую
a) прогестоген и/или эстроген и
b) триглицериды рыбьего жира, где триглицерид рыбьего жира состоит из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанной жирной кислоты.
Эмульсия типа масло-в-воде по настоящему изобретению включает масло и водную фазу.
Эмульсия типа масло-в-воде по настоящему изобретению включает прогестоген и/или эстроген в качестве активного фармацевтического ингредиента (API).
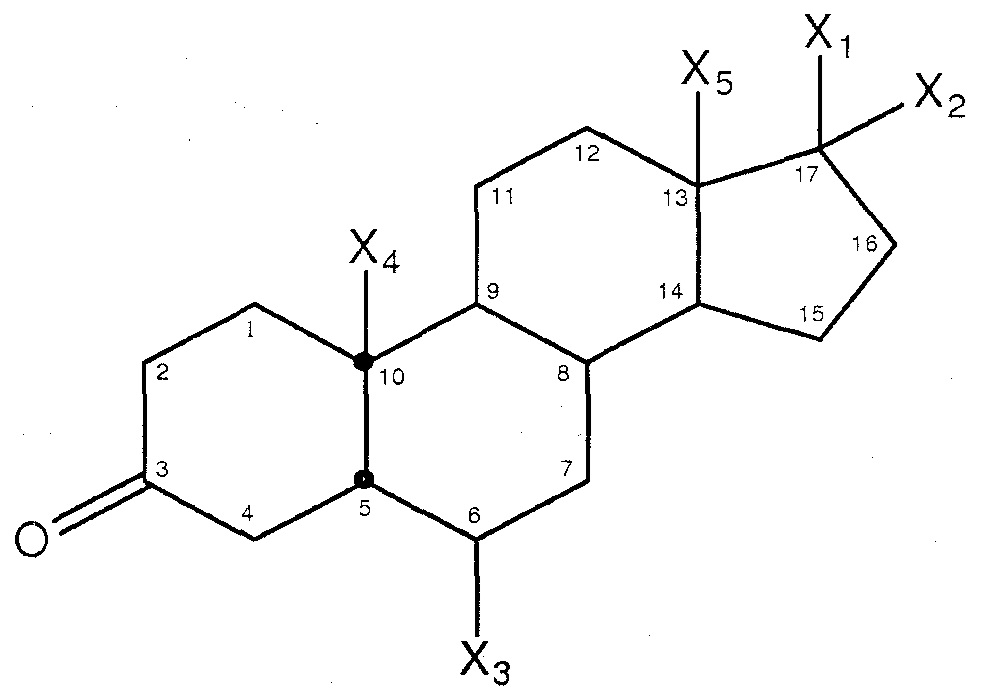
В настоящем описании, «прогестоген» включает и естественный прогестерон и синтетические прогестогены. В целом, прогестогены имеют общую Формулу I, в которой X1 и X2 независимо выбраны из -COCH3, -OCOC5H11, -OH, этинила, -OCOCH3, -H, -CH2CN; в которой X3 выбран из -H, -CH3 или -Cl;, в которой X4 выбран из -H, -OH или -CH3, и, в которой X5 выбран из CH3 или CH2CH3. Прогестоген может содержать кольцевые структуры с одной или большим количеством двойных связей, например, между углеродом 3 и 4, 4 и 5, 5 и 6, 6 и 7, 5 и 10, 10 и 9 и/или 15 и 16.
Формула I:
Такие прогестогены включают, например, производные соединения прогестерона, такие как 5-α-дигидропрогестерон, 6-дегидро-ретропрогестерон (дидрогестерон), гидроксипрогестерона капроат, левоноргестрел, норэтиндрон, норэтиндрона ацетат; норетинодрел, норгестрел, медроксипрогестерон, хлормадинон и мегестрол. «Прогестоген» также включает, но не ограничен модификациями, которые дают 17α-OH сложные эфиры прогестерона, так же как, модификации, которые вводят 6-α-метил, 6-метил, 6-ен и 6-хлор заместители в прогестерон и/или 19-нор-прогестероны. Дополнительно, неограничивающие примеры синтетических прогестогенов включают норэтиндрон (Micronor®), норгестрел (Ovrette®), левоноргестрел (Norplant®; с этинил эстрадиолом; Alesse®, Nordette®), гестоден, медроксипрогестерона ацетат (Provera®), промегестон, номегестрола ацетат, линестренол и диеногест.
В одном варианте осуществления настоящего изобретения прогестоген выбран из группы, состоящей из прогестерона, норетинодрела, норетидрона ацетата, медроксипрогестерона, медроксипрогестерона 17-ацетата, левоноргестрела, дидрогестерона, капроата гидроксипрогестерона, норетидрона, гестодена, номегестрола ацетата, промегестона, диеногеста, хлормадиниона, мегестрола, мегестрола ацетата и/или их смесей.
В специфических вариантах осуществления настоящего изобретения прогестоген выбран из группы, состоящей из 5-α-дигидропрогестерона, медроксипрогестерона, дидрогестерона и прогестерона и/или их смесей.
В дополнительном варианте осуществления настоящего изобретения прогестоген выбран из группы, состоящей из прегненолона, прогестерона, медроксипрогестерона и их фармацевтически приемлемых производных соединений.
В специфических вариантах осуществления настоящего изобретения прогестоген является прогестероном. Термин «прогестерон» относится к члену семейства прогестогена со структурой по формуле II ниже:
Формула II:
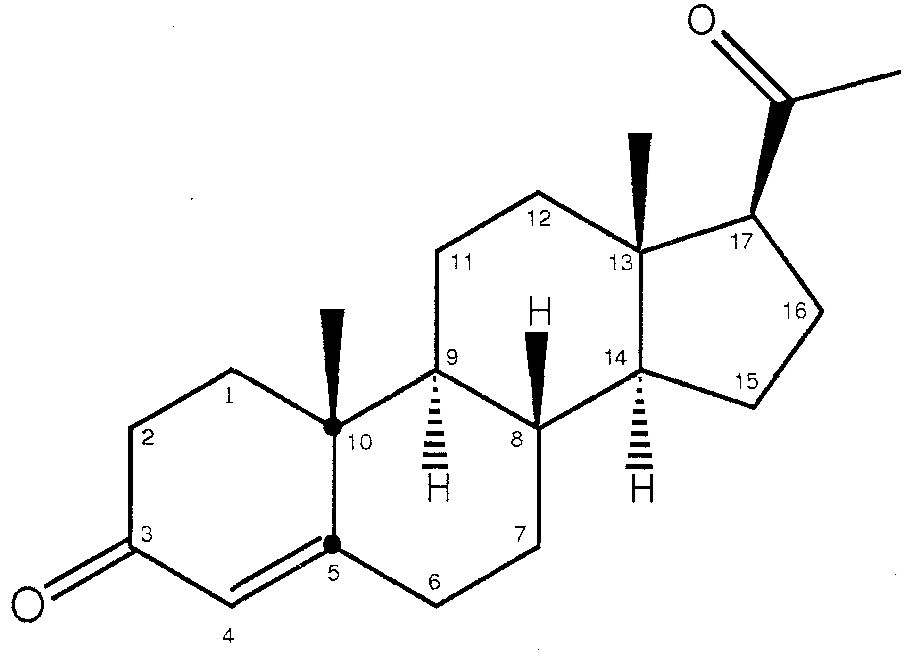
Прогестерон также известен как D4-прегнен-3,20-дион; дельта-4-прегнен-3,20-дион; или прегн-4-ен-3,20-дион. В очень специфических вариантах осуществления настоящего изобретения прогестерон является тонкоизмельченным. Proquina (Мексика) является одним поставщиком тонкоизмельченного прогестерона.
Прогестоген (например, любой прогестоген, включая прогестерон), который подходит для применения в соответствии с настоящим изобретением, может находиться в форме фармацевтически приемлемой соли.
Эмульсия типа масло-в-воде по настоящему изобретению может включать количество прогестогена, по меньшей мере, 0,1 г/л, предпочтительно, по меньшей мере, 0,15 г/л, более предпочтительно, в пределах от 0,15 г/л до 12,0 г/л, дополнительно предпочтительно, 0,8 г/л до 4,0 г/л, особенно 1,0 г/л до 2,5 г/л.
В предпочтительном варианте осуществления настоящего изобретения эмульсия типа масло-в-воде включает прогестерон в количестве в пределах от 0,15 г/л до 12 г/л.
Эмульсия типа масло-в-воде по настоящему изобретению может включать количество прогестогена (например, прогестерон), по меньшей мере, 0,3 г/л, по меньшей мере, 0,5 г/л, по меньшей мере, 1 г/л. В соответствии с любым из этих вариантов осуществления, эмульсия может включать количество прогестогена (например, прогестерон) меньше, чем или равное 3,0 г/л, меньше, чем или равное 2,5 г/л или меньше, чем или равное 2,0 г/л. В специфическом варианте осуществления настоящего изобретения эмульсия типа масло-в-воде по настоящему изобретению включает от приблизительно 1,0 г/л до 2,0 г/л прогестерона, в частности приблизительно 1,5 г/л прогестерона.
Согласно альтернативному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде включает один или более эстрогенов.
В предпочтительном варианте осуществления настоящего изобретения эмульсия включает эстриол (1,3,5(10)-эстратриен-3,16α,17β-триол), который изображен формулой III ниже:
Формула III:
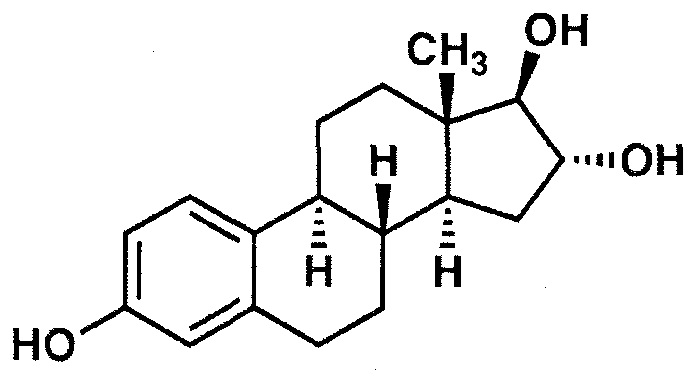
В дополнительном варианте осуществления настоящего изобретения эмульсия включает эстрадиол (1,3,5(10)-эстратриен-3,17β-диол), который изображен формулой IV ниже:
Формула IV:
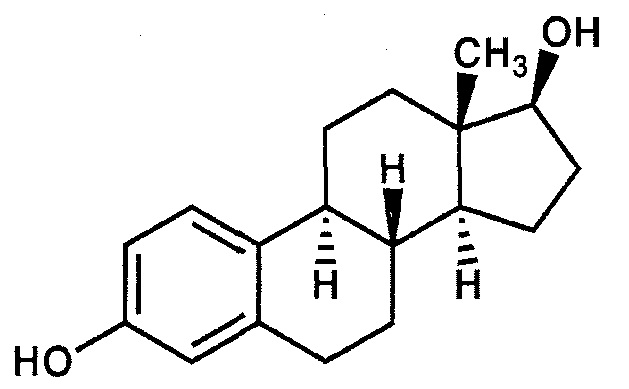
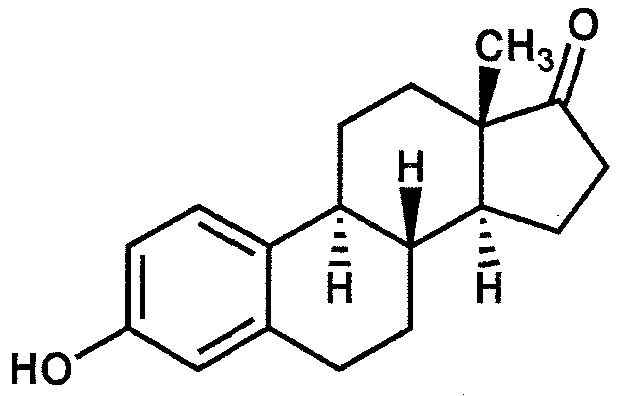
В дополнительном варианте осуществления настоящего изобретения эмульсия включает эстрон, который изображен формулой V ниже:
Формула V:
Согласно предпочтительному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде включает эстрогены, выбранные из группы, состоящей из эстрадиола, эстрона, эстриола и производных соединений так же как их смесей.
Специфично предпочтительный эстрадиол.
Эстрогены предпочтительно, присутствуют в эмульсии типа масло-в-воде в количестве в пределах от 0,015 г/л до 5 г/л, более предпочтительно, 0,015 г/л до 1,5 г/л и наиболее предпочтительно, от 0,05 г/л до 0,3 г/л (грамм за литр), на основе эмульсии.
В предпочтительном варианте осуществления настоящего изобретения эмульсия включает эстрадиол в количестве в пределах от 0,015 г/л до 1,5 г/л, предпочтительно, 0,05 г/л до 1,0 г/л, более предпочтительно, 0,08 г/л до 0,5 г/л и особенно 0,1 г/л до 0,3 г/л.
Согласно дополнительному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде включает комбинацию прогестогена и эстрогена. Весовое соотношение прогестогена к эстрогену в эмульсии может составлять от 2:1 до 500:1, предпочтительно, от 2:1 до 200:1, дополнительно предпочтительно, от 5:1 до 50:1 и, более предпочтительно, от 10:1 до 20:1.
Предпочтительно, эмульсия типа масло-в-воде включает эстрадиол и/или прогестерон.
Один вариант осуществления настоящего изобретения относится к комбинации эстрона с прегненолоном и/или прогестероном, другой к комбинации эстриола с прегненолоном и/или прогестероном. Альтернативный, в частности, предпочтительный вариант осуществления настоящего изобретения относится к комбинации эстрадиола и/или прегненолона и/или прогестерона, особенно с прогестероном. В обеих альтернативах может дополнительно содержаться медроксипрогестерон, или медроксипрогестерон может быть заменен прегненолоном и/или прогестероном. Таким образом, более двух гормонов могут также быть объединены согласно настоящему изобретению.
Для лучшего дозирования эмульсий типа масло-в-воде маточные эмульсии могут быть разбавлены в случае необходимости соответствующим количеством воды, предпочтительно, вплоть до четырехкратного количества воды.
Масляная фаза эмульсии типа масло-в-воде включает триглицериды рыбьего жира, где триглицерид рыбьего жира состоит из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанных жирных кислот, и предпочтительно, общая сумма омега-3-жирных кислот составляет, по меньшей мере, 50% по весу (вес.%), более предпочтительно, по меньшей мере, 55 весовых %, более предпочтительно, по меньшей мере, 60 весовых % и наиболее предпочтительно, по меньшей мере, 65 весовых % указанных жирных кислот.
В European Pharmacopeia (EP) находятся две монографии (т.е., EP 1352 под названием «Omega-3 Acid Triglycerides» и, EP 1912, под названием «Fish Oil, Rich in Omega-3 Acids»), которые посвящены рыбьему жиру, который является приемлемым для применения в эмульсиях для перентерального введения (EP 1352, EP 1912, 2008). Монография EP 1352 существенно отличается от EP 1912 тем, что композиция и требования к биоактивным n3-FAs в EP 1352, сильно выше, чем в EP 1912 (EP 1352: EPA + DHA ≥45%; общее количество n3-FAs ≥60% в сравнении с 1912 EP: EPA: ≥13%; DHA ≥9%; общее количество n3-FAs ≥28%). Уровни n3-FAs в EP 1912 сопоставимы с таковыми, обнаруживаемыми в природе. Для сравнения в EP 1352 концентрации n3-FA существенно выше и могут быть получены путем обогащения, таким как молекулярная дистилляция, при котором удаляются определенные присутствующие нежелательные жирные кислоты, например, миристиновая кислота, пальмитиновая кислота и стеариновая кислота. Таким образом, концентрации всех присутствующих жирных кислот, и, в частности, омега-3-жирных кислот, пропорционально увеличиваются. В типовом варианте осуществления настоящего изобретения триглицериды рыбьего жира включают омега-3-жирные кислоты в количестве, по меньшей мере, 60%, предпочтительно, по меньшей мере, 65% по весу на основе общего веса жирных кислот триглицеридов рыбьего жира. Триглицериды рыбьего жира включают в общей сумме эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA), по меньшей мере, 45%, предпочтительно, по меньшей мере, 50% по весу на основе общего веса жирных кислот триглицеридов рыбьего жира. Например, жирные кислоты и омега-3-жирные кислоты (такие как, например, EPA и DHA) рассмотренные в настоящем описании относятся к составным частям таких кислот в триглицериде рыбьего жира, в соответствии с EP 1352. Например, рассмотренные жирные кислоты и омега-3-жирные кислоты (такие как, например, EPA и DHA) находятся в их этерифицированной форме когда присутствуют в триглицеридах рыбьего жира.
Согласно настоящему изобретению триглицериды рыбьего жира включают омега-3-жирные кислоты, составленные из эйкозапентаеновой кислоты в количестве 30% или больше, докозагексаеновой кислоты в количестве 30% или меньше и докозапентаеновой кислоты в количестве приблизительно 40% или меньше на основе общего весового содержания омега-3-жирных кислот.
Триглицериды рыбьего жира могут содержать, по меньшей мере, одну омега-6-жирную кислоту, например, множество омега-6-жирных кислот. По меньшей мере, одна омега-6-жирная кислота может включать, например, арахидоновую кислоту или AA (20:4n6), линолевую кислоту или LA (18:2n6), гамма линоленовую кислоту или ALA (18:3n6) или их комбинацию. Например, общее содержание, по меньшей мере, одной омега-6-жирной кислоты может составлять от приблизительно 0,1% до приблизительно 1,0%, или от приблизительно 0,2% до приблизительно 0,9%, или от приблизительно 0,3% до приблизительно 0,8%, или от приблизительно 0,4% до приблизительно 0,7%, или от приблизительно 0,5% до приблизительно 0,6% на основе веса жирных кислот, которые этерифицированы глицерином с образованием триглицерида рыбьего жира.
Определение содержания омега-3-жирных кислот (n3-FAs) может быть осуществлено как описано в европейской Фармакопее «Fish oil, rich in omega-3 acids». Содержание n3-FAs может состоять из любой одной n3-FA или любой их комбинации. В типовом варианте осуществления настоящего изобретения композиция может содержать EPA, DHA, DPA или их комбинацию, например, каждую из EPA, DHA и DPA. Индивидуальная дозировка, например, общая ежедневная дозировка эйкозапентаеновой кислоты (EPA) может изменяться от 0 до 300 мг/кг композиции, например, от 50 до 250 мг/кг, например, от 100 до 200 мг/кг на основе массы тела. Индивидуальная дозировка, например, общая ежедневная дозировка докозагексаеновой кислоты (DHA) может изменяться от 0 до 300 мг/кг композиции, например, от 50 до 250 мг/кг, например, от 100 до 200 мг/кг на основе массы тела. Индивидуальная дозировка, например, общая ежедневная дозировка докозапентаеновой кислоты (DPA) может изменяться от 0 до 300 мг/кг композиции, например, от 50 до 250 мг/кг, например, от 100 до 200 мг/кг, на основе массы тела. Например, EPA, DHA и/или DPA могут присутствовать в количествах, эффективных для обеспечения нейрозащиты для жизненно важных органов.
Триглицериды рыбьего жира могут присутствовать в количестве, по меньшей мере, 25 весовых %, предпочтительно, по меньшей мере, 35 весовых %, дополнительно предпочтительно, по меньшей мере, 50 весовых %, особенно, по меньшей мере, 75 весовых % и в частности, по меньшей мере, 85 весовых %, где каждый взят на основе общего веса масляного компонента.
Согласно предпочтительному варианту осуществления триглицериды рыбьего жира присутствуют в количестве в пределах от 55 до 95 весовых %, более предпочтительно, от 60 до 92 весовых %, особенно от 70 до 90 весовых % на основе общего веса масляного компонента.
Согласно предпочтительному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде дополнительно включает среднецепочечные триглицериды (MCT).
Типовой второй компонент масляного компонента эмульсии может включать, по меньшей мере, один среднецепочечный триглицерид (MCT), например, множество MCT. Например, по меньшей мере, один MCT может присутствовать в количестве от приблизительно 10% до приблизительно 69% или от приблизительно 10% до приблизительно 40% или от приблизительно 10% до приблизительно 30%, или от приблизительно 10% до приблизительно 20%, или от приблизительно 10% до приблизительно 15%, или от приблизительно 20% до приблизительно 60%, или от приблизительно 30% до приблизительно 50%, или от приблизительно 40% до приблизительно 45% на основе общего веса масляного компонента эмульсии. Например, применением типовых диапазонов MCT количество этерифицированных омега-3-жирных кислот, доставляемых в тело человека, может быть увеличено. Например, применением типовых диапазонов MCT количество этерифицированных омега-3-жирных кислот, доставляемых в тело человека, может быть увеличено с применением относительно небольшого количества MCT, при этом все еще с достижением благоприятного метаболического выведения и физико-химических характеристик устойчивости эмульсии.
Например, MCT может включать насыщенную среднецепочечную жирную кислоту, например, множество насыщенных среднецепочечных жирных кислот. В типовом варианте осуществления настоящего изобретения MCT является триглицеридом жирной кислоты, содержащим от 6 до 12 углеродных атомов. MCT может быть получен из растения, такого как овощ, например, из множества растений. MCT может содержать каприловую кислоту (например, в количестве от приблизительно 50% до приблизительно 80% по весу MCT), 8-углеродную насыщенную ЖК (8:0). MCT может содержать каприновую кислоту (например, в количестве от приблизительно 20% до приблизительно 50% по весу MCT), 10-углеродную насыщенную ЖК (10:0). Например, среднецепочечные триглицериды могут содержать триглицериды каприловой кислоты и каприновой кислоты в количестве, по меньшей мере, 90% по весу среднецепочечных триглицеридов. Описание MCT для применения в этом раскрытии может, например, отвечать требованиям EP монографии 0868, под названием «Triglycerides, Medium Chain» (Триглицеридная насыщающая среда) (EP 0868, 2008).
Масло композиций эмульсии типа масло-в-воде, описанных в настоящем описании, может дополнительно включать среднецепочечные триглицериды. «Среднецепочечные триглицериды» (MCT) являются другим классом триглицеридного масла, которое может быть получено, как из естественного продукта, так и синтетическим путем. MCT образованы из жирных кислот с 6-14 атомами углерода, предпочтительно, 6-12 атомами углерода, в частности, с 8-10 атомами углерода в длину. Среднецепочечные триглицериды (MCT), применяемые с эмульсиями типа масло-в-воде преимущественно служат источником энергии. MCT является коммерчески доступным, как например Miglyol 812 (SASOL GmbH Германия) или CRODAMOL GTCC-PN (Croda Inc, Нью-Джерси).
Согласно предпочтительному варианту осуществления настоящего изобретения эмульсия включает MCT, который состоит из глицерина, который этерифицирован жирными кислотами, включающими, по меньшей мере, 50 весовых % жирных кислот, выбранных из группы жирных кислот, содержащих 7, 9 и 11 углеродных атомов.
Комбинация MCT с триглицеридами рыбьего жира, как определено выше, имеет преимущество для эмульсии типа масло-в-воде по настоящему изобретению.
Согласно предпочтительному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде включает среднецепочечные триглицериды в количестве в пределах от 5 до 75 весовых %, предпочтительно, от 10 до 55 весовых % и особенно от 15 до 45 весовых %, где каждый взят на основе общего веса масляного компонента.
В предпочтительном варианте осуществления настоящего изобретения масло в водной эмульсии включает триглицериды рыбьего жира и среднецепочечные триглицериды в весовом соотношении в пределах от 1:1 до 9:1, более предпочтительно, от 1,5:1 до 8:1, в частности, от 2:1 до 7:1.
Согласно особенно предпочтительному варианту осуществления количество триглицеридов рыбьего жира и MCT в масляной фазе составляет, по меньшей мере, 90 весовых %, предпочтительно, по меньшей мере, 95 весовых %, более предпочтительно, по меньшей мере, 98 весовых %, особенно, по меньшей мере, 99 весовых % на основе общего веса масляного компонента.
Масляный компонент может дополнительно включать дополнительные масла, которые предпочтительно, имеют точку плавления менее 30°C, больше специфично менее 20°C, и включая температуру менее 10°C.
Предпочтительно, масляный компонент содержит масло, включающее, по меньшей мере, 75 весовых % триглицеридов или, по меньшей мере, 85 весовых % триглицеридов на основе общего веса масляного компонента. В специфическом варианте осуществления настоящего изобретения масляный компонент включает, по меньшей мере, 90 весовых % триглицеридов или, по меньшей мере, 95 весовых % триглицеридов.
В дополнительных специфических вариантах осуществления настоящего изобретения масляная фаза дополнительно включает «длинноцепочечные триглицериды» (LCT).
В специфических вариантах осуществления настоящего изобретения масло может включать растительное масло. «Растительное масло» относится к маслу, получаемому из семян растений или орехов. Растительные масла, как правило, представляют собой «длинноцепочечные триглицериды» (LCT), образованные из трех жирных кислот (обычно от 14 до 22 атомов углерода в длину с ненасыщенными связями в различном количестве и месторасположении, в зависимости от источника масла) образующих сложноэфирные связи с тремя гидроксильными группами на глицерине. В специфических вариантах осуществления настоящего изобретения применяют растительные масла высокой очистки (также называемые «суперрафинированные»), чтобы обеспечить безопасность и устойчивость эмульсий типа масло-в-воде. В специфических вариантах осуществления настоящего изобретения могут быть применены растительные масла, которые получаю посредством контролируемого гидрирования растительного масла.
Типовые растительные масла включают, но не ограничены миндальным маслом, пальмовым маслом, маслом из семян черной смородины, маслом бурачника, маслом канолы, маслом из семян кастореума, кокосовым маслом, кукурузным маслом, хлопковым маслом, оливковым маслом, арахидным маслом, пальмовым маслом, пальмовым маслом из косточек плодов, рапсовым маслом, сафлоровым маслом, соевым маслом, подсолнечным маслом и кунжутным маслом. Гидрированные и/или частично гидрированные формы этих масел также могут быть применены. В специфических вариантах осуществления настоящего изобретения масло дополнительно включает сафлоровое масло, кунжутное масло, кукурузное масло, оливковое масло и/или соевое масло. В более специфических вариантах осуществления настоящего изобретения масло дополнительно включает сафлоровое масло и/или соевое масло.
В специфических вариантах осуществления настоящего изобретения, где масло дополнительно включает соевое масло, соевое масло может иметь содержание пальмитиновой кислоты (вес/вес) между 9 и 13%, содержание стеариновой кислоты между 2,5% и 5%, содержание олеиновой кислоты между 17% и 30%, содержание линолевой кислоты между 48% и 58% и содержание линоленовой кислоты между 5% и 11%.
Дополнительно, в специфическом варианте осуществления настоящего изобретения, композиции эмульсии типа масло-в-воде могут включать структурированные триглицериды. «Структурированный триглицерид», как применено в настоящем описании, является триглицеридом, включающим триглицериды или смеси триглицеридов, содержащих, по меньшей мере, одну группу жирной кислоты с длиной углеродной цепи от 6 до 12 углеродных атомов и, по меньшей мере, одну группу жирной кислоты с длиной углеродной цепи более 12 углеродных единиц.
Было обнаружено, что большое количество остатков омега-3-жирных кислот улучшает эффект гормонов в лечении пациентов. Поэтому, согласно определенному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде по существу не содержит растительных масел и/или масел, отличных от рыбьего жира и МСТ. По существу, не содержит, согласно настоящего изобретения, означает, что количество составляет менее 10 весовых %, предпочтительно, менее 5 весовых %, более предпочтительно, менее 2 весовых %, особенно менее 1 весового %, например, менее 0,1 весового % на основе общего веса эмульсии.
В специфическом варианте осуществления настоящего изобретения эмульсия содержит не более 0,9% вес/вес, включая количество не более 0,8% вес/вес, или не более 0,5% вес/вес модификатора полярности, выбранного из группы, состоящей из моноглицеридов, диглицеридов, ацетилированных моноглицеридов, ацетилированных диглицеридов и/или смесей. В другом специфическом варианте осуществления настоящего изобретения эмульсия содержит моноглицерид в количестве не более 0,9% вес/вес, включая количество не более 0,8% вес/вес, такое как не более 0,5% вес/вес.
По-другому выражая, в специфических вариантах осуществления настоящего изобретения эмульсия содержит не более 30%, включая не более 20%, не более 10% или не более 5% по весу фосфолипида, модификатора полярности, выбранного из группы, состоящей из моноглицеридов, диглицеридов, ацетилированных моноглицеридов, ацетилированных диглицеридов и/или их смесей. Применение модификатора полярности в значительной концентрации по отношению к содержанию фосфолипида в эмульсиях может иметь неблагоприятный эффект на стабилизирующие свойства фосфолипида.
В специфических вариантах осуществления настоящего изобретения эмульсия типа масло-в-воде включает от 100 г/л до 300 г/л, предпочтительно, от 120 г/л до 280 г/л и, в частности, от 150 г/л до 250 г/л масла, например, 200 г/л.
В специфических вариантах осуществления настоящего изобретения существенная часть прогестогена и/или эстрогена находится внутри масляных капелек эмульсии типа масло-в-воде. В специфических вариантах осуществления настоящего изобретения, в избытке 80% прогестогена и/или эстрогена растворяется и остается в пределах масляных капелек. В специфических вариантах осуществления настоящего изобретения больше 85%, 90%, 92%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5% прогестогена и/или эстрогена растворяется в масляной фазе (определяется при 20°C).
Эмульсия типа масло-в-воде по настоящему изобретению предпочтительно, включает эмульгатор, который, в частности, присутствует в количестве до 50 г/л или до 20 г/л, предпочтительно, от 2 до 15 г/л.
Эмульсия типа масло-в-воде по настоящему изобретению может дополнительно включать один или более эмульгаторов/поверхностно-активных веществ, включая фосфолипид. В некоторых вариантах осуществления настоящего изобретения эмульгатор имеет природное происхождение. Природные эмульгаторы включают лецитин сои, лецитин яйца, лецитин подсолнечного масла, сфингозин, ганглиозиды, фитосфингозин и их комбинации. Гидрированный лецитин, т.е. продукт контролируемого гидрирования лецитина, также может быть применен в настоящем изобретении.
В специфических вариантах осуществления композиция по настоящему изобретению включает фосфолипид в качестве поверхностно-активного вещества. Типовые фосфолипиды, полезные в настоящем изобретении, включают, но не ограничены фосфатидилхолином, фосфатидилэтаноламином, фосфатидилглицеролом, фосфатидной кислотой и их смесями. Они, как правило, содержат от 4 до 22 углеродных атомов, как, например, от 10 до 18 углеродных атомов, и различные степени насыщенности. Фосфолипидный компонент композиций может представлять собой как один фосфолипид, так и смесь нескольких фосфолипидов. Применяемые фосфолипиды могут быть природными или синтетическими, но должны быть приемлемыми для парентерального, в частности, внутривенного введения.
Неисчерпывающий список подходящих фосфолипидов приведен ниже:
фосфатидные кислоты, включая 1,2-димиристоил-sn-глицеро-3-фосфатидную кислоту, натриевую соль (DMPA, Na), 1,2-дипальмитоил-sn-глицеро-3-фосфатидную кислоту, натриевую соль (DPPA, Na), 1,2-дистеароил-sn-глицеро-3-фосфатидную кислоту, натриевую соль (DSPA, Na); фосфохолины, включая 1,2-дилауроил-sn-глицеро-3-фосфохолин (DLPC), 1,2-димиристоил-sn-глицеро-3-фосфохолин (DMPC), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC); фосфоэтаноламины, включая 1,2-дилауроил-sn-глицеро-3-фосфоэтаноламин (DLPE), 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин (DMPE), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (DPPE), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE); глицеринфосфорные кислоты, включая 1,2-дилауроил-sn-глицеро-3-фосфоглицерин, натриевую соль (DLPG, Na), 1,2-димиристоил-sn-глицеро-3-фосфоглицерин, натриевую соль (DMPG, Na), 1,2-димиристоил-sn-глицеро-3-фосфо-sn-1-глицерин, соль аммония (DMP-sn-1-G, NH4), 1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин, натриевую соль (DPPG, Na), 1,2-дистеароил-sn-глицеро-3-фосфоглицерин, натриевую соль (DSPG, Na), 1,2-дистеароил-sn-глицеро-3-фосфо-sn-1-глицерин, натриевую соль (DSP-sn-1G, Na); фосфосерины, включая 1,2-дипальмитоил-sn-глицеро-3-фосфо-L-серин, натриевую соль (DPPS, Na); смешанноцепочечные фосфолипиды, включая 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (POPC), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоглицерин, натриевую соль (POPG, Na), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоглицерин, соль аммония (POPG, NH4); лизофосфолипиды, включая 1-пальмитоил-2-лизо-sn-глицеро-3-фосфохолин (P-лизо-PC), 1-стеароил-2-лизо-sn-глицеро-3-фосфохолин (S-лизо-PC); пегилированные фосфолипиды, включая N-(карбонил-метоксиполиэтиленгликоль 2000)-MPEG-2000-DPPE, натриевую соль, N-(карбонил-метоксиполиэтиленгликоль 5000)-MPEG-5000-DSPE, натриевую соль, N-(карбонил-метоксиполиэтиленгликоль 5000)-MPEG-5000-DPPE, натриевую соль, N-(карбонил-метоксиполиэтиленгликоль 750)-MPEG-750-DSPE, натриевую соль, N-(карбонил-метоксиполиэтиленгликоль 2000)-MPEG-2000-DSPE, натриевую соль.
В одном варианте осуществления настоящего изобретения количество фосфолипида в композициях согласно настоящему изобретению, по массе на основе суммарного объема композиции, находится в пределах диапазона от 0,5 до 25 г/л. В специфических вариантах осуществления настоящего изобретения фосфолипид может присутствовать в пределах диапазона от 0,7 до 20 г/л, включая диапазон от 0,8 до 18 г/л, такой как от 1 до 15 г/л.
В других специфических вариантах осуществления настоящего изобретения источником эмульгатора фосфолипида является лецитин, такой как лецитин яйца. Согласно Фармакопеи США (USP), лецитин является непатентованным названием, описывающим сложную смесь ацетон-нерастворимых фосфолипидов, которые состоят в основном из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина и фосфатидилинозитола, объединенных с различным количеством других веществ, таких как триглицериды, жирные кислоты и углеводы.
Лецитин сои и лецитин яйца (включая гидрированные формы этих соединений) имеют длительную историю безопасности в биологических системах, обладают объединенным эмульгирующим и солюбилизирующим свойством, и имеют тенденцию метаболизироваться in vivo в безвредные вещества быстрее, чем большинство синтетических поверхностно-активных веществ. Коммерчески доступные фосфолипиды/лецитин сои являются продуктами Centrophase и Centrolex (Central Soya), Phospholipon (Phospholipid GmbH, Германия), Lipoid (Lipoid GmbH, Германия), EPIKURON (Degussa) и PL90 (Fresenius Kabi, Швеция). В специфических вариантах осуществления настоящего изобретения источником фосфолипида является лецитин яйца.
В специфических вариантах осуществления настоящего изобретения общая сумма эмульгатора, включая фосфолипид, в композициях составляет в пределах диапазона от 0,5 г/л до 48 г/л, в частности, от 0,8 г/л до 42 г/л по массе на основе суммарного объема композиции. В специфических вариантах осуществления настоящего изобретения таких как, когда эмульгатор является лецитином яйца, количество эмульгатора составляет в пределах диапазона от 1 г/л до 39 г/л, такого как от 3 г/л до 29 г/л, включая диапазон от 3,5 г/л до 27 г/л, включая диапазон от 4 г/л до 26 г/л, в частности, от 10 до 20 г/л, такой как от 11 до 15 г/л.
Предпочтительно, эмульсия включает фосфолипиды, включающие фрагменты омега-3-жирных кислот, предпочтительно, фосфолипиды, получаемые из криля (Euphausiacea).
В одном варианте осуществления настоящего изобретения эмульгатор является лецитином яйца, составляющим 60-80% вес/вес, таким как 67%-ый вес/вес фосфатидилхолин; 10-20% вес/вес, такой как 15%-ый вес/вес фосфатидилэтаноламин; <=3% вес/вес, такой как 2%-ый вес/вес сфингомиэлин; и <=3% вес/вес, такой как 1%-ый вес/вес, лизофосфатидилхолин.
«Лецитин яйца PL90» (Fresenius Kabi AB) является одним примером лецитина яйца, с таким содержанием фосфолипида.
Обнаружено, что остатки омега-3-жирных кислот улучшают эффект гормонов во время терапии и профилактики. Поэтому, согласно специфическому предпочтительному варианту осуществления настоящего изобретения эмульсия типа масло-в-воде включает фосфолипиды, содержащие фрагменты омега-3-жирных кислот, предпочтительно, фосфолипиды, получаемые из криля (Euphausiacea).
Фосфолипиды, включающие остатки омега-3-жирных кислот, могут быть получены из криля. Например, крилевое масло содержит фосфолипиды, содержащие омега-3 жирные кислоты, в количестве от приблизительно 20 до приблизительно 60%, например, от приблизительно 30 до приблизительно 50% на основе веса крилевого масла. В типовом варианте осуществления настоящего изобретения крилевое масло содержит триглицериды, содержащие омега-3 жирные кислоты, в количестве менее приблизительно 30%, например, менее приблизительно 5% на основе веса крилевого масла. В типовом варианте осуществления настоящего изобретения, крилевое масло может существенно не содержать триглицеридов, содержащих омега-3-жирные кислоты. Например, и фосфолипиды (PLs), и триглицериды (TGs) обладают основой из 3 атомов углерода (триацилглицерол), где определенные функциональные группы присоединены к каждому атому углерода в положениях -1, -2 и -3, отмеченных как sn1, sn2 и sn3, соответственно. Положения sn1 и sn2 и в PLs и в TGs могут содержать длинноцепочечные жирные кислоты, такие как соединения с 18 атомами углерода (например, линолевую, альфа-линоленовую, олеиновую и стеариновую кислоты) и/или очень длинноцепочечные жирные кислоты, содержащие 20 или более атомов углерода (например, арахидоновую, эйкозапентаеновую, докозапентаеновую и докозагексаеновую кислоты). В TGs положение sn3 также занято вышеуказанными длинноцепочечными жирными кислотами, и как таковые, эти соединения известны как «нейтральный жир», тогда как в PLs положение sn3 занято фосфорной кислотой, связанной со спиртом, таким как холин, этаноламин, серин, инозитол и т.д., который значительно изменяет молекулу, придавая ей свойство и гидрофильности, и гидрофобности, известный как амфифильное соединение. Как часть структуры биологических мембран и обладая амфифильными свойствами, PL играют жизненно важную ролью во многих метаболических процессах.
В типовом варианте осуществления настоящего изобретения предопределенное количество фосфолипидов, содержащих омега-3-жирные кислоты, содержат омега-3-жирные кислоты, присоединенные в положениях один и два у фосфолипида, но не в положении три у фосфолипида. Таким образом, предопределенное количество фосфолипидов, содержащих омега-3-жирные кислоты, может содержать омега-3-жирные кислоты в положении два (т.е. среднем положении) у фосфолипида. Например, фосфолипиды, содержащие омега-3-жирные кислоты, содержащие омега-3-жирные кислоты, присоединенные в положениях один и два у фосфолипида, но не в положении три у фосфолипида, могут присутствовать в количестве от приблизительно 70% до приблизительно 80%, например, от приблизительно 80% до приблизительно 95% на основе общего веса фосфолипида, содержащего омега-3-жирные кислоты.
Согласно другому типовому аспекту описан способ парентерального введения эмульсии типа масло-в-воде, способ, включающий парентеральное введение человеку композиции, содержащей фосфолипиды, получаемые из морских ракообразных, в виде парентеральной эмульсии типа масло-в-воде, которая содержит защитные концентрации природного антиоксиданта, астаксантина, против химического распада или окисления присутствующих ненасыщенных омега-3-жирных кислот. Окисление полиненасыщенной омега-3-жирной кислоты приводит к образованию форм реактивных с кислородом, которые могут быть вредными при внутривенном введении. Таким образом, определенная обогащенная омега-3-жирными кислотами эмульсия типа масло-в-воде нуждается в защите от химического распада. Астаксантин, обнаруживаемый в крилевом масле, может обеспечивать уникальную защиту против окисления омега-3-жирных кислот, подобно присутствию альфа-токоферола в соевом масле, которое защищает от окисления омега-6-жирных кислот. Также как в фосфолипидах морского происхождения, обнаруживаемых в крилевом масле, содержащиеся n3-ЖК в высокой концентрации, могут уникально усиливать физическую устойчивость эмульсии, присутствие астаксантина в крилевом масле уникально усиливает химическую устойчивость эмульсии типа масло-в-воде. В качестве типовых аспектов крилевого масла как основного поверхностно-активного вещества или вспомогательного поверхностно-активного вещества с фосфолипидами яйца, может быть, что астаксантин может являться основным антиоксидантом или cо-антиоксидантом с альфа-токоферолом.
Дополнительным альтернативным вариантом осуществления настоящего изобретения является гормонсодержащая эмульсия типа масло-в-воде для парентерального введения, включающая
a) прогестоген и/или эстроген, как определено выше и
b) фосфолипид, получаемый из морских ракообразных, как определено выше.
В одном варианте осуществления настоящего изобретения эмульсия включает не более 1,5% вес/вес, не более 1,2% вес/вес или не более 0,8% вес/вес, включая не более 0,4% вес/вес, полиэтиленгликоль 15-гидроксистеарат. В другом варианте осуществления настоящего изобретения композиции включают не более 1,5% вес/вес, не более 1,2% вес/вес или не более 0,8% вес/вес, включая не более 0,4% вес/вес сложного эфира полиэтиленгликоля и/или полиэтилен-пропиленгликоля.
В соответствии с некоторыми вариантами осуществления, настоящее изобретение описывает фармацевтические композиции, включающие прогестоген и/или эстроген, в котором указанные композиции находятся в форме эмульсии, включающей водную фазу, масляную фазу и поверхностно-активное вещество.
Водная среда
Как указано выше, эмульсия типа масло-в-воде по настоящему изобретению дополнительно включает водную среду. «Водная среда» или «водная фаза» относятся к водосодержащей жидкости. В некоторых вариантах осуществления настоящего изобретения водная среда является водой и/или водным буферным раствором.
Эмульсии типа масло-в-воде по настоящему изобретению могут включать от 70 до 98 весовых %, предпочтительно, от 70 до 90 весовых % воды.
В некоторых вариантах осуществления настоящего изобретения эмульсия может включать от 0 до 4 мМ физиологически совместимого буферного агента.
В некоторых вариантах осуществления настоящего изобретения эмульсии типа масло-в-воде согласно настоящему изобретению по желанию включают вспомогательное поверхностно-активное вещество. Вспомогательные поверхностно-активные вещества, подходящие для применения в эмульсиях по настоящему изобретению, являются такими, которые предотвращают выпадение хлопьев и/или коалесценцию липидной эмульсии. Типовые вспомогательные поверхностно-активные вещества включают, но не ограничены холестерином, олеиновой кислотой, олеатом, Tween80 (ПЭГ-сорбитанмоноолеат), HCO-60, Solutol H15 (полиоксиэтилен-660-гидроксистеарат), ПЭГ 400 (полиэтиленгликоль), Pluronic F68 (BASF), Cremophor EL (полиоксиэтилен-35-рицинолеат) или соль желчной кислоты, такой как дезоксихолевая кислота. В других вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество выбрано из группы, состоящей из C12-C22 жирных кислот, их солей и/или их смесей, таких как C16-C20 жирные кислоты, их соли и/или их смеси, или из C18 жирных кислот, их солей их и/или их смесей. В специфических вариантах осуществления настоящего изобретения жирная кислота является мононенасыщенной.
В некоторых вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество может присутствовать в композициях в количестве (вес/объем) большем или равном 0,005%, большем или равном 0,01% или большем или равном 0,02%. В соответствии с любым из этих вариантов осуществления вспомогательное поверхностно-активное вещество может присутствовать в количестве (вес/объем) меньшем или равном 4%, меньшем или равном 1% или меньшем или равным 0,04%.
В специфических вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество выбрано из группы, состоящей из длинноцепочечных жирных кислот, таких как пальмитиновая кислота, олеиновая кислота или стеариновая кислота, или их солей щелочных металлов. Олеат и/или олеиновая кислота, особенно олеат натрия, являются особенно подходящими вспомогательными поверхностно-активными веществами.
В специфических вариантах осуществления настоящего изобретения, где вспомогательное поверхностно-активное вещество является олеатом и/или олеиновой кислотой, вспомогательное поверхностно-активное вещество может присутствовать в количестве (вес/объем) равном или большем 0,005%, равном или большем 0,01% или равном или большем 0,02%. В соответствии с любым из этих вариантов осуществления, вспомогательное поверхностно-активное вещество может присутствовать в количестве (вес/объем) меньшем или равном 0,5%, меньшем или равном 0,2%, меньшем или равном 0,1% или меньшем или равном 0,05%. В специфических вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество является олеатом натрия и присутствует в количестве 0,03% вес/объем (0,3 г/л). Эмульсии, приведенные в настоящем описании, могут быть подходящими для парентерального введения, такого как внутривенная инъекция или внутривенное вливание, в течение длительных периодов. Типичная продолжительность лечения может составлять, например, 3-7 дней. В специфических вариантах осуществления настоящего изобретения концентрация определенных вспомогательных поверхностно-активных веществ поэтому сведена к минимуму, чтобы предотвратить побочные эффекты, такие как раздражение, ингибирование цитохрома P450 и т.д. В специфических вариантах осуществления настоящего изобретения Pluronic F68 (поли(этиленгликоль)-13-поли(пропиленгликоль cо-пропиленгликоль) присутствует в количестве менее 0,7% (вес/вес) или менее 0,5% (вес/вес). В других специфических вариантах осуществления настоящего изобретения Solutol-HS (макрогол-15-гидроксистеарат) присутствует в количестве менее 1,2% (вес/вес) или менее 1% (вес/вес).
Осмотический агент
Эмульсия типа масло-в-воде согласно настоящему изобретению может включать осмотический агент и/или модулятор тоничности. Такие композиции могут обладать осмоляльностью в диапазоне 200-1000 мОсмоль/кг.
В соответствии с определенными вариантами осуществления настоящего изобретения эмульсии могут быть изотоническими и изоосмотическими. Композиции могут иметь осмоляльность 220-600 мОсмоль/кг или 230-360 мОсмоль/кг.
Подходящие агенты осмотические и/или модулирующие тоничность включают хлорид калия или натрия, тригалозу, сахарозу, сорбит, глицерин, глюкозу, ксилит, маннитол, полиэтиленгликоль, пропиленгликоль, белок, аминокислоту и их смеси. В специфических вариантах осуществления настоящего изобретения осмоляльность 270-330 мОсмоль/кг, такая как 280-300 мОсмоль/кг, достигается посредством агента, который также увеличивает осмотическое давление, такого как глицерин, декстроза, лактоза, сорбит или сахароза.
В одном варианте осуществления настоящего изобретения осмотический агент является физиологически приемлемым полиолом, таким как глицерин, сорбит или ксилит. В специфическом варианте осуществления настоящего изобретения осмотический агент является глицерином.
Осмотический агент и/или агент регулирующий тоничность, в целом, применяют в количестве, которое не вызывает неблагоприятные биологические эффекты, но является достаточным для получения изосмотических и/или изотонических композиций. Когда глицерин является осмотическим агентом, глицерин может присутствовать в диапазоне от 2 до 5% (вес/объем), таком диапазоне как от 2,1% до 2,9% (вес/объем), включая диапазон от 2,3% до 2,7%. В специфических вариантах осуществления эмульсии по настоящему изобретению включают 2,5% глицерина (25 г/л).
pH-регулирующий агент
В некоторых вариантах осуществления эмульсии по настоящему изобретению имеют pH в пределах диапазона от pH 6,0 до pH 9,0, такого как pH 6,5 до pH 8,5, включая pH от 7,0 до 8,0. pH композиций может быть отрегулирован способами, известными в области техники, например, с помощью соответствующего основания, которое нейтрализует отрицательный заряд на жирных кислотах, с помощью соответствующего буфера или их комбинации. Множество оснований и буферов являются подходящими для применения с эмульсиями по настоящему изобретению. Специалист в области техники оценит, что добавление буфера к эмульсии влияет не только на итоговый pH, но также и на ионную силу эмульсии. Буферы с высокой ионной силой могут отрицательно влиять на дзета-потенциал эмульсии и, поэтому, не желательны. В специфических вариантах осуществления pH регулируют до желаемого значения путем добавление 1н гидроксида натрия.
Необязательные добавки
Эмульсия согласно настоящему изобретению, по желанию, включает одну или более фармацевтически приемлемых добавок, таких как связывающие, хелатирующие, комплексообразующие агенты, консервирующие средства (включая противомикробные препараты и антиоксиданты), модификаторы вязкости и другие биологически совместимые материалы или терапевтические средства.
Соотношения компонентов в композиции
В то время как типовое количество различных компонентов, которые могут быть включены в композиции по настоящему изобретению, сформулировано выше, другие аспекты настоящего изобретения относятся к соотношениям определенных компонентов, как рассмотрено ниже.
Эмульгатор (фосфолипид): масло
Обнаружено, что избыточное количество фосфолипида в эмульсиях типа масло-в-воде может приводить к увеличению продуктов разложения фосфолипида после автоклавирования и/или хранения, вызывая понижение pH, что в свою очередь отрицательно влияет на устойчивость эмульсии.
В предпочтительном варианте осуществления настоящего изобретения, в таком где эмульгатор является фосфолипидом, эмульсии включают эмульгатор в количестве (выраженном в % вес/вес от всего масляного компонента) в пределах диапазона от 6,8 до 43%, таком диапазоне как от 8,4 до 42,5%, включая диапазон от 12 до 26%, такой как от 14 до 25%, включая диапазон от 15 до 22%. В специфическом варианте осуществления настоящего изобретения эмульгатор является фосфолипидом и присутствует в количестве от 16 до 18% (вес/вес) масла.
В дополнительно предпочтительных вариантах осуществления настоящего изобретения эмульсии типа масло-в-воде включают фосфолипид в количестве, выраженном в % вес/вес масла, большем или равном 6,8%, большем или равном 8,4%, большем или равном 12%, большем или равном 14% или большем или равном 15%. В некоторых вариантах осуществления настоящего изобретения композиции включают фосфолипид в количестве, выраженном в % вес/вес масла, меньшем или равном 43%, меньшем или равном 42,5%, меньшем или равном 26%, меньшем или равном 25% или меньшем или равном 22%.
В другом предпочтительном варианте осуществления настоящего изобретения, таком, где источником фосфолипида является лецитин, композиции включают лецитин в количестве в пределах диапазона от 3 до 20% масла (вес/вес), таком как от 4 до 18% масла (вес/вес), включая диапазон от 6 до 16% масла (вес/вес), таком как от 8 до 14% масла (вес/вес). В специфическом варианте осуществления настоящего изобретения эмульгатор является лецитином яйца и присутствует в количестве от 19 до 21% (вес/вес) масла.
В некоторых вариантах осуществления настоящего изобретения эмульсии по настоящему изобретению включают лецитин, такой как лецитин яйца, в количестве, выраженном в % вес/вес масла, большем или равном 8%, большем или равном 10%, большем или равном 13%, большем или равном 15% или большем или равном 18%. В некоторых вариантах осуществления настоящего изобретения композиции включают лецитин, такой как лецитин яйца, в количестве, выраженном в % вес/вес масла, меньшем или равном 50%, меньшем или равном 48%, меньшем или равном 40%, меньшем или равном 33% или меньшем или равном 31%.
Вспомогательное поверхностно-активное вещество: масло
Как указано выше, в специфических вариантах осуществления настоящего изобретения композиции включают вспомогательное поверхностно-активное вещество, такое как олеат или олеиновая кислота. В специфических вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество может присутствовать в количестве, выраженном в % вес/вес масляного компонента, в пределах диапазона от 0,08 до 2%, такого как от 0,1 до 0,9%, включая диапазон от 0,3 до 0,7%. В другом варианте осуществления настоящего изобретения вспомогательное поверхностно-активное вещество присутствует в количестве, больше чем 0,02% вес/вес указанного масла. В специфическом варианте осуществления настоящего изобретения вспомогательное поверхностно-активное вещество является олеатом или олеиновой кислотой и присутствует в количестве 0,5% масла (вес/вес).
В некоторых вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество присутствует в количестве, выраженном в % вес/вес масла, большем, чем 0,02, большем или равном 0,08%, большем или равном 0,1% или большем или равном 0,3%. В других вариантах осуществления настоящего изобретения концентрация вспомогательного поверхностно-активного вещества в количестве, выраженном в % вес/вес масла, составляет меньше или равна 2%, меньше или равна 0,9% или меньше или равна 0,7%.
Вспомогательное поверхностно-активное вещество: эмульгатор (фосфолипид)
В предпочтительном варианте осуществления настоящего изобретения композиции включают фосфолипид как эмульгатор, и вспомогательное поверхностно-активное вещество, такое как олеат. В специфических аспектах этих вариантов осуществления вспомогательное поверхностно-активное вещество и эмульгатор могут присутствовать в соотношении вспомогательного поверхностно-активного вещества к фосфолипиду (вес/вес) в пределах диапазона от 1:85 до 1:12, такого как от 1:82 до 1:17, включая диапазон от 1:68 до 1:20, такой как от 1:51 до 1:26, включая диапазон от 2:85 до 1:34.
В предпочтительных вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество и фосфолипид присутствуют в соотношении вспомогательного поверхностно-активного вещества к фосфолипиду (вес/вес), большем или равном 1:85, большем или равном 1:82, большем или равном 1:68, большем или равном 1:51, или большем или равном 2:85. В некоторых вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество и фосфолипид присутствуют в соотношении вспомогательного поверхностно-активного вещества к фосфолипиду (вес/вес), меньшем или равном 1:12, меньшем или равном 1:17, меньшем или равном 1:20, меньшем или равном 1:26, или меньшем или равном 1:34.
В другом предпочтительном варианте осуществления настоящего изобретения композиции включают лецитин яйца как эмульгатор, и вспомогательное поверхностно-активное вещество, такое как олеат. В специфических аспектах этих вариантов осуществления вспомогательное поверхностно-активное вещество и эмульгатор могут присутствовать в соотношении вспомогательного поверхностно-активного вещества к лецитину (вес/вес) в пределах диапазона от 1:100 до 1:15, такого как от 1:80 до 1:20, включая диапазон от 1:70 до 3:70, такого как от 1:60 до 1:30, включая диапазон от 1:50 до 1:40.
В специфических вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество и лецитин присутствуют в соотношении вспомогательного поверхностно-активного вещества к лецитину (вес/вес) большем или равном 1:100, большем или равном 1:80, большем или равном 1:70, большем или равном 1:60, или большем или равном 1:50. В некоторых вариантах осуществления настоящего изобретения вспомогательное поверхностно-активное вещество и лецитин присутствуют в соотношении (вес/вес) меньшем или равном 1:15, меньшем или равном 1:20, меньшем или равном 3:70, меньшем или равном 1:30, или меньшем или равном 1:40.
В специфическом варианте осуществления настоящего изобретения, в котором вспомогательное поверхностно-активное вещество является олеатом, и эмульгатор является лецитином яйца, соотношение вспомогательного поверхностно-активного вещества к эмульгатору (вес/вес) составляет в пределах диапазона от 1:45 до 1:20, такого как от 1:40 до 1:25.
Упаковка
Эмульсия типа масло-в-воде по настоящему изобретению может быть предоставлена в виде готовых к применению композиций. «Готовый к применению», как применено в настоящем описании, обозначает, что не требуется никакого дополнительного составления в композицию, такого как растворение или смешивание вместе многих компонент.
Эмульсия типа масло-в-воде по настоящему изобретению может быть предоставлена в герметичной упаковке. Упаковка должна быть подходящей для применения с липидными композициями и прогестогенами и/или эстрогеном. Примеры материалов, менее подходящих для упаковки масляных композиций, включают ПВХ и ДЭГФ. Подходящая упаковка, которая является совместимой с масляными композициями, включает, но не ограничена пакетами на основе полипропилена и стеклянными баллонами. Обыкновенное стекло является подходящим упаковочным материалом для композиций по настоящему изобретению. В специфических вариантах осуществления настоящего изобретения эмульсию упаковывают в герметичные емкости. Емкость может быть обернута для обеспечения защиты физического влияния среды. В одном варианте осуществления настоящего изобретения композиция упакована в герметические емкости объемом 250 мл. В одном варианте осуществления настоящего изобретения эмульсия типа масло-в-воде упакована в герметическую емкость с объемом свободного пространства, заполненным инертным газом.
В некоторых вариантах осуществления настоящего изобретения композиции упакованы в инертные емкости. В некоторых вариантах осуществления настоящего изобретения инертные емкости слабо смыкаются. В других вариантах осуществления настоящего изобретения емкость включает двухслойную стену, и, в более специфических вариантах осуществления настоящего изобретения, область между этими двумя слоями заполнена инертным газом, чтобы предотвратить окисление. Для длительного хранения материал упаковки преимущественно предотвращает диффузию кислорода из окружающей атмосферы к композициям по настоящему изобретению, чтобы предотвратить образование продуктов окислительного распада в композициях.
В некоторых вариантах осуществления настоящего изобретения композиция упакована в единичной дозе. Единичная доза может обеспечивать достаточное количество композиции для введения прогестогена и/или болюсную дозу эстрогена для пациента, или для введения композиции в течение предопределенного промежутка времени, такого как первый час, первые 2 часа, первые 4 часа лечения и т.д. Единичная доза позволяет быстрое и удобное введение композиции в экстренных ситуациях, например, медработниками в машине скорой помощи, или первыми санитарами/медиками на месте получения травмы/происшествия. Неограничивающими примерами форм единичной дозы являются инъекции, наполненные шприцы, стеклянные пузырьки и/или герметичные пакеты.
В некоторых вариантах осуществления настоящего изобретения композиция упаковывается внутри устройства, подобного устройству-дозатору инсулина, которое применяют при осуществлении непрерывной инфузионной терапии, или картриджа, разработанного для применения с таким устройством. Типовыми дозаторами инсулина являются таковые, продаваемые MiniMed и Disetronic. Такие дозаторы могут включать например, канюлю, резервуар дозатора или картридж, в котором хранится композиция, дозатор, который может работать от батареи, и средства, позволяющие пользователю регулировать точное количество доставляемого активного вещества, такие как например, компьютерная микросхема.
Специфический пример
В одном специфическом варианте осуществления настоящего изобретения эмульсия по настоящему изобретению включает:
a) прогестерон в количестве в пределах от 1,0 до 2,0 г/л;
b) от 100 до 300 г/л на основе эмульсии типа масло-в-воде масляного компонента, включающей
i) по меньшей мере, 50 весовых % триглицеридов рыбьего жира, где триглицерид рыбьего жира состоит из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанных жирных кислот, и предпочтительно, общая сумма омега-3-жирных кислот составляет, по меньшей мере, 50% по весу указанных жирных кислот; и
ii) от 10 до 50 весовых % MCT на основе общего веса масляного компонента;
c) от 4 до 20 г/л фосфолипида, предпочтительно, от 8 до 20 г/л фосфолипида и
d) от 10 до 50 г/л глицерина.
В одном специфическом варианте осуществления настоящего изобретения эмульсия по настоящему изобретению включает
a) эстрадиол в количестве в пределах от 0,05 до 1,0 г/л и прогестерон в количестве в пределах от 1,0 до 2,0 г/л;
b) от 100 до 300 г/л на основе эмульсии типа масло-в-воде масляного компонента, включающей
i) по меньшей мере, 50 весовых % триглицеридов рыбьего жира, где триглицерид рыбьего жира состоит из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанных жирных кислот, и предпочтительно, общая сумма омега-3-жирных кислот составляет, по меньшей мере, 50% по весу указанных жирных кислот; и
ii) от 10 до 50 весовых % MCT на основе общего веса масляного компонента;
c) от 4 до 20 г/л фосфолипида, предпочтительно, от 8 до 20 г/л фосфолипида и
d) от 10 до 50 г/л глицерина.
В одном специфическом варианте осуществления настоящего изобретения эмульсия по настоящему изобретению включает
a) эстрадиол в количестве в пределах от 0,05 до 1,0 г/л;
b) от 100 до 300 г/л, на основе эмульсии типа масло-в-воде масляного компонента, включающей
i) по меньшей мере, 50 весовых % триглицеридов рыбьего жира, где триглицерид рыбьего жира состоит из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанных жирных кислот, и предпочтительно, общая сумма омега-3-жирных кислот составляет, по меньшей мере, 50% по весу указанных жирных кислот; и
ii) от 10 до 50 весовых % MCT на основе общего веса масляного компонента;
c) от 4 до 20 г/л фосфолипида, предпочтительно, от 8 до 20 г/л фосфолипида и
d) от 10 до 50 г/л глицерина.
Свойства эмульсии
Композиции согласно настоящему изобретению, как правило, являются молочными белыми на вид и представляются как визуально гомогенные эмульсии.
Распределение капельных частиц по размерам в эмульсии
Величина PFAT5
Фармакопея США (USP) устанавливает предел для распределения по размеру глобул в липидных эмульсиях для инъекций (USP 729-Pharm. Forum. 2005; 3:1448-1453). Предел для жировых глобул диаметром >5 мкм в инъекционных эмульсиях, выраженный в процентах средневзвешенных по объему жировых частиц >5 мкм не превышает 0,05%, или PFAT5 не превышает 0,05% (USP 729-Pharm. Forum. 2005; 3:1448-1453). Композиции, для которых PFAT5 превышает 0,05%, считаются небезопасными для внутривенного введения. Значение PFAT5 для эмульсии может зависеть от нескольких факторов, включая общее содержание масла в эмульсии, типа и количества фосфолипида, выбора вспомогательного поверхностно-активного вещества, соотношения вспомогательного поверхностно-активного вещества и масла и устойчивости эмульсионных капелек к коалесценции и/или выпадению хлопьев.
В специфических вариантах осуществления композиции по настоящему изобретению имеют значение PFAT5 меньше или равное 0,05%, такое как меньше или равное 0,04%, включая значение меньше или равное 0,02%, такое как меньше или равное 0,01%.
В одном варианте осуществления настоящего изобретения 100% эмульсионных капелек композиции по настоящему изобретению имеют диаметр меньше или равный 5 мкм, и, по меньшей мере, 98% капелек, включая 99% капелек, имеют диаметр меньше или равный 1,5 мкм. Распределение капельных частиц диаметром более 1 мкм по размерам определяют при помощи счетчика Coulter (Coulter Multisizer III).
PCS
В одном варианте осуществления настоящего изобретения капельки с диаметром меньше или равным 1 мкм, обладают максимальным z-средним PCS равным 350 нм и/или значение полидисперсии PCS не более 0,25. В специфическом варианте осуществления настоящего изобретения капельки с диаметром меньше или равным 1 мкм обладают максимальным z-средним равным 250 нм и/или значением полидисперсии не более 0,20. В даже более специфическом варианте осуществления настоящего изобретения капельки с диаметром меньше или равным 1 мкм обладают максимальным z-средним равным 220 нм и/или значением полидисперсии не более 0,15.
Медианный размер капель
Размер капель в эмульсии является основным ключевым параметром, определяющим кинетику дестабилизации эмульсии, поскольку размер капель непосредственно влияет на скорость таких явлений, как, коалесценция, расслоение, образование хлопьевидного осадка, Оствальдовское созревание осадка и в конечном счете разделение фаз. Размер капель в эмульсии поэтому является показательным для устойчивости эмульсии. Множество параметров влияет на размер капель в эмульсии, включая, например, тип масла, поверхностно-активное вещество и тип вспомогательного поверхностно-активного вещества, наличие активных ингредиентов, количество масла, соотношение масла и поверхностно-активного вещества и соотношение масла и вспомогательного поверхностно-активного вещества.
В специфическом варианте осуществления в композициях по настоящему изобретению поддерживается медианный по объему диаметр, или D[4,3], равный <=300 нм, такой как <=230 нм, включая приблизительно <=200 нм, такой как <=185 нм, включая приблизительно <=180 нм, после автоклавирования при 121°C в течение 15 минут, и/или после хранения при 60°C в течение, по меньшей мере, 3 недель, включая 4 недели.
Средний размер капель
В одном варианте осуществления настоящего изобретения капельные частицы в эмульсии для композиций по настоящему изобретению имеют средний по объему диаметр, или d(0,5), равный <=320 нм, такой как <=250 нм, включая <=200 нм, такой как <=185 нм, включая <=180 нм. Предпочтительно, капельные частицы варьируют в пределах от 240 до 320 нм.
В специфическом варианте осуществления в композициях по настоящему изобретению поддерживается средний по объему диаметр, или d(0,5), равный <=300 нм, такой как <=250 нм, включая <=200 нм, такой как <=185 нм, включая <=180 нм, после автоклавирования при 121°C в течение 15 минут, и/или после хранения при 60°C в течение, по меньшей мере, 3 недель, включая 4 недели.
Дзета-потенциал
Дзета-потенциал имеет отношение к устойчивости эмульсии. Эмульсии с высоким дзета-потенциалом являются электрически стабилизированными, в то время как таковые с низким дзета-потенциалом склонны к коагуляции или образованию хлопьевидного осадка. На дзета-потенциал эмульсий влияют например, выбор и количество поверхностно-активного вещества и вспомогательного поверхностно-активного вещества, pH эмульсий, так же как ионная сила водного раствора.
В одном варианте осуществления настоящего изобретения композиции по настоящему изобретению имеют дзета-потенциал в пределах диапазона от -30 мВ до -70 мВ, такого как от -40 мВ до -65 мВ, включая диапазон от -51 мВ до -60 мВ. Кроме того, дзета-потенциал эмульсионных композиций по настоящему изобретению может составлять -30 мВ, -35 мВ, -40 мВ, -45 мВ, -50 мВ, -55 мВ, -60 мВ, -65 мВ или-70 мВ или выше.
Частицы
В специфических вариантах осуществления эмульсии по настоящему изобретению не содержат кристаллическое твердое вещество при температуре окружающей среды (например, при одной или более температурах, выбранных из 4°C, от 2°C до 8°C или от 20°C до 25°C). В специфических вариантах осуществления настоящего изобретения эмульсионные композиции по настоящему изобретению соответствуют стандартам размеров и количества частиц в инъекционных жидкостях (USP 788, Способ 2 - Microscopic Particle count test). Например, композиции могут содержать 0-12 частиц на мл размером равным или большим 10 мкм, и 0-2 частицы на мл размером равным или большим 25 мкм.
Устойчивость эмульсий
Стерильность
В специфических вариантах осуществления эмульсии согласно настоящему изобретению являются стерильными. Как применено в настоящем описании, «стерильный» относится к композициям, отвечающим требованиям Главы <71> USP. В специфических вариантах осуществления настоящего изобретения композиции отвечают требованиям Главы <85> USP «Bacterial endotoxin test», и по желанию, дополнительно отвечают требованиям Главы <151> USP «pyrogen test».
В специфических вариантах осуществления в эмульсиях по настоящему изобретению достигается улучшенная растворимость прогестерона и/или эстрогена, при этом с поддержанием или улучшением химической устойчивости и/или физической устойчивости эмульсий. В специфических вариантах осуществления настоящего изобретения композиции могут быть стерилизованы нагреванием путем обработки в автоклаве при 121°C в течение 15 минут, не подвергая риску физическую или химическую целостность эмульсий. Стерилизация путем обработки в автоклаве является выгодной не только с точки зрения микробиологической безопасности, но также и в финансовом отношении является более рентабельной, по сравнению, например, со стерилизацией фильтрованием.
Кроме того, в специфических вариантах осуществления настоящего изобретения эмульсии демонстрируют преимущества безопасности перед предшествующим уровнем техники, такие как, например, (a) композиции отвечают стандартам размера и количества частиц в инъекционных жидкостях (USP 788, Способ 2) и/или имеют меньший уровень содержания кристаллов прогестогена и/или эстрогена, (b) композиции имеют низкое значение PFAT5 (как рассмотрено более подробно выше), (c) композиции имеют более низкие уровни содержания химических примесей, (d) композиции могут быть автоклавированы с применением способа золотого стандарта микробиологической безопасности и/или (e) композиции не содержат спирта или потенциально токсичных органических растворителей.
В результате одного или более вышеописанных преимуществ композиций, приведенных в настоящем описании, эмульсии обеспечивают улучшенную доступность содержащегося в них прогестогена (например, хорошая фармакокинетика и биодоступность, могут быть отражены в уровнях гормона в сыворотке крови и/или концентрации в плазме), и
введение эмульсий обеспечивает улучшенную системность в дозировании для пациента относительно композиций предшествующей области техники.
Наконец, эмульсионные композиции согласно настоящему изобретению в дополнение к тому, что они удобны и безопасны в применении, с преимуществом предоставляются в стерильной, готовой для применения форме, имеют срок хранения 1 или 2 года при комнатной температуре.
Получение
Дополнительный вариант осуществления настоящего изобретения является способом получения эмульсии типа масло-в-воде по настоящему изобретению.
Способ включает стадии:
a) растворение прогестогена и/или эстрогена в масляной фазе, включающей триглицериды рыбьего жира, где триглицериды рыбьего жира состоят из глицерина, который этерифицирован жирными кислотами, где указанные жирные кислоты включают эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA) в количестве, по меньшей мере, 45% по весу указанных жирных кислот и, предпочтительно, общая сумма омега-3-жирных кислот составляет, по меньшей мере, 60% по весу указанных жирных кислот;
b) эмульгирование масляной фазы в водной фазе, предпочтительно, в присутствии эмульгатора.
В другом аспекте настоящее изобретение относится к способу получения композиций эмульсии типа масло-в-воде, как определено в настоящем описании ранее, где указанный способ включает стадии:
a) объединение воды и фосфолипида и, по желанию, осмотического агента для получения водной композиции;
b) объединение прогестогена и/или эстрогена и масла для получения масляной композиции; и
c) объединение водной композиции и масляной композиции с последующей гомогенизацией для образования гомогенной эмульсии типа масло-в-воде.
Согласно специфическому варианту осуществления водную композицию гомогенизируют так, чтобы получить гомогенную суспензию перед тем, как указанная водная композиция будет объединена с масляной композицией. В другом преимущественном варианте осуществления настоящего изобретения прогестоген и/или эстроген добавляют к маслу при температуре, по меньшей мере, 40°C, чтобы ускорить разведение прогестогена и/или эстрогена. В других специфических вариантах осуществления настоящего изобретения масляную композицию фильтруют перед объединением с водной композицией.
В некоторых очень специфических вариантах осуществления настоящего изобретения способы получения включают следующие стадии:
A) растворение опционального осмотического агента в водной среде и перемешивание;
B) добавление эмульгатора, такого как лецитин яйца, и перемешивание;
C) по желанию, добавление вспомогательного поверхностно-активного вещества и, по желанию, pH-регулирующего агента и смешивание;
D) растворение прогестогена и/или эстрогена в масле для получения масляной фазы;
E) фильтрование масляной фазы, с последующим добавлением фильтрованной масляной фазы к водной фазе и смешивание;
F) гомогенизация для получения гомогенной эмульсии;
G) опциональное добавление воды;
H) опциональное добавление достаточного количества 1н NaOH для приведения pH к pH диапазону 8,0-8,8;
I) опциональное добавление достаточного количества водной среды для получения итогового объема.
В специфическом варианте осуществления настоящего изобретения гомогенизацию проводят при давлении большем или равном 350 бар, или большем или равном 370 бар.
В специфических вариантах осуществления настоящего изобретения способы получения эмульсий включают стадии растворения лецитина яйца в водной среде (а не в масле), добавления масляной фазы к водной фазе (а не наоборот) и гомогенизацию при давлении, большем или равном 350 бар. Считается, что эти стадии приводят к получению эмульсий с выгодными свойствами с точки зрения размера частиц и устойчивости эмульсии.
В других специфических вариантах осуществления настоящего изобретения эмульсию упаковывают в герметизированные емкости и стерилизует таким путем, как нагревание, по меньшей мере, до 121°C (например, от 121°C до 123°C) в течение минимум 15 минут времени выдержки. Программа автоклава может быть вращательным циклом.
В других очень специфических вариантах осуществления настоящего изобретения способы получения включают следующие стадии:
A) растворение осмотического агента в водной среде и перемешивание;
B) добавление фосфолипида, в частности, лецитина яйца, и перемешивание;
C) по желанию, добавление вспомогательного поверхностно-активного вещества и pH-регулирующего агента и смешивание;
D) растворение прогестерона и/или эстрогена в триглицеридах рыбьего жира для получения масляной фазы;
E) фильтрование масляной фазы с последующим добавлением фильтрованной масляной фазы к водной фазе и смешивание;
F) гомогенизация для получения гомогенной эмульсии;
G) опциональное добавление воды;
H) опциональное добавление достаточного количества 1н NaOH для приведения pH к диапазону pH 8,0-8,8;
I) опциональное добавление достаточного количества водной среды для получения итогового объема.
Далее приводится подробный пример способа получения. Специалист легко поймет, что могут быть сделаны различные модификации и вариации, и они все еще будут оставаться в рамках объема настоящего изобретения.
Способ лечения
Дополнительный вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, включающую или состоящую из эмульсии типа масло-в-воде по настоящему изобретению.
Предпочтительно, фармацевтическая композиция по настоящему изобретению предназначена для применения в лечении или профилактике неврологического повреждения после приступов и/или травмы.
Согласно дополнительному предпочтительному варианту осуществления фармацевтическая композиция по настоящему изобретению предназначена для применения в лечении или профилактике неврологического повреждения после сотрясения или для применения в лечении или профилактике травматических случаев.
Эмульсии, приведенные в настоящем описании, могут быть введены парентерально, так как внутривенно или внутриартериально пациентам с терапевтической или профилактической целью применения. В специфических вариантах осуществления настоящего изобретения субъект является млекопитающим, таким как человек.
Эмульсии, приведенные в настоящем описании, обладают нейропротекторными и/или нейрорегенеративными свойствами. Поэтому композиции являются полезными в лечении или профилактике нарушений нервной системы или состояний. Типовые нарушения и состояния включают, но не ограничены ими, нарушения или состояния центральной нервной системы (ЦНС), повреждение спинного мозга, черепно-мозговая травма, умеренная черепно-мозговая травма, включая сотрясение, характеризующееся временной потерей функции мозга, педиатрическую травму головного мозга, дегенеративные нарушения ЦНС, такие как болезнь Паркинсона, деменция, включая болезнь Альцгеймера, демиелинизирующие состояния, такие как рассеянный склероз и хроническая, диабетическая периферическая невропатология.
Другие типовые нарушения и состояния включают ишемические неврологические состояния, такие как ишемическое поражение ЦНС, инсульт, включая ишемический инсульт, геморрагический инсульт и переходящее ишемическое нарушение и нейрокогнитивные повреждения, связанные с операцией в условиях искусственного кровообращения, например, постперфузионный синдром. Дополнительные примеры включают афазию, нарушение сна и тревожные расстройства, такие как посттравматическое стрессовое расстройство.
Композиции также являются полезными для ослабления симптомов, связанных с вышеперечисленными нарушениями, как восстановление когнитивной функции, восстановление режима сна, нормализация расстройств настроения и т.д. Фармацевтические композиции также являются полезными для лечения посттравматических стрессовых расстройств.
В соответствии с одним вариантом осуществления настоящее изобретение описывает способы лечения млекопитающих пациентов с травматическим повреждением ЦНС, таким как черепно-мозговая травма. Типовые способы включают лечение ЧМТ у млекопитающего пациента путем введения нуждающемуся в этом пациенту фармацевтической композиции согласно настоящему изобретению, так, что доставляется терапевтически эффективная концентрация прогестогена и/или эстрогена. В специфическом варианте осуществления настоящего изобретения млекопитающим пациентом является человек. Например, способы по настоящему изобретению могут включать парентеральное введение содержащих прогестоген и/или эстрадиол фармацевтических композиций по настоящему изобретению пациенту с травматическим повреждением ЦНС, таким как ЧМТ. В соответствии со способом по настоящему изобретению, фармацевтическую композицию применяют для усиления положительного терапевтического отклика в отношении травматического повреждения центральной нервной системы.
Черепно-мозговая травма является физическим повреждением ткани головного мозга, которое временно или надолго ослабляет функцию головного мозга. Диагноз ставится клинически и может быть подтвержден визуализацией (прежде всего КТ). Клинические проявления заметно различаются по тяжести и последствиям. Повреждения обычно категоризируют на открытые или закрытые. Открытые повреждения включают проникновение через скальп и череп. Закрытые повреждения, как правило, встречаются, когда голова ударяется, сталкивается с предметом или резко встряхивается, вызывая резкое ускорение и замедление головного мозга.
Фармацевтические композиции по настоящему изобретению могут быть применены для лечения ЧМТ, включая тупые травмы (например, закрытые повреждения), так же как пронизывающие травмы. Под «лечением» подразумевается любое улучшение состояния пациента с травматическим повреждением ЦНС, включая и улучшенное морфологическое восстановление (т.е. усиленная жизнеспособность ткани) и/или поведенческое восстановление. Улучшение может быть охарактеризовано как увеличение в скорости, так и/или в степени поведенческого и анатомического восстановления после травматического повреждения ЦНС. Соответственно, «положительный терапевтический отклик» включает как полный отклик, так и частичный отклик. Различные способы определения того, происходит ли полный или частичный терапевтический отклик, рассмотрены подробно в патентных заявках WO2006/102644, WO2006102596 и WO2008/039898.
Под «терапевтически эффективным количеством» подразумевается количество прогестогена и/или эстрогена, достаточное для появления терапевтического эффекта. Таким образом, в некоторых вариантах осуществления настоящего изобретения количество прогестогена и/или эстрогена во введенной единичной дозе в соответствии с настоящим изобретением является эффективным в лечении или профилактике нейронного повреждения, которое следует за травматическим повреждением ЦНС и, следовательно, вызывает нейропротекторный эффект. Нейродегенерация является прогрессивной потерей нейронов в центральной нервной системе. Как применено в настоящем описании, «нейропротекция» является задержкой и/или изменением направления прогрессии нейродегенерации после травматического повреждения ЦНС. Терапевтически эффективное количество зависит от многих факторов, включая, например, удельную активность прогестогена и/или эстрогена, тяжесть и паттерн травматического повреждения, итоговое нейронное повреждение, чувствительность пациента, вес пациента, наряду с другой вариабельностью между пациентами, режим и/или способ введения и применяемую фармацевтическую композицию.
Фармацевтические композиции по настоящему изобретению могут быть введены с применением любого приемлемого способа, известного в области техники, включая внутривенную (ВВ) инъекцию, внутримышечную инъекцию (ВМ) или подкожную инъекцию (ПК). В специфических вариантах осуществления настоящего изобретения композицию вводят внутривенно, таким образом, как путем ВВ инъекции. При введении внутривенно композиция может быть введена путем инфузии в течение от 1 до 144 часов.
Прогестоген и/или эстроген можно вводить один раз или несколько раз в день. Продолжительность лечения может составлять по одному разу в сутки в течении 1, 2, 3, 4, 5, 6, 7 дней или более. Суточная доза может быть введена или в единичной дозе в форме индивидуальной дозировочной единицы или нескольких меньших дозировочных единиц или путем многократного введения частей дозы с определенным интервалом времени. Последующие дозировочные единицы могут быть введены в любое время после первого введения, таким образом, чтобы достичь терапевтического эффекта. Например, дополнительные дозировочные единицы могут быть введены для защиты пациента от вторичной волны отека, которая может произойти в первые несколько дней после травмы. В специфическом варианте осуществления настоящего изобретения первую дозировочную единицу вводят не позднее, чем через 8 часов после травмы.
В специфических вариантах осуществления настоящего изобретения прогестоген и/или эстроген вводят в режиме постоянного дозирования. Под «режимом постоянного дозирования» подразумевается, что прогестоген и/или эстроген вводят в постоянной дозе общей почасовой инфузии прогестогена и/или эстрогена в течение лечения.
В дополнительных вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный нейропротекторный агент может быть применен в комбинации с прогестогеном и/или эстрогеном (или как часть той же самой композиции или в отдельной композиции) для усиления нейропротекции после травматического повреждения ЦНС.
После приведенного общего описания настоящего изобретения, то же самое будет лучше понято со ссылками на конкретные специфические примеры, которые включены в настоящее описание только с целью иллюстрации и не предназначены для ограничения настоящего изобретения.
Примеры
Общий способ получения гормонсодержащей масляной эмульсии
После смешивания глицерина и части воды, эмульгатор (лецитин яйца) и вспомогательный эмульгатор, олеат натрия, диспергируют посредством гомогенизатора клеток Turrax® (раствор I). Параллельно получают масляную фазу, опционально с токоферолом, и эстрадиол и прогестерон растворяют при 70°C в инертной атмосфере азота (раствор II). Раствор II добавляют к раствору I с применением гомогенизатора клеток Ultra Turrax с последующими 4-5 циклами гомогенизации в гомогенизаторе высокого давления под давлением, по меньшей мере, от 400 бар до 800 бар при температуре от 30°C до 70°C. Затем добавляют остальную часть воды и значение рН получаемой эмульсии типа масло-в-воде приводят к диапазону от 7,5 до 9,0 посредством гидроксида натрия по возможности в виде раствора.
После заполнения емкости подходящего качества эмульсию стерилизуют нагреванием известными способами. В итоге получают стерильную и устойчивую м/в эмульсию с липидными каплями среднего размера масляных капель менее 0,5 мкм и устойчивостью при хранении, по меньшей мере, 18 месяцев.
|
|
|
|
Эксперименты с применением модели инсульта
Для определения эффектов эмульсии по настоящему изобретению в лечении неврологических повреждений после инсульта анализировали эмульсии, как отражено в таблице 4.
|
Модель инсульта, применяемая для определения эффектов эмульсий по настоящему изобретению, описана в J. Dong, B. Mitkari, M. Kipp and C. Beyer Brain, Behavior, and Immunity 25 (2011) 715-726.
Способ
Животные и процедура экспериментальной транзиторной окклюзии средней мозговой артерии (+MCAO) у нормальных крыс-самцов Wistar
Крыс-самцов Wistar (приблизительно 300 г, 3 месяца, Charles River, Германия) держали в среде без патогенов. За животными в клетках ухаживали стандартно один раз в неделю и проводили микробиологический контроль согласно рекомендациям Федерации европейской Лабораторной Ассоциации Зоологии.
Пища и вода были ad libitum. Исследование и процедуры ухода за животными были одобрены Наблюдательным советом для ухода за подопытными животными окружного правительства (Nordrhein-Westfalen, Германия). Животным делали анестезию 5%-ым изофлюраном (Abbott, Людвигсхафен, Германия), и поддерживали изофлюран на уровне 1,5-2,5% (в зависимости от индивидуального животного, и стадии действия) с применением лицевой маски. После рассечения шеи по срединной линии обнажались левая общая сонная артерия (CCA), внутренняя сонная артерия (ICA) и внешняя сонная артерия (ECA). Затем лигировали ближайшие ECA и CCA. Блуждающий нерв тщательно сохраняли в максимально возможной степени. Затем вводили коммерчески доступный катетер (Asahi PTCA Guide Wire Soft, Abbott Vascular, Германия) из дистального отдела CCA как раз перед бифуркацией в ICA пока вручную наблюдали устойчивость. Таким образом, начало средней мозговой артерии (MCA) было зажато кончиком катетера для снижения кровотока в мозгу (CBF) на >50% по сравнению с базовыми значениями (см. ниже). Температуру тела поддерживали при 37-37,5°C посредством электрогрелки и лампы в течение всей операции. Через один час катетер отодвигали, и начинался реперфузионный период. Затем, обнаженные сосуды тщательно лигировали для предотвращения кровотечения, разрез асептически закрывали, и животных возвращали в их клетки. 23 часа спустя крысам делали глубокую анестезию 5%-ым изофлюраном и проводили окрашивание ткани, молекулярный анализ и тестировали поведение животных.
Получение гормона и масляной эмульсии, а так же их применение
Применение эмульсий и забор крови
Эмульсии, как описано в таблице 4, вводили через постоянный яремный венный катетер 1 и 12 ч после начала tMCAO.
Для забора венозной крови и применения эмульсий, правую внешнюю яремную вену выводили наружу препарированием от всех соединительных тканей и соединительнотканной оболочки в вентральной области шеи.
После небольшого разреза в вену вводили дистально кончик яремного катетера (Alzet, крысиный яремный катетер, Cupertina, Калифорния, USA) приблизительно на 1-1,5 мм. Вену лигировали необратимо рострально 2 мм и свободно дистально рядом с разрезом над катетером. Катетер оставался в таком положении до конца эксперимента (забой через 24 ч).
Все инъекции выполняли медленно в объеме 500 мкл в течение 3 минут с применением микронасосной системы (Aesculap, Германия). Чтобы избежать коагуляции на кончике катетеров в пределах яремной вены, трубку заполняли высоко разбавленным гепарином (1:1000 в физиологическом растворе NaCl).
Все применяемые растворы нагревали до температуры тела (38°C) перед применением.
Гормоны получали (17ß-эстрадиол и прогестерон), растворяли в 100% этиловом спирте в качестве маточных растворов и далее разбавляли в описанных эмульсиях (Примеры 1-3).
Итоговая дозировка стероидов для применения составляла:
прогестерон (P, Sigma-Aldrich, Германия) 10 мг/кг массы тела.
17β-эстрадиол (E, Sigma-Aldrich, Германия) 25 мкг/кг массы тела.
Эмульсии с или без гормонов вводили 1 ч и 12 ч после начала tMCAO.
Дополнительно к эмульсиям, получали гормонсодержащий раствор хлорида натрия/этилового спирта, не содержащий липид (NaCl/EtOH E/P). Снова, маточный раствор получали растворением гормонов в этиловом спирте. Дополнительное разведение маточного раствора в солевом растворе (NaCl) приводило к такому же объему введения (500 мкл) и режиму дозировки, как показано выше для эмульсий.
Исследование регионального мозгового кровотока (rCBF)
Чтобы гарантировать соответствующую окклюзию MCA применяли Лазерную Доплеровскую флоуметрия (LDF) для измерения региональной перфузии головного мозга через MCA во время фокальной церебральной ишемии.
Поэтому, каждому животному делали трепанацию черепа для размещения 2-миллиметрового лазерного-допплеровского зонда (PeriFlux System 5000, Type PF 5001, Perimed, Швеция) над интактной твердой мозговой оболочкой приблизительно в 3-5 мм сзади от брегмы и в 4 мм сбоку от срединной линии. Измерения базовой линии проводили непосредственно перед вставкой катетера в ICA. rCBF через MCA регистрировали с 10-минутным интервалом, и вычисляли среднее значение. Только животных со снижением rCBF, по меньшей мере, на 50% (среднее значение) по сравнению с базовой линией далее включали в исследование. Других животных из исследования исключали, поскольку нельзя гарантировать никакого соответствующего недостатка кислорода/инфаркта.
Анализ животных
В целом, весь анализ проводили как односторонний слепой. В этом контексте, односторонний слепой обозначает, что первый экспериментатор, который осуществлял получение применяемых эмульсий, tMCAO хирургию и введение всех эмульсий, знал о тестируемых препаратах. Этот человек затем кодировал животных номерами. Второй экспериментатор, который проводил поведенческие тесты, анализ систолического объема крови, был совершенно не в курсе и действовал только с животными, маркированными закодированными номерами. Затем этот человек делал анализ и математические/статистические оценки и возвращал набор данных первому экспериментатору, который назначал присваивал данные соответствующим животным/лечениям.
Измерение объема инфаркта
Данные объема инфаркта, выраженные в процентном изменении, по сравнению с общим объемом инфаркта у незащищенных животных с tMCAO, который всегда брали за 100%. Это позволяет сразу лучше сравнивать уровни защиты.
Для точной оценки объема инфаркта применяли способ окрашивания хлоридом 2,3,5-трифенилтетразолиума (TTC). Головной мозг быстро вырезали и делали коронарные срезы толщиной 2 мм с применением матрицы крысиного головного мозга (Alto Brain Matrix 1 мм нержавеющей стали крысиный коронарный 300-600 GM, Havard-Apparatus). Затем срезы инкубировали в 2% растворе TTC (полученном в солевом растворе) при 37°C в течение 15 минут. Живые ткани окрашиваются в красный цвет, в то время как ткань, пораженная инфарктом, не окрашивается и остается светлой. После окрашивания TCC срезы хранили в замороженном виде. Изображения TTC-окрашенных срезов получали при помощи фотокамеры Canon Digital IXUS 9015. Общий корковый объем инфаркта вычисляли путем добавления средней площади каждого среза и умножением на 2 мм (толщина срезов). Поправку объема инфаркта на отек делали с применением уравнения, поправка на объем (корковый объем инфаркта × весь контралатеральный объем)/весь ипсилатеральный объем. Объем отека вычисляли вычитанием объема ипсилатерального пораженного объема из контралатерального полушария (Garcia с соавторами Stroke 26:627-634, 1995). Измерения проводили с применением прибора с бесплатным программным обеспечением (ImageJ 1.41, USA).
Поведенческое тестирование
Незадолго до нанесения надрезов у животных проводили поведенческие тесты (Garcia Neuroscoring) на всех крысах, включенных в исследование, согласно Garcia с соавторами (Stroke 26:627-634, 1995) с незначительными модификациями. Проводили шесть независимых поведенческих тестов, которые оценивали от 1-3 до максимум 18 баллов. Оценивали следующие поведенческие признаки: спонтанная активность, вытягивание передних лап и способность забираться вверх, проприорецепция тела тупой палкой), проприорецепция тела (вибрирующее касание), спонтанная ходьба. Как правило, интактные или ложнооперированные животные всегда имели оценку 18 баллов. Напротив, животные с tMCAO в среднем имели оценку приблизительно 6 баллов.
Результаты тестов с моделью инсульта отражены в четрежах 1 и 2.
В чертежах применены следующие аббревиатуры:
NaCl/EtOH E/P i/v: раствор гормонсодержащий хлористый натрий/этиловый спирт, как описано выше, который применяют внутривенно.
Липофундин MCT E/P i/v: эмульсия согласно примеру 1 в таблице 4 с гормонами, добавленными как описано выше, и вводимая внутривенно.
5/5 эмульсия i/v: эмульсия согласно примеру 2 без гормонов и вводимая внутривенно.
5:5 эмульсия E/P i/v: эмульсия согласно примеру 2 в таблице 4 с добавлением гормонов как описано выше и вводимая внутривенно.
9:1 эмульсия i/v: эмульсия согласно примеру 3 без гормонов и вводимая внутривенно.
9:1 эмульсия E/P i/v: эмульсия согласно примеру 3 в таблице 4 с добавлением гормонов и вводимая внутривенно.
Чертеж 1 демонстрирует эффект лечения на объем инфаркта коры головного мозга.
Чертеж 2 демонстрирует эффект лечения на оценку поведения.
Как можно видеть из результатов применение эмульсий, обогащенных омега-3-жирными кислотами рыбьего жира (примеры 2 и 3) вместе с гормонами прогестоген и эстроген демонстрируют синергический и неожиданный эффект улучшения.