Результат интеллектуальной деятельности: КОМПОЗИЦИИ АНТИТЕЛА И БЕЛКА
Вид РИД
Изобретение
Данная заявка является поданной 28 августа 2013 г. как международная патентная заявка РСТ. Она заявляет приоритет в соответствии с патентной заявкой США с регистрационным номером 13/601,598, поданной 31 августа 2012 г., и патентной заявкой США с регистрационным номером 13/843,780, поданной 15 марта 2013 г., раскрытие которых является введенным в данную заявку в качестве ссылки в их целостности.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данная заявка в общем случае относится к композициям антитела и другого белка, которые являются изотоническими и имеют низкую вязкость, включая композиции, которые являются полезными для инъекции и общего введения.
Пациенты с гемофилией имеют расстройства кровотечения, что приводит к задержке свертывания крови после повреждения или хирургии. Длительное кровотечение вызывается генетической патологией одного или более факторов свертывания крови. Два общих типа гемофилии являются известными - гемофилия А и гемофилия В. Гемофилия А вызывается патологией фактора VIII, в то время как гемофилия В вызывается патологией фактора IX. Приблизительно 75-80% от общего количества пациентов с гемофилией имеют гемофилию А.
Ингибитор пути тканевого фактора (TFPI) представляет собой человеческий ингибитор несвойственного пути коагуляции крови и функционирует при антикоагуляции. Антитела, которые являются направленными против TFPI, включая моноклональные антитела к TFPI (aTFPI МАТ), разрабатываются с целью блокирования функции TFPI. Одно такое aTFPI МАТ представляет собой человеческое IgG2 анти-TFPI МАТ, которое было разработано для лечения пациентов с гемофилией А и В.
Антитела и другие белки могут вводиться пациентам путем внутривенной, внутримышечной и/или подкожной инъекции. Для того, чтобы обеспечить удобства для пациента, является желательным, чтобы дозированные формы для подкожной инъекции были изотоническими и включали небольшие объемы инъекции (<2,0 мл на сайт инъекции). Для снижения объема введения, белки часто вводятся в интервале от 1 мг/мл до 150 мг/мл.
В то время как жидкие, так и лиофилизированные дозированные формы используются для лекарственных продуктов на основе антитела и другого белка, которые в настоящее время продаются на рынке, лиофилизированные формы более часто используются для лекарственных продуктов на основе белка и антитела, которые имеют высокие концентрации белка.
Дозированная форма белка и антитела может вызывать множество проблем при разработке рецептуры, в частности для жидкой композиции. Для композиций, в которых концентрация белка находится рядом с границей предельного насыщения его раствора, может иметь место разделение фаз путем осаждения, образования геля и/или кристаллизации. При высокой концентрации белка стабильность антитела или другого белка может становится проблематичной по причине образования растворимых и нерастворимых агрегатов белок-белок.
Композиции с высокой концентрацией белка часто имеют высокую вязкость, что создает трудности для обработки такой, как ультрафильтрация и стерилизующее фильтрование, а также для инъекции дозированного раствора. Кроме того, при концентрациях белка, которые являются желательными для композиций, предназначенных для внутримышечного или подкожного введения, высокие концентрации стабилизаторов, таких как сахароза и хлорид натрия, являются необходимыми для долгосрочной стабильности белка. Полученные гипертонические растворы часто вызывают боль при инъекции по причине повреждения тканей. Таким образом, является важным сбалансировать количество стабилизаторов для стабильности и осмоляльности композиции с высокой концентрацией белка.
По этой причине в области техники существует потребность в терапевтических композициях на основе антитела и другого белка в жидкой форме, которые демонстрируют высокие концентрации белка при отсутствии проблемы со значительно повышенной агрегацией белка, осмоляльностью или вязкостью, и/или сниженной стабильностью белка. Является, таким образом, желательным, чтобы композиции на основе антитела и другого белка содержали ограниченные количества наполнителей и малые объемы для облегчения терапевтического введения или доставки. Является также желательным, чтобы терапевтические композиции на основе антитела и другого белка были пригодными для лиофилизации с целью повышения стабильности белка при условиях длительного хранения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное описание обеспечивает жидкие и лиофилизированные композиции на основе антитела и белка, которые являются существенно изотоническими и имеют низкую вязкость, а также существенно не содержат никакой неорганической соли. Композиции антитела и другого белка, представленные в данной заявке, содержат от приблизительно 0 мМ до приблизительно 30 мМ гистидина; от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. неионного поверхностно-активного вещества такого, как, например, полисорбат (Твин®) 80 или полисорбат (Твин®) 20; от приблизительно 88 мМ до приблизительно 292 мМ сахара или сахарного спирта такого, как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при рН от приблизительно рН 4,0 до приблизительно рН 6,0. Композиции, которые раскрываются в данной заявке, демонстрируют вязкость, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С, и осмоляльность, которая колеблется от приблизительно 240 до приблизительно 380 ммоль/кг.
В рамках дополнительных аспектов данное описание обеспечивает способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества одной или более композиций, описанных в данной заявке. Например, обеспечиваются способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества композиции антитела или другого белка, как описывается более подробно в данной заявке.
Эти и другие признаки настоящего описания являются представленными в данной заявке.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Квалифицированный специалист в данной области техники поймет, что фигуры, описанные ниже, являются приведенными только с целью иллюстрации. Рисунки не являются предназначенными для ограничения объема настоящего изобретения каким-либо образом.
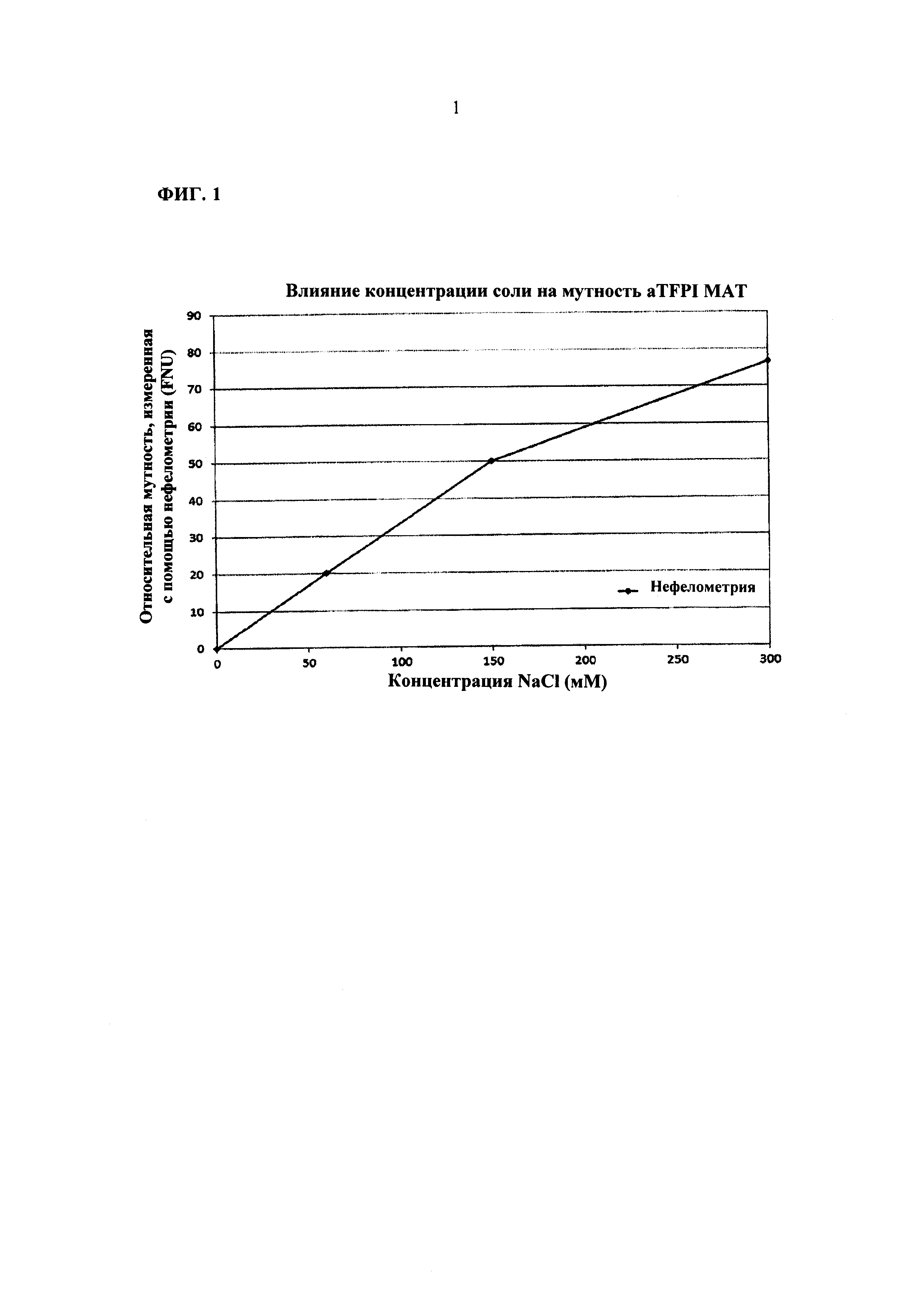
ФИГ. 1 представляет собой графическое представление влияние концентрации хлорида натрия (NaCl) на помутнение композиции на основе 20 мг/мл анти-TFPI МАТ при рН 5,5.
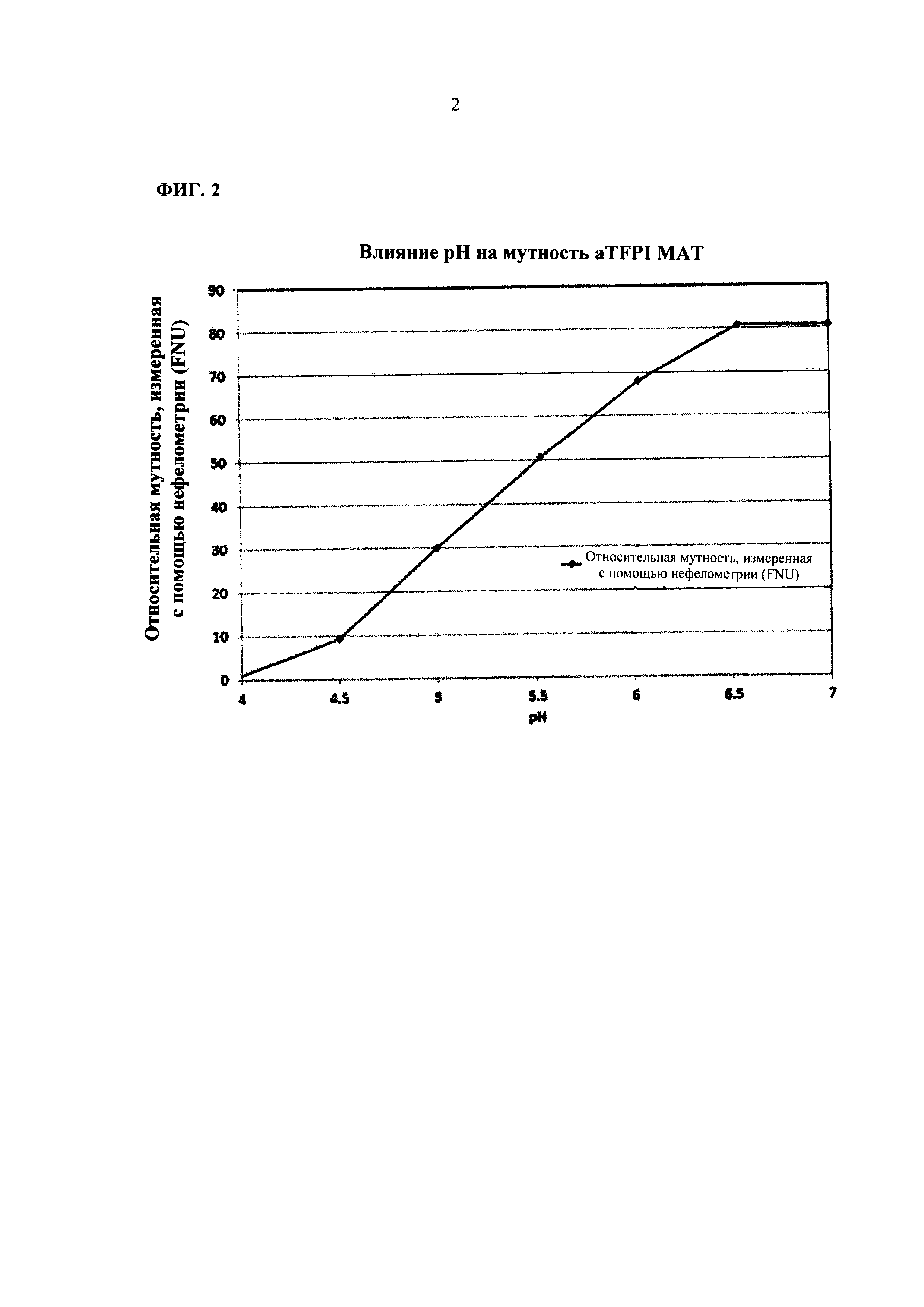
ФИГ. 2 представляет собой графическое представление влияние рН на помутнение лекарственного вещества на основе анти-TFPI МАТ.
ОПИСАНИЕ РАЗЛИЧНЫХ ВОПЛОЩЕНИЙ
Как описывается выше, данное раскрытие обеспечивает композиции антитела и другого белка, которые стабилизируют антитело или другой белок в жидкой форме или лиофилизированной форме при предполагаемых условиях хранения. Композиции, описанные в данной заявке, включают один или более фармацевтически приемлемых наполнителей или стабилизаторов, содержатся в забуференной среде при приемлемом значении рН и являются существенно изоосмотическими с физиологическими жидкостями. Для системного введения инъекция представляет собой один из путей введения, включая внутримышечную, внутривенную, интраперитонеальную и подкожную инъекцию.
По причине их низкой вязкости раскрытые в настоящей заявке белковые композиции могут подвергаться традиционной обработке путем, например, ультрафильтрации и стерилизующего фильтрования и могут вводиться пациенту путем инъекции, включая подкожную инъекцию. Кроме того, поскольку они являются изоосмотическими, раскрытые в настоящей заявке композиции антитела и белка снижают повреждение ткани или другие вредные физиологические эффекты и, таким образом, достигается благоприятная переносимость пациентом и улучшенное соблюдение режима пациентом.
Композиции, описанные в данной заявке, характеризуются существенным отсутствием добавляемой соли, что обеспечивает гибкость для повышения концентраций других стабилизаторов таких, как сахароза, при одновременном поддержании осмоляльности композиции для улучшенной in vivo переносимости и, следовательно, улучшенного соблюдения режима пациентом. Кроме того, низкая вязкость описанных в данной заявке композиций позволяет осуществлять удобную обработку, включая, но не ограничиваясь таковыми, ультрафильтрацию и стерилизующее фильтрование, а также инъекцию раствора лекарственного продукта посредством иглы.
Как используется в данной заявке, термин "вязкость" относится к сопротивлению жидкой композиции к перетеканию, так, например, тогда, когда вводится через иглу шприца во время введения пациенту. Измерения вязкости могут быть сделаны с помощью методики конуса и плоскости при использовании элемента Пельтье, установленного при определенных температурах, таких как 22°С, как описано в данной заявке. Типично, хорошо определенный градиент напряжения сдвига прикладывается к жидкой композиции, и измеряется показатель сдвига. Вязкость представляет собой соотношение сдвигового стресса к показателю сдвига. Как используется в данной заявке, вязкость выражается в единицах мПа-сек. при 22°С, где 1 мПа-сек. = 1 сантипуазу. Низкая вязкость существенно изоосмотической композиции, раскрытой в данной заявке, типично характеризуется наличием вязкости, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С.
Как используется в данной заявке, термин "осмоляльность" относится к мере концентрации растворенного вещества, которая определяется как количество ммолей растворенного вещества на кг раствора. Желаемый уровень осмоляльности может быть достигнут путем прибавления одного или более стабилизаторов таких, как сахар или сахарный спирт, включая, но без ограничения таковыми, маннит, дектрозу, глюкозу, трегалозу и/или сахарозу. Дополнительные стабилизаторы, которые могут быть приемлемыми для обеспечения осмоляльности, описываются в ссылках таких, как руководство Pharmaceutical Excipients (4-ое издание, Royal Pharmaceutical Society of Great Britain, Science & Practice Publishers) или Remingtons: The Science и Practice of Pharmacy (9-ое издание, Mack Publishing Company).
Как используется в данной заявке, термин "приблизительно" относится к +/- 10% от обеспечиваемого значения единицы. Как используется в данной заявке, термин "существенно" относится к качественному условию демонстрации полной или приблизительной степени характеристики или свойства, которое представляет интерес. Средний специалист в области биологии поймет, что биологические и химические явления редко, если вообще это является возможным, достигают или устраняют абсолютный результат. Термин существенно, таким образом, используется в данной заявке для охвата потенциального отсутствия завершенности, присущей многим биологическим и химическим явлениям. Как используется в данной заявке, термины "изоосмотический" и "изотонический" используются попеременно с терминами "существенно изоосмотический" и "существенно изотонический" и относятся к композиции, которая характеризуется наличием осмотического давления, которое является таким же, как или, по крайней мере, существенно эквивалентным осмотическому давлению другого раствора, которое достигается при использовании композиции, где общая концентрация растворенных веществ, включая как способные к проникновению, так и неспособные к проникновению, растворенные вещества, в композиции является такой же или, по крайней мере, существенно эквивалентной общему количеству растворенных веществ в другом растворе. Таким образом, в то время как специалистам в данной области техники должно быть понятным, что "изоосмотическая" и "изотоническая" композиции, которые используются для in vivo введения, в общем случае имеют осмоляльность, которая колеблется от приблизительно 270 ммоль/кг до приблизительно 310 ммоль/кг, в контексте композиции низкой вязкости в соответствии с настоящим описанием термины "изоосмотический", "изотонический", "существенно изоосмотический" и "существенно изотонический" используются попеременно по отношению к композиции, которая имеет осмоляльность, которая колеблется от приблизительно 240 ммоль/кг до приблизительно 380 ммоль/кг или от приблизительно 270 ммоль/кг до приблизительно 370 ммоль/кг, или от приблизительно 300 ммоль/кг до приблизительно 330 ммоль/кг.
Раскрытая в настоящей заявке композиция изоосмотического антитела и другого белка низкой вязкости существенно содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина; от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. неионного поверхностно-активного вещества такого как, например, полисорбат (Твин®) 80 или полисорбат (Твин®) 20; от приблизительно 88 мМ до приблизительно 292 мМ сахара или сахарного спирта, такого как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при рН от приблизительно рН 4 до приблизительно рН 6. Композиции, раскрытые в данной заявке, демонстрируют вязкость, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С, и осмоляльность, которая колеблется от приблизительно 240 до приблизительно 380 ммоль/кг.
В этой композиции гистидин представляет собой буферный агент, который может использоваться для поддержания значения рН композиции от приблизительно рН 4,0 до приблизительно рН 6,0, или приблизительно рН 5 до приблизительно рН 6, такого как приблизительно рН 5, приблизительно рН 5,5, или приблизительно рН 6. Сахар или сахарные спирты такие, как маннит, декстроза, глюкоза, трегалоза и/или сахароза, используются отдельно или в комбинации, оба в качестве криопротекторов и могут стабилизировать антитело в жидкой композиции, а также в процессе и после лиофилизации. Неионные поверхностно-активные вещества такие, как полисорбаты, включая полисорбат 20 и полисорбат 80; полоксамеры, включая полоксамер 184 и 188; полиолы Плюроник®; и другие блок полимеры этилена/полипропилена стабилизируют антитело в процессе обработки и хранения путем снижения межфазовое взаимодействие и предотвращают адсорбцию белка. Аргинин представляет собой белковый растворитель, а также стабилизатор, который снижает агрегацию антитела и другого белка, такую как агрегация aTFPI МАТ, и гликозилирование. Метионин представляет собой ингибитор окислительных реакций, который предотвращает окисление антитела в процессе обработки и хранения.
Сахара и неорганические соли обычно используются в качестве стабилизаторов белка; однако, оба сахара и неорганические соли являются также эффективными в качестве агентов, регулирующих тоничность. Если композиция требует высокой концентрации одного или более Сахаров для стабилизации белка, то концентрация неорганической соли должна быть равна нулю или поддерживаться на очень низком уровне для того, чтобы обеспечивать осмоляльность композиции так, чтобы боль при инъекции снижалась при введении. Совершенно неожиданно было обнаружено, что хлорид натрия повышает помутнение композиции антитела. В связи с этим неорганические соли существенно исключаются из добавления в композиции, описанные в данной заявке. Такие бессолевые композиции поддерживают осмоляльность композиции антитела и другого белка с повышенной стабильностью и снижают фазовые изменения такие, как преципитация или агрегация.
Как используется в данной заявке, термин "соль" относится к неорганическим солям, которые включают, но не ограничиваются таковыми, хлорид натрия (NaCl), сульфат натрия (Na2SO4), тиоцианат натрия (NaSCN), хлорид магния (MgCl), сульфат магния (MgSO4), тиоцианат аммония (NH4SCN), сульфат аммония ((NH4)2SO4), хлорид аммония (NH4Cl), хлорид кальция (CaCl2), сульфат кальция (CaSO4), хлорид цинка (ZnCl2) и тому подобное, или их комбинации. Композиции антитела и другого белка, раскрытые в данной заявке, характеризуются существенным отсутствием добавленной соли и, таким образом, упоминаются в данной заявке как свободные от соли композиции антитела и/или белка. Квалифицированному специалисту в данной области техники будет понятно, что присутствие неорганических солей в раскрытых в настоящей заявке композициях, которые вводятся для доведения значения рН, не рассматривается как добавление солей, и такие неорганические соли, в случае присутствия в композиция в соответствии с настоящей заявкой, не должны превышать концентрацию приблизительно 2 мМ.
Как используется в данной заявке, термин "поверхностно-активный агент" включает неионные поверхностно-активные вещества, включая, но без ограничения таковыми, полисорбаты такие, как полисорбат 20 или 80, и полоксамеры такие, как полоксамер 184 или 188, полиолы Плюроник® и другие блок полимеры этилена/полипропилена. Количества поверхностно-активных веществ, эффективные для обеспечения стабильной композиции антитела и другого белка, обычно находятся в интервале от 50 част, на млн. до 200 част, на млн.. Применение неионных поверхностно-активных веществ позволяет композиции подвергаться сдвиговому и поверхностному стрессу при отсутствии возникновения денатурации антитела или другого белка, а также снижает адсорбцию на поверхностях в процессе обработки и хранения. Композиции, раскрытые в данной заявке, включают, без ограничения, композиции, которые содержат один или более неионный(х) поверхностно-активный(х) агент(ов) включая, например, один или более полисорбат(ов) таких, как полисорбат 20 или 80; один или более полоксамеров таких, как полоксамер 184 или 188; один или более полиол(ы) Плюроник®; и/или один или более блок полимер(ов) этилена/полипропилена. В качестве примера в данной заявке являются представленными композиции, которые содержат полисорбат, такой как полисорбат 20 (Твин® 20) или полисорбат 80 (Твин® 80).
Как используется в данной заявке, термин "белок" относится к аминокислотным полимерам, содержащим, по крайней мере, пять последовательных аминокислот, которые являются ковалентно связанными с помощью пептидной связи. Составляющие аминокислоты могут быть выбраны из группы аминокислот, которые кодируются генетическим кодом и которые включают: аланин, валин, лейцин, изолейцин, метионин, фенилаланин, тирозин, триптофан, серии, треонин, аспарагин, глутамин, цистеин, глицин, пролин, аргинин, гистидин, лизин, аспарагиновую кислоту и глутаминовую кислоту. Как используется в данной заявке, термин "белок" представляет собой синоним с родственными терминами "пептид" и "полипептид".
Как используется в данной заявке, термин "антитело" относится к классу белков, которые в общем случае являются известными как иммуноглобулины. Антитела включают полноразмерные моноклональные антитела (МАТ) такие, как IgG2, моноклональные антитела, которые включают участки Fe иммуноглобулина. Термин "антитело" также включает биспецифические антитела, диатела, одноцепочечные молекулы и фрагменты антитела такие, как Fab, F(ab')2 и Fv.
Как используется в данной заявке, термин "антитело к TFPI" относится к антителу, которое обладает связывающей специфичностью в отношении человеческого TFPI белка, а также фрагментов и вариантов человеческого TFPI белка. Антитела к TFPI, представленные в данной заявке, могут представлять собой IgG2 антитела и включают анти-TFPI IgG2 моноклональные антитела такие, как химерные, гуманизированные и полностью человеческие анти-TFPI IgG2 моноклональные антитела. Антитела против TFPI в данной заявке являются представленными человеческим анти-TFPI IgG2 моноклональным антителом, которое имеет легкую цепь, включающую последовательность, представленную в данной заявке как SEQ ID NO: 1, и/или тяжелую цепь, представленную в данной заявке как SEQ ID NO: 2. Другие анти-TFPI моноклональные антитела, включая полноразмерные антитела и связывающие антиген фрагменты и их варианты, которые также являются приемлемыми для применения в композициях, раскрытых в данной заявке, являются представленными в публикациях РСТ WO 2011/109452 и WO 2010/017196, которые обе являются введенными в данную заявку в качестве ссылки в своей целостности.
"Моноклональные антитела" характеризуются наличием специфичности для одной антигенной детерминанты. Моноклональные антитела могут, например, быть получены при использовании гибридомной методики, описанной Kohler и Milstein, Nature 256: 495 (1975) или с помощью способов рекомбинантной ДНК таких, как те, что описаны в патенте США №4,816,567. Моноклональные антитела могут также быть изолированы из библиотек фагового дисплея при использовании методик таких, как те, которые описываются у Clackson и др., Nature 352: 624-628 (1991) и Marks и др., J. Mol. Biol. 222: 581-597(1991).
Моноклональные антитела включают "химерные моноклональные антитела", в которых часть тяжелой и/или легкой цепи включает последовательности из антитела, которое имеет происхождение от одних видов, в то время как оставшаяся часть антитела, включая участок Fe, содержит последовательности из антитела, которое имеет происхождение от другого вида, типично, другой вид представляет собой человека. Смотри, например, патент США №4,816,567 и Morrison и др., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984).
Моноклональные антитела также включают "гуманизированные моноклональные антитела", где один или более из участков, определяющих комплементарность (CDR), из последовательности тяжелой и/или легкой цепи антитела, которое имеет происхождение от одного из видов, заменяют одним или более CDR из последовательности тяжелой и/или легкой цепи из антитела, которое имеет происхождение от второго вида, типично, второй вид представляет собой человека. Процесс "гуманизации" обычно применяют к моноклональным антителам, которые разработаны для введения человеку. Смотри, например, Riechmann и др., Nature 332(6162): 323-27 (1988) и Queen и др., Proc. Natl. Acad. Sci. USA 86 (24): 10029-33 (1989).
Моноклональные антитела также включают "полностью человеческие моноклональные антитела", в которых полные последовательности тяжелой и легкой цепей имеют происхождение от последовательностей человеческого антитела. Полностью человеческие моноклональные антитела могут быть получены с помощью методик фагового дисплея и могут быть изолированы от мышей, которые были генетически созданы для экспрессии совокупности человеческих антител. Смотри, например, McCafferty и др., Nature 348(6301): 552-554 (1990), Marks и др., J. Mol. Biol. 222(3): 581-597 (1991), и Carmen и Jermutus, Brief Funct. Genomic Proteomic 1(2): 189-203 (2002).
Как используется в данной заявке, термин "фармацевтически эффективное количество" композиции антитела или другого белка относится к количеству композиции, которое обеспечивает терапевтический эффект при введении. Композиции антитела и белка, раскрытые в данной заявке, типично включают антитело или другой белок при концентрации, которая колеблется от приблизительно 1 мг/мл до приблизительно 150 мг/мл или от приблизительно 1 мг/мл до приблизительно 100 мг/мл, или от приблизительно 1 мг/мл до приблизительно 50 мг/мл, или от приблизительно 1 мг/мл до приблизительно 20 мг/мл, или от приблизительно 1 мг/мл до приблизительно 10 мг/мл, или от приблизительно 10 мг/мл до приблизительно 20 мг/мл, или от приблизительно 20 мг/мл до приблизительно 150 мг/мл, или от приблизительно 50 мг/мл до приблизительно 150 мг/мл, или от приблизительно 60 мг/мл до приблизительно 150 мг/мл, или от приблизительно 70 мг/мл до приблизительно 150 мг/мл, или от приблизительно 80 мг/мл до приблизительно 150 мг/мл, или от приблизительно 90 мг/мл до приблизительно 150 мг/мл, или от приблизительно 100 мг/мл до приблизительно 150 мг/мл, или от приблизительно 120 мг/мл до приблизительно 150 мг/мл, или от приблизительно 140 мг/мл до приблизительно 150 мг/мл. В некоторых аспектах концентрация белка или антитела в этих композициях составляет приблизительно 150 мг/мл. При подкожном введении такие композиции типично вводятся в объеме, который составляет менее чем приблизительно 2,0 мл или приблизительно 1,5 мл, или приблизительно 1 мл, или приблизительно 0,5 мл на сайт инъекции.
В некоторых аспектах композиция антитела или другого белка содержит приблизительно 30 мМ гистидина, приблизительно 100 част, на млн. Твина 80, приблизительно 292 мМ сахарозы, приблизительно 20 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 50 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 200 част, на млн. Твина 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 10 мМ аргинина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 0 мМ до приблизительно 10 мМ метионина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 30 мМ лизина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 30 мМ аргинина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 0 мМ до приблизительно 10 мМ метионина.
В данной заявке являются представленными композиции антитела, где антитела включают IgG2 антитела, такие как антитела к ингибитору пути тканевого фактора (aTFPI AT), включая человеческое IgG2 моноклональное антитело, которое имеет легкую цепь, включающую последовательность SEQ ID NO: 1, и тяжелую цепь, включающую последовательность SEQ ID NO: 2.
Таким образом, данное изобретение обеспечивает композиции анти-TFPI МАТ, включая композиции анти-TFPI IgG2 МАТ, где анти-TFPI МАТ представляет собой растворимые при высокой концентрации белки. Типично, анти-TFPI МАТ в композициях, раскрытых в данной заявке, остаются растворимыми при концентрациях от приблизительно 1 мг/мл до приблизительно 150 мг/мл, остаются стабильными при изоосмотических условиях хранения, а также демонстрируют сниженную вязкость по сравнению с доступными в настоящее время композициями антитела.
Анти-TFPI антитело, которое имеет легкую цепь, включающую последовательность SEQ ID NO: 1, и тяжелую цепь, включающую последовательность SEQ ID NO: 2, представляет собой IgG2 антитело, которое блокирует ингибитор пути тканевого фактора (TFPI). Поскольку TFPI подавляет несвойственную коагуляцию, антитело к TFPI может способствовать коагуляции, которая направляется несвойственным путем с помощью блокирования TFPI, образуя, таким образом, обходной путь FVIII или FIX патологии в присущем организму пути для лечения гемофилии. Композиции антитела к TFPI, свободные от соли, представленные в данной заявке, могут вводиться пациентам путем подкожной инъекции или с помощью других способов инъекции.
Как часть в соответствии с настоящим изобретением было обнаружено, что растворимость и стабильность антитела к TFPI подвергалась влиянию со стороны наполнителей. Растворимость антитела к TFPI повышается со снижением концентраций NaCl. При отсутствии NaCl растворимость антитела к TFPI выше, чем для композиции, которая включает NaCl. Кроме того, было обнаружено, что позитивно заряженные аминокислоты такие, как аргинин и лизин, могут улучшить стабильность антитела к TFPI, а также что значение рН значительным образом влияет на растворимость антитела к TFPI. Помутнение раствора антитела повышается с повышением значения рН; однако, преципитация является обратимой тогда, когда значение рН снижается. Оптимальное значение рН для стабилизации антитела к TFPI, представленного в данной заявке, колеблется от приблизительно рН 4 до приблизительно рН 6 или от приблизительно рН 5 до приблизительно рН 6, как, например, приблизительно рН 5, приблизительно рН 5,5 или приблизительно рН 6.
В данной заявке представлены композиции, которые описаны выше, где антитело представляет собой антитело к TFPI (aTFPI AT). По крайней мере, в одном антитело к TFPI представляет собой человеческое IgG2 моноклональное антитело. Например, человеческое анти-TFPI IgG2 моноклональное антитело включает антитело, которое содержит легкую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, и тяжелую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 2.

Данное раскрытие также обеспечивает способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества одной или более композиций, описанных в данной заявке. Например, обеспечиваются способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества композиция антитела или другого белка, которая содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина, от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. полисорбата (Твина®) 80 или полисорбата (Твина®) 20, от приблизительно 88 мМ до приблизительно 292 мМ сахарозы, от приблизительно 0 мМ до приблизительно 50 мМ аргинина, от приблизительно 0 мМ до приблизительно 50 мМ лизина, от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина, от приблизительно 0 мМ до приблизительно 10 мМ метионина и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при значении рН, которое колеблется от приблизительно рН 4,0 до приблизительно рН 6,0. По крайней мере, в соответствии с одним аспектом этих способов композиция антитела или другого белка может вводиться внутривенно. В рамках других аспектов этих способов композиция антитела или другого белка может вводиться подкожно. В соответствии с другими аспектами этих способов композиция антитела или другого белка может вводиться внутримышечно.
В соответствии с другими близкими аспектами данное раскрытие обеспечивает способы для лечения гемофилии А или гемофилии В у пациента, которые включают введение пациенту терапевтически эффективного количества композиции антитела к TFPI, которая содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина и от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. полисорбата (Твина®) 80 или полисорбата (Твина®) 20, от приблизительно 88 мМ до приблизительно 292 мМ сахарозы, от приблизительно 0 мМ до приблизительно 50 мМ аргинина, от приблизительно 0 мМ до приблизительно 50 мМ лизина, от приблизительно 0% (0 мМ) до приблизительно 1% (133 мМ) глицина, от приблизительно 0 мМ до приблизительно 10 мМ метионина и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при значении рН, которое колеблется от приблизительно рН 4,0 до приблизительно рН 6,0. В рамках, по крайней мере, одного аспекта этих способов композиция антитела к TFPI может вводиться внутривенно. В соответствии с другими аспектами этих способов композиция антитела к TFPI может вводиться подкожно. В соответствии с другими аспектами этих способов композиция антитела или другого белка может вводиться внутримышечно.
В соответствии с определенными аспектами этих способов для лечения гемофилии А или гемофилии В у пациента антитело к TFPI представляет собой человеческое анти-TFPI IgG2 моноклональное антитело такое, как, например, человеческое анти-TFPI IgG2 моноклональное антитело, которое содержит легкую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, и тяжелую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 2.
Для целей интерпретации данного описания будут применяться следующие определения и всякий раз, когда это является уместным, термины, используемые в единственном числе, будут также включать множественное число и наоборот. В случае, когда любое определение, изложенное ниже, входит в конфликт с использованием этого слова в любом другом документе, включая любой документ, который включен в данное описание в качестве ссылки, определения, изложенные ниже, всегда будут находиться под контролем для целей интерпретации данного описания и связанных с ним пунктов формулы изобретения, если только противоположный смысл явным образом не предполагается (например, в документе, где термин первоначально использовался). Применение "или" означает "и/или", если не указано иное. Применение слова "любой" здесь означает "один или более", если не указано иное, или где применение "один или более" явно является неприемлемым. Применение слов "содержат", "содержит", "содержащий", "включают", "включает" и "включающий" являются взаимозаменяющими и не являются предназначенными для ограничения. Кроме того, там, где описание одного или более воплощений использует термин "включающий", квалифицированный специалист в данной области техники поймет, что в некоторых специфических случаях воплощение или воплощения могут альтернативно описываться при использовании выражений "который существенно состоит из" и/или "который состоит из".
Аспекты настоящей заявки могут быть дополнительно раскрыты в свете следующих примеров, которые не являются предназначенными для ограничения объема настоящего раскрытия каким-либо образом.
ПРИМЕРЫ
Пример 1
Влияние концентрации NaCl и рН на помутнение растворов антитела
Этот пример раскрывает влияние концентрации соли (NaCl) и рН на помутнение растворов, которые содержат анти-TFPI человеческое моноклональное антитело, которое имеет легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 1, и тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 2.
Помутнение растворов измеряли с помощью нефелометрии для быстрой оценки влияния концентраций соли и рН на растворы aTFPI AT. Композиция анти-TFPI антитела, которая используется в этом Примере, содержит 10 мМ ацетатного буфера, 88 мМ сахарозы и 200 част, на млн. Твина 80. Концентрации NaCl варьировали в пределах от 0 мМ до 300 мМ. Результаты измерений помутнения, зависимого от NaCl, для композиции анти-TFPI при рН 5,5 являются представленными на Фигуре 1. Эти данные демонстрируют, что помутнение композиции анти-TFPI МАТ значительно увеличивалось при повышении концентрации NaCl. Увеличивающаяся от 0 до 300 мМ концентрация соли приводила к повышению на 72 FNU (формазиновая единица мутности) значения помутнения с помощью нефелометрии, что может приписываться преципитации, агрегации или нерастворимости aTFPI AT в растворе. Как результат этого факта, растворы без хлорида натрия были рекомендованы для раскрытых в настоящей заявке композиций антитела к TFPI.
Не имея намерения связывать себя какой-либо теорией, считается, что повышенное помутнение композиции анти-TFPI МАТ с повышенной концентрацией NaCl является результатом нейтрализации позитивных зарядов на боковых цепях аргинина анти-TFPI МАТ. Фазовое поведение aTFPI МАТ при различных значениях рН при воздействии моновалентной соли (NaCl) объясняет, почему могут быть достигнуты стабильные, растворимые, бессолевые и существенно изоосмоляльные композиции aTFPI МАТ.
Раскрытая в настоящей заявке молекула aTFPI МАТ имеет 116 аминокислот (42 аргинина и 74 лизина), имеющих боковую цепь, которая несет позитивные заряды при значении рН ниже PI. Такое антитело к TFPI имеет PI при ~7,9. При значении рН ниже PI, таком, как рН 4-6, это антитело к TFPI имеет общий позитивный заряд. Отталкивание положительных зарядов на поверхности этого антитела к TFPI также предотвращает образование ассоциации белок-белок между отдельными молекулами и, следовательно, значительно увеличивает растворимость. Предполагается, что анион (Cl-) соли связывается с группой гуанидиния на боковых цепях аргинина на поверхности антитела к TFPI с нейтрализацией положительных зарядов, что повышает взаимодействия белок-белок и, следовательно, приводит к низкой растворимости раствора и помутнению. Путем сдвига значения рН до 4-6 были разработаны бессолевые композиции, которые являются описанными в данной заявке, для достижения повышенной растворимости и стабильности антитела (смотри, Фигуру 1). При отсутствии соли концентрация других стабилизаторов таких, как сахароза, может быть увеличена до >150 мМ и <300 мМ без ущерба для осмоляльности.
Влияние рН на помутнение антитела к TFPI также было изучено. Как показано на Фиг. 2, рН может также значительно влиять на помутнение раствора aTFPI AT. Когда значение рН повышали с 4 до 6,5, помутнение раствора aTFPI AT увеличивалась на 81 FNU. При дальнейшем повышении рН до 7, помутнение раствора было вне диапазона для осуществления точного измерения. Однако образование осадка в растворе было обратимым при снижении значения рН. Этот результат можно объяснить нейтрализацией поверхностного заряда при повышении рН до значения, близкого к PI aTFPI AT, поскольку значение PI для aTFPI AT составляет примерно 7,9. По данным этого исследования было установлено, что низкие значения рН являются предпочтительными для композиции aTFPI Т. Однако низкое значение рН может вызвать раздражение тканей во время инъекции. Таким образом, нейтральное значение рН является предпочтительным для пациента с точки зрения безопасности. При балансе между двумя этими факторами оптимальное значение рН композиции aTFPI AT составляет от рН 5 до рН 6.
Пример 2
Композиты антитела к TFPI
На основе неожиданных открытий, представленных в Примере 1, получали существенно изоосмотические композиции антитела к TFPI при отсутствии NaCl. Такие композиции типично использовали высокую концентрацию сахарозы для того, чтобы помочь стабилизировать антитела к TFPI.
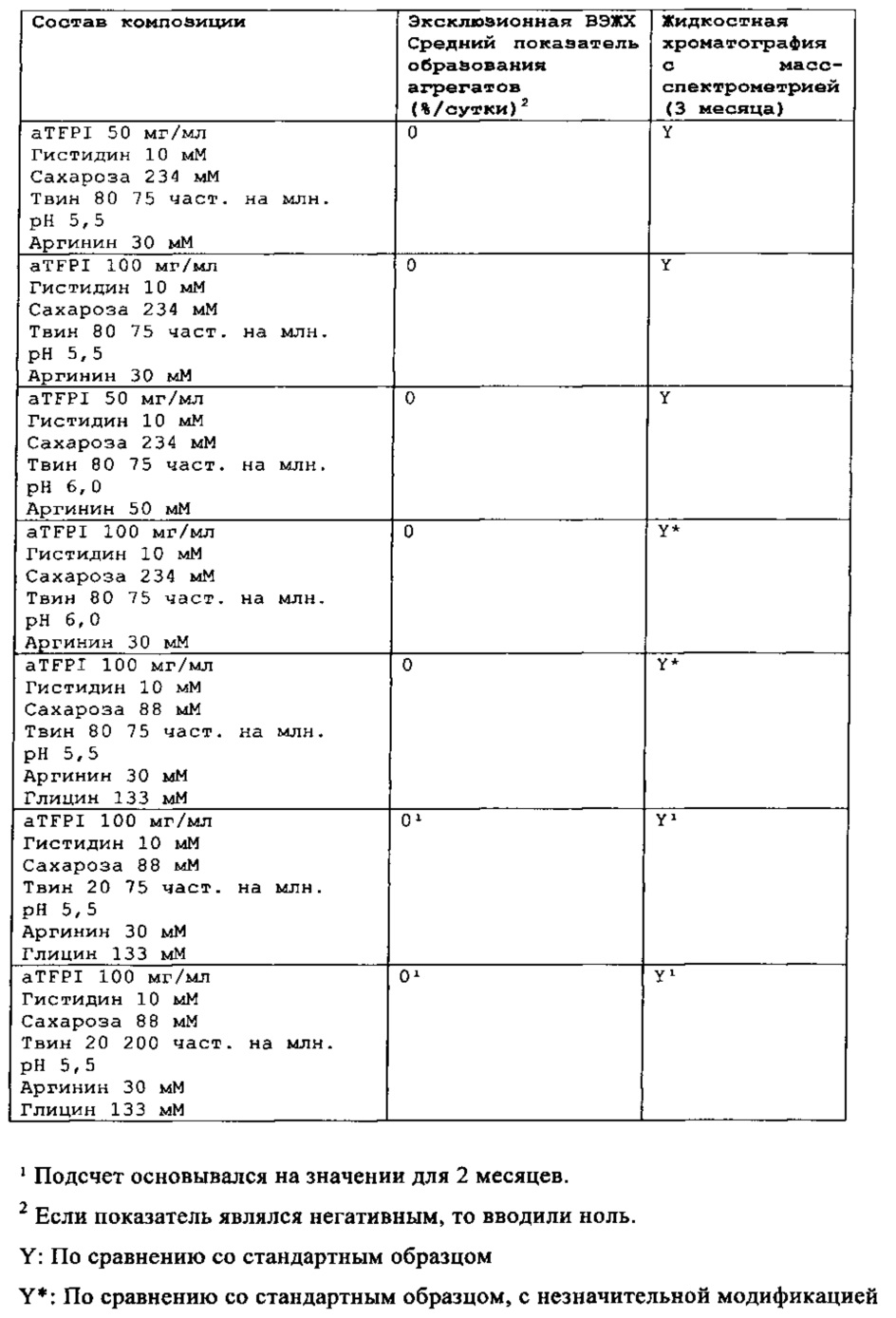
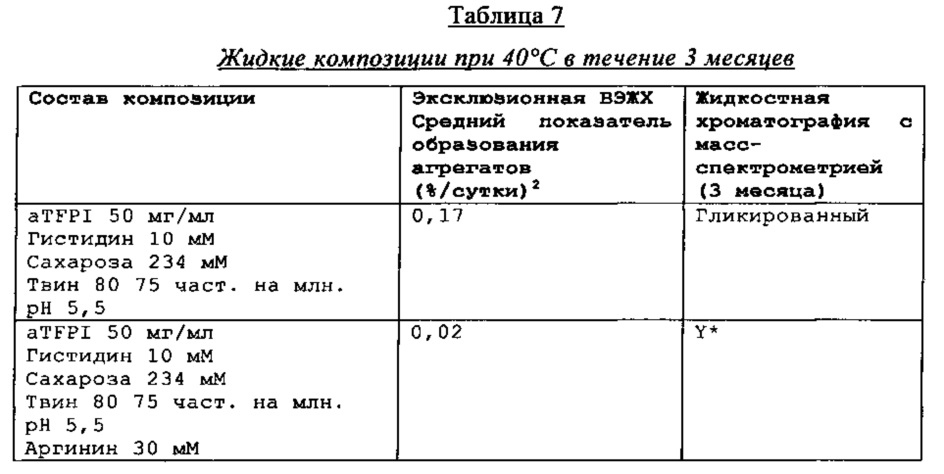
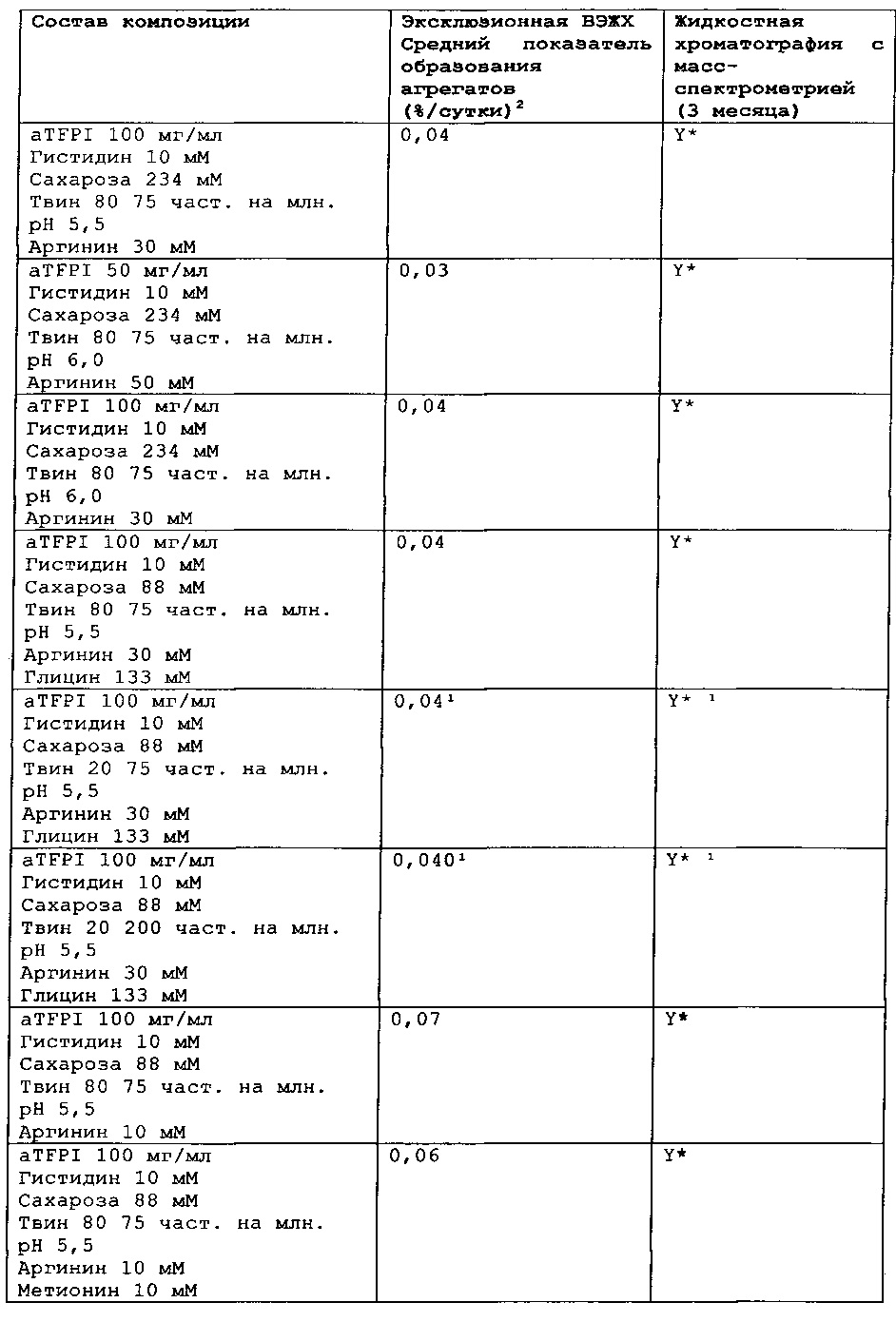
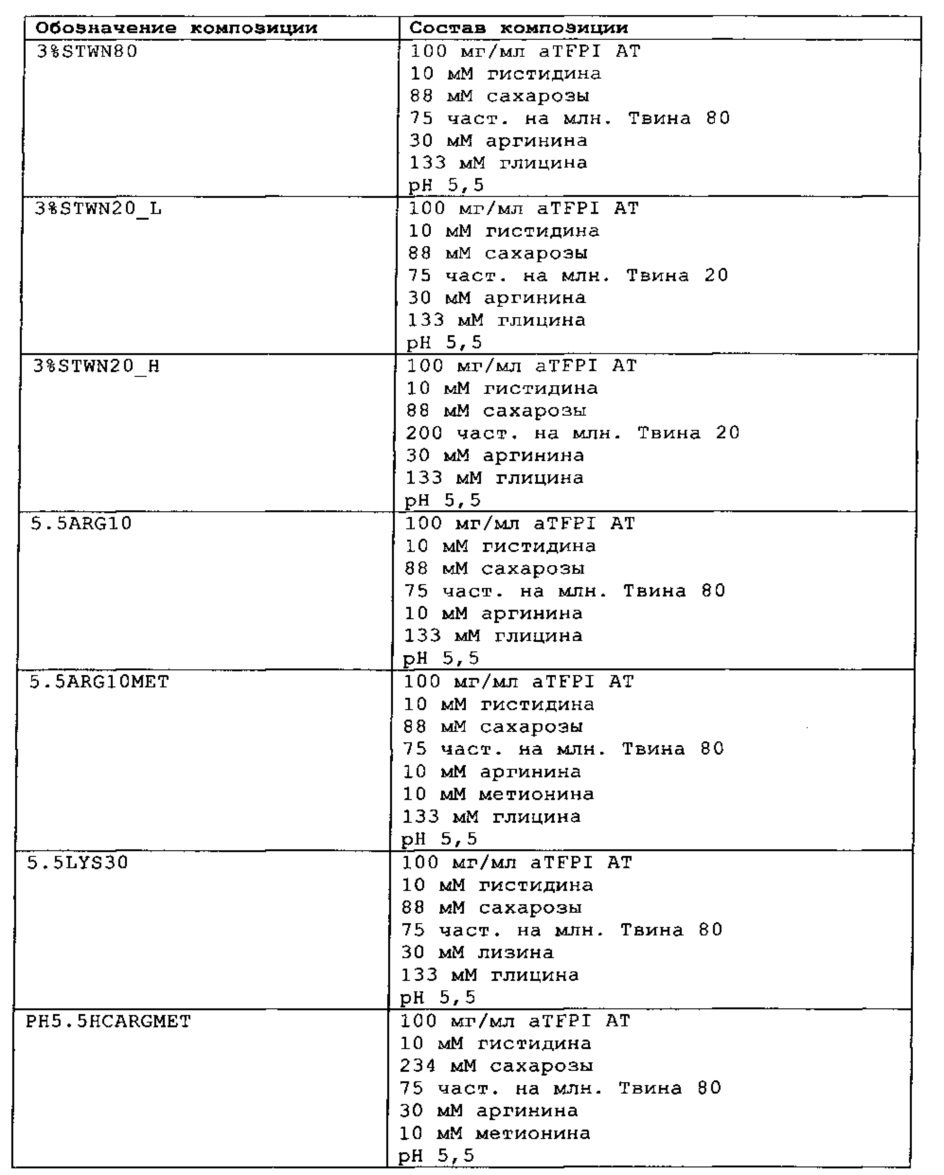
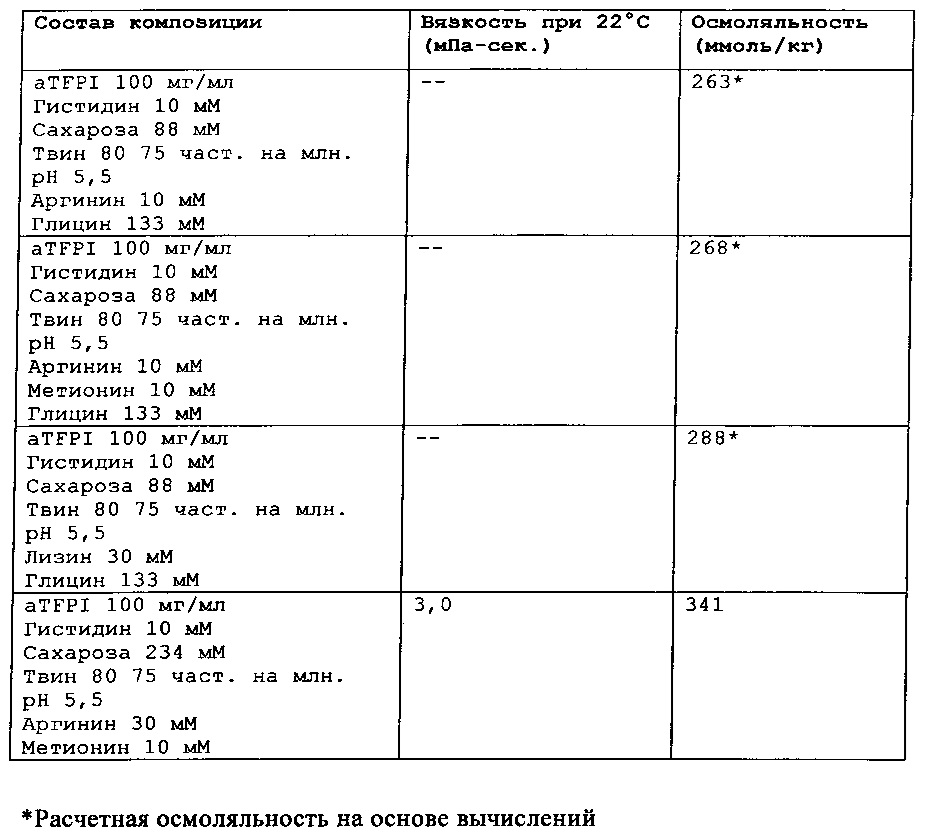
Замороженное антитело к TFPI оттаивали и повторно рецептировали при использовании диализа в соответствии с композициями, представленными в Таблице 1. Получали композиции и фильтровали их при использовании фильтра 0,22 мкм, вносили во флаконы из ампульного стекла и закрывали с помощью резиновых пробок.
Было также обнаружено, что отсутствие NaCl и присутствие сахарозы в концентрации от 88 мМ до 292 мМ и полисорбата 80 или полисорбата 20 (50-200 част, на млн.), позитивно заряженных аминокислот, таких как аргинин (10-50 мМ), может эффективно ингибировать гликирование TFPI AT.

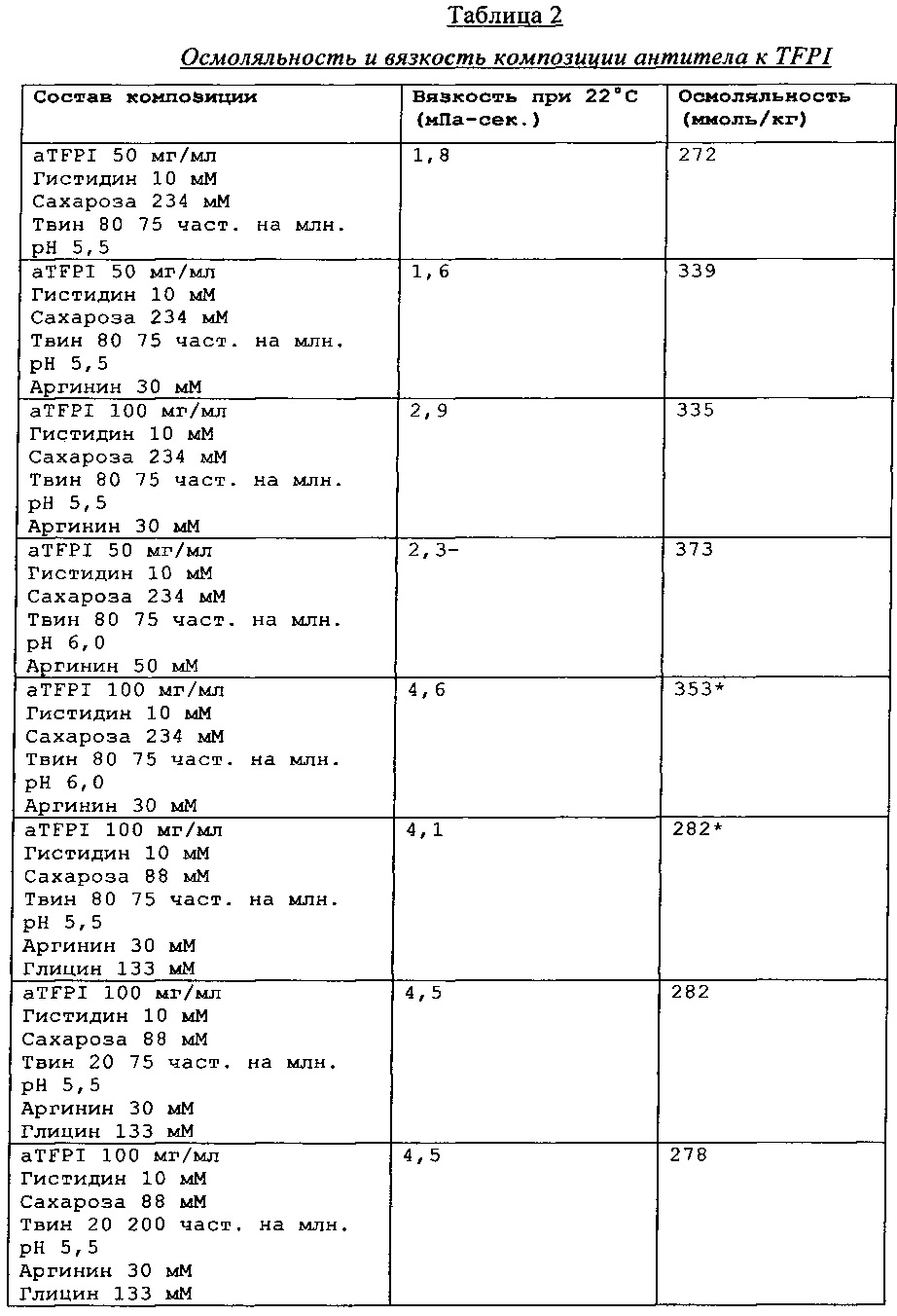
Каждую из этих композиций анти-TFPI МАТ подвергали анализу с помощью эксклюзионной ВЭЖХ на агрегацию и разложение белка, жидкостной хроматографии с масс-спектрометрией на структурные изменения aTFPI (гликирование и окисление), нефелометрии для оценки помутнения, вискозиметра для измерения вязкости и устройства для определения осмоляльности. Результаты этих анализов являются представленными в Таблице 2.
Пример 3
Влияние аргинина на гликирование антитела к TFPI
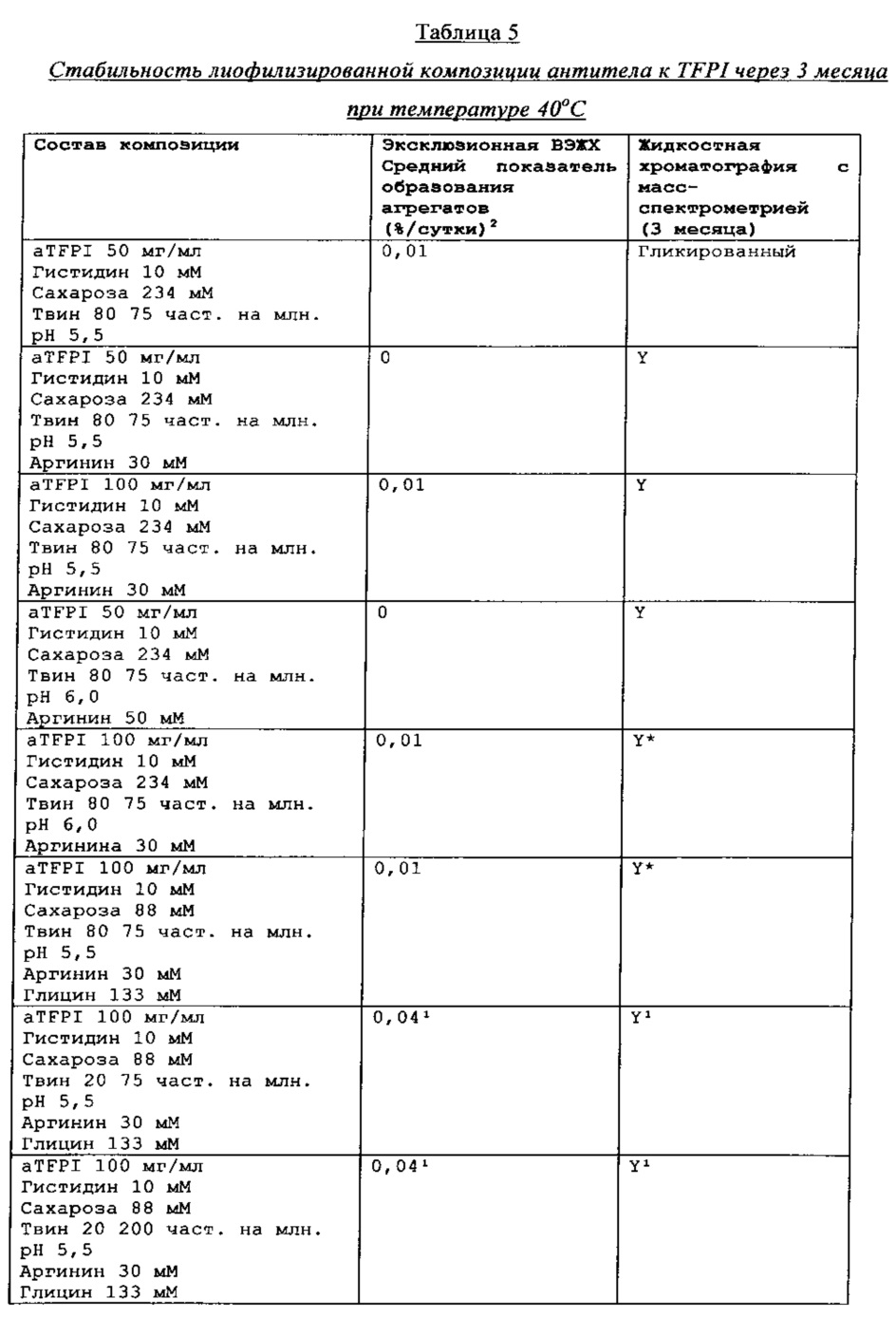
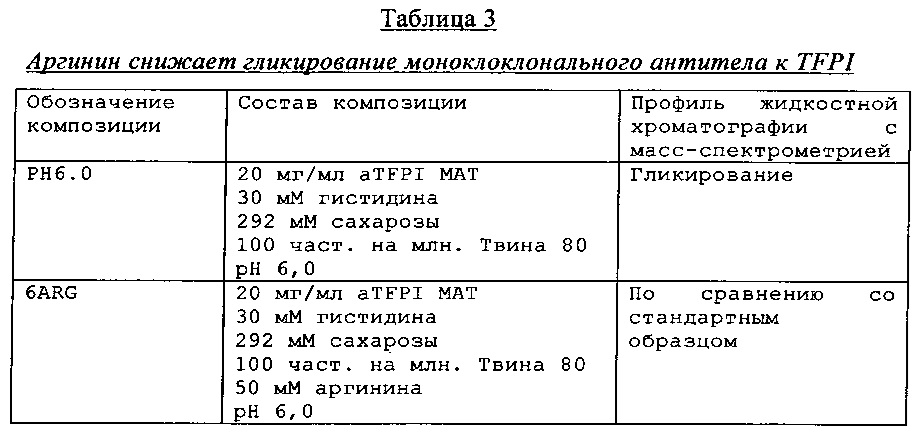
Пример демонстрирует, что композиции антитела к TFPI, которые содержат аргинин, демонстрируют сниженное гликирование антитела по сравнению с композициями антитела к TFPI без добавления аргинина.
Композиции антитела к TFPI, с аргинином или без него, при рН 6 хранили при 40°С в течение 14 дней и исследовали с помощью жидкостной хроматографии с масс-спектрометрией. Результаты, которые представленные в Таблице 3, демонстрируют, что позитивно заряженная аминокислота аргинин снижает гликирование антитела к TFPI, возможно, благодаря уникальной структуре aTFPI антитела, до уровня, обнаруженного в стандартном образце.
На основе этих результатов этого исследования можно сделать вывод, что стабильность антитела aTFPI подвергается значительному влиянию со стороны рН композиции, оптимальное значение рН для стабильности композиции составляет от рН 5 до рН 6, когда рассматривается внутривенная, внутримышечная и подкожная инъекции. Аргинин оказался способным предотвращать гликирование aTFPI антитела. Разработка композиции и изучение стабильности, представленные в Примере 4 и Примере 5, осуществлялись на основе этих открытий.
Пример 4
Стабильность композиции антитела к TFPI
Результаты эксклюзионной ВЭЖХ и результаты жидкостной хроматографии с масс-спектрометрией композиции антителак TFPI подытожены в Таблицах 4-7.