ПРОИЗВОДНЫЕ ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
В данной заявке испрашивается приоритет согласно предварительной патентной заявке США № 61/845342, поданной 11 июля 2013, озаглавленной “ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ” и предварительной патентной заявке США № 61/923179, поданной 2 января 2014, озаглавленной “ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ”, Содержание обеих заявок включено в данный документ посредством ссылки полностью. Эта заявка, в определенных аспектах, также относится к предварительной патентной заявке США № 61/586718, поданной 13 января 2012, озаглавленной “Гетероциклические соединения и их применение в качестве противораковых агентов”, предварительной патентной заявке США № 13/740182, поданной 12 января 2013, озаглавленной “ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ”, предварительной патентной заявке США № 61/680231, поданной 6 августа 2012, озаглавленной "НОВЫЕ МОДУЛЯТОРЫ РЭФР И ИХ ПРИМЕНЕНИЕ", предварительной патентной заявке США № 61/814147, поданной 19 апреля 2013, озаглавленной "НОВЫЕ СОЕДИНЕНИЯ ПИРРОЛОПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ", патентной заявке США № 13/843554, поданной 15 марта 2013, озаглавленной "НОВЫЕ МОДУЛЯТОРЫ РЭФР И ИХ ПРИМЕНЕНИЕ" и патентной заявке США 13/917514, поданной 13 июня 2013, озаглавленной " НОВЫЕ МОДУЛЯТОРЫ РЭФР И ИХ ПРИМЕНЕНИЕ". Содержание указанных выше заявок включено в данный документ посредством ссылки полностью.
Область техники
Областью данного изобретения являются фармацевтические соединения, композиции и способы, особенно если они относятся к композициям и способам лечения пролиферативных расстройств, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухости глаза или иммунологически родственного заболевания, и в некоторых вариантах, болезней или расстройств, связанных с дисрегуляцией киназы (такой как, но не ограниченной ими, РЭФР (включая HER), Alk, PDGFR, BLK, BMX/ETK, BTK, FLT3(D835Y), ITK, JAK1, JAK2, JAK3, TEC и TXK) и/или соответствующих путей.
Уровень техники
Протеинкиназы представляют собой группы ферментов, которые регулируют различные важные биологические процессы, включая рост клеток, пролиферацию, выживание, инвазию и дифференциацию, образование органов, заживление и регенерацию тканей, и т.д. Протеинкиназы осуществляют свои физиологические функции через катализирование фосфорилирования белка и, следовательно, модулирование клеточной активности. Так как протеинкиназы оказывают сильное действие на клетки, их активность регулируется в значительной степени. Киназы включаются или отключаются фосфорилированием (иногда аутофосфорилированием), через связывание активирующих белков или ингибирующих белков, или малых молекул, или через контроль их места в клетке по отношению к их субстратам. Известно, что дисфункции активности киназ, возникающие из-за генетических аномалий или факторов окружающей среды, связаны с множеством заболеваний. Некоторые тяжелые патологические состояния, включая рак и хроническое воспаление, связаны со стимулированием внутриклеточной подачи сигналов, и так как киназы положительно передают сигнальные события, их ингибирование является мощным способом ингибирования или контроля каскадов трансдукции сигналов.
Рецептор эпидермального фактора роста (РЭФР; ErbB-1; HER1 у человека) является членом семейства рецепторов ErbB, подсемейства четырех тесно родственных рецепторов тирозинкиназ: РЭФР (ErbB-1), HER2/c-neu (ErbB-2), Her 3 (ErbB-3) и Her 4 (ErbB-4). РЭФР является рецептором на поверхности клетки для членов семейства эпидермального фактора роста (ЭФР-семейства) внеклеточных белковых лигандов. Мутации, влияющие на экспрессию или активность РЭФР, могут вызвать рак. Описано, что РЭФР дерегулирован в большинстве твердых типов опухолей, например, раке легких, раке молочной железы и раке мозга. Предполагают, что мутации, амплификации или неправильное регулирование РЭФР или семейства членов вовлечены в около 30% случаев рака эпителия. Были разработаны терапевтические подходы на основе ингибирования РЭФР либо лекарственным средством на основе антитела, либо низкомолекулярным ингибирующим лекарственным средством, таким как гефитиниб и эрлотиниб. В случае не мелкоклеточного рака легких, гефитиниб и эрлотиниб оказывают положительное действие у около 10-40% пациентов. Однако приобретенная резистентность к гефитинибу или эрлотинибу через некоторое время после начала лечения становится основной клинической проблемой. Исследования подтвердили, что одной из основных причин развития резистентности является присутствие новой мутации T790M, которая является «привратником» РЭФР. Затем были разработаны ингибиторы, которые могут преодолевать эту T790M и показывают преимущество в клиническом испытании, такие как BIBW2992. Однако такой нацеленный на T790M ингибитор РЭФР все еще обладает родственным ингибирующим действием в отношении дикого типа РЭФР, что ограничивает клиническое применение. Необходимо далее разрабатывать более эффективный тип ингибитора РЭФР, который будет нацелен в основном на мутацию и практически не нацелен на белок дикого типа.
Другие протеинкиназы, которые являются полезными целями для низкомолекулярных фармацевтических препаратов, включают B лимфоидную тирозинкиназу (BLK), Янус-киназу 1 (JAK1), киназу костного мозга на X хромосоме (BMX/ETK), тирозинкиназ Брутона (BTK), Янус-киназу 2 (JAK2), Янус-киназу 3 (JAK3), тирозинкиназу, экспрессируемую в печеночно-клеточной карциноме (TEC), покоящуюся лимфоцитарную киназу (TXK, также известную как RLK), FMS-подобную тирозинкиназу 3 (FLT3) и FLT3 (D835Y).
Описание изобретения
В одном аспекте, в данном изобретении представлено гетероциклическое соединение, имеющее структуру формулы I:
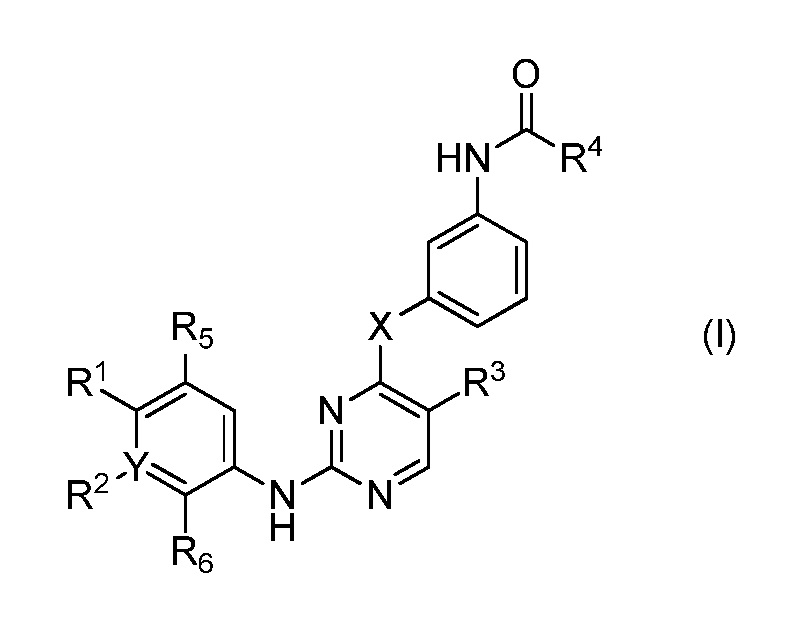 ,
,
где
R1 является Н, или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом, и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало;
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало или N,
где, по крайней мере, один из R2, R3, R5 и R6 не является H;
или его фармацевтически приемлемая соль.
В другом аспекте, в данном изобретении представлено гетероциклическое соединение, имеющее структуру формулы II:
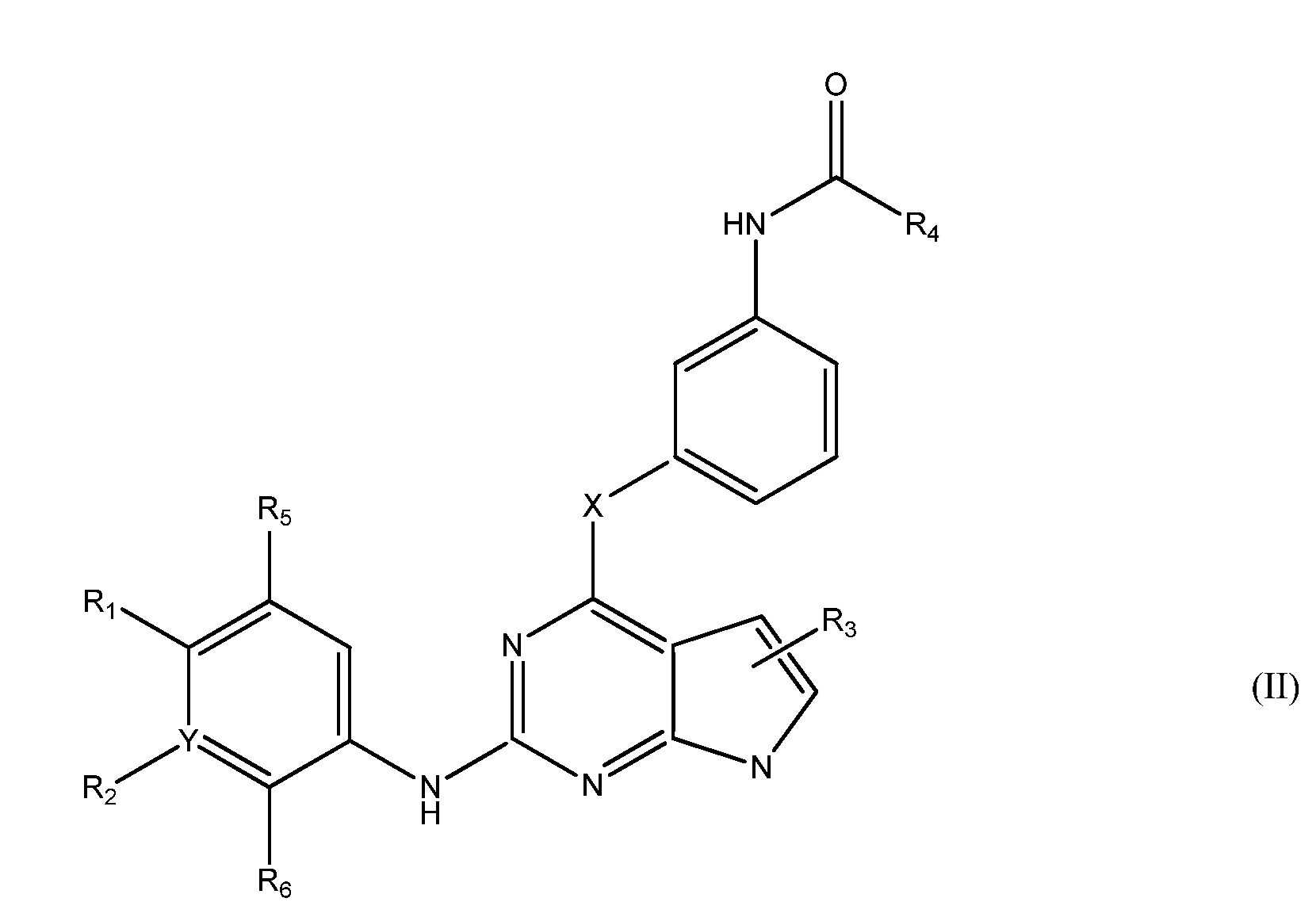 ,
,
где
R1 является Н или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом, и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
NReRf, где Re является C1-4 алкилом, и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало; или
ORg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 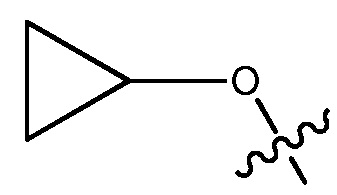 или
или 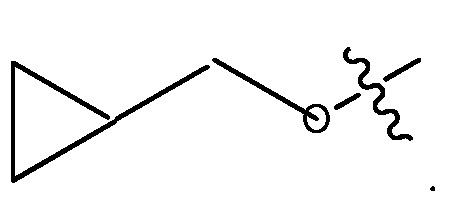 .
.
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало или N,
или его фармацевтически приемлемая соль.
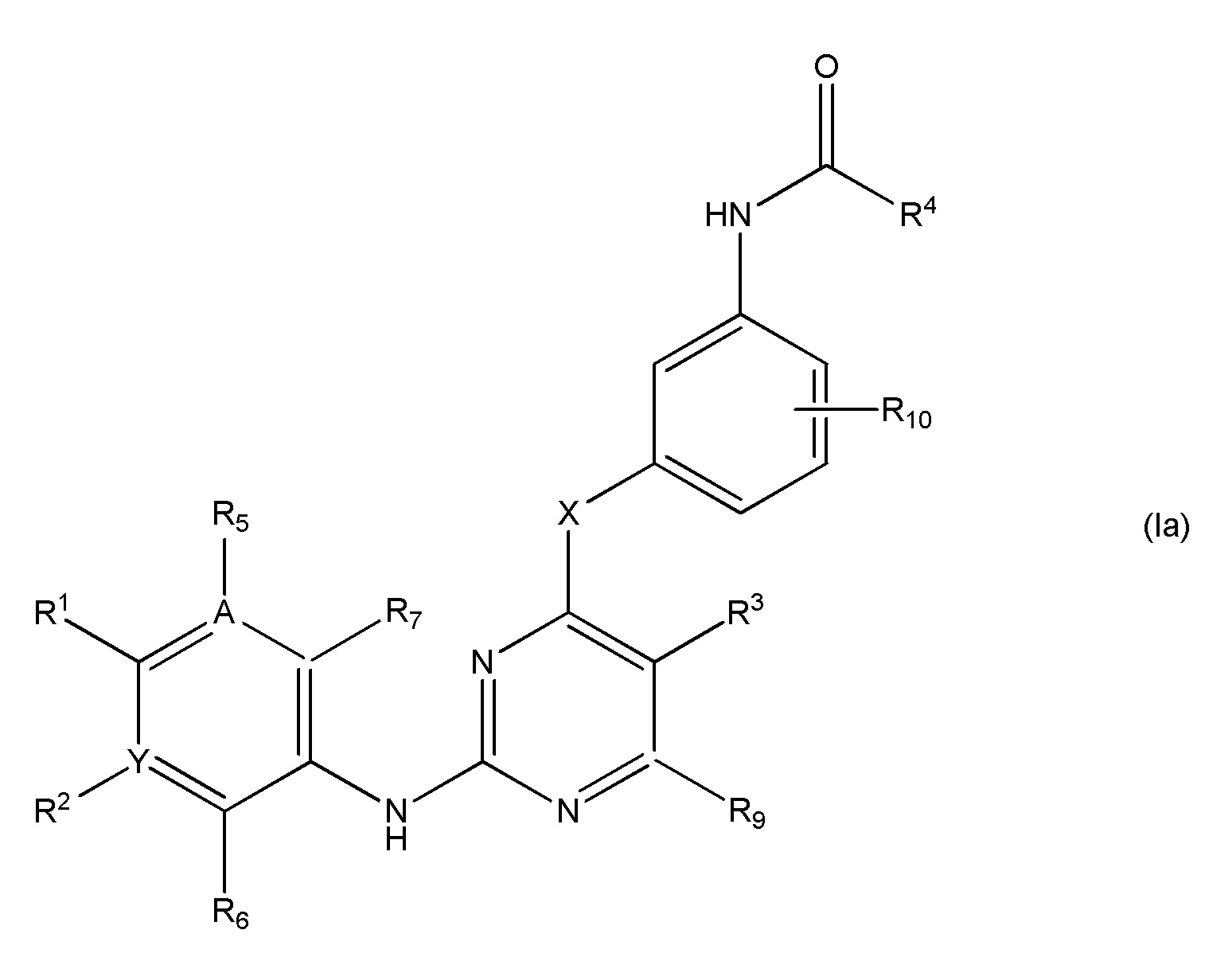
В еще одном аспекте, в данном изобретении представлено гетероциклическое соединение, имеющее структуру формулы Ia:
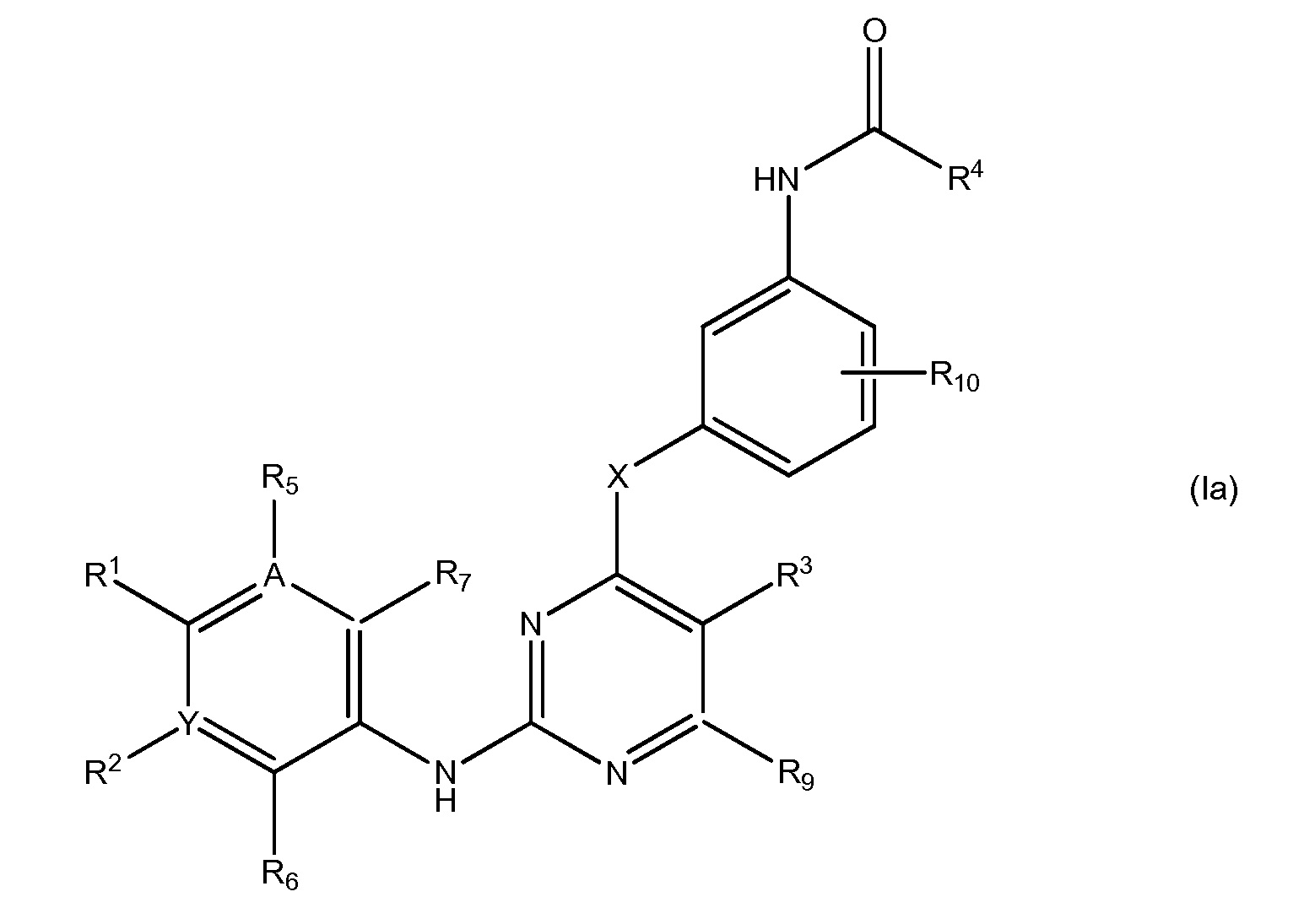 ,
,
где
R1 является Н или
NRcRd, где
Rc является Н, C1-4 алкилом, C1-4 алкенилом или 3-7-членным циклическим кольцом, где указанный C1-4 алкил, C1-4 алкенил или 3-7-членное циклическое кольцо необязательно замещено OZ, или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, который далее необязательно замещен OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, который далее необязательно замещен SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, и
Rd является Н, C1-4 алкилом, C1-4 алкенилом или 3-7-членным циклическим кольцом, где указанный C1-4 алкил, C1-4 алкенил или 3-7-членное циклическое кольцо необязательно замещено OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом; или
3-7-членное циклическое кольцо замещено Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4; или
O(CH2)mSO2 (CH2)nH, где m равно 1-4 и n равно 1-4;
R2 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R3 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R5 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R6 является Н, гало, C1-4 алкилом, C1-4 алкокси; или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R7 является Н, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R9 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R10 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом; или
R1 и R5 являются частью 3-7-членного циклического кольца, где указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, где указанный C1-4 алкил далее необязательно замещен гало, OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом, или один или более членов указанного 3-7-членного циклического кольца является необязательной частью карбонильной группы или сульфонильной группы; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом;
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2;
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало;
Y является C, CH, необязательно замещенным гало или N;
A является C, CH, необязательно замещенным гало или N; и
где по крайней мере, один из R2, R3, R5 и R6 не является H;
или его фармацевтически приемлемая соль.
В еще одном аспекте, в данном изобретении представлено гетероциклическое соединение, имеющее структуру формулы IIa:
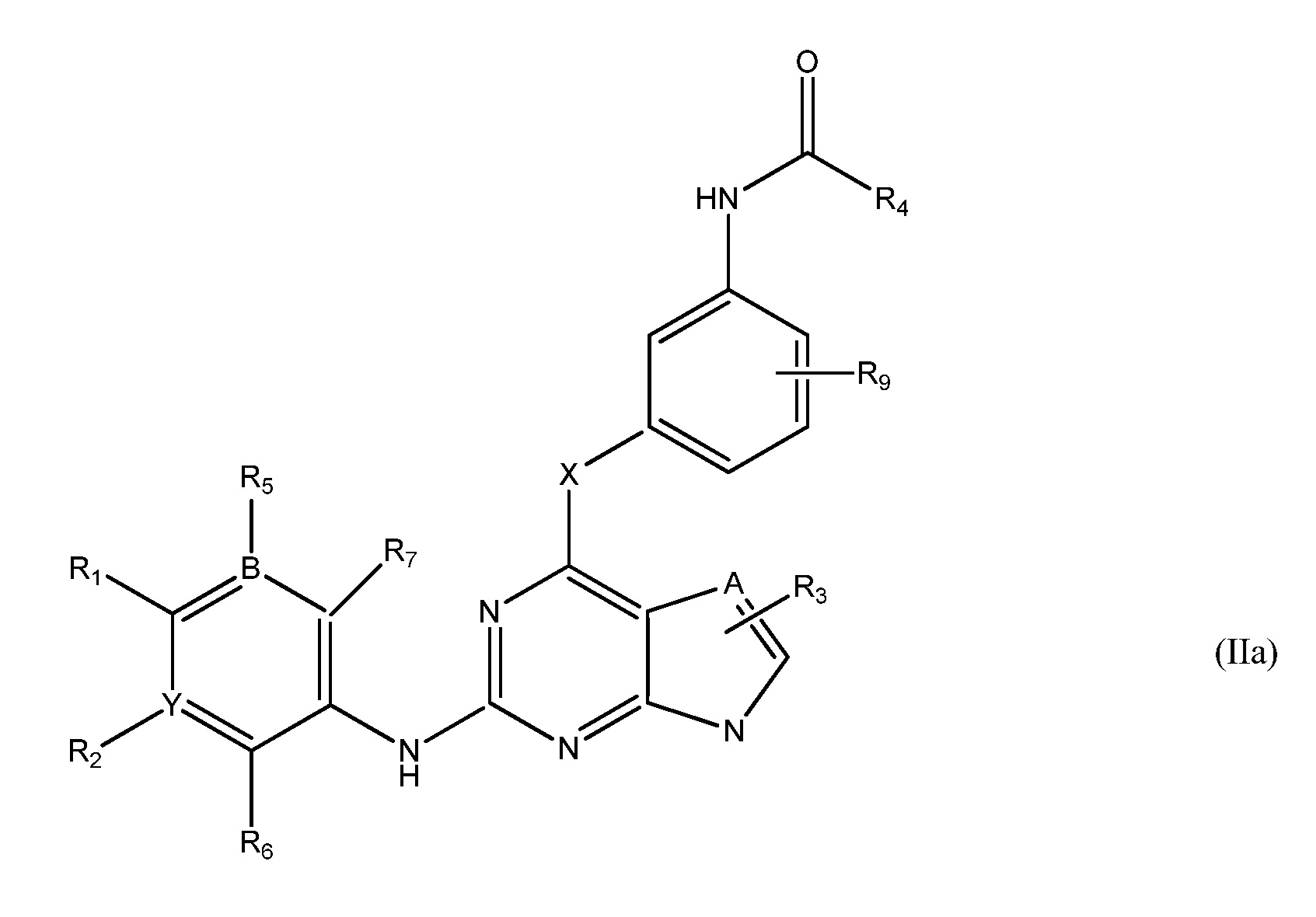 ,
,
где
R1 является Н или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом, где указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4, и Rd является Н, C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 являются H или C1-4 алкилом; или
NReRf, где Re является C1-4 алкилом, и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало; или
ORg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 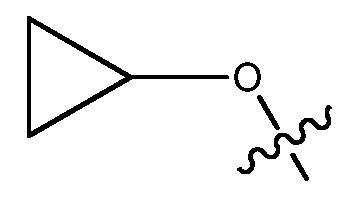 или
или 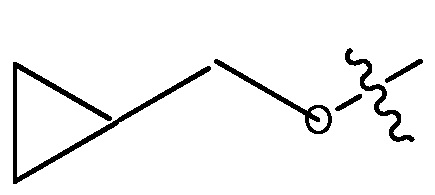 или 3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом;
или 3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом;
R2 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R3 отсутствует, является H, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R5 отсутствует, является H, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R7 является Н, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R9 является Н, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом; или
R1 и R5 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом;
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2;
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало;
Y является C, CH, необязательно замещенным гало или N;
A является C, CH, необязательно замещенным гало или N; и
B является C, CH, необязательно замещенным гало или N,
или его фармацевтически приемлемая соль.
Описанное выше соединение может применяться в любых подходящих целях. В некоторых вариантах, описанное выше соединение может применяться в терапии.
В еще одном аспекте, в данном изобретении представлена фармацевтическая композиция, содержащая описанное выше соединение, смешанное с, по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом.
В еще одном аспекте, в данном изобретении представлен способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухих глаз или иммунологически родственного заболевания или волчанки, который включает введение пациенту, нуждающемуся в таковом, эффективного количества описанного выше соединения или описанной выше фармацевтической композиции.
В еще одном аспекте, в данном изобретении представлено применение описанного выше соединения для производства лекарственного средства.
В еще одном аспекте, в данном изобретении представлена комбинация для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента, где комбинация включает эффективное количество описанного выше соединения или его фармацевтически приемлемой соли, и эффективное количество второго профилактического или терапевтического агента для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента.
В еще одном аспекте, в данном изобретении представлен способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента, где способы включают введение пациенту, нуждающемуся в таковом, эффективного количества описанной выше комбинации.
В еще одном аспекте, в данном изобретении представлен способ ингибирования активности тирозинкиназы Брутона (Btk или BTK) или Янус-киназы (JAK), РЭФР (включая HER), Alk, PDGFR, BLK, BMX/ETK, FLT3(D835Y), ITK, TEC, TXK, и соответствующих путей, в клетке или у пациента, где способ включает введение в клетку или пациенту, нуждающемуся в таковом, эффективного количества описанного выше соединения или описанной выше фармацевтической композиции или описанной выше комбинации.
Краткое описание чертежей
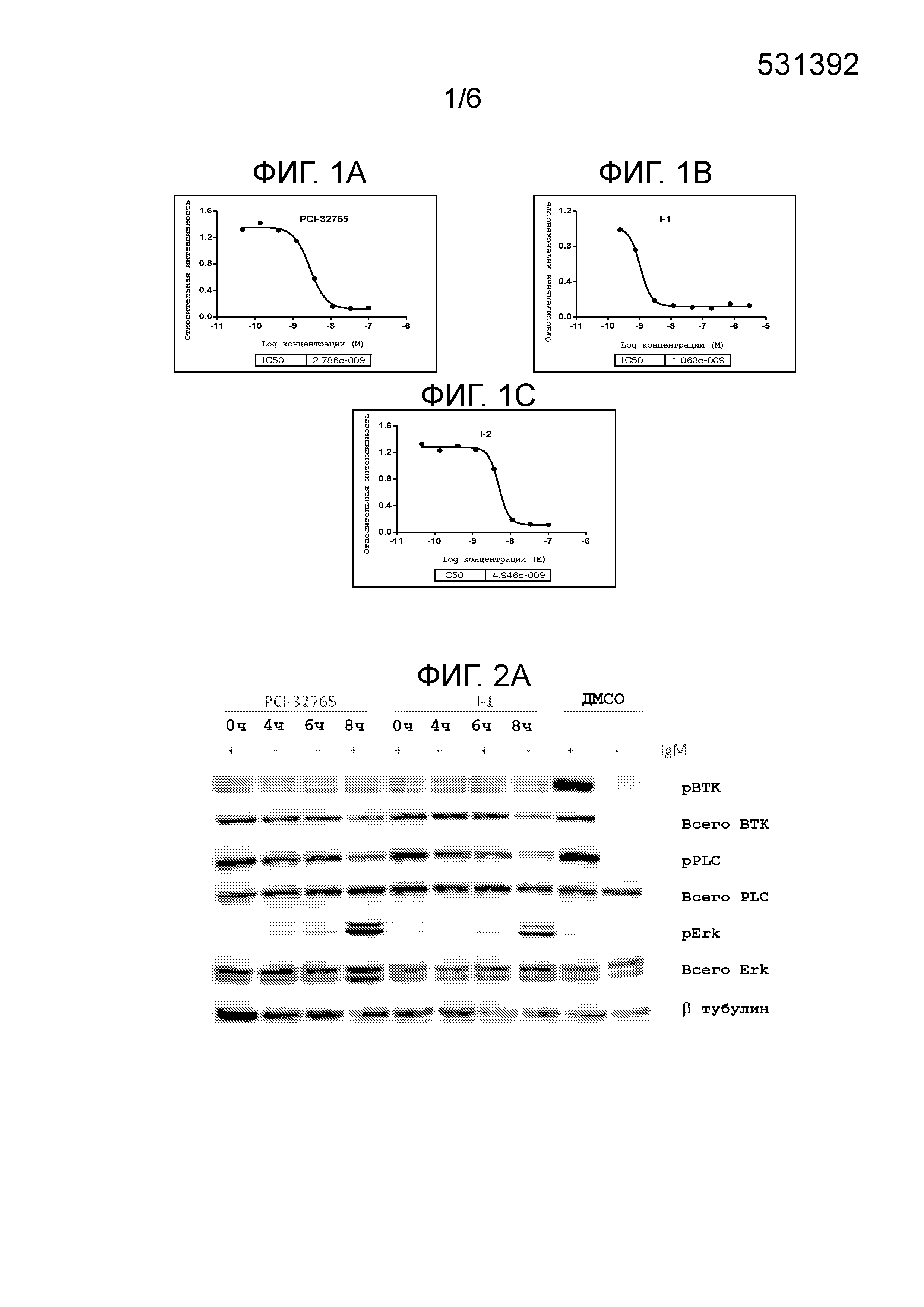
На фигуре 1 показано снижение Btk Tyr223 фосфорилирования в клетках Ramos типовыми соединениями. На фигуре 1A показано снижение Btk Tyr223 фосфорилирования в клетках Ramos PCI-32765 (Ибрутиниб). На фигуре 1B показано снижение Btk Tyr223 фосфорилирования в клетках Ramos соединением I-1. На фигуре 1C показано снижение Btk Tyr223 фосфорилирования в клетках Ramos соединением I-2.
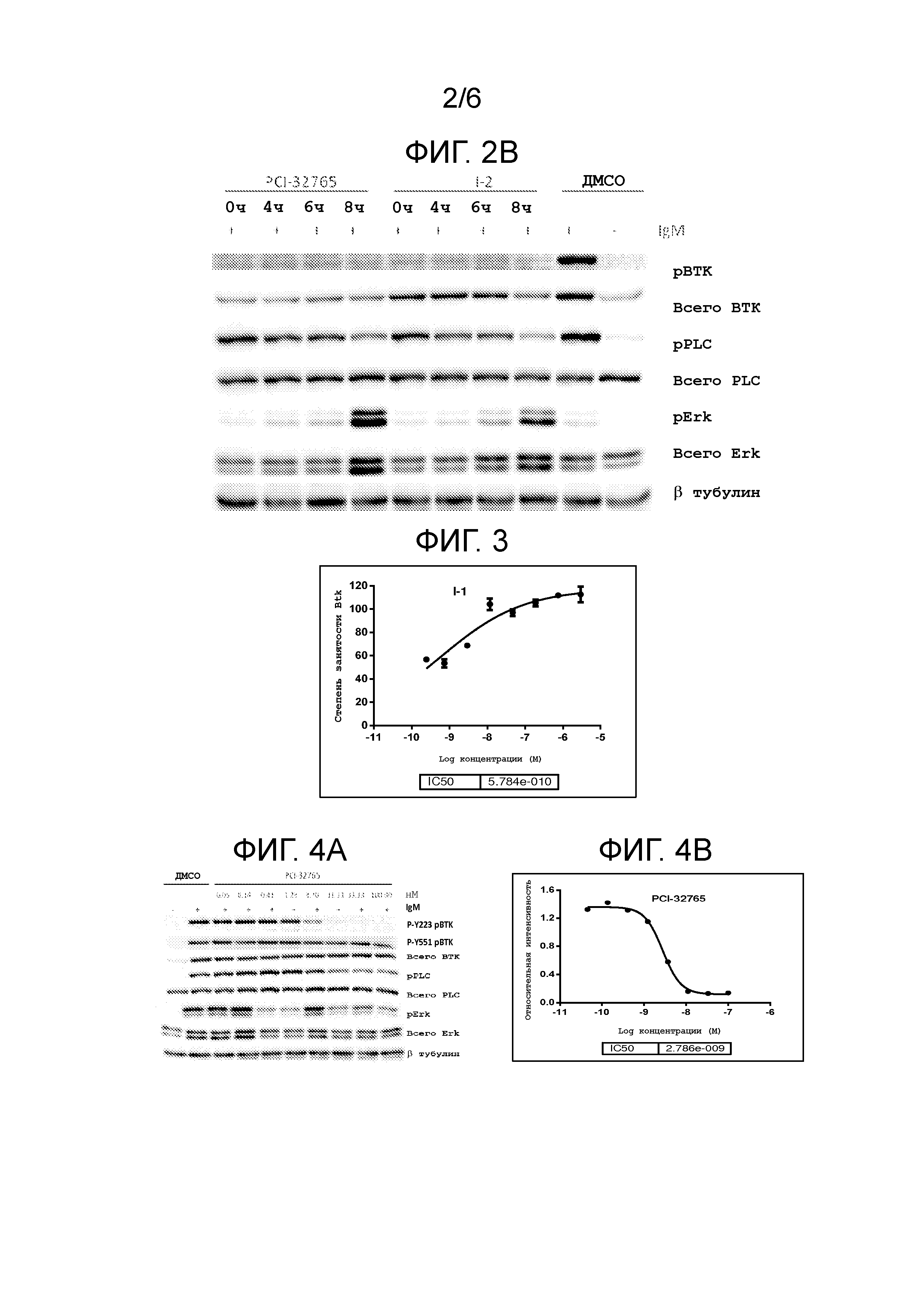
На фигуре 2 показано, что соединения I-1 и I-2 необратимо ингибируют BTK фосфорилирование в клетках Ramos.
На фигуре 3 показано дозозависимое ингибирование BTK фосфорилирования в клетках Ramos соединением I-1.
На фигуре 4A-4N показаны изображения типовых IC50 кривых вестерн-блоттинга для нескольких соединений, где PCI-32765 взят в качестве положительного Btk ингибитора.
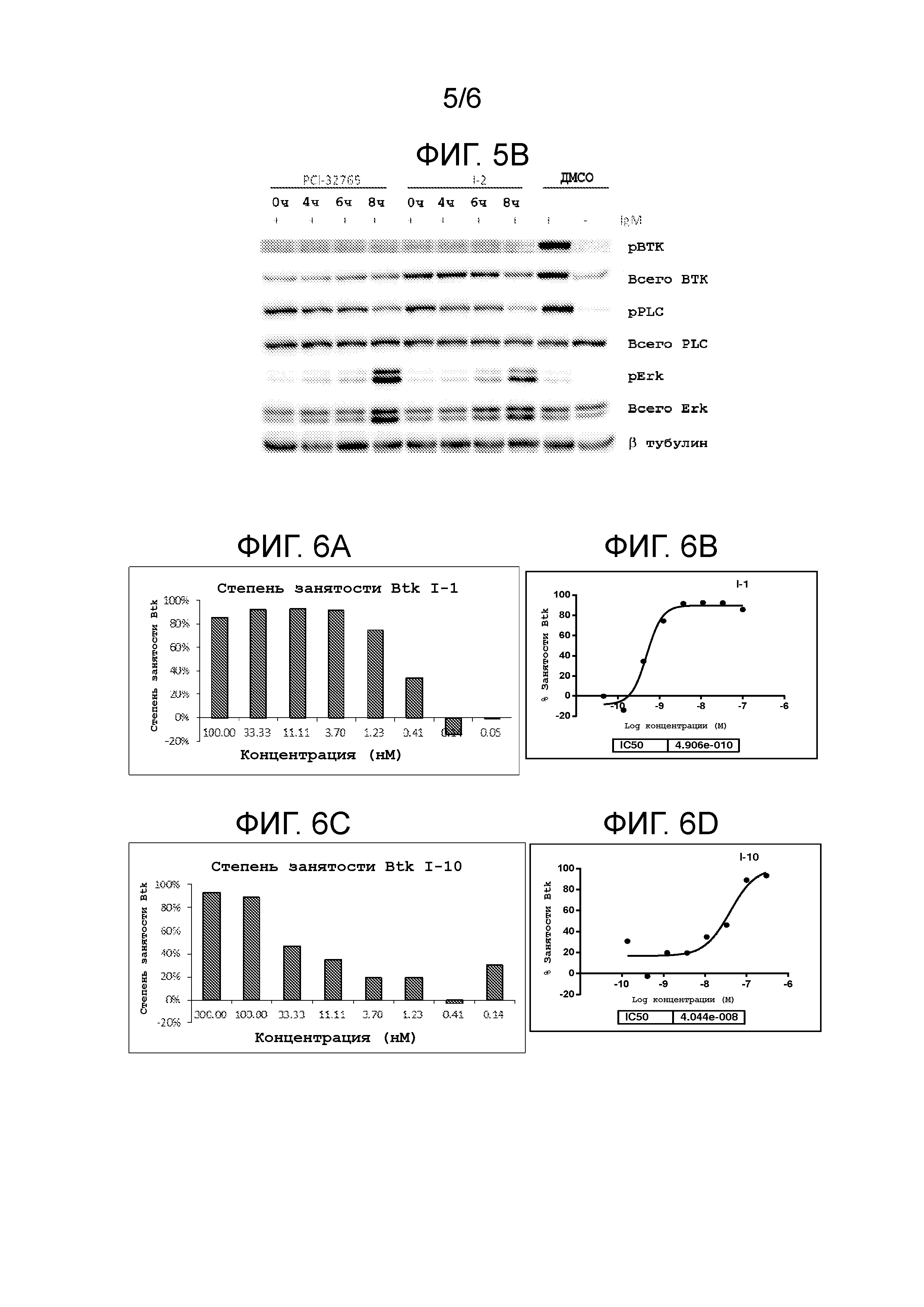
На фигуре 5A и 5B показано, что соединения I-1 и I-2 ингибируют Btk фосфорилирование в клетках Ramos через 8 часов после удаления.
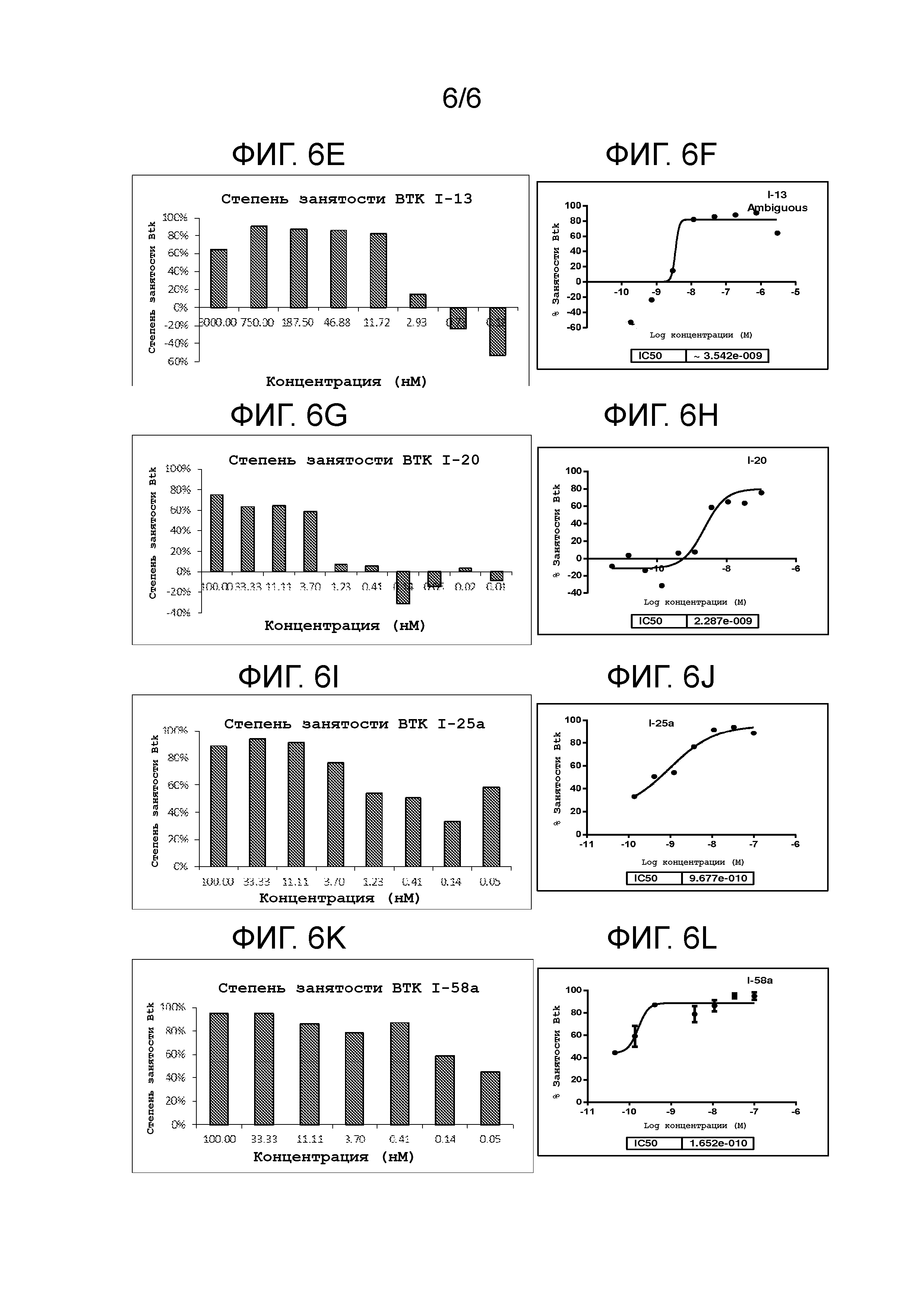
На фигуре 6A-6L показаны результаты типового ELISA анализа Btk занятости сайт-мишени для нескольких соединений.
Описание выбранных вариантов
Общие определения:
Если не указано иначе, все технические и научные термины, применяемые здесь, имеют значения, которые обычно принимаются специалистами в области техники, к которой принадлежит это изобретение. Все патенты, заявки, опубликованные заявки и другие публикации, указанные здесь, включены сюда в качестве ссылок полностью. Если представленное определение в этом разделе противоречит или другим образом не соответствует определению, данному в патенте, заявке или другой публикации, которая вставлена сюда в качестве ссылки, определение, данное в этом разделе, является приоритетным над определением, данным в ссылке.
В данном описании единственное число означает “по крайней мере, один” или “один или более”.
Термин “алкил” в данном описании относится к насыщенным углеводородным группам в прямой, разветвленной или циклической конфигурации или любом их сочетании, и в частности он включает алкильные группы, включающие группы, имеющие десять или менее атомов углерода, особенно, 1-6 атомов углерода, и низшие алкильные группы, имеющие 1-4 атомов углерода. Типовые алкильные группы включают метил, этил, пропил, изопропил, бутил, втор-бутил, третичный бутил, пентил, изопентил, гексил, циклопропилметил, и т.д.
Алкильные группы могут быть не замещенными или они могут быть замещены до такой степени, до которой такое замещение имеет химический смысл. Типовые заместители включают, но не ограничены ими, гало, =O, =N-CN, =N-ORa, =NRa, -ORa, -NRa2, -SRa, -SO2Ra, -SO2NRa2, -NRaSO2Ra, -NRaCONRa2, -NRaCOORa, -NRaCORa, -CN, -COORa, -CONRa2, -OOCRa, -CORa и -NO2, где каждый Ra независимо является H, C1-C8 алкилом, C2-C8 гетероалкилом, C3-C8 гетероциклилом, C4-C10 гетероциклилалкилом, C1-C8 ацилом, C2-C8 гетероацилом, C2-C8 алкенилом, C2-C8 гетероалкенилом, C2-C8 алкинилом, C2-C8 гетероалкинилом, C6-C10 арилом или C5-C10 гетероарилом, и каждый Ra необязательно замещен гало, =O, =N-CN, =N-ORb, =NRb, ORb, NRb2, SRb, SO2Rb, SO2NRb2, NRbSO2Rb, NRbCONRb2, NRbCOORb, NRbCORb, CN, COORb, CONRb2, OOCRb, CORb и NO2, где каждый Rb независимо является H, C1-C8 алкилом, C2-C8 гетероалкилом, C3-C8 гетероциклилом, C4-C10 гетероциклилалкилом, C1-C8 ацилом, C2-C8 гетероацилом, C6-C10 арилом или C5-C10 гетероарилом. Алкильные, алкенильные и алкинильные группы также могут быть замещены C1-C8 ацилом, C2-C8 гетероацилом, C6-C10 арилом или C5-C10 гетероарилом, каждый из которых может быть замещен заместителями, которые подходят для конкретной группы. Если замещающая группа содержит две Ra или Rb группы на одном или соседних атомах (например, -NRb2 или –NRb-C(O) Rb), две Ra или Rb группы могут быть необязательно взяты вместе с атомами в замещающей группе, к которым они присоединены, с образованием кольца, имеющего 5-8 членов в кольце, которое может быть замещено так, как эти применимо к самим Ra или Rb, и может содержать дополнительный гетероатом (N, O или S) в качестве члена кольца.
Термин “алкенил” в данном описании относится к алкилу, такому как определен выше, имеющему, по крайней мере, два атома углерода и, по крайней мере, одну двойную связь углерод-углерод. Таким образом, особенно предпочтительные алкенильные группы включают прямые, разветвленные или циклические алкенильные группы, имеющие от двух до десяти атомов углерода (например, этенил, пропенил, бутенил, пентенил и т.д.) или 5-10 атомов для циклических алкенильных групп. Алкенильные группы необязательно замещены группами, подходящими для алкильных групп, которые указаны здесь.
Также, термин “алкинил” в данном описании относится алкилу или алкенилу, такому как определен выше, и содержащему, по крайней мере, два (предпочтительно, три) атома углерода и, по крайней мере, одну тройную связь углерод-углерод. Особенно предпочтительные алкинилы включают прямые, разветвленные или циклические алкины, имеющие от двух до десяти атомов углерода (например, этинил, пропинил, бутил, циклопропилэтинил и т.д.). Алкинильные группы необязательно замещены группами, подходящими для алкильных групп, которые указаны здесь.
Термин “циклоалкил” в данном описании относится к циклическому алкану (т.е. в котором цепь атомов углерода углеводорода образует кольцо), предпочтительно, включающему от трех до восьми атомов углерода. Таким образом, типовые циклоалканы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Циклоалкилы также включают дну или две двойные связи, которые образуют “циклоалкенильные” группы. Циклоалкильные группы необязательно замещены группами, подходящими для алкильных групп, которые указаны здесь.
Термин “арил” или “ароматическая группа” в данном описании относится к ароматической кольцевой системе, которая может также включать один или более атомов, отличных от углерода. Она включает типовые 5-6-членные отдельные кольца или 8-10-членные бициклические группы, и может быть замещена. Таким образом, рассматриваемые арильные группы включают, например, фенил, нафтил и т.д., и пиридил. Также рассматриваемые арильные группы могут быть конденсированы (т.е., ковалентно связаны с 2 атомами на первом ароматическом кольце) с одной или двумя 5- или 6-членными арильными или гетероциклическими группами, и они обозначены как “конденсированный арил” или “конденсированная ароматическая группа”.
Ароматические группы, содержащие один или более гетероатомов (обычно N, O или S) в качестве членов кольца могут быть названы гетероарильными или гетероароматическими группами. Типовые гетероароматические группы включают моноциклические C5-C6 ароматические группы, такие как пиридил, пиримидил, пиразин, тиенил, фуранил, пирролил, пиразолил, тиазолил, оксазолил, изотиазолил, изоксазолил и имидазолил, и конденсированные бициклические группы, полученные конденсированием одной из этих моноциклических групп с фенильным кольцом или с любой из гетероароматических моноциклических групп с образованием C8-C10 бициклической группы, такие как индолил, бензимидазолил, индазолил, бензотриазолил, изохинолил, хинолил, бензотриазолил, бензофуранил, пиразолопиридил, пиразолопиримидил, хиназолинил, хиноксалинил, циннолинил и подобные. Любая моноциклическая или конденсированная кольцевая бициклическая система, которая имеет характеристики ароматичности в смысле распределения электронов в кольцевой системе, включена в данное определение. Термин также включает бициклические группы, в которых, по крайней мере, кольцо, которое непосредственно присоединено к остатку молекулы, имеет характеристику ароматичности. Обычно кольцевые системы содержат 5-12 атомов в кольце.
В данном описании также термины “гетероцикл”, “циклогетероалкил” и “гетероциклические группы” применяются взаимозаменяемо и относятся к любому соединению, в котором множество атомов образуют кольцо через множество ковалентных связей, где кольцо включает, по крайней мере, один атом, отличный от атома углерода в качестве члена кольца. Особенно предпочтительные гетероциклические кольца включают 5- и 6-членные кольца с атомами азота, серы или кислорода в качестве атомов, отличных от углерода (например, имидазол, пиррол, триазол, дигидропиримидин, индол, пиридин, тиазол, тетразол и т.д.). Обычно эти кольца содержат 0-1 атом кислорода или серы, по крайней мере, один, и обычно 2-3 атома углерода и вплоть до четырех атомов азота в качестве членов кольца. Другие предпочтительные гетероциклы могут быть конденсированы (т.е., ковалентно связаны с двумя атомами на первом гетероциклическом кольце) с одним или двумя карбоциклическими кольцами или гетероциклами, и они обозначены как “конденсированный гетероцикл” или “конденсированное гетероциклическое кольцо” или “конденсированные гетероциклические группы” в данном описании. Если кольцо является ароматическим, оно может быть обозначено здесь как ‘гетероарил’ или гетероароматические группы.
Гетероциклические группы, которые не являются ароматическими, могут быть замещены группами, подходящими в качестве заместителей алкильной группы, как указано выше.
Арильные и гетероарильные группы могут быть замещены там, где это возможно. Подходящие заместители включают, но не ограничены ими, гало, -ORa, -NRa2, -SRa, -SO2Ra, -SO2NRa2, -NRaSO2Ra, -NRaCONRa2, -NRaCOORa, -NRaCORa, -CN, -COORa, -CONRa2, -OOCRa, -CORa и -NO2, где каждый Ra независимо является H, C1-C8 алкилом, C2-C8 гетероалкилом, C3-C8 гетероциклилом, C4-C10 гетероциклилалкилом, C1-C8 ацилом, C2-C8 гетероацилом, C2-C8 алкенилом, C2-C8 гетероалкенилом, C2-C8 алкинилом, C2-C8 гетероалкинилом, C6-C10 арилом или C5-C10 гетероарилом, и каждый Ra необязательно замещен гало, =O, =N-CN, =N-ORb, =NRb, ORb, NRb2, SRb, SO2Rb, SO2NRb2, NRbSO2Rb, NRbCONRb2, NRbCOORb, NRbCORb, CN, COORb, CONRb2, OOCRb, CORb и NO2, где каждый Rb независимо является H, C1-C8 алкилом, C2-C8 гетероалкилом, C3-C8 гетероциклилом, C4-C10 гетероциклилалкилом, C1-C8 ацилом, C2-C8 гетероацилом, C6-C10 арилом или C5-C10 гетероарилом. Алкильные, алкенильные и алкинильные группы также могут быть замещены C1-C8 ацилом, C2-C8 гетероацилом, C6-C10 арилом или C5-C10 гетероарилом, каждый из которых может быть замещен заместителями, которые подходят для конкретной группы. Если замещающая группа содержит две Ra или Rb группы на одном или соседних атомах (например, -NRb2 или –NRb-C(O) Rb), две Ra или Rb группы могут быть необязательно взяты вместе с атомами в замещающей группе, в которым они присоединены, с образованием кольца, имеющего 5-8 членов в кольце, которое может быть замещено так, как подходит для самих Ra или Rb, и может содержать дополнительный гетероатом (N, O или S) в качестве члена кольца.
Также в данном описании термины “имидазопиридин” или “имидазопиримидин” или “тиазопиридин” или “тиазопиримидин” относятся к любому соединению, в котором два обозначенных гетероциклических кольца конденсированы с любыми двумя соседними атомами на двух гетероциклических кольцах.
Термин “алкокси” в данном описании относится к углеводородной группе, соединенной через атом кислорода, например, -O-Hc, где углеводородная часть Hc может иметь любое число атомов углерода, обычно 1-10 атомов углерода, которая также может включать двойную или тройную связь и сожжет включать один или два атома кислорода, серы или азота в алкильных цепях, и может быть замещена арильными, гетероарильными, циклоалкильными и/или гетероциклильными группами. Например, подходящие алкоксигруппы включают метокси, этокси, пропилокси, изопропокси, метоксиэтокси, бензилокси, аллилокси и подобные. Также, термин “алкилтио” относится к алкилсульфидам общей формулы –S-Hc, где углеводородная часть Hc такая, как описана для алкоксигрупп. Например, рассматриваемые алкилтиогруппы включают метилтио, этилтио, изопропилтио, метоксиэтилтио, бензилтио, аллилтио и подобные.
Термин “амино” в данном описании относится к группе –NH2. Термин “алкиламино” относится к аминогруппам, в которых один или оба атома водорода замещены углеводородной группой Hc, такой как описана выше, где атома азота амино “N” может быть замещен одной или двумя Hc группами, такими как описано для алкоксигрупп, описанных выше. Типовые алкиламиногруппы включают метиламино, диметиламино, этиламино, диэтиламино и т.д. Также термин “замещенный амино” относится к аминогруппам, в которых один или оба атома водорода замещены углеводородной группой Hc, такой как описана выше, где атома азота амино “N” может быть замещен одной или двумя Hc группами, такими как описано для алкоксигрупп, описанных выше.
Термин “ацил” в данном описании относится к группе формулы–C(=O)-D, где D является алкилом, алкенилом, алкинилом, циклоалкилом, арилом, гетероарилом или гетероциклом, таким как описано выше. Типовые примеры включают группы, где D является C1-C10 алкилом, C2-C10 алкенилом или алкинилом или фенилом, каждый из которых необязательно замещен. В некоторых вариантах, D может быть H, Me, Et, изопропилом, пропилом, бутилом, C1-C4 алкилом, замещенным –OH, -OMe или NH2, фенилом, галофенилом, алкилфенилом и подобными.
Термин “арилокси” в данном описании относится к арильной группе, соединенной с атомом кислорода, где арильная группа может быть далее замещена. Например, подходящие арилоксигруппы включают фенилокси и т.д. Также термин “арилтио” в данном описании относится к арильной группе, соединенной с атомом серы, где арильная группа может быть далее замещена. Например, подходящие арилтиогруппы включают фенилтио и т.д.
Углеводородная часть каждого алкокси, алкилтио, алкиламино и арилокси и т.д. может быть замещена подходящим для соответствующей углеводородной части образом.
Термин “галоген” в данном описании относится к фтору, хлору, брому и йоду. Если он присутствует в качестве замещающей группы, галоген или гало обычно относится к F или Cl или Br, более предпочтительно, F или Cl.
Термин “галоалкил” относится к алкильной группе, такой как описана выше, где один или более атомов водорода на алкильной группе замещены гало группой. Примеры таких групп включают, без ограничения, фторалкильные группы, такие как фторэтил, трифторметил, дифторметил, трифторэтил и подобные.
Термин “галоалкокси” относится к группе алкил-O-, где один или более атомов водорода на алкильной группе замещены гало группой, и включает, в качестве примера, группы, такие как трифторметокси и подобные.
Термин “сульфонил” относится к группе SO2-алкил, SO2-замещенный алкил, SO2-алкенил, SO2-замещенный алкенил, SO2-циклоалкил, SO2-замещенный циклоалкил, SO2-циклоалкенил, SO2-замещенный циклоалкенил, SO2-арил, SO2-замещенный арил, SO2-гетероарил, SO2-замещенный гетероарил, SO2-гетероциклический и SO2-замещенный гетероциклический, где каждый алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический такие, как определены выше. Сульфонил включает, в качестве примера, метил-SO2-, фенил-SO2- и 4-метилфенил-SO2-.
Термин “сульфониламино” относится к группе –NR21SO2R22, где R21 и R22 независимо выбирают из группы, включающей водород, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический, и где R21 и R22 необязательно объединены вместе с атомами, к которым они присоединены, с образованием гетероциклической или замещенной гетероциклической группы, и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический такие, как определены здесь.
Термин “аминосульфонил” относится к группе -SO2NR21R22, где R21 и R22 независимо выбирают из группы, включающей водород, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, гетероарил, замещенный гетероарил, гетероциклический, замещенный гетероциклический, и где R21 и R22 необязательно объединены вместе с атомом азота, к которому они присоединены, с образованием гетероциклической или замещенной гетероциклической группы, и алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический такие, как определены здесь.
Термин “ациламино” относится к группам -NR20C(O)алкил, -NR20C(O)замещенный алкил, -NR20C(O)циклоалкил, -NR20C(O)замещенный циклоалкил, -NR20C(O)циклоалкенил, -NR20C(O)замещенный циклоалкенил, -NR20C(O)алкенил, -NR20C(O)замещенный алкенил, -NR20C(O)алкинил, -NR20C(O)замещенный алкинил, -NR20C(O)арил, -NR20C(O)замещенный арил, -NR20C(O)гетероарил, -NR20C(O)замещенный гетероарил, -NR20C(O)гетероциклический и -NR20C(O)замещенный гетероциклический, где R20 является водородом или алкилом, и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический такие, как определены здесь.
Термин “алкоксикарбониламино” относится к группе -NRC(O)OR, где каждый R независимо является водородом, алкилом, замещенным алкилом, арилом, гетероарилом или гетероциклилом, где алкил, замещенный алкил, арил, гетероарил и гетероциклил такие, как определены здесь.
Термин “аминокарбониламино” относится к группе -NR20C(O)NR21R22, где R20 является водородом или алкилом, и R21 и R22 независимо выбирают из группы, включающей водород, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический, и где R21 и R22 необязательно объединены вместе с атомом азота, к которому они присоединены, с образованием гетероциклической или замещенной гетероциклической группы, и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклический и замещенный гетероциклический такие, как определены здесь.
Также должно быть понятно, что все определенные выше группы могут быть далее замещены одним или более заместителями, которые могут, в свою очередь, быть замещены гидрокси, амино, циано, C1-C4 алкилом, гало или C1-C4 галоалкилом. Например, атом водорода в алкиле или ариле может быть замещен амино, гало или C1-4 галоалкилом или алкильной группой.
Термин “замещенный” в данном описании относится к замещению атома водорода не замещенной группы функциональной группой, и особенно предпочтительные функциональные группы включают нуклеофильные группы (например, -NH2, -OH, -SH, -CN и т.д.), электрофильные группы (например, C(O)OR, C(X)OH и т.д.), полярные группы (например, -OH), не полярные группы (например, гетероцикл, арил, алкил, алкенил, алкинил и т.д.), ионные группы (например, -NH3+) и галогены (например, -F, -Cl), NHCOR, NHCONH2, OCH2COOH, OCH2CONH2, OCH2CONHR, NHCH2COOH, NHCH2CONH2, NHSO2R, OCH2-гетероциклы, PO3H, SO3H, аминокислоты и все их химически оправданные сочетания. Более того, термин “замещенный” также включает множественную степень замещения, и если множественные заместители описаны или заявлены, замещенное соединение может быть независимо замещено одной или более из описанных или заявленных замещающих групп.
В дополнение к данному описанию, в определенном варианте, замещенная группа имеет 1, 2, 3 или 4 заместителя, 1, 2 или 3 заместителя, 1 или 2 заместителя или 1 заместитель.
Понятно, что во всех замещенных группах, определенных выше, соединения, указанные при определении заместителей с другими заместителями их самих (например, замещенный арил, имеющий замещенную арильную группу в качестве заместителя, который сам замещен замещенной арильной группой, которая далее замещена замещенной арильной группой, и т.д.) сюда не включены. В таких случаях, максимальное количество замещений равно трем. Например, серийное замещение замещенных арильных групп, конкретно рассматриваемых здесь, ограничено замещенным арилом-(замещенным арилом)-замещенным арилом.
Если не указано иначе, номенклатура заместителей, которые отдельно не определены здесь, дается через наименование концевых частей функциональной группы, за которой следует соседняя функциональная группа в направлении точки присоединения. Например, заместитель “арилалкилоксикарбонил” относится к группе (арил)-(алкил)-O-C(O)-.
Что касается любых описанных здесь групп, которые содержат один или более заместителей, понятно, конечно, что такие группы не содержат каких-либо заместителей или схем замещения, которые пространственно нецелесообразны и/или синтетически невозможны. Кроме того, рассматриваемые соединения включают все стереохимические изомеры, возникающие при замещении этих соединений.
Термин “фармацевтически приемлемая соль” означает соль, которая приемлема для введения пациенту, такому как млекопитающее, такое как человек (соли с противоионами, обладающие приемлемой степенью безопасности для млекопитающих для данного режима дозирования). Такие соли могут быть получены из фармацевтически приемлемых неорганических или органических оснований и из фармацевтически приемлемых неорганических и органических кислот. “Фармацевтически приемлемая соль” относится к фармацевтически приемлемым солям соединения, где соли получают из множества органических и неорганических противоионов, хорошо известных в данной области техники, которые включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тераакиламмоний и подобные; и если молекула содержит основную функциональную группу, соли органических и неорганических кислот, такие как гидрохлорид, гидробромид, формат, тартрат, безилат, мезилат, ацетат, малеат, оксалат и подобные.
Термин “его соль” означает соединение, полученное при замещении протона кислоты катионом, таким как катион металла или органический катион и подобные. Если применимо, солью является фармацевтически приемлемая соль, хотя это не требуется для солей промежуточных соединений, которые не предназначены для введения пациенту. В качестве примера, соли соединений в соответствии с данным изобретением включают такие, где соединение протонировано неорганической или органической кислотой с получением катиона, с основанием, сопряженным с неорганической или органической кислотой, в качестве анионного компонента соли.
Соединения и композиции, описанные здесь, могут вводиться пациенту при необходимости лечения пролиферативных расстройств клеток, таких как рак, в частности, рак, выбранный из лейкемии, лимфомы, рака легких, рака толстой кишки, рака ЦНС, меланомы, рака яичников, рака почек, рака простаты, рака молочной железы, раков головы и шеи и рака поджелудочной железы. Пациентом обычно является млекопитающее, которому диагностирована необходимость в лечении одного или более из таких пролиферативных расстройств, и часто пациентом является человек. Способы включают введение эффективного количества, по крайней мере, одного соединения в соответствии с данным изобретением; необязательно соединение может вводиться в комбинации с одним или более дополнительными терапевтическими агентами, в частности, терапевтическими агентами, применяемыми для лечения рака или пролиферативного расстройства, поразившего конкретного пациента.
Типовые соединения
Формула I
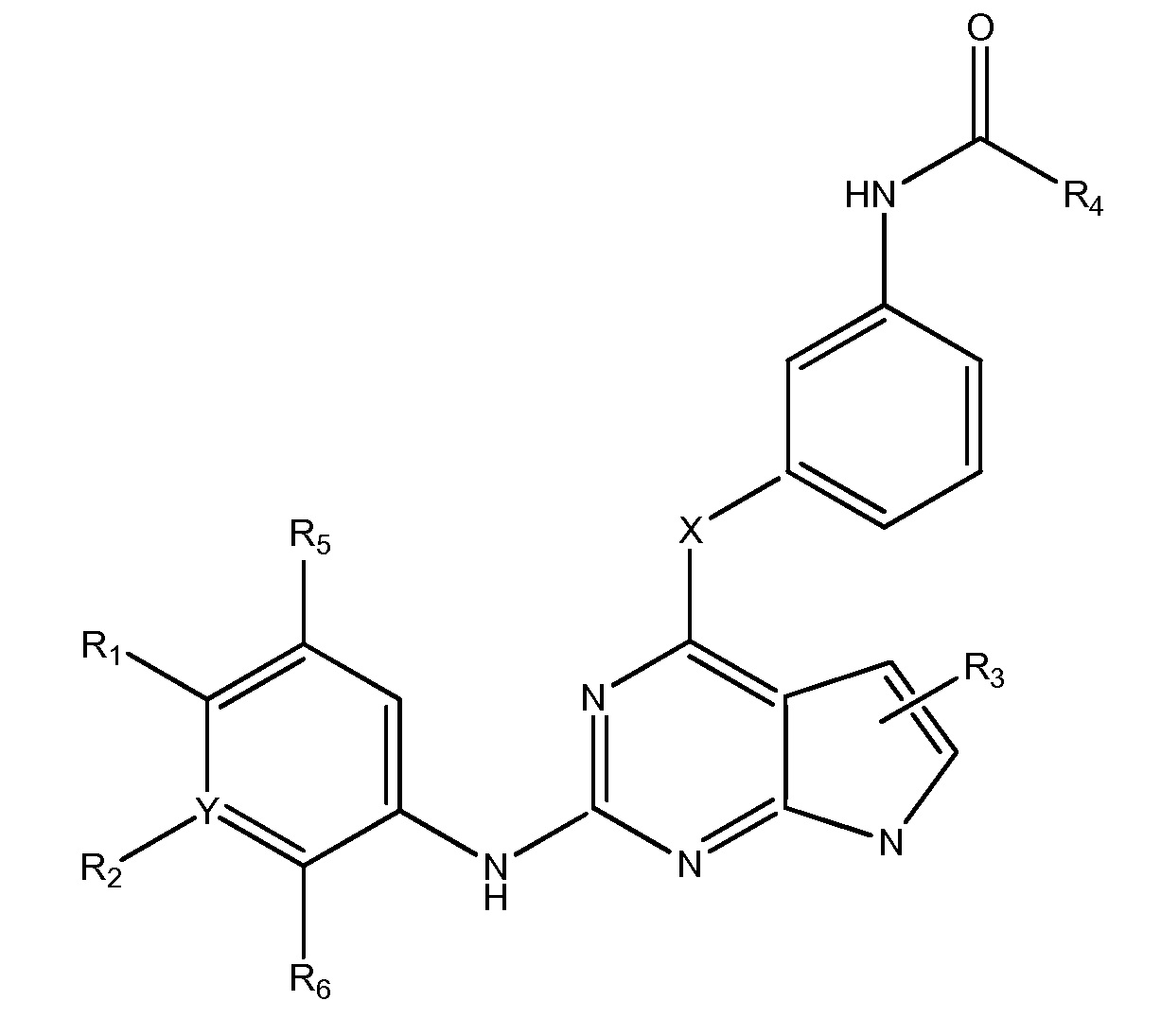
В одном аспекте, в данном изобретении представлено соединение формулы (I):
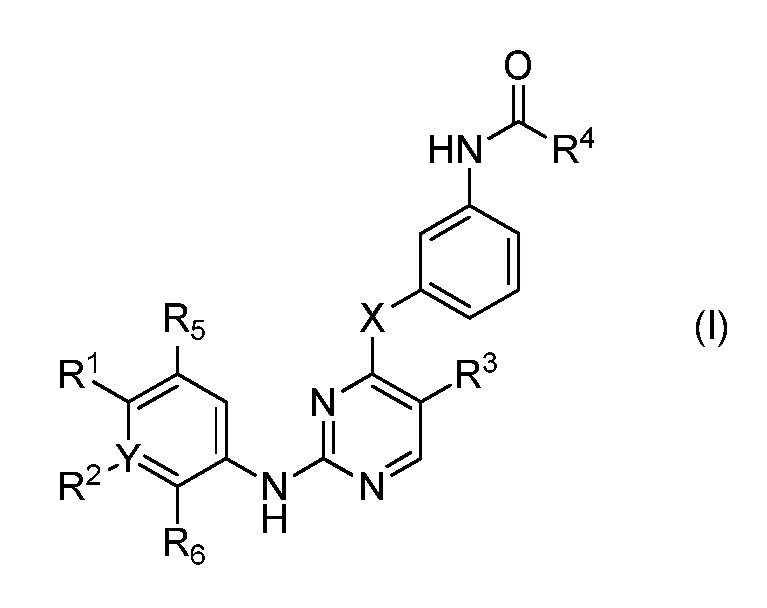 ,
,
где
R1 является Н, или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало;
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало, или N,
где, по крайней мере, один из R2, R3, R5 и R6 не является H;
или его фармацевтически приемлемая соль.
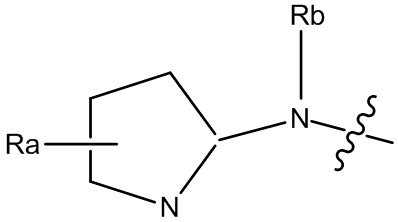
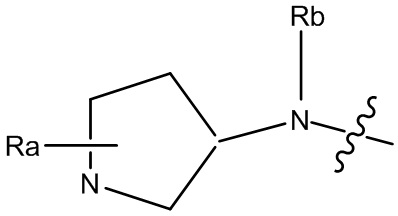
В некоторых вариантах, R1 является Н, и R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного OZ, где Z является Н или C1-4 алкилом, например, метилом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом.
В некоторых вариантах, R1 является NRcRd и Rc является метилом. В других вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть C3 циклическое кольцо. Rd может быть C2 алкилом, замещенным OZ, и Z является Н или C1-4 алкилом, например, метилом.
В некоторых вариантах, R1 является 3-7-членным циклическим кольцом, замещенным Ra. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, R1 может быть  или
или  .
.
В некоторых вариантах, R1 является  . Ra может быть C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси. Например, Ra может быть C1-4 алкилом, замещенным фтором или C1-8 алкилом, замещенным фтором. В других вариантах, R1 является
. Ra может быть C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси. Например, Ra может быть C1-4 алкилом, замещенным фтором или C1-8 алкилом, замещенным фтором. В других вариантах, R1 является 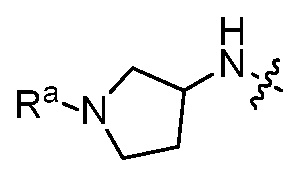 . Ra может быть C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси. Например, Ra может быть C1-4 алкилом, замещенным фтором или C1-8 алкилом, замещенным фтором.
. Ra может быть C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси. Например, Ra может быть C1-4 алкилом, замещенным фтором или C1-8 алкилом, замещенным фтором.
В некоторых вариантах, R2 может быть H. В других вариантах, R2 может быть гало, например, фтором. В других вариантах, R2 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R5 может быть H. В других вариантах, R5 может быть гало, например, фтором. В других вариантах, R5 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R6 может быть H. В других вариантах, R6 может быть гало, например, фтором. В других вариантах, R6 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R1 и R5 может быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R1 и R2 может быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R2 и R6 может быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть 5-членное циклическое кольцо. 5-членным циклическим кольцом может быть гетероциклическое кольцо, например, 5-членное гетероциклическое кольцо, которое содержит атом N. C1-4 алкилом может быть C1, C2, C3 или C4 алкил. Например, Z может быть метилом.
В некоторых вариантах, R3 может быть H. В других вариантах, R3 может быть гало, например, фтором. В других вариантах, R3 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R2, R5 или R6 является Н или гало и R3 является гало, C1-4 алкилом, например, метилом или C1-4 алкокси.
В некоторых вариантах, R4 может быть не замещенным C2 алкенилом. В других вариантах, R4 может быть C2 алкенилом, замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2.
В некоторых вариантах, X может быть O. В других вариантах, X может быть C1-4 алкилом, необязательно замещенным гало. Например, X может быть не замещенным C1-4 алкилом, например, CH2. В другом примере, X может быть C1-4 алкилом, замещенным гало, например, CF2. В других вариантах, X может быть NRb и Rb может быть H или C1-8 алкилом, необязательно замещенным гало. Например, Rb может быть H. В другом примере, Rb может быть C1-8 алкилом. В еще одном примере, Rb является C1-4 алкилом, например, C1, C2, C3 или C4 алкилом. C1-4 алкил или C1-8 алкил может быть замещен гало, например, фтором.
В некоторых вариантах, Y может быть CH. В других вариантах, Y может быть CF или N.
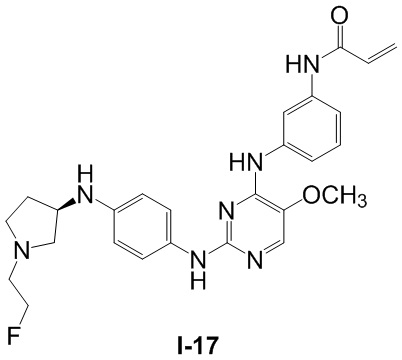
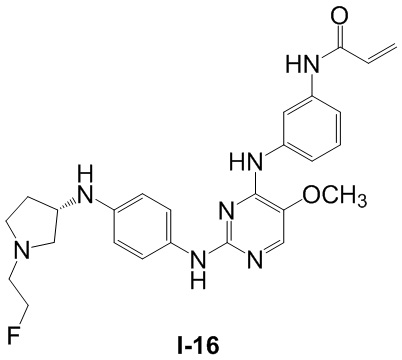
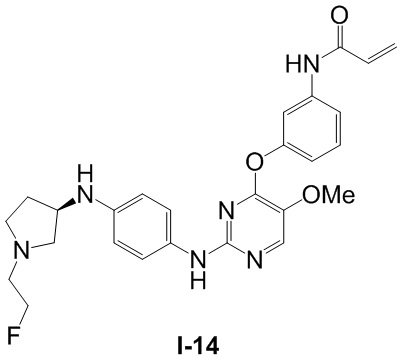
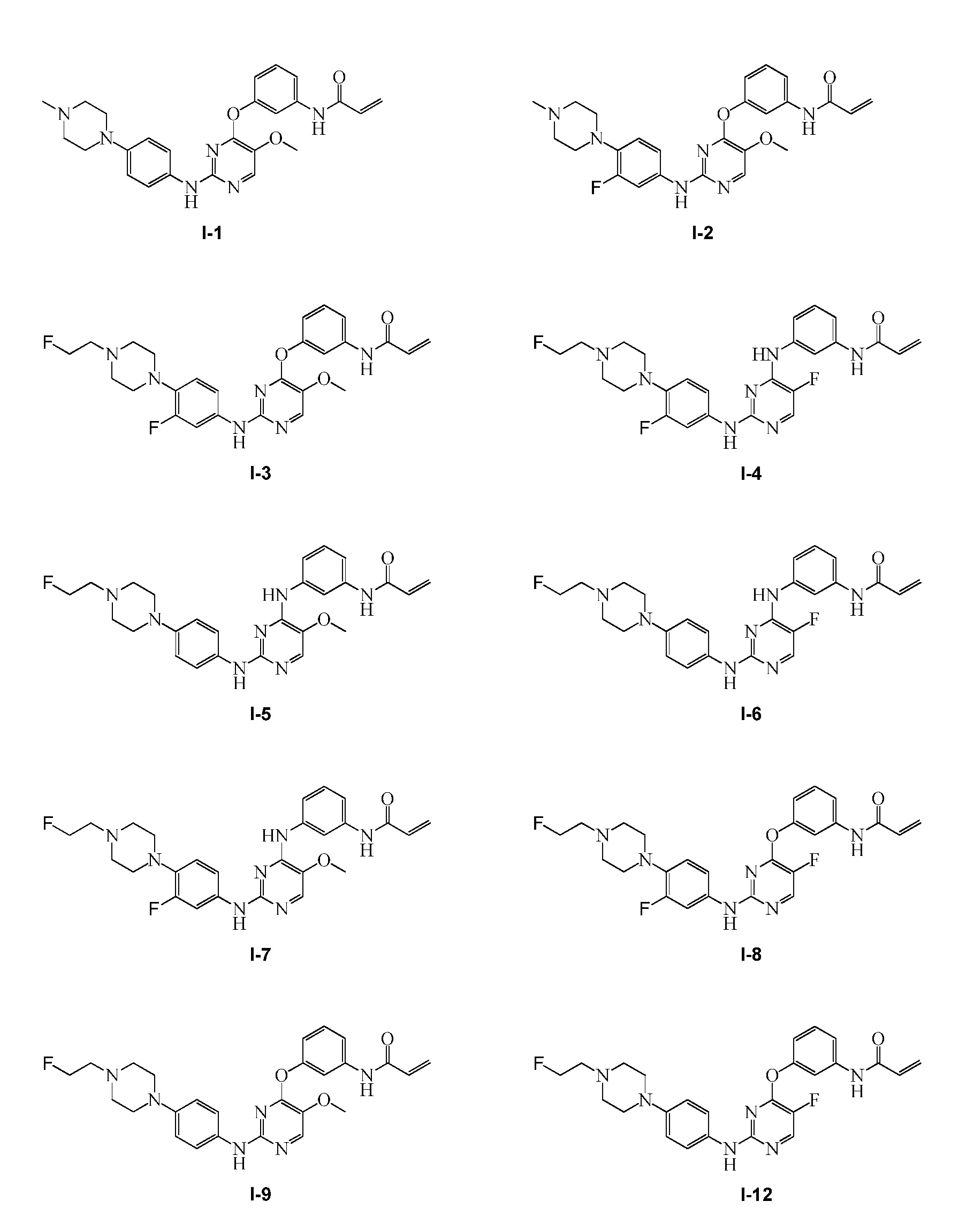
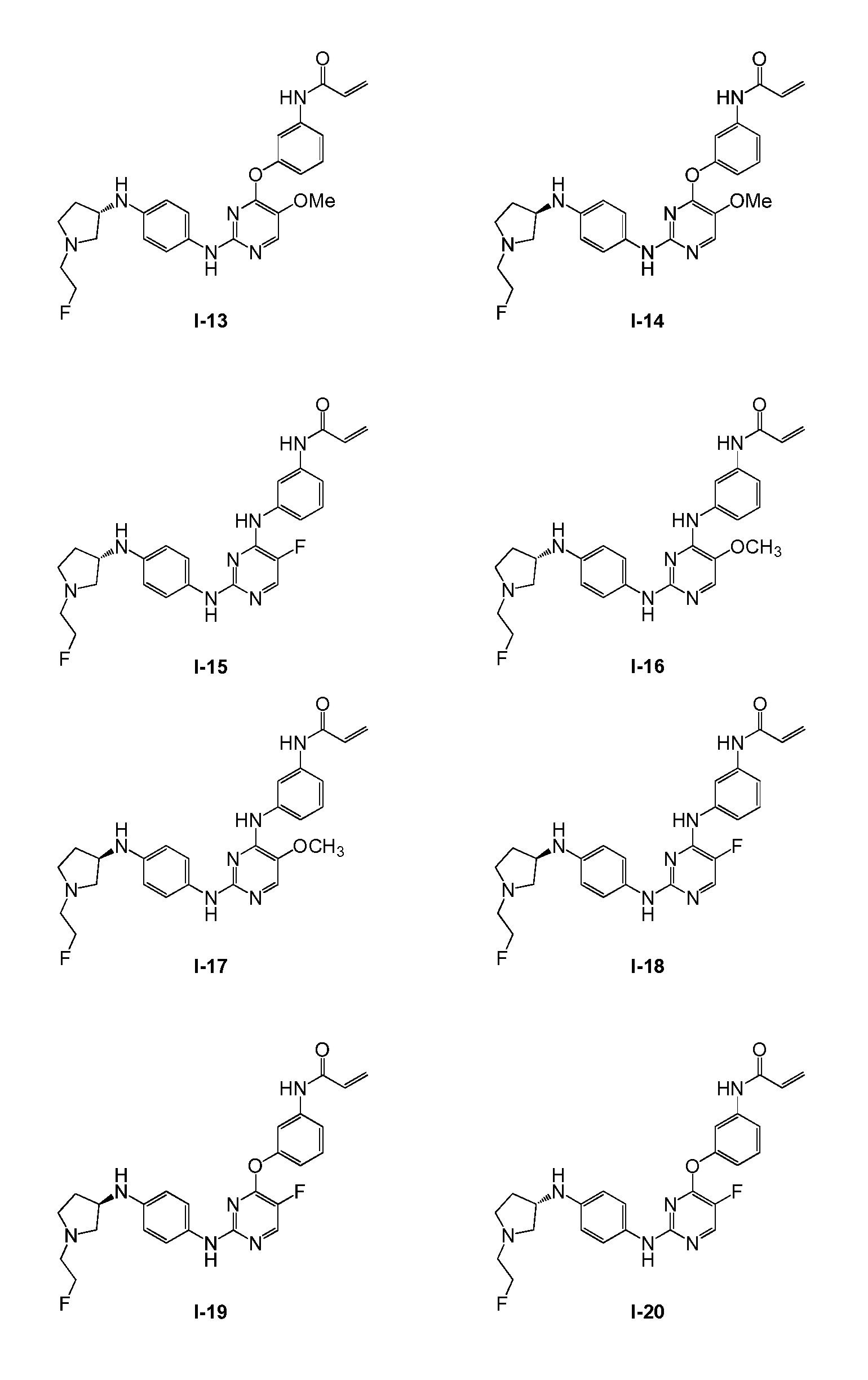
В некоторых вариантах, в данном изобретении представлено соединение, выбранное из группы, включающей соединение I-1, I-2, I-3, I-4, I-5, I-6, I-7, I-8, I-9, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20, I-21, I-22, I-23, I-24, I-25 и I-41, имеющее указанные ниже формулы.
Формула II
В другом аспекте, в данном изобретении представлено соединение формулы (II):
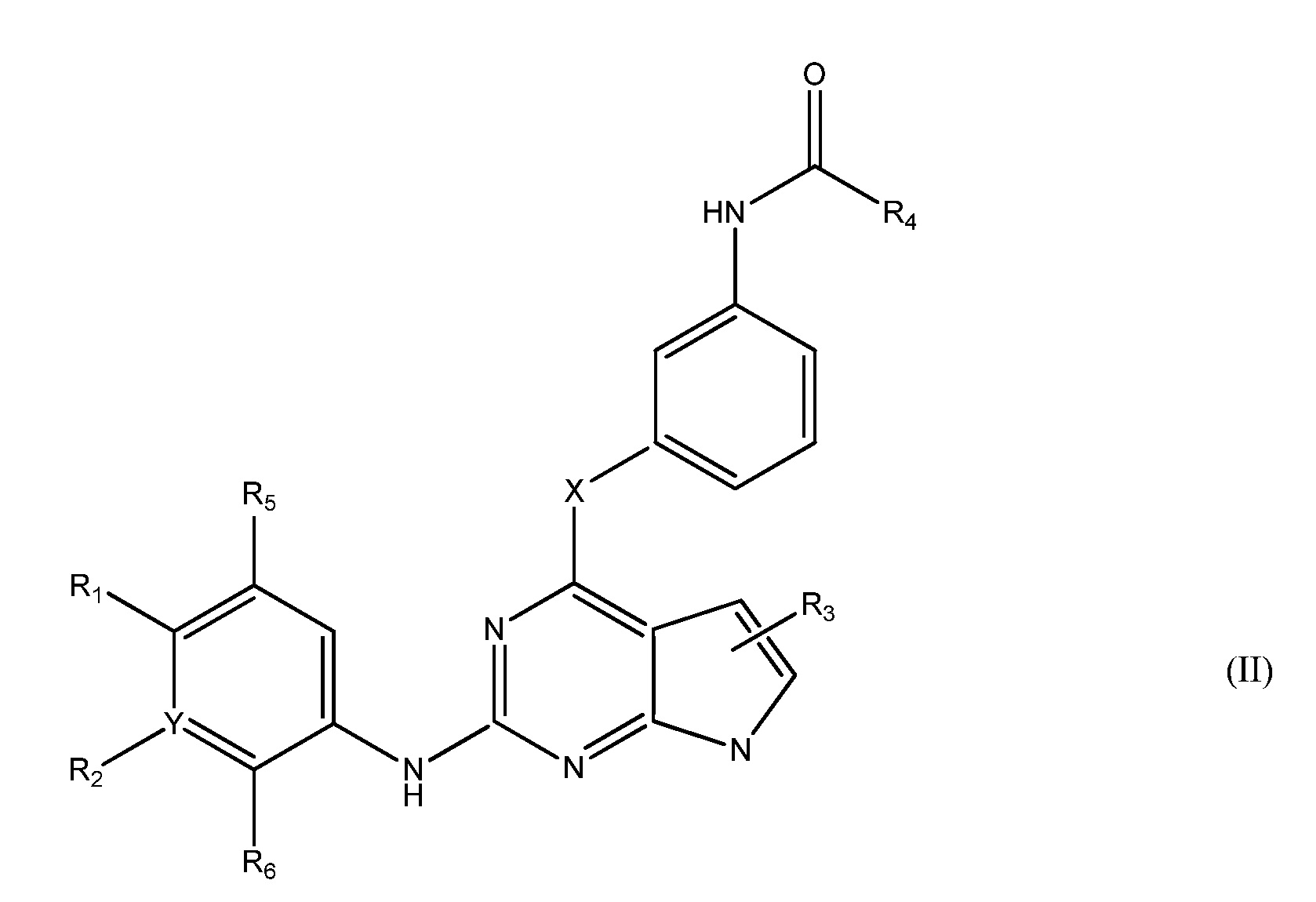 ,
,
где
R1 является Н или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом, и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
NReRf, где Re является C1-4 алкилом и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало; или
ORg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 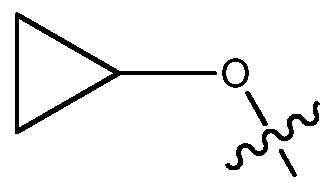 или
или 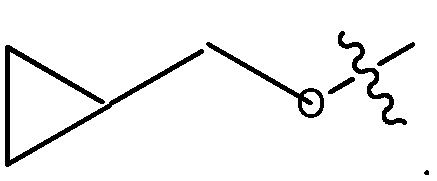
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало, или N,
или его фармацевтически приемлемая соль.
В некоторых вариантах, R1 может быть H и R2 и R6 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом.
В некоторых вариантах, R1 может быть NRcRd и Rc может быть C1-4 алкилом, например, метилом. В других вариантах, R1 может быть NRcRd и Rc может быть 3-7-членным циклическим кольцом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть C3 циклическое кольцо. Rd может быть C2 алкилом, замещенным OZ, и Z может быть C1-4 алкилом, например, метилом.
В некоторых вариантах, R1 может быть NReRf, Re может быть C1-4 алкилом и Rf может быть 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть 5-членное циклическое кольцо. В другом примере, 5-членным циклическим кольцом может быть гетероциклическое кольцо, например, 5-членное гетероциклическое кольцо, которое содержат атом N. 3-7-членное циклическое кольцо может быть замещено FCH2CH2-. C1-4 алкилом может быть C1, C2, C3 или C4 алкил.
В некоторых вариантах, R1 является ОRg и Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-,  или
или  C1-4 алкилом может быть C1, C2, C3 или C4 алкил, например, C2 алкил.
C1-4 алкилом может быть C1, C2, C3 или C4 алкил, например, C2 алкил.
В некоторых вариантах, R2 может быть H. В других вариантах, R2 может быть гало, например, фтором. В других вариантах, R2 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R5 может быть H. В других вариантах, R5 может быть гало, например, фтором. В других вариантах, R5 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R6 может быть H. В других вариантах, R6 может быть гало, например, фтором. В других вариантах, R6 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R1 и R5 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R1 и R2 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R2 и R6 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть 5-членное циклическое кольцо. 5-членным циклическим кольцом может быть гетероциклическое кольцо, например, 5-членное гетероциклическое кольцо, которое содержит атом N. C1-4 алкилом может быть C1, C2, C3 или C4 алкил. Например, Z может быть метилом.
В некоторых вариантах, R3 может быть H. В других вариантах, R3 может быть гало, например, фтором. В других вариантах, R3 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R2, R5 или R6 является Н или гало, и R3 является гало, C1-4 алкилом, например, метилом или C1-4 алкокси.
В некоторых вариантах, R4 может быть не замещенным C2 алкенилом. В других вариантах, R4 может быть C2 алкенилом, замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2.
В некоторых вариантах, X может быть O. В других вариантах, X может быть C1-4 алкилом, необязательно замещенным гало. Например, X может быть не замещенным C1-4 алкилом, например, CH2. В другом примере, X может быть C1-4 алкилом, замещенным гало, например, CF2. В других вариантах, X может быть NRb и Rb может быть H или C1-8 алкилом, необязательно замещенным гало. Например, Rb может быть H. В другом примере, Rb может быть C1-8 алкилом. В еще одном примере, Rb является C1-4 алкилом, например, C1, C2, C3 или C4 алкилом. C1-4 алкил или C1-8 алкил может быть замещен гало, например, фтором.
В некоторых вариантах, Y может быть CH. В других вариантах, Y может быть CF или N.
В некоторых вариантах, R1 является ОRg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-,  или
или  , и R2, R3, R5 и R6 являются H. В одном примере, Rg может быть C2 алкилом, замещенным CH3O-.
, и R2, R3, R5 и R6 являются H. В одном примере, Rg может быть C2 алкилом, замещенным CH3O-.
В некоторых вариантах, по крайней мере, один из R1, R2, R3, R5 и R6 не является H. Например, один, два, три, четыре или пять из R1, R2, R3, R5 и R6 не являются/являются H.
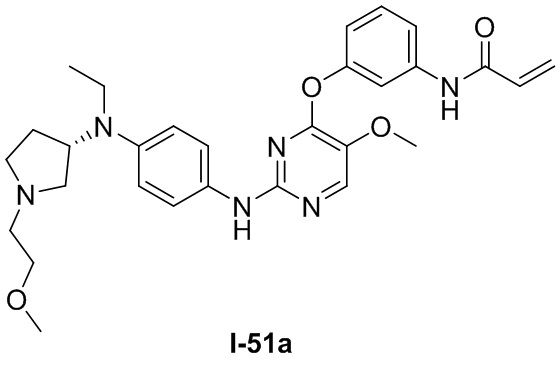
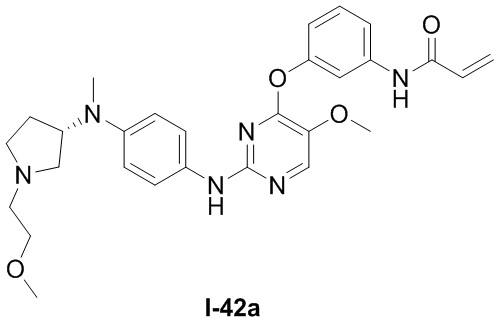
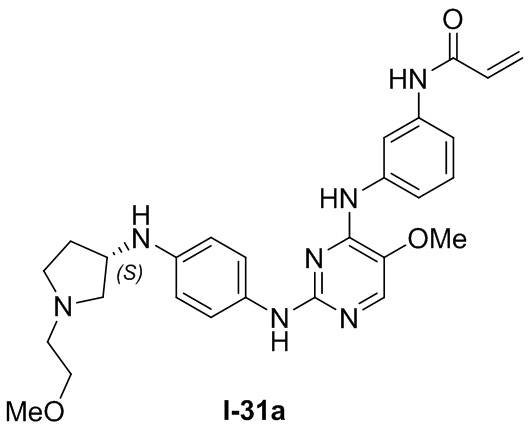
В некоторых вариантах, в данном изобретении представлено соединение, выбранное из группы, включающей соединение I-10, I-11, I-26, I-27, I-28, I-29, I-30, I-31, I-32, I-33, I-34, I-35, I-36, I-37, I-38, I-39 и I-40, имеющее представленную ниже формулу.
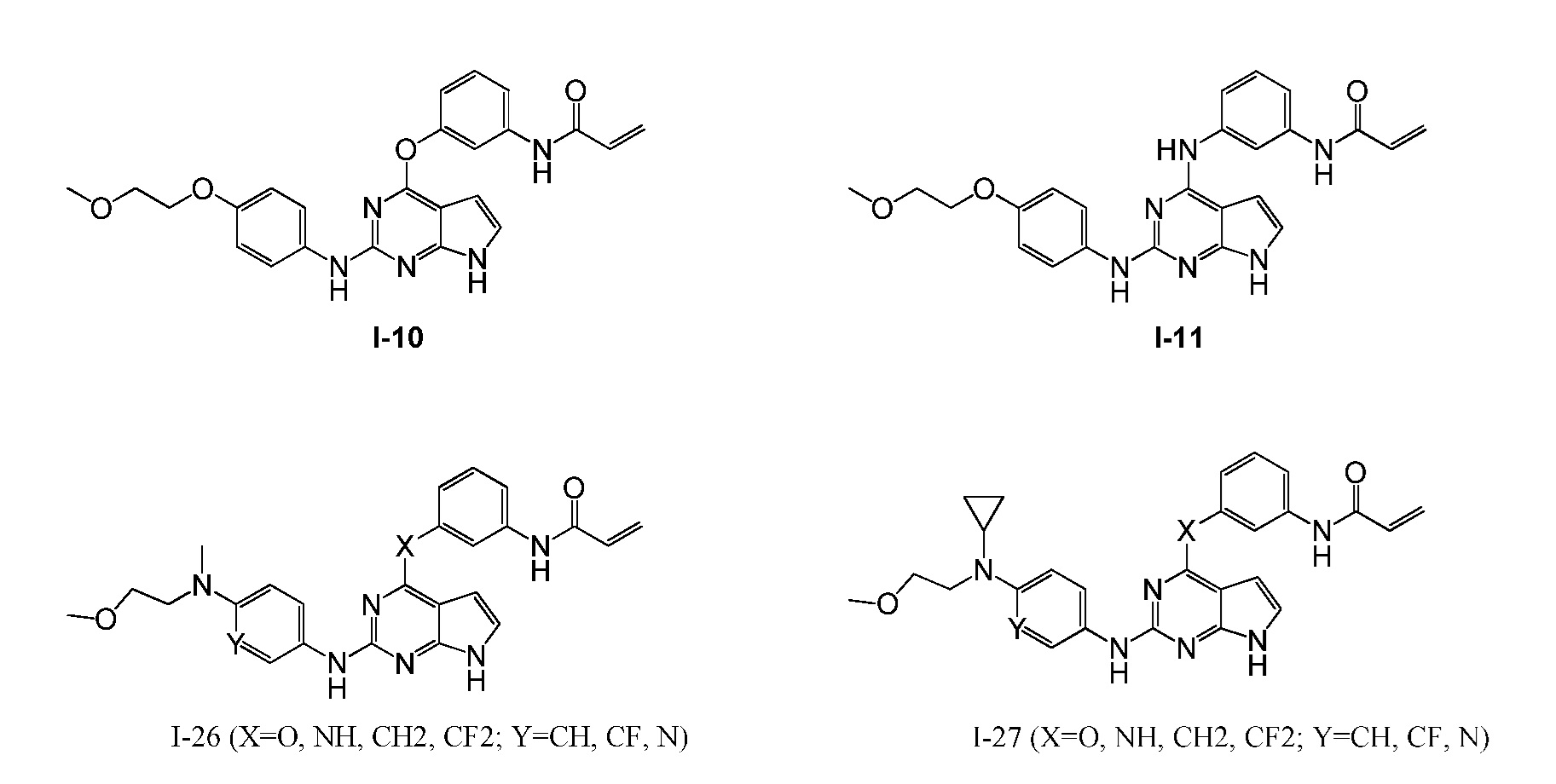
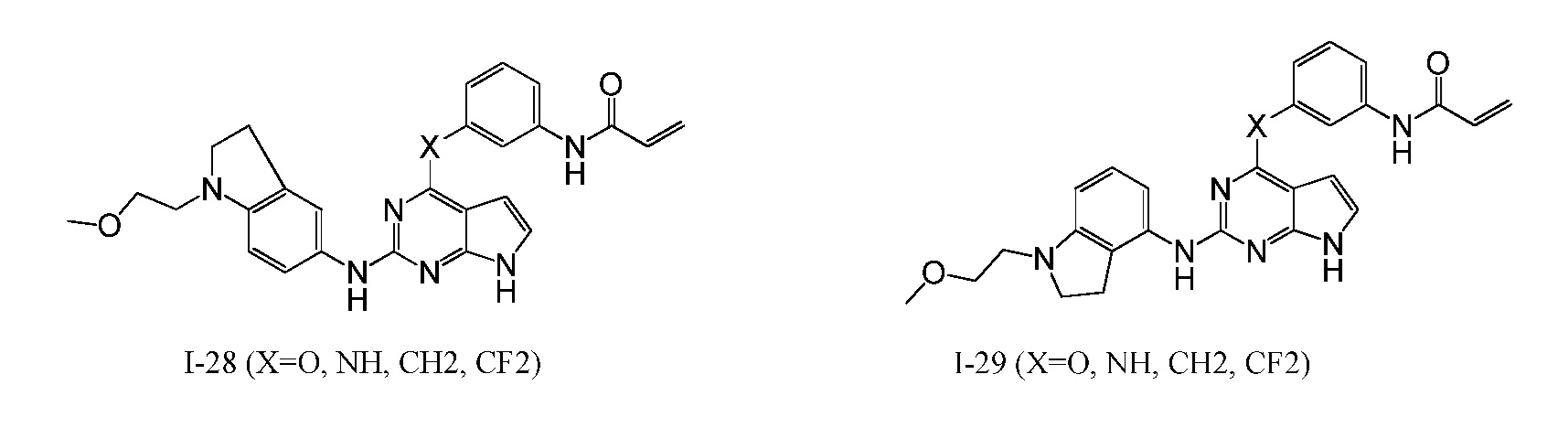
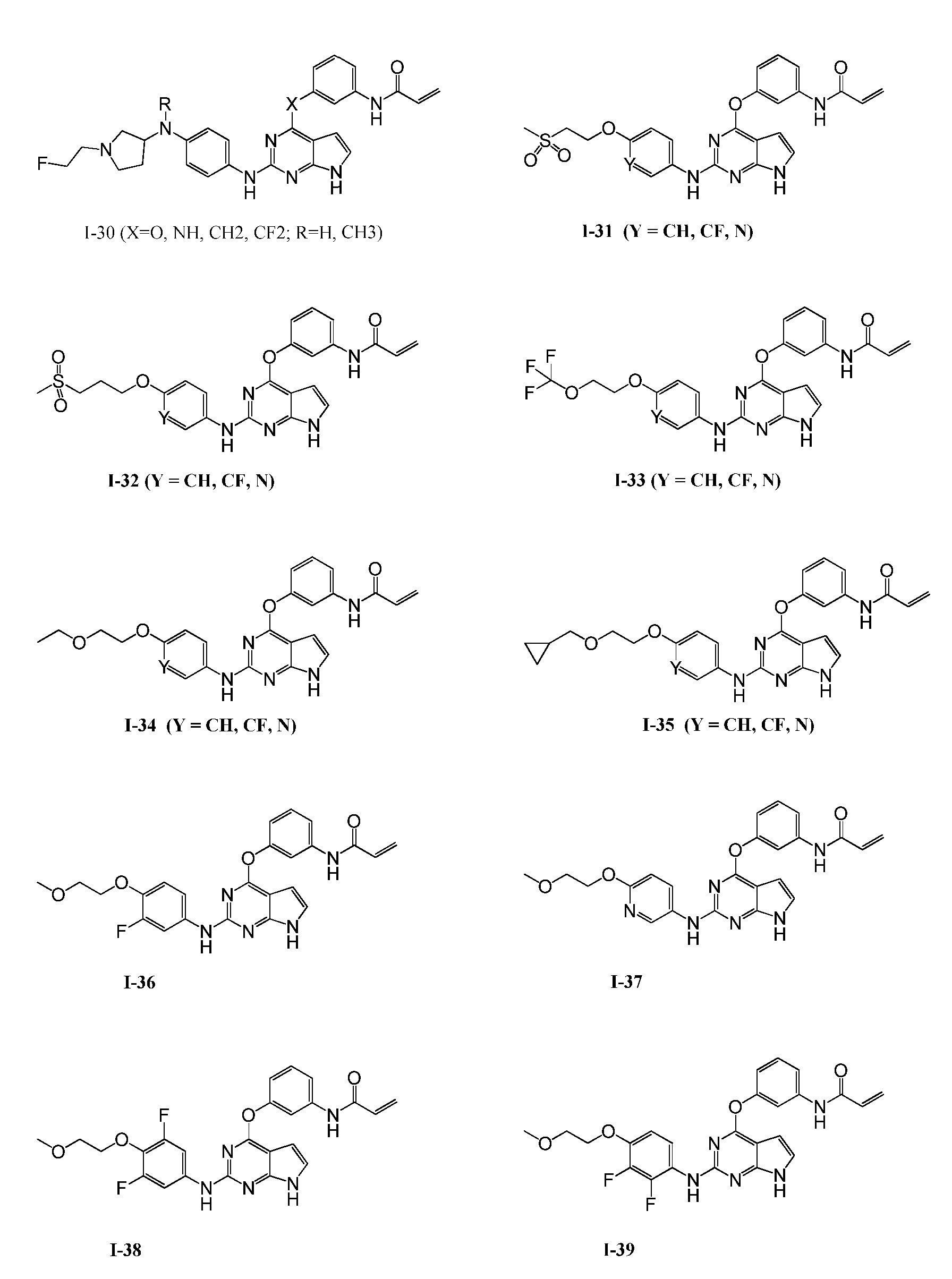
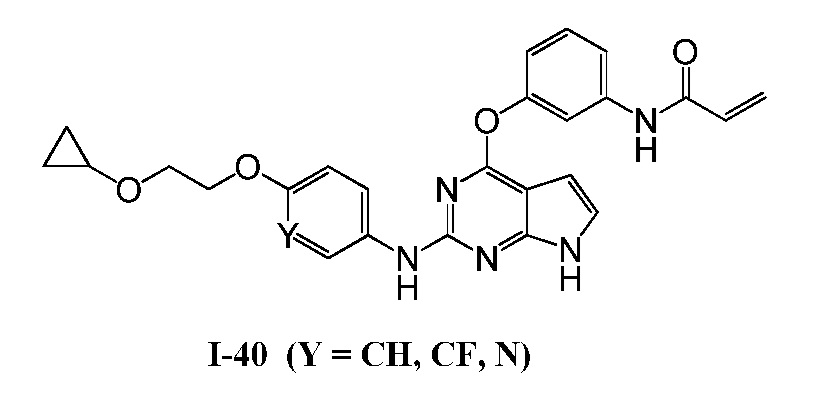
Формула III
В другом аспекте, в данном изобретении представлено соединение формулы (III):
где
R1 является  где Ra является CO-C1-4 алкил-CONH-(C1-4 алкил-O)m-C1-4 алкил-NH-(определяемая метка), m является целым числом 1-4;
где Ra является CO-C1-4 алкил-CONH-(C1-4 алкил-O)m-C1-4 алкил-NH-(определяемая метка), m является целым числом 1-4;
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало, или N,
или его фармацевтически приемлемая соль.
В некоторых вариантах, в Ra C1-4 алкилом может быть C1, C2, C3 или C4 алкил.
В некоторых вариантах, m может быть равно 1, 2, 3 или 4.
Может применяться любая подходящая определяемая метка. В некоторых вариантах, определяемой меткой является биотин.
В некоторых вариантах, R2 может быть H. В других вариантах, R2 может быть гало, например, фтором. В других вариантах, R2 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R5 может быть H. В других вариантах, R5 может быть гало, например, фтором. В других вариантах, R5 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R6 может быть H. В других вариантах, R6 может быть гало, например, фтором. В других вариантах, R6 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R1 и R5 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R1 и R2 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. В других вариантах, R2 и R6 могут быть частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом, например, метилом. 3-7-членным циклическим кольцом может быть 3, 4, 5, 6 или 7-членное циклическое кольцо. Оно может быть углеродным циклическим кольцом или гетероциклическим кольцом. Например, 3-7-членным циклическим кольцом может быть 5-членное циклическое кольцо. 5-членным циклическим кольцом может быть гетероциклическое кольцо, например, 5-членное гетероциклическое кольцо, которое содержит атом N. C1-4 алкилом может быть C1, C2, C3 или C4 алкил. Например, Z может быть метилом.
В некоторых вариантах, R3 может быть H. В других вариантах, R3 может быть гало, например, фтором. В других вариантах, R3 может быть C1-4 алкилом, например, метилом или C1-4 алкокси, например, метокси.
В некоторых вариантах, R2, R5 или R6 является Н или гало, и R3 является гало, C1-4 алкилом, например, метилом или C1-4 алкокси.
В некоторых вариантах, R4 может быть не замещенным C2 алкенилом. В других вариантах, R4 может быть C2 алкенилом, замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2.
В некоторых вариантах, X может быть O. В других вариантах, X может быть C1-4 алкилом, необязательно замещенным гало. Например, X может быть не замещенным C1-4 алкилом, например, CH2. В другом примере, X может быть C1-4 алкилом, замещенным гало, например, CF2. В других вариантах, X может быть NRb, и Rb может быть H или C1-8 алкилом, необязательно замещенным гало. Например, Rb может быть H. В другом примере, Rb может быть C1-8 алкилом. В еще одном примере, Rb является C1-4 алкилом, например, C1, C2, C3 или C4 алкилом. C1-4 алкил или C1-8 алкил может быть замещен гало, например, фтором.
В некоторых вариантах, Y может быть CH. В других вариантах, Y может быть CF или N.
В некоторых вариантах, в данном изобретении представлено соединение I-42, имеющее представленную ниже формулу.

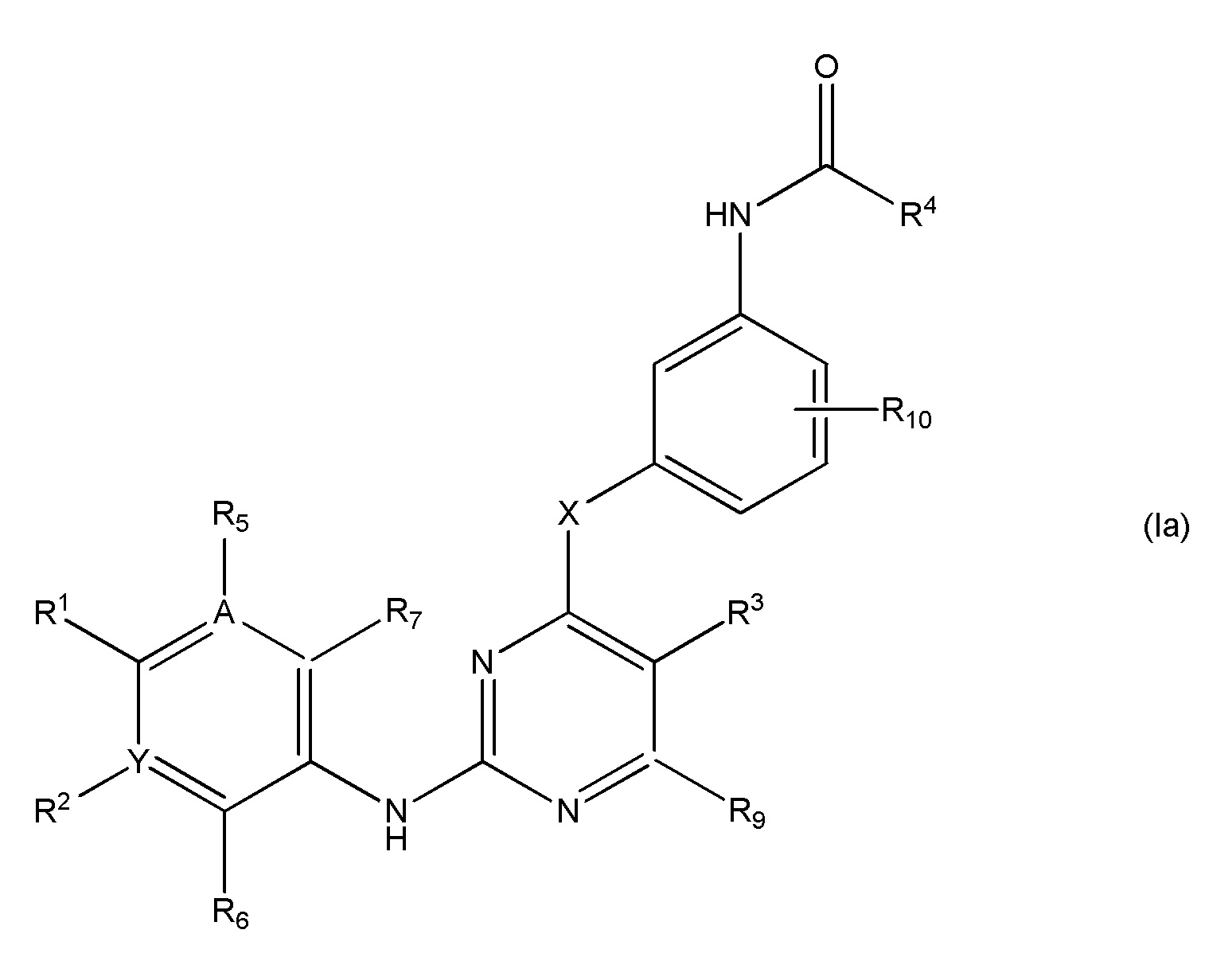
Формула Ia
В еще одном аспекте, в данном изобретении представлено соединение формулы (Ia):
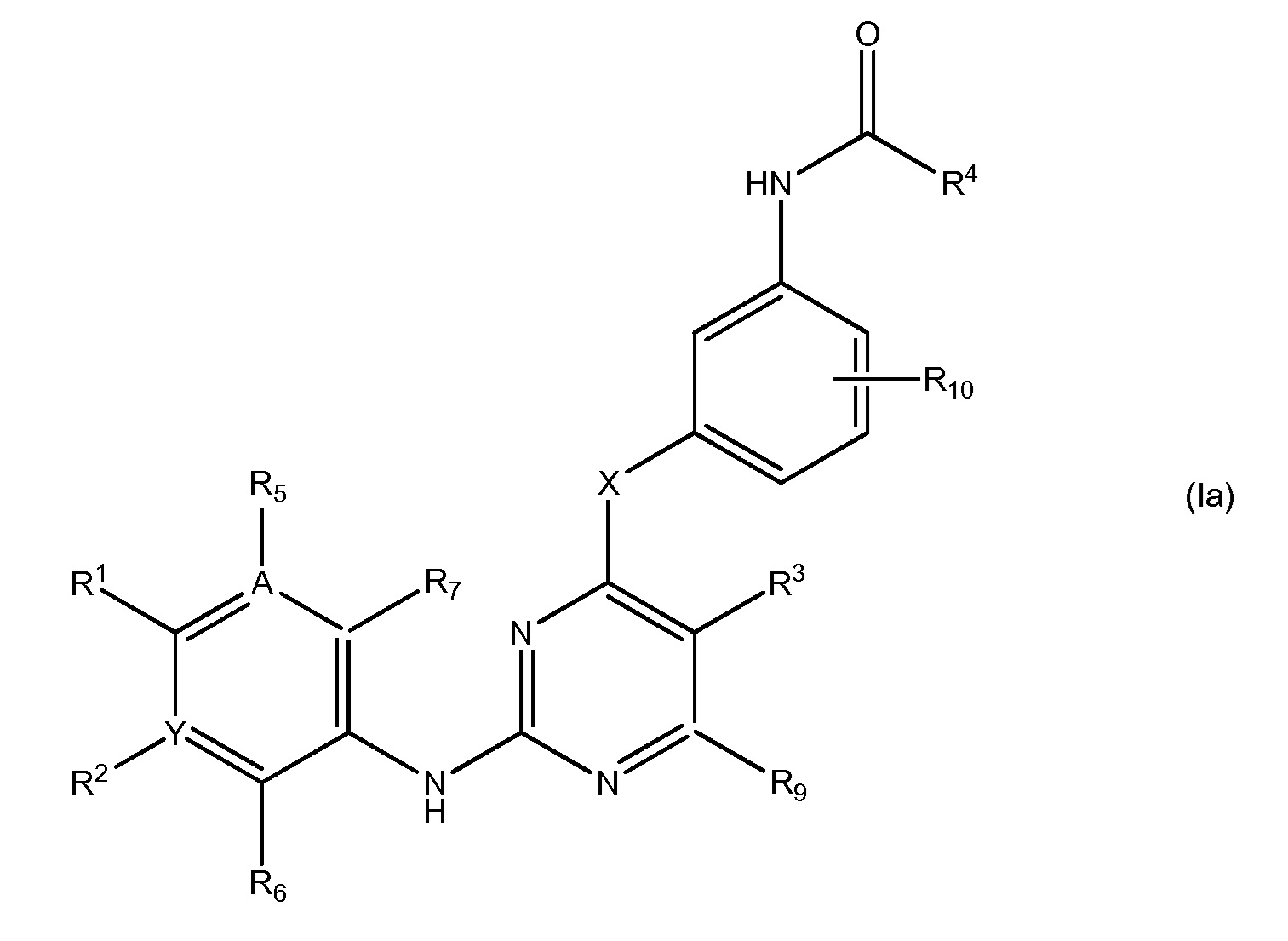 ,
,
где
R1 является Н или
NRcRd, где
Rc является Н, C1-4 алкилом, C1-4 алкенилом или 3-7-членным циклическим кольцом, указанные C1-4 алкил, C1-4 алкенил или 3-7-членное циклическое кольцо необязательно замещены OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, который далее необязательно замещен OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, который далее необязательно замещен SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, и
Rd является Н, C1-4 алкилом, C1-4 алкенилом или 3-7-членным циклическим кольцом, где указанные C1-4 алкил, C1-4 алкенил или 3-7-членное циклическое кольцо необязательно замещены OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом; или
3-7-членное циклическое кольцо замещено Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4; или
O(CH2)mSO2 (CH2)nH, где m равно 1-4 и n равно 1-4;
R2 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R3 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R5 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R6 является Н, гало, C1-4 алкилом, C1-4 алкокси; или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R7 является Н, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R9 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом;
R10 является Н, гидроксилом, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом; или
R1 и R5 являются частью 3-7-членного циклического кольца, где указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4; или
R1 и R2 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, указанный C1-4 алкил далее необязательно замещен гало, OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом, или один или более членов указанного 3-7-членного циклического кольца необязательно является частью карбонильной группы или сульфонильной группы; или
R2 и R6 являются частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом;
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2;
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало;
Y является C, CH, необязательно замещенным гало, или N;
A является C, CH, необязательно замещенным гало, или N; и
где, по крайней мере, один из R2, R3, R5 и R6 не является H;
или его фармацевтически приемлемая соль.
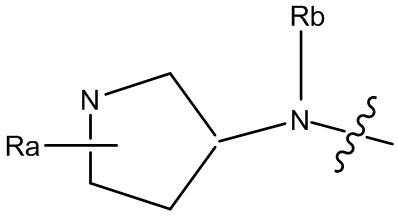
В некоторых вариантах, R1 является Н и R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ или NR11R12 где Z, R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является Н.
В некоторых вариантах, R1 является NRcRd и Rc является C1-4 алкилом, например, метилом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является C1-4 алкенилом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкил.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, который далее необязательно замещен OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, необязательно замещенным SO2(CH2)qH, где q равно 1-4.
В некоторых вариантах, 3-7-членным циклическим кольцом является 5-членное циклическое кольцо, которое содержит атом N, H, связанный с атомом N, замещен SO2(CH2)qH, где q равно 1-4, например, q равно 1.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, который далее необязательно замещен SO2(CH2)qH, где q равно 1-4. 3-7-членным циклическим кольцом может быть 5-членное циклическое кольцо, которое содержит атом N, H, связанный с атомом N, замещен C1-4 алкилом, который далее замещен SO2(CH2)qH, где q равно 1-4. H, связанный с атомом N, замещен C2 алкилом, который далее замещен SO2CH3.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, необязательно замещенным R8CO, где R8 является C1-4 алкилом. R1 может быть NRcRd и Rc является 5-членным циклическим кольцом, которое содержит атом N, H, связанный с атомом N, замещен R8CO, где R8 является C1-4 алкилом. H, связанный с атомом N, может быть замещен CH3CO.
В некоторых вариантах, Rd является Н. В других вариантах, Rd является C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом. В других вариантах, Rd является C1-4 алкенилом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом. В других вариантах, Rd является 3-7-членным циклическим кольцом, необязательно замещенным OZ или NR11R12, где Z, R11, R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, Rc является 5-членным циклическим кольцом, которое содержит атом N, H, связанный с атомом N, замещен C1-4 алкилом, который далее замещен OZ, где Z независимо является C1-4 алкилом и Rd является 3-7-членным циклическим кольцом, например, C3 циклическим кольцом.
В некоторых вариантах, R1 является 3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4. 3-7-членное циклическое кольцо может содержать атом N. H, связанный с атомом N, может быть замещен гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4.
R1 может быть любым подходящим 3-7-членным циклическим кольцом. В некоторых вариантах, R1 выбирают из группы, включающей
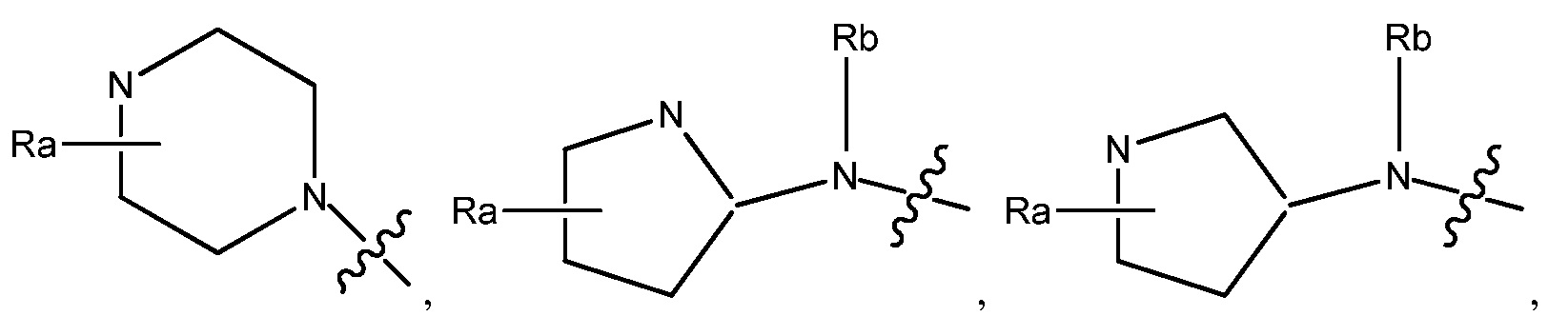
 и
и 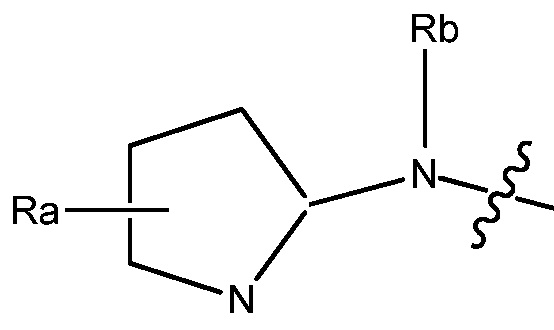
Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4, и Rb является Н или C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4. В других вариантах, R1 выбирают из группы, включающей  ,
,
 и
и 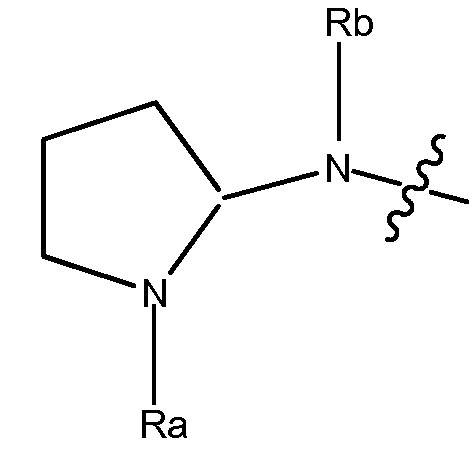 . В других вариантах, R1 является
. В других вариантах, R1 является 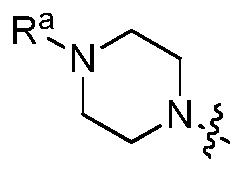 , и Ra является C2 алкилом, далее замещенным метокси. В других вариантах, R1 является
, и Ra является C2 алкилом, далее замещенным метокси. В других вариантах, R1 является 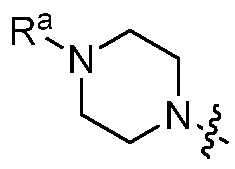 и Ra является C2 алкилом, далее замещенным SO2CH3.
и Ra является C2 алкилом, далее замещенным SO2CH3.
В некоторых вариантах, R1 является О(CH2)mSO2(CH2)nH, где m равно 1-4 и n равно 1-4. Например, R1 может быть O(CH2)2SO2CH3.
В некоторых вариантах, R2 отсутствует, является H или гало. В других вариантах, R2 является C1-4 алкилом или C1-4 алкокси. В других вариантах, R2 является алкиламином (NR11R12) и R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R3 является Н. В других вариантах, R3 является гидроксилом. В других вариантах, R3 является гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом. В других вариантах, R1 является 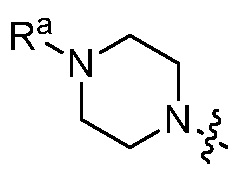 и Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4.
и Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4.
В некоторых вариантах, R5 отсутствует или является H. В других вариантах, R5 является гало. В других вариантах, R5 является C1-4 алкилом. В других вариантах, R5 является C1-4 алкокси. В других вариантах, R5 является алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R6 является Н. В других вариантах, R6 является гало. В других вариантах, R6 является C1-4 алкилом. В других вариантах, R6 является C1-4 алкокси. В других вариантах, R6 является алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R7 является Н. В других вариантах, R7 является гало. В других вариантах, R7 является C1-4 алкилом. В других вариантах, R7 является C1-4 алкокси, например, метокси. В других вариантах, R7 является алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R9 является Н. В других вариантах, R9 является гало. В других вариантах, R9 является C1-4 алкилом. В других вариантах, R9 является C1-4 алкокси. В других вариантах, R9 является алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R10 является Н. В других вариантах, R10 является гало. В других вариантах, R10 является C1-4 алкилом. В других вариантах, R10 является C1-4 алкокси. В других вариантах, R10 является алкиламином (NR11R12), где R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 и R5 является частью 3-7-членного циклического кольца, где указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом. В других вариантах, R1 и R5 является частью 3-7-членного циклического кольца, где указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом. Например, 3-7-членное циклическое кольцо замещено CH3CO. В других вариантах, R1 и R5 является частью 3-7-членного циклического кольца, где указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4. Например, 3-7-членное циклическое кольцо замещено SO2CH3.
В некоторых вариантах, R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкила, указанный C1-4 алкил далее необязательно замещен гало, OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом. В других вариантах, R1 и R2 является частью 3-7-членного циклического кольца и один или более членов указанного 3-7-членного циклического кольца необязательно является частью карбонильной группы или сульфонильной группы. Карбонильной группой может быть амид или сложная эфирная группа.
В некоторых вариантах, R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным необязательно OZ или NR11R12, где Z, R11 и R12 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R4 является не замещенным C2 алкенилом. В других вариантах, R4 является C2 алкенилом, замещенным C1-4 алкилом. Например, R4 может быть C2 алкенилом, замещенным -CH2OCH3 или -CH2N(CH3)2.
В некоторых вариантах, X является О. В других вариантах, X является не замещенным C1-4 алкилом, например, CH2 или C1-4 алкилом, замещенным гало, например, CF2. В других вариантах, X является NRb и Rb является Н или C1-8 алкилом, необязательно замещенным гало.
В некоторых вариантах, Y является C. В других вариантах, Y является СН или CH, замещенным гало, например, CF2. В других вариантах, Y является N.
В некоторых вариантах, A является C. В других вариантах, A является СН или CH, замещенным гало, например, CF2. В других вариантах, A является N.
В некоторых вариантах, 3-7-членным циклическим кольцом является 3-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 4-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 5-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 6-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 7-членное циклическое кольцо.
В некоторых вариантах, 3-7-членным циклическим кольцом является углеводородное 3-7-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является гетероциклическое кольцо. Например, гетероциклическое кольцо может содержать один или более атомов N.
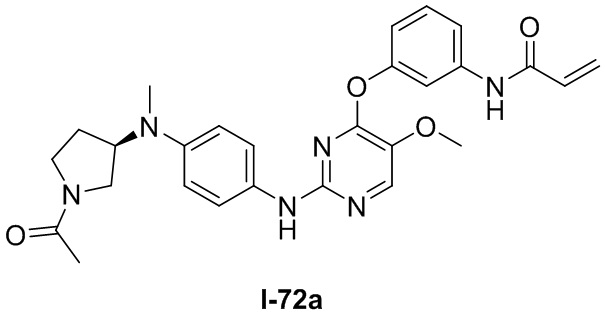
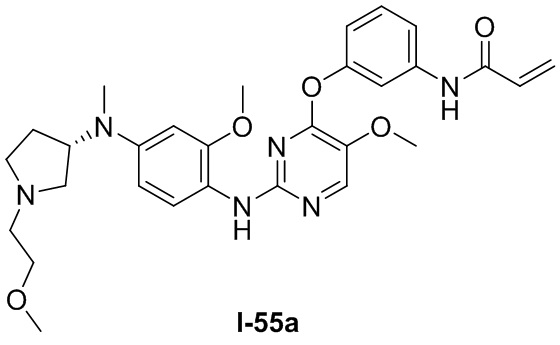
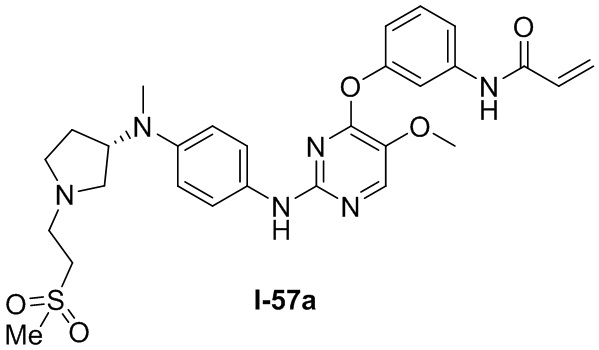
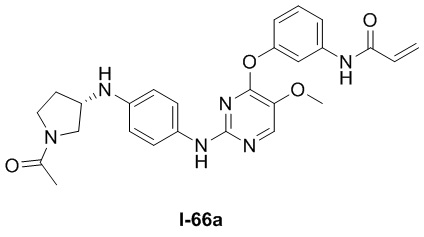
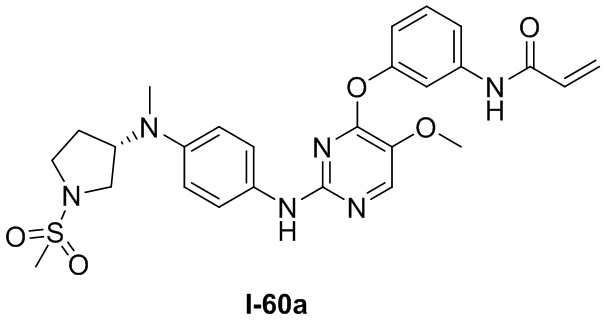
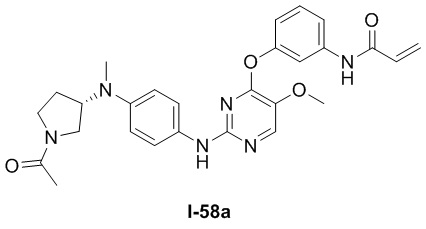
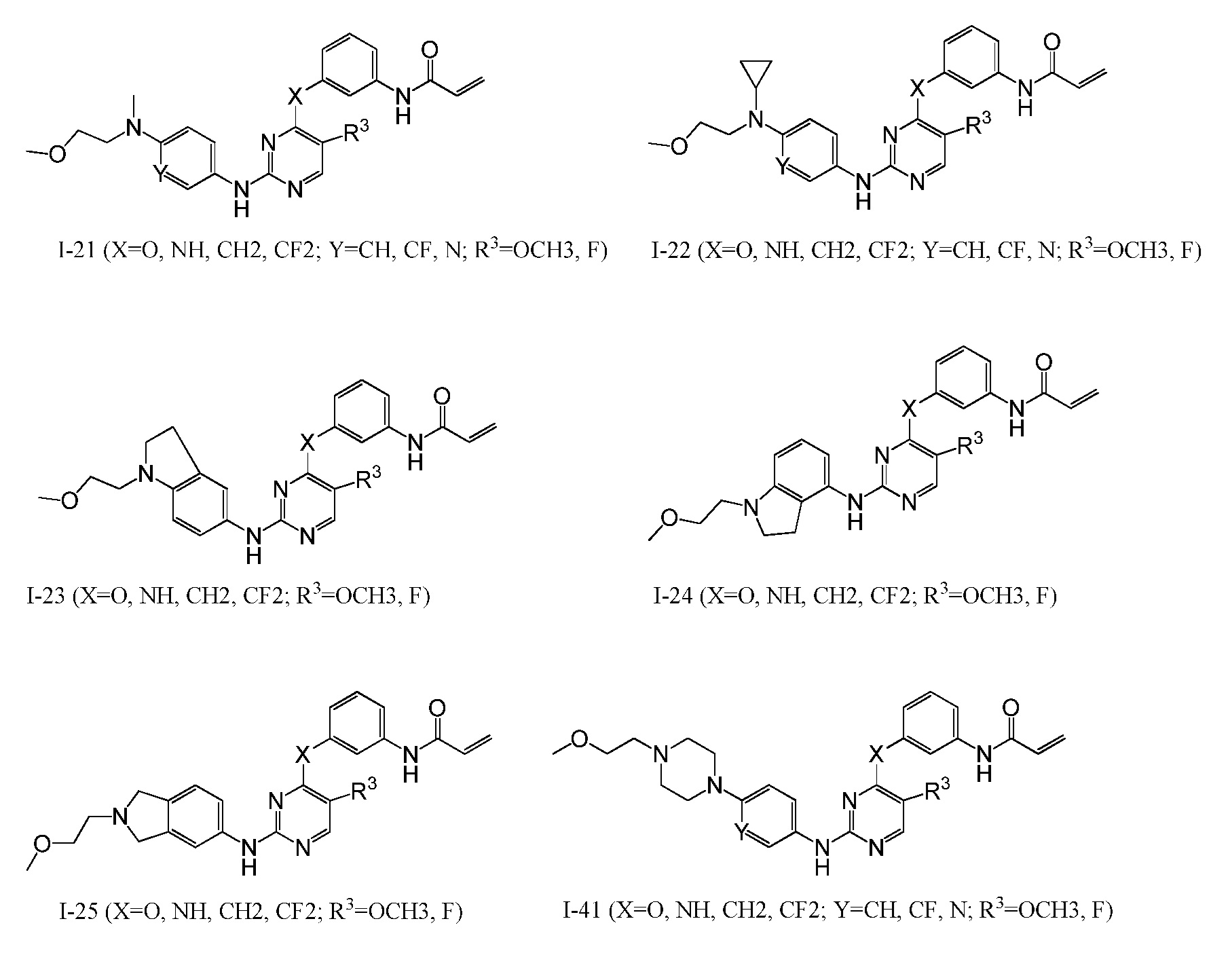
В некоторых вариантах, в данном изобретении представлено соединение, выбранное из группы, включающей соединение I-1, I-2, I-3, I-4, I-5, I-6, I-7, I-8, I-9, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20, I-21, I-22, I-23, I-24, I-25, I-41, I-23a, I-25a, I-28a, I-29a, I-30a, I-31a, I-32a, I-33a, I-34a, I-35a, I-38a, I-39a, I-42a, I-43a, I-44a, I-45a, I-50a, I-51a, I-52a, I-53a, I-54a, I-55a, I-56a, I-57a, I-58a, I-59a, I-60a, I-66a, I-70a и I-72a.
Формула IIa
В еще одном аспекте, в данном изобретении представлено соединение формулы (IIa):
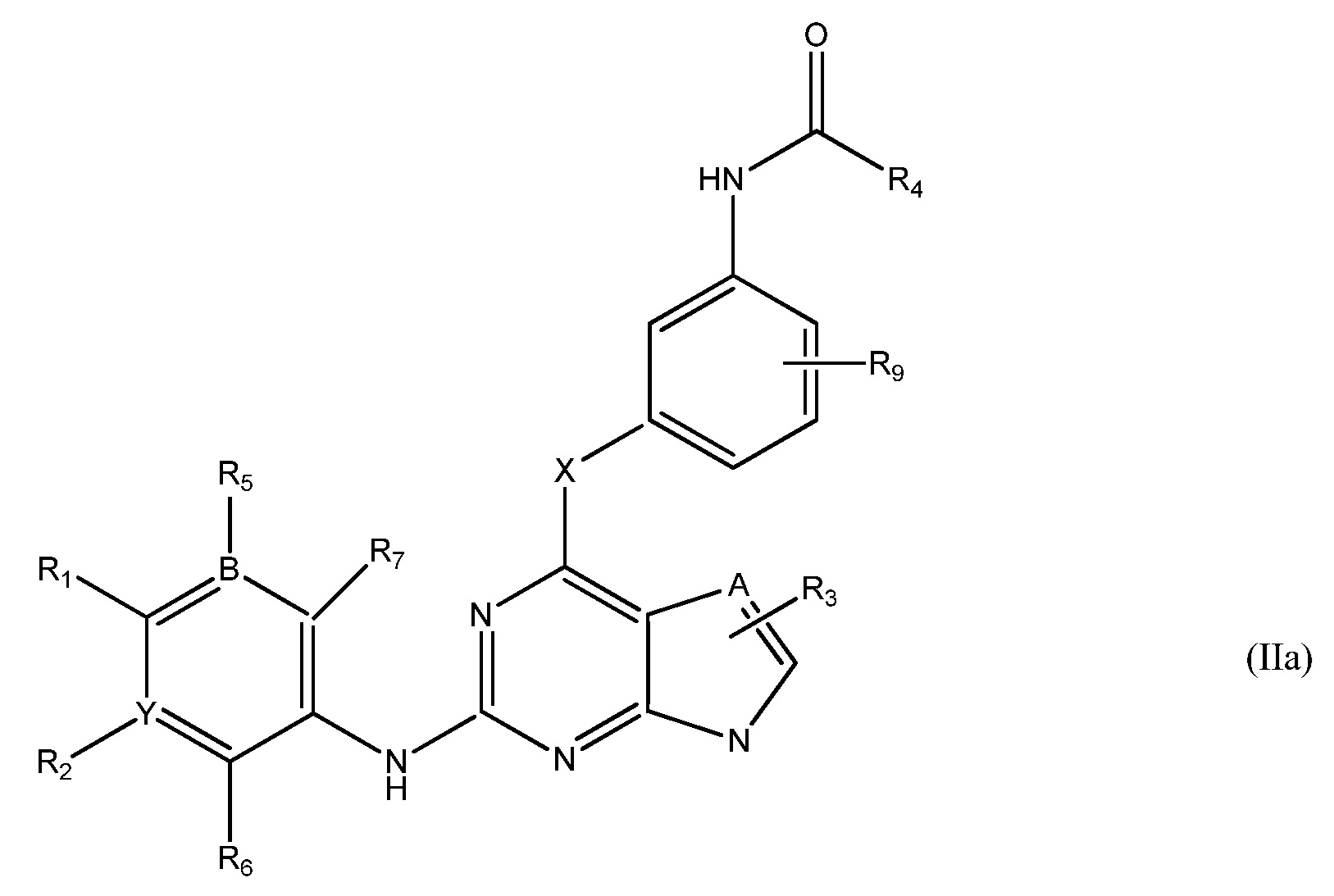 ,
,
где
R1 является Н, или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом, указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом, или указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4 и Rd является Н, C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 являются H или C1-4 алкилом; или
NReRf где Re является C1-4 алкилом и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало; или
ORg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 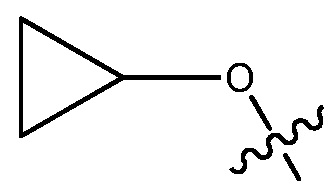 или
или 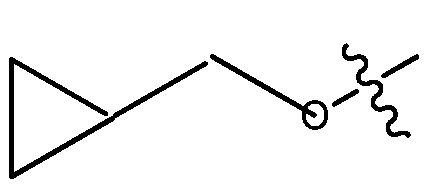 , или
, или
3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4, или указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом;
R2 отсутствует, является H, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R3 отсутствует, является H, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R5 отсутствует, является H, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R7 является Н, гало, C1-4 алкилом, C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом;
R9 является Н, гало, C1-4 алкилом или C1-4 алкокси или алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом;
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2;
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало;
Y является C, CH, необязательно замещенным гало, или N;
A является C, CH, необязательно замещенным гало, или N; и
B является C, CH, необязательно замещенным гало, или N,
или его фармацевтически приемлемая соль.
В некоторых вариантах, R1 является Н и R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является Н. В других вариантах, R1 является NRcRd и Rc является C1-4 алкилом.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, где указанное 3-7-членное циклическое кольцо необязательно замещено C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом. Указанное 3-7-членное циклическое кольцо может быть замещено C2 алкилом, замещенным метокси.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом. Указанное 3-7-членное циклическое кольцо может быть замещено CH3CO.
В некоторых вариантах, R1 является NRcRd и Rc является 3-7-членным циклическим кольцом, указанное 3-7-членное циклическое кольцо необязательно замещено SO2(CH2)qH, где q равно 1-4. Например, указанное 3-7-членное циклическое кольцо может быть замещено CH3SO2.
В некоторых вариантах, Rd является Н. В других вариантах, Rd является C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 являются H или C1-4 алкилом.
В некоторых вариантах, R1 является NReRf и Re является C1-4 алкилом. В других вариантах, R1 является NReRf и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало.
В некоторых вариантах, R1 является ОRg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-,  или
или  .
.
В некоторых вариантах, R1 является 3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4. Например, Ra может быть C2 алкилом, замещенным метокси. В другом примере, Ra является СН3SO2CH2CH2.
В некоторых вариантах, R1 является 3-7-членным циклическим кольцом, указанное 3-7-членное циклическое кольцо необязательно замещено R8CO, где R8 является C1-4 алкилом. Например, указанное 3-7-членное циклическое кольцо может быть замещено CH3CO.
R1 может быть любым подходящим 3-7-членным циклическим кольцом. В некоторых вариантах, R1 выбирают из группы, включающей
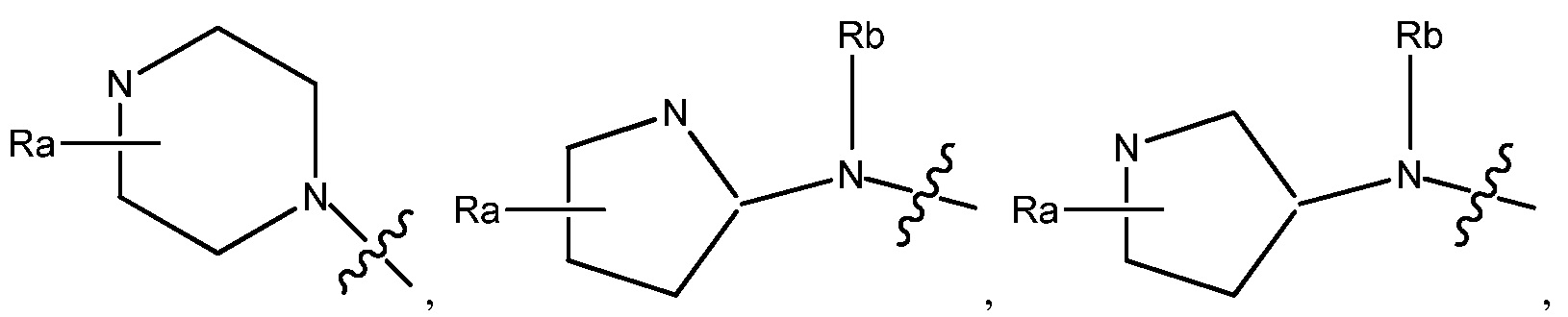
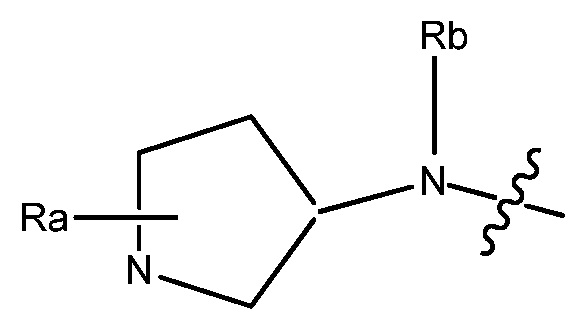 и
и 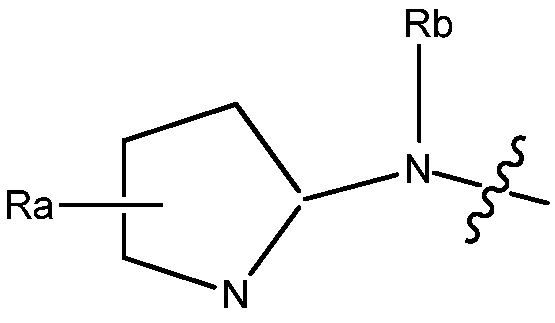 , Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4 и Rb является Н или C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4. В других вариантах, R1 выбирают из группы, включающей
, Ra является C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4 и Rb является Н или C1-8 алкилом, необязательно замещенным гало, C1-4 алкокси или SO2(CH2)qH, где q равно 1-4. В других вариантах, R1 выбирают из группы, включающей  ,
,
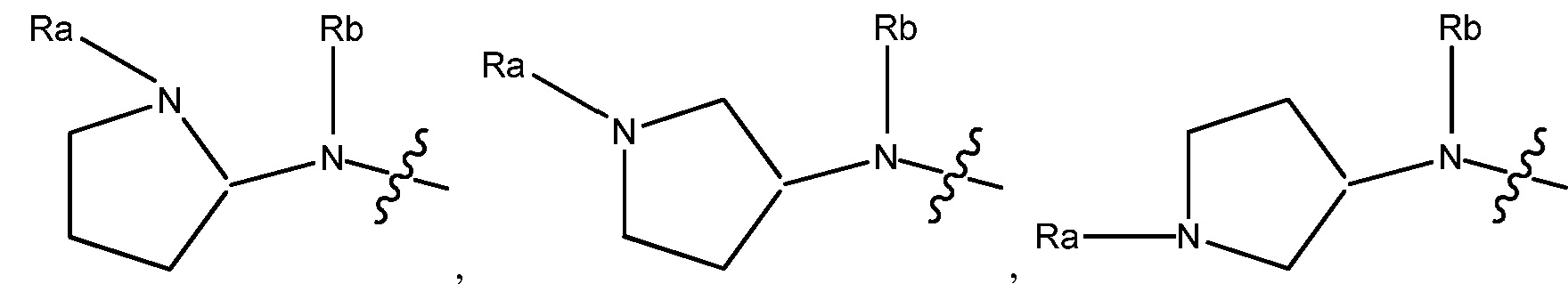 и
и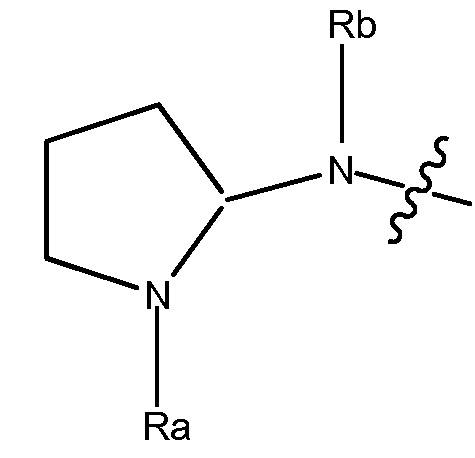 и. В других вариантах, R1 является
и. В других вариантах, R1 является  и Ra является C2 алкилом, далее замещенным метокси. В других вариантах, R1 является
и Ra является C2 алкилом, далее замещенным метокси. В других вариантах, R1 является  и Ra является C2 алкилом, далее замещенным SO2CH3.
и Ra является C2 алкилом, далее замещенным SO2CH3.
В некоторых вариантах, R2 отсутствует или является H. В других вариантах, R2 является гало. В других вариантах, R2 является C1-4 алкилом или C1-4 алкокси. В других вариантах, R2 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R3 отсутствует. В других вариантах, R3 является Н. В других вариантах, R3 является гало. В других вариантах, R3 является C1-4 алкилом. В других вариантах, R3 является C1-4 алкокси. В других вариантах, R3 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R5 отсутствует. В других вариантах, R5 является Н. В других вариантах, R5 является гало. В других вариантах, R5 является C1-4 алкилом. В других вариантах, R5 является C1-4 алкокси. В других вариантах, R5 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R6 является Н. В других вариантах, R6 является гало. В других вариантах, R6 является C1-4 алкилом. В других вариантах, R6 является C1-4 алкокси. В других вариантах, R6 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R7 является Н. В других вариантах, R7 является гало. В других вариантах, R7 является C1-4 алкилом. В других вариантах, R7 является C1-4 алкокси. В других вариантах, R7 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R9 является Н. В других вариантах, R9 является гало. В других вариантах, R9 является C1-4 алкилом. В других вариантах, R9 является C1-4 алкокси. В других вариантах, R9 является алкиламином (NR10R11), где R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или NR10R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, необязательно замещенным OZ или R10 и R11, где Z, R10 и R11 независимо являются H или C1-4 алкилом.
В некоторых вариантах, X является О. В других вариантах, X является не замещенным C1-4 алкилом, например, CH2 или C1-4 алкилом, замещенным гало, например, CF2. В других вариантах, X является NRb и Rb является Н или C1-8 алкилом, необязательно замещенным гало.
В некоторых вариантах, Y является C. В других вариантах, Y является СН или CH, замещенным гало, например, CF. В других вариантах, Y является N.
В некоторых вариантах, A является C. В других вариантах, A является СН или CH, замещенным гало, например, CF. В других вариантах, A является N.
В некоторых вариантах, B является C. В других вариантах, B является СН или CH, замещенным гало, например, CF. В других вариантах, B является N.
В некоторых вариантах, 3-7-членным циклическим кольцом является 3-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 4-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 5-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 6-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является 7-членное циклическое кольцо.
В некоторых вариантах, 3-7-членным циклическим кольцом является углеводородное 3-7-членное циклическое кольцо. В других вариантах, 3-7-членным циклическим кольцом является гетероциклическое кольцо. Например, гетероциклическое кольцо может содержать один или более атомов N.
В некоторых вариантах, в данном изобретении представлено соединение, выбранное из группы, включающей соединение I-10, I-11, I-26, I-27, I-28, I-29, I-30, I-31, I-32, I-33, I-34, I-35, I-36, I-37, I-38, I-39, I-40, I-24a, I-26a, I-27a, I-36a, I-37a, I-40a, I-41a, I-46a, I-47a, I-48a, I-49a, I-61a, I-62a, I-63a, I-64a, I-65a, I-67a, I-68a, I-69a и I-71a.
Фармацевтические композиции, комбинации и другие родственные области применения
В еще одном аспекте, в данном изобретении представлена фармацевтическая композиция, содержащая описанное выше соединение в смеси с, по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом.
Описанные выше соединения могут применяться для любой подходящей цели. Например, соединения в соответствии с данным изобретением могут применяться в терапии и/или для тестирования.
В еще одном аспекте, в данном изобретении представлен способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки, который включает введение пациенту, нуждающемуся в таковом, эффективного количества описанного выше соединения или описанной выше фармацевтической композиции.
В еще одном аспекте, в данном изобретении представлено применение описанного выше соединения для производства лекарственного средства.
В еще одном аспекте, в данном изобретении представлена комбинация для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента, где комбинация включает эффективное количество описанного выше соединения или его фармацевтически приемлемой соли и эффективное количество второго профилактического или терапевтического агента для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента.
В еще одном аспекте, в данном изобретении представлен способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента, где способы включают введение пациенту, нуждающемуся в таковом, эффективного количества описанной выше комбинации.
В еще одном аспекте, в данном изобретении представлен способ ингибирования активности тирозинкиназы Брутона (Btk или BTK) или Янус-киназы (JAK) РЭФР (включая HER), Alk, PDGFR, BLK, BMX/ETK, FLT3(D835Y), ITK, TEC, TXK и соответствующих путей, в клетке или у пациента, где способы включают введение в клетку или пациенту, нуждающемуся в таковом, эффективного количества описанного выше соединения или описанной выше фармацевтической композиции или описанной выше комбинации.
Способы в соответствии с данным изобретением могут применяться для ингибирования активности любой подходящей Btk, BTK или JAK. В некоторых вариантах, способы в соответствии с данным изобретением могут применяться для ингибирования активности JAK1, JAK2 или JAK3.
Способы в соответствии с данным изобретением могут применяться для любой подходящей цели. В некоторых вариантах, способы в соответствии с данным изобретением могут применяться для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания или волчанки у пациента. Способы в соответствии с данным изобретением могут применяться для лечения и/или профилактики любого подходящего пролиферативного расстройства. Типовые пролиферативные расстройства включают саркому, плоскоклеточный рак, фибросаркому, рак шейки матки, рак желудка, рак кожи, лейкоз, лимфому, рак легких, немелкоклеточный рак легкого, рак толстой кишки, рак ЦНС, меланому, рак яичников, рак почки, рак предстательной железы, рак молочной железы, рак печени, рак головы и шеи и рак поджелудочной железы.
В некоторых вариантах, любое из соединений, выбранных из группы, включающей соединение I-1, I-2, I-3, I-4, I-5, I-6, I-7, I-8, I-9, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20, I-21, I-22, I-23, I-24, I-25, I-41, I-23a, I-25a, I-28a, I-29a, I-30a, I-31a, I-32a, I-33a, I-34a, I-35a, I-38a, I-39a, I-42a, I-43a, I-44a, I-45a, I-50a, I-51a, I-52a, I-53a, I-54a, I-55a, I-56a, I-57a, I-58a, I-59a, I-60a, I-66a, I-70a, I-72a, I-10, I-11, I-26, I-27, I-28, I-29, I-30, I-31, I-32, I-33, I-34, I-35, I-36, I-37, I-38, I-39, I-40, I-24a, I-26a, I-27a, I-36a, I-37a, I-40a, I-41a, I-46a, I-47a, I-48a, I-49a, I-61a, I-62a, I-63a, I-64a, I-65a, I-67a, I-68a, I-69a и I-71a, может применяться в указанных выше фармацевтических композициях, комбинациях и других родственных применениях или способах.
Композиции
Может быть получена любая подходящая композиция описанных здесь соединений. См., в общем, Remington's Pharmaceutical Sciences, (2000) Hoover, J. E. editor, 20th edition, Lippincott Williams and Wilkins Publishing Company, Easton, Pa., страницы 780-857. Композицию выбирают так, чтобы она подходила для соответствующего способа введения. Если соединения являются достаточно щелочными или кислыми для образования стабильных не токсичных кислотных или основных солей, введение соединений в идее солей может быть предпочтительным. Примеры фармацевтически приемлемых солей включают органические кислотно-аддитивные соли, полученные с кислотами, которые образуют физиологически приемлемый анион, например, тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат и α-глицерофосфат. Также могут быть получены подходящие неорганические соли, включающие гидрохлорид, сульфат, нитрат, бикарбонат и карбонат. Фармацевтически приемлемые соли получают с применением стандартных методов, хорошо известных в данной области техники, например, взаимодействия достаточно щелочного соединения, такого как амин, с подходящей кислотой, с получением физиологически приемлемого аниона. Также получают соли щелочного металла (например, натрия, калия или лития) или щелочноземельного металла (например, кальция) с карбоновыми кислотами.
Когда рассматриваемые соединения вводят в фармакологической композиции, рассматривается, что соединения могут быть составлены в смеси с фармацевтически приемлемым эксципиентом и/или носителем. Например, рассматриваемые соединения могут вводиться перорально в виде нейтральных соединений или в виде фармацевтически приемлемых солей, или внутривенно в физиологическом растворе. Обычные буферы, такие как фосфаты, бикарбонаты или цитраты, могут применяться для этой цели. Конечно, специалист в данной области техники может модифицировать композиции с учетом сказанного в данном описании для получения множества композиций для конкретного способа введения. В частности, рассматриваемые соединения могут быть модифицированы так, чтобы сделать их более растворимыми в воде или другом носителе, что, например, может быть легко достигнуто при незначительных модификациях (образование соли, эстерификация и т.д.), которые хорошо известны специалисту в данной области техники. Также специалист в данной области техники сможет модифицировать способ введения и режим дозирования конкретного соединения для управления фармакокинетикой соединений в соответствии с данным изобретением для получения максимального благоприятного эффекта для пациента.
Соединения, имеющие формулу I-III, такую как описана здесь, обычно растворимы в органических растворителях, таких как хлороформ, дихлорметан, этилацетат, этанол, метанол, изопропанол, ацетонитрил, глицерин, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д. В одном варианте, в данном изобретении представлены композиции, полученные смешиванием соединения, имеющего формулу I-III, с фармацевтически приемлемым носителем. В одном аспекте, композиция может быть получена с применением способа, включающего: a) растворение описанного соединения в водорастворимом органическом растворителе, не ионном растворителе, водорастворимом жире, циклодекстрине, витамине, таком как токоферол, жирной кислоте, сложном эфире жирной кислоты, фосфолипиде или их сочетании, с получением раствора; и b) добавление физиологического раствора или буфера, содержащего 1-10% раствор углевода. В одном примере, углевод содержит декстрозу. Фармацевтические композиции, полученные способами в соответствии с данным изобретением, являются стабильными и применяются в медицине и ветеринарии.
Иллюстративные примеры водорастворимых органических растворителей для применения в способах в соответствии с данным изобретением включают, и не ограничены ими, полиэтиленгликоль (ПЭГ), спирты, ацетонитрил, N-метил-2-пирролидон, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид или их сочетание. Примеры спиртов включают, но не ограничены ими, метанол, этанол, изопропанол, глицерин или пропиленгликоль.
Иллюстративные примеры водорастворимых не ионных поверхностно-активных веществ для применения в способах в соответствии с данным изобретением включают, но не ограничены ими, CREMOPHOR® EL, модифицированный полиэтиленгликолем CREMOPHOR® (полиоксиэтиленглицеринтририцинолеат 35), гидрированный CREMOPHOR® RH40, гидрированный CREMOPHOR® RH60, ПЭГ-сукцинат, полисорбат 20, полисорбат 80, SOLUTOL® HS (полиэтиленгликоль 660 12-гидроксистуарат), сорбитан моноолеат, полоксамер, LABRAFIL® (этоксилированное персидское масло), LABRASOL® (каприл-капроил макроголь-8-глицерид), GELUCIRE® (сложный эфир глицерина), SOFTIGEN® (ПЭГ 6 каприловый глицерид), глицерин, гликоль-полисорбат или их сочетание.
Иллюстративные примеры водорастворимых жиров для применения в способах в соответствии с данным изобретением включают, но не ограничены ими, жидкие растительные жиры, триглицериды, растительные масла или их сочетания. Примеры жирных масел включают, но не ограничены ими, касторовое масло, полиэтиленгликоля касторовое масло, кукурузное масло, оливковое масло, хлопковое масло, арахисовое масло, масло мяты перечной, сафлоровое масло, конопляное масло, соевое масло, гидрированное растительное масло, гидрированное соевое масло, триглицерид кокосового масла, масло пальмовой косточки и их гидрированные формы или их сочетания.
Иллюстративные примеры жирных кислот и сложных эфиров жирных кислот для применения в способах в соответствии с данным изобретением включают, но не ограничены ими, олеиновую кислоту, моноглицериды, диглицериды, сложный эфир моно- или ди-жирной кислоты или ПЭГ или их сочетание.
Иллюстративные примеры циклодекстринов для применения в способах в соответствии с данным изобретением включают, но не ограничены ими, альфа-циклодекстрин, бета-циклодекстрин, гидроксипропил-бета-циклодекстрин или сульфобутиловый эфир-бета-циклодекстрин.
Иллюстративные примеры фосфолипидов для применения в способах в соответствии с данным изобретением включают, но не ограничены ими, соевый фосфатидилхолин или дистеароил фосфатидилглицерин и их гидрированные формы или их сочетания.
Специалист в данной области техники может модифицировать композиции с учетом сказанного в данном описании с получением множества композиций для конкретного способа введения. В частности, соединения могут быть модифицированы для того, чтобы сделать из более растворимыми в воде или другом носителе. Также специалист в данной области техники может модифицировать способ введения и режим дозирования конкретного соединения для управления фармакокинетикой соединений в соответствии с данным изобретением для получения максимального полезного эффекта у пациента.
Комбинации лекарственных средств
Способы из определенных вариантов включают введение эффективного количества, по крайней мере, одного типового соединения в соответствии с данным изобретением; необязательно соединение может вводиться в комбинации с одним или более дополнительными терапевтическими агентами, в частности, терапевтическими агентами, применяемыми для лечения пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания, которым страдает пациент.
Дополнительные активные ингредиенты могут вводиться в отдельной фармацевтической композиции от, по крайней мере, одного типового соединения в соответствии с данным изобретением, или могут быть включены с, по крайней мере, одним типовым соединением в соответствии с данным изобретением в одну фармацевтическую композицию. Дополнительные активные ингредиенты могут вводиться одновременно с, до или после введения, по крайней мере, одного типового соединения в соответствии с данным изобретением.
Способы применения типовых соединений и их фармацевтических композиций
В данном изобретении также представлены фармацевтические композиции для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания, включающие любое соединение, имеющее формулу I или II, или любое из соединений от I-1 до I-41.
Для практического применения способа в соответствии с данным изобретением, соединения, имеющие формулу, и их фармацевтические композиции могут вводиться перорально, парентерально, ингаляцией, местно, ректально, назально, буккально, вагинально, через имплантированный резервуар иди другими способами введения лекарственных средств. Термин “парентеральное” в данном описании включает методы подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, внутриартериальной, внутрисиновиальной, надчревной, интратекальной, внутриочаговой и внутричерепной инъекции или инфузии.
Стерильная композиция для инъекций, такая как стерильная водная или масляная суспензия для инъекций, может быть составлена по методике, известной в данной области техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильным препаратом для инъекций также может быть стерильный раствор или суспензия для инъекций в не токсичном парентерально приемлемом разбавителе или растворителе. Приемлемые носители и растворители, которые могут применяться, включают манит, воду, раствор Рингера и изотонический раствор хлорида натрия. Подходящие носители и другие компоненты фармацевтической композиции обычно являются стерильными.
Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, применяют в получении форм для инъекций, в также фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии также могут содержать длинноцепный спиртовой разбавитель или диспергирующий агент или карбоксиметилцеллюлозу или подобные диспергирующие агенты. Различные эмульгирующие агенты или улучшители биодоступности, которые обычно применяют при производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, также могут применяться для получения композиций.
Композицией для перорального применения может быть любая приемлемая лекарственная форма, включающая, но не ограниченная ими, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для перорального применения, обычно применяемые носители включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как стеарат магния, также могут быть добавлены. Для перорального введения в форме капсул полезные разбавители включают лактозу и высушенный кукурузный крахмал. Если водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендирован или растворен в масляной фазе, объединенной с эмульгирующими или суспендирующими агентами. При необходимости могут быть добавлены определенные подсластители, вкусовые добавки или красители. Назальный аэрозоль или композиции для ингаляций могут быть получены методами, хорошо известными в области фармацевтических композиций, и могут быть получены в виде растворов в, например, физиологическом растворе, с применением подходящих консервантов (например, бензилового спирта), промоторов абсорбции для улучшения биодоступности и/или других солюбилизирующих или диспергирующих агентов, известных в данной области техники.
Кроме того, соединения, имеющие формулу I или II, или любые соединения от I-1 до I-41, могут вводиться отдельно или в комбинации с другими терапевтическими агентами, например, противораковыми агентами, для лечения различных пролиферативных расстройств, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания. Комбинированные терапии в соответствии с данным изобретением включают введение, по крайней мере, одного типового соединения в соответствии с данным изобретением и, по крайней мере, одного другого фармацевтически активного ингредиента. Активный ингредиент(ы) и фармацевтически активные агенты могут вводить отдельно или вместе. Количества активного ингредиента(ов) и фармацевтически активного агента(ов) и соответствующее время введения выбираются так, чтобы достигнуть желаемого объединенного терапевтического эффекта.
Биологический скрининг и противораковое действие:
Некоторые типовые анализы и примеры для оценки терапевтической эффективности, например, противоракового действия типовых соединений в соответствии с данным изобретением описаны ниже.
In vitro клеточный скрининг с применением системы электронного распознавания клетки в режиме реального времени (ЭРК-РВ)
Некоторые типовые гетероциклические соединения в соответствии с данным изобретением разработаны для противоракового действия на раковые клетки с определенными молекулярными целями, т.е. РЭФР (рецептор эпидермального фактора роста). Противораковая эффективность этих гетероциклических соединений и их аналогов, описанных выше, может быть предварительно проверена in vitro с применением панели колоний раковых клеток РЭФР с применением системы электронного распознавания клетки в режиме реального времени (ЭРК-РВ) от ACEA Biosciences, Inc. (или системы xCELLigence от Roche Applied Sciences/ACEA Biosciences Inc.), которая дает информацию о динамической реакции клетки после обработки противораковым агентом.
Подробное описание методики электронного распознавания клетки, называемой электронным распознаванием клетки в режиме реального времени (ЭРК-РВ®) и соответствующие устройства, системы и способы применения описаны в патенте США № 7,732127; патенте № 7192752; патенте № 7459303; патенте № 7468255; патенте № 7470533; патенте № 7560269; предварительной заявке на патент США № 60/397749, поданной 20 июля 2002; предварительной заявке на патент США № 60/435400, поданной 20 декабря 2002; предварительной заявке на патент США № 60/469572, поданной 9 мая 2003, заявке РСТ № PCT/USO3/22557, поданной 18 июля 2003; Заявке РСТ № PCT/USO3/22537, поданной 18 июля 2003; Заявке РСТ № PCT/USO4/37696, поданной 12 ноября 2004; Заявке РСТ № PCT/USO5/04481, поданной 9 февраля 2005; Заявке на патент США № 10/705447, поданной 10 ноября 2003; Заявке на патент США № 10/705615, поданной 10 ноября 2003; Заявке на патент США № 10/987732, поданной 12 ноября 2004; Заявке на патент США № 11/055639, поданной 9 февраля 2005, каждая из которых включена сюда в качестве ссылки. Дополнительные подробности методики ЭРК-РВ также описана в Предварительной заявке на патент США № 60/519567, поданной 12 ноября 2003 и Предварительной заявке на патент США № 60/542927, поданной 9 февраля 2004, Предварительной заявке на патент США № 60/548713, поданной 27 февраля 2004, Предварительной заявке на патент США № 60/598608, поданной 4 августа 2004; Предварительной заявке на патент США № 60/598609, поданной 4 августа 2004; Предварительной заявке на патент США № 60/613749, поданной 27 сентября 2004; Предварительной заявке на патент США № 60/613872, поданной 27 сентября 2004; Предварительной заявке на патент США № 60/614601, поданной 29 сентября 2004; Предварительной заявке на патент США № 60/630071, поданной 22 ноября 2004; Предварительной заявке на патент США № 60/630131, поданной 22 ноября 2004, каждая из которых включена сюда в качестве ссылки.
Для измерения сопротивления клеточного субстрата или клеточного электрода с применением методики ЭРК-РВ, микроэлектроды, имеющие соответствующую геометрию, изготавливают на нижних поверхностях микротитровального планшета или подобного устройства, «лицом» к стенкам. Клетки вводят в лунки устройств и оставляют контактировать и присоединяться к поверхностям электродов. Присутствие, отсутствие или изменение свойств клеток влияет на прохождение электронов и ионов на поверхностях электродного датчика. Измерение сопротивления между или среди электродов дает информацию о биологическом статусе клеток, присутствующих на датчиках. Если имеются изменения в биологическом статусе аналога клеток, электронные сигналы считывания измеряют автоматически и в режиме реального времени и превращают в цифровые сигналы для обработки и анализа.
В системе ЭРК-РВ клеточный индекс автоматически получают на основе измеренных значений сопротивления электрода. Клеточный индекс, полученный для данной лунки, отражает: 1) как много клеток присоединены к поверхностям электродов в этой лунке; и 2) как клетки в лунке присоединены к поверхностям электродов в этой лунке. Таким образом, чем больше клеток одинакового типа в похожих физиологических условиях присоединяются к поверхностям электродов, тем больше клеточный индекс. И чем лучше клетки присоединены к поверхностям электродов (например, клетки распространены больше и имеют большие площади контакта, или клетки присоединены теснее к поверхностям электродов), тем больше клеточный индекс. Было обнаружено, что cMet-аддиктивные колонии клеток дают временный профиль реакции сопротивления при обработке ингибиторами положительного контроля РЭФР (рецептор эпидермального фактора роста).
С помощью системы ЭРК-РВ было показано, что гетероциклические соединения, описанные в примерах выше, дают профиль реакции сопротивления клетки на системе ЭРК-РВ, похожий на профиль ингибиторов положительного контроля. Кроме того, было показано, что эти соединения ингибируют вызванную РЭФР (рецептором эпидермального фактора роста) миграцию клеток в некоторых колониях клеток. Кроме того, было показано, что эти соединения не оказывают или оказывают незначительное действие при применении для обработки колонии не-cMet аддиктивных раковых клеток.
Система ЭРК-РВ (или система xCELLigence RTCA) включает три компонента, анализатор электронного датчика, станцию и 16X или 96X микротитровальные планшеты (т.е. E-Plate 16 или E-Plate 96). Ряд микроэлектродных датчиков устанавливают на предметном стекле литографическими методами микропроизводства, и содержащие электроды стекла собирают в пластиковые лотки с получением электродсодержащих лунок. Каждый 16X (или 96X) микротитровальный планшет, применяемый в системе ЭРК-РВ, содержит вплоть до 16 (или 96) таких электродсодержащих лунок. Станция включает 16X или 96X микротитровальных планшетов и способна электронно переключать любую из лунок на анализатор датчика для измерения сопротивления. При работе устройства с клетками, культивируемыми в лунках, помещают в станцию (станцию xCELLigence RTCA SP или станцию ЭРК-РВ SP), которая расположена внутри инкубатора. Электрический кабель соединяет станцию с анализатором датчика (анализатором xCELLigence RTCA или анализатором ЭРК-РВ). Под контролем программы ЭРК-РВ или xCELLigence RTCA, анализатор датчика может автоматически выбирать лунки для измерения и непрерывно проводить измерения сопротивления. Данные сопротивления из анализатора переносят в компьютер, анализируют и обрабатывают встроенной программой.
Сопротивление, измеренное между электродами в отдельных лунках, зависит от геометрии электрода, концентрации ионов в лунке и того, есть ли клетки, присоединенные к электродам. При отсутствии клеток, сопротивление электрода в основном определяется ионной окружающей средой на границе фаз электрода/раствора и в основной массе раствора. В присутствии клеток, клетки, присоединенные к поверхностям электродных датчиков, изменяют ионную окружающую среду на границе фаз электрода/раствора, что приводит к повышению сопротивления. Чем больше клеток на электродах, тем больше повышения сопротивления клетка-электрод. Более того, изменение сопротивления также зависит от морфологии клетки и степени, с которой клетка присоединяется к электродам.
Для количественного анализа клеточного статуса на основе измеренного сопротивления клетка-электрод, получают параметр, названный клеточный индекс, согласно
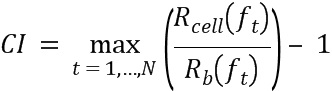
где Rb(f) и Rcell(f) являются зависимой от частоты резистентностью электродов (компонентом сопротивления) без клеток или в присутствии клеток, соответственно. N является числом значений частоты, при котором измеряют сопротивление. Таким образом, клеточный индекс является количественной мерой статуса клеток в электродсодержащей лунке. В одинаковых физиологических условиях, большее количество клеток, присоединенных к электродам, дает большее значение Rcell(f), что дает большее значение клеточного индекса. Более того, для одинакового количества клеток, присутствующих в лунке, изменение клеточного статуса, такого как морфология, приводит к изменению клеточного индекса. Например, повышение адгезии клеток или распространения клеток дает большую площадь контакта клетка-электрод, что приводит к повышению Rcell(f) и, таким образом, большему значению клеточного индекса. Клеточный индекс также может быть рассчитан с применением формулы, отличной от описанной здесь. Другие способы расчета клеточного индекса на основе измерения сопротивления можно найти в патенте США № 7732127; патенте № 7192752; патенте № 7459303; патенте № 7468255; патенте № 7470533; патенте № 7560269; Заявке РСТ № PCT/USO4/37696, поданной 12 ноября 2004, Заявке РСТ № PCT/USO5/04481, поданной 9 февраля 2005, заявке на патент США № 10/987732, поданной 12 ноября 2004 и заявке на патент США № 11/055639, поданной 9 февраля 2005.
Контрольные соединения для тестирования
Следующие соединения могут применяться в качестве сравнительных соединений для тестирования соединений в соответствии с данным изобретением.
WZ4002 является необратимо действующим ингибитором РЭФР T790M. (Nature 2009 December 24;462(7276): 1070–1074) Структура WZ4002 показана ниже:
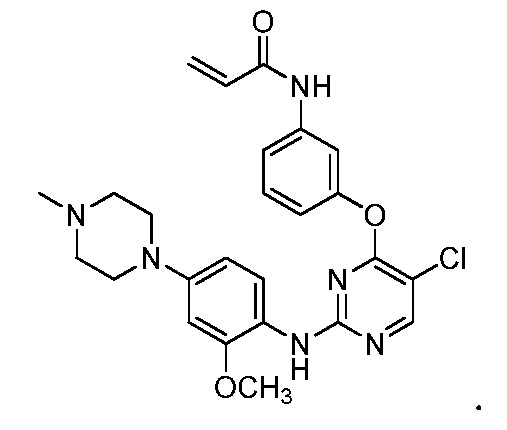
BIBW2992 (Афатиниб) является необратимо действующим ингибитором РЭФР/HER2. (Oncogene 2008;27:4702–4711) Структура BIBW2992 показана ниже:
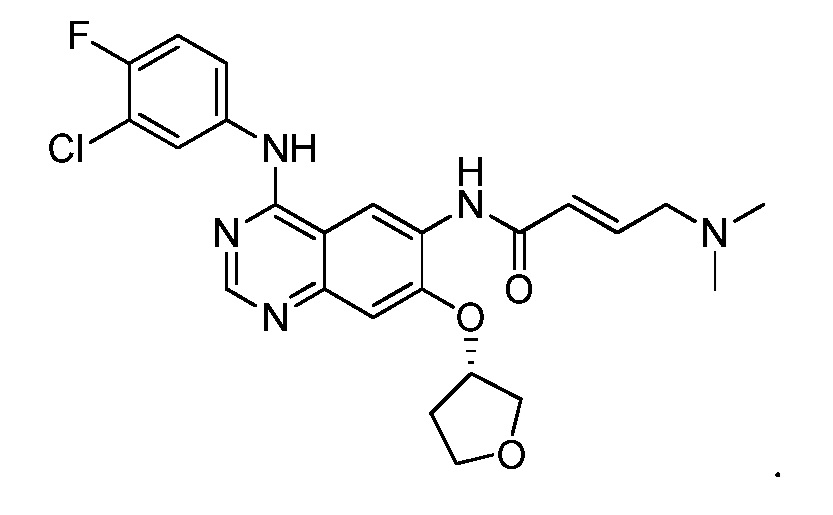
Эрлотиниб является необратимо действующим ингибитором тирозинкиназы, который действует на РЭФР. (Drugs 2000, 60 Suppl 1: 15–23; обсуждение 41–2.) Структура эрлотиниба показана ниже:
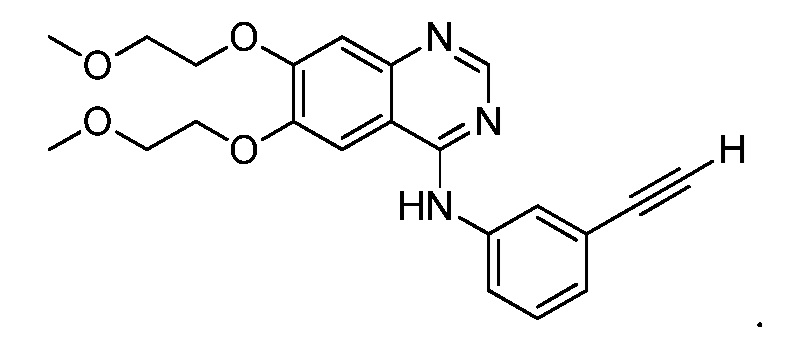
Примеры
Пример 1
Синтез N-(3-(5-метокси-2-(4-(4-метилпиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-1) и N-(3-((2-((3-фтор-4-(4-метилпиперазин-1-ил)фенил)амино)пиримидин-4-ил)окси)фенил)акриламида (I-2)
Схема синтеза соединений I-1 и I-2 представлена ниже:
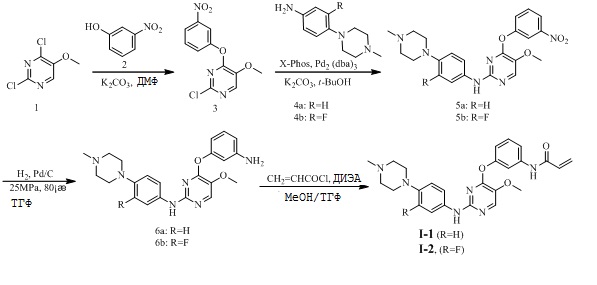
Стадия 1: Синтез 2-хлор-5-метокси-4-(3-нитрофенокси) пиримидина ( 3 )
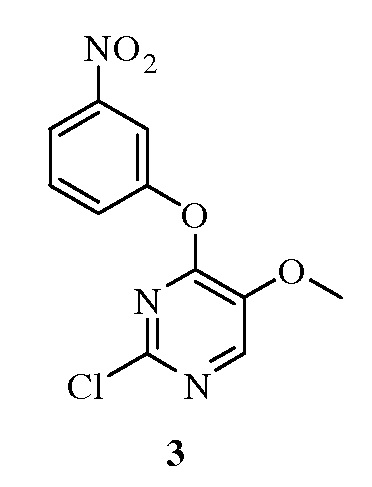
Смесь 2,4-дихлор-5-метоксипиримидин 1(130,0 г, 726,3 ммоль), 3-нитрофенол 2 (106,7 г, 767,0 ммоль) и K2CO3 (193 г, 1,40 моль) в ДМФ (625 мл) перемешивают при 30°С в течение 24 ч. Воду (3,12 л) затем добавляют в реакционную смесь. Смесь перемешивают в течение ~10 мин. Осадок собирают, промывают водой (200 мл×3) и сушат в течение ночи с получением соединения 3 (196,0 г, M+H+= 282,6) в виде белого твердого вещества.
Стадия 2: Синтез 5-метокси-N-(4-(4-метилпиперазин-1-ил)фенил)-4-(3-нитрофенокси)пиримидин-2-амина ( 5a )
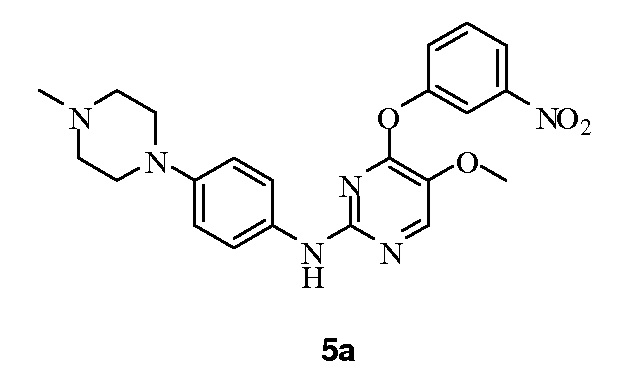
Смесь соединения 3 (80,0 г, 284,0 ммоль), 4-(4-метилпиперазин-1-ил)анилина 4 (54,3 г, 284,0 ммоль), X-Phos (8,0 г, 56,8 ммоль), Pd2(dba)3 (8,0 г, 28,4 ммоль), K2CO3 (78,5 г, 568,1 ммоль) в t-BuOH (1,0 л) перемешивают при кипении с обратным холодильником в течение 4 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Растворитель выпаривают при пониженном давлении. К остатку добавляют воду (400 мл). Смесь экстрагируют ДХМ (400 мл×3). Органические слои объединяют и обрабатывают активированным углем (для обесцвечивания) и затем фильтруют. Фильтрат концентрируют при пониженном давлении. Неочищенный продукт далее очищают кристаллизацией из этилацетата с получением желтых кристаллов 6 (92,0 г, M+H+= 437,5).
Стадия 3: Синтез 4-(3-аминофенокси)-5-метокси- N -(4-(4-метилпиперазин-1-ил)фенил)пиримидин-2-амина ( 6a )
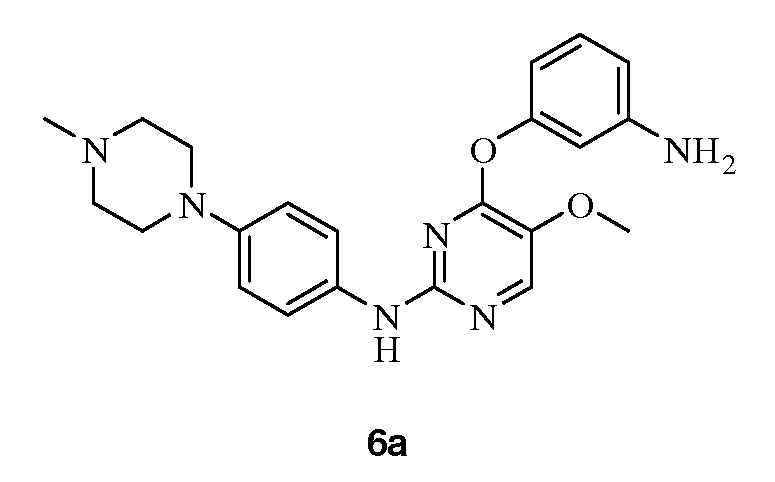
Раствор 5a (65,0 г, 143,0 ммоль) в ТГФ (150 мл) и 10% Pd/C (3,4 г, 5%) перемешивают при 25 МПа газообразного водорода при 80°С в течение 12 ч. Смесь охлаждают и фильтруют, и органический растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают кристаллизацией из этилацетата с получением 6a (42,0 г, M+H+= 407,5).
Синтез N-(3-(5-метокси-2-(4-(4-метилпиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида ( I-1 )
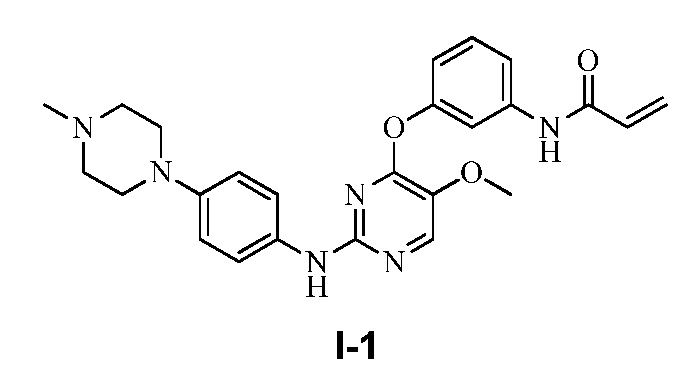
К смеси 6a (42,0 г, 103,3ммоль), ДИЭА (22,4 г, 173,6 ммоль) в MeOH (420 мл) и ТГФ(150 мл) добавляют хлорид акрилоила (15,7 г, 173,6 ммоль) при 0°С. Смесь перемешивают в течение 1 ч. Органический растворитель удаляют при пониженном давлении. Остаток повторно растворяют в ДХМ (800 мл) и промывают насыщенным водным бикарбонатом натрия (400 мл). Органический слой отделяют, и растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают кристаллизацией из ТГФ/H2O (3:10) с получением соединения I-1 (25,0 г, M+H+=461,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,34 (с, 1H), 9,01 (с, 1H), 8,17 (с, 1H), 7,64-7,59 (м, 2H), 7,43 (т, J=8,4 Гц, 1H), 7,28 (д, J=9,0 Гц, 2H), 6,95 (м, 1H), 6,64 (д, J=9,1 Гц, 2H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,35-6,19 (м, 1H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 3,87 (с, 3H), 3,02-2,91 (м, 4H), 2,48-2,39 (м, 4H), 2,23 (с, 3H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,32 (с), 161,43 (с), 155,79 (с), 154,79 (с), 147,52 (с), 145,95 (с), 142,27 (с), 136,62 (с), 135,09 (с), 133,70 (с), 131,87 (с), 129,25 (с), 121,10 (с, 2C), 118,76 (с), 118,17 (с), 117,71 (с, 2C), 114,94 (с), 59,63 (с), 56,65 (с, 2C), 50,92 (с, 2C), 47,71 (с).
Соединение (I-2) N-(3-(2-(3-фтор-4-(4-метилпиперазин-1-ил)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламид синтезируют с применением методик получения соединения I-1 с таким же выходом. Соединение (I-2): M+H+=479,5. 1H ЯМР (500 МГц, MeOD) δ 8,07 (с, 1H), 7,69 (т, J=2,0 Гц, 1H), 7,57 (дд, J=8,2, 1,0 Гц, 1H), 7,43 (т, J=8,2 Гц, 1H), 7,30 (дд, J=15,2, 2,5 Гц, 1H), 7,03-6,88 (м, 2H), 6,78 (т, J=9,5 Гц, 1H), 6,45 (дд, J=17,0, 9,9 Гц, 1H), 6,37 (дд, J=17,0, 2,0 Гц, 1H), 5,78 (дд, J=9,9, 2,0 Гц, 1H), 3,94 (с, 3H), 2,99 (шс, 4H), 2,62 (шс, 4H), 2,35 (с, J=6,2 Гц, 3H). 13C ЯМР (126 МГц, MeOD) δ 166,29 (с), 162,07 (с), 158,04 (с), 156,11 (с), 155,29 (с), 154,60 (с), 144,75 (с), 141,44 (с), 138,09 (д, J=11,1 Гц), 137,15 (с), 134,70 (д, J=9,8 Гц), 132,55 (с), 131,07 (с), 128,26 (с), 120,31 (д, J=4,1 Гц), 118,88 (с), 118,28 (с), 115,45-115,14 (м), 107,96 (д, J=26,4 Гц), 58,81 (с), 56,19 (с, 2C), 51,83 (д, J=2,6 Гц, 2C), 46,25 (с).
Пример 2
Синтез ключевых промежуточных соединений (I, II, III, IV и V)
Промежуточное соединение I (схема синтеза показана ниже):
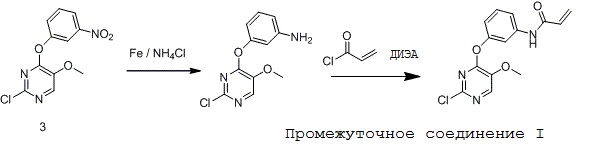
Стадия 1: Синтез 3-(2-хлор-5-метоксипиримидин-4-илокси)анилина
К раствору соединения 3 (35 г) в ТГФ (200 мл) добавляют воду (30 мл), NH4Cl (17 г) и Fe (15 г). Реакционную смесь нагревают до кипения с обратным холодильником при перемешивании в течение 3 ч. Реакционную смесь охлаждают и фильтруют, и слой ТГФ концентрируют при пониженном давлении. Неочищенный продукт повторно растворяют в этилацетате (200 мл) и pH корректируют водным раствором бикарбоната натрия и затем промывают водой (100 мл x3). Органический слой отделяют, и растворитель удаляют при пониженном давлении с получением указанного в заголовке соединения (13 г, M+H+ = 252,5).
Стадия 2: Синтез N-(3-(2-хлор-5-метоксипиримидин-4-илокси)фенил)акриламида ( I )
К раствору 3-(2-хлор-5-метоксипиримидин-4-илокси)анилина (7,5 г) и ДИЭА (6 г) в ТГФ (150 мл), хлорид акрилоила (2,7 г,) в ТГФ (10 мл) добавляют по каплям при 0°С на ледяной бане в течение более 20 мин. Затем реакционную смесь перемешивают в течение ночи, добавляют водный NaOH (1M, 40 мл). Реакционную смесь перемешивают при комнатной температуре в течение еще 0,5 ч. Слой ТГФ отделяют, и водный слой экстрагируют этилацетатом (100 мл). Объединенный органический слой концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (200 мл), промывают водой (100 мл ×3). Органический слой отделяют, и растворитель удаляют при пониженном давлении с получением неочищенного продукта, который далее очищают флэш-хроматографией на колонке с получением желаемого промежуточного соединения I (4 г, M+H+= 306,5).
Промежуточное соединение II (схема синтеза показана ниже):
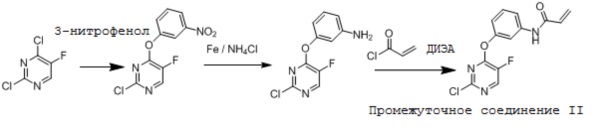
Стадия 1: синтез 2-хлор-5-фтор-4-(3-нитрофенокси) пиримидина
Смесь 2,4-дихлор-5-фторпиримидина (10,20 г), 3-нитрофенола (8,6 г) и K2CO3 (15,30 г) в ДМФ (80 мл) перемешивают в течение ночи при комнатной температуре. Добавляют воду (300 мл). Реакционную смесь перемешивают в течение 30 мин и затем фильтруют. Осадок собирают, промывают водой (100 мл ×2) и сушат. Твердое вещество повторно растворяют в этилацетате (200 мл), промывают водой (100 мл ×3). Органический слой отделяют, и растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают кристаллизацией из этилацетата/петролейного эфира (20 мл) с получением желтых кристаллов 3 (9,8 г, M+H+= 270,6).
Стадия 2: синтез 3-(2-хлор-5-фторпиримидин-4-илокси)анилина
К раствору 2-хлор-5-фтор-4-(3-нитрофенокси)пиримидина (6,8 г) в ТГФ (100 мл) добавляют воду (20 мл), NH4Cl (6,5 г) и Fe (6,5 г). Реакционную смесь перемешивают при кипении с обратным холодильником в течение 5 ч, охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (200 мл) и Ph корректируют водным раствором бикарбоната натрия. Смесь промывают водой (100 мл ×3). Органический слой отделяют, и растворитель удаляют при пониженном давлении с получением желаемого продукта с 66,2% выходом (4 г, M+H+= 240,5).
Стадия 3: синтез N-(3-(2-хлор-5-фторпиримидин-4-илокси)фенил)акриламида ( II )
К раствору 3-(2-хлор-5-фторпиримидин-4-илокси)анилина (3,9 г) и ДИЭА (3 г) в ТГФ (60 мл), хлорид акрилоила (1,6 г) в ТГФ (5 мл) добавляют по каплям при 0°С (ледяная баня) в течение более 15 мин. Затем реакционную смесь перемешивают в течение 4 ч, водный бикарбонат натрия (50 мл) добавляют по каплям. Реакционную смесь перемешивают в течение еще 0,5 ч. Органический слой отделяют. Водный слой экстрагируют этилацетатом (100 мл). Объединенные органические слои концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (200 мл), промывают водой (100 мл x3). Органический слой отделяют, и растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого промежуточного соединения II (4 г, M+H+= 294,5).
Промежуточное соединение III (схема синтеза показана ниже):
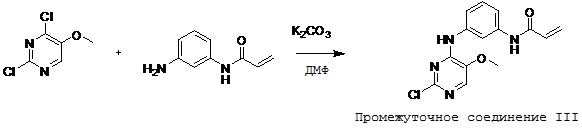
Синтез N-(3-(2-хлор-5-метоксипиримидин-4-иламино)фенил)акриламида (III)
К раствору 2,4-дихлор-5-метоксипиримидина 1 (2,55 г) и N-(3-аминофенил)акриламида (2,32 г) в ДМФ (30 мл) добавляют K2CO3 (4,14 г). Реакционную смесь перемешивают при 50°С в течение 16 ч. ТСХ (петролейный эфир:этилацетат = 1:1 в качестве элюирования) показывает завершение реакции. Добавляют этилацетат (200 мл), промывают водой (200 мл ×3). Органический слой отделяют, и растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого продукта III (3,5 г, M+H+= 305,7).
Промежуточное соединение IV (схема синтеза показана ниже):
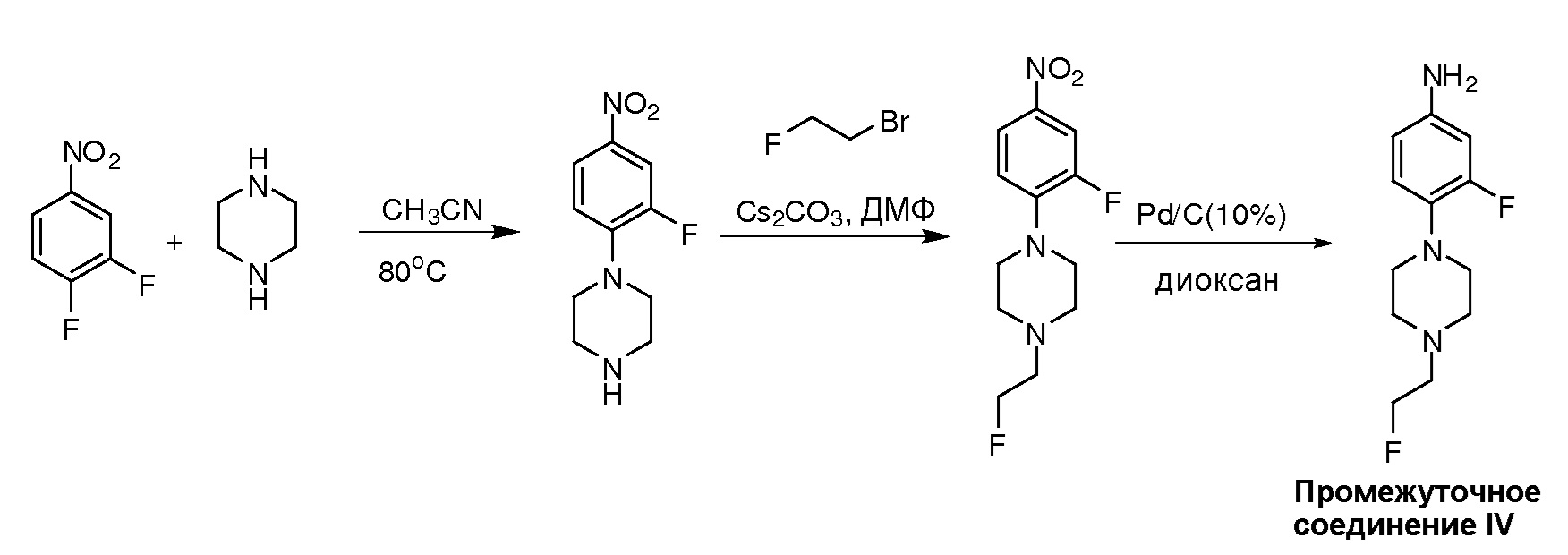
Стадия 1: синтез 1-(2-фтор-4-нитрофенил)пиперазина
В круглодонной колбе, 1,2-дифтор-4-нитробензол (23 г, 144,57 ммоль) добавляют к раствору пиперазина (21,66 г, 251,46 ммоль) в MeCN (200 мл). Смесь перемешивают при 80°С в течение 3 ч до завершения реакции, подтвержденного ТСХ (петролейный эфир:этилацетат = 3:1). Смесь концентрируют, затем добавляют воду (300 мл), экстрагируют этилацетатом (200 мл×3). Органические слои объединяют, сушат над Na2SO4 и концентрируют при пониженном давлении с получением желтого неочищенного продукта (30 г, M+H+ = 226,5).
Стадия 2: синтез 1-(2-фтор-4-нитрофенил)-4-(2-фторэтил)пиперазина
1-бром-2-фторэтан (5,4 г, 42,63 ммоль), ДМФ (48 мл), 1-(2-фтор-4-нитрофенил)пиперазин (8 г, 35,52 ммоль) и Cs2CO3 (25,2 г,77,34 ммоль) последовательно добавляют в колбу. Реакционную смесь перемешивают при 80°С в течение 7 ч до завершения реакции, подтвержденного ТСХ (этилацетат:петролейный эфир =1:3). Затем охлаждают до комнатной температуры, смесь фильтруют. Фильтрат выливают в воду (700 мл) при энергичном перемешивании. Осадок собирают, промывают водой и сушат с получением неочищенного продукта (9 г, M+H+ = 272,5).
Стадия 3: синтез 3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)анилина ( IV )
Раствор 1-(2-фтор-4-нитрофенил)-4-(2-фторэтил)пиперазина (1,1 г, 4,06 ммоль) и Pd/C (10%) (0,2 г, 1,87 ммоль) в 1,4-диоксане (10 мл) гидрируют в течение 12 ч при комнатной температуре до завершения реакции, подтвержденного ТСХ (MeOH:ДХМ = 1:4). Смесь фильтруют через слой Целита и промывают 1,4-диоксаном (5 мл). Фильтрат концентрируют при пониженном давлении с получением неочищенного продукта IV (1 г, M+H+= 242,5), который применяют на следующей стадии без дальнейшей очистки.
Промежуточное соединение V (схема синтеза показана ниже):
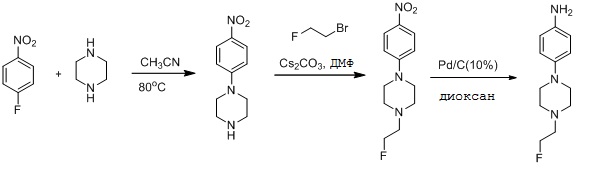
Используя методику получения промежуточного соединения IV, синтезируют промежуточное соединение (V) 4-(4-(2-фторэтил)пиперазин-1-ил)анилин.
Пример 3
Синтез N-(3-(2-(3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-3)
Схема синтеза соединения I-3 показана ниже:
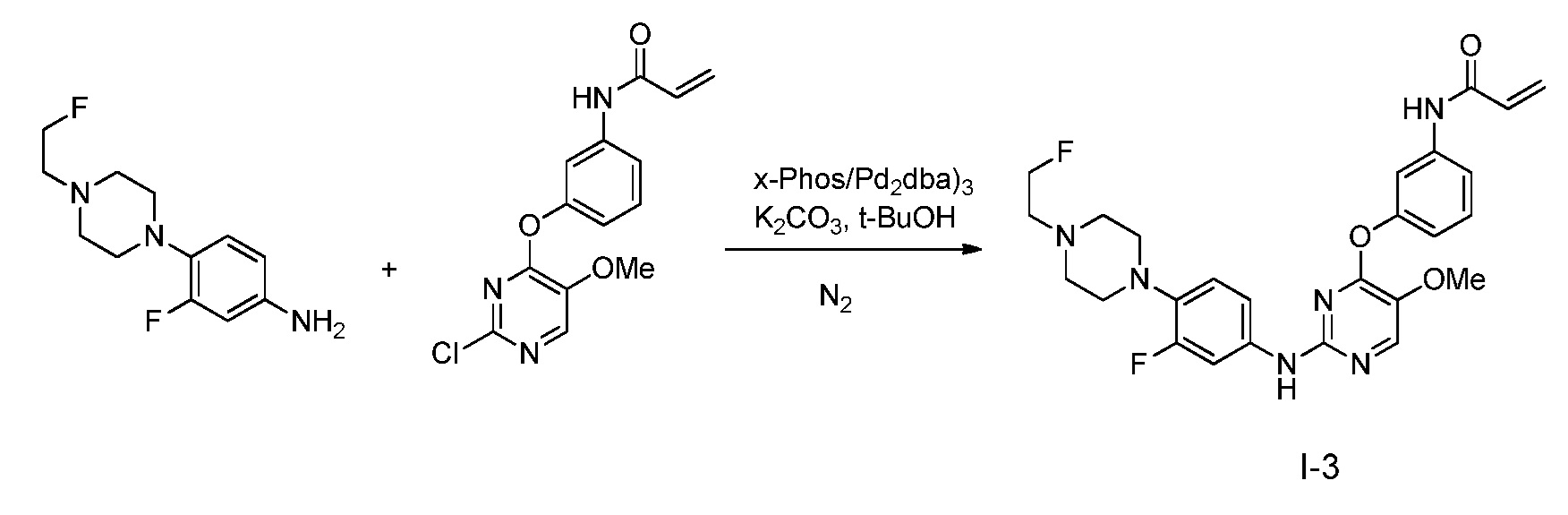
N-(2-(2-хлор-5-метоксипиримидин-4-илокси)фенил)акриламид (300 мг, 0,981 ммоль), 3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)анилин (236,8 мг, 0,981 ммоль), карбонат калия (175 мг, 1,27 ммоль), трис(дибензилиденацетон)дипалладий (35 мг, 0,07 ммоль) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (35 мг, 0,038 ммоль) и t-BuOH (3 мл) последовательно добавляют в 10 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (этилацетат/петролейный эфир/ТЭА = 1/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (10 мл) и активированный уголь (0,1 г). После перемешивания в течение 15 мин смесь фильтруют через Целит® и фильтровальную лепешку промывают этилацетатом (10 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке (этилацетат/петролейный эфир = 1/1 до 100% EtOAc в качестве элюирования) с получением указанного в заголовке соединения I-3 (120 мг, выход 26%, чистота 97,35%, M+H+ = 511,5) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,32 (с, 1H), 9,28 (с, 1H), 8,22 (с, 1H), 7,67 (т, J=2,1 Гц, 1H), 7,56 (дд, J=8,2, 1,0 Гц, 1H), 7,43 (т, J=8,1 Гц, 1H), 7,35 (дд, J=15,5, 1,9 Гц, 1H), 7,11 (дд, J=8,7, 1,9 Гц, 1H), 6,97 (м, 1H), 6,79-6,71 (м, 1H), 6,43 (дд, J=17,0, 10,2 Гц, 1H), 6,26 (дд, J=17,0, 1,9 Гц, 1H), 5,77 (дд, J=10,1, 1,9 Гц, 1H), 4,61 (т, J=4,9 Гц, 1H), 4,51 (т, J=4,9 Гц, 1H), 3,89 (с, 3H), 2,93-2,81 (м, 4H), 2,69 (т, J=4,9 Гц, 1H), 2,63 (т, J=4,9 Гц, 1H), 2,57 (шс, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,32 (с), 161,39 (с), 157,66 (с), 155,73 (с), 154,92 (д, J=65,0 Гц), 145,45 (с), 142,39 (с), 138,17 (д, J=11,0 Гц), 137,16 (с), 135,13 (д, J=9,3 Гц), 133,71 (с), 131,94 (с), 129,23 (с), 120,92 (с), 118,70 (с), 118,25 (с), 115,73 (с), 114,68 (с), 107,96 (д, J=26,1 Гц), 83,84 (д, J=164,5 Гц), 59,62 (с), 59,46 (с), 55,05 (с, 2C), 52,54 (с, 2C).
Пример 4
Синтез N-(3-((5-фтор-2-((3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)фенил)амино)пиримидин-4-ил)амино)фенил)акриламида (I-4)
Схема синтеза соединения I-4 показана ниже:
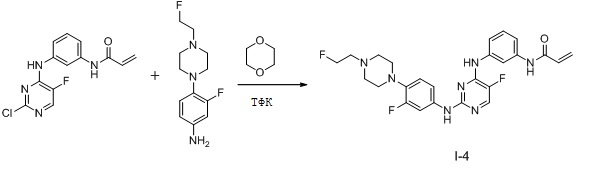
N-(3-(2-хлор-5-фторпиримидин-4-иламино)фенил)акриламид (878 мг), 1,4-диоксан (30 мл), 3-фтор-4-(4-(2-фторэтил)циклогексил)анилин (730 мг) и ТФК (0,7 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником в течение 24 ч. ТСХ (петролейный эфир:этилацетат = 2:1 в качестве элюирования) показывает завершение реакции. Реакционную смесь концентрируют при пониженном давлении. Неочищенный продукт повторно растворяют в этилацетате (100 мл), корректируют pH до 8 водным раствором бикарбоната натрия и промывают водой (100 мл x3). Органический слой отделяют, и растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением указанного в заголовке соединения I-4 (480 мг, M+H+ = 498,5 32% выход). 1H ЯМР (500 МГц, MeOD) δ 8,08 (с, 1H), 7,93 (д, J=3,8 Гц, 1H), 7,57 (дд, J=15,1, 2,5 Гц, 1H), 7,48-7,39 (м, 2H), 7,32 (т, J=8,1 Гц, 1H), 7,23-7,13 (м, 1H), 6,90 (т, J=9,2 Гц, 1H), 6,46 (дд, J=17,0, 9,9 Гц, 1H), 6,38 (дд, J=17,0, 1,9 Гц, 1H), 5,79 (дд, J=9,9, 1,9 Гц, 1H), 4,68 (т, J=4,5 Гц, 1H), 4,58 (т, J=4,5 Гц, 1H), 3,11-3,03 (м, 4H), 2,81 (т, J=4,5 Гц, 1H), 2,76-2,70(м, 5H). 13C ЯМР (126 МГц, MeOD) δ 166,30 (с), 158,11 (с), 157,14 (с), 156,17 (с), 152,12 (д, J=10,7 Гц), 143,43 (с), 141,61-140,82 (м), 140,37 (д, J=35,4 Гц), 138,06 (д, J=10,8 Гц), 135,17 (д, J=9,7 Гц), 132,75 (с), 130,22 (с), 128,07 (с), 120,36 (д, J=4,0 Гц), 119,38 (с), 117,04 (с), 116,11 (с), 115,41 (с), 108,84 (д, J=25,9 Гц), 82,71 (д, J=166,3 Гц), 59,44 (д, J=19,8 Гц), 54,75 (с, 2C), 51,95 (д, J=2,6 Гц, 2C).
Пример 5
Синтез N-(3-(2-(4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-5)
Схема синтеза соединения I-5 показана ниже:
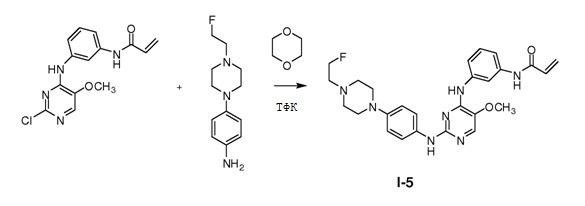
N-(3-(2-хлор-5-метоксипиримидин-4-иламино)фенил)акриламид (1,089 г,), 4-(4-(2-фторэтил)пиперазин-1-ил)анилин (0,800 г), карбонат калия (1,231 г), трис(дибензилиденацетон)дипалладий (0,300 г) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (0,300 г) и t-BuOH (30 мл) последовательно добавляют в 100 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (этилацетат/петролейный эфир/ТЭА = 1/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (50 мл) и активированный уголь (0,5 г). После перемешивания в течение 15 мин, смесь фильтруют через Целит®. Фильтровальную лепешку промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении, и неочищенный продукт далее очищают флэш-хроматографией на колонке (этилацетат/петролейный эфир = 1/1 до 100% этилацетата в качестве элюирования) с получением указанного в заголовке соединения I-5 (750 мг, выход 42,65%, чистота 95,8%, M+H+ = 492,5) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,09 (с, 1H), 8,69 (с, 1H), 8,58 (с, 1H), 7,98 (т, J=1,8 Гц, 1H), 7,82 (с, 1H), 7,55-7,49 (м, 3H), 7,42 (д, J=8,6 Гц, 1H), 7,26 (т, J=8,1 Гц, 1H), 6,77 (д, J=9,1 Гц, 2H), 6,47 (дд, J=17,0, 10,2 Гц, 1H), 6,27 (дд, J=17,0, 2,0 Гц, 1H), 5,76 (дд, J=10,1, 2,0 Гц, 1H), 4,65-4,59 (м, 1H), 4,56-4,50 (м, 1H), 3,85 (с, 3H), 3,05-2,95 (м, 4H), 2,70 (т, J=4,9 Гц, 1H), 2,64 (т, J=4,9 Гц, 1H), 2,62-2,54 (м, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,06 (с), 156,09 (с), 153,81 (с), 147,29 (с), 141,66 (с), 140,88 (с), 139,29 (с), 136,26 (с), 135,95 (с), 134,03 (с), 130,53 (с), 128,76 (с), 121,28 (с), 119,17 (с), 118,00 (с), 116,38 (с), 115,43 (с), 83,91 (д, J=164,3 Гц), 59,58 (д, J=19,5 Гц), 59,00 (с), 55,05 (с, 2C), 51,30 (с, 2C).
Пример 6
Синтез N-(2-(5-фтор-2-(4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)пиримидин-4-иламино)фенил)акриламида (I-6)
Схема синтеза соединения I-6 показана ниже:
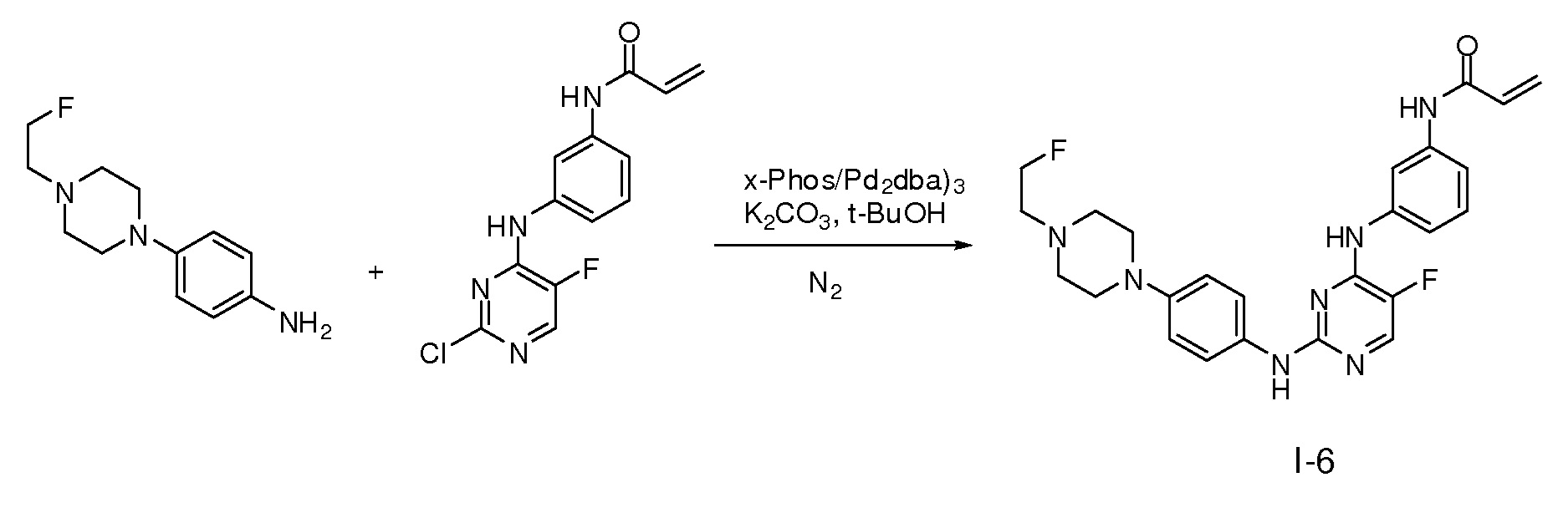
N-(2-(2-хлор-5-фторпиримидин-4-иламино)фенил)акриламид (2,010 г, 6,849 ммоль), 4-(4-(2-фторэтил)пиперазин-1-ил)анилин (2,008 г, 8,969 ммоль), карбонат калия (1,880 г, 13,698 ммоль), трис(дибензилиденацетон)дипалладий (630 мг, 0,685 ммоль) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (627 мг, 1,370 ммоль) и t-BuOH (20мл) последовательно добавляют в 100 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (EtOAc/петролейный эфир/ТЭА = 3/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (50 мл) и активированный уголь (0,5 г). После перемешивания в течение 15 мин, смесь фильтруют через Целит®. Фильтровальную лепешку промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке (EtOAc/петролейный эфир = 3/1 до EtOAc в качестве элюирования) с получением указанного в заголовке соединения I-6 (1,85 г, выход 56,23%, чистота 95%, M+H+ = 480,2) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, MeOD) δ 8,07 (с, 1H), 7,88 (д, J=3,7 Гц, 1H), 7,50-7,39 (м, 4H), 7,29 (т, J=8,1 Гц, 1H), 6,92-6,85 (м, 2H), 6,46 (дд, J=17,0, 9,8 Гц, 1H), 6,39 (дд, J=17,0, 2,1 Гц, 1H), 5,80 (дд, J=9,8, 2,1 Гц, 1H), 4,71-4,65 (м, 1H), 4,61-4,55 (м, 1H), 3,17-3,10 (м, 4H), 2,84-2,78 (м, 1H), 2,78-2,69 (м, 5H). 13C ЯМР (126 МГц, MeOD) δ 166,25 (с), 157,72 (с), 152,10 (д, J=10,7 Гц), 148,08 (с), 143,16 (с), 141,20 (с), 141,12 (с), 140,96 (с), 140,66 (с), 140,07 (с), 135,13 (с), 132,74 (с), 130,13 (с), 128,15 (с), 122,40 (с), 119,20 (с), 118,27 (с), 116,94 (с), 115,33 (с), 82,76 (д, J=166,4 Гц), 59,42 (д, J=19,7 Гц), 54,71 (с, 2C), 51,15 (с, 2C).
Пример 7
Синтез N-(2-(2-(3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)-5-метоксипиримидин-4-иламино)фенил)акриламида (I-7)
Схема синтеза соединения I-7 показана ниже:
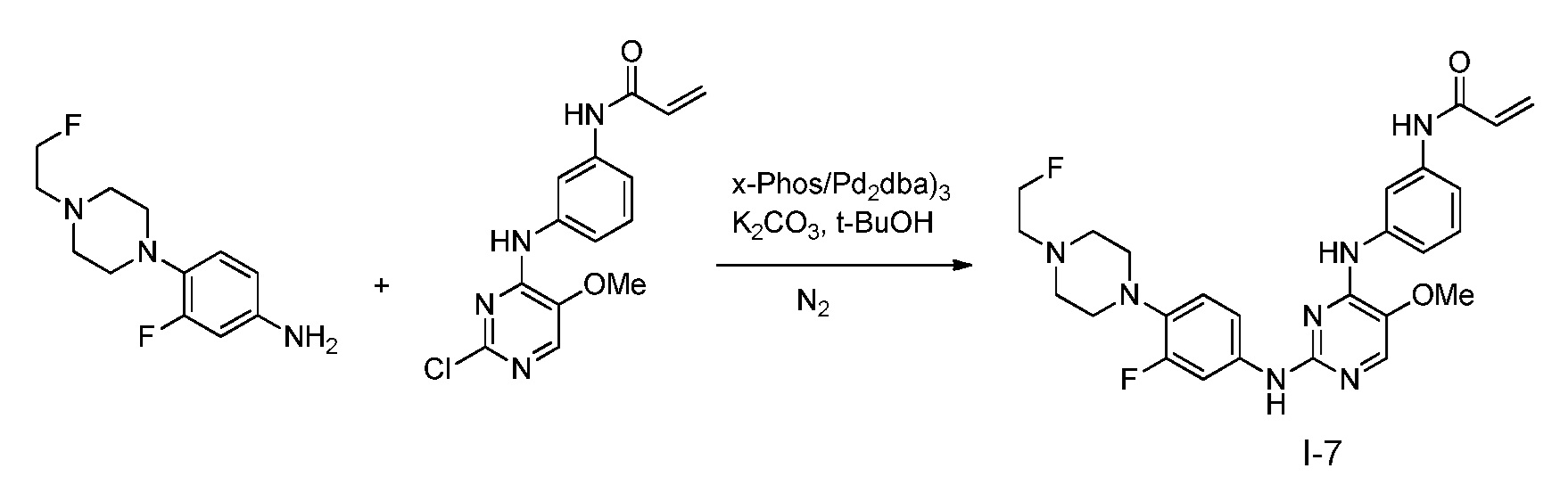
N-(2-(2-хлор-5-метоксипиримидин-4-иламино)фенил)акриламид (1,521 г, 5 ммоль), 3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)анилин (1,210 г, 5 ммоль), карбонат калия (1,383 г, 10 ммоль), трис(дибензилиденацетон)дипалладий (460 мг, 0,5 ммоль) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (475 мг, 1ммоль) и t-BuOH (50 мл) последовательно добавляют в 100 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (EtOAc/петролейный эфир/ТЭА = 1/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (50 мл) и активированный уголь (0,5 г). После перемешивания в течение 15 мин, смесь фильтруют через Целит®, и фильтровальную лепешку промывают этилацетатом (50 мл). Фильтрат концентрируют, и неочищенный продукт далее очищают флэш-хроматографией на колонке (EtOAc/петролейный эфир = 1/1 до EtOAc в качестве элюирования) с получением указанного в заголовке соединения I-7 (1,537 г, выход 60,2%, чистота 95,33%, M+H+ = 510,3) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,08 (с, 1H), 8,89 (с, 1H), 8,77 (с, 1H), 7,96 (т, J=1,8 Гц, 1H), 7,86 (с, 1H), 7,67 (дд, J=15,7, 2,4 Гц, 1H), 7,51 (д, J=8,0 Гц, 1H), 7,44 (д, J=8,7 Гц, 1H), 7,31 (дд, J=8,7, 2,0 Гц, 1H), 7,27 (т, J=8,1 Гц, 1H), 6,84 (дд, J=9,8, 9,1 Гц, 1H), 6,46 (дд, J=17,0, 10,2 Гц, 1H), 6,25 (дд, J=17,0, 2,0 Гц, 1H), 5,75 (дд, J=10,1, 2,0 Гц, 1H), 4,61 (т, J=4,9 Гц, 1H), 4,52 (т, J=4,9 Гц, 1H), 3,87 (с, 3H), 2,97-2,86 (м, 4H), 2,70 (т, J=4,9 Гц, 1H), 2,64 (т, J=4,9 Гц, 1H), 2,59 (с, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,07 (с), 157,89 (с), 155,97 (с), 155,49 (с), 153,84 (с), 141,51 (с), 141,07 (с), 139,06 (д, J=11,0 Гц), 138,82 (с), 136,67 (с), 134,63 (д, J=9,4 Гц), 134,06 (с), 130,60 (с), 128,67 (с), 121,06 (д, J=4,0 Гц), 119,34 (с), 116,48 (с), 115,75-115,32 (м), 107,95 (д, J=26,1 Гц), 83,85 (д, J=164,4 Гц), 59,57 (д, J=19,6 Гц), 58,89 (с), 55,11 (с, 2C), 52,65 (с, 2C).
Пример 8
Синтез N-(2-(5-фтор-2-(3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-8)
Схема синтеза соединения I-8 показана ниже:
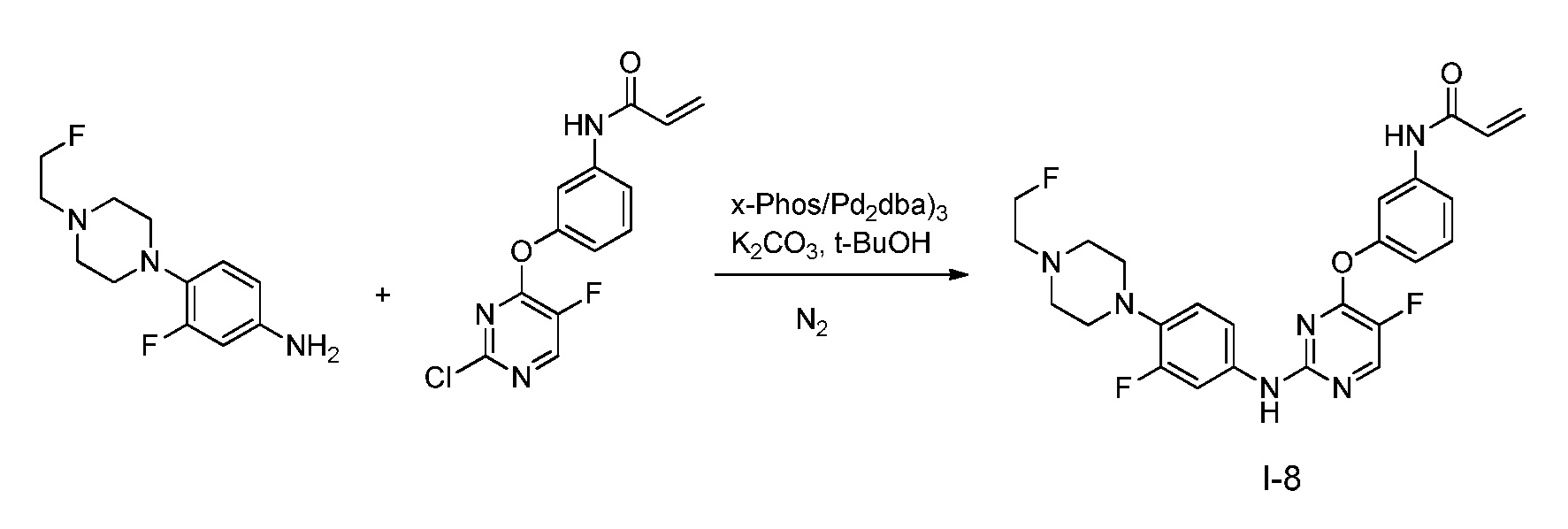
N-(2-(2-хлор-5-фторпиримидин-4-илокси)фенил)акриламид (1,461 г, 5 ммоль), 3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)анилин (1,210 г, 5 ммоль), карбонат калия (1,380 г, 10 ммоль), трис(дибензилиденацетон)дипалладий (460 мг, 0,5 ммоль) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (475 мг, 1 ммоль) и t-BuOH (50 мл) последовательно добавляют в 100 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (EtOAc/петролейный эфир/ТЭА = 1/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (50 мл) и активированный уголь (0,5 г). После перемешивания в течение 15 мин смесь фильтруют через Целит®, и фильтровальную лепешку промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении, и неочищенный продукт далее очищают флэш-хроматографией на колонке (EtOAc/петролейный эфир = 1/1 до EtOAc в качестве элюирования) с получением указанного в заголовке соединения I-8 (1,72 г, выход 69,1%, чистота 98,67%, M+H+ = 499,3) в виде светло-желтого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,35 (с, 1H), 9,60 (с, 1H), 8,49 (д, J=3,0 Гц, 1H), 7,74 (т, J=2,0 Гц, 1H), 7,61-7,55 (м, 1H), 7,46 (т, J=8,2 Гц, 1H), 7,32 (д, J=15,1 Гц, 1H), 7,10 (д, J=8,2 Гц, 1H), 7,04 (м, 1H), 6,77 (т, J=9,4 Гц, 1H), 6,44 (дд, J=17,0, 10,2 Гц, 1H), 6,27 (дд, J=17,0, 1,9 Гц, 1H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 4,61 (т, J=4,9 Гц, 1H), 4,51 (т, J=4,9 Гц, 1H), 2,94-2,83 (м, 4H), 2,69 (т, J=4,9 Гц, 1H), 2,63 (т, J=4,9 Гц, 1H), 2,57 (с, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,36 (с), 159,02 (д, J=11,0 Гц), 157,52 (с), 156,87 (д, J=3,4 Гц), 155,59 (с), 153,97 (с), 147,89 (д, J=22,1 Гц), 142,88 (с), 142,47 (с), 140,90 (с), 137,36 (д, J=10,9 Гц), 135,82 (д, J=9,3 Гц), 133,67 (с), 132,04 (с), 129,30 (с), 120,86 (д, J=3,9 Гц), 118,70 (с), 116,34 (с), 114,68 (с), 108,54 (д, J=26,0 Гц), 83,83 (д, J=164,4 Гц), 59,53 (д, J=19,5 Гц), 55,01 (с, 2C), 52,46 (д, J=2,4 Гц, 2C).
Пример 9
Синтез N-(2-(2-(3-фтор-4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-9)
Схема синтеза соединения I-9 показана ниже:
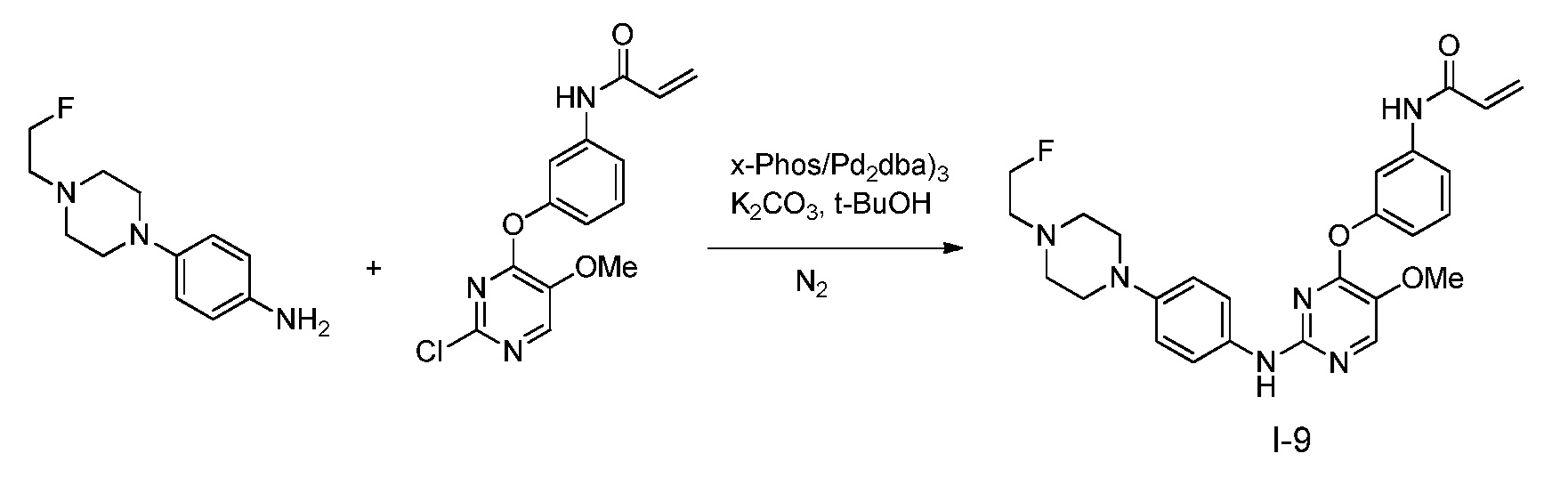
N-(2-(2-хлор-5-метоксипиримидин-4-илокси)фенил)акриламид (1,360 г, 4,48 ммоль), 4-(4-(2-фторэтил)пиперазин-1-ил)анилин 1 (1,002 г, 4,48 ммоль), карбонат калия (1,380 г, 10 ммоль), трис(дибензилиденацетон)дипалладий (460 мг, 0,5 ммоль) и дициклогексил (2',4',6'-триизопропилбифенил-2-ил)фосфин (475 мг, 1 ммоль) и t-BuOH (50 мл) последовательно добавляют в 100 мл круглодонную колбу с магнетитом. Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником в течение 5~7 ч до завершения реакции, подтвержденного ТСХ (EtOAc/петролейный эфир/ТЭА = 1/1/0,1 в качестве элюирования). Смесь концентрируют при пониженном давлении, затем добавляют EtOAc (50 мл) и активированный уголь (0,5 г). После перемешивания в течение 15 мин смесь фильтруют через Целит®, и фильтровальную лепешку промывают EA (50 мл). Фильтрат концентрируют, и неочищенный продукт далее очищают флэш-хроматографией на колонке (EtOAc/петролейный эфир = 1/1 до EtOAc в качестве элюирования) с получением указанного в заголовке соединения I-9 (840 мг, выход 38%, чистота 96,93%, M+H+ = 493,5) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,32 (с, 1H), 9,00 (с, J=24,8 Гц, 1H), 8,17 (с, 1H), 7,59-7,63 (м, 2H), 7,43 (т, J=8,4 Гц, 1H), 7,29 (д, J=9,0 Гц, 2H), 7,03-6,89 (м, 1H), 6,65 (д, J=9,1 Гц, 2H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,28 (дд, J=17,0, 1,9 Гц, 1H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 4,62 (т, J=4,9 Гц, 1H), 4,52 (т, J=4,9 Гц, 1H), 3,87 (с, J=15,8 Гц, 3H), 3,05-2,89 (м, 4H), 2,69 (т, J=4,9 Гц, 1H), 2,63 (т, J=4,9 Гц, 1H), 2,61-2,53 (м, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,32 (с), 161,44 (с), 155,80 (с), 154,79 (с), 147,56 (с), 145,97 (с), 142,27 (с), 136,63 (с), 135,12 (с), 133,70 (с), 131,88 (с), 129,26 (с), 121,13 (с, 2C), 118,76 (с), 118,16 (с), 117,74 (с, 2C), 114,95 (с), 83,90 (д, J=164,3 Гц), 59,64 (с), 59,48 (с), 54,99 (с, 2C), 51,13 (с, 2C).
Пример 10
Синтез N-(3-(2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-10)
Схема синтеза соединения I-10 показана ниже:
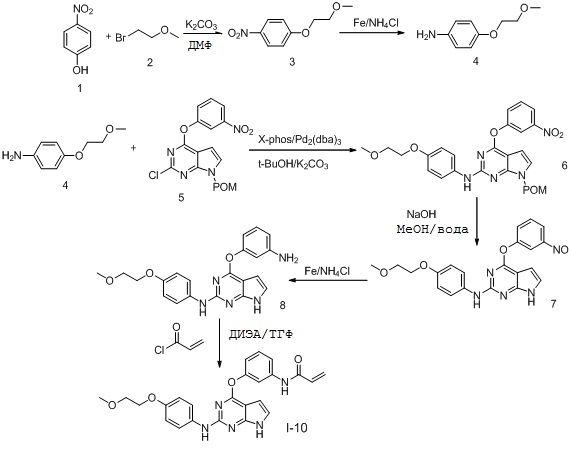
Стадия 1: Синтез 1-(2-метоксиэтокси)-4-нитробензола(3)
К раствору 4-нитрофенола (18,2 г, 130 ммоль) и 1-бром-2-метоксиэтана (20 г, 144 ммоль) в ДМФ (60 мл) добавляют K2CO3 (36 г, 260 ммоль). Реакционную смесь перемешивают при 65~70°C в течение 4 ч и затем охлаждают до комнатной температуры. Добавляют воду (200 мл), и смесь экстрагируют этилацетатом (200 мл ×3). Объединенные органические слои промывают водой (200 мл ×3), сушат над Na2SO4. Растворитель удаляют при пониженном давлении с получением желаемого продукта (3) в виде белого твердого вещества (25 г, 97,6% выход), которое применяют на следующей стадии без дальнейшей очистки.
Стадия 2: Синтез 4-(2-метоксиэтокси)анилина ( 4 )
К раствору соединения 3 (25 г, 127 ммоль) в ТГФ (180 мл) добавляют воду (60 мл). После перемешивания в течение ~ 5 мин, NH4Cl (28 г, 523 ммоль) и Fe (36 г, 635 ммоль) последовательно добавляют. Реакционную смесь нагревают до кипения с обратным холодильником и перемешивают в течение 4 ч. Затем охлаждают до комнатной температуры, смесь фильтруют через Целит® и промывают этилацетатом (200 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт повторно растворяют в этилацетате (500 мл), промывают насыщенным NaHCO3 (200 мл) и водой (200 мл). Органический слой концентрируют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого продукта 4 (12 г, 56,7% выход, M+H+= 168,5).
Стадия 3: Синтез пивалата (2-(4-(2-метоксиэтокси)фениламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила ( 6 )
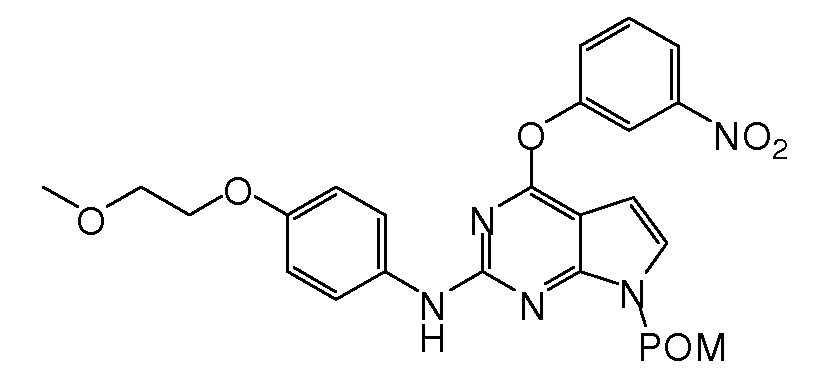
К раствору пивалата (2-хлор-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (4 г,10 ммоль), соединения 4 (1,67 г, 10 ммоль) в t-BuOH (40 мл) последовательно добавляют карбонат калия (2,8 г, 20 ммоль), трис(дибензилиденацетон)дипалладий (500 мг) и дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (500 мг). Реакционную смесь перемешивают под потоком N2 и нагревают до кипения с обратным холодильником. После перемешивания в течение 3~4, ТСХ (ДХМ/MeOH = 10/1 в качестве элюирования) показывает завершение реакции. Смесь охлаждают до 40~50°С, фильтруют через Целит®. Фильтровальную лепешку промывают t-BuOH. Фильтрат концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (200 мл), промывают водой и концентрируют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого продукта 6 (5,9 г, M+H+=536,5).
Стадия 4: Синтез N-(4-(2-метоксиэтокси)фенил)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-амина ( 7 )
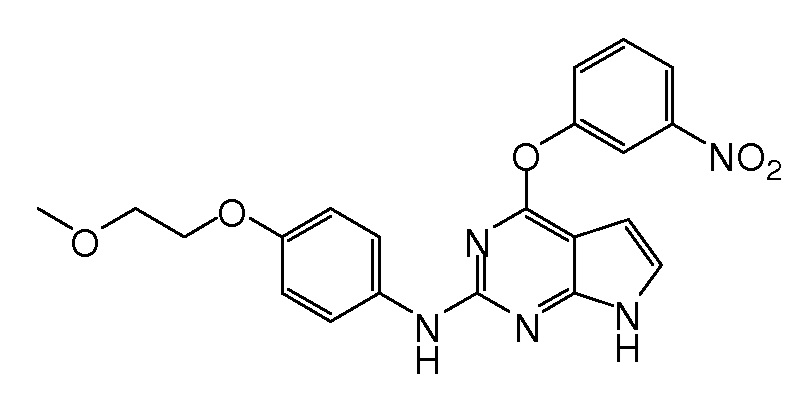
В реактор (250мл) загружают соединение 6 (5,9 г, 0,01 моль) и MeOH (120 мл). После полного растворения соединения 6 раствор охлаждают на ледяной бане до ~10°С. Затем добавляют раствор NaOH (2,5 M, 8 мл) в течение более 45 мин, сохраняя температуру ниже 16°С во время добавления. После завершения добавления реакционную смесь перемешивают в течение 4~5 ч при ~ 16°С. Завершение реакции отслеживают ТСХ и ЖХ-МС, когда они показывают потребление соединения 6 и низкое содержание (менее 8%) промежуточного соединения (ММ: 493). Воду (300 мл) добавляют к реакционной смеси в течение более 90 мин, сохраняя температуру ниже 20°С. Желаемый продукт 8 выпадает в осадок во время добавления воды. Смесь перемешивают в течение еще 15 мин после добавления воды. Осадок (неочищенный) собирают и промывают водой (200 мл). Неочищенный продукт повторно растворяют в этилацетате (200 мл) и промывают водой (200 млx3). Смесь пропускают через Целит® для удаления нерастворимого твердого вещества. Растворитель удаляют при пониженном давлении. Остаток далее очищают перекристаллизацией из этилацетата/петролейного эфира (5:4) с получением желаемого продукта 7 (3 г, 71,2% выход, M+H+=422,5).
Стадия 5: Синтез 4-(3-аминофенокси)-N-(4-(2-метоксиэтокси)фенил)-7H-пирроло[2,3-d]пиримидин-2-амина (8)
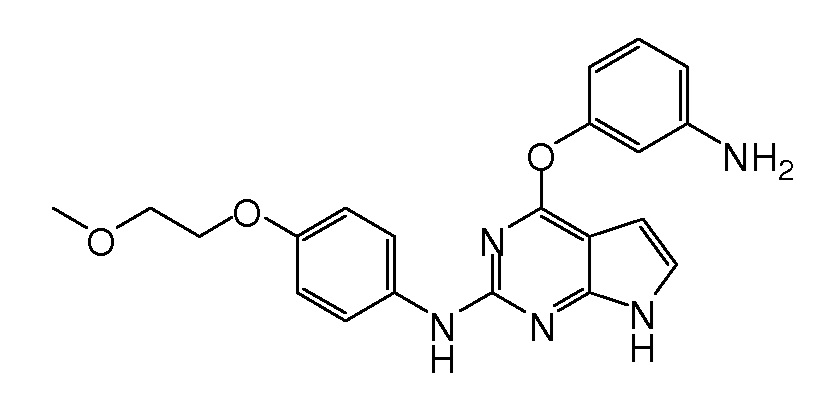
К раствору соединения 7 (3 г, 7,1 ммоль) в ТГФ (40 мл) добавляют воду (15 мл), NH4Cl (1,5 г, 28,4 ммоль) и Fe (2 г, 35,5 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры. Реакционную смесь фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (50 мл) и промывают насыщенным NaHCO3 (30 мл) и водой (50 мл ×3). Органический растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают перекристаллизацией из этилацетата/ПЭ (1:1) с получением желаемого продукта 8 (2,4 г, 86,2% выход, M+H+=392,5).
Стадия 6: Синтез N-(3-(2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида ( I-10 )
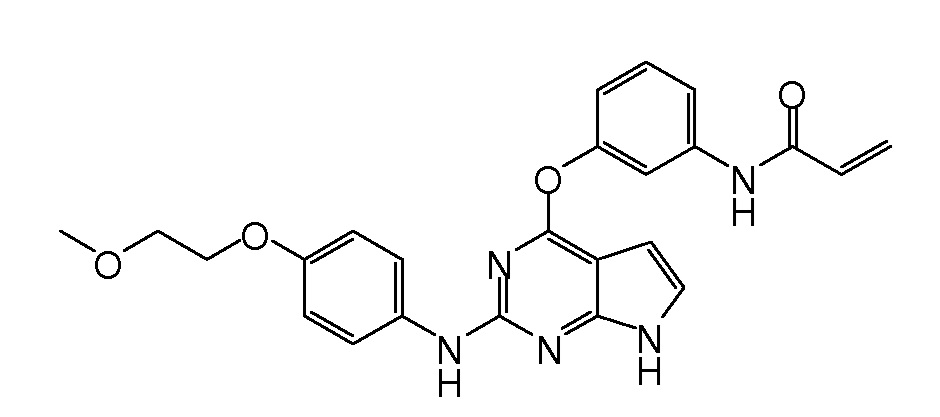
К раствору соединения 8 (328 мг, 0,83 ммоль) и ДИЭА (112 мг, 0,87 ммоль) в ТГФ (5 мл) на ледяной бане при -20°С добавляют хлорид акрилоила (79 мг, 0,87 ммоль) в течение более 5 мин, сохраняя температуру около -10°С в о время добавления. Реакционную смесь перемешивают в течение еще 30 мин при той же температуре после добавления. После нагревания до комнатной температуры добавляют этилацетат (50 мл). Смесь промывают водой (50 мл ×3). Органический растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого продукта I-10 (350 мг, 94,6% выход, M+H+=446,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 11,51 (с, J=26,7 Гц, 1H), 10,31 (с, 1H), 8,92 (с, J=7,3 Гц, 1H), 7,66 (т, J=2,1 Гц, 1H), 7,61-7,56 (м, 1H), 7,51 (д, J=8,9 Гц, 2H), 7,43 (т, J=8,1 Гц, 1H), 7,06 (дд, J=3,5, 2,3 Гц, 1H), 7,00 (м, 1H), 6,70 (д, J=9,0 Гц, 2H), 6,44 (дд, J=17,0, 10,2 Гц, 1H), 6,30-6,23 (м, 2H), 5,77 (дд, J=10,1, 1,9 Гц, 1H), 4,02-3,96 (м, 2H), 3,66-3,60 (м, 2H), 3,31 (с, J=2,3 Гц, 3H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,33 (с), 163,90 (с), 157,42 (с), 157,35 (с), 155,32 (с), 154,64 (с), 142,24 (с), 136,59 (с), 133,71 (с), 131,81 (с), 129,26 (с), 123,61 (с), 121,74 (с), 118,97 (с), 117,98 (с), 116,07 (с), 114,95 (с), 100,28 (с, 2C), 72,53 (с), 69,00 (с), 60,17 (с).
Пример 11
Синтез N-(3-(2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-иламино)фенил)акриламида (I-11)
Схема синтеза соединения I-11 показана ниже:
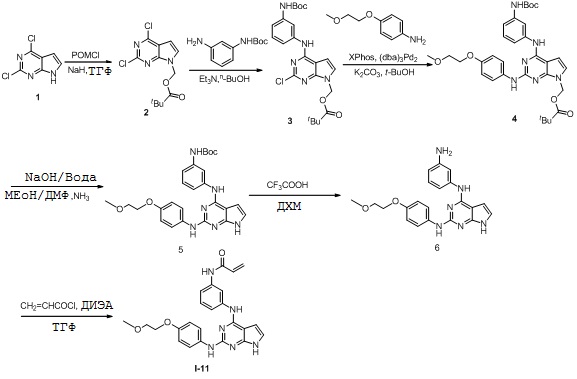
Стадия 1: Синтез пивалата (2,4-дихлор-7H-пирроло[2,3-d]пиримидин-7-ил)метила ( 2 )
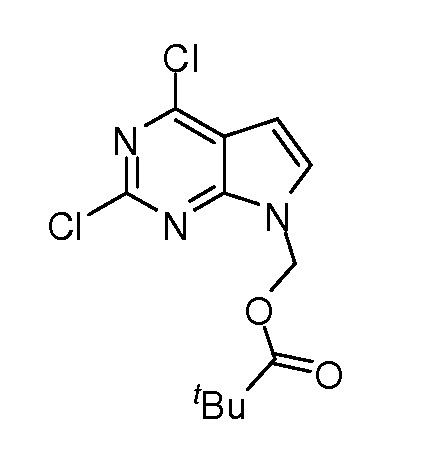
NaH (80%, 3,54 г, 0,117 моль) медленно добавляют к раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидина 1 (20,03 г, 0,106 моль) в ТГФ (200 мл) и поддерживают температуру ниже 0 ~ -5°С. Смесь перемешивают в течение еще 15 мин до прекращения выделения водорода. Раствор POMCl (18,96 г, 0,12 моль) в ТГФ (70 мл) добавляют в течение более 30 мин. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3~4 ч. Когда ВЭЖХ показывает потребление соединения 1, реакционную смесь фильтруют через Целит®, промывают этилацетатом (100 мл). Объединенные органические слои концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (300 мл), промывают водой (100 мл ×2) и насыщенным раствором соли (100 мл). Органический слой отделяют, и растворитель удаляют при пониженном давлении с получением желаемого продукта 2 в виде желтого твердого вещества, которое применяют непосредственно на следующей стадии без дальнейшей очистки.
Стадия 2: Синтез пивалата (4-(3-(тетрабутоксикарбониламино)-2-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)метила ( 3 )
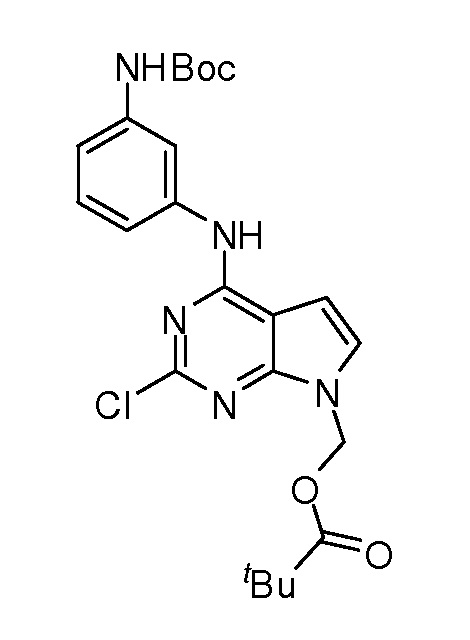
К смеси пиримидина 2 (6,1 г, 0,02 моль) и трет-бутил 3-аминофенилкарбамата (4,3 г, 0,019 моль) в н-BuOH (110 мл) добавляют ТЭА (7 мл). Реакционную смесь нагревают до кипения с обратным холодильником и перемешивают в течение 12~18 ч. Когда ВЭЖХ показывает потребление соединения 2, смесь охлаждают до комнатной температуры. Воду (200 мл) и этилацетат (100 мл) добавляют в эту смесь, которую перемешивают и разделяют слои. Органический слой промывают 1N HCl (20 мл), затем 5% NaHCO3 (50 мл), сушат над сульфатом натрия. Органический растворитель удаляют при пониженном давлении с получением легкого масла, в которое добавляют гексан (60 мл) и перемешивают в течение 2~3 ч. Осадок собирают и сушат с получением желаемого продукта (3,92 г, M+H+= 474,5) в виде белого твердого вещества.
Стадия 3: Синтез пивалата (4-(3-(трет-бутоксикарбониламино)фениламино)-2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила ( 4 )
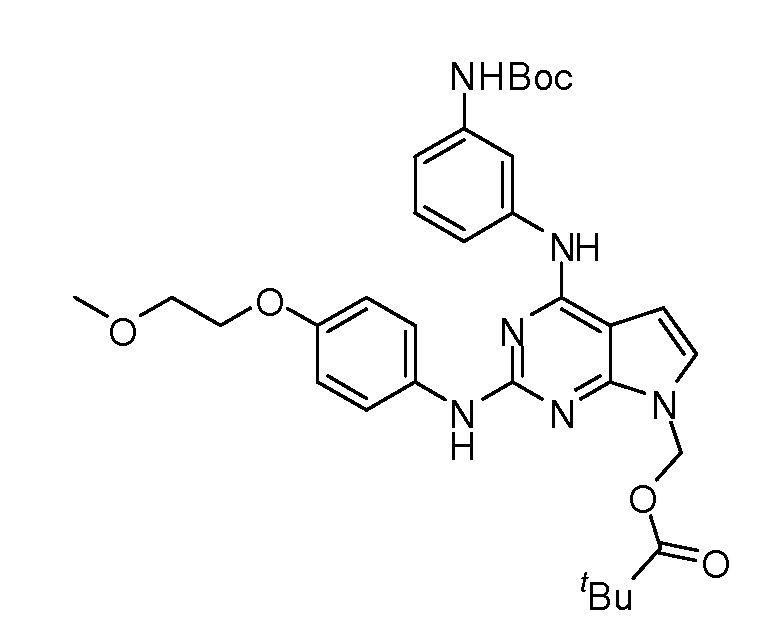
t-BuOH (80 мл) добавляют в КДК (250 мл), оборудованную магнитной мешалкой. Соединение 3 (3,92 г, 8,3 ммоль) и 4-(2-метоксиэтокси)анилин (1,5 г, 9 ммоль) последовательно добавляют и перемешивают в течение 5~10 мин. Карбонат калия (2,28 г, 16,5 ммоль), трис(дибензилиденацетон)дипалладий (750 мг, 0,9 ммоль) и дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (750 мг, 18 ммоль) последовательно добавляют и добавляют еще одну порцию трет-BuOH (20 мл). Колбу помещают на масляную баню и перемешивают под потоком N2. Реакционную смесь нагревают до кипения с обратным холодильником. После перемешивания в течение 3~4 ч завершение реакции подтверждают ТСХ (ДХМ/MeOH = 10/1 в качестве элюирования). Смесь охлаждают до 40~50°С и фильтруют через Целит®. Фильтровальную лепешку промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт затем очищают флэш-хроматографией на колонке (этилацетат:гексан = 1:10~1:3) с получением желаемого продукта 4 (1,74 г, M+H+= 605,5) в виде коричневого твердого вещества.
Стадия 4: трет-бутил 3-(2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-иламино)фенилкарбамат ( 5 )
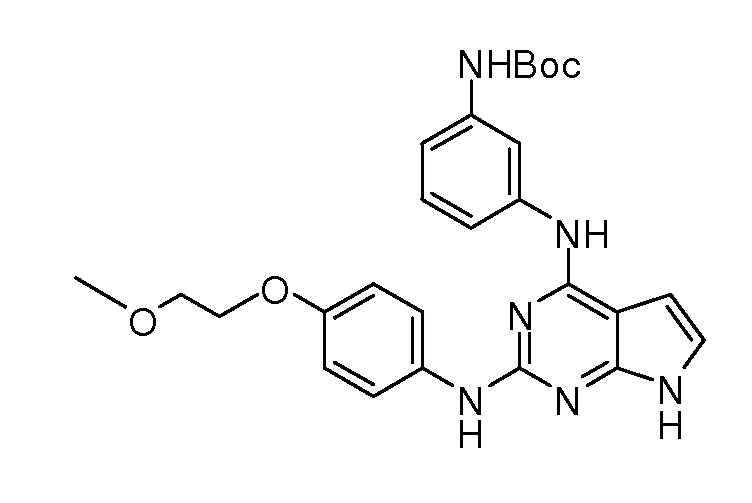
К раствору соединения 4 (1,74 г) в MeOH (25 мл) и ТГФ (15 мл) на ледяной бане добавляют раствор NaOH (2,5 M, 2,3 мл) в течение более 5 мин (температуру поддерживают около 6~10°С во время добавления). Затем реакционную смесь перемешивают в течение 4~5 ч при той же температуре, NH3 (газ) барботируют в эту реакционную смесь в течение 2~3 ч. Затем завершение реакции подтверждают ТСХ и ЖХ-МС с потреблением соединения 4 и низким содержанием (менее 2%) промежуточного соединения (ММ = 521). Добавляют воду (100 мл) и этилацетат (60 мл). Смесь перемешивают. Органическую фазу отделяют и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении с получением желаемого продукта 5 (1,35 г, M+H+= 491,5) в виде коричневого масла, которое применяют непосредственно на следующей стадии без дальнейшей очистки.
Стадия 5: Синтез N-(3-аминофенил)-N-(4-(2-метоксиэтокси)фенил)-7H-пирроло[2,3-d]пиримидин-2,4-диамина ( 6 )
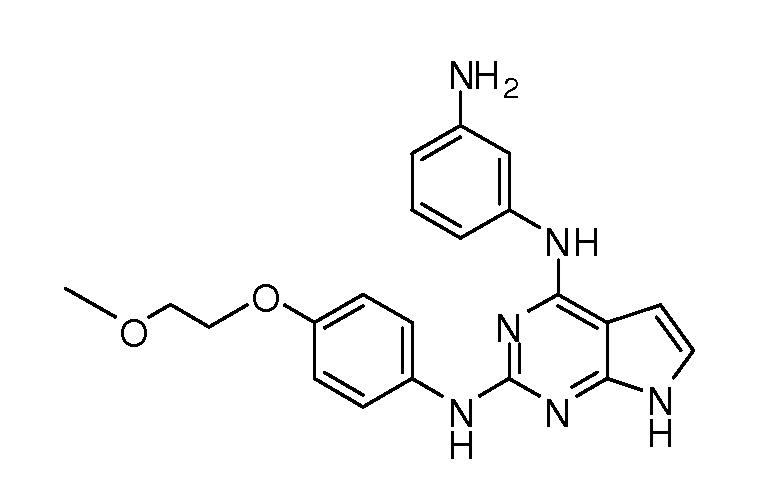
К раствору 5 в ДХМ (49 мл) добавляют ТФК (5,6 мл). Смесь перемешивают при комнатной температуре в течение 4 ч. В этот момент реакция завершается, что подтверждается ВЭЖХ, показывающей потребление соединения 5. Органический растворитель удаляют при пониженном давлении. Неочищенный продукт обрабатывают холодным (0°С) насыщенным бикарбонат натрия (30 мл) и этилацетатом (60 мл). Смесь перемешивают. Органическую фазу отделяют и сушат над сульфатом натрия. Органический растворитель удаляют при пониженном давлении. Неочищенный продукт (коричневое масло) далее очищают флэш-хроматографией на колонке (гексан:этилацетат = 1:5) с получением желаемого продукта (918 мг, M+H+= 391,5) в виде коричневого твердого вещества.
Стадия 6: Синтез N-(3-(2-(4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-иламино)фенил)акриламида ( I-11 )
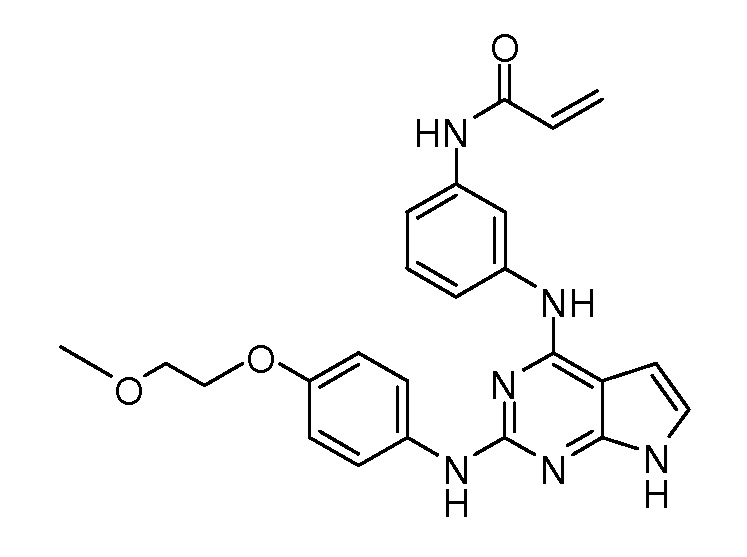
К раствору соединения 6 (918 мг, 2,35 ммоль) и ДИЭА (320 мг, 2,48 ммоль) в ТГФ (20 мл), охлажденному на ледяной бане (~-10°С), по каплям добавляют хлорид акрилоила (226 мг, 2,48 ммоль). Реакционную смесь перемешивают в течение 20 мин. В этот момент ТСХ (ДХМ/MeOH = 8/1 в качестве элюирования) показывает завершение реакции. Насыщенный раствор NaHCO3 (8 мл) добавляют для остановки реакции. ТГФ удаляют, и остаток повторно растворяют в этилацетате (50 мл) и воде (20 мл). Смесь перемешивают. Органическую фазу отделяют и сушат над сульфатом натрия. Органический растворитель удаляют при пониженном давлении. Неочищенный продукт (оранжевое масло) далее очищают флэш-хроматографией на колонке (100% этилацетат) с получением желаемого продукта I-11 (652 мг, M+H+= 445,5) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,15 (с, 3H), 10,07 (с, 3H), 9,18 (с, 3H), 8,51 (с, 3H), 8,13 (с, 3H), 7,77 (д, J=8,0 Гц, 3H), 7,73-7,66 (м, 6H), 7,33 (д, J=8,5 Гц, 3H), 7,27 (т, J=8,0 Гц, 3H), 6,88 (дд, J=3,4, 2,2 Гц, 3H), 6,85-6,79 (м, 6H), 6,67 (дд, J=3,5, 2,0 Гц, 3H), 6,48 (дд, J=17,0, 10,2 Гц, 3H), 6,29 (дд, J=17,0, 2,0 Гц, 3H), 5,77 (дд, J=10,1, 2,0 Гц, 3H), 4,04-4,01 (м, 7H), 3,67-3,63 (м, 6H), 3,32 (с, 9H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,08 (с), 157,81 (с), 155,89 (с), 154,61 (с), 154,48 (с), 142,86 (с), 140,98 (с), 137,20 (с), 134,07 (с), 130,62 (с), 128,71 (с), 121,86 (с, 2C), 120,80 (с), 118,30 (с), 116,24 (с, 2C), 115,39 (с), 114,09 (с), 101,24 (с), 100,12 (с), 72,59 (с), 69,08 (с), 60,19 (с).
Пример 12
Синтез N-(2-(5-фтор-2-((4-(4-(2-фторэтил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-12)
Схема синтеза соединения I-12 показана ниже:
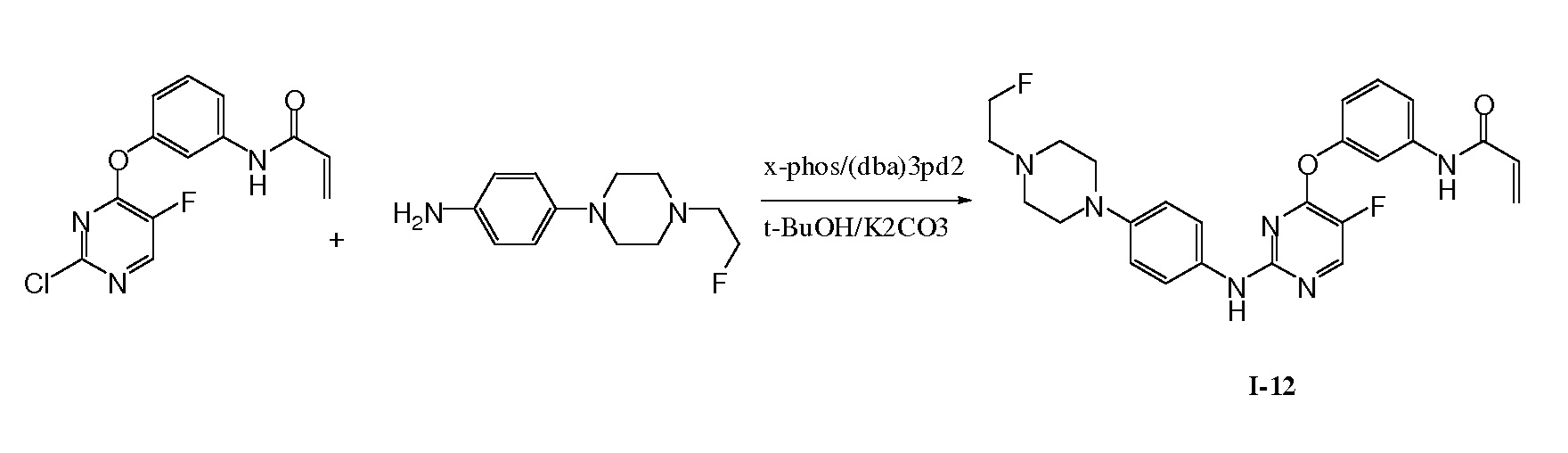
К раствору N-(3-(2-хлор-5-фторпиримидин-4-илокси)фенил)акриламида (1,3 г, 4,4 ммоль), 4-(4-(2-фторэтил)пиперазин-1-ил)анилина (1 г, 4,4 ммоль) в трет-BuOH (15 мл) последовательно добавляют карбонат калия (1,2 г, 8,8 ммоль), трис(дибензилиденацетон)дипалладий (400 мг) и дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (400 мг). Реакционную смесь нагревают до кипения с обратным холодильником и перемешивают под потоком N2 в течение 2 ч. В этот момент ТСХ (петролейный эфир:этилацетат = 1:1 в качестве элюирования) показывает завершение реакции. Смесь охлаждают до 40~50°С, фильтруют через Целит® и промывают трет-BuOH. Фильтрат концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (100 мл), промывают водой. Органический растворитель удаляют при пониженном давлении. Неочищенный продукт далее очищают флэш-хроматографией на колонке с получением желаемого продукта I-12 (1,2 г, 56,8% выход, M+H+= 481,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,36 (с, 1H), 9,33 (с, 1H), 8,43 (д, J=3,0 Гц, 1H), 7,68 (т, J=2,1 Гц, 1H), 7,63 (д, J=8,2 Гц, 1H), 7,45 (т, J=8,1 Гц, 1H), 7,27 (д, J=8,4 Гц, 2H), 7,02 (м, 1H), 6,66 (д, J=8,8 Гц, 2H), 6,45 (дд, J=17,0, 10,1 Гц, 1H), 6,28 (дд, J=17,0, 1,9 Гц, 1H), 5,79 (дд, J=10,1, 1,9 Гц, 1H), 4,66-4,58 (м, 1H), 4,56-4,49 (м, 1H), 3,04-2,93 (м, 4H), 2,69 (т, J=4,9 Гц, 1H), 2,63 (т, J=4,9 Гц, 1H), 2,60-2,54 (м, 4H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,37 (с), 158,94 (с), 158,86 (с), 157,34 (с), 157,31 (с), 154,09 (с), 148,11 (с), 142,33 (с), 134,28 (с), 133,65 (с), 131,99 (с), 129,34 (с), 121,74 (с), 118,76 (с), 118,63 (с), 117,59 (с), 114,94 (с), 83,90 (д, J=164,4 Гц), 59,55 (д, J=19,5 Гц), 54,96 (с, 2C), 50,96 (с, 2C).
Синтез промежуточных соединений (S-1 и R-1):
Промежуточное соединение S-1 : (S)-N-(1-(2-фторэтил)пирролидин-3-ил)бензол-1,4-диамин
Схема синтеза показана ниже:
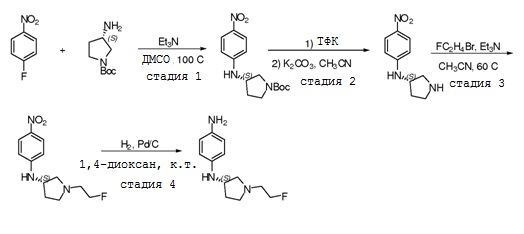
Стадия 1
В 3-горлую круглодонную колбу (250 мл), оборудованную конденсатором, загружают 4-фтор-1-нитробензол (7,3 г), (3S)-(-)-1-(трет-бутоксикарбонил)-3-аминопирролидин (11,2 г) и ТЭА (19 г) в диметилсульфоксиде (58 мл). Реакционную смесь нагревают при 100°C в течение ночи. После завершения реакции реакционную смесь выливают в воду. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над сульфатом натрия. Органический растворитель удаляют при пониженном давлении. Полученный неочищенный продукт (22,75 г) применяют непосредственно на следующей стадии реакции без дальнейшей очистки.
Стадия 2
К неочищенному продукту со стадии 1 (22,7 г) в 3-горлой круглодонной колбе (250 мл) добавляют ТФК (74 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении для удаления не прореагировавшего ТФА. Остаток повторно растворяют в MeOH и затем подщелачивают K2CO3 при температуре 0°С. Неочищенный продукт (29,95 г) получают после удаления непрореагировавшего K2CO3 и растворителя.
Стадия 3
К неочищенному продукту со стадии 2 (27 г) в MeCN (170 мл) добавляют ТЭА (35 мл) и 1,2-бромфторэтан (12 г). Реакционную смесь нагревают при 60°C в течение 25 часов. После завершения реакции, реакционную смесь выливают в воду. Смесь экстрагируют этилацетатом. Органический слой отделяют, промывают насыщенным раствором соли и сушат над сульфатом натрия. Органический растворитель удаляют при пониженном давлении. Полученный неочищенный продукт очищают флэш-хроматографией с получением желаемого продукта (11,3 г, 86% выход за 3 стадии) в виде желтого твердого вещества.
Стадия 4
Раствор полученного выше продукта со стадии 3 (2,183 г) и Pd/C (0,798 г) в 1,4-диоксане (43 мл) гидрируют в течение 22 часов при комнатной температуре. После завершения реакции реакционную смесь фильтруют через слой Целита. Слой Целита промывают 1,4-диоксаном. Фильтрат концентрируют с получением желаемого амина (2,022 г) в виде темного масла, которое применяют непосредственно на следующей стадии реакции без дальнейшей очистки.
(R)-N-(1-(2-фторэтил)пирролидин-3-ил)бензол-1,4-диамин (R-1)
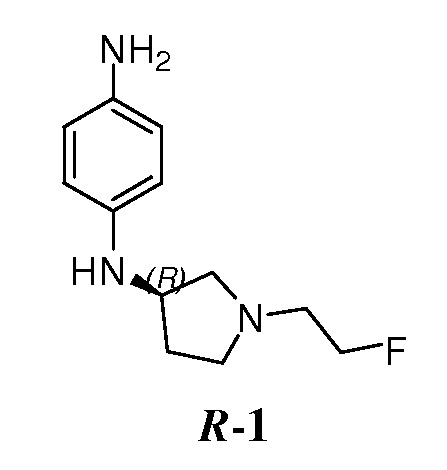
Указанное в заголовке соединение синтезируют с применением химии и методик, описанных выше, начиная с (3R)-(+)-1-(трет-бутоксикарбонил)-3-аминопирролидина.
Схема синтеза примеров XIII - XX показана ниже:
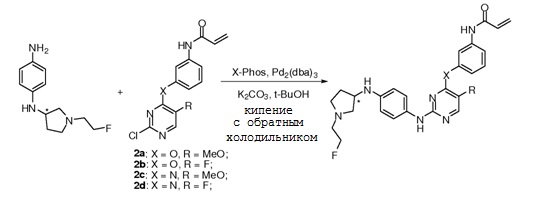
Пример 13
Синтез (S)-N-(3-(2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-13)
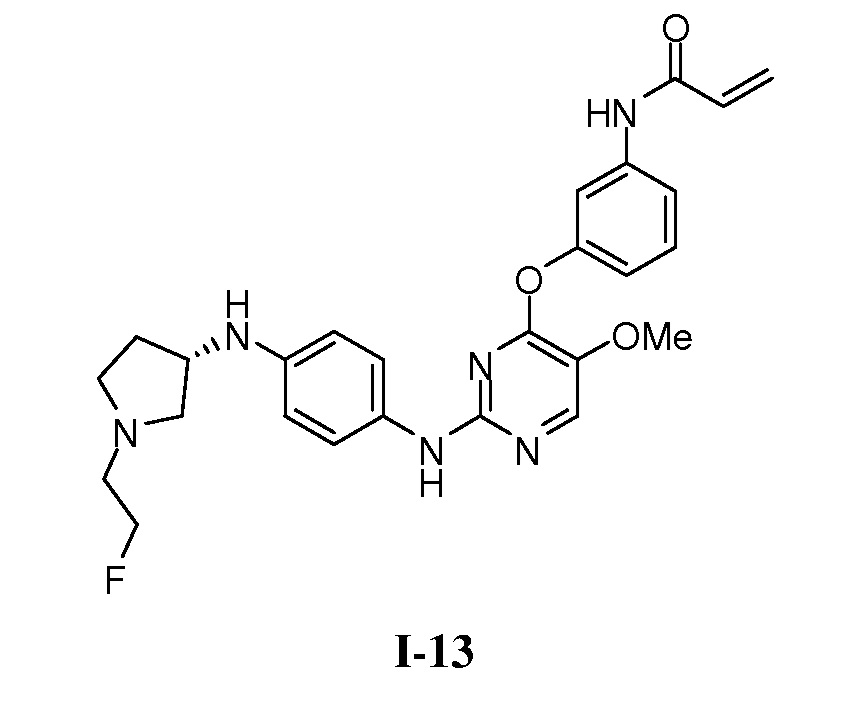
Смесь указанного выше соединения 2a (828 мг, 2,71 ммоль), S-1 (630 мг, 2,82 ммоль), трис(дибензилиденацетон)дипалладия (79 мг, 0,086 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (84 мг, 0,176 ммоль) и карбоната калия (758 мг, 5,48 ммоль) в трет-бутаноле (26 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 3,5 ч. После охлаждения до КТ реакционную смесь фильтруют через Целит. Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (ДХМ/MeOH = 50/1) с получением указанного в заголовке соединения (1,07 г, выход 81%, M+H+ = 493,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,32 (с, 1H), 8,80 (с, 1H), 8,13 (с, 1H), 7,65-7,53 (м, 2H), 7,41 (т, J=8,1 Гц, 1H), 7,13 (д, J=8,7 Гц, 2H), 6,94 (м, 1H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,35-6,20 (м, 3H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 5,23 (д, J=7,0 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,46 (т, J=5,0 Гц, 1H), 3,85 (с, 3H), 3,79-3,71 (м, 1H), 2,82 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,60 (м, 3H), 2,55-2,47 (м, 2H), 2,36 (дд, J=9,3, 4,6 Гц, 1H), 2,20-2,10 (м, 1H), 1,57-1,43 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,30 (с), 161,44 (с), 156,14 (с), 154,83 (с), 146,15 (с), 145,00 (с), 142,28 (с), 136,28 (с), 133,69 (с), 132,06 (с), 131,79 (с), 129,28 (с), 122,07 (с), 118,79 (с), 117,96 (с), 114,70 (с), 114,33 (с), 84,85 (д, J=164,4 Гц), 62,73 (с), 59,70 (с), 57,21 (д, J=19,5 Гц), 55,14 (с), 53,86 (с), 33,88 (с).
Пример 14
Синтез (R)-N-(3-(2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-14)
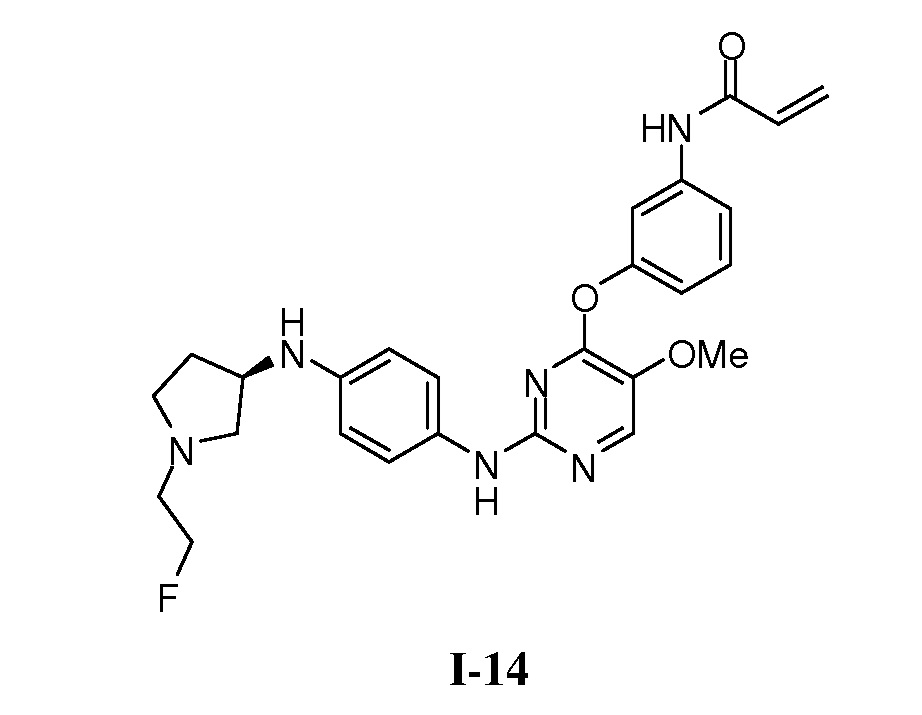
Смесь представленного выше 2a (1,5 г, 4,91 ммоль), R-1 (1,1 г, 4,91 ммоль), трис(дибензилиденацетон)дипалладия (400 мг, 0,437 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (400 мг, 5,87 ммоль) и карбоната калия (1,36 г, 9,84 ммоль) в трет-бутаноле (100 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 5 ч. После охлаждения до КТ реакционную смесь фильтруют через Целит. Целит промывают этилацетатом и объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (EA/PE = 10/1) с получением указанного в заголовке соединения (0,94 г, 40%, M+H+ = 493,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,32 (с, 1H), 8,80 (с, 1H), 8,13 (с, 1H), 7,65-7,53 (м, 2H), 7,41 (т, J=8,1 Гц, 1H), 7,13 (д, J=8,7 Гц, 2H), 6,94 (м, 1H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,35-6,20 (м, 3H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 5,23 (д, J=7,0 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,46 (т, J=5,0 Гц, 1H), 3,85 (с, 3H), 3,79-3,71 (м, 1H), 2,82 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,60 (м, 3H), 2,55-2,47 (м, 2H), 2,36 (дд, J=9,3, 4,6 Гц, 1H), 2,20-2,10 (м, 1H), 1,57-1,43 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,30 (с), 161,44 (с), 156,14 (с), 154,83 (с), 146,15 (с), 145,00 (с), 142,28 (с), 136,28 (с), 133,69 (с), 132,06 (с), 131,79 (с), 129,28 (с), 122,07 (с), 118,79 (с), 117,96 (с), 114,70 (с), 114,33 (с), 84,85 (д, J=164,4 Гц), 62,73 (с), 59,70 (с), 57,21 (д, J=19,5 Гц), 55,14 (с), 53,86 (с), 33,88 (с).
Пример 15
Синтез (S)-N-(3-(5-фтор-2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)пиримидин-4-иламино)фенил)акриламида (I-15)
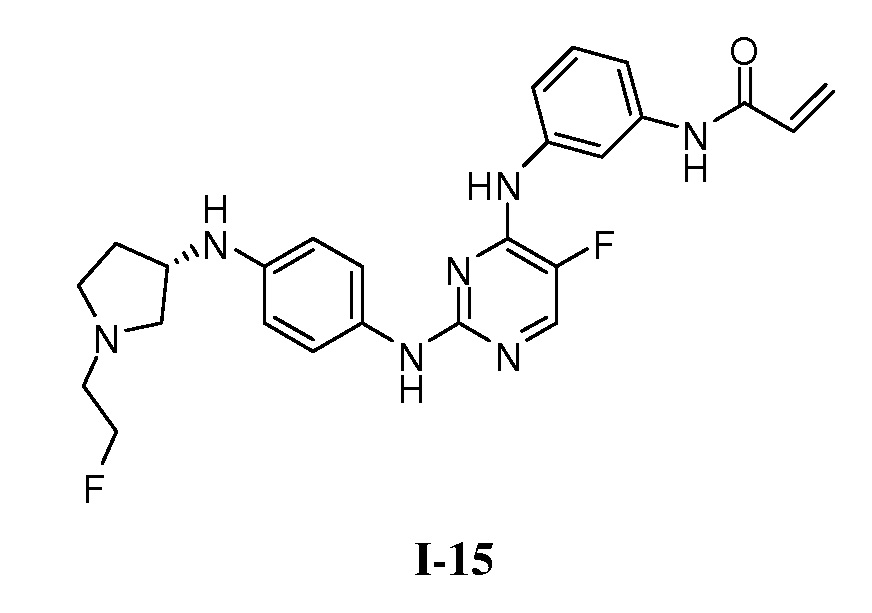
Смесь представленного выше соединения 2d (812 мг), S-1 (627 мг), трис(дибензилиденацетон)дипалладия (262 мг), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (271 мг) и карбоната калия (818 мг) в трет-бутаноле (20 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 3,5 ч. После охлаждения до КТ реакционную смесь фильтруют через Целит и Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (этилацетат/EtOH = 10/1) с получением указанного в заголовке соединения (100 мг, выход 7,4%, M+H+ = 480,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,12 (с, J=14,4 Гц, 1H), 9,30 (с, 1H), 8,67 (с, 1H), 8,02 (д, J=3,7 Гц, 1H), 7,94 (с, 1H), 7,55 (д, J=7,9 Гц, 1H), 7,42 (д, J=8,1 Гц, 1H), 7,31 (д, J=8,8 Гц, 2H), 7,24 (т, J=8,1 Гц, 1H), 6,53-6,39 (м, 3H), 6,28 (дд, J=17,0, 2,0 Гц, 1H), 5,84-5,69 (м, 1H), 5,30 (д, J=7,1 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,47 (т, J=5,0 Гц, 1H), 3,87-3,74 (м, 1H), 2,84 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,62 (м, 2H), 2,57-2,48 (м, 2H), 2,40 (дд, J=9,3, 4,5 Гц, 1H), 2,22-2,11 (м, 1H), 1,61-1,48 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 163,53 (с), 156,57 (с), 150,06 (д, J=10,5 Гц), 143,84 (с), 141,73-141,13 (м), 139,74 (с), 139,55 (с), 139,48 (с), 132,41 (с), 130,46 (с), 129,00 (с), 127,25 (с), 121,71 (с), 117,51 (с), 114,88 (с), 113,42 (с), 112,86 (с), 83,31 (д, J=164,4 Гц), 61,21 (с), 55,66 (д, J=19,5 Гц), 53,60 (с), 52,33 (с), 32,35 (с).
Пример 16
Синтез (S)-N-(3-(2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)-5-метоксипиримидин-4-иламино)фенил)акриламида (I-16)
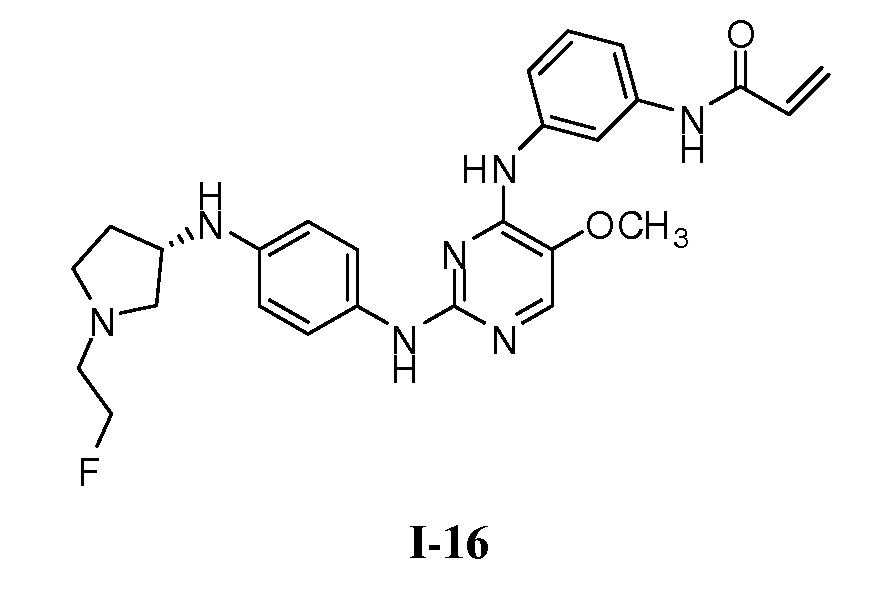
Смесь указанного выше соединения 2c (873 мг, 2,87 ммоль), S-1 (640 мг, 2,87 ммоль), трис(дибензилиденацетон)дипалладия (250 мг, 0,272 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (250 мг, 0,544 ммоль) и карбоната калия (795 мг, 5,84 ммоль) в трет-бутаноле (20 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 3,5 ч. После охлаждения до КТ реакционные смеси фильтруют через Целит и Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (ДХМ/MeOH = 50/1) с получением указанного в заголовке соединения (407 мг, выход 28,89%, M+H+ = 492,6). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,06 (с, 1H), 8,63 (с, 1H), 8,32 (с, 1H), 7,97 (с, 1H), 7,78 (с, J=5,0 Гц, 1H), 7,59 (д, J=8,1 Гц, 1H), 7,40 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,9 Гц, 2H), 7,23 (т, J=8,1 Гц, 1H), 6,53-6,38 (м, 3H), 6,27 (дд, J=17,0, 2,0 Гц, 1H), 5,76 (дд, J=10,1, 2,0 Гц, 1H), 5,21 (д, J=6,2 Гц, 1H), 4,57 (т, J=5,0 Гц, 1H), 4,47 (т, J=5,0 Гц, 1H), 3,83 (с, 3H), 3,81 (шс, 1H), 2,84 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,62 (м, 2H), 2,56-2,47 (м, 2H), 2,40 (дд, J=9,3, 4,6 Гц, 1H), 2,16 (квд, J=13,4, 7,9 Гц, 1H), 1,55 (дкв, J=7,7, 6,3 Гц, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,06 (с), 156,50 (с), 153,76 (с), 144,87 (с), 141,82 (с), 140,91 (с), 139,47 (с), 136,04 (с), 134,03 (с), 132,85 (с), 130,46 (с), 128,74 (с), 122,60 (с, 2C), 118,91 (с), 116,05 (с), 114,92 (с), 114,56 (с, 2C), 84,88 (д, J=164,4 Гц), 62,81 (с), 59,08 (с), 57,24 (д, J=19,5 Гц), 55,16 (с), 53,98 (с), 33,94 (с).
Пример 17
Синтез (R)-N-(3-(2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)-5-метоксипиримидин-4-иламино)фенил)акриламида (I-17)
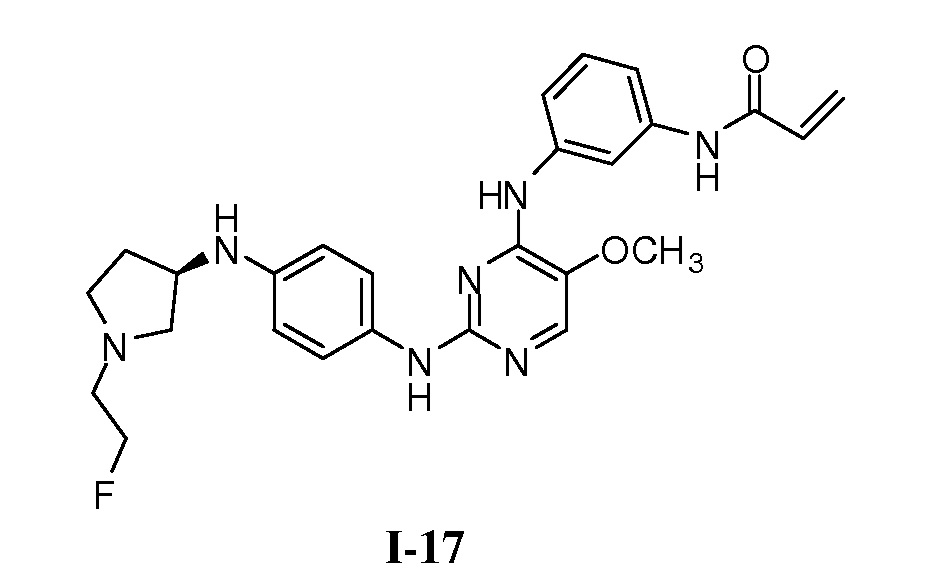
Смесь указанного выше соединения 2c (1412 мг), R-1 (1048 мг), трис(дибензилиденацетон)дипалладия (312 мг), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (324 мг) и карбоната калия (1246 мг) в трет-бутаноле (40 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 3,5 ч. После охлаждения до КТ, реакционную смесь фильтруют через Целит и Целит промывают ЭА. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (этилацетат/EtOH = 10/1) с получением указанного в заголовке соединения (800 мг, выход 34,6%, M+H+ = 492,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,06 (с, 1H), 8,63 (с, 1H), 8,32 (с, 1H), 7,97 (с, 1H), 7,78 (с, J=5,0 Гц, 1H), 7,59 (д, J=8,1 Гц, 1H), 7,40 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,9 Гц, 2H), 7,23 (т, J=8,1 Гц, 1H), 6,53-6,38 (м, 3H), 6,27 (дд, J=17,0, 2,0 Гц, 1H), 5,76 (дд, J=10,1, 2,0 Гц, 1H), 5,21 (д, J=6,2 Гц, 1H), 4,57 (т, J=5,0 Гц, 1H), 4,47 (т, J=5,0 Гц, 1H), 3,83 (с, 3H), 3,81 (шс, 1H), 2,84 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,62 (м, 2H), 2,56-2,47 (м, 2H), 2,40 (дд, J=9,3, 4,6 Гц, 1H), 2,16 (квд, J=13,4, 7,9 Гц, 1H), 1,55 (дкв, J=7,7, 6,3 Гц, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,06 (с), 156,50 (с), 153,76 (с), 144,87 (с), 141,82 (с), 140,91 (с), 139,47 (с), 136,04 (с), 134,03 (с), 132,85 (с), 130,46 (с), 128,74 (с), 122,60 (с, 2C), 118,91 (с), 116,05 (с), 114,92 (с), 114,56 (с, 2C), 84,88 (д, J=164,4 Гц), 62,81 (с), 59,08 (с), 57,24 (д, J=19,5 Гц), 55,16 (с), 53,98 (с), 33,94 (с).
Пример 18
Синтез (R)-N-(3-(5-фтор-2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-18)
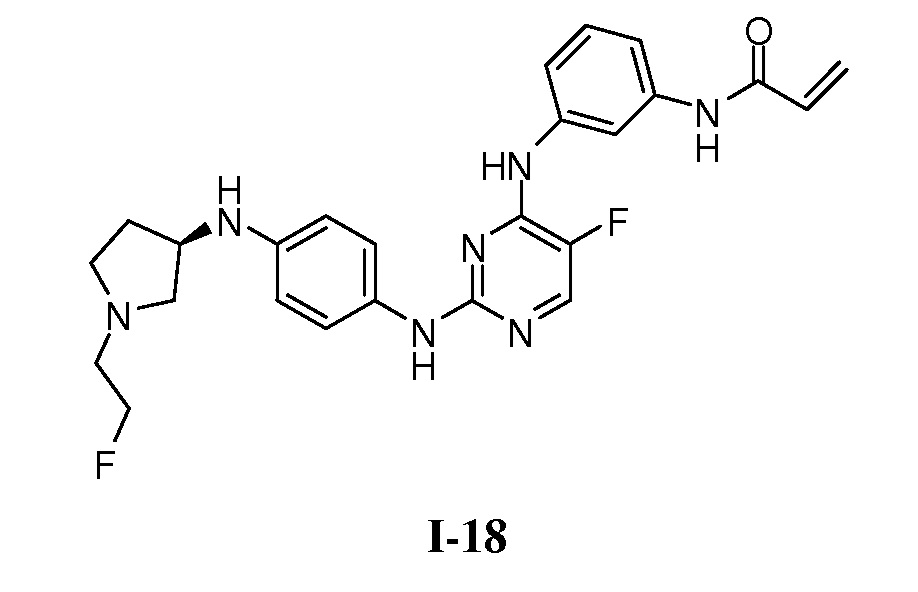
Смесь указанного выше соединения 2d (870 мг, 2,97 ммоль), R-1 (660 мг, 2,96 ммоль), трис(дибензилиденацетон)дипалладия (172 мг, 0,188 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (172 мг, 0,360 ммоль) и карбоната калия (800 мг, 5,79 ммоль) в трет-бутаноле (50 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 5 ч. После охлаждения до КТ, реакционную смесь фильтруют через Целит и Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (этилацетат/петролейный эфир = 10/1) с получением указанного в заголовке соединения (0,58 г, выход 41%, M+H+ = 480,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,12 (с, J=14,4 Гц, 1H), 9,30 (с, 1H), 8,67 (с, 1H), 8,02 (д, J=3,7 Гц, 1H), 7,94 (с, 1H), 7,55 (д, J=7,9 Гц, 1H), 7,42 (д, J=8,1 Гц, 1H), 7,31 (д, J=8,8 Гц, 2H), 7,24 (т, J=8,1 Гц, 1H), 6,53-6,39 (м, 3H), 6,28 (дд, J=17,0, 2,0 Гц, 1H), 5,84-5,69 (м, 1H), 5,30 (д, J=7,1 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,47 (т, J=5,0 Гц, 1H), 3,87-3,74 (м, 1H), 2,84 (дд, J=9,2, 6,9 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,62 (м, 2H), 2,57-2,48 (м, 2H), 2,40 (дд, J=9,3, 4,5 Гц, 1H), 2,22-2,11 (м, 1H), 1,61-1,48 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 163,53 (с), 156,57 (с), 150,06 (д, J=10,5 Гц), 143,84 (с), 141,73-141,13 (м), 139,74 (с), 139,55 (с), 139,48 (с), 132,41 (с), 130,46 (с), 129,00 (с), 127,25 (с), 121,71 (с), 117,51 (с), 114,88 (с), 113,42 (с), 112,86 (с), 83,31 (д, J=164,4 Гц), 61,21 (с), 55,66 (д, J=19,5 Гц), 53,60 (с), 52,33 (с), 32,35 (с).
Пример 19
Синтез (R)-N-(3-(5-фтор-2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-19)
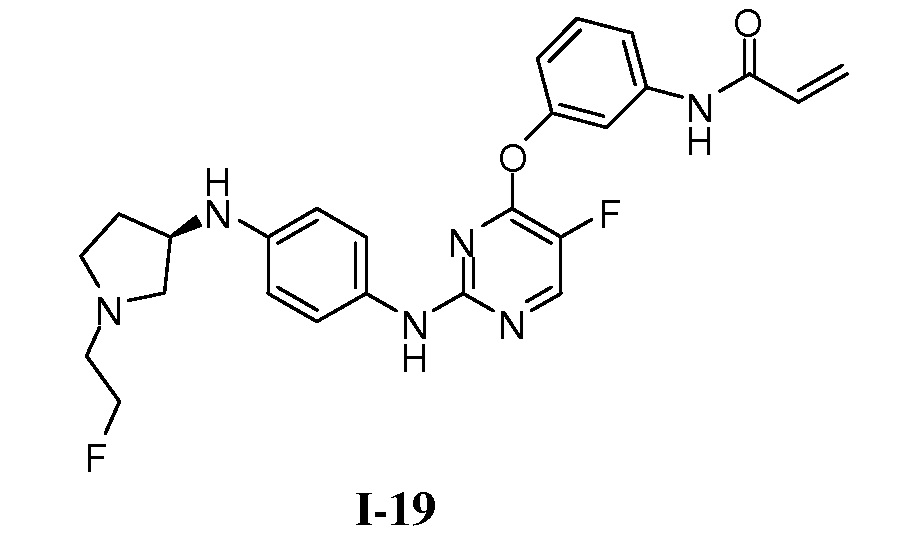
Смесь указанного выше соединения 2b (1408 мг), R-1 (1062 мг), трис(дибензилиденацетон)дипалладия (353 мг), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (359 мг) и карбоната калия (1260 мг) в трет-бутаноле (35 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 4,5 ч. После охлаждения до КТ, реакционную смесь фильтруют через Целит и Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (этилацетат/EtOH = 10/1) с получением указанного в заголовке соединения (987 мг, выход 42,9%, M+H+ = 481,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,35 (с, 1H), 9,13 (с, 1H), 8,38 (д, J=3,0 Гц, 1H), 7,67 (т, J=1,9 Гц, 1H), 7,61 (д, J=8,2 Гц, 1H), 7,43 (т, J=8,2 Гц, 1H), 7,12 (д, J=7,8 Гц, 2H), 7,02 (м, 1H), 6,45 (дд, J=17,0, 10,1 Гц, 1H), 6,35-6,24 (м, 3H), 5,79 (дд, J=10,1, 1,9 Гц, 1H), 5,32 (д, J=6,8 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,46 (т, J=5,0 Гц, 1H), 3,83-3,69 (м, 1H), 2,82 (дд, J=9,1, 7,0 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,60 (м, 2H), 2,55-2,47 (м, 2H), 2,37 (дд, J=9,2, 4,5 Гц, 1H), 2,19-2,10 (м, 1H), 1,59-1,45 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,35 (с), 158,84 (д, J=11,0 Гц), 157,58 (д, J=2,8 Гц), 154,14 (с), 147,88 (д, J=21,9 Гц), 145,58 (с), 142,35 (с), 140,31 (с), 133,66 (с), 131,90 (с), 131,24 (с), 129,34 (с), 122,68 (с), 118,78 (с), 118,43 (с), 114,69 (с), 114,23 (с), 84,84 (д, J=164,5 Гц), 62,69 (с), 57,19 (д, J=19,5 Гц), 55,13 (с), 53,80 (с), 33,85 (с).
Пример 20
Синтез (S)-N-(3-(5-фтор-2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-20)
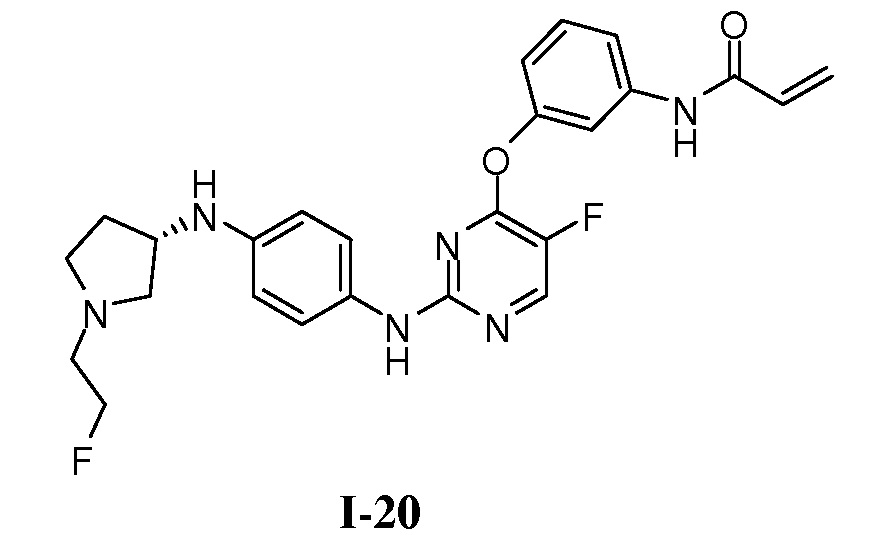
Смесь указанного выше соединения 2b (791 мг), S-1 (607 мг), трис(дибензилиденацетон)дипалладия (193 мг), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфина (200 мг) и карбоната калия (758 мг) в трет-бутаноле (30 мл) перемешивают под аргоном при температуре кипения с обратным холодильником в течение 7 ч. После охлаждения до КТ, реакционную смесь фильтруют через Целит и Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке (этилацетат/EtOH = 10/1) с получением указанного в заголовке соединения (441 мг, выход 34,1%, M+H+ = 481,5). 1H ЯМР (500 МГц, ДМСО-d6) δ 10,35 (с, 1H), 9,13 (с, 1H), 8,38 (д, J=3,0 Гц, 1H), 7,67 (т, J=1,9 Гц, 1H), 7,61 (д, J=8,2 Гц, 1H), 7,43 (т, J=8,2 Гц, 1H), 7,12 (д, J=7,8 Гц, 2H), 7,02 (м, 1H), 6,45 (дд, J=17,0, 10,1 Гц, 1H), 6,35-6,24 (м, 3H), 5,79 (дд, J=10,1, 1,9 Гц, 1H), 5,32 (д, J=6,8 Гц, 1H), 4,56 (т, J=5,0 Гц, 1H), 4,46 (т, J=5,0 Гц, 1H), 3,83-3,69 (м, 1H), 2,82 (дд, J=9,1, 7,0 Гц, 1H), 2,77-2,71 (м, 1H), 2,71-2,60 (м, 2H), 2,55-2,47 (м, 2H), 2,37 (дд, J=9,2, 4,5 Гц, 1H), 2,19-2,10 (м, 1H), 1,59-1,45 (м, 1H). 13C ЯМР (126 МГц, ДМСО-d6) δ 165,35 (с), 158,84 (д, J=11,0 Гц), 157,58 (д, J=2,8 Гц), 154,14 (с), 147,88 (д, J=21,9 Гц), 145,58 (с), 142,35 (с), 140,31 (с), 133,66 (с), 131,90 (с), 131,24 (с), 129,34 (с), 122,68 (с), 118,78 (с), 118,43 (с), 114,69 (с), 114,23 (с), 84,84 (д, J=164,5 Гц), 62,69 (с), 57,19 (д, J=19,5 Гц), 55,13 (с), 53,80 (с), 33,85 (с).
Пример 21
Синтез биотин-замещенного соединения (I-42)
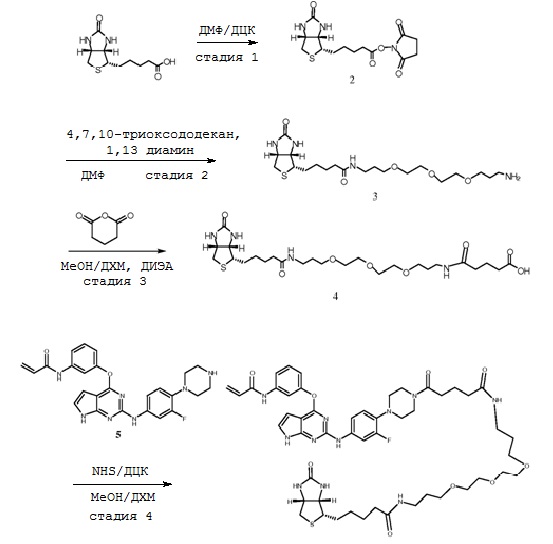
I-42
Стадия 1:
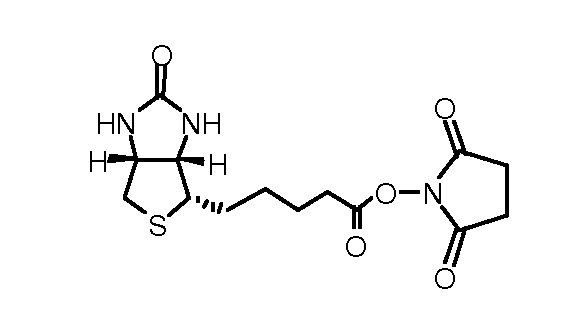
В круголодонную колбу с мешалкой добавляют биотин (2,0 г, 8,2 ммоль) и ДМФ (60 мл). Затем твердое вещество растворяют при нагревании, добавляют N-гидроксисукцинимид (0,944 г, 8,2 ммоль) и ДЦК (2,2 г, 10,7 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Белое твердое вещество фильтруют и ДМФ выпаривают при пониженном давлении. Полученный остаток далее очищают перекристаллизацией из изопропанола с получением желаемого продукта 2 (2,7 г, M+H+ = 342,5) в виде белых кристаллов.
Стадия 2:
К раствору 4,7,10-триоксододекан 1,13-диамина (6,7 г, 30,4 ммоль) в безводном ДМФ(100 мл) добавляют по каплям раствор соединения 2 (2,0 г, 5,86 ммоль) в сухом ДМФ (50 мл) в течение 30 мин под N2. Полученную густую белую суспензию перемешивают в течение 30 мин. Осадок фильтруют и промывают ДМФ. Объединенный фильтрат концентрируют и добавляют диэтиловый эфир. Осадок (липкое твердое вещество) собирают и очищают флэш-хроматографией (ДХМ/MeOH = 5/1) с получением желаемого соединения 3 (2,44 г, выход 93%, M+H+ = 448,5).
Стадия 3:
К раствору соединения 3 (2,44 г, 5,44 ммоль) в сухом метаноле/ДХМ (1:1, 60 мл) добавляют глутаровый ангидрид (0,61 г, 5,35 ммоль) и безводный диизопропилэтиламин (2,5 г, 19 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч и затем растворитель удаляют при пониженном давлении. Полученный остаток очищают флэш-хроматографией на колонке (ДХМ/MeOH = 5/1) с получением желаемого соединения 4 (1,3 г, выход 43%, M+H+ = 561,5).
Стадия 4:
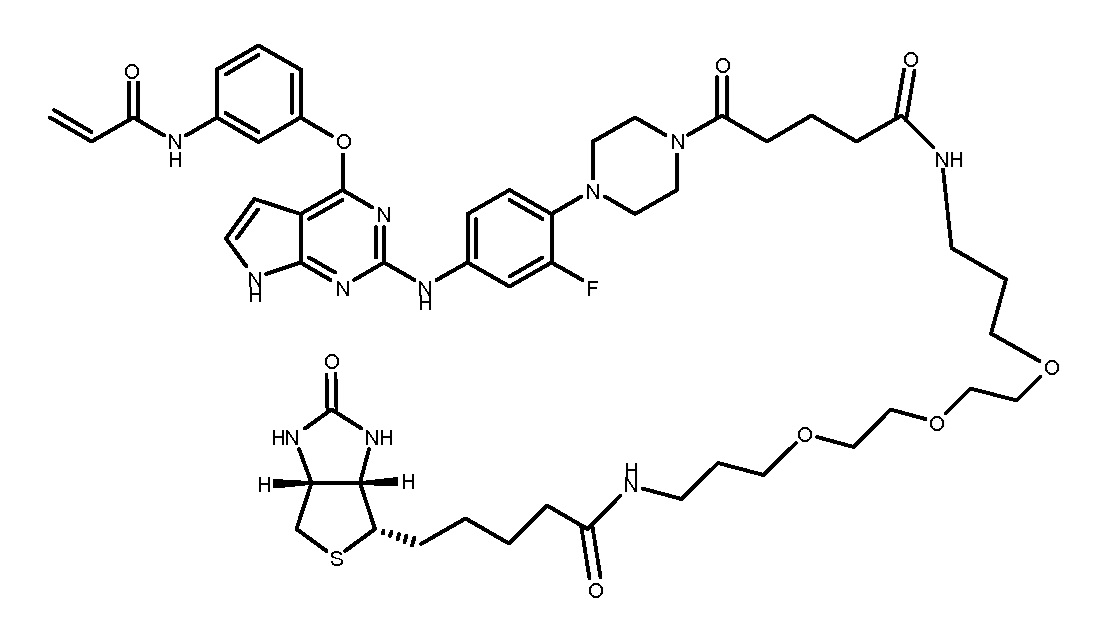
К раствору соединения 4 (290 мг, 0,516 ммоль) в сухом метаноле/ДХМ (3:5, 16 мл) добавляют N-гидроксисукцинимид (89 мг, 0,775 ммоль) и ДЦК (160 мг, 0,775 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч и затем добавляют раствор 5 (синтезированный разделенный) в сухом метаноле/ДХМ (1:1, 6 мл). Реакционную смесь перемешивают в течение ночи и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией на колонке (ДХМ/MeOH = от 50/1 до 15/1) с получением желаемого продукта I-42 (174 мг, выход 44%, M+H+ = 1017,6).
Пример 22
Синтез N-(3-(2-(3-фтор-4-(4-метилпиперазин-1-ил)фениламино)-5-гидроксипиримидин-4-илокси)фенил)акриламида (I-23a)
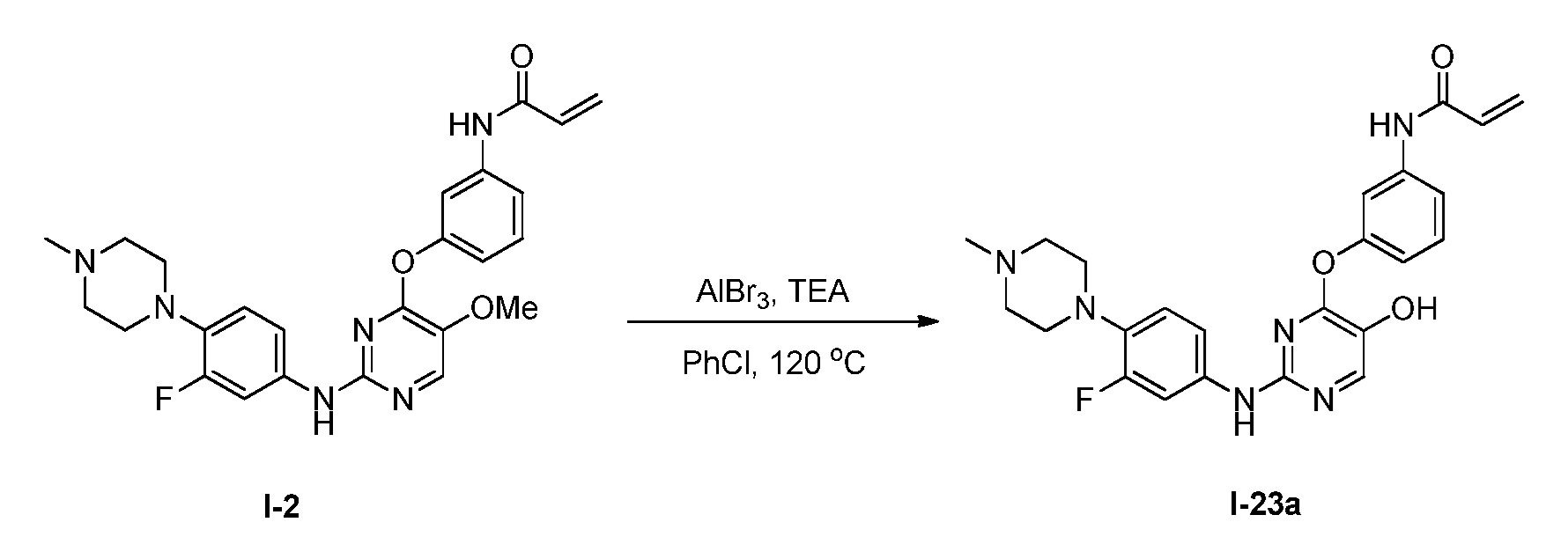
К раствору AlBr3 (2,733 г) в хлорбензоле (20 мл) добавляют по каплям ТЭА (0,434 г, 4,8 ммоль). Затем добавляют соединение I-2 (0,518 г). Реакционную смесь перемешивают при 120°С в течение 4,5 ч. Затем добавляют MeOH (10 мл) для остановки реакции. Добавляют воду и смесь экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (ДХМ/MeOH = 15/1 в качестве подвижной фазы) с получением желаемого продукта I-23a (0,07 г, 13,88%, M+H+=465,5).
Пример 23
Синтез N-(3-(2-(3-фтор-4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-24a)
Синтез 2-фтор-1-(2-метоксиэтокси)-4-нитробензола (1)
Смесь 2-фтор-4-нитрофенола (7,940 г, 50,57 ммоль), 1-бром-2-метоксиэтана (7,656 г, 55,09 ммоль), K2CO3 (13,880 г, 100,57 ммоль) в ДМФ (50 мл) перемешивают при 70-75°С в течение 3 ч до тех пор, пока ТСХ (ДХМ/MeOH = 50/1 в качестве подвижной фазы) не покажет завершение реакции. Смесь охлаждают до комнатной температуры и затем выливают в ледяную воду (180 мл). Желтый осадок собирают, промывают водой (100 мл) и сушат в вакууме в течение 5 часов с получением 2-фтор-1-(2-метоксиэтокси)-4-нитробензола 1 (10,33 г, 95,81%).
Синтез 3-фтор-4-(2-метоксиэтокси)анилина (2)
Смесь соединения 1 (5,15 г, 23,93 ммоль) и PtO2 (0,143 г, 0,63 ммоль) в EtOH (100 мл) перемешивают при комнатной температуре с водородным баллоном в течение ночи. После завершения реакции, реакционную смесь фильтруют через Целит®. Слой Целита промывают EtOH. Объединенный фильтрат концентрируют при пониженном давлении с получением соединения 2 (4 г, 91%, M+H+=186,5) без дальнейшей очистки.
Синтез пивалата (2-(3-фтор-4-(2-метоксиэтокси)фениламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (4)
Соединение 2 (4,432 г, 23,95 ммоль), соединение 3 (9,752 г, 24 ммоль), K2CO3 (6,659 г, 48,25 ммоль), трис(дибензилиденацетон)дипалладий (1,027 г, 1,12 моль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (1,121 г, 2,36 ммоль) и трет-BuOH (50 мл) последовательно добавляют в круглодонную колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. После взаимодействия в течение 3~4 ч ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (этилацетат:петролейный эфир = от 50% до 100% в качестве подвижной фазы) с получением соединения 4 (9,61 г, 72,39%, M+H+ = 554,5) в виде желтоватого твердого вещества.
Синтез N-(3-фтор-4-(2-метоксиэтокси)фенил)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-амина (5)
В круглодонную колбу (250 мл) загружают соединение 4 (9,608 г, 17,36 ммоль) и MeOH (60 мл). После полного растворения соединения 4 раствор охлаждают до ~10°С на ледяной бане. Водный раствор NaOH (2,5 M, 20 мл) медленно добавляют в колбу при сохранении температуры около 16°C во время добавления. Смесь продолжают перемешивать в течение еще 2 ч при этой температуре. Воду (150 мл) медленно добавляют в колбу в течение более 45 мин при сохранении температуры ниже 20°C во время добавления воды. Осадок собирают, промывают водой (50 мл) и сушат в вакууме с получением желаемого продукта 5 (4,232 г, 55%, M+H+ = 440,6), который применяют на следующей стадии без дальнейшей очистки.
Синтез 4-(3-аминофенокси)-N-(3-фтор-4-(2-метоксиэтокси)фенил)-7H-пирроло[2,3-d]пиримидин-2-амина (6)
Смесь соединения 5 (4,232 г, 9,6 ммоль) и PtO2 (0,101 г, 0,45 ммоль) в ТГФ (40 мл) перемешивают при комнатной температуре с водородным баллоном в течение ночи. После завершения реакции, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением желаемого продукта 6 (3,35 г, 85%, M+H+ = 410,5) в виде белого твердого вещества.
Синтез N-(3-(2-(3-фтор-4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-24a)
К раствору соединения 6 (2,05 г, 4 ммоль) и ДИЭА (1,341 г, 10,4 ммоль) в ТГФ (50 мл) при 0°C по каплям добавляют хлорид акрилоила (0,434 г, 4,8 ммоль) в течение более 6 мин. Реакционную смесь перемешивают в течение 1 ч при 0°C. В этот момент ТСХ показывает завершение реакции. Водный раствор NaOH (1 M, 4 мл) и воду (20 мл) добавляют для гашения реакции. Полученную смесь продолжают перемешивать в течение еще 10 мин. Верхнюю ТГФ фазу отделяют, и растворитель удаляют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат:петролейный эфир от 50% до 100% в качестве подвижной фазы) с получением соединения I-24a (1,420 г, 76,67%, M+H+ = 464,6) в виде белого твердого вещества.
Пример 24
Синтез N-(3-(5-метокси-2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-25a)
Синтез 1-(4-нитрофенил)пиперазина (1)
Смесь 4-нитрофторбензола (70,7 г), пиперазина (49,8 г) и ацетонитрила (400 мл) перемешивают при кипении с обратным холодильником в течение ночи. Реакцию отслеживают ТСХ. После завершения реакции реакционную смесь охлаждают до комнатной температуры, подщелачивают насыщенным раствором K2CO3 (500 мл) и затем экстрагируют этилацетатом. Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над Na2SO4 и концентрируют при пониженном давлении с получением 1-(4-нитрофенил)пиперазина 2 (88,4 г, 85,1%, M+H+= 208,5) в виде желтого твердого вещества.
Синтез 1-(2-метоксиэтил)-4-(4-нитрофенил)пиперазина (2)
К раствору 1-бром-2-метоксиэтана (60,5 г) и соединения 1 (78,5 г) в ДМФ (400 мл) при комнатной температуре добавляют Et3N (65,6 г). Смесь затем нагревают до 80°C и перемешивают в течение 4,5 ч. В этот момент ТСХ показывает завершение реакции. Реакционную смесь выливают в ледяную воду (1 л). Желтый осадок собирают и растворяют с этилацетатом. Раствор промывают водой, насыщенным раствором соли и сушат над Na2SO4. Органический растворитель удаляют при пониженном давлении. Неочищенный остаток повторно растворяют этилацетатом (300 мл) и затем добавляют петролейный эфир (250 мл). Полученный осадок убирают (нежелательный продукт). Фильтрат концентрируют при пониженном давлении с получением желаемого продукта 2 (65,4 г, 65,1%, M+H+= 266,6) в виде желтого твердого вещества.
Синтез 4-(4-(2-метоксиэтил)пиперазин-1-ил)анилина (3)
Раствор соединения 2 (63,4 г) и Pd/C (4,634 г, 10% активированный на угле) в ТГФ (500 мл) перемешивают при комнатной температуре с водородным баллоном в течение ночи. После завершения реакции реакционную смесь фильтруют через Целит®. Целит промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенного продукта 3 (54,0 г, 96,0%, M+H+= 236,6) без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-25a)
Соединение 3 (0,835 г), соединение 4 (1,1 г), K2CO3 (0,964 г), трис(дибензилиденацетон)дипалладий (0,164 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,157 г) и трет-BuOH (20 мл) последовательно добавляют в круглодонную колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. После взаимодействия в течение 3~4 ч, ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении. Неочищенный продукт далее очищают хроматографией на колонке (EtOAc:EtOH = 20:1 в качестве подвижной фазы) с получением соединения I-25a (0,923 г, 98,37%, M+H+= 505,6) в виде белого твердого вещества.
Пример 25
Синтез (S)-N-(3-(2-(4-((1-(2-фторэтил)пирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-26a)

Синтез (S)-1-(2-фторэтил)-N-метил-N-(4-нитрофенил)пирролидин-3-амина (2)
К раствору соединения 1 (см. предыдущий раздел для промежуточного соединения S-1, 2,572 г) в ДМФ (28 мл) при 0°C последовательно добавляют NaH (0,35 г, 80% дисперсия в минеральном масле) и CH3I (1,65 г). Полученную смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. В этот момент ТСХ показывает завершение реакции. Реакционную смесь затем гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой и сушат над Na2SO4. Органический растворитель удаляют при пониженном давлении с получением неочищенного продукта 2 (2,501 г, 91,1%, M+H+= 268,5), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N1-(1-(2-фторэтил)пирролидин-3-ил)-N1-метилбензол-1,4-диамина (3)
Смесь соединения 2 (2,501 г) и Pd/C (0,495 г, 10% активированный на угле) в MeOH (39 мл) перемешивают при комнатной температуре с водородным баллоном в течение 4,5 ч. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают MeOH. Объединенный фильтрат концентрируют при пониженном давлении с получением темного масла. Масляный остаток повторно растворяют в этилацетате. Полученную смесь промывают водой и сушат над Na2SO4. Органический растворитель удаляют при пониженном давлении с получением неочищенного продукта 3 (1,4 г, 63,1%, M+H+= 238,5), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-((1-(2-фторэтил)пирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-26a)
Соединение 3 (1,401 г), соединение 4 (1,985 г), K2CO3 (1,460 г), трис(дибензилиденацетон)дипалладий (0,65 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,65 г) и трет-BuOH (32 мл) последовательно добавляют в круглодонную колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2 в течение 3-4 ч. В этот момент ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенного продукта, который далее очищают хроматографией на колонке с получением соединения I-26a (415 мг, 13,16%, M+H+= 516,6).
Пример 26
Синтез (S)-N-(3-(2-(4-(1-(2-фторэтил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-27a)
Соединение 1 (см. предыдущий раздел для промежуточного соединения S-1, 1,010 г), соединение 2 (1,415 г), K2CO3 (1,30 г), трис(дибензилиденацетон)дипалладий (0,602 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,601 г) и трет-BuOH (28 мл) последовательно добавляют в круглодонную колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2 в течение 3~4 ч. В этот момент ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенного продукта, который далее очищают хроматографией на колонке с получением соединения I-27a (400 мг, 17,81%, M+H+= 502,6) в виде серого твердого вещества.
Пример 27
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)индолин-4-иламино)пиримидин-4-илокси)фенил)акриламида (I-28a)
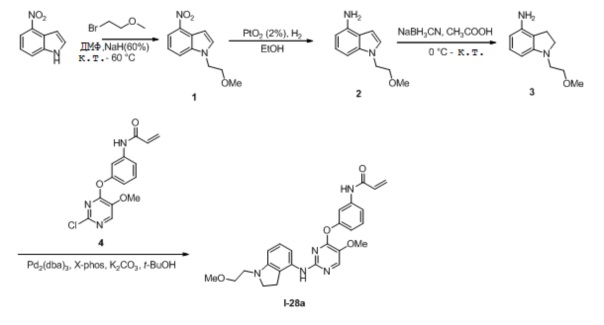
Синтез 1-(2-метоксиэтил)-4-нитро-1H-индола (1)
К раствору 4-нитро-1H-индола (5,1 г, 30,77 ммоль), 1-бром-2-метоксиэтана (5,134 г, 37 ммоль) в ДМФ (30 мл), порциями добавляют NaH (1,610 г, 80% дисперсия в минеральном масле, 40 ммоль) при комнатной температуре. Смесь перемешивают при 60°C в течение 3 ч до тех пор, пока ТСХ (петролейный эфир:этилацетат = 6:1 в качестве подвижной фазы) не покажет завершение реакции. Смесь охлаждают до комнатной температуры и затем выливают в воду (60 мл) и экстрагируют этилацетатом (50 мл × 4). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат и концентрируют. Остаток очищают хроматографией на колонке (этилацетат/петролейный эфир от 1/10 до 1/3 в качестве подвижной фазы) с получением соединения 1 (4,778 г, 21,5 ммоль, 69%) в виде желтого твердого вещества.
Синтез 1-(2-метоксиэтил)-1H-индол-4-амина (2)
Смесь 1-(2-метоксиэтил)-4-нитро-1H-индола 1 (4,778 г, 21 ммоль) и PtO2 (0,091 г, 0,40 ммоль) в EtOH (40 мл) перемешивают при комнатной температуре с водородным баллоном в течение ночи. ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают EtOH. Объединенный фильтрат концентрируют при пониженном давлении с получением соединения 2 (3,67 г, 91%, M+H+=191,2), которое применяют на следующей стадии реакции без дальнейшей очистки.
Синтез 1-(2-метоксиэтил)индолин-4-амина (3)
К раствору 1-(2-метоксиэтил)-1H-индол-4-амина 2 (1,590 г, 7,16 ммоль) в CH3COOH (10 мл) при 0°C добавляют NaBH3CN (1,286 г, 20,74 ммоль) порциями. Смесь перемешивают в течение 3 ч до тех пор, пока ТСХ (петролейный эфир/этилацетат = 1/2 в качестве подвижной фазы) не покажет завершение реакции. Затем растворитель удаляют, остаток подщелачивают насыщенным NaHCO3 (50 мл) и затем экстрагируют этилацетатом (30 мл × 4). Органические слои объединяют, сушат над Na2SO4 и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (этилацетат/петролейный эфир от 1/3 до 3/1 в качестве подвижной фазы) с получением соединения 3 (0,96 г, 4,37 ммоль, 61%, M+H+=193,5) в виде желтого твердого вещества.
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)индолин-4-иламино)пиримидин-4-илокси)фенил)акриламида (I-28a)
Соединение 3 (0,430 г, 2,24 ммоль), соединение 4 (0,936 г, 3,063 ммоль), K2CO3 (0,660 г, 4,783 ммоль), трис(дибензилиденацетон)дипалладий (0,270 г, 0,295 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,243 мг, 0,512 ммоль) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5~7 ч ТСХ (этилацетат:петролейный эфир:ТЭА = 1:1:0,1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (этилацетат:петролейный эфир от 50% до 100% в качестве подвижной фазы) с получением соединения I-28a (773 мг, 79,89%, M+H+ = 462,5) в виде белого твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ 7,98 (с, 1H), 7,92 (с, 1H), 7,54 (с, 1H), 7,48 (д, J=7,9 Гц, 1H), 7,36 (т, J=8,1 Гц, 1H), 7,04 (т, J=14,6 Гц, 1H), 6,97 (д, J=7,8 Гц, 1H), 6,84 (т, J=8,0 Гц, 1H), 6,57 (с, 1H), 6,42 (д, J=16,8 Гц, 1H), 6,23 (дд, J=16,8, 10,2 Гц, 1H), 6,16 (д, J=7,8 Гц, 1H), 5,74 (д, J=10,8 Гц, 1H), 3,94 (с, 3H), 3,60 (т, J=5,7 Гц, 2H), 3,42 (с, 3H), 3,36 (т, J=8,3 Гц, 2H), 3,23 (т, J=5,7 Гц, 2H), 2,74 (т, J=8,3 Гц, 2H).
Пример 28
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)индолин-4-иламино)пиримидин-4-иламино)фенил)акриламида (I-29a)
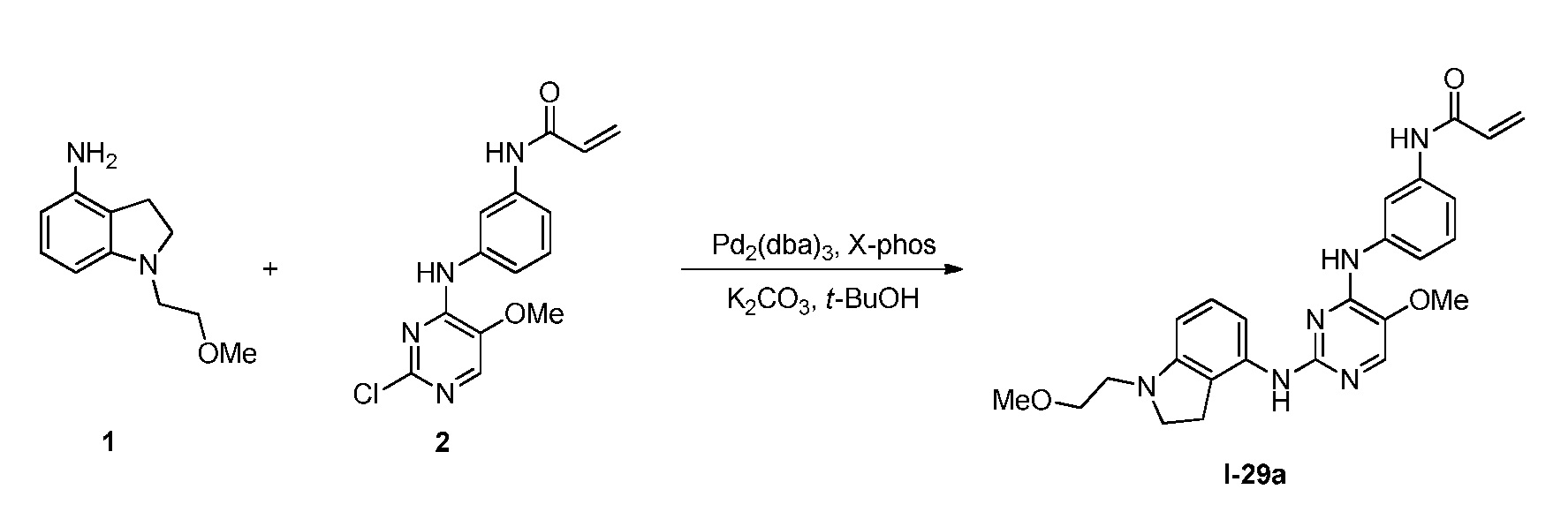
Соединение 1 (0,403 г, 2,099 ммоль), соединение 2 (0,880 г, 2,890 ммоль), K2CO3 (0,643 г, 4,659 ммоль), трис(дибензилиденацетон)дипалладий (0,233 г, 0,255 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,243 мг, 0,512 ммоль) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5~7 ч ТСХ (этилацетат:петролейный эфир:ТЭА = 1:1:0,1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (этилацетат:петролейный эфир от 50% до 100% в качестве подвижной фазы) с получением соединения I-29a (646 мг, 62,7%, M+H+ = 461,5) в виде белого твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ 8,24 (с, 1H), 7,68 (с, 1H), 7,58 (с, 1H), 7,57 (д, J=7,0 Гц, H), 7,26 (дт, J=10,6, 4,1 Гц, 3H), 7,13 (д, J=6,8 Гц, 1H), 7,08 (т, J=7,9 Гц, 1H), 6,68 (с, 1H), 6,45 (д, J=16,9 Гц, 1H), 6,32-6,19 (м, 2H), 5,78 (д, J=10,3 Гц, 1H), 3,89 (с, 3H), 3,62 (т, J=5,8 Гц, 2H), 3,45 (т, J=8,3 Гц, 2H), 3,41 (с, 3H), 3,30 (т, J=5,7 Гц, 2H), 2,95 (т, J=8,3 Гц, 2H).
Пример 29
Синтез (S)-N-(3-(5-метокси-2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-30a)
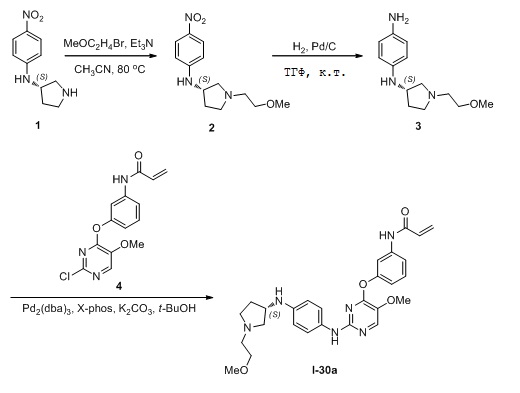
Синтез (S)-1-(2-метоксиэтил)-N-(4-нитрофенил)пирролидин-3-амина (2)
К соединению 1 (10 г) в MeCN (70 мл) добавляют Et3N (6,5 г) и 2-бромэтилметиловый эфир (6,5 г). Реакционную смесь перемешивают при 80°C в течение 28 ч. После завершения реакции органический растворитель удаляют при пониженном давлении. Остаток повторно растворяют в этилацетате и добавляют небольшое количество насыщенного водного раствора K2CO3. После перемешивания в течение нескольких минут органический слой отделяют, промывают насыщенным раствором соли и сушат над Na2SO4. Раствор концентрируют при пониженном давлении. Полученный неочищенный продукт очищают флэш-хроматографией с получением желаемого продукта 2 (6,213 г, 48%, M+H+ = 266,5) в виде желтого твердого вещества.
Синтез (S)-N1-(1-(2-метоксиэтил)пирролидин-3-ил)бензол-1,4-диамина (3)
Раствор соединения 2 (6,213 г) и Pd/C (0,584 г, 10% активированный на угле) в ТГФ (50 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают MeOH. Объединенные слои концентрируют при пониженном давлении с получением желаемого продукта 3 (4,8 г, 87,3%, M+H+= 236,5) без дальнейшей очистки.
Синтез (S)-N-(3-(5-метокси-2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-30a)
Соединение 3 (0,786 г), соединение 4 (1,083 г), K2CO3 (1,154 г), трис(дибензилиденацетон)дипалладий (0,117 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,120 г) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 6 ч ТСХ (ДХМ:MeOH = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (этилацетат:MeOH = 9:1 в качестве подвижной фазы) с получением соединения I-30a (1,2 г, 72,56%, M+H+ = 505,6).
Пример 30
Синтез (S)-N-(3-(5-метокси-2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)пиримидин-4-иламино)фенил)акриламида (I-31a)
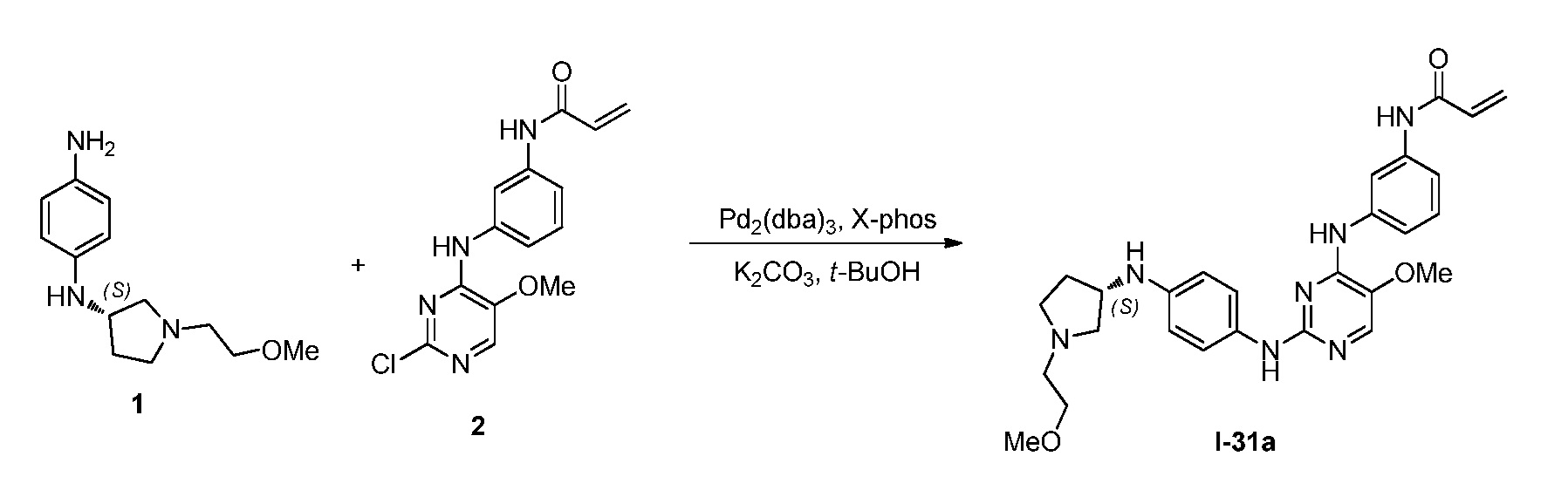
Соединение 1 (0,789 г), соединение 2 (1,041 г), K2CO3 (0,686 г), трис(дибензилиденацетон)дипалладий (0,148 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,156 г) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 18 ч ТСХ (ДХМ:MeOH = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат:MeOH = 10:1 в качестве подвижной фазы) с получением соединения I-31a (0,2 г, 12%, M+H+ = 504,6).
Пример 31
Синтез N-(3-(5-метокси-2-(4-(2-метоксиэтиламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-32a)
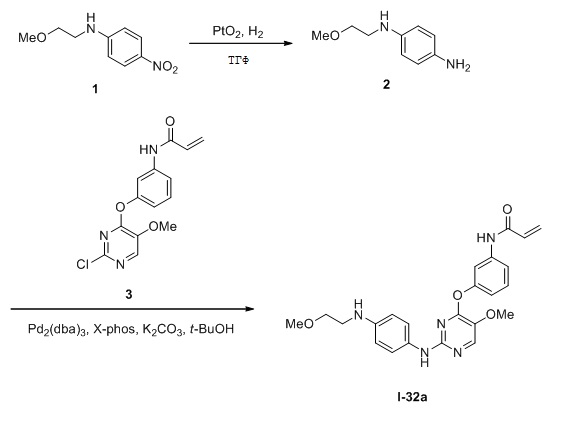
Синтез N1-(2-метоксиэтил)бензол-1,4-диамина (2)
Смесь соединения 1 (1,496 г) и PtO2 (0,060 г) в ТГФ (15 мл) гидрируют при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают этилацетатом. Объединенные слои концентрируют при пониженном давлении с получением желаемого продукта 2 (1,201 г, 94,43%, M+H+= 236,5) без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-(2-метоксиэтиламино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-32a)
Соединение 2 (0,532 г), соединение 3 (0,925 г), K2CO3 (0,931 г), трис(дибензилиденацетон)дипалладий (0,145 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,150 г) и трет-BuOH (10 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 2 ч ТСХ (ДХМ:MeOH = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат:MeOH = 10:1 в качестве подвижной фазы) с получением соединения I-32a (0,672 г, 48,2%, M+H+ = 436,2).
1H ЯМР (500 МГц, CDCl3) δ 7,96 (с, 1H), 7,79 (с, 1H), 7,58 (д, J=7,7 Гц, 1H), 7,45 (с, 1H), 7,36 (т, J=8,1 Гц, 1H), 7,11 (д, J=8,8 Гц, 2H), 6,97 (д, J=7,0 Гц, 1H), 6,78 (с, 1H), 6,47 (д, J=8,8 Гц, 2H), 6,43 (дд, J=16,9, 1,0 Гц, 1H), 6,23 (дд, J=16,8, 10,2 Гц, 1H), 5,75 (дд, J=10,3, 1,0 Гц, 1H), 3,92 (с, 3H), 3,58 (т, J=5,2 Гц, 2H), 3,39 (с, 3H), 3,22 (т, J=5,2 Гц, 2H).
Пример 32
Синтез N-(3-(5-метокси-2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-иламино)пиримидин-4-илокси)фенил)акриламида (I-33a)
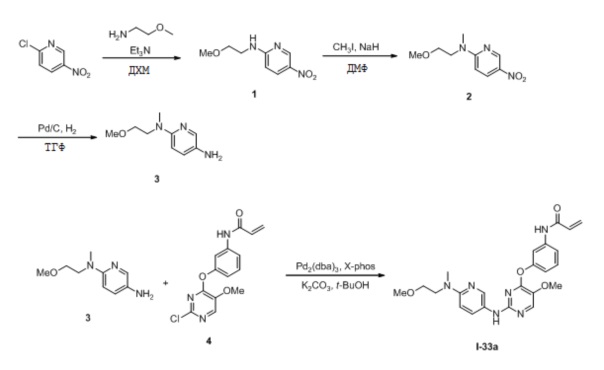
Синтез N-(2-метоксиэтил)-5-нитропиридин-2-амина (1)
Смесь 2-хлор-5-нитропиридина (1,578 г), 2-метоксиэтиламина (1,522 г) и Et3N (2,070 г) в ДХМ (10 мл) перемешивают при комнатной температуре в течение 6 ч. Затем смесь нагревают и перемешивают при кипении с обратным холодильником в течение еще 2 ч. Добавляют CH3CN (5 мл) и кипятят с обратным холодильником в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакцию гасят водой и затем экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением желаемого соединения 1 (1,868 г, 95%, M+H+ = 198,2).
Синтез N-(2-метоксиэтил)-N-метил-5-нитропиридин-2-амина (2)
К раствору соединения 1 (1,648 г) в ДМФ (15 мл) на ледяной бане последовательно добавляют NaH (0,302 г, 80% дисперсия в минеральном масле) и CH3I (1,418 г). Полученную смесь затем перемешивают при 0°С в течение 10 мин. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный продукт 2 (2,0 г, M+H+= 212,2) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез N2-(2-метоксиэтил)-N2-метилпиридин-2,5-диамина (3)
Раствор соединения 2 (2,0 г) и Pd/C (0,300 г, 10% активированный на угле) в ТГФ (20 мл) гидрируют при 40°C в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают MeOH. Объединенный фильтрат концентрируют при пониженном давлении с получением желаемого продукта 3 (1,687 г, 98%, M+H+=182,3) без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-иламино)пиримидин-4-илокси)фенил)акриламида (I-33a)
Соединение 3 (1,687 г), соединение 4 (2,827 г), K2CO3 (2,570 г), трис(дибензилиденацетон)дипалладий (0,6 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,6 г) и трет-BuOH (60 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3 ч ТСХ (этилацетат:EtOH = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат в качестве подвижной фазы) с получением соединения I-33a (2,591 г, 62,4%, M+H+ = 451,5).
Пример 33
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)индолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-34a)
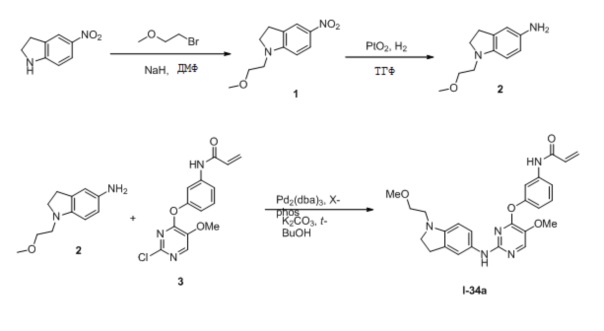
Синтез 1-(2-метоксиэтил)-5-нитроиндолина (1)
К раствору 5-нитроиндолина (5,718 г) в ДМФ (60 мл) при 0°C последовательно добавляют NaH (1,348 г, 60% дисперсия в минеральном масле) и 1-бром-2-метоксиэтан (5,368 г). Смесь перемешивают при 0°C в течение 2 ч и затем нагревают до комнатной температуры и перемешивают в течение еще 3 ч. В этот момент ТСХ показывает завершение реакции. Реакционную смесь выливают в ледяную воду. Осадок собирают и повторно растворяют в этилацетате. Органический слой промывают водой, насыщенным раствором соли и концентрируют при пониженном давлении с получением желаемого продукта 1 (7,292 г, 94%, M+H+= 223,3) в виде желтого твердого вещества.
Синтез 1-(2-метоксиэтил)индолин-5-амина (2)
Раствор 1 (7,272 г) и PtO2 (0,202 г) в ТГФ (100 мл) гидрируют при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением желаемого продукта 2 (6,247 г, 99,3%, M+H+= 193,5) который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)индолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-34a)
Соединение 2 (1,059 г), соединение 3 (1,813 г), K2CO3 (1,037 г), трис(дибензилиденацетон)дипалладий (0,146 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,152 г) и трет-BuOH (50 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (этилацетат:петролейный эфир = 1:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат:петролейный эфир = 1:3 в качестве подвижной фазы) с получением желаемого продукта I-34a (1,368 г, 53,9%, M+H+ = 462,6).
Пример 34
Синтез N-(3-(5-метокси-2-(4-((2-метоксиэтил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-35a)
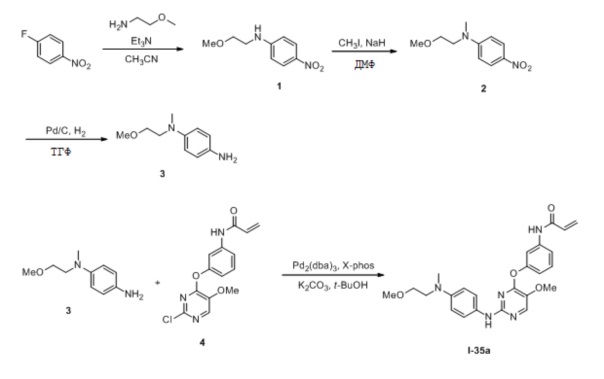
Синтез N-(2-метоксиэтил)-4-нитроанилина (1)
Смесь 1-фтор-4-нитробензола (2,820 г), 2-метоксиэтиламина (3,00 г) и Et3N (4,04 г) в CH3CN (20 мл) перемешивают при 50°C в течение ночи. Реакцию гасят водой, затем экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и затем концентрируют при пониженном давлении с получением желаемого соединения 1 (3,9 г, 99%, M+H+= 197,3), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(2-метоксиэтил)-N-метил-4-нитроанилина (2)
К раствору соединения 1 (1,047 г) в ДМФ (15 мл) на ледяной бане последовательно добавляют NaH (0,200 г) и CH3I (0,906 г). Полученную смесь затем перемешивают при 0°С в течение 10 мин. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный продукт 2 (1,0 г, 89%, M+H+ = 211,3) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез N1-(2-метоксиэтил)-N1-метилбензол-1,4-диамина (3)
Смесь соединения 1 (1,0 г) и Pd/C (0,100 г, 10% активированный на угле) в ТГФ (20 мл) гидрируют при 40°C в течение ночи. В этот момент, ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением желаемого продукта 3 (1,058 г, M+H+= 181,3) без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-((2-метоксиэтил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-35a)
Соединение 3 (1,058 г), соединение 80 (4 г), K2CO3 (1,630 г), трис(дибензилиденацетон)дипалладий (0,3 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,3 г) и трет-BuOH (50 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (этилацетат:этанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат в качестве подвижной фазы) с получением желаемого продукта I-35a (1,8 г, 68,7%, M+H+ = 450,6).
Пример 35
Синтез N-(3-(2-(1-(2-метоксиэтил)индолин-5-иламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-36a)
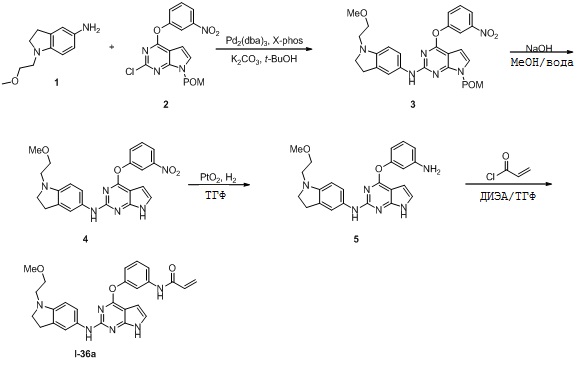
Синтез пивалата (2-(1-(2-метоксиэтил)индолин-5-иламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (0,7 г), соединение 2 (1,780 г), K2CO3 (1,01 г), трис(дибензилиденацетон)дипалладий (0,4 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,401 г) и трет-BuOH (16 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3,5 ч ТСХ (этилацетат:этанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения 3 (0,7 г, 34,2%).
Синтез N-(1-(2-метоксиэтил)индолин-5-ил)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-амина (4)
В круглодонную колбу (250 мл) загружают соединение 3 (700 мг), MeOH (6 мл) и ТГФ (1 мл). После полного растворения соединения 3 реакционную смесь охлаждают до ~10°C на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 2 мл), сохраняя температуру ~16°C во время добавления. Смесь перемешивают в течение 2 ч при этой температуре и затем добавляют воду (20 мл). Смесь экстрагируют этилацетатом. Органические слои объединяют и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения 4 (320 мг, 57,4%, M+H+= 447,6).
Синтез 4-(3-аминофенокси)-N-(1-(2-метоксиэтил)индолин-5-ил)-7H-пирроло[2,3-d]пиримидин-2-амина (5)
Смесь соединения 4 (320 мг) и PtO2 (8 мг) в ТГФ (5 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Слой Целита промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением желаемого соединения 5 (0,25 г, 83,75%).
Синтез N-(3-(2-(1-(2-метоксиэтил)индолин-5-иламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-36a)
К смеси соединения 5 (0,25 г) и ДИЭА (125 мг) в ТГФ (4 мл) при 0°C по каплям добавляют хлорид акрилоила (82 мг) в течение более 5 мин. Смесь перемешивают в течение 2 ч при этой температуре. Раствор NaOH (1M, 2 мл) добавляют для остановки реакции. Смесь перемешивают в течение 30 мин и затем разбавляют водой (30 мл), затем экстрагируют этилацетатом (30 мл). Органический слой отделяют и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-36a (186 мг, 65,85%, M+H+=471,6).
Пример 36
Синтез N-(3-(2-(3,5-дифтор-4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-37a)
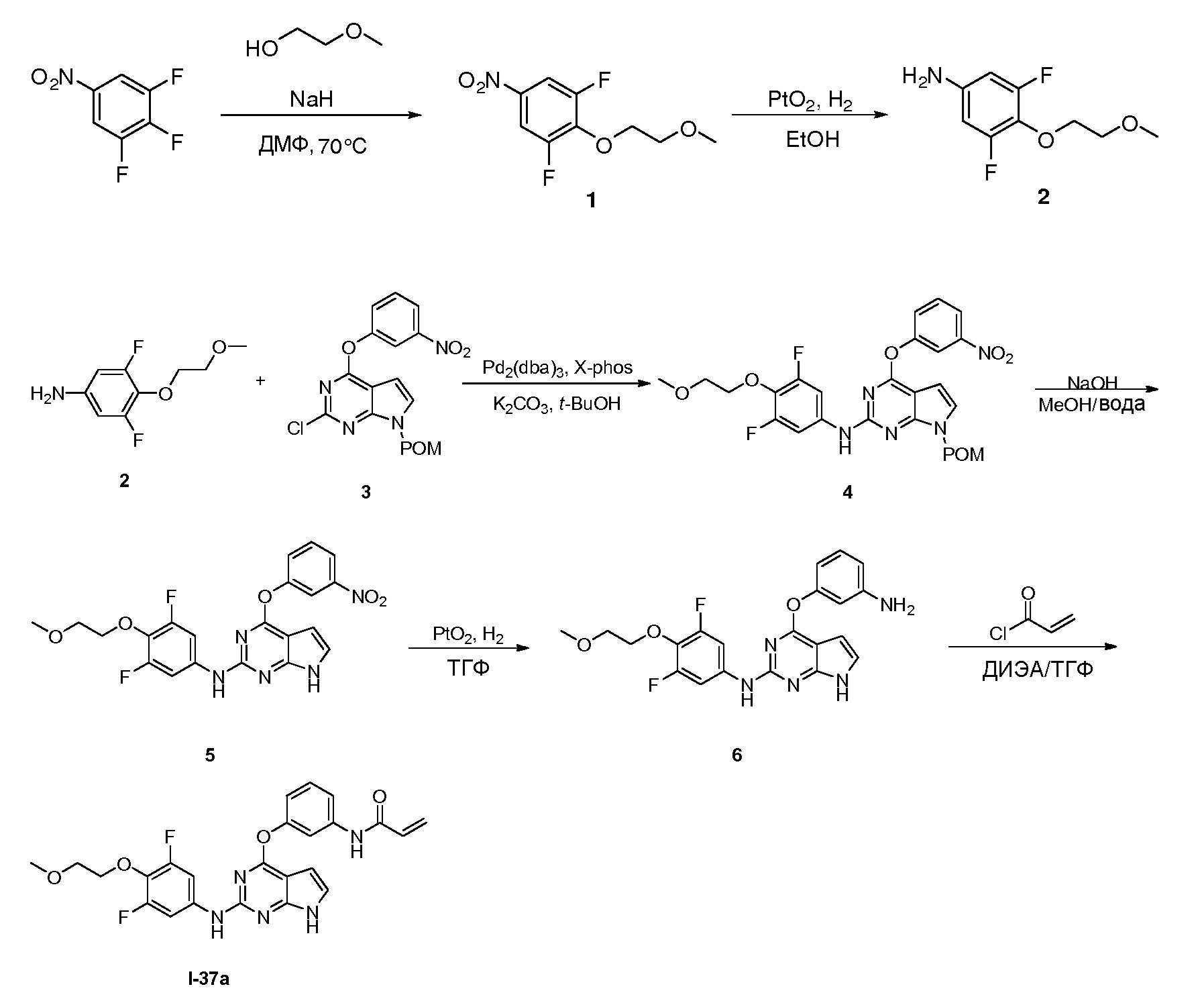
Синтез 1,3-дифтор-2-(2-метоксиэтокси)-5-нитробензола (1)
К раствору 1,2,3-трифтор-5-нитробензола (2,625 г, 14 ммоль) и 2-метоксиэтанола (1,3 г, 17 ммоль) в ДМФ (20 мл) добавляют NaH (0,815 г, 80% дисперсия в минеральном масле). Смесь перемешивают при комнатной температуре в течение 3 ч до тех пор, пока ТСХ (петролеум:этилацетат = 1:6 в качестве подвижной фазы) не покажет завершение реакции. Смесь выливают в воду (60 мл) и экстрагируют EA (40 мл ×4). Органический слой объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc/петролейный эфир от 1/7 до 1/3 в качестве подвижной фазы) с получением соединения 1 (2,609 г, 80%) в виде темно-желтого твердого вещества.
Синтез 3, 5-дифтор-4-(2-метоксиэтокси)анилина (2)
Смесь соединения 1 (3,88 г) и PtO2 (0,089 г) в EtOH (30 мл) гидрируют при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением желаемого продукта 2 (2,7 г, 95%) без дальнейшей очистки.
Синтез пивалата (2-(3,5-дифтор-4-(2-метоксиэтокси)фениламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (4)
Соединение 2 (2,7 г, 13,3 ммоль), соединение 3 (6,075 г, 15 ммоль), K2CO3 (4,140 г, 30 ммоль), трис(дибензилиденацетон)дипалладий (0,064 г, 0,07 моль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,065 г, 0,14 ммоль) и трет-BuOH (50 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3-4 ч ТСХ (ДХМ:метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc/петролейный эфир от 50% до 100%) с получением соединения 4 (4,932 г, 65%) в виде желтоватого твердого вещества.
Синтез N-(3,5-дифтор-4-(2-метоксиэтокси)фенил)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-амина (5)
В круглодонную колбу (250 мл) загружают соединение 4 (4,932 г, 8,64 ммоль) и MeOH (40 мл). Когда соединение 4 полностью растворится, раствор охлаждают до ~10°C на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 10 мл), сохраняя температуру ~16°C во время добавления. Смесь перемешивают в течение 2 ч при этой температуре. Воду (100 мл) добавляют в колбу в течение более 15 мин, сохраняя температуру ниже 20°C. Смесь непрерывно перемешивают в течение еще 15 мин. Осадок собирают, промывают водой (50 мл) и сушат в вакууме с получением соединения 5 (1,579 г, 40%).
Синтез 4-(3-аминофенокси)-N-(3,5-дифтор-4-(2-метоксиэтокси)фенил)-7H-пирроло[2,3-d]пиримидин-2-амина (6)
Смесь соединения 5 (1,579 г, 3,456 ммоль) и PtO2 (16 мг, 0,07 ммоль) в ТГФ (30 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенный фильтрат концентрируют с получением желаемого соединения 6 (1,401 г, 95%) в виде белого твердого вещества.
Синтез N-(3-(2-(3,5-дифтор-4-(2-метоксиэтокси)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-37a)
К раствору соединения 6 (1,401 г, 3,28 ммоль) и ДИЭА (0,464 г, 3,6 ммоль) в ТГФ (50 мл) при 0°C по каплям добавляют хлорид акрилоила (0,307 г, 3,4 ммоль) вы течение более 5 мин. Смесь перемешивают в течение 1 ч при этой температуре. Раствор NaOH (1M, 3 мл) и воду (20 мл) добавляют для остановки реакции. Смесь перемешивают в течение еще 10 мин и верхнюю ТГФ фазу отделяют и выпаривают при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc/петролейный эфир от 50% до 100% в качестве подвижной фазы) с получением соединения I-37a (1,090 г, 63%, M+H+ = 482,2) в виде белого твердого вещества.
Пример 37
Синтез N-(3-(5-метокси-2-(4-((2-метоксиэтил)(пропил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-38a)
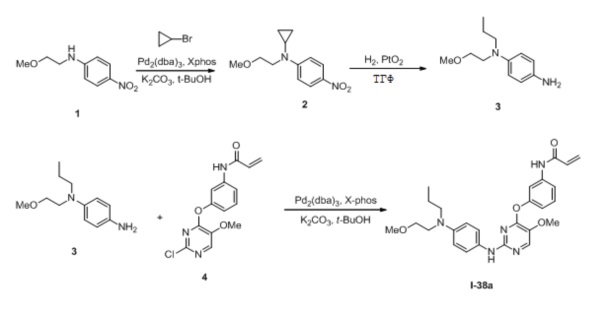
Синтез N-циклопропил-N-(2-метоксиэтил)-4-нитроанилина (2)
Смесь соединения 1 (1,001 г), циклопропилбромида (2,300 г), Pd2(dba)3 (0,132 г), X-Phos (0,100 г) и карбоната калия (1,070 г) в трет-бутаноле (20 мл) перемешивают под аргоном при кипении с обратным холодильником в течение ночи. ТСХ показывает завершение реакции. После охлаждения до комнатной температуры реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают флэш-хроматографией на колонке с получением желаемого соединения 2 (700 мг, 58,13%).
Синтез N1-(2-метоксиэтил)-N1-пропилбензол-1,4-диамина (3)
Смесь соединения 2 (0,556 г) и PtO2 (0,060 г) в ТГФ (15 мл) гидрируют при комнатной температуре в течение ночи. ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенного продукта 3 (0,55 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-((2-метоксиэтил)(пропил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-38a)
Соединение 3 (0,550 г), соединение 4 (0,571 г), K2CO3 (0,075 г), трис(дибензилиденацетон)дипалладий (0,075 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,071 г) и трет-BuOH (15 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3 ч ТСХ (этилацетат:этанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (10 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc/петролейный эфир от 50% до 100%) с получением соединения I-38a (0,182 г, 21,2%, M+H+=478,6).
1H ЯМР (500 МГц, CDCl3) δ 7,94 (с, 1H), 7,65 (с, 1H), 7,54-7,46 (м, 2H), 7,36 (т, J=8,1 Гц, 1H), 7,12 (д, J=8,9 Гц, 2H), 6,96 ((дд, J=7,9, 1,0 Гц, 1H), 6,61 (с, 1H), 6,50 (д, J=8,9 Гц, 2H), 6,42 (дд, J=16,8, 1,2 Гц, 1H), 6,22 (дд, J=16,8, 10,2 Гц, 1H), 5,75 (дд, J=10,2, 1,1 Гц, 1H), 3,90 (с, 3H), 3,48 (т, J=5,8 Гц, 2H), 3,42 (т, J=6,0 Гц, 2H), 3,35 (с, 3H), 3,19 (т, J=6,0 Гц, 2H), 1,58-1,49 (м, 2H), 0,88 (т, J=7,4 Гц, 3H).
Пример 38
Синтез N-(3-(2-(4-(циклопропил(2-метоксиэтил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-39a)
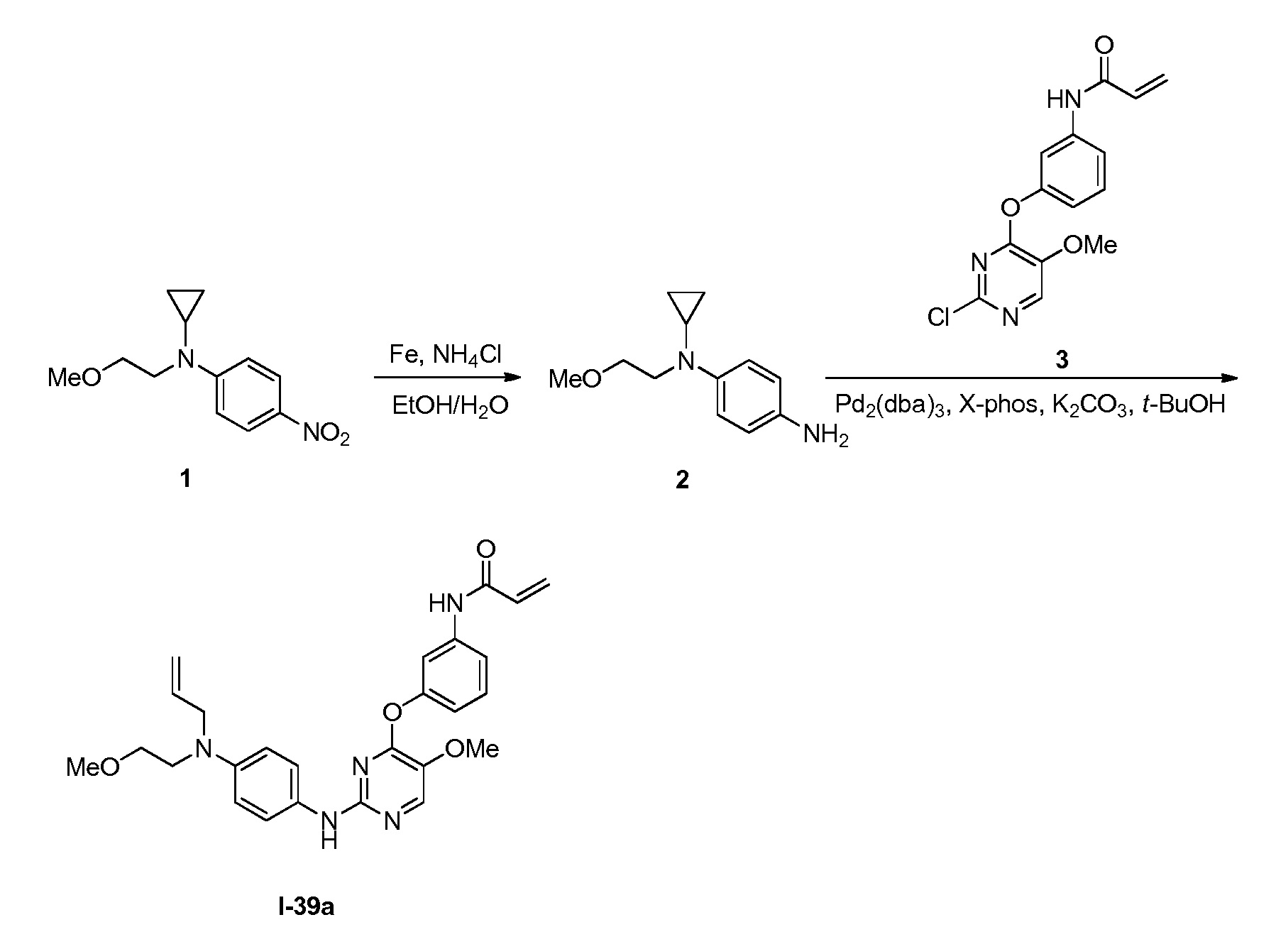
Синтез N1-циклопропил-N1-(2-метоксиэтил)бензол-1,4-диамина (2)
Соединение 1 (0,580 г) в EtOH/H2O (24 мл, 17:7) обрабатывают железом (0,62 г), затем хлоридом аммония (2,092 г). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь фильтруют через Целит®. Фильтрат подщелачивают NaHCO3 (водн, 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органический слой объединяют, сушат и концентрируют с получением неочищенного соединения 2 (0,545 г) которое применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(2-(4-(циклопропил(2-метоксиэтил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-39a)
Соединение 2 (0,5 г), соединение 3 (0,745 г), K2CO3 (0,890 г), трис(дибензилиденацетон)дипалладий (0,232 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,240 г) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 4 ч ТСХ (этилацетат:этанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и фильтруют через Целит®. Слой Целита промывают этилацетатом (10 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-39a (0,228 г, 17,4%, M+H+=476,6).
1H ЯМР (500 МГц, ДМСО) δ 10,33 (с, 1H), 8,86 (с, 1H), 8,13 (с, 1H), 7,60 (с, 1H), 7,59 (д, J=8,5 Гц, 1H), 7,39 (дд, J=26,8, 18,9 Гц, 1H), 7,18 (д, J=8,3 Гц, 2H), 6,94 (д, J=7,9 Гц, 1H), 6,44 (дд, J=19,2, 9,1 Гц, 3H), 6,27 (д, J=17,0 Гц, 1H), 5,76 (дд, J=17,6, 7,7 Гц, 2H), 5,09 (д, J=13,0 Гц, 2H), 3,85 (с, 3H), 3,89-3,80 (м, 2H), 3,47-3,32 (м, 4H), 3,25 (с, 3H).
13C ЯМР (126 МГц, ДМСО) δ 165,31 (с), 161,44 (с), 156,04 (с), 154,80 (с), 146,07 (с), 144,92 (с), 142,28 (с), 136,95 (с), 136,35 (с), 133,67 (с), 132,17 (с), 131,82 (с), 129,29 (с), 121,98 (с), 118,79 (с), 118,01 (с), 117,82 (с), 114,78 (с), 114,05 (с), 71,98 (с), 60,24 (с), 59,67 (с), 55,20 (с), 51,87 (с).
Пример 39
Синтез (S)-N-(3-(2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-40a)
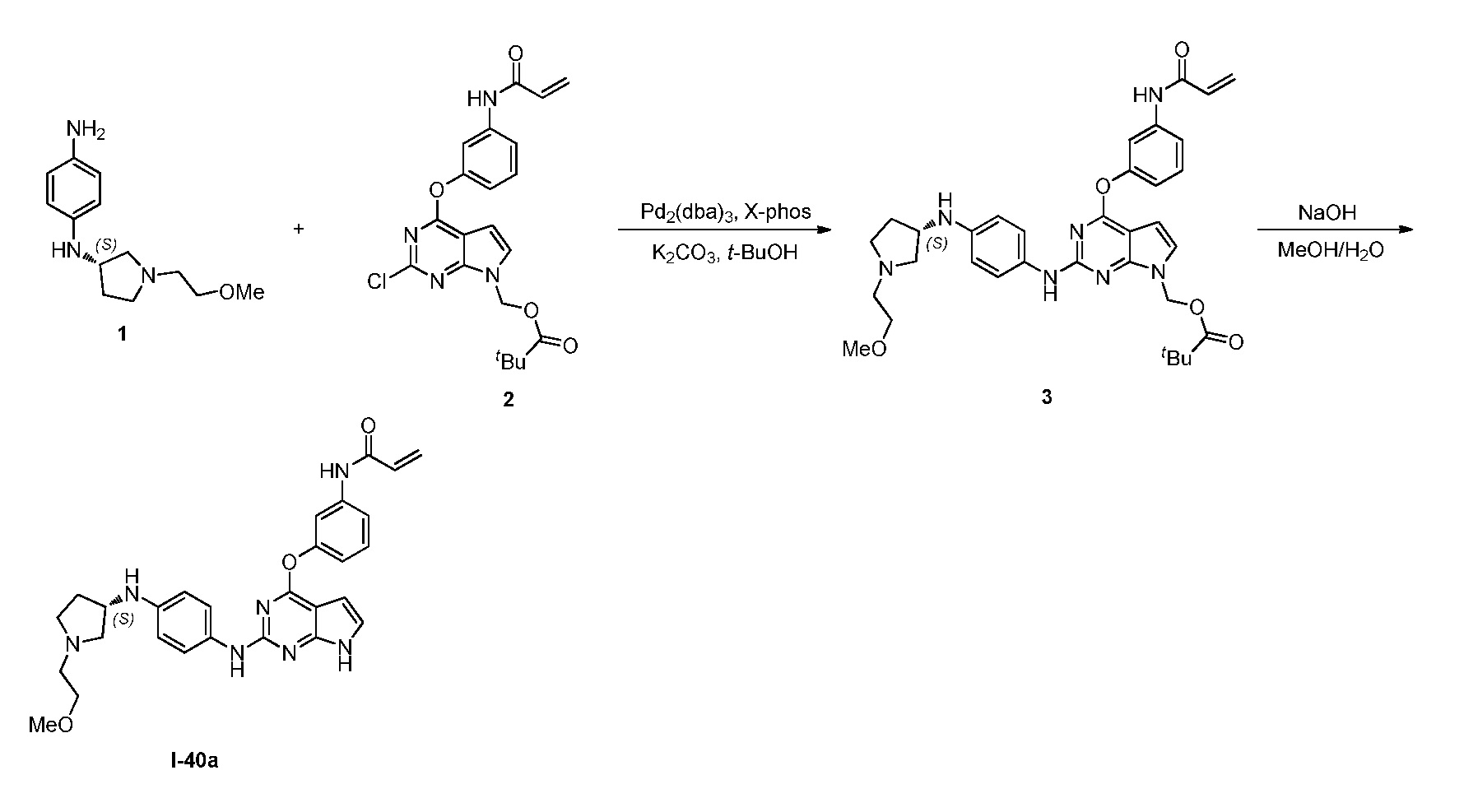
Синтез пивалата (S)-(4-(3-акриламидофенокси)-2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (1,008 г, 4,289 ммоль), соединение 2 (2,143 г, 5,007 ммоль), K2CO3 (1,455 г, 10,543 ммоль), трис(дибензилиденацетон)дипалладий (0,432 г, 0,472 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,434 г, 0,992 ммоль) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5-7 ч ТСХ (ДХМ:метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C, концентрируют при пониженном давлении и затем добавляют этилацетат (50 мл) и активированный уголь (0,5 г). Смесь перемешивают в течение 15 мин и затем фильтруют через Целит®. Слой Целита промывают этилацетат (50 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенного продукта 3 (1,723 г, 64%) в виде белого твердого вещества, который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-40a)
В круглодонную колбу (250 мл) загружают соединение 3 (0,550 г, 0,877 ммоль) и MeOH (20 мл). После полного растворения соединения 3 смесь охлаждают до ~10°C на ледяной бане. Раствор NaOH (2,5 M, 2 мл) затем медленно добавляют в колбу, сохраняя температуру ниже 16°C во время добавления. Смесь перемешивают в течение 1 ч при этой температуре. Затем в колбу медленно добавляют воду (100 мл) в течение более 15 мин (сохраняя температуру ниже 20°C). Смесь экстрагируют этилацетатом (30 мл ×4). Объединенные органические слои концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (этилацетат/петролейный эфир = от 10% до 100% в качестве подвижной фазы) с получением соединения I-40a (0,17 г, 29%, M+H+ = 514,5) в виде желтого твердого вещества.
Пример 40
Синтез N-(3-(2-(4-((2-метоксиэтил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламид (I-41a)
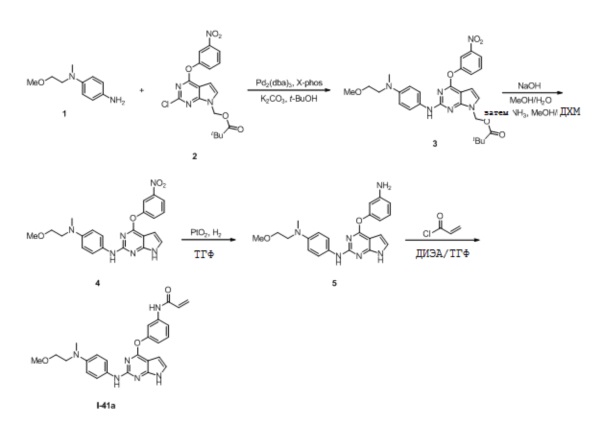
Синтез пивалата (2-(4-((2-метоксиэтил)(метил)амино)фениламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (3,0 г), соединение 2 (7,1 г), K2CO3 (4,78 г), трис(дибензилиденацетон)дипалладий (1,2 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (1,2 г) и трет-BuOH (100 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3 ч ТСХ (ДХМ:метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 3 (6,010 г, 65,8%).
Синтез N1-(2-метоксиэтил)-N1-метил-N4-(4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)бензол-1,4-диамина (4)
В круглодонную колбу (250 мл) загружают соединение 3 (6,01 г) и MeOH (50 мл). Когда соединение 3 полностью растворится, раствор охлаждают до ~10°C на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 10 мл), сохраняя температуру ниже 16°C во время добавления. Смесь перемешивают в течение 2,5 ч при этой температуре. Воду (150 мл) медленно добавляют в колбу в течение более 15 мин, сохраняя температуру ниже 20°C во время добавления. Смесь экстрагируют этилацетатом (100 мл ×2). Органические слои объединяют и концентрируют при пониженном давлении. Полученный неочищенный продукт повторно растворяют в MeOH/ДХМ (1:1, 50 мл) и полученный раствор барботируют NH3(г) при комнатной температуре. Через 7 ч ЖХ-МС показывает завершение реакции. Органический растворитель удаляют при пониженном давлении с получением соединения 4 (4,5 г, 94,7%), который применяют на следующей стадии без дальнейшей очистки.
Синтез N1-(4-(3-аминофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)-N4-(2-метоксиэтил)-N4-метилбензол-1,4-диамина (5)
Смесь соединения 4 (4,5 г) и PtO2 (50 мг) в ТГФ (52 мл) гидрируют с водородным баллоном при комнатной температуре в течение 44 ч. ТСХ и ЖХ-МС показывает неполное завершение реакции из-за медленного превращения из гидроксиламина в амин. Реакционную смесь фильтруют через Целит®. Фильтрат концентрируют. Остаток обрабатывают системой железо/NH4Cl водн./EtOH в течение 24 ч. Неочищенный продукт очищают хроматографией на колонке с получением желаемого соединения 5 (2,1 г, 50%) в виде белого твердого вещества.
Синтез N-(3-(2-(4-((2-метоксиэтил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-41a)
К раствору соединения 5 (2,1 г) и ДИЭА (1,01 г) в ТГФ (30 мл) при 0°C добавляют хлорид акрилоила (0,810 г) по каплям в течение более 5 мин. Смесь перемешивают в течение 3 ч при этой температуре. Раствор NaOH (1M, 3 мл) и воду (50 мл) добавляют для остановки реакции. Полученную смесь перемешивают в течение еще 10 мин и затем экстрагируют этилацетатом. Органические слои объединяют и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (ДХМ/MeOH = 20/1 в качестве подвижной фазы) с получением соединения I-41a (0,605 г, 95,9%, M+H+=459,5).
Пример 41
Синтез (S)-N-(3-(5-метокси-2-(4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-42a)
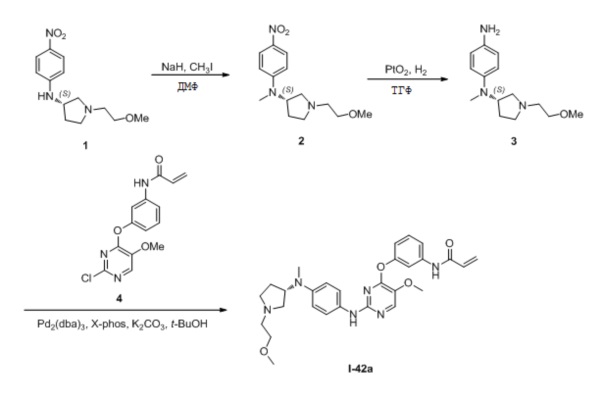
Синтез (S)-1-(2-метоксиэтил)-N-метил-N-(4-нитрофенил)пирролидин-3-амина (2)
К раствору соединения 1 (2,7 г) в ДМФ (15 мл) при 0°С последовательно добавляют NaH (0,611 г, 80% дисперсия в минеральном масле) и CH3I (1,5 г). Полученную смесь перемешивают в течение 3 ч при этой температуре. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт 2 (2,3 г) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез (S)-N1-(1-(2-метоксиэтил)пирролидин-3-ил)-N1-метилбензол-1,4-диамина (3)
Смесь соединения 2 (2,3 г) и PtO2 (0,057 г) в ТГФ (40 мл) гидрируют с водородным баллоном при комнатной температуре в течение 41 ч. ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением неочищенного соединения 3 (1,7 г) без дальнейшей очистки.
Синтез (S)-N-(3-(5-метокси-2-(4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-42a)
Соединение 3 (0,7 г), соединение 4 (0,905 г), K2CO3 (0,838 г), трис(дибензилиденацетон)дипалладий (0,275 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,271 г) и трет-BuOH (15 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-42a (0,66 г, 45,4%, M+H+=519,6).
1H ЯМР (500 МГц, ДМСО) δ 10,36 (с, 1H), 8,94 (с, 1H), 8,15 (с, 1H), 7,74-7,53 (м, 2H), 7,42 (т, J=8,4 Гц, 1H), 7,23 (д, J=8,9 Гц, 2H), 7,09-6,85 (м, 1H), 6,55 (д, J=9,0 Гц, 2H), 6,45 (дд, J=16,9, 10,1 Гц, 1H), 6,28 (дд, J=17,0, 1,8 Гц, 1H), 5,78 (дд, J=10,1, 1,8 Гц, 1H), 4,24-4,08 (м, 1H), 3,86 (с, 3H), 3,47-3,37 (м, 2H), 3,24 (с, 3H), 2,71 (тд, J=8,5, 4,3 Гц, 1H), 2,65 (с, 3H), 2,58 (дт, J=8,1, 6,0 Гц, 2H), 2,55-2,45 (м, 2H), 2,33 (кв, J=7,7 Гц, 1H), 2,05-1,90 (м, 1H), 1,57 (тд, J=13,4, 7,8 Гц, 1H).
13C ЯМР (126 МГц, ДМСО) δ 165,32 (с), 161,43 (с), 155,90 (с), 154,78 (с), 147,40 (с), 145,98 (с), 142,28 (с), 136,44 (с), 133,57 (д, J=18,4 Гц), 131,87 (с), 129,30 (с), 121,49 (с), 118,77 (с), 118,09 (с), 116,72 (с), 114,93 (с), 72,92 (с), 60,02 (с), 59,79 (с), 59,62 (с), 59,30 (с), 56,79 (с), 55,89 (с), 35,77 (с), 29,76 (с).
Пример 42
Синтез N-(3-(2-(1-(2-фторэтил)-1H-индол-5-иламино)-5-метоксипиримидин-4-илокси)фенил)акриламид (I-43a)
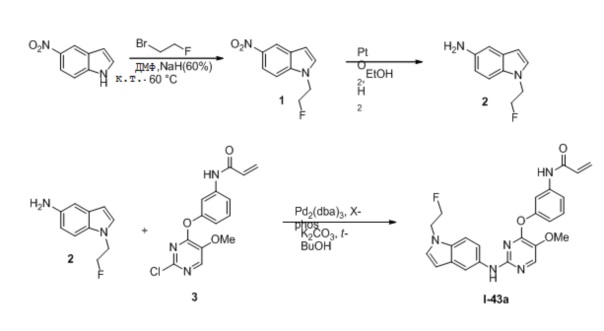
Синтез 1-(2-фторэтил)-5-нитро-1H-индола (1)
К раствору 5-нитро-1H-индола (1,618 г, 10 ммоль) вn ДМФ (10 мл) при 0°C последовательно добавляют NaH (0,805 г, 60% дисперсия в минеральном масле) и 1-бром-2-метоксиэтан (1,32 г). Смесь перемешивают при 60°C в течение 3 ч до тех пор, пока ТСХ (петролейный эфир:этилацетат = 5:1 в качестве подвижной фазы) не покажет завершение реакции. Смесь охлаждают до комнатной температуры, выливают в воду (60 мл) и затем экстрагируют этилацетатом (50 мл × 4). Органические слои объединяют и растворитель удаляют при пониженном давлении. Полученный остаток очищают хроматографией на колонке (EtOAc/петролейный эфир от 1/10 до 1/3 в качестве подвижной фазы) с получением соединения 1 (1,767 г, 8,5 ммоль, 85%) в виде желтого твердого вещества.
Синтез 1-(2-фторэтил)-1H-индол-5-амина (2)
Смесь соединения 1 (1,767 г, 8,5 ммоль) и PtO2 (0,046 г, 0,20 ммоль) в EtOH (40 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают небольшим количеством этанола. Объединенные фильтраты концентрируют при пониженном давлении с получением соединения 2 (1,347 г, 89%), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(2-(1-(2-фторэтил)-1H-индол-5-иламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-43a)
Соединение 2 (0,877 г, 4,867 ммоль), соединение 3 (1,902 г, 6,327 ммоль), K2CO3 (1,347 г, 9,743 ммоль), трис(дибензилиденацетон)дипалладий (0,455 г, 0,487 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,471 г, 0,974 ммоль) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (EtOAc/петролейный эфир/ТЭА = 1:1:0,1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-43a (1,66 г, 74%, M+H+=448,6) в виде светло-желтого твердого вещества.
Пример 43
Синтез N-(3-(5-метокси-2-(4-(2-(метилсульфонил)этокси)фениламино)пиримидин-4-илокси)фенил)акриламида (I-44a)
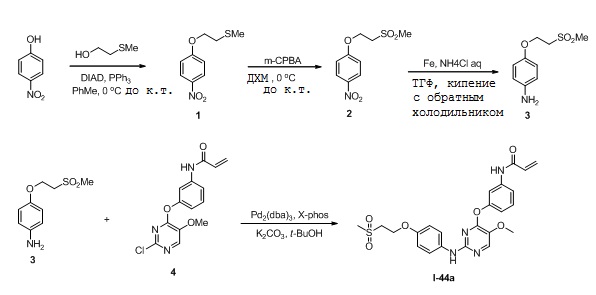
Синтез метил(2-(4-нитрофенокси)этил)сульфана (1)
К раствору 4-нитрофенола (1,413 г), 2-(метилтио)этанола (0,948 г) и PPh3 (3,216 г) в толуоле (30 мл) при 0°C медленно добавляют DIAD (4 мл). Смесь нагревают до комнатной температуры и перемешивают в течение ночи. Растворитель выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке (EtOAc/петролейный эфир от 1:20 до 1:10 в качестве подвижной фазы) с получением соединения 1 (1,879 г, 86,7%) в виде желтого масла.
Синтез 1-(2-(метилсульфонил)этокси)-4-нитробензола (2)
Раствор соединения 1 (1,490 г) в ДХМ (10 мл) при 0°C обрабатывают 3-хлорпербензойной кислотой (2,511 г). Полученную смесь перемешивают при температуре окружающей среды в течение ночи. Реакцию гасят насыщенным водным раствором NaHCO3 и затем экстрагируют ДХМ. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного соединения 2 (4,542 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез 4-(2-(метилсульфонил)этокси)анилина (3)
Раствор соединения 2 (4,542 г) в ТГФ (50 мл) обрабатывают железом (5,823 г) и насыщенным водным хлоридом аммония (5 мл). Смесь перемешивают при кипении с обратным холодильником в течение 2,5 ч. После охлаждения до комнатной температуры реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением неочищенного продукта 3 (2,785 г), который применяют в следующей реакции без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-(2-(метилсульфонил)этокси)фениламино)пиримидин-4-илокси)фенил)акриламида (I-44a)
Соединение 3 (2,304 г), соединение 4 (2,270 г), K2CO3 (3,270 г), трис(дибензилиденацетон)дипалладий (0,517 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,512 г) и трет-BuOH (60 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3,5 ч ТСХ (EtOAc/петролейный эфир/ТЭА = 1:1:0,1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-44a (1,8 г, 29,1%, M+H+=485,5) в виде светло-желтого твердого вещества.
1H ЯМР (500 МГц, ДМСО) δ 10,37 (с, 1H), 9,14 (с, 1H), 8,19 (с, 1H), 7,63 (т, J=2,0 Гц, 1H), 7,56 (д, J=9,1 Гц, 1H), 7,44 (т, J=8,1 Гц, 1H), 7,37 (д, J=9,0 Гц, 2H), 6,96 (ддд, J=8,1, 2,3, 0,8 Гц, 1H), 6,69 (д, J=9,1 Гц, 2H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,27 (дд, J=17,0, 1,9 Гц, 1H), 5,78 (дд, J=10,1, 1,9 Гц, 1H), 4,23 (т, J=5,6 Гц, 2H), 3,87 (с, 3H), 3,57 (т, J=5,6 Гц, 2H), 3,05 (с, 3H).
Пример 44
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)-1H-индол-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-45a)
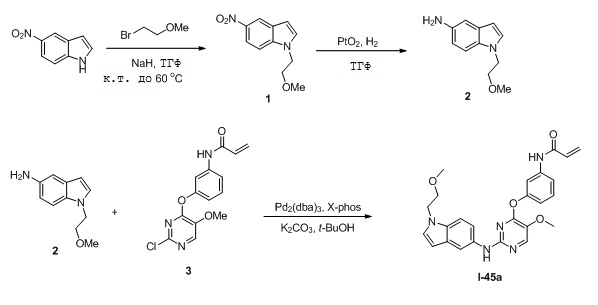
1-(2-метоксиэтил)-5-нитро-1H-индол (1)
К раствору 5-нитро-1H-индола (1,620 г) и 1-бром-2-метоксиэтана (1,412 г) в ТГФ (15 мл) при комнатной температуре добавляют NaH (0,420 г, 80% дисперсия в минеральном масле). Смесь перемешивают при 60°С в течение 6 ч. Добавляют другую часть 1-бром-2-метоксиэтана (0,301 г) и смесь непрерывно перемешивают при 60°C в течение ночи. Реакционную смесь охлаждают и выливают в ледяную воду. Осадки фильтруют, промывают водой и сушат с получением соединения 1 (2,10 г, 95,45%) в виде желтого твердого вещества.
Синтез 1-(2-метоксиэтил)-1H-индол-5-амина (2)
Раствор соединения 1 (2,052 г) и PtO2 (0,062 г) в ТГФ (20 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент, ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 2 (1,600 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)-1H-индол-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-45a)
Соединение 2 (1,001 г), соединение 3 (1,624 г), K2CO3 (1,495 г), трис(дибензилиденацетон)дипалладий (0,456 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,480 г) и трет-BuOH (15 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 6 ч ТСХ (EtOAc/петролейный эфир/ТЭА = 1:1:0,1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-45a (1,5 г, 62,5%, M+H+=460,5) в виде белого твердого вещества.
1H ЯМР (500 МГц, ДМСО) δ 10,37 (с, 1H), 9,06 (с, 1H), 8,20 (с, 1H), 7,70-7,66 (м, 2H), 7,64 (д, J=8,2 Гц, 1H), 7,51-7,36 (м, 1H), 7,22-7,16 (м, 2H), 7,10 (дд, J=8,8, 1,9 Гц, 1H), 6,99 (ддд, J=8,1, 2,3, 0,7 Гц, 1H), 6,44 (дд, J=17,0, 10,1 Гц, 1H), 6,27 (дд, J=17,0, 1,9 Гц, 1H), 6,11 (д, J=2,9 Гц, 1H), 5,77 (дд, J=10,1, 1,9 Гц, 1H), 4,21 (т, J=5,3 Гц, 2H), 3,88 (с, 3H), 3,59 (т, J=5,4 Гц, 2H), 3,19 (с, 3H).
13C ЯМР (126 МГц, ДМСО) δ 165,36 (с), 161,45 (с), 156,17 (с), 154,90 (с), 146,13 (с), 142,38 (с), 136,38 (с), 134,91 (с), 133,62 (д, J=14,8 Гц), 131,92 (с), 130,87 (с), 129,95 (с), 129,31 (с), 118,93 (с), 118,06 (с), 116,55 (с), 114,68 (с), 111,23 (с), 111,10 (д, J=27,6 Гц), 102,25 (с), 73,05 (с), 60,05 (с), 59,67 (с), 47,31 (с).
Пример 45
Синтез N-(3-(2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-иламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-46a)
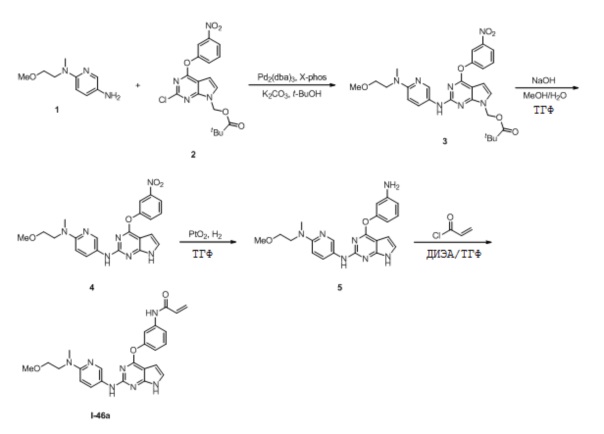
Синтез пивалата (2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-иламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (3,1 г), соединение 2 (10,0 г), K2CO3 (5,2 г), трис(дибензилиденацетон)дипалладий (1,2 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (1,2 г) и трет-BuOH (100 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3,5 ч ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 3 (6,875 г, 62,5).
Синтез N2-(2-метоксиэтил)-N2-метил-N5-(4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)пиридин-2,5-диамина (4)
В круглодонную колбу (250 мл) загружают соединение 3 (6,857 г) и MeOH (120 мл). Когда соединение 3 полностью растворится, раствор охлаждают на ледяной бане до температуры около 10°C. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 10 мл), сохраняя температуру ниже 16°C во время добавления. Смесь перемешивают в течение 1 ч при этой температуре, затем добавляют ТГФ (50 мл). Через 1,5 ч в колбу добавляют воду (100 мл) в течение более 15 мин, сохраняя температуру ниже 20°C. Смесь экстрагируют этилацетатом. Объединенные органические слои концентрируют при пониженном давлении. Растворители (50 мл, этилацетат/петролейный эфир = 1:4) добавляют в полученный неочищенный продукт и перемешивают в течение 2 ч. Полученное твердое вещество фильтруют и сушат с получением соединения 4 (5,13 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез N5-(4-(3-аминофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)-N2-(2-метоксиэтил)-N2-метилпиридин-2,5-диамина (5)
Смесь соединения 4 (5,13 г) и PtO2 (117 мг) в ТГФ (50 мл) гидрируют с водородным баллоном при 40°C в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенный фильтрат концентрируют при пониженном давлении с получением неочищенное соединение 5 (4,69 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-иламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-46a)
К раствору соединения 5 (3,734 г) и ДИЭА (1,480 г) в ТГФ (30 мл) при 0°C добавляют по каплям хлорид акрилоила (1,133 г) в течение более 5 мин. Смесь перемешивают в течение 1 при этой температуре. Насыщенный водный NaHCO3 (10 мл) добавляют для остановки реакции. Полученную смесь перемешивают в течение 10 мин и затем экстрагируют этилацетатом. Органические слои объединяют и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-46a (1,2 г, 28,4%, M+H+=460,5).
1H ЯМР (500 МГц, ДМСО) δ 11,48 (с, 1H), 10,31 (с, 1H), 8,73 (с, 1H), 8,28 (с, 1H), 7,72 (дд, J=9,0, 2,4 Гц, 1H), 7,63 (т, J=2,0 Гц, 1H), 7,58 (д, J=8,2 Гц, 1H), 7,41 (т, J=8,1 Гц, 1H), 7,03 (дд, J=3,4, 2,3 Гц, 1H), 6,99 (дд, J=8,1, 1,5 Гц, 1H), 6,43 (дд, J=16,9, 10,1 Гц, 2H), 6,27 (дд, J=17,0, 1,9 Гц, 1H), 6,22 (дд, J=3,4, 1,9 Гц, 1H), 5,82-5,75 (м, 1H), 3,62 (т, J=5,8 Гц, 2H), 3,46 (т, J=5,8 Гц, 2H), 3,24 (с, 3H), 2,95 (с, 3H).
Пример 46
Синтез N-(3-(2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-47a)
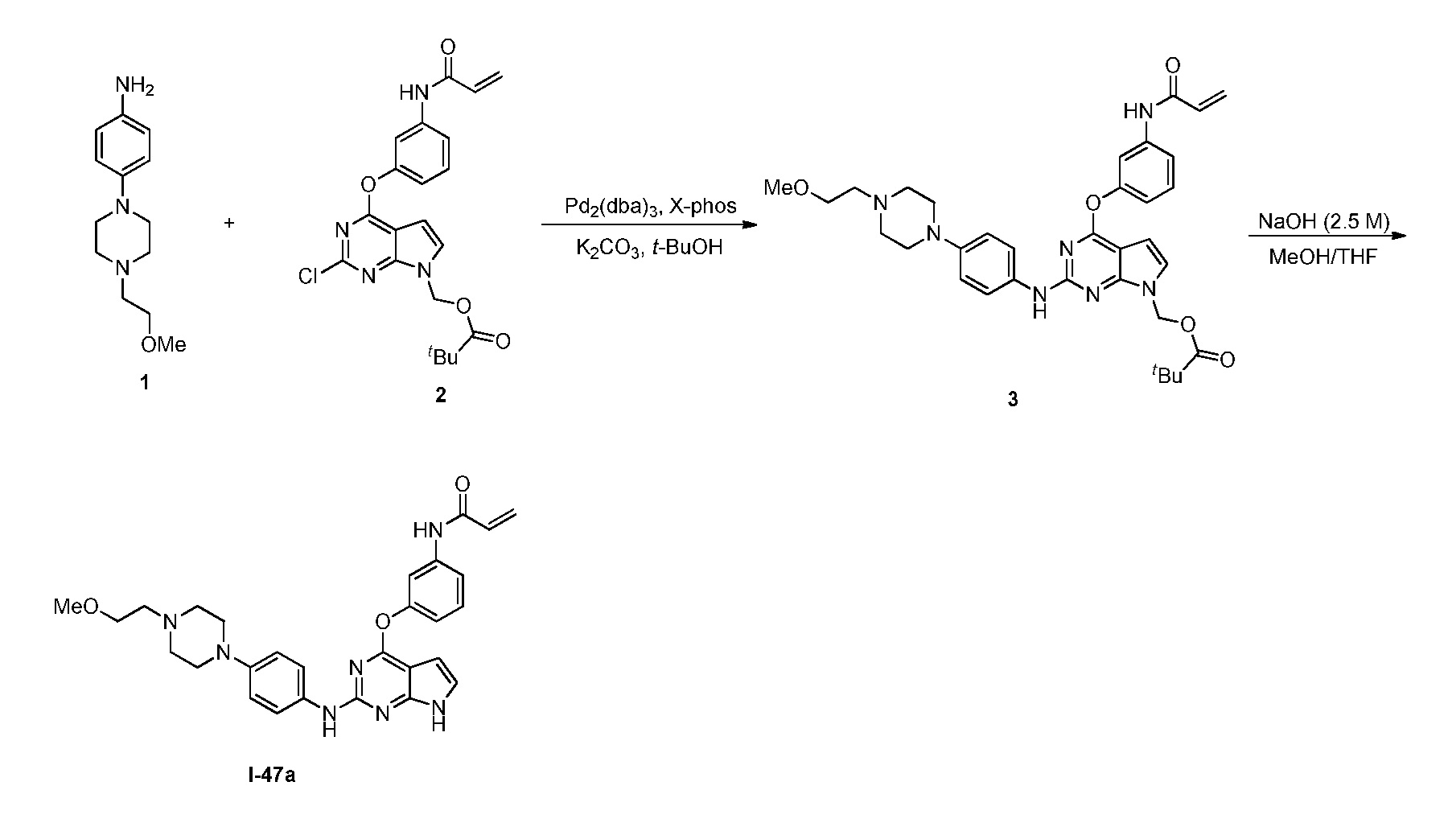
Синтез пивалата (4-(3-акриламидофенокси)-2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (2,445 г), соединение 2 (4,325 г), K2CO3 (2,801 г), трис(дибензилиденацетон)дипалладий (0,416 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,404 г) и трет-BuOH (60 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 3 (4,6 г, 72,7%).
Синтез N-(3-(2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-47a)
В круглодонную колбу (250 мл) загружают соединение 3 (4,5 г), MeOH (30 мл) и ТГФ (30 мл). Когда соединение 3 полностью растворится, раствор охлаждают до около 10°С на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 6 мл), сохраняя температуру ниже 16°C во время добавления. Смесь перемешивают в течение 1,5 ч при этой температуре. Затем воду (200 мл) добавляют в колбу в течение более 15 мин, сохраняя температуру ниже 20°C. Смесь экстрагируют этилацетатом (500 мл). Объединенные органические слои разделяют, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc в качестве подвижной фазы) с получением соединения I-47a (2,96 г, 80,4%, M+H+=514,6) в виде белого твердого вещества.
Пример 47
Синтез N-(3-(2-(3-фтор-4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-48a)
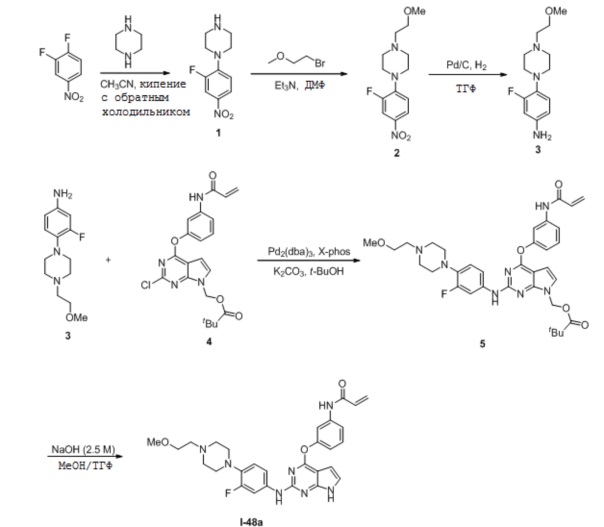
Синтез 1-(2-фтор-4-нитрофенил)пиперазина (1)
Смесь 1,2-дифтор-4-нитробензола (15,9 г), пиперазина (10,39 г) и ацетонитрила (100 мл) перемешивают при кипении с обратным холодильником в течение 7 ч. ТСХ показывает завершение реакции. После охлаждения смесь подщелачивают насыщенным водным раствором K2CO3 (100 мл) и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Растворители (40 мл, петролейный эфир/этилацетат = 1:1) добавляют к неочищенному продукту и перемешивают в течение ночи. Полученные остатки собирают и сушат с получением желаемого продукта 1, (13,5 г) в виде желтого твердого вещества.
Синтез 1-(2-фтор-4-нитрофенил)-4-(2-метоксиэтил)пиперазина (2)
К раствору 1-бром-2-метоксиэтана (8,7 г) и соединения 1 (11,4 г) в ДМФ (100 мл) при комнатной температуре добавляют Et3N (8,2 г). Смесь перемешивают при 54°C в течение ночи. Реакционную смесь выливают в ледяную воду (300 мл). Осадок собирают и повторно растворяют в этилацетате (200 мл). Органический слой промывают насыщенным раствором соли и концентрируют при пониженном давлении с получением желаемого соединения 2 (14,0 г, 98%), которое применяют на следующей стадии без дальнейшей очистки.
Синтез 3-фтор-4-(4-(2-метоксиэтил)пиперазин-1-ил)анилина (3)
Смесь соединения 2 (7,0 г) и Pd/C (0,586 г, 10% активированный на угле) в ТГФ (100 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. В этот момент ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 3 (6,3 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез пивалата (4-(3-акриламидофенокси)-2-(3-фтор-4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (5)
Соединение 3 (1,051 г), соединение 4 (1,806 г), K2CO3 (0,936 г), трис(дибензилиденацетон)дипалладий (0,166 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,195 г) и трет-BuOH (60 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 6 ч ТСХ (ДХМ/MeOH = 10/1 в качестве подвижной фазы) показывает завершение реакции. Смесь охлаждают до 40~50°C, фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения 5 (2,316 г, 90,9%).
Синтез N-(3-(2-(3-фтор-4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-48a)
В круглодонную колбу (250 мл) загружают соединение 5 (2,3 г), MeOH (10 мл) и ТГФ (10 мл). Когда соединение 5 полностью растворится, раствор охлаждают до около 10°С на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 3,5 мл), сохраняя температуру ниже 16°C во время добавления. Смесь непрерывно перемешивают в течение еще ч при этой температуре. Затем воду (40 мл) добавляют в колбу в течение более 15 мин, сохраняя температуру ниже 20°C. Смесь экстрагируют этилацетатом (500 мл). Объединенные органические слои разделяют, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-48a (0,814 г, 42,5%, M+H+=532,6).
1H ЯМР (500 МГц, CDCl3) δ 9,81 (с, 1H), 8,06 (с, 1H), 7,64 (с, 1H), 7,51-7,37 (м, 2H), 7,33 (т, J=8,0 Гц, 1H), 7,26 (с, 1H), 6,99 (д, J=7,3 Гц, 1H), 6,84 (д, J=8,0 Гц, 1H), 6,71 (т, J=9,1 Гц, 1H), 6,67 (с, 1H), 6,40 (д, J=16,8 Гц, 1H), 6,29-6,17 (м, 2H), 5,70 (д, J=10,2 Гц, 1H), 3,56 (дд, J=15,9, 11,0 Гц, 2H), 3,38 (с, 3H), 3,00 (с, 4H), 2,66 (д, J=4,7 Гц, 6H).
13C ЯМР (126 МГц, CDCl3) δ 171,28 (с), 163,75 (с), 162,68 (с), 156,59 (с), 155,11 (д, J=9,0 Гц), 154,65 (с), 153,45 (с), 138,98 (с), 135,62 (д, J=11,0 Гц), 134,26 (д, J=9,3 Гц), 130,98 (с), 129,75 (с), 128,04 (с), 120,68 (с), 119,07 (с), 117,96 (с), 116,88 (с), 114,53 (с), 114,08 (с), 107,60 (д, J=26,0 Гц), 99,56 (с), 99,39 (с), 69,91 (с), 58,91 (с), 57,96 (с), 53,63 (с), 50,69 (с).
Пример 48
Синтез (S)-N-(3-(2-(4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-49a)
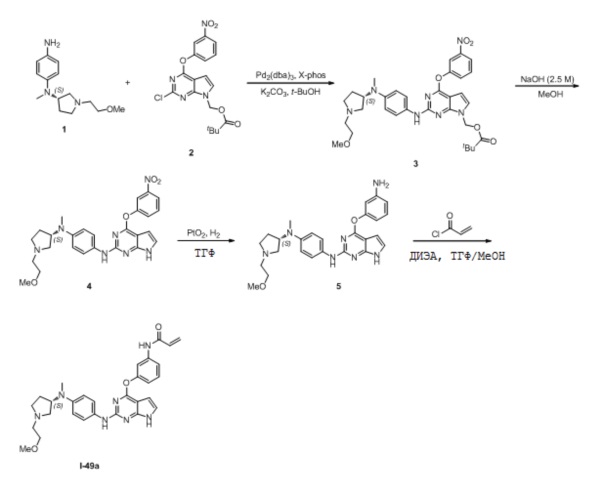
Синтез пивалата (S)-(2-(4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)-4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (1,010 г), соединение 2 (1,642 г), K2CO3 (1,262 г), трис(дибензилиденацетон)дипалладий (0,371 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,367 г) и трет-BuOH (15 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 22,5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (30 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (Этилацетат/MeOH = 20:1 в качестве подвижной фазы) с получением соединения 3 (1,74 г, 70,24%) в виде коричневого масла.
Синтез (S)-N1-(1-(2-метоксиэтил)пирролидин-3-ил)-N1-метил-N4-(4-(3-нитрофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)бензол-1,4-диамина (4)
В круглодонную колбу (250 мл) загружают соединение 3 (1,74 г), ТГФ (10 мл) и MeOH (20 мл). После того как соединение 3 полностью растворится, раствор охлаждают до ~10°C на ледяной бане. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 3 мл), сохраняя температуру ниже 16°C во время добавления. Смесь перемешивают в течение 5,5 ч при этой температуре. Воду (50 мл) медленно добавляют в колбу в течение более 15 мин, сохраняя температуру ниже 20°C во время добавления. Смесь экстрагируют этилацетатом. Объединенные органические слои концентрируют при пониженном давлении с получением соединения 4 (1,2 г).
Синтез (S)-N1-(4-(3-аминофенокси)-7H-пирроло[2,3-d]пиримидин-2-ил)-N4-(1-(2-метоксиэтил)пирролидин-3-ил)-N4-метилбензол-1,4-диамина (5)
Смесь соединения 4 (1,2 г) и PtO2 (33 мг) в ТГФ (15 мл) гидрируют с водородным баллоном при 50°C в течение 40 ч. ТСХ и ЖХ-МС показывают, что реакция не завершена. Реакционную смесь фильтруют через Целит®, и фильтрат концентрируют при пониженном давлении. Полученный остаток обрабатывают системой железо/NH4Cl водн./EtOH в течение 4 ч. В этот момент ТСХ и ЖХ/МС показывают завершение реакции. Смесь экстрагируют этилацетатом. Объединенные органические слои концентрируют при пониженном давлении с получением неочищенного продукта 5 (1,1 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-49a)
К раствору соединения 5 (1,1 г) и ДИЭА (1,001 г) в ТГФ/MeOH (4:1, 25 мл) при 0°C добавляют по каплям хлорид акрилоила (0,462 г) в течение более 5 мин. Смесь перемешивают в течение 1 ч при этой температуре. В этот момент ТСХ и ЖХ/МС показывают завершение реакции. Насыщенный водный раствор Na2CO3 (50 мл) добавляют для остановки реакции. Полученную смесь перемешивают в течение 10 мин и экстрагируют этилацетатом. Объединенные органические слои объединяют и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-49a (0,7 г, 57,1%, M+H+=528,6).
Пример 49
Синтез N-(3-(5-метокси-2-(2-(2-метоксиэтил)изоиндолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-50a)
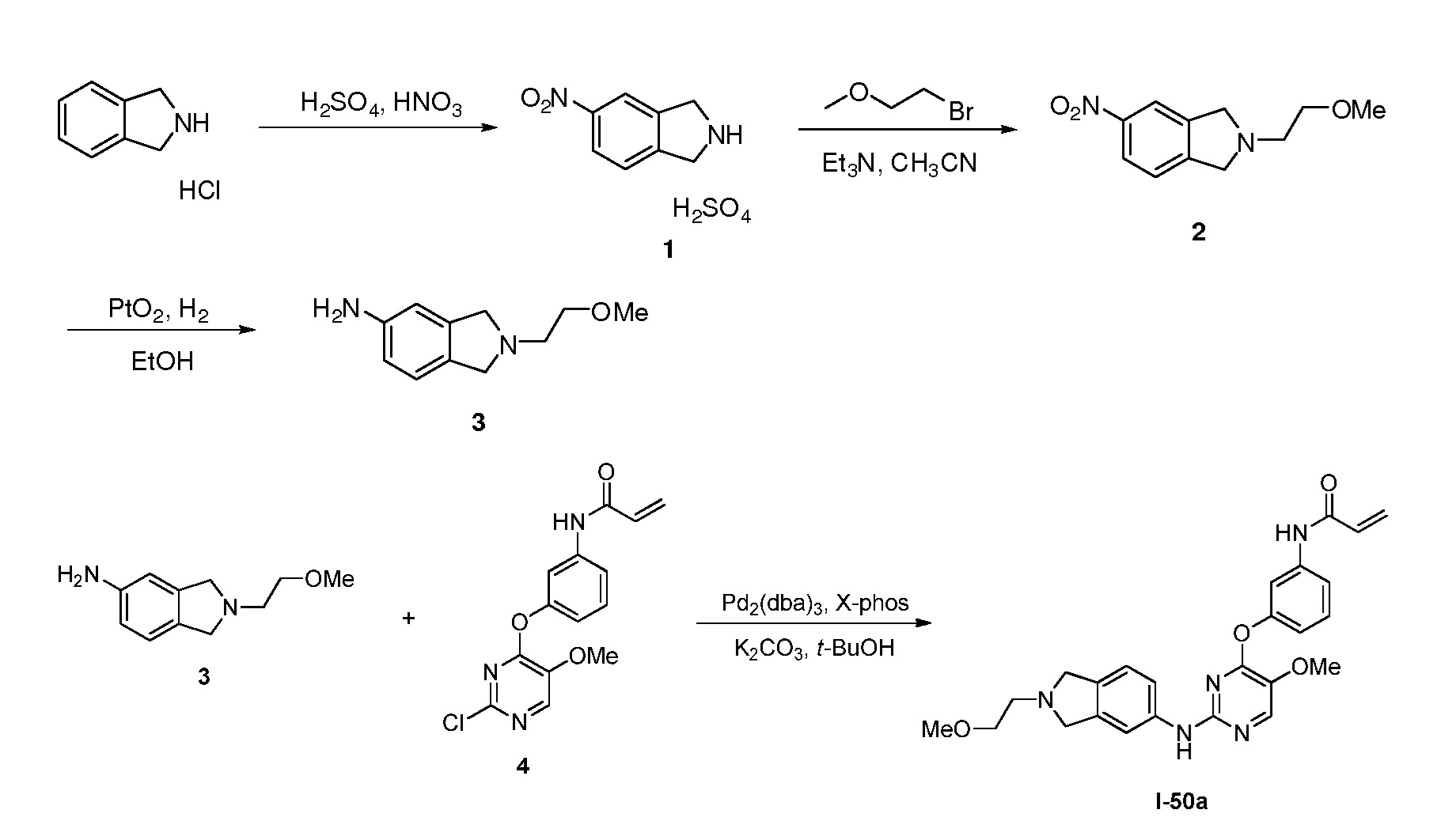
Синтез 5-нитроизоиндолина (1)
К концентрированной серной кислоте (3 мл) при -10°C добавляют гидрохлорид изоиндолина (1,569 г). Смесь перемешивают при -10°C в течение 15 мин. Дымящую азотную кислоту (3 мл) добавляют по каплям. Полученную смесь перемешивают в течение 35 мин при комнатной температуре и затем нагревают и перемешивают при 50°C в течение 35 мин. После охлаждения до комнатной температуры, смесь разбавляют этилацетатом (5 мл) и выливают в ледяную воду. Полученный осадок собирают, промывают небольшим количеством этилацетата и сушат с получением гидросульфата 5-нитроизоиндолина 1 (1,644 г, 62,7%).
Синтез 2-(2-метоксиэтил)-5-нитроизоиндолина (2)
К раствору 1-бром-2-метоксиэтана (0,5 г) и соединения 1 (0,5 г) в CH3CN (15 мл) добавляют Et3N (0,8 г). Смесь затем нагревают при 80°C и перемешивают в течение 7 ч. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и концентрируют при пониженном давлении с получением желаемого соединения 2 (650 мг, 96%), которое применяют на следующей стадии без дальнейшей очистки.
Синтез 2-(2-метоксиэтил)изоиндолин-5-амина (3)
Смесь соединения 2 (650 мг) и PtO2 (0,025 г) в ТГФ (10 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенные фильтраты концентрируют при пониженном давлении с получением желаемого продукта 3 (0,50 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(2-(2-метоксиэтил)изоиндолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-50a)
Соединение 3 (0,5 г), соединение 4 (0,8 г), K2CO3 (0,787 г), трис(дибензилиденацетон)дипалладий (0,116 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,126 г) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 19 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-50a (0,512 г, 42,7%, M+H+=462,5).
Пример 50
Синтез (S)-N-(3-(2-(4-(этил(1-(2-метоксиэтил)пирролидин-3-ил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-51a)
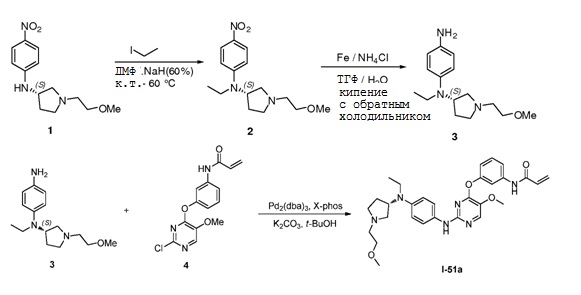
Синтез (S)-N-этил-1-(2-метоксиэтил)-N-(4-нитрофенил)пирролидин-3-амина (2)
К раствору соединения 1 (1,969 г, 7,428 ммоль) в ДМФ (10 мл) при 0°С последовательно добавляют NaH (0,318 г, 80% дисперсия в минеральном масле, 13,25 ммоль) и C2H5I (1,330 г, 8,52 ммоль). Смесь перемешивают при 60°C в течение 3 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (этилацетат/петролейный эфир от 33,3% до 100% в качестве подвижной фазы) с получением соединения 2 (0,280 г, 0,9 ммоль, 13%) в виде желтого масла.
Синтез (S)-N1-этил-N1-(1-(2-метоксиэтил)пирролидин-3-ил)бензол-1,4-диамина (3)
К соединению 2 (0,280 г, 0,9 ммоль) в ТГФ/H2O (20 мл/3 мл) добавляют железо (0,280 г, 5 ммоль) и NH4Cl (0,535 г, 10 ммоль). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. В этот момент ТСХ показывает завершение реакции. Смесь фильтруют. Фильтрат разбавляют этилацетатом и промывают насыщенным NaHCO3. Органический слой сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением желаемого соединения 3 (0,191 г, 81%), которое применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-(этил(1-(2-метоксиэтил)пирролидин-3-ил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-51a)
Соединение 3 (0,191 г, 0,73 ммоль), соединение 4 (0,315 г, 1 ммоль), K2CO3 (0,330 г, 2,5 ммоль), трис(дибензилиденацетон)дипалладий (0,096 г, 0,1 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,094 г, 0,2 ммоль) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-51a (0,150 г, 32%, M+H+=433,6).
1H ЯМР (500 МГц, CDCl3) δ 8,33 (с, 1H), 7,96 (с, 1H), 7,66 (с, 1H), 7,47 (д, J=7,7 Гц, 1H), 7,33 (т, J=8,1 Гц, 1H), 7,16 (д, J=8,7 Гц, 2H), 7,01-6,91 (м, 2H), 6,69 (д, J=8,8 Гц, 2H), 6,41 (д, J=16,7 Гц, 1H), 6,28 (дд, J=16,8, 10,2 Гц, 1H), 5,71 (д, J=10,4 Гц, 1H), 4,21-4,00 (м, 1H), 3,93 (д, J=16,2 Гц, 3H), 3,51 (т, J=5,6 Гц, 2H), 3,37 (с, 3H), 3,20-3,11 (м, 2H), 2,85 (д, J=10,0 Гц, 1H), 2,79-2,67 (м, 2H), 2,67-2,52 (м, 2H), 2,43 (дд, J=9,0, 7,3 Гц, 1H), 2,17-2,01 (м, 1H), 1,80-1,63 (м, 1H), 0,99 (т, J=7,0 Гц, 3H).
13C ЯМР (126 МГц, CDCl3) δ 163,73 (с), 160,38 (с), 154,20 (с), 152,97 (с), 144,59 (с), 142,94 (с), 139,24 (с), 135,36 (с), 131,91 (с), 131,07 (с), 129,61 (с), 127,97 (с), 120,12 (с), 118,43 (с), 117,96 (с), 116,76 (с), 114,05 (с), 71,14 (с), 58,87 (с), 58,60 (с), 58,53 (с), 58,06 (с), 55,76 (с), 53,89 (с), 44,13 (с), 29,32 (с), 13,36 (с).
Пример 51
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)-2-оксоиндолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-52a)
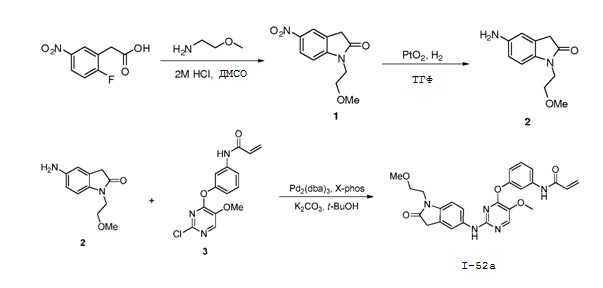
Синтез 1-(2-метоксиэтил)-5-нитроиндолин-2-она (1)
Раствор 2-(2-фтор-5-нитрофенил)уксусной кислоты (1,001 г) и 2-метоксиэтанамина (1,892 г) в ДМСО (5 мл) перемешивают при 45°C в течение ночи. Избыток 2-метоксиэтанамина удаляют при пониженном давлении, затем к смеси добавляют HCl (2M, 3 мл). Смесь перемешивают при 45°C в течение 1 ч. Реакцию гасят водой и экстрагируют этилацетатом. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке (ДХМ/петр. = 5/1 с каплями AcOH в качестве подвижной фазы) с получением соединения 1 (0,720 г, выход 60,7%) в виде желтого твердого вещества.
Синтез 5-амино-1-(2-метоксиэтил)индолин-2-она (2)
Смесь соединения 1 (0,401 г) и PtO2 (0,019 г) в ТГФ (15 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. После завершения реакции, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении и остаток повторно растворяют этилацетатом. Раствор промывают водой. Водный слой отделяют и экстрагируют этилацетатом (50 мл×3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением желаемого продукта 2 (0,345 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(1-(2-метоксиэтил)-2-оксоиндолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-52a)
Соединение 2 (0,360 г), соединение 3 (0,650 г), K2CO3 (0,610 г), трис(дибензилиденацетон)дипалладий (0,05 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,11 г) и трет-BuOH (13 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 6 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-52a (0,47 г, 56,6%, M+H+=476,5).
Пример 52
Синтез (S)-N-(3-(2-(4-(циклопропил(1-(2-метоксиэтил)пирролидин-3-ил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-53a)
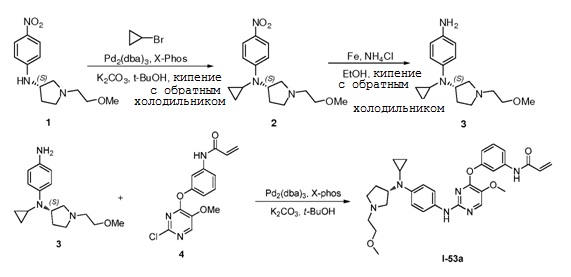
Синтез (S)-N-циклопропил-1-(2-метоксиэтил)-N-(4-нитрофенил)пирролидин-3-амина (2)
Смесь соединения 1 (1,090 г), циклопропилбромида (1,825 г), Pd2(dba)3 (0,200 г), X-Phos (0,201 г) и карбоната калия (2,032 г) в трет-бутаноле (15 мл) перемешивают под аргоном при кипении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтруют через Целит® и промывают этилацетатом. Объединенные фильтраты концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке с получением желаемого соединения 2 (260 мг, 21,85%).
Синтез (S)-N1-циклопропил-N1-(1-(2-метоксиэтил)пирролидин-3-ил)бензол-1,4-диамина (3)
К соединению 2 (260 мг) в EtOH/H2O (5:2, 14 мл) добавляют железо (201 мг) и NH4Cl (800 мг). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь фильтруют. Фильтрат разбавляют этилацетатом и промывают насыщенным водный раствором NaHCO3. Органический слой отделяют, сушат над Na2SO4 и концентрируют при пониженном давлении с получением желаемого соединения 3 (200 мг, 85,47%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-(циклопропил(1-(2-метоксиэтил)пирролидин-3-ил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-53a)
Соединение 3 (0,188 г), соединение 4 (0,235 г), K2CO3 (0,250 г), трис(дибензилиденацетон)дипалладий (0,076 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,085 г) и трет-BuOH (10 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-53a (70 мг, 18,8%, M+H+=545,6).
Пример 53
Синтез N-(3-(5-метокси-2-(4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-54a)
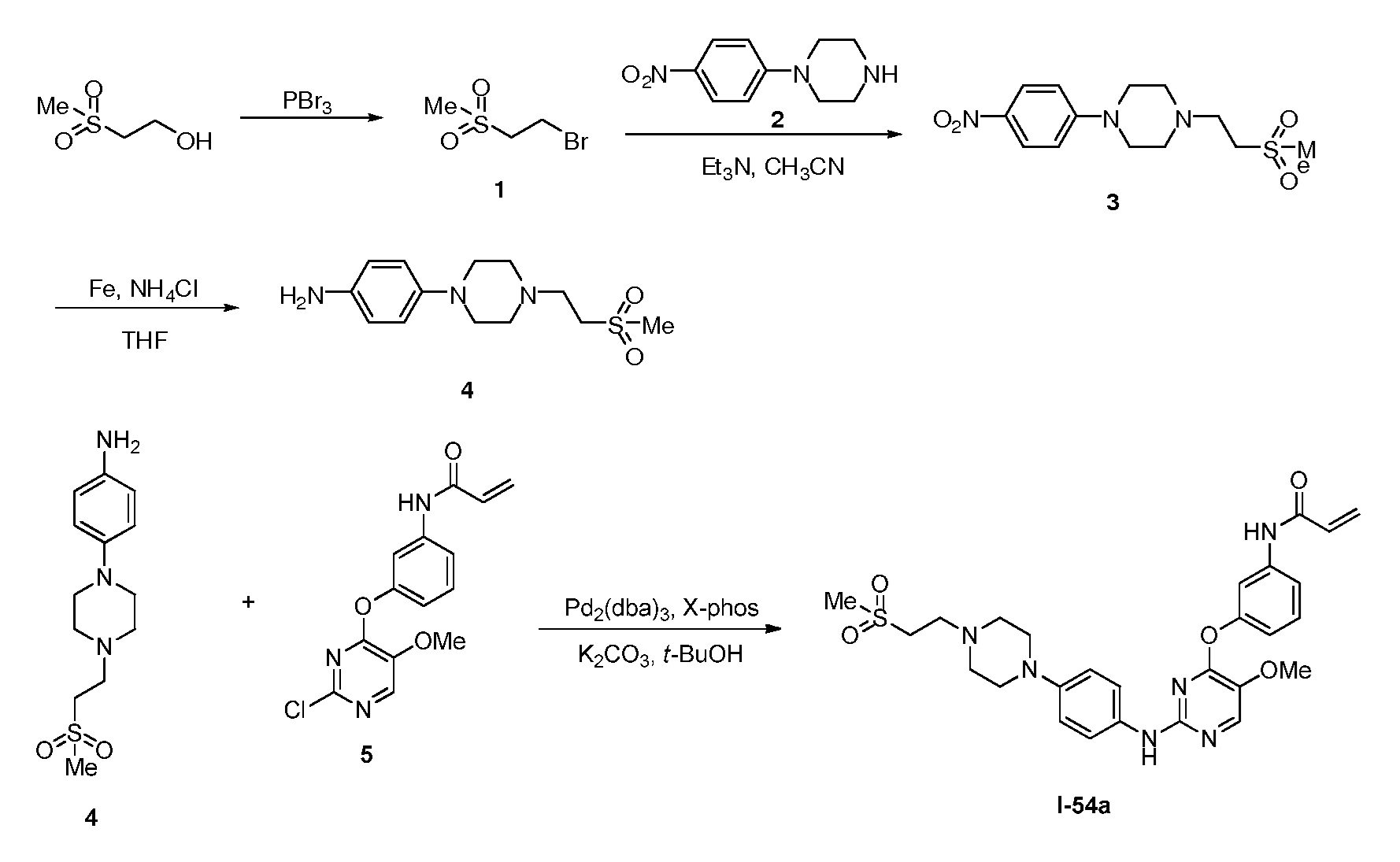
Синтез 1-бром-2-(метилсульфонил)этана (1)
Раствор 2-(метилсульфонил)этанола (2,5 г) и пиридина (0,1 мл) в ДХМ (30 мл) при 0°C добавляют PBr3 (6,3 г). Смесь нагревают и перемешивают при комнатной температуре в течение 4 ч. В этот момент ТСХ показывает завершение реакции. Смесь охлаждают до 0°C и воду добавляют для остановки реакции. Органический слой отделяют, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют при пониженном давлении с получением неочищенного продукта 1 (0,841 г, 22%), который применяют на следующей стадии без дальнейшей очистки.
Синтез 1-(2-(метилсульфонил)этил)-4-(4-нитрофенил)пиперазина (3)
К раствору 1-бром-2-(метилсульфонил)этана 1 (0,841 г) и соединения 2 (1,212 г) в CH3CN (20 мл) при комнатной температуре добавляют Et3N (1 мл). Смесь затем нагревают и перемешивают при 70°С в течение ночи. Органический растворитель удаляют при пониженном давлении. Остаток промывают этилацетатом, ТГФ и водой. Полученное твердое вещество собирают и сушат с получением неочищенного соединения 3 (1,2 г, 85%), которое применяют на следующей стадии без дальнейшей очистки.
Синтез 4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)анилина (4)
Раствор соединения 3 (1,2 г) в ТГФ/H2O (30 мл/5 мл) обрабатывают железом (2,1 г) и хлоридом аммония (1,0 г). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Смесь фильтруют через Целит® и промывают этилацетатом (100 мл). Фильтрат промывают насыщенным водным раствором NaHCO3 и водой и затем сушат над Na2SO4 и концентрируют при пониженном давлении с получением неочищенного продукта 4 (0,380 г, 35%), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)фениламино)пиримидин-4-илокси)фенил)акриламида (I-54a)
Соединение 4 (0,38 г), соединение 5 (0,463 г), K2CO3 (0,440 г), трис(дибензилиденацетон)дипалладий (0,913 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,860 г) и трет-BuOH (10 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-54a (0,564 г, 74,1%, M+H+=553,6).
Пример 54
Синтез (S)-N-(3-(5-метокси-2-(2-метокси-4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-55a)
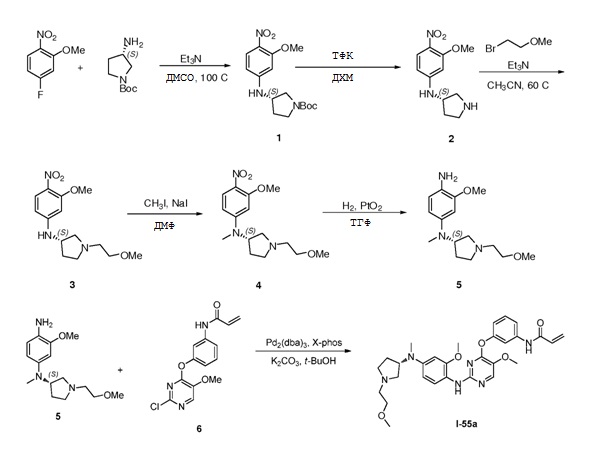
Синтез (S)-трет-бутил 3-(3-метокси-4-нитрофениламино)пирролидинe-1-карбоксилата (1)
В 3-горлую круглодонную колбу (250 мл), оборудованную парциальным конденсатором загружают 4-фтор-2-метокси-1-нитробензол (4,594 г) и (3S)-(-)-1-(трет-бутоксикарбонил)-3-аминопирролидин (5,0 г), ТЭА (3,030 г) в ДМСО (50 мл). Реакционную смесь нагревают и перемешивают при 80°C в течение ночи. После того, как ТСХ покажет завершение реакции, реакционную смесь гасят водой и перемешивают в течение 0,5 ч при комнатной температуре. Полученный осадок фильтруют и сушат с получением неочищенного соединения 1 (10,0 г) которое применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-метокси-4-нитрофенил)пирролидин-3-амина (2)
К неочищенному соединению 1 (10,0 г) в ДХМ (25 мл) добавляют ТФК (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После того, как ТСХ покажет завершение реакции, реакционную смесь концентрируют при пониженном давлении (для удаления большей части ТФК). Остаток разбавляют этилацетатом и подщелачивают добавлением насыщенного NaHCO3 (водн.) при 0°C. Органический слой отделяют, промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют при пониженном давлении с получением неочищенного соединения 2 (12 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-метокси-4-нитрофенил)-1-(2-метоксиэтил)пирролидин-3-амина (3)
К раствору 2-бромэтилметилового эфира (4,500 г) и соединения 2 (3,512 г) в CH3CN (100 мл) при комнатной температуре добавляют Et3N (6,0 г). Смесь нагревают и перемешивают при кипении с обратным холодильником в течение 2,5 ч. Реакционную смесь концентрируют при пониженном давлении. Остаток повторно растворяют в этилацетате (200 мл) и полученный раствор промывают водой, водный слой отделяют и экстрагируют этилацетатом. Органические слои объединяют, сушат над Na2SO4 и концентрируют при пониженном давлении. Неочищенный продукт промывают растворителями (петролейный эфир/этилацетат = 2:1) с получением желаемого соединения 3 (8,59 г, 57,5%).
(S)-N-(3-метокси-4-нитрофенил)-1-(2-метоксиэтил)-N-метилпирролидин-3-амин (4)
К раствору соединения 3 (8,590 г) в ДМФ (5 мл) при 0°С последовательно добавляют NaH (1,1 г, 80% дисперсия в минеральном масле) и CH3I (5,55 г). Полученную смесь затем перемешивают в течение 0,5 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Неочищенный продукт 4 (3,80 г, 42,2%) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез (S)-3-метокси-N1-(1-(2-метоксиэтил)пирролидин-3-ил)-N1-метилбензол-1,4-диамина (5)
Смесь соединения 4 (3,8 г) и PtO2 (0,130 г) в ТГФ (30 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. После завершения реакции, подтвержденного ТСХ, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке (этилацетат/EtOH = 8/2, 0,5% ТЭА в качестве подвижной фазы) с получением желаемого соединения 5 (2,323 г, 67,7%).
Синтез (S)-N-(3-(5-метокси-2-(2-метокси-4-((1-(2-метоксиэтил)пирролидин-3-ил)(метил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-55a)
Соединение 5 (2,323 г), соединение 6 (3,036 г), K2CO3 (2,289 г), трис(дибензилиденацетон)дипалладий (0,380 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,380 г) и трет-BuOH (40 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-55a (2,845 г, 62,4%, M+H+=549,6).
Пример 55
Синтез N-(3-(2-(1-ацетилиндолин-5-иламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-56a)
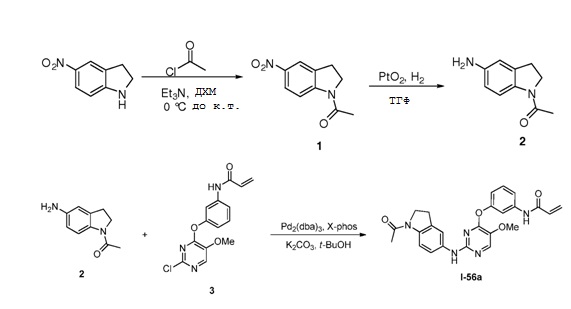
Синтез 1-(5-нитроиндолин-1-ил)этанона (1)
Раствор 5-нитроиндолина (1,010 г, 6,159 ммоль), ТЭА (0,810 г, 8,020 ммоль) в ДХМ (30 мл) при 0°C медленно добавляют ацетилхлорид (0,610 г, 7,82 ммоль). Смесь нагревают и перемешивают при комнатной температуре в течение 0,5 ч. Реакцию гасят водой (30 мл) и экстрагируют ДХМ (25 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 1 (1,015 г, 4,927 ммоль, 85%), который применяют на следующей стадии без дальнейшей очистки.
Синтез 1-(5-аминоиндолин-1-ил)этанона (2)
Смесь соединения 1 (1,015 г, 4,927 ммоль) и PtO2 (0,028 г, 0,14 ммоль) в ТГФ (30 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. После завершения реакции, подтвержденного ТСХ, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением желаемого продукта 2 (0,798 г, 92%), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(2-(1-ацетилиндолин-5-иламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-56a)
Соединение 2 (0,798 г, 4,531 ммоль), соединение 3 (1,956 г, 6,774 ммоль), K2CO3 (1,553 г, 11 ммоль), трис(дибензилиденацетон)дипалладий (0,313 г, 0,34 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,360 г, 0,68 ммоль) и трет-BuOH (40 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-56a (1,71 г, 84,8%, M+H+=446,6).
Пример 56
Синтез (S)-N-(3-(5-метокси-2-(4-(метил(1-(2-(метилсульфонил)этил)пирролидин-3-ил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-57a)
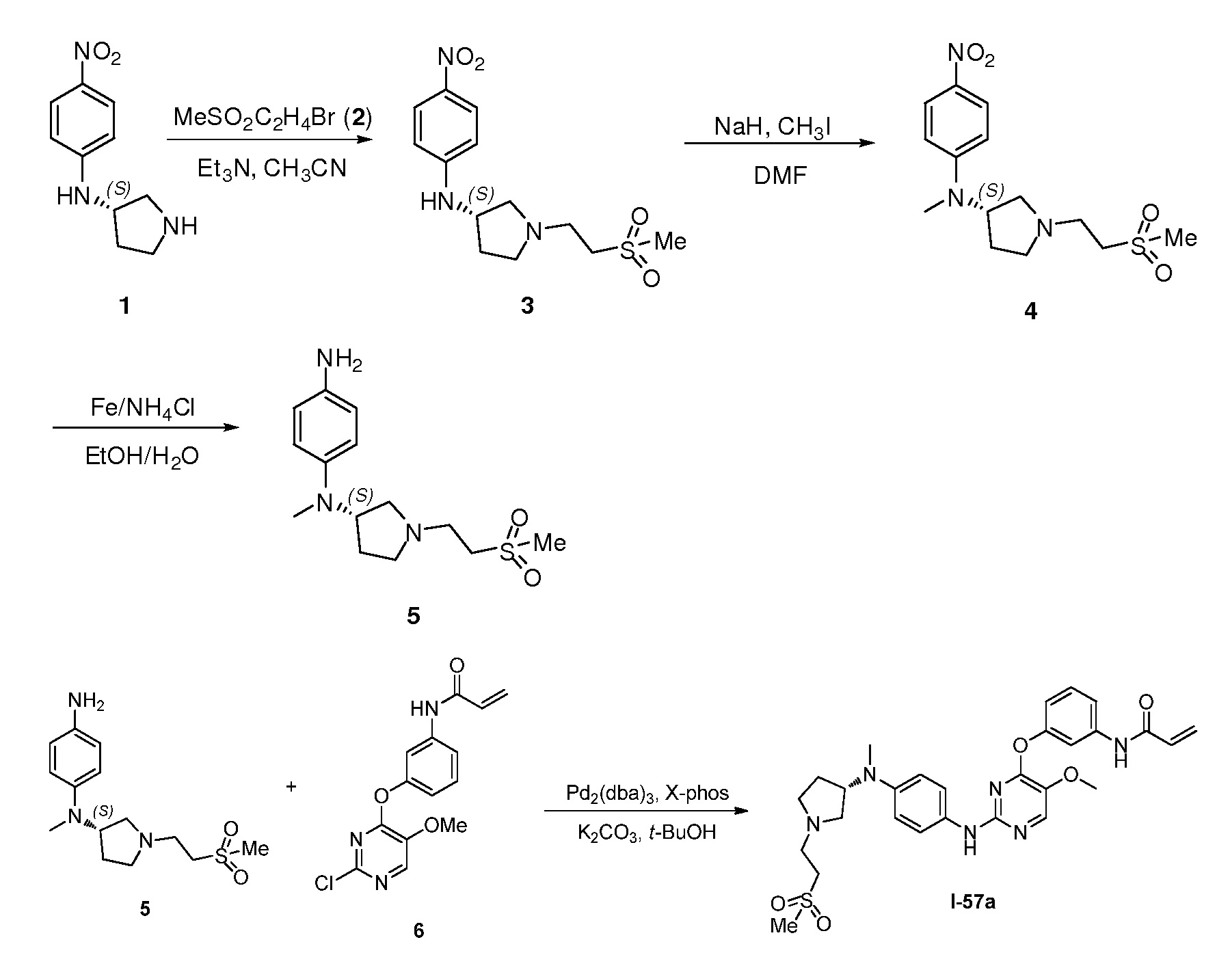
Синтез (S)-1-(2-(метилсульфонил)этил)-N-(4-нитрофенил)пирролидин-3-амина (3)
К раствору 1-бром-2-(метилсульфонил)этана (2, 3,824 г) и соединения 1 (3,512 г) в CH3CN (40 мл) при комнатной температуре добавляют Et3N (3,490 г). Смесь нагревают и перемешивают при кипении с обратным холодильником в течение 5 ч. Реакционную смесь затем выливают в ледяную воду (150 мл). Полученный осадок собирают, промывают и сушат с получением желаемого соединения 3 (3,484, 65,83%) в виде желтого твердого вещества, которое применяют на следующей стадии без дальнейшей очистки.
(S)-N-метил-1-(2-(метилсульфонил)этил)-N-(4-нитрофенил)пирролидин-3-амина (4)
К раствору соединения 3 (1,5 г) в ДМФ (10 мл) при 0°С последовательно добавляют NaH (0,399 г, 80% дисперсия в минеральном масле) и CH3I (0,924 г). Полученную смесь затем перемешивают в течение 1 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученный неочищенный продукт 4 (1,664 г) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез (S)-N1-метил-N1-(1-(2-(метилсульфонил)этил)пирролидин-3-ил)бензол-1,4-диамина (5)
Раствор соединения 4 (1,664 г) в EtOH/H2O (30 мл/1 мл) обрабатывают железом (1,143 г) и хлоридом аммония (4,512 г). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и фильтруют через Целит®. Фильтрат экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным водным раствором K2CO3 и концентрируют при пониженном давлении с получением неочищенного продукта 5 (0,758 г, 50%), который применяют на следующей стадии без дальнейшей очистки.
(S)-N-(3-(5-метокси-2-(4-(метил(1-(2-(метилсульфонил)этил)пирролидин-3-ил)амино)фениламино)пиримидин-4-илокси)фенил)акриламид (I-57a)
Соединение 5 (0,654 г), соединение 6 (0721 г), K2CO3 (0,702 г), трис(дибензилиденацетон)дипалладий (0,182 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,191 г) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 4,5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-57a (662 мг, 53,13%, M+H+=567,6).
Пример 57
Синтез (S)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-58a)
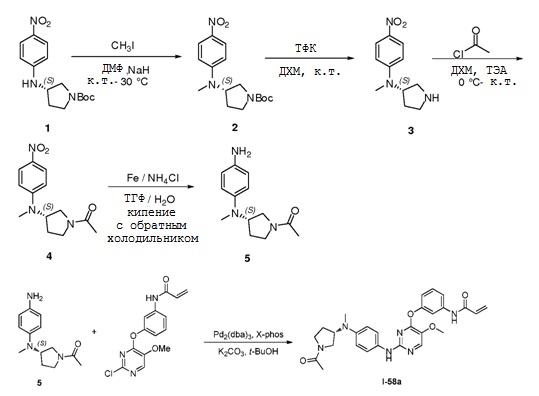
Синтез (S)-трет-бутил 3-(метил(4-нитрофенил)амино)пирролидинe-1-карбоксилата (2)
К раствору (S)-трет-бутил 3-(4-нитрофениламино)пирролидин-1-карбоксилата (1, 0,995 г, 3,257 ммоль) в ДМФ (5 мл) при 0°С последовательно добавляют NaH (0,165 г, 80% дисперсия в минеральном масле) и CH3I (0,705 г, 4,88 ммоль). Полученную смесь перемешивают в течение 0,5 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученный неочищенный продукт 2 (0,894 г, 2,931 ммоль, 90%) собирают, промывают, сушат и используют непосредственно на следующей стадии без дальнейшей очистки.
Синтез (S)-N-метил-N-(4-нитрофенил)пирролидин-3-амина (3)
К неочищенному соединению 2 (0,894 г, 2,931 ммоль) в ДХМ (10 мл) добавляют ТФК (2 мл). Реакционную смесь перемешивают при комнатной температуре до тех пор, пока ТСХ (петролейный эфир/этилацетат = 1/3 в качестве подвижной фазы) не покажет завершение реакции. Реакционную смесь концентрируют при пониженном давлении для удаления большей части ТФК. Остаток подщелачивают NaHCO3 (водн., 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 3 (0,504 г, 2,28 ммоль, 78%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-1-(3-(метил(4-нитрофенил)амино)пирролидин-1-ил)этанона (4)
В раствор соединения 3 (0,504 г, 2,28 ммоль), ТЭА (0,303 г, 3 ммоль) в ДХМ (20 мл) при 0°C медленно добавляют ацетилхлорид (0,610 г, 7,82 ммоль). Смесь нагревают и перемешивают при комнатной температуре в течение 0,5 ч. Реакцию гасят водой (30 мл) и экстрагируют ДХМ (25 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 4 (0,492 г, 1,87 ммоль, 82%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-1-(3-((4-аминофенил)(метил)амино)пирролидин-1-ил)этанона (5)
Раствор соединения 4 (0,320 г, 1,217 ммоль) в ТГФ/H2O (20 мл/3 мл) обрабатывают железом (0,280 г, 5 ммоль) и хлоридом аммония (0,535 г, 10 ммоль). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь фильтруют через Целит®. Фильтрат подщелачивают NaHCO3 (водн., 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 5 (0,230 г, 1 ммоль, 82%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-58a)
Соединение 5 (0,230 г, 1 ммоль), соединение 6 (0,368 г, 1,217 ммоль), K2CO3 (0,376 г, 2,5 ммоль), трис(дибензилиденацетон)дипалладий (0,058 г, 0,06 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,060 г, 0,12 ммоль) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 4,5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-58a (0,15 г, 30%, M+H+=503,6).
1H ЯМР (500 МГц, ДМСО) δ 10,35 (с, 1H), 8,99 (д, J=4,3 Гц, 1H), 8,16 (с, 1H), 7,67-7,56 (м, 2H), 7,49-7,37 (м, 1H), 7,28 (дд, J=9,0, 2,1 Гц, 2H), 6,95 (дд, J=8,0, 1,6 Гц, 1H), 6,65 (дд, J=9,1, 3,4 Гц, 2H), 6,44 (дд, J=16,9, 10,1 Гц, 1H), 6,27 (дд, J=17,0, 1,2 Гц, 1H), 5,77 (дд, J=10,1, 1,9 Гц, 1H), 4,24-3,99 (м, 1H), 3,87 (с, 3H), 3,63-3,46 (м, 2H), 3,33-3,07 (м, 2H), 2,63 (д, J=15,0 Гц, 3H), 1,93 (д, J=1,6 Гц, 3H), 2,06-1,80 (м, 2H).
13C ЯМР (126 МГц, ДМСО) δ 168,77 (д, J=6,8 Гц), 163,80 (с), 159,89 (с), 154,25 (д, J=1,6 Гц), 153,24 (с), 145,45 (д, J=7,3 Гц), 144,39 (с), 140,70 (с), 135,05 (д, J=2,5 Гц), 133,41 (с), 133,13 (с), 132,07 (с), 130,33 (с), 127,75 (с), 119,79 (д, J=4,9 Гц), 117,23 (с), 116,62 (д, J=5,8 Гц), 113,41 (с), 59,72 (с), 58,58 (с), 58,07 (с), 48,76 (с), 47,70 (с), 45,94 (с), 44,16 (с), 35,59 (с), 34,90 (с), 29,04 (с), 27,37 (с), 22,73 (с), 22,19 (с).
Пример 58
Синтез N-(3-(5-метокси-2-(1-(метилсульфонил)индолин-5-иламино)пиримидин-4-илокси)фенил)акриламид (I-59a)
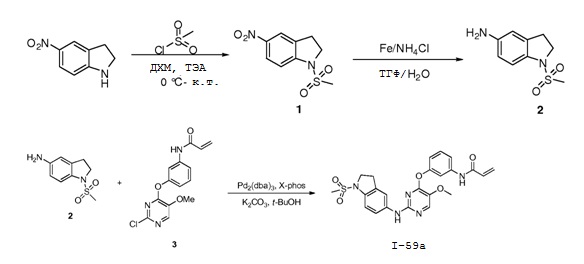
Синтез 1-(метилсульфонил)-5-нитроиндолина (1)
В раствор 5-нитроиндолина (1,033 г, 6,30 ммоль), ТЭА (0,827 г, 8,19 ммоль) в ДХМ (30 мл) при 0°C медленно добавляют метилсульфонилхлорид (0,868 г, 7,56 ммоль). Смесь нагревают и перемешивают при комнатной температуре в течение 0,5 ч. Реакцию гасят водой (30 мл) и экстрагируют ДХМ (25 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 1 (1,427 г, 5,9 ммоль, выход 95%), который применяют на следующей стадии без дальнейшей очистки.
Синтез 1-(метилсульфонил)индолин-5-амина (2)
Раствор соединения 1 (1,427 г, 5,9 ммоль) в ТГФ/H2O (20 мл/3 мл) обрабатывают железом (1,372 г, 24,5 ммоль) и хлоридом аммония (2,621 г, 49 ммоль). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь фильтруют через Целит®. Фильтрат подщелачивают NaHCO3 (водн., 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 2 (0,742 г, 3,5 ммоль, 59,3%), который применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-(5-метокси-2-(1-(метилсульфонил)индолин-5-иламино)пиримидин-4-илокси)фенил)акриламида (I-59a)
Соединение 2 (0,420 г, 2 ммоль), соединение 3 (0,660 г, 2,3 ммоль), K2CO3 (0,494 г, 3 ммоль), трис(дибензилиденацетон)дипалладий (0,093 г, 0,1 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,115 г, 0,22 ммоль) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-59a (0,24 г, 25%, M+H+=482,5).
Пример 59
Синтез (S)-N-(3-(5-метокси-2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-60a)
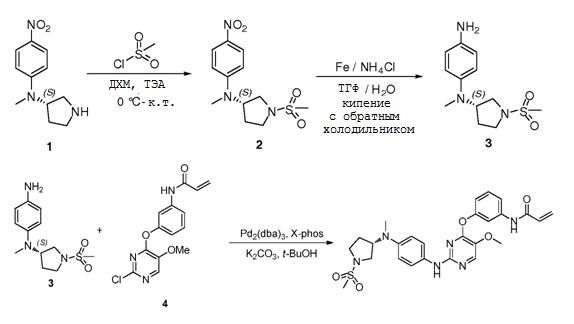
Синтез (S)-N-метил-1-(метилсульфонил)-N-(4-нитрофенил)пирролидин-3-амина (2)
Раствор соединения 1 (0,504 г, 3 ммоль), ТЭА (0,404 г, 4 ммоль) в ДХМ (20 мл) при 0°C медленно добавляют метилсульфонилхлорид (0,402 г, 3,5 ммоль). Смесь нагревают и перемешивают при комнатной температуре в течение 0,5 ч. Реакцию гасят водой (30 мл) и экстрагируют ДХМ (25 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного остатка 2 (0,762 г, 2,55 ммоль, выход 85%), который применяют на следующей стадии без дальнейшей очистки.
(S)-N1-метил-N1-(1-(метилсульфонил)пирролидин-3-ил)бензол-1,4-диамина (3)
Раствор соединения 2 (0,762 г, 2,55 ммоль) в ТГФ/H2O (20 мл/3 мл) обрабатывают железом (0,560 г, 10 ммоль) и хлоридом аммония (1,070 г, 20 ммоль). Смесь перемешивают при кипении с обратным холодильником в течение 2 ч. Реакционную смесь фильтруют через Целит®. Фильтрат подщелачивают NaHCO3 (водн., 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 3 (0,511 г, 1,9 ммоль, 75%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(5-метокси-2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)пиримидин-4-илокси)фенил)акриламида (I-60a)
Соединение 3 (0,340 г, 1,5 ммоль), соединение 4 (0,550 г, 1,8 ммоль), K2CO3 (0,414 г, 3 ммоль), трис(дибензилиденацетон)дипалладий (0,137 г, 0,15 ммоль), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,143 г, 0,3 ммоль) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-60a (0,33 г, 41%, M+H+=539,6).
1H ЯМР (500 МГц, CDCl3) δ 8,48 (с, 1H), 7,94 (с, 1H), 7,67 (с, 1H), 7,48 (д, J=7,8 Гц, 1H), 7,33 (т, J=8,1 Гц, 1H), 7,22 (с, J=14,5 Гц, 1H), 7,16 (д, J=8,8 Гц, 2H), 6,92 (д, J=7,1 Гц, 1H), 6,68 (д, J=8,8 Гц, 2H), 6,38 (дд, J=16,8, 1,3 Гц, 1H), 6,29 (дд, J=16,9, 10,0 Гц, 1H), 5,68 (дд, J=10,1, 1,3 Гц, 1H), 4,07-3,97 (м, 1H), 3,89 (с, 3H), 3,51-3,41 (м, 2H), 3,37-3,26 (м, 1H), 3,17 (дд, J=10,2, 6,7 Гц, 1H), 2,84 (с, 3H), 2,70 (с, 3H), 2,14-2,05 (м, 1H), 2,03-1,94 (м, 1H).
13C ЯМР (126 МГц, CDCl3) δ 163,90 (с), 160,47 (с), 153,91 (с), 152,97 (с), 145,41 (с), 142,83 (с), 139,37 (с), 135,46 (с), 133,38 (с), 131,13 (с), 129,61 (с), 127,92 (с), 119,96 (с, ×2), 118,61 (с, ×2), 117,87 (с), 116,88 (с), 114,16 (с), 60,56 (с), 58,04 (с), 49,98 (с), 46,60 (с), 37,28 (с), 34,79 (с), 29,24 (с).
Пример 60
Синтез (S)-N-(3-(2-(4-(1-ацетилпирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-61a)
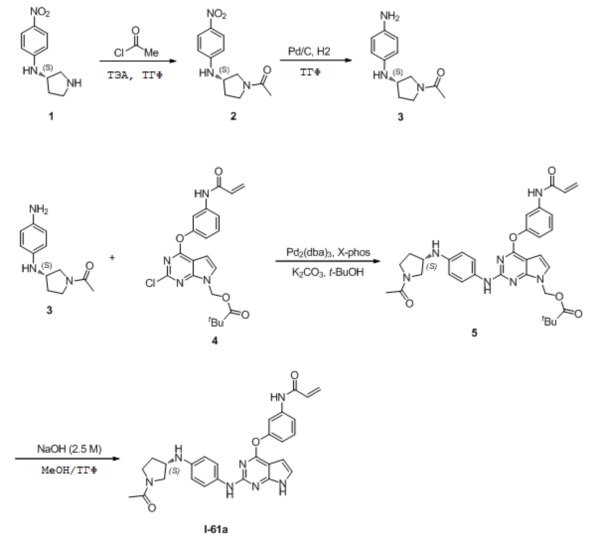
Синтез (S)-1-(3-(4-нитрофениламино)пирролидин-1-ил)этанона (2)
В раствор соединения 1 (2,139 г), ТЭА (1,568 г) в ТГФ (40 мл) при -10°C медленно добавляют ацетилхлорид (0,806 г, растворенный в 4 мл ТГФ). Смесь перемешивают при этой температуре в течение 4 ч. Реакцию гасят водой и экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 2 (1,88 г, 73,2%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-1-(3-(4-аминофениламино)пирролидин-1-ил)этанона (3)
Смесь соединения 2 (1,88 г) и Pd/C (0,198 г, 10% активированный на угле) в ТГФ (30 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. После завершения реакции, подтвержденного ТСХ, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 3 (1,65 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез пивалата (S)-(2-(4-(1-ацетилпирролидин-3-иламино)фениламино)-4-(3-акриламидофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (5)
Соединение 3 (1,6 г), соединение 4 (3,1 г), K2CO3 (2,0 г), трис(дибензилиденацетон)дипалладий (0,3 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,3 г) и трет-BuOH (50 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 5 (2,4 г, 54,2%).
Синтез (S)-N-(3-(2-(4-(1-ацетилпирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-61a)
В круглодонную колбу (250 мл) загружают соединение 5 (2,4 г), MeOH (15 мл) и ТГФ (15 мл). После того, как соединение 5 полностью растворится, раствор охлаждают до -5°C. Затем в колбу медленно добавляют водный раствор NaOH (2,5 M, 3,1 мл). Смесь перемешивают в течение 2 ч при этой температуре. Затем добавляют воду (80 мл) для остановки реакции. Смесь экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-61a (1,4 г, 71,8%, M+H+=498,6).
Пример 61
(S)-N-(3-(2-(4-(1-(метилсульфонил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-62a)
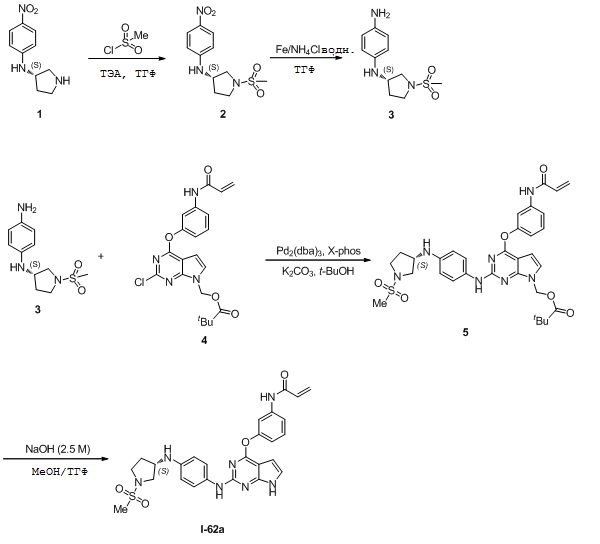
Синтез (S)-1-(метилсульфонил)-N-(4-нитрофенил)пирролидин-3-амина (2)
Раствор соединения 1 (4,158 г), ТЭА (3,026 г) в ТГФ (50 мл) при -10°C медленно добавляют метилсульфонилхлорид (2,3 г, растворенный в 5 мл ТГФ). Смесь перемешивают при этой температуре в течение 3 ч. Реакцию гасят водой (100 мл) и экстрагируют этилацетатом (150 мл). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 2 (4,3 г, 75,2%), который применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N1-(1-(метилсульфонил)пирролидин-3-ил)бензол-1,4-диамина (3)
Раствор соединения 2 (4,3 г) в ТГФ/H2O (90 мл/30 мл) обрабатывают железом (3,3 г), затем хлоридом аммония (4,8 г). Смесь перемешивают при кипении с обратным холодильником в течение 4,5 ч. После охлаждения до комнатной температуры, реакционную смесь фильтруют через Целит®. Фильтрат подщелачивают NaHCO3 (воде., 30 мл) и экстрагируют этилацетатом (30 мл ×4). Органический слой объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного соединения 3 (3,1 г, 80,7%), которое применяют на следующей стадии без дальнейшей очистки.
Синтез пивалата (S)-(4-(3-акриламидофенокси)-2-(4-(1-(метилсульфонил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (5)
Соединение 3 (3,1 г), соединение 4 (5,2 г), K2CO3 (2,5 г), трис(дибензилиденацетон)дипалладий (0,6 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,6 г) и трет-BuOH (80 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 4 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 5 (4,1 г, 52,2%).
Синтез (S)-N-(3-(2-(4-(1-(метилсульфонил)пирролидин-3-иламино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-62a)
В круглодонную колбу (250 мл) загружают соединение 5 (2,1 г), MeOH (12 мл) и ТГФ (12 мл). После того, как соединение 5 полностью растворится, раствор охлаждают до -5°C. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 3 мл). Смесь перемешивают в течение 1 ч при этой температуре. Затем добавляют воду (40 мл) для остановки реакции. Смесь экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-62a (1,0 г, 57,8%, M+H+=498,6).
Пример 62
(S)-N-(3-(2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-63a)
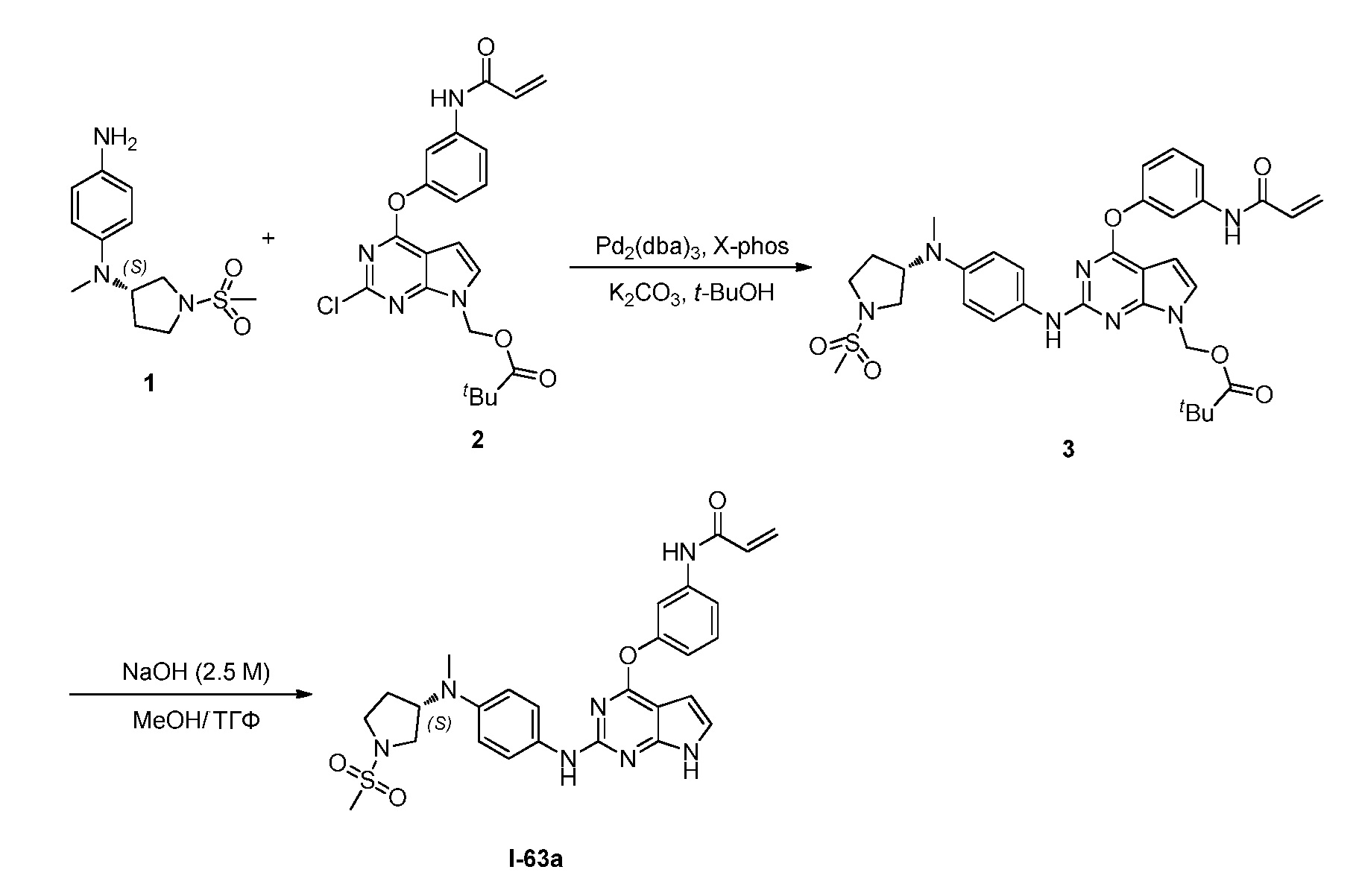
Синтез трет-бутилкарбоната (S)-(4-(3-акриламидофенокси)-2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (0,5 г), соединение 2 (0,876 г), K2CO3 (0,512 г), трис(дибензилиденацетон)дипалладий (0,102 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,104 г) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 3,5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетат (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 3 (0,8 г, 59,3%).
Синтез (S)-N-(3-(2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-63a)
В круглодонную колбу (250 мл) загружают соединение 3 (0,8 г), MeOH (20 мл) и ТГФ (2 мл). После того, как соединение 3 полностью растворится, раствор охлаждают до -5°C. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 1,5 мл). Смесь перемешивают в течение 2 ч при этой температуре. Воду (40 мл) добавляют для остановки реакции. Смесь экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке с получением соединения I-63a (0,25 г, 37,8%, M+H+=548,6).
Пример 63
Синтез (S)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-64a)
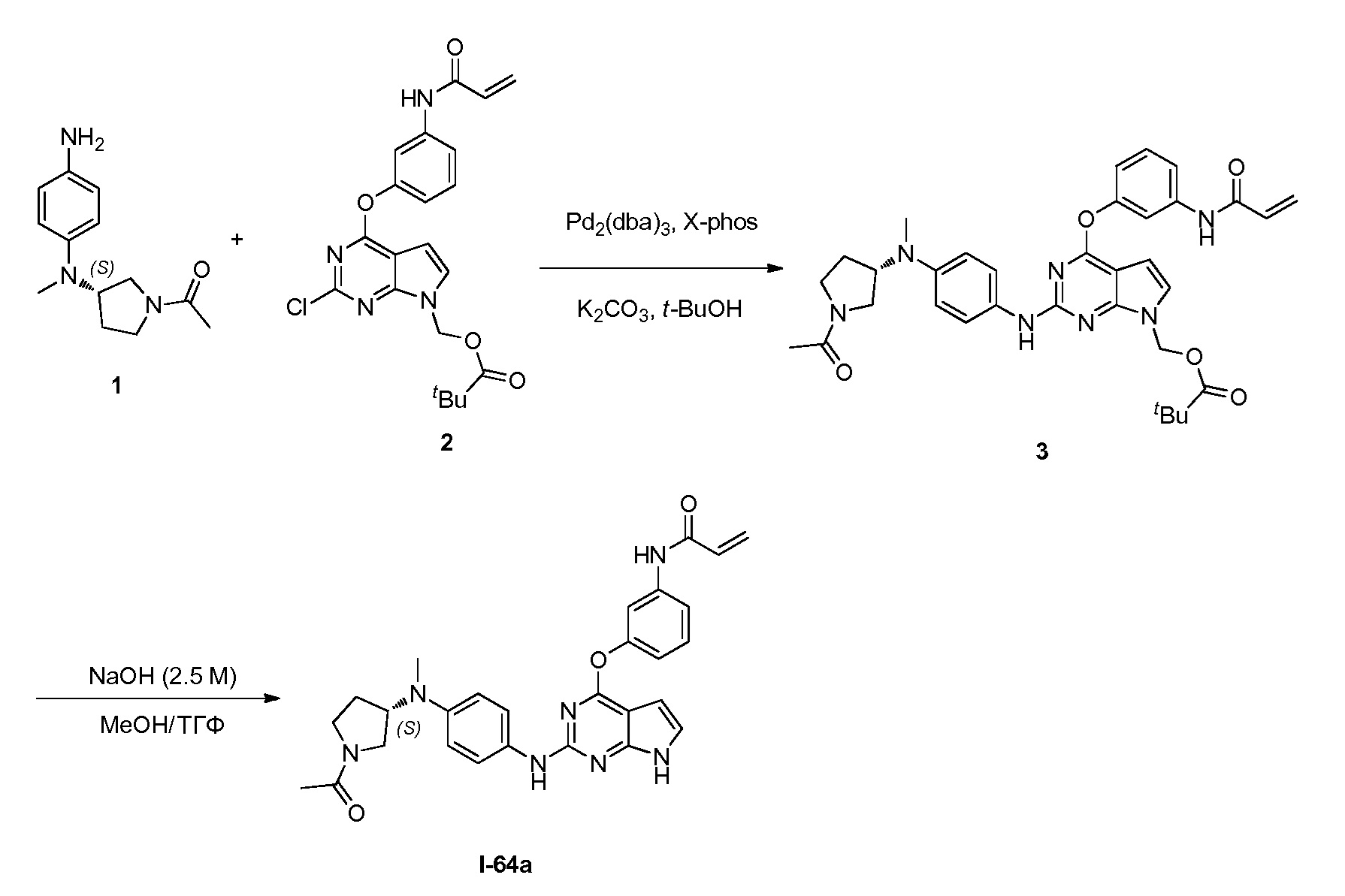
Синтез трет-бутилкарбоната (S)-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-4-(3-акриламидофенокси)-7H-пирроло[2,3-d]пиримидин-7-ил)метила (3)
Соединение 1 (0,9 г), соединение 2 (1,65 г), K2CO3 (1,07 г), трис(дибензилиденацетон)дипалладий (0,35 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,35 г) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 4 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения 3 (1,24 г, 51,7%).
Синтез (S)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-7H-пирроло[2,3-d]пиримидин-4-илокси)фенил)акриламида (I-64a)
В круглодонную колбу (250 мл) загружают соединение 3 (1,24 г), MeOH (10 мл) и ТГФ (5 мл). Когда соединение 3 полностью растворится, раствор охлаждают до -5°C. Затем в колбу медленно добавляют раствор NaOH (2,5 M, 1,6 мл). Смесь перемешивают в течение 1 ч при этой температуре. Воду (40 мл) добавляют для остановки реакции. Смесь экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке с получением соединения I-64a (0,265 г, 26,2%, M+H+=512,6).
Пример 64
Синтез N-(3-(2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-65a)
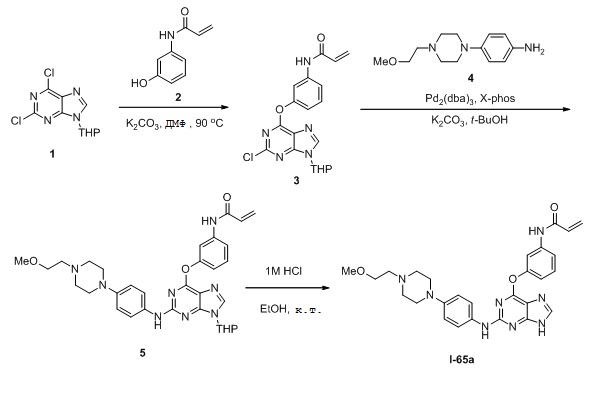
Синтез N-(3-(2-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламид (3)
К смеси пурина 1 (2,7 г) и фенола 2 (1,6 г) в ДМФ (40 мл) добавляют K2CO3 (2,2 г). Реакционную смесь перемешивают при 90°С в течение 4 ч. Как только ТСХ показывает завершение реакции, смесь выливают в воду (150 мл). Полученный осадок собирают, промывают водой (100 мл) и сушат в вакууме с получением желаемого соединения 3 (3,2 г, 80%) в виде белого твердого вещества.
Синтез N-(3-(2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламида (5)
Соединение 3 (1,6 г), соединение 4 (0,8 г), K2CO3 (0,97 г), трис(дибензилиденацетон)дипалладий (0,115 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,126 г) и трет-BuOH (20 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 23 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (EtOAc/MeOH = 15:1 в качестве подвижной фазы) с получением соединения 5 (1,1 г, 54,2%, M+H+= 599) в виде желтоватого твердого вещества.
Синтез N-(3-(2-(4-(4-(2-метоксиэтил)пиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-65a)
К раствору соединения 5 (0,6 г) в EtOH (10 мл)добавляют HCl водн. (2 мл, 1N). Смесь перемешивают при комнатной температуре в течение 3 ч. Затем добавляют еще порцию HCl водн. (0,5 мл, ~ 12 M) и реакционную смесь перемешивают в течение еще 3,5 ч, затем гасят и подщелачивают K2CO3 (1,3 г в 10 мл воды). Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. К этому неочищенному продукту (600 мг) добавляют этилацетат (30 мл) и перемешивают в течение 1,5 ч. Раствор концентрируют до снижения объема до 10 мл. Полученный осадок собирают, промывают и сушат с получением желаемого соединения I-65a (250 мг, 48,5%, M+H+=515,6)
Пример 65
Синтез (S)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-66a)
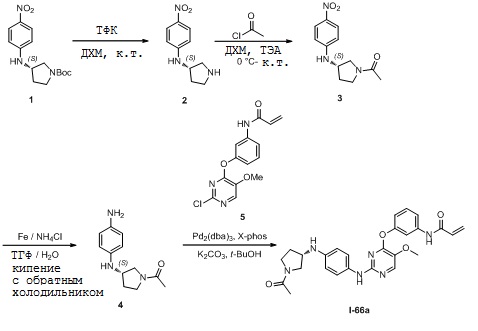
Соединение I-66 может быть синтезировано с применением указанной выше схемы синтеза. Соединение I-66a выделено как побочный продукт (неметилированный) синтеза I-58a.
Пример 66
Синтез (S)-N-(3-(2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-67a)
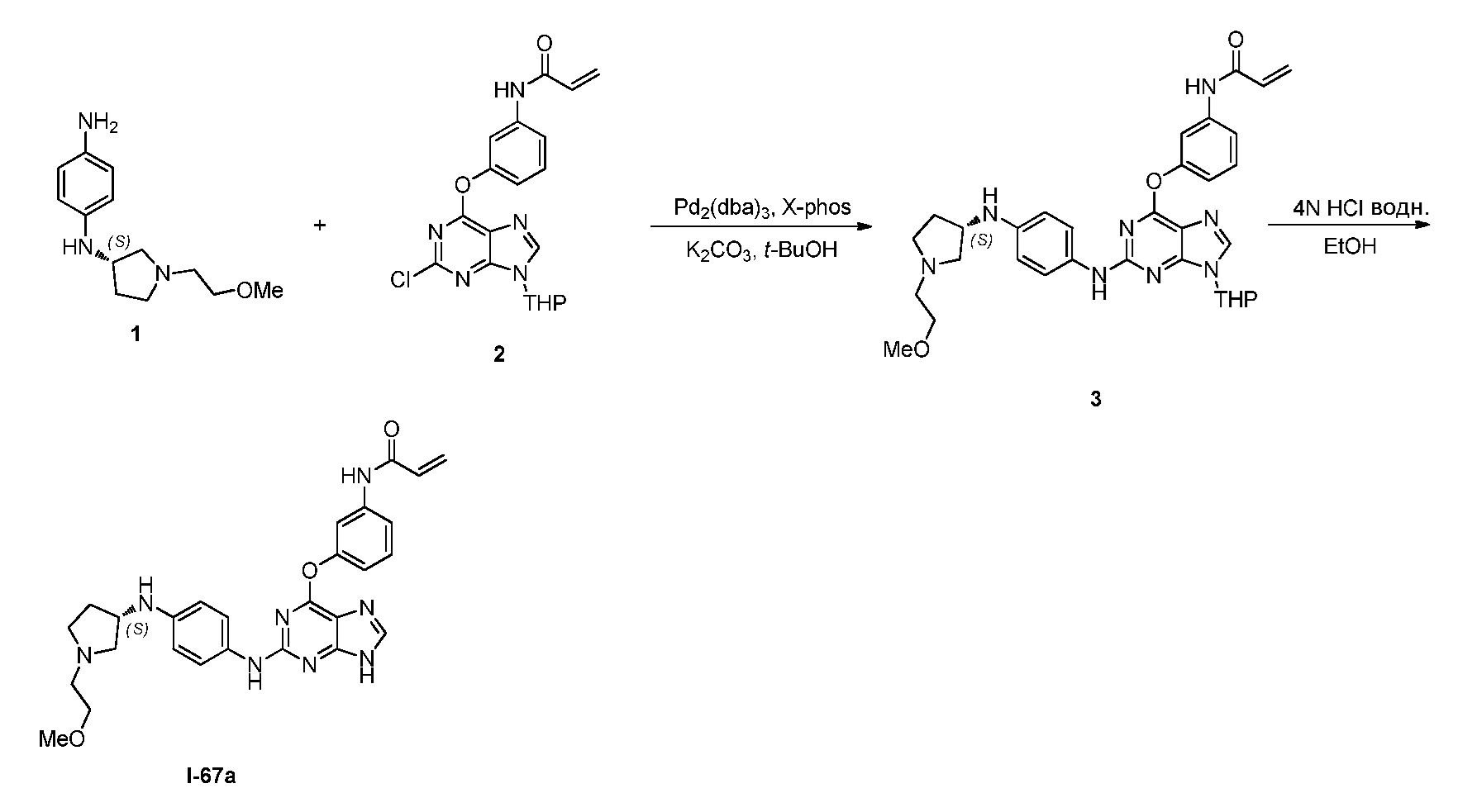
Синтез N-(3-(2-(4-((S)-1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламида (3)
Соединение 1 (0,99 г), соединение 2 (1,53 г), K2CO3 (1,90 г), трис(дибензилиденацетон)дипалладий (0,21 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,23 г) и трет-BuOH (25 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 20 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (EtOAc/EtOH = 10:1 в качестве подвижной фазы) с получением соединения 3 (1,0 г, 43,7%) в виде желтоватого твердого вещества.
Синтез (S)-N-(3-(2-(4-(1-(2-метоксиэтил)пирролидин-3-иламино)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-67a)
К раствору соединения 3 (1,0 г) в EtOH (10 мл) добавляют HCl водн. (3 мл, 4N). Смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят и подщелачивают водным раствором NaHCO3. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (EtOAc/EtOH = 10/1 в качестве подвижной фазы) с получением соединения I-67a (0,41 г, 47,7%, M+H+=515,6).
Пример 67
Синтез N-(3-(2-(4-(4-ацетилпиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-68a)
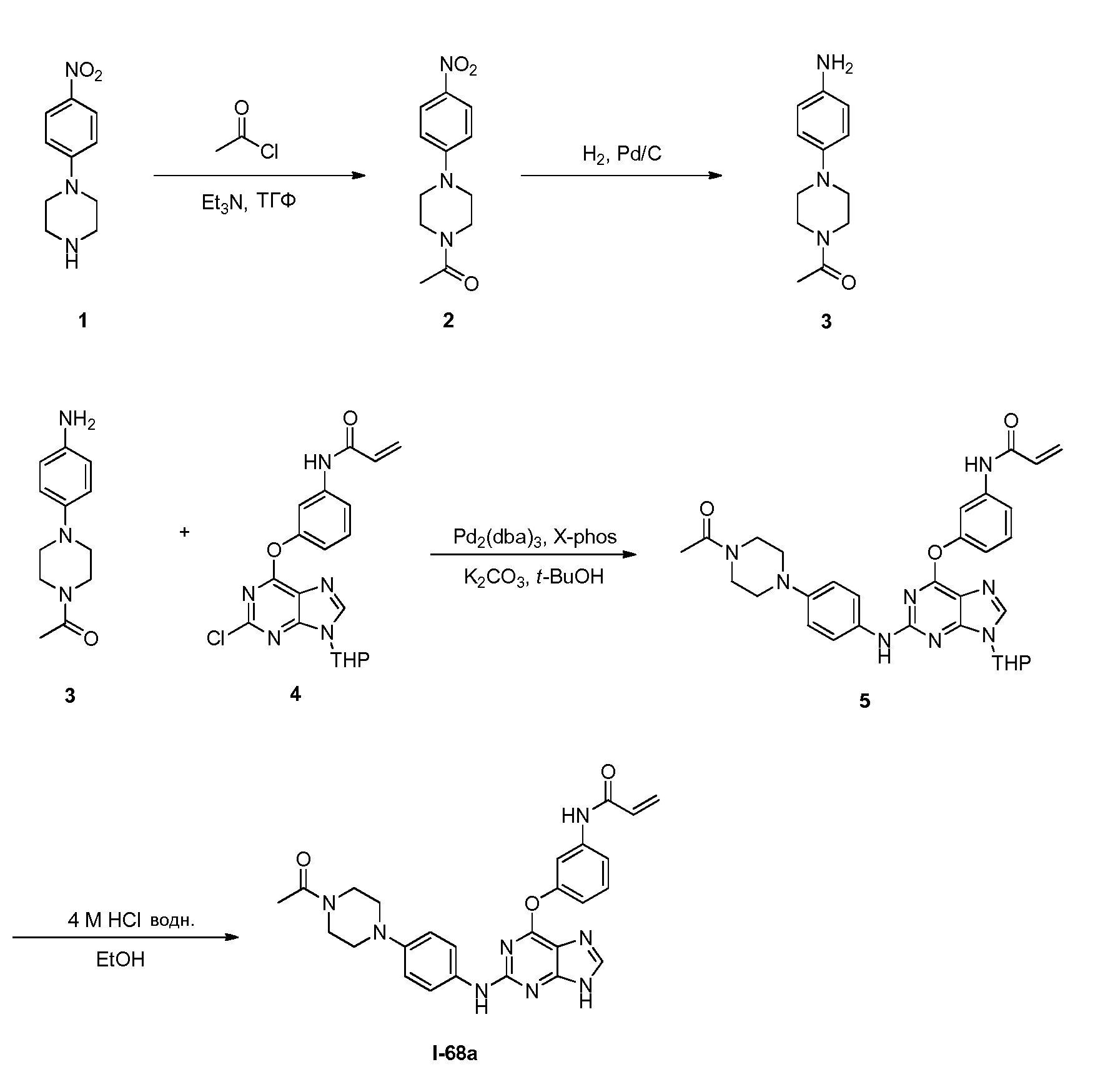
Синтез 1-(4-(4-нитрофенил)пиперазин-1-ил)этанона (2)
Раствор соединения 1 (10 г), ТЭА (5,891 г) в ТГФ (50 мл) при 0°C медленно добавляют ацетилхлорид (4,605 г). Смесь перемешивают при этой температуре в течение 1,5 ч. Растворитель удаляют. Полученный остаток разбавляют водой (30 мл), подщелачивают водным раствором K2CO3 (насыщенным, 20 мл) и затем экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного соединения 2 (10,2 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез 1-(4-(4-аминофенил)пиперазин-1-ил)этанона (3)
Раствор соединения 2 (9,0 г) и Pd/C (0,700 г, 10% активированный на угле) в ТГФ (30 мл) и 1,4-диоксане (30 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. Как только ТСХ покажет завершение реакции, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 3 (9,7 г), который применяют на следующей стадии без дальнейшей очистки.
N-(3-(2-(4-(4-ацетилпиперазин-1-ил)фениламино)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламида (5)
Соединение 3 (0,798 г), соединение 4 (1,605 г), K2CO3 (1,32 г), трис(дибензилиденацетон)дипалладий (0,167 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,172 г) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5,5 ч ТСХ (ДХМ:Метанол = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (EtOAc/EtOH = 25:1 в качестве подвижной фазы) с получением соединения 5 (1,4 г, 66,0%) в виде коричневого твердого вещества.
Синтез N-(3-(2-(4-(4-ацетилпиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-68a)
К раствору соединения 5 (1,4 г) в EtOH (10 мл) добавляют HCl водн. (4,6 мл, 4N). Смесь перемешивают при комнатной температуре в течение 5 ч. Добавляют еще HCl водн. (1 мл, ~ 12 M) и реакционную смесь перемешивают в течение еще 18 ч. ТСХ показывает завершение реакции. Реакцию гасят и подщелачивают K2CO3 водн. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (EtOAc/EtOH = 15/1 в качестве подвижной фазы) с получением соединения I-68a (0,254 г, 21,2%, M+H+=499,6).
Пример 68
Синтез N-(3-(2-(4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-69a)
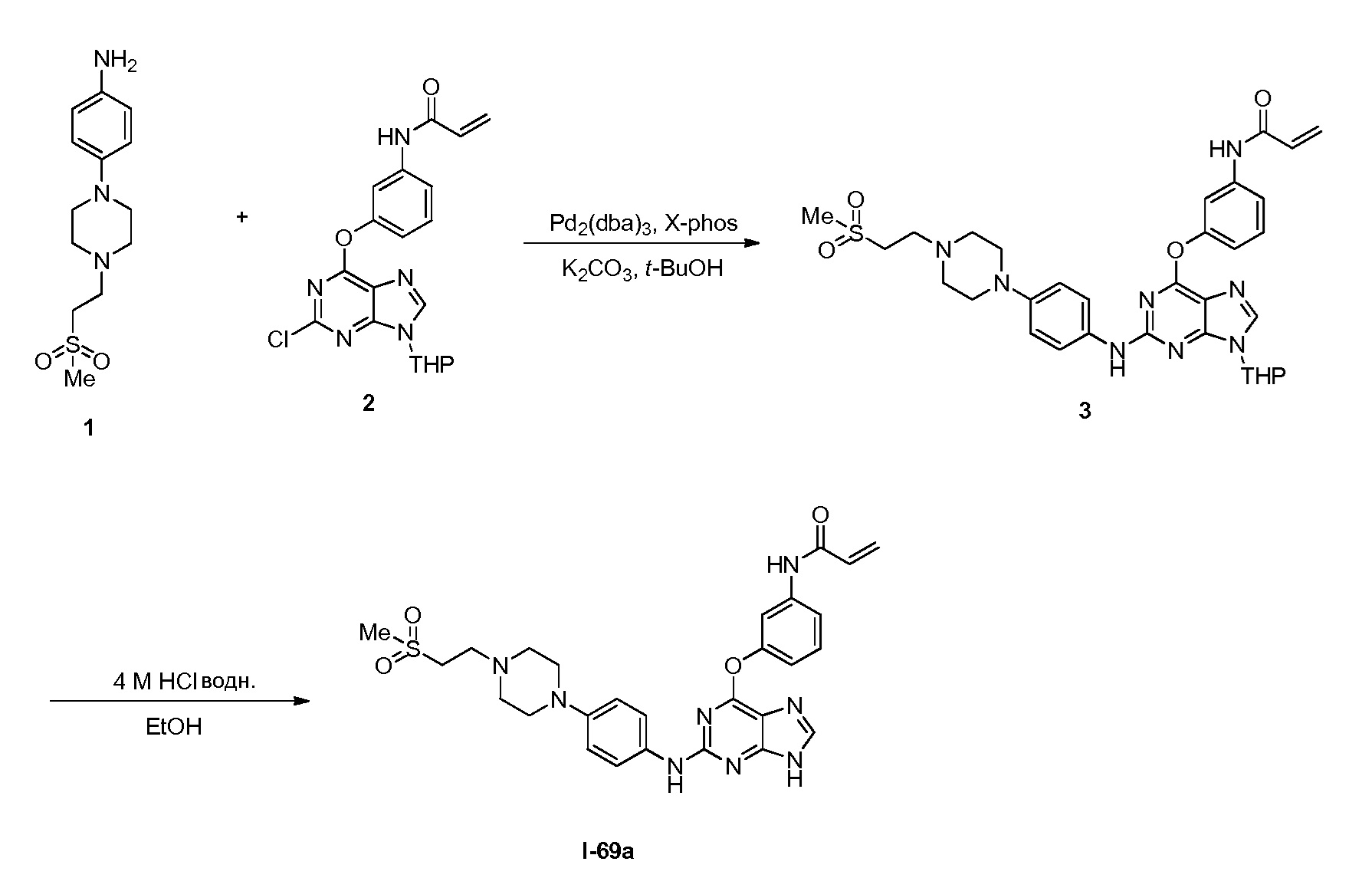
Синтез N-(3-(2-(4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)фениламино)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламида (3)
Соединение 1 (1,033 г), соединение 2 (1,616 г), K2CO3 (0,97 г), трис(дибензилиденацетон)дипалладий (0,170 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,185 г) и трет-BuOH (30 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 6 ч ТСХ (EtOAc:EtOH = 5:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (EtOAc/EtOH = 15:1 в качестве подвижной фазы) с получением соединения 5 (1,4 г, 59,3%, M+H+=647) в виде желтоватого твердого вещества.
Синтез N-(3-(2-(4-(4-(2-(метилсульфонил)этил)пиперазин-1-ил)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-69a)
К раствору соединения 3 (1,4 г) в EtOH (50 мл) добавляют HCl водн. (4,5 мл, 4N). Смесь перемешивают при комнатной температуре в течение 5 ч. Добавляют еще HCl водн. (1 мл, ~ 12M) и реакционную смесь перемешивают в течение еще 60 ч. ТСХ показывает завершение реакции. Реакцию гасят и подщелачивают K2CO3 водн. Реакционную смесь экстрагируют этилацетатом. Органический слой отделяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный неочищенный продукт очищают хроматографией на колонке (EtOAc/EtOH = 20/1 в качестве подвижной фазы) с получением соединения I-69a (0,22 г, 18%, M+H+ = 563,5).
Пример 69
Синтез N-(3-((2-((2,2-диоксидо-1,3-дигидробензо[c]изотиазол-5-ил)амино)-5-метоксипиримидин-4-ил)окси)фенил)акриламида (I-70a)
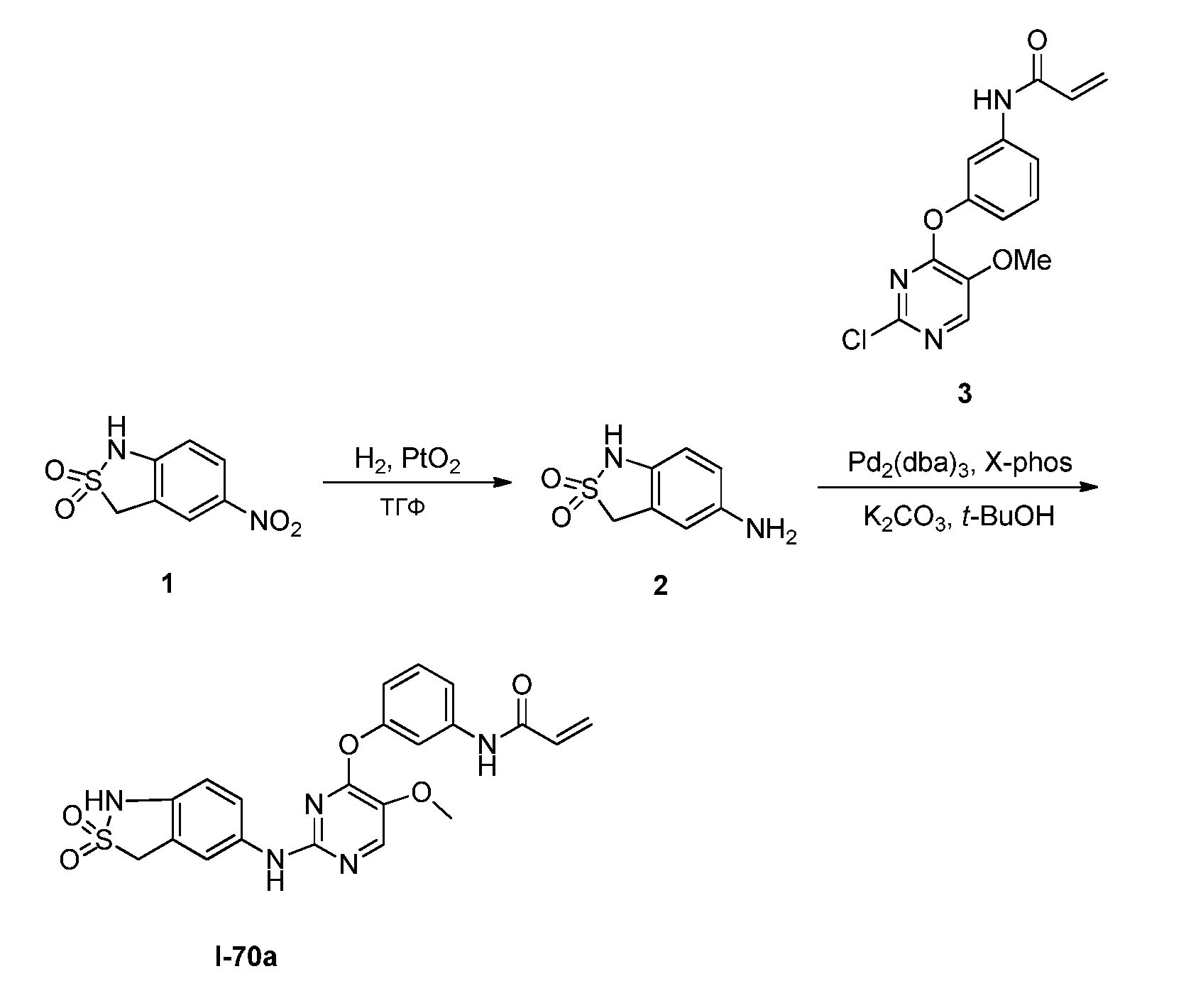
Синтез 2,2-диоксида 5-амино-1,3-дигидробензо[c]изотиазола (2):
Смесь соединения 1 (180 мг, синтезировано согласно WO2005/12295) и PtO2 (10 мг) в ТГФ (4 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. ТСХ показывает завершение реакции. Реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 2 (0,11 г), которое применяют на следующей стадии без дальнейшей очистки.
Синтез N-(3-((2-((2,2-диоксидо-1,3-дигидробензо[c]изотиазол-5-ил)амино)-5-метоксипиримидин-4-ил)окси)фенил)акриламида (I-70a)
Соединение 2 (0,11 г), соединение 3 (0,219 г), K2CO3 (0,22 г), трис(дибензилиденацетон)дипалладий (0,02 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,04 г) и трет-BuOH (3 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 7,5 ч ТСХ (ДХМ:MeOH = 10:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (ДХМ/MeOH = 50:1 в качестве подвижной фазы) с получением соединения I-70a (26 мг, 11,1%, M+H+=454,5) в виде желтоватого твердого вещества.
Пример 70
Синтез (S)-N-(3-(2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-71a)
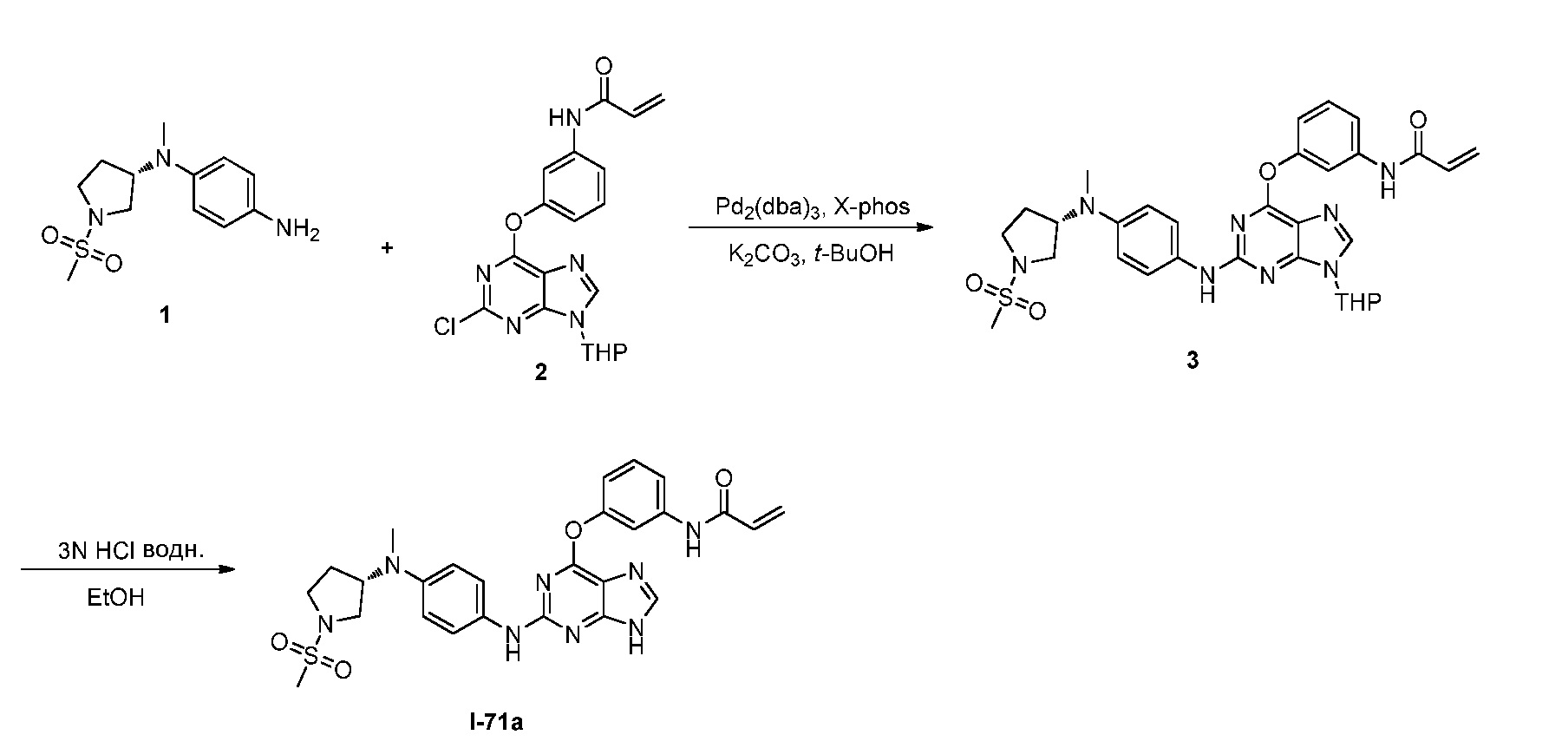
N-(3-(2-(4-(метил((S)-1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-илокси)фенил)акриламид (3)
Соединение 1 (0,35 г), соединение 2 (0,532 г), K2CO3 (0,362 г), трис(дибензилиденацетон)дипалладий (0,064 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,063 г) и трет-BuOH (10 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 5 ч ТСХ (ДХМ:MeOH = 25:1 в качестве подвижной фазы) показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением соединения 3 (664 мг), которое применяют на следующей стадии без дальнейшей очистки.
Синтез (S)-N-(3-(2-(4-(метил(1-(метилсульфонил)пирролидин-3-ил)амино)фениламино)-9H-пурин-6-илокси)фенил)акриламида (I-71a)
К раствору соединения 3 (1,4 г) в EtOH (20 мл) добавляют HCl водн. (6 мл, 3N). Смесь перемешивают при комнатной температуре в течение 16 ч. ТСХ показывает завершение реакции. Реакцию гасят и подщелачивают K2CO3 водн. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (ДХМ/MeOH = 20/1 в качестве подвижной фазы) с получением соединения I-71a (0,31 г, 53,88%, M+H+ = 549,6).
Пример 71
Синтез (R)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-72a)
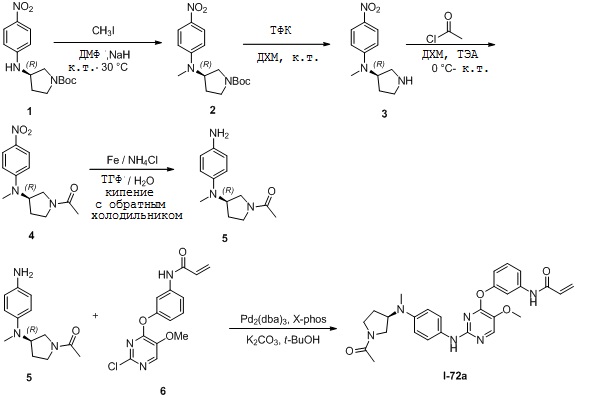
Синтез (R)-трет-бутил 3-(метил(4-нитрофенил)амино)пирролидин-1-карбоксилата (2)
К раствору (R)-трет-бутил 3-(4-нитрофениламино)пирролидин-1-карбоксилата (1, 5,1 г) в ДМФ (50 мл) при 0°С последовательно добавляют NaH (0,6 г, 80% дисперсия в минеральном масле) и CH3I (2,7 г). Полученную смесь затем перемешивают в течение 3 ч. Реакционную смесь гасят водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Полученный неочищенный продукт 2 (5,38 г) применяют непосредственно на следующей стадии без дальнейшей очистки.
Синтез (R)-N-метил-N-(4-нитрофенил)пирролидин-3-амина (3)
К неочищенному продукту 2 (5,3 г) в ДХМ (15 мл) добавляют ТФК (6,8 мл). Реакционную смесь перемешивают при комнатной температуре до тех пор, пока ТСХ (петролейный эфир/этилацетат = 1:3 в качестве подвижной фазы) не покажет завершение реакции. Реакционную смесь концентрируют при пониженном давлении для удаления большей части ТФК. Полученный остаток подщелачивают NaHCO3 (водн., 30 мл) и экстрагируют ЭА (30 мл ×4). Органические слои объединяют, сушат и концентрируют при пониженном давлении с получением неочищенного продукта 3 (4,54 г), который применяют на следующей стадии без дальнейшей очистки.
(R)-1-(3-(метил(4-нитрофенил)амино)пирролидин-1-ил)этанон (4)
Раствор соединения 3 (4,0 г), ТЭА (2,31 г) в MeOH (60 мл) при 0°C медленно добавляют ацетилхлорид (1,84 г). Смесь нагревают и перемешивают при комнатной температуре в течение 0,5 ч. Реакцию гасят водой (30 мл) и экстрагируют ДХМ (25 мл ×4). Органические слои объединяют, сушат и концентрируют с получением неочищенного продукта 4 (3,72 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез (R)-1-(3-((4-аминофенил)(метил)амино)пирролидин-1-ил)этанона (5)
Смесь соединения 4 (3,56 г) и Pd/C (310 мг, 10% активированный на угле) в ТГФ (60 мл) гидрируют с водородным баллоном при комнатной температуре в течение ночи. После завершения реакции, подтвержденного ТСХ, реакционную смесь фильтруют через Целит®. Фильтрат концентрируют при пониженном давлении с получением соединения 5 (3,21 г), который применяют на следующей стадии без дальнейшей очистки.
Синтез (R)-N-(3-(2-(4-((1-ацетилпирролидин-3-ил)(метил)амино)фениламино)-5-метоксипиримидин-4-илокси)фенил)акриламида (I-72a)
Соединение 5 (3,21 г), соединение 6 (4,26 г), K2CO3 (2,87 г), трис(дибензилиденацетон)дипалладий (0,64 г), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,65 г) и трет-BuOH (80 мл) последовательно добавляют в колбу. Реакционную смесь перемешивают при кипении с обратным холодильником под потоком N2. Через 17 ч ТСХ показывает завершение реакции. Реакционную смесь охлаждают до 40~50°C и затем фильтруют через Целит®. Слой Целита промывают этилацетатом (50 мл). Объединенный фильтрат концентрируют при пониженном давлении. Полученный неочищенный продукт далее очищают хроматографией на колонке (этилацетат/EtOH = 20:1 в качестве подвижной фазы) с получением соединения I-72a (1,5 г, 22%, M+H+=503,6).
Пример 72
Анализы ингибирования фосфорилирования Btk Tyr223
Материалы и способы
Клеточная культура и реагенты
Колонию клеток Ramos получают из American Type Culture Collection и хранят при 37°C с 5% CO2, в среде с добавлением 10% фетальной телячьей сыворотки, пенициллина (100 единиц/мл) и стрептомицина (100 мкг/мл). Козий F(ab')2 анти-человеческий IgM-UNLB получают от SouthernBiotech.
Вестерн блоттинг
Клетки Ramos обрабатывают соединениями в указанных дозах в течение 45 мин при комнатной температуре, затем стимулируют 12 мкг/мл IgM в течение 30 мин и затем лизируют. Вестерн блоттинг проводят на клеточном лизате с применением Phospho-Btk (Tyr223), Phospho-Btk (Tyr551), Btk, Phospho-PLCγ2 (Tyr1217), PLCγ2, Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) и p44/42 MAPK (Erk1/2) антител (Cell Signaling Technology). Плотность полосы блоттинга получают с применением программного обеспечения ImageJ и IC50 фосфорилированного Btk (Tyr223) строят с применением модели нелинейной регрессии с применением GraphPad Prism, версия 4,0.
Вестерн блоттинг с вытеснением метки для оценки необратимости соединения
Клетки Ramos обрабатывают соединением I-1 в дозе 100 нМ в течение 45 мин. Затем клетки повторно суспендируют в среде без соединения и стимулируют 6 мкг/мл IgM через 0, 4, 6 или 8 часов после удаления соединения. Затем клетки лизируют через 30 мин стимулирования IgM. Проводят вестерн-блоттинг.
Анализ ELISA степени занятости сайта-мишени Btk
Клетки Ramos обрабатывают соединением I-1 в указанных концентрациях в течение 1 ч, затем стимулируют 6 мкг/мл IgM в течение 30 мин и затем лизируют. Лизаты инкубируют с соединением I-21 (меченым биотином) в конечной концентрации 1 мкМ в ФРФБ, 0,05% Tween-20, 1% растворе БСА при встряхивании в течение 1 ч при комнатной температуре. Образцы переносят в покрытый стрептавидином 96-луночный планшет ELISA и смешивают при встряхивании в течение 1 ч при комнатной температуре. Затем применяют Btk антитело (BD 611116, 1:1000 разведение в ФРФБ + 0,05% Tween-20 + 0,5% БСА) и инкубируют в течение 1 ч при комнатной температуре. После промывания добавляют козий анти-мышиный-HRP (Pierce 31432, 1:1000 разведение в ФРФБ + 0,05% Tween-20 + 0,5% БСА) и инкубируют в течение 1 ч при комнатной температуре. ELISA проявляют добавлением тетраметилбензидина (ТМБ), с последующим добавлением стоп-реагента и считывают при OD 450 нМ.
Результаты
Соединения значительно снижают Btk Tyr223 фосфорилирование в клетках Ramos
Результаты этого анализа показаны в таблице 1 ниже. Соединения, имеющие активность, обозначенную “A” дают IC50 ≤ 10 нМ; соединения, имеющие активность, обозначенную “B” дают IC50 10-100 нМ; соединения, имеющие активность, обозначенную “C” дают IC50 > 100 нМ.
|
Клетки Ramos обрабатывают соединениями в указанных концентрациях в течение 45 мин и фосфорилирование BTK и потенциальных нижележащих эффекторов PLCγ2 и Erk отслеживают. Большинство соединений дозозависимо ингибируют фосфорилирование BTK белка, соединение I-1 достигает ингибирования IC50 при 1,1 нМ и соединение I-2 достигает ингибирование IC50 при 5,0 нМ.
Соединения I-1 и I-2 необратимо ингибирует BTK фосфорилирование в клетках Ramos
Клетки Ramos обрабатывают соединением I-1 и соединением I-2 в дозе 100 нМ в течение 45 мин и ингибирование BTK фосфорилирования отслеживают через 4, 6 и 8 часов после удаления соединения I-1 и соединения I-2. BTK остается ингибированным вплоть до 8 часов после обработки ковалентно-связанным соединением I-1 и соединением I-2, сто показывают, что соединение I-1 и соединение I-2 являются сильными необратимыми ингибиторами BTK белка.
Соединения I-1 и I-2 необратимо ингибируют фосфорилирование BTK в клетках Ramos
ELISA степени занятости сайта-мишени BTK применяют для определения свободного BTK белка из клеток Romas, обработанных повышающимися концентрациями соединений I-1. Как показано в таблице 2 и на фигуре 3, дозозависимая степень занятости соединением I-1 BTK белков коррелирует с его ингибирующим действием на BTK киназу, достигая IC50 в дозе 0,5 нМ.
|
Пример 73
Материалы и способы
Клеточная культура и реагенты
Все колонии клеток получают от American Type Culture Collection и хранят при 37°C с 5% CO2. Колонию клеток Ramos хранят в среде с добавлением 10% фетальной телячьей сыворотки, пенициллина (100 единиц/мл) и стрептомицина (100 мкг/мл). Колонию клеток NK-92 хранят в среде с добавлением 10% фетальной телячьей сыворотки и 10% лошадиной сыворотки, пенициллина (100 единиц/мл) и стрептомицина (100 мкг/мл), IL-2 10 нг/мл. Козий F(ab')2 анти-человеческий IgM-UNLB получают от SouthernBiotech. IL-2 получают от Peprotech.
Вестерн-блоттинг для Btk
Клетки Ramos обрабатывают соединениями в указанных дозах в течение 45 мин при комнатной температуре, затем стимулируют 6 мкг/мл анти-IgM в течение 30 мин и затем лизируют. Вестерн-блоттинг проводят на клеточном лизате с применением Phospho-Btk (Tyr223), Phospho-Btk (Tyr551), Btk, Phospho-PLCγ2 (Tyr1217), PLCγ2, Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) и p44/42 MAPK (Erk1/2) антител (Cell Signaling Technology). Плотность полосы блоттинга получают с применением программного обеспечения ImageJ и IC50 фосфорилированного Btk (Tyr223) строят с применением модели нелинейной регрессии с применением GraphPad Prism.
Вестерн-блоттинг анализ для Jak3 и Stat5
Клетки NK-92 обрабатывают соединениями в указанных дозах в течение 1 часа в инкубаторе, затем стимулируют IL-2 в течение 15 минут. Затем клетки собирают и лизируют с получением клеточного экстракта. Вестерн-блоттинг проводят на клеточном лизате с применением Phospho-Jak3, Jak3, Phospho-Stat5, Stat5 антител (Cell Signaling Technology). Плотность полосы блоттинга получают с применением программного обеспечения Image Lab (Bio-Rad) и IC50 цели генерируют с помощью GraphPad Prism.
Вестерн блоттинг с вытеснением метки для оценки связывающего свойства соединения
Клетки Ramos обрабатывают соединениями в дозе 100 нМ в течение 45 мин. Клетки затем повторно суспендируют в среде без соединения и стимулируют 6 мкг/мл анти-IgM через 0, 4, 6 или 8 часов после удаления соединения. Затем клетки лизируют через 30 мин анти-IgM стимулирования. Проводят вестерн-блоттинг анализ.
Анализ ELISA степени занятости сайта-мишени Btk
Клетки Ramos обрабатывают соединениями в указанных концентрациях в течение 1 ч, затем стимулируют 6 мкг/мл IgM в течение 30 мин и затем лизируют. Лизаты инкубируют с соединением I-21 (меченным биотином) в конечной концентрации 1 мкМ в ФРФБ, 0,05% Tween-20, 1% растворе БСА при встряхивании в течение 1 ч при комнатной температуре. Образцы переносят в покрытый стрептавидином 96-луночный планшет ELISA и смешивают при встряхивании в течение 1 ч при комнатной температуре. Затем применяют Btk антитело (BD 611116, 1:1000 разведение в ФРФБ + 0,05% Tween-20 + 0,5% БСА) и инкубируют в течение 1 ч при комнатной температуре. После промывания добавляют козий анти-мышиный-HRP (Pierce 31432, 1:1000 разведение в ФРФБ + 0,05% Tween-20 + 0,5% БСА) и инкубируют в течение 1 ч при комнатной температуре. ELISA проявляют добавлением тетраметилбензидина (ТМБ), с последующим добавлением стоп-реагента и считывают при OD 450 нМ.
Результаты
Соединения значительно снижают Btk Tyr223 фосфорилирование в клетках Ramos
Результаты вестерн-блоттинг анализа Btk показаны в таблице 3 ниже. Соединения, имеющие активность, обозначенную “A” дают IC50 ≤ 10 нМ; соединения, имеющие активность, обозначенную “B” дают IC50 10-100 нМ; соединения, имеющие активность, обозначенную “C” дают IC50 ≥ 100 нМ. “Н/Т” означает, что соединение не тестировалось. PCI-327265 применяют в качестве положительного контроля.
|
Типовые изображения вестерн-блоттинга для нескольких из представленных выше соединений показаны ниже на левой панели на фигуре 4, где PCI-32765 является положительным ингибитором Btk. Кривые IC50 представлены на правой панели на фигуре 4.
Соединения снижают Jak3 фосфорилирование в клетках NK-92
Результаты вестерн-блоттинг анализа Jak3 показаны в таблице 4 ниже. Соединения, имеющие активность, обозначенную “A” дают IC50 ≤ 200 нМ; соединения, имеющие активность, обозначенную “B” дают IC50 200~400 нМ; соединения, имеющие активность, обозначенную “C” дают IC50 ≥ 400 нМ.
|
Соединения снижают Stat5 фосфорилирование в клетках NK-92
Результаты вестерн-блоттинг анализа Stat5 показаны в таблице 5 ниже. Соединения, имеющие активность, обозначенную “A” дают IC50 ≤ 200 нМ; соединения, имеющие активность, обозначенную “B” дают IC50 200~400 нМ; соединения, имеющие активность, обозначенную “C” дают IC50 ≥ 400 нМ.
|
Вестерн блоттинг с вытеснением метки для оценки связывающего свойства соединения
Как показано на фигурах 5A и 5B, результатах после обработки и удаления соединений I-1 и I-2, долговременный эффект ингибирования наблюдается после удаления соединения вплоть до 8 часов. Такое сильное связывание соединения с целевым ферментом показывает сильное связывание соединения I-1 и I-2, которые химически разработаны так, чтобы ковалентно связывать Btk белок в определенном положении.
Как показано на фигурах 5A и 5B, соединения I-1 и I-2 ингибируют Btk фосфорилирование в клетках Ramos через 8 часов после удаления. Клетки Ramos обрабатывают соединением I-1 и соединением I-2 в дозе 100нМ в течение 45 мин и ингибирование фосфорилирования Btk отслеживают через 4, 6 и 8 часов после удаления соединения I-1 и соединения I-2. Btk остается ингибированным в течение вплоть до 8 часов после обработки ковалентно-связанным соединением I-1 и соединением I-2, показывая, что соединение I-1 и соединение I-2 являются сильными необратимыми ингибиторами Btk белка.
Анализ ELISA степени занятости сайта-мишени Btk
ELISA степени занятости сайта-мишени Btk применяют для определения свободного Btk белка из клеток Romas, обработанных повышающимися концентрациями нескольких соединений. Дозозависимая степень занятости соединениями Btk белков коррелирует с их ингибирующим действием на Btk киназу, как показано в таблице 6 ниже и на фигурах 6A-6L.
|
Данное изобретение далее иллюстрировано следующими типовыми примерами:
1. Соединение формулы (I):
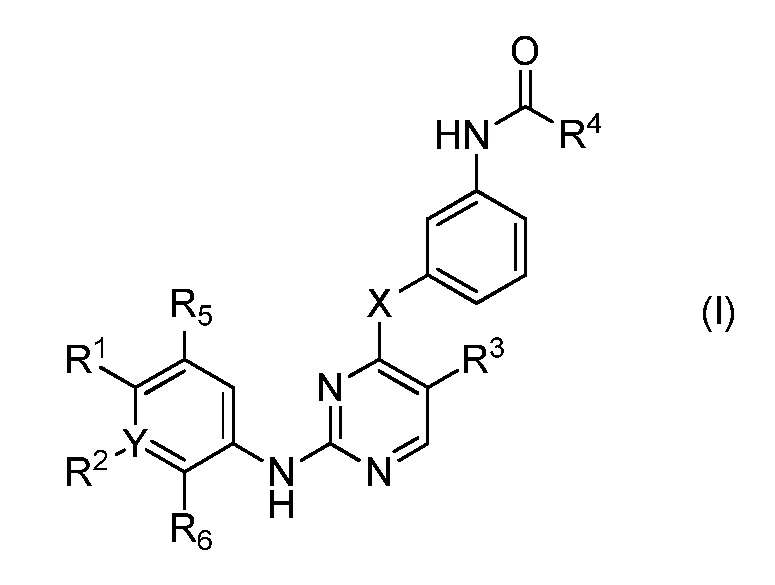 ,
,
где
R1 является Н или
NRcRd где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
3-7-членным циклическим кольцом, замещенным Ra, где Ra является C1-8 алкилом, необязательно замещенным гало;
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало или N,
где, по крайней мере, один из R2, R3, R5 и R6 не является H;
или его фармацевтически приемлемая соль.
2. Соединение по варианту 1, где R1 является Н и R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного OZ, где Z является Н или C1-4 алкилом.
3. Соединение по варианту 1, где R1 является NRcRd и Rc является метилом.
4. Соединение по варианту 1, где R1 является NRcRd и Rc является 3-7-членным циклическим кольцом.
5. Соединение по варианту 4, где 3-7-членным циклическим кольцом является C3 циклическое кольцо.
6. Соединение по любому из вариантов 3-5, где Rd является C2 алкилом, замещенным OZ, и Z является метилом.
7. Соединение по варианту 1, где R1 является 3-7-членным циклическим кольцом, замещенным Ra.
8. Соединение по варианту 7, где
R1 является  или
или  .
.
9. Соединение по варианту 8, где R1 является 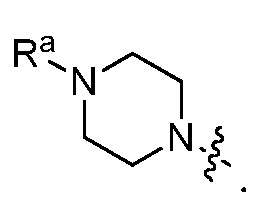 .
.
10. Соединение по варианту 9, где Ra является C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси.
11. Соединение по варианту 9 или 10, где Ra является C1-4 алкилом, замещенным фтором, или C1-8 алкилом, замещенным фтором.
12. Соединение по варианту 8, где R1 является 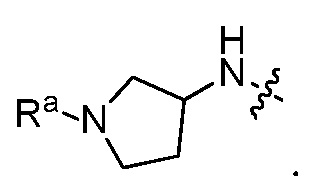 .
.
13. Соединение по варианту 12, где Ra является C1-4 алкилом, необязательно замещенным гало или C1-4 алкокси.
14. Соединение по варианту 12 или 13, где Ra является C1-4 алкилом, замещенным фтором, или C1-8 алкилом, замещенным фтором.
15. Соединение по любому из вариантов 1-14, где R2 является Н.
16. Соединение по любому из вариантов 1-14, где R2 является гало.
17. Соединение по любому из вариантов 1-14, где R2 является C1-4 алкилом или C1-4 алкокси.
18. Соединение по любому из вариантов 1-14, где R5 является Н.
19. Соединение по любому из вариантов 1-14, где R5 является гало.
20. Соединение по любому из пп.1-14, где R5 является C1-4 алкилом или C1-4 алкокси.
21. Соединение по любому из вариантов 1-14, где R6 является Н.
22. Соединение по любому из вариантов 1-14, где R6 является гало.
23. Соединение по любому из вариантов 1-14, где R6 является C1-4 алкилом или C1-4 алкокси.
24. Соединение по варианту 1, где R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
25. Соединение по варианту 1, где R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
26. Соединение по варианту 1, где R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
27. Соединение по любому из вариантов 24-26, где 3-7-членным циклическим кольцом является 5-членное циклическое кольцо.
28. Соединение по варианту 27, где 5-членным циклическим кольцом является гетероциклическое кольцо.
29. Соединение по варианту 28, где 5-членное гетероциклическое кольцо содержит атом N.
30. Соединение по любому из вариантов 24-29, где C1-4 алкилом является C2 алкил.
31. Соединение по варианту 30, где Z является метилом.
32. Соединение по любому из вариантов 1-31, где R3 является Н.
33. Соединение по любому из вариантов 1-31, где R3 является гало.
34. Соединение по любому из вариантов 1-31, где R3 является C1-4 алкилом или C1-4 алкокси.
35. Соединение по любому из вариантов 1-34, где R2, R5 или R6 являются Н или гало и R3 является гало, C1-4 алкилом или C1-4 алкокси.
36. Соединение по любому из вариантов 1-35, где R4 является незамещенным C2 алкенилом.
37. Соединение по любому из вариантов 1-35, где R4 является C2 алкенилом, замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2.
38. Соединение по любому из вариантов 1-37, где X является О.
39. Соединение по любому из вариантов 1-37, где X является C1-4 алкилом, необязательно замещенным гало.
40. Соединение по варианту 39, где X является незамещенным C1-4 алкилом.
41. Соединение по варианту 40, где X является СН2.
42. Соединение по варианту 39, где X является C1-4 алкилом, замещенным гало.
43. Соединение по варианту 42, где X является CF2.
44. Соединение по любому из вариантов 1-37, где X является NRb и Rb является Н или C1-8 алкилом, необязательно замещенным гало.
45. Соединение по варианту 44, где Rb является Н.
46. Соединение по варианту 44, где Rb является C1-8 алкилом.
47. Соединение по варианту 46, где Rb является C1-4 алкилом.
48. Соединение по варианту 46 или 47, где C1-4 алкил или C1-8 алкил замещен гало.
49. Соединение по любому из вариантов 1-48, где Y является СН.
50. Соединение по любому из вариантов 1-48, где Y является CF или N.
51. Соединение по варианту 1, которое выбирают из группы, включающей соединение I-1, I-2, I-3, I-4, I-5, I-6, I-7, I-8, I-9, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20, I-21, I-22, I-23, I-24, I-25 и I-41.
52. Соединение формулы (II):
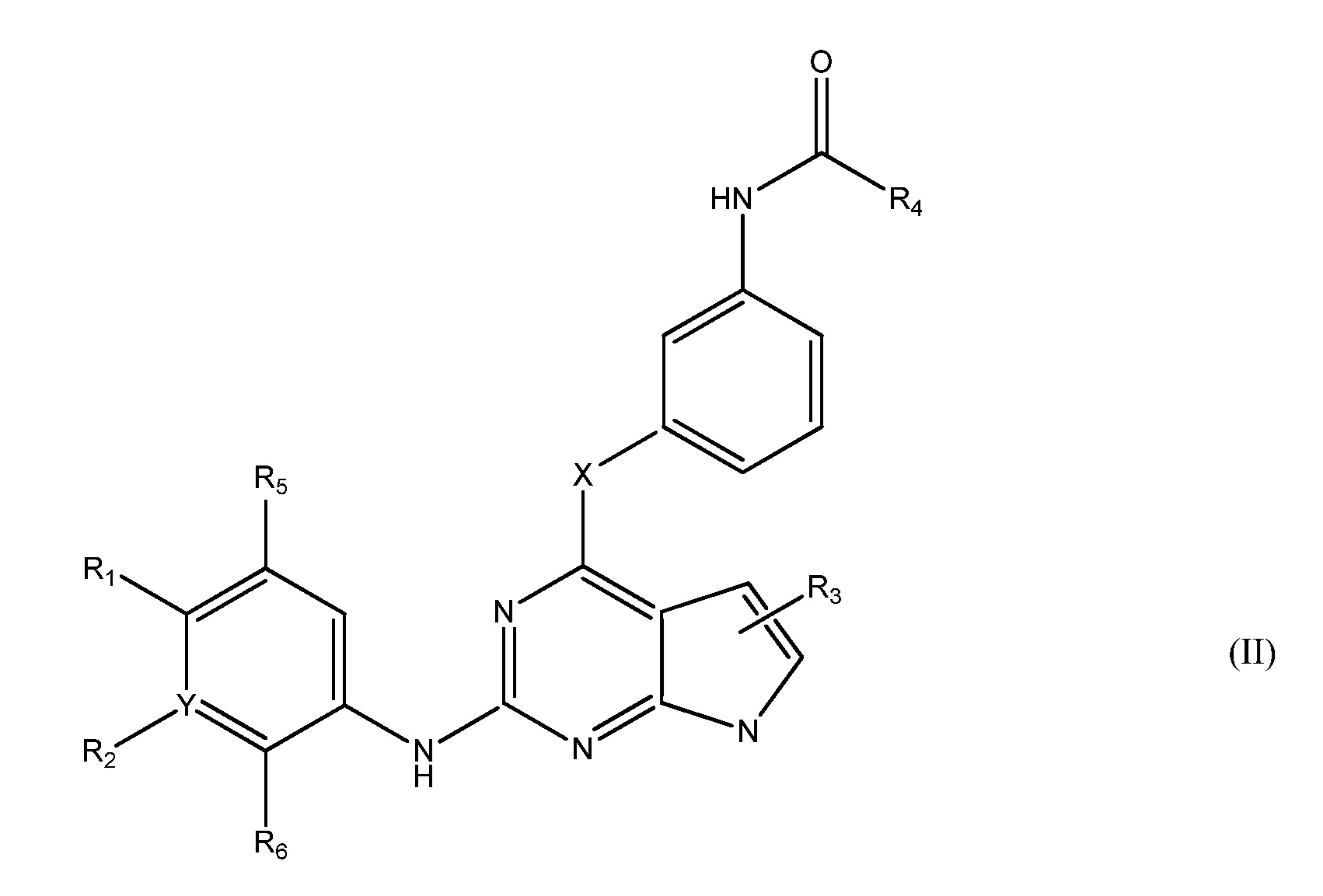 ,
,
где
R1 является Н или
NRcRd, где Rc является Н, C1-4 алкилом или 3-7-членным циклическим кольцом и Rd является Н, C1-4 алкилом, необязательно замещенным OZ, где Z является Н или C1-4 алкилом; или
NReRf, где Re является C1-4 алкилом и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало; или
ORg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-,  или
или 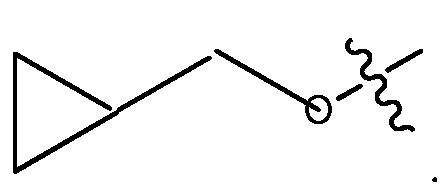 .
.
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало или N,
или его фармацевтически приемлемая соль.
53. Соединение по варианту 52, где R1 является Н и R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или метилом.
54. Соединение по варианту 52, где R1 является NRcRd и Rc является метилом.
55. Соединение по варианту 52, где R1 является NRcRd и Rc является 3-7-членным циклическим кольцом.
56. Соединение по варианту 55, где 3-7-членным циклическим кольцом является C3 циклическое кольцо.
57. Соединение по любому из вариантов 54-56, где Rd является C2 алкилом, замещенным OZ, и Z является метилом.
58. Соединение по варианту 52, где R1 является NReRf, Re является C1-4 алкилом и Rf является 3-7-членным циклическим кольцом, необязательно замещенным C1-4 алкилом, необязательно замещенным гало.
59. Соединение по варианту 58, где 3-7-членным циклическим кольцом является 5-членное циклическое кольцо.
60. Соединение по варианту 59, где 5-членным циклическим кольцом является гетероциклическое кольцо.
61. Соединение по варианту 60, где 5-членное гетероциклическое кольцо содержит атом N.
62. Соединение по любому из вариантов 58-61, где 3-7-членное циклическое кольцо замещено FCH2CH2-.
63. Соединение по варианту 52, где R1 является ОRg и Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 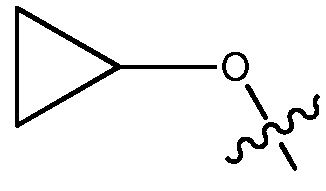 или
или 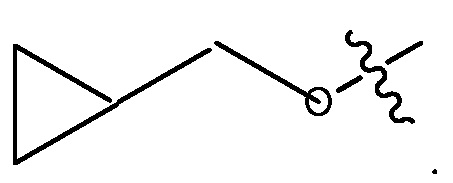 .
.
64. Соединение по варианту 63, где C1-4 алкилом является C2 алкил.
65. Соединение по любому из вариантов 52-64, где R2 является Н.
66. Соединение по любому из вариантов 52-64, где R2 является гало.
67. Соединение по любому из вариантов 52-64, где R2 является C1-4 алкилом или C1-4 алкокси.
68. Соединение по любому из вариантов 52-64, где R5 является Н.
69. Соединение по любому из вариантов 52-64, где R5 является гало.
70. Соединение по любому из вариантов 52-64, где R5 является C1-4 алкилом или C1-4 алкокси.
71. Соединение по любому из вариантов 52-64, где R6 является Н.
72. Соединение по любому из вариантов 52-64, где R6 является гало.
73. Соединение по любому из вариантов 52-64, где R6 является C1-4 алкилом или C1-4 алкокси.
74. Соединение по варианту 52, где R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
75. Соединение по варианту 52, где R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
76. Соединение по варианту 52, где R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом.
77. Соединение по любому из вариантов 74-76, где 3-7-членным циклическим кольцом является 5-членное циклическое кольцо.
78. Соединение по варианту 77, где 5-членным циклическим кольцом является гетероциклическое кольцо.
79. Соединение по варианту 78, где 5-членное гетероциклическое кольцо содержит атом N.
80. Соединение по любому из вариантов 74-79, где C1-4 алкилом является C2 алкил.
81. Соединение по варианту 80, где Z является метилом.
82. Соединение по любому из вариантов 52-81, где R3 является Н.
83. Соединение по любому из вариантов 52-81, где R3 является гало.
84. Соединение по любому из вариантов 52-81, где R3 является C1-4 алкилом или C1-4 алкокси.
85. Соединение по любому из вариантов 52-84, где R2, R5 или R6 является Н или гало и R3 является гало, C1-4 алкилом или C1-4 алкокси.
86. Соединение по любому из вариантов 52-85, где R4 является незамещенным C2 алкенилом.
87. Соединение по любому из вариантов 52-85, где R4 является C2 алкенилом, замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2.
88. Соединение по любому из вариантов 52-87, где X является О.
89. Соединение по любому из вариантов 52-87, где X является C1-4 алкилом, необязательно замещенным гало.
90. Соединение по варианту 89, где Х является незамещенным C1-4 алкилом.
91. Соединение по варианту 90, где X является СН2.
92. Соединение по варианту 89, где Х является C1-4 алкилом, замещенным гало.
93. Соединение по варианту 92, где Х является CF2.
94. Соединение по любому из вариантов 52-87, где Х является NRb и Rb является Н или C1-8 алкилом, необязательно замещенным гало.
95. Соединение по варианту 94, где Rb является Н.
96. Соединение по варианту 94, где Rb является C1-8 алкилом.
97. Соединение по варианту 96, где Rb является C1-4 алкилом.
98. Соединение по варианту 96 или 97, где C1-4 алкил или C1-8 алкил замещен гало.
99. Соединение по любому из вариантов 52-98, где Y является СН.
100. Соединение по любому из вариантов 52-98, где Y является CF.
101. Соединение по любому из вариантов 52-98, где Y является N.
102. Соединение по варианту 52, где R1 является ОRg, где Rg является C1-4 алкилом, замещенным CH3O-, CH3CH2O-, CH3(O)2S-, CF3O-, 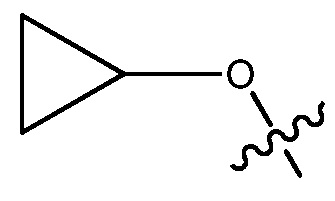 или
или  и R2, R3, R5 и R6 являются H.
и R2, R3, R5 и R6 являются H.
103. Соединение по варианту 102, где Rg является C2 алкилом, замещенным CH3O-.
104. Соединение по любому из вариантов 52-103, где по крайней мере, один из R1, R2, R3, R5 и R6 не является H.
105. Соединение по варианту 52, которое выбирают из группы, включающей соединение I-10, I-11, I-26, I-27, I-28, I-29, I-30, I-31, I-32, I-33, I-34, I-35, I-36, I-37, I-38, I-39 и I-40.
106. Фармацевтическая композиция, содержащая соединение по любому из вариантов 1-105, смешанная с, по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом.
107. Соединение по любому из вариантов 1-105 для применения в терапии.
108. Способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания, который включает введение пациенту, нуждающемуся в таковом, эффективного количества соединения по любому из вариантов 1-105 или фармацевтической композиции по варианту 106.
109. Применение соединения по любому из вариантов 1-105 для производства лекарственного средства.
110. Комбинация для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания у пациента, где комбинация включает эффективное количество соединения по любому из вариантов 1-105 или его фармацевтически приемлемой соли и эффективное количество второго профилактического или терапевтического агента для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания у пациента.
111. Способ лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания у пациента, где способ включает введение пациенту, нуждающемуся в таковом, эффективного количества комбинации по варианту 110.
112. Способ ингибирования активности тирозинкиназы Брутона (Btk или BTK) или a Янус-киназы (JAK) в клетке или у пациента, где способ включает введение в клетку или пациенту, нуждающемуся в таковом, эффективного количества соединения по любому из вариантов 1-105 или фармацевтической композиции по п.106 или комбинации по варианту 110.
113. Способ по варианту 112, где JAK является JAK1, JAK2 или JAK3.
114. Способ по варианту 112 или 113, который применяют для лечения и/или профилактики пролиферативного расстройства, рака, опухоли, воспалительного заболевания, аутоиммунного заболевания, псориаза, сухого глаза или иммунологически родственного заболевания у пациента.
115. Способ по варианту 114, где пролиферативного расстройство выбирают из группы, состоящей из саркомы, плоскоклеточного рака, фибросаркомы, рака шейки матки, рака желудка, рака кожи, лейкоза, лимфомы, рака легких, не-мелкоклеточного рака легких, рака толстой кишки, рака ЦНС, меланомы, рака яичников, рака почки, рака предстательной железы, рака молочной железы, рака печени, рака головы и шеи и рака поджелудочной железы.
116. Способ по любому из вариантов 112-115, где соединение выбирают из группы, включающей соединение I-1, I-2, I-3, I-4, I-5, I-6, I-7, I-8, I-9, I-10, I-11, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20, I-21, I-22, I-23, I-24, I-25, I-26, I-27, I-28, I-29, I-30, I-31, I-32, I-33, I-34, I-35, I-36, I-37, I-38, I-39, I-40 и I-41.
117. Соединение формулы (III):
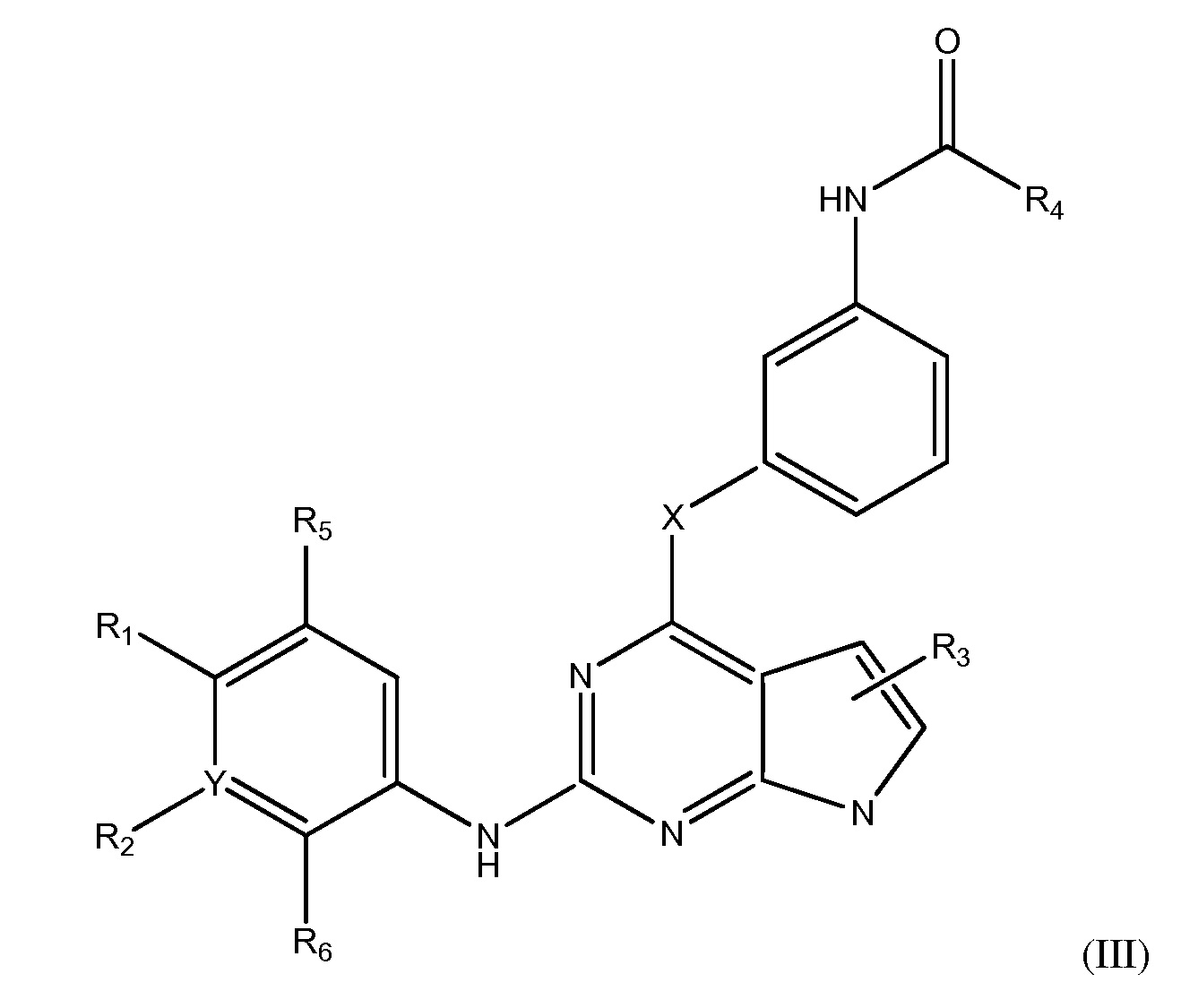 ,
,
где
R1 является  , где Ra является CO-C1-4 алкил-CONH-(C1-4 алкил-O)m-C1-4 алкил-NH-(определяемая метка), m является целым числом 1-4;
, где Ra является CO-C1-4 алкил-CONH-(C1-4 алкил-O)m-C1-4 алкил-NH-(определяемая метка), m является целым числом 1-4;
R2 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R3 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R5 является Н, гало, C1-4 алкилом или C1-4 алкокси;
R6 является Н, гало, C1-4 алкилом или C1-4 алкокси; или
R1 и R5 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R1 и R2 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R2 и R6 является частью 3-7-членного циклического кольца, необязательно замещенного C1-4 алкилом, замещенным OZ, где Z является Н или C1-4 алкилом; или
R4 является C2 алкенилом, необязательно замещенным C1-4 алкилом, -CH2OCH3 или -CH2N(CH3)2; и
X является О, C1-4 алкилом, необязательно замещенным гало или NRb, где Rb является Н или C1-8 алкилом, необязательно замещенным гало,
Y является СН, необязательно замещенным гало или N,
или его фармацевтически приемлемая соль.
118. Соединение по варианту 117, где в Ra C1-4 алкилом является C2 алкил.
119. Соединение по варианту 117 или 118, где m равно 3.
120. Соединение по любому из вариантов 117-119, где определяемой меткой является биотин.
121. Соединение по варианту 117, которое является соединением I-42.
122. Соединение по любому из вариантов 117-121 для применения для тестирования.
Подробное описание, представленное выше, дано для того, чтобы помочь специалисту в данной области техники практиковать данное изобретения. Однако изобретение, описанное и заявленное здесь, не ограничено в объеме конкретными описанными вариантами, так как эти варианты предназначены только для иллюстрации определенных аспектов изобретения. Любые эквивалентные варианты включены в объем данного изобретения. Конечно, различные модификации изобретения, в дополнение к показанным и описанным здесь, будут очевидны специалисту в данной области техники из представленного выше описания, которые не выходят за суть или объем данного изобретения. Такие модификации также включены в объем представленной формулы изобретения.
Все публикации, патенты, заявки на патенты и другие ссылки, представленные в данном описании, включены сюда в качестве ссылок полностью для всех целей до той степени, до которой каждая отдельная публикация, патент, заявка на патент или другая ссылка определенно и отдельно включена сюда в качестве ссылки полностью. Цитирование ссылки в данном описании не является признанием того, что она является известным уровнем техники в отношении данного изобретения.