Результат интеллектуальной деятельности: УСТРОЙСТВО И СПОСОБЫ РЕАЛИЗАЦИИ ПЕРФУЗИОННОГО НАСОСА
Вид РИД
Изобретение
[0001] Эта заявка испрашивает приоритет по заявке PCT/US12/50978 под названием "System and Method to Increase The Overall Diameter of Veins and Arteries", поданной 15 августа 2012 года, заявке PCT/US 12/50983 под названием "Blood Pump Systems and Methods", поданной 15 августа 2012 года, и предварительной заявке на патент США №61/684534 под названием "Blood Pump Systems and Methods," поданной 17 августа 2012 года, которая является частично продолжающей заявкой на патент США №61/564671 под названием "Blood Pump Systems and Methods," поданной 29 ноября 2011 года, являющаяся частично продолжающей заявкой на патент США №61/524761, под названием "Blood Pump Systems and Methods," поданной 17 августа 2011 года, являющейся частично продолжающей заявкой на патент США №13/030054, под названием "System and Method to Increase the Overall Diameter of Veins", поданной 17 февраля 2011 года, которая испрашивает приоритет по предварительной заявке №61/305508 под названием "System and Method to Increase the Overall Diameter of Veins", поданной 17 февраля 2010 года, и связанной с заявкой на патент США, находящейся на одновременном рассмотрении, №61/524759 под названием "System and Method to Increase the Overall Diameter of Veins and Arteries", поданной 17 августа 2011 года, и заявке на патент США №61/561859 под названием "System and Method to Increase the Overall Diameter of Veins and Arteries", поданной 19 ноября 2011 года, при этом все эти заявки включены в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к устройству перфузионного насоса, содержащего насос, соединительные трубки, блок управления и источник питания, за счет чего устройство можно применять при различных клинических показаниях, связанных с периферическими сосудами. В частности, данное изобретение пригодно для устойчивого увеличения общего диаметра и внутреннего просвета вен и артерий у пациентов, нуждающихся в размещении сосудистого доступа для гемодиализа, обходном сосудистом шунте или других типах оперативного вмешательства или процедурах, когда необходим больший диаметр вен или артерий. Данное изобретение также можно применять для улучшения венозного оттока в нижних конечностях и снижения венозного давления в нижних конечностях у пациентов с венозной гипертензией нижних конечностей, включая пациентов с нарушениями окраски кожи и трофическими язвами. Кроме того, данное изобретение можно успешно применять для увеличения локального кровотока к органам и тканям, нуждающимся в этом, таким как нижние конечности у пациентов с атеросклерозом периферических артерий (АПА).
УРОВЕНЬ ТЕХНИКИ
[0003] В США насчитывается более полмиллиона пациентов с хронической почечной недостаточностью, (ХПН) и каждый год появляется более 100000 новых пациентов с ХПН. Ежегодный прогнозируемой рост распространенности заболевания населения составляет четыре процента, что обусловлено воздействием различных факторов, например, высоким кровяным давлением, диабетом и старением населения.
[0004] Гемодиализ является предпочтительным методом лечения для 92% пациентов с ХПН, так как без гемодиализа или каких-либо других методов лечения эти пациенты обречены на смерть. Для прохождения процедуры гемодиализа сосудистая система обычного пациента с ХПН подключается к аппарату гемодиализа два или три раза в неделю. Для гемодиализа существуют три общих варианта места размещения сосудистого доступа. Предпочитаемым вариантом места доступа является артериовенозная фистула (АВФ), создаваемая хирургическим путем и напрямую соединяющая артерию и вену, предпочтительно в области запястья или, в качестве альтернативы, в области предплечья, плеча, нижней конечности или паховой области. Другим вариантом места доступа является артериовенозный трансплантат (АВТ), создаваемый хирургическим путем, соединяющий артерию и вену, с применением отрезка искусственного кровеносного сосуда. Последним значимым вариантом места доступа является катетер, устанавливаемый в большой кровеносный сосуд шеи, груди, нижней конечности или другие анатомические участки.
[0005] У пациентов с АВФ наблюдается меньше осложнений, у них ниже смертность, а также стоимость медицинского ухода по сравнению с пациентами с АВТ или катетером; следовательно, АВФ в области запястья является наиболее предпочтительной формой доступа для гемодиализа. Пациенты с АВТ или катетером имеют значительно более высокую степень инфицирования и смертности, чем пациенты с АВФ, при этом, пациенты с катетером имеют наихудшие результаты. Дополнительно, стоимость медицинского ухода для пациентов с АВТ или катетером является самой высокой, при этом самая высокая стоимость медицинского ухода у пациентов с катетером. Если пациенту есть возможность установить АВФ, то запястье или предплечье, в общем случае, является более предпочтительным местом по сравнению с плечом, поскольку наблюдается высокий процент ишемии верхней конечности, а также, как правило, сегменты вен плеча более короткие и находятся глубже.
[0006] К сожалению, около 85 процентов пациентов лишены возможности установки АВФ на запястье, поскольку, чаще всего, диаметры вен и артерий очень малы. Кроме того, около 60 процентов всех созданных АВФ не могут применять без дополнительных хирургических и интервенционных процедур, поскольку такие случаи часто называют "недостаток развития", что связано с малым диаметром вен и артерий. Доступность вен и артерий с большим диаметром влияет на высокую применимость АВФ и низкий процент недостатков развития.
[0007] В настоящий момент существуют несколько вариантов перманентного и устойчивого увеличения диаметра вен или артерий. Все существующие способы применяют механические процедуры расширения, такие как баллонная ангиопластика, которая может приводить к повреждению вен или артерий. Когда врачу нужно создать АВФ и необходимо, чтобы пациент имел определенный размер периферических вен и артерий, требуются способ и устройство для постоянного и устойчивого увеличения размера или диаметра периферических вен и артерий.
[0008] Около 7 миллионов человек в США страдают хронической венозной недостаточностью и артериальной гипертензией, которые могут приводить к образованию венозных язв. Язвы нижних конечностей являются наиболее распространенной формой хронических ран, распространенность которых, по оценкам, составляет около 1% населения США. Около 2,5 миллионов людей в США имеют язвенные образования нижних конечностей, и около 600000 человек в США каждый год обращаются за медицинской помощью для лечения венозных язв нижних конечностей. С учетом возраста населения ожидается рост количества заболеваний, связанных с венозными язвами.
[0009] В результате обследования пациентов с венозными язвами, 81% пациентов жалуются на неблагоприятное воздействие на подвижность, 56% жалуются на то, что они тратят до 8 часов в неделю на медицинские процедуры, 68% жалуются на негативное эмоциональное воздействие, включающее страх, социальную изоляцию, раздражение, депрессию и отрицательное представление о себе. В результате обследования, 80% пациентов работают, не выходя из дома; и у 20% принятых на работу, последствия язвенных образований на нижних конечностях приводят к потерям рабочего времени, потере работы и отрицательному влиянию на финансовое состояние.
[0010] Венозная гипертензия и язвенные образования нижних конечностей дороги в лечении и приводят к значительным затратам на системы и специалистов, обеспечивающие медицинское обслуживание. При изучении 78 пациентов с венозными язвами в клинике Кливленда было установлено, что средний размер язвы составляет 2,8 см2 (в среднем = 9,4 см2) и при этом 5% пациентов имеют двухсторонние язвы. Среднее время лечения язвы составляет 77 дней (в среднем = 108 дней) и средняя стоимость лечения составляет 2 400$ в месяц. Средняя общая стоимость лечения язвы для одного пациента составляет 9685$. Для пациентов, требующих лечения более года, средние общие затраты составляют 18534$.
[0011] В большинстве случаев венозная гипертензия и язвенные образования являются следствием недостаточности клапана сердца на фоне тромбоза глубоких вен или следствием неизвестных причин. В значительно меньшем количестве случаев венозная гипертензия и язвенные образования возникают в результате бедренной или тазовой венозной блокады на фоне тромбоза глубоких вен, повреждения вен или наружного сдавливания вен. Длительное воздействие на ткани локализованной венозной гипертензии приводит к дилатации капилляров с повышенной проницаемостью и транссудацией плазмы и эритроцитов, иммобилизации и активации лейкоцитов при микроциркуляции, и высвобождению свободных радикалов и других токсических продуктов, таких как факторы некроза опухоли и коллагеназа, которые способствуют гибели клеток и повреждению тканей. Транссудация фибриногена в окружающие ткани связывают или "улавливают" факторы роста и цитокины и делают их непригодными для поддержания и восстановления целостности тканей.
[0012] Венозная гипертензия нижних конечностей клинически проявляется в виде покраснения и нарушения окраски нижних конечностей, опухоли, болевых ощущений, отека, зуда, шелушения, выделений и липодерматосклероза. Язвы, как правило, развиваются в средней части нижней конечности и обладают границами неправильной формы, и могут сопровождаться острой болью. Венозные язвы обычно осложняются бактериальной инфекцией. Как правило, артериальная циркуляция остается удовлетворительной. Современные методы лечения венозной гипертензии и язв нижних конечностей, как правило, являются неэффективными. Чаще всего, пациенты предпочитают паллиативное лечение с целью излечения язв и предотвращения рецидивов, включая интенсивный уход за раной, компрессионную терапию для снижения венозного давления в нижних конечностях и улучшения венозного оттока, экстракцию или деструкцию вен нижних конечностей, и трансплантацию кожи. Тем не менее, современные методы лечения не в состоянии полностью излечить язвы и частота рецидивов остается высокой.
[0013] На сегодняшний момент, существуют небольшие "сердечные насосы"; тем не менее, такие насосы очень дороги и не предназначены и не имеют соответствующих размеров для применения в конечностях или в области применения, описанной в данном документе. По этой причине, в данной области техники существует потребность в системах, компонентах, способах и насосах, способных увеличивать диаметр периферических вен и артерий по разумной цене. Дополнительно, существует необходимость в системах, компонентах, способах и насосах, способных улучшать венозный отток в нижних конечностях, снижать венозную гипертензию в нижних конечностях и лечить венозные язвы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0014] Настоящая заявка относится к системе перфузионного насоса, включая систему перфузионного насоса с широким диапазоном производительности, низкой себестоимостью (COGS) и средним сроком эксплуатации. Данная система перфузионного насоса разработана для применения в различных клинических ситуациях и при различных клинических показаниях, как описано в данном документе.
[0015] Описанная в данном документе система перфузионного насоса может применяться для увеличения диаметра вен и артерий, предпочтительно, периферических вен и артерий. Система предназначена для перемещения крови таким образом, чтобы увеличивать диаметры вен и артерий. Выполнение данной функции достигается за счет нагнетания ("проталкивания") крови по венам и артериям или за счет отбора ("вытягивания") крови из вен и артерий. За счет обоих способов, система увеличивает поток крови в сосудах, что, в конечном счете, приводит к устойчивому увеличению диаметра сосудов. По этой причине, система и, в частности, насос применяет механические средства для активации биологической реакции проводящих путей, приводящей к расширению или "коррекции" вен и артерий. Система состоит из перфузионного насоса, соединительных трубок для переноса или транспортировки крови к перфузионному насосу или от него, системы управления для контроля и изменения режима работы перфузионного насоса, а также источника питания. Таким образом, система содержит группу элементов, имеющих, к примеру, жидкостное соединение с артерией с одной стороны и жидкостное соединение с веной с другой стороны, по которому, при активации, кровь прокачивается с интенсивностью, так что касательное давление на стенку (WSS) эндотелий вены, артерии или и того и другого, увеличено в течение определенного периода времени, достаточного для устойчивого увеличения вен и артерий. До тех пор, пока поток крови, проходящий через систему насоса, контролируется, могут применяться различные варианты насосов и систем насосов для получения желаемого увеличения диаметра кровеносных сосудов.
[0016] Система перфузионного насоса, описанная в данном документе, может применяться для улучшения венозного оттока в нижних конечностях, снижения венозной гипертензии в нижних конечностях и лечения венозных язв. Система функционирует таким образом, чтобы перемещать кровь из вены в пораженных нижних конечностях, например, бедренной, подкожной вены или подвздошной вены, в место венозного кровообращения, благодаря чему, улучшается отток венозной крови из нижних конечностей к сердцу. Участками в венозном кровообращении, куда осуществляется отток крови, являются яремная вена, подмышечная вена, подключичная вена, плечеголовная вена, верхняя полая вена и правое предсердие. Система состоит из перфузионного насоса, одной или более соединительных трубок для переноса или транспортировки крови к перфузионному насосу или от него, системы управления для контроля и изменения режимов работы перфузионного насоса, а также источника питания. Таким образом, система содержит группу элементов, имеющих, к примеру, жидкостное соединение с периферической веной с одной стороны и жидкостное соединение с центральной веной или правым предсердием с другой стороны, по которому, при активации, кровь прокачивается с такой интенсивностью, что венозное кровяное давление снижено в обрабатываемой нижней конечности в течение определенного времени, достаточного для частичного или полного излечения венозных язв. До тех пор, пока поток крови, проходящий через систему насоса, контролируется, различные варианты насосов и систем насосов могут применяться для получения желаемого эффекта.
[0017] Могут быть применены различные типы перфузионных насосов, включая поршневые и ротационные насосы, однако насосы ротационного типа являются предпочтительными. В одном варианте реализации изобретения ротационный перфузионный насос содержит насос, имеющий корпус с установленным впускным отверстием для приема крови и выпускным отверстием для выпуска крови. Корпус насоса и его размеры разработаны таким образом, чтобы разместить вращающуюся крыльчатку, подвешенную на подшипниках. Корпус насоса имеет первый подшипник в приемной части насоса и второй подшипник в выпускной части насоса. Кровь поступает и выходит через вращающуюся крыльчатку, за счет чего скорость крови на выходе увеличивается. Полученная таким образом увеличенная скорость на выходе восстанавливается или преобразуется в повышенное давление за счет замедления скорости потока крови внутри диффузора насоса, который подключен к выходному отверстию насоса.
[0018] В другом варианте реализации изобретения могут применяться различные типы роторных перфузионных насосов. Например, может применяться осевой насос, радиально-осевой насос, или, предпочтительно, центробежный насос. Дополнительно, могут применяться различные типы подшипников вращающейся крыльчатки, включая помимо всего прочего, магнитные подшипники, гидродинамические подшипники и, предпочтительно, упорные подшипники (контактные типы подшипников). Аналогичным образом, могут применяться различные типы диффузоров насоса, включая, помимо всего прочего, коллекторные диффузоры или, предпочтительно, спиральные диффузоры.
[0019] В одном варианте реализации изобретения центробежный перфузионный насос с упорными подшипниками скольжения состоит из корпуса насоса, с установленным на входном отверстии всасывающим диффузором, для приема крови и ее направления на крыльчатку, корпус насоса имеет верхнее посадочное место верхнего упорного подшипника, проходящее от верхней части корпуса к входному отверстию, и нижнее посадочное место нижнего упорного подшипника, проходящее от нижней части корпуса к внутреннему пространству корпуса. Насос также содержит крыльчатку, подвешенную внутри корпуса, крыльчатка дополнительно имеет полость для размещения оси крыльчатки. Ось крыльчатки имеет один конец, контактирующий упорным подшипником входной (верхней) части насоса и второй конец, контактирующий с упорным подшипником выходной (нижней) части насоса. В одном варианте реализации изобретения концы оси крыльчатки имеют выпуклую поверхность и по меньшей мере один конец каждого из упорных подшипников имеет вогнутую поверхность. В другом варианте реализации изобретения концы оси крыльчатки имеют выпуклую поверхность, а упорные подшипники имеют вогнутую поверхность. Крыльчатка может иметь различные конструкции лопастей в виде гребней или лопаток, разработанные для контакта и ускорения крови в спиральной камере насоса. Например, крыльчатка может быть оснащена множеством лопаток на ее верхней поверхности, которые направлены радиально от центра крыльчатки к ее наружному краю. Лопатки разгоняют кровь от центрального входного отверстия крыльчатки к ее периферическому выходному отверстию. В другом варианте крыльчатка может не иметь лопаток или гребней, однако содержит механизмы для передвижения или проталкивания крови. В качестве опции, крыльчатка оснащается по меньшей мере одной промывочной полостью, вырезом или каналом, проходящем, как правило, параллельно центральной оси крыльчатки от нижней поверхности через крыльчатку к верхней поверхности. Полость разработана таким образом, чтобы предотвратить застой крови под крыльчаткой и вокруг нижнего упорного подшипника.
[0020] Перфузионный насос содержит двигатель, предпочтительно электрический, разработанный для приведения в движение крыльчатки. В одном варианте реализации изобретения перфузионный насос содержит приводной двигатель, имеющий по меньшей мере один магнит, конструктивно закрепленный на крыльчатке и по меньшей мере один якорь, конструктивно закрепленный на корпусе. Якорь индуцирует ЭДС по меньшей мере в одном магните, закрепленном на крыльчатке. Электродвигатель насоса может быть бесщеточным пусковым электродвигателем постоянного тока (DC) с осевым зазором без датчиков обратной ЭДС (обратной ЭДС). Двигатель применяет металлокерамический сплав неодим ферробор (NdFeB) для магнитов в крыльчатке и 3-фазную плоскостную рамочную конструкцию статора типа "рейстрек". Двигатель имеет плоское отношение ширины к длине с очень малой осевой длиной по сравнению с его диаметром.
[0021] В одном варианте реализации изобретения система перфузионного насоса содержит центробежный перфузионный насос с рабочим диапазоном от около 50 миллилитров в минуту до около 1500 миллилитров в минуту. Система также содержит корпус насоса с установленным впускным отверстием для приема крови и направления ее на крыльчатку. Корпус насоса имеет верхний упорный подшипник, проходящий от верхней части корпуса к входному отверстию и нижний упорный подшипник, проходящий от нижней части корпуса к внутреннему пространству корпуса. Насос также содержит крыльчатку, подвешенную внутри корпуса, при этом первый зазор между крыльчаткой и верхней частью корпуса лежит в диапазоне от около 0,05 мм до около 0,2 мм.
[0022] Крыльчатка содержит ось крыльчатки, имеющую первый конец, контактирующий с верхней точной вращения и второй конец, контактирующий с нижней точкой вращения, а также множество лопаток на верхней поверхности крыльчатки, направленных радиально от центра крыльчатки, лопатки предназначены для усиления потока крови, полученной через впускное отверстие, через корпус насоса к выпускному отверстию. Крыльчатка также содержит по меньшей мере одну полость, проходящую параллельно центральной оси крыльчатки, от нижней поверхности через крыльчатку к верхней поверхности.
[0023] Дополнительно, насос содержит по меньшей мере один магнит, конструктивно закрепленный на крыльчатке и электродвигатель, воздействующий магнитным путем по меньшей мере на один магнит, при этом электромотор вращает по меньшей мере один магнит и крыльчатку. В других вариантах реализации изобретения насос также содержит ферромагнитную заднюю стенку для магнитного воздействия по меньшей мере на один магнит.
[0024] Система перфузионного насоса имеет одну или более соединительных трубок, включая первую (приточную) трубку, имеющую два конца, при этом первый конец имеет жидкостное соединение с местом доступа в сосудистую систему и получает кровь из места доступа, а второй конец имеет жидкостное соединение с насосом. По приточной соединительной трубке кровь доставляется к насосу. Система перфузионного насоса имеет вторую (выпускную) соединительную трубку, имеющую два конца, первый конец имеет жидкостное подключение к насосу и получает кровь от насоса и второй конец, также имеющий жидкостное соединение с местом доступа к сосудистой системе. По выпускной трубке кровь доставляется к сосудистой системе.
[0025] В различных вариантах реализации изобретения соединительные трубки системы перфузионного насоса имеют индивидуальную длину в диапазоне от 2 см. до 110 см., и общую длину в диапазоне от 4 см. до 220 см., и могут быть обрезаны до нужной длины хирургом или другим врачом во время имплантации системы насоса. Каждая соединительная трубка имеет внутренний диаметр в диапазоне от 2 мм до 10 мм, а также, предпочтительно, в диапазоне от 4 мм до 6 мм. Соединительные трубки могут быть частично выполнены из полиуретана (например, Pellethane® or Carbothane®), поливинилхлорида, полиэтилена, силиконового эластомера, политетрафторэтилена (PTFE), расширенного политетрафторэтилена (ePTFE), полиэтилентерефталата (PET, например, Dacron), а также их комбинации. Соединительные трубки могут дополнительно содержать эластичный резервуар.
[0026] Все соединительные трубки или их части могут быть усилены оплеткой или плетеным материалом с памятью формы, например, нитиноловым сплавом или другим самопружинящим или радиально экспансивным материалом, например, нержавеющей сталью. Для систем насосов, разработанных для лечения венозной гипертензии нижних конечностей и венозных язв, соединительные трубки, переносящие кровь от вен в нижних конечностях к части насоса общей системы перфузионного насоса, могут дополнительно содержать дистальные сегменты из ePTFE или Dacron, такие сегменты могут иметь жидкостное соединение с венами в нижних конечностях с помощью операционного анастомоза. Дополнительно, эти сегменты, выполненные из ePTFE или Dacron, могут содержать внешние усиливающие элементы, например, дополнительный слой ePTFE или Dacron, или другие самопружинящие или радиально экспансивные материалы, например, нитиноловый сплав или нержавеющую сталь. Эти дополнительные усиливающие элементы могут быть выполнены в форме спирали или плетения, или же могут содержать более совершенные кольцевые или гомогенные структуры, или могут быть исполнены другим способом, противодействующим разрушению, деформации или сжиманию в случаях, когда давление внутри соединительных трубок низкое или отрицательное. Соединительные трубки могут иметь концы с фаской, имеющие жидкостное соединение с сосудистой системой. Фаска на концах может быть выполнена под углом в диапазоне от 10 градусов и до 80 градусов. Одна или более соединительных трубок могут иметь некоторое количество отверстий или иметь ячеистую структуру в стенках дистальных сегментов, специально разработанных для размещения внутри просветов кровеносных сосудов или размещения в других местах внутри сосудов. Соединительные трубки могут подключаться к насосу с помощью радиально сжимаемых коннекторов.
[0027] В других вариантах реализации изобретения, система перфузионного насоса представляет собой перфузионный насос центробежного типа и корпус насоса, с установленным впускным отверстием для приема крови и направления ее на крыльчатку. Корпус насоса имеет верхний упорный подшипник, проходящий от верхней части корпуса к входному отверстию и нижний упорный подшипник, проходящий от нижней части корпуса к внутреннему пространству корпуса. Насос также содержит крыльчатку, подвешенную внутри корпуса, при этом первый зазор между крыльчаткой и верхней частью корпуса лежит в диапазоне от около 0,05 мм до около 0,2 мм.
[0028] Крыльчатка содержит ось крыльчатки, имеющую первый конец, контактирующий с верхней точной вращения и второй конец, контактирующий с нижней точкой вращения, а также множество лопаток на верхней поверхности крыльчатки, направленных радиально от центра крыльчатки, лопатки предназначены для усиления потока крови, полученной через впускное отверстие, через корпус насоса к выпускному отверстию. Крыльчатка также содержит по меньшей мере одну полость, проходящую параллельно центральной оси крыльчатки, от нижней поверхности через крыльчатку к верхней поверхности.
[0029] Дополнительно, насос содержит по меньшей мере один магнит, конструктивно закрепленный на крыльчатке и электродвигатель, воздействующий магнитным путем по меньшей мере на один магнит, при этом электромотор вращает по меньшей мере один магнит и крыльчатку. Перфузионный насос также содержит по меньшей мере одну соединительную рубку, имеющую конец, соединенный с впускным отверстием насоса или выпускным отверстием насоса, и дистальный конец для введения в кровеносный сосуд. Дистальный конец содержит заостренный, не скошенный дистальный наконечник, оснащенный, как правило, круговым торцевым отверстием, соосным с центральной продольной осью. Дистальный конец также содержит первое множество боковых отверстий, расположенных симметрично по периметру дистального наконечника, при этом первое множество боковых отверстий расположено вблизи торцевого отверстия и ориентировано вдоль центральной продольной оси наконечника. Дистальный наконечник также содержит второе множество боковых отверстий, расположенных симметрично по периметру дистального наконечника.
[0030] В различных вариантах реализации изобретения, соединительные трубки системы перфузионного насоса также содержат один или более боковых портов, соединенных с трубками. Система перфузионного насоса также содержит одну или более соединительных манжет для присоединения по меньшей мере одной трубки.
[0031] В одном варианте реализации изобретения система перфузионного насоса содержит перфузионный насос и систему управления для контроля и изменения режима работы системы перфузионного насоса, для поддержания повышенного среднего срезающего давления на стенку сосуда внутри артерии или вены, имеющей жидкостное подключение к перфузионному насосу. Система управления выполнена с возможностью поддержания среднего срезающего давления на стенку сосуда внутри вены в диапазоне от 0,76 до 23 Па или, предпочтительно, в диапазоне от 2,5 до 10 Па. В другом варианте реализации изобретения система управления контролирует и поддерживает повышенную среднюю скорость кровотока внутри артерий или вен, имеющих жидкостное подключение к перфузионному насосу. В этом варианте реализации изобретения система управления выполнена с возможностью поддержания средней скорости кровотока внутри артерии или вены в диапазоне от 10 см/с до 120 см/с, или, предпочтительно, в диапазоне от 25 см/с до 100 см/с. В обоих вариантах реализации изобретения система перфузионного насоса выполнена с возможностью поддержания повышенного среднего срезающего давления на стенку сосуда или повышенной средней скорости кровотока в течение по меньшей мере 1 дня, 7 дней, 14 дней, 28 дней, 42 дней, 56 дней, 84 дней или 112 дней. Используемый в данном документе термин скорость может относиться к скорости кровотока, независимо от направления координаты или вектора.
[0032] Система перфузионного насоса имеет систему управления для достижения и поддержания желаемой скорости потока, которая дополнительно может содержать устройство управления, получающее информацию от насоса и контролирующее работу системы перфузионного насоса. При минимальном значении, система управления может быть активирована вручную для регулировки скорости двигателя. В альтернативном варианте может применяться автоматическая ("интеллектуальная") система управления. Дополнительно, система управления содержит датчики, установленные в насосе, соединительных трубках или сосудистой системе пациента. Устройство управления может измерять скорость вращения двигателя на основании частоты перехода через ноль сигнала обратной ЭДС. Переход через ноль указывает на изменение магнитного поля крыльчатки. Скорость вращения двигателя управляется широтно-импульсной модуляцией (ШИМ) входного напряжения, а кутящий момент управляется ШИМ входного тока. Устройство управления также контролирует другие параметры состояния электродвигателя насоса, например, силу тока и напряжение, с помощью которых оцениваются и контролируются скорость потока через систему перфузионного насоса и срезающее давление на стенку сосуда в периферической кровеносной системе.
[0033] Предпочтительно, устройство управления содержит "процессор", который в свою очередь содержит этап измерений, этап обработки и этап управления питанием для приведения в движение и управления режимом работы электродвигателя насоса. Процессор подает питание на обмотку электродвигателя и управляет скоростью вращения двигателя за счет анализа обратной ЭДС в обмотке электродвигателя, а также за счет получения информации от дополнительных датчиков. Процессор способен выполнять алгоритмы управления, закодированные на машиночитаемых носителях. Система перфузионного насоса содержит устройство управления, подключаемое к насосу и дополнительным датчикам электрическим способом. Система перфузионного насоса также содержит источник питания, который, в различных вариантах реализации изобретения, может быть интегрирован в устройство управления. В различных вариантах реализации изобретения источник питания для системы перфузионного насоса может быть переносным (например, в виде перезаряжаемых батарей или топливных элементов) или стационарным (например, в виде блока питания, подключенного к электрической сети переменного тока).
[0034] Система управления может получать информацию от различных датчиков. Электронный блок управления двигателем внутри устройства управления может измерять один из следующих параметров: скорость вращения электродвигателя, входное напряжение или силу тока, необходимых для работы насоса. В других вариантах реализации изобретения система управления содержит датчики в перфузионном насосе или соединительных трубках, измеряющие по меньшей мере один из следующих параметров: скорость кровотока, скорость расхода крови, сопротивление потоку крови в периферических кровеносных сосудах, давление крови, пульсационный индекс, а также комбинацию этих параметров. В других вариантах реализации изобретения система управления содержит датчики в сосудистой системе пациента, измеряющие по меньшей мере один из следующих параметров: скорость кровотока, скорость расхода крови, давление крови, пульсационный индекс, диаметр сосудов, а также комбинацию этих параметров.
[0035] В различных вариантах реализации изобретения система управления способна оценивать и поддерживать желаемый уровень срезающего давления на стенку сосуда в целевом сосуде или донорской артерии или вене, с применением информации от устройства управления и/или датчиков, например, о скорости вращения двигателя, входном напряжении двигателя, скорости расхода через насос, гидростатическом давлении насоса, давлении вблизи места подключения выпускной соединительной трубки и целевом сосуде, перепаде давлений между кровеносными сосудами, а также комбинации этих параметров. В контексте настоящей заявки термин "целевой сосуд", "целевой кровеносный сосуд", "целевая вена" или "целевая артерия" означают определенный участок артерии или вены, в котором предполагается получить устойчивый увеличенный общий диаметр и диаметр просвет, при установке комплекта соединительных трубок насоса, сконфигурированного и работающего таким образом, чтобы в результате получать постоянное увеличение общего диаметра сосудов и просветов.
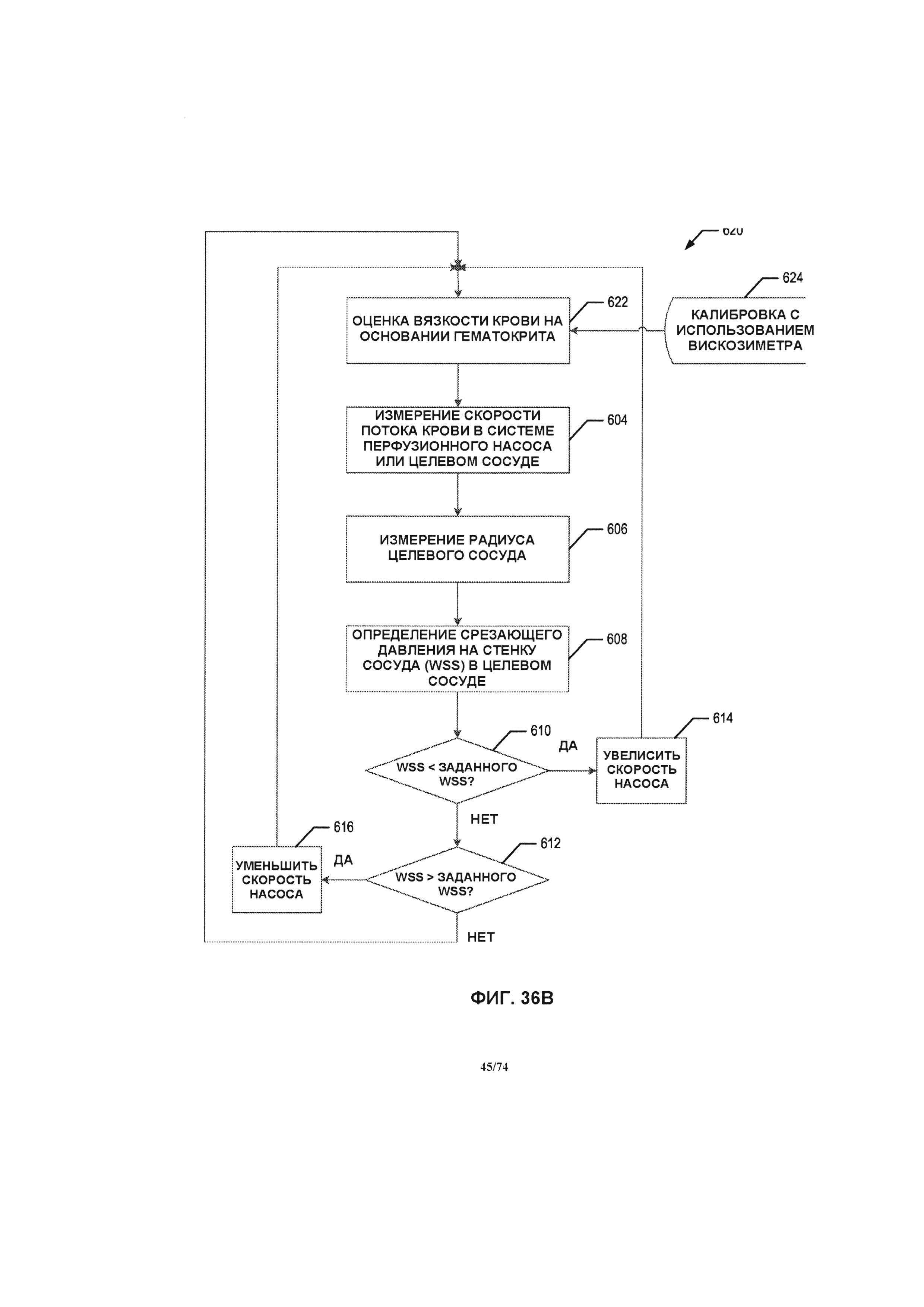
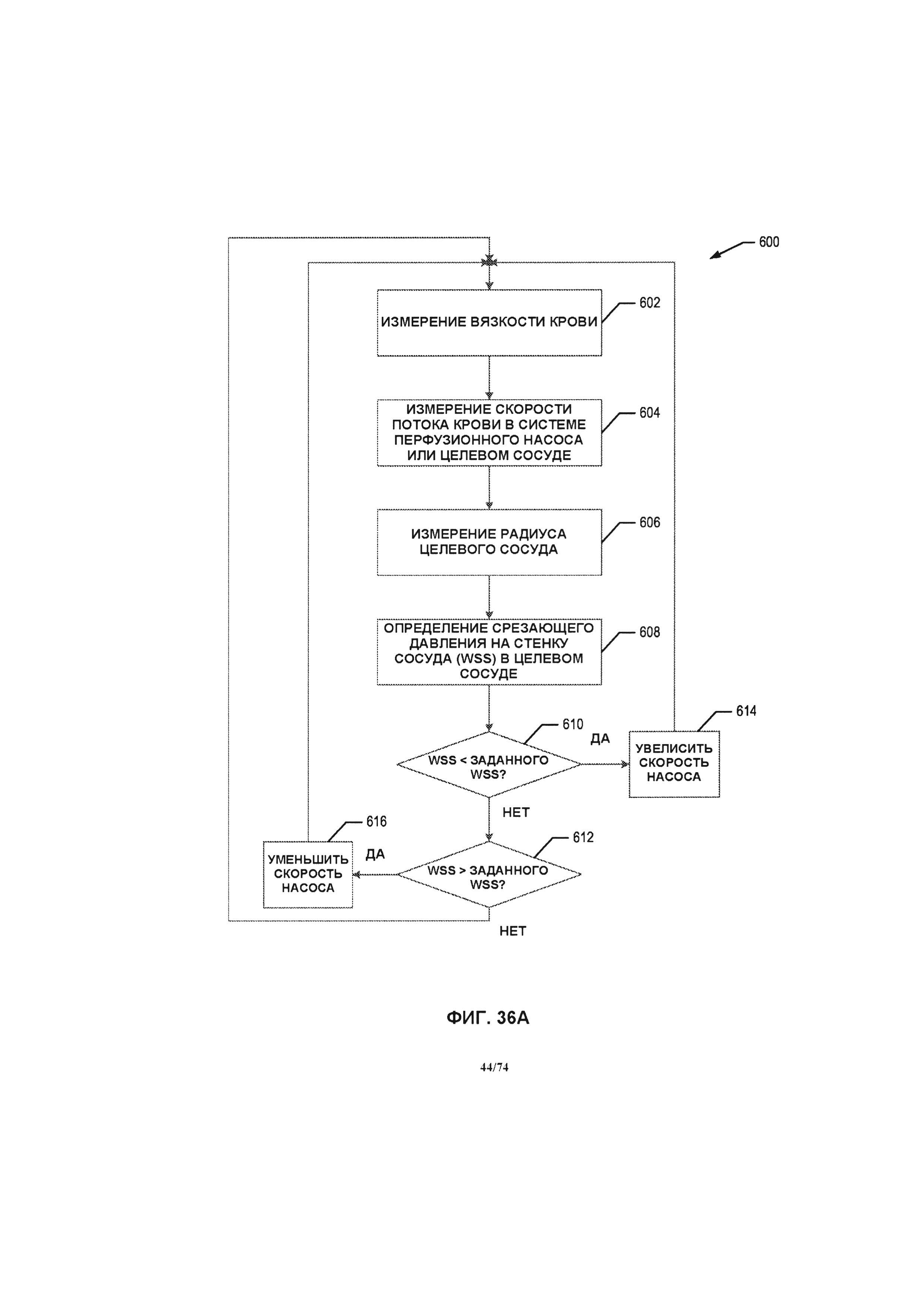
[0036] Для автоматического управления работой системы перфузионного насоса могут применяться различные способы. В одном варианте реализации изобретения способ определения и управления срезающим давлением на стенку сосуда в кровеносном сосуде содержит этапы измерения вязкости крови, измерения скорости расхода потока крови в системе перфузионного насоса и измерения радиуса кровеносных сосудов. Этапы также содержат определение срезающего давления на стенку сосуда в кровеносных сосудах за счет измерения вязкости крови, измерения скорости потока крови и радиуса кровеносных сосудов, сравнение определенных ранее параметров срезающего давления на стенку сосуда с предварительно заданным эталонным значением и регулировку скорости перфузионного насоса в том случае, если определенное значение срезающего давления на стенку сосуда не соответствует предварительно заданному эталонному значению. Этапы повторяются до тех пор, пока определенное срезающее давление на стенку сосуда не станет равным предварительно заданному эталонному значению.
[0037] В другом варианте реализации изобретения способ вычисления и управления срезающим давлением на стенку сосуда в кровеносном сосуде содержит этапы измерения вязкости крови, измерения скорости расхода потока крови в системе перфузионного насоса и измерения радиуса кровеносных сосудов. Этапы также содержат определение срезающего давления на стенку сосуда в кровеносных сосудах за счет измерения вязкости крови, измерения скорости потока крови и радиуса кровеносных сосудов, сравнение определенных ранее параметров срезающего давления на стенку сосуда с предварительно заданным эталонным значением и регулировку скорости перфузионного насоса в том случае, если определенное значение срезающего давления на стенку сосуда не соответствует предварительно заданному эталонному значению. Этапы повторяются до тех пор, пока определенное срезающее давление на стенку сосуда не станет равным предварительно заданному эталонному значению.
[0038] В одном варианте реализации изобретения способ оценки и управления срезающим давлением на стенку сосуда в кровеносных сосудах содержит этапы оценки вязкости крови, измерения вариантов состояния по меньшей мере одного двигателя системы перфузионного насоса, определяемых за счет параметров напряжения, силы тока, скорости насоса, а также оценки скорости потока крови в системе перфузионного насоса. Этапы также содержат измерения давления в кровеносных сосудах, определение сосудистого сопротивления кровеносных сосудов за счет оценки скорости потока крови и измерений давления в кровеносных сосудах, оценки радиуса кровеносных сосудов. Этапы дополнительно содержат определение срезающего давления на стенку сосуда в кровеносных сосудах за счет измерения вязкости крови, измерения скорости потока крови и радиуса кровеносных сосудов, сравнение определенных ранее параметров срезающего давления на стенку сосуда с предварительно заданным эталонным значением и регулировку скорости перфузионного насоса в том случае, если определенное значение срезающего давления на стенку сосуда не соответствует предварительно заданному эталонному значению. Этапы повторяются до тех пор, пока определенное срезающее давление на стенку сосуда не станет равным предварительно заданному эталонному значению.
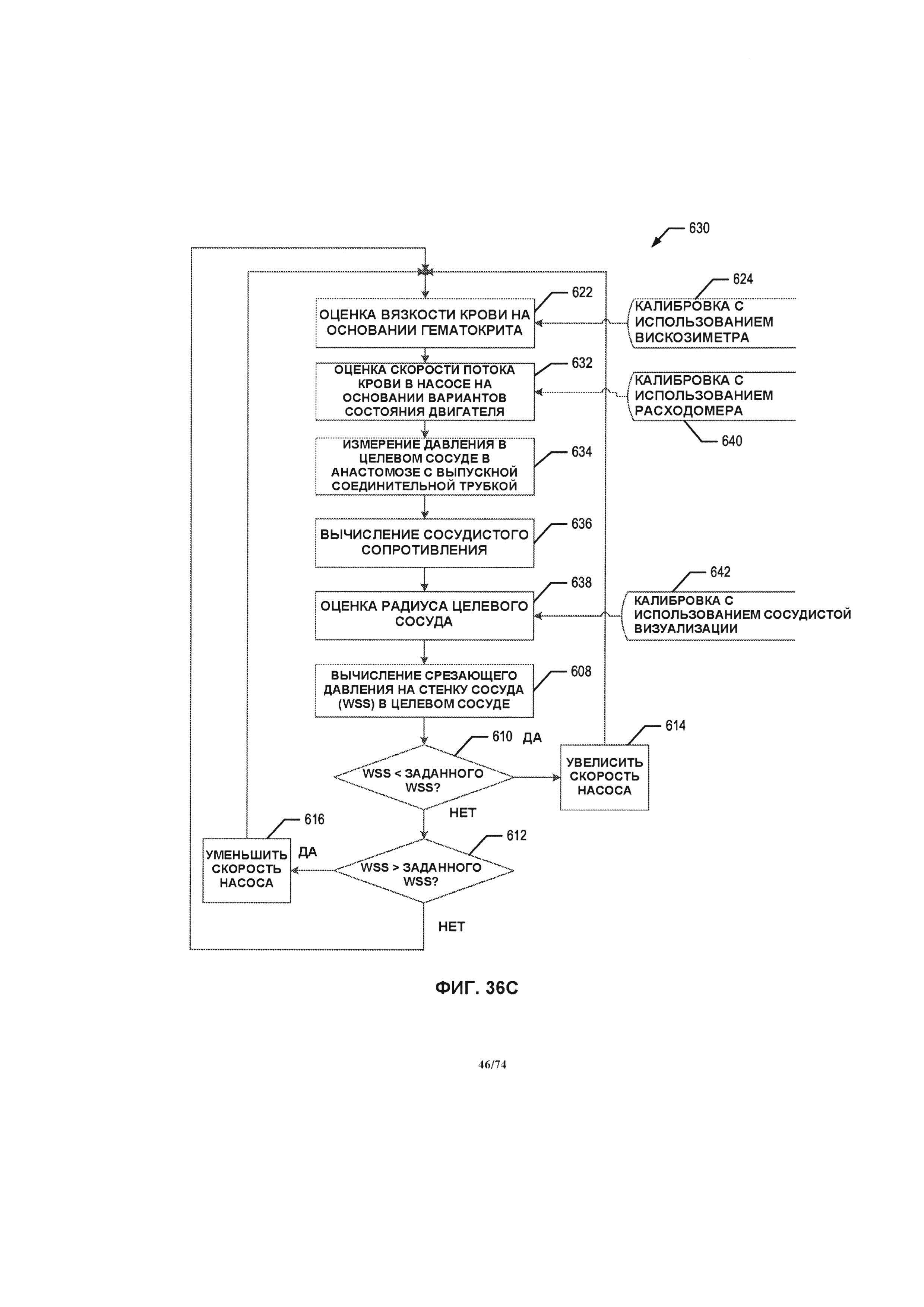
[0039] В другом варианте реализации изобретения способ оценки и управления срезающим давлением на стенку сосуда в кровеносных сосудах содержит этапы оценки вязкости крови, измерения вариантов состояния по меньшей мере одного двигателя системы перфузионного насоса, определяемых за счет параметров напряжения, силы тока, скорости насоса, а также оценки скорости потока крови в системе перфузионного насоса. Этапы также содержат вычисление сосудистого сопротивления кровеносных сосудов за счет оценки скорости потока крови и оценки давления в головной части насоса, оценки радиуса кровеносных сосудов и определения срезающего давления на стенку сосуда за счет оценки вязкости крови, оценки скорости потока крови и оценки радиуса кровеносных сосудов. Этапы дополнительно содержат сравнение определенного значения срезающего давления на стенку сосуда с предварительно заданным эталонным значением и регулировка скорости насоса, в том случае, если определенное значение срезающего давления на стенку сосуда не соответствует предварительно заданному эталонному значению. Этапы повторяются до тех пор, пока определенное срезающее давление на стенку сосуда не станет равным предварительно заданному эталонному значению.
[0040] В одном варианте реализации изобретения способ оценки и управления срезающим давлением на стенку сосуда в кровеносных сосудах с применением системы перфузионного насоса содержит этапы оценки по меньшей мере одного элемента, выбранного из группы элементов, состоящей из вязкости крови, скорости потока крови, давления в головной части насоса в системе перфузионного насоса и радиуса кровеносных сосудов, измерения по меньшей мере одного из вариантов состояния двигателя системы перфузионного насоса, выбранного из набора вариантов, состоящего из напряжения, силы тока, скорости вращения насоса и определения срезающего давления на стенку сосуда в кровеносном сосуде. Этапы также содержат сравнение определенного значения срезающего давления на стенку сосуда с предварительно заданным эталонным значением и регулировку скорости насоса, в том случае, если определенное значение срезающего давления на стенку сосуда не соответствует предварительно заданному эталонному значению. Этапы повторяются до тех пор, пока определенное срезающее давление на стенку сосуда не станет равным предварительно заданному эталонному значению.
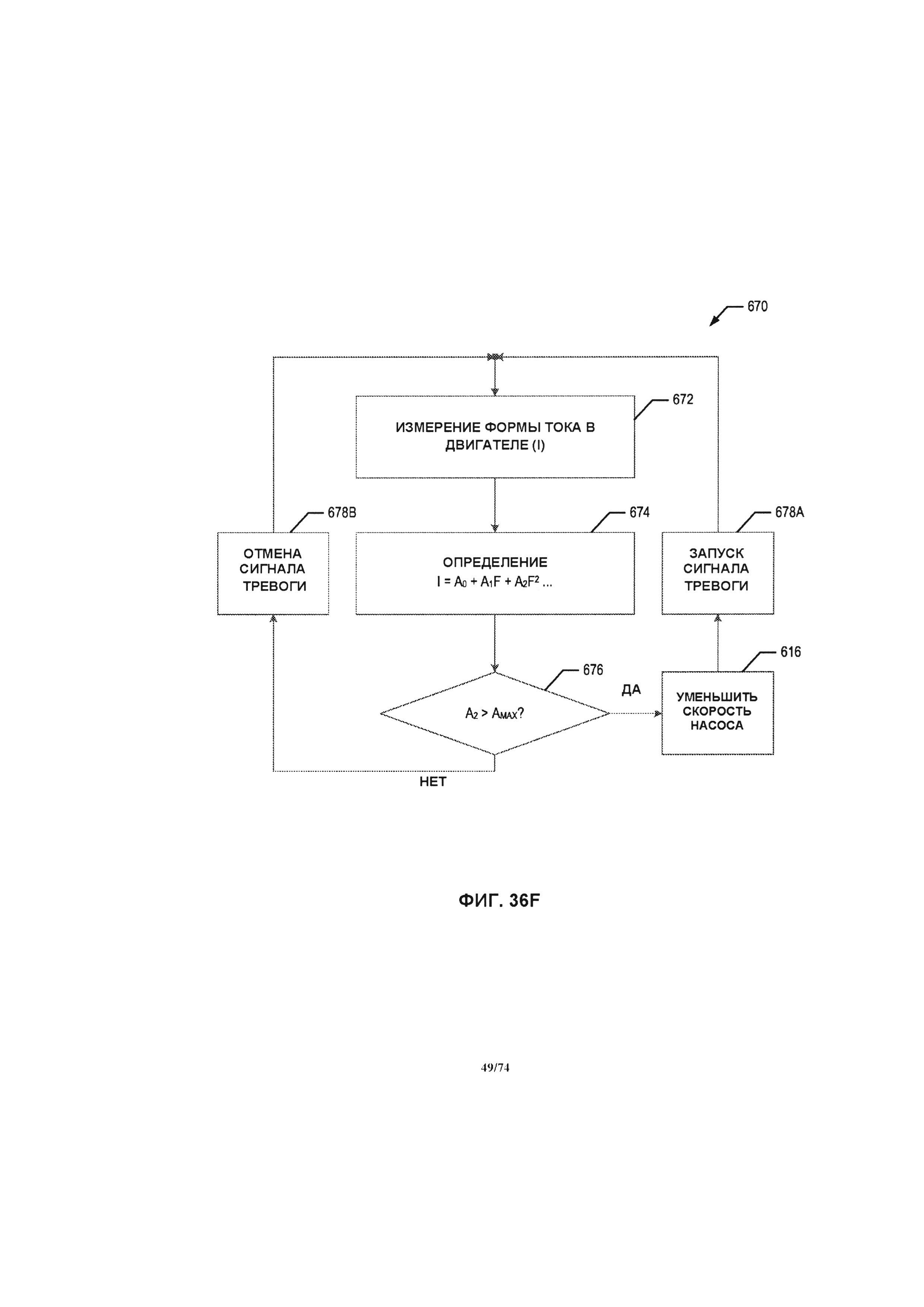
[0041] В еще одном варианте реализации изобретения, способ (без применения датчиков для предотвращения сжатия или соединения кровеносных сосудов или артериального просвета, имеющей жидкостное соединение с системой перфузионного насоса, при определении угрозы сжимания впускного отверстия системы перфузионного насоса), содержит этапы измерения силы тока в цепи двигателя перфузионного насоса и непрерывного определения спектрального анализа силы тока в цепи перфузионного насоса в форме преобразований Фурье. Этапы также содержат предоставление показаний измерений в том случае, когда амплитуда периода второй гармоники преобразований Фурье выходит за пределы эталонного значения, и уменьшение скорости вращения двигателя насоса в том случае, когда амплитуда второй гармоники преобразований Фурье выходит за пределы эталонного значения. Этапы повторяются до тех пор, пока амплитуда периода второй гармоники не упадет ниже эталонного значения.
[0042] В другом варианте реализации изобретения система перфузионного насоса содержит перфузионный насос и систему управления для контроля системы перфузионного насоса и изменения режима работы перфузионного насоса для поддержания снижения венозного кровяного давления в обрабатываемой нижней конечности. Перфузионный насос также выполнен с возможностью поддержания в полости приточной соединительной трубки и имеющей жидкостное соединение с сегментом периферической вены во время изменений положения тела, например, из положения стоя в положение лежа. В одном варианте реализации изобретения система управления контролирует давление крови в венах нижних конечностей, имеющих жидкостное соединение с приточной соединительной трубкой системы перфузионного насоса, и регулирует скорость насоса для поддержания венозного давления в заданном диапазоне, что приводит к достижению нужного венозного оттока через перфузионный насос, при этом, одновременно предотвращая сжатие стенок вен, склеивание или пролапс. В этом варианте реализации изобретения система управления выполнена с возможностью поддержания давления в участках вен нижних конечностей в непосредственной близости к приточной соединительной трубке в диапазоне от 5 мм ртутного столба до 100 мм ртутного столба или, предпочтительно, в диапазоне от 10 мм ртутного столба до 50 мм ртутного столба, или в диапазоне от 10 мм ртутного столба до 25 мм ртутного столба. В обоих вариантах реализации изобретения, система перфузионного насоса выполнена, как правило, с возможностью поддержания заданного давления в участке вен нижних конечностей в течение по меньшей мере 7 дней, 28 дней, 56 дней, 112 дней, 224 дней или 356 дней.
[0043] Система перфузионного насоса имеет систему управления, как правило, для обеспечения и поддержания желаемого диапазона давлений в венах нижних конечностей, которая может дополнительно содержать устройство управления для получения информации и управления режимом работы насоса в системе перфузионного насоса. При минимальном значении система управления может быть активирована вручную для регулировки скорости двигателя. В альтернативном варианте может применяться автоматическая ("интеллектуальная") система управления. Дополнительно, система управления содержит датчики, установленные в насосе, соединительных трубках или сосудистой системе пациента. Датчики, включая, помимо всего прочего, датчики положения, могут быть расположены внутри пациента или на пациенте в различных вариантах размещения. Устройство управления может измерять скорость вращения двигателя на основании частоты перехода через ноль сигнала обратной ЭДС. Переход через ноль указывает на изменение магнитного поля крыльчатки. Скорость вращения двигателя управляется широтно-импульсной модуляцией (ШИМ) входного напряжения, а кутящий момент управляется ШИМ входного тока. Устройство управления также контролирует другие варианты состояний двигателя насоса, например, силу тока и напряжение, за счет которых можно оценить и управлять скоростью потока через систему перфузионного насоса. Устройство управления, предпочтительно, содержит память, процессор для управления скоростью вращения двигателя насоса, анализа информации, поступающей от электронного блока управления двигателем и дополнительных датчиков, а также выполнения инструкций, закодированных на машиночитаемых носителях. Система перфузионного насоса содержит устройство управления, подключаемое к насосу и дополнительным датчикам электрическим способом. Система перфузионного насоса также содержит источник питания, который, в различных вариантах реализации изобретения, может быть интегрирован в устройство управления. В различных вариантах реализации изобретения источник питания для системы перфузионного насоса может быть переносным (например, в виде перезаряжаемых батарей или топливных элементов) или стационарным (например, в виде блока питания, подключенного к электрической сети переменного тока).
[0044] Система управления может получать информацию от различных датчиков. Электронный блок управления двигателем внутри устройства управления может измерять один из следующих параметров: скорость вращения электродвигателя, входное напряжение или силу тока, необходимых для работы насоса. В других вариантах реализации изобретения, система управления содержит датчики в перфузионном насосе или соединительных трубках, которые измеряют по меньшей мере один из параметров: скорость кровотока, скорость потока крови, давление крови, положение тела, а также комбинацию этих параметров. В других варианта реализации изобретения, система управления содержит датчики в сосудистой системе пациента, измеряющие по меньшей мере один из следующих параметров: скорость кровотока, скорость расхода крови, давление крови, а также комбинацию этих параметров.
[0045] Для автоматического управления работой системы перфузионного насоса могут применяться различные способы. В одном варианте реализации изобретения способ снижения давления в сегментах вен нижних конечностей содержит этапы оценки положения тела и регулировки скорости насоса на основании данных о положении тела. В другом варианте реализации изобретения способ снижения давления в сегментах вен нижних конечностей содержит этапы оценки положения тела, измерения давления крови в приточной соединительной трубке или сегменте вены, имеющем жидкостное соединение с приточной соединительной трубкой, и этап регулировки скорости насоса на основании данных о положении тела и давлении крови в приточной соединительной трубке или сегменте вены, имеющем жидкостное соединение с приточной соединительной трубкой. В другом варианте реализации изобретения способ снижения давления в сегментах вен нижних конечностей включает этапы измерений по меньшей мере одного варианта состояния двигателя системы перфузионного насоса, выбранного из группы параметров, содержащей параметры напряжения, силы тока и скорости насоса, а также регулировку скорости системы перфузионного насоса для обеспечения по меньшей мере определенного минимального потока крови через систему перфузионного насоса. В другом варианте реализации изобретения способ снижения давления в сегментах вен нижних конечностей включает этапы измерения потока крови через систему насоса и регулировку скорости системы перфузионного насоса для обеспечения по меньшей мере определенного минимального потока крови через систему перфузионного насоса.
[0046] В еще одном варианте реализации изобретения способ (без применения датчиков для предотвращения сжатия или соединения сегментов вен нижних конечностей, имеющих жидкостное соединение с системой перфузионного насоса, при определении угрозы сжимания вен или приточных соединительных трубок вблизи или непосредственно на впускном отверстии системы перфузионного насоса), содержит этапы измерения силы тока в цепи двигателя перфузионного насоса и непрерывного определения спектрального анализа силы тока в цепи перфузионного насоса в форме преобразований Фурье. Этапы также содержат предоставление показаний измерений в том случае, когда амплитуда периода второй гармоники преобразований Фурье выходит за пределы эталонного значения, и уменьшение скорости вращения двигателя насоса в том случае, когда амплитуда второй гармоники преобразований Фурье выходит за пределы эталонного значения. Этапы повторяются до тех пор, пока амплитуда периода второй гармоники не упадет ниже эталонного значения.
[0047] В различных других вариантах реализации изобретения устройство и способ, описанный в данном документе, может быть закодирован на машиночитаемом носителе, который может быть выполнен на устройстве обработки данных. Любые эталонные значения или предварительно заданные стандарты, применяемые устройством и способом реализации, могут быть сохранены в базе данных или другом подходящем хранилище данных.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
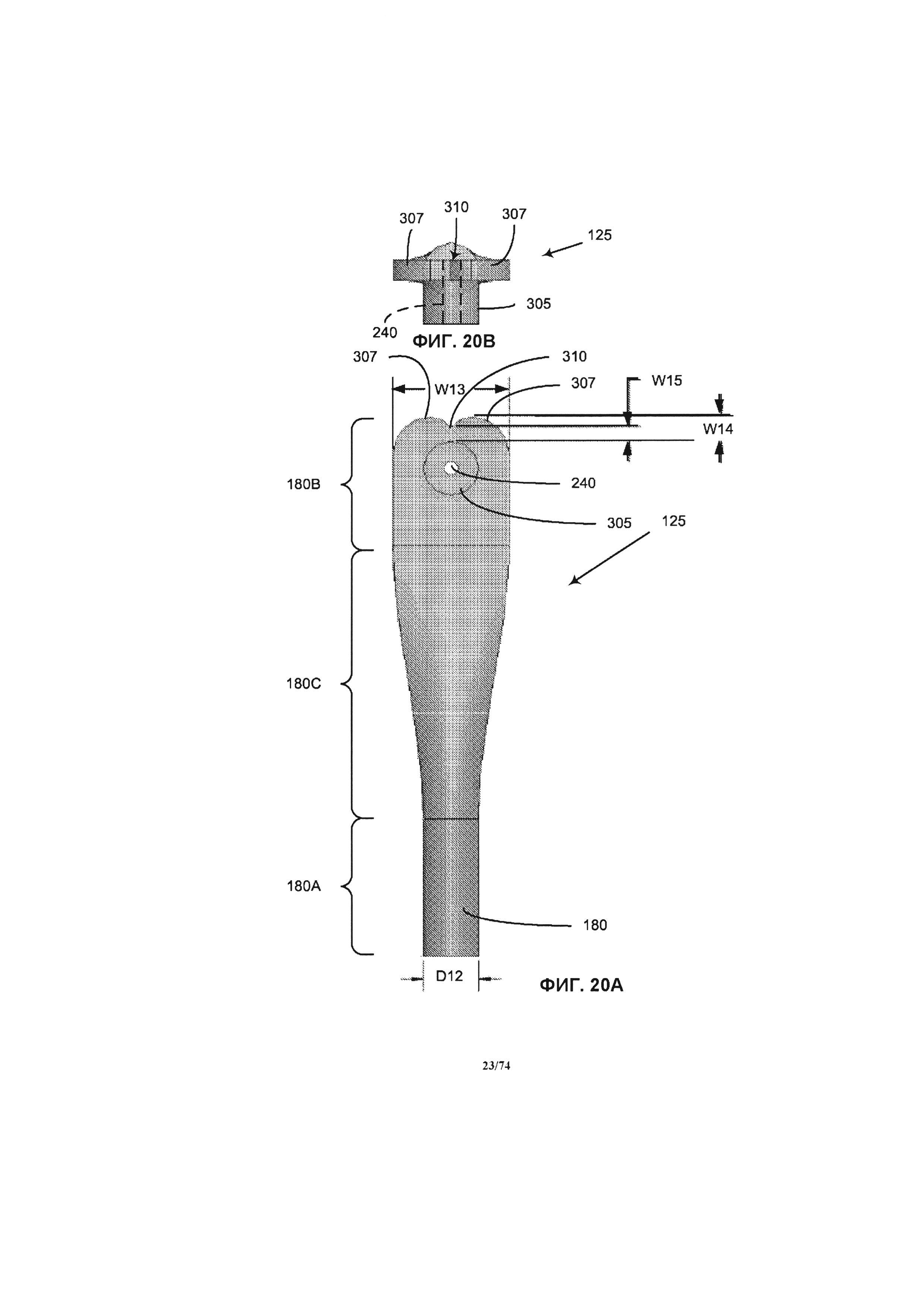
[0041] На ФИГ. 1 проиллюстрировано изометрическое изображение насоса.
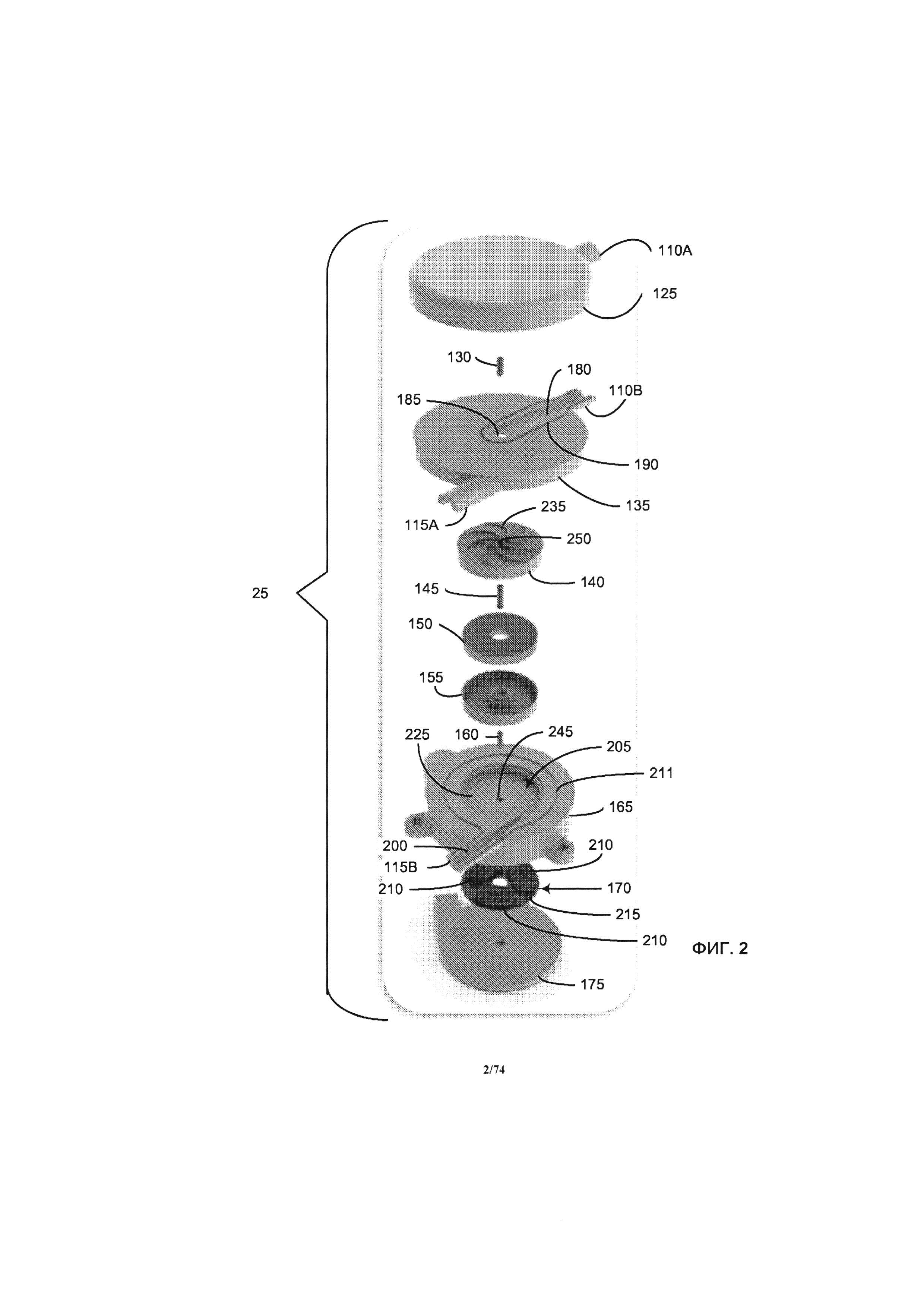
[0042] На ФИГ. 2 проиллюстрировано изометрическое изображение насоса в разобранном виде, с демонстрацией компонентов, содержащихся в корпусе, рассмотренном на ФИГ. 1.
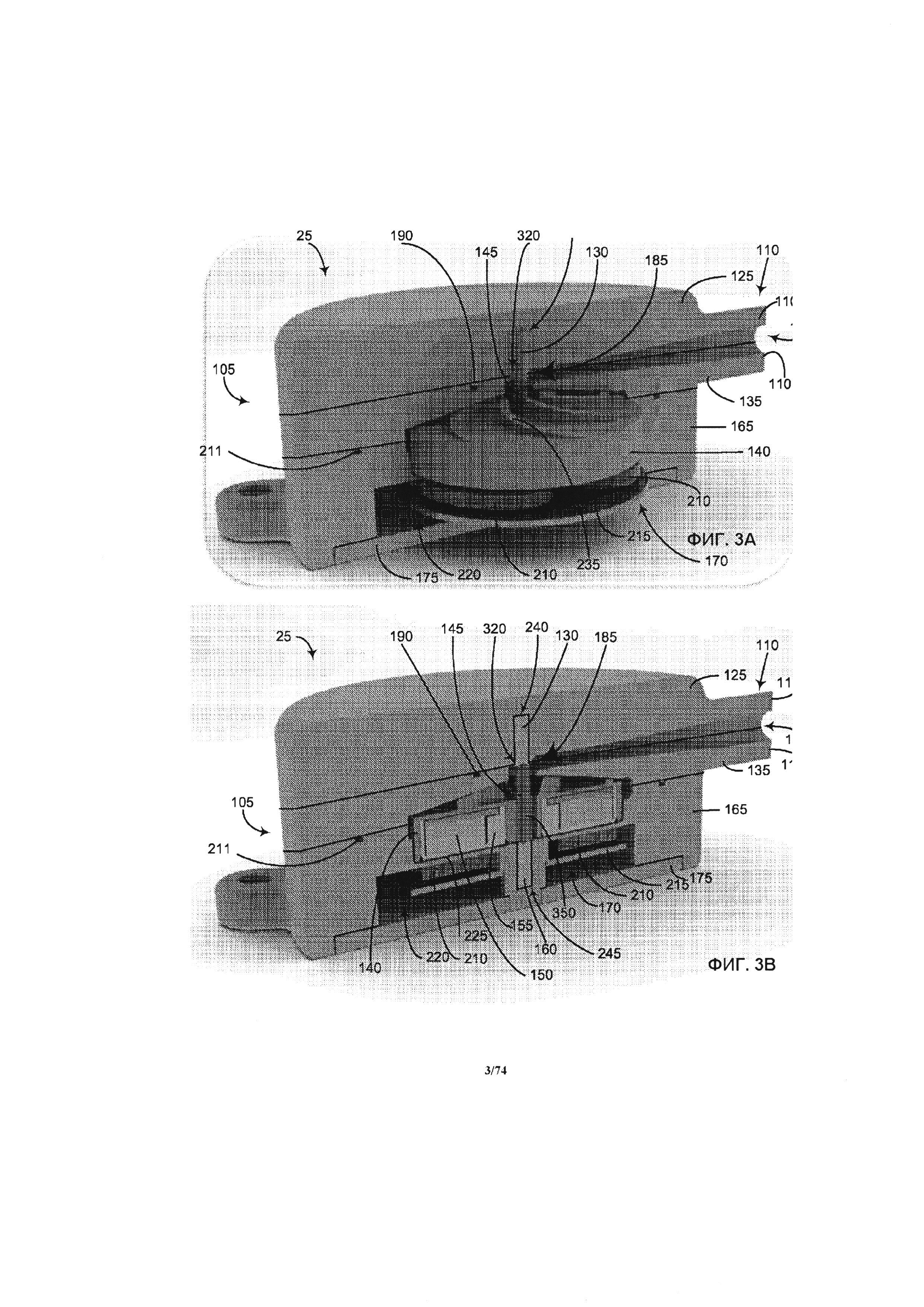
[0043] На ФИГ. 3А и 3В, соответственно, проиллюстрированы компоненты и полный поперечный разрез насоса вдоль линии разреза 3-3 на ФИГ. 1.
[0044] На ФИГ. 4А и 4В, соответственно, проиллюстрированы компоненты и полный поперечный разрез насоса вдоль линии разреза 4-4 на ФИГ. 1.
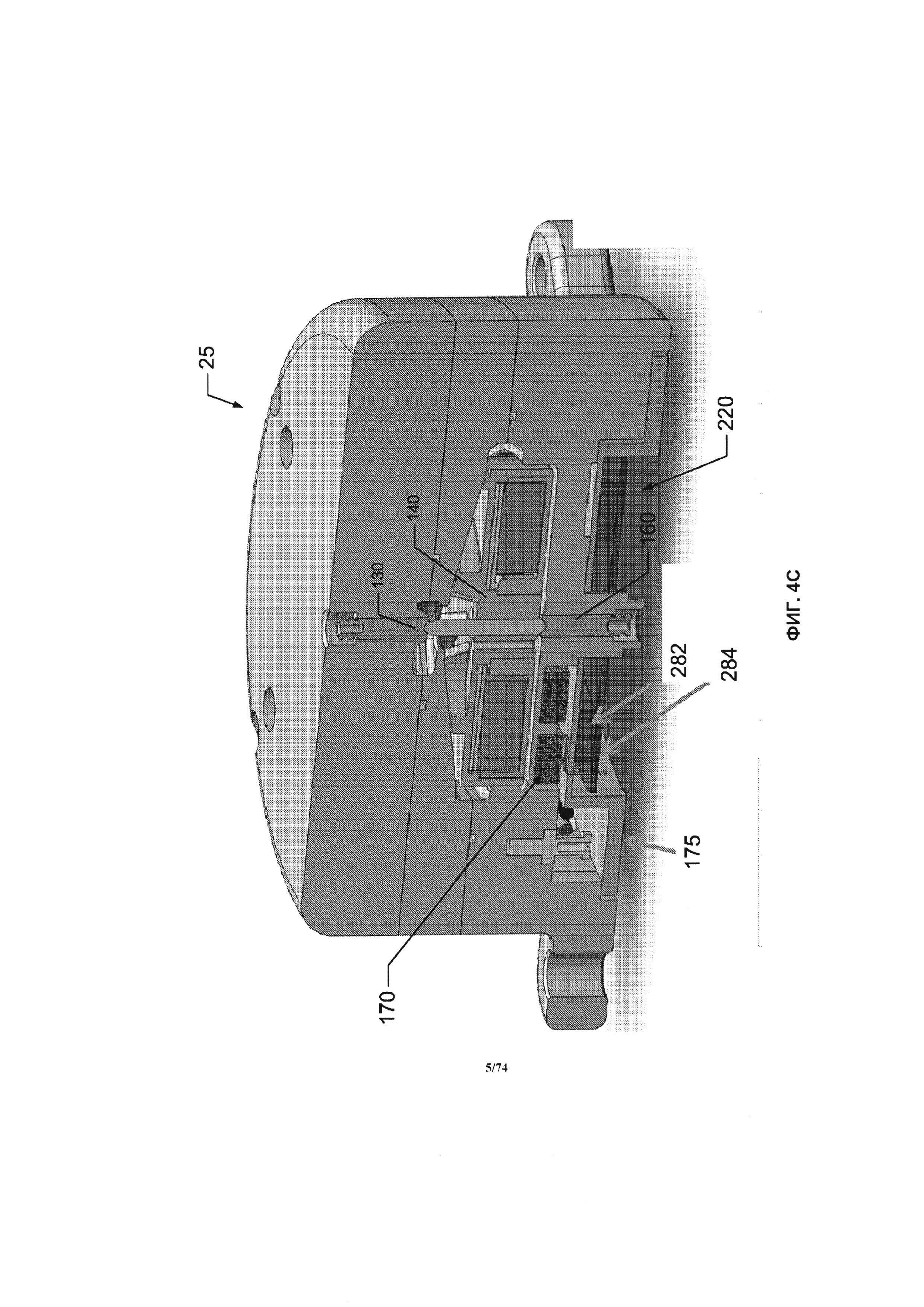
[0045] На ФИГ. 4С проиллюстрирован поперечный разрез другого варианта реализации насоса.
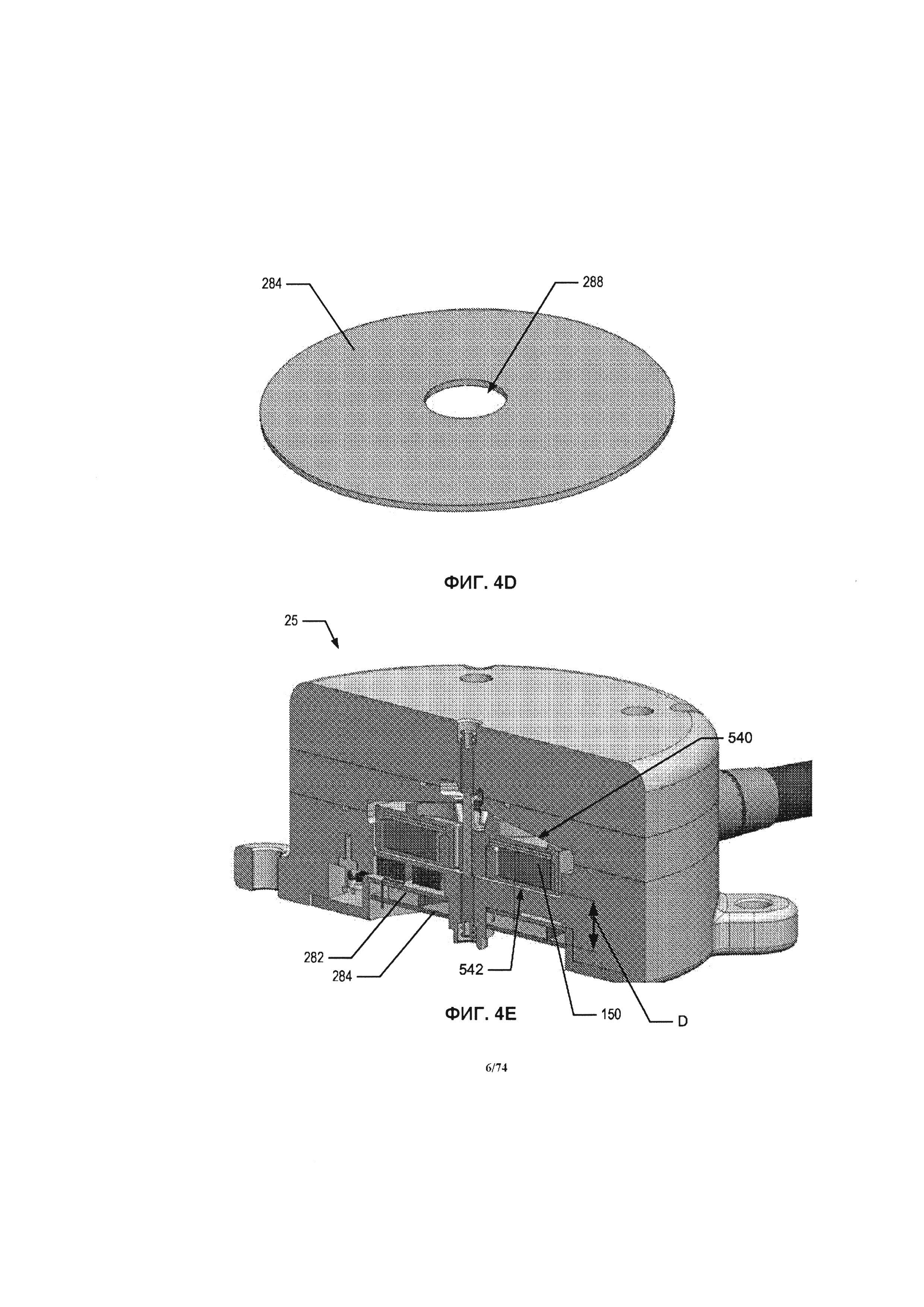
[0046] На ФИГ. 4D проиллюстрирован вид в перспективе задней стенки в соответствии с одним вариантом реализации изобретения.
[0047] На ФИГ. 4Е проиллюстрирован поперечный разрез насоса в соответствии с одним вариантом реализации изобретения.
[0048] На ФИГ. 4F проиллюстрирована схема и иллюстрация нагрузки на верхний
и нижний подшипники, как функция от расположения задней стенки в порядке, определенном в одном варианте реализации изобретения.
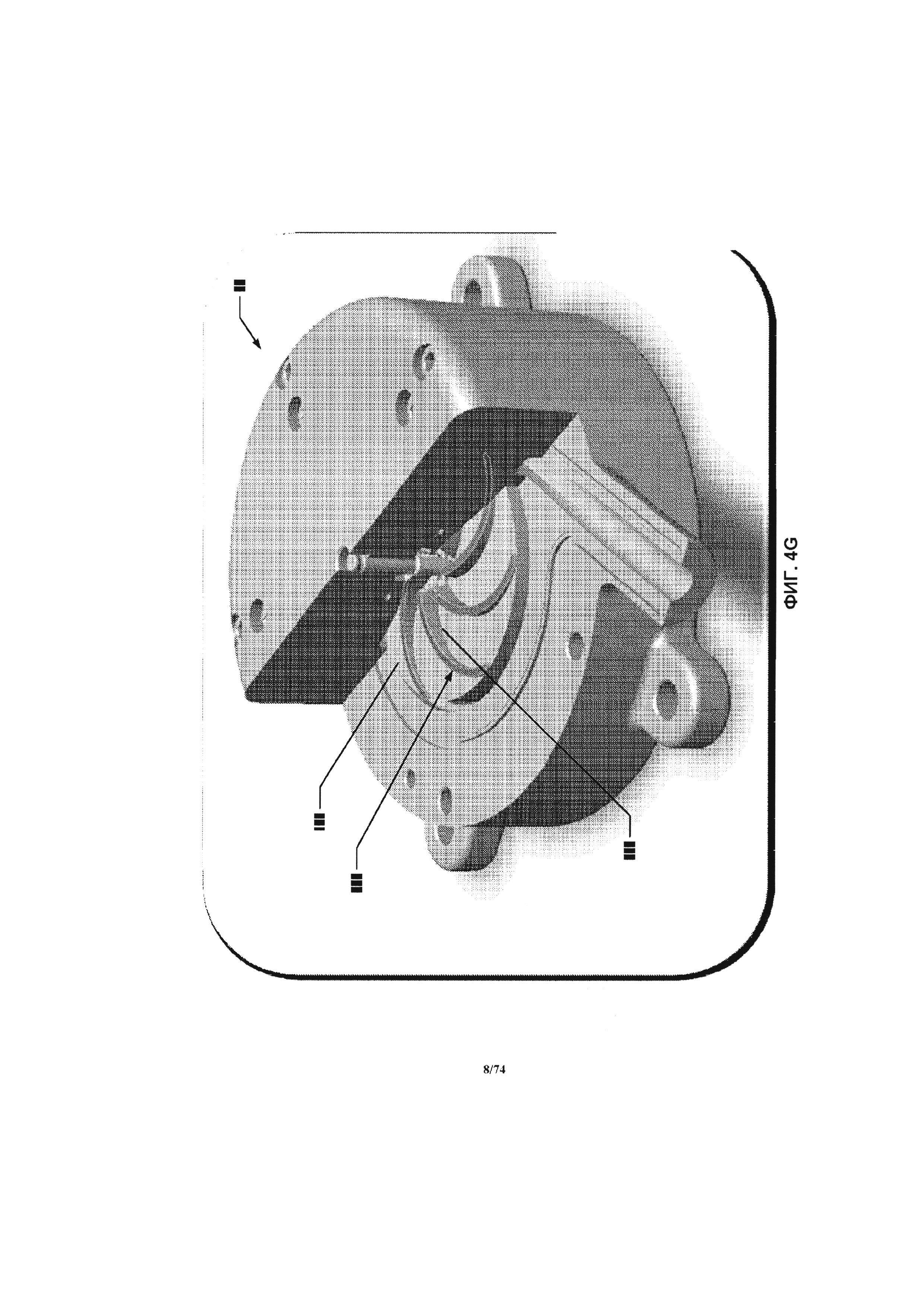
[0049] На ФИГ. 4G проиллюстрирован частичный разрез перфузионного насоса, иллюстрирующий площадь поверхности крыльчатки, оснащенной гидродинамическими подшипниками в соответствии с одним вариантом реализации изобретения.
[0050] На ФИГ. 4Н проиллюстрирована осевая нагрузка на верхний и нижний подшипники, как функция от верхнего зазора между крыльчаткой и верхним корпусом при 4000 об/мин.
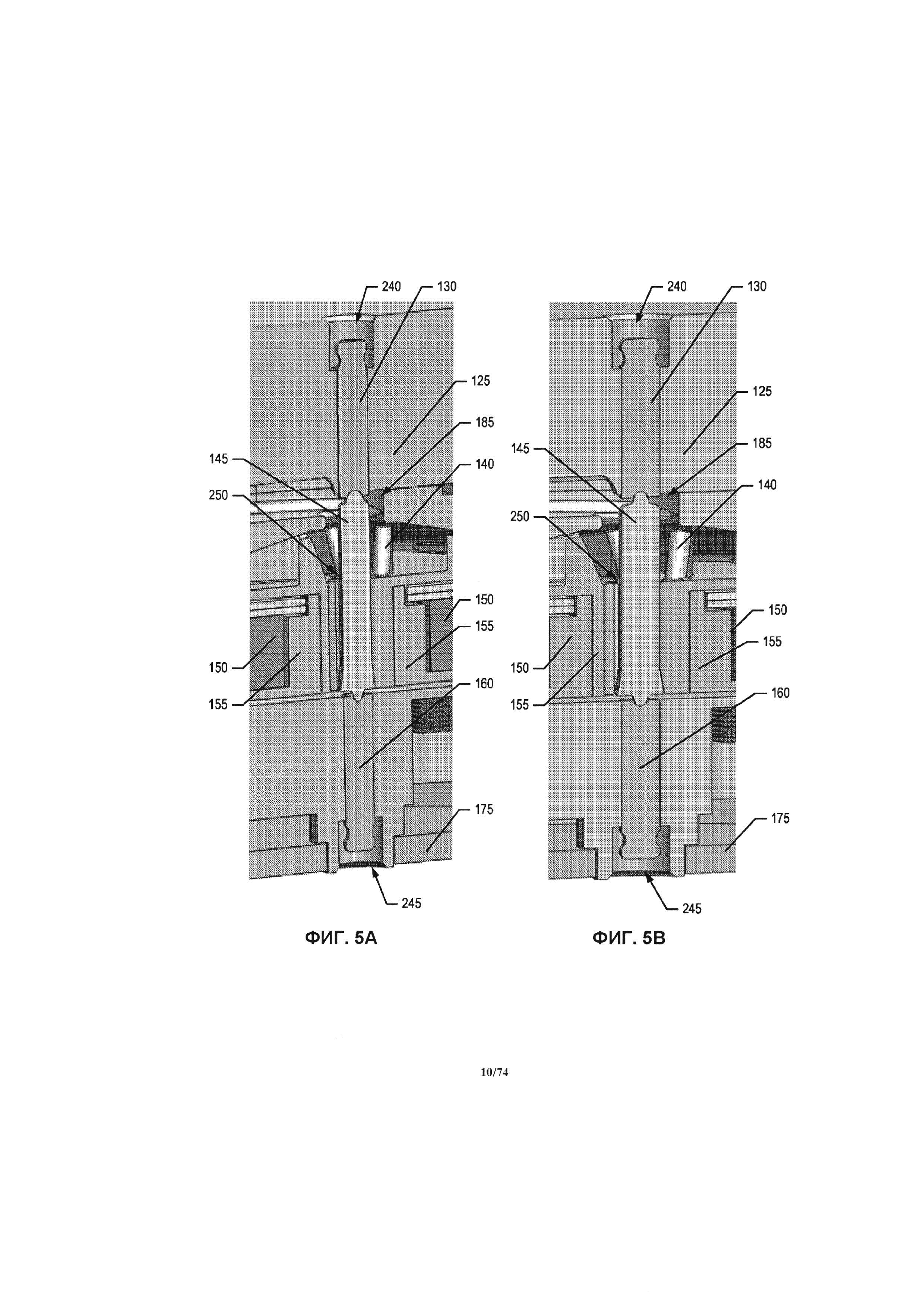
[0051] На ФИГ. 5А-5В проиллюстрировано увеличенное изображение области оси вращения, проиллюстрированной на ФИГ 3В и 4В.
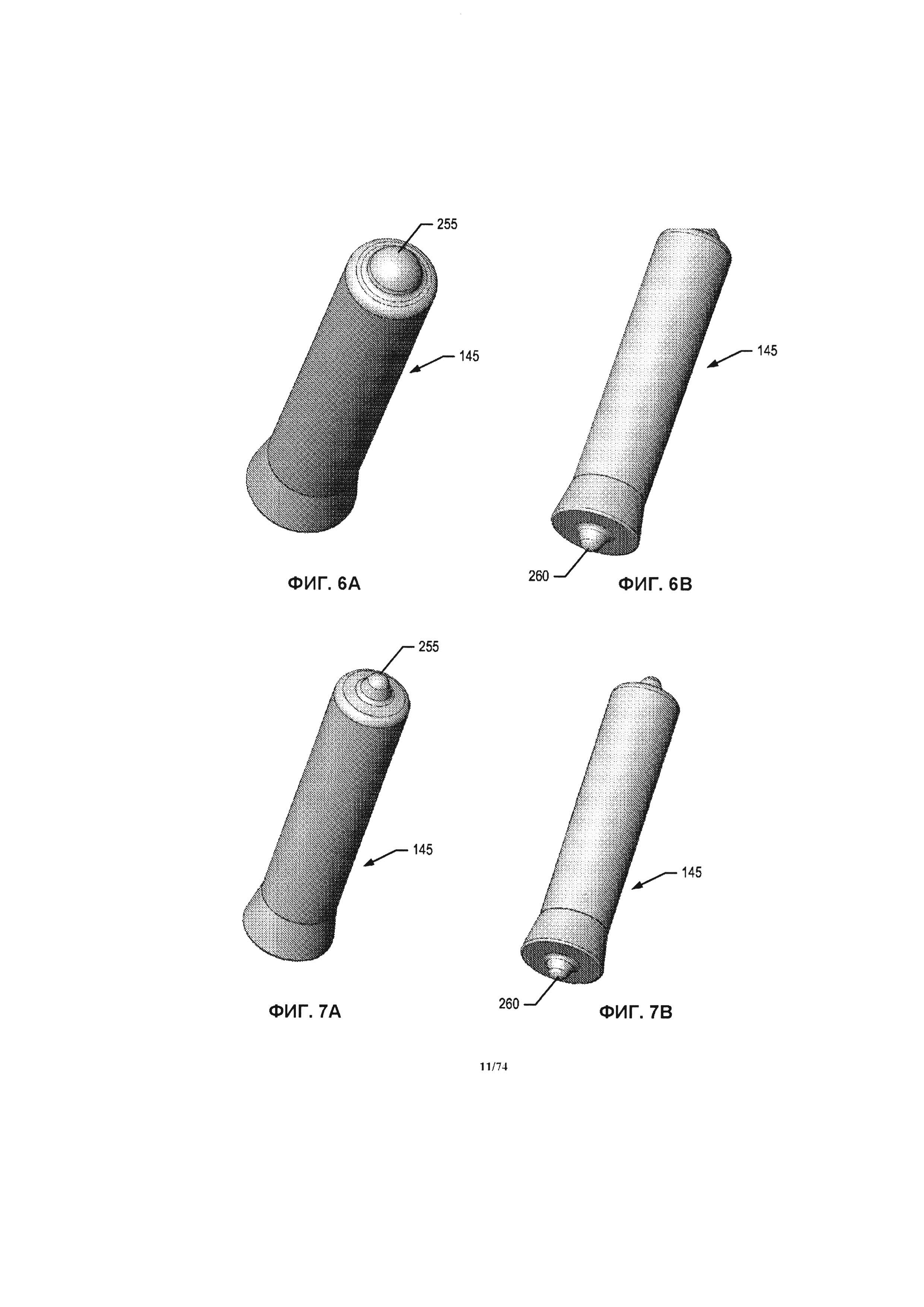
[0052] На ФИГ. 6А-В, соответственно, проиллюстрирована верхняя и нижняя изометрическая проекция оси крыльчатки.
[0053] На ФИГ. 7А-В, соответственно, проиллюстрирована верхняя и нижняя изометрическая проекция оси крыльчатки.
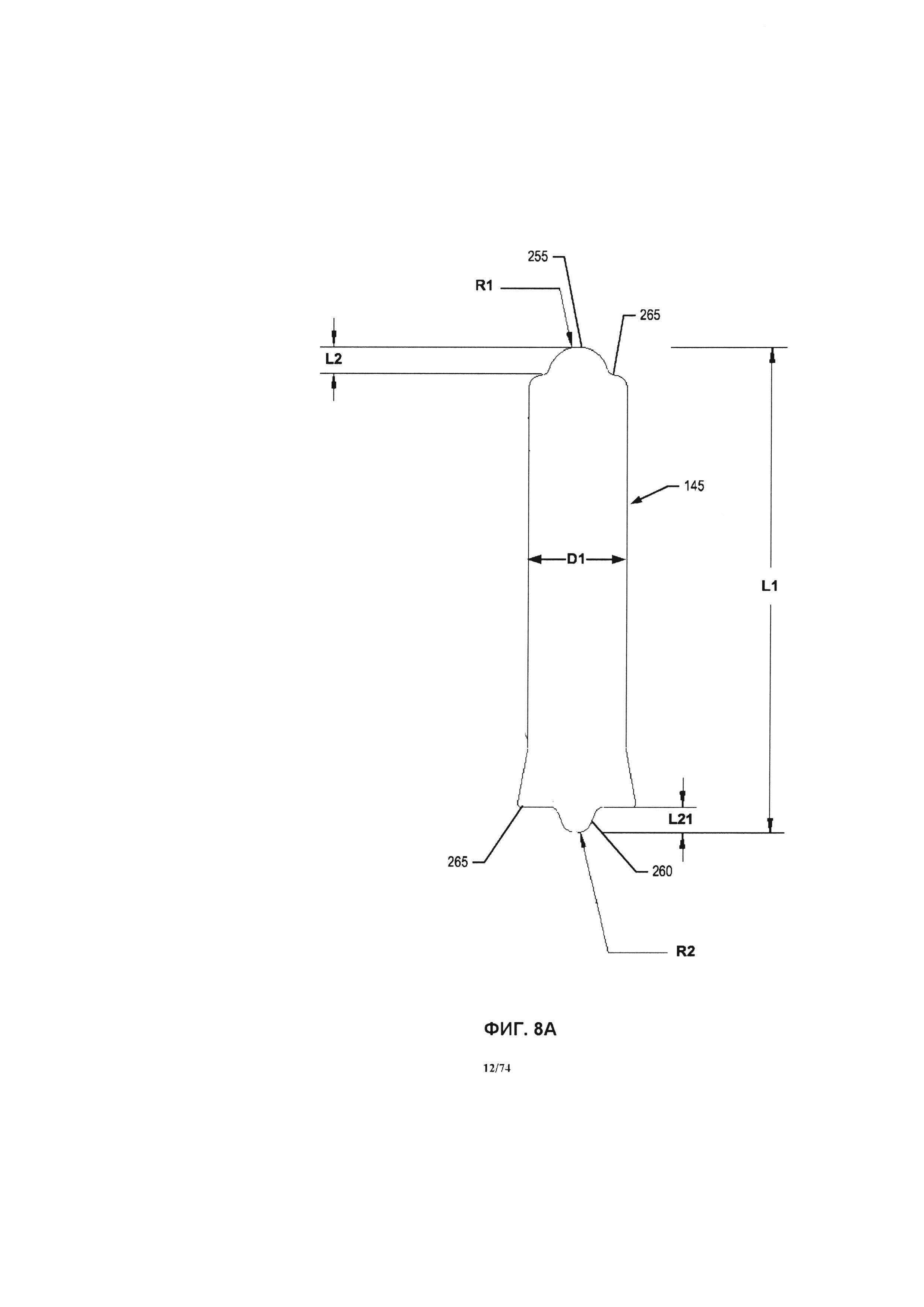
[0054] На ФИГ. 8А-В проиллюстрирована вертикальная боковая проекция варианта реализации оси крыльчатки.
[0055] На ФИГ. 8С проиллюстрирована вертикальная боковая проекция варианта реализации оси крыльчатки.
[0056] На ФИГ. 8D-E проиллюстрирована, соответственно, горизонтальная проекция верхней и нижней поверхности варианта реализации оси крыльчатки.
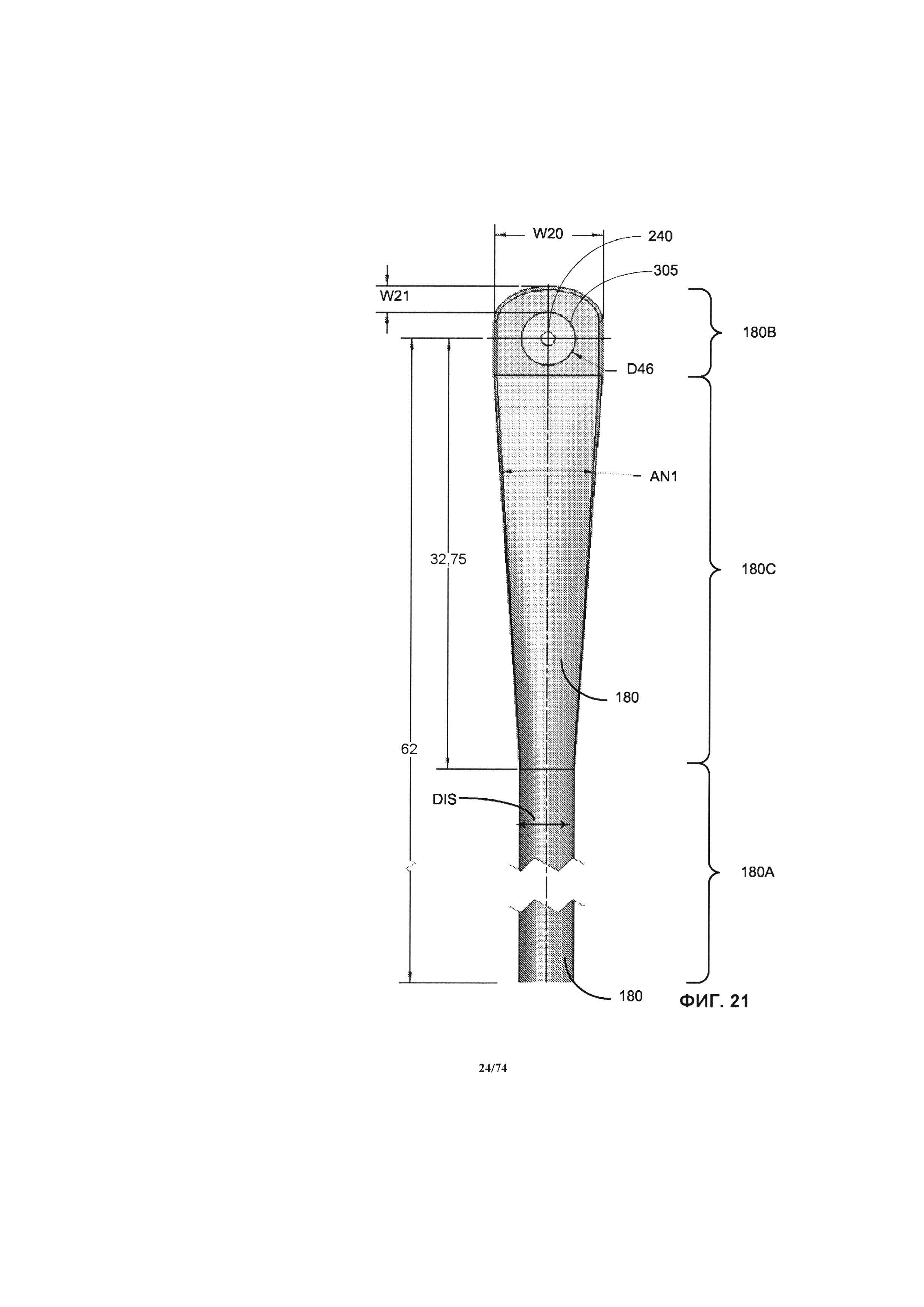
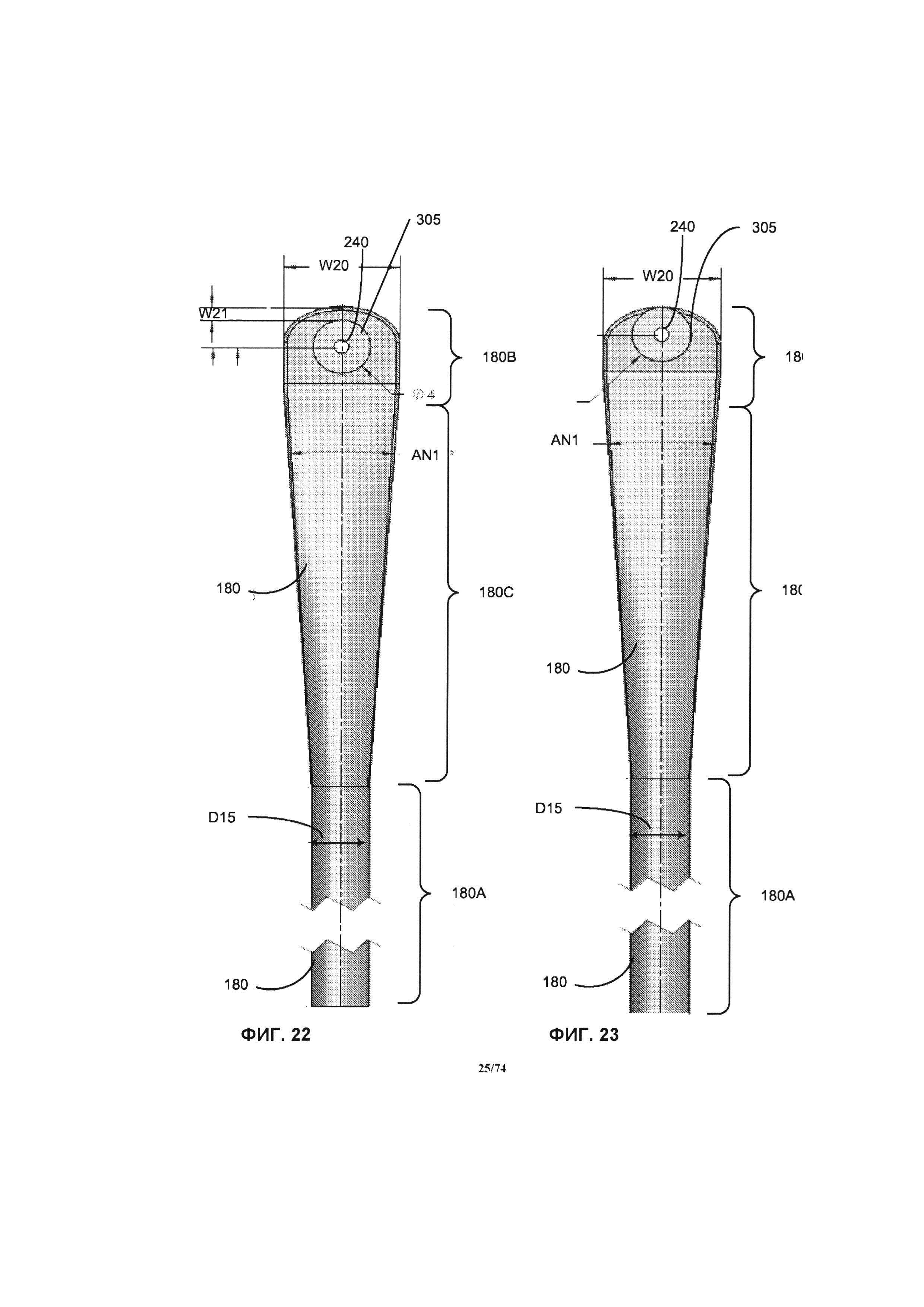
[0057] На ФИГ. 8F-G проиллюстрирован, соответственно, увеличенный масштаб проекции верхней и нижней части оси варианта реализации оси крыльчатки.
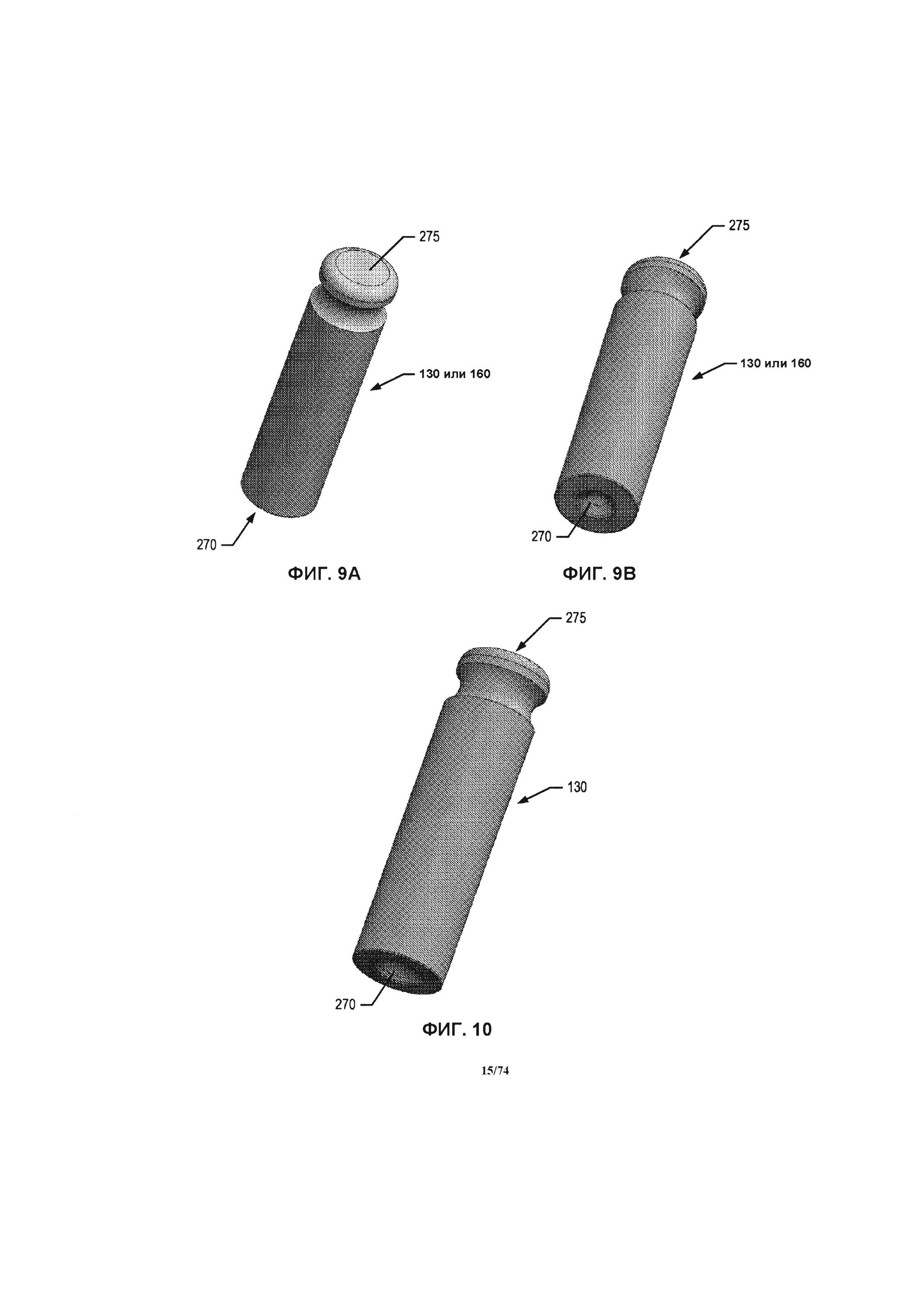
[0058] На ФИГ. 9А-В проиллюстрированы, соответственно, противоположные концы соответствующих шеек подшипника, применяемых на обоих концах оси крыльчатки для поддержания и обеспечения вращения оси крыльчатки.
[0059] На ФИГ. 10 проиллюстрировано изображение варианта реализации верхней шейки подшипника.
[0060] На ФИГ. 11А-В проиллюстрирована вертикальная боковая проекция варианта реализации типичной шейки подшипника.
[0061] На ФИГ. 11С проиллюстрирована вертикальная боковая проекция типичной шейки подшипника.
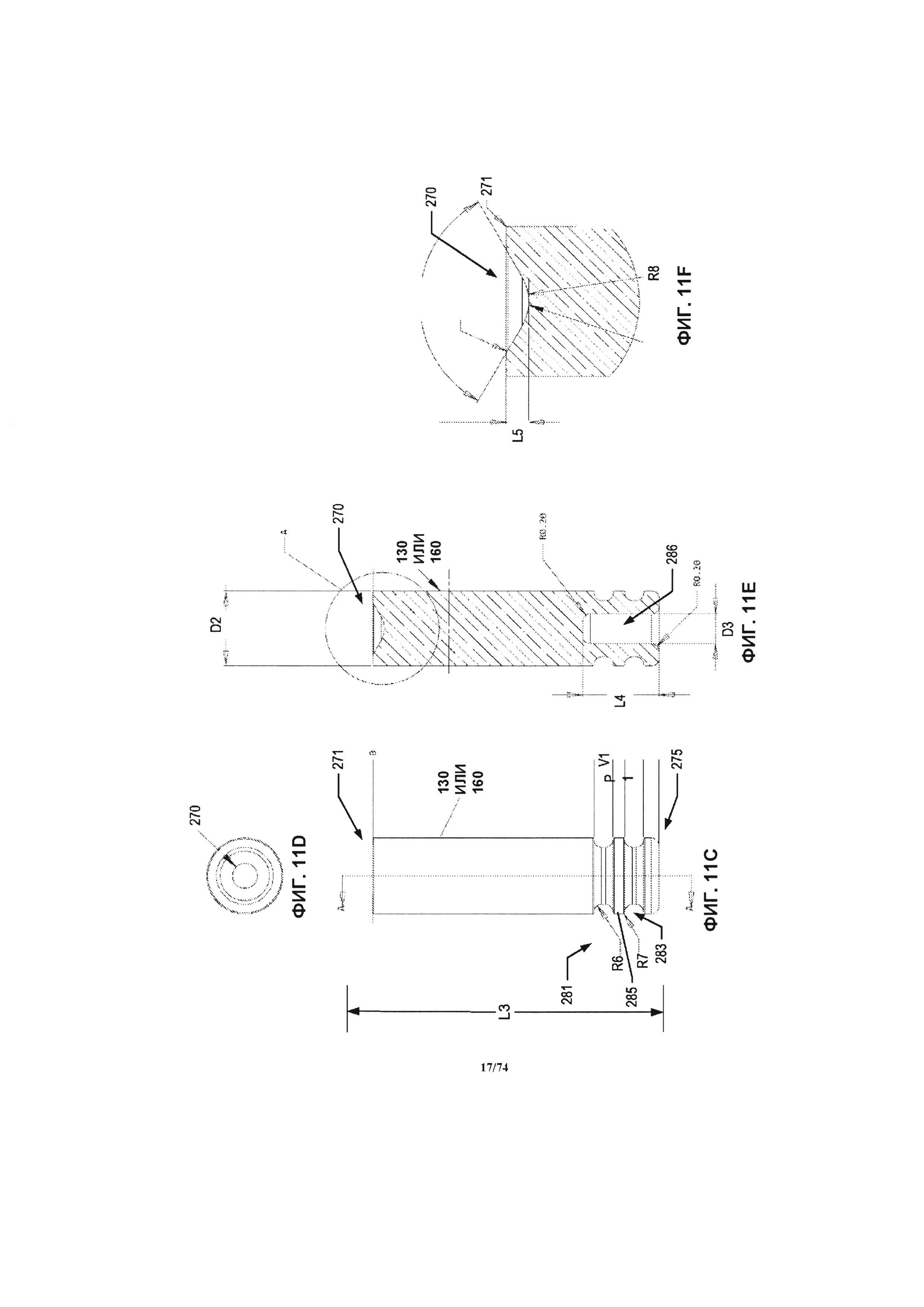
[0062] На ФИГ. 11D проиллюстрирована горизонтальная проекция одного конца типичной шейки подшипника.
[0063] На ФИГ. 11E-F проиллюстрирован, соответственно, поперечный разрез типичной шейки подшипника и поверхности контакта подшипника типичной шейки подшипника, взятой вдоль линии разреза А-А, проиллюстрированной на ФИГ. 11С.
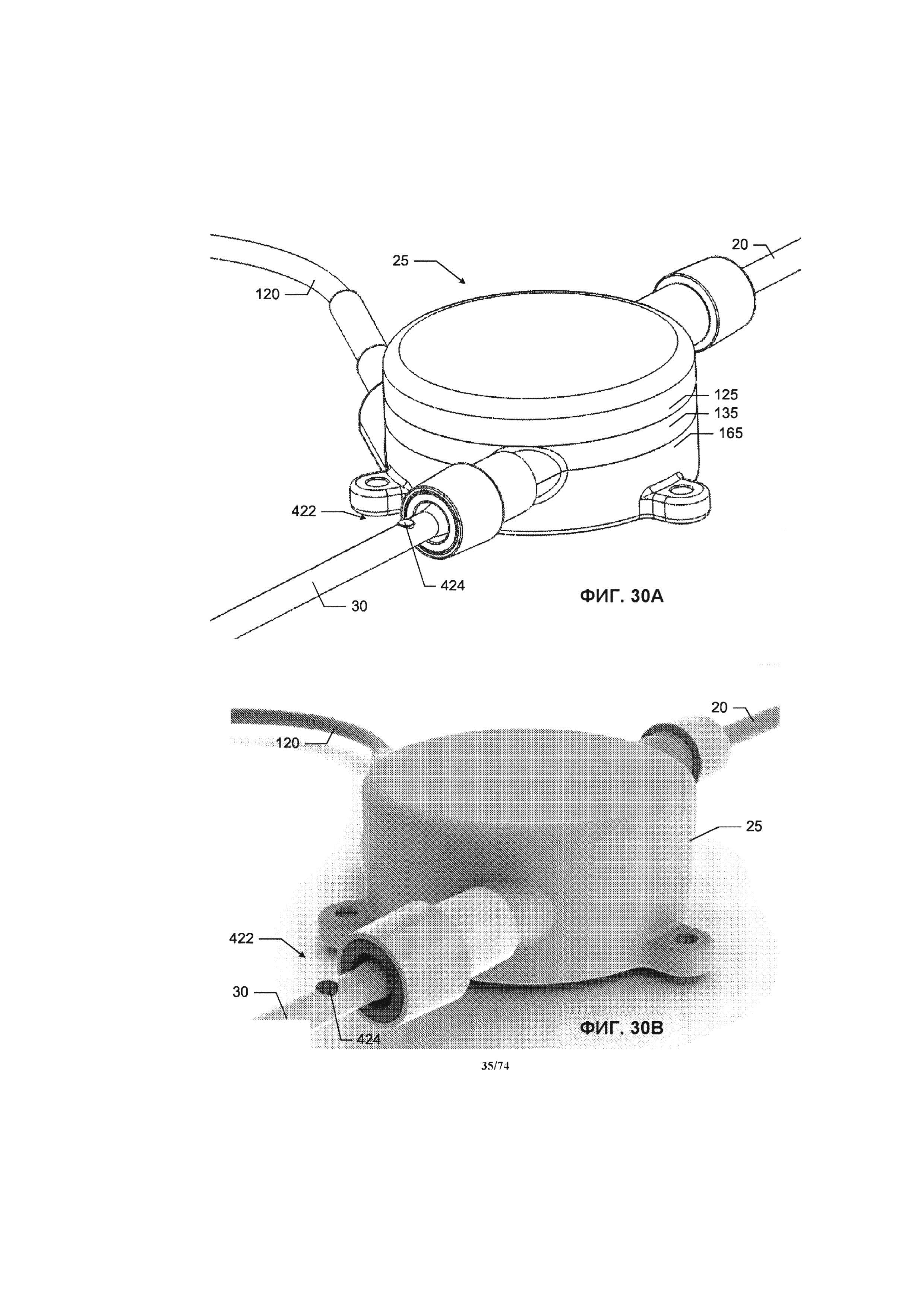
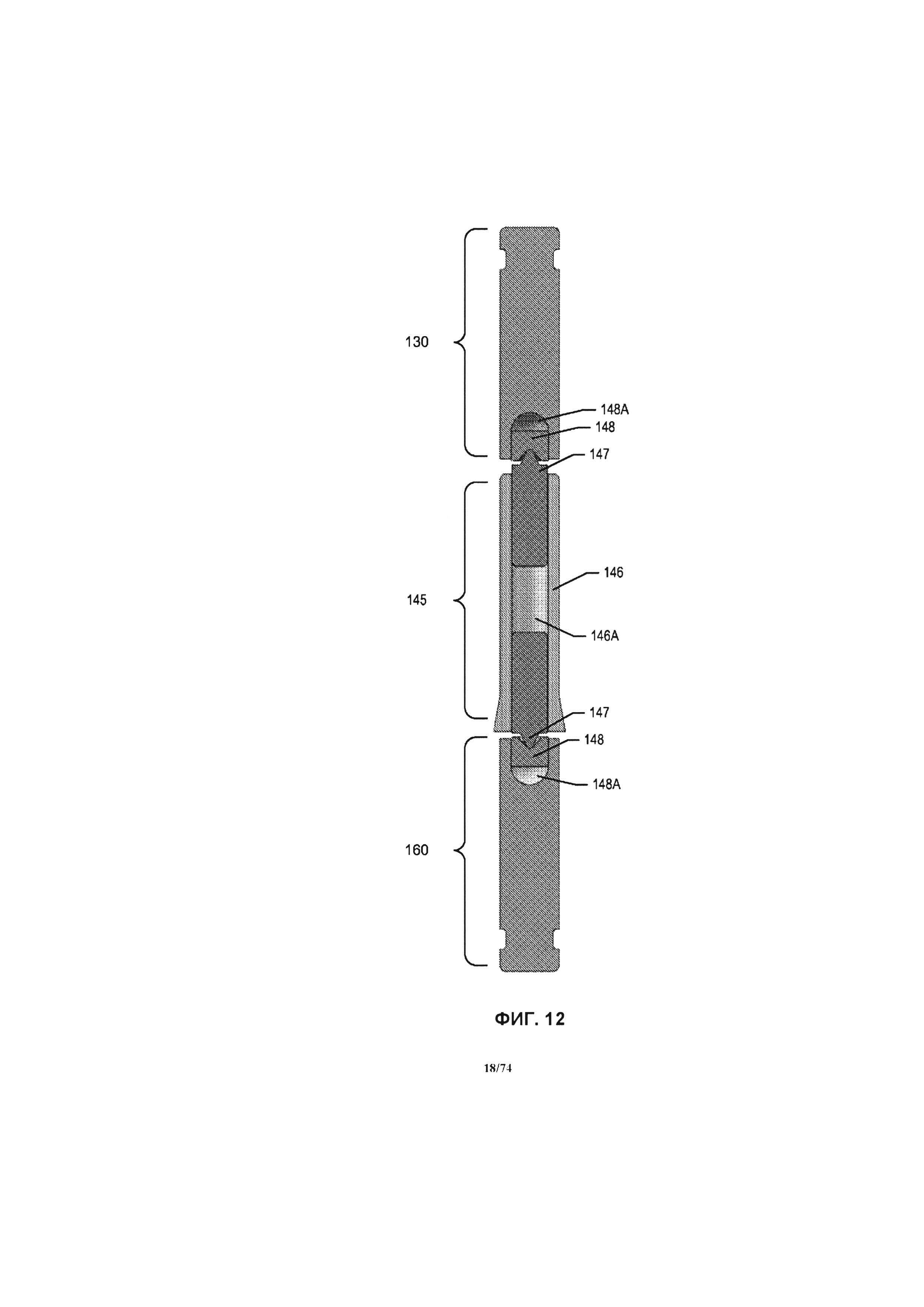
[0064] На ФИГ. 12 проиллюстрирован продольный разрез комплекта деталей типичной шейки подшипника.
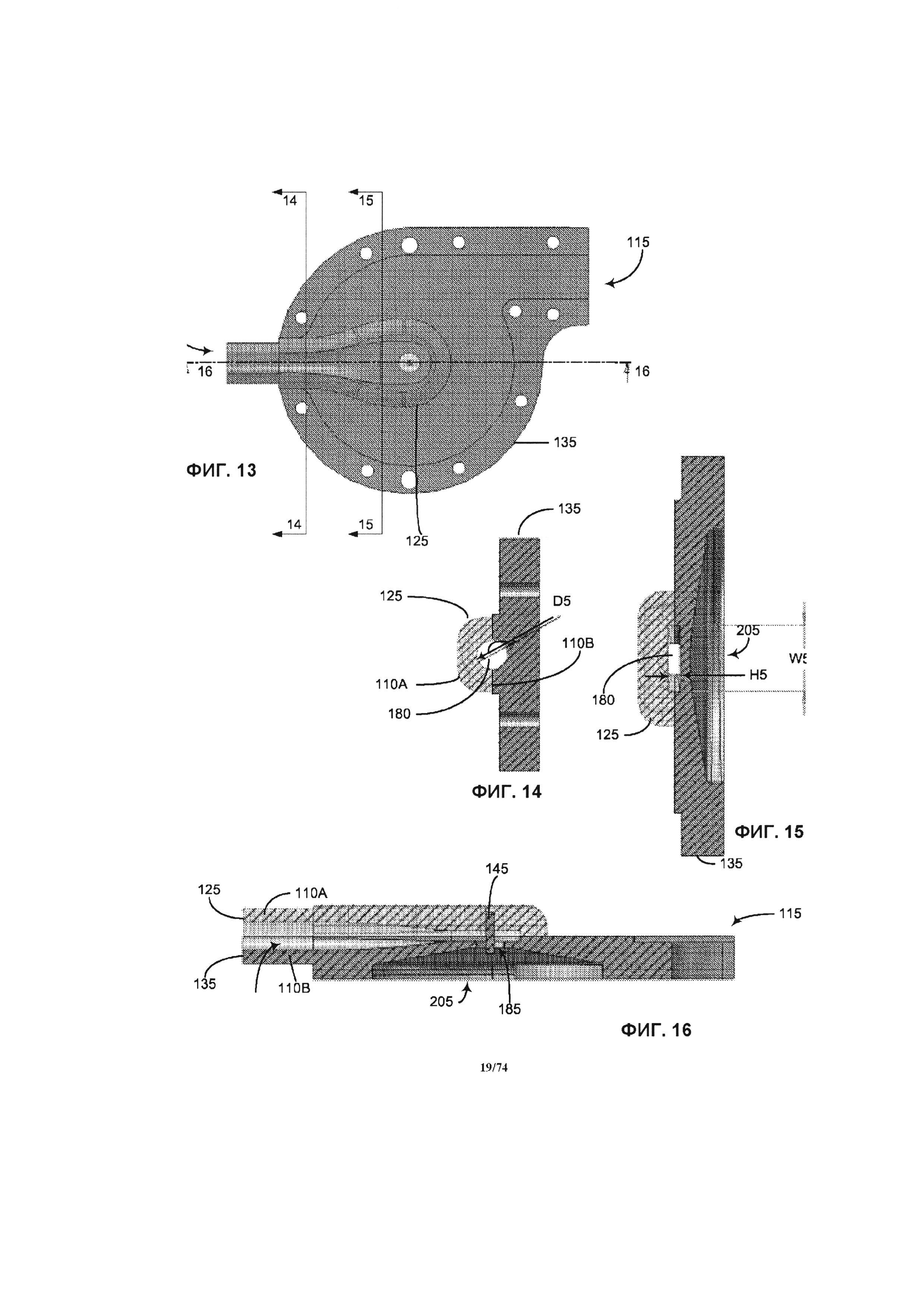
[0065] На ФИГ. 13 проиллюстрирована горизонтальная проекция крышки впускного отверстия и корпуса крыльчатки.
[0066] На ФИГ. 14-16 проиллюстрированы соответствующие поперечные разрезы, взятые по линии разреза 14-14, 15-15 и 16-16 на ФИГ. 13.
[0067] На ФИГ. 17 проиллюстрирован частичный изометрический разрез секции крыльчатки, в которой находится впускное отверстие.
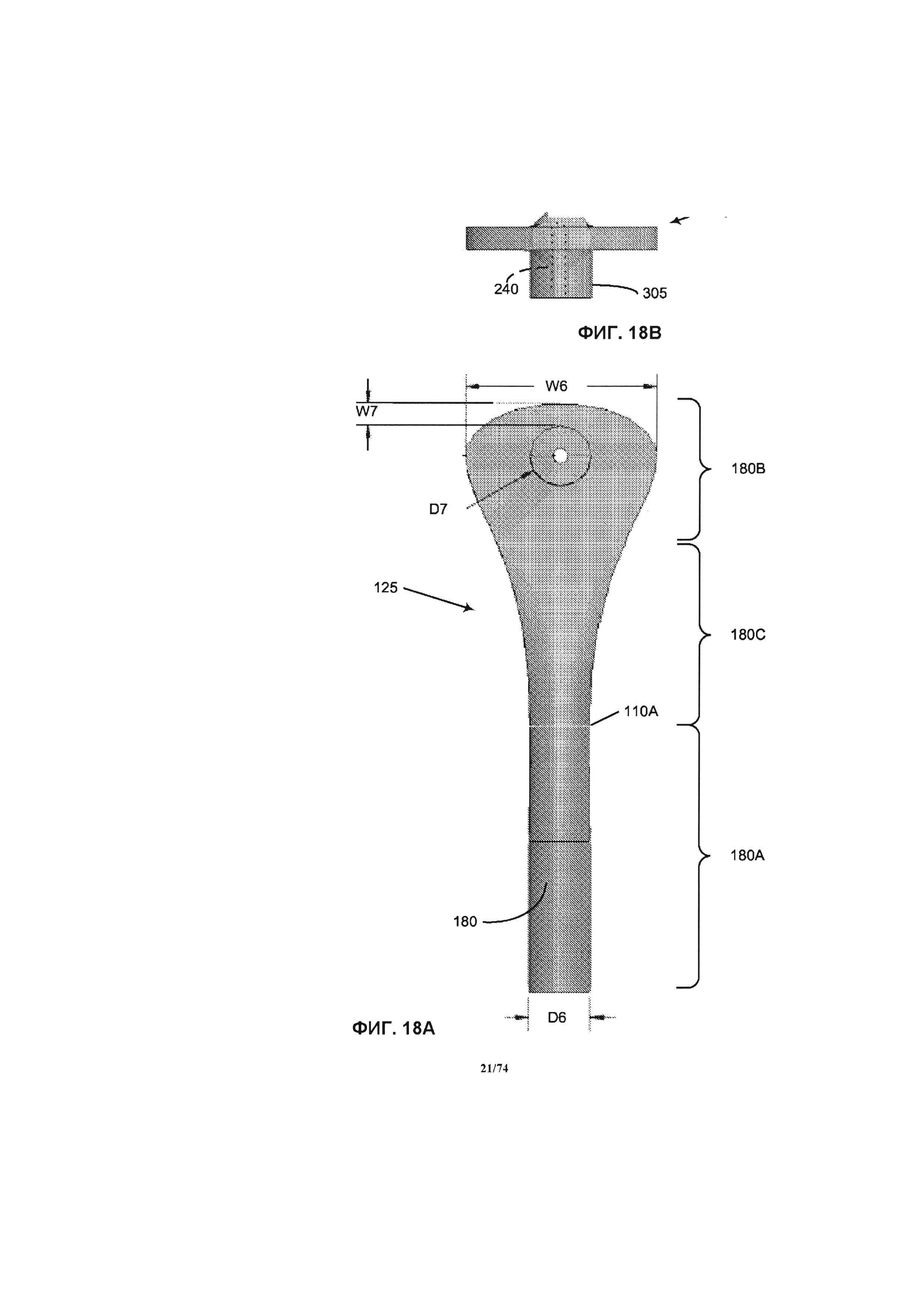
[0068] На ФИГ. 18А и 18В проиллюстрированы, соответственно, горизонтальная проекция части крышки впускного отверстия с впускным каналом и вид сбоку на эти элементы.
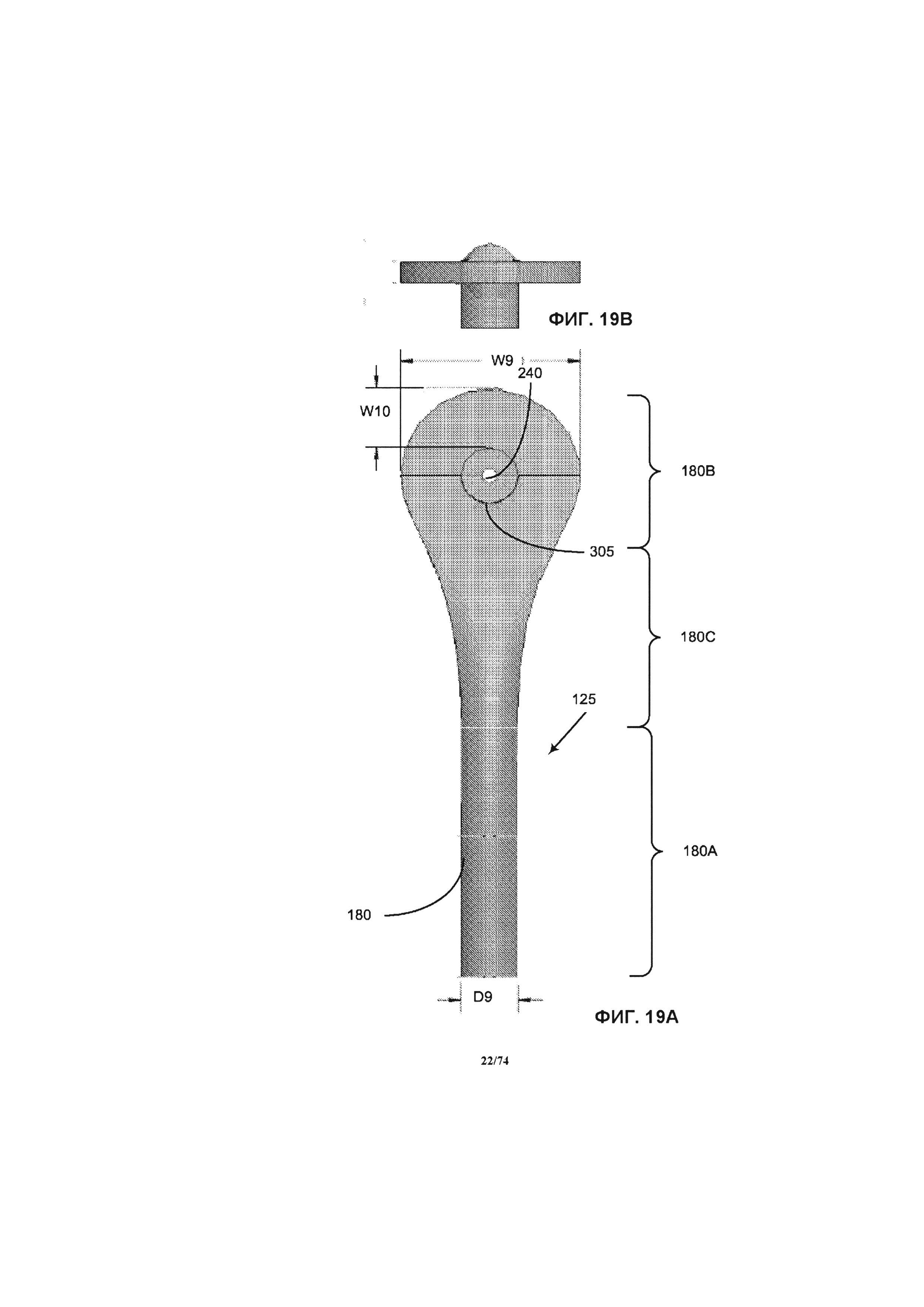
[0069] На ФИГ. 19А и 19В проиллюстрированы те же детали, что и на ФИГ. 18А и 18В, помимо других вариантов реализации изобретения.
[0070] На ФИГ. 20А и 20В проиллюстрированы те же детали, что и на ФИГ. 18А и 18В, помимо других вариантов реализации изобретения.
[0071] На ФИГ. 21-23 проиллюстрированы такие же детали, как и на ФИГ. 18А, помимо трех других вариантов реализации изобретения.
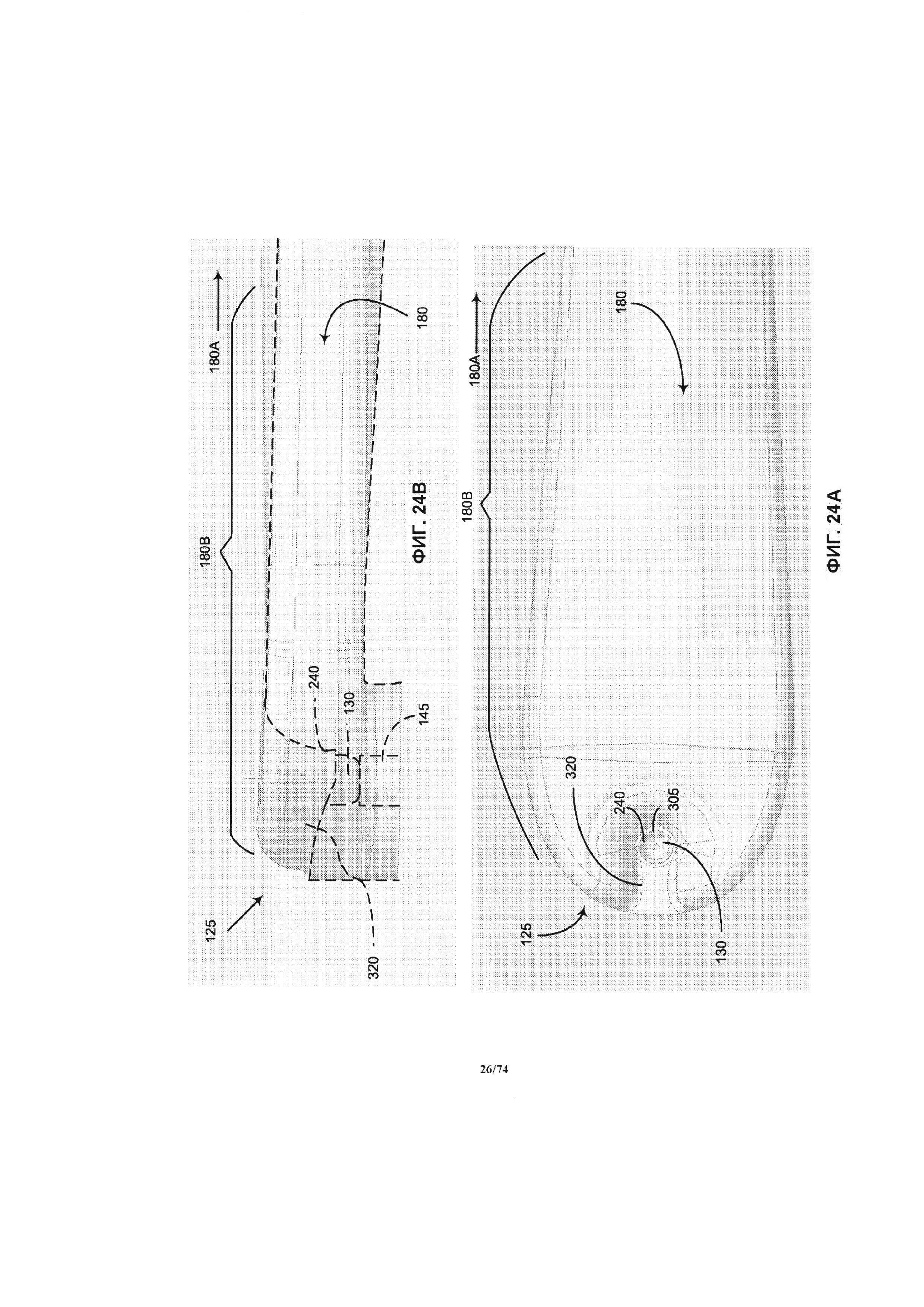
[0072] На ФИГ. 24А и 24В проиллюстрированы, соответственно, горизонтальная проекция и вертикальная боковая проекция другого варианта реализации корпуса впускного отверстия и впускного канала, аналогично проиллюстрированных на ФИГ. 21, помимо дополнительного включения дугообразной клиновидной части.
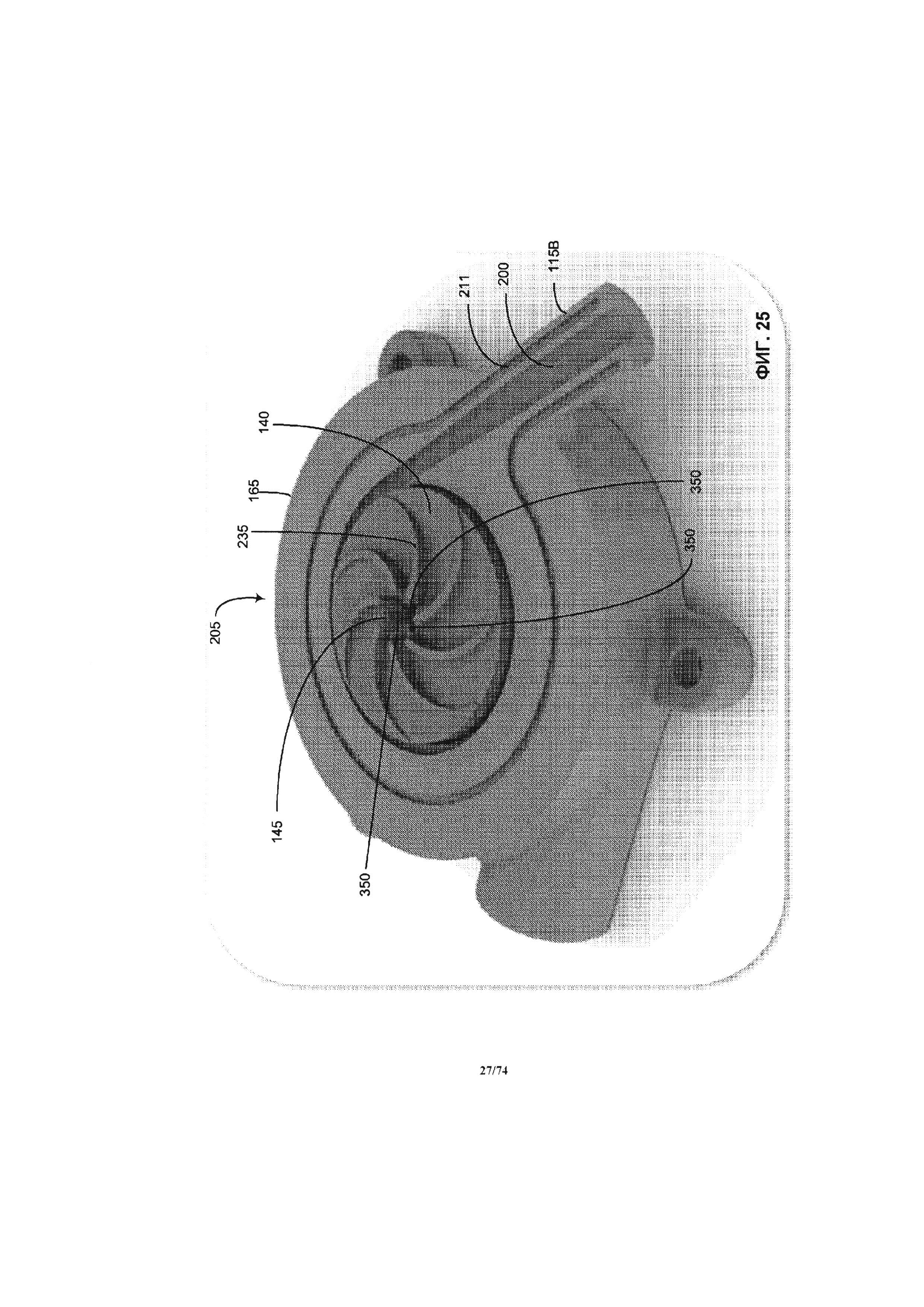
[0073] На ФИГ. 25 проиллюстрирован изометрический вид насоса со снятой верхней крышкой крыльчатки для показа крыльчатки, расположенной в пределах камеры крыльчатки.
[0074] На ФИГ. 26 проиллюстрирован вид в перспективе системы перфузионного насоса, в соответствии с вариантом реализации изобретения.
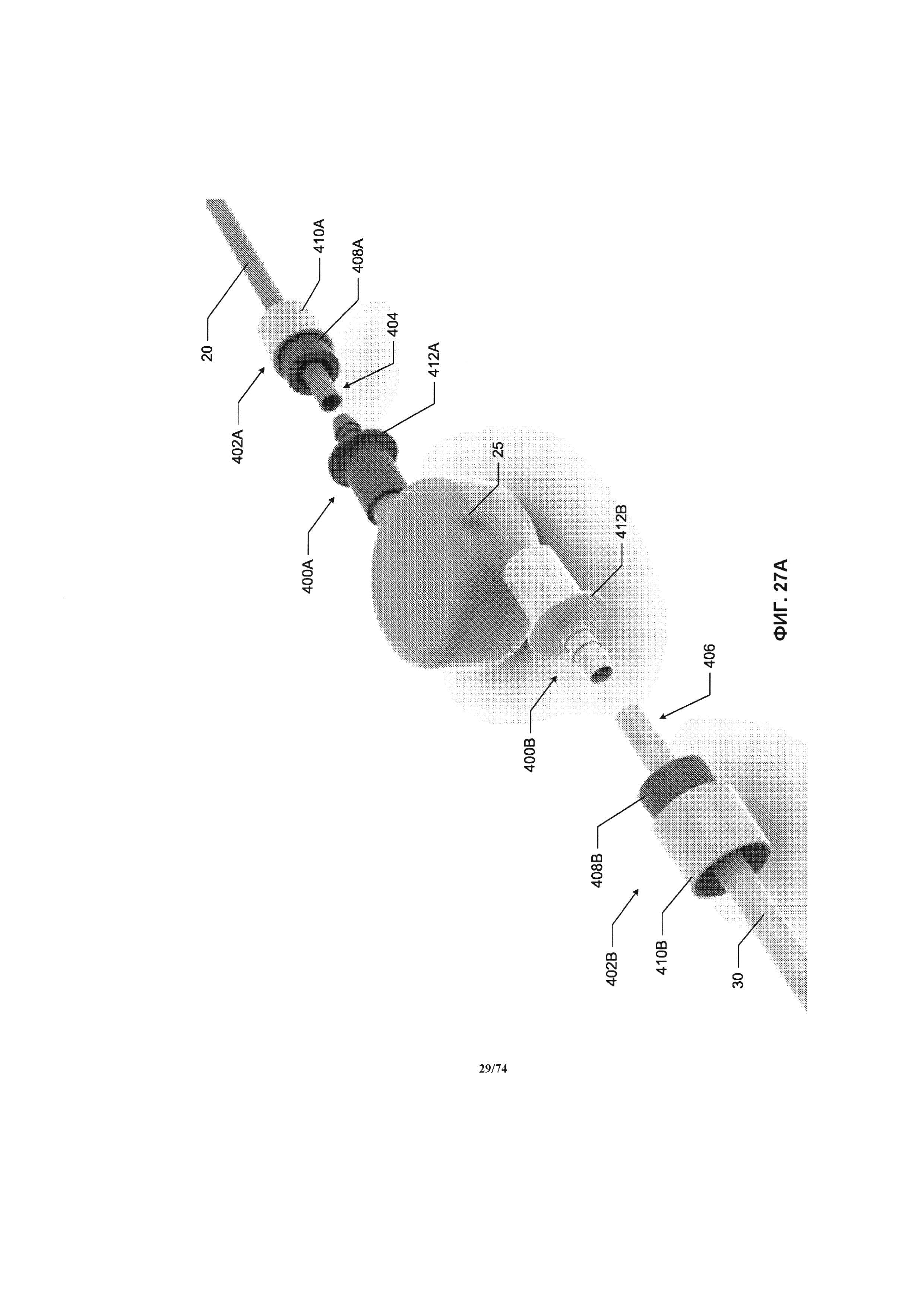
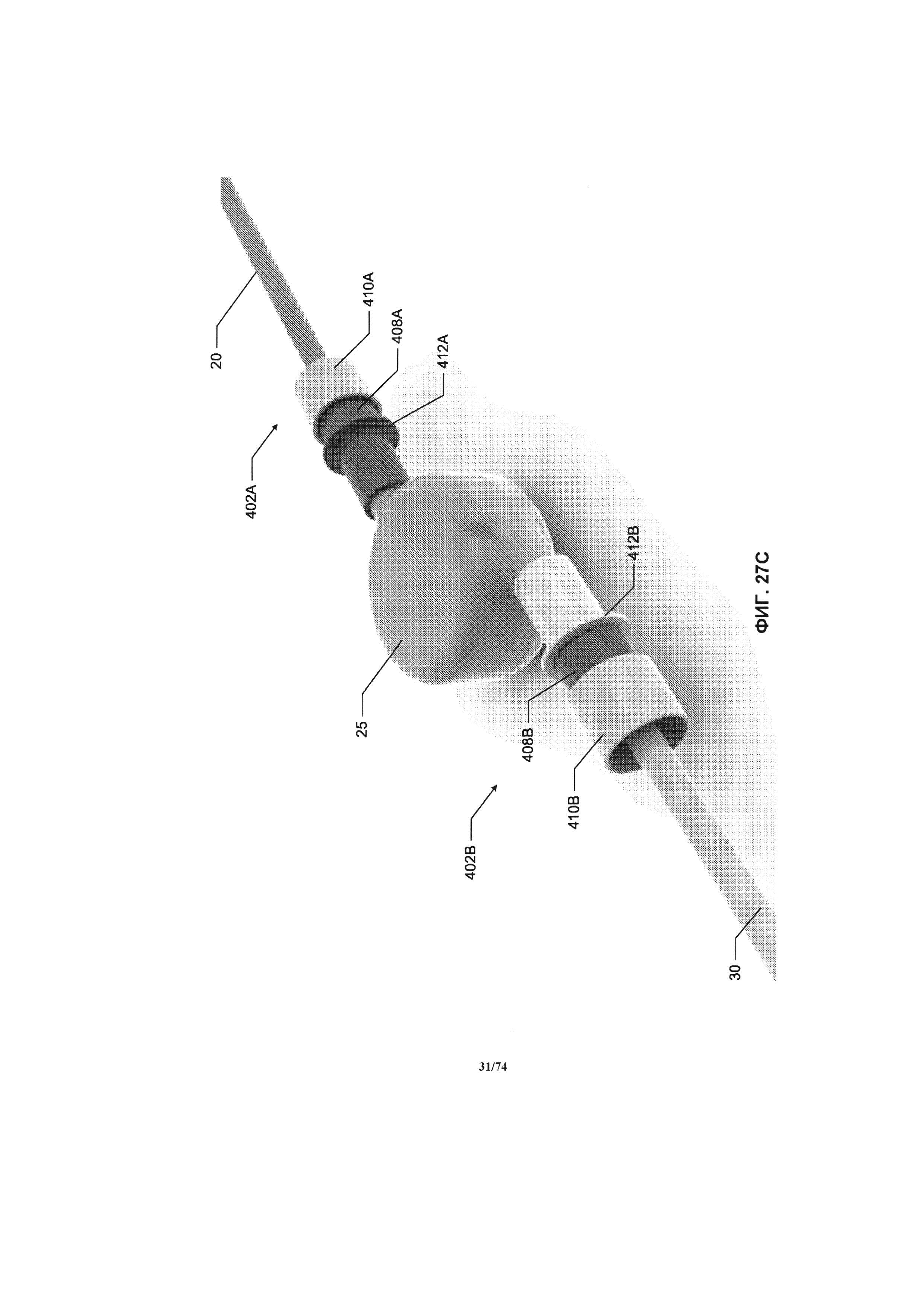
[0075] На ФИГ. 27A-27D проиллюстрирован вид в перспективе соединений между насосом и соединительными трубками, в соответствии с вариантом реализации изобретения.
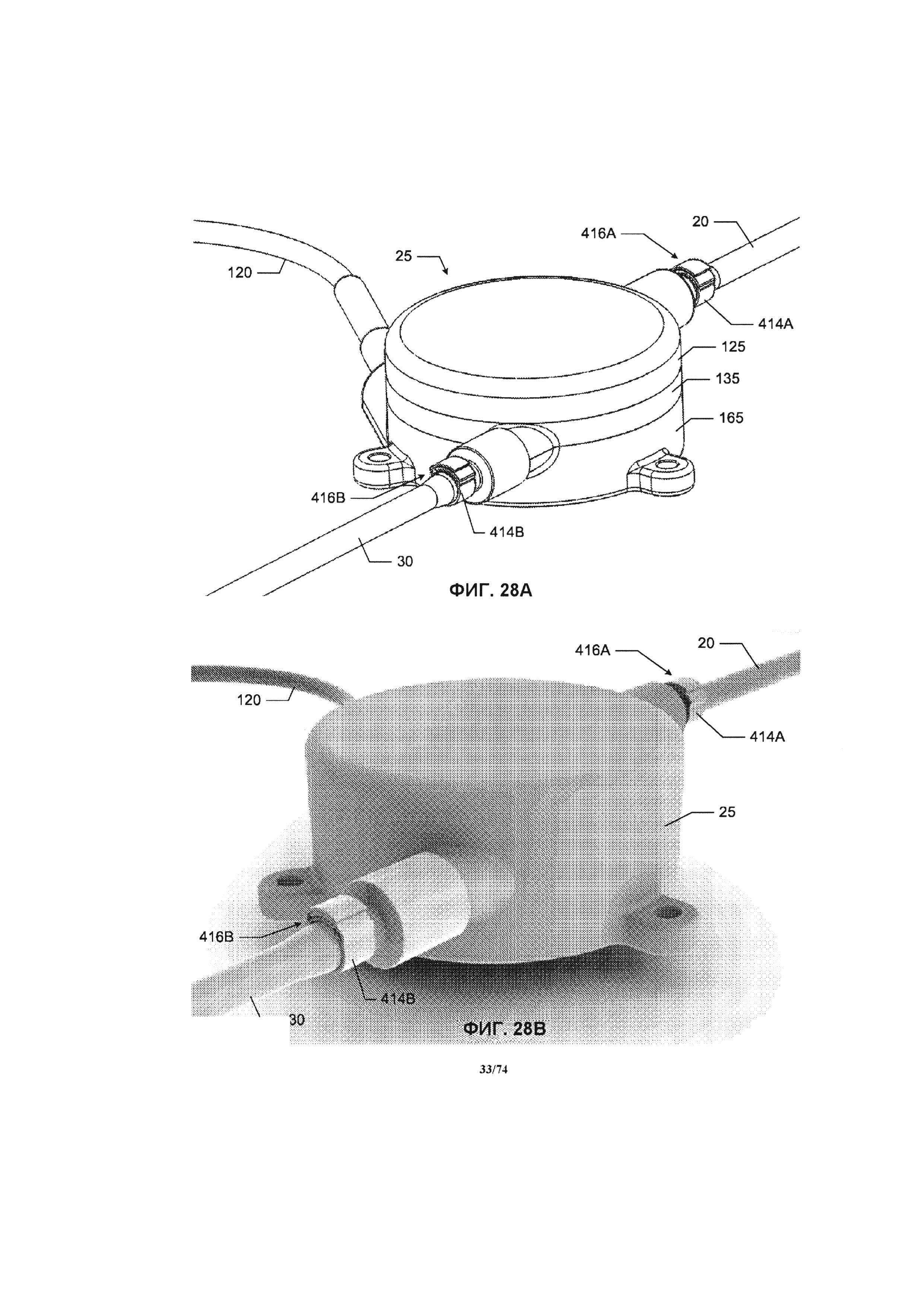
[0076] На ФИГ. 28А и 28 В проиллюстрирован вид в перспективе соединений между насосом и соединительными трубками, в соответствии с одним вариантом реализации изобретения.
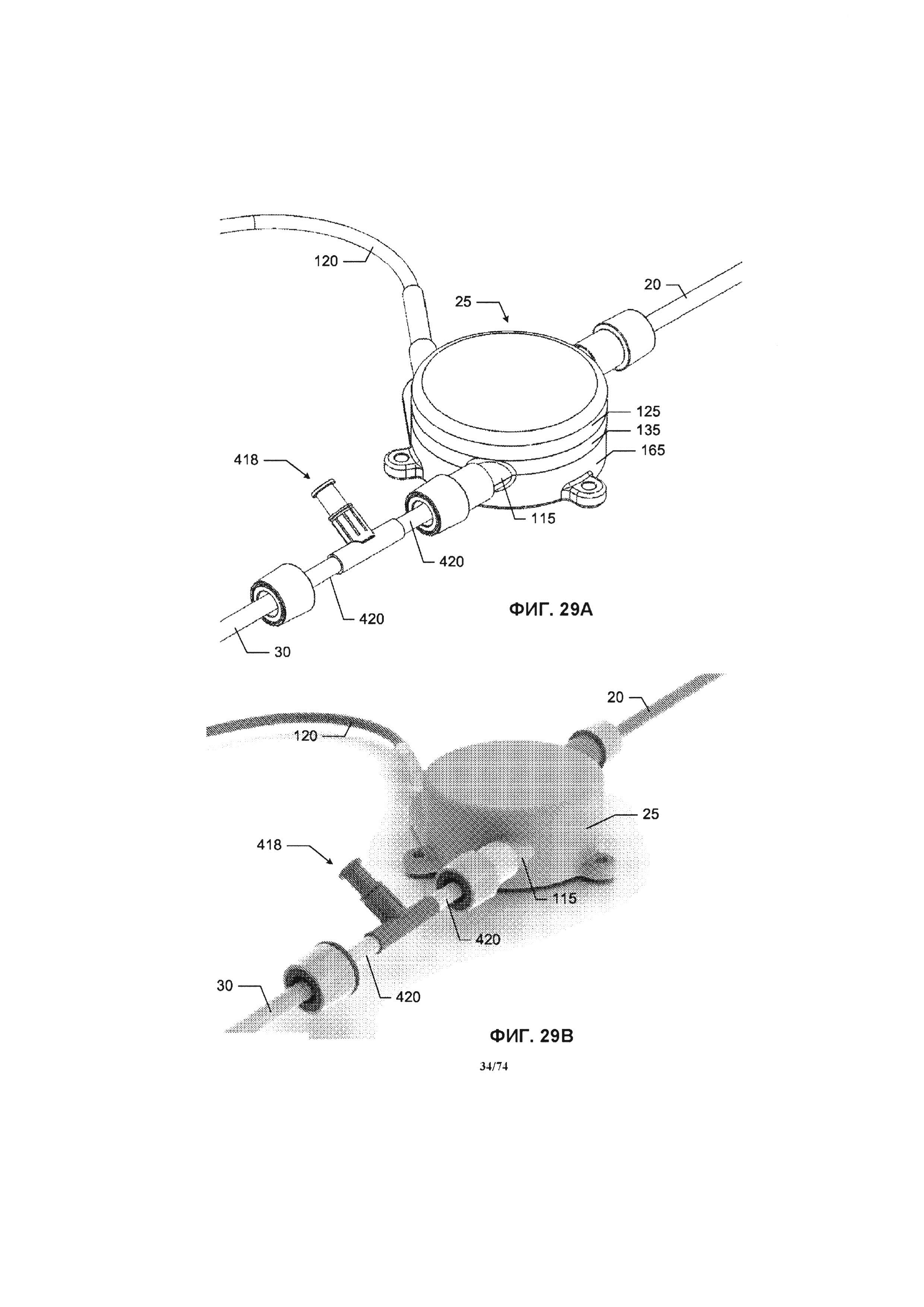
[0077] На ФИГ. 29А и 29В проиллюстрирован вид в перспективе соединений между насосом и соединительными трубками, содержащими боковой порт, в соответствии с одним вариантом реализации изобретения.
[0078] На ФИГ. 30А и 30В проиллюстрирован вид в перспективе соединений между насосом и соединительными трубками, содержащими мембрану, в соответствии с одним вариантом реализации изобретения.
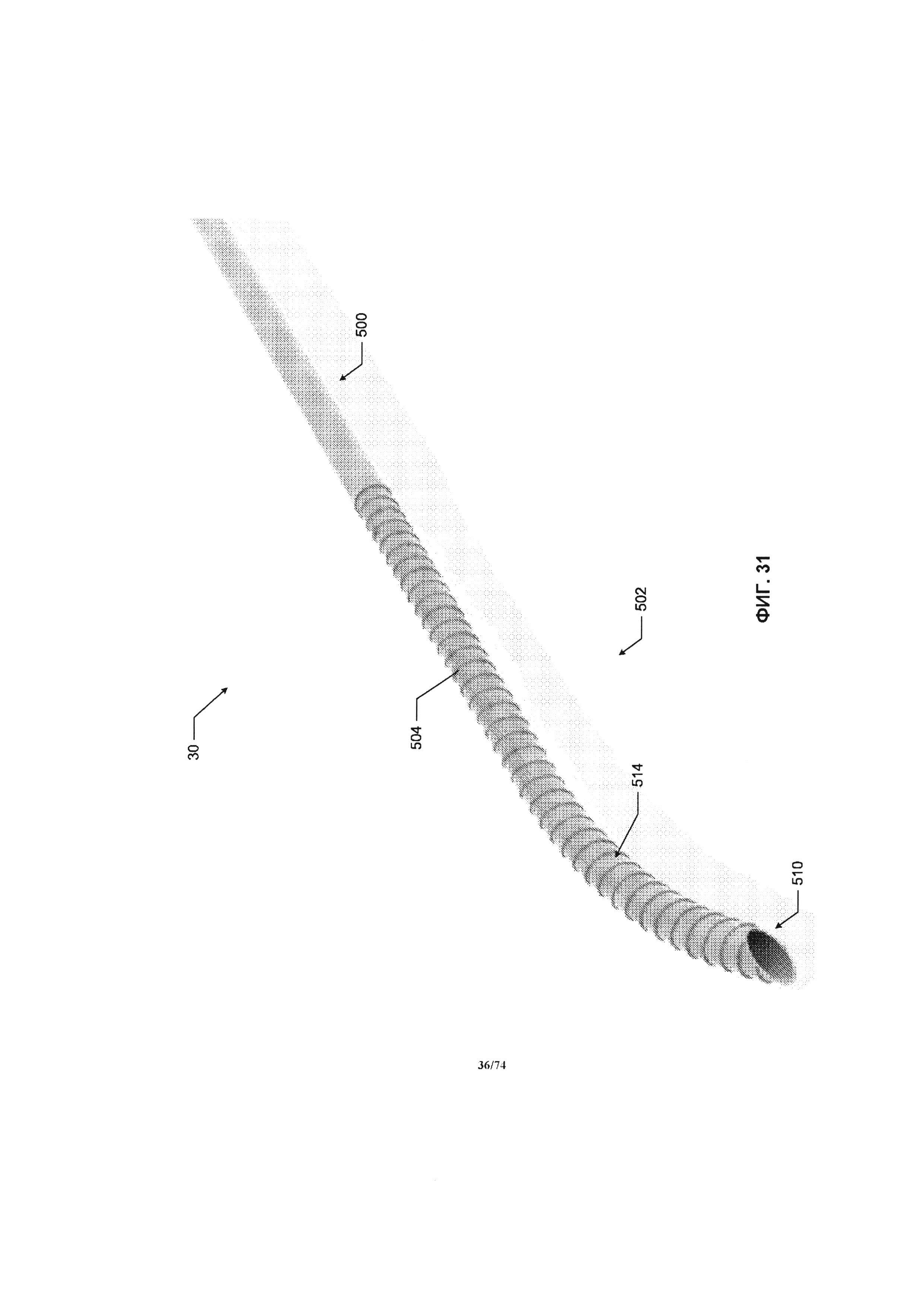
[0079] На ФИГ. 31 проиллюстрирован вид дистальной части выпускной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
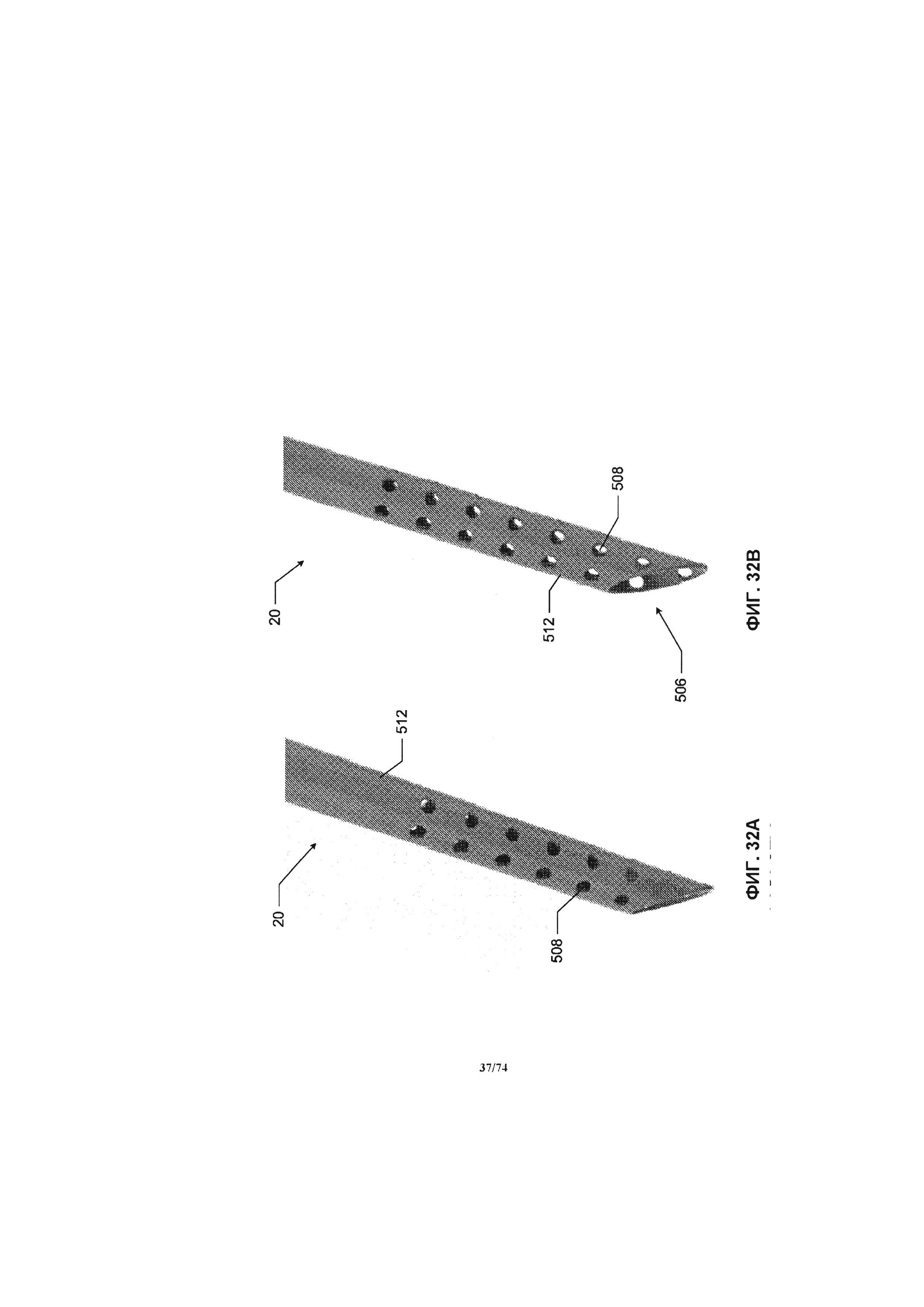
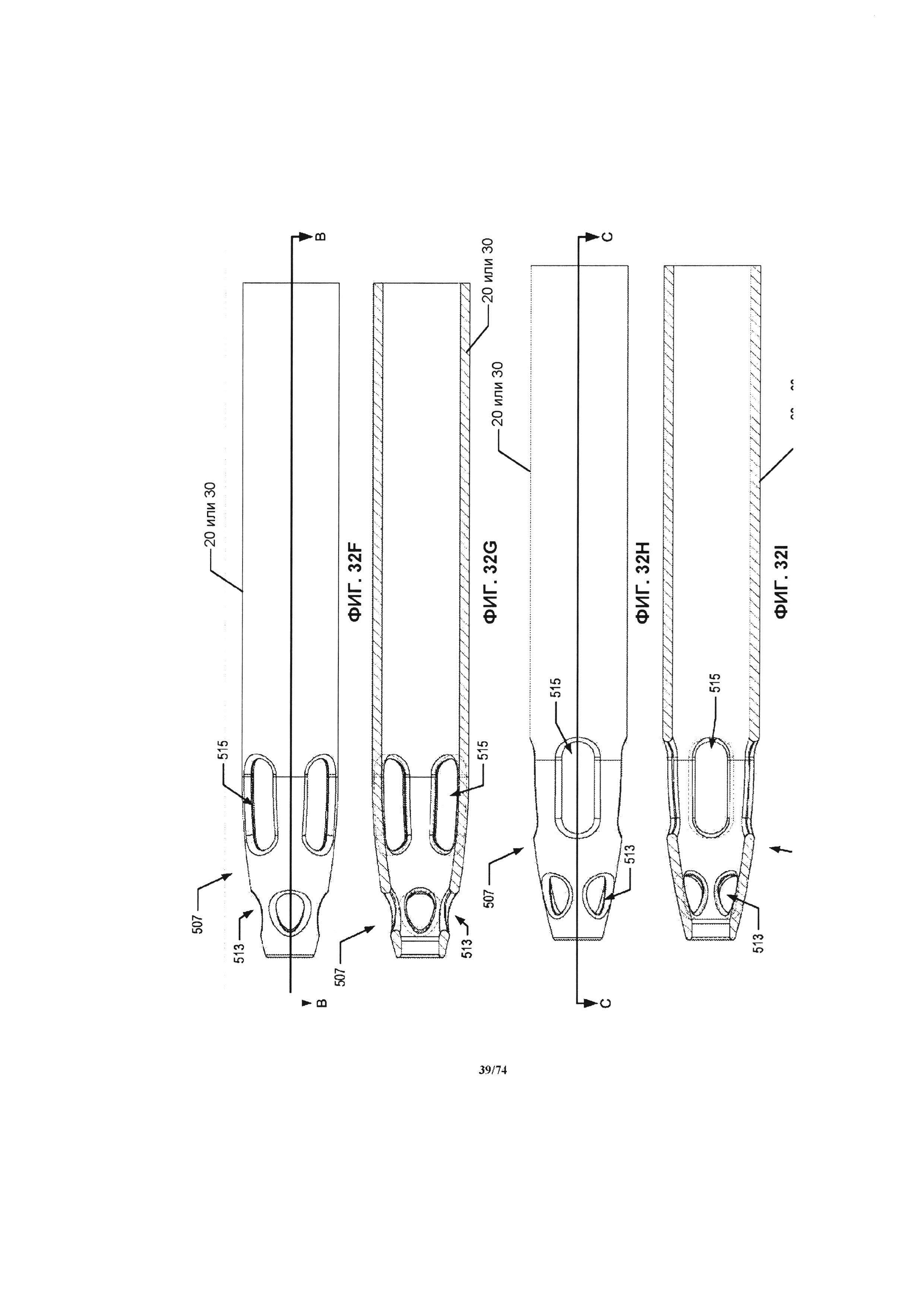
[0080] На ФИГ. 32А и 32В проиллюстрирован вид внутрисосудистой части приточной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
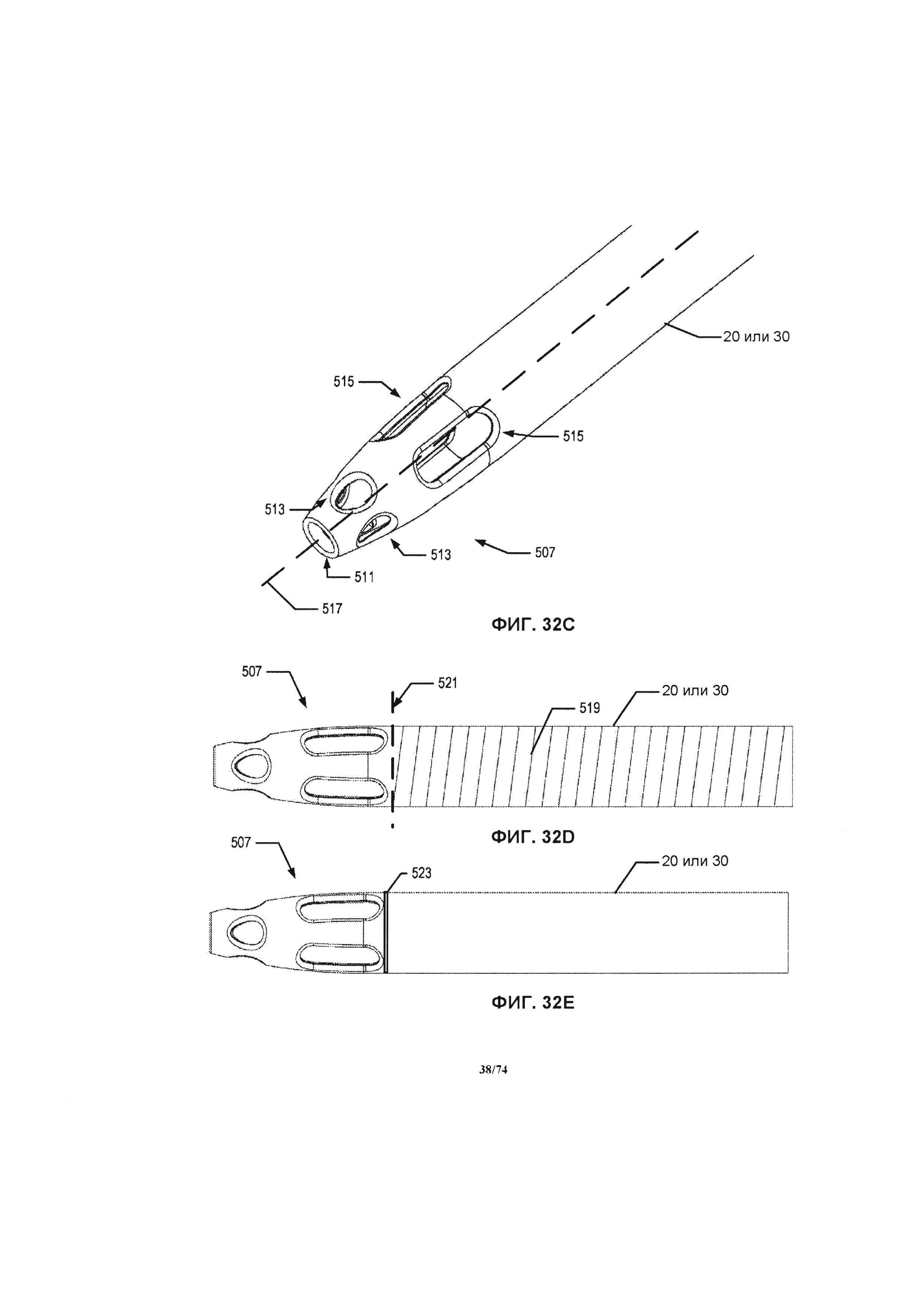
[0081] На ФИГ. 32С проиллюстрирован вид в перспективе внутрисосудистой части приточной или выпускной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
[0082] На ФИГ. 32D проиллюстрирована горизонтальная проекция
внутрисосудистой части приточной или выпускной соединительной трубки и усиливающей спирали, в соответствии с одним вариантом реализации изобретения.
[0083] На ФИГ. 32Е проиллюстрирована горизонтальная проекция внутрисосудистой части приточной или выпускной соединительной трубки и маркирующего слоя, в соответствии с одним вариантом реализации изобретения.
[0084] На ФИГ. 32F проиллюстрирована горизонтальная проекция внутрисосудистой части приточной или выпускной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
[0085] На ФИГ. 32G проиллюстрирован поперечный разрез внутрисосудистой части приточной или выпускной соединительной трубки, проиллюстрированной на ФИГ. 32F вдоль линии разреза В-В, в соответствии с одним вариантом реализации изобретения.
[0086] На ФИГ. 32Н проиллюстрирована горизонтальная проекция внутрисосудистой части приточной или выпускной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
[0087] На ФИГ. 32I проиллюстрирован поперечный разрез внутрисосудистой части приточной или выпускной соединительной трубки, проиллюстрированной на ФИГ. 32Н вдоль линии разреза С-С, в соответствии с одним вариантом реализации изобретения.
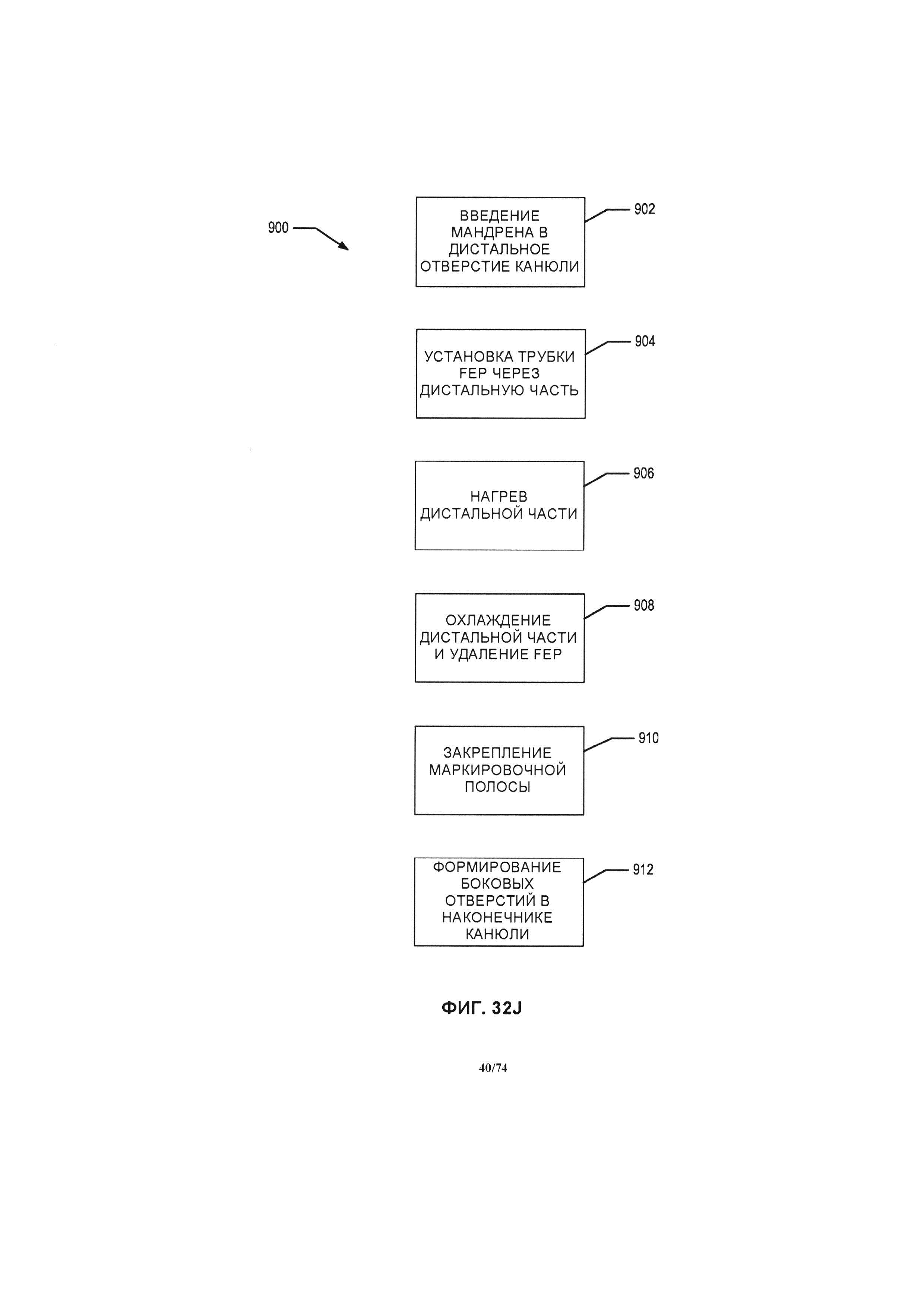
[0088] На ФИГ. 32J проиллюстрирована блок-схема способа изготовления наконечника канюли, в соответствии с одним вариантом реализации изобретения.
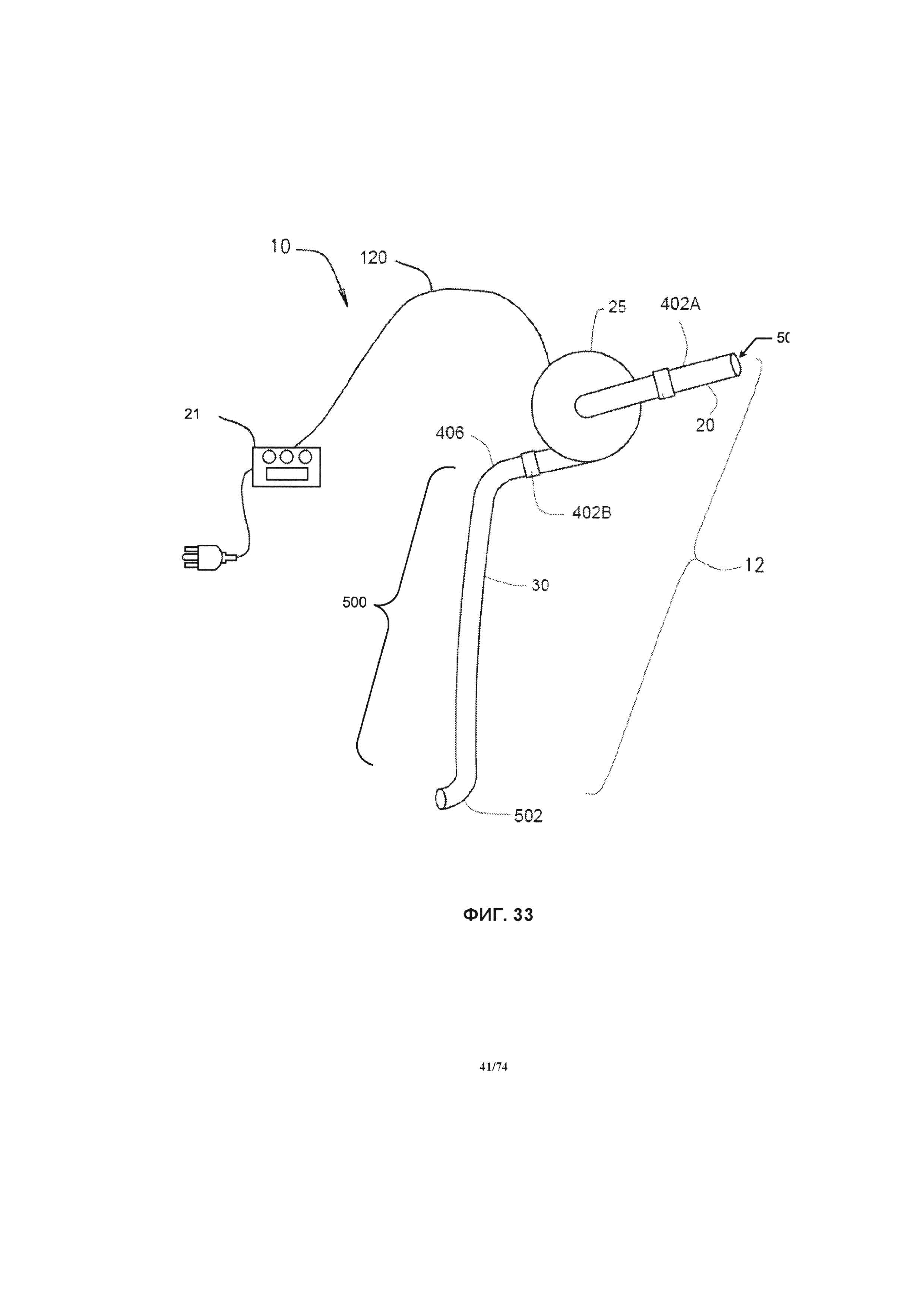
[0089] На ФИГ. 33 проиллюстрировано схематическое изображение системы перфузионного насоса, в соответствии с одним вариантом реализации изобретения.
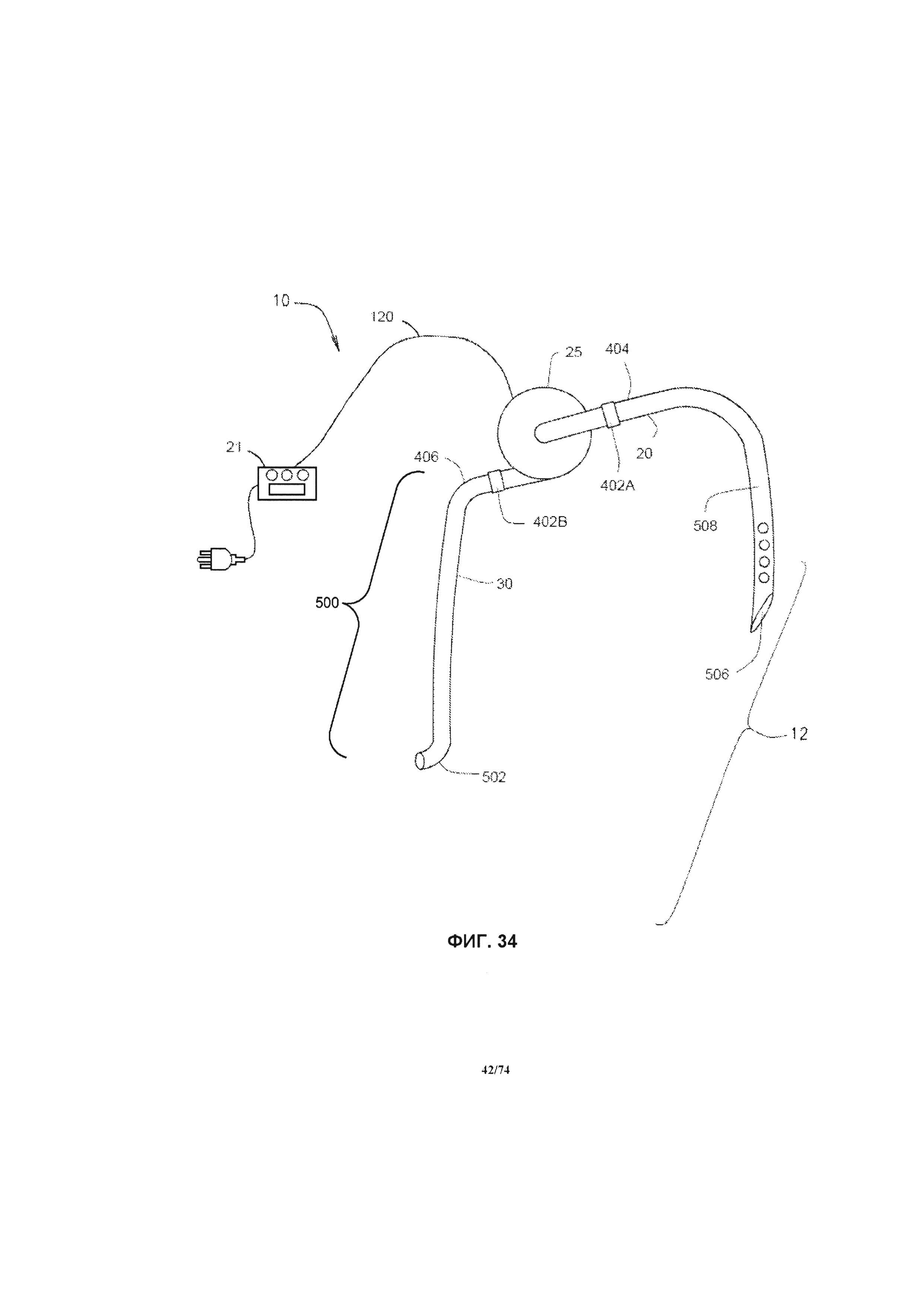
[0090] На ФИГ. 34 проиллюстрировано схематическое изображение системы перфузионного насоса, в соответствии с другим вариантом реализации изобретения.
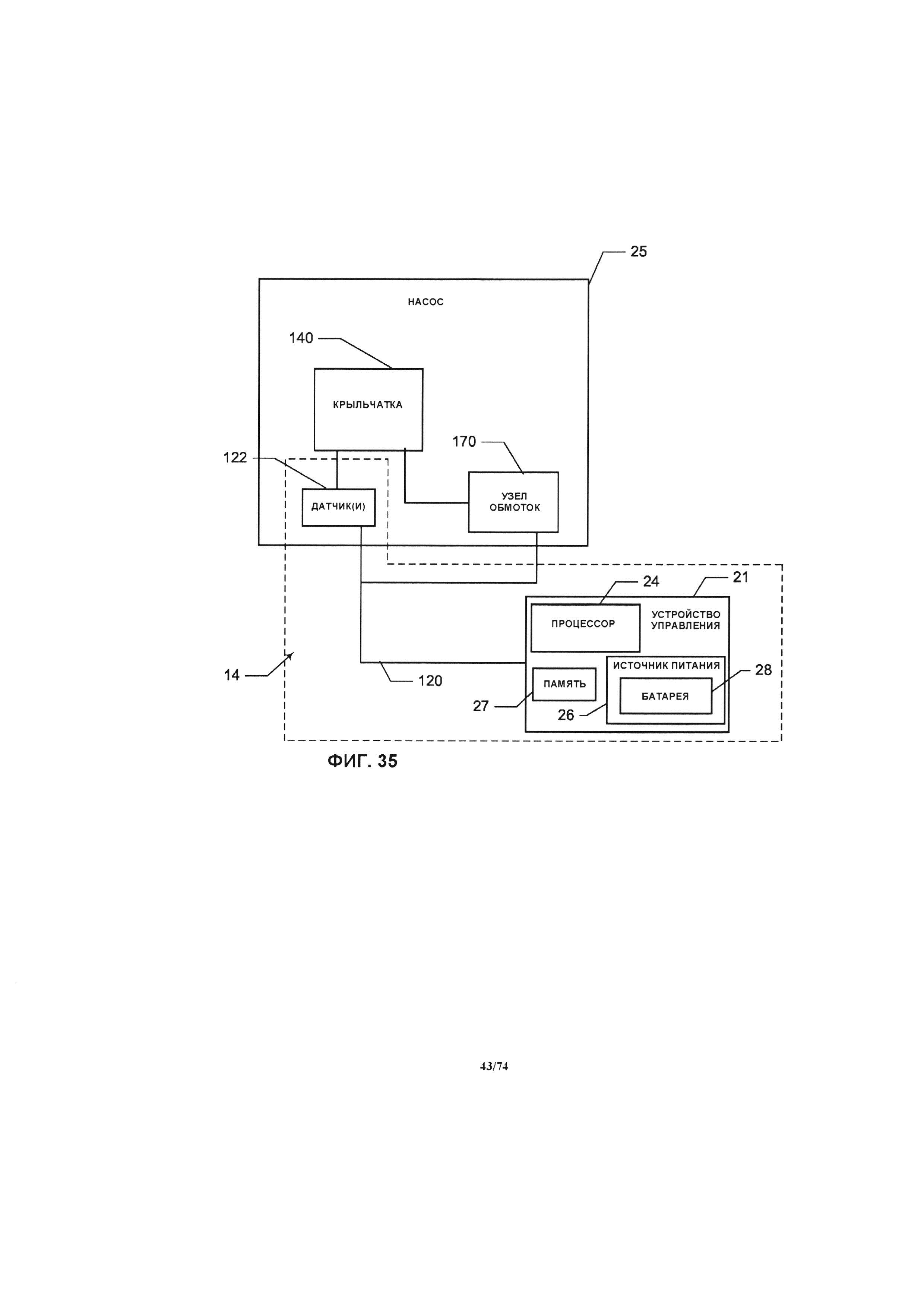
[0091] На ФИГ. 35 проиллюстрировано схематическое изображение системы управления, в соответствии с одним вариантом реализации изобретения.
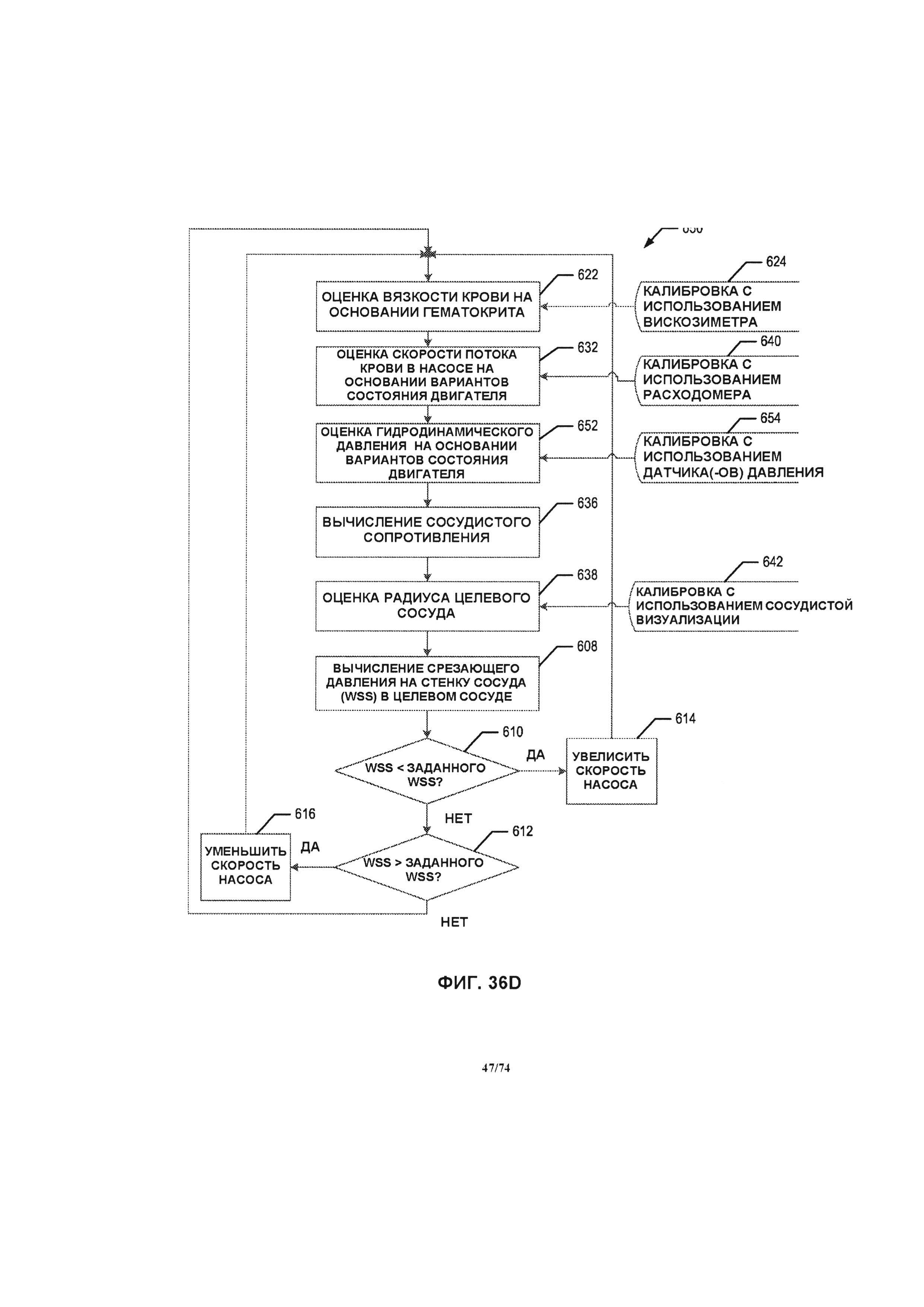
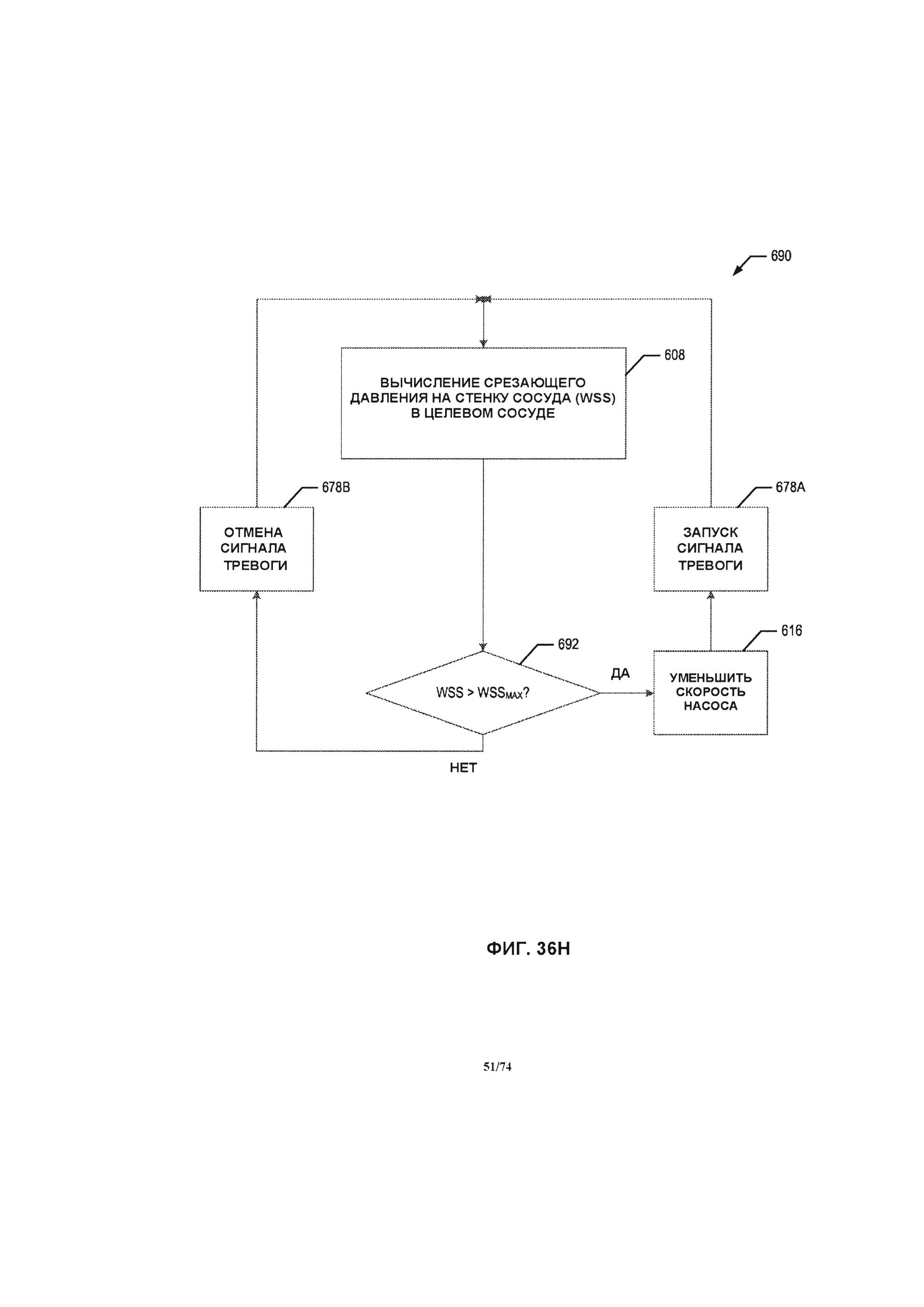
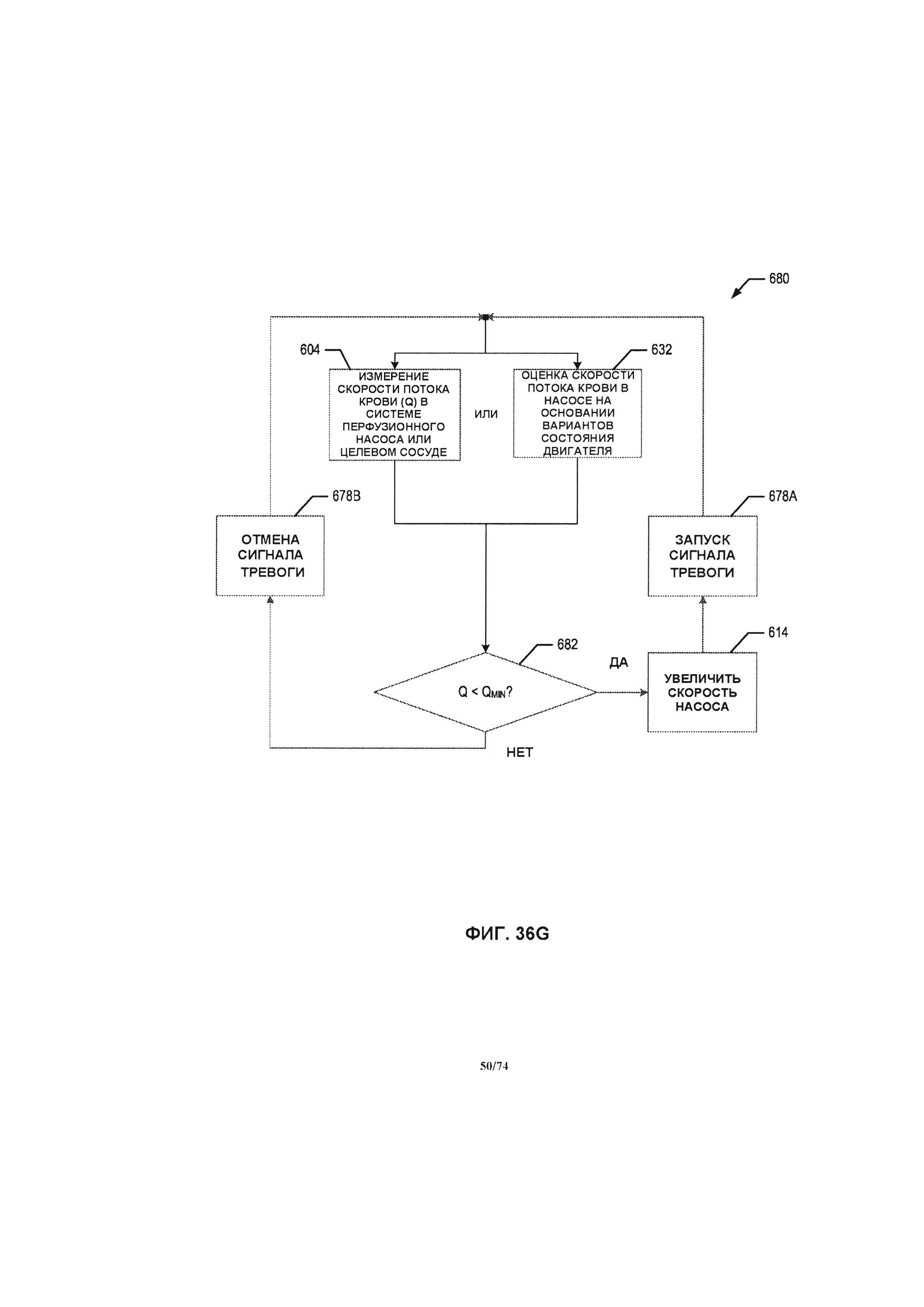
[0092] На ФИГ. 36A-36D проиллюстрированы блок-схемы способов системы управления, в соответствии с различными вариантами реализации изобретения.
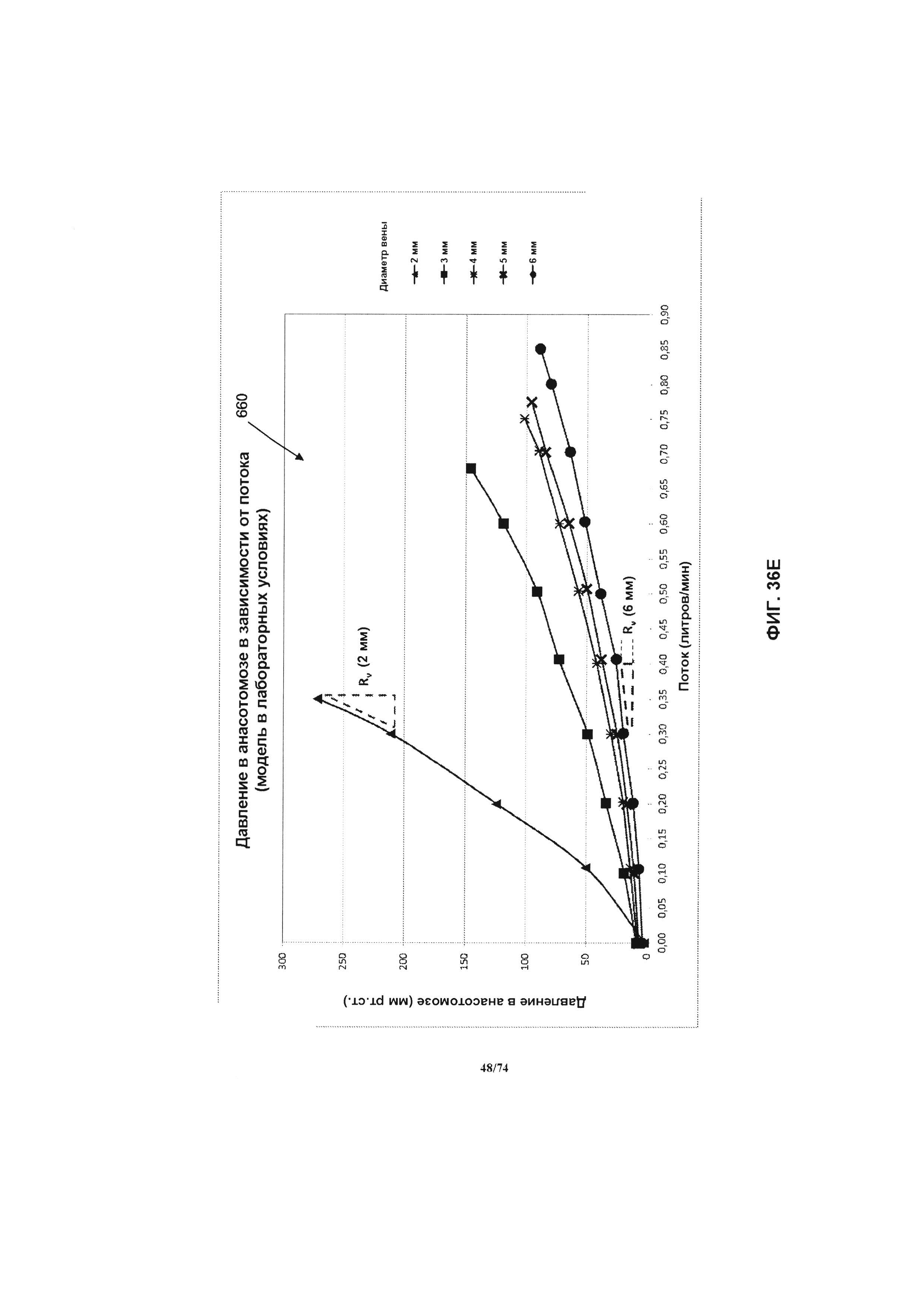
[0093] На ФИГ. 36Е проиллюстрирован график давления анастомоза и скорости потока крови в лабораторных условиях для модели системы перфузионного насоса, в соответствии с одним вариантом реализации изобретения.
[0094] На ФИГ. 36F-36H проиллюстрированы блок-схемы способов системы управления, в соответствии с различными вариантами реализации изобретения.
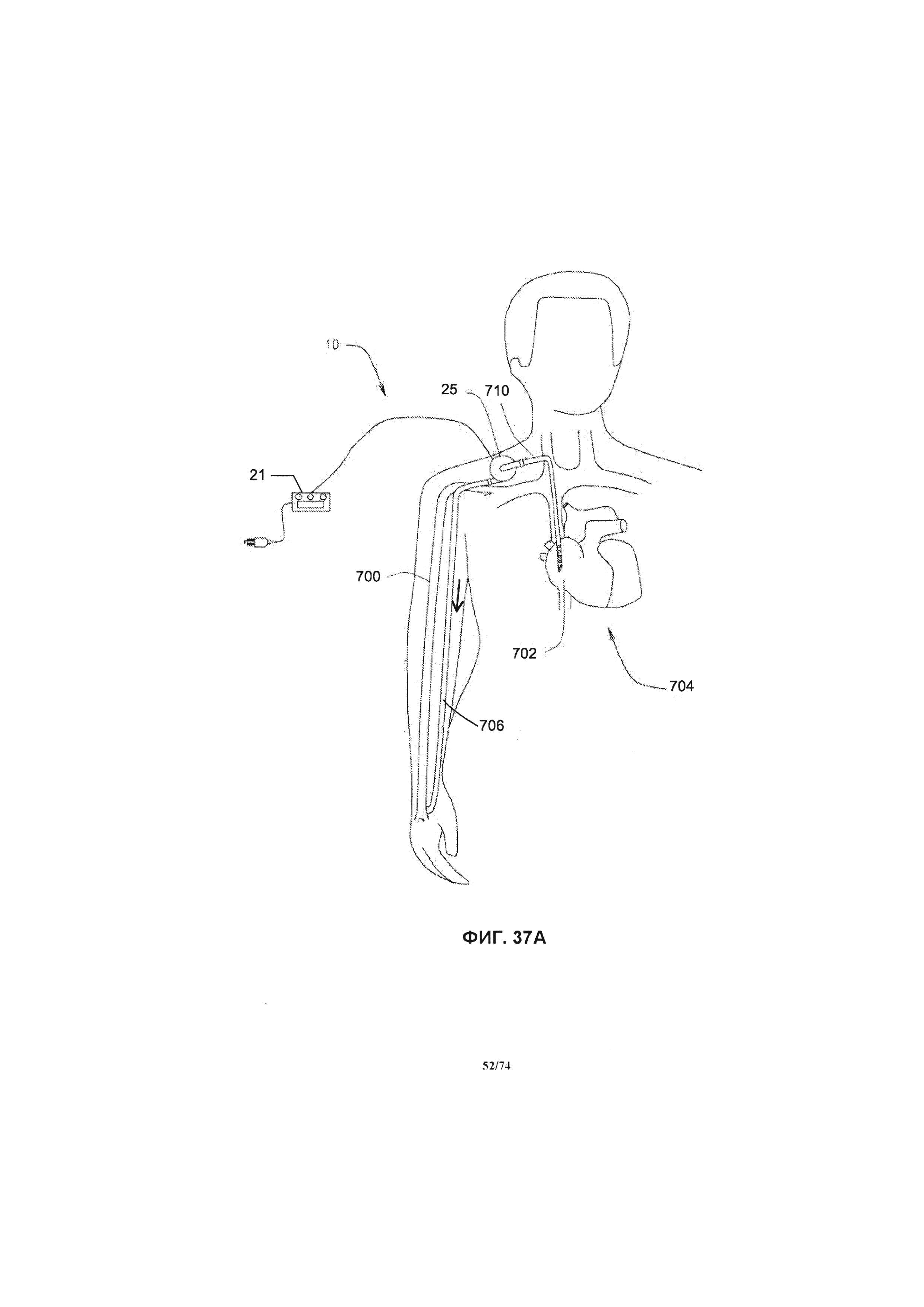
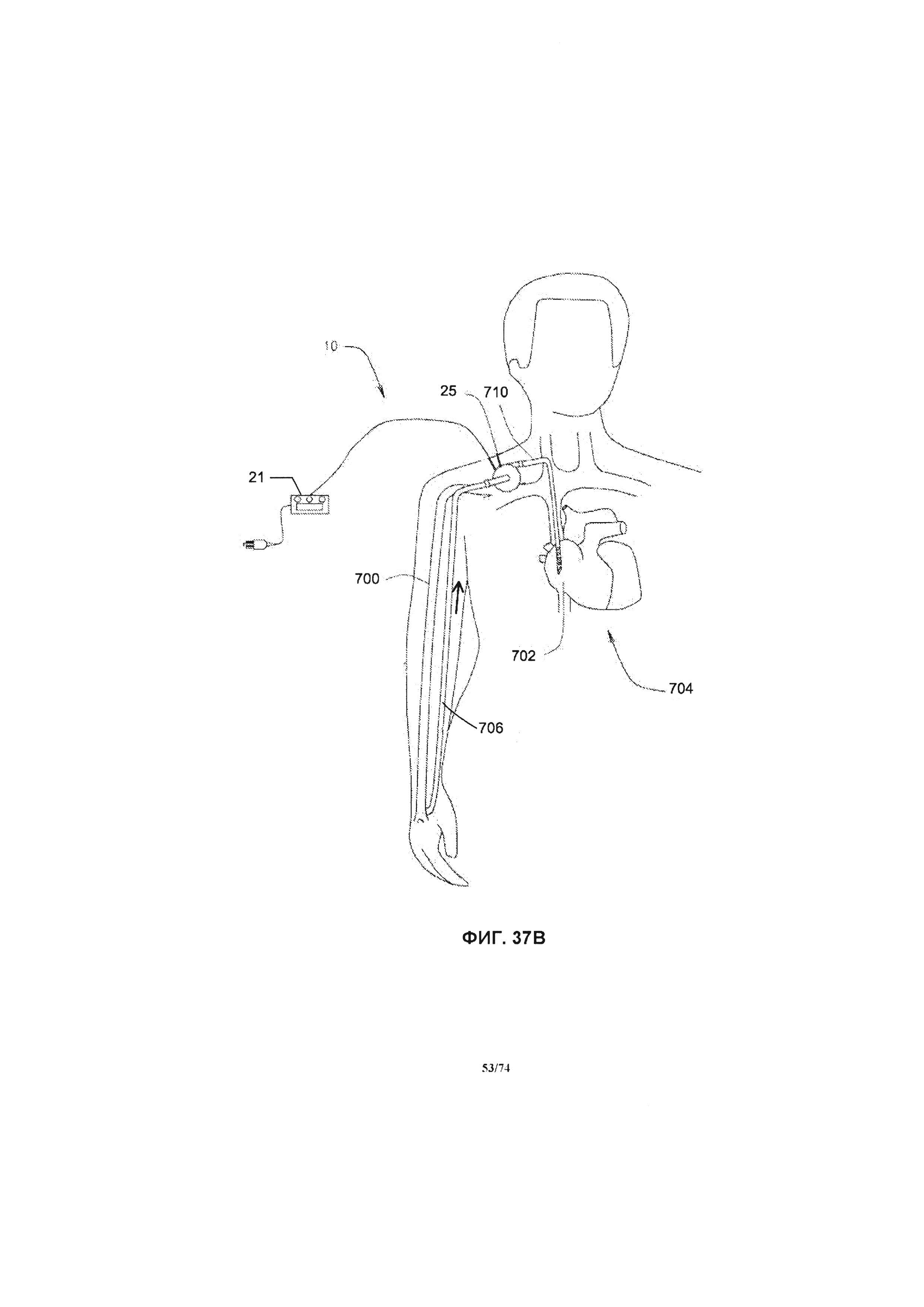
[0095] На ФИГ. 37А проиллюстрирован вид системы насоса, примененной в системе кровообращения пациента, в соответствии с одним вариантом реализации изобретения.
[0096] На ФИГ. 37В проиллюстрирован вид системы насоса, примененной в системе кровообращения пациента, в соответствии со вторым вариантом реализации изобретения.
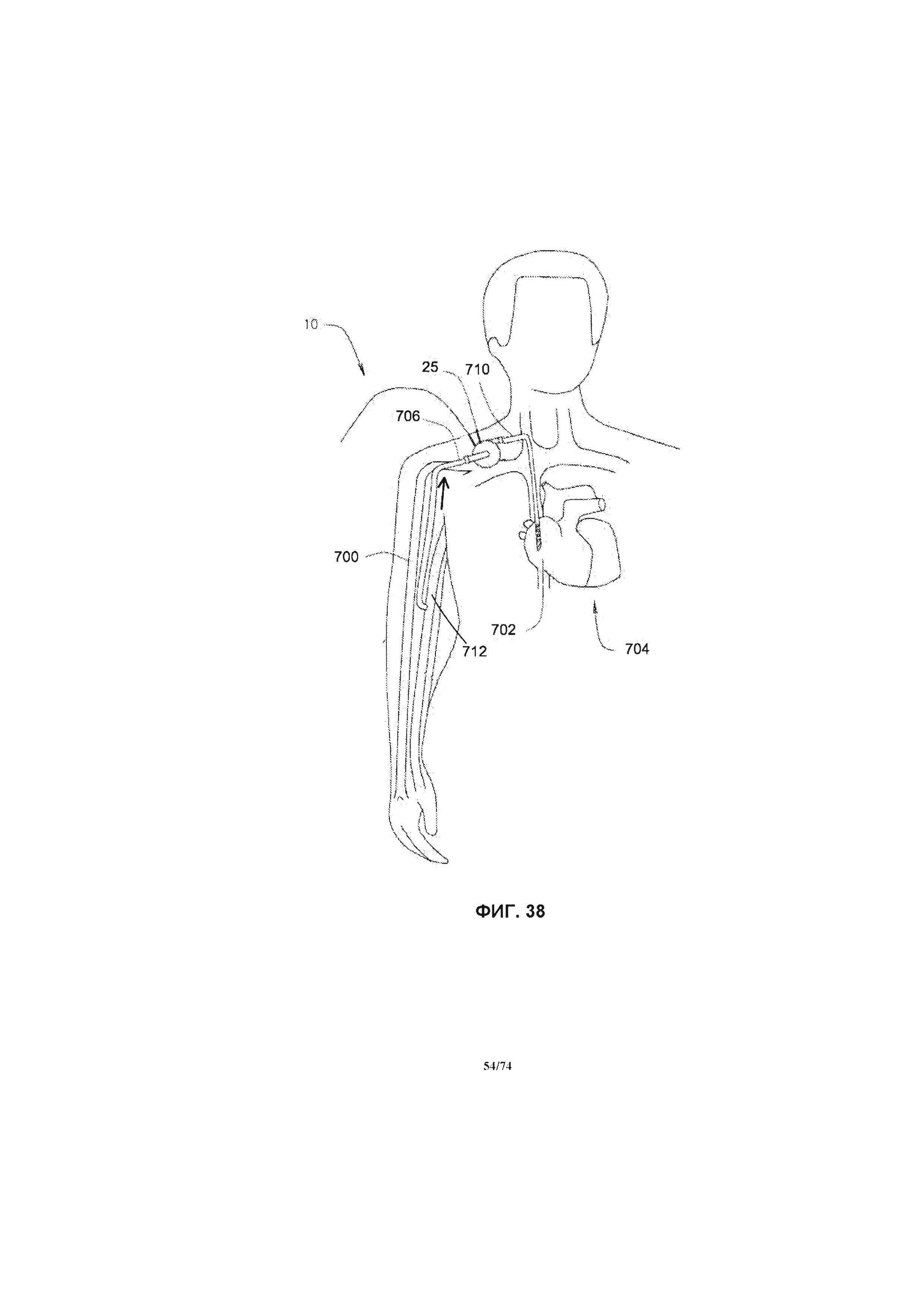
[0097] На ФИГ. 38 проиллюстрировано схематическое изображение системы насоса, примененной в системе кровообращения пациента, в соответствии с третьим вариантом реализации изобретения.
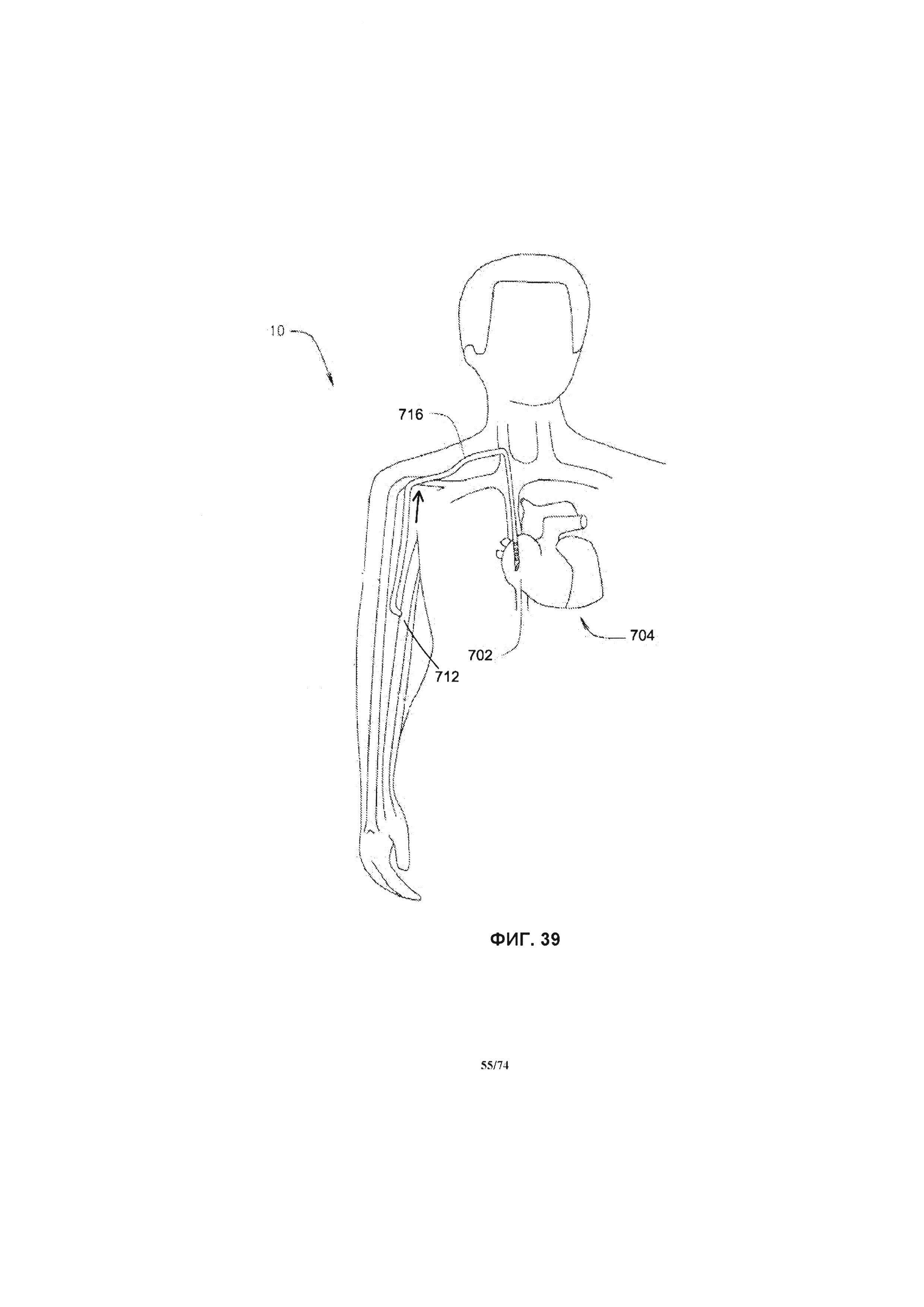
[0098] На ФИГ. 39 проиллюстрировано схематическое изображение системы без насоса, примененной в системе кровообращения пациента, в соответствии с четвертым вариантом реализации изобретения.
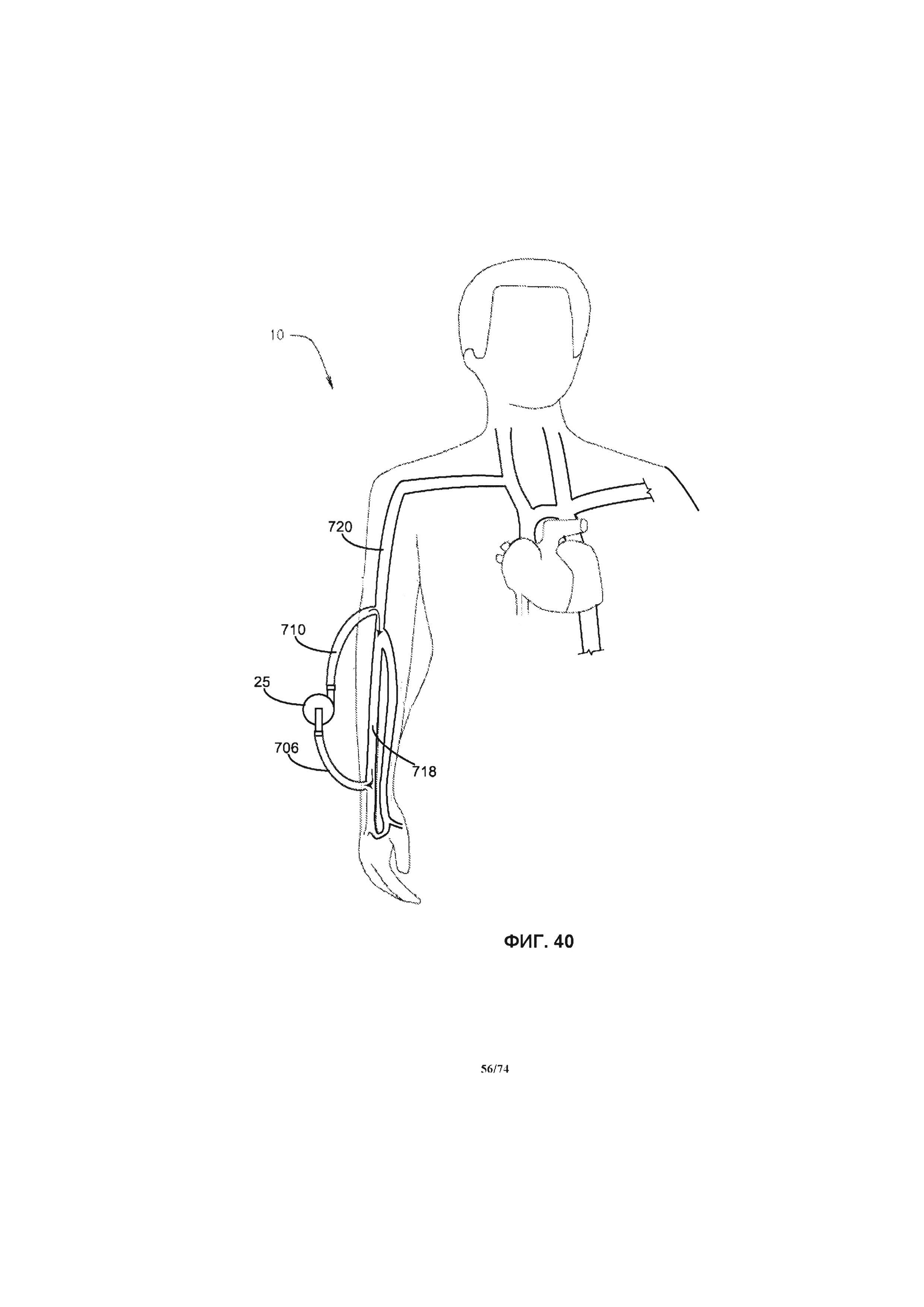
[0099] На ФИГ. 40 проиллюстрировано схематическое изображение системы насоса, примененной в системе кровообращения пациента, в соответствии с пятым вариантом реализации изобретения.
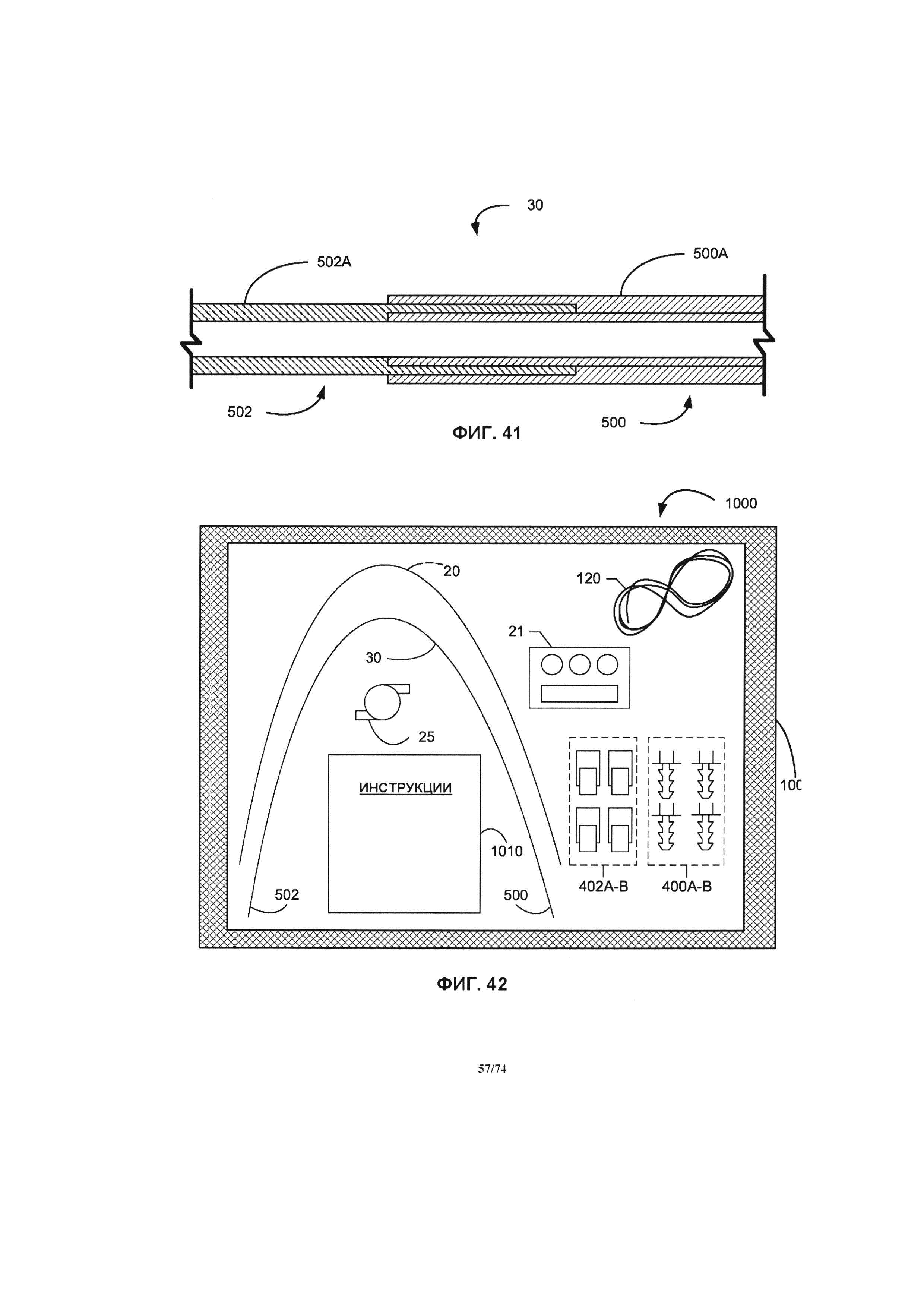
[00100] На ФИГ. 41 проиллюстрирован продольный разрез места соединения между ближайшим сегментом и дистальным сегментом.
[00101] На ФИГ. 42 проиллюстрирована горизонтальная проекция медицинской аптечки.
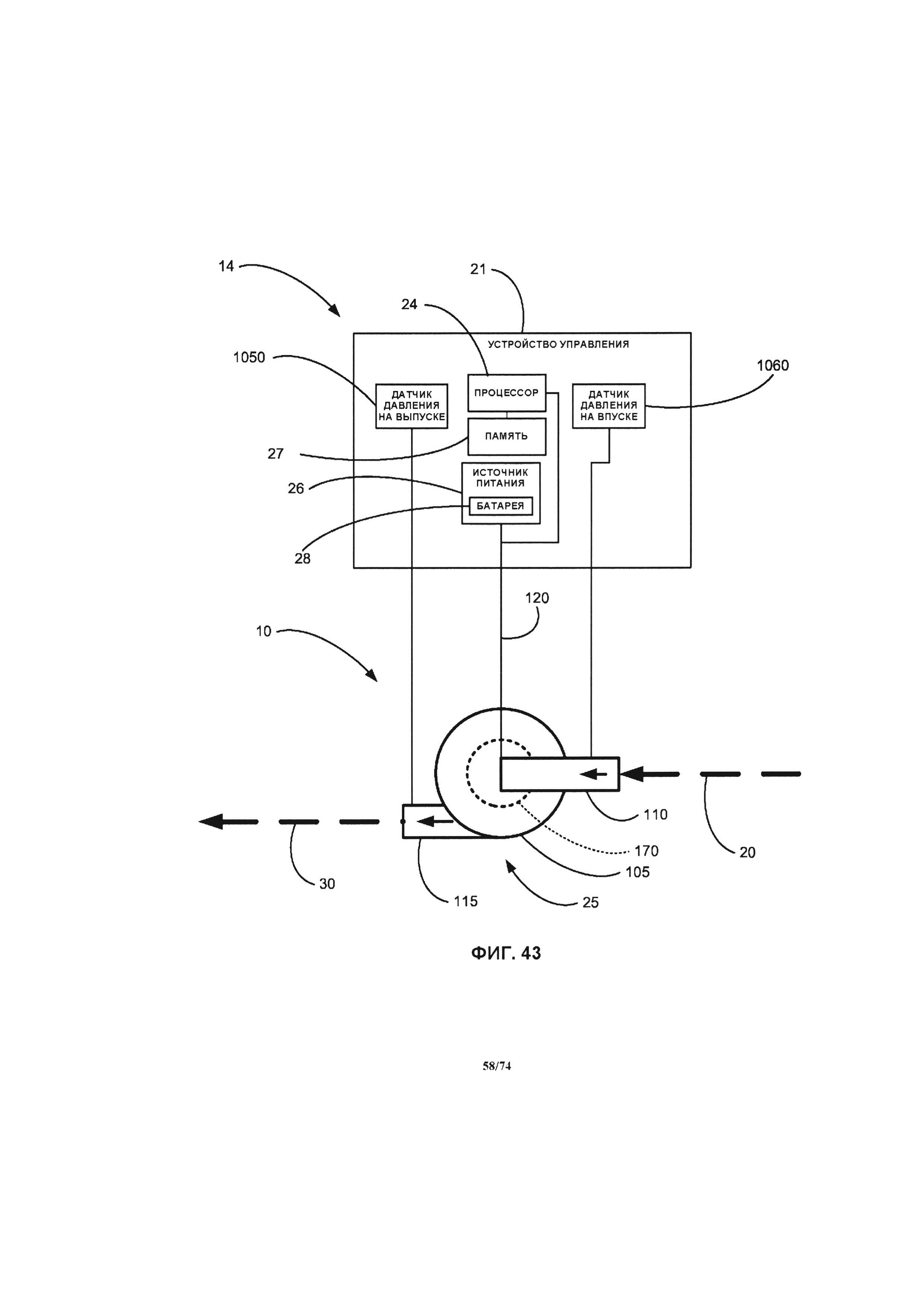
[00102] На ФИГ. 43 проиллюстрирована схематическая диаграмма системы насоса, управляемой в соответствии с выходным давлением.
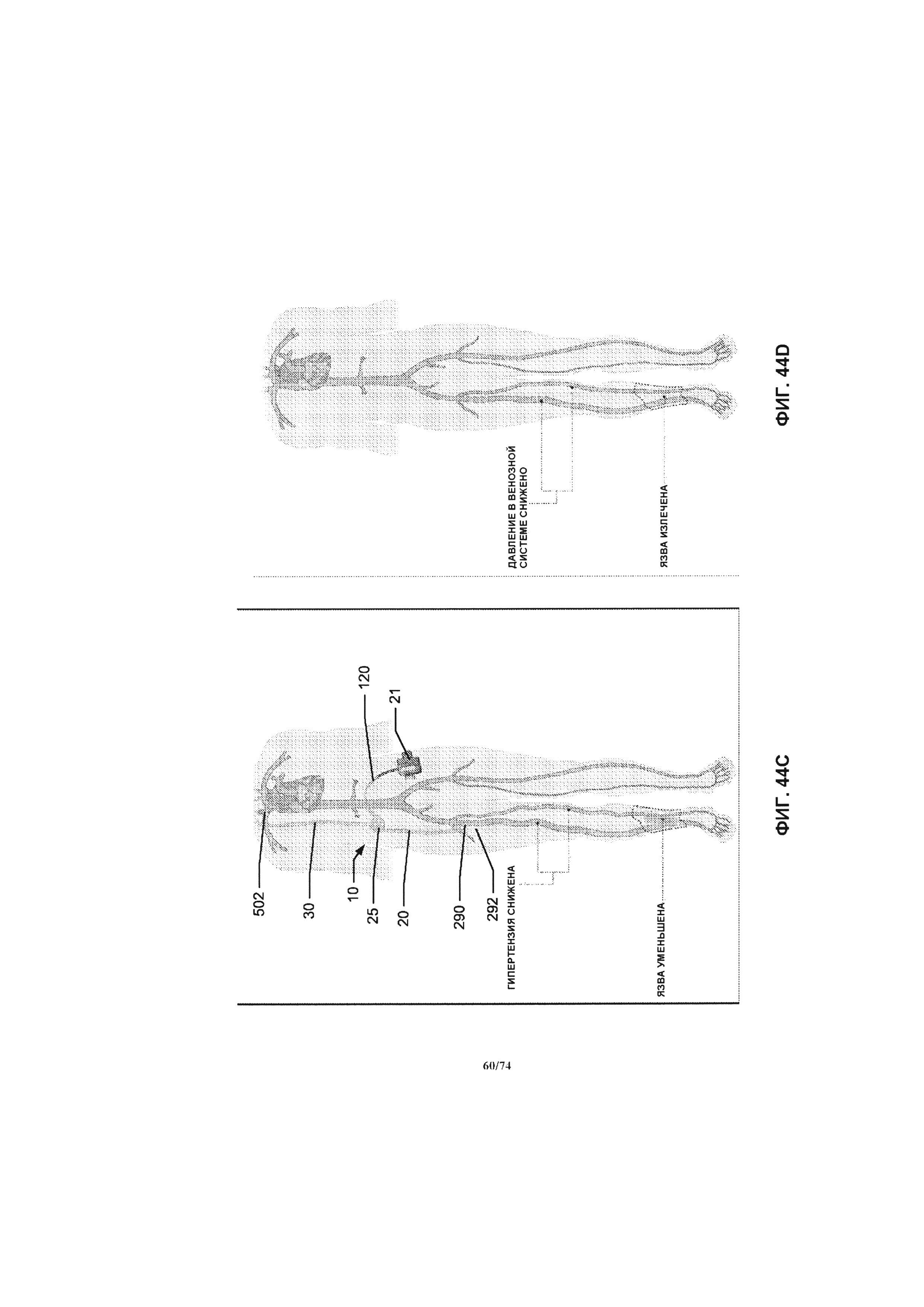
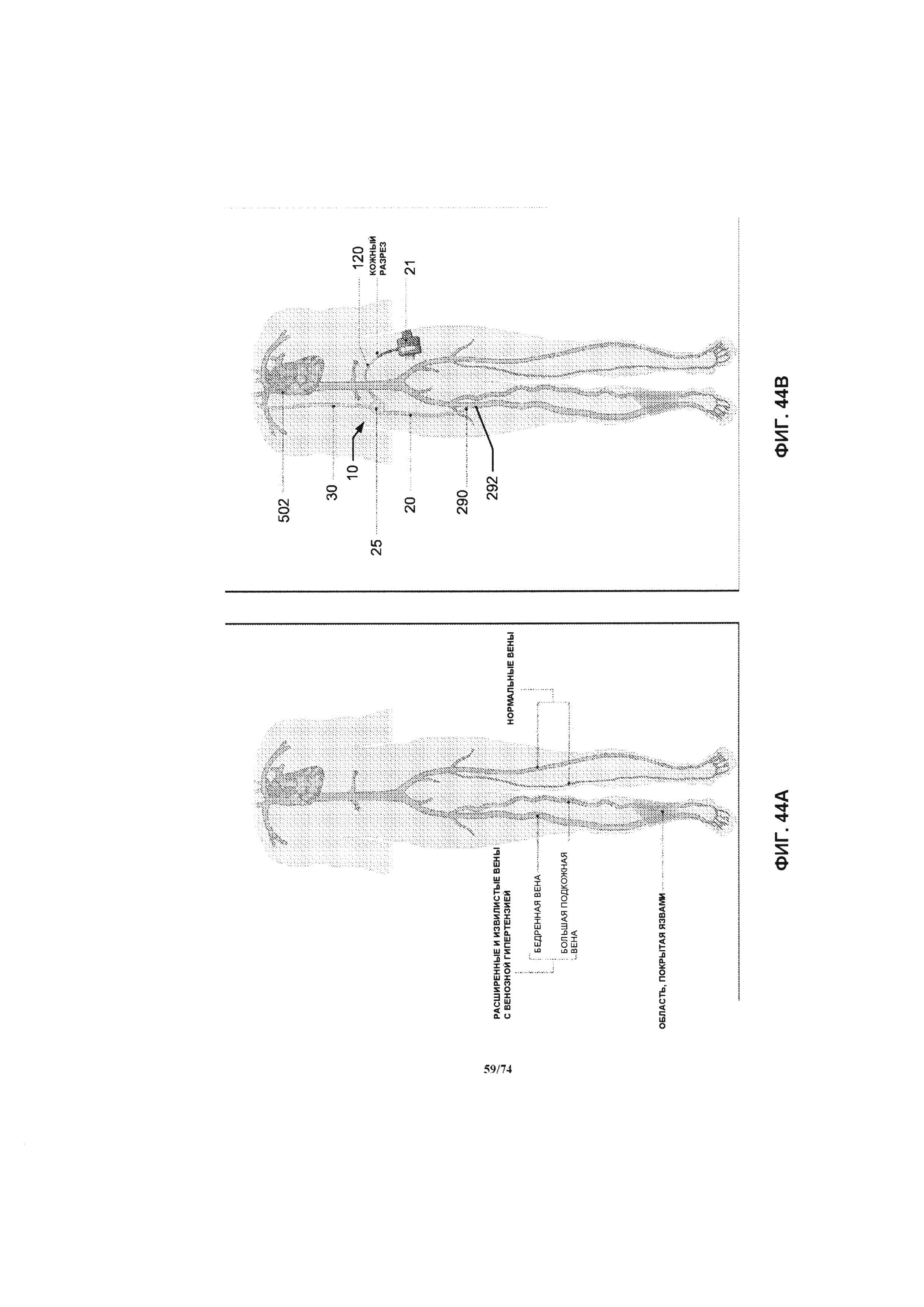
[00103] На ФИГ. 44A-D проиллюстрировано схематическое изображение системы насоса, примененной в венозной системе нижних конечностей пациента для лечения венозной гипертензии и венозных язв.
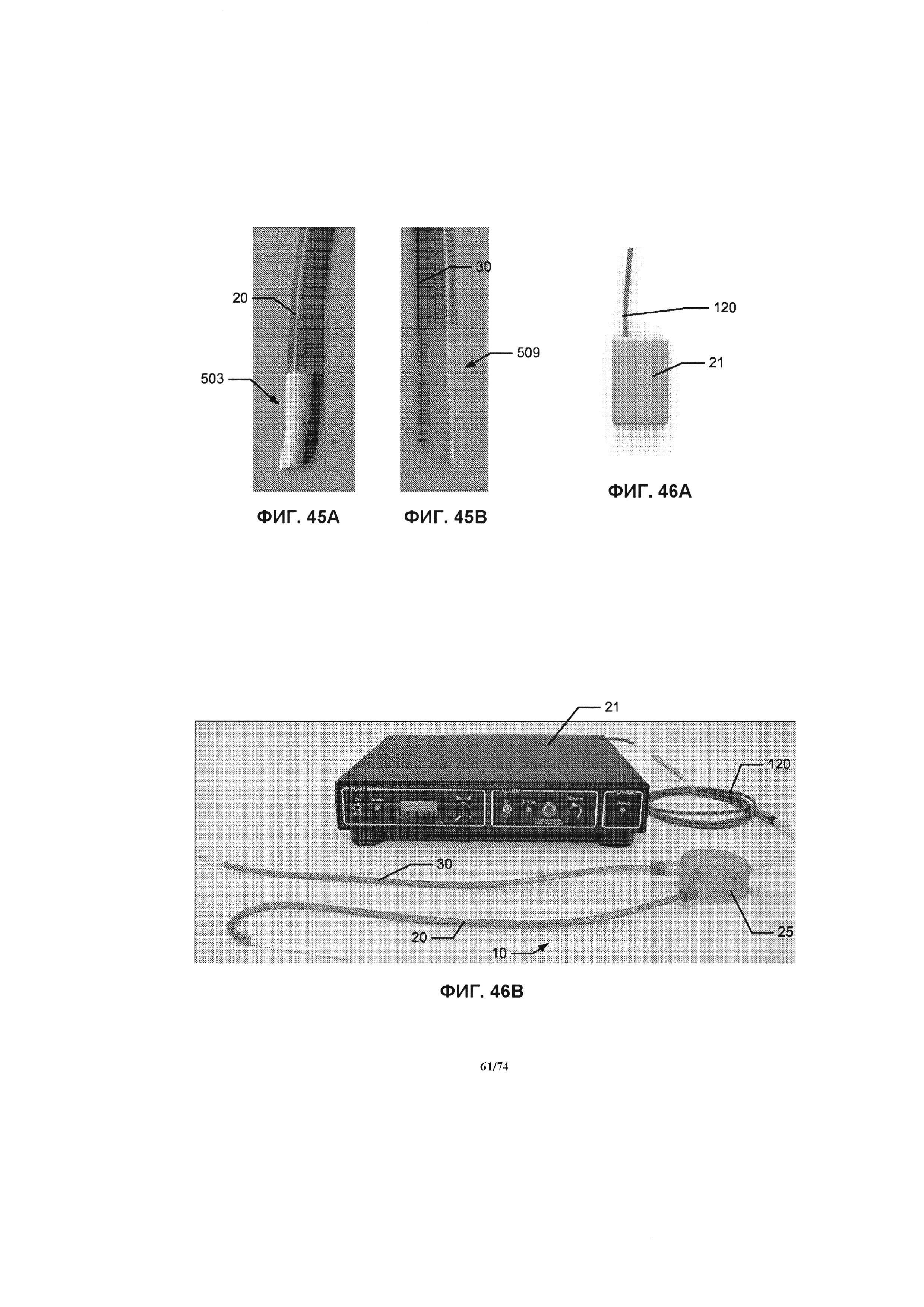
[00104] На ФИГ. 45А проиллюстрирована фотография части соединительной трубки, выполненной для жидкостного соединения с сосудистой системой за счет хирургического анастомоза.
[00105] На ФИГ. 45 В проиллюстрирована фотография части соединительной трубки, выполненной для ввода в полость части венозной системы.
[00106] На ФИГ. 46А-В проиллюстрированы, соответственно, фотографии носимого устройства управления и стационарного или устанавливаемого на столе устройства управления.
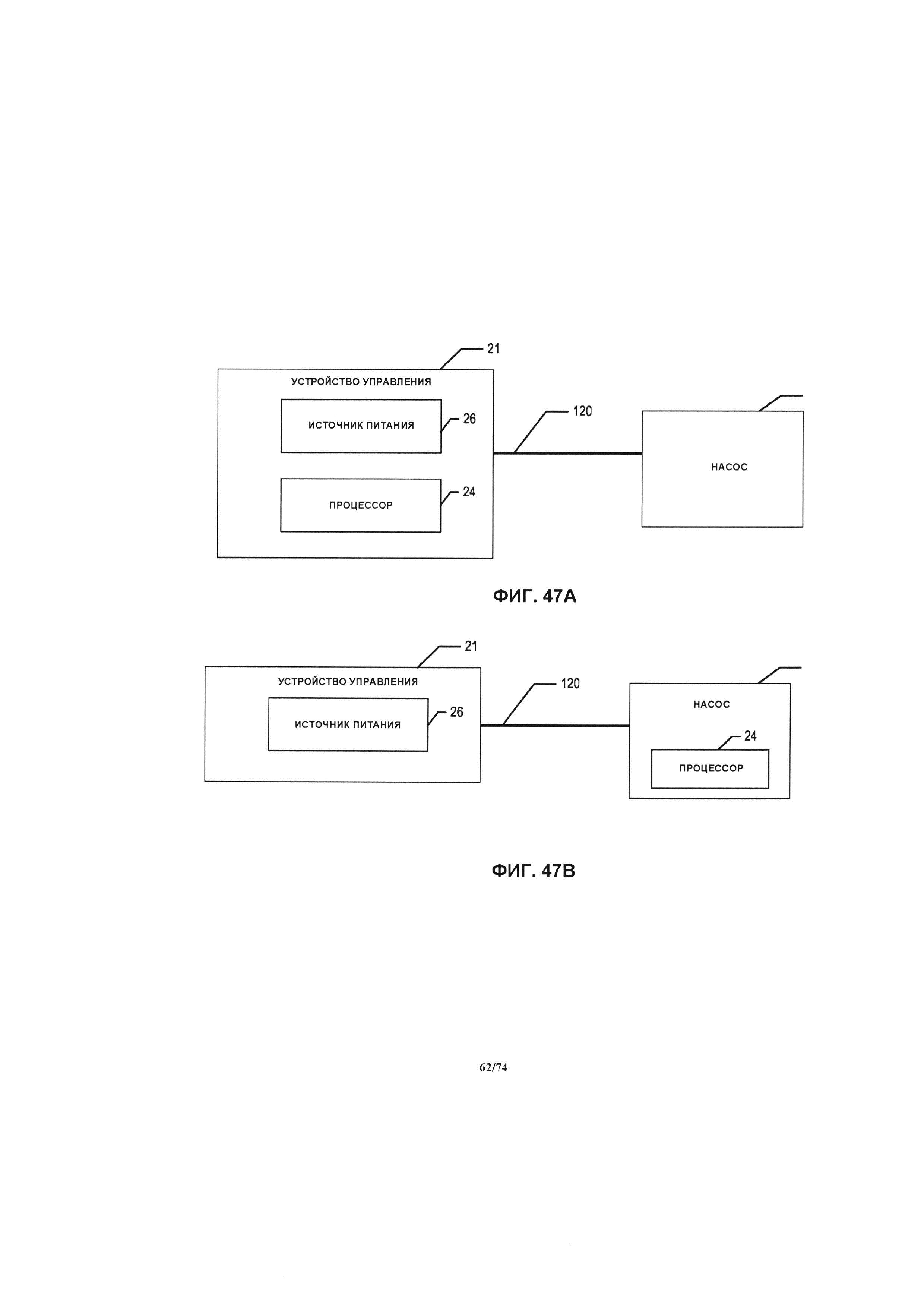
[00107] На ФИГ. 47А-В проиллюстрирована структурная схема различных вариантов устройства системы управления и перфузионного насоса, где процессор управления двигателем может быть расположен в устройстве управления или в корпусе перфузионного насоса.
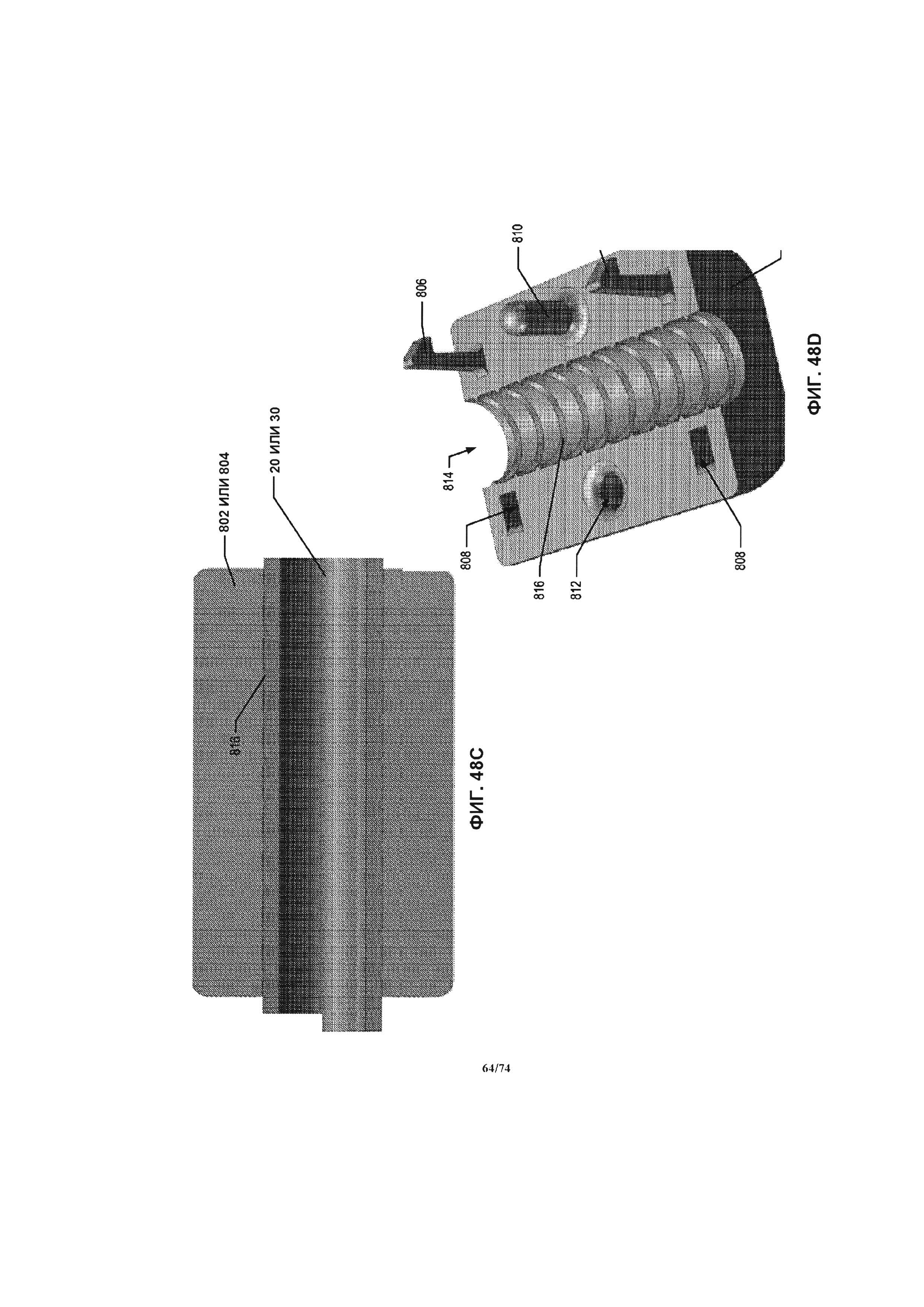
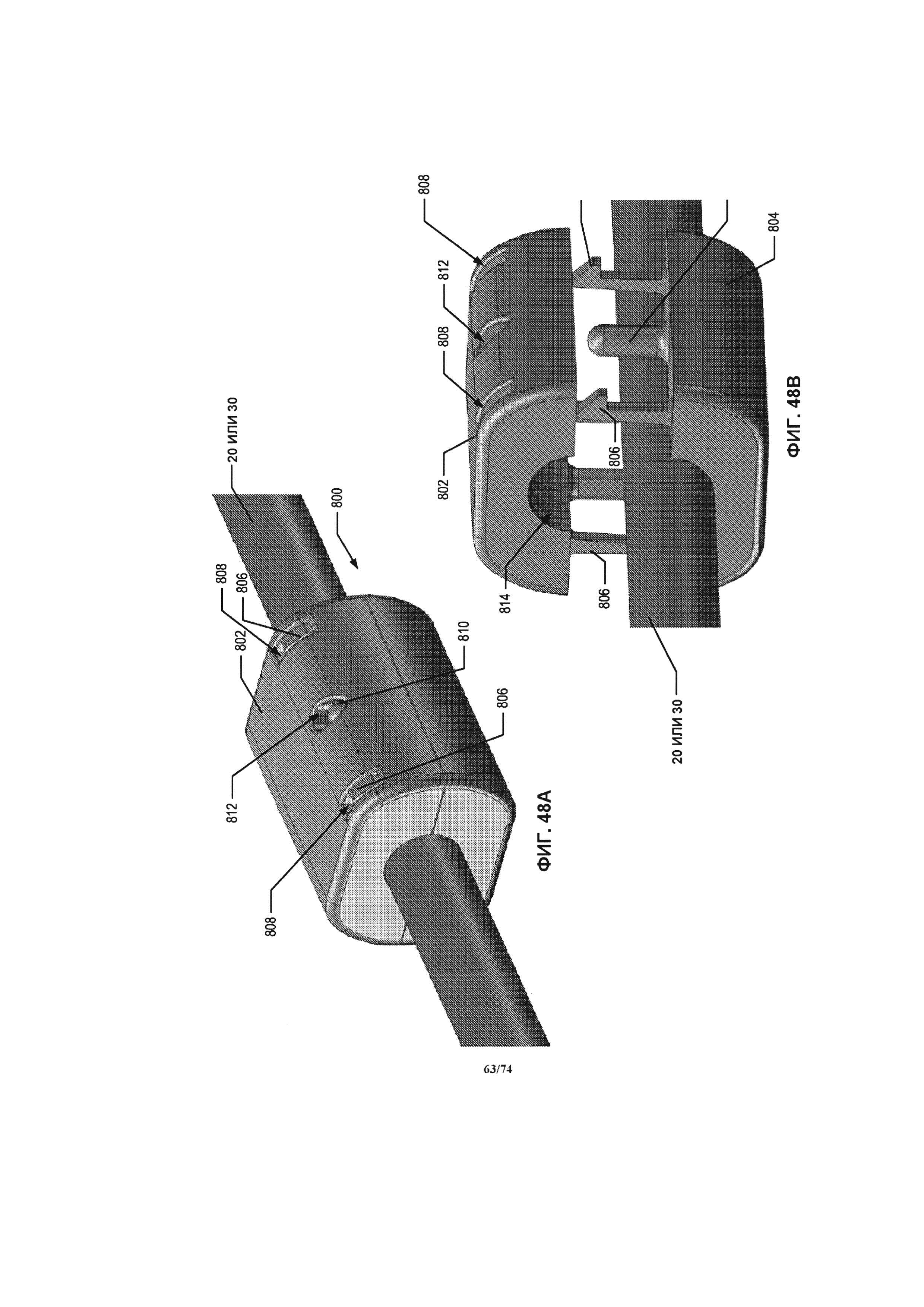
[00108] На ФИГ. 48A-D проиллюстрирован вид в перспективе части конструкции манжеты, которая может устанавливаться на внешнюю поверхность сегмента соединительной трубки.
[00109] На ФИГ. 48E-F проиллюстрированы фотографии конструкции манжеты, которая может быть установлена на внешнюю поверхность сегмента соединительной трубки.
[00110] На ФИГ. 49А-В проиллюстрированы ангиографические и гистологические результаты в лабораторных условиях изучения возможности применения системы AFE.
[0100] На ФИГ. 50 проиллюстрированы фотографии бокового порта в сборе для приточной и выпускной соединительной трубки, в соответствии с одним вариантом реализации изобретения.
[0101] На ФИГ. 51А-В проиллюстрированы фотографии, соответственно, не собранного и собранного "способа доступа" комплекта бокового порта, в соответствии с одним вариантом реализации изобретения.
[0101] На ФИГ. 52А-В проиллюстрированы фотографии, соответственно, не собранного и собранного "способа доступа" комплекта бокового порта, в соответствии с другим вариантом реализации изобретения.
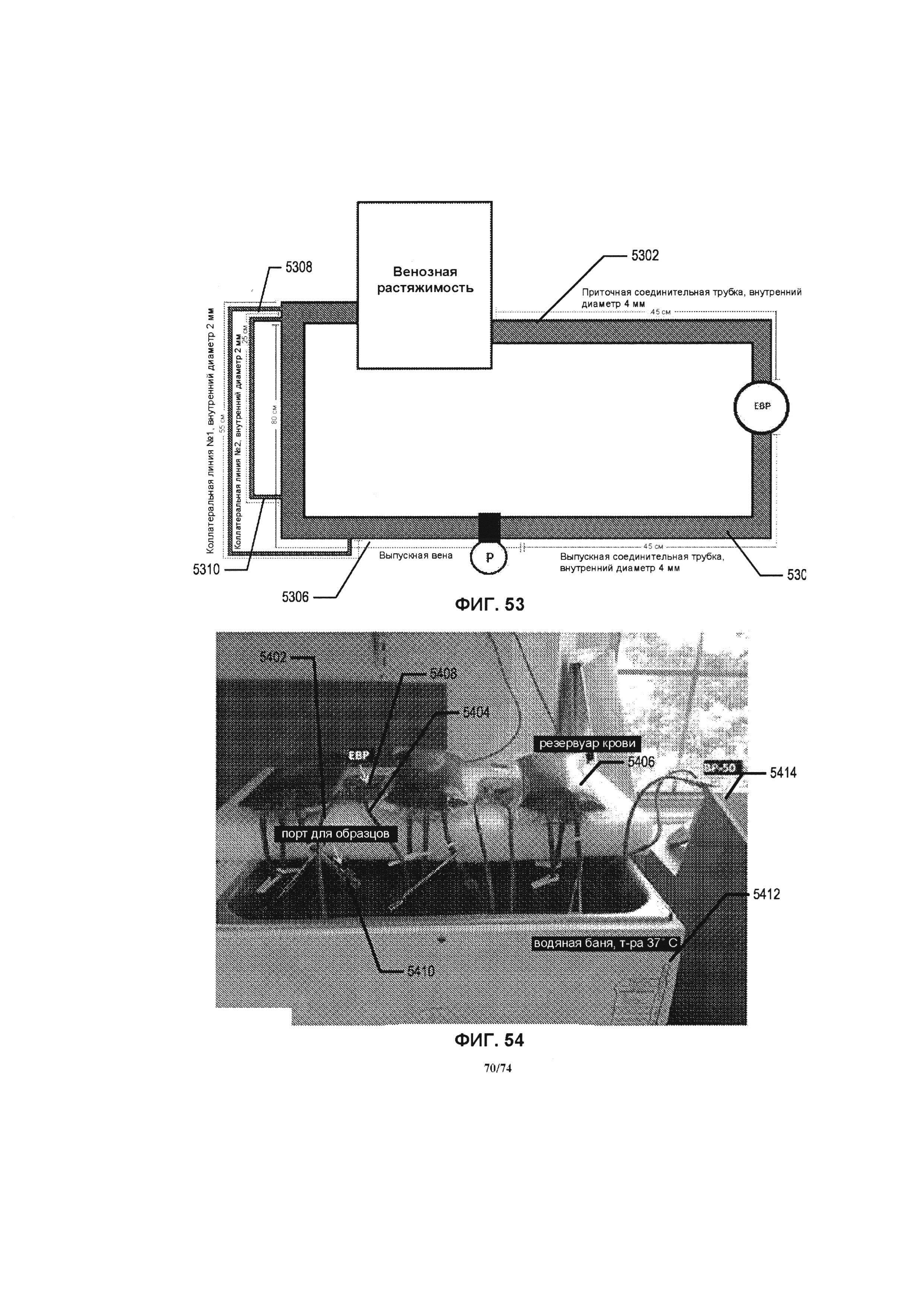
[0103] На ФИГ. 53 проиллюстрирована имитационная петля циркуляции, применяемая во время различных исследований и экспериментов, в соответствии с одним вариантом реализации изобретения.
[0104] На ФИГ. 54 проиллюстрирована фотография экспериментальной петли циркуляции, применяемой во время различных исследований и экспериментов, в соответствии с одним вариантом реализации изобретения.
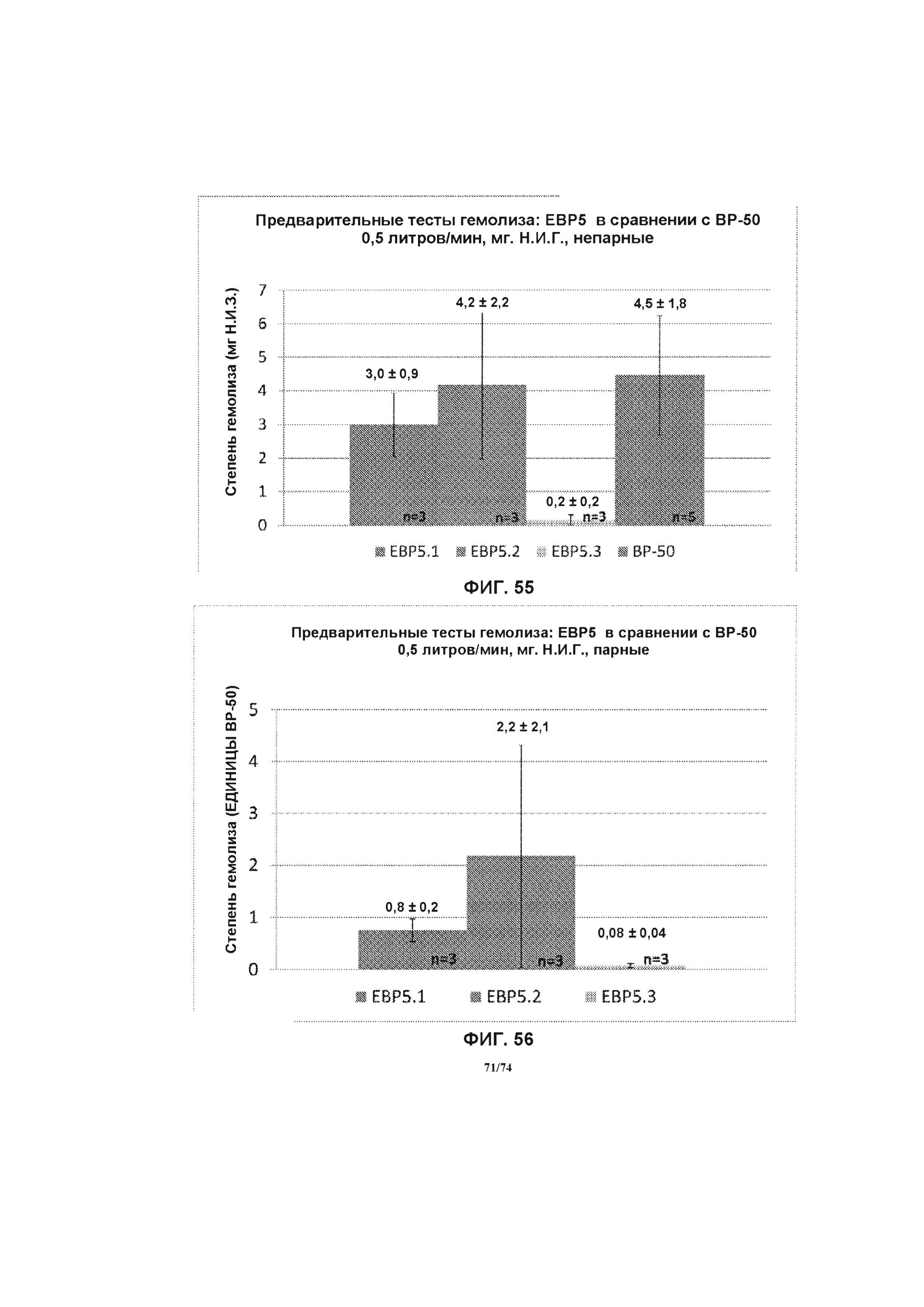
[0105] На ФИГ. 55 проиллюстрирован график, отображающий непарные результаты тестов насосов в единицах ВР-50 в сравнении с единицами мг. Н.И.З..
[0106] На ФИГ. 56 проиллюстрирован график, отображающий парные результаты тестов гемолиза с применением насосов в сравнении с единицами ВР-50.
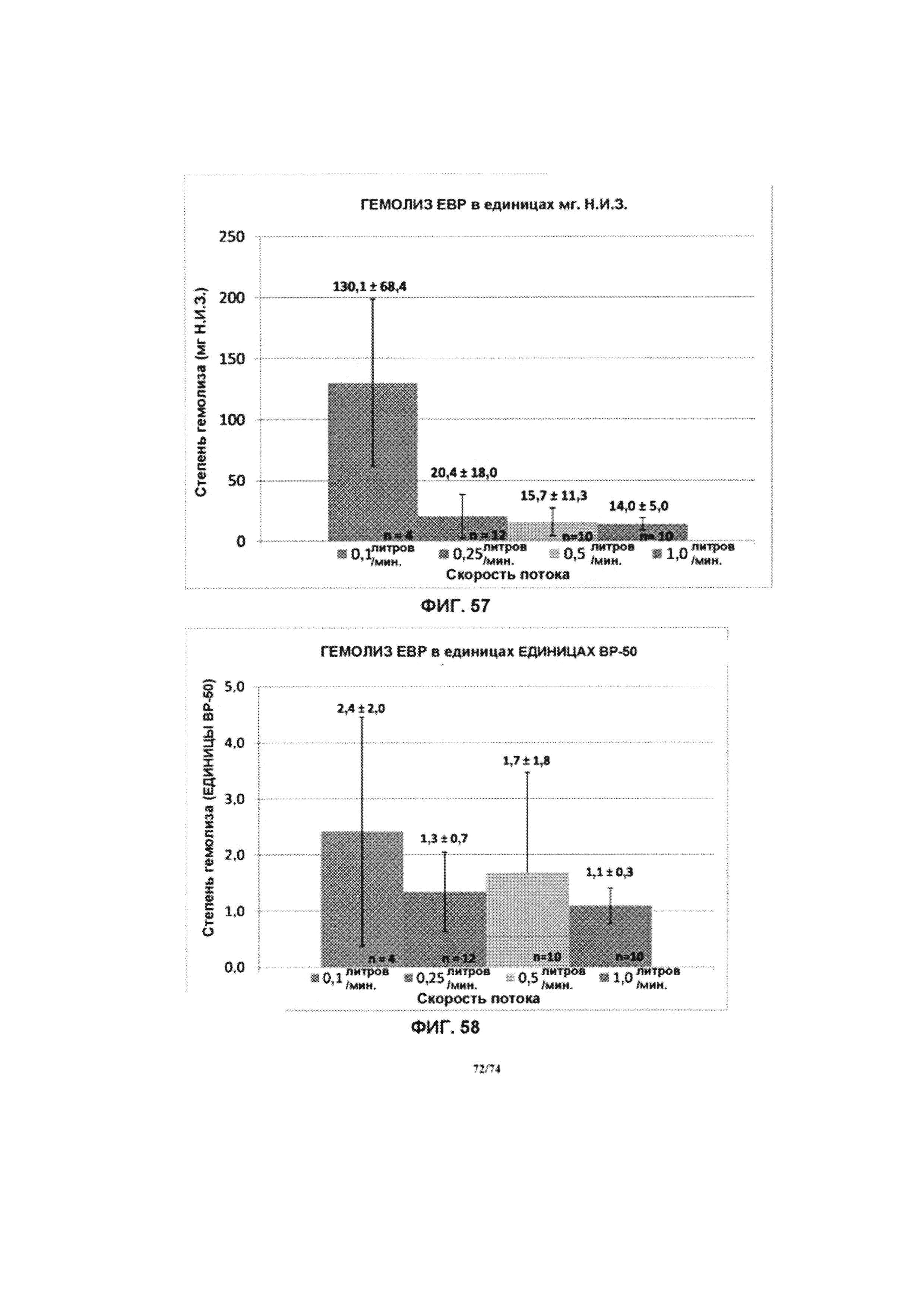
[0107] На ФИГ. 57 проиллюстрирован график, отображающий тест гемолиза насоса при различной скорости потока, в эквиваленте мг. Н.И.З. единиц, в соответствии с одним вариантом реализации изобретения
[0108] На ФИГ. 58 проиллюстрирован график, отображающий тест гемолиза насоса при различной скорости потока, в эквиваленте единиц ВР-50, в соответствии с одним вариантом реализации изобретения
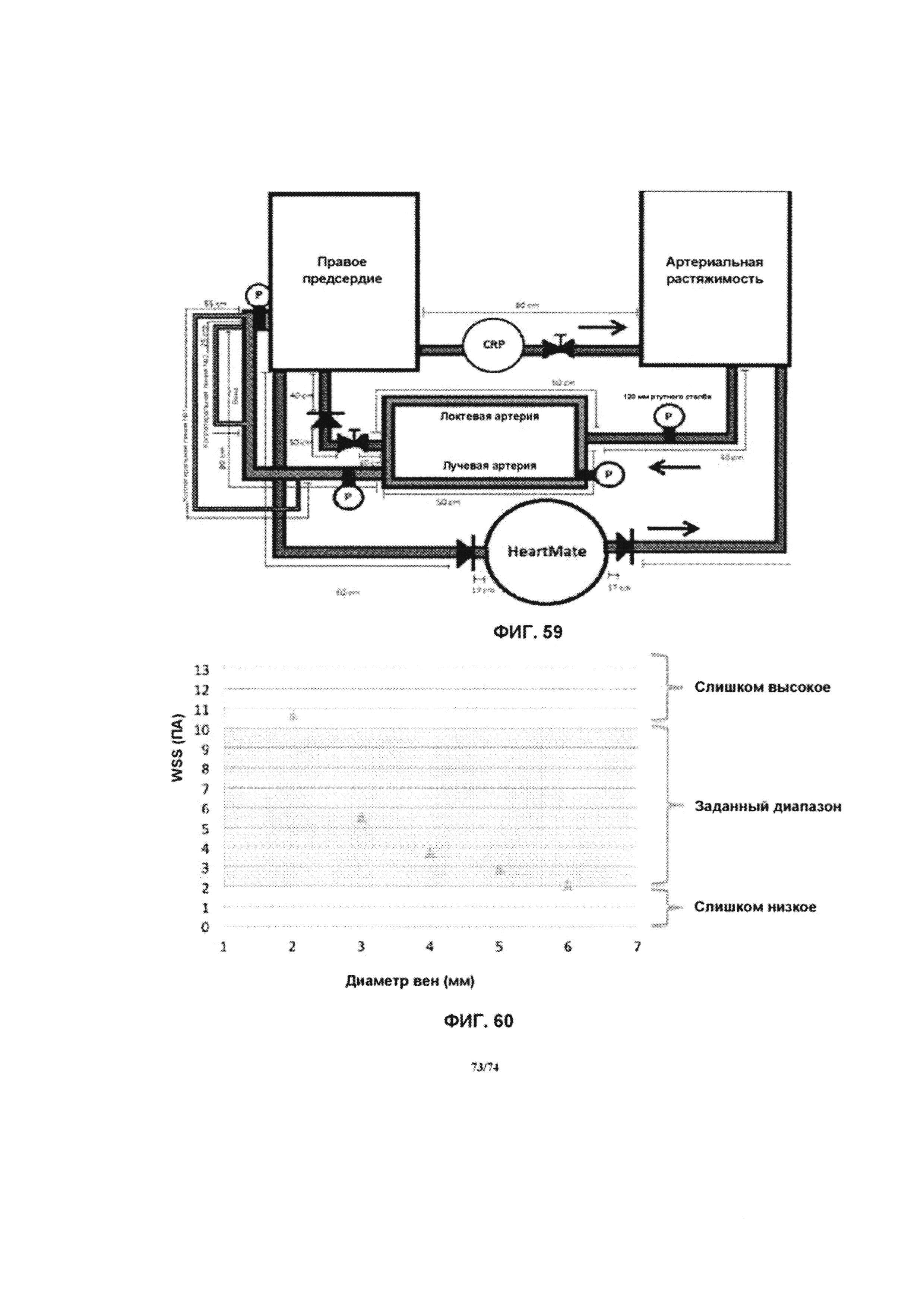
[0108] На ФИГ. 59 проиллюстрирован имитационный тест петли имитационной петли АВФ предплечья, в соответствии с одним вариантом реализации изобретения.
[0108] На ФИГ. 60 проиллюстрирован график, отображающий дозы WSS в сравнении с диаметром вен, в соответствии с одним вариантом реализации изобретения.
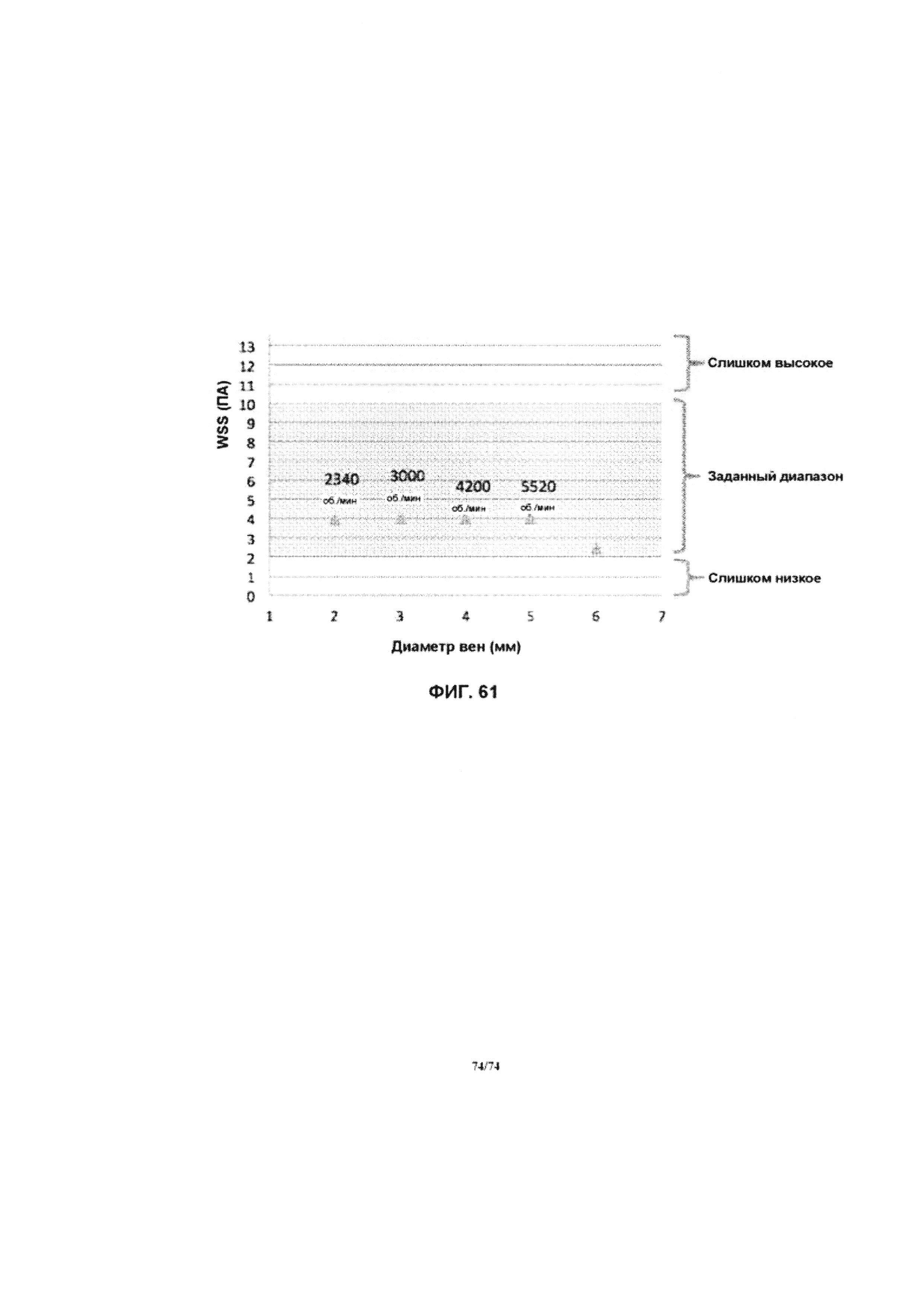
[0108] На ФИГ. 61 проиллюстрирован график, отображающий дозы WSS в сравнении с диаметром вен, в соответствии с другим вариантом реализации изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0109] Устройство и компоненты настоящей заявки относятся к системе перфузионного насоса. В различных вариантах реализации изобретения, настоящая заявка относится к перфузионному насосу, разработанному и имеющему определенные размеры для выпуска крови в заданный сосуд или забора крови из заданного сосуда таким образом и для такого периода времени, чтобы диаметр целевого сосуда (вены или артерии) был устойчиво увеличенным. Еще более конкретно, настоящая заявка относится к ротационной системе перфузионного насоса, выполненной с возможностью устойчивого увеличения средней и/или пиковой скорости кровотока, и/или пикового срезающего давления на стенку сосуда в выбранном сегменте вен или артерий в течение заданного периода времени, достаточного для постоянного увеличения общего диаметра и диаметра просвет выбранного сегмента вен или артерий. Термин "устойчивое увеличение" или "устойчивая дилатация", используемое для описания расширения или увеличения общего диаметра и диаметра просвета артерий или вен, используется в данном документе в том смысле, что даже если насос выключен, увеличение общего диаметра или диаметра просвета сосуда остается ярко выраженным, в сравнении с общим диаметром или диаметром просвета сосуда до момента начала прокачивания крови. Другими словами, общий диаметр или диаметр просвет сосуда становится больше, независимо от давления, производимого насосом. Следовательно, система перфузионного насоса будет весьма эффективна для определенных пациентов, включая пациентов с ХПН, нуждающихся в сосудистом доступе для гемодиализа. Система перфузионного насоса может содержать ротационный перфузионный насос, одну или более соединительную трубку для транспортировки крови, систему управления и источник питания. Система перфузионного насоса забирает кровь из одного места в сосудистой системе и выпускает кровь в другое место в сосудистой системе. Во время работы, такая система перфузионного насоса способна постоянно увеличивать среднюю или пиковую скорость кровотока, а также среднее или пиковое WSS в целевом кровеносном сосуде до определенного уровня и в течение определенного периода времени, достаточного для устойчивого увеличения общего диаметра и диаметра просвета заданного кровеносного сосуда. Система работает в конфигурации, когда кровь забирается из заданного кровеносного сосуда или в конфигурации, когда кровь выпускается в целевой кровеносный сосуд. Кроме того, система может одновременно применяться для увеличения размера донорского или принимающего сосуда.
[0110] В различных других вариантах реализации изобретения, настоящая заявка относится к перфузионному насосу, разработанному и имеющему определенные размеры для перемещения венозной крови из нижних конечностей к сердцу или другому месту венозной системы, откуда ей будет легче вернуться к сердцу, для снижения венозного кровяного давления в нижних конечностях, и, в иных случаях, для снижения опухоли или увеличения степени исцеления связанных кожных язвенных образований. Еще конкретнее, настоящая заявка относится к системе ротационного перфузионного насоса, выполненному с возможностью перемещения венозной крови из нижних конечностей к сердцу или другому месту венозной системы, откуда ей будет легче вернуться к сердцу, для снижения венозного кровяного давления в нижних конечностях, и, в иных случаях, для снижения отека или увеличения степени излечения связанных кожных язвенных образований. Следовательно, система перфузионного насоса может быть эффективной для определенных пациентов, включая пациентов с венозной гипертензией и/или венозными язвенными образованиями одной или обеих нижних конечностей, например, пациентов с закупорками вен или пациентов с поврежденными или недееспособным венозным клапаном в одной или обеих нижних конечностях. Система перфузионного насоса может содержать ротационный перфузионный насос, одну или более соединительную трубку для транспортировки крови, систему управления и источник питания. Система перфузионного насоса забирает кровь из сегментов вен нижних конечностей и выпускает кровь в другое место венозной системы. Участками в венозном кровообращении, куда осуществляется отток крови, являются яремная вена, подмышечная вена, подключичная вена, плечеголовная вена, верхняя полая вена и правое предсердие.
[0111] Дополнительные соединительные трубки, обеспечивающие транспортировку крови, могут содержать приточные соединительные трубки, для переноса крови из определенного места в сосудистой системе (например, донорской вены, донорской артерии или правого предсердия) к перфузионному насосу и выпускные соединительные трубки для переноса крови от перфузионного насоса к определенному месту в сосудистой системе (например, принимающей вене или артерии, или принимающему участку, например, правому предсердию). Система перфузионного насоса также содержит систему управления. Предпочтительной системой управления является система, разработанная для сбора информации о параметрах работы и производительности системы перфузионного насоса, а также изменений в сосудистой системе, например, изменений диаметра донорской артерии, донорской вены, принимающей вены, принимающей артерии или принимающей вены пациента. Система перфузионного насоса, в первую очередь, выполнена с возможностью прокачивать достаточное количество крови, такое, чтобы среднее и/или пиковое значение срезающего давления на стенку сосуда (WSS) было достигнуто внутри сегмента кровеносного сосуда ("целевого кровеносного сосуда" или "целевого сосуда"), и в течение достаточного периода времени, такого при котором перманентный или постоянный общий диаметр и диаметр просвета сегмента кровеносного сосуда был увеличен. Среднее значение WSS может быть рассчитано с применением измеренного, оцененного или рассчитанного диаметра сосуда, а также измеренного, оцененного или рассчитанного среднего значения скорости потока крови через систему перфузионного насоса.
[0112] Диаметр кровеносных сосудов может быть определен за счет измерений диаметра просвета внутренней части центра кровеносного сосуда. В контексте настоящей заявки такое измерение называют "диаметром просвета". Диаметр кровеносного сосуда может быть определен за счет измерения диаметра способом, который включает просвет внутренней части центра кровеносного сосуда и стенки кровеносного сосуда. В контексте настоящей заявки такое измерение называют "общим диаметром". Изобретение относится к одновременному и устойчивому увеличению общего диаметра и диаметра просвета периферических вен за счет перемещения крови (предпочтительно, с низким пульсовым давлением) в принимающую периферическую вену, таким образом, увеличивая скорость кровотока в периферических венах и увеличения WSS на эндотелии периферических принимающих сосудов. Устройство и способы, описанные в данном документе, увеличивают скорость кровотока в периферических принимающих венах и WSS на эндотелий периферических принимающих вен за счет применения насоса. Устройство и способы также описывают, что забор или "вытягивание" крови выполняется таким образом, что скорость кровотока и WSS увеличиваются в донорском сосуде, как в артерии, так и вене. Предпочтительно, насос интенсивно отбирает кровь в периферической принимающей вене, при этом у прокачиваемой крови снижается пульсовое давление, например, в случае, когда пульсовое давление ниже, чем в крови периферической артерии.
[0113] Систем перфузионного насоса, описанная в данном документе, может иметь одну или набор характеристик, которые отличаются от любых других систем перфузионных насосов. Например, система перфузионного насоса, описанная в данном документе, без преувеличения имеет самый широкий диапазон потока крови, например, диапазон от 50 мл/мин до 1500 мл/мин. В качестве еще одного примера, система перфузионного насоса, описанная в данном документе, при изготовлении может иметь низкую себестоимость (COGS), например, в диапазоне от 1000$ до 5000$. В качестве еще одного примера, система перфузионного насоса, описанная в данном документе, разработана для безотказной работы вне условий больниц или клиник в течение среднего периода времени, например, от 1 часа до 12 месяцев, или от 7 дней до 12 месяцев. В качестве некоторых примеров, система перфузионного насоса, описанная в данном документе, может иметь один, несколько или все эти факторы, так одна и более систем перфузионных насосов, описанных в данном документе, могут надежно работать в широком диапазоне потока крови, включая диапазон от 50 мл/мин. до 1500 мл/мин., иметь низкую себестоимость в пределах от 1000$ до 5000$, а также могут работать вне условий больниц или клиник в течение среднего периода времени, например, от 1 часа до 12 месяцев, или от 7 дней до 12 месяцев.
[0114] Для начала детального рассмотрения перфузионного насоса 25 системы 10, будем ссылаться на ФИГ. 1, на которой проиллюстрировано изометрическое изображение перфузионного насоса 25. В одном варианте реализации изобретения перфузионный насос 25 представляет собой миниатюрный центробежный насос, имеющий магнитный привод, при этом крыльчатка насоса приводится в действие за счет вращения магнитных полей. Например, вращающееся магнитное поле может генерироваться за счет возбуждения некоторого количества электромагнитов в определенной последовательности. В другом примере, вращающееся магнитное поле может генерироваться за счет вращения некоторого количества постоянных магнитов или возбужденных электромагнитов. Насос может иметь диаметр, приблизительно равный размеру монеты, например, равный около четверти доллара США, половине доллара США или иметь больший диаметр, при необходимости. Например, насос 25 имеет диаметр в диапазоне от около 2,0 см до около 5,0 см, в соответствии с различными вариантами реализации изобретения. Как проиллюстрировано на ФИГ. 1, перфузионный насос 25 содержит корпус 105, впускное отверстие 110 и выпускное отверстие 115, а также кабель питания 120. С помощью кабеля питания 120 перфузионный насос 25 подключается к устройству управления 21 системы управления 14 и источнику питания. Источник питания может являться частью устройства управления 21 или быть отдельным устройством. Кабель питания обеспечивает связь между устройством управления 21 и двигателем перфузионного насоса 25. Кабель также может применяться для передачи энергии от источника питания к двигателю насоса. В частности, кабель питания 120 соединяет электрические компоненты электромагнитного привода внутри корпуса 105 с электрическим источником питания (например, батареей).
[0115] Впускное отверстие 110 может иметь жидкостное соединение с приточной соединительной трубкой 20 с помощью соединительного механизма (например, бородчатого наконечника, фланца и запорного кольца). Впускное отверстие 110 обеспечивает подвод жидкости в область всасывания (то есть в центр) крыльчатки насоса. Область всасывания крыльчатки может иметь различную конструкцию, при условии, что выпускаемая наружу кровь через выпускное отверстие будет иметь большую скорость кровотока, чем скорость всасываемой крови. Выпускное отверстие 115 может иметь жидкостное соединение с выпускной соединительной трубкой 30 с помощью соединительного механизма (например, бородчатого наконечника, фланца и запорного кольца). Выпускное отверстие 115 обеспечивает направление потока жидкости из области выпускного отверстия (то есть периметра) крыльчатки насоса.
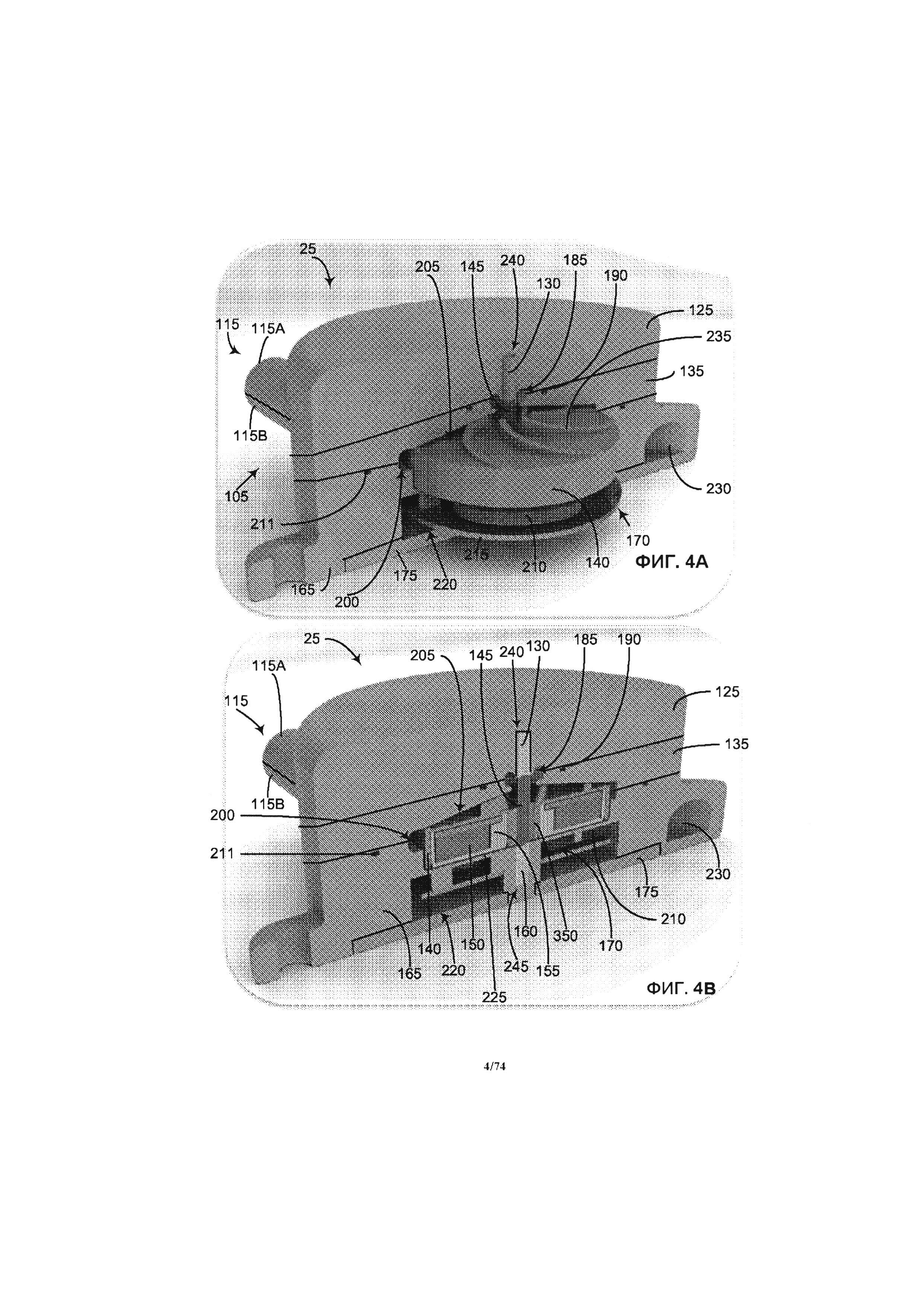
[0116] Как проиллюстрировано на ФИГ. 2, где проиллюстрирован изометрический вид перфузионного насоса 25 в разобранном виде, с демонстрацией его компонентов, содержащихся в корпусе 105, обозначенном на ФИГ. 1, перфузионный насос 25 содержит крышку впускного отверстия 125, верхнюю шейку подшипника 130, верхнюю крышку крыльчатки 135, крыльчатку 140, ось крыльчатки 145, магнитный узел 150, защитный корпус магнита 155, нижнюю шейку подшипника 160, нижнюю крышку крыльчатки 165, узел электрической обмотки 170 и крышку узла электрической обмотки 175. Корпус впускного отверстия 125 и верхняя крышка крыльчатки 135 размер, равный примерно половине впускного отверстия 110.
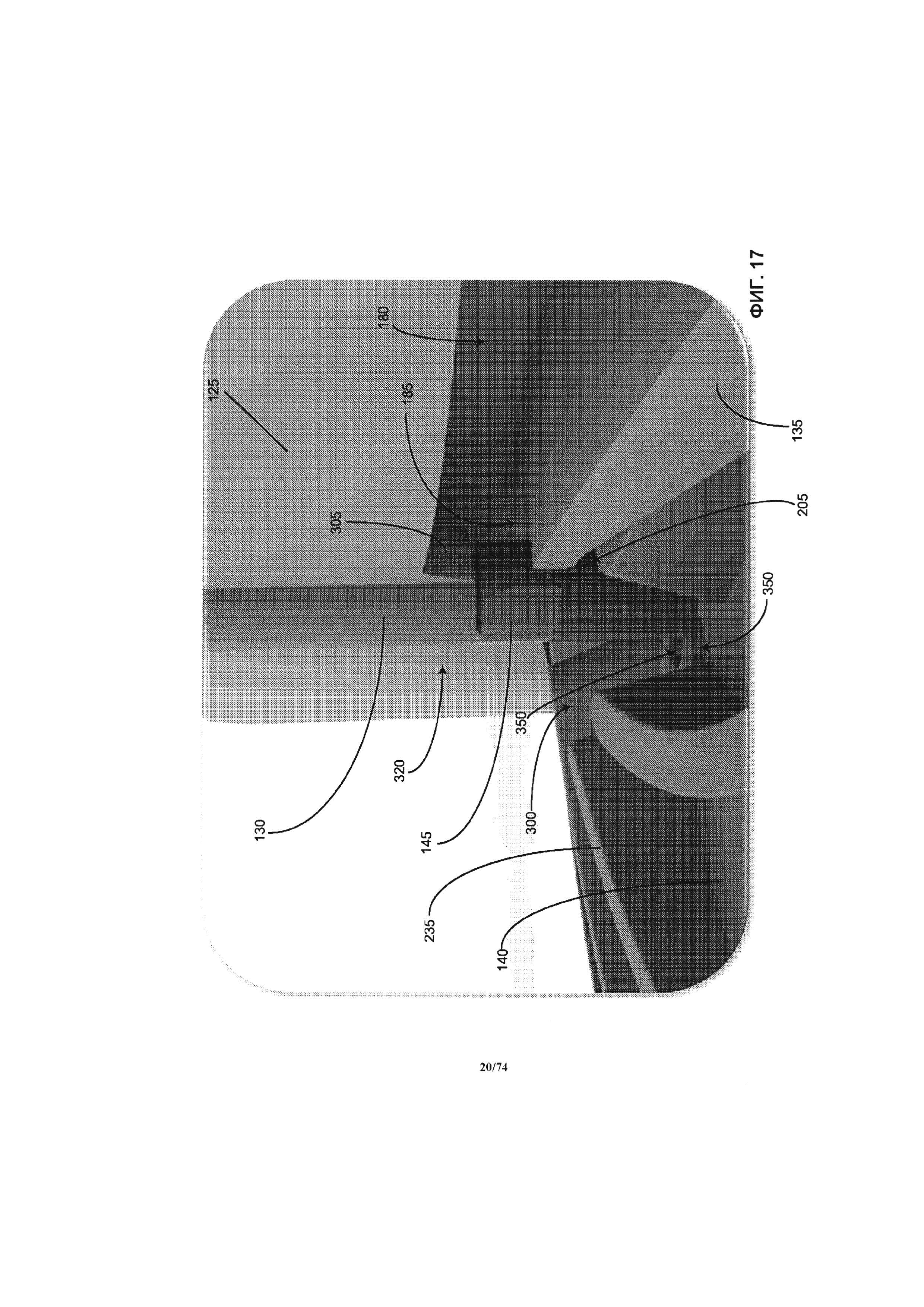
[0117] Как проиллюстрировано на ФИГ. 3А и 3В, представляющими собой, соответственно, частичный и полный поперечный разрез перфузионного насоса 25, взятый по линии разреза 3-3 на ФИГ. 1, компоненты, упоминавшиеся в отношении ФИГ. 2, образуют многослойную конструкцию, образующую форму насоса. Например, как понятно из ФИГ. 2-3А, корпус впускного отверстия 125 и верхняя крышка крыльчатки 135, соответственно, содержат верхнюю горизонтальную выступающую часть впускного отверстия 110А и нижнюю горизонтальную выступающую часть впускного отверстия 110В. Обычно, впускное и выпускное отверстия находятся друг против друга и расположены в разных плоскостях. При соединении вместе крышки впускного отверстия 125 и корпуса крыльчатки 135, они образуют канал впускного отверстия 180, ведущих через впускное отверстие 110 и впускное дроссельное отверстие 185 крыльчатки. Корпус впускного отверстия 125 и верхняя крышка крыльчатки 135, соответственно, образуют приблизительно верхнюю половину и нижнюю половину канала 180. Канавка под уплотнение 190 образована в верхней крышке крыльчатки 135, в непосредственной близости от канала 180 и адаптирована для установки гибких элементов жидкостного уплотнения для создания водонепроницаемого уплотнения между корпусом впускного отверстия 125 и верхней крышкой крыльчатки 135.
[0118] На ФИГ. 4А и 4В, соответственно, проиллюстрирован частичный и полный поперечный разрез перфузионного насоса 25, выполненный вдоль линии разреза 4-4 на ФИГ. 1. Как понятно из ФИГ. 2, 4А и 4В, верхняя крышка крыльчатки 135 и нижняя крышка крыльчатки 165, соответственно, содержат верхнюю горизонтальную выступающую часть выпускного отверстия 115А и нижнюю горизонтальную выступающую часть выпускного отверстия 115В. При соединении вместе верхней крышки крыльчатки 135 и нижней крышки крыльчатки 165, они образуют выпускной канал жидкости 200 (то есть спиральную камеру) ведущую от камеры крыльчатки 205 к выпускному отверстию 115. Верхняя крышка крыльчатки 135 и нижняя крышка крыльчатки 165, соответственно, образуют приблизительно верхнюю и нижнюю половину канала 200. Канавка под уплотнение 211 образована в нижней крышке крыльчатки 165, в непосредственной близости от канала 200 и камеры крыльчатки 205, и адаптирована для установки гибких элементов жидкостного уплотнения для создания водонепроницаемого уплотнения между верхней крышкой крыльчатки 135 и нижней крышкой крыльчатки 165.
[0119] Как проиллюстрировано на ФИГ. 2-4 В, магнитный узел крыльчатки 150 представляет собой множество магнитов в форме кольца или диска. Магниты 150 расположены в объеме защитного корпуса магнита 155 и объема крыльчатки 140. Защитный корпус магнита 155 размещен в крыльчатке 140. Защитный корпус магнита 155 и крыльчатка 140, соответственно, образуют нижнюю и верхнюю часть объема, в котором размещены магниты 150. Защитный корпус магнита 155, магнит 150 и крыльчатка 140 соединены вместе в общий интегральный скрепленный узел, вращающийся как одно целое внутри камеры крыльчатки 205. Для вращения крыльчатки может быть применена альтернативная конструкция.
[0120] Как проиллюстрировано на ФИГ. 2-4В, узел электрической обмотки 170 представляет собой множество электрических обмоток 210, образующих круговое расположение на нижней части крыльчатки, и дополнительно накрыто защитным диском 215. Узел электрической обмотки 170 зафиксирован внутри камеры обмотки 220, образованной в нижней части крышки крыльчатки 165 и прикрытой нижней крышкой узла электрической обмотки 175. Внутренняя конструкция перекрытия 225 отделяет камеру крыльчатки 205 от камеры обмотки 220. В одном варианте реализации изобретения камера обмотки 220 также содержит одну или более пустот или пространств, шайб 282 и ферромагнитных задних стенок 284, как проиллюстрировано на ФИГ. 4С. Эффективная сила магнитного поля формируется между магнитом крыльчатки 150 и задней стенкой 284, которая уравновешивает подъемную силу, продиктованную повышенным давлением крови, протекающей через зазор 542 между нижней поверхностью крыльчатки 140 и нижней крышкой крыльчатки 165, как проиллюстрировано на ФИГ. 4Е, и пониженным давлением во впускном дроссельном отверстии 185 камеры крыльчатки, над крыльчаткой. Результирующий эффект снимает нагрузку верхней шейки подшипника 130. В зависимости от положения задней стенки 284 и скорости вращения насоса 25, осевая нагрузка может распределяться между верхней и нижней шейкой подшипника 130 и 160, или переносится исключительно на нижнюю шейку подшипника или верхнюю шейку подшипника. Например, усилие на верхней шейке подшипника 130 может быть меньше, чем около 3Н, при рабочей скорости, равной около 6000 об/мин. Аналогично, усилие на нижней шейке подшипника 160 может быть меньше, чем около 4Н, при рабочей скорости, равной около 6000 об/мин. И наоборот, в состоянии покоя (то есть при 0 об/мин.), осевая нагрузка, определенная экспериментальным путем, составляет по меньшей мере 0,1Н и может быть увеличена до ЮН или больше.
[0121] Было выполнено некоторое количество экспериментов для измерения нагрузки на верхнюю и нижнюю шейку подшипника 130 и 160 при разной скорости вращения насоса и ориентации обратной стенки 284. Скорость, при которой происходит смещение нагрузки от нижней шейки подшипника 160 к верхней шейке подшипника 130, может регулироваться за счет изменения расстояния между крыльчаткой 140 и задней стенкой 284, например, за счет применения одной или более шайб 282. Аналогично, нагрузка на верхнюю и нижнюю шейку подшипника 130 и 160 при определенной скорости крыльчатки может регулироваться за счет изменения расстояния между крыльчаткой 140 и задней стенкой 284. Ферромагнитная задняя стенка 284 также служит для увеличения эффективности двигателя и крутящего момента, так как задняя стенка заставляет магнитный поток проникать глубже в обмотку 210, обеспечивая, таким образом, более высокую плотность осевого магнитного потока.
[0122] Один вариант реализации задней стенки 284 проиллюстрирован на ФИГ. 4D. Как проиллюстрировано, задняя стенка 284 имеет, в общем случае, форму диска и выполнена из композитного или ферромагнитного металла или сплава. В одном варианте реализации изобретения задняя стенка 284 состоит из мягкого магнитного сплава железо-кобальт-ванадиум, например, Hiperco® 50, производимого компанией Carpenter Technology. Толщина задней стенки 284 лежит в диапазоне от около 0,04 мм до около 0,07 мм и внешний диаметр в диапазоне от около 20 мм до около 40 мм. В предпочтительном варианте реализации изобретения задняя стенка 284 представляет собой сплошной диск, имеющий толщину около 0,53 мм и внешний диаметр около 31 мм. Задняя стенка 284 может содержать центральное отверстие 288 для обеспечения конструктивных особенностей насоса 25; тем не менее, в других вариантах реализации изобретения, может применяться сплошной диск 288 без отверстия. На ФИГ. 4Е проиллюстрирован вариант реализации насоса 25. Как проиллюстрировано, в одном варианте реализации изобретения задняя стенка 284 размещена на расстоянии "D" от магнита 150. В одном варианте реализации изобретения расстояние "D" находится в приблизительном диапазоне от около 4 мм до около 8 мм. В предпочтительном варианте реализации изобретения расстояние "D" равно около 6 мм. В другом варианте реализации изобретения задняя стенка 284 может быть размещена ближе к магнитам или дальше от магнитов 150, чтобы обеспечить необходимый зазор 540 между верхней поверхностью крыльчатки 140 и нижней крышкой крыльчатки 135, а также зазора 542 между нижней поверхностью крыльчатки и нижним корпусом крыльчатки 165.
[0123] На ФИГ. 4F проиллюстрирована крыльчатка 140 и задняя стенка 284, а также график, отображающий экспериментальные результаты измерения нагрузки на верхнюю и нижнюю шейку, как функцию от положения задней стенки 284 по отношению к магнитам 150. Эффективное расположение задней стенки 284 настраивается на основании различного расположения шайб 282 и толщины самой задней стенки 284. Как проиллюстрировано, предпочтительный вариант реализации содержит одну заднюю стенку 284, размещенную на расстоянии около 6 мм от двигателя с применением шайбы 282 толщиной 1,5 мм. Основываясь на величине желаемой или допустимой нагрузки на верхний и нижний подшипники, могут быть применены другие комбинации задней стенки и шайбы. Аналогично, на ФИГ. 4Н проиллюстрирован график осевой нагрузка на верхний и нижний подшипники, как функция от верхнего зазора 540 между крыльчаткой 140 и верхним корпусом 135, при работе насоса 25 со скоростью около 4000 об/мин.
[0124] Электрический кабель 120 (см. ФИГ. 1) проходит через проходное отверстие 230 в нижней части крышки крыльчатки 165 к камере электрической обмотки 220 и обмоткам 210. Электрическая энергия, подводимая к обмоткам 210 через электрический кабель 120, генерирует вращающее магнитное поле, которое воздействует на магниты 150, вызывая вращение магнитов и крыльчатки 140, соединенной с магнитами. Вращение крыльчатки заставляет лопатки крыльчатки 235 воздействовать на жидкость (то есть кровь), находящуюся в камере крыльчатки, что приводит к возникновению движущей силы, передаваемой жидкости, которая трансформируется в повышенное давление в выпускном канале жидкости 200. По этой причине, жидкость, всасываемая во впускное отверстие 110 с низким давлением, и выходит через выпускное отверстие 115 с повышенным давлением.
[0125] Как проиллюстрировано на ФИГ. 3А-4В, ось вращения крыльчатки 140, магнитов 150 и защитного корпуса 155 совпадает с осью крыльчатки 145. Как проиллюстрировано на ФИГ. 5А-В, ось крыльчатки 145 шарнирно поддерживается (то есть удерживается от свободного отклонения от оси вращения) с помощью верхней шейки подшипника 130 и нижней шейки подшипника 160. Верхняя шейка подшипника 130 помещена и удерживается в цилиндрическом углублении 240 в крышке впускного отверстия 125, при этом нижняя шейка подшипника 160 помещена и удерживается в цилиндрическом углублении 245 в нижней крышке крыльчатки 165. Ось крыльчатки 145 проходит через центральное цилиндрическое отверстие 250 в крыльчатке 140 и зафиксирована в нем.
[0126] В одном варианте реализации узла крыльчатки ось крыльчатки 145, верхняя шейка подшипника 130 и нижняя шейка подшипника 160 изготовлены из оксида алюминия высокой чистоты (Al2O3), например, CoorsTek® AD-998. В другом варианте реализации узла крыльчатки, ось крыльчатки 145, верхняя шейка подшипника 130 и нижняя шейка подшипника 160 выполнены из карбида кремния, армированного нитевидными кристаллами оксида алюминия, например, Greenleaf® WG-300. В еще одном варианте реализации изобретения, ось крыльчатки 145, верхняя шейка подшипника 130 и нижняя шейка подшипника 160 изготовлены из двуокиси циркония (ATZ), усиленного оксидом алюминия, который способен сделать подшипник более износоустойчивым, чем подшипник, изготовленный из оксида алюминия. За счет изготовление компонентов подшипника из ATZ можно также получить на выходе более гладкую финишную поверхность, чем у компонентов подшипника, выполненных из оксида алюминия. Во всех трех вариантах реализации изобретения, размеры оси крыльчатки 145, верхней шейки подшипника 130 и нижней шейки подшипника 160 разработаны для ограничения контактной нагрузки до допустимого уровня для оксида алюминия высокой чистоты, карбида кремния, армированного нитевидными кристаллами оксида алюминия или ATZ, соответственно, учитывая, что максимальная кратковременная нагрузка формируется гидростатическими силами и ударными нагрузками. В другом варианте реализации узла крыльчатки, ось крыльчатки 145 выполнен из карбида кремния, армированного нитевидными кристаллами оксида алюминия, например, Greenleaf® WG-300 или из оксида алюминия высокой чистоты, например, CoorsTek® AD-998, при этом верхняя шейка подшипника 130, нижняя шейка подшипника 160, или обе шейки выполнены из полиэтилена 130 сверхвысокой молекулярной массы. В различных других вариантах реализации изобретения, части полностью вся верхняя шейка подшипника и нижняя шейка подшипника 160 могут быть выполнены из полиэтилена. Дополнительно, геометрия каждого компонента узла крыльчатки выбирается таким образом, чтобы ограничить усталость и износ конструкции для удовлетворения требованиям безопасности и износостойкости системы 10. Были проведены несколько исследований для иллюстрации превосходных характеристик износостойкости ATZ в течение экспериментального срока службы насоса 25, в результате которых наблюдалось меньшее изменение общей высоты обоймы подшипника в сравнении с системами подшипников, содержащих оксид алюминия и полиэтилен.
[0127] Как проиллюстрировано на ФИГ. 6А-7В, ось крыльчатки содержит верхнюю полусферическую выпуклую поверхность контакта подшипника 255 и нижнюю полусферическую выпуклую поверхность контакта подшипника 260. Как проиллюстрировано на ФИГ. 6А, 6В и 8А, один вариант реализации оси крыльчатки имеет общую длину L1, равную около 10,15 мм, плюс или минус 0,05 мм и диаметр оси D1, равный около 2 мм, плюс или минус около 0,01 мм. Верхняя поверхность контакта подшипника 255 имеет радиус R1, равный около 0,61 мм, плюс или минус 0,02 мм и имеет выступающую часть длиной L2 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм. Нижняя поверхность контакта подшипника 260 имеет радиус R2, равный около 0,31 мм, плюс или минус 0,02 мм и имеет выступающую часть длиной L21 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм. Аналогично, альтернативный вариант реализации оси крыльчатки 145, как проиллюстрировано на ФИГ. 7А, 7В и 8В, имеет общую длину L1, равную около 10,15 мм, плюс или минус 0,05 мм, и диаметр оси D1, равный около 2 мм, плюс или минус около 0,01 мм. Верхняя поверхность контакта подшипника 255 имеет радиус R1, равный около 0,31 мм, плюс или минус 0,02 мм и имеет выступающую часть длиной L2 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм. Нижняя поверхность контакта подшипника 260 имеет радиус R2, равный около 0,31 мм, плюс или минус 0,02 мм, и имеет выступающую часть длиной L21 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм. На основании размеров и требований к рабочим характеристикам насоса могут применяться и другие размеры и размерности. За счет размеров, получаемый в результате насос, может применяться внутри пациента для увеличения диаметра сосудов.
[0128] Аналогично, альтернативный вариант реализации оси крыльчатки 145, как проиллюстрировано на ФИГ. 7А, 7В и 8В, имеет общую длину L1, равную около 10,15 мм, плюс или минус 0,05 мм, и диаметр оси D1, равный около 2 мм, плюс или минус около 0,01 мм. Верхняя поверхность контакта подшипника 255 имеет радиус R1, равный около 0,31 мм, плюс или минус 0,02 мм, и имеет выступающую часть длиной L2 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм. Нижняя поверхность контакта подшипника 260 имеет радиус R2 около 0,31 мм, плюс или минус 0,02 мм, и имеет выступающую часть длиной L21 после прилегающего выступа 265, равную около 0,55 мм, плюс или минус 0,02 мм.
[0129] Как понятно, исходя из ФИГ. 8C-8G, еще один вариант реализации оси крыльчатки 145 содержит верхнюю полусферическую выпуклую поверхность контакта подшипника 255 и нижнюю полусферическую выпуклую поверхность контакта подшипника 260. На ФИГ. 8D и 8Е проиллюстрирована горизонтальная проекция верхней полусферической поверхности контакта подшипника 255 и нижняя полусферическая поверхность контакта подшипника 260, соответственно, рассматриваемая по направлению к продольной оси крыльчатки 145. На ФИГ. 8F и 8G проиллюстрирован вид крупным планом нижней полусферической поверхности контакта подшипника 260 и верхняя полусферическая поверхность контакта подшипника 255, соответственно. Как проиллюстрировано на ФИГ. 8С, один вариант реализации оси крыльчатки имеет общую длину L1, равную около 10,45 мм, плюс или минус 0,05 мм, и диаметр оси D1, равный около 1,5 мм, плюс или минус около 0,005 мм. Верхняя поверхность контакта подшипника 255 имеет радиус R1, равный около 0,6 мм, плюс или минус 0,02 мм, и имеет выступающую часть длиной L2 после начала схождения на конус 266, равную около 1,4 мм, плюс или минус 0,10 мм. Начало схождения на конус 266 имеет радиус R3, равный около 0,20 мм, плюс или минус 0,02 мм, при этом поверхность 267 оси крыльчатки имеет конусность, направленную внутрь по всей длине L2 с углом наклона СА1, равным около 20 градусам. Нижняя поверхность контакта подшипника 260 имеет радиус R2, равный около 0,60 мм, плюс или минус 0,02 мм, и имеющий выступающую часть длиной L21 после начала схождения на конус 268, равную около 0,5 мм, плюс или минус 0,10 мм. Начало схождения на конус 268 имеет радиус R4, равный около 0,05 мм, при этом поверхность 267 оси крыльчатки имеет конусность, направленную внутрь по всей длине L21 с углом наклона СА2, равным около 90 градусам.
[0130] Как понятно, исходя из ФИГ. 5А и 5В, верхняя шейка подшипника 130 и нижняя шейка подшипника 160 обычно имеют одинаковую конфигурацию, однако противоположно ориентированы. Как проиллюстрировано на ФИГ. 9А-В, верхняя шейка подшипника 130 и нижняя шейка подшипника 160 имеют форму чаши или полусферическую вогнутую поверхность контакта подшипника 270 с одного конца и, как правило, плоскую поверхность 275 с противоположного конца. Аналогично, на ФИГ. 10 проиллюстрирован частный вариант реализации верхней шейки подшипника 130, которая имеет форму чаши или полусферическую вогнутую поверхность контакта подшипника 270 с одного конца и, как правило, плоскую поверхность 275 с противоположного конца. В данном варианте реализации изобретения, полусферическая вогнутая поверхность контакта подшипника 270 верхней шейки подшипника 130 имеет больший радиус, чем вогнутая поверхность контакта подшипника на нижней шейке подшипника 160.
[0131] На ФИГ. 11А проиллюстрирован один вариант реализации шейки подшипника 130, 160, имеющий общую длину L3, равную около 7,5 мм, плюс или минус 0,1 мм, минимальный диаметр оси D2, равный около 2 мм, плюс или минус 0,01 мм, и радиус, равный около 0,6 мм у грани, рядом с поверхностью контакта подшипника 270. Возле конца 275, который не является поверхностью контакта подшипника 130, 160, паз 280 проходит по окружности оси для обеспечения механической блокировки при сборке шейки подшипника по месту, внутри перфузионного насоса 25. Аналогично, альтернативный вариант шейки подшипника 130, 160, проиллюстрированный на ФИГ. 11В, имеет общую длину L3, равную около 7,5 мм, плюс или минус 0,1 мм, минимальный диаметр оси D2, равный около 3 мм, плюс или минус 0,01 мм, и радиус, равный около 0,2 мм у грани, рядом с плоским концом 275. Вблизи конца, который не является поверхностью контакта подшипника 130, 160, паз 280 проходит по окружности оси для обеспечения механической блокировки при сборке шейки подшипника по месту. В зависимости от размеров насоса, могут применяться другие размер и размерности, материалы шеек подшипников, а также силы, воздействующие на шейки подшипников.
[0132] Как понятно, исходя из ФИГ. 3В, 4В и 5А-11В, выпуклая поверхность верхней поверхности контакта подшипника 255 оси крыльчатки 145 получена симметрично относительно оси вращения в противоположность вогнутой поверхности 270 верхней шейки подшипника 130, а выпуклая поверхность нижней поверхности контакта подшипника 260 оси крыльчатки 145 получена симметрично относительно оси вращения в противоположность вогнутой поверхности контакта подшипника 270 нижней шейки подшипника 160. По этой причине, выпуклые концы подшипников 255, 260 оси крыльчатки 145 имеют шарнирные упоры за счет сопрягаемых вогнутых поверхностей контакта подшипника 270 верхней и нижней шейки подшипника 130 и 160 соответственно. Соответственно, узел крыльчатки способен свободно вращаться в камере крыльчатки 205 на оси крыльчатки 145, которая поддерживается с обоих концов с помощью шеек подшипника 130 и 160, в конфигурации, общеизвестной как "двухконтактный подшипник".
[0133] Как понятно, исходя из ФИГ. 11С-11F, еще один вариант реализации шейки подшипника 130, 160 имеет общую длину L3, равную около 7,5 мм, плюс или минус 0,1 мм, минимальный диаметр оси D2, равный около 2,0 мм, плюс или минус 0,01 мм. Конец подшипника 271 имеет радиус R5, равный около 0,3 мм у грани, рядом с поверхностью контакта подшипника 270. Возле конца 275, который не является поверхностью контакта подшипника 130, 160, группа пазов 281 проходит по окружности оси для обеспечения механической блокировки при сборке шейки подшипника по месту, внутри перфузионного насоса 25. Группа пазов 281 может быть задана одним или более канавкой 283, имеющей радиус R6 около 0,20 мм и плоский участок 285, имеющий радиус кромки R7 около 0,03 мм. Поперечное расстояние V1 каждой канавки составляет около 0,5 мм, при этом поперечное расстояние Р1 плоского участка 285 равно около 0,3 мм. Шейки подшипника 130 и 160 также могут содержать вырез 286, имеющий диаметр D3, равный около 0,8 мм, плюс или минус 0,01 мм, и длину L4, равную около 2,0 мм, как проиллюстрировано в разрезе на ФИГ. НЕ. На ФИГ. 11D проиллюстрирован вид сверху на поверхность контакта подшипника 270, рассматриваемая вдоль продольной ось шейки подшипника 130, 160. Поверхность контакта подшипника 270 может иметь радиус R8, равный около 0,65 мм, плюс или минус 0,01 мм, и глубину L5, равную около 0,3 мм, как проиллюстрировано в разрезе на ФИГ. 11F.
[0134] В еще одном варианте реализации узла крыльчатки узел крыльчатки может представлять собой сборный механизм, состоящий из оси крыльчатки 145, верхней шейки подшипника 130 и нижней шейки подшипника 160. Разработка сборного механизма целесообразно в отношении простоты, пределов погрешностей и стоимости обработки деталей компонентов подшипника. Все эти конструкции разработаны для того, чтобы обеспечить непрерывную работу двигателя в течение определенного времени, от около одного дня до 1-12 недель или больше, без поломки механизма.
[0135] Как проиллюстрировано на ФИГ. 12, ось крыльчатки 145 содержит корпус оси крыльчатки 146 и два вкладыша 147. Корпус ось крыльчатки 146 содержит металл, поддающийся механической обработке, например, нержавеющую сталь, а вкладыши оси крыльчатки 147 содержат оксид алюминия высокой чистоты (Al2O3), например, CoorsTek. AD-998, карбид кремния, усиленный нитевидными кристаллами оксида кремния, например, Greenleaf WG-300, или двуокись циркония (ATZ), усиленную оксидом алюминия. Вкладыши оси крыльчатки 147 прикреплены к корпусу оси крыльчатки 146 с помощью клеящего вещества и/или за счет посадки с натягом. Дополнительно, полость 146А может быть заполнена клеящим веществом или другой заливочной массой, способной выдерживать давление. Упомянутая выше конфигурация сборного механизма и применяемые материалы могут применяться для варианта реализации обоих, верхней и нижней, шеек подшипника 130 и 160, при этом вкладыши шейки подшипника 148 входят в зацепление с вкладышами оси крыльчатки 147. Дополнительно, полости 148А для каждой шейки подшипника 130 и 160 могут быть заполнены клеящим веществом или другой заливочной массой, способной выдерживать давление.
[0136] Крышка впускного отверстия 125 и ее впускной канал 180 могут иметь различные конфигурации, в зависимости от варианта реализации перфузионного насоса 25. Например, крышка впускного отверстия 125, проиллюстрированная на ФИГ. 2, проиллюстрирована как совпадающая по протяженности с крышкой крыльчатки 135. В другом варианте реализации изобретения крышка впускного отверстия 125 может быть значительно меньше и не совпадать по размеру с верхней крышкой крыльчатки 135, как проиллюстрировано на ФИГ. 13-15, где проиллюстрирован вид крышки впускного отверстия и крышка крыльчатки.
[0137] Как проиллюстрировано на ФИГ. 14-16, где, соответственно, проиллюстрированы поперечные разрезы, взятые вдоль оси разреза 14-14, 15-15 и 16-16 на ФИГ. 13, впускное отверстие 110 имеет конструкцию из двух частей, имеющую часть 110А и 110В, которые вместе образуют приблизительно половину впускного отверстия 110 и, соответственно, часть крышки впускного отверстия 125 и верхней крышки крыльчатки 135. Каждая часть 110А и 110В образуют, при этом, приблизительно половину впускного канала 180. Как проиллюстрировано на ФИГ. 14, впускной канал 180 изначально имеет круглый диаметр D5 около 4 мм. Как проиллюстрировано на ФИГ. 15, впускной канал 180 проходит от кругового сечения к прямоугольному сечению, имеющему ширину W5, равную около 8,4 мм, и высоту Н5, равную около 1,5 мм. В свою очередь, при изменении размеров будут внесены изменения в списки размерностей.
[0138] Как проиллюстрировано на ФИГ. 16, впускной канал 180 окружает впускное дроссельное отверстие 185 камеры крыльчатки, которое проходит вокруг верхней шейки подшипника 145, установленной и зафиксированной в крышке впускного отверстия 125. Как проиллюстрировано на ФИГ. 17, на которой изображен изометрический разрез впускного дроссельного отверстия 185 камеры крыльчатки, впускное дроссельное отверстие 185 камеры крыльчатки ведет к камере крыльчатки 205 рядом с областью впускного отверстия 300 крыльчатки 140. Верхний конец подшипника оси крыльчатки 145 проходит вверх через впускное дроссельное отверстие 185, образуя шарнирное соединение с верхней шейкой подшипника 130, закрепленной в крышке впускного отверстия 125. Лопатки крыльчатки 235 проходят радиально наружу от области впускного отверстия 300 крыльчатки 140.
[0139] Как проиллюстрировано на ФИГ. 18А и 18В, на которых проиллюстрирована, соответственно, горизонтальная проекция части крышки впускного отверстия 110А, определяющая впускной канал 180 и ее вид сбоку, в одном варианте реализации изобретения можно сказать, что впускной канал 180 имеет эллиптическую форму. В конкретном случае цилиндрическая часть канала 180А переходит в часть 180С и затем в эллиптическую часть 180В. Цилиндрическая часть секции или посадочное место 305, удерживающая верхнюю шейку подшипника 130, как правило, находится в центре эллиптической части канала 180В и содержит цилиндрическое отверстие 240, в котором размещается верхняя шейка подшипника 130, аналогично проиллюстрированному на ФИГ. 17. В одном варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6 около 4 мм. Эллиптическая часть канала 180 В имеет ширину W6 около 12,4 мм. Наружное расстояние W7 между стенкой посадочного места 305 и наружным концом стенки, определяющей эллиптическую часть канала 180В, равно около 1,5 мм. В другом варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6 около 5 мм или 6 мм.
[0140] Как проиллюстрировано на ФИГ. 19А и 19В, на которой изображены такие же горизонтальные проекции, как и на ФИГ. 18А и 18В, исключая другой вариант реализации, можно сказать, что впускной канал 180 имеет круглую конфигурацию. В конкретном случае, цилиндрическая часть канала 180А переходит в часть 180С и затем в круглую часть 180В. Цилиндрическая часть секции или посадочное место 305, удерживающая верхнюю шейку подшипника 130, как правило, находится в центре круглой части канала 180 В и содержит цилиндрическое отверстие 240, в котором размещается верхняя шейка подшипника 130, аналогично проиллюстрированному на ФИГ. 17. В одном варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6, равный около 3,5-4,5 мм, предпочтительно 4 мм. Круглая часть канала 180 В имеет ширину W9, равную от около 11,5 мм до 13 мм, предпочтительно 12,4 мм. Наружное расстояние W10 между стенкой посадочного места 305 и наружным концом стенки, определяющей круглую часть канала 180 В, равно от около 3,5 мм до 4,5 мм, предпочтительно 4,2 мм. В другом варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6 около 5 мм или 6 мм.
[0141] Как проиллюстрировано на ФИГ. 20А и 20В, на которой изображены такие же горизонтальные проекции, как и на ФИГ. 18А и 18В, исключая другой вариант реализации, можно сказать, что впускной канал 180 имеет комплексную арочную конфигурацию. В конкретном случае, цилиндрическая часть канала 180А переходит в часть 180С и затем в комплексную арочную часть 180 В. Цилиндрическая часть секции или посадочное место 305, удерживающая верхнюю шейку подшипника 130, как правило, находится в центре комплексной арочной части канала 180В и содержит цилиндрическое отверстие 240, в котором размещается верхняя шейка подшипника 130, аналогично проиллюстрированному на ФИГ. 17. В одном варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D12 около 4 мм. Комплексная арочная часть 180 В имеет ширину W13 около 8,4 мм. Наружное расстояние W14 между стенкой посадочного места 305 и наружным концом свода 307 стенки, образованной комплексной арочной частью канала 180В, равно около 1,75 мм. Наружное расстояние W15 между стенкой посадочного места 305 и наружным концом углубления 310 стенки, образованной комплексной арочной частью канала 180В, равно от около 0,5 мм до 1,5 мм, предпочтительно 1 мм. В других вариантах реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6 около 5 мм или 6 мм.
[0142] Как проиллюстрировано на ФИГ. 21-23, на которых проиллюстрирована такая же проекция, как и на ФИГ. 18А, исключая три другие варианта реализации изобретения, можно сказать, что впускной канал 180 имеет каплевидную конфигурацию. В конкретном случае, цилиндрическая часть канала 180А входит в каплевидную часть канала 180В. Цилиндрическая часть секции или посадочное место 305, удерживающая верхнюю шейку подшипника 130, как правило, находится в центре каплевидной части канала 180В и содержит цилиндрическое отверстие 240, в котором размещается верхняя шейка подшипника 130, аналогично проиллюстрированному на ФИГ. 17. В одном варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D15 около 4 мм. Каплевидная часть канала 180 В имеет ширину W20 около 8 мм. Посадочное место 305 имеет диаметр D16, равный 4 мм. Переходная зона 180С канала 180 между каплевидной частью 180В и цилиндрической частью 180А имеет стенки, которые отклонены друг от друга на угол AN1 около 8 градусов. В другом варианте реализации изобретения цилиндрическая часть канала 180А имеет диаметр D6 около 5 мм или 6 мм.
[0143] Для варианта реализации изобретения на ФИГ. 21 наружное расстояние W21 между стенкой посадочного места 305 и наружным концом стенки, образованной каплевидной частью канала 180В равно около 2 мм. Для варианта реализации изобретения на ФИГ. 22, наружное расстояние W21 между стенкой посадочного места 305 и наружным концом стенки, образованной каплевидной частью канала 180В, равно около 1 мм. Для варианта реализации изобретения на ФИГ. 23, наружное расстояние W21 между стенкой посадочного места 305 наружным концом стенки, образованной каплевидной частью канала 180В, равно около 0 мм, так как посадочное место 305 примыкает к наружному краю стенки, образованной каплевидной частью канала.
[0144] Как проиллюстрировано на ФИГ. 24А и 24В, на которых, соответственно, изображен вид сверху и вертикальная боковая проекция другого варианта реализации крышки впускного отверстия 110 и впускного канала 180, аналогично описанному на ФИГ. 21, дугообразная клиновидная часть 320 имеет выступ между наружной стенкой каплевидной части канала 180В и наружной стороной посадочного места 305. В этом варианте реализации изобретения, цилиндрическая часть секции или посадочное место 305, как правило, находится в центре каплевидной части канала 180 В и содержит цилиндрическое отверстие 240, в котором размещается верхняя шейка подшипника 130, аналогично проиллюстрированному на ФИГ. 17. В одном варианте реализации изобретения конфигурация размерностей варианта реализации изобретения, проиллюстрированная на ФИГ. 24А и 24В, в основном аналогична конфигурации, обсужденной в отношении ФИГ. 21, значимые различия присутствуют в реализации дугообразной клиновидной части 320. Как понятно, исходя из ФИГ. 24А и 24В, клиновидная часть 320 имеет стенки, которые изогнуты в виде плавной кривой от крышки и сопряженной стенки каплевидной части канала 180В к вертикальному продолжению посадочного места 305. Такую клиновидную часть 320 можно было наблюдать в варианте реализации изобретения, проиллюстрированном на ФИГ. 3А, 3В и 17, и она позволяет снижать торможение потока жидкости во впускном канале и способствует направлению по касательной приточной жидкости через впускное дроссельное отверстие 185 камеры крыльчатки.
[0145] Как проиллюстрировано на ФИГ. 25, на которой изображен изометрический вид перфузионного насоса со снятой крышкой крыльчатки, для демонстрации крыльчатки 140, размещенной в камере крыльчатки 205, выпускной канал жидкости 200 выходит из камеры крыльчатки, в основном по касательной, к наружному круговому краю крыльчатки. Как проиллюстрировано на ФИГ. 3В, 4В, 17 и 25, множество приливных отверстий 350 (то есть промывочных отверстий) размещены по окружности вокруг центрального отверстия 250 оси крыльчатки, и приливные отверстия 350, как правило, параллельны центральному отверстию 250 и увеличивают сквозную толщину крыльчатки для просвета на верхней и нижней границе крыльчатки. Нижние просветы приливных отверстий 350 расположены рядом с нижней границей подшипника, между нижним подшипником 165 и нижней поверхностью контакта подшипника 260 оси крыльчатки (см. ФИГ. 8). В результате, жидкость протекает через приливные отверстия 350 для очистки нижней границы подшипника. Например, жидкость моет протекать через отверстие на впуске 185 камеры крыльчатки, радиально наружу вдоль лопаток крыльчатки 235, через зазор 542 под крыльчаткой, а затем обратно к области отверстия на впуске 185 камеры крыльчатки. Это поток крови служит для очистки нижней стороны крыльчатки, нижней границы подшипника, верхней границы подшипника и области позади посадочного места 305.
[0146] Как понятно, исходя из ФИГ. 3В, 5, 17 и 25, в одном варианте реализации изобретения крыльчатка 140 удерживается с возможностью вращения в камере крыльчатки 205 на валу 145, проходящем через центр крыльчатки. Вал имеет верхний конец подшипника и нижний конец подшипника, каждый конец выполнен с возможностью вращения и соединен с корпусом насоса. Крыльчатка имеет верхнюю сторону и нижнюю сторону, а также множество приливных отверстий 350, проходящих через крыльчатку от верхней стороны к нижней стороне. Множество приливных отверстий, как правило, равномерно распределены радиально вокруг центра крыльчатки. Кроме того, множество приливных отверстий 350, проходящих через крыльчатку, как правило, параллельны друг другу и валу. Впускной канал 180 ведет к впускному дроссельному отверстию 185 камеры крыльчатки. Отверстия впускного канала сообщаются с камерой крыльчатки, как правило, перпендикулярно к впускному каналу. Впускное дроссельное отверстие проходит по меньшей мере часть наружной периферической поверхности вала, рядом с верхним концом подшипника. Впускное дроссельное отверстие и полости направлены, как правило, параллельно друг другу. Во время работы насоса по меньшей мере часть прокачиваемой крови через камеру крыльчатки циркулирует вдоль верхней и нижней поверхности крыльчатки через приливные отверстия. По этой причине приливные отверстия крыльчатки исключают протекание через заглушенные участки вокруг крыльчатки, в основном, за счет протекания крови вдоль всей поверхности контакта крыльчатки с кровью. Соответственно, приливные отверстия помогают предотвратить накопление крови в зоне пересечения вала/крыльчатки и вдоль боковых сторон и нижней поверхности крыльчатки.
[0147] В различных вариантах реализации изобретения, зазор между верхней стороной крыльчатки 140 и верхней крышкой крыльчатки 135 находится в диапазоне от 0,05 мм до 0,3 мм, с предпочтительным вариантом реализации в диапазоне от 0,075 мм до 0,125 мм. Несмотря на противоположное мнение, было установлено, что маленький зазор между верхней стороной крыльчатки 140 и верхней крышкой 135 является предпочтительным, так как это дает преимущественные свойства гидродинамического потока крови, протекающей вокруг крыльчатки, что снижает осевую нагрузку, прикладываемую к верхнему подшипнику, что, в некоторых случаях, может выполнять функцию гидродинамического подшипника, и может также заменить верхний подшипник или может дополнять верхний подшипник. Гидродинамический подшипник эффективно формируется за счет верхней поверхности лопаток 235 крыльчатки с малым зазором между верхней стороной крыльчатки 140 и верхней крышкой крыльчатки 135, снижающим нагрузку и, таким образом, износ верхней шейки подшипника. В результате, насос 25 может работать в течение более длительного периода времени без необходимости замены подшипников. В качестве примера, как проиллюстрировано на ФИГ. 4G, общая площадь поверхности верхней части лопаток крыльчатки 235, проиллюстрированная в общем случае, как 237, образует собой гидродинамический
подшипник, имеющий площадь в диапазоне от около 70 мм2 до около 120 мм2. В одном варианте реализации изобретения общая площадь поверхности лопаток крыльчатки 235, образующая собой гидродинамический подшипник, равна около 96 мм. В этом варианте реализации изобретения приблизительная площадь верхней поверхности ротора, за исключением центральных и промывочных отверстий, с удаленными лопатками, равна около 677,7 мм2. В связи с этим, если площадь верхних частей лопаток равна около 96,1 мм2, то около 14% площади поверхности используется для образования гидродинамического подшипника. В другом варианте реализации изобретения может применяться большее соотношение, такое как 20% или меньшее соотношение, например, 10% или менее от площади поверхности крыльчатки, для образования гидродинамического подшипника.
[0148] В различных вариантах реализации изобретения зазор 542 между нижней стороной крыльчатки и нижней крышкой крыльчатки 165 находится в приблизительном диапазоне от около 0,1 мм до 0,5 мм, с предпочтительным вариантом реализации, имеющем зазор в приблизительном диапазоне от около 0,2 мм до 0,35 мм. Больший зазор 542 между нижней стороной крыльчатки 140 и нижней крышкой крыльчатки 165 является предпочтительным, так как это улучшает промывку нижнего подшипника и снижает срезающее давление на стенку сосуда в крови в нижнем зазоре.
В различных вариантах реализации изобретения, достигается баланс между нижним расчетным режимом потока и широкой пропускной способностью системы перфузионного насоса. Указанные диапазоны верхнего и нижнего зазора корпуса ротора позволяют одновременно добиться гидравлической эффективности системы, снизить себестоимость производства, избежать нарушения крови и выполнить требования к сроку службы. Это было проверено с помощью различных исследований реальных рабочих прототипов, путем лабораторных ресурсных испытаний, продемонстрировавших пренебрежимо малый износ подшипников в течение 6 недель и исследований в организме, показавших резкую дилатацию вен в течение 9 дней обработки без клинически значимого гемолиза.
[0149] Корпус и крыльчатка перфузионного насоса 25, включая поверхности, контактирующие с кровью, сделаны из жестких, биологически совместимых материалов. Предпочтительные варианты содержат лекарственные формовочные пластики, например, поликарбонат и полиэфирэфиректон (РЕЕК). В различных вариантах реализации изобретения, поверхности перфузионного насоса 25, контактирующие с кровью, могут содержать Ti6Al4V, Ti6Al7Nb или другие сплавы технически чистого титана. В одном варианте реализации изобретения поверхность компонентов насоса, подвергающиеся воздействию крови пациента, могут иметь антитромботическое покрытие. Например, поверхности полостей могут быть покрыты Astute®, антитромботическим покрытием на основе гепарина компании Biolnteractions Ltd., или Applause™, покрытие на основе гепарина компании SurModics, Inc.
[0150] В других вариантах реализации изобретения, поверхность компонентов системы перфузионного насоса, контактирующие с тканями пациента, могут иметь антимикробное покрытие. Например, внешняя поверхность синтетических соединительных трубок 16 и 18, или внешняя поверхность насоса или кабеля питания 120 (который также известен под названием "электропровод") могут быть покрыты Avert®, поверхностно-активным антимикробным покрытием компании Biolnteractions Ltd.
[0151] В различных вариантах реализации изобретения перфузионный насос 25 может быть имплантирован внутрь пациента. В свою очередь, в другом варианте реализации изобретения перфузионный насос 25 может оставаться внешним устройством для пациента. Например, при внешнем расположении по отношению к пациенту, перфузионный насос 25 может крепиться к пациенту с применением ленты, хирургической нити, или другим подходящим способом фиксации насоса к пациенту. Система 10 может питаться от различных носимых электронных приборов, имеющих перезаряжаемые батареи 28, как проиллюстрировано на ФИГ. 34.
[0152] Насос для системы перфузионного насоса 10, описанный в данном документе, может быть роторным насосом, включая, к примеру, центробежный насос, осевой насос, радиально-осевой насос или насос смешанного типа. Как проиллюстрировано на ФИГ. 1-15, в одном варианте реализации изобретения насос представляет собой насос центробежного типа. Без учета специфических ограничений, перфузионный насос 25, к примеру, может быть выполнен с возможностью прокачивания в обычном режиме от около 0,05 до 1,5 литра/мин, от 0,1 до 1,5 литра/мин, или от 0,5 до 3,0 литра/мин.
[0153] Тогда как конфигурация насоса, обсуждаемая выше в соответствии с ФИГ. 1-25 является преимущественной, для устройства и способа перфузионного насоса, описанного в данном документе, могут применяться другие конфигурации насоса. Соответственно, устройство и способы, описанные в данном документе, не ограничивают конфигурацию насоса, обсуждаемого выше в соответствии с ФИГ. 1-25, однако могут включать все типы насосов, применяемых для устройства и способов, описанных в данном документе.
[0154] Предпочтительный вариант реализации системы перфузионного насоса 10, описанный в данном документе в соответствии с ФИГ. 1-25, удовлетворяет нескольким уникальным требованиям, которым не удовлетворяют никакие другие системы перфузионных насосов, известные в данной области техники. В конкретном случае, система насоса артериовенозной фистулы ("АВФ") ("AFE System") может быть настроена для работы до 12 недель при применении по назначению. Кроме того, система насоса AFE может быть настроена как система центробежного роторный перфузионного насоса для низкой величины расхода потока (например, от 50 до 1500 мл/мин) и среднего диапазона давлений (например, от 25 до 350 миллиметров ртутного столба).
[0155] Схема управления, применяемая с системой насоса AFE, может быть оптимизирована для поддержания постоянного и повышенного значения WSS от 0,76 до 23 Па, или, более предпочтительно, от 2,5 Па до 10 Па, в заданных венах, имеющих прямое жидкостное соединение с перфузионным насосом или соединительными трубками системы перфузионного насоса, или заданных венах, которые имеют прямое жидкостное соединение с веной, имеющей прямое жидкостное соединение с перфузионным насосом или соединительными трубками системы перфузионного насоса. С этой схемой управления, система AFE выполнена с возможностью работы в течение определенного периода времени, достаточному для общего постоянного увеличения диаметра и просвета целевой вены на 25%, 50%, 100% или более, применяя измерение рабочих параметров и периодическую регулировку скорости. Схема управления, применяемая с системой насоса AFE, может быть оптимизирована для поддержания постоянного давления в сегменте выпускных соединительных трубок, рядом с целевой веной, в диапазоне от 10 миллиметров ртутного столба до 350 миллиметров ртутного столба, предпочтительно, в диапазоне от 25 миллиметров ртутного столба до 100 миллиметров ртутного столба. С этой схемой управления, система AFE выполнена с возможностью работы в течение определенного периода времени, достаточному для общего постоянного увеличения диаметра и просвета целевой вены на 25%, 50%, 100% или более, применяя измерение рабочих параметров и периодическую регулировку скорости.
[0156] Для определенного варианта реализации изобретения, приточные соединительные трубки могут быть размещены за счет чрескожного доступа, с внутрисосудистым размещением части приточной соединительной трубки и выпускная соединительная трубка может быть размещена за счет хирургического доступа, приспособленного для начального диаметра вен, равного 1-6 мм. При таком положении, повышенное значение WSS в заданном кровеносном сосуде получается за счет выпуска крови в целевой кровеносный сосуд.
[0157] Для другого варианта реализации изобретения, выпускные соединительные трубки могут быть размещены за счет чрескожного доступа, с внутрисосудистым размещением части выпускной соединительной трубки и приточная соединительная трубка может быть размещена за счет хирургического доступа, приспособленного для начального диаметра вен или артерий, равного 1-6 мм. При таком положении, повышенное значение WSS в целевом кровеносном сосуде получается за счет выпуска крови из целевого кровеносного сосуда. В определенных вариантах, WSS может быть повышено в обоих кровеносных сосудах, из которых кровь откачивается и кровеносных сосудах, куда кровь выпускается, делая оба кровеносных сосуда целевыми кровеносными сосудами. Система насоса 10 обеспечивает как простоту установки/удаления, так и сопротивляемость к инфекциям. Система насоса 10 представляет собой переносную систему с насосом, то есть адаптированную как для имплантации, так и для экстракорпорального размещения. В различных вариантах реализации изобретения, система насоса 10 питается от носимых электронных устройств с перезаряжаемыми батареями.
[0158] Система насоса 10 содержит приточные соединительные трубки 20 и выпускные соединительные трубки 30, как проиллюстрировано на ФИГ. 26. Приточные соединительные трубки 20 размещаются в жидкостном взаимодействии с одним местом в сосудистой системе для забора крови из этого места и переноса ее к перфузионному насосу 25. В некоторых вариантах реализации изобретения, приточные соединительные трубки 20 выполнены с возможностью размещения по меньшей мере части приточных соединительных трубок внутри просветов сосудистой системы. В другом варианте реализации изобретения приточная соединительная трубка 20 подключена к кровеносному сосуду с помощью хирургического анастомоза. Выпускная соединительная трубка 30 выполнена с возможностью создания жидкостного соединения с другим местом в сосудистой системе и направлению крови от перфузионного насоса 25 к другим местам в сосудистой системе. В некоторых вариантах реализации изобретения, приточные соединительные трубки 20 выполнены с возможностью размещения по меньшей мере части выпускных соединительных трубок внутри просветов сосудистой системы. В другом варианте реализации изобретения выпускная соединительная трубка 30 подключена к кровеносному сосуду с помощью хирургического анастомоза.
[0159] Соединительные трубки 20 и 30 могут каждая иметь длину в диапазоне от 2 см до 110 см и общую комбинированную длину от 4 см до 220 см. Длина каждой соединительной трубки 20 и 30 может быть обрезана до желаемой длины, определяемой с учетом расположения перфузионного насоса 25 и расположения соединений между соединительными трубками и сосудистой системой. Соединительный трубки 20 и 30 также имеют тонкие стенки, но устойчивые к сжатию и излому, которые имеют толщину в диапазоне от 0,5 мм до 4 мм, а также внутренний диаметр в диапазоне от 2 мм до 10 мм. Предпочтительно, внутренний диаметр соединительных трубок составляет от 4 до 6 мм.
[0160] Приточные и выпускные соединительные трубки 20 и 30 могут подключаться к перфузионному насосу 25 с применением любых подходящих коннекторов, то есть надежных, препятствующих протеканию, и не подверженных самопроизвольному отсоединению. Как правило, передняя кромка коннектора является тонкой, для минимизации ступенчатых изменений диаметра тока жидкости между внутренним диаметром соединительных трубок 20 и 30, и внутренним диаметром коннектора. Предпочтительно, ступенчатое изменение диаметра тока жидкости должно быть менее 0,5 мм. В одном варианте реализации изобретения, как проиллюстрировано на ФИГ. 27A-27D, соединительные трубки 20 и 30 подключены к перфузионному насосу 25 с применением бородчатых соединений 400А и 400В, а также радиальных сжимающих стопорных соединений (например, стопорных колец) 402А и 402В. В качестве примера, помимо прочего, в качестве радиальных сжимающих стопорных соединений 402А и 402В могут применяться соединения BarbLock®, производимые компанией Saint-Gobain Performance Plastics, подразделением Saint-Gobain S.A., с головным офисом в Courbevoie, France. В другом варианте реализации изобретения соединительные трубки 20 и 30 подключены к перфузионному насосу 25 с применением стерильных коннекторов Pure-Fit®, также производимых Saint-Gobain Performance Plastics.
[0161] Радиальные сжимающие стопорные соединения 402А и 402В расположены ближнего к насосу конца 404 и 406, соответственно, приточной 20 и выпускной 30 соединительной трубки. Соединительные трубки 20 и 30 затем устанавливаются на бородчатое соединение 400А и 400В для формирования жидкостного соединения между соединительными трубками и перфузионным насосом 25. Конусная зажимная втулка 408А и 408В радиального сжимающего стопорного соединения 402А и 402В расположены вдоль соединительных трубок 20 и 30 для охвата по окружности соединительных трубок и бородчатых соединений 400А и 400В. Колпачки 410А и 410В радиальных сжимающих стопорных соединений 402А и 402В затем сдвигаются вдоль продольной оси соединений для обжимного соединения соответствующих колпачков 408А и 408В, соединительных трубок 20 и 30, а также бородчатых соединений 400А и 400В. В одном варианте реализации изобретения колпачки 410А и 410В сдвигаются с помощью обжимающих инструментов, выполненных с возможностью введения в зацепление колпачков и выступающего основания 412А и 412В бородчатых соединений 400А и 400В, соответственно. Обжимающие инструменты могут также выполняться с возможностью снятия радиальных сжимающих стопорных соединений 402А и 402В.
[0162] В другом варианте реализации изобретения могут применяться альтернативные варианты коннекторов. Предпочтительно, альтернативные варианты коннекторов должны быть надежными, препятствующими протеканию и не подверженных случайному смещению. Например, как проиллюстрировано на ФИГ. 28А-28В, соединительные трубки 20 и 30 вступают в зацепление аналогично бородчатым соединениям 400А и 400В, для формирования жидкостного соединения между соединительными трубками и перфузионным насосом 25. Соединительные трубки 20 и 30 прикрепляются к бородчатым соединениям с применением кольцевых зажимов 414А и 414В, которые прилагают радиальное зажимающее усилие к частям соединительных трубок на бородчатых соединениях, за счет храпового механизма зажимов 416А-416В. Кольцевые зажимы 4141А и 414В обеспечивают защиту от протекания и надежное соединение, которое может быть разобрано с помощью съемных инструментов (не проиллюстрированы), высвобождающих храповые механизмы зажимов 416А-416В.
[0163] В другом варианте реализации изобретения приточная соединительная трубка 20 и выпускная соединительная трубка 30 содержат по меньшей мере один боковой порт 417, как проиллюстрировано на ФИГ. 29А-В, 30А-В и 51А-В, и 52А-В, обеспечивающий контролируемый доступ к потоку жидкости. Боковой порт 417 может применяться периодически для введения контрастных веществ, позволяющих визуализировать часть системы AFE или части сосудистой системы, имеющие жидкостное соединение с соединительными трубками системы AFE, путем флюороскопии. Боковой порт 417 также может применяться для удаления и возврата крови из сосудистой системы пациента во время гемодиализа, плазмофереза, афереза или других клинических показаний, при которых кровь быстро удаляется и возвращается к пациенту. Боковой порт 417 может также применяться для получения образцов крови, для введения лекарственных препаратов или для других практических клинических целей. Любой боковой порт разработан для предоставления периодического доступа к потоку жидкости и не должен протекать или изменять направление потока жидкости, когда в доступе нет необходимости. В качестве примера, помимо прочего, боковой порт 417 может представлять собой "Т"-образное соединение, содержащее обратный клапан, который открывается при введении шприца и закрывается при удалении шприца. Как проиллюстрировано на ФИГ. 29А-В, "Т"-образный узел порта 418 со вспомогательными трубками 420 находятся в жидкостном соединении с выпускным отверстием 115 и выпускной соединительной трубкой 30.
[0164] В другом варианте реализации изобретения боковой порт 417 для приточной соединительной трубки 20, выпускной соединительной трубки 30 или их обеих применяет мембранный порт для доступа 422, имеющий мембрану 424, как проиллюстрировано на ФИГ. 30А-В, через которую, при необходимости, вводится игла шприца для доступа и последующего выведения, после чего мембрана закрывается, предотвращая утечку жидкости из соединительной трубки. Подходящие материалы для мембраны 424, включают, помимо прочего, силикон, полиуретан и другие эластичные полимеры. Сегменты приточной и/или выпускной соединительной трубки 20 и 30, соответственно, которые имеют мембрану 424, имеют подходящую толщину для закрытия гиподермального прокола, когда игла выводится. Как проиллюстрировано на ФИГ. 30А-В, изображен мембранный порт для доступа 422, в котором мембрана 424 выполнена как часть выпускной соединительной трубки 30. В качестве примера, помимо прочего, мембранный порт для доступа 422 может выступать на один сантиметр над выпускной соединительной трубкой 30. Мембрана 424 может прикрепляться к выпускной соединительной трубке 30 любым подходящим способом, включая, помимо прочего, клеевое соединение, термическое соединение и термическое соединение между внутренним и внешним слоем соединительной трубки.
[0165] В различных вариантах реализации изобретения соединительные трубки 20 и 30 могут содержать материалы, обычно применяемые для производства катетеров для гемодиализа, например, полиуретан, поливинилхлорид, силикон и политетрафторэтилен (PTFE), и содержать Pellethane® или Carbothane®. В других вариантах реализации изобретения, соединительные трубки могут содержать материалы, обычно применяемые для получения трансплантата при гемодиализе или синтетических обходных сосудистых шунтов, например, политетрафторэтилен (ePTFE) или Dacron. В дополнительных вариантах реализации изобретения соединительные трубки могут содержать комбинацию полиуретана, поливинилхлорида, полиэтилена, силикона, PTFE, Pellethane®, Carbothane®, Carbothane® РС-3575, ePTFE, или Dacron.
[0166] Например, полностью вся приточная соединительная трубка 20 может состоять из полиуретана. В другом варианте реализации изобретения, проиллюстрированном на ФИГ. 31, сегмент 500 выпускной соединительной трубки 30, выполненный с возможностью создания жидкостного соединения с перфузионным насосом 25, состоит из полиуретана, тогда как сегмент 502 выпускной соединительной трубки, выполненный с возможностью создания жидкостного соединения с сосудистой системой, состоит из ePTFE.
[0167] В качестве примера, помимо прочего, и как проиллюстрировано на ФИГ. 41, на которой проиллюстрирован продольный разрез места соединения между ближним сегментом 500 и дальним сегментом 502, ближний сегмент 500 выпускной соединительной трубки 30 соединен с дальним сегментом 502 выпускной трубки 502 во время процесса производства, путем укладывания одного или более слоев 502А из ePTFE дистального сегмента между слоями 500А из полиуретана ближнего сегмента. Затем, перекрывающиеся слои полиуретана и ePTFE ламинируются путем нагрева для связывания ближнего сегмента 500 и дистального сегмента 502 вместе.
[0168] В другом примере перед ламинированием путем нагрева соединительной трубки, выполняются одно или более отверстий внутри пересекающихся секций ePTFE сегмента 502. Затем выпускная соединительная трубка 30 нагревается до температуры, достаточной для плавления полиуретана без плавления ePTFE (например, до температуры от 200°F до 500°F), расплавленный полиуретан заправляется внутрь и затем охлаждается внутри отверстий, созданных в сегменте ePTFE 502. Внутренние и внешние слои сегмента 500 соединены с отверстиями для механического соединения двух сегментов 500 и 502 вместе, а также механического соединения внутреннего и внешнего слоев полиуретана в перекрывающихся сегментах.
[0169] Вариант реализации выпускной соединительной трубки 30 производится таким образом, чтобы обеспечить преимущество слоя ePTFE 502А, находящегося между слоями полиуретана 500А, за счет чего слой ePTFE 502А может быть легко сшит с кровеносным сосудом с применением стандартной технологии. Это также относится к случаю, когда приточная соединительная трубка 20 производится, как обсуждалось выше, в соответствии с ФИГ. 41.
[0170] Как проиллюстрировано на ФИГ. 42, на которой изображена горизонтальная проекция медицинский набор 1000, перфузионный насос 25, приточная соединительная трубка 20, выпускная соединительная трубка 30, устройство управления 21 и кабель питания 120, может быть предоставлен стерильный пакет 1005 с инструкцией 1010 по монтажу и имплантации пациенту системы насоса. Медицинский набор 1000 может также содержать бородчатые соединения 400А и 400В, и радиальные сжимающие стопорные соединения 402А и 402В.М. В одном варианте реализации изобретения одна или обе соединительные трубки 20, 30 произведены, как описано выше в соответствии с ФИГ. 41 и заключены в стерильном пакете 1005 вместе с перфузионным насосом 25. Медицинский набор 1000, как минимум, содержит систему для выпуска или извлечения крови и инструкции по применению и использованию.
[0171] В одном варианте реализации изобретения работа перфузионного насоса 25 контролируется с помощью устройства управления 21 системы управления насосом 14, путем, соответственно, считывания выпускного давления и регулировки скорости насоса. Например, как проиллюстрировано на ФИГ. 43, на которой изображена схематическая диаграмма системы насоса 10, управляемая в соответствии с давлением на выпуске, датчик на выпуске 1050 может быть функционально подключен к выпускному отверстию 115 перфузионного насоса 25 или дополнительному выходу потока жидкости, например, где-то вдоль линии протяженности выпускной соединительной трубки 30. Процессор 24 может сравнивать считываемое давление из датчика давления на выпуске 1050 с диапазоном заданных давлений, сохраненных в памяти 27. Затем, процессор регулирует скорость привода насоса 170, для соответствия считываемого давления от датчика давления на выходе 1050 с заданным диапазоном давлений, сохраненных в памяти.
[0172] В одном варианте реализации изобретения система управления 14 также содержит датчик давления на впуске 1060, который может быть функционально подключен к впускному отверстию 110 перфузионного насоса 25 или дополнительному входу потока жидкости, например, где-то вдоль линии протяженности приточной соединительной трубки 20. Процессор 24 способен считывать оба давления, за счет считывания информации от датчика давления на выходе 1050 и считывания информации от датчика давления на впуске 1060 и рассчитывать разницу давлений. Затем, эта разница давлений сравнивается с диапазоном заданной разницы давлений, сохраненной в памяти 1055. Затем процессор регулирует скорость привода насоса 170 для соответствия рассчитанной разницы давлений с заданной разницей давлений, сохраненной в памяти.
[0173] В другом варианте реализации изобретения приточная и выпускная трубки 20 и 30 могут быть выполнены из любого материала или комбинации материалов, при условии, что соединительные трубки 20 и 30 демонстрируют требуемые характеристики, такие как гибкость, стерильность, устойчивость к изгибам и давлению, и которые могут подключаться к кровеносным сосудам с помощью анастомоза или вводится в полость кровеносного сосуда, при необходимости. Дополнительно, соединительные трубки 20 и 30 демонстрируют характеристики, необходимые для подкожного тунеллирования, например, имеющие гладкое покрытие внешней поверхности, к примеру, улучшенное смазывающее покрытие Harmony™.
[0174] В качестве другого примера, приточные и выпускные соединительные трубки 20 и 30 могут иметь внешний слой, состоящий из материалов, отличных от материалов внутреннего слоя. Все или часть внешних слоев приточной или выпускной трубок 20 и 30 также могут быть покрыты смазывающим веществом, например, силиконом или гидрофильным покрытием для способствования выполнению подкожного тунеллирования и удаления из тела, а также для снижения возможных аллергических реакций на латекс. В некоторых вариантах реализации изобретения, по меньшей мере часть поверхности внешнего слоя приточной или выпускной соединительной трубки 20 и 30 может иметь антимикробное покрытие. В другом варианте реализации изобретения по меньшей мере часть поверхности перфузионного насоса 25 или кабеля питания 120 может иметь антимикробное покрытие. К примеру, может использоваться поверхностно-активное антимикробное покрытие Avert™. В некоторых вариантах реализации изобретения, часть поверхности внешнего слоя приточной или выпускной соединительной трубки может содержать материал, стойкий к инфекциям и способствующий введению в ткани, такой как Dacron, полиэфир велюр или силикон. Одним из таки материалов является антимикробная манжета VitaCuff® от компании Vitaphore Corp. VitaCuff содержит два концентрических скрученных слоя материала. Внутренний слой выполнен из силикона медицинского класса. Внешний, контактирующий с тканями слой содержит коллагенную матрицу с антимикробной активностью, обусловленной ионами серебра, связывающими коллаген. В некоторых вариантах реализации изобретения, материал абсорбирует физиологические жидкости, быстро расширяется и обеспечивает физиологический барьер на выходе места доступа. Происходит врастание ткани, дополнительно фиксируя соединительные трубки на месте и снижая перемещение соединительных трубок для снижения частоты случаев инфекции на выходе места доступа.
[0175] Как понятно, исходя из ФИГ. 48A-F, вариант реализации манжеты 800 для фиксации приточной или выпускной соединительной трубки 20 и 30 к пациенту в течение продолжительного времени и снижения попадания инородных веществ, таких как бактерии, на кожу в месте доступа или в тело через соединительные трубки. Манжета 800 может иметь конструкцию из двух частей, имеющую съемную верхнюю часть 802 и съемную нижнюю часть 804, входящие в зацепление друг с другом и с соединительной трубкой. Как проиллюстрировано на ФИГ. 48В и 48D, каждая часть, верхняя 802 и нижняя 804, содержат один или более фиксирующих элементов 806 и соответствующих вырезов для фиксации 808. В одном варианте реализации изобретения верхняя и нижняя часть 802 и 804 содержат два фиксирующих элемента 806, которые удерживаются в вырезах для фиксации 808 на противоположной части для скрепления частей вместе, как проиллюстрировано на ФИГ. 48А-В. Каждая часть 802 и 804 может также содержать направляющий элемент 810 для совмещения двух половин и соответствующих вырезов для направляющих 812, для фиксации направляющего элемента в противоположной части. Верхняя и нижняя часть 802 и 804 формируют канал 814 для удерживания соединительных трубок 20 или 30. Канал 814 дополнительно формирует серию непрерывных или, в качестве альтернативы, прерывистых выступов 816 по окружности, вырезанных в канале 814. Выступы 816 надежно фиксируют соединительные трубки 20 или 30 при закреплении манжеты 800 на соединительные трубки, для защиты от перемещения или проскальзывания манжеты относительно соединительной трубки. Выступы 816 также обеспечивают уплотнение вокруг внешней поверхности соединительных трубок 20 и 30. В различных вариантах реализации изобретения, внешняя часть манжеты может быть покрыта материалом 818, способствующим введению в ткани или стойким к инфекциям, например, материалом Dacron, полиэфир велюр или силиконом, как проиллюстрировано на ФИГ. 48E-F. Материал 818 может также содержать вещества с антимикробными свойствами. Материал 818 обеспечивает пористую внешнюю поверхность для манжеты 800, способствующий врастанию тканей, увеличивающий локальную адгезию между пациентом и соединительными трубками 20 или 30, и снижению попадания инородных предметов и бактерий под кожу в месте доступа, в тело пациента или по всей линии протяженности соединительных трубок.
[0176] Врач может регулировать длину подкожного туннеля для соединительных трубок 20 или 30, таким образом, что манжета 800 фиксируется на соединительных трубках в месте, которое расположено соответствующим образом внутри туннеля. Если манжета 800 выполнена для прикрепления или отсоединения от соединительных трубок 20 или 30, которые могут быть обрезаны на нужную длину, манжета 800 может фиксироваться на обрезанной соединительной трубке так, что манжета соответствующим образом будет расположена внутри подкожного туннеля.
[0177] В некоторых вариантах реализации изобретения по меньшей мере часть полых поверхностей, контактирующих с кровью, приточных или выпускных соединительных трубок 20 и 30 могут быть покрыты антитромботическим средством или материалом. Аналогично, по меньшей мере часть перфузионного насоса 25, контактирующая с кровью, может быть покрыта антитромботическим средством или материалом. Например, поверхность может быть покрыта средством Applause® от компании SurModics, Inc., или средством Astute® от компании Biolnteractions Ltd., которые являются гидрофильными сополимерами, содержащими гепарин.
[0178] В некоторых вариантах реализации изобретения по меньшей мере часть приточной соединительной трубки 20 и выпускной соединительной трубки 30 усилена преимущественно для стойкости к изгибам, давлению, сжиманию и склеиванию. Например, соединительные трубки 20 и 30 могут быть усилены никель-титановым сплавом или другим сплавом с памятью формы, или самопружинящим или радиально экспансивным материалом. Предпочтительно, слой плетеного нитинола навит вокруг по меньшей мере части каждой соединительной трубки 20 и 30 или внедрен в стенки соединительных трубок. В одном варианте реализации изобретения приточная соединительная трубка 20 усилена плетеным нитинолом, внедренным в стенки соединительной трубки. В другом варианте реализации изобретения приточная соединительная трубка может быть усилена плетеной нержавеющей сталью, которая внедрена в стенки соединительных трубок 20 и 30. В качестве альтернативы, спираль нитинола или PTFE может быть навита вокруг части соединительных трубок 20 и 30 или внедрена внутрь. Например, как проиллюстрировано на ФИГ. 31, дальний сегмент 502 выпускной соединительной трубки 30 имеет спираль PTFE 504, внедренную вокруг ePTFE трубки, формирующей стенку 514 соединительной трубки. В другом варианте реализации изобретения спираль нитинола может быть навита вокруг части соединительных трубок 20 и 30 или внедрена внутрь.
[0179] Плотность оплетки плетеного нитинола, внедренного в приточную и выпускную соединительные трубки 20 и 30, обычно выражается в пикселах на дюйм ("PPI"), и, как правило, лежит в диапазоне от около 10 до 200, и, предпочтительно, в диапазоне от около 20 до около 60. В различных вариантах реализации изобретения, плотность оплетки может меняться по всей длине приточной или выпускной соединительной трубки 20 и 30. Например, плотность оплетки может быть выше в части соединительной трубки 20 и 30, в непосредственной близости от перфузионного насоса 25, для поддержания большей жесткости соединительных трубок и минимизации риска внешнего давления на трубки или разрушению во время отсасывания крови, при этом обеспечивая большую гибкость в различных сегментах соединительных трубок.
[0180] В одном варианте реализации изобретения, как проиллюстрировано на ФИГ. 32А-32В, внутрисосудистая часть 506 приточной соединительной трубки 20 имеет ячеистую форму за счет множества боковых отверстий 508. Эти боковые отверстия увеличивают входящий поток крови и снижают риск разряжения в вене или стенке правого предсердия на крайнем отверстии в случае частичной непроходимости наконечника трубки. Боковые отверстия 508 могут иметь круглую форму и диаметр в диапазоне от 1,0 мм до 3,0 мм. В предпочтительном варианте реализации изобретения боковые отверстия 508 могут быть эллиптической формы или любой другой формы, подходящей для внутрисосудистой аспирации крови.
[0181] Как проиллюстрировано на ФИГ. 31 и 32А-В, дальний конец 506 приточной соединительной трубки 20 и дальний конец 510 соединительной трубки 30 обрезаны и скошены под углом, в диапазоне от около 10° до 80°. В некоторых вариантах реализации изобретения, такой скос снижает риск разряжения в вене или стенке правого предсердия на крайнем отверстии, в случае частичной непроходимости наконечника трубки при аспирации крови. В другом варианте реализации изобретения скос увеличивает площадь соединительной трубки, при ее подключении к сосудистой системе с помощью анастомозного соединения. В некоторых вариантах реализации изобретения, дальний конец 506 и 510 скошен под углом 45°. Приточные и выпускные соединительные трубки 20 и 30 адаптированы для легкого введения, подкожного туннелирования и выведения, а также обеспечивает устойчивость к инфекциям и тромбозам.
[0182] В другом варианте реализации изобретения, как проиллюстрировано на ФИГ. 32C-32I, внутрисосудистая часть 506 приточной соединительной трубки 20 и/или выпускной соединительной трубки 30 имеют дистальный наконечник 507, который оптимизирован для снижения застоя или рециркуляции потока внутри трубки. Дистальный наконечник 507 сходится на конус и не имеет скоса, круглое отверстие на конце 511 имеет диаметр в диапазоне от около 1,0 мм до около 3,0 мм, предпочтительно, диаметр равен около 2,0 мм. Дистальный наконечник 507 имеет ячеистую структуру за счет наличия множества групп боковых отверстий 513 и 515. Боковые отверстия 513 и 515 могут иметь различные размеры, форму и ориентацию. Например, набор из четырех боковых отверстий 513 расположен симметрично, непосредственно за носиком наконечника. Каждое боковое отверстие в наборе 513 имеет круглую форму и наклонены по отношению к центральной линии 517 полости приточной соединительной трубки. В одном аспекте, боковые отверстия 513 имеют диаметр в диапазоне от около 0,8 мм до около 2,5 мм, и, предпочтительно, диаметр около 1,7 мм. Более того, боковые отверстия 513 ориентированы под углом по отношению к центральной оси 517 в диапазоне от около 30° до около 60°; предпочтительно, отверстия ориентированы под углом, равным около 40°. Другой набор из четырех боковых отверстий 515, расположенных симметрично, расположен на расстоянии около 6,5 мм от носика наконечника 507. Боковые отверстия 515, как правило, имеют эллиптическую форму с большой осью в диапазоне от около 2,5 мм до около 7,0 мм; предпочтительно, большая ось имеет длину около 4,8 мм. Боковые отверстия 515 также имеют малую ось в диапазоне от около 1,0 мм до около 2,5 мм в длину; предпочтительно, малая ос имеет длину, равную около 1,7 мм. В различных аспектах, грани боковых отверстий 513 и 515 имеют округлую форму или скруглены по радиусу для предотвращения повреждения крови. Исследования показали, что вариант реализации наконечника канюли 507, описанный в данном документе, выполнен с возможностью формирования уровней WSS по меньшей мере на один порядок величины больше, чем существующие канюли. Можно полагать, что увеличение WSS является функцией различия в диаметре отверстий (в квадрате) и также обусловлено общим уменьшением диаметра канюли.
[0183] В различных вариантах реализации изобретения, наконечник канюли 507 не содержит усиливающей спирали на приточной соединительной трубке 20 или выпускной соединительной трубке 30. Как проиллюстрировано на ФИГ. 32D, нитиноловая оплетка 519, заделанная на приточной или выпускной соединительной трубке 20 и 30, соответственно, не заходит на наконечник канюли 507. Точнее, усиливающая спираль 519 заканчивается вблизи наконечника канюли 507, на что указывает номер 521. Как проиллюстрировано на ФИГ. 32Е, наконечник канюли 507 может также содержать рентгеноконтрастный материал, такой как кольцо или полоску 523. Маркировочная полоска 523 помогает позиционированию приточной и выпускной соединительной трубки 20 и 30 при введении в кровеносный сосуд с флюороскопией
[0184] В другом аспекте настоящее изобретение также относится способу производства дистального наконечника 507 канюли, как проиллюстрировано на ФИГ. 32C-32I. Блок-схема, демонстрирующая процесс 900 производства наконечника канюли 507 проиллюстрирован на ФИГ. 32J. На этапе 902 жесткий мандрен вводится через дистальное отверстие наконечника 511 не усиленного приточного конца канюли 20. В примере, наконечник канюли 507 имеет внутренний диаметр, равный около 4,0 мм, и наружный диаметр, равный около 5,4 мм, при этом мандрен имеет диаметр в диапазоне от около 1,5 мм до 2,0 мм. В различных аспектах мандрен может состоять из различных жестких материалов, включая металл, например, нержавеющую сталь. На этапе 904 сегмент тонкой термоусадочной трубки, содержащей фтор, из этилен пропилена (FEP) помещается на наконечник 507 и узел мандрена. На этапе 906 от около 0, 5 см до 2,5 см дистальной части наконечника 507 нагревается до температуры около 400°F. В одном аспекте, дистальная часть позиционируется под воздействием горячего воздуха, размягчающего наконечник канюли 507, которая может быть выполнена из полиуретана, а также приводит к усаживанию FEP и прижимает наконечник канюли вплотную к мандрену, и уменьшает внутренний диаметр дистального наконечника 511 до около 1,5-2,0 мм. Более того, за счет позиционирования дистальной части наконечника 507 и узла мандрена при нагревании, тепловой градиент прилагается вдоль трубки FEP, которая усаживается на разную величину, в зависимости от разницы температур вдоль линии приложения температурного градиента. В результате, полиуретановая канюля 507 сжимается на конус, за счет большего сжимающего усилия, прилагаемого к дистальной части, где температура является наиболее высокой и более низкого сжимающего давления в направлении, близком к месту соединения.
[0185] В различных вариантах реализации изобретения степень изменения, придаваемая дистальному наконечнику 507, может варьироваться в зависимости от желаемой конфигурации, задаваемой производителем или пользователем, а также за счет изменения параметров процесса, включая, помимо прочего, температурные условия нагрева, применяемые материалы для дистального наконечника 507, длину и начальный диаметр трубки FEP. После формирования конфигурации со схождением на конус дистального наконечника 507, на этапе 908 наконечник канюли подвергается охлаждению и трубка FEP удаляется, в результате получается равномерное схождение на конус дистального наконечника 507.
[0186] В одном варианте реализации изобретения на этапе 910, маркировочная полоска в виде кольца 522 приклеивается на наконечник канюли. В одном аспекте, маркировочная полоска имеет диаметр меньше, чем наружный диаметр дистального конца приточной канюли 20, и с усилием усаживается на наконечник 507 канюли перед применением трубки FEP и выполнением процесса формирования схождения на конус на этапе 904-908. Маркировочная полоска предпочтительно закрепляется в том месте, которое окажется внутри нагреваемой среды. Так как трубка FEP сжимается по отношению к маркировочной полоске, мягкий материал канюли (например, полиуретан) растекается вокруг и сверху полоски, заделывая, таким образом, полоску внутри стенки канюли.
[0187] На этапе 912 боковые отверстия 513 и 515 сформированы вместе с наконечником канюли 507. В одном аспекте боковые отверстия 513 и 515 сформированы путем пробивания насквозь стенок канюли 507 с применением длинных жестких трубок, например, помимо прочего, трубок из нержавеющей стали. Например, отверстия на окружности 513 могут быть сформированы путем пробивания боковых стенок наконечника канюли 507 с помощью трубок из нержавеющей стали, имеющей толщину стенок, равную около 0,5 мм. Один конец трубки заточен и выполнен с возможностью формирования направляющей внутренней кромки и поверхности с углом скоса кромки между внутренне и внешней поверхностью трубки, равным около 45°. Для формирования более вытянутых боковых отверстий 515 применяется заточенная трубки из нержавеющей стали, аналогичная той, которая применяется для формирования боковых отверстий 513. Тем не менее, трубка, применяемая для формирования боковых отверстий 515, как правило, имеет больший диаметр и больше сжата, для получения соответствующей эллипсоидной формы. Сжатая трубка, имеющая теперь вытянутое овальное или эллиптическое поперечное сечение, применяется для пробивания боковых стенок канюли 507.
[0188] В еще одном аспекте заостренный наконечник трубки из нержавеющей стали, применяемый для формирования боковых отверстий 513 и 515, может быть нагрет до температуры от около 250°F до около 400°F перед пробиванием насквозь поверхности наконечника канюли 507 на этапе 912. В одном аспекте, разогретая трубка нагревает и по меньшей мере размягчает материал наконечника канюли 517, что приводит к "растеканию" и формированию гладкой, закругленной поверхности боковых отверстий 513 и 515. В свою очередь, в другом варианте реализации изобретения боковые отверстия 513 и 515 могут быть выполнены любым подходящим способом, включая, помимо прочего, вырезание лазером или пробивание другим режущим инструментом.
[0189] В одном варианте реализации изобретения часть приточной соединительной трубки 20 может быть введена в просвет кровеносного сосуда и продвигаться до заданного положения с применением чрескожного доступа или хирургическим способом. Для помощи в позиционировании приточной и выпускной соединительной трубки 20 и 30, соединительные трубки могут иметь маркировочные полоски с контрастным веществом или другие контрастные материалы, заделанные внутри стенок 512 и 514 приточной и выпускной соединительной трубки соответственно, которые видны при флюороскопии. Например, части приточной и выпускной соединительной трубки 20 и 30 могут состоять из полиуретана Carbothane® РС-3575, заделанного вместе с солью сульфата бария. В другом варианте реализации изобретения части приточной и выпускной соединительной трубки 20 и 30, которые выполнены с возможностью введения в полость сосудистой системы, могут иметь самопружинящие или радиально экспансивные (например, могут быть выполнены с включением нитинола) стенки, для того, чтобы диаметр внутрисосудистой части приточной или выпускной соединительной трубки 20 и 30 совпадали с диаметром сосудистой системы, в этом месте, например, испытанный сегмент гибридного сосудистого трансплантата GORE®.
[0190] В различных вариантах реализации изобретения, включая вариант реализации изобретения, проиллюстрированный на ФИГ. 37, приточная и выпускная соединительная трубка 20 и 30 могут быть соединены с кровеносным сосудом с применением хирургического анастомоза, применением нити непрерывной или раздельной формы, далее описанном как "анастомозное соединение". Анастомозное соединение может также выполняться с помощью хирургического зажима и другими стандартными способами выполнения анастомоза. Например, анастомозное соединение может быть выполнено между дистальным сегментом ePTFE 502 выпускной соединительной трубки 30 и кровеносным сосудом.
[0191] В некоторых вариантах реализации изобретения, где создано анастомозное соединение, выпускная соединительная трубка 30, прикрепленная к кровеносному сосуду, имеет начальный диаметр в диапазоне от 1 мм до 20 мм, и, предпочтительно, сосуды имеют начальный диаметр в диапазоне от 1,5 мм до 6 мм.
[0192] В свою очередь, в другом варианте реализации изобретения, проиллюстрированном на ФИГ. 32А-В и 37-40, части приточной и выпускной соединительной трубки 20 и 30 размещены внутри кровеносного сосуда или правого предсердия. Например, дистальный конец 506 приточной соединительной трубки 20 может быть размещен внутри правого предсердия или верхней полой вене. Как проиллюстрировано на ФИГ. 32А-32В, боковые отверстия 508 помогают в аспирации или заборе крови, когда дистальный конец 506 размещен внутри сосуда.
[0193] В различных вариантах реализации изобретения по меньшей мере одна приточная и выпускная соединительная трубка 20 и 30 может быть пригодна для применения с аппаратом гемодиализа, или аппаратом, применяемым для плазмафереза или афереза. Например, пациент, применяющий систему перфузионного насоса 10, может также нуждаться в терапии с применением гемодиализа. В этом примере, кровь может забираться из системы перфузионного насоса, пропускаться через аппарат для гемодиализа, а затем выпускаться обратно в систему перфузионного насоса для доставки обратно в сосудистую систему, таким образом, исключая необходимость создания дополнительного сосудистого доступа у пациента. Боковой порт 417 на приточной и выпускной соединительной трубке 20 и 30 может способствовать удалению и возврату крови из системы AFE при гемодиализе, плазмаферезе, аферезе или других процедурах, при которых кровь забирается и возвращается пациенту. В некоторых вариантах реализации изобретения, боковой порт 417 может быть выполнен таким образом, чтобы обеспечить стерильный ввод эндоваскулярных устройств, например, проволочного направителя, баллонов ангиопластики, сосудистых стентов, сосудистых окклюзирующих устройств, локальных катетеров доставки лекарственных средств и тромболизных катетеров, а также устройств тромбэктомии, например, баллонов Фогарти. В некоторых из таких вариантов реализации изобретения продольная ось бокового порта 417 может быть выполнена под углом к продольной оси соединительной трубки, например, под углом 30 градусов, под углом 40 градусов или под углом 45 градусов, в числе прочих. В некоторых из таких вариантов реализации изобретения боковой порт 417 может содержать кровоостанавливающую манжету для быстрого и простого введения и удаления эндоваскулярных устройств.
[0194] Боковой порт 417 может прикрепляться к приточной и выпускной соединительной трубке 20 и 30, соответственно, любым подходящим способом. В одном варианте реализации изобретения на поверхность бокового порта 417 наносится слой клеящего материала, который потом будет удерживать порт внутри соединительных трубок 20 и 30. Боковой порт 417 соединяется с трубкой и клеящий материал вулканизируется, формируя герметичное посадочное место, как проиллюстрировано на ФИГ. 50. В одном аспекте клеящим материалом является вещество медицинского назначения, отвердевающее под воздействием ультрафиолета (УФ).
[0195] На ФИГ. 51А-В проиллюстрирован вариант реализации узла бокового порта 419, то есть "готовый к доступу" или "с функцией доступа" и выполненный с возможностью обеспечивать забор жидкости из соединительных трубок 20 или 30, и для введения веществ и других материалов, включая, помимо прочего, медицинские инструменты и устройства, в соединительную трубку. В частности, на ФИГ. 51А и 52А изображен разобранный узел 419, тогда как на ФИГ. 51В и 52В изображен соответствующий собранный узел бокового порта. В различных вариантах реализации изобретения боковой порт 417 содержит крышку для уплотнения бокового порта при необходимости. В качестве примера, помимо прочего, крышка может быть твердой или жесткой торцевой крышкой 421 с резьбовым соединением Люэра, которая может закручиваться и откручиваться с бокового порта. В другом примере, крышка представляет собой инфузионный клапан 423, который содержит плунжер, являющийся нормально закрытым, пока шприц вводится в крышку для инфузии или аспирации. Затем, когда шприц удаляется, плунжер возвращается в закрытое положение для герметизации крышки. В еще одном примере, крышка может представлять собой гемостатический клапан 425, аналогичный стандартной ангиографической манжете. Гемостатический клапан 425 позволяет крышке оставаться закрытой при введении проволочного направителя или катетера через клапан. Это позволяет оператору продвигать проволоку и катетеры в боковой порт 417 и из него без открытия или закрытия крышки вручную. Боковой порт 417 также может содержать трехстороннее боковое плечо 427, для одновременной инфузии и/или аспирации. Как проиллюстрировано на ФИГ. 51В, собранный вариант реализации "готового к доступу" бокового порта 417 содержит различные комбинации крышек, трехсторонних боковых плеч 427, а также один или более хомутов 429. В другом варианте реализации изобретения могут применяться другие комбинации нескольких или более крышек.
[0196] Когда система перфузионного насоса установлена с таким "готовым к доступу" боковым портом, эндоваскулярные процедуры могут легко выполняться на соединительных трубках и связанной сосудистой системе, например, тромбэктомия, баллонная ангиопластика связанных сосудов, например, выпускной вены системы AFE, эндоваскулярная окклюзия сосудистых боковых ответвлений и локальная доставка лекарственных средств в соединительные трубки и связанные сосуды, например, при тромболизе, направленном через катетер. В одном варианте реализации изобретения применение системы AFE комбинируется с применением устройств эндоваскулярной окклюзии. Например, во время обработки заданной вены с помощью системы AFE, одно или более боковых ответвлений заданной вены может расширяться в ответ на повышение WSS, таким образом, снижая дозу WSS в нисходящем потоке сегмента вены. В этой ситуации, поток крови в это боковое ответвление вены может блокироваться за счет размещения эндоваскулярных устройств окклюзии со стороны вены. Устройства, которые могут применяться для этих целей, содержат стандартные спирали для периферической сосудистой окклюзии: устройства Amplatz Vascular Plug (St. Jude Medical, Inc.) или Blockstent Microcatheters (Metactive Medical, LLC). Эти устройства могут помещаться через боковой порт на выпускной соединительной трубке 30 или через отдельный сосудистый доступ, например, через манжету, размещенную в периферической вене, например, в бедренной вене или головной вене.
[0197] Как проиллюстрировано на ФИГ. 35, проиллюстрированный вариант реализации системы управления 14 содержит устройство управления 21, имеющее по меньшей мере один процессор 24 и память 27 для снабжения насоса питанием и получения информации от перфузионного насоса 25, с помощью которого информация используется для настройки и управления скоростью насоса и оценки скорости потока крови, протекающей через систему насоса. Процессор 24 выполнен с возможностью считывания, обработки и выполнения системы, способов и инструкций, закодированных на машиночитаемых носителях. Затем, система управления 14 оценивает срезающее давление на стенку сосуда в заданном сосуде, используя измеренный или оцененный диаметр сосудов, и измеренную или оцененную среднюю скорость потока системы насоса. Устройство управления также содержит источник питания 26, дополнительно имеющий батарею 28.
[0198] В одном варианте реализации изобретения система управления 14 получает обратную связь по сигналам датчиков, применяя один или более датчиков 122. Могут применяться любые варианты подходящих датчиков для обнаружения любых изменений физических параметров крови, перфузионного насоса 15, системы перфузионного насоса 10 и/или целевого сосуда. В некоторых вариантах реализации изобретения, датчики могут применяться для определения положения или изменения положения тела. Датчики 122 формируют сигнал, указывающий на изменения, для анализа и/или обработки. В основном, датчики 122 контролируют различные свойства системы перфузионного насоса 10, крови, протекающей через систему, и заданного кровеносного сосуда, для определения изменений, которые могут обрабатываться и сравниваться с заданными эталонными значениями или предварительно заданными стандартами. Заданные эталонные значения или предварительно заданные стандарты могут храниться в базе данных или на другом подходящем носителе.
[0199] В различных вариантах реализации изобретения один или более датчиков 122 могут быть связаны с перфузионным насосом 25 приточной соединительной трубкой 20, выпускной соединительной трубой 30, донорским сосудом или местом, или принимающим сосудом или местом. В различных вариантах реализации изобретения система управления 14 или ее часть может быть расположена внутри корпуса или крышки перфузионного насоса 25. Например, один или более датчиков 122 могут быть расположены во впускном отверстии 110 или выпускном отверстии 115 перфузионного насоса 25. В другом варианте реализации изобретения система управления 14 может располагаться снаружи насоса.
[0200] Срезающее давление на стенку сосуда может применяться для настройки параметров работы системы насоса 10, в результате чего увеличивается общий диаметр и просветов заданных сосудов или увеличивается длина целевого сосуда.
[0201] Применяя закон Хагена-Пуазейля для течения крови (то есть параболического профиля ламинарного течения несжимаемой жидкости с постоянной скоростью) в просвете сосуда, имеющем круглое сечение, значение WSS можно определить, применяя равенство:

где:
Q = расход жидкости (m3/s)
μ = плотность крови (Па/с)
R = радиус сосуда (м)
Метод #1 контроля срезающего давления на стенку сосуда: ручной
[0202] Среднее и/или пиковое WSS в кровеносном сосуде может контролироваться путем регулировки скорости насоса, которая влияет на расход жидкости через систему насос-соединительные трубки и, таким образом, протекающую через целевой сосуд. Как проиллюстрировано на ФИГ. 36А, ручной способ управления 600 может выполнять непосредственное измерение вязкости крови на этапе 602 (путем взятия образцов крови пациента и анализа с помощью вискозиметра), измерение скорости потока в системе перфузионного насоса или скорости потока крови в целевом сосуде на этапе 604 (путем размещения ультразвуковых датчиков потока как на приточной, так и на выпускной соединительной трубке или за счет ультразвукового или термального метода дилюции, соответственно) и измерение радиуса сосудов на этапе 606 (за счет различных методов отображения, включая ангиографический, ультразвуковой, метод компьютерной томографии или магнитно-резонансного отображения). Воздействие WSS на стенку сосуда определяется на этапе 608, в сравнении с заданным уровнем на этапе 610 или 612, а затем скорость потока (Q) через насос регулируется путем изменения скорости вращения крыльчатки насоса на этапе 614 или 616. Изменения в скорости насоса выполняются путем различных циклических режимов пульсаций с модуляцией входящего напряжения на двигателе.
Метод #2 контроля срезающего давления на стенку сосуда: автоматический с непрямым измерением вязкости крови, непосредственным измерением потока крови и измерением диаметра целевого кровеносного сосуда
[0203] Автоматическая система управления WSS может выполнять непосредственное измерение скорости потока крови в системе насоса или заданном сосуде, и непосредственное измерение диаметра целевого кровеносного сосуда. Как проиллюстрировано на ФИГ. 36В, этот автоматический метод управления WSS 620 может выполнять непрямое измерение вязкости крови на этапе 622 (оценка основывается на известной взаимосвязи измеренного гематокрита и приближенного среднего значения WSS). Может выполняться периодическая калибровка устройства оценки вязкости на этапе 624 с применением непосредственного измерения вязкости, как описано ранее. В клинической практике, вязкость крови обычно меняется медленно.
Метод #3 контроля срезающего давления на стенку сосуда: автоматический с непрямым измерением вязкости крови, непосредственным измерением потока крови и измерением диаметра целевого кровеносного сосуда, и непосредственным измерением давления в вене
[0204] Как проиллюстрировано на ФИГ. 36С, метод автоматического управление WSS 630 может выполнять непрямое измерение вязкости крови (оценка основывается на известной взаимосвязи измеренного гематокрита и приближенного среднего значения WSS) на этапе 622, измерение скорости потока крови через систему перфузионного насоса (оценка основывается на ее связи с параметрами состояния двигателя) на этапе 632, измерение давления в целевом кровеносном сосуде на этапе 634, и измерение радиуса сосуда (оценка основывается на сосудистом сопротивлении) на этапе 638. Сосудистое сопротивление рассчитывается на этапе 636 на основании оценки скорости потока и измеренного давления крови в сосуде. Может выполняться периодическая калибровка устройства оценки вязкости крови, потока через насос и радиуса целевого сосуда, соответственно, с применением непосредственного измерения на этапе 624, 640 и 642, соответственно, как описано ранее.
Метод #4 контроля срезающего давления на стенку сосуда: автоматический с непрямым измерением вязкости крови, непосредственным измерением потока крови, давлением в головной части насоса и измерением диаметра целевого кровеносного сосуда
[0205] Как проиллюстрировано на ФИГ. 36D, метод автоматического управления WSS 650 может выполнять непрямое измерение вязкости крови (оценка основывается на известной взаимосвязи измеренного гематокрита и приближенного среднего значения WSS) на этапе 622, измерение скорости потока крови через систему перфузионного насоса (оценка основывается на ее связи с параметрами состояния двигателя) на этапе 632, и измерение радиуса сосуда (оценка основывается на сосудистом сопротивлении) на этапе 638. Сосудистое сопротивление рассчитывается на этапе 636 на основании скорости потока через насос, оцененной на этапе 632 и давления в головной части насоса, где давление в головной части насоса также оценено на этапе 652, на основании его связи с параметрами состояния двигателя. Может выполняться периодическая калибровка устройства оценки вязкости крови, потока через насос и радиуса целевого сосуда, соответственно, с применением непосредственного измерения на этапе 624, 640 и 642, соответственно, как описано ранее. Может выполняться периодическая калибровка устройства оценки гидростатического давления насоса за счет измерения давления на впуске и выпуске насоса с применением отдельных датчиков давления и подсчета разницы этих давлений на этапе 654, или за счет непосредственного измерения гидростатического давления насоса с помощью дифференциального датчика давления.
Определение скорости потока системы перфузионного насоса и гидростатического давления без применения датчиков:
[0206] Ссылаясь на ФИГ. 35, процессор 24 адаптирован для определения и контроля силы тока, возникающей в одной или боле электрических обмотках узла обмоток 170 насоса через кабель питания 120, который одновременно с мониторингом напряжения подаваемого на узел обмоток, позволяет процессору 24 вывести входящую мощность (Рвх), потребляемую перфузионным насосом, 25 и актуальную скорость вращения крыльчатки 140 (ω). Процессор 24 оценивает скорость потока насоса (Q) или изменение в скорости потока (AQ) как функцию от Рвх и ω. Например, Q=f[Pвх,ω]. В частности, применяется следующее тождество:
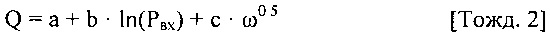
где:
Q = расход жидкости (литров/мин)
Рвх - Входящая мощность двигателя (Вт)
ω = Скорость насоса (об/мин)
Входящая мощность двигателя выводится путем измерения силы тока и напряжения на двигателе. Значения для а, b, и с выводятся за счет аппроксимации кривой графика скорости потока насоса, как функции от скорости двигателя и входящей мощности.
[0207] Процессор 24 также может определить гидростатическое давление насоса (Нр) или изменение гидростатического давления (ΔНР) как функцию от Рвх и ω. Например, Нр=f[Pвх,ω]. В частности, применяется следующее тождество:
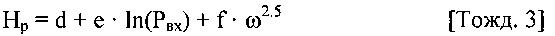
Значения для d, е и f выводятся за счет аппроксимации кривой графика гидростатического давления, как функции от скорости насоса и входящей мощности двигателя, где Нр измеряется поперек приточной соединительной трубки 20, насоса 25, и выпускной соединительной трубки 30.
Определение сосудистого сопротивления и оценка радиуса сосуда:
[0208] Сосудистое сопротивление (Rv) представляет собой сопротивление потоку, которое должна преодолеть кровь при прохождении через кровеносную систему. Сопротивление равно рабочему давлению (Hv), деленному на скорость потока. Когда система перфузионного насоса соединена с целевым сосудом, то есть с веной, сосудистое сопротивление рассчитывается с применением следующего тождества:

где:
Hv = потери гидростатического давления через периферический сосуд на обратном пути крови к сердцу (мм ртутного столба)
Pv = давление в вене на анастомозе (мм ртутного столба) CVP=центральное венозное давление (мм ртутного столба)
Rv = сосудистое сопротивление ((мм ртутного столба мин)/литр)
Обычно, давление CVP находится в диапазоне 2-8 мм ртутного столба и может быть проигнорировано в тождестве выше, так как рабочий диапазон Pv и Q пропорционально значительно больше. Как проиллюстрировано на ФИГ. 36Е, сосудистое сопротивление может быть представлено графически, в виде различных наклонных кривых 660 Pv в сравнении с Q. Так как кривые 660 являются нелинейными, угол наклона является функцией от Q. Как иллюстрирует следующее тождество, сосудистое сопротивление может быть выведено за счет временного увеличения скорости на несколько сотен оборотов в минуту (Δω), измерения изменений давления в вене (ΔPV), и измерения результирующего изменения потока в насосе (ΔQ):

Следует помнить, что сосудистое сопротивление является функцией, сильно зависящей от аргументов - диаметра или радиуса, с малыми венами, имеющими высокое сосудистое сопротивление. Сосудистое сопротивление может быть выражено в разных единицах, например, единицах Вуда ((мм ртутного столба ⋅ мин)/литр) и при умножении на восемь могут быть конвертированы в единицы СИ ((Па⋅с)/м3).
[0209] В альтернативном варианте гидростатическое давление насоса (Нр) может применяться как базис для расчета сосудистого сопротивления. Когда система насос-соединительные трубки выполнены с возможностью забора крови из одного места в сосудистой системе для выпуска ее в периферической артерии или вене, будет обоснованным предположение, что гидростатическое давление, усиливающееся при движении через систему (Нр), является в точности равным потерям гидростатического давления при движении через периферический сосуд на обратном пути крови к сердцу (Hv):

Радиус периферического сосуда обратно пропорционален его сосудистому сопротивлению (Rv), отношение Hv к Q. Применяя закон Хагена-Пуазейля для потока крови в сосудах круглого сечения, сосудистое сопротивление может быть представлено с применением тождества:
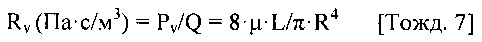
где:
Pv выражено в единицах Па
Q выражено в единицах (м3/с)
μ = плотность крови (Па/с)
R = радиус сосуда (м)
L = длина сосуда (м)
На практике Тожд. 7 должно быть переопределено на основании измерений in vivo падения давления через указанную вену известного диаметра. Перейдем к эмпирическому виду тождества:
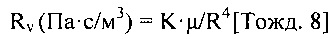
где:
К - это эмпирическая константа для заданной вены (м)
Определение срезающего давления на стенку сосуда:
[0210] Срезающее давление на стенку сосуда в заданном сосуде может быть определено на основании приведенного выше тождества. Применяя Тожд. 4, скорость потока насоса может быть выражена в соответствии со следующим тождеством:

Применяя Тожд. 8, радиус сосуда может быть выражен в соответствии со следующим тождеством:

Применяя Тожд. 1, 9, и 10, срезающее давление на стенку сосуда может быт выражено в соответствии со следующим тождеством:
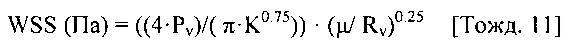
[0211] В различных вариантах реализации изобретения полученные значения переменных, применяемые системой управления, периодически калибруются. Например, оцененная скорость потока и гидростатическое давление периодически калибруется с применением актуальных измеренных значений в интервале от 1 минуты до 30 дней. Аналогично, оцененный радиус артерий или вен периодически калибруется с применением актуальных измеренных параметров в интервале от 1 минуты до 30 дней.
Меры безопасности и сигналы тревоги:
[0212] Автоматическая система управления также содержит меры безопасности для предотвращения факторов риска, связанных с изменениями в сердечно-сосудистой системе пациента или неисправности системы насоса или системы управления насосом. Как проиллюстрировано на ФИГ. 36F, способ управления скоростью 670 может определять изменение характеристик формы кривой тока в двигателе, связанных со снижением предварительной нагрузки или увеличения постнагрузки (например, в связи с тромбозом), всасывании, ограничении потока и угрозе коллапса сосудов вокруг наконечника приточной соединительной трубки на этапе 672. Спектральный анализ формы тока в двигателе выполняется с применением преобразований Фурье на этапе 674. Когда амплитуда периода вторичной гармоники ряда Фурье достигает предварительно заданного значения на этапе 676, происходит нарушение всасывания и возникает угроза коллапса. Скорость насоса немедленно уменьшается на этапе 616 и запускается сигнал тревоги на этапе 678А внутри устройства управления 21. При восстановлении нормального режима работы, сигнал тревоги отменяется на этапе 678В.
[0213] Как проиллюстрировано на ФИГ. 36G, способ управления скоростью 680 может определять условия низкой скорости потока. Когда скорость потока в насосе падает ниже безопасного порогового значения, для предотвращения тромбоза в системе насос-соединительные трубки 10 на этапе 682, скорость насоса мгновенного увеличивается на этапе 614 и запускается сигнал тревоги на этапе 678А внутри устройства управления 21. При восстановлении нормального режима работы, сигнал тревоги отменяется на этапе 678В.
[0214] Как проиллюстрировано на ФИГ. 36Н, способ управления скоростью 690 может определять параметры срезающего давления на стенку сосуда. Когда WSS превосходит безопасное пороговое значение, для предотвращения повреждения эндотелия сосуда на этапе 692, скорость насоса немедленно уменьшается на этапе 616 и запускается сигнал тревоги на этапе 678А внутри устройства управления 21. При восстановлении нормального режима работы, сигнал тревоги отменяется на этапе 678 В.
[0215] В еще одном варианте реализации изобретения, в котором приточная соединительная трубка 20 подключена к артерии и выпускная соединительная трубка 30 соединена с веной, система управления 14 контролирует и изменяет пульсовое давление потока крови, выпускаемой в принимающую вену. Например, система управления 14 может контролировать электрокардиограмму или контролировать циклические изменения пульсовой волны крови, поступающей в систему перфузионного насоса. Во время сокращения желудочков и распространения пульсовой волны, система управления может уменьшать скорость вращения насоса. Во время сокращения сердца и прохождения пульсовой волны система управления может увеличивать скорость вращения насоса. В этом случае пульсовое давление в крови, поступающей в принимающую вену, может быть снижено. В альтернативном варианте пульсовое давление крови в принимающей вене может периодически проверяться вручную, что может быть выполнено с помощью ультразвука, и насос может регулироваться вручную, например, за счет настройки характеристик напора насоса, добавления гибкого или эластичного резервуара (изменения сегмента или распространения) к впускному или выпускному отверстию насоса, или модуляции скорости насоса. Могут выполняться и другие регулировки. В альтернативном варианте гибкий резервуар или эластичный резервуар могут быть добавлены к приточной или выпускной соединительной трубке во время имплантации системы перфузионного насоса.
[0216] В некоторых вариантах реализации изобретения часть контроллера пациента системы управления 14 может содержать механизмы для пациента и поставщика услуг, позволяющие немедленно изменять скорость насоса в ответ на срочный или непредвиденный случай, например, кровотечение или боль. Например, пациент или поставщик услуг могут отключить насос с помощью функции аварийной остановки или могут изменить параметры работы насоса на "безопасный режим", при котором скорость насоса снижается так, чтобы давление в соединительных трубках и потоке крови снижалось, но при этом поток крови через систему насоса оставался на уровне, необходимом для работы без тромбозов. Эти механизмы дополнительно содержат систему, обеспечивающую инструкции для пациентов или поставщиков услуг, например, осуществляющих непосредственный медицинский уход вблизи больниц или клиник.
[0217] В различных вариантах реализации изобретения система управления 14 контролирует и регулирует вручную или с помощью программного обеспечения или приложений, закодированных на машиночитаемых носителях и выполняемых процессором 24, или другими автоматизированными системами. Машиночитаемые носители могут содержать изменяемые носители, неизменяемые носители, сменные носители, не сменные носители и/или другие доступные носители, доступ к которым осуществляется системой управления 14. В качестве примера, помимо прочего, машиночитаемые носители могут содержать компьютерные носители и средства коммуникации. Компьютерные носители информации содержат память, изменяемые носители, неизменяемые носители, сменные носители, и/или не сменные носители, реализованные таким способом или технологией, чтобы хранить информацию, например, машиночитаемые инструкции, структуры данных, программные модули или другие данные.
[0218] Программы могут содержать выполняемые инструкции для автоматической регулировки скорости насоса для поддержания заданной величины потока крови, средней скорости крови или скорости, и среднее значение WSS в сегменте обрабатываемого сосуда ("целевого сосуда" или "целевого кровеносного сосуда"), в котором задано желаемое постоянное увеличение общего диаметра или диаметра вен, или длины, ими являются донорская артерия, донорская вена, принимающая артерия или принимающая вена. В альтернативном варианте, общий диаметр, диаметр полостей, длина, поток крови в целевом сосуде может периодически проверятся вручную, что может быть выполнено с помощью ультразвука, и насос может регулироваться вручную, например, за счет настойки характеристик напора насоса или модуляции скорости насоса. Могут выполняться и другие регулировки.
[0219] В одном варианте реализации изобретения среднее значение потока крови определяется с помощью вычисления среднего значения из множества дискретных измерений скорости крови, путем суммирования дискретных измерений и деления общей суммы на количество измерений. Средняя скорость крови может быть рассчитана путем получения измерений в течение определенного периода, равного миллисекундам, секундам, 1 минуте, 5 минутам, 15 минутам, 30 минутам, 1 часу или нескольким часам.
[0220] В другом варианте реализации изобретения среднее значение WSS определяется путем получения серии дискретных измерений, формирования множества дискретных измерений WSS (применяя эти измерения), суммирования дискретных определенных значений WSS и деление общей суммы на количество измерений. Среднее значение WSS может быть рассчитано путем получения измерений и формирования дискретных значений WSS в течение определенного периода, равного секундам, 1 минуте, 5 минутам, 15 минутам, 30 минутам, 1 часу или нескольким часам.
[0221] В одном варианте реализации изобретения система управления 14 получает информацию от датчика 22, связанного с перфузионным насосом 25. В другом варианте реализации изобретения система управления 14 получает информацию от датчика 22, связанного приточной соединительной трубкой 20 или выпускной соединительной трубкой 30, или с сосудом, имеющим жидкостное соединение с приточной или выпускной соединительной трубкой. В различных вариантах реализации изобретения, вся или часть системы управления 14 может быть расположена внутри корпуса насоса 25, тогда как в другом варианте реализации изобретения вся или часть системы управления может быть расположена внутри соединительных трубок, или внутри устройства управления 21.
[0222] Устройство и способы реализации, описанные в данном документе, увеличивают среднее значение уровня WSS в периферических венах и артериях. Нормальное значение WSS для вен лежит в диапазоне от 0,076 Па до 0,76 Па. Устройства, описанные в данном документе, выполнены с возможностью увеличивать уровень WSS в принимающей периферической вене до уровня, в диапазоне от 0,76 Па до 23 Па, предпочтительно, в диапазоне от 2,5 Па до 10 Па. Нормальное значение WSS для артерий лежит в диапазоне от 0,3 Па до 1,5 Па. Для дилатации артерий, устройства и способы, описанные в данном документе, увеличивают уровень среднего значения WSS до уровня в диапазоне от 1,5 Па до 23 Па, предпочтительно, до диапазона от 2,5 Па до 10 Па. В некоторых случаях, устойчивое среднее значение WSS меньше чем 0,76 Па в венах или менее чем 1,5 Па в артериях, может увеличивать общий диаметр и диаметр просветов этих сосудов, однако величина и степень этого увеличения вряд ли являются клинически информативными или применимыми в обычной клинической практике. Постоянное среднее значение WSS большее, чем 23 Па в артериях или венах с большой вероятностью приводит к денудации (потере) эндотелия кровеносных сосудов, или повреждению эндотелия, которая известна как задержка дилатации кровеносных сосудов в ответ на увеличение среднего значения скорости крови и среднего значения WSS. Прокачивание крови способом, который увеличивает среднее значение WSS до желаемого диапазона, составляет предпочтительно от 1 дня до 84 дней, и более предпочтительно, от 7 до 42 дней, например, получение постоянного увеличения общего диаметра и диаметра просветов в принимающей вене, донорской вене, или донорской артерии, приводит к тому, что вены и артерии, которые были изначально непригодны или не оптимальны для применения в качестве места доступа при гемодиализе или обходного сосудистого шунта, в результате вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Процесс прокачивания крови может периодически контролироваться и регулироваться. Например, насос может регулироваться в течение периода времени, равного минутам, часам, 1 дню, 3 дням, 1 неделе или нескольким неделям для учета изменений в периферических венах и артериях (например, постоянного увеличения общего диаметра или диаметра полостей), перед достижением заданной постоянной дилатации.
[0223] Ссылаясь на ФИГ. 37-40, система 10 для увеличения общего диаметра и диаметра просвета вен и артерий проиллюстрирована при применении на пациенте 1. На ФИГ. 37 система 10 забирает бедную кислородом венозную кровь от венозной системы пациента и выпускания этой крови в принимающий сосуд 700. Система 10 также увеличивает среднюю скорость крови в принимающем периферическом сосуде 700 и увеличивает среднее значение WSS, прилагаемое на эндотелий принимающей периферической вены 700, для увеличения общего диаметра и просветов принимающего сосуда 700, расположенного, к примеру, в верхней конечности или нижней конечности. Диаметр кровеносных сосудов, например, периферических вен, может быть определен путем измерения диаметра просветов, которые представляет собой открытое место в центре кровеносного сосуда, где протекает кровь или за счет измерения диаметра всех вен, содержащих открытые места и стенки кровеносных сосудов.
[0224] Изобретение также относится к одновременному и устойчивому увеличению общего диаметра и диаметра просветов периферических вен или артерий за счет направления крови внутрь или же из периферической вены или артерии, таким образом, увеличивая среднее значение скорости крови в периферической вене или артерии и увеличивая среднее значение WSS на эндотелии периферических вен или артерий. Устройства, описанные в данном документе, увеличивают среднее значение скорости крови в периферических венах или артериях и среднее значение WSS на эндотелии периферических вен или артерий за счет применения системы перфузионного насоса. Предпочтительно, насос направляет кровь в периферическую принимающую вену, при этом у прокачиваемой крови снижается пульсовое давление, например, в случае, когда пульсовое давление ниже, чем в крови периферической артерии.
[0225] Система 10 пригодна для поддержания потока крови, предпочтительно, в диапазоне от 50 мл/мин до 2500 мл/мин и дополнительно от 50 мл/мин до 1500 мл/мин или в диапазоне от 100 мл/мин до 1000 мл/мин, при этом также поддерживается диапазон давления в выпускной соединительной трубке от 10 мм ртутного столба до 350 мм ртутного столба, предпочтительно, от 25 мм ртутного столба до 100 мм ртутного столба. Как описано ранее, система управления 14 может быть оптимизирована для поддержания постоянного среднего значения срезающего давления на стенку сосуда в диапазоне от 0,76 Па до 23 Па, предпочтительно, от 2,5 Па до 10 па, или от 2,5 Па до 7,5 Па в периферических венах, благодаря чему общий диаметр и диаметр просветов периферических вен постоянно увеличены на целых 5%, или даже более чем 500%.
[0226] Устройства, описанные в данном документе, также увеличивают среднее значение скорости крови в периферических венах. В состоянии покоя, среднее значение скорости крови в головной вене человека (со средним диаметром просвета 2,4±0,5 мм) обычно составляет от 5 до 9 см/с (0,05 до 0.09 м/с). Для устройств, описанных в данном документе, средняя скорость крови в периферических венах увеличивается до диапазона от 5 см/с до 235 см/с (0,05 до 2,35 м/с), предпочтительно, до диапазона от 15 см/с до 100 см/с (0,15 м/с до 1,0 м/с), на основании данных о начальном заданном общем диаметре или диаметре полостей периферических принимающих вен и конечного диаметра общего или диаметра просветов. Устройства, описанные в данном документе, также увеличивают среднее значение скорости крови в периферических артериях. В состоянии покоя, среднее значение скорости крови в плечевой вене человека (со средним диаметром просветов 3,7±0,7 мм) обычно составляет от 10 до 15 см/с (от 0,1 до 0.15 м/с). Для устройств и способов, описанных в данном документе, средняя скорость крови в периферических артериях увеличивается до диапазона от 15 см/с до 360 см/с (0,1 до 3,6 м/с), предпочтительно, до диапазона от 25 см/с до 160 см/с (0,25 м/с до 1,6 м/с), на основании данных о начальном заданном общем диаметре или диаметре просветов периферических принимающих вен и конечного диаметра общего или диаметра просветов.
[0227] Предпочтительно, среднее значение скорости крови увеличивается до диапазона от 1 дня до 84 дней или, предпочтительно, от 7 до 42 дней, для стимулирования постоянного увеличения общего диаметра и диаметра просветов в периферических принимающих венах, периферических принимающих артериях, периферических донорских венах или периферических донорских артериях, благодаря чему, вены и артерии, которые изначально были не пригодны или не оптимизированы для применения в качестве место доступа при гемодиализе или обходного сосудистого шунта, в результате, вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Это может быть выполнено за счет периодического увеличения средней скорости крови во время обработки, с промежуточными периодами нормального значения скорости крови.
[0228] Исследования показали, что основная линия направленности гемодинамических сил и изменений гемодинамических сил внутри вен и артерий играет важную роль в определении общего диаметра и диаметра просветов, а также длины этих вен и артерий. Например, постоянное увеличение средней скорости крови и среднего значения WSS может привести к постоянному увеличению диаметра просвета и общего диаметра и длины вен и артерий. Увеличенное среднее значение скорости крови и среднее значение WSS ощущается клетками эндотелия, которые запускают сигнальный механизм, в результате чего стимулируются клетки гладкой мускулатуры сосудов, притягиваются моноциты и макрофаги, и синтезируется и высвобождается протеиназа, способная снижать компоненты внеклеточного матрикса, например, коллаген и эластин. По этой причине, настоящее изобретение относится к увеличению средней скорости крови и среднего значения WSS в течение периода времени, необходимого для того, чтобы реконструировать вены и артерии и увеличить общий диаметр и диаметр просвета и длину вен и артерий.
[0229] Описанные в данном документе устройства увеличивают среднее значение уровня WSS в периферических венах или артериях. Нормальное значение WSS для вен лежит в диапазоне от 0,076 Па до 0,76 Па. Устройства, описанные в данном документе, выполнены с возможностью увеличивать средний уровень WSS в принимающей периферической вене до уровня, в диапазоне от 0,76 Па до 23 Па, предпочтительно, в диапазоне от 2,5 Па до 10 Па. Нормальное значение WSS для артерий лежит в диапазоне от 0,3 Па до 1,5 Па. Для постоянного увеличения общего диаметра и диаметра просвета артерий, устройства и способы, описанные в данном документе, увеличивают среднее значение уровня WSS до диапазона от 1,5 па до 23 Па, предпочтительно, до диапазона от 2,5 Па до 10 Па. Предпочтительно, среднее значение WSS увеличивается до диапазона от 1 дня до 84 дней или, предпочтительно, от 7 до 42 дней, для стимулирования устойчивого увеличения общего диаметра и диаметра просветов в периферических принимающих венах, периферических принимающих артериях, периферических донорских венах или периферических донорских артериях, благодаря чему, вены и артерии, которые изначально были не пригодны или не оптимизированы для применения в качестве место доступа при гемодиализе или обходного сосудистого шунта, в результате, вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Это также может быть выполнено за счет периодического увеличения среднего значения WSS во время обработки, промежуточными периодами нормального значения WSS.
[0230] При некоторых обстоятельствах длительные периоды среднего значения WSS в периферических венах ниже, чем 0. 76 Па или ниже чем 1,5 в периферических артериях может привести к увеличению общего диаметра и диаметра просветов этих вен и артерий, однако величина и степень этого увеличения вряд ли являются клинически информативными или применимыми в обычной клинической практике. Постоянное среднее значение уровня WSS в периферических венах и артериях выше, чем 23 Па с большой вероятностью приводит к денудации (потере) эндотелия вен или повреждению эндотелия вен. Денудация эндотелия или повреждение эндотелия кровеносных сосудов, известно, как снижение увеличения общего диаметра и диаметра просветов кровеносных сосудов на фоне увеличения средней скорости и среднего значения WSS. Увеличенное среднее значение WSS стимулирует достаточное устойчивое увеличение общего диаметра и диаметра полостей, или длины вен или артерий, которые изначально были не пригодны или не оптимизированы для применения в качестве место доступа при гемодиализе или обходного сосудистого шунта, в результате, вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Диаметр периферической принимающей вены, периферической принимающей артерии, периферической донорской вены или периферической донорской артерии может определяться периодически, например, каждый 1 день, 3 дня, 1 неделю или каждые несколько недель, например, для того, чтобы дать возможность регулировать скорость насоса для оптимизации степени и величины постоянного увеличения общего диаметра и диаметра просветов вен и артерий во время обработки.
[0231] Устройства, описанные в данном документе, также увеличивают среднее значение скорости крови в периферических венах. В состоянии покоя, среднее значение скорости крови в головной вене человека (со средним диаметром полостей 2,4±0,5 мм) обычно составляет от 5 до 9 см/с (от 0,05 до 0.09 м/с). Для устройств, описанных в данном документе, средняя скорость крови в периферических венах увеличивается до диапазона от 5 см/с до 235 см/с (от 0,05 до 2,35 м/с), предпочтительно, до диапазона от 15 см/с до 100 см/с (от 0,15 м/с до 1,0 м/с), на основании данных о начальном заданном общем диаметре или диаметре просветов периферических принимающих вен и желаемого конечного диаметра общего или диаметра просветов периферических принимающих вен. Устройства, описанные в данном документе, также увеличивают среднее значение скорости крови в периферических артериях. В состоянии покоя, среднее значение скорости крови в плечевой артерии человека (со средним диаметром полостей 3,7±0,7 мм) обычно составляет от 10 до 15 см/с (от 0,1 до 0.15 м/с). Для устройств и способов, описанных в данном документе, средняя скорость крови в периферических артериях увеличивается до диапазона от 15 см/с до 360 см/с (от 0,1 до 3,6 м/с), предпочтительно, до диапазона от 25 см/с до 160 см/с (от 0,25 м/с до 1,6 м/с), на основании данных о начальном общем диаметре или диаметре просветов периферических принимающих артерий и конечного желаемого диаметра общего или диаметра просветов периферических артерий. Предпочтительно, среднее значение скорости крови увеличивается до диапазона от 1 дня до 84 дней или, предпочтительно, от 7 до 42 дней, для стимулирования устойчивого увеличения общего диаметра и диаметра просветов или длины в периферических принимающих венах, периферических принимающих артериях, периферических донорских венах или периферических донорских артериях, благодаря чему, вены и артерии, которые изначально были не пригодны или не оптимизированы для применения в качестве место доступа при гемодиализе или обходного сосудистого шунта, в результате, вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Среднее значение уровня скорости крови в периферических принимающих венах или донорских венах ниже, чем от 5 см/с до 15 см/с (от 0,05 м/с до 0,15 м/с) или средний уровень скорости в периферических принимающих или донорских артериях ниже, чем от 15 см/с до 25 см/с (от 0,15 м/с до 0,25 м/с) может привести к увеличению общего диаметра и диаметра просветов этих вен и артерий, однако, величина и степень этого увеличения вряд ли являются клинически информативными или применимыми в обычной клинической практике. Средний уровень скорости крови в периферических принимающих или донорских венах выше диапазона от 160 см/с до 235 см/с (0,16 м/с до 2,35 м/с) или средний уровень скорости крови в периферических принимающих или донорских артериях выше, чем диапазон от 250 см/с до 360 см/с (от 0,25 м/с до 0,36 м/с) с большой вероятностью приводят к денудации (потере) эндотелия вен или повреждению эндотелия вен. Денудация или повреждение эндотелия кровеносных сосудов известно как снижение увеличения общего диаметра и диаметра просветов кровеносных сосудов, наблюдаемых на фоне увеличения средней скорости крови. Увеличенная скорость крови в заданном диапазоне и в течении достаточного периода времени стимулирует достаточное устойчивое увеличение общего диаметра и диаметра просветов или длины вен и артерий, которые изначально были не пригодны или не оптимизированы для применения в качестве место доступа при гемодиализе или обходного сосудистого шунта, в результате, вены и артерии малого диаметра становятся пригодными для применения или более оптимальными. Общий диаметр или диаметр просвета периферической принимающей вены, периферической принимающей артерии, периферической донорской вены или периферической донорской артерии может определяться периодически, например, каждые минуту (несколько минут), час(ы), 1 день, 3 дня, 1 неделю или каждые несколько недель, например, для того чтобы дать возможность регулировать скорость насоса для оптимизации степени и величины постоянного увеличения общего диаметра и диаметра просветов вен и артерий во время обработки.
[0232] В одном варианте реализации изобретения, проиллюстрированном на ФИГ. 34, система 10 содержит перфузионный насос 25, пару соединительных трубок 12 и устройство управления 21 для продвижения венозной крови, бедной кислородом, из донорской вены или места в венозной системе пациента к периферической принимающей вене. В различных вариантах реализации изобретения периферическая принимающая вена может являться головной веной, срединной веной, локтевой веной, латеральной подкожной веной, головной срединной веной, промежуточной медиальной веной, подкожной медиальной веной, плечевой веной, малой подкожной веной, большой подкожной веной, бедренной веной или другой веной. Могут быть применены другие вены, которые могут быть пригодны при создании места доступа для гемодиализа или обходного сосудистого шунта, или другие вены, пригодные для других сосудистых хирургических процедур требующих применения вен. Соединительные трубки 12 переносят кровь, бедную кислородом, к периферической принимающей вене. Постоянное повышенное значение скорости крови и повышенное значение WSS в периферических сосудах приводит к устойчивому и прогрессирующему увеличению общего диаметра и диаметра просветов периферической принимающей вены. Таким образом, система 10 по данному изобретению преимущественно увеличивает диаметр или длину периферической вены 4, что может быть применено, к примеру, для формирования места доступа для гемодиализа (например, АВФ или АВТ), обходного сосудистого шунта, или применено для других клинических ситуаций, при которых необходима вена определенного диаметра или длины, определяемого специалистом в данной области техники.
[0233] Используемый в данном документе термин бедная кислородом кровь представляет собой кровь, протекающую через капиллярную систему и имеющую кислород, удаленный окружающими тканями, и, затем, протекающею через венозную систему. Термин периферические вены, используемый в данном документе, означает любые вены с участками, находящимися вне грудной клетки, брюшного отдела или таза. В варианте реализации изобретения, проиллюстрированном на ФИГ. 37А, периферическая принимающая вена 712 представляет собой головную вену. Тем не менее, в различных вариантах реализации изобретения, периферическая принимающая вена может являться головной веной, срединной веной, локтевой веной, латеральной подкожной веной, головной срединной веной, промежуточной медиальной веной, подкожной медиальной веной, плечевой веной, малой подкожной веной, большой подкожной веной, бедренной веной или другой веной. В дополнение к периферической вене, другие вены могут быть пригодны для создания места доступа для гемодиализа или обходного сосудистого шунта, или другие вены, пригодные для других сосудистых хирургических процедур, требующих использования вен, также могут быть использованы в качестве принимающих вен, например, те, которые расположены в грудной клетке, брюшном отделе и тазовой области.
[0234] ФИГ. 37В иллюстрирует другой вариант реализации применения системы 10 для увеличения общего диаметра и диаметра просветов кровеносных сосудов. В данном варианте реализации изобретения, система 10 выполнена с возможностью выведения бедной кислородом крови из донорской вены 700 и перемещения крови в полой верхней вене или правому предсердию 702 сердца 704. Как проиллюстрировано, приточная соединительная трубка 706 имеют жидкостное соединение с донорской веной 700, в этом случае с головной веной. В одном варианте реализации изобретения соединение может быть выполнено с применением короткого сегмента ePTFE приточной соединительной трубки 706, который применяется для фиксации приточной соединительной трубки 706 к донорской вене 700, тогда как остальной сегмент приточной соединительной трубки сделан из полиуретана. В другом варианте реализации изобретения по меньше мере часть приточной соединительной трубки или выпускной соединительной трубки дополнительно содержит нитинол, для стойкости к изгибам и сжатию. Как проиллюстрировано, один конец выпускной соединительной трубки 710 соединен с перфузионным насосом 25, тогда как другой конец выпускной трубки имеет жидкостное соединение с верхней полой веной и правым предсердием 702 через внутрисосудистую часть. Для варианта реализации изобретения на ФИГ. 37 перфузионный насос применяет повышение интенсивности перемещения крови из донорской вены 700 к верхней полой вене и правому предсердию 702 сердца 704 для достижения заданного желаемого повышенного уровня среднего значения скорости крови и повышенного уровня среднего значения WSS в донорской вене 700. Насос работает с интенсивностью и в течение периода времени, достаточного для получения желаемого устойчивого увеличения общего диаметра и диаметра просветов донорских вен, например, увеличения на 10%, увеличения на 25%, увеличения на 50% или увеличения на 100% или более от начального диаметра. В дополнительном варианте реализации изобретения, один или более венозный клапан между местом соединения приточной соединительной трубки 706 и донорской вены 700, правого предсердия 702 могут быть выполнены некомпетентно или менее компетентно (с применением любого способа, доступного специалистам в данной области техники), что позволит крови протекать в обратном направлении в донорскую вену 700 и затем в приточную соединительную трубку 706.
[0235] ФИГ. 38 иллюстрирует другой вариант реализации применения системы 10 для увеличения общего диаметра и диаметра просветов кровеносных сосудов. В этом варианте реализации изобретения, система 10 выполнена с возможностью выведения бедной кислородом крови из донорской вены 712 (в этом случае, из плечевой артерии) и перемещения крови к верхней полой вене и правому предсердию 702 сердца 704. Как проиллюстрировано, приточная соединительная трубка 706 имеет жидкостное соединение с донорской артерией 712. В одном варианте реализации изобретения соединение может быть выполнено с применением короткого сегмента ePTFE приточной соединительной трубки 706, который применяется для фиксации приточной соединительной трубки 706 к донорской артерии 712, тогда как остальной сегмент приточной соединительной трубки сделан из полиуретана. В другом варианте реализации изобретения один или оба сегмента приточной соединительной трубки 706 дополнительно содержат нитинол, для повышения стойкости к изгибам и сжатию. Как проиллюстрировано, один конец выпускной соединительной трубки 710 соединен с перфузионным насосом 25, тогда как другой конец выпускной трубки имеет жидкостное соединение с верхней полой веной и правым предсердием 702 через внутрисосудистую часть. Для варианта реализации изобретения на ФИГ. 38, перфузионный насос применяет повышение интенсивности перемещения крови из донорской артерии 712 к верхней полой вене и правому предсердию 702 сердца 704 для достижения заданного желаемого повышенного уровня среднего значения скорости крови и повышенного уровня среднего значения WSS в донорской артерии 712. Насос работает с интенсивностью и в течение периода времени, достаточного для получения желаемого постоянного увеличения общего диаметра и диаметра просветов донорских артерий, например, увеличения на 10%, увеличения на 25%, увеличения на 50% или увеличения на 100% или более от начального диаметра.
[0236] В другом варианте реализации изобретения бедная кислородом артериальная кровь может быть перемещена из донорской артерии к принимающему местоположению. Донорская артерия может содержать, помимо прочего, лучевую артерию, локтевую артерию, межкостную артерию, плечевую артерию, переднюю большеберцовую артерию, заднюю болынеберцовую артерию, малоберцовую артерию, подколенную артерию, поверхностную бедренную артерию или бедренную артерию.
[0237] ФИГ. 39 иллюстрирует другой вариант реализации применения системы 10 для увеличения общего диаметра и диаметра просветов кровеносных сосудов. В этом варианте реализации изобретения, система 10 выполнена с возможностью выведения бедной кислородом крови из донорской вены 712 (в этом случае, из плечевой артерии) и перемещения крови к верхней полой вене и правому предсердию 702 сердца 704. Как проиллюстрировано, соединительная трубка 716 имеет жидкостное соединение с донорской артерией 712. В одном варианте реализации изобретения соединение может быть выполнено с применением короткого сегмента ePTFE приточной соединительной трубки 716, который применяется для фиксации приточной соединительной трубки к донорской артерии 712, тогда как остальной сегмент приточной соединительной трубки сделан из полиуретана. В другом варианте реализации изобретения один или оба сегмента соединительной трубки 716 дополнительно содержат нитинол, для повышения стойкости к изгибам и сжатию. В варианте реализации изобретения на ФИГ. 39, в котором не применяется насос, кровь перемещается пассивно из донорской артерии под высоким давлением 712 к верхней полой вене и правому предсердию 702 с низким давлением, а соединительные трубки 716 сконфигурированы с длиной и диаметром просветов, позволяющих достигать желаемого повышения уровня среднего значения скорости крови и среднего значения WSS в донорской вене 712. Соединительные трубки 716 остаются на месте в течение периода времени, достаточного для получения желаемого постоянного увеличения общего диаметра и диаметра просветов донорских артерий 712, например, увеличения на 10%, увеличения на 25%, увеличения на 50% или увеличения на 100% или более от начального диаметра.
[0238] ФИГ. 40 иллюстрирует другой вариант реализации применения системы 10 для увеличения общего диаметра и диаметра просветов периферических артерий. В этом варианте реализации изобретения, система 10 выполнена с возможностью выведения бедной кислородом крови из заданной вены 718, например, лучевой артерии и переноса крови к принимающей артерии 720, например, плечевой артерии. Как проиллюстрировано, приточная соединительная трубка 706 имеет жидкостное соединение с целевой артерией 718. В одном варианте реализации изобретения, соединение между приточной соединительной трубкой 706 и артерией или выпускной соединительной трубкой 710 и артерией может быть выполнено с применением короткого сегмента из ePTFE соответствующей соединительной трубки, который применяется для получения жидкостного соединения приточной соединительной трубки с целевой артерией 718 или выпускной соединительной трубкой 710, которая имеет жидкостное соединение с принимающей артерией 720, тогда как оставшиеся сегменты приточной или выпускной соединительной трубки могут быть выполнены из полиуретана. В другом варианте реализации изобретения один или оба сегмента часть приточной соединительной трубки 706 или выпускной соединительной трубки 710 дополнительно содержит нитинол, для стойкости к изгибам и сжатию.
[0239] Как проиллюстрировано, один конец выпускной соединительной трубки 710 соединен с перфузионным насосом 25, тогда как другой конец выпускной соединительной трубки имеет жидкостное соединение с принимающей артерией 720. Для варианта реализации изобретения на ФИГ. 40 перфузионный насос 25 применяет повышение интенсивности, с которой кровь выводится из целевой артерии 718 для достижения желаемого повышенного уровня средней скорости крови и повышенного среднего уровня WSS в целевой артерии. Насос работает с интенсивностью и в течение периода времени, достаточного для получения желаемого устойчивого увеличения общего диаметра и диаметра просветов целевых артерий 718, например, увеличения на 10%, увеличения на 25%, увеличения на 50% или увеличения на 100% или более от начального диаметра.
[0240] Ссылаясь теперь на ФИГ. 44A-D, система насоса 10 может также применяться для возврата венозной крови из нижних конечностей к сердцу, снижения гипертензии нижних конечностей, а также лечения венозных язв за счет прокачивания венозной крови из нижних конечностей, например, нижней конечности, к другому местоположению в венозной циркуляции, в этом случае к верхней полой вене и правому предсердию.
[0241] В одном варианте реализации изобретения, как проиллюстрировано на ФИГ. 45А, приточная соединительная трубка 20 содержит опорные элементы из нитинола, гидрофильное покрытие и присоединенный сегмент ePTFE 503, который выполнен для формирования анастомоза 290 для бедренной вены 292. Разрушение и окклюзию в наконечнике приточной соединительной трубки можно предотвратить за счет применения алгоритма обнаружения аспирации, как проиллюстрировано на ФИГ. 36F, для регулировки скорости насоса и/или усиленной спиралью секции трансплантата ePTFE, как проиллюстрировано на ФИГ. 31, для сопротивления коллапсу при отрицательном давлении. Выпуская соединительная трубка 30 содержит опорные элементы из нитинола, гидрофильное покрытие и не усиленный сегмент 509 с боковым отверстием для выпуска, выполненного с возможностью введения в верхнюю полую вену и правое предсердие, как проиллюстрировано на ФИГ. 45В.
[0242] Могут быть применены различные варианты реализации устройства управления 21. Например, система насоса 10 может управляться небольшим переносным устройством управления 21, оптимизированным для применения амбулаторными больными, как проиллюстрировано на ФИГ. 46А, которое пациент может носить на поясе, в кармане или носить в футляре для переноски во время процедур. Переносное устройство управления 21 может содержать перезаряжаемые батареи для обеспечения питанием насоса 25 через кабель 120. Устройство управления 21 может также предоставлять пациенту информацию о состоянии системы и регулировать скорость насоса и другие системные параметры в зависимости от положения тела пациента (например, обычное, положение лежа и так далее) или давления крови в приточной соединительной трубке 20, выпускной соединительной трубке 30, в сегменте вены, рядом с приточной соединительной трубкой или выпускной соединительной трубкой. В другом варианте реализации изобретения устройство управления 21 может представлять собой большой базовый блок, оптимизированный для применения пациентами, находящимися на стационарном лечении в больницах или клиниках, или применения в ночное время дома амбулаторными пациентами, как проиллюстрировано на ФИГ. 46В, и может выполнено с возможностью размещения на столе, при питании от сети переменного тока, или на тележке, при питании от перезаряжаемых батарей.
[0243] В одном аспекте система насоса 10 может переносить венозную кровь из нижней конечности к другому месту в венозной системе для снижения венозного давления в нижних конечностях и содействия в лечении язвенных образований после около трех месяцев применения, как проиллюстрировано на ФИГ. 44С. Система насоса 10 может быть удалена после полного излечения от язв, как проиллюстрировано на ФИГ. 44D.
[0244] В различных вариантах реализации изобретения устройство управления 21, как проиллюстрировано на ФИГ. 46А-В, процессор 24 управляющий насосом 25, может быть размещен внутри насоса. Размещение процессора 24 внутри насоса 25 снижает количество прокладываемых проводов, находящихся внутри кабеля питания 120. Это снижение количества проводов улучшает способность определять задержку изменения направления тока с помощью обратной ЭДС, которая приходит из незадействованной фазы двигателя с трехфазной обмоткой.
[0245] Один вариант реализации устройства управления 21, как проиллюстрировано на ФИГ. 46В, содержащего базовый блок, питающийся от сети переменного тока и оптимизированный для больниц и клиник, применяемый пациентами, проходящими стационарное лечение, связан с перфузионным насосом 25 кабелем 120, как проиллюстрировано на ФИГ. 47А. В этом варианте реализации изобретения, процессор 24 и источник питания 26 расположены внутри устройства управления 21. Так как длинный кабель 120 может выполнять роль антенны, любой сигнал изменения направления тока в двигателе, формируемый в перфузионном насосе 25, принимаемый на устройство управления 21 и наоборот, любая пульсация силы переменного тока на двигателе, формируемая на устройстве управления, принимаемая перфузионным насосом, чрезвычайно чувствительна к радиочастотному (РЧ) шуму. В связи с этим, необходимо уделить внимание защите от РЧ шума и заземлению компонентов для обеспечения безотказной работы.
[0246] В одном варианте реализации устройства управления 21 и насос 25, в котором процессор 24 находится ближе к насосу, либо оба находятся внутри корпуса перфузионного насоса 105, как проиллюстрировано на ФИГ. 47В, либо по меньшей мере, соединение между кабелем 120 и перфузионным насосом встроено в корпус, и эффект влияния РЧ шума значительно ослаблен. В этих вариантах реализации изобретения, передаваемое через кабель питания 120 постоянное напряжение, значительно меньше подвержено влиянию РЧ шума.
[0247] В другом варианте реализации устройства управления 21, как проиллюстрировано на ФИГ, 46А, содержащего переносное, питаемое от батарей устройство, оптимизированное для применения амбулаторными пациентами, применяется короткий кабель 120, который значительно меньше подвержен влиянию РЧ шума. Следовательно, процессор 24 может быть расположен либо в устройстве управления 21, либо в насосе 25.
Пример исследований и экспериментов
[0248] В серии исследований работоспособности in vivo, вариант реализации системы AFE был имплантирован свинье. В частности, система AFE была размещена во взаимодействии с левой яремной веной и левой подкожной латеральной веной задней конечности (SV). В одном исследовании различные гемодинамические показатели, включая среднее значение давления в правом предсердии (RAP), среднее значение давления в малом кругу (РАР), насыщенность кислородом (О2), артериальное кровяное давление (АВР), скорость потока, были измерены для изучения непосредственного эффекта на свинье, весом 21 килограмм. В период активных исследований скорость потока в 100-500 мл/мин не вызвала изменений в гемодинамических показателях или сердечной функции в сравнении с базовыми параметрами.
[0249] В другом исследовании, состоящем из длительного исследования антикоагулированной свиньи, весом 28 кг, латеральная подкожная вена подвергалась воздействию в течение 9 дней с WSS равным около 4 Па. Во время длительных исследований, прокачиваемый поток был увеличен с 270 мл/мин на 0 день до 947 мл/мин на 9 день, выпускной сегмент подкожной вены был увеличен с 3,7 мм до 13,8 мм, как проиллюстрировано на ФИГ. 49А, без ангиографических данных о стенозе. Вскрытие на 9-й день показало, что увеличенный сегмент подкожной вены был удлинен и легко мобилизован. Гистология показала экстенсивную дилаторную реконструкцию и очень малую гиперплазию интимы, как проиллюстрировано на ФИГ. 49В.
[0250] Для сравнения результатов системы AFE с существующими стандартами ухода за артериовенозной фистулой (АВФ), было выполнено исследование, при котором латеральная подкожная вена была мобилизована и соединена с бедренной артерией анастомозом бок (артерия) в конец (вена), для получения АВФ. Диаметр и скорость потока крови выпускной вены АВФ были определены после 4 недель с помощью ультразвука и ангиографии. Все четыре АВФ, которые были созданы, не развились в соответствии с критериями Инициативы по качеству лечения и исходам заболеваний почек (6 мм - диаметр вен и 600 мл/мин - скорость потока крови), в связи с развитием жесткой гиперплазии интимы и стеноза в выпускном сегменте вены, рядом с артерией. В течение 4 недель одна АВФ была окклюдирована и три другие ближайшие АВФ также были окклюзированы.
[0251] Длительное изучение проводилось на антикоагулированных свиньях, весом 20-25 кг, причем артериовенозная фистула была выполнена между бедренной артерией и мобилизованной латеральной подкожной веной, симметрично у 2 свиней (n=4 артериовенозных фистулы).
[0252] Результаты этих пилотных испытаний продемонстрировали эффективность системы AFE для расширения и развития периферических вен in vivo. В частности, исследования показали увеличение диаметра вен до около 10,1 мм, что равно около 275% увеличения, достигнутого после девяти дней обработки с поддержкой WSS на уровне 4 Па, с малым образованием гиперплазии интимы в обрабатываемой, расширяемой вене. Эти результаты с установкой системы AFE отличаются от результатов стандартных способов ухода за АВФ, при которых увеличение вен было неудовлетворительным, и поток крови через АВФ ограничивался возникшей жесткой гиперплазией интимы и стенозом в выпускной вене.
[0253] В другом исследовании, гемолитические свойства единиц экстракорпорального перфузионного насоса (ЕВР), включая один, аналогичны насосу 25, были повышены как до, так и после серии тестов гидравлической производительности. С помощью таких тестов производительности определялись свойства тестовых единиц ЕВР. Была создана закрытая имитационная циркуляция, без пульсаций, для каждого насоса в тестах гемолиза. Пример закрытой имитационной циркуляции, примененной во время исследований, проиллюстрированы на ФИГ. 54. Каждая циркуляционная петля содержит PVC трубки с внутренним диаметром 4 мм (Tygon stock #AAC1S1518) для приточной и выпускной соединительной трубки 5402 и 5404, резервуар 5406 и насос 5408. Приточная и выпускная соединительные трубки имеют длин 0,5 метра. Кровь крупного рогатого скота, собранная с помощью прокола вены и сохраненная в пакетах из CPDA-1 была использована в течение 48 часов (Lampire, CN #7200805) в соответствии с ASTM F1830-97. Кровь была перенесена в другой пакет для крови (1 литр, Sorin Group #00-700-1001), примененный в качестве резервуара, имеющий три порта 5410, примененных в качестве приточной, выпускной и трубки для образцов. Применялся прямой бородчатый коннектор для надежного соединения трубки к порту резервуара. Водяная баня 5412 была отрегулирована на 37°C. Кровь крупного рогатого скота прокачивалась через каждый насос и циркулировала в течение 30 минут для промывки системы перед проведением тестов. Перед проведением тестов резервуары были размещены над водяной баней с приточными и выпускными соединительными трубками, подвешенными в бане для подогрева циркулирующей крови до 37°C, как проиллюстрировано на ФИГ. 54.
[0254] Насосы, протестированные в анализе гемолиза, были типа Medtronic ВР-50, насос применялся для педиатрического аппарата искусственного кровообращения (СРВ) и экстракорпорального насыщения кислородом (ЕСМО), и тестовых образцов ЕВР. Скорость насосов выбиралась для поддержания скорости потока крови на уровне 500 мл/мин. Скорость для каждого ЕВР контролировалась с помощью mPBU, тогда как скорость ВР-50 5414 поддерживалась с применением консоли (Medtronic Biomedicus 540 Bioconsole). Поток в каждой петле измерялся с применением заказного ультразвукового датчика потока (Transonic Systems model ME3PXL) крови при температуре 37°C и измерителя потока (Transonic Systems model TS410). Каждый тест гемолиза выполнялся в течение 6 часов, со сбором образцов, объемом 3-5 мл, каждые 15 минут. Применялся колориметрический анализ для определения характеристик повреждения крови, с применением способов, описанных ранее. Результаты представлялись как концентрация бесплазменного гемоглобина (PFH) в течение всего времени, и наклон наилучшей эмпирической кривой применялся для вычисления степени гемолиза. Эти исследования выполнялись по три раза для каждого насоса, как до, так и после ресурсных испытаний. После каждого изучения гемолиза, насосы промывались при комнатной температуре солевыми растворами запасов крови.
[0255] Результаты гемолиза вычислялись в миллиграммах нормализованного индекса гемолиза (мг Н.И.З.), на основании ASTM F-1841, для выбора предпочтительных результатов для сравнения данных из литературы и устройств ВР-50. Отчеты по устройствам ВР-50 для ежедневных вариаций и вариаций животное-к-животному в пробах на резистентность эритроцитов, нормализованные степенью гемолиза ЕВР с применением результатов тестов ВР-50, вычислялись день в день, с применением таких же образцов крови. Они выводятся путем деления степени мг Н.И.З. ЕВР на степень мг Н.И.З. ВР-50. мг Н.И.З. определяется по формуле:
мг Н.И.З. = Δfree Hb × V × (100-Ht) / 100 × 100 / (Q×T); где
[0256] мг PFH, добавляемый на 100 мг прокачиваемой крови скорректирован для объема плазмы и нормализовано скоростью потока и временем работы. По этой причине, высокие значения ожидается при высокой скорости потока, если насос является нормально гемолитическим. Устройства ВР-50 нормализованы путем применения мг Н.И.Г. ВР-50 при такой же скорости потока с применением такого же источника крови.
[0257] На ФИГ. 55 проиллюстрированы непарные результаты для ЕВР, сравниваемых с ВР-50, выраженные в мг. Н.И.З.. На ФИГ. 56 проиллюстрированы парные результаты предварительных тестов гемолиза, результаты ЕВР в сравнении с ВР-50. На ФИГ. 57 проиллюстрирован график, отображающий тест гемолиза насоса при различной скорости потока, в эквиваленте мг. Н.И.З., тогда как на ФИГ. 58 проиллюстрирован график, отображающий тест гемолиза насоса при различной скорости потока, в эквиваленте единиц ВР-50, в соответствии с одним вариантом реализации изобретения.
[0258] Несколько исследований проведены для определения оптимального расстояния для зазора 540 и 542 между крыльчаткой и крышкой крыльчатки. Эти зазоры, предпочтительно, оптимизированы для ограничения разрушения красных кровяных телец (RBCs) за счет воздействия срезающего напряжения, как результата гемолиза. Дополнительно, желательно достигнуть эффекта гидродинамического подшипника в верхнем зазоре для противостояния гидростатической силе давления, воздействующего на нижнюю поверхность ротора и снижающего силу на верхнем подшипнике. В связи с этим, верхний и нижний зазор корпус-ротор выбирается для обеспечения минимального гемолиза и максимального гидродинамического эффекта подшипника для EBPs, работа которого требует расчетного режима скорости, потока, гидростатического давления, равных 3800 об/мин, 538 мл/мин, 125 мм ртутного столба и идеальным рабочим диапазоном потока является 50-1250 мл/мин.
[0259] В очень упрощенной модели повреждения крови гемолиз представляет собой экспоненциальную функцию срезающего давления и времени воздействия. RBCs могут допускать высокое срезающее давление (>100 Па) для короткого времени воздействия (<1 с). В ламинарном потоке между вращающимся диском и параллельным стационарным диском, срезающее давление увеличивается прямо пропорционально скорости вращения поверхности и обратно пропорционально толщине зазора. Малый зазор порядка диаметра RBC (10 μm) исключает RBC и ограничивает гемолиз. Большой диаметр порядка 1 мм связанный с рециркуляцией, которая может увеличить время воздействия и способствовать гемолизу. Посредством гидродинамического моделирования ЕВР, был протестирован верхний зазор 50, 75 и 125 μm, а также протестирован нижний зазор, равный 250 μm, для оценки гемолиза. На практике, эти зазоры имеют технологические допуски и способы производства, разработанные на ситуативном базисе для как можно меньших ограничений допусков, практичности и экономической эффективности.
[0260] Для первого исследования, описанного ниже, EBPs построены с заданным верхним зазором ротор-корпус, равным 125±50 μm и заданным нижним зазором, равным 250±50 μm. Механически обработанные компоненты имеют допуски, равные ±100 μm. Отражены средние 3 измерения общего (то есть верхнего + нижнего) зазора собранного насоса. Конический корпус или поверхность ротора отшлифована для достижения заданного общего зазора. Верхний зазор подшипника задается за счет посадки верхнего подшипника.
[0261] Тесты в лабораторных условиях прототипов ЕВР с верхним зазором 125 μm и нижним зазором 250 μm демонстрируют среднюю степень гемолиза 14 - 130 мг Н.И.Г. (или мг бесплазменного гемоглобина добавляемого на 100 литров прокачиваемой крови) при рабочем диапазоне прокачиваемого потока 100-1000 мл/мин (проиллюстрировано на ФИГ. 57). Этот выигрыш в сравнении с конкурентными тестами, одобренными FDA, Medtronic Model ВР-50 Bio-Pump® Центробежный перфузионный насос при таком же диапазоне потока с ЕВР демонстрирует нормализованную степень гемолиза, равную 1,1-2,4 ВР-50 единиц (проиллюстрировано на ФИГ. 58).
[0262] В тестах в лабораторных условиях прототипов ЕВР с верхним зазором, равным 50 μm, продемонстрирована средняя степень гемолиза, равная 3,0-4,2 мг Н.И.З. (или мг бесплазменного гемоглобина, добавляемого на 100 литров прокачиваемой крови), при работе на скорости 500 мл/мин (проиллюстрировано на ФИГ. 55). Этот выигрыш в сравнении с конкурентными тестами, одобренными FDA, Medtronic Model ВР-50 Bio-Pump® Центробежный перфузионный насос при таком же диапазоне потока с ЕВР демонстрирует нормализованную степень гемолиза, равную 0,8-2,0 ВР-50 единиц (проиллюстрировано на ФИГ. 56).
[0263] В тестах в лабораторных условиях прототипов ЕВР с верхним зазором, равным 100 μm, продемонстрирована средняя степень гемолиза, равная 0,2 мг Н.И.З. (или мг бесплазменного гемоглобина, добавляемого на 100 литров прокачиваемой крови), при работе на скорости 500 мл/мин (проиллюстрировано на ФИГ. 55). Этот выигрыш в сравнении с конкурентными тестами, одобренными FDA, Medtronic Model ВР-50 Bio-Pump® Центробежный перфузионный насос при таком же диапазоне потока с ЕВР демонстрирует нормализованную степень гемолиза, равную менее 0,1 ВР-50 единиц (проиллюстрировано на ФИГ. 56).
[0264] Эффект гидродинамического подшипника возникает, когда слой жидкости между подвижной и стационарной поверхностью совпадает в направлении сдвига. Жидкость втягивается и протекает через слой за счет подвижной поверхности. Давление внутри слоя жидкости пропорционально скорости поверхности, умноженной на вязкость жидкости и обратно пропорционально квадрату толщины слоя. Силы гидродинамического подшипника между поверхностями пропорциональны площади, на которую воздействует давление.
[0265] Верхняя поверхность 7 лопаток крыльчатки ЕВР имеет комбинированную площадь, равную 96, 1 мм2 (ссылаясь на ФИГ. 4G). В лабораторных условиях изучение нагрузки на подшипник прототипов ЕВР без обратной стенки двигателя демонстрируют разгрузку верхнего подшипника при 4000 об/мин для верхнего зазора, равного 0-175 μm (проиллюстрировано на ФИГ. 4Н).
[0266] На основании приведенного выше анализа и тестов верхний и нижний зазор ротор-корпус в этом варианте реализации ЕВР находится в диапазоне от 25 до 225 μm и от 150 до 350 μm, соответственно, или, предпочтительно, в диапазоне от 75 до 175 μm и от 200 до 300 μm, соответственно, или, номинально, от 100 μm до 250 μm, соответственно.
[0100] Затем была создана артериовенозная фистула (АВФ) и было выполнено прямое хирургическое соединение между артерией и веной. Для того чтобы попытаться получить АВФ для применения в качестве места сосудистого доступа при длительном гемодиализе, пациент обычно нуждается в том, чтобы периферические вены имели диаметр >2,5-3,0 мм. После создания "приточная" артерия и "выпускная" вена содержат АВФ, необходимую для расширения, а поток крови в АВФ выпускной вены, нуждающейся в увеличении для АВФ, для развития и последующей пригодности для гемодиализа. В соответствии с критериями, установленными Национальным почечным фондом (KDOQI) для АВФ, считающейся развивающейся, выпускная вена должна быть расширена по меньшей мере до 6 мм и поток крови в выпускной вене должен быть повышен по меньшей мере до 600 мл/мин.
Применяя имитационную петлю АВФ, проиллюстрированную на ФИГ. 59, был выполнен стендовый эксперимент для определения воздействия диаметра выпускной вены АВФ на срезающее давление на стенку сосуда (WSS) выпускной вены АВФ при начальном диаметре приточной артерии, равном 4 мм (внутр.). Применялся HeartMate 2000 IP LVAS для формирования САД (среднее артериальное давление)=120 мм ртутного столба в имитационной циркуляционной петле. Около 50 см трубки Tygon с внутренним диаметром 4 мм использовалось для симуляции АВФ приточной лучевой артерии. Применяли около 80 см трубки Tygon для симуляции АВФ выпускной головной вены с внутренним диаметром 2, 3, 4, 5 или 6 мм. Применяли ультразвуковой датчик потока Transonic (TS410/ME3PXL) для определения скорости потока крови в АВФ выпускающей вены. Был размещен датчик давления NETech (Digimano 200-2000IN) на впускное отверстие насоса, выпускное отверстие насоса, анастомозе соединительная трубка-вена. Применяли 35% раствор глицерина в водопроводной воде при @ 22°C для симуляции крови. Как проиллюстрировано на ФИГ. 60, уровень WSS АВФ выпускающей вены изменяется в широких пределах в зависимости от диаметра АВФ выпускной вены, демонстрируя, что артериальное кровяное давление и диаметр сосудов определяют уровень WSS выпускной вены, факторы, которые не могут эффективно контролироваться при создании АВФ и ее развитии.
Применяя имитационную циркуляционную петлю АВФ, проиллюстрированную на ФИГ. 53, был выполнен стендовый эксперимент для определения воздействия скорости системы насоса AFE и диаметра выпускной вены системы AFE на срезающее давление на стенку сосуда (WSS) выпускной вены системы AFE. Тестовая цепь содержит приточные и выпускные соединительные трубки 5302 и 5304, имитационную выпускную вену 5306 и имитационный коллатеральный сосуд 5308 и 5310. Применяли резервуар А 1 L для симуляции венозной системы. Применяли около 45 см трубки Tygon с внутренним диаметром 4 мм для симуляции приточной и выпускной соединительной трубки системы AFE. Применяли около 80 см трубки Tygon для симуляции выпускной вены с внутренним диаметром 2, 3, 4, 5 или 6 мм. Применяли ультразвуковой датчик потока Transonic (TS410/ME3PXL) для определения скорости потока крови в АВФ выпускающей вены. Были размещены датчики давления NETech (Digimano 200-2000IN) на впускное отверстие насоса, выпускное отверстие насоса, анастомозе соединительная трубка-вена. Применяли 35% раствор глицерина в водопроводной воде при @ 22°C для симуляции крови. Как проиллюстрировано на ФИГ. 61, постоянная доза WSS, равная 4 Па, управляется выпускной веной системы AFE с диаметром вены до 5 мм путем изменения скорости насоса.
[0267] Тогда как изобретение было пояснено в отношении образца и варианта реализации, следует понимать, что для специалистов в данной области техники будут очевидны различные модификации после прочтения описания. В связи с этим следует понимать, что раскрытое в данном документе изобретение предположительно покрывает такие модификации в пределах объема прилагаемой формулы изобретения.