БИОЛОГИЧЕСКИЕ МАРКЕРЫ, КОТОРЫЕ МОГУТ БЫТЬ ИСПОЛЬЗОВАНЫ В ИММУНОТЕРАПИИ РАКА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к области иммунотерапии рака и к области противовоспалительных лекарственных средств. В частности, настоящее изобретение относится к способам и наборам, предназначенным для применения в лечении, в котором используется диагностическое/прогностическое значение эотаксина и С-реактивного белка.
Уровень техники
16-мерный пептид EARPALLTSRLRFIPK (SEQ ID NO: 1; также называемый "GV1001") представляет собой фрагмент человеческого фермента теломеразы (WO 00/02581). Пептид GV1001 связывается с некоторыми молекулами главного комплекса тканевой совместимости человека (HLA) II класса и несет предполагаемые эпитопы I класса HLA. В этой связи считается, что указанный пептид способен вызывать комбинированную реакцию CD4/CD8 Т-клеток, которая в свою очередь имеет значение для запуска уничтожения опухолей и долговременной памяти. В клинических исследованиях были выявлены GV1001-специфичные Т-клеточные реакции, без клинически значимой токсичности более чем у 50% больных распространенным раком поджелудочной железы и раком легких (Kyte J.A. (2009), Expert Opin. Investig Drugs 18(5):687-94.
Фондом Продления жизни (Life Extension foundation) была опубликована он-лайн статья о хроническом воспалении (www.lef.org; доступна с 6 июня 2013 года), посвященная отдаленным последствиям для здоровья хронического, слабо выраженного воспаления, и в этой статье рассмотрены различные маркеры и медиаторы воспаления, в том числе фактор некроза опухоли - альфа (TNF-α), ядерный фактор каппа-B (NF-В), интерлейкины, С-реактивный белок (CRP), эйкозаноиды, циклооксигеназы (COX) и липооксигеназы (LOX) и различные другие индуцирующие факторы.
Guo et al. (J. Immunol. 2001; 166: 5208-5218) выявили положительную регуляцию мРНК эотаксина и белка во время воспалительной реакции в крысиной модели острого воспалительного повреждения, и исследовали роль этого феномена в рекрутинге нейтрофилов.
Эотаксин-1, -2 и -3 (также называемые CCL11, CCL24 и CCL26) представляют собой известные хемокины, участвующие в рекрутинге эозинофилов и других лейкоцитов, и эффекты указанных эотаксинов обусловлены связыванием с клеточной поверхностью рецепторов хемокинов (например, CCR3).
Раскрытие изобретения
Техническая задача
Целью вариантов осуществления настоящего изобретения является разработка улучшенных способов прогнозирования эффективности лечения лекарственными препаратами, полученными из GV1001, а также способов прогнозирования выживаемости больных раком, в частности, раком поджелудочной железы.
Решение задачи
Было проведено многоцентровое клиническое исследование (TeloVac), III фаза, по применению вакцины на основе GV1001 при распространенном и метастатическом раке поджелудочной железы, посредством Отдела клинических исследований UK Liverpool Clinical Trials Unit, при поддержке GemVax AS, дочерней компании KAEL-GemVax.
В клиническом исследовании принимали участие 1062 пациента в 52 центрах по всей Великобритании. На фоне отсутствия каких-либо существенных различий в общей выживаемости между группами, которые получали вакцину и контрольной группой, в которой применяли химиотерапию, в это испытание, тем не менее, также была включена обширная программа трансляционного исследования. Начальные результаты показали, что вакцина вызывает выраженный противовоспалительный ответ, что хорошо коррелирует с новым исследованием, которое проводит материнская компания Kael-GemVax. Дополнительно, в подгруппе пациентов были выявлены в качестве индикаторов повышенной выживаемости 3 возможных биомаркера - эотаксин, MIP1α и CRP.
Полезные эффекты изобретения
Таким образом, в широком аспекте, настоящее изобретение относится к применению эотаксина и/или MIP1α и/или CRP в качестве прогностических инструментов, используемых в терапевтическом лечении вместе с материалом, полученным из GV1001.
Краткое описание чертежей
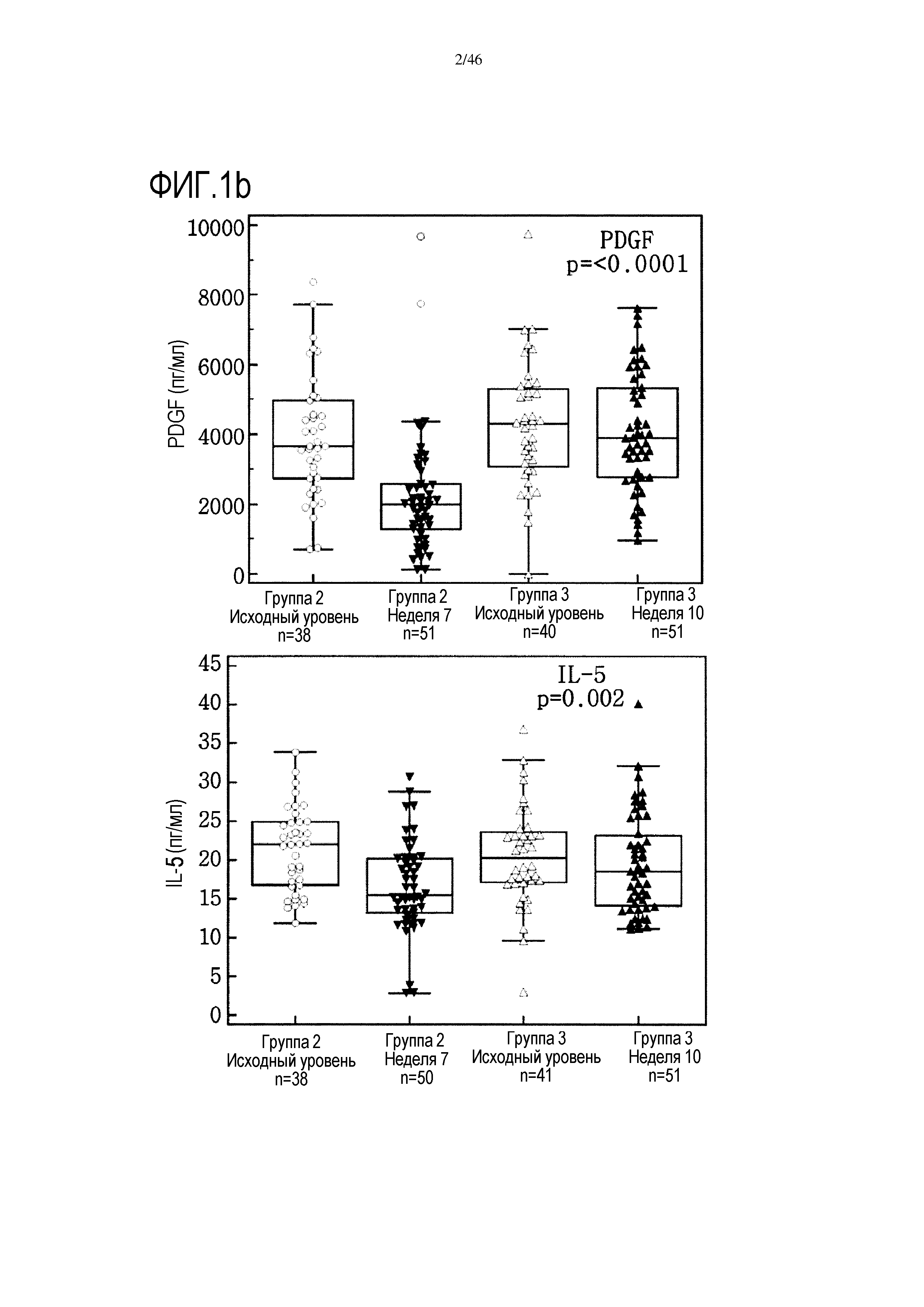
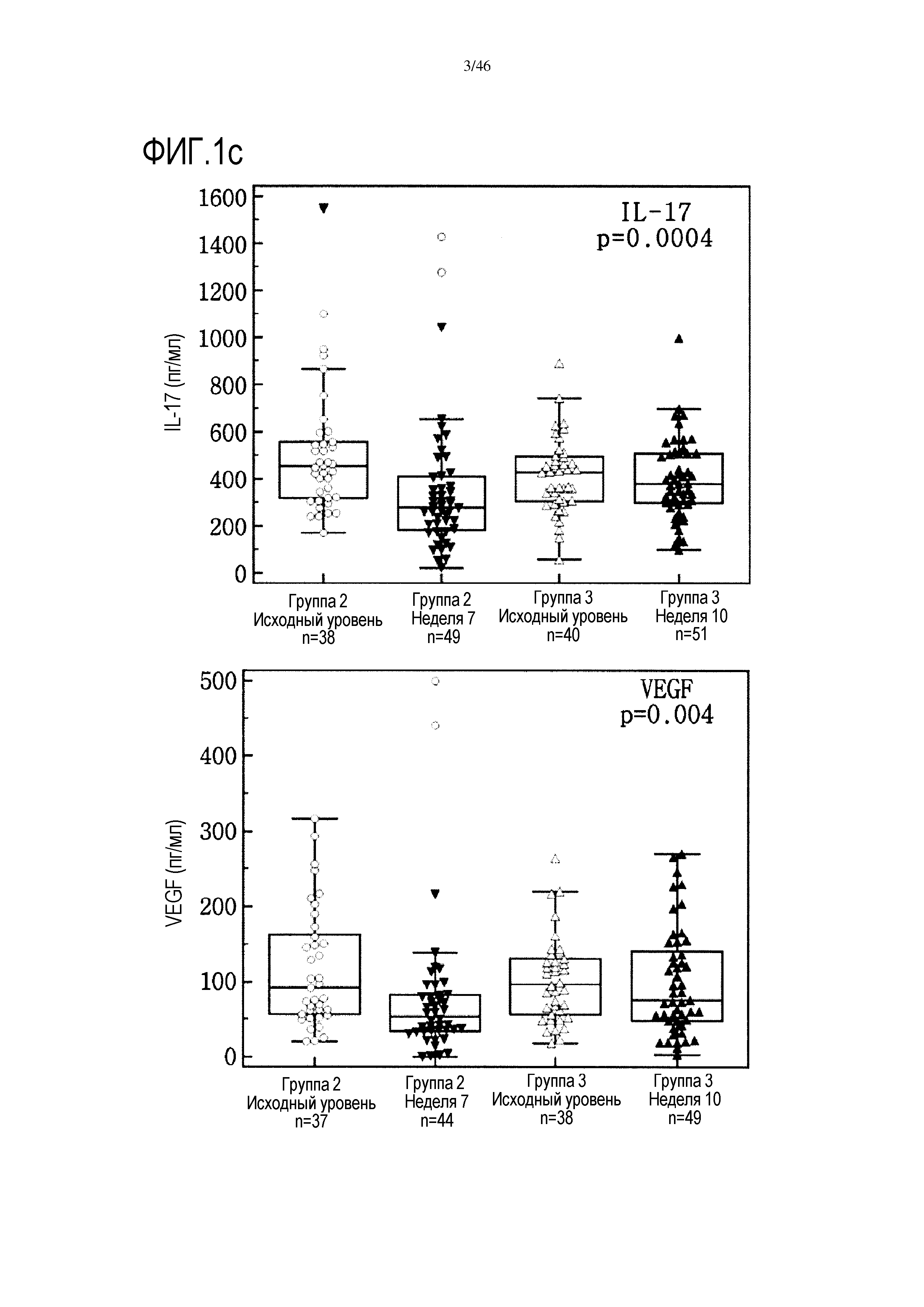
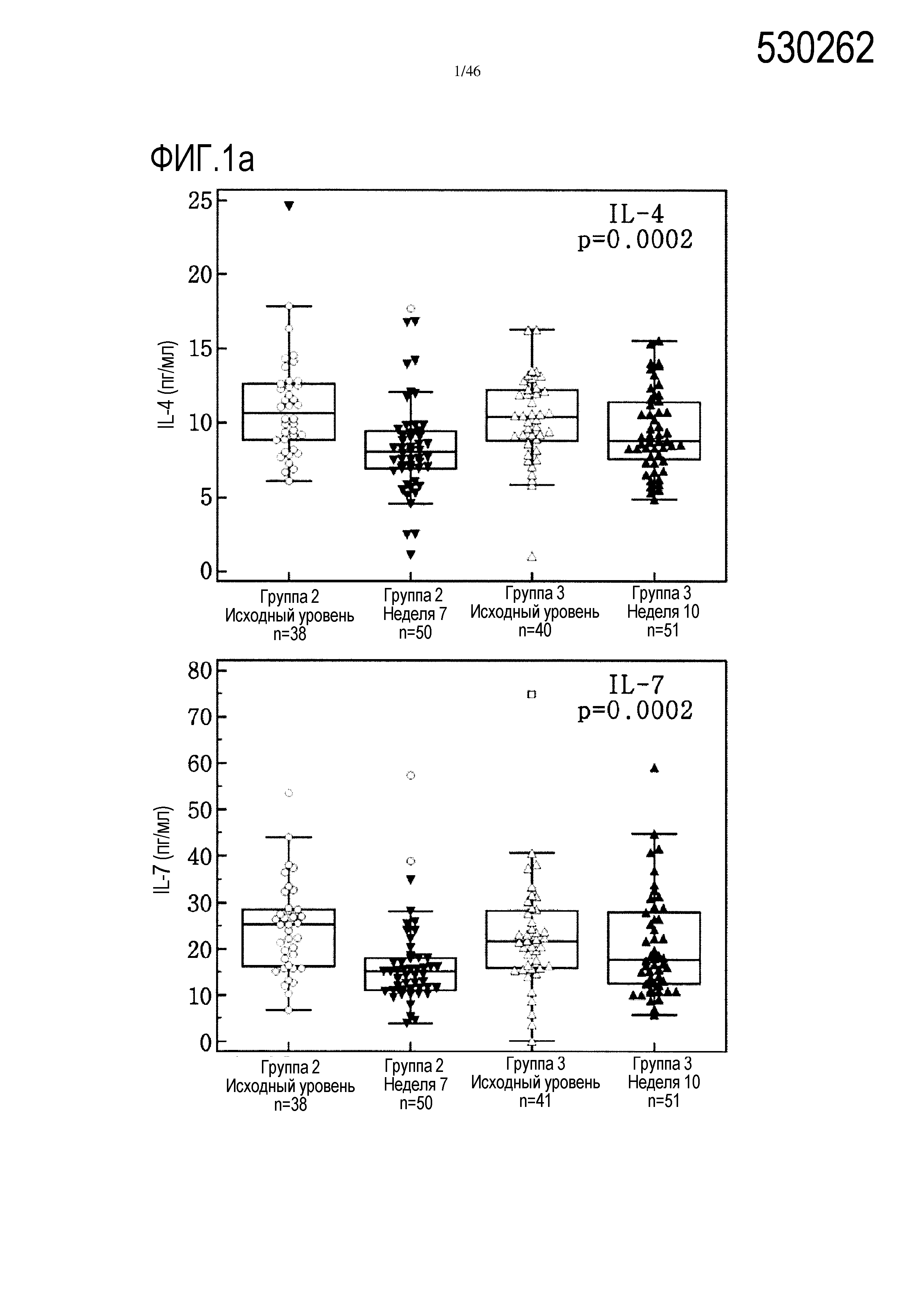
Фигура 1(a-c): графики, показывающие уровни IL-4, IL-5, IL-7, IL-17, тромбоцитарного фактора роста (PDGF) и фактора роста эндотелия сосудов (VEGF) в сыворотке от испытуемых пациентов исходных групп 2 и 3, от группы 2 на 7 неделе и от группы 3 на 10 неделе (нескорректированные р-значения в тесте Крускала-Уоллиса).
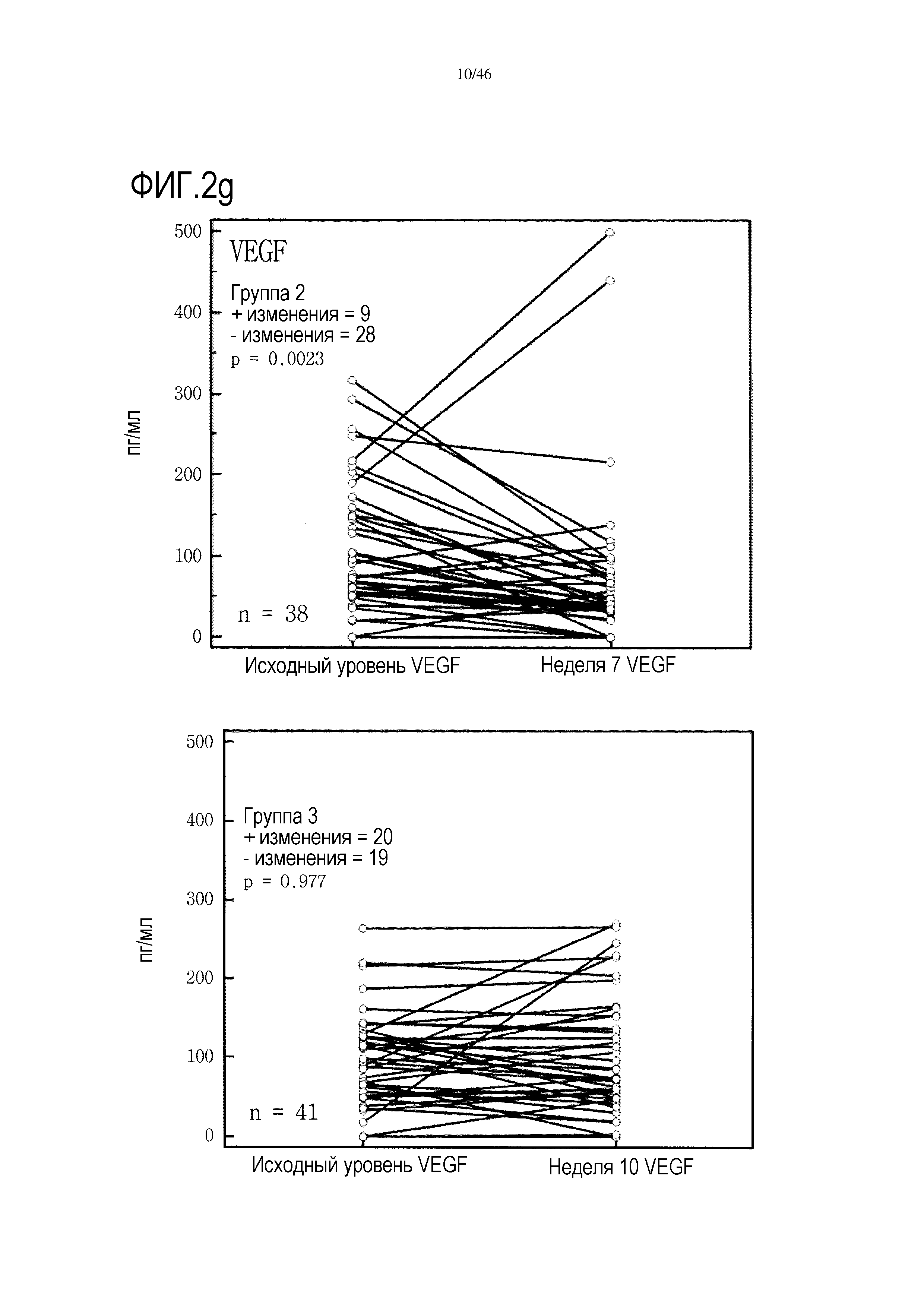
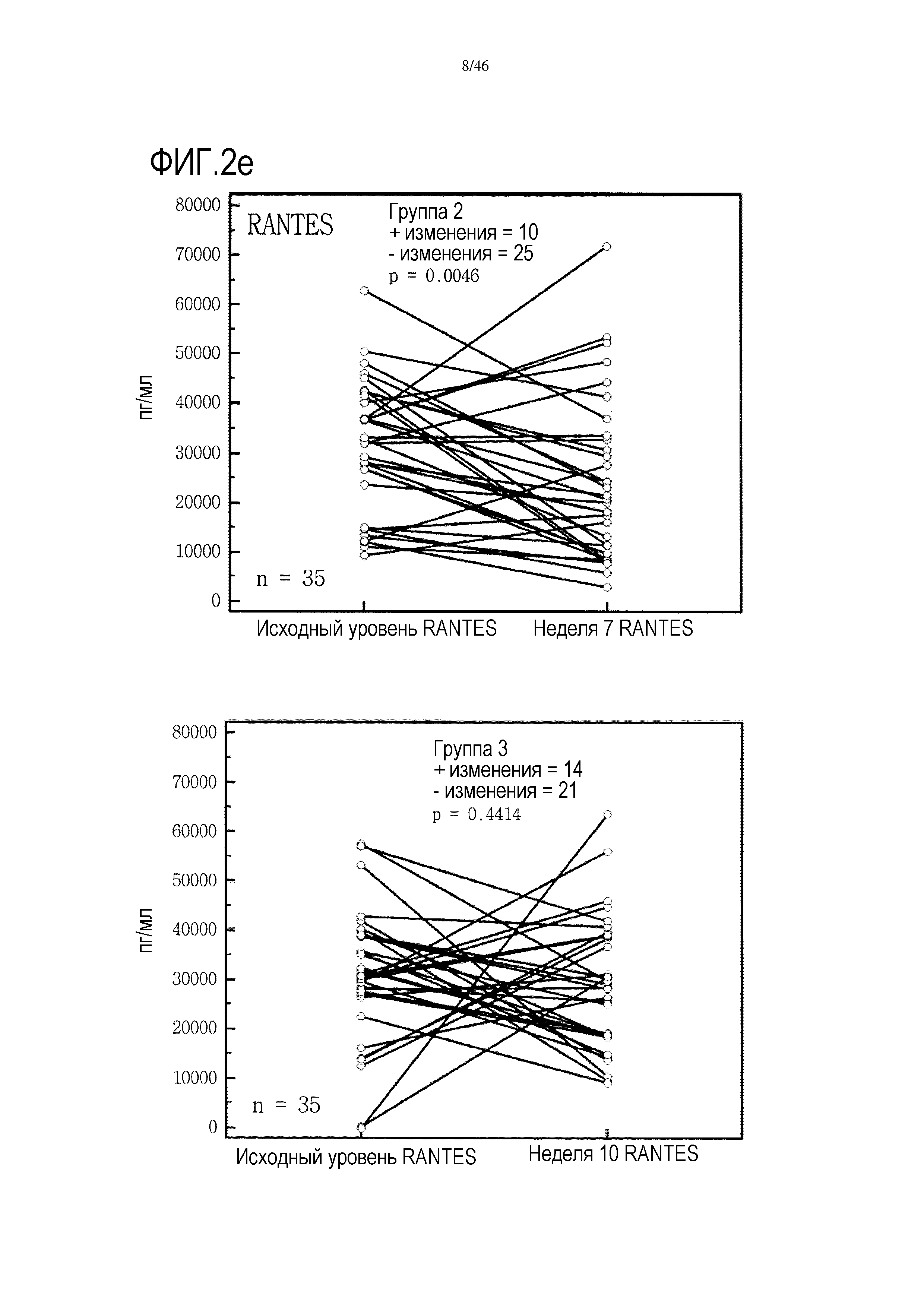
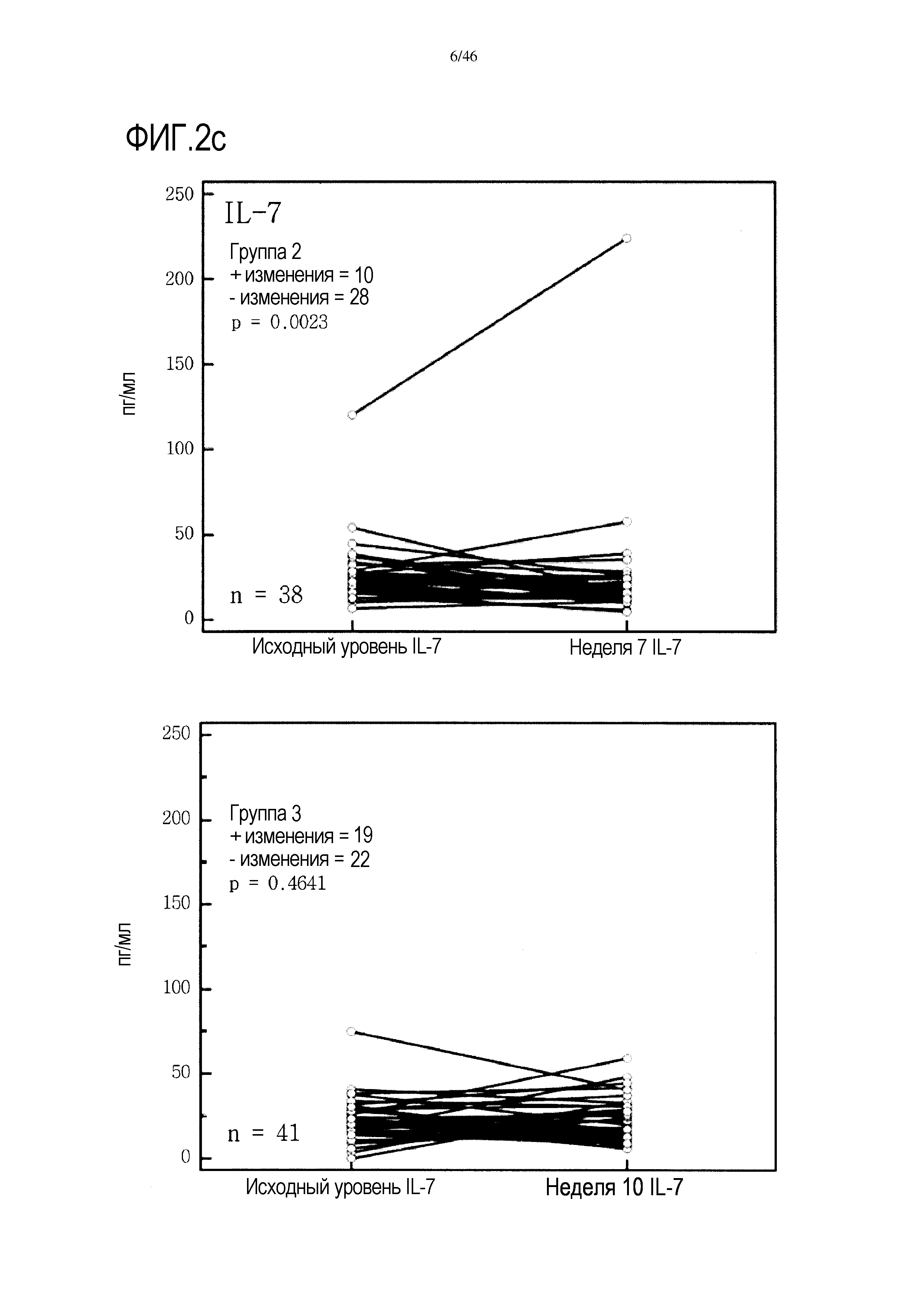
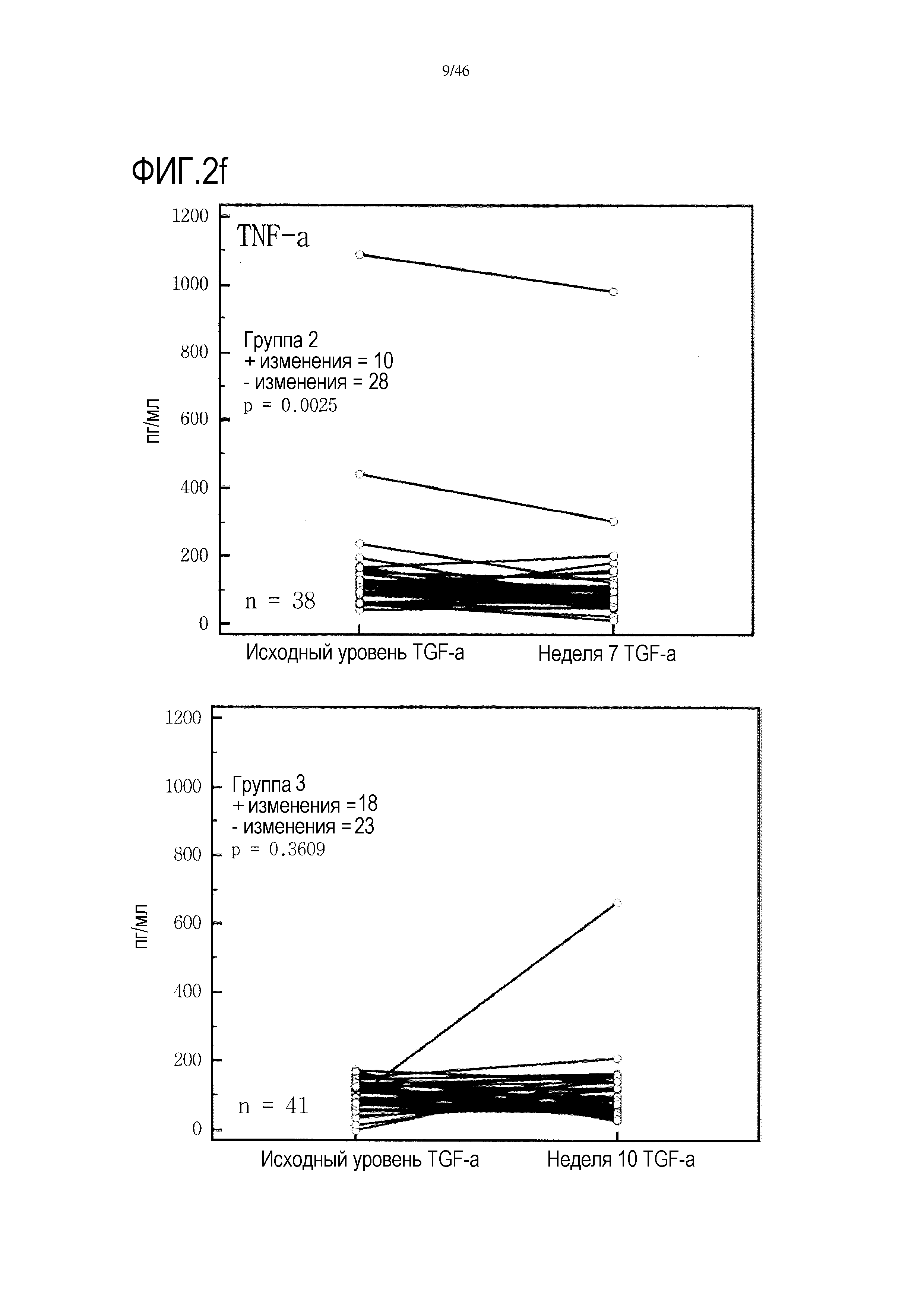
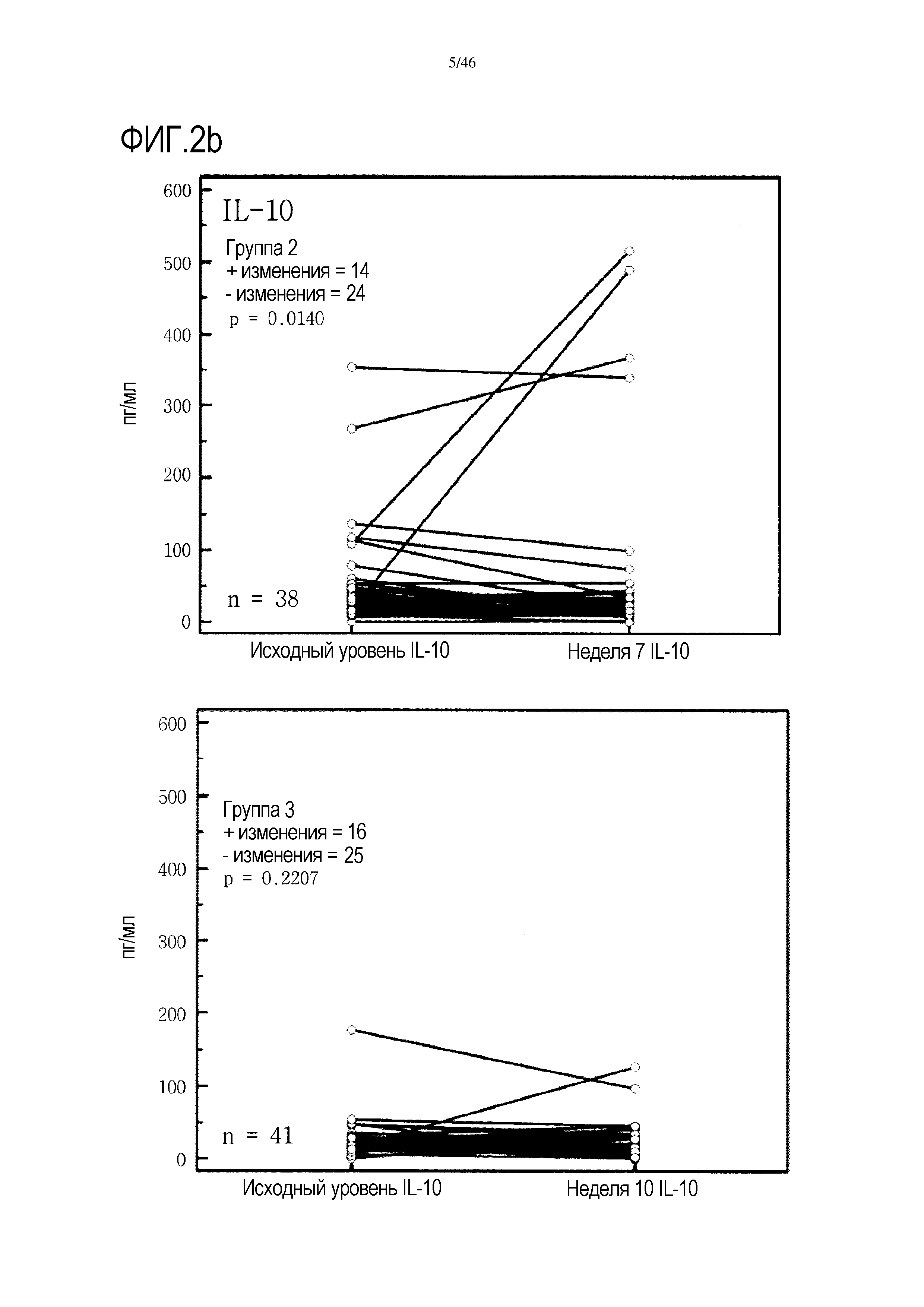
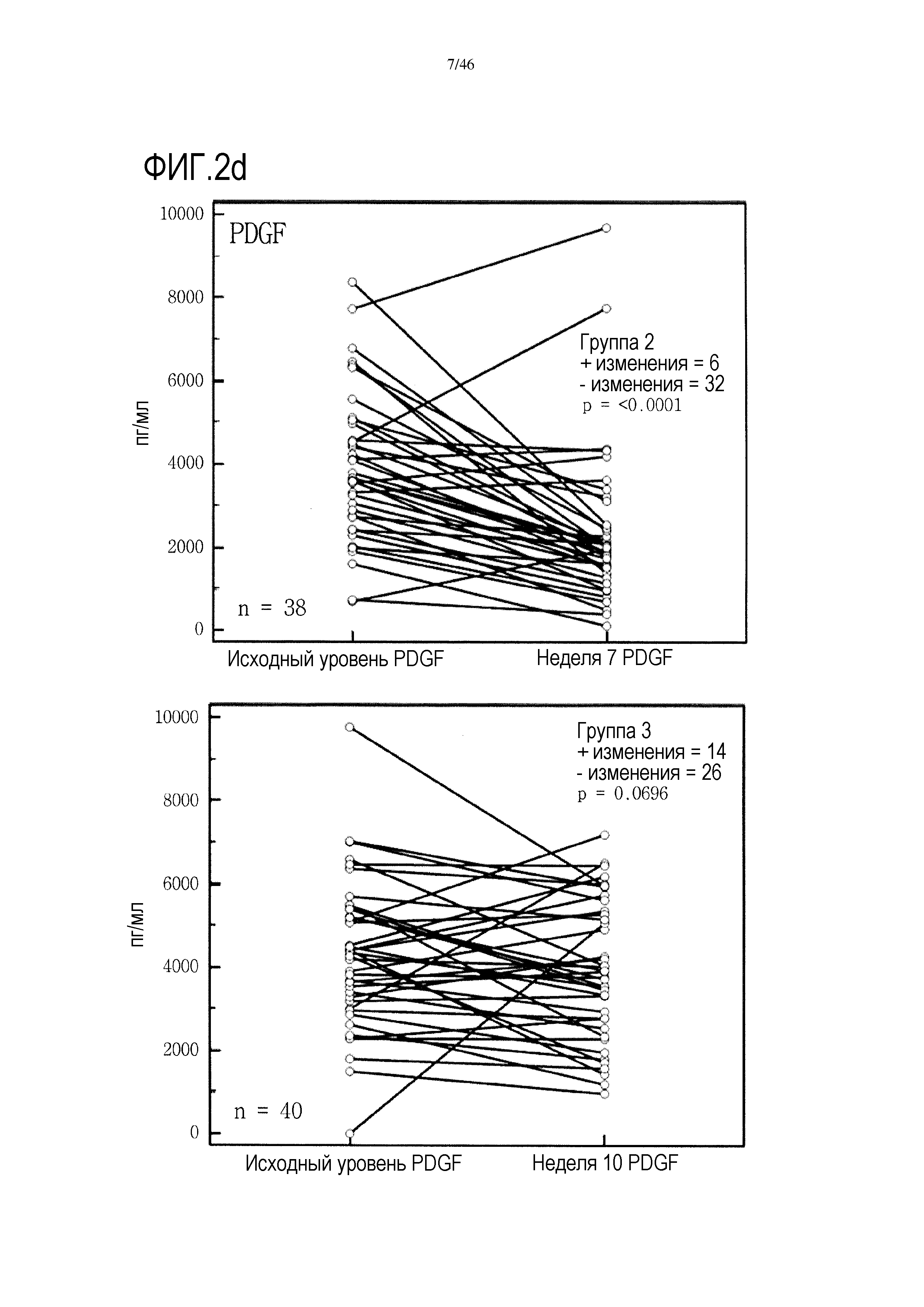
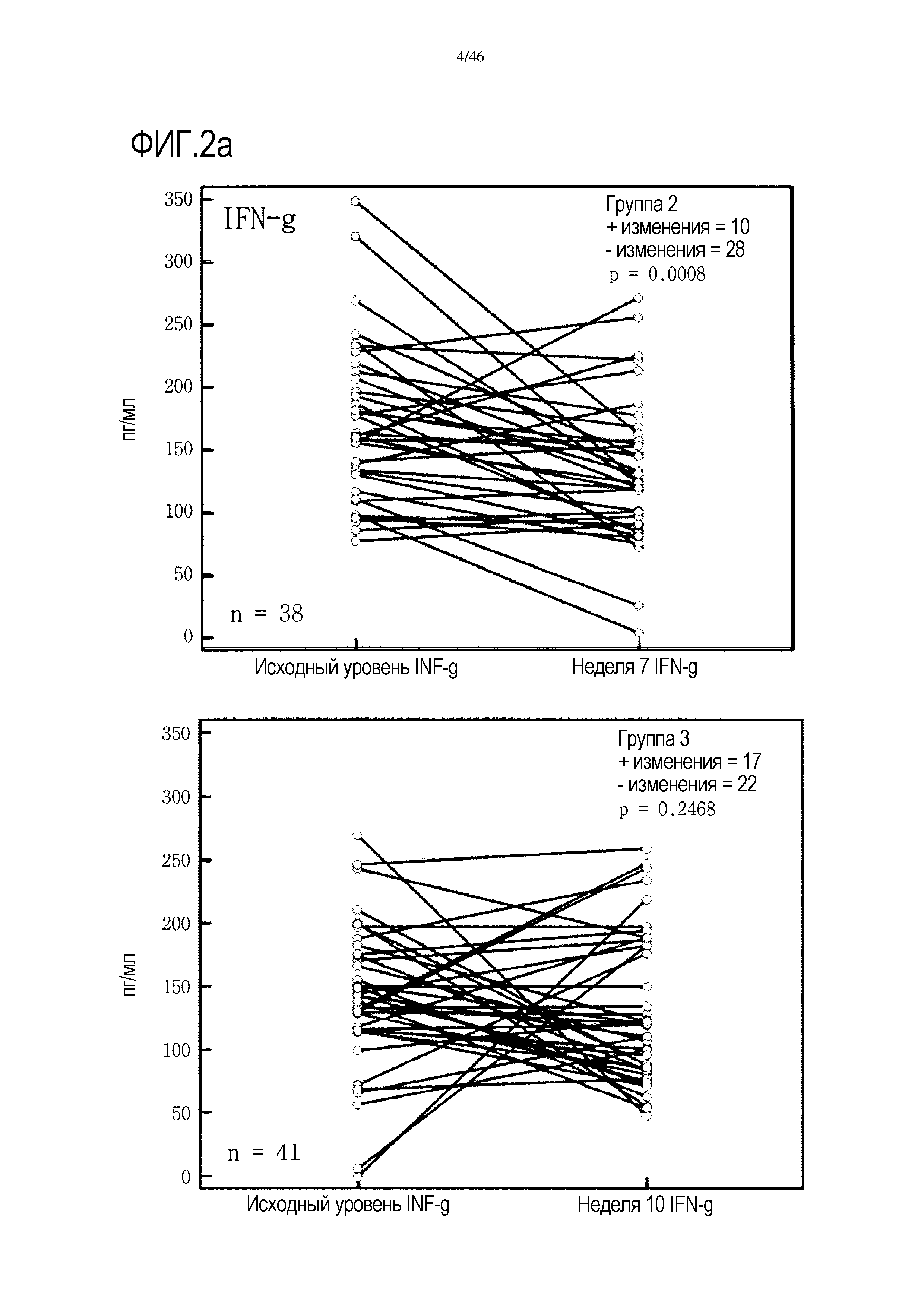
Фигура 2(a-g): графики, показывающие изменение уровней IFNγ, IL-10, IL-7, PDGF, хемокина, экспрессируемого и секретируемого T-клетками при активации (RANTES), TNF и VEGF в группах 2 и 3. Вместе с р-значениями также показано количество положительных (+) и отрицательных (-) изменений.
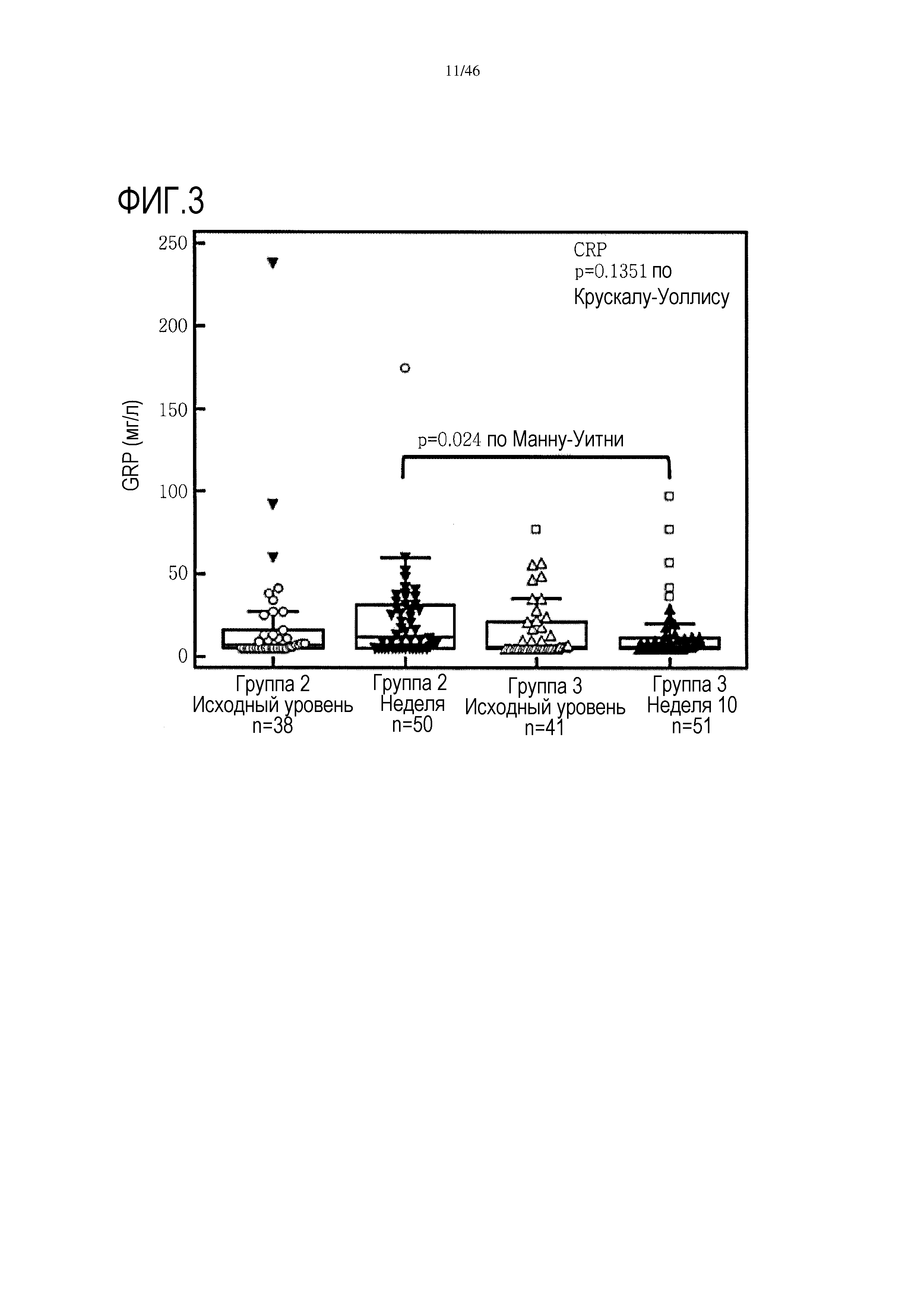
Фигура 3: Исходные уровни CRP и уровни CRP после лечения в группах 2 и 3 пациентов.
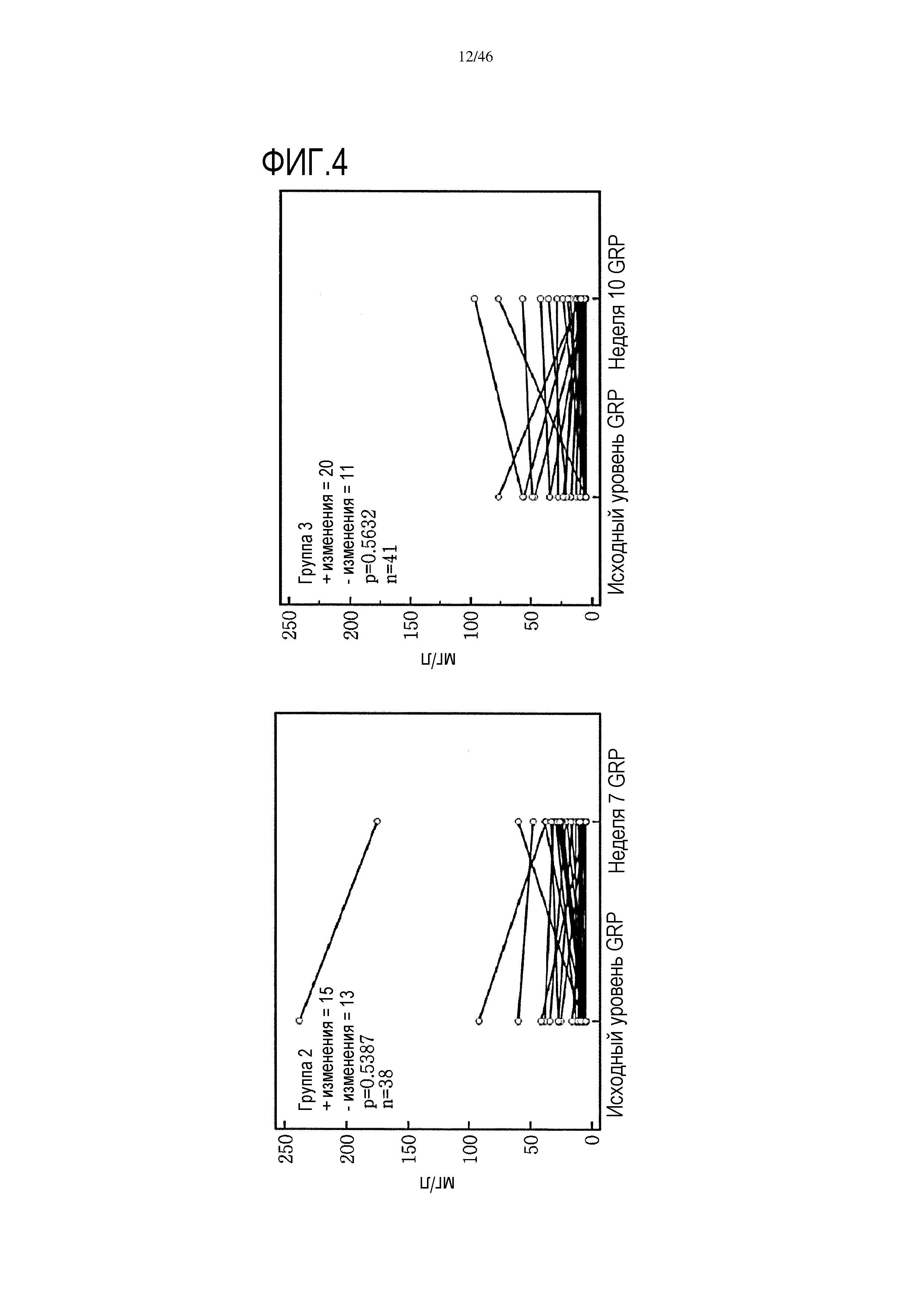
Фигура 4: Парный анализ CRP в группе 2 пациентов (слева) и в группе 3 пациентов (справа), исходный уровень и уровень после лечения. Вместе с р-значениями также показано количество положительных (+) и отрицательных (-) изменений.
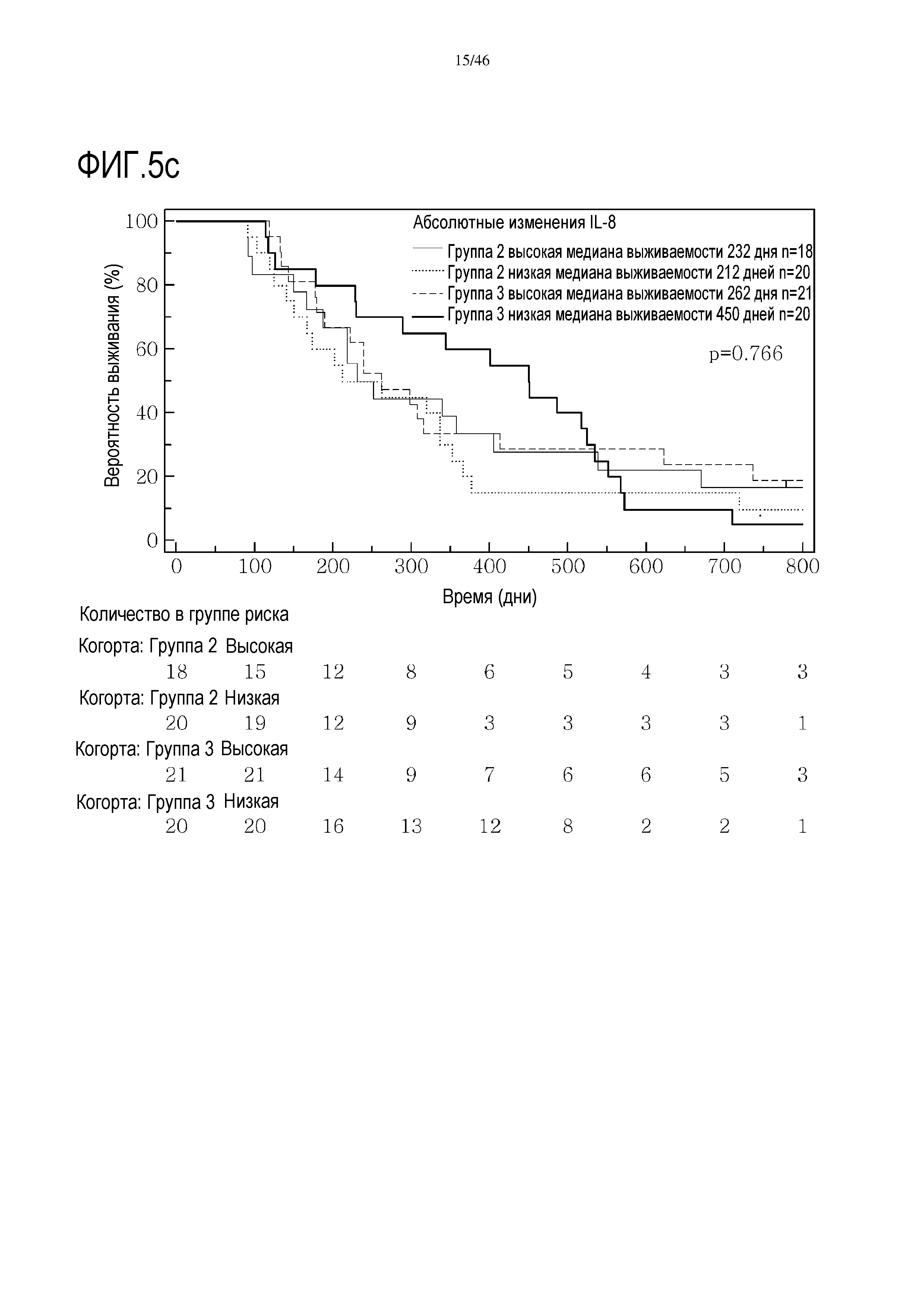
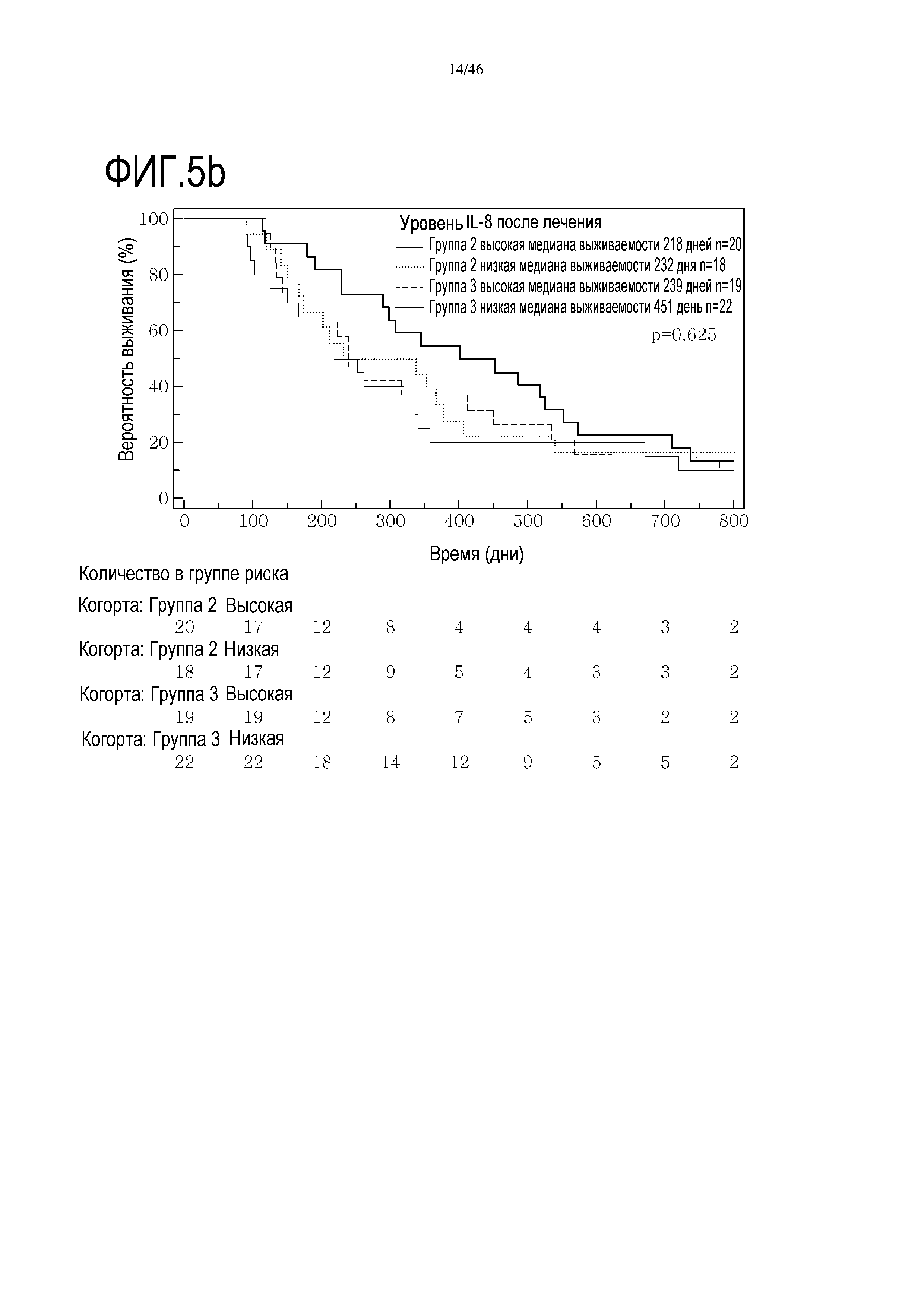
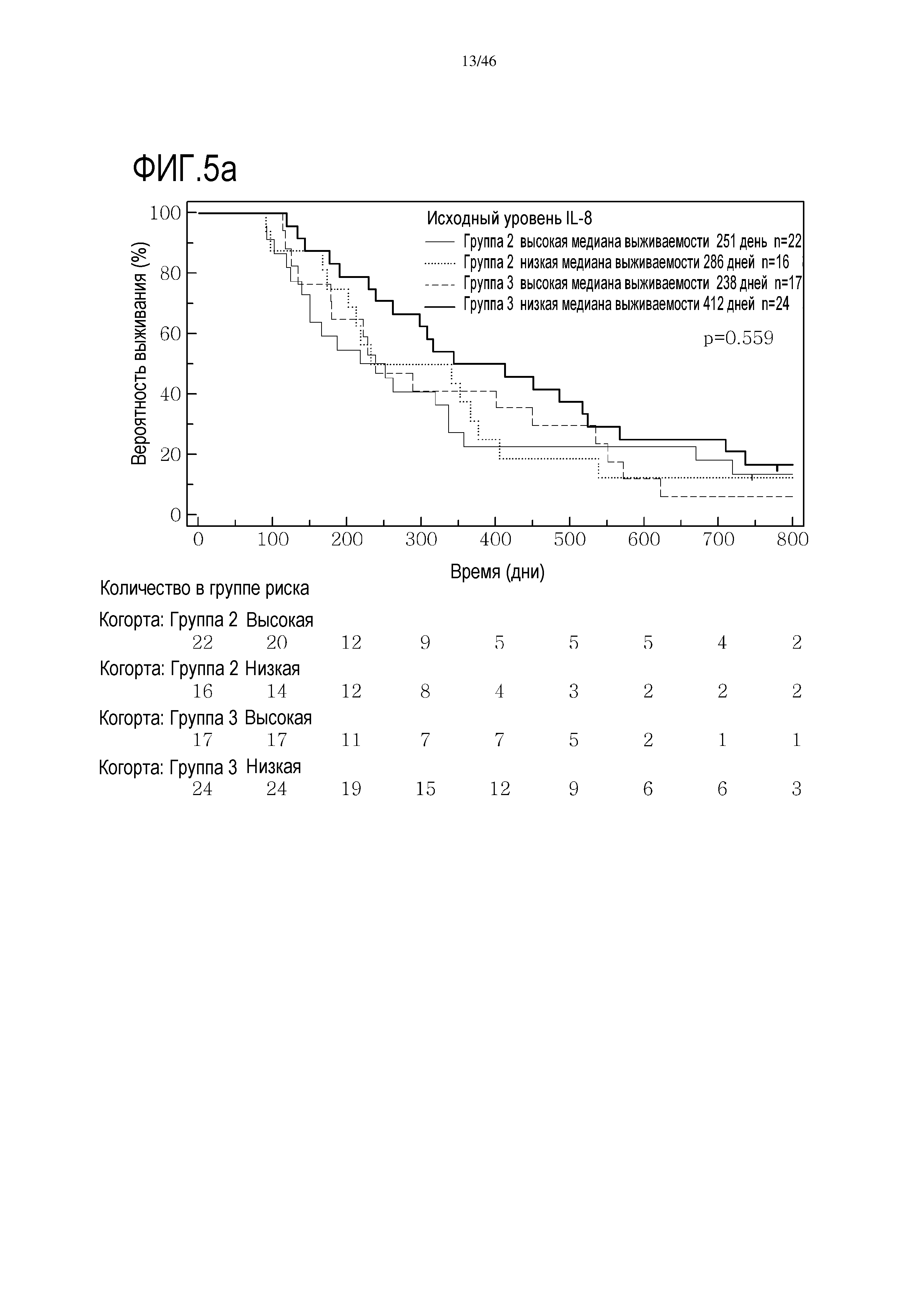
Фигура 5: Кривые выживаемости при использовании IL-8, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
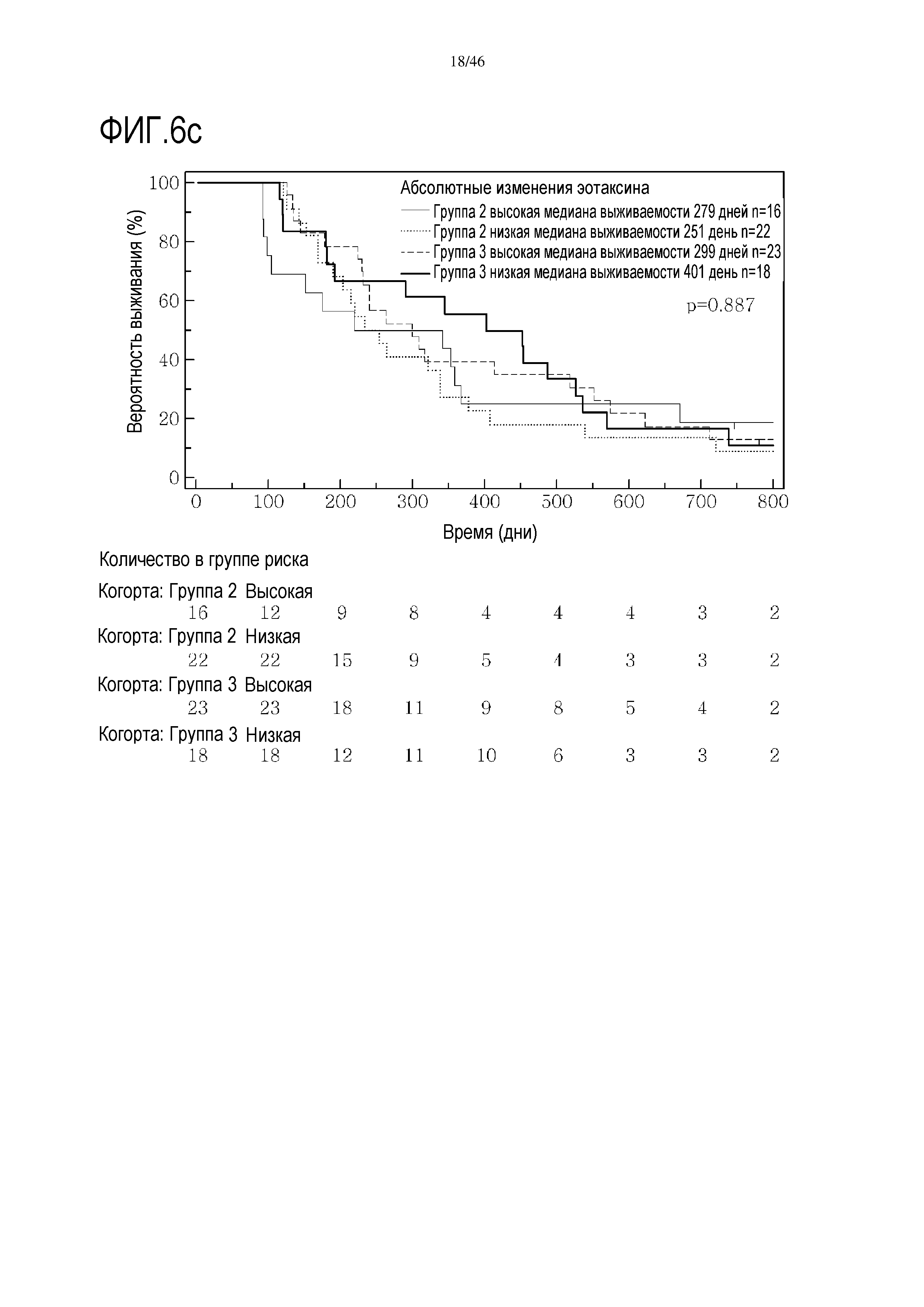
Фигура 6: Кривые выживаемости при использовании эотаксина, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
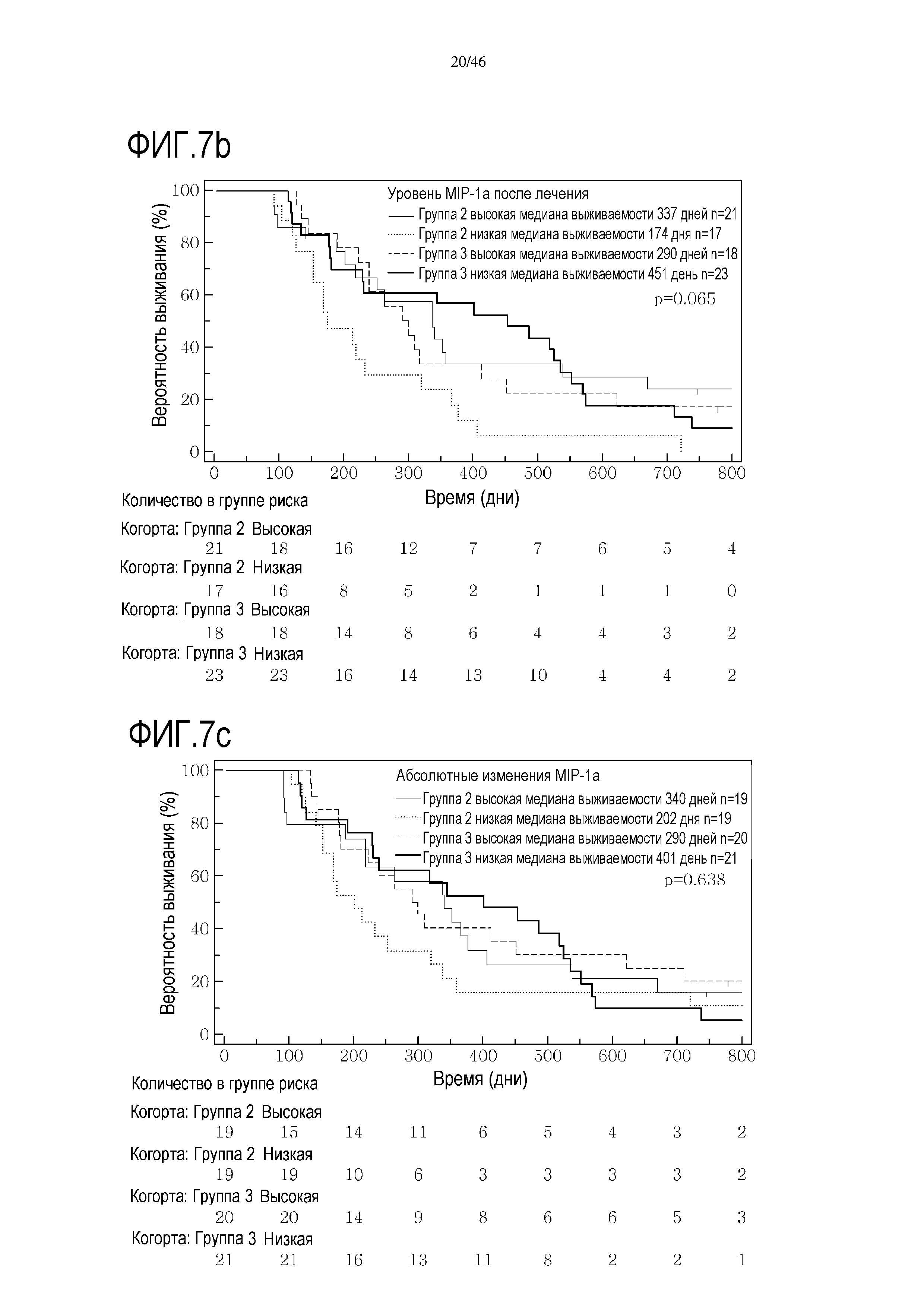
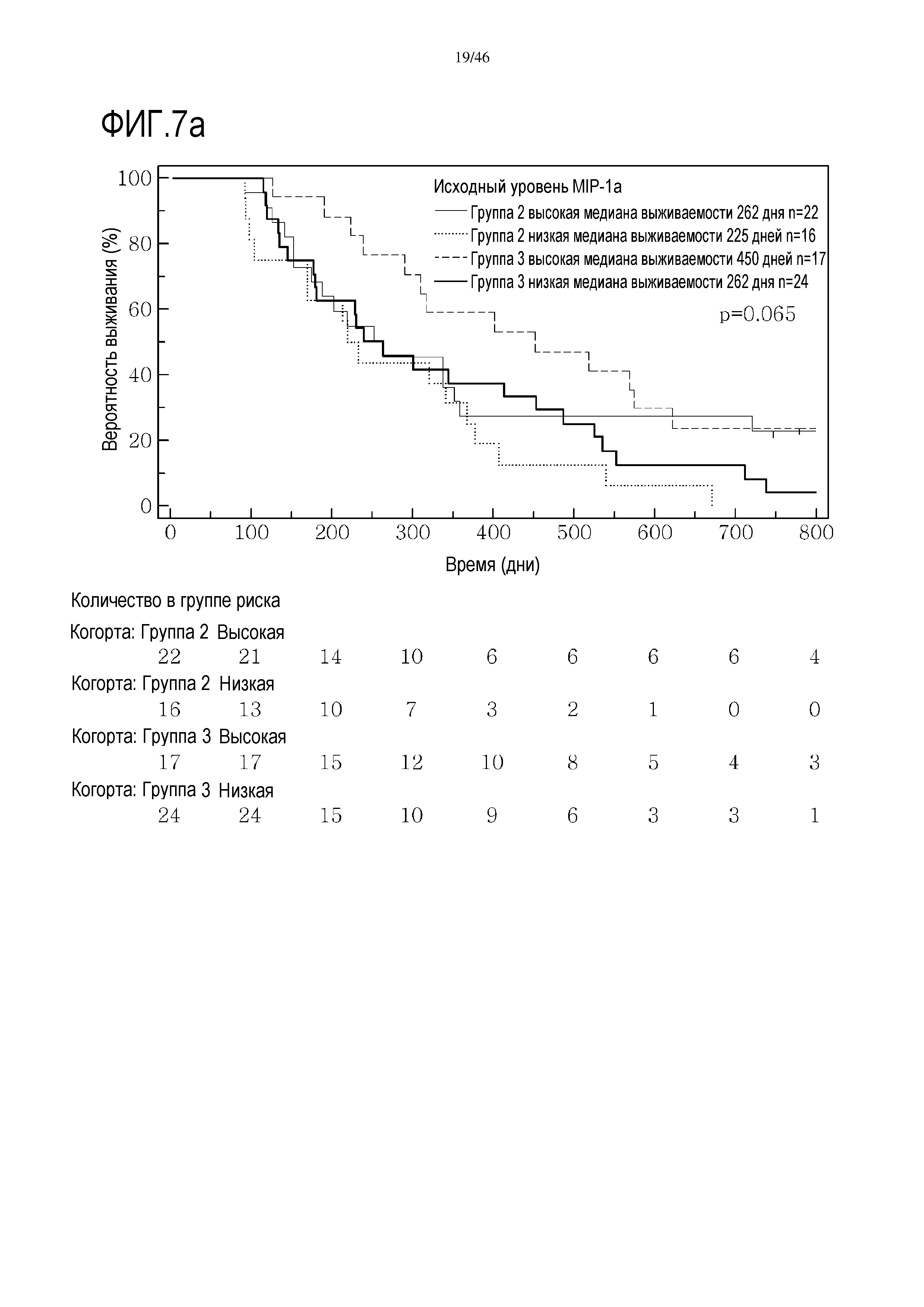
Фигура 7(a-b): Кривые выживаемости при использовании MIP1α, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
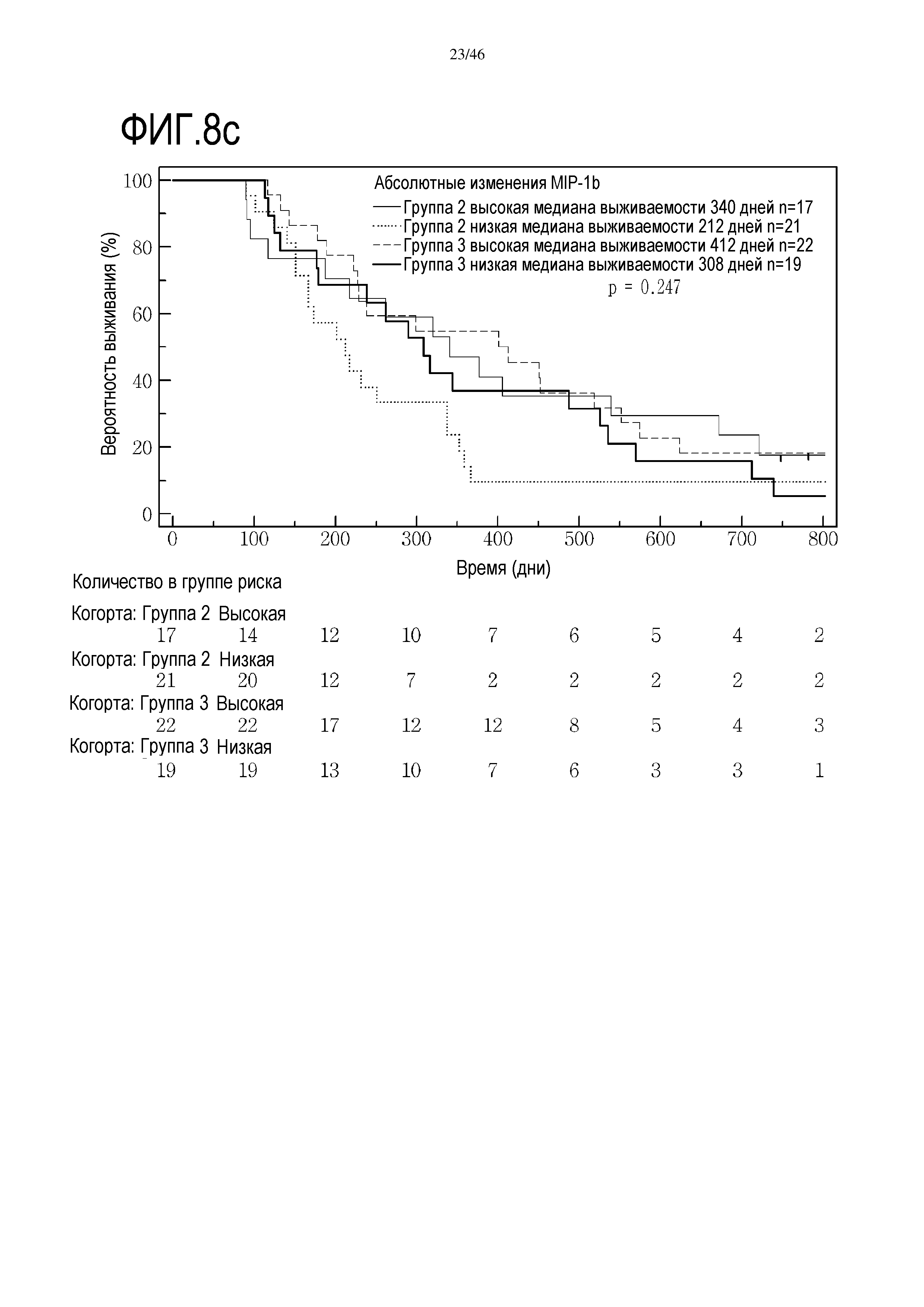
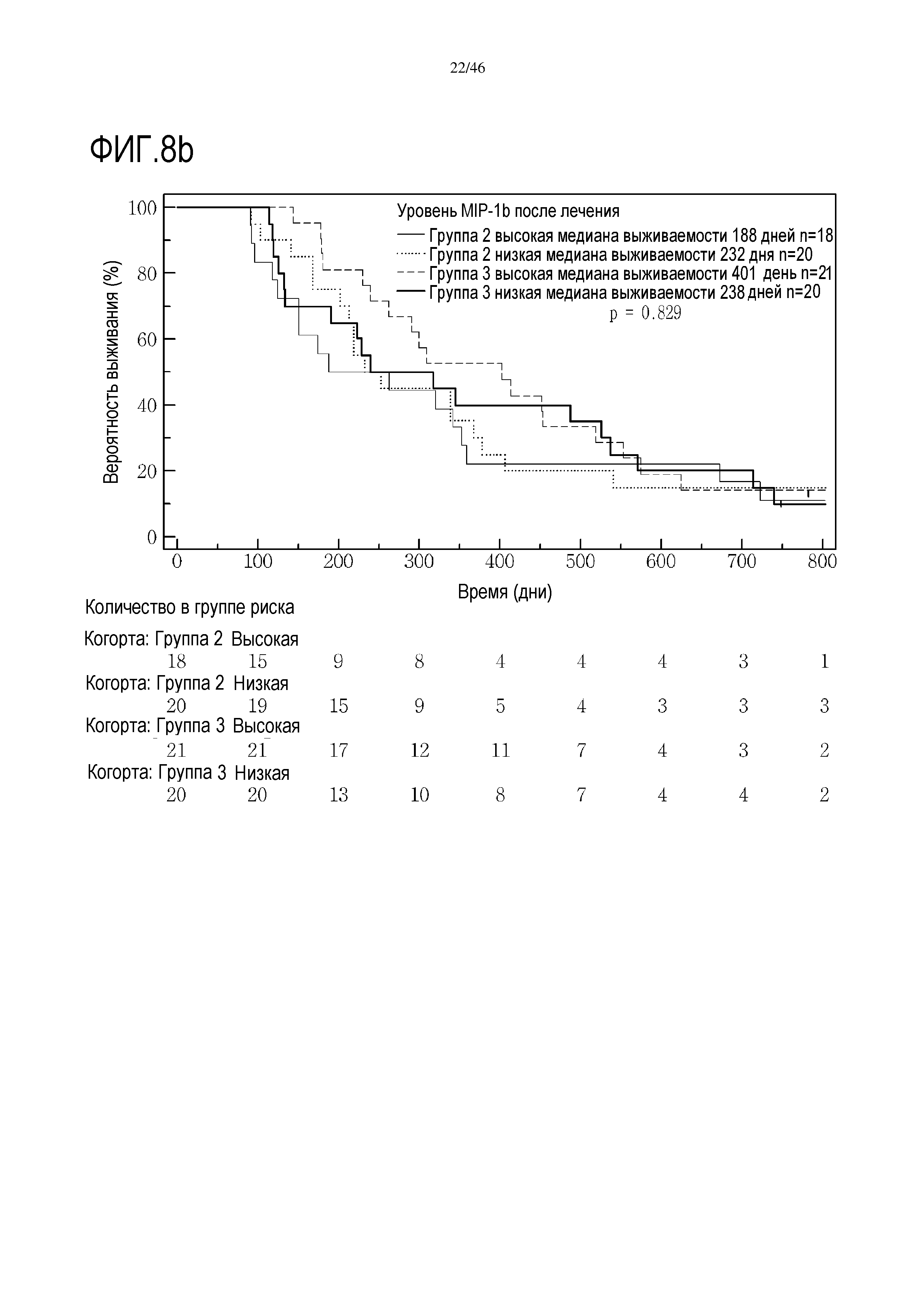
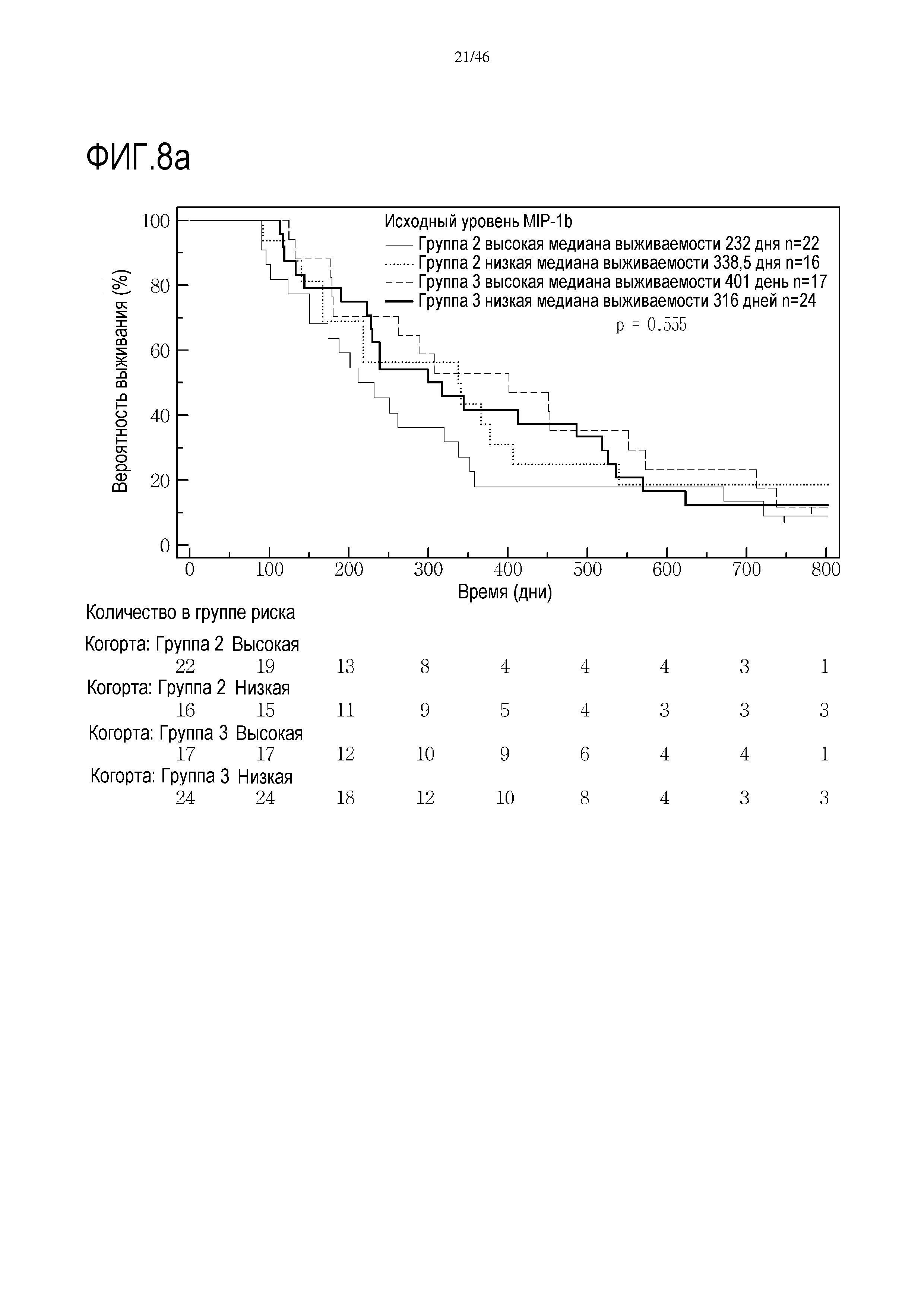
Фигура 8: Кривые выживаемости при использовании MIP1β, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
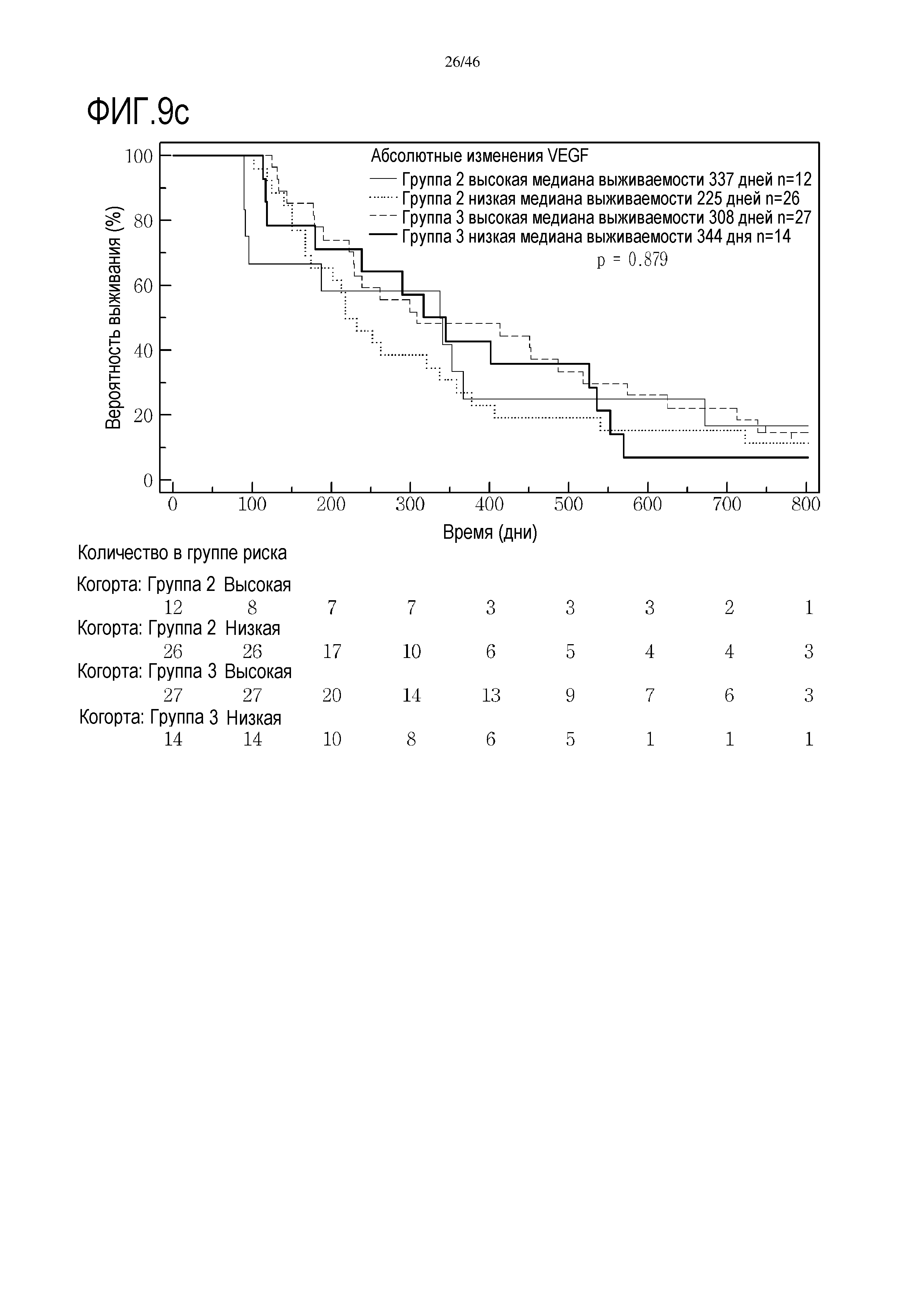
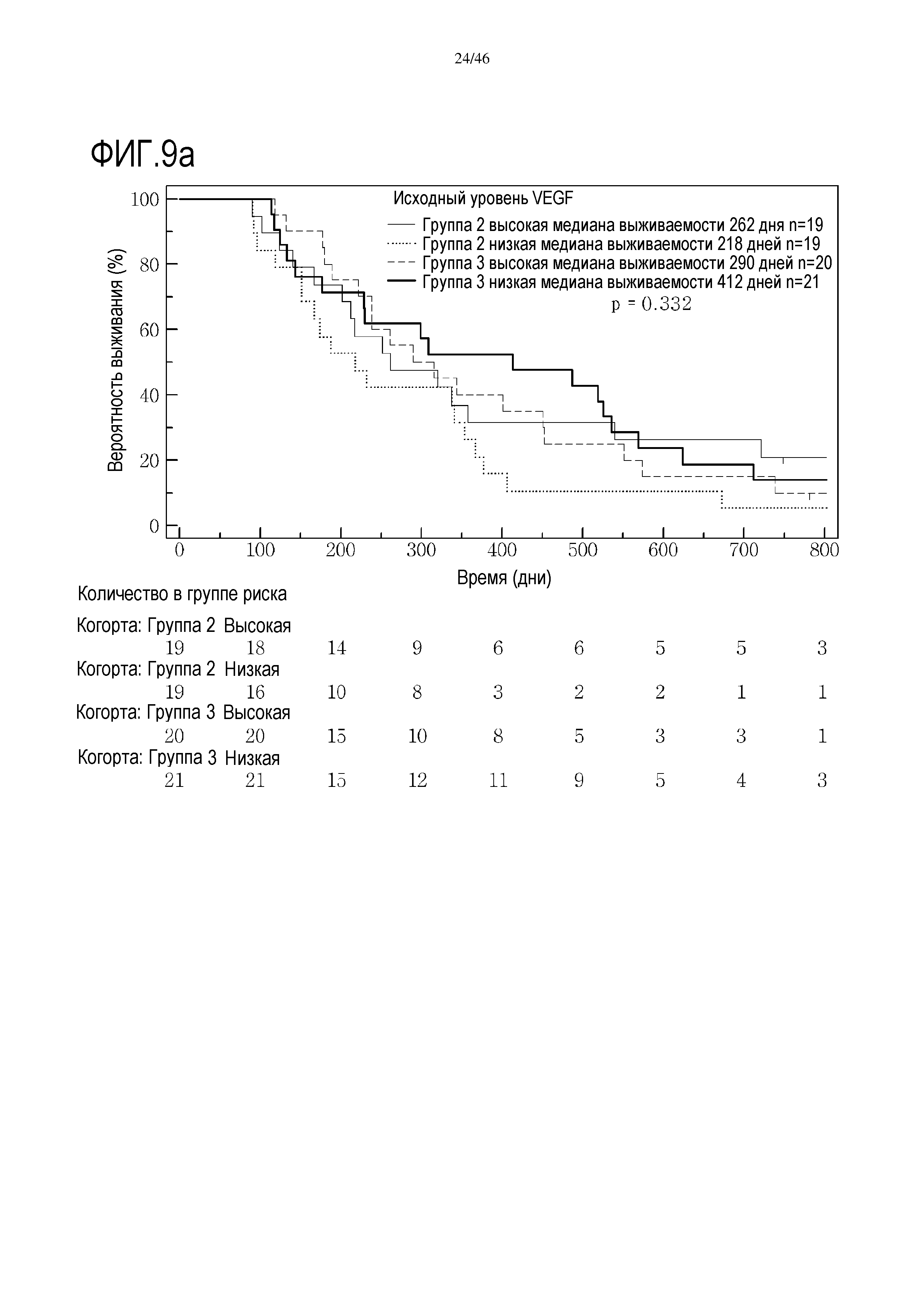
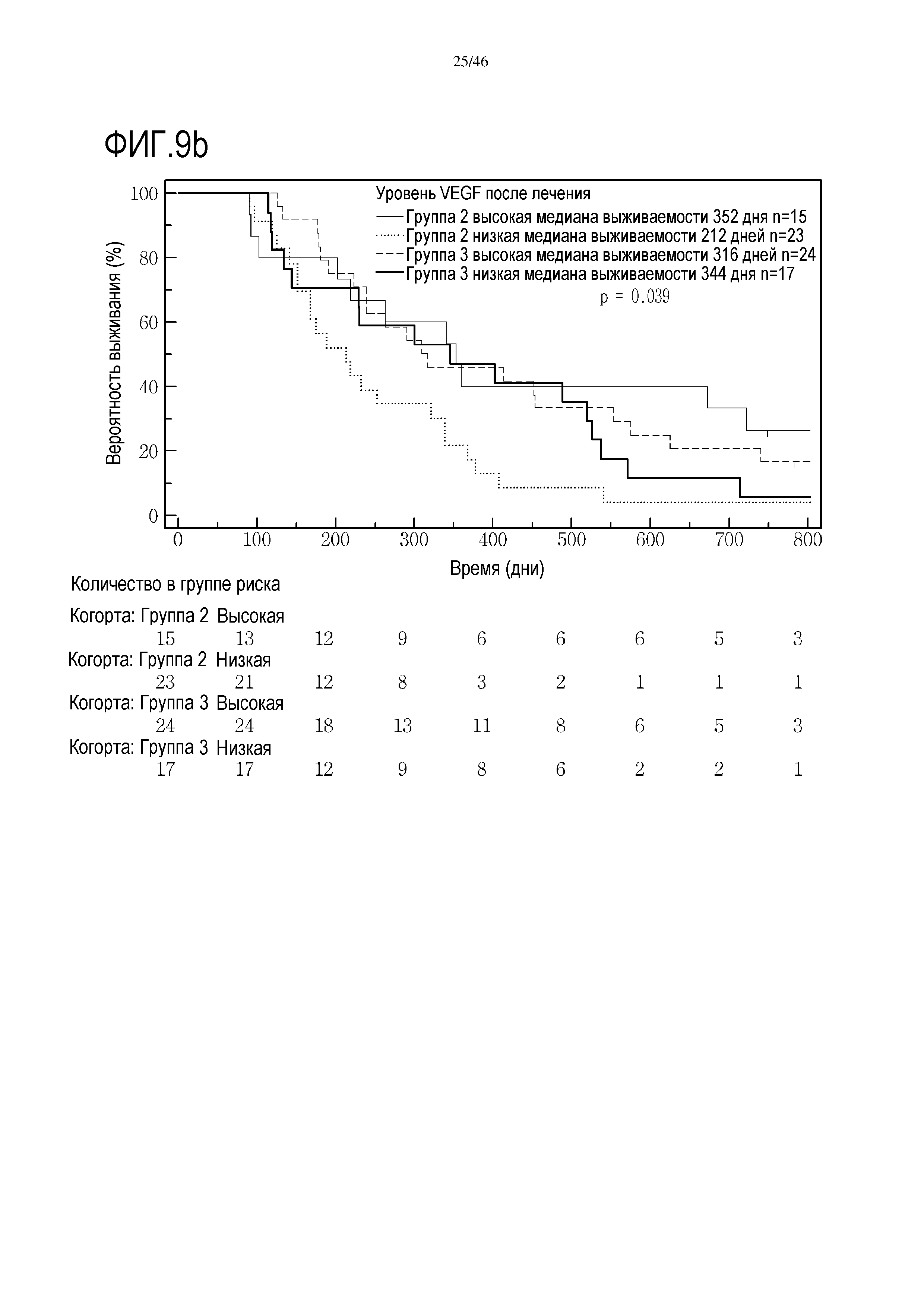
Фигура 9: Кривые выживаемости при использовании VEGF, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
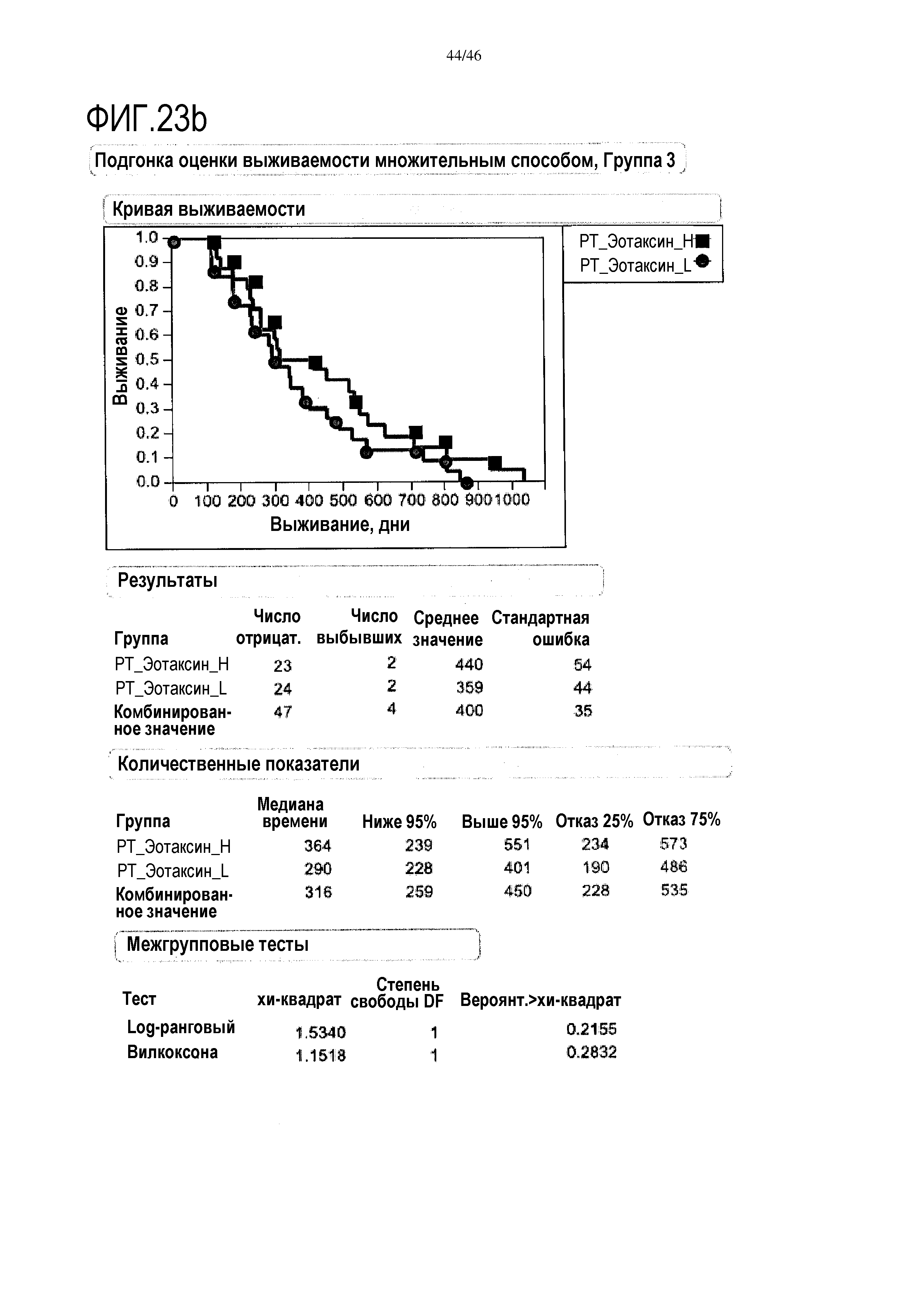
Фигура 10: Кривые выживаемости при использовании CRP, дихотомизированные по среднему значению исходных уровней, уровней после лечения и по абсолютному изменению от исходного уровня до уровня после лечения.
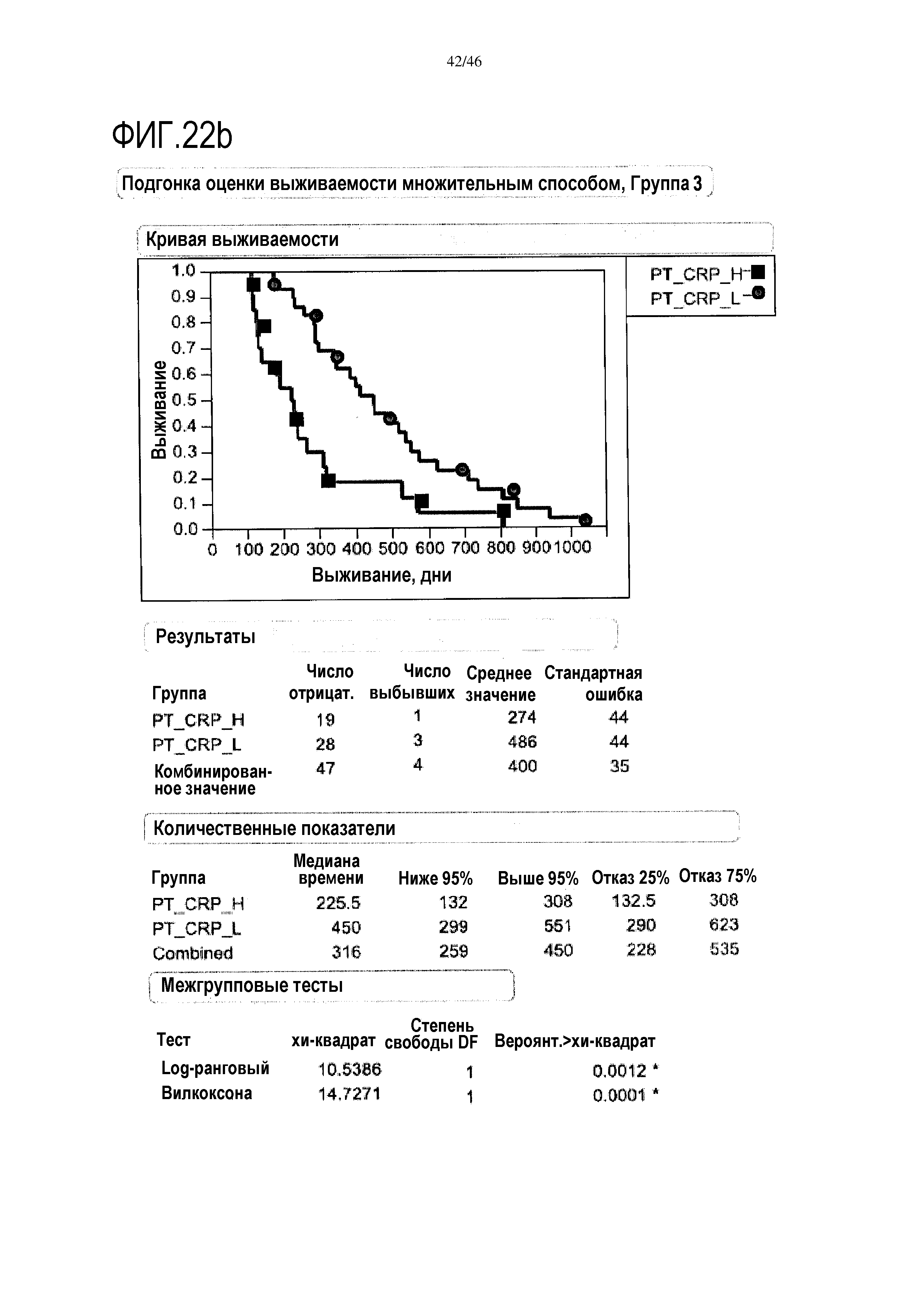
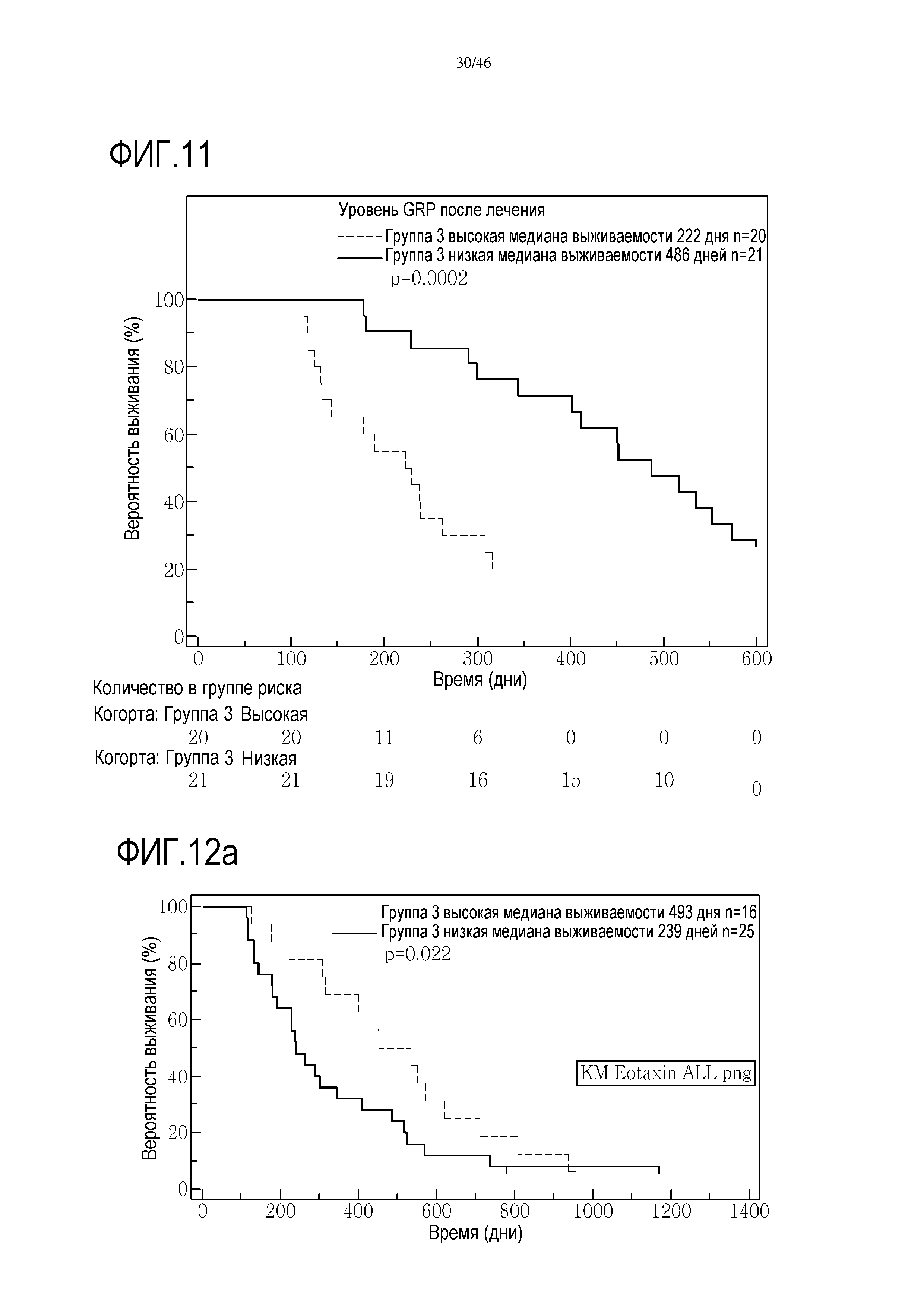
Фигура 11: Кривые выживаемости при использовании CRP, дихотомизированные по среднему значению уровня после лечения в группе 3.
Фигура 12: (А) Кривые выживаемости при использовании эотаксина (высокая: медиана выживаемости 493 дней, n=16; низкая: медиана выживаемости 239 дней, n=25). (B) Кривые выживаемости при использовании CRP (высокая: медиана выживаемости 222 дней, n=20; низкая: медиана выживаемости 486 дней, n=21).
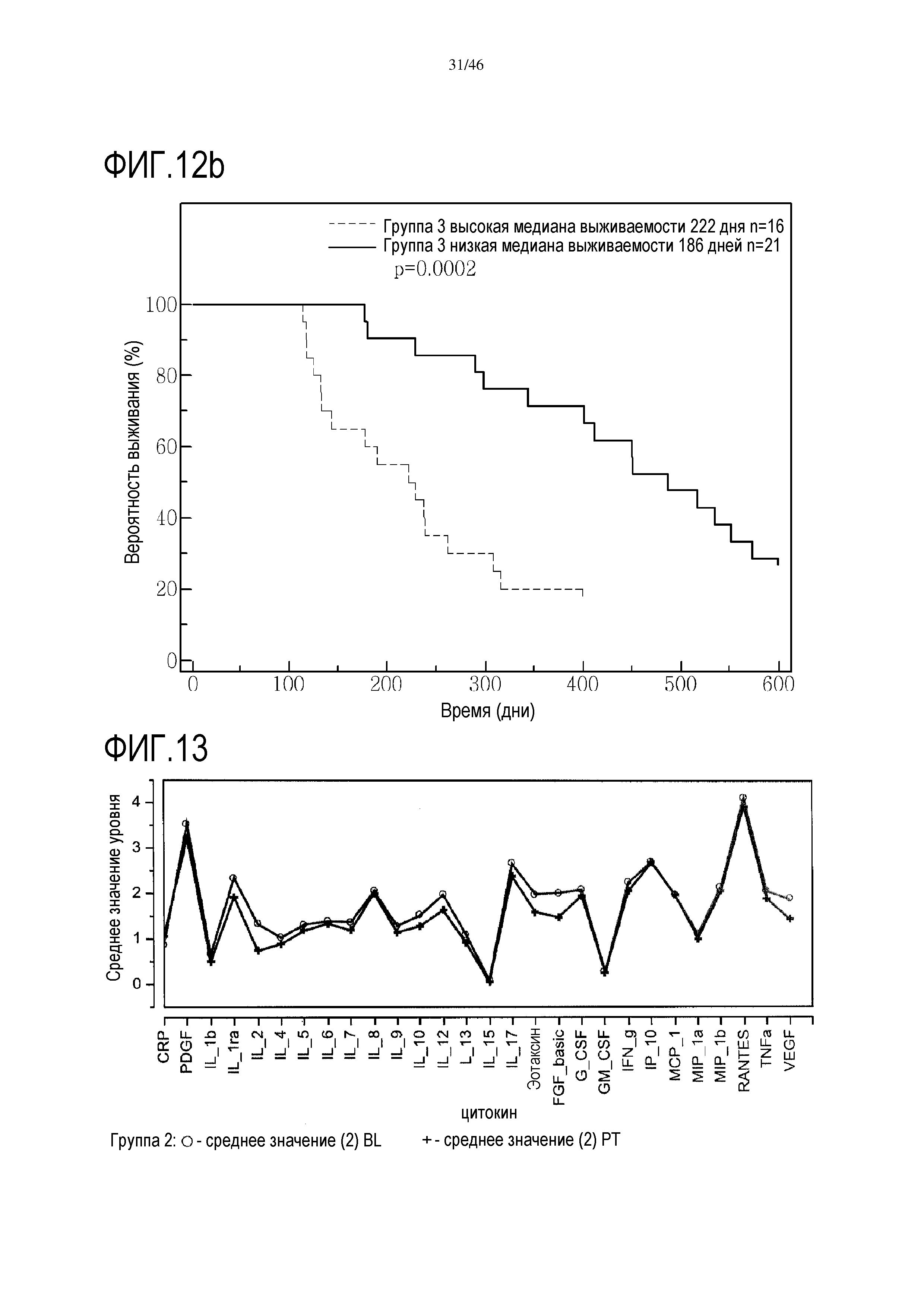
Фигура 13: графически показаны профили исходных значений и значений после лечения по логарифмическим данным уровня цитокинов в сыворотке крови в группе 2. Обозначения: BL=исходный уровень, PT=уровень после лечения.
Фигура 14: показаны средние значения исходного уровня и уровня после лечения по логарифмическим данным уровня цитокинов в сыворотке крови в группе 3.
Фигура 15: графически показан профиль средних различий (уровень после лечения - исходный уровень) для цитокинов в сыворотке крови для каждой группы. Примечание: для 19 цитокинов выявлено статистически значимое снижение между исходным уровнем и уровнем после лечения в группе 2 (PDGF, IL1β, IL-1ra, IL-2, IL-4, IL-5, IL-7, IL-10, IL-12, IL-13, IL-17, гранулоцитарный колониестимулирующий фактор G-CSF, интерферон IFNγ, эотаксин, фактор роста фибробластов FGFb, MIP1β, RANTES, TNF, VEGF; но не выявлено такое снижение для CRP, IL-6, IL-8, IL-9, IL-15, гранулоцитарно-макрофагального колониестимулирующего фактора GM-CSF, IP10, MCP1, MIP1α), и не выявлено такое снижение в группе 3.
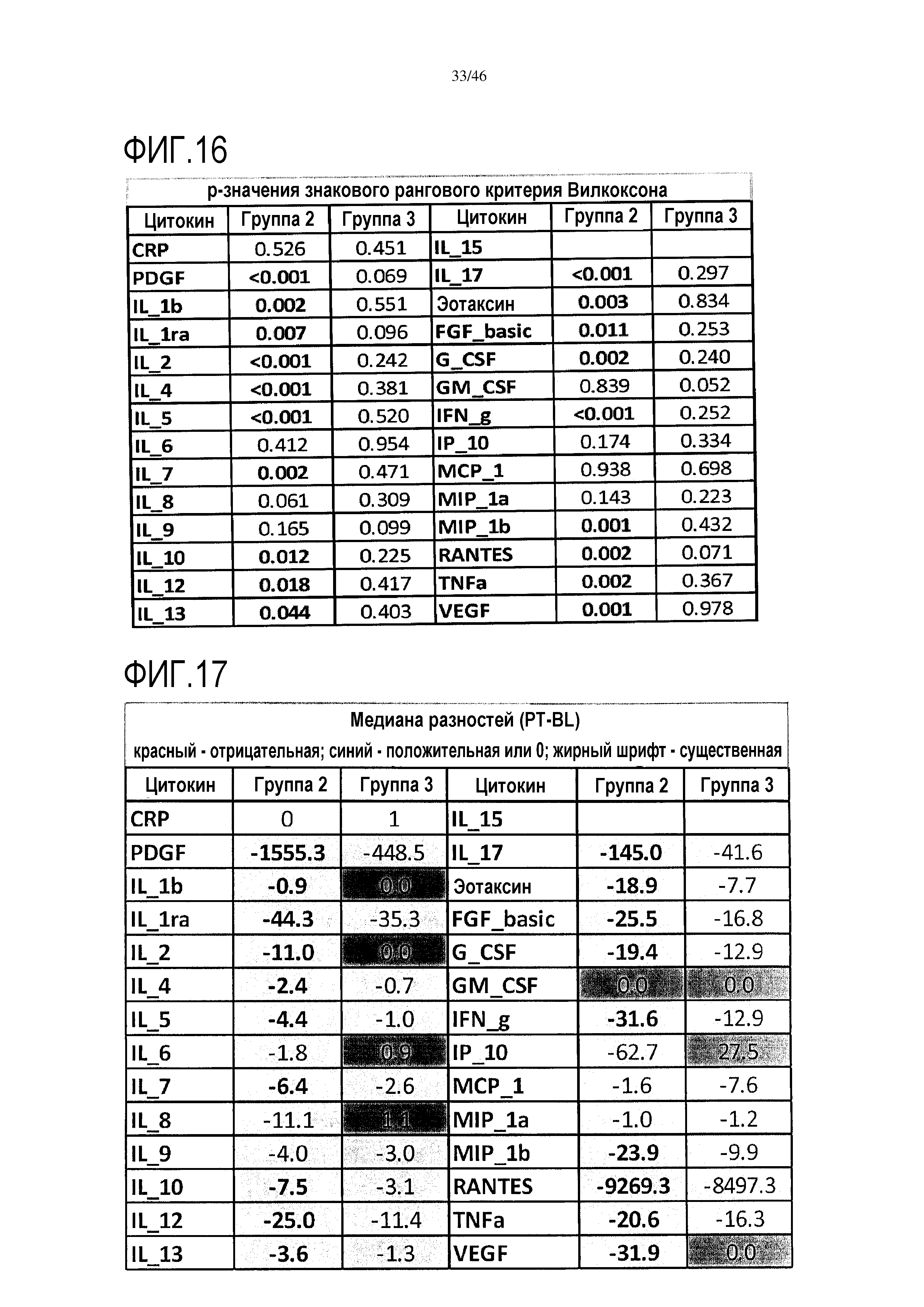
Фигура 16: показаны p-значения, полученные с помощью знакового рангового критерия Вилкоксона, который использовался для каждого цитокина из сыворотки в каждой группе для анализа увеличения/уменьшения значений от исходного уровня до уровня после лечения. Существенные различия (р<0,05) показаны жирным серым шрифтом. Увеличение было более значительным в группе 2, чем в группе 3, и в 19 случаев отмечено значительное снижение в группе 2, при этом в группе 3 такое снижение отсутствует.
Фигура 17: показано среднее различие в разности уровня после лечения и исходного уровня, для каждого цитокина в сыворотке, для каждой группы исследования. Уменьшения выделены светлым фоном, увеличения/отсутствие изменений выделены темным фоном.
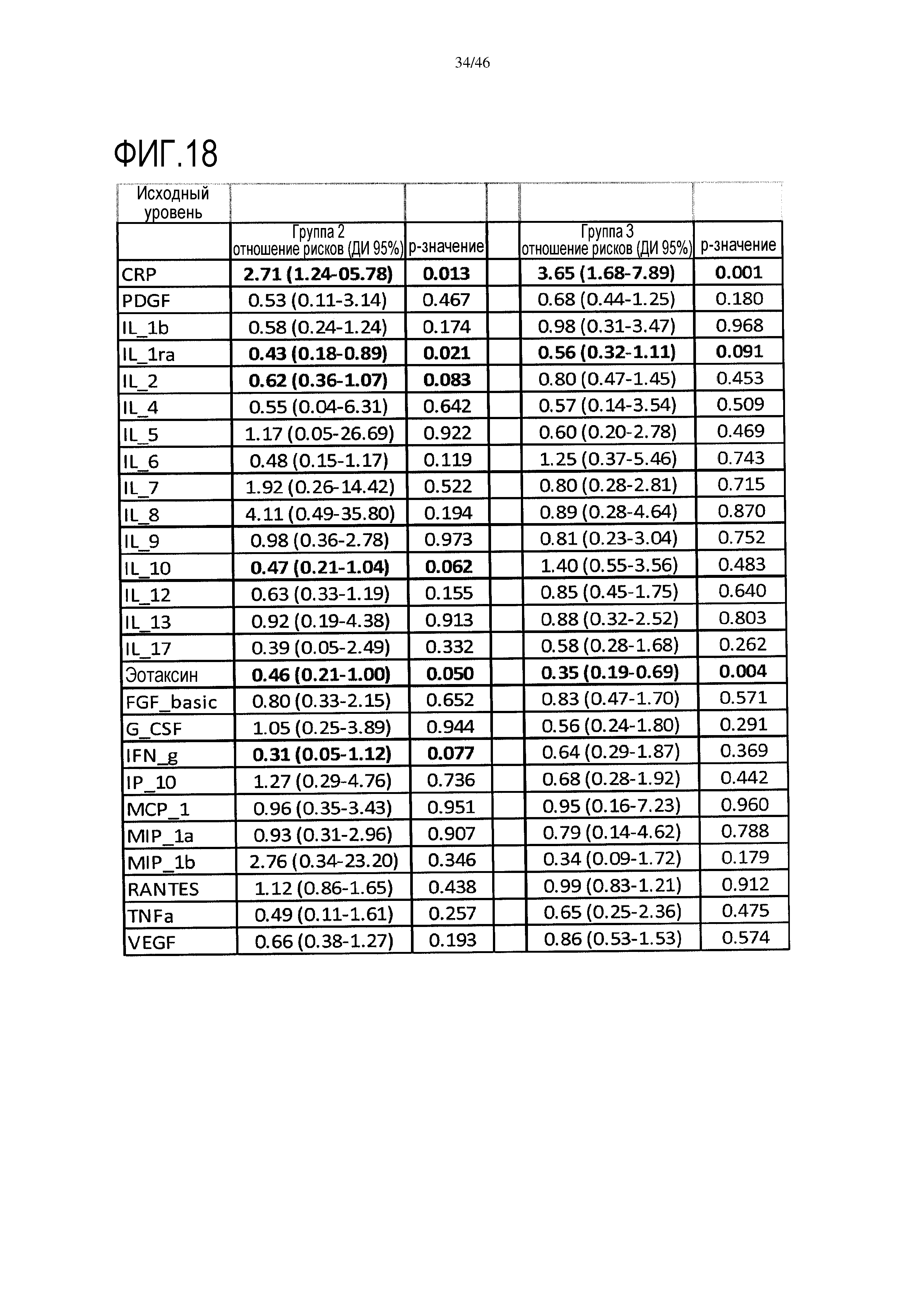
Фигура 18: показаны модели пропорциональных рисков Кокса на исходных данных для каждого цитокина в сыворотке для каждой группы исследования. В таблице приведены одномерные анализы для исходных данных и показаны отношения рисков с р-значениями и доверительными интервалами 95%. Уровни CRP, IL-1ra, IL-2, IL-10, IFNγ и эотаксина являются значительными (р<0,1) в группе 2, при этом в группе 3 значительными являются уровни CRP, IL-1ra и эотаксина.
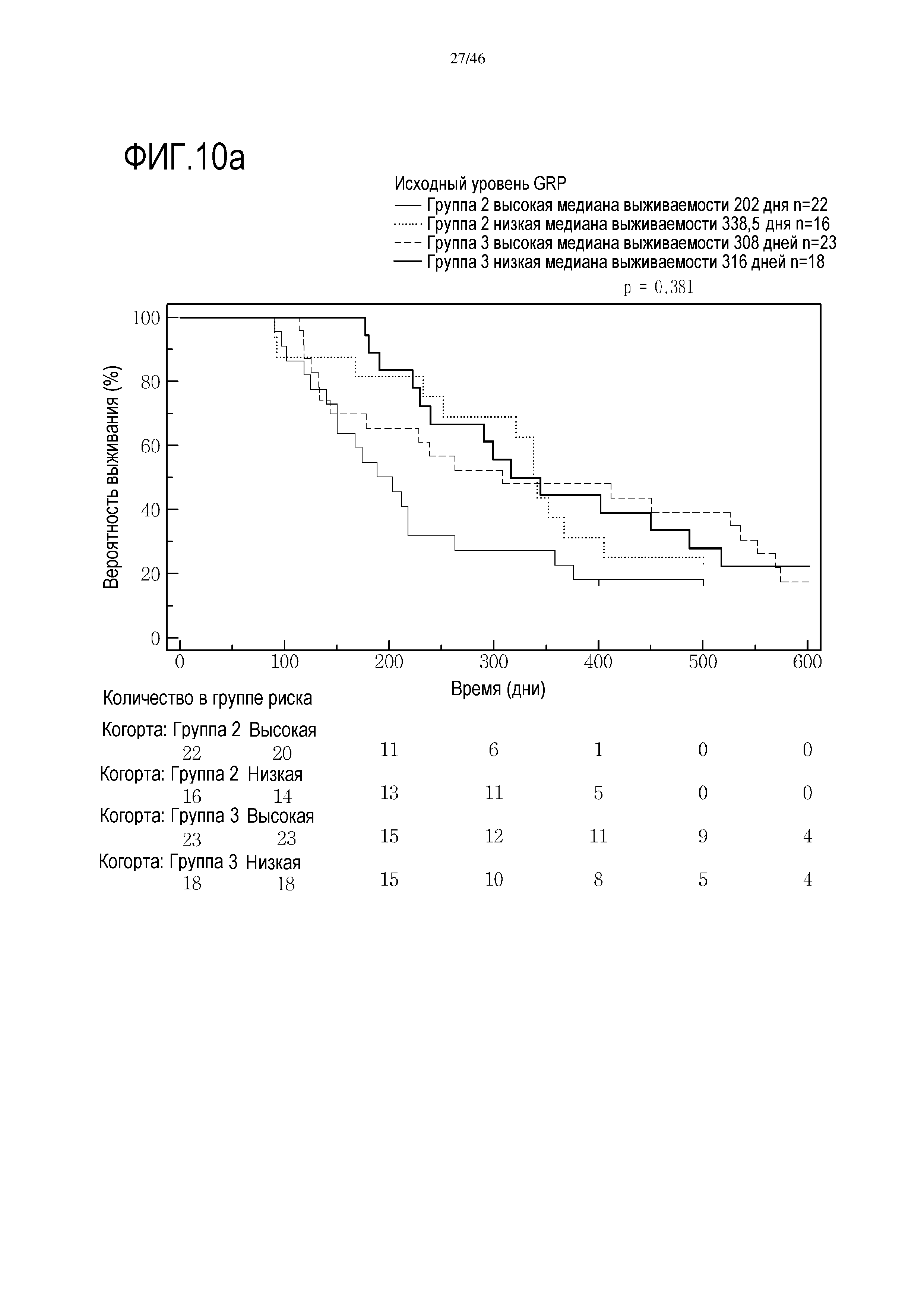
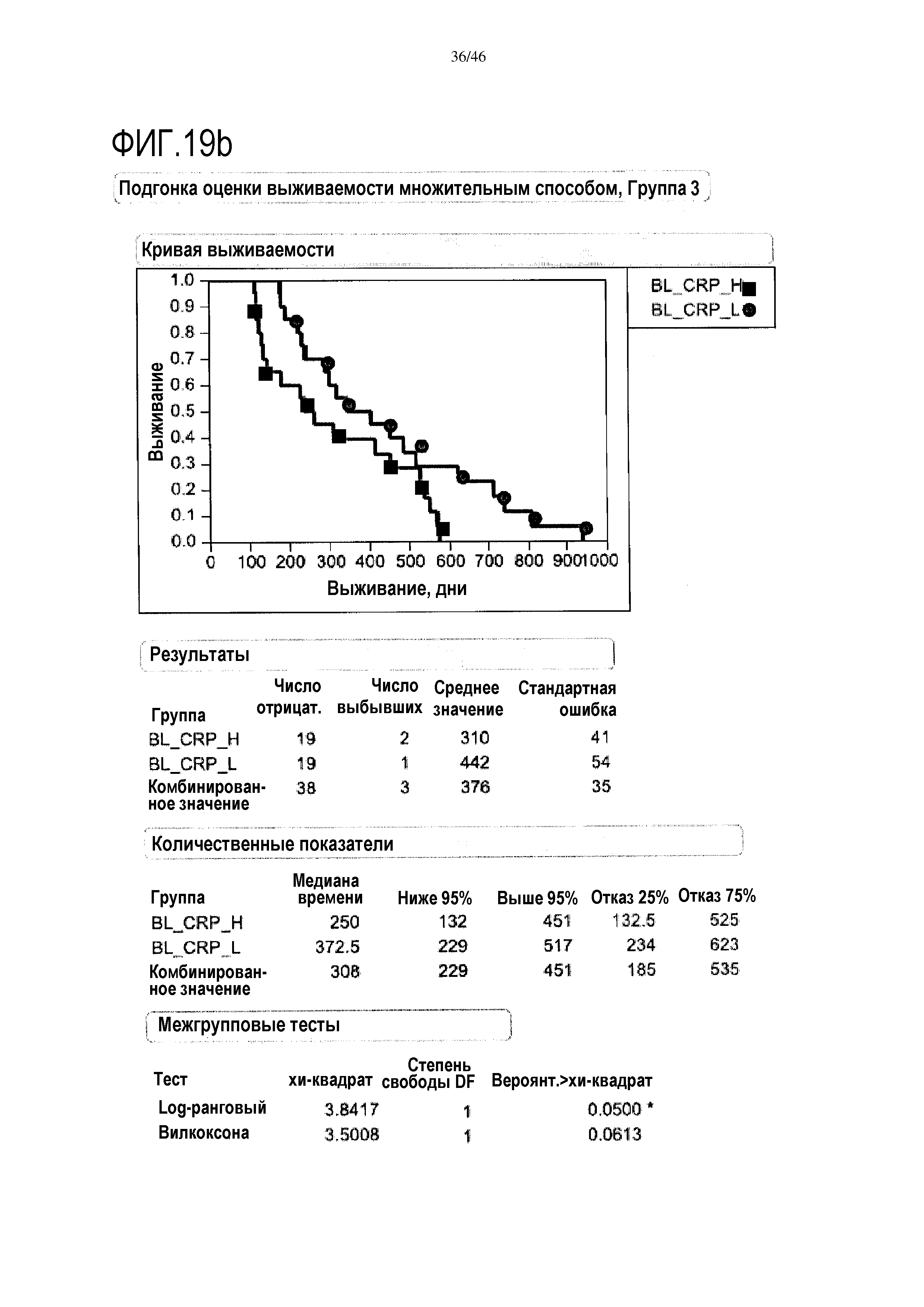
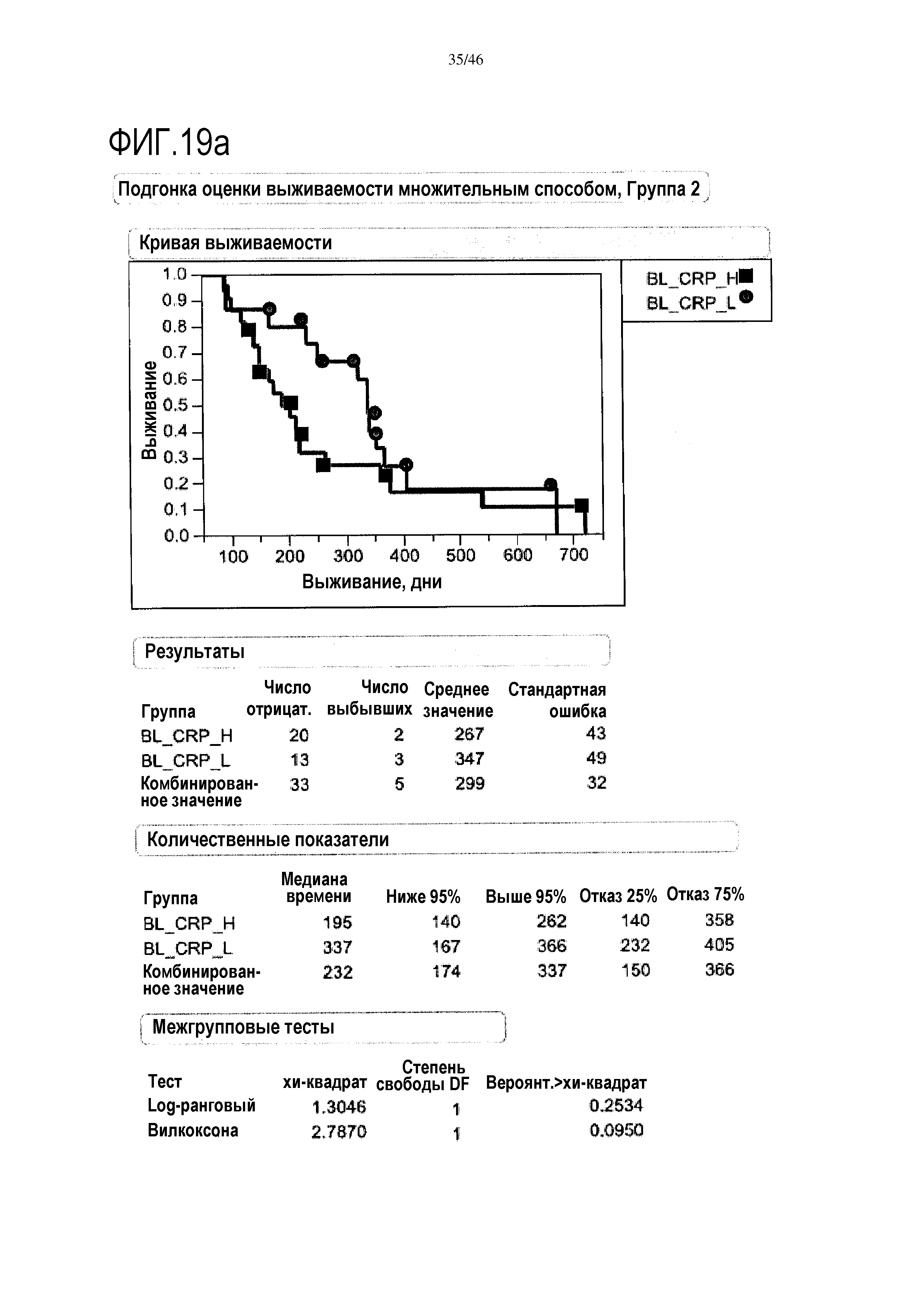
Фигура 19a и фиг. 19b: показаны исходные уровни CRP в группе 2 и группе 3. При низком уровне CRP медиана выживаемости составляет 337 дней в группе 2, и в группе 3 медиана выживаемости составляет 373 дней. Исходные уровни CRP являются прогностическими для общей средней выживаемости (ДИ 95%) в группе 3 (высокий уровень CRP=250 [132-451] дней; низкий уровень CRP=372,5 [229-517] дней; р=0,0500), в отличие от группы 2 (высокий уровень CRP=195 [140-262] дней; низкий уровень CRP=337 [167-366] дней; р=0,2534)
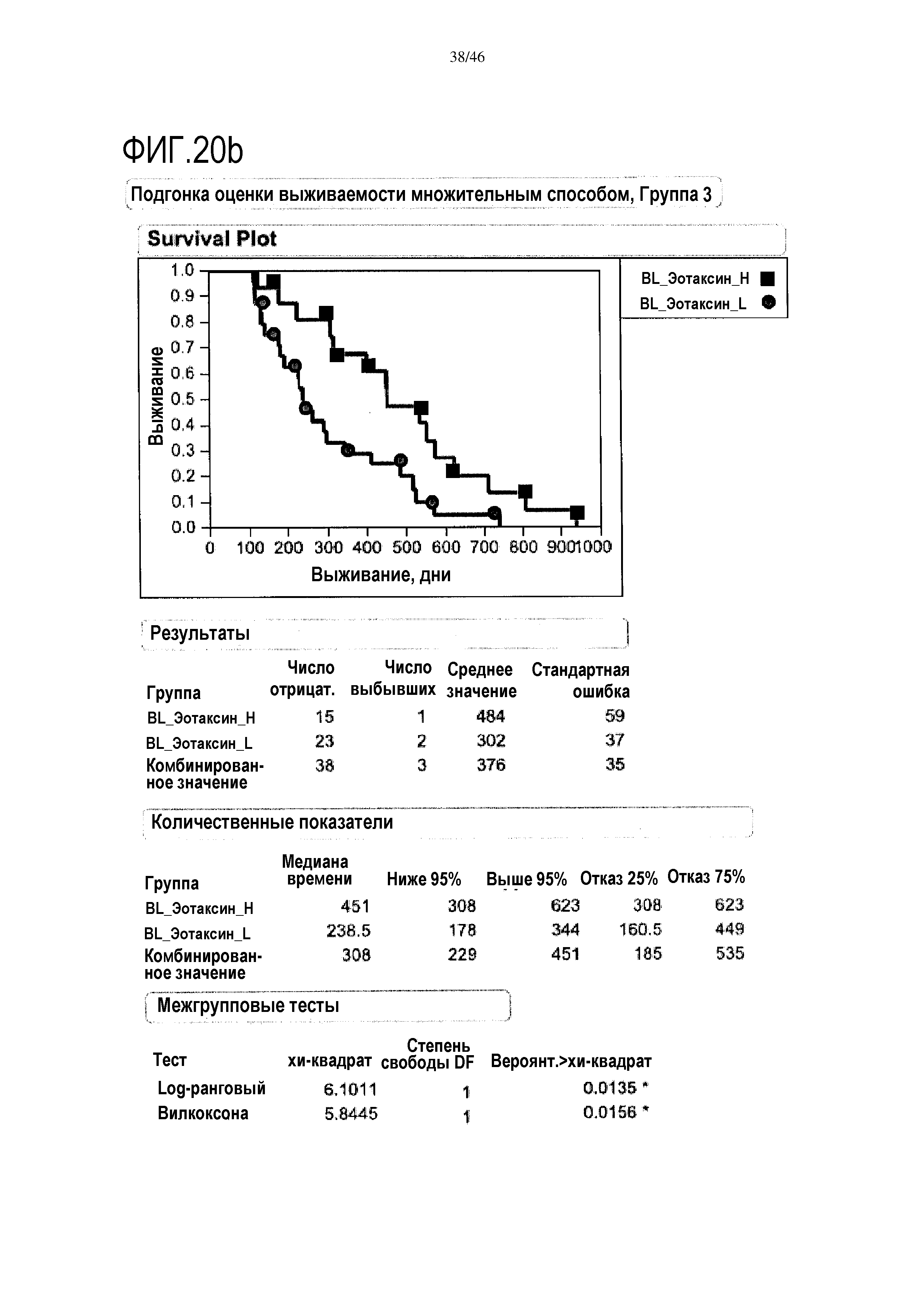
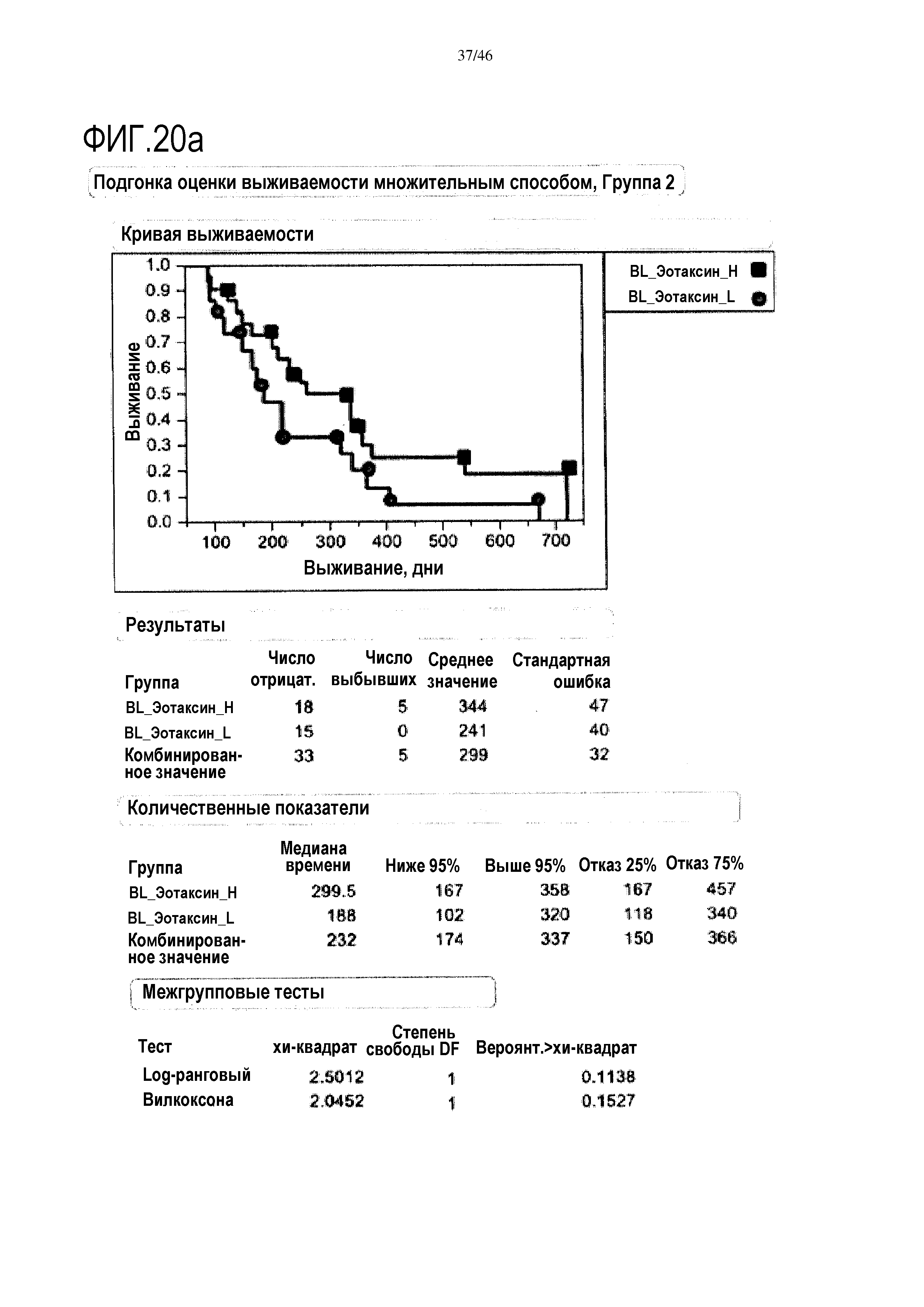
Фигура 20а и фиг. 20b: показаны исходные уровни эотаксина в группе 2 и группе 3. При низком уровне эотаксина в сыворотке медиана выживаемости составляет 300 дней в группе 2, и в группе 3 медиана выживаемости составляет 451 день. Исходные уровни эотаксина являются прогностическими для общей средней выживаемости (ДИ 95%) в группе 3 (высокий уровень эотаксина=451 [308-623] дней; низкий уровень эотаксина=238,5 [178-344] дней; р=0,0135), в отличие от группы 2 (высокий уровень эотаксина=299,5 [167-358] дней; низкий уровень эотаксина=188 [102-320] дней; р=0,1138).
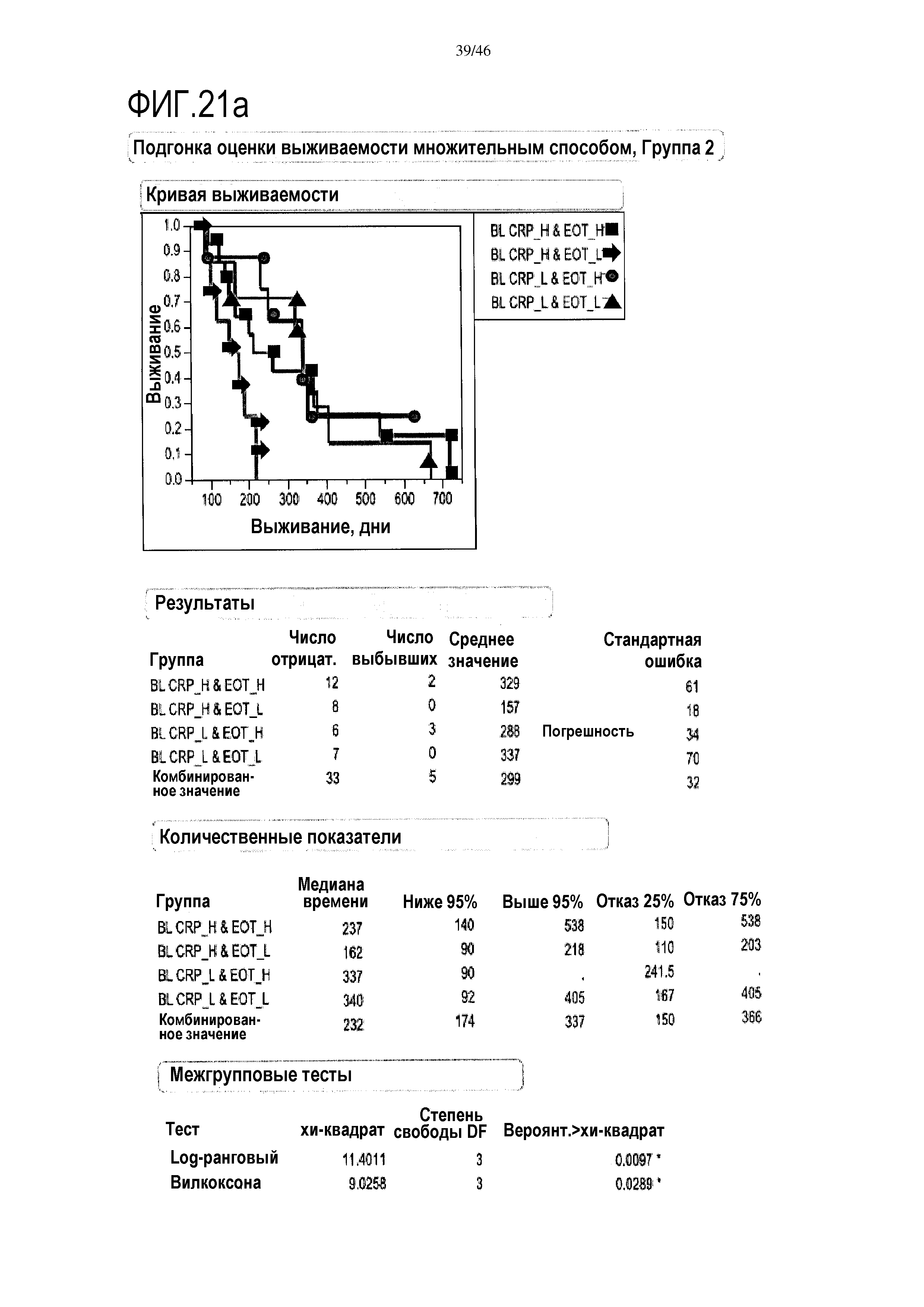
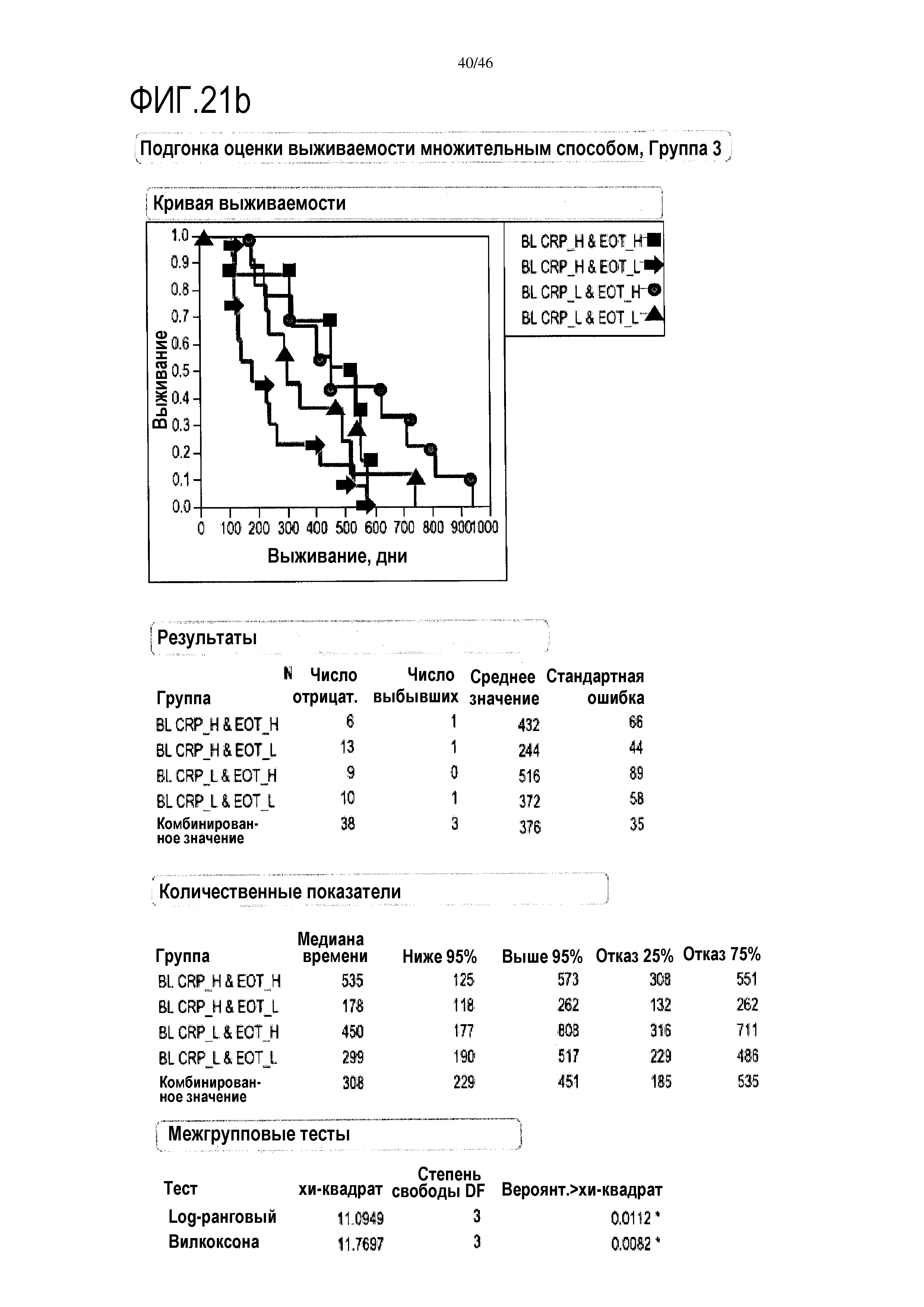
Фигура 21a и фиг. 21b: показаны модели пропорциональных опасностей с помощью дихотомизированных переменных объединенных исходных данных уровней CRP и эотаксина в сыворотке. При объединении переменных на исходном уровне прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=337 дней) и аналогично для группы 3 (медиана выживаемости=450 дней).
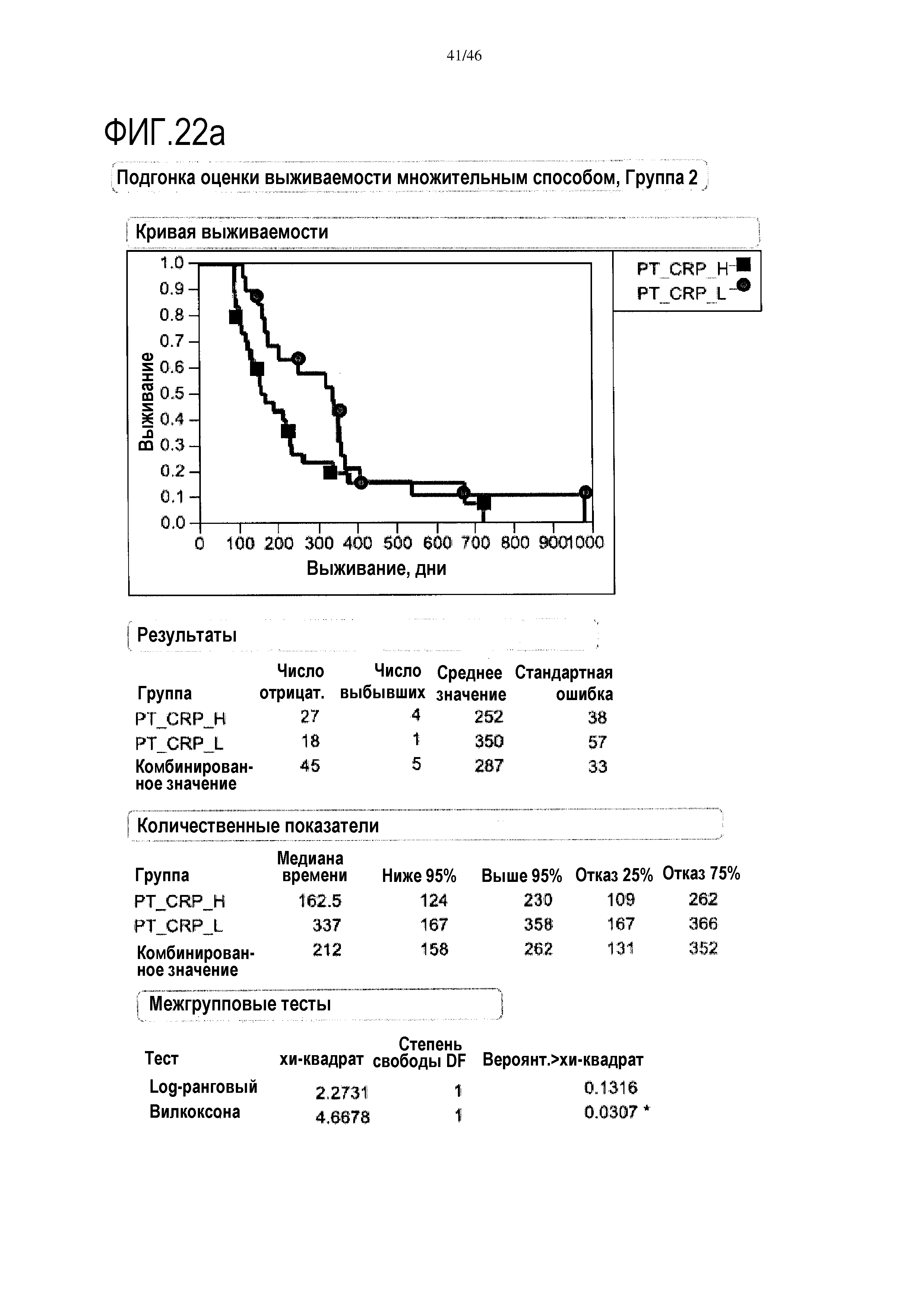
Фигура 22а и фиг. 22b: показан уровень CRP в сыворотке крови после лечения в группе 2 и группе 3. При низком уровне CRP медиана выживаемости составляет 337 дней в группе 2, и в группе 3 медиана выживаемости составляет 450 дней.
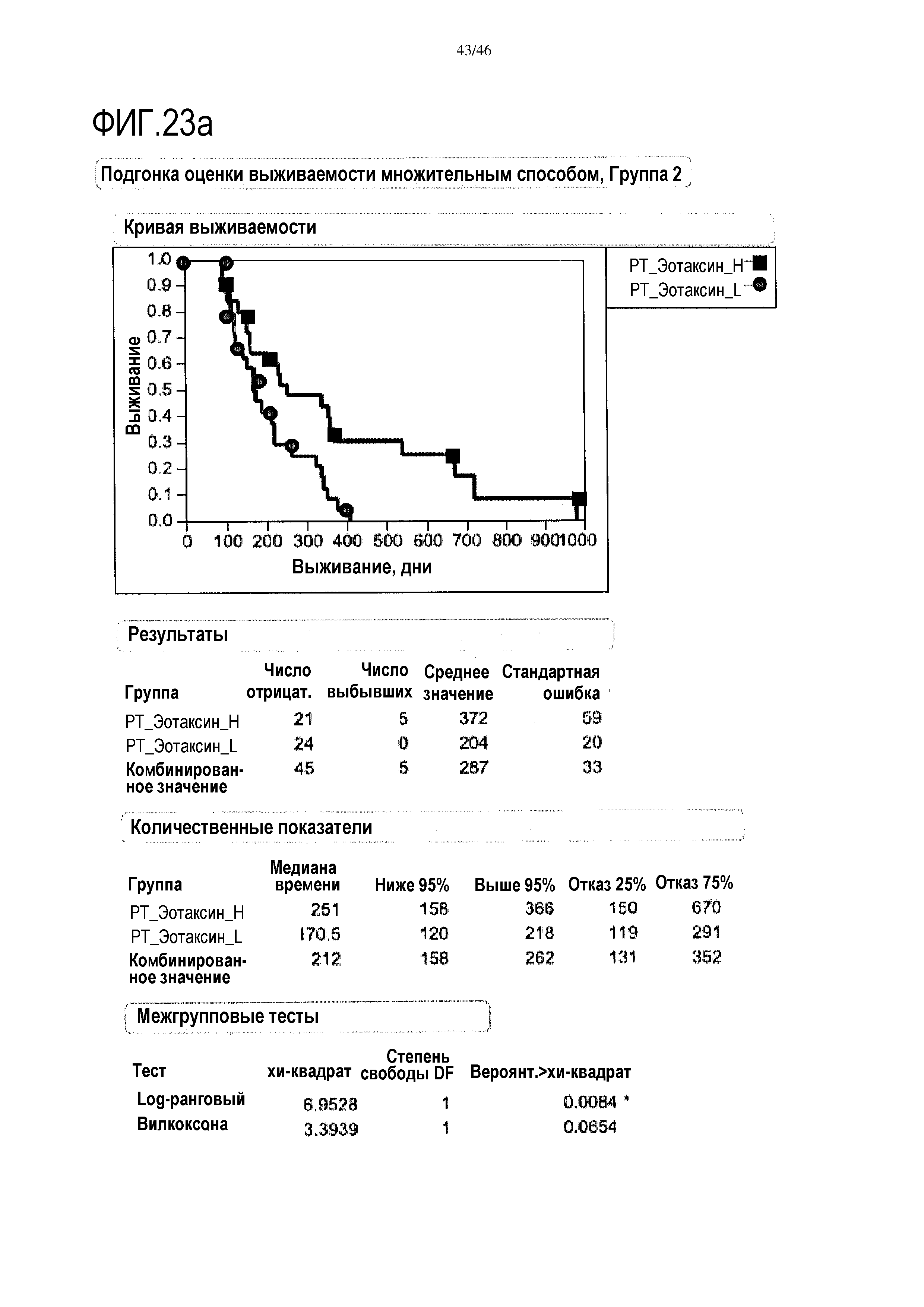
Фигура 23а и фиг. 23b: показан уровень эотаксина в сыворотке после лечения в группе 2 и группе 3. При высоком уровне эотаксина медиана выживаемости составляет 251 дней в группе 2, и в группе 3 медиана выживаемости составляет 364 дня.
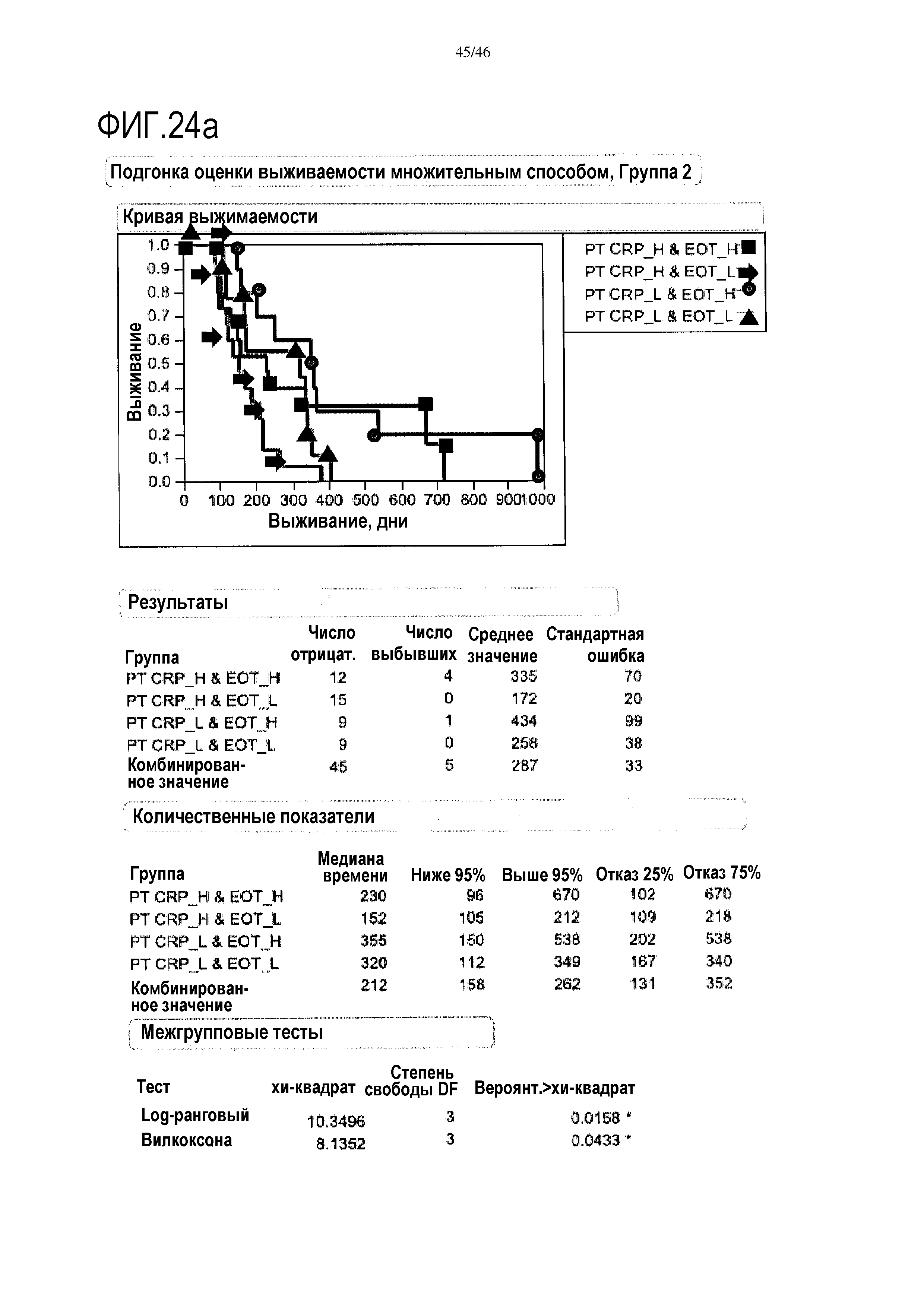
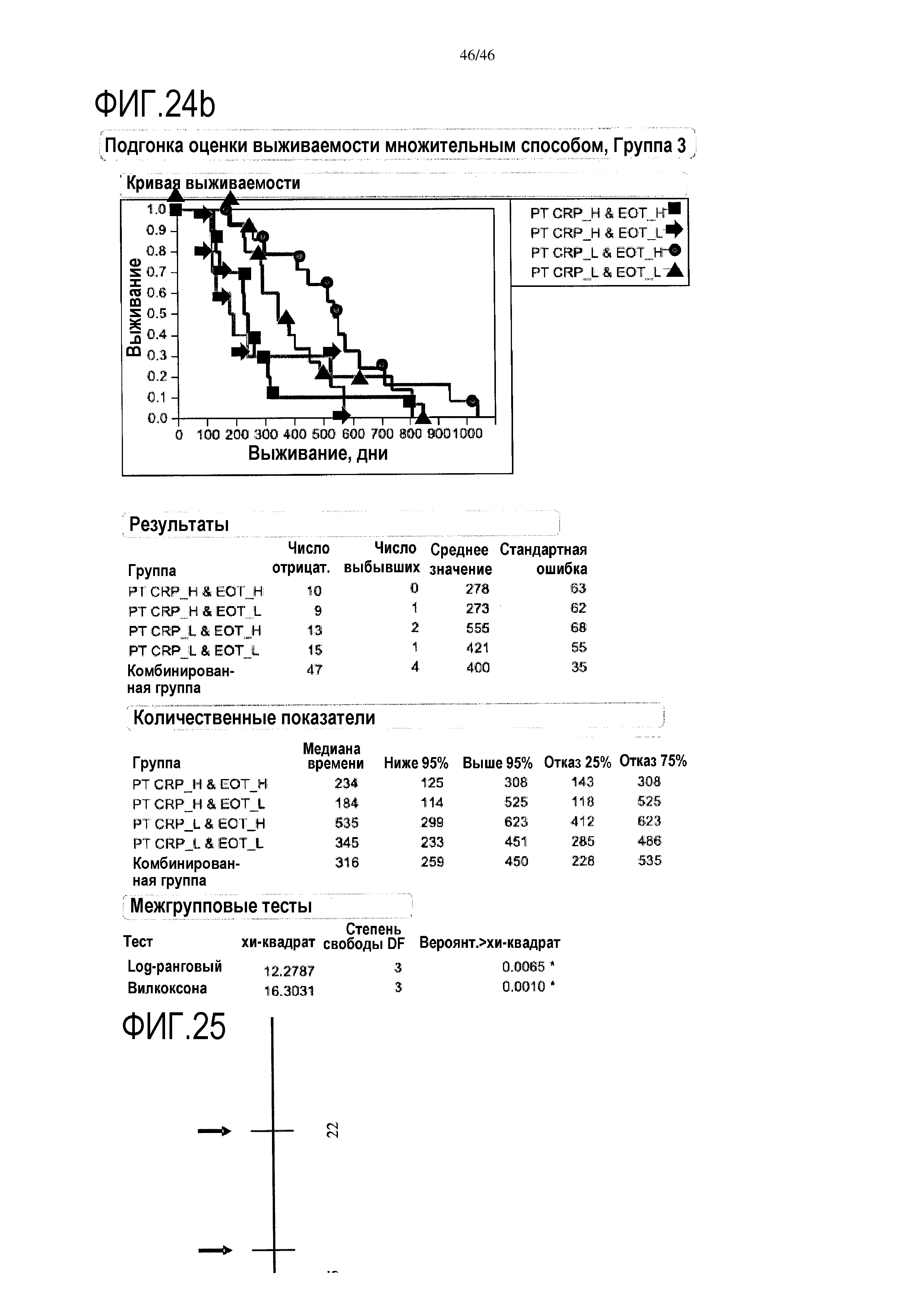
Фигура 24а и фиг.24b: показаны модели пропорциональных опасностей с помощью дихотомизированных переменных объединенных данных уровней CRP и эотаксина в сыворотке после лечения. При объединении переменных прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=355 дней) и аналогично для группы 3 (медиана выживаемости=535 дней). При объединении переменных, по данным после лечения, прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=355 дней) и аналогично для группы 3 (медиана выживаемости=535 дней).
Фигура 25: показана схема иммунизации, используемая в примерах.
Лучший вариант осуществления изобретения
Определения
Термин "GV1001" означает пептид теломеразного происхождения, имеющий последовательность SEQ ID NO: 1: EARPALLTSRLRFIPK.
Термин "эотаксин" означает белок, имеющий любую одну из аминокислотных последовательностей SEQ ID NO: 2-4 (или их аллельные или природные изоформы или варианты), которые могут кодироваться с помощью любой из последовательностей нуклеиновых кислот SEQ ID NO: 5-7, соответственно.
"CRP" представляет собой белок, имеющий аминокислотную последовательность SEQ ID NO: 8 (или ее аллельные или другие природные изоформы или их варианты), которые могут кодироваться нуклеотидной последовательности SEQ ID NO: 9.
"MIP1α" представляет собой белок, имеющий аминокислотную последовательность SEQ ID NO: 10 (или ее аллельные или другие природные изоформы или их варианты), которые могут кодироваться последовательностью нуклеиновой кислоты SEQ ID NO: 11.
Конкретные варианты осуществления изобретения
В одном варианте осуществления настоящее изобретение относится к способу лечения рака и/или к способу противовоспалительного лечения нуждающегося в этом человека, путем введения терапевтически эффективного количества полипептида, который содержит SEQ ID NO: 1, или содержит фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот (например, из 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот), если у указанного человека выявлен повышенный уровень в сыворотке эотаксина и/или MIP1α по сравнению со средним показателем в популяции или по сравнению с популяцией людей, больных этим же видом рака и/или воспалительным состоянием.
Родственный вариант осуществления относится к способу определения момента начала противоракового и/или противовоспалительного лечения нуждающегося в этом человека, при этом в указанное противораковое лечение и/или противовоспалительное лечение входит введение полипептида, который содержит SEQ ID NO: 1 или содержит фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот, и указанный способ содержит определение наличия у указанного человека повышенного уровня в сыворотке эотаксина и/или MIP1α по сравнению со средними показателями в популяции или по сравнению с популяцией больных этим же видом рака и/или воспалительного состояния, и положительные результаты такого определения свидетельствуют о том, что указанное лечение является оправданным.
Согласно приведенным примерам, авторы настоящего изобретения обнаружили, что медиана выживаемости больных раком, получающим раскрытое в изобретении лечение, находится на самом высоком уровне, если в сыворотке этих больных выявлено исходное высокое содержание эотаксина в сочетании с низким содержанием CRP. Дополнительно, авторы также обнаружили, что у больных с такой же комбинацией (высокий уровень эотаксина и низкий уровень CRP), выявленной после лечения, также наблюдается максимальная средняя выживаемость.
Таким образом, согласно настоящему изобретению, лечение по настоящему изобретению предпочтительно представляет собой лечение, при котором пациенты, подвергаемые таким видам лечения, являются пациентами, у которых до начала лечения выявлены повышенные уровни эотаксина и/или MIP-1α в сыворотке крови в сочетании со сниженным уровнем CRP, при этом, как указано выше, эти уровни определяются или по отношению к среднему показателю (или к медиане) популяции в целом, или по отношению к среднему показателю или к медиане в соответствующей группе пациентов.
В зависимости от конкретного пути введения может варьироваться эффективное количество, которое вводится в соответствии с различными вариантами осуществления изобретения. Если полипептид вводят в качестве вакцины, такое количество обычно составляет от 0,5 мкг до 500 мг, при этом предпочтительное вводимое количество находится в диапазоне от 10 мкг до 1000 мкг, в частности, от 20 до 200 мкг. Указанные диапазоны также являются подходящими, если этот полипептид вводится в качестве противовоспалительного средства, а также могут быть подходящими, например, если этот полипептид вводится внутривенно или внутриартериально, при этом вводимое количество регулируется, исходя из состояния пациента, его массы тела и возраста.
Определение повышенных уровней эотаксина и/или MIP1α и/или CRP в релевантных вариантах осуществления проводят в соответствии со стандартными анализами, известными в данной области, и предпочтительно, выполняют иммунные анализы, например, ELISA. Также для этих целей подходят анализы, которые определяют активность указанных цитокинов на подходящей клетке-мишени или подходящей молекуле-мишени. При высокой чувствительности и точности анализа даже небольшое увеличение по сравнению со стандартными значениями может иметь значение, тогда как при использовании менее чувствительных или точных анализов необходимо иметь возможность определения более значительных отклонений от стандартных значений. Обычно, в заданном анализе для конкретного цитокина существует диапазон нормальных значений и, если уровень цитокинов находится вне этих нормальных значений, уровень эотаксина или MIP1α будет считаться повышенным. Обычно повышение исходного уровня эотаксина и/или MIP1α составляет по меньшей мере 10%, но можно рассматривать более высокое увеличение значений: по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% и даже по меньшей мере 100%.
Другой вариант осуществления изобретения относится к способу лечения рака и/или противовоспалительного лечения нуждающегося в этом человека путем введения терапевтически эффективного количества полипептида, который содержит последовательность SEQ ID NO: 1 или содержит фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот, при этом указанное лечение продолжают после начального этапа указанного лечения, если в сыворотке указанного пациента выявляют снижение уровня CRP после указанного начального этапа указанного лечения. Это означает, что лечение было начато, но впоследствии для оценки эффективности схемы лечения применяют измерение CRP. Если сывороточный уровень CRP не снижается или возрастает (см. замечания, касающиеся чувствительности анализа выше), исходя из этих результатов, согласно настоящему изобретению, возникает вопрос о целесообразности для пациента продолжения лечения полученным из GV1001 полипептидом, и это означает, что можно принять решение о прекращении этого этапа лечения и о применении возможных видов альтернативного или паллиативного лечения.
С этим вариантом осуществления связан способ определения эффективности терапевтического лечения человека с использованием полипептида, который содержит последовательность SEQ ID NO: 1 или содержит фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот, и указанный способ содержит определение уровня сывороточного CRP у указанного человека после начального этапа указанного лечения и сравнение полученных данных с уровнем сывороточного CRP перед указанным начальным этапом лечения, при этом снижение указанного уровня в сыворотке свидетельствует о том, что указанное лечение является эффективным с точки зрения эффекта увеличения продолжительности жизни,
Указанное снижение уровня сывороточного СRP обычно должно составлять по меньшей мере 10%, при этом может быть релевантным дальнейшее снижение этого значения: по меньшей мере на 15%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% и даже по меньшей мере на 80%.
Описанные выше варианты были сфокусированы на использовании полученного из GV1001 полипептида, но в важных вариантах осуществления изобретения противораковое лечение и/или противовоспалительное лечение включает сопутствующее лечение с применением, по меньшей мере одного цитостатического или цитотоксического средства. Например, сопутствующее лечение может включать введение капецитабина и гемцитабина (GemCap), согласно приведенным примерам, при этом, в зависимости от подлежащего лечению ракового или воспалительного заболевания, введение полученного из GV1001 полипептида можно комбинировать, в соответствии с настоящим изобретением, с введением цитостатических/цитотоксических средств, которые конкретно подходят для лечения рассматриваемого заболевания.
Очень важными вариантами осуществления настоящего изобретения являются варианты, в которых лечение представляет собой противораковое лечение, и особенно предпочтительно, лечение рака поджелудочной железы. Тем не менее, рассматривается лечение других видов ракового заболевания, и вид рака можно выбирать из группы, состоящей из эпителиального рака, не-эпителиального рака и сочетанного рака. Эпителиальный рак может представлять собой и карциному и аденокарциному, и не-эпителиальным раковым заболеванием или сочетанной формой рака обычно является липосаркома, фибросаркома, хондросаркома, остеосаркома, лейомиосаркома, рабдомиосаркома, глиома, нейробластома, медуллобластома, злокачественная меланома, злокачественная менингиома, нейрофибросаркома, лейкоз, миелопролиферативное расстройство, лимфома, гемангиосаркома, саркома Капоши, злокачественная тератома, дисгерминома, семинома или хориосаркома.
Также рак может иметь любую анатомическую локализацию в организме. Таким образом, раком могут быть поражены глаз, нос, рот, язык, глотка, пищевод, желудок, толстый кишечник, прямая кишка, мочевой пузырь, мочеточник, уретра, почки, печени, поджелудочная железа, щитовидная железа, надпочечники, молочная железа, кожа, центральная нервная система, периферическая нервная система, мозговые оболочки, сосудистая система, яички, яичники, матка, шейка матки, селезенка, кость или хрящ.
Обычно упомянутый полипептид вводят парентерально, и при введении в качестве вакцины полипептид обычно следует вводить подкожно или внутрикожно. Если наиболее желателен противовоспалительный эффект, также можно применять внутривенный или внутриартериальный пути введения.
Определение упомянутых выше сывороточных уровней выполняют in vitro. Обычно образец сыворотки подвергают иммуноферментному анализу ELISA для количественного определения уровней цитокинов в сыворотке.
Во всех рассмотренных выше вариантах осуществления полипептид может предпочтительно представлять собой SEQ ID NO: 1 (т.е. 16-мерный пептид как есть) или фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот; то есть, предполагается, что дополнительные аминокислоты необязательно включены в пептиды, полученные из GV1001.
В целом в вариантах осуществления представлено использование эотаксина, и/или MIP1α и/или CRP в качестве прогностического маркера при противораковом и/или противовоспалительном лечении, в частности, если указанное лечение включает введение полипептида, который содержит последовательность SEQ ID NO: 1 или содержит фрагмент SEQ ID NO: 1 по меньшей мере из 8 аминокислот. Как указано выше, типичным применением будет использование вещества, которое захватывается/определяется в подходящем анализе, таким образом, этот аспект изобретения также охватывает применение антител и других агентов, которые специфично связываются с любым из трех цитокинов.
Интересный вариант осуществления изобретения относится к способу модуляции активности эотаксина, и/или MIP1α и/или CRP у нуждающегося в этом человека, и указанный способ содержит введение терапевтически эффективного количества полипептида согласно изобретению, и такой способ может быть нацелен на негативное воздействие, вызванное у человека аномальными уровнями упомянутых цитокинов. Следовательно, этот вариант осуществления изобретения относится к использованию этих полипептидов в качестве модуляторов эотаксина, и/или MIP1α и/или CRP.
Наконец, отдельный вариант осуществления настоящего изобретения относится к набору, который содержит:
a) фармацевтическую композицию, содержащую полученный из GV1001 полипептид, описанный выше,
b) способы для определения концентрации эотаксина в сыворотке, и/или способы для определения концентрации MIP1α в сыворотке, и/или способы для определения концентрации CRP в сыворотке. Эти способы могут представлять собой, например, подходящий иммунный анализ.
Вариант осуществления изобретения
Пример
В исследовании TeloVac было задействовано 1062 пациентов в 52 центрах по всей Великобритании. Какие-либо существенные различия в общей выживаемости между группами, которые получали вакцину и контрольной группой, в которой применяли химиотерапию, отсутствовали, тем не менее, в это клиническое испытание также была включена обширная программа трансляционного исследования, результаты которого продолжают оцениваться. Вместе с тем, результаты показали, что вакцина вызывает выраженный противовоспалительный ответ, и что иммунизация с одновременной химиотерапией обеспечивает эффективный способ как создания иммунного ответа, так и стимуляции противовоспалительного действия. Важно отметить, что в подгруппе пациентов в ответ на введение вакцины были выявлены биомаркеры повышенной выживаемости.
Материалы и способы
В клиническом исследовании TeloVac, начатом в январе 2007 года, проводили сравнение комбинированной терапии капецитабином и гемцитабином (GemCap) с одновременным и последовательным применением химио-иммунотерапии с использованием GV1001 при локально-распространенном и метастатическом раке поджелудочной железы.
Схема иммунизации
Фигура 25 показывает применяемую схему иммунизации: внутрикожные инъекции GV1001 проводили три раза (предпочтительно в понедельник, среду и пятницу) в течение первой недели (неделя 1), и один раз в неделю в течение недель 2, 3, 4 и 6. После этого GV1001 вводили один раз в месяц. Отдельно, приблизительно в той же локализации, вводили GM-CSF в виде внутрикожных инъекций за 10-15 минут перед всеми инъекциями GV1001.
Больные раком поджелудочной железы имеют короткую предполагаемую продолжительность жизни, при быстром истощении иммунной системы. Следовательно, окно для индукции иммунного ответа является ограниченным. Поэтому важно использовать схему частой иммунизации с целью максимально быстрой индукции эффективной иммунной реакции. Применяемая для GV1001 схема иммунизации с агрессивной иммунизацией в течение первых шести недель лечения была основана на аналогичной схеме, используемой для другой пептидной вакцины, которая доказала свою эффективность в индукции иммунного ответа у больных раком поджелудочной железы.
Анализ воспалительных цитокинов
Образцы сыворотки (только из группы 3), полученные на 1 неделе (исходный уровень) и неделе 10 (гемцитабин + капецитабин + GV1001) были проанализированы с помощью анализа цитокинов Luminex multiplex. В общей сложности были проанализированы 26 цитокинов, анализ уровня CRP проводили посредством ELISA.
|
Выделено серым цветом: анализ плазмы
Выделено курсивом: анализ сыворотки
Группа 1: пациенты получали GemCap в качестве единственного лечения, т.е. принятый в настоящее время стандарт химиотерапевтической схемы лечения больных раком поджелудочной железы с использованием комбинации гемцитабина (Gemcitabine, введение один раз в неделю в/в) и капицетабина (Capecitabine, (введение в таблетированной форме два раза в день). Группа 2: пациенты получали лечение GemCap с последующим введением GV1001 на неделе 7. Группа 3: пациенты получали одновременную терапию GemCap и GV1001 в течение всего периода лечения.
Цитокины
Группы некоторых цитокинов, тестированных на:
Факторы, связанные с функциями иммунной стимуляции:
INF-γ иммуностимулирующий
IL-12 (р70) иммуностимулирующий
IL-1β иммуностимулирующий
IL-6 иммуностимулирующий
TNF-α иммуностимулирующий
Факторы, связанные с функциями иммунной супрессии:
IL-10 иммуносупрессивный
IL-1Ra иммуносупрессивный
IL-4 иммуносупрессивный
VEGF иммуносупрессивный
Факторы, связанные с хемотаксическими функциями:
Эотаксин хемотактический
IL-8 хемотактический
IP-10 хемотактический
МСР-1 хемотактический
MIP-1α хемотактический
MIP-1β хемотактический
RANTES хемотактический
Факторы, связанные с функциями сосудистого ремоделирования:
FGF основной фактор ремоделирования сосудов
PDGF-BB сосудистое ремоделирование
VEGF сосудистое ремоделирование
Анализ сыворотки пациента
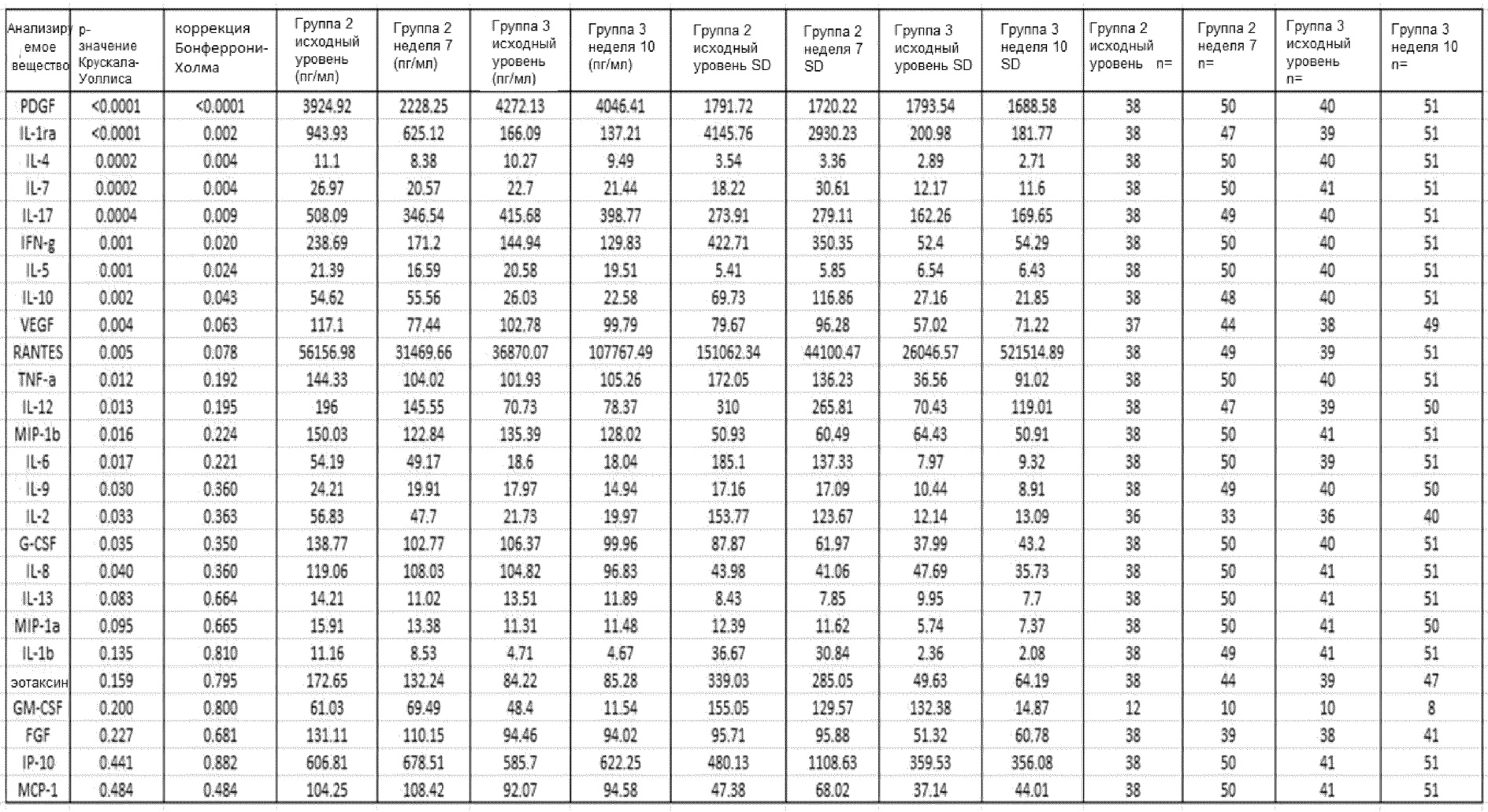
Результаты анализа цитокинов: в таблице 1 ниже приведены сравнительные исходные данные образцов сыворотки по тесту Крускала-Уоллиса в группе 2 и группе 3 (то есть до лечения), группы 2 на 7 неделе (GemCap) и группы 3 на 10 неделе (GemCap и GV1001). В тестировании по Крускалу-Уоллису идентифицировано 18 цитокинов со значительным различием по содержанию; после коррекции Бонферрони-Холма показатели 8 из этих цитокинов оставались на значительном уровне.
Результаты
Результаты показаны в таблицах 1-6 и фигурах 1-24.
Выявлено 7 цитокинов (IL-4, IL-5, IL-7, IL-17, PDGF, VEGF и RANTES), уровень которых был значительно более высоким после введения GV1001/GemCap по сравнению с введением GemCap в качестве единственного лечения. При использовании приблизительного нескорректированного двустороннего теста Манна-Уитни наиболее значительными были показатели PDGF (р<0,0001) и RANTES (р=0,002). После коррекции Бонферрони-Холма оба указанных показателя оставались значительными (табл. 2 и фиг. 1).
Введение GemCap вызывало снижение уровня некоторых цитокинов (показатели перед лечением по сравнению с показателями после лечения) во фракции сыворотки крови (но не в плазме); это снижение не было выявлено в присутствии GV1001 (таблица 3 и фиг. 2).
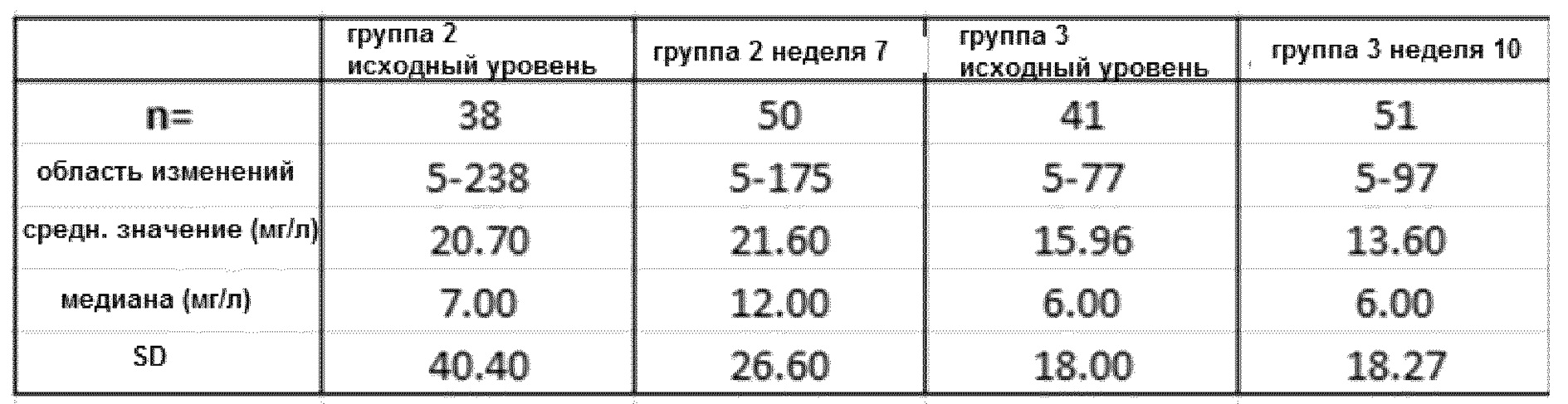
Уровни C-реактивного белка были значительно ниже в сыворотке пациентов, получавших GV1001/GemCap по сравнению с пациентами, получавшими лечение только GemCap (см. фиг. 3). Отсутствует какое-либо существенное различие в содержании CRP на исходном уровне (до лечения) по сравнению с уровнем после лечения GemCap (n=38), или при сравнении исходного уровня (до лечения) с уровнем после лечения GemCap и GV1001 (n=41) (фиг. 4).
В анализе первичной приблизительной выживаемости по уровню CRP было показано, что перед лечением [на исходном уровне] отсутствуют какие-либо доказательства, демонстрирующие связь между общей выживаемостью и уровнем CRP (уровень отсечки 6 мг/л) и в группе 2 и в группе 3. Дополнительно, после лечения в группе 2 не выявлено какой-либо связи между общей выживаемостью и уровнем CRP (отсечка 9 мг/мл). В противоположность этому, выявленный после лечения в группе 3 низкий уровень CRP был связан с более высокой общей выживаемостью и медианой выживаемости (486 дней) по сравнению с пациентами с высоким уровнем CRP (медиана 222 дня; р=0,0002) (фиг. 11). Без связи с какой-либо теорией, у пациентов, реагирующих на вакцину уменьшением уровня CRP, выявлен значительно более продолжительный период выживания, чем у пациентов без такой реакции.
Высокие исходные уровни эотаксина или MIP1α были связаны со значительным увеличением выживаемости в группе 3 (фиг. 6 и 7). Как и в случае CRP уровня после начального лечения, это необходимо подтверждать путем минимизации потенциальных стандартных ошибок от других прогностических критериев, но отмечен выраженный эффект. В некоторой степени удивительно, что при лечении с применением GV1001 не очевидна его возможность регулировать сывороточные уровни эотаксина или MIP1α, о чем свидетельствуют следующие данные:
|
Анализ сыворотки:
В таблице 1 показано сравнение Крускала-Уоллиса показателей исходного уровня в сыворотке крови в группах 2 и 3, в группе 2 на 7 неделе (GemCap) с показателями в группе на 10 неделе (GemCap и GV1001).
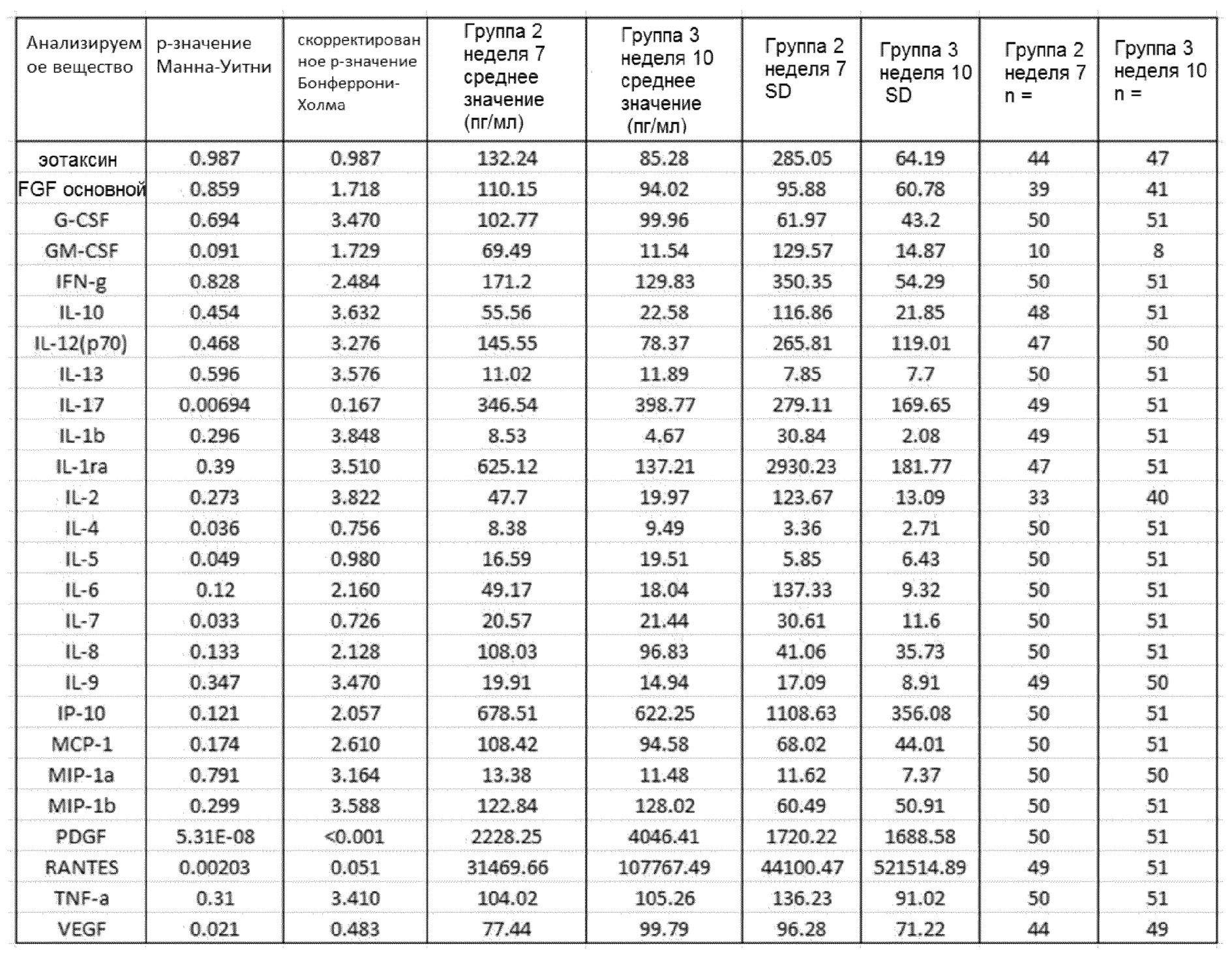
Сравнение показателей в группе 2 на 7 неделе (GemCap) с группой 3 на 10 неделе (GemCap и GV1001) в образцах сыворотки представлено в таблице 2.
С помощью анализа Манна-Уитни показано наличие значительного увеличения уровней IL-17, IL-4, IL-5, IL-7, PDGF, RANTES и VEGF в сыворотке пациентов из группы 3 на 10 неделе, которым вводили GemCap и GV1001, по сравнению с показателями в образцах сыворотки от пациентов группы 2 на 7 неделе, которые получали лечение только GemCap. Тем не менее, после коррекции Бонферрони-Холма только показатели PDGF оставались значительными. Сравнительные графики исходного уровня цитокинов IL-4, IL-5, IL7, IL-17, PDGF и VEGF в группах 2 и 3 и их уровня после лечения представлены на фиг. 1.
Был выполнен парный анализ:
- у пациентов группы 2 на исходном уровне и после 7 недель лечения GemCap.
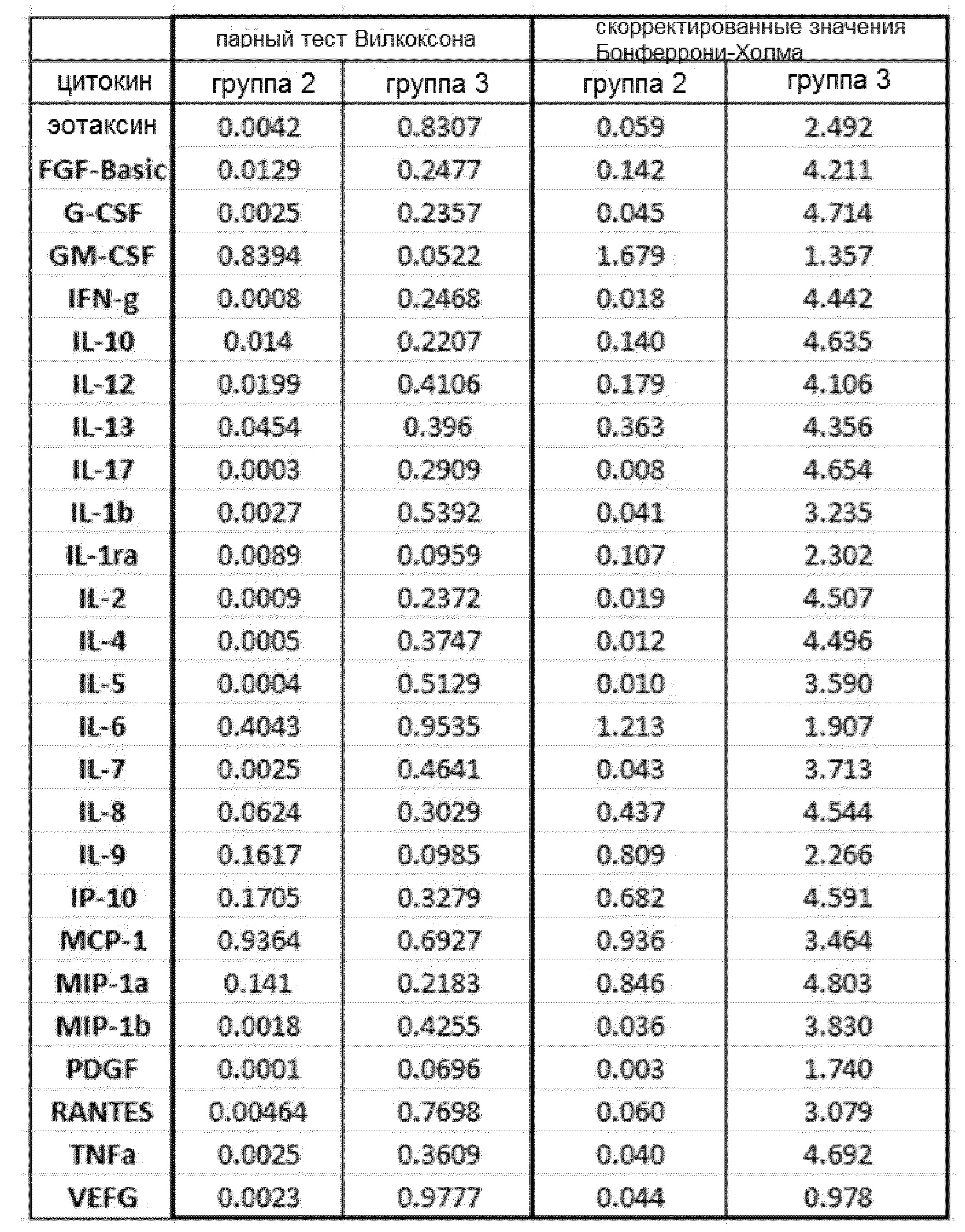
- у пациентов группы 3 на исходном уровне и после 10 недель лечения GemCap и GV1001. Полученные в этих анализах совокупные p-значения приведены в таблице 3.
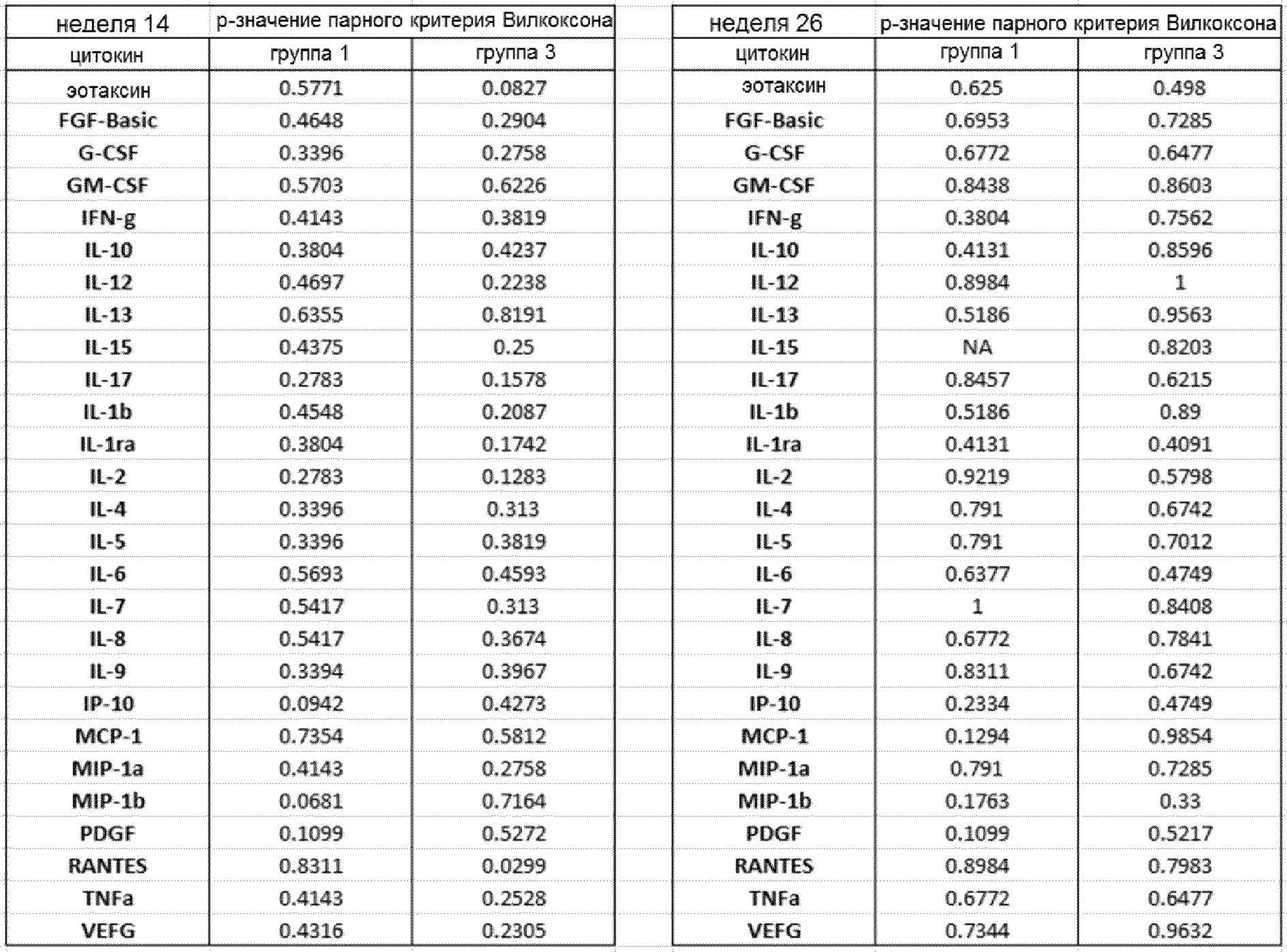
Выявлено отчетливое различие р-значений от пациентов и в группе 2 и в группе 3. В парном анализе Вилкоксона было показано, что существуют значительные различия между исходным уровнем 19 цитокинов в группе 2, и через 7 недель после лечения GemCap наблюдается снижение до 10 цитокинов в соответствии с коррекцией Бонферрони-Холма. Вместе с тем, в группе 3 только показатель GM-CSF приблизился к значению (р=0,052) между исходным уровнем и уровнем после 10 недель лечения GV1001/GemCap, что, в соответствии с коррекцией Бонферрони-Холма, уже не было релевантным.
Графики, показывающие парный анализ у пациентов в обеих группах 2 и 3 для выбора цитокинов, приведены на фиг. 2. На этой фигуре также показано количество положительных и отрицательных изменений, выявленных в образцах пациентов от исходного уровня до уровня после лечения. У большинства пациентов 2 группы уровень проанализированных цитокинов снижался от исходного уровня до недели 7, т.е. во время лечения GemCap. Эти результаты отличаются от результатов группы 3, где число положительных и отрицательных изменений распределено относительно равномерно.
Результаты анализов С-реактивного белка:
Были проанализированы показатели сывороточного CRP. На фигуре 3 показаны исходные уровни CRP в сыворотке у пациентов в группах 2 и 3 и уровни после лечения. Данные показывают, что отсутствует существенная разница в исходных уровнях CRP, при этом анализ после лечения показывает, что существует значительное различие, и уровень CRP у пациентов, получающих GV1001/GemCap, значительно ниже, чем у пациентов, получающих только GemCap. В таблице 4 приведены сводные статистические данные по различиям уровней CRP по группам и уровням - исходному и после лечения.
Как и в случае данных по цитокинам, выполняли парный анализ, что показано на фиг. 4. Отсутствовали какие-либо существенные различия и в группе 2 и в группе 3 от исходного уровня до уровня после лечения.
Анализ плазмы
Результаты анализа цитокинов:
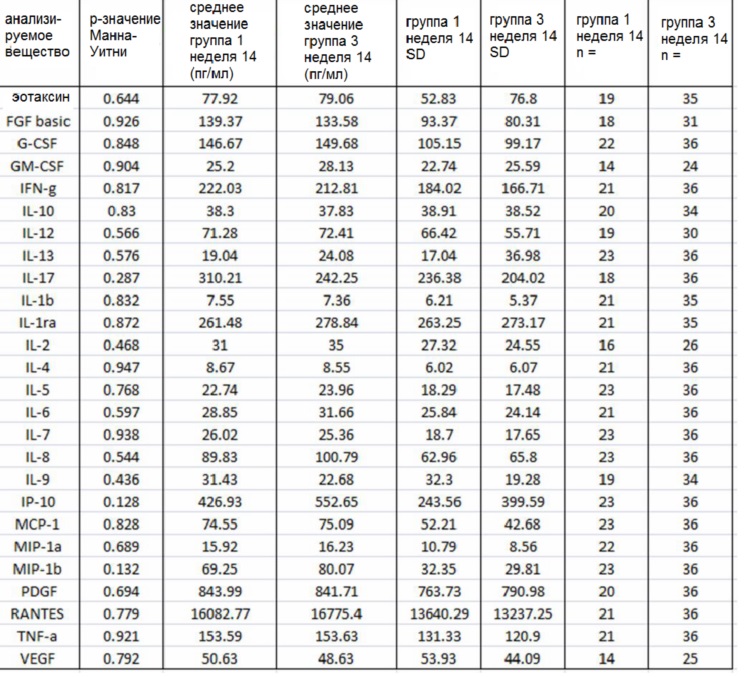
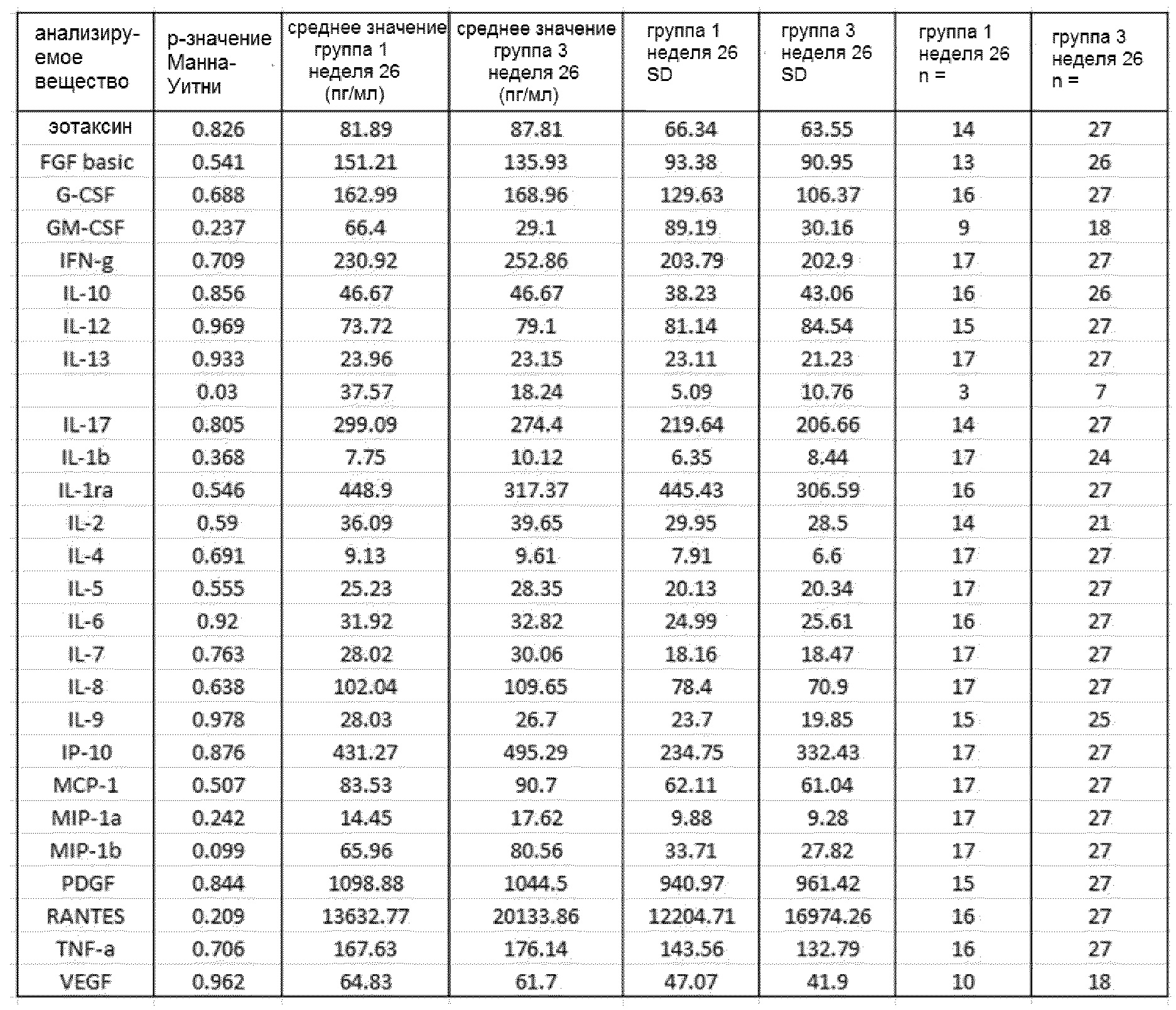
Сравнительные показатели образцов плазмы от группы 1 на 14 неделе (GemCap) и группы 3 на 14 неделе (GemCap и GV1001) приведены в таблице 4, при отсутствии существенных различий. Сравнительные показатели образцов плазмы от группы 1 на 26 неделе (GemCap) и группы 3 на 26 неделе (GemCap и GV1001) приведены в таблице 5, при отсутствии существенных различий.
Как и в случае анализа сыворотки, анализы плазмы выполняли с помощью парного теста Вилкоксона, и в приведенной ниже таблице 6 показаны следующие группы сравнения и р-значения:
- Группа 1 пациентов на исходном уровне и после 14 недель лечения GemCap.
- Группа 3 пациентов на исходном уровне и после 14 недель лечения GemCap и GV1001.
- Группа 1 пациентов на исходном уровне и после 26 недель лечения GemCap.
- Группа 3 пациентов на исходном уровне и после 26 недель лечения GemCap и GV1001.
Было отмечено, что снижение, которое выявлено для цитокинов в сыворотке после лечения GemCap, не было выявлено в плазме. Наблюдалось только одно существенное различие, выявленное для RANTES, в группе пациентов 3 на 14 неделе, где уровни снизились после лечения GemCap и GV1001, вместе с тем, в соответствии с коррекцией Бонферрони-Холма, это уже не было существенным.
Анализ выживаемости
Сывороточные цитокины:
В анализах первичной выживаемости при исходном уровне цитокинов, уровне после лечения и в анализе абсолютных изменений уровней цитокинов были показаны эффекты выживаемости в одной или в обеих группах на примере IL-8 (фиг. 5), эотаксина (фиг. 6), MIP1α (фиг. 7), MIP1β (фиг. 8) и VEGF (фиг. 9).
CRP:
В анализе первичной выживаемости выявлено влияние исходного уровня CRP на выживаемость, однако, этот эффект не достигает значимых показателей. Тем не менее, в группе 3 после лечения уровень CRP выявлена очевидная значительная корреляция с разницей в выживаемости (медиана выживаемости при высоком уровне CRP составляет 222 дня, медиана выживаемости при низком уровне CRP составляет 486 дней, р=0,002, фиг. 11), и этого не выявлено в группе 2 (фиг. 10).
|
|
|
|
|
|
|
Дополнительные результаты анализов
Фигура 13: графически показаны профили исходных значений и значений после лечения по логарифмическим данным уровня цитокинов в сыворотке крови в группе 2.
Фигура 14: показаны средние значения исходного уровня и уровня после лечения по логарифмическим данным уровня цитокинов в сыворотке крови в группе 3.
Фигура 15: графически показан профиль средних различий (уровень после лечения - исходный уровень) для цитокинов в сыворотке крови для каждой группы.
Примечание: для 19 цитокинов выявлено статистически значимое снижение между исходным уровнем и уровнем после лечения в группе 2 (PDGF, IL1β, IL-1ra, IL-2, IL-4, IL-5, IL-7, IL-10, IL-12, IL-13, IL-17, G-CSF, IFNγ, эотаксин, FGFb, MIP1β, RANTES, TNF, VEGF; но не выявлено такое снижение для CRP, IL-6, IL-8, IL-9, IL-15, GM-CSF, IP10, MCP1, MIP1α), и не выявлено такое снижение в группе 3. Согласно фигуре 16, представлены p-значения, полученные с помощью знакового рангового критерия Вилкоксона, который использовался для каждого цитокина из сыворотки в каждой группе для анализа увеличения/уменьшения значений от исходного уровня до уровня после лечения. Существенные различия (р<0,05) показаны жирным серым шрифтом. Увеличение было более значительным в группе 2, чем в группе 3, и в 19 случаев отмечено значительное снижение в группе 2, при этом в группе 3 такое снижение отсутствует.
Фигура 17: показано среднее различие в разности уровня после лечения и исходного уровня, для каждого цитокина в сыворотке, для каждой группы исследования. Уменьшения выделены светлым фоном, увеличения/отсутствие изменений выделены темным фоном.
Фигура 18: показаны модели пропорциональных рисков Кокса на исходных данных для каждого цитокина в сыворотке для каждой группы исследования. В таблице приведены одномерные анализы для исходных данных и показаны отношения рисков с р-значениями и доверительными интервалами 95%. Уровни CRP, IL-1ra, IL-2, IL-10, IFNγ и эотаксина являются значительными (р<0,1) в группе 2, при этом в группе 3 значительными являются уровни CRP, IL-1ra и эотаксина.
Фигура 19a и фиг. 19b: показаны исходные уровни CRP в группе 2 и группе 3. При низком уровне CRP медиана выживаемости составляет 337 дней в группе 2, и в группе 3 медиана выживаемости составляет 373 дней. Исходные уровни CRP являются прогностическими для общей средней выживаемости (ДИ 95%) в группе 3 (высокий уровень CRP=250 [132-451] дней; низкий уровень CRP=372,5 [229-517] дней; р=0,0500), в отличие от группы 2 (высокий уровень CRP=195 [140-262] дней; низкий уровень CRP=337 [167-366] дней; р=0,2534)
Фигура 20а и фиг. 20b: показаны исходные уровни эотаксина в группе 2 и группе 3. При низком уровне эотаксина в сыворотке медиана выживаемости составляет 300 дней в группе 2, и в группе 3 медиана выживаемости составляет 451 день. Исходные уровни эотаксина являются прогностическими для общей средней выживаемости (ДИ 95%) в группе 3 (высокий уровень эотаксина=451 [308-623] дней; низкий уровень эотаксина=238,5 [178-344] дней; р=0,0135), в отличие от группы 2 (высокий уровень эотаксина=299,5 [167-358] дней; низкий уровень эотаксина=188 [102-320] дней; р=0,1138).
Фигура 21a и фиг. 21b: показаны модели пропорциональных опасностей с помощью дихотомизированных переменных объединенных исходных данных уровней CRP и эотаксина в сыворотке. При объединении переменных на исходном уровне прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=337 дней) и аналогично для группы 3 (медиана выживаемости=450 дней).
Фигура 22а и фиг. 22b: показан уровень CRP в сыворотке крови после лечения в группе 2 и группе 3. При низком уровне CRP медиана выживаемости составляет 337 дней в группе 2, и в группе 3 медиана выживаемости составляет 450 дней.
Фигура 23а и фиг. 23b: показан уровень эотаксина в сыворотке после лечения в группе 2 и группе 3. При высоком уровне эотаксина медиана выживаемости составляет 251 дней в группе 2, и в группе 3 медиана выживаемости составляет 364 дня.
Фигура 24а и фиг.24b: показаны модели пропорциональных опасностей с помощью дихотомизированных переменных объединенных данных уровней CRP и эотаксина в сыворотке после лечения. При объединении переменных прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=355 дней) и аналогично для группы 3 (медиана выживаемости=535 дней). При объединении переменных, по данным после лечения, прогнозировалась максимальная общая выживаемость с помощью комбинации низких уровней CRP плюс высоких уровней эотаксина в группе 2 (медиана выживаемости=355 дней) и аналогично для группы 3 (медиана выживаемости=535 дней).
Список последовательностей (в произвольной форме)
Данные биологических последовательностей
SEQ ID NO: 1: аминокислотная последовательность GV1001: EARPALLTSRLRFIPK
SEQ ID NO: 2: Человеческий эотаксин (эотаксин 1) (хемокин CCL11 (CC мотив) лиганд 11); Белок: UniProt ID: P51671; Длина: 97 аминокислот, молекулярная масса MW: 10,732 КДа: MKVSAALLWLLLIAAAFSPQGLAGPASVPTTCCFNLANRKIPLQRLESYRRITSGKCPQKAVIFKTKLAKDICADPKKKWVQDSMKYLDQKSPTPKP
SEQ ID NO: 3: Человеческий эотаксин 2 (CCL24); Белок; UniProt ID: O00175; Длина: 119 аминокислот, МW: 13,134 КДа: MAGLMTIVTSLLFLGVCAHHIIPTGSVVIPSPCCMFFVSKRIPENRVVSYQLSSRSTCLKAGVIFTTKKGQQFCGDPKQEWVQRYMKNLDAKQKKASPRARAVAVKGPVQRYPGNQTTC
SEQ ID NO: 4: Человеческий эотаксин 3 (CCL26); Белок; UniProt ID: Q9Y258; Длина: 94 аминокислот, MW: 10,648 кД: MMGLSLASAVLLASLLSLHLGTATRGSDISKTCCFQYSHKPLPWTWVRSYEFTSNSCSQRAVIFTTKRGKKVCTHPRKKWVQKYISLLKTPKQL
SEQ ID NO: 5; Человеческий эотаксин (эотаксин 1) (CCL11 хемокин (CC мотив) лиганд 11); нуклеиновая кислота; NCBI GeneBank ID:NM_002986.2: ATGGGCAAAGGCTTCCCTGGAATCTCCCACACTGTCTGCTCCCTATAAAAGGCAGGCAGATGGGCCAGAGGAGCAGAGAGGCTGAGACCAACCCAGAAACCACCACCTCTCACGCCAAAGCTCACACCTTCAGCCTCCAACATGAAGGTCTCCGCAGCACTTCTGTGGCTGCTGCTCATAGCAGCTGCCTTCAGCCCCCAGGGGCTCGCTGGGCCAGCTTCTGTCCCAACCACCTGCTGCTTTAACCTGGCCAATAGGAAGATACCCCTTCAGCGACTAGAGAGCTACAGGAGAATCACCAGTGGCAAATGTCCCCAGAAAGCTGTGATCTTCAAGACCAAACTGGCCAAGGATATCTGTGCCGACCCCAAGAAGAAGTGGGTGCAGGATTCCATGAAGTATCTGGACCAAAAATCTCCAACTCCAAAGCCATAAATAATCACCATTTTTGAAACCAAACCAGAGCCTGAGTGTTGCCTAATTTGTTTTCCCTTCTTACAATGCATTCTGAGGTAACCTCATTATCAGTCCAAAGGGCATGGGTTTTATTATATATATATATTTTTTTTTTTAAAAAAAAAACGTATTGCATTTAATTTATTGAGGCTTTAAAACTTATCCTCCATGAATATCAGTTATTTTTAAACTGTAAAGCTTTGTGCAGATTCTTTACCCCCTGGGAGCCCCAATTCGATCCCCTGTCACGTGTGGGCAATGTTCCCCCTCTCCTCTCTTCCTCCCTGGAATCTTGTAAAGGTCCTGGCAAAGATGATCAGTATGAAAATGTCATTGTTCTTGTGAACCCAAAGTGTGACTCATTAAATGGAAGTAAATGTTGTTTTAGGAATACATAAAGTATGTGCATATTTTATTATAGTCACTAGTTGTAATTTTTTTGTGGGAAATCCACACTGAGCTGAGGGGG
SEQ ID NO: 6: Человеческий эотаксин 2 (CCL24); нуклеиновая кислота; NCBI GeneBank ID: NM_002991.2:
ATGGCAGGCCTGATGACCATAGTAACCAGCCTTCTGTTCCTTGGTGTCTGTGCCCACCACATCATCCCTACGGGCTCTGTGGTCATCCCCTCTCCCTGCTGCATGTTCTTTGTTTCCAAGAGAATTCCTGAGAACCGAGTGGTCAGCTACCAGCTGTCCAGCAGGAGCACATGCCTCAAGGCAGGAGTGATCTTCACCACCAAGAAGGGCCAGCAGTTCTGTGGCGACCCCAAGCAGGAGTGGGTCCAGAGGTACATGAAGAACCTGGACGCCAAGCAGAAGAAGGCTTCCCCTAGGGCCAGGGCAGTGGCTGTCAAGGGCCCTGTCCAGAGATATCCTGGCAACCAAACCACCTGCTAA
SEQ ID NO: 7: Человеческий эотаксин 3 (CCL26); нуклеиновая кислота; NCBI GeneBank ID: NM_006072.4:
CTGGAATTGAGGCTGAGCCAAAGACCCCAGGGCCGTCTCAGTCTCATAAAAGGGGATCAGGCAGGAGGAGTTTGGGAGAAACCTGAGAAGGGCCTGATTTGCAGCATCATGATGGGCCTCTCCTTGGCCTCTGCTGTGCTCCTGGCCTCCCTCCTGAGTCTCCACCTTGGAACTGCCACACGTGGGAGTGACATATCCAAGACCTGCTGCTTCCAATACAGCCACAAGCCCCTTCCCTGGACCTGGGTGCGAAGCTATGAATTCACCAGTAACAGCTGCTCCCAGCGGGCTGTGATATTCACTACCAAAAGAGGCAAGAAAGTCTGTACCCATCCAAGGAAAAAATGGGTGCAAAAATACATTTCTTTACTGAAAACTCCGAAACAATTGTGACTCAGCTGAATTTTCATCCGAGGACGCTTGGACCCCGCTCTTGGCTCTGCAGCCCTCTGGGGAGCCTGCGGAATCTTTTCTGAAGGCTACATGGACCCGCTGGGGAGGAGAGGGTGTTTCCTCCCAGAGTTACTTTAATAAAGGTTGTTCATAGAGTTGACTTGTTCAT
SEQ ID NO: 8: Человеческий CRP (С-реактивный белок); Белок; UniProt ID: Q5VVP7; Длина: 102 аминокислот, MW: 11,632 КДа: MEKLLCFLVLTSLSHAFGQTDMSRKAFVFPKESDTSYVSLKAPLTKPLKAFTVCLHFYTELSSTHEINTIYLGGPFSPNVLNWRALKYEVQGEVFTKPQLWP
SEQ ID NO: 9: Человеческий CRP (С-реактивный белок); нуклеиновая кислота; NCBI GeneBank ID: NM_000567.2:
AAGGCAAGAGATCTAGGACTTCTAGCCCCTGAACTTTCAGCCGAATACATCTTTTCCAAAGGAGTGAATTCAGGCCCTTGTATCACTGGCAGCAGGACGTGACCATGGAGAAGCTGTTGTGTTTCTTGGTCTTGACCAGCCTCTCTCATGCTTTTGGCCAGACAGACATGTCGAGGAAGGCTTTTGTGTTTCCCAAAGAGTCGGATACTTCCTATGTATCCCTCAAAGCACCGTTAACGAAGCCTCTCAAAGCCTTCACTGTGTGCCTCCACTTCTACACGGAACTGTCCTCGACCCGTGGGTACAGTATTTTCTCGTATGCCACCAAGAGACAAGACAATGAGATTCTCATATTTTGGTCTAAGGATATAGGATACAGTTTTACAGTGGGTGGGTCTGAAATATTATTCGAGGTTCCTGAAGTCACAGTAGCTCCAGTACACATTTGTACAAGCTGGGAGTCCGCCTCAGGGATCGTGGAGTTCTGGGTAGATGGGAAGCCCAGGGTGAGGAAGAGTCTGAAGAAGGGATACACTGTGGGGGCAGAAGCAAGCATCATCTTGGGGCAGGAGCAGGATTCCTTCGGTGGGAACTTTGAAGGAAGCCAGTCCCTGGTGGGAGACATTGGAAATGTGAACATGTGGGACTTTGTGCTGTCACCAGATGAGATTAACACCATCTATCTTGGCGGGCCCTTCAGTCCTAATGTCCTGAACTGGCGGGCACTGAAGTATGAAGTGCAAGGCGAAGTGTTCACCAAACCCCAGCTGTGGCCCTGAGGCCCAGCTGTGGGTCCTGAAGGTACCTCCCGGTTTTTTACACCGCATGGGCCCCACGTCTCTGTCTCTGGTACCTCCCGCTTTTTTACACTGCATGGTTCCCACGTCTCTGTCTCTGGGCCTTTGTTCCCCTATATGCATTGCAGGCCTGCTCCACCCTCCTCAGCGCCTGAGAATGGAGGTAAAGTGTCTGGTCTGGGAGCTCGTTAACTATGCTGGGAAACGGTCCAAAAGAATCAGAATTTGAGGTGTTTTGTTTTCATTTTTATTTCAAGTTGGACAGATCTTGGAGATAATTTCTTACCTCACATAGATGAGAAAACTAACACCCAGAAAGGAGAAATGATGTTATAAAAAACTCATAAGGCAAGAGCTGAGAAGGAAGCGCTGATCTTCTATTTAATTCCCCACCCATGACCCCCAGAAAGCAGGAGGGCATTGCCCACATTCACAGGGCTCTTCAGTCTCAGAATCAGGACACTGGCCAGGTGTCTGGTTTGGGTCCAGAGTGCTCATCATCATGTCATAGAACTGCTGGGCCCAGGTCTCCTGAAATGGGAAGCCCAGCAATACCACGCAGTCCCTCCACTTTCTCAAAGCACACTGGAAAGGCCATTAGAATTGCCCCAGCAGAGCAGATCTGCTTTTTTTCCAGAGCAAAATGAAGCACTAGGTATAAATATGTTGTTACTGCCAAGAACTTAAATGACTGGTTTTTGTTTGCTTGCAGTGCTTTCTTAATTTTATGGCTCTTCTGGGAAACTCCTCCCCTTTTCCACACGAACCTTGTGGGGCTGTGAATTCTTTCTTCATCCCCGCATTCCCAATATACCCAGGCCACAAGAGTGGACGTGAACCACAGGGTGTCCTGTCAGAGGAGCCCATCTCCCATCTCCCCAGCTCCCTATCTGGAGGATAGTTGGATAGTTACGTGTTCCTAGCAGGACCAACTACAGTCTTCCCAAGGATTGAGTTATGGACTTTGGGAGTGAGACATCTTCTTGCTGCTGGATTTCCAAGCTGAGAGGACGTGAACCTGGGACCACCAGTAGCCATCTTGTTTGCCACATGGAGAGAGACTGTGAGGACAGAAGCCAAACTGGAAGTGGAGGAGCCAAGGGATTGACAAACAACAGAGCCTTGACCACGTGGAGTCTCTGAATCAGCCTTGTCTGGAACCAGATCTACACCTGGACTGCCCAGGTCTATAAGCCAATAAAGCCCCTGTTTACTTGAAAAAAAAAA
SEQ ID NO: 10: Человеческий MIP1α (CCL3 хемокин (CC мотив) лиганд 3); Белок; UniProt ID: P10147; Длина: 92 аминокислот, MW: 10,085 кД:
MQVSTAALAVLLCTMALCNQFSASLAADTPTACCFSYTSRQIPQNFIADYFETSSQCSKПГVIFLTKRSRQVCADPSEEWVQKYVSDLELSA
SEQ ID NO: 11: Человеческий MIP1α (CCL3 хемокин (CC мотив) лиганд 3); нуклеиновая кислота; NCBI GeneBank ID: NM_002983.2: AGCTGGTTTCAGACTTCAGAAGGACACGGGCAGCAGACAGTGGTCAGTCCTTTCTTGGCTCTGCTGACACTCGAGCCCACATTCCGTCACCTGCTCAGAATCATGCAGGTCTCCACTGCTGCCCTTGCTGTCCTCCTCTGCACCATGGCTCTCTGCAACCAGTTCTCTGCATCACTTGCTGCTGACACGCCGACCGCCTGCTGCTTCAGCTACACCTCCCGGCAGATTCCACAGAATTTCATAGCTGACTACTTTGAGACGAGCAGCCAGTGCTCCAAGCCCGGTGTCATCTTCCTAACCAAGCGAAGCCGGCAGGTCTGTGCTGACCCCAGTGAGGAGTGGGTCCAGAAATATGTCAGCGACCTGGAGCTGAGTGCCTGAGGGGTCCAGAAGCTTCGAGGCCCAGCGACCTCGGTGGGCCCAGTGGGGAGGAGCAGGAGCCTGAGCCTTGGGAACATGCGTGTGACCTCCACAGCTACCTCTTCTATGGACTGGTTGTTGCCAAACAGCCACACTGTGGGACTCTTCTTAACTTAAATTTTAATTTATTTATACTATTTAGTTTTTGTAATTTATTTTCGATTTCACAGTGTGTTTGTGATTGTTTGCTCTGAGAGTTCCCCTGTCCCCTCCCCCTTCCCTCACACCGCGTCTGGTGACAACCGAGTGGCTGTCATCAGCCTGTGTAGGCAGTCATGGCACCAAAGCCACCAGACTGACAAATGTGTATCGGATGCTTTTGTTCAGGGCTGTGATCGGCCTGGGGAAATAATAAAGATGCTCTTTTAAAAGGTAAAAAAAAAAAAAAAAAAA