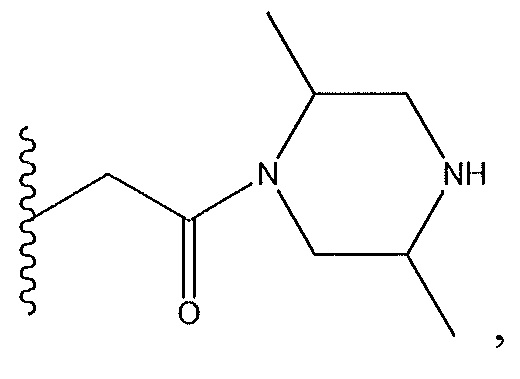
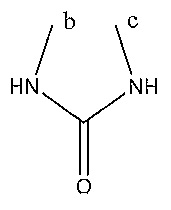
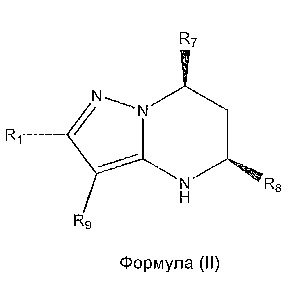
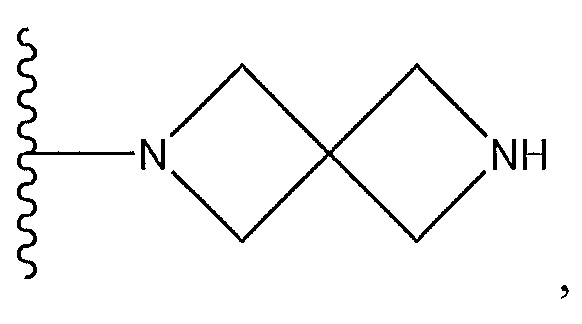
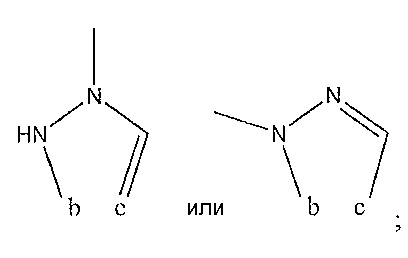
Результат интеллектуальной деятельности: СОЕДИНЕНИЯ ТЕТРАГИДРОПИРАЗОЛОПИРИМИДИНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
[0001] По данной заявке испрашивают приоритет предварительной патентной заявки США № 61/654023, поданной 31 мая 2012 года. Упомянутая выше заявка включена в настоящий документ в качестве ссылки.
ПРЕДПОСЫЛКИ
[0002] Область техники
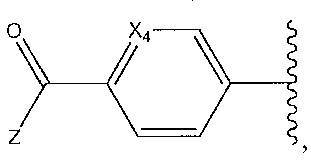
[0003] Варианты осуществления изобретения относятся к соединениям тетрагидропиразолопиримидина («THPP») и фармацевтическим средствам, содержащим одно или несколько этих соединений в качестве активного ингредиента(ов). Более конкретно, варианты осуществления изобретения относятся к соединению THPP, которое выполняет функцию антагониста или ингибитора Toll-подобных рецепторов (TLR) 7 и 8, и его применению в фармацевтической композиции, эффективной для лечения системной красной волчанки (SLE) и волчаночного нефрита.
[0004] Описание смежных (перекрестных) областей
[0005] Системная красная волчанка (SLE) и волчаночный нефрит представляют собой аутоиммунные заболевания, отличающиеся воспалением и повреждением тканей. Например, SLE может вызывать повреждение кожи, печени, почек, суставов, легких и центральной нервной системы. Страдающие SLE могут испытывать общие симптомы, такие как крайнее утомление, болезненные и набухшие суставы, необъяснимая лихорадка, кожная сыпь и нарушение функции почек. Поскольку вовлечение органов различается среди пациентов, симптомы могут варьировать. SLE преимущественно представляет собой заболевание молодых женщин, с пиковым началом в возрасте между 15-40 годами и приблизительно 10-кратным преобладанием распространенности среди женщин по сравнению с мужчинами.
[0006] Существующее лечение для SLE традиционно включает иммуномодулирующие лекарственные средства, такие как гидроксихлорохин, преднизон и циклофосфамид. Все эти лекарственные средства могут иметь дозолимитирующие побочные эффекты.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
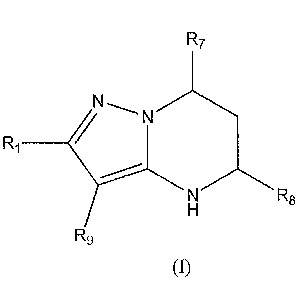
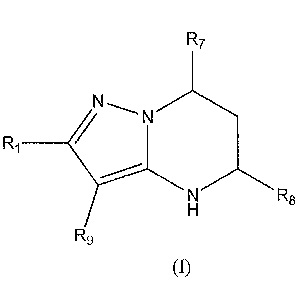
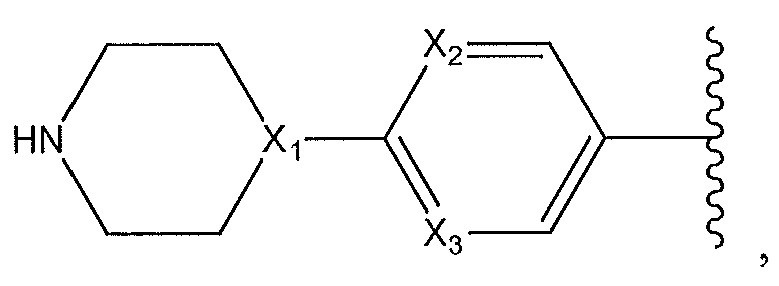
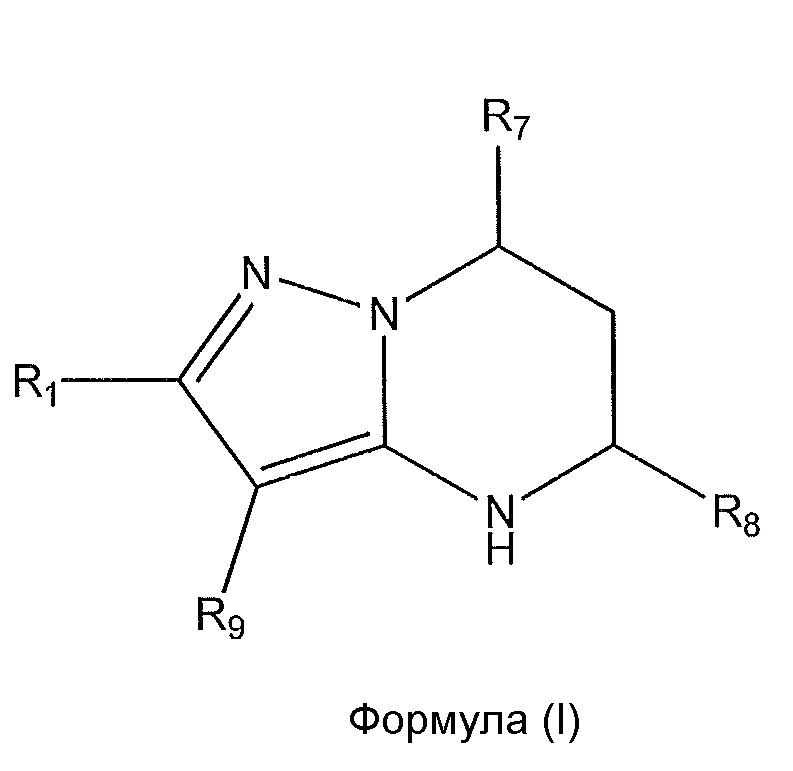
[0007] Варианты осуществления изобретения раскрывают соединения и способы применения для предотвращения или лечения заболеваний или состояний у пациента, отличающихся активацией Toll-подобного рецептора 7 или 8. Один из вариантов осуществления изобретения направлен на соединение формулы (I):
 ,
,
или его фармацевтически приемлемую соль или его стереоизомеры или их смесью, где
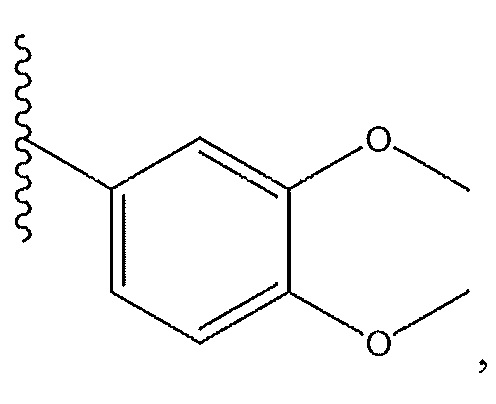
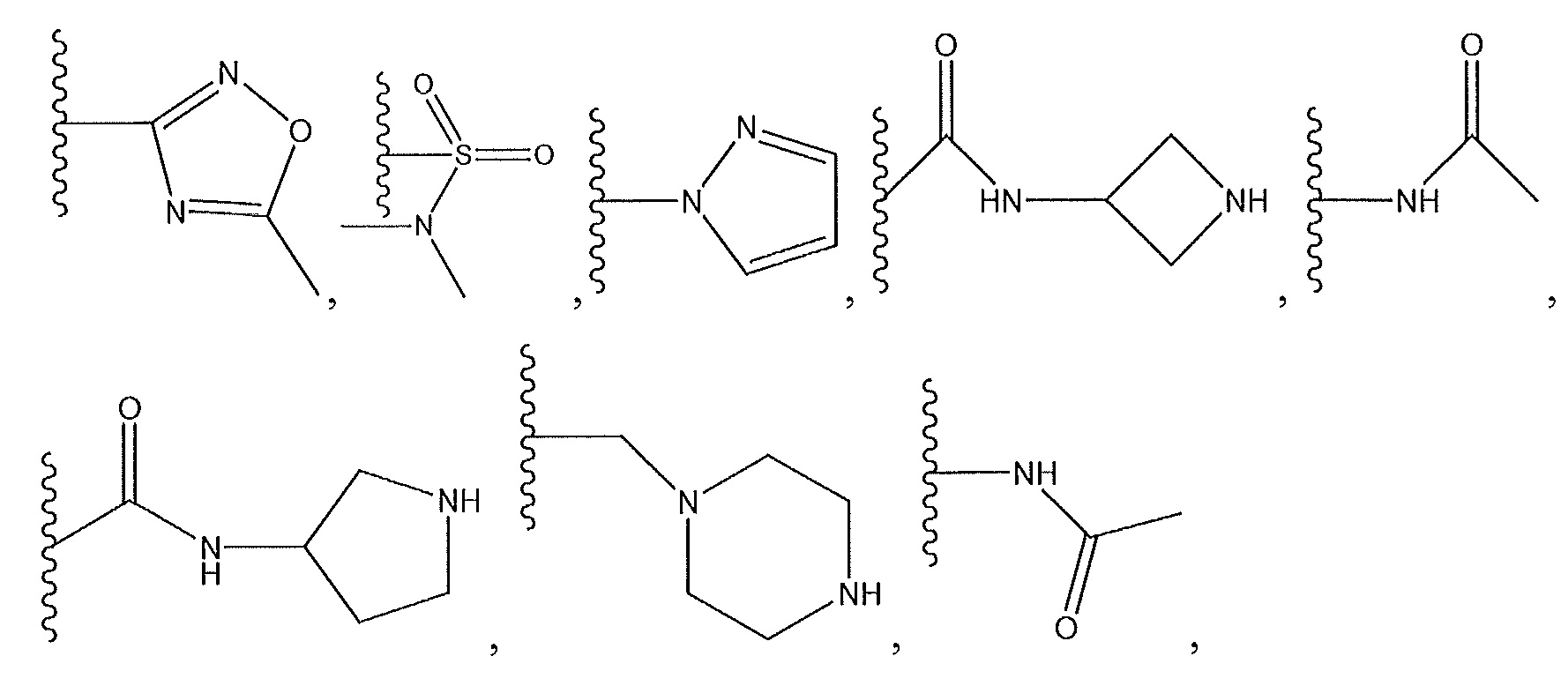
R1 представляет собой необязательно замещенный пиперидинил, необязательно замещенный пиридил, необязательно замещенный пирролил, необязательно замещенный пирролидинил, необязательно замещенный тиазолил, 1,4-климетилтиазолил, 2-этил-4-метилтиазолил, 2-изопропилтиазол-5-ил, тиазолил, 3- этилтиазол-5-ил, 1-метилсульфонилпиперидин-4-ил, или
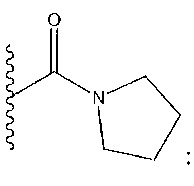
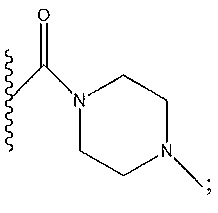
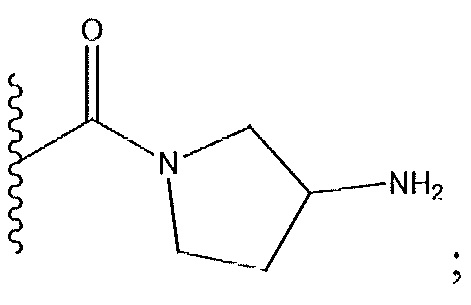
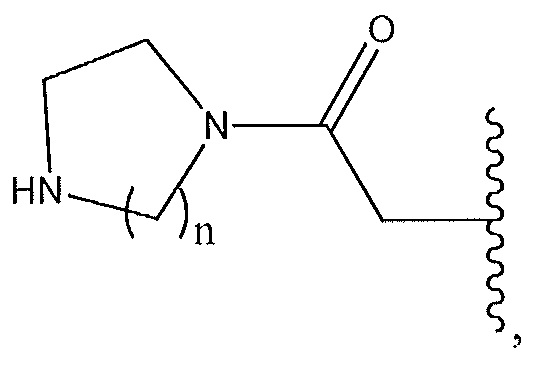
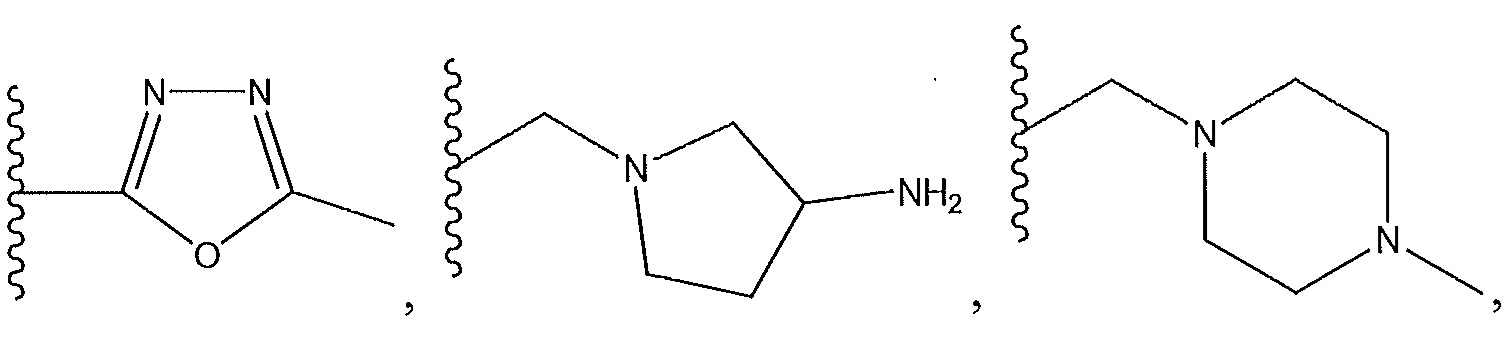
R1 представляет собой -C(O)Z, где Z представляет собой необязательно замещенный пиперазинил, необязательно замещенный пиридил, необязательно замещенный пирролил, (S)-2-(3-этилпиперазин-1-ил), необязательно замещенный пирролопирролил, пиперидин-3-иламино, или
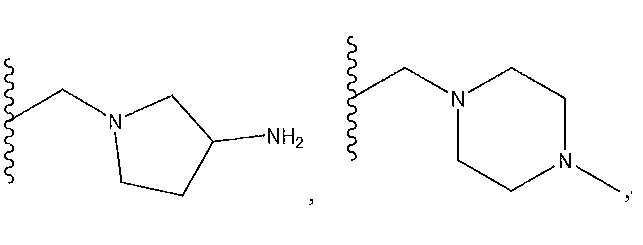
R1 представляет собой
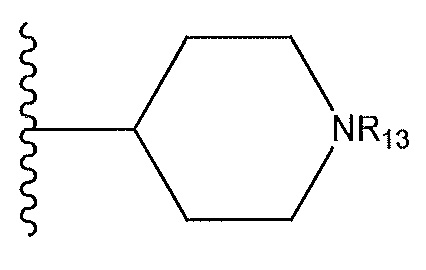 ,
,
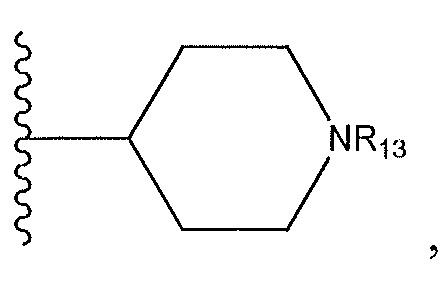
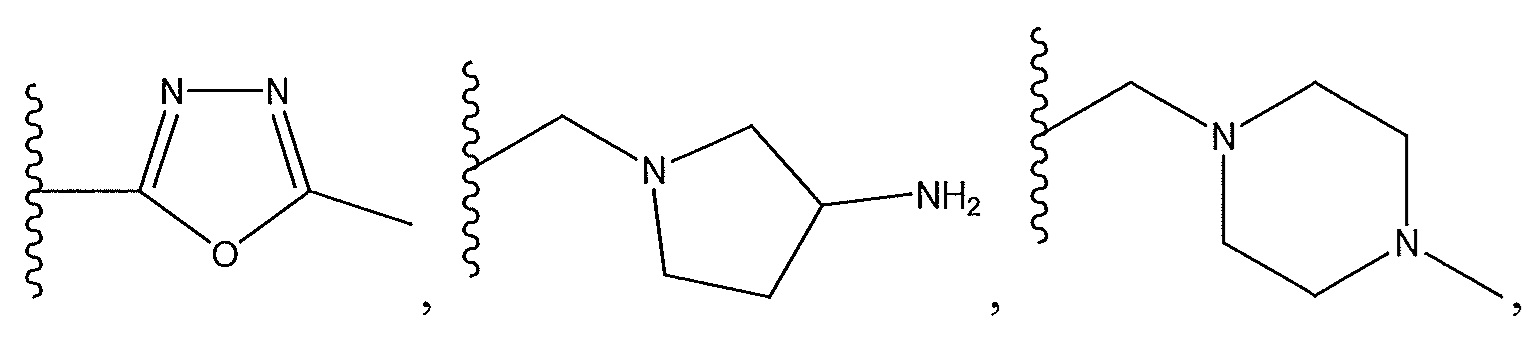
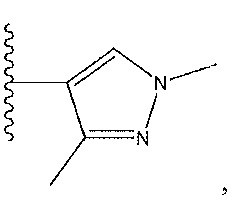
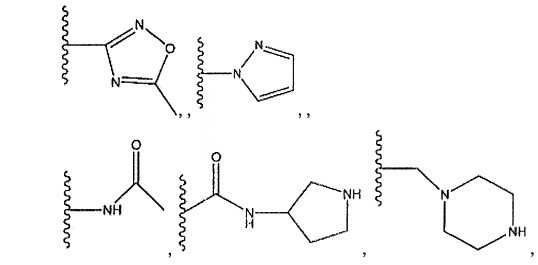
где R13 представляет собой H, необязательно замещенный пиразолил, необязательно замещенный имидазолил, бензил, 3-гидроксибутил, 3-(диметиламино)-2,2-диметилпропил, амид, метиламид, этиламид, необязательно замещенный пиридил, метилсульфонил, (1-метилимидазол-2-ил)метил, (1,5-диметилимидазол-4-ил)метил, (1-метилпиррол-2-ил)метил, или где R13 представляет собой C(O)W, где W представляет собой -N(CH3)2, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, необязательно замещенный пиразолил, необязательно замещенный пирролил или необязательно замещенный морфолинил, или
R1 представляет собой
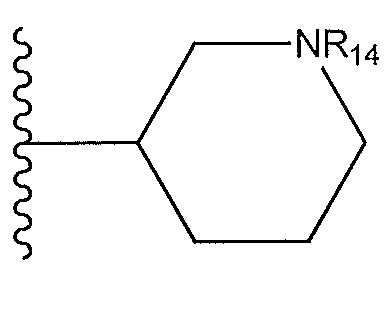 ,
,
где R14 представляет собой -C(O)CH3, H или (1-метилпиррол-2-ил)метил, или
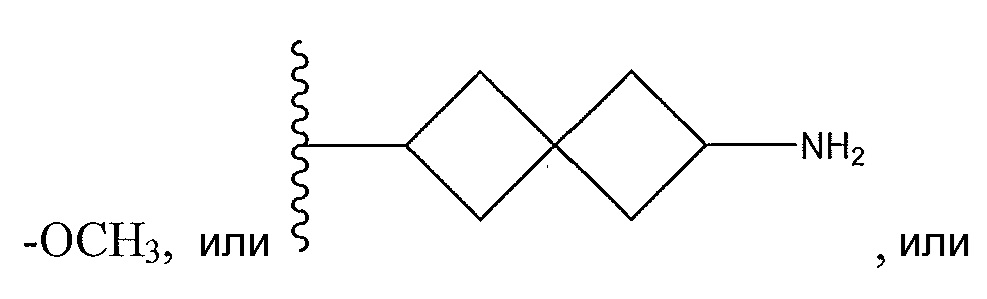
R1 представляет собой
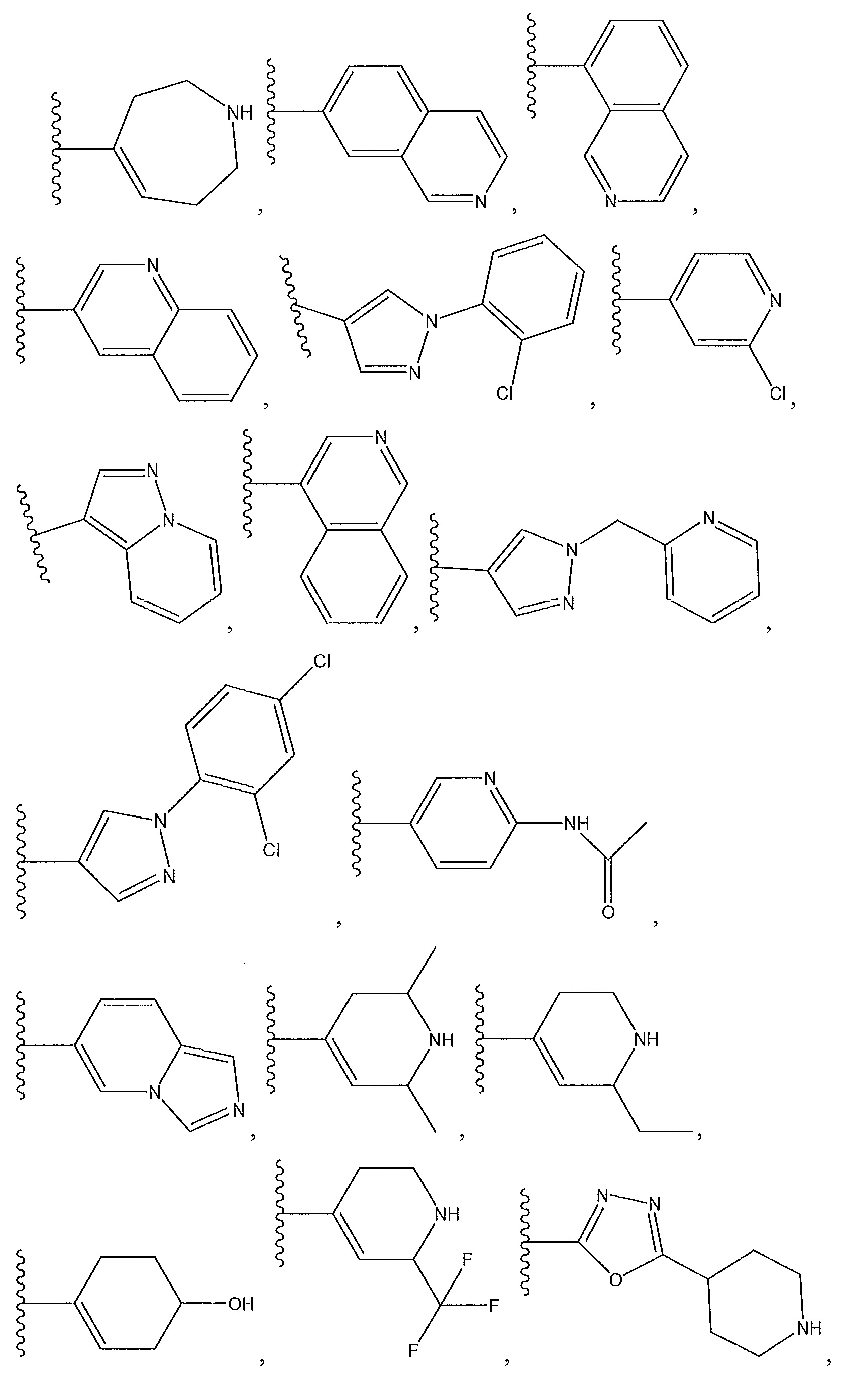
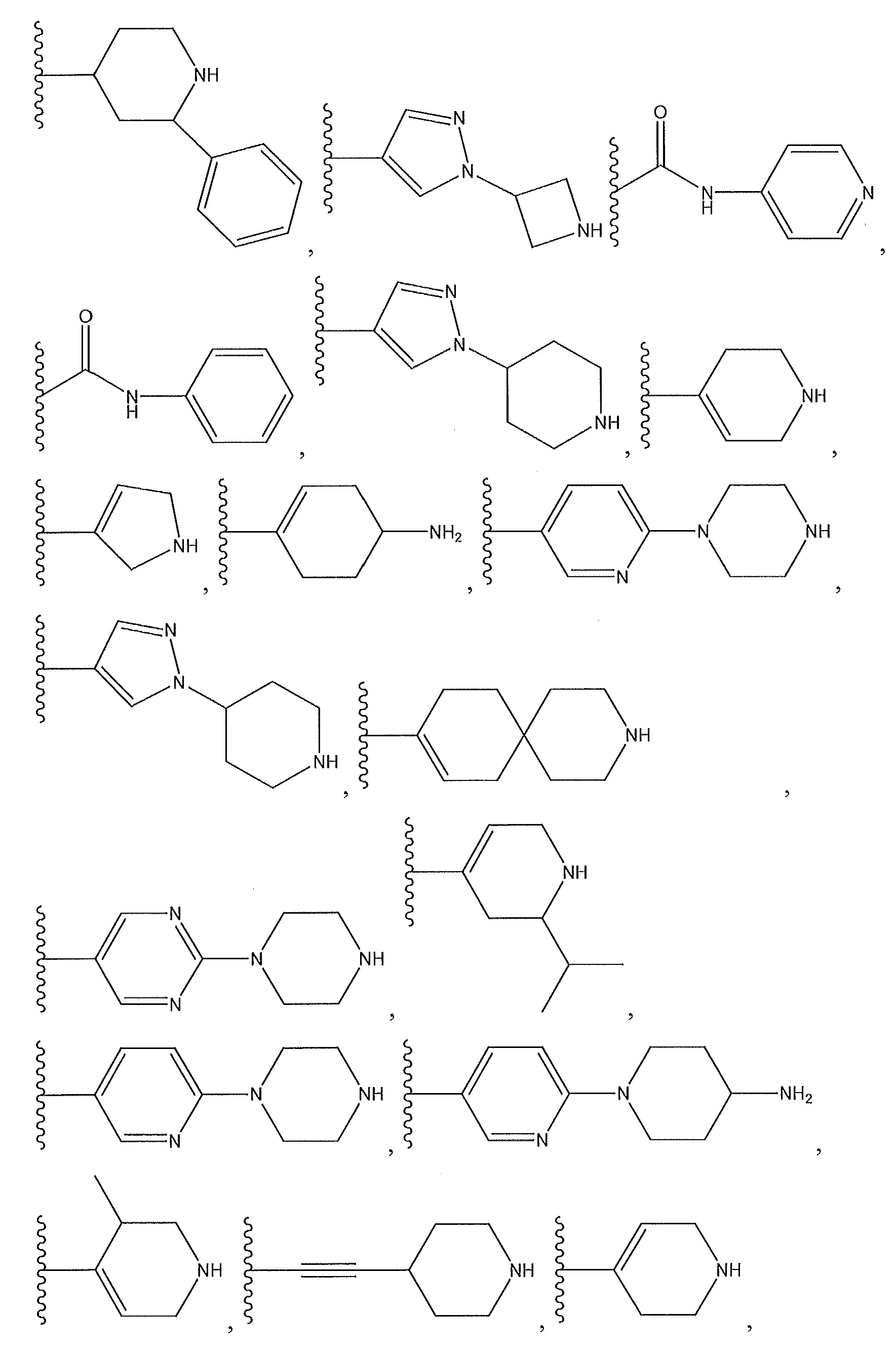
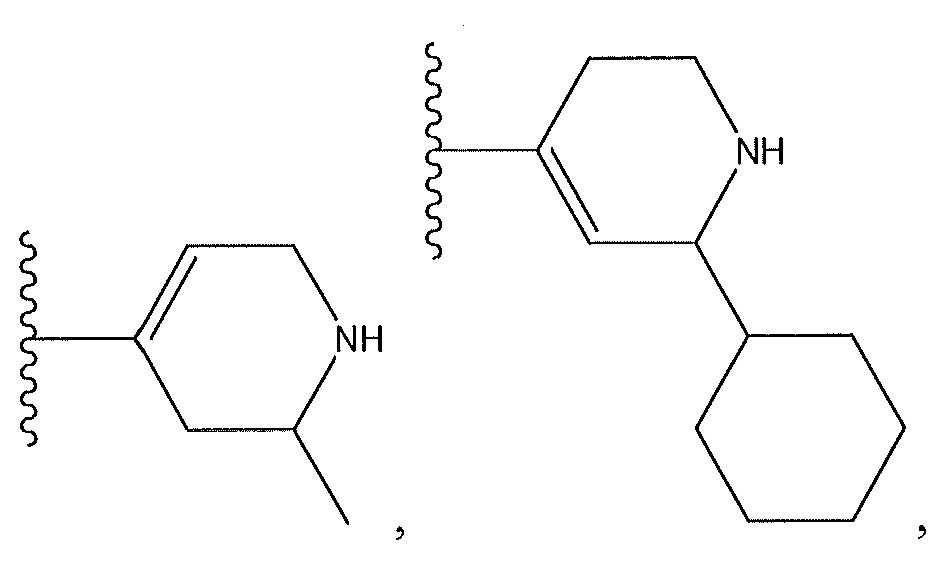
необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, необязательно замещенный пиразолил, необязательно замещенный пирролил, или
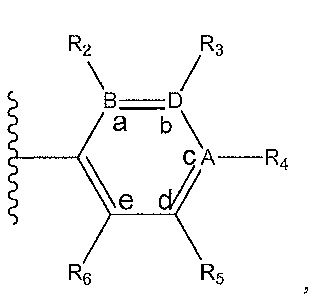
R1 представляет собой
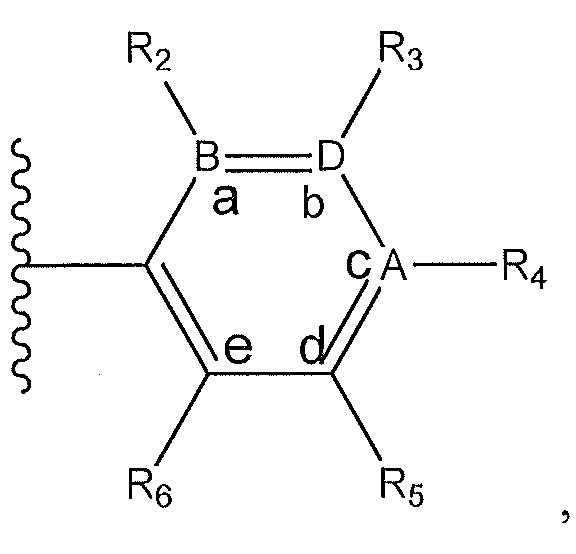
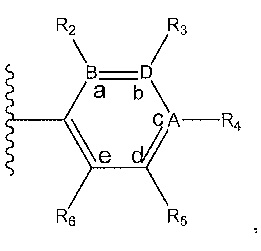
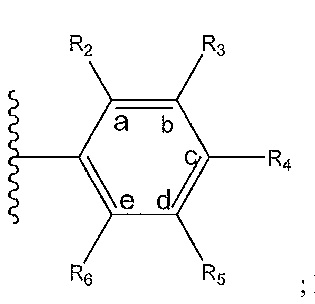
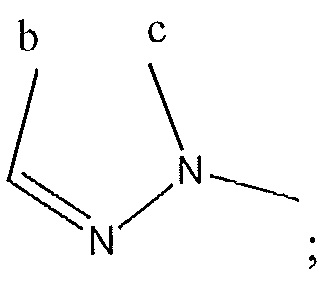
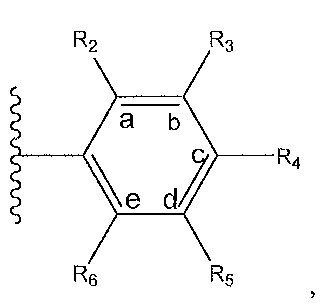
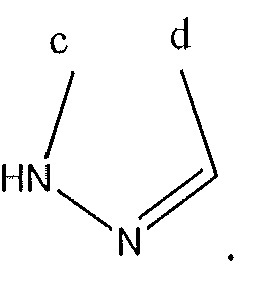
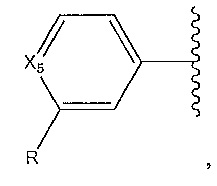
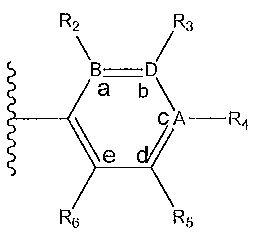
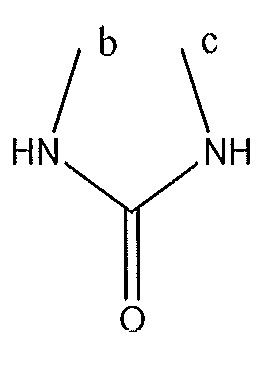
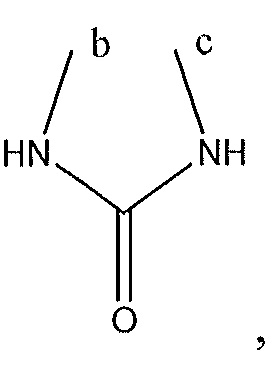
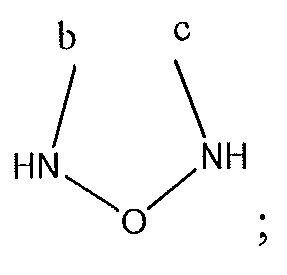
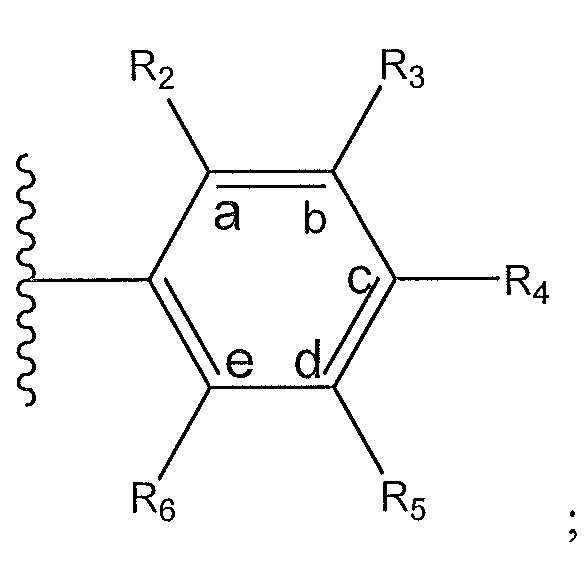
где A, B и D все могут представлять собой углерод, или где два из A, B и D представляют собой углерод, а другой представляет собой азот, или где один из A, B и D представляет собой углерод, а остальные два представляют собой азот; и когда A представляет собой азот, R4 отсутствует, когда B представляет собой азот, R2 отсутствует, и когда D представляет собой азот, R3 отсутствует; и где
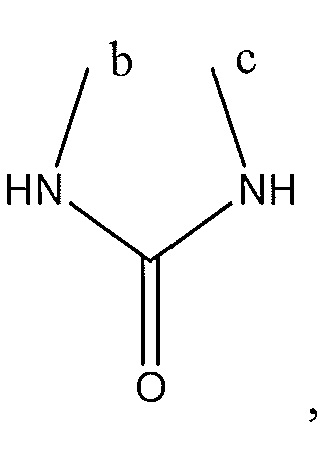
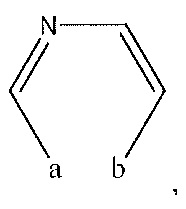
R2 представляет собой H, -CH3 или F или с R3 и атомами в положениях a и b формирует необязательно замещенный пиридин или пиразол; и где
R3 представляет собой H, F, Cl, -CN, -CH3, -OCH3, -OH, -NH2, метилсульфонил,
или с R4 и атомами в b и c образует необязательно замещенный бензол, необязательно замещенный имидазол, необязательно замещенный пиразол, необязательно замещенный пиразолидин, необязательно замещенный имидазолидин, необязательно замещенный изотиазол,
 ,
,
или с R2 и атомами в a и b образует необязательно замещенный пиридин или необязательно замещенный пиразол; и где
R4 представляет собой F, -CN, -OCH3, -OEt, H, Cl, Br, -NH-C(O)-CH-(CH3)2, -N(CH3)2, -CH3, -CH2OH,
необязательно замещенный пиперазинил, необязательно замещенный пиперидинил, необязательно замещенный пиразолил, необязательно замещенный пирролил, 4-гидроксипиперизин-1-ил, необязательно замещенный пиперидинил, не прикрепленный к фенильной группе через азот, или с R3 и атомами в b и c образует необязательно замещенное пиразольное кольцо или
или с R5 и атомами в c и d образует необязательно замещенный пиразол или необязательно замещенный пиррол, или
R4 представляет собой -(q)-C(O)X, где q представляет собой одинарную связь, представляет собой -NH- или представляет собой -CH2-, и
где X представляет собой -NR11R12,
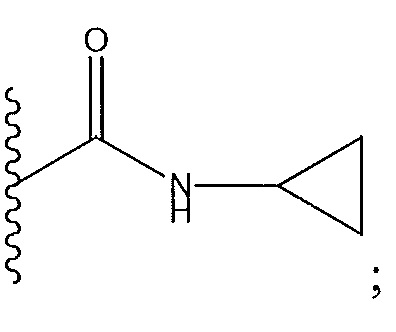
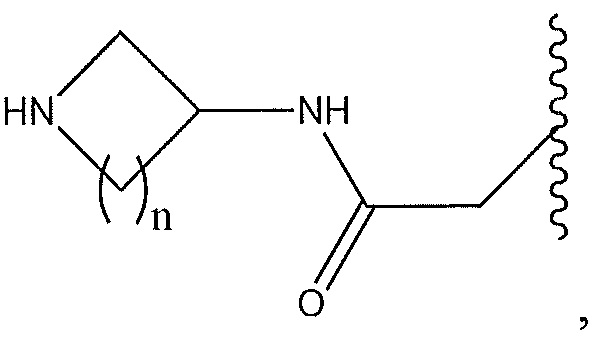
где R11 и R12 представляют собой два H, два -CH2CH3 или два -CH3, или где один из R11 и R12 представляет собой H, а другой представляет собой 1,1-диметилэтил, циклобутил, циклопропил, низший алкил, метиловый спирт, этиловый спирт, пропиловый спирт, циклобутилметил; 2,3-дигидроксипропил, бензил, азетидинил, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, необязательно замещенный пиразолил, необязательно замещенный пирролил, необязательно замещенный азетидинил, -CH2-NH-CH3, спирт,
где X представляет собой необязательно замещенный пирролидинил, необязательно замещенный пиперидинил, необязательно замещенный пирролидинил, необязательно замещенный пиперазинил или необязательно замещенный морфолинил,
и где
R5 представляет собой H, F, Cl, -CH3, -OCH3, пирролил, -CH2OH, -NH2, -OH,
или с R4 и атомами в c и d образует необязательно замещенный бензол, необязательно замещенный пиразол, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил или необязательно замещенный пиррол, или с R6 и атомами в d и c образует необязательно замещенный пиридин, или R5 представляет собой C(O)Y, где Y представляет собой -NH2, -N(CH3)2, необязательно замещенный пиперазинил, необязательно замещенный пиперидинил, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, необязательно замещенный пиразолил, необязательно замещенный пирролил,
и где
R6 представляет собой H, F, -CH3, -CF3 или с R5 и атомами в c и d образует необязательно замещенный бензол или необязательно замещенный пиразол; и где
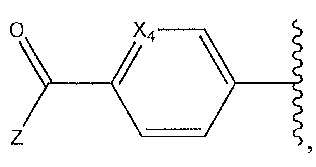
R7 представляет собой H, -CF3, -CHF2, -CF2CH3, -CH3 или -C(CH3)3; и где
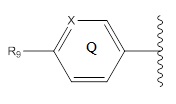
R8 представляет собой
и где
R9 представляет собой Br, Cl, F, I или H.
[0008] В некоторых вариантах осуществления по изобретению имеет место одно или несколько условий. Упомянутые выше условия традиционно исключают одно или несколько соединений, которые могут быть включены в заявленный класс. При рассмотрении условий, приведенных ниже, понятно, что обратное также применимо. Например, если условие устанавливает, что когда R4 представляет собой F, то R2 не представляет собой CH3 или F, и тогда применимо то, что когда R2 выбирают, который представляет собой -CH3 или F, то R4 не представляет собой F. Также следует отметить, что когда условие представляют как последовательность утверждений, последующие утверждения не связаны до тех пор, пока это не представлено непосредственно в качестве условий в другом месте в документе. Например, если условие устанавливет, что когда R4 представляет собой F, R2 не представляет собой -CH3 или F; и R3 не представляет собой -CH3, тогда не следует подразумевать только из этого утверждения, что когда R3 представляет собой -CH3, тогда R2 не представляет собой -CH3 или F.
[0009] Одно или несколько следующих условий можно применять в различных вариантах осуществления, представленных в настоящем документе:
когда R4 представляет собой F: R2 не представляет собой CH3 или F; R3 не представляет собой -CH3, -CN, F, Cl или -OCH3; R5 не представляет собой -CH3, F, Cl или -OCH3; и R6 не представляет собой -CH3 или F;
когда R4 представляет собой Cl: R2 не представляет собой F; R3 не представляет собой F или -CN; R5 не представляет собой F, -CN или -C(O)N(CH3)2; R6 не представляет собой -CF3 или F; D не представляет собой азот; и также R5 представляет собой -C(O)NH2, или один из R2, R3, R5 и R6 представляет собой -CH3;
когда R4 представляет собой -CH3: R3 не представляет собой F; R5 не представляет собой F; и R5 и R6 не образуют пиримидин вместе с атомами в d и e;
когда R4 представляет собой -OCH3: R2 не представляет собой F; R3 не представляет собой Cl или -OCH3, R5 не представляет собой Cl или -OCH3; и R6 не представляет собой F или -CF3;
когда R4 представляет собой –CN: R2 не представляет собой F; R3 не представляет собой Cl, F или -OCH3; R5 не представляет собой Cl, F или -OCH3; и R6 не представляет собой F;
когда R4 представляет собой -OCH2CH3: R3 не представляет собой Cl или F; R5 не представляет собой Cl или F; и R6 не представляет собой -CF3;
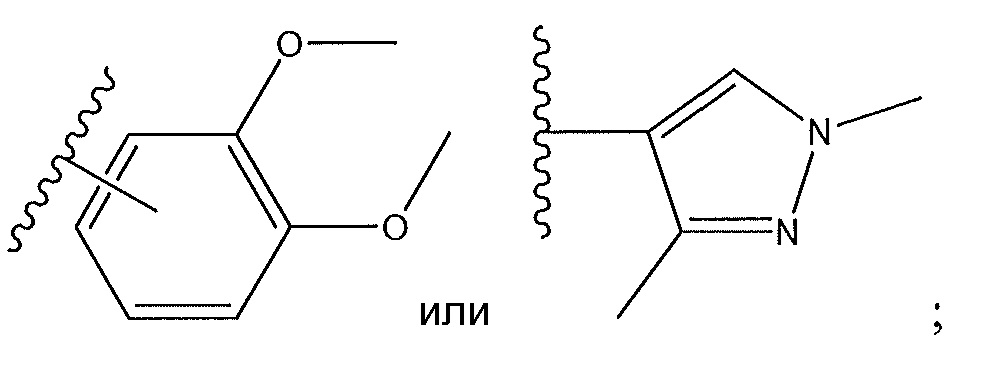
когда R4 представляет собой
R3 не представляет собой H или F; и R5 не представляет собой H или F;
когда R4 представляет собой
по меньшей мере один из R2, R3, R5 и R6 не представляет собой H;
когда R4 представляет собой
R3 не представляет собой F; и R5 не представляет собой F;
когда R2 представляет собой F: R3 не представляет собой -OCH3 или F; R5 не представляет собой -CN; и по меньшей мере один из R3, R4, R5 и R6 не представляет собой H;
когда R2 представляет собой Cl: R3 не представляет собой F;
когда R2 представляет собой -CH3: R3 не представляет собой Cl; по меньшей мере один из R3, R4, R5 и R6 не представляет собой -CH3; и R4 и R5 не образуют пиразолил с атомами в c и d;
когда R3 представляет собой -OCH3: R2 не представляет собой F; и R6 не представляет собой F;
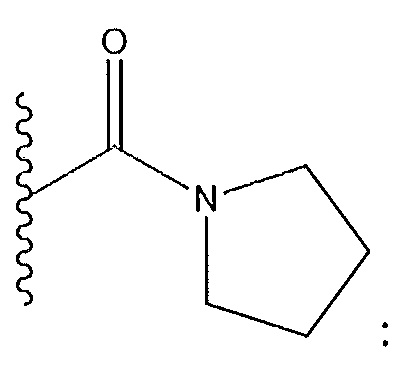
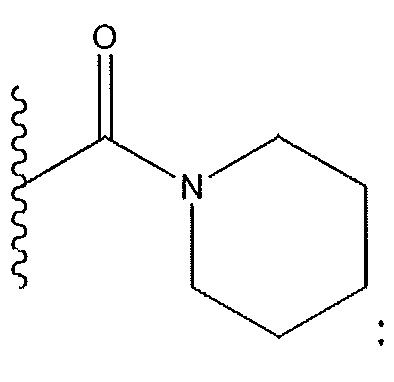
когда R3 представляет собой F: R2 не представляет собой -OCH3; и X не представляет собой
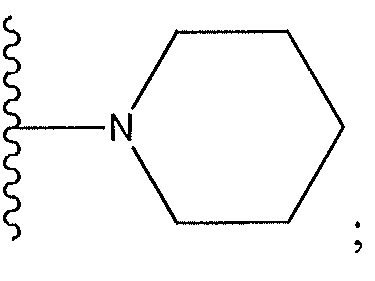
когда R3 представляет собой Cl: R5 не представляет собой Cl; R11 не представляет собой бензил; и R12 не представляет собой бензил;
когда R5 представляет собой Cl: R6 не представляет собой -CH3; R11 не представляет собой бензил; и R12 не представляет собой бензил;
когда R5 представляет собой F или -OCH3: R6 не представляет собой F;
когда R6 представляет собой F: по меньшей мере один из R2, R3, R4 и R5 не представляет собой H;
когда R3 и R5 представляют собой H: R11 не представляет собой циклопропил; и R12 не представляет собой циклопропил;
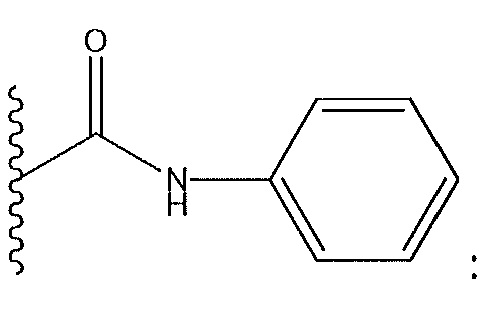
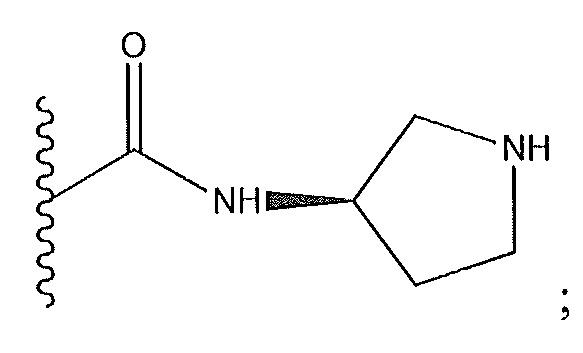
когда R9 представляет собой Cl: R1 не представляет собой амидную группу;
когда B представляет собой азот и A и D представляют собой углерод: R4 может не представлять собой -CN или
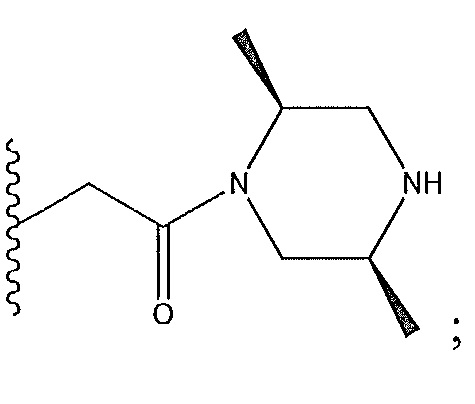
когда R7 представляет собой -CHF2 и R4 представляет собой
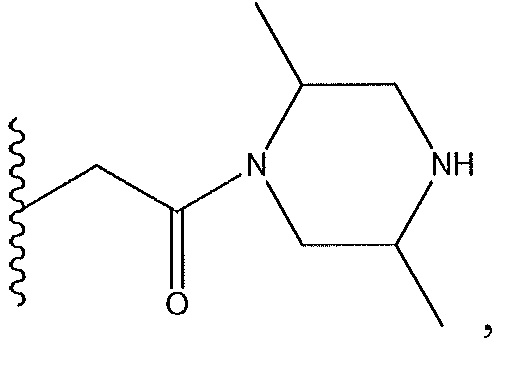
тогда R4 не имеет абсолютную стереохимию
и где, когда R8 представляет собой
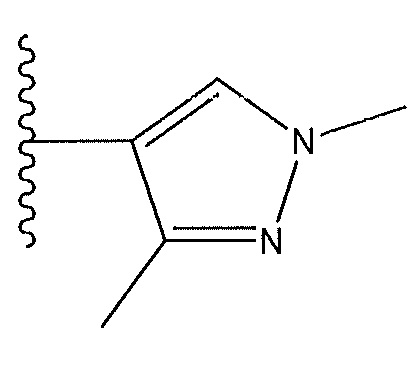
тогда действуют следующие условия:
когда R4 представляет собой F: по меньшей мере один из R2, R3, R5 и R6 не представляет собой H; R3 не представляет собой C(O)N(CH3)2; и R5 не представляет собой C(O)N(CH3)2;
когда R4 представляет собой Cl: по меньшей мере один из R2, R3, R5 и R6 не представляет собой H;
когда R3 представляет собой F: R4 не представляет собой C(O)NHCH2CH2CH2CH3, C(O)N(CH3)2, C(O)NHCH2CH2CH3 или C(O)NHC(CH3)3;
R4 не представляет собой C(O)NHCH2CH2CH2OH, C(O)NHCH(CH3)2, -CN или
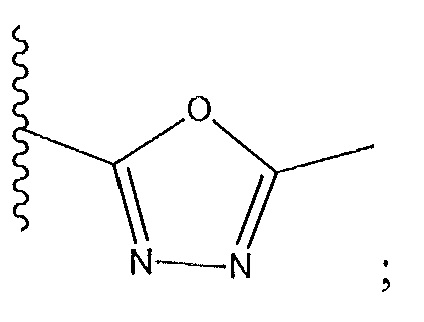
R1 не представляет собой
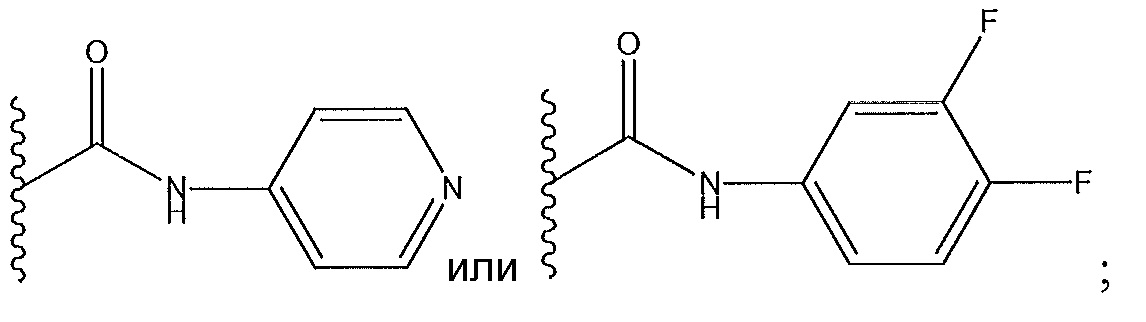
R5 не представляет собой
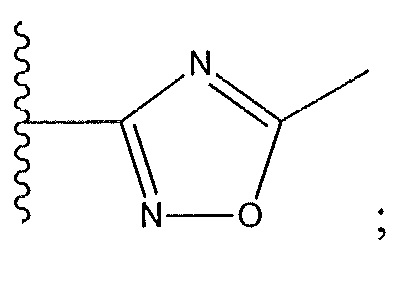
R3 не представляет собой
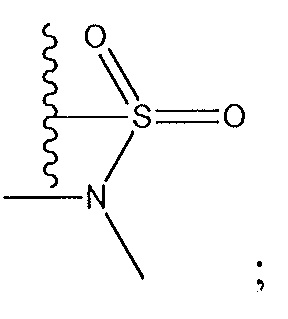
когда R2 представляет собой F: R5 не представляет собой -C(O)NH2;
когда R2 представляет собой -CH3, R4 и R5 не образуют пиразол с атомами в c и d; и когда B представляет собой азот, R3 и R4 не образуют необязательно замещенный имидазол с атомами в b и c; и
где, когда R8 представляет собой
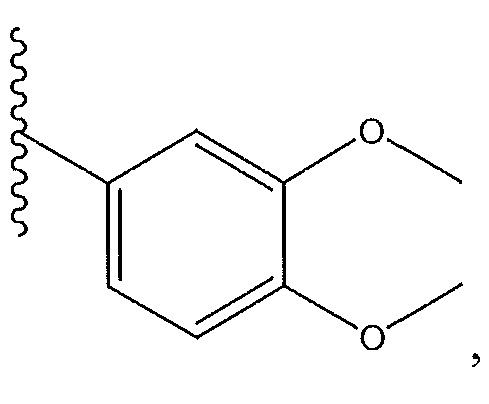
тогда действуют следующие условия:
R4 не представляет собой -CH3, -C(O)NHCH2CH2OH, -NHC(O)CH(CH3)2 или
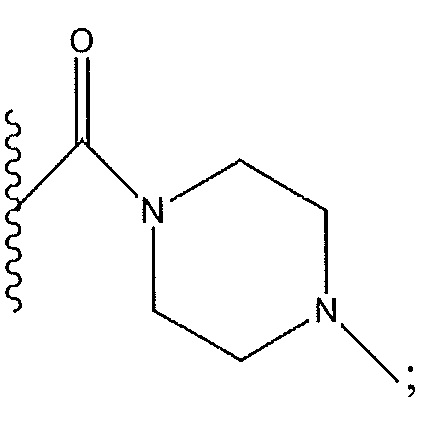
когда R4 представляет собой C(O)NHCH3: по меньшей мере один из R2, R3, R5 и R6 не представляет собой H;
когда R4 представляет собой -OCH3: R3 не представляет собой F или -CH3; и R5 не представляет собой F или -CH3;
когда R4 представляет собой
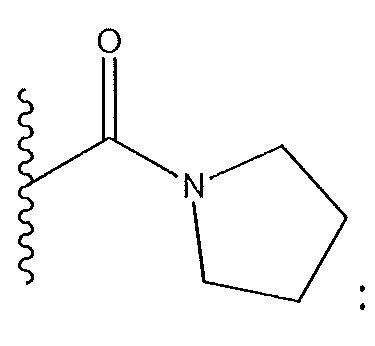
R3 не представляет собой Cl и R5 не представляет собой Cl;
когда R4 представляет собой -C(O)NHCH(CH3)2 или -C(O)N(CH2CH3)2: по меньшей мере один из R3 и R5 не представляет собой H;
R5 не представляет собой -C(O)NH2; и
R6 не представляет собой -CF3.
[0010] В дополнительном варианте осуществления соединение формулы (I) имеет абсолютную стереохимию, представленную в формуле (II):
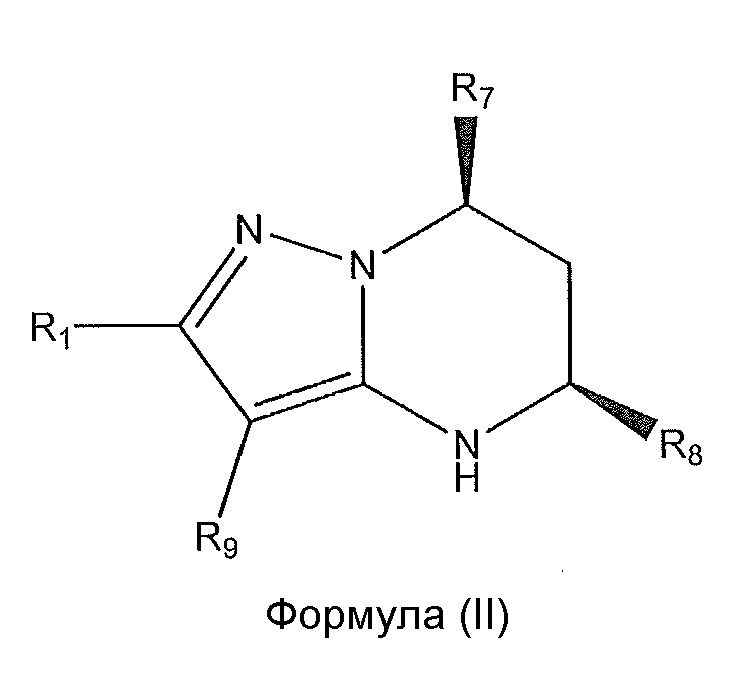 ,
,
при условии, что ,когда R8 представляет собой
действуют следующие условия:
когда R3 представляет собой F, R4 не представляет собой
когда R5 представляет собой F, R4 не представляет собой
когда R5 представляет собой -CH3, R3 и R4 с атомами в b и c не образуют
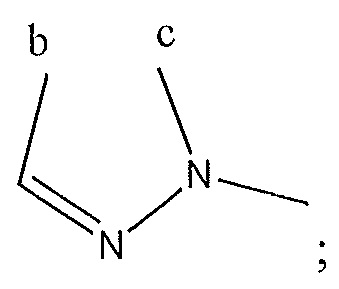
и когда R3 представляет собой -CH3, R4 и R5 с атомами в c и d не образуют
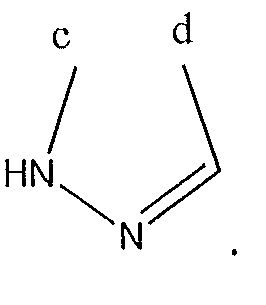
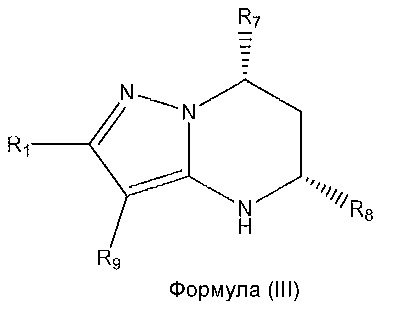
[0011] В дополнительном варианте осуществления соединение формулы (I) имеет абсолютную стереохимию, представленную в формуле (III):
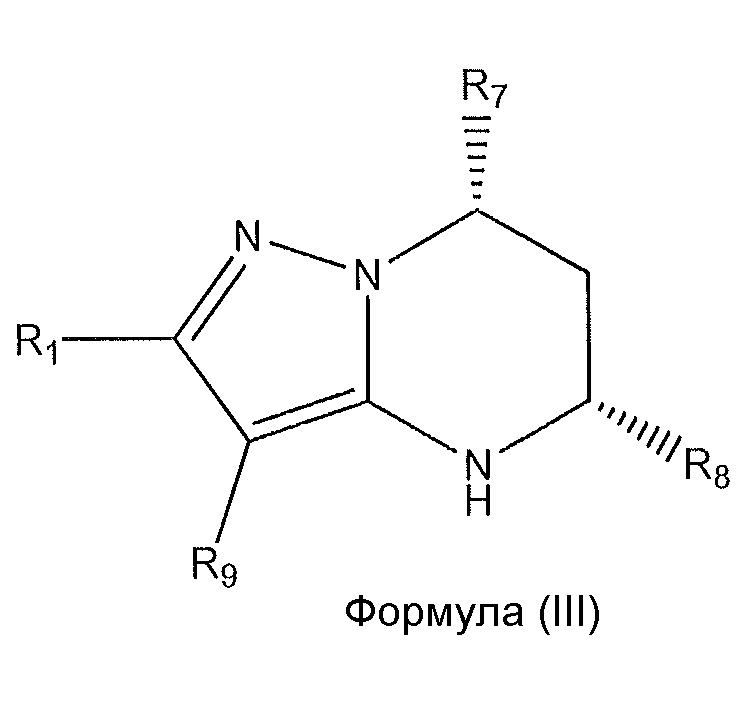 ,
,
при условии, что когда R8 представляет собой
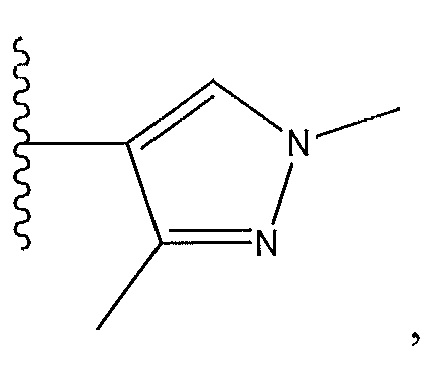
R4 не представляет собой
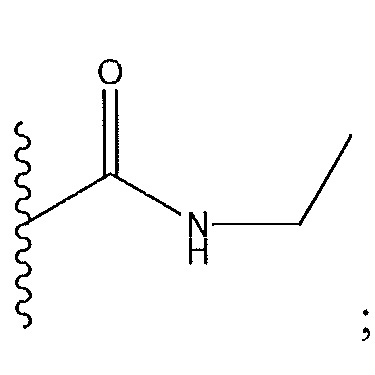
и при условии, что когда R8 представляет собой
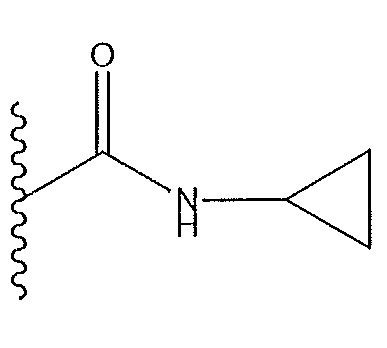
действуют следующие условия:
когда R2 представляет собой -CH3: R3 и R4 не образуют необязательно замещенный пиразолил с атомами в b и c;
когда R2 представляет собой -CH3: R4 и R5 не образуют необязательно замещенный пиразолил с атомами в c и d;
когда R2 представляет собой F: R4 не представляет собой C(O)NH2;
R3 и R4 с атомами в b и c не образуют
когда R3 представляет собой Cl: R4 не представляет собой -C(O)NHCH3 или -C(O)NH2;
R3 не представляет собой пиразолил;
когда R3 представляет собой F: R4 не представляет собой
или -C(O)NH2;
когда R3 представляет собой -CH3: R4 и R5 не образуют необязательно замещенный пиразолил с атомами в c и d;
R4 не представляет собой -C(O)NHCH2CH2CH2OH;
R4 не представляет собой –CN или
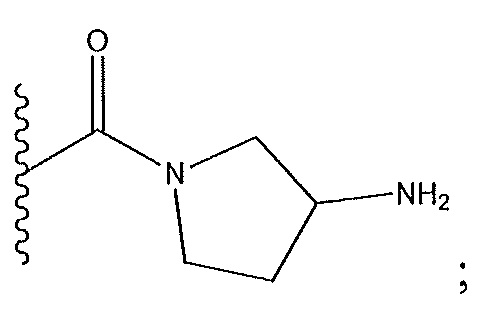
когда R5 представляет собой -CH3: R3 и R4 не образуют необязательно замещенный пиразолил с атомами в b и c;
когда R5 представляет собой Cl: R4 не представляет собой -C(O)NH2;
когда R5 представляет собой F: R4 не представляет собой C(O)NH2;
R5 не представляет собой пиразолил;
когда R6 представляет собой -CH3: R4 и R5 не образуют необязательно замещенный пиразолил с атомами в c и d; и
когда B представляет собой азот, R4 не представляет собой -C(O)NHCH3.
[0012] В одном варианте осуществления R1 представляет собой пиперидинил или пиридил; R7 представляет собой -CF3; R8 представляет собой
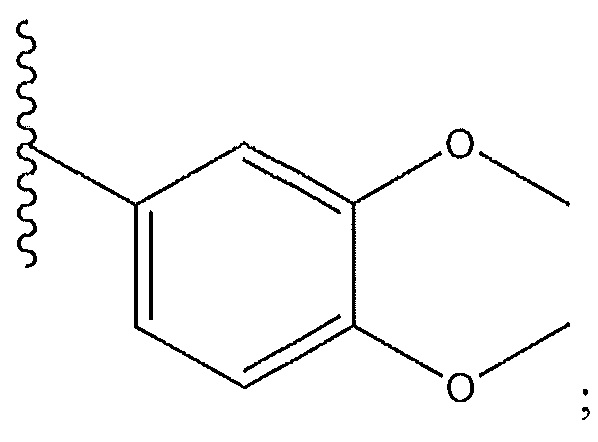
и R9 представляет собой F, Cl, Br или I.
[0013] В другом варианте осуществления R1 представляет собой -C(O)Z, где Z представляет собой пиперазинил, пиперидинил, пирролопирролил или пиперидинил пропил; R7 представляет собой -CH3; R8 представляет собой
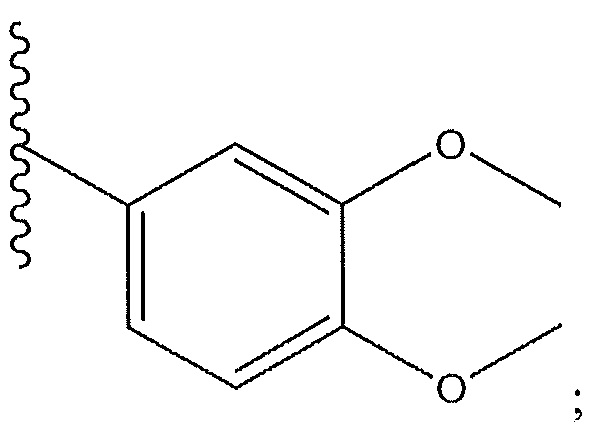
и R9 представляет собой H.
[0014] В другом варианте осуществления R1 представляет собой
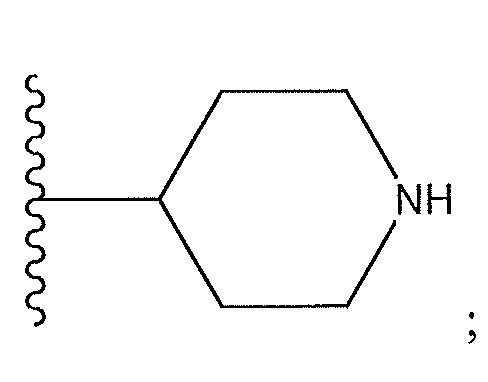
R7 представляет собой -CF3, R8 представляет собой
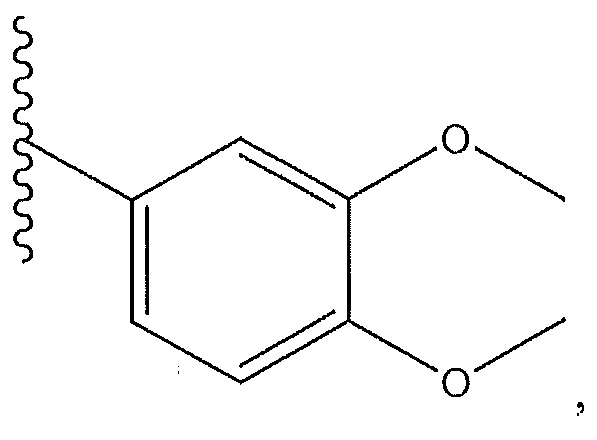
и R9 представляет собой H.
[0015] В другом варианте осуществления R1 представляет собой
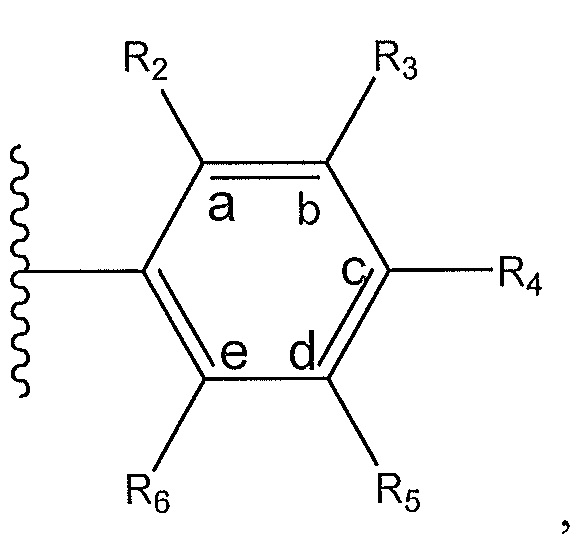
R2 представляет собой H, -CH3 или с R3 образует
R3 представляет собой H или с R2 образует
или с R4 образует
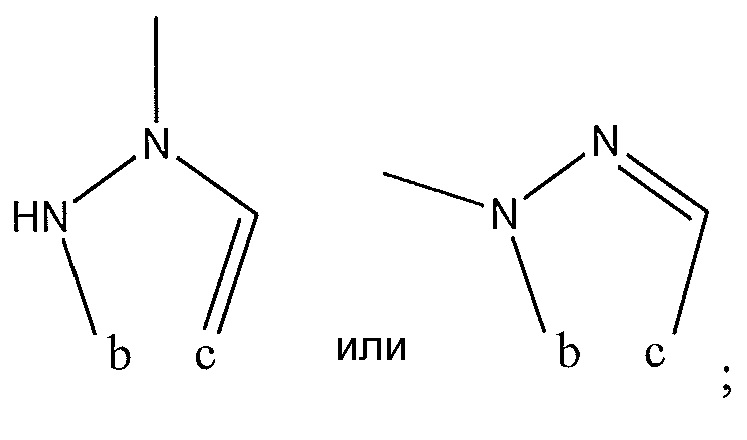
R4 представляет собой H, -CH3, -NHC(O)NH2 или с R3 образует
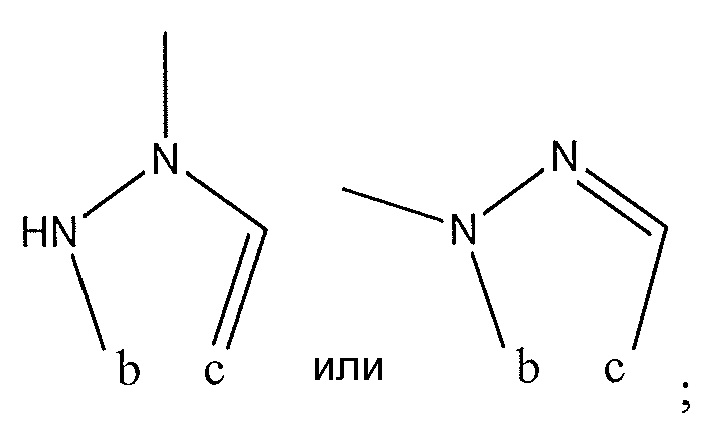
R5 представляет собой H; R6 представляет собой H; R7 представляет собой -CF3; R8 представляет собой
и R9 представляет собой H.
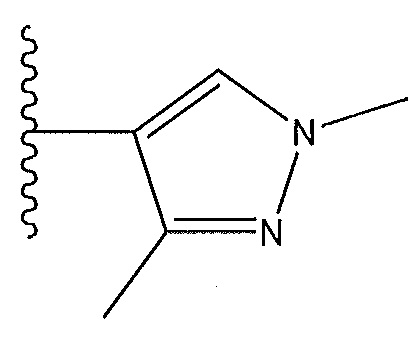
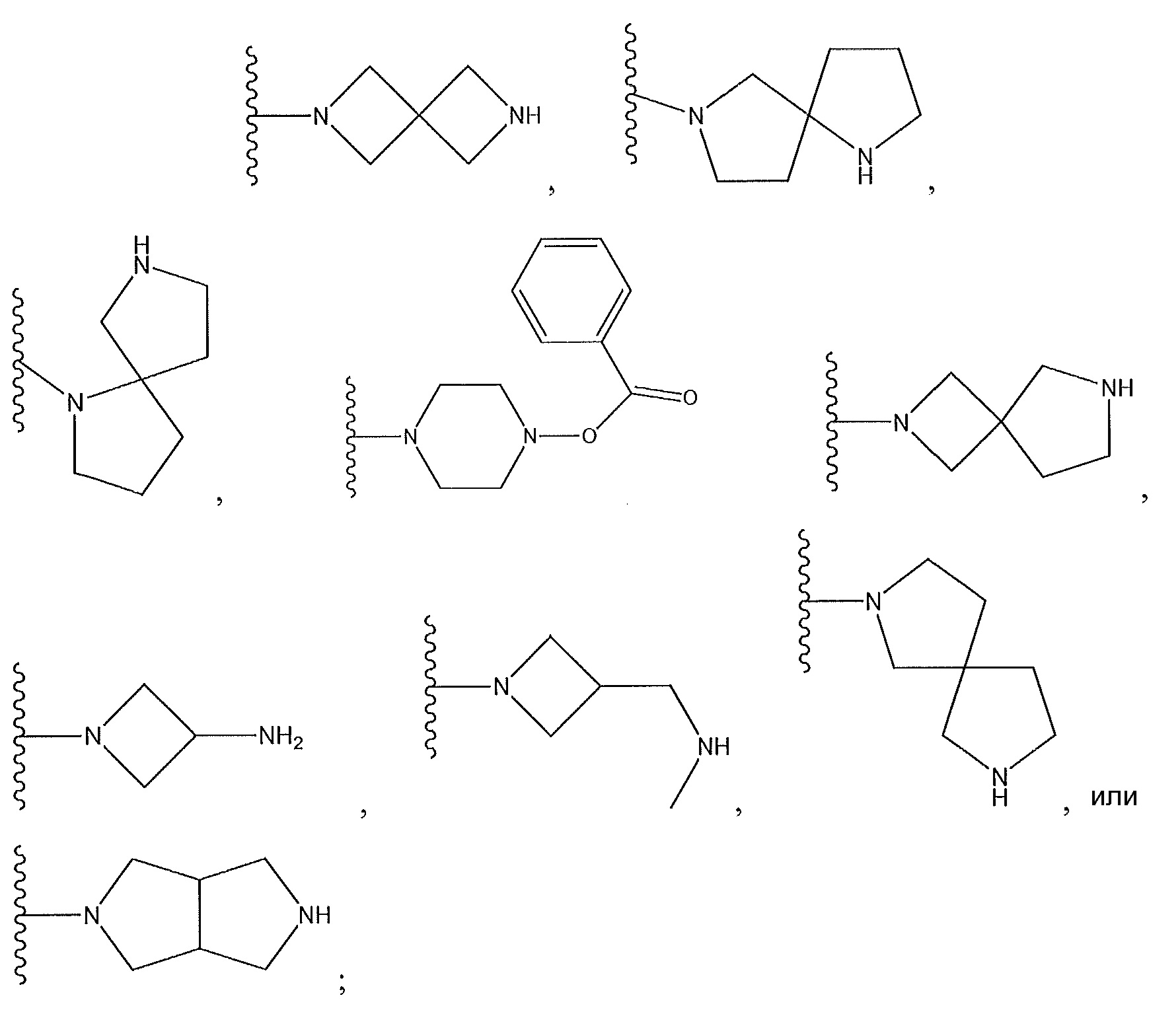
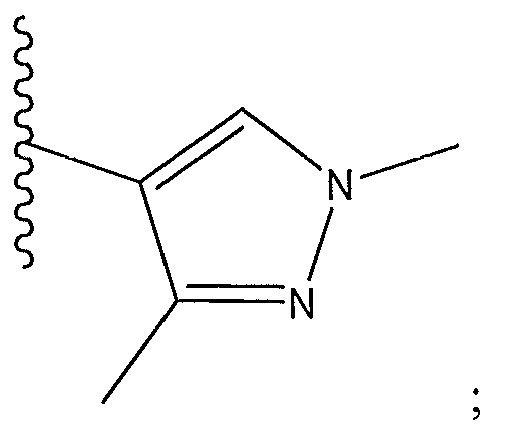
[0016] В другом варианте осуществления R1 представляет собой
R2 представляет собой H, F или -CH3; R3 представляет собой H или F; R4 представляет собой -(q)-C(O)X, где q представляет собой связь или -CH2-, и X представляет собой пиперазинил, прикрепленный через азот к карбонильной группе в R4, пирролидинил, прикрепленный через азот к карбонильной группе в R4, пирролопирролил, прикрепленный через азот к карбонильной группе в R4, азетидинил, прикрепленный через азот к карбонильной группе в R4, или
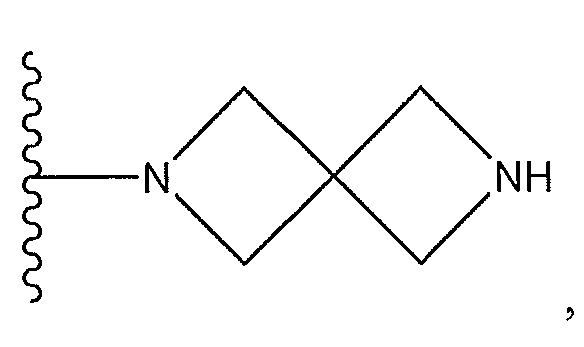
или X представляет собой -NR11R12, где один из R11 и R12 представляет собой H, а другой представляет собой необязательно замещенный пирролидинил, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил или необязательно замещенный азетидинил; R5 представляет собой H или C(O)Y, где Y представляет собой -NH(CH3)2, необязательно замещенный пиперазинил, необязательно замещенный пиперидинил,
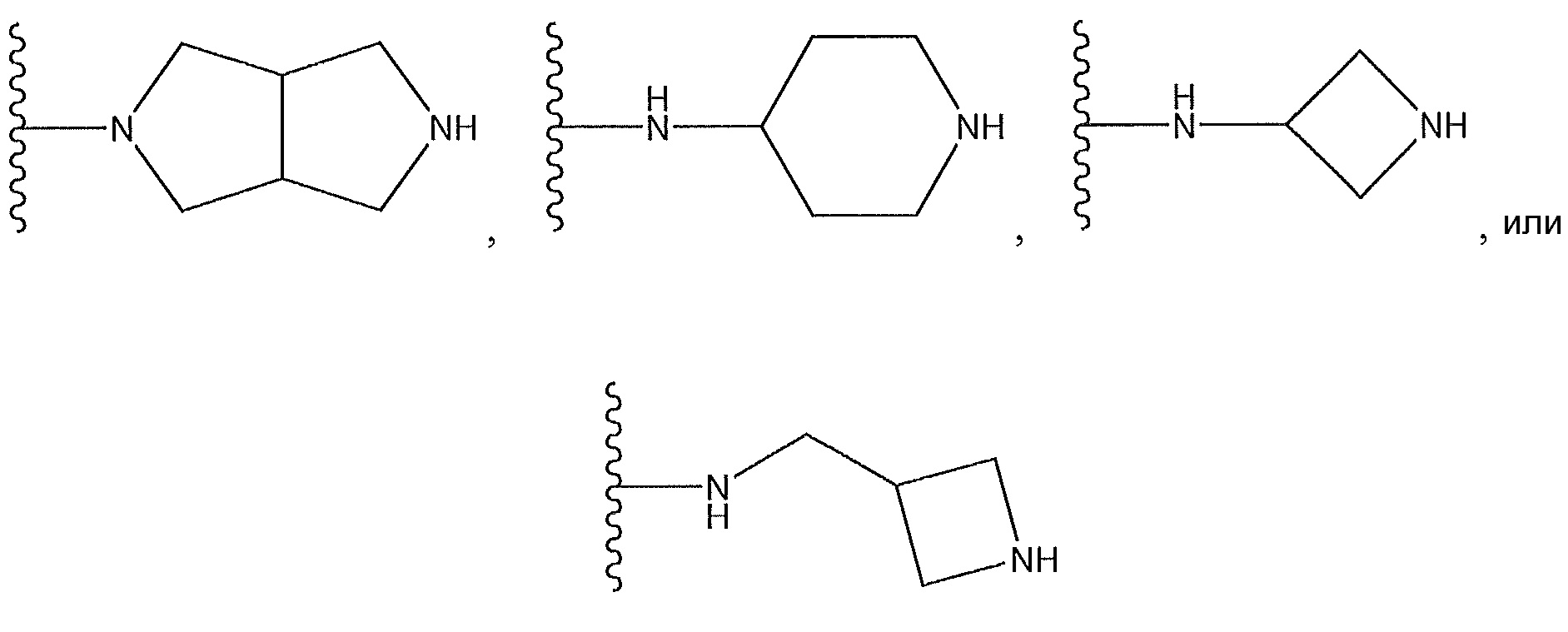 ;
;
R6 представляет собой H, R7 представляет собой -CHF2, R8 представляет собой
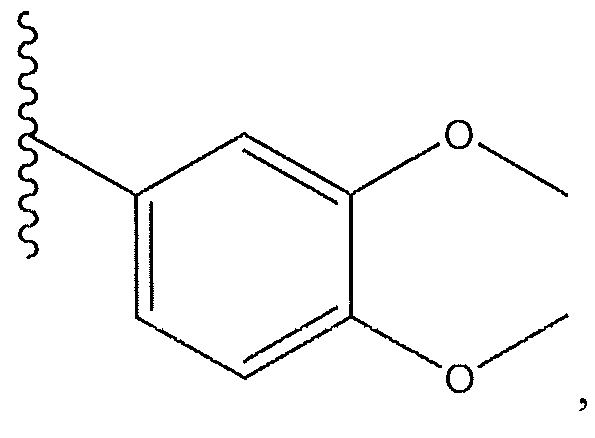
и R9 представляет собой H.
[0017] В дополнительном варианте осуществления R1 представляет собой
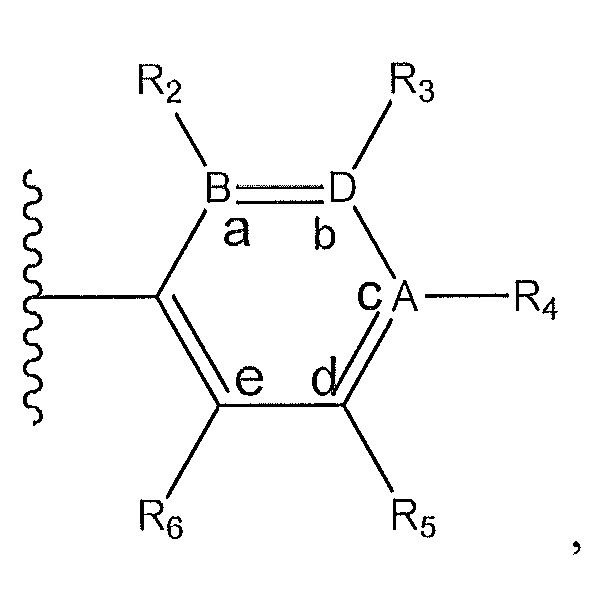
где A, B и D все могут представлять собой углерод, или где два из A, B и D представляют собой углерод, а другой представляет собой азот, и когда A представляет собой азот, R4 отсутствует, когда B представляет собой азот, R2 отсутствует, и когда D представляет собой азот, R3 отсутствует; R2 представляет собой H; R3 представляет собой H или -CH3; R4 представляет собой -C(O)X, где X представляет собой необязательно замещенный пиперазинил, или X представляет собой -NR11R12, где R11 и R12 представляют собой H, или где один из R11 или R12 представляет собой H, а другой представляет собой пиперидинил, пирролидинил или -CH3; R5 представляет собой -OCH3, H или Cl; R6 представляет собой H, R7 представляет собой CF3, R8 представляет собой
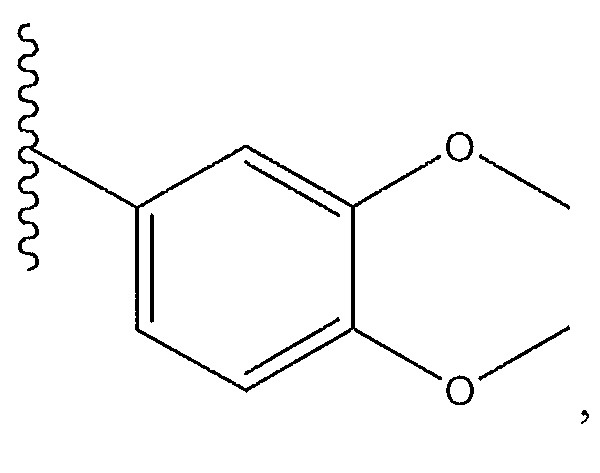
и R9 представляет собой H.
[0018] В дополнительном варианте осуществления R1 представляет собой
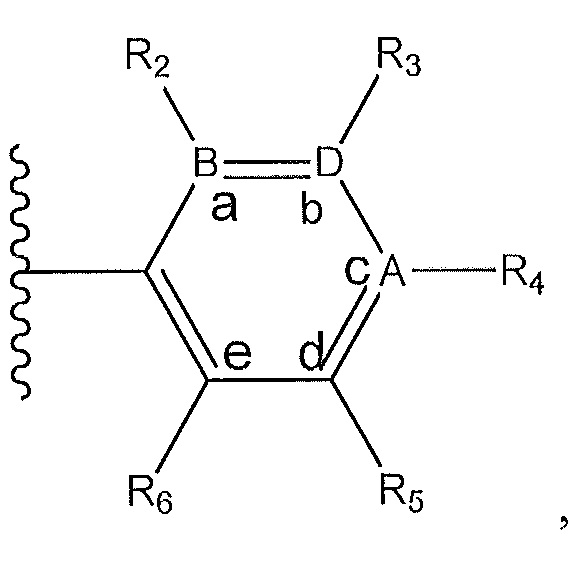
где A, B и D представляют собой углерод;
R2 представляет собой H, -CH3 или F или с R3 и атомами в положениях a и b образует необязательно замещенный пиразол;
R3 представляет собой H, F, Cl, -CN, -CH3,
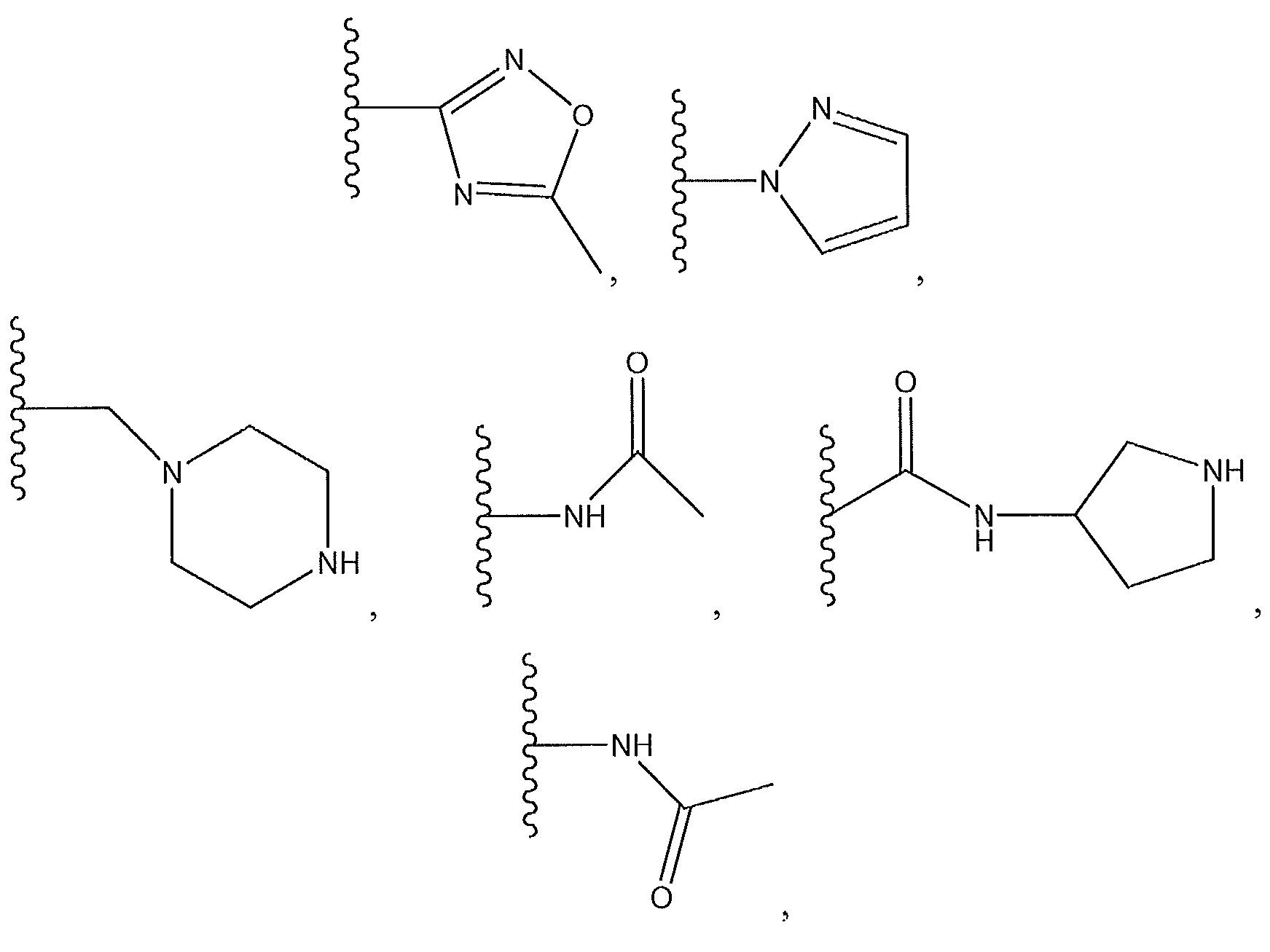
или с R4 и атомами в b и c образует необязательно замещенный пиразол или
 ,
,
или с R2 и атомами в a и b образует необязательно замещенный пиразол;
R4 представляет собой -CN, -CH2OH, H,
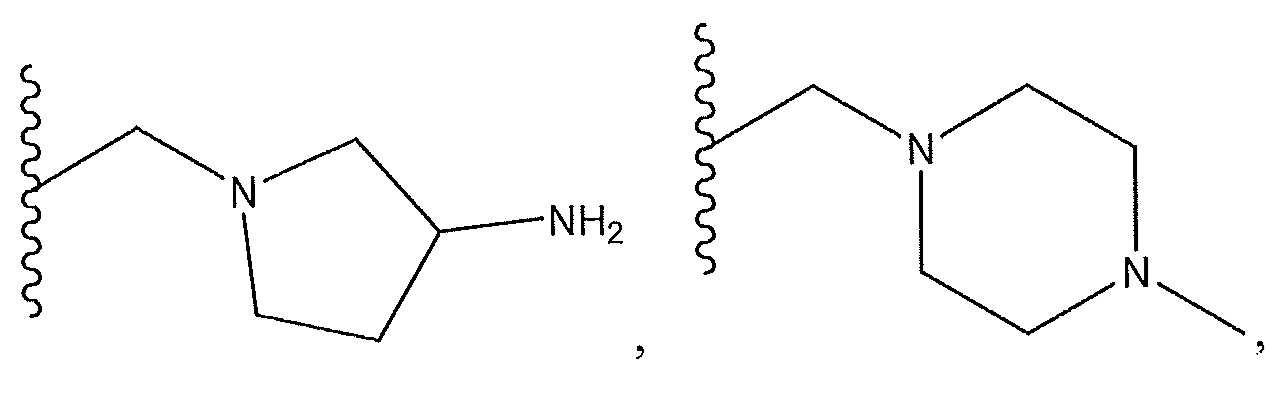
необязательно замещенный пиперазинил или с R3 и атомами в b и c образует необязательно замещенное пиразольное кольцо или
или с R5 и атомами в c и d образует необязательно замещенное пиразольное кольцо, или R4 представляет собой -(q)-C(O)X, где q представляет собой связь, и
где X представляет собой -NR11R12,
где R11 и R12 оба представляют собой H, или где один из R11 и R12 представляет собой H, а другой представляет собой 1,1-диметилэтил, циклобутил, циклопропил, низший алкил, C1-3 спирт, циклобутилметил; 2,3-дигидроксипропил, бензил, азетидинил, пирролидинил, пиперидинил, метилазетидинил, пиразолил, пиперазинил, спирт, -OCH3 или
 ,
,
или где X представляет собой необязательно замещенный пиперидинил, прикрепленный через азот к карбонильной группе в R4, необязательно замещенный пиперазинил, прикрепленный через азот к карбонильной группе в R4, необязательно замещенный пирролидинил, прикрепленный через азот к карбонильной группе в R4, или необязательно замещенный азетидинил, прикрепленный через азот к карбонильной группе в R4,
R5 представляет собой H или с R4 и атомами в c и d образует необязательно замещенный бензол, необязательно замещенный пиразол, или с R6 и атомами в d и e образует необязательно замещенный пиридин, или R5 представляет собой C(O)Y, где Y представляет собой -NH2, -NH(CH3)2, необязательно замещенный пиперазинил, прикрепленный через азот к карбонильной группе в R5, необязательно замещенный пиперидинил, прикрепленный через азот к карбонильной группе в R5,
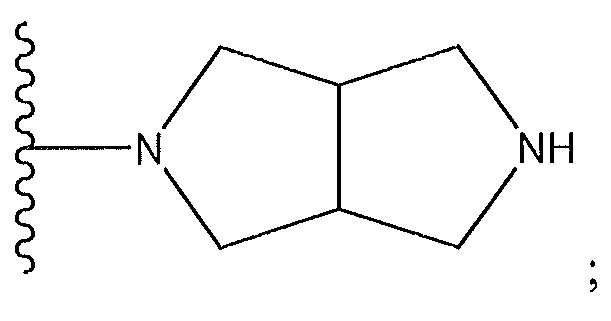 и
и
R6 представляет собой H, F, -CH3 или с R5 и атомами в c и d образует необязательно замещенный пиразол;
R7 представляет собой -CF3;
R8 представляет собой
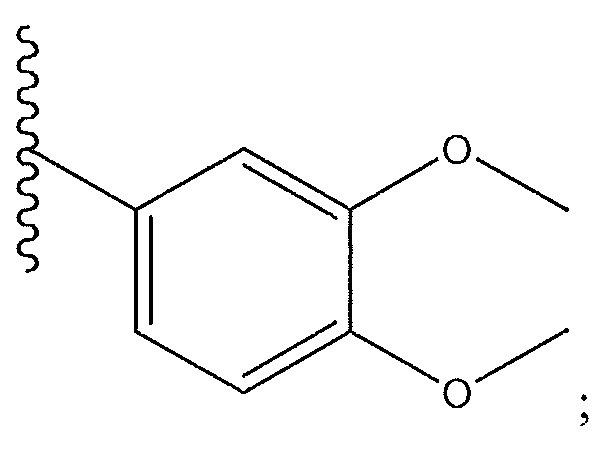
и R9 представляет собой H.
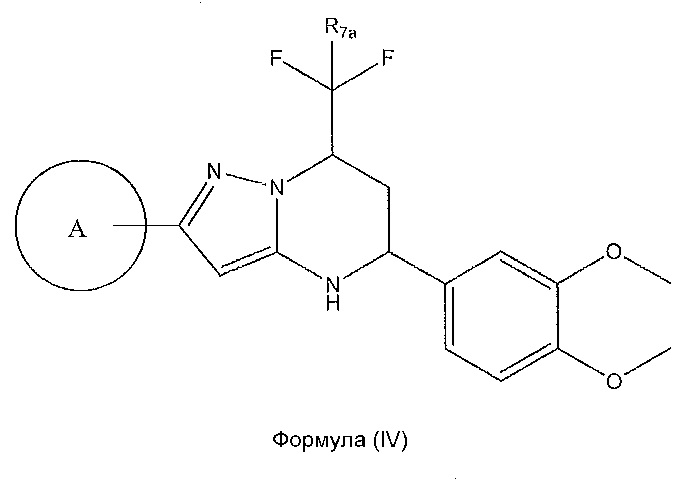
[0019] Другой вариант осуществления включает соединение формулы (IV):
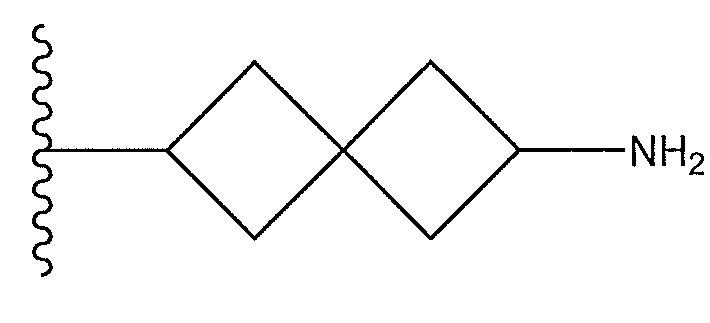
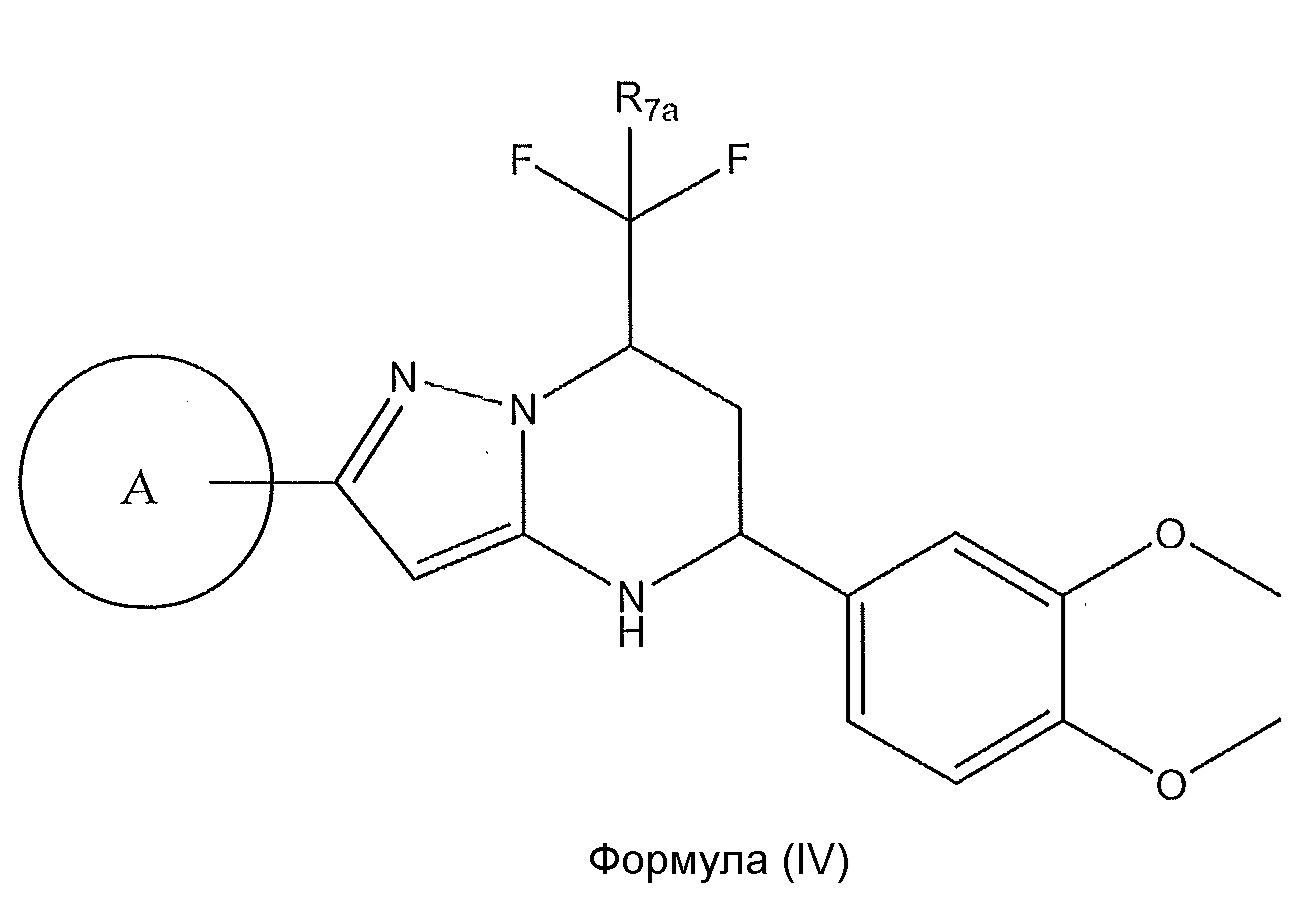 ,
,
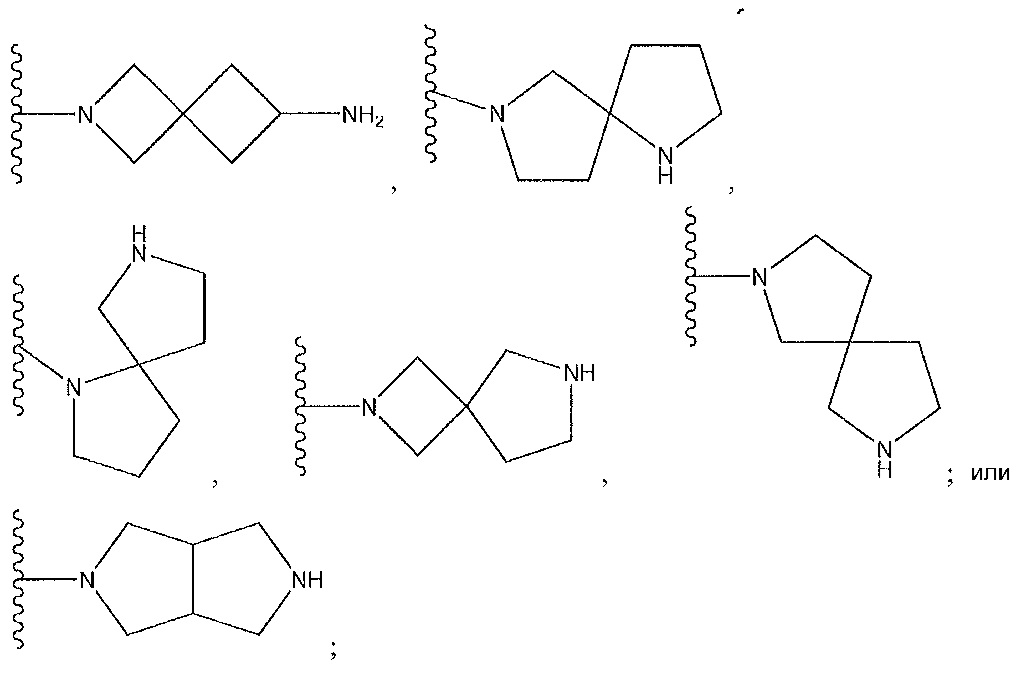
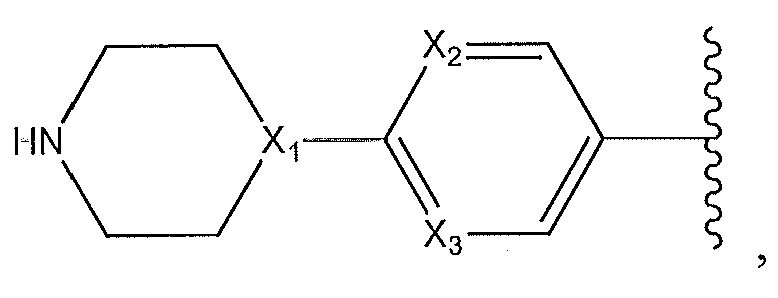
или его фармацевтически приемлемую соль или его стереоизомеры или их смесь, где: R7a представляет собой H или F; и где кольцо A представляет собой:
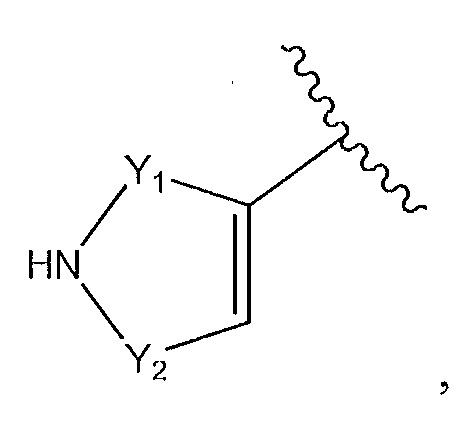
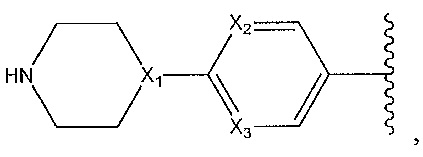
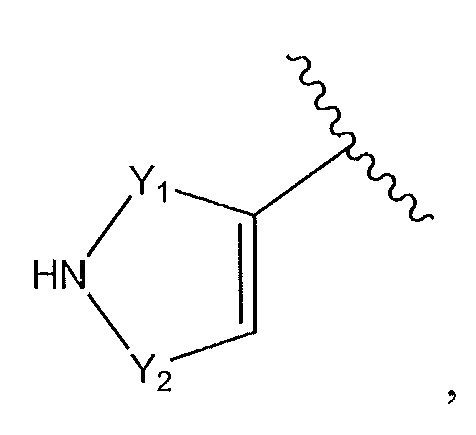
где Y1 и Y2 независимо выбирают из группы, состоящей из -CH2- и -CH2CH2-, и где каждый из Y1 и Y2 необязательно замещен C1-3 алкилом;
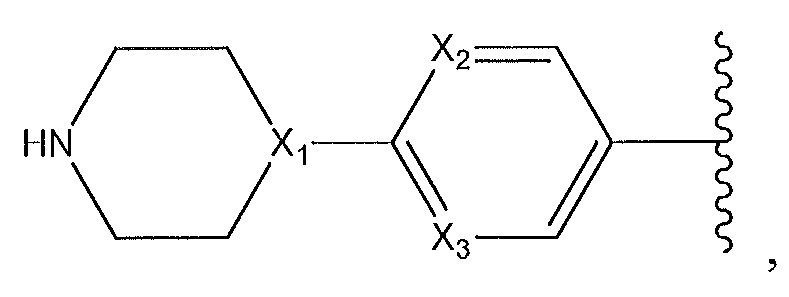
где X1, X2 и X3 независимо выбирают из группы, состоящей из -CH- и N;
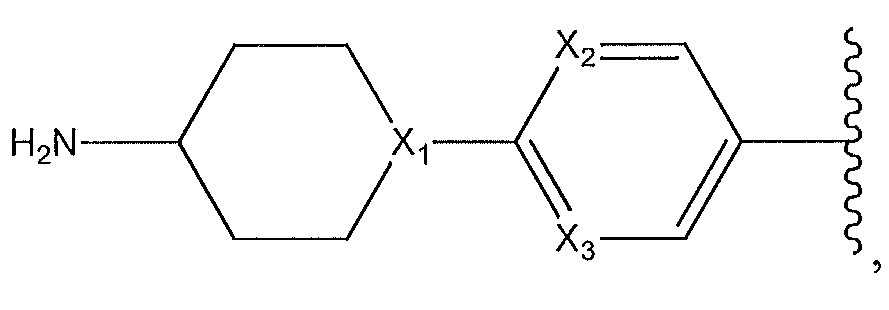
где X1, X2 и X3 независимо выбирают из группы, состоящей из -CH- и N;
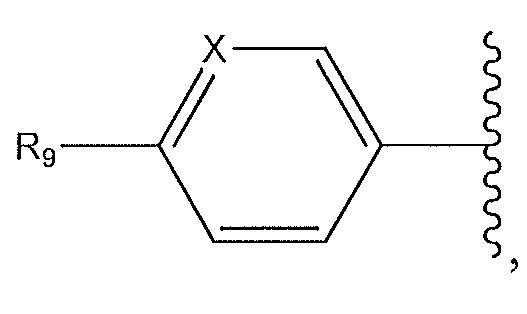
где X представляет собой N или -CH-, необязательно замещенный -CH3, F или Cl, и
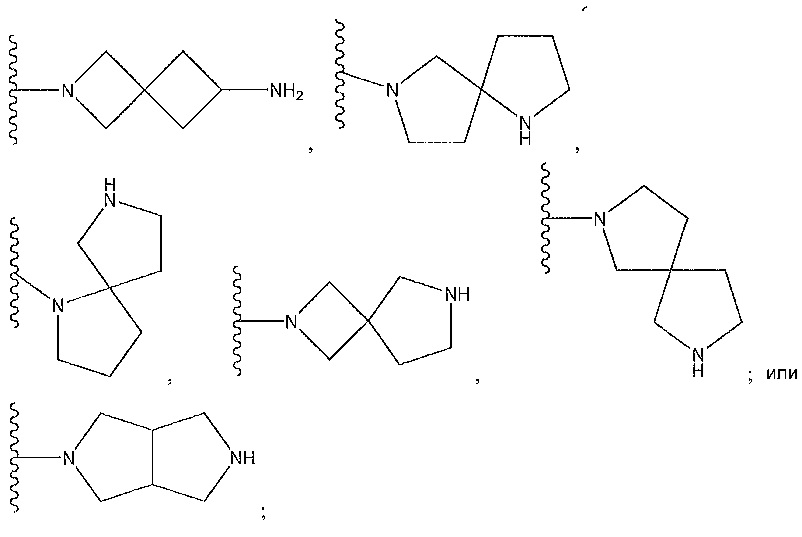
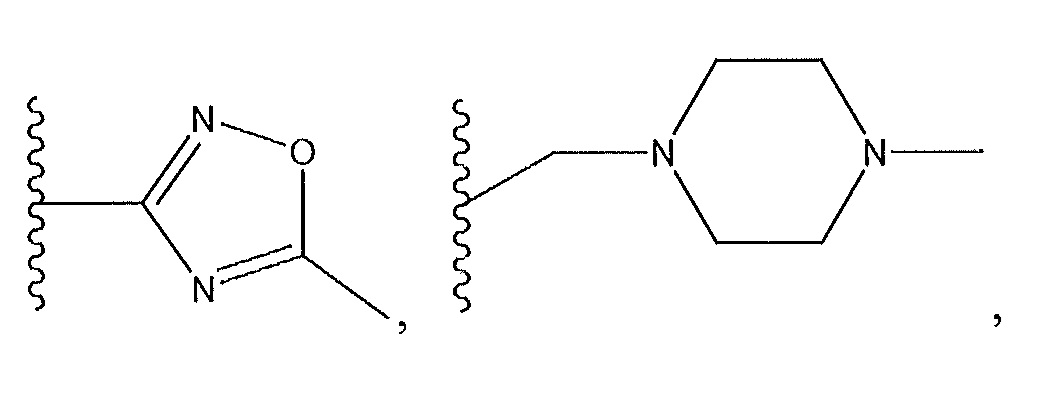
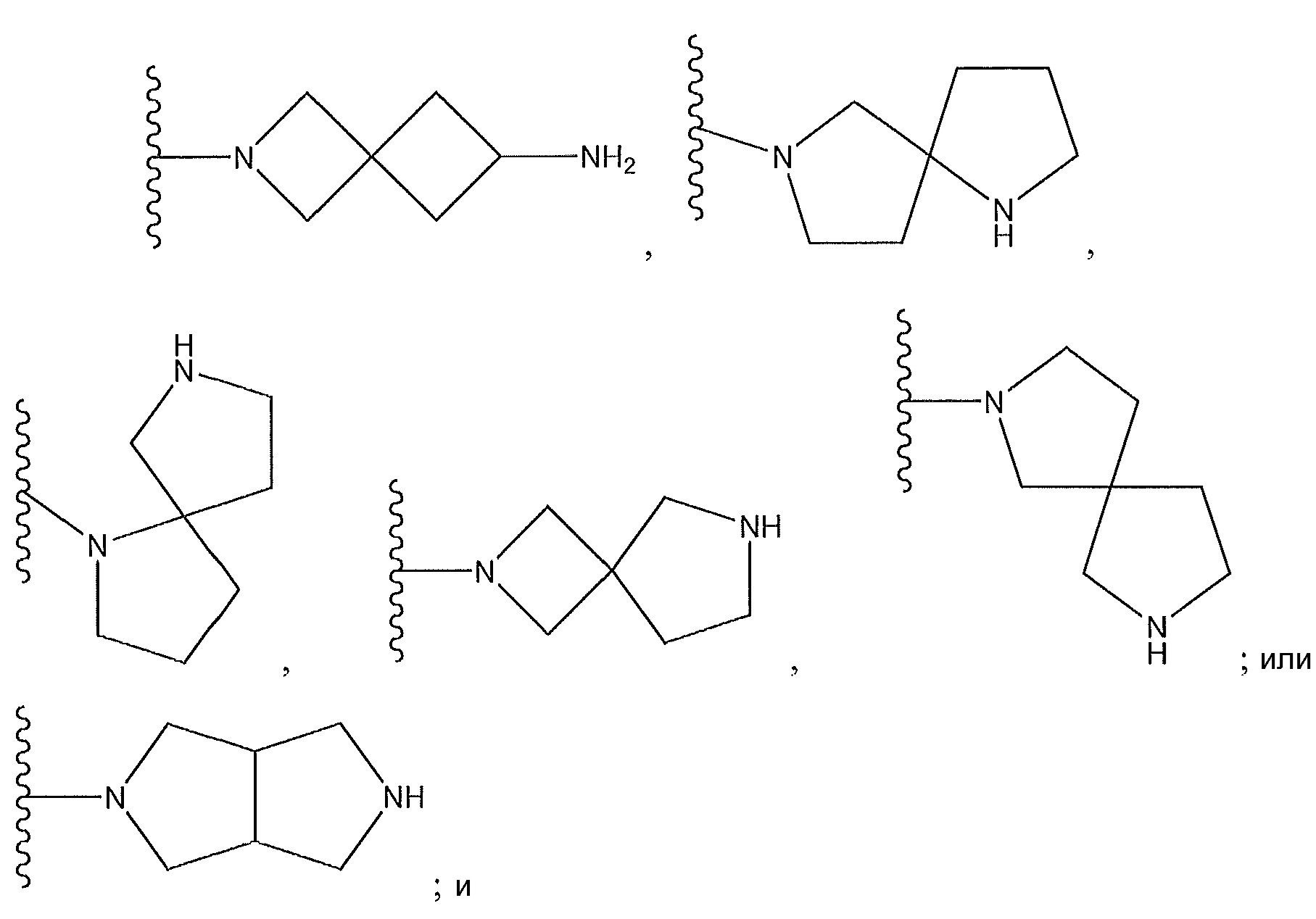
где R9 представляет собой -C(O)Z, где Z представляет собой 2,3-дигидроксипропиламин; циклический диамин, содержащий от пяти до семи звеньев, который необязательно содержит мостик или необязательно замещен по углеродному атому низшим алкилом; бициклодиамин, содержащий от семи до десяти звеньев; спиродиамин, содержащий от семи до одиннадцати звеньев; -NH, замещенный циклическим амином, содержащим от четырех до семи звеньев, необязательно замещенным с использованием -NH2; -OH; -CH2NHR, где R представляет собой H или низший алкил; -NH, замещенный спироалканом, содержащим от семи до одиннадцати звеньев, необязательно замещенным с использованием -NH2; или
R9 представляет собой CH3NHC(O)-, и углеродный атом на арильном кольце, к которому прикрепляют R9, замещен одним из -CH3, F или Cl; R9 представляет собой (CH3)2CHNHC(O)-, и углеродный атом на арильном кольце, к которому прикрепляют R9, замещен одним из -CH3, F или Cl; или R9 представляет собой (CH3)3CNHC(O)-, и углеродный атом на арильном кольце, к которому прикрепляют R9, замещен одним из -CH3, F или Cl; или
R9 представляет собой
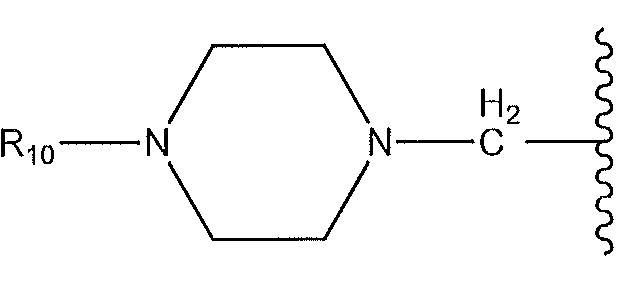 ,
,
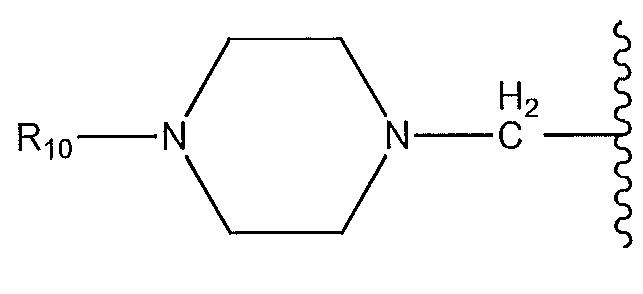
где пиперазин необязательно содержит мостик или замещен низшим алкилом и R10 представляет собой H или -CH3; или
R9 представляет собой
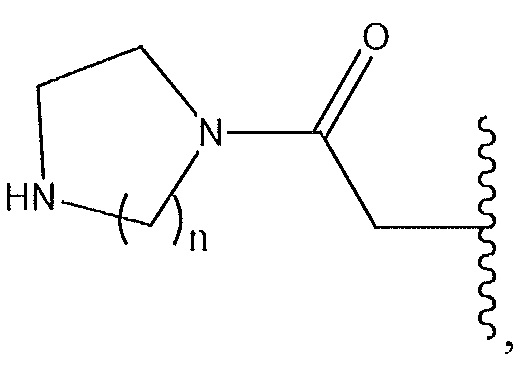
где n равен от 1 до 3 и циклический диамин необязательно содержит мостик или замещен низшим алкилом; или
R9 представляет собой
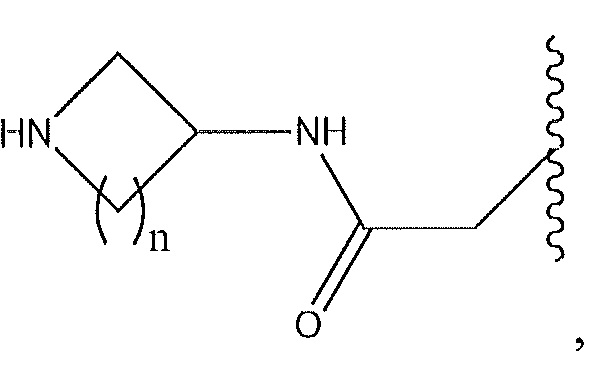
где n равен от 1 до 4; или
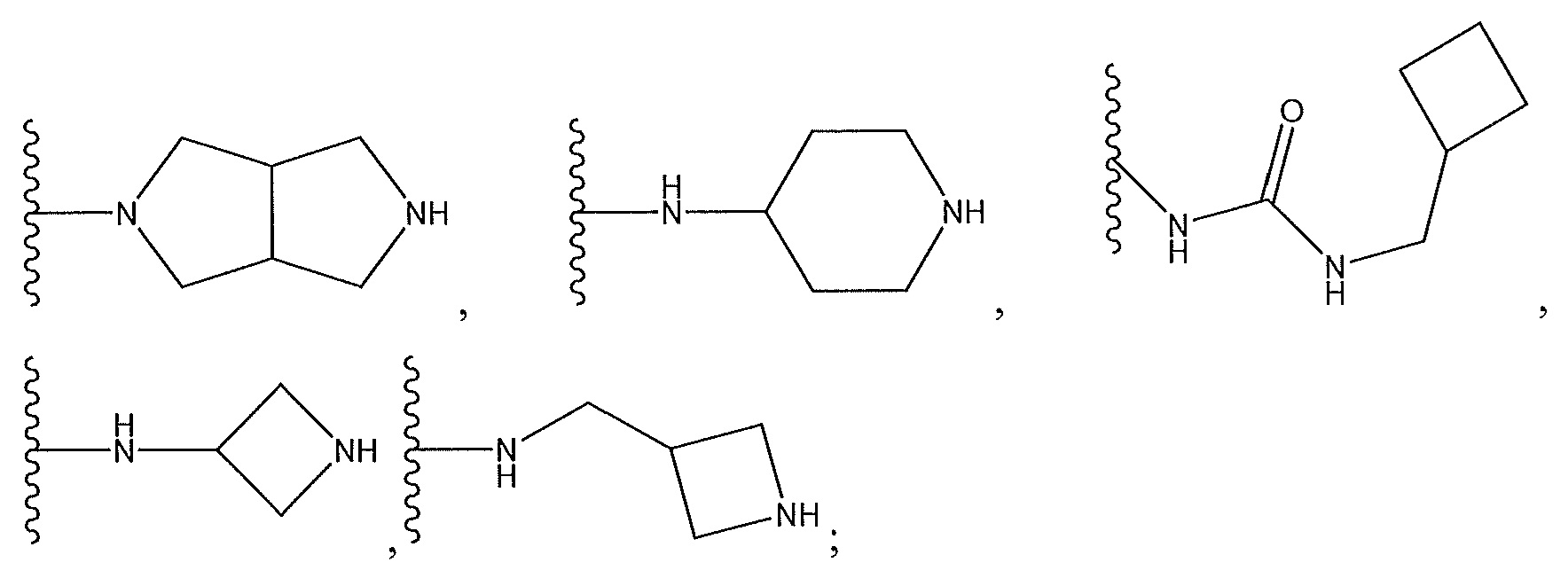
R9 представляет собой -NHC(O)NH2, -CH2C(O)NH-, где азот замещен циклическим амином, который содержит от четырех до семи звеньев; -CH2-C(O)-, где карбонил замещен бициклодиамином, который содержит от семи до десяти звеньев; и циклический амин, который содержит от четырех до семи звеньев, замещенный с использованием -CH2C(O)NH2; или
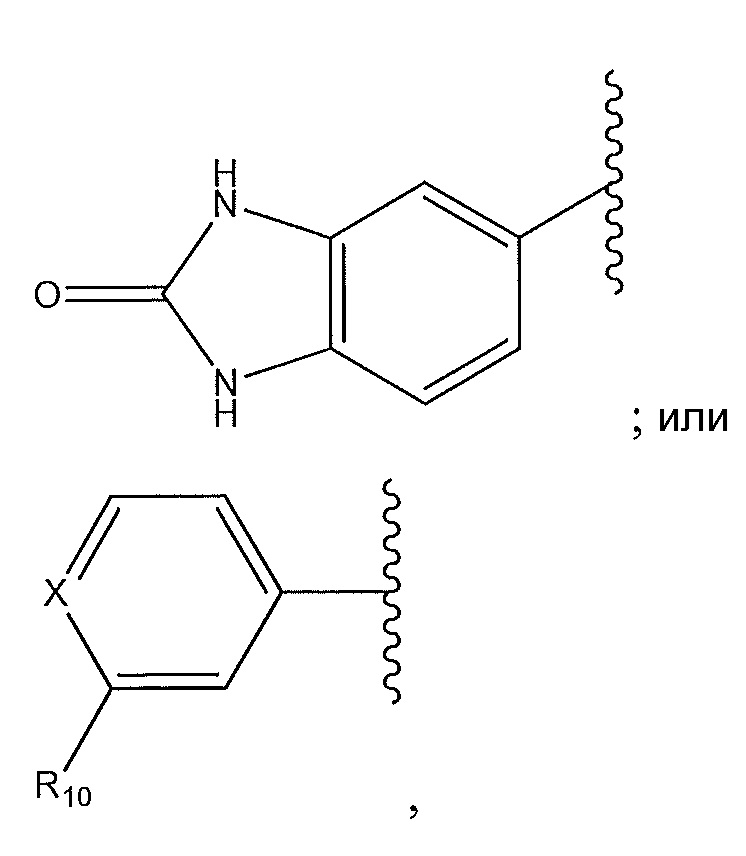
где X представляет собой N или -CH-, где C необязательно замещен с помощью -CH3, F или Cl, и где
R10 представляет собой -C(O)NH-, где азот замещен циклическим амином, который содержит от четырех до семи звеньев; -C(O)-, замещенный бициклодиамином, который содержит от семи до десяти звеньев; -C(O)-, замещенный спиродиамином, который содержит от семи до одиннадцати звеньев; пиразол; [1,2,4]оксадиазол, необязательно замещенный с помощью -CH3 по углеродному атому оксадиазола; -NHC(O)CH3; -CH2-, замещенный пиперазином; -CH2-, замещенный пиперазином, содержащим метиловый заместитель; -C(O)-, замещенный циклическим диамином, который содержит от пяти до семи звеньев; -C(O)NHCH2-, где -CH2- замещен азетидином; или -C(O)-, замещенный циклическим амином, который содержит от пяти до семи звеньев, где амин содержит заместитель -NH2; или
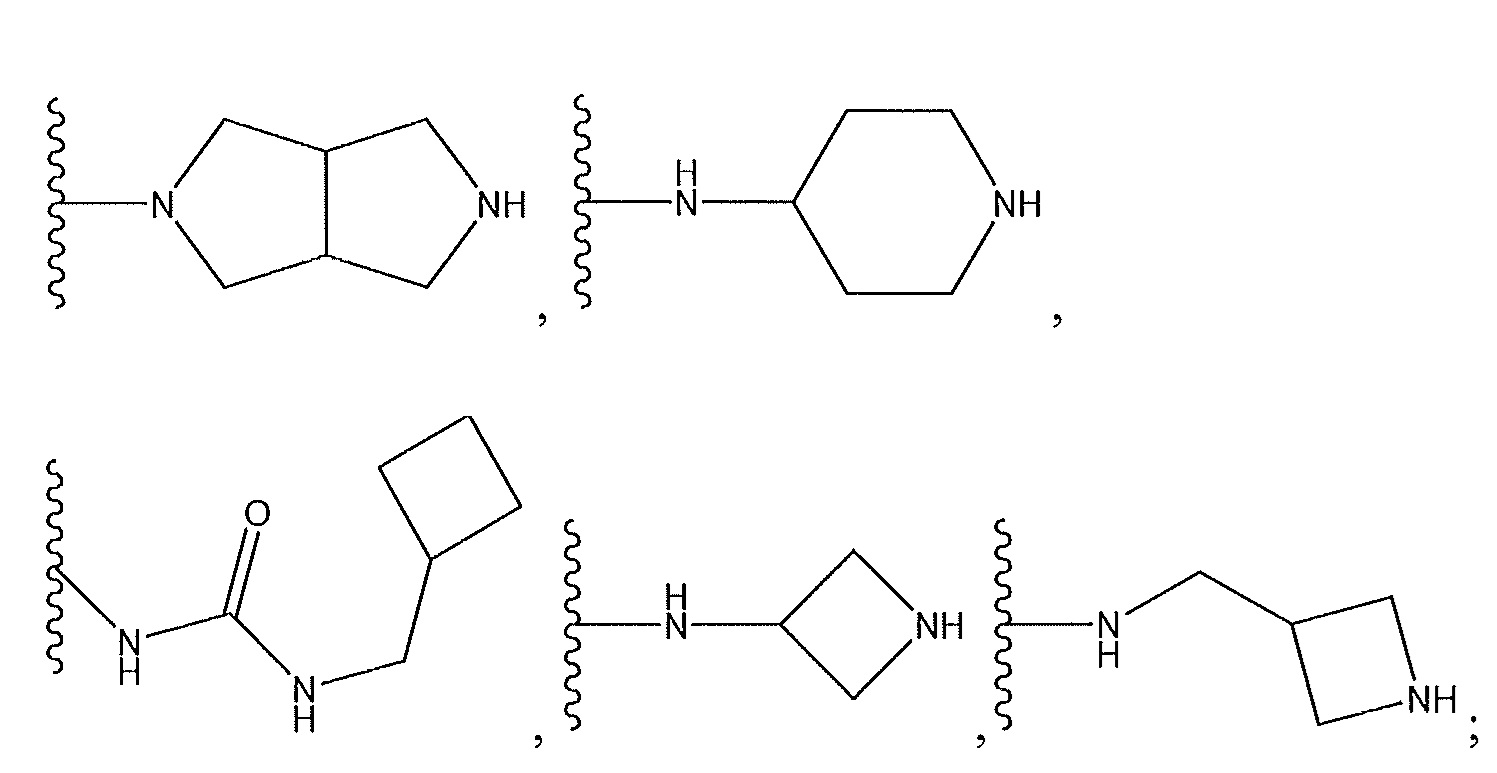
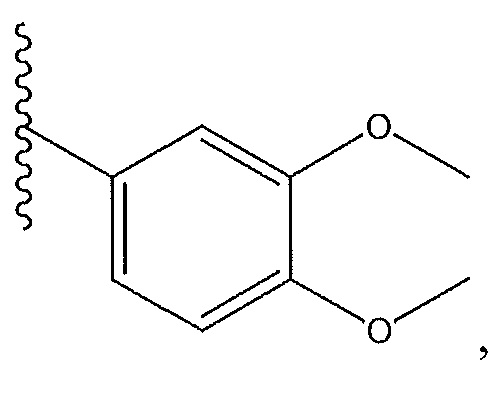
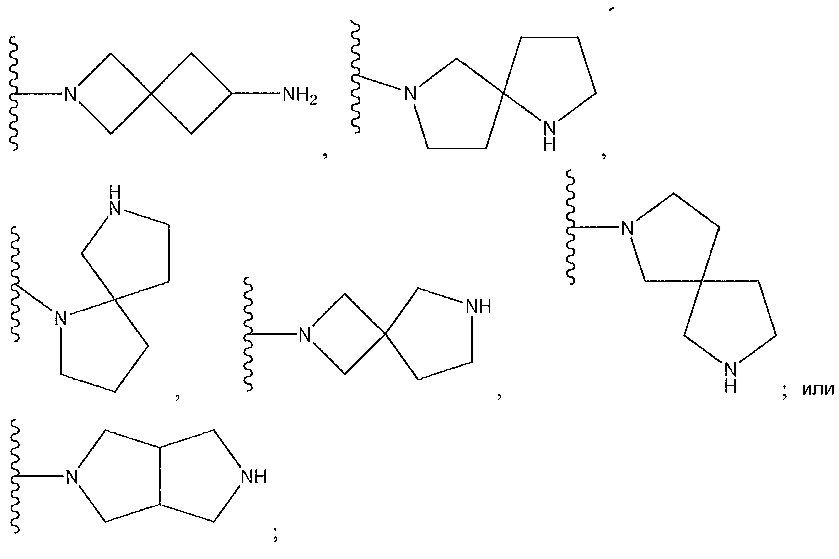
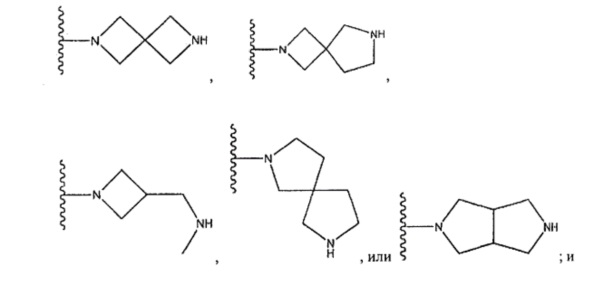
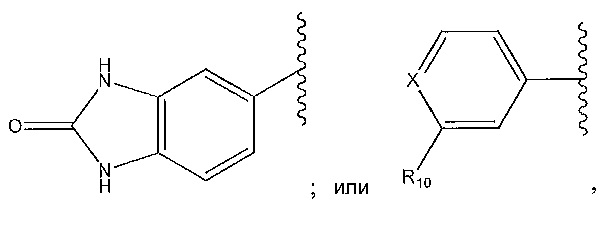
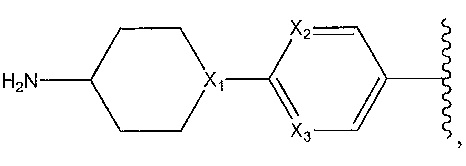
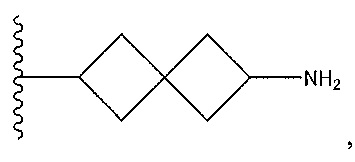
цианофенил; изохинолин; циклогексен, замещенный с использованием -NH2 в положении 4'; 1,4-диметилиндазол-5-ил; 1,6-диметилиндазол-5-ил; циклогексен, замещенный спиропиперидином в положении 4'; 1-пиперидинопиразол; или о-метоксипиридин.
[0020] В дополнительном варианте осуществления соединение или фармацевтически эффективная соль по предшествующему параграфу этого описания имеет IC50 меньше чем или равную 100 нМ по отношению к рецепторам TLR7 человека, экспрессируемым на клеточной линии HEK-293. В дополнительном варианте осуществления IC50 в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293, измеряют посредством (1) высевания клеток клеточной линии HEK-293, которые стабильно экспрессируют TLR7, в модифицированную по способу Дульбекко среду Игла, содержащую 10% эмбриональную телячью сыворотку, с плотностью 2,22×105 клеток/мл в 384-луночный планшет и инкубирования в течение 2 суток при 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубации клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) по 3 мкг/мл и инкубирования клеток в течение приблизительно 20 часов; и (4) количественного определения активации NF-каппаB зависимого репортера посредством измерения люминесценции.
[0021] Дополнительный вариант осуществления включает соединение формулы IV или его фармацевтически эффективную соль, где кольцо A представляет собой:
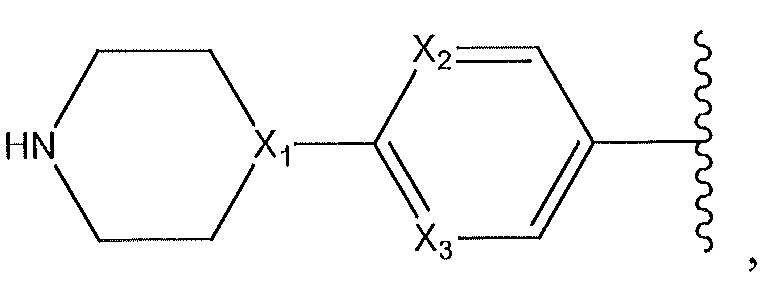
где X1, X2 и X3 независимо выбирают из группы, состоящей из -CH- и N;

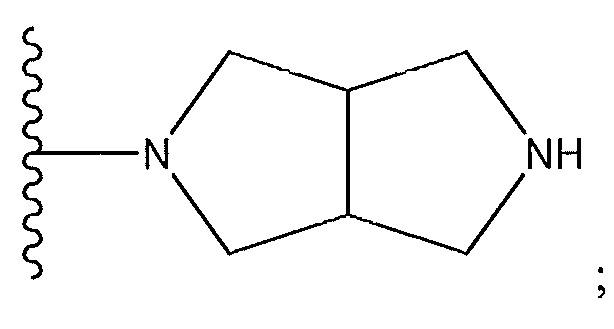
где X4 представляет собой -CH- или N; и где Z представляет собой пиперазин, необязательно содержащий мостик или замещенный по углероду с помощью -CH3; гексагидропирроло[3,4]пиррол; циклический амин, который содержит от четырех до семи звеньев, замещенный с использованием -OH или -NH2; или -NH-, замещенный циклическим амином, который содержит четырех до семи звеньев;
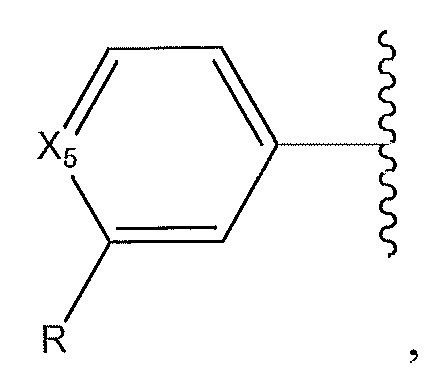
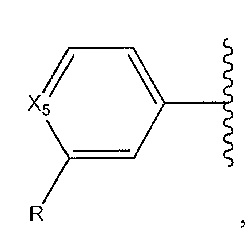
где X5 представляет собой -CH- или N; и где R представляет собой пиразол; [1,2,4]оксадиазол, необязательно замещенный с помощью -CH3 по углероду в оксадиазоле; или -C(O)N-, замещенный по его азоту циклическим амином, который содержит от четырех до семи звеньев;
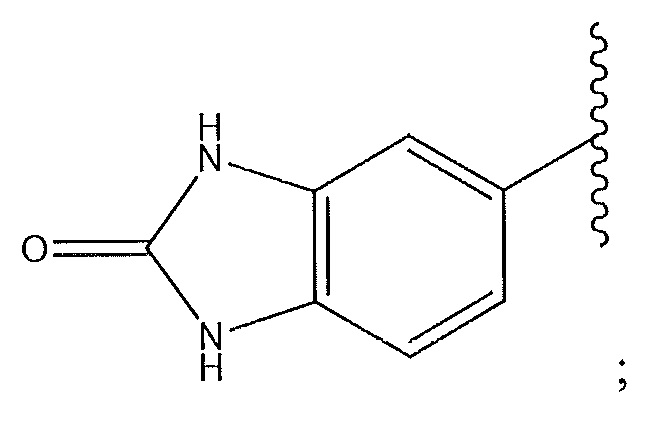
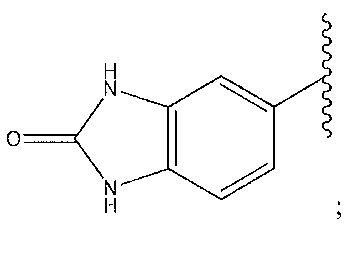
1,4-диметилиндазол-5-ил; 1,6-диметилиндазол-5-ил; 1-пиперидинопиразол; циклогексен, замещенный -NH2 в положении 4'; циклогексен, замещенный спиропиперидином в положении 4’; или 2-метоксипиридин-4-ил.
[0022] В дополнительном варианте осуществления соединение или его фармацевтически эффективная соль по предшествующему параграфу настоящего описания имеет IC50 меньше чем или равную 20 нМ в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293. В дополнительном варианте осуществления соединение или его фармацевтически эффективная соль по предшествующему параграфу этого описания имеет IC50 меньше чем или равную 100 нМ в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293. В дополнительном варианте осуществления IC50 в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293, измеряют посредством (1) высевания клеток клеточной линии HK-293, которая стабильно экспрессирует TLR7, в модифицированную по способу Дульбекко среду Игла, содержащую 10% эмбриональную телячью сыворотку, с плотностью 2,22×105 клеток/мл в 384-луночный планшет и инкубирования в течение 2 суток при 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубирования клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) по 3 мкг/мл и инкубирования клеток в течение приблизительно 20 часов; и (4) количественного определения активации NF-каппаB зависимого репортера посредством измерения люминесценции.
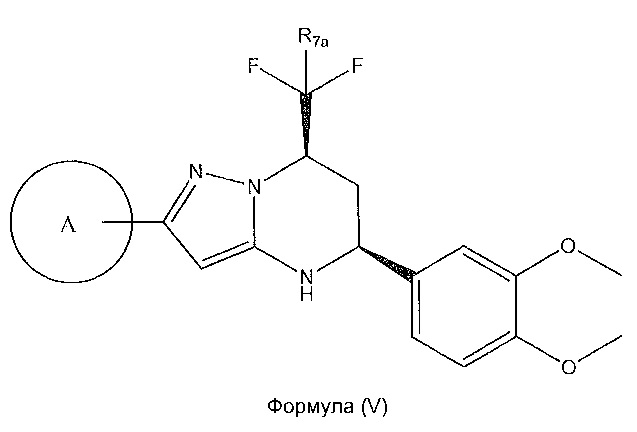
[0023] Дополнительный вариант осуществления включает соединение, которое имеет абсолютную конфигурацию стереохимии, представленную в формуле (V):
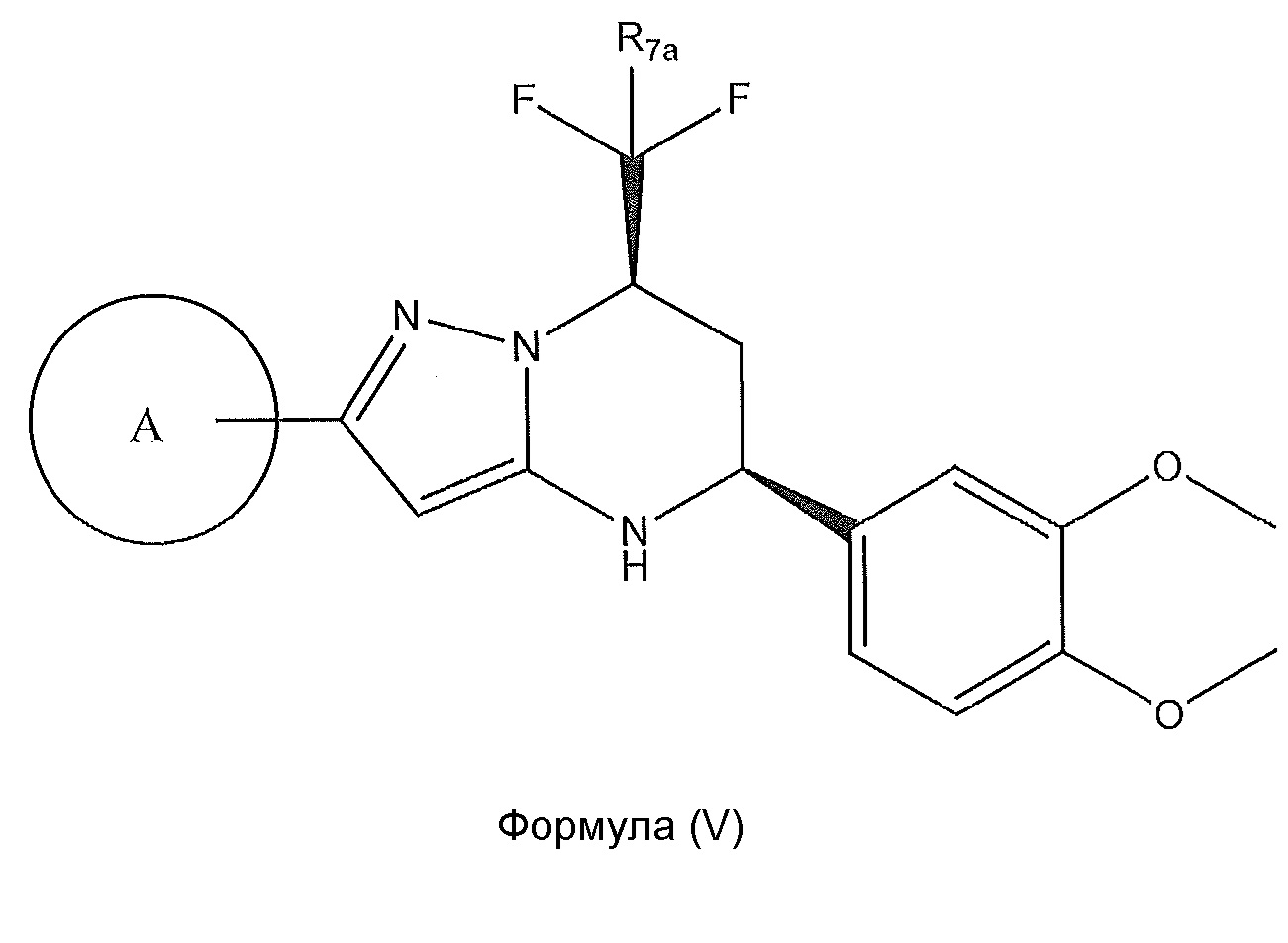 ,
,
или его фармацевтически приемлемую соль, где: R7n представляет собой H или F; где кольцо A представляет собой:
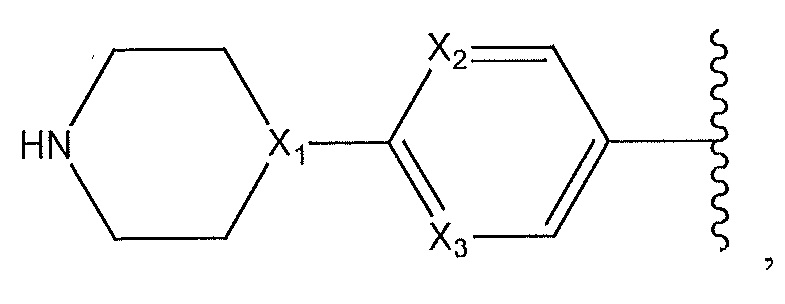
где X1, X2 и X3 независимо выбирают из группы, состоящей из -CH- и N;
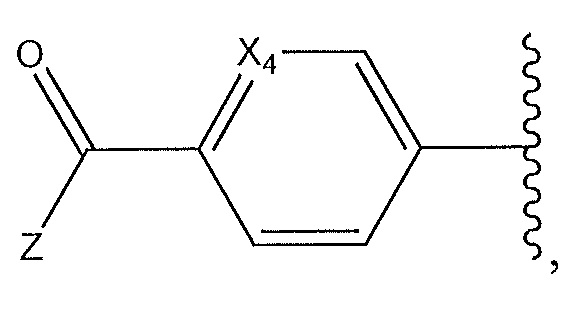
где X4 представляет собой -CH- или N; и где Z представляет собой пиперазин, необязательно содержащий мостик или замещенный по углероду с помощью -CH3; гексагидропирроло[3,4]пиррол; циклический амин, который содержит от четырех до семи звеньев, замещенный с использованием -OH или -NH2; или -NH-, замещенный циклическим амином, который содержит от четырех до семи звеньев;
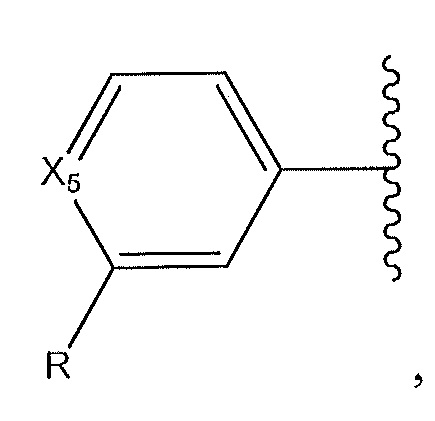
где X5 представляет собой -CH- или N; и где R представляет собой пиразол; [1,2,4]оксадиазол, необязательно замещенный с помощью -CH3 по углероду в оксадиазоле; или -C(O)NH-, замещенный по его азоту циклическим амином, который содержит от четырех до семи звеньев;
1,4-диметилиндазол-5-ил; 1,6-диметилиндазол-5-ил;
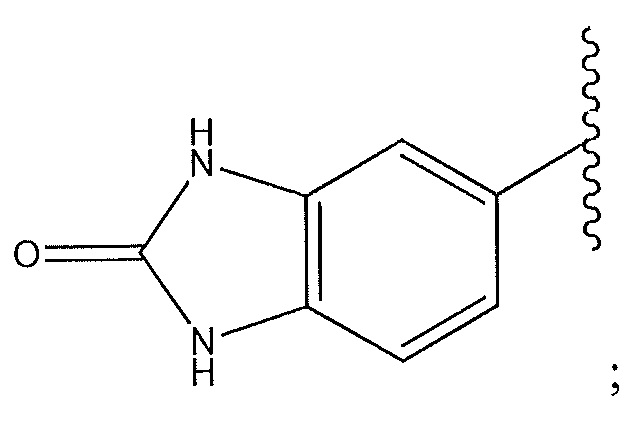
1-пиперидинопиразол; циклогексен, замещенный с использованием -NH2 в положении 4’; циклогексен, замещенный спиропиперидином в положении 4’; или 2-метоксипиридин-4-ил.
[0024] В дополнительном варианте осуществления соединение или его фармацевтически эффективная соль по предшествующему параграфу имеет IC50 меньше чем или равную 20 нМ в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HΕΚ-293. В дополнительном варианте осуществления соединение или его фармацевтически эффективная соль по предшествующему параграфу этого описания имеет IC50 меньше чем или равную 100 нМ в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293. В дополнительном варианте осуществления IC50 в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293, измеряют посредством (1) высевания клеток клеточной линии HEK-293, стабильно экспрессирующих TLR7, в модифицированную по способу Дульбекко среду Игла, содержащую 10% эмбриональную телячью сыворотку, с плотностью 2,22×105 клеток/мл в 384-луночный планшет и инкубирования в течение 2 суток при 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубирования клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) по 3 мкг/мл и инкубирования клеток в течение приблизительно 20 часов; и (4) количественного определения активации NF-каппаB зависимого репортера посредством измерения люминесценции.
[0025] В дополнительных вариантах осуществления изобретения соединения имеют IC50 в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293, меньше чем или равную 200 нМ, меньше чем или равную 180 нМ, меньше чем или равную 160 нМ, меньше чем или равную 140 нМ, меньше чем или равную 120 нМ, меньше чем или равную 100 нМ, меньше чем или равную 80 нМ, меньше чем или равную 60 нМ, меньше чем или равную 40 нМ или меньше чем или равную 20 нМ. В дополнительных вариантах осуществления изобретения соединения имеют IC50 в отношении рецепторов TLR7 человека, экспрессируемых на клеточной линии HEK-293, от 10 нМ до 30 нМ, от 10 нМ до 50 нМ, от 10 нМ до 100 нМ, от 30 нМ до 50 нМ, от 30 нМ до 100 нМ или от 50 нМ до 100 нМ. В дополнительных вариантах осуществления IC50 в отношении рецепторов TLR7 человека, экспрессируемых в HRK-293 клеточной линии, измеряют посредством (1) высевания клеток HRK-293 клеточной линии, стабильно экспрессирующих TLR7, в модифицированную по способу Дульбекко среду Игла, содержащую 10% эмбриональную телячью сыворотку, с плотностью 2,22×105 клеток/мл, в 384-луночный планшет и инкубирования в течение 2 суток при 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубирования клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) по 3 мкг/мл и инкубирования клеток в течение приблизительно 20 часов; и (4) количественного определения активации NF-каппаB зависимого репортера посредством измерения люминесценции.
[0026] Дополнительные варианты осуществления предусматривают способы лечения системной красной волчанки или волчанки, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0027] Дополнительные варианты осуществления раскрывают способы антагонистического воздействия на TLR7, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0028] Дополнительные варианты осуществления раскрывают способы антагонистического воздействия на TLR8, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0029] Дополнительные варианты осуществления раскрывают фармацевтические композиции, которые содержат по меньшей мере одно соединение или фармацевтически приемлемую соль по раскрытию и по меньшей мере один фармацевтически приемлемый носитель.
[0030] Дополнительные варианты осуществления раскрывают способы лечения системной красной волчанки или волчанки, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0031] Дополнительные варианты осуществления раскрывают способы антагонистического воздействия на TLR7, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0032] Дополнительные варианты осуществления раскрывают способы антагонистического воздействия на TLR8, включающие введение фармацевтически эффективного количества соединения или фармацевтически приемлемой соли по изобретению.
[0033] Дополнительные варианты осуществления раскрывают фармацевтические композиции, которые содержат по меньшей мере одно соединение или фармацевтически приемлемую соль по изобретению и по меньшей мере один фармацевтически приемлемый носитель.
[0034] Термин «необязательно замещенный», как используют в настоящем документе, обозначает, что рассматриваемая структура может содержать, но не обязательно содержит, один или несколько заместителей, независимо выбранных из низшего алкила, метокси-, -OH, -NH2, -CH2-NH-CH2, -OCH2CH2CH3 или -OCH(CH3)2. Если необязательно замещенный фрагмент является циклическим, то необязательное замещение может представлять собой метиловый мостик между двумя атомами в кольце.
[0035] Символ «C(O)», как используют в настоящем документе, относится к карбонильной группе, имеющей формулу C=O.
[0036] Если не указано иное, формы единственного числа, как используют в этом раскрытии, включая формулу изобретения, обозначают «один или несколько».
[0037] Как используют в настоящем документе, «низший алкил» относится к неразветвленным или, в случае групп из трех и четырех углеродов, неразветвленным, разветвленным или циклическим насыщенным углеводородам, которые имеют от одного до четырех углеродных атомов.
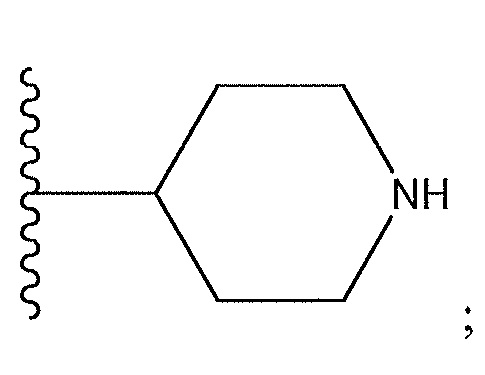
[0038] Как используют в настоящем документе, термин «прикрепленный через азот», когда относится к гетероциклическому фрагменту, включающему азот, обозначает, что точка прикрепления фрагмента к другой структуре представляет собой азот, который является частью гетероцикла.
[0039] Как используют в настоящем документе, термин «TLR7/8» обозначает «TLR7 и TLR8» или «TLR7 или TLR8» или «TLR7 и/или TLR8», Конкретное значение может понять специалист в данной области, исходя из контекста, в котором встречается «TLR7/8».
[0040] Гетероциклические фрагменты, перечисленные в настоящем документе, включают азетидинил, пирролидинил, пиперидинил, метилазетидинил, пиразолил, пиперазинил, морфолинил, тиазолил, пирролопирролил, имидазолидинил и изотиазолил. Когда указана гетероциклическая группа, если не указано иное, понятно, что гетероциклический атом(ы) в группе может быть в любом положении в группе. Кроме того, понятно, что имидазолил, пиразолил, тиазолил и пирролил могут быть ненасыщенными или частично ненасыщенными. Вариант осуществления по изобретению может включать фармацевтическую композицию, которая содержит одно или несколько соединений по изобретению с фармацевтически приемлемым эксципиентом. Эти фармацевтические композиции можно использовать для лечения или предотвращения заболевания или состояния, отличающегося активацией TLR7/8 у пациента, типично пациента-человека, который имеет или предрасположен к тому, чтобы иметь такое состояние или заболевание. Примеры заболеваний или состояний, отличающихся активацией TLR7/8, включают системную красную волчанку (SLE) и волчаночный нефрит.
[0041] Как используют в настоящем документе, «эффективное количество» соединения по варианту осуществления изобретения представляет собой эффективное количество идентифицированных выше соединений в количестве, достаточном для лечения или предотвращения SLE и волчаночного нефрита.
[0042] Варианты осуществления, представленные в настоящем документе, могут включать асимметричные или хиральные центры. Варианты осуществления включают различные стереоизомеры и их смеси. Индивидуальные стереоизомеры соединений по вариантам осуществления изобретения можно получать синтетически из коммерчески доступных исходных материалов, которые содержат асимметричные или хиральные центры, или посредством получения смесей энантиомерных соединений, после чего следует разрешение этих соединений. Подходящие способы разрешения включают прикрепление рацемической смеси энантиомеров, обозначаемых (±), к хиральному вспомогательному средству, разделение получаемого диастереомера посредством хроматографии или перекристаллизации и отделение оптически чистого продукта от вспомогательного средства; или прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках.
[0043] Варианты осуществления изобретения также включают фармацевтическую композицию, которая содержит какое-либо соединение по изобретению, а также фармацевтически приемлемый эксципиент. Фармацевтические композиции можно использовать для того, чтобы лечить или предотвращать SLE и волчаночный нефрит. Следовательно, варианты осуществления изобретения также могут отличаться способом лечения или предотвращения SLE или волчаночного нефрита у пациента-человека, который имеет или предрасположен к тому, чтобы иметь волчаночный нефрит или SLE.
[0044] Варианты осуществления изобретения включают фармацевтически приемлемые соли соединений, представленных в настоящем документе. Термин «фармацевтически приемлемая соль» относится к тем солям, которые входят в объем здравого медицинского суждения, пригодным для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения или аллергического ответа. Фармацевтически приемлемые соли хорошо известны в данной области. Например, S. M. Berge, et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences 66: 1-19, 1977. Соли можно получать in situ во время конечного выделения и очистки соединения или отдельно посредством реакции свободной группы основания с подходящей органической кислотой. Иллюстративные примеры кислотно-аддитивных солей включают такие соли, как ацетат, адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептонат, глицерофосфат, гемисульфат, гептонат, гексаноат, гидробромид, гидрохлорид, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, мономалеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, толуенсульфонат, трифторацетат, ундеканоат, валерат и т.п. Иллюстративные соли щелочных или щелочноземельных металлов включают натрий, литий, калий, кальций, магний и т.п., а также нетоксичные катионы аммония, четвертичного аммония и аминов, включая в качестве неограничивающих примеров аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. Термин «фармацевтически приемлемый сложный эфир», как используют в настоящем документе, представляет сложные эфиры, которые гидролизуются in vivo, и включает те, которые легко распадаются в организме человека, оставляя исходное соединение или его соль. Подходящие сложноэфирные группы включают, например, те, которые получены из фармацевтически приемлемых алифатических карбоновых кислот, в частности, алкановых, алкеновых, циклоалкановых и алкандиеновых кислот, в которых каждая алкиловая или алкенильная группа типично имеет не больше чем 6 углеродных атомов. Примеры конкретных сложных эфиров включают формиаты, ацетаты, пропионаты, бутилаты, акрилаты и этилсукцинаты.
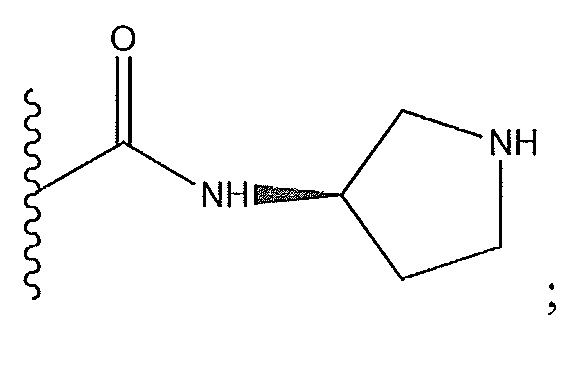
[0045] В этой заявке энантиомеры обозначают символами «R» или «S» или изображают стандартными средствами с использованием жирных линий, опеределяющих заместители выше плоскости страницы в трехмерном пространстве, и пунктирных или штриховых линий, определяющих заместители ниже плоскости напечатанной страницы в трехмерном пространстве. Если стереохимическое обозначение не выполнено, то определение структуры включает обе стереохимические возможности.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
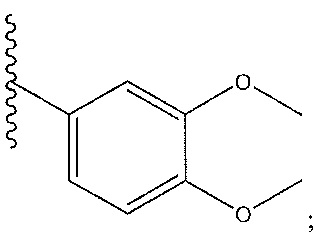
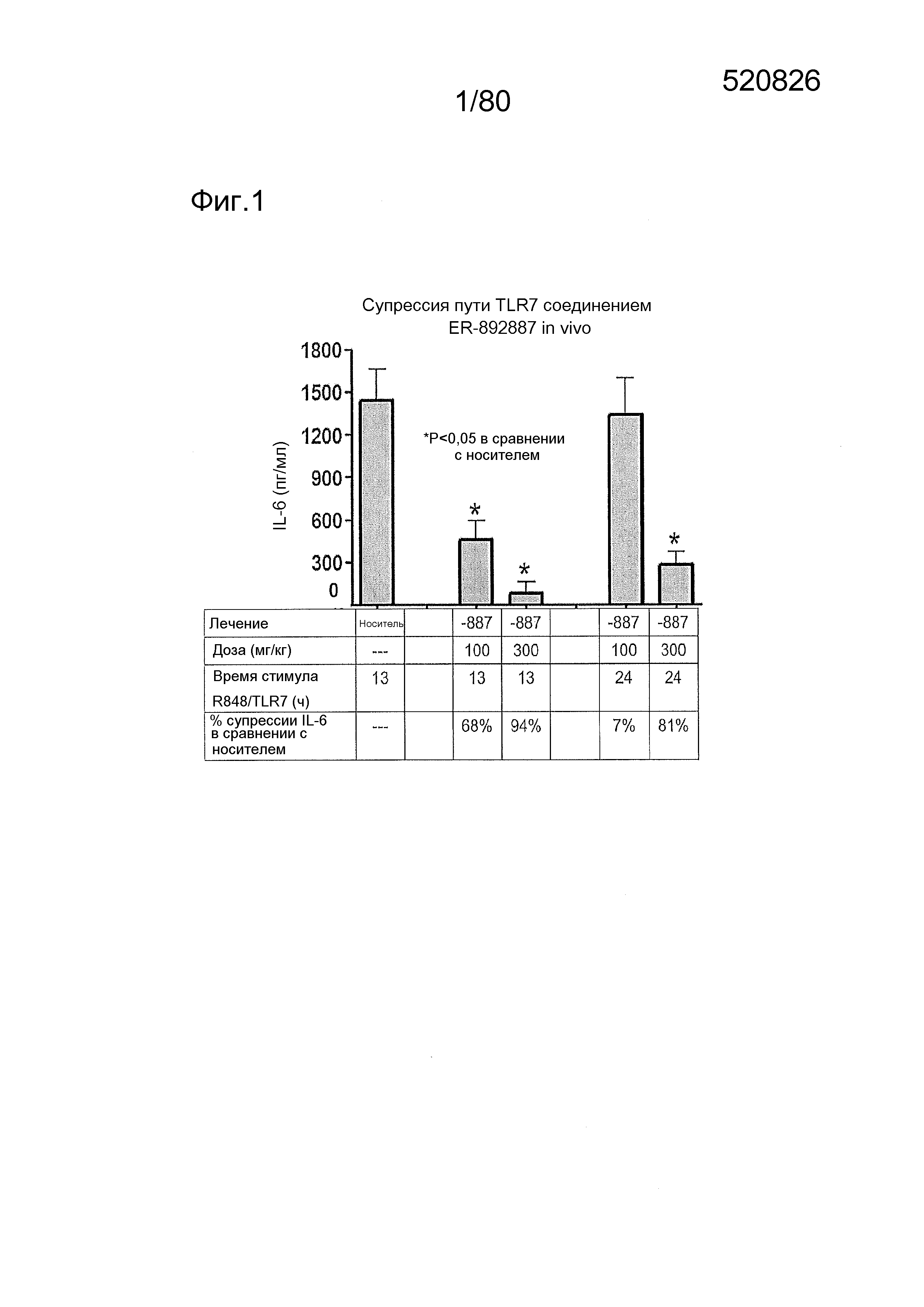
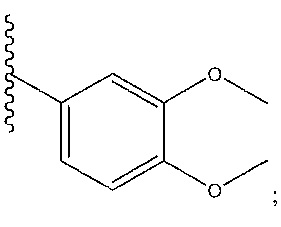
[0046] На фиг. 1 представлена кратковременная активность in vivo в отношении пути TLR7 у мыши для соединения ER-892887 (которое имеет химическое название (4-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)фенил)(пиперазин-1-ил)метанон). Условные обозначения на фигуре: самкам мышей BALB/c дозировали посредством перорального принудительного кормления только наполнитель (0,5% водная метилцеллюлоза) или соединение ER- 892887, сформулированное в наполнителе по 100 мг/кг или 300 мг/кг. В 13 или 24 часа после перорального дозирования мышам подкожно инъецировали 15 мкг R848 для того, чтобы стимулировать TLR7. Плазму крови собирали посредством сердечного прокола, и затем оценивали уровень IL-6 через 1,5 часа после стимуляции TLR7 посредством стандартной процедуры ELISA. Процент супрессии указан относительно индукции IL-6 после дозирования контроля с наполнителем. Статистическую значимость определяли посредством критерия Манна-Уитни.
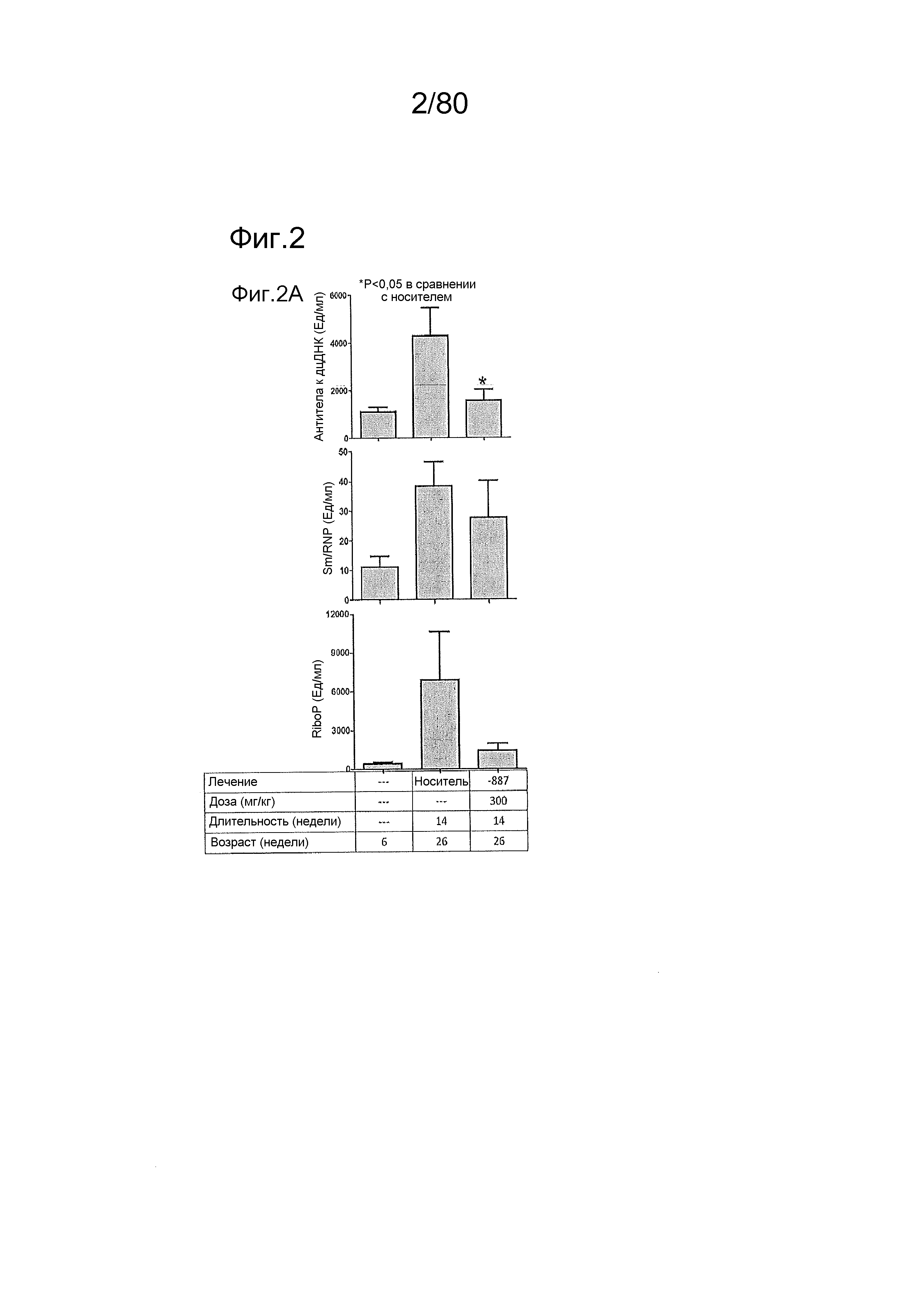
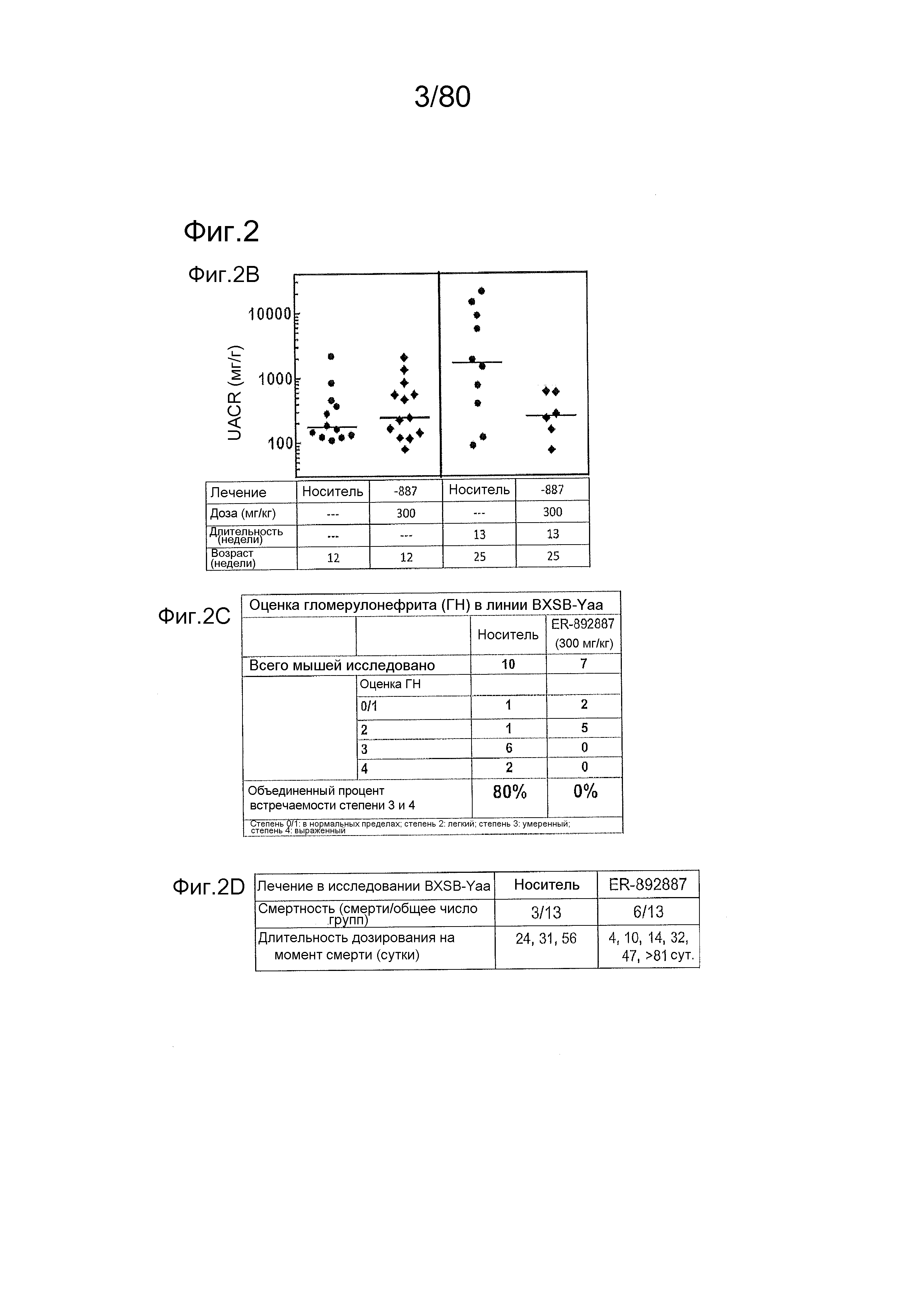
[0047] На фиг. 2 представлены результаты тестирования соединения ER-892887 в модели заболевания волчанкой на линии BXSB-Yaa. Условные обозначения на фигуре: мышей BXSB-Yaa в возрасте двенадцати недель рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили раз в сутки перорально с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-892887 в течение всего 14 недель. (A) Всех мышей умерщвляли в возрасте 26 недель, и конечные титры антител к дцДНК, антител к Sm/nRNP и антител к RiboP оценивали посредством ELISA по сравнению с титрами, наблюдаемыми у мышей перед заболеванием в возрасте 6 недель. (B) Приблизительно за одну неделю до умерщвления (возраст 25 недель, 13 недель лечения), мышей содержали по 1-2 на клетку в метаболических клетках в течение 18 часов для того, чтобы собирать мочу, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного в качестве опосредованной меры функции почек. (C) В момент умерщвления почки собирали у отдельных мышей, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. (D) Сводка по смертности, наблюдаемой в исследовании SLE-8. Статистическую значимость определяли посредством критерия Манна-Уитни для (A).
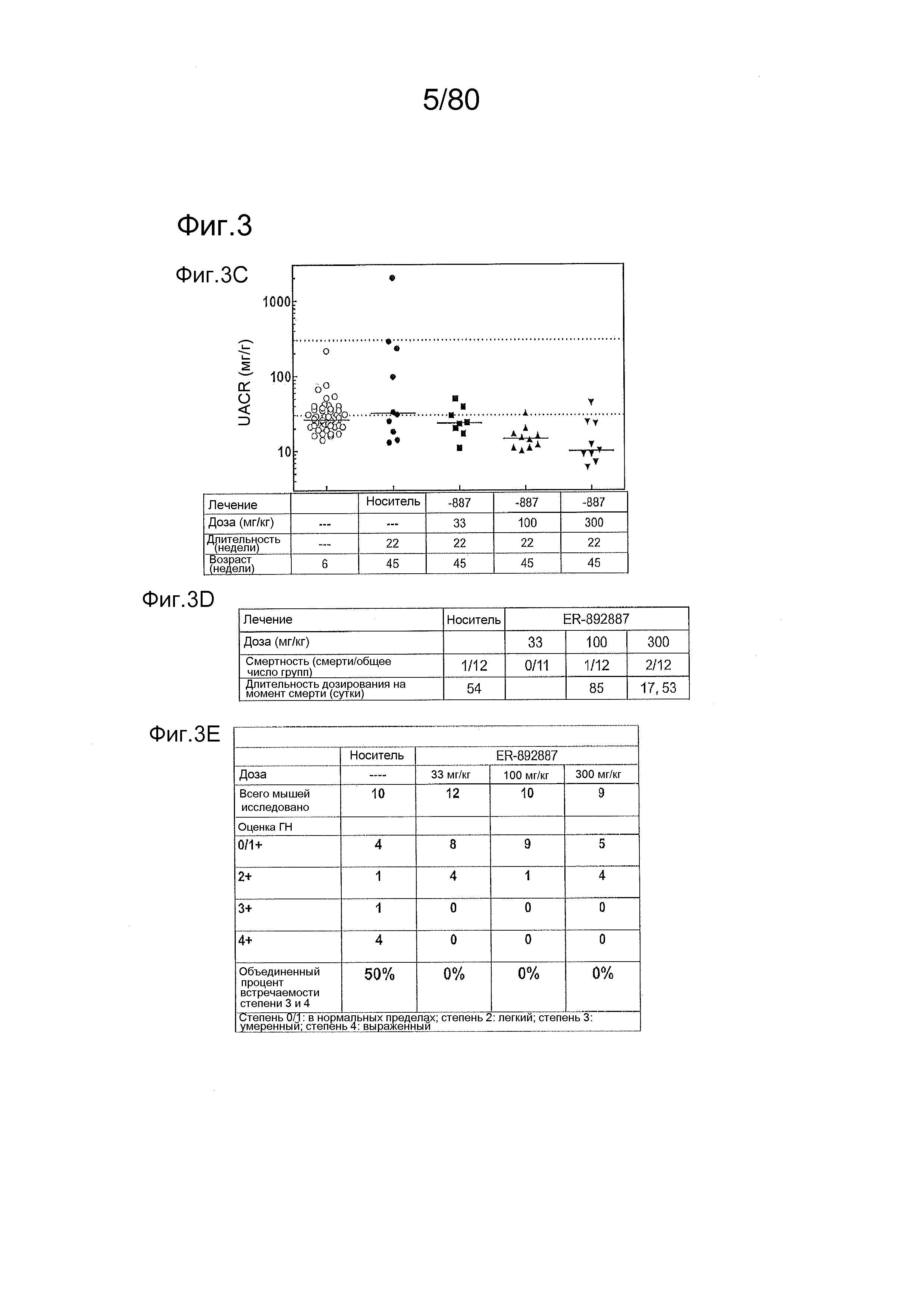
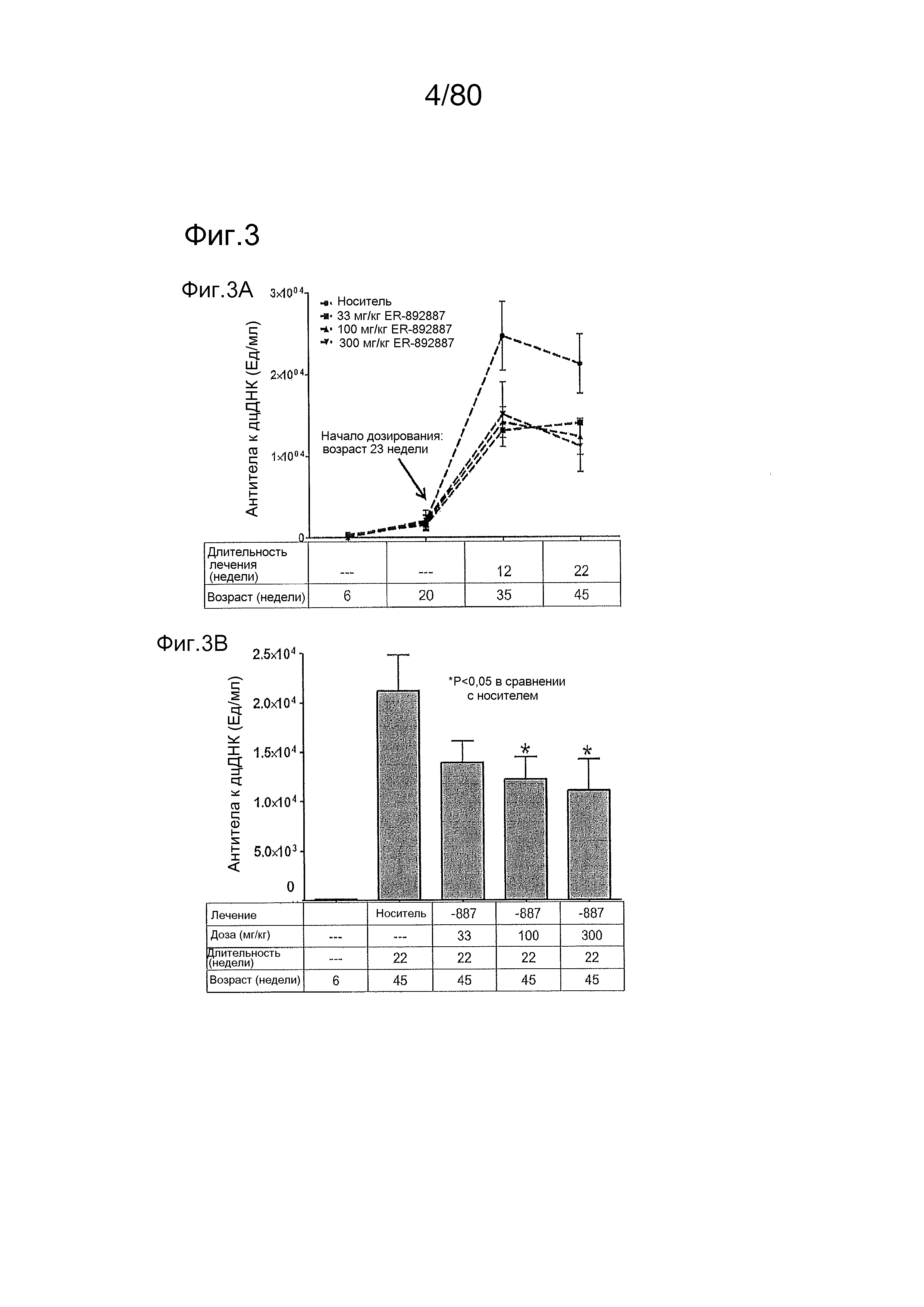
[0048] На фиг. 3 представлены результаты тестирования соединения ER-892887 в модели заболевания волчанкой на линии NZBxNZW. Условные обозначения на фигуре: Самок мышей NZBWF1/J получали в возрасте 6 недель, получали кровь для определения базовых уровней, и у мышей осуществляли мониторинг прогрессирования заболевания, следя за титрами антител к дцДНК. В возрасте 20 недель мышей рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили в возрасте 23 недели только наполнителем (Veh; 0,5% метилцеллюлоза) или 33, 100 или 300 мг/кг ER-892887 раз в сутки перорально (QD PO). Всех мышей умерщвляли в возрасте 45 недель (всего 22 недели лечения), и определяли титры антител к дцДНК в плазме крови посредством ELISA. (A) Влияние лечения ER-892887 с течением времени на титры антител к дцДНК. (B) Столбчатая диаграмма по данным +22 недель лечения для ER-892887, полученным из данных, представленных на (A). (C) Прямо перед окончанием в возрасте 45 недель (после 22 недель лечения), у отдельных мышей мочу собирали, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного в качестве опосредованной меры функции почек. (D) Сводка по смертности, наблюдаемой в этом исследовании. (E) В момент умерщвления у отдельных мышей собирали почки, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. Статистическую значимость определяли посредством критерия Манна-Уитни для (C).
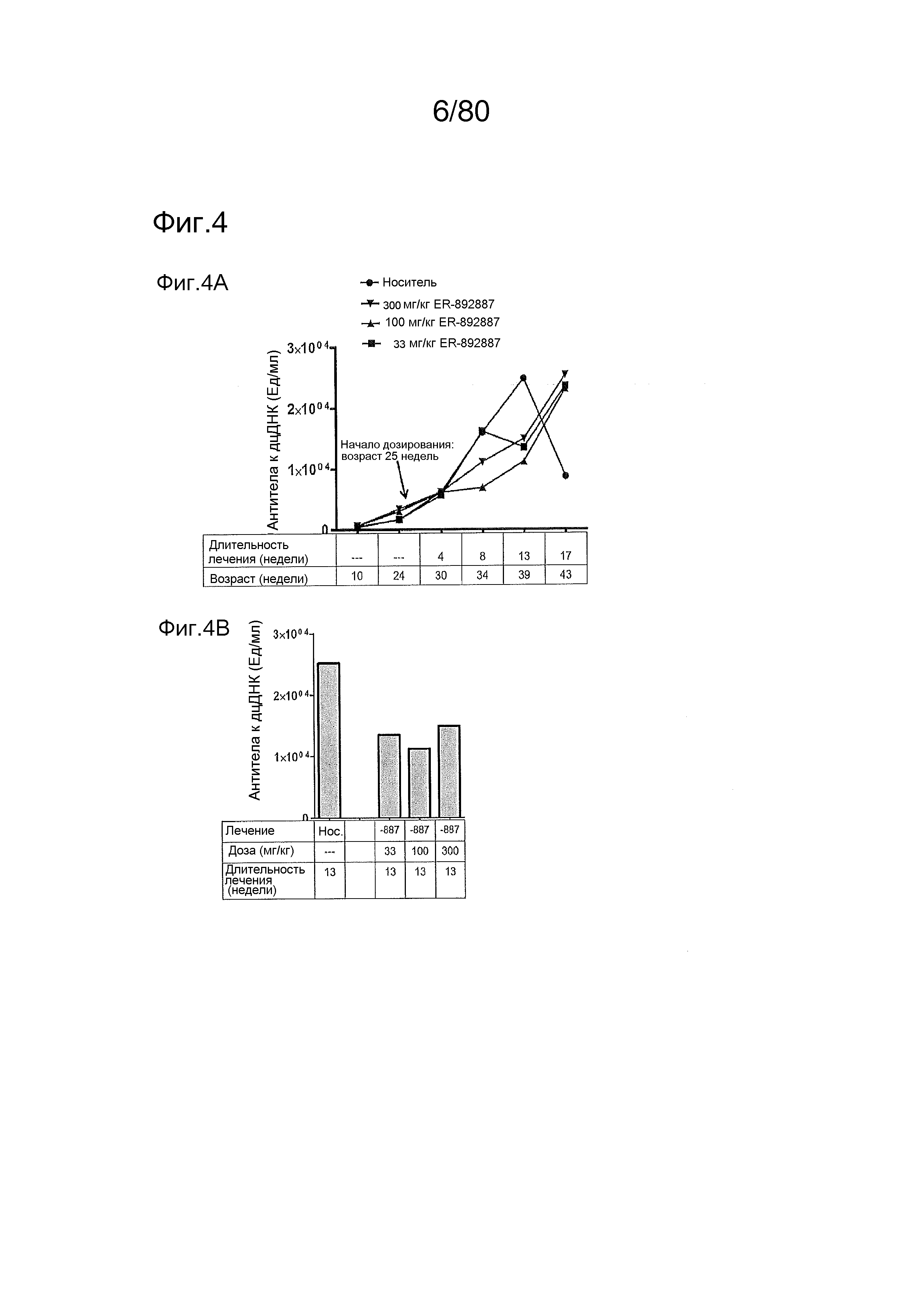
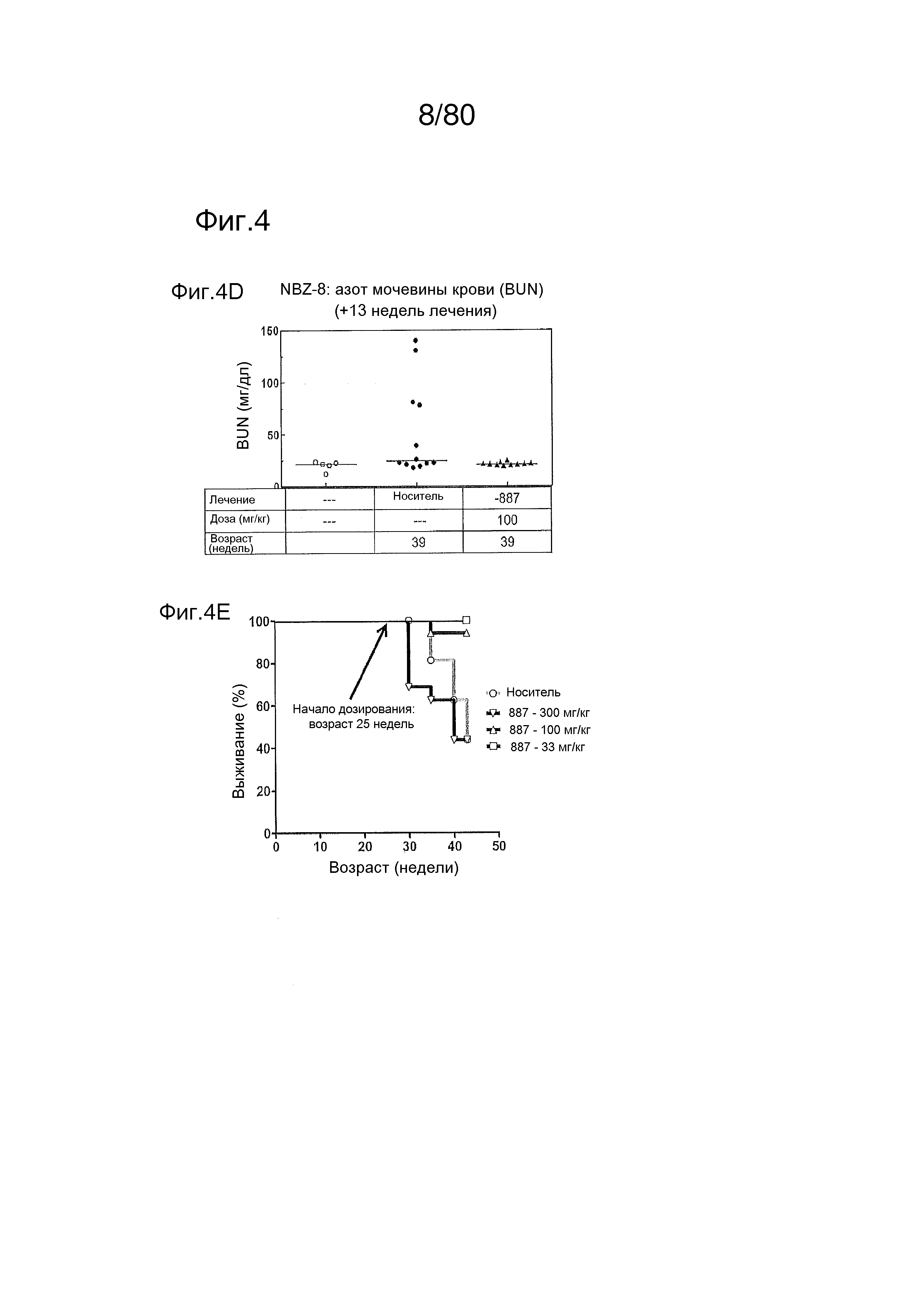
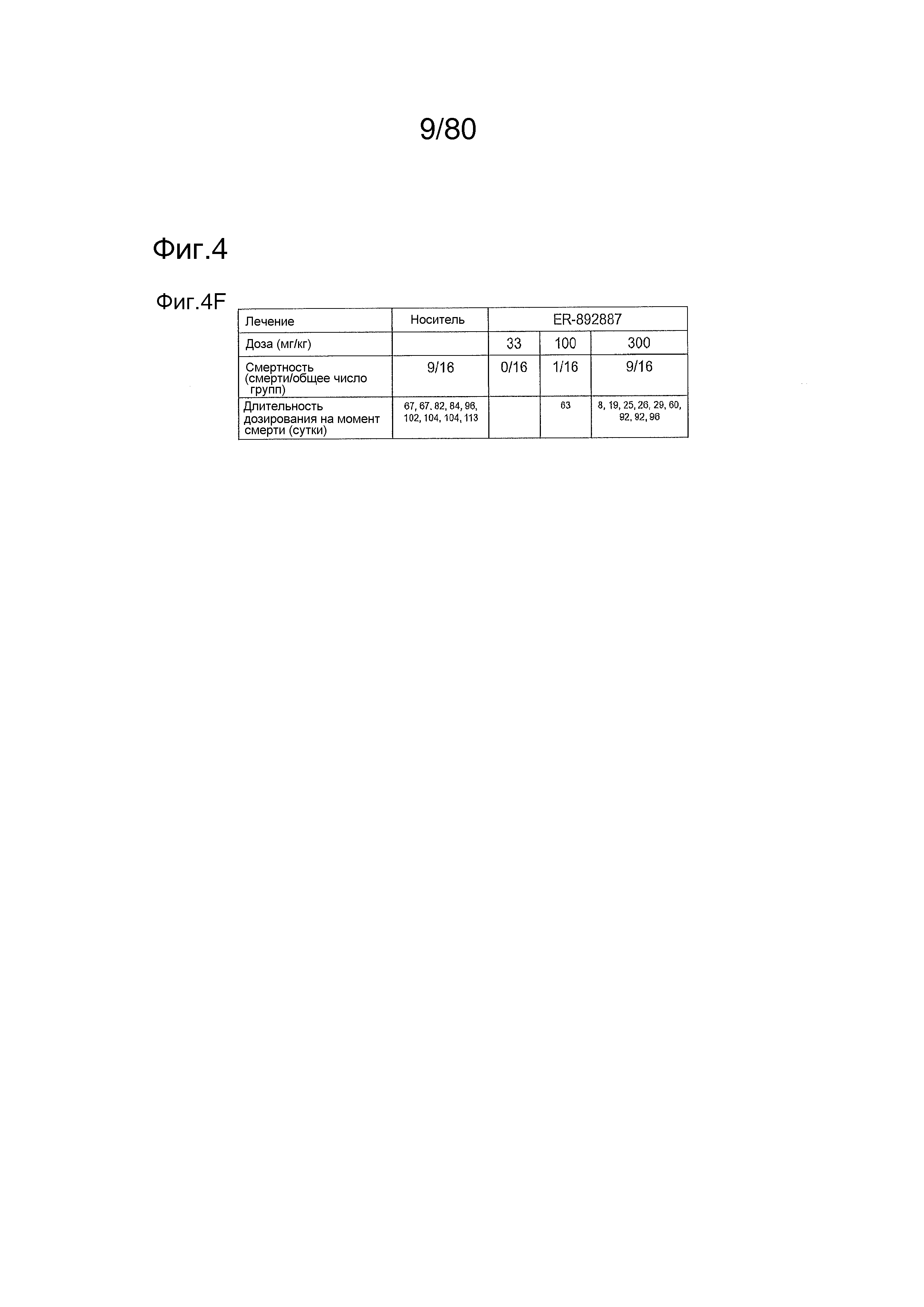
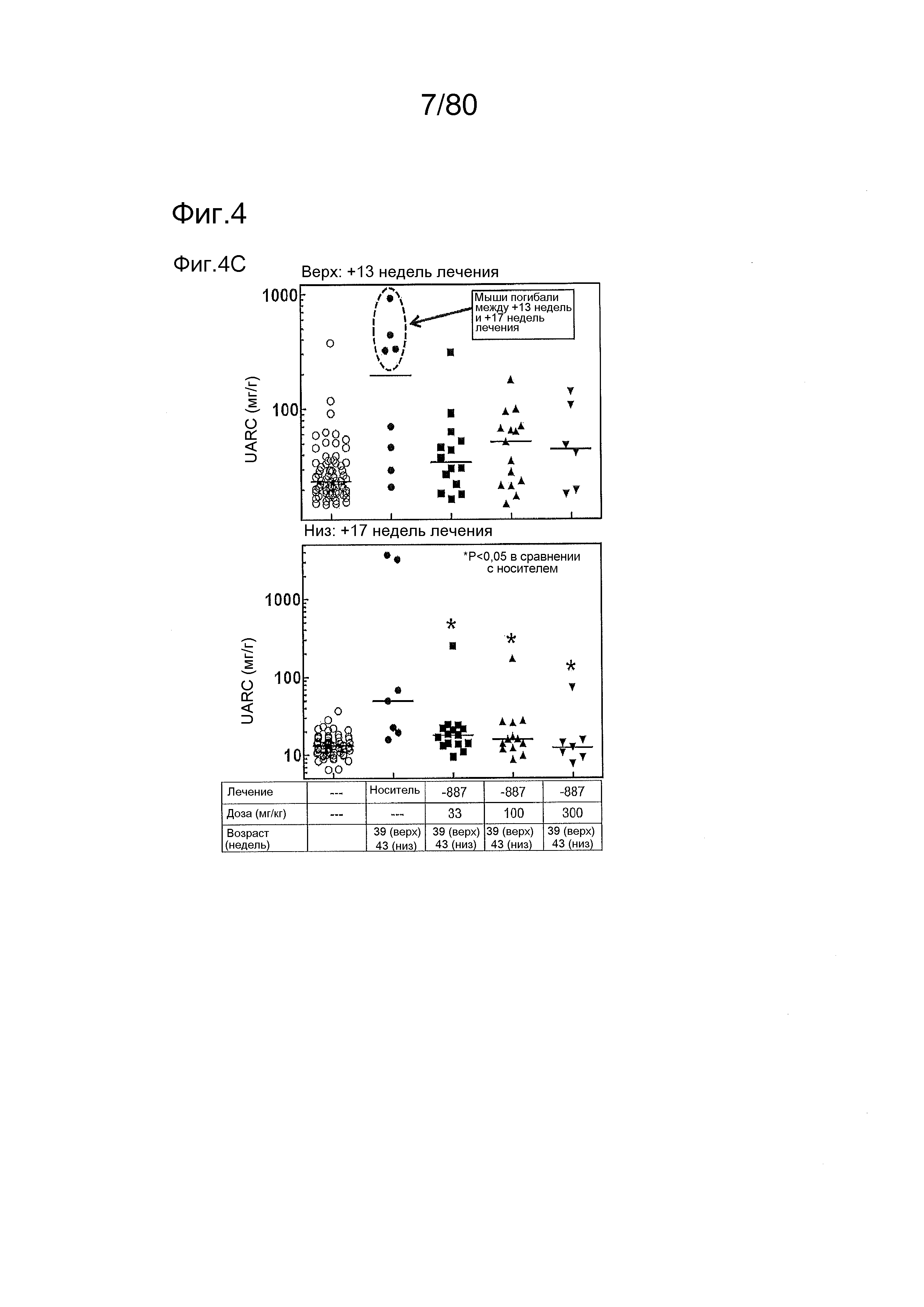
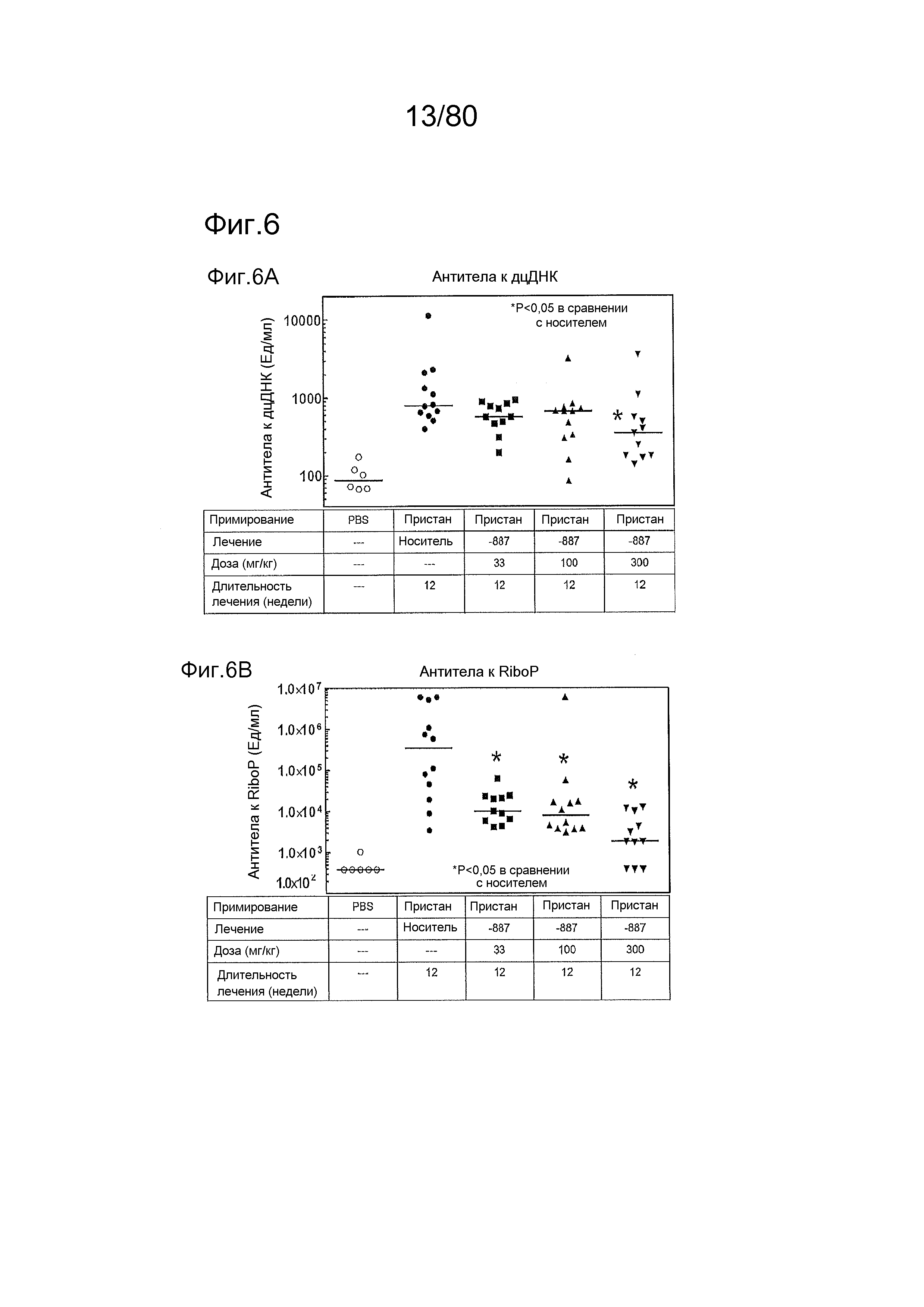
[0049] На фиг. 4 представлены результаты дополнительного тестирования соединения ER-892887 в модели заболевания волчанкой на линии NZBxNZW. Условные обозначения на фигуре: самок мышей NZBWF1/J получали в возрасте 8 недель, получали кровь для определения базовых уровней, и у мышей осуществляли мониторинг прогрессирования заболевания, следя за титрами антител к дцДНК. В возрасте 24 недели мышей рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили в возрасте 25 недель QD PO с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 33, 100 или 300 мг/кг ER-892887. Титры антител к дцДНК определяли посредством ELISA в образцах плазмы крови в указанные моменты времени. (A) Влияние лечения соединением на медианные титры антител к дцДНК с течением времени вплоть до +17 недель лечения. (B) Влияние лечения соединением на медианные титры антител к дцДНК в момент времени +13 недель лечения только по данным, представленным на (A). (C) После 13 недель (верхний график) или 17 недель (нижний график) лечения соединением у отдельных мышей собирали мочу, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного в качестве опосредованной меры функции почек. Мыши, приведенные внутри овала, с высоким UACR, представляют собой тех животных, которые погибли между +13 неделями и +17 неделями лечения (статистическую значимость определяли посредством критерия Манна-Уитни). (D) Азот мочевины крови (BUN), измеренный в плазме от выбранных групп после 13 недель лечения. (E) Кривые смертности для мышей, которых лечили наполнителем, в сравнении с соединением, вплоть до 17 недель лечения. Анализ кривой смертности до +17 недель лечения показывал, что лечение ER-892887 33 мг/кг и 100 мг/кг давало статистически значимое преимущество в выживаемости в сравнении с наполнителем, как определяют посредством логарифмического рангового критерия (Кокса-Мантеля). (F) Сводка по смертности, наблюдаемой в этом исследовании.
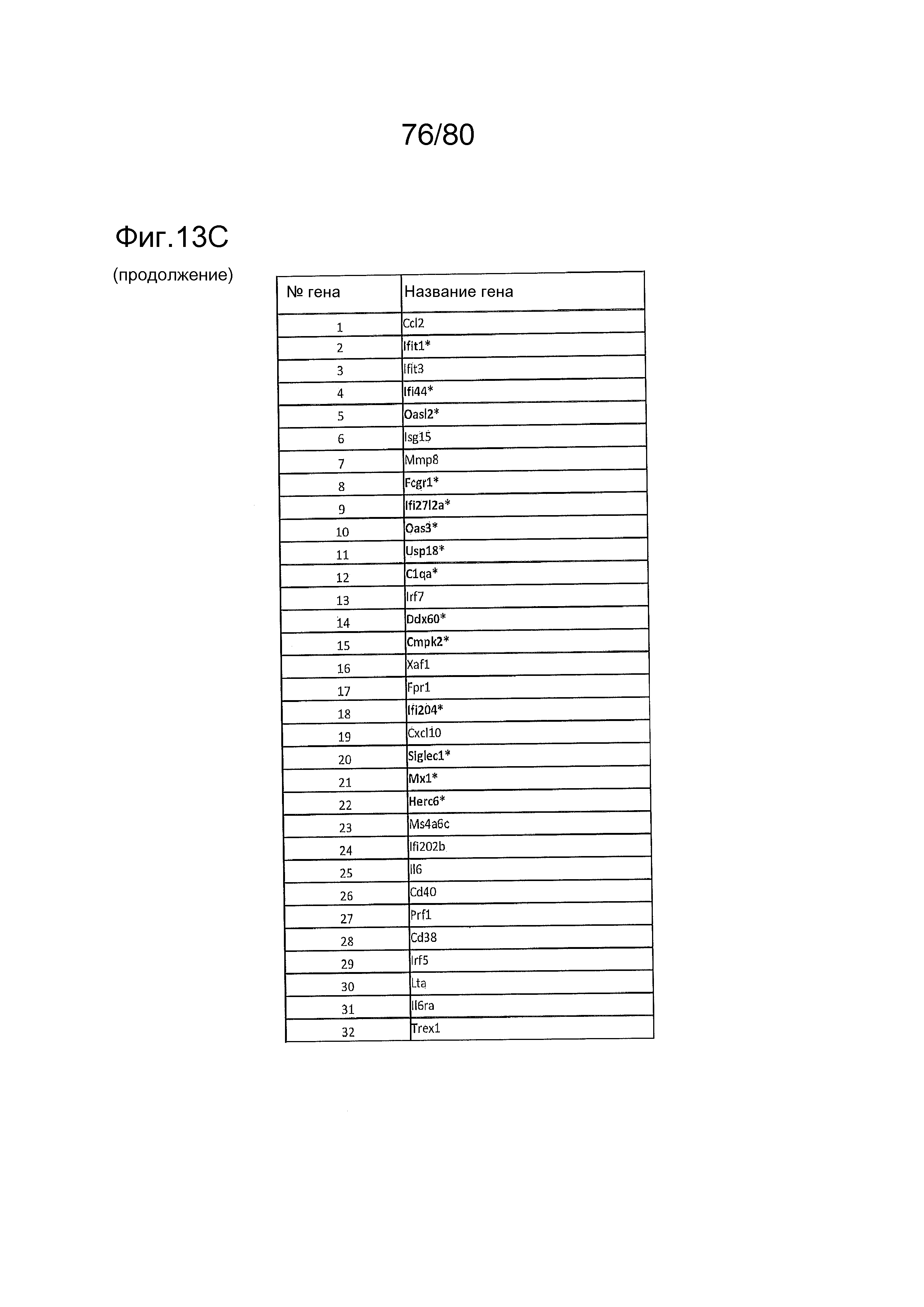
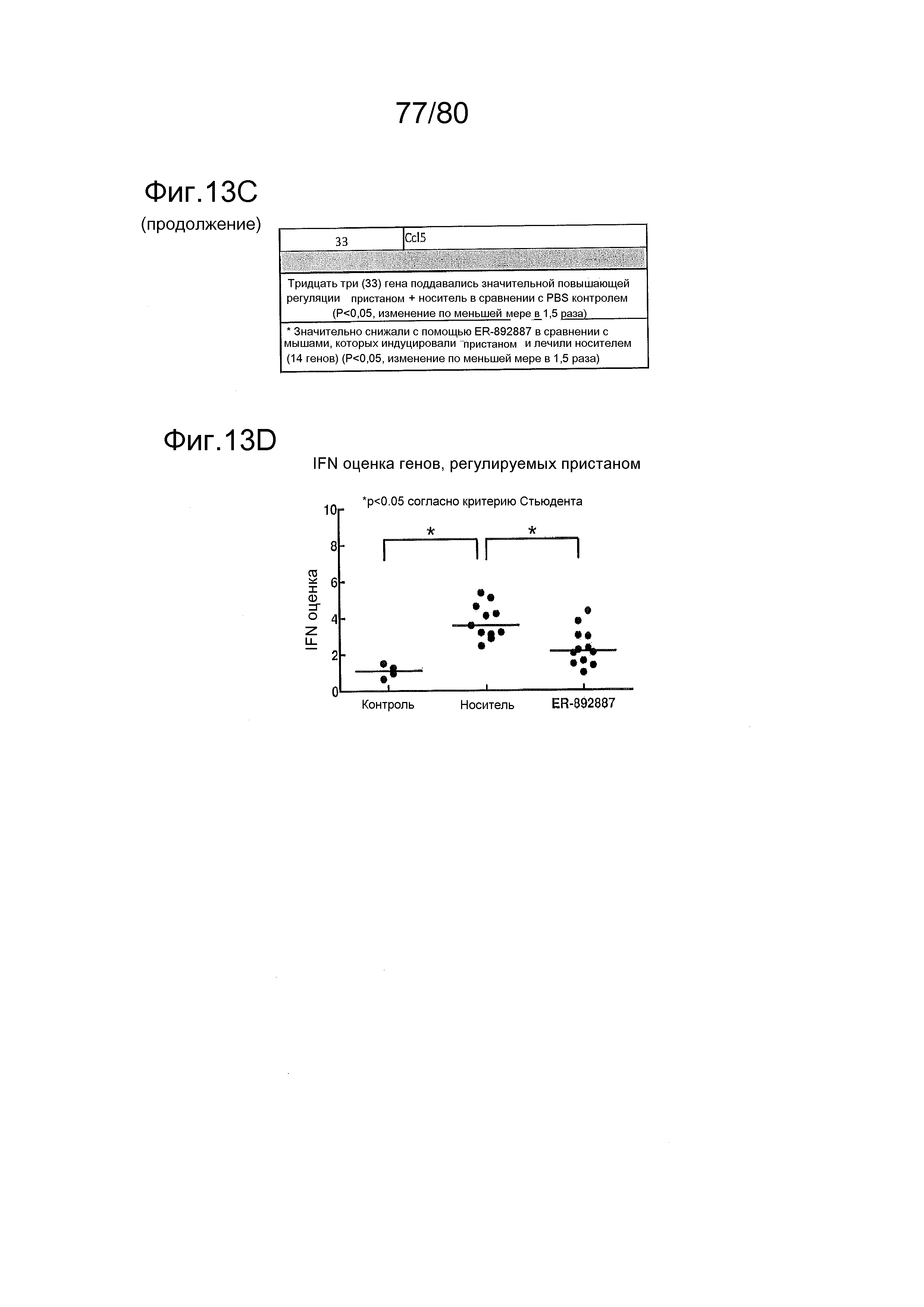
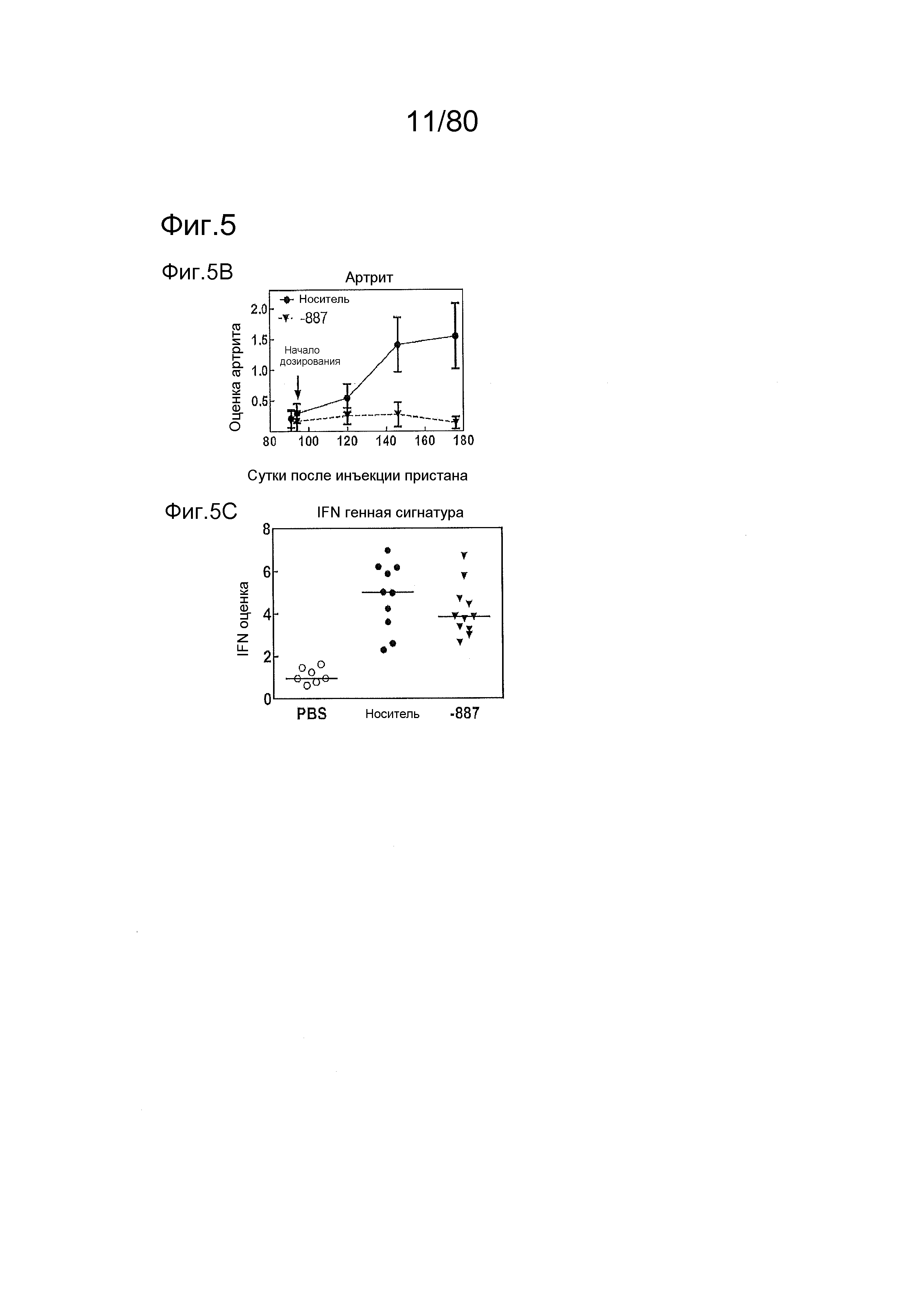
[0050] На фиг. 5 представлены результаты тестирования соединения ER-892887 в пристане: модель заболевания волчанкой на линии DBA/1. Условные обозначения на фигуре: самкам мышей DBA/1 в возрасте 10-11 недель вводили интраперитонеально инъекцию 0,5 мл пристана или PBS. Раз в сутки пероральное дозирование с наполнителем (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-892887 начинали через 3,5 месяца после инъекции пристана в течение всего 3 месяцев лечения. (A) Мышей умерщвляли после 3 месяцев лечения соединением, и измеряли титры антител к дцДНК и антител к RiboP в образцах плазмы крови посредством ELISA (статистическую значимость определяли посредством критерия Манна-Уитни). (B) Развитие артрита оценивали ежемесячно посредством визуальной оценки. (C) Экспрессию IFN-регулируемых генов в цельной крови измеряли с помощью панели qPCR после 3 месяцев лечения, и вычисляли оценку IFN генетической сигнатуры (см. подробности, касающиеся вычисления IFN оценки, в разделе про фармакологические материалы и способы). (D) Полный список из 21 гена, подвергающегося значительной повышающей регуляции посредством лечения пристаном в сравнении с PBS контролями, и отдельные гены, которые значительно снижали с помощью ER-892887 (критерий Стьюдента).
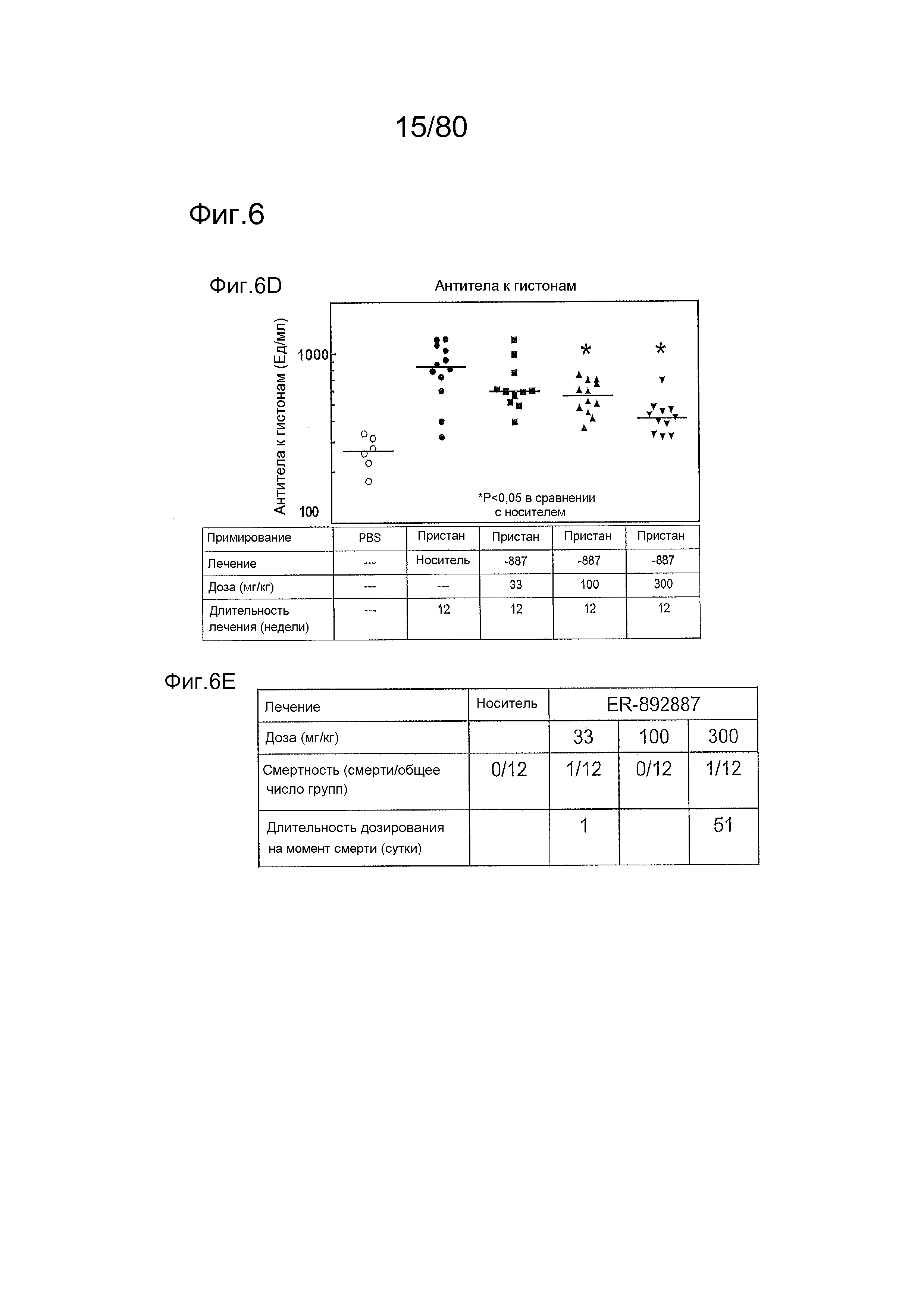
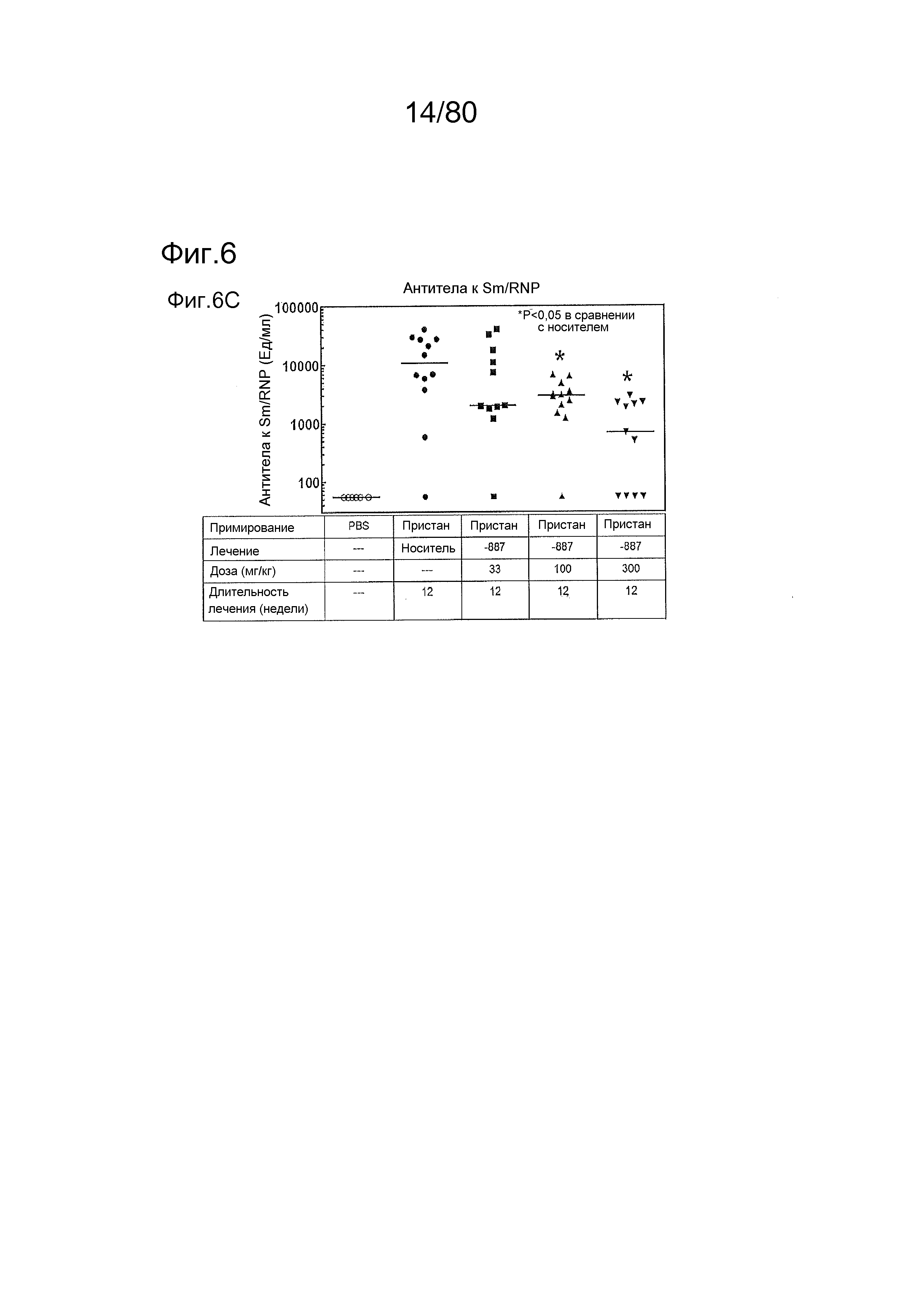
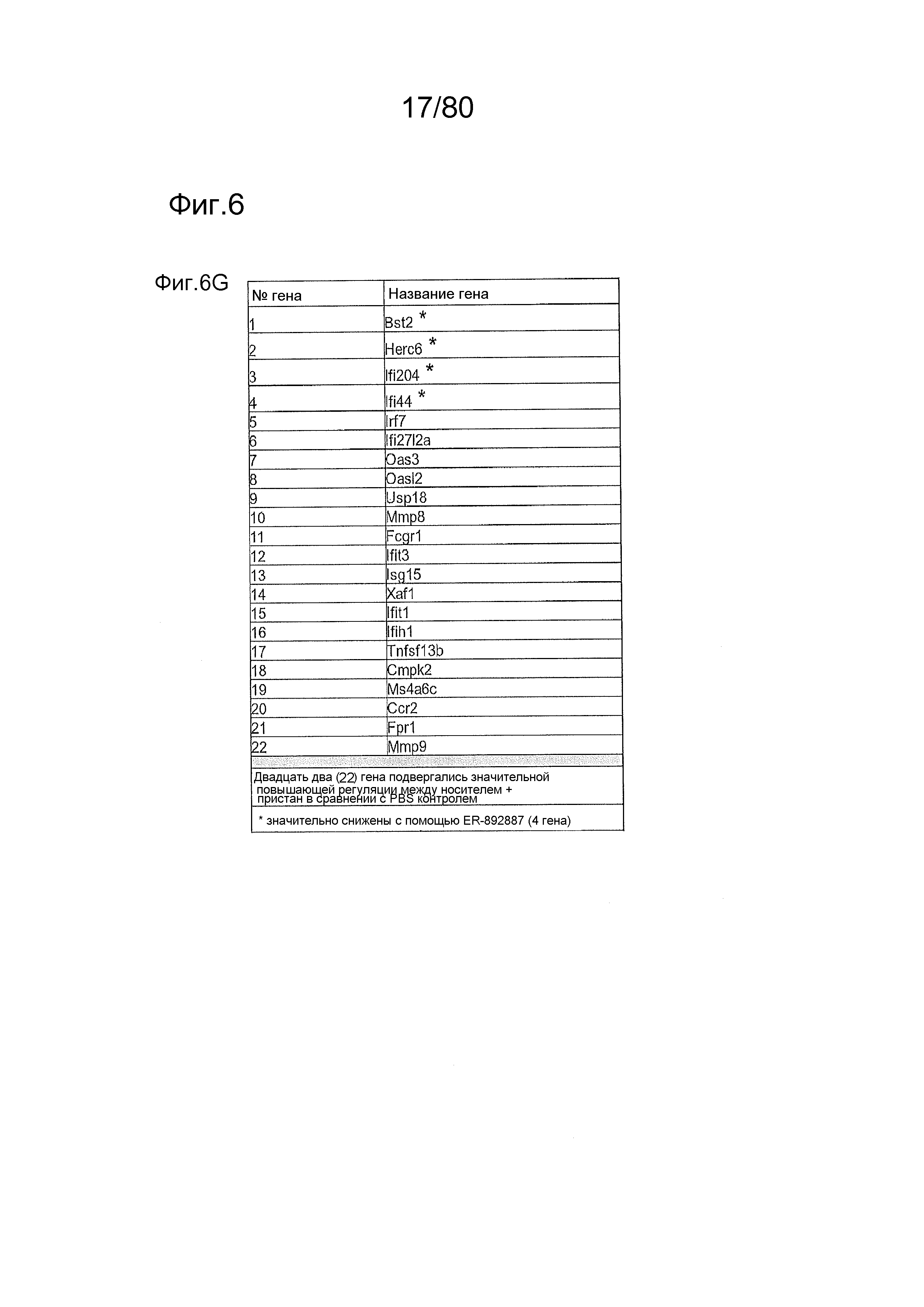
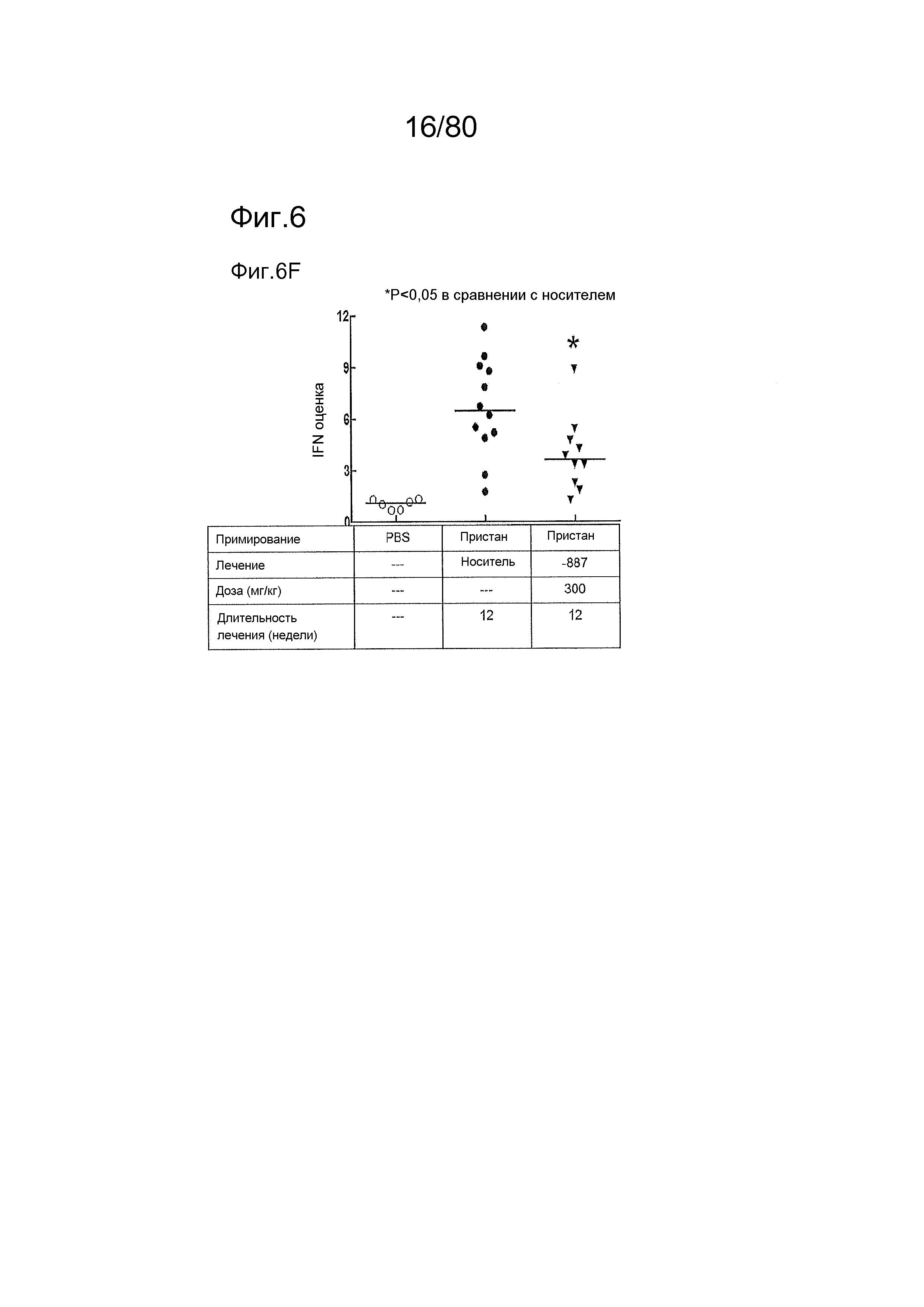
[0051] На фиг. 6 представлены результаты дополнительного тестирования соединения ER-892887 в пристане: модель заболевания волчанкой на линии DBA/1. Условные обозначения на фигуре: самкам мышей DBA/1 в возрасте 11-12 недель вводили интраперитонеально инъекцию 0,5 мл пристана или PBS. Раз в сутки пероральное дозирование с использованием наполнителя (Veh; 0,5% метилцеллюлоза) или 33, 100 или 300 мг/кг ER-892887 начинали через 2 месяца после инъекции пристана в течение всего 3 месяцев лечения. Мышей умерщвляли после 3 месяцев лечения соединением, и измеряли титры антител к дцДНК (A), RiboP (B), Sm/nRNP (C) и гистонам (D) в образцах плазмы крови посредством ELISA (статистическая значимость, определяемая посредством критерия Манна-Уитни). (E) Сводка по смертности, наблюдаемой в этом исследовании во время 3 месяцев лечения соединением. (F) Экспрессию IFN-регулируемых генов в цельной крови измеряли посредством панели qPCR в последний момент времени для мышей, которых лечили наполнителем и 300 мг/кг ER-892887, и вычисляли оценку IFN генетической сигнатуры (см. подробности, касающиеся вычисления IFN оценки, в разделе про фармакологические материалы и способы). (G) Полный список из 22 генов, подвергающихся значительной повышающей регуляции посредством лечения пристаном в сравнении с PBS контролями, и отдельные гены, которые значительно снижали с помощью ER-892887 (критерий Стьюдента).
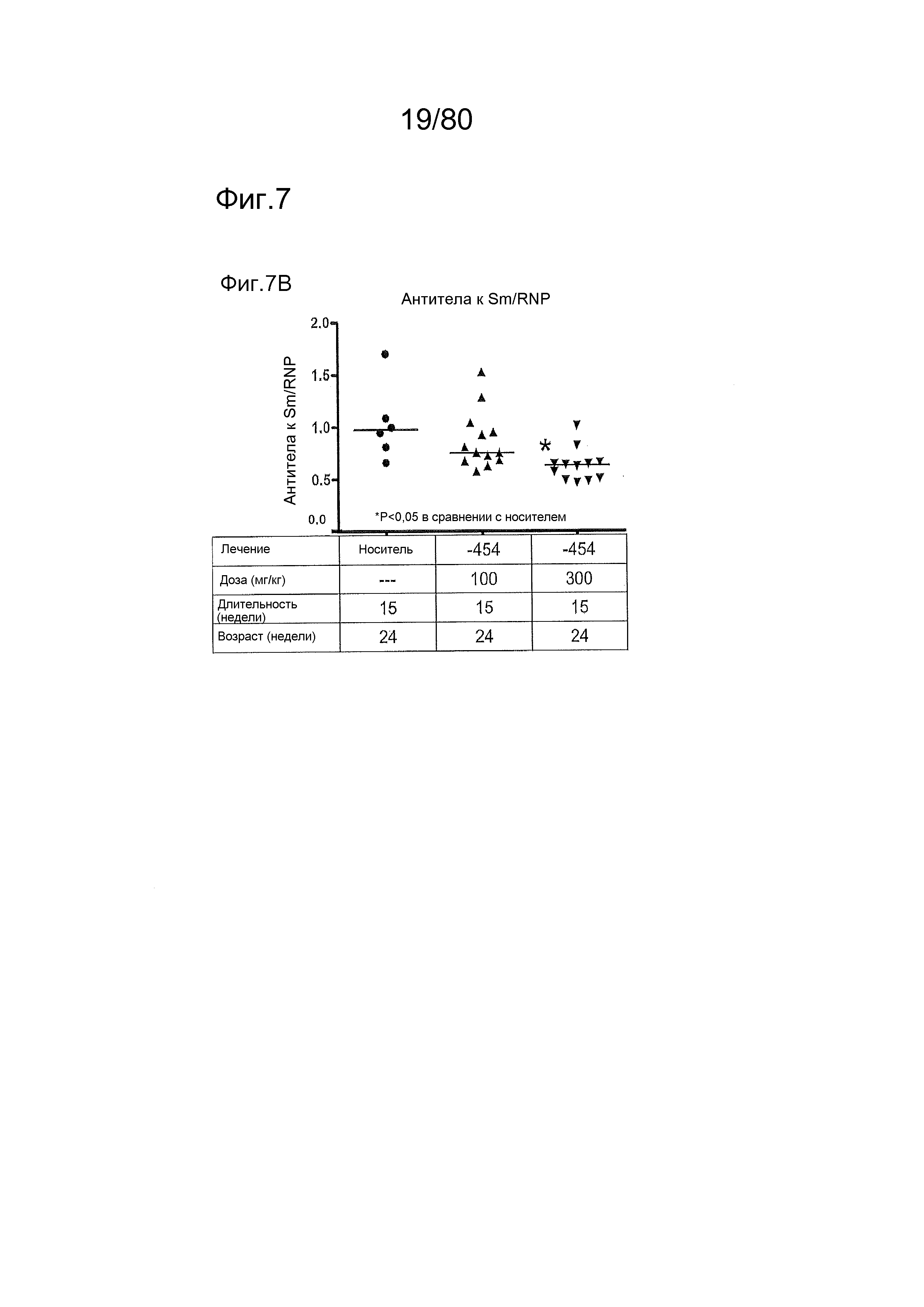
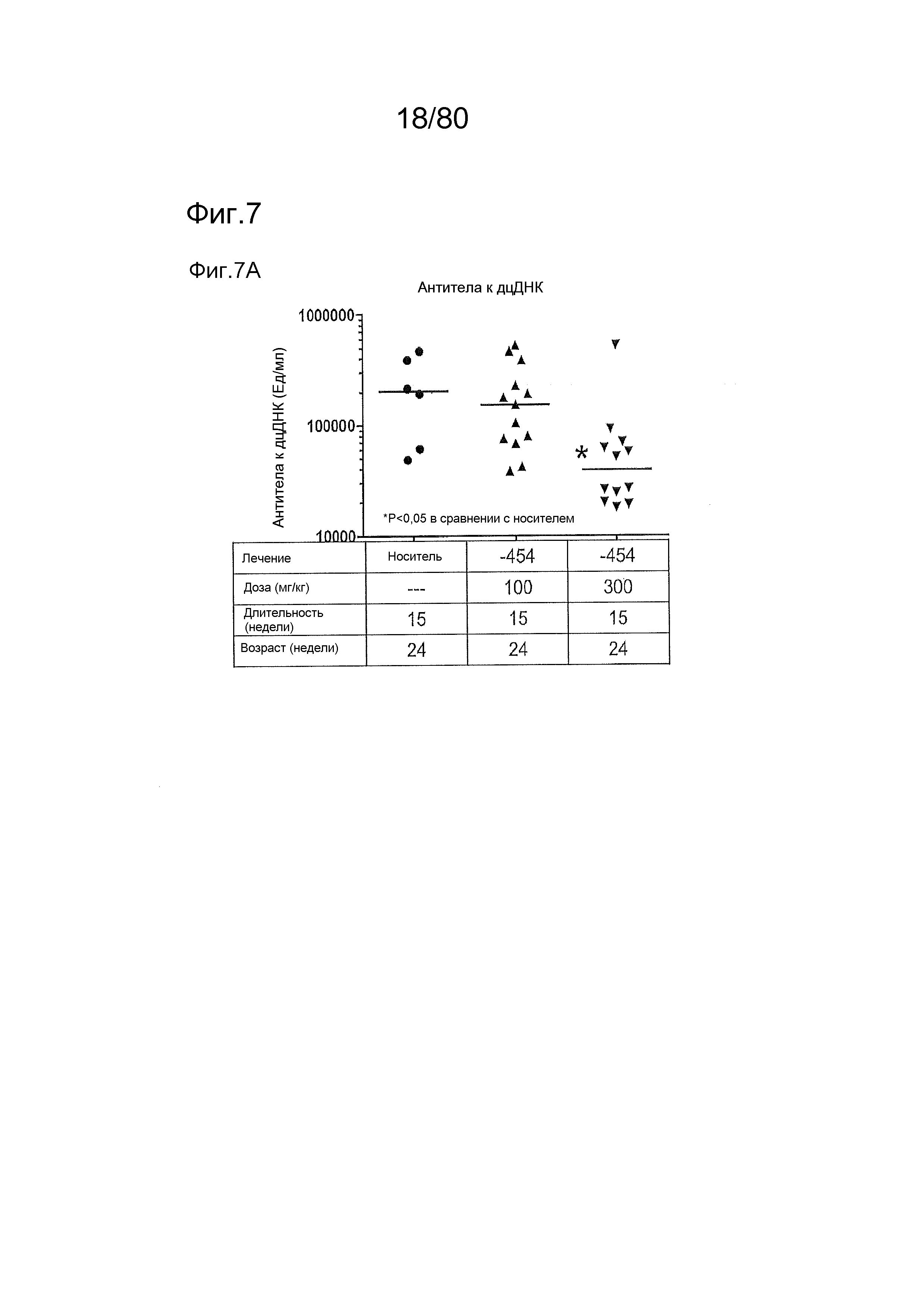
[0052] На фиг. 7 представлены результаты тестирования соединения ER-885454 в модели заболевания волчанкой на линии BXSB-Yaa. Условные обозначения на фигуре: самцов мышей BXSB-Yaa в возрасте девяти недель лечили раз в сутки перорально с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 100 мг/кг или 300 мг/кг ER-885454 в течение всего 15 недель. Всех мышей умерщвляли в возрасте 24 недели, и конечные титры антител к дцДНК (A) и антител к Sm/RNP (B) оценивали посредством ELISA. (C) Приблизительно за одну неделю до умерщвления, мышей содержали по 1-2 на клетку в метаболических клетках в течение 18 часов для того, чтобы собирать мочу, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного в качестве опосредованной меры функции почек. (D) В момент умерщвления почки собирали у отдельных мышей, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. Статистическую значимость определяли посредством критерия Манна-Уитни для (A), (B) и (C), выше.
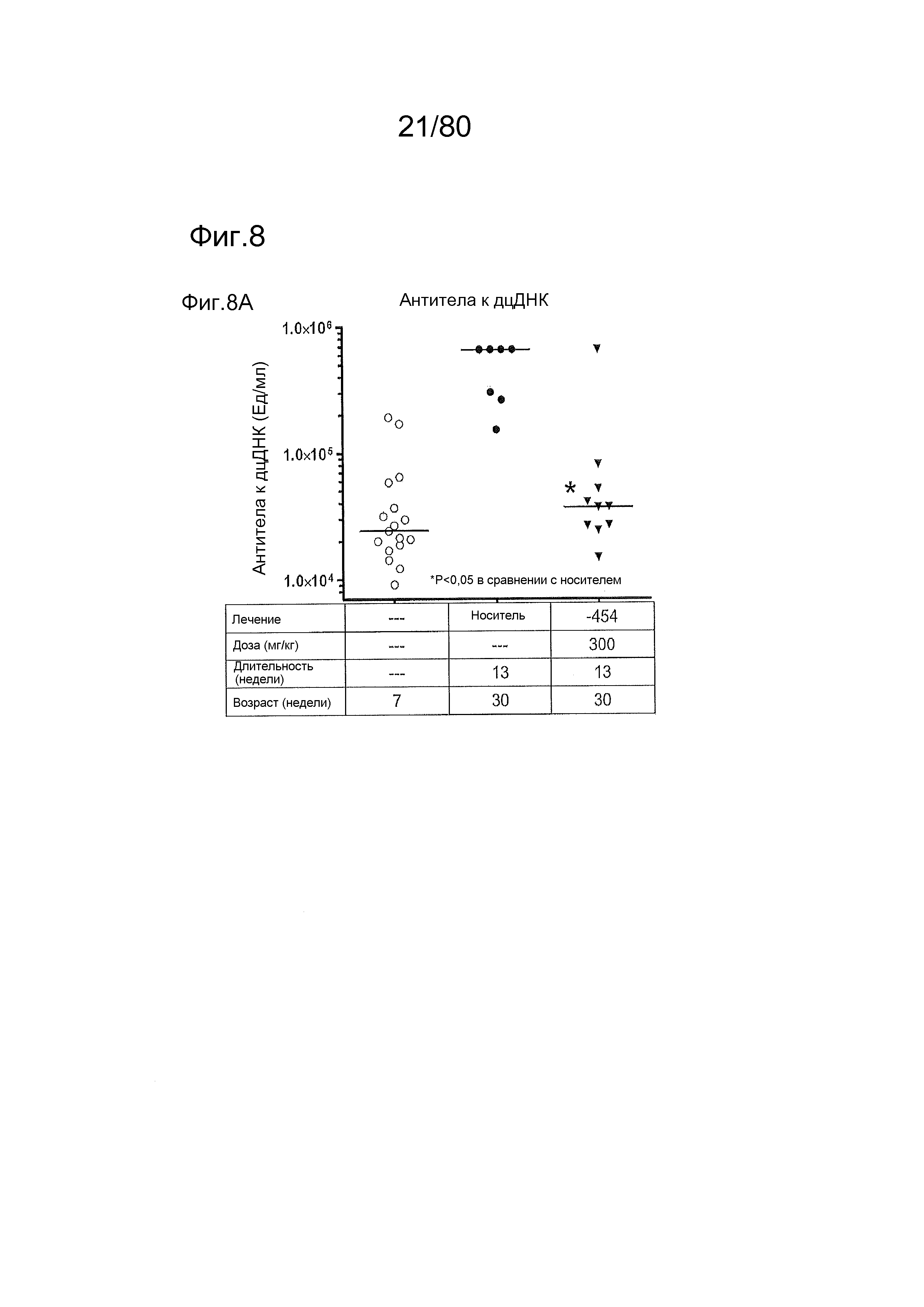
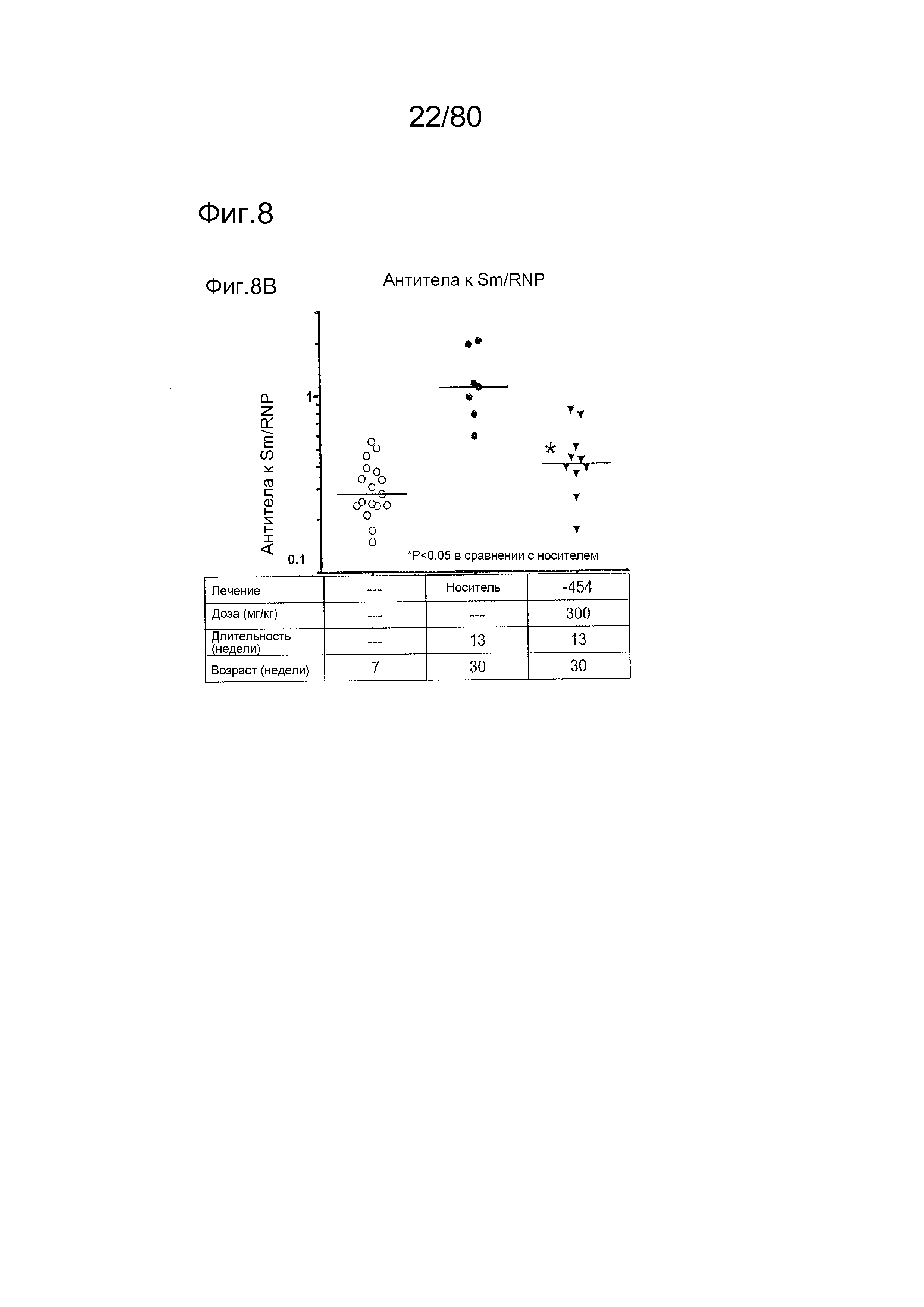
[0053] На фиг. 8 представлены результаты дополнительного тестирования соединения ER-885454 в модели заболевания волчанкой на линии BXSB-Yaa. Условные обозначения на фигуре: мышей BXSB-Yaa в возрасте семнадцать недель рандомизировали в две группы с эквивалентными медианными титрами антител к дцДНК и лечили раз в сутки перорально с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-885454 в течение всего 13 недель. Всех мышей умерщвляли в возрасте 30 недель, и оценивали конечные титры антител к дцДНК (A) и антител к Sm/RNP (B) посредством ELISA по сравнению с титрами, наблюдаемыми у мышей в возрасте 7 недель перед заболеванием. (C) Приблизительно за одну неделю до умерщвления мышей содержали по 1-2 на клетку в метаболических клетках в течение 18 часов для того, чтобы собирать мочу, и соотношение альбумина и креатинина в моче (UACR, протеинурия) определяли для каждого животного в качестве опосредованной меры функции почек. (D) В момент умерщвления почки собирали у отдельных мышей, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. Статистическую значимость определяли посредством критерия Манна-Уитни для (A), (B) и (C), выше.
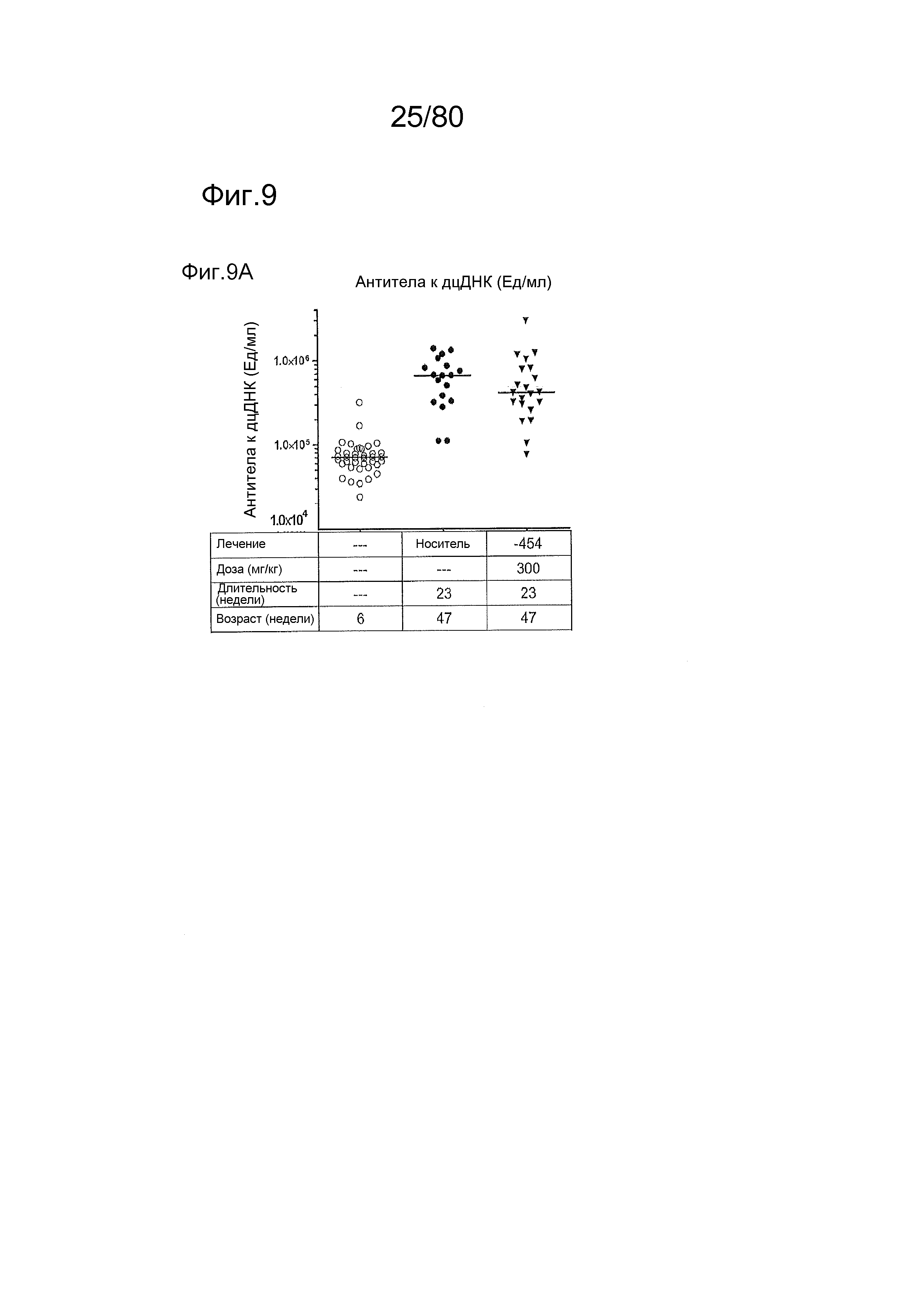
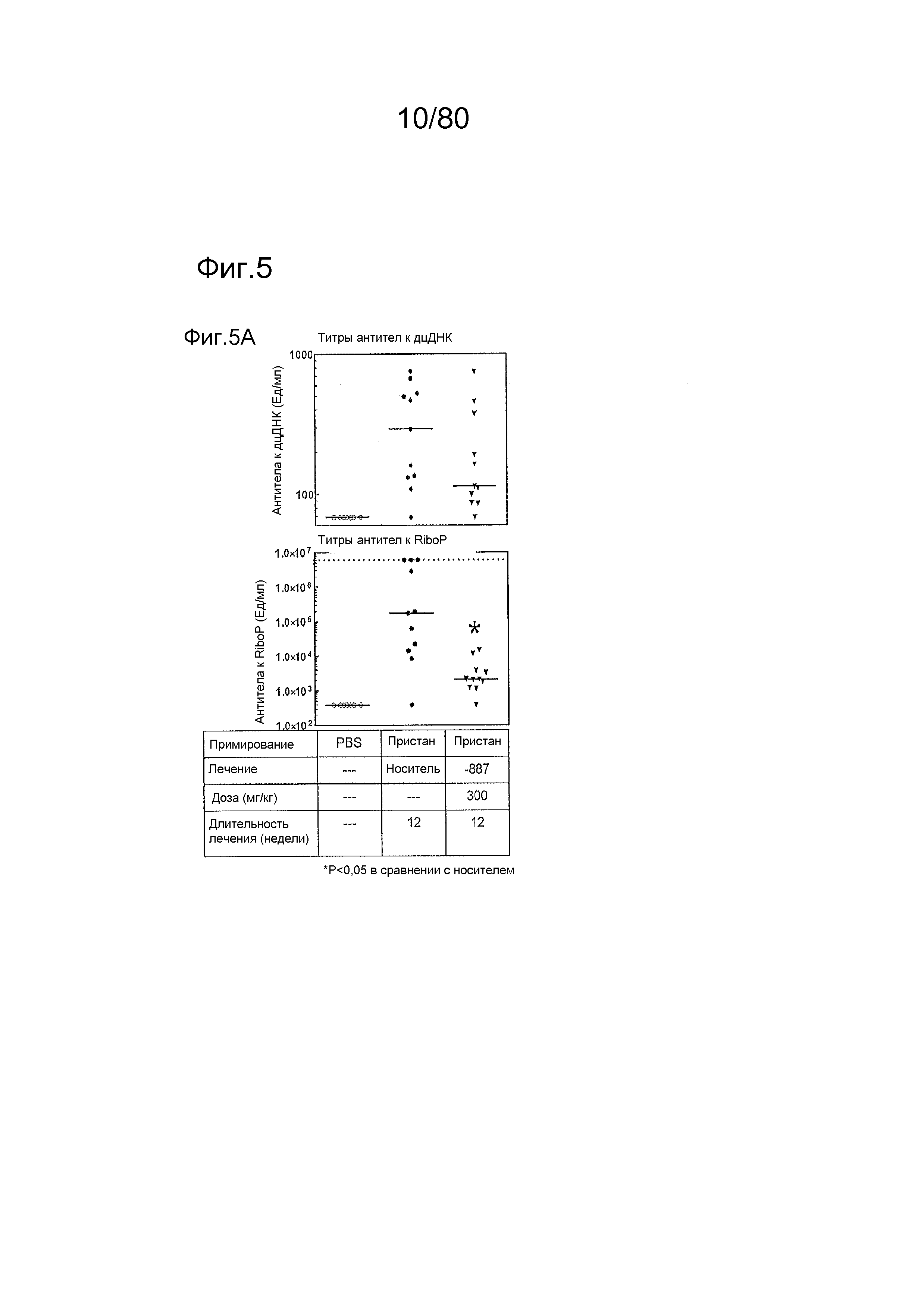
[0054] На фиг. 9 представлены результаты тестирования соединения ER-885454 в модели заболевания волчанкой на линии NZBxNZW. Условные обозначения на фигуре: получали самок мышей NZBWF1/J в возрасте 6 недель, получали кровь для определения базовых уровней, и у мышей осуществляли мониторинг прогрессирования заболевания, следя за титрами антител к дцДНК. В возрасте 24 недели мышей рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-885454 раз в сутки перорально (QD PO). Всех мышей умерщвляли в возрасте 47 недель (всего 23 недели лечения), и определяли титры антител к дцДНК в плазме крови посредством ELISA (A). (B) Прямо перед окончанием в возрасте 47 недель мочу собирали у отдельных мышей, и соотношение альбумина и креатинина в моче (UACR, протеинурия) определяли для каждого животного в качестве опосредованной меры функции почек. (C) В момент умерщвления почки собирали у отдельных мышей, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. Статистическую значимость определяли посредством критерия Манна-Уитни для (A), выше.
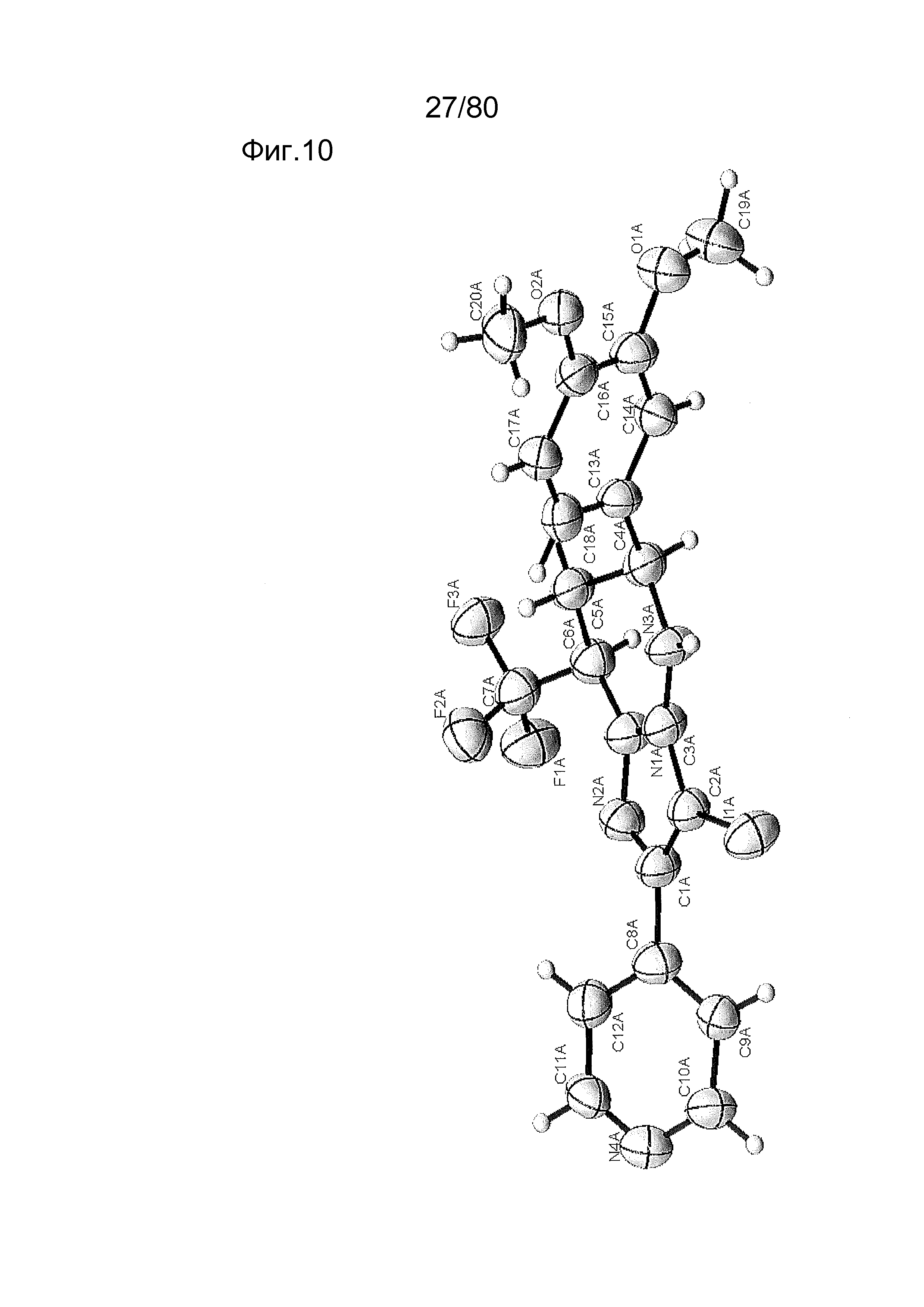
[0055] На фиг. 10 приведено ORTEP представление рентгеновской структуры соединения ER-887006.
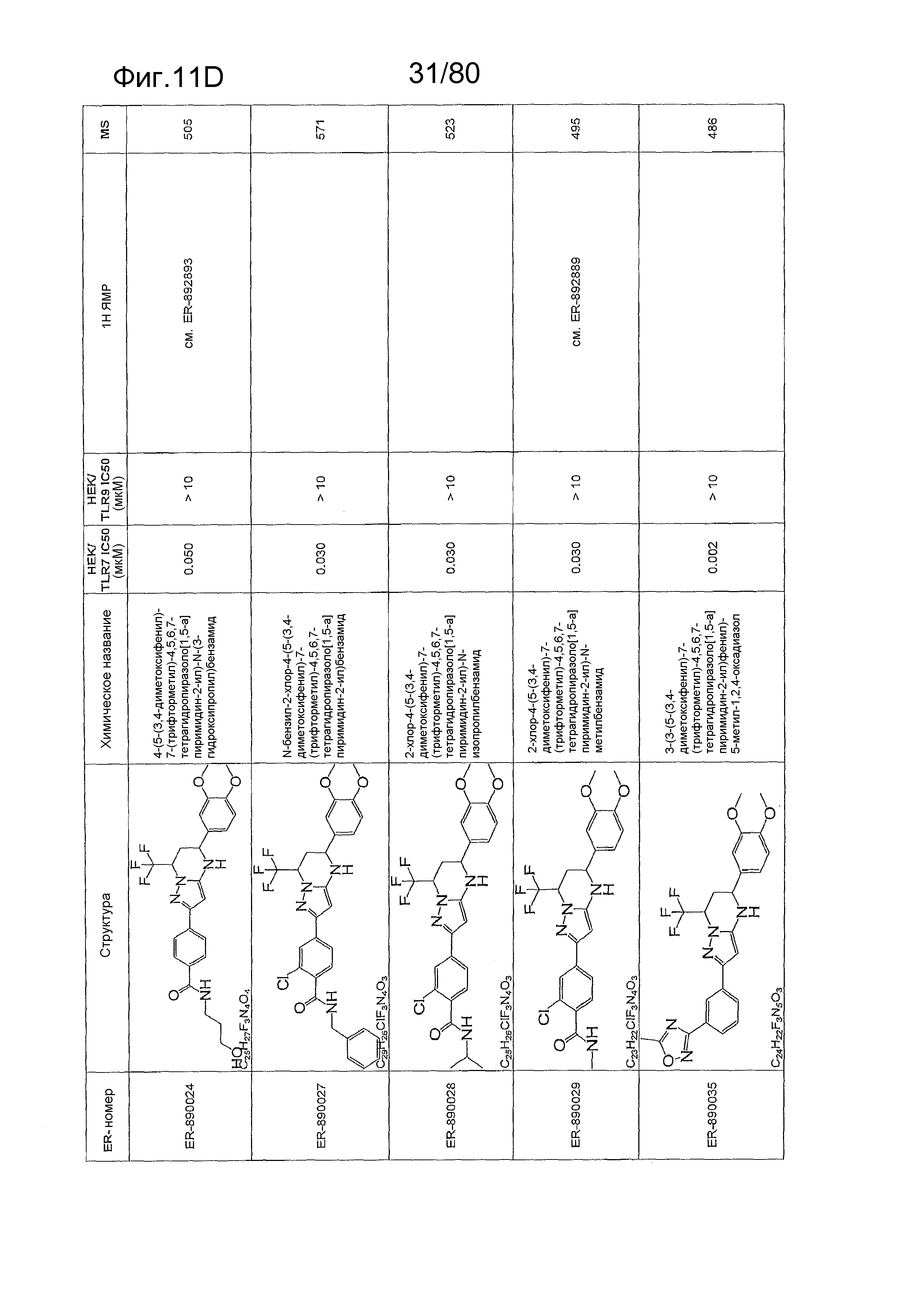
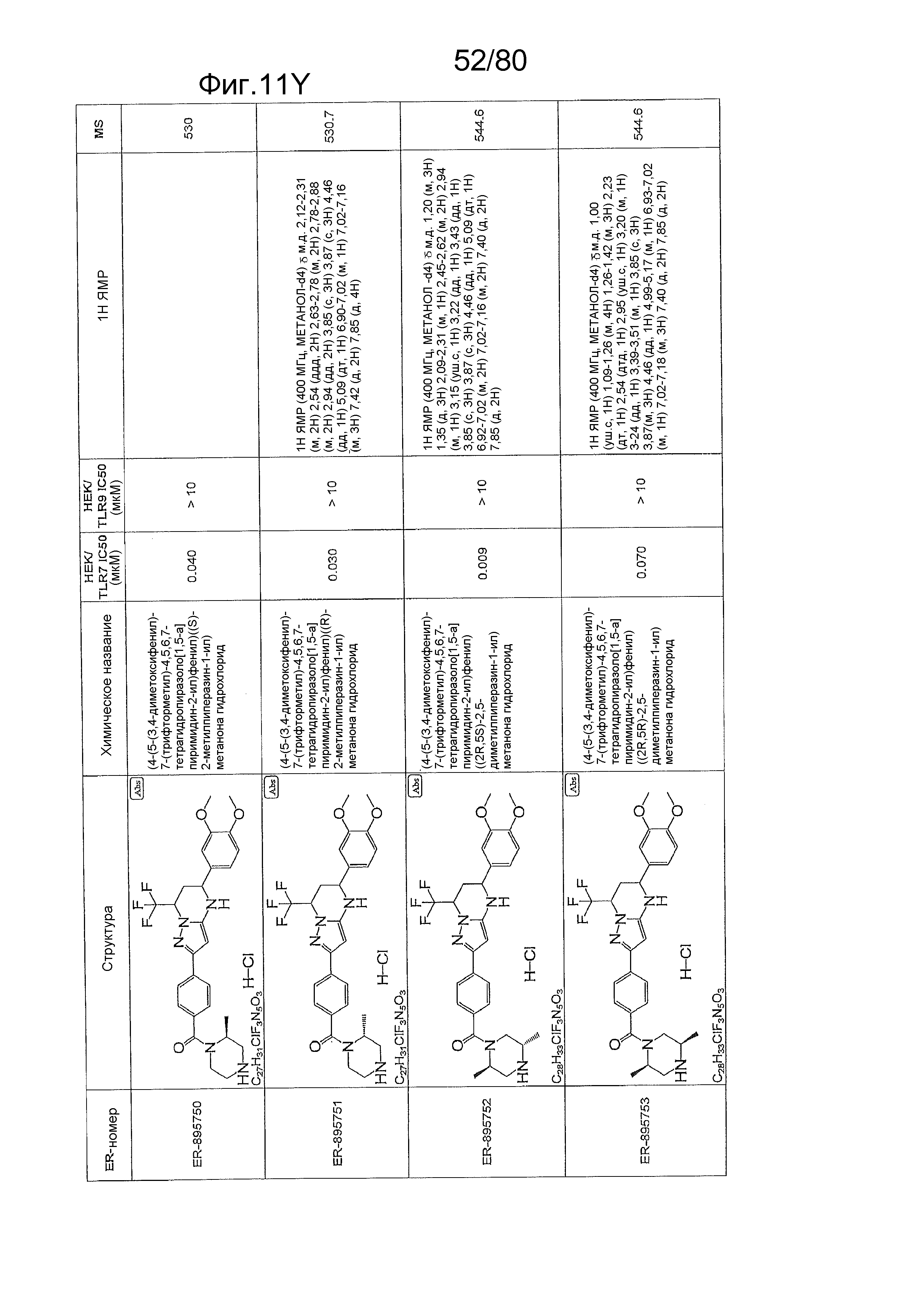
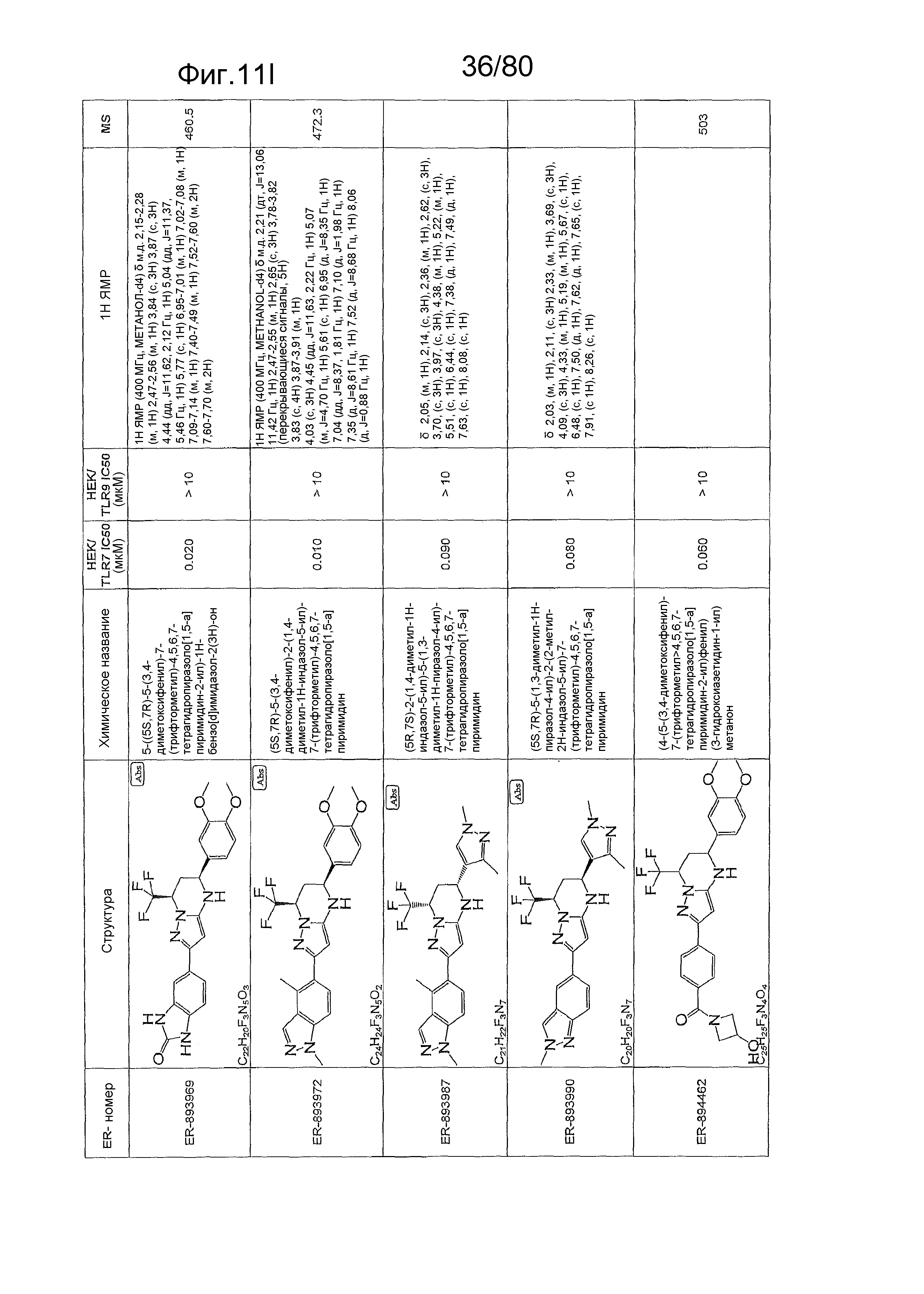
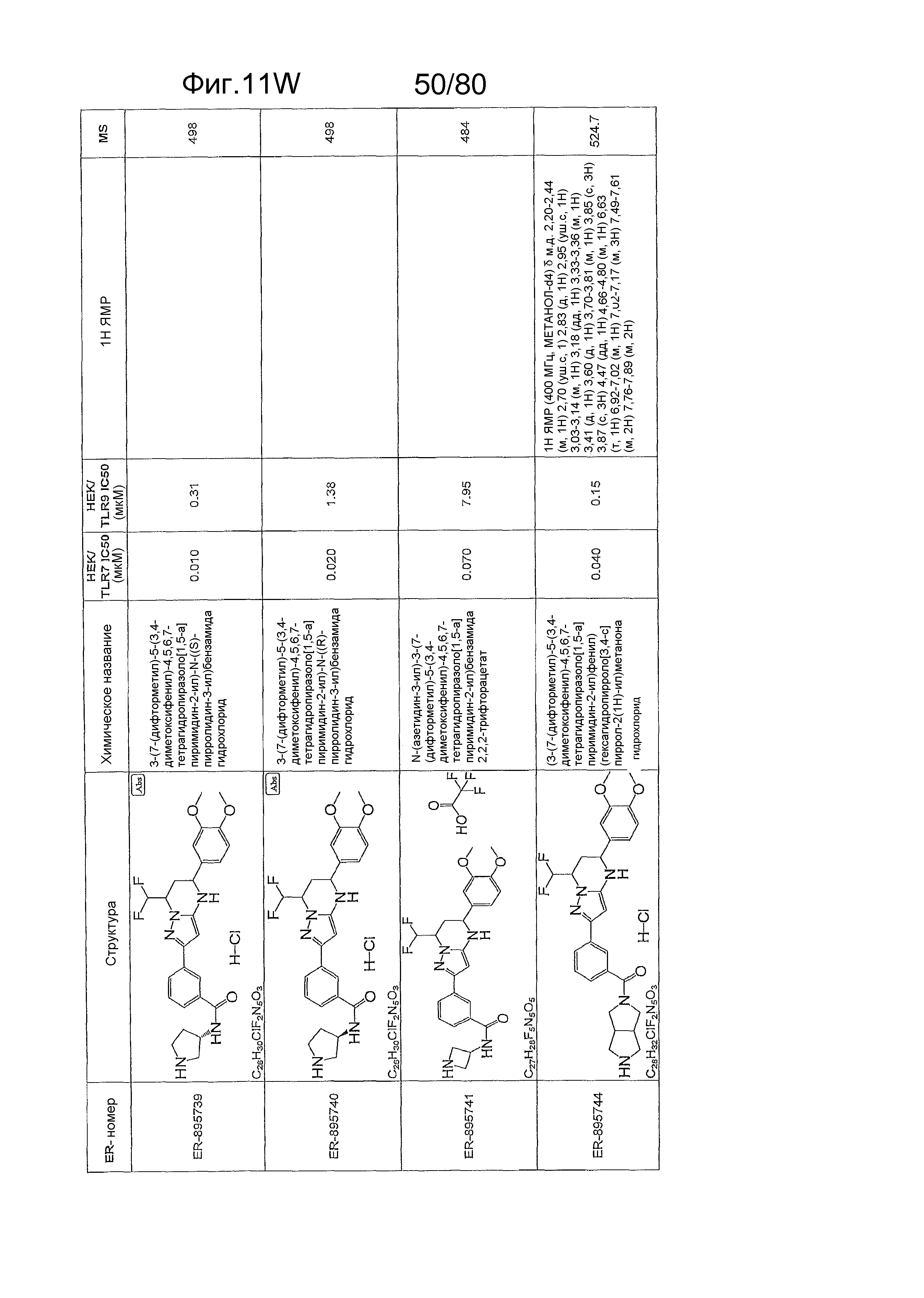
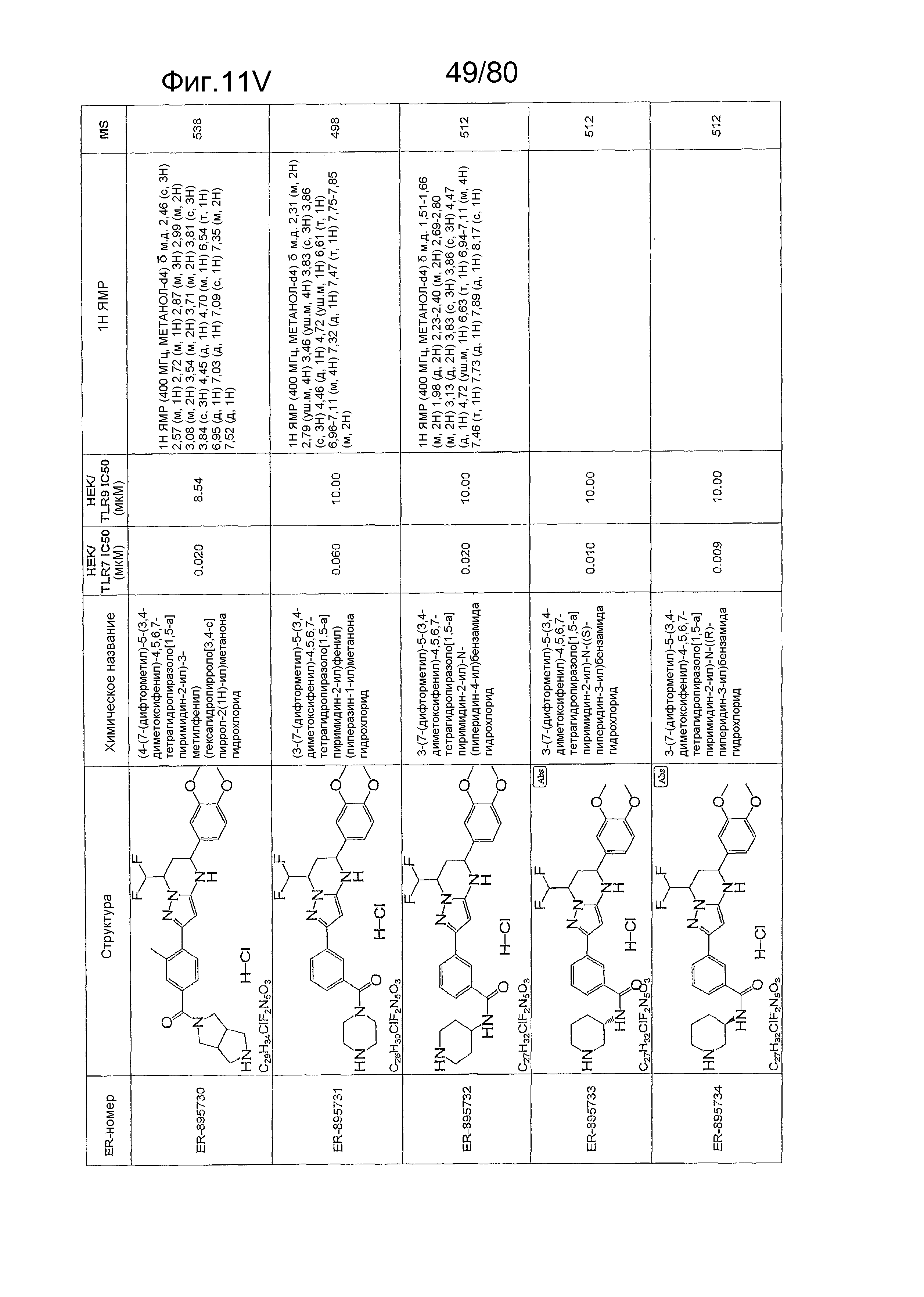
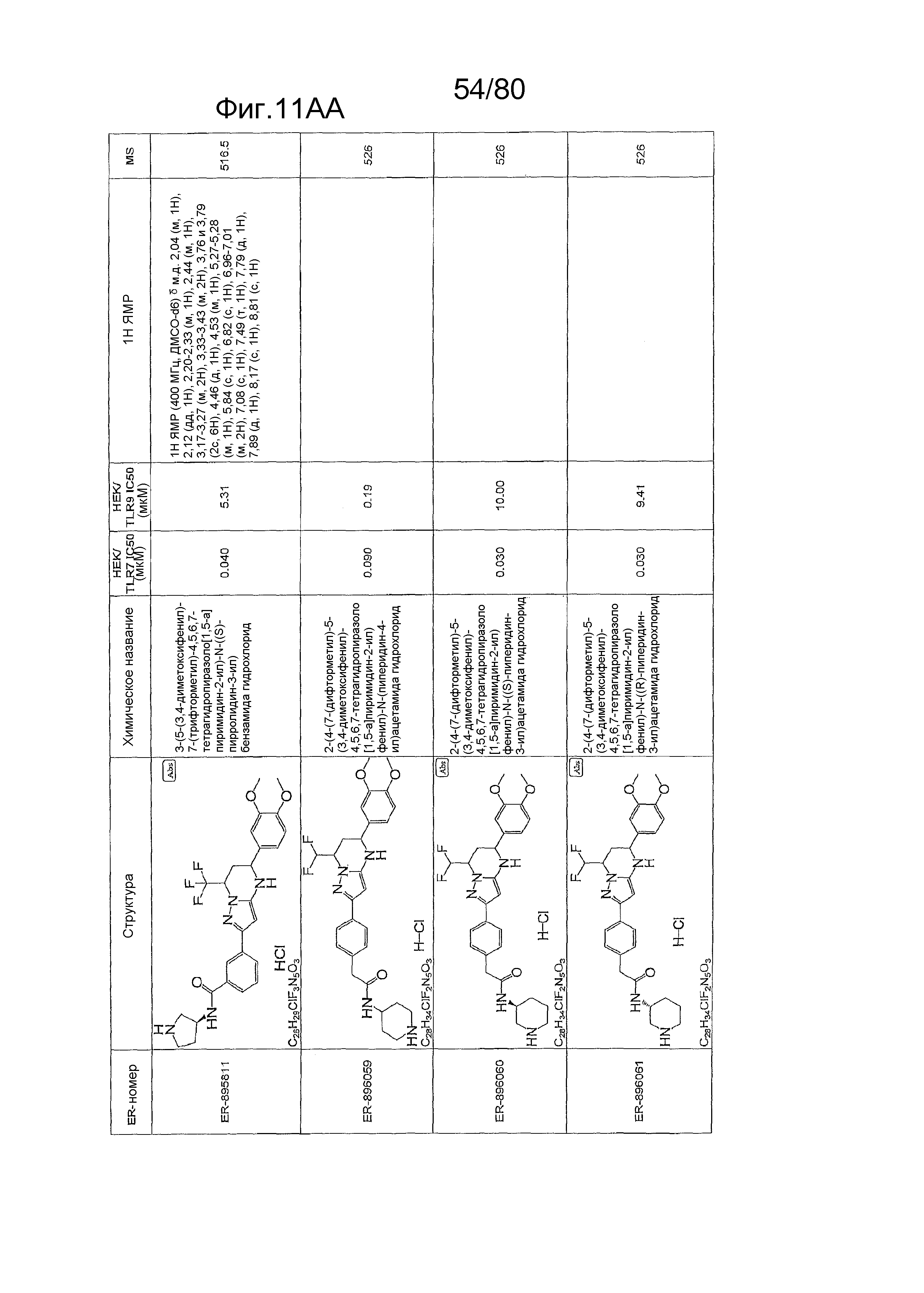
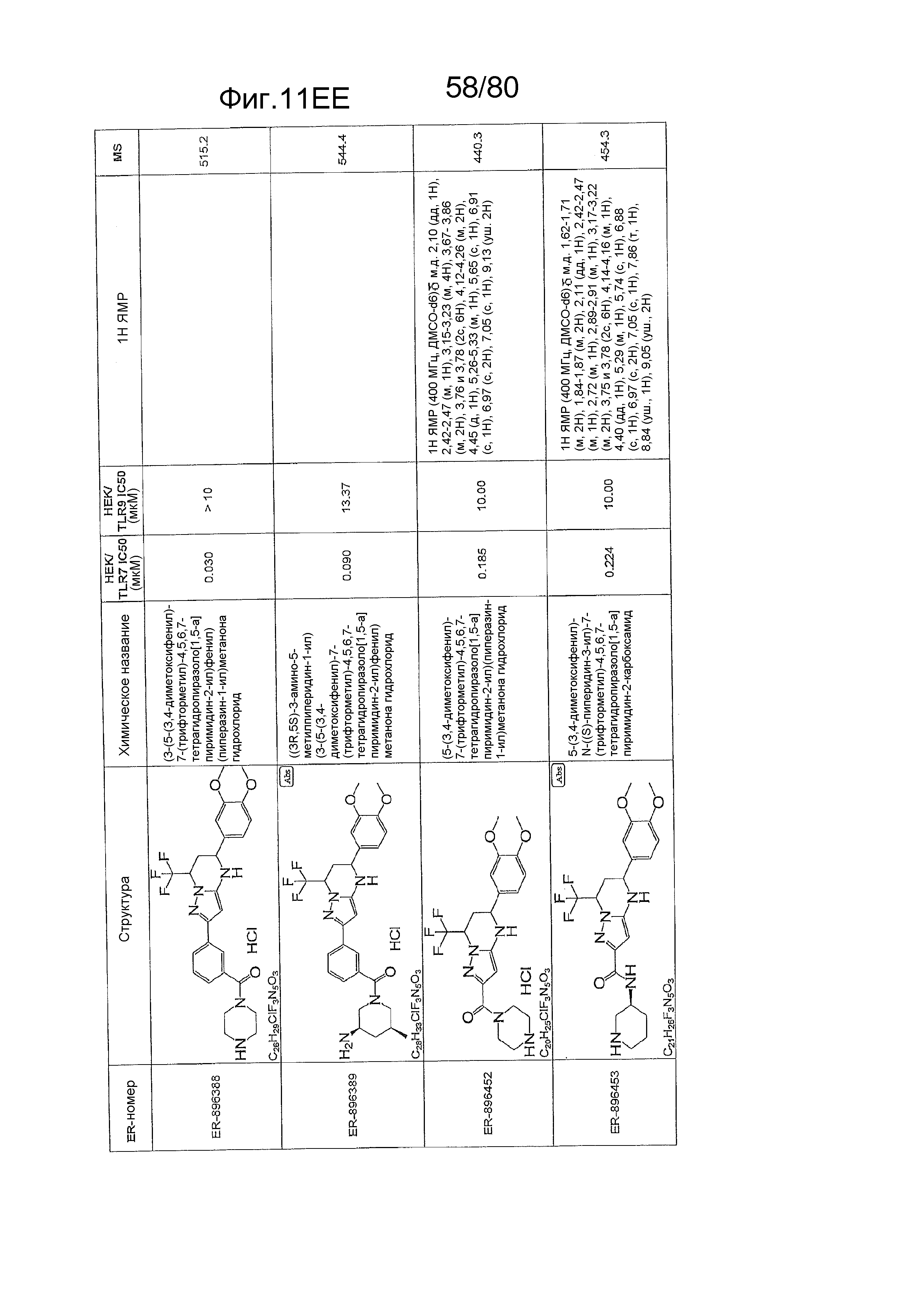
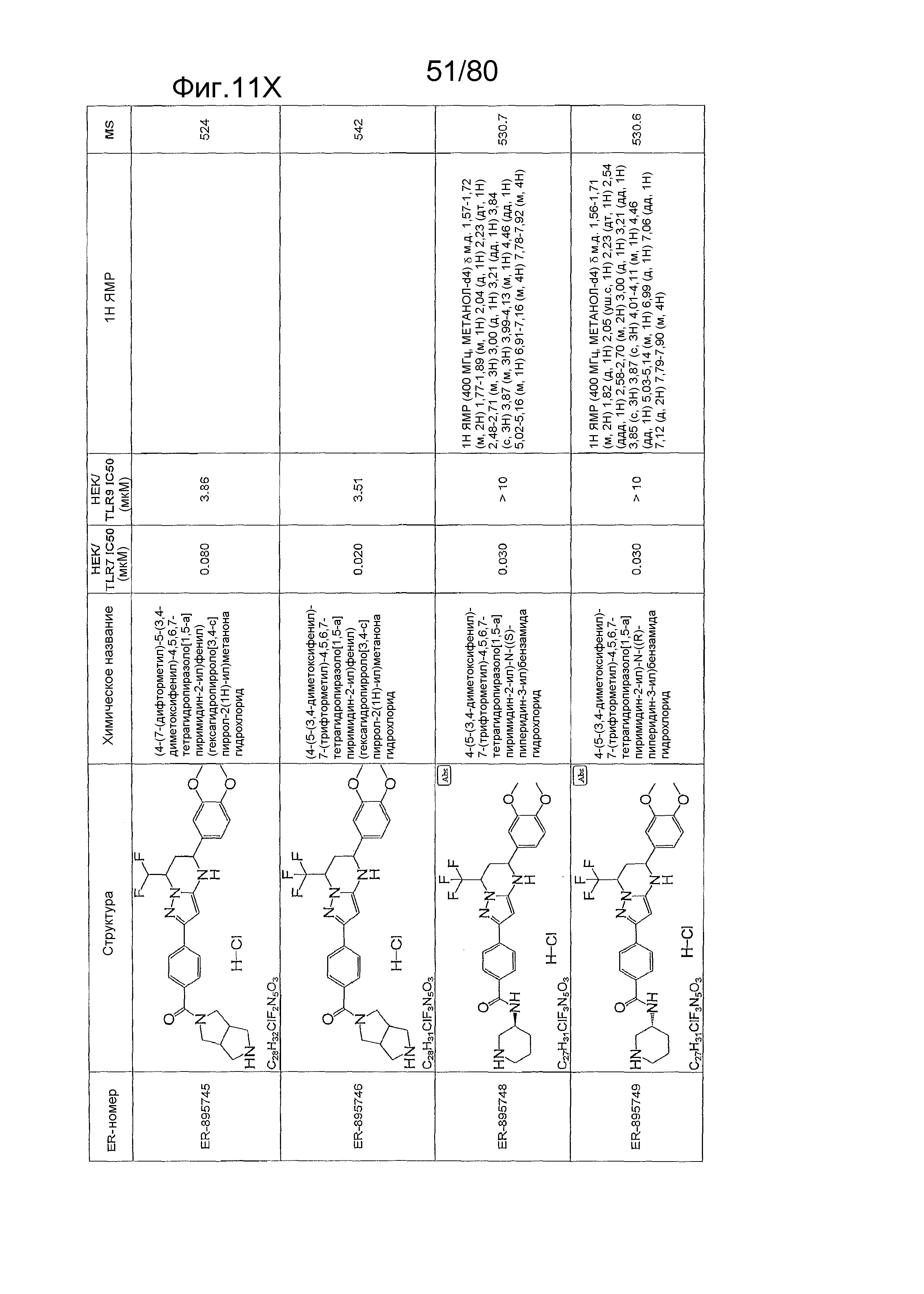
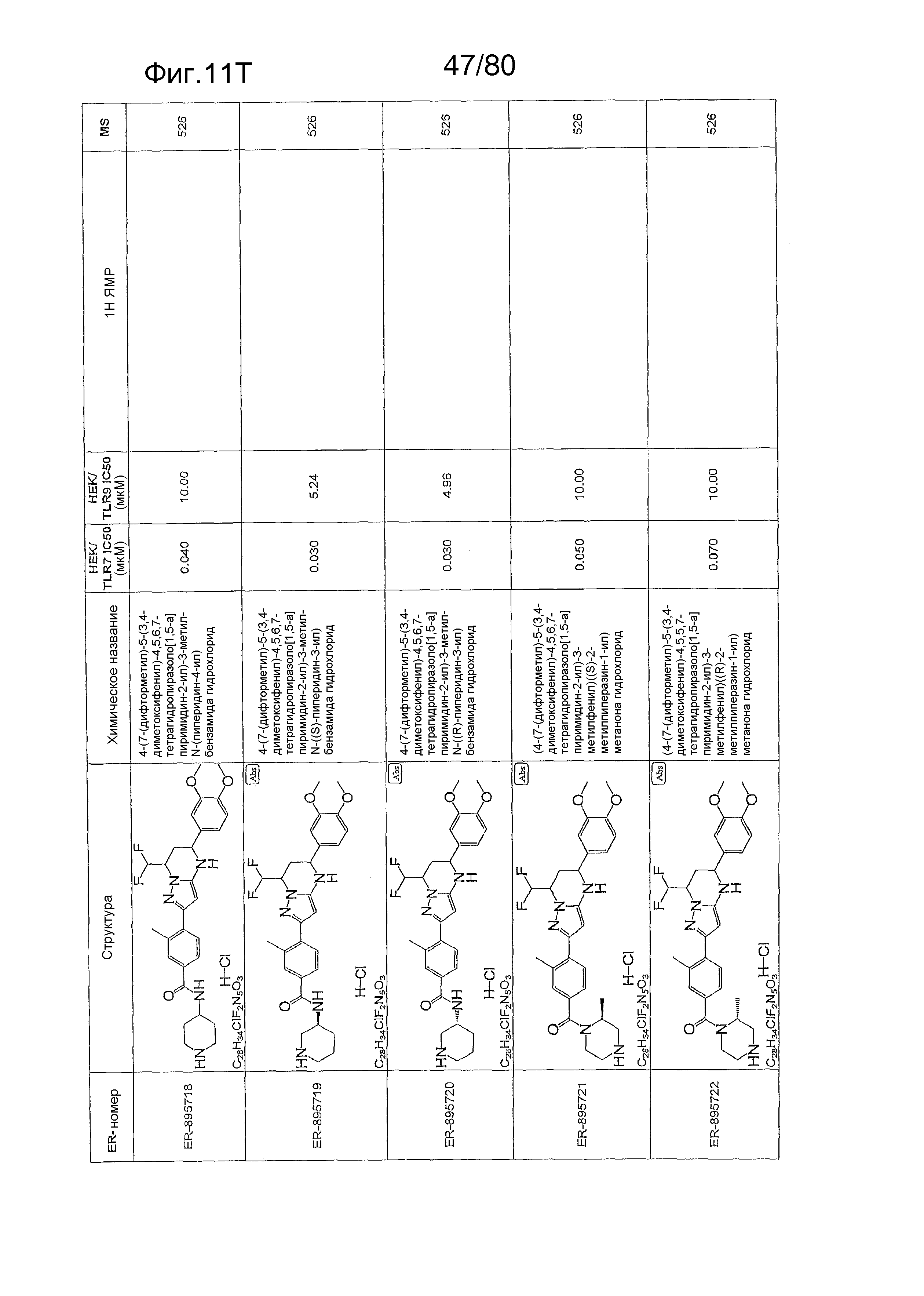
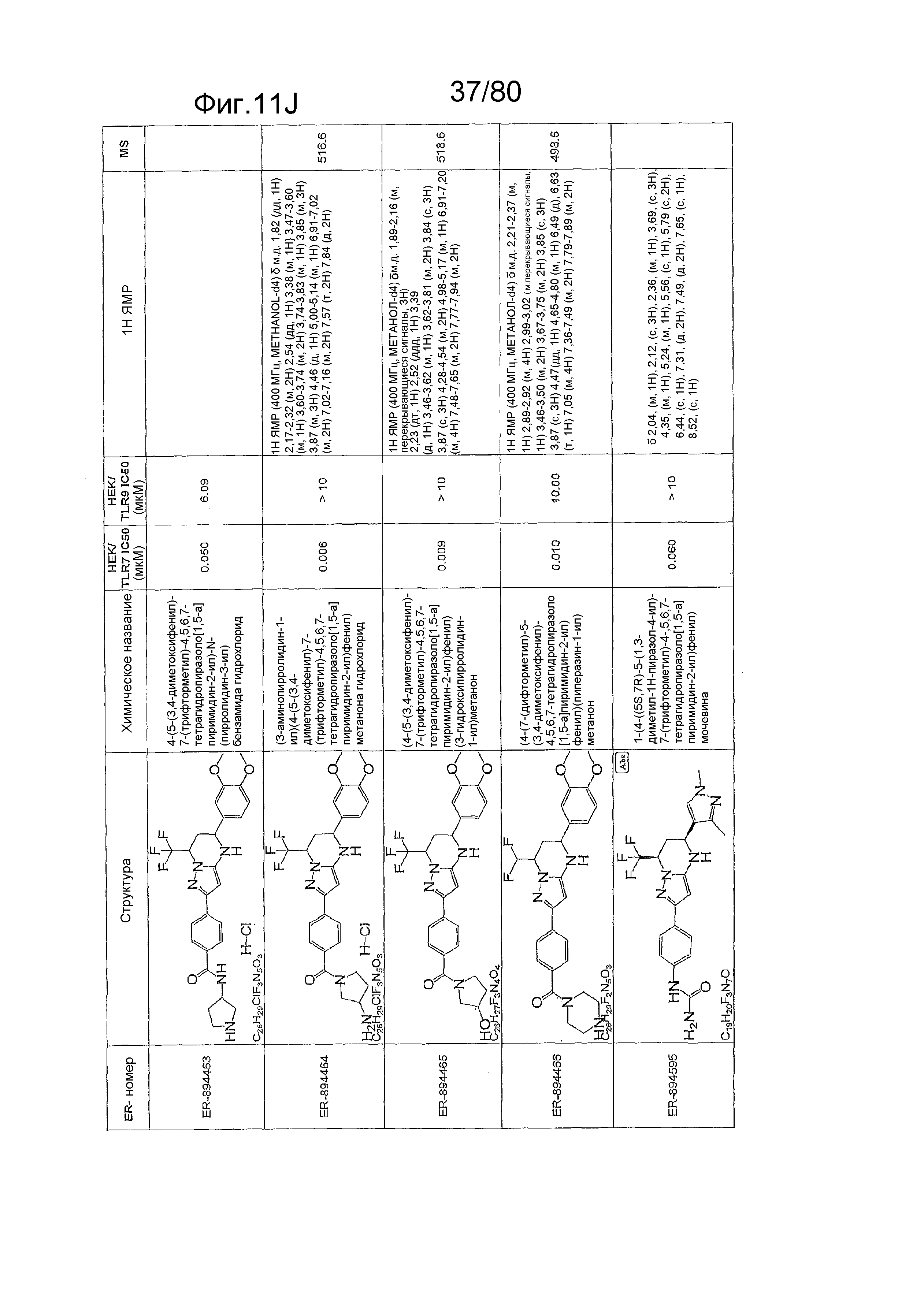
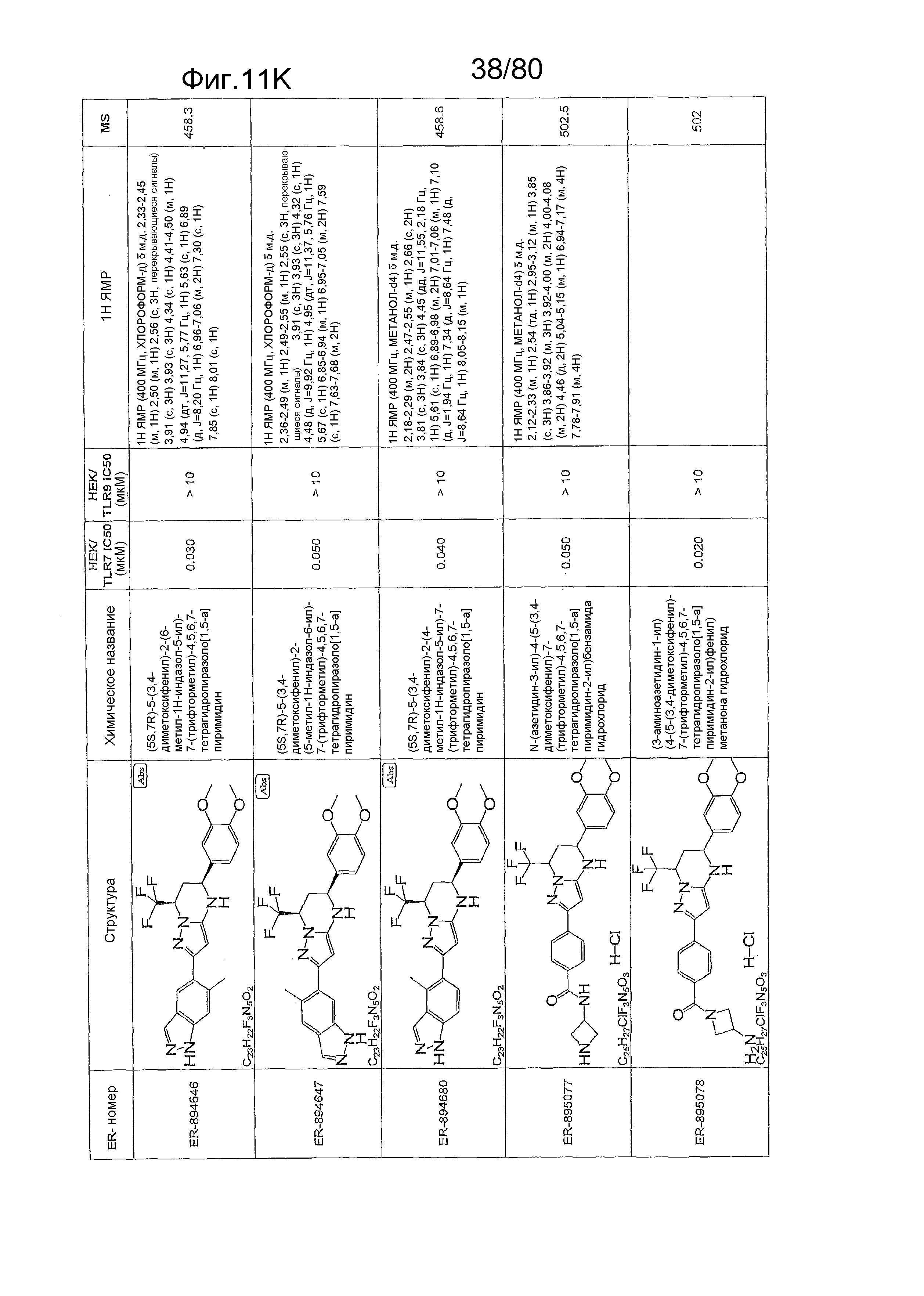
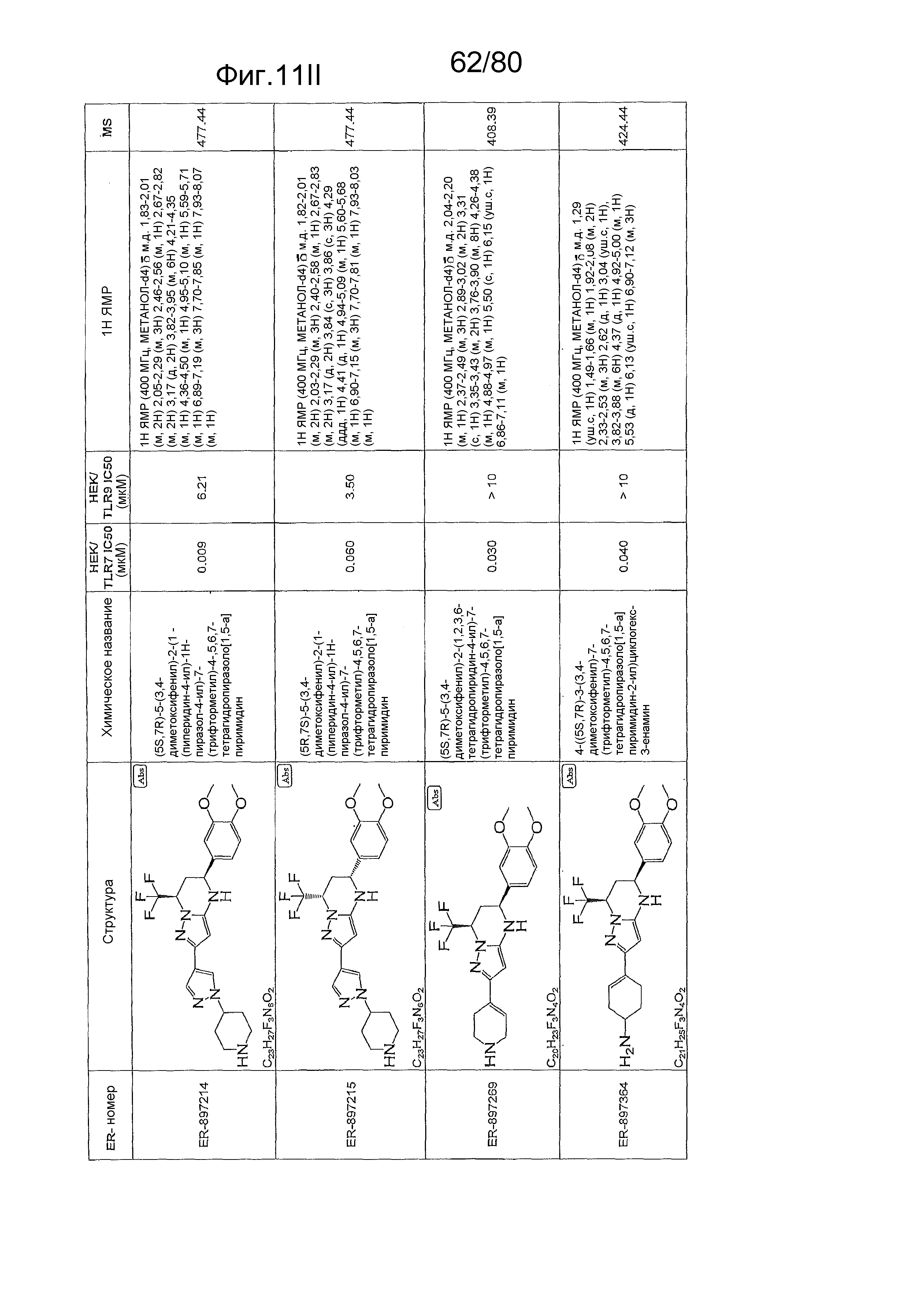
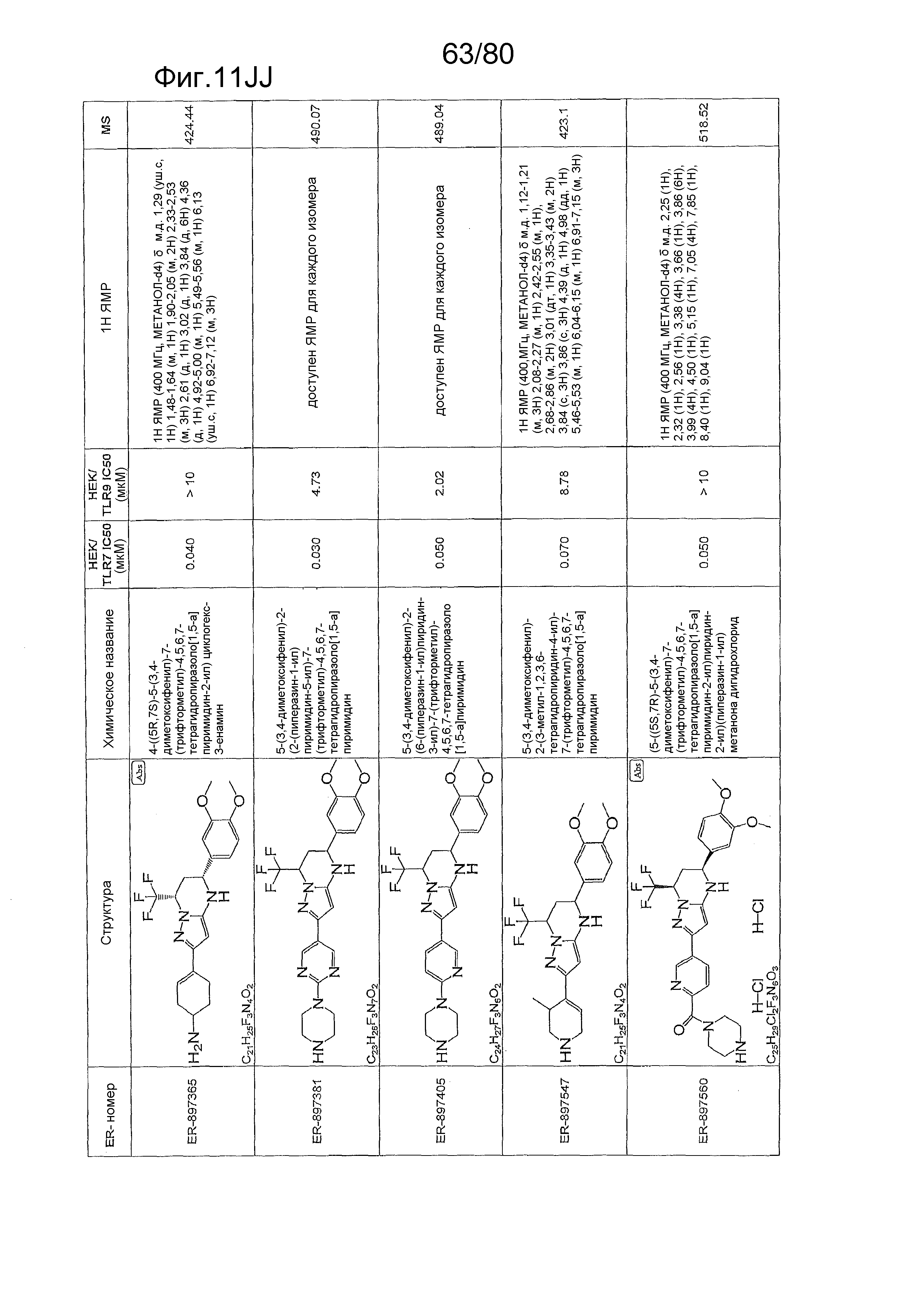
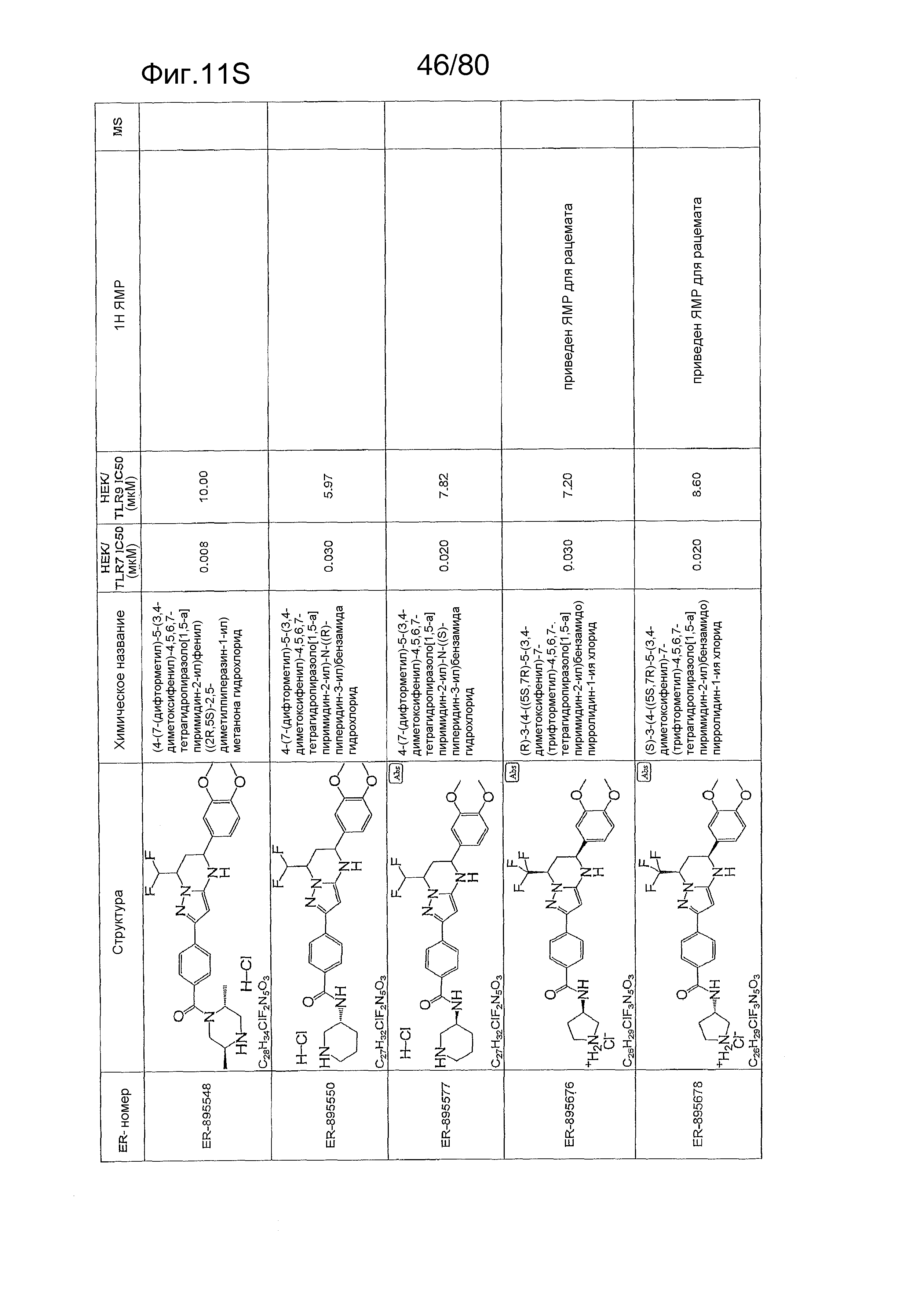
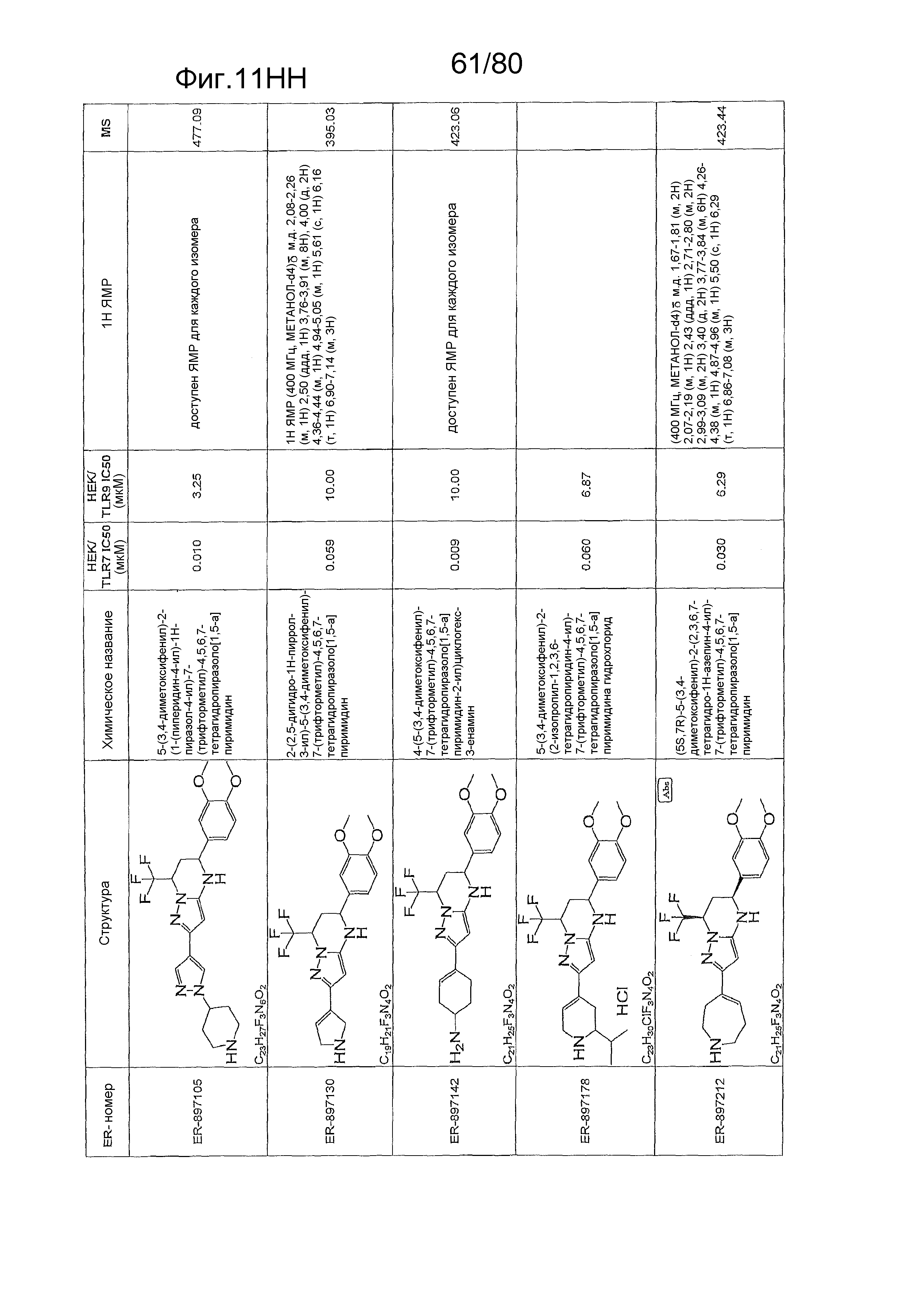
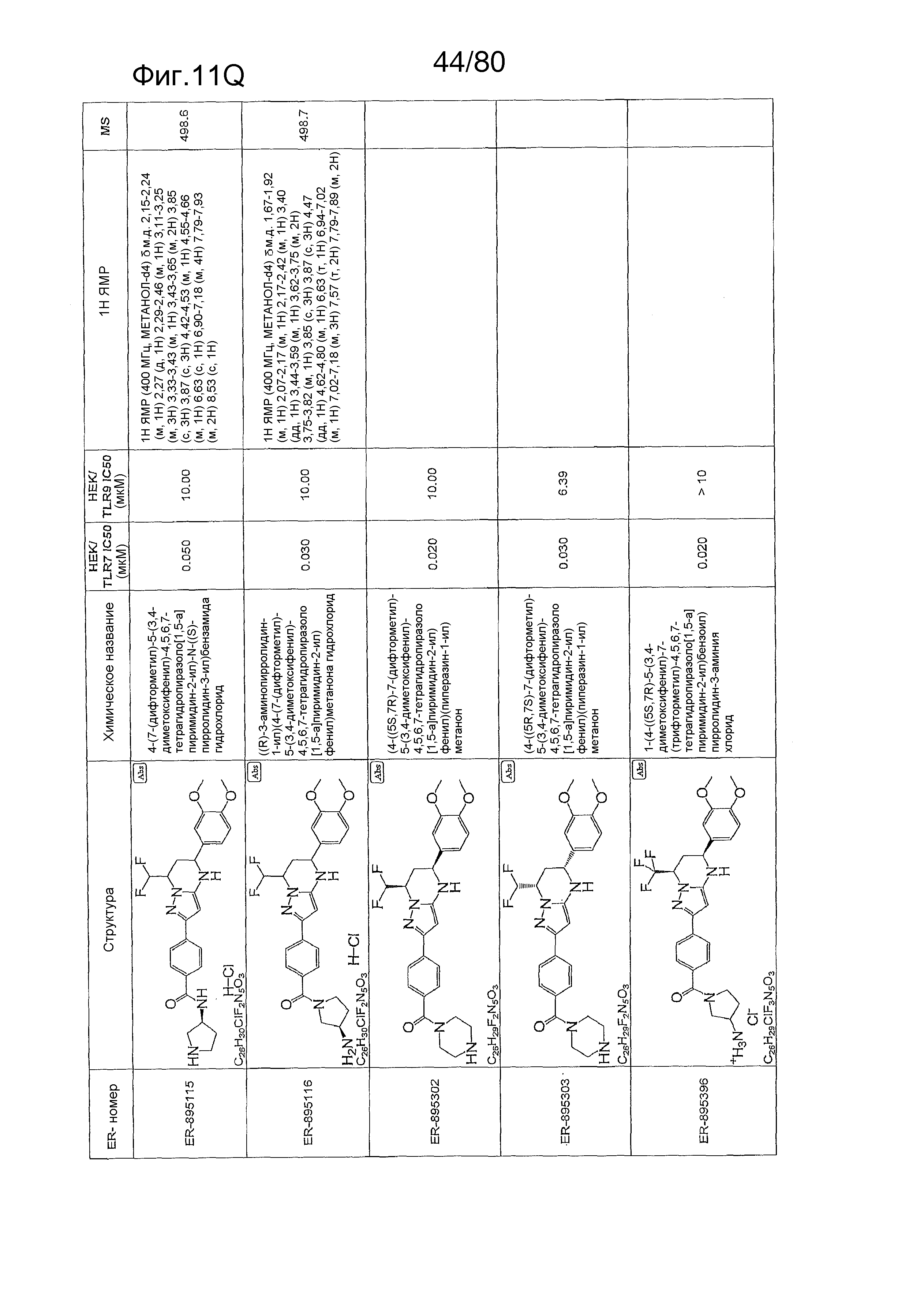
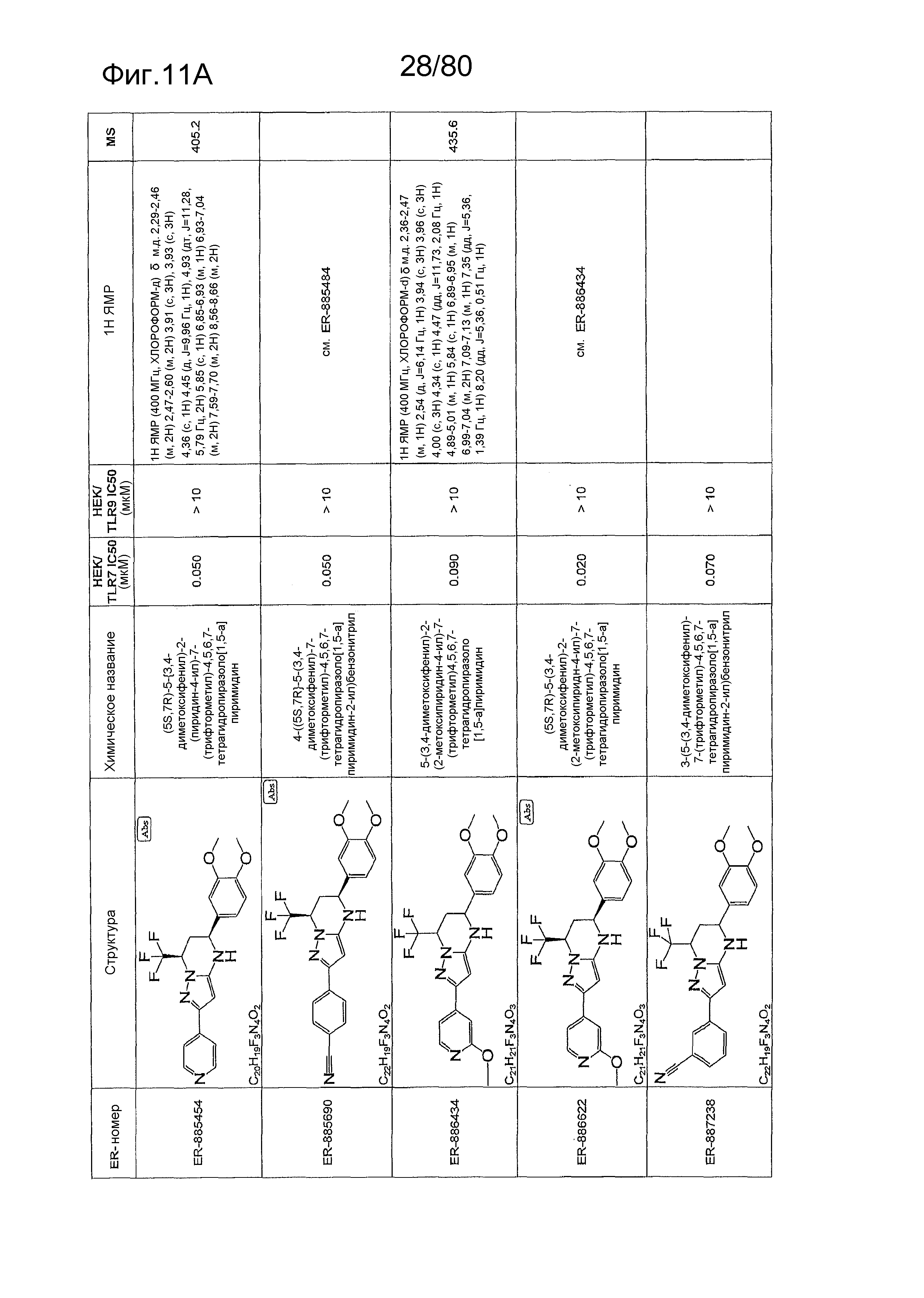
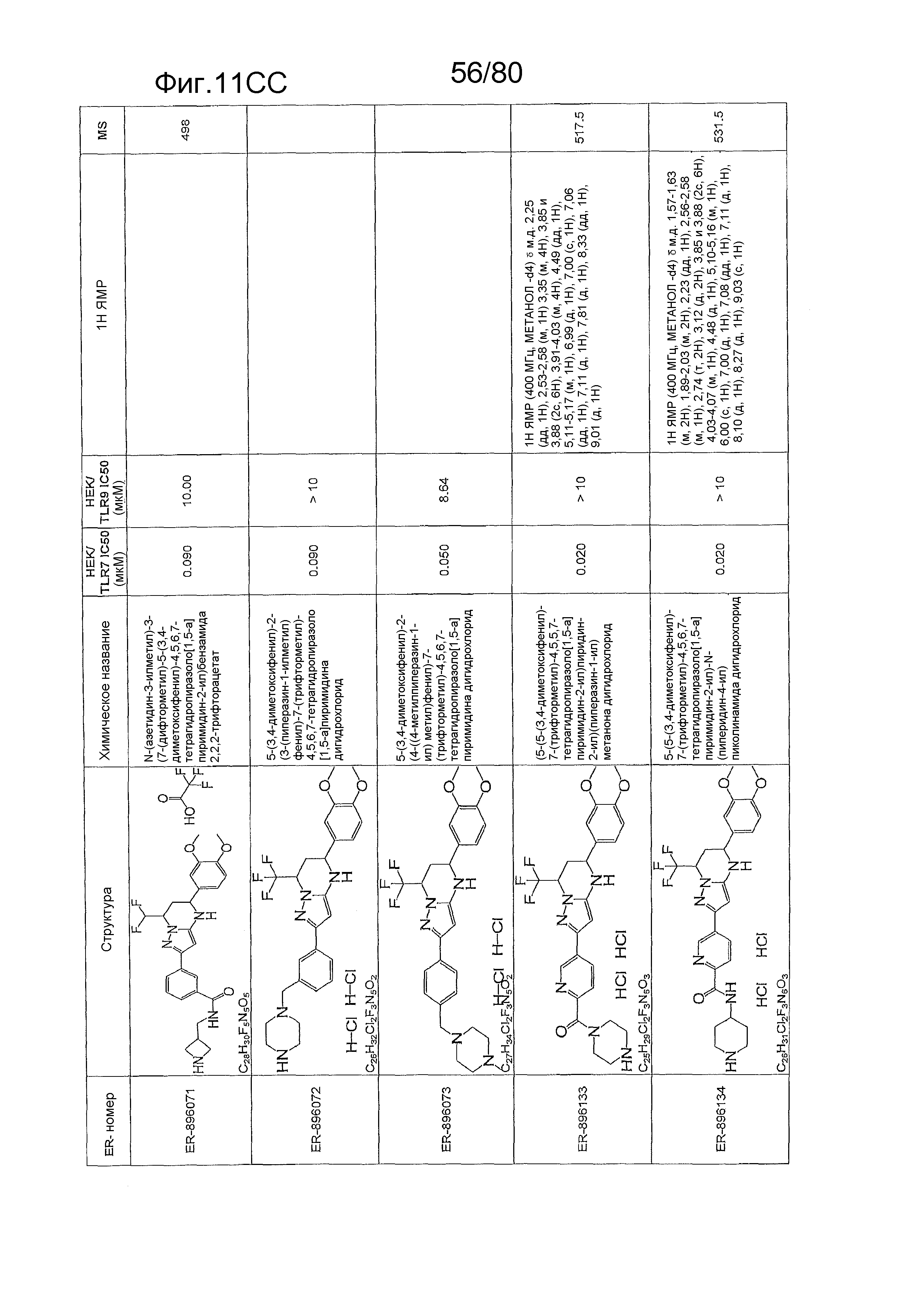
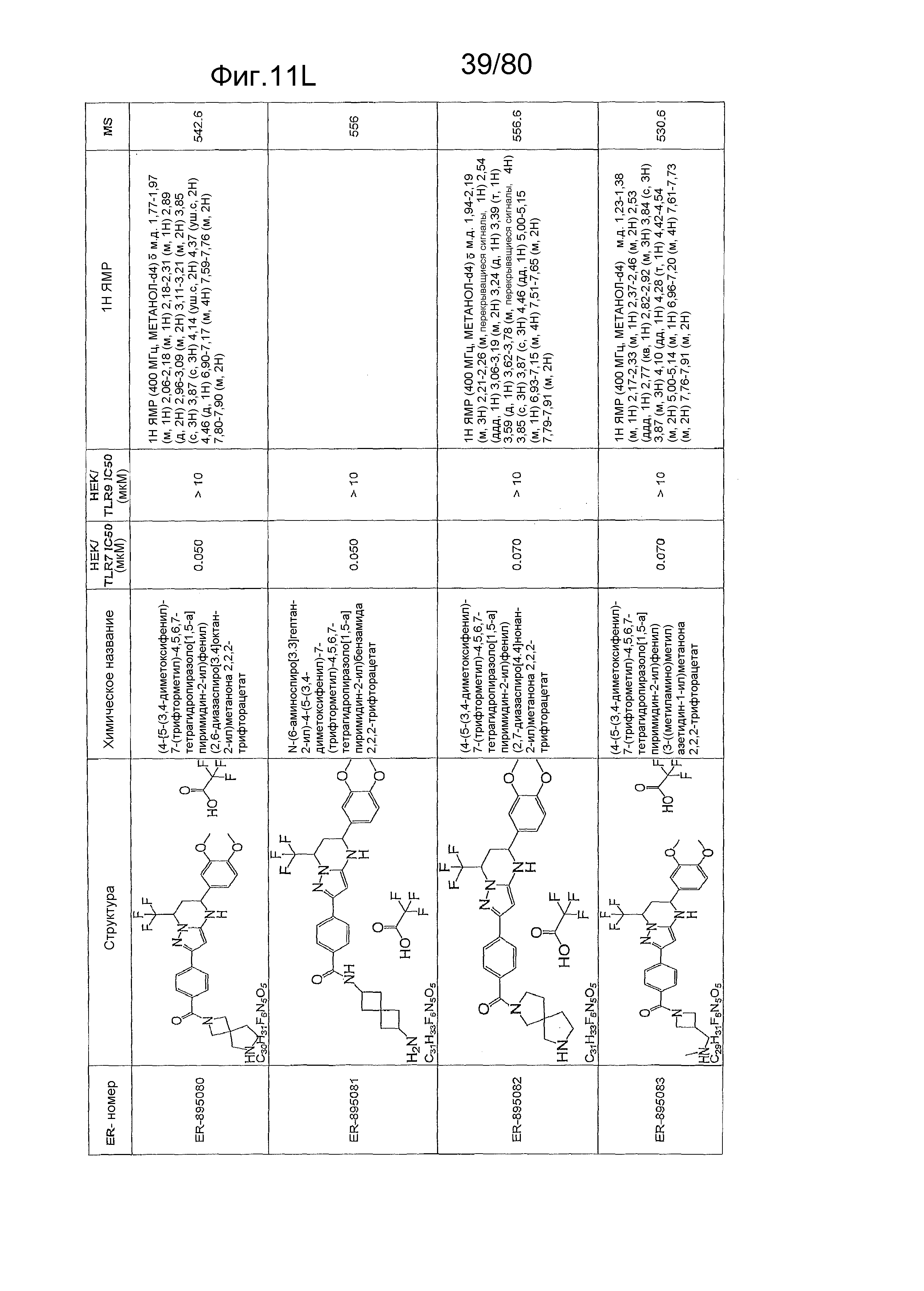
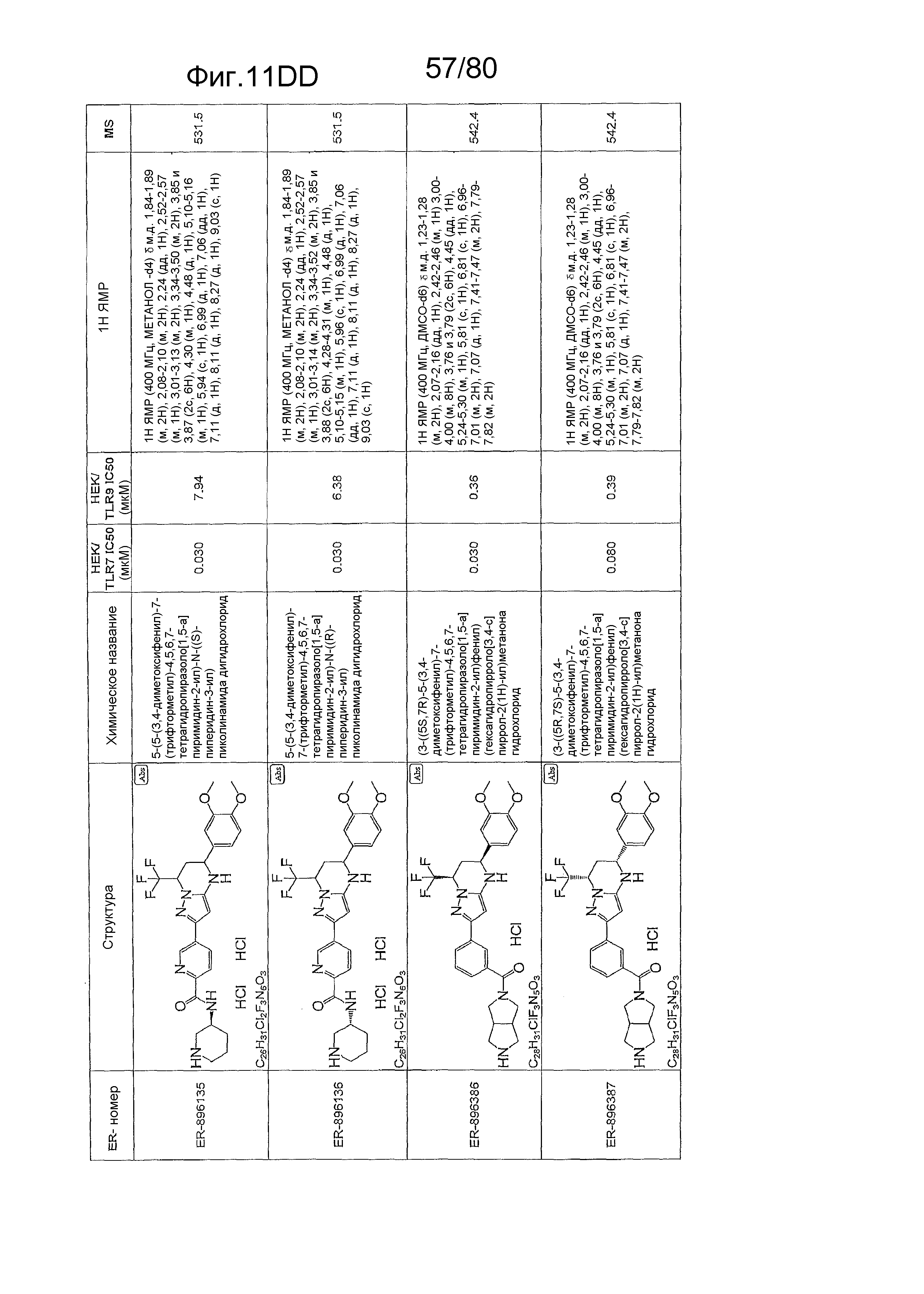
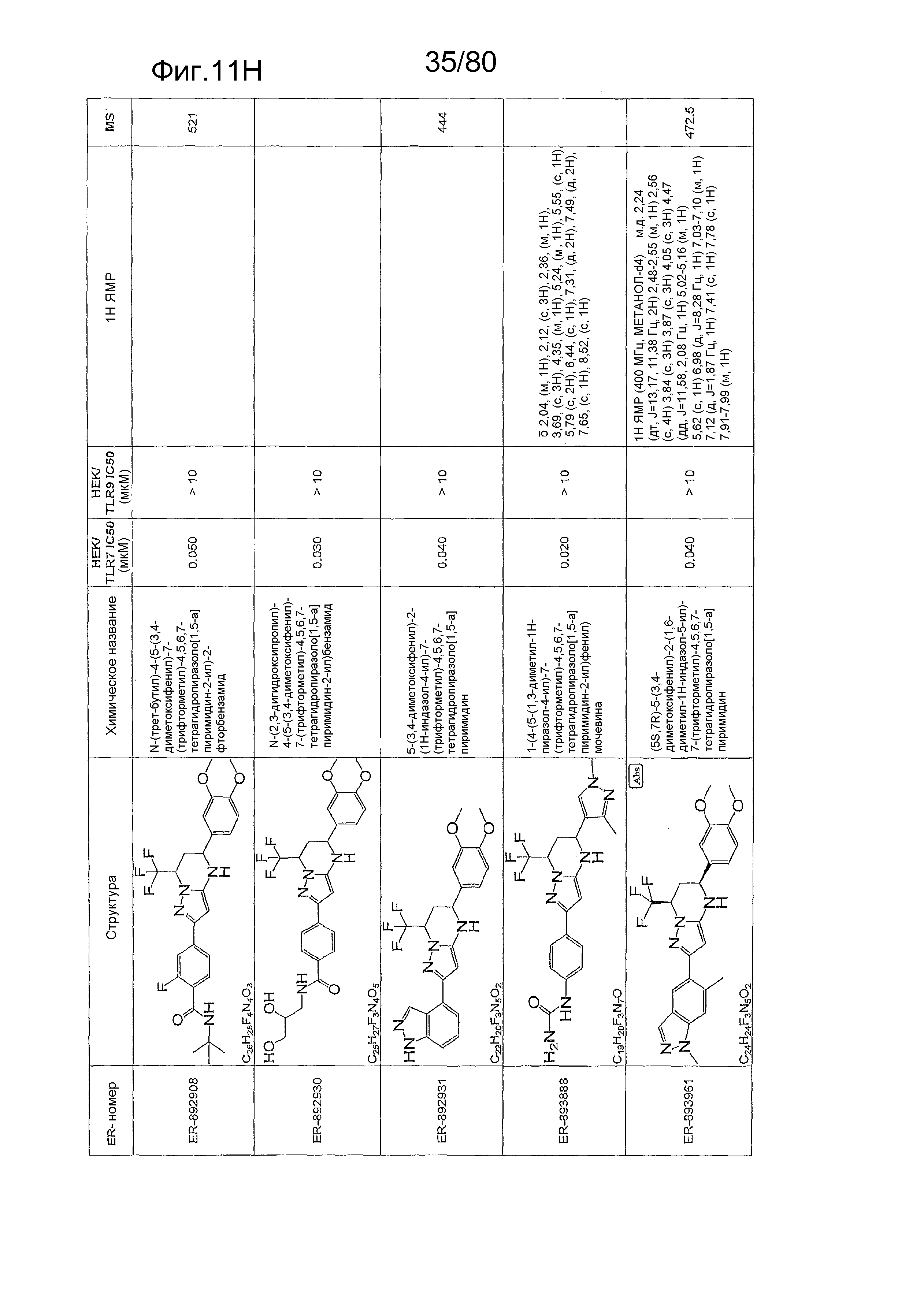
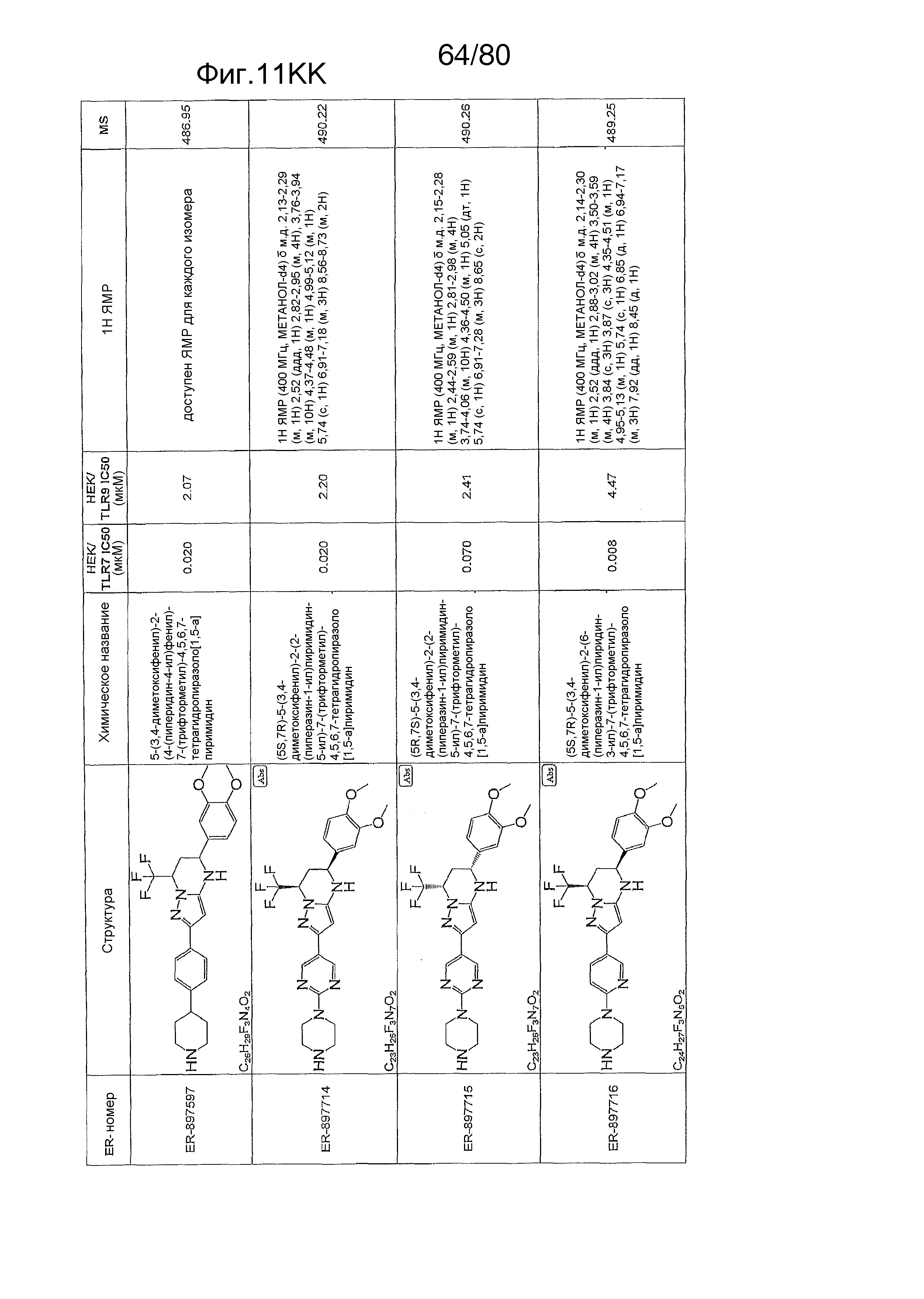
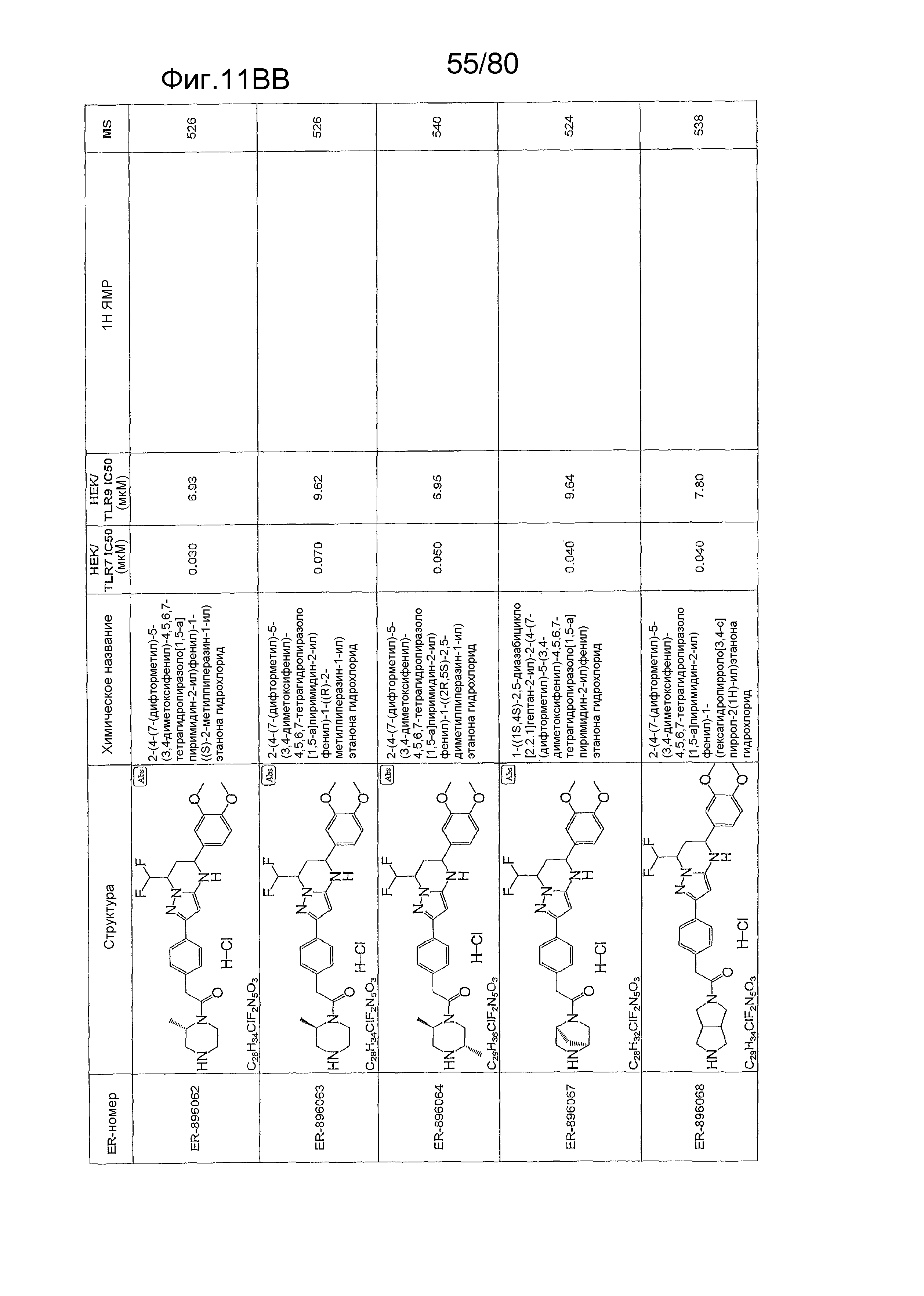
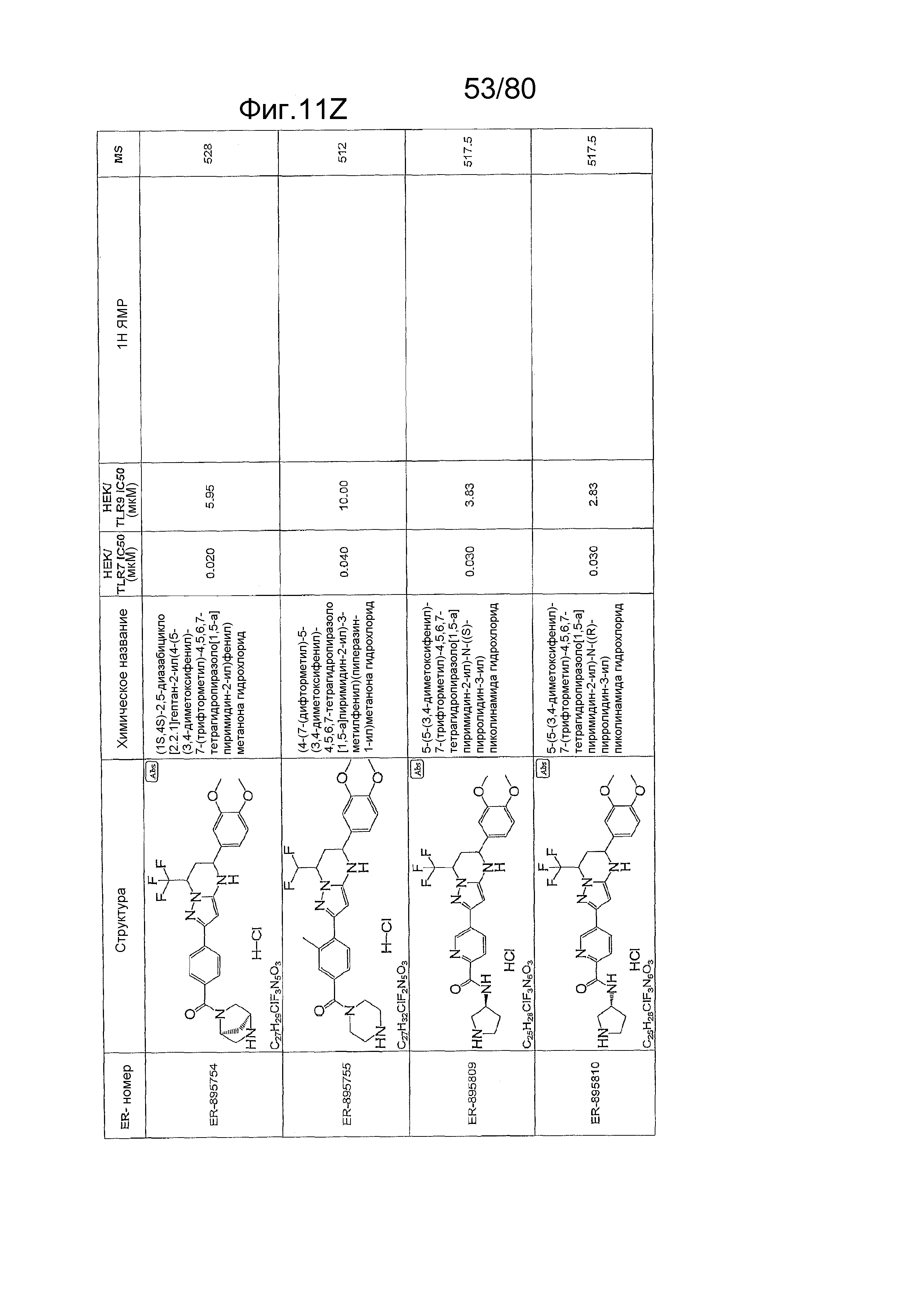
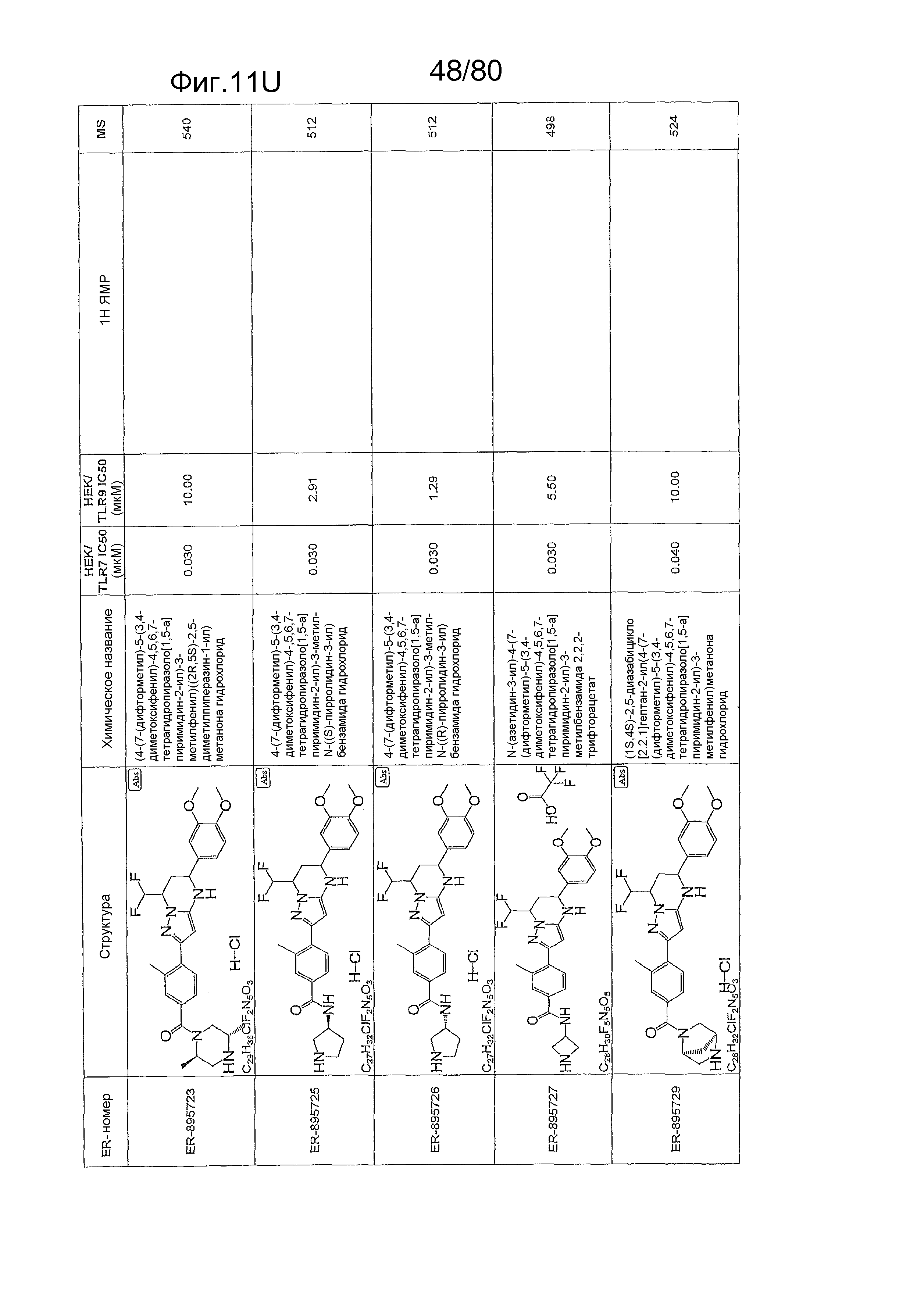
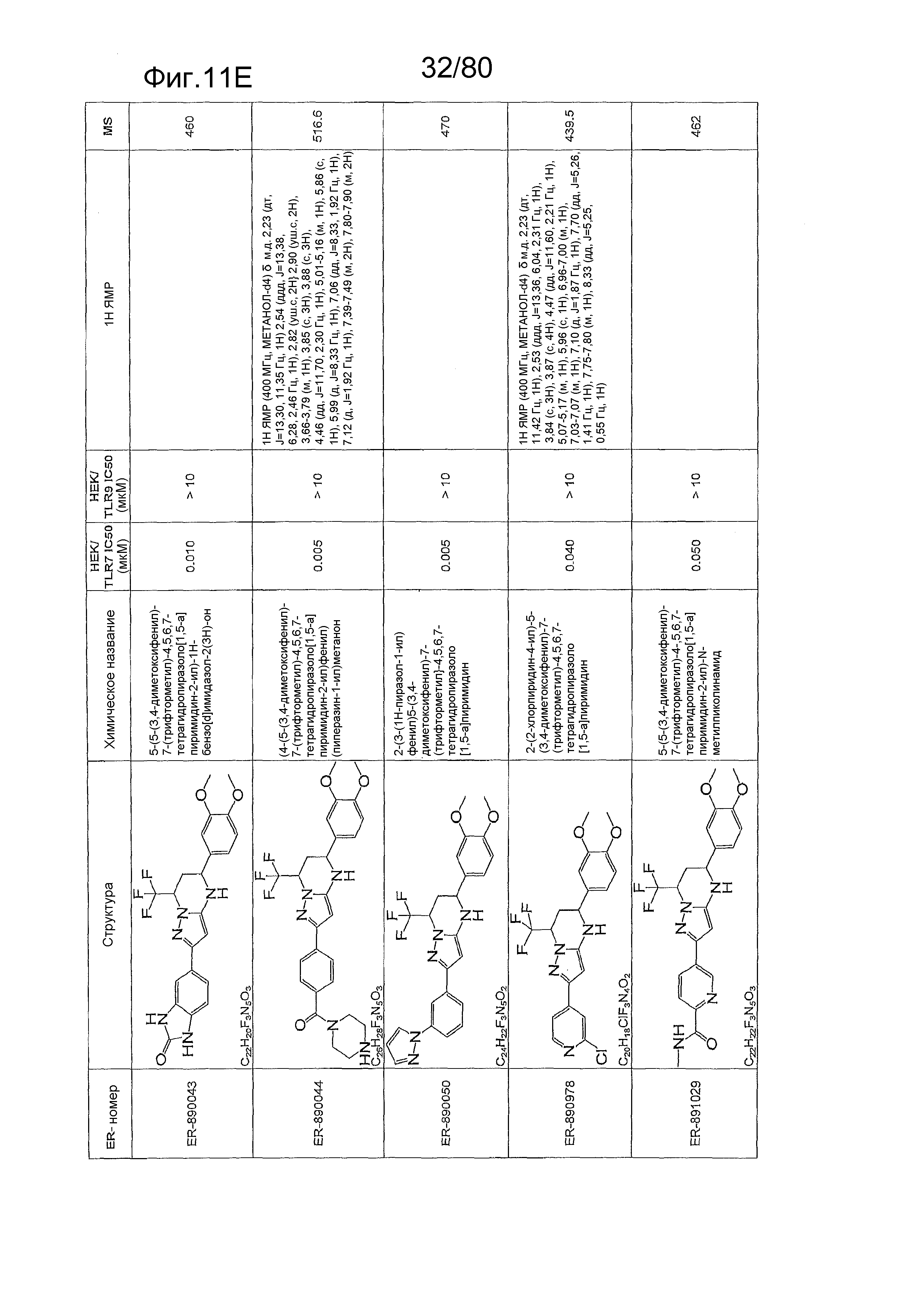
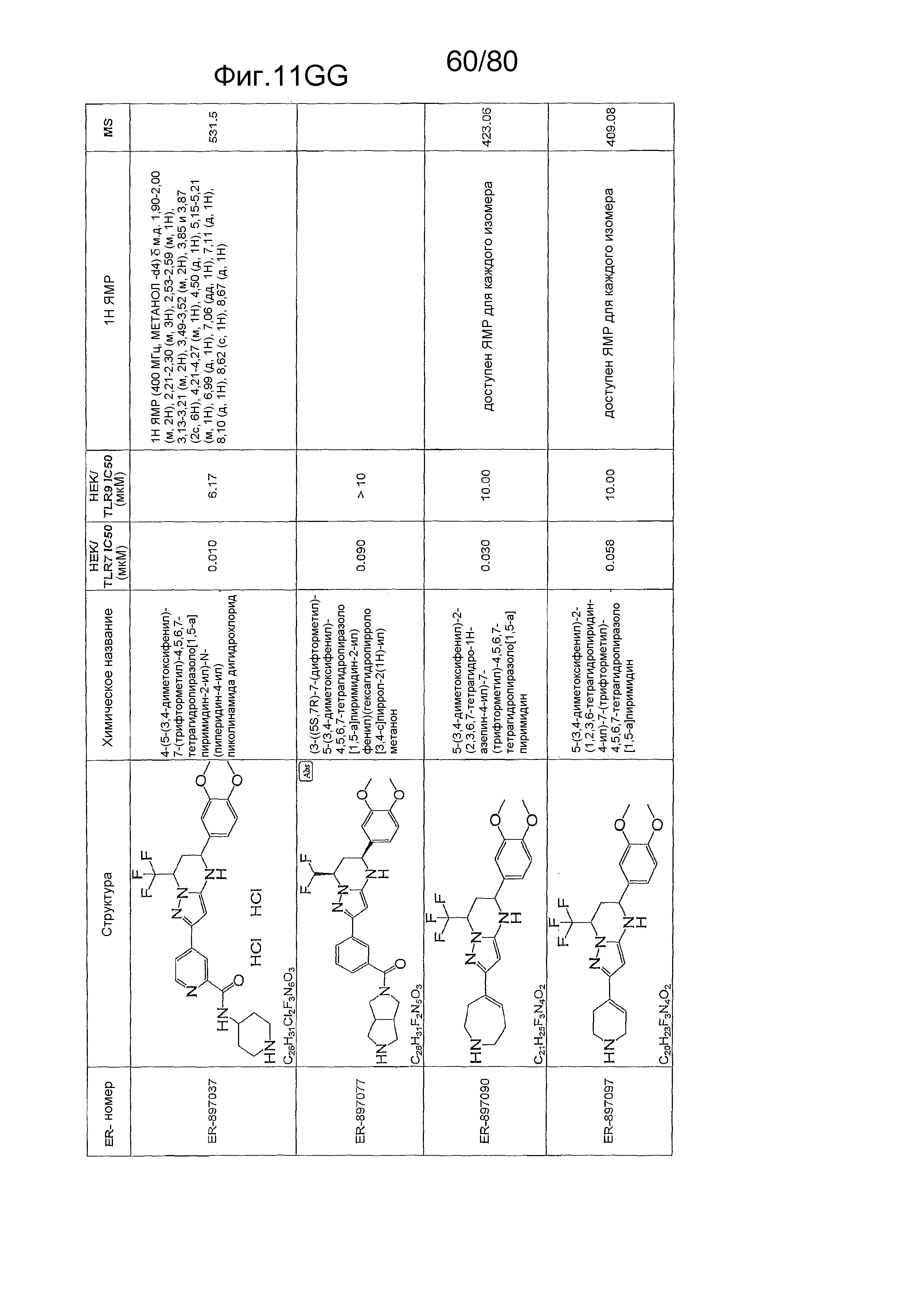
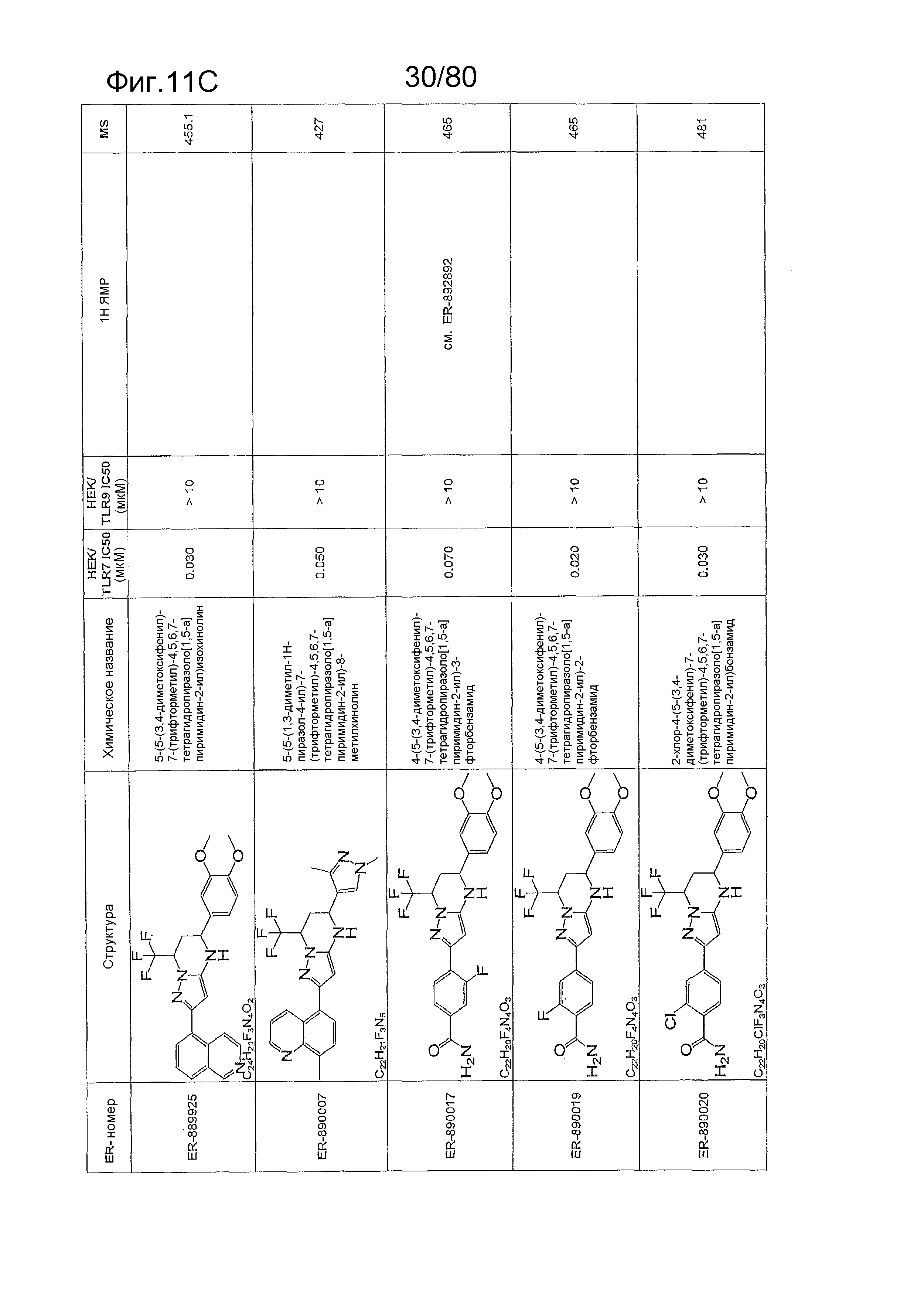
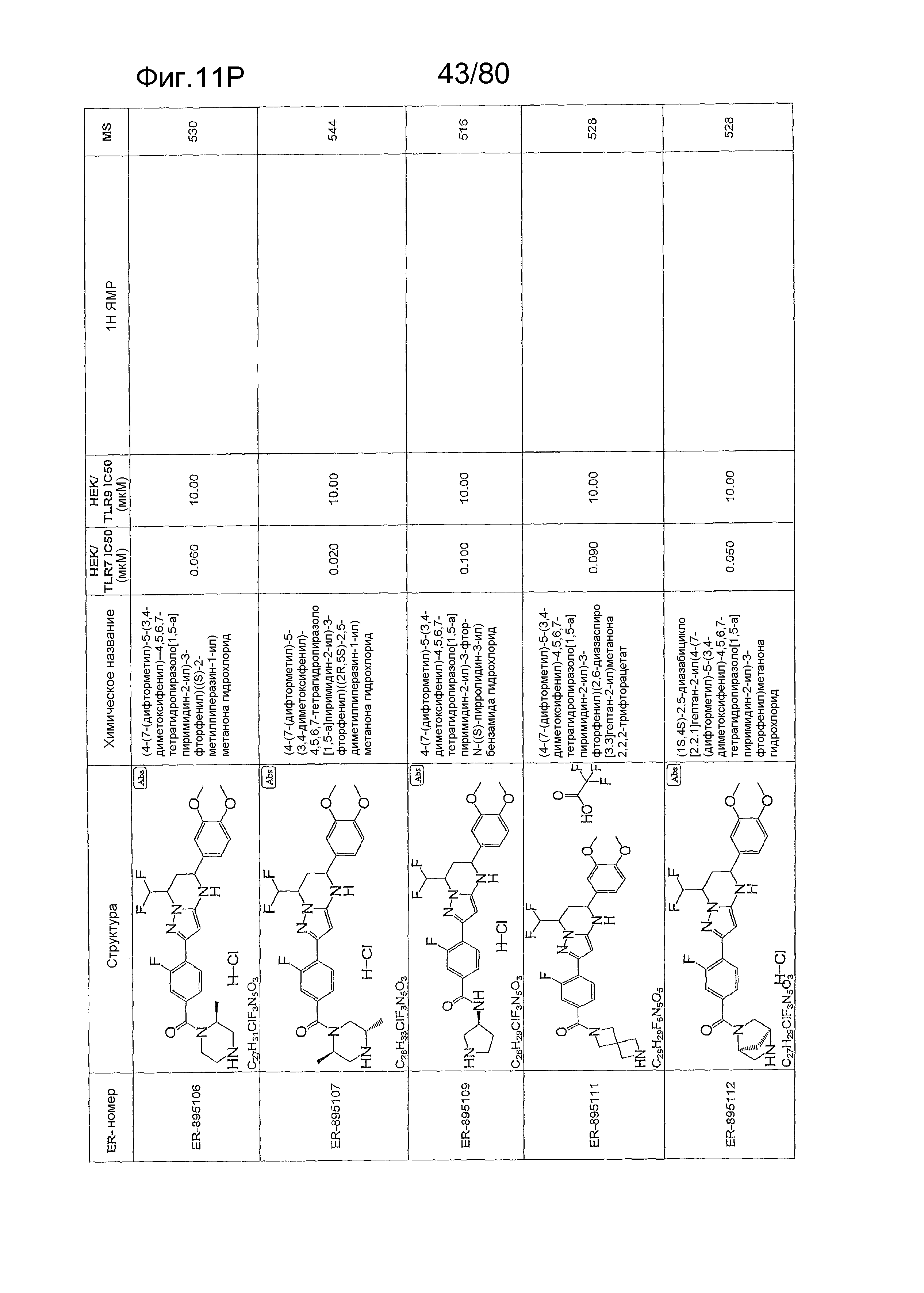
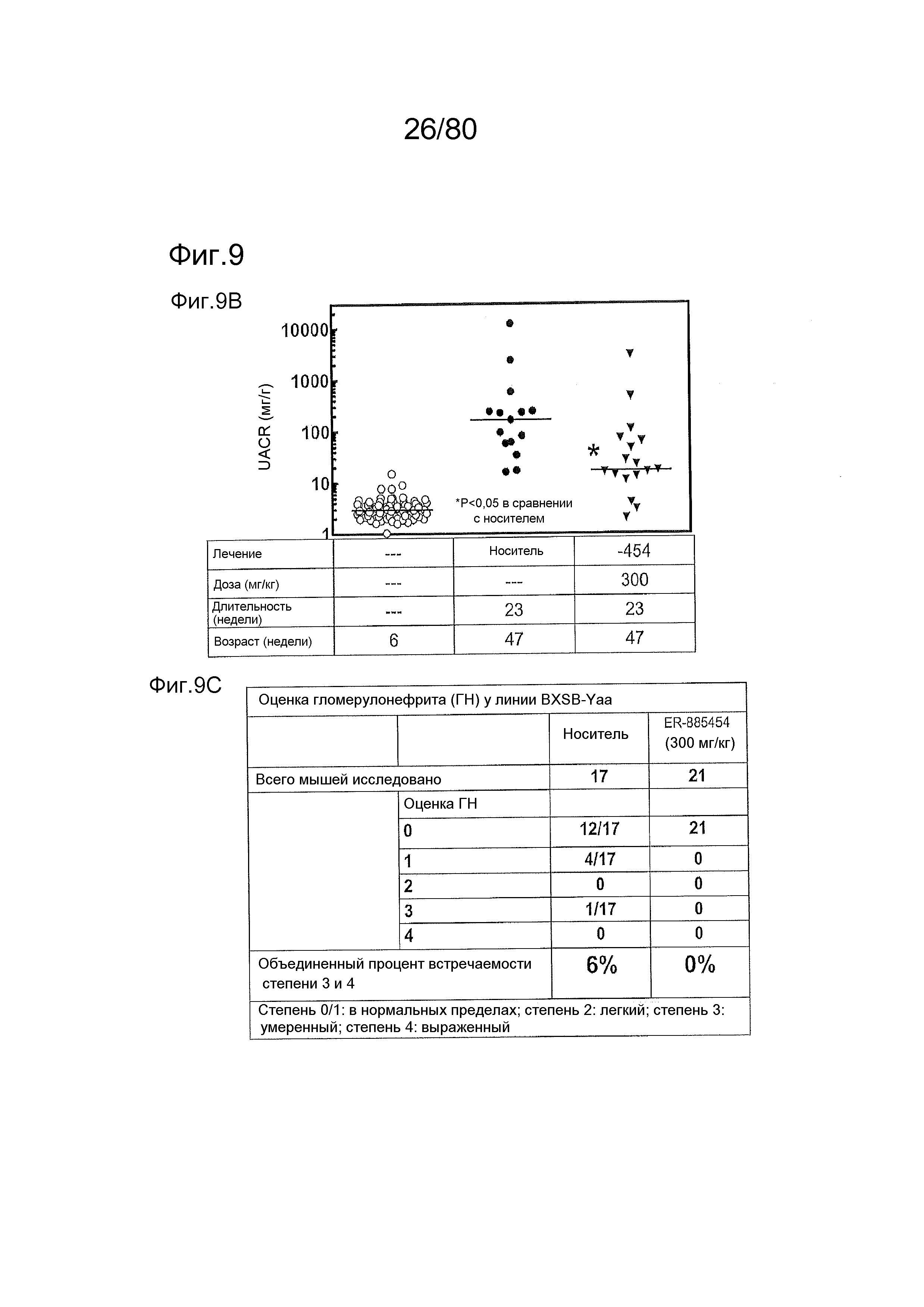
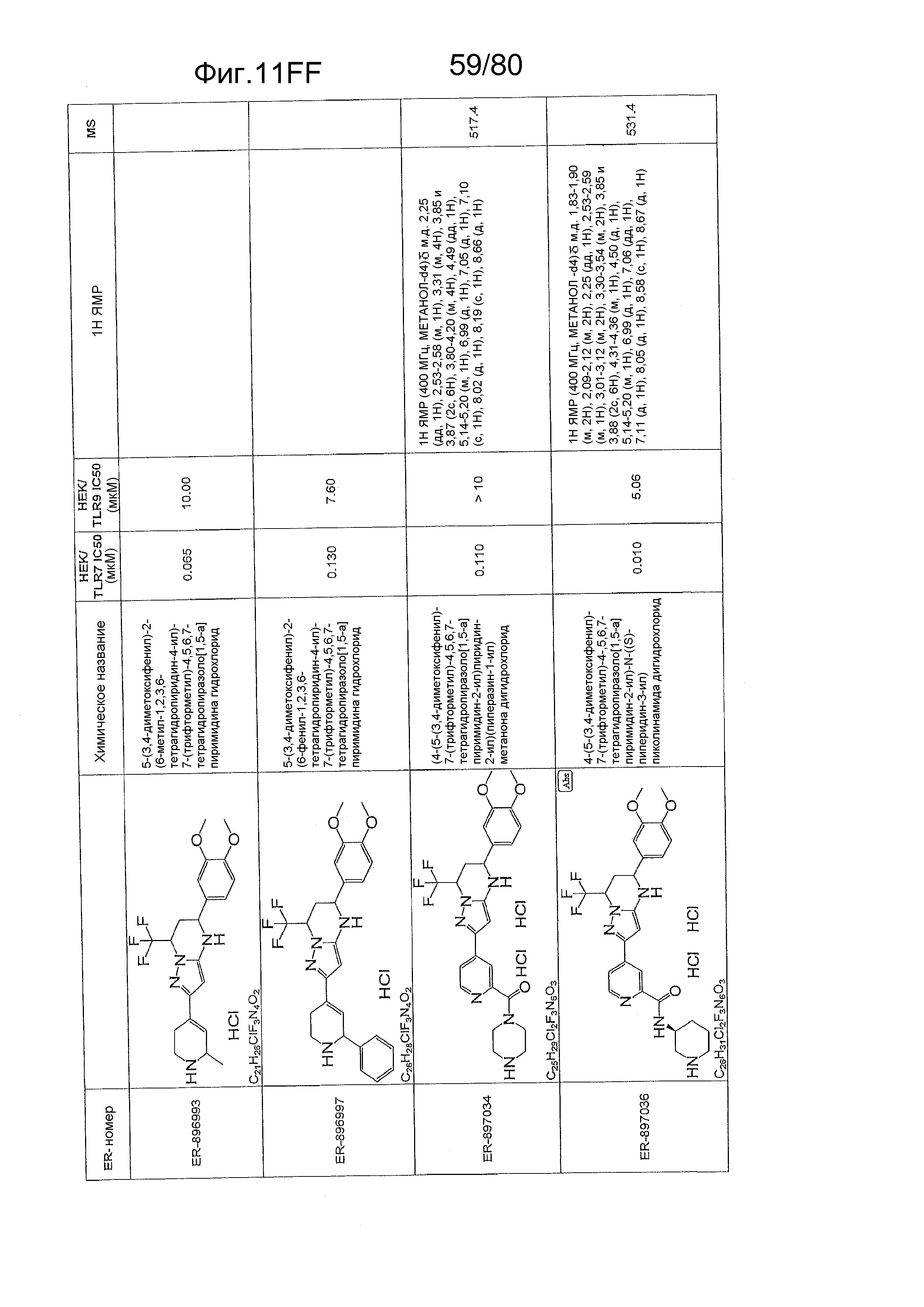
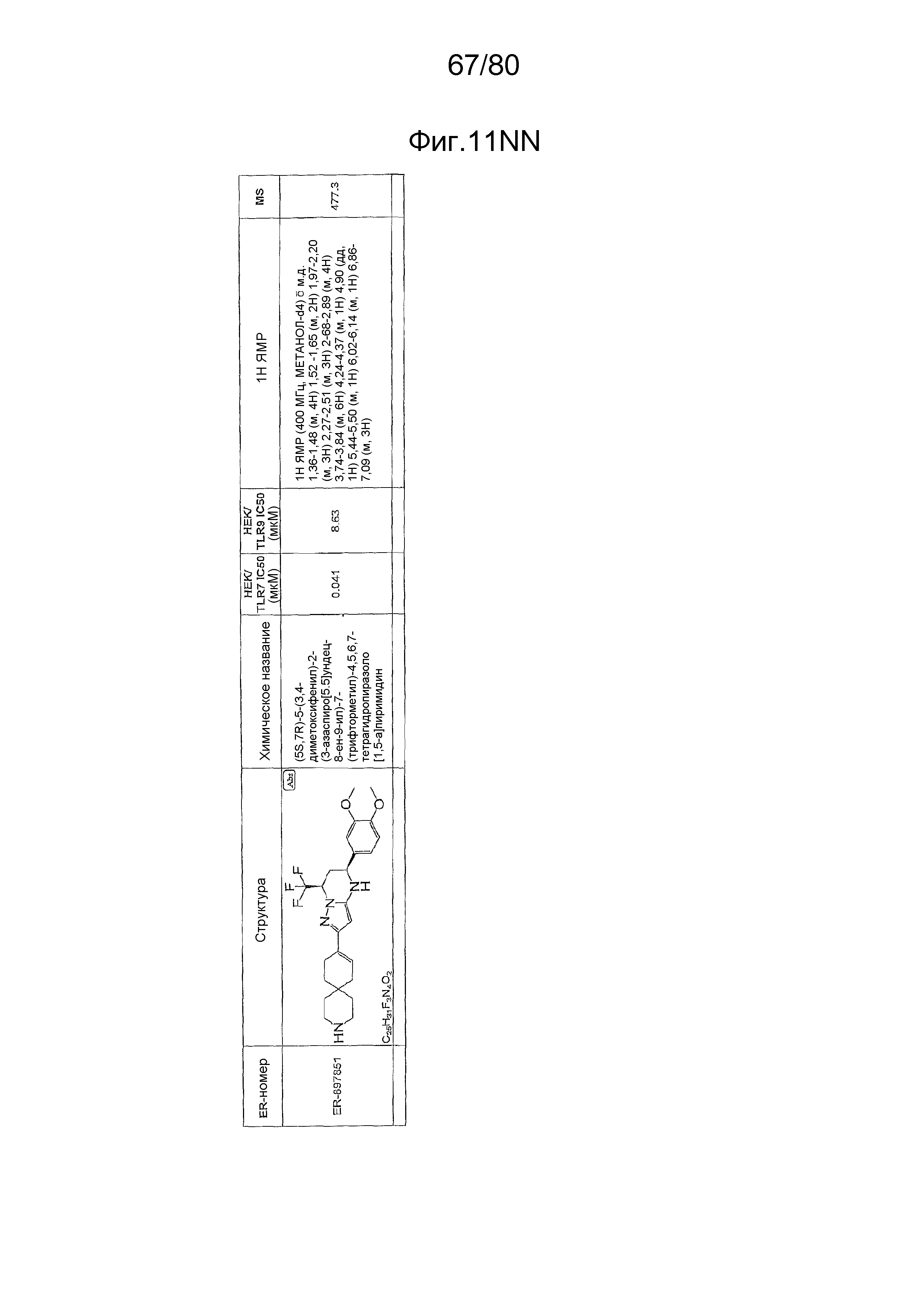
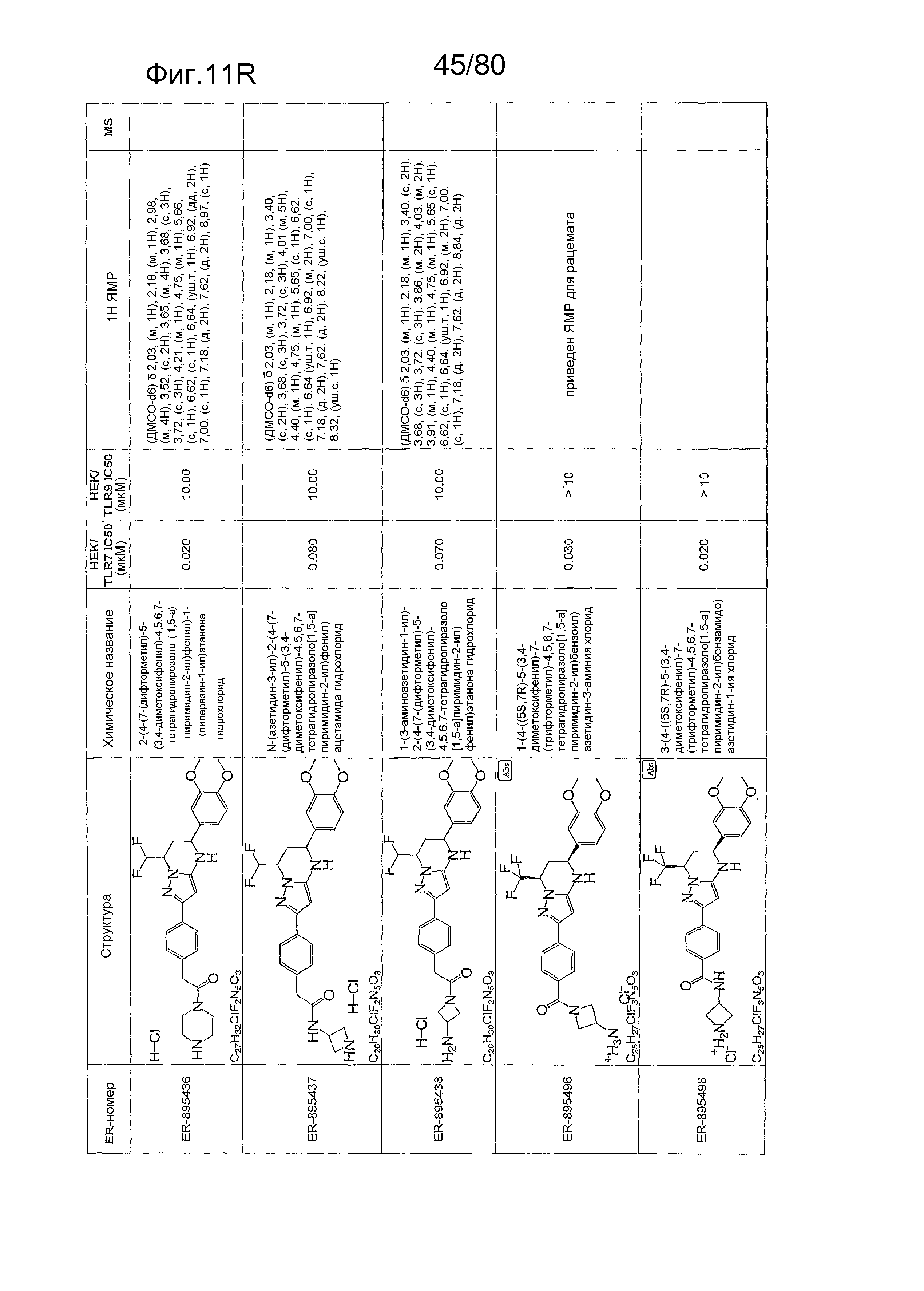
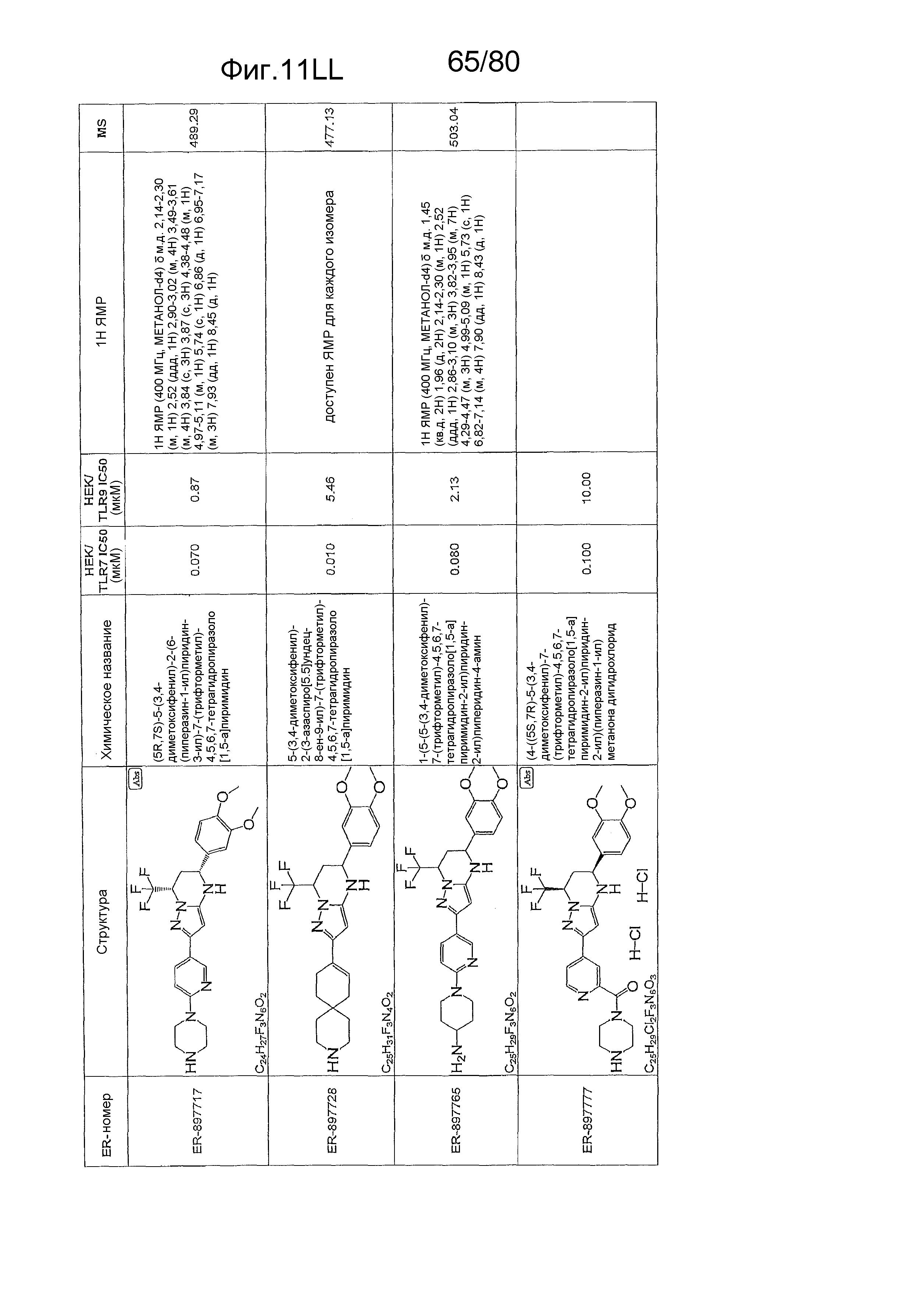
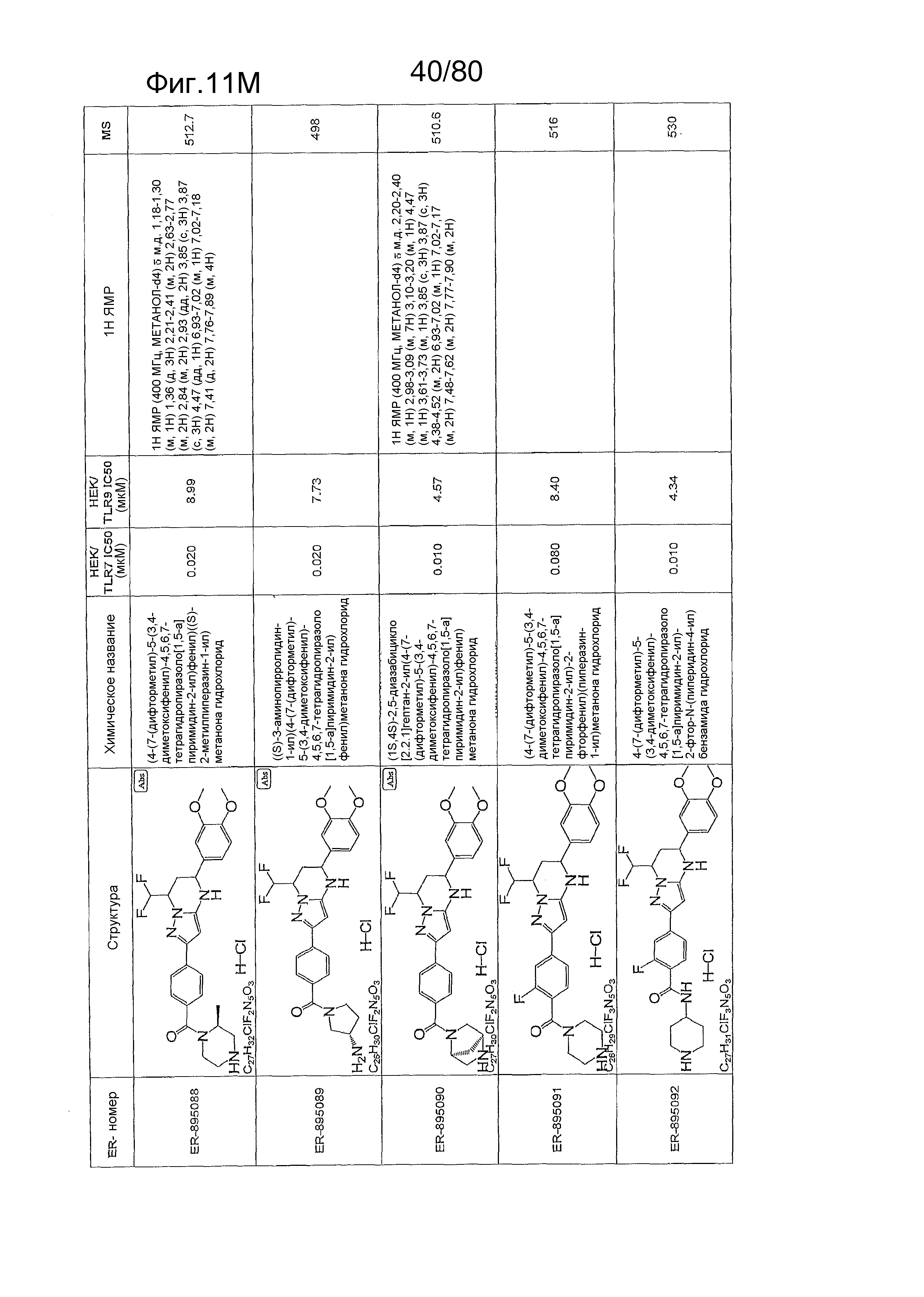
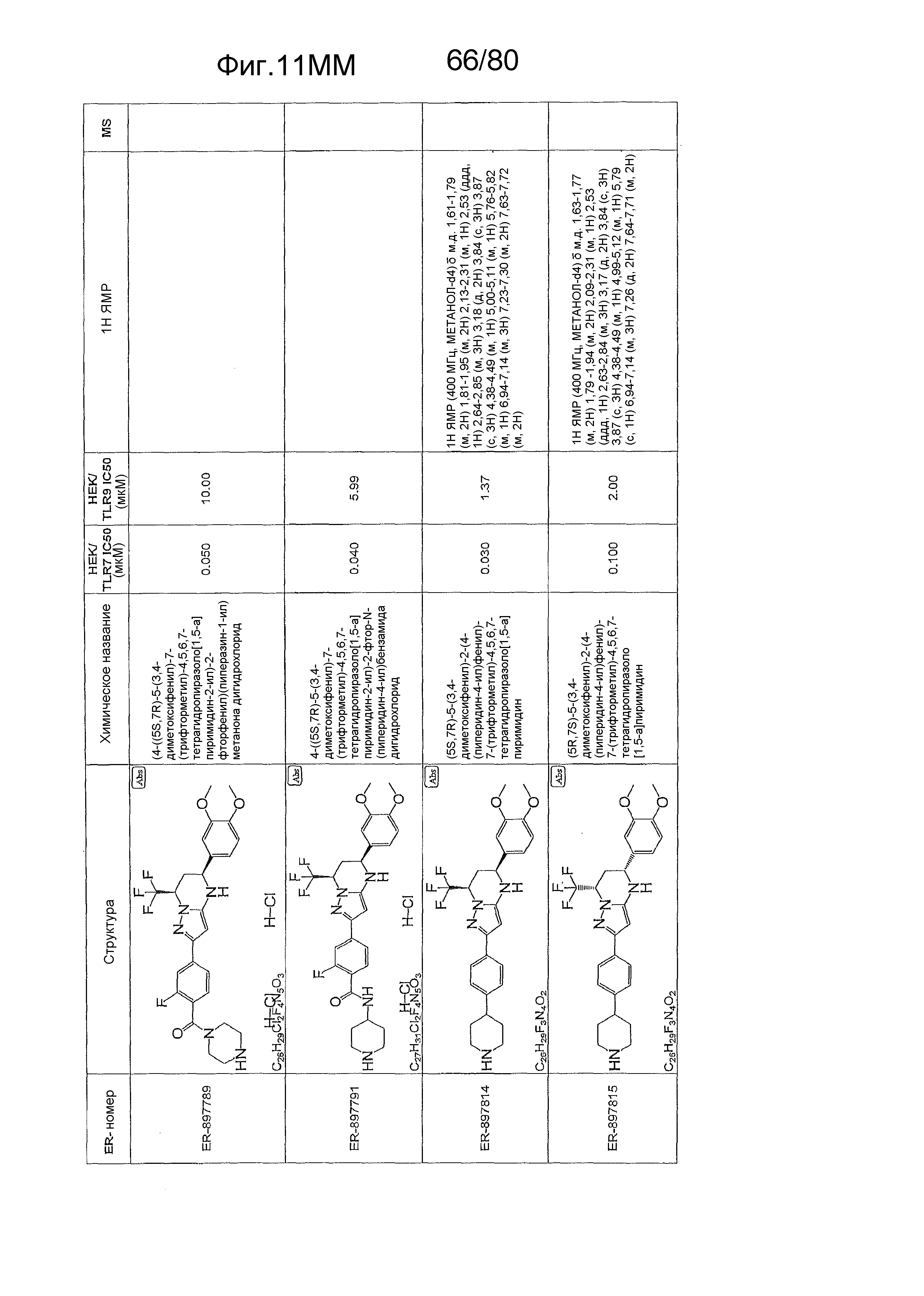
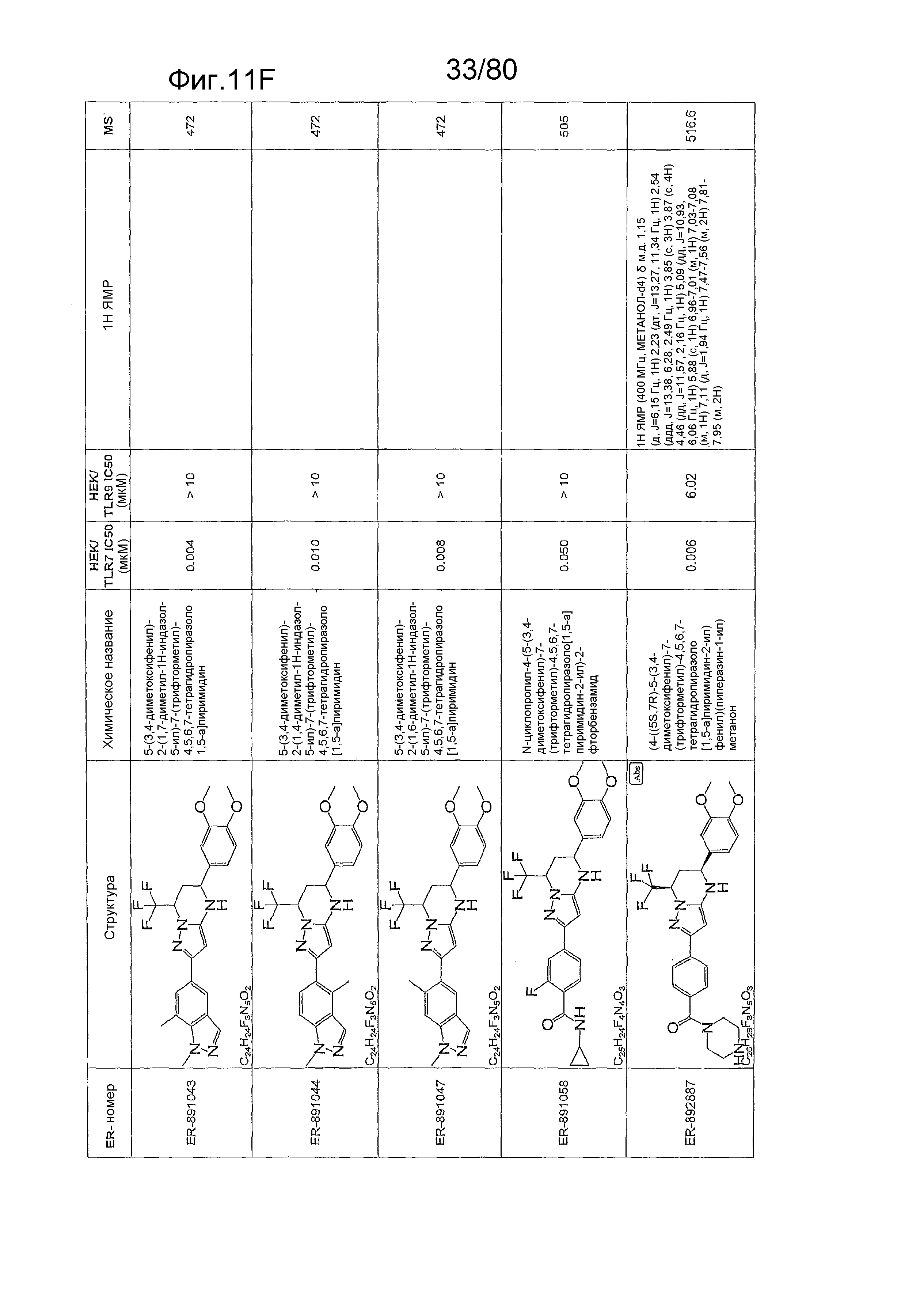
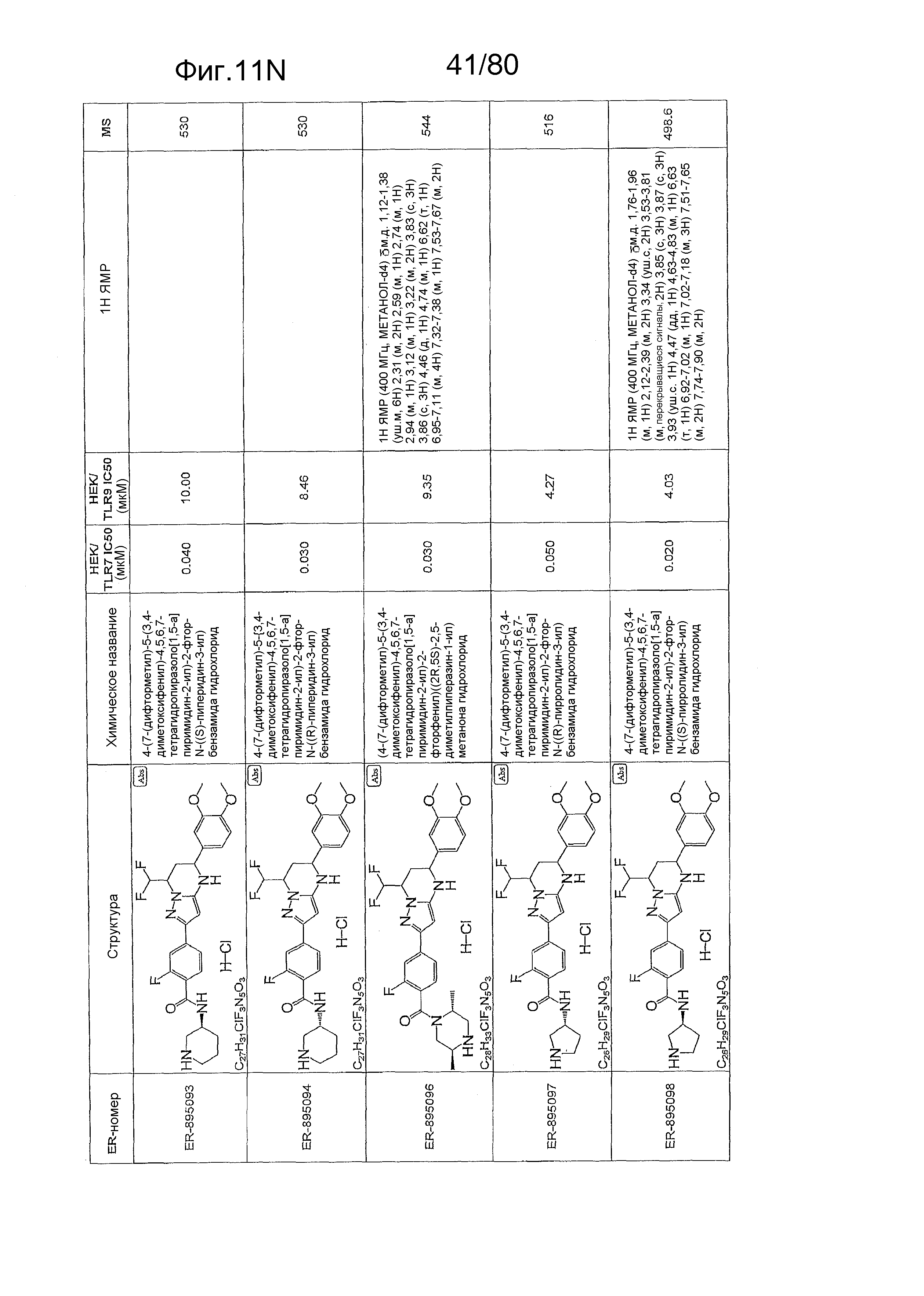
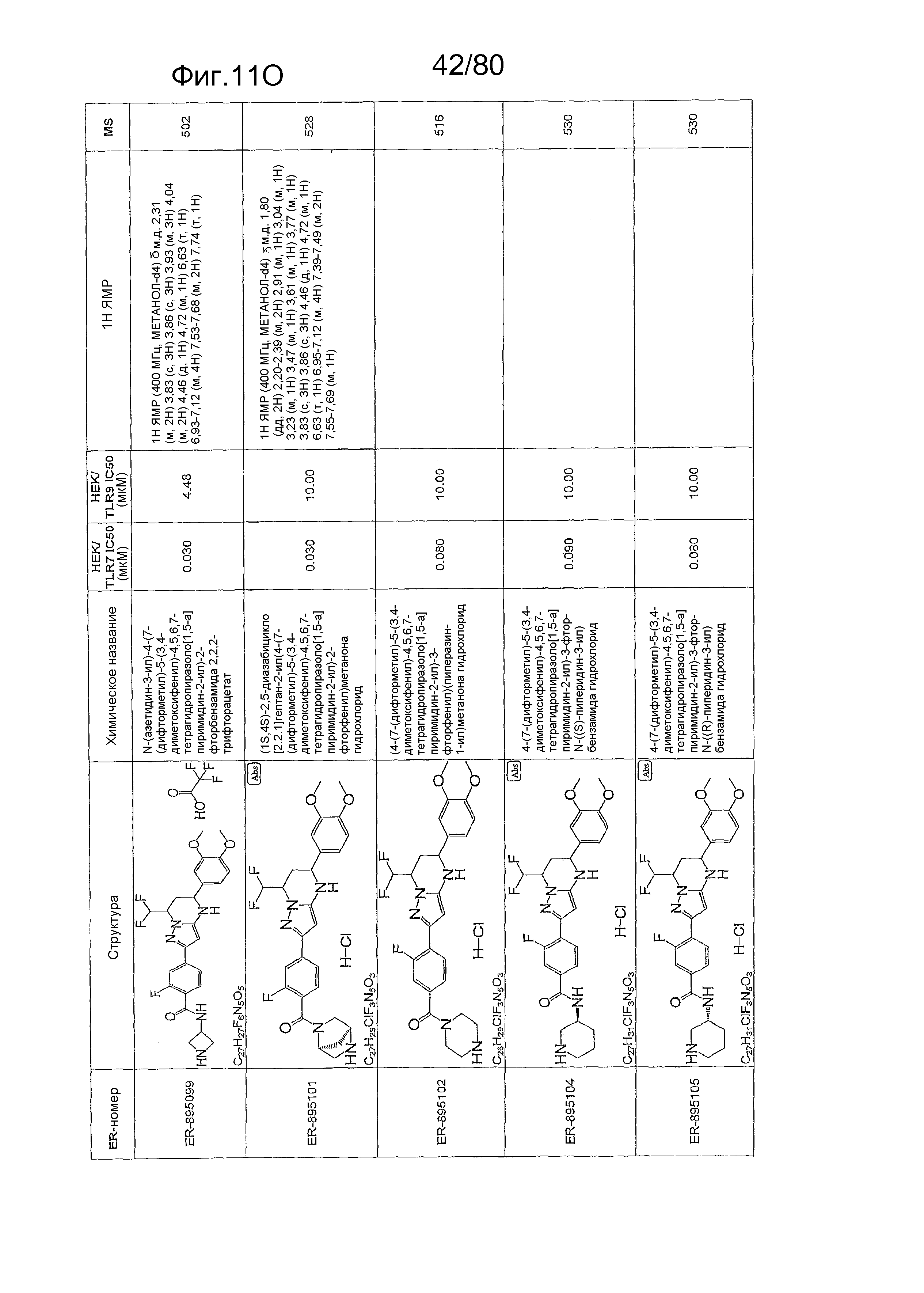
[0056] На фиг. 11A-11NN представлены структуры и соответствующие химические названия в соответствии с различными вариантами осуществления, представленными в настоящем документе. «ER-номер» представляет собой идентификационный номер, присвоенный каждому соединению. Где доступно, активность в отношении клеточной линии HEK, стабильно экспрессирующей TLR7 человека, активность в отношении клеточной линии HEK, стабильно экспрессирующей TLR9 человека, также включены 1H ЯМР данные и данные масс-спектрометрии.
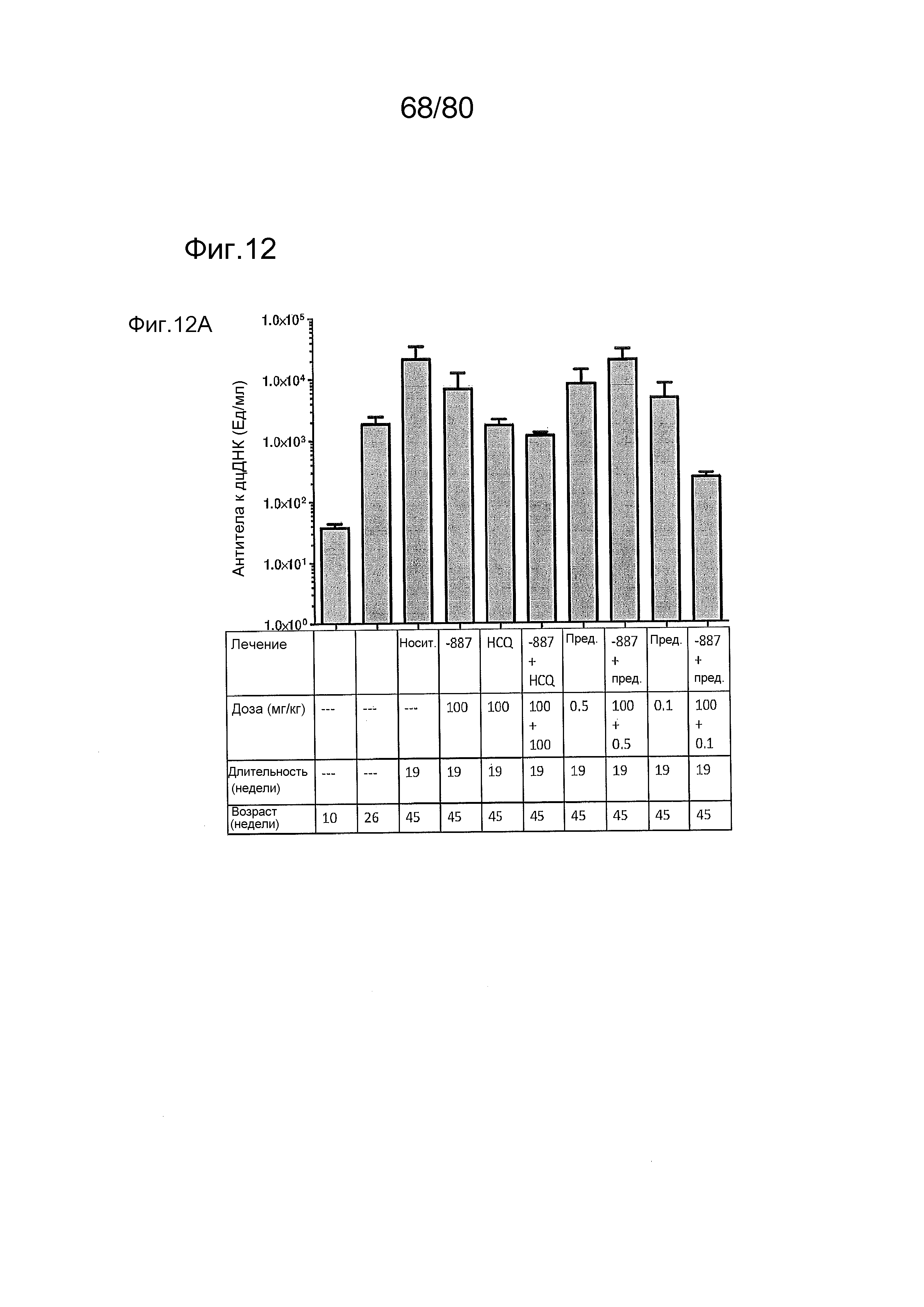
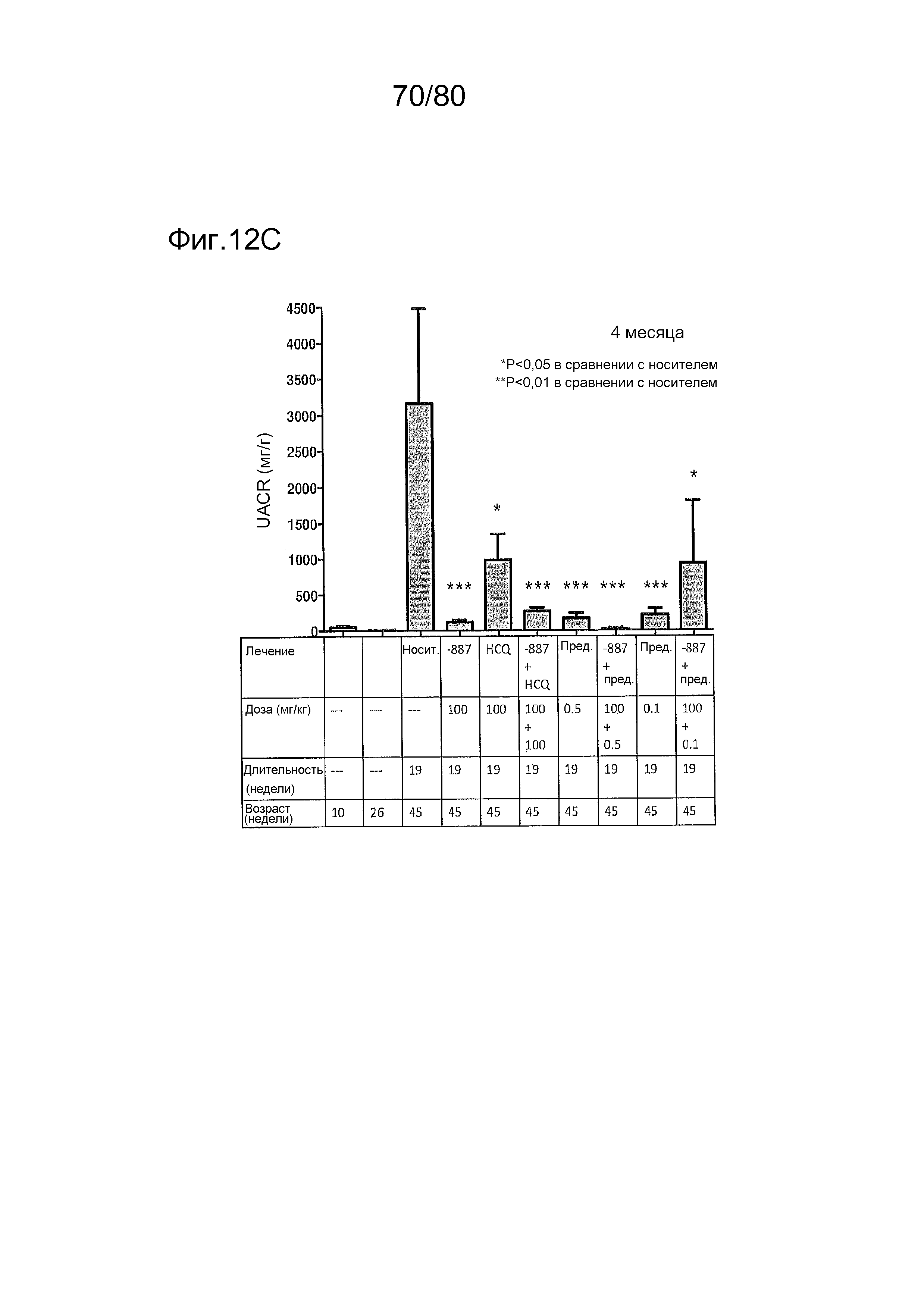
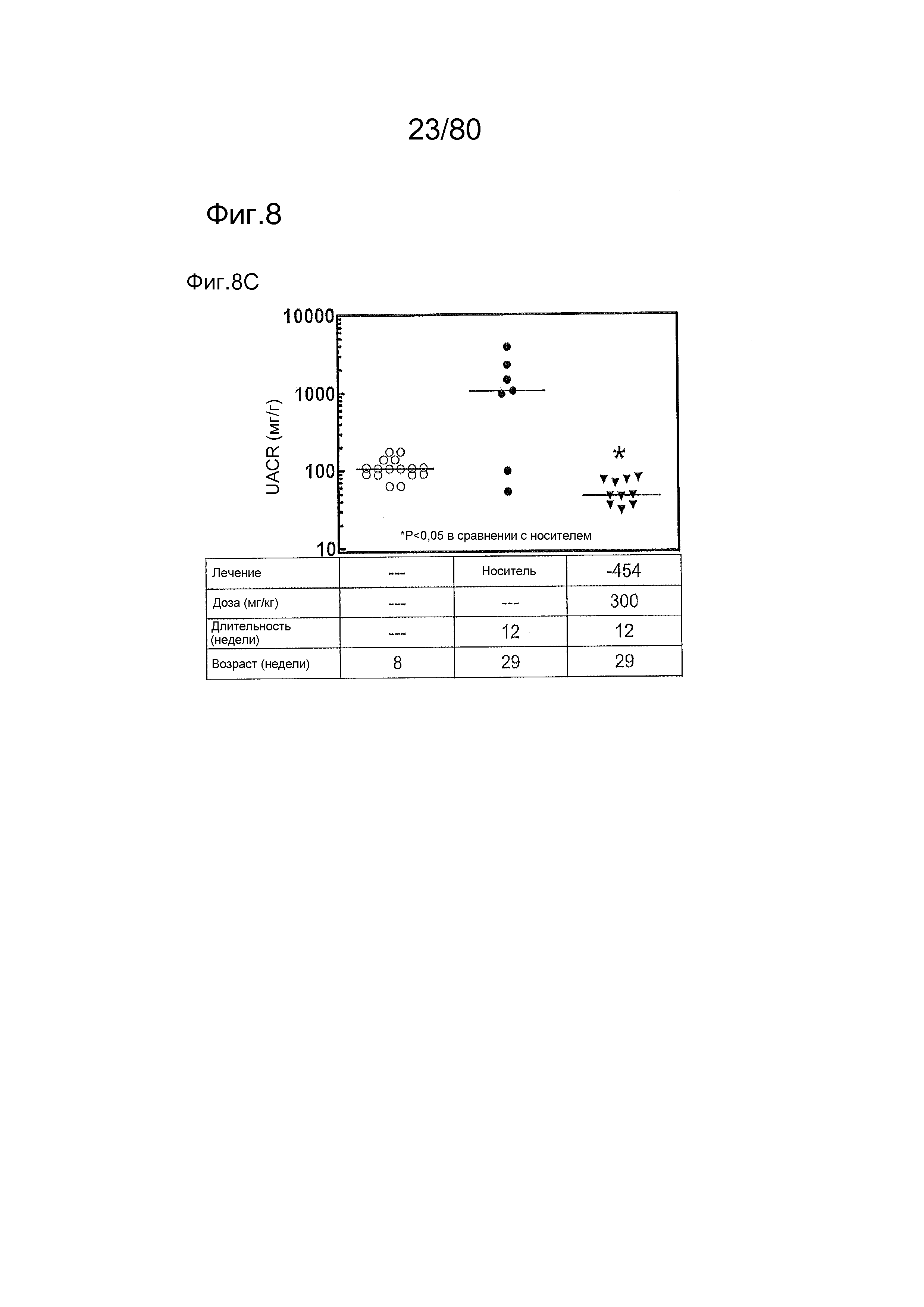
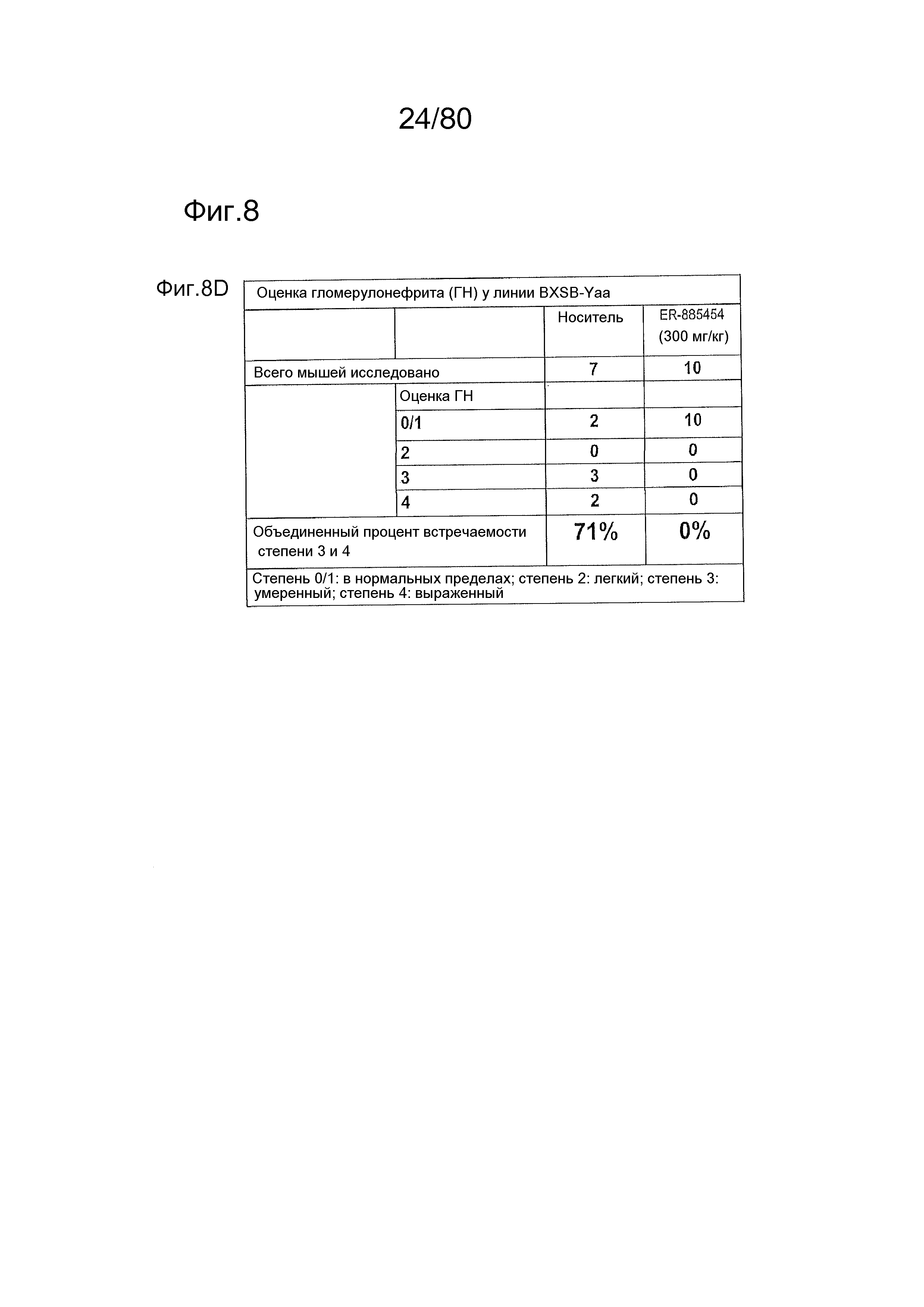
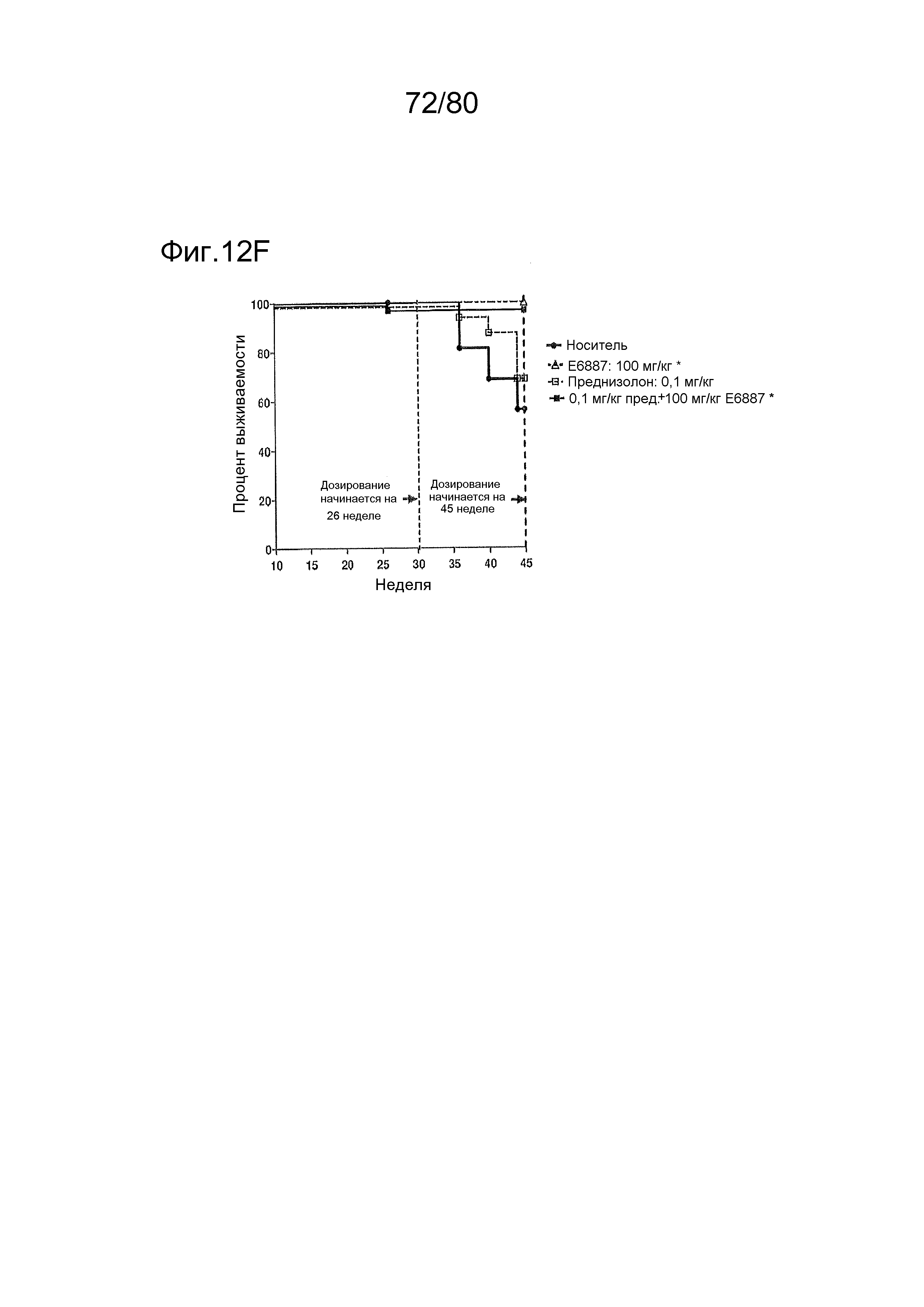
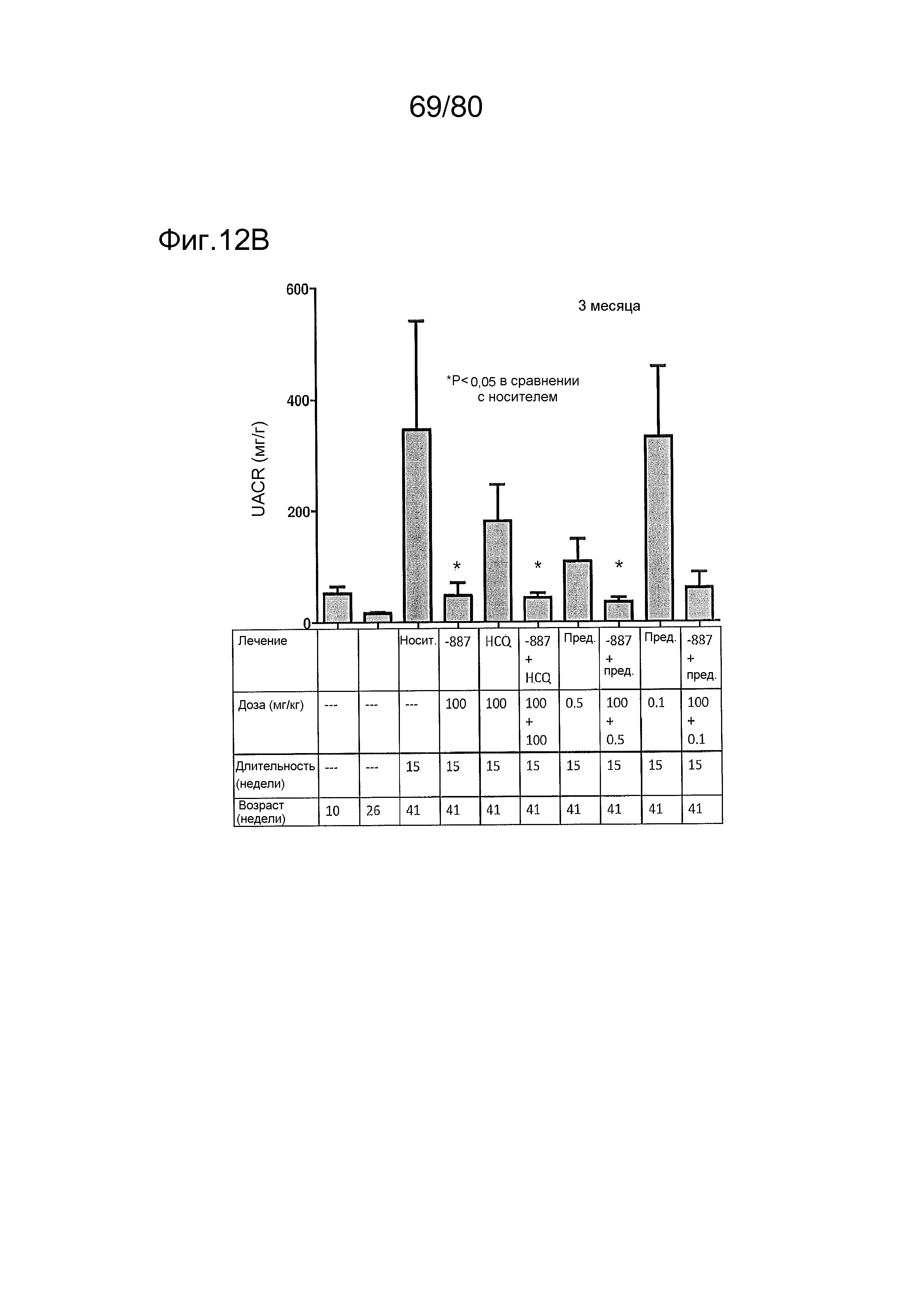
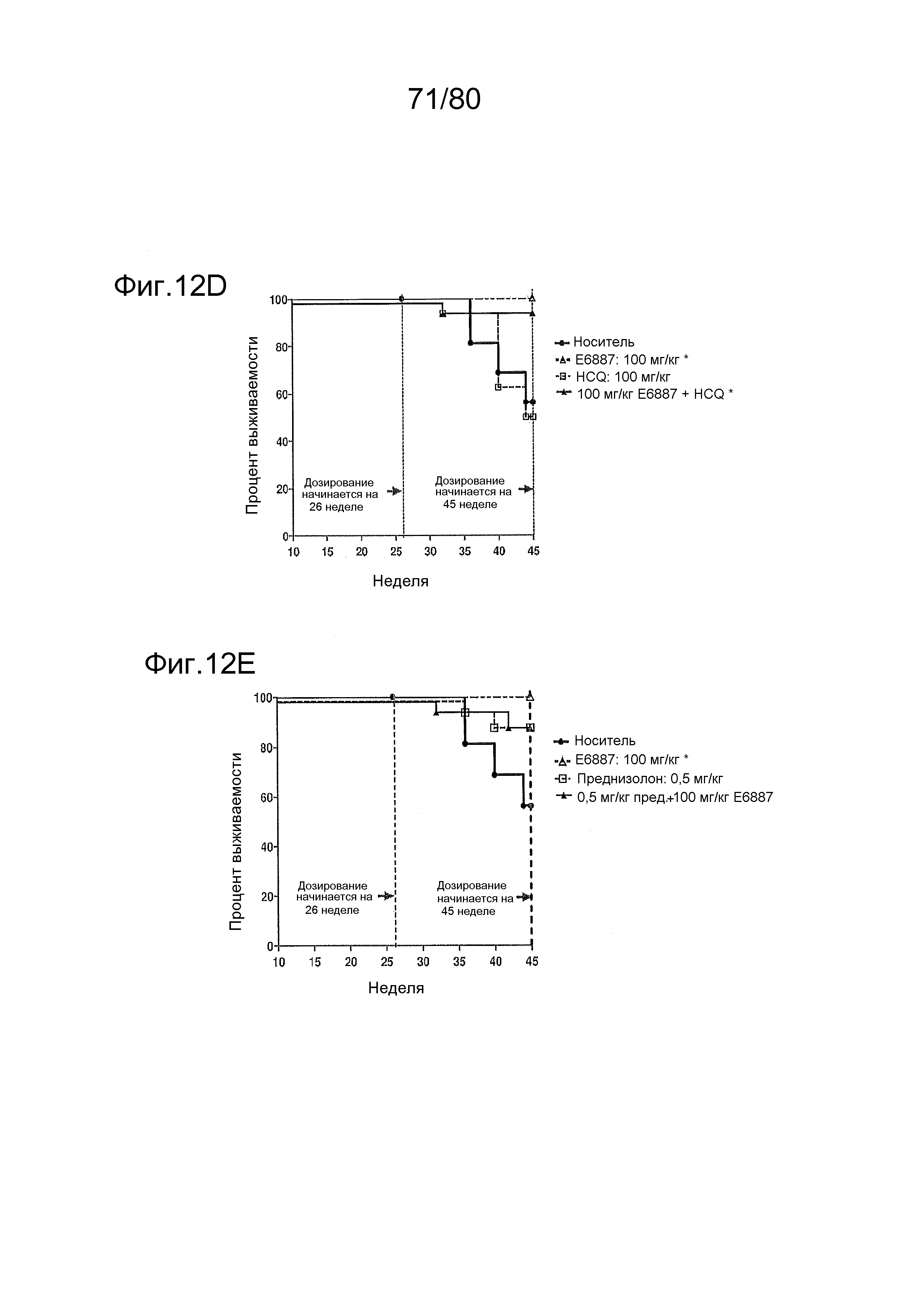
[0057] На фиг. 12 представлен эффект ER-892887 и двух широко используемых способов лечения волчанки человека в модели заболевания волчанкой на линии NZBxNZW. Условные обозначения на фигуре: самок мышей NZBWF1/J получали в возрасте 4 недель, получали кровь для определения базовых уровней на 10 и 26 неделях, и у мышей осуществляли мониторинг прогрессирования заболевания, следя за титрами антител к дцДНК и протеинурией. В возрасте 26 недель мышей рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 100 мг/кг ER-892887, 100 мг/кг гидроксихлорохина, 0,1 мг/кг преднизолона или 0,5 мг/кг преднизолона, отдельно или в указанных комбинациях, раз в сутки перорально (QD PO). Всех мышей умерщвляли в возрасте 45 недель (19 недель лечения лекарственными средствами), и определяли титры антител к дцДНК в плазме крови посредством ELISA. (A) Влияние лечения ER-892887 на титры антител к дцДНК по окончании. (B) В возрасте 41 недели (после 15 недель лечения) мочу собирали у отдельных мышей, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного в качестве опосредованной меры функции почек. (C) Позже мочу собирали у отдельных мышей прямо перед окончанием в возрасте 45 недель, после 19 недель лечения, и определяли соотношение альбумина и креатинина в моче (UACR, протеинурия) для каждого животного. (D, E, F) Кривые выживаемости, наблюдаемой в этом исследовании во время лечения с использованием E6887, каждый элемент сопоставления стандартного лечения (D, гидроксихлорохин; E, 0,1 мг/кг преднизолон; F, 0,5 мг/кг преднизолон) или комбинации Е6887 и одного из элементов сравнения. Группы лечения тестировали в сравнении с наполнителем с помощью критерия Кокса-Мантеля.
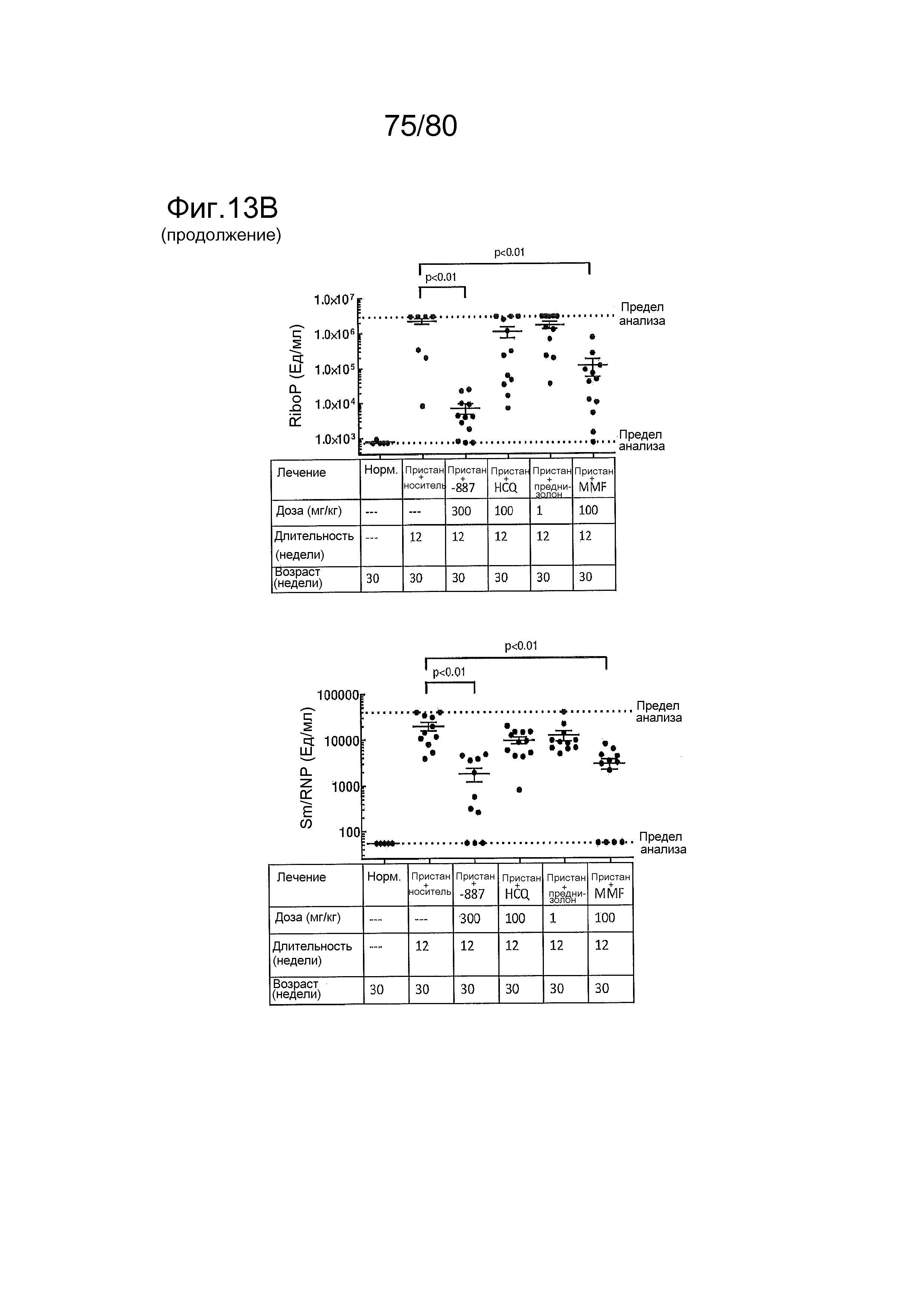
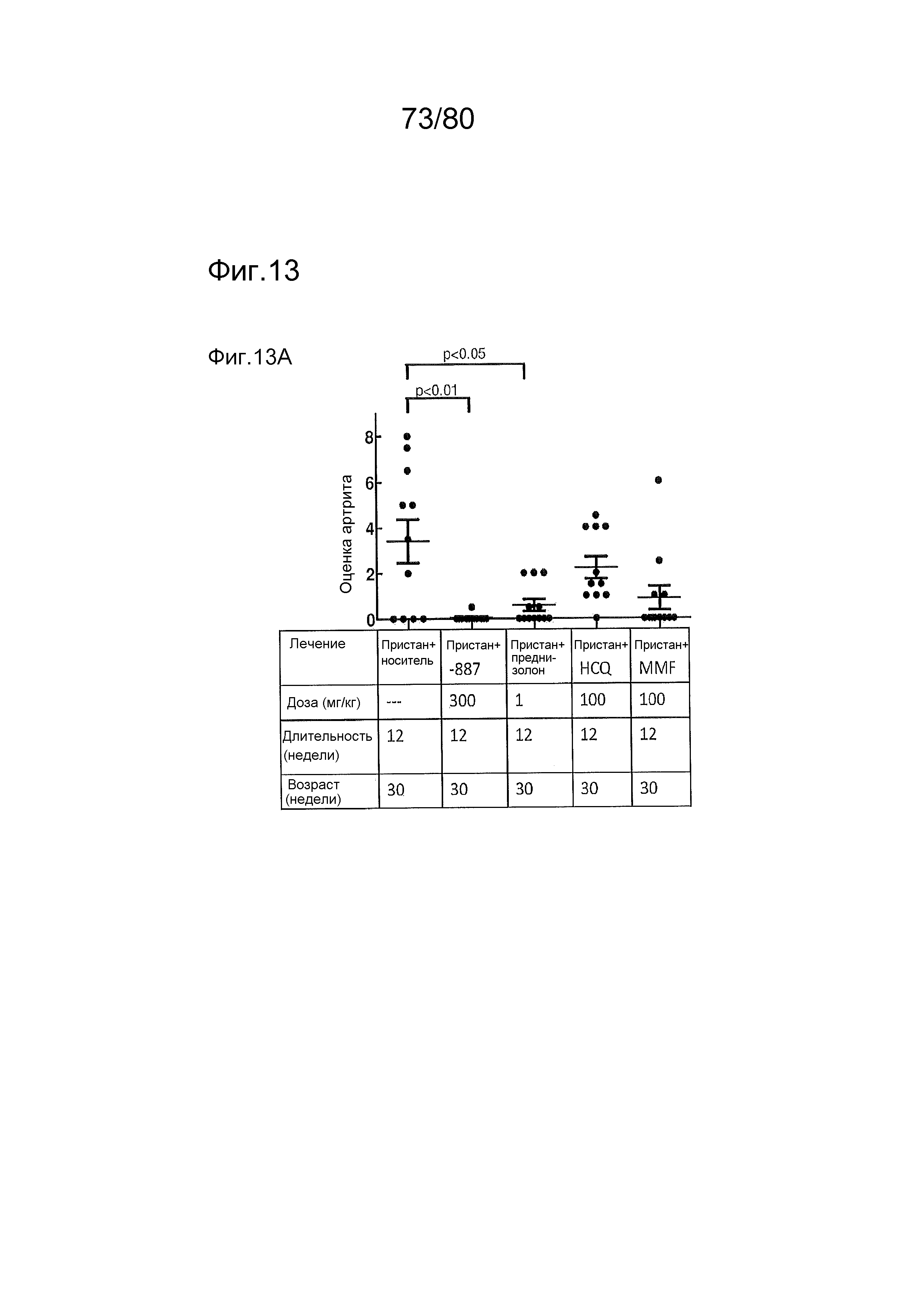
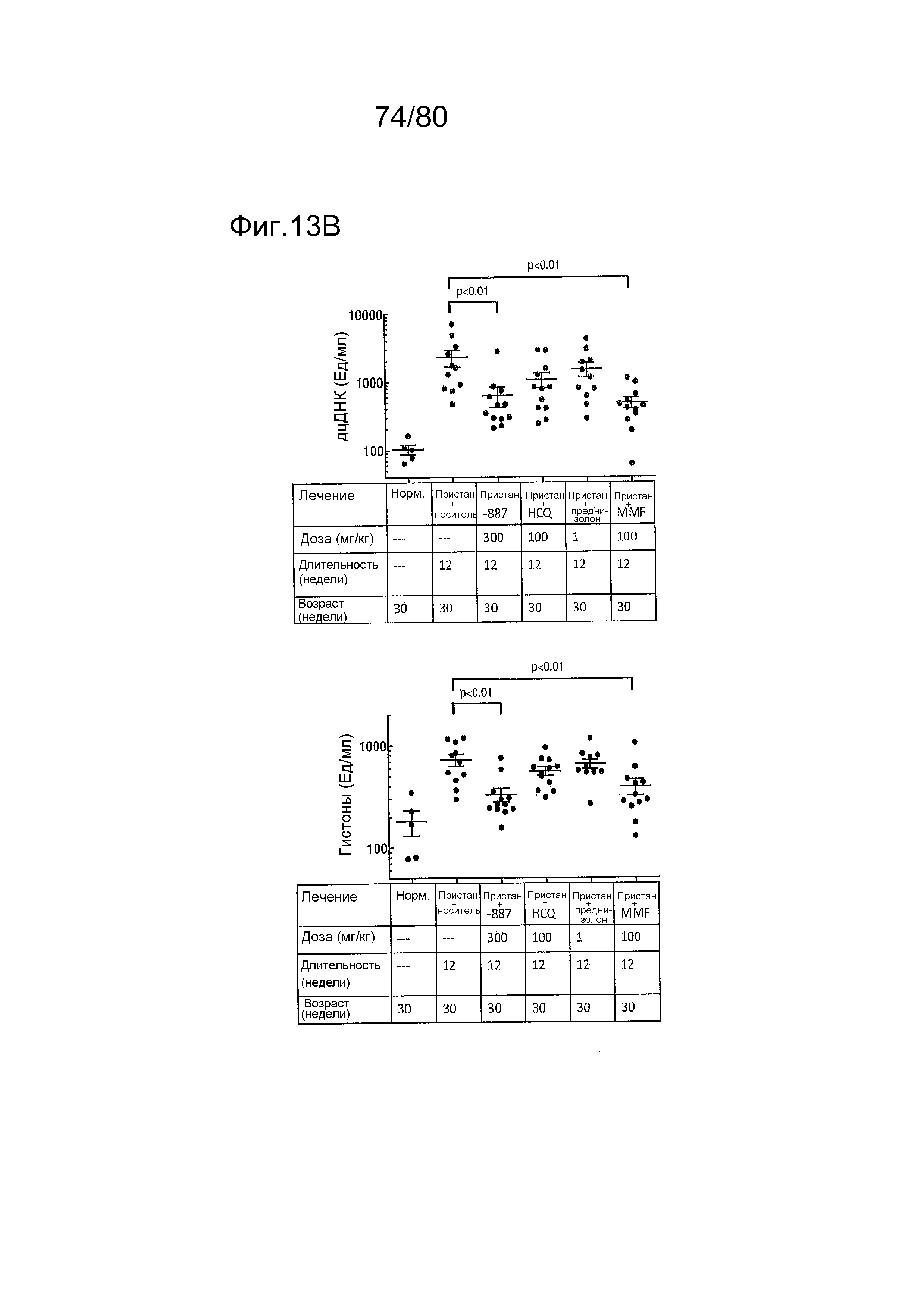
[0058] На фиг. 13 представлены результаты тестирования соединения ER-892887 и трех широко используемых способов лечения волчанки человека в пристане: модель заболевания волчанкой на линии DBA/1. Условные обозначения на фигуре: самкам мышей DBA/1 в возрасте 11 недель вводили интраперитонеально инъекцию 0,5 мл пристана или PBS. Раз в сутки пероральное дозирование с использованием наполнителя (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-892887, 100 мг/кг гидроксихлорохина, 1 мг/кг преднизолона или 100 мг/кг микофенолата начинали через 2 месяца после инъекции пристана и продолжали в течение 3 месяцев лечения. (A) В конце 3 месяца лечения развитие артрита оценивали посредством визуальной оценки отека и воспаления. (B) Мышей умерщвляли после 3 месяцев лечения соединением, и измеряли титры антител к дцДНК, антител к гистонам, антител к Sm/RNP и антител к RiboP в образцах плазмы крови посредством ELISA (статистическую значимость определяли посредством критерия Манна-Уитни). Значениям ELISA, попадающим выше или ниже диапазона калибровочной кривой, присваивали значения, равные наибольшему или наименьшему достоверному измерению, в зависимости от ситуации. (C) Экспрессию IFN-регулируемых генов в цельной крови измеряли посредством qPCR панели после 3 месяцев лечения. Приведен полный список интерферон-регулируемых генов, которые подвергались значительной повышающей регуляции посредством лечения пристаном в сравнении PBS контролями, и отдельные гены, которые значительно снижали посредством ER-892887 (критерий Стьюдента), помечены полужирным начертанием со звездочкой. (D) В этом эксперименте представлены IFN оценки генов, регулируемых пристаном.
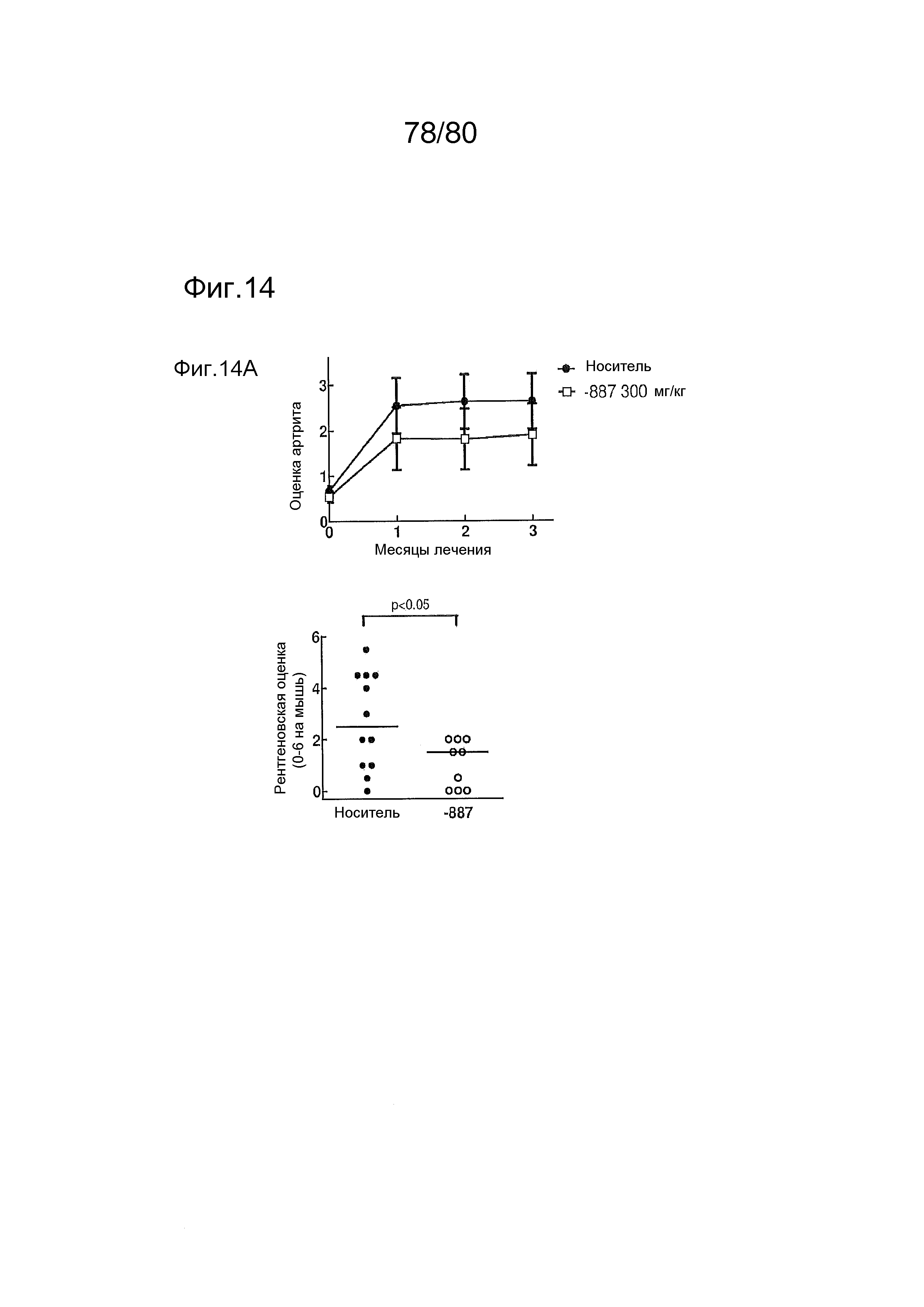
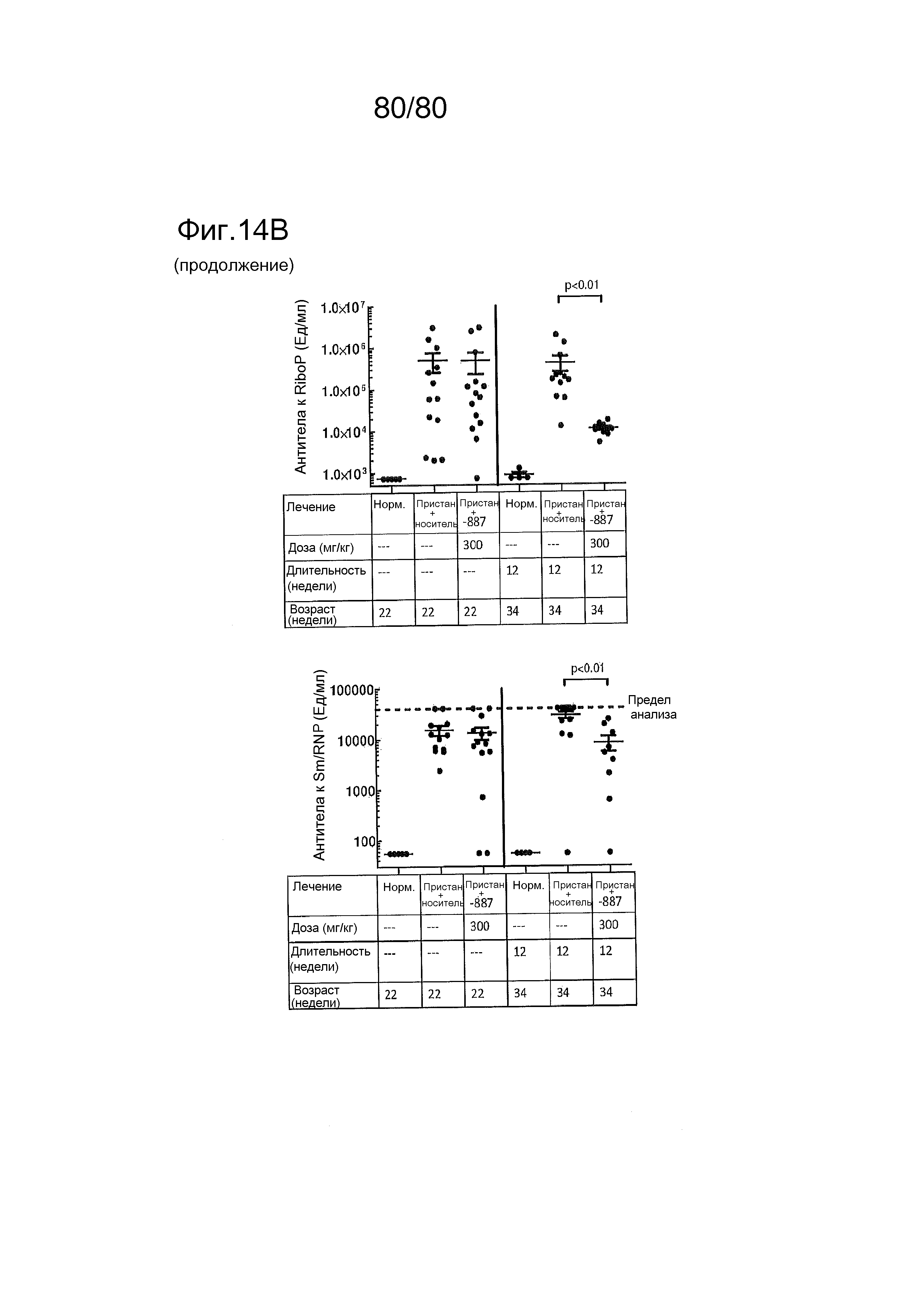
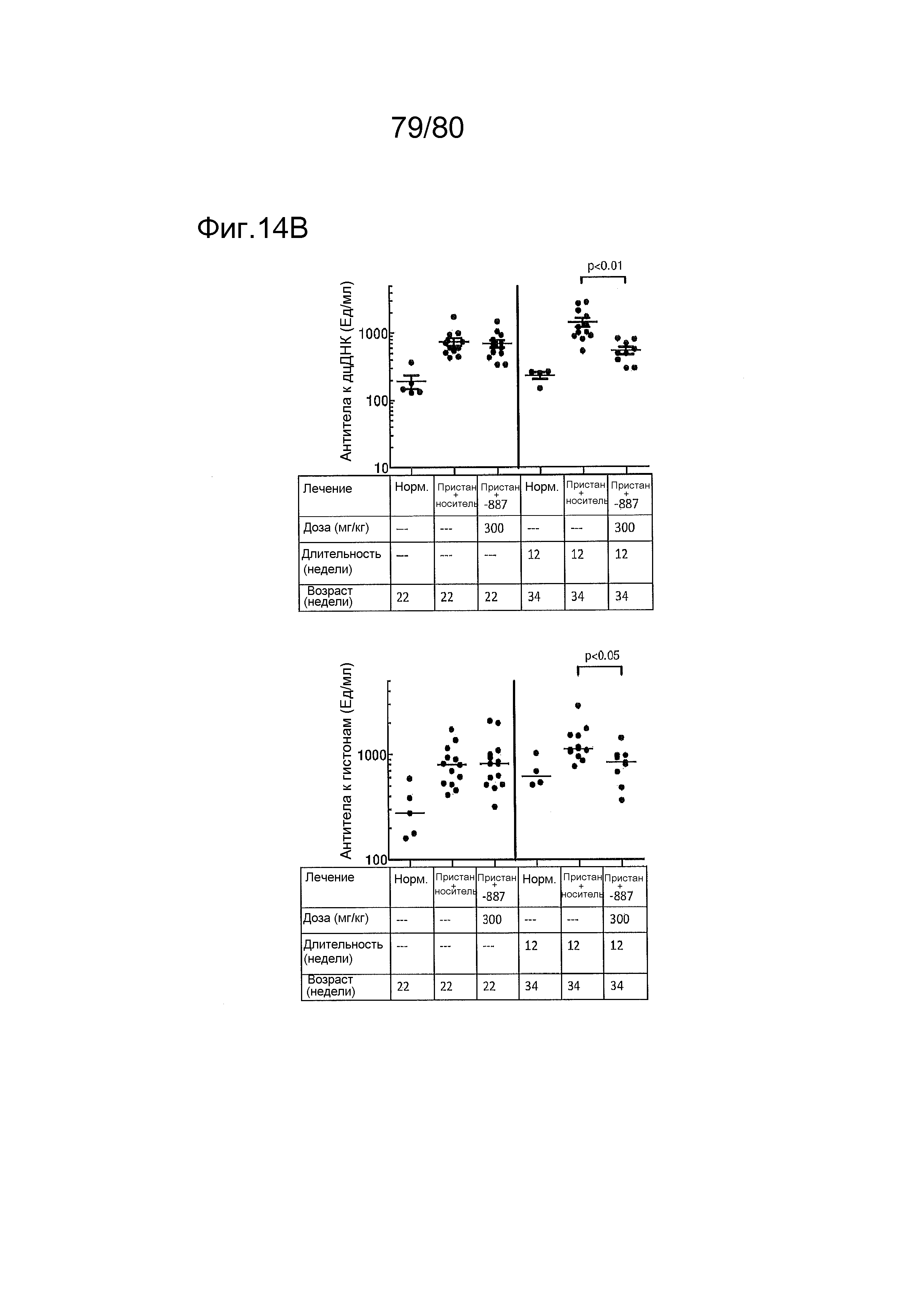
[0059] На фиг. 14 представлен эффект соединения ER-892887, оказываемый на артрит и аутоантитела в пристане: модель заболевания волчанкой на линии DBA/1. Условные обозначения на фигуре: самкам мышей DBA/1 в возрасте 10 недель вводили интраперитонеально инъекцию 0,5 мл пристана или PBS. В возрасте 22 недель мышей рандомизировали в группы с эквивалентными медианными титрами антител к дцДНК и лечили с использованием только наполнителя (Veh; 0,5% метилцеллюлоза) или 300 мг/кг ER-892887 раз в сутки перорально (QD PO). Симптомы артрита (отек и воспаление) регистрировали ежемесячно вслепую с помощью наблюдателей. Всех мышей умерщвляли в возрасте 34 недель (12 недель лечения), и определяли титры аутоантител в плазме крови посредством ELISA. Перед окончанием проводили рентгенологическое исследование лап и оценку повреждения и эрозии костей вслепую с помощью двух аналитиков. (A) Вверху - оценки артрита вычисляли ежемесячно в группах дозирования наполнителя и соединения. (A) Внизу - рентгенологические оценки вычисляли после трех месяцев лечения. (B) Титры аутоантител измеряли в конечных образцах плазмы крови посредством ELISA (статистическую значимость определяли посредством критерия Манна-Уитни).
[0060] ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0061] В дополнение к их роли в качестве врожденных иммунных рецепторов, способных обнаруживать экзогенные («не собственные») патоген-ассоциированные молекулярные паттерны (PAMP - т.е. обнаружение бактериальных LPS с помощью TLR4), Toll-подобные рецепторы млекопитающих (TLR) также способны распознавать эндогенные стимулы (DAMP), высвобождаемые после повреждения тканей самого организма или стресса. Kono, H. и K.L. Rock, How dying cells alert the immune system to danger. Nat Rev Immunol, 2008. 8(4): стр. 279-89. В последнее десятилетие появилось понимание связи между активацией TLR посредством эндогенных («собственных») ассоциированных с опасностью молекулярных паттернов (DAMP) и этиологией аутоиммунных нарушений. В частности, TLR7 можно активировать с помощью одноцепочечной РНК (оцРНК), происходящей как от млекопитающих, так и от вирусных источников, тогда как TLR9 можно активировать посредством ДНК, полученной из млекопитающих, вирусных и бактериальных источников.
[0062] Волчанка отличается аутоантителами, обладающими реактивностью к самой двухцепочечной ДНК (дцДНК) и ассоциированным белкам (гистонам), а также к широкому спектру РНК-ассоцииированных белков, таких как Ro, La, Smith (Sm) и U1 snRNP. Kirou, K.A., et al., Activation of the interferon-alpha pathway identifies a subgroup of systemic lupus erythematosus patients with distinct serologic features and active disease. Arthritis Rheum, 2005. 52(5): стр. 1491-503. Вторым общим признаком волчанки, для которого показана корреляция непосредственно с тяжестью заболевания, является нарушение регуляции экспрессии интерферонов 1-го типа (IFN), в частности IFNα, и соответствующее повышение большой панели IFNα-регулируемых генов в PBMC пациентов с волчанкой (так называемая «генетическая сигнатура IFN 1-го типа»). Kirou, K.A., et al., выше. Основным источником в IFN в крови является специализированный иммуноцит, называемый плазмоцитоидной дендритной клеткой (pDC), которая конститутивно экспрессирует и TLR7, и TLR9.
[0063] Причинную связь между этими двумя характеристиками заболевания, аутоантителами и уровнями IFN, постулировали, когда множество исследовательских групп совместно продемонстрировали, что комплексы антител, выделенные у пациентов с волчанкой, но не у здоровых доноров, способны управлять образованием IFN в pDC в зависимости от TLR7/9 и РНК/ДНК. Means, T.K., et al., Human lupus autoantibody-DNA complexes activate DCs through cooperation of CD32 and TLR9. J Clin Invest, 2005. 115(2): стр. 407-17; Vollmer, J., et al., Immune stimulation mediated by autoantigen binding sites within small nuclear RNAs involves Toll-like receptors 7 and 8. J Exp Med, 2005. 202(11): стр. 1575-85; Savarese, E., et al., U1 small nuclear ribonucleoprotein immune complexes induce type 1 interferon in plasmacytoid dendritic cells through TLR7. Blood, 2006. 107(8): стр. 3229-34. Кроме того, IFN стимулирует повышенную экспрессию TLR7/9 на B-клетках, тем самым усиливая активацию TLR/BCR (B-клеточного рецептора) аутореактивных B-клеток для дифференциации в антителопродуцирующие плазматические клетки. Banchereau, J. and V. Pascual, Type I interferon in systemic lupus erythematosus and other autoimmune diseases. Immunity, 2006. 25(3): стр. 383-92. Таким образом, уровни комплексов аутоантител, содержащих лиганды из нуклеиновых кислот для TLR7/9, управляют провоспалительным циклом и прогрессированием заболевания волчанкой. Сообщалось, что отдельно IFN 1-го типа вызывает у человека симптомы, похожие на волчанку. Ho, V., et al., Severe systemic lupus erythematosus induced by antiviral treatment for hepatitis C. J. Clin Rheumatol, 2008. 14(3): 166-8. Ronnblom L.E., et al. Possible induction of systemic lupus erythematosus by interferon-alpha treatment in a patient with a malignant carcinoid tumor. J. Internal Med. 1990. 227: 207-10. Авторы настоящего изобретения полагают, что вероятно, что фармакологический антагонизм TLR7/8 принесет терапевтическую пользу пациентам с волчанкой посредством нарушения этого провоспалительного цикла, снижая уровни IFN и гася аутоиммунный патологический процесс, опосредованный с помощью pDC и B-клеток.
[0064] Некоторые другие данные намекают на роль TLR7 в этиологии волчанки человека и поддерживают мнение о том, что TLR-рецепторы представляют собой правильные мишени для вмешательства в заболевание. Идентифицированы конкретные полиморфизмы в 3' UTR в TLR7, и показана их корреляция как с повышенной экспрессией TLR7, так и с усиленной IFN генетической сигнатурой. Shen, N., et al., Sex-specific association of X-linked Toll-like receptor 7 (TLR7) with male systemic lupus erythematosus. Proc Natl Acad Sci U S A, 2010. 107(36): стр. 15838-43. Кроме того, противомалярийные лекарственные средства, входящие в стандарт лечения (SOC) волчанки, такие как хлорохин, нарушают передачу сигнала эндосомальных TLR7/9 и ингибируют образование IFNα в PBMC и/или pDC, индуцирумое комплексами оцРНК-рибонуклеопротеина или сывороткой пациента с волчанкой. Кроме того, миелоидные DC и моноциты продуцируют IL-12p40, TNFα и IL-6 после передачи сигнала собственной РНК/TLR8, что указывает на дополнительный вклад TLR8-зависимых провоспалительных цитокинов в этиологию волчанки человека в дополнение к TLR7-управляемому IFN посредством pDC. Vollmer, выше; Gorden, K.B., et al., Synthetic TLR agonists reveal functional differences between human TLR7 and TLR8. J Immunol, 2005. 174(3): стр. 1259-68.
[0065] Также существует доказательство роли TLR в волчанке на мышиной модели. Опубликованные исследования совместно демонстрируют, что делеция одного TLR7 или двух TLR7/9 генов или двойное фармакологическое ингибирование TLR7/9 снижает тяжесть заболевания в четырех различных моделях волчанки. Nickerson, K.M., et al., TLR9 regulates TLR7- and MyD88-dependent autoantibody production and disease in a murine model of lupus. J Immunol, 2010. 184(4): стр. 1840-8; Fairhurst, A.M., et al., Yaa autoimmune phenotypes are conferred by overexpression of TLR7. Eur J Immunol, 2008. 38(7): стр. 1971-8; Deane, J.A., et al., Control of toll-like receptor 7 expression is essential to restrict autoimmunity and dendritic cell proliferation. Immunity, 2007. 27(5): стр. 801-10; Savarese, E., et al., Requirement of Toll-like receptor 7 for pristane-induced production of autoantibodies and development of murine lupus nephritis. Arthritis Rheum, 2008. 58(4): стр. 1107-15. Подчеркивая роль TLR7 в качестве ключевого определяющего фактора аутоиммунности, трансгенная сверхэкспрессия только TLR7 ведет к самопроизвольной аутореактивности против РНК и нефриту у обычно устойчивой к заболеванию линии C57BL/6. Deane, выше.
[0066] С точки зрения безопасности, нет сообщений о том, что мыши с дефицитом одного из TLR7, 8 или 9 или двух 7/8 и 7/9 генов имеют иммунитет, нарушенный до такой степени, чтобы наблюдать инфекцию оппортунистическими патогенами. Аналогичным образом, SOC противомалярийные средства считают в целом безопасными и эффективными для длительного использования у человека, для того чтобы управлять неожиданными обострениями заболевания волчанкой, в дозах, для которых прогнозируют по меньшей мере частичное ингибирование передачи сигнала TLR7/9. Lafyatis, R., M. York, and A. Marshak-Rothstein, Antimalarial agents: closing the gate on Toll-like receptors? Arthritis Rheum, 2006. 54(10): стр. 3068-70; Costedoat-Chalumeau, N., et al., Low blood concentration of hydroxychloroquine is a marker for and predictor of disease exacerbations in patients with systemic lupus erythematosus. Arthritis Rheum, 2006. 54(10): стр. 3284-90. Фактически, за исключением повышенной восприимчивости к грамположительным бактериальным инфекциям в детстве и в меньшей степени в зрелости, люди с сильно нарушенными путями передачи сигналов TLR и IL-1R (недостаточность MyD88 или IRA-4), тем не менее, являются здоровыми и в достаточной мере поддерживают механизмы защиты организма-хозяина. Casanova, J.L., L. Abel, and L. Quintana-Murci, Human TLRs and IL-1Rs in Host Defense: Natural Insights from Evolutionary, Epidemiological, and Clinical Genetics. Annu Rev Immunol, 2010.
[0067] На основе этой и другой информации, авторы настоящего изобретения полагают, что в частности TLR7 является хорошо проверенной мишенью в контексте доклинических моделей SLE на мышах. Как генетические, так и функциональные исследования у человека подтверждают гипотезу о том, что антагонизм путей TLR7 и/или TLR8 будет приносить терапевтическую пользу пациентам с волчанкой. Кроме того, как исследования делеции генов TLR у мышей, так и длительное использование противомалярийных средств у человека указывает на то, что можно выполнять фармакологическую супрессию TLR7, 8 и/или 9 без значительного нарушения защиты организма-хозяина.
[0068] Следовательно, можно ожидать, что соединение, которое вызывает супрессию TLR7, TLR8 или и TLR7 и TLR8, действует в качестве терапевтического или профилактического средства для SLE или волчаночного нефрита.
[0069] Авторы настоящего изобретения обнаружили соединения, которые подавляют TLR 7 и/или 8, и, следовательно, ожидают, что они обладают профилактическим или терапевтическим эффектом, оказываемым на SLE или волчаночный нефрит. Соединения и способы по раскрытию описаны в настоящем документе.
[0070] II. Терапевтическое использование
[0071] Уровни доз активных ингредиентов в фармацевтических композициях по изобретению можно варьировать для того, чтобы получать количество активного соединения(й), которое достигает желаемого терапевтического ответа для конкретного пациента, композиции и способа введения. Выбранный уровень дозы зависит от активности конкретного соединения, пути введения, тяжести соединения, подлежащего лечению, и состояния или предшествующей медицинской истории пациента, подлежащего лечению. Дозы определяют для каждого конкретного случая с использованием стандартных способов в соответствии с уникальными факторами пациента, включая возраст, массу, общее состояние здоровья и другие факторы, которые могут влиять на эффективность соединения(й) по изобретению. В целом, в случае перорального введения, THPP соединение согласно настоящему изобретению или его фармацевтически приемлемую соль вводят в дозе приблизительно от 30 мкг до 100 мкг, в дозе от 30 мкг до 500 мкг, в дозе от 30 мкг до 10 г, в дозе от 100 мкг до 5 г или в дозе от 100 мкг до 1 г на одного взрослого в сутки. В случае введения инъекцией, его вводят в дозе приблизительно от 30 мкг до 1 г, в дозе от 100 мкг до 500 мг или в дозе от 100 мкг до 300 мг на одного взрослого в сутки. В обоих случаях дозу вводят за раз или делят на несколько введений. Дозу можно моделировать, например, с использованием программы Simcyp®.
[0072] Не предполагают, что введение соединения по изобретению млекопитающему, включая человека, ограничено конкретным способом введения, дозой или частотой дозирования. Настоящее изобретение рассматривает все способы введения, включая пероральный, интраперитонеальный, внутримышечный, внутривенный, внутрисуставный, внутрь повреждения, подкожный или какой-либо другой путь, достаточный для того, чтобы предоставить надлежащую дозу для того, чтобы предотвращать или лечить SLE или волчаночный нефрит. Одно или несколько соединений по изобретению можно вводить млекопитающему однократной дозой или множественными дозами. Когда вводят множество доз, дозы могут отделять друг от друга, например, несколько часов, одни сутки, одна неделя, один месяц или один год. Следует понимать, что для какого-либо конкретного субъекта конкретные схемы дозирования следует корректировать с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением человека, вводящего или наблюдающего за введением фармацевтической композиции, которая содержит соединение по изобретению.
[0073] Для клинических применений, соединение по настоящему изобретению обычно можно вводить внутривенно, подкожно, внутримышечно, в ободочную кишку, назально, интраперитонеально, ректально, трансбуккально или перорально. Композиции, содержащие по меньшей мере одно соединение по изобретению, которое пригодно для использования у человека или в ветеринарии, можно представлять в формах, допускающих введение подходящим путем. Эти композиции можно получать в соответствии с обычными способами, используя один или несколько фармацевтически приемлемых адъювантов или эксципиентов. Адъюванты включают, среди прочего, разбавители, стерильные водные среды и различные нетоксичные органические растворители. Приемлемые носители или разбавители для терапевтического использования хорошо известны в фармацевтической области и описаны, например, в Remington: The Science and Practice of Pharmacy (20th ed.), ed. A. R. Gennaro, Lippincott Williams & Wilkins, 2000, Philadelphia, и Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988, 1999, Marcel Dekker, New York. Композиции можно представлять в форме таблеток, пилюль, гранул, порошков, водных растворов или суспензий, инъецируемых растворов, эликсиров или сиропов, и композиции необязательно могут содержать одно или несколько средств, выбранных из группы, включающей подсластители, ароматизаторы, красители и стабилизаторы, чтобы получать фармацевтически приемлемые препараты.
[0074] Выбор наполнителя и содержание активного вещества в наполнителе обычно определяют в соответствии с растворимостью и химическими свойствами продукта, конкретным способом введения и положениями, подлежащими наблюдению в фармацевтической практике. Например, эксципиенты, такие как лактоза, цитрат натрия, карбонат кальция и фосфат дикальция, и средства для улучшения распадаемости, такие как крахмал, альгиновые кислоты и определенные комплексные силикаты, в комбинации со смазывающими средствами (например, стеарат магния, лаурилсульфат натрия и тальк) можно использовать для получения таблеток. Для того чтобы получать капсулу, благоприятно использовать лактозу и высокомолекулярные полиэтиленгликоли. Когда используют водные суспензии, они могут содержать эмульгирующие средства, которые содействуют суспензии. Также можно использовать разбавители, такие как сахароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин, хлороформ или их смеси.
[0075] Для парентерального введения используют эмульсии, суспензии или растворы композиций по изобретению в растительном масле (например, кунжутном масле, масле земляного ореха или оливковом масле), водно-органические растворы (например, вода и пропиленгликоль), инъецируемые органические сложные эфиры (например, этилолеат) или стерильные водные растворы фармацевтически приемлемых солей. Растворы солей композиций по изобретению в частности можно использовать для введения посредством внутримышечной или подкожной инъекции. Водные растворы, которые включают растворы солей в чистой дистиллированной воде, можно использовать для внутривенного введения при условии, что (i) их pH корректируют соответствующим образом, (ii) их надлежащим образом забуферивают и делают изотоническими с использованием достаточного количества глюкозы или хлорида натрия, и (iii) их стерилизуют нагреванием, облучением или микрофильтрованием. Подходящие композиции, содержащие соединение по изобретению, можно растворять или суспендировать в подходящем носителе для использования в небулайзере или аэрозоле суспензии или раствора, или можно абсорбировать или адсорбировать на подходящем твердом носителе для использования в ингаляторе сухого порошка. Твердые композиции для ректального введения включают суппозитории, формулированные в соответствии с известными способами и содержащие по меньшей мере одно соединение по изобретению.
[0076] Дозированные составы соединения по раскрытию, подлежащие использованию для терапевтического введения, должны быть стерильными. Стерильности легко достигают посредством фильтрования через стерильные мембраны (например, мембраны 0,2 мкм) или посредством других стандартных способов. Составы обычно хранят в лиофилизированной форме или в виде водного раствора. pH композиций по этому изобретению в некоторых вариантах осуществления, например, может составлять между 3 и 11, может составлять между 5 и 9 или может составлять между 7 и 8, включительно.
[0077] Несмотря на то, что один путь введения опосредован пероральным введением дозы, можно использовать другие способы введения. Например, композиции можно вводить подкожно, внутривенно, внутримышечно, в ободочную кишку, ректально, назально или интраперитонеально в различных дозированных формах, таких как суппозитории, имплантированные гранулы или маленькие цилиндры, аэрозоли, пероральные дозированные составы и топические составы, такие как мази, капли и кожные пластыри. Соединения по вариантам осуществления изобретения можно встраивать в профилированные изделия, такие как импланты, включая в качестве неограничивающих примеров клапаны, стенты, трубки и протезы, в которых можно использовать инертные материалы, такие как синтетические полимеры или силиконы, (например, композиции Silastic®, силиконовый каучук или другие коммерчески доступные полимеры). Такие полимеры могут включать поливинилпирролидон, пирановые сополимеры, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксид-полилизин, замещенный пальмитоиловыми остатками. Кроме того, соединение по изобретению можно сочетать с классом биоразрушаемых полимеров, которые можно использовать для достижения контролируемого высвобождения лекарственного средства, например, полимолочная кислота, полигликолевая кислота, сополимеры полимолочной и полигликолевой кислоты, полиэпсилонкапролактон, полигидроксимасляная кислота, сложные полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и сшитые или амфипатические блок-сополимеры гидрогелей.
[0078] Соединение по изобретению также можно вводить в форме липосомальных систем доставки, таких как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы можно формировать из различных липидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединение по изобретению также можно доставлять с использованием антител, фрагментов антител, факторов роста, гормонов или других направленных фрагментов, с которыми сопрягают молекулы соединений (например, см. Remington: The Science and Practice of Pharmacy, см. выше), включая конъюгацию соединения по варианту осуществления изобретения с компонентами крови in vivo.
[0079] III. Синтез
[0080] Предоставлены общие и конкретные пути синтеза, которые авторы настоящего изобретения находят эффективными для получения вариантов осуществления по изобретению. Специалисты в данной области могут признать, что определенные вариации или модификации этих процедур также могут вести к синтезу соединений в соответствии с изобретением. В некоторых ситуациях фразу «такой как» используют для того, чтобы перечислять различные альтернативы для более общих соединений или структур. Понятно, что «такой как» не следует толковать в качестве ограничения, и что его значение соответствует «включает, например, но не ограничиваясь этим».
[0081] Определенные условия являются общими для конкретных примеров, представленных ниже. Микроволновое нагревание осуществляли с использованием микроволнового реактора Biotage® Emrys Liberator или Initiator. Колоночную хроматографию осуществляли с использованием системы флэш-хроматографии Biotage® SP4. Удаление растворителя осуществляли с использованием или роторного испарителя Büchii, или центробежного испарителя Genevac®. ЯМР-спектры регистрировали при 400 МГц на спектрометре Varian Unity® с использованием дейтерированных растворителей. Химические сдвиги приводят относительно остаточного протонированного растворителя.
[0082] Тонкослойную хроматографию осуществляли на стеклянных пластинах Whatman®, предварительно покрытых 0,25-мм слоем силикагеля с использованием различных соотношений одного или нескольких из следующих растворителей: этилацетат, гептан, дихлорметан или метанол.
[0083] Аналитическую LC/MS осуществляли на системе Waters Aequity™ с использованием колонки XBridge™ C18 1,7 мкм 2,1×50 мм. Растворители A и B представляют собой воду с 0,1% муравьиной кислотой и ацетонитрил с 0,1% муравьиной кислотой, соответственно. Общее время способа 5 минут с от 5% B до 99% B за 4 минуты при скорости потока 0,3 мл/мин. Данные масс-спектрометрии получали на Waters SQD из 100-2000 а.е.м. в режиме положительного электрораспыления. Эти условия обозначают далее как «условия I».
[0084] Альтернативно, подтверждение чистоты и массы осуществляли на системе Waters Autopurification с использованием колонки XBridge™ C8 3,5 мкм 4,6×50 мм. Растворители A и B представляют собой воду с 0,1% муравьиной кислотой и ацетонитрил с 0,1% муравьиной кислотой, соответственно. Общее время способа 6 минут с от 10% B до 95% B за 5 минут при скорости потока 2,5 мл/мин. Данные масс-спектрометрии получали на Micromass ZQ™ из 130-1000 а.е.м. в режиме положительного электрораспыления. Эти условия обозначают далее как «условия II».
[0085] Препаративную LC/MS с обращенной фазой осуществляли на системе Waters Autopurification с использованием колонки XBridge™ C8 5 мкм, 19×100 мм. Растворители A и B представляют собой воду с 0,1% муравьиной кислотой и ацетонитрил с 0,1% муравьиной кислотой, соответственно. Общее время способа 12 минут с от 30% B до 95% B за 10 минут при скорости потока 20 мл/мин. Данные масс-спектрометрии получали на Micromass ZQ™ из 130-1000 а.е.м. в режиме положительного электрораспыления. Эти условия обозначают далее как «условие III».
[0086] Разрешение рацемических соединений препаративной ВЭЖХ осуществляли с использованием одной из следующих хиральных колонок: Chiralpak® IA (5 см × 50 см или 2 см × 25 см), Chiralpak® AD (2 см × 25 см) или Chiralcel® OD (2 см × 25 см). Соотношения энантиомеров в очищенных соединениях определяли посредством ВЭЖХ анализа на 0,45 см × 25 см колонке, содержащей ту же стационарную фазу (TA, AD или OD).
[0087] Общие способы и эксперименты для получения соединений по настоящему изобретению изложены ниже. В определенных случаях конкретное соединение описано в качестве примера. Однако следует принимать во внимание, что в каждом случае ряд соединений по настоящему изобретению получали в соответствии со схемами и экспериментами, описанными ниже. Для тех соединений, где доступны данные ЯМР и/или масс-спектрометрии, данные представляют сразу после описания синтеза соединения или в таблице 11.
[0088] В настоящем документе используют следующие сокращения:
Определения: следующие сокращения имеют указанные значения:
HATU: N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония гексафторфосфат
DIEA: N,N-диизопропилэтиламин
DMAP: 4-диметиламинопиридин
TEA: триэтиламин
DMF: N,N-диметилформамид
NMP: N-метилпирролидин
THF: тетрагидрофуран
DCM: дихлорметан
MTBE: метил-трет-бутиловый эфир
TFA: трифторуксусная кислота
EDC: 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид
NaOH: гидроксид натрия
NaBH4: борогидрид натрия
IPA: изопропиловый спирт или изопропанол
EtOH: этанол
EtOAc: этилацетат
TLR: Toll-подобный рецептор
DAMP: ассоциированный с опасностью молекулярный паттерн
PAMP: патоген-ассоциированный молекулярный паттерн
IFN: интерферон
pDC: плазмоцитоидная дендритная клетка
PBMC: мононуклеарная клетка периферической крови
qPCR: количественная полимеразная цепная реакция
TLDA: Taqman® Low Density Array
PBS: фосфатно-солевой буфер
оцРНК: одноцепочечная РНК
дцДНК: двухцепочечная ДНК
SOC: стандарт лечения
R848: резиквимод
HCQ: гидроксихлорохин
HCl: соляная кислота
водн.: водный
AcOH: уксусная кислота
PhNTf2: N-фенилтрифторметансульфонимид
Tf: трифторметансульфонат
MeOH: метанол
ee: энантиомерный избыток
HEPES: 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота
NH4Cl: хлорид аммония
[0089] Пример 1
[0090] Общие способы синтеза
[0091] Соединения по изобретению получали в соответствии с общей схемой синтеза, представленной ниже:
[0092]
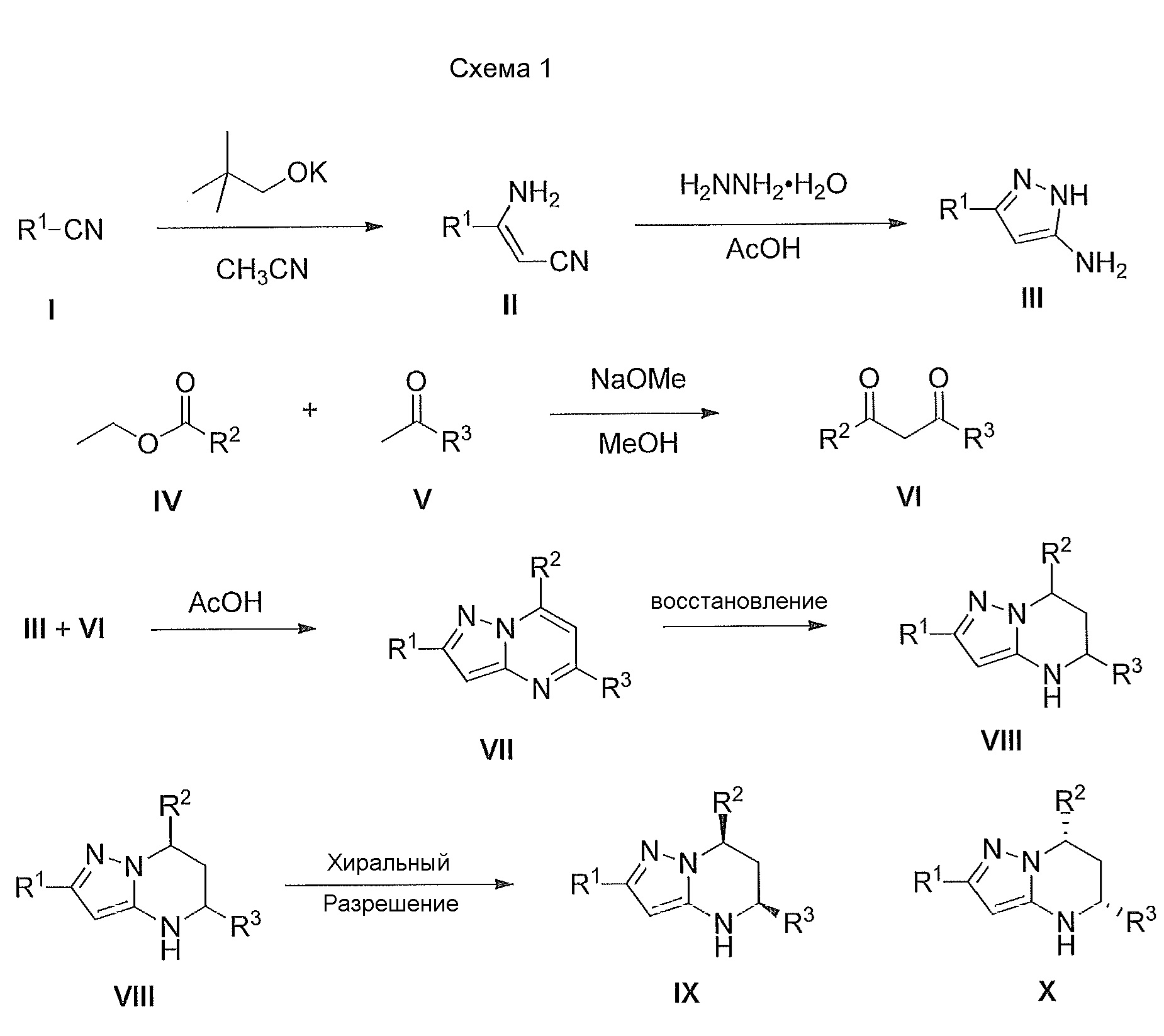
[0093] При получении нескольких примеров используют путь, изображенный на схеме 1. Традиционно, коммерчески доступный нитрил, такой как ароматический, гетероциклический, алифатический или гетероалифатический нитрил (I), подвергают воздействию ацетонитрила в присутствии сильного протонного органического основания, такого как т-амилат калия в нейтральном растворителе, таком как толуол, при 0°C или комнатной температуре, чтобы предоставлять цианоимин (II). После этого проводят реакцию получаемого имина с гидразином в присутствии органической кислоты, такой как уксусная кислота, чтобы предоставить ключевое промежуточное соединение или 3-замещенный-5-аминопиразол (III). Правую половину этих примеров получают посредством конденсации Клайзена с использованием ароматического или гетероароматического ацилкетона (V) с замещенным сложным ацетиловым эфиром, таким как трифтор-, дифтор- или незамещенный сложный ацетиловый эфир (IV), чтобы формировать дикетон (VI).
[0094] Конденсация двух промежуточных соединений III и VI предоставляет 2,3-b-пиразолопиримидин в присутствии слабой органической кислоты, такой как уксусная кислота. В некоторых случаях 5-замещенные-3-аминопиразолы (III) коммерчески доступны, и их используют в этой реакции непосредственно. Восстановление, для того чтобы формировать рацемический 5,7-цис-тетрагидропиразолопиримидин (VIII), осуществляют с использованием источника гидрида или посредством каталитической гидрогенизации. Разрешение посредством хиральной высокоэффективной жидкостной хроматографии или с использованием диастереомерной кристаллизации предоставляет конечные желаемые продукты IX и X. Во многих примерах рацемическую смесь соединения VIII оценивали биологически без дополнительной очистки посредством хирального разрешения.
[0095]
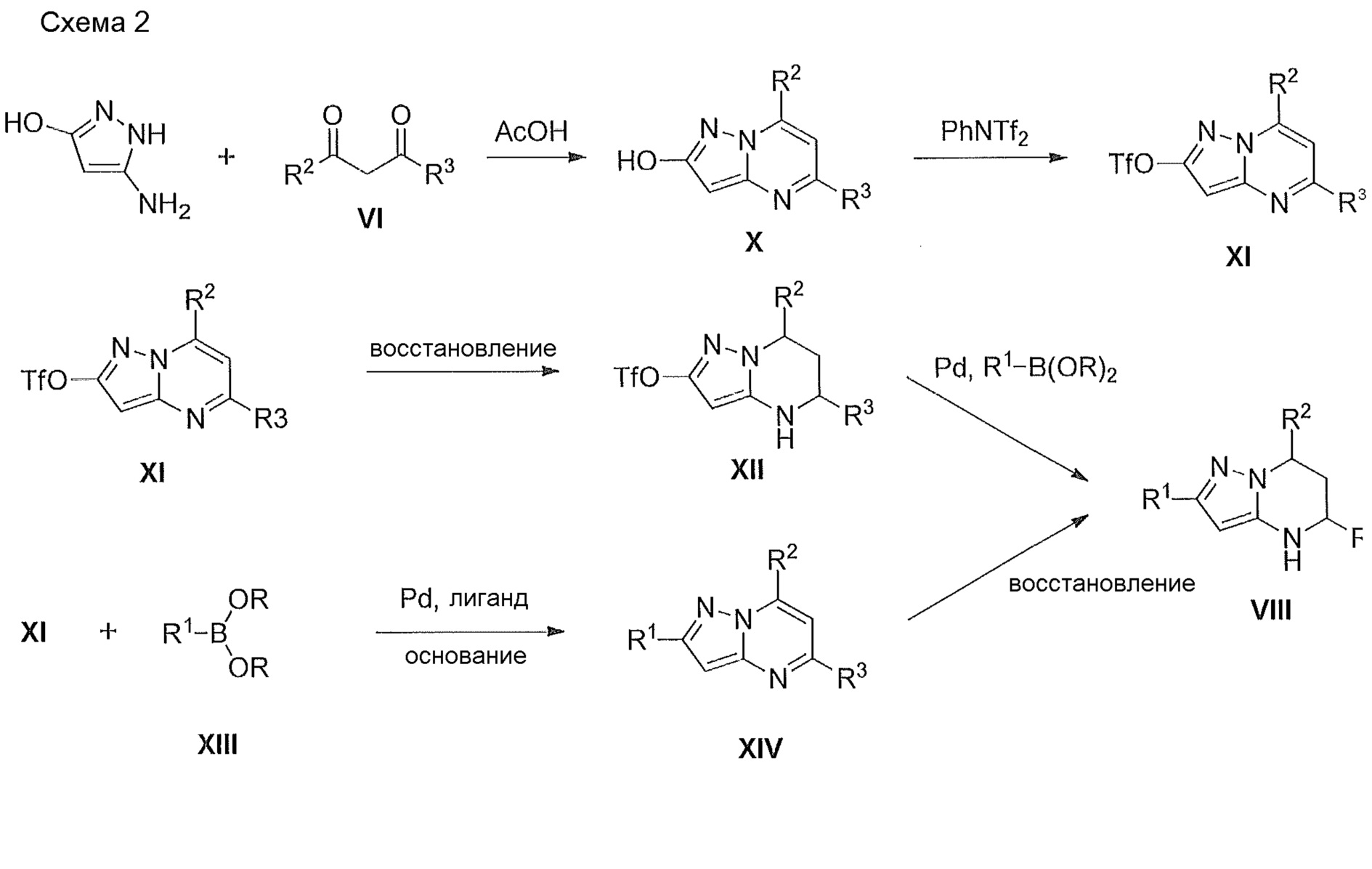
[0096] Схема 2 иллюстрирует альтернативный путь для различных соединений по изобретению, начиная с коммерчески доступного 3-гидрокси-5-аминопиразола, конденсированного с дикетоном VI, чтобы предоставлять 2-гидроксипиразолопиримидин X в качестве ключевого промежуточного соединения. Обработка X с использованием подходящего реактива для трифторметилсульфонилирования предоставляет промежуточное соединение трифлата XI. Восстановление трифлата XI, за которым следует перекрестное сочетание Сузуки, с использованием различных боронатов, где R1 является собой ароматическим, гетероароматическим, аллиловым, гетероаллиловым или алифатическим, дает рацемический конечный продукт VIII. Альтернативно, трифлат XI сначала подвергают перекрестному сочетанию Сузуки, и затем промежуточное соединение XIV восстанавливают до рацемического конечного продукта VIII. Как на схеме 1, рацемическое соединение VIII разрешают на составляющие его энантиомеры посредством хиральной хроматографии или посредством диастереомерной кристаллизации.
[0097]
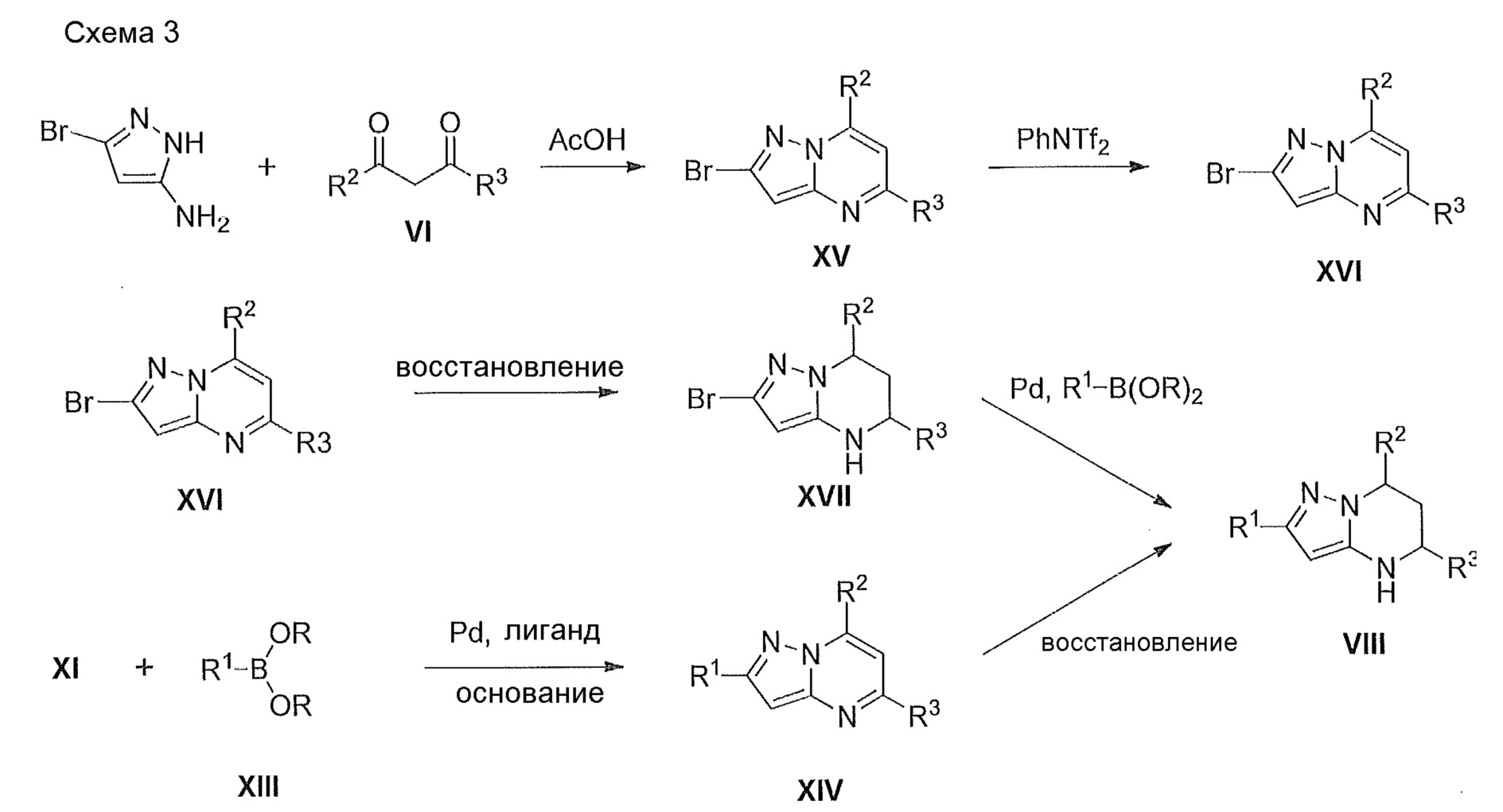
[0098] Путь, используемый на схеме 3, представляет собой модификацию схемы 2, в которой бромид замещает трифлат, т.е. группу трифлата в соединении XI заменяют на бромид, как показано в XVI. 3-Бром-5-аминопиразол синтезировали в соответствии со способами из литературы (Moy, et al. J. Med. Chem. 2010, 53, 1238). Условия для перекрестного сочетания Сузуки по существу являются такими же, как на схеме 2.
[0099]
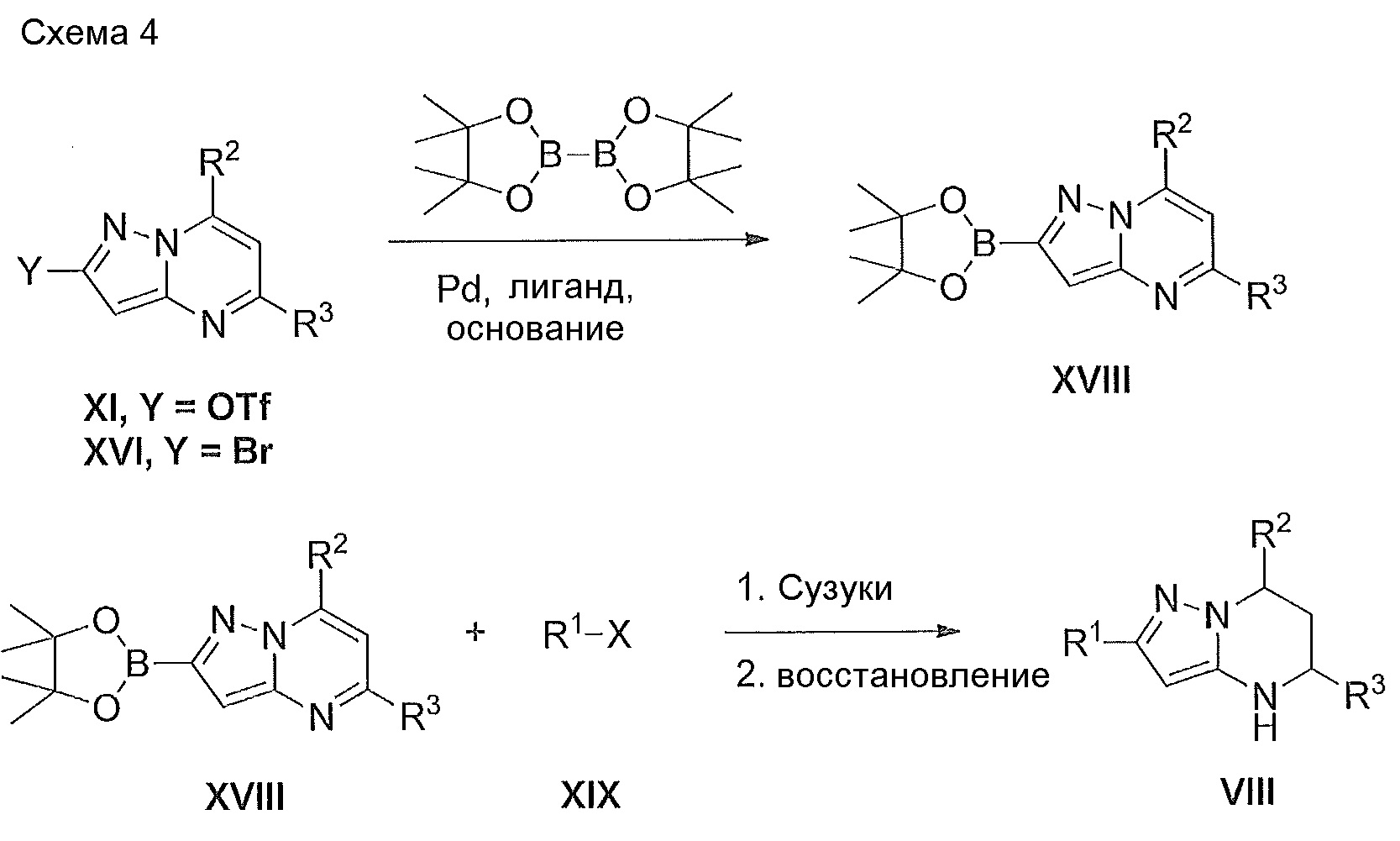
[0100] Путь на схеме 4 изменяет направление перекрестного сочетания Сузуки для исходных материалов посредством образования сложного эфира бороната на ключевом пиразолопиримидине, которое следует за конденсацией подходящего электрофила (XIX, X=OTf, Cl, Br, I), для получения VIII после восстановления.
[0101]
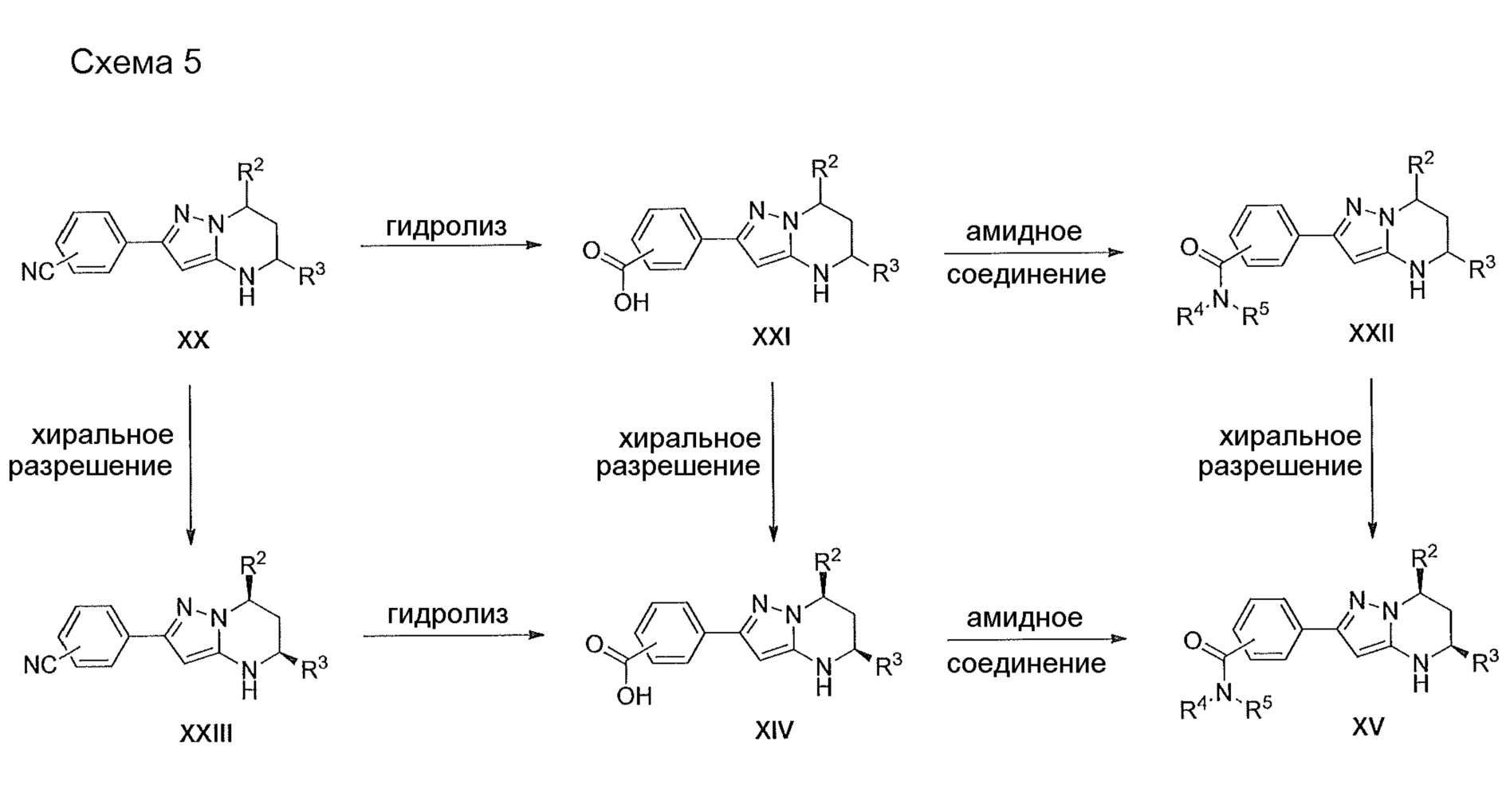
[0102] На схеме 5 изображены конечные стадии синтеза нескольких примеров общей структуры XV, представленных в настоящем документе. Соответственно, используемое общее промежуточное соединение представляет собой бензонитрил XX, типично замещенный в 3 или 4 положении относительно фрагмента пиразолопиримидина, который превращают в бензойную кислоту XXI через кислый или основный гидролиз. Сочетание XXI с подходящим амином (R4R5NH) предоставляет рацемический амид XXII, который разрешают в его чистый энантиомер XV. Альтернативно, хиральное разрешение можно осуществлять или на этапе бензонитрила (XX->XXIII) или бензойной кислоты (XXI->XXIV), и энантиочистые материалы преобразуют схожим образом в конечный продукт XV.
[0103] Примеры синтеза - раздел A
[0104]
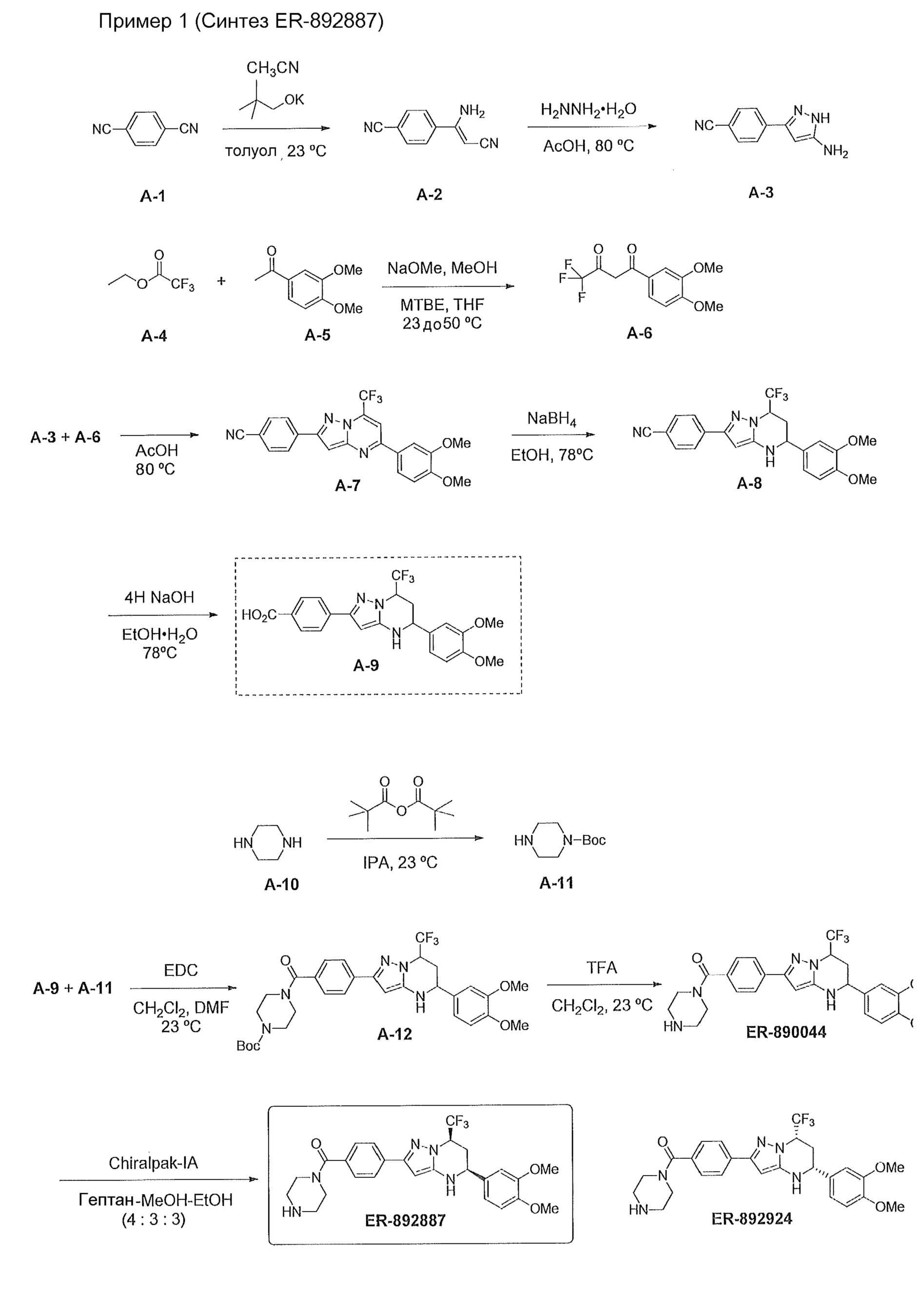
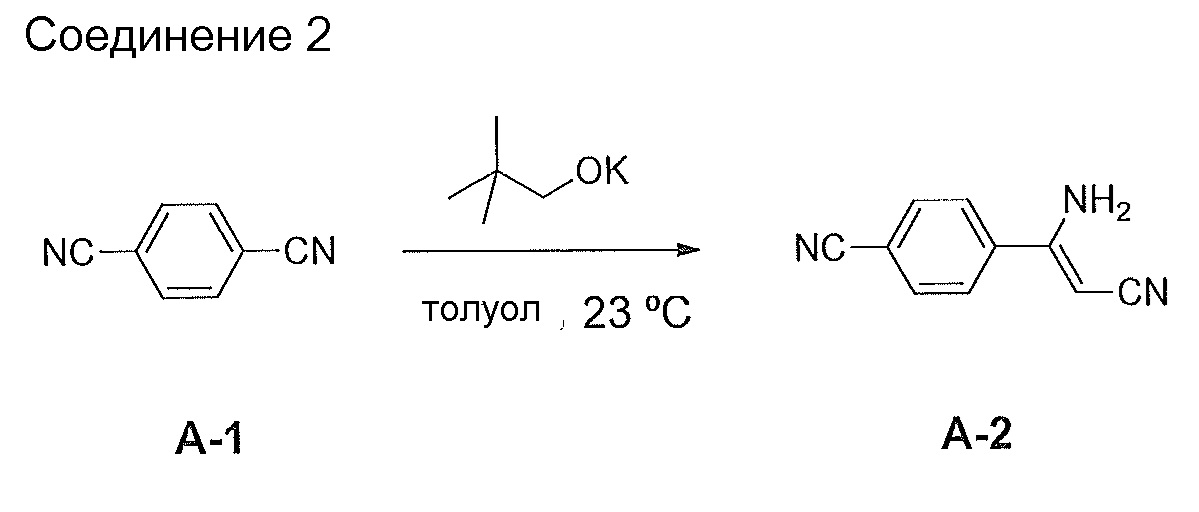
[0105] В 5-л колбу, загруженную терефталонитрилом (300,0 г, 2,34 моль), добавляли толуол (1,80 л, после чего следовал ацетонитрил (245 мл) при комнатной температуре. Добавляли 24,2% масс. т-амилата калия (1,672 л, 1,338 кг, 2,58 моль), при этом контролируя температуру <30°C в течение периода в 1 час.
[0106] Смесь (густая паста желтого цвета) оставляли остывать до 20°C и перемешивали в течение 16 часов, по истечении этого времени добавляли воду (0,9 л) в энергично перемешиваемую смесь до тех пор, пока твердое вещество желтого цвета не становилось твердым веществом светло-коричневого цвета. Смесь фильтровали через стеклянный фильтр, получаемое твердое вещество промывали водой (1,8 л), после чего следовал IPA (1,8 л), собирали и сушили под вакуумом при 40°C в течение 46 часов. 374,1 г соединения A-2 (2,21 моль, 94% выход) получали в виде порошка светло-коричневого цвета.
[0107] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 4,26 (с, 1H) 7,72-7,77 (м, 2H) 7,77-7,82 (м, 2H).
[0108] MS (Μ+H+) 170,1.
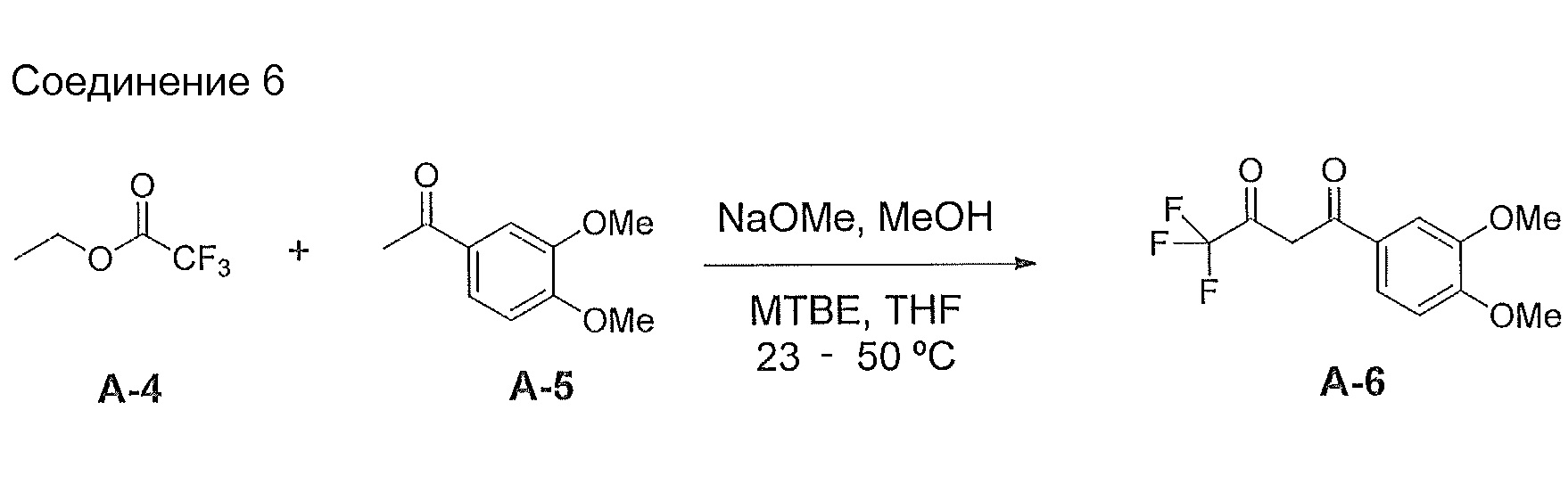
[0109] В 5-л колбу загружали 1-(3,4-диметоксифенил)этанон (487 г, 2,70 моль), добавляли THF (487 мл), после чего следовал MTBE (1,46 л). Добавляли этилтрифторацетат (516 мл, 4,33 моль), после чего следовал 25% масс. раствор метоксида натрия (701 г, 3,24 моль) в метаноле при комнатной температуре. Получаемую смесь нагревали вплоть до 40°C и перемешивали при 40-43°C в течение 16 ч, по истечении этого времени реакционную смесь охлаждали до 10°C и выливали в предварительно охлажденную (10°C) смесь MTBE (2,44 л) и 20% масс. лимонной кислоты (1,217 г, 1,279 моль), при этом поддерживая внутреннюю t <20°C. После 30 мин энергичного перемешивания, органический слой отделяли и последовательно промывали два раза с использованием 20% масс. хлорида натрия (1,46 л) и затем концентрировали приблизительно до 1/3 объема.
[0110] Получаемый остаток разводили в MTBE (3,90 л), промывали водой (1,95 л) и концентрировали приблизительно до 1/3 объема, в течение этого времени значительное количество твердого продукта выпадало в осадок из раствора. Получаемую смесь превращали в азеотропную смесь с двукратным высушиванием с использованием н-гептана (1,95 л). Добавляли н-гептан (877 мл) и MTBE (97 мл) и получаемую смесь нагревали до 50°C, оставляли остывать до 15°C в течение периода 2 часов и затем фильтровали осадок. Получаемое твердое вещество коричневого цвета сушили в вакуумной печи (40°C в течение 16 ч, затем 20°C в течение 48 ч), чтобы предоставлять 714,3 г соединения A-6 (2,59 моль, 96% выход).
[0111] 1H ЯМР (400 МГц, хлороформ-d) δ м.д. 3,97 (с, 3H) 3,98 (с, 3H) 6,53 (с, 1H) 6,94 (д, 7=8,51 Гц, 1H) 7,48 (д, 7=2,10 Гц, 1H) 7,60 (дд, 7=8,51, 2,10 Гц, 1H).
[0112] MS (M+H+) 277,2.
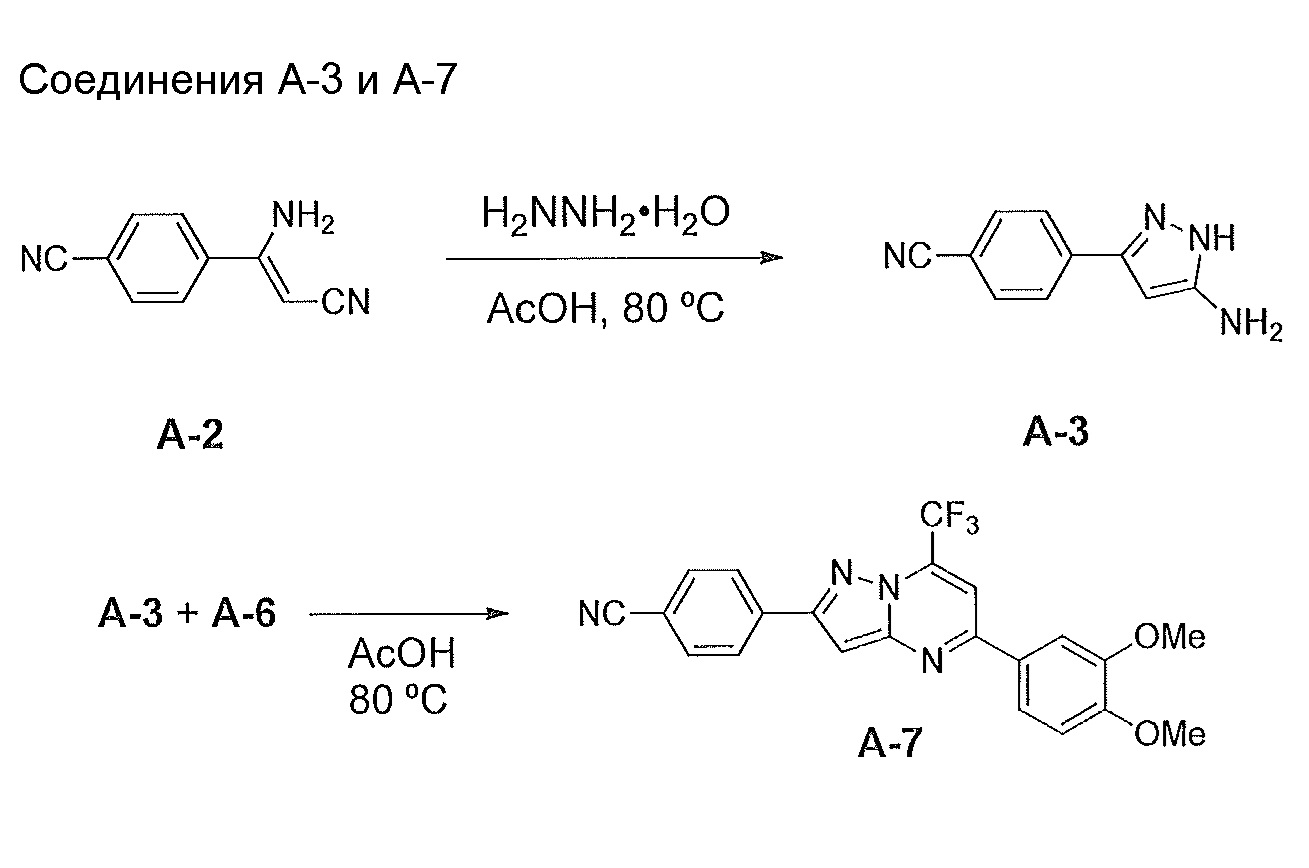
[0113] Соединение A-2 (250 г, 1,478 моль) суспендировали в уксусной кислоте (1,0 л) при перемешивании при комнатной температуре, по истечении этого времени добавляли гидразин (72,5 мл, 1,478 моль) в воде (75 мл) с повышением внутренней температуры до 42°C. Получаемую суспензию нагревали до 70°C и поддерживали при этой температуре в течение 5 мин, в это время суспензия почти превращалась в прозрачную смесь и затем снова становилась мутной, чтобы предоставлять соединение A-3 in situ.
[0114] Толуол (1,50 л) быстро добавляли в приведенную выше смесь (температура падала до 48°C), после чего следовало соединение A-6 (408 г, 1,478 моль). Получаемую смесь нагревали до 80°C, в это время накапливалось значительное количество твердого вещества желтого цвета, образуя очень густую пасту. После поддержания реакции при 80°C в течение 30 мин, смесь охлаждали до 50°C, и ледяную воду (1,50 л) добавляли при энергичном перемешивании. Желтый осадок собирали посредством фильтрования и промывали водой (3,75 л), водой (2,5 л) и IPA (2,50 л). Получаемое твердое вещество желтого цвета сушили под вакуумом (40°C) в течение 3 суток, чтобы предоставлять 464 г соединения A-7 (1,09 моль, 74% выход).
[0115] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 3,90 (с, 4H) 3,95 (с, 4H) 7,10 (д, J=8,54 Гц, 1H) 7,30 (с, 1H) 7,83 (д, J=8,01 Гц, 2H) 7,89 (д, J=2,02 Гц, 1H) 7,92 (с, 1H) 8,23 (д, J=8,66 Гц, 2H).
[0116] MS (M+H+) 425,4.
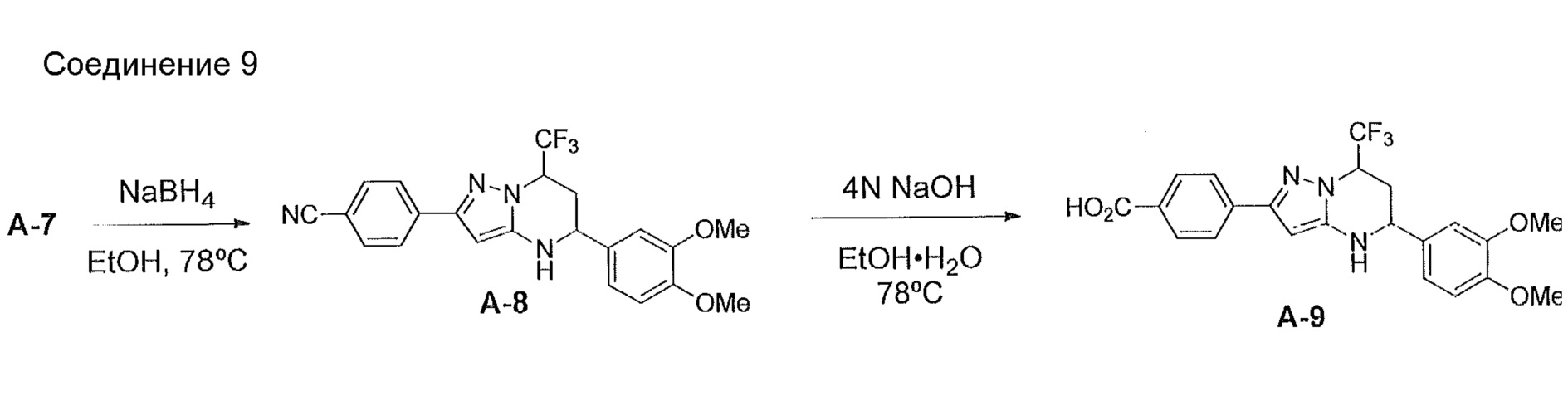
[0117] Соединение A-7 (326 г, 768,2 ммоль) суспендировали в этаноле (3,26 л) и воде (815 мл), после чего следовало нагревание до 68-70°C. Стоковый раствор борогидрида натрия [предварительно полученный отдельно посредством добавления борогидрида натрия (96 г, 2,54 моль) в водный раствор 0,1 М гидроксида натрия (815 мл, 81,50 ммоль) при комнатной температуре, после чего следовало перемешивание в течение 30 мин] добавляли при комнатной температуре в течение 1,5 часа, в течение которых температура реакции росла до 68-71°C. После завершения добавления смесь нагревали при 68-71°C в течение 4 ч, по истечении этого времени смесь охлаждали до 40°C, и ацетон (564 мл) добавляли в течение 30 мин (внутренняя t 40-42°C), после чего следовало перемешивание дополнительные 30 мин при 40-42°C, чтобы предоставлять соединение A-8 in situ.
[0118] 1H ЯМР (400 МГц, хлороформ-d) м.д. 2,33-2,44 (м, 1H) 2,51 (д, J=6,09 Гц, 1H) 3,91 (с, 3H) 3,93 (с, 3H) 4,33 (с, 1H) 4,45 (дд, J=11,80, 2,08 Гц, 1H) 4,87-4,97 (м, 1H) 5,81 (с, 1H) 6,87-6,91 (м, 1H) 6,96-7,01 (м, 2H) 7,64-7,68 (м, 2H) 7,85-7,90 (м, 2H).
[0119] MS (M+H+) 428,9.
[0120] Гидроксид натрия (461 г, 11,52 моль) добавляли в указанную выше смесь, по истечении этого времени экзотермическую реакцию нагревали до 70-73°C и перемешивали в течение 16 часов. После охлаждения до комнатной температуры воду со льдом (3,260 л) добавляли в смесь для того, чтобы охлаждать ее до 10°C, после чего следовало медленное добавление 10% водной HCl (4,75 л) при поддержании температуры <25°C с энергичным перемешиванием. Энергичное перемешивание продолжали в течение 30 мин. Конечную реакционную смесь декантировали на стеклянный фильтр, чтобы выделять любой неочищенный продукт коричневого цвета из растворителя.
[0121] Твердое вещество, которое оставалось в реакционном сосуде, суспендировали в воде (3,26 л) и перемешивали энергично в течение 30 мин и декантировали, как указано выше. Этот процесс повторяли в течение дополнительного времени. Конечное выделенное твердое вещество промывали водой (3,26 л), после чего следовал IPA (2,61 л), и сушили на воздухе/под вакуумом for 1hand, затем под вакуумом при 45°C в течение 20 ч, чтобы предоставлять 226,7 г соединения A-9 (0,507 моль, 66% выход) в виде твердого вещества светло-коричневого цвета.
[0122] 1H ЯМР (400 МГц, DMSO-d6) δ м.д. 3,76 (с, 3H) 3,79 (с, 3H) 5,86 (с, 1H) 6,84 (с, 1H) 6,92-7,04 (м, 2H) 7,08 (д, J=1,50 Гц, 1H) 7,84 (м, J=8,33 Гц, 2H) 7,95 (м, J=8,23 Гц, 2H).
[0123] MS (M+H+) 448,4.
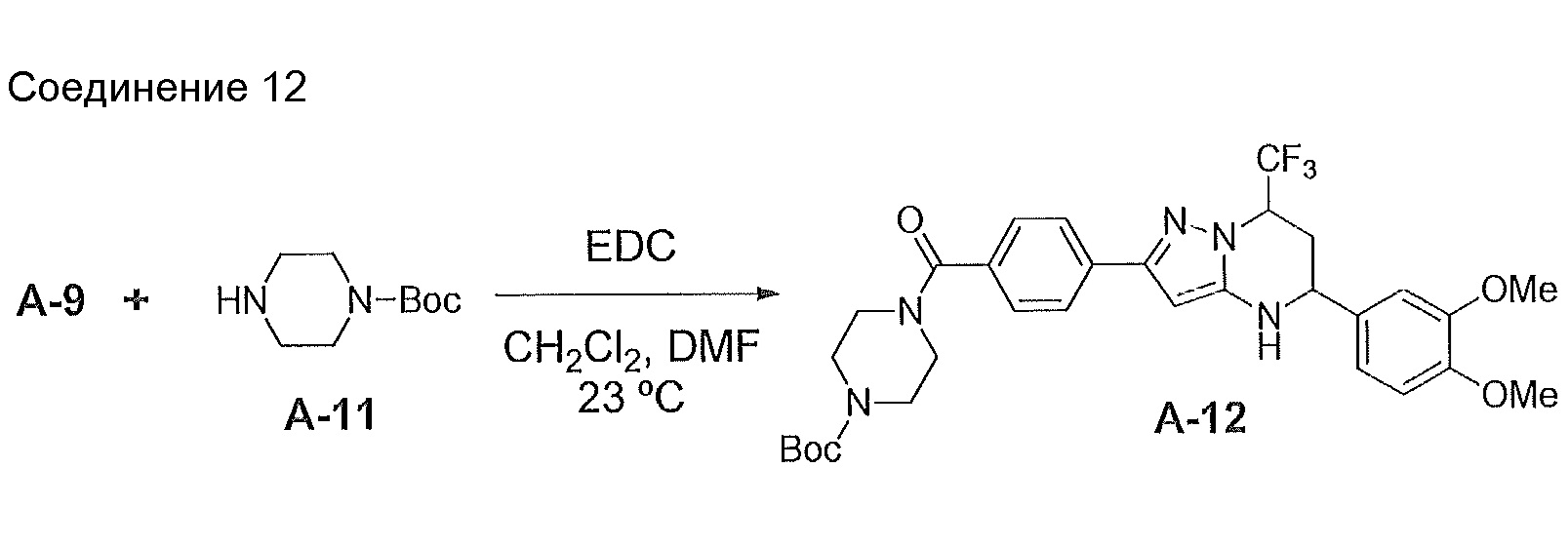
[0124] Соединение A-9 (333,8 г, 746,1 ммоль) растворяли в DMF (1,335 л) и затем разбавляли с использованием DCM (1,00 л), при этом перемешивая при комнатной температуре. Добавляли трет-бутил-пиперазин-1-карбоксилат (139 г, 746,1 ммоль), после чего следовало перемешивание при комнатной температуре в течение дополнительных 20 мин. Добавляли EDC (143 г, 746,1 ммоль), получаемую смесь перемешивали в течение 2 часов при комнатной температуре. В энергично перемешиваемую смесь добавляли н-гептан (4,01 л), после чего следовала вода (5,34 л), при сохранении температуры ниже 25°C. Получаемую двухфазную смесь перемешивали при комнатной температуре в течение дополнительных 30 мин, по истечении этого времени твердое вещество фильтровали, после чего следовало промывание водой (4,0 л) и затем н-гептаном (2,0 л). Твердое вещество сушили под вакуумом при 50°C в течение 18 ч, чтобы предоставлять 478,5 г неочищенного соединения A-12.
[0125] 473 г неочищенного соединения A-12 суспендировали в смеси растворителей из н-гептана (1,0 л) и IPA (1,0 л), после чего следовало нагревание до 50°C и перемешивание при 50°C в течение дополнительных 10 мин. Суспензию охлаждали до 20°C в течение периода 30 минут, после чего следовало перемешивание в течение дополнительных 30 мин. Твердое вещество фильтровали, промывали смесью растворителей из IPA (500 мл) и н-гептана (500 мл) и затем сушили под вакуумом при 50°C в течение 5 ч. Этот приведенный выше процесс суспендирования и фильтрования повторяли один дополнительный раз. 403 г соединения A-12 (0,655 моль, 88% выход?) получали в виде порошка коричневого цвета.
[0126] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 0,94-1,14 (м, 1H) 1,45-1,51 (м, 9Н) 1,57-1,75 (м, 1H) 2,17-2,29 (м, 1H) 2,49-2,58 (м, 1H) 3,84 (с, 3H) 3,87 (с, 3H) 4,45 (д, J=11,44 Гц, 1H) 5,03-5,15 (м, 1H) 6,96-7,01 (м, 1H) 7,03-7,08 (м, 1Н) 7,11 (д, J=1,79 Гц, 1Н) 7,40-7,52 (м, 1H) 7,85 (д, J=8,09 Гц, 2H) 7,99-8,08 (м, 1H).
[0127] MS (M+H+) 616,3.
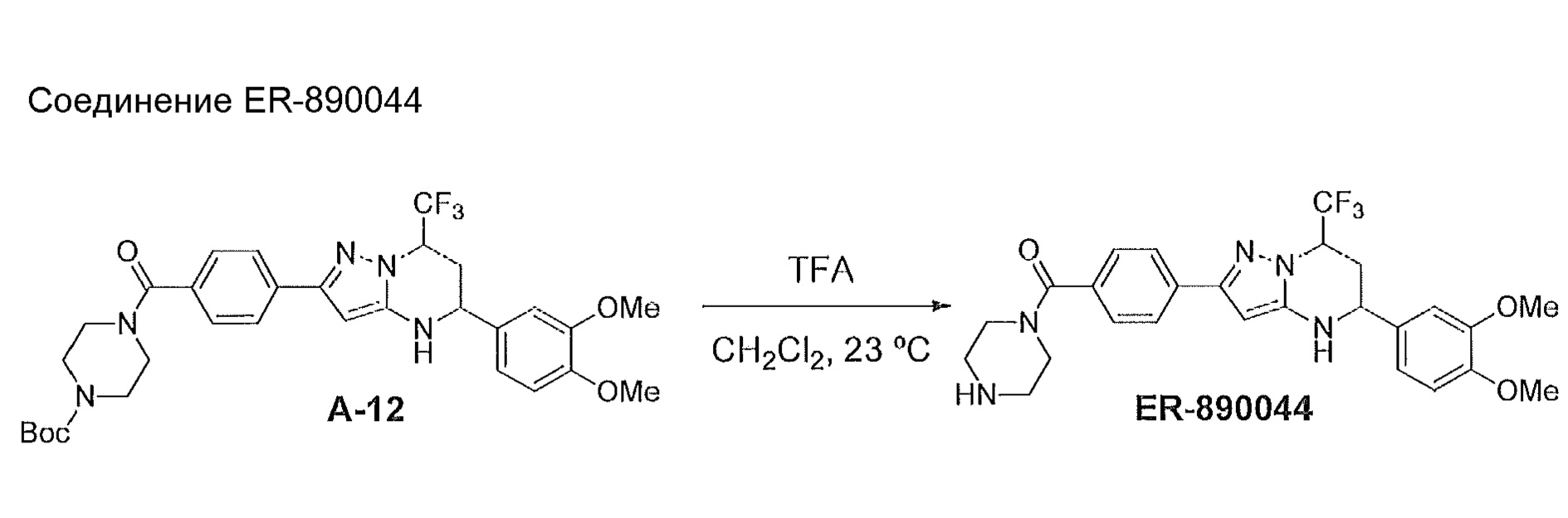
[0128] Соединение A-12 (340 г, 0,552 моль) суспендировали в DCM (510 мл, 7,926 моль и в суспензию добавляли TFA (510 мл, 6,619 моль) в течение 10 мин. Смесь перемешивали при 23-27°C в течение 3 ч, после которых смесь охлаждали до 15°C и разбавляли водой (1700 мл, 9,436 моль), при этом сохраняя внутреннюю температуру ниже 20°C. Смесь разводили н-гептаном (3,4 л, 23,209 моль), затем охлаждали до 15°C. Гидроксид натрия (2,872 кг, 7,179 моль) добавляли в течение 30 мин, при этом контролируя внутреннюю t<25°C. Получаемую смесь перемешивали при 20-25°C в течение 20 мин, затем фильтровали для того, чтобы собирать осадок светло-коричневого цвета. Осадок сначала промывали водой (3,4 л) и затем смесью н-гептана (1,36 л) и DCM (204 мл). Влажный отфильтрованный осадок переносили на лоток и сушили в вакуумной печи при 50°C в течение ночи, чтобы получать 248,8 г (0,483 моль, 87% выход) ER-890044 в виде твердого вещества светло-коричневого цвета.
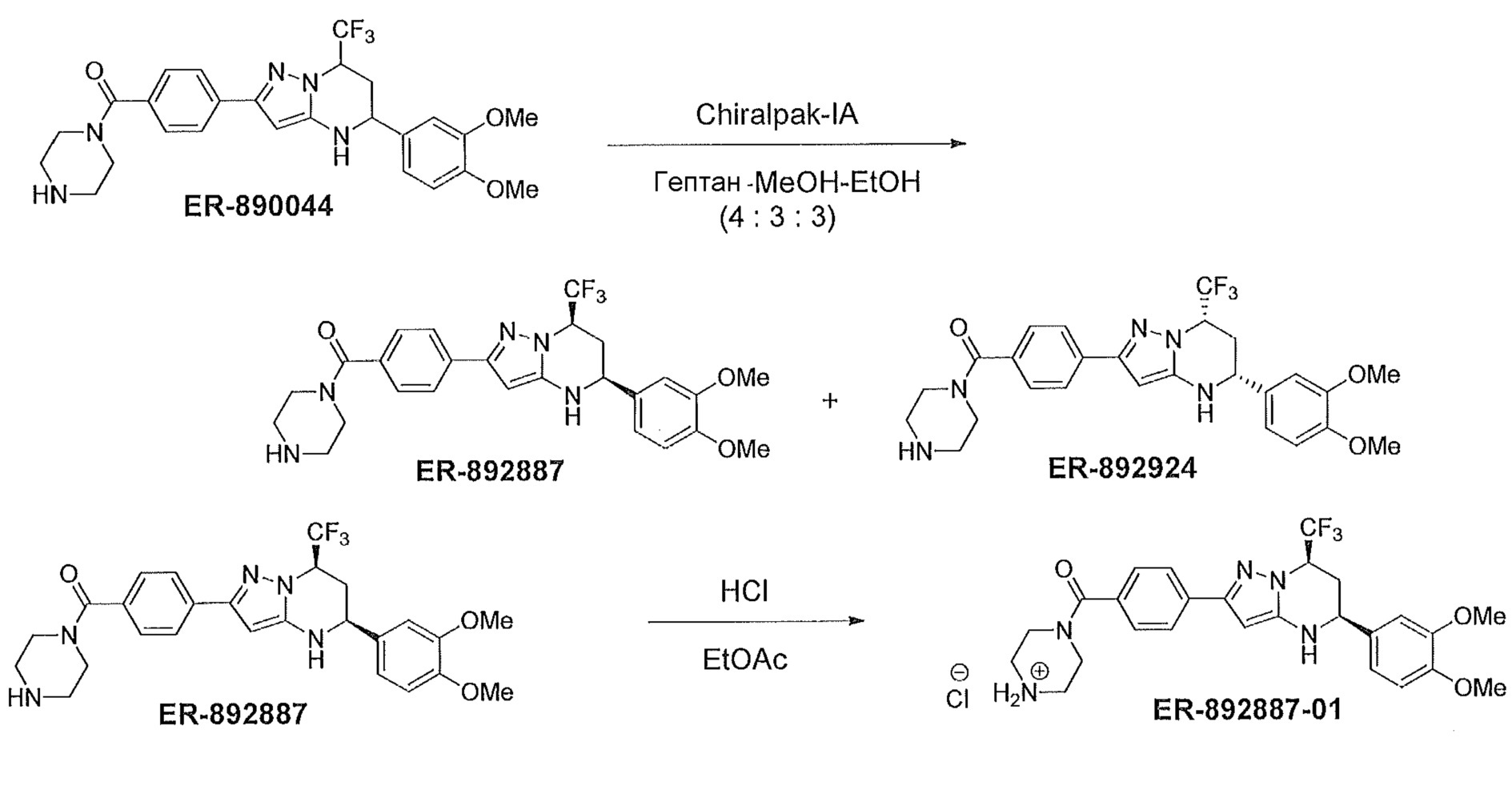
[0129] ER-890044 (30,3 г, 58,8 ммоль) растворяли в растворе дихлорметана и метанола 1:1 (120 мл) и мутный раствор фильтровали через воронку Бюхнера средней пористости. Чистый фильтрат непосредственно использовали для хиральной ВЭЖХ-очистки. 4 мл этого раствора загружали на колонку Chiralpak IA 5 см × 50 см и элюировали с подвижной фазой, содержащей гептан, метанол и этанол (соотношение 4:3:3; модифицированной 0,06% диэтиламином), при скорости потока 75 мл/мин. ER-892887 собирали между 18,5 мин и 23,2 мин, тогда как ER-892924 собирали между 24,2 мин и 32 мин. Осуществляли 30 таких инжекций, и объединенные фракции концентрировали при пониженном давлении, чтобы предоставлять чистые энантиомерные продукты ER-892887 (10,5 г, 20,3 ммоль, >95% ee) и ER-892924 (9,8 г, 19,0 ммоль, >95% ee).
[0130] В раствор ER-892887 (8,50 г, 16,5 ммоль) в сухом этилацетате (500 мл) добавляли 4 M HCl в диоксане (4,53 мл, 18,1 ммоль) по каплям в течение 10 мин. Получали осадок белого цвета. Получаемую суспензию перемешивали при температуре окружающей среды в течение 15 мин, затем фильтровали при пониженном давлении. Собранное твердое вещество промывали в этилацетате (2×100 мл) и простом эфире (2×100 мл) и сушили под вакуумом для того, чтобы получать 8,29 г гидрохлоридной соли ER-892887 (15,0 ммоль, 91% выход)) в виде твердого вещества белого цвета.
[0131] ER-892930
[0132] В 5-мл пробирку с винтовой крышкой добавляли соединение A-9 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойную кислоту (21,7 мг, 0,049 ммоль), 3-амино-1,2-пропандиол (13,2 мг, 0,145 ммоль), HATU (1,10 экв., 24,8 мг, 0,065 ммоль), NMP (0,500 мл) и основание Хунига (6,00 мкл, 0,044 ммоль). Реакционную смесь перемешивали при 30°C в течение ночи. Материал очищали посредством LC/MS с использованием условий III для ВЭЖХ. Фракции, содержащие продукт, объединяли и концентрировали в вакууме, чтобы получать соединение ER-892930 в виде твердого вещества грязно-белого цвета (13,3 мг, 53% выход).
[0133] ER-894463
[0134] В 5-мл пробирку с винтовой крышкой добавляли соединение A-9 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойную кислоту (30,0 мг, 0,067 ммоль), трет-бутил-3-аминопирролидин-1-карбоксилат (74,9 мг, 0,402 ммоль), HATU (50,9 мг, 0,134 ммоль), NMP (0,500 мл) и основание Хунига (6,00 мкл, 0,044 ммоль). Реакционную смесь перемешивали при 30°C в течение ночи. Материал очищали посредством LC/MS с использованием условий III для ВЭЖХ. Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Затем получаемый материал растворяли в этаноле (1,0 мл) и 4,0 M HCl в диоксане (1,0 мл, 4,00 ммоль) и смесь перемешивали при КТ в течение 1 ч. Затем смесь концентрировали в вакууме, чтобы получать соединение ER-894463 в виде твердого вещества желтого цвета (22,1 мг, 60% выход).
[0135] ER-895080
[0136] В 5-мл пробирку с винтовой крышкой добавляли соединение A-9 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойную кислоту (20,0 мг, 0,045 ммоль), трет-бутил-2,6-диазаспиро[3,4]октан-6-карбоксилат (18,98 мг, 0,089 ммоль), HATU (18,7 мг, 0,049 ммоль), NMP (0,500 мл) и основание Хунига (6,00 мкл, 0,044 ммоль). Реакционную смесь перемешивали при 30°C в течение ночи. Материал очищали посредством LC/MS с использованием условий III для ВЭЖХ. Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Затем получаемый материал поднимали в этаноле (1,0 мл) и 50% трифторуксусной кислоте в DCM (1,0 мл, 4,00 ммоль) и смесь перемешивали при КТ в течение 1 ч. Затем смесь концентрировали в вакууме, чтобы получать соединение ER-895080 в виде твердого вещества желтого цвета (2,40 мг, 8% выход).
[0137] Пример ER-894462-00 получали из соединения ER-886619 (30,0 мг, 0,067 ммоль) и коммерчески доступного азетидин-3-ола (29,4 мг, 0,402 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (8,1 мг, 24%).
[0138] Пример ER-894465-00 получали из соединения ER-886619 (30,0 мг, 0,067 ммоль) и коммерчески доступного пирролидин-3-ола (35,0 мг, 0,402 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,5 мг, 53%).
[0139] Пример ER-894464-01 получали из соединения ER-886619 (30,0 мг, 0,067 ммоль) и коммерчески доступного трет-бутил-пирролидин-3-илкарбамата (74,9 мг, 0,402 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (32,6 мг, 88%).
[0140] Пример ER-895077-01 получали из соединения ER-886619 (30,0 мг, 0,067 ммоль) и коммерчески доступного трет-бутил-3-аминоазетидин-1-карбоксилата (69,3 мг, 0,402 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (8,6 мг, 24%).
[0141] Пример ER-895078-01 получали из соединения ER-886619 (30,0 мг, 0,067 ммоль) и коммерчески доступного трет-бутил-азетидин-3-илкарбамата (69,3 мг, 0,402 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (29,7 мг, 82%).
[0142] Пример ER-895746-01 получали из соединения ER-886619 (7,8 мг, 0,062 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (37,0 мг, 0,174 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (27,5 мг, 77%).
[0143] Пример ER-895748-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (35,5 мг, 0,177 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (31,3 мг, 99%).
[0144] Пример ER-895749-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (36,6 мг, 0,183 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (29,5 мг, 93%).
[0145] Пример ER-895750-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-метилпиперазин-1-карбоксилата (31,7 мг, 0,158 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (30,6 мг, 97%).
[0146] Пример ER-895751-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-метилпиперазин-1-карбоксилата (43,5 мг, 0,217 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (31,2 мг, 98%).
[0147] Пример ER-895752-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (2S,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (30,3 мг, 0,141 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (30,6 мг, 94%).
[0148] Пример ER-895753-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (2R,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (37,6 мг, 0,175 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (19,5 мг, 60%).
[0149] Пример ER-895754-01 получали из соединения ER-886619 (25,0 мг, 0,056 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (33,5 мг, 0,169 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (26,7 мг, 85%).
[0150] Пример ER-895083-15 получали из соединения ER-886619 (24,5 мг, 0,055 ммоль) и коммерчески доступного трет-бутил-(азетидин-3-илметил)(метил)карбамата (22,4 мг, 0,112 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (0,6 мг, 2%).
[0151] Пример ER-895081-15 получали из соединения ER-886619 (20,6 мг, 0,046 ммоль) и коммерчески доступного трет-бутил-(6-аминоспиро[3.3]гептан-2-ил)карбамата (23,4 мг, 0,103 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (13,3 мг, 43%).
[0152] Пример ER-895082-15 получали из соединения ER-886619 (23,5 мг, 0,053 ммоль) и коммерчески доступного трет-бутил-2,7-диазаспиро[4.4]нонан-2-карбоксилата (25,1 мг, 0,111 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (5,3 мг, 15%).
[0153] Получали пример ER-898416. 3-(5-(3,4-Диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойную кислоту получали из (3-цианофенил)бороновой кислоты (93 мг, 0,631 ммоль) и 5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-илтрифторметансульфоната (100,0 мг, 0,21 ммоль) и таким образом, который подобен таковому для 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (раздел G, получение ER-893393), чтобы получать 3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензонитрил (46 мг, 51% выход). Гидролиз материала (75 мг, 0,175 ммоль), полученного таким образом, который подобен таковому для соединения A-9, давал желаемое соединение (42 мг, 54% выход).
[0154] Пример ER-895811 получали в две стадии из 3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (24 мг, 0,054 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (40 мг, 0,215 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3S)-трет-бутил-3-(3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензамидо)пирролидин-1-карбоксилат (7 мг, 0,011 ммоль, 21% выход). Затем это промежуточное соединение (6 мг, 0,0097 ммоль) обрабатывали HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-895811 (4,4 мг, 82% выход).
[0155] Пример ER-896386 получали в две стадии из 3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (119 мг, 0,266 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (226 мг, 1,06 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-5-(3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (94 мг, 0,146 ммоль, 55% выход). Затем это промежуточное соединение разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), чтобы получать трет-бутил-5-(3-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (33 мг, 0,051 ммоль) и трет-бутил-5-(3-((5R,7S)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (33 мг, 0,051 ммоль). Затем промежуточное соединение трет-бутил-5-(3-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (22 мг, 0,034 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896386 (19 мг, 96% выход).
[0156] Пример ER-896387 получали из промежуточного соединения трет-бутил-5-(3-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата, полученного в примере ER-896386. Затем это промежуточное соединение (16 мг, 0,025 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896387 (14 мг, 99% выход).
[0157] Пример ER-896388 получали в две стадии из 3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (42 мг, 0,224 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-4-(3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)пиперазин-1-карбоксилат (18 мг, 0,029 ммоль, 52% выход). Затем это промежуточное соединение (16 мг, 0,026 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896388 (14 мг, 98% выход).
[0158] Пример ER-896389 получали в две стадии из соединения 3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-((3R,5S)-5-метилпиперидин-3-ил)карбамата (48 мг, 0,224 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-((3R,5S)-1-(3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензоил)-5-метилпиперидин-3-ил)карбамат (22 мг, 0,034 ммоль, 61% выход). Затем это промежуточное соединение (20 мг, 0,031 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896389 (17,5 мг, 97% выход).
[0159]
[0160| Примеры синтеза - раздел B
[0161] Пример 2 (получение ER-885681)
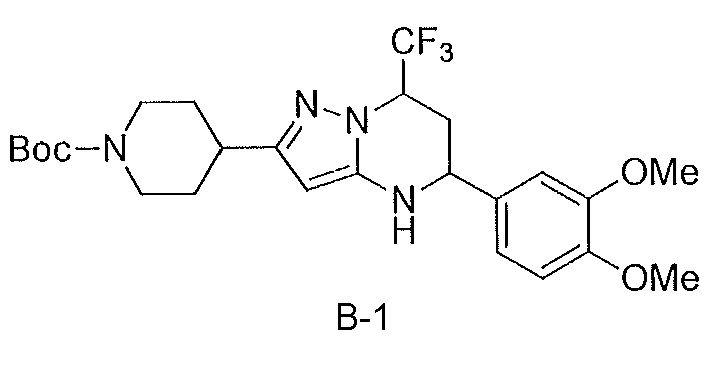
[0162] Соединение B-1 получали из коммерчески доступного трет-бутил-4-цианопиперидин-1-карбоксилата таким образом, который подобен для соединения A-8 (56 г, 70% выход для конечной стадии).
[0163] 1H ЯМР (400 МГц, хлороформ-d) δ м.д. 1,44-1,49 (м, 10H) 1,50-1,62 (м, 6Н) 1,89 (д, J=12,05 Гц, 2H) 2,31 (дт, J=13,69, 11,51 Гц, 1H) 2,41-2,49 (м, 1H) 2,69-2,88 (м, 3H) 3,89 (с, 3H) 3,91 (с, 3H) 4,06-4,21 (м, 3H) 4,38 (дд, J=11,71, 1,95 Гц, 1H) 4,81 (дт, J=11,29, 5,80 Гц, 1H) 5,28 (с, 1H) 6,84-6,89 (м, 1H) 6,93-6,98 (м, 2H).
[0164] MS (M+H+) 511,0.
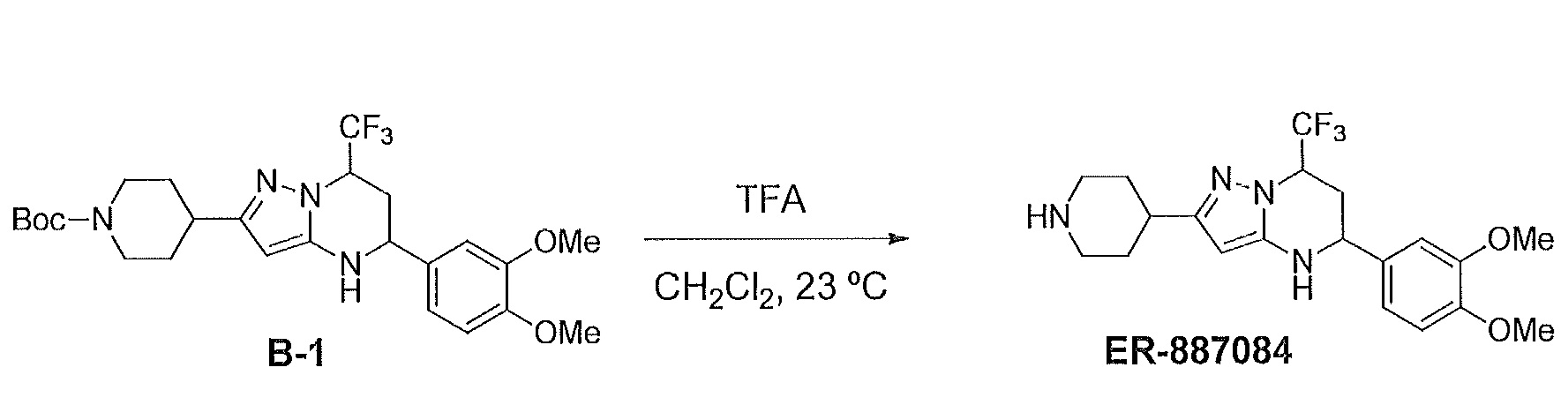
[0165] Трифторуксусную кислоту (15 мл) добавляли в раствор соединения B-1 (7,86 г, 15,4 ммоль) в метиленхлориде (15 мл) и смесь перемешивали при КТ. После 15 мин реакционную смесь концентрировали при пониженном давлении, и остаток распределяли между MTBE и насыщ. NaHCO3. Слои разделяли, и водный раствор дополнительно экстрагировали дихлорметаном (2×). Объединенные экстракты промывали солевым раствором, сушили (Na2SO4) и концентрировали при пониженном давлении, чтобы получать ER-887084 в виде твердого вещества белого цвета (4,28 г, 68%).
[0166] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 1,52-1,64 (м, 3H) 1,84 (уш.с, 1H) 2,06-2,17 (м, 1H) 2,40-2,47 (м, 1H) 2,59-2,70 (м, 5H) 3,01-3,09 (м, 3H) 3,79 (с, 3H) 3,82 (с, 3H) 4,33 (дд, J=11,59, 2,25 Гц, 1H) 4,87-4,95 (м, 1H) 5,30 (с, 1H) 6,93 (д, J=8,31 Гц, 1H) 6,96-7,00 (м, 1H) 7,04 (д, J=1,90 Гц, 1H).
[0167] MS (M+H+) 411,5.
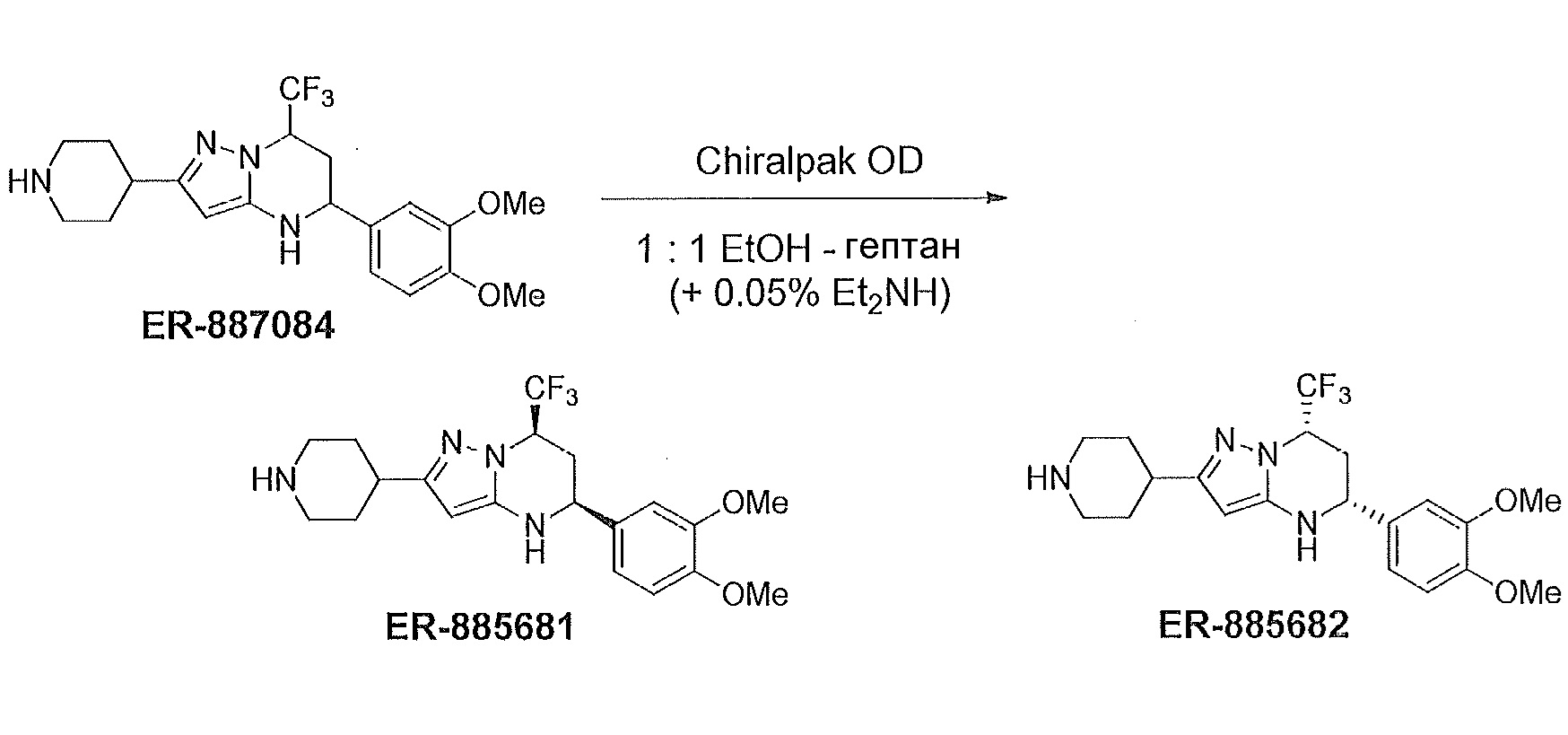
Соединения ER-885681 и ER-885682
[0168] Соединение ER-887084 (1,19 г, 2,91 ммоль) растворяли в метаноле (11 мл) и раствор дополнительно разбавляли 19 мл раствора этанол-гептан 1:1, модифицированного 0,05% диэтиламином. 1 мл этого раствора загружали на колонку Chiralcel OD 2 см × 25 см и элюировали с подвижной фазой, содержащей гептан-этанол 1:1 (содержащие 0,05% диэтиламина), при скорости потока 15 мл/мин. Соединение ER-885681 собирали между 7,3 мин и 9,6 мин, тогда как соединение ER-885682 собирали между 9,8 мин и 14,5 мин. Осуществляли 33 такие инжекции, и объединенные фракции концентрировали при пониженном давлении, чтобы предоставлять соединения чистых энантиомерных продуктов ER-885681 (571 мг, 96% выход, >95% ee) и ER-885682 (ER-887275) (574 мг, 96% выход, >95% ee).
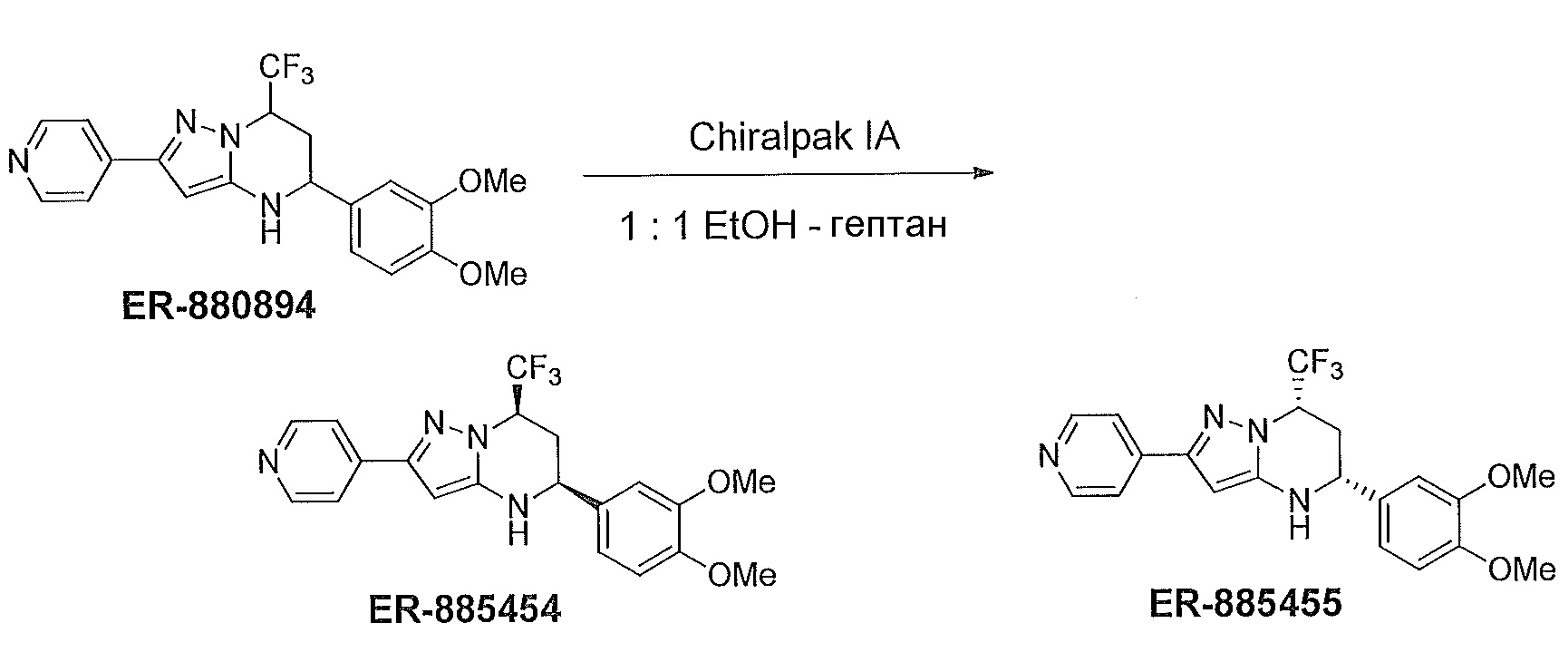
[0169] Примеры ER-885454 и ER-885455
[0170] Соединение ER-880894 получали из коммерчески доступного 4-цианопиридина (450 г, 4,32 моль) с использованием общей последовательности, изображенной на схеме I и проиллюстрированной получением соединения A-8 (ER-890044), чтобы получать ER-880894 (205 г, ммоль 12% общий выход).
[0171] 1H ЯМР (400 МГц, хлороформ-d) δ м.д. 2,29-2,46 (м, 2H) 2,47-2,60 (м, 2H) 3,91 (с, 3H) 3,93 (с, 3H) 4,36 (с, 1H) 4,45 (д, J=9,96 Гц, 1H) 4,93 (дт, J=11,28, 5,79 Гц, 2H) 5,85 (с, 1H) 6,85-6,93 (м, 1H) 6,93-7,04 (м, 2H) 7,59-7,70 (м, 2H) 8,56-8,66 (м, 2H).
[0172] MS (M+H+) 405,2.
[0173] Разрешение ER-880894 (200 мг, 0,495 ммоль) посредством хиральной ВЭЖХ таким образом, который подобен таковому для ER-890044 (за тем исключением, что этанол-гептан 1:1 использовали в качестве подвижной фазы), давало ER-885454 (96 мг, 48% выход) и ER-885455 (91,2 мг, 46% выход).
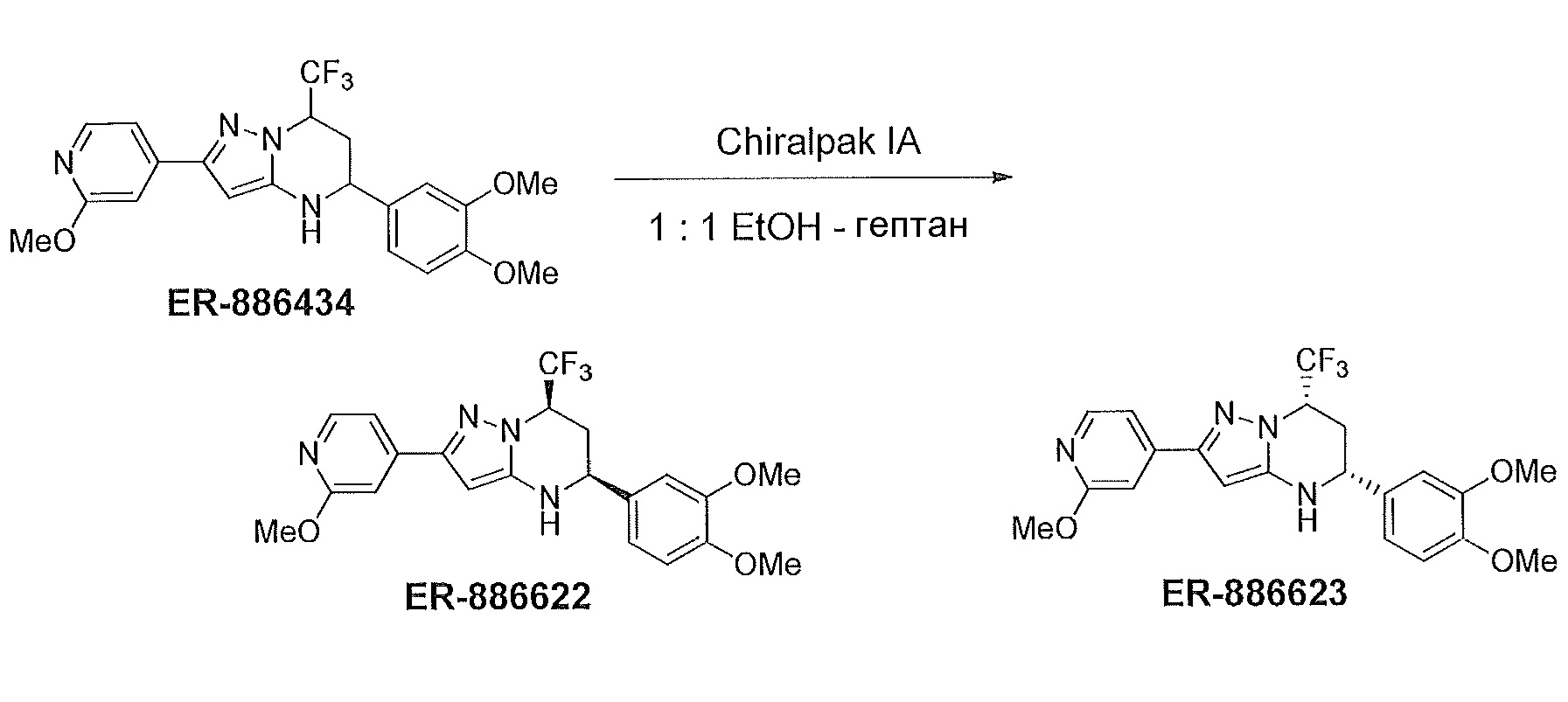
[0174] Примеры ER-886622 и ER-886623
[0175] Пример ER-886434 получали из коммерчески доступного 4-циано-2-метоксипиридина (мг, ммоль) таким образом, который подобен таковому для соединения ER-880894, чтобы получать ER-886434 (127 мг, 62% выход).
[0176]
[0177]
[0178] MS (M+H+) 435,6.
[0179] Разрешение посредством хиральной ВЭЖХ таким образом, который подобен таковому для ER-880894, давало ER-886622 (21,5 мг, 44% выход, >95% ee) и ER-886623 (20,2 мг, 41% выход, >95% ee).
[0180] Примеры синтеза - раздел C
[0181] Получение ER-890035
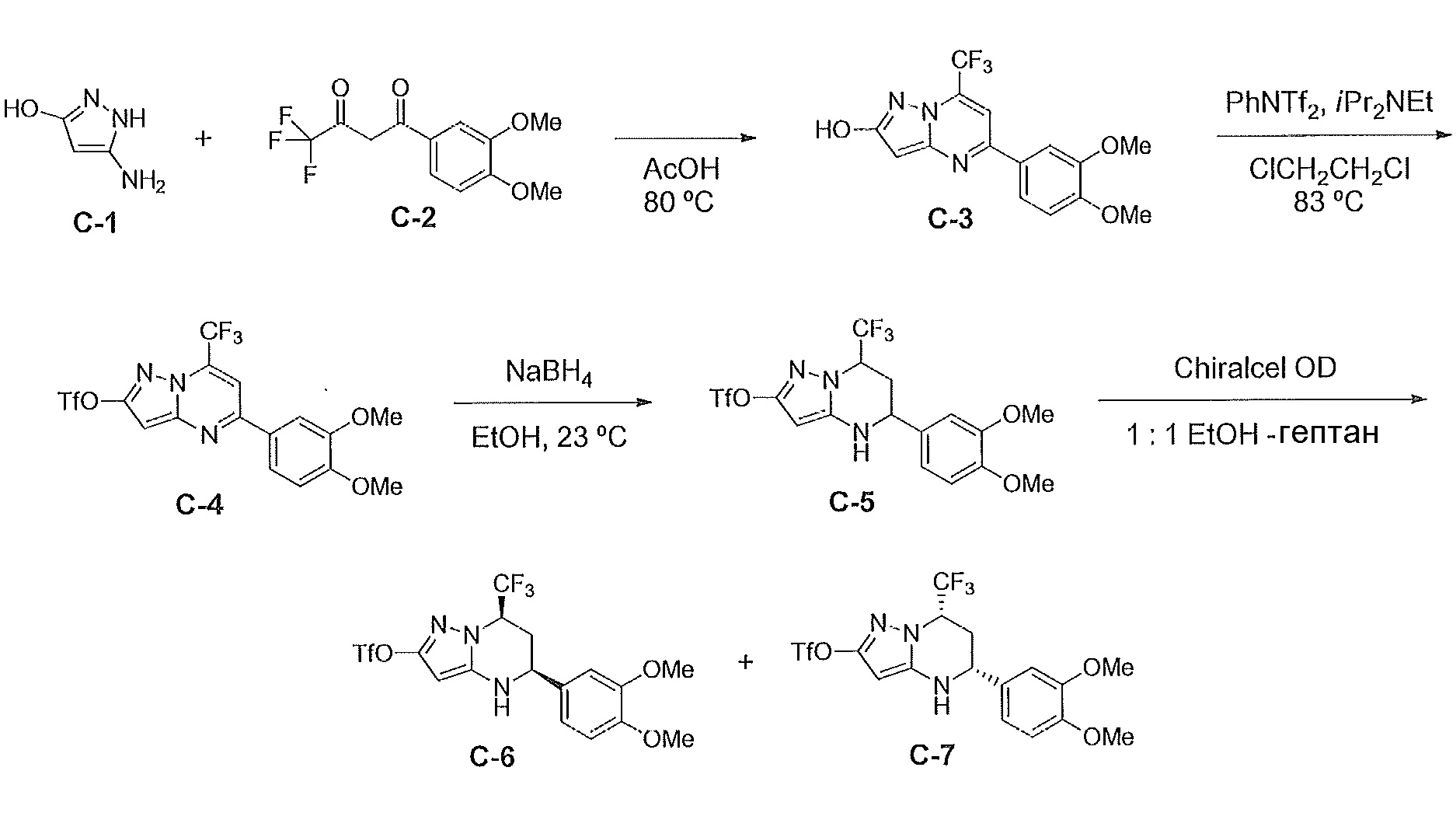
[0182] Соединение C-3
[0183] Раствор соединения C-1 (9,91 г, 100 ммоль) и соединения C-2 (27,6 г, 100 ммоль) в уксусной кислоте (60 мл) нагревали при 80°C. Прозрачная реакционная смесь темно-оранжевого цвета прогрессивно становилась светлее, когда начиналось образование осадка желтого цвета. В пределах 30 мин реакционная смесь превращалась в густую суспензию желтого цвета. Смесь поддерживали при 80°C в течение других 15 мин. Смесь охлаждали до КТ и добавляли IPA. Суспензию нагревали приблизительно до 75°C, затем охлаждали до комнатной температуры. Осадок желтого цвета фильтровали, и твердое вещество промывали дополнительным IPA и сушили при пониженном давлении. Соединение C-3 получали в виде твердого вещества светло-желтого цвета (30,9 г, 91% выход).
[0184] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 3,92-3,92 (м, 3H) 3,96 (с, 3H) 7,10 (д, J=8,51 Гц, 1H) 7,67 (с, 1H) 7,75 (дд, J=8,47, 2,21 Гц, 1H) 7,83-7,86 (м, 1H) (главный таутомер).
[0185] MS (M+H+) 340,5.
[0186] Соединение C-4
[0187] Соединение C-3 (9,9 г, 29,2 ммоль) растворяли в N,N- диизопропилэтиламине (25,4 мл) и 1,2-дихлорэтане (100 мл) и смесь перемешивали при КТ. В этот раствор добавляли N-фенилбис(трифторметансульфонимид) (20,8 г, 58,2 ммоль) и смесь нагревали с обратным холодильником. После 45 мин реакционную смесь охлаждали до КТ и концентрировали при пониженном давлении, чтобы получать остаток оранжево-коричневого цвета. Остаток очищали хроматографией на силикагеле с использованием градиентного элюирования (от 10 до 40% EtOAc в гептане), чтобы получать соединение C-4 в виде твердого вещества желтого цвета (7,10 г, 52% выход). В реакции формировали малое количество N-сульфонилированного региоизомера, но не выделяли.
[0188] 1H ЯМР (400 МГц, DMSO-d6) δ м.д. 3,87 (с, 3H) 3,90 (с, 3H) 7,15 (д, J=8,65 Гц, 1H) 7,20 (с, 1H) 7,85 (д, J=2,14 Гц, 1H) 8,00 (дд, J=8,55, 2,14 Гц, 1H) 8,35 (с, 1H).
[0189] MS (M+H+) 472,3.
[0190] Соединение C-5
[0191] В раствор соединения C-4 (2,24 г, 0,00475 моль) в этаноле (29,9 мл) добавляли борогидрид натрия (360 мг, 9,50 моль) и смесь перемешивали при КТ. После 30 мин реакционную смесь осторожно выливали в смесь 1:1 насыщенного раствора NH4Cl и воды. Водный раствор экстрагировали дихлорметаном (3×); объединенные экстракты промывали солевым раствором, сушили и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством хроматографии на силикагеле с использованием градиентного элюирования (от 0 до 50% EtOAc в гептане), чтобы получать соединение C-5 в виде твердого вещества белого цвета (1,94 г, 86% выход).
[0192] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 2,18 (дт, J=13,35, 11,43 Гц, 1Н) 2,47 (ддд, J=13,43, 5,95, 2,59 Гц, 1H) 3,80 (с, 3H) 3,82 (с, 3H) 4,44 (дд, J=11,63, 2,44 Гц, 1H) 4,92- 5,03 (м, 1H) 5,32 (с, 1H) 6,94 (д, J=8,28 Гц, 1H) 6,99 (дд, J=8,41, 1,89 Гц, 1H) 7,04 (д, J=1,95 Гц, 1H). MS (M+H+) 472,3.
[0193] Соединения C-6 и C-7
[0194] Соединение C-5 (900 мг, 1,91 ммоль) растворяли в метаноле (10 мл) и раствор дополнительно разбавляли этанолом (5 мл) и гептаном (5 мл). 1 мл этого раствора загружали на колонку Chiralcel® OD 2 см × 25 см и элюировали с подвижной фазой, содержащей гептан-этанол 1:1, при скорости потока 15 мл/мин. Соединение C-6 (ER-887274) собирали между 6,0 мин и 7,7 мин, тогда как соединение C-7 (ER-887275) собирали между 8,75 мин и 11,5 мин. Осуществляли 17 таких инжекций, и объединенные фракции концентрировали при пониженном давлении, чтобы предоставлять соединения чистых энантиомерных продуктов C-6 (ER-887274) (683 мг, 1,44 ммоль, >95% ee) и C-7 (ER-887275) (671 мг, 1,41 ммоль, >95% ee).
[0195] Пример ER-890035. В пробирку с винтовой крышкой 15 мм × 75 мм добавляли (3-(5-метил-1,2,4-оксадиазол-3-ил)фенил)бороновую кислоту (36,1 мг, 0,177 ммоль), 0,0750 M тетракис(трифенилфосфин)палладий(0) в 1,4-диоксане (80,0 мкл, 0,006 ммоль), 0,150 M 5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-илтрифторметансульфонат (C-5) в 1,4-диоксане (420,0 мкл, 0,0631 ммоль) и 2,00 M карбонат натрия в воде (60,0 мкл, 120 ммоль). Реакционный сосуд продували азотом и герметизировали. Сосуд встряхивали и нагревали в алюминиевом блоке при 85°C в течение ночи. В смесь добавляли 1,0 мл насыщенного водного бикарбоната натрия, и затем смесь экстрагировали этилацетатом (2×2,0 мл). Объединенные органические слои концентрировали в вакууме. Остающийся остаток растворяли в 500 мкл DMSO. Материал очищали посредством LC/MS на колонке XTerra C8 19×100 мм с градиентом ацетонитрил:вода (муравьиная кислота). Фракции, содержащие продукт, объединяли и концентрировали в вакууме, чтобы получать соединение ER-890035 в виде твердого вещества желтого цвета, 2,9 мг (9,5% выход).
[0196] Пример ER-893972 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (1,4-диметил-1H-индазол-5-ил)бороновой кислоты (200 мг, 1,05 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (159 мг, 64% выход).
[0197] Пример ER-892893 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (4-((3-гидроксипропил)карбамоил)фенил)бороновой кислоты (235 мг, 1,05 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (166 мг, 63% выход).
[0198] Пример ER-892892 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (4-карбамоил-2-фторфенил)бороновой кислоты (192 мг, 1,05 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (179 мг, 73% выход).
[0199] Пример ER-892892 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (4-карбамоил-2-фторфенил)бороновой кислоты (192 мг, 1,05 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (179 мг, 73% выход). Пример ER-894680 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (4-метил-1H-индазол-5-ил)бороновой кислоты (185 мг, 1,05 ммоль таким образом, который подобен таковому для примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (90 мг, 37% выход).
[0200] Пример ER-887734 получали из соединения C-6 (20 мг, 0,042 ммоль) и коммерчески доступной (3-ацетамидофенил)бороновой кислоты (22,6 мг, 0,126 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS (Rt 7,45 мин, условия II) давала желаемый продукт (9,7 мг, 50% выход).
[0201] Пример ER-887738 получали из соединения C-6 (20 мг, 0,042 ммоль) и коммерчески доступной (3-ацетамидофенил)бороновой кислоты (20,3 мг, 0,126 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS (Rt 8,58 мин, условия II) давала желаемый продукт (6,5 мг, 35% выход).
[0202] Пример ER-892889 получали из соединения C-6 (200 мг, 0,421 ммоль) и коммерчески доступной (3-хлор-4-(метилкарбамоил)фенил)бороновой кислоты (180 мг, 0,843 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (88 мг, 42% выход).
[0203] Пример ER-892890 получали из соединения C-6 (250 мг, 0,526 ммоль) и коммерчески доступной (4-карбамоил-3-хлорфенил)бороновой кислоты (210 мг, 1,05 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью хроматографии на силикагеле давала желаемый продукт (138 мг, 55% выход).
[0204] Пример ER-893961 получали из соединения C-6 (40 мг, 0,084 ммоль) и коммерчески доступной (1,6-диметил-1H-индазол-5-ил)бороновой кислоты (51 мг, 0,268 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS давала желаемый продукт (8,9 мг, 22% выход).
[0205] Пример ER-893961 получали из соединения C-6 (40 мг, 0,084 ммоль) и коммерчески доступного 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-2(3H)-она (80,55 мг, 0,309 ммоль) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS давала желаемый продукт (4,3 мг, 11% выход).
[0206] Пример ER-889871 получали из соединения C-5 (50,0 мг, 0,105 ммоль) и коммерчески доступной (4-карбамоилфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (12,8 мг, 27%).
[0207] Пример ER-889874 получали из соединения C-5 (50,0 мг, 0,105 ммоль) и коммерчески доступной (4-(гидроксиметил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (7,8 мг, 17%).
[0208] Пример ER-890017 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-карбамоил-2-фторфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (13,4 мг, 46%).
[0209] Пример ER-890019 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-карбамоил-3-фторфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (11,7 мг, 40%).
[0210] Пример ER-890020 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-карбамоил-3-хлорфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14 мг, 46%).
[0211] Пример ER-890024 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-((3-гидроксипропил)карбамоил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (11,5 мг, 36%).
[0212] Пример ER-890027 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-(бензилкарбамоил)-3-хлорфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (12,3 мг, 34%).
[0213] Пример ER-890028 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (3-хлор-4-(изопропилкарбамоил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,1 мг, 55%).
[0214] Пример ER-890029 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (3-хлор-4-(метилкарбамоил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (15,4 мг, 49%).
[0215] Пример ER-890035 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (3-(5-метил-1,2,4-оксадиазол-3-ил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (2,9 мг, 9%).
[0216] Пример ER-890043 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (5,6 мг, 19%).
[0217] Пример ER-890044 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-(пиперазин-1-карбонил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (13,7 мг, 42%).
[0218] Пример ER-890050-00 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (3-(1H-пиразол-1-ил)фенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (15,4 мг, 52%).
[0219] Пример ER-891029-00 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (6-(метилкарбамоил)пиридин-3-ил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (9 мг, 31%).
[0220] Пример ER-891043 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (1,7-диметил-1H-индазол-5-ил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18 мг, 61%).
[0221] Пример ER-891044 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (1,4-диметил-1H-индазол-5-ил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому для примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14,3 мг, 48%).
[0222] Пример ER-891047 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (1,6-диметил-1H-индазол-5-ил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому для примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,1 мг, 61%).
[0223] Пример ER-891058 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-(циклопропилкарбамоил)-3-фторфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (13,8 мг, 43%).
[02241 Пример ER-892908 получали из соединения C-5 (30,0 мг, 0,063 ммоль) и коммерчески доступной (4-(трет-бутилкарбамоил)-3-фторфенил)бороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (7 мг, 21%).
[0225] Пример ER-892931 получали из соединения C-5 (32,6 мг, 0,069 ммоль) и коммерчески доступной (1H-индазол-4-ил)бороновой кислоты (2,70 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (5,5 мг, 18%).
[0226] Раздел C.1 (Соединения, полученные перекрестным сочетанием из бромида)
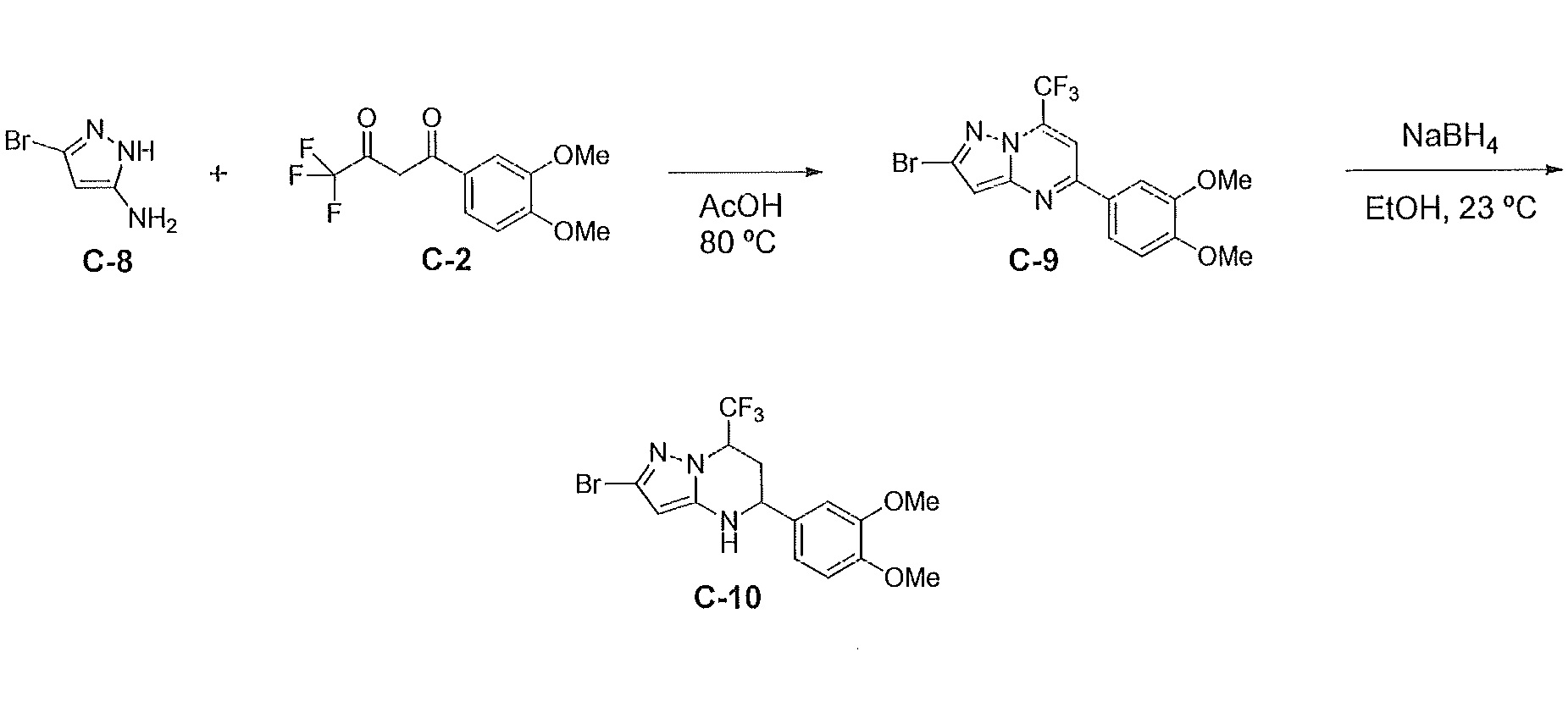
[0227] Соединение C-9
[0228] Смесь 3-амино-5-бромпиразола C-8 (3,24 г, 20 ммоль) и дикетона C-2 (5,52 г, 20 ммоль) в уксусной кислоте (20 мл) нагревали до 80°C. После 1 ч реакционную смесь охлаждали до КТ и разбавляли с использованием IPA. В смеси происходило образование осадка желтого цвета, который собирали фильтрованием. При отстаивании происходило образование дополнительного осадка в маточном растворе. Объединенные порции собирали и сушили под вакуумом, чтобы получать 3,89 г соединения C-9 в виде твердого вещества желтого цвета (9,67 ммоль, 48% выход).
[0229] 1H ЯМР (400 МГц, хлороформ-d) δ м.д. 3,99 (с, 3H) 4,05 (с, 3H) 6,85 (с, 1H) 7,00 (д, J=8,47 Гц, 1H) 7,57 (с, 1H) 7,62 (дд, J=8,45, 2,16 Гц, 1H) 7,80 (д, J=2,14Гц, 1H).
[0230] MS (M+H+) 402,2
[0231] Соединение C-10
[0232] Соединение C-9 (1,1 г, 2,74 ммоль) суспендировали в этаноле (5 мл) и добавляли борогидрид натрия (155 мг, 4,1 ммоль). Смесь перемешивали при КТ в течение 1,5 ч. В этот момент добавляли дополнительный борогидрид натрия (155 мг) и смесь перемешивали при КТ в течение других 2 ч. Уксусную кислоту (1,56 мл) добавляли для того, чтобы гасить реакцию, и получаемый водный раствор выливали в насыщенный раствор NaHCO3. Осажденное твердое вещество белого цвета собирали с помощью фильтрования, промывали водой и сушили при пониженном давлении, чтобы получать 667 мг соединения C-10 в виде твердого вещества грязно-белого цвета (1,64 г, 60% выход).
[0233] 1H ЯМР (400 МГц, хлороформ-d) δ м.д. 2,34-2,37 (м, 1H) 2,49 (м, 1H) 3,86 (с, 1H) 3,91 (с, 3H) 3,92 (с, 3H) 4,40 (дд, J=11,75, 2,44 Гц, 1H) 4,82 (дт, J=11,32, 5,73 Гц, 1H) 5,51 (с, 1H) 6,80-6,91 (м, 2H) 6,93-7,00 (м, 1Н).
[0234] MS (M+H+) 406,4.
[0235] Пример ER-889925 получали из соединения C-10 (37,0 мг, 0,091 ммоль) и коммерчески доступной изохинолин-5-илбороновой кислоты (2,50 экв.) таким образом, который подобен таковому из примера ER-890035. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (9,9 мг, 24%).
[0236] Примеры синтеза - раздел D
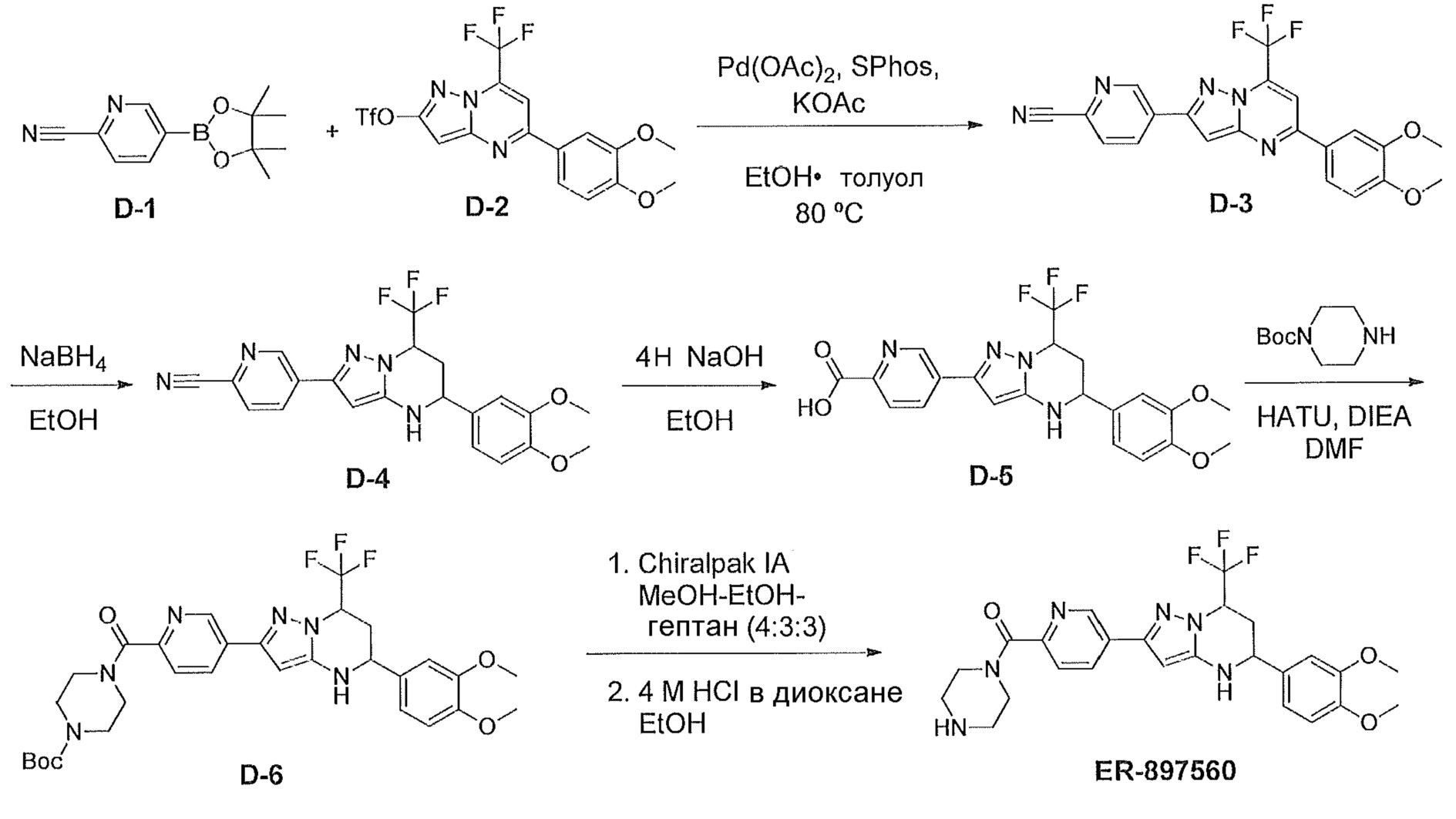
[0237] 5-(5-3,4-Диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)пиколинонитрил (D-3)
[0238] В сосуд добавляли 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиколинонитрил (1,95 г, 8,48 ммоль), дициклогексил(2',6'-диметокси-[1,1'-бифенил]-2-ил)фосфин (0,261 г, 0,636 ммоль), 5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил трифторметансульфонат (2,00 г, 4,24 ммоль), ацетат калия (0,833 г, 8,49 ммоль) и ацетат палладия(II) (0,095 г, 0,424 ммоль). После прокачки сосуда и содержимого азотом добавляли дегазированный раствор толуол/этанол 1:1 (20 мл), сосуд герметизировали и нагревали до 80°C в течение 2 суток. Этилацетат добавляли в получаемый осадок светло-желтого цвета, собирали с помощью фильтрования и сушили под глубоким вакуумом (1,13 г, 63%). Этот материал использовали на следующей стадии без дополнительной очистки.
[0239] 1H ЯМР (400 МГц CDCl3) δ м.д. 4,00 (3H), 4,06 (3H), 7,02 (2H), 7,21 (1H), 7,66 (2H), 7,84 (2H), 8,5 (1H), 9,33 (1Н).
[0240] MS (M+H+) 426,0.
[0241] 5-(5-(3,4-Диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинонитрил (D-4)
[0242] В смесь 5-(5-3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)пиколинонитрила (1,03 г, 2,43 ммоль) в этаноле (23,0 мл) добавляли борогидрид натрия (0,276 г, 7,29 ммоль); реакционную смесь нагревали с обратным холодильником в течение 2 ч, после которых реакционную смесь оставляли остывать до комнатной температуры и перемешивали в течение ночи. Добавляли уксусную кислоту (1,40 мл), за которой следовал 1,0 Н раствор соляной кислоты (48,6 мл) и смесь концентрировали с использованием роторного испарения. В остаток добавляли дихлорметан и фильтровали. Концентрация фильтрата посредством роторного испарения давала неочищенный продукт в виде пены светло-коричневого цвета (0,694 г, 66%). Этот материал использовали на следующей стадии без дополнительной очистки.
[0243] 1H ЯМР (400 МГц DMSO-d6) м.д. 2,13 (1H), 2,46 (1H), 3,77 (6Н), 4,48 (1H), 5,36 (1H), 5,97 (1H), 6,98 (3H), 7,08 (1H), 8,08 (1H), 8,28 (1H), 9,05 (1H).
[0244] MS (M+H+) 430,0.
[0245] 5-(5-(3,4-Диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновая кислота (D- 5)
[0246] В суспензию 5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинонитрила (0,694 г, 1,62 ммоль) добавляли 4,00 M раствор гидроксида натрия в воде (2,02 мл). Получаемую смесь нагревали с обратным холодильником в течение 3 ч, добавляли 1,0 Н раствор соляной кислоты (11,3 мл), и осадок светло-коричневого цвета фильтровали, промывали обильными количествами воды, сушили на воздухе/под вакуумом в течение 30 мин и затем под глубоким вакуумом 48 ч с получением твердого вещества светло-коричневого цвета (0,535 г, 74%). Этот материал использовали на следующей стадии без дополнительной очистки.
[0247] 1H ЯМР (400 МГц DMSO-d6) м.д. 2,13 (1H), 2,46 (1H), 3,76 (3H), 3,79 (3H), 4,48 (1H), 5,35 (1H), 6,00 (1H), 6,99 (3H), 7,08 (1H), 8,11 (1H), 8,32 (1H), 9,04 (1H).
[0248] MS (M+H+) 449,01.
[0249] Трет-бутил-4-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (D-6)
[0250] В раствор 5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновой кислоты (458 мг, 1,02 ммоль) в DMF (4,0 мл) добавляли N,N-диизопропилэтиламин (535 мкл, 3,06 ммоль) и HATU (427 мг, 1,12 ммоль). После перемешивания в течение 1 ч при КТ добавляли трет-бутил-пиперазин-1-карбоксилат (209 мг, 1,12 ммоль) и реакцию перемешивали в течение ночи при комнатной температуре. Воду добавляли, и получаемый осадок светло-коричневого цвета собирали с помощью фильтрования (0,5385 г). Очистка с помощью колоночной хроматографии (от 15% до 100% этилацетат/гептан) давала трет-бутил-4-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (332 мг, 54%) в виде твердого вещества светло-желтого цвета.
[0251] 1H ЯМР (400 МГц CD3OD) δ м.д. 1,46 (9H), 2,2 (1H), 2,5 (1H), 3,50 (8H), 3,73 (1H), 3,82 (6Н), 4,45 (1H), 5,08 (1H), 5,91 (1H), 7,02 (3H), 7,62 (1H), 8,23 (1H), 8,92 (1H).
[0252] MS (M+H+) 617,2.
[0253] (5-(5-(3,4-Диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиридин-2-ил)пиперазин-1-ил)метанон (ER-897560)
[0254] Соединение D-6 (66 мг, 0,107 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), чтобы получать трет-бутил-4-(5-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (9,2 мг, 14% выход) и трет-бутил-4-(5-((5R,7S)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (9,2 мг, 14% выход).
[0255] В раствор трет-бутил-4-(5-((5S,7R)-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (90,0 мг, 0,146 ммоль) в этаноле (4 мл) добавляли 4,0 M HCl в 1,4-диоксане (1,84 мл). Реакцию нагревали до 40°C в течение 1 ч. Реакционную смесь концентрировали посредством роторного испарения и превращали в азеотроп с использованием толуола, чтобы получать ER-897560 в виде твердого вещества бледно-желтого цвета (91 мг, 106% выход).
[0256] Пример ER-897097 получали из соединения C-9 (500 мг, 1,243 ммоль) и коммерчески доступного трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилата (461 мг, 1,492 ммоль) таким образом, который подобен таковому из примера D-4. Очистка с помощью хроматографии на силикагеле давала Boc-защищенное ER-897097 (460 мг, 73% выход). Снятие защитных групп с этого Boc-защищенного продукта (100 мг, 0,197 ммоль) осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897097 (80 мг, 99% выход). (LC-MS: Rt 1,49 мин, (M+1)+ 409,08 при условиях II).
[0257] Пример ER-897269
[0258] Соединение ER-897097 (94 мг, 0,229 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A) чтобы получать один из изомеров ER-897269 (15 мг, 16% выход, >95% ee).
[0259] Пример ER-897105 получали из соединения C-9 (500 мг, 1,243 ммоль) и коммерчески доступного трет-бутил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилата (563 мг, 1,492 ммоль) таким образом, который подобен таковому из примера D-4. Очистка с помощью хроматографии на силикагеле давала Boc-защищенное ER-897105 (312 мг, 44% выход). Снятие защитных групп с этого Boc-защищенного продукта (100 мг, 0,173 ммоль) осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897105 (71 мг, 86% выход).
[0260] LC-MS: Rt 1,48 мин, (M+1)+ 477,09 при условиях II.
[02611 Примеры ER-897214 и ER-897215
[0262] Соединение ER-897105 (50 мг, 0,105 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), чтобы получать ER-897214 (19 мг, 39% выход, >95% ee) и ER-897215 (19 мг, 39% выход, >95% ee).
[0263] Пример ER-897381 получали из соединения C-4 (500 мг, 1,061 ммоль) и коммерчески доступного трет-бутил-4-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-ил)пиперазин-1-карбоксилата (621 мг, 1,591 ммоль) таким образом, который подобен таковому из примера D-4. Очистка с помощью хроматографии на силикагеле давала Boc-защищенное ER-897381 (311 мг, 50% выход). Снятие защитных групп с этого Boc-защищенного продукта (100 мг, 0,17 ммоль) осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897381 (75 мг, 90% выход). LC-MS: Rt 1,52 мин, (M+1)+ 489,21 при условиях II).
[0264] Пример ER-897714 и ER-897715
[0265] Соединение ER-897381 (71 мг, 0,134 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому из ER-890044 (раздел A), чтобы получать ER-897714 (27 мг, 38% выход, >95% ee) и ER-897716 (30 мг, 42% выход, >95% ee).
[0266] Пример ER-897405 получали из соединения C-4 (500 мг, 1,061 ммоль) и коммерчески доступного трет-бутил-4-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперазин-1-карбоксилата (619 мг, 1,591 ммоль) таким образом, который подобен таковому из примера D-4. Очистка с помощью хроматографии на силикагеле давала Boc-защищенное ER-897405 (311 мг, 65% выход). Снятие защитных групп с этого Boc-защищенного продукта (100 мг, 0,17 ммоль) осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897405 (72 мг, 87% выход). LC-MS: Rt 1,45 мин, (M+1)+ 489,04 при условиях II.
[0267] Пример ER-897716 и ER-897717
[0268] Соединение ER-897405 (70 мг, 0,143 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), чтобы получать ER-897716 (23 мг, 33% выход) и ER-897717 (23 мг, 33% выход).
[0269] Пример ER-897765 получали из соединения C-4 (438 мг, 0,93 ммоль) и коммерчески доступного трет-бутил-(1-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперидин-4-ил)карбамата (250 мг, 0,62 ммоль) таким образом, который подобен таковому из примера D-4. Очистка с помощью хроматографии на силикагеле давала Boc-защищенное ER-897765 (161 мг, 43% выход). Снятие защитных групп с этого Boc-защищенного продукта (161 мг, 0,267 ммоль) осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897765 (131 мг, 98% выход).
[0270] Пример ER-895809 получали в две стадии из соединения D-5 (19 мг, 0,042 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (32 мг, 0,169 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3S)-трет-бутил-3-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пирролидин-1-карбоксилат (19 мг, 0,031 ммоль, 72% выход). Затем это промежуточное соединение (17 мг, 0,028 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-895809 (16 мг, 98% выход).
[0271] Пример ER-895810 получали в две стадии из соединения D-5 (19 мг, 0,042 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопирролидин-1-карбоксилата (32 мг, 0,169 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3R)-трет-бутил-3-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пирролидин-1-карбоксилат (24 мг, 0,039 ммоль, 92% выход). Затем это промежуточное соединение (22 мг, 0,036 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-895810 (21 мг, 100% выход). Точная вычисленная масса: 516,21. Наблюдаемая: 517,5.
[0272] Пример ER-896133 получали в две стадии из соединения D-5 (15 мг, 0,033 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (25 мг, 0,134 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-4-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (6 мг, 0,009 ммоль, 29% выход). Затем это промежуточное соединение (6 мг, 0,009 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896133 (5,3 мг, 92% выход).
[0273] Пример ER-896134 получали в две стадии из соединения D-5 (15 мг, 0,033 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (27 мг, 0,134 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-4-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пиперидин-1-карбоксилат (7 мг, 0,011 ммоль, 33% выход). Затем это промежуточное соединение (7 мг, 0,011 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896134 (5,8 мг, 87% выход).
[0274] Пример ER-896135 получали в две стадии из соединения D-5 (15 мг, 0,033 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (27 мг, 0,134 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3S)-трет-бутил-3-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пиперидин-1-карбоксилат (7 мг, 0,011 ммоль, 33% выход). Затем это промежуточное соединение (7 мг, 0,011 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896135 (6,5 мг, 97% выход).
[0275] Пример ER-896136 получали в две стадии из соединения D-5 (15 мг, 0,033 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (27 мг, 0,134 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3R)-трет-бутил-3-(5-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пиперидин-1-карбоксилат (7 мг, 0,011 ммоль, 33% выход). Затем это промежуточное соединение (7 мг, 0,011 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-896136 (6,1 мг, 91% выход).
[0276] Пример ER-896137 получали из соединения D-5 (15 мг, 0,033 ммоль) и коммерчески доступного пропан-2-амина (8 мг, 0,134 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать желаемый продукт ER-896137 (5 мг, 31% выход).
[0277] 4-(5-(3,4-Диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновую кислоту получали таким образом, который подобен таковому из примера D-5 (101 мг, 29% выход).
[0278] Пример ER-897034 получали в две стадии из 4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновой кислоты (25 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (31 мг, 0,167 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил- 4-(4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиноил)пиперазин-1-карбоксилат (15 мг, 0,024 ммоль, 44% выход). Затем это промежуточное соединение (13 мг, 0,021 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-897034 (12,2 мг, 98% выход).
[0279] Пример ER-897036 получали в две стадии из 4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновой кислоты (25 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (33 мг, 0,167 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение (3S)-трет-бутил-3-(4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пиперидин-1-карбоксилат (15 мг, 0,024 ммоль, 43% выход). Затем это промежуточное соединение (13 мг, 0,021 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-897036 (12 мг, 96% выход).
[0280] Пример ER-897037 получали в две стадии из 4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколиновой кислоты (25 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (33 мг, 0,167 ммоль) таким образом, который подобен таковому из примера D-6, чтобы получать промежуточное соединение трет-бутил-4-(4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)пиколинамидо)пиперидин-1-карбоксилат (14 мг, 0,022 ммоль, 40% выход). Затем это промежуточное соединение (13 мг, 0,021 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-897560, чтобы получать желаемый продукт ER-897037 (11 мг, 90% выход).
[0281] Примеры синтеза - раздел F
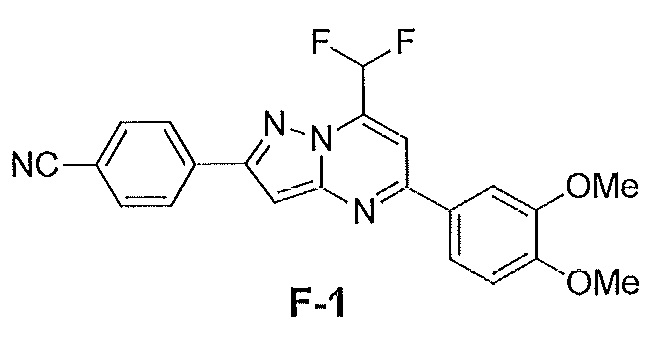
[0282] Соединение F-1 (9,84 г, 77% выход) получали с использованием 4-(5-амино-1H-пиразол-3-ил)бензонитрила (соединение A-2; 5,31 г, 31,4 ммоль) и коммерчески доступного l-(3,4-диметоксифенил)-4,4-дифторбутан-1,3-диона (8,1 г, 31,4 ммоль) таким образом, который подобен таковому для соединения A-7. MS (M+H+) 407,3.
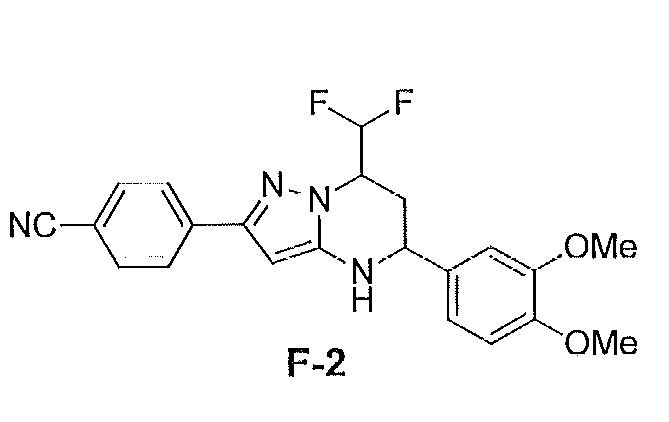
[0283] Соединение F-2 (9,8 г, 99% выход) получали восстановлением F-1 (9,8 г, 24,1 ммоль) с помощью NaBH4 таким образом, который подобен таковому для соединения A-8.
[0284] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 2,17-2,39 (м, 2H) 3,83-3,85 (м, 3H) 3,85-3,88 (м, 3H) 4,47 (дд, J=10,87, 2,29 Гц, 1H) 4,66-4,81 (м, 1H) 5,86 (с, 1H) 6,60 (т, J=55,00 Гц, 1H) 6,97 (д, J=7,97 Гц, 1H) 7,01-7,07 (м, 1H) 7,10 (с, 1H) 7,66-7,76 (м, 2H) 7,91 (д, J=8,13 Гц, 2H). MS (M+H)+ 411,7.
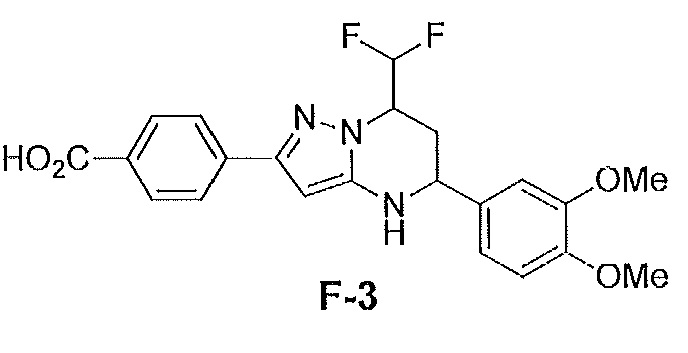
[0285] Соединение F-3 (9,4 г, 100% выход) получали с помощью гидролиза F-1 (8,94 г, 21,8 ммоль), используя водный NaOH, таким образом, который подобен таковому для соединения A- 9.
[0286] 1H ЯМР (400 МГц, метанол-d4) м.д. 2,21-2,37 (м, 2H) 3,80-3,82 (м, 4H) 3,84 (с, 3H) 4,46 (дд, J=10,83, 2,56 Гц, 1H) 6,60 (т, J=55,00 Гц, 1H) 6,95 (д, J=8,28 Гц, 1H) 7,00-7,04 (м, 1H) 7,08 (д, J=1,91 Гц, 1H) 7,81 (м, J=8,35 Гц, 2H) 8,00 (м, J=8,39 Гц, 2H). MS (M+H+) 431,4.
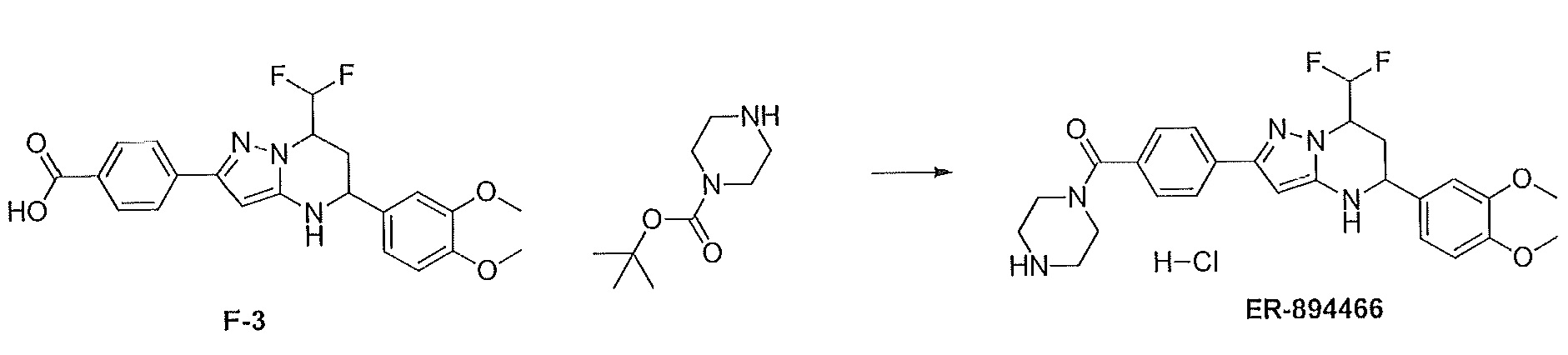
[0287] В 5-мл пробирку с винтовой крышкой добавляли соединение F-3 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойную кислоту (1,99 г, 4,64 ммоль), трет-бутил-пиперазин-1-карбоксилат (1,05 г, 5,61 ммоль), HATU (2,14 г, 5,62 ммоль), DMF (10,0 мл) и основание Хунига (0,815 мл, 4,67 ммоль). Реакционную смесь перемешивали при 30°C в течение ночи. Смесь разводили этилацетатом, промывали водой, промывали 0,1 Н водной соляной кислотой, промывали водным бикарбонатом натрия, промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением твердого вещества коричневого цвета. Материал очищали посредством флэш-хроматографии с градиентом гептан:этилацетат 0-90%. Фракции, содержащие продукт, объединяли и концентрировали в вакууме с получением твердого вещества грязно-белого цвета. Затем получаемое твердое вещество растворяли в этаноле (10,0 мл) и 4,0 M HCl в диоксане (10,0 мл, 40,00 ммоль), и смесь перемешивали при КТ в течение 1 ч. Затем смесь концентрировали в вакууме с получением соединения ER-894466 в виде твердого вещества желтого цвета (1,91 г, 77% выход).
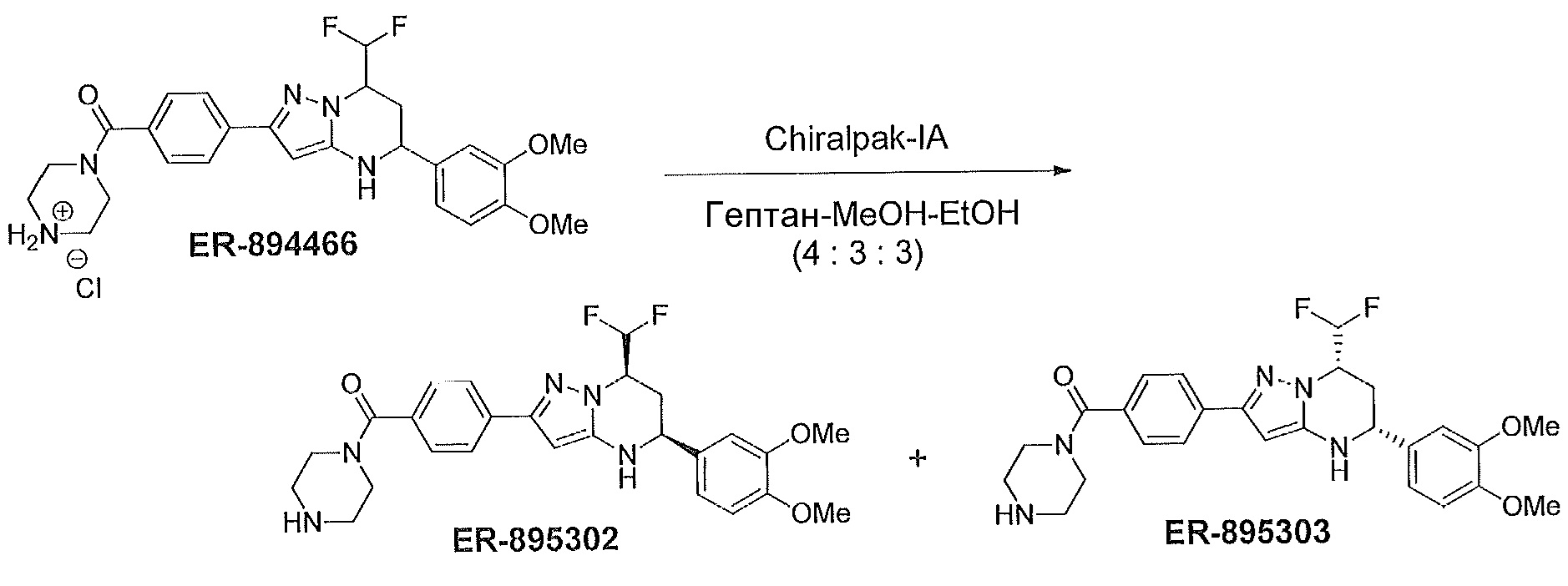
[0288] Хиральное разделение ER-894466 (1,91 г, 3,59 ммоль) с помощью ВЭЖХ таким образом, который подобен ER-890044, предоставляло ER-895302 (538 мг, 56% выход, >95% ee) и ER-895303 (671 мг, 70% выход, >95% ee).
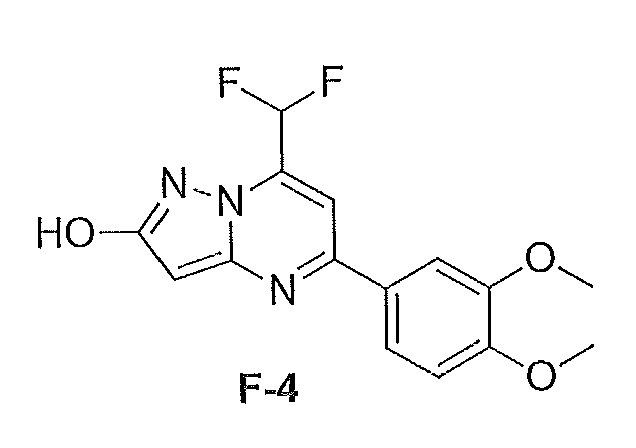
[0289] Соединение F-4 7-(дифторметил)-5-(3,4-диметоксифенил)пиразоло[1,5-a]пиримидин-2-ол (30,6 г, 95 ммоль, 95% выход) получали с помощью 5-амино-1H-пиразол-3-ола (9,91 г, 100 ммоль) и 1-(3,4-диметоксифенил)-4,4-дифторбутан-1,3-диона (25,8 г, 100 ммоль) таким образом, который подобен таковому для соединения A-14.
[0290] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 3,87-3,90 (м, 3H) 3,90-3,93 (м, 3H) 5,94 (с, 1H) 7,06 (д, J=8,39 Гц, 1H) 7,29 (т, J=53,00 Гц, 1H) 7,47 (с, 1H) 7,67 (дд, J=8,43, 1,45 Гц, 1H) 7,77 (д, J=1,75 Гц, 1H). MS (M+H+) 323,3.
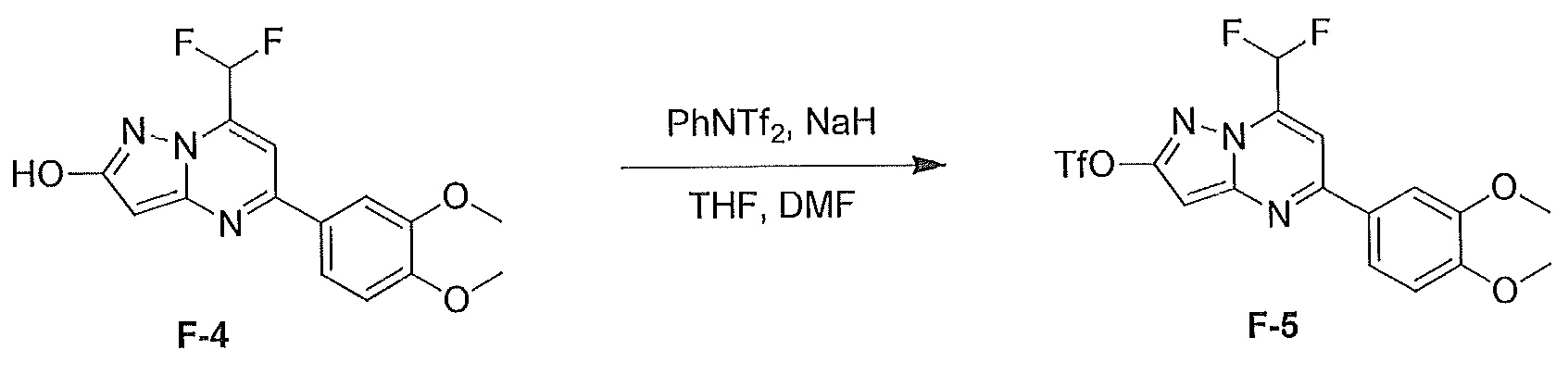
[0291] В суспензию соединения F-4 7-(дифторметил)-5-(3,4-диметоксифенил)пиразоло[1,5-a]пиримидин-2-ола (3,21 г, 9,99 ммоль) в DMF (5,00 мл) и THF (25,0 мл) при 0°C добавляли гидрид натрия (0,480 г, 11,99 ммоль) маленькими частями. Смесь перемешивали при 0°C в течение 30 мин. 1,1,1-Трифтор-N-фенил-N-(трифторметил)сульфонилметансульфонамид (4,28 г, 11,99 ммоль) добавляли малыми частями и смеси позволяли достигать КТ. Через 1 час реакционную смесь выливали в 0,1 Н раствор HCl, что приводило к образованию осадка белого цвета, который фильтровали и промывали водой. Неочищенный продукт суспендировали в IPA, нагревали до ~70°C и охлаждали до КТ. Получаемый осадок белого цвета промывали дополнительным IPA и сушили при пониженном давлении с получением соединения F-5 7-(дифторметил)-5-(3,4-диметоксифенил)пиразоло[1,5-a]пиримидин-2-илтрифторметансульфоната в виде твердого вещества белого цвета (2,85 г, 6,29 ммоль, 62,9% выход).
[0292] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 3,89 (с, 3H) 3,92 (с, 3H) 6,70 (с, 1H) 7,07 (д, J=8,50 Гц, 1H) 7,17-7,27 (м, 2H) 7,29-7,38 (м, 1Н) 7,78 (дд, J=8,51, 2,14 Гц, 1H) 7,82-7,89 (м, 2H). MS (M+H+) 454,4.
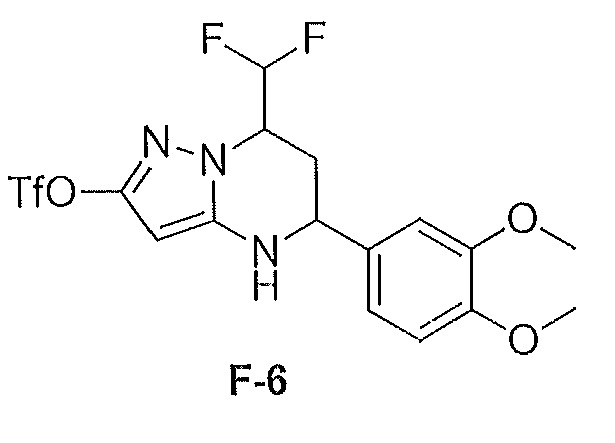
[0293] Соединение F-6 (27,2 г, 77% выход) получали восстановлением соединения F-5 (35,0 г, 77,2 ммоль) с помощью NaBH4 таким образом, который подобен таковому для соединения A-16.
[0294] 1H ЯМР (400 МГц, метанол-d4) δ м.д. 2,14-2,32 (м, 2H) 3,79 (с, 3H) 3,81 (с, 3H) 4,44 (дд, J=11,06, 2,67 Гц, 1H) 4,53-4,66 (м, 1H) 5,28 (с, 1H) 6,40 (т, J=2,49 Гц, 1H) 6,91-6,94 (м, 1H) 6,96-7,00 (м, 1H) 7,03 (д, J=1,94 Гц, 1H). MS (M+H+) 458,1.
[0295] Пример ER-895088-01 получали из соединения ER-895305 (25,0 мг, 0,058 ммоль) и коммерчески доступного (S)-трет-бутил-3-метилпиперазин-1-карбоксилата (35,2 мг, 0,177 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (9,3 мг, 29%).
[0296] Пример ER-895116 получали из соединения ER-895305 (25,0 мг, 0,058 ммоль) и коммерчески доступного (R)-трет-бутил-пирролидин-3-илкарбамата (36,5 мг, 0,196 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (16 мг, 52%).
[0297] Пример ER-895089 получали из соединения ER-895305 (25,0 мг, 0,058 ммоль) и коммерчески доступного (S)-трет-бутил пирролидин-3-илкарбамата (36,7 мг, 0,197 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (7,1 мг, 23%).
[0298] Пример ER-895090 получали из соединения ER-895305 (25,0 мг, 0,058 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (38,6 мг, 0,196 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,1 мг, 57%).
[0299] Пример ER-895115 получали из соединения ER-895305 (25,6 мг, 0,060 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (31,5 мг, 0,169 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (3,5 мг, 11%).
[0300] Пример ER-895745 получали из соединения ER-895305 (26,2 мг, 0,061 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (32,9 мг, 0,155 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,1 мг, 53%).
[0301] Пример ER-895091-01 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (21,0 мг, 0,113 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (2,5 мг, 8%).
[0302] Пример ER-895092 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (5,2 мг, 16%).
[0303] Пример ER-895093 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (10,3 мг, 32%).
[0304] Пример ER-895094 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (7,4 мг, 23%).
[0305] Пример ER-895096 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (2S,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (24,0 мг, 0,113 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (13,9 мг, 43%).
[0306] Пример ER-895097 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопирролидин-1-карбоксилата (21,0 мг, 0,113 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (17,3 мг, 56%).
[0307] Пример ER-895098 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (21,0 мг, 0,113 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,5 мг, 60%).
[0308] Пример ER-895101 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (22,0 мг, 0,112 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (9 мг, 28%).
[0309] Пример ER-895099 получали из соединения 4-(7- (дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-3-аминоазетидин-1-карбоксилата (19,0 мг, 0,110 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14,1 мг, 41%).
[0310] Пример ER-895102 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (21,0 мг, 0,113 ммоль) таким образом, который подобен таковому для примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (17,2 мг, 56%).
[0311] Пример ER-895104 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому для примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (17,1 мг, 54%).
[0312] Пример ER-895105 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому для примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (15,8 мг, 50%).
[0313] Пример ER-895106 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-метилпиперазин-1-карбоксилата (22,0 мг, 0,110 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14,9 мг, 47%).
[0314] Пример ER-895107 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (2S,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (24,0 мг, 0,112 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14,2 мг, 44%).
[0315] Пример ER-895109 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (21,0 мг, 0,113 ммоль) таким образом, который подобен таковому для примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (17,7 мг, 57%).
[0316] Пример ER-895112 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (22,0 мг, 0,111 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (14,4 мг, 46%).
[0317] Пример ER-895111 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-фторбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-2,6-диазаспиро[3.3]гептан-2-карбоксилата (22,0 мг, 0,111 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (22,7 мг, 63%).
[0318] Пример ER-895731 получали из соединения 3-(7- (дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (32,8 мг, 0,176 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (22,1 мг, 70%).
[0319] Пример ER-895732 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (31,0 мг, 0,155 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (22 мг, 70%).
[0320] Пример ER-895733 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (34,0 мг, 0,170 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (26,5 мг, 85%).
[0321] Пример ER-895734 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (36,3 мг, 0,181 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (23,4 мг, 75%).
[0322] Пример ER-895739 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (37,7 мг, 0,202 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (22,9 мг, 73 %).
[0323] Пример ER-895740 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопирролидин-1-карбоксилата (34,8 мг, 0,187 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (23,1 мг, 73%).
[0324] Пример ER-895744 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (26,9 мг, 0,127 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (26,5 мг, 82%).
[0325] Пример ER-895741 получали из соединения 3-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)бензойной кислоты (25,0 мг, 0,058 ммоль) и коммерчески доступного трет-бутил-3-аминоазетидин-1-карбоксилата (30,1 мг, 0,175 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (5,5 мг, 16%).
[0326] Пример ER-895718 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (45,4 мг, 0,227 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (21,4 мг, 68%).
[0327] Пример ER-895719 получали из соединения 4-(7- (дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил3-аминопиперидин-1-карбоксилата (29,8 мг, 0,149 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (21,6 мг, 69%).
[0328] Пример ER-895720 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (28,6 мг, 0,143 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (21,7 мг, 69%).
[0329] Пример ER-895721 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-метилпиперазин-1-карбоксилата (31,1 мг, 0,155 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (20,2 мг, 64%).
[0330] Пример ER-895722 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-метилпиперазин-1-карбоксилата (41,2 мг, 0,206 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (21 мг, 67%).
[0331] Пример ER-895723 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (2S,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (34,1 мг, 0,159 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (20,5 мг, 64%).
[0332] Пример ER-895725 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопирролидин-1-карбоксилата (43,7 мг, 0,235 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (19,8 мг, 65%).
[0333] Пример ER-895726 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопирролидин-1-карбоксилата (31,0 мг, 0,167 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (20,6 мг, 67%).
[0334] Пример ER-895729 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (29,9 мг, 0,151 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (19,6 мг, 62%).
[0335] Пример ER-895730 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (28,9 мг, 0,136 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (23,9 мг, 74%).
[0336] Пример ER-895755 получали из соединения 4-(7- (дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,5 мг, 0,058 ммоль) и коммерчески доступного трет-бутил-пиперазин-1-карбоксилата (27,9 мг, 0,150 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (28,3 мг, 89%).
[0337] Пример ER-895727 получали из соединения 4-(7-(дифторметил)-5-(3,4-диметоксифенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-3-метилбензойной кислоты (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-3-аминоазетидин-1-карбоксилата (37,0 мг, 0,215 ммоль) таким образом, который подобен таковому из примера ER-895080. Очистка помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (22,3 мг, 65%).
[0338] Пример ER-896059 получали из соединения ER-895435 (10,0 мг, 0,023 ммоль) и коммерчески доступного трет-бутил-4-аминопиперидин-1-карбоксилата (17,8 мг, 0,089 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (11,2 мг, 87%).
[0339] Пример ER-896060 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (19,3 мг, 0,096 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (12,3 мг, 95%).
[0340] Пример ER-896061 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-аминопиперидин-1-карбоксилата (16,9 мг, 0,084 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (12,2 мг, 94%).
[0341] Пример ER-896062 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (S)-трет-бутил-3-метилпиперазин-1-карбоксилата (23,9 мг, 0,119 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (10,7 мг, 83%).
[0342] Пример ER-896063 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (R)-трет-бутил-3-метилпиперазин-1-карбоксилата (20,5 мг, 0,102 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (10,9 мг, 84%).
[0343] Пример ER-896064 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (2S,5R)-трет-бутил-2,5-диметилпиперазин-1-карбоксилата (17,2 мг, 0,080 ммоль) таким образом, который подобен таковому для примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (10,3 мг, 78%).
[0344] Пример ER-896067 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного (1S,4S)-трет-бутил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (15,2 мг, 0,077 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (9,9 мг, 77%).
[0345] Пример ER-896068 получали из соединения ER-895435 (25,0 мг, 0,056 ммоль) и коммерчески доступного трет-бутил-гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (17,3 мг, 0,081 ммоль) таким образом, который подобен таковому из примера ER-894463. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (12,3 мг, 93%).
[0346] Пример ER-896071 получали из соединения ER-895435 (25,9 мг, 0,060 ммоль) и коммерчески доступного трет-бутил-3-(аминометил)азетидин-1-карбоксилата (30,4 мг, 0,163 ммоль) таким образом, который подобен таковому для примера ER-895080. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала желаемый продукт (18,6 мг, 51%).
[0347] Примеры синтеза - раздел G
[0348] Получение ER-893993
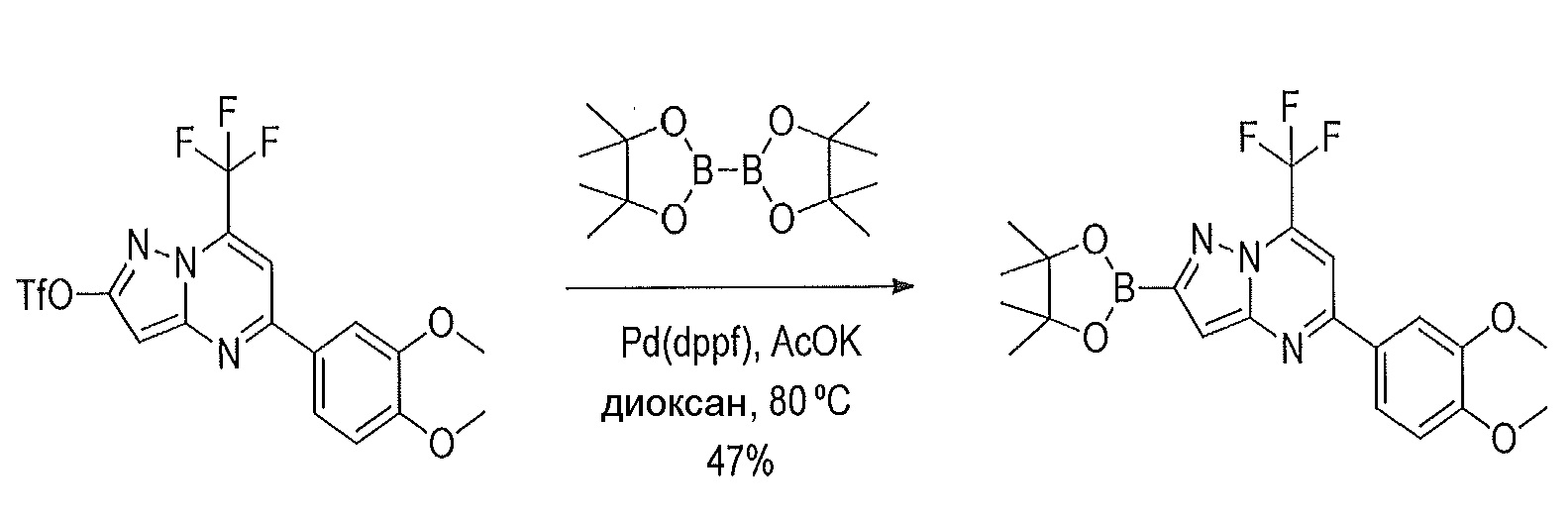
[0349] В 500-мл колбу загружали 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (10,78 г, 42 ммоль), 5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-илтрифторметансульфонат (10,0 г, 21 ммоль), ацетат калия (10,41 г, 106 ммоль) и 1,4-диоксан (100 мл). Реакционную смесь дегазировали азотом в течение 15 минут. Добавляли комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (4,33 г, 5,3 ммоль) и смесь герметизировали и перемешивали в течение 3 часов при 80°C. Реакционную смесь охлаждали при комнатной температуре и разделяли между EtOAc (1000 мл) и насыщенным раствором NaHCO3 (200 мл). Фазы разделяли, и водную фазу снова экстрагировали 2× с использованием EtOAc (200 мл). Объединенные органические слои промывали солевым раствором (200 мл). Органический слой сушили безводным сульфатом натрия, фильтровали и концентрировали. Неочищенный материал растворяли в EtOAc (500 мл), добавляли гептан (500 мл), и твердые примеси черного цвета удаляли с помощью фильтрования. Фильтрат, содержащий желаемый продукт, концентрировали при пониженном давлении, суспендировали в 150 мл IPA, нагревали при 70°C в течение 30 минут и затем охлаждали при комнатной температуре. Осадок зеленого цвета отфильтровывали, промывали IPA и сушили под вакуумным насосом. 5-(3,4-Диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидин (4,50 г, 10,02 ммоль, 47,2% выход).
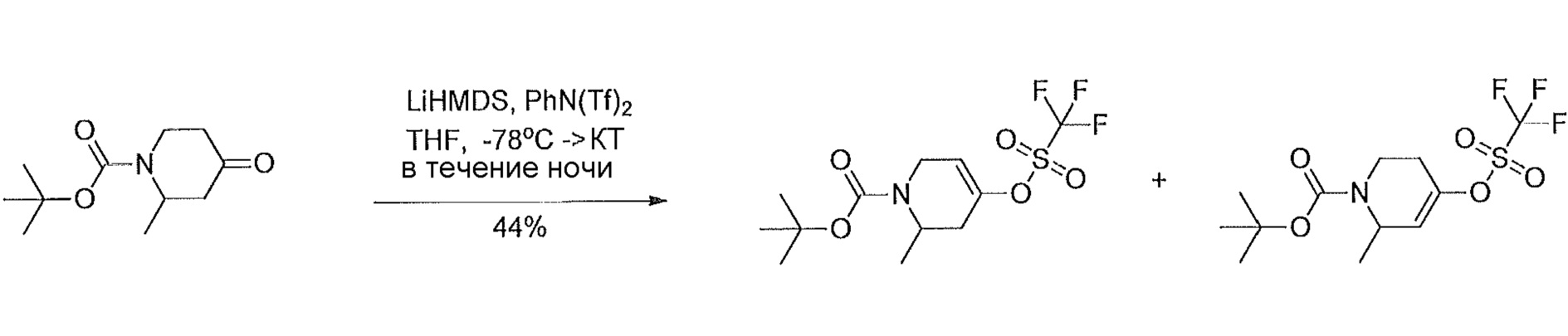
[0350] В 25-мл колбе и под атмосферой азота в раствор трет-бутил-2-метил-4-оксопиперидин-1-карбоксилата (558 мг, 2,6 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметил)сульфонилметансульфонамида (1869 мг, 5,2 ммоль) в безводном THF (5 мл) при -78°C добавляли 1,0 М LiHMDS в THF (5,23 мл, 5,2 ммоль). Смесь перемешивали в течение ночи, при этом позволяя медленно нагреваться при комнатной температуре. Реакцию гасили насыщенным NaHCO3. Затем смесь экстрагировали 3× с использованием MTBE. Объединенные органические слои сушили сульфатом натрия, фильтровали и концентрировали. Смесь региоизомеров (трет-бутил-6-метил-4-(((трифторметил)сульфонил)окси)-5,6-дигидропиридин-1(2H)-карбоксилат и трет-бутил-2-метил-4-(((трифторметил)сульфонил)окси)-5,6-дигидропиридин-1-(2H)-карбоксилат) получали в виде масла бледно-желтого цвета (397 мг, 44% выход).
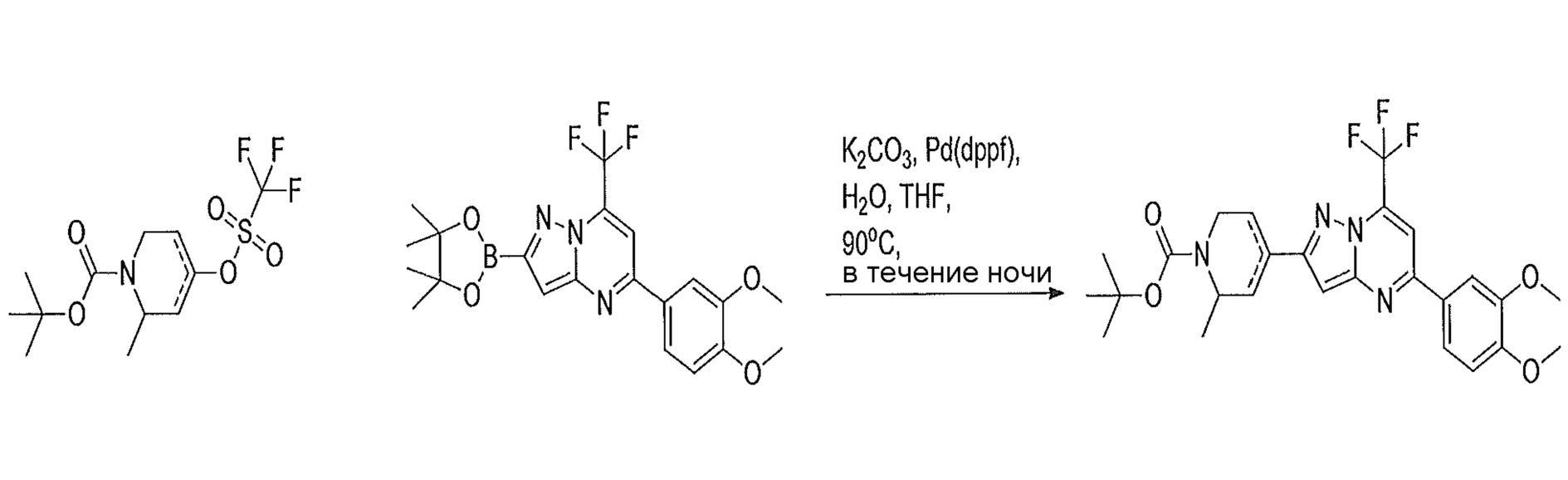
[0351] В 5-10-мл микроволновый сосуд загружали 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидин (650 мг, 1,45 ммоль), трет-бутил-2-метил-4-(((трифторметил)сульфонил)окси)-5,6-дигидропиридин-1(2H)-карбоксилат (смесь с трет-бутил-6-метил-4-(((трифторметил)сульфонил)окси)-5,6-дигидропиридин-1(2H)- карбоксилатом, всего 396 мг, 1,15 ммоль), карбонат калия (792 мг, 5,7 ммоль), воду (2,0 мл) и THF (4,5 мл). Реакционную смесь дегазировали азотом в течение 15 минут. Добавляли комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (234 мг, 0,29 ммоль) и смесь шкалировали и перемешивали в течение ночи при 90°C. Реакционную смесь охлаждали при комнатной температуре и концентрировали. Неочищенный продукт очищали на силикагеле (Column Interchim 40 г, 30 мкМ), элюируя с использованием 12-100% EtOAc/гептана. Смесь региоизомеров (трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-2-метил-5,6-дигидропиридин-1(2H)-карбоксилат и трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-6-метил-5,6-дигидропиридин-1(2H)-карбоксилат) получали в виде твердого вещества желтого цвета (142 мг, 24% выход).
[0352] Синтез ER-896993
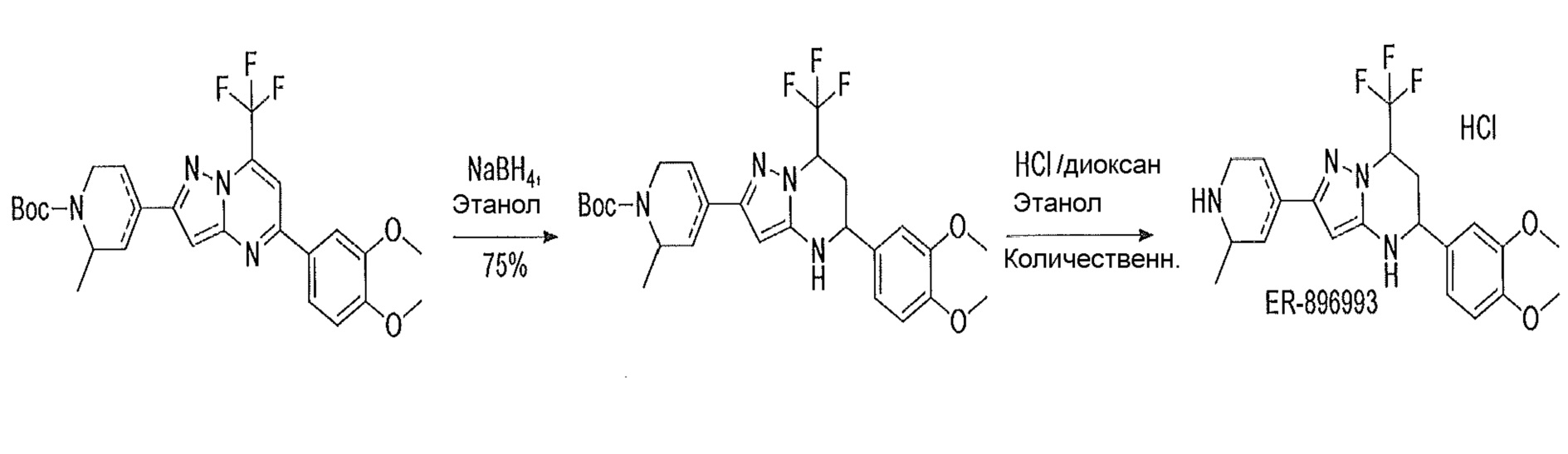
[0353] Тетрагидроборат натрия (10,94 мг, 0,29 ммоль) медленно добавляли в суспензию трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-2-метил-5,6-дигидропиридин-1(2H)-карбоксилата (смесь с региоизомером трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-6-метил-5,6-дигидропиридин-1(2H)-карбоксилатом, всего 50 мг, 0,096 ммоль) в этаноле (1,0 мл) при комнатной температуре. Смесь нагревали до 80°C в течение 60 минут. Добавляли этилацетат. Смесь последовательно промывали насыщенным водным раствором NH4Cl и затем солевым раствором.
[0354] Органический слой сушили с использованием безводного сульфата натрия, фильтровали и концентрировали. Неочищенный продукт очищали на силикагеле (Column Interchim 25 г, 30 мкМ), элюируя с использованием 12-100% EtOAc/гептана. Смесь региоизомеров (трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-метил-5,6-дигидропиридин-1(2H)-карбоксилат и трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-6-метил-5,6-дигидропиридин-1(2H)-карбоксилат) получали в виде твердого вещества белого цвета (38 мг, 75% выход).
[0355] Трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-метил-5,6-дигидропиридин-1(2H)-карбоксилат (смесь с региоизомером трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-6-метил-5,6-дигидропиридин-1(2H)-карбоксилатом, всего 34 мг, 0,065 ммоль) растворяли в этаноле (0,5 мл) и 4,00 М HCl в диоксане (0,5 мл) и смесь перемешивали при 40°C в течение 1 часа. Добавляли 1 мл толуола. Реакционную смесь концентрировали.
[0356] Продукт сушили под вакуумным насосом с получением 29 мг конечного продукта в виде соли HCl (смесь региоизомеров 5-(3,4-диметоксифенил)-2-(6-метил-1,2,3,6-тетрагидропиридин-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина гидрохлорида и 5-(3,4-диметоксифенил)-2-(2-метил-1,2,3,6-тетрагидропиридин-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина гидрохлорида) (ER-896993).
[0357] Синтез ER-896994
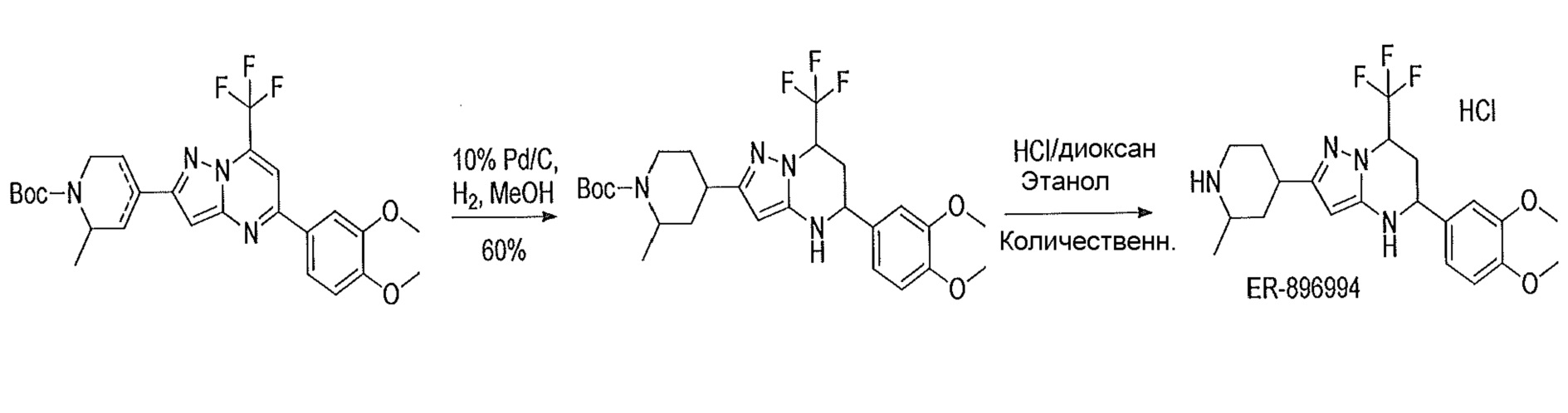
[0358] Трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-2-метил-5,6- дигидропиридин-1(2H)-карбоксилат (смесь с региоизомером трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-6-метил-5,6-дигидропиридин-1(2H)-карбоксилатом, всего 60 мг, 0,116 ммоль) растворяли в метаноле (2,5 мл). Раствор обрабатывали водородом в течение 2,5 ч при комнатной температуре с использованием H-Cube (полный H2, 1 мл/мин, малый размер (30 мм) 10% палладий на углероде картридж). Добавляли 1 мл толуола. Растворитель концентрировали. Неочищенный продукт очищали на силикагеле (Column Interchim 25 г, 30 мкМ), элюируя с использованием 12-100% EtOAc/гептана, с получением трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-метилпиперидин-1-карбоксилата (36 мг, 0,069 ммоль, 59% выход) в виде твердого вещества белого цвета.
[0359] Трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-ил)-2-метилпиперидин-1-карбоксилат (29 мг, 0,055 ммоль) растворяли в этаноле (0,5 мл) и 4,00 М HCl в диоксане (0,5 мл) и смесь перемешивали при 40°C в течение 1 часа. Добавляли 1 мл толуола. Реакционную смесь концентрировали. Продукт сушили под вакуумным насосом с получением 25 мг конечного продукта в виде соли HCl (5-(3,4-диметоксифенил)-2-(2-метилпиперидин-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина гидрохлорид, ER-896994).
[0360] Пример ER-897090
[0361] Пример ER-897090 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (507 мг, 1,129 ммоль) и трет-бутил-4-(((трифторметил)сульфонил)окси)-2,3,6,7-тетрагидро-1H-азепин-1-карбоксилата (300 мг, 0,869 ммоль), полученного из коммерчески доступного трет-бутил-4-оксоазепан-1-карбоксилата таким образом, который подобен таковому для ER-896993 (раздел G), за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), чтобы получать ER-897090 (96 мг, 26% выход). LC-MS: Rt 1,49 мин, (M+1)+ 423,06 при условиях II.
[0362] Соединение ER-897090 (94 мг, 0,224 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), с получением один из изомеров ER-897212 (17 мг, 18% выход).
[0363] Пример ER-897130 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (493 мг, 1,097 ммоль) и трет-бутил-3-(((трифторметил)сульфонил)окси)-2,5-дигидро-1H-пиррол-1-карбоксилата (174 мг, 0,548 ммоль), полученного из коммерчески доступного трет-бутил-3-оксопирролидин-1-карбоксилата таким образом, который подобен таковому для ER-896993 (раздел G) за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), с получением ER-897130 (68 мг, 31% выход).
[0364] Пример ER-897142 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (489 мг, 1,089 ммоль) и 4-((трет-бутоксикарбонил)амино)циклогес-1-ен-1-илтрифторметансульфоната (188 мг, 0,544 ммоль), полученного из коммерчески доступного трет-бутил-(4-оксоциклогексил)карбамата таким образом, который подобен таковому для ER-896993 (раздел G) за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), с получением ER-897142 (111 мг, 48% выход). (LC-MS: Rt 1,57 мин, (M+1)+ 423,06 при условиях II)
[0365] Пример ER-897364 и ER-897365
[0366] Соединение ER-897090 (100 мг, 0,237 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), с получением ER-897364 (4 мг, 4% выход, >95% ee) и ER-897365 (6,4 мг, 6% выход, >95% ee).
[0367] Пример ER-897547
[0368] Получение трет-бутил-3-метил-4-оксопиперидин-1-карбоксилата
[0369] Раствор 1-бензил-3-метилпиперидин-4-она (1,63 г, 8,018 ммоль) и ди-трет-бутил-дикарбоната (1,925 г, 8,82 ммоль) в 50 мл метанола гидрогенизировали с использованием H-Cube (контролируемый H2 при 50 бар, скорость потока 1,0 мл/мин) с Pd-C картриджем. Реакционную смесь рециркулировали в течение 12 часов. После промывания H-Cube тщательно метанолом, растворитель выпаривали и получаемое масло очищали с помощью хроматографии на силикагеле с получением указанного в заголовке соединения (1,5 г, 88%).
[0370] Пример ER-897547 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразолол[1,5-a]пиримидина (488 мг, 1,086 ммоль) и трет-бутил-5-метил-4-(((трифторметил)сульфонил)окси)-5,6-дигидропиридин-1(2H)-карбоксилата (250 мг, 0,724 ммоль), полученного из трет-бутил-3-метил-4-оксопиперидин-1-карбоксилата таким образом, который подобен таковому для ER-896993 (раздел G), за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), с получением ER-897547 (68 мг, 31% выход).
[0371] Пример ER-897597 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (475 мг, 1,058 ммоль) и коммерчески доступного трет-бутил-4-(4-бромфенил)пиперидин-1-карбоксилата (240 мг, 0,705 ммоль) таким образом, который подобен таковому для ER-896993 (раздел G), за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), с получением ER-897597 (32 мг, 9% выход). LC-MS: Rt 1,72 мин, (M+1)+ 486,95 при условиях II.
[0372] Пример ER-897814 и ER-897815
[0373] Соединение ER-897597 (20 мг, 0,041 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), с получением ER-897814 (7 мг, 35% выход, >95% ee) и ER-897815 (3 мг, 15% выход, >95% ee).
[0374] Пример ER-897728
[0375] Получение бензил-9-оксо-3-азаспиро[5,5]ундец-7-ен-3-карбоксилата
[0376] Бензил-4-формилпиперидин-1-карбоксилат (5,17 г, 20,907 ммоль) и моногидрат п-толуолсульфоновой кислоты (0,398 г, 2,091 ммоль) перемешивали в бензоле (30,0 мл, 334,136 ммоль) при 70°C. Добавляли бут-3-ен-2-он (3,76 мл, 41,813 ммоль) и нагревали реакционную смесь с обратным холодильником в течение ночи, при этом удаляя воду с использованием ловушки Дина-Старка. После охлаждения реакционной смеси до КТ, добавляли насыщенный раствор NaHCO3, и органический слой сушили над Na2SO4 и выпаривали. Получаемое масло очищали посредством Biotage (SiO2, 250 г, EtOAc/гептан от 10% до 50%), с получением указанного в заголовке соединения (3,58 г, 11,96 ммоль, 57,2% выход).
[0377] Получение трет-бутил-9-оксо-3-азаспиро[5,5]ундекан-3-карбоксилата
[0378] Раствор бензил-9-оксо-3-азаспиро[5,5]ундец-7-ен-3-карбоксилата (1,26 г, 4,209 ммоль), ди-трет-бутилдикарбоната (1,01 г, 4,63 ммоль) и TEA (1,47 мл, 10,522 ммоль) в 50 мл метанола гидрогенизировали с использованием H-Cube (полный H2, скорость потока 1,0 мл/мин) с Pd-C картриджем. Реакционную смесь рециркулировали в течение 5 часов. После тщательного прорывания H-Cube метанолом, растворитель выпаривали, и получаемое масло очищали с помощью хроматографии на силикагеле с получением указанного в заголовке соединения (681 мг, 61%).
[0379] Пример ER-897728 получали из 5-(3,4-диметоксифенил)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (489 мг, 1,089 ммоль) и трет-бутил-9-(((трифторметил)сульфонил)окси)-3-азаспиро[5,5]ундец-8-ен-3-карбоксилата (290 мг, 0,726 ммоль), полученного из трет-бутил-9-оксо-3-азаспиро[5,5]ундекан-3-карбоксилата таким образом, который подобен таковому для ER-896993 (раздел G), за тем исключением, что стадию снятия защитных групп осуществляли таким образом, который подобен таковому для ER-887084 (раздел B), с получением ER-897728 (91 мг, 26% выход). LC-MS: Rt 1,67 мин, (M+1)+ 477,13 при условиях II.
[0380] Пример ER-897851
[0381] Соединение ER-897728 (85 мг, 0,178 ммоль) разделяли на составляющие его энантиомеры таким образом, который подобен таковому для ER-890044 (раздел A), с получением одного из изомеров ER-897851 (28 мг, 33% выход).
[0382] Пример ER-890978 получали из соединения G2 (600 мг, 1,34 ммоль) и коммерчески доступного 4-бром-2-хлорпиридина таким образом, который подобен таковому из примера ER-896993, с получением 2-(2-хлорпиридин-4-ил)-5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (311 мг, 54% выход), после чего следовало восстановление с использованием NaBH4 (осуществляли на 300 мг этого материала). Очистка с помощью хроматографии на силикагеле давала желаемый продукт (277 мг, 92% выход).
[0383] Примеры синтеза - раздел H
[0384] Получение 1: 1-метил-2-(пропан-2-илиден)гидразин
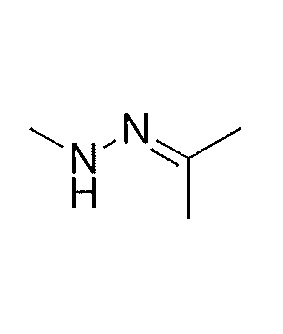
[0385] Ацетон (100 мл) обрабатывали по каплям (шприцевой насос) в течение 45 минут N-метилгидразином (20 мл), и реакционный раствор перемешивали при комнатной температуре в течение 45 минут. Реакционный раствор после этого нагревали при 55°C в течение дополнительных 15 минут, охлаждали до комнатной температуры, сушили над сульфатом натрия, фильтровали и концентрировали с помощью роторного испарителя при 40°C или менее. Затем неочищенный продукт очищали посредством дистилляции при 110-122°C с получением указанного в заголовке соединения в виде бесцветного масла (14,2 г, 43,9%).
1H ЯМР (400 МГц, DMSO-d6) δ 1,58 (с, 3H), 1,72 (с, 3H), 2,63 (с, 3H), 5,21 (уш.с, 1H).
[0386] Получение 2: 3-(этоксиметилен)пентан-2,4-дион
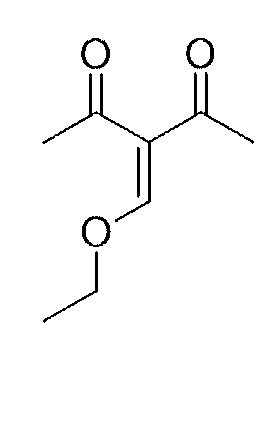
[0387] Раствор ацетилацетона (40 мл), этилортоформиата (95,4 мл) и уксусного ангидрида (54,2 мл) нагревали с обратным холодильником (150°C) в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры и непосредственно подвергали колоночной флэш-хроматографии (E.Merck силикагель (~120 г); элюент: 100% EtOAc, после чего следовал 5% EtOH в EtOAc). Концентрирование фракций, содержащих чистый продукт, с использованием роторного испарителя при 40°C давало указанное в заголовке соединение в виде вязкого масла темно-красного цвета (10,4 г, 17,0%).
[0388] 1H ЯМР (400 МГц, CDCl3) δ 1,36 (т, 3H), 2,28 (с, 3H), 2,35 (с, 3H), 4,22 (кв., 2H), 7,67 (с, 1H).
[0389] Получение 3: 3-((1-метил-2-(пропан-2-илиден)гидразинил)метилен)пентан-2,4-дион
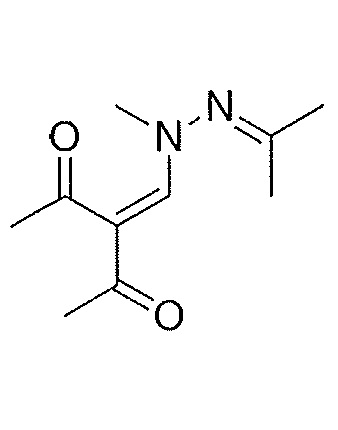
[0390] 3-(Этоксиметилен)пентан-2,4-дион (получение 2, 8,6 г) растворяли в простом эфире (30 мл) и охлаждали до 0°C. Реакционный раствор после этого медленно обрабатывали 1-метил-2-(пропан-2-илиден)гидразином (получение 1, 4,8 г) по каплям в течение 5 минут и затем нагревали и перемешивали при комнатной температуре в течение ночи. Реакционный раствор очищали непосредственно посредством колоночной флэш-хроматографии (Biotage Quad 25; элюент: 20% EtOH в EtOAc) с получением указанного в заголовке соединения в виде твердого вещества светло-красного цвета (9,1 г, 84,0%).
[0391] 1H ЯМР (400 МГц, DMSO-d6) δ 1,82 (с, 3H), 1,89 (с, 3H), 2,05 (с, 6H), 3,07 (с, 3H), 7,40 (с, 1Н).
[0392] Получение 4: 1-(1,3-диметил-1H-пиразол-4-ил)этанон
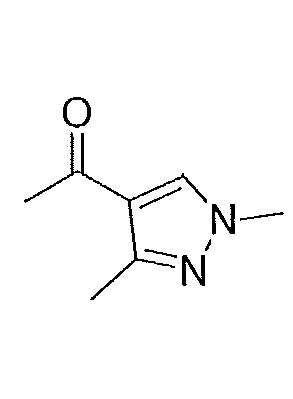
[0393] 3-((1-Метил-2-(пропан-2-илиден)гидразинил)метилен)пентан-2,4-дион (получение 3, 9,1 г) растворяли в этаноле (20 мл) и обрабатывали 1 М хлороводородом в воде (20 мл). Реакционный раствор перемешивали при комнатной температуре в течение 15 минут. После этого реакционный раствор концентрировали под вакуумом с использованием роторного испарителя до общего объема приблизительно 20 мл. Реакционный раствор после этого обрабатывали насыщенным водным бикарбонатом натрия (45 мл) и экстрагировали метиленхлоридом (4×50 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, что давало указанное в заголовке соединение в виде твердого вещества светло-оранжевого цвета (6,2 г, 97%).
[0394] 1H ЯМР (400 МГц, CDCl3) δ 2,37 (с, 3H), 2,45 (с, 3H), 3,84 (с, 3H), 7,75 (с, 1Н).
[0395] Получение 5: 1-(1,3-диметил-1H-пиразол-4-ил)-4,4,4-трифтор-3-гидроксибут-2-ен-1-он
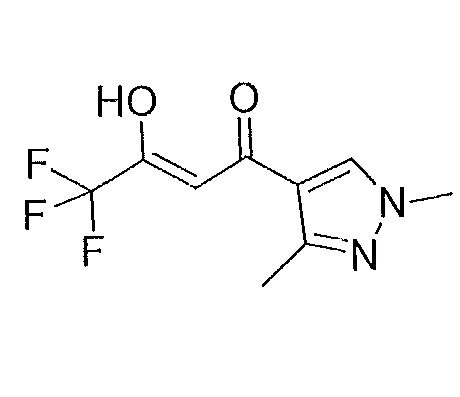
[0396] 1-(1,3-Диметил-1H-пиразол-4-ил)этанон (получение 4, 4,46 г) растворяли в метаноле (21 мл) и добавляли 25% метоксид натрия в метаноле (11,07 мл). Смесь перемешивали в течение 5 минут и добавляли уксусную кислоту, трифтор-, сложный этиловый эфир (7,701 мл). Смесь нагревали с обратным холодильником при 75°C и перемешивали в течение 19 часов. Реакционный раствор очищали непосредственно посредством колоночной флэш-хроматографии (Biotage Quad 25; элюент: 100% EtOAc, после чего следовал 5% EtOH в EtOAc и затем 20% EtOH в EtOAc), что давало указанное в заголовке соединение (таутомер) в виде пенного твердого вещества светло-красного цвета (7,0 г, 92,3%).
[0397] 1H ЯМР (400 МГц, CDCl3) δ: 2,33 (с, 3H), 3,76 (с, 3H), 6,10 (с, 1H), 7,84 (с, 1Н).
[0398] Получение 6: 3-бром-1H-пиразол-5-амин
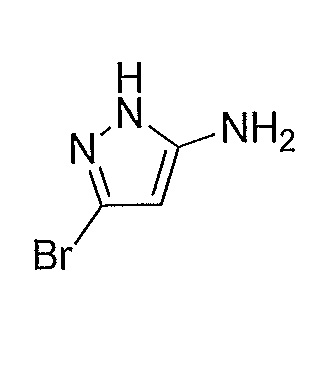
[0399] В раствор 3,4,5-трибромпиразола (60 г) в уксусной кислоте (900 мл) при 10°C добавляли азотную кислоту (21 мл) (90%, дымящуюся). Затем добавляли уксусный ангидрид (300 мл) в течение 20 минут. Реакционный раствор нагревали до комнатной температуры и перемешивали в течение 3 часов. Затем реакционную смесь выливали на лед, что вело к осадку белого цвета. Осадок отфильтровывали и промывали водой (200 мл). Фильтрованный осадок после этого растворяли в толуоле (750 мл), промывали водой (200 мл) и солевым раствором (100 мл), сушили над сульфатом натрия и фильтровали. Затем в раствор толуола добавляли 1H-пиразол, 3,5-диметил (20 г), и раствор нагревали с обратным холодильником в течение 20 минут. Реакционный раствор охлаждали и концентрировали в вакууме. Неочищенный продукт растирали с гептаном, и получаемый осадок, который содержал основной продукт, с помощью TLC фильтровали и сушили в вакууме. Неочищенное указанное в заголовке соединение использовали без дополнительной очистки (71,7 мг, 67,6%).
[0400] Это промежуточное соединение, 3,4-дибром-5-нитро-1H-пиразол (69 г), восстанавливали посредством нагревания с обратным холодильником с использованием хлорида олова, дигидрата (135 г) в этилацетате (600 мл) и этаноле (300 мл) при 110°C в течение 45 минут. Гомогенный реакционный раствор желтого цвета охлаждали до комнатной температуры и медленно выливали в энергично перемешиваемый раствор бикарбоната натрия (33 г) в воде (200 мл) и этилацетате (800 мл). В получаемую суспензию добавляли целит (30 г), и эту суспензию фильтровали через слой целита. Отфильтрованный осадок промывали дополнительным этилацетатом (600 мл). После этого органический раствор промывали солевым раствором (200 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением неочищенного продукта в виде масла оранжевого цвета. Затем неочищенный продукт очищали посредством колоночной флэш-хроматографии (Biotage, Quad 25; элюент: 6% EtOH в метиленхлориде). Это давало указанное в заголовке соединение в виде твердого вещества светло-бежевого цвета (13,2 г, 32%). 1H ЯМР (400 МГц, DMSO-d6) δ 5,20 (м, 3H), 11,60 (уш.с, 1H).
[0401] Получение 7: 2-бром-5-(1-этил-3-метил-1H-пиразол-4-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидин
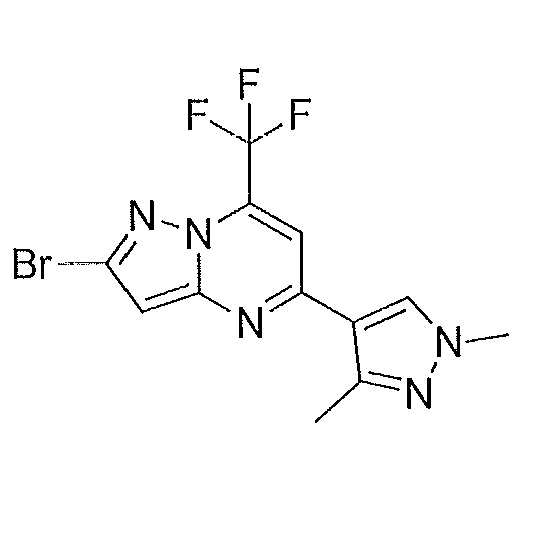
[0402] 1-(1,3-Диметил-1H-пиразол-4-ил)-4,4,4-трифтор-3-гидроксибут-2-ен-1-он (получение 5, 1,7 г) и 3-бром-1H-пиразол-5-амин (получение 6, 1,18 г) в уксусной кислоте (52,61 мл) нагревали при 120°C в герметизированной пробирке в течение ночи. Реакционный раствор охлаждали до комнатной температуры и выливали в воду со льдом (500 мл), что давало осадок белого цвета. Преципитат фильтровали и промывали обильными количествами воды. Затем осадок собирали и сушили в вакууме с получением указанного в заголовке соединения в виде белого порошка (1,9 г, 73,1%). 1H ЯМР (400 МГц, DMSO-d6) 2,47 (с, 3H), 3,79 (с, 3H), 6,95 (с, 1Н), 7,73 (с, 1H), 8,67 (с, 1H).
[0403] Получение 8: 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин
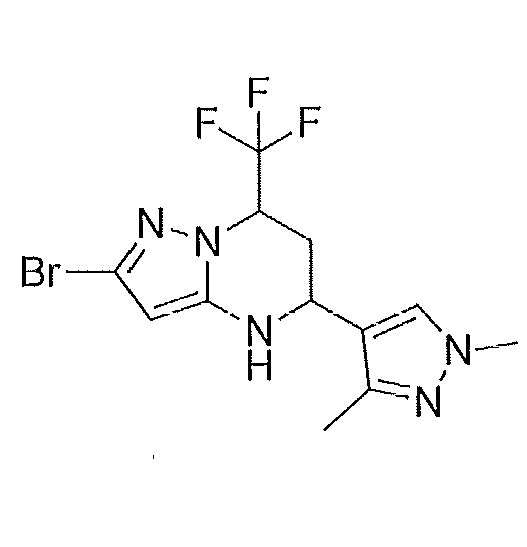
[0404] Тетрагидроборат натрия (472 мг) медленно добавляли в суспензию 2-бром-5-(1-этил-3-метил-1H-пиразол-4-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидина (получение 7, 1,8 г) в этаноле (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Затем реакционный раствор очень медленно добавляли в охлажденную льдом 1 Н HCl до тех пор, пока не достигали pH=2,0, чтобы гасить любой оставшийся тетрагидроборат натрия. Затем раствор концентрировали под глубоким вакуумом для того, чтобы удалять большую часть этанола. Насыщенный водный раствор бикарбоната натрия после этого медленно добавляли в кислый раствор до тех пор, пока не достигали нейтрального pH (7,0) и не происходило образование осадка белого цвета. Преципитат отфильтровывали и промывали водой (200 мл) и простым эфиром (20 мл). Осадок белого цвета собирали и сушили в вакууме с получением указанного в заголовке соединения в виде порошка белого цвета (1,36 г, 74,7%). 1H ЯМР (400 МГц, DMSO-d6) 2,00 (м, 1Н), 2,09 (с, 3H), 2,30 (м, 1H), 3,67 (с, 3H), 4,34 (м, 1H), 5,15 (м, 1Н), 5,31 (с, 1H), 6,69 (с, 1H), 7,63 (с, 1H).
[0405] Получение 9: (5S,7R)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин
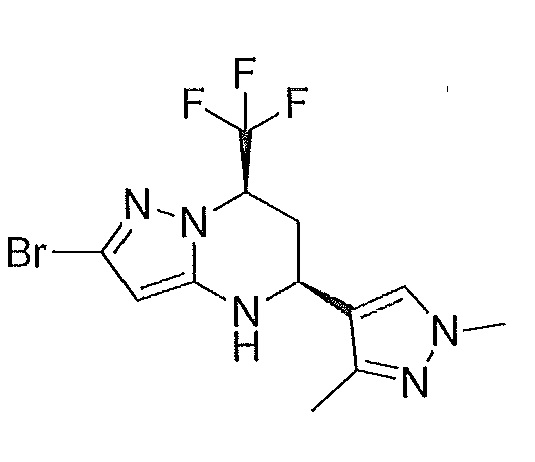
[0406] Рацемический 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин (1,5 г, 4,1 ммоль, получение 8) растворяли в метаноле (35 мл) и мутный раствор мягко нагревали, предоставляя прозрачный раствор. Затем раствор фильтровали через воронку Бюхнера средней пористости. Прозрачный фильтрат непосредственно использовали для хиральной ВЭЖХ-очистки. 1 мл этого раствора загружали на колонку Chiralcel OD 2,1 см × 25 см и элюировали с использованием подвижной фазы, содержащей изопропиловый спирт и метанол (соотношение 1:1) при скорости потока 15 мл/мин. Два (R и S) энантиомера собирали отдельно. Выполняли 27 таких инъекций, и объединенные фракции чистых (R и S) энантиомеров концентрировали при пониженном давлении. Указанное в заголовке соединение выделяли в виде белого порошка (0,71 г, 1,95 ммоль, >95% ee).
[0407] Получение 10: (5R,7S)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин
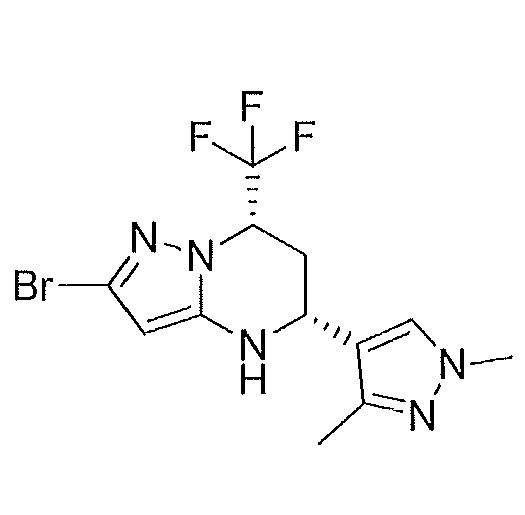
[0408] Рацемический 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин (1,5 г, 4,1 ммоль, получение 8) растворяли в метаноле (35 мл) и мутный раствор мягко нагревали, предоставляя прозрачный раствор. Затем раствор фильтровали через воронку Бюхнера средней пористости. Прозрачный фильтрат непосредственно использовали для хиральной ВЭЖХ-очистки. 1 мл этого раствора загружали на колонку Chiralcel OD 2,1 см × 25 см и элюировали с использованием подвижной фазы, содержащей изопропиловый спирт и метанол (соотношение 1:1) при скорости потока 15 мл/мин. Два (R и S) энантиомера собирали отдельно. Осуществляли 27 таких инжекций и объединенные фракции чистых (R и S) энантиомеров концентрировали при пониженном давлении. Указанное в заголовке соединение выделяли в виде порошка белого цвета (0,71 г, 1,95 ммоль, >95% ee).
[0409] Пример ER-889996:
[0410] В 5-мл сосуд с винтовой крышкой добавляли 4-(пиперазин-1-карбонил)фенилбороновую кислоту, пинаколовый эфир (51,0 мг, 0,161 ммоль), тетракис(трифенилфосфин)палладий(0) в 1,4-диоксане (0,075 М, 90 мкл), раствор 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7- тетрагидропиразоло[1,5-a]пиримидина (25,0 мг, 0,069 ммоль, получение 8) в 1,4-диоксане (450 мкл) и 2 М карбонат натрия в воде (70 мкл). Реакционный сосуд продували азотом и герметизировали. Сосуд встряхивали и нагревали в алюминиевом блоке при 85°C в течение 40 ч. В смесь добавляли 1,0 мл насыщенного водного бикарбоната натрия, и затем смесь экстрагировали этилацетатом (2×2,0 мл). Объединенные органические слои концентрировали в вакууме. Остающийся остаток очищали посредством LC/MS в соответствии со способом. Это давало указанное в заголовке соединение в виде белого порошка (7,8 мг, 24,0%).
[0411] Пример ER-889862 получали из 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (40,1 мг, 0,11 ммоль, получение 8) и коммерчески доступной изохинолин-5-илбороновой кислоты (2,5 экв.) таким образом, который подобен таковому из примера ER-889996. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала указанное в заголовке соединение в виде порошка белого цвета (7,5 мг, 17%).
[0412] Пример ER-890007 получали из 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (25,0 мг, 0,069 ммоль, получение 8) и коммерчески доступной 8-метилхинолин-5-илбороновой кислоты (2,5 экв.) таким образом, который подобен таковому из примера ER-889996. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала указанное в заголовке соединение в виде порошка белого цвета (12,2 мг, 42%).
[0413] Пример ER-892900 получали из 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (23,0 мг, 0,063 ммоль, получение 8) и коммерчески доступной 1,4-диметил-1H-индазол-5-илбороновой кислоты (2,5 экв.) таким образом, который подобен таковому из примера ER-889996. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала указанное в заголовке соединение в виде порошка белого цвета (7,7 мг, 28%).
[0414] Пример ER-890066 получали из 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (25,0 мг, 0,069 ммоль, получение 8) и коммерчески доступной 2-метил-2H-индазол-5-илбороновой кислоты (2,5 экв.) таким образом, который подобен таковому из примера ER-889996. Очистка с помощью LCMS, с использованием условий III для ВЭЖХ, давала указанное в заголовке соединение в виде порошка белого цвета (0,2 мг, 1%).
[0415] Пример ER-889550
[0416] Герметизированную пробирку загружали 2-бром-5-(1-этил-3-метил-1H-пиразол-4-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидином (40 мг, 0,11 ммоль, получение 7), 4-(N-этиламинокарбонил)фенилбороновой кислотой (73,2 мг, 0,38 ммоль), карбонатом калия (76,8 мг, 0,56 ммоль), водой (0,559 мл) и тетрагидрофураном (0,838 мл). Реакционную смесь перемешивали, при этом дегазируя азотом, в течение 15 минут. Добавляли комплекс [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (22,7 мг, 0,03 ммоль) и реакционную смесь герметизировали и нагревали при 95°C в течение 16 часов. Неочищенную реакционную смесь охлаждали до комнатной температуры и затем очищали непосредственно колоночной флэш-хроматографией (Biotage Quad 25; элюент: 100% EtOAc). Это давало 4-(5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)пиразоло[1,5-a|пиримидин-2-ил)-N-этилбензамид в виде твердого вещества светло-желтого цвета (41,1 мг, 86,4%).
[0417] Тетрагидроборат натрия (6,62 мг) добавляли в суспензию 4-(5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-ил)-N-этилбензамида (30 мг, 0,07 ммоль) в этаноле (1 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали под потоком азота. Затем 1 Н HCl очень медленно добавляли до тех пор, пока борогидрид не расходовался полностью (~2 мл), что вело к осадку коричневого цвета. Водный раствор декантировали и медленно нейтрализовали насыщенным бикарбонатом натрия до тех пор, пока не достигали pH=7,0. Затем нейтрализованный раствор экстрагировали с EtOAc (2×5 мл). Органические экстракты комбинировали и промывали солевым раствором (2 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Это давало указанное в заголовке соединение в виде порошка белого цвета (18,8 мг, 62,1%).
[0418] Пример ER-893888
[0419] В герметизированную пробирку загружали 2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин (30 мг, 0,08 ммоль, получение 8), 4-(уреидо)фенилбороновую кислоту, пинаколовый эфир (73,8 мг, 0,28 ммоль), карбонат калия (56,9 мг, 0,41 ммоль), воду (0,414 мл) и тетрагидрофуран (0,621 мл). Реакционную смесь перемешивали, при этом дегазируя азотом, в течение 15 минут. Добавляли комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (16,8 мг, 0,02 ммоль) и реакционную смесь герметизировали и нагревали при 95°C в течение 16 часов. Неочищенную реакционную смесь охлаждали до комнатной температуры и затем очищали непосредственно колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc). Это давало указанное в заголовке соединение в виде порошка светло-желтого цвета (31,1 мг, 90,0%).
[0420] Пример ER-894595 получали из (5S,7R)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (150,0 мг, 0,41 ммоль, получение 9) и коммерчески доступного пинаколового эфира 4-(уреидо)фенилбороновой кислоты (368,8 мг, 1,4 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка светло-желтого цвета (141,6 мг, 82,0%).
[0421] Пример ER-894596 получали из (5R,7S)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (150,0 мг, 0,41 ммоль, получение 10) и коммерчески доступного пинаколового эфира 4-(уреидо)фенилбороновой кислоты (368,8 мг, 1,4 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка бледно-желтого цвета (144,6 мг, 83,7%).
[0422] Пример ER-893986 получали из (5S,7R)-2-бромо-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (50,0 мг, 0,14 ммоль, получение 9) и коммерчески доступной 1,4-диметил-1H-индазол-5-бороновой кислоты (89,1 мг, 0,47 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка светло-желтого цвета (42,7 мг, 72,4%).
[0423] Пример ER-893987 получали из (5R,7S)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (150,0 мг, 0,41 ммоль, получение 10) и коммерчески доступной 1,4-диметил-1H-индазол-5-бороновой кислоты (267,3 мг, 1,41 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка светло-желтого цвета (155,7 мг, 88,0%).
[0424] Пример ER-893990 получали из (5S,7R)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (40,0 мг, 0,11 ммоль, получение 9) и коммерчески доступного пинаколового эфира 2-метилиндазол-5-бороновой кислоты (96,8 мг, 0,38 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка светло-желтого цвета (36,9 мг, 80,9%).
[0425] Пример ER-893991 получали из (5R,7S)-2-бром-5-(1,3-диметил-1H-пиразол-4-ил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидина (30,0 мг, 0,082 ммоль, получение 10) и коммерчески доступного пинаколового эфира 2-метилиндазол-5-бороновой кислоты (72,6 мг, 0,28 ммоль) таким образом, который подобен таковому из примера ER-893888. Очистка колоночной флэш-хроматографией (Biotage Quad 25; элюент: 10% EtOH в EtOAc) давала указанное в заголовке соединение в виде порошка светло-желтого цвета (22,0 мг, 64,3%).
[0426] Примеры синтеза - раздел J
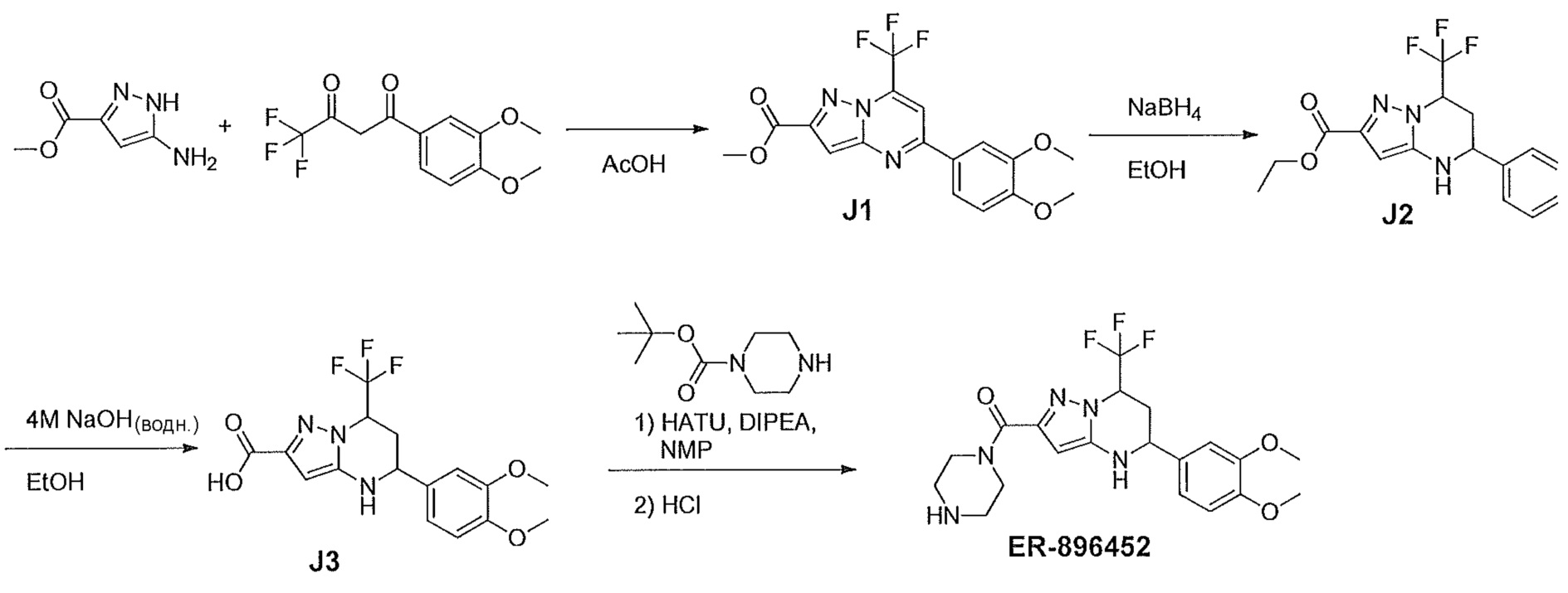
[0427] Суспензию метил-5-амино-1H-пиразол-3-карбоксилата (1,00 г, 7,086 ммоль) и 1-(3,4-диметоксифенил)-4,4,4-трифторбутан-1,3-диона (2,153 г, 7,794 ммоль) в уксусной кислоте (10 мл, 174,682 ммоль) нагревали с обратным холодильником (при 100°C) в течение 5 часов. Смесь охлаждали при комнатной температуре, добавляли воду, и осадок собирали с помощью фильтрования, промывали водой и сушили под вакуумом с получением J1 в виде твердого вещества зеленого цвета 2,33 г (86% выход).
[0428] Борогидрид натрия (0,446 г, 11,802 ммоль) медленно добавляли в суспензию метил-5-(3,4-диметоксифенил)-7-(трифторметил)пиразоло[1,5-a]пиримидин-2-карбоксилата (1,00 г, 2,623 ммоль) в этаноле (25 мл, 428,167 ммоль) при комнатной температуре. Смесь нагревали с обратным холодильником (80°C) в течение 60 минут и осуществляли мониторинг реакции с помощью UPLC/MS. Смесь охлаждали при комнатной температуре. Избыток борогидрида натрия разлагали уксусной кислотой (1,501 мл, 26,226 ммоль). Реакцию выливали в 1,00 M HCl в воде (52,5 мл, 52,451 ммоль) и перемешивали в течение 5 минут. Осадок собирали с помощью фильтрования, промывали водой и сушили на воздухе. Материал очищали посредством флэш-хроматографии с использованием колонки с 25 г диоксида кремния и градиента гептан:этилацетат с получением J2 в виде твердого вещества белого цвета, 507 мг (48% выход).
[0429] В суспензию этил-5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-карбоксилата (503 мг, 1,26 ммоль) в этаноле (5,0 мл, 85,633 ммоль) добавляли 4,00 M гидроксид натрия в воде (1,574 мл, 6,298 ммоль). Смесь нагревали при 50°C в течение 1 часа. Смесь охлаждали при комнатной температуре и подкисляли с использованием 1,00 M HCl в воде (12,60 мл, 12,595 ммоль), добавляли воду, и осадок собирали с помощью фильтрования, промывали водой и сушили под вакуумом с получением J3 в виде твердого вещества белого цвета 422 мг (95% выход).
[0430] В 5-мл микроволновый сосуд загружали 5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-карбоновую кислоту (50 мг, 0,135 ммоль), трет-бутил-пиперазин-1-карбоксилат (75 мг, 0,404 ммоль), HATU (205 мг, 0,539 ммоль), N,N-диизопропилэтиламин (0,059 мл, 0,337 ммоль) и DMF (1,0 мл, 12,915 ммоль). Сосуд закрывали крышкой, и смесь перемешивали в течение 6 часов при 40°C. Смесь разводили этилацетатом (5 мл), промывали 2× водой (2 мл), промывали 0,1 Н водной HCl (2 мл), промывали насыщенным водным бикарбонатом натрия (2 мл), промывали солевым раствором (2 мл), сушили сульфатом натрия, фильтровали и концентрировали. Соединение очищали посредством хроматографии на Biotage SP4 (Column Interchim 25 г, 30 мкМ) с использованием 12-100% EtOAc/гептана в качестве элюента с получением промежуточного соединения трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-карбонил)пиперазин-1-карбоксилат (38 мг, 0,070 ммоль, 52,3% выход).
[0431] Промежуточное соединение трет-бутил-4-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-карбонил)пиперазин-1-карбоксилат (36 мг, 0,067 ммоль) растворяли в этаноле (0,5 мл, 8,563 ммоль) и 4,00 М HCl в диоксане (0,5 мл, 2,00 ммоль) и смесь перемешивали при 40°C в течение 1 часа. Реакционную смесь концентрировали, и продукт сушили под вакуумным насосом с получением ER-896452 в виде соли HCl (31,0 мг, 0,065 ммоль, 98% выход).
[0432] ER-896453
[0433] Пример ER-896453 получали в две стадии из кислоты J3 (50 мг, 0,135 ммоль) и коммерчески доступного (S)-трет-бутил-3-аминопиперидин-1-карбоксилата (81 мг, 0,404 ммоль) таким образом, который подобен таковому из примера ER-896452, с получением промежуточного соединения (3S)-трет-бутил-3-(5-(3,4-диметоксифенил)-7-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-2-карбоксамидо)пиперидин-1-карбоксилат (67 мг, 0,121 ммоль, 90% выход). Это промежуточное соединение (49 мг, 0,089 ммоль) обрабатывали с использованием HCl таким образом, который подобен таковому из примера ER-896452, с получением желаемого продукта ER-896453 (42 мг, 97% выход).
[0434] Определение абсолютной конфигурации ER-885454 и ее корреляция с ER-892887
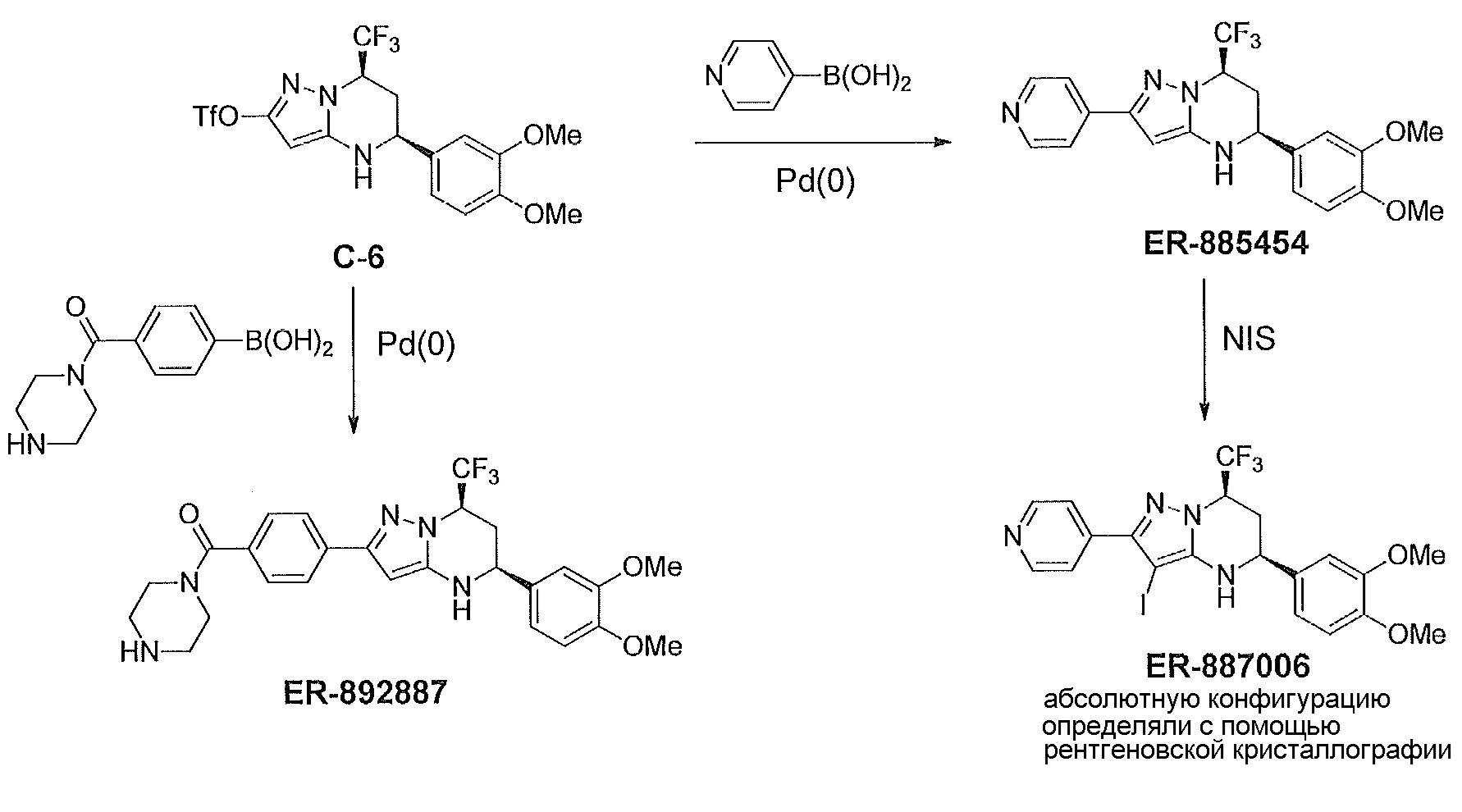
[0435] Абсолютную конфигурацию ER-885454 устанавливали посредством превращения его в 3-йод-производное ER-887006, как показано выше. Структуру ER-887006 определяли посредством рентгеновской дифракции на монокристаллах. Результаты представлены на фиг. 10. Поскольку это преобразование не затрагивает хиральные центры в молекуле, абсолютная конфигурация ER-885454 представляет собой то, что показано. Кроме того, абсолютную конфигурацию ER-892887 устанавливали посредством ее корреляции с соединением C-6, которое в свою очередь коррелировали с ER-885454.
[0436] Общий скрининговый анализ и фармакологическая стратегия.
[0437] Для того чтобы идентифицировать активные и селективные к TLR7/8 соединения, изначально осуществляли скрининг аналогов на клеточной панели репортерных по TLR4, TLR7, и TLR9 линий человека (дополнительные детали см. в материалах и способах). Поднабор соединений, которые эффективны и селективны в отношении TLR7, также тестировали на TLR8 активность (см. ниже таблицу 2) и на TLR7/8 активность в первичном анализе PBMC человека (дополнительные детали см. в материалах и способах). Определенные соединения подвергались кратковременному анализу in vivo (STIV) для определения дозозависимой активности и длительности действия в отношении TLR7 мыши (дополнительные детали см. в материалах и способах). Затем выбранные соединения оценивали по влиянию на одну или несколько из следующих моделей заболевания волчанкой на мышах: BXSB-Yaa, NZBxNZW и пристан:DBA/1.
[0438] Многие соединения, приведенные в качестве вариантов осуществления в настоящем документе, демонстрируют наномолярную активность в отношении как TLR7 человека и мыши, так и TLR8 человека, когда эти рецепторы, экспрессируемые или на клеточных линиях или эмбриональных клетках, стимулируют синтетическим низкомолекулярным соединением (CL097, R848) или лигандами нуклеиновыми кислотами (РНК). Наоборот, большинство соединений, приведенных в качестве вариантов осуществления в настоящем документе, неактивны в отношении пути TLR9.
[0439] Лекарственные средства существующего стандарта лечения волчанки включают противомалярийные средства, такие как хлорохин и гидроксихлорохин (HCQ), для которых показано, что они ингибируют передачу сигнала TLR7/9 in vitro. Это может, по меньшей мере частично, объяснять их эффективность для управления неожиданным обострением волчанки. Однако показано, что варианты осуществления по изобретению предлагают значительно более активное ингибирование. Например, обнаружено, что соединение ER-892887 (показано и рассмотрено выше) приблизительно в 100 раз более активно в отношении РНК-Ig TLR7/8 стимула в сравнении с HCQ (ER-892887 IC50=0,015 мкМ, HCQ IC50~1,5 мкМ). Это подсказывает, что ER-892887 будет обеспечивать значительно более эффективное ингибирование пути TLR7/8 по сравнению с существующим лечением волчанки. Это демонстрируют результаты, представленные ниже в таблице 1.
[0440]
|
|
[0441]
|
|
[0442] Кратковременный анализ in vivo (STIV): для того чтобы оценивать активность соединения in vivo в отношении TLR7 мыши, использовали кратковременный анализ in vivo (STIV). В кратком изложении, мышам перорально дозировали соединения и в различные моменты времени после этого подкожно инъецировали агонист R848 для того, чтобы стимулировать TLR7. Затем с помощью ELISA измеряли уровень IL-6 в плазме после R848-стимуляции для того, чтобы оценивать активность соединения и длительность действия. Что важно, с использованием TLR7-дефицитных мышей показано, что образование цитокинов после R848-стимуляции in vitro или in vivo полностью зависит от TLR7. Следовательно, активность соединений в STIV анализе можно уверенно приписывать их модуляции пути TLR7. Одна пероральная доза ER-892887 по 300 мг/кг супрессирует путь R848/TLR7/IL-6 in vivo на 80-90% в течение по меньшей мере 24 часов (см. фиг. 1). Сводка по активности для панели соединений в STIV анализе представлена ниже в таблице 3.
[0443] 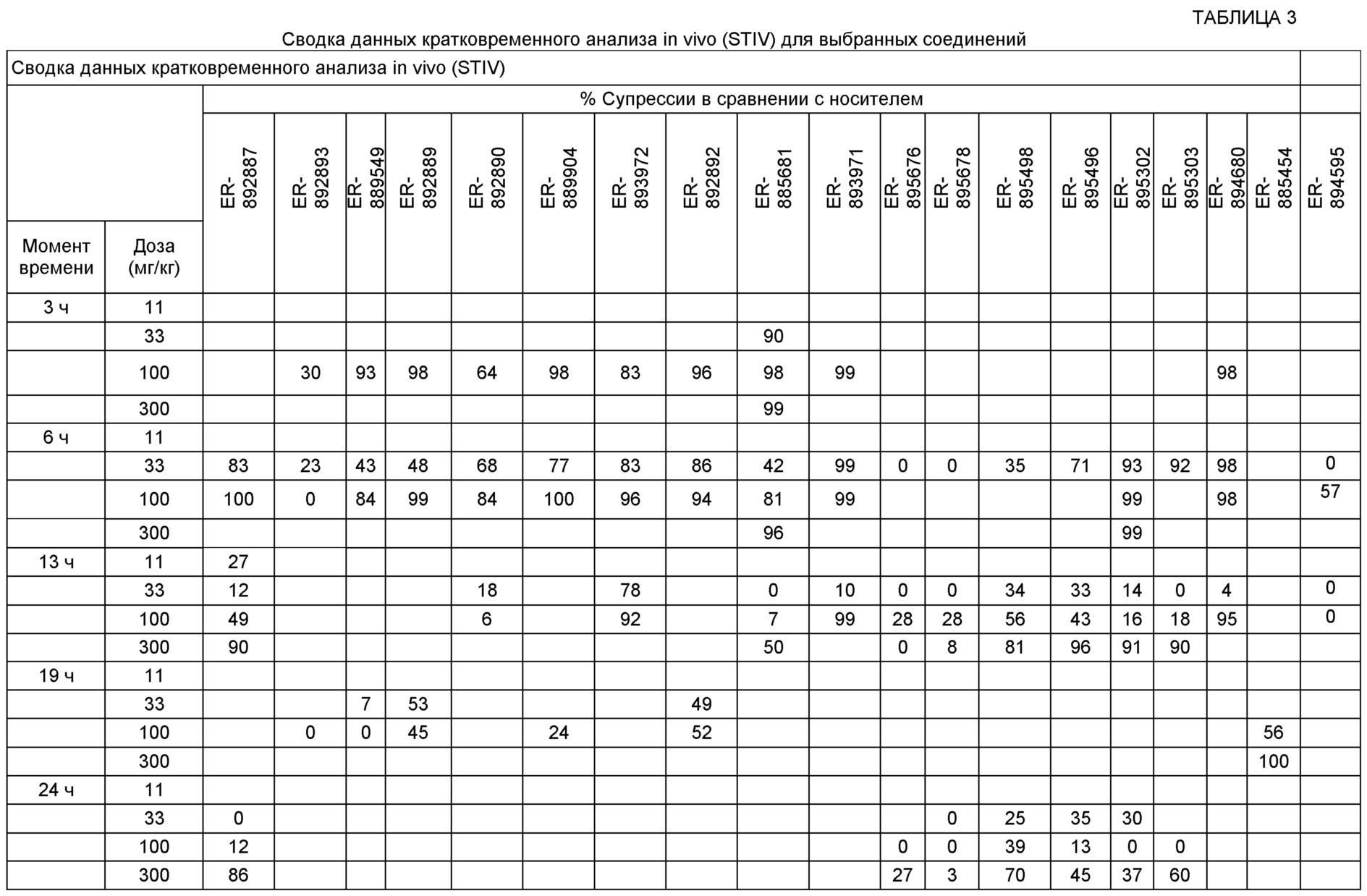
[0444] Модели заболевания волчанкой на мышах. Три различных модели заболевания волчанкой (BXSB-Yaa, NZBxNZW и пристан) выбирали для POC оценки соединения, поскольку (1) линии BXSB-Yaa и NZB/W самопроизвольно развивают заболевание с полигенной этиологией, демонстрируя многие признаки волчанки человека, такие как ДНК- и РНК-ассоциированная аутореактивность, протеинурия и опосредованные иммунными комплексами нефриты, и (2) положительные результаты валидации мишеней TLR7 и/или TLR9 приведены для всех трех моделей заболевания.
[0445] Сделаны следующие ключевые находки для ER-892887 в моделях заболевания SLE (см. фиг. 1-6 и 12-14):
1) ER-892887 значительно снижал титры антител к дцДНК в TLR7-зависимой BXSB-Yaa модели, что соответствует тенденции в направлении сниженной протеинурии и полного предотвращения начала нефрита 3/4 степени;
2) ER-892887 снижал титры антител к дцДНК в модели NZB/W. Более низкие дозы (33-100 мг/кг) ER-892887 давали преимущество в выживаемости в этой модели, что соответствует сниженной протеинурии и гистологическим признакам гломерулонефрита. ER-892887 задерживал развитие протеинурии в модели NZB/W более эффективно, чем два лекарственных средства, широко используемых при лечении волчанки человека, и был эффективен в комбинации с гидроксихлорохином и преднизолоном;
3) ER-892887 супрессировал различные аутоантитела в модели с пристаном, при особенно сильном воздействии на РНК-связанную реактивность, например, на титры антител к RiboP. Эти изменения соответствовали восстановлению экспрессии генов, управляемой интерфероном цельной крови, и оценке IFN генетической сигнатуры с помощью ER-892887 в этой модели. ER-892887 снижал тяжесть артрита в модели с пристаном и значительно снижал оценку интерфероновой генетической сигнатуры, тогда как три широко используемых способа лечения волчанки не делали этого. ER-892887 также подавлял аутоантитела лучше, чем гидроксихлорохин или преднизолон в тестируемых дозах.
[0446] Сделаны следующие ключевые находки для ER-885454 в моделях заболевания SLE (см. фиг. 7-9):
1) ER-885454 значительно снижал титры антител к дцДНК и антител к Sm/nRNP в TLR7-зависимой BXSB-Yaa модели, что соответствует значительно сниженной протеинурии и полному предотвращению начала нефрита 3/4 степени;
2) ER-885454 снижал антитела к дцДНК, протеинурию и гистологические признаки гломерулонефрита в модели NZB/W.
[0447] Краткое изложение находок: эти данные показывают модерирующий эффект описанных соединений, оказываемый на процессы, вовлеченные в важные аспекты волчанки человека. Иммунные комплексы, содержащие нуклеиновые кислоты, могут управлять продукцией интерферона 1 типа дендритными клетками, и «интерфероновая сигнатура», которая отражает присутствие интерферона и последующую экспрессию регулируемых интерфероном генов, связана с тяжестью заболевания. ER-892887 блокирует цитокиновые ответы на комплексы РНК-Ig in vitro, и подавлял повышающую регуляцию управляемых интерфероном генов в модели с пристаном. Как ER-892887, так и ER-885454 ограничивал образование нескольких специфичностей аутоантител, и подавлял заболевание почек, манифестация которого происходила посредством протеинурии и гистологических изменений. Лечение с использованием ER-892887 значительно увеличивало выживаемость в исследованиях длительного дозирования в самопроизвольной модели NZB/W. Результаты показывают, что эти соединения имеют потенциал для контролирования симптомов и прогрессирования волчанки у пациентов-людей.
[0448] ФАРМАКОЛОГИЧЕСКИЕ МАТЕРИАЛЫ И СПОСОБЫ
[0449] Фармакологические исследования in vitro: в клетки HEK-293 (ATCC) вводили конструкции, которые стабильно экспрессируют индуцируемый фактором транскрипции NF-κB E-селектиновый (ELAM-1) люциферазный репортер, полученный из плазмиды pGL3 (Promega), содержащей пары оснований от -2241 п.о. до -254 п.о. из промотора гена E-селектина человека (№ доступа NM_000450). Затем в эти клетки впоследствии вводили конструкции для того, чтобы стабильно и индивидуально экспрессировать кДНК полноразмерного ORF TLR4, TLR7 или TLR9 человека. кДНК TLR4 человека (№ доступа NM_138554) клонировали в экспрессирующий вектор pcDNA 3.0 (Invitrogen). В трансфицированные TLR4 клетки также вводили конструкции для того, чтобы экспрессировать корецептор MD-2 человека [кДНК MD-2 (№ доступа NM_015364) клонировали в вектор pEF-BOS], и добавляли 10 нМ растворимого CD14 (R&D Systems) в средах для того, чтобы оптимизировать восприимчивость LPS. кДНК человека TLR9 (№ доступа NM_017442) клонировали в вектор pBluescript II KS (Agilent). кДНК TLR7 человека (№ доступа NM_016562) получали из OriGene. Клетки HEK-293, стабильно экспрессирующие TLR8 человека (№ доступа NM_138636) или TLR7 мыши (№ доступа NM_133211), приобретали в InvivoGen и затем стабильно трансфицировали с использованием плазмиды pNiFty2(NF-κB)-люциферазный репортер (InvivoGen). Каждый тип клеток высевали в модифицированную по способу Дульбекко среду Игла (DMEM), содержащую 10% эмбриональную телячью сыворотку (FBS), при плотности 2,22×105 клеток/мл в 384-луночный планшет и инкубировали в течение 2 суток при 37°C, 5% CO2. Затем добавляли различные концентрации антагонистических соединений. Затем клетки инкубировали в течение других 30 минут перед добавлением подходящего агониста TLR следующим образом (указаны конечные концентрации): липополисахарид (LPS; Sigma) 10 нг/мл для TLR4, CL097 (InvivoGen) по 3 мкг/мл для TLR7 и TLR8 человека и TLR7 мыши, и CpG-2006-2A [последовательность: TCGTCGTTAAGTCGTTAAGTCGTT (SEQ ID NO: 1) с фосфоротиоатным остовом, синтезированная в Sigma-Aldrich] 0,6 мкМ для TLR9. Затем клетки инкубировали в течение ночи, и активацию NF-κB-зависимого люциферазного репортера количественно определяли посредством измерения люминесценции с использованием реактива SteadyGlo® (Promega) или Steadylite™ (Perkin Elmer) согласно предложенному производителем протоколу.
[0450] Анализ на основе клеток PBMC человека. Мононуклеарные клетки периферической крови (PBMC) человека выделяли из свежевзятой гепаринизированной (10 USP Ед./мл, Hospira, Lakeforest, IL) цельной крови здоровых доноров с помощью градиента плотности (Histopaque® 1077, Sigma, inc., St. Louis, MO). В кратком изложении, 25 мл крови разводили в 15 мл PBS (без Ca2+, Mg2+) в 50-мл конической пробирке и подслаивали 12 мл Histopaque с использованием иглы для спинномозговой пункции. Пробирки центрифугировали в течение 45 минут на 1200 об./мин (350xg), и PBMC собирали из лейкотромбоцитарного слоя. Затем клетки два раза промывали в PBS, и красные клетки крови лизировали посредством суспензии в 5 мл раствора хлорида аммония (IX Red Blood Cell Lysis Buffer, eBioscience) в течение 5 минут при комнатной температуре. После конечного промывания в PBS, PBMC ресуспендировали при конечной концентрации 2×106/мл в среде RPMI-1640 с L-глутамином (Invitrogen) и с добавлением 25 мМ HEPES (Mediatech, Inc, Manassas VA), 10% эмбриональной телячьей сыворотки (HyClone, Logan, UT) и пенициллин-стрептомицин-глутамин (Mediatech) и высевали по 100 мкл/лунка (2×105 клеток/лунка) в обработанные 96-луночные планшеты для тканевой культуры (Falcon).
[0451] Антагонистические соединения, солюбилизированные и серийно разведенные в 100% DMSO, добавляли три раза в клетки, чтобы получать конечную концентрацию 0,1% DMSO (об./об.). Гидроксихлорохин (Acros Organics), солюбилизированный и серийно разведенный в PBS, добавляли три раза в клетки. PBMC инкубировали с антагонистическими соединениями или HCQ в течение 30 минут при 37°C, 5% CO2, перед добавлением различных TLR агонистических реактивов в 100 мкл полной среды на лунку следующим образом (указаны конечные концентрации): R848 (резиквимод; GLSynthesis, Worcester, MA) 1 мкМ для TLR7 и TLR8, Pam3CSK4 (InvivoGen) 50 нг/мл для TLR1/2, LPS (Sigma) 10 нг/мл для TLR4, и CpG-2216 (InvivoGen) 5 мкг/мл для TLR9. Для того чтобы получать агонист TLR7/8, который имитирует иммунные комплексы РНК-содержащих аутоантител у пациентов с волчанкой, синтезировали 26-мер РНК с последовательностью, полученной из стебля/петли IV мяРНК U1 человека [(последовательность: GGGGGACUGCGU-UCGCGCUUUCCC (SEQ ID NO: 2) с фосфоротиоатным остовом] (Dharmacon, Inc., Lafayette, CO), для которой предварительно показано, что она представляет собой сильный агонист TLR7 и TLR8. Эту молекулу РНК разводили до 2,5 мкМ в бессывороточной RPMI, и моноклональное антитело мыши против одноцепочечной ДНК человека (MAB3034, Millipore, Inc., Billerica, MA), которое также обладает перекрестной реактивностью с РНК, добавляли в разведении 1:25 или 1 мкг/мл. Получаемый стимул «РНК-Ig» инкубировали при комнатной температуре в течение 15-30 минут перед добавлением в клетки. PBMC инкубировали с различными агонистами TLR в течение 20 часов при 37°C, 5% CO2. Собирали супернатанты клеточных культур, и оценивали уровни различных цитокинов человека, как указано, с помощью стандартной процедуры ELISA в соответствии с рекомендованным производителем протоколом (BD Biosciences, Inc., San Diego, CA). В таблице 4 представлены результаты испытаний ингибирования IL-6 PBMC человека для выбранных соединений.
|
|
|
[0452] Анализ на основе клеток селезенки мыши. Селезенки брали у самок мышей BALB/c (Jackson Labs, Bar Harbor, ME), которых умерщвляли с помощью CO2. Получали одну клеточную суспензию посредством пропускания селезенок через 40-мкм нейлоновое клеточное сито. Клетки промывали два раза с использованием 50 мл PBS (Mediatech, Inc., Manassas, VA), и красные клетки крови лизировали в 5 мл RBC Lysis Buffer (eBioscience, Inc., San Diego, CA) в течение 5 минут при комнатной температуре. Клетки промывали еще два раза в PBS и наконец ресуспендировали до 2,5×106 клеток/мл в PMT-1640 с добавками. Клетки высевали по 100 мкл/лунка (2,5×105 клеток/лунка) в обработанные 96-луночные планшеты для тканевой культуры (Falcon). Серийные разведения соединений, солюбилизированных в 100% DMSO, добавляли три раза в клетки, чтобы получать конечную концентрацию 0,1% DMSO. Клетки инкубировали с соединением в течение 30 минут при 37°C, 5% CO2 перед добавлением 740 нМ R848 по 100 мкл/лунка (резиквимод; GLSynthesis, Worcester, MA) в полных средах до конечной концентрации R848 370 нМ. Клетки инкубировали в течение 20 часов при 37°C, 5% CO2. Культуральные супернатанты собирали, и оценивали уровни IL-6 с помощью стандартной процедуры ELISA в соответствии с рекомендованным производителем протоколом (BD Biosciences, Inc., San Diego, CA). Результаты испытаний для выбранных соединений приведены в таблице 5.
|
[0453] Фармакологические исследования in vivo:
[0454] Кратковременный анализ in vivo (STIV). Самкам мышей BALB/c в возрасте от шести до восьми недель (Jackson Labs, Bar Harbor, ME) дозировали посредством перорального принудительного кормления в 200-мкл объеме антагонистические соединения, сформулированные в 0,5% водной метилцеллюлозе (Sigma, St. Louis, MO). В различные моменты времени после этого, мышам подкожно инъецировали (s.c.) в 100-мкл объеме 15 мкг R848 (резиквимод; GLSynthesis, Worcester, MA) для того, чтобы стимулировать TLR7. Плазму крови собирали посредством сердечного прокола и оценивали уровни IL-6 через 1,5 часа после стимуляции TLR7 посредством стандартной процедуры ELISA в соответствии с рекомендованным производителем протоколом (R&D Systems).
[0455] Линии мышей с моделями заболевания волчанкой. Самцов мышей BXSB-Yaa и самок мышей NZBWF1/J приобретали в Jackson Labs (Bar Harbor, ME), и те и другие манифестируют самопроизвольное заболевание волчанкой. Самок мышей DBA/1 приобретали в Harlan Laboratories (Indianapolis, IN) и в указанных возрастах давали интраперитонеальную инъекцию 0,5 мл пристана (2,6,10,14-тетраметилпентадекан; Sigma, St. Louis, MO), чтобы химически индуцировать заболевание волчанкой, или 0,5 мл PBS для того, чтобы создавать не больных контрольных мышей с совпадающим возрастом. Мышам дозировали ежедневно посредством перорального введения соединения или лекарственного средства в 0,5% метилцеллюлозе, в течение указанного периода времени.
[0456] Оценка титров аутоантител с помощью ELISA. Титры антител к дцДНК, Sm/nRNP, RiboP и гистонам оценивали с помощью стандартного подхода ELISA. В кратком изложении, 96-луночные планшеты EIA/RIA ELISA (Corning) покрывали с использованием 100 мкл разведенного антигена в PBS в течение 90 минут при комнатной температуре следующим образом (указаны конечные концентрации): 10 Ед/мл комплекса Sm/nRNP (Immunovision), 10 мкг/мл дцДНК тимуса теленка (Sigma), 5 Ед/мл RiboP (Immunovision) и 5 мкг/мл гистонов (Immunovision). Планшеты промывали с использованием PBS/0,05% Tween20 (промывающий буфер) и блокировали в течение ночи с использованием PBS/1% BSA (блокирующий буфер) при 4°C. Планшеты промывали, в лунки добавляли образцы плазмы мышей, разбавленные в блокирующем буфере (в диапазоне от 1:25 до 1:10000 в зависимости от модели и антигена), в объеме 100 мкл на лунку, и планшеты инкубировали в течение 90 минут при комнатной температуре. Затем планшеты промывали, в каждую лунку добавляли 100 мкл конъюгата антитела к IgG мыши с HRPO (Southern Biotech), разбавленного 1:50000 в PBS/1% BSA/0,05% Tween, и планшеты инкубировали в течение 90 минут при комнатной температуре. Планшеты промывали и в лунки добавляли 100 мкл смеси 1:1 из компонентов субстратов из набора субстратов OptEIA TMB (BD Biosciences). Планшеты инкубировали при комнатной температуре, и после достаточного развития окраски, реакцию останавливали посредством добавления 100 мкл 0,18 M раствора серной кислоты. Планшеты считывали с помощью спектрофотометрии на 450 нм.
[0457] Оценка протеинурии. Мочу собирали вручную у отдельных мышей или посредством содержания 1-2 мышей на одну метаболическую клетку в течение 18 часов, и соотношение альбумина и креатинина в моче (UACR) определяли для каждого животного в качестве опосредованной меры функции почек (UACR вычисляли как соотношение мг альбумина/г креатининина на дл мочи). Уровни альбумина в образцах мочи определяли с использованием обычного протокола сэндвич-ELISA с использованием набора антител против альбумина мыши (Bethyl Labs), который содержал покрывающее антитело и вторичное антитело, меченное конъюгатом HRP для обнаружения. Уровни креатининина определяли с использованием коммерческого набора для анализа креатининина (Cayman).
[0458] Гистологическая оценка нефрита. Почки собирали у отдельных мышей, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и создавали окрашенные ГЭ срезы для гистопатологической оценки слепым образом. Признаки для оценок заболевания нефритом представляют собой следующее: степень 0 - нормальные пределы; степень 1 - лентоподобное утолщение капиллярной стенки; степень 2 - повышенное содержание паренхиматозных клеток, сегментация, формирование полулуний; степень 3 - см. степень 2, увеличенные тяжесть и масштабы (% пораженных клубочков) повреждения клубочков; степень 4 - склероз; тяжелое заболевание клубочков (нефункциональный орган).
[0459] Статистика: различия в UACR, цитокинах или титрах антител между группами лечения лекарственными средствами и наполнителем вычисляли с использованием значений от всех отдельных животных в группе. Их тестировали посредством однофакторного дисперсионного анализа с использованием апостериорного критерия Данна для того, чтобы сравнивать каждую экспериментальную группу с наполнителем. P-значения представлены на фигурах, или согласно правилу одна звездочка обозначает p<0,05, две звездочки обозначают p<0,01 и три звездочки обозначают p<0,001. Наборы кривых смертности сравнивали с помощью критерия Кокса-Мантеля и, когда обнаруживали значимость, пары кривых тестировали на различие с использованием анализа Вилкоксона.
[0460] Оценка экспрессии генов интерферона в цельной крови. Экспрессию IFN-регулируемых генов в цельной крови измеряли посредством qPCR. В кратком изложении, мышей умерщвляли, кровь собирали через полую вену, и 100 мкл консервировали в пробирках, содержащих RNAlater (Ambion, Austin TX). Общую РНК выделяли с использованием Mouse RiboPure Blood RNA Isolation Kit (Ambion). Концентрации РНК определяли с использованием спектрофотометра NanoDrop ND-1000 (Thermo Scientific, Waltham MA). Первую цепь кДНК синтезировали из 100 нг общей РНК с использованием High Capacity RNA-to-cDNA Master Mix (Applied Biosystems, Foster City CA). После обратной транскрипции кДНК разводили безнуклеазной водой и смешивали с Gene Expression Master Mix (Applied Biosystems). Затем смесь наносили на специальный TaqMan® Low Density Array (TLDA) производства Applied Biosystems, и qPCR осуществляли на ABI 7900HT Fast Real-time PCR System (Applied Biosystems). Исходные данные собирали с использованием RQ Manager 1.2.1 (Applied Biosystems) и анализировали с использованием программного обеспечения GeneData Analyst 2.2 (GeneData).
[0461] Панель TLDA содержала целых 45 генов-мишеней, выбранных из таблицы 6, приведенной ниже, и 3 конститутивных гена для нормализации. Конститутивный ген Hprt1 выбирали для нормализации на основе коэффициента вариации. Относительные количества определяли для генов-мишеней и использовали для того, чтобы вычислять кратность изменения для каждой больной мыши относительно не больной контрольной группы, получающей интраперитонеально только инъекцию PBS. Стандартный критерий Стьюдента использовали для того, чтобы определять, какие гены-мишени значительно возрастали между не больной группой (лечили PBS) и больной группой, которую лечили наполнителем (лечили пристаном), тем самым представляя набор регулируемых заболеванием генов. Впоследствии «IFN оценку» вычисляли для каждой мыши в виде срединного значения кратности изменения всех регулируемых заболеванием генов, идентифицированных с помощью критерия Стьюдента.
|
|
|
|