Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ФУМАРОВОЙ И МАЛЕИНОВОЙ КИСЛОТ В ПЛАЗМЕ КРОВИ МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ
Вид РИД
Изобретение
Изобретение относится к области аналитической химии и может быть использовано в санитарно-гигиенических, экологических, лечебных и научных организациях, осуществляющих деятельность в области санитарной токсикологии, профпатологии и экологии человека.
Актуальность определения фумаровой и малеиновой кислот в биологических средах связана с профессиональной деятельностью работников производства фумаровой кислоты, условия труда которых характеризуются воздействием комплекса химических веществ, в том числе, фумаровой и малеиновой кислот, обуславливающих риск нарушения здоровья.
Фумаровая и малеиновая кислоты являются цис- и транс-изомерами этилен-1,2-дикарбоновой кислоты, поэтому необходимо проводить их раздельное определение при возможном совместном присутствии в пробе крови человека.
Для оценки риска воздействия производственных факторов на состояние здоровья у работников производства фумаровой кислоты актуальным является разработка и совершенствование методического обеспечения по определению массовых концентраций фумаровой и малеиновой кислот в крови, как на уровне фоновых значений, так и выше, с использованием высокочувствительного и селективного метода высокоэффективной жидкостной хроматографии.
Из уровня техники известны способы раздельного количественного определения фумаровой и малеиновой кислот в различных средах, а именно:
- в растворе ацетона и этиленгликоля при их совместном присутствии путем потенциометрического титрования (далее - метод 1) (изобретение «Способ количественного определения адипиновой, малеиновой и фумаровой кислот в их смеси» по авторскому свидетельству СССР №427279).
- в водных растворах полярографическим методом (далее - метод 2) (изобретение «Способ раздельного количественного определения малеиновой и фумаровой кислот при их совместном присутствии» по авторскому свидетельству СССР №364887).
Недостатками указанных известных методов являются использование высокотоксичных органических растворителей для титрования (бензола, изопропилового спирта) (метод 1), низкие чувствительность и точность определения (методы 1 и 2), невозможность применения известного способа для анализа смеси малеиновой и фумаровой кислот в биологических средах, в том числе в крови (методы 1, 2).
Также известны способы определения содержания фталевой и/или фумаровой кислот в пищевых продуктах:
- определение фумаровой кислоты в меде методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Мед в количестве 7,5 г растворяют в 75 мл воды. Доводят pH до 10,5 с помощью 0,1 М раствора гидроокиси натрия NaOH и смесь перемешивают в течение 15 мин, используя магнитную мешалку. Затем доводят pH до 5, используя 0,1 М раствор серной кислоты H2SO4. Смесь переносят в мерную колбу и доводят дистиллированной водой до объема 100 мл. 10 мл этого раствора фильтруют через целлюлозный фильтр с размером пор 0,45 мкм. Проводят твердофазную экстракцию на ионно-обменном картридже, который активируют 10 мл 0,1 М раствором гидроксида натрия, скорость фильтрации 3 мл/мин. Пропускают через картридж 10 мл раствора меда со скоростью 0,5 мл/мин. Картридж промывают 10 мл воды, затем вымывают органические кислоты, пропуская через картридж 4 мл 0,1 М раствора серной кислоты. Этот раствор анализируют методом ВЭЖХ. Разделение фумаровой и малеиновой кислот проводят на колонке Spherisorb ODS-2 S5 длиной 250 мм и внутренним диаметром 4,6 мм в изократическом режиме элюирования с использованием в качестве элюента 4,5%-ного водного раствора фосфорной кислоты (pH 2,2) со скоростью 0,7 мл/мин. Длина волны ультрафиолетового детектора 215 нм. Чувствительность определения известным способом малеиновой кислоты 0,059 мг/кг, фумаровой кислоты 0,006 мг/кг (далее - метод 3) (Suarez-Luque S., Mato I., Huidobro J., Simal-Lozano J. Rapid determination of minority organic acids in honey by high-performance liquid chromatography // Journal of Chromatography A, 955. - 2002. - P. 207-214);
- определение массовой концентрации фумаровой кислоты в соковой продукции методом высокоэффективной жидкостной хроматографии. Известный способ основан на фильтровании пробы через обеззоленный фильтр или центрифугировании, определении фумаровой кислоты в подготовленной пробе с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Условия хроматографирования:
- температура термостата колонки 40±5°C;
- объем вводимой пробы 20 мм3;
- элюент - раствор серной кислоты молярной концентрации 0,005 моль/дм3;
- режим элюирования - изократический;
- скорость подачи потока элюента 0,6 см3/мин.
Пробы осветленных соков, не содержащих нерастворимые в воде вещества, фильтруют через мембранный фильтр с диаметром пор не более 0,45 мкм и анализируют на приборе. Пробы осветленных соков, содержащих нерастворимые в воде вещества, предварительно фильтруют через обеззоленный фильтр «белая лента» или центрифугируют, затем фильтруют через мембранный фильтр. Пробы с объемной долей мякоти выше 10% разбавляют дистиллированной водой в 5 раз, центрифугируют для осаждения осадка, отбирают 1-2 мл верхнего слоя и фильтруют через мембранный фильтр. Идентификацию и количественный расчет пиков проводят с применением спектрофотометрического детектора в ультрафиолетовой области спектра при максимуме поглощения 210 нм. В указанном известном способе диапазон измеряемых концентраций фумаровой кислоты составляет 1-50 мг/дм3, точность определения 9-38% (далее - метод 4) (ГОСТ 32712-2014 Продукция соковая. Определение фумаровой кислоты методом высокоэффективной жидкостной хроматографии).
Недостатками указанных известных методов являются сложность и длительность пробоподготовки (метод 3), низкая чувствительность (методы 3, 4), невозможность применения описанных способов пробоподготовки для извлечения смеси малеиновой и фумаровой кислот из крови (методы 3, 4).
В зарубежной литературе описан способ определения диметил- и монометилфумаратов и их метаболита - фумаровой кислоты в крови методом высокоэффективной жидкостной хроматографии. В пробирку с отобранной кровью добавляют фторид натрия и оксалат калия в качестве антиоксидантов и ингибиторов ацетилхолинэстеразы. Образцы перемешивают, охлаждают и центрифугируют при 4°C в течение 10 мин со скоростью 1500 об/мин. Полученный супернатант хранят при -30°C до анализа. Перед анализом пробу размораживают, осаждают белки фосфорной кислотой, доводя pH пробы до значения 0,5, затем проводят жидкостную экстракцию диэтиловым эфиром. В пробу добавляют хлорид натрия и центрифугируют 10 минут со скоростью 12000 об/мин. Эфирный слой выпаривают и перерастворяют в смеси метанола и 0,1 М фосфатнного буферного раствора (КН2РО4/К2НРО4; pH 7,5) с добавлением тетрабутиламмония дигидрофосфата (5 мМ) в соотношении 1:1. Анализ проводят на жидкостном хроматографе на колонке с обращенной фазой С18. В качестве подвижной фазы используют смесь метанола и буферного раствора фосфата калия с тетрабутиламмония дигидрофосфатом (20:80 объемных частей). Предел определения 0,01 мг/дм3 (Litjens N., Burggraaf J., Strijen E., Gulpen С., Mattie H., Schoemaker R., Dissel J., Thio H., Nibbering P. Pharmacokinetics of oral fumarates in healthy subjects // British Journal of Clinical Pharmacology. - 2004. - 58:4. - 429-432 p.).
Недостатки известного способа: низкая чувствительность определения, сложность пробоподготовки, применение высоколетучего органического растворителя (диэтилового эфира) в качестве экстрагента при проведении жидкостной экстракции. Кроме того, использование подвижной фазы на основе буферного раствора требует длительной промывки колонки после проведения серии анализов для предотвращения ее загрязнения.
Также известен способ, описанный в Методических указаниях МУК 4.1.2772-10 «Определение массовой концентрации фталевой кислоты в пробах крови методом высокоэффективной жидкостной хроматографии». Известный способ, охарактеризованный в указанных МУК, предназначен для селективного определения фталевой кислоты в присутствии бензолкарбоновых кислот, в том числе малеиновой кислоты, в крови методом ВЭЖХ. Согласно известному способу отбирают пробу венозной крови объемом не менее 8 см3 в чистую пробирку, содержащую 0,2 см3 раствора гепарина. Далее производят ее пробоподготовку путем переноса 4 см3 крови в центрифужную пробирку и центрифугирования со скоростью 1500 об/мин в течение 5 мин. Отбирают 2 см3 плазмы, добавляют 20 мкл концентрированной фосфорной кислоты и проводят твердофазную экстракцию, последовательно пропуская под вакуумом через картридж с сорбентом Oasrs HLB 1CC 1 см3 метанола, 1 см3 дистиллированной воды, 2 см3 плазмы и 1 см3 5%-ного раствора метанола в воде со скоростью потока не более 1 см3/мин, слив отбрасывают. Далее пропускают через картридж 1,0 см3 метанола. Метанольный экстракт высушивают в потоке воздуха, остаток растворяют в 0,2 см3 подвижной фазы (смесь метанола и дистиллированной воды в соотношении 15:85, подкисленной фосфорной кислотой до pH 3). Далее производят введение подготовленной пробы в пробоотборное устройство жидкостного хроматографа, проводят анализ экстракта в количестве 10 см3 на обращено-фазной колонке длиной 80 мм и внутренним диаметром 2 мм, заполненной Диасорбом C16, скорость движения подвижной фазы 100 мм3/мин, длина волны УФ-детектора 200 нм, время удерживания фталевой кислоты 4,2 мин. Определяют содержание фталевой кислоты с использованием ранее построенного градуировочного графика. Диапазон измеряемых концентраций фталевой кислоты в крови 1-20 мг/дм3, погрешность определения 23% (МУК 4.1.2772-10 Определение массовой концентрации фталевой кислоты в пробах крови методом высокоэффективной жидкостной хроматографии. Определение массовой концентрации химических веществ в атмосферном воздухе и биологических средах: Сборник методических указаний по методам контроля. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011. - 67 стр.)
Недостатки известного способа:
- невозможность раздельного определения фумаровой и малеиновой кислот этим способом, в частности, при использовании в качестве подвижной фазы смеси ацетонитрила и дистиллированной воды в соотношении 15:85, подкисленной фосфорной кислотой до pH 3, т.к. в таких условиях фумаровая и малеиновая кислоты не удерживаются на обращено-фазных колонках с привитыми фазами C8-C18, проходят через колонку неразделенными и на хроматограмме фиксируются в виде одного пика;
- подкисление пробы (2 см3 плазмы) фосфорной кислотой в количестве 20 мкл недостаточно для подавления диссоциации молекул фумаровой и малеиновой кислот в плазме с целью проведения хроматографического анализа в молекулярной форме (константы диссоциации: малеиновая кислота pKa1 1,09 и pKa2 6,07; фумаровая кислота pKa1 3,03 и pKa2 4,44; фталевая кислота pKa1 2,95 и pKa2 5,41);
- элюирование анализируемой пробы подвижной фазой, имеющей кислотность pH 3, приводит к ионизации молекул малеиновой кислоты в случае ее присутствия в пробе, вследствие чего концентрация малеиновой кислоты снижается, что приводит к пониженным результатам анализа.
Кроме того, данный известный метод не позволяет определять содержание фумаровой и малеиновой кислот в крови на уровне концентраций ниже 1 мг/дм3, реально присутствующих в крови.
При этом из уровня техники не были выявлены известные способы количественного определения фумаровой и малеиновой кислот в крови при их совместном присутствии, поэтому сделать выбор ближайшего аналога к заявляемому изобретению не представляется возможным.
Технический результат, достигаемый предлагаемым способом, заключается в повышении чувствительности и достижении селективности раздельного определения содержания фумаровой и малеиновой кислот в крови на уровне от 0,025 мг/дм3, при одновременном уменьшении объема пробы крови, необходимой для анализа.
Дополнительным техническим результатом является экономия химических реактивов: ацетонитрила и дистиллированной воды, за счет снижения скорости потока элюента до величины 0,1 мл/мин при проведении операции элюирования.
Поставленный технический результат достигается предлагаемым Способом определения содержания фумаровой и малеиновой кислот в плазме крови методом высокоэффективной жидкостной хроматографии, заключающимся в том, что производят отбор пробы крови, осуществляют ее пробоподготовку путем твердофазной экстракции и проводят последующее исследование экстракта с использованием высокоэффективной жидкостной хроматографии, при этом перед пробоподготовкой пробу крови подвергают центрифугированию со скоростью 4000 об/мин в течение 10 мин. с отделением плазмы, которую далее подкисляют концентрированной фосфорной кислотой до pH=1, осуществляют последующую твердофазную экстракцию этой плазмы на сорбенте Oasis HLB 1СС путем последовательного пропускания через указанный сорбент ацетонитрила, дистиллированной воды, плазмы, 5%-ного водного раствора ацетонитрила, экстрагируют аналиты с картриджа путем пропускания через него чистого ацетонитрила, экстракт высушивают под вакуумом, сухой остаток перерастворяют в метаноле, пропускают через мембранный фильтр, и проводят последующее исследование экстракта с использованием высокоэффективной жидкостной хроматографии, для этого осуществляют элюирование экстракта смесью ацетонитрила и дистиллированной воды, подкисленной фосфорной кислотой до pH=1, в градиентном режиме подачи элюента, который осуществляют путем пропускания со скоростью 0,1 мл/мин через колонку в течение 1,5 мин элюента из смеси ацетонитрила и дистиллированной воды в соотношении 1:99 об %; затем путем увеличения в течение 5 мин в элюенте ацетонитрила до 20 об. %, дальнейшего увеличения его концентрации в течение 1,5 мин. до 70 об. %, затем увеличения концентрации ацетонитрила в течение 3,5 мин. до 80 об. %, с последующим снижением объемного количества ацетонитрила до 1 об. % и пропусканием такого элюента в течение 4,5 мин. до уравновешивания колонки, а количество фумаровой и малеиновой кислот в плазме крови устанавливают по градуировочному графику.
В качестве колонки при осуществлении высокоэффективной жидкостной хроматографии используют обращенно-фазную колонку Zorbax SB-C18 длиной 100 мм и внутренним диаметром 4,6 мм, с зернением частиц 3,5 мкм.
Высокоэффективную жидкостную хроматографию проводят на жидкостном хроматографе Agilent серии 1200 с диодноматричным детектором при длине волны возбуждения 220 нм при температуре колонки +27°C.
В качестве мембранного фильтра используют фильтр с размером пор 0,45 мкм.
Указанный технический результат достигается за счет следующего.
Благодаря тому, что пробу крови центрифугируют именно со скоростью 4000 об./мин в течение 10 минут, достигается более полное выделение слоя плазмы, что позволяет повысить чувствительность способа.
Подкисление плазмы концентрированной фосфорной кислотой до pH=1 обеспечивается подавление диссоциации молекул фумаровой и особенно малеиновой кислот в плазме, и при этом не будет происходить денатурация белков плазмы, что влияет на точность определения.
Использование в качестве экстрагента при проведении твердофазной экстракции ацетонитрила, обладающего более высокой элюирующей способностью по сравнению с метанолом, позволяет обеспечить более полное извлечение фумаровой и малеиновой кислот с сорбента Oasis HLB 1CC.
Благодаря тому, что экстракт высушивают под вакуумом, используя центрифужный вакуумный концентратор, сокращается длительность проведения пробоподготовки.
Использование при элюировании в качестве элюента смеси ацетонитрила и воды, подкисленную до pH=1 фосфорной кислотой, обеспечивается предотвращение диссоциации фумаровой и малеиновой кислот, а значит их потери, что способствует повышению точности определения этих кислот по отдельности.
Проведение операции элюирования в градиентном режиме подачи элюента при заданных режимах обеспечивает промывку колонки от сопутствующих компонентов, что играет на достижение цели - повышение точности.
Заявляемые режимы работы колонки при элюировании: температура колонки 27°C, объем анализируемой пробы 20 мкл, длина волны УФ-детектора 220 нм, являются оптимальными для обеспечения точности и чувствительности предлагаемого способа. Длина волны УФ-детектора, равная 220 нм, близка к максимумам поглощения обеих кислот, в то же время при анализе низких концентраций анализируемых кислот именно при такой длине не происходит перекрывания их хроматографических пиков ацетонитрилом, что позволяет проводить раздельное определение кислот.В предлагаемый условиях время выхода малеиновой кислоты составляет 3,60 мин, фумаровой - 4,42 мин.
Предлагаемый способ был опробован в лабораторных условиях. Для его реализации были использованы следующие химреактивы, оборудование и расходные материалы:
- фумаровая кислота, аналитический стандарт с массовой долей основного вещества не менее 99,0%;
- малеиновая кислота, аналитический стандарт с массовой долей основного вещества не менее 99,0%;
- ацетонитрил для хроматографии, сорт «0», ТУ 2634-002-54260861-2013;
- метанол, химически чистый, ТУ 6-09-1709-77
- кислота ортофосфорная, химически чистая, ТУ 2612-014-00203677;
- дистиллированная вода, ГОСТ 6709-72;
- жидкостный хроматограф, оснащенный детектором с диодной матрицей, насосом для градиентного элюирования;
- центрифужный вакуумный концентратор;
- pH-метр лабораторный (основная погрешность измерения не более±0,05 единиц pH);
- магнитная мешалка;
- весы лабораторные электронные аналитические 2 класса точности, погрешность взвешивания ±0,5 мг, ГОСТ Р 53228;
- центрифуга, обеспечивающая скорость вращения 4000 об./мин;
- колонка хроматографическая металлическая с обращенной фазой Zorbax SB-C18, длиной 100 мм и внутренним диаметром 4,6 мм зернением частиц 3,5 мкм;
- картриджи с сорбентом Oasis HLB 1CC;
- мембранные фильтры с размером пор 0,45 мкм.
Приготовление растворов и подготовку проб к анализу проводят при следующих условиях:
- температура воздуха (20±5)°C;
- атмосферное давление 630-800 мм рт.ст.;
- влажность воздуха от 30 до 80%.
Приготовление растворов:
1. Водный раствор ортофосфорной кислоты (pH=1)
В мерный стакан вместимостью 250 см3 вносят 100 см3 дистиллированной воды, устанавливают стакан на магнитную мешалку. Небольшими порциями, с помощью пипетки добавляют кислоту ортофосфорную до установления pH 1. Значение pH раствора определяют с помощью pH-метра. Используют свежеприготовленный раствор.
2. Исходный раствор фумаровой и малеиновой кислот для построения градуировочного графика.
Взвешивают по 1 мг фумаровой и малеиновой кислот, переносят в мерную колбу вместимостью 100 см3, доводят дистиллированной водой до метки, закрывают пробкой и перемешивают. Выдерживают раствор при комнатной температуре в течение суток до полного растворения кристаллов. Массовая концентрация фумаровой и малеиновой кислот в исходном водном растворе для градуировки составляет 0,01 мг/см3. Срок хранения 5 дней при комнатной температуре.
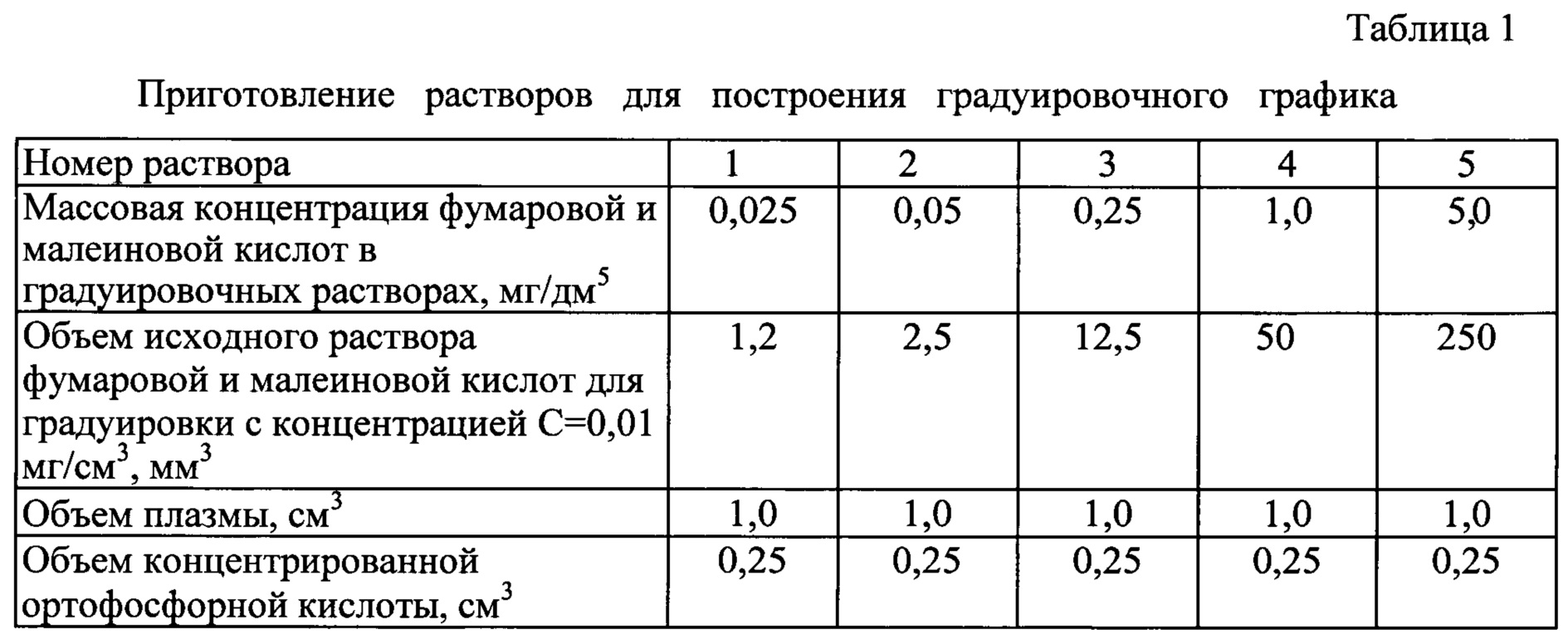
3. Раствор №1 с массовой концентрацией фумаровой и малеиновой кислот в плазме крови 0,025 мг/дм3. Образец цельной крови объемом 2 см3 центрифугируют со скоростью 4000 об./мин в течение 10 минут, отделяют 1 см3 плазмы в мерную пробирку вместимостью 10 см3, добавляют 0,25 см3 концентрированной фосфорной кислоты, пробу перемешивают, затем добавляют микрошприцем 1,2 мм3 исходного раствора фумаровой и малеиновой кислот для градуировки с массовой концентрацией 0,01 мг/см3, перемешивают. Используют свежеприготовленный раствор.
4. Раствор №2 с массовой концентрацией фумаровой и малеиновой кислот в плазме крови 0,05 мг/дм3. Образец цельной крови объемом 2 см3 центрифугируют со скоростью 4000 об./мин в течение 10 минут, отделяют 1 см3 плазмы в мерную пробирку вместимостью 10 см3, добавляют 0,25 см3 концентрированной фосфорной кислоты, пробу перемешивают, затем добавляют микрошприцем 2,5 мм3 исходного раствора фумаровой и малеиновой кислот для градуировки с массовой концентрацией 0,01 мг/см3, перемешивают.
5. Раствор №3 с массовой концентрацией фумаровой и малеиновой кислот в плазме крови 0,25 мг/дм3. Образец цельной крови объемом 2 см3 центрифугируют со скоростью 4000 об./мин в течение 10 минут, отделяют 1 см3 плазмы в мерную пробирку вместимостью 10 см3, добавляют 0,25 см3 концентрированной фосфорной кислоты, пробу перемешивают, затем добавляют микрошприцем 12,5 мм3 исходного раствора фумаровой и малеиновой кислот для градуировки с массовой концентрацией 0,01 мг/см3, перемешивают.
6. Раствор №4 с массовой концентрацией фумаровой и малеиновой кислот в плазме крови 1 мг/дм3. Образец цельной крови объемом 2 см3 центрифугируют со скоростью 4000 об./мин в течение 10 минут, отделяют 1 см3 плазмы в мерную пробирку вместимостью 10 см3, добавляют 0,25 см3 концентрированной фосфорной кислоты, пробу перемешивают, затем добавляют дозатором 50 см3 исходного раствора фумаровой и малеиновой кислот для градуировки с массовой концентрацией 0,01 мг/см3, перемешивают.
7. Раствор №5 с массовой концентрацией фумаровой и малеиновой кислот в плазме крови 5 мг/дм3. Образец цельной крови объемом 2 см3 центрифугируют со скоростью 4000 об./мин в течение 10 минут, отделяют 1 см3 плазмы в мерную пробирку вместимостью 10 см3, добавляют 0,25 см3 концентрированной фосфорной кислоты, пробу перемешивают, затем добавляют дозатором 250 мм3 исходного раствора фумаровой и малеиновой кислот для градуировки с массовой концентрацией 0,01 мг/см3, перемешивают.
Построение градуировочного графика производят с использованием растворов, приведенных в таблице 1.
Для построения градуировочного графика проводят твердофазную экстракцию градуировочных растворов. Для этого кондиционируют картридж с сорбентом Oasis HLB 1СС, пропуская через него под вакуумом со скоростью потока не более 1 см3/мин по 1 см3 ацетонитрила и дистиллированной воды. Затем наносят на картридж градуировочные растворы, приготовленные на основе плазмы, в полном объеме, пропускают через картридж 1 см3 5%-ного раствора ацетонитрила, слив отбрасывают. Затем извлекают анализируемые соединения с картриджа, пропуская через картридж 1 см3 чистого ацетонитрила. Экстракт высушивают, перерастворяют в 0,2 см3 метанола, пропускают через мембранный фильтр с диаметром пор 0,45 мкм и анализируют аликвотную часть полученного экстракта (20 мм) на жидкостном хроматографе. Рассчитывают градуировочный коэффициент по формуле:
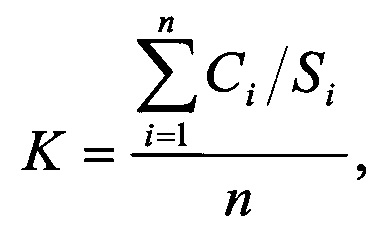 где
где
Ci - концентрация фумаровой или малеиновой кислот в градуировочном растворе i-й концентрации, мг/дм3;
Si - среднее значение измерений площади пика фумаровой или малеиновой кислот i-й концентрации, единицы оптической плотности (е.о.п.);
n - количество градуировочных смесей (n=5).
Градуировку проверяют один раз в квартал и при смене партии реактивов.
Предлагаемый способ осуществляют следующим образом.
Производят отбор проб крови в химически чистые пробирки с добавлением антикоагулянта (гепарин) или в вакуумные пробирки с внесенным антикоагулянтом.
Далее проводят подготовку проб крови способом твердофазной экстракции. Для этого пробу крови объемом 2 см3 дозатором вносят в конические градуированные пробирки из полипропилена вместимостью 15 см3, пробу крови центрифугируют со скоростью 4000 об./мин в течение 10 минут и отделяют плазму в объеме 1 см3.. Затем добавляют концентрированную фосфорную кислоту в объеме 0,25 см3. Перед проведением твердофазной экстракции кондиционируют картридж с сорбентом Oasis HLB 1СС, пропуская через него 1 см3 ацетонитрила и 1 см3 дистиллированной воды. Наносят на картридж образец плазмы (т.е. пропускают через картридж), подкисленной до pH=1 концентрированной фосфорной кислотой и промывают картридж 1 см3 5%-ного раствора ацетонитрила, слив отбрасывают. Затем экстрагируют аналиты с картриджа Oasis HLB 1СС, пропуская через него 1 см3 чистого ацетонитрила. Экстракт высушивают, перерастворяют в 0,2 см3 метанола, пропускают через мембранный фильтр с диаметром пор 0,45 мкм и анализируют аликвотную часть полученного экстракта (20 мм3) на жидкостном хроматографе.
При реализации предлагаемого способа готовят две параллельные пробы крови, одновременно готовят холостую пробу. В качестве холостой пробы служит 1 см3 ацетонитрила, пропущенный через картридж Oasis HLB 1СС, подготовленный аналогично картриджам при анализе образцов плазмы, высушенный и перерастворенный в 0,2 см3 метанола и профильтрованный через мембранный фильтр с диаметром пор 0,45 мкм.
Проводят хроматографическое разделение фумаровой и малеиновой кислот на обращенно-фазной колонке Zorbax SB-C18 длиной 100 мм и внутренним диаметром 4,6 мм с зернением частиц 3,5 мкм, устойчивой к низким значениям pH подвижной фазы (т.е. элюента) (pH=0,8-8,0). Элюирование проводят смесью ацетонитрила и воды, подкисленной до pH=1 фосфорной кислотой (кислая среда pH=1 предотвращает диссоциацию фумаровой и малеиновой кислот), в градиентном режиме подачи элюента, который задают с помощью программы «Настройка насоса»: от 0 мин до 1,5 мин подача смеси ацетонитрила и воды в соотношении 1:99 об %; от 1,5 мин до 6,5 мин увеличение объемной доли ацетонитрила в смеси до 20 об %; от 6,5 мин до 10 мин увеличение объемной доли ацетонитрила в смеси до 80 об % (чтобы промыть колонку от сопутствующих компонентов); от 10 мин до 10,5 мин снижение объемной доли ацетонитрила в смеси до 1 об %; от 10,5 мин до 15 мин подача смеси ацетонитрила и воды в соотношении 1:99 об % (подготовка колонки к следующему анализу). Скорость элюирования составляет 0,1 мл/мин. Температура колонки 27°C, объем анализируемой пробы 20 мкл, длина волны УФ-детектора 220 нм. Длина волны УФ-детектора, равная 220 нм, близка к максимумам поглощения обеих кислот, в то же время при анализе низких концентраций анализируемых кислот при такой длине волны 220 нм не происходит перекрывания их хроматографических пиков ацетонитрилом.
В данных условиях время выхода малеиновой кислоты составляет 3,60 мин, фумаровой - 4,42 мин.
Концентрацию малеиновой и фумаровой кислот в плазме крови определяют с помощью градуировочных графиков.
Для каждой серии измерений одновременно готовят 1-2 холостых пробы, повторяя процедуру подготовки проб крови.
При измерении растворов проб с массовой концентрацией фумаровой кислоты выше 5 мг/дм3 рекомендуется провести повторный анализ пробы меньшего объема (1-10 мкл), учитывая данный объем при вычислении результатов.
Результат определения представляется как среднее из измерений двух параллельных проб.
Массовую концентрацию малеиновой и фумаровой кислот в плазме крови рассчитывают по формуле:
С=(S-Sхол)⋅K, где
С - концентрация фумаровой или малеиновой кислот в анализируемой пробе, мг/дм3;
S - площадь пика фумаровой или малеиновой кислот в анализируемой пробе, (е.о.п.);
Sхол - площадь пика фумаровой или малеиновой кислот в холостой пробе, (е.о.п.);
К - градуировочный коэффициент.
Полученные результаты измерения концентраций малеиновой и фумаровой кислот в плазме крови предлагаемым способом приведены в таблице 2.
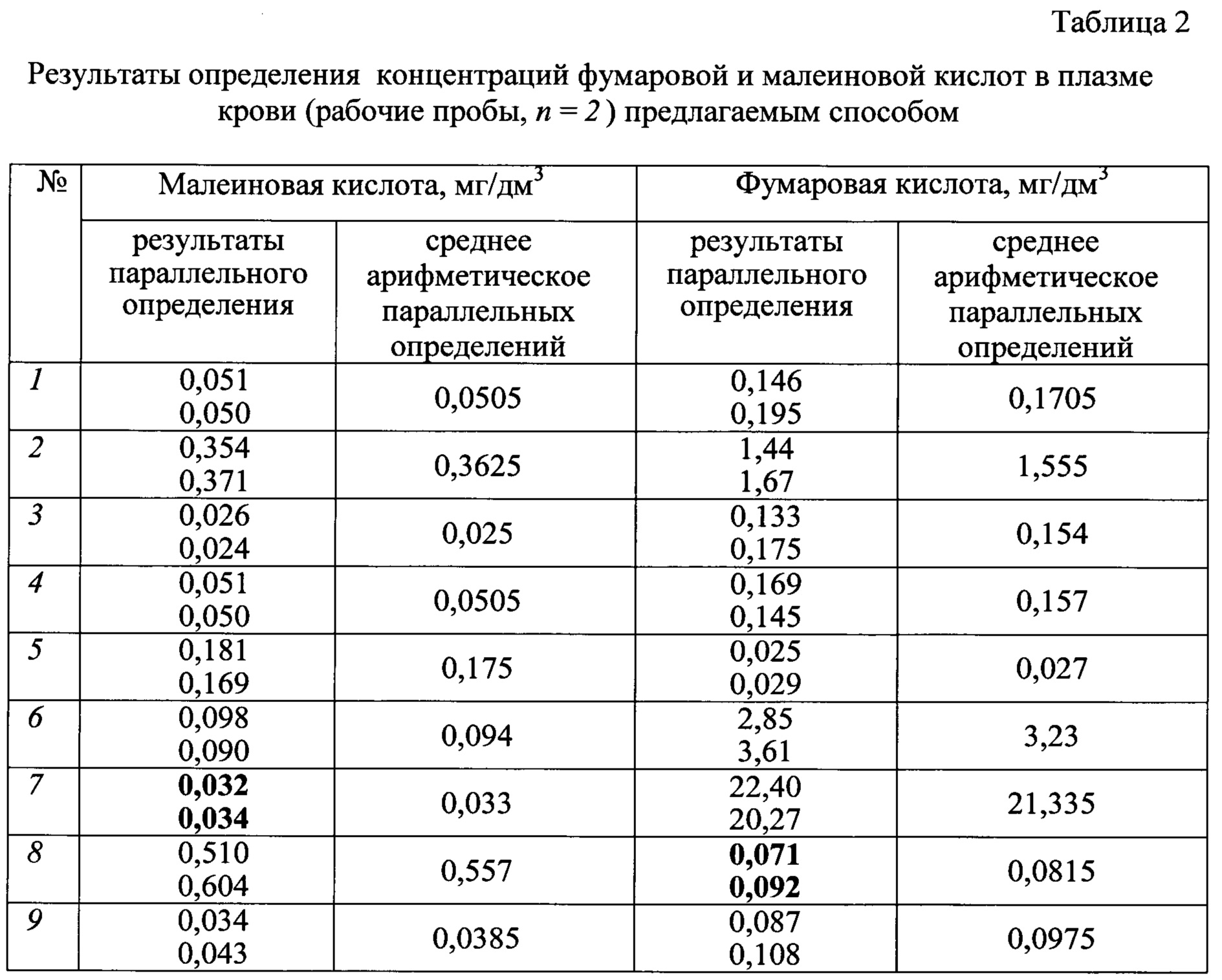
Данные, приведенные в таблице 2, показывают реальное содержание фумаровой и малеиновой кислот в пробах крови работающих в условиях отсутствия и наличия экспозиции, связанной с профессиональной деятельностью.
Для расчета относительной погрешности предлагаемого способа использовали способ «введено-найдено».
Для этого проводят анализ проб крови без добавления и с добавлением в них определенного количества анализируемого компонента (добавка составляет 50-150% от найденной концентрации малеиновой и фумаровой кислот в рабочей пробе) для выяснения правильности и точности заявляемого способа (относительная погрешность). Полученные результаты измерений малеиновой и фумаровой кислот в рабочей пробе плазмы крови без добавки приведены в таблицах 3 и 4 соответственно.
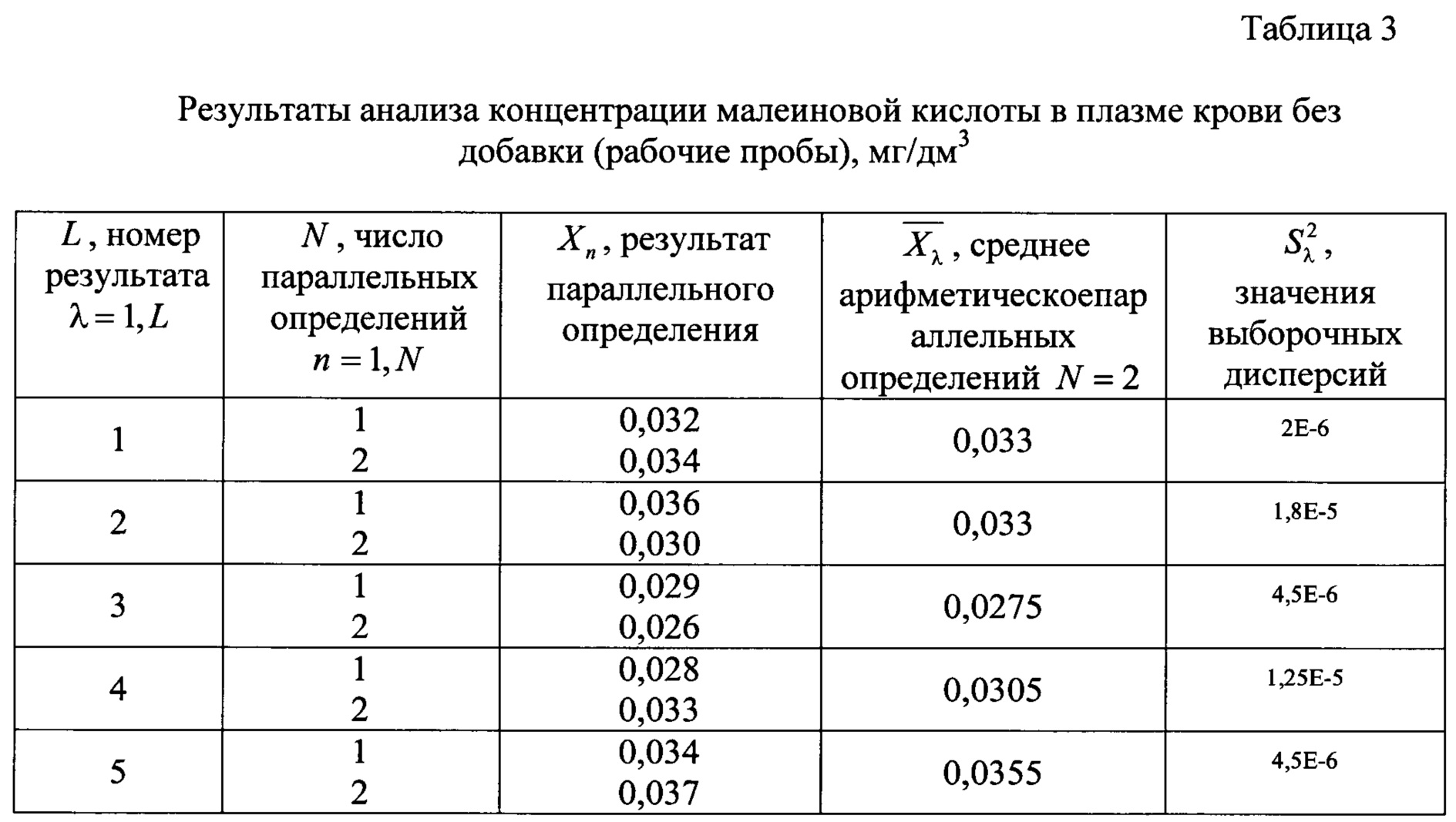
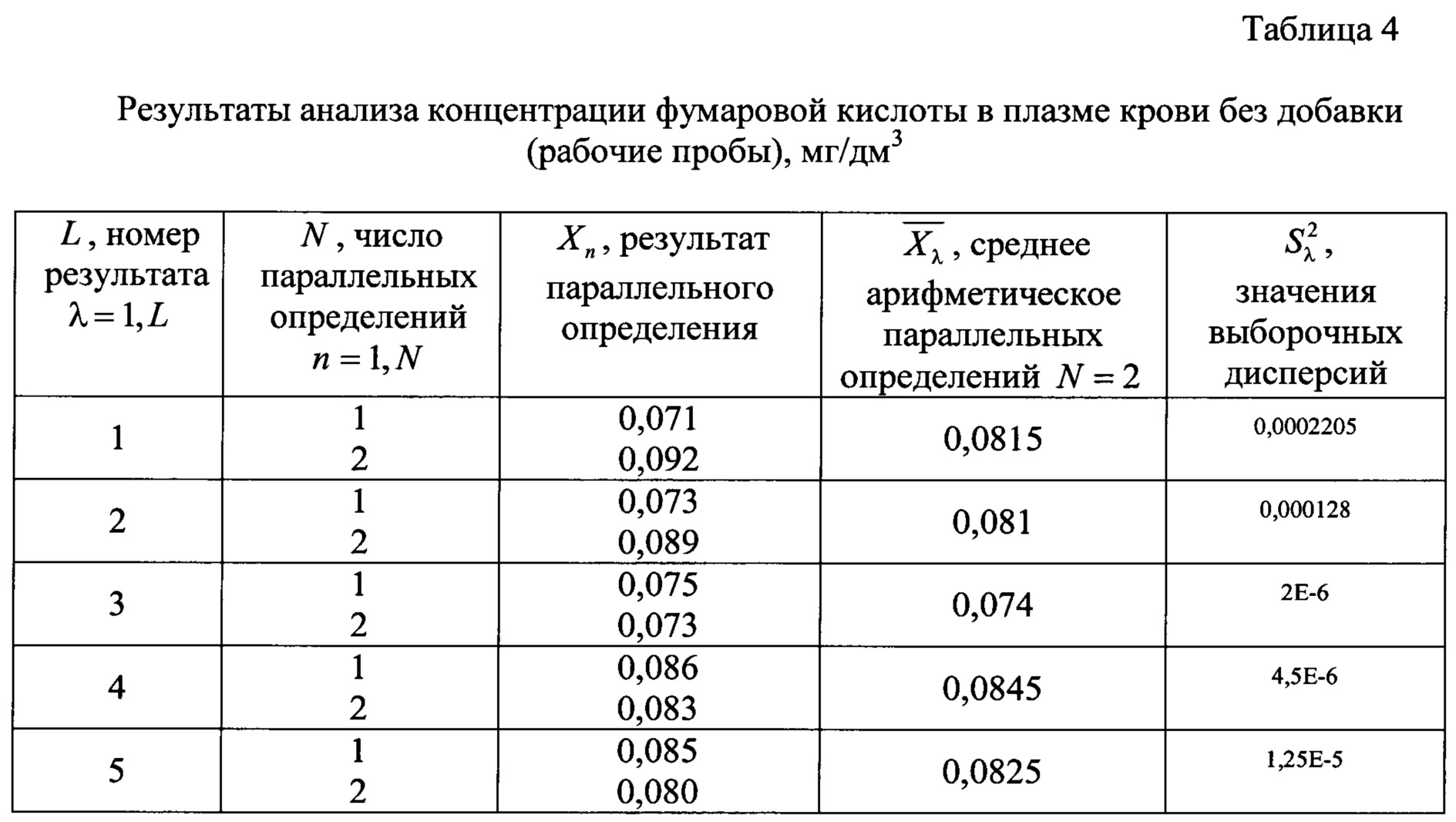
Результаты измерений малеиновой и фумаровой кислот в подготовленной пробе с его добавкой в пробу крови приведены в таблицах 5 и 6 соответственно.
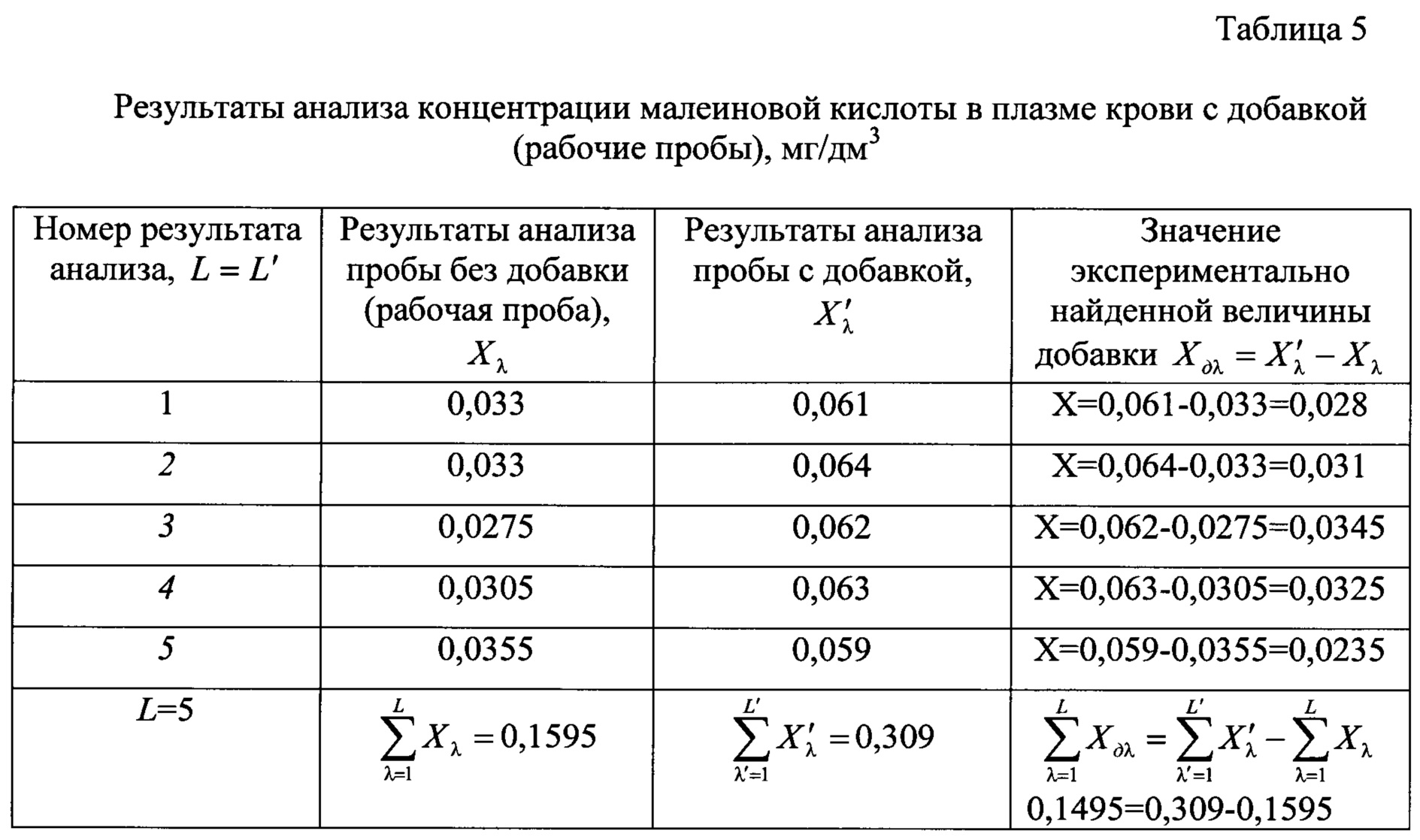
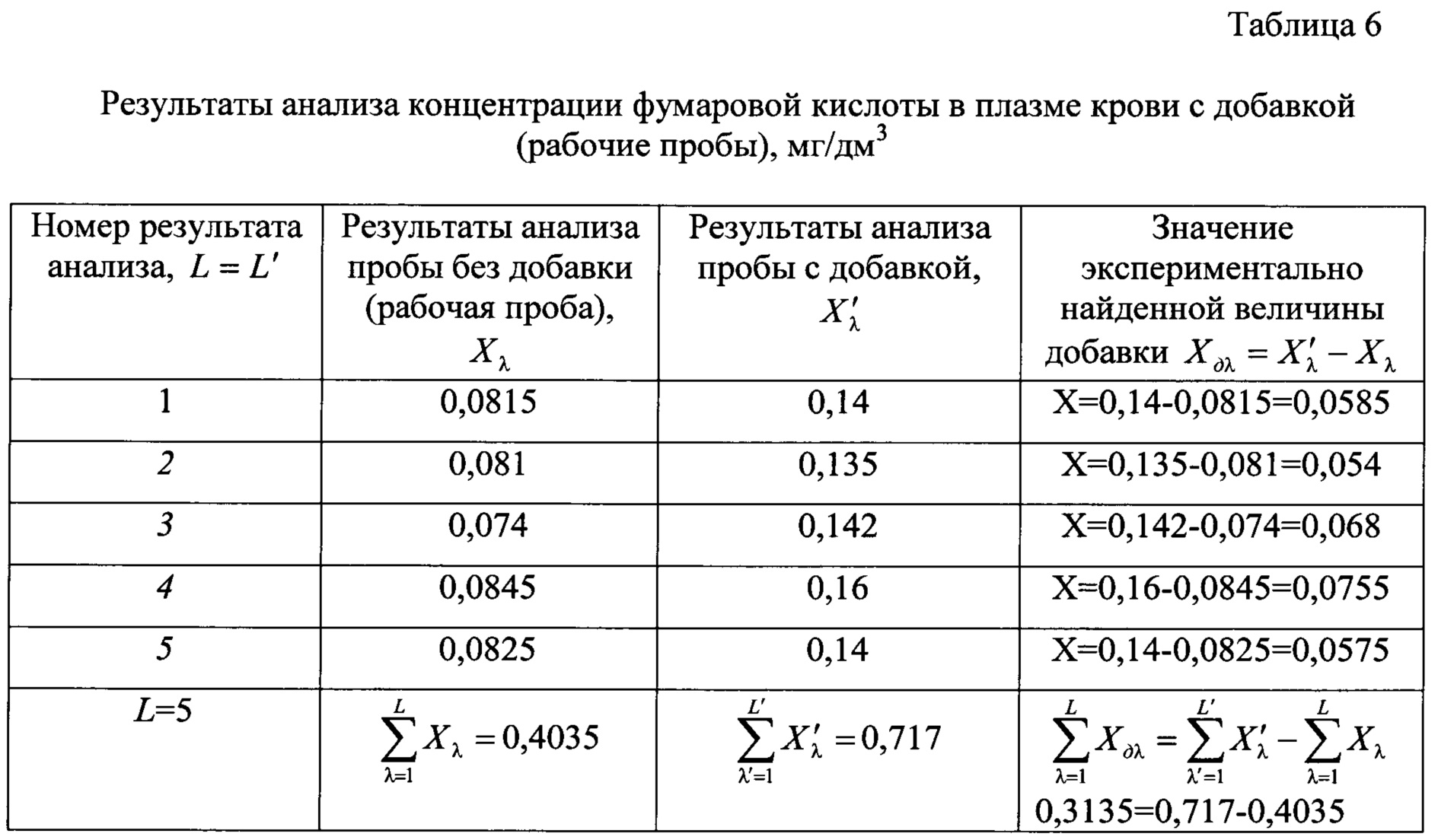
В данном примере величина добавки малеиновой кислоты в пробу плазмы крови была равна 0,032 мг/дм3, добавка фумаровой кислоты 0,75 мг/дм3. Среднее обнаруженное значение внесенной добавки малеиновой кислоты составило 0,031 мг/дм3, добавки фумаровой кислоты - 0,072 мг/дм3, что доказывает высокую точность и правильность анализа при реализации предлагаемого способа.
Также в ходе лабораторных испытаний предлагаемого способа были установлены следующие характеристики: диапазоны измерений фумаровой и малеиновой кислот в плазме крови, значения показателей точности, правильности, повторяемости и внутрилабораторной прецизионности. Полученные данные приведены в таблицах 7 и 8.
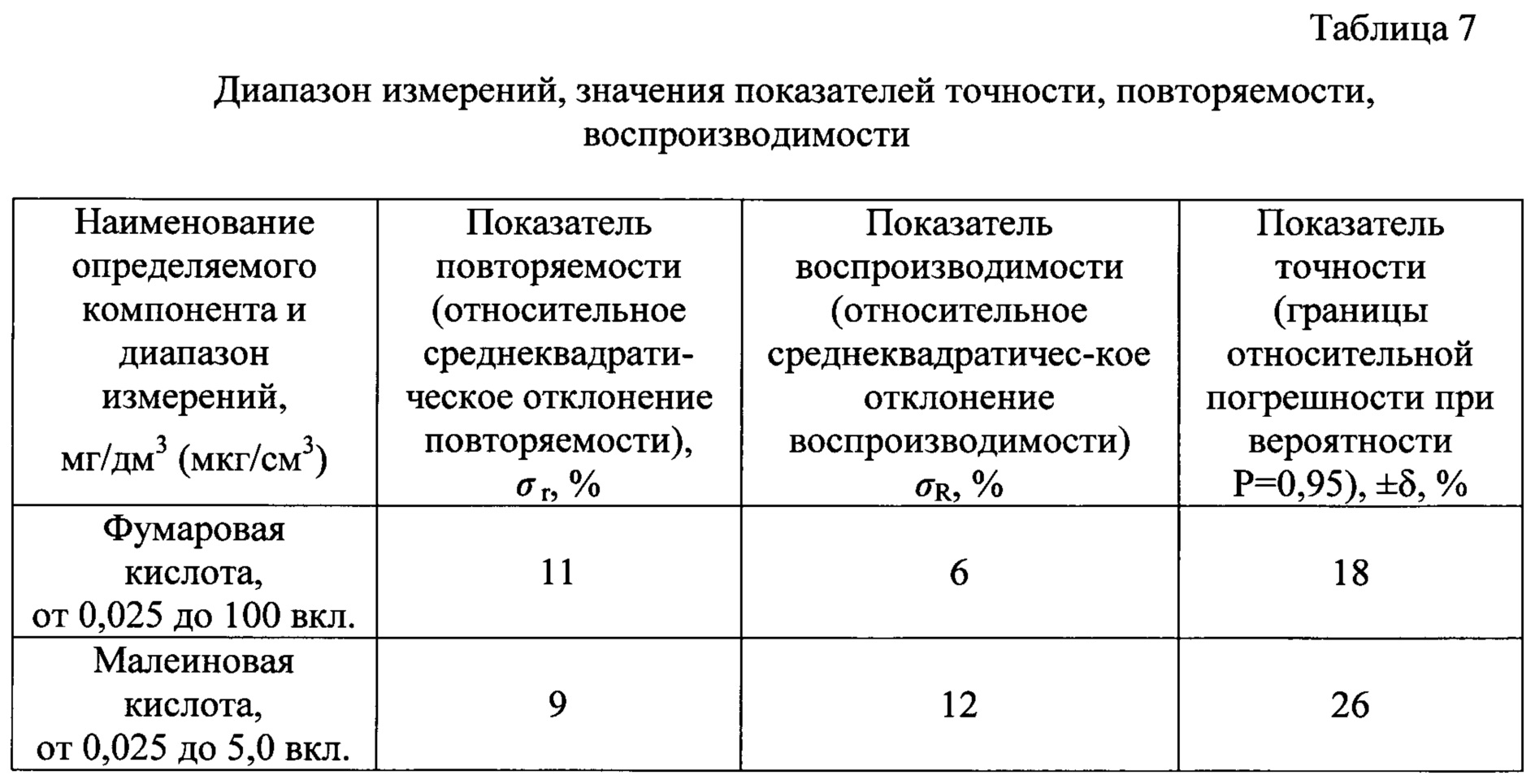

Приведенные в таблицах 7 и 8 данные показывают, что предлагаемый способ позволяет с высокой точностью определять в плазме крови фумаровую и малеиновую кислоты. Точность определения фумаровой кислоты не более 17%, малеиновой кислоты - не более 26% в диапазоне концентраций 0,025-100 мг/дм3 и 0,025-5,0 мг/дм3 соответственно.
Чувствительность заявляемого способа позволяет обнаружить даже низкие концентрации, в том числе на уровне фоновых значений (как продуктов метаболизма), а также высокие концентрации, связанные с контаминацией биологических сред в условиях производства.
Таким образом, разработанный способ раздельного определения фумаровой и малеиновой кислот в пробе крови позволяет адекватно диагностировать химическую нагрузку на человека, что может являться доказательным звеном воздействия химических факторов окружающей среды на здоровье.

