Результат интеллектуальной деятельности: КАТАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ, ПРЕКАТАЛИЗАТОР ДЛЯ КАТАЛИТИЧЕСКОЙ СИСТЕМЫ И СПОСОБ ПОЛУЧЕНИЯ КАТАЛИТИЧЕСКОЙ СИСТЕМЫ
Вид РИД
Изобретение
Область техники
Предлагаемое изобретение относится к области каталитических систем Циглера-Натта, состоящих из соединения переходного металла, активатора (обычно алюминийорганического соединения или его смеси с магнийорганическим соединением) и растворителя, и предназначенных для сополимеризации, олигомеризации и полимеризации олефинов.
Уровень техники
В настоящее время рассматриваются три типа каталитических систем Циглера-Натта: классические, металлоценовые и постметаллоценовые. В классическом (исторически первом) варианте в качестве соединения переходного металла, как правило, применяются простые соединения титана и ванадия (галогениды, алкоксиды), в качестве активаторов простые алкильные соединения алюминия из ряда AlR3-nXn, где R-Me, Et, i-Bu; X-R, Hal; n=0-1, и процесс превращения олефина проводят исключительно в гетерогенном режиме. В системах на основе металлоценов используют соединения металлов 4 группы с ценовыми лигандами (циклопентадиенил, инден, флуорен), в качестве активатора используется только {МеАlO}n, он же полиметилалюмоксан или МАО, а процесс проводят как в гомогенном режиме, так и при использовании иммобилизованных комплексов. В постметалоценовых системах в качестве основного компонента используют координационные соединения переходных металлов 4, 5, 8, 9 и 10 групп с разнообразными органическими лигандами, в качестве активаторов применяют простые алюминийорганические соединения (триметилалюминий, триэтилалюминий, триизобутилалюминий, диэтилалюмнийхлорид, сесквихлорид алюминия (Al2Et3Cl3), МАО, магнийорганические соединения (дибутилмагний, реактив Гриньяра) иди смеси этих активаторов, а процессы проводят как в гомогенном режиме, так и в гетерогенном при иммобилизации комплексов на носитель.
Постметаллоценовый катализ с участием комплексных соединений переходных металлов является одним из активно развивающихся направлений в химии координационных и высокомолекулярных соединений. Это обусловлено, с одной стороны, созданием нового поколения дешевых, высокоэффективных и стереоспецифичных катализаторов полимеризации олефинов, сочетающих в себе достоинства гомогенных и классических гетерогенных катализаторов Циглера-Натта, а, с другой, требованиями рынка к новым типам высокомолекулярных соединений с заданным комплексом полезных свойств.
Такие системы показали не только очень высокую эффективность в катализе, но и позволяют получать линейный полиэтилен с широким разбросом молекулярных масс: от олигомеров до сверхвысокомолекулярного полиэтилена. За последние 10 лет разработаны десятки постметаллоценовых каталитических систем с самыми разнообразными координационными соединениями и, соответственно, разнообразными свойствами получаемых полимеров, сополимеров и олигомеров. Небольшая часть из этих систем отмечена в обзорах [Е.Р. Talsi, Bryliakov K.P., Topics Catalysis, 2013, 56, 914; N.N. Semikolenova, V.A. Zakharov et al, Catalysis Today, 2009, 144, 344; L.R. Sita, Angew. Chem. Inter. Ed., 2009, 48, 2464; H. Bochmann, Organometallics, 2010, 29, 4711; H. Makio, H. Terao et al, Chem. Rev., 2011, 111, 2363; E. Ljmeshek R.L. Batrice et al., Dalton Trans., 2013, 42, 9069; M. Sturzel, S. Mihan et al, Chem. Rev., 2016, 116, 1398; C. Redshaw, Dalton. Trans., 2016, 45, 9018; W. Coates, P.D. Hustad, S. Reinartz, Angew. Chem. Int. Ed., 2002, 41, 2237; H Makio, N. Kashiwa, T. Fujita, Adv. Synth. Catal., 2001, 344, 1]. Среди них особый интерес представляют системы, в состав которых входят феноксииминные (FI) хелатные комплексы переходных металлов 4 группы [W. Coates, P.D. Hustad, S. Reinartz, Angew. Chem. Int. Ed., 2002, 41, 2237; H Makio, N. Kashiwa, T. Fujita, Adv. Synth. Catal., 2001, 344, 1], которые в настоящее время являются наиболее эффективными среди прочих каталитических систем постметаллоценового типа. Следует, однако, отметить, что высокая активность этих катализаторов наблюдается лишь в течение первых 5-10 минут при максимальном времени их работы около 30 минут и только при использовании в качестве активатора МАО - очень дорогого сокатализатора часто с непредсказуемыми свойствами. Это делает большинство процессов с его участием неоправданно затратными.
Как отмечалось выше, классические системы Циглера-Натта изначально являются гетерогенными системами. Постметаллоценовые системы в большинстве случаев являются гомогенными системами и в случае перспективы промышленного применения требуют гетерогенизации или иммобилизации. Обычно их гетерогенизация производится на носители из ряда оксидов (например, окись алюминия или окись кремния) или на полимерные вещества (например, на полистирол или то же полиэтилен). Однако эта операция, как правило, приводит к резкому уменьшению активности системы, но увеличивает ее устойчивость к реакции дезактивации и позволяет получать полимерный продукт определенного гранулометрического состава. Единственное исключение из этой закономерности - нанесение как классических циглеровских систем, так и некоторых металлоценовых и постметаллоценовых на безводный хлорид магния, приготовленный по специальным технологиям, например при кристаллизации из спиртов [K.S. Thushara, R. Mathew et al, J. Phys. Chem. С, 2009, 113, 8556] или при активации постметаллоценовых комплексов с лигандами OO типа (фенолоспирты - производные 2,4-ди-трет-бутил-фенола, диолы типа ТАДДОЛов - производные 1,3-диоксалан-4,5-дикарбоксилатов) общей формулы LMX2, где L - хелатирующий ОО-лиганд, М - металл 4-5 группы, X-Hal, OR, NR2, или аддукты галогенидов этих металлов с n-донорными молекулами типа простых эфиров (например, тетрагидрофуран, диэтиловый эфир) бинарным активатором Et2AlCl/MgBu2, который продуцирует хлорид магния в ходе формирования каталитической системы [V.A. Tuskaev, S.Ch. Gagieva, D.A. Kurmaev et al, Inorg. Chim. Acta, 2015, 425, 285, S.Ch. Gagieva, V.A. Tuskaev, I.V. Fedyanin et al, J. Organomet. Chem. 2016, 828, 89]. В этих двух исключениях применение носителя, в большинстве случаев, приводит к росту каталитической активности систем, причем в рамках постметаллоценового катализа, очень существенному.
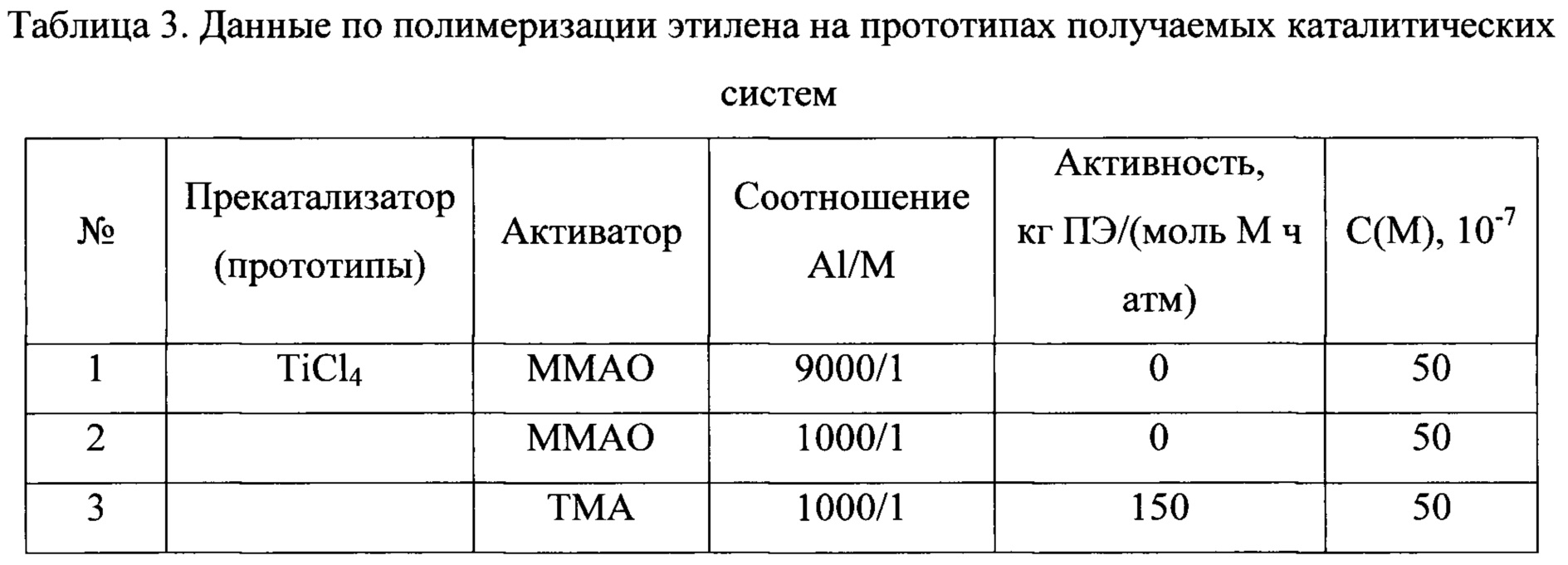
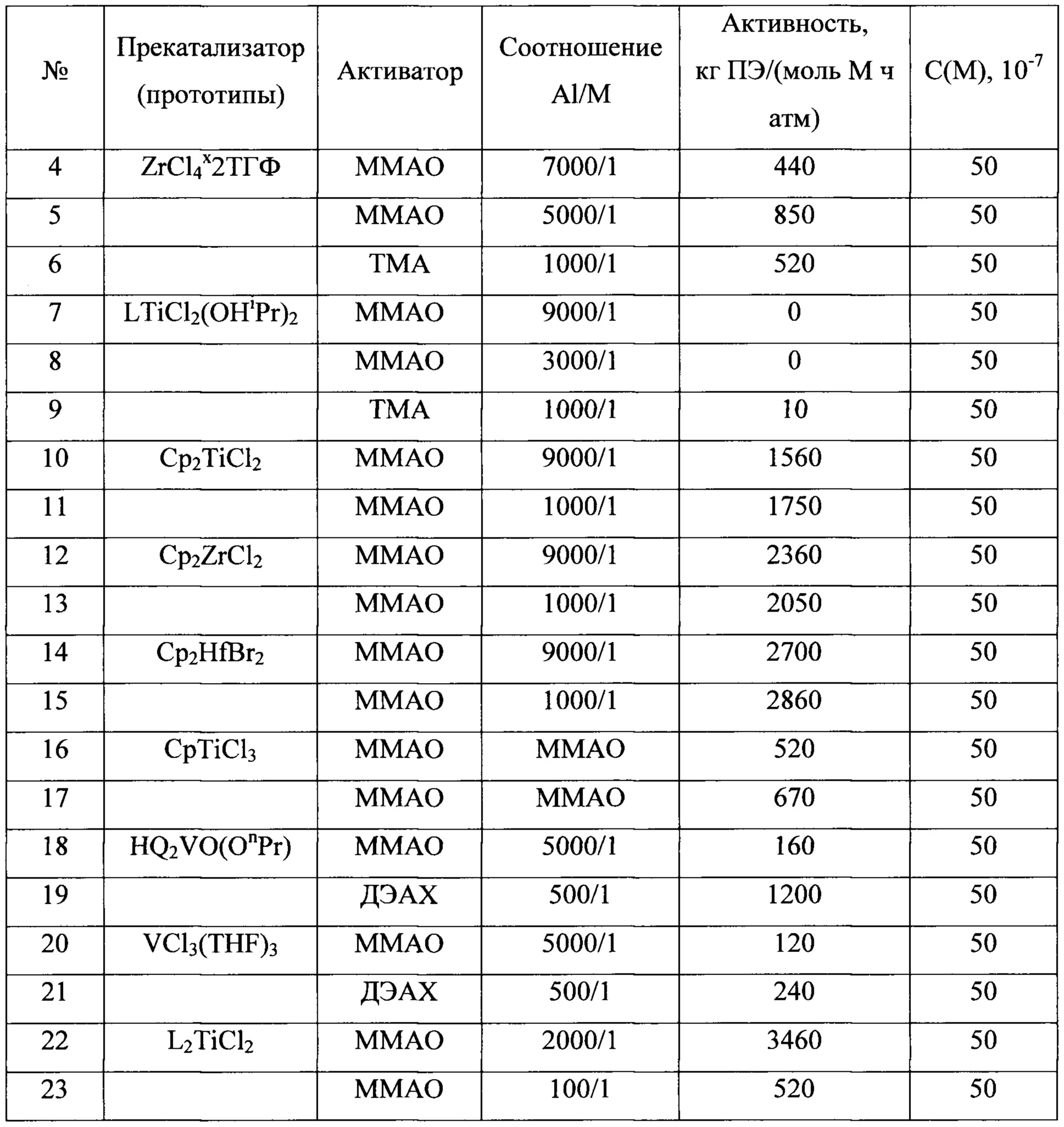
Среди пост-металлоценовых систем наиболее близкими к заявляемой (прототип) являются системы, содержащие прекатализатор и активатор. В качестве прекатализатора используются комплексы титана, например, хлоридные комплексы с фенолоспиртовыми лигандами (схема 3), содержащие побочные продукты его синтеза - галогениды щелочных металлов или магния и образующиеся по реакции 1
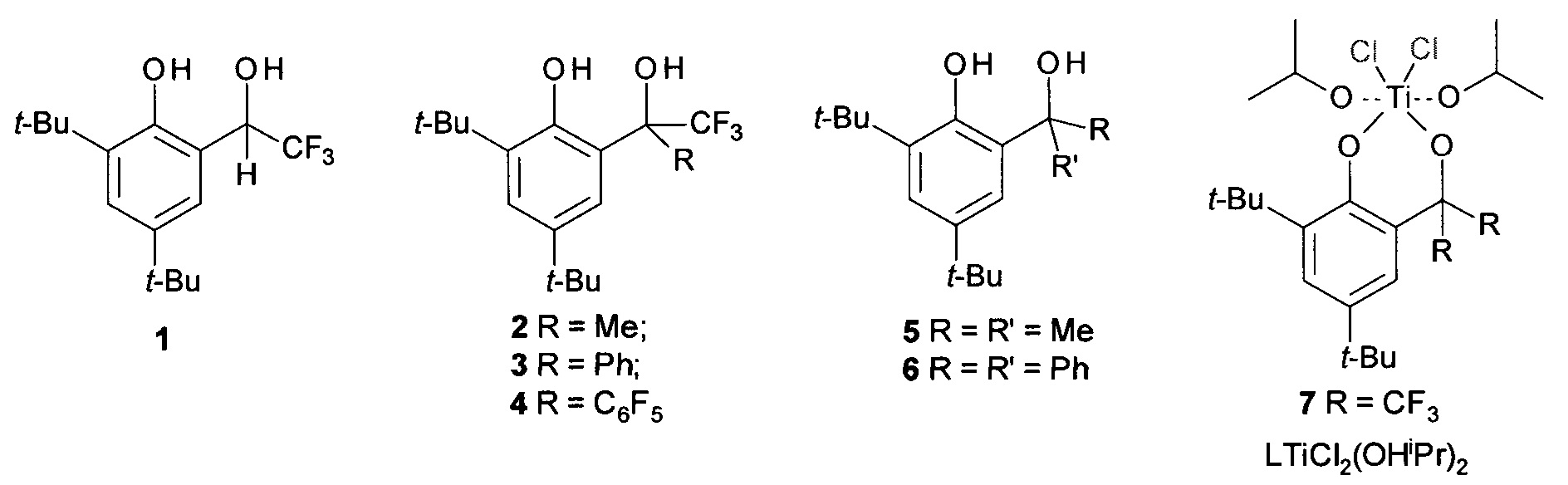
Схема 3. Фенолоспиртовые лиганды и комплексы дихлортитана с их участием.
как результат использования литий- или магнийорганических соединений, а в
качестве активатора - алюминийорганическое соединение состава AlR3-nCln (n=0,1), полиметилалюмоксан (он же МАО), или бинарная смесь AlR2Cl/MgBu2 [M.V.  , S.Ch. Gagieva, V.A. Tuskaev, et al, Russ. Chem. Bull, 2011, 60, 2227; M.V.
, S.Ch. Gagieva, V.A. Tuskaev, et al, Russ. Chem. Bull, 2011, 60, 2227; M.V.  , S.Ch. Gagieva, V.A. Tuskaev V.A., et al, J. Organomet. Chem., 2015, 797, 159; V.A. Tuskaev, S.Ch Gagieva, M.V.
, S.Ch. Gagieva, V.A. Tuskaev V.A., et al, J. Organomet. Chem., 2015, 797, 159; V.A. Tuskaev, S.Ch Gagieva, M.V.  et al, J. Organomet, Chem., 2015, 797, 159].
et al, J. Organomet, Chem., 2015, 797, 159].
Следует особо подчеркнуть, что сами по себе индивидуальные комплексы не формируют каталитических систем даже после их активации AlR3-nXn или МАО. Каталитическими системами они становятся только в присутствии галогенида щелочного металла, или хлорида магния, или при активации комплекса бинарным активатором Et2AlCl/MgBu2, продуцирующим, как отмечалось выше, при формировании каталитической системы хлорид магния. При этом условии, образуются системы, которые катализируют реакцию полимеризации этилена с активностями от 150-200 кг ПЭ (моль Ti. ч. атм)-1 (в присутствии LiCl) до 3000-3300 кг ПЭ (моль Ti ч атм)-1 (в присутствии MgCl2), давая при этом сверхвысокомолекулярный полиэтилен [S.Ch. Gagieva, V.A. Tuskaev, I.V. Fedyanin et al, J. Organomet. Chem. 2016, 828, 89]. Причина этого - реакции вторичного комплексообразования. В работае [L.Yu. Ustynyuk, В.М. Bulychev, J. Organomet. Chem., 2015, 793, 160] показано, что в этом случае комплекс переходного металла вступает в реакцию с побочными продуктами базовой реакции - хлоридами непереходных металлов (например, по уравнениям 1, 2), образуя гетерометаллические комплексы, и именно эти соединения формируют активные каталитические центры.
Однако из-за небольшой растворимости компонентов этой сложной системы в ароматических или несколько хуже в алифатических растворителях она все же остается преимущественно двухфазной. Возможно, именно этим объясняется широкое молекулярно-массовое распределение получаемых полимеров. В качестве недостатков рассмотренных систем можно выделить недостаточную скорость полимеризации, что приводит к низкому итоговому выходу полимера, недостаточная термостабильность, что приводит к резкому падению каталитической активности с повышением температуры реакции. Также все рассматриваемые системы представляют собой гомогенные катализаторы, что усложняет их применение в промышленности.
Раскрытие изобретения
Задачей и техническим результатом заявляемого изобретения является повышение продуктивности (эффективности) каталитической системы за счет увеличения скорости реакции полимеризации олефинов и выхода целевого продукта и одновременное упрощение технологии процесса за счет ее (системы) полной или частичной гетерогенизации.
Данная задача была решена настоящим изобретением.
Поставленная задача решается также другим изобретением - прекатализатором для каталитической системы для полимеризации олефинов.
Прекатализатор, согласно изобретению, представляет собой продукт взаимодействия галоидного алкила и/или арила, а также соединения переходного металла 4-5 групп со щелочными или щелочно-земельными металлами.
В качестве алкильного соединения предпочтительно использовать соединение формулы AlkX, где Alk=C1-С10, а X=Cl, Br, I.
В качестве арильного соединения предпочтительно использовать соединение формулы ArRX, где Ar=С6Н5-, С10Н7-, C14H9-, R=C1-С10, а X=Cl, Br, I.
В качестве галоидного арила предпочтительно использовать α, α, α - трихлорарила, в качестве галоидного алкила - бромоформ.
Для образования прекатализатора используют щелочные или щелочноземельные металлы, взятые из расчета 1-50 моль на 1 ммоль соединения переходного металла.
Прекатализатор, содержащий в качестве упомянутого продукта взаимодействия, продукт реакции алкил хлоридов и\или бромидов и\или α, α, α - трихлорарилов, а также соединения переходного металла 4-5 групп с натрием и\или калием в количествах достаточных для полного связывания хлора или брома в галоидном алкиле и\или ариле.
Прекатализатор, содержащий в качестве упомянутого продукта взаимодействия, продукт реакции алкил хлоридов и\или бромидов и\или α, α, α - трихлорарилов, а также соединения переходного металла 4-5 групп с кальцием или магнием в количествах достаточных для полного связывания хлора или брома в галоидном алкиле и\или ариле.
Прекатализатор, содержащий в качестве упомянутого продукта взаимодействия, продукт реакции алкил хлоридов и\или бромидов и\или α, α, α - трихлорарилов, а в качестве соединения переходного металла галогенид или алкоксид или алкококсогалогенид титана или циркония или гафния или ванадия в различных степенях окисления, или их комплексные или металлорганические соединения, стабилизированные органическими лигандами, с щелочными или щелочноземельными металлами.
Прекатализатор, содержащий в качестве упомянутого продукта взаимодействия продукт реакции в среде абсолютного органического растворителя донорного типа.
Прекатализатор, содержащий в качестве упомянутого продукта взаимодействия продукт реакции, осуществленной в режиме механической активации.
Каталитическая система для полимеризации олефинов, включающая прекатализатор и активатор, согласно изобретению, в качестве прекатализатора содержит продукт взаимодействия галоидного алкила и/или арила, а также соединения переходного металла 4-5 групп со щелочными или щелочно-земельными металлами, а в качестве активатора, по меньшей мере, один активатор, выбранный из группы алкильных, галоидалкильных или оксоалкильных соединений алюминия или их смеси с алкильным соединением магния, соответствующие формуле - AlR3-nXn; {МеАlO}n или AlR2X/Bu2Mg; AlR2X/RMgBr, где R-Me, Et, i-Bu, X-Hal (предпочтительно, Cl), n=0-1.
Каталитическая система предпочтительно содержит 10-9300 ммоль активатора на 1 ммоль прекатализатора, более предпочтительно 1000-6000 ммоль активатора на 1 ммоль прекатализатора.
Поставленная задача решается также другим изобретением - способом получения прекатализатора.
Способ получения прекатализатора, согласно изобретению, включает стадии взаимодействия галоидного алкила и/или арила со щелочным или щелочноземельными металлами в присутствии соединения переходного металла 4-5 групп с получением прекатализатора. Для осуществления способа берут от 0.5 ммоль до 15 ммоль галоидного алкила и/или арила и от 40 ммоль до 50 ммоль щелочного или щелочноземельного металла, при этом щелочные или щелочноземельные металлы, берут из расчета 1-50 моль на 1 ммоль соединения переходного металла. Взаимодействие осуществляют в результате механохимической реакции, проводимой в планетарном реакторе. Продолжительность реакции не более 10 минут, скорость вращения реактора - 800±200 об/мин., при комнатной температуре. Исходные соединения, вещества и растворители для проведения реакции помещаются в реактор в анаэробной атмосфере с использованием перчаточного бокса. После окончания реакции раствор аккуратно переносят из активатора в стакан, эфирный раствор декантируют с осадка, а осадок промывают толуолом (РhСН3) до полного растворения получаемого пре-катализатора. Реакционный сосуд и шары также промывают толуолом (РhСН3). Полученные толуольные растворы объединяют, декантируют от избытка магния (Mg) и выделяют продукт упариванием в вакууме.
Таким образом, образование прекатализатора происходит в процессе одновременного взаимодействия, осуществляемого в органическом растворителе донорного типа (эфирах) в условиях механохимической активации, трех компонентов - галоидного алкила (арила), щелочного (щелочноземельного) металла и соединения переходного метала. В результате этого взаимодействия образуется органический полимерный носитель - поли[(R)карбин] (R=H, алкил, арил), способ получения которого описан ранее [Патент РФ 2466150 «Способ получения поли[(R)карбинов] (R=H, алкил, арил)», Сизов А.И., Звукова Т.М., Кравченко О.В., Булычев Б.М., Гулиш О.К.; Патент РФ 2575711 «Способ получения легированных поли {(R)карбинов (R=H, алкил, арил), Звукова Т.М., Сизов А.И., Булычев Б.М., Гулиш О.К.], в качестве побочного продукта выделяется неорганический носитель - бромид (хлорид) щелочного или щелочноземельного металла. В процессе синтеза происходит активация соединения переходного металла и встраивание его и галогенида щелочного или щелочноземельного металла в пористую структуру полимерного носителя.
Поставленная задача решается также другим изобретением - способом получения каталитической системы.
Способ получения каталитической системы, согласно изобретению, включает активацию прекатализатора алкильным, галоидалкильным или оксоалкильным соединением алюминия или его смесью с алкильным соединением магния.
За счет упомянутых признаков достигается следующий технический эффект: увеличивается скорость реакции полимеризации и выход полимера.
Осуществление изобретения
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С.
Изобретение иллюстрируется следующими примерами.
Примеры получения прекатализаторов.
Пример 1. Получение прекатализатора Ti-1.
В реакционный сосуд планетарной мельницы АГО-2У в атмосфере азота помещают раствор, содержащий 3.05 г бромоформа (12 мммол СНВr3), 0.13 мл TiCl4 (1.2 ммоль) и 40 мл сухого перегнанного эфира (Et2O). К раствору добавляют 1.0 г магния (40 ммоль) в виде мелкой стружки. Реакцию проводят в течение 9 минут при температуре 20°С. Масса полученного коричневого порошка - 107 мг. По данным элементного анализа осадок содержит 12.5% Mg и 6.7% Ti. Соотношение Mg/Ti=4.
Пример 2. Получение прекатализатора Ti-2.
Пример 2 отличается от примера 1 использованием в качестве исходного вещества α, α, α - трихлортолуола (РhCCl3). В реактор мельницы загружают 2,4 г РhCCl3, 0.8 г магния, 0.13 мл TiCl4 и 40 мл сухого перегнанного эфира (Et2O). Реакцию проводят в течение 9 мин при 20°С. Масса полученного коричневого порошка - 314 мг. По данным элементного анализа осадок содержит 10.5% Mg и 5.9% Ti. Соотношение Mg/Ti=3.5.
Пример 3. Получение прекатализатора Zr-3.
Пример 3 отличается от примера 1 использованием в качестве соединения переходного металла ZrCl4x2TГФ. В барабан активатора загружали 3.08 г бромоформа (СНВr3), 1.0 г магния, 0.63 г ZrCl4x2TГФ и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводят в течение 9 мин при 20°С. Масса полученного коричневого порошка - 115 мг. По данным элементного анализа осадок содержит 10.5% Mg и 6.5% Zr. Соотношение Mg/Zr=6.
Пример 4. Получение прекатализатора Ti-4.
Пример 4 отличается от примера 2 использованием в качестве источника переходного металла комплекса 2,4-Ди-трет-бутил-6-(1,1,1,3,3,3-гексафторо-2-гидроксипропан-2-ил)фенолята дихлорида титана(+4) (LTiCl2(OHiPr)2) В барабан активатора загружали 2,5 г РhССl3, 1.0 г магния, 410 мг LTiCl2(OHiPr)2 и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводят в течение 9 мин при 20°С. Масса полученного коричневого порошка - 153 мг. По данным элементного анализа осадок содержит 9.5% Mg и 1.2% Ti. Соотношение Mg/Ti=16.
Пример 5. Получение прекатализатора Ti-5.
Пример 5 отличается от примера 4 использованием в качестве соединения переходного металла Ср2ТiCl2, а также одновременным использованием СНВr3 и PhCCl3. В планетарный реактор в атмосфере азота помещают раствор, содержащий 1.25 г бромоформа (СНВr3), 0.98 г α, α, α - трихлортолуола (РhССl3), 0.3 г Ср2TiCl2 и 40 мл сухого перегнанного эфира (Et2O). К раствору добавляют 1.0 г магния (Mg) в виде мелкой стружки. Масса полученного коричневого порошка - 290 мг. По данным элементного анализа осадок содержит 14.8% Mg и 7.3% Ti. Соотношение Mg/Ti=4.
Пример 6. Получение прекатализатора Zr-6.
Пример 6 отличается от примера 5 использованием в качестве исходного вещества Cp2ZrCl2. В барабан активатора загружали 1.25 г бромоформа (СНВr3), 0.98 г α, α, α - трихлортолуола (РhССl3), 1.0 г магния, 0.33 г Cp2ZrCl2 и 40 мл сухого перегнанного эфира (Et2O). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 306 мг. По данным элементного анализа осадок содержит 11.8% Mg и 5.2% Zr. Соотношение Mg/Zr=9.
Пример 7. Получение прекатализатора Hf-7.
Пример 7 отличается от примера 5 использованием в качестве исходного вещества Ср2HfBr2. В барабан активатора загружали 1.25 г бромоформа (СНВr3), 0.98 г α, α, α - трихлортолуола (РhССl3), 1.0 г магния, 0.58 г Ср2HfBr2 и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 332 мг. По данным элементного анализа осадок содержит 13.1% Mg и 8.4% Hf. Соотношение Mg/Hf=12.
Пример 8. Получение прекатализатора Ti-8.
Пример 8 отличатся от примера 4 использованием, помимо РhССl3-СНВr3. В планетарный реактор помещают раствор, содержащий 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhССl3), 407 мг (LTiCl2(OHiPr)2) и 40 мл сухого перегнанного эфира (Et2O). К раствору добавляют 1.0 г магния (Mg) в виде мелкой стружки. Масса полученного коричневого порошка - 188 мг. По данным элементного анализа осадок содержит 15.1% Mg и 0.6% Ti. Соотношение Mg/Ti=50.
Пример 9. Получение прекатализатора Ti-9.
Пример 9 отличается от примера 1 использованием в качестве исходного вещества CpTiCl3. В барабан активатора загружали 3.05 г бромоформа (СНВr3), 1.0 г магния, 0.25 г CpTiCl3 и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 208 мг. По данным элементного анализа осадок содержит 8.5% Mg и 8.7% Ti. Соотношение Mg/Ti=2.
Пример 10. Получение прекатализатора Ti-10.
Пример 10 отличается от примера 8 использованием в качестве исходного вещества феноксиимина титана L2TiCl2, где L=ОН-С6Н4-СН=N-Ph (2-[фенилиминометил]фенол). В барабан активатора загружали 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhССl3, 1.0 г магния, 610 мг феноксиимина титана и 40 мл сухого перегнанного эфира (Et2O). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 197 мг. По данным элементного анализа осадок содержит 12.5% Mg и 1.3% Ti. Соотношение Mg/Ti=19.
Пример 11. Получение прекатализатора Zr-11.
Пример 11 отличается от примера 6 использованием в качестве растворителя - тетрагидрофурана. В барабан активатора загружали 3.05 г бромоформа (СНВr3), 1.0 г магния, 0.35 г Cp2ZrCl2 и 40 мл перегнанного тетрагидрофурана (THF). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 243 мг. По данным элементного анализа осадок содержит 12.1% Mg и 7.1% Zr. Соотношение Mg/Zr=6.5.
Пример 12. Получение прекатализатора Zr-12.
Пример 12 отличается от примера 11 использованием в качестве исходного вещества α, α, α - трихлортолуола (РhССl3). В барабан активатора загружали 2,4 г РhССl3, 1.6 г магния, 0.35 г Cp2ZrCl2 и 40 мл перегнанного тетрагидрофурана (THF). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 365 мг. По данным элементного анализа осадок содержит 10.1% Mg и 5.1% Zr. Соотношение Mg/Zr=7.5.
Пример 13. Получение прекатализатора Ti-13.
Пример 13 отличается от примера 8 использованием в качестве восстановителя металлического кальция (Са). В барабан активатора загружали 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhССl3), 1.8 г кальция, 407 мг (LTiCl2(OHiPr)2). и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводили в течение 12 мин при 20°С. Масса полученного коричневого порошка - 118 мг. По данным элементного анализа осадок содержит 12.5% Са и 14.9% Ti. Соотношение Ca/Ti=1.
Пример 14. Получение прекатализатора Ti-14.
Пример 14 отличается от примера 13 использованием в качестве восстановителя смеси металлических натрия (Na) и калия (K). В барабан активатора загружали 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhССl3), 0.73 г калия и 0.43 г натрия, 407 мг (LTiCl2(OHiPr)2). и 40 мл сухого перегнанного эфира (Et2O). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 183 мг. По данным элементного анализа осадок содержит 11.5% Na/K и 14.7% Ti. Соотношение Na-K/Ti=3.
Пример 15. Получение прекатализатора V-15.
Пример 15 отличается от примера 8 использованием в качестве исходного вещества 8-оксихинолинат ванадия (+5) НQ2VО(ОnРr). В барабан активатора загружали 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhCСl3), 1.0 г магния, 142 мг HQ2VO(OnPr) и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 97 мг. По данным элементного анализа осадок содержит 10.8% Mg и 5.9% V. Соотношение Mg/V=4.
Пример 16. Получение прекатализатора V-16.
Пример 16 отличается от примера 15 использованием в качестве исходного вещества оксихинолинат ванадия (+5) VCl3(THF)3. В барабан активатора загружали 2.1 г бромоформа (СНВr3), 0.72 г α, α, α - трихлортолуола (РhССl3), 1.0 г магния, 115 мг HQ2VO(OnPr) и 40 мл сухого перегнанного эфира (Еt2О). Реакцию проводили в течение 9 мин при 20°С. Масса полученного коричневого порошка - 123 мг. По данным элементного анализа осадок содержит 12.1% Mg и 6.8% V. Соотношение Mg/V=3.5.
Примеры превращения прекатализаторов в каталитические системы и их применение в полимеризации олефинов
Полимеризация этилена.
Пример 17.
Полимеризацию этилена осуществляли в толуоле в стальном реакторе объемом 300 см3 при давлении этилена 0.7 атм. Предварительно реактор откачивали 1 ч при 90°С, затем охлаждали до температуры 30°С, добавляли при перемешивании 100 мл толуола, 4.4 мл (4.68⋅10-3 моль) 7%-ного раствора полиметилалюмоксана (МАО) в толуоле и этилен. Реакцию полимеризацию начинали через 15-20 минут после окончания подготовительных операций, разбивая в реакторе стеклянную ампулу, содержащую 5.4 мг прекатализатора Ti-8 (7.8⋅10-7 моль Ti) в 1 мл толуола, полученного согласно примеру 8 (соотношение Al/Ti=6000). Полимеризацию прекращали введением в содержимое реактора 10%-ного раствора НСl в этиловом спирте. Полимерный продукт отфильтровывали, промывали спиртом и водой и высушивали в вакууме при 50-60°С до постоянного веса. Выход 3.54 г. Активность=12.97 тонн ПЭ/(моль Ti час там). Температура плавления 141°С, ΔHпл, 225 Дж/г. Mw=980000, Mw/Mn=6.5. Степень кристалличности 73%. Аналогично проводили полимеризацию для прекатализаторов примеры 1-15, данные по активности и по свойствам образующихся полимеров приведены в таблице 1, 2.
Пример 18.
Пример 18 отличается от примера 17 использованием 2.2 мл (2.34⋅10-3 моль) 7%-ого раствора полиметилалюмоксана (МАО) в толуоле. Соотношение Al/Ti составляет 3000. Выход 6.54 г. Активность=23.96 тонн ПЭ/(моль Ti час там). Температура плавления 145°С, ΔHпл, 243 Дж/г. Mw=1100000, Mw/Mn=3.4. Степень кристалличности 75%.
Пример 19.
Пример 19 отличается от примера 17 использованием 0.73 мл (0.78⋅10-3 моль) 7%-ого раствора полиметилалюмоксана (МАО) в толуоле. Соотношение Al/Ti составляет 1000. Выход 2.9 г. Активность=10.62 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 209 Дж/г. Mw=680000, Mw/Mn=7.3. Степень кристалличности 64%.
Пример 19.
Пример 19 отличается от примера 17 использованием 0.73 мл (0.78⋅10-3 моль) 7%-ого раствора полиметилалюмоксана (МАО) в толуоле. Соотношение Al/Ti составляет 1000. Выход 2.9 г. Активность=10.62 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 209 Дж/г. Mw=680000, Mw/Mn=7.3. Степень кристалличности 64%.
Пример 20.
Пример 20 отличается от примера 17 использованием 4.7 мл (4.68⋅10-3 моль) 1М-ого раствора триметилалюминия (AlMe3) в гексане. Соотношение Al/Ti составляет 6000. Выход: 0.23 г. Активность=0.84 тонн ПЭ/(моль Ti час там). Температура плавления 137°С, ΔHпл, 239 Дж/г. Mw=750000, Mw/Mn=3.1. Степень кристалличности 72%.
Пример 21.
Пример 21 отличается от примера 18 использованием 2.3 мл (2.34⋅10-3 моль) 1М-ого раствора триметилалюминия (AlMe3) в гексане. Соотношение Al/Ti составляет 3000. Выход 0.15 г. Активность=0.55 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 185 Дж/г. Mw=650000, Mw/Mn=3.8. Степень кристалличности 71%.
Пример 22.
Пример 22 отличается от примера 19 использованием 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора триметилалюминия (AlMe3) в гексане. Соотношение Al/Ti составляет 1000. Выход 0.13 г. Активность=0.48 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 215 Дж/г. Mw=560000, Mw/Mn=5.4. Степень кристалличности 69%.
Пример 23.
Пример 23 отличается от примера 17 использованием 4.7 мл (4.68⋅10-3 моль) 1М-ого раствора триэтилалюминия (AlЕt3) в гексане. Соотношение Al/Ti составляет 6000. Выход: 0.27 г. Активность=0.99 тонн ПЭ/(моль Ti час там). Температура плавления 143°С, ΔHпл, 235 Дж/г. Mw=1250000, Mw/Mn=3.1. Степень кристалличности 77%.
Пример 24.
Пример 24 отличается от примера 18 использованием 2.3 мл (2.34⋅10-3 моль) 1М-ого раствора триэтилалюминия (AlEt3) в гексане. Соотношение Al/Ti составляет 3000. Выход 0.22 г. Активность=0.8 тонн ПЭ/(моль Ti час там). Температура плавления 136°С, ΔHпл, 192 Дж/г. Mw=570000, Mw/Mn=5.8. Степень кристалличности 59%.
Пример 25.
Пример 25 отличается от примера 19 использованием 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора триэтилалюминия (AlEt3) в гексане. Соотношение Al/Ti составляет 1000. Выход 0.12 г. Активность=0.44 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 209 Дж/г. Mw=680000, Mw/Mn=7.3. Степень кристалличности 64%.
Пример 26.
Пример 26 отличается от примера 17 использованием 4.7 мл (4.68⋅10-3 моль) 1М-ого раствора триизобутилалюминия (AltBu3) в гексане. Соотношение Al/Ti составляет 6000. Выход: 0.39 г. Активность=1.4 тонн ПЭ/(моль Ti час там). Температура плавления 141°С, ΔHпл, 212 Дж/г. Mw=1060000, Mw/Mn=4.4. Степень кристалличности 75%.
Пример 27.
Пример 27 отличается от примера 18 использованием 2.3 мл (2.34⋅10-3 моль) 1М-ого раствора триизобутилалюминия (АltBu3) в гексане. Соотношение Al/Ti составляет 3000. Выход 0.35 г. Активность=1.28 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 175 Дж/г. Mw=630000, Mw/Mn=3.9. Степень кристалличности 71%.
Пример 28.
Пример 28 отличается от примера 19 использованием 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора триизобутилалюминия (AltBu3) в гексане. Соотношение Al/Ti составляет 1000. Выход 0.27 г. Активность=0.44 тонн ПЭ/(моль Ti час там). Активность=0.9 тонн ПЭ/(моль Ti час там). Температура плавления 142°С, ΔHпл, 224 Дж/г. Mw=960000, Mw/Mn=2.5. Степень кристалличности 69%.
Пример 29.
Пример 29 отличается от примера 17 использованием 4.7 мл (4.68⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Et2AlCl) в толуоле. Соотношение Al/Ti составляет 6000. Выход: 0.14 г. Активность=0.5 тонн ПЭ/(моль Ti час там). Температура плавления 144°С, ΔHпл, 232 Дж/г. Mw=1320000, Mw/Mn=2.8. Степень кристалличности 73%.
Пример 30.
Пример 30 отличается от примера 18 использованием 2.3 мл (2.34⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Et2AlCl) в толуоле. Соотношение Al/Ti составляет 3000. Выход 0.25 г. Активность=0.9 тонн ПЭ/(моль Ti час там). Температура плавления 143°С, ΔHпл, 253 Дж/г. Mw=990000, Mw/Mn=3.3. Степень кристалличности 75%.
Пример 31.
Пример 31 отличается от примера 19 использованием 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Et2AlCl) в толуоле. Соотношение Al/Ti составляет 1000. Выход 0.23 г. Активность=0.84 тонн ПЭ/(моль Ti час там). Температура плавления 137°С, ΔHпл, 173 Дж/г. Mw=780000, Mw/Mn=6.1. Степень кристалличности 64%.
Пример 32.
Пример 32 отличается от примера 17 использованием 2.35 мл (4.68⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (El3Al2Cl3) в толуоле. Соотношение Al/Ti составляет 6000. Выход: 0.29 г. Активность=1.06 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 186 Дж/г. Mw=590000, Mw/Mn=7.4. Степень кристалличности 55%.
Пример 33.
Пример 33 отличается от примера 18 использованием 1.15 мл (2.34⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (Еt3Al2О3) в толуоле. Соотношение Al/Ti составляет 3000. Выход 0.46 г. Активность=1.68 тонн ПЭ/(моль Ti час там). Температура плавления 138°С, ΔHпл, 175 Дж/г. Mw=750000, Mw/Mn=10.4. Степень кристалличности 62%.
Пример 34.
Пример 34 отличается от примера 19 использованием 0.4 мл (0.78⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (Et3Al2Cl3) в толуоле. Соотношение Al/Ti составляет 1000. Выход 0.39 г. Активность=1.4 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 194 Дж/г. Mw=690000, Mw/Mn=7.9. Степень кристалличности 64%.
Пример 35.
Пример 35 отличается от примера 29 использованием помимо 4.7 мл (4.68⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Еt2АlCl) в толуоле - 1.56 мл (1.56⋅10-3 моль) 1М-ого раствора дибутилмагния (Bu2Mg) в гексане. Соотношение Al/Ti составляет Al/Mg/Ti составляет 6000/2000/1. Выход: 1.6 г. Активность=5.86 тонн ПЭ/(моль Ti час там). Температура плавления 141°С, ΔHпл, 223 Дж/г. Mw=890000, Mw/Mn=3.1. Степень кристалличности 76%.
Пример 36.
Пример 36 отличается от примера 30 использованием помимо 2.3 мл (2.34⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Et2AlCl) в толуоле - 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора дибутилмагния (Bu2Mg) в гексане. Соотношение Al/Ti составляет Al/Mg/Ti составляет 3000/1000/1. Выход 1.06 г. Активность=3.88 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 235 Дж/г. Mw=820000, Mw/Mn=5.4. Степень кристалличности 73%.
Пример 37.
Пример 37 отличается от примера 31 использованием помимо 0.78 мл (0.78⋅10-3 моль) 1М-ого раствора диэтилалюминийхлорида (Et2AlCl) в толуоле - 0.26 мл (0.26⋅10-3 моль) 1М-ого раствора дибутилмагния (Bu2Mg) в гексане. Соотношение Al/Ti составляет Al/Mg/Ti составляет 1000/330/1. Выход 0.78 г. Активность=2.85 тонн ПЭ/(моль Ti час там). Температура плавления 137°С, ΔHпл, 165 Дж/г. Mw=520000, Mw/Mn=7.3. Степень кристалличности 59%.
Пример 38.
Пример 38 отличается от примера 35 использованием 2.35 мл (4.68⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (Еt3Al2Cl3) в толуоле. Выход: 1.85 г. Активность=6.8 тонн ПЭ/(моль Ti час там). Температура плавления 144°С, ΔHпл, 236 Дж/г. Mw=1120000, Mw/Mn=2.9. Степень кристалличности 79%.
Пример 39.
Пример 39 отличается от примера 36 использованием 1.15 мл (2.34⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (Еt3Al2Cl3) в толуоле. Выход 1.56 г. Активность=5.7 тонн ПЭ/(моль Ti час там). Температура плавления 140°С, ΔHпл, 202 Дж/г. Mw=920000, Mw/Mn=3.9. Степень кристалличности 72%.
Пример 40.
Пример 40 отличается от примера 37 использованием 0.4 мл (0.78⋅10-3 моль) 1М-ого раствора этилалюминийсесквихлорида (Et3Al2Cl3) в толуоле. Выход 0.98 г. Активность=3.6 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 192 Дж/г. Mw=860000, Mw/Mn=6.1. Степень кристалличности 61%.
Пример 41.
Пример 41 отличается от примера 35 использованием вместо 1М-ого раствора дибутилмагния (Bu2Mg) в гексане - 1М-ый раствор этилмагнийбромида (EtMgBr) в диэтиловом эфире (Et2O) - 1.56 мл (1.56⋅10-3 моль). Соотношение Al/Ti составляет Al/Mg/Ti составляет 6000/2000/1. Выход: 1.35 г. Активность=4.94 тонн ПЭ/(моль Ti час там). Температура плавления 140°С, ΔHпл, 216 Дж/г. Mw=860000, Mw/Mn=3.7. Степень кристалличности 72%.
Пример 42.
Пример 42 отличается от примера 36 использованием вместо 1М-ого раствора дибутилмагния (Bu2Mg) в гексане - 1М-ый раствор этилмагнийбромида (EtMgBr) в диэтиловом эфире (Et2O) - 0.78 мл (0.78⋅10-3 моль). Соотношение Al/Ti составляет Al/Mg/Ti составляет 3000/1000/1. Выход 1.03 г. Активность=3.77 тонн ПЭ/(моль Ti час там). Температура плавления 139°С, ΔHпл, 220 Дж/г. Mw=810000, Mw/Mn=5.7. Степень кристалличности 71%.
Пример 43.
Пример 43 отличается от примера 37 использованием вместо 1М-ого раствора дибутилмагния (Bu2Mg) в гексане - 1М-ый раствор этилмагнийбромида (EtMgBr) в диэтиловом эфире (Et2O) - 0.26 мл (0.26⋅10-3 моль). Соотношение Al/Ti составляет Al/Mg/Ti составляет 1000/330/1. Выход 0.34 г. Активность=1.2 тонн ПЭ/(моль Ti час там). Температура плавления 137°С, ΔHпл, 171 Дж/г. Mw=4500000, Mw/Mn=5.2. Степень кристалличности 53%.
Полимеризация пропилена в «массе».
Пример 44.
Полимеризацию пропилена проводили в интервале температур 40-70°С в стальном реакторе с мешалкой в режиме полного заполнения реактора жидким мономером при давлении, превышающем насыщенную упругость паров пропилена, соответствующем данной температуре. Перед проведением эксперимента стальной реактор (объем 200 мл) вакуумировали в течение 1 ч при температуре опыта, несколько раз промывали пропиленом, затем понижали температуру до 10°С и заполняли жидким пропиленом (10.89 моль/л). После достижения рабочей температуры (50°С) включали мешалку, вводили 4.4 мл (4.68⋅10-3 моль) 7%-ого раствора МАО и разбивали стеклянную ампулу стеклянную ампулу, содержащую 5.4 мг прекатализатора Ti-8 (7.8⋅10-3 моль Ti), полученного согласно примеру 8 (соотношение Al/Ti=6000), размещенную в нижней части реактора. Скорость полимеризации определяли по количеству пропилена, который вводили градуированным шприцом для поддержания постоянного давления в реакторе в ходе опыта. После завершения времени полимеризации (1 ч) давление в аппарате стравливали до атмосферного, реактор открывали, в реакционную смесь добавляли этиловый спирт, содержащий 10% раствор НСl. Высадившийся полимер отфильтровывали, промывали водой, сушили при комнатной температуре, затем - в вакуумном сушильном шкафу при температуре 80°С до постоянной массы.
Выход 30 г. Активность=2.56 тонн ПП/(моль Ti час атм). 13С NMR (mmmm 35.5%, mmmr 6.9%, rmmr 3.4%, mmrr 6.6%, mmrm+rmmr 14.2%, rmrm 5.0%, rrrr 10.2%, mrrr 9.0, mrrm 9.2%), Mw=900900 г/моль, Mw/Mn=10.1. Механические свойства: модуль упругости 3.9 МПа, εp, % 1800, σт, МПа 6.4%. Температура плавления 154°С, ΔHпл, 37 Дж/г. Mw=1180000, Mw/Mn=4,8. Степень кристалличности 20%.
Полимеризация пропилена в толуоле.
Пример 45.
При изучении каталитических реакций полимеризации пропилена применяли толуол марки «осч», толуол «осч». Растворители очищали от возможных примесей перегонкой над натриевой пылью дважды. Аргон и пропилен («ос.ч.») сушили пропусканием газов через колонку, заполненную молекулярными ситами 5  . Все операции по сборке аппаратуры, порядку подготовки и способам введения в реактор тестируемых комплексов и газообразного пропилена, а также измерению кинетики полимеризации аналогичны описанным ранее в примере 40. После полного растворения пропилена в толуоле и достижения рабочей температуры (50°С) в реактор последовательно вводили 4.4 мл (4.68⋅10-3 моль) 7%-ого раствора МАО и 5.4 мг прекатализатора Ti-8 (7.8⋅10-7 моль Ti), полученного согласно примеру 8 (соотношение Al/Ti=6000). После прекращения времени полимеризации (1 ч) реакцию останавливали обработкой содержимого 10%-ным раствором НСl в этаноле. Полимерный продукт отфильтровывали, промывали этанолом и водой и сушили в вакууме при 50-60°С до постоянной массы. Выход 0.25 г. Активность=0.9 тонн ПП/(моль Ti час там).
. Все операции по сборке аппаратуры, порядку подготовки и способам введения в реактор тестируемых комплексов и газообразного пропилена, а также измерению кинетики полимеризации аналогичны описанным ранее в примере 40. После полного растворения пропилена в толуоле и достижения рабочей температуры (50°С) в реактор последовательно вводили 4.4 мл (4.68⋅10-3 моль) 7%-ого раствора МАО и 5.4 мг прекатализатора Ti-8 (7.8⋅10-7 моль Ti), полученного согласно примеру 8 (соотношение Al/Ti=6000). После прекращения времени полимеризации (1 ч) реакцию останавливали обработкой содержимого 10%-ным раствором НСl в этаноле. Полимерный продукт отфильтровывали, промывали этанолом и водой и сушили в вакууме при 50-60°С до постоянной массы. Выход 0.25 г. Активность=0.9 тонн ПП/(моль Ti час там).
13С NMR (mmmm 21.1%, mmmr 3.6%, rmmr 9.6%, mmrr 9.9%, mmrm+rmmr 15.6%, rmrm 6.2%, rrrr 14.0%, mrrr 10.0, mrrm 4.0%). Температура плавления 150°С, ΔHпл, 22 Дж/г. Mw=311000, Mw/Mn=13,2. Степень кристалличности 32%.
Сополимеризация пропилена и этилена.
Пример 46.
Сополимеризацию пропилена и этилена также проводили в режиме полного заполнения реактора жидким пропиленом. Концентрацию этилена поддерживали постоянной в ходе опыта (соотношение этилен-пропилен=60-40). Все операции по сборке аппаратуры, порядку подготовки и способам введения в реактор тестируемых комплексов и газообразного пропилена, а также измерению кинетики полимеризации аналогичны описанным ранее в примере 40. После полного растворения смеси этилена и пропилена в толуоле и достижения рабочей температуры (50°С) в реактор последовательно вводили 4.4 мл (4.68⋅10-3 моль) 7%-ого раствора МАО и 5.4 мг прекатализатора Ti-8 (7.8⋅10-7 моль Ti), полученного согласно примеру 8. Полимерный продукт отфильтровывали, промывали этанолом и водой и сушили в вакууме при 50-60°С до постоянной массы. Выход 1.5 г. Активность=5.5 тонн СПЭП/(моль Ti час там).
Mw=560000, Mw/Mn=4.8. Степень кристалличности 12%. Степень включения пропилена - 15%.
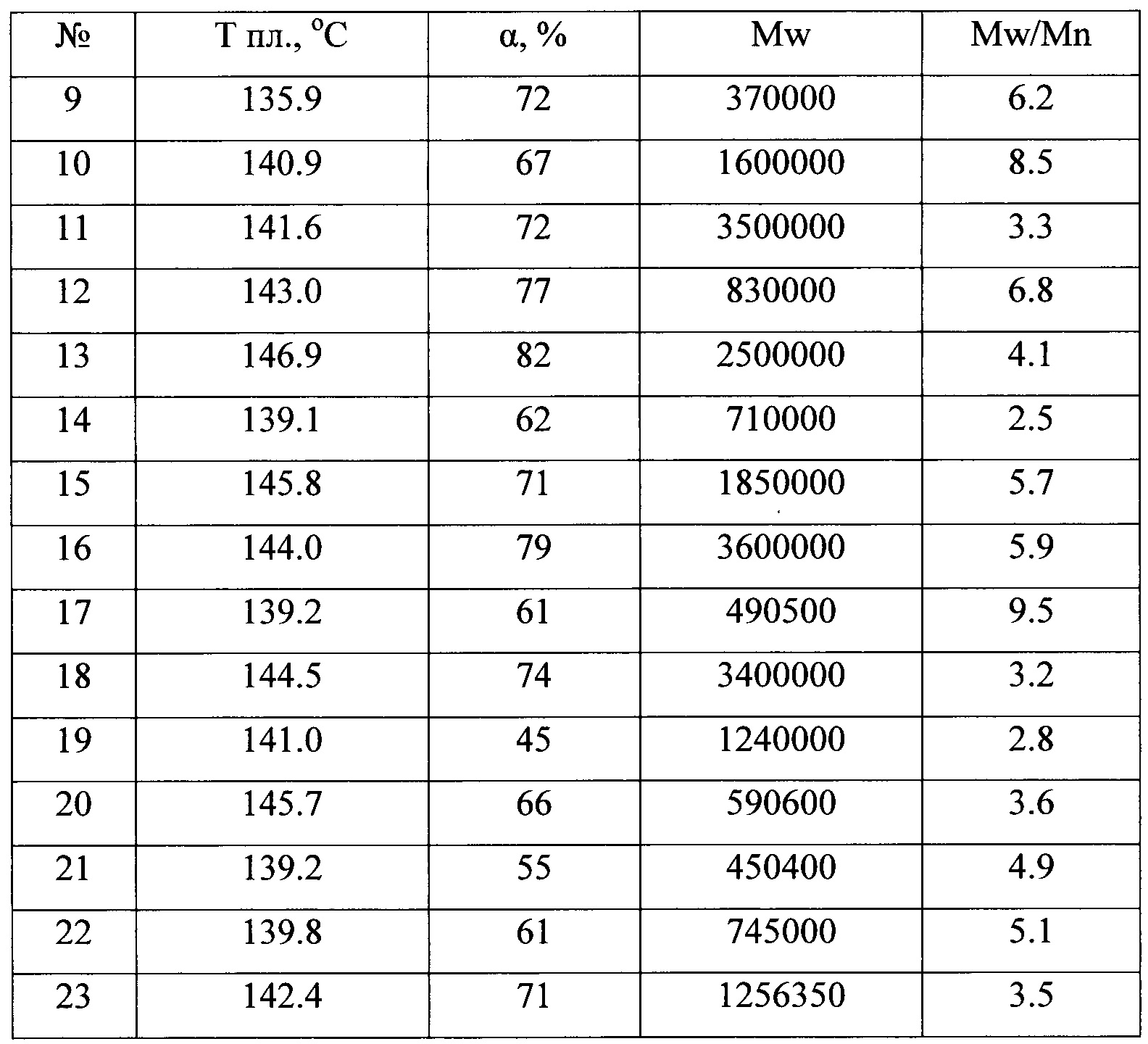
В таблице 1 приведены каталитические характеристики для каталитических систем, полученных согласно примерам 1-15 в реакции полимеризации этилена. Полимеризация была проведена согласно примерам 16-42. В таблице 2 приведены характеристики полученных полиолефинов. Как видно из таблицы, образующийся полиэтилен может иметь температуру плавления от 136 до 147°С, высокий молекулярный вес от 350000 до 3900000, молекулярно-массовое распределение от 2.5 до 14.
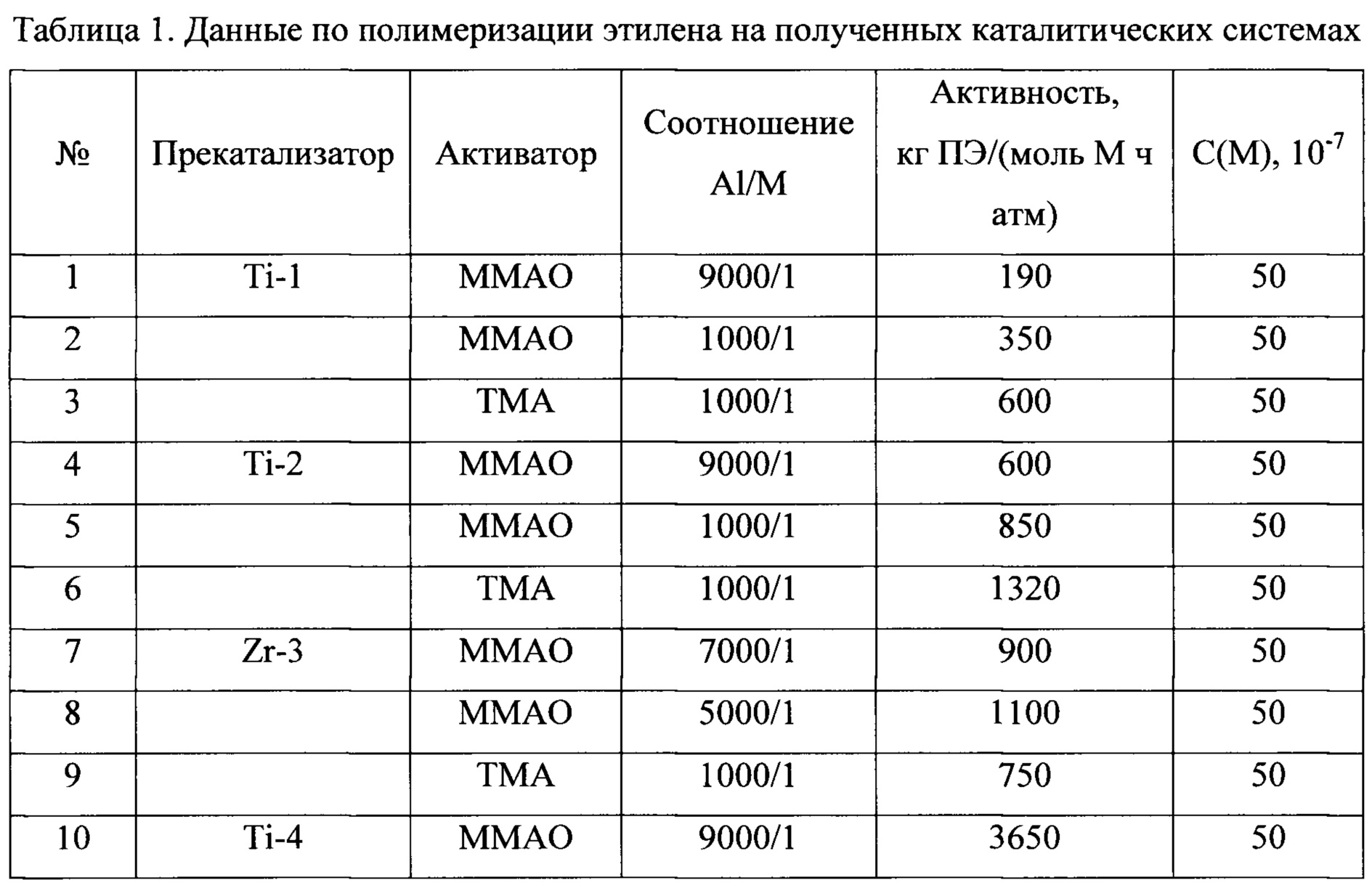
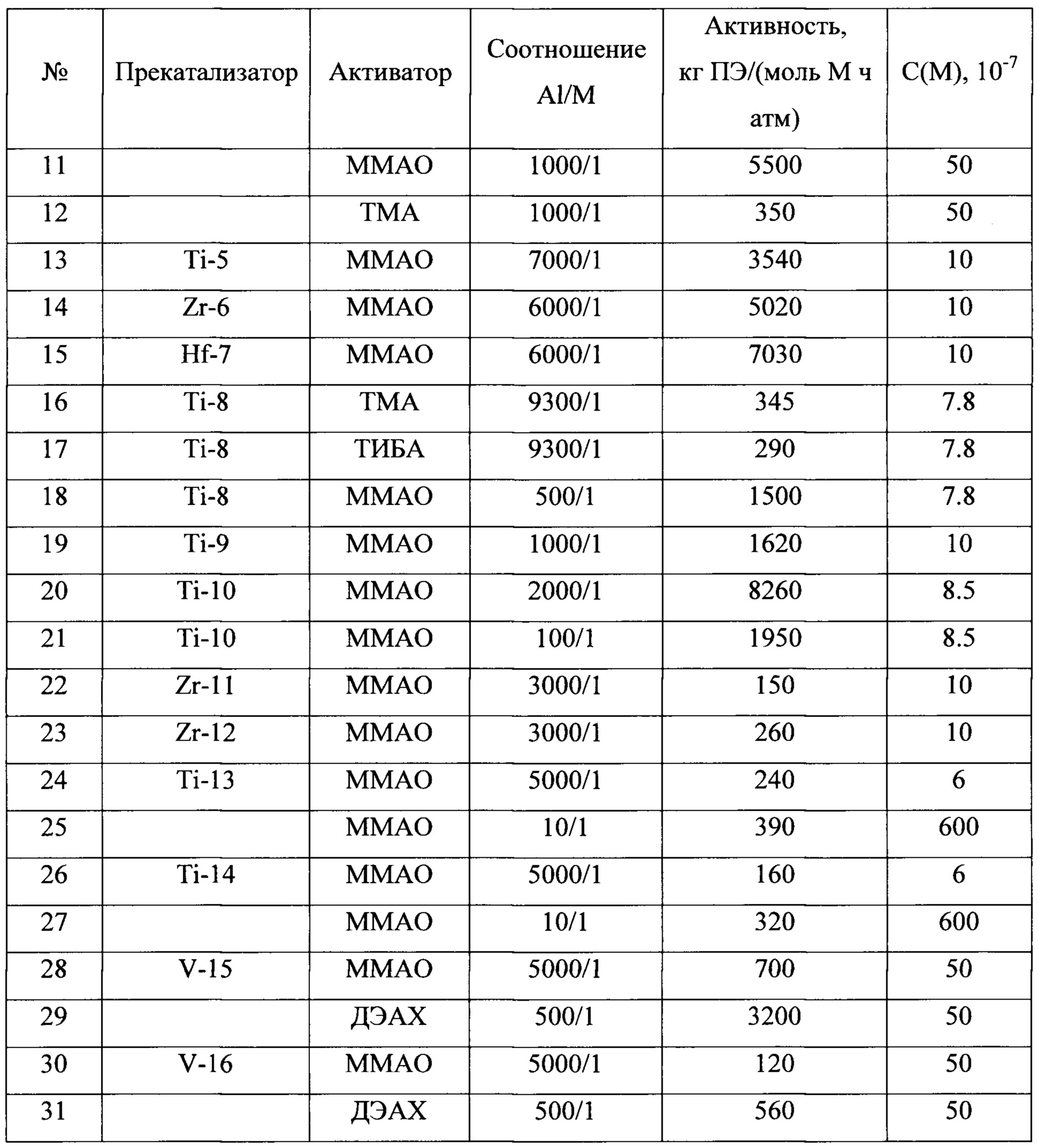
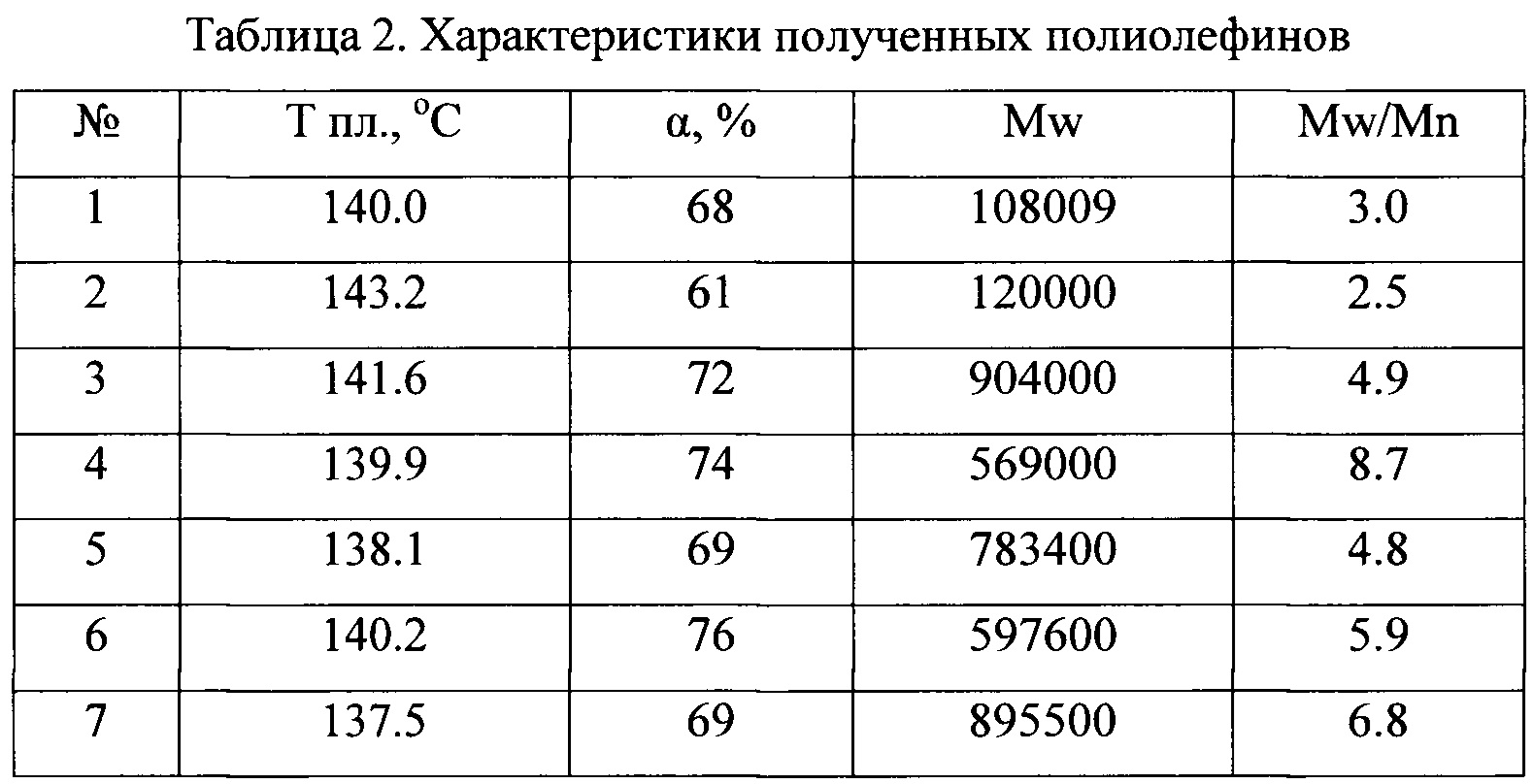
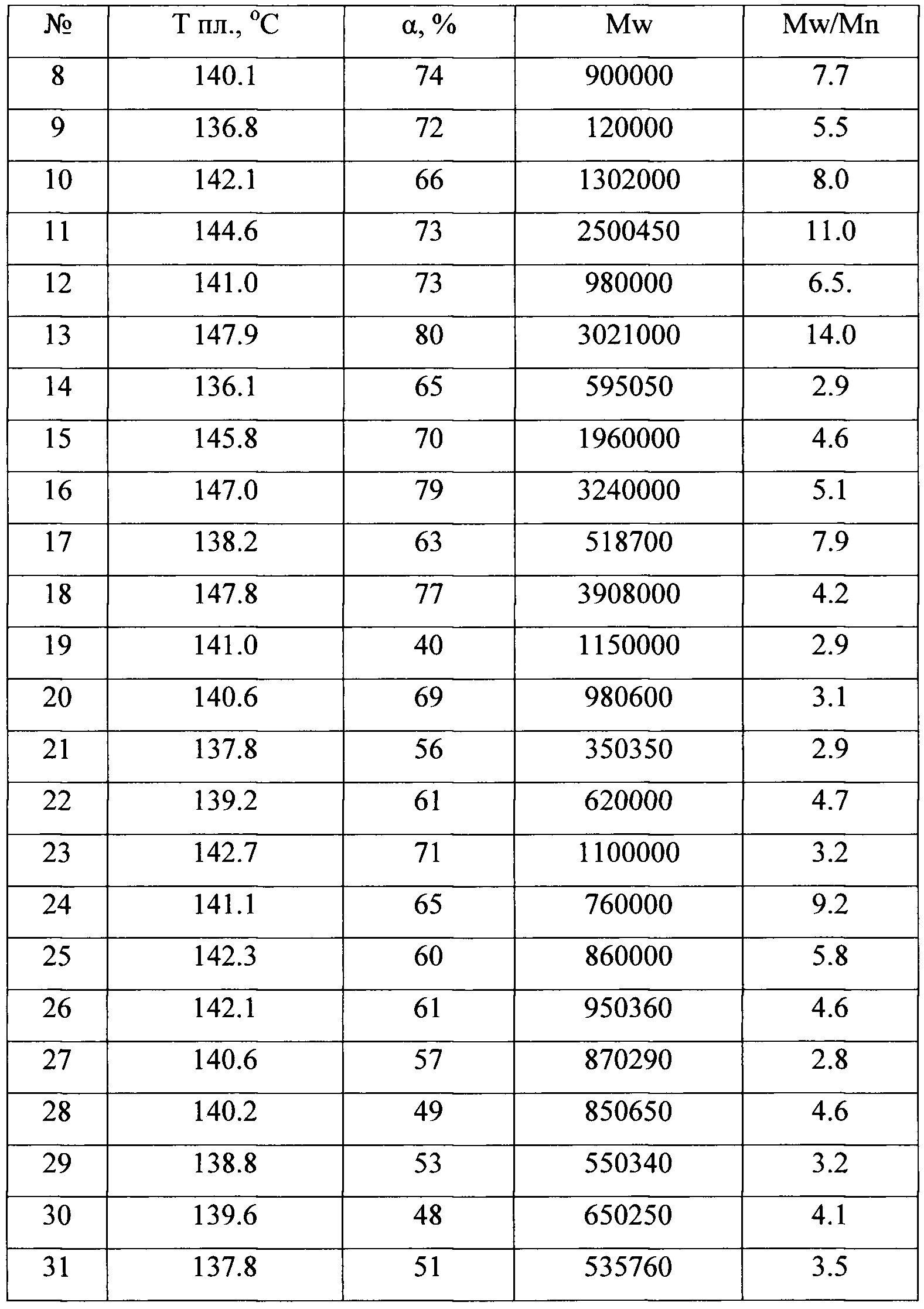
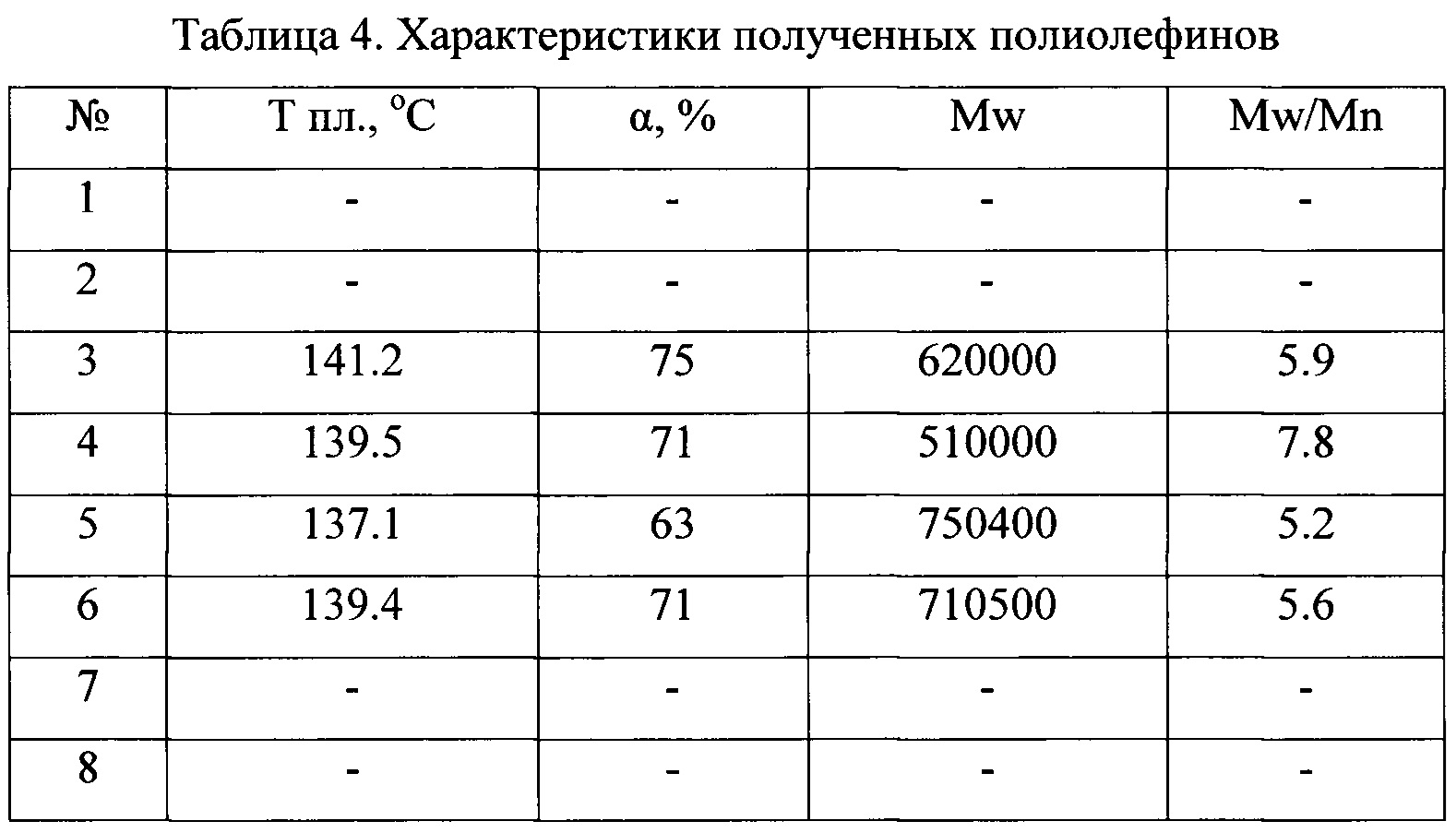
Таким образом, как видно из представленных результатов, за счет использования в каталитической системе полимеризации олефинов прекатализатора, представляющего собой продукт взаимодействия галоидного алкила и/или арила и соединения переходного металла 4-5 групп со щелочными или щелочноземельными металлами, увеличивается скорость реакции полимеризации и выход полимера.

