Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 3-ЗАМЕЩЁННЫХ СЛОЖНЫХ ЭФИРОВ (ИНДОЛ-1-ИЛ)-УКСУСНОЙ КИСЛОТЫ
Вид РИД
Изобретение
Настоящее изобретение относится к способу получения сложных эфиров (5-галоген-2-метил-индол-1-ил)-уксусной кислоты, замещенных в 3-положении - СН2-арильной группой, и, в частности, к способу с высоким выходом продукта, который подходит для применения в промышленных масштабах.
WO 2005/044260 относится к соединениям, которые представляют собой антагонисты CRTH2 и которые, следовательно, подходят для лечения заболеваний и состояний, опосредованных активностью PGD2 на рецепторе CRTH2. Схожие соединения описаны в WO 2006/095183, WO 2008/012511 и WO 2009/090414. Все приведенные в указанных документах соединения представляют собой производные 5-галоген-2-метил-индол-1уксусной кислоты с заместителем -СН2-арил в 3-положении. Было проведено несколько исследований этих соединений, в том числе в ходе клинических испытаний на людях, при этом испытания продемонстрировали, что указанные соединения эффективны в лечении аллергического ринита и астмы, в частности эозинофильной астмы и атопической астмы.
Индольные производные уксусной кислоты, описанные в WO 2005/044260, WO 2006/095183, WO 2008/012511 и WO 2009/090414 могут быть получены путем гидролиза соответствующих алкиловых или бензиловых сложных эфиров, и такие эфиры также полезны в качестве пролекарств индольных соединений уксусной кислоты.
В соответствии с примером 1 из WO 2005/044260, {3-[1-(4-хлор-фенил)-этил]-5-фтор-2-метил-индол-1-ил}-уксусную кислоту получают в следующей последовательности:
I. (5-фтор-2-метил-индол-1-ил)-уксусную кислоту и 4-ацетилхлорбензол подвергали взаимодействию друг с другом в присутствии трифторуксусной кислоты и триэтилсилана в 1,2-дихлорэтане в качестве растворителя для получения сложного этилового эфира {3-[1-(4-хлорфенил)этил]-5-фтор-2-метил-индол-1-ил}уксусной кислоты;
II. сложный эфир подвергали гидролизу с помощью гидроксида лития в смеси тетрагидрофурана и воды в качестве растворителя с получением продукта.
Аналогичные способы применяли в WO 2006/095183 и WO 2008/012511.
WO 2009/090414 относится к соединениям общей формулы:
 ,
,
где
W представляет собой хлор или фтор;
R1 представляет собой фенил, необязательно замещенный одним или более заместителями, выбранными из галогена, -CN, -C1-С6 алкил, -SOR3', -SO2R3', -SO2N(R2')2, -N(R2')2, -NR2'C(O)R3', -CO2R2', -CONR2'R3', -NO2, -OR2', -SR2', -O(CH2)pOR2' и -O(CH2)pO(CH2)qOR2', где
каждый из R2' независимо представляет собой водород, -C1-С6 алкил, -С3-С8 циклоалкил, арил или гетероарил;
каждый из R3' независимо представляет собой -С1-С6 алкил, -С3-С8 циклоалкил, арил или гетероарил;
каждый из p и q независимо представляет собой натуральное число от 1 до 3.
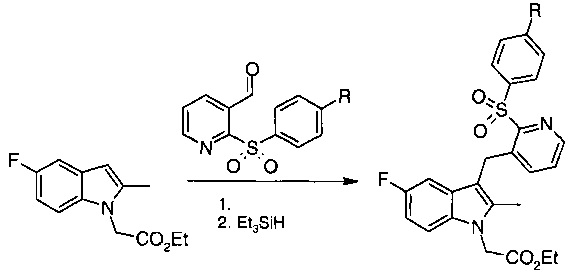
Описанный в WO 2009/090414 способ синтеза указанных соединений приведен на схеме 1 ниже, где R может представлять собой водород, галоген, -CN, -С1-С6 алкил, -SOR3', -SO2R3', -SO2N(R2')2, -N(R2')2, -NR2'C(O)R3', -CO2R2', -CONR2'R3', -NO2, -OR2', -SR2', -O(CH2)pOR2' и -0(CH2)pO(CH2)qOR2', где R2' и R3' являются такими, как определено для представленной выше структуры. В частности, в настоящей заявке описывается синтез соединений, в котором R представляет собой Н (пример 1), F (пример 2) или Cl (пример 3).
Схема 1
Этап 1
Этап 2
Этап 3
Путь, показанный на схеме 1, по существу представляет собой такой же путь, что и применяемый для получения соединений согласно WO 2005/044260, WO 2006/095183 и WO 2008/012511. Как видно из схемы 1, способ включает три этапа, и во всех случаях этап 2 оказался особенно проблематичным.
В WO 2005/044260, WO 2006/095183 и WO 2008/012511 этап 2 проводили в одну стадию путем добавления трифторуксусной кислоты к раствору альдегида, индольного сложного эфира и триэтилсилана. Тем не менее, хотя этот способ был подходящим для получения соединений в лабораторном масштабе, он оказался неподходящим для применения в промышленном масштабе из-за неустойчивости промежуточных спиртов, получаемых на этапе 2. Более того, этот способ оказался совершенно неподходящим для получения соединений, описанных в WO 2009/090414, так как большая часть продукта, полученного в каждом случае, представляла собой бис-индолильный продукт, образующийся в результате дальнейшего алкилирования спиртового промежуточного вещества на этапе 2 способа.
Поэтому этап 2 способа был адаптирован и способ, описанный в WO 2009/090414, отличается от того, что описан в предшествующих документах тем, что применяемая кислота Льюиса представляет собой триметилсилилтрифторметансульфонат (TMSOTf), а не трифторуксусную кислоту. Этап 2 способа, описанного в WO 2009/090414, более подробно проиллюстрирован на схеме 2, где R представляет собой то же, что и определено выше в схеме 1, и R' представляет собой C1-С6-алкил или бензил.
Схема 2 - Этап 2 способа по схеме 1
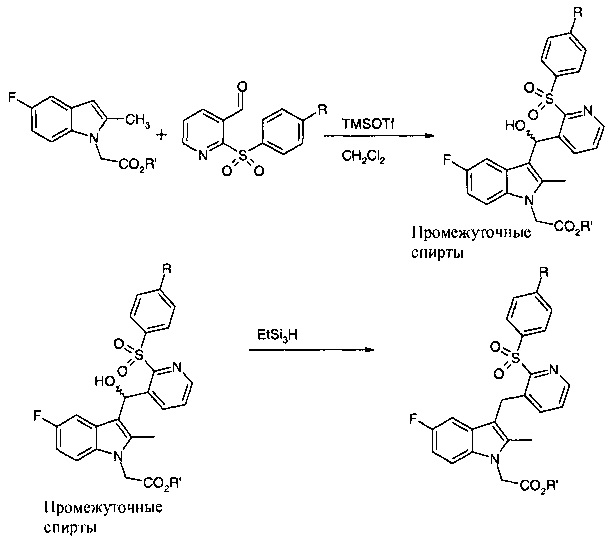
Этот способ успешно применяли в лабораторном масштабе для получения соединений, описанных в WO 2009/090414. Тем не менее, попытки увеличить масштаб способа были менее успешными.
Как и в случае способов с применением других кислот Льюиса, способ, приведенный на схеме 2, проявляет тенденцию приводить к образованию к бис-индолильной примеси формулы:
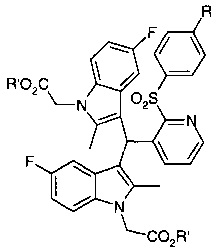
где R является таким, как определено в схеме 1, и R' представляет собой C1-С6-алкил или бензил.
Авторам WO 2009/090414 удалось минимизировать количество этой примеси путем применения водной обработки и путем проведения реакции при очень большом разбавлении. Тем не менее, эти решения не подходят для способа промышленного масштаба. В частности, отношение исходного материала к растворителю, используемому в способе, описанном в WO 2009/090414, составляет примерно 1:50 масса/объем и разведения такого порядка просто не применимы в промышленных масштабах.
Когда авторы настоящего изобретения попытались провести реакцию при более приемлемой в промышленном отношении концентрации примерно от 1:10 до 1:15 масса/объем, было установлено, что промежуточный спирт осаждается в виде смолистого материала, который скапливается на лопастной мешалке, и который может привести к повреждению оборудования при больших масштабах. При более высоком разведении, применявшемся в WO 2009/090414, нерастворимый промежуточный спирт все еще присутствовал, но не скапливался на мешалке.
Таким образом, авторы изобретения предприняли попытку осуществить реакцию этапа 2 при концентрациях от примерно 1:10 до 1:15 масса/объем с применением ряда альтернативных кислот Льюиса, включая трифторуксусную кислоту, трифторметансульфоновоую кислоту, трифторид бора, трихлорид алюминия и дибромид цинка. Тем не менее, все указанные кислоты Льюиса либо привели к неприемлемо высокому уровню бис-индолильной примеси, показанной выше, или к смолистому агломерату промежуточного спирта, аналогичному полученному при применении TMSOTf. Тем не менее, авторы настоящего изобретения неожиданно обнаружили, что, в отличие от всех остальных испытанных кислот Льюиса, тетрахлорид титана (TiCl4) действительно привел к приемлемым результатам на этапе восстановительного алкилирования.
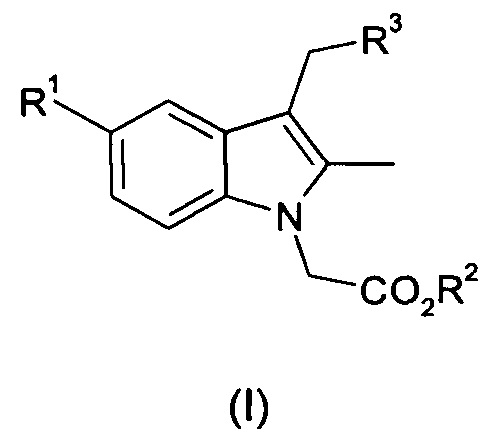
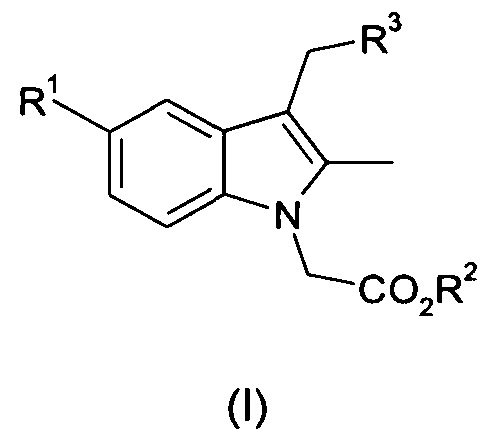
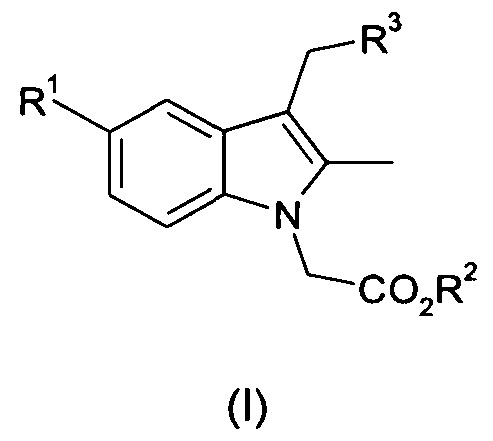
Таким образом, согласно первому аспекту настоящего изобретения предложен способ получения соединения общей формулы (I):
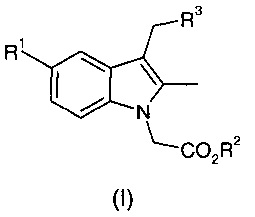
где R1 представляет собой фтор, хлор или бром;
R2 представляет собой C1-С6 алкил или бензил; и
R3 представляет собой арил или гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из галогена, ОН, CN, R4, COR4, CH2R4, OR4, SR4, SO2R4 или SO2YR4;
R4 представляет собой C1-C6 алкил, С3-C8 циклоалкил, гетероциклил, арил или гетероарил, любой из которых может быть необязательно замещен одним или несколькими заместителями, выбранными из галогена, ОН, CN, NO2, C1-C6 алкила или O(С1-С6 алкил); и
Y представляет собой NH или линейную или разветвленную С1-С4-алкиленовую цепь;
способ, включающий:
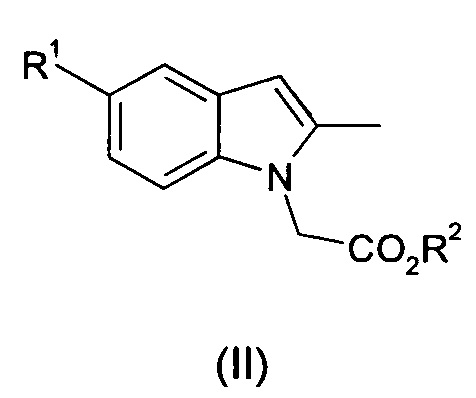
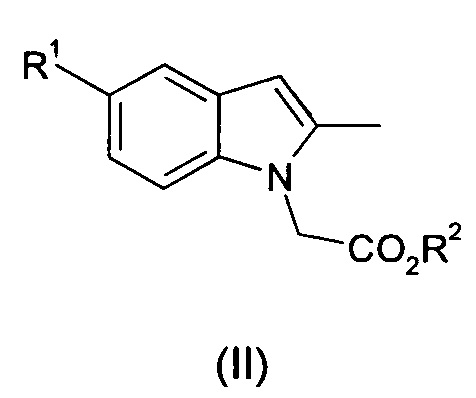
I. осуществление взаимодействия соединения общей формулы (II):
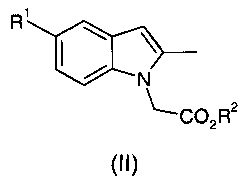
где R1 и R2 являются такими, как определено для общей формулы (I);
с соединением общей формулы (II):
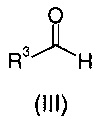
где R3 является таким, как определено для общей формулы (I);
в подходящем растворителе и в присутствии тетрахлорида титана, где отношение соединения общей формулы (II) к растворителю составляет от 1:8 до 1:20 масса/объем; и
II. осуществление взаимодействия продукта стадии (I) с восстанавливающим агентом с получением соединения общей формулы (I).
Авторы настоящего изобретения обнаружили, что, когда реакцию проводят с применением TiCl4 в качестве кислоты Льюиса, продукт стадии (I) выпадает в осадок в виде твердого вещества, но образует суспензию, а не смолистую массу и, следовательно, не скапливается на мешалке, даже несмотря на то, что применяемое количество растворителя значительно ниже, чем для способов, в которых применяется трифторуксусная кислота или триметилсилилтрифлат. Кроме того, количество бис-индолильной примеси, которая образуется в результате реакции следующей молекулы соединения общей формулы (II) с продуктом стадии (I), сохраняется на приемлемом уровне. Эти результаты оказались неожиданными, так как они отличались от результатов, полученных с другими испытанными кислотами Льюиса.
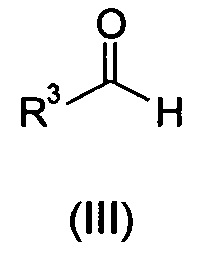
Авторы настоящего изобретения попытались рационализировать причины положительных результатов при применении TiCl4 в качестве кислоты Льюиса для этого способа путем более полного рассмотрения реакции соединения общей формулы (II) с соединением общей формулы (III).
Ранее когда реакцию проводили с применением протонсодержащей кислоты, такой как трифторуксусная кислота, было высказано предположение, что она протекает по механизму, показанному на схеме 3.
Схема 3
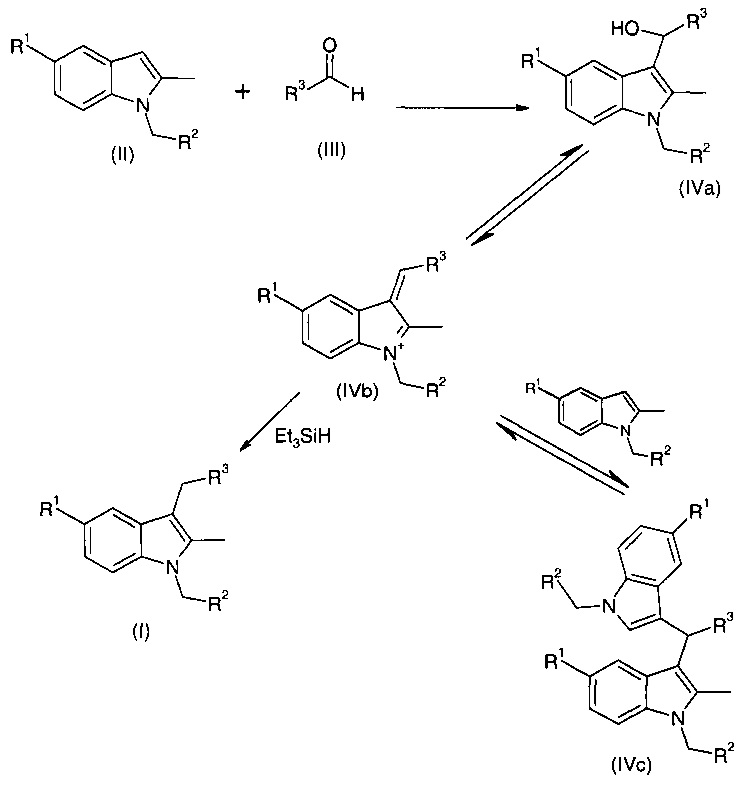
Как было объяснено выше, бис-индолильное соединение (IVc) оказалось основным продуктом при применении большинства кислот Льюиса, хотя пропорции соединений формул (I) и (IVc) будут варьироваться в зависимости от конкретного целевого соединения общей формулы (I).
Как показано на схеме 3, соединение общей формулы (II) вступает в реакцию с соединением общей формулы (III) в присутствии кислоты Льюиса с образованием промежуточного спирта общей формулы (IVa). Промежуточный спирт находится в равновесии с промежуточным соединением общей формулы (IVb), которое может или взаимодействовать с восстанавливающим агентом с образованием соединения общей формулы (I) или, в качестве альтернативы, может вступать в реакцию с дополнительной молекулой соединения общей формулы (II) с образованием бис-индолильного соединения общей формулы (IVc).
Бис-индолильное соединение общей формулы (IVc) находится в равновесии с промежуточным соединением общей формулы (IVb), и поэтому в некоторых случаях, например, при применении не протонсодержащей кислоты Льюиса, такой как TMSOTf, оказалось возможным преобразовать бис-индолильное соединение в промежуточные соединения общей формулы (IVb) и (IVa) и исходный материал формулы (II) путем добавления небольшого количества воды, например, примерно 1 эквивалента, при завершении восстановления.
Тем не менее, оказалось неожиданным, что, когда в качестве кислоты Льюиса применяется TiCl4, для удаления бис-индолильного продукта не требуется добавление воды, и поэтому авторы настоящего изобретения предположили, что реакция может протекать с образованием иных промежуточных продуктов вместо или в дополнение к промежуточным продуктам общей формулы (IVa) и (IVb), что, возможно, вызвано добавлением Cl-, а не ОН-. Таким образом, возможные промежуточные продукты могут иметь структуру:
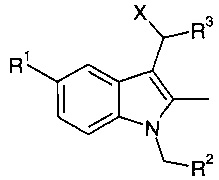
где X может представлять собой, например, Cl или фрагмент на основе титана.
Продукт стадии (I) способа согласно настоящему изобретению, не известен, но возможно, что присутствие альтернативных промежуточных продуктов может быть причиной того, что продукт стадии (I) образует суспензию, а не скапливается на мешалке, как при применении других кислот Льюиса. Тем не менее, это является только теорией, и эффективность способа согласно настоящему изобретению не зависит от ее правильности.
В настоящем описании изобретения "С1-С6-алкил" относится к линейной или разветвленной насыщенной углеводородной цепи, содержащей от одного до шести атомов углерода, и необязательно замещенной одним или несколькими циклоалкильными группами С3-С7. Примеры включают метил, этил, н-пропил, изопропил, трет-бутил, н-гексил, метиленциклопропил, метиленциклобутан и метиленциклопентил.
"C1-C4-алкил" и "C1-C18-алкил" имеют аналогичные значения, за исключением того, что они содержат от одного до четырех и от одного до восемнадцати атомов углерода, соответственно.
С3-С7-циклоалкил означает насыщенное 3-7-членное карбоциклическое кольцо. Примеры таких групп включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин "С1-С4-алкилен" в контексте настоящего описания относится к дизамещенной неразветвленной или разветвленной насыщенной углеводородной цепи, содержащей от одного до четырех атомов углерода.
В настоящем описании термин "галоген" обозначает фтор, хлор, бром или йод.
Термин "арил" в контексте настоящего описания относится к ароматической кольцевой системе, содержащей от 5 до 14 кольцевых атомов углерода и содержащий до трех колец. Примерами арильных групп являются бензол и нафталин.
Термин "гетероарил" в контексте настоящего описания относится к кольцевой системе с ароматическим характером, содержащей от 5 до 14 атомов в кольце, по меньшей мере один из которых представляет собой гетероатом, выбранный из N, О и S, и содержащей до трех колец. Если гетероарильная группа содержит больше одного кольца, то не все кольца должны быть полностью ароматическими по своему характеру. Кольца, которые не являются полностью ароматическими, могут быть замещены одной или более оксогруппами. Примеры гетероарильных групп включают пиррол, тиофен, тиазол, пиридин, пиримидин, индол, бензофуран, бензимидазол, тетрагидрохинолин, индолин, хинолин, изохинолин, хиноксалин, имидазо[1,2-а]пиридин и пиразоло[1,5-а]пиридин.
Термин "гетероциклил" в контексте настоящего описания относится к насыщенной кольцевой системе, содержащей от 4 до 8 атомов в кольце, по меньшей мере один из которых представляет собой гетероатом, выбранный из N, О и S, и которая может быть необязательно замещена одной или более оксогруппами. Примеры гетероциклильных групп включают азетидинил, пиперидинил; тетрагидрофуранил, тетрагидропиранил, диоксанил, тиоморфолинил, 1,1-диоксо-1λ6-тиоморфолинил, морфолинил, пирролил, пиперазинил, азепанил, 1,4-диазепанил, 1,4-оксазепанил и азоканил.
Если в соединении согласно настоящему изобретению присутствует хиральный центр или другая форма изомерного центра, предполагается, что настоящее изобретение охватывает все формы такого изомера или изомеров, включая энантиомеры и диастереоизомеры. Соединения по настоящему изобретению, содержащие хиральный центр, можно применять в виде рацемической смеси, энантиомерно обогащенной смеси, или рацемическую смесь можно разделять с применением хорошо известных способов, и индивидуальный энантиомер можно применять отдельно.
Подходящие соединения, которые могут быть получены способом согласно изобретению, представляют собой те, в которых, независимо друг от друга или в любой комбинации:
R1 представляет собой фтор;
R2 представляет собой С1-С4 алкил; и
R3 представляет собой хинолин, хиноксалин, изохинолин, тиазол, фенил, нафталин, тиофен, пиррол или пиридин, любой из которых необязательно может быть замещен, как указано выше.
Более предпочтительно, R2 представляет собой метил или этил, в частности этил.
Более типичные группы R3 включают необязательно замещенный хинолин, фенил, нафталин, тиофен, пиррол или пиридин.
Если R3 представляет собой хинолин или изохинолин, он является соответствующим образом незамещенным или замещенным одним или более галогеновыми заместителями, в частности фтором.
Если R3 представляет собой фенил, нафталин, тиофен, пиррол или пиридин, он может необязательно содержать один или более заместителей, с особенно подходящими заместителями, включающими OR4, SO2R4 или SO2YR4; где R4 и Y являются такими, как определено выше.
Обычно в этом случае R4 представляет собой C1-С6-алкил, 4- или 6-членную циклоалкильную группу, 5- или 6-членную гетероциклильную группу или фенил, каждый из которых может быть замещен, как определено выше.
Если R3 представляет собой пиридил, то наиболее подходящим является 3-пиридильный фрагмент.
В более активных соединениях, Y, если он присутствует, представляет собой фрагмент СН2.
Если R3 замещен SO2R4 или SO2YR4, группа R4 обычно является незамещенной или замещенной одним или более заместителями, выбранными из метила и галогена, в частности хлора или фтора.
Если R3 замещен OR4, группа R4 может быть незамещенной или замещенной одним или более заместителями, выбранными из галогена, циано, С1-С4-алкила и O(С1-С4-алкил).
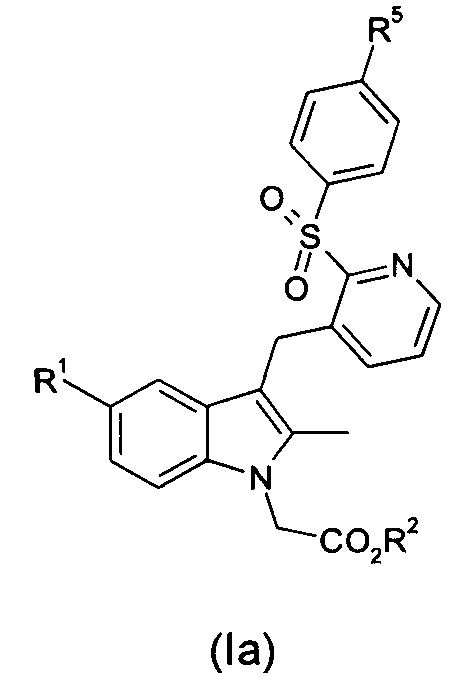
Способ согласно настоящему изобретению является особенно подходящим для получения соединений формулы (Ia):
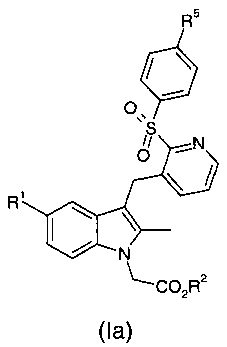
где R1 и R2 являются такими, как определено выше для общей формулы (I);
R5 представляет собой водород, галоген, -CN, -C1-C6 алкил, -SOR7, -SO2R7, -SO2N(R6)2, -N(R6)2, -NR6C(O)R7, -CO2R6, -CONR6R7, -NO2, -OR6, -SR6, -O(CH2)pOR6 и -O(CH2)pO(CH2)qOR6, где
каждый из R6 независимо представляет собой водород, -C1-С6 алкил, -С3-С8 циклоалкил, арил или гетероарил;
каждый из R7' независимо представляет собой -C1-С6 алкил, -С3-С8 циклоалкил, арил или гетероарил;
каждый из p и q независимо представляет собой натуральное число от 1 до 3.
Получение соединений общей формулы (Ia) оказалось особенно сложным, при том, что попытки с применением ТФУ не позволили синтезировать целевые соединения, и применение TMSOTf требует очень высокой степени разбавления реакционной смеси для получения целевого продукта реакции.
Особенно подходящими соединениями формулы (Ia) являются те, в которых, независимо друг от друга или в комбинации:
R1 представляет собой фтор; и
R2 представляет собой С1-С4 алкил, более часто метил или этил и особенно этил.
В соединениях формулы (Ia), R5 предпочтительно представляет собой водород или галоген, более предпочтительно водород, фтор или хлор.
Соединения общей формулы (I), которые могут быть получены способом согласно настоящему изобретению, включают C1-С6-алкиловые или бензиловые сложные эфиры:
{3-[1-(4-хлор-фенил)этил]-5-фтор-2-метил-индол-1-ил-уксусной кислоты;
{5-фтор-2-метил-3-[1-(4-трифторметил-фенил)-этил]-индол-1-ил}-уксусной кислоты;
{3-[1-(4-трет-бутил-фенил)этил]-5-фтор-2-метил-индол-1-ил}-уксусной кислоты;
{5-фтор-3-[1-(4-метансульфонил-фенил)-этил]-2-метил-индол-1-ил}-уксусной кислоты;
[5-фтор-2-метил-3-(1-нафтален-2-ил-этил)-индол-1-ил]-уксусной кислоты;
(5-фтор-2-метил-3-хинолин-2-илметил-индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-нафтален-2-илметил-индол-1-ил)-уксусной кислоты;
[5-фтор-3-(8-гидроксихинолин-2-илметил)-2-метил-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(хиноксалин-2-илметил)индол-1-ил]-уксусной кислоты;
[5-фтор-3-(4-метокси-бензил)-2-метил-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(1,3-тиазол-2-илметил)индол-1-ил]-уксусной кислоты;
[3-(4-хлор-бензил)-5-фтор-2-метил-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(4-трифторметил-бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(4-трет-бутил-бензил)-индол-1-ил]-уксусной кислоты;
{5-фтор-2-метил-3-[(4-фенилфенил)метил]индол-1-ил}-уксусной кислоты;
[5-фтор-3-(4-метансульфонил-бензил)-2-метил-индол-1-ил]-уксусной кислоты;
{5-фтор-3-[(6-фторхинолин-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
(2-метил-3-хинолин-2-илметил-индол-1-ил)-уксусной кислоты;
(5-хлор-2-метил-3-хинолин-2-илметил-индол-1-ил)-уксусной кислоты;
(3-{[1-(бензолсульфонил)пиррол-2-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
[5-фтор-2-метил-3-({1-[(4-метилбензол)сульфонил]пиррол-2-ил}метил)индол-1-ил]-уксусной кислоты;
[3-({1-[(2,4-дифторбензол)сульфонил]пиррол-2-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
(3-{[2-(бензолсульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
[3-({2-[(4-хлорбензол)сульфонил]фенил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
[5-фтор-3-({2-[(4-фторбензол)сульфонил]фенил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
(3-{[2-(бензолсульфонил)пиридин-3-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
[5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
[3-({2-[(4-хлорбензол)сульфонил]пиридин-3-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
2-(3-(4-(бензилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(4-(4-хлорбензилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(3-(бензилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(5-фтор-3-(3-(4-фторбензилсульфонил)бензил)-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(2-(бензилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(4-(4-фторбензилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(2-(циклогексилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(5-фтор-2-метил-3-(2-(пиперидин-1-илсульфонил)бензил)-индол-1-ил)-уксусной кислоты;
2-(3-(2-(циклопентилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(5-фтор-2-метил-3-(3-(пиперидин-1-илсульфонил)бензил)-индол-1-ил)-уксусной кислоты;
2-(5-фтор-2-метил-3-(2-(пирролидин-1-илсульфонил)бензил)-индол-1-ил)-уксусной кислоты;
2-(3-(4-(циклогексилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(4-(циклопентилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(3-(2-(циклобутилсульфонил)бензил)-5-фтор-2-метил-индол-1-ил)-уксусной кислоты;
2-(5-фтор-2-метил-3-(3-(пирролидин-1-илсульфонил)бензил)-индол-1-ил)-уксусной кислоты;
2-(5-фтор-2-метил-3-(4-(пиперидин-1-илсульфонил)бензил)-индол-1-ил)-уксусной кислоты;
[5-фтор-2-метил-3-(2-феноксибензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(4-метоксифенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(4-метилфенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(2,4-дихлорфенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(4-фторфенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(3,4-дифторфенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(4-цианофенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(4-хлорфенокси)бензил)-индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(2-(2-цианофенокси)бензил)-индол-1-ил]-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(4-метилфенокси)пиридин-3-ил]метил}индол-1-ил)-уксусной кислоты;
{5-фтор-3-[(3-метансульфонилнафтален-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
{5-фтор-3-[(1-метансульфонилнафтален-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
{5-фтор-3-[(6-метансульфонилнафтален-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
[5-фтор-2-метил-3-(хинолин-3-илметил)индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(хиноксалин-6-илметил)индол-1-ил]-уксусной кислоты;
[5-фтор-2-метил-3-(хинолин-7-илметил)индол-1-ил]-уксусной кислоты;
{5-фтор-3-[(6-метансульфонилхинолин-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
{5-фтор-3-[(4-метансульфонилхинолин-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
(5-фтор-2-метил-3-{пиразоло[1,5-а]пиридин-3-илметил}индол-1-ил)-уксусной кислоты;
(5-фтор-3-{имидазо[1,2-а]пиридин-2-илметил}-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(метилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[3-(метилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(этилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[4-(этилсульфанил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(н-пропилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(изопропилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(трет-бутилсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пентан-3-илсульфанил)фенил]метил}индол-1-ил)-уксусной кислоты;
[3-({4-[(циклопропилметил)сульфанил]фенил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
{3-[(4,4-диметил-2,3-дигидро-1-бензотиопиран-6-ил)метил]-5-фтор-2-метилиндол-1-ил}-уксусной кислоты;
(3-{[2-(этансульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(пропан-1-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(пропан-2-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[2-(бутан-1-сульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(3-{[2-(бутан-2-сульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(2-метилпропан-2-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(пентан-1-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[2-(циклопропилметан)сульфонилфенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(пропилсульфамоил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[2-(бутилсульфамоил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[3-(пропилсульфамоил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[3-(бутилсульфамоил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(трифторметан)сульфонилфенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[4-(этансульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пропан-1-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пропан-2-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[4-(бутан-1-сульфонил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(2-метилпропан-2-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пентан-1-сульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пентан-3-илсульфонил)фенил]метил}индол-1-ил)-уксусной кислоты;
[3-({4-[(циклопропилметил)сульфонил]фенил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(пропилсульфамоил)фенил]метил}индол-1-ил)-уксусной кислоты;
(3-{[4-(бутилсульфамоил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[4-(трифторметокси)фенил]метил}индол-1-ил)-уксусной кислоты;
(5-фтор-3-{[4-метансульфонил-3-(трифторметил)фенил]метил}-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-3-{[4-метансульфонил-3-(трифторметокси)фенил]метил}-2-метилиндол-1-ил)-уксусной кислоты;
{5-фтор-3-[(5-метансульфонилтиофен-2-ил)метил]-2-метилиндол-1-ил}-уксусной кислоты;
{3-[(4,4-диметил-1,1-диоксо-2,3-дигидро-1λ6-бензотиопиран-6-ил)метил]-5-фтор-2-метилиндол-1-ил}-уксусной кислоты;
[3-({1-[(4-хлорбензол)сульфонил]пиррол-2-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
[5-фтор-3-({1-[(4-фторбензол)сульфонил]пиррол-2-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
[5-фтор-3-({1-[(4-метоксибензол)сульфонил]пиррол-2-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
{3-[1-(2,4-дихлор-бензолсульфонил)пиррол-2-илметил]-5-фтор-2-метил-индол-1ил}-уксусной кислоты;
[5-фтор-3-({1-[(4-метансульфонилбензол)сульфонил]пиррол-2-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
{5-фтор-2-метил-3-[(2-фенилфенил)метил]индол-1-ил}-уксусной кислоты;
(3-{[1-(бензолсульфонил)индол-2-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(3-{[2-(4-хлорфенил)фенил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
(5-фтор-2-метил-3-{[2-(4-метилфенил)фенил]метил}индол-1-ил)-уксусной кислоты;
{5-фтор-2-метил-3-[(3-феноксифенил)метил]индол-1-ил}-уксусной кислоты;
[5-фтор-3-({4-[(4-фторфенил)карбонил]-1-метилпиррол-2-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
{5-фтор-2-метил-3-[(6-{[3-(трифторметил)фенил]метил}пиридин-3-ил)метил]индол-1-ил}-уксусной кислоты;
{5-фтор-2-метил-3-[(3-фенокситиофен-2-ил)метил]индол-1-ил}-уксусной кислоты;
(3-{[2-(бензолсульфонил)-1,3-тиазол-5-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
{3-[(1-бензилпиразол-4-ил)метил]-5-фтор-2-метилиндол-1-ил}-уксусной кислоты;
(3-{[5-(4-хлорфенокси)-1-метил-3-(трифторметил)пиразол-4-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
[3-({5-[(4-хлорбензол)сульфонил]фуран-2-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
[3-({5-[(4-хлорбензол)сульфонил]тиофен-2-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
[3-({3-[(4-хлорбензол)сульфонил]тиофен-2-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
{3-[(2-бензилфенил)метил]-5-фтор-2-метилиндол-1-ил}-уксусной кислоты;
причем этиловые сложные эфиры указанных выше соединений являются особенно подходящими для получения этим способом.
Среди перечисленных выше соединений способ особенно подходит для получения сложных эфиров соединений общей формулы (Ia), а именно: C1-C6-алкиловых и бензиловых сложных эфиров:
(3-{[2-(бензолсульфонил)пиридин-3-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты;
[5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты;
[3-({2-[(4-хлорбензол)сульфонил]пиридин-3-ил}метил)-5-фтор-2-метилиндол-1-ил]-уксусной кислоты;
и, в частности, этиловых сложных эфиров указанных соединений.
Подходящие растворители для этого процесса включают, в частности, галогенированные растворители, например, хлорированные растворители, такие как хлороформ, 1,2-дихлорэтан и особенно дихлорметан.
Более предпочтительное отношение соединения общей формулы (II) к растворителю составляет от 1:10 до 1:15, например от 1:10 до 1:12 и обычно составляет примерно 1:12 масса/объем.
Относительное содержание растворителя относится к общему количеству растворителя, применяемому на стадии (I), и включает, например, любой растворитель, в который добавили тетрахлорид титана; любой растворитель, в который добавили соединения общей формулы (II) и общей формулы (III), и любой растворитель, добавленный в реакционный сосуд для промывки или дальнейшего разбавления.
Кроме того, стало возможным оптимизировать реакцию таким образом, что чистота продукта составляет не менее 95% или, при выражении в массовых процентах, по меньшей мере 95 масс. %. Реакция была разработана с целью получения продукта, в котором количество образовавшейся бис-индолильной примеси составляет ≥5% по площади пика ВЭЖХ и в некоторых случаях ≥2% площади пика ВЭЖХ. Авторы настоящего изобретения получили продукт, содержащий менее 0,5 масс. % бис-индолильной примеси и менее 0,5 масс. % спиртового промежуточного продукта. Выход также значительно увеличился по сравнению с предыдущими способами получения указанных соединений; при применении способа согласно настоящему изобретению оказалось возможным получить продукт с выходом по меньшей мере, примерно 75%. В некоторых случаях выход еще выше, например, по меньшей мере примерно 80% или по меньшей мере примерно 85%.
Одним из способов регулирования количества бис-индолильной примеси в конечном продукте является регулировка молярного соотношения тетрахлорида титана и соединения формулы (II). Оно обычно составляет от 1:1 до 3:1 и еще чаще от 1,1:1 до 2,5:1. С точки зрения затрат является выгодным поддерживать количество тетрахлорида титана на минимальном уровне, но было установлено, что увеличение стехиометрии тетрахлорида титана от 1,1:1 до 2:1 уменьшает количество образовавшейся бис-индолильной примеси от примерно 20% площади пика до менее 10% площади пика. Поэтому является предпочтительным, чтобы молярное отношение тетрахлорида титана к соединению общей формулы (II) составляло от примерно 1,8:1 до 2,2:1, обычно примерно 2:1.
Количество бис-индолильной примеси также можно уменьшить путем проведения реакции стадии (I) при соответствующей температуре, а затем поддержания ее при этой температуре в течение соответствующего периода времени после добавления соединений формул (II) и (III).
Обычно реакцию проводят при температуре от -10 до 25°С, еще чаще при комнатной температуре, например, примерно 20°С. Бис-индолильная примесь находится в равновесии с промежуточными продуктами и исходным материалом общей формулы (II), и авторы настоящего изобретения обнаружили, что при температуре 20°С равновесие смещается в сторону обратной реакции образования из бис-индолильной примеси исходного материала и промежуточных продуктов таким образом, что после длительного периода перемешивания при подходящей температуре в сочетании с подходящим стехиометрическим соотношением TiCl4 и соединения формулы (II) содержание бис-индолильной примеси может быть уменьшено до ≥5% площади пика. В противоположность этому, при 40°С наблюдается побочная реакция, что снижает выход соединения общей формулы (I).
Поэтому после добавления соединений общих формул (II) и (III), реакционную смесь предпочтительно выдерживают при температуре 15-25°С, предпочтительно при комнатной температуре, например 18-22°С и обычно при температуре примерно 20°С, предпочтительно при перемешивании, в течение примерно от 10 до 24 часов, еще чаще от 12 до 18 часов, например, примерно 15 часов.
В способе, описанном выше, значения для количества различных соединений выражены в % площади пика. Это относится к проценту площади пика, представляющего отдельную молекулу на хроматограмме ВЭЖХ.
Стадию восстановления (II) способа можно осуществлять с применением любого восстанавливающего агента, способного восстанавливать бензиловый спирт до соответствующего алкана, хотя было установлено, что особенно подходящим является триэтилсилан. Тем не менее, также можно применять другие силановые восстанавливающие агенты или другие способы восстановления, например, гидрогенизацию, обычно с применением металлического катализатора, такого как палладий или платина. В этом способе восстановление можно проводить в инертной атмосфере, такой как атмосфера азота или аргона.
Является удобным применение триэтилсилана в качестве восстановителя на стадии (II), его медленно добавляют к смеси, полученной на стадии (I), в течение периода времени от примерно 1 до 3 ч, обычно примерно 2 часов. Молярное отношение восстанавливающего агента к соединению общей формулы (II) составляет от примерно 2:1 до 4:1, например, примерно 3:1.
Восстановление триэтилсиланом требует кислых условий среды, и это обеспечивается тетрахлоридом титана, который остается в реакционной смеси после стадии (I). Еще одно преимущество применения TiCl4 в качестве кислоты Льюиса заключается в том, что на стадии восстановления (II) бис-индолильная примесь, остающаяся в реакционной смеси, медленно переходит в промежуточное соединение общей формулы (IVb), которое, в свою очередь, восстанавливается с образованием соединения формулы (I).
После завершения реакции стадии (II) можно выделить продукт общей формулы (I). Поэтому способ согласно настоящему изобретению может дополнительно включать стадию:
(iii) выделения и очистки соединения общей формулы (I).
Предпочтительно, как только реакция завершается, температуру реакционной смеси снижают до примерно 0-5°С, после чего к реакционной смеси добавляют воду. Продукт затем можно экстрагировать в органический растворитель, который впоследствии может быть удален любым подходящим способом, например перегонкой.
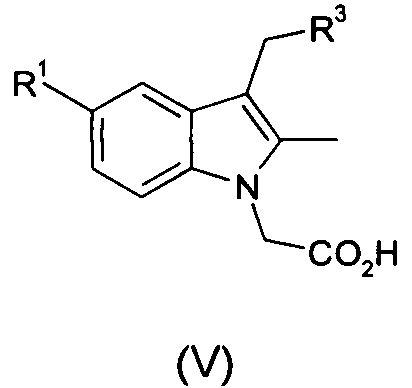
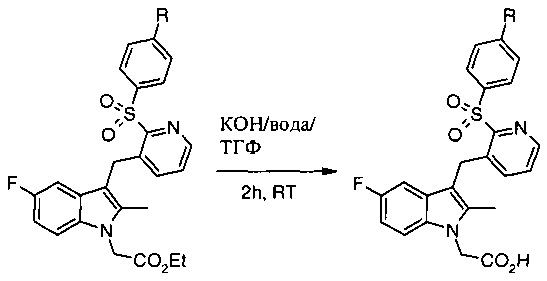
Как указано выше, соединение формулы (I) является промежуточным продуктом в получении индольных производных уксусной кислоты, которые обладают фармакологической активностью в качестве антагонистов CRTH2, и поэтому в следующем аспекте способ согласно настоящему изобретению включает дополнительную стадию:
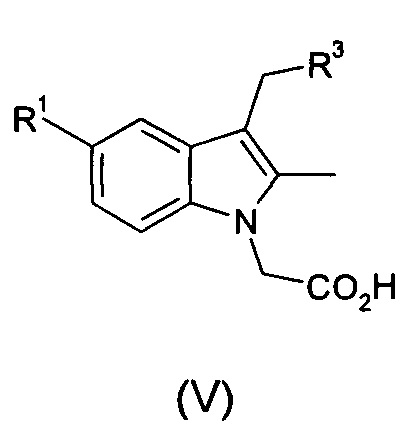
(iv) осуществление преобразования соединения формулы (I) в соединение общей формулы (V):
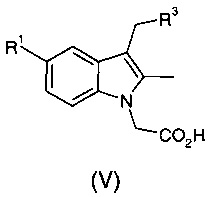
где R1 и R3 являются такими, как определено в общей формуле (I);
при этом указанный способ включает осуществление гидролиза соединения формулы (I).
Можно использовать как кислотный, так и щелочной гидролиз соединения формулы (I), хотя особенно подходит щелочной гидролиз.
Обычно гидролиз будет проводиться в водном растворе с использованием сильного основания, такого как гидроксид натрия, калия или аммония. Однако, особенно подходит гидроксид калия. Подходящим основанием будет 50% водный раствор гидроксида калия.
Количество используемого основания, как правило, составляет от 1,5 до 4 мольных эквивалентов соединения формулы (I). Соответственно, молярное отношение основание: соединение формулы (I) составляет 2:1.
Этап (v) можно проводить при комнатной температуре, например, от 20 до 25°С.
Было установлено, что после усовершенствований стадии 2 согласно способу по изобретению продукт стадии (V) может быть получен в форме, которая достаточно чиста для использования в качестве фармацевтического средства, так что дальнейшая очистка не является необходимой.
Для того чтобы получить исходный материал общей формулы (II), способ может включать дополнительные стадии перед стадией (I).
Таким образом, в дополнительном аспекте изобретение включает, перед стадией (I) способ получения соединения формулы (II), включающий:
Осуществление реакции 5-фтор-2-метил-индола с соединением формулы (VI):

где X представляет собой уходящую группу, например, атом галогена, такого как бром, и R1 является таким, как определено для формулы (I).
Реакция может проводиться в присутствии слабого основания, такого как карбонат калия или цезия, чаще карбоната цезия, в полярном органическом растворителе, таком как ацетонитрил.
Подходящее количество используемого растворителя составляет от 7 до 30 л растворителя на 1 кг 5-фтор-2-метил-индола, более обычно от 7 до 20 л, например, от примерно 7 до 15 л и более приемлемо около 10 л растворителя на 1 кг 5-фтор-2-метил-индола.
Реакцию можно проводить при температуре от примерно 15 до 30°С, более обычно 20-25°С в течение времени от 10 до 36 часов, обычно от 18 до 30 часов, например, примерно 24 часов, и ход реакции можно контролировать, например, методом хроматографии, таким как газовая хроматография (ГХ).
Когда реакция завершена, соединение формулы (II) может быть выделено и/или очищено для удаления примесей, таких как 5-фтор-2-метил индол и соединение формулы (VI). В альтернативном варианте стадии очистки (III) может быть достаточно.
Присутствие неорганических солей, полученных из исходного материала общей формулы (IV) нежелательно. Неорганические соли могут быть удалены путем промывания реакционной смеси водой при сохранении продукта формулы (II) в органической фазе. Когда в качестве растворителя для реакции используется такой растворитель, как ацетонитрил, может оказаться целесообразным заменить его на этой стадии альтернативным, менее полярным растворителем, таким как толуол.
Далее изобретение будет описано более подробно со ссылками на примеры.
В примерах использованы следующие аббревиатуры:

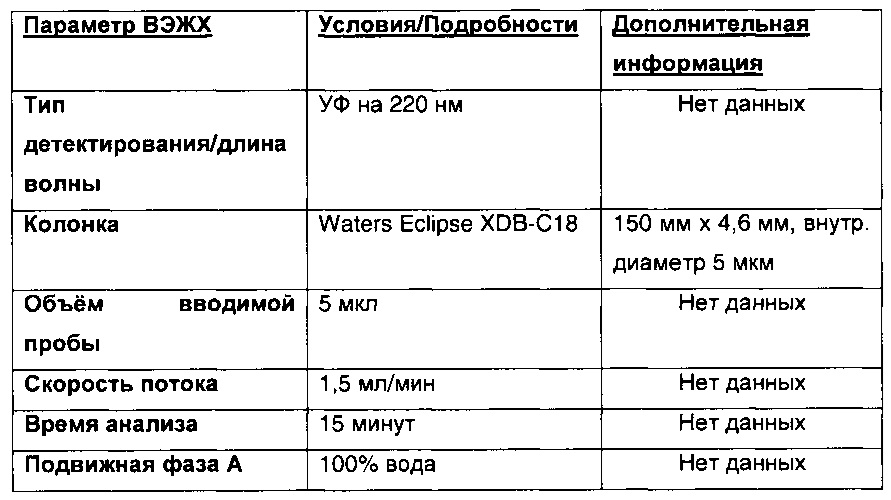
В примерах, изложенных ниже, и во всем описании настоящего изобретения количество различных соединений выражается в % площади пика. Это относится к проценту площади пика, представляющего отдельную молекулу на хроматограмме ВЭЖХ. Подходящие способы проведения ВЭЖХ могут быть разработаны специалистами в данной области техники.
Параметры ВЭЖХ, применявшиеся в сравнительном примере 4 и примере 5, приведены в таблице ниже.
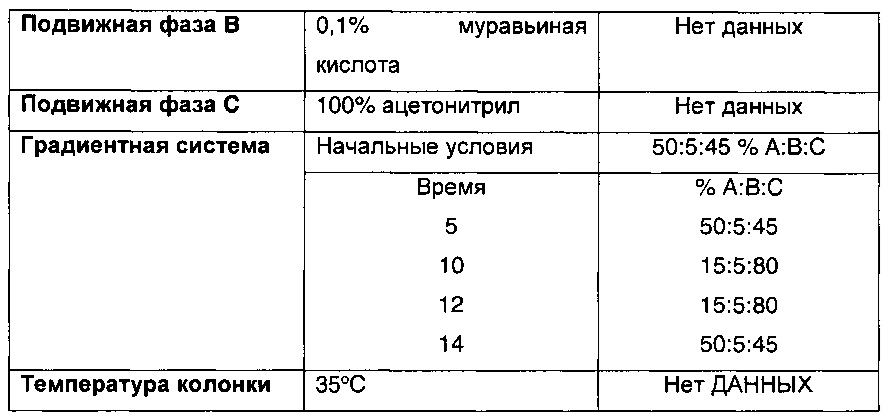
Пример 1 - Получение 5-фтор-2-метил-индол-N-этилацетата (этап 1 способа)
Протокол эксперимента
В реакционную смесь, состоящую из 1,0 кг 5-фтор-2-метилиндола (1,0 экв, 6,70 моль) и 0,99 кг карбоната цезия (3,02 моль - 0,45 экв) с 9 л ацетонитрила добавляют при 20-25°С в течение ~12 ч раствор 1,34 кг этилбромацетата (8,04 моль - 1,2 экв) в 1 л ацетонитрила. Две дополнительных порции по 0,99 кг карбоната цезия каждая добавляют через 4 часа и через 8 ч реакции (3,02 моль - 0,45 экв.). Добавляют заключительную порцию в 0,33 кг карбоната цезия (1,01 моль - 0,15 экв) и 0,056 кг этилбромацетата (0,335 моль - 0,15 экв) через 18 часов. Реакционную смесь выдерживают при перемешивании при 20-25°С до завершения реакции. Добавляют 5 л воды, чтобы растворить неорганические соли. Перемешивание поддерживают при 20-25°С до полного растворения неорганических солей, затем реакционной смеси дают разделиться. Органическую фазу концентрируют до приблизительно 3 л. Добавляют толуол (5 л), затем смесь концентрируют до приблизительно 3 л. Толуол (5 л) добавляют к реакционной смеси; которую затем промывают водой (3 л), чтобы устранить остаточные соли и концентрируют до приблизительно 3 л под вакуумом. Ожидаемый выход: 90±5%.
Метод в большем масштабе
Указанный выше способ осуществляли с размером партии 5-фтор-2-метил-индола до 234 кг.
Количество полученного этилового сложного эфира (5-фтор-2-метилиндол-1-ил)-уксусной кислоты составило 337 кг с выходом 91,3%; что хорошо соотносится с ожидаемым выходом 90±5%.
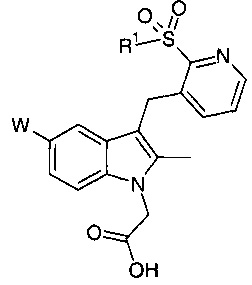
Пример 2 - исследование условий реакции для синтеза этилового сложного эфира [5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты
Реакция между (4-фторбензолсульфонил)-пиридин-3-карбоксальдегидом и 5-фтор-2-метил-индол-N-этилацетатом протекает в две стадии в соответствии со схемой, приведенной ниже. 2-(4-фторбензолсульфонил)-пиридин-3-карбоксальдегид может быть получен, как описано в WO 2009/090414.
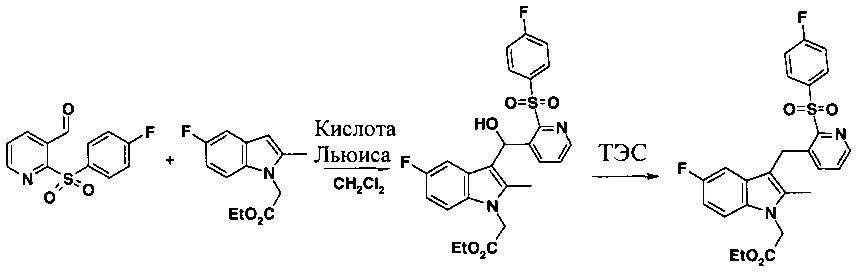
При осуществлении в лабораторном масштабе, способ, описанный в WO 2009/090414, приводит к получению материала хорошего качества с приемлемым выходом, но очень большое разбавление (50 объмов метиленхлорида) и высокая стоимость триметилсилилтрифторметансульфоната (TMSOTf) в качестве кислоты Льюиса не были признаны приемлемыми для производства в большем масштабе.
Испытания с применением TMSOTf проводили при более высокой концентрации (около 10 объемов растворителя на массу исходного индола), но в этих экспериментах промежуточный спирт осаждается в виде смолистого материала, который скапливается на лопастной мешалке. Это может привести к повреждению оборудования при более крупном масштабе. При более высоком разведении (50 объемов растворителя на массу исходного индола), нерастворимый материал все еще присутствует, но не скапливается на мешалке.
а) Этап 1 - Получение промежуточного спирта
Исследование проводили с целью определения, можно ли применять другие кислоты Льюиса вместо TMSOTf. ТФУ, трифторметансульфоновая кислота (трифлатная кислота), BF, AlCl, ZnBr - все указанные соединения привели или к высокому содержанию бис-индолильной примеси формулы:
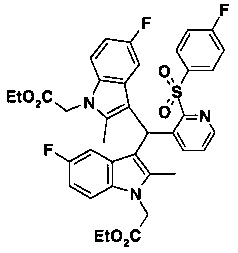
или к образованию нерастворимого смолистого материала. Тем не менее, при применении хлорида титана спиртовое промежуточное соединение осаждается в виде твердого вещества коричневого цвета, образующего перемешиваемую суспензию.
Результаты шести репрезентативных экспериментов представлены в таблице 1, ниже которой представлены профили ВЭЖХ (% площади пика) основных компонентов реакционных смесей до стадии восстановления. Все реакции проводили в 10-12 объемах метиленхлорида на массу индольного исходного вещества.
Исходные материалы вводили в течение 60-150 минут при температуре от -10 до +20°С. Было испытано несколько кислот Льюиса, и результаты показаны для AlCl3, ZnBr2 и TiCl4.
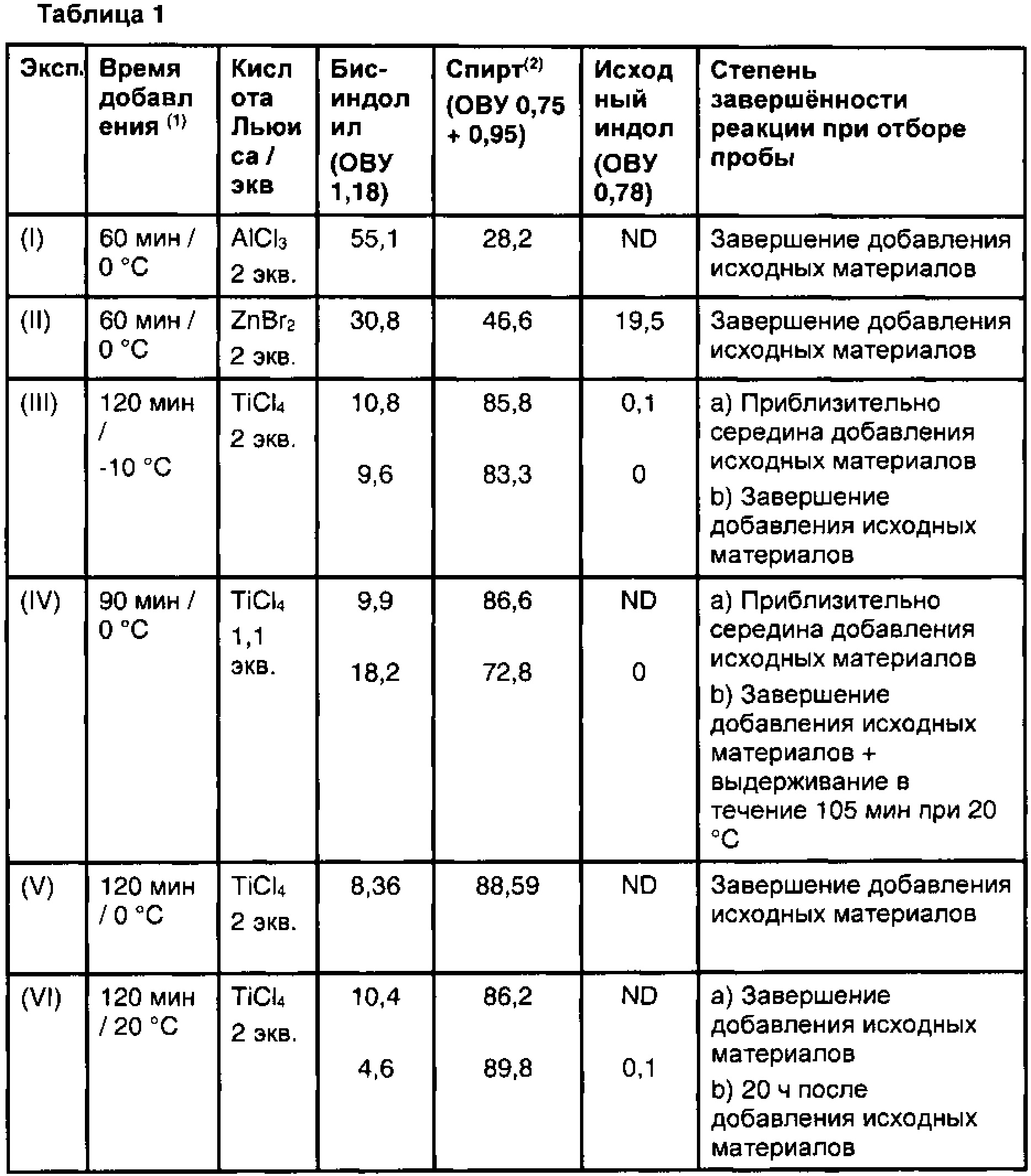
(1) т.е. время, необходимое для добавления исходных веществ и температура реакции при дозировании раствора альдегида и индола в кислоту Льюиса
(2) на хроматограммах ВЭЖХ видны два пика, которые исчезли во время стадии восстановления. Наибольший из них был идентифицирован как спирт с помощью ЖХ/МС. Значение в таблице представляет собой сумму % площади двух пиков.
При сравнении результатов экспериментов (I) и (II) с данными экспериментов от (III) до (VI) можно видеть, что количество бис-индолильной примеси было значительно выше, а количество спирта было значительно ниже при применении AlCl3 или ZnBr2 в качестве кислоты Льюиса, чем при использовании TiCl4.
Результаты экспериментов (III) (V) и (VI) показывают, что изменение температуры реакции в диапазоне от -10°С до 20°С не оказывает существенного влияния на аналитический профиль реакционной смеси.
В эксп. (IV), стехиометрия хлорида титана уменьшилась с 2,0 до 1,1, и это привело к образованию большего количества бис-индолильной примеси (~20%).
b) Этап 2 - восстановление промежуточного спирта с получением этилового сложного эфира [5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты
Восстановление проводили с 3 эквивалентами триэтилсилана (ТЭС) при комнатной температуре.
Стабильность промежуточного спирта
Основная примесь, которая образуется в ходе реакции, представляет собой бис-индолильный продукт, полученный в результате конденсации промежуточного продукта со вторым эквивалентом индольного исходного материала.
Считается, что при применении протонной кислоты реакция протекает, как показано на вышеприведенной схеме 3, где бис-индолильная примесь находится в равновесии со спиртом. С помощью некоторых кислот Льюиса, в частности TMSOTf, бис-индолильная примесь может быть полностью удалена на стадии восстановления путем добавления воды, что приводит к возврату к спирту и индольному исходному материалу. Тем не менее, это приводит к потере выхода.
Когда реакцию проводили с использованием TiCl4 в качестве кислоты Льюиса, неожиданно было обнаружено, что при определенных условиях бис-индолильный продукт может быть преобразован в требуемый продукт. Это позволило авторам настоящего изобретения предположить, что реакция может протекать через один или несколько альтернативных промежуточных продуктов вместо или в дополнение к спирту. Тем не менее, характер этих промежуточных продуктов не был исследован на настоящий момент.
Таким образом, в ходе исследования устойчивости реакционной смеси (Эксперимент VI) было показано, что при 20°С равновесие смещается в сторону обратной реакции преобразования бис-индолила до промежуточного продукта; что приводит через 24 ч перемешивания к содержанию бис-индолильного побочного продукта ниже 5%. При 40°С наблюдали разложение спирта.
Результаты всей реакции, включая результаты стадии восстановления, приведены ниже в таблице 2. Результаты представлены на стадии восстановления экспериментов (III), (V) и (VI) показанных в таблице 1 выше; вместе с дополнительными экспериментами с применением TMSOTf в качестве кислоты Льюиса. Все реакции проводили в 10-12 объемах метиленхлорида на массу индольного исходного материала, кроме эксперимента (IX), который был проведен в 50 объемах. При использовании способа с применением хлорида титана вязкость реакционной смеси возрастает во время восстановления и, следовательно, необходимо добавлять ТЭС медленно к реакционной смеси.
Наши результаты показывают, что применение TiCl4 или TMSOTf в качестве кислоты Льюиса не приводит к значительной разнице в содержании бис-индолила в конце стадии восстановления.
При применении TMSOTf добавление небольшого количества воды приводит к исчезновению бис-индолильной примеси в течение 1-3 часов, и к образованию индола исходного материала и требуемого продукта. Таким образом, хотя бис-индолильные примеси могут быть удалены без труда, таблица 2 показывает, что уменьшение выхода требуемого продукта и увеличение количества исходного индола наблюдается для экспериментов (VII), (VIII) и (IX) по сравнению с экспериментами (III), (V) и (VI).
При применении хлорида титана в качестве кислоты Льюиса, бис-индолил медленно переходит в промежуточное соединение, которое затем восстанавливается до требуемого продукта.
Профиль ВЭЖХ указанной реакционной смеси после восстановления является аналогичным или лучшим при применении хлорида титана вместо TMSOTf.
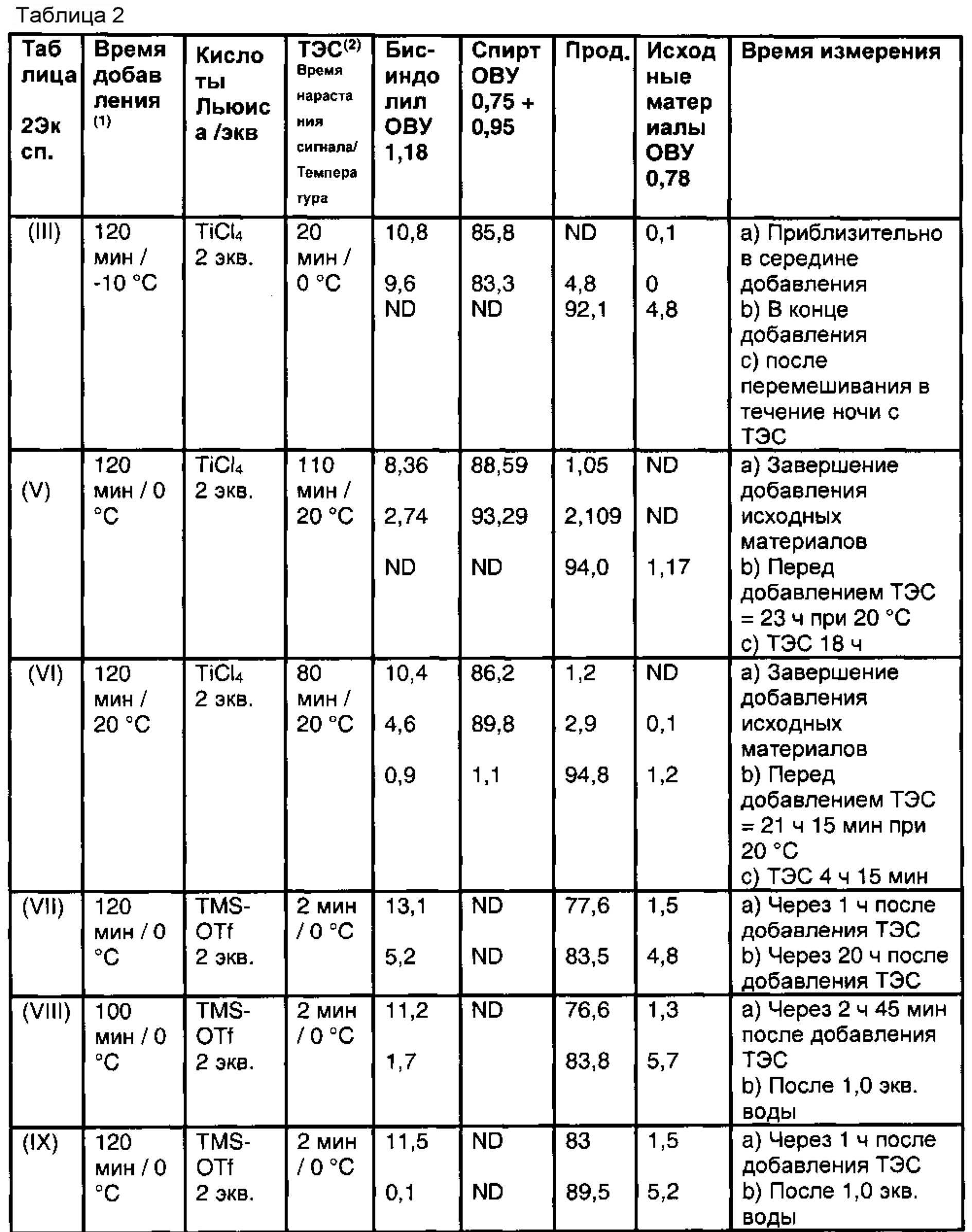
(1) т.е. время, необходимое для добавления исходных веществ и температура реакционной смеси при дозировании раствора альдегида и индола в кислоту Льюиса
(2) время дозирования ТЭС и температура реакционной смеси
Пример 3 - Получение этилового сложного эфира [5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты
Протокол эксперимента
В реактор помещают 1,612 кг TiCl4 (2 эквивалента по отношению к 5-фтор-2-метил-индол-N-этилацетату) и 5 л дихлорметана. Сосуд охлаждают до 0±3°С. В другом сосуде получают раствор 1 кг 5-фтор-2-метил-индол N-этилацетата и 1,18 кг 2-(4-фторбензолсульфонил)пиридин-3-карбоксальдегида (1,05 экв.) в 6 л дихлорметана и добавляют к раствору TiCl4 в течение 2 ч, поддерживая температуру на уровне 0±3°с (во время добавления наблюдается образование осадка). Сосуд промывают 1 л дихлорметана, который затем добавляют к реакционной смеси. Смесь нагревают до 20±3°С и выдерживают при этой температуре в течение 15 часов до завершения реакции.
К смеси добавляют 1,483 кг триэтилсилана (3 экв.) при температуре 20±3°С, в течение примерно 2 часов. Сосуд для загрузки и линии промывают 0,5 л дихлорметана, который добавляют к реакционной смеси, и суспензию выдерживают при 20±3°С в течение 4 часов до завершения реакции по данным ВЭЖХ.
Выделение продукта реакции
Суспензию охлаждают до 0-5°С и быстро добавляют 4 литра воды, поддерживая температуру ниже 20°С. Водный слой отделяют и промывают 2 л дихлорметана. Органические слои объединяют и промывают 3 л воды и затем водным раствором бикарбоната натрия (9 масс. %), пока pH водной фазы не достигнет 8,0±1. Водный слой отбрасывают, а органическую фазу дополнительно промывают 2 л воды и проверяют pH (pH=8,0±1). Целью в этот момент является нейтрализация HCl, образовавшейся в результате гидролиза тетрахлорида титана.
Органический слой сушат путем азеотропной перегонки при атмосферном давлении. Высушенный раствор фильтруют в другой сосуд и фильтрат концентрируют до остаточного объема примерно 6 литров (6 об.). Затем добавляют этанол (6 литров), поддерживая температуру выше 50°С и смесь концентрируют до остаточного объема примерно 6 литров. Продукт кристаллизуется в ходе концентрирования. Добавляют еще 2 литра этанола и суспензию снова концентрируют до 6 литров. В конце этой стадии температура в верхней части дистилляционной колонны превышает 76°С.
Суспензию охлаждают до 20±3°С и фильтруют. Влажный осадок на фильтре дважды промывают 3 л этанола при 20±3°С, сушат на воздухе и переносят в вакуумную сушилку. Продукт сушат при 55°С в вакууме.
Выход = 85±7%.
Метод в большем масштабе
Реакцию, описанную выше, проводили с использованием 8 кг 5-фтор-2-метил-индол-N-этилацетата и 9,5 кг 2-(4-фторбензолсульфонил)-пиридин-3-карбоксальдегида в 48 л дихлорметана, который был добавлен к 12,9 кг тетрахлорида титана в 40 л дихлорметана. Во время введения исходных материалов промежуточный спирт выпал в осадок, но смесь не стала слишком густой и перемешивание оставалось эффективным. Количество триэтилсилана, применявшееся для восстановления, составляло 12 кг. Количество полученного этилового сложного эфира [5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метилиндол-1-ил]-уксусной кислоты составило 13,8 кг, общий выход составил 84,2%. Чистота продукта составляла 99% площади пика по ВЭЖХ или 96,1 масс. %..
Следующее опытное испытание проводили с использованием 7,7 кг 5-фтор-2-метил-индол-N-этилацетата и 9,1 кг 2-(4-фторбензолсульфонил)-пиридин-3-карбоксальдегида в 46 л дихлорметана, который был добавлен к 12,4 кг тетрахлорида титана в 39 л дихлорметана. Количество триэтилсилана, применявшееся на стадии восстановления, составляло 11,4 кг.
Было получено 13,5 кг (выход 85,6%) продукта, и анализ показал, что чистота продукта составляла 99% площади пика по ВЭЖХ или 98,2 масс. %.
Таким образом, было показано, что способ согласно изобретению позволяет получить продукт с выходом, систематически превышающим 80%, чистота которого систематически превышает 95 масс. %.
Полученный продукт может быть преобразован в [5-фтор-3-({2-[(4-фторбензол)сульфонил]пиридин-3-ил}метил)-2-метил-индол-1-ил]-уксусную кислоту с применением способа, описанного в WO 2009/090414.
Сравнительный пример 4 - Синтез этилового сложного эфира (3-{[2-(бензолсульфонил)пиридин-3-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты с применением TMSOTf
Эксперимент был проведен с применением способа, аналогичного описанному в WO 2009/090414 с применением TMSOTf в качестве кислоты Льюиса для сочетания 5-фтор-2-метил-индол-N-этилацетата и 2-(бензолсульфонил)-пиридин-3-карбоксальдегида с последующим восстановлением с помощью ТЭС. 2-(бензолсульфонил)-пиридин-3-карбоксальдегид получали в соответствии со способом, аналогичным приведенному в WO 2009/090414.
Раствор TMSOTf (31,0 г, 0,139 моль) в дихлорметане (310 мл) охлаждали до температуры -5°С в атмосфере азота. Раствор 5-фтор-2-метил-индол N-этилацетата (10,92 г, 0,046 моль) и 2-(бензолсульфонил)-пиридин-3-карбоксальдегида (11,46 г, 0,046 моль) в дихлорметане (310 мл) добавляли к раствору трифлата в течение 40 мин, поддерживая температуру при 0°С. Реакционную смесь выдерживали в течение еще 30 мин, затем добавляли триэтилсилан (16,2 г, 0,140 моль) и нагревали до температуры окружающей среды. Добавляли раствор бикарбоната натрия (насыщенный, 225 мл), фазы разделяли и органическую фазу промывали водой (100 мл), затем концентрировали досуха. Некоторое количество надосадочной жидкости удаляли из масла путем декантации и остаточное масло растирали в порошок с водой (140 мл) с получением твердого вещества. Твердое вещество растворяли в ацетоне (90 мл) при температуре 50°С и кристаллизовали путем добавления воды (35 мл) при 0°С. Продукт фильтровали и сушили в вакуумной печи в течение ночи с получением требуемого продукта (14,7 г, 68%). ЖХ-МС анализ показал, что продукт является однокомпонентным.
Из-за высокой необходимой степени разбавления и низкого выхода, достигнутого при применении этого способа, был предпринят альтернативный синтез с применением тетрахлорида титана, а не TMSOTf, в качестве кислоты Льюиса.
Пример 5 - Синтез этилового сложного эфира (3-{[2-(бензолсульфонил)пиридин-3-ил]метил}-5-фтор-2-метилиндол-1-ил)-уксусной кислоты с применением тетрахлорида титана в качестве кислоты Льюиса
Повторяли способ из примера 3 с применением 2-(бензолсульфонил)-пиридин-3-карбоксальдегида вместо 2-(4-фторбензолсульфонил)пиридин-3-карбоксальдегида в качестве исходного материала. Указанное соединение может быть получено способом, приведенными в WO 2009/090414. Сначала реакцию проводили в масштабе 11 г 2-(бензолсульфонил)-пиридин-3-карбоксальдегида, а затем повторяли в масштабе 150 г и 230 г. Способ для эксперимента с масштабом 150 г состоит в следующем.
Тетрахлорид титана (219,2 г, 1,155 моль, Aldrich 99,9%) растворяли в ДХМ (0,54 л) и охлаждали до -5°С. Добавляли раствор 2-(бензолсульфонил)-пиридин-3-карбоксальдегида (150,0 г, 0,607 моль) и 5-фтор-2-метил-индол-N-этилацетата (135,9 г, 0,578 моль) в дихлорметане (0,81 л) в течение 2-х часов 10 минут, поддерживая температуру ниже 0°С (обычно -1°С). Реакционную смесь выдерживали в течение еще 2 ч, пока смесь превращается в густую суспензию. ТСХ (этилацетат/гептан 1:1) и ЖХ-МС показали полное расходование исходных материалов. Добавляли триэтилсилан (201,5 г, 1,737 моль, Aldrich 99%) в течение 2-х часов, поддерживая температуру на уровне 20-25°С, а затем перемешивали при 20-25°С в течение ночи. Наблюдалось потемнение реакционной смеси во время добавления восстановителя. Реакционную смесь охлаждали до 0-5°С и добавляли воду (0,54 л) для сохранения экзотермы на уровне <15°С. Твердые вещества, растворяли в ходе добавления воды и разделяли полученную водную и органическую фазы. Органическую фазу последовательно промывали водой (0,70 л), бикарбонатом натрия (насыщенный 2×0,50 л) и водой (0,50 л). Органический раствор продукта концентрировали до половины объема и добавляли этанол (1,30 л) с последующей кристаллизацией продукта. Объем суспензии снова концентрировали до половины объема и затем разбавляли дополнительным количеством этанола (0,75 л). Суспензию перемешивали в течение 1 ч при 20-25°С, фильтровали и осадок на фильтре промывали этанолом (0,30 л), затем сушили в вакууме при температуре <40°C с получением продукта в виде белого твердого вещества (213,5 г, выход 79%). ВЭЖХ-анализ показал 99,6% площади пика требуемого продукта с тремя примесями при относительном времени удерживания 0,15 (0,06%), 0,87 (0,08%) и 1,07 (0,25%).
Способ согласно настоящему изобретению представляет собой значительное улучшение по сравнению со способами, описанными в предыдущих документах, поскольку он в общем случае применим ко многим различным индольным производным уксусной кислоты, в отличие от способов с применением ТФУ. Кроме того, реакция может быть проведена с использованием значительно сниженного количество растворителя по сравнению со способами с применением TMSOTf в качестве кислоты Льюиса, и в указанной реакции выход продукта более высокий.