ПЕПТИДЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к пептидам, по меньшей мере часть которых получена из рецептора гормона, стимулирующего деятельность щитовидной железы (здесь и далее тиреотропного гормона) (ТТГР). Указанные пептиды могут быть полезны для профилактики и/или лечения болезни Грейвса (БГ).
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Болезнь Грейвса характеризуется гиперактивностью щитовидной железы, результатом которой является продуцирование избыточного количества тиреоидного гормона и увеличение щитовидной железы (зоб). Возникающее состояние гипертиреоидизма может стать причиной широкого круга нейрофизиологических и физических симптомов. Болезнь Грейвса является наиболее общим случаем гипертиреоидизма (60-90% из всех случаев) и обычно проявляет себя в среднем возрасте, но также встречается у детей, подростков и лиц преклонного возраста. Она поражает вплоть до 2% женского населения, и встречается в пять-десять раз чаще у женщин, чем у мужчин. Педиатрическая болезнь Грейвса поражает около 6000 детей в США и 6000 детей в Европе. БГ является также наиболее частой причиной тяжелого гипертиреоидизма, который сопровождается более выраженными клиническими признаками и симптомами и лабораторными аномалиями по сравнению с менее тяжелыми формами гипертиреоидизма.
С болезнью Грейвса связан сильный наследственный компонент. В настоящее время не существует популяционных исследований в отношении БГ, однако, существует несколько квази-популяционных исследований гипертиреоидизма, и все они лишь приблизительно оценивают частоту возникновения и преобладания болезни Грейвса. Число случаев гипертиреоидизма варьируется от 26:100000 до 93:100000 и полное их преобладание оценивают как 1,3%, причем 42% случаев являются клинически выраженными и 62% являются субклиническими.
Около 30-50% людей с БГ также будут страдать офтальмопатией Грейвса (ОГ), экзофтальмом одного или обоих глаз. Множество случаев ОГ являются умеренными и локальными, однако в 20% случаев представляют собой существенное/умеренное до тяжелого заболевание, причем по меньшей мере половина из них требует использования стероидов, и 3-5% из пациентов с ОГ имеют заболевание с болевым синдромом, угрожающее потерей зрения, с дистиреоидной оптической невропатией (ДОН). Выпячивание глаз может стать причиной сильной сухости роговицы, так как веки глаз не способны закрываться ночью. Повышенное давление глазного нерва может привести к дефектам зрительного поля и к потере зрения. ОГ также может быть связана с ограниченной микседемой кожи.
Все симптомы и признаки БГ виртуально проистекают из прямых и косвенных эффектов гипертиреоидизма, причем основными исключениями являются ОГ, зоб и ограниченная микседема кожи. Симптомы гипертиреоидизма могут включать бессонницу, тремор рук, гиперактивность, выпадение волос, избыточную потливость, непереносимость тепла и потерю массы, несмотря на повышенный аппетит. Дополнительными признаками чаще всего являются диффузно увеличенная (обычно симметрично) нечувствительная щитовидная железа, ретракция верхнего века, избыточная слезоточивость, вызванная офтальмопатией Грейвса, сердечная аритмия и гипертония. Тиреотоксические пациенты могут испытывать поведенческие и персональные изменения, такие как психозы, возбуждение и депрессия. В случае умеренного гипертиреоидизма пациенты могут испытывать менее очевидные проявления, например, тревогу, беспокойство, раздражительность и эмоциональную лабильность.
В настоящее время не существует способов лечения БГ, и существующие в настоящее время способы лечения поэтому направлены на выявленные симптомы. Существуют три способа лечения БГ: оральные антитиреоидные лекарственные средства (АТЛС), радиоактивный йод (РАИ) и удаление щитовидной железы. Два последних подхода приводят к необходимости в течение жизни дополнительно принимать тиреоидные гормоны. В Соединенных Штатах наиболее часто используют лечение радиоактивным йодом, тогда как в Европе, Японии и в большинстве других стран применяют в первую очередь АТЛС.
АТЛС терапия связана с некоторыми редкими побочными эффектами, и процент пациентов с клинической ремиссией достигает 50-60%.
Растет понимание того, что метод РАИ может вызвать или осложнить активную ОГ, и число пациентов, которых лечат АТЛС в Соединенных Штатах возрастает.
Из-за переменных успехов каждого из способов лечения, пациентов часто подвергают более чем одному способу лечения, если не доказано, что первые попытки лечения оказались полностью успешными. Риск рецидива и последующего гипотиреоидизма является существенным, и общая эффективность доступных способов лечения БГ далека от желаемой. Таким образом, существует необходимость в альтернативных способах лечения БГ, которые были бы эффективны при лечении БГ и ослабляли бы или уменьшали симптомы заболевания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
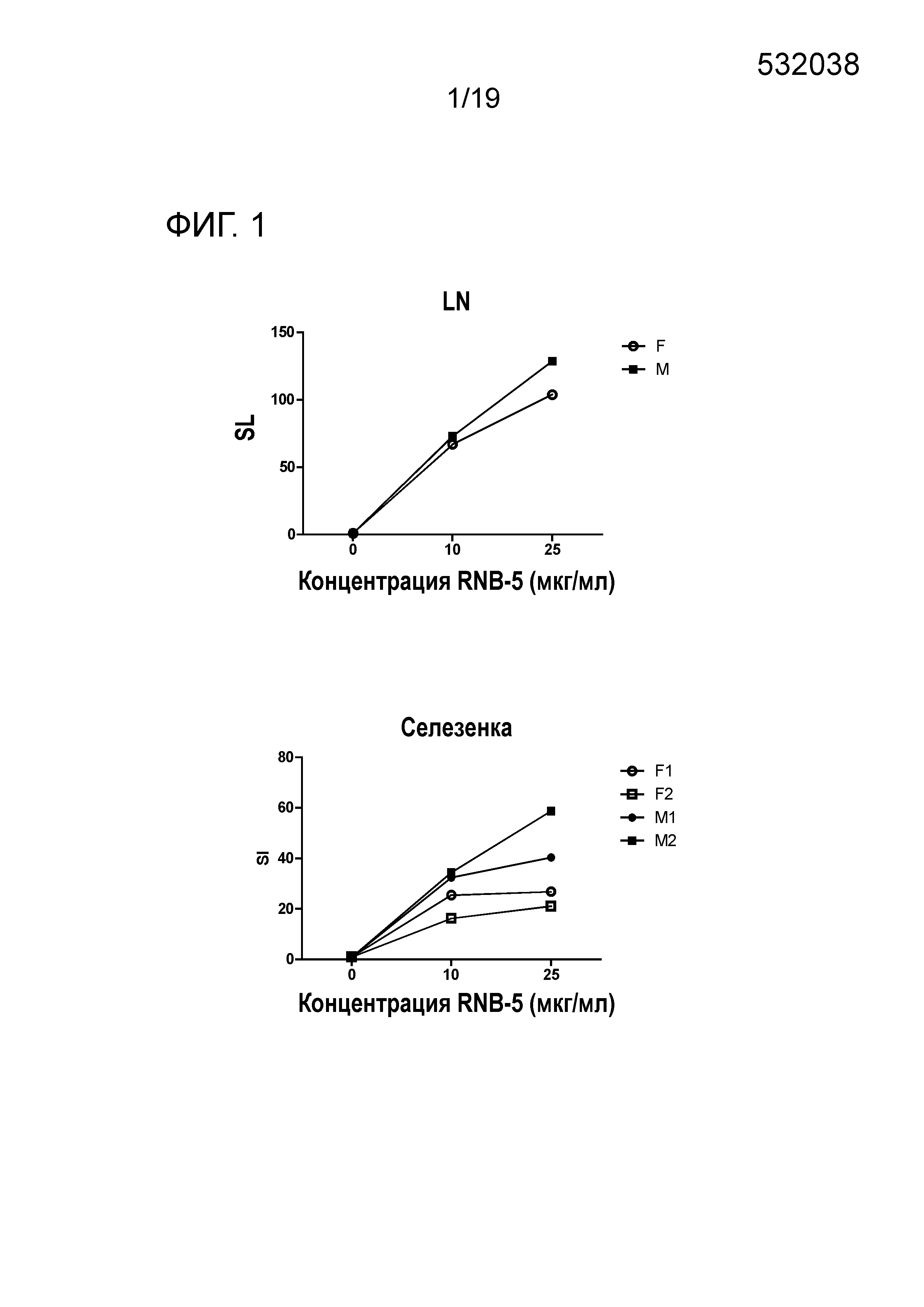
ФИГ. 1: Иммуногенность RNB-5 у DR3 мышей. Мышей (N=2 самцы; N=2 самки) примируют RNB-5, и через 10 дней LN клетки (объединенные по гендерному признаку) и спленоциты культивируют с различными концентрациями пептида и измеряют Т-клеточную пролиферацию. Индексы стимуляции (ИС) представляют собой отношение включения тимидина в пептид-стимулированной культуре к включению тимидина в нестимулированной культуре. F, самки; M, самцы; LN, лимфатические узлы.
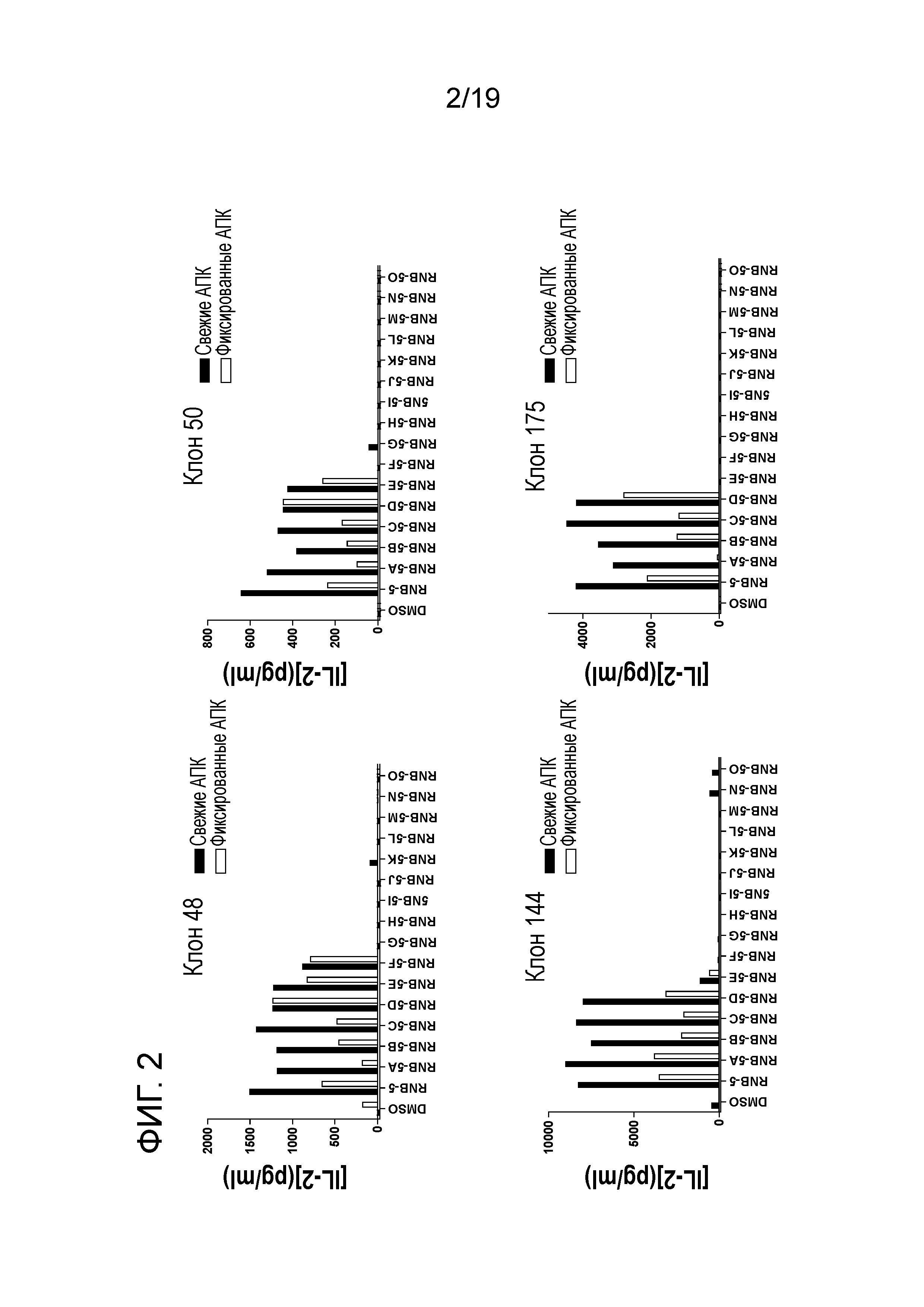
ФИГ. 2: Идентификация апитопов в RNB-5. DR3 мышей иммунизируют RNB-5/CFA и создают гибридомы. 5×l04 ТТГР-специфических гибридомных клеток культивируют с 5×104 свежими (зачерненные прямоугольники) или фиксированными (пустые прямоугольники) VAVY клетками и 25 мкг/мл антигена (RNB-5 или RNB-5 нестед пептиды). Показаны представительные клоны. Через 48 часов измеряют продуцирование антиген-индуцированных IL-2. График изображает среднее из дубликатных измерений, и результаты представлены из 2 независимых экспериментов. АПК, антиген-представляющие клетки.
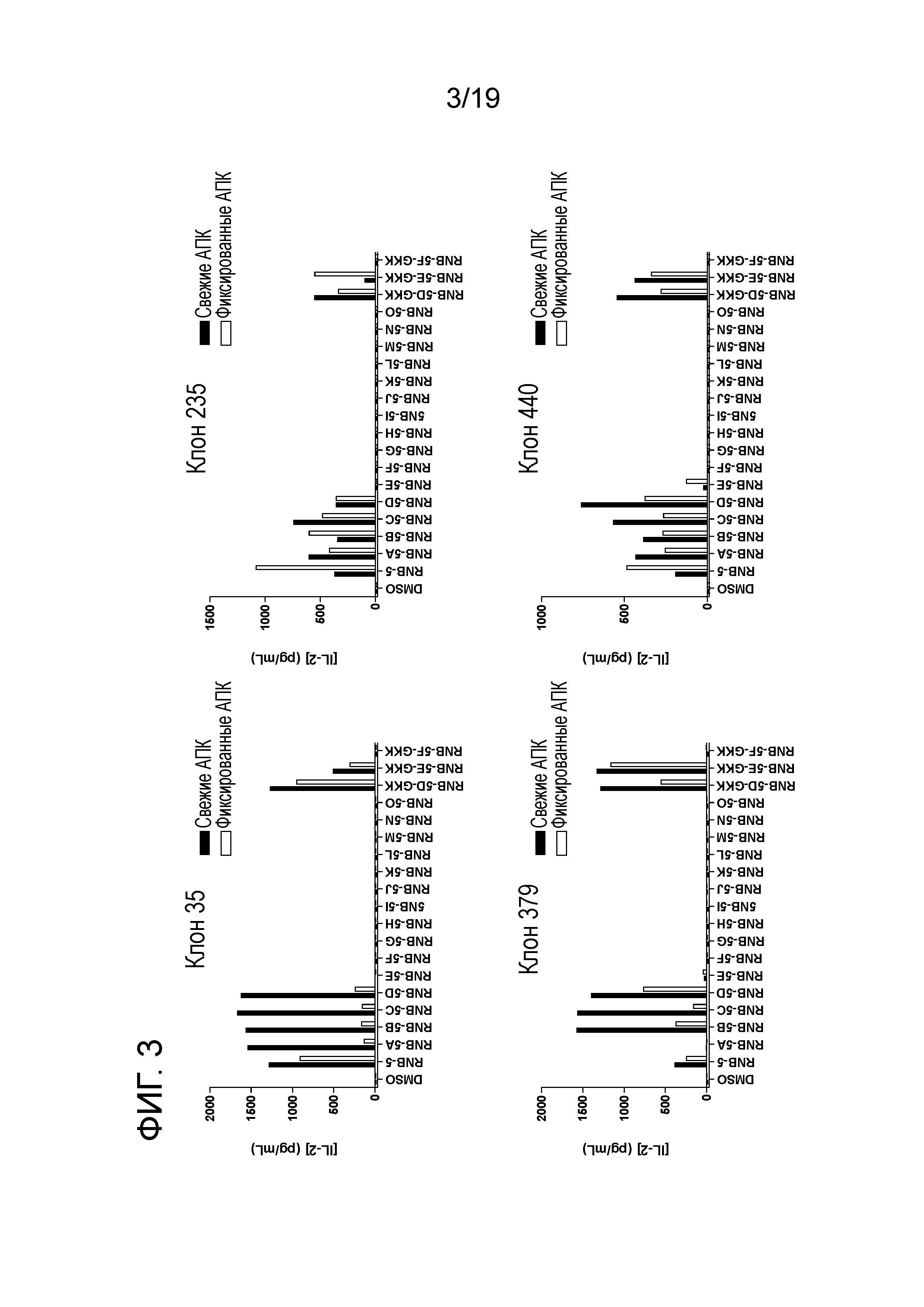
ФИГ. 3: Идентификация апитопов в RNB-5. DR4 мышей иммунизируют ТТГР/CFA, и создают гибридомы. 5xl04 ТТГР-специфических гибридомных клеток культивируют с 5xl04 свежими (зачерненные прямоугольники) или фиксированными (пустые прямоугольники) BM14 клетками и 25 мкг/мл антигена (ТТГР, RNB-5 или RNB-5 нестед пептиды). Изображены представительные клоны. Через 48 часов измеряют продуцирование антиген-индуцированных IL-2. График представляет собой среднее из дубликатных измерений. АПК, антиген-представляющие клетки.
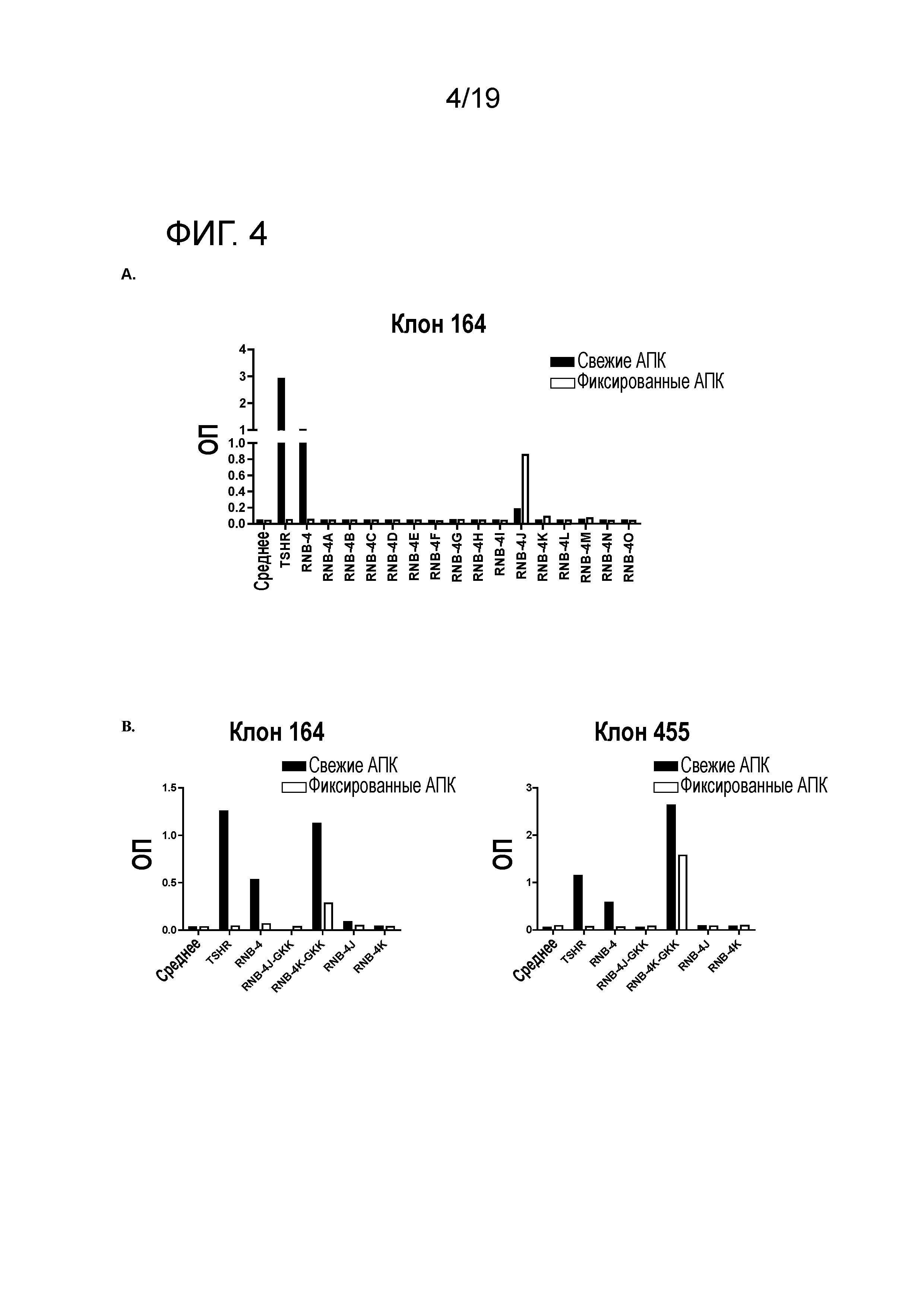
ФИГ. 4A: Идентификация апитопов в RNB-4. DR4 мышей иммунизируют ТТГР/CFA, и создают гибридомы. 5×104 ТТГР-специфических гибридомных клеток культивируют с 5×104 свежими (зачерненные прямоугольники) или фиксированными (пустые прямоугольники) BM 4 клетками и 25 мкг/мл антигена (ТТГР, RNB-4 или RNB-4 нестед пептида). Изображены представительные клоны. Через 48 часов измеряют продуцирование антиген-индуцированных IL-2 и представляют как значения OD. График представляет собой среднее из дубликатных измерений, и результаты представляют 3 независимых измерения. АПК, антиген-представляющие клетки.
ФИГ. 4B: Идентификация апитопов в RNB-4. DR4 мышей иммунизируют ТТГР/CFA и создают гибридомы. 5×l04 ТТГР-специфических гибридомных клеток культивируют с 5×l04 свежими (зачерненные прямоугольники) или фиксированными (пустые прямоугольники) BM14 клетками и антигеном (25 ТТГР из RNB-4; 100 мл RNB-4 нестед пептида). Через 48 часов измеряют продуцирование антиген-индуцированных IL-2 и представляют как OD значения.
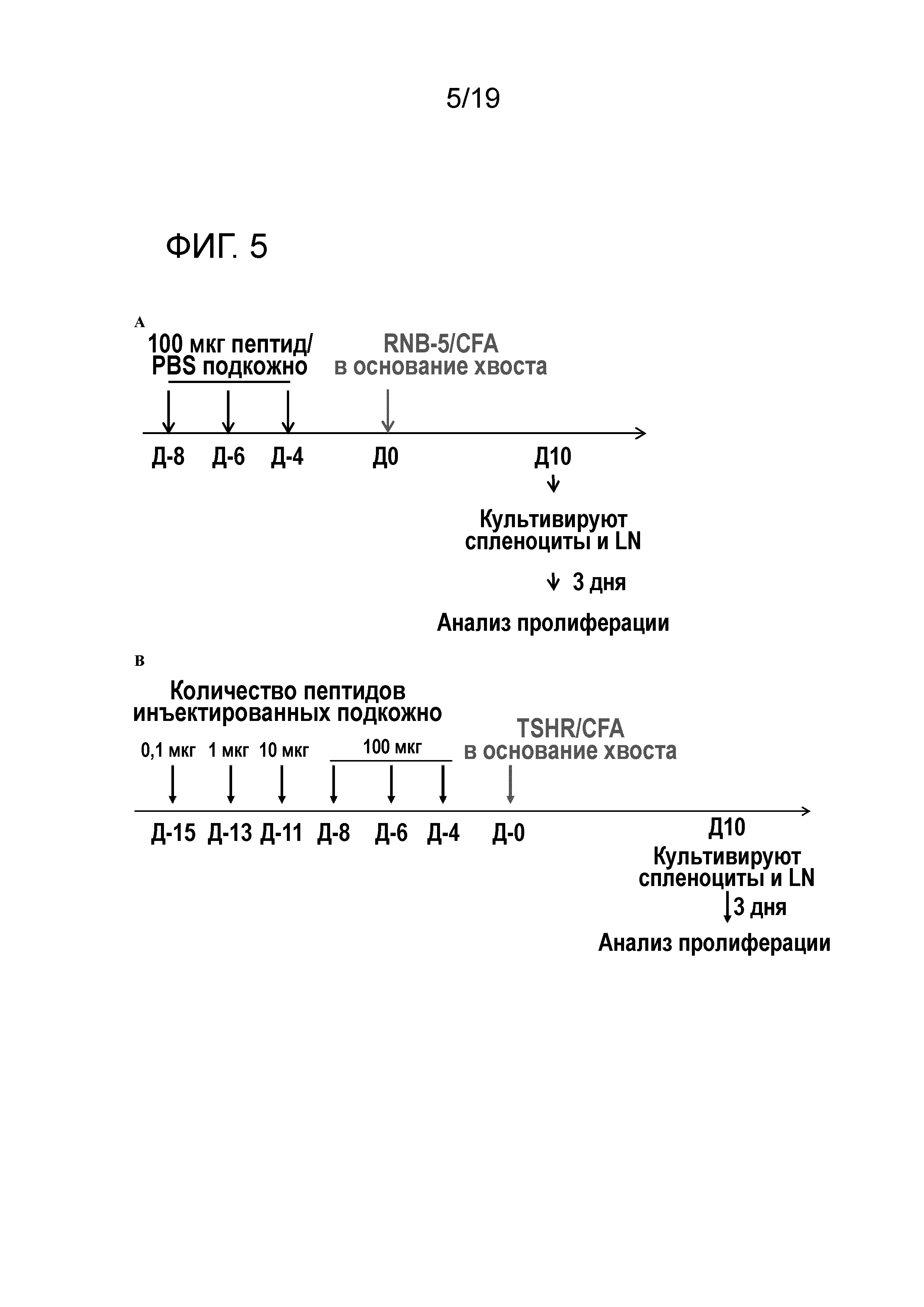
ФИГ. 5: Протокол ex vivo толеризации. A, Мышам подкожно вводят в затылочную часть шеи 100 мкг пептида в дни -8, -6 и -4 (схема высоких доз). В день 0, мышам подкожно вводят в основание хвоста RNB-5/CFA. B, Мышам подкожно вводят в затылочную часть шеи 0,1 мкг, 1 мкг и 10 мкг пептида в дни -15, -13 и -11, с последующими тремя инъекциями 100 мкг пептида в дни -8, -6 и -4 (схема увеличивающихся доз). В день 0, мышам подкожно вводят в основание хвоста ТТГР/CFA или пептид/CFA. В обеих схемах мышей умерщвляют через 10 дней после иммунизации для измерения пролиферации LN клеток и спленоцитов после повторной стимуляции ТТГР.
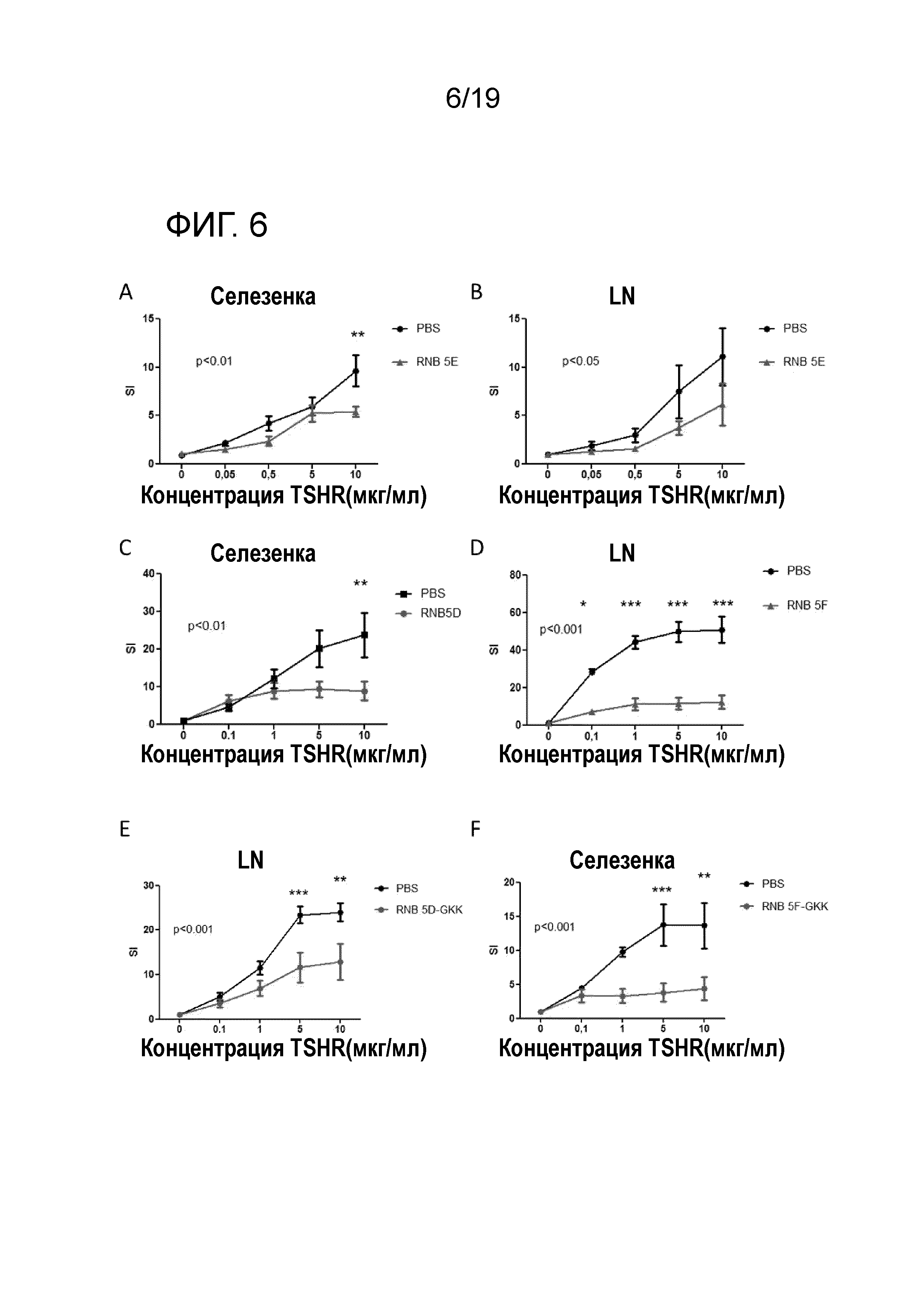
ФИГ. 6: Ex vivo толерантность, индуцированная RNB-5 апитопами. Мышей предварительно обрабатывают, используя RNB-5 апитопы по схеме высоких доз (A-B) или по схеме увеличивающихся доз (C-F). Результаты представляют как среднее ± SEM значения ИС для PBS-обработанных мышей (черные линии) и для пептидом обработанных мышей (красные линии). Графики A, B, C, E и F представляют результаты экспериментов, осуществленных на DR3 мышах, график D представляет эксперимент, осуществленный на DR4 мышах. Двухфакторный дисперсионный анализ ANOVA используют для определения эффектов полной обработки в отношении T-клеточной пролиферации, и на графиках указаны p-значения. Используют пост-хок тестирование Бонферрони, и значимые различия указаны на графиках (* p<0,05; ** p<0,01; *** p<0,001). SI, индекс стимуляции; LN, лимфатические узлы.
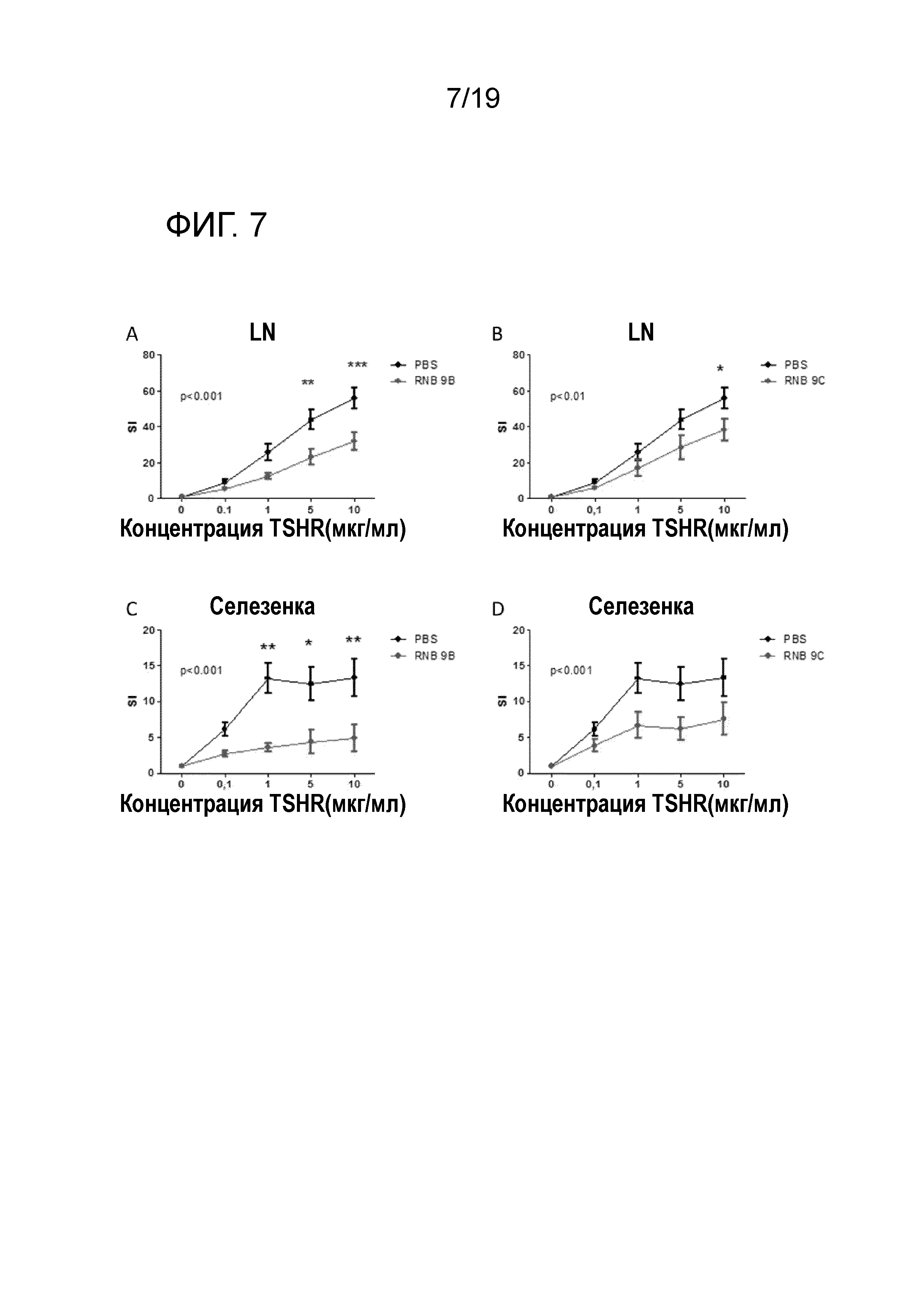
ФИГ. 7: Индуцирование ex vivo толерантности с использованием RNB-9 пептидов. DIG мышей предварительно обрабатывают в соответствии со схемой увеличивающихся доз, используя RNB-9B (A,C) или RNB-9C (B,D). Результаты представляют как среднее ± SEM из ИС значений для PBS-обработанных мышей (черные линии) и пептидом обработанных мышей (красные линии). Двухфакторный дисперсионный анализ ANOVA используют для определения влияния полных эффектов обработки в отношении T-клеточной пролиферации, и p-величины указаны на графиках. Используют пост-хок тестирование Бонферрони и значимые различия указаны на графиках (* p<0,05; ** p<0,01; *** p<0,001). SI, индекс стимуляции; LN, лимфатические узлы.
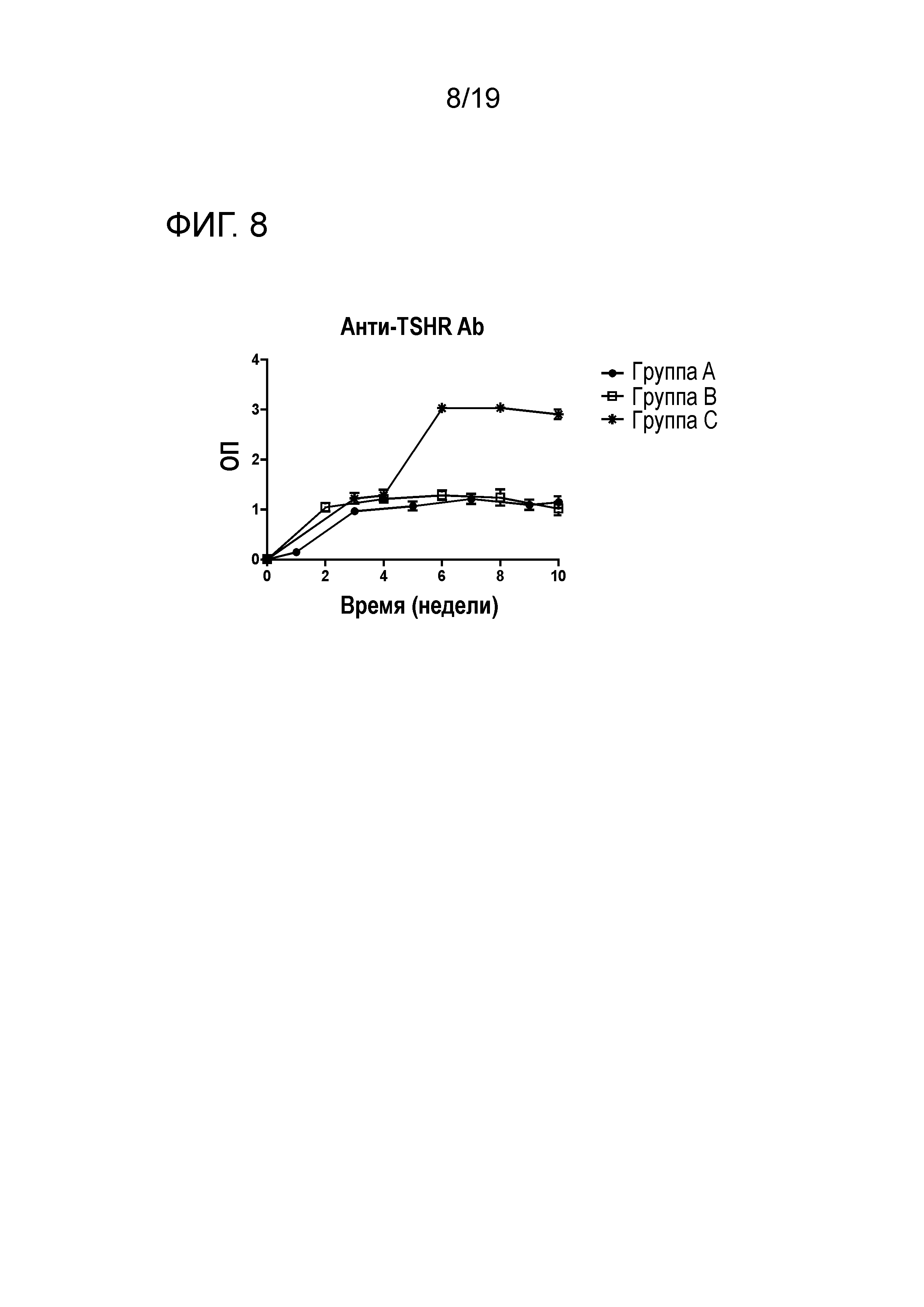
ФИГ. 8: Уровни ТТГР антител (полный IgG), определенные с помощью ELISA. Мышей иммунизируют один раз (группа A+B) или дважды (группа C), используя 50 мкг ТТГР в адъюванте. OD значения представлены для группы как среднее ± SEM.
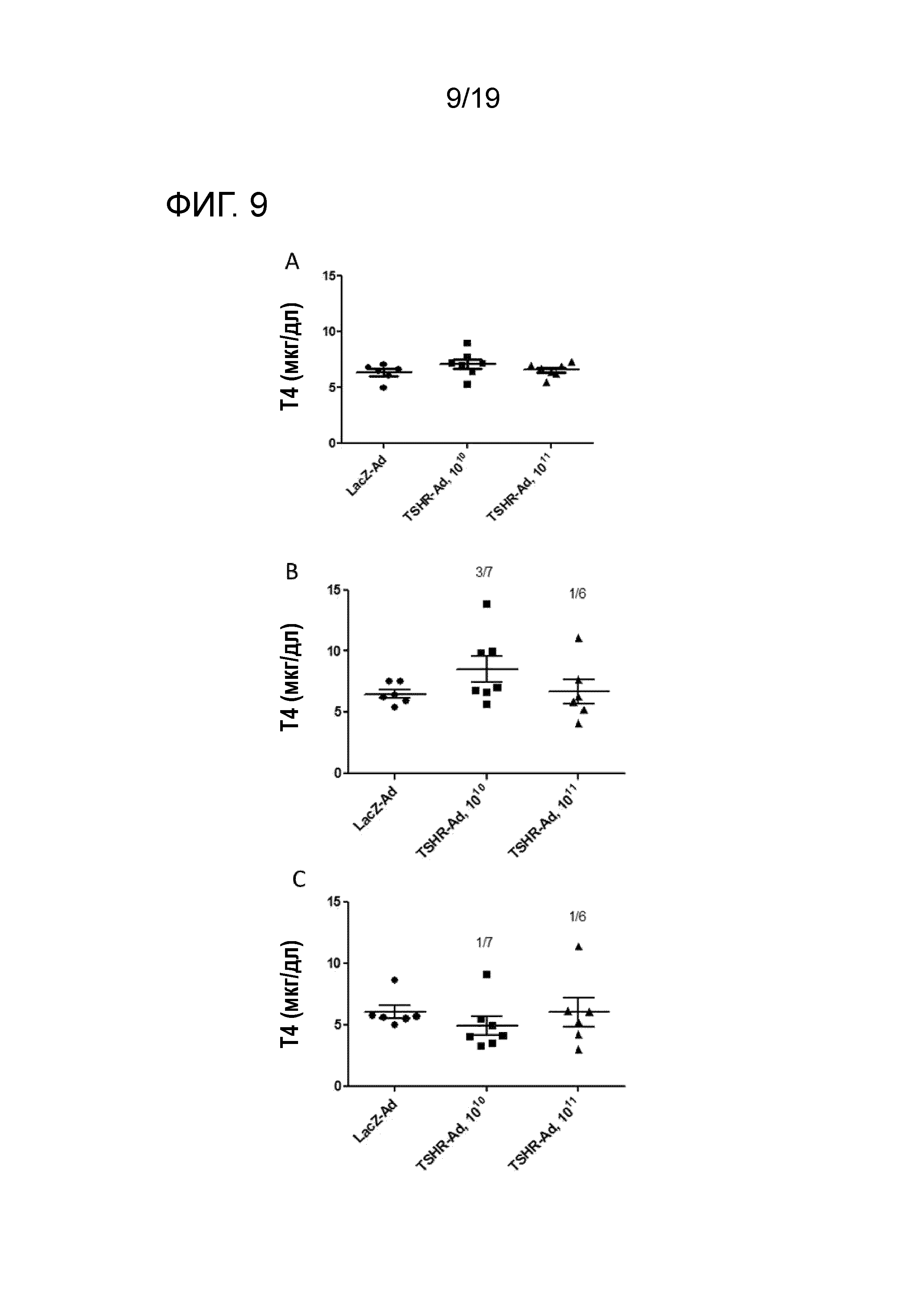
ФИГ. 9: Уровни сыворотки T4 у LacZ-Ad и Ad-ТТГР-Ad иммунизированных мышей. Результаты представлены как индивидуальные значения для мышей из различных групп до (A), через 4 недели после (B) и через 10 недель после (C) первой иммунизации. Указано число гипертиреоидных особей по отношению к полному числу для каждой группы. Мышей признают больными гипертиреоидозмом, когда у них уровни T4 превышают среднее+2SD для значений T4 в сыворотке у LacZ-Ad иммунизированных мышей. Средние уровни T4 существенно не отличаются для мышей, которым вводят ТТГР-Ad и LacZ-Ad через 4 или 10 недель. Однофакторный дисперсионный анализ ANOVA, пост-хок тестирование Бонферрони, p<0,05 признают значительным различием.
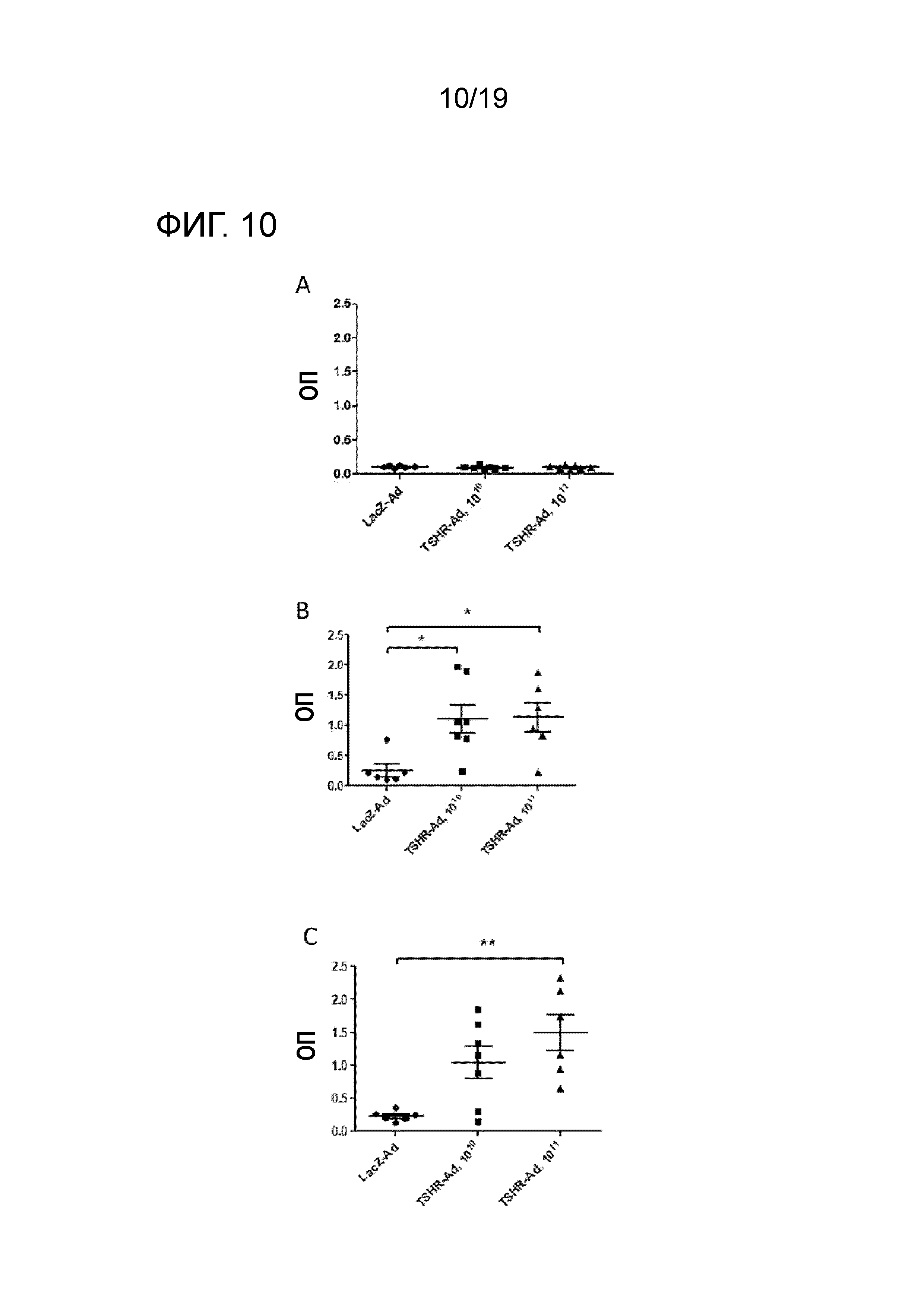
ФИГ. 10: Уровни анти-ТТГР антител (полный IgG, ELISA) у LacZ-Ad и ТТГР-Ad иммунизированных мышей. Результаты представлены как индивидуальные значения для мышей из различных групп до (A), через 4 недели после (B) и через 10 недель после (C) первой иммунизации. Статистический анализ осуществляют, используя однофакторный дисперсионный анализ ANOVA и пост-хок тестирование Бонферрони. Значимые различия указаны на графиках (* p<0,05; ** p<0,01).
ФИГ. 11: Реакция ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D модифицированные пептиды. Гибридомные клоны (представлены различным цветами) культивируют со свежими АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2. Замена аминокислот в центральных участках RNB-5D-GKK или RNB-5D-KKK хамперами распознавания гибридомными клонами, свидетельствует о том, что указанные аминокислоты являются важными в эпитопном участке.
ФИГ. 12: Реакция ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D модифицированные пептиды. Гибридомные клоны (представлены различными цветами) культивируют со свежими (зачерненные прямоугольники) или фиксированными (пустые прямоугольники) АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2.
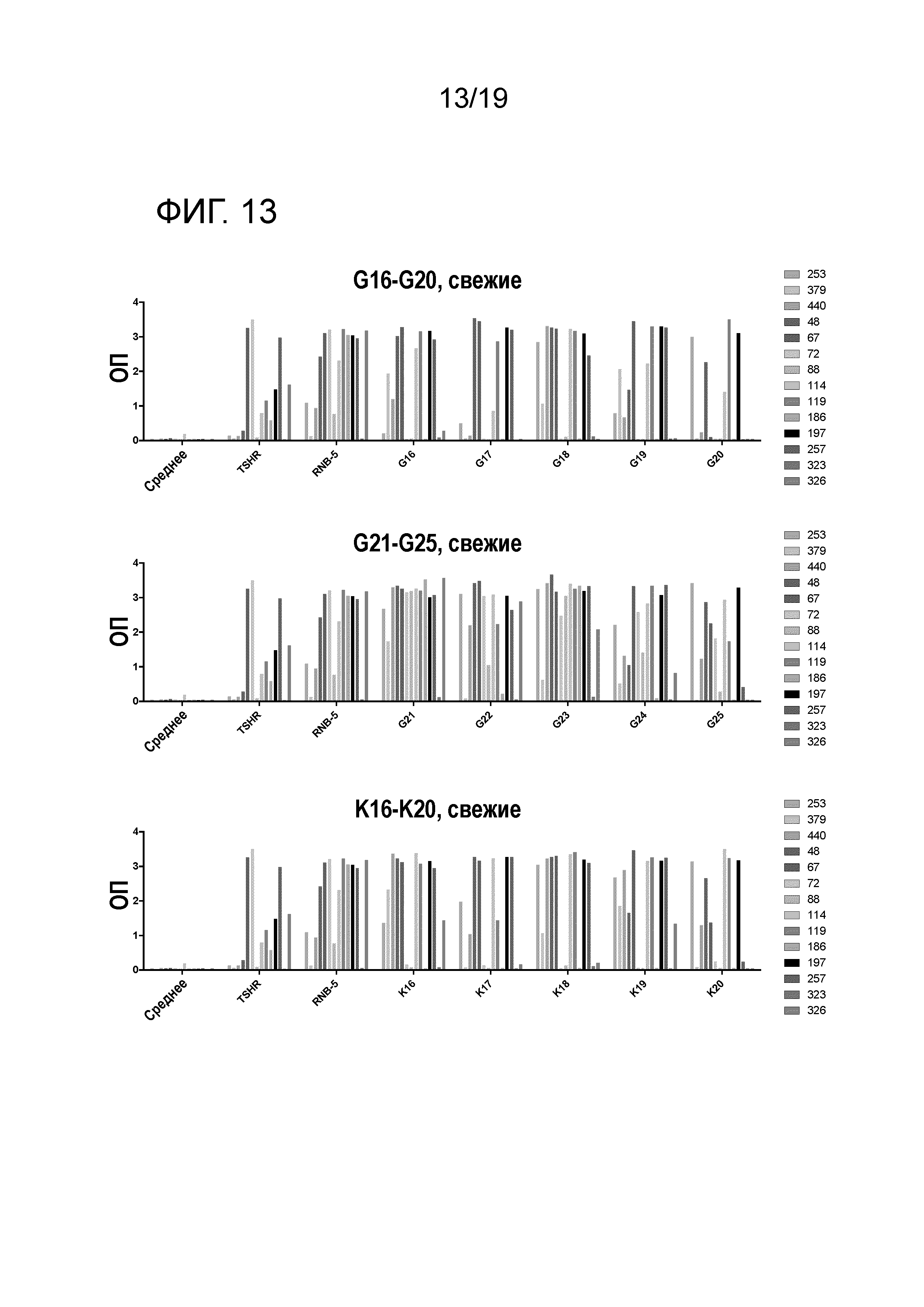
ФИГ. 13: Реакция ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D модифицированные пептиды. Гибридомные клоны (представлены различными цветами) культивируют со свежими АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2.
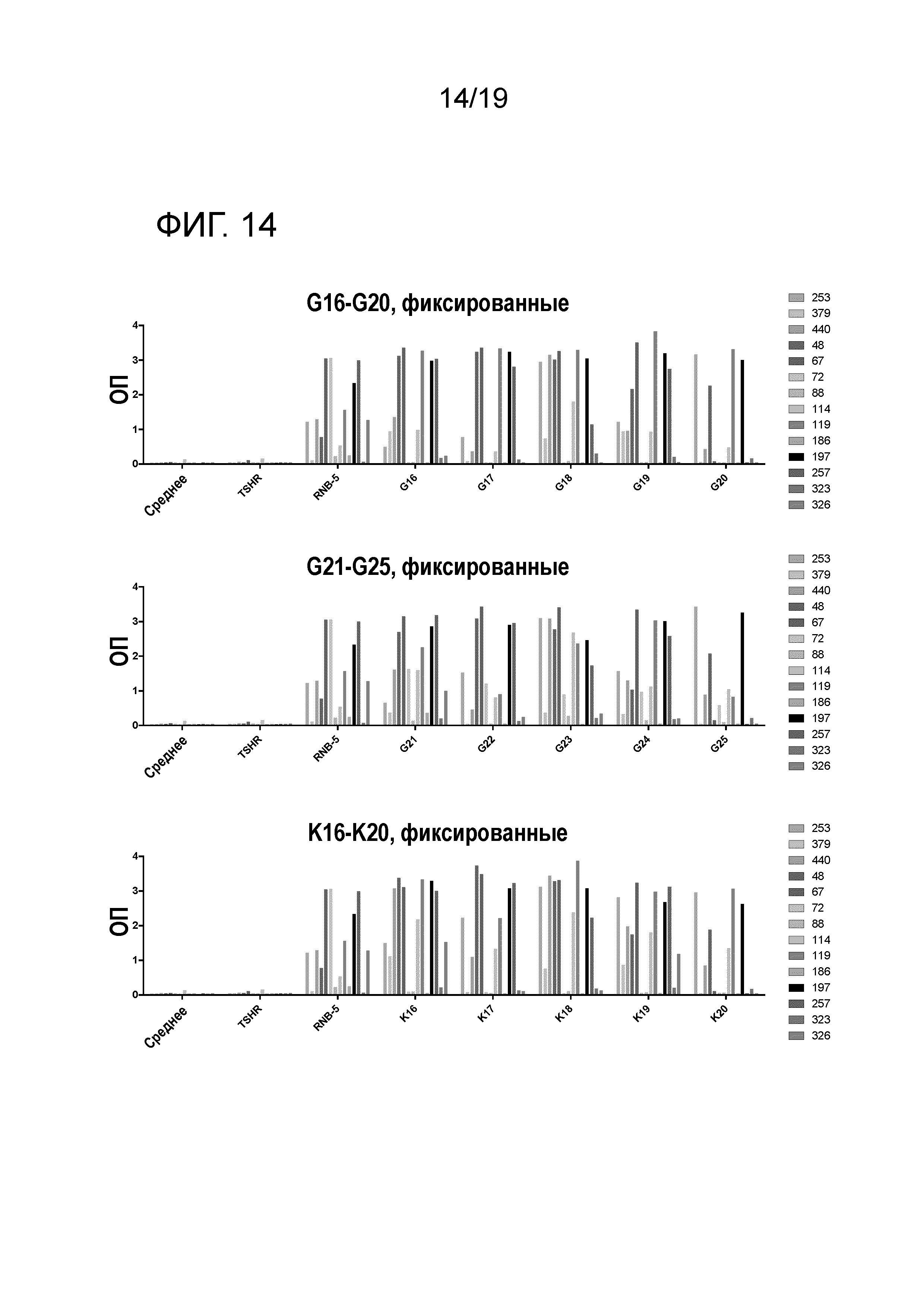
ФИГ. 14: Реакция ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D модифицированные пептиды. Гибридомные клоны (представлены различными цветами) культивируют с фиксированными АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2.
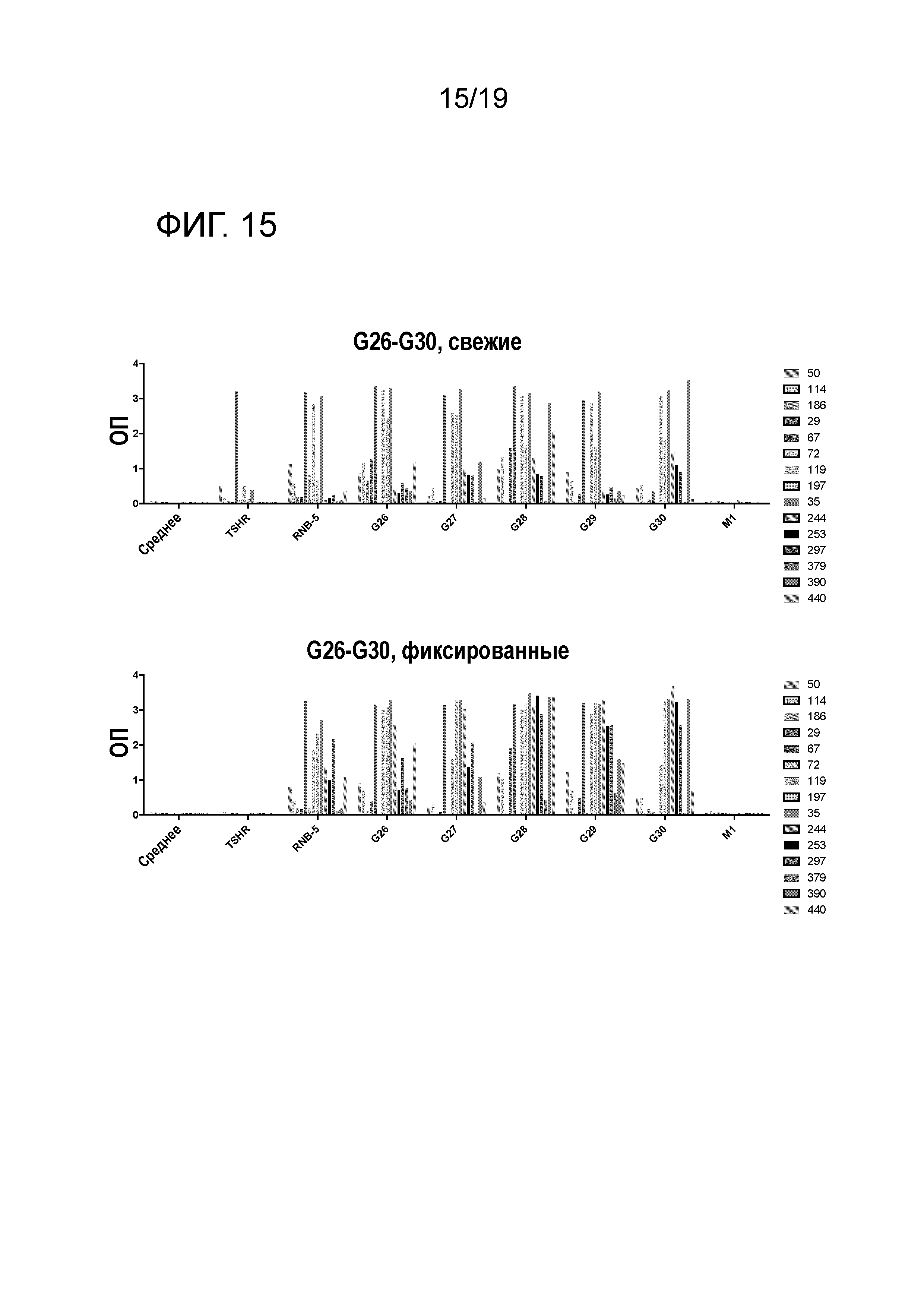
ФИГ. 15: Реакция ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D модифицированные пептиды. Гибридомные клоны (представлены различными цветами) культивируют со свежими и фиксированными АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2.
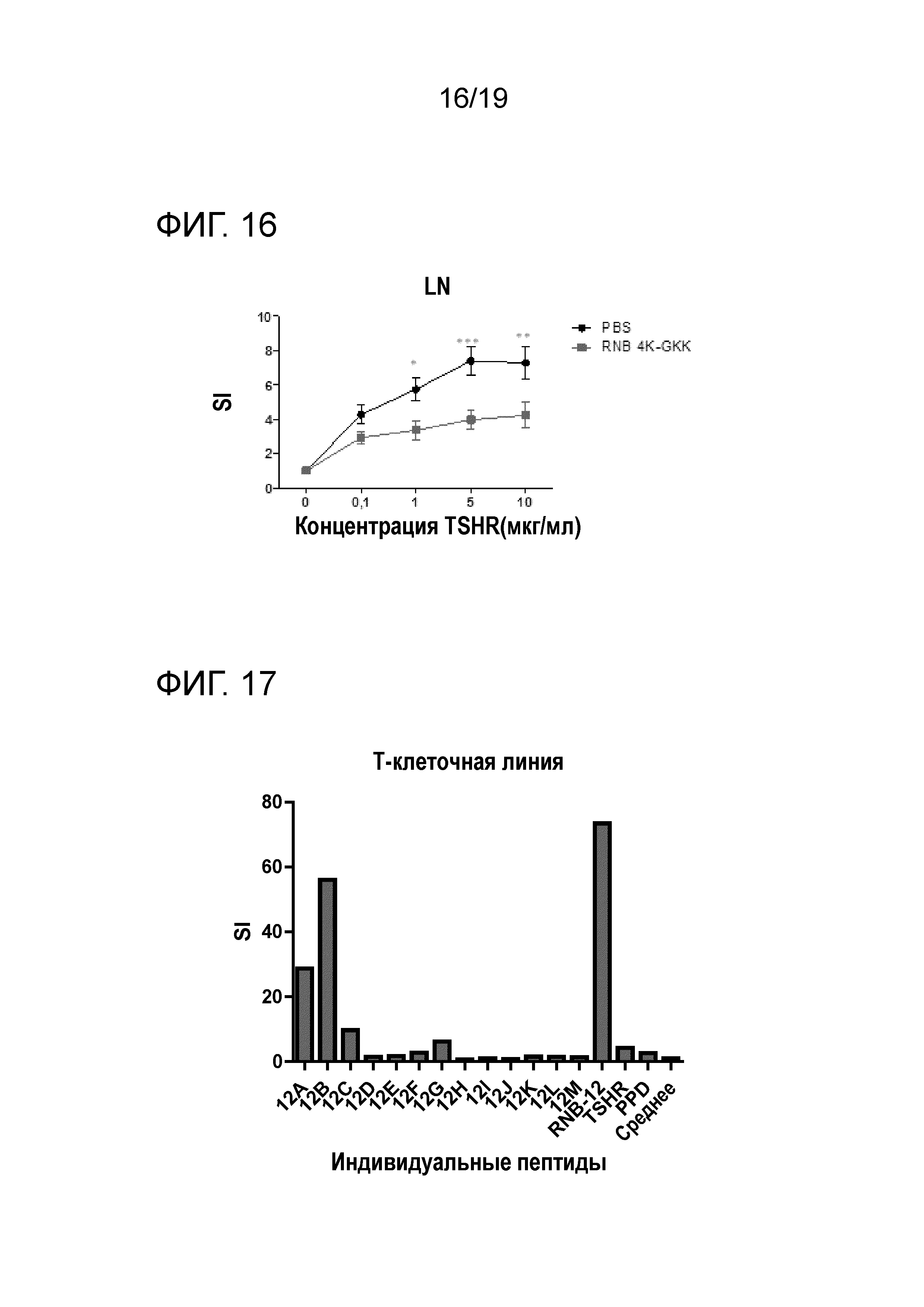
ФИГ. 16: Ex vivo индуцирование толерантности с использованием RNB 4K-GKK у DR4 мышей в соответствии со схемой увеличения дозы. Двухфакторный дисперсионный анализ ANOVA используют для определения влияния полных эффектов обработки на T-клеточную пролиферацию, и p-значения представлены на графиках. Используют пост-хок тестирование Бонферрони, и значимые различия указаны на графиках (* p<0,05; ** p<0,01; *** p<0,001) Результаты представляют собой среднее±SEM для PBS-обработанных (черные линии) и пептидом обработанных мышей (красные линии). SI индекс стимуляции; LN лимфатические узлы
ФИГ. 17: Идентификация RNB12 участка по реактивности T-клеточной линии, полученной от пациентов с болезнью Грейвса. T-клеточную линию создают путем стимуляции выделенных МКПК (PBMCs-мононуклеарных клеток периферической крови) от пациента с болезнью Грейвса с использованием RNB12 в течение 12 дней. После дополнительного цикла повторного стимулирования в 12 дней, RNB12 специфические T-клетки тестируют в отношении распознавания индивидуальных нестед пептидов в RNB12 участке. SI, индекс стимуляции.
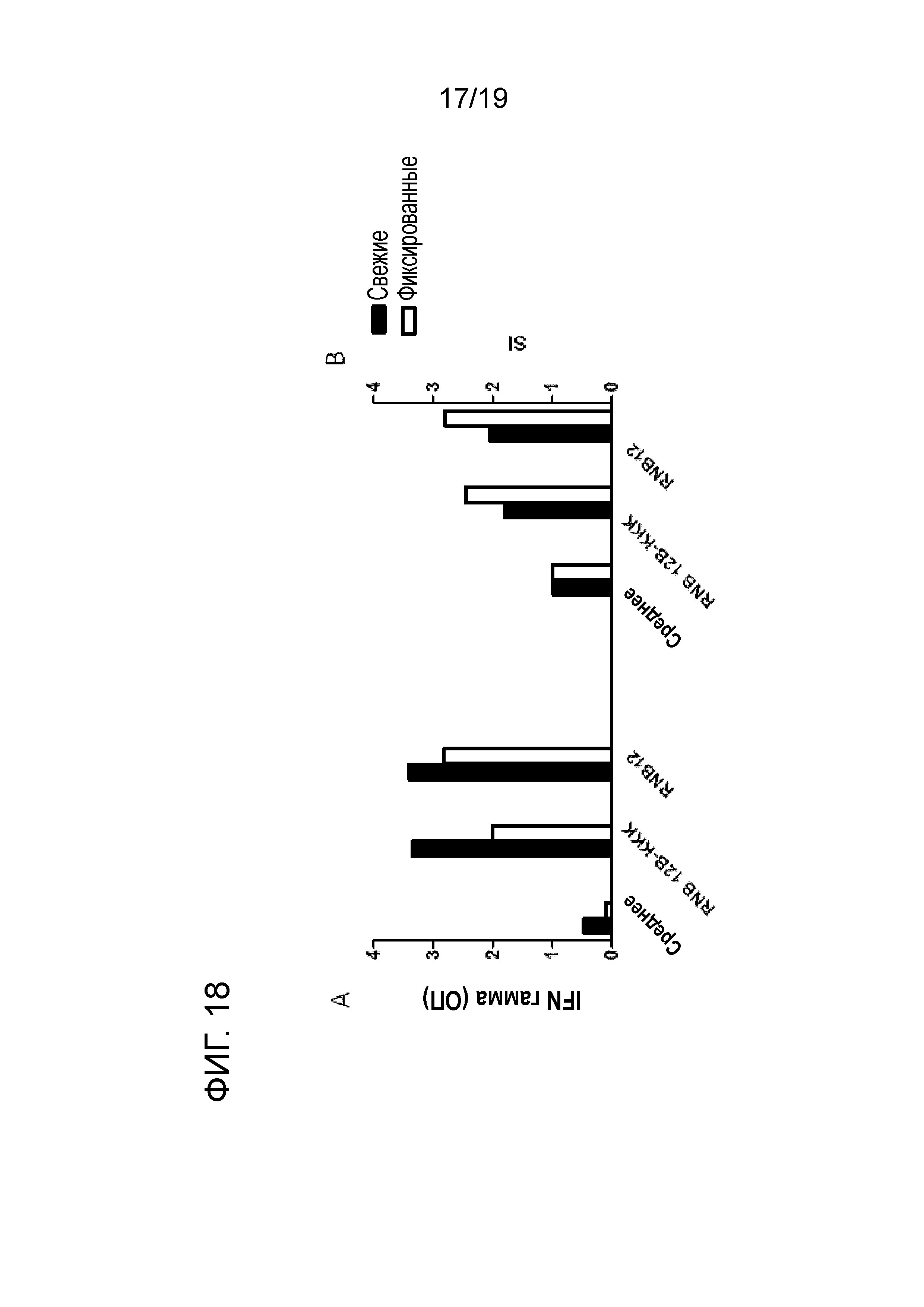
ФИГ. 18: Идентификация апитопов в RNB12 участке с использованием RNB12-специфических TCL, полученных от здорового донора. RNB12-специфические T-клетки культивируют с BM14, человеческой клеточной линией, экспрессирующей человеческие молекулы MHC класса II в присутствии пептида. Зачерненные прямоугольники представляют собой стимуляцию в присутствии свежих, но облученных BM14 клеток, и пустые прямоугольники - в присутствии фиксированных АПК. (См. раздел материалы и методы). Перед добавлением к культурам 3H-тимидина, надосадочную культуральную жидкость собирают и замораживают. Надосадочную жидкость анализируют на присутствие IFN-гамма (A) для подтверждения пролиферативной реакции (В) Т-клеток. TCL, T-клеточная линия; АПК, антиген-представляющие клетки; MHC класс II, главный комплекс гистосовместимости класса II; SI, индекс стимуляции; OD, оптическая плотность.
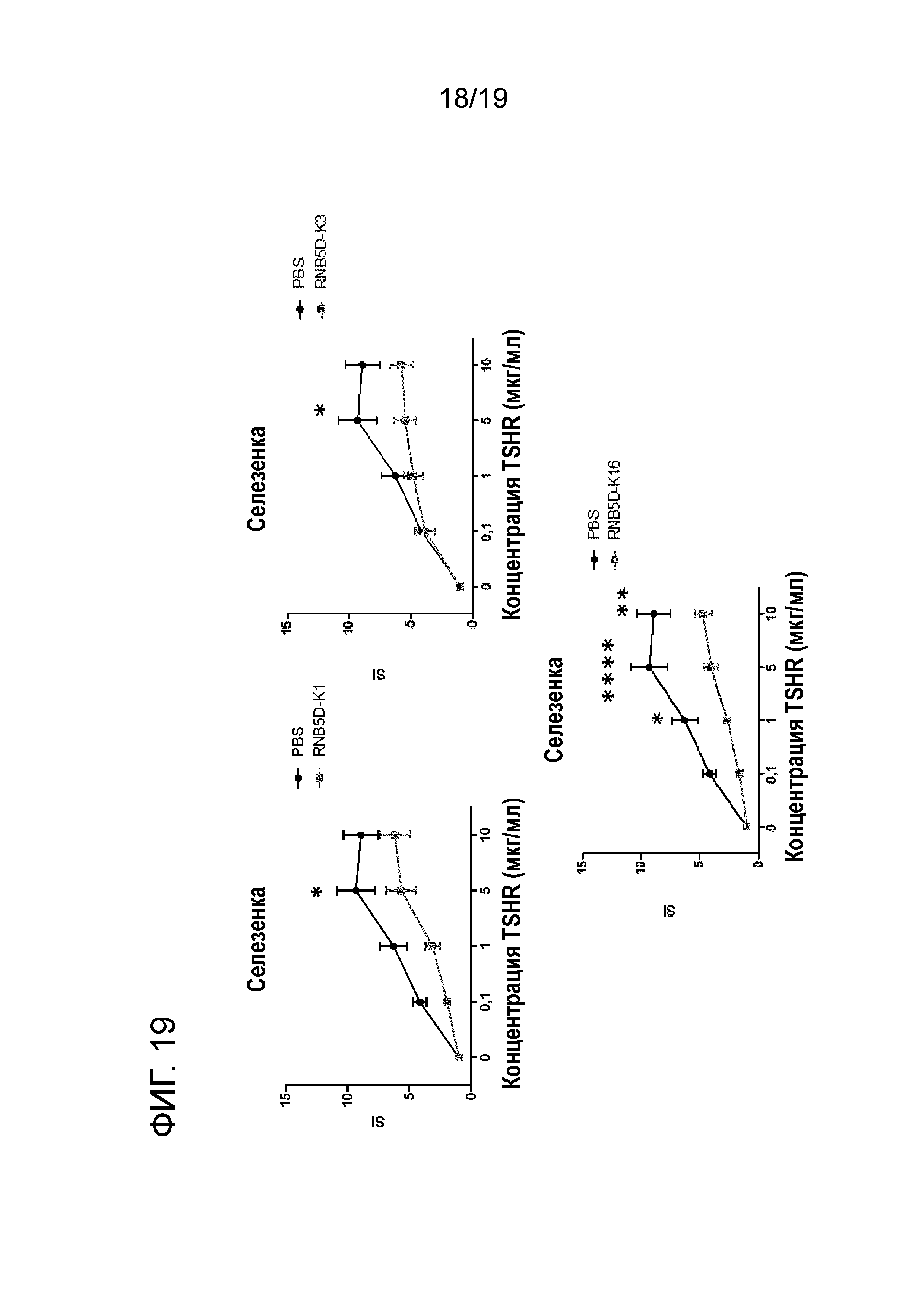
ФИГ. 19: Примеры Ex vivo толерантности, индуцированной модифицированными RNB5D модифицированными пептидами у DR3 мышей в соответствии со схемой увеличивающихся доз. Двухфакторный дисперсионный анализ ANOVA используют для измерения влияния полных эффектов обработки на T-клеточную пролиферацию, и p-значения указаны на графиках. (* p<0,05; ** p<0,01; *** p<0,001; **** p<0,0001) Результаты представляют среднее±SEM для PBS обработанных (черные линии) и пептидом обработанных мышей (красные линии). SI индекс стимуляции. A: RNB5D-K1; B: RNB5D-K3; C: RNB5D-K16.
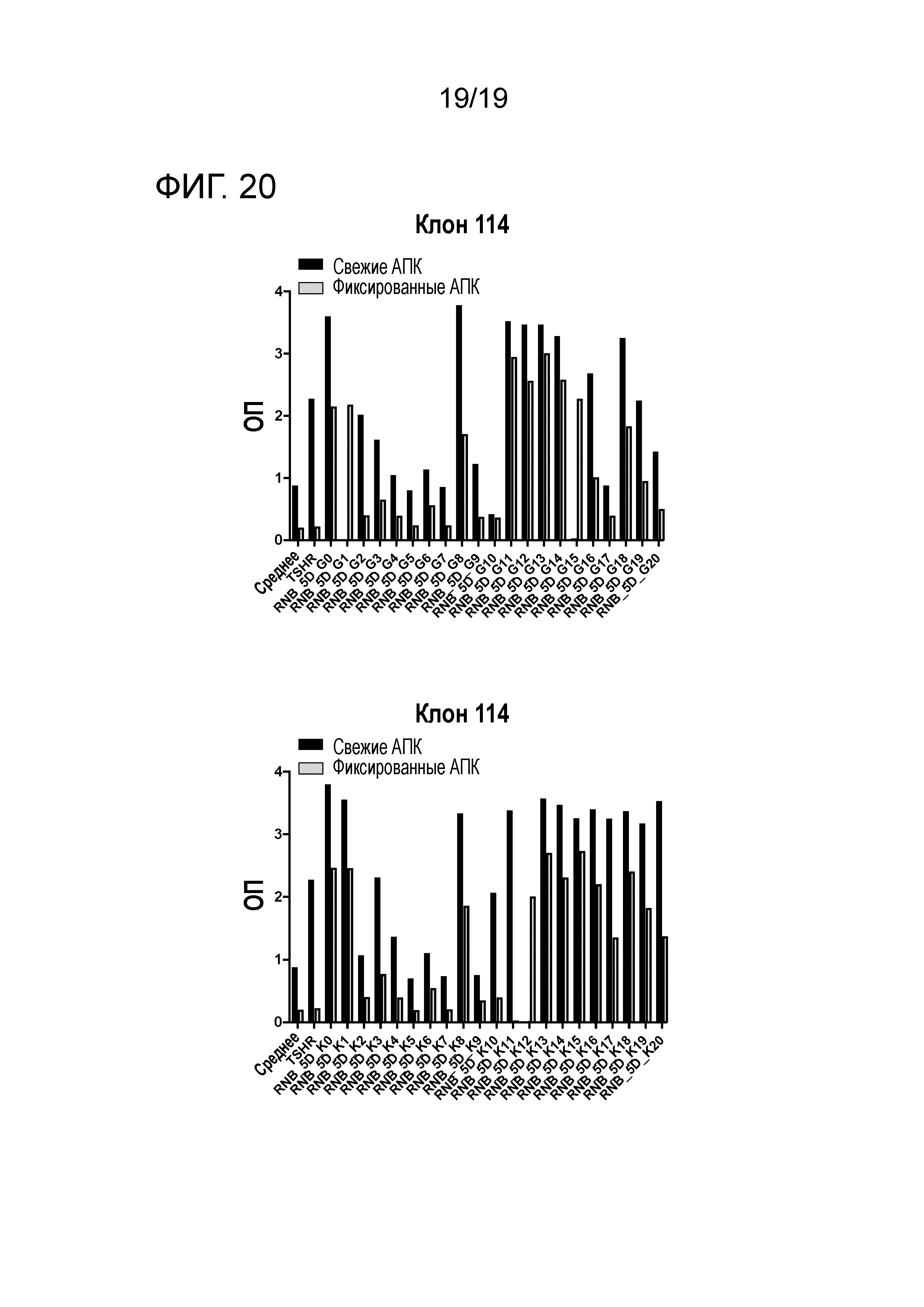
ФИГ. 20: График, иллюстрирующий статусы апитопов RNB-5D-модифицированных пептидов. Пример реакции ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 и HLA-DR4 мышей, иммунизированных ТТГР/CFA, на RNB-5D-модифицированные пептиды. Гибридомные клоны культивируют со свежими (зачерненные прямоугольники) и фиксированными (пустые прямоугольники) АПК и 25 мкг/мл антигена в течение 48 часов до определения продуцирования IL-2.
ОБОБЩЕНИЕ АСПЕКТОВ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения идентифицировали ряд пептидов, полученных из ТТГР, которые являются эффективными для профилактики и/или лечения БГ.
В первом аспекте в настоящем изобретении предложен пептид, который способен к связыванию с молекулами MHC in vitro и может быть представлен T-клеткам без процессинга антигена, и который включает все или часть из следующих пептидов рецепторов тиреотропного гормона (ТТГР):
RNB_5: ISRIYVSIDVTLQQLESHSFYNLSKVTHI (SEQ ID No 1)
RNB_4: LRTIPSHAFSNLPNISRIYVSIDVTLQQL (SEQ ID No 2)
RNB_9: TGLKMFPDLTKVYSTDIFFILEITDNPYM (SEQ ID No 3)
RNB_12: LTLKLYNNGFTSVQGYAFNGTKLDAVYL (SEQ ID No 64)
Указанный пептид можно выбрать из следующих ТТГР пептидов и их производных:
RNB_5D-GKK: KKGIYVSIDVTLQQLESHGKK (SEQ ID No 12)
RNB_5D-KKK: KKKIYVSIDVTLQQLESHKKK (SEQ ID No. 21)
RNB_5E-GKK: KKGYVSIDVTLQQLESHSGKK (SEQ ID No 13)
RNB_5A: ISRIYVSIDVTLQQL (SEQ ID No 6)
RNB_5B: SRIYVSIDVTLQQLE (SEQ ID No 7)
RNB_5C: RIYVSIDVTLQQLES (SEQ ID No 8)
RNB_5D: IYVSIDVTLQQLESH (SEQ ID No 9)
RNB_5E: YVSIDVTLQQLESHS (SEQ ID No 10)
RNB_5F: VSIDVTLQQLESHSF (SEQ ID No 11)
RNB_5F-GKK: KKGVSIDVTLQQLESHSFGKK (SEQ ID No 14)
RNB_4J-GKK: KKGSNLPNISRIYVSIDVGKK (SEQ ID No 16)
RNB_4J: SNLPNISRIYVSIDV (SEQ ID No 15)
RNB_4K: NLPNISRIYVSIDVT (SEQ ID No. 62)
RNB_4K-GKK: KKGNLPNISRIYVSIDVTGKK (SEQ ID No. 63)
RNB_9A: TGLKMFPDLTKVYST (SEQ ID No 17)
RNB_9B: GLKMFPDLTKVYSTD (SEQ ID No 18)
RNB_9C: LKMFPDLTKVYSTDI (SEQ ID No 19)
RNB_9D: KMFPDLTKVYSTDIF (SEQ ID No 20)
RNB_12A: LTLKLYNNGFTSVQG (SEQ ID No. 65)
RNB_12B: TLKLYNNGFTSVQGY (SEQ ID No. 66)
RNB_12B-KKK: KKK TLKLYNNGFTSVQGYKKK (SEQ ID No. 67)
Пептид может включать RNB 5A, 5B, 5C, 5D, 5E, 5F, 4J, 4K, 9A, 9B, 9C, 9D, 12A или 2B последовательности, или их варианты, в которых одна или более из аминокислот была заменена другой аминокислотой, такой как K, которая была модифицирована по одному или по обоим концам, например, путем введения "GKK" или "KKK" последовательностей.
Пептид может включать RNB-5D последовательность, или ее вариант, в котором одна или более из аминокислот была заменена другой аминокислотой, такой как K, которая была модифицирована по одному или по обоим концам, например, путем введения "GKK" или "KKK" последовательностей.
В настоящем изобретении также предложен пептид, который включает последовательность:
KK-(G/K)-aal-(RNB-5D пептид)-aa2-aa3-Z-(G/K)-KK,
где aal не является аминокислотой, I, K или T;
RNB-5D пептид представляет собой YVSIDVTLQQLE, или его вариант, в котором одна или более из аминокислот была заменена K,
aa2 не является аминокислотой, S или K;
aa3 не является аминокислотой, H или K,
который способен к связыванию с молекулой MHC in vitro и может быть представлен T-клеткам без процессинга антигена.
В указанном варианте RNB-5D пептид может быть YVSIDVTLQQLE, или его вариантом, в котором одна, две или три аминокислоты заменены на K.
Пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы (Таблица 1):
KKGIYVSIDVTLQQLESHGKK (SEQ ID No 12), KKGKYVSIDVTLQQLESHGKK (SEQ ID No 22), KKGIKVSIDVTLQQLESHGKK (SEQ ID No 23), KKGIYKSIDVTLQQLESHGKK (SEQ ID No 24), KKGIYVSIDVKLQQLESHGKK (SEQ ID No 25), KKGIYVSIDVTLQKLESHGKK(SEQ ID No 26), KKGIYVSIDVTLQQKESHGKK (SEQ ID No 27), KKGIYVSIDVTLQQLKSHGKK (SEQ ID No 28), KKGIYVSIDVTLQQLEKHGKK (SEQ ID No 29), KKGIYVSIDVTLQQLESKGKK (SEQ ID No 30), KKGYVSIDVTLQQLEGKK (SEQ ID No 31), KKGYVSIDVKLQQLEGKK (SEQ ID No 32), KKGYVSIDVTLQKLEGKK (SEQ ID No 33), KKGYVSIDVTLQQKEGKK (SEQ ID No 34), KKGYVSIDVKLQKKEGKK (SEQ ID No 35), KKGIYVSIDVTLQQLEGKK (SEQ ID No 36), KKGIYVSIDVKLQQLEGKK (SEQ ID No 37), KKGIYVSIDVTLQKLEGKK (SEQ ID No 38), KKGIYVSIDVTLQQKEGKK (SEQ ID No 39), KKGIYVSIDVKLQKKEGKK (SEQ ID No 40), KKGTYVSIDVTLQQLEGKK (SEQ ID No 41), KKGTYVSIDVKLQQLEGKK (SEQ ID No 42), KKGTYVSIDVTLQKLEGKK (SEQ ID No 43), KKGTYVSIDVTLQQKEGKK (SEQ ID No 44), KKGTYVSIDVKLQKKEGKK (SEQ ID No 45), KKKIYVSIDVTLQQLESHKKK (SEQ ID No 21), KKKKYVSIDVTLQQLESHKKK (SEQ ID No 46), KKKIKVSIDVTLQQLESHKKK (SEQ ID No 47), KKKIYKSIDVTLQQLESHKKK (SEQ ID No 48), KKKIYVKIDVTLQQLESHKKK (SEQ ID No 49), KKKIYVSIDVKLQQLESHKKK (SEQ ID No 50), KKKIYVSIDVTLKQLESHKKK (SEQ ID No 51), KKKIYVSIDVTLQKLESHKKK (SEQ ID No 52), KKKIYVSIDVTLQQKESHKKK (SEQ ID No 53), KKKIYVSIDVTLQQLKSHKKK (SEQ ID No 54), KKKIYVSIDVTLQQLEKHKKK (SEQ ID No 55), KKKIYVSIDVTLQQLESKKKK (SEQ ID No 56), KKKYVSIDVTLQQLEKKK (SEQ ID No 57), KKKYVSIDVKLQQLEKKK (SEQ ID No 58), KKKYVSIDVTLQKLEKKK (SEQ ID No 59), KKKYVSIDVTLQQKEKKK (SEQ ID No 60), KKKYVSIDVKLQKKEKKK (SEQ ID No. 61).
Пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы и обладают повышенной растворимостью:
KKGKYVSIDVTLQQLESHGKK (SEQ ID No. 22), KKGIYKSIDVTLQQLESHGKK (SEQ ID No. 24), KKGYVSIDVTLQQLEGKK (SEQ ID No. 31), KKGYVSIDVKLQQLEGKK (SEQ ID No. 32), KKGYVSIDVTLQKLEGKK (SEQ ID No. 33), KKGYVSIDVTLQQKEGKK (SEQ ID No. 34), KKGYVSIDVKLQKKEGKK (SEQ ID No. 35), KKGIYVSIDVKLQKKEGKK (SEQ ID No. 40), KKGTYVSIDVKLQQLEGKK (SEQ ID No. 42), KKGTYVSIDVKLQKKEGKK (SEQ ID No. 45), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKIYVKIDVTLQQLESHKKK (SEQ ID No. 49), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVKLQQLEKKK (SEQ ID No. 58), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60), KKKYVSIDVKLQKKEKKK (SEQ ID No. 61).
Пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы, и обладают наилучшей растворимостью:KKGIYKSIDVTLQQLESHGKK (SEQ ID No. 24), KKGYVSIDVKLQQLEGKK (SEQ ID No 32), KKGYVSIDVTLQKLEGKK (SEQ ID No. 33), KKGYVSIDVTLQQKEGKK (SEQ ID No. 34), KKGYVSIDVKLQKKEGKK (SEQ ID No. 35), KKGTYVSIDVKLQQLEGKK (SEQ Id No. 42), KKGTYVSIDVKLQKKEGKK (SEQ ID No. 45), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60).
Следующие пептиды представляют особенный интерес:
KKGYVSIDVTLQKLEGKK (SEQ ID No. 32), KKGYVSIDVKLQKKEGKK (SEQ ID No. 34), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60).
Во втором аспекте в настоящем изобретении предложена композиция, включающая множество пептидов, включая один или более из пептидов в соответствии с первым аспектом настоящего изобретения.
В третьем аспекте в настоящем изобретении предложен пептид в соответствии с первым аспектом настоящего изобретения, или композиция в соответствии со вторым аспектом настоящего изобретения для применения в подавлении или предотвращении продуцирования ТТГР аутоиммунных антител in vivo.
В четвертом аспекте в настоящем изобретении предложен пептид в соответствии с первым аспектом настоящего изобретения, или композиция в соответствии со вторым аспектом настоящего изобретения для применения в лечении и/или профилактике болезни Грейвса у субъекта.
В пятом аспекте в настоящем изобретении предложено применение пептида в соответствии с первым аспектом настоящего изобретения, или композиции в соответствии со вторым аспектом настоящего изобретения для изготовления лекарственных средств для подавления или предотвращения продуцирования ТТГР аутоиммунных антител in vivo.
В шестом аспекте в настоящем изобретении предложено применение пептида в соответствии с первым аспектом настоящего изобретения, или композиции в соответствии со вторым аспектом настоящего изобретения для изготовления лекарственного средства для лечения и/или профилактики болезни Грейвса.
В седьмом аспекте в настоящем изобретении предложен способ подавления или предотвращения продуцирования ТТГР аутоиммунных антител у субъекта, который включает стадию введения указанному субъекту пептида в соответствии с первым аспектом настоящего изобретения или композиции в соответствии со вторым аспектом настоящего изобретения.
В восьмом аспекте в настоящем изобретении предложен способ лечения болезни Грейвса у субъекта, который включает стадию введения указанному субъекту пептида в соответствии с первым аспектом настоящего изобретения или композиции в соответствии со вторым аспектом настоящего изобретения.
Субъектом может быть HLA-DR3 или HLA-DR4.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ИЗОБРЕТЕНИЯ
ПЕПТИДЫ
В первом аспекте настоящее изобретение относится к пептидам.
Термин "пептид" используют в обычном смысле для обозначения ряда остатков, обычно L-аминокислот, соединенных друг с другом обычно пептидными связями между α-амино и карбоксильными группами соседних аминокислот. Термин включает модифицированные пептиды и синтетические пептидные аналоги.
Пептиды настоящего изобретения можно получить, используя химические методы (Peptide Chemistry, A practical Textbook. Mikos Bodansky, Springer-Verlag, Berlin). Например, пептиды можно синтезировать, используя твердофазные методики (Roberge JY et al (1995) Science 269: 202-204), отщепляя от смолы и очищая с помощью препаративной высокоэффективной жидкостной хроматографии (e.g., Creighton (1983) Proteins Structures and Molecular Principles, H Freeman and Co, New York NY). Автоматизированный синтез можно осуществить, например, используя пептидный синтезатор ABI 431 peptide Synthesizer (Perkin Elmer) в соответствии с инструкциями изготовителя.
Альтернативно, пептид можно получить, используя рекомбинантные методики, или путем расщепления более длинных полипептидов. Например, пептид можно получить, расщепляя белок рецептора тиреотропина, после чего можно модифицировать один или оба его конца. Состав пептида можно подтвердить, используя аминокислотный анализ или секвенирование (например, процедуру расщепления по Эдману).
Для практических целей существуют различные другие характеристики, которые может демонстрировать пептид. Например, для того, чтобы пептид был терапевтически полезен, важно, чтобы он был достаточно стабилен in vivo. Срок полу-жизни пептида in vivo может быть по меньшей мере 10 минут, 30 минут, 4 часа или 24 часа.
Пептид может также демонстрировать высокую биодоступность in vivo. Пептид может сохранять конформацию in vivo, что обеспечивает его связывание с молекулами MHC на клеточной поверхности без соответствующих затруднений.
АПИТОПЫ
При адаптивной иммунной реакции T-лимфоциты способны распознавать внутренние эпитопы белкового антигена. Антиген-представляющие клетки (АПК) захватывают белковые антигены и расщепляют их на короткие пептидные фрагменты. Пептид может связываться с молекулами главного комплекса гистосовмстимости (MHC) класса I или II внутри клетки и может быть перенесен на клеточную поверхность. Если антиген представлен на клеточной поверхности в связи с молекулой MHC, такой пептид может быть распознан T-клеткой (через T-клеточный рецептор (TCR)), и в таком случае указанный пептид является T-клеточным эпитопом.
Таким образом, эпитоп представляет собой пептид, полученный из антигена, который способен к связыванию с пептид-связывающей бороздкой молекулы MHC класса I или II и распознается T-клеткой.
Минимальный эпитоп представляет собой самый короткий фрагмент, получаемый из эпитопа, который способен к связыванию с пептид-связывающей бороздкой молекулы MHC класса I или II и распознается Т-клеткой. Для конкретного иммуногенного участка обычно возможно создать "нестед набор" перекрывающихся пептидов, которые действуют как эпитопы, причем все они содержат минимальный эпитоп, но отличаются своими фланкирующими участками.
Таким же способом можно идентифицировать минимальный эпитоп для конкретной комбинации MHC молекула:T-клетка, измеряя реакцию на усеченные пептиды. Например, если возникает реакция на пептид, включающий остатки 1-15 в перекрывающейся библиотеке, наборы, которые усечены с обоих концов (т.е. 1-14, 1-13, 1-12 и т.д. и 2-15, 3-15, 4-15 и т.д.) можно использовать для идентификации минимального эпитопа.
Авторы настоящего изобретения ранее определили, что существует связь между способностью пептида к связыванию с молекулами MHC класса I или II и представлению T-клеткам без дополнительного процессинга, и способностью пептидов индуцировать толерантность in vivo (WO 02/16410). Если пептид слишком длинен, чтобы связываться с бороздкой пептидного связывания молекул MHC без дополнительного процессинга, (например, тримминга), или связывается в неподходящей конформации, тогда он не является толерогенным in vivo. Если, с другой стороны, пептид имеет подходящий размер и конформацию для непосредственного связывания с бороздкой связывания MHC пептида и представления T-клеткам, тогда можно предсказать, что такой пептид может быть полезен для индуцирования толерантности.
Таким образом, можно исследовать толерогенную способность пептида, исследуя возможность его связывания с молекулами MHC класса I или II и возможность его представления Т-клеткам без дополнительного процессинга антигена in vitro.
Пептиды настоящего изобретения представляют собой апитопы (эпитопы, независимые от процессинга антигена) в том, что они способны к связыванию с молекулами MHC и способны стимулировать реакции ТТГР-специфических T-клеток без дополнительного процессинга антигена. Можно предполагать, что такие апитопы вызовут толерантность к ТТГР, если следовать правилам способа, раскрытого в WO 02/16410.
Пептид настоящего изобретения может быть любой длины, если способен к связыванию с молекулой MHC класса I или II без дополнительного процессинга. Обычно пептид настоящего изобретения способен к связыванию с MHC класса II.
Пептиды, которые связываются с молекулами MHC класса I, обычно бывают длиной от 7 до 13, чаще от 8 до 10 аминокислот. Связывание пептида стабилизируется по двум его концам путем контактирования между атомами основной цепи пептида и инвариантными сайтами в пептид-связывающих бороздках всех молекул MHC класса I. Существуют инвариантные сайты с обоих концов бороздки, которые связывают амино и карбокси концы пептида. Вариации длины пептида приспосабливаются за счет изгибания скелетной цепи пептида, часто по пролиновым или глициновым остаткам, которые обеспечивают гибкость.
Пептиды, которые связываются с молекулами MHC класса II, обычно бывают длиной от 8 до 20 аминокислот, чаще от 10 до 17 аминокислот и могут быть длиннее (например, вплоть до 40 аминокислот). Такие пептиды расположены в вытянутой конформации вдоль бороздок связывания пептидов MHC класса II, которые (в отличие от бороздок связывания пептидов MHC класса I) открыты с обоих концов. Пептиды сохраняются на месте главным образом за счет контактов атомов основной цепи с консервативными остатками, которые выстилают бороздки связывания пептидов.
Пептиды настоящего изобретения могут включать от 8 до 30 аминокислот, например, от 8 до 25 аминокислот, от 8 до 20 аминокислот, от 8 до 5 аминокислот или от 8 до 12 аминокислот.
ЧАСТЬ
Пептиды настоящего изобретения могут включать все или часть ТТГР-полученных пептидов, представленных как последовательности SEQ ID No. 1-3.
Термин "часть" относится к пептиду, который получен из SEQ ID No. 1-3 и содержит по меньшей мере минимальный эпитоп пептида.
Такой пептид может включать одну или более из мутаций, обычно аминокислотных замещений внутри ТТГР-полученной последовательности. Такая аминокислота может замещать такие аминокислоты, как глицин, лизин или глутамовая кислота. Пептид может включать вплоть до трех, вплоть до двух или одно аминокислотное замещение из ТТГР-полученной последовательности.
Такой пептид может включать по одному или по обоим концам аминокислоты, которые не получают из ТТГР последовательности. Например, пептид может иметь один или более из остатков глицина и/или лизина и/или глутамовой кислоты по одному или по обоим концам. Например, дополнительные аминокислоты могут включать глициновый или лизиновый спейсер, после которого следуют пары аминокислот KK, KE, EK или EE по одному или по обоим концам.
Например, такой пептид может иметь следующую формулу:
KKG-ТТГР-полученная часть-GKK.
Пептид, включающий не-ТТГР-полученные аминокислоты, должен быть апитопом, т.е. должен быть способен к связыванию с молекулой MHC in vitro и способен быть представленным T-клетке без процессинга антигена.
РЕЦЕПТОР ТИРЕОТРОПНОГО ГОРМОНА (ТТГР)
БГ представляет собой аутоиммунное заболевание, вызванное аутореактивными T и B лимфоцитами, направленными в основном на аутоантиген, рецептор тиреотропного гормона (ТТГР).
ТТГР представляет собой G-белок, связанный с рецептором фолликулярных клеток щитовидной железы, который стимулирует продуцирование тироксина (T4) и трииодотиронина (T3) за счет cAMP сигнального каскада после связывания его лиганда, тиреоид-стимулирующего гормона (TSH). После интернализации, расщепления и презентации ТТГР за счет АПК, T-клетки становятся активированными и взаимодействуют с аутореактивными B клетками, что в свою очередь вызывает стимуляцию агонистических аутоиммунных антител, направленных против ТТГР. Тиреоид-стимулирующие иммуноглобулины связываются с тем же самыми рецепторными карманами, что и TSH, активируя опосредованный ТТГР сигнал трансдукции и приводя к продуцированию избытка тиреоидного гормона щитовидной железой и к росту щитовидной железы.
ТТГР, также известный как рецептор тиреотропина, экспрессируется, главным образом, на эпителиальных клетках щитовидной железы.
ТТГР холорецептор содержит 764 остатков, и включает N-концевой внеклеточный домен, с которым связываются TSH, серпентин (или трансмембранный домен) и C-концевой внутриклеточный домен.
ТТГР включает большой внеклеточный домен (418 аминокислот) с высоко консервативными Cys остатками, что облегчает образование третичной структуры внеклеточного домена, что может быть важным как для связывания лиганда, так и для неактивной конформации рецептора. Такой внеклеточный домен включает более половины длины белка и является достаточным для связывания лиганда с высокой афинностью. После переноса на поверхность клетки рецепторная молекула подвергается внутримолекулярному расщеплению, что приводит к удалению последовательности, содержащей 50 аминокислот, расположенной между остатками 316 и 366. В результате указанный рецептор включает две субъединицы, причем субъединица α включает внеклеточный лиганд-связывающий домен и β субъединица включает трансмембранный домен и короткую С-концевую последовательность, связанные вместе дисульфидными связями. На следующих стадиях α субъединицу удаляют, что приводит к избытку лиганд-связывающего домена, лишенного ß субъединиц, на клеточной мембране.
После связывание циркулирующего TSH с ТТГР, сигнальный каскад G-белка активирует аденилилциклазу, и внутриклеточные уровни cAMP повышаются. cAMP активирует все функциональные аспекты тиреоидной клетки, включая накачку йода, синтез тиреоглобулина, иодирование, эндоцитоз и протеолиз, активность тиреоидной пероксидазы и выделение гормона.
Аминокислотная последовательность зрелого ТТГР представлена ниже (SEQ ID No 5).
1 mrpadllqlv llldlprdlg gmgcssppce chqeedfrvt ckdiqripsl ppstqtlkli
61 ethlrtipsh afsnlpnisr iyvsidvtlq qleshsfynl skvthieirn trnltyidpd
121 alkelpllkf lgifntglkm fpdltkvyst diffileitd npymtsipvn afqglcnetl
181 tlklynngft svqgyafngt kldavylnkn kyltvidkda fggvysgpsl ldvsqtsvta
241 lpskglehlk eliarntwtl kklplslsfl hltradlsyp shccafknqk kirgileslm
301 cnessmqslr qrksvnalns plhqeyeenl gdsivgykek skfqdthnna hyyvffeeqe 361 deiigfgqel knpqeetlqa fdshydytic gdsedmvctp ksdefnpced imgykflriv
421 vwfvsllall gnvfvllill tshyklnvpr flmcnlafad fcmgmyllli asvdlythse
481 yynhaidwqt gpgcntagff tvfaselsvy tltvitlerw yaitfamrld rkirlrhaca 541 imvggwvccf llallplvgi ssyakvsicl pmdtetplal ayivfvltln ivafvivccc
601 yvkiyitvrn pqynpgdkdt kiakrmavli ftdficmapi sfyalsailn kplitvsnsk
661 illvlfypln scanpflyai ftkafqrdvf illskfgick rqaqayrgqr vppknstdiq
721 vqkvthdmrq glhnmedvye lienshltpk kqgqiseeym qtvl.
Пептид настоящего изобретения по меньшей мере частично получают из ТТГР. Указанный пептид или его часть можно получить из участков 64-92, 78-106, 107-135, 136-164 или 201-229 ТТГР. Указанный пептид или его часть можно получить из фрагмента антигена, который образуется в результате естественного процессинга антигена антиген-представляющими клетками.
Участок 64-92 ТТГР (RNB 4) имеет следующую последовательность:
LRTffSHAFSNLPNISRIYVSIDVTLQQL (SEQ ID No 2)
Пептид может включать минимальный эпитоп из следующего пептида:
ТТГР 73-87 (RNB_4J): SNLPNISRIYVSIDV (SEQ ID No 15)
ТТГР 73-87 (RNB 4J-GKK): KKGSNLPNISRIYVSIDVGKK (SEQ ID No 16)
Пептид может включать минимальный эпитоп из следующего пептида:
ТТГР 74-88 (RNB_4K): NLPNISRIYVSIDVT (SEQ ID No. 62)
ТТГР 74-88 (RNB_4K-GKK): KKGNLPNISRIYVSIDVTGKK (SEQ ID No. 63)
Участок 78-106 ТТГР (RNB_5) имеет следующую последовательность:ISRIYVSIDVTLQQLESHSFYNLSKVTHI (SEQ ID No 1)
Пептид может включать минимальный эпитоп из следующих пептидов: ТТГР 78-92 (RNB_5A), 79-93 (RNB_5B), 80-94 (RNB_5C), 81-95 (RNB_5D), 82-96 (RNB_5E) и 83-97 (RNB_5F).
Последовательности ТТГР 78-92, 79-93, 80-94, 81-95, 82-96 и 83-97 являются следующими:
TSHR 78-92 (RNB_5A): ISRIYVSIDVTLQQL (SEQ ID No 6)
TSHR 79-93 (RNB_5B): SRIYVSIDVTLQQLE (SEQ ID No 7)
TSHR 80-94 (RNB_5C): RIYVSIDVTLQQLES (SEQ ID No 8)
TSHR 81-95 (RNB_5D): IYVSIDVTLQQLESH (SEQ ID No 9)
TSHR 82-96 (RNB_5E): YVSIDVTLQQLESHS (SEQ ID No 10)
TSHR 83-97 (RNB_5F): VSIDVTLQQLESHSF (SEQ ID No 11)
TSHR 81-95 (RNB_5D-GKK): KKGIYVSIDVTLQQLESHGKK (SEQ ID No 12)
TSHR 81-95 (RNB_5D-KKK):KKKIYVSIDVTLQQLESHKKK(SEQ ID No. 21)
TSHR 82-96 (RNB_5E-GKK): KKGYVSIDVTLQQLESHSGKK (SEQ ID No 13)
TSHR 83-97 (RNB_5F-GKK): KKGVSIDVTLQQLESHSFGKK (SEQ ID No 14)
Пептид настоящего изобретения по меньшей мере частично получают из ТТГР. Указанный пептид или его часть можно получить из участков 64-92, 78-106, 107-135, 136-164 или 201-229 ТТГР. Указанный пептид или его часть можно получить из фрагмента антигена, который образуется в результате естественного процессинга антигена антиген-представляющими клетками.
Участок 64-92 ТТГР (RNB 4) имеет следующую последовательность:
LRTffSHAFSNLPNISRIYVSIDVTLQQL (SEQ ID No 2)
Пептид может включать минимальный эпитоп из следующего пептида:
ТТГР 73-87 (RNB_4J): SNLPNISRIYVSIDV (SEQ ID No 15)
ТТГР 73-87 (RNB 4J-GKK): KKGSNLPNISRIYVSIDVGKK (SEQ ID No 16)
Пептид может включать минимальный эпитоп из следующего пептида:
ТТГР 74-88 (RNB_4K): NLPNISRIYVSIDVT (SEQ ID No. 62)
ТТГР 74-88 (RNB_4K-GKK): KKGNLPNISRIYVSIDVTGKK (SEQ ID No. 63)
Участок 78-106 ТТГР (RNB_5) имеет следующую последовательность: ISRIYVSIDVTLQQLESHSFYNLSKVTHI (SEQ ID No 1)
Пептид может включать минимальный эпитоп из следующих пептидов: ТТГР 78-92 (RNB_5A), 79-93 (RNB_5B), 80-94 (RNB_5C), 81-95 (RNB_5D), 82-96 (RNB_5E) и 83-97 (RNB_5F).
Последовательности ТТГР 78-92, 79-93, 80-94, 81-95, 82-96 и 83-97 являются следующими:
TSHR 136-150 (RNB_9A): TGLKMFPDLTKVYST (SEQ ID No 17)
TSHR 137-151 (RNB_9B): GLKMFPDLTKVYSTD (SEQ ID No 18)
TSHR 138-152 (RNB_9C): LKMFPDLTKVYSTDI (SEQ ID No 19)
TSHR 139-153 (RNB_9D): KMFPDLTKVYSTDIF (SEQ ID No 20)
Участок 80-207 ТТГР (RNB_12) имеет следующую последовательность:
LTLKLYNNGFTSVQGYAFNGTKLDAVYL (SEQ ID No 64)
Указанный пептид может включать минимальный эпитоп из одного из пептидов, представленных в следующей таблице
|
Указанный пептид может включать минимальный эпитоп из одного из следующих пептидов:
TSHR 180-194 (RNB_12A): LTLKLYNNGFTSVQG (SEQ ID No. 65)
TSHR 180-194 (RNB_12B): TLKLYNNGFTSVQGY (SEQ ID No. 66)
TSHR 180-194 (RNB_12B-KKK): KKKTLKLYNNGFTSVQGYKKK (SEQ ID No. 67).
В настоящем изобретении также предложен пептид, который включает последовательность:
KK-(G/K)-aal-(RNB-5D пептид)-aa2-aa3-Z-(G/K)-KK
где aal не является аминокислотой, I, K или T;
RNB-5D пептид представляет собой YVSIDVTLQQLE (SEQ ID No. 4), или его вариант, в котором одна или более из аминокислот была заменена на K,
aa2 не является аминокислотой, S или K;
aa3 не является аминокислотой, H или K,
который способен к связыванию с молекулой MHC in vitro и способен быть представлен T-клетке без процессинга антигена.
В рассматриваемом варианте, RNB-5D пептид может быть YVSIDVTLQQLE (SEQ ID No. 4), или его вариантом, где одна, две или три аминокислоты заменена(заменены) на K.
Указанный пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы (Таблица 1):
KKGIYVSIDVTLQQLESHGKK (SEQ ID No 12), KKGKYVSIDVTLQQLESHGKK (SEQ ID No 22), KKGIKVSIDVTLQQLESHGKK (SEQ ID No 23), KKGIYKSIDVTLQQLESHGKK (SEQ ID No 24), KKGIYVSIDVKLQQLESHGKK (SEQ ID No 25), KKGIYVSIDVTLQKLESHGKK(SEQ ID No 26), KKGIYVSIDVTLQQKESHGKK (SEQ ID No 27), KKGIYVSIDVTLQQLKSHGKK (SEQ ID No 28), KKGIYVSIDVTLQQLEKHGKK (SEQ ID No 29), KKGIYVSIDVTLQQLESKGKK (SEQ ID No 30), KKGYVSIDVTLQQLEGKK (SEQ ID No 31), KKGYVSIDVKLQQLEGKK (SEQ ID No 32), KKGYVSIDVTLQKLEGKK (SEQ ID No 33), KKGYVSIDVTLQQKEGKK (SEQ ID No 34), KKGYVSIDVKLQKKEGKK (SEQ ID No 35), KKGIYVSIDVTLQQLEGKK (SEQ ID No 36), KKGIYVSIDVKLQQLEGKK (SEQ ID No 37), KKGIYVSIDVTLQKLEGKK (SEQ ID No 38), KKGIYVSIDVTLQQKEGKK (SEQ ID No 39), KKGIYVSIDVKLQKKEGKK (SEQ ID No 40), KKGTYVSIDVTLQQLEGKK (SEQ ID No 41), KKGTYVSIDVKLQQLEGKK (SEQ ID No 42), KKGTYVSIDVTLQKLEGKK (SEQ ID No 43), KKGTYVSIDVTLQQKEGKK (SEQ ID No 44), KKGTYVSIDVKLQKKEGKK (SEQ ID No 45), KKKIYVSIDVTLQQLESHKKK (SEQ ID No 21), KKKKYVSIDVTLQQLESHKKK (SEQ ID No 46), KKKIKVSIDVTLQQLESHKKK (SEQ ID No 47), KKKIYKSIDVTLQQLESHKKK (SEQ ID No 48), KKKIYVKIDVTLQQLESHKKK (SEQ ID No 49), KKKIYVSIDVKLQQLESHKKK (SEQ ID No 50), KKKIYVSIDVTLKQLESHKKK (SEQ ID No 51), KKKIYVSIDVTLQKLESHKKK (SEQ ID No 52), KKKIYVSIDVTLQQKESHKKK (SEQ ID No 53), KKKIYVSIDVTLQQLKSHKKK (SEQ ID No 54), KKKIYVSIDVTLQQLEKHKKK (SEQ ID No 55), KKKIYVSIDVTLQQLESKKKK (SEQ ID No 56), KKKYVSIDVTLQQLEKKK (SEQ ID No 57), KKKYVSIDVKLQQLEKKK (SEQ ID No 58), KKKYVSIDVTLQKLEKKK (SEQ ID No 59), KKKYVSIDVTLQQKEKKK (SEQ ID No 60), KKKYVSIDVKLQKKEKKK (SEQ ID No. 61).
Указанный пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы и обладают повышенной растворимостью: KKGKYVSIDVTLQQLESHGKK (SEQ ID No. 22), KKGIYKSIDVTLQQLESHGKK (SEQ ID No. 24), KKGYVSIDVTLQQLEGKK (SEQ ID No. 31), KKGYVSIDVKLQQLEGKK (SEQ ID No. 32), KKGYVSIDVTLQKLEGKK (SEQ ID No. 33), KKGYVSIDVTLQQKEGKK (SEQ ID No. 34), KKGYVSIDVKLQKKEGKK (SEQ ID No. 35), KKGIYVSIDVKLQKKEGKK (SEQ ID No. 40), KKGTYVSIDVKLQQLEGKK (SEQ ID No. 42), KKGTYVSIDVKLQKKEGKK (SEQ ID No. 45), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKIYVKIDVTLQQLESHKKK (SEQ ID No. 49), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVKLQQLEKKK (SEQ ID No. 58), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60), KKKYVSIDVKLQKKEKKK (SEQ ID No. 61).
Указанный пептид можно выбрать из следующей группы, в которой все члены идентифицированы как апитопы и обладают самой высокой растворимостью: KKGIYKSIDVTLQQLESHGKK (SEQ ID No. 24), KKGYVSIDVKLQQLEGKK (SEQ ID No 32), KKGYVSIDVTLQKLEGKK (SEQ ID No. 33), KKGYVSIDVTLQQKEGKK (SEQ ID No. 34), KKGYVSIDVKLQKKEGKK (SEQ ID No. 35), KKGTYVSIDVKLQQLEGKK (SEQ Id No. 42), KKGTYVSIDVKLQKKEGKK (SEQ ID No. 45), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60).
Следующие пептиды представляют наибольший интерес: KKGYVSIDVTLQKLEGKK (SEQ ID No. 32), KKGYVSIDVKLQKKEGKK (SEQ ID No. 34), KKKKYVSIDVTLQQLESHKKK (SEQ ID No. 46), KKKIYKSIDVTLQQLESHKKK (SEQ ID No. 48), KKKYVSIDVTLQQLEKKK (SEQ ID No. 57), KKKYVSIDVTLQQKEKKK (SEQ ID No. 60).
ТОЛЕРАНТНОСТЬ
T-клеточные эпитопы играют центральную роль в адаптивных иммунных реакциях на любой антиген, независимо от того, свой он или чужой. Центральная роль, которую играют T-клеточные эпитопы в заболеваниях, связанных с гиперчувствительностью (которые включают аллергию, аутоиммунные заболевания и отторжение трансплантатов) была продемонстрирована с использованием экспериментальных моделей. Существует возможность вызывать воспалительные или аллергические заболевания путем инъекций синтетических пептидов (основанных на структуре T-клеточных эпитопов) в комбинации с адъювантом.
Напротив, была продемонстрирована возможность индуцирования иммуногенной толерантности в отношении конкретных антигенов путем введения пептидных эпитопов в растворимой форме. Было продемонстрировано введение растворимых пептидных антигенов, как эффективных средств ингибирования заболеваний при экспериментальном аутоиммунном энцефаломиелите (EAE - модель рассеянного склероза (MS)) (Metzler and Wraith (1993) Int. Immunol. 5:1159-1165; Liu and Wraith (1995) Int. Immunol.7: 1255-1263; Anderton and Wraith (1998) Eur. J. Immunol. 28:1251-1261); и в экспериментальных моделях артрита, диабета и увеоретинита (обзор Anderton and Wraith (1998) см. выше). Введение пептидных антигенов было также продемонстрировано как средство лечения протекающего заболевания в EAE (Anderton and Wraith (1998) см. выше).
Толерантность представляет собой неспособность к реакции на антиген. Толерантность к “своим” антигенам является существенной особенностью иммунной системы, и если она утрачена, может возникнуть аутоиммунное заболевание. Адаптивная иммунная система должна сохранять способность реагировать на огромное разнообразие инфекционных агентов и при этом избегать аутоиммунных атак своих антигенов, содержащихся в собственных тканях. В значительной степени это контролируется чувствительностью незрелых T лимфоцитов к апоптотической гибели клеток в тимусе (центральная толерантность). Однако не все свои антигены определяются в тимусе, и поэтому гибель аутореактивных тимоцитов остается неполной. Существуют также механизмы, в соответствии с которыми толерантность может быть приобретена за счет зрелых аутореактивных T лимфоцитов в периферических тканях (периферическая толерантность). Обзор механизмов центральной и периферической толерантности приведен у Anderton et al (1999) (Immunological Reviews 169:123-137).
В настоящее время считают, что БГ вызывается ТТГР- стимулирующими аутоиммунными антителами, которые связываются с ТТГР и активируют их, тем самым стимулируя синтез и секрецию тиреоидного гормона и рост щитовидной железы.
Пептиды настоящего изобретения способны индуцировать толерантность к ТТГР, так что, будучи введены субъекту, они могут восстановить толерантность к ТТГР своего белка и ослабить патогенную иммунную реакцию.
Толерантность может возникнуть в результате или может характеризоваться индуцированием энергии в по меньшей мере части CD4+ T-клеток. Чтобы активировать T-клетки, пептид должен ассоциироваться с "профессиональными" АПК, способными передавать два сигнала к T-клеткам. Первый сигнал (сигнал 1) передается комплексом MHC-пептид на поверхности клеток АПК и воспринимается T-клетками через посредство TCR. Второй сигнал (сигнал 2) передается ко-стимуляторными молекулами на клеточной поверхности АПК, такими как CD80 и CD86, и воспринимается CD28 на поверхности Т-клеток. Считают, что если Т-клетки получают сигнал в отсутствии сигнала 2, они не активируются и в действительности, становятся анергическими. Анергические T-клетки невосприимчивы к последующей стимуляции антигеном, и могут быть способны подавлять другие иммунные реакции. Считают, что анергические T-клетки вовлечены в опосредованную Т-клетками толерантность.
Пептиды, которые требуют процессинга до того, как они могут быть представлены в совокупности с молекулами MHC, не индуцируют толерантность, так как они должны быть обработаны зрелыми антиген-представляющими клетками. Зрелые антиген-представляющие клетки (такие как макрофаги, B клетки и дендритные клетки) способны к процессингу антигена, но также и к передаче обоих сигналов 1 и 2 к T-клеткам, что вызывает активацию T-клеток. Апитопы, с другой стороны, будут способны связывать MHC класса II с незрелыми АПК. Таким образом, они будут представлены T-клеткам без ко-стимуляции, что приведет к анергичности Т-клеток и к толерантности.
Естественно, апитопы также способны связываться с молекулами MHC на клеточной поверхности зрелых АПК. Однако иммунная система содержит гораздо большее количество незрелых АПК, нежели зрелых АПК (предполагалось, что активируется менее чем 10% дендритных клеток Summers et al. (2001) Am. J. Pathol. 159:285-295). Неправильное положение по отношению к апитопу скорее приведет к анергии/толерантности, нежели к активации.
Было показано что, если толерантность индуцируют с помощью ингаляции пептидами, способность антиген-специфических CD4+ T-клеток к пролиферации снижается. Также, продуцирование IL-2, IFN-γ и IL-4 такими клетками снижается, но продуцирование IL-10 повышается.
Было показано, что нейтрализация IL-10 у мышей в состоянии пептид-индуцированной толерантности полностью восстанавливает восприимчивость к заболеванию. Было высказано предположение, что в толерантном состоянии сохраняется популяция регуляторных клеток, которые продуцируют IL-10 и опосредуют иммунную регуляцию (Burkhart et al (1999) Int. Immunol. 11: 1625-1634).
КОМПОЗИЦИИ
Настоящее изобретение также относится к композициям, таким, как фармацевтические композиции, включающие один или более из пептидов в соответствии с первым или вторым аспектами настоящего изобретения. Такой пептид может включать множество пептидов, например, два, три, четыре, пять или шесть пептидов. Композиции настоящего изобретения могут быть предназначены для профилактического или терапевтического использования. Если композицию вводят с профилактической целью, такая композиция может снижать или предотвращать выработку иммунной реакции на ТТГР. Уровень иммунной реакции оказывается меньше, чем уровень в случае, если бы пациенту не была введена композиция. Термин "снижает" означает, что наблюдается частичное снижение иммунной реакции, например, такое как снижение реакции на 50%, 70%, 80% или 90% по сравнению с тем, что наблюдалось бы, если бы пациенту не ввели композицию (или наблюдалось бы у не подвергнутого обработке пациента за тот же самый промежуток времени). Термин "предотвращает" означает, что не наблюдается существенной иммунной реакции на ТТГР.
Если композицию вводят для терапевтического использования, композиция может подавить уже существующую иммунную реакцию на ТТГР. Термин "подавляет" указывает на снижение уровня существующей иммунной реакции, по сравнению с уровнем, который наблюдался до введения пептида, или с уровнями, которые наблюдались бы в тот же момент времени, если бы не был введен пептид.
Введение композиции настоящего изобретения может стать
причиной снижения уровня любого или всех из следующих:
i) ТТГР аутоиммунных антител
ii) CD4+ T-клеток специфических для ТТГР
iii) B клеток, секретирующих ТТГР аутоиммунные антитела.
Определение всех факторов можно осуществить, используя способы, хорошо известные специалистам в данной области, такие как ELISA, цитометрия в потоке и т.д.
Лечение композициями настоящего изобретения может также или альтернативно стать причиной анергии в CD4+ T-клетках специфических для ТТГР. Анергию можно определить, например, осуществляя последующую иммунизацию ТТГР in vitro.
В случае если существуют два или более апитопа, фармацевтическая композиция может быть в форме набора, в котором несколько или каждый из апитопов представлен отдельно для одновременного, раздельного или последовательного введения.
Альтернативно (или в дополнение) если фармацевтическая композиция (или любая ее часть) должна быть введена в виде множества доз, каждая доза может быть упакована отдельно.
Также, в фармацевтических композициях настоящего изобретения любой или каждый апитоп может быть в смеси с любым подходящим связующим(ими), суспендирующим агентом(агентами), кроющим агентом (агентами) или солюбилизирующим агентом (агентами).
ЛЕКАРСТВЕННЫЕ ФОРМЫ
Композиции настоящего изобретения можно приготовить в виде композиций для инъекций, или в виде жидких растворов или суспензий; можно также приготовить в виде твердых форм, подходящих для растворения или суспендирования в жидкостях перед инъекцией.
Лекарственные формы могут также быть эмульгированы или пептиды могут быть инкапсулированы в липосомы.
Активные ингредиенты могут быть смешаны с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом.
Подходящими эксципиентами являются, например, вода, солевой раствор (например, буферированный фосфатом солевой раствор), декстроза, глицерин, этанол или т.п., и их комбинации.
Кроме того, при желании, композиции настоящего изобретения могут содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие вещества, и/или буферирующие рН вещества. Буферирующие соли, включая фосфаты, цитраты, ацетаты, хлористоводородную кислоту и/или гидроксид натрия, могут быть использованы для регулирования величины pH. Для стабилизации могут быть использованы дисахариды, такие как сахароза или трегалоза.
Если композиция включает множество пептидов, относительное количество пептидов может быть приблизительно равным. Альтернативно, относительные количества каждого из пептидов могут изменяться, например, для того, чтобы сфокусировать толерогенную реакцию на конкретной разновидности аутореактивных T-клеток, или в случае, если обнаружено, что один из пептидов функционирует лучше остальных в конкретных HLA типах.
После приготовления композиции настоящего изобретения можно заключить в стерильные контейнеры, которые затем запаивают и хранят при низких температурах, например, при 4°C, или их можно высушить замораживанием.
Удобно приготавливать композиции в виде лиофилизированного (высушенного замораживанием) порошка. Лиофилизация обеспечивает длительный срок хранения в стабилизированной форме. Процедуры лиофилизации хорошо известны специалистам в данной области, см., например, http://www.devicelink.com/ivdt/archive/97/01/006.html.
Увеличивающие объем вещества используют перед сушкой вымораживанием, такие как манит, декстран или глицин.
Композиции настоящего изобретения можно вводить обычными способами, таким как пероральный, внутривенный (если они водорастворимы), внутримышечный, подкожный сублингвальный, трансназальный, чрезкожный или в виде суппозиториев или с помощью имплантаций (например, используя медленно высвобождающиеся молекулы).
Композиции настоящего изобретения выгодно вводить интраназально, подкожно или чрезкожно.
Пептиды и композиции настоящего изобретения можно использовать для лечения людей. Такими пациентами могут быть пациенты с болезнью Грейвса. Пациенты могут иметь ТТГР аутоиммунные антитела.
Такие субъекты могут иметь HLA-гаплотип, который связан с предрасположенностью к выработке ингибиторных THSR аутоиммунных антител. Субъект может экспрессировать HLA-DR3 или HLA-DR4. Способы определения HLA-гаплотипа у индивидуумов хорошо известны специалистам в данной области.
Обычно врач определяет реальные дозы, которые будут наиболее подходящими для индивидуального пациента, и такие дозы будут варьироваться в зависимости от возраста, массы и реакции конкретного пациента.
В предпочтительном варианте может быть использована схема "увеличения доз", при которой пациенту вводят множество доз в возрастающих концентрациях. Такой подход используют, например, для пептидов фосфолипазы A2 в иммунотерапевтических применениях против аллергии на пчелиный яд (Miiller et al (1998) J. Allergy Clin Immunol. 10:747-754 и Akdis et al (1998) J. Clin. Invest. 102:98-106)
НАБОРЫ
Обычно, если композиция включает множество пептидов, их можно вводить совместно в форме смешанной композиции или коктейля. Однако могут возникнуть обстоятельства, при которых предпочтительно предоставлять пептиды отдельно в форме набора для одновременного, раздельного, последовательного или комбинированного введения.
Такие наборы могут также включать средства смешивания и/или введения (например, испаритель для интраназального введения; или шприцы и иглы для подкожного/чрезкожного введения доз). Такие наборы могут также включать инструкции для применения.
Фармацевтические композиции или наборы настоящего изобретения можно использовать для лечения и/или профилактики заболеваний. В частности, композиции/наборы настоящего изобретения можно использовать для лечения и/или профилактики болезни Грейвса.
ПРИМЕРЫ
Пример 1 - Селекция HLA-DR3 ТТГР пептидов
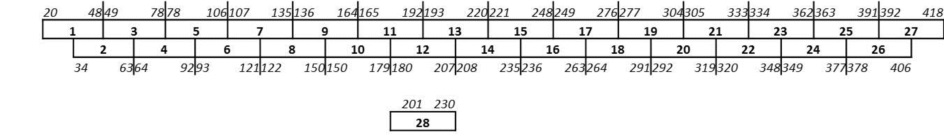
Для определения важных участков в ТТГР, ECD ТТГР (AA20-418) разделяют на 28 перекрывающихся пептидов, содержащих 28-30 аминокислот (28-30-мер) перекрывающихся 15 аминокислотами, как изображено ниже.
|
Затем оценивают иммуногенность всех пептидов путем иммунизации ULA-DRB1*0301 трансгенных мышей (DR3 мыши) 200 мкг пула из 3 пептидов, эмульгированных в CFA. Через 10 дней выделяют LN клетки и спленоциты и стимулируют in vitro, используя 10-25 мкг/мл соответствующих индивидуальных пептидов. Было обнаружено, в расчете на индексы стимуляции (ИС; включение 3H-тимидина (импульсы в минуту) пептид-стимулированных клеток деленное на значение для нестимулированных клеток), что пептиды RNB-5 и RNB-9 обладают высокой иммуногенностью (ИС>10).
ФИГ. 1 демонстрирует, что LN (лимфатические узлы) и спленоциты, выделенные из RNB-5 иммунизированных мышей, сильно реагируют на RNB-5 стимуляцию in vitro.
Все раскрытые далее примеры будут сфокусированы на пептидах RNB-5.
Пример 2 Идентификация апитопов внутри RNB-5
Для определения точного положения эпитопов внутри RNB-5, синтезируют панель 15-мерных перекрывающихся пептидов, охватывающих RNB-5, используя стандартную F-moc химию. Каждый пептид заменяют 1 аминокислотой, как представлено далее:
|
|
Вначале пептиды анализируют, используя гибридомы, созданные на основе DR3 мышей. Показано, что гибридомы, специфические для ТТГР и RNB-5, реагируют с RNB-5 A-F, представленными как свежими, так и фиксированными VAVY клетками. Антиген-индуцированное продуцирование IL-2 представительными клонами изображено на ФИГ. 2.
Для определения способности указанных 15-мерных пептидов связываться с HLA-DR молекулами, используют 2 программы: NetMHCII (http://www.cbs.dtu.dk/services/NetMHCII) и базу данных иммунных эпитопов (Immune Epitope DataBase) (http://tools.immuneepitope.org/analyze/html/mhc_II_binding.html). Используя оба метода, нестед пептиды RNB-5A вплоть до RNB-5F идентифицируют как эффективно связывающиеся как с HLA-DRB1*0301, так и с HLA-DRB1*0401 молекулами.
Хотя БГ у людей в значительной степени связана с HLA-DRB1*0301 гаплотипом, HLA-DRB1*0401 гаплотип также часто встречается у пациентов с БГ. Так как предсказано, что RNB-5A до 5F пептиды связываются с HLA-DRB1*0401 молекулами, RNB-5 тестируют в отношении их способности вызывать иммунную реакцию у DR4 мышей in vivo. LN клетки и спленоциты, выделенные из RNB-5/CFA-иммунизированных DR4 мышей, демонстрируют сильные иммунные реакции при стимуляции RNB-5 нестед пептидами. Кроме того, RNB-5 специфические гибридомы, созданные в DR3 мышах, реагируют на RNB-5 нестед пептиды, будучи представлены BM14-клетками (HLA-DRB1*0401). Поэтому, новые гибридомы создают путем иммунизации DR4 мышей ТТГР/CFA. Гибридомы, специфические как для ТТГР белка, так и для и RNB-5 пептида, отбирают для идентификации апитопов внутри RNB-5. Пептиды RNB-5A до 5F снова идентифицируют как апитопы (ФИГ. 3). RNB-5 DEF нестед пептиды модифицируют, добавляя аминокислоты 'GKK' с обоих C- и N-концов. ТТГР- и RNB-5-специфические гибридомы также реагируют с указанными модифицированными пептидами, будучи представлены как свежими, так и фиксированными АПК. Взятые вместе, полученные результаты подчеркивают то, что указанный участок представляет интерес для БГ пациентов HLA-DRB1*0301 или HLA-DRB1*0401 гаплотипов.
Было показано, что часть ТТГР-специфических гибридом, созданных путем иммунизации DR4 мышей с помощью ТТГР/CFA, связываются с RNB-4 вместо RNB-5, что указывает на присутствие других иммуногенных участков внутри ТТГР. RNB-4 специфические гибридомы выбирают для идентификации апитопов внутри RNB-4. Пептид RNB-4J идентифицируют как апитоп (ФИГ. 4). RNB-4 нестед пептидные последовательности представлены в таблице далее.
|
|
Исследуют также апитопный статус RNB-5D-модифицированных пептидов (ФИГ. 20).
В дополнении к RNB-4 и RNB-5 апитопам, компьютерное программное моделирование также показало, что пептиды RNB-9A до 9D являются сильным связующими с HLA-DRB1*0301 молекулами. Их пептидные последовательности представлены далее в таблице.
|
Тестируют реакции ТТГР- и RNB-5-специфических гибридомных клонов, выделенных из HLA-DR3 или HLA-DR4 мышей, иммунизированных ТТГР/CFA, с RNB-5D-модифицированными пептидами. Результаты представлены на ФИГ. 11 до 15.
Пример 3 - Анализ толерантности ex vivo
Для оценки способности RNB-5 апитопов индуцировать толерантность, вначале исследуют способность указанных апитопов ингибировать реакции у здоровых HLA-DRB1*0301 или HLADRB1*0401 ex vivo. Мышей предварительно обрабатывают различными RNB-5 апитопами в соответствии со схемами высоких доз или возрастающих доз, что раскрыто в разделе способ. Исследования показали, что предварительная обработка RNB-5 апитопами значительно снижает ТТГР-индуцированную T-клеточную пролиферацию, как у DR3, так и у DR4 мышей (ФИГ. 6A-D). RNB-5 DEF нестед пептиды модифицируют, добавляя аминокислоты 'GKK' с обоих C- и N-концов. Обработка такими модифицированными апитопами до лечения также значительно снижает ТТГР-индуцированную T-клеточную пролиферацию (ФИГ. 6E-F).
Было предсказано, что пептиды RNB-9A до 9D эффективно связываются с HLA-DRB1*0301 молекулами, и их способность индуцировать специфическую иммунную толерантность также исследовали. DR3 мышей предварительно обрабатывают RNB-9A до 9D в соответствии со схемой увеличения доз. Предварительная обработка RNB-9B и 9C вызывает значительное снижение ТТГР-индуцированной T-клеточной пролиферации как в LN, так и в клетках спленоцитов. (ФИГ. 7).
Было также показано, что пептид RNB 4K-GKK значительно снижает ТТГР-индуцированную T-клеточную пролиферацию у DR4 мышей (ФИГ. 16). RNB-5D модифицированные пептиды также значительно снижают ТТГР-индуцированную T-клеточную пролиферацию.
Представительные примеры экспериментов с RNB5D-K1, RNB5D-K3 и RNB5D-K16 представлены на ФИГ. 19.
Пример 4 - Экспериментальная модель БГ на животных
Для исследования способности RNB-5 апитопов уменьшать БГ-подобные симптомы у мышей, были разработаны две различные модели БГ на животных.
Вначале C57/B16 мышей иммунизируют ТТГР/CFA для индуцирования выработки анти-ТТГР антител. Для исследования того, приведет ли бустерная иммунизация к дальнейшему повышению уровня анти-ТТГР антител, для одной группы мышей проводят вторую иммунизацию ТТГР/IFA через 4 недели. Уровни анти-ТТГР антител в сыворотке мышей, иммунизированных один раз, достигают уровня плато через 2 недели после иммунизации. Вторичная иммунизация вызывает существенное повышение уровней анти-ТТГР антител (ФИГ. 8).
Во-вторых, Balb/c мышам вводят инъекцией LacZ-Ad или ТТГР-Ad вирусные частицы для индуцирования гипертиреоидизма, вызванного действием анти-ТТГР антител на щитовидную железу. Уровни T4 гормона и полный титр анти-ТТГР антител IgG в сыворотке всех мышей измеряют до, через 4 недели после и через 10 недель после первой инъекции аденовирусных векторов (ФИГ. 9). Иммунизация мышей 1010 ТТГР-Ad вирусными частицами вызывает гипертиреоидизм у 3/7 мышей и 1/7 мышей при измерениях через 4 недели и через 10 недель после первой иммунизации, соответственно. Результаты показали, что уровни T4 у 2 мышей нормализовались в течение эксперимента. Иммунизация мышей l011 ТТГР-Ad вирусными частицами индуцировала гипертиреоидизм у 1/6 мышей, как через 4 недели, так и через 10 недель после первой иммунизации. Итак, одна мышь с гипертиреоидизмом через 4 недели имела нормальные уровни T4 через 10 недель, тогда как уровни T4 у других мышей сильно повысились между 4 и 10 неделями. Уровни анти-ТТГР антител измеряют как полные значения IgG, не определяя их стимулирующий или блокирующий эффект в отношении ТТГР (ФИГ. 10). Иммунизация мышей ТТГР-Ad вирусными частицами отчетливо индуцирует продуцирование анти-ТТГР антител. Мыши, иммунизированные 1010 или 1011 ТТГР-Ad вирусными частицами, продуцируют значительно больше антител, чем LacZ-Ad иммунизированные мыши. Уровни анти-ТТГР антител не отличаются для 1010-ТТГР-Ad и 1011-ТТГР-Ad иммунизированных мышей. Не обнаружено корреляции между полными уровнями IgG анти-ТТГР антител и уровнями T4.
Описанные модели на животных используют для исследования того, могут ли RNB-5 апитопы уменьшать симптомы, подобные симптомам БГ in vivo.
Пример 5 - Идентификация апитопов в участке RNB12
RNB12 также как нестед пептиды не являются иммуногенными у мышей. Поэтому указанный участок идентифицируют по реакционной способности Т-клеточной линии, полученной от пациентов с болезнью Грейвса. На ФИГ. 17 представлены результаты, полученные для такой Т-клеточной линии.
Подтверждено, что RNB12 и модифицированный пептид RNB12-K являются апитопами (ФИГ. 18).
Материалы и методы
Мыши
HLA-DRB1*0301 трансгенных мышей (DR3 мыши) выращивают и содержат в иммуногенетической мышиной колонии Mayo Clinic. HLA DR3-tg мышей-основателей получают от Gunter Hammerling (German Cancer Research Center, Heidelberg, Germany). Короче, 6-kb Ndel фрагмент HLA DRA геномного клона в pUC и 24-kb ClaIxSalI фрагмент cos 4.1, содержащий B ген, совместно вводят в оплодотворенные яйца (C57BL/6×DBA/2)-Fl доноров, спаренных с C57BL/6 самцами. Трансгенных мышей скрещивают с I-Ab нокаутными мышами. DR3 мышей скрещивают с C57BL/10 фоновым генотипом в течение 10 поколений. Такие DR3 мыши экспрессируют молекулы HLA-DRB1*0301, но не мышиные молекулы MHC-II.
Указанный штамм DR4 мышей исходно создают по способу Lars Fugger et al (PNAS 1994; volume 91:6151-6155) в том, что HLA-DRA*0101/HLA-DRB1*0101 и mCD3-huCD4c/g конструкции совместно микроинъектируют в эмбрионы от (DBA/l×A.CA)Fl скрещивания, и жизнеспособные эмбрионы переносят в псевдобеременных самок (Balb/c×129)F1 для развития до срока. Полученное потомство позднее скрещивают с IA-b нокаутным C57BL/6 фоновым генотипом (AB0 мыши), у которых отсутствует экспрессия мышиных молекул MHC класса II. Поэтому только молекулы MHC класса II, экспрессируемые такими DR4 мышами, являются человеческими HLA DR4 молекулами.
Исследования на животных были разрешены 'Этическим комитетом для экспериментов на животных' (ECD) в университете Hasselt University и осуществлялись в соответствии с высшими стандартами ухода в несодержащем патогенов виварии.
Пептиды
Пептиды синтезированы в GL Biochem Ltd (Shangai, China) и хранятся в диметилсульфоксиде (ДМСО; Sigma-Aldrich, Bornem, Belgium) при -80°C.
Исследование связывания пептидов с HLA-DRB1*0301
NetMHCII 2.2 Сервер
NetMHCII 2.2 сервер прогнозирует связывание пептидов с HLA-DRBl*0301 с использованием искусственных нейронных сетей. Предполагаемые значения выражены в нМ ИК50 значений. Пептиды, обладающие сильной и слабой связывающей способностью, указаны в выводах. Пептиды, обладающие высокой связывающей способностью, имеют значения ИК50 ниже, чем 50 нМ, и пептиды, обладающие низкой связывающей способностью, имеют значения ИК50 ниже 500 нМ. Результаты представлены как предполагаемая оценка, рассчитанная следующим образом: l-log50000(aff). Адрес вебсайта:
http://www.cbs.dtu.dk/services/NetMHCII.
База данных иммунных эпитопов (IEDB): метод консенсуса
Для каждого пептида, перцентильный ранк для каждого из четырех методов (ARB, комбинаторная библиотека, подгонка и Sturniolo) создают, сравнивая оценки пептидов с оценками для пяти миллионов случайных 15-меров, выбранных из базы данных SWISSPROT. Малочисленный перцентильный ранг свидетельствует о высоком сродстве. Средний перцентильный ранк из четырех способов затем используют для создания согласованного способа. Адрес вебсайта: http://tools.immuneepitope.org/analyze/html/mhc_II_binding.html.
Определение иммуногенности длинных пептидов
Примирование
DR3 мышам подкожно вводят в основание хвоста 100 мкг антигена в PBS (Lonza, Verviers, Belgium), эмульгированного в полном адъюванте Фрейнда ((CFA; BD Benelux, Erembodegem, Belgium), содержащем 4 мг/мл Mycobacterium tuberculosis (MTb, BD Benelux)) (100 мкл/инъекцию). В зависимости от эксперимента RNB пептиды или полной длины ТТГР-289 белок используют в качестве антигена. Контрольным животным в то же самое время вводят только PBS/CFA.
Клеточная культура
Через десять дней после иммунизации, дренирующие лимфатические узлы (LN) и селезенку извлекают. LN клетки и спленоциты выделяют и культивируют в X-vivo 15 среде (дополненной глутамином, пенициллином и стрептомицином; Lonza) в 96-луночных плоскодонных планшетах. Для исследования антиген-индуцированной клеточной пролиферации, 0,5×l06 клеток/лунку культивируют (200 мкл/лунку) в течение 72 часов с различными концентрациями антигена (0-25 мкг/мл) или с 12,5 мкг/мл очищенного белкового производного (PPD; контроль примирования; Statens serum institut, Copenhagen, Denmark).
Анализ пролиферации и анализ цитокинов
Через 72 часа, 60 мкл клеточной надосадочной жидкости собирают и замораживают. Затем к клеткам добавляют 20 мкл/лунку меченного тритием тимидина (PerkinElmer, Zaventem, Belgium) до получения конечной концентрации 1 мкКюри/лунку. Клетки инкубируют при 37°C, и через 16 часов планшеты замораживают. Оттаившие планшеты собирают и считывают, используя β-счетчик (Wallac 1450 Microbeta Trilux Liquid Scintillation Counter) для оценки клеточной пролиферации. Оттаившую надосадочную жидкость анализируют, используя мышиные Thl/Th2 l0plex FlowCytomix Multiplex (Bender MedSystems, Vienna, Austria) для измерения антиген-индуцированного продуцирования цитокинов.
Создание RNB-5-специфических гибридом
Примирование и создание T-клеточной линии
В день 0, мышам подкожно вводят путем инъекции в основание хвоста 100 мкг антиген/CFA (RNB-5 для DR3 мышей; ТТГР для DR4 мышей). Контрольных мышей иммунизируют PBS/CFA. На 10 день дренирующие LN и селезенки извлекают и создают одноклеточные суспензии. Некоторое количество клеток используют для измерения антиген-индуцированной клеточной пролиферации, как раскрыто выше. Оставшиеся спленоциты и LN клетки смешивают, и CD4+ T-клетки выделяют, используя набор для негативной очистки (нетронутые CD4+ T-клетки; Miltenyi, Leiden, The Netherlands). Затем CD4+ T-клетки культивируют вместе с антигеном (5 мкг/мл RNB-5 или 0,5 мкг/мл ТТГР-289 белка) и облученными спленоцитами (3000 рад) от DR3 мышей (отношение АПК:CD4+ T-клетки 1:1; 5×l06 клеток/мл). Клетки культивируют в X-vivo 15 среде, чтобы избежать активации, индуцированной фетальной телячьей сывороткой (FCS). На 4 день к клеткам добавляют 20 ед/мл человеческих рекомбинантных IL-2 (R&D, Abingdon, United Kingdom). На 7 день живые клетки собирают, удаляя мертвые клетки, используя разделение по градиенту плотности Фиколла (Histopaque 1083, Sigma-Aldrich). Затем клетки повторно стимулируют, как раскрыто выше, изменяя соотношение АПК:CD4+ T-клетки на 2:1. На 9 день живые клетки собирают, и некоторое количество из них используют для слияния. Остальные CD4+ T-клетки оставляют в культуре, и IL-2 добавляют в день 10. В день 14 живые клетки собирают, повторно стимулируют антигеном в присутствии АПК (отношение АПК:CD4+ T-клетки около 3:1), и используют для второго слияния в день 16.
Слияние
1×l07 BW5147 клеток (Health Protection Agency Culture Collections, Salisbury, UK) и 5×l06 CD4+ T-клеток смешивают в 50 мл ампуле и промывают при 37°C в не содержащей сыворотки среде. После центрифугирования клеточный осадок осторожно суспендируют снова. 1 мл 37°C полиэтиленгликоля (PEG; 40-50% раствор, Sigma-Aldrich) добавляют в течение 45 секунд, сохраняя клетки на небольшой водяной бане при 37°C. Клетки инкубируют при 37°C в течение 45 секунд. Затем добавляют, 1 мл 37°C несодержащей сыворотки среды в течение 30 сек., при вращении, затем добавляют 2, 3, 4, 10 и 30 мл последовательно. Ампулы переворачивают очень медленно и инкубируют при 37°C в течение 4 минут. Клетки центрифугируют в течение 5 минут при скорости 1300 об/мин при комнатной температуре (КТ) без перерыва. Надосадочную жидкость удаляют, и 50 мл КТ не содержащей сыворотки среды добавляют медленно, чтобы избежать перемешивания с клеточным осадком. Стадию промывки повторяют, используя полную среду. И наконец, клетки снова суспендируют в полной среде с 10%-FCS при КТ и помещают при различных концентрациях в 96-луночные плоскодонные планшеты (100 мкл/лунку). Через 48 часов клетки культивируют в l×гипоксантин-аминоптерин-тимидиновой (HAT, Sigma-Aldrich) среде, и рост гибридом определяют приблизительно через 6 дней. Клоны культивируют в HAT среде до тех пор, пока они являются стабильными, затем переносят из гипоксантин-тимидиновой (HT, Sigma-Aldrich) среды в полную RPMI среду. Как обычно клоны замораживают в замораживающей среде (90% FCS+10% ДМСО).
Оценка антиген-специфичности клонов
Гибридомные клетки культивируют с 5×104 VAVY или BM14 клетками (человеческие клеточные линии, экспрессирующие HLA-DRB1*0301 или HLA-DRB1*0401, соответственно; International Histocompatibility Working Group, Seattle, USA) и антигеном (10-25 мкг/мл). Через 48 часов измеряют антиген-индуцированное продуцирование IL-2, используя иммуносорбентный ферментный анализ (ELISA).
ELISA IL-2
96-луночные планшеты (Immunosorb 96 well, Fisher Scientific, Erembodegem, Belgium) покрывают на ночь при 4°C 50 мкл/лунку очищенного агента захвата Ab крысиных анти-мышиных IL-2 (BD Biosciences, Oxford, UK), разбавленного 1:250 в карбонатном буфере. После 2 промывок PBS-0,05% Твин, лунки блокируют 10% FCS/PBS в течение 1 часа при КТ. Затем лунки инкубируют с 50 мкл/лунку надосадочной жидкости клеточной культуры или IL-2 стандартом (BD Biosciences, Belgium, Erembodegem) в течение 2 часов при КТ. Планшеты инкубируют с 50 мкл/лунку биотин-крысиными анти-мышиными IL-2 (BD Biosciences), разбавленными 1:1000 в 0% FCS/PBS в течение 1 часа при КТ, с последующим инкубированием с 50 мкл/лунку экстравидин-пероксидазой (Sigma-Aldrich), разбавленной 1:1000 в PBS в течение 30 минут при КТ. Для определения связывания антител, добавляют раствор 50 мкл/лунку TMB субстрата (Perbio Science, Erembodegem, Belgium). Через 11 минут реакцию окрашивания останавливают, используя 50 мкл/лунку 2M H2SO4. Оптическую плотность (ОП) измеряют на 450 нм (630 нм сравн.) (Tecan Benelux, Mechelen, Belgium).
Независимая от процессинга система презентации антигена
Антиген-специфические клоны тестируют по их реакционной способности в отношении 15-мерных пептидов (RNB-5A до 50), представленных фиксированным или не фиксированным VAVY или BM14 клеткам (=АПК). 5×l04 клеток из индивидуальных клонов культивируют с 25 мкг/мл пептидов и 5×l04 фиксированными или свежими АПК. Для фиксации АПК клетки инкубируют с 0,5% параформальдегидом (Merck, Darmstadt, Germany) (pH 7) в течение 5 минут при КТ. Реакцию фиксации останавливают, 0,4 M глицином (Sigma-Aldrich) и промывают полученные клетки в RPMI-10%FCS. Дополнительно измеряют реакционную способность в отношении человеческого ТТГР-289 белка (Chesapeake-PERL, Savage, Maryland, USA) для измерения криптических эпитопов. Через 48 часов измеряют антиген-индуцированное продуцирование IL-2 с помощью ELISA.
Оценка растворимости RNB-5 эпитопов
Растворимость пептидов анализируют, используя Anabiotec (Zwijnaarde, Belgium). Короче, образцы пептидов растворяют в двух различных целевых концентрациях (l мг/мл и 4 мг/мл), добавляя PBS pH 7,0±0,1. Пептидные растворы инкубируют при КТ в течение по меньшей мере 16 часов. Мутность измеряют на 320 и 360 нм, до и после центрифугирования. Концентрацию пептидов определяют, используя поглощение на 280 и 205 нм и по данным ВЭЖХ-УФ. Пептиды растворяют в исходной концентрации 20 мг/мл в ДМСО. Приготавливают сериальные разбавления до целевых концентраций 4, 2 и 1 мг/мл в PBS. Пептидные растворы инкубируют при КТ в течение 16-17 часов, чтобы образовался осадок. Помутнение оценивают визуально, и поглощение измеряют на 205 нм, 280 нм и 320 нм, используя устройство Nanodrop. Пептидные растворы центрифугируют при 14800 об/мин в течение 10 минут, и визуальную оценку и измерения поглощения повторяют. Рассчитывают концентрацию пептидов, используя следующую формулу:

Индуцирование толерантности обработкой RNB-5 апитопами
DR3 мышам подкожно инъектируют в затылочную часть шеи RNB-5 15-мерные пептиды (100 мкг/инъекцию) или PBS в дни -8, -6, -4 (схема высоких доз) (ФИГ. 5). Альтернативно, мышам вводят 0,1 мкг, 1 мкг и 10 мг пептидов в дни -15, -13 и -11 соответственно, затем вводят 3 инъекции 1 пептида в дни -8, -6 и -4 (схема увеличивающихся доз). В день 0 мышам подкожно вводят инъекцией в основание хвоста 100 мкг антиген/CFA (RNB-5 пептид или ТТГР-289 белок). Через 10 дней после иммунизации, собирают дренирующие LN и селезенки. Анализ пролиферации и измерения цитокинов осуществляют, как раскрыто выше.
Модель БГ на животных
Иммунизация мышей ТТГР A-субъединичным аденовирусом
Аденовирус, экспрессирующий человеческие ТТГР A-субъединицы (аминокислотные остатки 1-289, A-субъединица Ad) и контрольные аденовирусы (LacZ-Ad), экспрессирующие β-галактозидазу, закупают у Viraquest (North Liberty, IA, USA). Шестинедельным самкам Balb/cJOlaHsd мышей (Harlan Laboratories, Venray, The Netherlands) внутримышечно инъектируют в бедренную мышцу ТТГР-Ad (1010 или 1011 частиц) или LacZ-Ad (1010 частиц). Всех мышей иммунизируют одновременно, используя одну и ту же порцию исходного аденовируса. Мышам вводят инъекции три раза с трехнедельными интервалами (дни 0, 21 и 42), и кровь отбирают до первой иммунизации и через одну неделю после второй иммунизации. Всех мышей умерщвляют через 4 недели после третьей инъекции (10 неделя) для получения крови и щитовидных желез.
Иммунизация мышей ТТГР/CFA
Шестинедельных самок C57/Bl6JOlaHsd мышей (Harlan Laboratories) (8 мышей в группе) подкожно иммунизируют инъекциями в основание хвоста 50 мкг ТТГР-289 белка, эмульгированного в CFA с 4 мг/мл MTb (50 мл). У мышей отбирают кровь из хвоста в дни 0 (преиммунно), 7, 21, 35, 49, 63 (группа A), в дни 0, 14, 28, 42, 56 (группа B) или в дни 0, 21, 28, 42, 56 (группа C). Мышам группы C проводят бустерную иммунизацию в 4 неделю, используя 50 мкг ТТГР-289 белка, эмульгированного в неполном адъюванте Фрейнда (IFA). Через 10 недель после первой иммунизации, всех мышей умерщвляют, и отбирают кровь, используя сердечную пункцию.
ТТГР антитела
Анти-ТТГР антитела (IgG класс) против очищенного ТТГР-289 белка (Chesapeake-Perl) измеряют, используя ELISA. 96-луночные планшеты (половину площади 96-лунок, Fisher Scientific) покрывают на ночь при КТ 50 мкл/лунку ТТГР-289 белка в PBS (0,5 мкг/мл). После промывки PBS-0,05% Твин, лунки блокируют 1% BSA (масс/об) в PBS в течение 1 часа при КТ, и инкубируют с тестовой сывороткой (дубликатные аликвоты, 1:50 разбавление). Мышиные анти-ТТГР антитела (A9, Abeam, Cambridge, UK) используют в качестве позитивного контроля. Связывание антител определяют, используя конъюгированный с пероксидазой хрена козий анти-мышиный IgG (Abeam), и сигнал проявляют, используя TMB. Оптическую плотность (OD) измеряют, используя считывающее устройство для планшетов на частоте 450 нм (Tecan Benelux).
Сывороточный тироксин и гистология щитовидной железы
Полный тироксин (T4) измеряют в неразбавленной мышиной сыворотке (10 мкл), используя набор CBI мышиный/крысиный тироксин ELISA (Calbiotech, Spring Valley, CA, USA) в соответствии с инструкциями изготовителя. Значения T4 рассчитывают, используя стандарты, представленные в наборе, и выражают как мкг/дл. Щитовидные железы фиксируют в 10% нейтральном буферированном формалине (pH 7,5), разрезают на секции и окрашивают гематоксилином и эозином. Секции рассматривают на предмет патологических изменений (гипертрофия, гиперцеллюлярность эпителиальных клеток и инфильтрация лимфоцитов) и проводят оценку (KWS Biotest, Bristol, UK).
|
|
T-клеточные линии человеческих PBMC (Пример 5)
Моноциты периферической крови (PBMC) здоровых доноров или пациентов с болезнью Грейвса выделяют (Histopaque-1077, Sigma-Aldrich) и замораживают аликвотами. В день 0, клетки оттаивают, и 106 PBMC/мл культивируют с 20 мкг/мл пептида в дополненной (l0 мМ HEPES, 50 ед/мл пенициллин/стрептомицина и 4 мМ L-глутамина (Lonza)) RPMI 1640 (Lonza) с 5% AB сывороткой (Sigma Aldrich), добавленной в 6-луночный планшет(Greiner Bio-one), и инкубируют при 37°C и 5% CO2. Через 7 дней rhIL-2 (R&D Systems) добавляют до конечной концентрации 20 ед/мл. На 12 день клетки собирают, промывают и снова возвращают в культуру при концентрации 106+2×106 новых оттаивших облученных аутологусных PBMCs/мл в 6 луночном планшете, стимулированных 5-l0 мкг/мл пептида и 20 ед/мл rhIL-2. В дни 15, 18 и 21 добавляют дополнительно rhIL-2 до конечной концентрации 20 ед/мл.
В день 24 клетки собирают, промывают и 2x104 культивируют в 96 луночном круглодонном планшете (Cellstar, Greiner Bio One) со 105 облученными аутологусными PBMC и VAVY/BM14/MGAR человеческой клеточной линией, экспрессирующей человеческие молекулы MHC класса II (International Histocompatibility Working Group, Seattle, US), в дополненной RPMI+5% AB сывороткой в присутствии различных антигенов (пептиды, белок) в концентрациях 5-50 мкг/мл. Культуры инкубируют в течение 48 часов с 0,5 мкКюри/лунку 3H-тимидина (Perkin Elmer), добавленного в последние 18 часов. После замораживания планшетов клетки собирают и считывают значения, используя β-счетчик (Wallac 1450 Microbeta Trilux) для оценки пролиферации. Перед добавлением 3H-тимидина отбирают 60 мкл/лунку клеточных культур для анализа цитокинов.
ELISA IFN гамма
Надосадочные жидкости TCL культур оценивают по содержанию IFN гамма, используя набор Human IFN-gamma Duoset kit, R&D Systems в соответствии с инструкциями изготовителей. Оптическую плотность измеряют на длине волны 450 нм (Tecan Benelux).
Все публикации, упомянутые в приведенном выше описании, включены в описание по ссылке. Различные модификации и вариации раскрытых способов и систем настоящего изобретения будут очевидны специалистам в данной области, не выходя за рамки объема и сути изобретения. Хотя настоящее изобретение было раскрыто в связи с конкретными предпочтительными вариантами, следует понимать, что настоящее изобретение в том виде, как оно заявлено, не следует несправедливо ограничивать такими конкретными вариантами. В действительности, различные модификации раскрытых способов осуществления изобретения, которые очевидны специалистам в молекулярной биологии, иммунологии или родственных областях, должны быть включены в объем приведенной формулы изобретения.