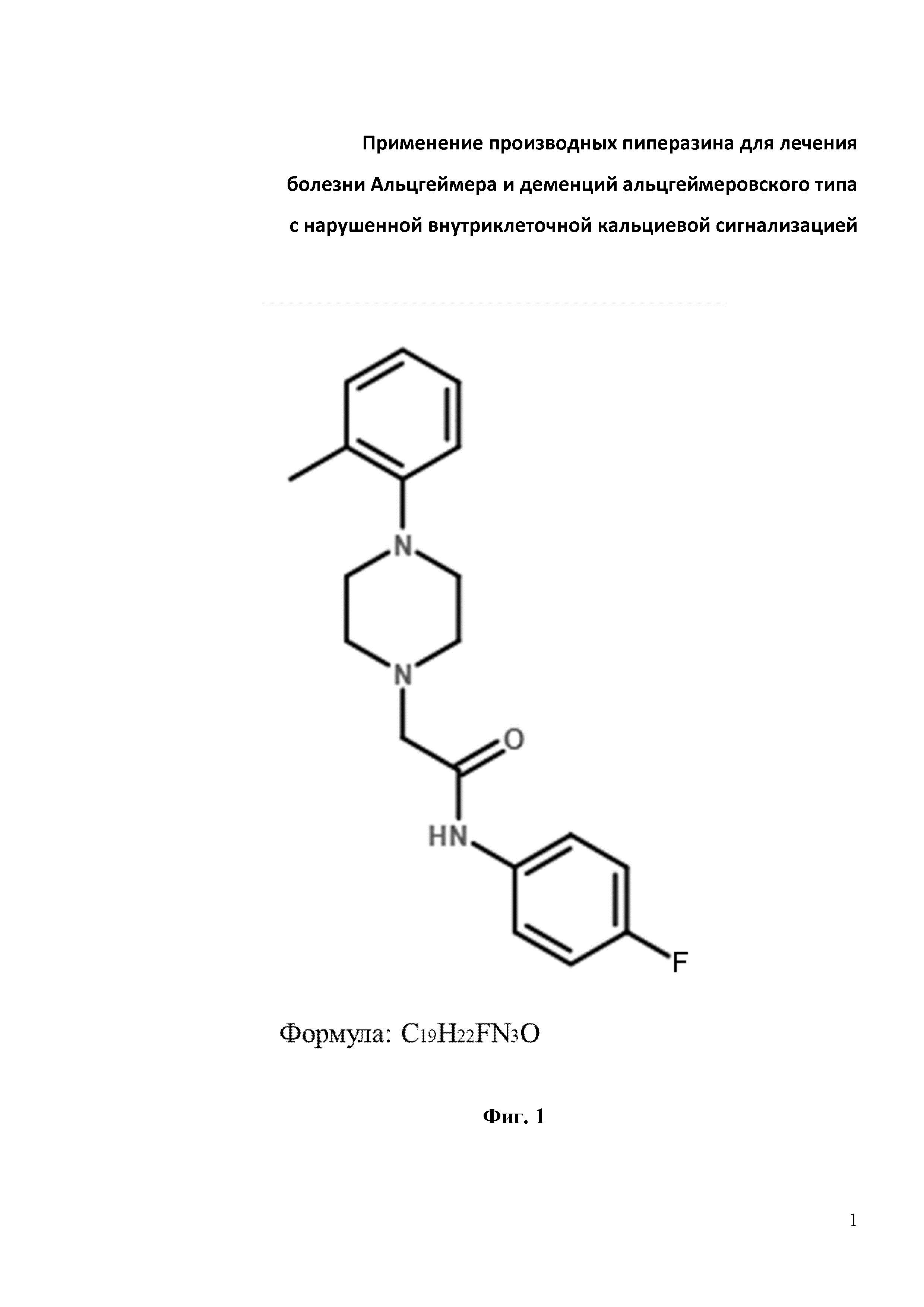
Результат интеллектуальной деятельности: Применение производных пиперазина для лечения болезни Альцгеймера и деменций альцгеймеровского типа с нарушенной внутриклеточной кальциевой сигнализацией
Вид РИД
Изобретение
Изобретение относится к биологии и медицине, а именно к неврологии, и может быть использовано при лечении пациентов с болезнью Альцгеймера (БА) и для предотвращения ее развития. Более конкретно, рассматриваются вещества на основе производных пиперазина, которые могут быть использованы для получения лекарственного средства, предназначенного для терапевтического лечения пациентов, страдающих БА и деменций альцгеймеровского типа.
Единственным доступным на фармакологическом рынке аналогом C18H20ClN3O является соединение природного происхождения гиперфорин. Гиперфорин – это фитохимическое соединение, вырабатываемое некоторыми представителями рода Hypericum, в частности Hypericum perforatum (Зверобой продырявленный). В настоящее время на фармакологическом рынке гиперфорин существует в виде биологически-активной добавки, а именно сухого экстракта из зверобоя. Ранее было показано, что активация каналов TRPC6 с помощью гиперфорина способна замедлить амилоид-индуцированную нейротоксичность и восстановить пространственную память в мышиной модели БА APPPSENdE9 [1-3]. Хорошо известным побочным эффектом применения гиперфорина является расстройство желудочно-кишечного тракта, связанное с высоким уровнем экспрессии каналов TRPC6 в гладкой мускулатуре желудка [4]. Однако, помимо этого гиперфорин (активный компонент экстракта из травы зверобоя) хорошо зарекомендовал себя как лекарственное антидепрессантное средство с минимальными побочными эффектами [5, 6].
Производные пиперазина, применяемые в заявляемом изобретении, обладают минимальным набором побочных эффектов, благодаря тому, что их рабочая концентрация лежит в наномолярном диапазоне. Кроме того, в отличие от гиперфорина производные пиперазина С19H22FN3O (Фиг. 1) и C18H20ClN3O (Фиг. 2) не напрямую активируют каналы TRPC6, а являются их положительными модуляторами, используя диацилглицерол (DAG) в качестве посредника. Сухой экстракт из травы зверобоя помимо гиперфорина также содержит гиперицин и флавоноиды, механизм действия которых отличается от гиперфорина. Кроме этого, гиперфорин является плохо растворимым в воде, нестабилен на свету и кислороде, способен активировать прегнан Х рецептор, стимулируя тем самым экспрессию различных генов, вовлеченных в метаболизм ксенобиотиков. Перечисленные недостатки природного гиперфорина можно устранить путем модификации химической структуры соединения, однако химический синтез гиперфорина представляет собой сверхтрудную задачу [7], значительно увеличивая стоимость фармацевтического производства.
Технический результат заявляемого изобретения заключается в возможности применения соединений производных пиперазина с известной биологической мишенью (каналы TRPC6), обладающих высокой аффинностью к клеточной мишени, химический синтез которых не является дорогостоящим и трудоемким процессом, для получения лекарственного средства, предназначенного для предупреждения и/или лечения нейродегенеративного заболевания, представляющего собой раннюю стадию болезни Альцгеймера и деменции альцгеймеровского типа.
Гиперфорин является широко запатентованным соединением в России и за рубежом (заявки WO9940905, WO0057707, WO9941220 «Hyperforin derivatives, the use thereof and formulations containing them», WO2014202597 «Hyperforin derivatives and their use in Alzheimer disease», патенты РФ № 2240304 «Производные гиперфорина, их использование и препараты, содержащие эти производные», № 2320636 «Производные гиперфорина, их применение и содержащие их составы»).
Еще одним известным аналогом C18H20ClN3O является соединение NSN21778 (заявка № WO2016182812, опубл. 17.11.2016 по классу МПК A61K31/517). Механизм действия NSN21778 является аналогичным соединению C18H20ClN3O, NSN21778 также является положительным модулятором TRPC6-зависимого нДУВК [8]. Преимущество C18H20ClN3O по сравнению с NSN21778 заключается в более низкой рабочей концентрации, которая составляет 10 нМ (Фиг. 4, 6), по сравнению с рабочей концентрацией для NSN21778, которая составляет 30нМ.
Болезнь Альцгеймера – это нейродегенеративное заболевание, поражающее в большинстве случаев людей преклонного возраста, отличительной чертой которого является прогрессирующая потеря памяти. Потеря синаптических контактов и гибель нейронов, наблюдающаяся при БА, наиболее сильно затрагивает области коры головного мозга и гиппокампа, что в конечном счете, приводит к их атрофии. Также, отличительными патофизиологическими признаками БА является накопление в головном мозге пациентов нейрофибриллярных клубков и амилоидных бляшек. Средняя продолжительность жизни после постановки диагноза БА оценивается как 7-10 лет. БА затрагивает психические и физические функции человека, приводя к многочисленным нарушениям когнитивной функции и потери способности к самообслуживанию. Забота о больном требует больших временных и финансовых затрат, и, в большинстве случаев, ложится на плечи близких и родственников, значительно снижая их качество жизни. Поскольку как в развитых, так и в развивающихся странах мира наблюдается неуклонное старение населения, общая частота нейродегенеративных заболеваний имеет четкую тенденцию к увеличению. У людей старше 70 лет распространенность БА составляет около 5%, а среди лиц старше 80 лет уже достигает 10-15%. Таким образом, для современного общества БА представляет крайне важную социальную проблему, решение которой на данный момент отсутствует.
Пока что еще доминирующая «амилоидная» гипотеза БА утверждает, что ключевой причиной, вызывающей прогрессирующую нейродегенерацию, является накопление в головном мозге различных форм бета-амилоида. Однако клинически доказано, что применение медицинских препаратов, направленных только на уничтожение амилоидных агрегатов или снижение выработки амилоида в головном мозге человека не способно остановить или замедлить прогрессирование болезни. На данный момент пациентом с диагнозом БА доступны только медицинские препараты, предоставляющие исключительно симптоматическое лечение, среди них: Мемантин, Донепецил, Галантамин и Ривастигмин.
В основе настоящего изобретения лежит теория кальциевой дисрегуляции в патогенезе БА. Все больше ученых сходятся во мнении, что «хранение» памяти в гиппокампе на клеточном уровне осуществляется за счет формирования сильных и стабильных синаптических контактов, образованных со стороны дендрита так называемыми грибовидными дендритными шипиками. В серии фундаментальных исследований авторами было обнаружено, что для стабилизации грибовидных шипиков необходим перманентный вход кальция через депо-управляемые каналы [9-11]. Ранее было показано, что причиной элиминации грибовидных шипиков в различных мышиных моделях БА является нарушение депо-управляемого входа кальция (ДУВК) в нейронах и его восстановление способно предотвратить описанную выше потерю синаптических контактов [9-11]. Исходя из полученных результатов, сделан вывод о том, что активаторы нейронального ДУВК являются потенциальными терапевтическими препаратами для разработки лекарственных средств для лечения БА.
Ранее была изучена молекулярная идентичность каналов, осуществляющих нейрональный ДУВК. Было показано, что в нейронах гиппокампа роль нДУВК выполняет троичный белковый комплекс STIM2-ORAI2-TRPC6 [12], где белки семейства TRPC и ORAI это кальций-проводящие ионные каналы плазматической мембраны нейронов. Более того, был изучен специфичный активатор нДУВК – молекула NSN21778 [12]. В доклинических исследованиях на мышиных нокиновых моделях БА было показано, что соединение NSN21778 способно восстановить синаптические контакты и улучшить когнитивные функции подопытных мышей. Однако было обнаружено, что данное соединение обладает плохой фармакокинетикой, а именно быстро выводится из организма подопытного животного (в течение нескольких часов), плохо проникает через гематоэнцефалический барьер и вызывает потерю веса у подопытных животных.
Настоящее изобретение направлено на поиск веществ, которые отличаются по структуре от NSN, но активируют каналы TRPC6. В химической библиотеке Черноголовки (IBS, Россия) было выбрано два соединения - аналога, имеющих высокий процент (≥88%) совпадения со структурой известных в литературе активаторов TRPC6.
Затем, используя биоинформатическую программу PASS online (http://www.way2drug.com/passonline), были оценены биологическая активность, токсичность и мутагенность двух соединений (таблицы 1, 2).
Таблица 1. Механизм действия
|
Таблица 2. Возможные неблагоприятные и токсические эффекты.
|
На основании биоинформатического анализа были выбраны два соединения С19H22FN3O (Фиг. 1) и C18H20ClN3O (Фиг. 2), потенциальных активаторов каналов TRPC6.
Далее с помощью метода кальциевого имиджинга было показано, что соединение C18H20ClN3O обладает способностью активировать TRPC6 каналы в клетках линии НЕК, гиперэкспрессирующих TRPC6 (Фиг. 7, 8, 9, 10). Кроме того, было показано, что данное соединение способно активировать постсинаптический нДУВК в условиях амилоидной токсичности (Фиг. 11, 12, 13). Также была подтверждена специфическая активность данного соединения в скрининнговом эссе, где показано, что соединение C18H20ClN3O защищает грибовидные шипики от амилоидной токсичности. Минимальная рабочая концентрация составляла всего 10нМ (Фиг. 4, 6). Полученные данные свидетельствуют о том, что соединение C18H20ClN3O демонстрирует хорошие нейропротекторные свойства в in vitro моделях БА и может быть применено для лечения болезни Альцгеймера.
Описание чертежей
Фиг. 1. Химическая структура соединения N-(4-фторфенил)-2-(4-(о-толил)пиперазин-1-ил)ацетамид (С19H22FN3O), изученного на предмет защиты грибовидных шипиков от амилоидной токсичности.
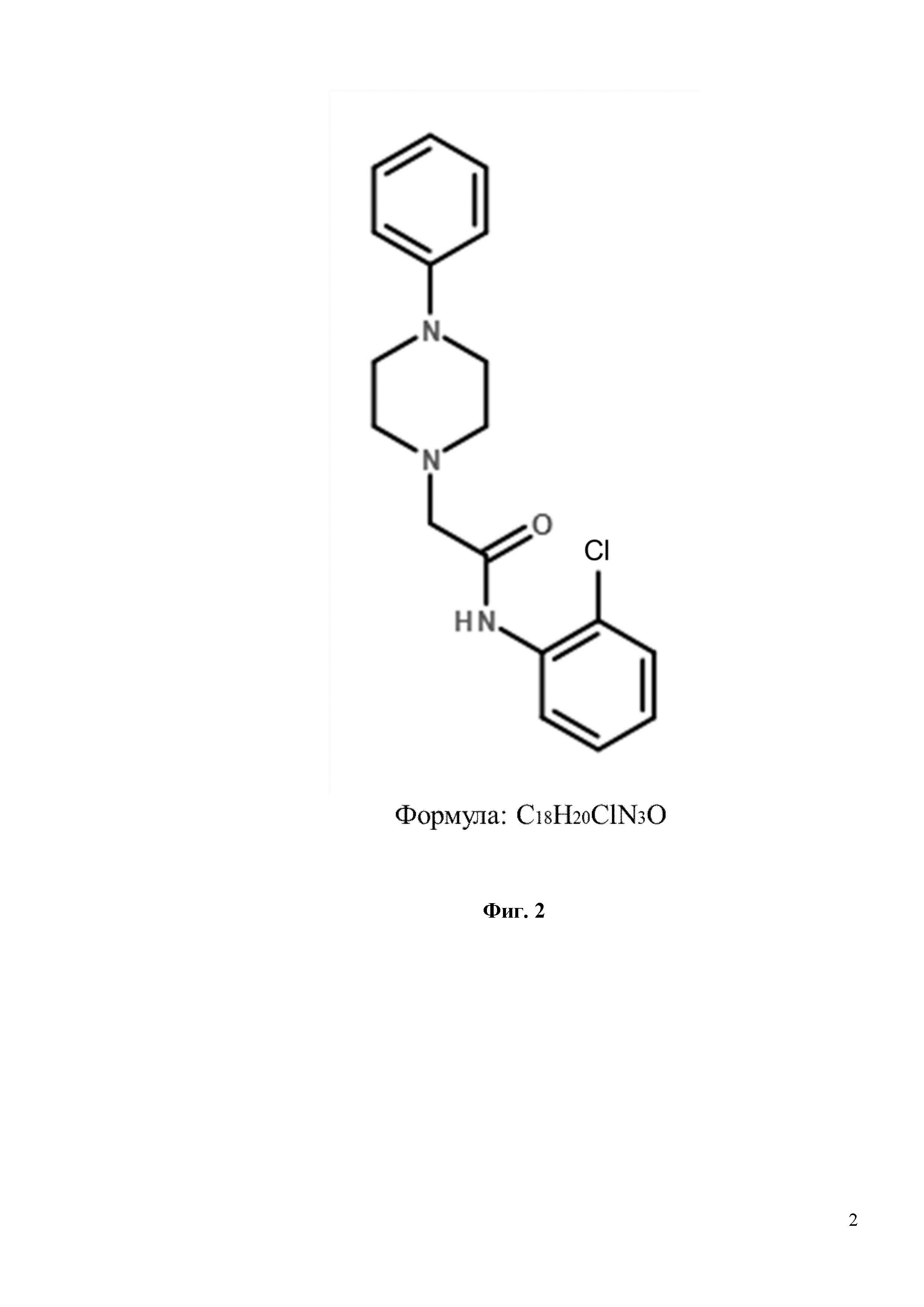
Фиг. 2. Химическая структура соединения N-(2-хлорфенил)-2-(4-фенилпиперазин-1-ил)ацетамид (С18H20ClN3O), изученного на предмет защиты грибовидных шипиков от амилоидной токсичности.
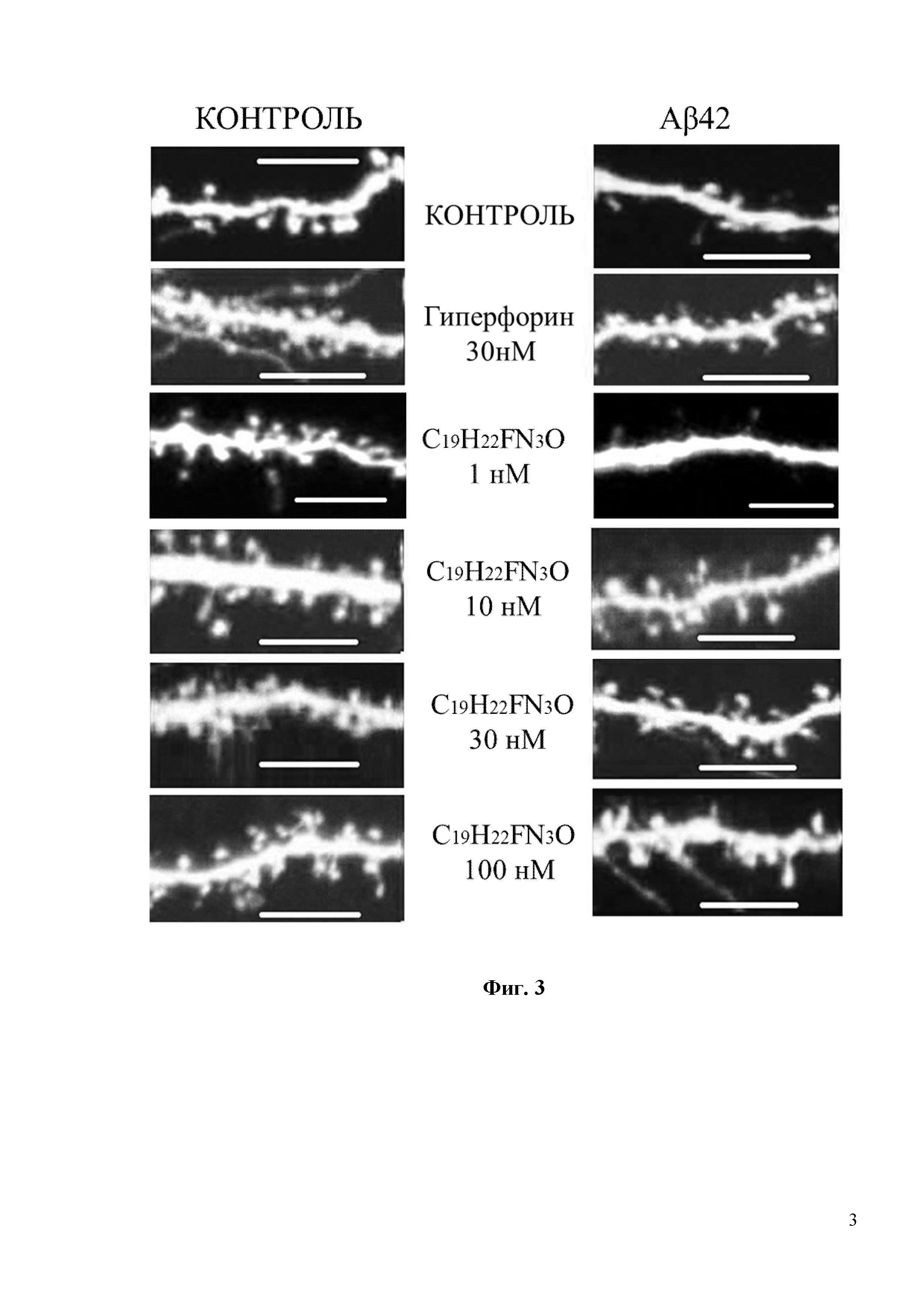
Фиг. 3. Восстановление грибовидных шипиков с помощью соединения С19H22FN3O в условиях амилоидной синаптотоксичности. На фиг. 3 показаны конфокальные изображения нейронов гиппокампа, трансфецированных плазмидой TD-Tomato на DIV7. Олигомерную фракцию Aβ42 добавляли на DIV 12-13. В качестве контроля использовалась культура клеток, где вместо Aβ42 добавляли равный объем среды для культивирования. Соединение С19H22FN3O или положительный контроль Гиперфорин добавляли при указанных концентрациях к культурам за 16 часов до фиксации. Масштабная метка соответствует 10 мкм.
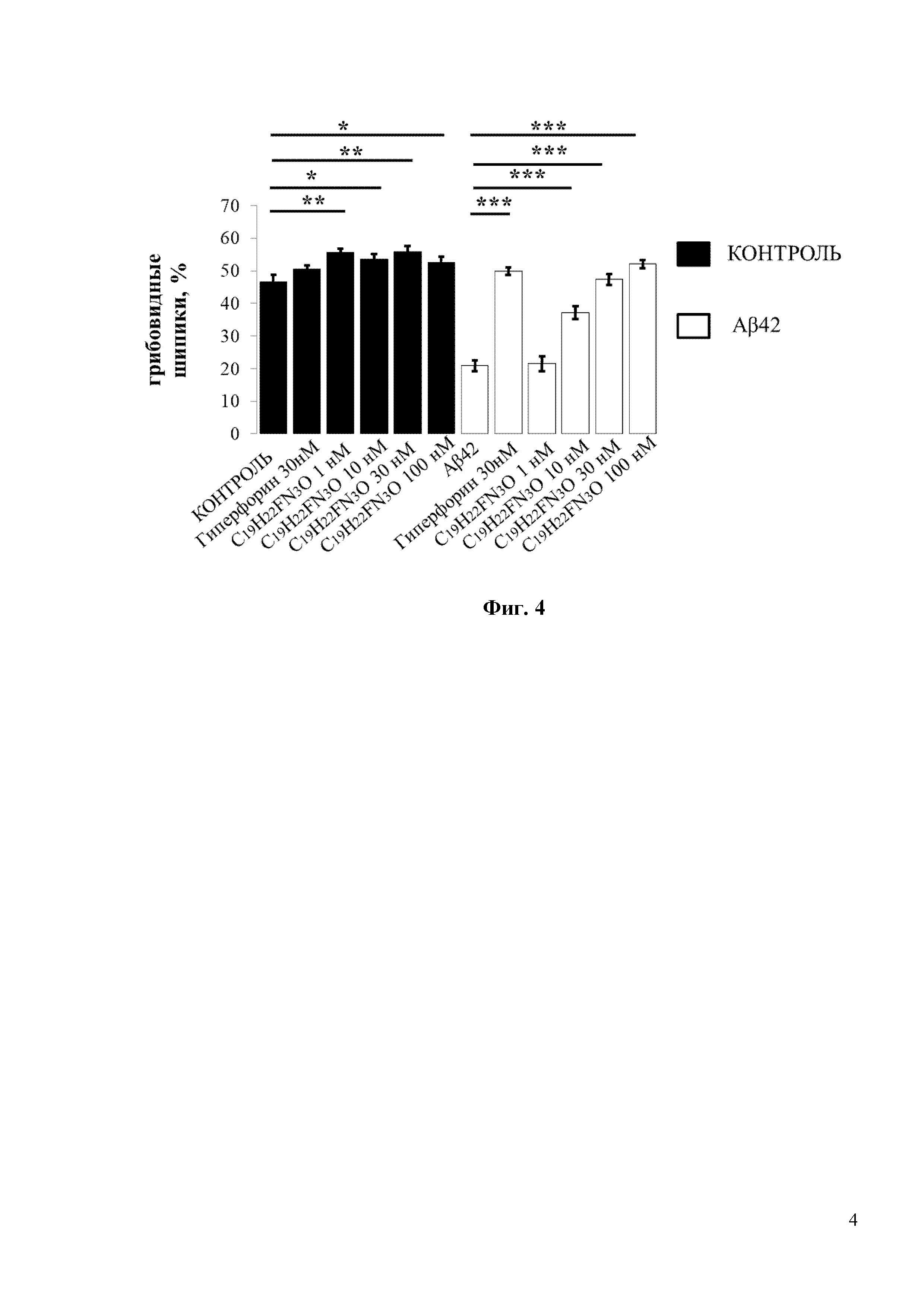
Фиг. 4. Средний процент грибовидных шипиков для каждой группы клеток, изображенных на фиг. 3. Данные представлены в виде среднее значение ± SEM (n = 22-32 нейронов для каждой группы). Контроль – контрольная группа нейронов. Столбец, соответствующий контрольной группе (Контроль), отмечен черным цветом. Белые столбцы соответствуют культурам гиппокампа, которые были обработаны олигомерным Aβ42. * p <0,05, ** p <0,005, *** p <0,0005.
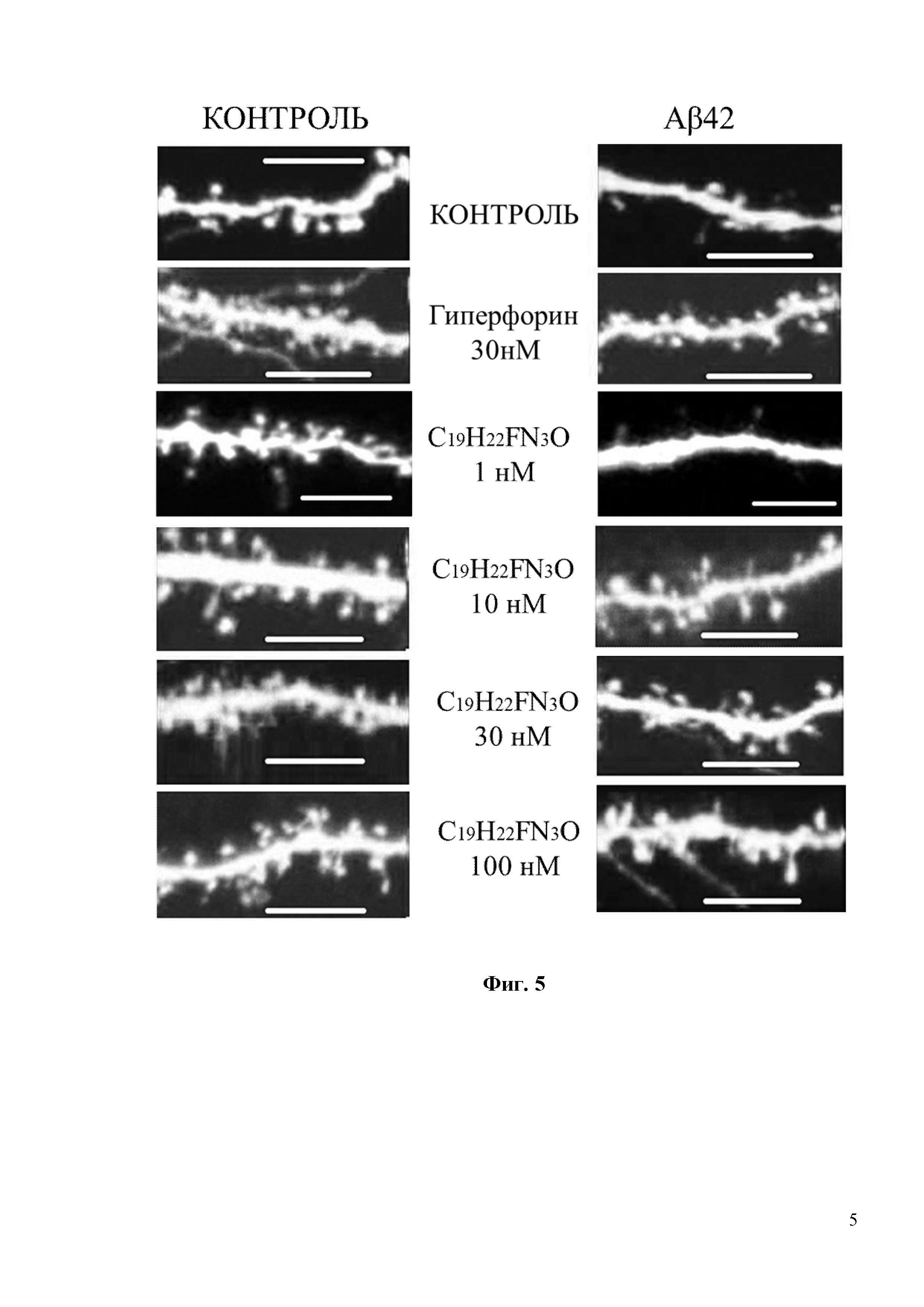
Фиг. 5. Восстановление грибовидных шипиков с помощью соединения С18H20ClN3O в условиях амилоидной токсичности. Показаны конфокальные изображения нейронов гиппокампа, трансфецированных плазмидой TD-Tomato на DIV7. Олигомерную фракцию Aβ42 добавляли на DIV 12-13. В качестве контроля использовалась культура клеток, где вместо Aβ42 добавляли равный объем среды для культивирования. Соединение С18H20ClN3O или положительный контроль Гиперфорин добавляли при указанных концентрациях к культурам за 16 часов до фиксации. Масштабная метка соответствует 10 мкм.
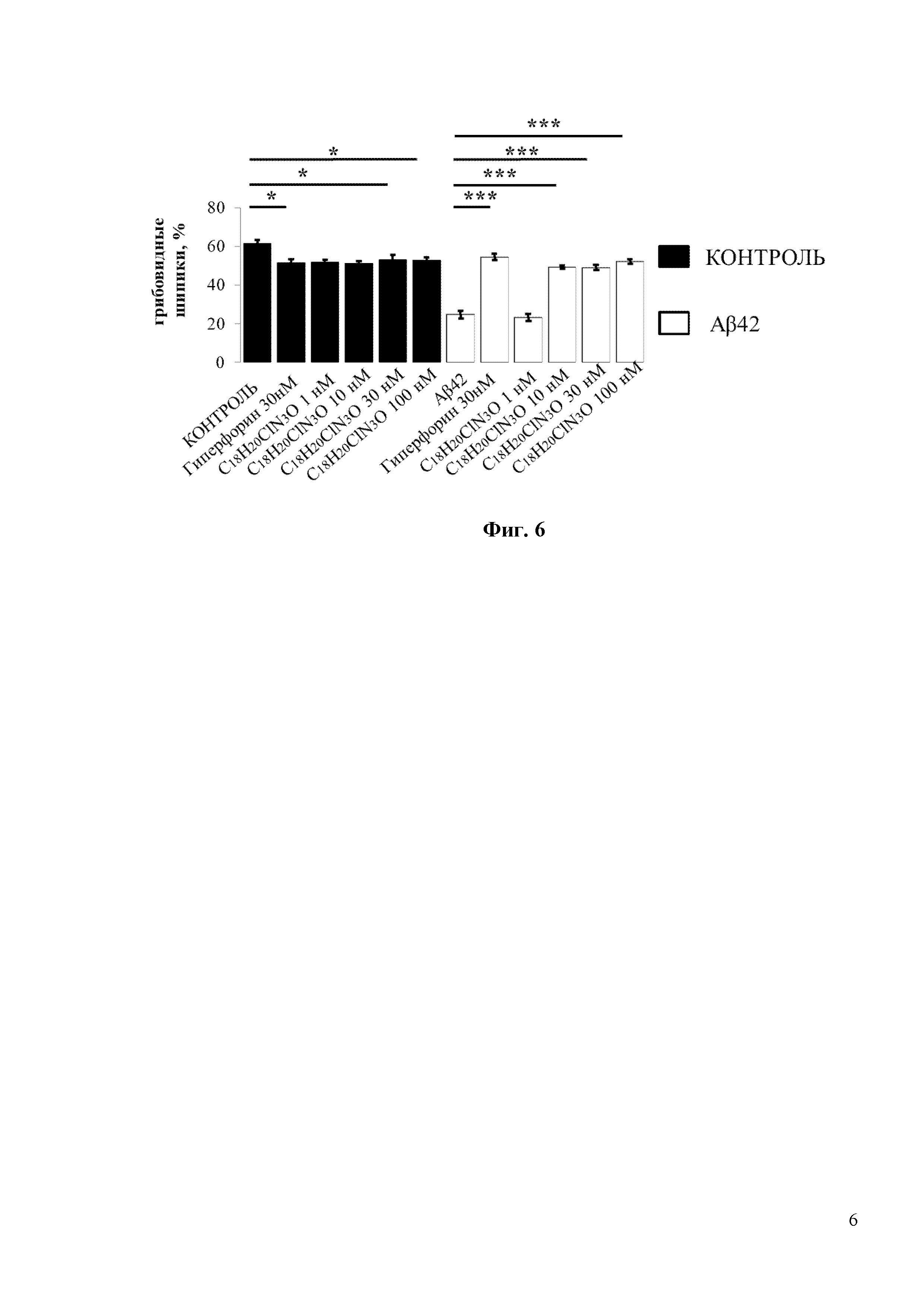
Фиг. 6. Средний процент грибовидных шипиков для каждой группы клеток, изображенных на фиг. 5. Данные представлены в виде среднее значение ± SEM (n = 22-32 нейронов для каждой группы). Контроль – контрольная группа нейронов. Столбец, соответствующий контрольной группе (Контроль), отмечен черным цветом. Белые столбцы соответствуют культурам гиппокампа, которые были обработаны олигомерным Aβ42 * p <0,05, *** p <0,001.
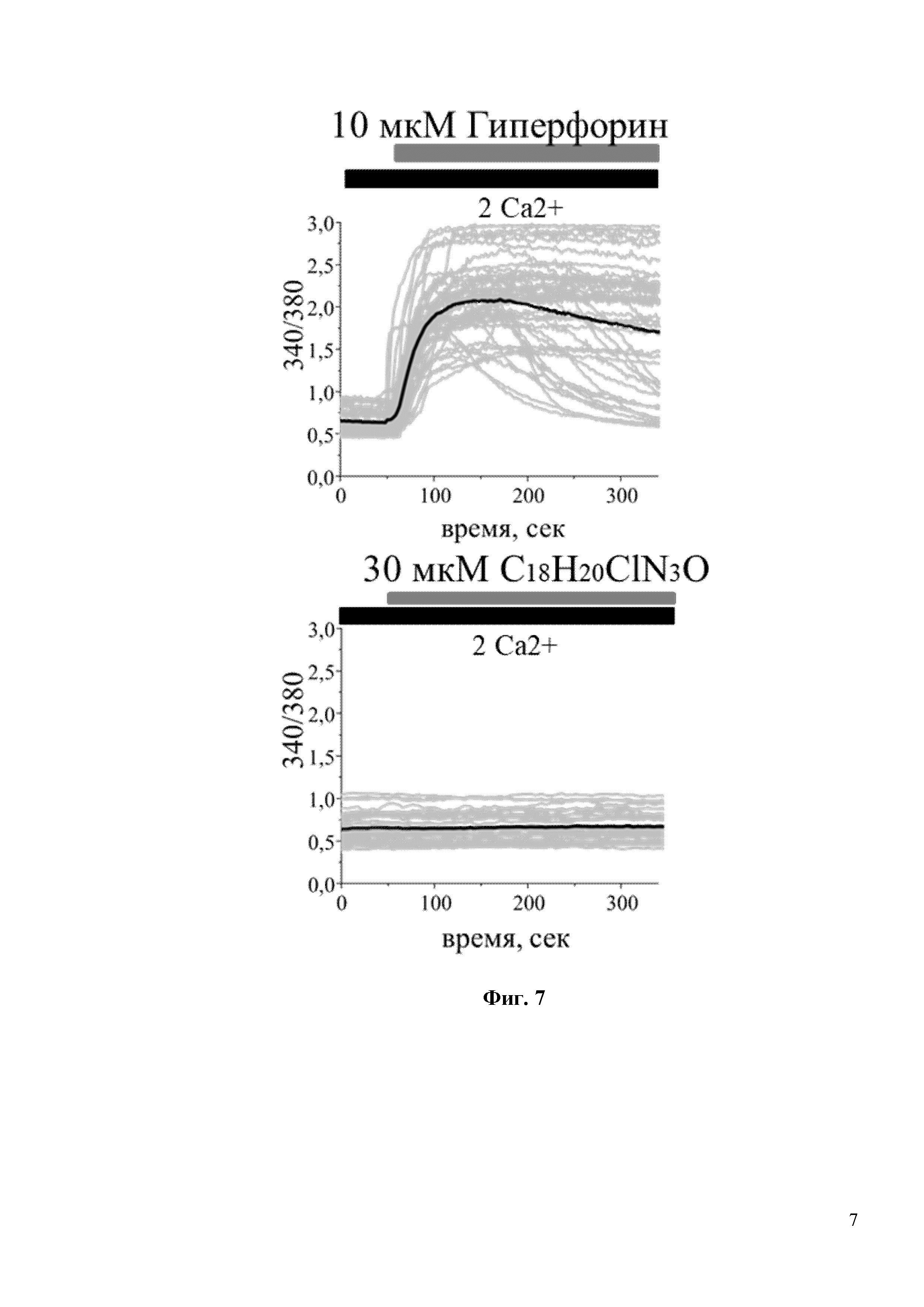
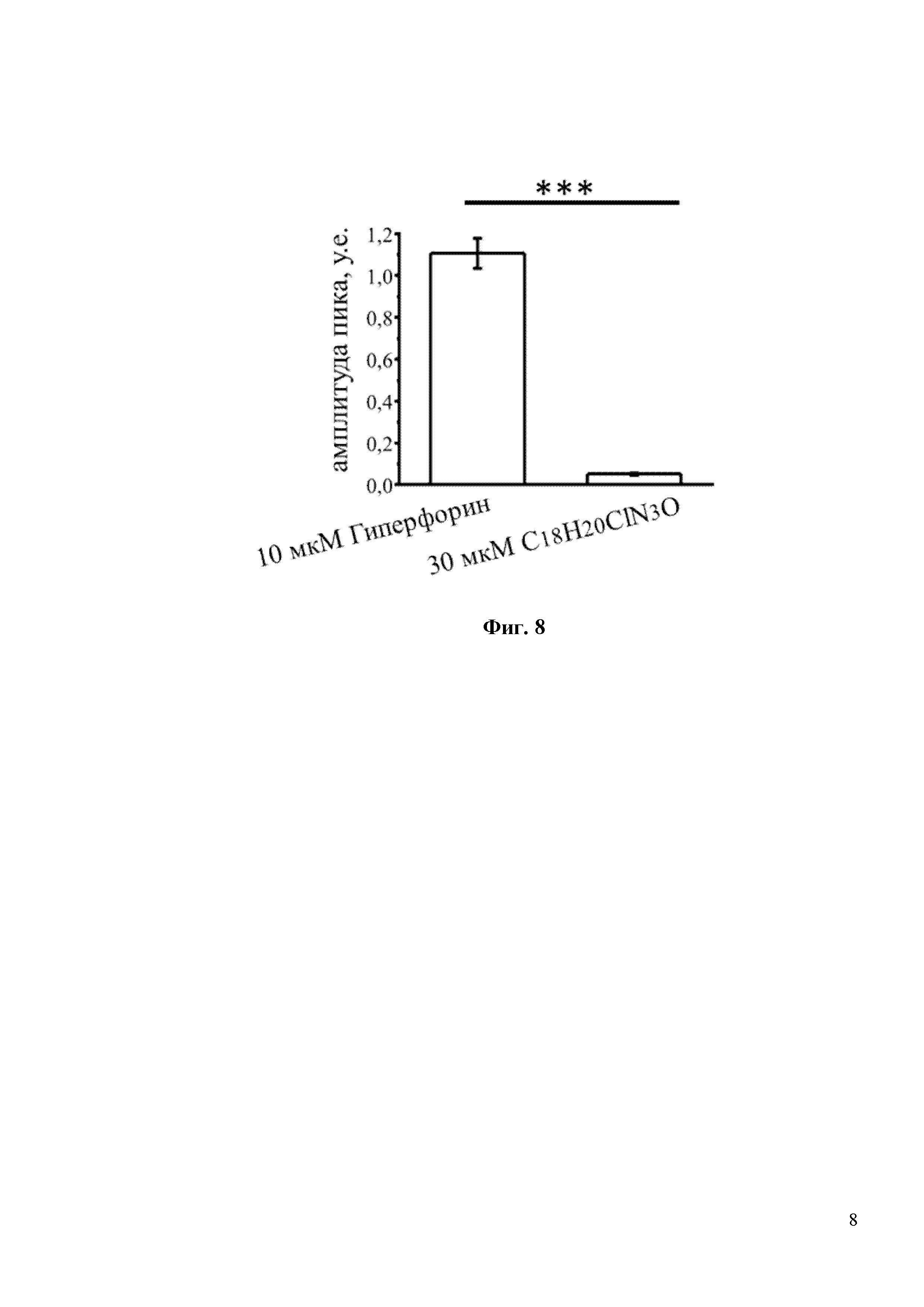
На Фиг. 7 показано, что С18H20ClN3O не является прямым активатором каналов TRPC6. В частности, интенсивность флуоресценции Fura-2 (340/380) не изменяется при добавлении 30мкM С18H20ClN3O в культуру клеток HEK293, трансфицированных плазмидой TRPC6. В то время как положительный контроль – 10 мкМ Гиперфорин, вызывает сильное увеличение флуоресценции Fura-2.
На Фиг. 8 показан количественный анализ результатов, изображенных на фиг. 7. Показано, что амплитуда пика (в у.е.) в присутствии 10мкМ Гиперфорина составляла 1,0. В то время как для 30мкМ С18H20ClN3O амплитуда пика ровнялась 0,0 у.е. *** p <0,001.
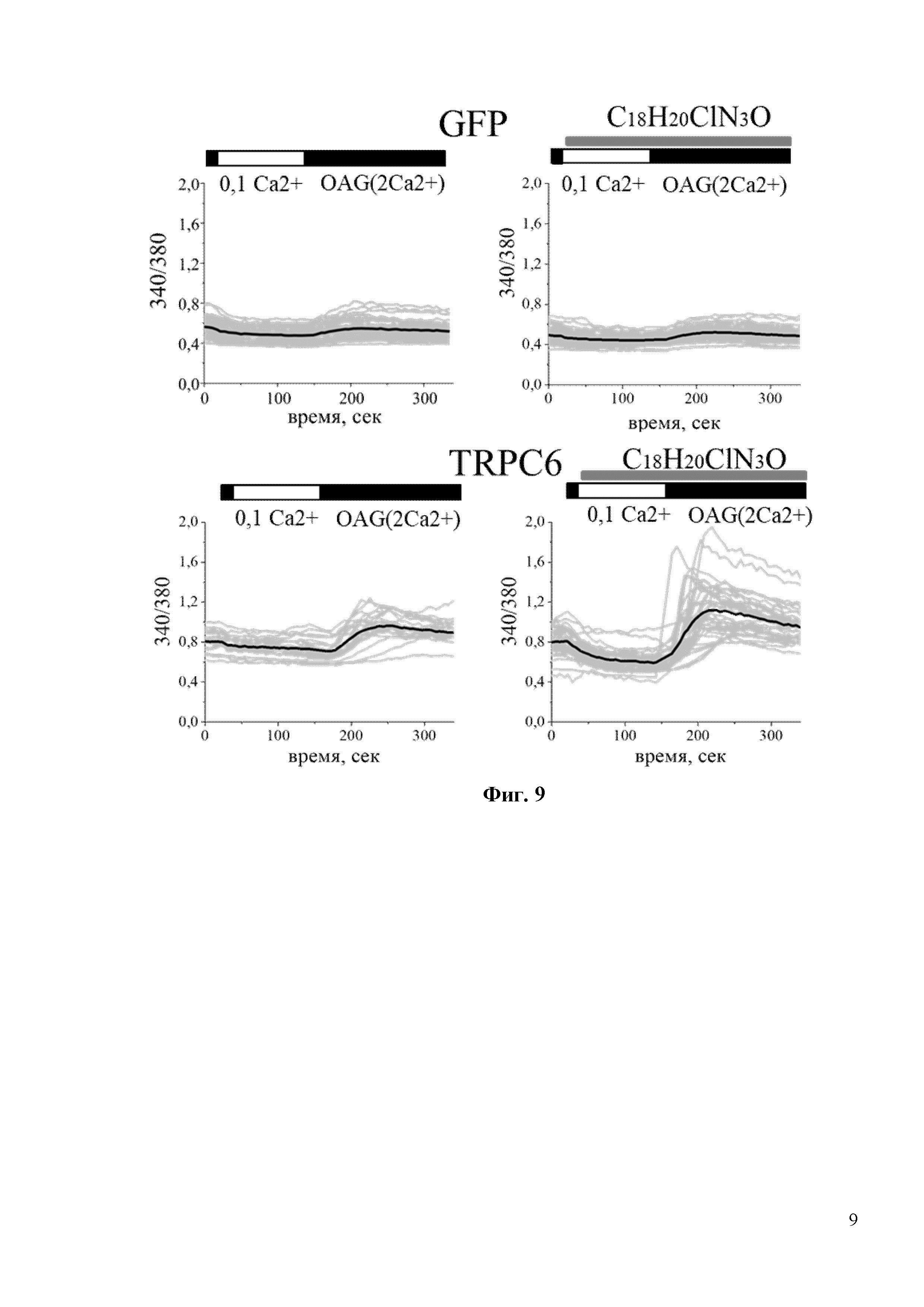
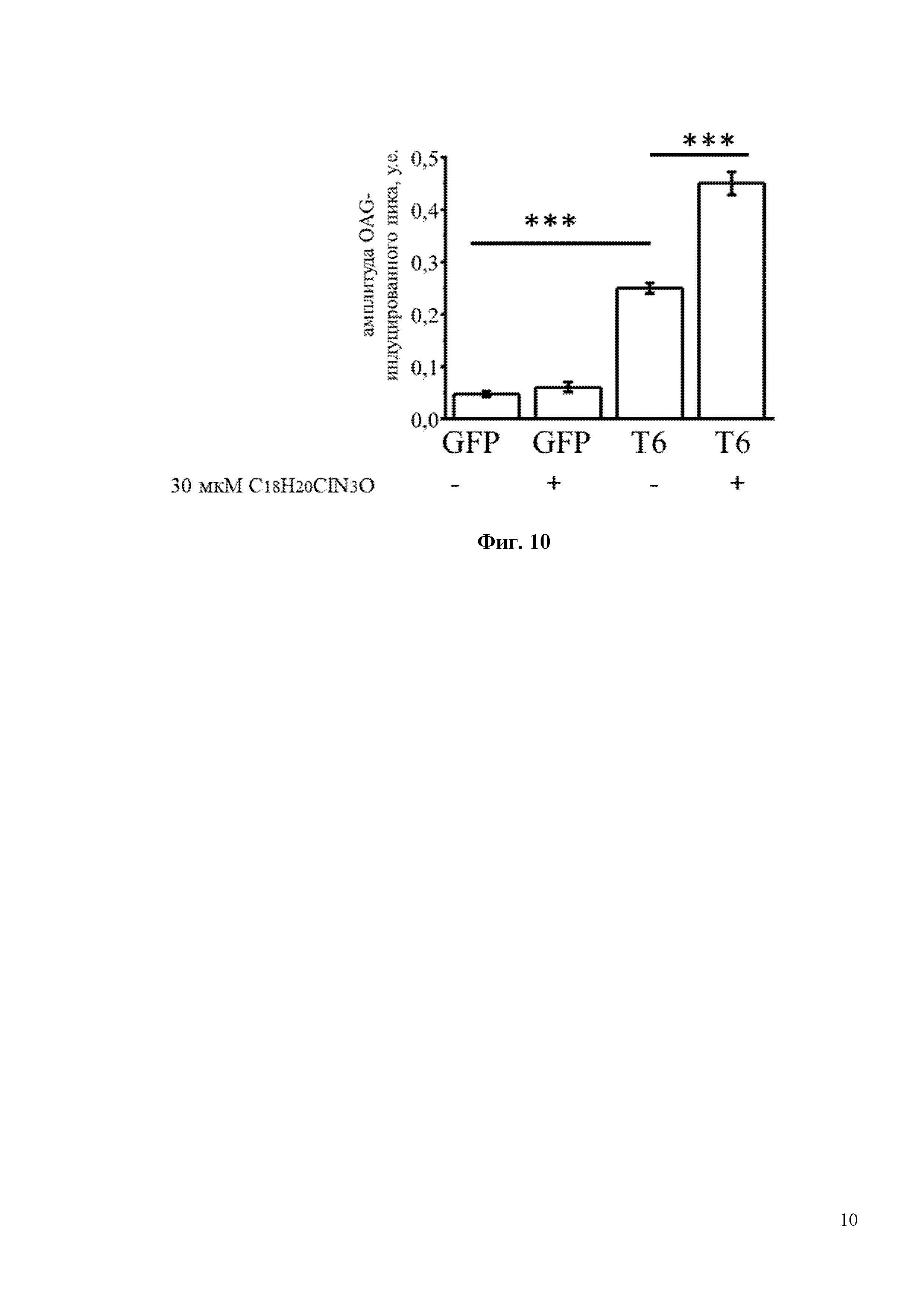
На Фиг. 9 показано, что соединение С18H20ClN3O активирует каналы TRPC6 по OAG-зависимому пути. В частности, в экспериментах, показанных на фиг. 9 HEK клетки, трансфецировали плазмидой EGFP (GFP) или комбинацией EGFP и TRPC6 плазмид (TRPC6). Клетки переносили в модифицированную среду aCSF, содержащую 0,1 мМ Ca2+, в течение 2 минут, а затем возвращали в среду, содержащую 2 мМ Ca2+, с добавлением 50 мкМ ОАG. Время добавления 30 мкМ С18H20ClN3O обозначено серыми полосками над кривыми Fura-2. Для каждой экспериментальной группы показаны ответы отдельных клеток (серый цвет) и усредненный ответ (черный цвет).
На Фиг. 10 показан количественный анализ результатов, изображенных на фиг. 9. Показано, что 30мкМ С18H20ClN3O увеличивает амплитуду пика (в у.е.) с 0,25 до 0,45 в НЕК клетках, трансфецированных плазмидой TRPC6. *** p <0,001.
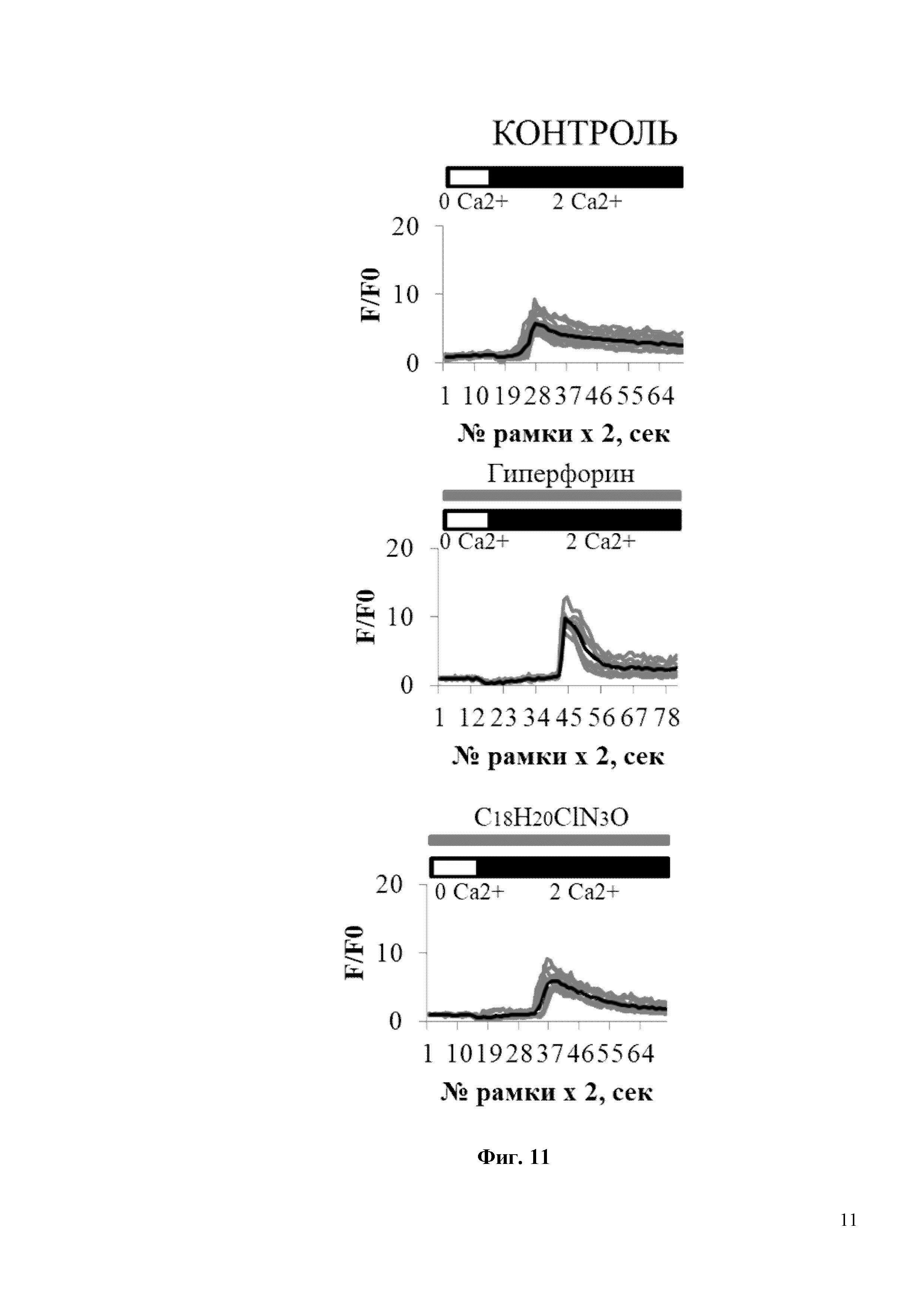
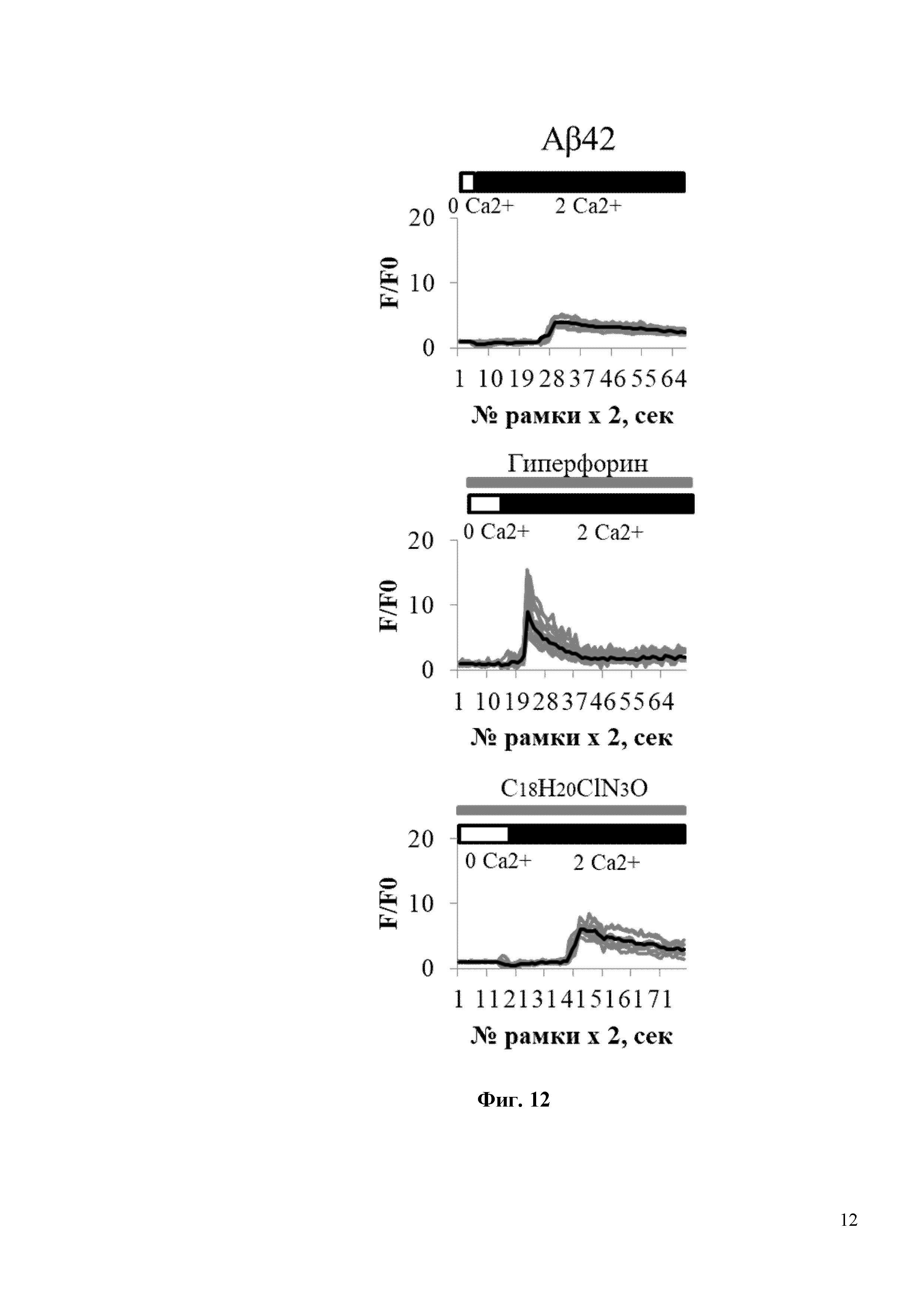
На Фиг. 11 показано, что соединение С18H20ClN3O не вызывает изменения нДУВК в постсинаптических дендритных шипиках нейронов гиппокампа дикого типа. По оси ординат приведены значения нормированной флуоресценции GCaMP5.3 (F/F0), где F – регистрируемая на каждой рамке считывания флуоресценция GCamp5.3, F0 – базовая флуоресценция GCamp5.3, регистрируемой в каждом отдельном шипике. По оси абсцисс приведены номера временных рамок считывания флуоресценции GCamp5.3. Интервал между рамками считывания составлял 2 секунды (сек). В частности, на фиг. 11 показаны временные зависимости изменения сигнала нормированной флуоресценции (F/F0) GCaMP5.3 в шипиках нейронов гиппокампа дикого типа без воздействия (контроль), либо в присутствии 300 нМ Гиперфорина (Гиперфорин), либо в присутствии 300 нм С18H20ClN3O (С18H20ClN3O). Блокаторы кальциевых каналов (TTX, нифедипин, D-AP5, CNQX) присутствовали в камере для кальциевого имиджинга на протяжении всего эксперимента. Присутствие 300 нМ Гиперфорина или 300 нм С18H20ClN3O обозначается серыми полосами над кривыми GCaMP5.3. Для каждой экспериментальной группы показаны индивидуальные кривые (серая кривая) и усредненная (черная кривая) изменения флуоресценции. Каждая серая кривая соответствует изменению флуоресценции в отдельном шипике.
На Фиг. 12 показано, что соединение С18H20ClN3O восстанавливает нДУВК в дендритных шипиках в первичной культуре гиппокампа в условиях амилоидной токсичности. На Фиг. 12 показаны временные зависимости изменения сигнала нормированной флуоресценции (F/F0) GCaMP5.3 в шипиках нейронов гиппокампа в условиях амилоидной синаптотоксичности (Аβ42) без воздействия каким-либо соединением, либо в присутствии 300 нМ Гиперфорина (Гиперфорин), либо в присутствии 300 нм С18H20ClN3O (С18H20ClN3O). Время добавления 2 мМ Ca2+ обозначается черной полосой над кривыми флуоресценции GCaMP5.3. Блокаторы кальциевых каналов (TTX, нифедипин, D-AP5, CNQX) присутствовали в камере для кальциевого имиджинга на протяжении всего эксперимента. Присутствие 300 нМ Гиперфорина или 300 нм С18H20ClN3O обозначается серыми полосами над кривыми GCaMP5.3. Для каждой экспериментальной группы показаны индивидуальные кривые (серая кривая) и усредненная (черная кривая) изменения флуоресценции. Каждая серая кривая соответствует изменению флуоресценции в отдельном шипике.
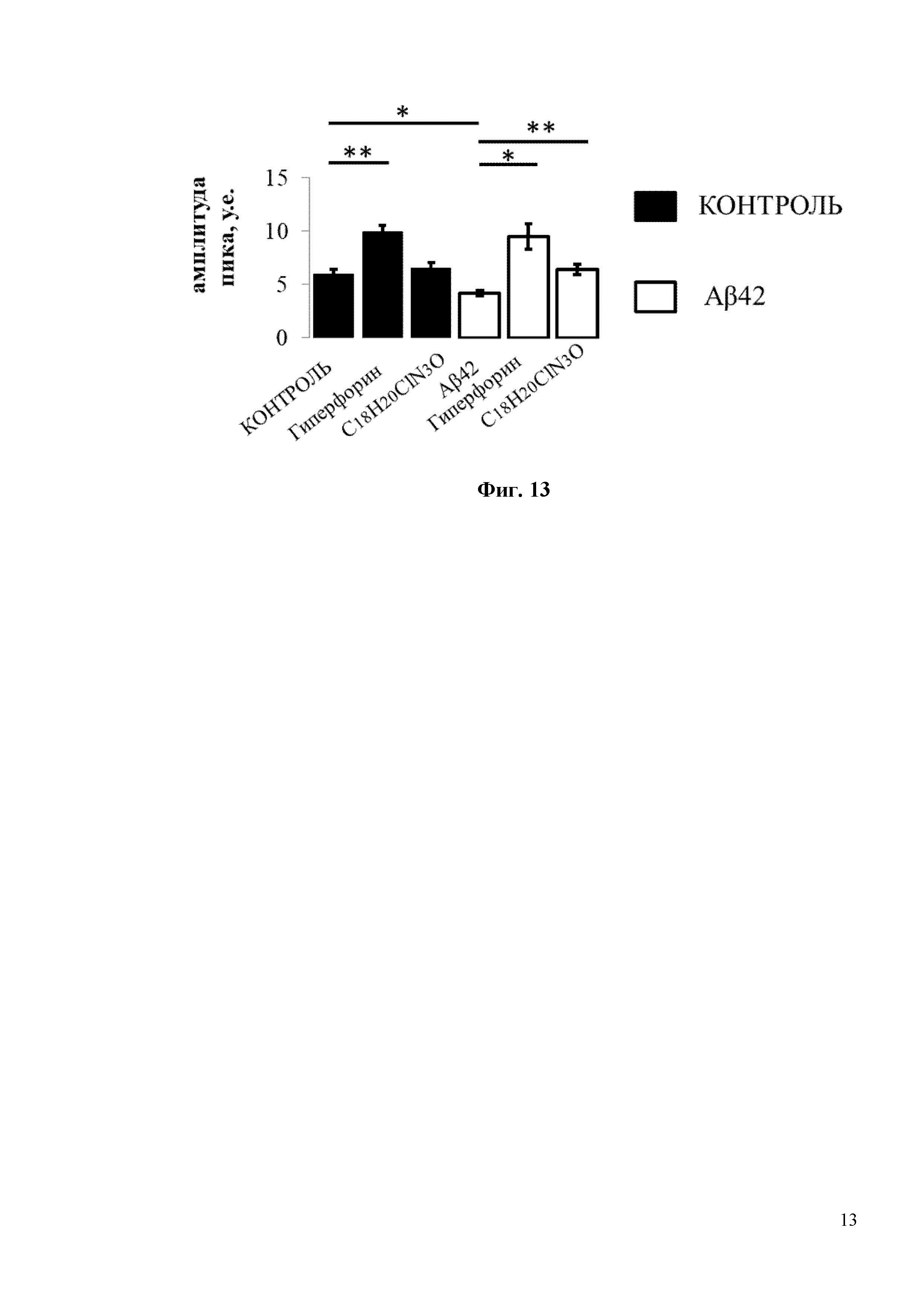
На Фиг. 13 показана гистограмма с усредненной амплитудой пика (в условных единицах, у.е.) нДУВК для каждой экспериментальной группы, изображенной на Фиг. 11 и Фиг. 12. Средние сигналы нормированной флуоресценции F/F0 для каждой группы представлены как среднее значение ± SEM (n = 20 шипов), * p <0,05, ** p <0,005.
Сведения, подтверждающие возможность осуществления изобретения
В качестве источника нервных клеток головного мозга для экспериментов с культурами гиппокампа использовались нелинейные мыши дикого типа (WT) (питомник Рапполово, Ленинградская область, Россия) или инбредные мыши WT (происхождение - C57BL/6J), полученные из Jackson Laboratory, инвертарный номер: 000664. Мыши содержались в виварии Лаборатории Молекулярной Нейродегенерации Санкт-Петербургского политехнического университета Петра Великого с 12-часовым световым циклом.
Биоинформатический анализ активаторов TRPC6
Используя биоинформатическую программу PASS online (http://www.way2drug.com/passonline), была оценена биологическая активность, токсичность, мутагенность соединений С19H22FN3O и C18H20ClN3O. Принимая во внимание, что TRPC6 является совершенно новой мишенью для фармакологических исследований, вероятность найти в программном обеспечении PASS такой пункт биологической активности, как «агонист TRPC6» была ничтожно мала. Поэтому вместо исследования активности «агонист TRPC6» исследовалась способность соединений С19H22FN3O и C18H20ClN3O активировать любые известные кальциевые каналы. В то же время необходимо было показать, что соединения С19H22FN3O и C18H20ClN3O не обладают неблагоприятными и токсическими эффектами или, по крайней мере, демонстрируют умеренную токсичность. Данные анализа PASS суммированы в таблицах 1 и 2. Согласно данным PASS оба соединения обладают способностью активировать кальциевые каналы (потенциалзависимые) с вероятностной активностью Pa в диапазоне от 0,49 до 0,624, причем максимальное значение принадлежит соединению C18H20ClN3O, а минимальное значение - С19H22FN3O. Программа PASS показала еще одну биологическую активность под названием «Активатор канала кальция» (таблица 1). К сожалению, нет данных, какой тип кальциевых каналов активируется конкретным соединением. Вероятностная активность Pa для активации кальциевых каналов принимает значения в диапазоне от 0,22 до 0,368. Программное обеспечение PASS онлайн позволяет оценить возможные неблагоприятные и токсичные эффекты выбранных соединений (таблица 2). С19H22FN3O и C18H20ClN3O не проявляют канцерогенных и кардиодепрессантных свойств, а также не обладают сосудистой/ дыхательной токсичностью и демонстрируют значения Pa около 0,2. Однако C18H20ClN3O обладает такими неблагоприятными эффектами, как кровоизлияние в желудочно-кишечный тракт и множественный органный сбой со значениями Pa в диапазоне от 0,56 до 0,78. С19H22FN3O показывает умеренное неблагоприятное воздействие с Pa=0,38 для желудочно-кишечного кровотечения и Pa=0,39 для множественной органной недостаточности. Принимая во внимание, что рабочая концентрация для обоих соединений лежит в наномолярном диапазоне и механизм действия исследованных в данном изобретении соединений связан с OAG-зависимым способом активации каналов TRPC6, авторы предполагают, что возможные побочные эффекты будут сведены к нулю при дальнейших исследованиях.
Исследование нейропротекторных свойств соединений С19H22FN3O и C18H20ClN3O
Ранее была разработана in vitro модель низкой амилоидной синаптотоксичности [10]. Было показано, что эта модель является удобным инструментом для проверки молекул, способных защитить грибовидные шипики от амилоидной синаптотоксичности [10]. Дендритные шипики – мембранные выросты на поверхности дендритов, образующие синаптические контакты между нейронами. Грибовидные шипики являются самыми стабильными структурами, принимающими участие в формировании памяти и хранении воспоминаний. Отличительной чертой БА является прогрессивная потеря памяти. Было показано, что на ранних стадиях БА происходит потеря дендритных шипиков, в частности грибовидных. Данная потеря нарастает с прогрессированием болезни. Считается, что терапевтические соединения способные остановить данную синаптическую потерю смогут остановить развитие патогенеза БА. Таким образом, модель амилоидной синаптотоксичности используется в настоящем изобретении в качестве скринингового анализа для подтверждения наличия нейропротекторных свойств у исследуемых соединений.
При проведении исследований 30нМ Гиперфорин использовался в качестве положительного контроля. 30нМ Гиперфорин восстанавливал процент грибовидных шипиков с 20% до 50% (Фиг. 4). Согласно полученным результатам, С19H22FN3O демонстрирует хорошие нейропротекторные свойства при концентрациях 10 и 30 нМ, восстанавливая процент грибовидных шипиков в группе с Aβ42 с 20% до 35% и 45% соответственно (Фиг. 4).
По сравнению с соединением С19H22FN3O соединение С18H20ClN3O обладает более сильными нейропротекторными свойствами. В частности, соединение С18H20ClN3O увеличивает процент грибовидных шипиков в нейронах, обработанных Аβ42, почти до 50% при концентрации 10 нМ (Фиг. 6). При 10нМ концентрации соединение С18H20ClN3O демонстрирует на 15% более высокую нейропротекторную эффективность, чем соединение С19H22FN3O (Фиг. 4 и Фиг. 6).
Исследование каналов TRPC6 в качестве мишени для соединения C18H20ClN3O
Так как соединение C18H20ClN3O является аналогом известного из литературных данных активатора TRPC6 каналов (N - (2 - Хлорфенил) - 2 - [4 - (2,3 - диметилфенил)пиперазин - 1 - ил]ацетамидтрифторацетат), но тем не менее отличия в структуре между этими соединениями составляют 12%, важно продемонстрировать, что C18H20ClN3O способен активировать вход кальция через TRPC6 in vitro.
Для исследования активации входа кальция через TRPC6 in vitro был проведен эксперимент на широко распространенной в клеточной биологии, и ранее проверенной [8] клеточной линии HEK, которую трансфицировали плазмидами, экспрессирующими GFP или TRPC6. Затем была проведена серия экспериментов по кальциевому имиджингу с использованием кальций чувствительной краски Fura-2-AM. В стандартных условиях записи, когда соединение добавляют непосредственно к клеточной линии HEK-TRPC6 в присутствии 2 мМ Ca2+ записать вход Ca2+ после воздействия на клетки C18H20ClN3O даже при очень высокой концентрации 30 мкМ не получилось (Фиг. 7). Положительный и прямой активатор каналов TRPC6 Гиперфорин при концентрации 10 мкМ вызывал быстрый и сильный ответ в клеточной линии HEK-TRPC6 (Фиг. 7), о чем свидетельствует резкое увеличение интенсивности флуоресценции Fura-2-AM (340/380) с 0,75 у.е. до 2,0 у.е. (Фиг. 8). Существуют данные, что механизм активации каналов TRPC6 может быть различным, в частности активация может происходить через посредника. Таким посредником может быть диацилглицерол (DAG), который образуется при расщеплении фосфолипазы С и активирует каналы TRPC6. Однако синтетический DAG нельзя использовать в in vitro экспериментах, т.к. при его внеклеточном добавлении в среду он не проникает через клеточные мембраны. OAG является синтетическим аналогом DAG, способным проникать в клетку. Таким образом, была исследована способность соединения C18H20ClN3O активировать TRPC6 каналы в присутствии OAG. Клетки в течение пары минут инкубировали в условиях частично истощенных внутриклеточных депо в 0,1 мМ Ca2+, затем среду меняли на 2 мМ Ca2+ в присутствии 50 мкМ OAG. Применение 50 мкМ OAG само по себе не влияло на вход Ca2+ в трансфицированных GFP клетках HEK (Фиг. 9). В HEK клетках, трансфицированных TRPC6, применение 50 мкМ OAG индуцировало небольшое увеличение входа Ca2+ (Фиг. 9). C18H20ClN3O при концентрации 30 мкМ дополнительно увеличивал амплитуду входа Ca2+, индуцированного OAG, через каналы TRPC6 (Фиг. 9). Последний результат свидетельствует о том, что соединение C18H20ClN3O активирует TRPC6 каналы по OAG зависимому пути.
Исследование активации нДУВК в нейронах гиппокампа, обработанных Aβ42, соединением C18H20ClN3O
Для исследования активации синаптического нДУВК в нейронах гиппокампа соединением C18H20ClN3O в условиях амилоидной синаптотоксичности были проведены эксперименты по визуализации кальция с использованием индикатора GCamp5.3. Для проведения экспериментов по визуализации кальция гиппокампальные нейроны трансфицировали плазмидой, экспрессирующей генетически кодируемый индикатор кальция GCamp5.3. В день записи изображений стекла с нейронами в течение 30 минут инкубировали в 0 мМ Ca2+ в присутствии блокаторов кальциевых каналов (TTX, нифедипин, D-AP5, CNQX), без или с добавлением C18H20ClN3O (или с положительным контролем Гиперфорин), а затем добавляли 10 мМ Ca2+. Эксперименты по визуализации кальция показали, что Aβ42 подавляет амплитуду нДУВК в постсинаптических дендритных шипиках нейронов гиппокампа с 6 у.е. до 4 у.е. (Фиг. 13). Инкубация с C18H20ClN3O в течение 30 минут способствует восстановлению амплитуды нДУВК в нейронах гиппокампа, обработанных Aβ42, с 4 у.е. до 6 у.е. (Фиг. 13). Важно отметить, что положительный модулятор каналов TRPC6 - Гиперфорин показал гораздо более сильный эффект при активации нДУВК в культурах гиппокампа (Фиг. 11-13). Гиперфорин активировал нДУВК даже в контрольных клетках (Фиг. 11, 12). Таким образом, соединения С19H22FN3O и С18H20ClN3O активируют TRPC6 по OAG-зависимому пути и потому не должны вызывать серьезных нарушений в желудочно-кишечном тракте, которые описаны для Гиперфорина.
Литература
|