Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СВОБОДНОГО ОСНОВАНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к кристаллам свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она и способам получения и применения таких кристаллических форм свободного основания.
УРОВЕНЬ ТЕХНИКИ
[0002] Соединение (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он раскрыто в WO 2009/075784 (публикация заявки на патент США 2010/0273754). Это соединение, как было установлено, является мощным и селективным ингибитором фосфодиэстеразы 1 (PDE 1), полезным для лечения или профилактики нарушений, характеризующихся низкими уровнями цАМФ и/или цГМФ в клетках, экспрессирующих PDE1, и/или пониженной сигнальной активностью рецепторов дофамина D1 (например, болезни Паркинсона, синдрома Туретта, аутизма, синдрома ломкой X-хромосомы, СДВГ, синдрома беспокойных ног, депрессии, когнитивного нарушения при шизофрении, нарколепсии); и/или любого заболевания или состояния, которое может быть облегчено при усилении сигнализации прогестерона. Данный список нарушений является примерным и не должен рассматриваться как исчерпывающий.
[0003] В публикации WO 2009/075784 в общем раскрыто соединение (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он в форме свободного основания и в общем в форме фармацевтически приемлемой соли. Кристаллические формы монофосфатной соли соединения (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он ("Соединение") раскрыты в предварительном заявке на патент США 61/662335. В указанных заявках, тем не менее, не раскрыты конкретные кристаллические формы Соединения в форме свободного основания и применение таких кристаллических форм свободного основания, которые теперь являются объектом настоящей заявки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] С применением комбинации из двадцати четырех различных растворителей с созреванием, цикличным изменением температуры, выпариванием, быстрым охлаждением, добавлением антирастворителя, вызванной влажностью кристаллизацией, методиками кристаллизации с применением отжига и обработки ультразвуком было неожиданно обнаружено, что Соединение (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он в форме свободного основания ("Соединение A"), несмотря на то, что оно существует в виде аморфных твердых веществ или масел во многих системах растворителей, может быть выделено в кристаллической форме при использовании определенной системы растворителей и методик. Такие кристаллические формы свободных оснований стабильны и особенно выгодны при получении кристаллических форм монофосфатной соли указанного Соединения A, при этом получение таких кристаллических форм солей обычно требует строго регулируемого стехиометрического количества фосфорной кислоты для получения соотношения 1:1 Соединения A и кислоты. Не связываясь с какой-либо конкретной теорией, считают, что Соединение A в форме кристалла свободного основания содержит минимальное количество примесей по сравнению с аморфной формой, что позволяет четко определить количество фосфорной кислоты для получения монофосфатной соли присоединения кислоты Соединения A и, таким образом, эффективно, единообразно и воспроизводимо получать кристаллические формы монофосфатной соли. Таким образом, в первом аспекте изобретения предложено следующее:
1.1 Кристалл Соединения A, то есть свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она ("кристалл свободного основания");
1.2 Кристалл свободного основания согласно формуле 1.1, где кристалл свободного основания находится в несольватированной форме;
1.3 Кристалл свободного основания согласно формуле 1.1, где кристалл свободного основания находится в форме сольвата;
1.4 Кристалл свободного основания согласно формуле 1.3, где кристалл свободного основания находится в форме сольвата со спиртом;
1.5 Кристалл свободного основания согласно формуле 1.4, где кристалл свободного основания находится в форме сольвата с метанолом, этанолом, пропанолом (например, н-пропанолом или изопропанолом) или бутанолом (например, н-бутанолом);
1.6 Кристалл свободного основания согласно любой из формул 1.1-1.5, где кристалл свободного основания находится в гидратированной или негидратированной форме;
1.7 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группа, состоящей из 6,2, 7,6, 8,2, 11,2, 12,4, 12,8, 13,4, 15,2, 16,5, 17,6, 18,2, 19,1, 19,8, 21,0, 21,9, 22,6, 23,1, 23,7, 24,8, 25,8, 26,6, 27,8, 28,4, 29,6, 30,9, 31,8, 32,6, 33,4, 34,3, 36,3, 37,2, 38,4 и 39,5 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.8 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,34, 11,65, 10,83, 7,91, 7,16, 6,89, 6,59, 5,82, 5,37, 5,03, 4,87, 4,64, 4,48, 4,23, 4,06, 3,93, 3,85, 3,75, 3,59, 3,45, 3,35, 3,21, 3,14, 3,01, 2,89, 2,81, 2,74, 2,68, 2,61, 2,47, 2,42, 2,34 и 2,28 Å;
1.9 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,34, 11,65, 10,83, 5,82, 4,87, 4,64, 4,48, 4,23, 3,93 и 3,21 Å;
1.10 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из соответствующих значений, представленных в Таблице 1 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.11 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из соответствующих значений, представленных в Таблице 1-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
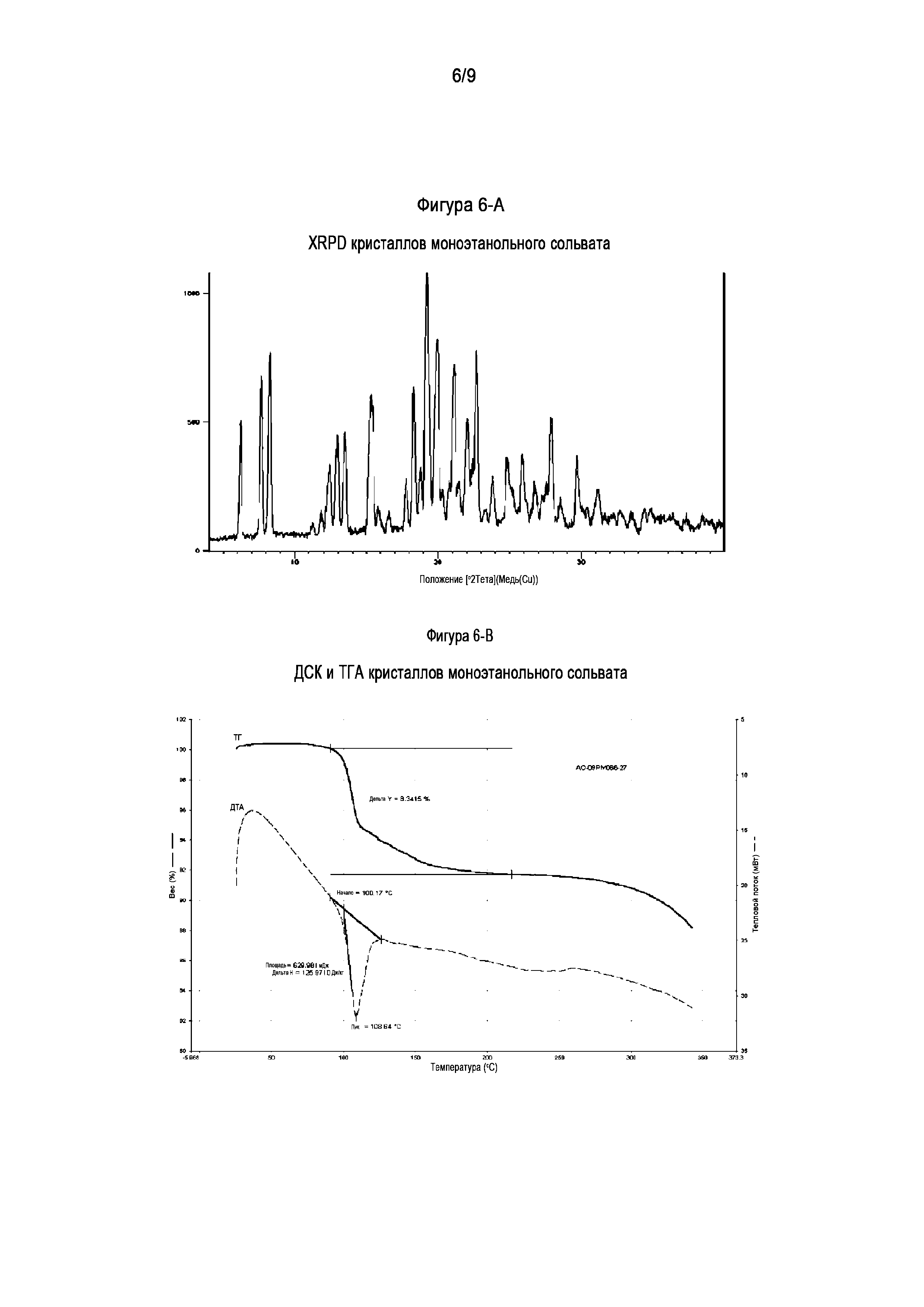
1.12 Кристалл свободного основания согласно любой из формул 1.4-1.11, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 1-B или 6-A;
1.13 Кристалл свободного основания согласно любой из формул 1.4-1.12, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик приблизительно при 107°C-108°C;
1.14 Кристалл свободного основания согласно формуле 1.13, где кристалл демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 1-A или 6-B;
1.15 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группы, состоящей из 6,0, 7,6, 8,1, 11,1, 12,0, 12,1, 13,0, 15,1, 15,9, 16,3, 18,2, 19,3, 20,4, 21,0, 21,5, 22,1, 22,5, 23,3, 24,0, 25,3, 25,8, 26,7, 27,6, 28,8, 29,6, 30,3, 30,7, 31,3, 32,3, 34,1, 35,1, 35,8, 37,2 и 38,5 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.16 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,67, 11,68, 10,96, 7,95, 7,39, 7,30, 6,80, 5,85, 5,57, 5,42, 4,86, 4,60, 4,36, 4,23, 4,14, 4,03, 3,95, 3,82, 3,71, 3,51, 3,46, 3,34, 3,22, 3,10, 3,02, 2,94, 2,91, 2,86, 2,77, 2,62, 2,55, 2,51, 2,42 и 2,33 Å;
1.17 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,67, 11,68, 10,96, 5,85, 4,86, 4,60, 4,23, 4,03, 3,95 и 3,22 Å.
1.18 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 2 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.19 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 2-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
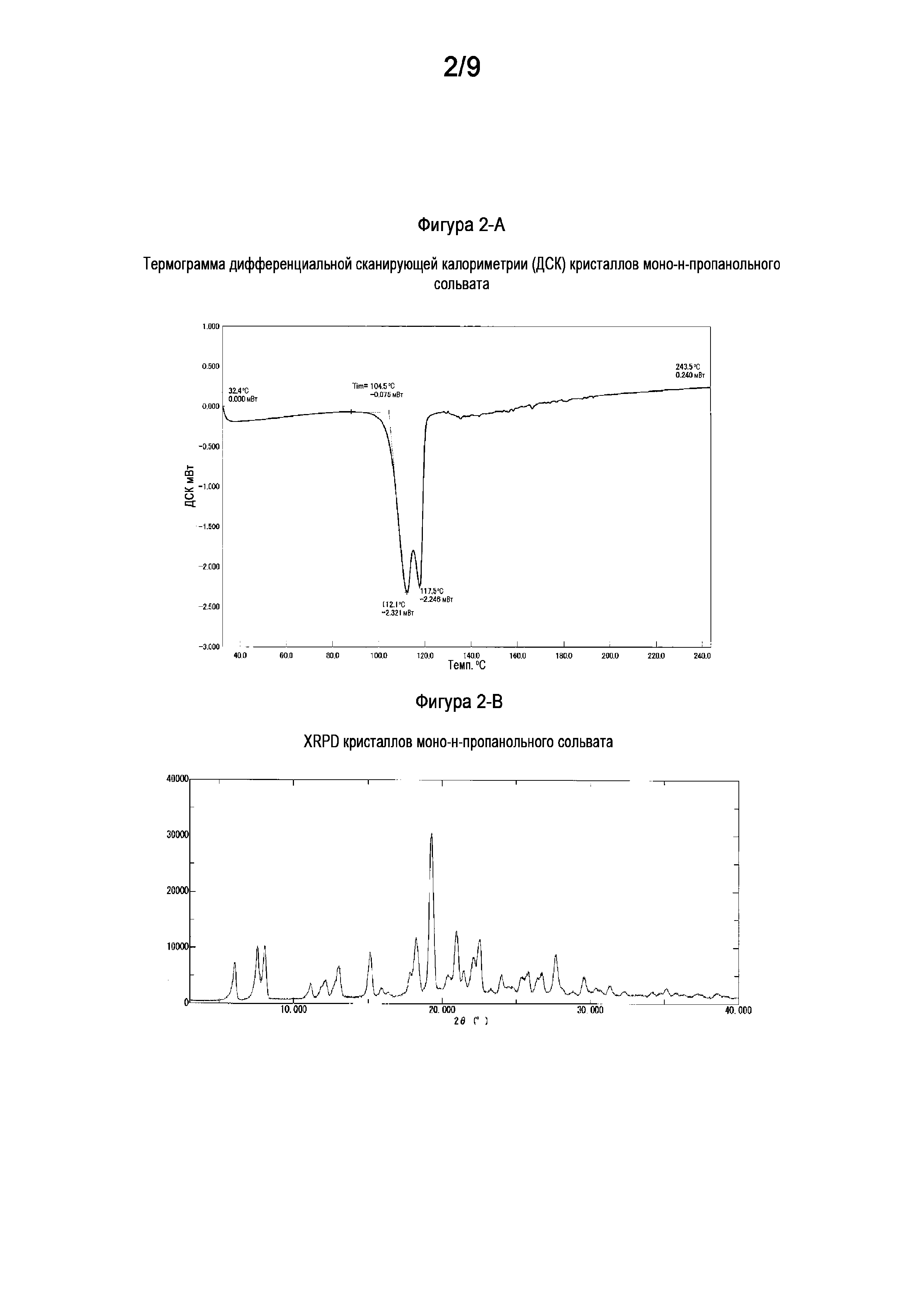
1.20 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.15-1.19, где кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 2-B;
1.21 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.15-1.20, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик в диапазоне 112-118°C, например, при 112°C или 118°C;
1.22 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.15-1.21, где кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 2-A;
1.23 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группы, состоящей из 6,0, 7,7, 8,2, 11,1, 12,2, 12,8, 13,4, 14,9, 15,4, 16,4, 18,2, 18,9, 19,8, 20,5, 20,9, 21,9, 22,5, 23,2, 24,7, 25,9, 26,5, 27,5, 27,9, 29,6, 30,2, 31,1, 32,3, 33,0, 34,1, 34,7, 35,4, 36,2, 37,7, 38,3 и 38,8 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.24 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,67, 11,53, 10,80, 7,95, 7,25, 6,93, 6,59, 5,95, 5,76, 5,41, 4,86, 4,68, 4,47, 4,33, 4,24, 4,06, 3,95, 3,82, 3,61, 3,44, 3,36, 3,25, 3,19, 3,02, 2,96, 2,87, 2,77, 2,71, 2,63, 2,58, 2,53, 2,48, 2,38, 2,35 и 2,32 Å;
1.25 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 14,67, 11,53, 10,80, 5,76, 4,86, 4,68, 4,47, 4,24, 4,06 и 3,95 Å;
1.26 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 3 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.27 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 3-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.28 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.23-1.27, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 3-B;
1.29 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.23-1.28, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик приблизительно при 97°C;
1.30 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.23-1.29, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 3-A;
1.31 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группы, состоящей из 4,6, 7,1, 7,7, 8,0, 9,2, 9,9, 10,5, 13,4, 13,9, 14,5, 15,4, 16,6, 17,3, 18,3, 19,4, 20,2, 21,3, 22,7, 23,3, 24,9, 26,4, 27,3, 28,3, 29,4, 30,0, 31,2 и 31,4 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.32 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 19,11, 12,51, 11,41, 11,01, 9,58, 8,95, 8,40, 6,60, 6,37, 6,10, 5,74, 5,33, 5,13, 4,83, 4,56, 4,39, 4,16, 3,91, 3,81, 3,58, 3,37, 3,26, 3,15, 3,03, 2,97, 2,87 и 2,84 Å;
1.33 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 12,51, 11,41, 11,01, 9,58, 8,95, 6,60, 5,13, 4,16 и 3,81Å;
1.34 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 4 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.35 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 4-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.36 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6 или 1.31-1.35, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 4-B;
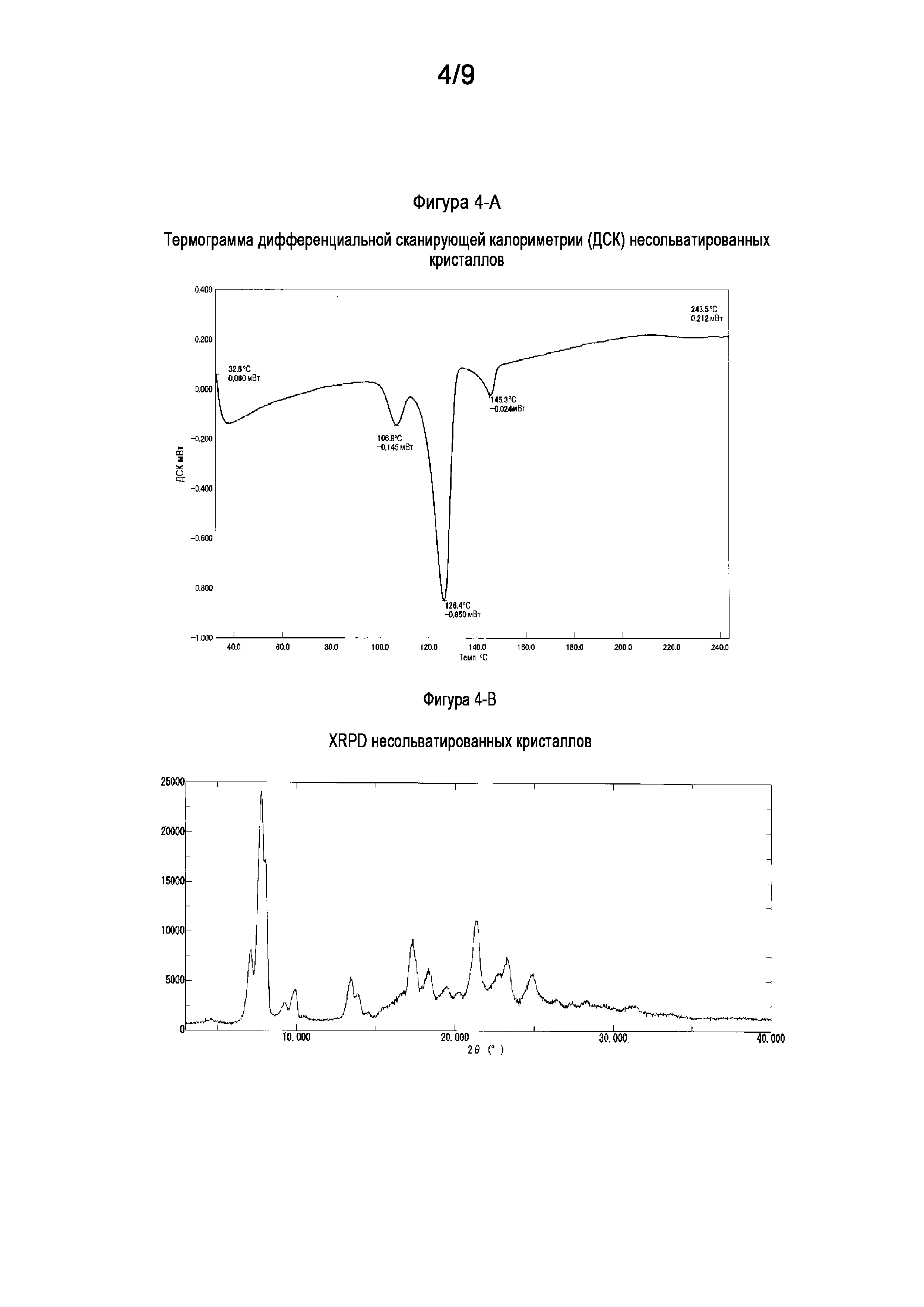
1.37 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6 или 1.31-1.36, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик приблизительно при 126°C;
1.38 Кристалл свободного основания согласно любой из формул 1.1-1.2, 1.6 или 1.31-1.37, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 4-A;
1.39 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группы, состоящей из 7,0, 8,2, 9,9, 11,4, 12,0, 12,7, 13,5, 14,5, 16,1, 17,2, 18,7, 19,9, 21,5, 22,4, 22,9, 23,4, 23,9, 24,5, 25,6, 26,8, 27,4, 28,4, 29,2, 29,9, 30,7, 31,3, 31,9, 32,2, 34,4, 35,0, 36,3 и 38,6 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.40 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 12,58, 10,75, 8,89, 7,76, 7,36, 6,95, 6,57, 6,10, 5,50, 5,16, 4,74, 4,47, 4,12, 3,96, 3,87, 3,80, 3,72, 3,63, 3,47, 3,33, 3,25, 3,14, 3,06, 2,99, 2,91, 2,86, 2,81, 2,78, 2,61, 2,56, 2,47 и 2,33 Å;
1.41 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 12,58, 10,75, 5,50, 4,74, 4,47, 3,96, 3,87, 3,80, 3,72 и 3,14 Å;
1.42 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 5 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.43 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 5-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.44 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.39-1.43, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 5-B;
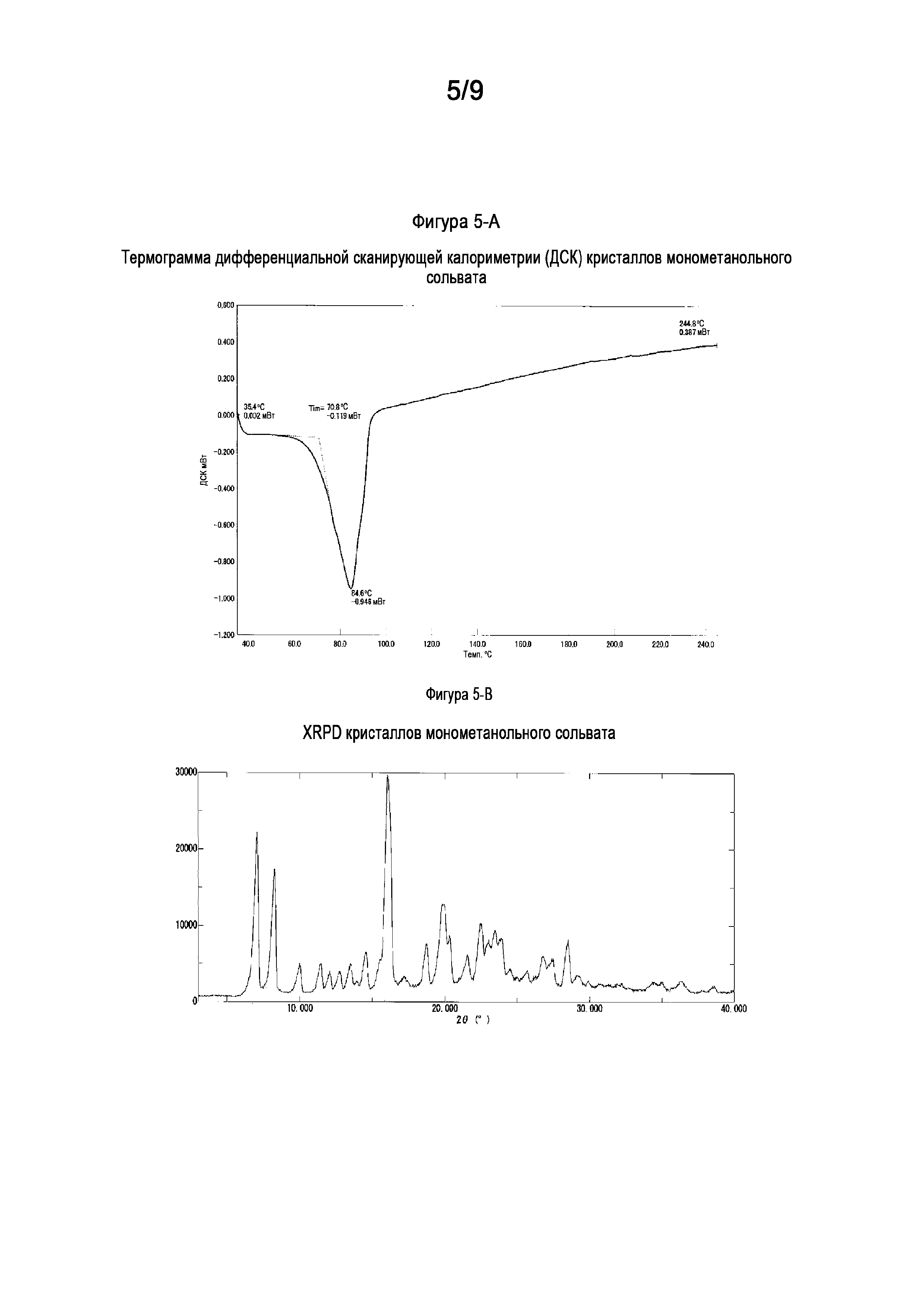
1.45 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.39-1.44, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик приблизительно при 84-85°C, например, приблизительно 84,6°C; или термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 5-A;
1.46 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета, выбранные из группы, состоящей из 7,1, 8,2, 9,9, 11,4, 12,1, 12,8, 13,4, 14,4, 16,0, 17,3, 18,6, 19,9, 21,4, 22,4, 23,4, 24,4, 25,3, 26,2, 27,1, 28,3, 29,2, 33,8, 34,0, 35,8 и 36,3 градусов, где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.47 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 12,51, 10,80, 8,95, 7,78, 7,28, 6,93, 6,62, 6,14, 5,53, 5,13, 4,77, 4,45, 4,14, 3,96, 3,79, 3,64, 3,52, 3,40, 3,28, 3,15, 3,05, 2,65, 2,63, 2,51 и 2,47 Å;
1.48 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из 12,51, 10,80, 5,53, 4,77, 4,45, 4,14, 3,96, 3,79, 3,64, 3,40, 3,28 и 3,15 Å;
1.49 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 6 ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
1.50 Кристалл свободного основания согласно любой из формул 1.4-1.6, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения угла 2-тета и/или межатомного расстояния d, выбранные из значений, представленных в Таблице 6-A ниже:
|
где дифрактограмму XRPD измеряют на дифрактометре при использовании медного анода, например, при длине волны альфа1 1,5406 Å и длине волны альфа2 1,5444 Å;
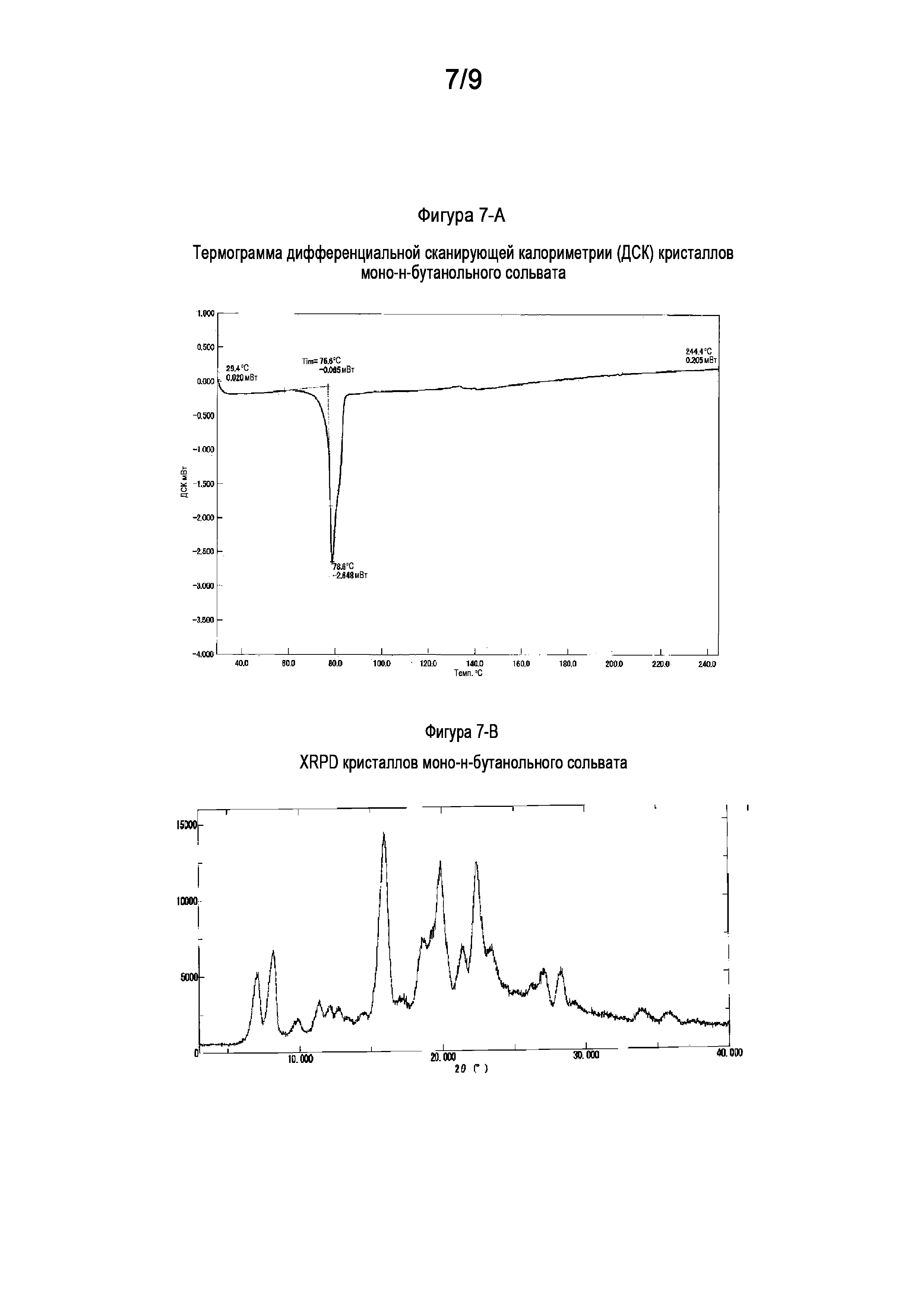
1.51 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.46-1.50, где указанный кристалл свободного основания демонстрирует порошковую рентгеновскую дифрактограмму, соответствующую или по существу такую, как показано на Фигуре 7-B;
1.52 Кристалл свободного основания согласно любой из формул 1.4-1.6 или 1.46-1.51, где указанный кристалл свободного основания демонстрирует термограмму дифференциальной сканирующей калориметрии (ДСК), включающую эндотермический пик приблизительно при 79°C, например, приблизительно 78,6°C; или термограмму дифференциальной сканирующей калориметрии (ДСК), соответствующую или по существу такую, как показано на Фигуре 7-A;
1.53 Кристалл свободного основания согласно любой из вышеуказанных формул, где указанный кристалл свободного основания находится в монокристаллической форме и не содержит или по существу не содержит какую-либо другую форму, например, меньше 10% по весу, предпочтительно меньше чем приблизительно 5% по весу, более предпочтительно меньше чем приблизительно 2% по весу, еще более предпочтительно меньше чем приблизительно 1% по весу, все еще предпочтительно меньше чем приблизительно 0,1%, наиболее предпочтительно меньше чем приблизительно 0,01% по весу аморфной формы;
1.54 Кристалл свободного основания согласно любой из вышеуказанных формул, где указанный кристалл свободного основания находится в монокристаллической форме и не содержит или по существу не содержит какую-либо другую форму, например, меньше 10% по весу, предпочтительно меньше чем приблизительно 5% по весу, более предпочтительно меньше чем приблизительно 2% по весу, еще более предпочтительно меньше чем приблизительно 1% по весу, еще более предпочтительно меньше чем приблизительно 0,1%, наиболее предпочтительно меньше чем приблизительно 0,01% по весу других кристаллических форм;
1.55 Кристалл свободного основания согласно любой из вышеуказанных формул, где указанный кристалл свободного основания находится в монокристаллической форме и не содержит или по существу не содержит какую-либо другую форму, например, меньше 10% по весу, предпочтительно меньше чем приблизительно 5% по весу, более предпочтительно меньше чем приблизительно 2% по весу, еще более предпочтительно меньше чем приблизительно 1% по весу, еще более предпочтительно меньше чем приблизительно 0,1%, наиболее предпочтительно меньше чем приблизительно 0,01% по весу аморфной и других кристаллических форм;
1.56 Кристалл свободного основания согласно любой из вышеуказанных формул, где указанный кристалл свободного основания получен согласно любому из описанных способов или аналогично описанному ниже в Способе III или в любом из Примеров 1-7 или Примере 13.
[0005] Во втором аспекте изобретения предложен способ (Способ I) получения соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]-пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A), включающий:
(1) растворение кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A), то есть кристалла свободного основания Соединения A, в несольватированной или сольватированной форме в растворителе;
(2) добавление кислоты, необязательно в растворителе, к раствору, полученному в стадии (1), и
(3) перемешивание смеси, полученной в стадии (2), с получением требуемой соли.
[0006] В другом варианте осуществления второго аспекта изобретения предложен Способ I, где соль является кристаллом соли, например, кристаллом фумарата (например, гемифумарата), фосфата (например, монофосфата), (1-гидрокси-2)-нафтоата или мезилата. Таким образом, в конкретном варианте осуществления применимая кислота стадии (2) Способа I для получения кристаллических форм соли Соединения A включает фумаровую кислоту, фосфорную кислоту, винную кислоту (например, L-винную кислоту) и метансульфоновую кислота. Растворитель, применимый в Способе I для получения кристаллических форм соли, является метанолом, ацетонитрилом, ацетоном или их смесями. В еще одном другом варианте осуществления соль является кристаллом бензоата, а применимая кислота стадии (2) Способа I для получения указанного кристалла бензоата Соединения A является бензойной кислотой. Растворитель, применимый в Способе I для получения кристаллической формы бензоата, включает этилацетат и ксилол.
[0007] В другом варианте осуществления второго аспекта изобретения предложен способ (Способ II) получения кристалла монофосфата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]-пиразоло[4,3-e]пиримидин-4(2H)-она (кристалл монофосфата Соединения A), включающий:
(1) растворение кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (то есть кристалла свободного основания Соединения A) в несольватированной или сольватированной форме в растворителе;
(2) добавление фосфорной кислоты в растворителе к раствору, полученному в стадии (1), и
(3) перемешивание смеси, полученной в стадии (2), с получением требуемого кристалла монофосфата.
[0008] В другом варианте осуществления изобретения предложен Способ II получения кристалла монофосфата Соединения A следующим образом:
2.1 Способ II, как описано выше, где растворитель в стадии (1) выбран из ацетона и ацетонитрила;
2.2 Способ II, как описано выше, или 2.1, где растворитель в стадии (2) выбран из ацетона или ацетонитрила;
2.3 Способ II, как описано выше, или 2.1 или 2.2, где количество фосфорной кислоты, добавляемой в стадии (2), является практически (приблизительно) эквимолекулярным количеством относительно количества кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристалла свободного основания Соединения A) в несольватированной форме или в сольватированной форме стадии (1); В конкретном варианте осуществления количество фосфорной кислоты, добавляемой в стадии (2), составляет 0,5-2,0 эквивалента, более предпочтительно 0,8-1,2 эквивалента и наиболее предпочтительно 0,9-1,1 эквивалента количества кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристалла свободного основания Соединения A) в несольватированной форме или в сольватированной форме стадии (1);
2.4 Способ II, как описано выше, или любой из 2.1-2.3, где воду дополнительно добавляют в стадии (2);
2.5 Способ II, как описано выше, или любой из 2.1-2.4, где смесь перемешивают при 20-70°C в стадии (3);
2.6 Способ II, как описано выше, или любой из 2.1-2.4, где смесь перемешивают приблизительно при 50°C, приблизительно при 32°C, приблизительно при 38°C или приблизительно при 39°C;
2.7 Способ II, как описано выше, или любой из 2.1-2.6, где кристалл свободного основания Соединения A в стадии 1 находится в несольватированной форме;
2.8 Способ II, как описано выше, или любой из 2.1-2.6, где кристалл свободного основания Соединения A в стадии 1 находится в сольватированной форме, например, в форме спиртового сольвата, например, в форме этанольного сольвата, например, в форме моноэтанольного сольвата.
[0009] В третьем аспекте изобретения предложен способ получения кристалла свободного основания Соединения A в сольватированной форме или несольватированной форме согласно любой из формул 1.1-1.56 (Способ III). В одном варианте осуществления изобретения предложен способ получения кристалла Соединения свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристалла свободного основания Соединения A) в форме сольвата (Способ III-A), который включает:
(1) перемешивание (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]-имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в растворителе в присутствии основания, анилина, палладиевого катализатора и лиганда, с последующим отделением органического слоя;
(2) добавление растворителя, соответствующего требуемой сольватированной формы, к органическому слою, полученному в стадии (1).
[0010] В другом варианте осуществления третьего аспекта изобретения предложен способ получения кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристалла свободного основания Соединения A) в несольватированной форме (Способ III-B), который включает:
(1) перемешивание (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента-[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в растворителе в присутствии основания, анилина, палладиевого катализатора и лиганда, с последующим отделением органического слоя;
(2) добавление затравочного кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в несольватированной форме к органическому слою, полученному в стадии (1).
[0011] Основание, применимое в Способе III изобретения, как описано выше, включает, без ограничения перечисленными, карбонат, бикарбонат, фосфат или гидроксид щелочного или щелочноземельного металла (например, карбонат, бикарбонат, гидроксид, бутилат или фосфат натрия, магния, кальция, калия, цезия или бария, например, карбонат натрия, гидрокарбонат натрия, гидроксид натрия, т-бутилат натрия, карбонат кальция, карбонат калия, гидроксид калия, т-бутилат калия, фосфат калия, карбонат цезия, гидроксид цезия). Предпочтительно, основанием согласно стадии (1) способа изобретения является карбонат калия или K2CO3. Предпочтительно, палладиевый катализатор, применимый в стадии (1) из Способа III изобретения, включает, без ограничения перечисленными, ацетат палладия II, хлорид палладия, бромид палладия, Pd(PPh3)4, PdCl2(PPh3)2, Pd(dba)2, Pd/C и трис(дибензилиденацетон)дипалладий (0). Предпочтительно, палладиевым катализатором, применимым в Способе III настоящего изобретения, является ацетат палладия II или Pd(OAc)2.
[0012] Лиганд, применимый в Способе III изобретения, является бидентатным лигандом, предпочтительно ксантфосом.
[0013] Растворитель, применимый в Способе III изобретения, включает органический растворитель, такой как толуол, тетрагидрофуран, ксилол, диметилацетамид, предпочтительно ксилол или комбинацию диметилацетамида и ксилола.
[0014] Способ III изобретения предпочтительно выполняют под атмосферой азота. Между Стадией (1) и Стадией (2) Способа III изобретения отделенный органический слой предпочтительно промывают подходящим раствором и затем обрабатывают активированным углем для удаления остатка палладиевого катализатора. В одном варианте осуществления стадия (1) Способа III, как описано выше, дополнительно включает стадию добавления воды, например, перед отделением органического слоя. В другом варианте осуществления стадия (1) из Способа III, как описано выше, дополнительно включает стадию добавления раствора цистеина в воде, необязательно с дополнительным растворителем (например, с дополнительным диметилацетамидом и ксилолом).
[0015] В другом варианте осуществления третьего аспекта изобретения предложен Способ III-C, где кристалл Соединения A (то есть кристалл свободного основания Соединения A) в сольватированной форме получают при использовании кристалла соли Соединения A. Таким образом, в изобретении предложен способ получения кристалла свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристалл свободного основания Соединения A) в сольватированной форме, включающий:
(1) растворение кристалла соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A) (то есть кристалла соли Соединения A), в несольватированной или сольватированной форме, в смеси органического растворителя, воде и водном растворе основания;
(2) отделение органического слоя;
(3) добавление растворителя в стадии (2) с получением требуемого сольвата;
(4) перемешивание смеси, полученной в стадии (3), с получением требуемых кристаллической формы.
[0016] Кристалл соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (кристаллическая форма соли Соединения A) может быть кристаллической формой фумарата, например, гемифумарата; фосфата (например, монофосфата); (1-гидрокси-2)-нафтоата; мезилата или бензоата. В предпочтительнном варианте осуществления получаемый кристалл свободного основания Соединения A находится в форме этанольного сольвата (например, в форме моноэтанольного сольвата), и кристалл соли стадии (1) находится в форме сольвата гемифумарата в этилацетате/ацетоне (например, форма сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона).
[0017] Кристаллические формы соли стадии (1) Способа III могут быть получены путем (1) перемешивания (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроцикло-пента[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в растворителе в присутствии основания, анилина, палладиевого катализатора и лиганда; (2) отделения органического слоя; (3) добавления кислоты, необязательно в растворителе, к раствору, полученному в стадии (2), и перемешивания смеси, полученной в стадии (3), с получением требумой соли. Применимое основание, палладиевый катализатор, лиганд и растворитель стадии (1) определены ранее в Способе III. Применимая кислота стадии (2) определена ранее в Способе I (например, фумаровая кислота, фосфорная кислота, винная кислота (например, L-винная кислота), метансульфоновая кислотная, а также бензойная кислота).
[0018] Кристалл свободного основания Соединения A, полученный Способом III-C, также может применяться для получения кристалла соли, описанного в Способе I, в особенности кристалл монофосфата, описанного в Способе II. Таким образом, в конкретном варианте осуществления изобретения предложен способ получения кристалла соли Соединения A согласно Способу II, описанному выше, который дополнительно включает стадии получения кристалла свободного основания Соединения A согласно Способу III-C, как описано выше. Таким образом, в изобретении предложен способ получения кристалла соли Соединения A, включающий: (a) получение кристалла свободного основания Соединения A, как описано в способе III-A, III-B или III-C; (b) выделение кристалла свободного основания Соединения A из стадии (a); (c) растворение кристаллической формы свободного основания, полученных в Способе III-A, III-B или III-C; (d) добавление кислоты, необязательно в растворителе, к раствору, полученному в стадии (c), и (e) перемешивание смеси, полученной в стадии (d), с получением требуемой соли. В другом конкретном варианте осуществления изобретения предложен способ получения кристалла монофосфата Соединения A, включающий: (a) получение кристалла свободного основания Соединения A, как описано в способе III-A, III-B или III-C; (b) выделение кристалла свободного основания Соединения A из стадии (a); и (c) растворение кристаллов свободного основания, полученных в от Способе III-A, III-B или III-C; (d) добавление кислоты, необязательно в растворителе, к раствору, полученному в стадии (c), и (e) перемешивание смеси, полученной в стадии (d), с получением требуемой соли. Таким образом, в конкретном варианте осуществления изобретения предложен способ получения кристалла монофосфата Соединения A, включающий:
(a) растворение кристалла соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]-пиримидин-4(2H)-она (соединение A) в гемифумарате в несольватированной или сольватированной форме, в смеси органического растворителя и водного основного раствора;
(b) отделение органического слоя;
(c) добавление этанола к органическому раствору, полученному в стадии (b);
(d) перемешивание смеси, полученной в стадии (c), с получением требуемых кристаллов;
(e) выделение кристаллов, полученных в стадии (d);
(f) растворение кристаллов, полученных в стадии (e);
(g) добавление фосфорной кислоты (например, 0,5-2,0 эквивалента, предпочтительно 0,8-1,2 эквивалента, более предпочтительно, 0,9-1,1 эквивалента количества кристалловсвободного основания Соединения A) в растворителе к раствору, полученному в стадии (f); и
(h) перемешивание смеси, полученной в стадии (g), с получением требуемой соли.
[0019] В четвертом аспекте изобретения предложен новый кристалл соли Соединения A. Таким образом, в изобретении предложен кристалл соли Соединения A в форме сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона; или в форме несольватированного бензоата.
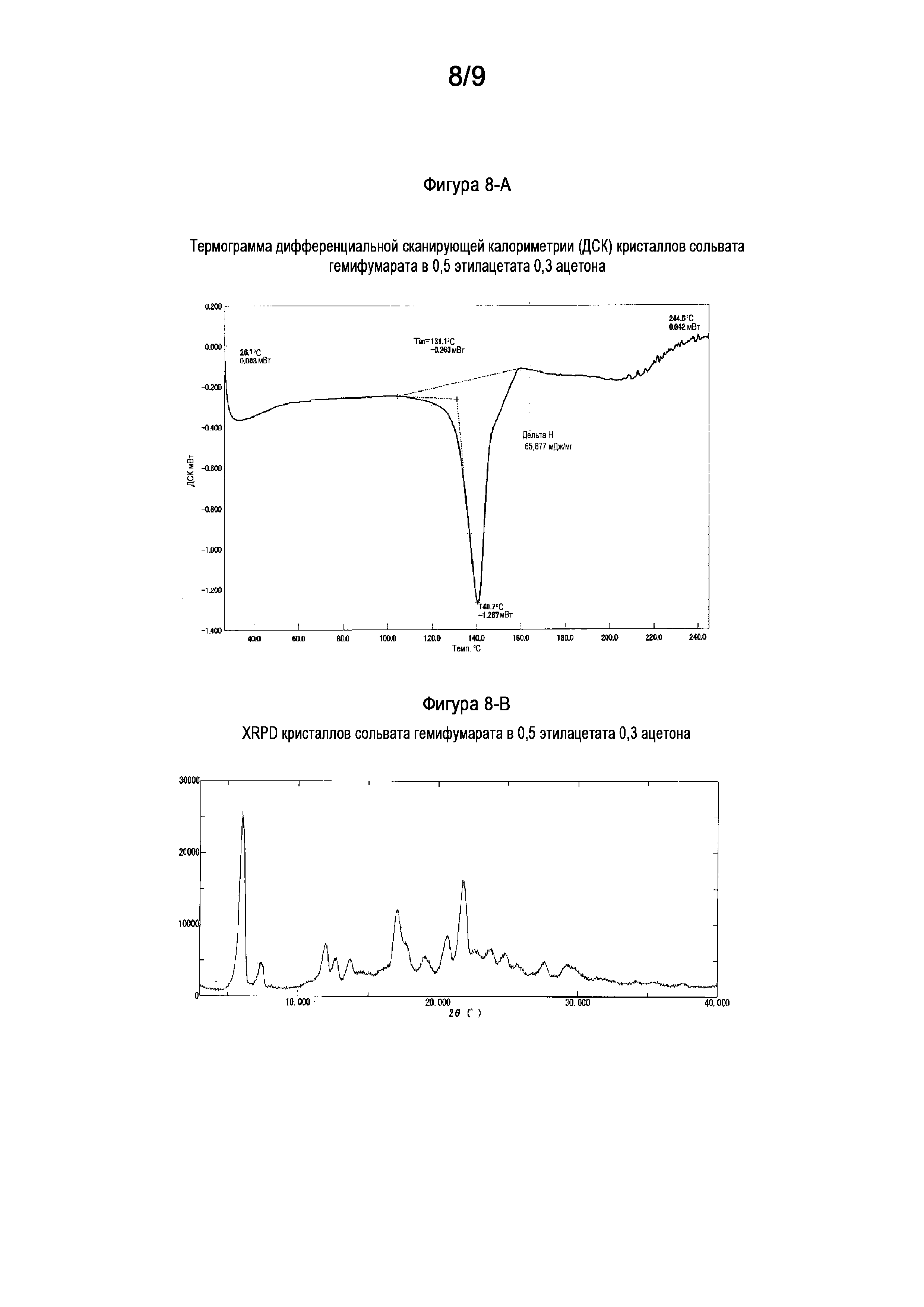
[0020] Кристалл соли Соединения A в форме сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона, где кристалл соли демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из: 14,67, 11,97, 10,99, 8,19, 7,41, 6,98, 6,46, 6,14, 5,89, 5,59, 5,20, 5,01, 4,66, 4,61, 4,30, 4,07, 3,93, 3,74, 3,59, 3,47, 3,34, 3,23, 3,06, 3,00, 2,94, 2,86, 2,80, 2,62, 2,54, 2,51 и 2,40 Å. В другом варианте осуществления кристалл соли Соединения A в форме сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона, где кристалл соли демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из: 14,67, 11,97, 7,41, 6,98, 6,46, 5,20, 5,01, 4,66, 4,30, 4,07, 3,93, 3,74 и 3,59 Å. В другом варианте осуществления кристалл сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона согласно изобретению, как описано выше, демонстрирует порошковую рентгеновскую дифрактограмму, по существу как показано на Фигуре 8-B. В еще одном другом варианте осуществления кристалл сольвата гемифумарата в 0,5 этилацетата, 0,3 ацетона согласно изобретению демонстрирует термограмму дифференциальной сканирующей калориметрии, по существу как показано на Фигуре 8-A.
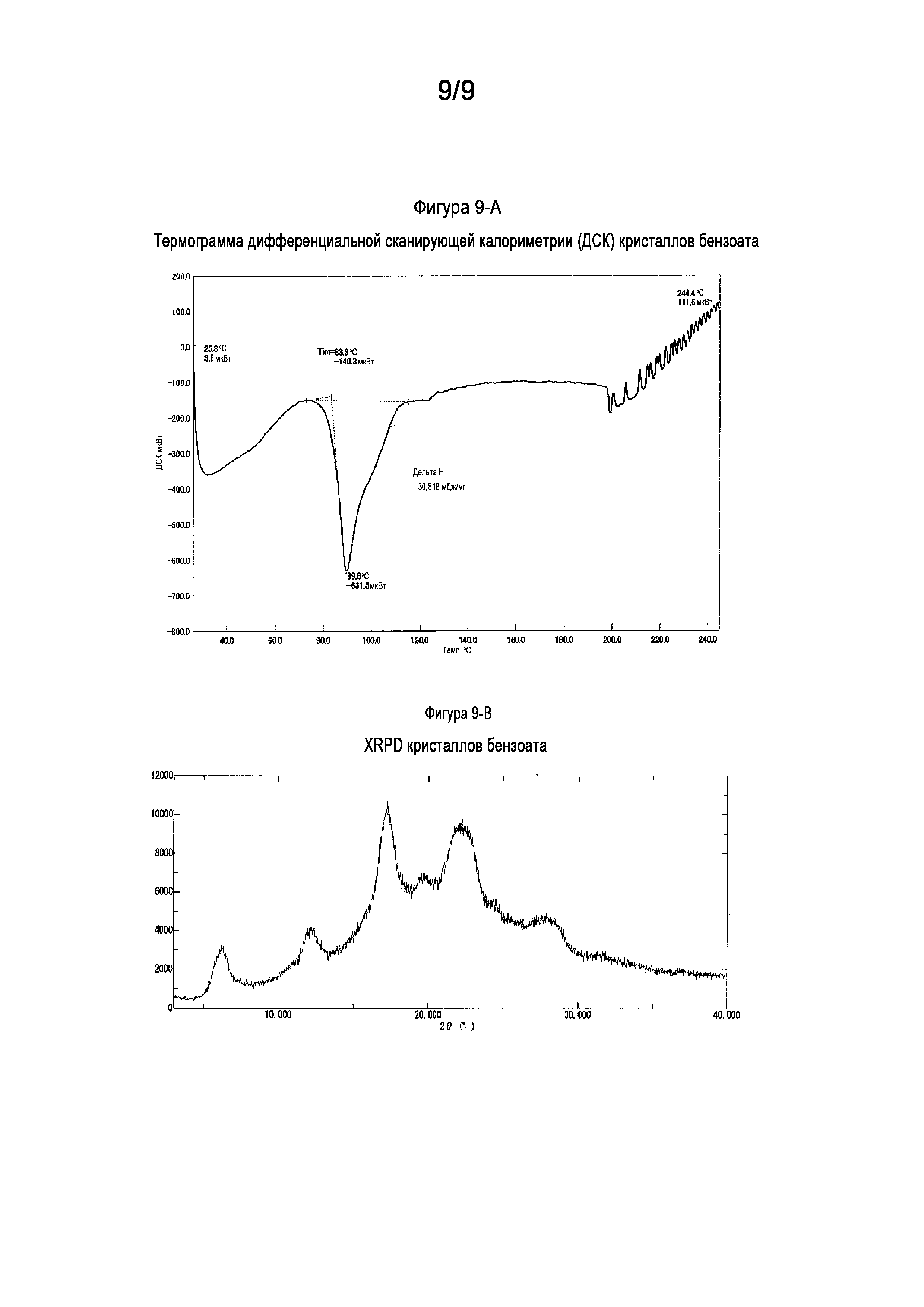
[0021] Кристалл соли Соединения A в форме несольватированного бензоата, где кристалл соли демонстрирует порошковую рентгеновскую дифрактограмму, включающую по меньшей мере пять пиков, имеющих значения межатомного расстояния d, выбранные из группы, состоящей из: 14,15, 12,17, 7,31, 5,93, 5,59, 5,15, 4,52, 4,07, 3,92, 3,64, 3,50, 3,42, 3,29, 3,21 и 3,11 Å. В другом варианте осуществления кристалл соли Соединения A в форме несольватированного бензоата демонстрирует порошковую рентгеновскую дифрактограмму, включающую все пики, имеющие значения межатомного расстояния d, выбранные из группы, состоящей из: 14,15, 7,31, 5,15, 4,07 и 3,92 Å. В другом варианте осуществления кристалл несольватированного бензоата изобретения, как описано выше, демонстрирует порошковую рентгеновскую дифрактограмму, по существу как показано на Фигуре 9-B. В еще одном другом варианте осуществления кристалл несольватированного бензоата согласно изобретению демонстрирует термограмму дифференциальной сканирующей калориметрии, по существу как показано на Фигуре 9-A.
[0022] В пятом аспекте изобретения предложена фармацевтическая композиция, включающая кристалл монофосфата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A) в смеси с фармацевтически приемлемым растворителем или носителем. В конкретном варианте осуществления фармацевтически приемлемые растворители или носитель выбраны из группы маннита, микрокристаллической целлюлозы, гидроксипропилцеллюлозы, натрий крахмалгликолята, стеарата магния, гипромеллозы, полиэтиленгликоля, диоксида титана, оксида железа (красного и/или желтого). В другом конкретном варианте осуществления фармацевтическая композиция изобретения включает следующее:
|
КРАТКОЕ ОПИСАНИЕ ФИГУР
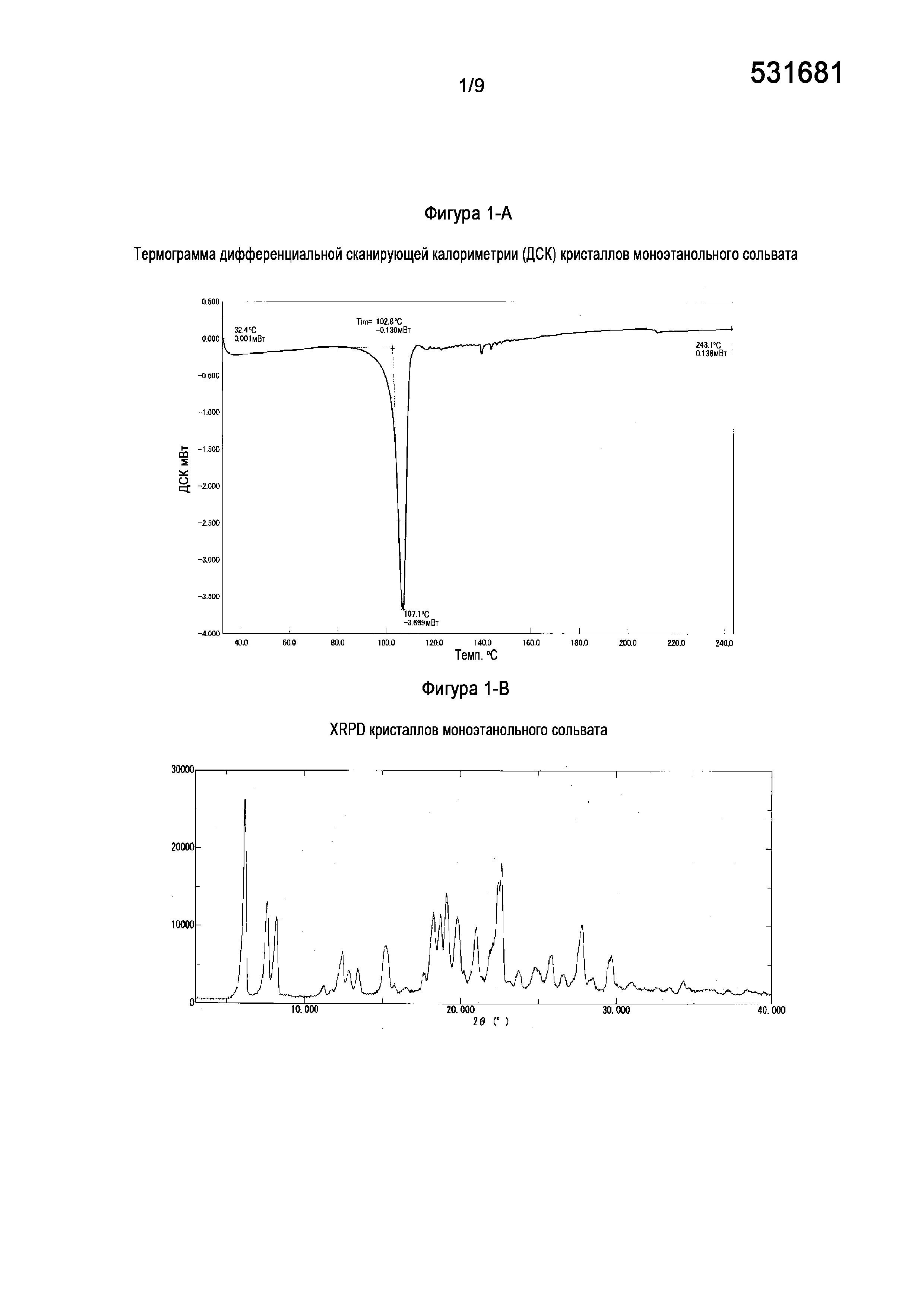
[0023] На Фигуре 1-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0024] На Фигуре 1-B показана порошковая рентгеновская дифрактограмма кристаллов моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0025] На Фигуре 2-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов моно-н-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0026] На Фигуре 2-B показана порошковая рентгеновская дифрактограмма кристаллов моно-н-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
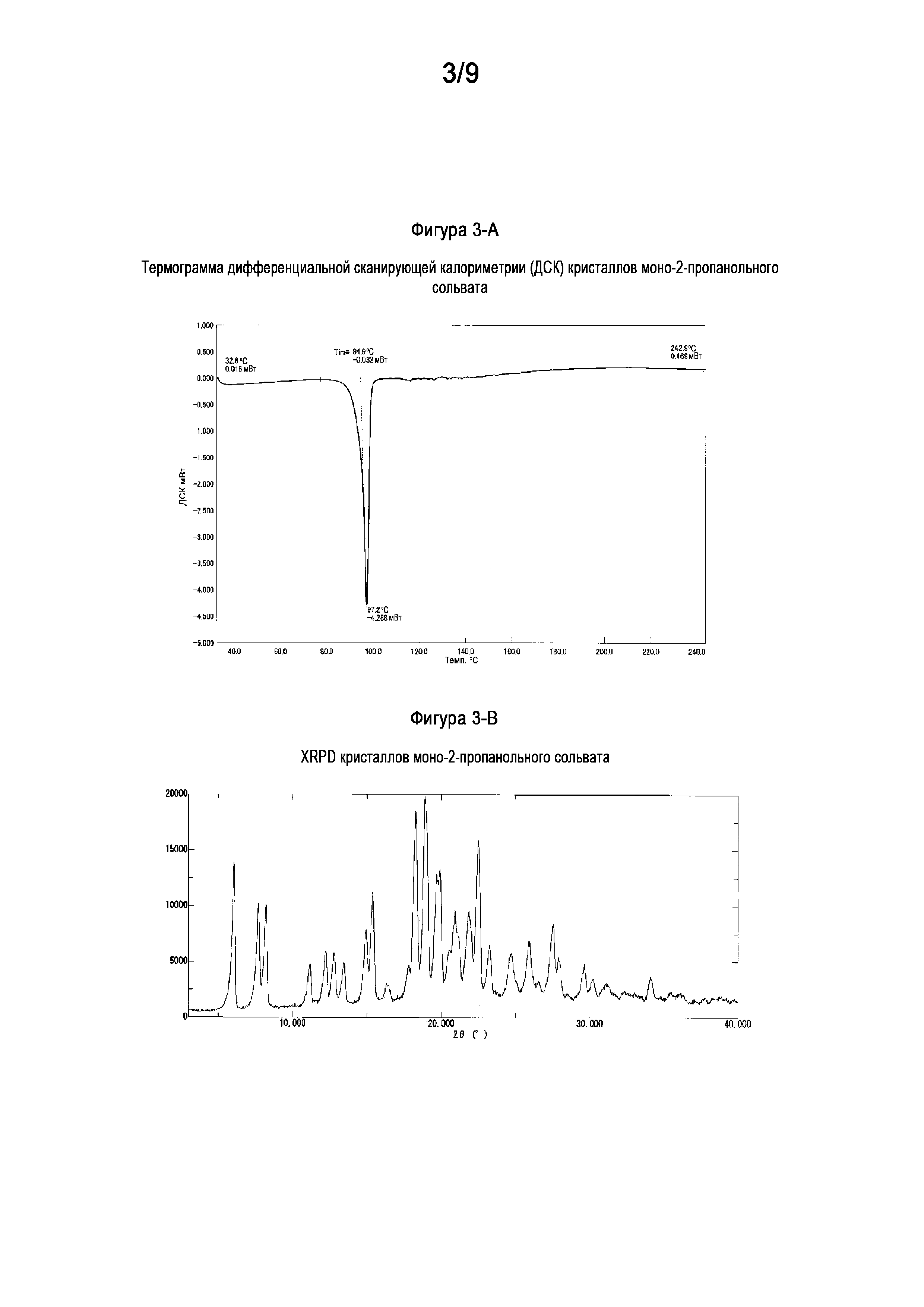
[0027] На Фигуре 3-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов моно-2-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0028] На Фигуре 3-B показана порошковая рентгеновская дифрактограмма кристаллов моно-2-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0029] На Фигуре 4-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0030] На Фигуре 4-B показана порошковая рентгеновская дифрактограмма кристаллов несольватированного свободного основания ((6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0031] На Фигуре 5-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов монометанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0032] На Фигуре 5-B показана порошковая рентгеновская дифрактограмма монометанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0033] На Фигуре 6-A показана порошковая рентгеновская дифрактограмма кристаллов моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0034] На Фигуре 6-B показана термограмма дифференциальной сканирующей калориметрии (ДСК) и термогравиметрический анализ (ТГА) кристаллов моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0035] На Фигуре 7-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллов моно-н-бутанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0036] На Фигуре 7-B показана порошковая рентгеновская дифрактограмма кристаллов моно-н-бутанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0037] На Фигуре 8-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристалла сольвата в 0,5 этилацетата 0,3 ацетона гемифумарата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0038] На Фигуре 8-B показана порошковая рентгеновская дифрактограмма кристалла сольвата в 0,5 этилацетата 0,3 ацетона гемифумарата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0039] На Фигуре 9-A показана термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллических формкристаллических форм несольватированного бензоата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
[0040] На Фигуре 9-B показана порошковая рентгеновская дифрактограмма кристаллов несольватированного бензоата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (Соединение A).
ПОДРОБНОЕ ОПИСАНИЕ
[0041] При использовании в настоящем описании, термин "кристалл" или "кристаллические формы", или "кристаллический" относится к любому твердому веществу, которое имеет ближний или дальний порядок молекул, атомов или ионов в фиксированной структурной решетке. Кристаллические формы настоящего изобретения могут находиться в форме монокристалла. Таким образом, кристаллические формы настоящего изобретения могут находиться в триклинной, моноклинной, орторомбической, тетрагональной, ромбоэдрической, гексагональной или кубической кристаллической форме или в виде их смеси. В конкретном варианте осуществления кристаллические формы настоящего изобретения находятся в сухой кристаллической форме. В другом конкретном варианте осуществления кристаллические формы настоящего изобретения по существу не содержат других форм, например не содержат аморфных или других кристаллических форм.
[0042] Термин "по существу не содержит" других кристаллических форм относится к меньше чем приблизительно 10% по весу, предпочтительно меньше чем приблизительно 5% по весу, более предпочтительно меньше чем приблизительно 2% по весу, еще более предпочтительно меньше чем приблизительно 1% по весу, еще более предпочтительно меньше чем приблизительно 0,1%, наиболее предпочтительно меньше чем приблизительно 0,01% по весу других кристаллических форм, например аморфных или других кристаллических форм.
[0043] Термин "преимущественно" или "по существу полностью в одной форме" относится к меньше чем приблизительно 10% по весу, предпочтительно меньше чем приблизительно 5% по весу, более предпочтительно меньше чем приблизительно 2% по весу, еще более предпочтительно меньше чем приблизительно 1% по весу, еще более предпочтительно меньше чем приблизительно 0,1%, наиболее предпочтительно меньше чем приблизительно 0,01% по весу других кристаллических форм, например аморфных или других кристаллических форм.
[0044] В конкретном варианте осуществления кристаллические формы изобретения могут содержать некоторое количество растворителя, например в форме сольвата, или следовые количества воды, например в форме гидрата. Предпочтительно кристаллические формы изобретения находятся в сольватированной форме или несольватированной форме. Еще более предпочтительно кристаллические формы изобретения находятся в сольватированной и негидратированной форме.
[0045] Кристаллические формы монофосфатной соли изобретения предпочтительно имеют отношение свободного основания к кислоте от 1 до 1. Например, кристалл фосфатной соли изобретения может включать 1 молярный эквивалент свободного основания на 1 молярный эквивалент фосфата.
[0046] Термин "сольват" относится к кристаллическим твердым аддуктам, содержащим стехиометрическое или нестехиометрическое количество растворителя, включенного в кристаллическую структуру. Таким образом, термин "несольватированная" форма в настоящем описании относится к кристаллам, которые не содержат или по существу не содержат молекулы растворителя в кристаллических структурах изобретения. Аналогичным образом, термин "негидратированная" форма в настоящем описании относится к кристаллам, которые не содержат или по существу не содержат молекулы воды в кристаллических структурах изобретения.
[0047] Термин "аморфная" форма относится к твердым веществам из неупорядоченно расположенных молекул, не обладающим различимой кристаллической решеткой.
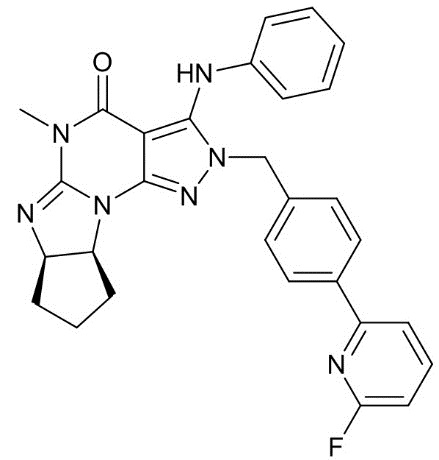
[0048] Если далее не изменено, термин "Соединение A" относится к (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-ону в форме свободного основания, имеющему следующую структуру:
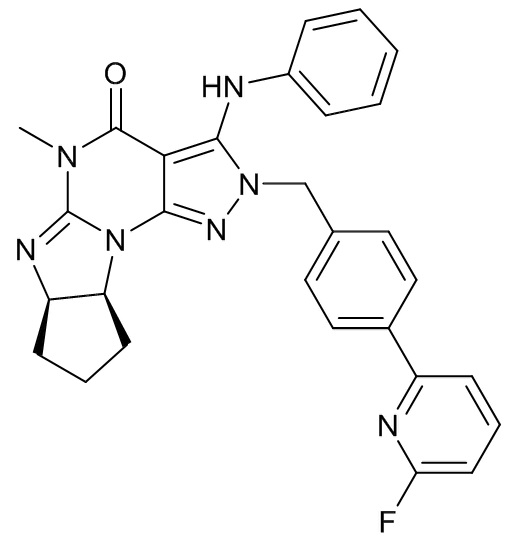
[0049] Фраза "кристалл Соединения A" относится к кристаллу соединения A в форме свободного основания. Термин "кристалл свободного основания" также используется для обозначения такого кристалла. Таким образом, "кристалл свободного основания Соединения A" также относится к кристаллу Соединения A в форме свободного основания. Термин "кристалл соли" предназначен для обозначения кристалла Соединения A в форме соли.
[0050] Кристалличность или морфология кристаллов настоящего изобретения могут быть определены многими методами, включающими, без ограничения перечисленными, рентгенодифракционный анализ монокристалла, порошковую рентгеновскую дифрактометрию, поляризационную оптическую микроскопию, тепловую микроскопию, дифференциальную сканирующую калориметрию (ДСК), термогравиметрический анализ (ТГА), адсорбционную ИК-спектроскопию и рамановскую спектроскопию. Исследование сольватов или гидратов или определение их отсутствия может быть также выполнено с помощью ДСК и/или ТГА.
[0051] Следует понимать, что порошковая рентгеновская дифрактограмма и термограмма дифференциальной сканирующей калориметрии данного образца могут несколько изменяться в зависимости от используемого прибора, времени и температуры образца при измерении, и стандартных экспериментальных ошибок. Поэтому значения температуры и углов 2-тета, значений межатомного расстояния d, высот и относительной интенсивности пиков, приведенные в Таблицах 1-6 или на Фигурах 1-A - 9-A и 1-B - 9B, будут иметь допустимый уровень отклонения. Например, значения могут иметь допустимое отклонение, например, приблизительно 20%, 15%, 10%, 5%, 3%, 2% или 1%. В одном варианте осуществления значения 2-тета и/или значения межатомного расстояния d дифрактограммы XRPD кристаллов настоящего изобретения имеют допустимое отклонение ±0,2 градуса и/или Å. Кроме того, дифрактограмма XRPD кристаллических форм изобретения может быть идентифицирована по характеристическим пикам, как изестно специалисту в данной области. Например, кристаллические формы изобретения могут быть идентифицированы, например, по меньшей мере по пяти характеристическим пикам, например, по меньшей мере трем или по меньшей мере пяти пикам, например, по меньшей мере трем или по меньшей мере пяти пикам, имеющим значения 2-тета, и/или по меньшей мере трем или по меньшей мере пяти пикам, имеющим значения межатомного расстояния d, приведенным в XRPD дифрактограммах, представленных в настоящей заявке. В другом варианте осуществления кристаллические формы изобретения могут быть идентифицированы по значениям 2-тета и/или значениям межатомного расстояния d, приведенным в XRPD дифрактограммах, представленных в настоящей заявке. Таким образом, термин "соответствующий или по существу такой как", представленный в любой из Таблиц 1-6 или изображенный на любой из Фигур 1-B, 2-B, 3-B, 4-B, 5-B, 6-A, 7-B, 8-B или 9-B, относится к любым кристаллам, которые имеют дифрактограмму XRPD, включающую основные или характеристические пики, представленные в таблицах/на фигурах.
[0052] Термин "приблизительно" перед числовым значением относится к числовому значению непосредственно или числовому значению непосредственно ±20%, ±15%, ±10%, предпочтительно ±5%, предпочтительно ±3%, предпочтительно ±2%, предпочтительно ±1% от указанного значения. Например, в случае применения к температуре, термин "приблизительно" относится к температуре непосредственно ±10°C, предпочтительно ±5°C, предпочтительно ±3°C от указанной температуры. В другом примере, в случае применения к значениям углов 2-тета, термин "приблизительно" относится к числовому значению угла 2-тета непосредственно ±0,2 градуса от указанного значения угла 2-тета. В еще одном другом примере, в случае применения к значениям межатомного расстояния d, термин "приблизительно" относится к числовому значению угла 2-тета непосредственно ±0,2 Å от указанного значения межатомного расстояния d.
ПРИМЕРЫ
[0053] Способ получения Соединения (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он в общем описан в заявке WO 2009/075784, содержание которой полностью включено посредством отсылки. Это соединение может быть также получено, как представлено или аналогично представлено на следующей схеме реакции.
В частности (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он (Int-5) может быть получен, как описано или аналогично описано ниже. Кристаллические формы свободного основания и кристаллические формы монофосфатной соли изобретения могут быть получены при использовании описанных способов или аналогично описанному в Примерах 1-14 ниже.
Получение (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она(4-(6-фторпиридин-2-ил)фенил)метанол
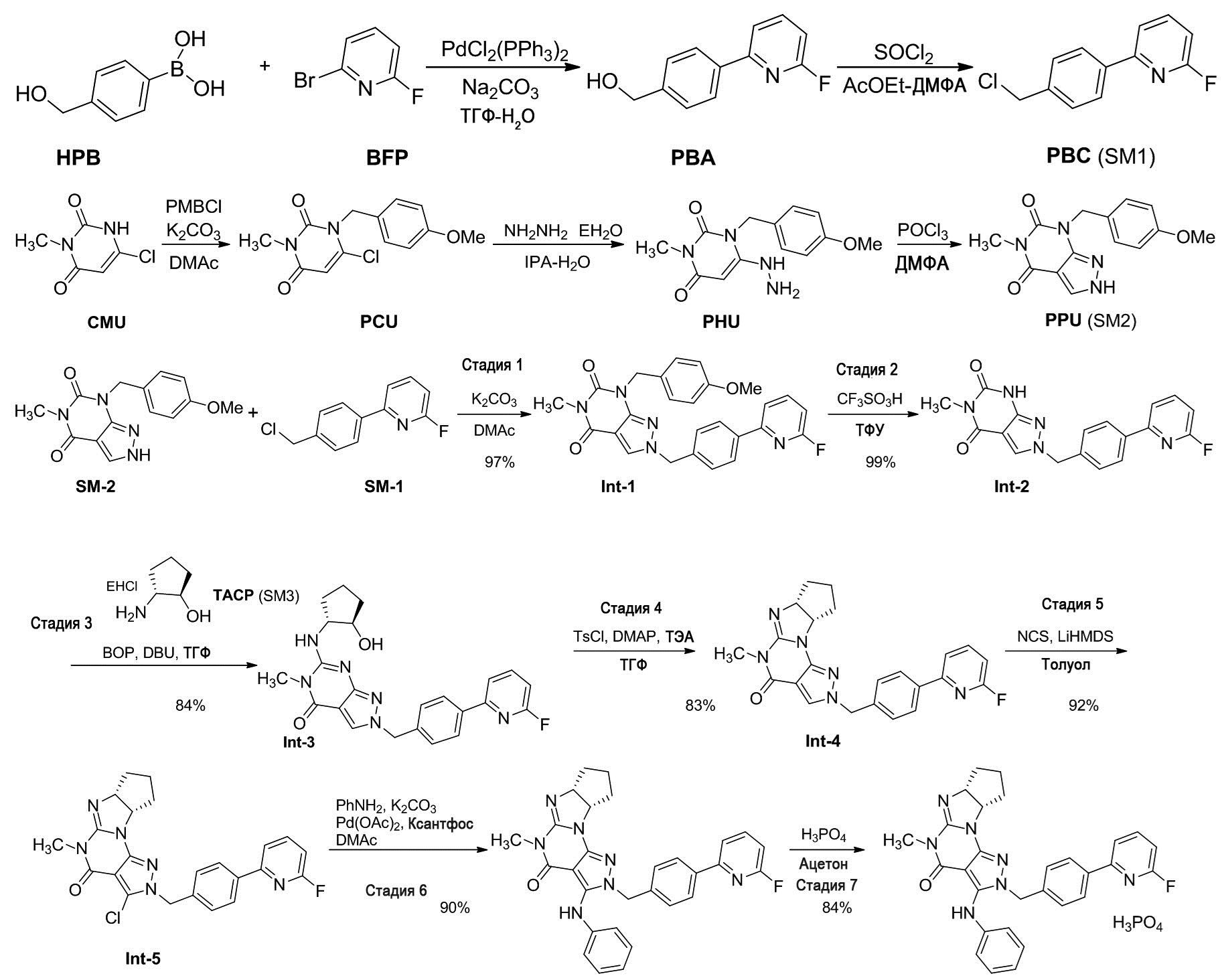
[0054] Смесь Na2CO3 (121 г), воды (500 мл), ТГФ (650 мл), PdCl2(PPh3)2 (997 мг), 2-бром-6-фторпиридина (100 г) и 4-(гидроксиметил)фенилбороновой кислоты (90,7 г) перемешивали при 65°C в течение 4 ч под атмосферой азота. После охлаждения до комнатной температуры добавляли ТГФ (200 мл). Органический слой отделяли и дважды промывали 5% раствором NaCl. Органический слой упаривали до 400 мл. После добавления толуола (100 мл) добавляли гептан (500 мл) при 55°C. Смесь охлаждали до комнатной температуры. Кристаллы выделяли фильтрацией, промывали смесью толуола (100 мл) и гептана (100 мл) и сушили с получением (4-(6-фторпиридин-2-ил)фенил)метанола (103 г). 1H-ЯМР (500 МГц, CDCl3) δ 1,71-1,78 (м, 1H), 4,74-4,79 (м, 2H), 6,84-6,88 (м, 1H), 7,44-7,50 (м, 2H), 7,61-7,65 (м, 1H), 7,80-7,88 (м, 1H), 7,98-8,04 (м, 2H).
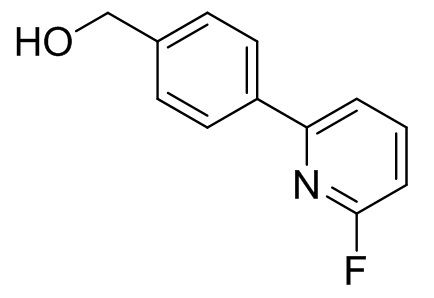
2-(4-(хлорметил)фенил)-6-фторпиридин
[0055] Раствор тионилхлорида (43,1 мл) в AcOEt (200 мл) добавляли к смеси (4-(6-фторпиридин-2-ил)фенил)метанола (100 г), ДМФА (10 мл) и AcOEt (600 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 ч. После охлаждения до 10°C добавляли 15% раствор Na2CO3. Органический слой отделяли и промывали водой (500 мл) и дважды 5% раствором NaCl (500 мл). Органический слой упаривали до 500 мл. После добавления EtOH (500 мл) смесь упаривали до 500 мл. После добавления EtOH (500 мл) смесь упаривали до 500 мл. После добавления EtOH (500 мл) смесь упаривали до 500 мл. После добавления EtOH (200 мл) добавляли воду (700 мл) при 40°C. Смесь перемешивали при комнатной температуре. Кристаллы выделяли фильтрацией и сушили с получением 2-(4-(хлорметил)фенил)-6-фторпиридина (89,5 г). 1H-ЯМР (500 МГц, CDCl3) δ 4,64 (с, 2H), 6,86-6,90 (м, 1H), 7,47-7,52 (м, 2H), 7,60-7,65 (м, 1H), 7,82-7,88 (м, 1H), 7,98-8,03 (м, 2H).
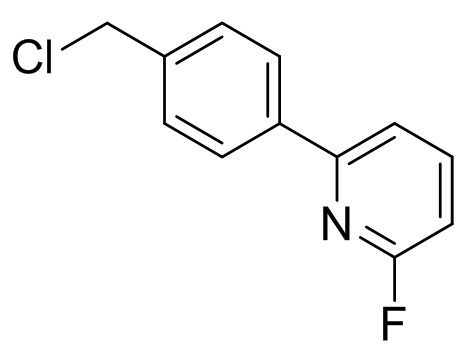
6-хлор-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-дион
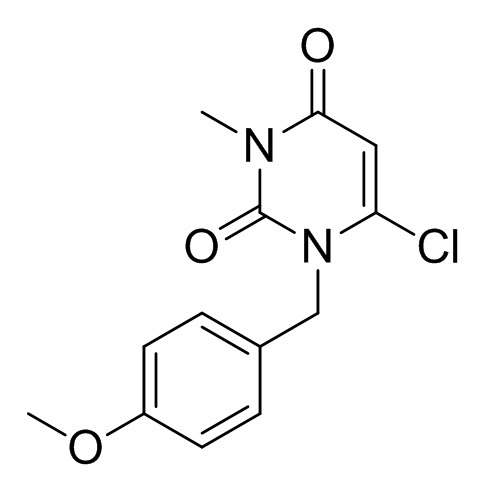
[0056] Смесь 6-хлор-3-метилурацила (100 г), п-метоксибензилхлорида (107 г), K2CO3 (86,1 г) и DMAc (600 мл) перемешивали при 75°C в течение 4 ч. Добавляли воду (400 мл) при 45°C и охлаждали смесь до комнатной температуры. Добавляли воду (800 мл) и перемешивали смесь при комнатной температуре. Кристаллы выделяли фильтрацией, промывали смесью DMAc и воды (1:2, 200 мл) и сушили, получив 6-хлор-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-дион (167 г). 1H-ЯМР (500 МГц, CDCl3) δ 3,35 (с, 3H), 3,80 (с, 3H), 5,21 (с, 2H), 5,93 (с, 1H), 6,85-6,89 (м, 2H), 7,26-7,32 (м, 2H).
6-гидразинил-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-дион
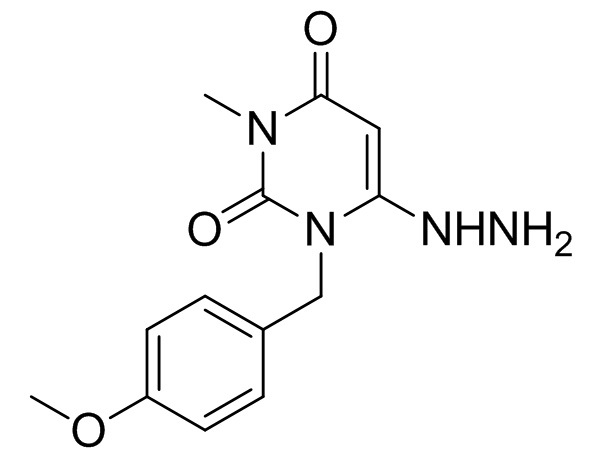
[0057] Смесь 6-хлор-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-диона (165 г), IPA (990 мл), воды (124 мл) и гидрата гидразина (62,9 мл) перемешивали при комнатной температуре течение 1 ч. Смесь нагревали до 60°C и перемешивали при той же температуре в течение 4 ч. При 45°C добавляли изопропилацетат (1485 мл) и перемешивали смесь при той же температуре в течение 0,5 ч. Смесь охлаждали при 10°C и перемешивали в течение 1 ч. Кристаллы выделяли фильтрацией, промывали смесью IPA и изопропилацетата (1:2, 330 мл) и сушили с получением 6-гидразинил-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-диона (153 г). 1H-ЯМР (500 МГц, ДМСО-d6) δ 3,12 (с, 3H), 3,71 (с, 3H), 4,36 (с, 2H), 5,01 (с, 2H), 5,14 (с, 1H), 6,87-6,89 (м, 2H), 7,12-7,17 (м, 2H), 8,04 (с, 1H).
7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-дион
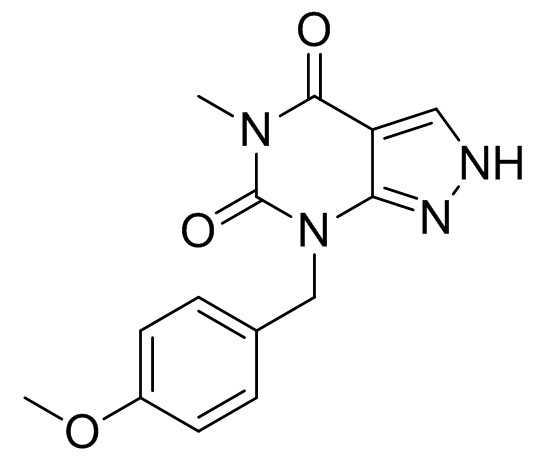
[0058] К смеси ДМФА (725 мл) и 6-гидразинил-1-(4-метоксибензил)-3-метилпиримидин-2,4(1H,3H)-диона (145 г) при 5°C добавляли POCl3 (58,5 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. При 50°C добавляли воду (725 мл) и перемешивали смесь при комнатной температуре в течение 1 ч. Кристаллы выделяли фильтрацией, промывали смесью ДМФА и воды (1:1, 290 мл) и сушили с получением 7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (145 г). 1H-ЯМР (500 МГц, ДМСО-d6) δ 3,23 (с, 3H), 3,71 (с, 3H), 5,05 (с, 2H), 6,82-6,90 (м, 2H), 7,28-7,36 (м, 2H), 8,48 (с, 1H), 13,51 (ш, 1H).
2-(4-(6-фторпиридин-2-ил)бензил)-7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-дион
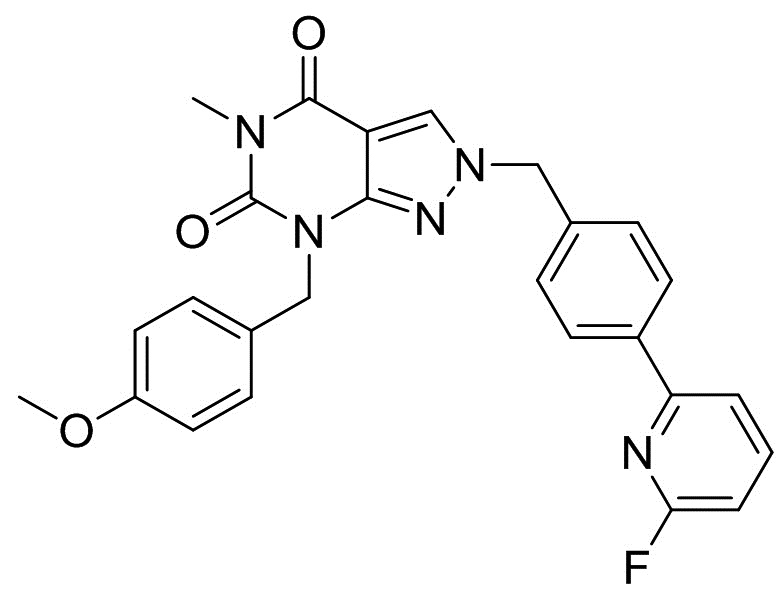
[0059] Смесь 2-(4-(хлорметил)фенил)-6-фторпиридина (100 г), 7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (129 г), K2CO3 (62,3 г) и DMAc (1500 мл) перемешивали при 45°C в течение 5 ч. При 40°C добавляли воду (1500 мл) и перемешивали смесь при комнатной температуре в течение 1 ч. Кристаллы выделяли фильтрацией, промывали смесью DMAc и воды (1:1, 500 мл) и сушили с получением 2-(4-(6-фторпиридин-2-ил)бензил)-7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (207 г). 1H-ЯМР (500 МГц, ДМСО-d6) δ 3,21 (с, 3H), 3,66 (с, 3H), 4,98 (с, 2H), 5,45 (с, 2H), 6,77-6,82 (м, 2H), 7,13-7,16 (м, 1H), 7,25-7,30 (м, 2H), 7,41-7,44 (м, 2H), 7,92-7,96 (м, 1H), 8,04-8,11 (м, 3H), 8,68 (с, 1H).
2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-дион
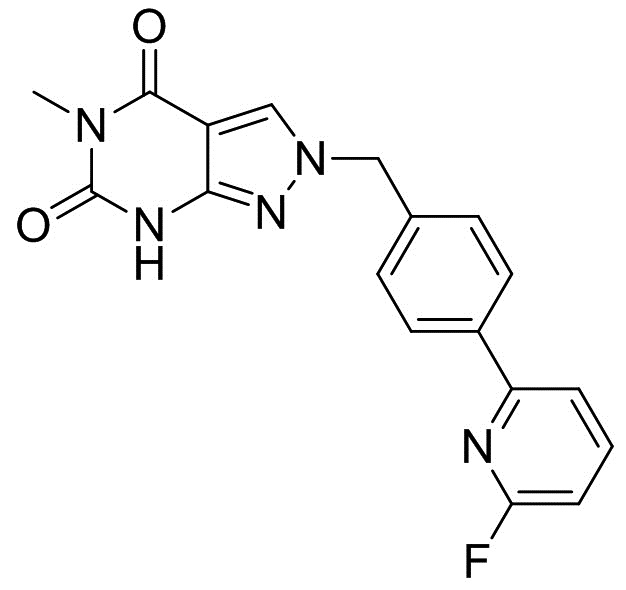
[0060] Смесь 2-(4-(6-фторпиридин-2-ил)бензил)-7-(4-метоксибензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (105 г), CF3COOH (300 мл) и CF3SO3H (100 г) перемешивали при комнатной температуре в течение 10 ч. Добавляли ацетонитрил (1000 мл). Смесь добавляли к смеси 25% NH3 (1000 мл) и ацетонитрила (500 мл) при 10°C. Смесь перемешивали при комнатной температуре в течение 1 ч. Кристаллы выделяли фильтрацией, промывали смесью ацетонитрила и воды (1:1, 500 мл) и сушили с получением неочищенного продукта. Смесь неочищенного продукта и AcOEt (1200 мл) перемешивали при комнатной температуре в течение 1 ч. Кристаллы выделяли фильтрацией, промывали AcOEt (250 мл) и сушили с получением 2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (75,3 г). 1H-ЯМР (500 МГц, ДМСО-d6) δ 3,16 (с, 3H), 3,50-4,00 (ш, 1H), 5,40 (с, 2H), 7,13-7,16 (м, 1H), 7,41-7,44 (м, 2H), 7,91-7,94 (м, 1H), 8,04-8,10 (м, 3H), 8,60 (с, 1H).
2-(4-(6-фторпиридин-2-ил)бензил)-6-(((1R,2R)-2-гидрокси-циклопентил)амино)-5-метил-2H-пиразоло[3,4-d]пиримидин-4(5H)-он
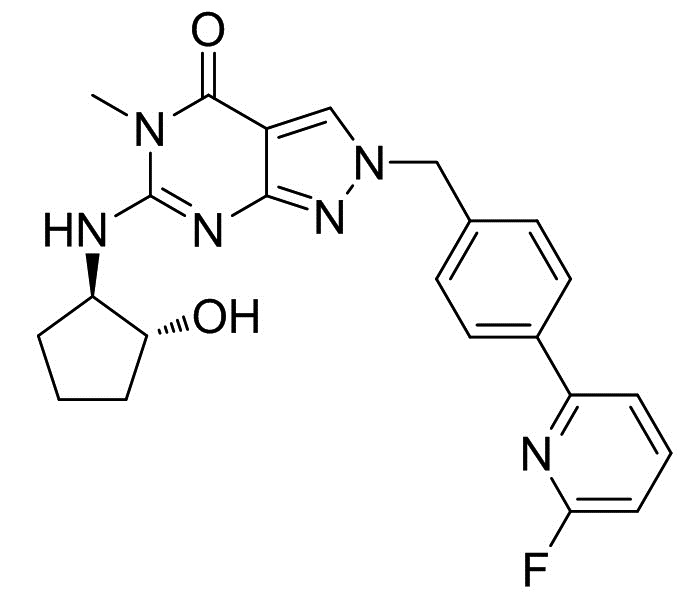
[0061] Смесь реагента BOP (126 г), 2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-2H-пиразоло[3,4-d]пиримидин-4,6(5H,7H)-диона (80 г), DBU (136 мл) и ТГФ (1120 мл) перемешивали при комнатной температуре в течение 1 ч. Добавляли гидрохлорид (1R,2R)-2-аминоциклопентанола (37,6 г) и ТГФ (80 мл) и перемешивали смесь при комнатной температуре в течение 5 ч. После добавления 5% NaCl (400 мл) и AcOEt (800 мл) органический слой отделяли. Органический слой последовательно промывали 10% NaCl (400 мл), 1M HCl 15% NaCl (400 мл), 5% NaCl (400 мл), 5% NaHCO3 (400 мл) и 5% NaCl (400 мл). После обработки активированным углем органический слой упаривали до 400 мл. После добавления ацетонитрила (800 мл) смесь упаривали до 400 мл. После добавления ацетонитрила (800 мл) при 40°C добавляли затравочные кристаллы. Смесь упаривали до 400 мл. Добавляли воду (800 мл) при комнатной температуре и смесь перемешивали в течение 2 ч. Кристаллы выделяли фильтрацией, промывали смесью ацетонитрила и воды (1:2, 400 мл) и сушили с получением 2-(4-(6-фторпиридин-2-ил)бензил)-6-(((1R,2R)-2-гидроксициклопентил)амино)-5-метил-2H-пиразоло[3,4-d]пиримидин-4(5H)-он (81,7 г). 1H-ЯМР (500 МГц, CDCl3) δ 1,47-1,59 (м, 1H), 1,68-1,93 (м, 3H), 2,02-2,12 (м, 1H), 2,24-2,34 (м, 1H), 3,42 (с, 3H), 3,98-4,12 (м, 2H), 4,68-4,70 (м, 1H), 5,37 (с, 2H), 6,86-6,90 (м, 1H), 7,36-7,42 (м, 2H), 7,58-7,63 (м, 1H), 7,81-7,88 (м, 1H), 7,89 (с, 1H), 7,97-8,01 (м, 2H).
(6aR,9aS)-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он
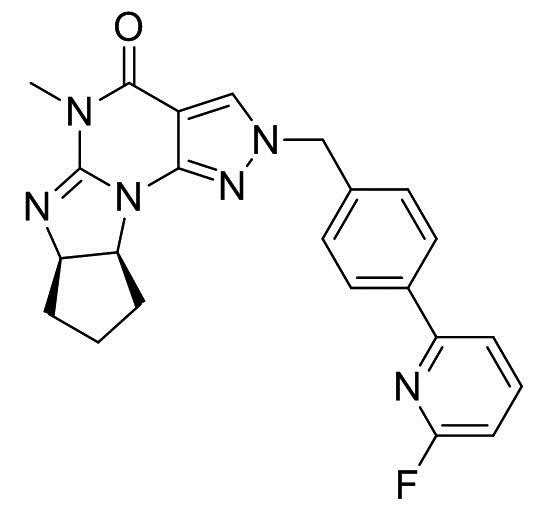
[0062] Смесь 2-(4-(6-фторпиридин-2-ил)бензил)-6-(((1R,2R)-2-гидроксициклопентил)амино)-5-метил-2H-пиразоло[3,4-d]пиримидин-4(5H)-она (80 г), п-толуолсульфонилхлорида (38,6 г), Et3N (28,2 мл), N,N-диметиламинопиридина (24,7 г) и ТГФ (800 мл) перемешивали при 50°C в течение 10 ч. К смеси при комнатной температуре добавляли 8M NaOH (11,5 мл) и смесь перемешивали в течение 2 ч. После добавления 5% NaCl (400 мл) и AcOEt (800 мл) органический слой отделяли. Органический слой два раза промывали 5% NaCl (400 мл). Органический слой упаривали до 240 мл. После добавления MeOH (800 мл) смесь упаривали до 240 мл. После добавления MeOH (800 мл) смесь упаривали до 240 мл. После добавления MeOH (160 мл) смесь перемешивали при комнатной температуре в течение 1 ч и при 0°C в течение 1 ч. Кристаллы выделяли фильтрацией, промывали холодным MeOH (160 мл) и сушили с получением (6aR,9aS)-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (55,7 г). 1H-ЯМР (500 МГц, CDCl3) δ 1,39-1,54 (м, 1H), 1,58-1,81 (м, 3H), 1,81-1,92 (м, 1H), 2,12-2,22 (м, 1H), 3,28 (с, 3H), 4,61-4,70 (м, 2H), 5,20 (с, 2H), 6,79-6,85 (м, 1H), 7,25-7,32 (м, 2H), 7,53-7,58 (м, 1H), 7,68 (с, 1H), 7,75-7,83 (м, 1H), 7,92-7,98 (м, 2H).
(6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он
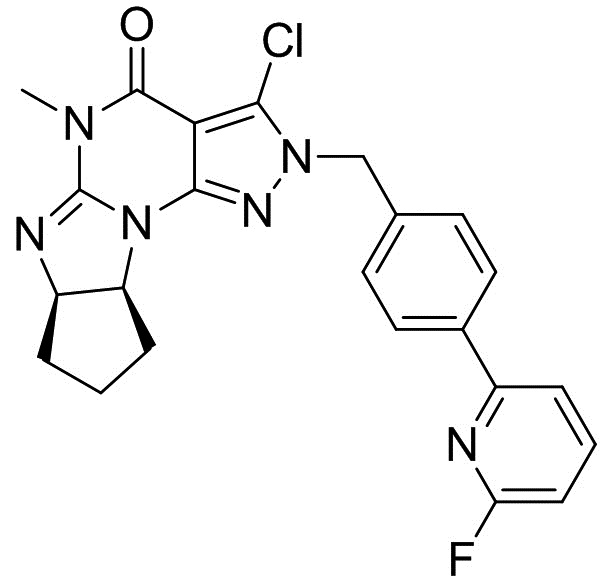
[0063] Смесь (6aR,9aS)-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (50 г) и толуола (1000 мл) упаривали до 750 мл под атмосферой азота. Добавляли толуол (250 мл) и NCS (24 г). К смеси добавляли LiHMDS (1M раствор в ТГФ, 204 мл) при 0°C и смесь перемешивали в течение 0,5 ч. К смеси добавляли 20% NH4Cl (50 мл) при 5°C. Смесь упаривали до 250 мл. После добавления EtOH (250 мл) смесь упаривали до 150 мл. После добавления EtOH (250 мл) смесь упаривали до 200 мл. После добавления EtOH (200 мл) смесь нагревали до 50°C. Добавляли воду (300 мл) и смесь перемешивали при 50°C в течение 0,5 ч. После перемешивания при комнатной температуре в течение 1 ч кристаллы выделяли фильтрацией, промывали смесью EtOH и воды (1:1, 150 мл) и сушили с получением (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (51,1 г). 1H-ЯМР (500 МГц, CDCl3) δ 1,46-1,61 (м, 1H), 1,67-1,90 (м, 3H), 1,92-2,00 (м, 1H), 2,19-2,27 (м, 1H), 3,37 (с, 3H), 4,66-4,77 (м, 2H), 5,34 (с, 2H), 6,87-6,93 (м, 1H), 7,35-7,41 (м, 2H), 7,59-7,65 (м, 1H), 7,82-7,91 (м, 1H), 7,97-8,05 (м, 2H).
ПРИМЕР 1
Кристаллические формы моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
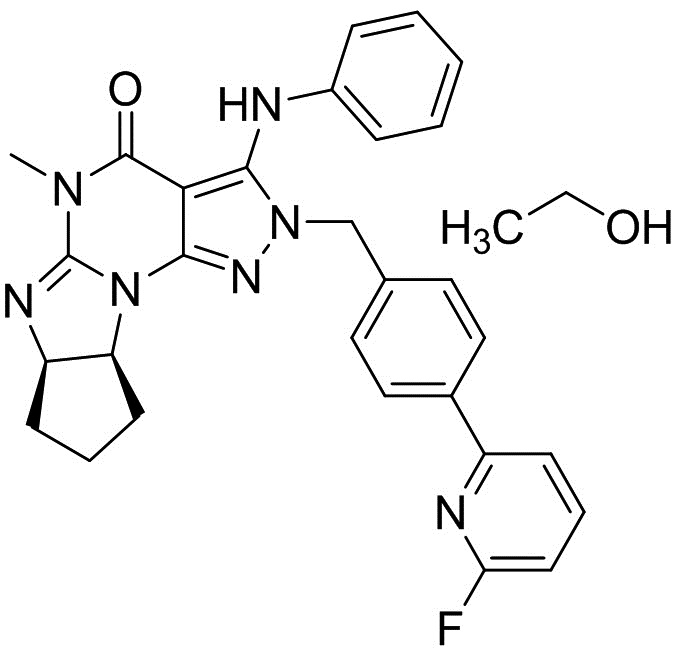
[0064] Смесь (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (2,5 г), K2CO3 (1,53 г), Pd(OAc)2 (12,5 мг), Ксантфоса (32 мг), анилина (0,76 мл) и ксилола (12,5 мл) перемешивали при 125°C в течение 7 ч под атмосферой азота. После добавления воды (12,5 мл) органический слой отделяли. Органический слой два раза промывали водой (12,5 мл). Органический слой экстрагировали смесью DMAc (6,25 мл) и 0,5Н HCl (12.5 мл). Органический слой экстрагировали смесью DMAc (3,2 мл) и 0,5Н HCl (6,25 мл). После добавления DMAc (6,25 мл), ксилола (12,5 мл) и 25% по весу водного раствора NH3 к объединенному водному слою, органический слой отделяли. Водный слой экстрагировали ксилолом (6,25 мл). Объединенный органический слой последовательно промывали водой (12,5 мл), 2,5% по весу водным раствором 1,2-циклогександиамина (12,5 мл) два раза и водой (12,5 мл). После обработки активированным углем органический слой упаривали. После добавления EtOH (12,5 мл) смесь упаривали. После добавления EtOH (12,5 мл) упаривали смесь. После добавления EtOH (12,5 мл) добавляли н-гептан (25 мл) при 70°C. Смесь охлаждали до 5°C и перемешивали при той же температуре. Кристаллы выделяли фильтрацией и сушили с получением моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (2,56 г) в виде кристаллов.
[0065] 1H-ЯМР (500 МГц, ДМСО-d6) δ 0,98-1,13 (м, 3H), 1,34-1,52 (м, 1H), 1,54-1,83 (м, 4H), 2,03-2,17 (м, 1H), 3,11 (с, 3H), 3,39-3,54 (м, 2H), 4,29-4,43 (м, 1H), 4,51-4,60 (м, 1H), 4,60-4,70 (м, 1H), 5,15-5,35 (м, 2H), 6,71-6,88 (м, 3H), 7,05-7,29 (м, 5H), 7,81-7,93 (м, 1H), 7,94-8,11 (м, 3H), 8,67 (с, 1H).
[0066] Термограммы дифференциальной сканирующей калориметрии (ДСК) кристаллической формы моноэтанольного сольвата свободного основания получены, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 1-A. Приблизительно 2 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0067] XRPD кристаллической формы моноэтанольного сольвата свободного основания получена, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 1-B. Приблизительно 20 мг образца осторожно помещали в стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали при использовании следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длины волны альфа 1: 1,5406 A
Длины волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы моноэтанольного сольвата показана на Фигуре 1-B и имеет пики, представленные в Таблице 1 ниже:
|
ПРИМЕР 1-B
Кристаллические формы моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
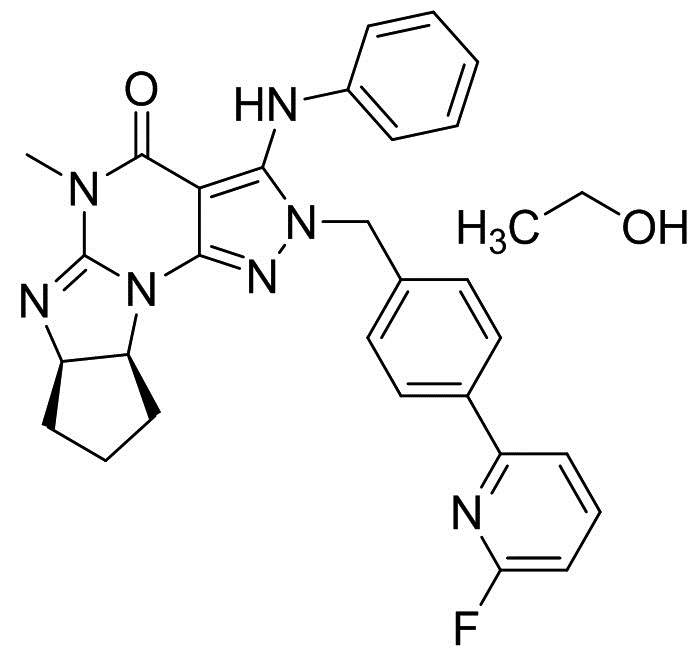
[0068] 31 мг свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она растворяли в 1 мл этанола. Раствор обрабатывали ультразвуком в течение 10 секунд, после чего наблюдали осаждение белых твердых частиц. Твердые частицы отфильтровывали при использовании вакуумной фильтрации и затем сушили на воздухе.
[0069] Термограмма дифференциальной сканирующей калориметрии (ДСК) и термогравиметрический анализ (ТГА) кристаллической формы моноэтанольного сольвата получены, как описано или аналогично описанному в настоящей заявке, и ДСК и ТГА показаны на Фигуре 6-B.
[0070] ДСК: Приблизительно 4 мг образца взвешивали в алюминиевом тигле для ДСК. Затем образец помещали в Perkin-Elmer Jade ДСК при -10°C. Образец нагревали с -10°C до 90°C при различной скорости сканирования (1°C/мин и 50°C/мин), и исследовали тепловой поток. Подачу азота 20 см3/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора. Перед анализом прибор калибровали по температуре и тепловому потоку с использованием стандартного образца индия.
[0071] ТГА: Приблизительно 5 мг образца тщательно взвешивали в керамическом тигле и помещали в камеру ТГА/ДТА анализатора Perkin-Elmer STA 600 при окружающей температуре. Затем образец нагревали при скорости 10°C/мин с 25°C до 350°C, при этом отслеживали изменение веса, а также сигнал ДТА. Для продувки использовали азот при объемной скорости потока 20 см3/мин. Перед анализом прибор калибровали при использовании эталонного веса 100 мг, и температуру калибровали при использовании стандартного образца индия.
[0072] Порошковая рентгеновская дифрактограмма твердых веществ получена при использовании описанного метода или аналогично описанного в настоящей заявке, и XRPD показана на Фигуре 6-A. Приблизительно 20 мг образца мягко уплотняли на держателе образца для XRPD из диоксида кремния с нулевым фоном и одним угловым торцом. Затем образец помещали в дифрактометр Philips X-Pert PRO и анализировали с использованием следующих условий эксперимента:
Анод трубки: Cu
Напряжение генератора: 40 кВ
Ток трубки: 40 мА
Длина волны альфа1: 1,5406 Å
Длина волны альфа2: 1,5444 Å
Начальный угол [2-тета]: 4
Конечный угол [2-тета]: 40
Время на шаг: 2,5 секунды
Величина шага сканирования: 0,016
ПРИМЕР 2
Кристаллическая форма моно-н-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
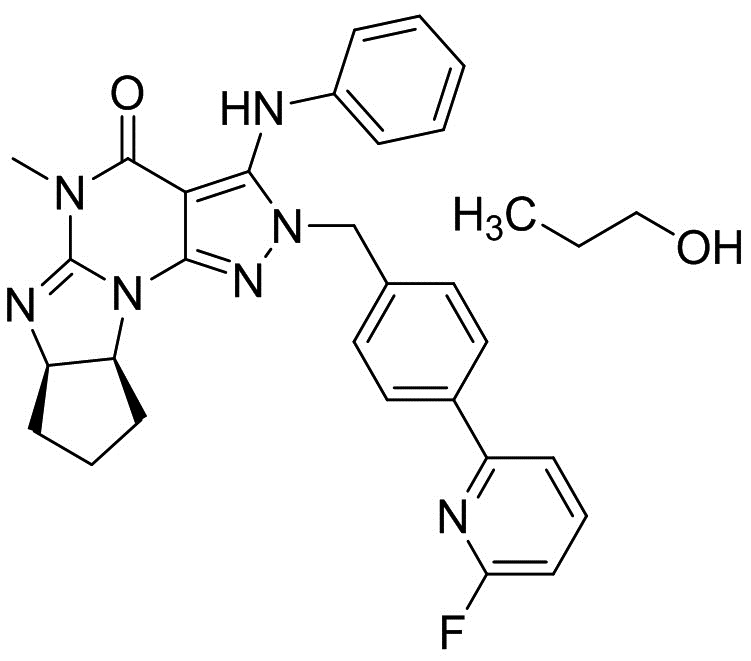
[0073] Смесь (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (10 г), K2CO3 (6,14 г), Pd(OAc)2 (50 мг), Ксантфоса (128 мг), анилина (3,04 мл), DMAc (5 мл) и ксилола (50 мл) перемешивали при 125°C в течение 5 ч под атмосферой азота. После добавления воды (50 мл) органический слой отделяли. Органический слой два раза промывали смесью DMAc (25 мл) и воды (50 мл). Органический слой экстрагировали смесью DMAc (25 мл) и 0,5Н HCl (50 мл). Органический слой экстрагировали смесью DMAc (12,5 мл) и 0,5Н HCl (25 мл). После добавления DMAc (25 мл), ксилола (50 мл) и 25% по весу водного раствора NH3 к объединенному водному слою, органический слой отделяли. Водный слой экстрагировали ксилолом (25 мл). Объединенный органический слой последовательно промывали водой (50 мл), 2,5% по весу водным раствором 1,2-циклогександиамина (50 мл) два раза и водой (50 мл). После обработки активированным углем получали органический слой (300 г). Органический слой (60 г) измеряли и упаривали. После добавления н-пропанола смесь упаривали. После добавления н-пропанола (10 мл) добавляли н-гептан (10 мл) при 90°C. Смесь охлаждали до комнатной температуры. Кристаллы выделяли фильтрацией и сушили с получением моно-н-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (2,23 г) в виде кристаллов.
[0074] 1H-ЯМР (500 МГц, ДМСО-d6) δ 0,74-0,92 (м, 3H), 1,31-1,50 (м, 3H), 1,54-1,83 (м, 4H), 1,98-2,21 (м, 1H), 3,11 (с, 3H), 3,25-3,42 (м, 2H), 4,29-4,43 (м, 1H), 4,51-4,60 (м, 1H), 4,60-4,70 (м, 1H), 5,15-5,35 (м, 2H), 6,71-6,88 (м, 3H), 7,05-7,29 (м, 5H), 7,81-7,93 (м, 1H), 7,94-8,11 (м, 3H), 8,66 (с, 1H).
[0075] Термограмму дифференциальной сканирующей калориметрии (ДСК) кристаллической формы моно-н-пропанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 2-A. Приблизительно 3 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0076] XRPD кристаллической формы моно-н-пропанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 2-B. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы моно-н-пропанольного сольвата свободного основания показана на Фигуре 2-B и имеет пики, представленные в Таблице 2 ниже:
|
ПРИМЕР 3
Кристаллическая форма моноизопропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
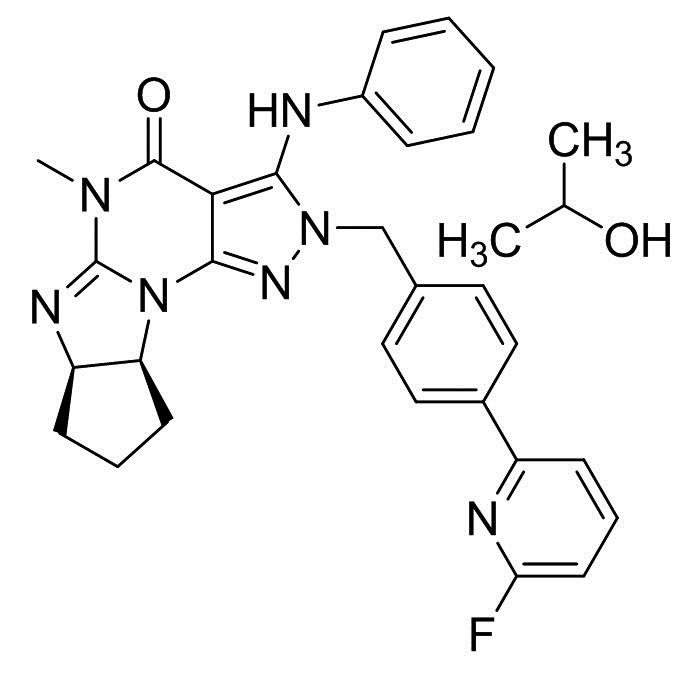
[0077] Смесь (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (10 г), K2CO3 (6,14 г), Pd(OAc)2 (50 мг), Ксантфоса (128 мг), анилина (3,04 мл), DMAc (5 мл) и ксилола (50 мл) перемешивали при 125°C в течение 5 ч под атмосферой азота. После добавления воды (50 мл) органический слой отделяли. Органический слой два раза промывали смесью DMAc (25 мл) и воды (50 мл). Органический слой экстрагировали смесью DMAc (25 мл) и 0,5Н HCl (50 мл). Органический слой экстрагировали смесью DMAc (12,5 мл) и 0,5Н HCl (25 мл). После добавления DMAc (25 мл), ксилола (50 мл) и 25% по весу водного раствора NH3 к объединенному водному слою, органический слой отделяли. Водный слой экстрагировали ксилолом (25 мл). Объединенный органический слой последовательно промывали водой (50 мл), 2,5% по весу водным раствором 1,2-циклогександиамина (50 мл) два раза и водой (50 мл). После обработки активированным углем получали органический слой (300 г). Органический слой (60 г) измеряли и упаривали. После добавления 2-пропанола смесь упаривали. После добавления 2-пропанола (10 мл) добавляли н-гептан (20 мл) при 70°C. Смесь охлаждали до комнатной температуры. Кристаллы выделяли фильтрацией и сушили с получением моноизопропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)-метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (2,13 г) в виде кристаллов.
[0078] 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,04 (д, 6H, J=5,99 Гц), 1,30-1,50 (м, 1H), 1,51-1,83 (м, 4H), 1,99-2,20 (м, 1H), 3,11 (с, 3H), 3,72-3,88 (м, 1H), 4,28-4,40 (м, 1H), 4,50-4,60 (м, 1H), 4,60-4,70 (м, 1H), 5,15-5,32 (м, 2H), 6,71-6,91 (м, 3H), 7,01-7,30 (м, 5H), 7,84-7,94 (м, 1H), 7,94-8,12 (м, 3H), 8,65 (с, 1H).
[0079] Термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллической формы моноизопропанольного сольвата свободного основания получена, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 3-A. Приблизительно 2 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0080] XRPD кристаллической формы моноизопропанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 3-B. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длины волны альфа 1: 1,5406 A
Длины волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы моноизопропанольного сольвата свободного основания показана на Фигуре 3-B и содержит пики, представленные в Таблице 3 ниже:
|
ПРИМЕР 4
Кристаллическая форма несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
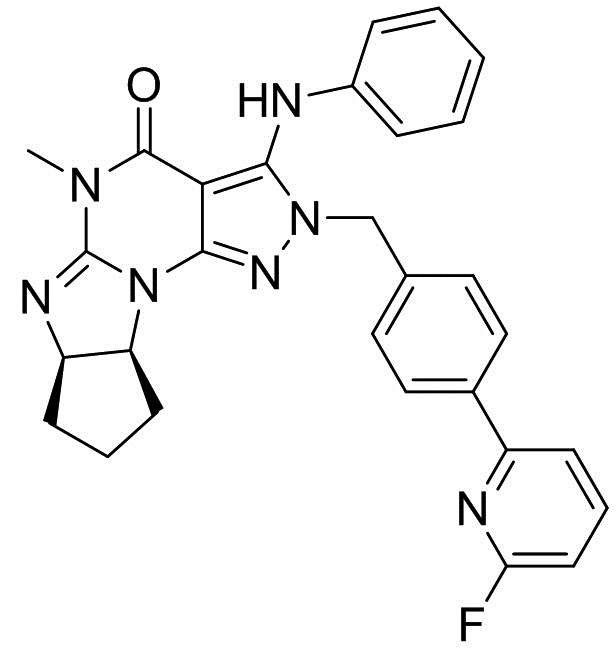
[0081] Кристаллы моно-н-пропанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (2,0 г) растворяли в этаноле (10 мл) при 70°C. Добавляли изопропиловый эфир (20 мл) и охлаждали смесь до 45°C. Добавляли изопропиловый эфир (10 мл) и перемешивали смесь при 40°C. Смесь охлаждали до 5°C и перемешивали при той же температуре. Кристаллы выделяли фильтрацией и сушили с получением несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (1,7 г) в виде кристаллов.
[0082] 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,32-1,51 (м, 1H), 1,53-1,83 (м, 4H), 1,97-2,20 (м, 1H), 3,11 (с, 3H), 4,49-4,60 (м, 1H), 4,60-4,69 (м, 1H), 5,13-5,37 (м, 2H), 6,70-6,90 (м, 3H), 7,04-7,31 (м, 5H), 7,82-7,93 (м, 1H), 7,93-8,12 (м, 3H), 8,67 (с, 1H).
[0083] Термограмму дифференциальной сканирующей калориметрии (ДСК) кристаллической формы несольватированного свободного основания получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 4-A. Приблизительно 3 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0084] XRPD кристаллической формы несольватированного свободного основания получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 4-B. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы несольватированного свободного основания показана на Фигуре 4-B и содержит пики, представленные в Таблице 4 ниже:
|
ПРИМЕР 5
Кристаллическая форма несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
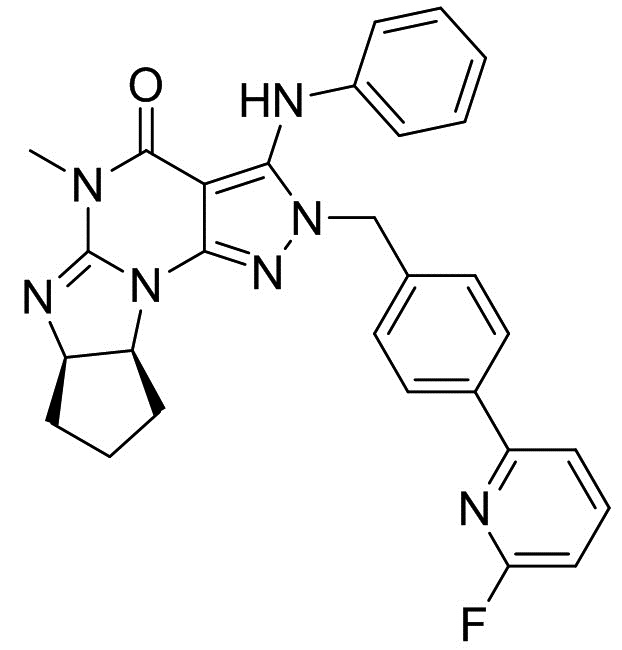
[0085] Смесь (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (25 г), K2CO3 (15,4 г), Pd(OAc)2 (125 мг), Ксантфоса (321 мг), анилина (7,6 мл), DMAc (6,25 мл) и ксилола (125 мл) перемешивали при 125°C в течение 6,5 ч под атмосферой азота. После добавления воды (125 мл) и DMAc (50 мл) органический слой отделяли. Органический слой два раза промывали смесью DMAc (50 мл) и воды (125 мл). Органический слой экстрагировали смесью DMAc (50 мл) и 0,5Н HCl (125 мл). Органический слой экстрагировали смесью DMAc (50 мл) и 0,5Н HCl (62,5 мл). После добавления DMAc (50 мл), ксилола (125 мл) и 25% по весу водного раствора NH3 (25 мл) к объединенному водному слою отделяли органический слой. Водный слой экстрагировали ксилолом (62,5 мл). Объединенный органический слой последовательно промывали смесью DMAc (50 мл) и воды (125 мл), смесью DMAc (50 мл) и 2,5% по весу водного раствора 1,2-циклогександиамина (125 мл) два раза и смесью DMAc (50 мл) и воды (125 мл). После обработки активированным углем (1,25 г) органический слой упаривали до 75 мл. После добавления EtOH (125 мл) смесь упаривали до 75 мл. После добавления EtOH (125 мл) смесь упаривали до 75 мл. После добавления EtOH (125 мл) добавляли н-гептан (250 мл) при 70°C. После добавления затравочных кристаллов несольватированного (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она смесь охлаждали до комнатной температуры и перемешивали при комнатной температуре. Кристаллы выделяли фильтрацией и сушили с получением несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо-[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (23,8 г) в виде кристаллов.
ПРИМЕР 6
Кристаллическая форма монометанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
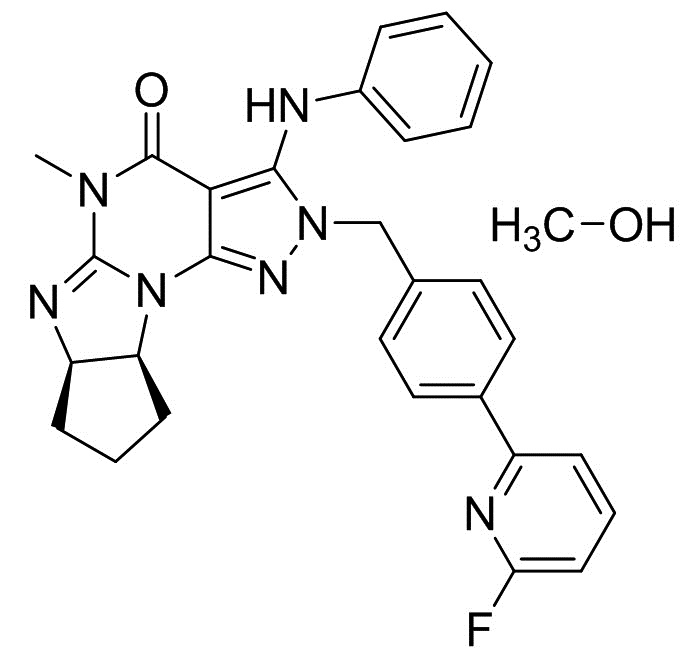
[0086] Кристаллы моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (10 г) растворяли в толуоле (60 мл) при комнатной температуре. Смесь упаривали. После добавления метанола (60 мл) смесь упаривали. После добавления метанола (60 мл) смесь упаривали. После добавления метанола (70 мл) смесь перемешивали при 40°C в течение 1 ч. Смесь охлаждали до комнатной температуры и перемешивали при той же температуре. Кристаллы выделяли фильтрацией и сушили с получением монометанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (6,9 г) в виде кристаллы.
[0087] 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,34-1,51 (м, 1H), 1,52-1,80 (м, 4H), 2,02-2,16 (м, 1H), 3,12 (с, 3H), 3,18 (д, 3H, J=5,36 Гц), 4,10 (к, 1H, J=5,36 Гц), 4,52-4,59 (м, 1H), 4,60-4,69 (м, 1H), 5,14-5,32 (м, 2H), 6,74-6,85 (м, 3H), 7,08-7,27 (м, 5H), 7,85-7,93 (м, 1H), 7,93-8,10 (м, 3H), 8,65 (с, 1H).
[0088] Термограмму дифференциальной сканирующей калориметрии (ДСК) кристаллов монометанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 5-A. Приблизительно 3 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30° до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0089] XRPD кристаллической формы монометанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 5-B. Приблизительно 20 мг образца осторожно помещали в стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы монометанольного сольвата свободного основания показана на Фигуре 5-B и содержит пики, представленные в Таблице 5 ниже:
|
ПРИМЕР 7
Кристаллическая форма моно-н-бутанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
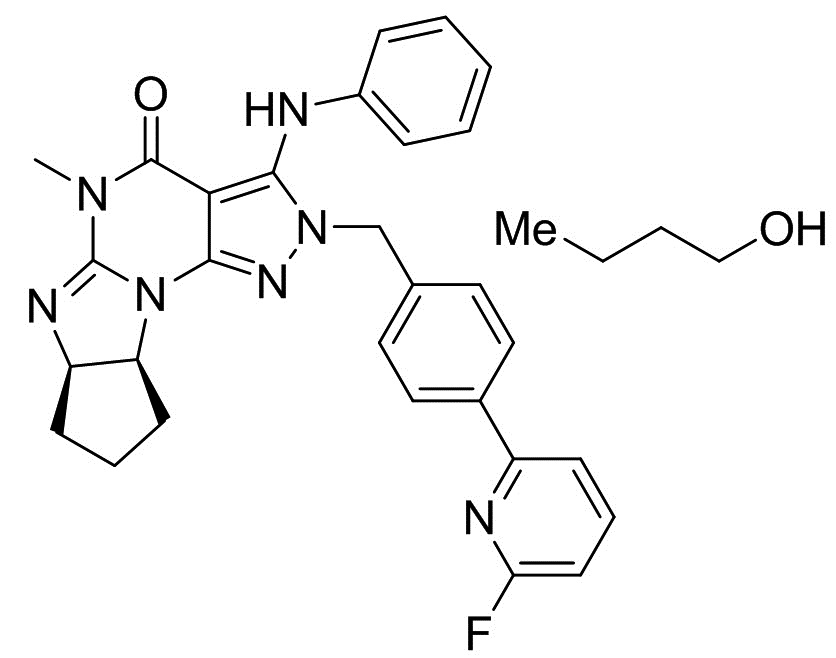
[0090] Кристаллы моноэтанольного сольват свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (0,5 г) растворяли в н-бутаноле (3 мл) при 65°C. После добавления гептана (2 мл) смесь перемешивали при 25°C. Добавляли гептан (1 мл) и смесь перемешивали при 5°C. Кристаллы выделяли фильтрацией и сушили с получением моно-н-бутанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (0,3 г) в виде кристаллов.
[0091] 1H-ЯМР (500 МГц, ДМСО-d6) δ 0,87 (т, J=7,4 Гц, 3H), 1,25-1,48 (м, 5H), 1,54-1,78 (м, 4H), 2,00-2,20 (м, 1H), 3,11 (с, 3H), 3,30-3,42 (м, 2H), 4,29-4,32 (м, 1H), 4,51-4,60 (м, 1H), 4,60-4,70 (м, 1H), 5,19-5,30 (м, 2H), 6,71-6,90 (м, 3H), 7,05-7,25 (м, 5H), 7,81-7,93 (м, 1H), 7,94-8,10 (м, 3H), 8,64 (с, 1H).
[0092] Термограмму дифференциальной сканирующей калориметрии (ДСК) кристаллической формы моно-н-бутанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 6-A. Приблизительно 2 мг образца взвешивале в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0093] XRPD кристаллической формы моно-н-бутанольного сольвата свободного основания получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 7-A. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
Дифрактограмма XRPD кристаллической формы моно-н-бутанольного сольвата свободного основания показана на Фигуре 7-B и содержит пики, представленные в Таблице 6 ниже:
Таблица 6
|
ПРИМЕР 8
Монофосфатная соль (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
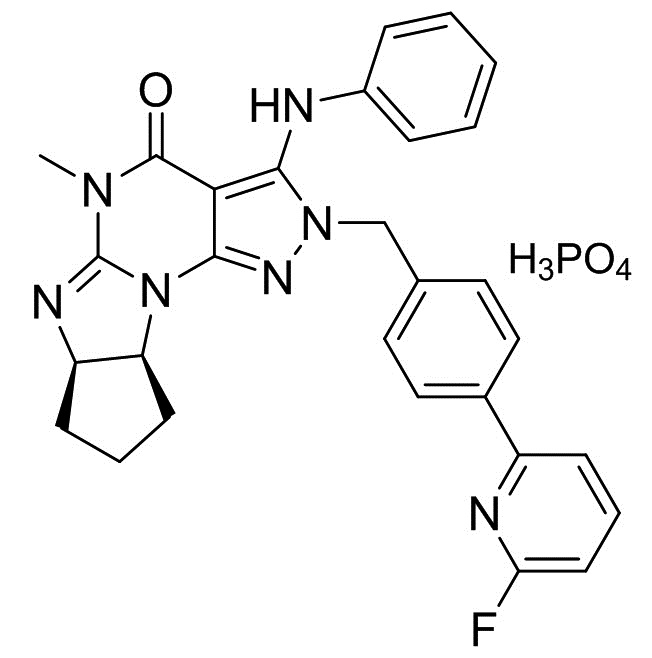
[0094] Кристаллы несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (20 г) растворяли в ацетонитриле (60 мл) при 50°C. После добавления активированного угля (1 г) смесь перемешивали при той же температуре в течение 0,5 ч. Активированный уголь удаляли фильтрацией и промывали ацетонитрилом (40 мл). Фильтрат и промывочный раствор объединяли и нагревали до 50°C. Добавляли 85% по весу раствор фосфорной кислоты (2,64 мл) в ацетонитриле (100 мл). После добавления воды (20 мл) смесь перемешивали при 50°C в течение 1 ч. Кристаллы выделяли фильтрацией, промывали ацетонитрилом (60 мл ×3) и сушили с получением монофосфатной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (20,5 г).
ПРИМЕР 9
Монофосфатная соль (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
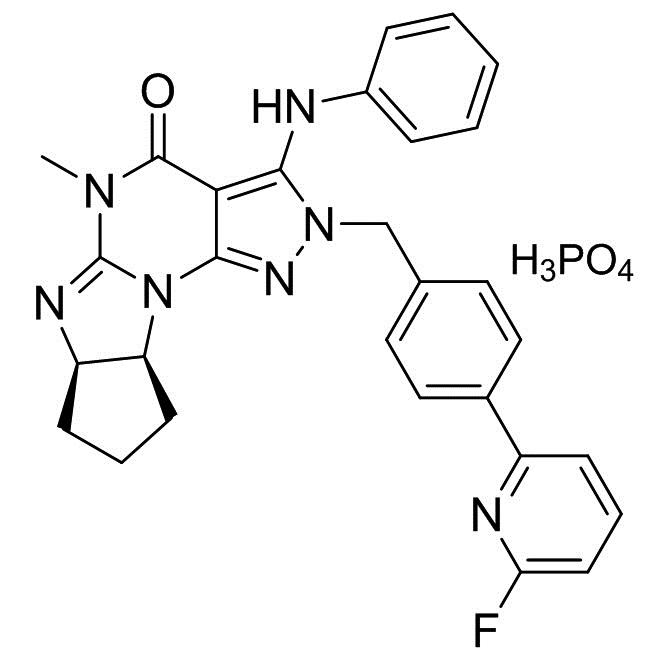
[0095] Кристаллы моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (4 г) растворяли в ацетонитриле (12 мл) при 50°C. После добавления активированного угля (0,2 г) смесь перемешивали при той же температуре в течение 0,5 ч. Активированный уголь удаляли фильтрацией и промывали ацетонитрилом (8 мл). Фильтрат и промывочный раствор объединяли и нагревали до 50°C. Добавляли 85% по весу раствор фосфорной кислоты (0,528 мл) в ацетонитриле (20 мл). После добавления воды (4 мл) смесь перемешивали при 50°C в течение 1 ч. Кристаллы выделяли фильтрацией, промывали ацетонитрилом (12 мл ×3) и сушили с получением монофосфатной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-он (4,01 г).
ПРИМЕР 10
Монофосфатная соль (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
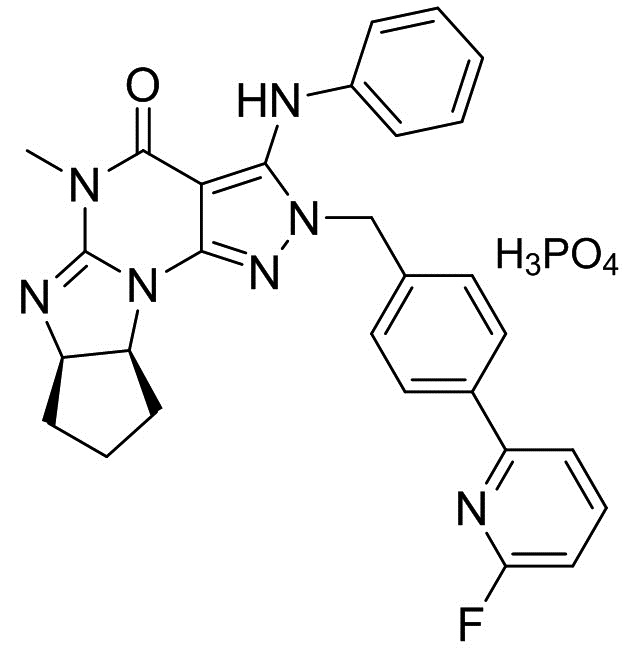
[0096] Кристаллы несольватированного свободного основания (6aR,9aS)-5,6a,7,8,9,9a-Гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (20 г) растворяли в ацетоне (60 мл) при 32°C. После добавления активированного угля (1 г) смесь перемешивали при той же температуре в течение 0,5 ч. Активированный уголь удаляли фильтрацией и промывали ацетоном (40 мл). Фильтрат и промывочный раствор объединяли и нагревали до 39°C. Добавляли 85% по весу раствор фосфорной кислоты (2,64 мл) в ацетоне (100 мл). После добавления воды (20 мл) смесь перемешивали при 40°C в течение 1 ч. Кристаллы выделяли фильтрацией, промывали ацетоном (60 мл ×3) и сушили с получением монофосфатной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (22,86 г).
ПРИМЕР 11
Монофосфатная соль (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
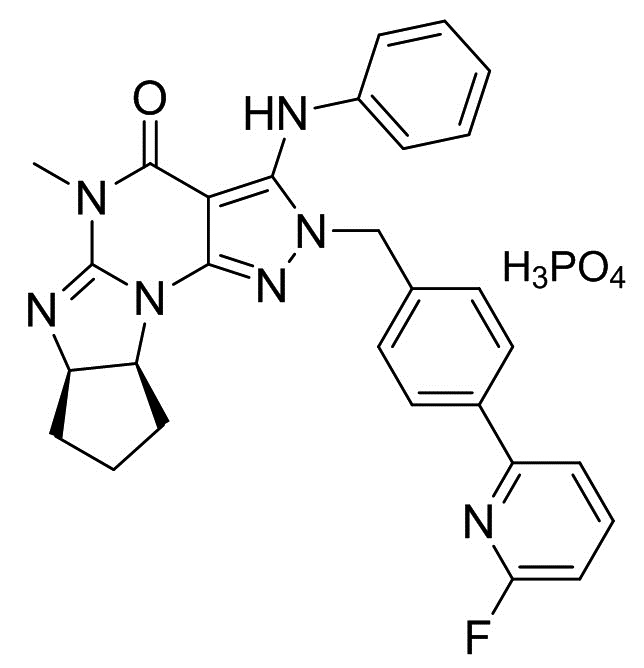
[0097] Кристаллы моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (20 г) растворяли в ацетоне (60 мл) при 38°C. После добавления активированного угля (1 г) смесь перемешивали при той же температуре в течение 0,5 ч. Активированный уголь удаляли фильтрацией и промывали ацетоном (40 мл). Фильтрат и промывочный раствор объединяли и нагревали до 38°C. Добавляли 85% по весу раствор фосфорной кислоты (2,64 мл) в ацетоне (100 мл). После добавления воды (20 мл) смесь перемешивали при 40°C в течение 1 ч. Кристаллы выделяли фильтрацией, промывали ацетоном (60 мл ×3) и сушили с получением монофосфатной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (23,2 г).
ПРИМЕР 12
Кристаллическая форма сольвата гемифумарата в 0,5 этилацетата 0,3 ацетона (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
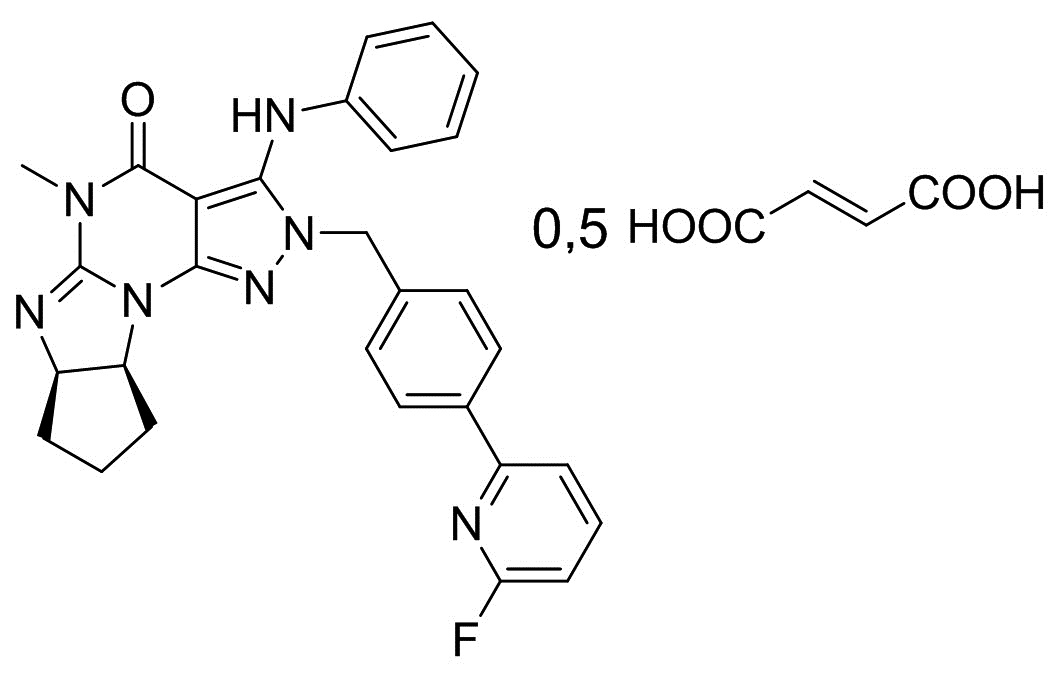
[0098] Смесь (6aR,9aS)-3-хлор-2-(4-(6-фторпиридин-2-ил)бензил)-5-метил-5,6a,7,8,9,9a-гексагидроциклопента[4,5]ими-дазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (50 г), K2CO3 (30,7 г), Pd(OAc)2 (249 мг), Ксантфоса (642 мг), анилина (15,5 г), DMAc (12,5 мл) и ксилола (250 мл) перемешивали при 125 °C в течение 6 ч под атмосферой азота. После добавления раствора цистеина (12,5 г) в воде (250 мл), DMAc (100 мл) и ксилола (50 мл) отделяли органический слой. Органический слой экстрагировали смесью воды (500 мл), DMAc (100 мл) и 12Н HCl (20 мл). Водный слой промывали EtOAc (375 мл). После добавления EtOAc (500 мл) и 25% по весу водного раствора NH3 (27,5 мл) органический слой отделяли. Органический слой упаривали до 400 мл. Добавляли активированный уголь (5 г) и Quadrasil MP (10 г) и перемешивали смесь в течение 2 ч при 50°C. После фильтрации нерастворимые вещества промывали EtOAc (100 мл) и ацетоном (100 мл). Добавляли фумаровую кислоту (0,64 г) при 40°C. После перемешивания в течение 1 ч фумаровую кислоту (2,58 г) добавляли при 45°C. После перемешивания в течение 10 мин фумаровую кислоту (1,29 г) добавляли при 45°C. После перемешивания в течение 10 мин фумаровую кислоту (1,29 г) добавляли при 45°C. После перемешивания в течение 10 мин фумаровую кислоту (1,29 г) добавляли при 45°C. Смесь перемешивали при комнатной температуре в течение ночи и охлаждали до 10°C. Смесь перемешивали при той же температуре в течение 2 ч. Кристаллы выделяли фильтрацией, промывали ацетоном/EtOAc (1/1, 200 мл) и сушили с получением сольвата гемифумарата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в 0,5 этилацетата 0,3 ацетона (62,76 г) в виде кристаллов.
[0099] 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,18 (т, J=7,09 гц, 1,5-ых), 1,38-1,52 (м, 1H), 1,56-1,80 (м, 4H), 2,00 (с, 1,5 H), 2,05-2,16 (м, 3H), 3,12 (с, 3H), 4,04 (к, J=6,94 Гц, 1H), 4,54-4,61 (м, 1H), 4,62-4,71 (м, 1H), 5,20-5,31 (м, 2H), 6,62 (с, 1H), 6,77-6,84 (м, 3H), 7,12-7,24 (м, 5H), 7,89-7,92 (м, 1H), 7,98-8,10 (м, 3H), 8,69 (с, 1H).
[0100] Термограмма дифференциальной сканирующей калориметрии (ДСК) кристаллической формы сольвата гемифумаратной соли в 0,5 этилацетата, 0,3 ацетона получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 8-A. Приблизительно 3 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0101] XRPD кристаллической формы сольвата гемифумаратной соли в 0,5 этилацетата 0,3 ацетона получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 8-B. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
[0102] Дифрактограмма XRPD кристаллической формы сольвата гемифумаратной соли в 0,5 этилацетата 0,3 ацетона показана на Фигуре 8-B и содержит пики, представленные в Таблице 7 ниже:
|
ПРИМЕР 13
Кристаллическая форма моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
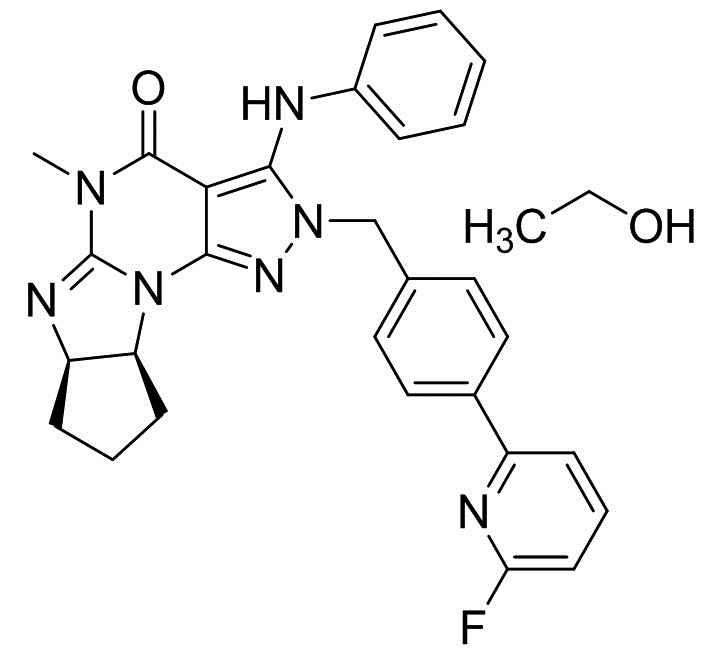
[0103] К смеси кристаллов сольвата гемифумаратной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она в 0,5 этилацетата 0,3 ацетона (61,63 г) с EtOAc (750 мл) и водой (250 мл) добавляли 25% по весу водный раствор NH3 (25 мл). Органический слой отделяли и промывали водой (250 мл). Органический слой упаривали до 150 мл. После добавления EtOH (300 мл) смесь упаривали до 150 мл. Добавляли гептан (750 мл) при 50°C и смесь охлаждали до 5°C и перемешивали при той же температуре в течение 2 ч. Кристаллы выделяли фильтрацией, промывали EtOH/гептаном (1/5, 150 мл) и сушили с получением моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (52,7 г) в виде кристаллов.
ПРИМЕР 14
Кристаллическая форма бензоатной соли (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она
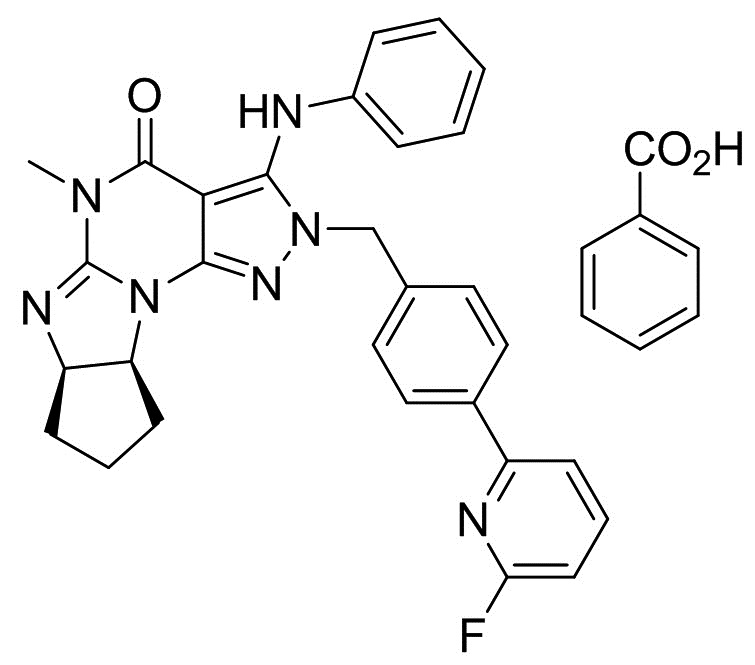
[0104] Бензойную кислоту (2,21 г) добавляли к смеси моноэтанольного сольвата свободного основания (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (5,00 г), EtOAc (25 мл) и ксилола (25 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 6 ч. Кристаллы выделяли фильтрацией, промывали EtOAc/ксиленом (1/1, 20 мл) и сушили с получением неочищенного продукта. Неочищенный продукт добавляли к ацетону (50 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Кристаллы выделяли фильтрацией, промывали ацетоном (25 мл) и сушили с получением бензоата (6aR,9aS)-5,6a,7,8,9,9a-гексагидро-5-метил-3-(фениламино)-2-((4-(6-фторпиридин-2-ил)фенил)метил)-циклопент[4,5]имидазо[1,2-a]пиразоло[4,3-e]пиримидин-4(2H)-она (3,00 г) в виде кристаллов.
[0105] 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,37-1,50 (м, 1H), 1,58-1,76 (м, 4H), 2,06-2,13 (м, 1H), 3,12 (с, 3H), 4,54-4,60 (м, 1H), 4,62-4,67 (м, 1H), 5,20-5,29 (м, 2H), 6,77-6,84 (м, 3H), 7,11-7,24 (м, 5H), 7,49-7,53 (м, 2H), 7,60-7,65 (м, 1H), 7,89-7,92 (м, 1H), 7,93-7,97 (м, 2H), 7,97-8,02 (м, 2H), 8,02-8,09 (м, 1H), 8,67 (с, 1H), 12,95 (ш, 1H).
[0106] Термограмму дифференциальной сканирующей калориметрии (ДСК) кристаллов бензоатной соли получали, как описано или аналогично описанному в настоящей заявке, и ДСК показана на Фигуре 9-A. Приблизительно 3 мг образца взвешивали в алюминиевом тигле для ДСК и герметично закрывали крышкой (запрессовывали). Затем образец помещали в Hitachi High-Tech DSC6220ASD-2 при 30°C. Образец нагревали с 30 до 250°C при скорости сканирования 5°C/мин и исследовали тепловой поток. Подачу азота при 50 мл/мин использовали для предотвращения вызванного нагревом окисления образца во время нагревания и уменьшения тепловой инерции в образце для увеличения чувствительности прибора.
[0107] XRPD кристаллов бензоатной соли получали, как описано или аналогично описанному в настоящей заявке. Результат показан на Фигуре 9-B. Приблизительно 20 мг образца осторожно помещали на стеклянный держатель образца для XRPD. Затем образец помещали в MiniFlex II и анализировали с использованием следующих условий эксперимента.
Анод трубки: Cu
Напряжение генератора: 30 кВ
Ток трубки: 15 мА
Длина волны альфа 1: 1,5406 A
Длина волны альфа 2: 1,5444 A
Начальный угол [2-тета]: 3
Конечный угол [2-тета]: 40
Скорость сканирования 6,000°/мин
Величина шага сканирования: 0,02
[0108] Дифрактограмма XRPD кристаллов бензоатной соли показана на Фигуре 9-B и содержит пики, представленные в Таблице 8 ниже:
|
ПРИМЕР 15
Фармацевтическая композиция, включающая кристаллическую форму монофосфатной соли Соединения A
[0109] Раствор связующего вещества получали при растворении гидроксипропилцеллюлозы (157,5 г) в очищенной воде (2468 г). Кристаллы монофосфатной соли Соединения A (1232 г), маннит (2996 г), микрокристаллическую целлюлозу (367,5 г) и крахмалгликолят натрия (262,5 г) загружали в гранулятор с псевдоожиженным слоем. Загруженные порошки (5016 г) гранулировали путем распыления раствора связующего вещества (2626 г) в грануляторе с псевдоожиженным слоем. Гранулы сушили в грануляторе с псевдоожиженным слоем. Высушенные гранулы измельчали при использовании мельницы с ситом ∅ 1,5 мм. Измельченные гранулы (4299 г) смешивали с микрокристаллической целлюлозой (135,0 г) и стеаратом магния (66,00 г) в диффузионном смесителе. Смешанные гранулы (4200 г) прессовали в таблетки при использовании таблетирующего пресса с пуансоном ∅ 7 мм при весе 150 мг. Таблетки (3000 г) покрывали водным пленкообразующим раствором, содержащим подготовленную смесь 1 (гипромеллоза 2910/полиэтиленгликоль 8000/диоксид титана/оксид железа красный=9/2/1/0,2) и подготовленную смесь 2 (гипромеллоза 2910/полиэтиленгликоль 8000/диоксид титана /оксид железа желтый=9/2/1/0,2) в дражировочном барабане.
|