Результат интеллектуальной деятельности: СТАБИЛИЗИРОВАННЫЕ СОСТАВЫ ВАНКОМИЦИНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет Предварительной патентной заявки США серийный No. 61/731363, поданной November 29 ноября 2012, полное содержание которой приведено в настоящем документе в качестве ссылки для всех целей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Ванкомицин представляет собой разветвленный трициклический гликозилированный нерибосомальный пептидный антибиотик, получаемый посредством ферментации Actinobacteria вида Amycolaopsis orientalis, и считают, что он действует посредством ингибирования правильного синтеза клеточной стенки у грамположительных бактерий. Кроме того, считают, что ванкомицин изменяет проницаемость мембраны клетки и синтез РНК. Соответственно, ванкомицин, как правило, используют для профилактики и лечения инфекций, вызванных грамположительными бактериями, которые не отвечают на другие типы антибиотиков.
[0003] Ванкомицин опубликован в качестве крайней меры лечения для инфекций, устойчивых к другим антибиотикам первой линии. Это вызвано тем, что ванкомицин вводят внутривенно для большинства показаний. Кроме того, для ванкомицина присутствуют опасения относительно токсичности, и разработаны полусинтетические пенициллины, и их используют предпочтительно по сравнению с ванкомицином. Тем не менее, использование ванкомицина увеличивается, в частности, с распространением Staphylococcus aureus с множественной устойчивостью (MRSA).
[0004] Способы лечения легочных нарушений с использованием липосомных составов с ванкомицином описаны в публикациях Патентных заявок США No. US 2009-0105126 и US 2009-0104257, и Предварительных патентных заявок США No. 61/103725 и 60/981990, полное содержание всех из которых, таким образом, приведено в качестве ссылки. В данной области существует необходимость в экономически целесообразных составах ванкомицина, которые деградируют с более медленной скоростью и, таким образом, обладают улучшенной стабильностью. Настоящее изобретение направлено на эти и другие нужды.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0005] В одном аспекте представлена стабилизированная композиция гликопептидного антибиотика на основе липидов. В одном варианте осуществления композиция содержит липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления аминокислота или ее производное связывает гликопептидный антибиотик и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В следующем варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом или формирует с ним комплекс. В одном варианте осуществления антибиотик представляет собой ванкомицин. В другом варианте осуществления антибиотик представляет собой тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин. В одном варианте осуществления липидный компонент представляет собой смесь двух или трех липидов.
[0006] В одном варианте осуществления представлена фармацевтическая композиция, содержащая гликопептидный антибиотик на основе липида. В следующем варианте осуществления композиция содержит липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления аминокислота или ее производное стабилизирует гликопептидный антибиотик. В следующем варианте осуществления антибиотик и аминокислота захвачены липидом или формируют с ним комплекс. В одном варианте осуществления антибиотик представляет собой ванкомицин, тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин. В следующем варианте осуществления антибиотик представляет собой ванкомицин.
[0007] В одном варианте осуществления представлен стабилизированный состав ванкомицина на основе липида, который образует продукты распада со скоростью менее приблизительно 0,05% по массе в неделю при 4°C. В другом варианте осуществления представлена стабилизированная композиция ванкомицина на основе липида, и композиция образует продукты распада со скоростью менее приблизительно 0,03% по массе в неделю при 4°C. В следующем варианте осуществления представлена стабилизированная композиция ванкомицина на основе липида, образующая продукты распада со скоростью менее приблизительно 0,02% по массе в неделю при 4°C. В следующем варианте осуществления представлена стабилизированная композиция ванкомицина на основе липида, образующая продукты распада со скоростью менее приблизительно 0,01% по массе в неделю при 4°C. В одном варианте осуществления продукты распада представляют собой кристаллические продукты распада.
[0008] В одном варианте осуществления представлен стабилизированный состав ванкомицина на основе липида, образующий продукты распада со скоростью менее приблизительно 0,5% по массе в неделю при комнатной температуре (RT). В другом варианте осуществления представлена стабилизированная композиция ванкомицина на основе липида, образующая продукты распада со скоростью менее приблизительно 0,4% по массе в неделю при RT. В следующем варианте осуществления представлена стабилизированная композиция ванкомицина на основе липида, где композиция образует продукты распада со скоростью менее приблизительно 0,2% по массе в неделю при RT. В одном варианте осуществления продукты распада представляют собой кристаллические продукты распада.
[0009] В одном варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, является по меньшей мере приблизительно на 44% более стабильной или по меньшей мере приблизительно на 55% более стабильной, или по меньшей мере приблизительно на 66% более стабильной, или по меньшей мере приблизительно на 77% более стабильной, или по меньшей мере приблизительно на 88% более стабильной, чем композиция гликопептидного антибиотика на основе липида, не содержащая аминокислоту или ее производное.
[00010] В другом варианте осуществления, настоящее изобретение относится к стабилизированному гликопептидному антибиотику на основе липида, содержащему липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, где липидный компонент содержит фосфолипид. В следующем варианте осуществления фосфолипид представляет собой фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилинозитол (PI), фосфатидилсерин (PS), фосфатидилэтаноламин (PE), фосфатидную кислоту (PA), фосфатидилхолин яйца (EPC), фосфатидилглицерин яйца (EPG), фосфатидилинозитол яйца (EPI), фосфатидилсерин яйца (EPS), фосфатидилэтаноламин (EPE), фосфатидную кислоту (EPA), фосфатидилхолин сои (SPC), фосфатидилглицерин сои (SPG), фосфатидилсерин сои (SPS), фосфатидилинозитол сои (SPI), фосфатидилэтаноламин сои (SPE), фосфатидную кислоту сои (SPA), гидрогенизированный фосфатидилхолин яйца (HEPC), гидрогенизированный фосфатидилглицерин яйца (HEPG), гидрогенизированный фосфатидилинозитол яйца (HEPI), гидрогенизированный фосфатидилсерин яйца (HEPS), гидрогенизированный фосфатидилэтаноламин (HEPE), гидрогенизированную фосфатидную кислоту (HEPA), гидрогенизированный фосфатидилхолин сои (HSPC), гидрогенизированный фосфатидилглицерин сои (HSPG), гидрогенизированный фосфатидилсерин сои (HSPS), гидрогенизированный фосфатидилинозитол сои (HSPI), гидрогенизированный фосфатидилэтаноламин сои (HSPE), гидрогенизированную фосфатидную кислоту сои (HSPA), дипальмитоилфосфатидилхолин (DPPC), димиристоилфосфатидилхолин (DMPC), димиристоилфосфатидилглицерин (DMPG), дипальмитоилфосфатидилглицерин (DPPG), дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилхолин (DOPC), диолеилфосфатидилэтаноламин (DOPE), пальмитоилстеароилфосфатидилхолин (PSPC), пальмитоилстеароилфосфатидилглицерин (PSPG), моноолеоилфосфатидилэтаноламин (MOPE), токоферол, гемисукцинат токоферола, сульфат холестерина, гемисукцинат холестерила, производные холестерина, соли аммония и жирных кислот, соли аммония и фосфолипидов, соли аммония и глицеридов, миристиламин, пальмитиламин, лауриламин, стеариламин, дилауроилэтилфосфохолин (DLEP), димиристоилэтилфосфохолин (DMEP), дипальмитоилэтилфосфохолин (DPEP) и дистеароилэтилфосфохолин (DSEP), хлорид N-(2,3-ди-(9-(Z)-октадеценилокси)-проп-1-ил-N,N,N-триметиламмония (DOTMA), 1,2-бис(олеоилокси)-3-(триметиламмонио)пропан (DOTAP), дистеароилфосфатидилглицерин (DSPG), димиристоилфосфатидиловую кислоту (DMPA), дипальмитоилфосфатидиловую кислоту (DPPA), дистеароилфосфатидиловую кислоту (DSPA), димиристоилфосфатидилинозитол (DMPI), дипальмитоилфосфатидилинозитол (DPPI), дистеароилфосфатидилинозитол (DSPI), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), дистеароилфосфатидилсерин (DSPS) или их смеси. В одном варианте осуществления липидный компонент содержит DPPC. В другом варианте осуществления липидный компонент содержит DPPG. В другом варианте осуществления липидный компонент содержит DPPC и DPPG. В одном варианте осуществления липидный компонент содержит один липид, два липида или три липида. В другом варианте осуществления липидный компонент состоит из одного липида, двух липидов или трех липидов.
[00011] В другом варианте осуществления стабилизированный гликопептидный антибиотик на основе липида содержит стерол, гликопептидный антибиотик и аминокислоту или ее производное. В одном варианте осуществления стерол представляет собой холестерин. В другом варианте осуществления композиция дополнительно содержит DPPC.
[00012] В другом варианте осуществления настоящее изобретение относится к стабилизированному гликопептидному антибиотику на основе липида, содержащему липидный компонент, содержащий фосфолипид и стерол, гликопептидный антибиотик, и аминокислоту или ее производное. В одном варианте осуществления фосфолипид и стерол представляют собой дипальмитоилфосфатидилхолин (DPPC) и холестерин, соответственно. В другом варианте осуществления фосфолипид и стерол представляют собой дипальмитоилфосфатидилглицерин (DPPG) и холестерин. В другом варианте осуществления фосфолипид и стерол содержат DPPC, DPPG и холестерин.
[00013] В одном варианте осуществления настоящее изобретение относится к стабилизированному гликопептидному антибиотику на основе липида, содержащему липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, где аминокислота или ее производное конъюгированы с гликопептидным антибиотиком для формирования стабилизированного комплекса гликопептидный антибиотик-аминокислота. В следующем варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом. В следующем варианте осуществления липидный компонент представляет собой клатрат липида, пролипосому, мицеллу или липосому. В следующем варианте осуществления липосома обладает средним размером частиц от приблизительно 0,05 до приблизительно 10 микрон, от 0,05 до приблизительно 1 микрон, от 0,05 до приблизительно 0,5 микрон, от приблизительно 0,1 до приблизительно 5,0 микрон, от приблизительно 0,1 до приблизительно 3,0 микрон, от приблизительно 0,1 до приблизительно 2,0 микрон, от приблизительно 0,1 до приблизительно 1,0 микрон, от приблизительно 0,1 до приблизительно 0,5 микрон, от приблизительно 0,1 до приблизительно 0,4 микрон, от приблизительно 0,1 до приблизительно 0,3 микрон, или от приблизительно 0,1 до приблизительно 0,2 микрон. В другом варианте осуществления средний размер частиц липосомы составляет приблизительно 1,0 микрон или менее, приблизительно 0,9 микрон или менее, приблизительно 0,8 микрон или менее, приблизительно 0,7 микрон или менее, приблизительно 0,6 микрон или менее, приблизительно 0,5 микрон или менее, приблизительно 0,4 микрон или менее, приблизительно 0,3 микрон или менее, или приблизительно 0,2 микрон или менее.
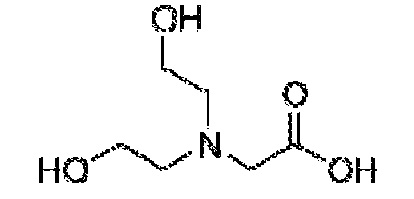
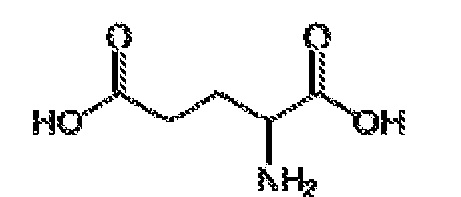
[00014] В одном варианте осуществления, настоящее изобретение относится к стабилизированной композиции гликопептидного антибиотика на основе липида, содержащей липидный компонент, ванкомицин и аминокислоту или ее производное. В одном варианте осуществления аминокислота представляет собой D-аланин. В другом варианте осуществления аминокислота представляет собой аспарагиновую кислоту. В другом варианте осуществления, производное аминокислоты представляет собой бицин. В другом варианте осуществления аминокислота представляет собой D-глутаминовую кислоту. В другом варианте осуществления производное аминокислоты представляет собой глицилглицин (GLY-GLY). В другом варианте осуществления производное аминокислоты представляет собой иминодиуксусную кислоту (IDAA). В одном варианте осуществления ванкомицин конъюгирован с аминокислотой или ее производным.
[00011] В одном варианте осуществления представлен стабилизированный липид-гликопептидный антибиотик, содержащий липидный компонент, гликопептидный антибиотик, и аминокислоту или ее производное, где молярное соотношение гликопептидного антибиотика к аминокислоте или ее производному составляет от приблизительно 1:1 до приблизительно 1:4. В следующем варианте осуществления молярное соотношение гликопептидного антибиотика к аминокислоте или ее производному составляет от приблизительно 1:1 до приблизительно 1:2. В следующем варианте осуществления молярное соотношение гликопептидного антибиотика к аминокислоте или ее производному составляет приблизительно 1:1. В другом варианте осуществления молярное соотношение гликопептидного антибиотика к аминокислоте или ее производному составляет приблизительно 1:2.
[00016] В другом варианте осуществления настоящее изобретение относится к стабилизированной композиции липида-гликопептидного антибиотика, содержащей липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, где массовое соотношение общего липидного компонента к гликопептидному антибиотику составляет от приблизительно 0,1:1 до приблизительно 5:1. В следующем варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет приблизительно 3:1 или менее. В следующем варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет приблизительно 1:1 или менее. В другом варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет менее 1:1.
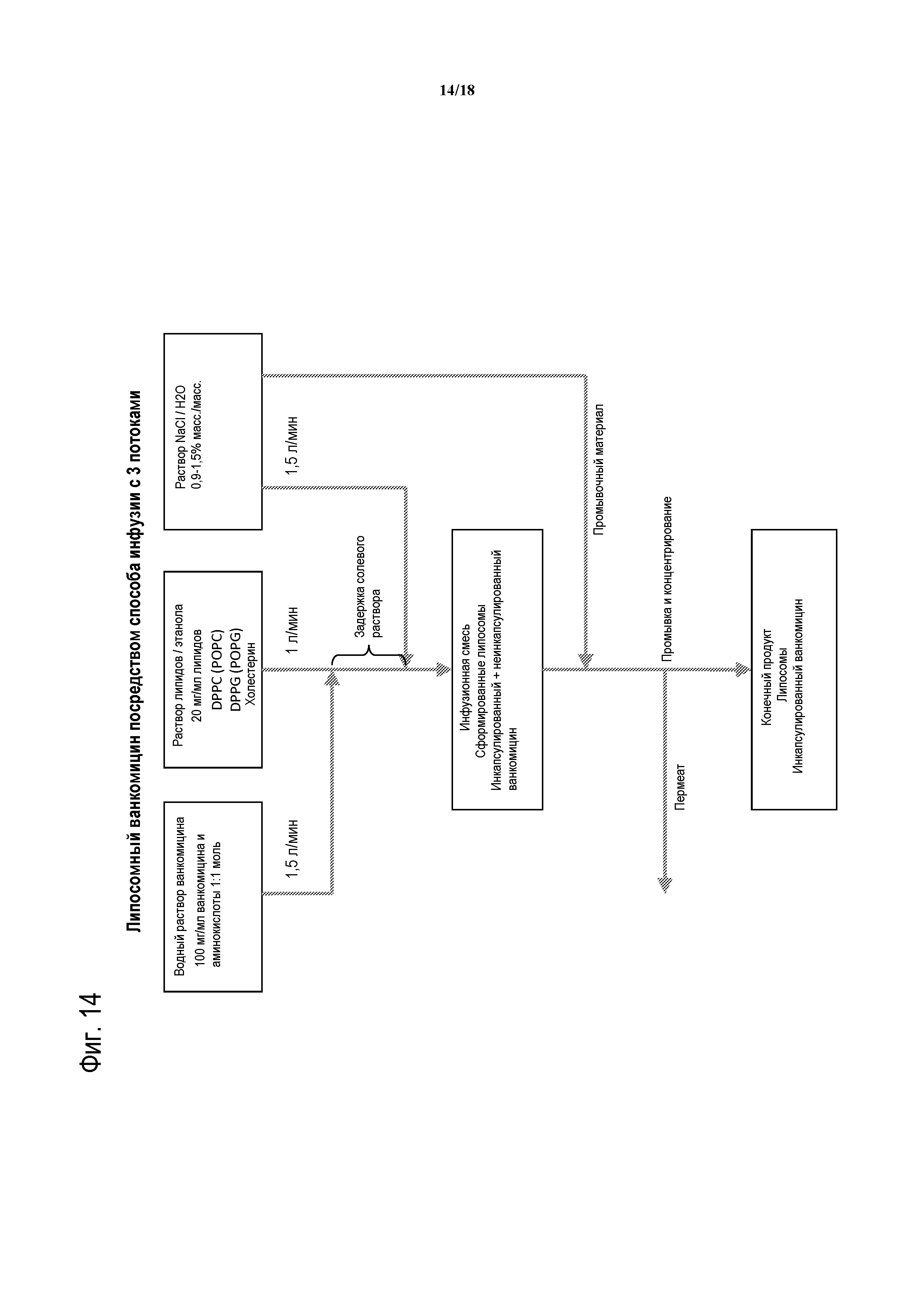
[00017] Другой аспект изобретения относится к способу получения стабилизированной композиции гликопептидного антибиотика на основе липида. В некоторых вариантах осуществления гликопептидный антибиотик представляет собой ванкомицин. В следующем варианте осуществления способ включает в себя смешивание первого потока липидного раствора, содержащего липид в растворителе, с вторым потоком водного раствора, содержащего гликопептидный антибиотик (например, ванкомицин) и аминокислоту или ее производное. В одном варианте осуществления смешивание двух потоков включает в себя инфузию поточным способом первого потока липидного раствора со вторым потоком водного раствора, содержащего гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления гликопептидный антибиотик и аминокислота или ее производное присутствуют в форме конъюгированного комплекса. В следующем варианте осуществления комплекс гликопептидный антибиотик-аминокислота захватывается липидом во время смешивания поточным способом. В следующем варианте осуществления растворитель представляет собой этанол. В другом варианте осуществления первый поток липидного раствора поставляют при первой скорости потока, и второй поток водного раствора поставляют при второй скорости потока. В следующем варианте осуществления первая скорость потока составляет приблизительно1 л/мин, и вторая скорость потока составляет приблизительно 1,5 л/мин.
[00018] В одном варианте осуществления второй поток водного раствора содержит аминокислоту D-аланин. В другом варианте осуществления аминокислота в водном растворе представляет собой аспарагиновую кислоту. В другом варианте осуществления, производное аминокислоты в водном растворе представляет собой бицин. В другом варианте осуществления аминокислота в водном растворе представляет собой D-глутаминовую кислоту. В другом варианте осуществления производное аминокислоты в водном растворе представляет собой глицилглицин (GLY-GLY). В другом варианте осуществления производное аминокислоты в водном растворе представляет собой иминодиуксусную кислоту (IDAA).
[00019] Другой аспект изобретения относится к способу лечения бактериальной легочной инфекции с помощью стабилизированной композиции гликопептидного антибиотика. В одном варианте осуществления, способ включает в себя введение нуждающемуся в этом субъекту терапевтически эффективного количества стабилизированной аминокислотой композиции гликопептидного антибиотика на основе липида. В следующем варианте осуществления гликопептидный антибиотик представляет собой ванкомицин. В другом варианте осуществления бактериальная легочная инфекция вызвана грамположительными бактериями, выбранными из группы, состоящей из Staphylococcus, Streptococcus, Enterococcus, Bacillus, Corynebacterium, Nocardia, Clostridium и Listeria. В следующем варианте осуществления грамположительные бактерии выбраны из группы, состоящей из устойчивого к метициллину Staphylococcus aureus (MRSA), Escherichia coli, Klebsiella, Enterobacter, Serratia, Haemophilus, Yersinia pesos, Burkholderia pseudomallei, Burkholderia cepacia, Burkholderia gladioli, Burkholderia multivorans, Burkholderia vietnamiensis, Mycobacterium tuberculosis, комплекса Mycobacterium avium (MAC)(Mycobacterium avium и Mycobacterium intracellulare), Mycobacterium kansasii, Mycobacterium xenopi, Mycobacterium marinum, Mycobacterium mucogenicum, Mycobacgerium gordonae, Mycobacterium ulcerans и комплекса Mycobacterium fortuitum (включая, но без ограничения, Mycrobacterium fortuitum, Mycrobacterium peregrinum, Mycrobacterium chelonae, Mycrobacterium abscessus, и Mycrobacterium mucogenicum.
[00020] В одном варианте осуществления представлен способ лечения легочного заболевания с помощью стабилизированной композиции гликопептидного антибиотика. В одном варианте осуществления легочное заболевание представляет собой кистозный фиброз, бронхоэктаз, пневмонию или хроническое обструктивное заболевание легких (COPD). В другом варианте осуществления представлен способ лечения остеомиелита; эндокардита; бронхита; гепатита; миокардита; нефрита; бактериемии; инфекции кожи или соединительных тканей, включая, но без ограничения, фолликулит, целлюлит, фурункулы или пиомиозит; или инфекции раны или области хирургического вмешательства с помощью стабилизированной композиции гликопептидного антибиотика.
[00021] В одном варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида для использования в терапии кистозного фиброза, бронхоэктаза, пневмонии или хронического обструктивного заболевания легких (COPD). В другом варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида, для использования в терапии остеомиелита; эндокардита; бронхита; гепатита; миокардита; нефрита; бактериемии; инфекции кожи или соединительных тканей, включая, но без ограничения, фолликулит, целлюлит, фурункулы или пиомиозит; или инфекции раны или области хирургического вмешательства. В одном варианте осуществления композиция для использования в терапии содержит липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления аминокислота или ее производное связывает гликопептидный антибиотик и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В следующем варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом или формирует с ним комплекс. В одном варианте осуществления антибиотик представляет собой ванкомицин. В другом варианте осуществления антибиотик представляет собой тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин.
[00022] В одном варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида, для использования в качестве лекарственного средства для лечения кистозного фиброза, бронхоэктаза, пневмонии или хронического обструктивного заболевания легких (COPD). В другом варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида, для использования в качестве лекарственного средства для лечения остеомиелита; эндокардита; бронхита; гепатита; миокардита; нефрита; бактериемии; инфекции кожи или соединительных тканей, включая, но без ограничения, фолликулит, целлюлит, фурункулы или пиомиозит; или инфекции раны или области хирургического вмешательства. В одном варианте осуществления композиция для использования в качестве лекарственного средства содержит липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления аминокислота или ее производное связывает гликопептидный антибиотик и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В следующем варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом или формирует с ним комплекс. В одном варианте осуществления антибиотик представляет собой ванкомицин. В другом варианте осуществления антибиотик представляет собой тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин.
[00023] В одном варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида, для использования в изготовлении лекарственного средства против кистозного фиброза, бронхоэктаза, пневмонии или хронического обструктивного заболевания легких (COPD). В другом варианте осуществления представлена композиция, содержащая стабилизированный гликопептидный антибиотик на основе липида, для использования в изготовлении лекарственного средства против остеомиелита; эндокардита; бронхита; гепатита; миокардита; нефрита; бактериемии; инфекции кожи или соединительных тканей, включая, но без ограничения, фолликулит, целлюлит, фурункулы или пиомиозит; или инфекции раны или области хирургического вмешательства. В одном варианте осуществления композиция для использования в изготовлении лекарственного средства содержит липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В следующем варианте осуществления аминокислота или ее производное связывает гликопептидный антибиотик и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В следующем варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом или формирует с ним комплекс. В одном варианте осуществления антибиотик представляет собой ванкомицин. В другом варианте осуществления антибиотик представляет собой тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин.
[00020] В другом варианте осуществления терапевтически эффективное количество стабилизированной композиции гликопептидного антибиотика на основе липида представляет собой количество, превышающее минимальную ингибирующую концентрацию (MIC) для бактериальной легочной инфекции. В другом варианте осуществления терапевтически эффективное количество стабилизированной композиции гликопептидного антибиотика на основе липида представляет собой дозу приблизительно 50-1000 мг/сутки, приблизительно 100-500 мг/сутки или приблизительно 250-500 мг/сутки. В следующем варианте осуществления доза составляет приблизительно 100 мг/сутки. В других вариантах осуществления доза составляет приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг или приблизительно 500 мг в сутки. В другом варианте осуществления композицию вводят от 1 раза до 4 раз в сутки. В следующем варианте осуществления композицию вводят один раз в сутки, два раза в сутки, три раза в сутки или четыре раза в сутки. В другом варианте осуществления композицию вводят в цикле ежесуточного лечения в течение некоторого периода времени, или вводят в цикле на каждые вторые сутки, на каждые третьи сутки, на каждые четвертые сутки, на каждые пятые сутки, на каждые 6-е сутки или один раз в неделю в течение периода времени, где период времени составляет от одной недели до нескольких месяцев, например, 1, 2, 3 или 4 недели, или 1, 2, 3, 4, 5 или 6 месяцев.
[00025] В другом варианте осуществления композицию гликопептидного антибиотика на основе липида вводят посредством ингаляции в форме ингаляционного спрея, порошка или аэрозоля. В следующем варианте осуществления стабилизированную композицию гликопептида на основе липида вводят посредством ингалятора.
КРАТКОЕ ОПИСАНИЕ ФИГУР
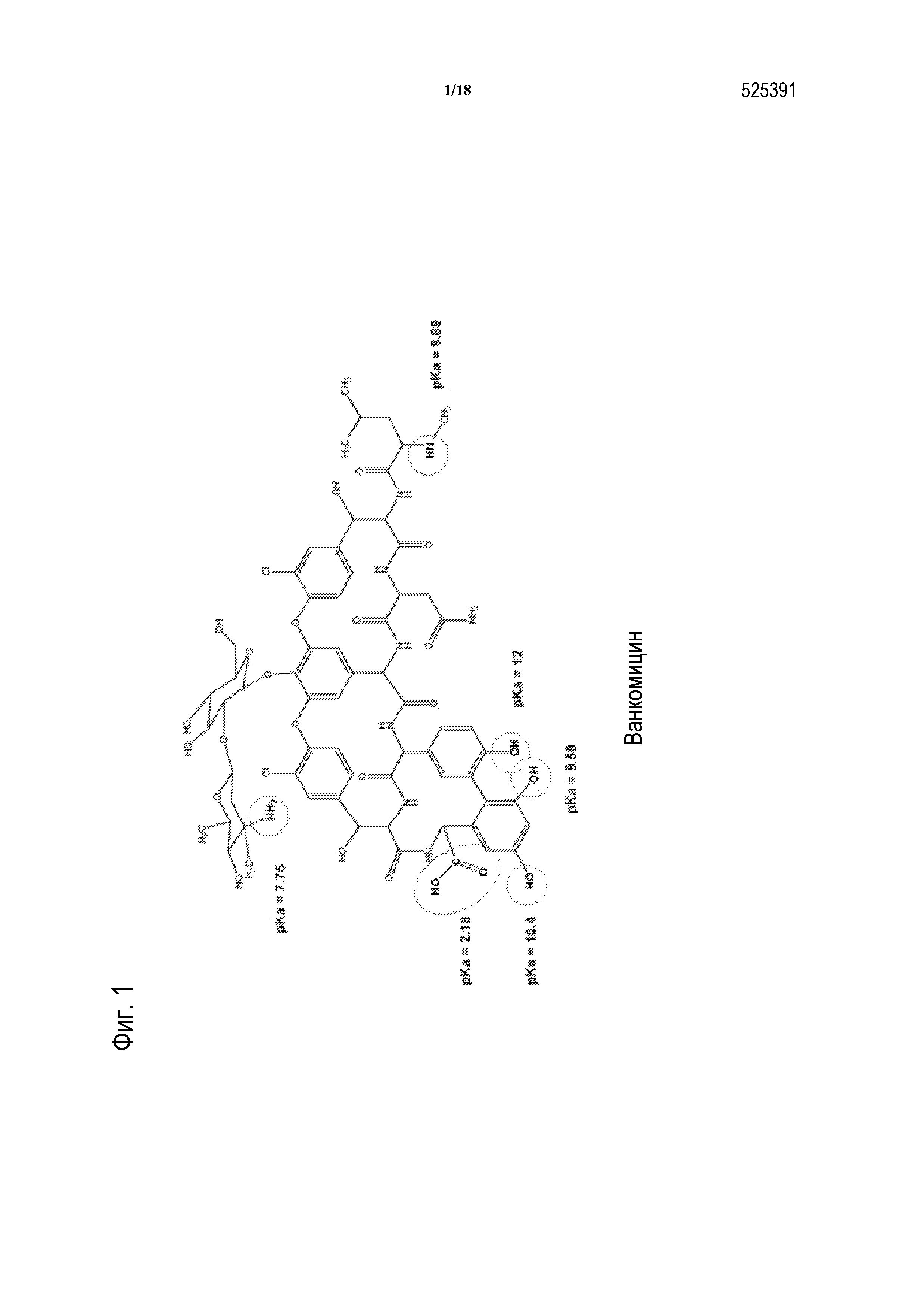
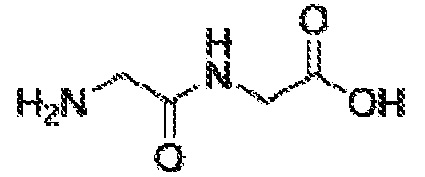
[00026] На ФИГУРЕ 1 показана структура ванкомицина.
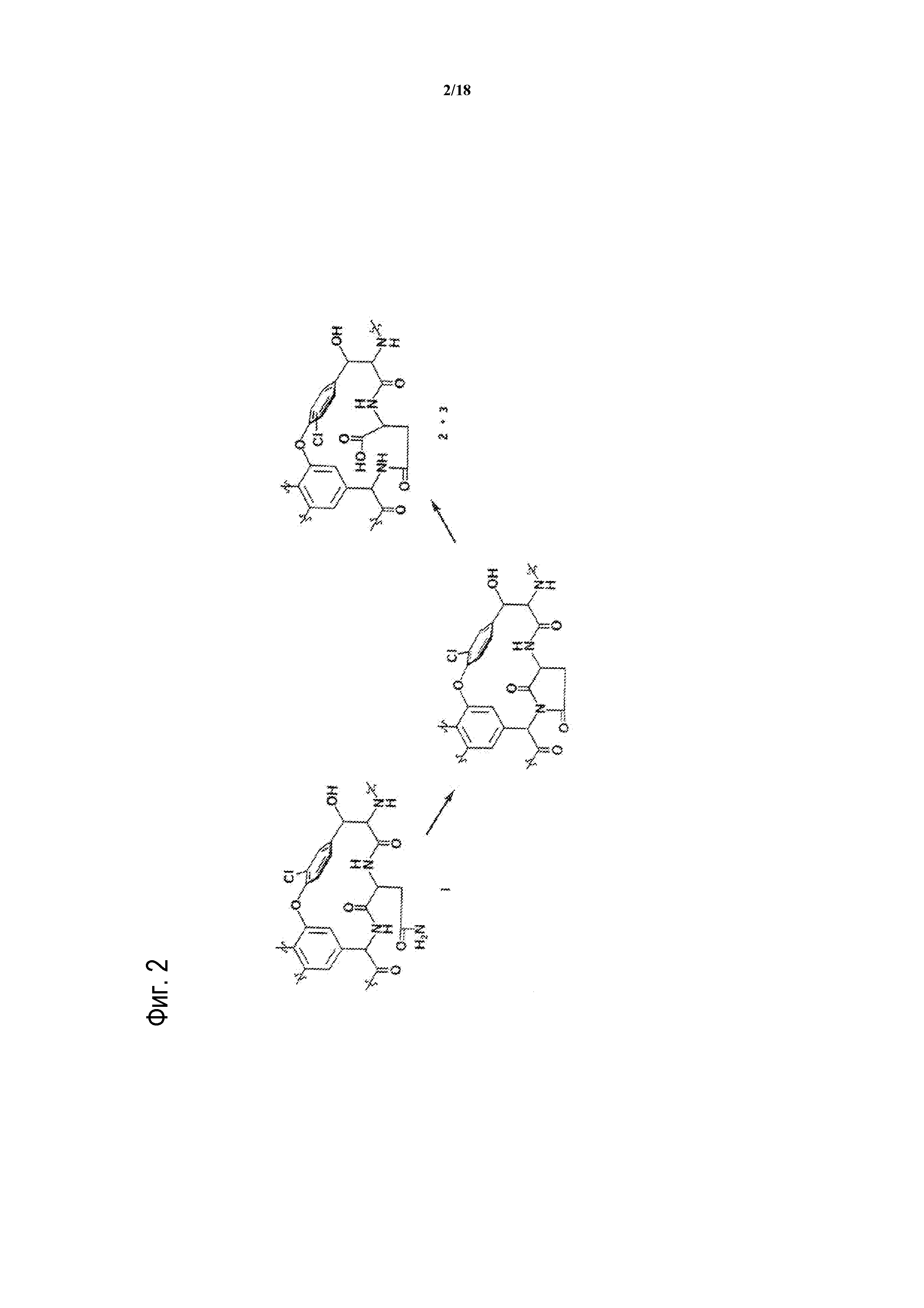
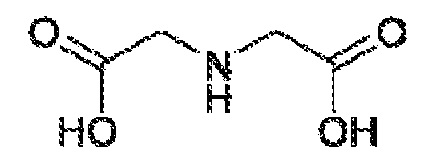
[00027] На ФИГУРЕ 2 показаны структурные изменения в ходе распада ванкомицина до кристаллического продукта распада-I (CDP-I).
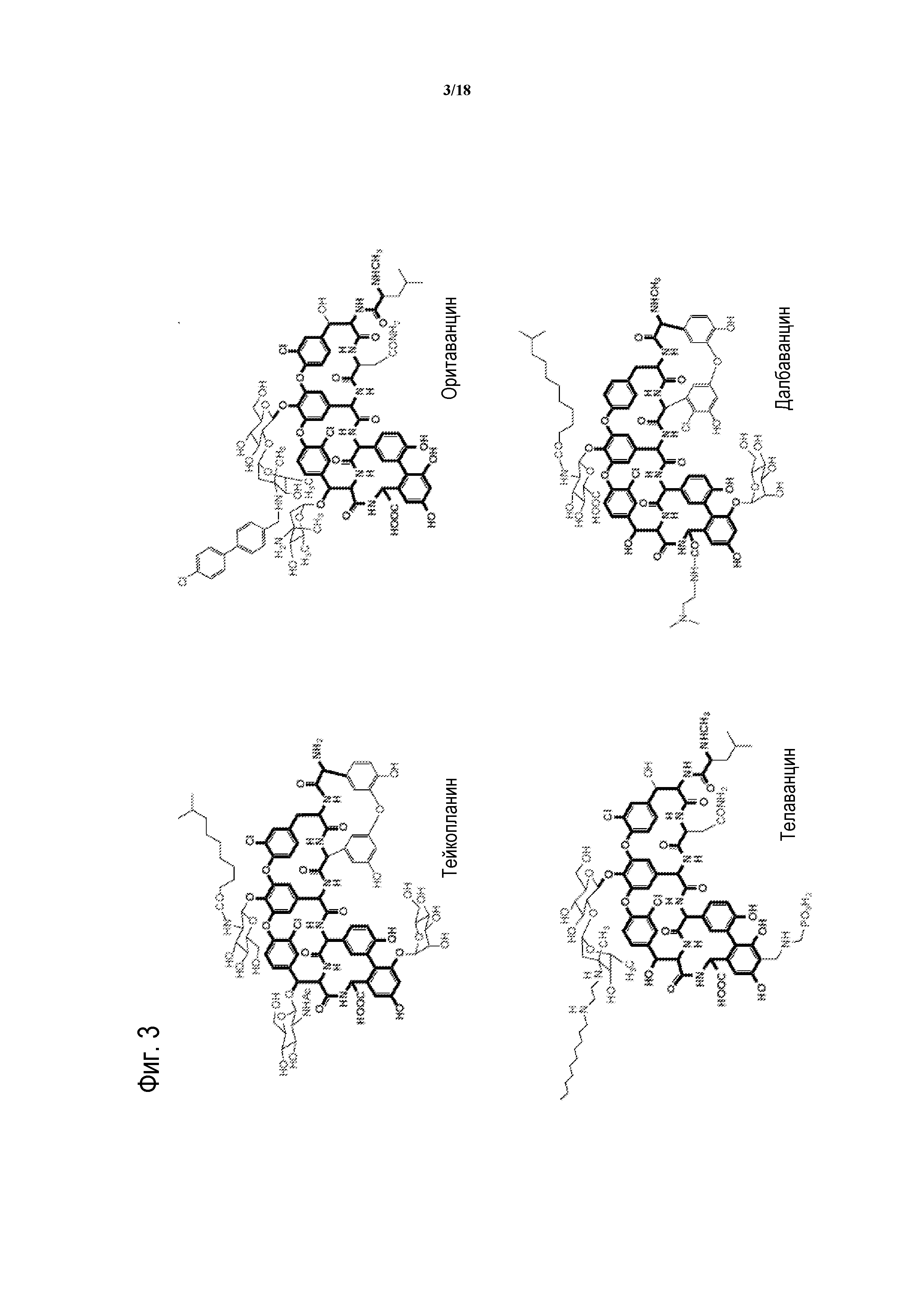
[00028] На ФИГУРЕ 3 показана общая структура четырех типов природных гликопептидных антибиотиков.
[00029] ФИГУРА 4 представляет собой типичную хроматограмму ванкомицина с использованием колонки ZIC-HILIC. Пики CDP-I-M, CDP-I-m и ванкомицина показаны на время удержания 13, 5, 4,9 и 23,9, соответственно.
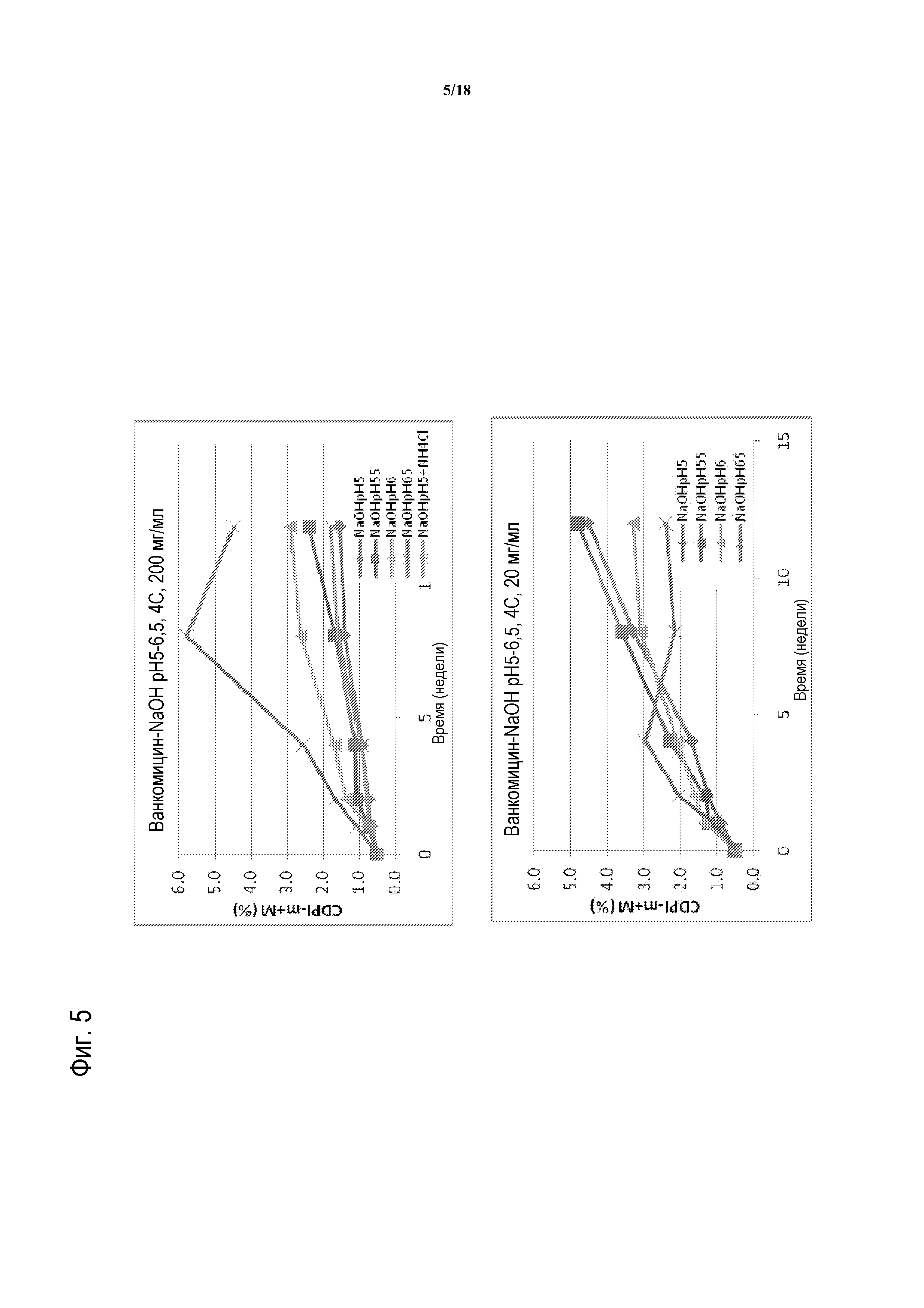
[00030] ФИГУРА 5 представляет собой график распада ванкомицина с течением времени при pH 5, 5,5, 6 или 6,5, при 4°C, и при концентрации 200 мг/мл (верхняя панель) или 20 мг/мл (нижняя панель).
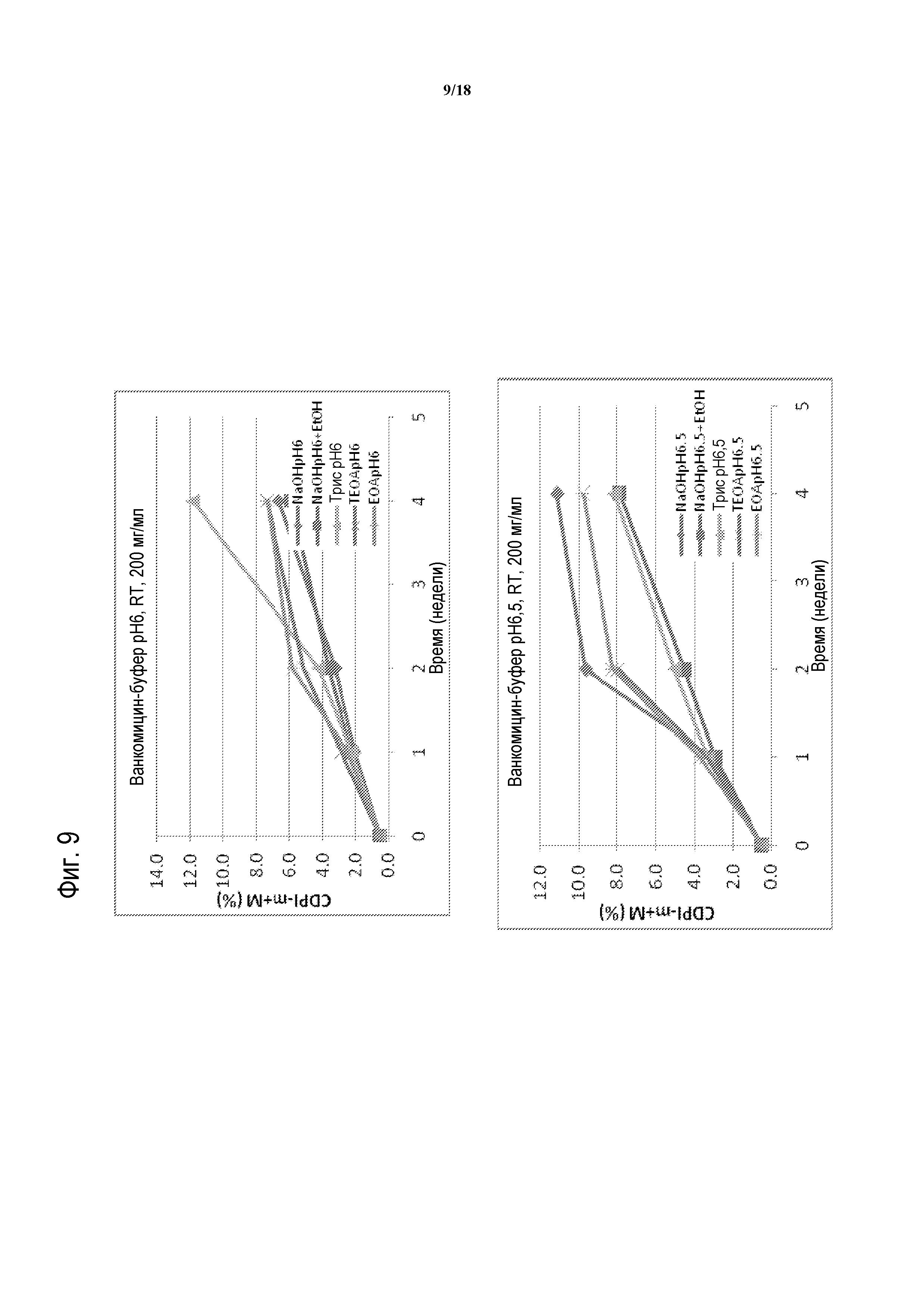
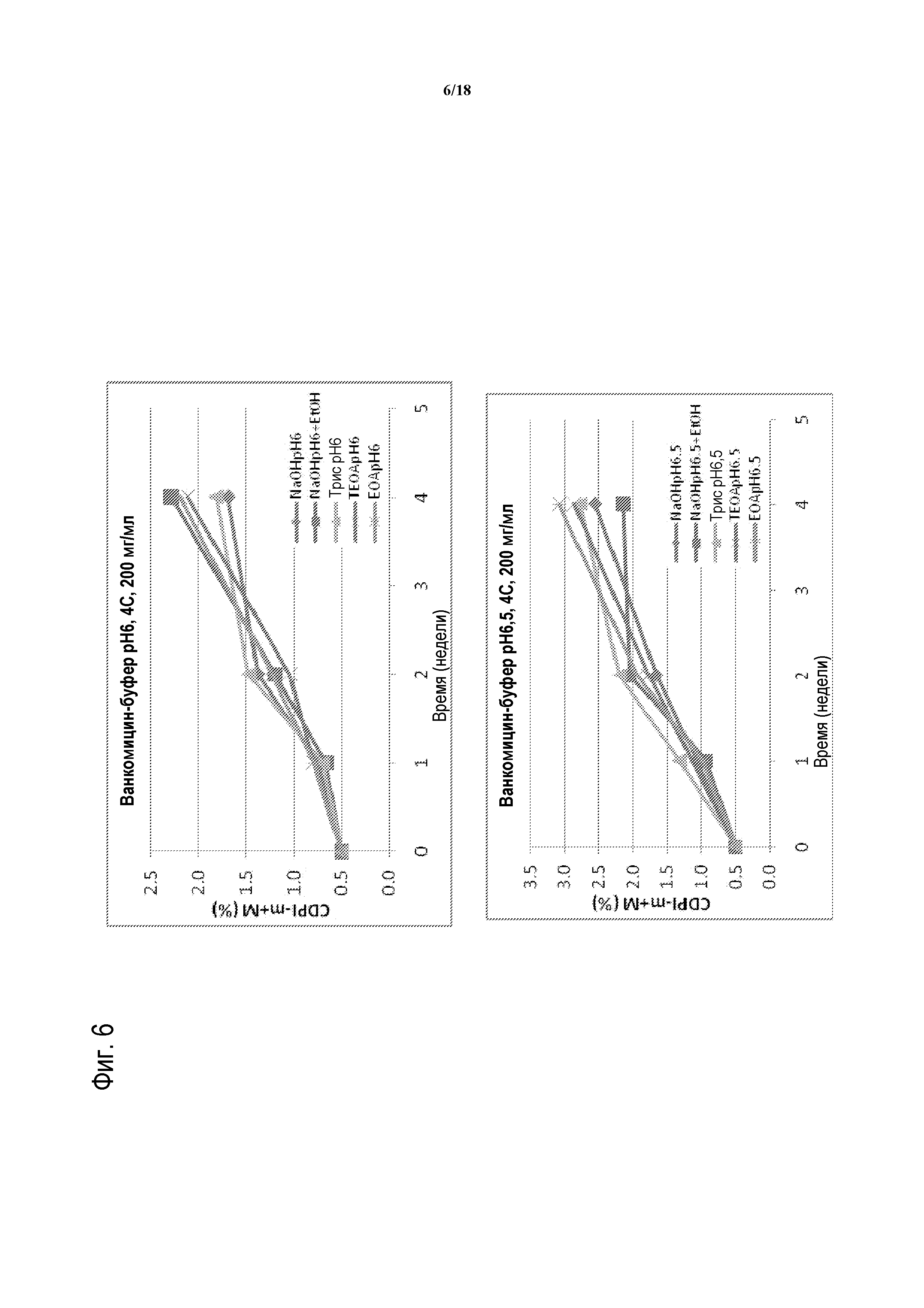
[00031] ФИГУРА 6 представляет собой график распада ванкомицина с течением времени в NaOH (ромбы); NaOH с EtOH (квадраты); Трис-основании (треугольные символы); триэтаноламине (TEOA; X); или этаноламине (EOA; звездочки) при 4°C и при pH 6 (верхняя панель) или pH 6,5 (нижняя панель).
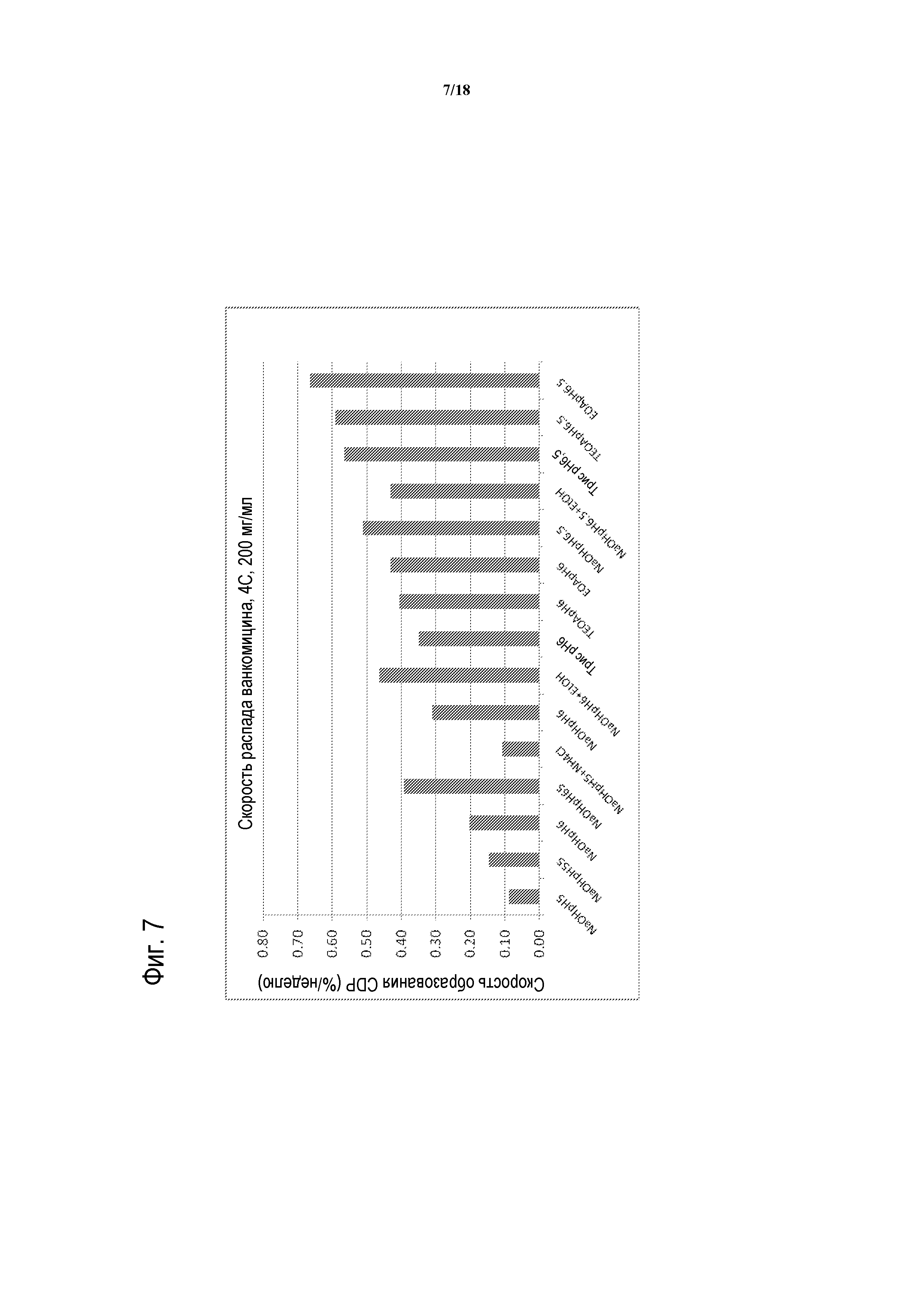
[00032] ФИГУРА 7 представляет собой столбчатую диаграмму скорости распада ванкомицина при 4°C в присутствии указанных органических буферов при указанных pH.
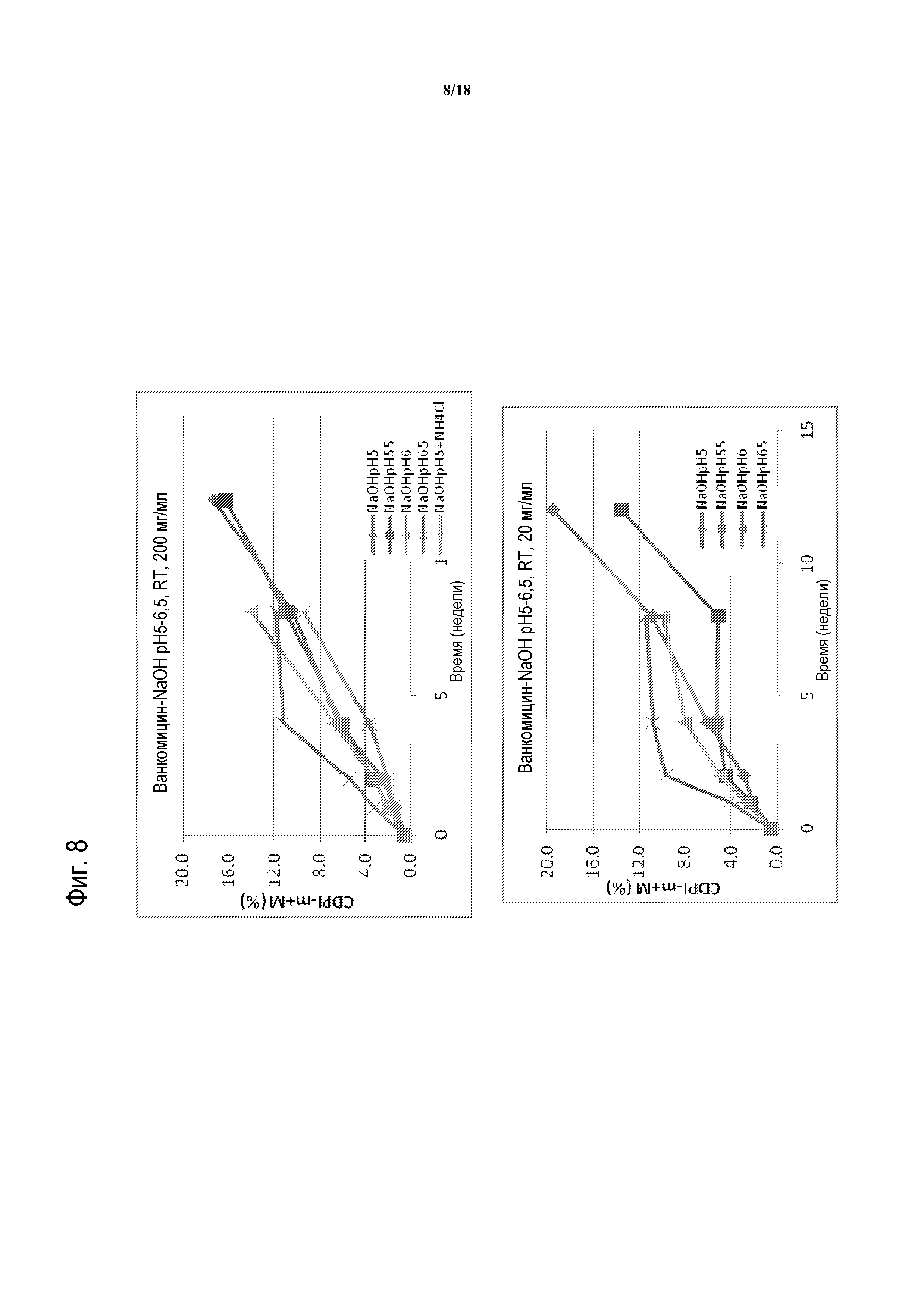
[00033] ФИГУРА 8 представляет собой график распада ванкомицина с течением времени при pH 5, 5,5, 6 или 6,5, при комнатной температуре (RT), и при концентрации 200 мг/мл (верхняя панель) или 20 мг/мл (нижняя панель).
[00034] ФИГУРА 9 представляет собой график распада ванкомицина с течением времени в присутствии NaOH (ромбы); NaOH с EtOH (квадраты); Трис-основании (треугольники); триэтаноламине (TEOA; X); или этаноламине (EOA; звездочки), при комнатной температуре (RT), и при pH 6 (верхняя панель) или pH 6,5 (нижняя панель).
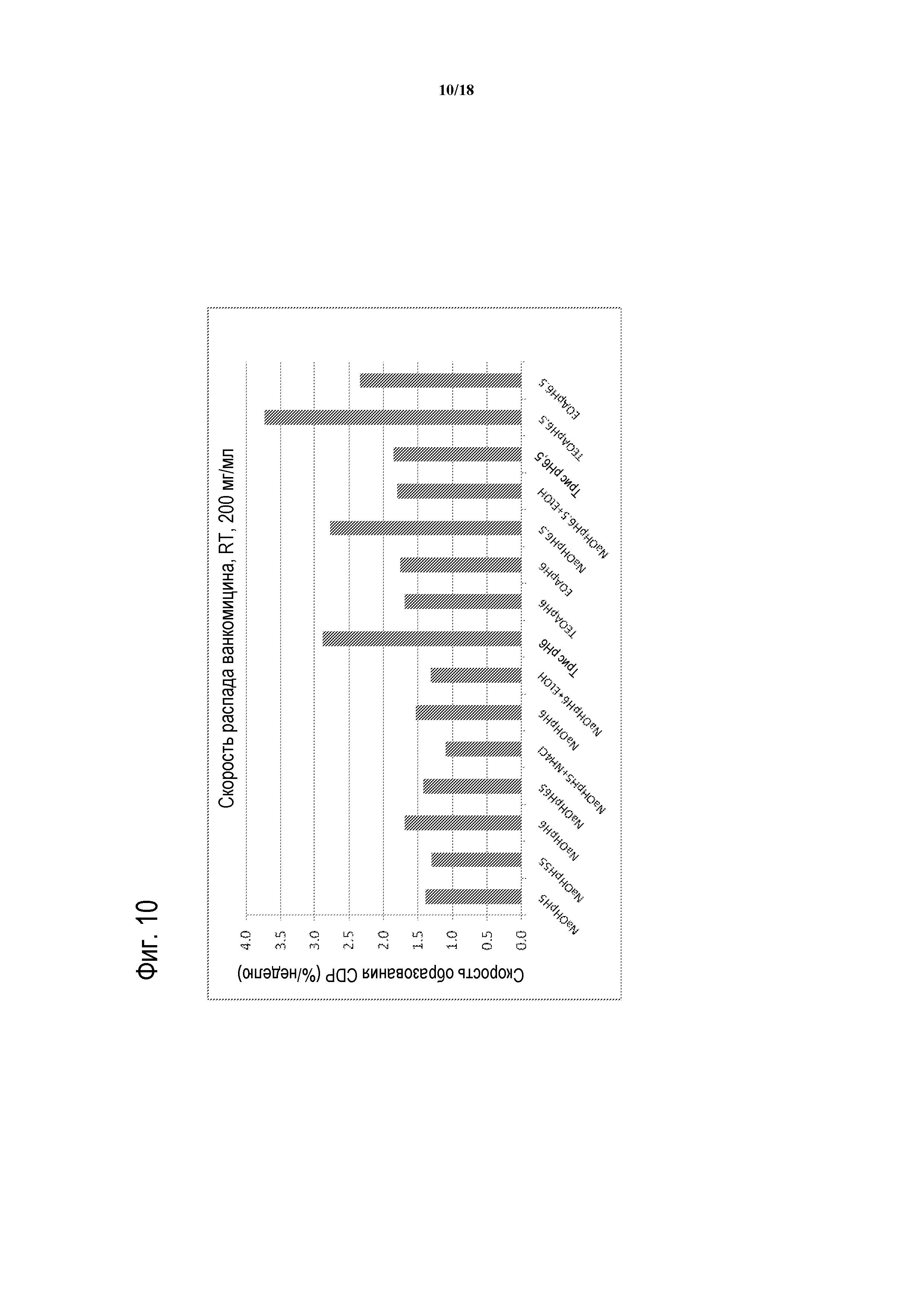
[00035] ФИГУРА 10 представляет собой график скорости распада ванкомицина при комнатной температуре (RT) в присутствии указанных органических буферов и при указанном pH.
[00036] ФИГУРА 11 представляет собой график распада ванкомицина с течением времени (верхняя панель) и скорости распада ванкомицина (нижняя панель) в композициях ванкомицина с указанной аминокислотой или ее производным при 4°C. Аминокислоты добавлены на основе моля на моль, если не указано иначе. На верхней панели, композиции ванкомицина содержат: контроль (только NaOH, pH 5, темные ромбы); bALA (темные квадраты); ALA (темные треугольники); GABA, pH5,5 (светлые круги); GLY (темная линия с символами X); D-ALA (темная линия с символами звездочек); 3-ABA (темные круги); GLU (темная линия с символами плюс); G-GLU (темная линия без символов); ASP (средняя линия без символов); D-ASP (светлые ромбы); бицин (светлые квадраты); трицин (светлые треугольники); саркозин (светлая линия с X); IDAA (светлая линия со звездочками); GLY-GLY (светлая линия с символами плюс); GLU, pH5 (соотношение GLU-ванкомицин 2:1, pH5; более светлая линия без символов); и GLU, pH5,5 (соотношение GLU-ванкомицин 2:1, pH5,5; наиболее светлая линия без символов).
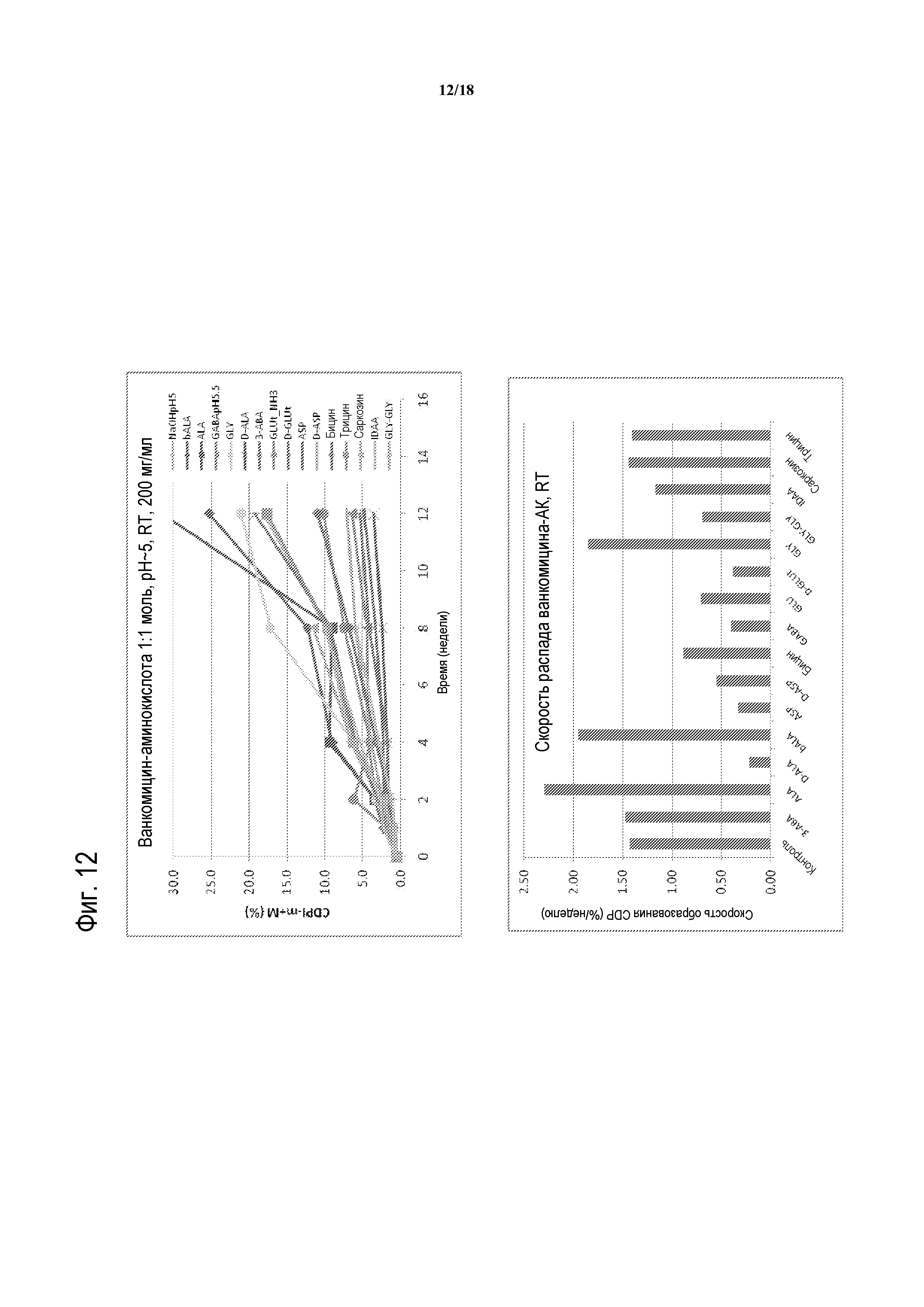
[00037] ФИГУРА 12 представляет собой график распада ванкомицина с течением времени (верхняя панель) и скорости распада ванкомицина (нижняя панель) в композициях ванкомицина с указанной аминокислотой или ее производным при RT. Аминокислоты добавлены на основе моля на моль, если не указано иначе. На верхней панели, композиции ванкомицина содержат: контроль (NaOH только, pH 5, светлая линия с символами плюс); bALA (темные ромбы); ALA (темные квадраты); GABA, pH5,5 (темные треугольники); GLY (светлые круги); D-ALA (темная линия с символами X); 3-ABA (темная линия с символами звездочек); GLUt (темные круги); G-GLUt (темная линия с символами плюс); ASP (темная линия без символов); D-ASP (средняя линия без символов); бицин (светлые ромбы); трицин (светлые кврадраты); саркозин (светлые треугольники); IDAA (светлая линия с символами звездочек); GLY-GLY (светлая линия с символами плюс); GLU pH5 (соотношение GLU-ванкомицин 2:1, pH5; светлая линия с символами X); и GLU pH5,5 (соотношение GLU-ванкомицин 2:1, pH5,5; светлая линия с символами звездочек).
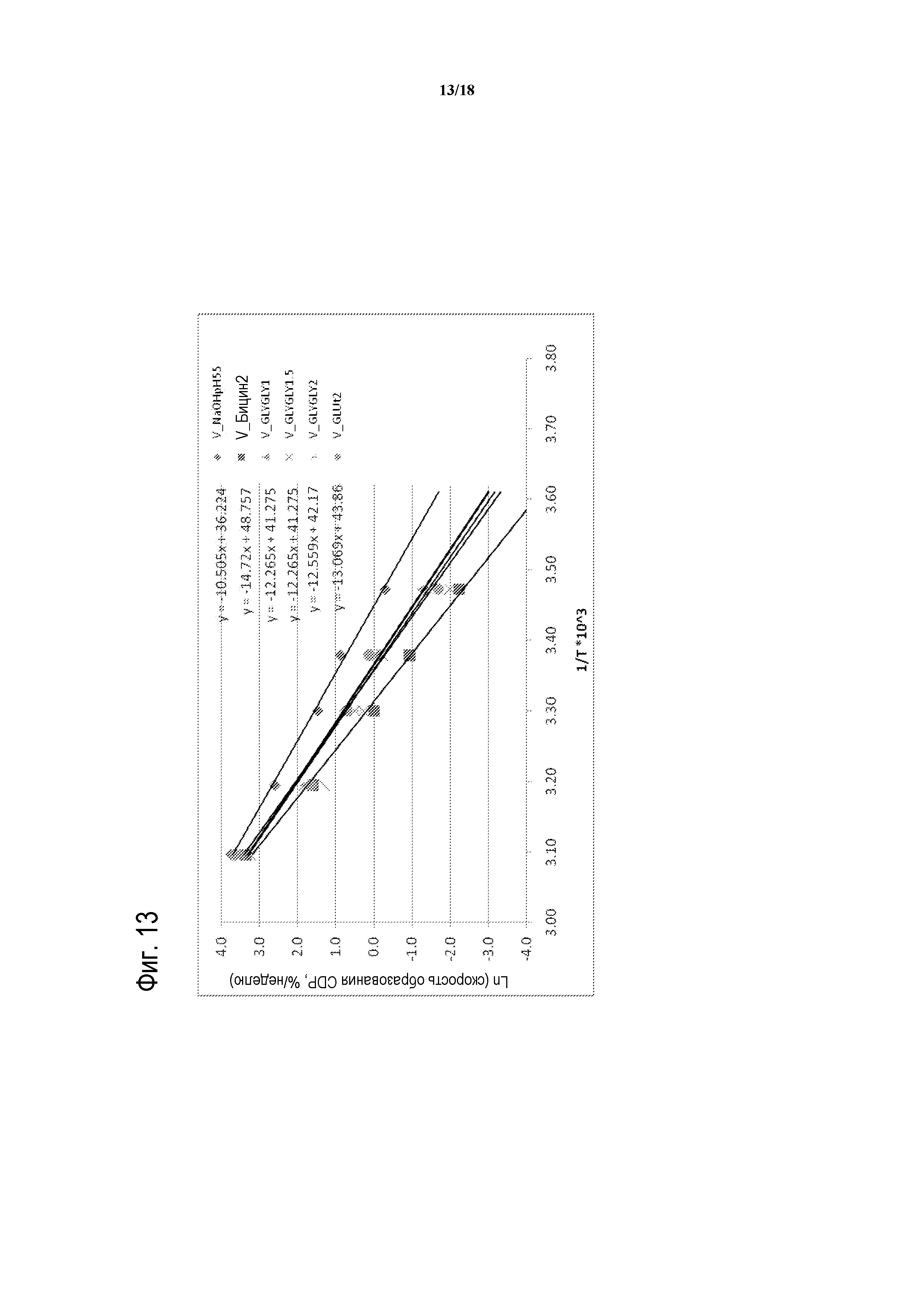
[00038] На ФИГУРЕ 13 показан график Аррениуса для скоростей распада ванкомицина на основе таблицы 14. Ванкомицин в NaOH при pH 5,5 (ромбы); бицин-ванкомицин в соотношении 2:1 (квадраты); GLY-GLY-ванкомицин в соотношении 1:1 (треугольники); GLY-GLY-ванкомицин в соотношении 1,5:1 (X); GLY-GLY-ванкомицин в соотношении 2:1 (звездочки); и GLU-ванкомицин в соотношении 2:1 (круги).
[00039] НА ФИГУРЕ 14 показана схема инфузии липосомного ванкомицина (способ инфузии с тремя потоками).
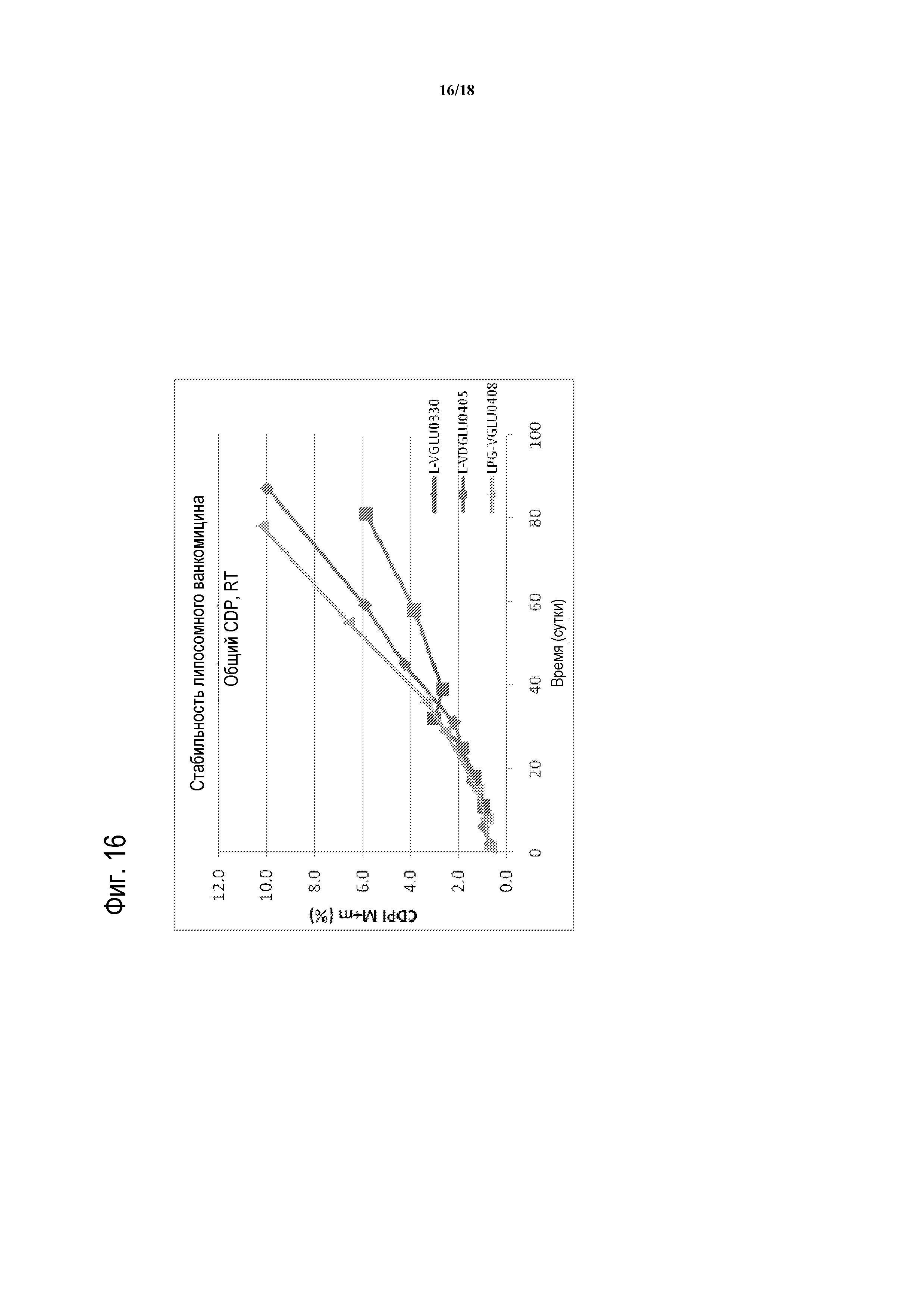
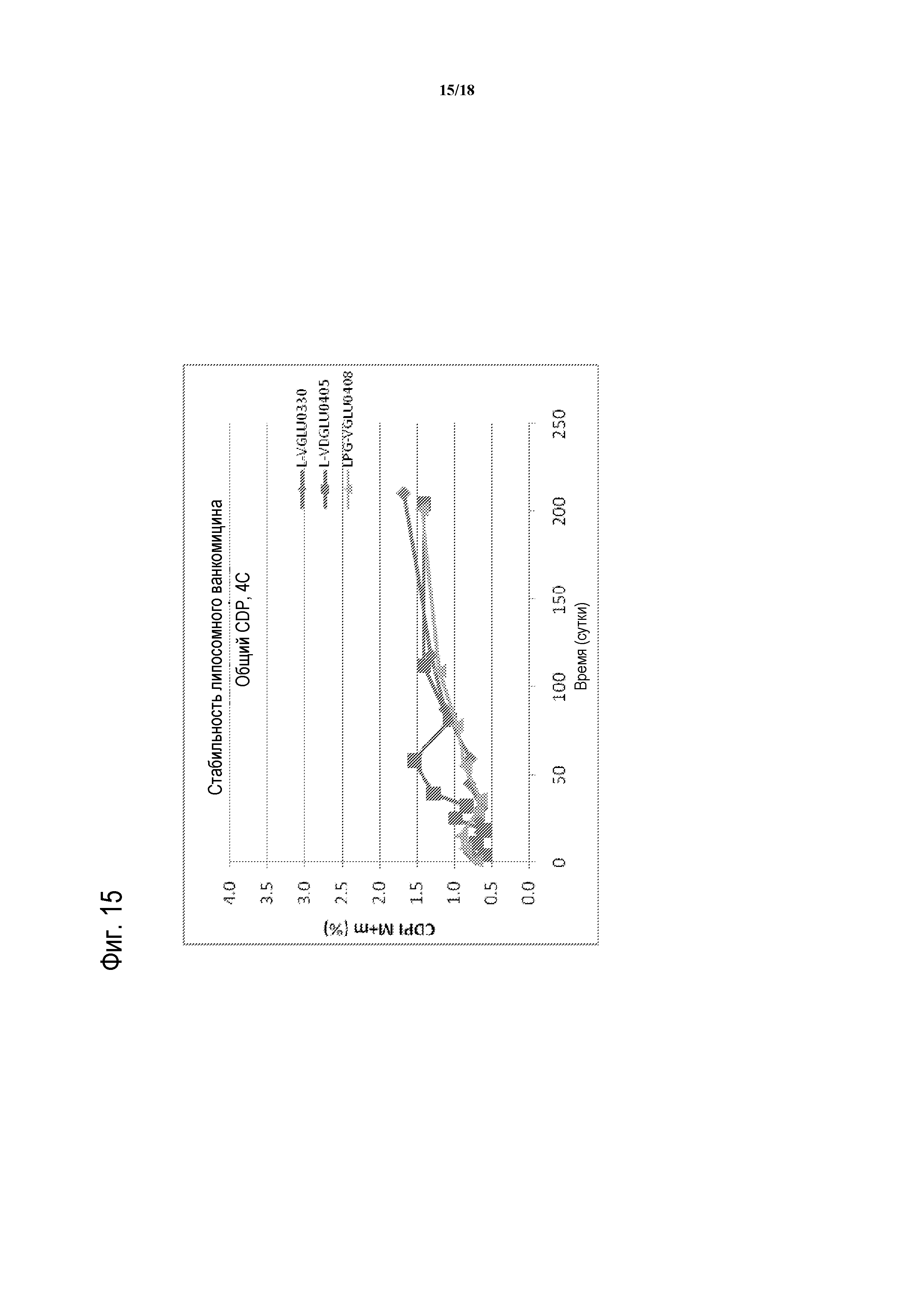
[00040] ФИГУРА 15 представляет собой график стабильности с течением времени для композиций липосомного ванкомицина-GLU при 4°C. Партии тестированных композиций липосомного ванкомицина представляют собой партии, показанные в таблице 15 (т.е., ромбы соответствуют L-VGLU0330, содержащей GLU и DPPC/холестерин; квадраты соответствуют L-VDGLU0405, содержащей D-GLU и DPPC/DPPG/холестерин; и треугольники соответствуют LPG-VGLU0408, содержащей GLU и DPPC/холестерин).
[00041] ФИГУРА 16 представляет собой график стабильности с течением времени для композиций липосомного ванкомицина-GLU при RT. Партии тестированных композиций липосомного ванкомицина представляют собой партии, показанные в таблице 15 (т.е., ромбы соответствуют L-VGLU0330, содержащей GLU и DPPC/холестерин; квадраты соответствуют L-VDGLU0405, содержащей D-GLU и DPPC/DPPG/холестерин; и треугольники соответствуют LPG-VGLU0408, содержащей GLU и DPPC/холестерин).
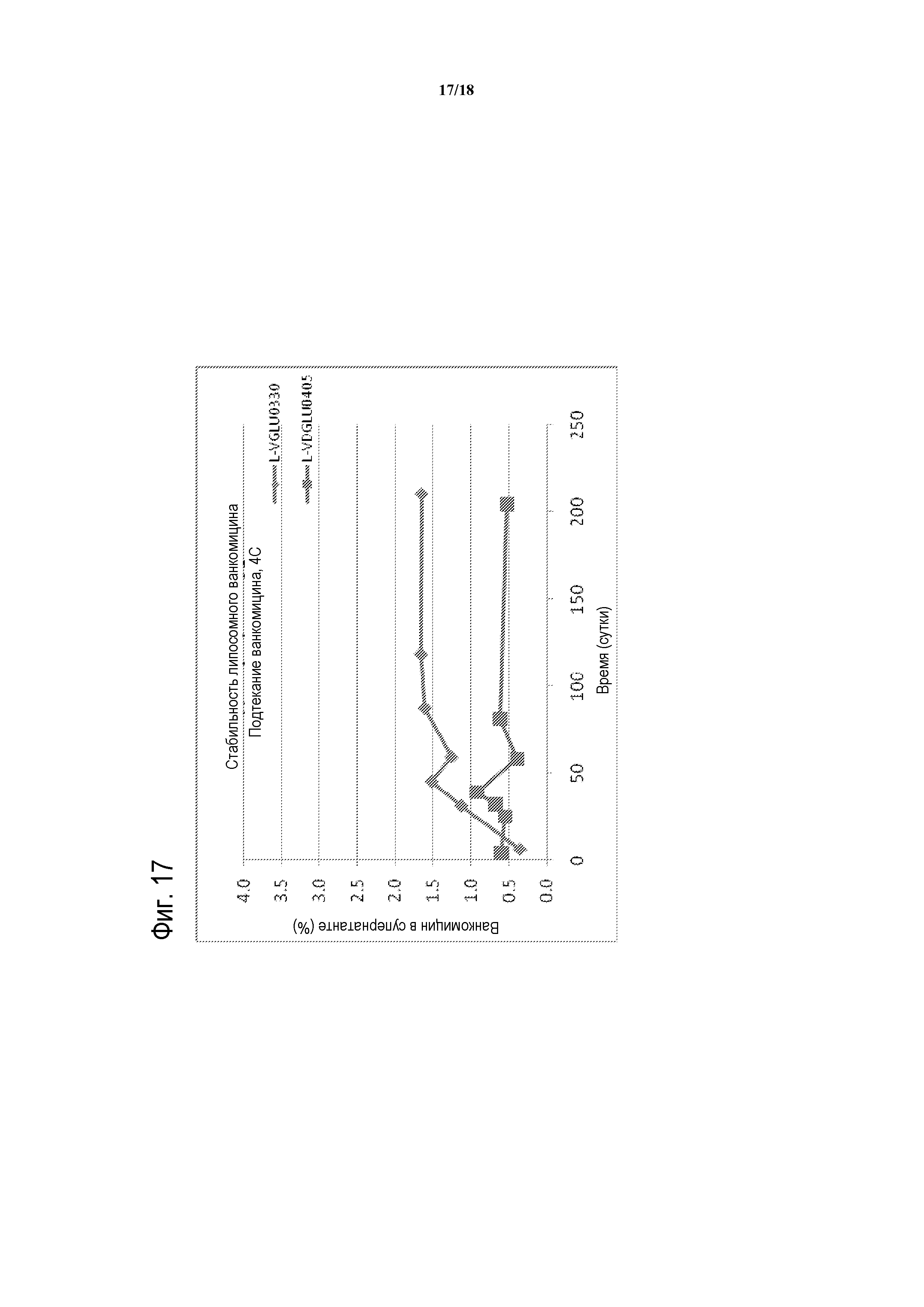
[00042] ФИГУРА 17 представляет собой график стабильности с течением времени для композиций липосомного ванкомицина-GLU при 4°C. Партии тестированных композиций липосомного ванкомицина представляют собой партии, показанные в таблице 15 (т.е., ромбы соответствуют L-VGLU0330, содержащей GLU и DPPC/холестерин; и квадраты соответствуют L-VDGLU0405, содержащей D-GLU и DPPC/DPPG/холестерин).
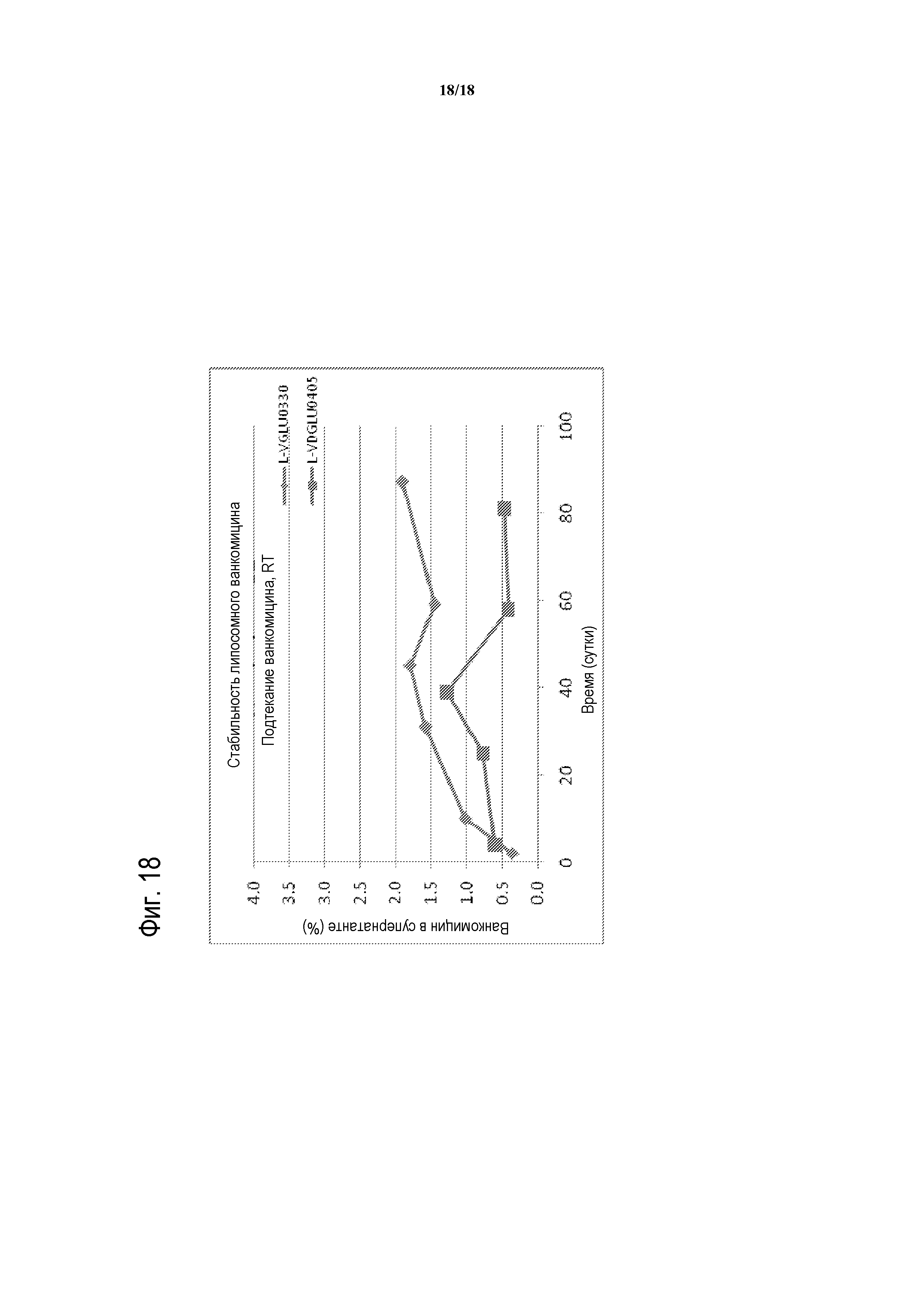
[00043] ФИГУРА 18 представляет собой график стабильности с течением времени для композиций липосомного ванкомицина-GLU при RT. Партии тестированных композиций липосомного ванкомицина представляют собой партии, показанные в таблице 15 (т.е., ромбы соответствуют L-VGLU0330, содержащей GLU и DPPC/холестерин; и квадраты соответствуют L-VDGLU0405, содержащей D-GLU и DPPC/DPPG/холестерин).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00044] Сокращения, применяемые в настоящем документе для аминокислот, представляют собой сокращения, которые являются общепринятыми: A=Ala=Аланин; R=Arg=Аргинин; N=Asn=Аспарагин; D=Asp=Аспарагиновая кислота; C=Cys=Цистеин; Q=Gln=Глутамин; E=Glu=Глутаминовая кислота; G=Gly=Глицин; H=His=Гистидин; I=Ile=Изoлейцин; L=Leu=Лейцин; K=Lys=Лизин; M=Met=Метионин; F=Phe=Фенилаланин; P=Pro=Пролин; S=Ser=Серин; T=Thr=Треонин; W=Trp=Триптофан; Y=Tyr=Тирозин; V=Val=Валин. Аминокислоты в композициях, представленных в настоящем документе, представляют собой L- или D-аминокислоты. В одном варианте осуществления синтетическую аминокислоту используют в композициях, представленных в настоящем документе. В одном варианте осуществления аминокислота увеличивает время полужизни, эффективность и/или биодоступность гликопептидного антибиотика в композиции. В следующем варианте осуществления гликопептидный антибиотик представляет собой ванкомицин.
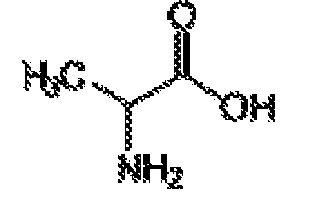
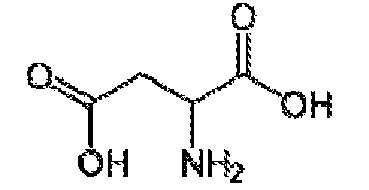
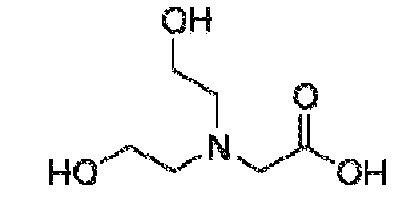
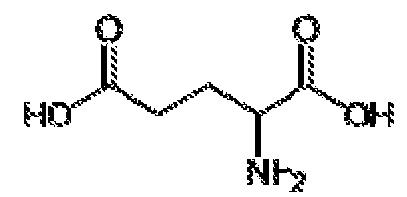
[00045] Термин «производное аминокислоты», как применяют в настоящем документе, относится к группе, обладающей как функциональной аминогруппой, любой из NH2, NHR, или NR2, так и функциональной группой карбоновой кислоты, любой из NH2, NHR или NR2, и функциональной группой карбоновой кислоты. Термин «аминокислоты» охватывает как природные, так и неприродные аминокислоты и может относится к альфа-аминокислотам, бета-аминокислотам или гамма-аминокислотам. Если не указано иначе, структура аминокислоты, на которую ссылаются в настоящем документе, может представлять собой любой возможный стереоизомер, например, D или L энантиомер. В некоторых вариантах осуществления, производные аминокислот представляют собой короткие пептиды, включая дипептиды и трипептиды. Иллюстративные аминокислоты и производные аминокислот, пригодные по изобретению, включают в себя аланин (ALA), D-аланин (D-ALA), аланин-аланин (ALA-ALA), бета-аланин (bALA), аланин-бета-аланин (ALA-bALA), 3-аминобутановую кислоту (3-ABA), гамма-аминомасляную кислоту (GABA), глутаминовую кислоту (GLU или GLUt), D-глутаминовую кислоту (D-GLU), глицин (GLY), глицилглицин (GLY-GLY), глицин-аланин (GLY-ALA), аланин-глицин (ALA-GLY), аспарагиновую кислоту (ASP), D-аспарагиновую кислоту (D-ASP), лизин-аланин-аланин (LYS-ALA-ALA), L-Лизин-D-аланин-D-аланин (L-LYS-D-ALA-D-ALA), бицин, трицин, саркозин и иминодиуксусную кислоту (IDAA). Аминокислоты и их производные можно синтезировать в соответствии с известными способами или можно закупать от поставщиков, например, Sigma-Aldrich (Milwaukee, WI).
[00046] Термин «введение» включает в себя введение in vivo, так же как введение непосредственно в ткань ex vivo. Как правило, композиции можно вводить системно перорально, трансбуккально, парентерально, местно, посредством ингаляции или инсуфляции (т.е., через рот или через нос) или ректально в единичных дозированных составах, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и связующие, как желательно, или можно вводить местно посредством таких способов, как, но без ограничения, инъекция, имплантация, трансплантация, местное введение или парентеральный способ.
[00047] В одном варианте осуществления композицию по изобретению вводят посредством ингаляции. В следующем варианте осуществления композицию по изобретению вводят посредством распыления, испарения, получения аэрозоля или ингаляции сухого порошка. «Ингалятор» или «генератор аэрозолей» в одном варианте осуществления, используют для введения композиций по настоящему изобретению нуждающемуся в этом пациенту. «Ингалятор» или «генератор аэрозолей» представляет собой устройство, которое может переводить жидкость в аэрозоль размера, с помощью которого можно осуществлять ингаляцию в дыхательные пути. Пневматические, ультразвуковые, электронные ингаляторы, например, ингаляторы с пассивным электронным ситом, ингаляторы с активным электронным ситом и ингаляторы с вибрирующим ситом являются пригодными для использования по изобретению, если конкретный ингалятор испускает аэрозоль с требуемыми свойствами и при требуемой интенсивности потока.
[00048] Способ пневматического перевода непрерывного объема жидкости в небольшие капли называют распылением. Действие пневматического ингалятора требует подачи сжатого газа в качестве движущей силы для распыления жидкости. В ультразвуковых распылителях используют электричество, подаваемое пьезоэлектрический элементом в резервуар для жидкости для перевода жидкости в пригодные для вдыхания капли. Различные типы ингаляторов описаны в Respiratory Care, Vol. 45, No. 6, pp. 609-622 (2000), полное содержание описания которого приведено в настоящем документе в качестве ссылки. Термины «ингалятор» или «генератор аэрозолей» используют взаимозаменяемо на протяжении описания. «Устройство для ингаляции», «система для ингаляции» и «распылитель» также используют в литературе взаимозаменяемо с терминами «ингалятор» и «генератор аэрозолей».
[00049] «Масс-медианный аэродинамический диаметр » или «MMAD» является нормализованным в отношении аэродинамического разделения капель водного аэрозоля, и его определяют посредством измерений импактором, например, Anderson Cascade Impactor (ACI) или Next Generation Impactor (NGI). Скорость потока газа, в одном варианте осуществления, составляет 28 литров в минуту по Anderson Cascade Impactor (ACI) и 15 литров в минуту по Next Generation Impactor (NGI). «Геометрическое стандартное отклонение» или «GSD» является мерой разброса распределения аэродинамических размеров частиц.
[00050] В одном варианте осуществления MMAD аэрозоля фармацевтической композиции составляет менее приблизительно 4,9 мкм, менее приблизительно 4,5 мкм, менее приблизительно 4,3 мкм, менее приблизительно 4,2 мкм, менее приблизительно 4,1 мкм, менее приблизительно 4,0 мкм или менее приблизительно 3,5 мкм, как измерено посредством ACI при скорости потока газа приблизительно 28 л/минуту, или посредством Next Generation Impactor (NGI) при скорости потока газа приблизительно 15 л/минуту.
[00051] В одном варианте осуществления MMAD аэрозоля фармацевтической композиции составляет от приблизительно 1,0 мкм до приблизительно 4,2 мкм, от приблизительно 3,2 мкм до приблизительно 4,2 мкм, от приблизительно 3,4 мкм до приблизительно 4,0 мкм, от приблизительно 3,5 мкм до приблизительно 4,0 мкм или от приблизительно 3,5 мкм до приблизительно 4,2 мкм, как измерено посредством ACI. В одном варианте осуществления MMAD аэрозоля фармацевтической композиции составляет от приблизительно 2,0 мкм до приблизительно 4,9 мкм, от приблизительно 4,4 мкм до приблизительно 4,9 мкм, от приблизительно 4,5 мкм до приблизительно 4,9 мкм, или от приблизительно 4,6 мкм до приблизительно 4,9 мкм, как измерено посредством NGI.
[00052] «Фракция тонкодисперсных частиц» или «FPF», как применяют в настоящем документе, относится к фракции аэрозоля, обладающей размером частиц менее 5 мкм в диаметре, как измерено способом каскадного импактора. FPF обычно выражают как процент.
[00053] В одном варианте осуществления, фракция тонкодисперсных частиц (FPF) композиции после распыления, т.е., переведенной в аэрозольное состояние фармацевтической композиции, составляет приблизительно 50% или приблизительно 55%, или приблизительно 60%, или приблизительно 65%, или приблизительно 70%, или приблизительно 75%, как измерено посредством NGI или ACI. В следующем варианте осуществления FPF аэрозоля превышает или равна приблизительно 64%, как измерено посредством ACI, превышает или равна приблизительно 70%, как измерено посредством ACI, превышает или равна приблизительно 51%, как измерено посредством NGI, или превышает или равна приблизительно 60%, как измерено посредством NGI.
[00054] В одном варианте осуществления FPF переведенной в аэрозольное состояние композиции превышает или равна 50%, превышает или равна 60%, превышает или равна 70%, превышает или равна 80%, превышает или равна 90%, превышает или равна 95%, превышает или равна 97,5%, или превышает или равна 99%, как измерено способом каскадного импактора. В следующем варианте осуществления, композиция содержит ванкомицин и липосомы.
[00055] Термины «носитель», «эксципиент» и «связующее» используют в настоящем документе взаимозаменяемо, и они относятся к материалам, пригодным для составления и введения фармацевтически приемлемых композиций, описанных в настоящем документе. Носители, пригодные в настоящем документе, включают в себя любые материалы, известные в данной области, которые являются нетоксичными, не взаимодействуют с другими компонентами, не вызывают значительного раздражения в организме и не подавляют биологическую активность и свойства соединения из композиции по описанному изобретению. Носители должны обладать достаточно высокой чистотой и достаточно низкой токсичностью для обеспечения их пригодности для введения млекопитающему, подвергаемому лечению. Термин «фармацевтически приемлемая соль» обозначает соли, которые, в пределах оценки с медицинской точки зрения, пригодны для использования в контакте с тканями человека и низших животных без неспецифической токсичности, раздражения, аллергического ответа и т.п., и соответствуют целесообразному соотношению польза/риск. Термин «коацервация» относится к разделению на две жидкие фазы в коллоидных системах. Фазу, более сконцентрированную в коллоидном компоненте (активное средство), обозначают в настоящем документе как «коацерват», и другая фаза представляет собой равновесный раствор. Образование коацервата приводит к более высоким концентрациям активного средства по сравнению с внешними концентрациями активного средства, и более низким соотношениям липида к лекарственному средству.
[00056] Термин «коллоидный» относится к тому, что является коллоидом или относится к коллоиду, или обладает свойствами коллоида, обозначая агрегаты атомов или молекул в тонкодисперсном (субмикроскопическом) состоянии, диспергированные в газообразной, жидкой или твердой среде, и устойчивые к осаждению, диффузии и фильтрации. Раствор макромолекул является простой и наиболее распространенной коллоидной системой. Малые молекулы также могут формировать ассоциированные коллоиды в форме обратимых агрегатов. Ассоциированный коллоид представляет собой обратимое химическое соединение, обусловленное силами слабого химического связывания , где вплоть до сотен молекул или ионов агрегируют с формированием коллоидных структур с размерами от приблизительно 1 до приблизительно 2000 нанометров или более.
[00057] Термин «эффективное количество» относится к количеству, необходимому или достаточному для реализации желательного биологического эффекта.
[00058] Термин «гидрофильный» относится к материалу или веществу, обладающему аффинностью для полярных веществ, таких как вода. Термин «липофильный» относится к предпочтению неполярного окружения или обладанию аффинности к неполярному окружению по сравнению с полярным или водным окружением.
[00059] Термин «растворитель», как применяют в настоящем документе, относится к веществу, способному растворять другое вещество («растворенное вещество») с формированием раствора.
[00060] «Инфузия растворителя» представляет собой способ, включающий в себя растворение одного или нескольких липидов в небольшом, минимальном, количестве совместимого со способом растворителя с формированием липидной суспензии или раствора, и затем добавление раствора в водную среду, содержащую биологически активные средства. Как правило, совместимый со способом растворитель представляет собой растворитель, который можно отмыть водным способом, таким как диализ. Композиция, которую подвергают циклическому охлаждению/нагреванию в одном варианте осуществления, получена посредством инфузии растворителя. В одном варианте осуществления растворитель представляет собой спирт. В следующем варианте осуществления спирт представляет собой этанол. «Инфузия этанола» представляет собой тип инфузии растворителя, и представляет собой способ, включающий в себя растворение одного или нескольких липидов в небольшом, минимальном, количестве этанола с формированием липидного раствора и затем добавления раствора в водную среду, содержащую биологически активные средства. «Небольшое» количество растворителя представляет собой количество, совместимое с формированием липосом или липидных комплексов в процессе инфузии. Термин «инфузия растворителя» включает в себя также способ поточной инфузии, где два потока компонентов состава смешивают непрерывно.
[00061] Термин «симптом», как применяют в настоящем документе, относится к феномену, который возникает из-за конкретного заболевания или нарушения и сопутствует конкретному заболеванию или нарушению, и служит его признаком.
[00062] Термин «терапевтический эффект» относится к последствию лечения, результаты которого считают желательными и обеспечивающими преимущество. Терапевтический эффект может включать в себя, напрямую или опосредованно, арест, уменьшение или прекращение проявления заболевания. Терапевтический эффект может также включать в себя, напрямую или опосредованно, арест, уменьшение или прекращение прогрессирования заболевания или состояния, или задержку рецидива заболевания или состояния.
[00063] Термин «лечить» или «лечение» включает в себя подавление, значительное ингибирование, замедление или обращение прогрессирования заболевания, состояния или нарушения, значительное облегчение клинических или эстетических симптомов состояния, по существу предотвращение появления клинических или эстетических симптомов заболевания, состояния или нарушения, и защиту от опасных или раздражающих симптомов. Термин «лечить» или «лечение», как применяют в настоящем документе, дополнительно относится к осуществлению одного или нескольких из следующего: (a) уменьшения тяжести нарушения; (b) ограничения развития симптомов, характерных для нарушения(нарушений), подвергаемого лечению; (c) ограничения ухудшения симптомов, характерных для нарушения(нарушений), подвергаемого лечению; (d) ограничение рецидивирования нарушения(нарушений) у пациентов, которые ранее страдали нарушением(нарушения); и (e) ограничение рецидивирования симптомов у пациентов, которые ранее обладали симптомами нарушения(нарушений).
[00064] Термин «минимальная ингибирующая концентрация» или «MIC», как применяют в настоящем документе, относится к наиболее низкой концентрации противомикробного средства, которая может ингибировать видимый рост микроорганизма после инкубации в течение ночи (этот период продлевают для таких организмов, как анаэробы, требующих продленной инкубации для роста). «MIC10», «MIC50» или «MIC90», как применяют в настоящем документе, относятся к концентрации противомикробного средства, которая может ингибировать рост микроорганизмов на 10%, 50% или 90%, соответственно. Когда не используют нижнего индекса, MIC, принимают, что то, что обсуждают, представляет собой MIC50. Диапазон концентраций антибиотика, используемый для определения MIC, является общепринятым как двойные стадии разведения выше и ниже 1 мг/мл, по необходимости (Andrews, J., J. Antimicrob. Chemother., 2001, 48, (Suppl.1), 5-16, полное содержание которого приведено в настоящем документе).
[00065] Один аспект изобретения относится к стабилизированной композиции гликопептидного антибиотика на основе липида, содержащей липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, где аминокислота или ее производное конъюгированы с гликопептидным антибиотиком. Конъюгация аминокислоты или ее производного с гликопептидным антибиотиком образует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В одном варианте осуществления комплекс гликопептидный антибиотик-аминокислота ассоциирован с липидом. Например, в одном варианте осуществления, липид является конъюгированным (например, связанным) с комплексом гликопептидный антибиотик-аминокислота. В одном варианте осуществления, комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом, например, где липид присутствует в форме липосомы.
[00066] Композиция, описанная в настоящем документе, в одном варианте осуществления содержит липосому, пролипосому, липидную коллоидную дисперсию, мицеллу, инвертированную мицеллу, дискоидную структуру или их комбинацию. В следующем варианте осуществления композиция содержит липосому. Гликопептидный антибиотик и аминокислота или ее производное, в одном варианте осуществления, образуют комплекс с липосомой или инкапсулированы липосомой.
[00067] «Инкапсулированный» и «инкапсуляция» используют для обозначения адсорбции активных средств на поверхности состава на основе липидов, ассоциации активных средств в промежуточной области бислоев или между двумя монослоями, захвата активных средств в пространстве между двумя бислоями или захвата активных средств в пространство, окруженное наиболее внутренним бислоем или монослоем.
[00068] Липиды, используемые в композициях по настоящему изобретению, могут представлять собой синтетические, полусинтетические или природные липиды, включая фосфолипиды, такие как фосфатидилглицерины (PG), фосфатидные кислоты (PA), фосфатидилхолины (PC), фосфатидилинозитолы (PI) и фосфатидилсерины (PS); жирные кислоты; соли аммония и жирных кислот; токоферолы; производные токоферола; стеролы; производные стерола; и глицериды. Жирные кислоты обладают углеродными цепями длиной от 12 до 26 атомов углерода, которые являются либо насыщенными, либо ненасыщенными. Липиды могут являться анионными, катионными или нейтральными, где нейтральные включают в себя как незаряженные липиды, так и цвиттерионные липиды. В соответствии с одним вариантом осуществления, липидный компонент является в основном свободном от анионных липидов. В соответствии с другим вариантом осуществления, липидный компонент содержит только нейтральные липиды. В соответствии с другим вариантом осуществления, липидный компонент является свободным от анионных липидов.
[00069] В соответствии с другим вариантом осуществления, липид в композиции содержит фосфолипид. Фосфолипиды состоят из сложноэфирных связей жирных кислот в положениях 2 и 3 глицерина, содержащих цепи из 12-26 атомов углерода, и различных концевых групп в положении 1 глицерина, включающих в себя холин, глицерин, инозитол, серин, этаноламин, так же как соответствующие фосфатидные кислоты. Цепи этих жирных кислот могут являться насыщенными или ненасыщенными, и фосфолипид может состоять из жирных кислот с различной длиной цепи и с различной степенью ненасыщенности.
[00070] Почти все встречающиеся в природе фосфолипиды построены из комбинаций аполярных групп и групп «остова»: группы глицерина (или другого полиола), замещенной одной или двумя ацильными или алкильными цепями или N-ацилированным сфингоидным основанием (т.е., церамидом). Как правило, гидроксильная группа в положении 3 глицерина эстерифицирована с фосфорной кислотой, в то время как гидроксильные группы в положениях 1 и 2 глицерина эстерифицированы с помощью жирных кислот с длинной цепью, придающих липидные характеристики фосфолипиду. Одну из оставшихся кислородных групп фосфорной кислоты можно эстерифицировать далее со множеством органических молекул, включая глицерин, холин, этаноламин, серин, и инозитол. Фосфатная группа вместе с присоединенным спиртом представляет концевую группу фосфолипида. Часть жирной кислоты фосфолипида является важной в том, что часть жирной кислоты может изменять характеристики фосфолипида. Жирные кислоты могут отличаться по длине их углеродных цепей (например, короткие, средние или длинные цепи) и уровню насыщения.
[00071] В одном варианте осуществления один или несколько фосфолипидов присутствуют в композиции по настоящему изобретению. Наиболее распространенным фосфолипидом у растений и животных является фосфатидилхолин (известный также как лецитин) и фосфатидилэтаноламин, которые составляют главную структурную часть большинства биологических мембран. В фосфатидилсерине группа фосфорной кислоты эстерифицирована с гидроксильной группой аминокислоты L-серина, в то время как, в фосфатидилинозитоле, группа фосфорной эстерифицирована с циклическим сахарным спиртом инозитолом. Другим типом фосфолипида, обнаруженного у человека, является фосфатидилглицерин, который представляет собой природный компонент легочного сурфактанта. В случае фосфатидилглицерина, спирт, который является эстерифицированным с группой фосфата, представляет собой глицерин вместо фосфорной кислоты (Vemuri, S. and Rhodes, C., 1995, Pharmaceutica Acta Helvetiae 70: 95-111).
[00072] Примеры фосфолипидов, которые можно использовать в композиции по настоящему изобретению, включают в себя, но без ограничения, фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилинозитол (PI), фосфатидилсерин (PS), фосфатидилэтаноламин (PE), фосфатидную кислоту (PA), фосфатидилхолин яйца (EPC), фосфатидилглицерин яйца (EPG), фосфатидилинозитол яйца (EPI), фосфатидилсерин яйца (EPS), фосфатидилэтаноламин (EPE), фосфатидную кислоту (EPA), фосфатидилхолин сои (SPC), фосфатидилглицерин сои (SPG), фосфатидилсерин сои (SPS), фосфатидилинозитол сои (SPI), фосфатидилэтаноламин сои (SPE), фосфатидную кислоту сои (SPA), гидрогенизированный фосфатидилхолин яйца (HEPC), гидрогенизированный фосфатидилглицерин яйца (HEPG), гидрогенизированный фосфатидилинозитол яйца (HEPI), гидрогенизированный фосфатидилсерин яйца (HEPS), гидрогенизированный фосфатидилэтаноламин (HEPE), гидрогенизированную фосфатидную кислоту (HEPA), гидрогенизированный фосфатидилхолин сои (HSPC), гидрогенизированный фосфатидилглицерин сои (HSPG), гидрогенизированный фосфатидилсерин сои (HSPS), гидрогенизированный фосфатидилинозитол сои (HSPI), гидрогенизированный фосфатидилэтаноламин сои (HSPE), гидрогенизированную фосфатидную кислоту сои (HSPA), дипальмитоилфосфатидилхолин (DPPC), димиристоилфосфатидилхолин (DMPC), димиристоилфосфатидилглицерин (DMPG), дипальмитоилфосфатидилглицерин (DPPG), дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилхолин (DOPC), диолеилфосфатидилэтаноламин (DOPE), пальмитоилстеароилфосфатидилхолин (PSPC), пальмитоилстеароилфосфатидилглицерин (PSPG), моноолеоилфосфатидилэтаноламин (MOPE), токоферол, гемисукцинат токоферола, сульфат холестерина, гемисукцинат холестерила, производные холестерина, соли аммония и жирных кислот, соли аммония и фосфолипидов, соли аммония и глицеридов, миристиламин, пальмитиламин, лауриламин, стеариламин, дилауроилэтилфосфохолин (DLEP), димиристоилэтилфосфохолин (DMEP), дипальмитоилэтилфосфохолин (DPEP) и дистеароилэтилфосфохолин (DSEP), хлорид N-(2,3-ди-(9-(Z)-октадеценилокси)-проп-1-ил-N,N,N-триметиламмония (DOTMA), 1,2-бис(олеоилокси)-3-(триметиламмонио)пропан (DOTAP), дистеароилфосфатидилглицерин (DSPG), димиристоилфосфатидиловую кислоту (DMPA), дипальмитоилфосфатидиловую кислоту (DPPA), дистеароилфосфатидиловую кислоту (DSPA), димиристоилфосфатидилинозитол (DMPI), дипальмитоилфосфатидилинозитол (DPPI), дистеароилфосфатидилинозитол (DSPI), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), дистеароилфосфатидилсерин (DSPS) или их смесь.
[00073] В одном варианте осуществления композиция содержит DPPC и/или DPPG.
[00074] В соответствии с другим вариантом осуществления, фосфолипид, используемый в композиции по настоящему изобретению, представляет собой смешанный фосфолипид, включая, но без ограничения, пальмитоилстеароилфосфатидилхолин (PSPC) и пальмитоилстеароилфосфатидилглицерин (PSPG)), триацилглицерин, диацилглицерин, церамид, сфингозин, сфингомиелин и одиночные ацилированные фосфолипиды, такие как моноолеоилфосфатидилэтаноламин (MOPE).
[00075] В одном варианте осуществления липидный компонент по настоящему изобретению содержит один или несколько стеролов. В следующем варианте осуществления, стерол представляет собой холестерин. Стеролы, из которых холестерин и его производные наиболее широко исследованы в системах млекопитающих, составляют компонент мембранных липидов, вместe с глицерофосфолипидами и сфингомиелинами (Bach et al., 2003, Biochem. Biophys. Acta., 1610: 187-197). Стероловые липиды подразделяют в первую очередь на основании биологической функции. Существует множество примеров уникальных стеролов из растительных, грибных и морских источников, обозначенных как отдельные подклассы стеролов. Их подразделяют на основании количества атомов углерода в каркасе сердцевины. C18 стеролы включают в себя семейство эстрогенов, в то время как C19 стеролы включают в себя андрогены, такие как тестостерон и андростерон. Подкласс C21, содержащий две боковых углеродных цепи в положении C17, включает в себя прогестогены, так же как глюкокортикоиды и минералокортикоиды. Секостеролы, включающие в себя различные формы витамина D, характеризуются расщеплением B-кольца структуры сердцевины, отсюда приставка «секо». Дополнительными классами внутри категории стеролов являются желчные кислоты, которые у млекопитающих представляют собой первичные производные холан-24-овой кислоты, синтезированной из холестерина в печени, и их конъюгаты (с серной кислотой, таурином, глицином, глюкуроновой кислотой и другие) (Fahy, E. et al., 2005, J. Lipid Res., 46:839-861). Полное содержание каждой из публикаций, на которые ссылаются в этом разделе, приведено в настоящем документе в качестве ссылки.
[00076] Как представлено в настоящем документе, в одном варианте осуществления липидный компонент по настоящему изобретению содержит холестерин. Холестерин обнаружен в мембранах у животных, и его использовали в получении липосом для улучшения характеристик бислоя липосом. Молекула холестерина ориентируется среди молекул фосфолипида с ее гидроксильной группой, направленной к водной фазе, трициклическим кольцом, расположенным в виде сэндвича между первыми несколькими атомами углерода жирных ацильных цепей, в углеводородной сердцевине бислоя (Vermuri, S. and Rhode, C., Pharmaceutica Acta Helvetiae, 1995, 70: 95-111). Холестерин улучшает текучесть бислойной мембраны, снижает проницаемость водорастворимых молекул через мембрану, и улучшает стабильность бислойной мембраны в присутствии биологических жидкостей, таких как кровь/плазма. Липосомы без холестерина проявляют тенденцию вступать в реакцию с белками крови, такими как альбумин, м-трансферрин и макроглобулин, что проявляет тенденцию дестабилизировать липосомы и уменьшать применимость липосом в качестве систем доставки лекарственных средств.
[00077] В соответствии с другим вариантом осуществления липидный компонент состоит в основном из фосфатидилхолина. В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из дипальмитоилфосфатидилхолина (DPPC). В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из пальмитоилолеоилфосфатидилхолина (POPC).
[00078] В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из фосфатидилглицерина. В соответствии с другим вариантом осуществления липидный компонент состоит в основном из 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоглицерина (POPG).
[00079] В соответствии с одним из вариантов осуществления, стабилизированный гликопептидный антибиотик захвачен липидным компонентом или образует с ним комплекс. В одном варианте осуществления, липидный компонент находится в форме липосомы. Липосомы представляют собой полностью закрытые липидные бислойные мембраны, содержащие захваченный водный объем. Опубликовано, что липосомы формируются спонтанно, когда фосфолипиды диспергируют в водной среде (Bangham et al., 1974, In Korn, E.D. ed., Methods in Membrane Biology, Vol. 1. Plenum Press, New York, pp. 1-68, полное содержание которого приведено в настоящем документе в качестве ссылки). Гидрофильное взаимодействие групп головок липидов с водой приводит к формированию везикул, состоящих из простых липидных бислоев, напоминающих биологические мембраны, в форме сферической оболочки. Липосомы могут представлять собой моноламеллярные везикулы (обладающие одним мембранным бислоем) или мультиламеллярные везикулы (подобные луковице структуры, характеризующиеся множеством мембранных бислоев, где каждый отделен от следующего водным слоем), или их комбинацию. Бислой состоит из двух липидных монослоев, обладающих областью гидрофобного «хвоста» и областью гидрофильной «головки». Структура мембранного бислоя является такой, что гидрофобные (неполярные) «хвосты» липидных моносолев ориентированы по направлению к центру бислоя, в то время как гидрофильные «головки» ориентированы по направлению к водной фазе.
[00080] В зависимости от способа получения, липосомы по изобретению широко меняются по размеру (например, 0,02-10 мкм) и по количеству слоев (т.е., количеству бислоев, присутствующих в липосоме). Как правило, липосомы классифицируют на три категории на основании их размера и ламеллярности: малые моноламеллярные везикулы (SUV), малые олиголамеллярные везикулы (OLV), большие моноламеллярные везикулы (LUV), и мультиламеллярные везикулы (MLV). Более подробная классификация на основании структуры показана в таблице 1. (Smad, A. et al., Current Drug Delivery, 2007, 4: 297-305, полное содержание которого приведено в настоящем документе в качестве ссылки).
[00081] В соответствии с одним из вариантов осуществления, фармацевтическая композиция содержит липосому или множество липосом. Гликопептидный антибиотик и аминокислота (или ее производное) захвачены липосомой (или множеством липосом), формируют комплекс с липосомой (или множеством липосом), например, комплекс с бислоем липосомы, или представляют собой комбинацию захваченных и образовавших комплекс.
[00082] В одном варианте осуществления, липосома представляет собой моноламеллярную везикулу (UV). В соответствии с дополнительным вариантом осуществления, липосома представляет собой малую моноламеллярную везикулу (SUV), среднюю моноламеллярную везикулу (MUV), большую моноламеллярную везикулу (LUV) или гигантскую моноламеллярную везикулу (GUV). В соответствии с другим вариантом осуществления, липосома представляет собой олиголамеллярную везикулу (OV). В соответствии с другим вариантом осуществления, множество липосом содержит липосомы, представляющие собой мультиламеллярные везикулы (MV) и моноламеллярные везикулы. В соответствии с другим вариантом осуществления, липосома содержит мультиламеллярную везикулу (MV).
|
[00083] В соответствии с одним из вариантов осуществления, липосома обладает средним размером частиц от приблизительно 0,05 до приблизительно 10 микрон, от 0,05 до приблизительно 1 микрон, от 0,05 до приблизительно 0,5 микрон, от приблизительно 0,1 до приблизительно 5,0 микрон, от приблизительно 0,1 до приблизительно 3,0 микрон, от приблизительно 0,1 до приблизительно 2,0 микрон, от приблизительно 0,1 до приблизительно 1,0 микрон, от приблизительно 0,1 до приблизительно 0,5 микрон, от приблизительно 0,1 до приблизительно 0,4 микрон, от приблизительно 0,1 до приблизительно 0,3 микрон, или от приблизительно 0,1 до приблизительно 0,2 микрон. В другом варианте осуществления, средний размер частиц липосомы составляет приблизительно 1,0 микрон или менее, приблизительно 0,9 микрон или менее, приблизительно 0,8 микрон или менее, приблизительно 0,7 микрон или менее, приблизительно 0,6 микрон или менее, приблизительно 0,5 микрон или менее, приблизительно 0,4 микрон или менее, приблизительно 0,3 микрон или менее, или приблизительно 0,2 микрон или менее.
[00084] В соответствии с одним из вариантов осуществления, липидный компонент по настоящему изобретению существует в форме мицеллы или множества мицелл. Многие поверхностно-активные вещества могут собираться в основном объеме раствора в агрегаты или мицеллы. Концентрация, при которой поверхностно-активные вещества начинают формировать мицеллы, известна как «критическая концентрация мицеллообразования» («CMC»). Липид в композициях, представленных в настоящем документе, в одном варианте осуществления, представляет собой поверхностно-активное вещество с необычайно низкой CMC.
[00085] В соответствии с другим вариантом осуществления, стабилизированный гликопептидный антибиотик захвачен липидным клатратом. Липидный клатрат представляет собой трехмерную, подобную решетке структуру с использованием одного или нескольких липидов, где структура захватывает биологически активное средство. Такие клатраты включены в объем настоящего изобретения.
[00086] В соответствии с другим вариантом осуществления, стабилизированный гликопептидный антибиотик захвачен пролипосомой или множеством пролипосом. Пролипосомы представляют собой составы, которые могут становиться липосомами или липидными комплексами после вступления в контакт с водной жидкостью, и включают в себя, например, сухие порошки. Встряхивание или другое смешивание может являться необходимым. Такие пролипосомы включены в объем настоящего изобретения.
[00087] Известно, что на распределение в тканях и кинетику выведения содержащих лекарственное средство липосом влияет состав липидов и поверхностный заряд (Juliano and Stamp, Biochem. Biophys. Res. Commun., 1975, 63: 651, полное содержание которого приведено в настоящем документе в качестве ссылки). Существует ряд синтетических фосфолипидов, доступных и используемых в получении липосом. Ганглиозиды, класс сфинголипидов, иногда включают в составы липосом для обеспечения слоя групп с поверхностным зарядом, которые обеспечивают более длительную циркуляцию липосом в кровотоке. Такие составы липосом, содержащие сфинголипиды, включены в объем настоящего изобретения.
[00088] Композиция по настоящему изобретению включает один или несколько гликопептидных антибиотиков. Гликопептидные антибиотики, включая ванкомицин и тейкопланин, представляют собой большие, жесткие молекулы, ингибирующие позднюю стадию синтеза пептидогликана в клеточной стенке бактерий. Гликопептиды характеризуются полициклической пептидной сердцевиной, содержащей шесть пептидных связей, неканоническую группу трифенилового эфира и сахара, присоединенные в различных участках. Опубликовано более 30 антибиотиков, обозначенных как принадлежащие к классу гликопептидов. Среди гликопептидов, ванкомицин и тейкопланин широко используют и рекомендуют для лечения тяжелых инфекций, особенно инфекций, вызванных грамположительными патогенами с множественной лекарственной устойчивостью. Гликопептид авопарцин вводили в качестве стимулятора роста в животноводстве в прошлом, и он является основным источником устойчивости к ванкомицину типа VanA у энтерококков. Для полусинтетических производных ванкомицина и тейкопланина, липогликопептидов, показан расширенный спектр активности против бактерий с множественной устойчивостью и частичной устойчивостью к ванкомицину (Reynolds P., Eur. J. Clin Microbiol Infect Dis, 1989, 8: 943-950; Renolds, 1989; Nordmann et al., Curr. Opin. Microbiol., 2007, 10: 436-440). Полное содержание каждой из публикаций, на которую ссылаются в этом разделе, приведено в настоящем документе в качестве ссылки.
[00089] Гликопептидные антибиотики являются активными против грамположительных организмов и небольшого количества анаэробов. Основными показаниями для гликопептиднных антибиотиков являются инфекции, вызванные продуцирующим бета-лактамазу Staphylococcus aureus (для которых устойчивые к бета-лактамазе пенициллины, цефалоспорины и комбинации пенициллинов с ингибиторами бета-лактамаз обеспечивают более безопасные альтернативы), и колит, вызванный Colstridium difficile. Появление и быстрое распространение устойчивых к метициллину штаммов S. aureus (MRSA), которые являлись устойчивыми не только ко всем бета-лактамам, но также к основным классам антибиотиков, обновило интерес к ванкомицину и продвинуло тейкопланин, другой природный гликопептид, на рынок. Тейкопланин является сравнимым с ванкомицином в отношении активности, но предоставляет фармакокинетические преимущества, такие как продленное время полужизни, позволяя ежесуточное введение (van Bambeke F., Curr. Opin. Pharm., 4(5):471-478).
[00090] До 1984 г. класс гликопептидов включал в себя несколько членов помимо ванкомицина, тейкопланина, ристоцетина и авопарцина. Благодаря угрозе, представляемой устойчивостью к антибиотикам, класс расширился до включения тысяч природных и полусинтетических соединений. Структурные исследования этих соединений прояснили биологический механизм действия и служили основанием для обоснованных предсказаний относительно взаимосвязей структура-активность.
[00091] Определены структуры сотен природных и полусинтетических гликопептидов. Эти структуры являются близко родственными и попадают в пять структурных подтипов, I-V. Из различных структурных подтипов, структуры типа I содержат алифатические цепи, в то время как типы II, III и IV включают в себя ароматические боковые цепи внутри этих аминокислот. В отличие от типов I и II, типы III и IV содержат дополнительную кольцевую систему F-O-G. Соединения типа IV обладают, кроме того, длинной цепью жирной кислоты, присоединенной к группе сахара. Структуры типа V, такие как комплестатин, хлорпептин I и кистаминцин A и B, содержат характерную группу триптофана, связанную с центральной аминокислотой. Структуры подтипов известны в данной области и описаны в Nicolaou et al. (Angew. Chem. Int. Ed., 1999, 38: 2096-2152, полное содержание которого приведено в настоящем документе в качестве ссылки), полное содержание которого приведено в настоящем документе в качестве ссылки. Соединения каждого из структурных подтипов, упомянутых выше, можно использовать в композициях, описанных в настоящем документе.
[00092] Биохимические исследования механизма действия гликопептидных антибиотиков показывают, что эти вещества ингибируют синтез пептидогликана клеточной стенки. Обработка интактных бактерий ванкомицином в концентрациях, близких к минимальным ингибирующим концентрациям (MIC), приводила к накоплению локализованных в цитоплазме предшественников стенки (Reynolds et al., Biochimica et Biophysica Acta, 1961, 52: 403 -405; Jordan. Biochemical and Biophysical Research Communications, 1961, 6: 167-170), что позволяет предполагать, что гликопептиды мешают поздней стадии сборки пептидогликана. Ванкомицин и другие гликопептиды не могут проникать через цитоплазматическую мембрану (Perkins et al., Biochemical Journal, 1970, 116: 83-92) и таким образом, критическая реакция трансгликозилирования является первой, подлежащей ингибированию (Jordan and Reynolds: Vancomycin. In: Corcoran, J. W., Hahn, F. E. (ed.): Antibiotics, volume III. Mechanism of action of antimicrobial and antitumor agents. Springer-Verlag, Berlin, 1974, 704-718.). Ингибирование этой реакции приводит к накоплению липидных промежуточных соединений в пути биосинтеза и UDP-MurNAc-пентапептида в цитоплазме. Полное содержание каждой из публикаций, на которую ссылаются в этом разделе, приведено в настоящем документе в качестве ссылки.
[00093] Гликопептидные антибиотики проявляют тенденцию являться нестабильными в растворе, что приводит к потере активности. Стабильность гликопептидов можно усиливать с использованием одного из двух пептидов Ac-D-Ala-D-Ala и Di-Ac-L-Lys-D-Ala-D-Ala (Harris et al., 1985, J. Antibiot, 38(1):51-7, полное содержание которого приведено в настоящем документе в качестве ссылки). Однако, существует необходимость большего улучшения стабильности гликопептидных антибиотиков, предпочтительно, экономически эффективным способом. Неожиданно, композиции по настоящему изобретению, содержащие гликопептидный антибиотик, аминокислоту или ее производное и липидный компонент, обладают превосходной стабильностью по сравнению с композициями гликопептидных антибиотиков, которые не основаны на липидах и/или не содержат аминокислоту или ее производное.
[00094] Репрезентативные номера гликопептидов, которые можно использовать в композициях по настоящему изобретению, представлены в таблице 2. Комплексы антибиотиков перечислены в алфавитном порядке вместе с типом структуры и продуцирующим организмом. Эти метаболиты выработаны различными типами актиномицетов в диапазоне от наиболее распространенных видов Streptomyces до относительно редких родов Streptosporangium и Saccharomonospora. Наименее распространенные Actionplanes и Amycolatopsis лежат в основе почти половины из продуцирующих организмов (Nagarajan, R., Glycopeotide Antibiotics, CRC Press, 1994, полное содержание которого приведено в настоящем документе в качестве ссылки).
|
[00095] В соответствии с другим вариантом осуществления, гликопептидный антибиотик, используемый в композиции по настоящему изобретению, включает в себя, но без ограничения, A477, A35512, A40926, A41030, A42867, A47934, A80407, A82846, A83850, A84575, AB-65, актапланин, актиноидин, ардацин, авопарцин, азуреомицин, хлорориентицин хлорполиспорин, декапланин, N-деметилванкомицин, эремомицин, галакардин, хелвекардин, изупептин, кибделин, LL-AM374, маннопептин, MM45289, MM47761, MM47766, MM55266, MM55270, OA-7653, ориентицин, парводицин, ристоцетин, ристомицин, синмоницин, тейкопланин, UK-68597, UK-69542, UK-72051, ванкомицин и их смесь.
[00096] В соответствии с одним из вариантов осуществления, гликопептидный антибиотик по настоящему изобретению представляет собой ванкомицин. Ванкомицин представляет собой водорастворимый амфотерный гликопептидный бактерицидный антибиотик, который ингибирует биосинтез мукопептида грамположительных бактерий. Он состоит из структуры трициклической нерибосомальной гептапептидной сердцевины, к которой присоединено дисахаридное звено, состоящее из аминодезоксисахара, ванкозамина, и D-глюкозы (фигура 1). Этот природный антибиотик ~1450 Дальтон получают из Streptomyces orientalis (известный также как; Nocardia orientalis или Amycolatopsis orientalis). Ванкомицин обладает одной карбоксильной группой с pKa 2,18, и двумя аминогруппами: первичным амином с pKa 7,75 и вторичным амином с pKa 8,89. При pH ниже физиологического ванкомицин обладает суммарным положительным зарядом.
[00097] Хотя опубликовано, что ванкомицин является бактерицидным, не обязательно возникает случай, когда бактерии уничтожаются. Без желания быть связанными с теорией, вместо этого предотвращают рост бактерий посредством насыщения доступных точек роста пептидогликана. На нековалентный характер связывания ванкомицина с важными участками указывает простота, с которой можно обращать ингибирование либо роста бактерий, либо синтеза пептидогликана. Такого обращения достигают добавлением в среду для роста или для инкубации пригодного пептида, который эффективно конкурирует с природными пептидами стенки в точках роста за доступный гликопептид (Nieto, M. et al., Biochemical Journal, 1972, 126: 139-149, содержание которого приведено в качестве ссылки).
[00098] Исследования показали, что ванкомицин обратимо связывается с фрагментом L-Lys-D-Ala-D-Ala пептидогликановго мономера. Это обратимое, нековалентное взаимодействие ингибирует прохождение трансгликозидирования и транспептидации. Ингибирование этих процессов приводит к резкому уменьшению количества пептидогликана посредством окончательного сдвига динамического равновесия в сторону разборки, что ускоряет лизис клеток и гибель бактерий.
[00099] Сильное связывание ванкомицина с L-Lys-D-Ala-D-Ala является последствием пяти четко выраженных водородных связей. В грамположительных бактериях, гликопептидные антибиотики легко диффундируют через пептидогликановый слой и достигают периплазматического пространства, где имеет место полимеризация пептидогликана. Посредством захвата в хвосты L-Lys-D-Ala-D-Ala мономеров, антибиотик располагается для ингибирования присоединения углевода трансгликозидазой.
[000100] Из-за характера способа изготовления ванкомицина, неочищенный материал обычно содержит ряд примесей. Кроме того, ванкомицин является не очень стабильным в растворе и деградирует до нескольких продуктов, известных как продукты распада. Считают, что основным продуктом распада ванкомицина является кристаллический продукт распада один (CDP-I), и он возникает в результате дезамидирования остатка аспарагина. Структурные изменения в ходе распада ванкомицина до CDP-I показаны на фигуре 2. CDP-I обладает ограниченной растворимостью в воде и существует в двух изомерных формах, часто обозначаемых как CDP-I-m (минорный) и CDP-I-M (мажорный). Они представляют собой атропизомеры, включающие в себя различные ориентации замещенного ароматического кольца остатка 2 CI. Считают, что порядок образования CDP представляет собой: ванкомицин → сукцинимидное промежуточное соединение → CDP-I-m → CDP-I-M (Harris, C. et al., 1983, Journal of the American Chemical Society, 105 (23):6915-6922, содержание которого приведено в настоящем документе в качестве ссылки). При равновесии, соотношение двух форм в растворе составляет приблизительно 1:2, и время установления равновесия составляет 24 часа при pH 6,5 при 25°C. CDP-I можно далее переводить в кристаллический гидрохлорид CDP-II посредством инкубации с 0,6 Н HCl (Marshall, 1965, J. Med Chem, 8:18-22, полное содержание которого приведено в настоящем документе в качестве ссылки). CDP-II, по-видимому не образуется в поддающихся измерению количествах в нормальных условиях.
[000101] В соответствии с одним из вариантов осуществления, гликопептидный антибиотик по настоящему изобретению представляет собой оритаванцин (LY333328). Оритаванцин получают посредством восстановительного алкилирования с помощью 4’-хлорбифенилкарбоксальдегида природного гликопептида хлорэремомицина, который отличается от ванкомицина добавлением сахара 4-эпиванкозамина и заменой ванкозамина на 4-эпиванкозамин (Cooper, R. et al., J Antibiot (Tokyo) 1996, 49:575-581, полное содержание которого приведено в настоящем документе в качестве ссылки). Структура оритаванцина показана на фигуре 3. Хотя оритаванцин представляет общий спектр активности, сравнимый с активностью ванкомицина, он предоставляет значительные преимущества в отношении собственной активности (особенно против стрептококков) и остается нечувствительным к механизмам устойчивости, развитых стафилококками и энтерококками. Поскольку аффинность связывания ванкомицина и оритаванцина со свободным D-Ala-D-Ala и D-Ala-D-Lac обладают одинаковым порядком величины, различия в их активности приписывают кооперативным взаимодействиям, которые могут возникать между лекарственным средством и обоими типами предшественников in situ. Предшествующее исследование позволяет предполагать, что эффект, возможно, вызван более сильной способностью к димеризации и заякориванию в цитозольной мембране боковой цепи хлорбифенила (Allen, et al., FEMS Microbiol Rev, 2003, 26:511-532, содержание которого приведено в настоящем документе в качестве ссылки).
[000102] Эффективность оритаванцина показана в моделях менингита на животных, вызванного пневмококками, чувствительными или устойчивыми к β-лактамам (даже несмотря на то, что их концентрация в спинномозговой жидкости составляет только 5% от уровня в сыворотке) (Gerber et al., Antimicrob Agents Chemother, 2001, 45:2169-2172, полное содержание которого приведено в настоящем документе в качестве ссылки; Cabellos et al., Antimicrob Agents Chemother, 2003, 47:1907-1911, полное содержание которого приведено в настоящем документе в качестве ссылки); в моделях ассоциированной с центральным венозным катетером инфекции устойчивым к ванкомицину Enterococcus faecium (Rupp et al., J Antimicrob Chemother 2001, 47:705-707, полное содержание которого приведено в настоящем документе в качестве ссылки); и в моделях эндокардита, вызванного чувствительным или устойчивым к ванкомицину Enterococcus faecalis (Lefort et al., Antimicrob Agents Chemother, 2000, 44:3017-3021, полное содержание которого приведено в настоящем документе в качестве ссылки). Исследования фармакодинамики в модели нейтропении на бедре мыши при инфекции S. aureus позволили предполагать, что параметром, лучше всего предсказывающим эффективность оритаванцина, является соотношение между свободной Cмакс концентрацией и минимальной ингибирующей концентрацией (MIC) для провоцирующего организма (свободная Cмакс/MIC) (Boylan, C. et al., Antimicrob Agents Chemother, 2003, 47:1700-1706). Дополнительные предоставляющие преимущество фармакодинамические характеристики включают в себя продленные эффекты после антибиотика, и синергизм с β-лактамами или аминогликозидами (Lefort et al., Antimicrob Agents Chemother, 2000, 44:3017-3021, содержание которого приведено в настоящем документе в качестве ссылки; Baltch et al., Antimicrob Agents Chemother 1998, 42:2564-2568, полное содержание которого приведено в настоящем документе в качестве ссылки).
[000103] Соответственно, оритаванцин можно классифицировать как сильно зависимый от концентрации бактерицидный антибиотик с эффектами продленной персистенции, таким же образом, как аминогликозиды и, до некоторой степени, хинолоны (Craig, Infect Dis Clin North Am, 2003, 17:479-501, полное содержание которого приведено в настоящем документе в качестве ссылки). Фармакодинамический профиль отличается от профиля общепринятых гликопептидов, для которых эффективность в основном зависит от соотношения площадь под кривой/MIC, поскольку для них показаны зависимые от времени эффекты активности и персистенции (Craig, Infect Dis Clin North Am, 2003, 17:479-501, полное содержание которого приведено в настоящем документе в качестве ссылки).
[000104] Одним из фармакокинетических свойств оритаванцина является продленное удержание в организме, что предопределяет схему его введения раз в сутки. Исключительно длинное терминальное время полужизни позволяет предполагать существование участков накопления в организме. Исследования на культивированных макрофагах показали, что лекарственное средство накапливается медленно (посредством процесса эндоцитоза), но, что важно, в лизосомах, его истечение из которых является необычайно медленным. Это объясняет, почему он является бактерицидным против внутриклеточных форм инфекции Staphylococcus или Enterococcus, но не против цитозольных бактерий, таких как Listeria monocytogenes (Al Nawas et al., Infection 2000, 28:214-218, полное содержание которого приведено в настоящем документе в качестве ссылки; Seral et al., Antimicrob Agents Chemother, 2003, 47:2283-2292v). Подтверждая эти данные, недавнее исследование на добровольцах показало, что оритаванцин достигает высоких концентраций не только в жидкости эпителиальной выстилки, но также в альвеолярных макрофагах (Rodvold et al., Clin Microbiol Infect 2004, полное содержание которого приведено в настоящем документе в качестве ссылки).
[000105] В соответствии с одним из вариантов осуществления, гликопептидный антибиотик по настоящему изобретению представляет собой телаванцин (TD-6424). Телаванцин представляет собой полусинтетическое производное ванкомицина, обладающее гидрофобной боковой цепью на сахаре ванкозамине (дециламиноэтилом) и аминометильным заместителем (фосфонометилом) на циклической пептидной сердцевине (фигура 3; van Bambeke, F., Curr. Opin. Pharm., 4(5): 471-478; Judice, J. et al., Bioorg Med Chem Lett 2003, 13: 4165-4168, полное содержание которого приведено в настоящем документе в качестве ссылки). Длину гидрофобной боковой цепи выбирали для достижения компромисса между оптимизированной активностью против MRSA (8-10 атомов углерода) и энтерококков VanA (12-16 атомов углерода). Фармакологические исследования позволяют предполагать, что усиленная активность телаванцина против S. pneumoniae, S. aureus (до меньшей степени) и стафилококков или энтерококков, несущих кластер генов vanA, является результатом комплексного механизма действия, который, на основании данных, полученных с близкими аналогами, вовлекает нарушение синтеза липидов и возможное разрушение мембраны.
[000106] Полярный заместитель, введенный в группу резорцинола, улучшает распределение молекул в организме и уравновешивает продленный эффект липофильной боковой цепи на время полужизни, которое в настоящее время составляет приблизительно 7 час и еще совместимо с ежесуточным введением. Фармакодинамические свойства включают в себя продленный эффект после антибиотика и зависимую от концентрации бактерицидную активность; таким образом, можно предложить расчет точки перегиба кривой фармакодинамики на основании соотношения свободной Cмакс/MIC, как выполнено для оритаванцина.
[000107] В соответствии с одним из вариантов осуществления, гликопептидный антибиотик по настоящему изобретению представляет собой далбаванцин (BI 397). Далбаванцин представляет собой полусинтетическое производное A40926, гликопептид со структурой, родственной структуре тейкопланина (фигура 3; Malabarba et al., Curr Med Chem 2001, 8:1759-1773, полное содержание которого приведено в настоящем документе в качестве ссылки; Malabarba et al., J Antibiot (Tokyo) 1994, 47:1493-1506, полное содержание которого приведено в настоящем документе в качестве ссылки).
[000108] Как и в случае оритаванцина и телаванцина, далбаванцин является более активным против S. pneumoniae, чем общепринятые гликопептиды, и его активность против S. aureus также является значительно улучшенной, чего не наблюдали для полусинтетических производных ванкомицина. Однако, исследования показали, что он не является более активным, чем тейкопланин, против энтерококков, несущих фенотип VanA устойчивости к гликопептидам. Далбаванцин также характеризуется заметным бактерицидным характером и синергизмом с пенициллином. Точка перегиба кривой фармакодинамики, рассчитанная (как и для других бактерицидных гликопептидов) на основании соотношения свободной Cмакс/MIC, обладает таким же порядком величины. Фармакокинетичечские параметры и точки перегиба кривой фармакодинамики для гликопептидов в дозах, соответствующих их использованию для человека (или в прогнозируемых дозах для находящихся в разработке молекул), показаны в таблице 3. Для далбаванцина показано настолько продленное время полужизни, что его концентрация в плазме превышает его минимальную бактерицидную концентрацию для организмов-мишеней даже через одну неделю после введения однократной дозы 1000 мг; свободные уровни, однако, были близкими к MIC в этих условиях (Steiert, M. et al., Curr Opin Investig Drugs 2002, 3:229-233, полное содержание которого приведено в настоящем документе в качестве ссылки). Эти результаты показывают, что однократная доза далбаванцина значительно снижает бактериальную нагрузку в моделях на животных гранулемы кармана из-за инфекции MRSA (Jabes et al., Antimicrob Agents Chemother 2004, 48:1118-1123, полное содержание которого приведено в настоящем документе в качестве ссылки), эндокардита из-за чувствительных к ванкомицину стафилококков или стафилококков с промежуточной устойчивостью (Lefort et al., Antimicrob Agents Chemother 2004, 48:1061-1064, полное содержание которого приведено в настоящем документе в качестве ссылки), или пневмонии из-за устойчивых к пенициллину пневмококков (Candiani et al., 41th Interscience Conference on Antimicrobial Agents and Chemotherapy 2001, Chicago, IL [Abstract 989], полное содержание которого приведено в настоящем документе в качестве ссылки).
|
[000109] В соответствии с одним из вариантов осуществления, гликопептидный антибиотик по настоящему изобретению конъюгирован с аминокислотой или ее производным. В следующем варианте осуществления, конъюгация гликопептидов происходит с N-концом или C-концом аминокислоты или ее производного. В другом варианте осуществления гликопептидный антибиотик конъюгирован с боковой цепью аминокислоты.
[000110] В одном варианте осуществления, конъюгация аминокислоты или ее производного с гликопептидным антибиотиком формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота. В одном варианте осуществления стабилизированный комплекс гликопептидный антибиотик-аминокислота ассоциирован с липидом. Например, в одном варианте осуществления липид является конъюгированным (например, связанным) с комплексом гликопептидный антибиотик-аминокислота. В одном варианте осуществления комплекс гликопептидный антибиотик-аминокислота захвачен липидным компонентом, например, где липид присутствует в форме липосомы или множества липосом.
[000111] В одном варианте осуществления стабилизированная композиция гликопептидного антибиотика по описанному изобретению включает аминокислоту или ее производное. В одном варианте осуществления аминокислота или ее производное выбраны из группы, состоящей из аланина (ALA), D-аланина (D-ALA), аланин-аланина (ALA-ALA), бета-аланина (bALA), 3-аминобутановой кислоты (3-ABA), гамма-аминомасляной кислоты (GABA), глутаминовой кислоты (GLU), D-глутаминовой кислоты (D-GLU), глицина (GLY), глицилглицина (GLY-GLY), аспарагиновой кислоты (ASP), D-аспарагиновой кислоты (D-ASP), бицина, трицина, саркозина, иминодиуксусной кислоты (IDAA) и их комбинаций. Структуры иллюстративных аминокислот или их производных, пригодных по изобретению, показаны ниже в таблице 4.
|
[000112] В соответствии с одним из вариантов осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 98,0% ее исходной биологической активности в течение по меньшей мере 200 суток при 4°C. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 98,5% ее исходной биологической активности в течение по меньшей мере 150 суток при 4°C. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 99,0% ее исходной биологической активности в течение по меньшей мере 100 суток при 4°C. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 99,5% ее исходной биологической активности в течение по меньшей мере 50 суток при 4°C. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 99,9% ее исходной биологической активности в течение по меньшей мере двух недель при 4°C.
[000113] В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида сохраняет по меньшей мере 80% ее исходной биологической активности в течение по меньшей мере 200 суток при комнатной температуре (RT).
[000114] В соответствии с одним из вариантов осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению образует кристаллические продукты распада со скоростью менее 0,05% по массе в неделю при 4°C. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида образует продукты распада со скоростью менее 0,04% по массе в неделю при 4°C. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида образует продукты распада со скоростью менее 0,03% по массе в неделю при 4°C. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида образует продукты распада со скоростью менее 0,02% по массе в неделю при 4°C. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида образует продукты распада со скоростью менее 0,01% по массе в неделю при 4°C. В одном варианте осуществления, продукты распада, образованные при 4°C, представляют собой кристаллические продукты распада (т.е., CDP-I-m плюс CDP-I-M).
[000115] В соответствии с одним из вариантов осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению образует продукты распада со скоростью менее приблизительно 0,5% по массе в неделю при комнатной температуре. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению образует продукты распада со скоростью менее приблизительно 0,4% по массе в неделю при комнатной температуре. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению образует продукты распада со скоростью менее приблизительно 0,3% по массе в неделю при комнатной температуре. В соответствии со следующим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению образует продукты распада со скоростью менее приблизительно 0,2% по массе в неделю при комнатной температуре. В одном варианте осуществления продукты распада, образованные при комнатной температуре, представляют собой кристаллические продукты распада (т.е., CDP-I-m плюс CDP-I-M).
[000116] В одном варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, компонент гликопептидного антибиотика и аминокислоту или ее производное, является по меньшей мере на 44% более стабильной, чем гликопептидный антибиотик на основе липида, не содержащий аминокислоту или ее производное. В следующем варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, компонент гликопептидного антибиотика и аминокислоту или ее производное, является по меньшей мере на 55% более стабильной, чем гликопептидный антибиотик на основе липида, не содержащий аминокислоту или ее производное. В следующем варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, компонент гликопептидного антибиотика и аминокислоту или ее производное, является по меньшей мере на 66% более стабильной, чем гликопептидный антибиотик на основе липида, не содержащий аминокислоту или ее производное. В следующем варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, компонент гликопептидного антибиотика и аминокислоту или ее производное, является по меньшей мере на 77% более стабильной, чем гликопептидный антибиотик на основе липида, не содержащий аминокислоту или ее производное. В следующем варианте осуществления стабилизированная композиция гликопептидного антибиотика на основе липида, содержащая липидный компонент, компонент гликопептидного антибиотика и аминокислоту или ее производное, является по меньшей мере на 88% более стабильной, чем гликопептидный антибиотик на основе липида, не содержащий аминокислоту или ее производное.
[000117] В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:4. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:3. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:2. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:4. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:3. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:2. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:1.
[000118] В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,0 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,1 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,2 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,3 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,4 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,5 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,6 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,7 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,8 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 5,9 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 6,0 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 6,1 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 6,2 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 6,3 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH в диапазоне от приблизительно 6,4 до приблизительно 6,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH 5,0. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH 5,5. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH 6,0. В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида обладает pH 6,5.
[000119] В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 20 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 30 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 40 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 50 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 60 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 70 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 80 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 90 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 100 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 110 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 120 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 130 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 140 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 150 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 160 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 170 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 180 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции лежит в диапазоне от 190 мг/мл до 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции составляет 200 мг/мл. В соответствии с другим вариантом осуществления, концентрация гликопептидного антибиотика в композиции составляет 100 мг/мл.
[000119] В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида по настоящему изобретению содержит водную дисперсию липосом. Состав может содержать липидные эксципиенты для формирования липосом и соли/буферы для обеспечения пригодной осмолярности и pH. Состав может содержать фармацевтический эксципиент. Фармацевтический эксципиент может представлять собой жидкость, разбавитель, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспорт любой рассматриваемой композиции или ее компонента из одного органа, или части организма, к другому органу или части организма. Каждый эксципиент должен являться «приемлемым» в смысле совместимости с рассматриваемой композицией и ее компонентами и не опасным для пациента. Пригодные эксципиенты включают в себя трегалозу, рафинозу, маннит, сахарозу, лейцин, трилейцин и хлорид кальция. Примеры других пригодных эксципиентов включают в себя (1) сахара, такие как лактоза и глюкоза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера; и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
[000121] Репрезентативные составы гликопептидного антибиотика на основе липидов показаны в таблице 5.
|
[000122] В одном варианте осуществления настоящее изобретение относится к стабилизированной гликопептидной композиции, содержащей липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное. В одном варианте осуществления, молярное соотношение липида к гликопептиду составляет 10:1 или менее, 9:1 или менее, 8:1 или менее, 7:1 или менее, 6:1 или менее, 5:1 или менее, 4:1 или менее, 3:1 или менее, 2:1 или менее, 1:1 или менее, 0,75:1 или менее или 0,5:1 или менее. В другом варианте осуществления, молярное соотношение липида к гликопептиду составляет приблизительно 1:1, приблизительно 2:1, приблизительно 3:1, приблизительно 4:1 или приблизительно 5:1.
[000123] В одном варианте осуществления настоящее изобретение относится к стабилизированной композиции липид-гликопептидный антибиотик, содержащей липидный компонент, гликопептидный антибиотик и аминокислоту или ее производное, где массовое соотношение общего липидного компонента к гликопептидному антибиотику составляет от приблизительно 0,1:1 до приблизительно 5:1. В следующем варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет приблизительно 3:1 или менее. В следующем варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет приблизительно 1:1 или менее. В другом варианте осуществления массовое соотношение липидного компонента к гликопептидному антибиотику составляет менее 1:1.
[000124] Понятно, что для диапазонов значений, представленных выше, каждое промежуточное значение, до десятой единицы нижнего предела, если контекст явно не требует иного, между верхним и нижним пределом этого диапазона, и любое другое указанное или промежуточное значение в этом указанном диапазоне охвачено изобретением. Верхний и нижний пределы этих меньших диапазонов, которые могут быть независимо включены в меньшие диапазоны, также охвачены изобретением, с учетом любого конкретно исключенного предела в указанном диапазоне. Когда указанный диапазон включает один или оба предела, диапазоны, исключающие любые два из этих включенных пределов, также включены в изобретение.
[000125] Репрезентативные составы гликопептидного антибиотика на основе липида с иллюстративными соотношениями липида к гликопептиду показаны в таблице 6.
|
[000126] В соответствии с другим аспектом, описанное изобретение относится к способу получения стабилизированной композиции гликопептидного антибиотика на основе липида, где способ включает в себя:
инфузию поточным способом, первого потока липидного раствора, содержащего липидный компонент в растворителе, с вторым потоком водного раствора, содержащего гликопептидный антибиотик и аминокислоту или ее производное, где аминокислота или ее производное связывается с гликопептидным антибиотиком и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота, и стабилизированный комплекс гликопептидный антибиотик-аминокислота захватывается липидным компонентом (т.е., одним липидом или смесью множества липидов) или образует с ним комплекс.
[000127] В соответствии с некоторыми вариантами осуществления, первый поток на стадии (a) содержит липид, растворенный в растворителе. В соответствии с некоторыми такими вариантами осуществления, растворитель представляет собой этанол.
[000128] В соответствии с другим вариантом осуществления, липидный раствор содержит от приблизительно 2 мг/мл до 200 мг/мл липидов. В соответствии с другим вариантом осуществления, липидный раствор содержит приблизительно 20 мг/мл липидов.
[000129] Примеры липидного компонента, который можно использовать для получения стабилизированной композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, но без ограничения, фосфатидилхолин (PC), фосфатидилглицерин (PG), фосфатидилинозитол (PI), фосфатидилсерин (PS), фосфатидилэтаноламин (PE), фосфатидную кислоту (PA), фосфатидилхолин яйца (EPC), фосфатидилглицерин яйца (EPG), фосфатидилинозитол яйца (EPI), фосфатидилсерин яйца (EPS), фосфатидилэтаноламин (EPE), фосфатидную кислоту (EPA), фосфатидилхолин сои (SPC), фосфатидилглицерин сои (SPG), фосфатидилсерин сои (SPS), фосфатидилинозитол сои (SPI), soy фосфатидилэтаноламин сои (SPE), фосфатидную кислоту сои (SPA), гидрогенизированный фосфатидилхолин яйца (HEPC), гидрогенизированный фосфатидилглицерин яйца (HEPG), гидрогенизированный фосфатидилинозитол яйца (HEPI), гидрогенизированный фосфатидилсерин яйца (HEPS), гидрогенизированный фосфатидилэтаноламин (HEPE), гидрогенизированную фосфатидную кислоту (HEPA), гидрогенизированный фосфатидилхолин сои (HSPC), гидрогенизированный фосфатидилглицерин сои (HSPG), гидрогенизированный фосфатидилсерин сои (HSPS), гидрогенизированный фосфатидилинозитол сои (HSPI), гидрогенизированный фосфатидилэтаноламин сои (HSPE), гидрогенизированную фосфатидную кислоту сои (HSPA), дипальмитоилфосфатидилхолин (DPPC), димиристоилфосфатидилхолин (DMPC), димиристоилфосфатидилглицерин (DMPG), дипальмитоилфосфатидилглицерин (DPPG), дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилхолин (DOPC), диолеилфосфатидилэтаноламин (DOPE), пальмитоилстеароилфосфатидилхолин (PSPC), пальмитоилстеароилфосфатидилглицерин (PSPG), моноолеоилфосфатидилэтаноламин (MOPE), токоферол, гемисукцинат токоферола, сульфат холестерина, гемисукцинат холестерила, производные холестерина, соли аммония и жирных кислот, соли аммония и фосфолипидов, соли аммония и глицеридов, миристиламин, пальмитиламин, лауриламин, стеариламин, дилауроилэтилфосфохолин (DLEP), димиристоилэтилфосфохолин (DMEP), дипальмитоилэтилфосфохолин (DPEP) и дистеароилэтилфосфохолин (DSEP), хлорид N-(2,3-ди-(9-(Z)-октадеценилокси)-проп-1-ил-N,N,N-триметиламмония (DOTMA), 1,2-бис(олеоилокси)-3-(триметиламмонио)пропан (DOTAP), дистеароилфосфатидилглицерин (DSPG), димиристоилфосфатидиловую кислоту (DMPA), дипальмитоилфосфатидиловую кислоту (DPPA), дистеароилфосфатидиловую кислоту (DSPA), димиристоилфосфатидилинозитол (DMPI), дипальмитоилфосфатидилинозитол (DPPI), дистеароилфосфатидилинозитол (DSPI), димиристоилфосфатидилсерин (DMPS), дипальмитоилфосфатидилсерин (DPPS), дистеароилфосфатидилсерин (DSPS) или их смесь.
[000130] В соответствии с другим вариантом осуществления, липидный компонент, который можно использовать для получения стабилизированной композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включает в себя смешанные фосфолипиды, например, пальмитоилстеароилфосфатидилхолин (PSPC) и пальмитоилстеароилфосфатидилглицерин (PSPG), триацилглицерин, диацилглицерин, церамид, сфингозин, сфингомиелин и одиночные ацилированные фосфолипиды, такие как моноолеоилфосфатидилэтаноламин (MOPE).
[000131] В соответствии с другим вариантом осуществления, липидный компонент, который можно использовать для получения стабилизированной композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включает в себя соли аммония и жирных кислот, фосфолипиды и глицериды, стеролы, фосфатидилглицерины (PG), фосфатидные кислоты (PA), фосфотидилхолины (PC), фосфатидилинозитолы (PI) и фосфатидилсерины (PS). Жирные кислоты включают в себя жирные кислоты с углеродными цепями длиной 12-26 атомов углерода, которые являются либо насыщенными, либо ненасыщенными. Некоторые конкретные примеры включают в себя, но без ограничения, миристиламин, пальмитиламин, лауриламин и стеариламин, дилауроилэтилфосфохолин (DLEP), димиристоилэтилфосфохолин (DMEP), дипальмитоилэтилфосфохолин (DPEP) и дистеароилэтилфосфохолин (DSEP), хлорид N-(2,3-ди-(9-(Z)-октадеценилокси)-проп-1-ил-N,N,N-триметиламмония (DOTMA) и 1,2-бис(олеоилокси)-3-(триметиламмонио)пропан (DOTAP).
[000132] В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из фосфатидилхолина. В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из дипальмитоилфосфатидилхолина (DPPC). В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из пальмитоилолеоилфосфатидилхолина (POPC).
[000133] В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из фосфатидилглицерина. В соответствии с другим вариантом осуществления, липидный компонент состоит в основном из 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоглицерина (POPG).
[000134] В соответствии с другим вариантом осуществления, липидный компонент содержит стерол, включая, но без ограничения, холестерин и эргостерол. В одном варианте осуществления липидный компонент состоит из стерола и одного дополнительного липида. В следующем варианте осуществления стерол представляет собой холестерин.
[000135] В соответствии с другим вариантом осуществления, первая скорость потока составляет между 0,1 л/мин и 100 л/мин. В соответствии с другим вариантом осуществления, первая скорость потока составляет между 0,5 л/мин и 10 л/мин. В соответствии с другим вариантом осуществления, первая скорость потока составляет между 0,5 л/мин и 1,5 л/мин. В соответствии с другим вариантом осуществления, первая скорость потока составляет приблизительно 10 л/мин. В соответствии с другим вариантом осуществления, первая скорость потока составляет приблизительно 1 л/мин.
[000136] В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:4. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:3. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты лежит в диапазоне от приблизительно 1:1 до приблизительно 1:2. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:4. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:3. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:2. В соответствии с другим вариантом осуществления, молярное соотношение гликопептидного антибиотика и аминокислоты или производного аминокислоты составляет приблизительно 1:1.
[000137] В соответствии с другим вариантом осуществления, водный раствор содержит между приблизительно 20 мг/мл и приблизительно 500 мг/мл гликопептидного антибиотика. В соответствии с другим вариантом осуществления, первый поток содержит между приблизительно 50 мг/мл и приблизительно 250 мг/мл гликопептидного антибиотика. В соответствии с другим вариантом осуществления, первый поток содержит между приблизительно 100 мг/мл и приблизительно 200 мг/мл гликопептидного антибиотика. В соответствии с другим вариантом осуществления, первый поток содержит приблизительно 100 мг/мл гликопептидного антибиотика. В соответствии с другим вариантом осуществления, первый поток содержит приблизительно 200 мг/мл гликопептидного антибиотика.
[000138] В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,0 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,1 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,2 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,3 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,4 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH в диапазоне от 5,5 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,6 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,7 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,8 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 5,9 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 6,0 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 6,1 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 6,2 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 6,3 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH от 6,4 до 6,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH 5,0. В соответствии с другим вариантом осуществления, водный раствор обладает pH 5,5. В соответствии с другим вариантом осуществления, водный раствор обладает pH 6,0. В соответствии с другим вариантом осуществления, водный раствор обладает pH 6,5.
[000139] В соответствии с одним из вариантов осуществления, вторая скорость потока составляет между 0,1 л/мин и 100 л/мин. В соответствии с другим вариантом осуществления, скорость второго потока составляет между 0,5 л/мин и 10 л/мин. В соответствии с другим вариантом осуществления, скорость второго потока составляет между 0,5 л/мин и 2 л/мин. В соответствии с другим вариантом осуществления, скорость второго потока составляет между 1 л/мин и 2 л/мин. В соответствии с другим вариантом осуществления, скорость второго потока составляет приблизительно 1,5 л/мин. В соответствии с другим вариантом осуществления, скорость второго потока составляет приблизительно 10 л/мин.
[000140] В соответствии с одним из вариантов осуществления, соотношение второй скорости потока к первой скорости потока составляет от приблизительно 0,1:1,0 до приблизительно 1:0,1,0. В соответствии с другим вариантом осуществления, соотношение второй скорости потока к первой скорости потока составляет от приблизительно 0,5:1,0 до приблизительно 2,0:1,0. В соответствии с другим вариантом осуществления, соотношение второй скорости потока к первой скорости потока составляет от приблизительно 1,0:1,0 до приблизительно 2,0:1,0. В соответствии с одним из вариантов осуществления, соотношение второй скорости потока к первой скорости потока составляет приблизительно 1,5:1,0.
[000141] В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 0,9% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит менее 0,9% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит приблизительно 0,9% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,0% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от 1,1% масс./масс. до 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,2% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,3% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от 1,4% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит по меньшей мере 1,5% масс./масс. хлорида натрия (NaCl).
[000142] В соответствии с одним из вариантов осуществления, скорость потока солевого раствора составляет между 0,1 л/мин и 10 л/мин. В соответствии с другим вариантом осуществления, скорость потока солевого раствора составляет между 0,5 л/мин и 2 л/мин. В соответствии с другим вариантом осуществления, скорость потока солевого раствора составляет приблизительно 1,5 л/мин. В соответствии с другим вариантом осуществления, скорость потока солевого раствора составляет приблизительно10 л/мин.
[000143] В соответствии с другим вариантом осуществления, способом получают инфузионную смесь, где инфузионная смесь содержит первую популяцию гликопептидных антибиотиков, захваченных липидом, и вторую популяцию гликопептидных антибиотиков, не захваченных липидом.
[000144] В соответствии с другим вариантом осуществления, способ получения дополнительно включает в себя промывку инфузионной смеси, содержащей ассоциированные с липидом или не ассоциированные с липидом гликопептидные антибиотики, посредством инфузии промывочного материала с четвертой скоростью потока, где промывочный материал содержит солевой раствор.
[000145] В соответствии с другим вариантом осуществления, стадию промывки проводят после формирования инфузионной смеси, где инфузионная смесь содержит первую популяцию гликопептидных антибиотиков, захваченных липидом, и вторую популяцию гликопептидных антибиотиков, не захваченных липидом.
[000146] В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 0,9% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит 0,9% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,0% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от 1,1% масс./масс. до 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,2% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от приблизительно 1,3% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит от 1,4% масс./масс. до приблизительно 1,5% масс./масс. хлорида натрия (NaCl). В соответствии с другим вариантом осуществления, солевой раствор содержит 1,5% масс./масс. хлорида натрия (NaCl).
[000147] В соответствии с другим вариантом осуществления, способ дополнительно включает в себя стадию концентрирования ассоциированных с липидом гликопептидных антибиотиков в составе.
[000148] В соответствии с другим аспектом, описанное изобретение относится к способу лечения бактериальной легочной инфекции, где способ включает в себя введение нуждающемуся в этом субъекту терапевтически эффективного количества стабилизированной композиции гликопептидного антибиотика на основе липида, где композиция содержит:
[000149] (a) липидный компонент, (b) компонент гликопептидного антибиотика, и (c) аминокислоту или ее производное, где аминокислота или ее производное связывается с гликопептидным антибиотиком и формирует стабилизированный комплекс гликопептидный антибиотик-аминокислота, и где стабилизированный комплекс гликопептидный антибиотик-аминокислота захвачен липидом.
[000150] В соответствии с другим вариантом осуществления, стабилизированная композиция гликопептидного антибиотика на основе липида может лечить инфекции, вызванные грамположительными бактериями, включая, но без ограничения, роды Staphylococcus, Streptococcus, Enterococcus, Bacillus, Corynebacterium, Nocardia, Clostridium и Listeria.
[000151] Стафилококки представляют собой грамположительные шаровидные бактерии, встречающиеся в микроскопических кластерах, напоминающих гроздья винограда. В то время как существует 20 видов стафилококков, только Staphylococcus aureus и Staphylococcus epidermis известны как значимые по их взаимодействию с человеком. S. aureus колонизирует в основном носовой проход, но его регулярно можно обнаруживать в большинстве анатомических локализаций, включая кожу, полость рта и желудочно-кишечный тракт. S. epidermis представляет собой организм, населяющий кожу. Примеры стафилококков, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, но без ограничения, S. aureus, S. auricularis, S. carnosus, S. epidermidis, S. haemolyticus, S. hyicus, S. intermedius, S. lugdunensis, S. saprophyticus, S. sciuri, S. simulans и S. warneri.
[000152] Стрептококки представляют собой грамположительные, неподвижные кокки, которые делятся в одной плоскости, образуя цепи клеток. Стрептококки представляют собой очень гетерогенную группу бактерий. Первичные патогены включают в себя S. pyrogenes и S. pneumoniae, однако, другие виды могут являться оппортунистическими. S. pyrogenes является ведущей причиной бактериального фарингита и тонзиллита. Он может также вызывать синусит, отит, артрит и инфекции костей. Некоторые штаммы предпочитают кожу, вызывая либо поверхностные (импетиго), либо глубокие (целлюлит) инфекции. S. pneumoniae является основной причиной бактериальной пневмонии у взрослых. Его вирулентность обусловлена его капсулой. Токсины, продуцируемые стрептококками, включают в себя: стрептолизины (S и O), НАДазу, гиалуронидазу, стрептокиназу, ДНКазы, эритрогенный токсин (который вызывает точечную скарлатинозную сыпь, вызывая повреждение кровеносных сосудов; требует лизогении бактериальных клеток фагом, кодирующим токсин). Примеры стрептококков, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению включают в себя, но без ограничения, S. agalactiae, S. anginosus, S. bovis, S. canis, S. constellatus, S. dysgalactiae, S. equi, S. equinus, S. iniae, S. intermedius, S. mitis, S. mutans, S. oralis, S. parasanguinis, S. peroris, S. pneumoniae, S. pyogenes, S. ratti, S. salivarius, S. salivarius ssp. thermophilus, S. sanguinis, S. sobrinus, S. suis, S. uberis, S. vestibularis, S. viridans и S. zooepidemicus.
[000153] Род энтерококков состоит из грамположительных, факультативно анаэробных организмов, которые являются яйцевидными по форме и появляются в мазках в коротких цепочках, в парах или в форме отдельных клеток. Энтерококки являются важными патогенами человека, которые обладают увеличивающейся устойчивостью к противомикробным средствам. Ранее эти организмы считали частью рода стрептококков, но недавно их переклассифицировали в их собственный род, называемый энтерококками. До настоящего времени, описано 12 видов, патогенных для человека, включая наиболее распространенные человеческие изоляты, Enterococcus faecalis и Enterococcus faecium. Энтерококки вызывают между 5 и 15% случаев эндокардита, который наилучшим образом лечат посредством комбинации средства, действующего на клеточную стенку (такого как пенициллин или ванкомицин), и аминогликозида, к которому организм не обладает высокой устойчивостью; что характерно приводит к синергическому бактерицидному эффекту. Примеры энтерококков, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, но без ограничения, E. avium, E. durans, E. faecalis, E. faecium, E. gallinarum и E. solitarius.
[000154] Бактерии рода бацилл представляют собой аэробные, образующие эндоспоры, грамположительные палочки. Род является одной из наиболее разнообразных и коммерчески пригодных групп микроорганизмов. Представители этого рода широко распространены в почве, воздухе и воде, где они вовлечены в ряд химических превращений. Известно, что некоторые виды бацилл вызывают проблемы со здоровьем у человека. Например, сибирскую язву вызывает Bacillus anthracis. Люди получают заболевание непосредственно из-за контакта с инфицированными травоядными или опосредованно через их продукты. Клинические формы включают в себя (1) кожную сибирскую язву, из-за манипуляций с инфицированным материалом; (2) кишечную сибирскую язву, из-за употребления в пищу инфицированного мяса; и (3) легочную сибирскую язву из-за вдыхания нагруженной спорами пыли. Несколько других видов бацилл, в частности, B. cereus и в меньшей степени, B. subtilis и B. licheniformis, периодически ассоциированы с бактериемией/септицемией, эндокардитом, менингитом и инфекциями ран, ушей, глаз, дыхательных путей, мочевыводящих путей и желудочно-кишечного тракта. Bacillus cereus вызывает два различных синдрома пищевого отравления: синдром рвоты с быстрым началом, характеризующийся тошнотой и рвотой, и синдром диареи с более медленным началом. Примеры патогенных видов бацилл, инфекция которыми поддается лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, но без ограничения, B. anthracis, B. cereus и B. coagulans.
[000155] Коринебактерии представляют собой мелкие, как правило, неподвижные, грамположительные, не образующие спор, плеоморфные бациллы. Они являются хемоорганотрофными, аэробными или факультативно анаэробными, и они проявляют ферментативный метаболизм. Corybacterium diphtheriae является этиологическим агентом дифтерии, заболевания верхних дыхательных путей, в основном поражающего детей. Факторы вирулентности (т.е., дифтерийный токсин) интенсивно изучали. Примеры видов коринебактерий, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, в качестве неограничивающих примеров, Corynebacterium diphtheria, Corynebacterium pseudotuberculosis, Corynebacterium tenuis, Corynebacterium striatum и Corynebacterium minutissimum.
[000156] Бактерии рода нокардий представляют собой грамположительные, частично кислотоустойчивые палочки, которые медленно растут в ветвящихся цепях, напоминающих гифы грибов. Три вида вызывают почти все инфекции у человека: N. asteroides, N. brasiliensis и N. caviae. Инфекция происходит посредством вдыхания переносимых воздухом бацилл из внешнего источника (почвы или органического материала); заболевание не является заразным. Поражения кожи, вызванные N. brasiliensis, часто возникают в результате прямой инокуляции. Нокардия нарушает противомикробные механизмы фагоцитов, вызывая образование абсцесса или редко, гранулему с гематогенным или лимфатическим распределением к коже или центральной нервной системе. Примеры видов нокардий, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, в качестве неограничивающих примеров, N. aerocolonigenes, N. africana, N. argentinensis, N. asteroides, N. blackwellii, N. brasiliensis, N. brevicatena, N. carnea, N. caviae, N. cerradoensis, N. corallina, N. cyriacigeorgica, N. dassonvillei, N. elegans, N. farcinica, N. nigiitansis, N. nova, N. opaca, N. otitidis-cavarium, N. paucivorans, N. pseudobrasiliensis, N. rubra, N. transvelencesis, N. uniformis, N. vaccinii и N. veterana.
[000157] Клостридии являются образующими споры, грамположительными анаэробами. Клостридии являются палочковидными, но при образовании спор они выглядят более похожими на барабанные палочки с вздутием на одном конце. Существует три вида клостридий, которые вызывают широко известные и часто смертельные заболевания. C. tetani является этиологическим агентом столбняка, C. botulinum является этиологическим агентом ботулизма, и C. perfringens является одним из этиологических агентов газовой гангрены. Столбняк передается посредством контакта между спорами C. tetani и открытой раной, например, если наступить на ржавый гвоздь. Если присутствует анаэробное окружение, споры могут прорастать. Столбняк представляет собой неврологическое заболевание, при котором C. tetani высвобождает экзотоксин, называемый токсином столбняка, который блокирует высвобождение нейротрансмиттеров из пресинаптической мембраны ингибиторных промежуточных нейронов спинного мозга и ствола головного мозга млекопитающих, регулирующих сокращение мышц. Примеры видов клостридий, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, в качестве неограничивающих примеров, C. botulinum, C. tetani, C.difficile, C. perfringens, и C. sordellii.
[000158] Листерии представляют собой не образующие спор, неветвящиеся грамположительные палочки, которые встречаются индивидуально или формируют короткие цепочки. Листерии являются внутриклеточными патогенами, использующими продуцированные хозяином актиновые филаменты для подвижности внутри клетки-хозяина. L. monocytogenes является этиологическим агентом листериоза. L. monocytogenes представляет собой пищевой патоген, который может переживать нормальные способы охлаждения. Он может вызывать тяжелое заболевание у индивидуумов с иммунной недостаточностью и беременных женщин. Примеры видов листерий, поддающихся лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, в качестве неограничивающих примеров, L. grayi, L. innocua, L. ivanovii, L. monocytogenes, L. seeligeri, L. murrayi и L. welshimeri.
[000159] Другие примеры вдов грамположительных бактерий, инфекция которыми поддается лечению с помощью композиции гликопептидного антибиотика на основе липида по настоящему изобретению, включают в себя, но без ограничения, устойчивый к метициллину Staphylococcus aureus (MRSA), Escherichia coli, Klebsiella, Enterobacter, Serratia, Haemophilus, Yersinia pesos, Burkholderia pseudomallei, Burkholderia cepacia, Burkholderia gladioli, Burkholderia multivorans, Burkholderia vietnamiensis, Mycobacterium tuberculosis, комплекс Mycobacterium avium (MAC) (Mycobacterium avium и Mycobacterium intracellulare), Mycobacterium kansasii, Mycobacterium xenopi, Mycobacterium marinum, Mycobacterium mucogenicum, Mycobacgerium gordonae, Mycobacterium ulcerans и комплекс Mycobacterium fortuitum (включая, но без ограничения, Mycrobacterium fortuitum, Mycrobacterium peregrinum, Mycrobacterium chelonae, Mycrobacterium abscessus, и Mycrobacterium mucogenicum).
[000160] Устойчивый к метициллину Staphyloccus aureus (MRSA) представляет собой тип стафилококковых бактерий, который является устойчивым к конкретным антибиотикам, называемым бета-лактамами. Эти антибиотики включают в себя метициллин и другие более распространенные антибиотики, такие как оксициллин, пенициллин и амоксициллин.
[000161] Микобактерии представляют собой неподвижные плеоморфные палочки, родственные актиномицетам. Они являются относительно непроницаемыми для различных основных красителей, но после окрашивания, они прочно сохраняют красители. Они устойчивы к обесцвечиванию с помощью подкисленных органических растворителей, и таким образом, их называют кислотоустойчивыми. Они могут казаться грамположительными, но они поглощают краситель слабо и нерегулярно, и без необходимости обработки иодом для его сохранения.
[000162] На основании скорости роста, продукции каталазы и ниацина, и пигментации на свету или в темноте, микобактерии классифицируют на члены комплекса Mycobacterium tuberculosis (включая, но без ограничения, M tuberculosis, M bovis, Mycobacterium bovis BCG, Mycobacterium africanum, Mycobacterium microti, Mycobacterium canettii, Mycobacterium caprae и Mycobacterium pinnipedii) и нетуберкулезные виды. Большинство микобактерий обнаружено в такой среде обитания, как вода или почва. Однако, несколько являются внутриклеточными патогенами животных и человека. Mycobacterium tuberculosis, вместе с M. bovis, M. africanum и M. microti, все вызывают заболевание, известное как туберкулез (TB). Каждый член TB комплекса является патогенным, но M. tuberculosis является патогенной для человека, в то время как M. bovis обычно является патогенной для животных. Туберкулезные микобактерии входят в альвеолы посредством переноса воздухом. Они устойчивы к разрушению альвеолярными макрофагами и размножаются, формируя первичный очаг или туберкулу; затем они распространяются в местные лимфатические узлы, входят в кровоток и заново засевают легкие. Разрушение тканей происходит из-за опосредованной клетками гиперчувствительности.
[000163] Mycobacterium abscessus представляет собой часть комплекса Mycobacterium fortuitum, группы быстро растущих микобактерий, являющихся широко распространенной в окружающей среде (почве и воде). Комплекс Mycobacterium fortuitum, например, включает в себя: Mycobacterium fortuitum, Mycobacterium peregrinum, Mycobacterium chelonae, Mycobacterium abscessus и Mycobacterium mucogenicum. Изоляты комплекса Mycobacterium fortuitum являются ответственными почти за все инфекции человека, вызванные быстро растущими микобактериями. Инфекции лежат в диапазоне от местной инфекции раны до респираторного заболевания, до тяжелой диссеминированной инфекции. Mycobacterium abscessus обычно вызывает респираторные инфекции и инфекции мягких тканей/кожи.
[000164] Комплекс Mycobacterium avium (MAC) представляет собой выделяемую в большинстве случаев группу микобактерий и широко распространен в природе (вода, почва, птицы и другие животные, и пыль). Комплекс M. avium включает M. avium и M. intracellulare. Инфекции у иммунокомпетентных пациентов обычно являются легочными; инфекции у пациентов с ослабленным иммунитетом (например, пациентов, зараженных СПИД, или пациентов, количество клеток CD4+ у которых менее 200), обычно являются диссеминированными. Изоляты MAC часто являются устойчивыми к лекарственным средствам, и их трудно лечить; лечение рекомендовано только при ослабленном иммунитете и в случаях повторного выделения при существовании клинических симптомов.
[000165] Mycobacterium chelonae представляет собой часть комплекса Mycobacterium fortuitum, группы быстро растущих микобактерий, повсеместно распространенной в окружающей среде (почве и воде). Mycobacterium chelonae обычно вызывает инфекции мягких тканей и кожи. Необходимо дифференцировать группу Mycobacterium fortuitum (Mycobacterium fortuitum и Mycobacterium peregrinum) от Mycobacterium chelonae и Mycobacterium abscessus, поскольку последние два вида из комплекса являются очень устойчивыми к терапии лекарственными средствами против микобактерий.
[000166] Mycobacterium fortuitum и Mycobacterium peregrinum являются частью комплекса Mycobacterium fortuitum. Комплекс Mycobacterium fortuitum включает в себя: Mycobacterium fortuitum, Mycobacterium peregrinum, Mycobacterium chelonae, Mycobacterium abscessus и Mycobacterium mucogenicum. Изоляты комплекса Mycobacterium fortuitum являются ответственными почти за все инфекции человека, вызванные быстро растущими микобактериями. Спектр заболеваний, вызванных этими организмами. включает в себя абсцесс мягких тканей, инфекции ран грудины после хирургической операции на сердце, эндокардит искусственного клапана, диссеминированную и местную инфекцию у пациентов при гемодиализе и перитонеальном диализе, легочное заболевание, инфекцию травматической раны и диссеминированное заболевание, часто с поражениями кожи.
[000167] Mycobacterium kansasii является важной причиной хронического легочного заболевания у человека, напоминающего заболевание, вызванное Mycobacterium tuberculosis. Однако, в отличие от инфекции Mycobacterium tuberculosis, существует минимальный риск передачи от человека к человеку. Факторы риска часто предрасполагают к инфекции (основное легочное заболевание, злокачественная опухоль, алкоголизм, и т.п.). Mycobacterium kansasii обычно выделяют из образцов воды; считают, что инфекция происходит аэрозольным путем. Mycobacterium kansasii является второй из наиболее распространенных причин микобактериальной инфекции у пациентов со СПИД (после комплекса Mycobacterium avium).
[000168] Mycobacterium marinum представляет собой патоген рыбы, обнаруженный в природных водах. Он лучше растет при ниже 33°C и вызывает подобное туберкулезу заболевание у рыбы и хроническое поражение кожи, известное как «гранулема пловцов», у человека. Инфекцию получают посредством ранения конечности в среде домашнего аквариума или в морской окружающей среде, и она может приводить к серии восходящих подкожных абсцессов. M. marinum напоминает M. kansasii в том, что является фотохромогенной. M. marinum различается по чувствительности к противомикробным средствам.
[000169] Называемая ранее «подобными Mycobacterium chelonae организмами (MCLO)», Mycobacterium mucogenicum является частью комплекса Mycobacterium fortuitum. Mycobacterium mucogenicum является редкой причиной заболевания человека; определили, что большинство респираторных изолятов являются непатогенными (за исключением пациентов с иммунной недостаточностью), в то время как нереспираторные изоляты являются патогенными (обычно раневые инфекции). Изоляты Mycobacterium mucogenicum выглядят слизеобразующими на лабораторных средах.
[000170] Mycobacterium scrofulaceum является обычной причиной лимфаденита у детей в возрасте от 1 до 3 лет. Лимфаденит обычно затрагивает один узел или кластер узлов в поднижнечелюстной области. Характерно, что узлы медленно увеличиваются в течение периода нескольких недель. Присутствует мало местных или системных симптомов. Без лечения, инфекция обычно направляется к поверхности, происходит разрыв, формирование дренирующего свища и в конечном счете, обызвествление. Иногда возникает инфекция в других тканях. У детей обнаружено очень мало случаев, напоминающих прогрессирующий первичный туберкулез. У детей может быть выражено метастазирующее заболевание кости. Колонии обычно являются желто-оранжевыми даже при росте в темноте (скотохромогенными). Они обычно являются устойчивыми к противотуберкулезным лекарственным средствам in vitro.
[000171] Mycobacterium ulcerans, обнаруживаемая в основном в Африке и Австралии, растет только при менее 33°C. Она вызывает хронические глубокие кожные язвы у человека и обычно образует повреждения на самых холодных участках тела. Mycobacterium ulcerans обладает уникальным характером устойчивости к лекарственным средствам, т.е., устойчивостью к INH и этамбутолу и чувствительностью к стрептомицину и рифампину. Заболевание человека плохо отвечает на лечение лекарственными средствами и часто необходимо радикальное иссечение с последующей пересадкой кожи.
[000172] Исследования позволили предполагать, что источником инфекции Mycobacterium xenopi у человека является переведенная в аэрозольное состояние вода, подобно комплексу Mycobacterium avium. Mycobacterium xenopi не является настолько общераспространенным во всех источниках воды, как Mycobacterium avium, предпочитая расти в горячих источниках воды. Для иммунокомпетентных пациентов, легочное заболевание является наиболее распространенным; факторы риска включают в себя основное заболевание легких, интенсивное курение, алкогольную зависимость и воздействие воды, содержащей эти микобактерии. СПИД является другим фактором риска для инфекции Mycobacterium xenopi, часто приводящим к диссеминированной инфекции у этих пациентов.
[000173] Субъект или пациент, нуждающийся в лечении, в одном варианте осуществления, страдает легочным заболеванием. В одном варианте осуществления, легочное заболевание представляет собой кистозный фиброз, бронхоэктаз, пневмонию или хроническое обструктивное заболевание легких (COPD).
[000174] В другом варианте осуществления, субъект или пациент, нуждающийся в лечении, страдает остеомиелитом. В другом варианте осуществления, субъект или пациент, нуждающийся в лечении, страдает эндокардитом, бронхитом, гепатитом, миокардитом и/или нефритом. В другом варианте осуществления, субъект или пациент, нуждающийся в лечении, страдает бактериемией. В другом варианте осуществления, субъект или пациент, нуждающийся в лечении, страдает инфекцией кожи или соединительной ткани, включая, но без ограничения, фолликулит, целлюлит, фурункулы или пиомиозит. В другом варианте осуществления, субъект или пациент, нуждающийся в лечении, страдает инфекциями раны или области хирургического вмешательства.
[000175] Лекарственные средства в композициях по настоящему изобретению вводят в терапевтически эффективных количествах. В сочетании с объяснениями, представленными в настоящем документе, посредством выбора среди различных активных соединений и взвешивания таких факторов, как активность, относительная биодоступность, масса тела пациента, тяжесть неблагоприятных побочных эффектов и способ введения, можно планировать эффективный режим профилактического или терапевтического лечения, который не вызывает существенной токсичности и еще является эффективным для лечения конкретного субъекта. Эффективное количество для любого конкретного применения может меняться в зависимости от таких факторов, как подвергаемое лечению заболевание или состояние, вводимое конкретное лекарственное средство(средства), рост субъекта, или тяжесть заболевания или состояния. Специалист в данной области может эмпирически определить эффективное количество конкретного лекарственное средства(средств) без необходимости излишнего экспериментирования. В одном варианте осуществления используют наивысшую безопасную дозу в соответствии с некоторыми медицинскими заключениями. Термины «доза» и «дозировка» используют взаимозаменяемо в настоящем документе.
[000176] Для любого соединения, описанного в настоящем документе, терапевтически эффективное количество можно первоначально определять из предварительных исследований in vitro и/или в моделях на животных. Терапевтически эффективную дозу можно определять также по данным у человека для лекарственного средства(средств), которые тестировали для человека, и для соединений, известных как обладающие сходной фармакологической активностью, таких как другие родственные активные средства. Применяемую дозу можно корректировать на основании относительной биодоступности и активности вводимого соединения. Корректировка дозы для достижения максимальной эффективности на основании способов, описанных выше, и других способов, полностью находится в компетенции специалиста в данной области.
[000177] В соответствии с некоторыми вариантами осуществления, стабилизированный гликопептидный антибиотик на основе липида вводят в количестве, превышающем минимальную ингибирующую концентрацию (MIC) для легочной инфекции. Например, MIC для легочной инфекции составляет по меньшей мере приблизительно 0,10 микрограмм/мл, приблизительно 0,10-10 микрограмм/мл или приблизительно 0,10-5 микрограмм/мл.
[000178] В соответствии с другим вариантом осуществления, после введения стабилизированных гликопептидных антибиотиков на основе липидов, Log10 КОЕ (колониеобразующих единиц) в легком субъекта, или в мокроте или ткани, собранной из легкого, уменьшено. Log10 КОЕ представляет собой логарифмическое значение колониеобразующих единиц (КОЕ). В микробиологии, колониеобразующая единица (КОЕ или кое) относится к измерению количества жизнеспособных бактерий. В отличие от прямого подсчета под микроскопом, где подсчитывают все клетки, мертвые и живые, КОЕ измеряет жизнеспособные клетки. В соответствии с некоторыми вариантами осуществления, после введения стабилизированных гликопептидных антибиотиков на основе липида, Log10 КОЕ в легком субъекта можно уменьшать по меньшей мере приблизительно на 0,5, приблизительно на 1,0, приблизительно на 1,5, приблизительно на 2,0 или приблизительно на 2,5. В соответствии с другим вариантом осуществления, общее КОЕ в легком составляет менее приблизительно 1,0, приблизительно 0,75, приблизительно 0,5, или приблизительно 0,25 после введения состава стабилизированного гликопептидного антибиотика на основе липида. В соответствии с другим вариантом осуществления, первичная инфекция в легком субъекта уменьшена после введения стабилизированных гликопептидных антибиотиков на основе липида. В соответствии с другим вариантом осуществления, легочная инфекция в легком субъекта уничтожена после введения стабилизированных гликопептидных антибиотиков на основе липида. В соответствии с другим вариантом осуществления, легочная инфекция уменьшена более, чем посредством лечения ингаляцией с помощью такой же дозы свободного гликопептидного антибиотика. В соответствии с другим вариантом осуществления, скорость уменьшения или уничтожения легочной инфекции в популяции субъектов выше при лечении с помощью состава гликопептидного антибиотика на основе липида по сравнению с популяцией после лечения с помощью такой же дозы введенного ингаляцией свободного гликопептидного антибиотика. В соответствии с другим вариантом осуществления, уменьшение инфекции среди популяции, подвергнутой лечению с помощью введенного ингаляцией состава стабилизированного гликопептидного антибиотика, по меньшей мере приблизительно на 20, приблизительно на 30, приблизительно на 40, приблизительно на 50, приблизительно на 70, приблизительно на 80 или приблизительно на 90% более по сравнению с лечением введенным ингаляцией свободным гликопептидным антибиотиком. В соответствии с другим вариантом осуществления, легочная инфекция уменьшена за более короткий период времени по сравнению с лечением с помощью такой же дозы введенного ингаляцией свободного ванкомицина. В соответствии с другим вариантом осуществления, время до рецидива легочной инфекции или необходимости медицинского вмешательства увеличено до более длительного периода времени по сравнению с лечением с помощью такой же дозы введенного ингаляцией свободного ванкомицина.
[000179] В соответствии с другим вариантом осуществления, стабилизированный гликопептидный антибиотик на основе липида по описанному изобретению можно вводить посредством ингаляции в форме распыляемого спрея, порошка или аэрозоля, или посредством интратрахеального введения. В соответствии с другим вариантом осуществления, введение является менее частым и/или обладает увеличенным терапевтическим индексом по сравнению с ингаляцией свободного лекарственного средства или парентеральной формы лекарственного средства. Кроме того, время для введения желательной терапевтической дозы гликопептидного антибиотика уменьшено по сравнению с ингаляцией свободного лекарственного средства. Таким образом, в некоторых вариантах осуществления, состав гликопептидного антибиотика на основе липида является более эффективным, чем ингаляция такого же количества свободного лекарственного средства. Липосомы или другие липидные составы являются особенно преимущественными из-за их способности защищать лекарственное средство, в то же время являясь совместимыми с выстилкой легких или легочным сурфактантом. Без связи с какой-либо конкретной теорией, считают, что состав гликопептидного антибиотика на основе липида по настоящему изобретению обладает эффектом депо в легких. В силу этого, гликопептидный антибиотик на основе липида сохраняет терапевтическую биодоступность в течение некоторого периода времени после завершения введения посредством ингаляции. В соответствии с некоторыми вариантами осуществления, этот период времени дольше, чем количество времени, которое свободный гликопептидный антибиотик остается терапевтически доступным. Например, терапевтическая биодоступность гликопептидного антибиотика на основе липида может быть дольше, чем 3, 4, 5, 6, 7, 8, 9 или 10 суток после лечения, или даже дольше, чем две недели после введения.
[000180] В соответствии с некоторыми вариантами осуществления, по меньшей мере приблизительно 25% гликопептидного антибиотика является ассоциированным с липосомами после распыления. В соответствии с другим вариантом осуществления, по меньшей мере приблизительно 50% или по меньшей мере приблизительно 60% гликопептидного антибиотика является ассоциированным с липосомами после распыления. В соответствии с другим вариантом осуществления, приблизительно 50-95%, приблизительно 50-80% или приблизительно 60-75% гликопептидного антибиотика является ассоциированным с липосомами после распыления.
[000181] В соответствии с некоторыми вариантами осуществления, стабилизированный гликопептидный антибиотик на основе липида вводят внутривенно, подкожно, перорально, назально, внутрибрюшинно, подъязычно, трансбуккально, чрескожно, посредством подкожной или субдермальной имплантации, или внутримышечно.
[000182] В соответствии с некоторыми вариантами осуществления, стабилизированный гликопептидный антибиотик на основе липида вводят посредством инъекции. В соответствии со следующими вариантами осуществления, стабилизированный гликопептидный антибиотик на основе липида вводят посредством внутривенной инъекции. В соответствии с другим вариантом осуществления, введение является менее частым и/или обладает улучшенным терапевтическим индексом по сравнению с инъекцией свободного лекарственного средства или парентеральной формы лекарственного средства. Кроме того, время для введения желательной терапевтической дозы гликопептидного антибиотика уменьшено по сравнению с инъекцией свободного лекарственного средства. Таким образом, в некоторых вариантах осуществления, состав гликопептидного антибиотика на основе липида является более эффективным, чем инъекция такого же количества свободного лекарственного средства. В соответствии с другим вариантом осуществления, время до рецидива бактериальной инфекции или необходимости медицинского вмешательства увеличено до более длительного периода времени по сравнению с лечением с помощью такой же дозы инъецированного свободного ванкомицина. В соответствии с некоторыми вариантами осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 50-1000 мг/сутки, приблизительно 100-500 мг/сутки или приблизительно 250-500 мг/сутки. В соответствии с другим вариантом осуществления, доза составляет приблизительно 100 мг/сутки. В соответствии с другим вариантом осуществления, доза составляет приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг или приблизительно 500 мг в сутки.
[000183] В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000001 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000002 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000003 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000004 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000005 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000006 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000007 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000008 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,000009 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00001 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00002 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,0003 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00004 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00005 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00006 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00007 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00008 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,00009 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе от приблизительно 0,0001 мг/кг массы тела до приблизительно 10 г/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 0,0005 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 0,001 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 0,005 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 0,01 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 0,1 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 1 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 10 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 20 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 30 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 40 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 50 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 60 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 70 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 80 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 90 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 100 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 110 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 120 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 130 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 140 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 150 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 160 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 170 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 180 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 190 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 200 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 250 мг/кг массы тела. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят в дозе приблизительно 500 мг/кг массы тела.
[000184] В соответствии с некоторыми вариантами осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят интратрахеально. В соответствии с другим вариантом осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят посредством ингаляции. В соответствии с некоторыми вариантами осуществления, стабилизированную композицию гликопептидного антибиотика на основе липида вводят посредством ингалятора. В соответствии с другим вариантом осуществления, введение происходит парентерально. В соответствии с другим вариантом осуществления, введение происходит внутривенно. В соответствии с другим вариантом осуществления, введение происходит внутримышечно. В соответствии с другим вариантом осуществления, введение происходит внутрибрюшинно.
[000185] В соответствии с другим вариантом осуществления, композицию вводят от 1 раза до 4 раз в сутки. В соответствии с другим вариантом осуществления, композицию вводят один раз в сутки, два раза в сутки, три раза в сутки или четыре раза в сутки. В соответствии с другим вариантом осуществления, композицию вводят в цикле ежесуточного лечения в течение некоторого периода времени, или вводят в цикле на каждые вторые сутки, на каждые третьи сутки, на каждые четвертые сутки, на каждые пятые сутки, на каждые 6-е сутки или один раз в неделю в течение периода времени, где период времени составляет от одной недели до нескольких месяцев, например, 1, 2, 3 или 4 недели, или 1, 2, 3, 4, 5 или 6 месяцев.
[000186] Описанное изобретение можно осуществлять в других конкретных формах без отклонения от его содержания или существенных особенностей и, соответственно, следует ссылаться на прилагаемую формулу изобретения, а не на предшествующее описание, как на указание объема изобретения.
ПРИМЕРЫ
[000187] Следующие примеры изложены так, чтобы обеспечить специалиста в данной области полным раскрытием и описанием того, как осуществлять и использовать настоящее изобретение, и как не предназначены для ограничения объема того, что авторы изобретения рассматривают как их изобретение, так и не предназначены для представления того, что эксперименты ниже представляют собой все или единственные проведенные эксперименты. Если не указано иначе, части представляют собой части по массе, молекулярная масса представляет собой средневзвешенную молекулярную массу, температура приведена в градусах Цельсия, и давление является атмосферным или близким.
Пример 1. Стабильность ванкомицина в водном растворе
Реагенты и оборудование
[000188] Холестерин (Кат. No. 700000P) и дипальмитоилфосфатидилхолин (DPPC, Кат. No. 850355P) закупали из Avanti Polar Lipids Certified Reference Standard. Хлорид ванкомицина (Партия HVN0701303) закупали из North China Pharmaceutical Group. Метанол (квалификации HPLC, Кат No. AH230-4), ацетонитрил (квалификации HPLC), гидроксид аммония (квалификации HPLC) закупали из Burdick & Jackson. Ледяную уксусную кислоту (квалификации HPLC; JT9515-3) и хлорид натрия (ACS Reagent; Кат. No. 3628-05) закупали из JT Baker. Очищенную воду получали с использованием воды Milli-Q 18,0 MOм.
[000189] Оборудование для высокоэффективной жидкостной хроматографии (HPLC) поставлено из Shimadzu (10 AVP, оборудованный УФ-детектором и детектором заряженных аэрозолей CORONA (CAD), и программное обеспечение для HPLC поставлено из LC Solutions™. Охлаждаемая универсальная центрифуга (5810R) поставлена из Eppendorf (Westbury, NY).
Анализ ванкомицина HILIC HPLC с нормальными фазами
[000190] Анализ ванкомицина HILIC HPLC с нормальными фазами проводили с использованием системы Shimadzu 10AVP HPLC, оборудованной УФ детектором (необязательно, CAD), в следующих условиях:
• Колонка: ZIC-HILIC 150×4,6 мм, 3,5 мкм, 200 A (SeQuant)
• Температура колонки: 30°C
• Подвижная фаза: ацетонитрил 37%, метанол 24%, вода 39%, уксусная кислота 0,08%, гидроксид аммония 0,02%
• Скорость потока: 0,5 мл/мин, изократический
• Объем инъекции: 20 мкл
• Образцы растворяли в подвижной фазе. Смесь подвижной фазы с н-пропанолом 4:1 можно использовать при получении содержащих липид образцов.
• Стандарты ванкомицина: пригодный диапазон 10-200 мг/мл, растворенный в подвижной фазе. Калибровочную кривую аппроксимировали до линейной функции
• УФ-детектор: Длина волны 280 нм
• Хроматограмма: время удержания для
CDP-I-M: приблизительно 14 мин
CDP-I-m: приблизительно 16 мин
Ванкомицин: приблизительно 24 мин
Дополнительные мажорные пики присутствовали при: 20, 22, 27 мин. Общее время регистрации 35 мин
Анализ ванкомицина обращеннофазовой HPLC
[000191] Анализ ванкомицина обращеннофазовой HPLC (который нельзя использовать для содержащих липиды образцов) проводили с использованием системы Shimadzu 10AVP HPLC, оборудованной УФ детектором (необязательно, CAD), в следующих условиях:
• Колонка: Atlantis® dC18, 5μ, 250×4,6 мм (Waters)
• Подвижная фаза A: ацетонитрил 5%, ацетат аммония 15 мМ, pH 6,0. Подвижная фаза B: ацетонитрил 20%, ацетат аммония 15 мМ, pH 6,0. Раствор 1 M ацетата аммония, pH 6,0: приблизительно 6% ледяная уксусная кислота (1 M) и 9% 30% раствора гидроксид аммония.
• Скорость потока: 1 мл/мин, бинарный градиент
|
• Объем инъекции: 20 мкл
• Образцы растворяли в подвижной фазе.
• Стандарты ванкомицина: пригодный диапазон 10-200 мг/мл, растворенный в подвижной фазе. Калибровочную кривую аппроксимировали до линейной функции
• УФ-детектор: Длина волны 280 нм
• Хроматограмма: время удержания для
CDP-I-M: приблизительно 7 мин
CDP-I-m : приблизительно 16 мин
Ванкомицин: приблизительно 26 мин
Общее время регистрации 55 мин
Анализ ванкомицина посредством визуализации в УФ
[000192] Образцы, подлежащие анализу, растворяли в растворе н-пропанола/H2O (60/40, об./об.), так чтобы конечные концентрации ванкомицина-HCl составляли между 0 мкг/мл и 200мкг/мл. Предварительное растворение с помощью H2O может являться необходимым, если концентрация ванкомицина в исходном образце составляет >10мг/мл. Концентрации образцов рассчитывали по сравнению их оптической плотности при 280 нм с оптической плотностью по линейной стандартной кривой (стандарты получали из неочищенного материала при 0, 50, 100, 150 и 200 мкг/мл).
[000193] Альтернативно, образцы растворяли в подвижной фазе, используемой для способа HILIC HPLC, смешанной с н-пропанолом при 3:1 об. В последнем случае, коэффициент поглощения ванкомицина составлял приблизительно 5,4 мг/мл-1см-1 или приблизительно 7800 M-1см-1 (1A на 185 мкг/мл)
Анализ липидов HPLC
[000194] Анализ липидов HPLC проводили с использованием системы Shimadzu 10AVP HPLC, оборудованной детектором заряженных аэрозолей Corona (CAD), при следующих условиях и параметрах:
• Колонка: Phenomenex Luna 3μ, C8(2), 75×4,6 мм
• Температура колонки: 30°C
• Подвижная фаза: ацетонитрил 43%, н-пропанол 43%, вода 14%, уксусная кислота 0,1%, TEA 0,1%
• Скорость потока: 1 мл/мин, изократический
• Объем инъекции: 20 мкл
• Образцы растворяли в растворе A: ацетонитрил 30%, н-пропанол 30%, вода 40%
• Стандарты липидов (DPPC/холестерин 20/10, 30/15 и 40/20 мкг/мл)
• Калибровку аппроксимировали до линейной функции
• Хроматограмма: время удержания для холестерина ~4 мин, DPPC ~6 мин, общее время регистрации 10 мин
Образцы раствора ванкомицина для исследования стабильности
[000195] Образцы раствора ванкомицина (1 мл 200 мг/мл) помещали в 4 мл стеклянные флаконы и инкубировали при указанной температуре. Выбранные образцы инкубировали также при более низкой концентрации (20 мг/мл).
Анализ ванкомицина HILIC HPLC с нормальными фазами
[000196] Ранее, анализ обращеннофазовой HPLC разработали и использовали в первом исследовании при разработке липосомного ванкомицина (Публикация патентной заявки США No. US 2009-0104257, озаглавленной «Liposomal Vancomycin Formulations», полное содержание которой приведено в настоящем документе в качестве ссылки). В способе использовали колонку Atlantis® dC18 (Waters) и использовали бинарный градиент подвижной фазы с концентрацией ацетонитрила, меняющейся от 7% до 20% в воде. Подвижная фаза, однако, являлась слишком полярной для растворения содержащих липид образцов. Пробовали экстракцию органической фазы, но возникли проблемы.
[000197] По настоящему изобретению, разработан новый анализ, т.е., HILIC (жидкостная хроматография гидрофильного взаимодействия) HPLC с нормальными фазами. В новом анализе используют колонку ZIC-HILIC (SeQuant) и разделяют соединения по различиям полярности. Более того, в способе HILIC можно использовать менее полярную подвижную фазу, и таким образом, можно растворять как ванкомицин, так и (см. раздел Материалы и методы). В частности, в качестве подвижной фазы выбрана: ацетонитрил 37%, метанол 24%, вода 39%, уксусная кислота 0,08%, гидроксид аммония 0,02%. Недостатками этого способа являются: высокая (однако, управляемая) чувствительность к составу подвижной фазы, и более широкие пики по сравнению с анализом RP. См. типичную хроматограмму на фигуре 4.
Химическая стабильность ванкомицина в водном растворе
[000198] Образцы растворов ванкомицина в концентрации 200 мг/мл и pH 5,0, 5,5, 6,0 и 6,5, получали добавлением подходящего количества раствора NaOH (50 мМ или 100 мМ). В забуференные образцы добавляли подходящее количество добавки буфера или аминокислоты. Значения pH выбирали для покрытия диапазона между низшим и высшим приемлемыми значениями pH, включая pH 5,0, по соображениям стабильности липида, и pH 6,5, выше которого ожидают непрактично быстрое разложение.
[000199] Концентрацию 200 мг/мл выбрали для имитации того, насколько высокой она может быть внутри липосом, но не выше, чем концентрация для целей практических манипуляций. Все образцы представляли собой жидкие растворы после получения. В ходе инкубации, большинство образцов перешли в гелеобразную консистенцию и последняя твердела дальше до воскообразной формы. В некоторых образцах с высоким уровнем распада, наблюдали кристаллические гранулы, погруженные в сформированный гель.
[000200] Эксперимент начинали с образцов ванкомицина, в которых pH корректировали посредством добавления NaOH или органического основания (например, Трис-основания, этаноламина (EOA) или триэтаноламина (TEOA)), как показано в таблице 7. Для сравнения, растворы с более низкой концентрацией (20 мг/мл) также получали посредством разведения образцов 200 мг/мл в 10 раз в воде. Образцы инкубировали при 4°C (в холодильнике) и при температуре окружающей среды (приблизительно 23°C, обозначенной в настоящем документе как «комнатная температура» или «RT»).
|
|
|
[000201] При более высокой концентрации и более низком pH, ванкомицин являлся более стабильным (таблица 8, фигура 5). При низкой концентрации, эффект казался неявным или даже обратным. Основным различием образцов с низкой и высокой концентрацией являлось их физическое состояние. При высокой концентрации ванкомицин с течением времени формировал гелеобразную структуру. При низкой концентрации, он оставался жидким, пока не начинал формироваться белый преципитат. Исключение ионов натрия и использование вместо них органических буферных оснований для коррекции pH заметно не изменяло кинетику распада (фигура 6).
[000202] В общем, обобщенный график на фигуре 7 показывает, что при высокой концентрации и низком pH ванкомицин может являться до некоторой степени стабильным со скоростью распада приблизительно 0,1% в неделю. Однако, это не считают достаточно хорошим для разработки практичного коммерческого продукта. Добавление эквимолярного количества ионов аммония (NH4Cl) не улучшало стабильности ванкомицина. Этанол при 10% эффективно предотвращал гелеобразование и преципитацию ванкомицина, но опять не замедлял скорость его распада.
[000203] При комнатной температуре скорости распада были приблизительно в десять раз выше, но для данных показана более сильная вариабельность (таблица 9 и фигуры 8-10).
|
|
[000204] Не присутствовало явных эффектов буферов, ионов аммония или добавленного этанола. Высокую вариабельность данных можно объяснить негомогенным характером образцов после длительной инкубации при комнатной температуре. Образцы отверждались и обладали рядом погруженных в них кристаллических гранул. Отбор аликвоты образца для анализа часто приводил к получению части образца меняющейся консистенции.
Пример 2. Эффект аминокислотных добавок на химическую стабильность ванкомицина
[000205] Известно, что некоторые пептиды, настолько короткие, как две или три аминокислоты, могут прочно связываться с ванкомицином и таким образом стабилизировать его структуру против дезамидирования (Harris et al., 1985, J. Antibiot, 38(1):51-7). Идентифицировано два таких пептида, т.е., Ac-D-Ala-D-Ala и Di-Ac-L-Lys-D-Ala-D-Ala. В то время как их потенциально можно использовать для обеспечения улучшенной стабильности ванкомицина, они не являются экономически эффективными средствами для улучшения стабильности ванкомицина.
[000206] Ниже приведен список аминокислот, идентифицированных для тестирования (таблица 10). Аминокислоты добавляли на основе моля на моль, если не указано иначе. Конечный pH доводили до pH 5,0 или pH 5,5, где указано, посредством добавления соответствующего количества NaOH. Образцы в концентрации 200 мг/мл, по 1 мл каждый, помещали в 4 мл стеклянные флаконы и инкубировали при конкретной контролируемой температуре. Образцы анализировали посредством HILIC HPLC, и CDP % рассчитывали как сумму CDP-I-m и CDP-I-M % для суммы ванкомицина и его продуктов.
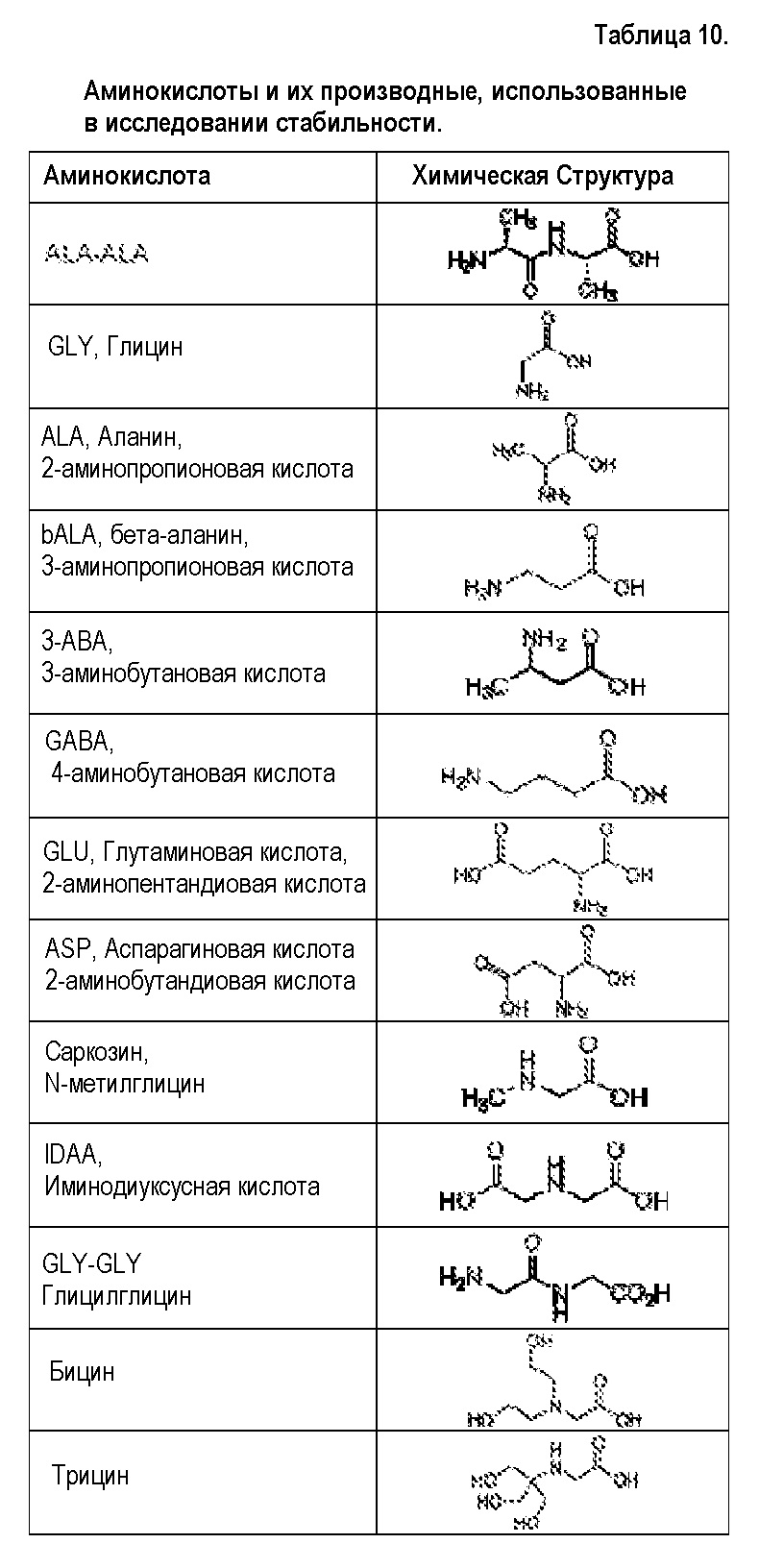
[000207] Подробная таблица данных о стабильности при 4°C представлена в таблице 11 и на фигуре 11. Обнаружены значительные различия в скорости распада, где наихудшая скорость обнаружена для образцов, инкубированных с L-ALA, b-ALA, 3-ABA и GLY. В то же самое время, большое улучшение наблюдали при использовании бицина, иминодиуксусной кислоты (IDAA), глицилглицина (GLY-GLY) и GLU при молярном соотношении с ванкомицином 2:1. Скорость, настолько низкую, как 0,01% в неделю, наблюдали для некоторых соединений, включая бицин, IDAA и GLY-GLY. В отличие от этого, для контрольных соединений, не содержащих аминокислоту или ее производное, наблюдали скорость 0,09%. Таким образом, стабилизированная композиция гликопептидного антибиотика, содержащая аминокислоту, например, такую как бицин, IDAA или GLY-GLY, являлась по меньшей мере на 88% более стабильной при 4°C, чем гликопептидный антибиотик, не содержащий аминокислоту или ее производное.
|
|
[000208] Подобное исследование, проведенное для образцов при комнатной температуре, представлено в таблице 13 и на фигуре 12. Некоторые из аминокислот, не действовавших очень хорошо при 4°C, были значительно лучше для стабилизации ванкомицина при комнатной температуре. GABA, D-ALA, D-GLU и ASP уменьшали распадом до приблизительно 0,2-0,4% в неделю, по сравнению с приблизительно 1,4% в неделю в контроле. Таким образом, стабилизированная композиция гликопептидного антибиотика, содержащая аминокислоту или ее производное, например, такое как GABA, D-ALA, D-GLU или ASP, являлась от приблизительно 71,4% до приблизительно 85,7% более стабильной при RT, чем гликопептидный антибиотик, не содержащий аминокислоту или ее производное.
|
[000209] Соотношение скорости превращения при комнатной температуре (RT) к скорости при 4°C рассчитано в последней колонке в таблице 13. Это соотношение существенно варьирует, от 3,3 для D-ALA до 145 для IDAA. Это может указывать на то, что различные АК по разному влияют на реакцию превращения ванкомицина в CDP. Без ограничения теорией, скорость можно изменять посредством изменения энергии активации или посредством изменения других факторов, таких как ориентация функциональной группы или вероятность столкновения.
[000210] Одним из способов исследования этих факторов является определение скорости превращения при различных температурах и представление данных в форме графика Аррениуса. График Аррениуса показывает логарифм кинетических констант (ln(k), ось ординат), нанесенный на график в зависимости от обратной температуры (1/T, абсцисса). Для одиночного ограниченного по скорости термически активированного процесса, график Аррениуса образует прямую линию, из которой можно определить как энергию активации, так и предэкспоненциальный множитель.
[000211] Уравнение Аррениуса можно записать как:
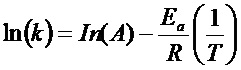
где:
k=Константа скорости
A=Предэкспоненциальный множитель
Ea=Энергия активация
R=Газовая постоянная
T=Абсолютный температура, K
[000212] При нанесении на график описанным выше способом, значение «точки пересечения с осью Y» соответствует ln(A), и наклон линии равен −Ea/R. Предэкспоненциальный множитель, A, представляет собой коэффициент пропорциональности, принимающий во внимание ряд факторов, таких как частота столкновений между вступающими в реакцию частицами и их ориентация.
|
[000213] Для этого уравнения использовали образцы ванкомицина при 200 мг/мл и pH, доведенном до pH 5,5. Из наклона кривой аппроксимированной линии на графике Аррениуса (Фигура 13) определяли энергию активации для превращения ванкомицина в CDP (Таблица 14). В контрольном образце без аминокислот, энергия активации составляла 89,7 кДж/моль. Все тестированные аминокислоты увеличивали энергию активации, где бицин приводил к увеличению до приблизительно 123 кДж/моль.
Пример 3. Стабильность составов липосомного ванкомицина-аминокислот
[000214] Три состава (см. таблицу 15) липосомного ванкомицина получали с использованием способа инфузии с 3 потоками, показанного на фигуре 14.
|
[000215] Липосомы промывали и концентрировали до приблизительно 20 мг/мл липида. Соотношение лекарственное средство:липид составляло приблизительно 0,2. Приблизительно 1 мл каждого образца инкубировали при 4°C и при RT. С течением времени липосомы осели в первых двух партиях. В супернатанте этих образцов анализировали ванкомицин в качестве показателя свободного ванкомицина. Распад общего ванкомицина измеряли после встряхивания образцов и отбора аликвот по 10 мкл.
[000216] Данные представлены в таблице 16 и на фигурах 15 и 16. По этому ограниченному времени инкубации можно видеть, что стабильность ванкомицина внутри липосом является сравнимой или лучшей, чем стабильность в растворе ванкомицина с добавленным GLU. Например, скорость для ванкомицина - GLU (1:1) составляла 0,12% в неделю (таблица 11), по сравнению с 0,025-0,035% в неделю (таблица 16) при инкапсуляции в липосомы.
[000217] Кроме того, оценка свободного ванкомицина на основании уровня ванкомицина в супернатанте указывает на умеренное или слабое подтекание при 4°C и при RT (фигуры 17 и 18, соответственно). Таким образом, композиции стабилизированного гликопептидного антибиотика на основе липида по настоящему изобретению неожиданно являются более стабильными по сравнению с композициями гликопептидного антибиотика, не основанными на липиде и/или не содержащими аминокислоту или ее производное.
|
[000218] В общем, данные указывают на то, что добавление аминокислот и их производных заметно влияло на скорость распада ванкомицина. Наиболее многообещающими аминокислотами являлись бицин, иминодиуксусная кислота (IDAA), глицилглицин (GLY-GLY) и GLU (при использовании в молярном соотношении с ванкомицином 2:1). При 4°C наблюдали скорости распада, настолько низкие, как 0,01% в неделю. Графики Аррениуса для распада в присутствии ключевых аминокислот можно было хорошо аппроксимировать до линейной функции. Данные позволяют предполагать, что улучшение стабильности вызвано увеличением значения энергии активации от 87 кДж/моль до вплоть до 120 кДж/моль. Более того, для инкапсуляции в липосомы композиций ванкомицина-аминокислоты показали превосходную химическую стабильность.
Пример 4. Стабильность составов липосомного гликопептидного антибиотика-аминокислот
[000219] Составы липосомного гликопептидного антибиотика, содержащие тейкопланин, телаванцин, оритаванцин, декапланин или далбаванцин, получали с использованием способа инфузии с 3 потоками, показанного на фигуре 14. Липидные компоненты в составах содержат DPPC, DPPC + холестерин, DPPG, DPPG + холестерин, DPPC + DPPC + холестерин или POPC. Аминокислотные компоненты в составах содержат бицин, GLU, GLY-GLY, IDAA, ASP или D-ALA.
[000220] Липосомы промывали и концентрировали до приблизительно 20 мг/мл липида. Приблизительно 1 мл каждого образца инкубировали при 4°C и при RT. Для оценки стабильности гликопептидного антибиотика в составе, свободный гликопептидный антибиотик анализировали в супернатанте. Распад общего гликопептидного антибиотика измеряли после встряхивания образцов и отбора аликвот по 10 мкл.
* * * * *
[000221] Полное содержание всех публикаций, прoтоколов, патентов и патентных заявок, процитированных в настоящем документе, приведено в настоящем документе в качестве ссылок для всех целей.
[000222] В то время как описанное изобретение описано в отношении конкретных вариантов его осуществления, специалистам в данной области следует понимать, что можно вносить различные изменения, и эквиваленты можно заменять без отклонения от фактической сущности и объема изобретения. Кроме того, множество модификаций можно выполнять для адаптации фактической сущности и объема изобретения к конкретной ситуации, материалу, смеси химически связанных веществ, способу, стадии или стадиям способа. Все такие модификации предназначены для включения в объем прилагаемой формулы изобретения.