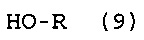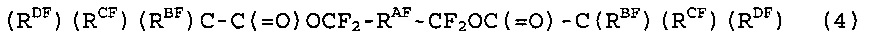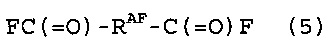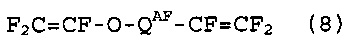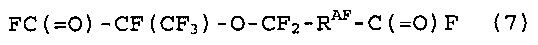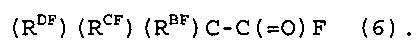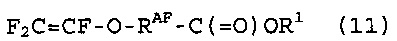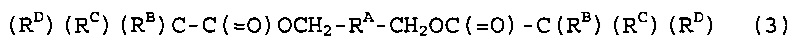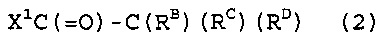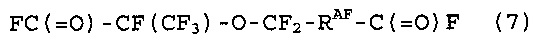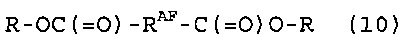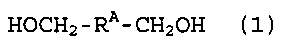Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ФТОРИРОВАННОГО СОЕДИНЕНИЯ
Вид РИД
Изобретение
область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к способу получения применяемого в промышленности фторированного соединения.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Фторированный мономер, такой как перфтор(алкилвиниловый эфир), является пригодным в качестве исходного мономера для фторированной смолы, которая обладает превосходной стойкостью против теплового старения и химической устойчивостью. Например, перфтор(алкилвиниловый эфир), содержащий карбоксильную группу в своей молекуле, является пригодным в качестве исходного мономера для ионообменной мембраны, и его получают через диацилфторид (непатентный документ 1).
В качестве способа получения диацилфторида, применяемого для получения фторированного мономера, известен способ, включающий следующие стадии (1)-(3) (патентный документ 1).
Стадия (1): стадия реакции бифункционального спирта с моноацилфторидом, получая частично фторированный эфир.
Стадия (2): стадия получения перфторэфира из частично фторированного эфира реакцией фторирования.
Стадия (3): стадия получения диацилфторида реакцией разложения перфторэфира.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентный документ
Патентный документ 1: WO2002/004397
НЕПатентный документ
Непатентный документ 1: J. Fluorine Chem., 94, 65-68 (1999)
ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Однако в способе получения, описанном в патентном документе 1, выход перфторэфира на стадии (2) выше является низким.
Цель настоящего изобретения заключается в обеспечении способа получения требуемого перфторированного соединения с хорошим выходом на стадии фторирования частично фторированного эфира.
РЕШЕНИЕ ПРОБЛЕМЫ
Настоящее изобретение обеспечивает способ получения фторированного соединения, имеющий следующие пункты [1]-[14].
[1] Способ получения фторированного соединения, который включает стадию (I) реакции соединения (1), представленного следующей формулой (1), и соединения (2), представленного следующей формулой (2), получая соединение (3), представленное следующей формулой (3) (в котором содержание фтора составляет, по меньшей мере, 30% по массе), и стадию (II) фторирования соединение (3) в жидкой фазе, получая соединение (4), представленное следующей формулой (4),
|
где
RA: двухвалентный насыщенный углеводородный радикал или частично галогенированный двухвалентный насыщенный углеводородный радикал,
RB, RC и RD: RB представляет собой такую же фторированную моновалентную органическую группу как RBF, моновалентную органическую группу, которая превращается в RBF реакцией фторирования, атом водорода или атом галогена; RC представляет собой такую же фторированную моновалентную органическую группу как RCF или моновалентную органическую группу, которая превращается в RCF реакцией фторирования; и RD представляет собой такую же фторированную моновалентную органическую группу как RDF или моновалентную органическую группу, которая превращается в RDF реакцией фторирования,
X1: атом галогена,
RAF: группа, в которой все атомы водорода в RA замещены атомами фтора,
RBF: где RB представляет собой атом водорода, RBF представляет собой атом фтора; когда RB представляет собой атом галогена, RBF представляет собой такой же атом галогена как RB; и когда RB не является ни атомом водорода, ни атомом галогена, RBF представляет собой фторированную моновалентную органическую группу, которая является одинаковой или отличной от RB, и когда она является отличной, RBF представляет собой группу, которая является RB фторированной,
RCF: моновалентная фторированная органическая группа, которая является одинаковой или отличной от RC, и когда она является отличной, RCF представляет собой группу, которая является RC фторированной, и
RDF: фторированная моновалентная органическая группа, которая является одинаковой или отличной от RD, и когда она является отличной, RDF представляет собой группу, которая является RD фторированной.
[2] Способ получения фторированного соединения по [1], где количество атомов углерода RA равно самое большое 20, и когда каждый из RB, RC и RD представляет собой фторированную моновалентную органическую группу или моновалентную органическую группу, количество их атомов углерода равно самое большое 10.
[3] Способ получения фторированного соединения по [1] или [2], где RA представляет собой (CH2)n, и RAF представляет собой (CF2)n (когда n представляет собой целое от 1 до 10).
[4] Способ получения фторированного соединения по любому из [1]-[3], где RB и RBF представляют собой атомы фтора, RC и RCF представляют собой одинаковые C1-3 перфторалкильные группы, и RD и RDF представляют собой одинаковые C1 перфторалкильные группы, одинаковые C2-6 перфторалкоксильные группы или одинаковые C4-8 перфторалкоксильные группы, содержащие один эфирный атом кислорода.
[5] Способ получения фторированного соединения по любому из [1]-[4], где на стадии (II) фторирование осуществляют подводом газообразного фтора, разбавленного инертным газом, в жидкую фазу, и доля газообразного фтора составляет от 30 до 60% по объему в суммарных 100% по объему инертного газа и газообразного фтора.
[6] Способ получения фторированного соединения по любому из [1]-[5], где фторирование осуществляют в жидкой фазе, содержащий растворитель для реакции фторирования, и растворитель для реакции фторирования представляет собой фторированный растворитель, не содержащий C-H связи и содержащий эфирный атом кислорода.
[7] Способ получения фторированного соединения по [6], где фторированный растворитель представляет собой (RDF)(RCF)(RBF)C-C(=O)F, где RBF, RCF и RDF являются одинаковыми, как определено выше.
[8] Способ получения фторированного соединения, который включает стадии (I) и (II), как определено в любом из [1]-[7], и стадию (III) реакции расщепления соединения (4), получая, по меньшей мере, одно из соединения (5), представленного следующей формулой (5), и соединения (6), представленного следующей формулой (6):
|
[9] Способ получения фторированного соединения по [8], где на стадии (II) фторирование осуществляют в жидкой фазе, содержащей растворитель для реакции фторирования, и растворитель для реакции фторирования представляет собой, по меньшей мере, один член, выбранный из группы, состоящей из соединения (5) и соединения (6).
[10] Способ получения фторированного соединения, который включает стадии (I), (II) и (III), как определено в [8] или [9], стадию (IV) реакции соединение (5) с гексафторпропиленоксидом, получая соединение (7), представленное следующей формулой (7), и стадию (V) теплового разложения соединение (7), получая соединение (8), представленное следующей формулой (8):
|
где
RAF: такой же, как определено выше, и
QAF: когда количество атомов углерода RAF равно 1, QAF представляет собой одинарную связь; когда количество атомов углерода RAF равно, по меньшей мере, 2, QAF представляет собой группу, в которой количество атомов углерода является меньшим на 1, чем в RAF, и где все атомы водорода в насыщенном двухвалентном углеводородном радикале или частично галогенированном двухвалентном углеводородном радикале замещены атомами фтора.
[11] Способ получения фторированного соединения, который включает стадии (I), (II) и (III), как определено в [8] или [9], и стадию (VI) реакции соединение (5) с соединением (9), представленным следующей формулой (9), получая соединение (10), представленное следующей формулой (10):
|
где R представляет собой группу, выбранную из группы, состоящей из -CH3, -CH2CH3 и -CH(CH3)2.
[12] Способ получения фторированного соединения, который включает стадии (I), (II) и (III), как определено в [8] или [9], стадию (IV) реакции соединение (5) с гексафторпропиленоксидом, получая соединение (7), представленное следующей формулой (7), и стадию (VII) теплового разложения соединение (7), с последующей реакцией с R1OH, получая соединение (11), представленное следующей формулой (11):
|
где
RAF: такой же, как определено выше, и
R1: C1-10 алкильная группа.
[13] Способ получения фторированного полимера, который включает получение соединения (8) способом, как определено в [10], и полимеризацию соединения (8).
[14] Способ получения фторированного полимера, который включает получение соединения (11) способом, как определено в [12], и полимеризацию соединение (11).
ПОЛЕЗНЫЕ ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Согласно способу получения фторированного соединения настоящего изобретения в реакции фторирования частично фторированного эфира требуемое перфторированное соединение можно получить с хорошим выходом.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В настоящем описании, соединение, представленное формулой (1), приводится как соединение (1). Соединения, представленные другими формулами, также приводятся аналогичным способом.
Следующие определения терминов применяют во всем описании, включая формулу изобретения.
В настоящем описании “органическая группа” представляет собой группу, по существу содержащую атомы углерода, и “углеводородный радикал” представляет собой группу, состоящую из атомов углерода и атомов водорода.
В настоящем описании “галоген” обозначает фтор, хлор, бром или йод.
В настоящем описании “галогенирование” обозначает замещение атома, который не является атомом галогена (например, атома водорода, соединенного с атомом углерода), атомом галогена, замещение группы, соединенной с атомом углерода (например, гидрокси группы, соединенной с атомом углерода), атомом галогена, или присоединение атома галогена к группе атомов, не содержащей атома галогена (например, группе атомов, состоящей из двух атомов углерода, которые образуют двойную связь или тройную связь). Кроме того, замещение атома галогена другим атомом галогена можно также называть “галогенированием” замещенного атома галогена (например, фторирование может иногда обозначать замещение атома хлора или подобного атомом фтора).
В настоящем описании группа, “которую можно галогенировать”, представляет собой группу, содержащую, по меньшей мере, один атом, группу и группу атомов, которую можно галогенировать реакцией галогенирования.
В настоящем описании “галогенированная группа” представляет собой органическую группу, которая образована галогенированием органической группы, содержащей группу, которую можно галогенировать. Например, галогенированный углеводородный радикал представляет собой органическую группу, образованную галогенированием углеводородного радикала.
“Частично галогенированная группа” представляет собой группу, которая представляет собой галогенированную группу, и которая содержит группу, которую можно галогенировать.
“Пергалогенированная группа” представляет собой группу, которая представляет собой галогенированную группу, и которая не содержит группу, которую можно галогенировать.
“Фторированная пергалогенированная группа” представляет собой пергалогенированную группу, содержащую, по меньшей мере, один атом фтора среди атомов галогена.
В следующем настоящем описании, включая формулу изобретения, “реакция фторирования” обозначает реакцию фторирования на стадии (II) в настоящем изобретении.
Аналогично, “фторирование” обозначает фторирование в реакции фторирования на стадии (II) в настоящем изобретении.
В следующем настоящем описании, органическая группа, “которую можно фторировать”, обозначает органическую группу, содержащую, по меньшей мере, один из атома, группы и группы атомов, которые можно фторировать реакцией фторирования на стадии (II) в настоящем изобретении.
В настоящем описании, “углеводородный радикал, содержащий гетероатом” представляет собой углеводородный радикал, содержащий гетероатом, который не превращается реакцией фторирования (например, атом кислорода в алкокси группе или эфирный атом кислорода), или углеводородный радикал, содержащий гетероатомную группу, которая не превращается реакцией фторирования (например, карбонильную группу или сульфонильную группу).
Галогенированная (углеводород, содержащий гетероатом) группа представляет собой группа, которая образована галогенированием углеводородного радикала, содержащего гетероатом. Пергалогенированная (углеводород, содержащий гетероатом) группа представляет собой галогенированную (углеводород, содержащий гетероатом) группу, не содержащую группу, которую можно галогенировать, и частично галогенированная (углеводород, содержащий гетероатом) группа представляет собой галогенированную (углеводород, содержащий гетероатом) группу, содержащую группу, которую можно галогенировать.
Способ получения фторированного соединения настоящего изобретения включает следующую стадию (I) и стадию (II) и, по мере надобности, включает следующие стадии (III)-(VI).
Далее, будет описана каждая стадия.
[Стадия (I)]
Стадия (I) представляет собой стадию реакции следующего соединения (1) и следующего соединения (2), получая следующее соединение (3) (в котором содержание фтора составляет, по меньшей мере, 30% по массе).
|
(RA)
RA представляет собой двухвалентный насыщенный углеводородный радикал или частично галогенированный двухвалентный насыщенный углеводородный радикал. RA не содержит гетероатом, такой как эфирный атом кислорода. Когда RA не содержит гетероатом, такой как эфирный атом кислорода, соединение (3) не склонно к разложению после приведенной стадии (II). Таким образом, выход требуемого соединения (4) на стадии (II) является превосходным. Количество атомов углерода RA составляет предпочтительно 1-20, особенно предпочтительно 1-10, с точки зрения растворимости соединения (3) в жидкой фазе и т.д., на приведенной выше стадии (II).
Двухвалентный насыщенный углеводородный радикал может, например, представлять собой алкиленовую группу или двухвалентный насыщенный углеводородный радикал, содержащий кольцевую структуру. Двухвалентный насыщенный углеводородный радикал, содержащий кольцевую структуру, может, например, представлять собой двухвалентный насыщенный углеводородный радикал, содержащий замещающую группу, выбранную из группы, состоящей из циклоалкильной группы, бициклоалкильной группы и моновалентной группы, содержащей алициклическую спироструктуру; циклоалкиленовую группу; бициклоалкиленовую группу; или двухвалентный насыщенный углеводородный радикал, содержащий циклоалкиленовую группу или бициклоалкиленовую группу в качестве частичной структуры.
Двухвалентный насыщенный углеводородный радикал предпочтительно представляет собой алкиленовую группу, с точки зрения доступности. Алкиленовая группа может быть линейной или разветвленной, и алкиленовая группа предпочтительно является линейной, поскольку степень превращения соединения (3) на стадии (II) является превосходной.
Частично галогенированный двухвалентный насыщенный углеводородный радикал предпочтительно представляет собой группу, в которой некоторые из атомов водорода в двухвалентном насыщенном углеводородном радикале выше замещены атомами галогена, особенно предпочтительно частично галогенированную алкиленовую группу, в которой некоторые из атомов водорода в алкиленовой группе замещены атомами галогена. Атом галогена в частично галогенированной алкиленовой группе предпочтительно представляет собой атом фтора, атом хлора или атом брома.
RA предпочтительно представляет собой C1-20 линейную алкиленовую группу, особенно предпочтительно C1-10 линейную алкиленовую группу. Конкретно, можно привести -(CH2)2-, -(CH2)3-, -(CH2)4- или подобные.
(RB, RC и RD)
RB представляет собой такую же фторированную моновалентную органическую группу как RBF, моновалентную органическую группу, которая превращается в RBF реакцией фторирования, атом водорода или атом галогена.
RC представляет собой такую же фторированную моновалентную органическую группу как RCF или моновалентную органическую группу, которая превращается в RCF реакцией фторирования.
RD представляет собой такую же фторированную моновалентную органическую группу как RDF или моновалентную органическую группу, которая превращается в RDF реакцией фторирования.
В формуле (2), -C(RB)(RC)(RD) группа представляет собой разветвленную группу. Разветвленная группа имеет большой объем и, посредством этого, соединение (3), содержащее данную группу, с трудом разлагается на стадии (II). Соответственно, выход соединения (4) на стадии (II) является превосходным.
<RB>
Когда RB представляет собой такую же фторированную моновалентную органическую группу как RBF, RB представляет собой фторированную моновалентную органическую группу, которая не фторируется реакцией фторирования. Например, можно привести фторированный пергалогенированный моновалентный насыщенный углеводородный радикал; фторированную пергалогенированную группу (моновалентный насыщенный углеводород, содержащий гетероатом); и т.д.
Органическая группа, которую можно фторировать реакцией фторирования на стадии (II), содержит, по меньшей мере, один член, выбранный из группы, состоящей из следующих атома, группы атомов и группы. Органическая группа, которая не фторируется реакцией фторирования, не содержит любого из них.
Атом, который можно фторировать реакцией фторирования, может, например, представлять собой атом водорода, соединенный с атомом углерода.
Группа атомов, которую можно фторировать реакцией фторирования, может, например, представлять собой группу атомов, с которой может быть соединен атом фтора, такую как >C=C< или -C≡C-. >C=C< фторируют до >CF-CF<, и -C≡C- фторируют до -CF2-CF2-. Кроме того, атом, который можно фторировать, можно присоединять к группе атомов, которую можно фторировать, и например, -CH=CH- фторируют до -CF2-CF2-.
Группа, которую можно фторировать реакцией фторирования, может, например, представлять собой карбокси группу, становящуюся фторкарбонильной группой реакцией фторирования; или группу, содержащую карбонильную группу, встроенную между углерод-углеродной связью алкильной группы.
Моновалентный насыщенный углеводородный радикал, становящийся фторированным пергалогенированным моновалентным насыщенным углеводородным радикалом или фторированной пергалогенированной (моновалентный насыщенный углеводород, содержащий гетероатом) группой, может, например, представлять собой алкильную группу, циклоалкильную группу или моновалентный насыщенный углеводородный радикал, содержащий кольцевую структуру (такую как циклоалкильная группа, циклоалкилалкильная группа или бициклоалкильная группа, группа, содержащая алициклическую спироструктуру, или группа, содержащая данную группу в качестве частичной структуры).
Когда RB представляет собой такую же фторированную моновалентную органическую группу как RBF, конкретно RB предпочтительно представляет собой фторированную пергалогенированную алкильную группу, фторированную пергалогенированную алкильную группу, содержащую, по меньшей мере, один эфирный атом кислорода, фторированную пергалогенированную алкокси группу или фторированную пергалогенированную алкокси группу, содержащую, по меньшей мере, один эфирный атом кислорода, особенно предпочтительно перфторалкильную группу, перфторалкильную группу, содержащую, по меньшей мере, один эфирный атом кислорода, перфторалкокси группу или перфторалкокси группу, содержащую, по меньшей мере, один эфирный атом кислорода.
Когда RB представляет собой такую же фторированную моновалентную органическую группу как RBF, количество атомов углерода RB предпочтительно составляет 1-20, особенно предпочтительно 1-10, с точки зрения растворимости соединения (3) в жидкой фазе на приведенной выше стадии (II), подавления разложения соединения (3) на стадии (II) и т.д. RB может быть линейным или разветвленным.
Когда RB представляет собой моновалентную органическую группу, становящуюся RBF реакцией фторирования, RB может, например, представлять собой моновалентный насыщенный углеводородный радикал; моновалентный насыщенный углеводородный радикал, содержащий гетероатом; частично галогенированный моновалентный насыщенный углеводородный радикал; частично галогенированную (моновалентный насыщенный углеводород, содержащий гетероатом) группу; моновалентный ненасыщенный углеводородный радикал; моновалентный ненасыщенный углеводородный радикал, содержащий гетероатом; частично галогенированный моновалентный ненасыщенный углеводородный радикал; частично галогенированную (моновалентный ненасыщенный углеводород, содержащий гетероатом) группу; или моновалентную органическую группу, содержащую группу, которую можно фторировать.
Моновалентный насыщенный углеводородный радикал в моновалентном насыщенном углеводородном радикале, содержащем гетероатом, частично галогенированном моновалентном насыщенном углеводородном радикале и частично галогенированной (моновалентный насыщенный углеводород, содержащий гетероатом) группе может, например, быть такой же группой, как приведено в качестве моновалентного насыщенного углеводородного радикала в фторированном пергалогенированном моновалентном насыщенном углеводородном радикале и фторированной пергалогенированной (моновалентный насыщенный углеводород, содержащий гетероатом) группе.
Конкретно, моновалентный ненасыщенный углеводород, который можно фторировать, может, например, представлять собой циклогексенильную группу, фенильную группу, алкенильную группу или алкинильную группу.
Когда RB представляет собой моновалентную органическую группу, которая превращается в RBF реакцией фторирования, RB особенно предпочтительно представляет собой моновалентный насыщенный углеводородный радикал; моновалентный насыщенный углеводородный радикал, содержащий гетероатом; частично галогенированный моновалентный насыщенный углеводородный радикал; или частично галогенированную (моновалентный насыщенный углеводород, содержащий гетероатом) группу. Конкретно, предпочтительной является алкильная группа, алкокси группа, алкильная группа, содержащая, по меньшей мере, один эфирный атом кислорода, алкокси группа, содержащая, по меньшей мере, один эфирный атом кислорода, частично галогенированная алкильная группа, частично галогенированная алкокси группа, частично галогенированная алкильная группа, содержащая, по меньшей мере, один эфирный атом кислорода, или частично галогенированная алкокси группа, содержащая, по меньшей мере, один эфирный атом кислорода.
Когда RB представляет собой моновалентную органическую группу, которая превращается в RBF реакцией фторирования, количество атомов углерода RB предпочтительно составляет 1-20, особенно предпочтительно 1-10, с точки зрения растворимости соединения (3) в жидкой фазе на приведенной выше стадии (II), подавления разложения соединения (3) на стадии (II) и т.д. RB может быть линейным или разветвленным.
Когда RB представляет собой атом галогена, RB предпочтительно представляет собой атом фтора, атом хлора или атом брома, особенно предпочтительно атом фтора.
<RC>
Когда RC представляет собой такую же фторированную моновалентную органическую группу как RCF, RC может, например, представлять такую же группу, как представлено RB, и такая же группа является предпочтительной.
Когда RC представляет собой моновалентную органическую группу, которая превращается в RCF реакцией фторирования, RC может, например, представлять такую же группу, как представлено RB, и такая же группа является предпочтительной.
Когда RC представляет собой такую же фторированную моновалентную органическую группу как RCF или моновалентную органическую группу, которая превращается в RCF реакцией фторирования, количество атомов углерода RC предпочтительно составляет 1-20, особенно предпочтительно 1-10, с точки зрения растворимости соединения (3) в жидкой фазе на приведенной выше стадии (II), подавления разложения соединения (3) на стадии (II) и т.д. RC может быть линейным или разветвленным.
<RD>
Когда RD представляет собой такую же фторированную моновалентную органическую группу как RDF, RD может, например, представлять такую же группу, как представлено RB, и такая же группа является предпочтительной.
Когда RD представляет собой моновалентную органическую группу, которая превращается в RDF реакцией фторирования, RD может, например, представлять такую же группу, как представлено RB, и такая же группа является предпочтительной.
Когда RD представляет собой такую же фторированную моновалентную органическую группу как RDF или моновалентную органическую группу, которая превращается в RDF реакцией фторирования, количество атомов углерода RD предпочтительно составляет 1-20, особенно предпочтительно 1-10, с точки зрения растворимости соединения (3) в жидкой фазе на приведенной выше стадии (II), подавления разложения соединения (3) на стадии (II) и т.д. RC может быть линейным или разветвленным.
<Комбинация RB, RC и RD>
В качестве комбинации RB, RC и RD, предпочтительная комбинация является такой, что любой из RC и RD представляет собой C1-3 моновалентную органическую группу, любой из RC и RD представляет собой C1-10 моновалентную органическую группу, и RB представляет собой атом водорода или атом галогена, с точки зрения растворимости соединения (3) в жидкой фазе на стадии (II), подавления разложения соединения (3) на стадии (II) и т.д.
В качестве данной комбинации можно привести, например, такую комбинацию, что RC представляет собой группу, выбранную из группы, состоящей из -CF3, -CF2CF3, -CF2CF2CF3 и -CF(CF3)2, RD представляет собой группу, выбранную из группы, состоящей из -CF3, -OCF2CF(CF3)OCF2CF2CF3, -OCF3, -OCF2CF3, -OCF2CF2CF3, -OCF2CF2CFClCF2Cl, -OCF2CF2Br, -OCF(CF3)CF2CFClCF2Cl и -OCH2CH2CH3, и RB представляет собой атом водорода или атом галогена.
В качестве комбинации RB, RC и RD, более предпочтительной является комбинация, когда RC представляет собой C1-3 перфторалкильную группу или C1-3 перфторалкокси группу, RD представляет собой C1 перфторалкильную группу, C2-10 перфторалкильную группу, содержащую, по меньшей мере, один эфирный атом кислорода, C1-10 перфторалкокси группу или C2-10 перфторалкокси группу, содержащую, по меньшей мере, один эфирный атом кислорода, и RB представляет собой атом фтора.
Комбинация RB, RC и RD представляет собой особенно предпочтительно комбинацию, когда RC представляет собой C1-3 перфторалкильную группу, RD представляет собой C1 перфторалкильную группу, C2-6 перфторалкокси группу или C4-8 перфторалкокси группу, содержащую, по меньшей мере, один эфирный атом кислорода, и RB представляет собой атом фтора.
Более предпочтительная или особенно предпочтительная комбинация может, например, представлять собой комбинацию, когда RC представляет собой группу, выбранную из группы, состоящей из -CF3, -CF2CF3, -CF2CF2CF3 и -CF(CF3)2, RD представляет собой группу, выбранную из группы, состоящей из -CF3, -OCF2CF(CF3)OCF2CF2CF3 и -OCF2CF2CF3, и RB представляет собой атом фтора.
(X1)
X1 представляет собой атом галогена. В качестве атома галогена, можно привести атом фтора, атом хлора, атом брома или атом йода. Атом галогена предпочтительно представляет собой атом фтора, атом хлора или атом брома, особенно предпочтительно атом фтора, с точки зрения реакционноспособности на стадии (1).
(Соединение (1))
В качестве соединения (1), можно конкретно привести следующее соединение (1-1).
|
где n представляет собой количество атомов углерода RA и предпочтительно составляет 1-20, более предпочтительно 1-10, более предпочтительно 1-8, особенно предпочтительно 2-8.
(Соединение (2))
В качестве соединения (2), можно конкретно привести следующие соединения (2-1)-(2-7), и соединения (2-1)-(2-3) являются особенно предпочтительными.
|
Температура кипения соединения (2) предпочтительно составляет -10-200°C, особенно предпочтительно 0-170°C. Когда температура кипения соединения (2) попадает в приведенный выше диапазон, легко осуществлять операцию извлечения для извлечения непрореагировавшего соединения (2) после стадии (I). Например, когда температура кипения соединения (2) равна, по меньшей мере, нижнему пределу в приведенном выше диапазоне, можно извлечь непрореагировавшее соединение (2) без крупногабаритного оборудования, такого как холодильная установка. Когда температура кипения равна самое большое верхнему пределу в приведенном выше диапазоне, без специального нагревательного прибора, непрореагировавшее соединение (2) можно извлечь, применяя универсальный нагревательный прибор, такой как паровая установка. Температуры кипения соединения (2-1)-(2-7) находятся в диапазоне 0-170°C, соответственно.
Соединение (2) можно получить способом получения имеющегося в продаже продукта, способом получения известным способом или подобными.
(Комбинация соединения (1) и соединения (2))
Соединение (1) и соединение (2) смешивают так, чтобы содержание фтора соединения (3), которое получают на стадии (I), составляло, по меньшей мере, 30% по массе. Когда содержание фтора соединения (3) составляет, по меньшей мере, 30% по массе, растворимость соединения (3) в жидкой фазе на стадии (II) является превосходной. Таким образом, реакцию фторирования на стадии (II) можно легко осуществлять в однородной системе, и выход соединения (4) на стадии (II) увеличивается. Содержание фтора соединения (3) предпочтительно составляет 30-86% по массе, особенно предпочтительно 30-76% по массе.
В настоящем изобретении, содержание фтора представляет собой массовую долю атомов фтора в молекулярной массе соединения.
В качестве комбинации соединение (1) и соединение (2), предпочтительно, чтобы соединение, не содержащее атом фтора, применялось в качестве любого из двух, и соединение, содержащее атом фтора, применялось в качестве другого, с точки зрения доступности соединения (1) и соединения (2). Среди них, особенно предпочтительно, чтобы соединение, не содержащее атом фтора, применяли в качестве соединения (1), и соединение, содержащее атом фтора, применяли в качестве соединения (2).
(Соединение (3))
Соединение (3) предпочтительно представляет собой соединение, содержащее в качестве атома, группы атомов или группы, которую можно фторировать, только атом водорода, соединенный с атомом углерода. В данном случае, реакция фторирования на стадии (II) представляет собой только реакцию, в которой атом водорода, соединенный с атомом углерода, замещают атомом фтора. Когда -CH2-RA-CH2- содержит в качестве атома, группы атомов или группы, которую можно фторировать, только атом водорода, соединенный с атомом углерода, и каждый из RB, RC и RD не является группой или атомом, который можно фторировать, фторирование соединения (3) представляет собой только реакцию, в которой атом водорода в -CH2-RA-CH2- замещают атомом фтора.
Конкретно, в качестве соединения (3) можно привести следующее соединение (3-1), полученное реакцией соединения (1-1) и соединения (2-1), следующее соединение (3-2), полученное реакцией соединения (1-1) и соединения (2-2), следующее соединение (3-3), полученное реакцией соединения (1-1) и соединения (2-3), следующее соединение (3-4), полученное реакцией соединения (1-1) и соединения (2-4), следующее соединение (3-5), полученное реакцией соединения (1-1) и соединения (2-5), следующее соединение (3-6), полученное реакцией соединения (1-1) и соединения (2-6), или следующее соединение (3-7), полученное реакцией соединения (1-1) и соединения (2-7).
|
В формулах, n является таким же как n в формуле (1-1).
(Реакция соединения (1) и соединения (2))
Реакция соединения (1) и соединения (2) представляет собой реакция этерификации, и ее можно осуществлять известным способом. Реакцию этерификации можно осуществлять в присутствии растворителя (далее в настоящем изобретении, также называют “растворителем для реакции этерификации”) или в отсутствии растворителя. Растворитель для реакции этерификации предпочтительно представляет собой дихлорметан, хлороформ, триэтиламин или смешанный растворитель триэтиламина и тетрагидрофурана. Количество растворителя для реакции этерификации, которое будут применять, предпочтительно составляет 50-500 частей по массе на 100 частей по массе соединения (1) и соединения (2) в сумме. В случае, когда реакцию этерификации осуществляют в реакторе периодического действия, реакцию этерификации предпочтительно осуществляют в отсутствии растворителя для реакции этерификации, с точки зрения увеличения загружаемого количества соединения (1) и соединения (2) на удельный объем реактора и превосходной производительности.
В реакции этерификации, количество соединения (2) относительно соединения (1) предпочтительно является 1,5-10 кратным по молям, особенно предпочтительно 2-5 кратным по молям.
Нижний предел температуры для реакции соединения (1) и соединение (2) составляет предпочтительно -50°C. В случае, когда реакцию осуществляют в присутствии растворителя для реакции этерификации, верхний предел предпочтительно представляет собой наименьшую температуру между 100°C и температурой кипения растворителя для реакции этерификации. В случае, когда реакцию осуществляют в отсутствии растворителя для реакции этерификации, верхний предел предпочтительно составляет 100°C. Температура реакции особенно предпочтительно составляет -50-100°C.
Продолжительность реакции соединения (1) и соединения (2) можно подходящим способом изменять, в зависимости от скорости подачи исходных соединений и количества соединений, применяемого для реакции. Давление реакции предпочтительно составляет 0-2 МПа (манометрическое давление).
Кислота, представленная HX1, образуется реакцией соединения (1) и соединения (2). Когда X1 представляет собой атом фтора, образуется HF и, следовательно, предпочтительно обеспечить скавенджер HF в реакционной системе. Скавенджер HF может, например, представлять собой фторид щелочного металла или триалкиламин. Фторид щелочного металла предпочтительно представляет собой NaF или KF. В случае, когда не применяют скавенджер HF, предпочтительно, чтобы реакцию осуществляют при температуре реакции, при которой испаряется HF, и HF откачивают потоком азота. Количество скавенджера HF предпочтительно является 1-10 кратным по молям относительно соединения (2).
Неочищенный продукт, содержащий соединение (3), полученное реакцией соединения (1) и соединения (2), можно очищать или можно применять как есть для реакции на стадии (II). Неочищенный продукт предпочтительно очищают с точки зрения хорошего протекания реакции фторирования на стадии (II).
Способ очистки может, например, представлять собой способ перегонки неочищенного продукта как есть, способ обработки неочищенного продукта разбавленной щелочной водой или подобным, с последующей экстракцией жидкость-жидкость, способ экстракции неочищенного продукта подходящим органическим растворителем, с последующей перегонкой или колоночной хроматографией на силикагеле.
[Стадия (II)]
Стадия (II) представляет собой стадию фторирования соединение (3) в жидкой фазе, получая соединение (4), представленное следующей формулой (4). Соединение (4) представляет собой соединение, в котором все атомы, группы атомов и группы, которую можно фторировать в соединении (3)? являются фторированными. Соединение (3), полученное реакцией соединения (1) и соединения (2), почти не разлагается на стадии (II). Таким образом, применяя соединение (3) в качестве соединения для фторирования, соединение (4) можно получить с хорошим выходом.
|
RAF представляет собой группу, в которой все атомы водорода в RA замещены атомами фтора.
(RBF, RCF и RDF)
Когда RB представляет собой атом водорода, RBF представляет собой атом фтора, и когда RB представляет собой атом галогена, RBF представляет собой такой же атом галогена как RB. Когда RB не является ни атомом водорода, ни атомом галогена, RBF представляет собой фторированную моновалентную органическую группу, которая является одинаковой или отличной от RB, и когда она является отличной, RBF представляет собой группу, которая является RB фторированной (группа, в которой все атомы, группы атомов и группы, которые можно фторировать, в RB являются фторированными).
RCF представляет собой фторированную моновалентную органическую группу, которая является одинаковой или отличной от RC, и когда она является отличной, RCF представляет собой группу, которая является RC фторированной (группа, в которой все атомы, группы атомов и группы, которые можно фторировать, в RC являются фторированными).
RDF представляет собой фторированную моновалентную органическую группу, которая является одинаковой или отличной от RD, и когда она является отличной, RDF представляет собой группу, которая является RD фторированной (группа, в которой все атомы, группы атомов и группы, которые можно фторировать, в RD, являются фторированными).
(Соединение (4))
Конкретно, в качестве соединения (4) можно привести следующее соединение (4-1), полученное реакцией фторирования соединения (3-1), следующее соединение (4-2), полученное реакцией фторирования соединения (3-2), следующее соединение (4-3), полученное реакцией фторирования соединения (3-3), следующее соединение (4-4), полученное реакцией фторирования соединения (3-4), следующее соединение (4-5), полученное реакцией фторирования соединения (3-5), следующее соединение (4-6), полученное реакцией фторирования соединения (3-6), или следующее соединение (4-7), полученное реакцией фторирования соединения (3-7).
|
В формулах, n является таким же, как n в формуле (1-1).
(Реакция фторирования соединения (3))
Реакцию фторирования соединения (3) осуществляют в жидкой фазе. Реакцию фторирования предпочтительно осуществляют в жидкой фазе, содержащей растворитель (далее в настоящем изобретении также называют “растворителем для реакции фторирования”). В качестве источника фтора, предпочтительно применяют газообразный фтор. В качестве газообразного фтора, предпочтительно применяют газообразный фтор, разбавленный инертным газом. В качестве инертного газа можно привести благородный газ, такой как газообразный гелий, газообразный неон или газообразный аргон или газообразный азот, газообразный азот или газообразный гелий является предпочтительным, и с точки зрения экономических преимуществ, газообразный азот является особенно предпочтительным. Доля газообразного фтора (далее в настоящем изобретении также называют “количеством газообразного фтора”) предпочтительно составляет 30-60% по объему в 100% по объему суммарного газообразного фтора и инертного газа. Когда количество газообразного фтора составляет, по меньшей мере, нижний предел в приведенном выше диапазоне, предварительно определенное количество газообразного фтора, требуемое для реакции фторирования, можно подводить в реактор в течение короткого периода времени, и посредством этого производительность является превосходной. Кроме того, степень превращения соединения (3) является высокой, селективность соединения (4) становится высокой. Когда количество газообразного фтора составляет, самое большое, верхний предел в приведенном выше диапазоне, безопасность является превосходной.
Соединение (3), полученное реакцией соединения (1) и соединения (2), имеет высокую степень превращения соединения (3) и высокую селективность для соединения (4) даже в условиях, при которых количество газообразного фтора является относительно большим. Таким образом, в данных условиях, при которых количество газообразного фтора является большим, и производительность является превосходной, соединение (4) можно получить с хорошим выходом.
Растворитель для реакции фторирования предпочтительно представляет собой фторированный растворитель, который не фторируется реакцией фторирования, и может, например, представлять собой, перфторалкан или органический растворитель, полученный перфторированием известного органического растворителя, содержащего, по меньшей мере, один атом, выбранный из группы, состоящей из атома хлора, атома азота и атома кислорода в его структуре.
Растворитель для реакции фторирования предпочтительно представляет собой растворитель, являющийся жидким при -100-300°C, особенно предпочтительно растворитель, являющийся жидким при -80-200°C.
В качестве растворителя для реакции фторирования предпочтительно применяют растворитель, в котором растворимость соединения (3) является большой, фторированный растворитель, в котором, по меньшей мере, 1% по массе соединения (3) растворяется при 20°C, является особенно предпочтительным, и растворитель, в котором растворяется, по меньшей мере, 5% по массе соединения (3), является особенно предпочтительным.
В качестве растворителя для реакции фторирования конкретно можно привести перфторалканы (торговое название: FC-72 и т.д.), перфторэфиры (торговое название: FC-75, FC-77 и т.д.), перфторполиэфиры (торговое название: KRYTOX, FOMBLIN, GALDEN, Demnum и т.д.), хлорфторэфиры, хлорфторуглероды (торговое название: Flon Lube), хлорфторполиэфиры, перфторалкиламины (например, перфтортриалкиламин и т.д.) и инертную жидкость (торговое название: ФТОРRT).
Растворитель для реакции фторирования предпочтительно представляет собой фторированный растворитель, содержащий эфирный атом кислорода, и например, можно привести приведенные выше перфторэфиры, перфторполиэфиры и хлорфторэфиры. Среди них, фторированный растворитель, не содержащий атом хлора, является предпочтительным, и перфторэфир или перфторполиэфир является особенно предпочтительным.
В качестве растворителя для реакции фторирования, также предпочтительно применять, по меньшей мере, один член из соединения (5) и соединения (6), которые представляют собой продукты на приведенной выше стадии (III). Когда применяют, по меньшей мере, один член из соединения (5) и соединения (6), необязательно извлекать растворитель после стадии (III), и посредством этого последующая обработка является простой. Обычно, растворитель для реакции фторирования предпочтительно представляет собой соединение (6), поскольку соединение (5) представляет собой требуемый продукт.
Количество растворителя для реакции фторирования, которое будут применять, предпочтительно составляет, по меньшей мере, 5 кратное по массе, особенно предпочтительно 10-100 кратное по массе относительно соединения (3).
Реакционная система для реакции фторирования предпочтительно представляет собой систему периодического действия или систему непрерывного действия. Реакцию фторирования предпочтительно осуществляют <способом 1> или <способом 2>, которые будут описаны далее в настоящем изобретении, и реакция фторирования особенно предпочтительно представляет собой <способ 2>, с точки зрения выхода реакции и селективности соединения (4). Кроме того, газообразный фтор предпочтительно разбавляют инертным газом, таким как газообразный азот для применения, осуществляют ли реакцию в системе периодического действия или в системе непрерывного действия.
<Способ 1>
Способ, в котором соединение (3) и растворитель для реакции фторирования, загружают в реактор, начинают перемешивание, и реакцию осуществляют при непрерывной подаче газообразного фтора, разбавленного инертным газом, к растворителю для реакции фторирования при заданной температуре реакции и давлении реакции.
<Способ 2>
Способ, в котором растворитель для реакции фторирования загружают в реактор и перемешивают. Затем, газообразный фтор, разбавленный инертным газом, соединение (3) и растворитель для реакции фторирования непрерывно подают в растворитель для реакции фторирования при заданном молярном соотношении, при заданной температуре реакции и давлении реакции.
<Способ 3>
Растворитель для реакции фторирования непрерывно загружают в трубчатый реактор, и он попадает в трубчатый реактор. Затем, фторированный газ, разбавленный инертным газом, и растворитель для реакции фторирования, в котором растворено соединение (3), непрерывно подают соответственно в поток растворителя для реакции фторирования в трубчатом реакторе в количествах, при которых газообразный фтор и соединение (3) будут иметь предварительно определенное молярное соотношение, и они смешиваются. В трубчатом реакторе, газообразный фтор и соединение (3) контактируют и реагируют, и растворитель для реакции фторирования, содержащий продукт реакции, удаляют из трубчатого реактора. В данном способе, растворитель для реакции фторирования циркулирует, и продукт реакции удаляют из циркулирующего растворителя для реакции фторирования, посредством этого можно осуществлять реакцию фторирования непрерывным способом.
Аналогично способу 3, в способе 2, в момент подачи соединения (3), предпочтительно подают соединение (3), разбавленное растворителем для реакции фторирования, посредством этого селективность соединения (4) увеличивается, и количество побочных продуктов уменьшается. Кроме того, в момент разбавления соединения (3) растворителем, количество растворителя для реакции фторирования предпочтительно составляет, по меньшей мере, 5 кратное по массе, особенно предпочтительно, по меньшей мере, 10 кратное по массе, относительно соединения (3).
Или в системе периодического действия или в системе непрерывного действия в реакции фторирования, количество фтора (F2) для фторирования предпочтительно регулируют так, чтобы оно всегда составляло избыточное количество относительно всех атомом, групп атомов и групп, которые можно фторировать, в соединении (3). Количество фтора предпочтительно является, по меньшей мере, 1,1 кратным по эквивалентам, особенно предпочтительно, по меньшей мере, 1,3 кратным по эквивалентам, относительно теоретического количества, требуемого для фторировании всех атомов, групп атомов и групп, которые можно фторировать.
Например, в случае, когда соединение (3) содержит только атомы, которые можно фторировать, из атомов, групп атомов и групп, которые можно фторировать, и атомы, которые можно фторировать, представляют собой атомы водорода, количество фтора (F2) предпочтительно всегда составляет избыточное количество относительно атомов водорода. Конкретно, количество фтора предпочтительно является, по меньшей мере, 1,1 кратным по эквивалентам (т.е., по меньшей мере, 1,1 кратным по молям) относительно атомов водорода, особенно предпочтительно, по меньшей мере, 1,3 кратным по эквивалентам (т.е., по меньшей мере, 1,3 кратным по молям) с точки зрения селективность. Количество фтора предпочтительно составляет избыточное количество с начала и до конца реакции. Соответственно, когда растворитель для реакции фторирования загружают в реактор вначале реакции, предпочтительно, чтобы достаточное количество фтора было предварительно растворено в растворителе для реакции фторирования.
Температура жидкой фазы в реакции фторирования предпочтительно составляет 10-50°C, особенно предпочтительно 10-30°C, с точки зрения выхода соединения (4), селективности, безопасности и простоты осуществления производственного эксперимента.
Давление реакции в реакции фторирования конкретно не ограничено и предпочтительно составляет от атмосферного давления до 2 МПа (манометрическое давление), с точки зрения выхода соединения (4), селективности, безопасности и простоты осуществления производственного эксперимента.
Кроме того, для того чтобы обеспечить эффективное протекание реакции фторирования, предпочтительно добавлять соединение, содержащие C-H связь, отличное от соединения (3), в реакционную систему, или осуществлять ультрафиолетовое облучение. Это предпочтительно осуществляют на последующем этапе реакции фторирования, посредством этого соединение (3), присутствующее в реакционной системе, можно эффективно фторировать, и выход соединения (3) можно существенно повысить.
Соединение, содержащие C-H связь, предпочтительно представляет собой ароматический углеводород, и можно привести бензол, толуол или подобные. Количество соединения, содержащего C-H связь, которое будут добавлять, предпочтительно составляет 0,1-10 моль%, особенно предпочтительно 0,1-5 моль%, относительно атомов водорода в соединении (3).
Соединение, содержащие C-H связь, предпочтительно добавляют в реакционную систему, в которой присутствует газообразный фтор. Кроме того, в случае, когда добавляют соединение, содержащие C-H связь, предпочтительно создавать давление в реакционной системе. Давление для создания избыточного давления предпочтительно составляет 0,01-5 МПа (манометрическое давление).
В случае, когда применяют ультрафиолетовое излучение, продолжительность ультрафиолетового облучения предпочтительно составляет 0,1-3 часа.
В реакции фторирования, в которой атом водорода, соединенный с атомом углерода, замещают атомом фтора, HF образуется в качестве побочного продукта. Для удаления побочного продукта HF, предпочтительно применять скавенджер HF. Конкретно, можно привести способ обеспечения совместного нахождения скавенджера HF в реакционной системе или способ обеспечения контакта выходящего газа со скавенджером HF на выпускном отверстии для газа реактора. В качестве данного скавенджера HF можно применять те же скавенджеры, как приводилось выше, и NaF является предпочтительным.
В случае, когда обеспечивают совместное нахождение скавенджера HF в реакционной системе, количество скавенджера HF предпочтительно является 1-20 кратным по молям, особенно предпочтительно 1-5 кратным по молям относительно атомом водорода, присутствующих в соединении (3). В случае, когда скавенджер HF помещают у выпускного отверстия для газа реактора, предпочтительно применять уплотненный слой гранул NaF, который образуется формованием NaF в качестве скавенджера HF в виде гранул и упаковкой гранул NaF. Конкретно, предпочтительно комбинировать (a) охлаждающий элемент (предпочтительно поддерживая температуру от 10°C до комнатной температуры, особенно предпочтительно приблизительно равной 20°C), (b) плотный слой гранул NaF и (c) охлаждающий элемент (предпочтительно поддерживая температуру -78°C - +10°C, более предпочтительно -30°C-0°C) последовательно в порядке (a)-(b)-(c). Кроме того, охлаждающий элемент (c) можно обеспечивать линией возвращения жидкости, возвращая конденсированную жидкость из охлаждающего элемента (c) в реактор.
Неочищенный продукт, содержащий соединение (4), полученный реакцией фторирования, можно применять непосредственно для последующей стадии, или можно очищать до продукта, имеющего высокую чистоту. Способ очистки может, например, представлять собой способ, в котором неочищенный продукт перегоняют непосредственно при атмосферном давлении или пониженном давлении.
[Стадия (III)]
Стадия (III) представляет собой стадию применения соединения (4) в реакции расщепления, получая, по меньшей мере, один член соединения (5), представленного следующей формулой (5), и соединения (6), представленного следующей формулой (6).
|
(Соединение (5))
В качестве соединения (5) можно привести следующее соединение (5-1), полученное применением соединения (4-1)-(4-7) в реакции расщепления.
|
где n является таким же как n в формуле (1-1).
(Соединение (6))
В качестве соединение (6) можно привести следующее соединение (6-1), полученное применением соединения (4-1) в реакции расщепления, следующее соединения (6-2), полученное применением соединения (4-2) в реакции расщепления, следующее соединение (6-3), полученное применением соединения (4-3) в реакции расщепления, следующее соединение (6-4), полученное применением соединения (4-4) в реакции расщепления, следующее соединение (6-5), полученное применением соединения (4-5) в реакции расщепления, следующее соединение (6-6), полученное применением соединения (4-6) в реакции расщепления, и следующее соединение (6-7), полученное применением соединения (4-7) в реакции расщепления.
|
(Реакция расщепления соединения (4))
Реакция расщепления соединения (4) представляет собой реакцию диссоциации эфирной связи. Реакцию диссоциации предпочтительно осуществляют пиролизом или реакцией диссоциации, осуществляемой в присутствии нуклеофильного агента или электрофильного агента. Реакция диссоциации особенно предпочтительно представляет собой реакцию диссоциации, осуществляемую в присутствии нуклеофильного агента или электрофильного агента.
В случае, когда реакцию диссоциации эфирной связи осуществляют реакцией соединения (4) с нуклеофильным агентом или электрофильным агентом в жидкой фазе, данную реакцию можно осуществлять в присутствии или отсутствии растворителя для реакции диссоциации. Реакцию диссоциации предпочтительно осуществляют в отсутствии растворителя для реакции диссоциации, поскольку само соединение (4) служит в качестве растворителя и не требуется отделять растворитель от продукта реакции. В качестве нуклеофильного агента F- является предпочтительным, и особенно предпочтительным является F-, полученный из фторида щелочного металла. В качестве фторида щелочного металла, NaF, NaHF2, KF или CsF является предпочтительным, и среди них, KF является особенно предпочтительным, с точки зрения реакционноспособности.
В случае, когда реакцию диссоциации эфирной связи осуществляют, применяя F- в качестве нуклеофильного агента, F- будет нуклеофильно присоединяться к карбонильной группе, присутствующей в эфирной связи в соединении (4), посредством этого будет отщепляться -OCF2-RAF-CF2O- и будет образовываться соединение (6). Кроме того, F- будет отщепляться от -OCF2-RAF-CF2O-, образуя соединение (5). Отщепленный F- будет реагировать с другой молекулой соединения (4) аналогичным способом. Соответственно, нуклеофильный агент, первоначально применяемый для реакции, может быть в каталитическом количестве или в избыточном количестве. Количество нуклеофильного агента, такого как F-, предпочтительно составляет 0,1-500 моль%, более предпочтительно 0,1-100 моль%, особенно предпочтительно 0,5-50 моль%, относительно соединения (4).
Температура реакции предпочтительно составляет от -30°C до температуры кипения растворителя или соединения (4), более предпочтительно -20°C-250°C.
Реакцию диссоциации также предпочтительно осуществляют, проводя перегонку аппаратом для реакции, содержащим перегонную колонну.
Кроме того, в объясненном выше способе, в случае, когда соединение (6), образовавшееся на стадии (III), представляет собой такое же соединение, как соединение (2), применяемое на стадии (I), соединение (6), образовавшееся на стадии (III), применяют (рециклируют) в качестве соединения (2) на стадии (I), посредством этого можно непрерывно получать соединение (5). Например, способ можно проводить так, чтобы часть или все образовавшееся соединение (6) применялось в качестве соединения (2) и реагировало с соединением (1).
Кроме того, как описано выше, соединение (6) можно применять в качестве растворителя для реакции фторирования. Соответственно, соединение (1) смешивают с избыточным количеством соединения (6), и оно реагирует, образуя соединение (3), посредством этого можно получить раствор соединения (6), в котором растворено соединение (3). Данный раствор можно применять в качестве растворителя для реакции фторирования, в котором соединение (3) растворяется на стадии (II).
[Стадия (IV) и стадия (V)]
Стадия (IV) представляют собой стадию реакции соединение (5) и гексафторпропиленоксида (далее в настоящем изобретении также называют “HFPO”), получая соединение (7), представленное следующей формулой (7). Стадия (V) представляет собой стадию пиролиза соединения (7), получая соединение (8), представленное следующей формулой (8). Соединение (8) представляет собой фторированный мономер, который можно циклополимеризовать, и но является пригодным в качестве исходного соединения для фторированной смолы. Когда соединение (8) получают из соединения (5), применяя способ получения, в котором соединение (7) образуется в качестве промежуточного соединения, как описано выше, соединение (8) можно эффективно получить несколькими стадиями.
|
RAF является таким же как определение выше, а именно, представляет собой группу, в которой все атомы водорода в RA замещены атомами фтора.
(QAF)
QAF: когда количество атомов углерода RAF равно 1, QAF представляет собой одинарную связь; когда количество атомов углерода RAF составляет, по меньшей мере, 2, QAF представляет собой группу, в которой количество атомов углерода является меньшим на 1, чем в RAF и, в которой все атомы водорода в двухвалентном насыщенном углеводородном радикале или частично галогенированном двухвалентном насыщенном углеводородном радикале замещены атомами фтора.
(Соединение (7))
В качестве соединения (7) можно привести следующее соединение (7-1), полученное реакцией соединения (5-1) и HFPO.
|
где n является таким же как n в формуле (1-1).
(Соединение (8))
В качестве соединения (8) можно привести следующее соединение (8-1), полученное пиролизом соединения (7-1).
|
где n является таким же как n в формуле (1-1).
Среди них, F2C=CF-O-(CF2)2-CF=CF2, в котором n равно 3, и F2C=CF-O-CF2-CF=CF2, в котором n равно 2, являются особенно пригодными в качестве фторированных мономеров, которые можно циклополимеризовать. В качестве полимера, который будут получать, можно привести CYTOP (зарегистрированная торговая марка), полученный Asahi Glass Company, Limited.
Реакция, в которой реагируют соединение (5) и HFPO, давая соединение (7), можно осуществлять в присутствии или в отсутствии растворителя. Когда применяют растворитель, тетраглим является предпочтительным в качестве растворителя. Температура реакции предпочтительно составляет -50-0°C, и особенно предпочтительно -15 - -5°C, с точки зрения простоты контролирования реакции и селективности соединения (7). Реакцию предпочтительно осуществляют при нормальном давлении и конкретно особенно предпочтительно при -0,1 - 0,5 МПа (манометрическое давление). Реакцию осуществляют в отсутствии влаги и кислых компонентов.
Реакцию пиролиза соединения (7) предпочтительно осуществляют в присутствии катализатора в газовой фазе. Например, можно привести способ, в котором применяют аппарат для реакции в псевдоожиженном слое, реакцию осуществляют в реакторе, в котором стеклянные шарики упакованы в качестве катализатора. В случае данного способа, без временного образования металлической соли соединения (7), соединение (8) можно непосредственно получить из соединения (7) одной стадией.
Реакцию предпочтительно осуществляют в условиях нормального давления, температуры реакции 100-350°C и продолжительности пребывания соединения (7) 1-30 секунд, с точки зрения подавления избыточного разложения соединения (7) и изомеризации соединения (7). В настоящем изобретении, продолжительность прохождения представляет собой продолжительность времени, в течение которой соединение (7) находится в контакте с уплотняющим слоем катализатора, где катализатор является уплотненным.
[Стадия (VI)]
Стадия (VI) представляет собой стадию реакции соединения (5) и соединения (9), представленного следующей формулой (9), давая соединение (10), представленное следующей формулой (10). Соединение (10) можно превратить в диизоцианатное соединение, содержащее RAF группу, и диизоцианатное соединение, содержащее RAF группу, является пригодным в качестве фторированного полиуретанового материала для получения полимера, промежуточного соединения для связующего материала для медицинского применения и т.д.
|
R представляет собой группу, выбранную из группы, состоящей из -CH3, -CH2CH3 и -CH(CH3)2.
(RAF)
RAF является такой же, как определено выше, а именно, представляет собой группу, в которой все атомы водорода в RA замещены атомами фтора.
(Соединение (9))
Соединение (9) представляет собой или CH3OH, CH3CH2OH или (CH3)2CHOH.
(Соединение (10))
В качестве соединения (10) можно привести следующее соединение, полученное реакцией соединения (5-1) и соединения (9).
|
где n является таким же как n в формуле (1-1).
Реакцию соединения (5) и соединения (9) можно осуществлять в присутствии или в отсутствии растворителя. Растворитель предпочтительно представляет собой растворитель, который не реагирует с соединением (10), и который можно отделить от соединения (10) способом, таким как разделение перегонкой или колоночное разделение. Реакцию можно осуществлять в отсутствии растворителя, поскольку само соединение (9) служит в качестве растворителя. Нижний предел температуры реакции предпочтительно составляет -20°C. Верхний предел температуры реакции предпочтительно представляет собой наименьшую температуру между 100°C и температурой кипения растворителя. Температура реакции особенно предпочтительно составляет 0-40°C. Давление предпочтительно составляет 0-2 МПа (манометрическое давление).
В реакции соединения (5) и соединения (9), в качестве побочного продукта образуется HF. Для удаления побочного продукта HF, предпочтительно применять скавенджер HF или щелочной водный раствор. В качестве скавенджера HF можно аналогично применять приведенный выше скавенджер. Щелочной водный раствор может, например, представлять собой водный раствор гидроксида калия или раствор гидроксида натрия. В случае, когда скавенджер HF не применяют, предпочтительно осуществлять реакцию при температуре, при которой HF испаряется, и HF удаляют потоком азота из реакционной системы. Количество скавенджера HF или щелочного водного раствора, который будут применять, предпочтительно является 1-10 кратным по молям относительно соединения (5).
[Стадия (IV) и стадия (VII)]
Стадия (IV) представляет собой стадию реакции соединение (5) и HFPO, получая соединение (7), представленное следующей формулой (7), как описано выше. Стадия (VII) представляет собой стадию пиролиза соединения (7), с последующей реакцией с R1OH, получая соединение (11), представленное следующей формулой (11). Соединение (11) является пригодным в качестве исходного соединения для фторированной смолы. В случае, когда соединение (11) получают из соединения (5), применяя способ получения, в котором соединение (7) образуется в качестве промежуточного соединения, как описано выше, соединение (11) можно эффективно получить несколькими стадиями.
|
RAF является такой же, как определено выше, а именно, представляет собой группу, в которой все атомы водорода в RA замещены атомами фтора.
(R1)
R1: C1-10 алкильная группа
(Соединение (11))
В качестве соединения (11) можно привести следующее соединение (11-1), полученное пиролизом соединения (7-1), с последующей реакцией с R1OH.
|
где n является таким же как n в формуле (1-1).
Среди них, F2C=CF-O-(CF2)n-C(=O)OCH3, в котором R1 представляет собой CH3 (а именно R1OH представляет собой метанол), является пригодным в качестве фторированного мономера для получения фторированного полимера, и n особенно предпочтительно равно 3.
Реакция для пиролиза соединения (7) для получения соединения (11) предпочтительно осуществляют в газовой фазе в присутствии катализатора. Например, можно привести такой способ, что применяя установку для реакции в псевдоожиженном слое, реакцию осуществляют в реакторе, в котором стеклянные шарики упакованы в качестве катализатора. После прохождение через слой катализатора, соединение (7) реагирует с метанолом, посредством этого без временного выделения соединения (7), соединение (11) можно непосредственно получить из соединения (7).
Реакцию предпочтительно осуществляют в таких условиях, как нормальное давление, температура реакции составляет 100-350°C, предпочтительно 150-250°C, и продолжительность прохождения соединения (7) составляет 1-20 секунд, с точки зрения подавления избыточного разложения соединения (7). Кроме того, продолжительность прохождения представляет собой продолжительность времени, в течение которого соединение (7) находится в контакте со слоем упакованного катализатора, в котором упакован катализатор.
Как описано выше, в способе получения настоящего изобретения на стадии (II) реагирует соединение (1), полученное на стадии (I), и соединение (2), давая соединение (3), и соединение (3) фторируют, посредством этого соединение (4) можно получить с хорошим выходом.
Кроме того, осуществлением стадий (III)-(V), соединение (5) и соединение (6) получают из соединения (4), и соединение (8) можно получить из соединения (5) через соединение (7). Соединение (8) является пригодным в качестве фторированного мономера, который будут циклополимеризовать.
Кроме того, на стадии (VI) соединение (10) можно получить из соединения (5). Соединение (10) является пригодным в качестве промежуточного соединения для медицинского связующего материала, и т.д.
Кроме того, на стадии (VII) соединение (11) можно получить из соединения (5). Соединение (11) является пригодным в качестве фторированного мономера.
Каждое из соединения (8) и соединения (11) можно независимо полимеризовать в качестве фторированного мономера, получая фторированный полимер, или их можно полимеризовать в комбинации, получая фторированный полимер.
ПРИМЕРЫ
Далее, настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако настоящее изобретение этим далеко не ограничивается. Примеры 1-5 и примеры 11 и 12 являются демонстрационными примерами настоящего изобретения, и примеры 6-10 являются сравнительными примерами.
Сокращения в примерах обозначают следующее:
(HFPO)3: CF3CF2CF2OCF(CF3)CF2OCF(CF3)C(=O)F
TMS: тетраметилсилан
[ГХ чистота]
ГХ чистота представляет собой величину (моль %) доли соединения (3) в неочищенной жидкости, которую определяют отношением площадей пиков газовой хроматографии (GC), и она представлена в процентах.
[Измерение 19F-ЯМР и 1H-ЯМР]
Для измерения 19F-ЯМР, перфторбензол (C6F6) применяли в качестве образца внутреннего стандарта, и для измерения 1H-ЯМР применяли TMS.
ЯМР спектральные данные показаны без изменения наблюдаемых химических сдвигов.
[19F-ЯМР степень превращения]
19F-ЯМР степень превращения представляет собой величину (моль %) количества превратившегося соединения (3), которая представлена в процентах мольного стандарта, в количестве соединения (3), загруженного в реакцию фторирования. 19F-ЯМР степень превращения можно получить по формуле: 100-(количество извлеченного непрореагировавшего соединения (3)/количество загруженного соединения (3))×100.
Конкретно, количество соединения (3), загруженное в реакцию фторирования, представляет собой реально измеренную величину, и количество извлеченного непрореагировавшего соединения (3) представляет собой величину, полученную анализом извлеченного продукта, извлеченного из автоклава, 19F-ЯМР.
[19F-ЯМР выход]
19F-ЯМР выход представляет собой величину (моль%) количества (полученного количества) извлеченного соединения (4), представленную в процентах молярного стандарта, относительно количества соединения (3), загруженного в реакцию фторирования, и его получают расчетной формулой: (количество извлеченного соединения (4)/количество загруженного соединения (3))×100.
Конкретно, количество соединения (3), загруженного в реакцию фторирования, представляет собой реально измеренную величину, и количество извлеченного соединения (4) представляет собой величину, полученную анализом извлеченного продукта, извлеченного из автоклава, 19F-ЯМР.
[Пример 1]
(Пример 1-1) получение (CF3)2CFCOO(CH2)5OCOCF(CF3)2 (соответствующего соединению (3-1))
В 5 л колбу загружали 1000 г HO(CH2)5OH (соответствующего соединению (1-1)) и перемешивали при барботировании газообразного азота. Затем, загружали 4400 г (CF3)2CFC(=O)F (соответствующего соединению (2-1)) (барботированный) в жидкую фазу в течение 2,5 часов, поддерживая температуру внутри колбы равной 25-30°C. После прекращения загрузки, смесь перемешивали при комнатной температуре в течение 15 часов, и полученную неочищенную жидкость извлекали.
Чистота по ГХ неочищенной жидкости составляла 95%.
Кроме того, 1H-ЯМР и 19F-ЯМР спектры регистрировали, и подтверждали, что основной компонент представлял собой указанное выше соединение (содержание фтора=53,6% по массе).
ЯМР спектры
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53 (м, 2H), 1,70-1,84 (м, 4H), 4,20-4,50 (м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -74,3(12F), -181,9(2F).
(ПРИМЕР 1-2) получение (CF3)2CFCOO(CF2)5OCOCF(CF3)2 (соответствующего соединению (4-1))
В 3000 мл автоклав, сделанный из никеля, 2800 г (HFPO)3 добавляли в качестве растворителя для реакции фторирования, перемешивали и поддерживали при 25°C. На выпускном отверстии для газа автоклава устанавливали охлаждающий элемент, поддерживаемый при -20°C. После подачи газообразного азота в течение 1,0 часа, разбавленный газообразный фтор, содержащий количество газообразного фтора 50% по объему, который разбавляли газообразным азотом (далее в настоящем изобретении также называют “50% газообразный фтор”) загружали при 36 л/ч в течение 1 часа.
Затем, подавая 50% газообразный фтор при той же скорости потока, 40 г (CF3)2CFCOO(CH2)5OCOCF(CF3)2, полученного в примере 1-1, вводили в течение периода времени 2 часа. Кроме того, 50% газообразный фтор загружали при той же скорости потока в течение 1 часа, и дополнительный газообразный азот загружали в течение 1 часа.
Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта, 19F-ЯМР выход составлял 96%, и 19F-ЯМР степень превращения составляла 98%.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ(ppm):-74,3(с, 12F), -86,1(4F), -122,6(2F), -125,7(4F), -181,9(2F).
[ПРИМЕР 2] получение (CF3)2CFCOO(CF2)5OCOCF(CF3)2 (соответствующего соединению (4-1))
(CF3)2CFCOO(CH2)5OCOCF(CF3)2 получали тем же способом, как в примере 1-1. Затем, эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
[ПРИМЕР 3]
(ПРИМЕР 3-1) получение (CF3)2CFCOO(CH2)6OCOCF(CF3)2 (соответствующего соединению (3-1))
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 96%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение (содержание фтора =52,2% по массе).
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53 (м, 4H), 1,70-1,84 (м, 4H), 4,20-4,50 (м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -74,3(12F), -181,9(2F).
(ПРИМЕР 3-2) получение (CF3)2CFCOO(CF2)6OCOCF(CF3)2 (соответствующего соединению (4-1))
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили (CF3)2CFCOO(CH2)6OCOCF(CF3)2, полученный в примере 3-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -74,3(с, 12F), -86,1(4F), -122,6(4F), -125,7(4F)-181,9(2F).
[ПРИМЕР 4]
(ПРИМЕР 4-1) получение CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CH2)6-OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3 (соответствующего соединению (3-2))
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 97%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение (содержание фтора=60,1% по массе).
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53 (м, 4H), 1,70-1,84 (м, 4H), 4,20-4,50 (м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,9(4F), -80,5(6F), -83,1(16F), -130,7(4F), -132,7(2F), -145,2(2F).
(ПРИМЕР 4-2) получение CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CF2)6OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3 (соответствующего соединению (4-2))
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CH2)6OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3, полученный в примере 4-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,9(4F), -80,5(6F), -83,1(16F), -86,1(4F), -122,6(4F), -125,7(4F), -130,7(4F), -132,7(2F), -145,2(2F).
[ПРИМЕР 5]
(ПРИМЕР 5-1) получение CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CH2)5OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3 (соответствующего соединению (3-2))
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 95%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение (содержание фтора=60,9% по массе).
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53(м, 2H), 1,70-1,84(м, 4H), 4,20-4,50(м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,9(4F), -80,5(6F), -83,1(16F), -130,7(4F), -132,7(2F), -145,2(2F).
(ПРИМЕР 5-2) Получение CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CF2)5OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3 (соответствующего соединению (4-2))
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CH2)5OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3, полученный в примере 5-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,9(4F), -80,5(6F), -83,1(16F), -86,1(4F), -122,6(2F), -125,7(4F), -130,7(4F), -132,7(2F), -145,2(2F).
[ПРИМЕР 6]
(ПРИМЕР 6-1) Получение CF3CF2CF2OCF(CF3) COO(CH2)4OCOCF(CF3)OCF2CF2CF3 (соответствующего соединению (3-3))
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 97%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение (содержание фтора=58,5% по массе).
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,70-1,84(м, 4H), 4,20-4,50(м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,5(6F), -80,9(4F), -83,1(6F), -130,7(4F), -145,2(2F).
(ПРИМЕР 6-2) Получение CF3CF2CF2OCF(CF3) COO(CF2)4OCOCF(CF3)OCF2CF2CF3 (соответствующего соединению (4-3))
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2CF2OCF(CF3) COO(CH2)4OCOCF(CF3)OCF2CF2CF3, полученный в примере 6-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,5(6F), -80,9(4F), -83,1(6F), -122,6(4F), -126,6(4F)-130,7(4F), -145,2(2F).
[ПРИМЕР 7]
(ПРИМЕР 7-1) получение CF3CF2COO(CH2)5OCOCF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составлял 97%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение.
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53(м, 2H), 1,70-1,84(м, 4H), 4,20-4,50(м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,0(6F), -121,4(4F)
(ПРИМЕР 7-2) получение CF3CF2COO(CF2)5OCOCF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2COO(CH2)5OCOCF2CF3, полученный в примере 7-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Однако протекала реакция окисления, и в извлеченном продукте из автоклава подтверждали большое количество образовавшихся продуктов. 19F-ЯМР выход указанного выше соединения в извлеченном продукте показан в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,0(6F), -86,1(4F), -121,4(4F), -122,6(2F), -125,7(4F).
[ПРИМЕР 8]
(ПРИМЕР 8-1) получение CF3CF2COO(CH2)6OCOCF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 96%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение.
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,42-1,53(м, 4H), 1,70-1,84(м, 4H), 4,20-4,50(м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,0(6F), -121,4(4F).
(ПРИМЕР 8-2) получение CF3CF2COO(CF2)6OCOCF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2COO(CH2)6OCOCF2CF3, полученный в примере 8-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,0(6F), -86,1(4F), -121,4(4F), -122,6(4F), -125,7(4F).
[ПРИМЕР 9]
(ПРИМЕР 9-1) получение CF3CF2CF2OCF(CF3)COOCH2CH(CH3)O(CH2)5OCOCF(CF3)OCF2CF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 95%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение.
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,19(3H), 1,39-1,49(2H), 1,54-1,63(2H), 1,71-1,80(2H), 3,39-3,53(2H), 3,66-3,72(1H), 4,21-4,46(4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -80,9(2F), -82,3(6F), -83,1(6F), -87,4(2F), -130,7(4F), -132,7(2F).
(ПРИМЕР 9-2) получение CF3CF2CF2OCF(CF3)COOCF2CF(CF3)O(CF2)5OCOCF(CF3)OCF2CF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-2, за исключением того, что в качестве соединения, которое будут вводить в автоклав, вводили CF3CF2CF2OCF(CF3)COOCH2CH(CH3)O(CH2)5OCOCF(CF3)OCF2CF2CF3, полученный в примере 9-1, и реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -79,2--80,7(7F), -81,5-82,0(12F), -85,9--87(6F), -122,4(2F), -125,3(4F)-129,6(4F), -131,4(2F), -144,9(1F).
[ПРИМЕР 10] получение CF3CF2CF2OCF(CF3)COOCF2CF(CF3)O(CF2)5OCOCF(CF3)OCF2CF2CF3
CF3CF2CF2OCF(CF3)COOCH2CH(CH3)O(CH2)5OCOCF(CF3)OCF2CF2CF3 получали тем же способом, как в примере 9-1. Затем, эксперимент осуществляли тем же способом, как в примере 9-2, за исключением того, что реакцию фторирования осуществляли в условиях, показанных в таблице 1. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта. 19F-ЯМР выход и 19F-ЯМР степень превращения показаны в таблице 1.
[ПРИМЕР 11]
(ПРИМЕР 11-1) получение CF3CF2COO(CH2)4OCOCF2CF3
Эксперимент осуществляли тем же способом, как в примере 1-1, за исключением того, что исходные соединения загружали, как показано в таблице 1. Чистота по ГХ извлеченной неочищенной жидкости составляла 98%. Кроме того, регистрировали 1H-ЯМР и 19F-ЯМР спектры, и подтверждали, что основной компонент представлял собой указанное выше соединение.
ЯМР спектры:
1H-ЯМР (399,78 МГц, растворитель: CDCl3, стандарт: TMS) δ (ppm): 1,70-1,84(м, 4H), 4,20-4,50(м, 4H).
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,0(6F), -121,4(4F).
(ПРИМЕР 11-2) получение CF3CF2COO(CF2)4OCOCF2CF3
В 3000 мл автоклав, сделанный из никеля, добавляли 2800 г (HFPO)3, перемешивали и поддерживали при 25°C. На выходном отверстии автоклава устанавливали охлаждающий элемент, поддерживаемый при -20°C. Кроме того, линию возврата жидкости устанавливали для возвращения жидкости, сконденсированной в охлаждающем элементе, поддерживаемом при -20°C, в автоклав. После подачи газообразного азота в течение 2 часов, 50% газообразный фтор загружали при скорости потока 7,8 л/ч в течение 1 часа. Затем, при подаче 50% газообразного фтора при той же скорости потока, вводили CF3CF2COO(CH2)4OCOCF2CF3 (25 г), полученный в примере 11-1, в течение периода времени 6 часов. Затем, 50% газообразный фтор загружали при той же скорости в течение 1 часа, и дополнительный газообразный азот загружали в течение 1 часа. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта, 19F-ЯМР выход составлял 51%, и 19F-ЯМР степень превращения составляла 80%.
Кроме того, подавая 50% газообразный фтор при той же скорости потока, вводили CF3CF2COO(CH2)4OCOCF2CF3 (25 г), полученный в примере 11-1, в течение периода времени 6 часов. Затем, 50% газообразный фтор загружали при той же скорости в течение 1 часа, и дополнительный газообразный азот загружали в течение 1 часа. Образовавшийся продукт в извлеченном продукте из автоклава содержал указанное выше соединение в качестве основного продукта, 19F-ЯМР выход составлял 83%, и 19F-ЯМР степень превращения составляла 100%.
ЯМР спектры:
19F-ЯМР (376,17 МГц, растворитель: CDCl3, стандарт: C6F6) δ (ppm): -83,8(6F), -87,3(4F), -122,6(4F), -126,6(4F)
|
В примерах 1-6, требуемый продукт можно получить с хорошим выходом реакцией фторирования. Среди них, в примерах 1 и 3-6, требуемый продукт можно получить с хорошим выходом в условиях, когда количество газообразного фтора является большим (50% по объему). С другой стороны, в примерах 7-11, требуемый продукт нельзя получить с хорошим выходом. Например, в примерах 7-9, когда реакцию фторирования осуществляли в условиях, когда количество газообразного фтора является большим, хотя степень превращения является высокой, селективность требуемого продукта является низкой, и в связи с этим выход является низким. В примере 10, когда реакцию фторирования осуществляли в условиях, когда количество газообразного фтора является небольшим, хотя селективность требуемого продукта слегка увеличивается, нельзя получить достаточный выход. В примере 11, продолжительность введения (продолжительность реакции) соединения, которое будут фторировать, увеличивают, увеличивая степень превращения, однако, селективность является низкой, и нельзя получить достаточный выход.
[ПРИМЕР 12]
(ПРИМЕР 12-1) получение FC(=O)(CF2)3C(=O)F (соответствующего соединению (5-1))
В 1 л колбу загружают 500 г (CF3)2CFCOO(CF2)5OCOCF(CF3)2 (соответствующего соединению (4-1)), полученного в примере 1-2, и затем загружают 41 г порошкообразного KF. При интенсивном перемешивании колбу нагревают при 100°C в течение 5 часов в масляной бане. В верхнюю часть колбы устанавливают последовательно обратный холодильник, отрегулированный на температуру 20°C и фторполимерный газозборник. После нагревания, колбу охлаждали, и извлекали жидкий образец и газообразный образец. Жидкий образец очищали перегонкой. ГХ-МС анализом подтверждали, что указанное выше соединение являлось основным продуктом. Выход составлял 82 моль%. Выход представляет собой моль% требуемого соединения, содержащегося в извлеченной фракции, полученной очисткой перегонкой, когда молярное количество требуемого соединения, которое теоретически получают из загруженной композиции, составляет 100%.
(ПРИМЕР 12-2) получение FC(=O)CF(CF3)O(CF2)4C(=O)F (соответствующего соединению (7-1))
В 2 л автоклав загружали 360 г FOC(CF2)3COF, полученного в примере 12-1, 11,4 г фторида цезия и 56,8 г тетрагилма и, поддерживая автоклав при -10°C, добавляли 260 г гексафторпропиленоксида. После прекращения реакции, нижний слой извлекали и очищали перегонкой. По ГХ-МС подтверждали, что указанное выше соединение представляло собой основной продукт. Выход требуемого соединения, как определено в пример 12-1, составлял 60 моль%.
(ПРИМЕР 12-3) получение F2C=CFO(CF2)2CF=CF2 (соответствующего соединению (8-1))
1 дюймовый реактор, изготовленный из инконеля, заполняли стеклянными шариками так, чтобы высота наполнителя составляла 20 см и нагревали при 330°C. 500 г FC(=O)CF(CF3)O(CF2)4C(=O)F, полученного в примере 12-2, разбавляли газообразным азотом так, чтобы он составлял 10% по объему, и вводили в реактор. Линейную скорость контролировали так, чтобы она составляла 2,0 см/с, и поддерживая продолжительность прохождения реакционного газа через слой стеклянных шариков 10 секунд, осуществляли реакцию. Отходящий реакционный газ собирали посредством ловушки с сухим льдом и этанолом. Собранную в ловушке жидкость очищали перегонкой и анализировали ГХ-МС, и как результат, подтверждали, что указанное выше соединение представляло собой основной продукт. Выход требуемого соединения, как определено в примере 12-1, составлял 48 моль%.
(ПРИМЕР 12-4) получение F2C=CFO(CF2)2CF=CF2 (соответствующего соединению (8-1))
В 1 л съемную колбу загружали 150 г F2C=CFO(CF2)2CF=CF2, полученного в примере 12-3, 28,0 г метанола, 3,8 г инициатора (10% по массе 1,1,1,2,2,3,3,4,4,5,5,6,6-тридекафторгексановый раствор [(CH3)2CHOCO]2), 5,7 г диспергатора (торговое название: Newcol 714SN, полученный NIPPON NYUKAZAI CO., LTD) и 800 г ультрачистой воды, и полимеризацию в суспензии осуществляли перемешиванием в течение в сумме 26 часов: 20 часов при 40°C и 6 часов при 50°C. Выход полученных частиц полимера (циклополимера) составлял 88%, и характеристическая вязкость составляла 0,34. Циклополимер представлял собой прозрачный упругий полимер, и его можно было растворить в перфторном растворителе, таком как перфтортрибутиламин, получая тонкое пленочное покрытие на кремниевой подложке или стекле.
Выход полимерных частиц представляет собой % по массе полученных полимерных частиц, когда масса загруженных мономеров составляет 100%.
Характеристическую вязкость определяют следующей формулой (A). Характеристическую вязкость измеряют, как описано ниже. Раствор получают растворением полимерных частиц в 1,1,1,2,2,3,4,5,5,5-декафтор-3-метокси-4-(трифторметил)пентане, и при разбавлении концентрации c, его скорость течения измеряли посредством визкозиметра Ubbelohde. Характеристическая вязкость представляет собой экстраполированную величину, полученную построением графика в логарифмических координатах по обеим осям ηsp/c и c и экстраполированием его концентрации к 0.
Характеристическая вязкость [η]=lim (ηsp/c) (A)
где c=концентрация полимера (г/дл), ηsp=t1/t0-1 (t0: время истечения растворителя, t1: время истечения раствора).
[ПРИМЕР 13]
(ПРИМЕР 13-1) получение FC(=O)(CF2)4C(=O)F (соответствующего соединению (5-1))
В 1л колбу загружали 500 г CF3CF2CF2OCF(CF3)CF2OCF(CF3)COO(CF2)6-OCOCF(CF3)OCF2CF(CF3)OCF2CF2CF3, полученного в примере 4-2, и 2,1 г порошкообразного KF, и при энергичном перемешивании колбу нагревали при 100°C в течение 5 часов на масляной бане. В верхнюю часть колбы устанавливали обратный холодильник, отрегулированный на температуру 20°C. После охлаждения, извлекали образец жидкости. Образец жидкости очищали перегонкой. Анализом ГХ-МС подтверждали, что указанное выше соединение представляло собой основной продукт. Выход составлял 85 моль%. Выход получали тем же способом, как в примере 12-1.
(ПРИМЕР 13-2) получение H3COC(=O)(CF2)4C(=O)OCH3 (соответствующего соединению (10))
В 500 мл колбу загружали 300 г FC(=O)(CF2)4C(=O)F, полученного в примере 13-1, и поддерживая колбу при температуре 10°C, добавляли 110 г метанола (соответствующего соединению (9)). После перемешивания в течение 2 часов, добавляли водный раствор гидрохлорида калия, извлекая нижний слой, и нижний слой очищали перегонкой. Анализом ГХ-МС подтверждали, что указанное выше соединение представляло собой основной продукт. Выход требуемого соединения, как определено в примере 12-1, составлял 87 моль%.
[ПРИМЕР 14]
(ПРИМЕР 14-1) получение FC(=O)(CF2)2C(=O)F (соответствующего соединению (5-1))
В 1 л колбу загружали 1000 г CF3CF2CF2OCF(CF3)COO(CF2)4OCOCF(CF3)OCF2CF2CF3 (соответствующего соединению (4-3)), полученного в примере 6-2, и затем 6,5 г порошкообразного KF. При энергичном перемешивании, колбу нагревали при 100°C в течение 5 часов на масляной бане. В верхнюю часть колбы устанавливали последовательно обратный холодильник, отрегулированный на температуру 20°C, и фторполимерную емкость для сбора газа. После нагревания, колбу охлаждали, и извлекали образец жидкости и водный образец. Образец жидкости очищали перегонкой. Анализом ГХ-МС подтверждали, что указанное выше соединение представляло собой основной продукт. Выход составлял 85 моль%. Выход представляет собой моль% требуемого соединения, содержащегося в извлеченной фракции, полученной очисткой перегонкой, когда молярное количество требуемого соединения, которое будут получать теоретически для загруженной композиции, составляет 100%.
(ПРИМЕР 14-2) получение FC(=O)CF(CF3)O(CF2)3C(=O)F (соответствующего соединению (7-1))
В 2 л автоклав загружали 500 г FOC(CF2)2COF, полученного в примере 14-1, 39,1 г фторида цезия и 115 г тетраглима, и поддерживая автоклав при температуре -10°C, добавляли 470 г гексафторпропиленоксида. После прекращения реакции, нижний слой извлекали и очищали перегонкой. По ГХ-МС подтверждали, что указанное выше соединение представляло собой основной продукт. Выход требуемого соединения, как определено в примере 14-1, составлял 62 моль%.
(ПРИМЕР 14-3) получение F2C=CFO(CF2)3C(=O)OCH3 (соответствующего соединению (9-1))
В 1 дюймовый реактор, изготовленный из инконеля, заполняли стеклянными шариками так, чтобы высота наполнителя составляла 20 см и нагревали при 250°C. 500 г FC(=O)CF(CF3)O(CF2)3C(=O)F, полученного в примере 14-2, разбавляли газообразным азотом так, чтобы он составлял 10% по объему, и вводили в реактор. Линейную скорость контролировали так, чтобы она составляла 2,0 см/с, и поддерживая продолжительность прохождения реакционного газа через слой стеклянных шариков равной 10 секунд, осуществляли реакцию. Отходящий реакционный газ собирали посредством ловушки с сухим льдом и этанолом, в которую добавляли метанол. Собранную в ловушке жидкость очищали перегонкой и анализировали ГХ-МС, и как результат, подтверждали, что указанное выше соединение представляло собой основной продукт. Выход требуемого соединения, как определено в примере 14-1, составлял 42 моль%.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно способу получения фторированного соединения настоящего изобретения, требуемое перфторированное соединение можно получить с высоким выходом реакцией фторирования частично фторированного эфира. Применяя соединение выше в качестве исходного соединения, можно получить фторированный мономер в качестве материала для фторированной смолы или промежуточного соединения для медицинского связующего материала.
Полное описание японской патентной заявки No. 2013-175041, поданной 26 августа 2013, включая описание, формулу изобретения и реферат, включено в настоящее изобретение с помощью ссылки во всей своей полноте.