Результат интеллектуальной деятельности: НОВЫЕ ПОЛИПЕПТИДЫ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептидам, которые ковалентно связаны с молекулярными каркасами, так чтобы две или более полипептидных петли были замкнуты между точками присоединения к каркасу. В частности, изобретение относится к пептидам, которые являются специфичными к протеазе плазмы - калликреину человека и крысы, и модифицированы в одной или двух пептидных петлях для повышения эффективности и/или устойчивости к протеазам.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Циклические пептиды способны связываться с высокой аффинностью и специфичностью к мишеням с белками-мишенями и, таким образом, являются привлекательным классом молекул для разработки терапевтических средств. В действительности, несколько циклических пептидов уже успешно используются в клинике, как например, антибактериальный пептид ванкомицин, иммунодепрессивное лекарственное средство циклоспорин или лекарственное средство против злокачественной опухоли октреотид (Driggers et al. (2008), Nat Rev Drug Discov 7 (7), 608-24). Свойства высокого связывания являются результатом относительно большой поверхности взаимодействия, формирующейся между пептидом и мишенью, а также уменьшенной конформационной гибкости циклических структур. Как правило, макроциклы связываются с поверхностями нескольких сотен квадратных ангстрем, как например, циклический пептидный антагонист CXCR4 CVX15 (400 Å2; Wu et al. (2007), Science 330, 1066-71), циклический пептид с мотивом Arg-Gly-Asp, связывающимся с интегрином αVb3 (355 Å2) (Xiong et al. (2002), Science 296 (5565), 151-5) или циклический пептидный ингибитор упаин-1, связывающийся с активатором плазминогена урокиназного типа (603 Å2; Zhao et al. (2007), J Struct Biol 160 (1), 1-10).
Вследствие их циклической конфигурации, пептидные макроциклы являются менее гибкими, чем линейные пептиды, что приводит к меньшей потере энтропии при связывании с мишенями и приводит к более высокой аффинности связывания. Сниженная гибкость также приводит к фиксации специфичных к мишени конформаций, повышая специфичность связывания по сравнению с линейными пептидами. Этот эффект был проиллюстрирован с использованием мощного и селективного ингибитора матриксной металлопротеиназы 8 (MMP-8), который утрачивал его селективность и связывался с другими MMP, когда кольцо было раскрытым (Cherney et al. (1998), J Med Chem 41 (11), 1749-51). Благоприятные связывающие свойства, достигнутые с использованием макроциклизации, являются еще более выраженными в мультициклических пептидах, имеющих более одного пептидного кольца, как например, в ванкомицине, низине и актиномицине.
Различные исследовательские группы ранее уже проводили связывание полипептидов, имеющих остатки цистеина, с синтетической молекулярной структурой (Kemp and McNamara (1985), J. Org. Chem; Timmerman et al. (2005), ChemBioChem). Meloen и коллеги использовали трис(бромметил)бензол и родственные молекулы для быстрой и количественной циклизации множества пептидных петель на синтетических каркасах для структурной мимикрии белковых поверхностей (Timmerman et al. (2005), ChemBioChem). Способы получения соединений, являющихся кандидатами для лекарственных средств, где указанные соединения получают путем связывания цистеинсодержащих полипептидов с молекулярным каркасом, например, таким как трис(бромметил)бензол, описаны в WO 2004/077062 и WO 2006/078161.
Были разработаны комбинаторные подходы на основе фагового дисплея для получения и скрининга больших библиотек бициклических пептидов для представляющих интерес мишеней (Heinis et al. (2009), Nat Chem Biol 5 (7), 502-7 и WO2009/098450). В кратком изложении, комбинаторные библиотеки линейных пептидов, содержащие три остатка цистеина и две области из шести случайных аминокислот (Cys-(Xaa)6-Cys-(Xaa)6-Cys) (SEQ ID NO: 97) были экспонированы на фаге и циклизованы путем ковалентного связывания боковых цепей цистеина с низкомолекулярным соединением (трис-(бромметил)бензол). Бициклические пептиды, выделенные при аффинной селекции в отношении к протеазам человека катепсину G и калликреину плазмы (PK), продемонстрировали наномолярные константы ингибирования. В WO 2013/050615 и WO 2013/050616 описаны другие бициклические пептидные лиганды, специфические в отношении калликреина плазмы человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретения, предусматривается пептидный лиганд, специфичный к калликреину плазмы, содержащий полипептид, содержащий по меньшей мере три остатка цистеина, разделенных по меньшей мере двумя последовательностями петель, и молекулярный каркас, который образует ковалентные связи с остатками цистеина полипептида, так что на молекулярном каркасе образуется по меньшей мере две полипептидных петли, где пептидный лиганд содержит пептидную последовательность, выбранную из любого из:
(a) -Ci-N-X-W-N-P-W-Cii-O/U-X-X-X-O/J-X-Ciii- (SEQ ID NO: 1);
(b) -Ci-B-N-J-W-N-P-Cii-X-L-O-X-X-X-Ciii- (SEQ ID NO: 2);
(c) -Ci-Q-K-F-E-S-R-Cii-X-X-X-X-X-X-Ciii- (SEQ ID NO: 3);
(d) -Ci-P-L-S-D-T-L-Cii-Y-R-R-M-P-P-Ciii- (SEQ ID NO: 4);
(e) -Ci-P-Y-P-F-R-Cii-X-H-X-X-X-Ciii- (SEQ ID NO: 5); и
(f) -Ci-(N)a-U-J-P-J-R-Cii-V-Y-Y-P-D-I-Ciii- (SEQ ID NO: 6);
или его модифицированное производное или фармацевтически приемлемая соль;
где:
Ci, Cii и Ciii обозначают первый, второй и третий остатки цистеина, соответственно;
подстрочная буква "a" обозначает целое число, выбранное из 0 или 1;
X обозначает любой аминокислотный остаток;
O обозначает неполярный алифатический аминокислотный остаток, выбранный из G, A, I, L, P и V;
J обозначает неполярный ароматический аминокислотный остаток, выбранный из F, W и Y;
U обозначает полярный незаряженный аминокислотный остаток, выбранный из N, C, Q, M, S и T; и
B обозначает полярный положительно заряженный аминокислотный остаток, выбранный из R, H и K.
Новые связывающие калликреин бициклические пептидные лиганды по изобретению были идентифицированы после биологической селекции, как описано в настоящем описании в разделе "Примеры". Путем переключения мишеней между калликреинами человека и крысы в процессе биологической селекции, были идентифицированы лидирующие последовательности с высокой перекрестной реактивностью. В молекулы были внесены солюбилизирующие модификации для повышения способности бициклических пептидных лидирующих соединений к составлению, и фармакокинетические анализы на крысах выявили последовательности с высокой метаболической стабильностью in vivo.
Согласно следующему аспекту изобретения, предусматривается фармацевтическая композиция, содержащая пептидный лиганд, как определено в настоящем описании, в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами.
В соответствии со следующим аспектом изобретения, предусматривается пептидный лиганд, как определено в настоящем описании, для применения для предупреждения, подавления или лечения воспалительных состояний, аллергической гиперчувствительности, злокачественной опухоли, бактериальной или вирусной инфекции и аутоиммунных нарушений.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
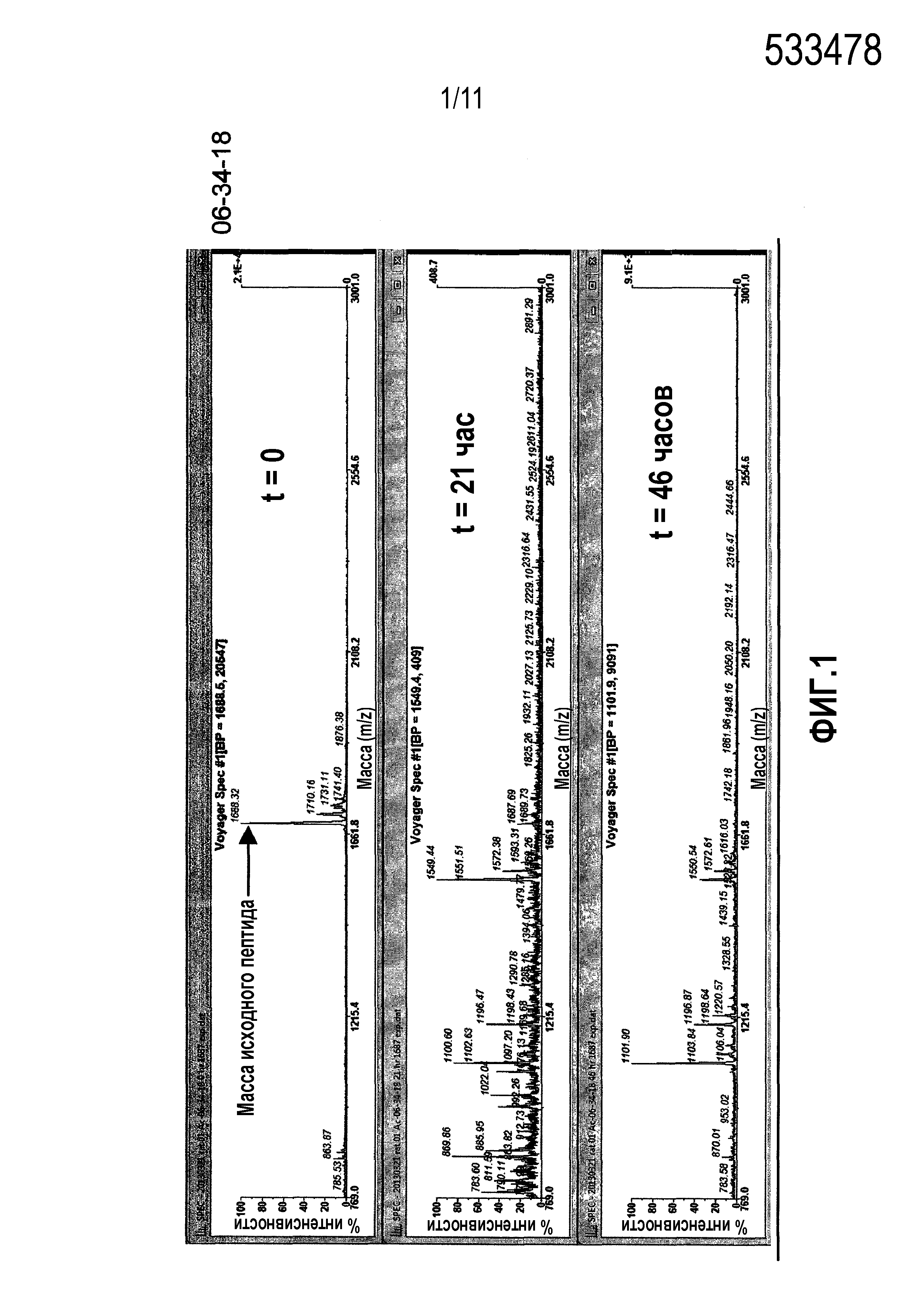
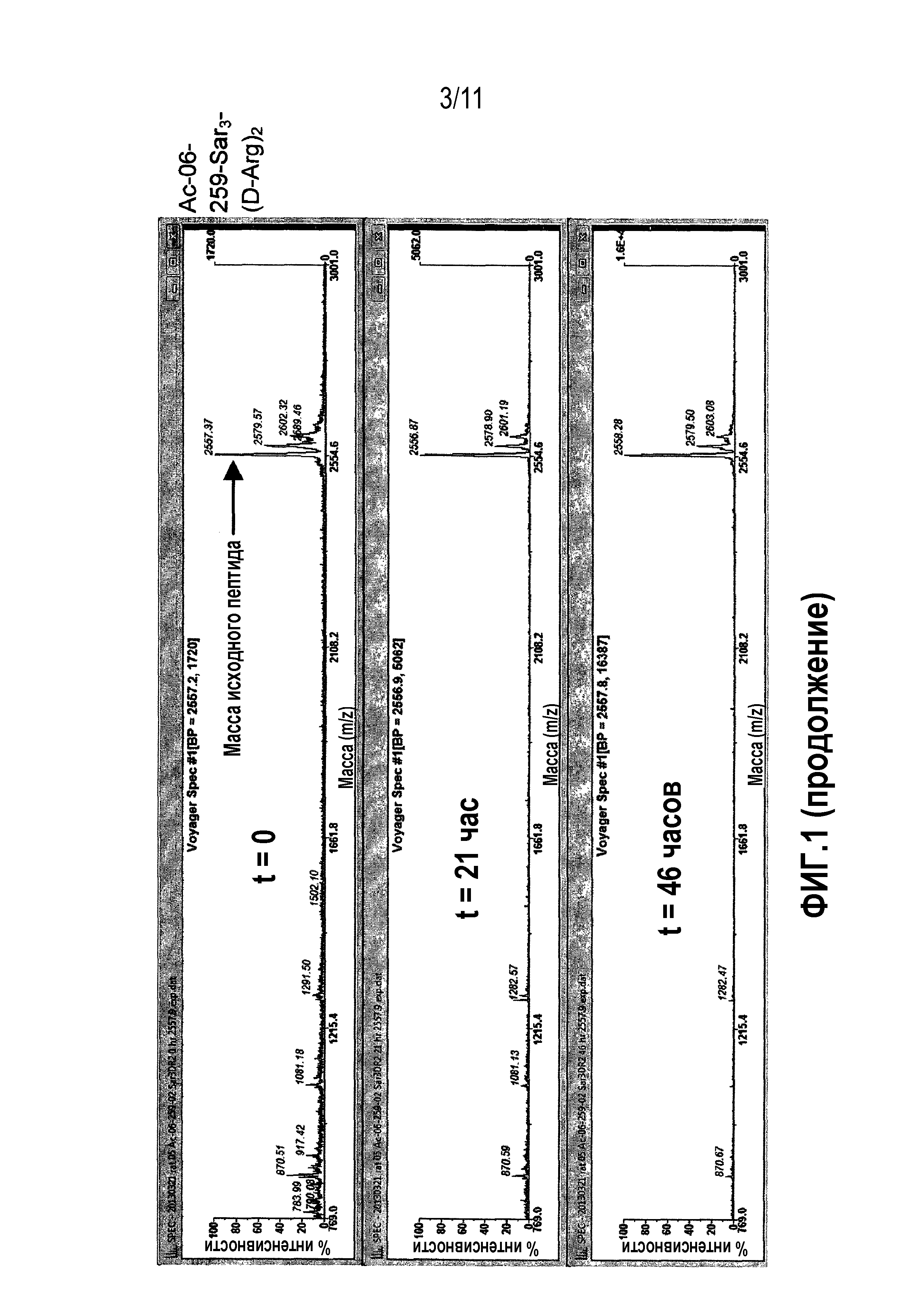
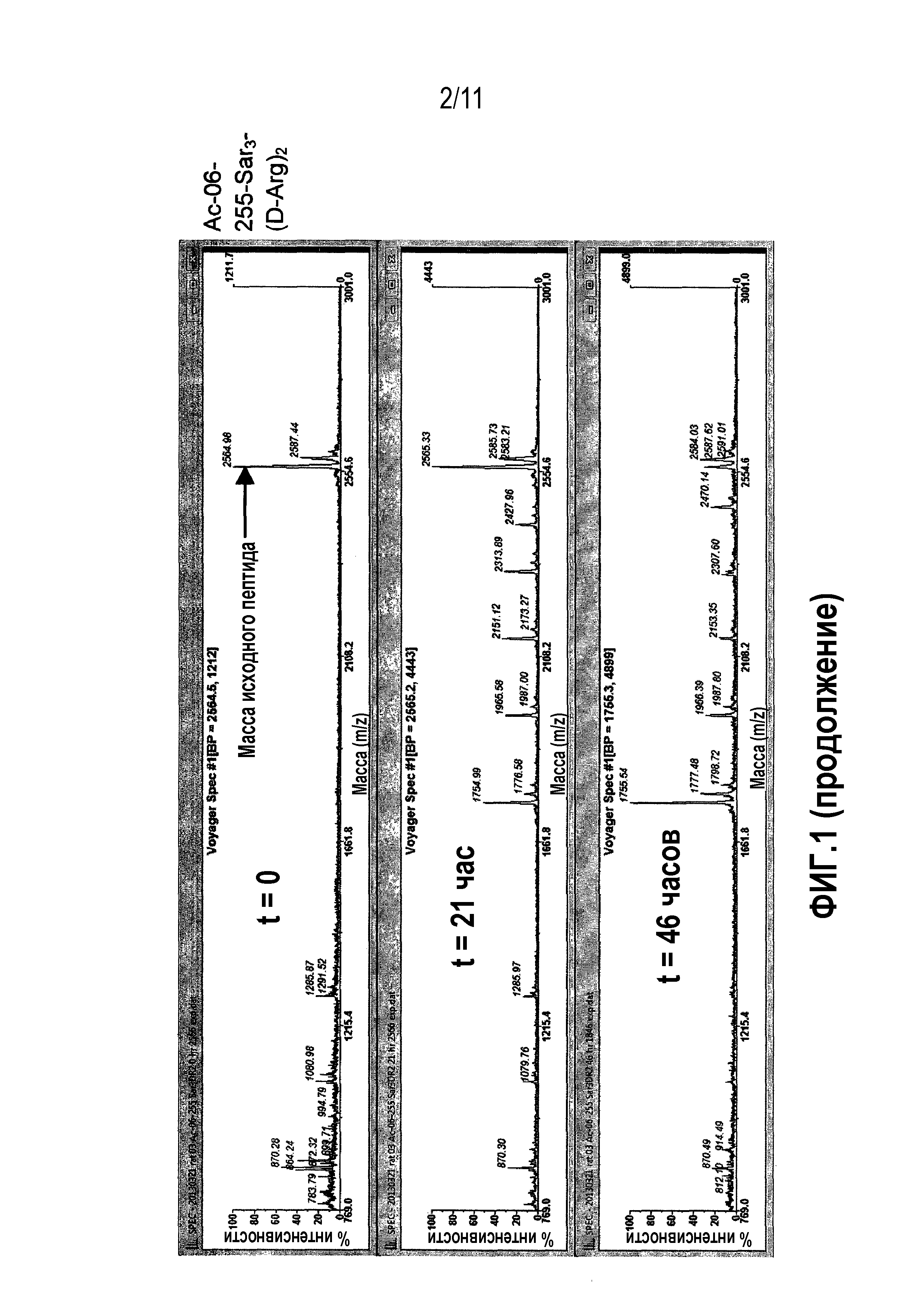
Фиг.1: Сравнительная стабильность в плазме крысы контроля 06-34-18 против перекрестно реагирующих новых калликреин-связывающих бициклических лидирующих соединений.
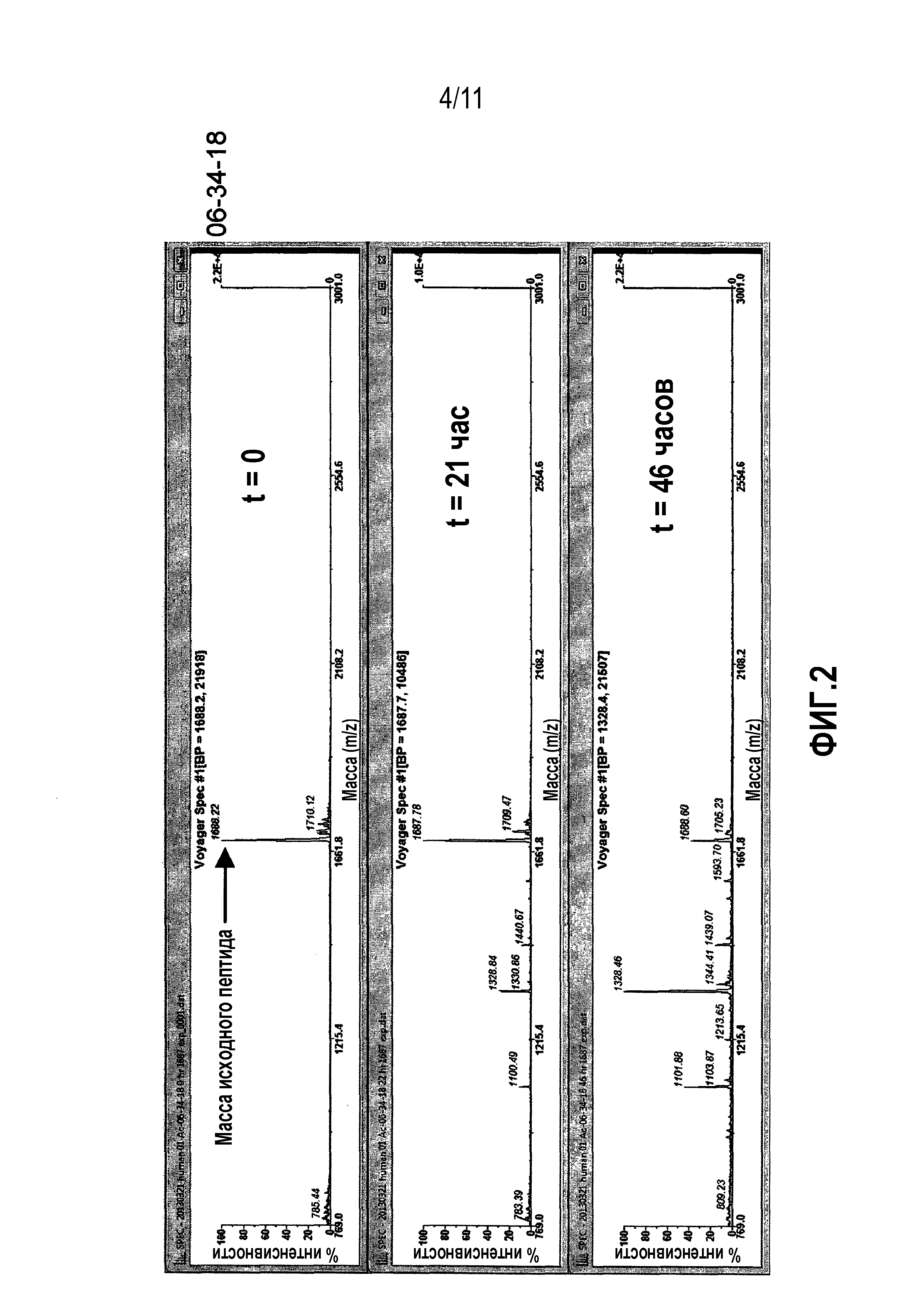
Фиг.2: Сравнительная стабильность в плазме человека контроля 06-34-18 против перекрестно реагирующих новых калликреин-связывающих бициклических лидирующих соединений.
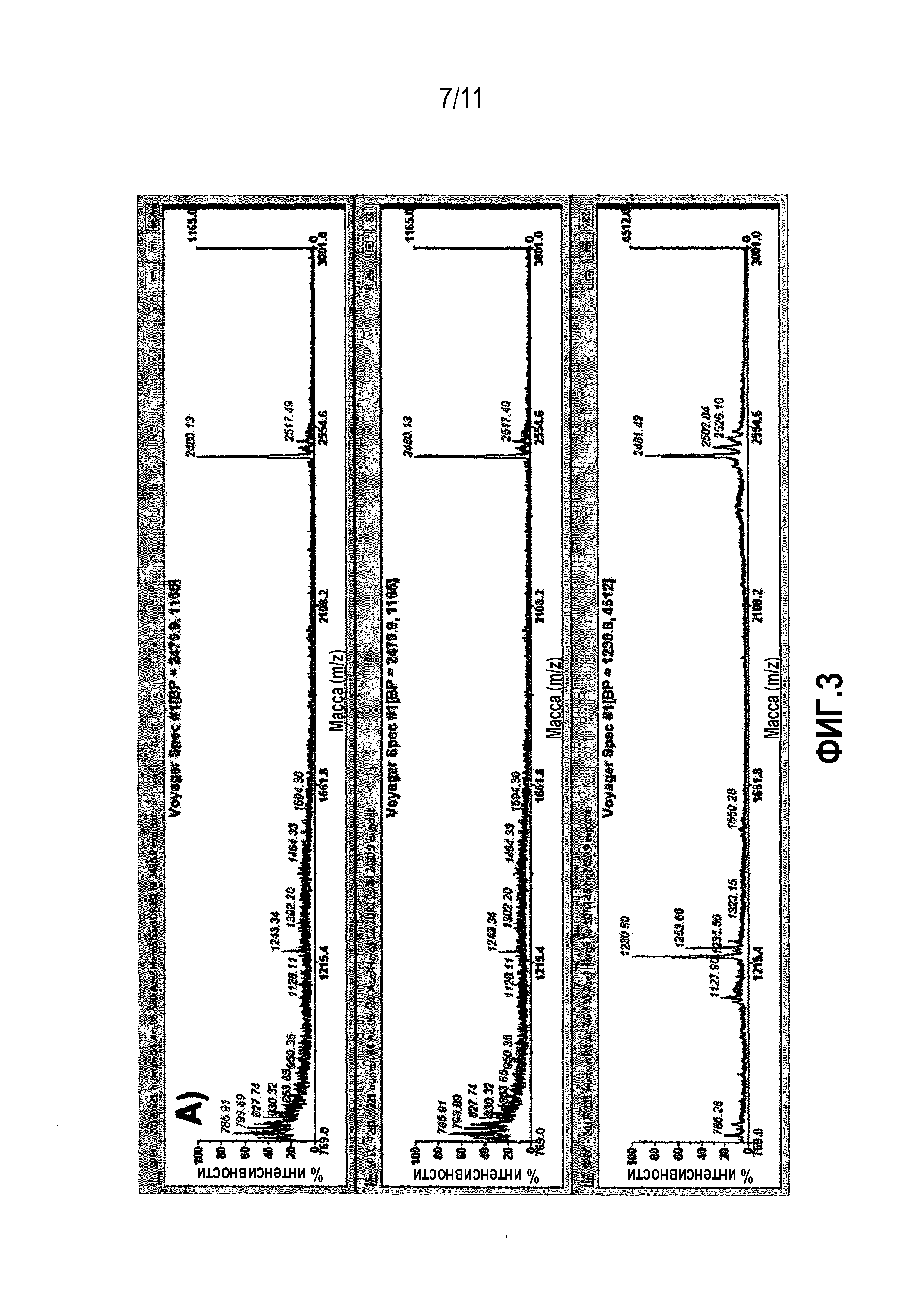
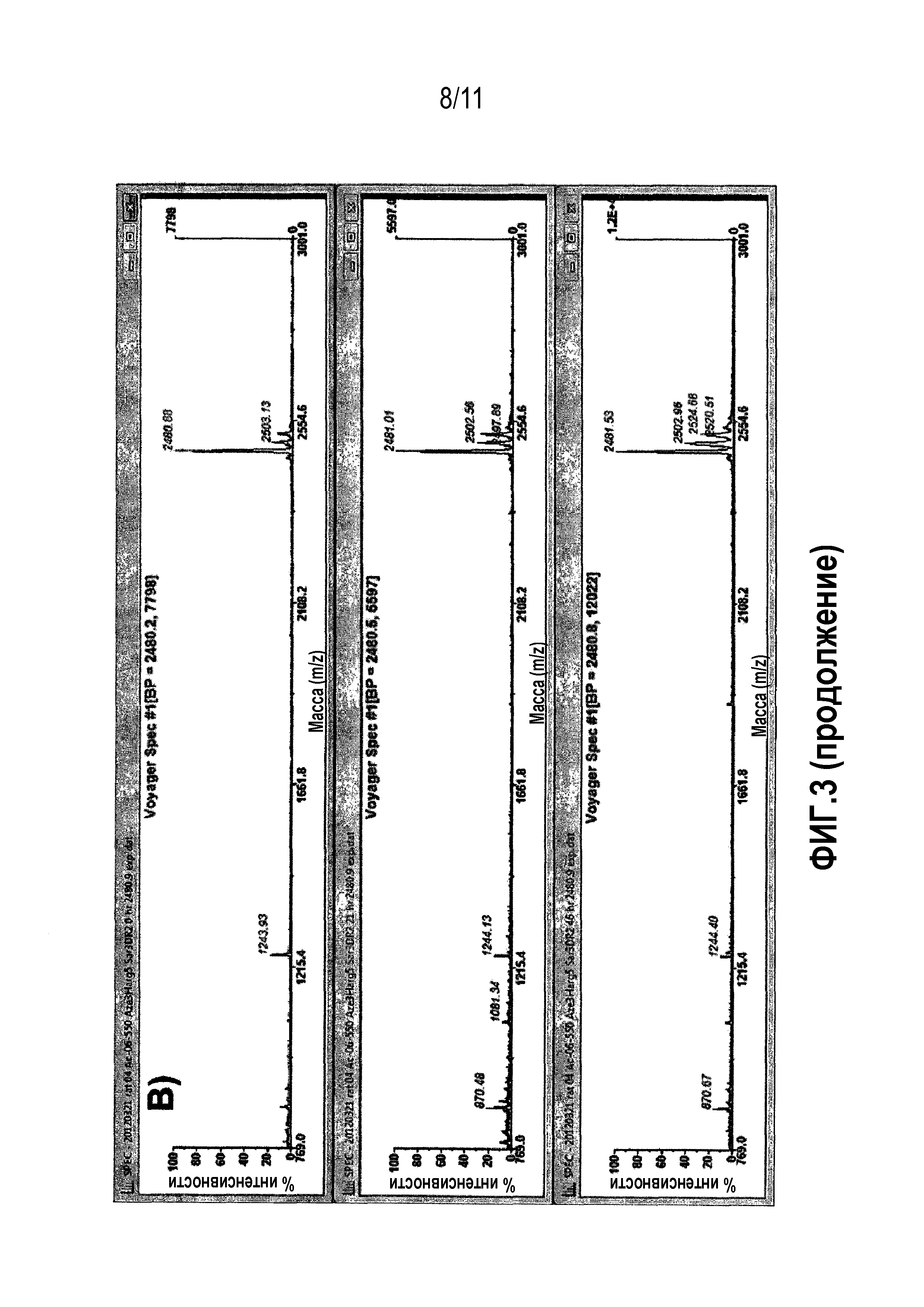
Фиг.3: Сравнительная стабильность производного 06-550 в плазме человека (A) и крысы (B). Взятие образцов смеси плазмы и пептидов проводили в моменты времени 0 (сверху), 21 (в середине) и 46 (снизу) ч. Исходный пик пептида находится на уровне 2481,9 MH+. В течение 46 часов наблюдают небольшую деградацию, поскольку относительная доля исходного пика остается высоким.
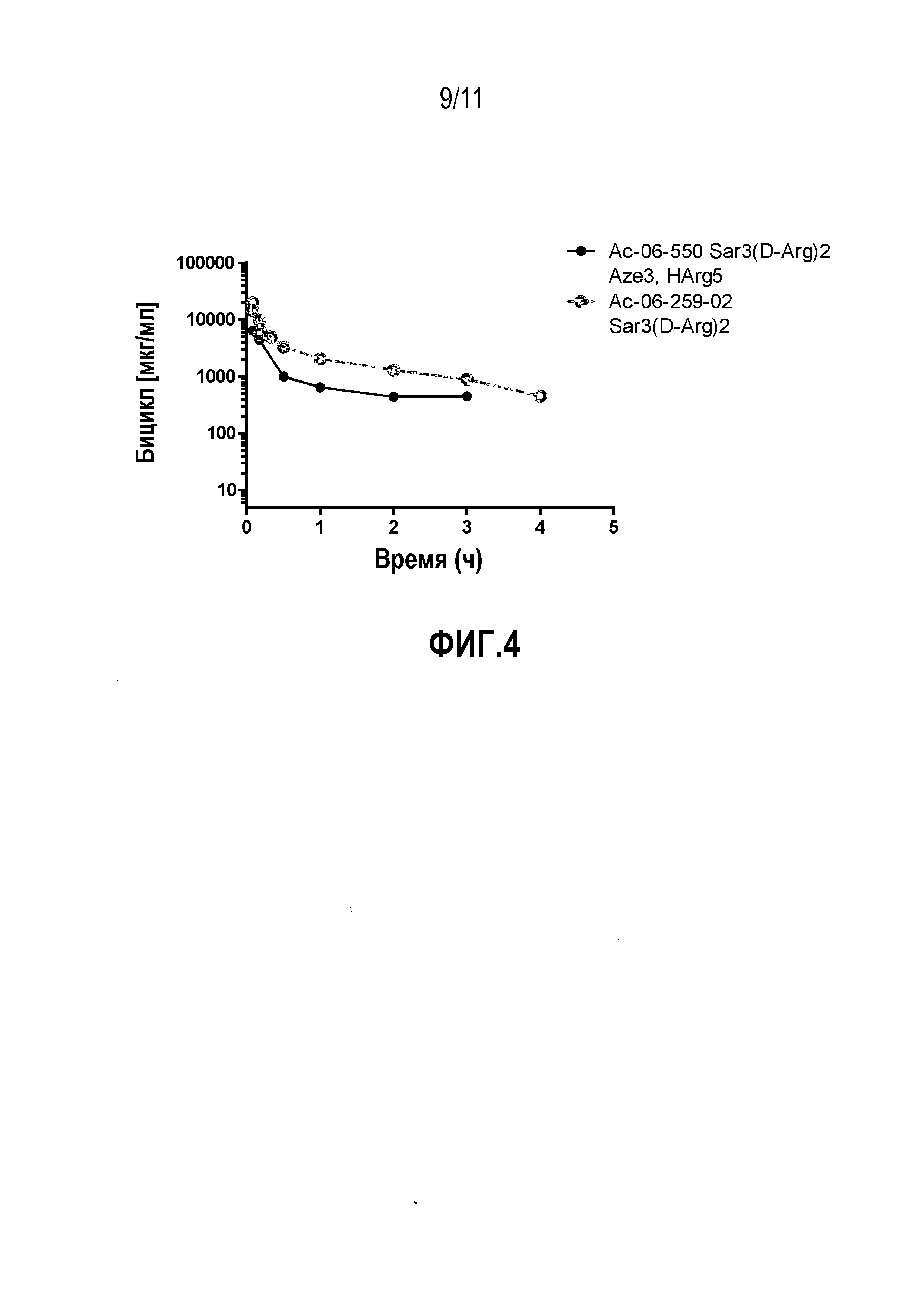
Фиг.4: Фармакокинетический профиль in vivo двух выбранных пептидов у крыс. Производное 06-259-02, в частности, проявляет выраженную стабильность в кровотоке крысы, поскольку его выведение по большей части осуществляется почечной фильтрацией.
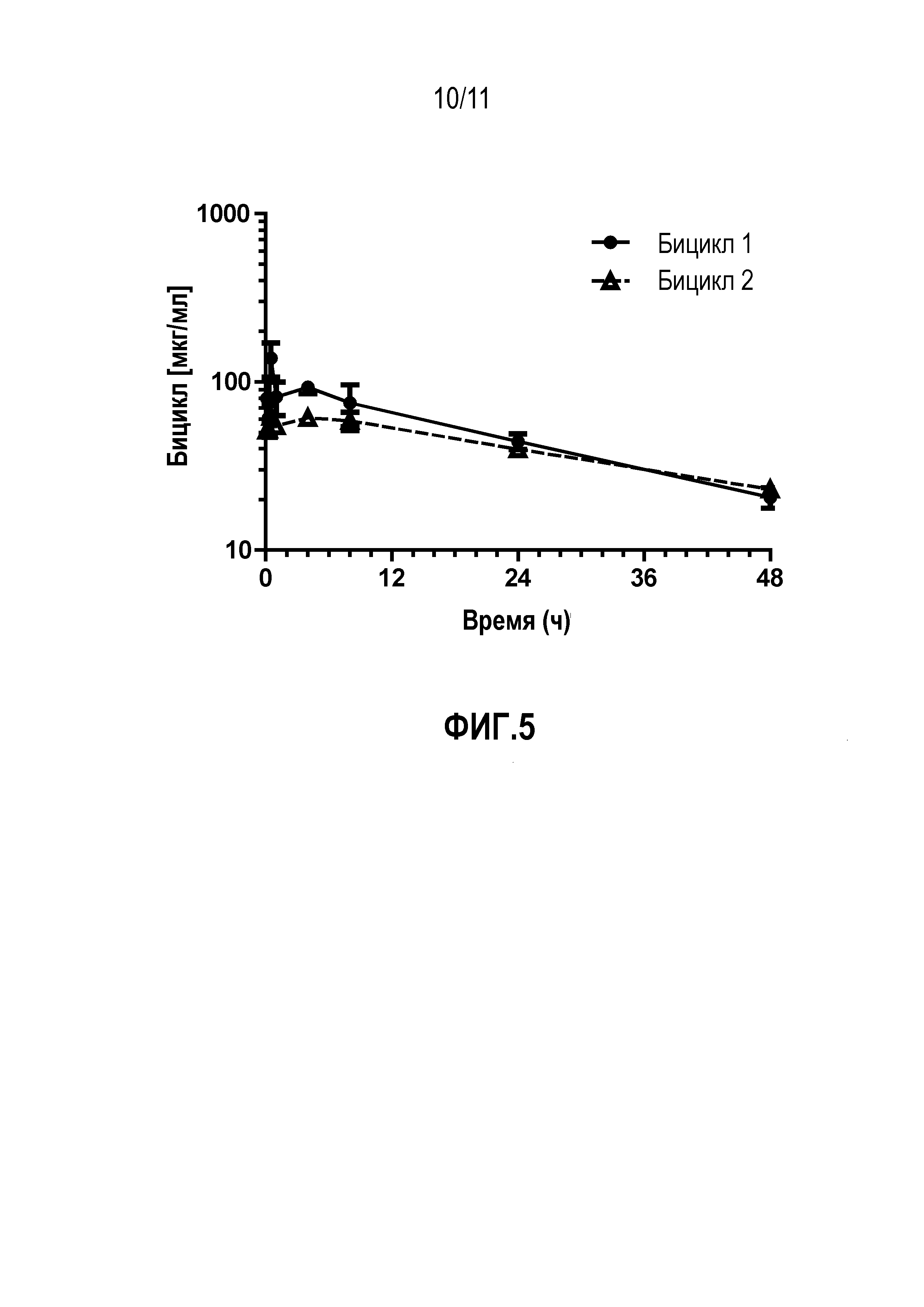
Фиг.5: Фармакокинетический анализ in vivo после инъекции внутрь стекловидного тела кроликам двух выбранных пептидов. Оба пептида, включая производное 06-550, медленно выводились из жидкости стекловидного тела с временем полувыведения 20-30 ч.
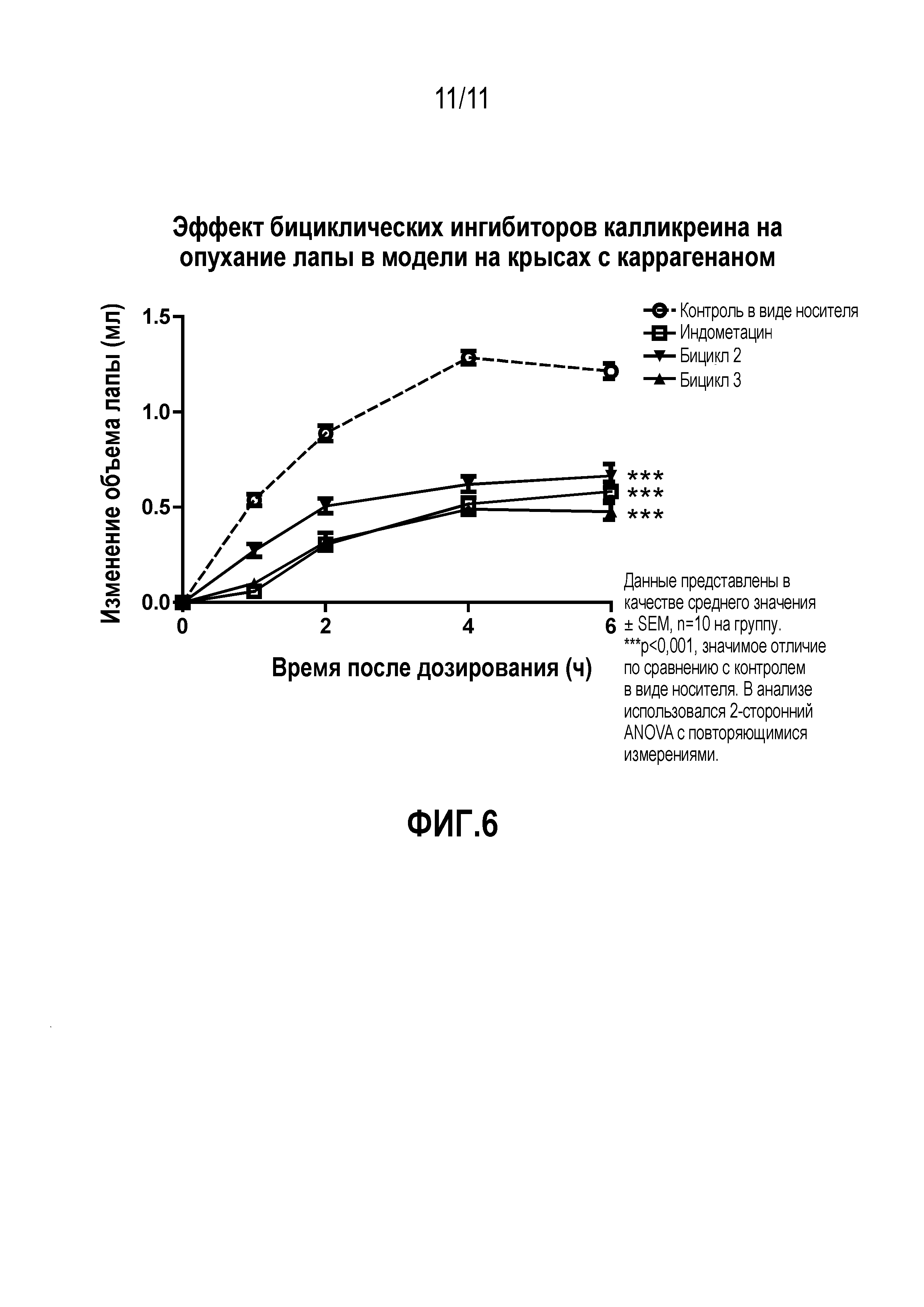
Фиг.6: Эффект двух выбранных пептидов на индуцируемый каррагенаном отек лапы. Оба пептида, включая производное 06-259-02, ингибировали опухание лапы, индуцируемое каррагенаном, во все моменты времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевают специалисты в таких областях, как область химии пептидов, культивирования клеток и фагового дисплея, химии нуклеиновых кислот и биохимии. Для молекулярно-биологических, генетических и биохимических способов используют стандартные технологии (см. Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., 2001, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel et al., Short Protocols in Molecular Biology (1999) 4th ed., John Wiley & Sons, Inc.), которые включены в настоящее описание в качестве ссылок.
Пептидные лиганды
Пептидный лиганд, как упоминается в настоящем описании, относится к пептиду, ковалентно связанному с молекулярным каркасом. Как правило, такие пептиды содержат две или более реакционноспособных групп (т.е. остатков цистеина), которые способны образовывать ковалентные связи с каркасом, и последовательность, стягивающую указанные реакционноспособные группы, которую называют последовательностью петли, поскольку она образует петлю, когда пептид связан с каркасом. В настоящем случае, пептиды содержат по меньшей мере три остатка цистеина (обозначаемых как Ci, Cii и Ciii) и образуют по меньшей мере две петли на каркасе.
В одном варианте осуществления пептидный лиганд содержит последовательность формулы (a). Консенсусная последовательность формулы (a) содержит мотивы из первоначального лидирующего бициклического пептида 06-259, а также каждую из наиболее перспективных пептидных последовательностей, идентифицированных посредством созревания аффинности исходной лидирующей последовательности, как описано в примере 1 и в таблицах 2 и 4.
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из -Ci-N-X-W-N-P-W-Cii-O/U-X-X-X-O-X-Ciii- (SEQ ID NO: 7).
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из -Ci-N-T/H/Y-W-N-P-W-Cii-G/S/P-A/V/W/D/S-D/E/V/T/P-A/G/P/I/R/D-G/P/Y/I-F/I/L/V/R/G/D-Ciii- (SEQ ID NO: 8).
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из -Ci-N-T/H/Y-W-N-P-W-Cii-G/S/P-A/V/W-D/E/V-A/G/P-G/P-F/I/L/V-Ciii- (SEQ ID NO: 9).
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из:
-Ci-N-T-W-N-P-W-Cii-G-W-V-G-G-F-Ciii- (06-259) (SEQ ID NO: 10);
-Ci-N-H-W-N-P-W-Cii-S-V-E-P-P-V-Ciii- (06-259-01) (SEQ ID NO: 11);
-Ci-N-T-W-N-P-W-Cii-P-W-D-A-P-L-Ciii- (06-259-02) (SEQ ID NO: 12);
-Ci-N-H-W-N-P-W-Cii-S-A-D-P-P-I-Ciii- (06-259-03) (SEQ ID NO: 13);
-Ci-N-Y-W-N-P-W-Cii-P-W-D-A-P-L-Ciii- (06-259-04) (SEQ ID NO: 14);
-Ci-N-H-W-N-P-W-Cii-S-A-D-P-P-R-Ciii- (06-259-F1) (SEQ ID NO: 15);
-Ci-N-H-W-N-P-W-Cii-P-A-D-I-P-V-Ciii- (06-259-E2) (SEQ ID NO: 16);
-Ci-N-H-W-N-P-W-Cii-S-D-D-P-Y-I-Ciii- (06-259-H3) (SEQ ID NO: 17)
-Ci-N-H-W-N-P-W-Cii-S-S-D-P-P-V-Ciii- (06-259-H4) (SEQ ID NO: 18)
-Ci-N-Y-W-N-P-W-Cii-S-D-T-R-I-G-Ciii- (06-259-A6) (SEQ ID NO: 19); и
-Ci-N-T-W-N-P-W-Cii-S-W-P-D-I-D-Ciii- (06-259-F2) (SEQ ID NO: 20).
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из:
-Ci-N-H-W-N-P-W-Cii-S-V-E-P-P-V-Ciii- (06-259-01) (SEQ ID NO: 11);
-Ci-N-T-W-N-P-W-Cii-P-W-D-A-P-L-Ciii- (06-259-02) (SEQ ID NO: 12);
-Ci-N-H-W-N-P-W-Cii-S-A-D-P-P-I-Ciii- (06-259-03) (SEQ ID NO: 13); и
-Ci-N-Y-W-N-P-W-Cii-P-W-D-A-P-L-Ciii- (06-259-04) (SEQ ID NO: 14).
После созревания аффинности пептиды согласно этому варианту осуществления были идентифицированы как одни из наиболее эффективных кандидатов (см. пример 1 и таблицу 4). Более того, было идентифицировано, что каждый из пептидов согласно этому варианту осуществления демонстрирует как высокую эффективность, так и высокую перекрестную реактивность между калликреинами крысы и человека (см. таблицу 5).
В следующем варианте осуществления пептид формулы (a) содержит последовательность, выбранную из -Ci-N-T-W-N-P-W-Cii-P-W-D-A-P-L-Ciii- (06-259-02) (SEQ ID NO: 12). Пептид согласно этому варианту осуществления был идентифицирован как наиболее эффективный перекрестно реагирующий и стабильный представитель семейства пептидных лигандов формулы (a) (см. примеры 1 и 2). Например, первоначальный скрининг с использованием способа #1, описанного в настоящем описании, показал, что 06-259-02 является более стабильным, чем большинство из остальных бициклических лидирующих соединений, исходя из окна определения, составляющего вплоть до 10 суток (данные не представлены). Более того, стабильность ex vivo также была воспроизводимой in vivo, в частности, у крыс, где метаболизм пептида практически отсутствовал, исходя из клиренса и сравнения с известной скоростью гломерулярной фильтрации (пример 4).
В одном варианте осуществления пептидный лиганд содержит последовательность формулы (b). Консенсусная последовательность формулы (b) содержит мотивы из обоих исходных лидирующих бициклических пептидов 06-254 и 06-255, а также каждую из наиболее перспективных пептидных последовательностей, идентифицированных после созревания аффинности первоначального лидирующего соединения 06-254, как описано в примере 1 и в таблицах 2 и 3.
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из -Ci-K/R-N-Y-W-N-P-Cii-D/T/G-L-I/V/L-E/M/N/P/T/Q/S/Y/G/D/W/R/H/A-D/G/I/T/A/S/P/V-P/S/T/A/K/G/H/F/Q/D/L/I/M/R/Y-Ciii- (SEQ ID NO: 21).
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из -Ci-K/R-N-Y-W-N-P-Cii-D/T-L-I/V-E/M/N/P/T-D/G/I/T-P/S/T-Ciii- (SEQ ID NO: 22).
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из:
-Ci-K-N-Y-W-N-P-Cii-D-L-V-T-I-S-Ciii- (06-254) (SEQ ID NO: 23);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-E-T-T-Ciii- (06-254-01) (SEQ ID NO: 24);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-G-P-Ciii- (06-254-02) (SEQ ID NO: 25);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-M-D-T-Ciii- (06-254-03) (SEQ ID NO: 26);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-Q-D-A-Ciii- (06-254-F4) (SEQ ID NO: 27);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-S-I-K-Ciii- (06-254-B3) (SEQ ID NO: 28);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-T-G-Ciii- (06-254-G3) (SEQ ID NO: 29);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-Q-I-H-Ciii- (06-254-H4) (SEQ ID NO: 30);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-G-I-T-Ciii- (06-254-G2) (SEQ ID NO: 31);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-D-T-F-Ciii- (06-254-A4) (SEQ ID NO: 32);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-E-A-Q-Ciii- (06-254-G4) (SEQ ID NO: 33);
-Ci-K-N-F-W-N-P-Cii-D-L-I-P-I-S-Ciii- (06-254-D3) (SEQ ID NO: 34);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-W-T-D-Ciii- (06-254-E2) (SEQ ID NO: 35);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-D-L-Ciii- (06-254-F5) (SEQ ID NO: 36);
-Ci-K-N-Y-W-N-P-Cii-D-L-L-E-S-T-Ciii- (06-254-E5) (SEQ ID NO: 37);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-R-P-P-Ciii- (06-254-D1) (SEQ ID NO: 38);
-Ci-K-N-Y-W-N-P-Cii-D-L-L-G-I-A-Ciii- (06-254-B9) (SEQ ID NO: 39);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-H-D-I-Ciii- (06-254-E3) (SEQ ID NO: 40);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-D-M-Ciii- (06-254-D6) (SEQ ID NO: 41);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-A-D-L-Ciii- (06-254-H3) (SEQ ID NO: 42);
-Ci-K-N-Y-W-N-P-Cii-D-L-L-H-V-R-Ciii- (06-254-A7) (SEQ ID NO: 43);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-A-P-Y-Ciii- (06-254-C1) (SEQ ID NO: 44);
-Ci-K-N-Y-W-N-P-Cii-G-L-V-Y-S-T-Ciii- (06-254-E6) (SEQ ID NO: 45);
-Ci-K-N-Y-W-N-P-Cii-D-L-L-P-D-L-Ciii- (06-254-B1) (SEQ ID NO: 46); и
-Ci-R-N-Y-W-N-P-Cii-T-L-I-N-I-T-Ciii- (06-255) (SEQ ID NO: 47).
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из:
-Ci-K-N-Y-W-N-P-Cii-D-L-I-E-T-T-Ciii- (06-254-01) (SEQ ID NO: 24);
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-G-P-Ciii- (06-254-02) (SEQ ID NO: 25);
-Ci-K-N-Y-W-N-P-Cii-D-L-V-M-D-T-Ciii- (06-254-03) (SEQ ID NO: 26); и
-Ci-R-N-Y-W-N-P-Cii-T-L-I-N-I-T-Ciii- (06-255) (SEQ ID NO: 47).
После созревания аффинности пептиды согласно этому варианту осуществлению были идентифицированы в качестве наиболее эффективных кандидатов (см. пример 1 и таблицу 3). Более того, было идентифицировано, что каждый из пептидов согласно этому варианту осуществления демонстрирует как высокую эффективность, так и высокую перекрестную реактивность между калликреинами крысы и человека (см. таблицу 5).
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из:
-Ci-K-N-Y-W-N-P-Cii-D-L-I-P-G-P-Ciii- (06-254-02) (SEQ ID NO: 25); и
-Ci-R-N-Y-W-N-P-Cii-T-L-I-N-I-T-Ciii- (06-255) (SEQ ID NO: 47).
Пептиды согласно этому варианту осуществления были идентифицированы как наиболее мощные представители каждого семейства пептидных лигандов формулы (b) (см. пример 2).
В следующем варианте осуществления пептид формулы (b) содержит последовательность, выбранную из -Ci-R-N-Y-W-N-P-Cii-T-L-I-N-I-T-Ciii- (06-255) (SEQ ID NO: 47). Первоначальный скрининг с использованием способа #1, описанный в настоящем описании, показал, что 06-255 был более стабильным, чем большинство остальных бициклических лидирующих соединений, исходя из окна обнаружения вплоть до 10 суток (данные не представлены).
В одном варианте осуществления пептидный лиганд содержит последовательность формулы (c). Консенсусная последовательность формулы (c) содержит фиксированный мотив QKFESR (SEQ ID NO: 48) в петле 1 из исходного лидирующего бициклического пептида 06-256 и сходные производные, содержащиеся в нем, как описано в примере 1 и в таблице 2.
В следующем варианте осуществления пептид формулы (c) содержит последовательность, выбранную из -Ci-Q-K-F-E-S-R-Cii-R-V-D-T-R-Y-Ciii- (06-256) (SEQ ID NO: 49). Данные о перекрестной реактивности для 06-256 между белками человека, крысы и кролика представлены в таблице 1 и 5.
В одном варианте осуществления пептид лиганд содержит последовательность формулы (d). Пептидная последовательность формулы (d) соответствует последовательности первоначального лидирующего бициклического пептида 06-257, как описано в примере 1 и в таблице 1. Данные о перекрестной реактивности для 06-257 между человеком, крысой и кроликом представлены в таблицах 1 и 5.
В одном варианте осуществления пептидный лиганд содержит последовательность формулы (e). Консенсусная последовательность формулы (e) содержит консервативный мотив PYPFR (SEQ ID NO: 50) в петле 1 и остаток гистидина в положении 2 петли 2 в исходном лидирующем бициклическом пептиде 06-258, где консенсусная последовательность основана на сходных последовательностях, идентифицированных в ходе первоначальных раундов селекции (пример 1 и таблица 2).
В следующем варианте осуществления пептид формулы (f) содержит последовательность, выбранную из -Ci-(N)a-U-F-P-J-R-Cii-V-Y-Y-P-D-I-Ciii- (SEQ ID NO: 51).
В следующем варианте осуществления пептид формулы (e) содержит последовательность, выбранную из -Ci-P-Y-P-F-R-Cii-L-H-E-N-L-Ciii- (06-258) (SEQ ID NO: 52). Было идентифицировано, что пептид согласно этому варианту осуществления демонстрирует высокую эффективность и высокую перекрестную реактивностью между калликреинами крысы и человека (см. таблицу 5).
В одном варианте осуществления пептидный лиганд содержит последовательность формулы (f). Консенсусная последовательность формулы (f) содержит мотивы из обоих исходных лидирующих бициклических пептидов 06-261 и 06-550, а также каждую из наиболее перспективных пептидных последовательностей, идентифицированных в первоначальном скрининге, как описано в примере 1 и в таблицах 1 и 2.
В следующем варианте осуществления пептид формулы (f) содержит последовательность, выбранную из -Ci-(N)a-N/S-F-P-F/Y-R-Cii-V-Y-Y-P-D-I-Ciii- (SEQ ID NO: 53).
В следующем варианте осуществления пептид формулы (f) содержит последовательность, выбранную из:
-Ci-N-N-F-P-F-R-Cii-V-Y-Y-P-D-I-Ciii- (06-261) (SEQ ID NO: 54); или
-Ci-S-F-P-Y-R-Cii-V-Y-Y-P-D-I-Ciii- (06-550) (SEQ ID NO: 55).
В следующем варианте осуществления пептид формулы (f) содержит последовательность, выбранную из -Ci-N-N-F-P-F-R-Cii-V-Y-Y-P-D-I-Ciii- (06-261) (SEQ ID NO: 54). Пептид согласно этому варианту осуществления после селекций был идентифицирован как один из наиболее эффективных кандидатов (см. пример 1 и таблицу 1). Более того, было идентифицировано, что пептид согласно этому варианту осуществления демонстрирует как высокую эффективность, так и высокую перекрестную реактивность между калликреинами крысы и человека (см. таблицу 5).
В альтернативном варианте осуществления пептид формулы (f) содержит последовательность, выбранную из -Ci-S-F-P-Y-R-Cii-V-Y-Y-P-D-I-Ciii- (06-550) (SEQ ID NO: 55). Данные, демонстрирующие преимущества 06-550, описаны в примерах 3 и 4, где можно видеть, что он является эффективным химерным бициклом. В частности, перекрестную реактивность между калликреинами человека, крысы и кролика можно видеть в таблице 7.
В одном варианте осуществления определенные пептидные лиганды по изобретению являются специфичными в отношении калликреина плазмы человека, крысы и/или кролика. В следующем варианте осуществления определенные пептидные лиганды по изобретению являются специфичными в отношении калликреина плазмы человека и/или крысы. В следующем варианте осуществления определенные пептидные лиганды по изобретению являются специфичными в отношении калликреина плазмы человека.
Преимущества пептидных лигандов
Определенные бициклические пептиды по настоящему изобретению имеют ряд преимущественных свойств, которые позволяют рассматривать их как подходящие подобные лекарственным средствам молекулы для инъекционного, ингаляционного, назального, глазного, перорального или местного введения. Такие преимущественные свойства включают:
- Видовую перекрестную реактивность. Это является типичным требованием для доклинической фармакодинамической и фармакокинетической оценки;
- Устойчивость к протеазам. Пептидные лиганды, являющиеся кандидатами для бициклических пептидных лидирующих соединений, должны в идеальном случае демонстрировать устойчивость к протеазам плазмы, эпителиальным ("заякоренным на мембране") протеазам, протеазам желудка и кишечника, поверхностным протеазам легких, внутриклеточным протеазам и т.п. Устойчивость к протеазам должна сохраняться между различными видами, так что бициклическое лидирующее соединение-кандидат можно разрабатывать в моделях на животных, а также уверенно вводить человеку.
- Желаемый профиль растворимости. Он является функцией соотношения заряженных и гидрофильных против гидрофобных остатков и образования внутри/межмолекулярных H-связей, которое является важным для целей составления и всасывания; и
- Оптимальное время полужизни в кровотоке. В зависимости от клинического показания и режима лечения, может потребоваться разработка бициклического пептида для кратковременного воздействия в условиях управления течением острым заболеванием, или разработка бициклического пептида с увеличенным удержанием в кровотоке, и, таким образом, являющегося оптимальным для управления течением более хронических болезненных состояний.
Фармацевтически приемлемые соли
Будет понятно, что в объем настоящего изобретения входят солевые формы, и упоминание соединений формулы (I) включает солевые формы указанных соединений.
Соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основную или кислотную часть, общепринятыми химическими способами, такими как способы, описанные в Pharmaceutical Salts: Properties, Selection, and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 pages, August 2002. Как правило, такие соли можно получать посредством реакции форм свободной кислоты или основания этих соединений с соответствующим основанием или кислотой в воде или в органическом растворителе, или в их смеси.
Кислотно-аддитивные соли (моно- или дисоли) можно получать с использованием широкого множества кислот, как неорганических, так и органических. Примеры кислотно-аддитивных солей включают моно- или дисоли, образованные с кислотой, выбранной из группы, состоящей из уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензолсульфоновой, бензойной, 4-ацетамидобензойной, бутановой, (+) камфорной, камфор-сульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновый, каприловой, коричной, лимонной, цикламовой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактаровой, гентизиновой, глюкогептоновой, D-глюконовой, глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой кислотами, галогенводородными кислотами (например, бромистоводородной, хлористоводородной, йодистоводородной), изетионовой, молочной (например, (+)-L-молочной, (±)-DL-молочной), лактобионовой, малеиновой, яблочной, (-)-L-яблочной, малоновой, (±)-DL-миндальной, метансульфоновой, нафталин-2-сульфоновой, нафталин-1,5-дисульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памовой, фосфорной, пропионовой, пировиноградной, L-пироглутаминовой, салициловой, 4-аминосалициловой, себациновой, стеариновой, янтарной, серной, танновой, (+)-L-виннокаменной, тиоциановой, п-толуолсульфоновой, ундециленовой и валериановой кислотами, а также ацетилированными аминокислотами и катионообменными смолами.
Одна конкретная группа солей состоит из солей, образованных уксусной, хлористоводородной, йодистоводородной, фосфорной, азотной, серной, лимонной, молочной, янтарной, малеиновой, яблочной, изетионовой, фумаровой, бензолсульфоновой, толуолсульфоновой, серной, метансульфоновой (мезилат), этансульфоновой, нафталинсульфоновой, валериановой, пропионовой, бутановой, малоновой, глюкуроновой и лактобионовой кислотами. Одной конкретной солью является соль хлористоводородной кислоты. Другой конкретной солью является ацетат.
Модифицированные производные
Будет понятно, что модифицированные производные пептидных лигандов, как определено в настоящем описании, входят в объем настоящего изобретения. Примеры таких подходящих модифицированных производных включают одну или несколько модификаций, выбранных из: N-концевых и/или C-концевых модификаций; замены одного или нескольких аминокислотных остатков одним или несколькими неприродными аминокислотными остатками (такие как замена одного или нескольких полярных аминокислотных остатков одной или несколькими изостерическими или изоэлектронными аминокислотами; замена одного или нескольких гидрофобных аминокислотных остатков другими неприродными изостерическими или изоэлектронными аминокислотами); присоединения спейсерной группы; замены одного или нескольких чувствительных к окислению аминокислотных остатков одним или несколькими устойчивыми аминокислотными остатками; замены одного или нескольких аминокислотных остатков аланином, замены одного или нескольких L-аминокислотных остатков одним или несколькими D-аминокислотными остатками; N-алкилирования одной или нескольких амидных связей в бициклическом пептидном лиганде; замены одной или нескольких пептидных связей заместительной связью; модификации длины пептидного остова; замены водорода на α-углероде одного или нескольких аминокислотных остатков другой химической группой и постсинтетической модификации аминокислот, таких как цистеин, лизин, глутамат/аспартат и тирозин подходящими реагентами, реагирующими с амином, тиолом, карбоновой кислотой и фенолом.
В одном варианте осуществления модифицированное производное содержит N-концевую и/или C-концевую модификацию.
В следующем варианте осуществления модифицированное производное содержит N-концевую модификацию. В следующем варианте осуществления N-концевая модификация включает N-концевую ацетильную группу. В этом варианте осуществления N-концевую цистеиновую группу (группа, обозначаемая в настоящем описании как Ci) кэппируют уксусным ангидридом или другими подходящими реагентами в процессе синтеза пептидов, что приводит к молекуле, которая является ацетилированной на N-конце. Этот вариант осуществления обеспечивает преимущество удаления потенциальной точки распознавания для аминопептидазы и лишен потенциала к деградации бициклического пептида.
В следующем варианте осуществления модифицированное производное содержит C-концевую модификацию. В следующем варианте осуществления C-концевая модификация содержит амидную группу. В этом варианте осуществления C-концевую цистеиновую группу (группа, обозначаемая в настоящем описании как Ciii) синтезируют в качестве амида в процессе синтеза пептидов, что приводит к молекуле, которая амидирована на C-конце. Этот вариант осуществления обеспечивает преимущество удаления потенциальной точки распознавания для карбоксипептидазы и лишен потенциала к деградации бициклического пептида.
В одном варианте осуществления модифицированное производное содержит замену одного или нескольких аминокислотных остатков одним или несколькими неприродными аминокислотными остатками. В этом варианте осуществления могут быть выбраны неприродные аминокислоты, имеющие изостерические/изоэлектронные боковые цепи, которые более не распознаются деградирующими протеазами, а также не имеют эффекта на эффективность в отношении мишени.
Альтернативно можно использовать неприродные аминокислоты, имеющие ограниченные боковые цепи аминокислот, чтобы существовало конформционное или стерическое препятствие протеолитическому гидролизу близлежащей пептидной связи является. В частности, это касается аналогов пролина, объемных боковых цепей, Cα-дизамещенных производных (например, аминоизомасляная кислота, Aib и циклоаминокислот, где простым производным является аминоциклопропилкарбоновая кислота.
В следующем варианте осуществления остаток пролина может быть заменен остатком L-азетидинкарбоновой кислоты и/или остаток аргинина может быть заменен остатком N-α -метиларгинина или L-гомоаргинина. В рамках настоящего изобретения представлены данные, которые демонстрируют, что присутствие таких неприродных аминокислот повышает протеолитическую стабильность при сохранении или усилении аффинности бициклических пептидных лигандов к мишени.
В примере 3 продемонстрированы выбранные неприродные производные пептидного лиганда 06-550. Таким образом, в одном варианте осуществления изобретение относится к неприродному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из:
-Ci-S-F-P-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) HArg5) (SEQ ID NO: 56);
-Ci-S-F-[Aze]-Y-R-Cii-V-Y-Y-P-D-I-Ciii- (SEQ ID NO: 57);
-Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 HArg5) (SEQ ID NO: 58);
-Ci-S-F-P-Y-[NMeR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) NMeArg5) (SEQ ID NO: 59); и
-Ci-S-F-[Aze]-Y-[NMeR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 NMeArg5) (SEQ ID NO: 60);
где Aze представляет собой остаток L-азетидинкарбоновой кислоты, hR представляет собой остаток L-гомоаргинина и NMeR представляет собой остаток N-α -метиларгинина.
В следующем варианте осуществления изобретение относится к неприродному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из:
-Ci-S-F-P-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) HArg5) (SEQ ID NO: 56);
-Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 HArg5) (SEQ ID NO: 58);
-Ci-S-F-P-Y-[NMeR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) NMeArg5) (SEQ ID NO: 59); и
-Ci-S-F-[Aze]-Y-[NMeR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 NMeArg5) (SEQ ID NO: 60);
где Aze представляет собой остаток L-азетидинкарбоновой кислоты, hR представляет собой остаток L-гомоаргинина и NMeR представляет собой остаток N-α -метиларгинина.
Перекрестная реактивность этих модифицированных пептидов между калликреинами человека, крысы и кролика представлена в таблице 7.
В следующем варианте осуществления изобретение относится к модифицированному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из:
-Ci-S-F-P-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) HArg5) (SEQ ID NO: 56); и
-Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 HArg5) (SEQ ID NO: 58);
где Aze представляет собой остаток L-азетидинкарбоновой кислоты и hR представляет собой остаток L-гомоаргинина.
Продемонстрировано, что пептиды согласно этому варианту осуществления являются более пригодными, чем соответствующие N-метилмодифицированные производные (см. пример 3).
В следующем варианте осуществления изобретение относится к неприродному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из -Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii- ((06-550) Aze3 HArg5) (SEQ ID NO: 58), где Aze представляет собой остаток L-азетидинкарбоновой кислоты и hR представляет собой остаток L-гомоаргинина.
Продемонстрировано, что пептид согласно этому варианту осуществления является хорошо переносимым, поскольку аффинность как в отношении белка человека, так и в отношении белка крысы, является высокой (см. пример 3 и таблицу 7).
В одном варианте осуществления модифицированное производное включает присоединение спейсерной группы. В следующем варианте осуществления модифицированное производное включает присоединение спейсерной группы на N-концевом цистеине (Ci) и/или C-концевом цистеине (Ciii). В следующем варианте осуществления модифицированное производное содержит присоединение спейсерной группы на C-концевом цистеине (Ciii). В следующем варианте осуществления спейсерная группа содержит одну или несколько групп саркозина (в подходящем случае 3 группы саркозина), связанных с двумя или более остатками D-аргинина (в подходящем случае с 2 остатками D-аргинина). В настоящем описании представлены данные, которые демонстрируют, что присутствие такого спейсера повышает растворимость бициклических пептидных лигандов в воде.
В одном варианте осуществления изобретение относится к модифицированному производному формулы (a), которое содержит пептид, имеющий последовательность, выбранную из -Ci-N-T-W-N-P-W-Cii-P-W-D-A-P-L-Ciii-Sar3-(D-Arg)2 ((06-259-02 (Sar3-(D-Arg)2) (SEQ ID NO: 61); где Sar3 представляет собой 3 саркозиновых спейсера и (D-Arg)2 представляет собой 2 остатка D-аргинина.
Пептид согласно этому варианту осуществления продемонстрировал благоприятный фармакокинетический профиль in vivo, как описано в примере 4. В частности, пептид продемонстрировал выжаренную стабильность в кровотоке крысы, поскольку его выведение по большей частью осуществляется посредством почечной фильтрации. Более того, пептид согласно этому варианту осуществления также продемонстрировал в высокой степени значительное ингибирование индуцируемого каррагенаном опухания лапы, как описано в примере 6, которое было сравнимо с золотым стандартом (индометацин) для такой модели.
В одном варианте осуществления изобретение относится к модифицированному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из:
-Ci-S-F-P-Y-R-Cii-V-Y-Y-P-D-I-Ciii-Sar3-(D-Arg)2 ((06-550)-Sar3-(DArg2)) (SEQ ID NO: 62); и
-Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii-Sar3-(D-Arg)2 ((06-550)-Sar3-(DArg2) Aze3 HArg5) (SEQ ID NO: 63);
где Sar3 представляет собой 3 саркозиновых спейсера, (D-Arg)2 представляет собой 2 остатка D-аргинина, Aze представляет собой остаток L-азетидинкарбоновой кислоты и hR представляет собой остаток L-гомоаргинина.
Продемонстрировано, что пептиды согласно этому варианту осуществления имеют более благоприятную растворимость в воде (см. пример 3). Более важно, добавление группы Sar3-(D-Arg)2 (SEQ ID NO: 98) является допустимым, поскольку эффективность остается неизмененной по сравнению с пептидами, лишенными этой модификации (см. пример 3 и таблицу 7).
В следующем варианте осуществления изобретение относится к модифицированному производному формулы (f), которое содержит пептид, имеющий последовательность, выбранную из -Ci-S-F-[Aze]-Y-[hR]-Cii-V-Y-Y-P-D-I-Ciii-Sar3-(D-Arg)2 ((06-550)-Sar3-(DArg2) Aze3 HArg5) (SEQ ID NO: 63);
где Sar3 представляет собой 3 саркозиновых спейсера, (D-Arg)2 представляет собой 2 остатка D-аргинина, Aze представляет собой остаток L-азетидинкарбоновой кислоты и hR представляет собой остаток L-гомоаргинина. В примере 3 продемонстрировано, что пептид согласно этому варианту осуществления обладает высокой стабильностью, поскольку наблюдали мало продуктов деградации. Более того, пептид согласно этому варианту осуществления также продемонстрировал благоприятный фармакокинетический профиль in vivo, как описано в примере 4. Более того, пептид согласно этому варианту осуществления продемонстрировал медленное выведение из жидкости стекловидного тела после инъекции в стекловидное тело глаза кролика, как описано в примере 5. Являясь само по себе уже преимущественным, это свойство, кроме того, обеспечивает преимущество, состоящее в том, что это идеально подходит для состава с замедленным высвобождением для введения в глаз.
В одном варианте осуществления модифицированное производное содержит замену одного или нескольких чувствительных к окислению аминокислотных остатков одним или несколькими устойчивыми к окислению аминокислотными остатками. В следующем варианте осуществления модифицированное производное содержит замену остатка триптофана остатком фенилаланина. Этот вариант осуществления обеспечивает преимущество улучшения профиля фармацевтической стабильности конечного бициклического пептидного лиганда.
В одном варианте осуществления модифицированное производное содержит замену одного или нескольких заряженных аминокислотных остатков одним или несколькими гидрофобными аминокислотными остатками. В альтернативном варианте осуществления модифицированное производное содержит замену одного или нескольких гидрофобных аминокислотных остатков одним или несколькими заряженными аминокислотными остатками. Правильный баланс заряженных относительно гидрофобных аминокислотных остатков является важной характеристикой бициклических пептидных лигандов. Например, гидрофобные аминокислотные остатки влияют на степень связывания белков плазмы и, таким образом, концентрацию свободной доступной фракции в плазме, в то время как заряженные аминокислотные остатки (в частности, аргинин) могут влиять на взаимодействие пептида с фосфолипидными мембранами на клеточных поверхностях. В совокупности они могут влиять на время полужизни, объем распределения и экспозицию пептидного лекарственного средства, и могут быть адаптированы в соответствии с клиническим результатом. Кроме того, правильная комбинация и количество заряженных относительно гидрофобных аминокислотных остатков могут снижать раздражение в области инъекции (когда пептидное лекарственное средство вводят подкожно).
В одном варианте осуществления модифицированное производное одержит замену одного или нескольких L-аминокислотных остатков одним или несколькими D-аминокислотными остатками. Полагают, что этот вариант осуществления увеличивает устойчивость к протеолизу посредством пространственного препятствования и вследствие склонности D-аминокислот к стабилизации конформаций β-изгиба (Tugyi et al (2005) PNAS, 102(2), 413-418).
В одном варианте осуществления модифицированное производное содержит N-алкилированное производное одной или нескольких амидных связей в бициклическом пептидном лиганде. Полагают, что этот вариант осуществления сообщает защиту от протеолиза посредством прямой модификации поддающейся расщеплению амидной связи (Fiacco et al, Chembiochem. (2008), 9(14), 2200-3). Также полагают, что N-метилирование оказывает выраженный эффект на торсионные углы пептидной связи и, как полагают, способствует проникновению в клетки и пероральной доступности (Biron et al (2008), Angew. Chem. Int. Ed., 47, 2595 -99)
В одном варианте осуществления модифицированное производное содержит замену одной или нескольких пептидных связей заместительной связью, выбранной из одной или нескольких из N-алкилированного производного (например -CO-NR), восстановленной пептидной связи (например -CH2-NH-), пептоидной связи (например -NR-CH2-CO-), тиоамидной связи (например -CS-NH-), азапептидной связи (например -CO-NH-NR-), транс-алкеновой связи (например -RHC=C-), ретро-инверсной связи (например -NH-CO-) и заместительной связи мочевины (например -NH-CO-NHR-).
В одном варианте осуществления в модифицированном производном удалены какие-либо аминокислотные остатки аланина. Этот вариант осуществления обеспечивает преимущество удаления потенциального участка(ов) протеолитической атаки.
В одном варианте осуществления модифицированное производное содержит модификацию длины пептидной связи. В следующем варианте осуществления модификация длины пептидной связи включает использование одного или нескольких β2/3-аминокислотных остатков (таких как -NH-CR-CH2-CO или -NH-CH2-CHR-CO-).
В одном варианте осуществления модифицированное производное содержит замещение на α-углероде одного или нескольких аминокислотных остатков. Этот вариант осуществления обеспечивает преимущество, состоящее в ограничении конформаций остова. В следующем варианте осуществления модифицированное производное содержит замену одного или нескольких аминокислотных остатков 2-аминоизомасляной кислотой (также известной как α-аминоизомасляная кислота (AIB), α-метилаланин или 2-метилаланин).
Следует отметить, что каждая из упомянутых выше модификаций служит для намеренного повышения эффективности пептида в отношении мишени. Дальнейшие усовершенствования эффективности посредством модификаций могут быть достигнуты с помощью следующих механизмов:
- Включение гидрофобных частей, которые задействуют гидрофобный эффект и приводят к более низким константам диссоциации, так что достигается более высокая аффинность;
- Включение заряженных групп, в которых используются ионные взаимодействия в широких пределах, что приводит к более быстрым константам ассоциации и к более высокой аффинности (см. например Schreiber et al, Rapid, electrostatically assisted association of proteins (1996), Nature Struct. Biol. 3, 427-31); и
- Включение дополнительного ограничения в пептид, например, посредством правильного ограничения боковых цепей аминокислот, так чтобы потеря энтропии при связывании мишени была минимальной, ограничение торсионных углов остова, так чтобы потеря энтропии при связывании мишени была минимальной, и внесение дополнительной циклизации в молекулу по идентичным причинам.
(для обзора см. Gentilucci et al, Curr. Pharmaceutical Design, (2010), 16, 3185-203, и Nestor et al, Curr. Medicinal Chem (2009), 16, 4399-418)
Активность связывания
Специфичность в контексте настоящего изобретения относится к способности лиганда связываться или иным образом взаимодействовать с распознаваемой им мишенью для исключения структур, которые сходны с мишенью. Например, специфичность может относиться к способности лиганда ингибировать действие фермента человека, но не гомологичного фермента другого вида. С использованием подхода, описанного в настоящем описании, специфичность можно модулировать, т.е. повышать или снижать, чтобы лиганды стали в большей или меньшей степени способными взаимодействовать с гомологами или паралогами предполагаемой мишени. Подразумевается, что специфичность не является синонимом активности, аффинности или авидности, и эффективность действия лиганда в отношении его мишени (например, такая как аффинность связывания или уровень ингибирования) не обязательно связана с его специфичностью.
Активность связывания, как используют в рамках изобретения, относится к количественным показателям связывания, полученным в анализах связывания, например, как описано в настоящем описании. Таким образом, активность связывания относится к количеству пептидного лиганда, которое связывается при данной концентрации мишени.
Мультиспецифичность представляет собой способность связывать две или более мишеней. Как правило, связывающие пептиды способны связываться с одной мишенью, такой как эпитоп в случае антитела, вследствие их конформационных свойств. Однако могут быть разработаны пептиды, которые могут связываться с двумя или более мишенями - антитела с двойной специфичностью, например, которые известны в данной области, как упоминается выше. В рамках настоящего изобретения пептидные лиганды могут быть способны связываться с двумя или более мишенями и, таким образом, являются мультиспецифическими. В подходящем случае, они связываются с двумя мишенями и обладают двойной специфичностью. Связывание может независимым, что означает, что участкам связывания для мишеней на пептид не препятствует структурно связывание одной или других мишеней. В этом случае, обе мишени могут связываться независимо. Более часто, ожидается, что связывание одной мишени будет по меньшей мере частично препятствовать связыванию другой.
Существует принципиальное отличие между лигандом с двойной специфичностью и лигандом со специфичностью, которая охватывает две родственных мишени. В первом случае лиганд является специфичным в отношении обеих мишеней по отдельности и взаимодействует с каждой из них специфически. Например, первая петля в лиганде может связываться с первой мишенью, а вторая петля может связываться со второй мишенью. Во втором случае лиганд является неспецифическим, поскольку он не различает две мишени, например, посредством взаимодействия с эпитопом мишеней, который является общим для них.
В контексте настоящего изобретения, является возможным, чтобы лиганд, который обладает активностью в отношении, например, мишени и ортолога, был биспецифическим лигандом. Однако в одном варианте осуществления лиганд не является биспецифическим, а обладает менее точной специфичностью, так что он связывает как мишень, так и один или несколько ортологов. Как правило, лиганд, который не был подвергнут селекции как в отношении мишени, так и в отношении ортолога, с меньшей вероятностью будет биспецифическим вследствие отсутствия селективного давления в сторону биспецифичности. Длина петли в бициклическом пептиде может быть решающей в отношении обеспечения подходящей связывающей поверхности, чтобы можно было достигнуть высокой перекрестной реактивности в отношении мишени и ортолога при сохранении высокой селективности в отношении менее родственных гомологов.
Если лиганды являются в действительности биспецифическими в одном варианте осуществления, по меньшей мере одна из специфичностей к мишени у лигандов будет общей среди выбранных лигандов, и уровень этой специфичности можно модулировать способами, описанными в настоящем описании. Вторая или последующие специфичности не должны быть общими и не должны подергаться процессам, описанным в настоящем описании.
Мишень представляет собой молекулу или ее часть, с которой пептидные лиганды связываются или взаимодействуют иным образом. Хотя связывание наблюдают в качестве предпосылки активности большинства типов и оно само по себе может представлять собой активность, предусматриваются другие виды активности. Таким образом, настоящее изобретение не требует измерения связывания прямо или непрямо.
Молекулярный каркас представляет собой любую молекулу, которая может быть присоединена к пептиду в множестве точек для сообщения пептиду одного или нескольких структурных признаков. Предпочтительно, молекулярный каркас содержит по меньшей мере три точки присоединения пептида, называемых реакционноспособными группами каркаса. Эти группы способны реагировать с остатками цистеина (Ci, Cii и Ciii) на пептиде с образованием ковалентной связи. Они не только образуют дисульфидную связь, которая подвергается восстановительному расщеплению и сопутствующему расщеплению молекулы, но и образует стабильные ковалентные простые тиоэфирные связи. Предпочтительные структуры молекулярных каркасов описаны ниже.
Молекулярный каркас
Молекулярные каркасы описаны, например, в WO 2009/098450 и в ссылках, цитированных в ней, в частности, WO 2004/077062 и WO 2006/078161.
Как отмечалось в указанных выше документах, молекулярный каркас может представлять собой низкомолекулярное соединение, такое как низкомолекулярную органическую молекулу.
В одном варианте осуществления молекулярный каркас может представлять собой или может быть основан на природных мономерах, таких как нуклеозиды, сахара или стероиды. Например, молекулярный каркас может содержать короткий полимер таких структур, такой как димер или тример.
В одном варианте осуществления молекулярный каркас представляет собой соединение с известной токсичностью, например, низкой токсичностью. Примеры подходящих соединений включают холестерины, нуклеотиды, стероиды или существующие лекарственные средства, такие как тамазепам.
В одном варианте осуществления молекулярный каркас может представлять собой макромолекулу. В одном варианте осуществления молекулярный каркас представляет собой макромолекулу, состоящую из аминокислот, нуклеотидов или углеводов.
В одном варианте осуществления молекулярный каркас содержит реакционноспособные группы, которые способны реагировать с функциональной группой(ами) полипептида с образованием ковалентных связей.
Молекулярный каркас может содержать химические группы, такие как амины, тиолы, спирты, кетоны, альдегиды, нитрилы, карбоновые кислоты, сложные эфиры, алкены, алкины, азиды, ангидриды, сукцинимиды, малеинимиды, алкилгалогениды и ацилгалогениды.
В одном варианте осуществления молекулярный каркас может содержать или может состоять из трис(бромметил)бензола, особенно 1,3,5-трис(бромметил)бензола ("TBMB"), или его производного.
В одном варианте осуществления молекулярный каркас представляет собой 2,4,6-трис(бромметил)мезитилен. Эта молекула сходна с 1,3,5-трис(бромметил)бензолом, однако содержит три дополнительных метильных группы, связанных с бензольным кольцом. Это имеет преимущество, состоящее в том, что дополнительные метильные группы могут образовывать дополнительные контакты с полипептидом и, таким образом, добавлять дополнительное структурное ограничение.
Молекулярный каркас по изобретению содержит химические группы, которые позволяют функциональным группам полипептида кодируемой библиотеки по изобретению образовывать ковалентные связи с молекулярным каркасом. Указанные химические группы выбирают из широкого диапазона функциональных групп, включая амины, тиолы, спирты, кетоны, альдегиды, нитрилы, карбоновые кислоты, сложные эфиры, алкены, алкины, ангидриды, сукцинимиды, малеинимиды, азиды, алкилгалогениды и ацилгалогениды.
Реакционноспособные группы каркаса, которые можно использовать на молекулярном каркасе для реакции с тиольными группами остатков цистеина, представляют собой алкилгалогениды (или также называемые галогенoалканами или галоалканами).
Примеры включают бромметилбензол (реакционноспособная группа каркаса, иллюстрируемая TBMB) или йодацетамид. Другими реакционноспособными группами каркасов, которые используют для селективного связывания соединений с остатками цистеина в белках, являются малеинимиды. Примеры малеинимидов, которые можно использовать в качестве молекулярных каркасов в рамках изобретения, включают: трис-(2-малеимидоэтил)амин, трис-(2-малеимидоэтил)бензол, трис-(малеимидо)бензол. Селеноцистеин также представляет собой природную аминокислоту, которая имеет сходную реакционную способность с цистеином и может быть использована для тех же реакций. Таким образом, когда упоминают цистеин, также обычно является приемлемой замена на селеноцистеин, если контекст явно не указывает на иное.
Эффекторные и функциональные группы
Эффекторные и/или функциональные группы могут быть связаны, например, с N- или C-концами полипептида или с молекулярным каркасом.
Соответствующие эффекторные группы включают антитела и их части или фрагменты. Например, эффекторная группа может включать константную область легкой цепи (CL) антитела, CH1-домен тяжелой цепи антитела, CH2-домен тяжелой цепи антитела, CH3-домен тяжелой цепи антитела или любую их комбинацию, в дополнение к одному или нескольким доменам константной области. Эффекторная группа также может содержать шарнирную область антитела (такую как область, обычно находящуюся между CH1- и CH2-доменами молекулы IgG).
В следующем варианте осуществления этого аспекта изобретения эффекторная группа в соответствии с настоящим изобретением представляет собой Fc-область молекулы IgG. Предпочтительно, конструкция пептидный лиганд-эффекторная группа в соответствии с настоящим изобретением содержит или состоит из слитой конструкции пептидный лиганд-Fc, имеющей время полужизни tβ, составляющее сутки или более, двое суток или более, 3 суток или более, 4 суток или более, 5 суток или более, 6 суток или более или 7 суток или более. Более предпочтительно, пептидный лиганд в соответствии с настоящим изобретением содержит или состоит из слитой конструкции пептидный лиганд-Fc, имеющей время полужизни tβ, составляющее сутки или более.
Функциональные группы обычно включают связывающие группы, лекарственные средства, реакционноспособные группы для связывания других структур, функциональные группы, которые облегчают захват макроциклических пептидов в клетки и т.п.
Способность пептидов проникать в клетки позволит пептидам против внутриклеточных мишеней быть эффективными. Мишени, которые могут быть доступны для пептидов со способностью проникать в клетки, включают факторы транскрипции, молекулы внутриклеточной передачи сигнала, такие как тирозинкиназы, и молекулы, вовлеченные в апоптотический путь. Функциональные группы, которые обеспечивают проникновение в клетки, включают пептиды или химические группы, которые присоединены либо к пептидному, либо к молекулярному каркасу. Пептиды, такие как пептиды, происходящие из VP22, HIV-Tat, гомеобокс-белка Drosophila (Antennapedia), например, как описано в Chen and Harrison, Biochemical Society Transactions (2007) Volume 35, part 4, p821; Gupta et al. in Advanced Drug Discovery Reviews (2004) Volume 57 9637. Примеры коротких пептидов, для которых было показано, что они являются эффективными в отношении транслокации через плазматические мембраны, включают пептид пенетратин из 16 аминокислот из белка Antennapedia Drosophila (Derossi et al (1994) J Biol. Chem. Volume 269 p10444), "модельный амфипатический пептид" из 18 аминокислот (Oehlke et al (1998) Biochim Biophys Acts Volume 1414 p127) и аргинин-богатые области белка TAT ВИЧ. Непептидные подходы включают применение низкомолекулярных миметиков или SMOC, которые могут быть без труда присоединены к биомолекулам (Okuyama et al (2007) Nature Methods Volume 4 p153). Другие химические стратегии присоединения групп гуанидиния к молекулам также повышают проникновение в клетки (Elson-Scwab et al (2007) J Biol Chem Volume 282 p13585). К молекулярному каркасу можно добавлять низкомолекулярные молекулы, такие как стероиды, для усиления захвата в клетки.
Один класс функциональных групп, который может быть связан с пептидными лигандами, включает антитела и их связывающие фрагменты, такие как Fab, Fv или однодоменные фрагменты. В частности, можно использовать антитела, которые связываются с белками, способными увеличивать время полужизни пептидного лиганда in vivo.
Также могут быть включены RGD-пептиды, которые связываются с интегринами, которые присутствуют на многих клетках.
В одном варианте осуществления конструкция пептидный лиганд-эффекторная группа согласно изобретению имеет время полужизни tβ, выбранное из группы, состоящей из: 12 часов или более, 24 часов или более, 2 суток или более, 3 суток или более, 4 суток или более, 5 суток или более, 6 суток или более, 7 суток или более, 8 суток или более, 9 суток или более, 10 суток или более, 11 суток или более, 12 суток или более, 13 суток или более, 14 суток или более, 15 суток или более или 20 суток или более. Предпочтительно конструкция пептидный лиганд-эффекторная группа или композиция согласно изобретению имеют время полужизни tβ в диапазоне от 12 до 60 часов. В следующем варианте осуществления она будет иметь время полужизни tβ сутки или более. В следующем варианте осуществления она будет находиться в диапазоне от 12 до 26 часов.
Функциональные группы включают лекарственные средства, такие как цитотоксические средства для терапии злокачественной опухоли. Они включают: алкилирующие средства, такие как цисплатин и карбоплатин, а также оксалиплатин, мехлорэтамин, циклофосфамид, хлорамбуцил, ифосфамид; антиметаболиты, включая аналоги пуринов азатиоприн и меркаптопурин или аналоги пиримидинов; алкалоиды растений и терпеноиды, включая алкалоиды барвинка, такие как винкристин, винбластин, винорелбин и виндезин; подофиллотоксин и его производные этопозид и тенипозид; таксаны, включая паклитаксел, первоначально известный как таксол; ингибиторы топоизомераз, включая камптотецины: иринотекан и топотекан, и ингибиторы типа II, включая амсакрин, этопозид, этопозид фосфат и тенипозид. Следующие средства могут включать противоопухолевые антибиотики, которые включают иммунодепрессант дактиномицин (который используют при трансплантации почек), доксорубицин, эпирубицин, блеомицин и другие.
Возможные эффекторные группы также включают ферменты, например, такие как карбоксипептидаза G2 для применения в ферментной/пролекарственной терапии, где пептидный лиганд заменяет антитела в ADEPT.
Синтез
Пептиды по настоящему изобретению можно изготавливать синтетически стандартными способами с последующей реакцией с молекулярным каркасом in vitro. Когда это осуществляют, можно использовать стандартную химию. Это обеспечивает быстрое крупномасштабное получение растворимого материала для последующих экспериментов или валидации. Такие способы можно проводить с использованием общепринятых химических реакций, таких как химические реакции, описанные в Timmerman et al (выше).
Таким образом, изобретение также относится к производству полипептидов или конъюгатов, подвергнутых селекции, как описано в настоящем описании, где производство включает необязательные дополнительные стадии, как пояснено ниже. В одном варианте осуществления эти стадии проводят на конечном продукте полипептиде/конъюгате, полученном химическим синтезом.
Необязательно аминокислотные остатки в представляющем интерес полипептиде можно замещать при производстве конъюгата или комплекса.
Пептиды также можно удлинять для включения, например, другой петли и, таким образом, внесения множественной специфичности.
Для удлинения пептида его можно просто удлинять химически на его N-конце или C-конце или в петлях с использованием ортогонально защищенных остатков лизина (и аналогов) с использованием стандартной твердофазной химии или химии в жидкой фазе. Для внесения активируемого N- или C-конца можно использовать стандартную химию белков. Альтернативно присоединение можно проводить посредством конденсации фрагментов или нативного химического лигирования, например, как описано в (Dawson et al. 1994. Synthesis of Proteins by Native Chemical Ligation. Science 266:776-779), или посредством ферментов, например, с использованием субтилигазы, как описано в (Chang et al Proc Natl Acad Sci U S A. 1994 Dec 20; 91(26):12544-8 или в Hikari et al Bioorganic & Medicinal Chemistry Letters Volume 18, Issue 22, 15 November 2008, Pages 6000-6003).
Альтернативно пептиды можно удлинять или модифицировать путем дальнейшей конъюгации через дисульфидные связи. Это имеет дополнительное преимущество, состоящее в том, что первый и второй пептиды диссоциируют друг от друга после попадания в восстанавливающую среду клетки. В этом случае молекулярный каркас (например TBMB) можно присоединять в процессе химического синтеза первого пептида, чтобы он реагировал с тремя группами цистеина; а затем другой цистеин можно присоединять на N-конец первого пептида, чтобы только этот цистеин реагировал со свободным цистеином второго пептида.
Сходные способы применимы в равно степени к синтезу/связыванию двух бициклических и биспецифических макроциклов, потенциально создавая тетраспецифическую молекулу.
Более того, присоединение других функциональных групп или эффекторных групп можно проводить аналогичным образом с использованием соответствующих химических реакций, присоединяя их к N- или C-концам или через боковые цепи. В одном варианте осуществления связывание проводят так, чтобы оно не блокировало активность любой из структур.
Фармацевтические композиции
Согласно следующему аспекту изобретения, предусматривается фармацевтическая композиция, содержащая пептидный лиганд, как определено в настоящем описании, в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами.
Как правило, пептидные лиганды по настоящему изобретению можно использовать в очищенной форме вместе с фармакологически приемлемыми эксципиентами или носителями. Как правило, эти эксципиенты или носители включают водные или спиртовые/водные растворы, эмульсии или суспензии, включая солевые растворы и/или буферные среды. Паренетеральные носители включают раствор хлорида натрия, раствор декстрозы Рингера, раствор декстрозы и хлорида натрия и лактатный раствор Рингера. Пригодные физиологически приемлемые адъюванты, если необходимо для поддержания полипептидного комплекса в суспензии, можно выбирать из загустителей, таких как карбоксиметилцеллюлоза, поливинилпирролидон, желатин и альгинаты.
Внутривенные носители включают средства для восполнения жидкости и питательных веществ и средства для восполнения электролитов, такие как средства на основе раствора декстрозы Рингера. Также могут присутствовать консерванты и другие добавки, такие как противомикробные средства, антиоксиданты, хелатирующие агенты и инертные газы (Mack (1982) Remington's Pharmaceutical Sciences, 16th Edition).
Пептидные лиганды по настоящему изобретению можно использовать в качестве отдельно вводимых композиций или вместе с другими средствами. Они могут включать антитела, фрагменты антител и различные иммунотерапевтические средства, такие как циклоспорин, метотрексат, адриамицин или цисплатин, и иммунотоксины. Фармацевтические композиции могут включать "коктейли" различных цитотоксических или других средств вместе с белковыми лигандами по настоящему изобретению, или даже комбинации подвергнутых селекции полипептидов в соответствии с настоящим изобретением, имеющих различную специфичность, таких как полипептиды, подвергнутые селекции с использованием различных лигандов-мишеней, как объединяемые перед введением, так и не объединяемые.
Путь введения фармацевтических композиций по изобретению могут представлять собой любой из путей введения, широко известных средним специалистам в данной области. Для терапии, включая, но не ограничиваясь ими, иммунотерапию, пептидные лиганды по изобретению можно вводить любому пациенту в соответствии со стандартными способами. Введение можно осуществлять любым подходящим путем, в том числе парентерально, внутривенно, внутримышечно, внутрибрюшинно, трансдермально, легочным путем или также, соответственно, путем прямой инфузии с использованием катетера. Дозировка и частота введения зависят от возраста, пола и состояния пациента, сопутствующего введения других лекарственных средств, противопоказаний и других параметров, учитываемых клиницистом.
Будет понятно, что, когда пептидные лиганды по изобретению составляют в качестве офтальмологических композиций для лечения офтальмологических нарушений, путь введения, как правило, представляет собой прямое введение в область офтальмологического нарушения, такое как введение внутриглазным путем, таким как местный, субконъюнктивальный, субтеноновый, внутриглазной, посредством глазных имплантатов и т.д. В одном варианте осуществления путь введения представляет собой внутриглазную инъекцию. В альтернативном варианте осуществления офтальмологическую композицию доставляют местным путем (например, внеглазное применение) или системно (например, пероральный или другой парентеральный путь, например, такой как подкожное введение) при условии, что достаточное количество пептида в клетках или ткани, расположенных в глазу или рядом с глазом, достигает контакта с областью офтальмологического состояния. В альтернативном варианте осуществления офтальмологическую композицию доставляют парентерально. Точный путь введения будет сразу понятен квалифицированному специалисту с учетом офтальмологического нарушения, подлежащего лечению в соответствии с общей информацией и методологией, описанными в WO 2007/104541, содержание которых включено в настоящее описание в качестве ссылки.
Пептидные лиганды по настоящему изобретению можно лиофилизировать для хранения и разбавлять подходящим носителем перед применением. Было показано, что этот способ является эффективным и можно использовать известные в данной области способы лиофилизации и разбавления. Специалистам в данной области будет понятно, что лиофилизация и разбавление могут приводить к различным степеням потери активности, и что уровни можно повышать для компенсации.
Композиции, содержащие настоящие пептидные лиганды или их коктейль, можно вводить для профилактического и/или терапевтического лечения. В определенных терапевтических применениях достаточное количество для осуществления по меньшей мере частичного ингибирования, подавления, модулирования, уничтожения или некоторого другого поддающегося измерению параметра популяции подвергнутых селекции клеток определяют как "терапевтически эффективная доза". Количества, требуемые для достижения этой дозировки, будут зависеть от тяжести заболевания и общего состояния собственной иммунной системы пациента, однако как правило, они находятся в диапазоне от 0,005 до 5,0 мг выбранного пептидного лиганда на килограмм массы тела, причем более часто используют от 0,05 до 2,0 мг/кг/доза. Для профилактических применений композиции, содержащие настоящие пептидные лиганды или их коктейли, можно вводить в сходных или несколько более низких дозировках
Композицию, содержащую пептидный лиганд в соответствии с настоящим изобретением, можно использовать в профилактических и терапевтических условиях для способствования изменению, инактивации, уничтожению или удаления отдельной популяции клеток-мишеней у млекопитающего. Кроме того, пептидные лиганды, описанные в настоящем описании, можно использовать экстракорпорально или in vitro селективно для уничтожения, истощения или иного эффективного удаления популяции клеток-мишеней из гетерогенной совокупности клеток. Кровь млекопитающего можно комбинировать экстракорпорально с выбранными пептидными лигандами, при этом нежелательные клетки уничтожаются или иным образом выводятся из крови, а затем возвращать млекопитающему в соответствии со стандартными способами.
Терапевтические применения
Полипептидные лиганды, подвергнутые селекции способом по настоящему изобретению, можно использовать в терапевтических и профилактических применениях in vivo, диагностических применениях in vitro и in vivo, в анализе in vitro и применениях реагентов, и т.п. Лиганды, имеющие выбранные уровни специфичности, являются пригодными в применениях, которые вовлекают тестирование у не являющихся человеком животных, где является желательной перекрестная реактивность, или в диагностических применениях, где перекрестная реактивность в отношении гомологов или паралогов должна тщательно контролироваться. В некоторых применениях, таких как вакцинные применения, способность индуцировать иммунный ответ на заданные диапазоны антигенов можно использовать для приспособления вакцины к конкретным заболеваниям и патогенам.
По существу чистые пептидные лиганды с гомогенностью по меньшей мере от 90 до 95% являются предпочтительными для введения млекопитающему, и для фармацевтических применений наиболее предпочтительной является гомогенность от 98 до 99% или более, особенно когда млекопитающее представляет собой человека. После очистки, частично или до гомогенности, если желательно, выбранные полипептиды можно использовать диагностически или терапевтически (в том числе экстракорпорально) или при разработке и проведении методик анализа, иммунофлуоресцентного окрашивания и т.п. (Lefkovite and Pernis, (1979 и 1981) Immunological Methods, Volumes I and II, Academic Press, NY).
Пептидные лиганды по настоящему изобретению, как правило, пригодны для предупреждения, подавления или лечения воспалительных состояний, аллергической гиперчувствительности, злокачественной опухоли, бактериальной или вирусной инфекции и аутоиммунных нарушений (которые включают, но не ограничиваются ими, диабет типа I, рассеянный склероз, ревматоидный артрит, системную красную волчанку, болезнь Крона и миастению).
Таким образом, согласно следующему аспекту изобретения предусматривается пептидный лиганд, как определено в настоящем описании, для применения для предупреждения, подавления или лечения воспалительных состояний, аллергической гиперчувствительности, злокачественной опухоли, бактериальной или вирусной инфекции и аутоиммунных нарушений.
Согласно следующему аспекту изобретения предусматривается способ предупреждения, подавления или лечения воспалительных состояний, аллергической гиперчувствительности, злокачественной опухоли, бактериальной или вирусной инфекции, офтальмологических нарушений и аутоиммунных нарушений, который включает введение пациенту, нуждающемуся в этом, пептидного лиганда, как определено в настоящем описании.
В одном варианте осуществления офтальмологические нарушения по изобретению представляют собой нарушения, обусловленные нарушением проницаемости и/или целостности сосудов сетчатки. В следующем варианте осуществления офтальмологические нарушения по изобретению представляют собой нарушения, обусловленные разрывом микрососудов сетчатки, ведущим к очаговым кровоизлияниям. В следующем варианте осуществления офтальмологические нарушения по настоящему изобретению представляют собой заболевания задней части глаза, в частности, заболевания сетчатки. В следующем варианте осуществления офтальмологические нарушения по изобретению представляют собой заболевания передней части глаза. В следующем варианте осуществления офтальмологические нарушения по изобретению представляют собой нарушения, ассоциированные с избыточной сосудистой проницаемостью и/или отеком глаза.
Примеры подходящих "офтальмологических нарушений" (включая экссудативные и/или воспалительные офтальмологические нарушения, нарушения, обусловленные нарушенной проницаемостью и/или целостностью сосудов сетчатки, нарушения, обусловленные разрывом микрососудов сетчатки, ведущим к очаговым кровоизлияниям, заболевания задней части глаза, заболевания сетчатки и заболевания передней части глаза) включают, но не ограничиваются ими: возрастную дегенерацию желтого пятна (ARMD), экссудативную дегенерацию желтого пятна (также известную как "влажная" или неоваскулярная связанная со старением дегенерация желтого пятна (влажная AMD), отек желтого пятна, старческую дисковидную дегенерацию желтого пятна, кистоидный отек желтого пятна, отек век, отек сетчатки, диабетическую ретинопатию, острую нейроретинопатию желтого пятна, центральную серозную хориоретинопатию, хориоретинопатию, хориоидальную неоваскуляризацию, неоваскулярную макулопатию, неоваскулярную глаукому, обструктивную артериальную и венозную ретинопатию (например, окклюзию вен сетчатки или окклюзию артерий сетчатки), окклюзию центральной вены сетчатки, диссеминированную внутрисосудистую коагулопатию, окклюзию ветви вены сетчатки, гипертензивные изменения дна, синдром ишемии глаз, ретинальные артеиальные микроаневризмы, болезнь Коатса, парафовеолярную телеангиэктазию, гемиретинальную окклюзию вен, папиллофлебит, окклюзию центральной ретинальной артерии, окклюзию ветви артерии сетчатки, болезнь сонных артерий (CAD), ангиит замороженной ветви, серповидноклеточную ретинопатию и другие гемоглобулинопатии, ангиоидные полосы сетчатки, отек желтого пятна в результате таких этиологий, как заболевание (например диабетический отек желтого пятна), травму глаза или хирургическую операцию на глазе; ишемию или дегенерацию сетчатки в результате, например, повреждения, травмы или опухолей, увеит, ирит, ретинальный васкулит, эндофтальмит, панофтальмит, метастатическую офтальмию, хориоидит, ретинальный пигментный эпителиит, конъюнктивит, циклит, склерит, эписклерит, оптический неврит, ретробульбарный оптический неврит, кератит, блефарит, экссудативное отслоение сетчатки, язву роговицы, изъязвление конъюнктивы, хронический монетовидный кератит, кератит Тигесона, прогрессирующую язву Морена, воспалительное заболевание глаза, обусловленное бактериальной или вирусной инфекцией и офтальмологической операцией, воспалительное заболевание глаза, вызванное физическим повреждением глаза, симптом, вызываемый воспалительным заболеванием глаза, включая зуд, покраснение, отек и изъязвление, эритему, экссудативную мультиформную эритему, узловатую эритему, колцевидную эритему, склеродермию, дерматит, ангионевротческий отек, ларингеальный отек, отек складок голосовой щели, подсвязочный ларингит, бронхит, ринит, фарингит, синусит, ларингит или отит среднего уха.
Указание в настоящем описании на "заболевания задней части глаза" включает заболевания, поражающие, среди прочих, сетчатку, желтое пятно, ямку в задней области глаза. Примеры подходящих "заболеваний задней части глаза" включают, но не ограничиваются ими: отек желтого пятна, такой как клинический отек желтого пятна или ангиографический кистоидный отек желтого пятна различной этиологии, такой как диабет, экссудативную дегенерацию желтого пятна и отек желтого пятна вследствие лазерного лечения сетчатки, связанную со старением дегенерацию желтого пятна, ретролентальную фиброплазию (также известную как ретролентальная фиброплазия), ишемию сетчатки и хориоидальную неоваскуляризацию, заболевания сетчатки (диабетическая ретинопатия, диабетический отек сетчатки, отслоение сетчатки, старческая дегенерация желтого пятна вследствие субретинальной неоваскуляризации, миотическая ретинопатия); воспалительные заболевания; увеит, обусловленный новообразованиями, такими как ретинобластома или псевдоглиома; неоваскуляризацию после витроэктомии; сосудистые заболевания (ишемия сетчатки, хориоидальная сосудистая недостаточность, хориоидальный тромбоз, ретинопатии вследствие ишемии сонной артерии); и неоваскуляризацию оптического нерва.
Указание в настоящем описании на "заболевания передней части глаза" относится к заболеваниям, поражающим в основном ткани передней части глаза, такие как роговица, радужная оболочка, ресничное тело, конъюнктива и т.д. Примеры подходящих "заболеваний передней части глаза" включают, но не ограничиваются ими: неоваскуляризацию роговицы (вследствие воспаления, трансплантации, связанной с развитием гипоплазии радужной оболочки, заболеваний роговицы или помутнения с экссудативным или воспалительным компонентом, неоваскуляризацию вследствие пенетрации глаза или контузионного повреждения глаза; хронический увеит; передний увеит; воспалительные состояния в результате хирургических операций, таких как LASIK, LASEK, рефракционная хирургическая операция, имплантация IOL; необратимый отек роговицы в качестве осложнения хирургической операции в связи с катарактой; отек в результате повреждения или травмы (физических, химических, фармакологических и т.д.); воспаление; конъюнктивит (например, персистирующий аллергический, гигантский папиллярный, сезонный интермиттирующий аллергический, круглогодичный аллергический, токсический, конъюнктивит, вызываемой инфекцией бактериями, вирусами или хламидиями); кератоконъюнктивит (весенний, атопический, сухой); иридоциклит; ирит; склерит; эписклерит; инфекционный кератит; поверхностный точечный кератит; кератоконус; заднюю полиморфную дистрофию; дистрофию Фуха (роговичная и эндотелиальная); афакическую и артифакическую буллезную кератопатию; отек роговицы; склеральное заболевание; глазной рубцовый пемфигоид; срединный увеит; синдром Познера-Шлоссмана; болезнь Бехчета; синдром Фогта-Коянаги-Харада; реакции гиперчувствительности; поверхностные нарушения глаз; отек конъюнктивы; токсоплазмозный хориоретинит; воспалительную псевдоопухоль глазницы; хемоз; венозный застой конъюнктивы; периорбитальный целлюлит; острый дакриоцистит; неспецифический васкулит; саркоидоз и цитомегаловирусную инфекцию.
Примеры подходящих "нарушений, обусловленных избыточной сосудистой проницаемостью и/или отеком глаза", например, в сетчатке или стекловидном теле, включают, но не ограничиваются ими, связанную со старением дегенерацию желтого пятна (AMD), отек сетчатки, кровоизлияние в сетчатку, кровоизлияние в стекловидное тело, отек желтого пятна (ME), диабетический отек желтого пятна (DME), пролиферативную диабетическую ретинопатию (PDR) и непролиферативную диабетическую ретинопатию (DR), радиационную ретинопатию, телеангиэктазии, центральную серозную ретинопатию и окклюзии вен сетчатки. Отек сетчатки представляет собой скопление жидкости во внутриретинальном пространстве. DME является результатом микрососудистых изменений, которые возникают у пациентов с диабетом. Это нарушение гемато-ретинального барьера приводит к утечке компонентов плазмы в окружающую сетчатку, что приводит к отеку сетчатки. Другие нарушения сетчатки включат окклюзии вен сетчатки (например окклюзии ветвей или центральной вены), радиационную ретинопатию, серповидноклеточную ретинопатию, ретролентальную фиброплазию, болезнь Гиппеля-Линдау, задний увеит, хроническое отслоение сетчатки, синдром Ирвина-Гасса, болезнь Илса, ретинит и/или хориоидит.
Указание в настоящем описании на термин "предупреждение" вовлекает введение защитной композиции до индукции заболевания. "Подавление" относится к введению композицию индуцирующего события, но до клинического проявления заболевания. "Лечение" вовлекает введение защитной композиции после проявления симптомов заболевания.
Являются доступными модельные системы на животных, которые можно использовать для скрининга эффективности пептидных лигандов в отношении защиты от заболевания или его лечения. Применение модельных систем на животных облегчается с использованием настоящего изобретения, что позволяет разработку полипептидных лигандов, которые перекрестно реагируют с мишенями человека и животных, позволяя применять модели на животных.
Способы тестирования системной красной волчанки (SLE) у предрасположенных мышей известны в данной области (Knight et al. (1978) J Exp. Med., 147: 1653; Reinersten et al. (1978) New Eng. J: Med., 299: 515). Миастению (MG) исследуют у самок мышей SJL/J путем индукции заболевания растворимым белком AchR другого вида (Lindstrom et al. (1988) Adv. Immunol., 42: 233). Артрит индуцируют у предрасположенной линии мышей путем инъекции коллагена типа II (Stuart et al. (1984) Ann. Rev. Immunol., 42: 233). Описана модель, посредством которой индуцируют адъювантый артрит у предрасположенных крыс путем инъекции белка теплового шока микобактерий (Van Eden et al. (1988) Nature, 331: 171). Тиреоидит индуцируют у мышей путем введения тиреоглобулина, как описано (Maron et al. (1980) J. Exp. Med., 152: 1115). Инсулинзависимый сахарный диабет (IDDM) встречается в природе или может быть индуцирован у определенных линий мышей, таких как линии мышей, описанные в Kanasawa et al. (1984) Diabetologia, 27: 113. EAE у мышей и крыс служит в качестве модели MS у человека. В этой модели демиелинизирующее заболевание индуцируют посредством введения основного белка миелина (см. Paterson (1986) Textbook of Immunopathology, Mischer et al., eds., Grune и Stratton, New York, pp. 179-213; McFarlin et al. (1973) Science, 179: 478: и Satoh et al. (1987) ; Immunol., 138: 179).
Далее изобретение описано с помощью следующих примеров.
Примеры
Материалы и способы
Клонирование фаговых библиотек
Фаговые библиотеки получали согласно Heinis et al., Nat Chem Biol 2009, 5 (7), 502-7.
Селекции фагов
Исходные фаговые библиотеки в глицерине разбавляли до OD600=0,1 в 500 мл культур с 2YT/хлорамфеникола (30 мг/мл) и фаги продуцировали при 30°C в течение ночи (15-16 ч). Фаг очищали и химически модифицировали, как описано в Heinis, et al., Nat Chem Biol 2009, 5 (7), 502-7. Биотинилированный hPK (3 мг) (IHPKA, из плазмы человек, Innovative Research, Novi, MI, USA) инкубировали с 50 мл предварительно промытых магнитных гранул со стрептавидином (Dynal, M-280 от Invitrogen, Paisley, Великобритания) в течение 10 минут при к.т. Гранулы промывали 3 раза, а затем блокировали 0,5 мл буфера для промывания (10 мМ Tris-Cl, pH 7,4, 150 мМ NaCl, 10 мМ MgCl2, 1 мМ CaCl2), содержавшего 1% BSA и 0,1% Tween 20, в течение 30 минут при к.т. при вращении. Химически модифицированный фаг (как правило, 1010-1011 t.u., растворенный в 2 мл буфера для промывания) параллельно блокировали добавлением 1 мл буфера для промывания, содержавшего 3% BSA и 0,3% Tween 20. Затем блокированные гранулы смешивали с блокированным химически модифицированным фагом и инкубировали в течение 30 минут на вращающем устройстве при к.т. Гранулы промывали 8 раз промывочным буфером, содержавшим 0,1% Tween 20, и два раза промывочным буфером перед инкубацией с 100 мл 50 мМ глицина, pH 2,2, в течение 5 минут. Элюированный фаг переносили в 50 мл 1 M Tris-Cl, pH 8, для нейтрализации, инкубировали с 30 мл клеток TG1 при OD600=0,4 в течение 90 минут при 37°C, и клетки высевали на большие чашки с 2YT/хлорамфениколом. Проводили один или два дополнительных раунда пэннинга с использованием тех же методик. На втором раунде селекции использовали покрытые нейтравидином магнитные гранулы для предупреждения обогащения стрептавидин-специфическими пептидами. Нейтравидиновые гранулы получали путем реакции 0,8 мг нейтравидина (Pierce, Rockford, IL, США) с 0,5 мл активированных тозилом магнитных гранул (Dynal, M-280 от Invitrogen, Paisley, Великобритания) в соответствии с инструкциями поставщика.
Для библиотек 5x5 и 6x6 использовали стандартный процесс селекции с использованием снижающихся концентраций биотинилированного калликреина человека в течение первого и второго раундов, а затем биотинилированного калликреина либо человека, либо крысы, на третьем и четвертом раундах. Калликреин человека не является рекомбинантным и, таким образом, присутствует тяжелая цепь; калликреин крысы является рекомбинантным, лишен тяжелой цепи, и, возможно имеет более низкую активность, чем ожидалось (исходя из активности белка человека). Поскольку возможно существует меньшая активность, концентрацию мишени крысы не снижали настолько, насколько снижали концентрацию белка человека.
Клонирование и экспрессия PK человека, обезьяны и крысы
Каталитический домен PK человека, обезьяны и крысы экспрессировали в клетках млекопитающих в качестве неактивного предшественника, имеющего пропеприд, связанный на N-конце через участок расщепления proTEV с каталитическим доменом. Экспрессирующий вектор клонировали и белок экспрессировали, активировали и очищали, как описано ниже. Синтетические гены, кодирующие сигнальную последовательность PK, полигистидиновую метку, участок расщепления proTEV, зрелый каталитический домен PK и стоп-кодон, приобретали от Geneart (Регенсбург, Германия) (дополнительные материалы). Плазмидную ДНК, содержащую синтетические гены для PK человека, обезьяны (Macaca mulatta) и крысы, получали и подвергали генному переносу в экспрессирующий вектор млекопитающих pEXPR-IBA42 (IBA Biotechnology, Геттинген, Германия) с использованием пары ферментов рестрикции XhoI и HindIII (Fermentas, Вильнюс, Латвия) и ДНК-лигазы T4 (Fermentas). Лигированные плазмиды трансформировали в электрокомпетентные клетки XL-1 blue (Stratagene, Санта-Клара, США) и высевали на чашки с агаром 2YT, содержащим ампициллин (10 мкг/мл). ДНК из трех экспрессирующих векторов (называемую mPK, rPK и hPK) продуцировали и правильные последовательности подтверждали секвенированием ДНК (Macrogen, Сеул, Южная Корея).
Три оротологичных калликреина плазмы экспрессировали в клетках человека следующим образом. 50 мл адаптированных к суспензии клеток HEK-293 выращивали в бессывороточной среде ExCell 293 (SAFC Biosciences, St. Louis, MO) в присутствии 4 мМ глутамина и ингибитора деацетилазы гистонов вальпроевой кислоты (3,75 мМ) в 100-мл колбе на орбитальном шейкере при 180 об/мин в инкубаторе an ISF-4-W (Kühner AG, Бирсфельден, Швейцария) при 37°C в присутствии 5% CO2. Клетки почки эмбриона (HEK-293) с высокой плотностью клеток (20×106 клеток/мл) (Backliwal, et al. Biotechnol Bioeng 2008, 99 (3), 721-7) трансфицировали тремя плазмидами (300 мг/мл) с использованием линейного полиэтиленимина (PEI, Polysciences, Эппельхайм, Германия). В конце фазы продукции в течение 7 суток клетки собирали центрифугированием при 2500 об/мин в течение 15 мин при 4°C. Любой дополнительный клеточный дебрис удаляли из среды фильтрацией через 0,45-мкм мембраны PES (верхний фильтр TPP емкостью 250 мл с низким связыванием белков). Меченный полигистидином белок очищали Ni-аффинной хроматографией с использованием смолы Ni-NTA, промывочного буфера (500 мМ NaCl, 25 мМ Na2HPO4, pH7,4) и элюирующего буфера (500 мМ NaCl, 25 мМ Na2HPO4, pH 7,4, 500 мМ имидазол). Белок частично активировали (50 единицами) proTEV (Promega, Мэдисон, Висконсин, США) и далее очищали Ni-аффинной хроматографией и гель-фильтрацией (колонка PD10, 150 мМ NaCl, 0,5 мМ EDTA, 50 мМ HEPES, pH 7).
Использование полипептидов с увеличенной активностью связывания
Рандомизация индивидуальных положений
Конструирование библиотеки: Для картирования аминокислот в связывающих калликреин бициклических пептидах конструировали набор малых библиотек. Для бицикла, содержащего 2 петли из 5 остатков, получали 10 отдельных библиотек, каждая из которых имела рандомизацию в конкретном кодоне пептидной последовательности. Для каждой библиотеки конструировали олигонуклеотиды для внесения мутаций в геномную ДНК фаза сайт-направленным мутагенезом. Мутагенез включал рандомизацию представляющего интерес кодона (замена на NNS) и удаление уникального участка рестрикции ApaL1 из матричной геномной последовательности. Продукт мутагенеза очищали с использованием набора QIAgen QIAquick PCR Purification Kit с элюированием в сверхчистую воду. Каждую библиотек использовали отдельно для трансформации E coli TG1 посредством электропорации с использованием устройства BioRad Micropulser Machine (программа Ec1) и 1-мм кюветы BioRad. После восстановления в течение 1 часа при 37°C в 1 мл среды SOC трансформанты библиотеки выращивали в течение ночи в 25 мл бульона 2TY, содержавшего антибиотик, для селективного выращивания только трансформантов библиотеки. Бактерии собирали центрифугированием и ДНК фаговой библиотеки очищали из E. coli с использованием набора QIAgen Плазмида Plus Midi Kit и элюировали в дистиллированную воду. Очищенную ДНК расщепляли ApaL1 в течение 2 часов в буфере New England Biolabs 4 для удаления исходного материала. После расщепления ДНК повторно очищали с использованием набора QIAgen PCR Purification Kit (как описано выше) и использовали для трансформации TG1 (электропорация; как описано выше). После восстановления в течение 1 часа в SOC трансформанты высевали на чашки с агаром LB, содержавшие селективный антибиотик, и колониям позволяли расти в течение ночи при 37°C.
Анализ связывания индивидуальных клонов: Колонии трансформантов библиотеки отбирали случайным образом и выращивали в качестве индивидуальных культур в бульоне 2TY, содержавшем селективный антибиотик. Отобранные колонии подвергали секвенированию ДНК с использованием ДНК-секвенатора QIAgen PyroMark Q96 ДНК для выявления аминокислотной замены, присутствующей в каждом клоне. После выделения клон для каждой уникальной замены анализировали в отношении связывания калликреина плазмы следующим образом. Содержащий фаг супернатант собирали с культуры и фаг подвергали циклизации с использованием трис-бромметилбензола (TBMB) на основе способов Heinis et al (Nature Chemical Biology vol. 5 pp 502-507 (2009)). Очищенный в этом процессе фаг анализировали в отношении связывания биотинилированного калликреина плазмы человека с использованием гомогенного анализа связывания на планшетах; данные анализа измеряли на устройстве для считывания планшетов BMG Labtech Pherastar FS. Количественные данные связывания для трех экземпляров анализируемых образцов усредняли (среднее значение) и выражали в качестве соотношения сигнал:фоновый шум (где фоновый шум соответствовал образцу, анализированному без материала мишени). Соотношение сигнал:фоновый шум выражали в качестве % от параллельного исходного образца. Планки погрешностей обозначают стандартное отклонение среднего значения. Показанные анализы являются репрезентативными по меньшей мере для 2 независимых экспериментов. Данные анализа сопоставляли с пептидными последовательностями. Замены, обозначенные серым цветом, не тестировали (клон не было выделен при случайном отборе образцов библиотеки. Параллельно анализировали образец не связывающегося (произвольного) бицикла для иллюстрации исходного уровня анализа.
Рандомизация пептидных доменов
Конструирование библиотеки: Малые библиотеки фагов получали способами Heinis et al, как описано в разделе "Клонирование фаговых библиотек" выше. Праймер sficx3ba модифицировали так, чтобы кодирующая бицикл часть была основана на последовательности ДНК исходного бицикла 5x5 или 6x6 (5x5: две петли из 5 остатков, 6x6: две петли из 6 остатков) только с 4-6 кодонами, рандомизированными до NNS. Рандомизированные кодоны представляли собой кодоны, кодирующие представляющий интерес пептидный домен/мотив.
Анализ связывания индивидуальных клонов: Колонии трансформантов библиотек или итоговые колонии селекции, отбирали и выращивали в качестве индивидуальных культур в бульоне 2TY, содержащем селективный антибиотик. Отобранные колонии подвергали секвенированию ДНК с использованием ДНК-секвенатора QIAgen PyroMark Q96 для выявления аминокислотной замены, присутствующей в каждом клоне, и анализировали в отношении связывания калликреина плазмы человека следующим образом. Содержащий фаг супернатант собирали с культуре и фаг подвергали циклизации с использованием способов на основе трис-бромметилбензола (TBMB), Heinis et al (Nature Chemical Biology vol. 5 pp 502-507 (2009)). Очищенный в этом процессе фаг анализировали в отношении связывания с биотинилированным калликреином плазмы человека с использованием гомогенного анализа связывания на планшетах; данные анализа измеряли на устройстве для считывания планшетов BMG Labtech Pherastar FS. Количественные данные связывания для дублированных анализируемых образцов усредняли (среднее значение) и выражали в качестве соотношения сигнал:фоновый шум. Представленные данные анализа являются репрезентативными по меньшей мере для 2 независимых экспериментов. Данные анализа сопоставляли с пептидными последовательностями.
Синтез пептидов
Синтез пептидов был основан на химических реакциях Fmoc, с использованием устройства для синтеза пептидов Symphony, производимого Peptide Instruments. Использовали стандартные Fmoc-аминокислоты (Sigma, Merck), со следующими защитными группами боковых цепей: Arg(Pbf); Asn(Trt); Asp(OtBu); Cys(Trt); GIu(OtBu); Gln(Trt); His(Trt); Lys(Boc); Ser(tBu); Thr(tBu); Trp(Boc), Tyr(tBu) (Sigma). Связывающим реагентом был HCTU (Pepceuticals), в качестве основания использовали диизопропилэтиламин (DIPEA, Sigma), и удаление защитной группы осуществляли с использованием 20% пиперидина в DMF (AGTC). Синтез проводили в масштабе 100 мкмоль с использованием 0,37 ммоль/г Fmoc-амидной смолы Ринка AM (AGTC), Fmoc-аминокислоты использовали в четырехратном избытке, и основание было в четырехкратном избытке относительно аминокислот. Аминокислоты растворяли в количестве 0,2 M в DMF, HCTU в количестве 0,4 M в DMF и DIPEA в количестве 1,6 M в N-метилпирролидоне (Alfa Aesar). Время присоединения обычно составляло 30 минут и время удаления защитной группы составляло 2×2,5 минут. Fmoc-N-метилглицин (Fmoc-Sar-OH, Merck) подвергали присоединению в течение 1 ч, и время удаления защитной группы и присоединения для следующего остатков составляло 20 мин и 1 ч, соответственно. После синтеза смолу промывали дихлорметаном и сушили. Отщепление защитных групп боковых цепей и от подложки проводили с использованием 10 мл 95:2,5:2,5:2,5 об./об./об./масс. смеси TFA/H2O/iPr3SiH/дитиотреитол в течение 3 часов. После расщепления использованную смолу удаляли фильтрацией и фильтрат добавляли в 35 мл диэтилового эфира, который был охлажден при -80°C. Пептидный осадок центрифугировали, супернатант с простым эфиром удаляли и пептидный осадок промывали холодным простым эфиром еще два раза. Затем пептиды ресолюбилизировали в 5-10 мл смеси ацетонитрил-вода и лиофилизировали. Малый образец отбирали для анализа чистоты неочищенного продукта масс-спектрометрией (MALDI-TOF, Voyager DE от Applied Biosystems). После лиофилизирации пептидные порошки отбирали в 10 мл 6 M гидрохлорида гуанидиния в H2O, дополняли 0,5 мл 1 M дитиотреитолом и загружали на колонку для препаративной ВЭЖХ C8 Luna (Phenomenex). Растворители (H2O, ацетонитрил) подкисляли 0,1% гептафтормасляной кислотой. Градиент находился в диапазоне 30-70% ацетонитрила в течение 15 минут при скорости потока 15/20 мл/мин, с использованием системы для препаративной ВЭЖХ Gilson. Фракции, содержавшие чистый линейный пептидный материал (как идентифицируют посредством MALDI), объединяли и модифицировали трисбромметилбензолом (TBMB, Sigma). Для этого линейный пептид разбавляли H2O в количестве вплоть до ~35 мл, добавляли ~500 мкл 100 мМ TBMB в ацетонитриле и реакцию инициировали 5 мл 1 M NH4HCO3 в H2O. Реакции позволяли протекать в течение ~30-60 мин при к.т. и лиофилизировали после завершения реакции (исходя из MALDI). После лиофилизации модифицированный пептид очищали, как описано выше, заменяя Luna C8 колонкой Gemini C18 (Phenomenex), и заменяя кислоту 0,1% трифторуксусной кислотой. Очищенные фракции, содержавший правильный модифицированный посредством TMB материал, объединяли, лиофилизировали и держали при -20°C для хранения.
Все аминокислоты, если нет иных указаний, использовали в L-конфигурациях.
Бициклические пептиды, прямо идентифицированные при фаговой селекции, обычно содержали два инвариантных остатка аланина на N/C-концах. Для пептидов, использованных в исследованиях стабильности в плазме и фармакокинетических исследованиях, пептиды ресинтезировали, как указано, без концевых остатков аланина и с N-концевым ацетилированием, как указано.
Пептиды, использованные для фармакокинетических исследований в примере 4, лиофилизировали из 10 мМ HCl в воде 3 раза с получением хлористоводородных солей соединений. Растворы дозировали посредством внутривенной болюсной инъекции в концентрации 1 мг/мл в 50 мМ Hepes, pH 7,0, 5% глицерине, 1,9% DMSO для двух соединений (Ac-(06-550) Aze3 HArg5 Sar3-(D-Arg2)) и (06-259-02)-Sar3-(D-Arg2)) в дозе 5 мг/кг у крыс Spraguely Dawely. Проводили серийный отбор образцов крови (~0,2 мл) в EDTA в указанные моменты времени и плазму разделяли центрифугированием и замораживали при -20 C для анализа. Затем с использованием стандартных биоаналитических способов образцы плазмы анализировали и количественно определяли в отношении остаточного исходного соединения с использованием Waters, Xevo TQS LC-MS. Параметры PK определяли с использованием пакета программ PK Solutions 2.0 от Summit Research Services.
Пептиды, использованные для исследований в примерах 5 и 6, получали из чистых (>95%) фракций, полученных путем проведения обращено-фазовой очистки в присутствии 0,5% уксусной кислоты, которая после лиофилизации обеспечила ацетатные соли пептидов.
Ферментные анализы
Функциональные ферментные анализы проводили в 10 мМ Tris HCl, 150 мМ NaCl, 10 мМ MgCl2, 1 мМ CaCl2 и 1 мг/мл BSA (все от Sigma, Великобритания), pH7,4, при 25°C в сплошных черных 96- или 384-луночных планшетах. В кратком изложении 26,5 пМ калликреин плазмы человека (приобретенный от Stratech, Великобритания) или 13,25 пМ калликреин плазмы крысы (экспрессированный и очищенный в собственной лаборатории) инкубировали в отсутствие и в присутствии возрастающих концентраций исследуемого пептида в течение 15 минут, а затем добавляли флуорогенный субстрат Z-PheArg-AMC (Enzo Lifesciences, Великобритания) до конечной концентрации в анализе 100 мМ в 4% DMSO. Высвобождение AMC измеряли с использованием Pherastar FS (BMG Labtech), возбуждение при 360 нм, испускание при 460 нм. Скорость линейной фазы реакции, как правило, от 5 до 45 минут, вычисляли с использованием программного обеспечения для анализа данных MARS (BMG labtech). Затем скорость использовали для вычисления IC50 и Ki в Prism (GraphPad). Нелинейное регрессионное уравнение с четырьмя параметрами для ингибирования использовали для вычисления IC50. Уравнение One site - fit Ki использовали для вычисления Ki, ограничивая Ki до Km для субстрата, который является 150 мкМ для фермента человека и 200 мкМ для ортолога из крысы. Все величины Ki/IC50 представляют собой среднее значение для по меньшей мере двух независимых экспериментов и по меньшей мере для трех в случае пептидов с величинами Ki ниже 1 нМ. Для калликреина кролика использовали от 7 до 14 пМ фермента с 33 мкМ субстратом с Km 50 мкМ.
Пептиды растворяли в виде солей TFA в их порошковой форме и исходные растворы обычно приготавливали в воде. Все растворы центрифугировали и фильтровали (20-мкм шприцевые фильтры) перед измерением поглощения при 280 нм. Коэффициенты экстинкции вычисляли на основе содержания Trp/Tyr в пептиде и TMB (центральная часть TMB, когда она содержится в пептиде, имеет коэффициент экстинкции ~300 M-1см-1).
Определение профиля стабильности в плазме
Способ #1:
Был разработан быстрый анализ определения профиля в плазме, в котором использовалась масс-спектрометрическая детекция (MALDI-TOF, Voyager DE, Applied Biosystems) массы исходного пептида до того времени, когда масса исходного пептида не переставала обнаруживаться. В частности, 200 мкМ пептид инкубировали в присутствии 35% плазмы крысы или человека (Sera labs, с использованием цитрата в качестве антикоагулянта) при 37°C, которая была дополнена 1 x PBS (полученный из исходного 10x PBS, Sigma). В различные моменты времени (т.е. t=0, 3, 24 ч, после этого каждые сутки вплоть до 10 суток), 2 мкл образца добавляли к 18 мкл 30 мМ бикарбоната аммония в смеси 1:1 ацетонитрил:H2O. Образцы замораживали при -80°C до анализа. Для масс-спектрометрического анализа, который определяет приблизительное окно обнаружения пептида, образец, разбавленный ацетонитрилом:H2O, (0,7 мкл) в данный момент времени наносили точечно прямо на планшет для MALDI. Матрицу (альфа-цианокоричная кислота, Sigma, приготовленная в качестве насыщенного раствора 1:1 в смеси ацетонитрил:вода, содержащего 0,1% трифторуксусную кислоту) наслаивали на образец (1 мкл). В сходных условиях интенсивности лазера на MALDI TOF, можно было определить время, когда исходный пептид более не поддавался обнаружению. Следует отметить, что этот качественный анализ служит для обнаружения относительных изменений стабильности в плазме.
Способ #2
Для более быстрого получения данных стабильности пептиды также оценивали в 95% плазме. В данном случае, PBS исключали и 1-5 мМ исходный раствор пептида (в DMSO) прямо разбавляли плазмой (т.е. 2,5 мкл исходный раствор в 47,5 мкл плазмы), до конечной концентрации 50 мкМ. 5-мкл образцы отбирали в соответствующие моменты времени и замораживали при -80°C. Для анализа образцы размораживали, смешивали с 25 мкл смеси ацетонитрил:метанол:вода 3:3:1, и центрифугировали при 13000 в течение 5 мин. 5 мкл содержащего пептид супернатанта аспирировали и смешивали с 30 мМ бикарбонатом аммония в смеси ацетонитрил:H2O 1:1. Затем 1 мкл этой смеси наносили точечно на планшет для MALDI и анализировали, как описано выше. Как описано выше, следует отметить, что этот качественный анализ служит для обнаружения относительных изменений стабильности в плазме.
Способ #3
Для получения количественной величины стабильности в плазме исходные растворы пептидов (1 мМ в DMSO) отправляли в Biofocus, Великобритания, где проводили анализ. Пептиды разбавляли до 100 мкМ водой и разбавляли 1:20 в плазме (конечная концентрация 5 мкМ, с концентрацией плазмы 95%), взятой соответствующим образом, преципитировали, как описано выше, и количественно определяли посредством LC-MS с использованием Waters Xevo TQ-MS.
Пример 1: Идентификация связывающихся с калликреином бициклических пептидов с подходящей селективностью в отношении гомолога и видовой перекрестной реактивностью
(a) Идентификация новых, эффективных перекрестно реагирующих в отношении человека и крысы лидирующих последовательностей
Для любого данного терапевтического бициклического пептида его фармакодинамические и фармакокинетические свойства необходимо оценивать у доклинических видов животных. Обычные доклинические виды включают крысу, мышь, кролика, собаку, карликовую домашнюю свинью и яванского макака.
Вследствие обычно высокой селективности бициклических пептидов, которой частично способствует их большая площадь контакта с белком-мишенью, высокоаффинные бициклические пептиды к белку-мишени человека могут не реагировать перекрестно с тем же белком-мишенью, происходящим из данного доклинического вида, что делает доклиническую оценку такого лигирующего соединения трудной. Пример включает PK15 (как описано в WO 2009/098450), который представляет собой мощный бициклический пептид (размер петли 6x6) с Ki ~1,2 нМ в отношении калликреина человека. Эффективность в отношении калликреина крысы значительно снижена, составляя Ki ~500 нМ, что делает это лидирующее соединение не пригодным для доклинической оценки.
Для идентификации лидирующих бициклических пептидов размером 5×5 и 6×6 с высокой эффективностью в отношении калликреина человека при сохранении существенной эффективности в отношении калликреина крысы проводили фаговую селекцию, где калликреины как крысы, так и человека, чередовали в качестве приманок на каждом раунде селекции. Путем изменения концентраций приманки в ходе раундов селекции, можно было идентифицировать различные перекрестно реагирующие лидирующие последовательности. Образец каждого продукта селекции подвергали скринингу в отношении связывания с калликреином человека, а затем секвенировали.
В частности, первые два раунда селекции проводили с калликреином человека при концентрациях мишени в диапазоне от 3 до 100 нМ, а затем проводили два раунда селекции с использованием калликреина крысы при концентрации мишени 30 нМ.
Скрининг индивидуальных клонов фагов в отношении связывания калликреина в гомогенном скрининговом анализе выявил ряд уникальных последовательностей с вплоть до 50-кратным увеличением сигнала относительно фонового уровня. Их получали в качестве синтетических пептидов и оценивали в отношении ингибирования калликреинов человека, крысы и кролика (таблица 1).
|
Инвариантные остатки цистеина выделены серым цветом, и консервативные остатки для каждого лидирующего соединения подчеркнуты.
Несколько из лидирующих соединений проявляют высокую перекрестную реактивность между калликреинами крысы и человека: 06-254, 06-255, 06-258 и 06-261 (таблица 1). Путем оценки конечных последовательностей для каждого семейства лидирующих соединений, можно было идентифицировать полуконсервативные остатки, и они подчеркнуты (таблица 1).
06-254 и 06-255 обладают практически идентичной первой петлей, однако их вторые петли различаются. 06-258 представляет собой единственную идентифицированную перекрестно реагирующую лиридующую последовательность, содержащую 5 аминокислот как в 1 петле, так и во 2 петле (5×5).
(b) Созревание аффинности перекрестно реагирующих с калликреином крысы-человека бициклических пептидных последовательностей
Отдельные бициклические пептидные кандидаты (таблица 1) были отобраны для созревания аффинности. Консенсусные остатки экстраполировали из результатов первоначальной селекции. Для созревания аффинности остатки, которые оказались вне консенсусной области, рандомизировали, согласно информации в таблице 2.
|
ID-номера последовательностей: 06-254, исходная (SEQ ID NO: 23), библиотека (SEQ ID NO: 64); 06-256, исходная (SEQ ID NO: 49), библиотека (SEQ ID NO: 65); 06-258, исходная (SEQ ID NO: 52), библиотека (SEQ ID NO: 66); 06-259, исходная (SEQ ID NO: 10), библиотека (SEQ ID NO: 67); 06-261, исходная (SEQ ID NO: 54), библиотека (SEQ ID NO: 99).
Остатки вне более консервативного связывающего мотива рандомизировали ("X"). В случае 06-261, его подобный 06-34-18 мотив FPFR (SEQ ID NO: 100) рандомизировали, а окружающие остатки фиксировали.
Конечные последовательности библиотек после созревания аффинности показаны на двух примерах: 06-254 и 06-259:
Последовательности, полученные из 06-254:
В таблице 3 показаны наиболее эффективные варианты 06-254, идентифицированные с использованием скринингового анализа.
|
S:B относится к соотношению сигнал:фоновый шум. Эффективные связывающиеся соединения были идентифицированы с использованием гомогенного скринингового анализа и было проведено их сравнение с исходной последовательностью (06-254) и связывающим калликреин соединением PK15 6×6 (WO 2009/098450).
Наиболее эффективные кандидаты (06-254-01, 06-254-02 и 06-254-03) отбирали для пептидного синтеза и оценивали в отношении ингибирования калликреина крысы и человека.
Последовательности, полученные из 06-259:
В таблице 4 показаны наиболее эффективные варианты 06-254, идентифицированные с использованием скринингового анализа.
|
S:B относится к соотношению сигнал:фоновый шум. Эффективные связывающиеся соединения были идентифицированы с использованием гомогенного скринингового анализа, и было проведено их сравнение с исходной последовательностью (06-259) и связывающим калликреин соединением PK15 6×6 (WO 2009/098450).
Наиболее эффективные кандидаты (06-259-01, 06-259-02, 06-259-03 и 06-259-04) отбирали для пептидного синтеза и измерения аффинности в отношении калликреина крысы и человека.
Эффективность и перекрестная реактивность синтетических пептидов in vitro обобщенно представлена в таблице 5.
|
Бициклические пептидые лидирующие соединения с константами диссоциации ниже 10/20 нМ в отношении калликреина человека/крысы, соответственно, указаны полужирным шрифтом.
Взятые вместе, они представляют собой несколько кандидатов, которые проявляют высокую эффективность и высокую перекрестную реактивность между калликреинами крысы и человека, как например, 06-254-01, 06-254-02, 06-254-03, 06-255, 06-258, 06-259-01, 06-259-02, 06-259-03, 06-259-04 и 06-261 (полужирным шрифтом, см. таблица 5).
Пример 2: Скрининг стабильности в плазе связывающих калликреин бициклических пептидов выявляет перспективные лидирующие кандидаты
В примере 1 было идентифицировано несколько новых бициклических лидирующих последовательностей с высокой эффективностью у человека и крысы. Наиболее эффективный представитель каждого семейства был отобран для сравнения стабильности в плазме крысы и человека. Они представляли собой 06-254-02, 06-255, 06-259-02 и 06-261. Первоначальный скрининг с использованием способа #1 показал, что 06-255 и 06-259-02 являются более стабильными, чем остальные бициклические пептиды, исходя из более длительного окна обнаружения этих двух пептидов (вплоть до 10 суток, данные не представлены). Остальные пептиды не обнаруживались уже после2-3 суток, проявляя сходную низкую стабильность с немодифицированной последовательностью 06-34-18.
Как 06-255, так и 06-259-02 имели низкий профиль растворимости, и, таким образом, их ресинтезировали с солюбилизирующим C-концевым удлинением (Sar3-(D-Arg)2 (SEQ ID NO: 98)). Саркозин3 (Sar3) в данном случае служит в качестве молекулярного спейсера, в то время как остатки D-аргинина сообщают молекуле более высокую растворимость в воде вследствие их в высокой степени ионной природы, образующей комплексы с водой при физиологических значениях pH.
Солюбилизирующее удлинение не ухудшало в значительной степени константы ингибирования фермента, как указано в таблице 6.
|
Пептиды анализировали в плазме человека и крысы в условиях, описанных для способа #2. Стабильность оценивали по сравнению с 06-34-18, который имеет количественное значение t1/2 2,3 ч в плазме крысы и 2 ч в плазме человека (WO 2013/050616). На фиг.1 и 2 продемонстрировано, что бициклическое пептидное лидирующее соединение 06-259-02 имеет особенно благоприятный профиль стабильности в плазме, поскольку он является значительно более стабильным в плазме как человека, так и крысы, по сравнению с 06-255 и 06-34-18.
Пример 3: Пересадка пептидных петель между различными бициклическими пептидными лидирующими соединениями приводит к образованию новых химерных конструкций с благоприятными свойствами
Первая петля в описанной выше последовательности 06-34-18 (WO 2013/050616, последовательность: CSWPARCLHQDLC (SEQ ID NO: 86)) обладает сходным мотивом FPFR (SEQ ID NO: 100, подчеркнут) с пептидом 06-261, идентифицированном в настоящем описании (последовательность: CNNFPFRCVYYPDIC (SEQ ID NO: 54)). Однако описано, что 06-34-18 содержит два участка протеолитического распознавания, которые сообщают пептиду неустойчивость к протеазам плазмы и, таким образом, он непригоден в качестве ингибирующего калликреин терапевтического средства. Эти участки содержат остатки Arg5 и His7 06-34-18 (CSWPARCLHQDLC (SEQ ID NO: 86): подчеркнуты и выделены полужирным шрифтом). В описанной в настоящей заявке последовательности 06-261 (пример 1), эквивалентный гистидиновый участок протеолитического распознавания в петле 2 отсутствует.
Вследствие отсутствия His7 во второй петле 06-261 (последовательность: VYYPDI (SEQ ID NO: 87)), авторы настоящего изобретения заменили протеолитически неустойчивую содержащую гистидин вторую петлю 06-34-18 второй петлей из 06-261 в надежде получить полностью эффективный химерный пептид с повышенной протеолитической стабильностью в петле 2. В частности, эта последовательность содержит первую петлю 06-34-18 (последовательность: SFPYR (SEQ ID NO: 88)) и вторую петлю 06-261 (последовательность: VYYPDI (SEQ ID NO: 87)), которые обеспечивают химерную полную последовательность CSFPYRCVYYPDIC (SEQ ID NO: 55) (или эквивалент WPAR, т.е. CSWPARCVYYPDIC (SEQ ID NO: 89)). Этот химерный пептид назван 06-550, и он имеет 5 остатков в петле 1, и 6 остатков в петле 2.
Ранее было описано (WO 2013/050616), что индуцируемая Arg5 протеолитическая неустойчивость в 06-34-18 может быть устранена или снижена путем замены Arg5 N-α -метиларгинином (NMe-Arg) или гомоаргинином (HArg). Кроме того, может быть внесена сопутствующая повышающая аффинность замена исходного пролина в 3 положении на L-азетидинкарбоновую кислоту (Aze).
Поскольку химерный бициклический пептид 06-550 сохраняет первую петлю 06-34-18, были осуществлены идентичные модификации Arg5/Pro3 на HArg5/Aze3, и этот пептид назван 06-550 Aze3 HArg5.
Однако вследствие отсутствия повышающего растворимость гистидина 7 в последовательности, 06-550 (или 06-550 Aze3 HArg5) проявлял значительно сниженную растворимость в воде по сравнению с 06-34-18. Для повышения растворимости этих молекул в воде синтезировали производные, которые содержали C-концевые удлинения, содержащие спейсеры из саркозина3, за которыми следовали два остатка D-аргинина. Включение остатков D-аргинина приводило к более высокой растворимости этих пептидов в воде.
Константы ингибирования калликреина для этих пептидов обобщенно представлены в таблице 7.
|
Из данных очевидно, что модификация Aze3-HArg5 была допустимой, поскольку аффинность как в отношении белка человека, так и в отношении белка крысы, является высокой. Модификация N-метилом является менее пригодной. В равной степени, солюбилизирующее удлинение Sar3-(D-Arg2) (SEQ ID NO: 98) было допустимым, поскольку эффективность остается неизмененной по сравнению с пептидами, лишенными этого удлинения.
Сравнительное определение профиля стабильности в плазме у производных 06-550
Стабильность бициклического пептида "Ac-(06-550)-Sar3-(DArg2) Aze3 HArg5" (таблица 7) оценивали в отношении относительной стабильности в плазме человека и крысы согласно способу #2 (фиг.3) и сравнивали с нестабильным 06-34-18 (фиг.1 и 2).
В плазме обоих видов пептид проявляет высокую стабильность, поскольку наблюдают мало продуктов деградации. Для сравнения, масса исходного нестабильного 06-34-18 в основном исчезала за тот же период времени (данные представлены в примере 2). Таким образом, идея объединения петель из различных исходных последовательностей (06-261 и 06-34-18) обеспечила новую, химерную, мощную и протеолитически стабильную молекулу.
Пример 4: Фармакокинетическое поведение in vivo выбранных ингибирующих калликреин бициклических пептидов
Пептиды Ac-(06-550)-Sar3-(D-Arg)2 Aze3 HArg5 (которые содержат стабилизирующие и повышающие аффинность модификации Aze3 и HArg5, и солюбилизирующее C-концевое удлинение Sar3-(D-Arg)2) (SEQ ID NO: 98) и Ac-(06-259-02)-Sar3-(D-Arg)2 отбирали для фармакокинетической оценки у крыс. Пептиды инъецировали внутривенно в буферном растворе в концентрации 1 мг/мл в дозе 5 мг/кг крысам Sprague Dawley и проводили взятие образцов крови и анализ в отношении концентраций пептидов в ряд моментов времени после инъекции.
Оба пептида проявляли клиренс между 17 (06-550) и 7 мл/мин/кг (06-259-02) (таблица 8, фиг.4), который является близким к опубликованной скорости почечной фильтрации у крыс (~8-9 мл/мин/кг) [Jobin J, Bonjour JP, (1985) Am J Physiol.;248(5 Pt 2):F734-8].
Это подтверждает увеличенную протеолитическую стабильность Ac-(06-550)-Sar3-(D-Arg)2 Aze3 HArg5, который содержит две стабилизирующих модификации Aze3 и HArg5 и последовательность в петле, которая является по своей природе протеолитически стабильной.
В случае Ac-(06-259-02)-Sar3-(D-Arg)2 природная последовательность является достаточно протеолитически стабильной у крысы, так что клиренс по большей части обеспечивается почечной экскрецией.
|
Пример 5: Фармакокинетический анализ in vivo после инъекции внутрь стекловидного тела выбранных ингибирующих калликреин бициклических пептидов
В этом анализе пептид Ac-(06-550)-Sar3-(D-Arg)2 Aze3 HArg5 (обозначаемый в данном исследовании как бицикл 1 и содержащий стабилизирующие и повышающие аффинность модификации Aze3 и HArg5, и солюбилизирующее C-концевое удлинение Sar3-(D-Arg)2 (SEQ ID NO: 98); см. примеры 3 и 4 настоящего описания) оценивали путем сравнения с пептидом Ac-(06-34-18) Phe2 Aze3 Tyr4 HArg5 Ala(ψCH2NH)6 (обозначаемый в данном исследовании как бицикл 2 и описанный в таблице 26b и на фиг.22 PCT/EP2014/057440). Новозеландских белых кроликов (2-3 кг) подвергали анестезии и оба пептида вводили посредством инъекции внутрь стекловидного тела (100 мкг/глаз) в соответствии с протоколом, описанным в таблице 9.
|
После соответствующего периода времени кроликов умерщвляли и получали образцы жидкости стекловидного тела, сетчатки и плазмы. Образцы анализировали посредством LC-MS для определения концентрации пептида. Результаты этого исследования представлены на фиг.5, где можно наблюдать, что оба пептида медленно выводились из жидкости стекловидного тела с половинным временем элиминации 20-30 ч. Это является значительно более медленным, чем выведение низкомолекулярных соединений, таких как антибиотик ципрофлоксацин (описанное время полужизни в нормальном стекловидном теле кролика 2,2 ч; Pearson et al. 1993, Retina 13:326-330).
Пример 6: Эффект выбранных ингибирующих калликреин бициклических пептидов на индуцируемый каррагенаном отек лапы
В этом анализе пептид Ac-(06-259-02)-Sar3-(D-Arg)2 (обозначаемый в этом исследовании как бицикл 3; см. пример 2 настоящего описания) оценивали по сравнению с пептидом Ac-(06-34-18) Phe2 Aze3 Tyr4 HArg5 Ala(ψCH2NH)6 (обозначаемый в этом исследовании как бицикл 2 и описанный в таблице 26b и на фиг.22 PCT/EP2014/057440). Воспаление индуцировали у самцов крыс Sprague-Dawley (n=10 на группу) посредством инъекции 100 мкл 1% раствора каррагенана в подподошвенную область правой задней лапы. Животным проводили введение пептидов и индометацина в соответствии с таблицей 10:
|
Носитель=50 мМ натрий-ацетатный буфер, pH 5,0, 20% PEG400 и 10% Kolliphor EL
Через 1, 2, 4 и 6 часов после введения каррагенана объем лапы измеряли способом вытеснения воды. Статистический анализ проводили с использованием 2-стороннего ANOVA с повторяющимися измерениями (GraphPad Prism).
Результаты этого исследования представлены на фиг.6, где можно наблюдать, что оба пептида ингибировали опухание лапы, индуцируемое каррагенаном, во все моменты времени. Введение либо пептида, либо положительного контроля индометацина приводило к значительному уменьшению опухания лапы (p<0,001). Важно, что степень ингибирования была сравнимой между двумя пептидами и индометацином, последний из которых считается золотым стандартом терапевтического вещества в этой модели.