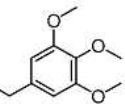
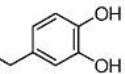
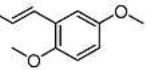
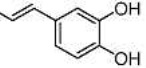
Результат интеллектуальной деятельности: СЛОЖНЫЙ α-АЗАРИ-ЛАЛДЕГИДНЫЙ ЭФИР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[01] Настоящее изобретение в основном относится к способу получения сложного эфира α-Азаронола (3-(2,4,5-триметокси-фенил)-проп-2-ен-1-ола) и к исследованию лекарственного средства для успокоения, транквилизации, противодействия сенильной деменции, противодействия судорогам, противодействия эпилепсии и противодействия депрессии.
Уровень техники
[02] Об Acorus gramineus Soland впервые сообщается в ʺShen Nong's Herbal Classicʺ как высший сорт, и его получают из сухого корня многолетнего травянистого растения рода araceae, Acorus tatarinowii Schott. Acorus gramineus Soland имеет согревающие свойства, острый и горький вкус и ароматический запах, и он может поступать в сечение сердца и желудка. Acorus gramineus Soland имеет ароматический запах, острый вкус и согревающие свойства, может удалять гнилость для восстановления нормального функционирования желудка и разжижать мокроту для восстановления жизненных функций, и обладает воздействием способствования интеллектуальной деятельности и транквилизации, и поэтому широко используется для лечения инсульта, эпилепсии с обморочными состояниями с выделением пены, комы, беспамятства, и так далее. Основная химическая композиция содержит летучее масло в основном содержащее β-азарон, α-азарон, и тому подобное, аминокислоты и сахара, и так далее. Современные фармакологические исследования говорят, что Acorus gramineus Soland имеет воздействия противодействия деменции, защиты нервных клеток, противодействия мутациям, противоэпилептические воздействия, и так далее.
[03] Polygala tenuifolia впервые зарегистрирована в ʺShen Nong's Herbal Classicʺ как высший сорт, и ее получают из сухого корня polygalaceae polygala tenuifalia Willd или polygala sibirica L. Polygala tenuifolia имеет горький и острый вкус и согревающие свойства, и имеет воздействие способствования интеллектуальной деятельности транквилизации, а также удаление мокроты и уменьшения отека. Химическая композиция polygala tenuifolia в основном содержит тритерпеноидные сапонины, сложные эфиры сахаров и ксантоны, а также содержит малое количество алкалоидов, кумарина, лигнина, и так далее. Исследования показали, что Polygala tenuifolia имеет хорошую активность при противодействии деменции, защите головного мозга, успокоении, противодействии судорогам, противодействии депрессии, в качестве отхаркивающего и откашливающего средства, при защите сердечно-сосудистой системы и сосудов головного мозга, и тому подобное.
[04] Wang Shasha et al. обнаружили в крови и желчи крыс, которым вводили внутрижелудочно экстракт Polygala tenuifolia, активные вещества 3,4,5-триметоксикоричную кислоту (TMCA), метил3,4,5-триметоксикоричную кислоту (M-TMCA) и п-метоксикоричную кислоту (PMCA), которые могут продлевать время сна, вызываемого пентобарбиталом натрия, у мышей, это говорит о том, что водный экстракт Polygala tenuifolia содержит природные пролекарства TMCA (WANG S. S. WaKan Iyakugaku Zasshi, 1995, 12(2), 102).
[05] LING Yangzhi et al. осуществили структурное объединение TMCA и получили 3,4,5-триметоксициннамамидные соединения, которые имеют хорошую противосудорожную активность (LING Yangzhi, Pharmaceutical Industry, 1987, 18 (2): 56).
[06] На основе хорошей фармакологической активности TMCA из Polygala tenuifolia и α-азарона из Acorus gramineus Soland при успокоении, при транквилизации, противодействии судорогам и при защите нервных клеток, авторы разработали сложный 3,4,5-триметоксициннаматный эфир α-Азаронола и ряд сложноэфирных производных α-Азаронола посредством структурного и фармакофорного объединения, в надежде на получение новых химических лекарственных средств с более высокой эффективностью при противодействии сенильной деменции, защите головного мозга, успокоении, противодействии судорогам, противодействии депрессии, и тому подобное.
Сущность изобретения
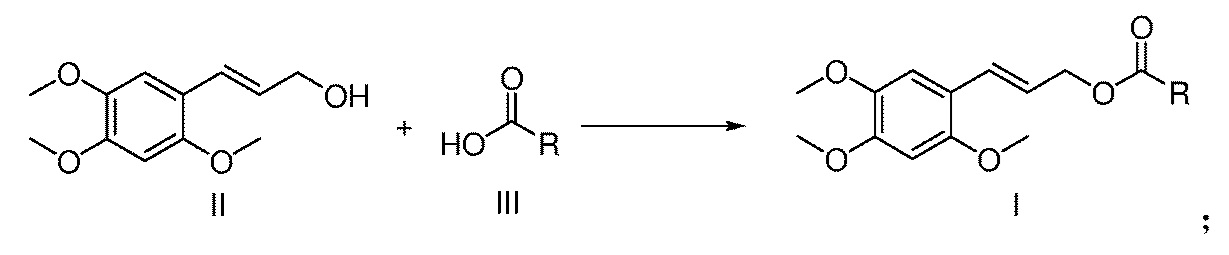
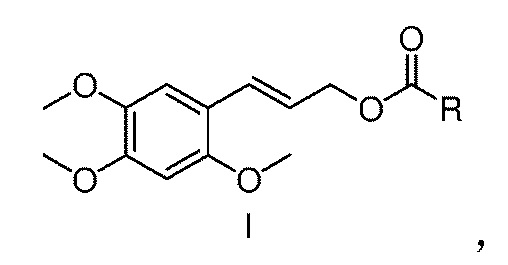
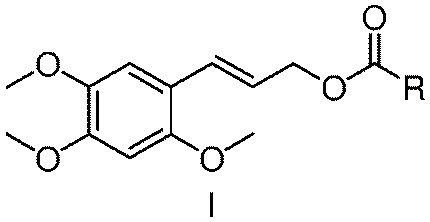
[07] Настоящее изобретение предлагает сложный эфир α-Азаронола, имеющий структуру, представленную формулой I

где
R представляет собой разветвленный или линейный C1-12 алкил, алкенил или алкинил; C3-9 циклоалкил или замещенный циклоалкил; C3-9 циклоалкенил или замещенный циклоалкенил; арил, монозамещенный арил или полизамещенный арил; гетероциклический арил, монозамещенный гетероциклический арил или полизамещенный гетероциклический арил; или группу аминокислоты.
[08] Кроме того, необязательно, R представляет собой арилметил, монозамещенный арилметил или полизамещенный арилметил; арилэтил, монозамещенный или полизамещенный арилэтил; арилвинил, монозамещенный или полизамещенный арилвинил; или замещенный феноксиэтил.
[09] Кроме того, необязательно, R представляет собой:


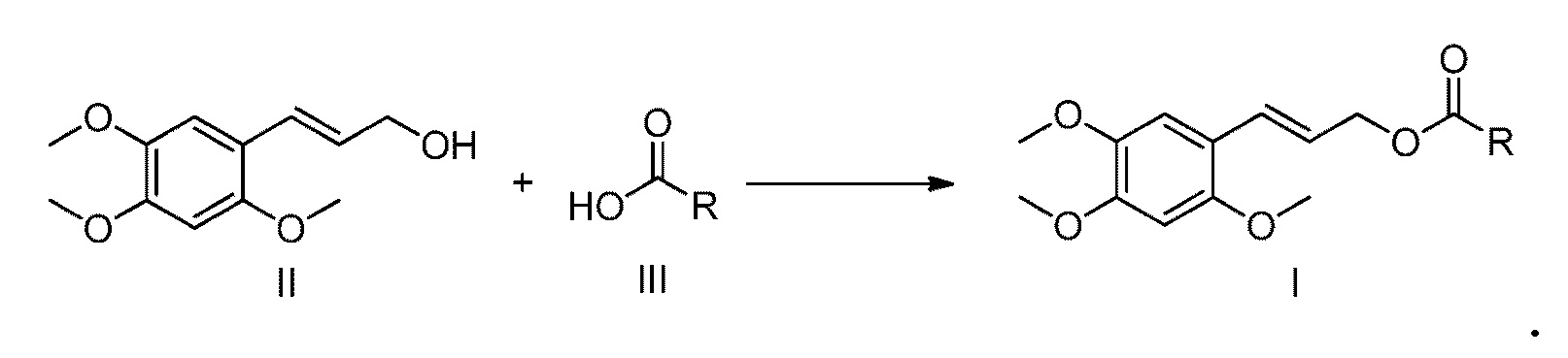
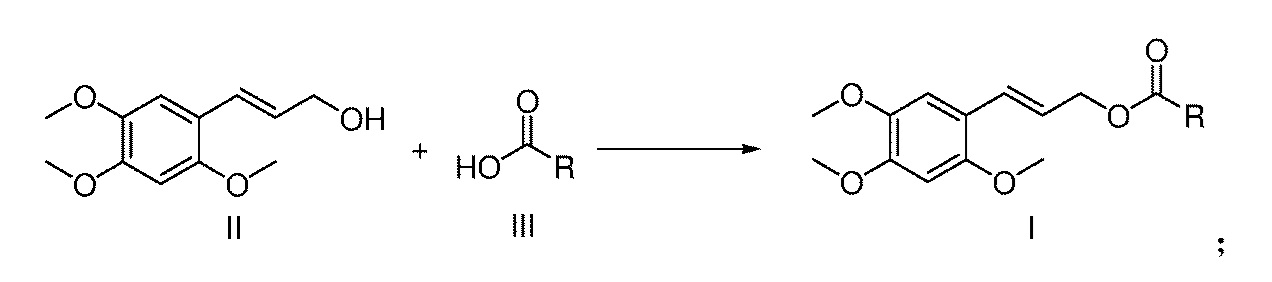
[10] Настоящее изобретение также предлагает способ получения сложного эфира α-Азаронола, указанный выше, включающий: последовательное добавление соединения формулы II, соединения формулы III и катализатора при молярном отношении от 1,0 до 2,0: от 1,0 до 2,0: от 0,1 до 1,0 в реакционную емкость, содержащую пригодный для использования органический растворитель, и после завершения растворения, добавление дегидратирующего агента, где молярное отношение дегидратирующего агента к соединению формулы II составляет от 1 до 2:1, перемешивание смеси при комнатной температуре в течение 5-20 часов, а после завершения реакции, экстрагирование реакционной смеси смесью этилацетат/вода для отделения органической фазы, которую затем сушат над безводным сульфатом натрия, концентрируют и очищают с помощью колоночной хроматографии с получением продукта,
где катализатор представляет собой одно соединение из пиридина, 2,4,6-триметилпиридина, 2,6-диметилпиридина, 2,6-ди-трет-бутил-4-метилпиридина и 4-диметилпиридина (DMAP) или любое их сочетание;
органический растворитель представляет собой одно соединение из дихлорметана, трихлорметана, тетрахлорметана, тетрагидрофурана, этилацетата, простого метил трет-бутилового эфира, простого диэтилового эфира, 1,4-диоксана, N,N-диметилформамида, N-метил пирролидона, N,N-диметилацетамида и диметилсульфоксида или любое их сочетание; и
дегидратирующий агент представляет собой дициклогексилкарбодиимид (DDC), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид(EDCI) или диизопропилкарбодиимид (DIC).
[11] Настоящее изобретение также предлагает другой способ получения сложного эфира α-Азаронола, указанного выше, включающий:
взаимодействие α-Азаронола с соединением формулы III при условиях реакции Мицунобу с получением сложного эфира α-Азаронола
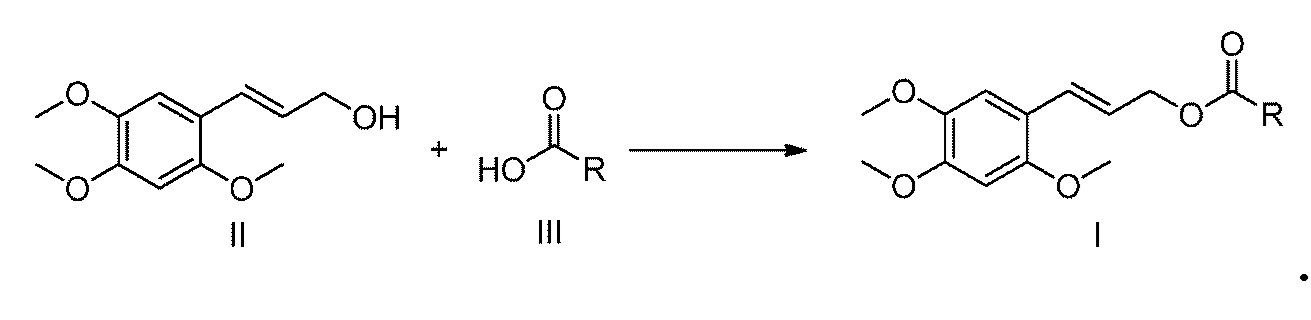
[12] Конкретно, способ включает растворение α-Азаронола, соединения формулы III, азо соединения и фосфорорганического соединения при молярном отношении от 1 до 1,5: от 1 до 1,5: от 1 до 1,5: от 1 до 1,5 в сухом тетрагидрофуране, взаимодействие при комнатной температуре в течение 10-48 часов, экстрагирование реакционной смеси смесью этилацетат/вода для отделения органической фазы, которую затем сушат над безводным сульфатом натрия, концентрируют и очищают с помощью колоночной хроматографии с получением продукта.
[13] Необязательно, азо соединение представляет собой диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD), азодикарбоксилдипиперидид (ADDP), N,N,N',N'-тетраметилазодикарбоксамид (TMAD), N,N,N',N'-тетраизопропилазодикарбоксамид (TIPA) или 4,7-диметил-3,4,5,6,7,8-гексагидро-1,2,4,7-тетраазадицин-3,8-дион (DHTD).
[14] Необязательно, фосфорорганическое соединение представляет собой трифенилфосфин, трибутилфосфин или триметилфосфин.
[15] Настоящее изобретение также предлагает стереоизомер или смесь различных стереоизомерных соединений, указанных выше.
[16] Настоящее изобретение также предлагает применение соединений, указанных выше, при приготовлении лекарственного препарата для успокоения, транквилизации, противодействия сенильной деменции, противодействия судорогам, противодействия эпилепсии и противодействия депрессии.
Описание
[17] Настоящее изобретение предлагает сложный эфир α-Азаронола, имеющий структуру, представленную формулой I
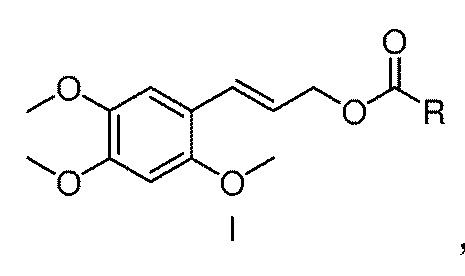
где в формуле I, R представляет собой разветвленный или линейный C1-12 алкил, алкенил или алкинил; C3-9 циклоалкил или замещенный циклоалкил; C3-9 циклоалкенил или замещенный циклоалкенил; арил, монозамещенный или полизамещенный арил; гетероциклический арил, монозамещенный гетероциклический арил или полизамещенный гетероциклический арил; арилметил, монозамещенный арилметил или полизамещенный арилметил; арилэтил, монозамещенный или полизамещенный арилэтил; арилвинил, монозамещенный или полизамещенный арилвинил; замещенный феноксиэтил; или группу аминокислоты.
[18] Способ получения соединения по настоящему изобретению представляет собой следующее:
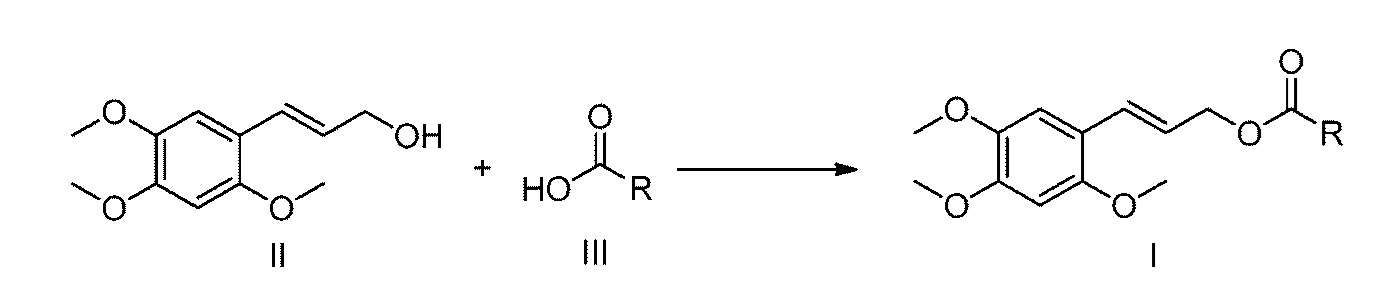
необязательно, схема (1): взаимодействие соединения формулы II с соединением формулы III в присутствии дегидратирующего агента/катализатора с получением соответствующего сложного эфира α-Азаронола (соединение формулы I);
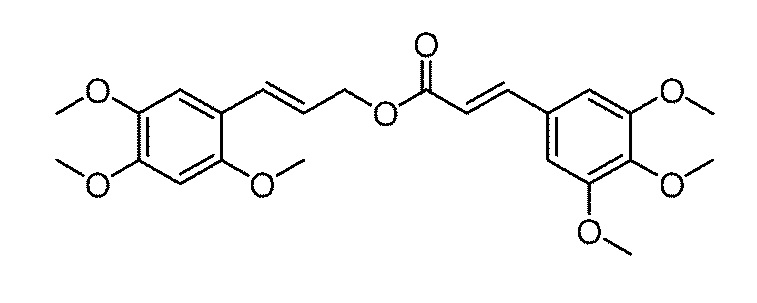
при этом в реакционную емкость, содержащую пригодный для использования органический растворитель, последовательно добавляются соединение формулы II, соединение формулы III и катализатор при молярном отношении от 1,0 до 2,0: от 1,0 до 2,0: от 0,1 до 1,0, и после их полного растворения, добавляется дегидратирующий агент, где молярное отношение дегидратирующего агента к соединению формулы II составляет от 1 до 2:1, смесь перемешивается при комнатной температуре в течение 5-20 часов, и после завершения реакции, реакционная смесь экстрагируется смесью этилацетат/вода для отделения органической фазы, которую затем сушат над безводным сульфатом натрия, концентрируют и очищают с помощью колоночной хроматографии с получением продукта. В этой схеме, молярное отношение соединения формулы II, соединения формулы III и катализатора предпочтительно составляет 1,0: от 1,0 до 1,2: от 0,1 до 0,3.
[19] На схеме, катализатор содержит пиридин, 2,4,6-триметилпиридин, 2,6-диметилпиридин, 2,6-ди-трет-бутил-4-метилпиридин, 4-диметилпиридин или любое их сочетание, а предпочтительно, в качестве катализатора используется 4-диметилпиридин;
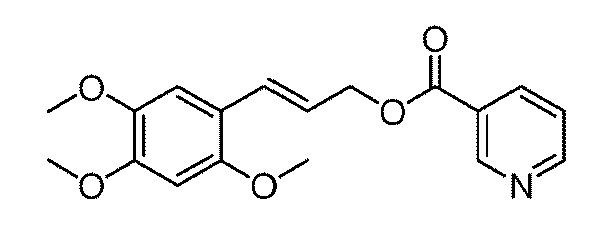
органический растворитель включает дихлорметан, трихлорметан, тетрахлорметан, тетрагидрофуран, этилацетат, простой метил трет-бутиловый эфир, простой диэтиловый эфир, 1,4-диоксан, N,N-диметилформамид, N-метил пирролидон, N,N-диметилацетамид, диметилсульфоксид или любое их сочетание, а предпочтительно, в качестве растворителя используется N,N-диметилформамид, дихлорметан или тетрахлорметан; и
дегидратирующий агент представляет собой дициклогексилкарбодиимид (DDC), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI), или диизопропилкарбодиимид (DIC), а предпочтительно, в качестве дегидратирующего агента используется EDCI.
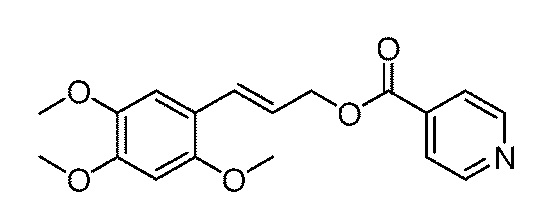
[20] Необязательно, схема (2): получение хлорангидридного соединения из соединения формулы III, а затем взаимодействие хлорангидридного соединения с соединением формулы II с получением соответствующего сложного эфира α-Азаронола (соединение формулы I), конкретно, следующим образом: тионилхлорид добавляется в соединение формулы III на ледяной бане, смесь нагревается с обратным холодильником в течение 2-5 часов, охлаждается и дистиллируется при пониженном давлении для удаления избытка тионилхлорида; в остаток добавляется тетрагидрофурана при перемешивании для получения раствора соединения формулы III в смеси хлорангидрид-тетрагидрофуран; раствор соединения формулы III в смеси хлорангидрид-тетрагидрофуран, указанный выше, добавляется в раствор в тетрагидрофуране, содержащий соединение формулы II и пиридин, на ледяной бане и перемешивается в течение 10-20 мин, а затем нагревается с обратным холодильником в течение 3-4 часов; после завершения реакции, реакционная смесь охлаждается и фильтруется для удаления пиридина гидрохлорида; тетрагидрофуран отгоняется из фильтрата при пониженном давлении, и он экстрагируется смесью этилацетат/вода для отделения органической фазы, которую затем сушат над безводным сульфатом натрия, концентрируют и очищают с помощью колоночной хроматографии с получением продукт.
[21] На схеме, молярное отношение соединения формулы III к тионилхлориду составляет от 1:10 до 1:100, предпочтительно, молярное отношение соединения формулы III к тионилхлориду составляет 1:50.
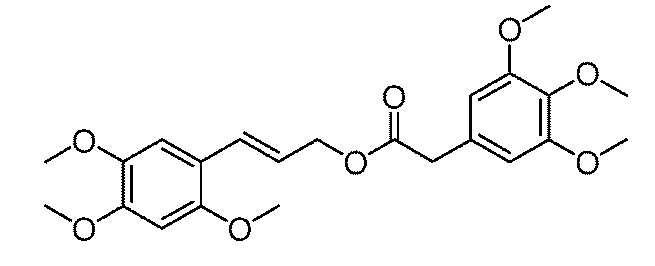
[22] Необязательно, схема (3): взаимодействие соединения формулы II с соединением формулы III при условиях реакции Мицунобу с получением соединения формулы I, конкретно, следующим образом:
растворение соединения формулы II, соединения формулы III, азо соединения и фосфорорганического соединения при молярном отношении от 1 до 1,5: от 1 до 1,5: от 1 до 1,5: от 1 до 1,5 в сухом тетрагидрофуране, взаимодействие при комнатной температуре в течение 10-48 часов, экстрагирование реакционной смеси смесью этилацетат/вода для отделения органической фазы, которую затем сушат над безводным сульфатом натрия, концентрируют и очищают с помощью колоночной хроматографии с получением продукта, где, предпочтительно, молярное отношение соединения формулы II, соединения формулы III, азо соединения и фосфорорганического соединения составляет 1: от 1 до 1,1: от 1 до 1,2: от 1 до 1,2.
[23] На схеме, азо соединение включает диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD), азодикарбонилдипиперидид (ADDP), N,N,N',N'-тетраметилазодикарбоксамид(TMAD), N,N,N',N'-тетраизопропилазодикарбоксамид (TIPA) или 4,7-диметил-3,4,5,6,7,8-гексагидро-1,2,4,7-тетраазадицин-3,8-дион (DHTD), а предпочтительно, DIAD и DEAD.
[24] Фосфорорганическое соединение включает трифенилфосфин, трибутилфосфин или триметилфосфин, а предпочтительно, трифенилфосфин. Соединение формулы I по настоящему изобретению может содержать один или несколько асимметричных атомов углерода, и любые его стереоизомеры и смеси стереоизомеров находятся в рамках настоящего изобретения.
[25] Исследование лекарственного средства на основе соединения формулы I для успокоения, для транквилизации, противодействия сенильной деменции, противодействия судорогам, противодействия эпилепсии и противодействия депрессии.
[26] Способ получения α-Азаронола, включенный в настоящее изобретение, включает:
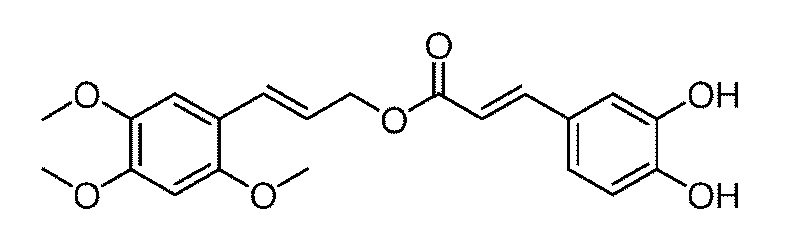
(1) взаимодействие соединения IV с соединением V в присутствии жирного спирта и катализатора с получением соединения VI:
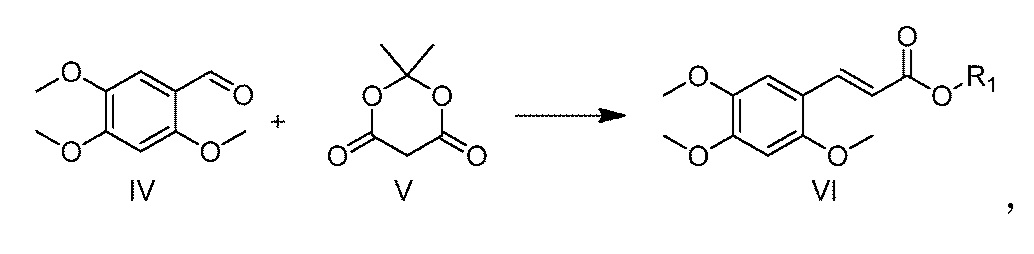
где R1 выбирается из линейного или разветвленного C1-C5 алкила;
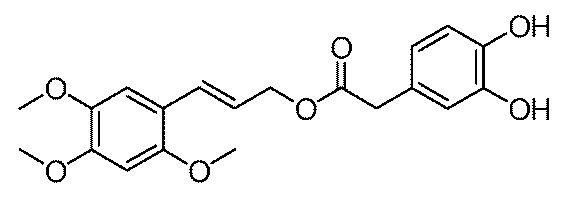
(2) восстановление соединения VI с получением соединения II;
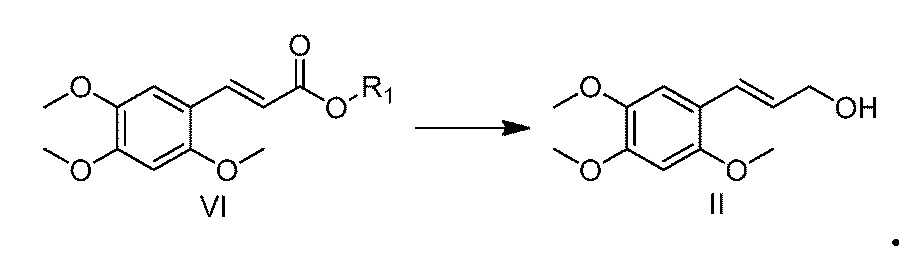
[27] Стадия (1) конкретно представляет собой следующее. Соединение V и алифатический спирт сначала нагревают с обратным холодильником в ксилоле, толуоле или бензоле в течение 3-12 часов, а предпочтительно, в течение 4-10 часов. После охлаждения до комнатной температуры, к реакционной смеси добавляют 2,4,5-триметоксибензальдегид (соединение IV) и катализатор, и смесь нагревают с обратным холодильником в течение 5-24 часов, а предпочтительно, в течение 8-14 часов, с получением соединения VI. Алифатический спирт, используемый на стадии (1), представляет собой один спирт из метанола, этанола, пропанола, изопропанола, бутанола, изобутанола, н-амилового спирта и изоамилового спирта, или любое их сочетание, а предпочтительно, он представляет собой один спирт из метанола и этанола, или любое их сочетание. Молярное отношение алифатического спирта к соединению V составляет от 1:1 до 1:10, а предпочтительно, молярное отношение алифатического спирта к соединению V составляет от 1:1 до 1:4. Используемый катализатор представляет собой одно соединение из пиридина, 2,4,6-триметилпиридина, 2,6-диметилпиридина, 2,6-ди-трет-бутил-4-метилпиридина, 4-диметилпиридина, пиперидина и тетрагидропиррола или любое их сочетание. Молярное отношение катализатора к 2,4,5-триметоксибензальдегиду составляет от 0,1:1 до 2:1.
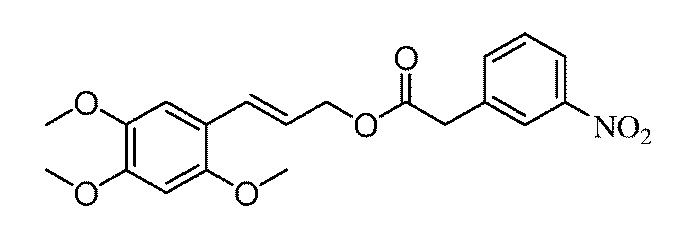
[28] На стадии 2, используемый восстанавливающий агент представляет собой натрий борогидрид, натрий дигидро-бис(2-метоксиэтокси)алюминат, литий-алюминий гидрид или диизобутилалюминий гидрид, и молярное отношение восстанавливающего агента к соединению VI составляет от 1:1 до 10:1. Используемый растворитель представляет собой один растворитель из тетрагидрофурана, 1,4-диоксана, простого диметилэтилового эфира, толуола, бензола, ксилола, простого диэтилового эфира, простого метил трет-бутилового эфира, дихлорметана, дихлорэтана, трихлорметана, тетрахлорметана и н-гексана или любое их сочетание. Температура реакции находится в пределах между -78°C и 25°C; и время реакции находится в пределах между 0,5 и 24 часов.
[29] Настоящее изобретение будет понято лучше из следующего далее описания примеров, которые являются только иллюстративными, и преимущественные варианты осуществления настоящего изобретения ими не ограничиваются.
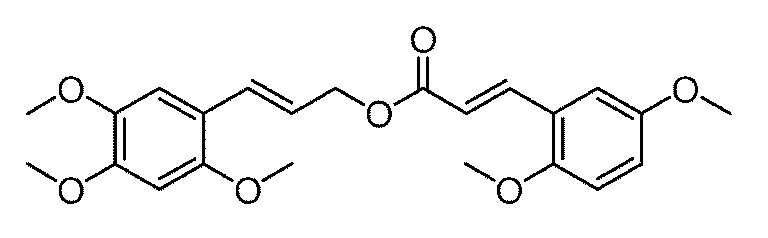
[30] α-Азаронол, используемый в следующих далее примерах, синтезируется с помощью следующего далее способа.
Получение метил 2,4,5-триметоксициннамата
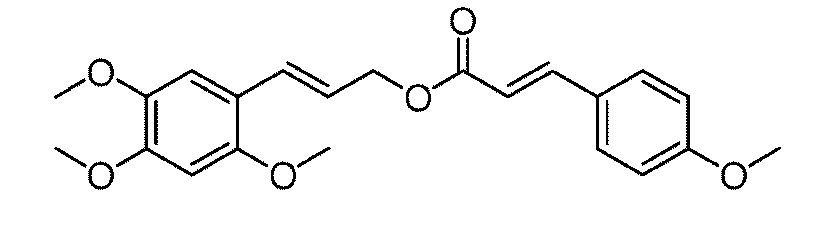
[31] Кислоту Мельдрума 195,5 г (1,35 моль), метанол (50 мл) и толуол (750 мл) добавляют соответствующим образом в 3-л трехгорлую колбу, снабженную термометром и холодильником, и нагревают при 110°C с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры, к реакционной смеси добавляют 2,4,5-триметоксибензальдегид 196,2 г (1,0 моль), пиридин 134,5 г (1,7 моль) и пиперидин 14,5 г (0,17 моль), и нагревают их с обратным холодильником в течение 18 часов. После концентрирования при пониженном давлении, к смеси добавляют этилацетат (200 мл) и воду (200 мл), и смесь экстрагируют и разделяют три раза. Органические фазы объединяют и концентрируют при пониженном давлении, а затем добавляют этанол (1000 мл). Органический материал помещают в холодильник на ночь и дают ему возможность для преципитации. После фильтрования с отсасыванием, остаток промывают три раза 500 мл этанола со льдом с получением 166,3 г бледно-желтого твердого продукта с выходом 66%.
[32] LiAlH4 28,5 г (0,75 моль) (растворенного в 250 мл тетрагидрофурана) добавляют в 3-л трехгорлую колбу, снабженную воронкой постоянного давления, и перемешивают на ледяной бане в течение 20 минут. В смесь добавляют AlCl3 42,6 г (0,32 моль) (растворенного в 150 мл тетрагидрофурана) и перемешивают в течение 30 минут, а затем медленно добавляют по каплям 63,1 г метил 2,4,5-триметоксициннамата (0,25 моль) (растворенного в 200 мл тетрагидрофурана) при 0°C. Смесь медленно нагревают и перемешивают при комнатной температуре в течение 1 часа. Затем, медленно добавляют воду (23 г), 10% гидроксид натрия (23 мл) и воду (69 мл). После преципитации, смесь фильтруют с отсасыванием и концентрируют при пониженном давлении. Затем к смеси добавляют этилацетат (50 мл) и воду (100 мл), и смесь экстрагируют и разделяют три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 28,0 г бледно-желтого твердого продукта с выходом 50%.
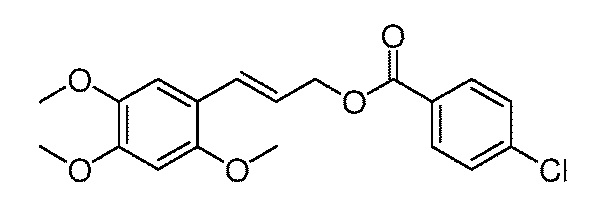
Пример 1
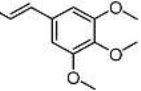
[33] α-Азаронол 3,4,5-триметоксициннамат
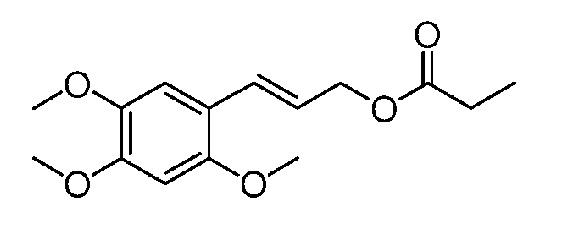
[34] В 250-мл одногорлую колбу добавляют 11,20 г α-Азаронола (50,0 ммоль), 17,85 г 3,4,5-триметоксикоричной кислоты (75,0 ммоль), 1,83 г DMAP (15,0 ммоль) и дихлорметан (120 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 14,38 г EDCI (75,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC (тонкослойной хроматографии). После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 17,76 г желтого твердого продукта с выходом 80%.
m/z=[M+Na] 467,1684
1H ЯМР (600 МГц, cdcl3) δ 7,64 (д, J=15,9 Гц, 1H), 7,00 (t, J=7,9 Гц, 2H), 6,76 (с, 2H), 6,51 (с, 1H), 6,39 (д, J=15,9 Гц, 1H), 6,26 (дт, J=13,8, 6,7 Гц, 1H), 4,87 (д, J=6,7 Гц, 2H), 3,90 (с, 3H), 3,88 (с, 9H), 3,87 (с, 3H), 3,84 (с, 3H).
13C ЯМР (600 МГц, cdcl3) δ 166,78 (с), 153,41 (с), 151,70 (с), 149,95 (с), 144,87 (с), 143,29 (с), 140,07 (с), 129,92 (с), 129,23 (с), 128,84 (с), 125,93 (с), 121,30 (с), 117,34 (с), 116,86 (с), 110,01 (с) 105,18 (с), 97,46 (с), 65,97 (с), 60,97 (с), 56,58 (с), 56,50 (с), 56,13 (с), 56,06 (с).
Пример 2
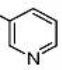
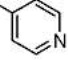
[35] α-Азаронол никотинат
[36] В 100-мл одногорлую колбу добавляют 1,12 г α-Азаронола (5,0 ммоль), 0,92 г никотиновой кислоты (7,5 ммоль), 0,18 г DMAP (1,5 ммоль) и N,N-диметилформамид (20 мл). После перемешивания смеси при комнатной температуре в течение 35 минут, добавляют 1,44 г EDCI (7,5 ммоль) и осуществляют реакцию при комнатной температуре в течение 8 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,82 г желтого твердого продукта с выходом 50%.
Пример 3
[37] α-Азаронол изоникотинат
[38] В 100-мл одногорлую колбу добавляют 0,90 г α-Азаронола (4,0 ммоль), 0,74 г изоникотиновой кислоты (6,0 ммоль), 0,15 г DMAP (1,2 ммоль) и трихлорметан (20 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 1,15 г EDCI (6,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,59 г желтого твердого продукта с выходом 45%.
Пример 4
[39] α-Азаронол 3,4,5-триметоксифенилацетат
[40] В 100-мл одногорлую колбу добавляют 1,34 г α-Азаронола (6,0 ммоль), 2,03 г 3,4,5-триметоксифенилуксусной кислоты (9,0 ммоль), 0,22 г DMAP (1,8 ммоль) и N,N-диметилформамид (30 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 1,73 г EDCI (9,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 1,68 г желтого твердого продукта с выходом 65%.
Пример 5
[41] Сложный эфир L-пролина и α-Азаронола

[42] (i) В 100-мл трехгорлую колбу, снабженную термометром, добавляют 2,30 г L-пролина (20,0 ммоль), 1,4-диоксан (10 мл) и водный раствор 2 моль/л гидроксида натрия (30 мл). После охлаждения до 0°C, смесь перемешивают в течение 10 минут, в нее по каплям добавляют 6,55 г ди-трет-бутилдикарбоната, (30,0 ммоль) в течение 60 мин. Смесь медленно нагревают и перемешивают при комнатной температуре в течение 6 часов или в течение ночи. После доведения pH до pH=4 с помощью разбавленного раствора 2 моль/л хлористводородной кислоты, реакционный раствор экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, и сушат над безводным сульфатом натрия с получением 3,78 г белого твердого продукта boc-L-пролина с выходом 88%.
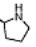
[43] (ii) В 100-мл одногорлую колбу добавляют 1,46 г boc-L-пролина (6,8 ммоль) в продукте(i), 1,01 г α-Азаронола (4,5 ммоль), 0,22 г DMAP (1,8 ммоль) и дихлорметан (30 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 1,73 г EDCI (9,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют и разделяют смесью этилацетат/вода три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 1,10 г желтого твердого продукта boc-L-пролина α-Азаронола с выходом 58%.
[44] (iii) В 100-мл одногорлую колбу добавляют 0,97 г boc-L-пролина α-Азаронола (2,3 ммоль) в (ii) и дихлорметан (10 мл), а затем добавляют по каплям трифторацетат (3 мл) в атмосфере азота, и смесь перемешивают при комнатной температуре в течение 5 часов. После концентрирования при пониженном давлении, добавляют этилацетат (20 мл), воду (20 мл) и насыщенный водный раствор бикарбоната натрия (50 мл), и смесь экстрагируют и разделяют три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении с получением 0,69 г бледно-желтого твердого продукта L-пролина α-Азаронола с выходом 93%.
Пример 6
[45] α-Азаронол 3,4-дигидроксициннамат
[46] В 100-мл одногорлую колбу добавляют 1,79 г α-Азаронола (8,0 ммоль), 2,16 г 3,4-дигидроксикоричной кислоты (12,0 ммоль), тетрагидрофуран (30 мл), 2,10 г трифенилфосфина (8,0 ммоль) и 1,62 г диизопропилазодикарбоксилата (8,0 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение 36 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 1,24 г желтого твердого продукта с выходом 40%.
Пример 7
[47] α-Азаронол 3,4-дигидроксифенилацетат
[48] В 100-мл одногорлую колбу добавляют 1,68 г α-Азаронола (7,5 ммоль), 1,90 г 3,4-дигидрокси фенилуксусной кислоты (11,3 ммоль), тетрагидрофуран (30 мл), 1,97 г трифенилфосфина (7,5 ммоль) и 1,52 г диизопропилазодикарбоксилата (7,5 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение 40 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 1,23 г желтого твердого продукта с выходом 44%.
Пример 8
[49] α-Азаронол 3-нитрофенилацетат
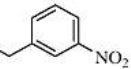
[50] В 100-мл одногорлую колбу добавляют 0,57 г α-Азаронола (7,0 ммоль), 1,90 г 3-нитрофенилуксусной кислоты (10,5 ммоль), 0,26 г DMAP (2,1 ммоль) и N,N-диметилформамид (30 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 2,01 г EDCI (10,5 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,81 г желтого твердого продукта с выходом 30%.
Пример 9
[51] α-Азаронол 2,5-метоксициннамат
[52] В 100-мл одногорлую колбу добавляют 0,90 г α-Азаронола (4,0 ммоль), 1,25 г 2,5-метоксикоричной кислоты (6,0 ммоль), 0,15 г DMAP (1,2 ммоль) и дихлорметан (20 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 1,15 г EDCI (6,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 9 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 1,03 г желтого твердого продукта с выходом 62%.
Пример 10
[53] α-Азаронол п-метоксициннамат
[54] В 100-мл одногорлую колбу добавляют 0,67 г α-Азаронола (3,0 ммоль), 0,80 г п-метоксикоричной кислоты (4,5 ммоль), 0,11 г DMAP (0,9 ммоль) и дихлорметан (20 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 0,86 г EDCI (4,5 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,69 г желтого твердого продукта с выходом 60%.
Пример 11
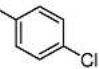
[55] α-Азаронол п-хлорбензоат
[56] В 100-мл одногорлую колбу добавляют 0,45 г α-Азаронола (2,0 ммоль), 0,47 г п-хлорбензойной кислоты (3,0 ммоль), 0,07 г DMAP (0,6 ммоль) и дихлорметан (20 мл). После перемешивания смеси при комнатной температуре в течение 30 минут, добавляют 0,58 г EDCI (3,0 ммоль) и осуществляют реакцию при комнатной температуре в течение 6 часов. Реакцию отслеживают с помощью TLC. После завершения взаимодействия исходных материалов, добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до pH=7-8. Смесь экстрагируют системой этилацетат/вода и промывают три раза. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,35 г желтого твердого продукта с выходом 48%.
Пример 12
[57] α-Азаронол пропионат
[58] В 100-мл одногорлую колбу добавляют пропионовую кислоту, и при условиях ледяной бани, добавляют тионилхлорид (12 мл). Смесь нагревают с обратным холодильником в течение 3 часов, а затем охлаждают до комнатной температуры. После отгонки избытка тионилхлорида при пониженном давлении, в остаток добавляют тетрагидрофуран и, как следует, перемешивают, с получением раствора пропионилхлорида в тетрагидрофуране. При условиях ледяной бани, добавляют 0,56 г α-Азаронола (2,5 ммоль), 0,60 г пиридина (7,6 ммоль) и раствор пропионилхлорида в фуране. Смесь перемешивают в течение 15 минут и нагревают с обратным холодильником в течение 3 часов. После завершения реакции, смесь охлаждают, и пиридин гидрохлорид удаляют посредством фильтрования. Тетрагидрофуран отгоняют из фильтрата при пониженном давлении. Остаток отделяют с использованием смеси этилацетат/вода. Органические фазы объединяют, сушат над безводным сульфатом натрия, фильтруют с отсасыванием и концентрируют при пониженном давлении. Полученный в результате сырой продукт выделяют на колонке с силикагелем с получением 0,44 г желтого твердого продукта с выходом 65%.
Исследование активности α-Азаронола 3,4,5-триметоксициннамата
[59] α-Азаронол 3,4,5-триметоксициннамат используют для лечения судорог и эпилепсии. Противоэпилептические фармакологические исследования осуществляют с использованием программы разработки противоэпилептических лекарственных средств, осуществляемой National Institutes of Health (NIH), они включают Maximal Electroshock Seizure (MES, тест максимального электрошока) для оценки противоэпилептической активности и теста Rotarod (вращающегося стержня) для исследования нейротоксичности. Для дополнительного исследования и оценки фармакологического механизма противосудорожного воздействия в различных химических моделях, используют две классических химических модели, пентаротетразол и 3-меркаптопропионовую кислоту.
(1) Maximal Electroshock Seizure (MES, тест максимального электрошока)
[60] MES представляет собой широко используемую экспериментальную модель эпилептических тестов, при этом, если исследуемое соединение является значимым по отношению к MES, это соединение может разрабатываться в качестве клинически эффективного лекарственного средства для лечения эпилепсии.
[61] Процедура: мышей KM подвергают следующему предварительному скринингу, перед тем как их исследуют, и только прошедших скрининг мышей отбирают для следующего эксперимента. Способ скрининга осуществляют следующим образом: за день до исследования, исследуемых мышей электрически стимулируют при 15 В, 60 Гц, где два электрода зажимаются на каждом ухе мыши и подключаются к питанию в течение 0,45 секунды. Мышей с ригидностью задней конечности включают в группы экспериментальных мышей и используют для последующих экспериментов. Исследование переносимости теста максимального электрошока осуществляют следующим образом: мышам вводят внутрижелудочно исследуемое соединение после того как его растворяют, а затем через 0,25 час, 0,5 час, 1 час, 2 час, 3 час и 4 час после введения, стимулируют с помощью электродов на их ушах при 15 В, 60 Гц с помощью электрической стимуляции в течение 0,45 сек, соответственно. Если мыши не показывают ригидности задней конечности, исследуемое соединение имеет противосудорожную активность при этой дозе. В соответствии с режимом дозирования, разрабатывается градиент концентраций, и мышам вводят исследуемое соединение при различных градиентах концентрации и наблюдают их относительно противосудорожной активности. Наконец, вычисляют половинную эффективную дозу исследуемого соединения при максимальной противосудорожной активности в соответствии со следующими уравнениями:
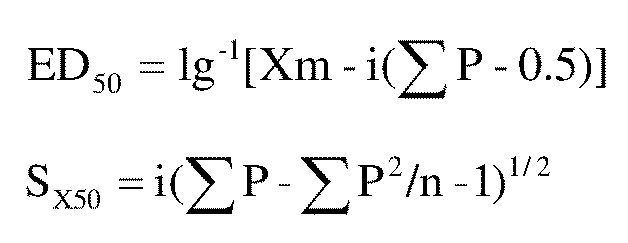
95% доверительный интервал для ED50=lg-1(lgED50 ± 1,96SX50)
где значения символов в уравнениях являются следующими:
Xm представляет собой десятичный логарифм максимальной дозы;
i представляет собой десятичный логарифм отношения между дозами
p представляет собой положительную оценку для каждой группы, выраженную в десятичных знаках после запятой
n представляет собой количество животных в группе
SX50 представляет собой стандартную ошибку lgED50
Таблица 1. Результаты начального противосудорожного теста α-Азаронола 3,4,5-триметоксициннамата на мышах
(внутрижелудочно)a
|
a исследуемое соединение плюс Tween, растворенные в воде
b Тест Maximal Electroshock Seizure осуществляют через 0,25 час, 0,5 час, 1 час, 2 час, 3 час и 4 час после внутрижелудочного введения;
c количество исследуемых мышей составляет 6;
d ED50 представляет собой половинную эффективную дозу;
e 95% доверительный интервал приводится в скобках;
(2) Исследование нейротоксичности
[62] Процедура: экспериментальных мышей помещают в устройство для испытания на усталость с вращающимся стержнем, вращающееся при 16 оборотов в минуту через 0,25 час, 0,5 час, 1 час и 2 час после внутрижелудочного введения, соответственно. Если мыши не падают или падают в пределах трех раз в течение трех минут, это показывает, что соединение не имеет нейротоксичности при этой дозе; если мыши падают более трех раза, это показывает, что соединение имеет нейротоксичность при этой дозе. В соответствии с режимом дозирования, разрабатывается градиент концентрация и мышам вводят исследуемое соединение при различных градиентах концентрации, и они наблюдаются относительно противосудорожной активности. Половинную токсичную дозу (TD50) вычисляют в соответствии со следующими уравнениями:
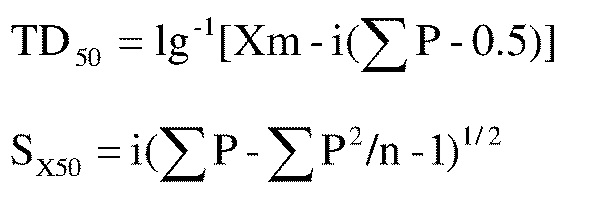
95% доверительный интервал для TD50=lg-1(lgTD50±1,96SX50)
где обозначения символов в уравнении являются следующими:
Xm представляет собой десятичный логарифм для максимальной дозы;
i представляет собой десятичный логарифм отношения между дозами
p представляет собой положительную оценку для каждой группы, выраженную в десятичных знаках после запятой
n представляет собой количество животных в группе
SX50 представляет собой стандартную ошибку lgTD50
Таблица 2. Анализ данных по нейротоксичности и противосудорожной активности α-Азаронола 3,4,5-триметоксициннамата
(внутрижелудочно)a
|
a исследуемое соединение плюс Tween, растворенные в воде
b эксперимент относительно нейротоксичности осуществляют через 0,25 час, 0,5 час, 1 час и 2 час после внутрижелудочного введения;
c количество исследуемых мышей составляет 4;
d TD50 представляет собой половинную токсичную дозу;
e ED50 представляет собой половинную эффективную дозу;
f PI представляет собой степень защиты (TD50/ED50)
g 95% доверительный интервал приведен в скобках
[63] Согласно вычислениям на основе экспериментальных данных, показано, что α-Азаронол 3,4,5-триметоксициннамат демонстрирует ED50=90,3 мг/кг, TD50=939,7 мг/кг, и степень защиты PI=10,4, после его внутрижелудочного введения при тесте максимального электрошока, он показывает хорошую противосудорожную активность и не показывает значимой токсичности.
[64] Для изучения возможного механизма противосудорожного действия α-Азаронола 3,4,5-триметоксициннамата, в этом исследовании, используют пентилентетразол, 3-меркаптопропионовую кислоту и другие режимы химических исследований для начальной оценки противосудорожной активности исследуемого соединения (внутрижелудочно: 160 мг/кг, 80 мг/кг, 40 мг/кг).
(3) Экспериментальная модель эпилепсии, вызываемой пентилентетразолом
[65] Процедура: мышей случайным образом разделяют на пять групп: лечебную группу (внутрижелудочно: 160 мг/кг, 80 мг/кг, 40 мг/кг), контрольную группу и группу плацебо (n=6). Лечебной группе вводят внутрижелудочно исследуемое соединение, контрольной группе - положительное лекарственное средство карбамазепин, и группе плацебо - физиологический солевой раствор. Через 30 минут, мышам вводят внутрижелудочно пентилентетразол при 200 мг/кг. Каждое исследуемое животное помещают в одну клетку и наблюдают в течение 60 минут. Регистрируют латентность клонических судорог, количество клонических судорог, количество тонических судорог и количество смертей для мышей в каждой группе.
Таблица 3. Результаты относительно противосудорожной активности α-Азаронола 3,4,5-триметоксициннамата для модели мышей с эпилепсией, вызванной пентилентетразолом
|
** p<0,01 по сравнению с группой с физиологическим солевым раствором,
* p<0,05 по сравнению с группой с физиологическим солевым раствором
[66] Для модели эпилепсии, вызванной пентилентетразолом, по сравнению с группой с физиологическим солевым раствором, α-Азаронол 3,4,5-триметоксициннамат при исследуемой дозе (160 мг/кг, 80 мг/кг, 40 мг/кг) может значительно продлить время клонических судорог у мышей (p<0,05), и может ингибировать тонические судороги и уменьшить смертность мышей; по сравнению с карбамазепином, α-Азаронол 3,4,5-триметоксициннамат при такой же дозе имеет сравнимое воздействие на ингибирование тонических судорог и уменьшение смертности мышей. Пентилентетразол несет ответственность за судороги из-за ингибирования нейротрансмиттеров на основе γ-аминомасляной кислоты (GABA), главного ингибиторного нейротрансмиттера, присутствующего в головном мозге, и тесно связан с эпилепсией. Согласно Таблице 3, α-Азаронол 3,4,5-триметоксициннамат, возможно, ингибирует или уменьшает судороги, вызываемые пентилентетразолом, посредством повышения уровней нейротрансмиттеров GABA.
(4) Экспериментальная модель эпилепсии, вызываемой 3-меркаптопропионовой кислотой
[67] Процедура: мышей случайным образом разделяют на пять групп: лечебную группу (внутрижелудочно: 160 мг/кг, 80 мг/кг, 40 мг/кг), контрольную группу и группу плацебо (n=6). Лечебной группе вводят внутрижелудочно исследуемое соединение, контрольной группе - положительное лекарственное средство карбамазепин, и группе плацебо - физиологический солевой раствор. Через 30 минут, мышам вводят внутрижелудочно 3-меркаптопропионовую кислоту при 60 мг/кг. Каждое исследуемое животное помещают в одну клетку и наблюдают в течение 60 минут. Регистрируют латентность клонических судорог, количество клонических судорог, количество тонических судорог и количество смертей для мышей в каждой группе.
Таблица 4. Результаты относительно противосудорожной активности α-Азаронола 3,4,5-триметоксициннамата для модели мышей с эпилепсией, вызываемой 3-меркаптопропионовой кислотой
|
* p<0,05 по сравнению с группой с физиологическим солевым раствором
[68] Для модели эпилепсии, вызываемой 3-меркаптопропионовой кислотой, по сравнению с группой с физиологическим солевым раствором, α-Азаронол 3,4,5-триметоксициннамат при исследуемой дозе (160 мг/кг, 80 мг/кг) может значительно продлить время клонических судорог у мышей (p<0,05), и он может ингибировать тонические судороги и уменьшить смертность мышей; по сравнению с карбамазепином, α-Азаронол 3,4,5-триметоксициннамат при исследуемой дозе (160 мг/кг, 80 мг/кг) имеет сравнимое воздействие на ингибирование тонических судорог и уменьшение смертности мышей. 3-меркаптопропионовая кислота представляет собой конкурентный ингибитор GABA синтазы глютаматдекарбоксилазы и ингибирует синтез GABA, приводя к понижению уровней GABA в головном мозге. α-Азаронол 3,4,5-триметоксициннамат может умеренно уменьшать судороги, вызываемые 3-меркаптопропионовой кислотой, это показывает, что α-Азаронол 3,4,5-триметоксициннамат может активировать GABA синтазу глютаматдекарбоксилазу или ингибировать GABA в головном мозге.