Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 4-АМИНОМЕТИЛБЕНЗОЙНОЙ КИСЛОТЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к производным 4-аминометилбензойной кислоты, обладающим гемнезависимым эффектом активации растворимой гуанилатциклазы (sGC), и к содержащим их лекарственным средствам.
Уровень техники
[0002] Растворимая гуанилатциклаза (sGC) представляет собой фермент, продуцирующий циклический гуанозинмонофосфат (cGMP) из гуанозинтрифосфата (GTP), и состоит из димера α субъединиц и β субъединиц. β субъединица связана с гемом, и обычно имеет неактивную структуру, в которой координированное в геме железо и 105й гистидиновый остаток взаимодействуют друг с другом. Монооксид азота (NO) известен как основной sGC-стимулирующий фактор in vivo, и взаимодействует с гемовой формой железа, присутствующей в β субъединице sGC, разрушает взаимодействие гемовой формы железа и гистидинового остатка β субъединицы, в результате чего происходит перевод sGC в активированную форму. cGMP, продуцируемые за счет активированных sGC, впоследствии активируют, например, протеинкиназу или ионные канальцы, и играют различные роли, такие как релаксация гладких мышц сосудов, подавление активации тромбоцитов, подавление клеточного роста и нейропередача запахов. В патологических состояниях происходит снижение активности sGC и разрушение sGC, что ведет к подавлению cGMPs, сокращению гладких мышц сосудов, активации тромбоцитов или клеточного роста, и со временем может стать причиной гипертонии, легочной гипертонии, сердечной недостаточности, эндотелиальной дисфункции, атеросклероза, болезни периферических сосудов, стенокардии, тромбоза, инфаркта миокарда, эректильной дисфункции или почечной дисфункции (не патентные документы 1 и 2).
[0003] Нитратсодержащие агенты, такие как нитроглицерин, широко используются клинически для активации sGC. Они поставляют экзогенный NO, вызывая тем самым активацию sGC, и проявляют фармакологическое действие. Однако, известно, что нитратсодержащие агенты обладают толерантностью, помимо побочных эффектов, что является серьезным недостатком таких лекарственных средств. Высказано предположение, что указанный феномен торлерантности к нитратсодержащим агентам связан с механизмом, который не ассоциирован с sGC, таким как снижение активности митохондриальной альдегиддегидрогеназы, которая участвует в выделении NO (не патентный документ 3). То есть, соединения, непосредственно активирующие sGC, независимо от выделения NO, могут предотвратить толерантность. Кроме того, предполагают, что в старости или при патологических состояниях, таких как, гипертония, диабет и гиперлипидемия, окисление гемового железа и разрушение гема усиливаются в связи с оксидативным стрессом, и NO не способен взаимодействовать с гемом, и не следует ожидать существенной активации sGC (не патентный документ 4). В качестве отличного от NO sGC-стимулирующего агента, известен непосредственно sGC-стимулирующий агент, представленный риоцикватом (патентный документ 1), который зависит от гема. Показано, что хотя такие соединения активируют sGC независимо от NO, они не могут в достаточной степени проявлять способность активации sGC в условиях окисления гемового железа (не патентный документ 5). Соответственно, предполагают, что соединения, проявляющие эффект непосредственной активации sGC вне зависимости от степени окисления гема, отличающиеся от NO или риоциквата, являются эффективными для лечения или профилактики различных заболеваний таких как гипертония, легочная гипертония, сердечная недостаточность, эндотелиальная дисфункция, атеросклероз, заболевание периферических сосудов, стенокардия, тромбоз, инфаркт миокарда, эректильная дисфункция и почечная дисфункция.
[0004] В качестве соединения, имеющего эффект непосредственной активации sGC без влияния на степень окисления гема, раскрытые Cinaciguat и родственные производные в патентном документе 2, пиразольные и триазольные производные в патентном документе 3, 2,6-дизамещенные производные пиридина в патентном документе 4 и гетероциклические производные в патентном документе 5.
Список ссылок
[0005] Патентные документы
Патентный документ 1: WO 2003/095451 A
Патентный документ 2: WO 2001/019780 A
Патентный документ 3: WO 2009/032249 A
Патентный документ 4: WO 2009/071504 A
Патентный документ 5: WO 2009/123316 A
[0006] Не патентные документы
Не патентный документ 1: Handbook of Experimental Pharmacology, Germany, Springer-Verlag, 2009, Vol. 191, p. 309-339
Не патентный документ 2: Handbook of Experimental Pharmacology, Germany, Springer-Verlag, 2009, Vol. 191, p. 277-308
Не патентный документ 3: The Journal of Clinical Investigation, US, American Society for Clinical Investigation, 2004, Vol. 113, 352-354
Не патентный документ 4: The Journal of Clinical Investigation, US, American Society for Clinical Investigation, 2006, Vol. 116, p. 2552-2561
Не патентный документ 5: European Respiratory Journal, Switzerland, European Respiratory Society, 2008, Vol. 32, p. 881-891
Сущность изобретения
Проблемы, которые следует решить в настоящем изобретении
[0007] Целью настоящего изобретения является создание новых соединений, которые обладали бы гемнезависимым эффектом активации в отношении растворимой гуанилатциклазы, и были бы полезны в качестве фармацевтических продуктов.
Средства решения указанной проблемы
[0008] В результате авторы настоящего изобретения синтезировали различные соединения, и провели скринирование для определения коэффициента эффекта активации растворимой гуанилатциклазы. В результате авторы настоящего изобретения обнаружили, что соединения, содержащие 4-аминометилбензойную кислоту в качестве основной структуры, оказываются в высшей степени гемнезависимыми, и обладают превосходным эффектом активации растворимой гуанилатциклазы, и их можно использовать в качестве лекарственных средств, тем самым завершив настоящее изобретение.
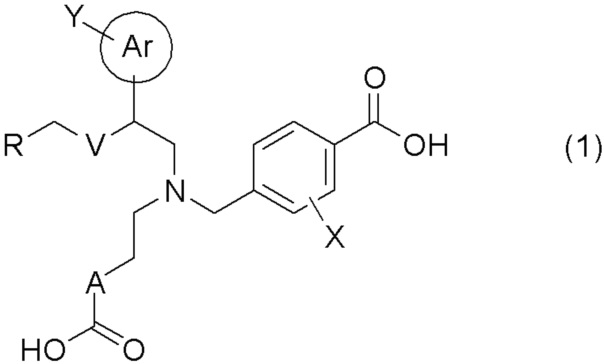
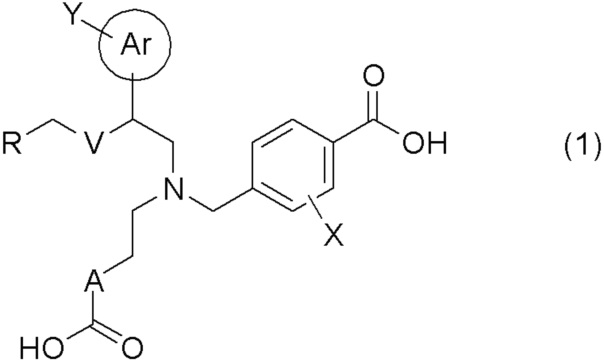
[0009] Более конкретно, в настоящем изобретении предложены соединения, представленные общей формулой (1):
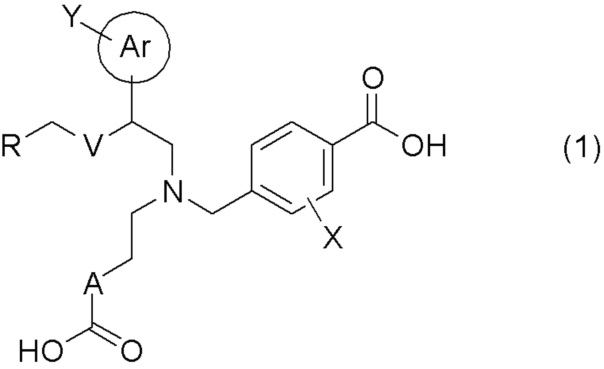
[0010] их фармацевтически приемлемые соли или их сольваты;
[0011] где Ar представляет собой арильную группу, или 5- или 6-членную гетероарильную группу, содержащую атом азота, атом кислорода или атом серы;
Y представляет собой атом водорода, C1-C6 алкильную группу, галоген C1-C4 алкильную группу, цианогруппу, или атом галогена;
A представляет собой C1-C3 алкиленовую цепь, которая может быть замещена двумя C1-C2 алкильными группами, где две C1-C2 алкильные группы могут быть заместителями у одного и того же атома углерода C1-C3 алкиленовой цепи, и кроме того, две C1-C2 алкильные группы, взятые вместе, могут образовывать C3-C5 насыщенное углеводородное кольцо, содержащее один атом углерода C1-C3 алкиленовой цепи;
X представляет собой атом водорода или атом галогена;
V представляет собой атом кислорода или метиленовую цепь;
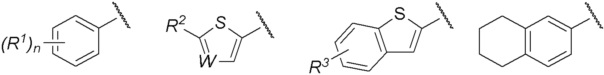
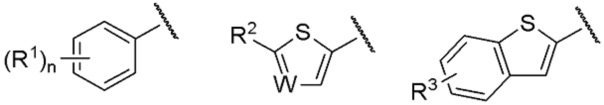
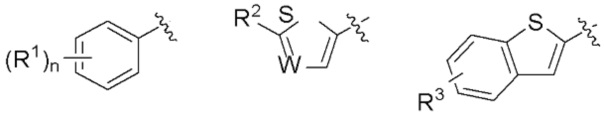
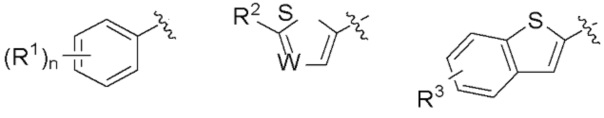
R представляет собой группу, выбранную из представленных ниже формул
[0012]
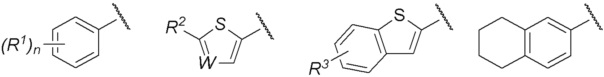
[0013] где R1, R2 и R3 каждый независимо представляет собой атом водорода, атом галогена, C1-C6 алкильную группу, которая может иметь замещающую группу, C1-C6 алкоксигруппу, C3-C6 циклоалкильную группу, C3-C6 циклоалкоксигруппу, галоген C1-C4 алкильную группу, арильную группу, которая может иметь замещающую группу у ароматического кольца, арилоксигруппу, которая может иметь замещающую группу у ароматического кольца, бензильную группу, которая может иметь замещающую группу у бензольного кольца, фенэтильную группу, которая может иметь замещающую группу у бензольного кольца, или бензилоксигруппу, которая может иметь замещающую группу у бензольного кольца,
W представляет собой =CH- или атом азота,
n представляет собой целое число от 1 до 3, и если n равно 2 или больше, значения n для R1 могут отличаться друг от друга.
[0014] В настоящем изобретении предложено лекарственное средство, содержащее соединение, представленное общей формулой (1), его фармацевтически приемлемую соль или его сольват.
В настоящем изобретении предложена фармацевтическая композиция, содержащая соединение, представленное общей формулой (1), его фармацевтически приемлемую соль или его сольват, и фармацевтически приемлемый носитель.
Кроме того, в настоящем изобретении предложены соединения, представленные общей формулой (1), их фармацевтически приемлемые соли или их сольваты, для применения в качестве лекарственного средства, предпочтительно, для применения для профилактики или лечения заболеваний, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертония, легочная гипертония и ишемическая болезнь сердца.
Кроме того, в настоящем изобретении предложено применение соединений, представленных общей формулой (1), их фармацевтически приемлемых солей или их сольватов, для получения лекарственных средств, и предпочтительно, средств для профилактики или лечения заболеваний, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертония, легочная гипертония и ишемическая болезнь сердца.
Кроме того, в настоящем изобретении предложен способ профилактики или лечения заболеваний, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертония, легочная гипертония и ишемическая болезнь сердца, причем способ включает введение эффективного количества соединения, представленного общей формулой (1), его фармацевтически приемлемой соли или его сольвата.
Благоприятные эффекты изобретения
[0015] Соединения настоящего изобретения обладают в высшей степени гемнезависимыми характеристиками, и превосходным эффектом активации растворимой гуанилатциклазы, и являются полезными в качестве средств для профилактики или лечения различных заболеваний, связанных с растворимой гуанилатциклазой. Примеры таких заболеваний, которые можно предотвратить или лечить за счет эффекта активации растворимой гуанилатциклазы, включают сердечную недостаточность, гипертонию, легочную гипертонию или ишемическую болезнь сердца.
Описание предпочтительного варианта изобретения
[0016] Термин "арильная группа" здесь обозначает C6-C10 арильную группу, более конкретно C6-10 моноциклическую или полициклическую ароматическую углеводородную группу. Конкретные примеры арильных групп включают фенильную группу, 1-нафтильную группу и 2-нафтильную группу.
Выражение "5- или 6-членная гетероарильная группа, содержащая атом азота, атом кислорода или атом серы" в описании представляет собой C4-5 моноциклическую гетероарильную группу, содержащую 1 или 2 из атомов азота, атомов кислорода, или атомов серы. Конкретные примеры 5- или 6-членных гетероарильных групп, содержащих атом азота, атом кислорода или атом серы, включают фурильную группу, тиенильную группу, пиразолильную группу, тиазолильную группу, изотиазольную группу, оксазолильную группу, изоксазолильную группу, имидазолильную группу, пирролильную группу, пиридильную группу, пиридазинильную группу, пиримидильную группу и пиразинильную группу.
Примеры "атомов галогенов" в описании включают атом фтора, атом хлора, атом брома и атом йода.
[0017] Термин "C1-C6 алкильная группа" в описании представляет собой C1-6 линейную алкильную группу или C3-6 алкильную группу с разветвленной цепью. Примеры C1-C6 алкильных групп включают метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, н-гексильную группу, 2,2-диметилпропильную группу, 3-метилбутильную группу, 3-этилбутильную группу и 3,3-диметилбутильную группу.
Термин "C1-C6 алкоксигруппа" в описании представляет собой группу, полученную в результате замещения одного атома водорода атомом кислорода в C1-C6 алкильной группе. Более конкретно, C1-C6 алкоксигруппа представляет собой C1-6 линейную алкоксигруппу или C3-6 алкоксигруппу с разветвленной цепью, и примеры C1-C6 алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу и н-гексилоксигруппу.
Термин "C3-C6 циклоалкильная группа" в описании представляет собой C3-6 циклическую алкильную группу. Более конкретно, примеры C3-C6 циклоалкильных групп включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Термин "C3-C6 циклоалкоксигруппа" в описании представляет собой группу, полученную в результате замещения одного атома водорода атомом кислорода в "C3-C6 циклоалкильной группе". Более конкретно, примеры C3-C6 циклоалкоксигрупп включают циклопропоксигруппу, циклобутоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу.
[0018] Термин "галоген C1-C4 алкильная группа" в описании представляет собой группу, полученную в результате замещения одного или более из атомов галогенов в C1-C4 алкильной группе, то есть, в C1-4 линейной или C3-4 алкильной группе с разветвленной цепью. Примеры галоген C1-C4 алкильных групп включают хлорметильную группу, дихлорметильную группу, трихлорметильную группу, фторметильную группу, дифторметильную группу, трифторметильную группу, бромметильную группу, дибромметильную группу, трибромметильную группу, 2-хлорэтильную группу, 2,2-дихлорэтильную группу, 2,2,2-трихлорэтильную группу, 2-фторэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2-тетрафторэтильную группу, пентафторэтильную группу, 2-бромэтильную группу, 2,2,2-трибромэтильную группу, 3,3,3-трихлорпропильную группу, 3,3,3-трифторпропильную группу, 3,3,3-трибромпропильную группу, 4,4,4-трихлорбутильную группу и 4,4,4-трифторбутильную группу.
[0019] Термин "арилоксигруппа" в описании представляет собой группу, полученную в результате замещения одного атома водорода атомом кислорода в "C6-C10 арильной группе". Более конкретно, примеры арилоксигрупп включают феноксигруппу, 1-нафтоксигруппу и 2-нафтоксигруппу.
Термин "C1-C3 алкиленовая цепь" в описании представляет собой C1-3 линейную алкиленовую группу. Более конкретно, примеры C1-C3 алкиленовых цепей включают -CH2-, -(CH2)2- и -(CH2)3-.
[0020] Выражение "который может иметь замещающую группу" в описании означает, что предмет может быть незамещенным или имеет один или более, и предпочтительно, 1 или 2, более предпочтительно, один заместитель, которые могут быть одинаковыми или различными, в положении замещения. Примеры заместителей включают, атом галогена, C1-C6 алкильную группу, C1-C6 алкоксигруппу, C3-C6 циклоалкильную группу, C3-C6 циклоалкоксигруппу, C6-C10 арильную группу, C6-C10 арилоксигруппу, бензильную группу, фенэтильную группу и бензилоксигруппу. Определения каждого из заместителей представлены выше, и они могут дополнительно иметь заместители.
[0021] Атом галогена, представленный как R1, R2 и R3, предпочтительно, является атомом фтора или атомом хлора.
Примеры заместителей в случае, когда имеется C1-C6 алкильная группа, которая может иметь замещающую группу, представленную как R1, R2 и R3, имеет заместитель, включают C1-C6 алкоксигруппу, C3-C6 циклоалкильную группу и C3-C6 циклоалкоксигруппу. Среди них предпочтительны C3-C6 циклоалкильные группы, и особенно предпочтительны циклопентильная группа или циклогексильная группа. C1-C6 алкильная группа, которая может иметь замещеющую группу, предпочтительно, представляет собой, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, 3,3-диметилбутильную группу, 2-циклопентилэтильную группу или 2-циклогексилэтильную группу. Среди, C1-C6 алкильных групп более предпочтительны трет-бутильная группа, 3,3-диметилбутильная группа, 2-циклопентилэтильная группа или 2-циклогексилэтильная группа.
C3-C6 циклоалкильные группы, представленные как R1, R2 и R3, предпочтительно, представляют собой циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу, и среди них особенно предпочтительна циклопропильная группа.
Галоген C1-C4 алкильная группа, представленная как R1, R2 и R3, является, предпочтительно, C1-C4 алкильной группой, замещенной одним или более из атомов фтора, и среди них более предпочтительны, C1-C4 алкильные группы, замещенные 1-5 атомами фтора. Более конкретно, примеры галоген C1-C4 алкильных групп включают трифторметильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2-тетрафторэтильную группу и пентафторэтильную группу, и среди них особенно предпочтительна, трифторметильная группа.
[0022] Ароматическое кольцо в C6-C10 арильной группе, которая может иметь замещающую группу у ароматического кольца, или в C6-C10 арилоксигруппе, которая может иметь замещающую группу у ароматического кольца, представленную как R1, R2 и R3, является, предпочтительно, бензольным кольцом. В случае если ароматическое кольцо имеет заместитель, такой заместитель является, предпочтительно, атомом галогена, C1-C6 алкильной группой или цианогруппой. C6-C10 арильная группа, которая может иметь замещающую группу у ароматического кольца, или C6-C10 арилоксигруппа, которая может иметь замещающую группу у ароматического кольца, предпочтительно, содержит от 1 до 2 заместителей или заместители отсутствуют. Примеры C6-C10 арильных групп, которые могут иметь замещающую группу у ароматического кольца, или C6-C10 арилоксигрупп, которые могут иметь замещающую группу у ароматического кольца, включают более конкретно фенильную группу, 4-фторфенильную группу, 4-хлорфенильную группу, 4-метилфенильную группу, 4-трет-бутилфенильную группу, 4-цианофенильную группу, феноксигруппу, 4-фторфеноксигруппу, 4-хлорфеноксигруппу, 4-метилфеноксигруппу, 4-трет-бутилфеноксигруппу и 4-цианофеноксигруппу. Среди C6-C10 арильных групп, которые могут иметь замещающую группу у ароматического кольца, или C6-C10 арилоксигрупп, которые могут иметь замещающую группу у ароматического кольца, предпочтительны, фенильная группа, 4-трет-бутилфенильная группа, 4-хлорфеноксигруппа, 4-метилфеноксигруппа или 4-цианофеноксигруппа.
[0023] Бензильная группа, которая может иметь замещающую группу у бензольного кольца, фенэтильная группа, которая может иметь замещающую группу у бензольного кольца, или бензилоксигруппа, которая может иметь замещающую группу у бензольного кольца, представленные как R1, R2 и R3 (здесь и далее, бензильная группа, фенэтильная группа и бензилоксигруппа коллективно именуются как бензильная группа или т.п.), предпочтительно, или содержит один или два заместителя у бензольного кольца или они отсутствуют, и особенно предпочтительно, если содержит один заместитель в пара-положении. Такой заместитель является, предпочтительно, атомом галогена или галоген C1-C4 алкильной группой, и среди них более предпочтительны, атомом хлора или трифторметильная группа. Бензильная группа или т.п. является, предпочтительно, фенэтильной группой или бензилоксигруппой. Примеры бензильных групп или т.п., которые могут иметь замещающую группу у бензольного кольца, включают более конкретно фенэтильную группу, бензилоксигруппу, (4-фтор)фенэтильную группу, (4-хлор)фенэтильную группу и (4-трифторметил)фенэтильную группу. Среди бензильных групп или т.п., которые могут иметь замещающую группу у бензольного кольца, предпочтительны фенэтильная группа, бензилоксигруппа, (4-хлор)фенэтильная группа или (4-трифторметил)фенэтильная группа.
[0024] Примеры C6-C10 арильных групп или 5- или 6-членных гетероарильных групп, содержащих атом азота, атом кислорода или атом серы, представленных как Ar, включают более конкретно фенильную группу, фурильную группу, тиенильную группу, тиазолильную группу, оксазолильную группу, имидазолильную группу, пирролильную группу, пиридильную группу и пиримидильную группу. Среди C6-C10 арильных групп или 5- или 6-членных гетероарильных групп, содержащих атом азота, атом кислорода или атом серы, представленных как Ar, предпочтительны фенильная группа или тиенильная группа.
[0025] Y представляет собой атом водорода, C1-C6 алкильную группу, галоген C1-C4 алкильную группу, цианогруппу или атом галогена.
Примеры C1-C6 алкильных групп, представленных как Y, включают более конкретно метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, изопропильную группу, изобутиьнуюл группу, втор-бутильную группу, трет-бутильную группу и 2,2-диметилпропильную группу. Среди C1-C6 алкильных групп, представленных как Y, предпочтительны метильная группа, этильная группа или трет-бутильная группа, и наиболее предпочтительна метильная группа.
Галоген C1-C4 алкильная группа, представленная как Y, является, предпочтительно, фторметильной группой, дифторметильной группой, трифторметильной группой или пентафторэтильной группой.
Примеры атомов галогенов, представленных как Y, включают более конкретно атом фтора, атом хлора, атом брома и атом йода. Среди атомов галогенов, представленных как Y, предпочтительны атом хлора и атом фтора, и особенно предпочтителен атом хлора.
В качестве Y особенно предпочтительны, метильная группа, цианогруппа или атом хлора. Что касается положения такого Y заместителя относительно Ar, если Ar представляет собой 6-членное кольцо, предпочтительными являются мета-положение или пара-положение, и наиболее предпочтительно мета-положение. Что касается положения такого Y заместителя относительно Ar, если Ar представляет собой гетероарильную группу, то предпочтительно, это атом углерода, соседний с гетероатомом.
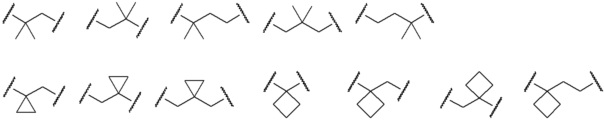
[0026] Примеры C1-C3 алкиленовых цепей, которые могут быть замещены двумя C1-C2 алкильными группами, представленными как A, включают более конкретно -CH2-, -(CH2)2-, -(CH2)3- или раскрытые далее структуры.
[0027]
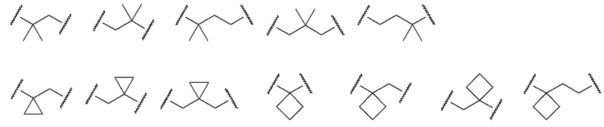
[0028] (левый конец в каждой из структур представляет собой сайт связывания с карбоксильной группой.)
Среди C1-C3 алкиленовых цепей предпочтительны -(CH2)2- или структуры, выбранные из представленных ниже формул.
[0029]
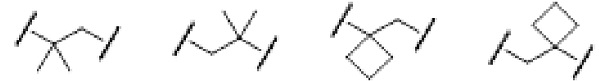
[0030] (левый конец в каждой из структур представляет собой сайт связывания с карбоксильной группой.)
[0031] X представляет собой атом водорода или атом галогена. Среди значений X предпочтительны атом водорода или атом фтора. Что касается положения таких X заместителей, то предпочтительно орто-положение относительно карбоксильной группы. V представляет собой атом кислорода или метиленовую цепь, и среди них предпочтителен атом кислорода.
[0032] В случае, если группа, представленная как R, имеет представленную ниже формулу,
[0033]
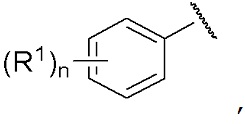 ,
,
[0034] особенно предпочтительно, чтобы n было равно 1 или 2.
[0035] В случае если группа, представленная как R, имеет представленную ниже формулу,
[0036]
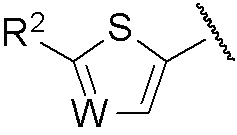 ,
,
[0037] W в указанной формуле представляет собой =CH- или атом азота, и среди них, предпочтительно, =CH-.
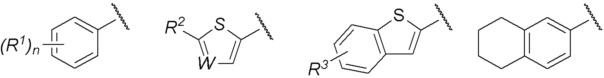
Группа, представленная как R, является, предпочтительно, группой, выбранной из представленных ниже формул
[0038]
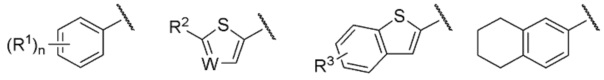
[0039] и особенно предпочтительно,
[0040]
[0041] среди них.
[0042] R1 является, предпочтительно, атомом галогена, C1-C6 алкильной группой, которая может иметь замещающую группу, галоген C1-C4 алкильной группой, арильной группой, которая может иметь замещающую группу у ароматического кольца, арилоксигруппой, которая может иметь замещающую группу у ароматического кольца, бензильной группой или т.п., которые могут иметь замещающую группу у бензольного кольца. Среди R1 более предпочтительна C1-C6 алкильная группа, которая может иметь замещающую группу, или фенэтильная группа или бензилоксигруппа, которые могут иметь замещающую группу у бензольного кольца. Положение заместителя R1 является, предпочтительно, мета-положением или пара-положением. Кроме того, положение заместителя R1 в случае, когда n=2, является, предпочтительно, комбинацией орто-положения и пара-положения, или комбинацией мета-положений. В описании заместителем у C1-C6 алкильной группы является, предпочтительно, C3-C6 циклоалкильная группа. Арильной группой является, предпочтительно, фенильная группа, и арилоксигруппа является, предпочтительно, феноксигруппой, и заместителем у таких арильной группы или арилоксигруппы являются, предпочтительно, атом галогена, C1-C6 алкильная группа, галоген C1-C4 алкильная группа или цианогруппа. Заместителем у бензольного кольца является, предпочтительно, атом галогена или галоген C1-C4 алкильная группа.
[0043] R2 является, предпочтительно, C1-C6 алкильной группой которая может иметь замещающую группу, арильной группой, которая может иметь замещающую группу у ароматического кольца, арилоксигруппой, которая может иметь замещающую группу у ароматического кольца, или фенэтильной группой, которая может иметь замещающую группу у бензольного кольца. Среди R2 наиболее предпочтительна фенэтильная группа, которая может иметь замещающую группу у бензольного кольца. В описании заместитель у C1-C6 алкильной группе, предпочтительно, отсутствует. Арильной группой является, предпочтительно, фенильная группа, и арилоксигруппа является, предпочтительно, феноксигруппой, и заместитель у такой арильной группы или фенэтилной группы, предпочтительно, отсутствует, и заместителем у арилоксигруппы является, предпочтительно, C1-C6 алкильная группа.
[0044] R3 является, предпочтительно, атомом галогена, или C1-C6 алкильной группой или C3-C6 циклоалкильной группой, которая может иметь замещающую группу. Положение заместителя R3 наиболее предпочтительно, является положением 6. В описании заместитель у C1-C6 алкильной группы или C3-C6 циклоалкильной группы, предпочтительно, отсутствует.
[0045] В общей формуле (1), предпочтительно, чтобы Ar представлял собой фенильнную группу или тиенильную группу;
Y представляет собой атом водорода, C1-C6 алкильную группу, цианогруппу или атом галогена;
A представляет собой, например, -(CH2)2- или структуру, соответствующую одной из представленных ниже формул,
[0046]
[0047] (левый конец в каждой из структур представляет собой сайт связывания с карбоксильной группой.)
X представляет собой атом водорода или атом галогена;
V представляет собой атом кислорода; и
R имеет следующие значения.
[0048]
[0049] В описании R1, R2, R3, W и n имеют раскрытые выше значения.
[0050] В общей формуле (1), более предпочтительно, чтобы Ar представлял собой фенильную группу или тиенильную группу;
Y представляет собой атом водорода, C1-C6 алкильную группу, цианогруппу или атом галогена;
A представляет собой, например, -(CH2)2- или структуру, представленную одной из представленных далее формул,
[0051]
[0052] (левый конец в каждой из структур представляет собой сайт связывания с карбоксильной группой.)
X представляет собой атом водорода или атом галогена;
V представляет собой атом кислорода; и
R имеет следующие значения.
[0053]
[0054] В описании R1, R2, R3, W и n имеют указанные выше значения.
[0055] В предпочтительном варианте R1 является, предпочтительно, атомом галогена, C1-C6 алкильной группой, которая может иметь замещающую группу, галоген C1-C4 алкильной группой, арилоксигруппой, которая может иметь замещающую группу у ароматического кольца, фенэтильной группой, которая может иметь замещающую группу у бензольного кольца, или бензилоксигруппой, которая может иметь замещающую группу у бензольного кольца. Среди R1 более предпочтительны C1-C6 алкильная группа, которая может иметь замещающую группу, фенэтильная группа, которая может иметь замещающую группу у бензольного кольца, или бензилоксигруппа, которая может иметь замещающую группу у бензольного кольца. В описании заместители у алкильной группы, арилоксигруппы и бензольного кольца имеют, предпочтительно, раскрытые выше значения.
[0056] R2 является, предпочтительно, C1-C6 алкильной группой, которая может иметь замещающую группу, арильной группой, которая может иметь замещающую группу у ароматического кольца, арилоксигруппой, которая может иметь замещающую группу у ароматического кольца, или фенэтильной группой, которая может иметь замещающую группу у бензольного кольца. Среди R2 наиболее предпочтительна фенэтильная группа, которая может иметь замещающую группу у бензольного кольца. В описании заместители у алкильной группы, арильной группы, арилоксигруппы и у бензольного кольца являются, предпочтительно, одними из раскрытых выше заместителей.
[0057] R3 является, предпочтительно, атомом галогена, C1-C6 алкильной группой, которая может иметь замещающую группу, или C3-C6 циклоалкильной группой. В описании заместителем алкильной группы является, предпочтительно, один из раскрытых выше заместителей.
[0058] Наиболее предпочтительные примеры соединений общей формулы (1) настоящего изобретения, наряду с другими, конкретно включают раскрытые далее соединения.
4-{[N-(4-карбоксибутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 2)
4-{[N-[2-(3-трет-бутилбензилокси)-2-фенилэтил]-N-(4-карбоксибутил)амино]метил}бензойная кислота (Пример 10)
4-{[N-(5-карбоксипентил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 15)
4-{[N-(4-карбокси-4-метилпентил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 16)
4-{[N-(4-карбокси-3,3-диметилбутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 18)
4-{[N-(4-карбоксибутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-(2-тиенил)этил]амино]метил}бензойная кислота (Пример 19)
4-{[N-(4-карбоксибутил)-N-[2-(3-хлорфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензойная кислота (Пример 22)
4-{[N-(4-карбоксибутил)-N-[2-(3-метилфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензойная кислота (Пример 23)
4-{[N-(4-карбоксибутил)-N-[2-(3-хлорфенил)-2-[5-(2-фенилэтил)тиофен-2-илметокси]этил]амино]метил}бензойная кислота (Пример 24)
[0059] 4-{[N-(4-карбоксибутил)-N-[2-[5-(2-фенилэтил)тиофен-2-илметокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 25)
4-{[N-(4-карбоксибутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-(3-тиенил)этил]амино]метил}бензойная кислота (Пример 26)
4-{[N-(4-карбоксибутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-(5-хлор-2-тиенил)этил]амино]метил}бензойная кислота (Пример 27)
4-{[N-(4-карбоксибутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-(5-метил-2-тиенил)этил]амино]метил}-2-фторбензойная кислота (Пример 28)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-(3-хлорфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензойная кислота (Пример 29)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-(3-цианофенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензойная кислота (Пример 30)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 32)
[0060] (-)-4-{[N-[(2R)-2-(3-трет-бутилбензилокси)-2-(3-хлорфенил)этил]-N-(4-карбоксибутил)амино]метил}бензойная кислота (Пример 34)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[4-(2-циклопентилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 39)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[4-[2-(4-хлорфенил)этил]бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 40)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[4-(4-хлорфенилокси)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 42)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[5-(2-фенилэтил)тиофен-2-илметокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 43)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-[2-фтор-4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 45)
(-)-4-{[N-(4-карбоксибутил)-N-[(2R)-2-(3,5-ди-трет-бутилбензилокси)-2-фенилэтил]амино]метил}бензойная кислота (Пример 46)
4-{[N-(4-карбоксибутил)-N-[2-[3-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота (Пример 60)
[0061] В описании соединения общей формулы (1) могут иметь изомеры, такие как геометрические изомеры, оптические изомеры, стерические изомеры и таутомеры, и соединения общей формулы (1) настоящего изобретения включают все такие изомеры или их смеси.
Кроме того, соединения общей формулы (1) настоящего изобретения включают соединения, меченные, например, изотопами (например, 2H, 3H, 14C, 35S или 125I).
[0062] Кроме того, настоящее изобретение включает фармацевтически приемлемые соли соединений общей формулы (1). Более конкретно, примеры фармацевтически приемлемых солей включают соли присоединения неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат и фосфат, и соли присоединения органических кислот, такие как формиат, ацетат, трихлорацетат, трифторацетат, пропионат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, тартрат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, p-толуолсульфонат (4-метилбензолсульфонат), аспартат или глутамат; соли присоединения неорганических оснований, такие как соли натрия, соли калия, соли магния, соли кальция, соли аммония и соли алюминия, и соли присоединения органических оснований, таких как метиламин, этиламин, этаноламин, лизин и орнитин.
[0063] Кроме того, в настоящем изобретении, соединение (1) настоящего изобретения и его фармацевтически приемлемая соль могут присутствовать в виде гидрата, различных сольватов и в виде кристаллической полиморфной формы, и аналогично этим не ограничены, и любая из указанных кристаллических форм может быть в виде одного кристалла или в виде смеси кристаллов, и все они включены в настоящее изобретение.
[0064] Кроме того, соединение (1) настоящего изобретения можно превратить в пролекарство, используя фармакологически приемлемые группы. Примеры фармакологически приемлемых групп, которые могут образовывать пролекарства, включают, например, группы, раскрытые в Prog. Med., 5, 2157-2161 (1985) и в "Development of medicine" (Hirokawa Publishing Company, 1990) Vol. 7, Molecular Design p. 163-198.
[0065] Соединения общей формулы (1) настоящего изобретения, его фармацевтически приемлемые соли или сольваты (здесь и далее, они коллективно именуются как соединения настоящего изобретения) можно получить, используя различные известные способы синтеза, касающиеся введения заместителей или замены функциональных групп с использованием особенностей, основанных на основной структуре или на типах используемых заместителей.
[0066] Здесь и далее представлены примеры способов получения соединений настоящего изобретения. Однако способы получения соединений настоящего изобретения вовсе ими не ограничиваются.
[0067] Соединение общей формулы (1) можно получить, например, используя представленную ниже схему.
[0068]
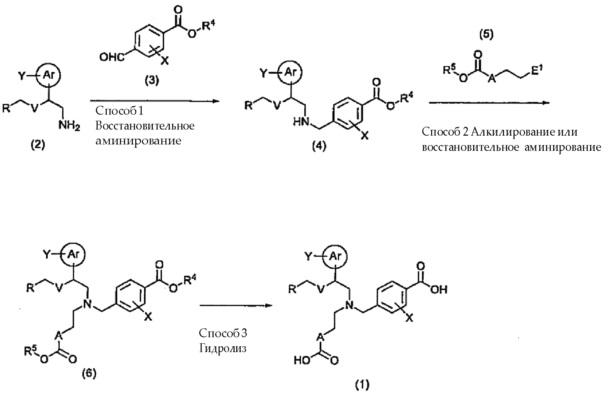
[0069] (где Ar, Y, R, V, X и A имеют указанные выше значения. Каждый из R4 и R5 представляет собой C1-C6 алкильную группу или бензильную группу. E1 представляет собой уходящую группу или формильную группу.)
[0070] В описании термин "уходящая группа" представляет собой группу, которая заменена в присутствии основания, или группу, содержащую активированный атом кислорода. Более конкретно, примеры уходящих групп включают атом галогена; тригалогенометилоксигруппы, такие как трихлорметилоксигруппа; низшие алкансульфонилоксигруппы, такие как метансульфонилоксигруппа и этансульфонилоксигруппа; галогенсодержащие низшие алкансульфонилоксигруппы, такие как трифторметансульфонилоксигруппа и пентафторэтансульфонилоксигруппа; и арилсульфонилоксигруппы, такие как бензолсульфонилоксигруппа, 4-толуолсульфонилоксигруппа и 4-нитробензолсульфонилоксигруппа.
[0071] Способ 1: Восстановительное аминирование
Соединение (2) и соединение (3) подвергают взаимодействию в отсутствии растворителя или в инертном растворителе, в отсутствии или в присутствии кислоты, получая вначале основание Шиффа, и затем осуществляя его реакцию в присутствии восстанавливающего агента, получая в результате соединение (4).
Количество используемого соединения (3) обычно составляет от 1 до 3 эквивалентов, и предпочтительно, от 1 до 1,5 эквивалентов в расчете на количество соединения (2). В качестве кислоты используют, например, неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота; или органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, метансульфоновая кислота и p-толуолсульфоновая кислота. Примеры используемых восстанавливающих агентов включают, например, боргидридные соединения, такие как комплекс боран-тетрагидрофуран, боргидрид натрия, цианоборгидрид натрия и триацетоксиборгидрид натрия; соединения алюминийгидридов, такие как литийалюминийгидрид; и водород в присутствии катализатора на основе переходного металла. Количество используемого восстанавливающего агента обычно составляет от 1 до 10 эквивалентов, и предпочтительно, от 1 до 5 эквивалентов в расчете на количество соединения (2). В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ и дихлорметан, простые эфиры, такие как диэтиловый эфир и тетрагидрофуран (здесь и далее, именуемый как ТГФ), сложные эфиры, такие как этилацетат, пропилацетат и бутилацетат, спирты, такие как метанол, этанол и 2-пропанол, или их смеси. Температура реакции обычно составляет от -78°C до 150°C, и предпочтительно, от 0°C до 60°C. Время реакции обычно составляет от 5 минут до 48 часов, и предпочтительно, от 30 минут до 24 часов.
[0072] Способ 2: Алкилирование или восстановительное аминирование
В случае если E1 представляет собой уходящую группу в соединении (5), соединение (4) и соединение (5) подвергают взаимодействию в отсутствии растворителя или в инертном растворителе в присутствии основания и, при необходимости, добавки до получения соединения (6). Количество используемого соединения (5) обычно составляет от 1 до 5 эквивалентов, и предпочтительно, от 1 до 3 эквивалентов в расчете на количество соединения (4). В качестве основания обычно используют, например, карбонат щелочного металла, гидрокарбонат щелочного металла, гидрид щелочного металла, алкоксид щелочного металла или органические амины, такие как триэтиламин, диизопропилэтиламин и пиридин. В качестве добавки используют, например, иодид щелочного металла, тетрабутиламмониевую соль, или катализаторы межфазного переноса, такие как краун-эфир. В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, нитрилы, такие как ацетонитрил, пропионитрил и бутиронитрил, галогенированные углеводороды, такие как хлороформ и дихлорметан, кетоны, такие как ацетон и метилэтилкетон, простые эфиры, такие как диэтиловый эфир и ТГФ, спирты, такие как метанол, этанол и 2-пропанол, амиды, такие как N,N-диметилформамид (здесь и далее, именуемый как ДМФ) и N,N-диметилацетамид (здесь и далее, именуемый как DMA), или их смеси. Температура реакции обычно составляет от -30°C до 150°C, и предпочтительно, 0°C до 100°C. Время реакции обычно составляет от 0,5 до 72 часов, и предпочтительно, 0,5 до 48 часов.
Кроме того, в случае если E1 представляет собой формильную группу в соединении (5), соединение (6) можно получить, используя способ, аналогичный способу 1, из соединения (4) и соединения (5).
[0073] Способ 3: Гидролиз
Соединение (6), полученное способом 2, подвергают де-этерификации, до получения соединения общей формулы (1). Процесс де-этерификации обычно осуществляют в соответствии с хорошо известными способами в области органической синтетической химии, в зависимости от типа сложноэфирной группы (CO2R4, CO2R5). Например, соединение общей формулы (1) можно получить, осуществляя реакцию гидролиза в присутствии основания.
В качестве основания используют, например, карбонат щелочного металла, гидроксид щелочного металла, гидроксид щелочноземельного металла или алкоксид щелочного металла. В качестве растворителя используют простые эфиры, такие как диэтиловый эфир и ТГФ, спирты, такие как метанол, этанол и 2-пропанол, воду или их смеси. Необходимо отметить, что в реакции гидролиза вода играет существенную роль. Температура реакции обычно составляет от 0°C до 150°C, и предпочтительно, от комнатной температуры до 80°C. Время реакции обычно составляет от 1 до 48 часов, и предпочтительно, от 3 до 24 часов.
[0074] Необходимо отметить, что оптически активные соединения общей формулы (1) можно получить, используя оптически активные соединения (2). Кроме того, оптически активные соединения общей формулы (1) можно получить, используя такие способы, как выделение с помощью ВЭЖХ с хиральной колонкой, получая соединение общей формулы (1).
[0075] Кроме того, соединение (2), соединение (3) и соединение (5) коммерчески доступны, или их можно получить, используя известные способы.
[0076] Необходимо отметить, что в случае, если V представляет собой -O-, соединение (2) можно получить, используя способ, представленный далее на схеме.
[0077]
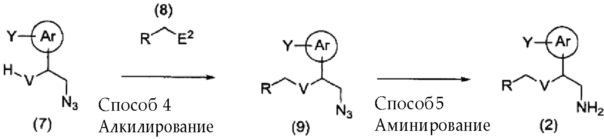
[0078] (где Ar, Y и R имеют указанные выше значения, и V в описании представляет собой -O-. E2 представляет собой уходящую группу).
[0079] Способ 4: Алкилирование
Соединение (9) можно получить, используя способ, аналогичный способу 2, из соединения (7) и соединения (8).
Необходимо отметить, что соединение (7) и соединение (8) коммерчески доступны, или их можно получить, используя известные способы синтеза.
[0080] Способ 5: Аминирование
Соединение (9), полученное способом 4, и фосфорорганическое соединение подвергают взаимодействию в отсутствии растворителя или в инертном растворителе в присутствии воды, получая в результате соединение (2).
Фосфорорганическими соединениями, которые используют, являются, например, трифенилфосфин, три-н-бутилфосфин или 1,2-бис(дифенилфосфино)этан. Количество используемого фосфорорганического соединения обычно составляет от 1 до 10 эквивалентов, и предпочтительно, от 1 до 5 эквивалентов в расчете на количество соединения (9). В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, нитрилы, такие как ацетонитрил, пропионитрил и бутиронитрил, галогенированные углеводороды, такие как хлороформ и дихлорметан, простые эфиры, такие как диэтиловый эфир и ТГФ, сложные эфиры, такие как этилацетат, пропилацетат и бутилацетат, амиды, такие как ДМФ и DMA, сульфоксиды, такие как диметилсульфоксид (здесь и далее, именуемый как ДМСО) и сульфолан, воду, или их смеси. Температура реакции обычно составляет от 0°C до 100°C, и предпочтительно, от 0°C до 60°C. Время реакции обычно составляет от 0,5 до 48 часов, и предпочтительно, от 1 до 24 часов.
[0081] Кроме того, соединение (4) можно получить, осуществляя взаимодействие соединения (9) и фосфорорганического соединения в отсутствии растворителя или в инертном растворителе, получая вначале иминофосфоран, и затем осуществляя его взаимодействие с соединением (3), получая основание Шиффа, и затем осуществляя реакцию восстановления основания в присутствии восстанавливающего средства.
В качестве фосфорорганического соединения используют, например, трифенилфосфин, три-н-бутилфосфин или 1,2-бис(дифенилфосфино)этан. Количество используемого фосфорорганического соединения обычно составляет от 1 до 10 эквивалентов, и предпочтительно, от 1 до 3 эквивалентов в расчете на количество соединения (9). Количество используемого соединения (3) обычно составляет от 1 до 3 эквивалентов, и предпочтительно, от 1 до 1,5 эквивалентов в расчете на количество соединения (9). Примеры используемых восстанавливающих агентов включают, например, боргидридные соединения, такие как комплекс боран-тетрагидрофуран, боргидрид натрия, цианоборгидрид натрия и триацетоксиборгидрид натрия; соединения алюминийгидридов, такие как литийалюминийгидрид; и водород в присутствии катализатора на основе переходного металла. Количество используемого восстанавливающего агента обычно составляет от 1 до 10 эквивалентов, и предпочтительно, от 1 до 5 эквивалентов в расчете на количество соединения (9). В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, галогенированные углеводороды, такие как хлороформ и дихлорметан, простые эфиры, такие как диэтиловый эфир и ТГФ, сложные эфиры, такие как этилацетат, пропилацетат и бутилацетат, спирты, такие как метанол, этанол и 2-пропанол, или их смеси. Температура реакции обычно составляет от -30°C до 100°C, и предпочтительно, от 0°C до 60°C. Время реакции обычно составляет от 1 до 48 часов, и предпочтительно, от 2 до 24 часов.
[0082] Кроме того, соединение (2), где V представляет собой -CH2-, можно получить, используя способ, представленный далее на схеме.
[0083]
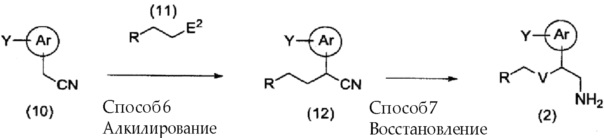
[0084] (где Ar, Y, R и E2 имеют указанные выше значения, и V здесь представляет собой -CH2-.)
[0085] Способ 6: Алкилирование
Соединение (12) можно получить, используя способ, аналогичный способу 2, из соединения (10) и соединения (11).
Необходимо отметить, что соединение (10) и соединение (11) коммерчески доступны, или их можно получить, используя известные способы синтеза.
[0086] Способ 7: Восстановление
Соединение (12), полученное способом 6, подвергают взаимодействию с восстанавливающим средством в инертном растворителе, получая в результате соединение (2).
В качестве восстанавливающего средства используют, например, соединения алюминийгидридов, такие как литийалюминийгидрид и натрийалюминийгидрид; боргидриные соединения, такие как литийтриэтилборгидрид; или комбинации таких металлических катализаторов, как никель Рэнея и палладий-на-угле, и водород. Количество используемого восстанавливающего средства обычно составляет от 1 до 10 эквивалентов, и предпочтительно, от 1 до 3 эквивалентов в расчете на количество соединения (12). В указанном способе можно при необходимости использовать кислоту или основание. В качестве кислоты можно использовать, например, неорганические кислоты, такие как хлористоводородная кислота и бромистоводородная кислота; или органические кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота. В качестве основания можно использовать, например, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метоксид лития, метоксид натрия, этоксид натрия, трет-бутоксид натрия и трет-бутоксид калия; или аммиак. В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, простые эфиры, такие как диэтиловый эфир и ТГФ, спирты, такие как метанол, этанол и 2-пропанол, амиды, такие как ДМФ и DMA, воду или их смеси. Температура реакции обычно составляет от -30°C до 100°C, и предпочтительно, от 0°C до 80°C. Время реакции обычно составляет от 30 минут до 48 часов, и предпочтительно, от 1 до 24 часов.
[0087] Кроме того, соединение (6), где Y представляет собой цианогруппу или метильную группу, получают, осуществляя взаимодействие соединения (6), где Y представляет собой группу хлора, с каждым из реагентов цианида или производного борной кислоты в отсутствии растворителя или в растворителе, в отсутствии или в присутствии палладиевого катализатора и основания, и его можно использовать в способе 3.
В качестве реагента цианида используют, например, цианид три-н-бутилолова, цианид цинка, цианид меди, цианид натрия или цианид калия. Количество используемого реагента цианида обычно составляет от 1 до 5 эквивалентов, и предпочтительно, от 1 до 2 эквивалентов в расчете на количество соединения (6). В качестве производного борной кислоты используют, например, метилбороновую кислоту, ангидрид метилбороновой кислоты или калийметилтрифторборат. Количество используемого производного борной кислоты обычно составляет от 1 до 5 эквивалентов, и предпочтительно, от 1 до 3 эквивалентов в расчете на количество соединения (6). Используемый палладиевый катализатор конкретно не ограничен, если его обычно используют в реакции получения углерод-углеродной связи, и представляет собой, например, тетракис(трифенилфосфин)палладий(0), бис[1,2-бис(дифенилфосфино)этан]палладий(0), трис(дибензилиденацетон)дипалладий(0), бис(три-трет-бутилфосфин)палладий(0), ацетат палладия(II), дихлорбис(трифенилфосфин)палладий(II) или аддукт дихлорбис[метиленбис(дифенилфосфин)]дипалладий-дихлорметана. Фосфорсодержащий лиганд, который может быть скоординирован с палладиевым катализатором, можно использовать при необходимости в указанном способе. В качестве фосфорсодержащего лиганда используют, например, трифенилфосфин, три-o-толилфосфин, три-трет-бутилфосфин, 1,3-бис(дифенилфосфино)пропан, 1,1'-бис(дифенилфосфино)ферроцен, 2-(дициклогексилфосфино)-2',6'-диметокси 1,1'-бифенил, 2-(дициклогексилфосфино)-2',4',6'-три-изопропил-1,1'-бифенил или 2-(дициклогексилфосфино)-3,6,-диметокси-2',4',6'-триизопропил-1,1'-бифенил. В качестве основания используют, например, карбонат щелочного металла, гидрокарбонат щелочного металла, триэтиламинфосфат щелочного металла, или органические амины, такие как триэтиламин, диизопропилэтиламин и пиридин. В таком способе при необходимости можно использовать соли металлов в качестве катализаторов. В качестве солей металлов используют, например, соли меди, такие как хлорид меди(I), бромид меди(I), иодид меди(I), хлорид меди(II), бромид меди(II) и иодид меди(II), В качестве растворителя используют, например, ароматические углеводороды, такие как бензол и толуол, нитрилы, такие как ацетонитрил, пропионитрил и бутиронитрил, галогенированные углеводороды, такие как хлороформ и дихлорметан, кетоны, простые эфиры, такие как диэтиловый эфир, ТГФ и 1,4-диоксан, спирты, такие как метанол, этанол и 2-пропанол, амиды, такие как ДМФ, н-метил-2-пирролидон и DMA, или их смеси. Температура реакции обычно составляет от 0°C до 200°C, и предпочтительно, от 50°C до 180°C. Время реакции обычно составляет от 30 минут до 48 часов, и предпочтительно, от 1 до 24 часов.
[0088] Полученные таким образом соединения настоящего изобретения проявляют превосходный гемнезависимый эффект активации sGC, как показано в представленных далее тестовых примерах. Соответственно, соединения настоящего изобретения можно использовать в качестве лекарственных средств для профилактики или лечения заболеваний, в которых участвуют sGC, у животных, включая человека, особенно различных заболеваний при которых эффективна активация sGC. Примеры таких заболеваний включают сердечную недостаточность, гипертонию, легочную гипертонию или ишемическую болезнь сердца.
[0089] В случае, если соединения настоящего изобретения используют в качестве лекарственного средства, их можно вводить перорально или парэнтерально. Дозу соединения настоящего изобретения удобно определять индивидуально с учетом подлежащей лечению болезни или симптомов, возраста, массы тела или пола субъекта, которому предстоит такое введение. Доза соединения настоящего изобретения в день для взрослого пациента (массой около 60 кг) в случае перорального введения обычно составляет от 1 до 1000 мг, предпочтительно, от 3 до 300 мг, и более предпочтительно, от 10 до 200 мг, которую вводят сразу, или от 2 до 4 раз. Кроме того, дневная доза для взрослого пациента в случае внутривенного введения обычно составляет от 0,01 до 100 мг, предпочтительно, от 0,01 до 50 мг и более предпочтительно, от 0,01 до 20 мг на 1 кг массы тела, которую вводят один раз, или в виде множества доз.
[0090] Фармацевтическую композицию настоящего изобретения можно получить обычными способами, используя один или более из типов соединений настоящего изобретения и фармацевтически приемлемую добавку.
[0091] Примеры фармацевтических композиций настоящего изобретения для перорального введения включают таблетки, пилюли, капсулы, гранулы, порошки, эмульсии, растворы, суспензии, сиропы, или эликсиры. Их обычно получают в виде фармацевтических композиций, смешивая один или более из типов соединений настоящего изобретения и добавки, такие как фармацевтически приемлемые разбавители, эксципиенты и носители. Кроме того, фармацевтические композиции настоящего изобретения для перорального введения могут содержать добавки, такие как связующие, разрыхлители, смазывающие средства, способствующие набуханию средства, кроющие средства, пластификаторы, стабилизаторы, консерванты, антиоксиданты, красители солюбилизаторы, суспендирующие средства, эмульгаторы, подсластители, консерванты, буферные средства и увлажнители.
Примеры фармацевтических композиций настоящего изобретения для парэнтерального введения включают препараты для инъекций, суппозитории, глазные капли, препараты для ингаляций, мази, гели, кремы и пластыри. Обычно их получают в виде фармацевтических композиций путем смешивания одного или более из типов соединений настоящего изобретения с добавками, такими как фармацевтически приемлемые разбавители, эксципиенты и носители.
Кроме того, фармацевтические композиции настоящего изобретения для парэнтерального введение могут содержать такие добавки, как стабилизаторы, консерванты, солюбилизирующие средства, увлажнители, консерванты, антиоксиданты, вкусовые вещества, желирующие вещества, нейтрализаторы, буферы, регулирующие изотоничность вещества, поверхностно активные вещества, красители, загустители, увлажнители, наполнители, промотеры абсорбции, суспендирующие вещества и связующие.
Кроме того, фармацевтические композиции, содержащие соединения настоящего изобретения, могут содержать другие медицинские ингредиенты, такие как диуретики, при условии, что они не вступают в конфликт с соединениями настоящего изобретения.
ПРИМЕРЫ
[0092] Здесь и далее, настоящее изобретение более конкретно разъясняется на примерах, но настоящее изобретение ими не ограничивается.
[0093] Соединение сравнительного примера 1
2-азидо-1-(5-метилтиофен-2-ил)этанон
2-бром-1-(5-метилтиофен-2-ил)этанон (1,19 г) растворяют в ацетоне (5,0 мл), и добавляют азид натрия (414 мг) и воду (2,5 мл), и реакционный раствор перемешивают при комнатной температуре в течение 1,25 часа. Растворитель выпаривают при пониженном давлении, и полученный остаток экстрагируют диэтиловым эфиром. Полученный остаток промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 6 до 40% этилацетат/гексан), получая указанное в заголовке соединение (753 мг) в виде масла желтого цвета.
1H-ЯМР(CDCl3) δ: 7,54 (1H, д, J=3,7 Гц), 6,84 (1H, д, J=3,7 Гц), 4,39 (2H, с), 2,56(3H, с).
[0094] Соединение сравнительного примера 2
2-азидо-1-(5-хлортиофен-2-ил)этанон
Указанное в заголовке соединение (446 мг) получают в виде порошка оранжевого цвета из 2-бром-1-(5-хлор-2-тиенил)этанона (718 мг) способом, аналогичным способу сравнительного примера 1.
1H-ЯМР(CDCl3) δ: 7,52 (1H, д, J=4,2 Гц), 7,00 (1H, д, J=4,2 Гц), 4,38 (2H, с).
[0095] Соединение сравнительного примера 3
2-азидо-1-(5-метилтиофен-2-ил)этанол
Соединение сравнительного примера 1 (736 мг) растворяют в метаноле (12,0 мл), и добавляют боргидрид натрия (178 мг) при охлаждении льдом, и реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Добавляют насыщенный водный раствор аммонийхлорида, и реакционный раствор перемешивают, затем растворитель выпаривают при пониженном давлении, и полученный остаток экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 2 до 22% этилацетат/гексан), получая указанное в заголовке соединение (774 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 6,82 (1H, д, J=3,5 Гц), 6,66-6,61 (1H, м), 5,03 (1H, дт, J=7,1, 4,2 Гц), 3,57 (1H, дд, J=12,5, 7,1 Гц), 3,51 (1H, дд, J=12,5, 4,2 Гц), 2,47 (3H, с), 2,35 (1H, д, J=4,2 Гц).
[0096] Соединение сравнительного примера 4
2-азидо-1-(5-хлортиофен-2-ил)этанол
Указанное в заголовке соединение (444 мг) получают в виде масла оранжевого цвета из соединения сравнительного примера 2 (440 мг) способом, аналогичным способу сравнительного примера 3.
1H-ЯМР(CDCl3) δ: 6,83-6,78 (2H, м), 5,07-4,95 (1H, м), 3,55 (1H, с),3,53 (1H, с), 2,51 (1H, д, J=4,2 Гц).
[0097] Соединение сравнительного примера 5
Этил-5-бром-2,2-диметилвалерат
Этил-изобутират (2,32 г) растворяют в ТГФ (25,0 мл), и по каплям добавляют 1 моль/л литийдиизопропиламид (21 мл) при -78°C, и реакционный раствор перемешивают при той же самой температуре в течение 30 минут. По каплям добавляют ТГФ раствор 1,3-дибромпропана (2,24 мл) при той же температуре, и реакционный раствор перемешивают в течение 1 часа, и затем перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор гасят насыщенным водным раствором аммонийхлорида, и экстрагируют этилацетатом. Объединенные органические слои промывают водой и солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают перегонкой при пониженном давлении (0,15 Па, 42-43°C), получая указанное в заголовке соединение (3,55 г) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 4,12 (2H, кв, J=7,1 Гц), 3,38 (2H, т, J=6,6 Гц), 1,86-1,62 (4H, м), 1,25 (3H, т, J=7,1 Гц), 1,18 (6H, с).
[0098] Соединение сравнительного примера 6
Этил-1-(3-бромпропил)циклобутанкарбоксилат
Указанное в заголовке соединение (3,09 г) получают в виде бесцветного масла из этил циклобутанкарбоксилата (2,56 г) способом, аналогичным способу сравнительного примера 5.
1H-ЯМР(CDCl3) δ: 4,15 (2H, кв, J=7,0 Гц), 3,40 (2H, т, J=6,5 Гц), 2,49-2,34 (2H, м), 1,95-1,84 (6H, м), 1,80-1,71 (2H, м),1,27 (3H, т, J=7,0 Гц).
[0099] Соединение сравнительного примера 7
Бензил-5-гидрокси-3,3-диметилвалерат
Монобензил-3,3-диметилглутарат (200 мг) растворяют в ТГФ (4,0 мл), и по каплям добавляют раствор 0,9 моль/л боран-тетрагидрофуран/ТГФ (1,6 мл), и реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор гасят насыщенным водным раствором бикарбоната натрия при охлаждении льдом, и экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (от 30 до 60% этилацетат/гексан), получая указанное в заголовке соединение (183 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,37-7,31 (5H, м), 5,11 (2H, с), 3,76-3,70 (2H, м), 2,35 (2H, с), 1,63 (2H, т, J=6,9 Гц), 1,03(6H, с).
[0100] Соединение сравнительного примера 8
Бензил-3,3-диметил-5-оксовалерат
Соединение сравнительного примера 7 (500 мг) растворяют в дихлорметане (11,0 мл), и при охлаждении льдом добавляют периодинан Десс-Мартина (987 мг), и реакционный раствор перемешивают при той же самой температуре в течение 1 часа. Реакционный раствор очищают, используя хроматографическую колонку с силикагелем (с 10 до 30% этилацетат/гексан), получая указанное в заголовке соединение (491 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 9,81 (1H, т, J=2,5 Гц), 7,40-7,30(5H, м), 5,11 (2H, с), 2,49 (2H, д, J=2,5 Гц), 2,45 (2H, с), 1,15(6H, с).
[0101] Соединение сравнительного примера 9
Метил-5-(2-фенилэтил)тиофен-2-карбоксилат
Метил-5-(2-фенилэтенил)тиофен-2-карбоксилат (830 мг) растворяют в смешанном растворе метанола и ТГФ (4:1, 25,0 мл), добавляют 5% палладий-на-угле (STD тип) (124 мг), и реакционный раствор перемешивают при нормальном давлении и при комнатной температуре в атмосфере водорода в течение 18 часов. Реакционный раствор фильтруют через целит, промывают метанолом, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 5 до 20% этилацетат/гексан), получая указанное в заголовке соединение (831 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,61 (1H, д, J=3,8 Гц), 7,32-7,16 (5H, м), 6,74 (1H, д, J=3,8 Гц), 3,86(3H, с), 3,18-3,11 (2H, м), 3,03-2,96 (2H, м).
[0102] Соединение сравнительного примера 10
Этил-4-(2-циклопентилэтинил)бензоат
Этил-4-иодобензоат (1,00 г) растворяют в ДМФ (18,0 мл), и последовательно добавляют циклопентилацетилен (933 мкл), триэтиламин (1,51 мл), иодид меди(I) (34,5 мг) и бис(трифенилфосфин)палладий(II)хлорид (254 мг), и реакционный раствор перемешивают при комнатной температуре в атмосфере аргона в течение 1,5 часа. Растворитель выпаривают при пониженном давлении, и полученный остаток суспендируют в диизопропиловом эфире и фильтруют через целит, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (от 1 до 6% этилацетат/гексан), получая указанное в заголовке соединение (1,07 г) в виде порошка коричневого цвета.
1H-ЯМР(CDCl3) δ: 7,95 (2H, д, J=8,2 Гц), 7,43 (2H, д, J=8,2 Гц), 4,37 (2H, кв, J=7,1 Гц), 2,91-2,77 (1H, м), 2,09-1,92 (2H, м), 1,86-1,53 (6H, м), 1,39 (3H, т, J=7,1 Гц).
[0103] Соединения сравнительных примеров 11 и 12, полученные способом, аналогичным способу сравнительного примера 10, с использованием соответствующих исходных материалов, представлены в таблице 1.
[0104] 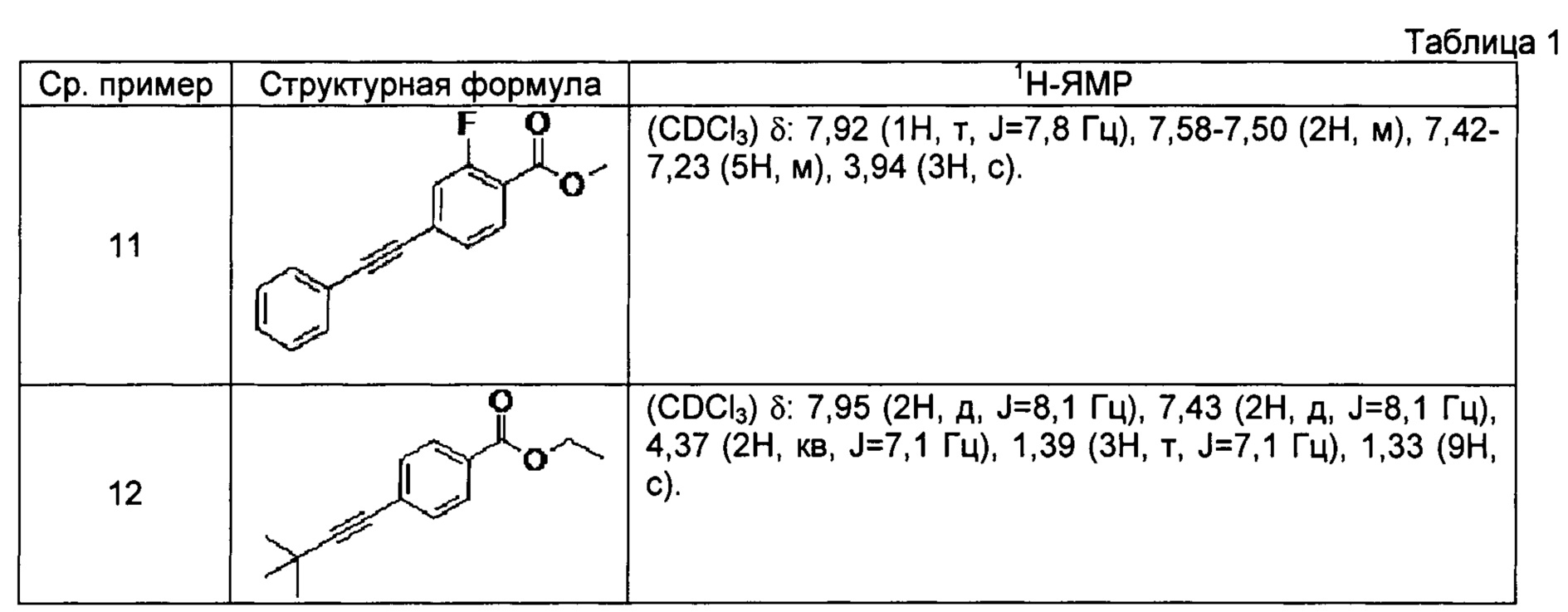
[0105] Соединение сравнительного примера 13
Этил-4-(2-циклопентилэтил)бензоат
Соединение сравнительного примера 10 (990 мг) растворяют в метаноле (16,0 мл), добавляют 5% палладий-на-угле (STD тип) (990 мг), и реакционный раствор перемешивают при нормальном давлении и при комнатной температуре в атмосфере водорода в течение 3 часов. Реакционный раствор фильтруют через целит, промывают метанолом, затем растворитель выпаривают при пониженном давлении. Полученный остаток разбавляют этилацетатом, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении, получая указанное в заголовке соединение в виде сырого продукта (масло желтого цвета).
1H-ЯМР(CDCl3)δ: 7,95 (2H, д, J=8,2 Гц), 7,24 (2H, д, J=8,2 Гц), 4,36 (2H, кв, J=7,1 Гц), 2,74-2,58 (2H, м), 1,78-1,12 (14H, м).
[0106] Соединения сравнительных примеров 14-18, полученные способом, аналогичным способу сравнительного примера 13, с использованием соответствующих исходных материалов или соединений сравнительных примеров 11 и 12, представлены в таблице 2.
[0107]
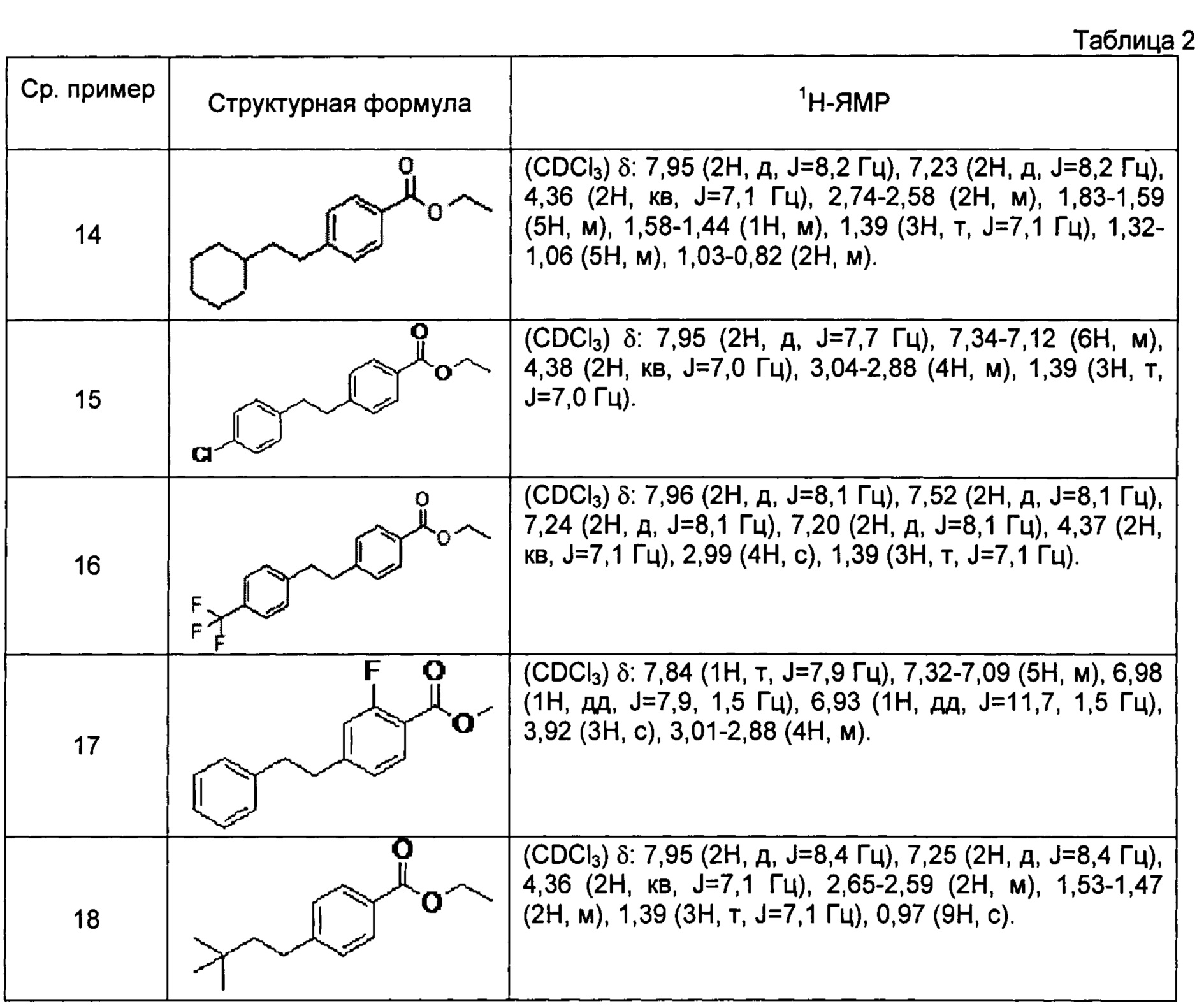
[0108] Соединение сравнительного примера 19
Метил-4-(4-трет-бутилфенил)-2-фторбензоат
Метил-2-фтор-4-иодобензоат (505 мг) растворяют в диметоксиэтане (4,0 мл) и добавляют последовательно 4-трет-бутилфенилбороновую кислоту (385 мг), бис(трифенилфосфин)палладий(II)хлорид (63,3 мг) и безводный карбонат натрия (430 мг) при комнатной температуре в атмосфере аргона, и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 4,66 часа. Реакционный раствор охлаждают до комнатной температуры, и затем растворитель выпаривают при пониженном давлении. Полученный остаток суспендируют в хлороформе и фильтруют через целит, затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (от 1 до 10% этилацетат/гексан), получая указанное в заголовке соединение (421 мг) в виде твердого вещества бледно желтого цвета.
1H-ЯМР(CDCl3) δ: 7,99 (1H, т, J=7,9 Гц), 7,56 (2H, д, J=8,5 Гц), 7,49 (2H, д, J=8,5 Гц), 7,43 (1H, дд, J=7,9, 1,6 Гц), 7,36 (1H, дд, J=12,1, 1,6 Гц), 3,95 (3H, с), 1,36(9H, с).
[0109] Соединение сравнительного примера 20:
Метил-4-(4-хлорфенилокси)-2-фторбензоат
4-хлорфенол (200 мг) растворяют в дихлорметане (16,0 мл), и при охлаждении льдом, добавляют [3-фтор-4-(метоксикарбонил)фенил]бороновую кислоту (400 мг), триэтиламин (1,08 мл) и ацетат меди(II) (282 мг), и реакционный раствор перемешивают при комнатной температуре в течение 2,5 часа. Растворитель выпаривают при пониженном давлении, полученный остаток суспендируют в этилацетате и фильтруют через целит, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 2 до 8% этилацетат/гексан), получая указанное в заголовке соединение (130 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,92 (1H, т, J=8,6 Гц), 7,38 (2H, д, J=9,0 Гц), 7,02 (2H, д, J=9,0 Гц), 6,76 (1H, дд, J=8,6, 2,4 Гц), 6,67 (1H, дд, J=11,9, 2,4 Гц), 3,91(3H, с).
[0110] Соединение сравнительного примера 21
[5-(2-фенилэтил)тиофен-2-ил]метиловый спирт
К суспензии литийалюминийгидрида (206 мг) в ТГФ (30,0 мл), по каплям добавляют ТГФ раствор (12,0 мл) соединения сравнительного примера 9 (2,06 г) при охлаждении льдом, и реакционный раствор перемешивают при той же самой температуре в течение 1 часа. Порциями добавляют 10-гидрат сульфата натрия при той же температуре, и затем реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор фильтруют через целит, промывают этилацетатом, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 15 до 30% этилацетат/гексан), получая указанное в заголовке соединение (1,58 г) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,32-7,25 (2H, м), 7,25-7,17 (3H, м), 6,81 (1H, д, J=3,5 Гц), 6,62 (1H, д, J=3,5 Гц), 4,75 (2H, д, J=6,0 Гц), 3,15-3,06 (2H, м), 3,02-2,93 (2H, м),1,67 (1H, т, J=6,0Гц).
[0111] Соединения сравнительных примеров 22-29, полученные способом, аналогичным способу сравнительного примера 21, с использованием соединений сравнительных примеров 13-20, представлены в таблице 3.
[0112]
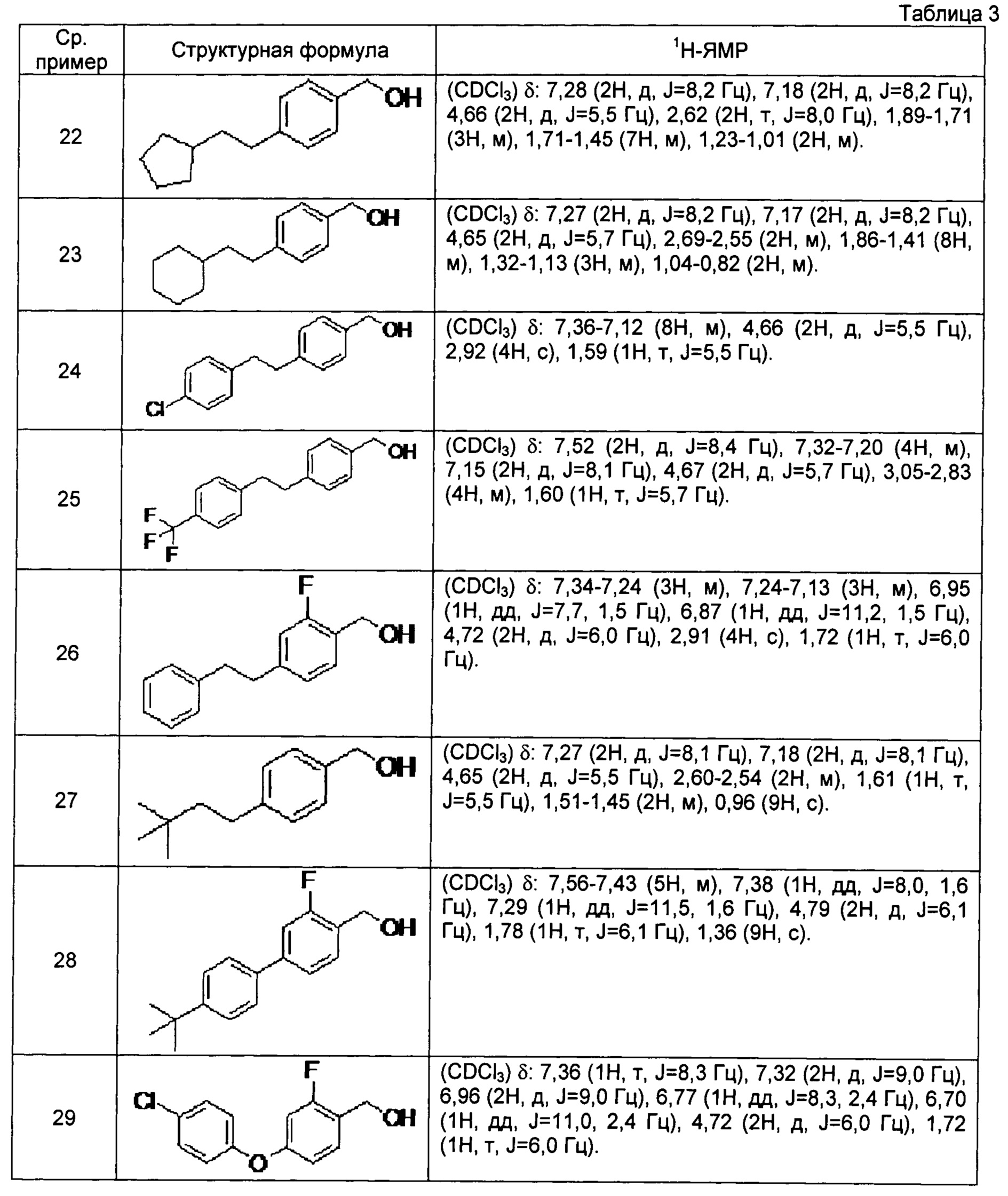
[0113] Соединение сравнительного примера 30
(2-трет-бутил-1,3-тиазол-5-ил)метанол
2-трет-бутил-1,3-тиазол-5-карбальдегид (535 мг) растворяют в метаноле (15,0 мл), при охлаждении льдом добавляют боргидрид натрия (132 мг), и реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Добавляют насыщенный водный раствор аммонийхлорида, реакционный раствор перемешивают, и затем растворитель выпаривают при пониженном давлении, а полученный остаток экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 5 до 50% этилацетат/гексан), получая указанное в заголовке соединение (467 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,53 (1H, с), 4,83 (2H, дд, J=6,0, 0,6 Гц), 1,82 (1H, т, J=6,0 Гц), 1,43(9H, с).
[0114] Соединение сравнительного примера 31
[5-(4-метилфенилокси)тиофен-2-ил]метанол
Указанное в заголовке соединение (391 мг) получают в виде бесцветного масла из 5-(4-метилфенилокси)тиофен-2-карбальдегида (375 мг) способом, аналогичным способу сравнительного примера 30.
1H-ЯМР(CDCl3) δ: 7,12 (2H, д, J=8,8 Гц), 6,99 (2H, д, J=8,8 Гц), 6,71 (1H, дт, J=3,8, 0,8 Гц), 6,35 (1H, д, J=3,8 Гц), 4,70 (2H, дд, J=6,0, 0,8 Гц), 2,32 (3H, с), 1,70 (1H, т, J=6,0 Гц).
[0115] Соединение сравнительного примера 32
(6-циклопропилбензо[b]тиофен-2-ил)метанол
(6-бромбензо[b]тиофен-2-ил)метанол (500 мг) растворяют в толуоле (9,0 мл) и воде (1,0 мл), и последовательно добавляют циклопропилтрифторборат калия (457 мг), карбонат калия (853 мг), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (196 мг) и ацетат палладия (46 мг) в атмосфере аргона, и реакционный раствор перемешивают при 100°C в течение 19 часов. Реакционный раствор охлаждают до комнатной температуры, фильтруют через целит, и промывают этилацетатом, и затем полученный фильтрат разбавляют водой и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с амино-функционализированным силикагелем (с 20 до 40% этилацетат/гексан), получая указанное в заголовке соединение (223 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,59 (1H, д, J=8,2 Гц), 7,52 (1H, д, J=0,7 Гц), 7,14 (1H, д, J=0,7 Гц), 7,06 (1H, дд, J=8,2, 1,5 Гц), 4,89 (2H, д, Гц), 2,05-1,95 (1H, м),1,87 (1H, т, J=5,5 Гц), 1,03-0,93 (2H, м), 0,77-0,67 (2H, м).
[0116] Соединение сравнительного примера 33
[5-(2-фенилэтил)-2-хлорметил]тиофен
Соединение сравнительного примера 21 (327 мг) растворяют в дихлорметане (8,0 мл), добавляют тионилхлорид (129 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Растворитель и реагенты выпаривают при пониженном давлении, получая указанное в заголовке соединение в виде сырого продукта (масло бледно-пурпурного цвета).
1H-ЯМР(C6D6) δ: 6,77-6,63 (3H, м), 6,57-6,50 (2H, м), 6,08 (1H, д, J=3,5 Гц), 5,87 (1H, д, J=3,5 Гц), 3,83 (2H, с), 2,40-2,26 (4H, м).
[0117] Соединения сравнительных примеров 34-41, полученные способом, аналогичным способу сравнительного примера 33, с использованием соединений сравнительных примеров 22-29, представлены в таблице 4.
[0118]
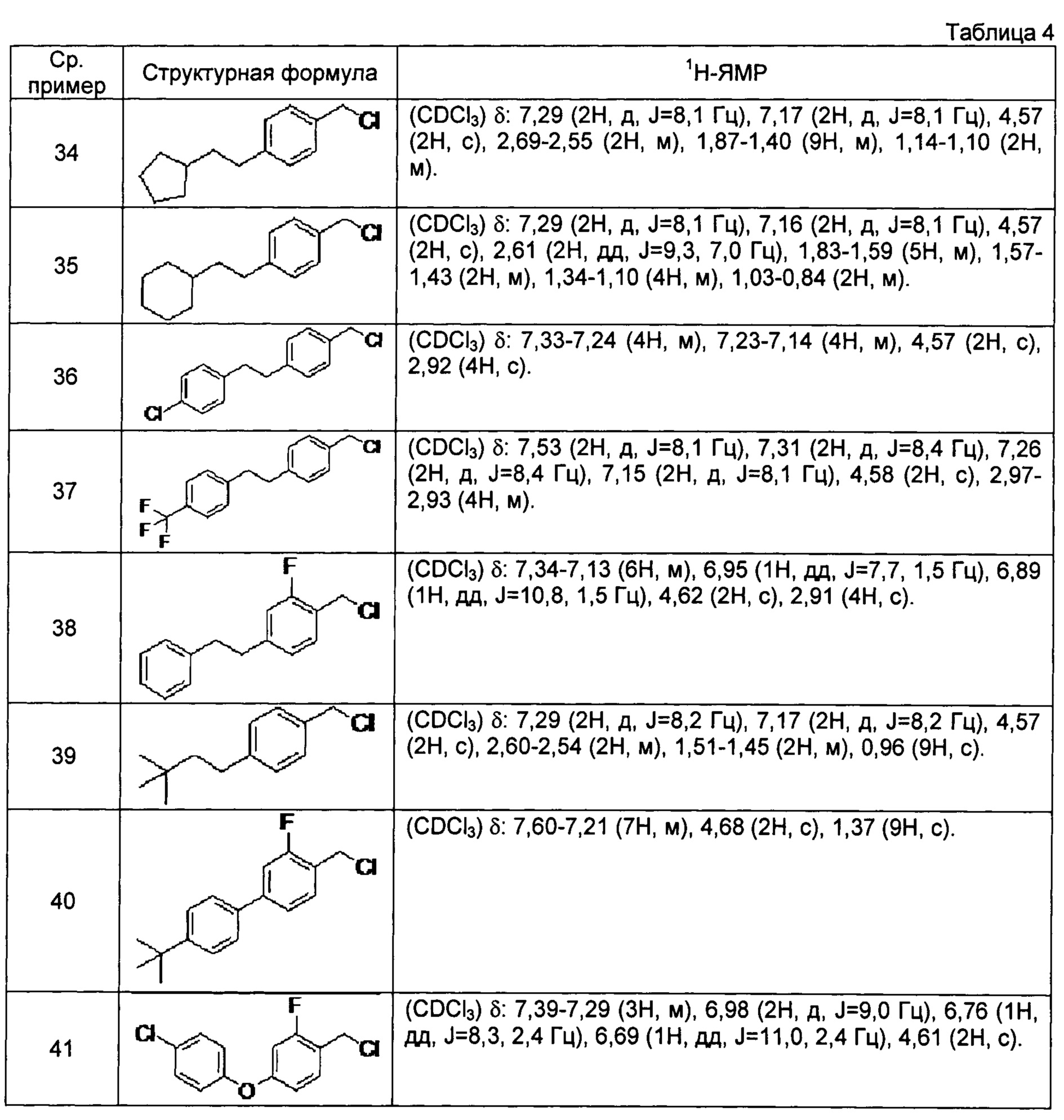
[0119] Соединение сравнительного примера 42
5-бромметил-2-трет-бутилтиазол
Соединение сравнительного примера 30 (375 мг) растворяют в дихлорметане (7,0 мл), и добавляют трифенилфосфин (603 мг) и четырехбромистый углерод (762 мг) при охлаждении льдом, и реакционный раствор перемешивают при комнатной температуре в течение 1,16 часа. Растворитель выпаривают при пониженном давлении, и полученный остаток экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 0 до 5% этилацетат/гексан), получая указанное в заголовке соединение (465 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,60 (1H, с), 4,69 (2H, с), 1,43 (9H, с).
[0120] Соединение сравнительного примера 43
2-азидо-1-фенилэтил-4-трет-бутилбензиловый эфир
2-азидо-1-фенилэтанол (362 мг) растворяют в ДМФ (11 мл), при охлаждении льдом добавляют гидрид натрия (133 мг), и реакционный раствор перемешивают при той же самой температуре в течение 30 минут. 4-Трет-бутилбензилбромид (756 мг) добавляют при той же температуре, и реакционный раствор перемешивают при комнатной температуре в течение 1,25 часов. Реакционный раствор гасят водой, и экстрагируют диэтиловым эфиром. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 0 до 2% этилацетат/гексан), получая указанное в заголовке соединение (606 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,43-7,24 (9H, м), 4,58 (1H, дд, J=8,6, 3,7 Гц), 4,51 (1H, д, J=11,5 Гц), 4,36 (1H, д, J=11,5 Гц), 3,56 (1H, дд, J=12,9, 8,6 Гц), 3,19 (1H, дд, J=12,9, 3,7 Гц), 1,32 (9H,с).
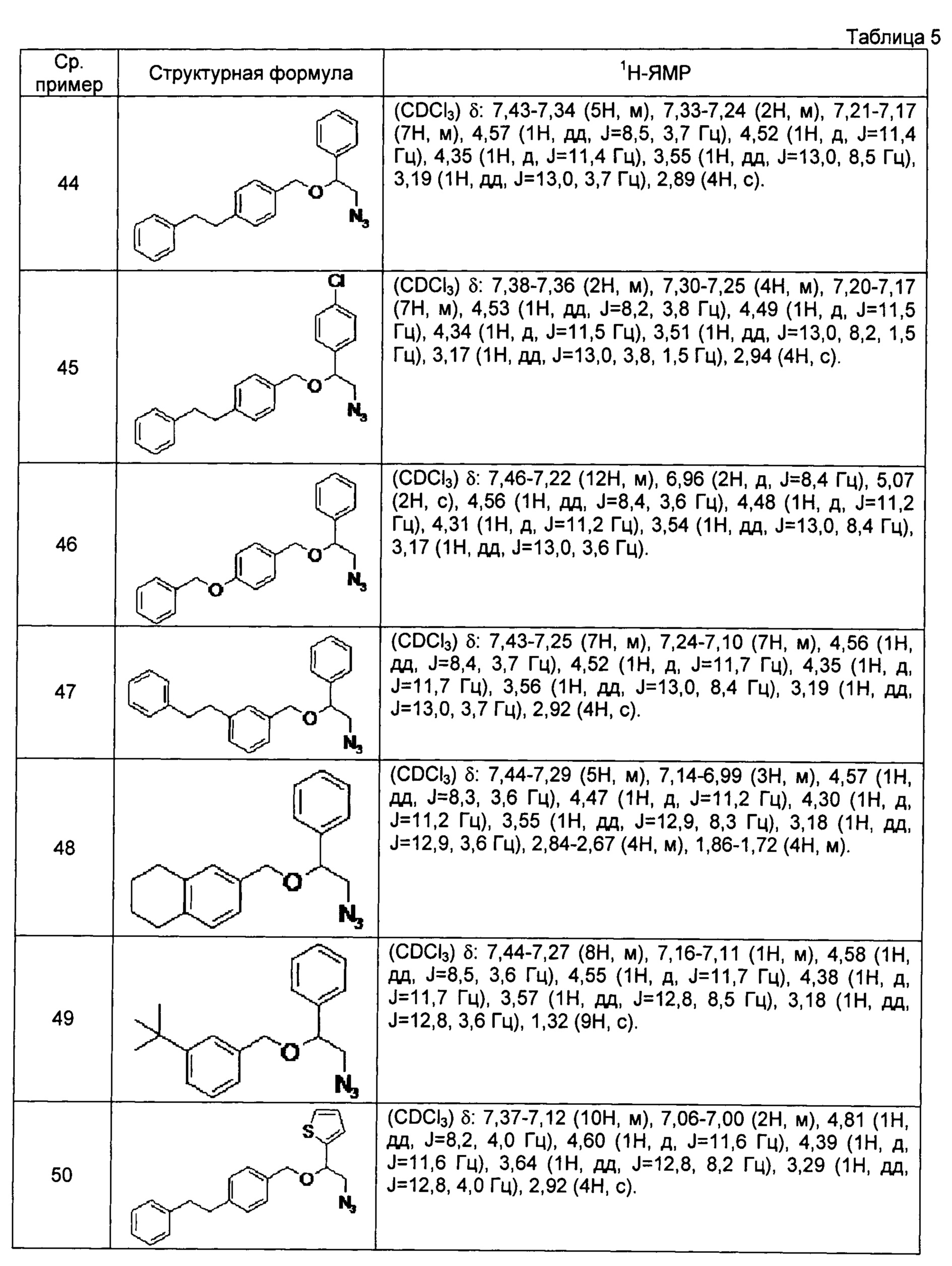
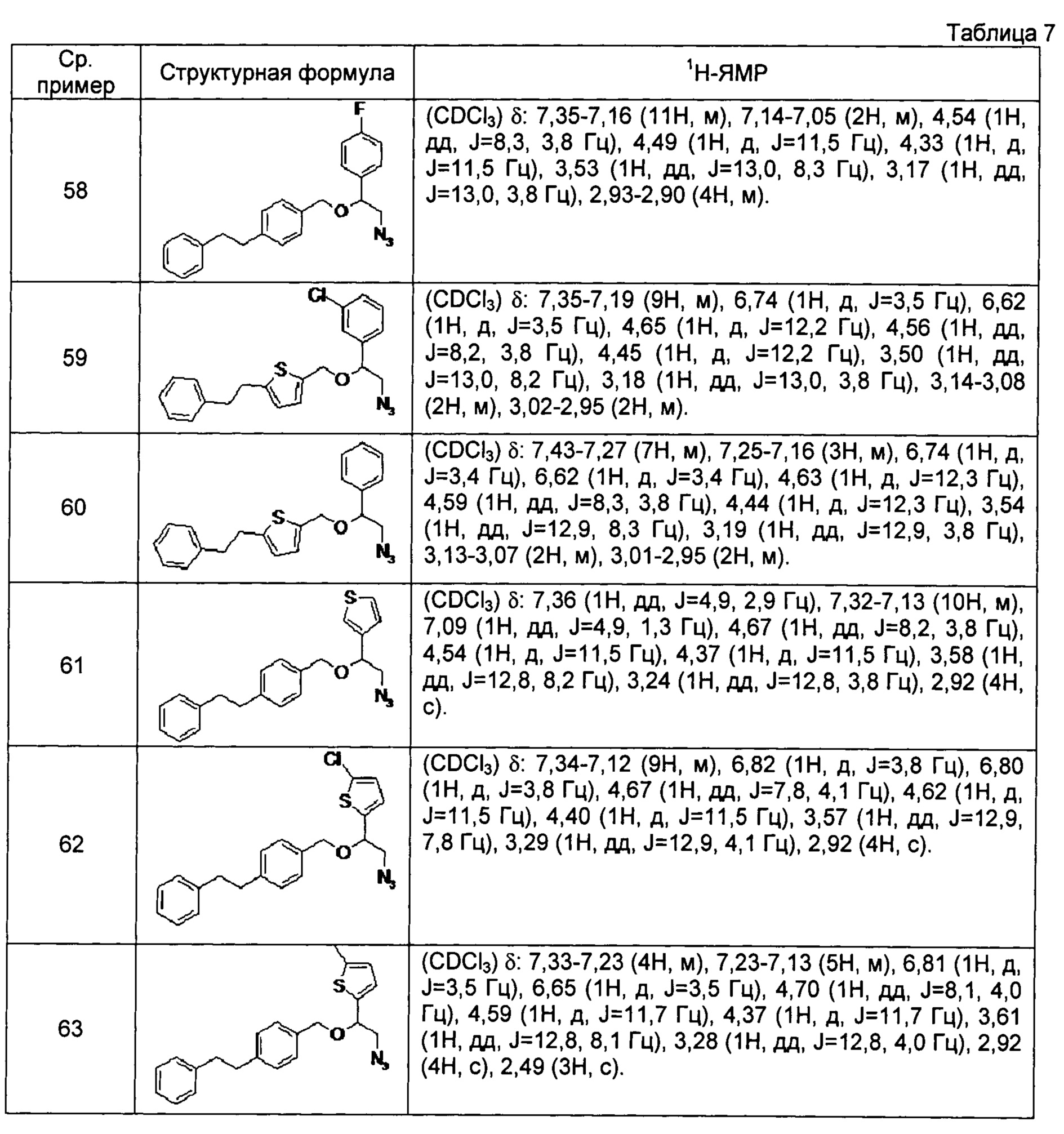
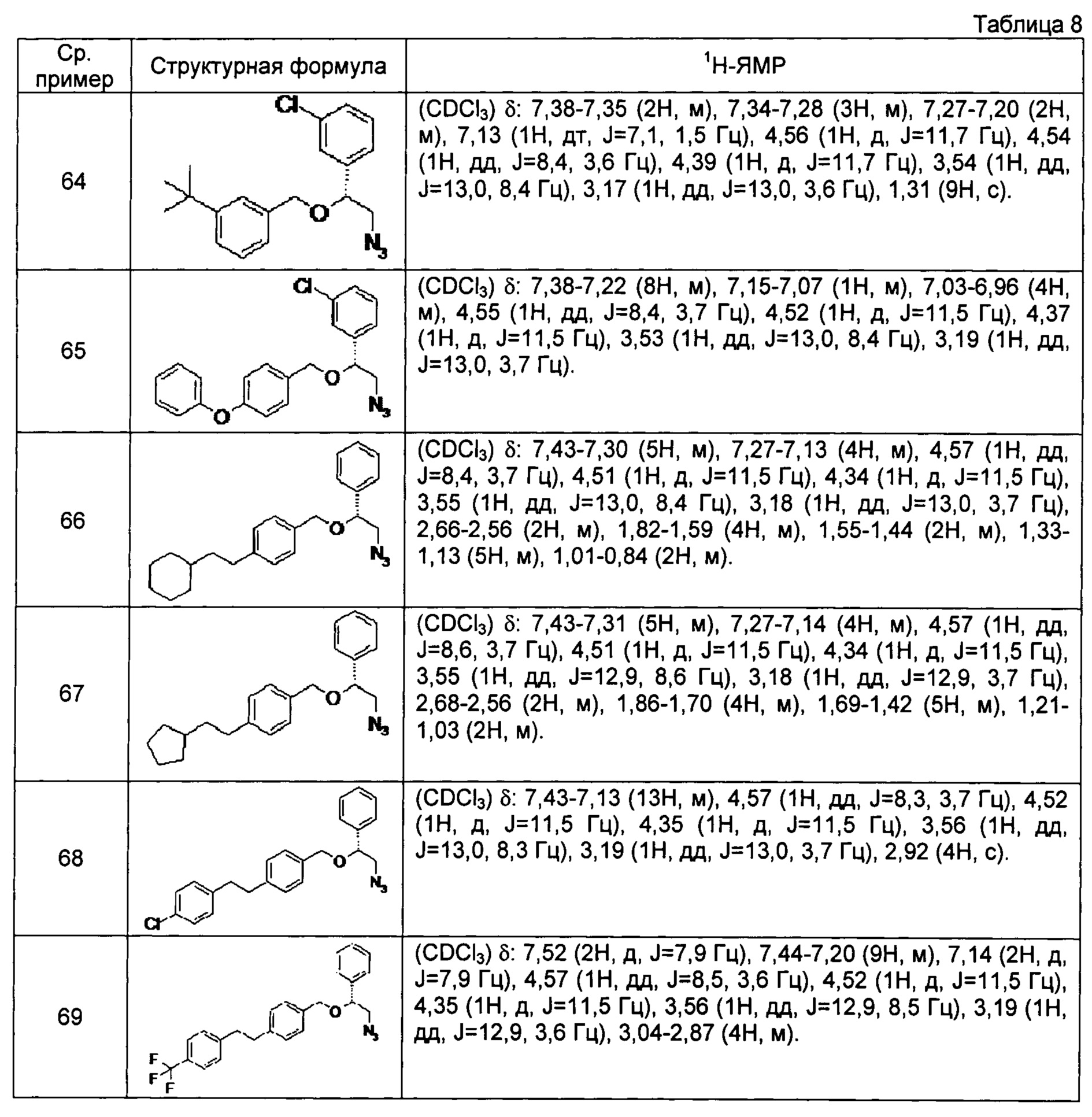
[0121] Соединения сравнительных примеров 44-81, полученные способом, аналогичным способу сравнительного примера 43, с использованием соответствующих исходных материалов или соединений сравнительных примеров, представлены в таблицах 5-10.
[0122]
[0123]
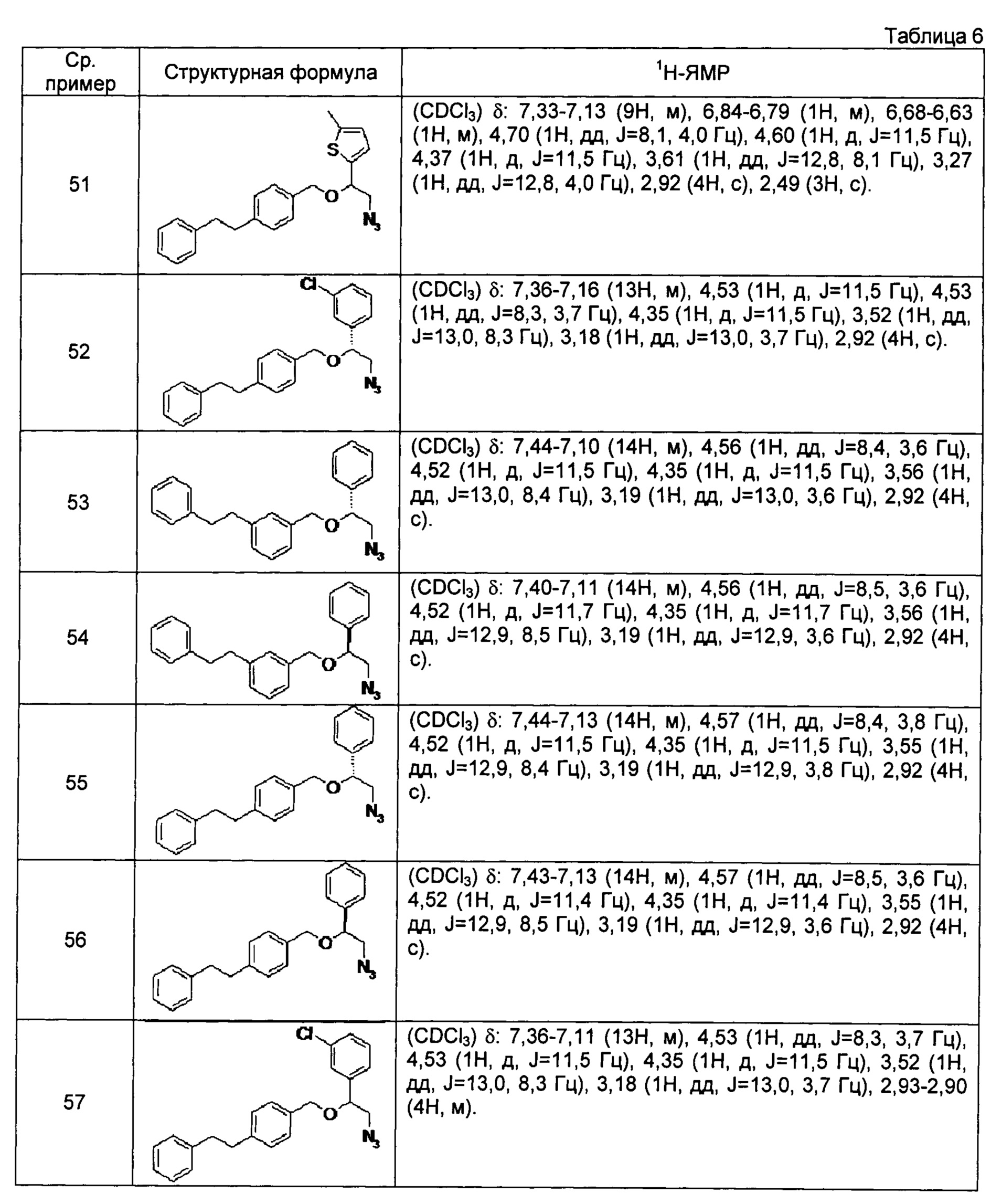
[0124]
 [0125]
[0125]
 [0126]
[0126]
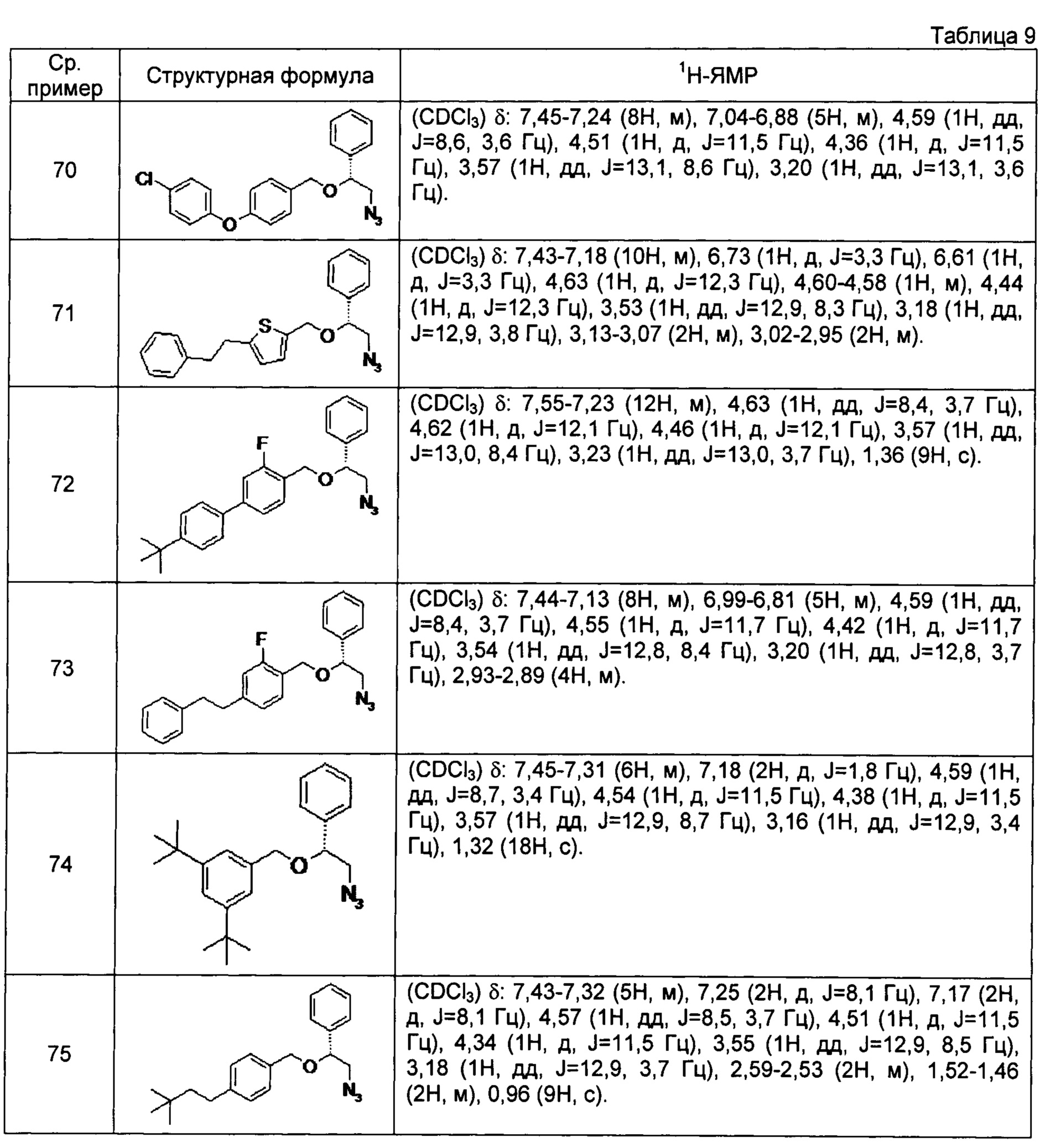 [0127]
[0127]
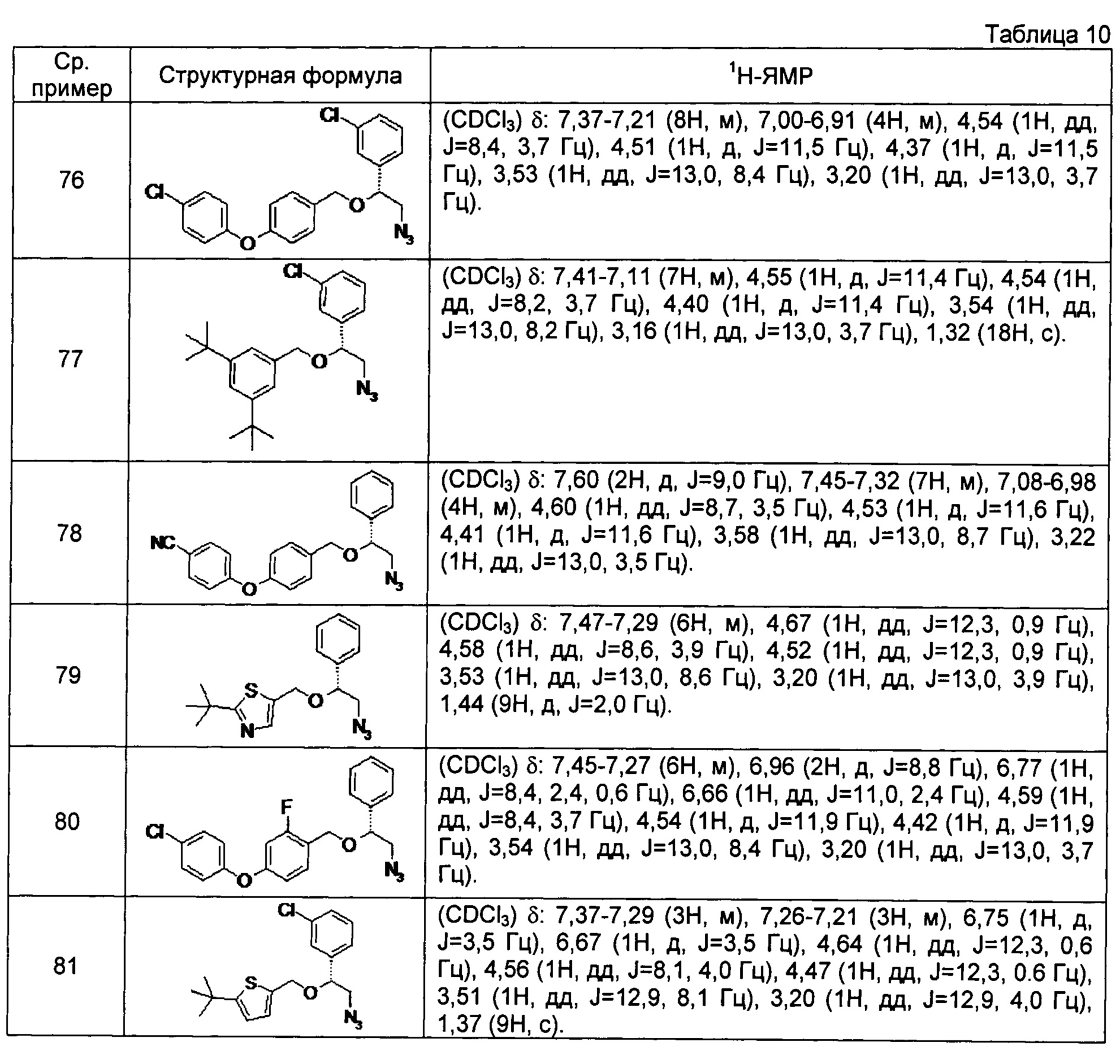
[0128] Соединение сравнительного примера 82
(1R)-2-азидо-1-(3-хлорфенил)этил-6-циклопропилбензо[b]тиофен-2-иловый эфир
Соединение сравнительного примера 32 (215 мг) растворяют в дихлорметане (4,0 мл), добавляют тионилхлорид (151 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 2 часов. Растворитель и реагенты выпаривают при пониженном давлении, получая сырой продукт (масло коричневого цвета). (1R)-2-азидо-1-(3-хлорфенил)этанол (198 мг) растворяют в ДМФ (4,0 мл), добавляют гидрид натрия (48 мг) при охлаждении льдом, и реакционный раствор перемешивают при той же самой температуре в течение 5 минут. Сырой продукт добавляют при той же температуре, и реакционный раствор перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор гасят водой и экстрагируют этилацетатом, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 3 до 20% этилацетат/гексан), получая указанное в заголовке соединение (240 мг) в виде масла светло-желтого цвета.
1H-ЯМР(CDCl3) δ: 7,60 (1H, д, J=8,2 Гц), 7,53 (1H, с), 7,38-7,30 (4H, м), 7,10-7,04 (2H, м), 4,79 (1H, дд, J=12,7,1,0 Гц), 4,60 (1H, дд, J=8,0, 3,8 Гц), 4,58 (1H, дд, J=12,7, 1,0 Гц), 3,53 (1H, дд, J=13,0, 8,0 Гц), 3,26-3,18 (1H, м), 3,22 (1H, дд, J=13,0, 3,8 Гц), 2,04-1,96 (1H, м), 1,04-0,97 (2H, м), 0,79-0,72 (2H, м).
[0129] Соединения сравнительных примеров 83 и 84, полученные способом, аналогичным способу сравнительного примера 82, с использованием соответствующих исходных материалов или соединений сравнительных примеров, представлены в таблице 11.
[0130]
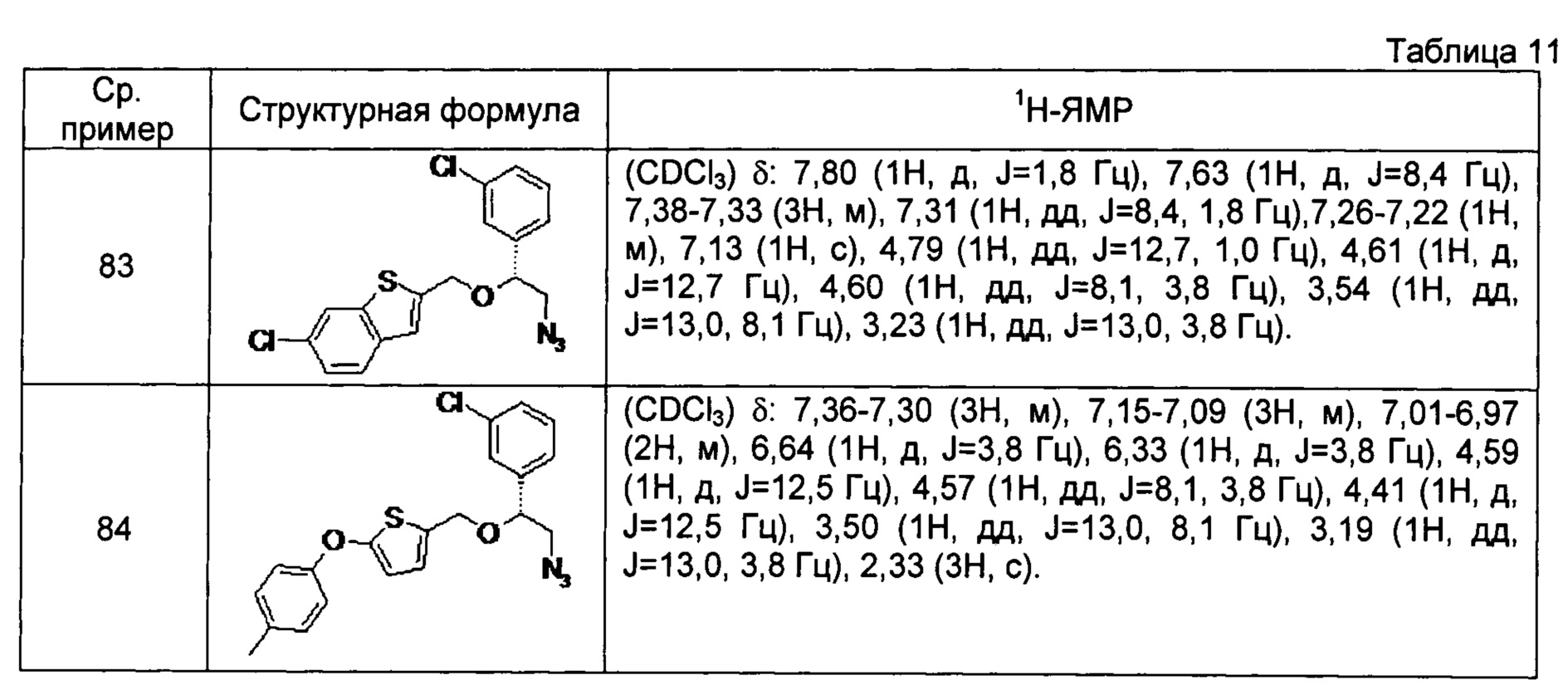
[0131] Соединение сравнительного примера 85
2-(4-трет-бутилбензилокси)-2-фенилэтил амин
Соединение сравнительного примера 43 (600 мг) растворяют в смеси ТГФ-вода (9:1, 10,0 мл), и добавляют трифенилфосфин (661 мг), и реакционный раствор перемешивают при комнатной температуре в течение 19 часов. Растворитель выпаривают при пониженном давлении, и полученный остаток экстрагируют хлороформом, промывают водой и насыщенным солевым раствором. Объединенные органические слои сушат над безводным сульфатом натрия, затем растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (от 1 до 9% метанол/хлороформ), получая указанное в заголовке соединение (185 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,42-7,23 (9H, м), 4,49 (1H, д, J=11,4 Гц), 4,36 (1H, дд, J=7,8, 4,3 Гц), 4,29 (1H, д, J=11,4 Гц), 2,96 (1H, дд, J=13,3, 7,8 Гц), 2,86 (1H, дд, J=13,3, 4,3 Гц), 1,32(9H, с).
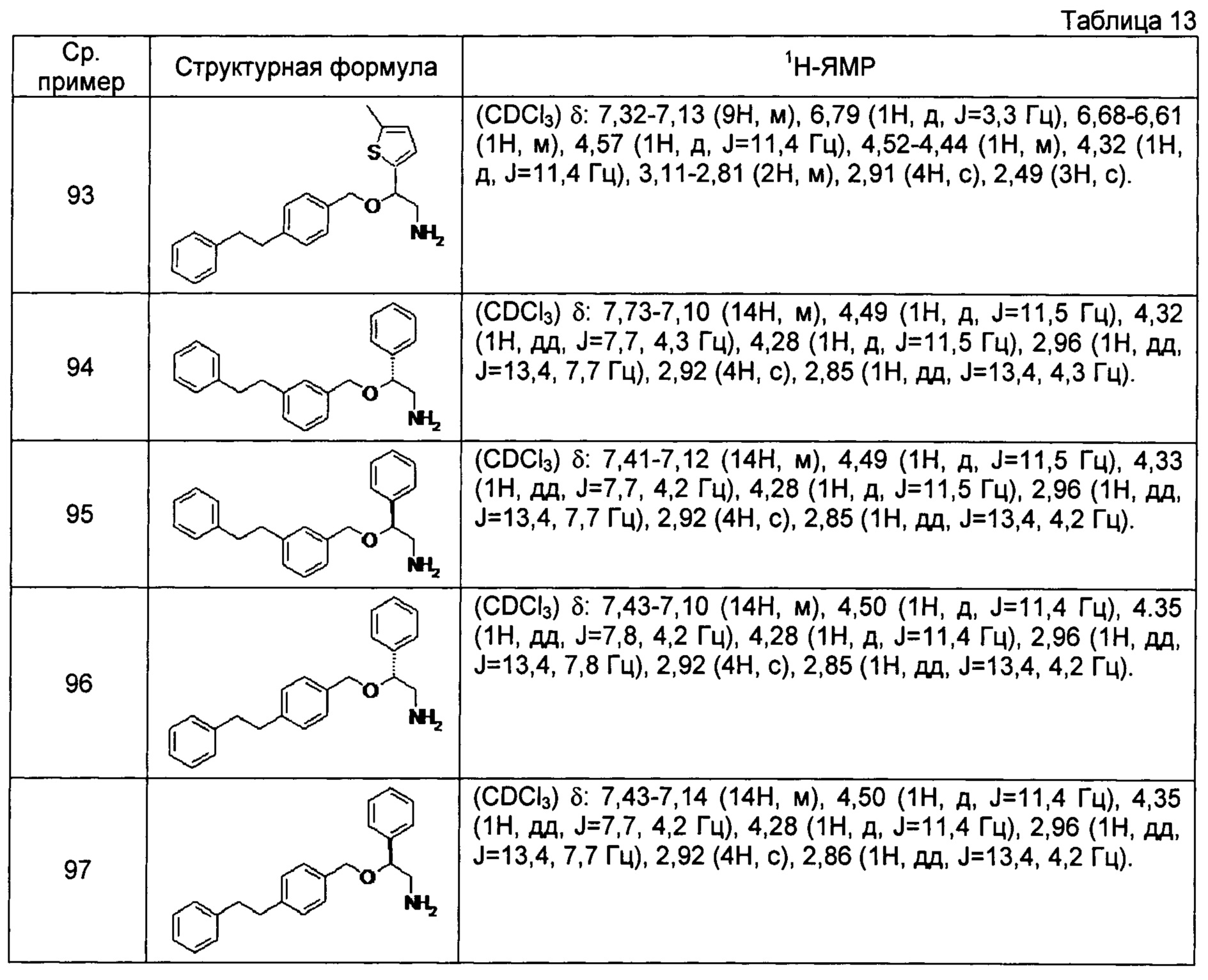
[0132] Соединения сравнительных примеров 86-97, полученные способом, аналогичным способу сравнительного примера 85, с использованием соединений сравнительных примеров 44-51 и сравнительных примеров 53-56, представлены в таблицах 12 и 13.
[0133]
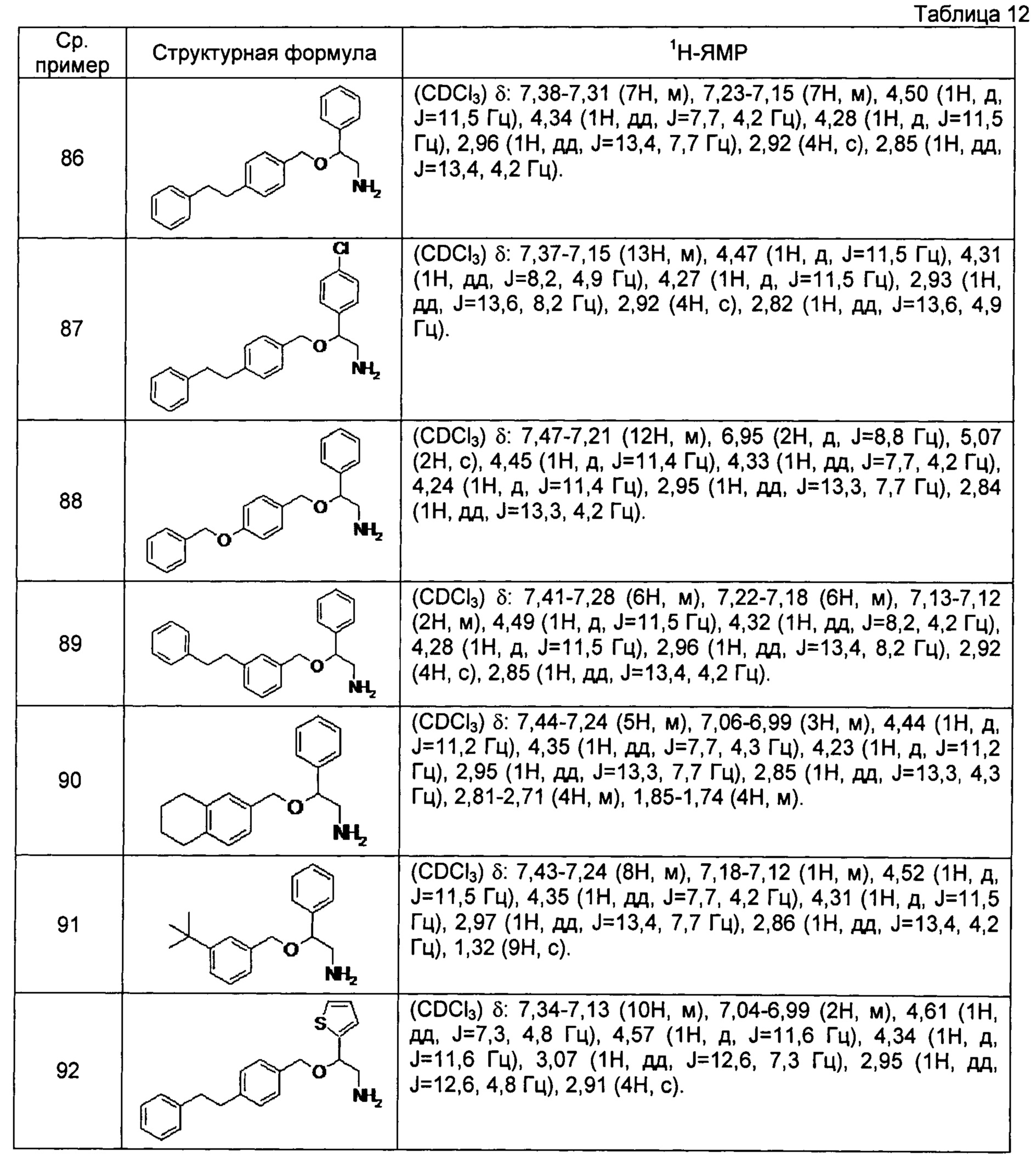
[0134]
[0135] Соединение сравнительного примера 98
1-(2-бромэтил)-4-(2-фенилэтил)бензол
Указанное в заголовке соединение (446 мг) получают в виде порошка оранжевого цвета из 2-[4-(2-фенилэтил)фенил]этанола (600 мг) способом, аналогичным способу сравнительного примера 42.
1H-ЯМР(CDCl3) δ: 7,31-7,26 (2H, м), 7,21-7,16 (3H, м), 7,15-7,09(4H, м), 3,55 (2H, т, J=7,7 Гц), 3,13 (2H, т, J=7,7 Гц), 2,91(4H, с).
[0136] Соединение сравнительного примера 99
4-(4-(2-фенилэтил)фенил)-2-фенилбутиронитрил
Указанное в заголовке соединение (497 мг) получают в виде бесцветного масла, используя соединение сравнительного примера 98 (732 мг) и фенилацетонитрил (269 мг) способом, аналогичным способу сравнительного примера 43.
1H-ЯМР(CDCl3) δ: 7,41-7,27(6H, м), 7,21-7,08(8H, м), 3,73 (1H, дд, J=8,9, 6,1 Гц), 2,90 (4H, с), 2,82-2,74 (2H, м), 2,32-2,04 (2H, м).
[0137] Соединение сравнительного примера 100
4-(4-(2-фенилэтил)фенил)-2-фенилбутиламин
Указанное в заголовке соединение (321 мг) получают в виде бесцветного масла из соединения сравнительного примера 99 (490 мг) способом, аналогичным способу сравнительного примера 21.
1H-ЯМР(CDCl3) δ: 7,37-7,23 (5H, м), 7,22-7,16(5H, м), 7,08 (2H, д, J=8,1 Гц), 7,02 (2H, д, J=8,1 Гц), 2,96-2,81 (2H, м), 2,89 (4H, с), 2,65-2,38(3H, м), 2,04-1,84 (2H, м), 1,41-1,25 (2H, м).
[0138] Соединение сравнительного примера 101
Метил-4-{[N-[2-(4-трет-бутилбензилокси)-2-фенилэтил]амино]метил}бензоат
Соединение сравнительного примера 85 (180 мг) и метил терефталальдегинат (104 мг) растворяют в ТГФ (5,0 мл), добавляют уксусную кислоту (91 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 30 минут. Затем добавляют триацетоксиборгидрид натрия (403 мг), и затем реакционный раствор перемешивают при той же самой температуре в течение 16 часов. Растворитель выпаривают при пониженном давлении, и добавляют насыщенный водный раствор бикарбоната натрия. Реакционный раствор перемешивают, затем экстрагируют этилацетатом, и промывают водой и насыщенным солевым раствором. Объединенные органические слои сушат над безводным сульфатом натрия, затем растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 6 до 50% этилацетат/гексан), получая указанное в заголовке соединение (259 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,97 (2H, д, J=8,2 Гц), 7,39-7,21 (11H, м), 4,58 (1H, дд, J=9,0, 3,7 Гц), 4,46 (1H, д, J=11,4 Гц), 4,27 (1H, д, J=11,4 Гц), 3,90(3H, с), 3,84 (1H, д, J=13,8 Гц), 3,79 (1H, д, J=13,8 Гц), 2,95 (1H, дд, J=12,3, 9,0 Гц), 2,73 (1H, дд, J=12,3, 3,7 Гц), 1,31 (9H, с).
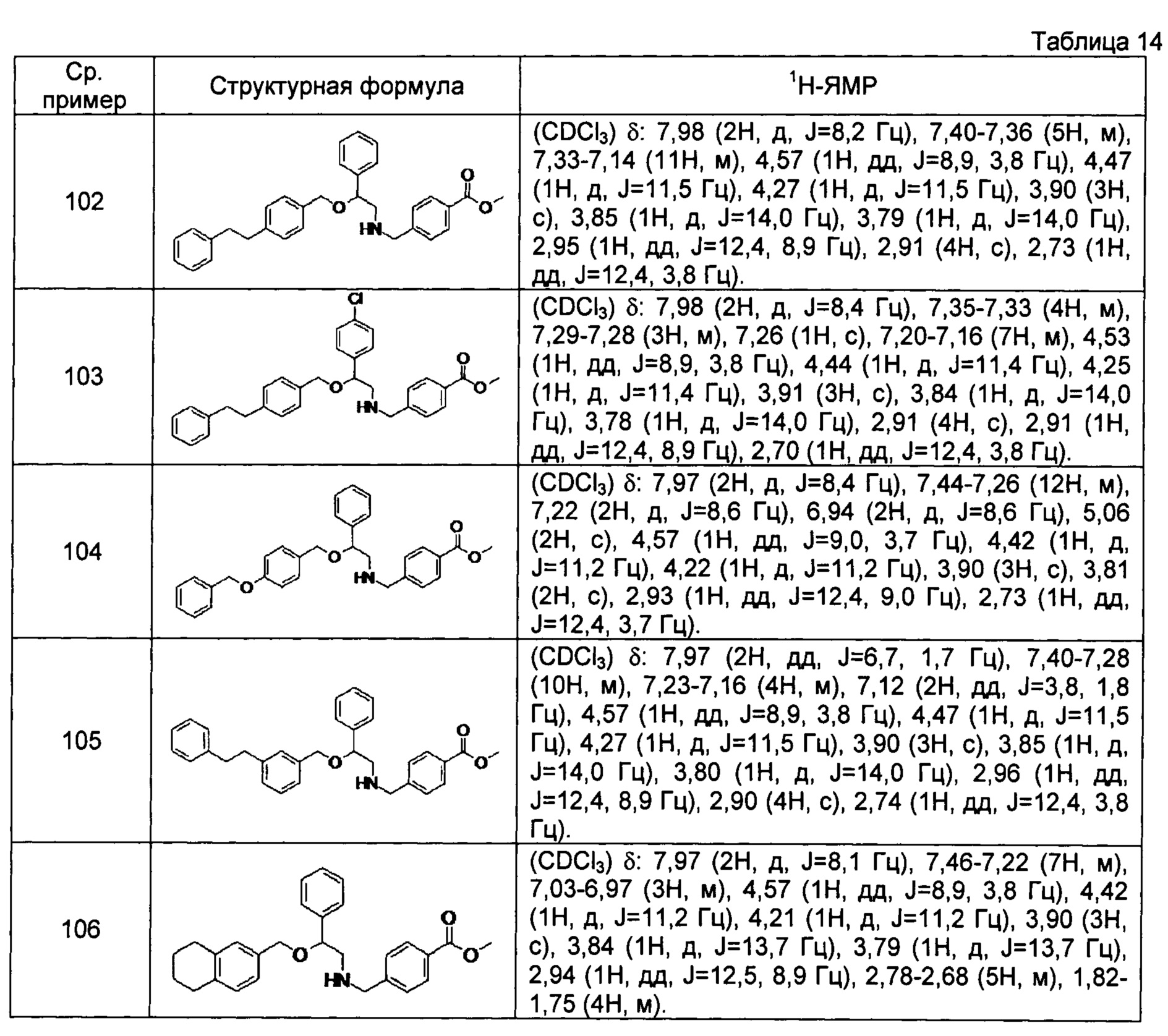
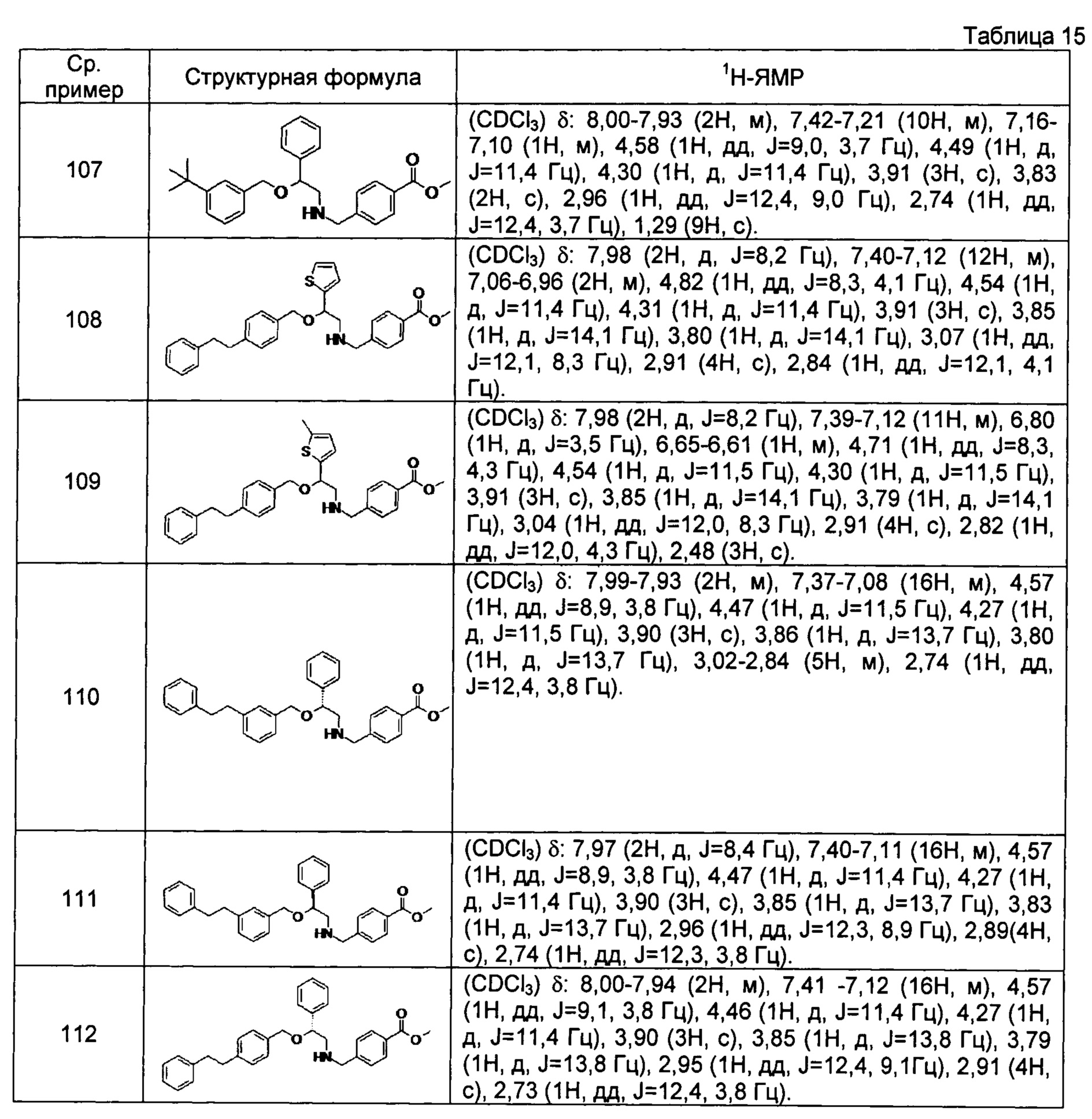
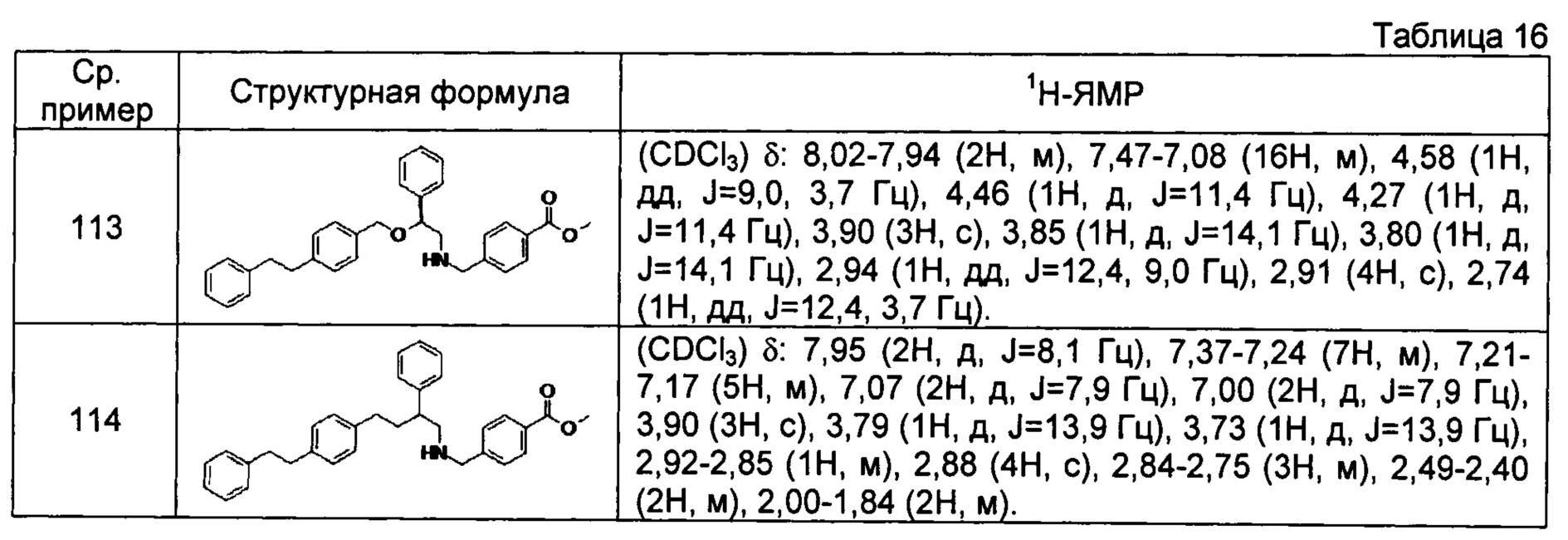
[0139] Соединения сравнительных примеров 102-114, полученные способом, аналогичным способу сравнительного примера 101, с использованием сравнительных примеров 86-97 и сравнительного примера 100, представлены в таблицах 14-16.
[0140]
[0141]
[0142]
[0143] Соединение сравнительного примера 115
Метил-4-{[N-[2-(3-хлорфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензоат
Соединение сравнительного примера 57 (1,60 г) растворяют в ТГФ (26,0 мл), добавляют три-н-бутилфосфин (1,12 мл), и реакционный раствор перемешивают при комнатной температуре в течение 30 минут. Затем добавляют метил терефтальальдегидат (670 мг) и реакционный раствор перемешивают при той же самой температуре в течение 18 часов. Затем добавляют боргидрид натрия (231 мг) и метанол (16,0 мл), и реакционный раствор перемешивают при той же самой температуре в течение 3 часов. Реакционный раствор гасят 1 моль/л водным раствором хлористоводородной кислоты, перемешивают, и затем нейтрализуют насыщенным водным раствором бикарбоната натрия, и экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия, затем растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 20 до 60% этилацетат/гексан), получая указанное в заголовке соединение (1,99 г) в виде масла светло-желтого цвета.
1H-ЯМР(CDCl3) δ: 8,06-7,96 (2H, м), 7,45-7,12(15H, м), 4,53 (1H, дд, J=8,8, 3,5 Гц), 4,47 (1H, д, J=11,4 Гц), 4,27 (1H, д, J=11,4 Гц), 3,91 (3H, с), 3,83 (1H, д, J=14,1 Гц), 3,78 (1H, д, J=14,1 Гц), 2,91 (4H, с), 2,91 (1H, дд, J=12,5, 8,8 Гц), 2,71 (1H, дд, J=12,5, 3,7 Гц).
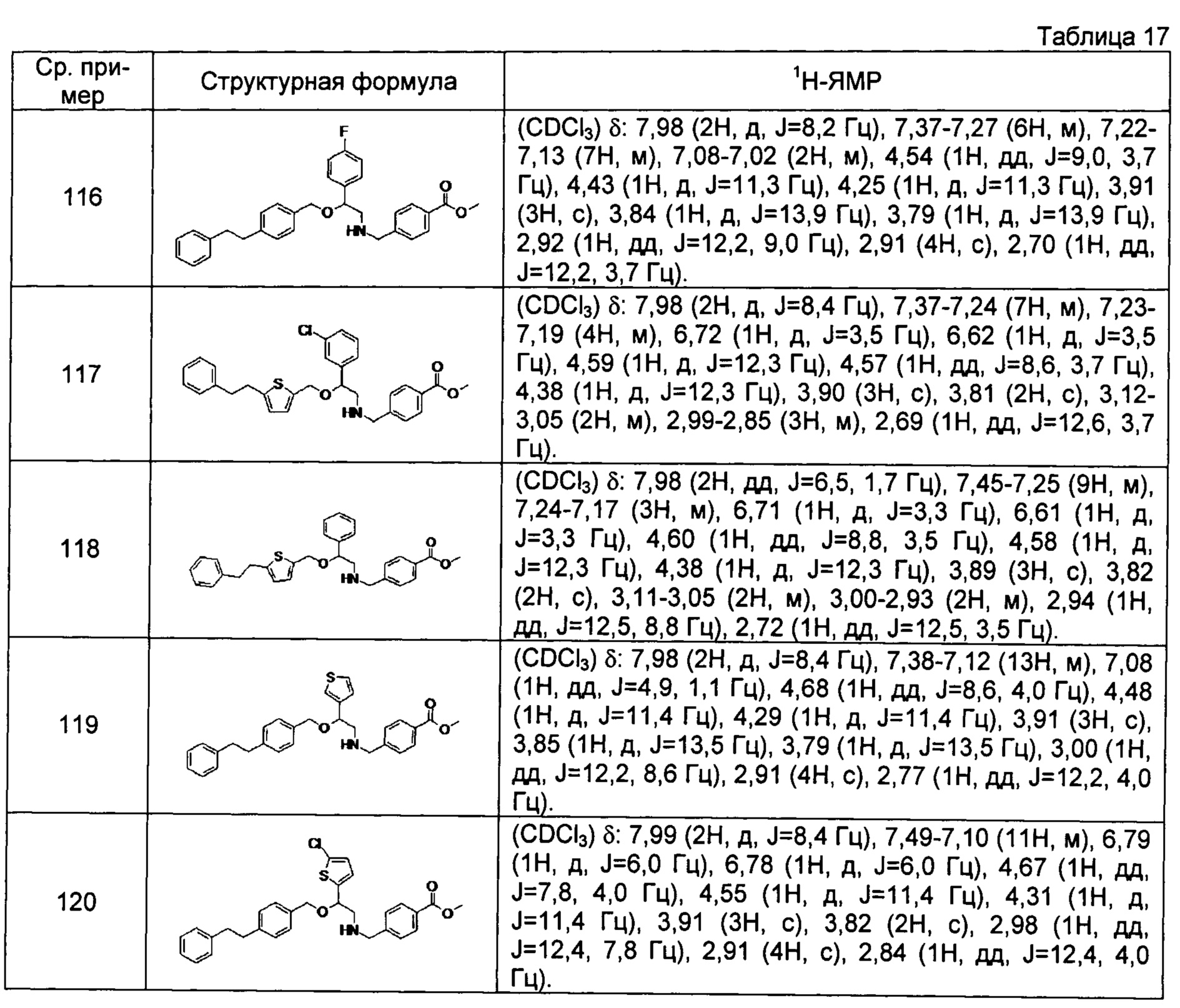
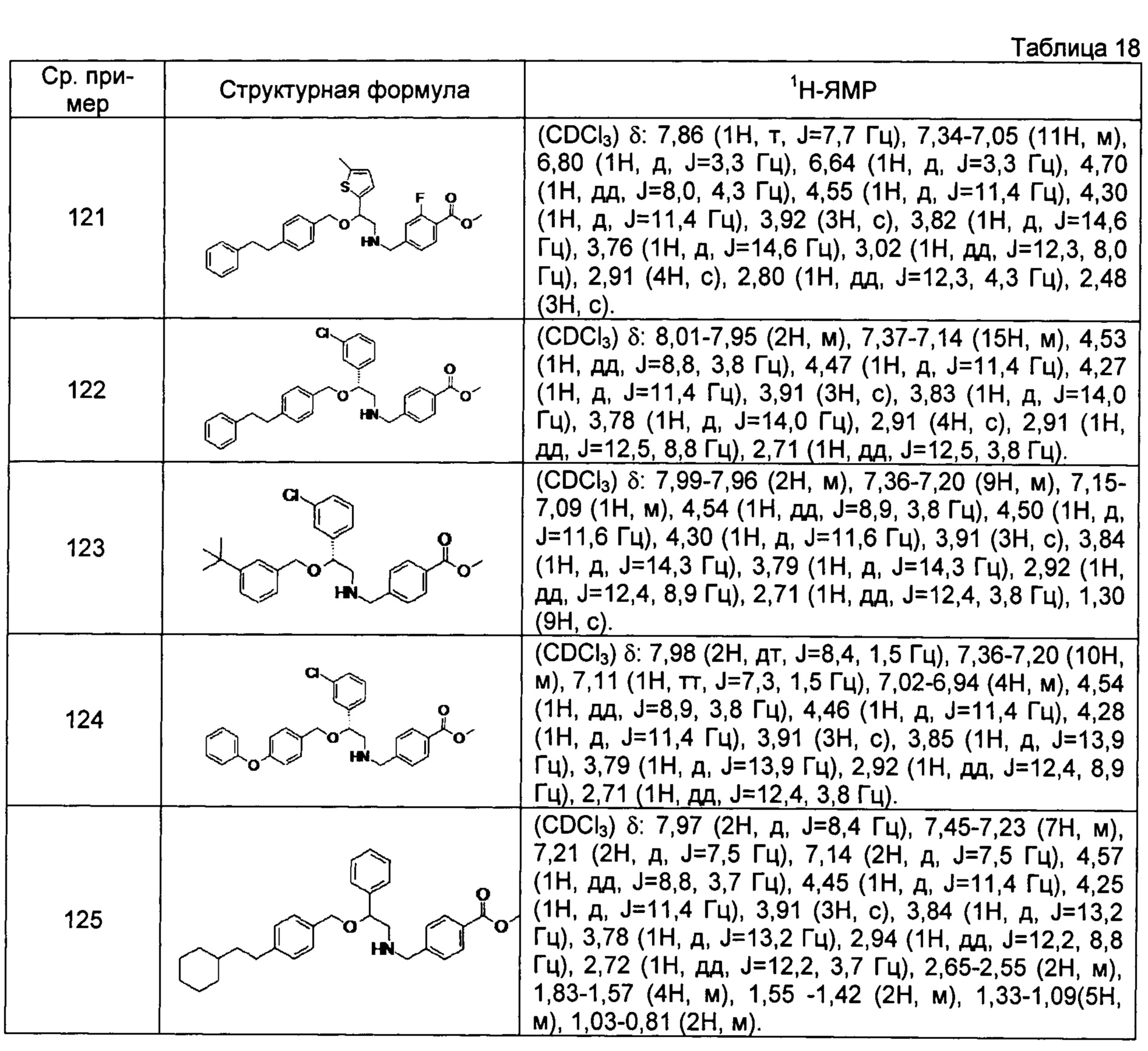
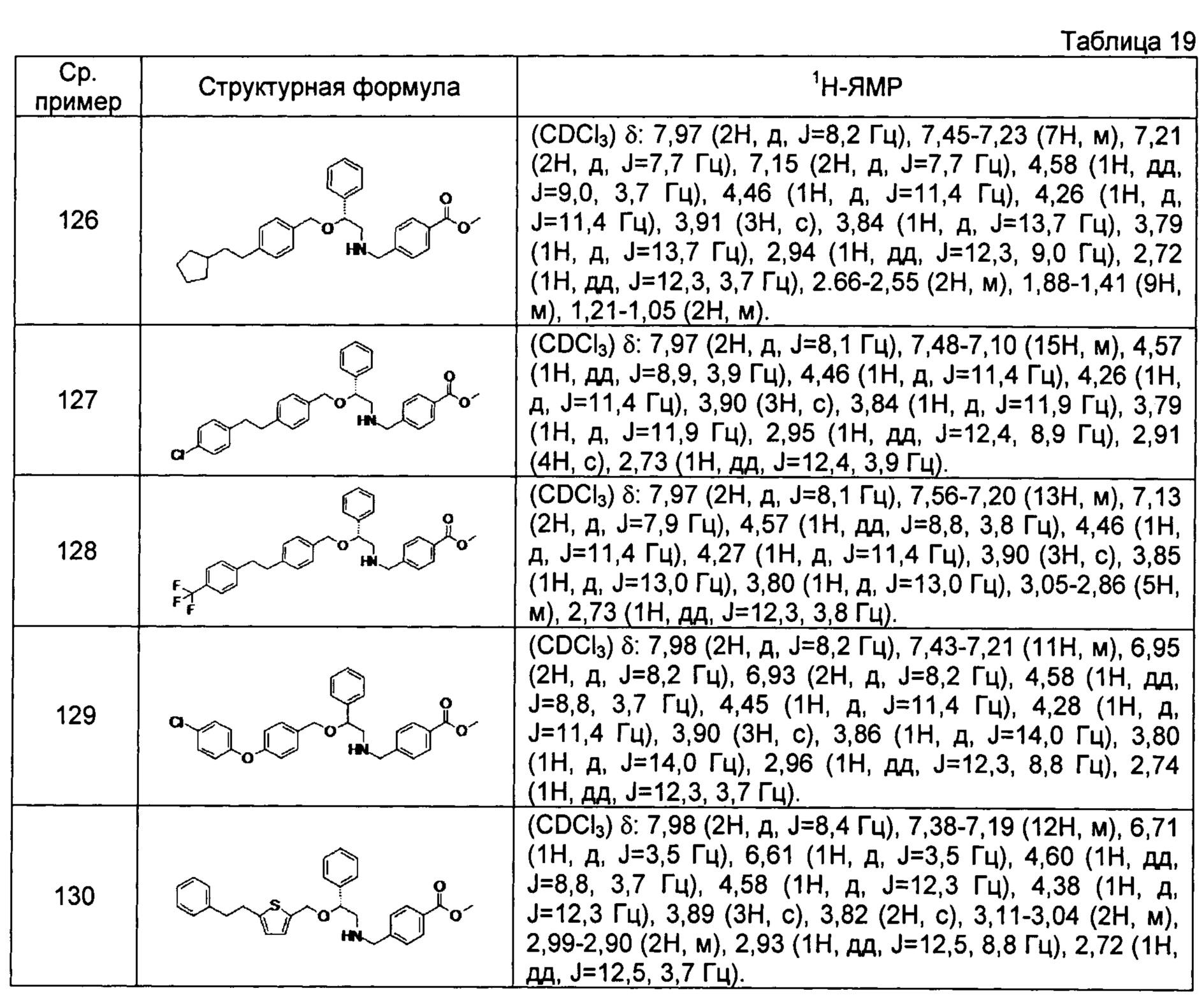
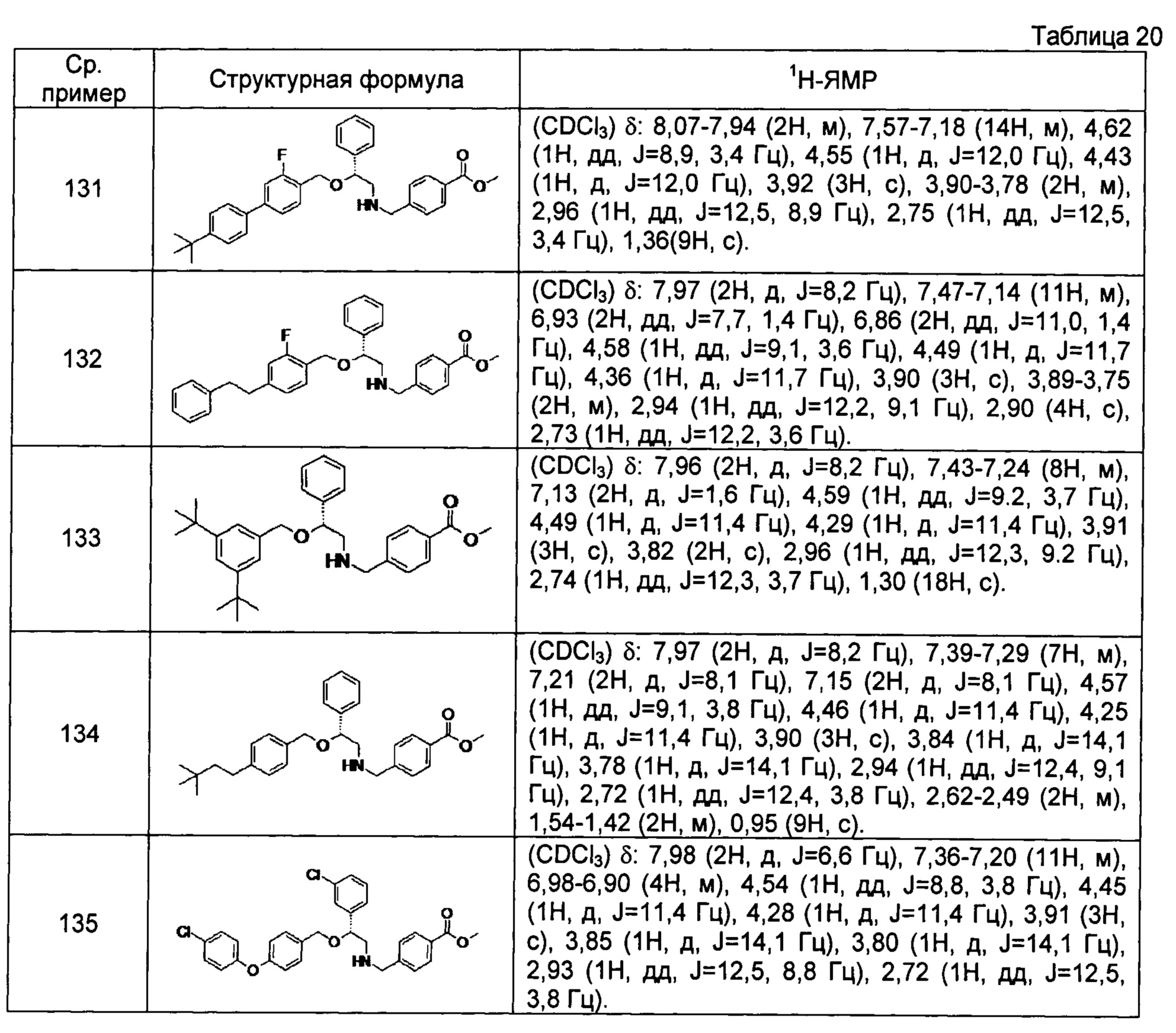
[0144] Соединения сравнительных примеров 116-142 полученные способом, аналогичным способу сравнительного примера 115, с использованием соединений сравнительного примера 52 и сравнительных примеров 58-83, представлены в таблицах 17-22.
[0145]
[0146]
[0147]
[0148]
[0149]
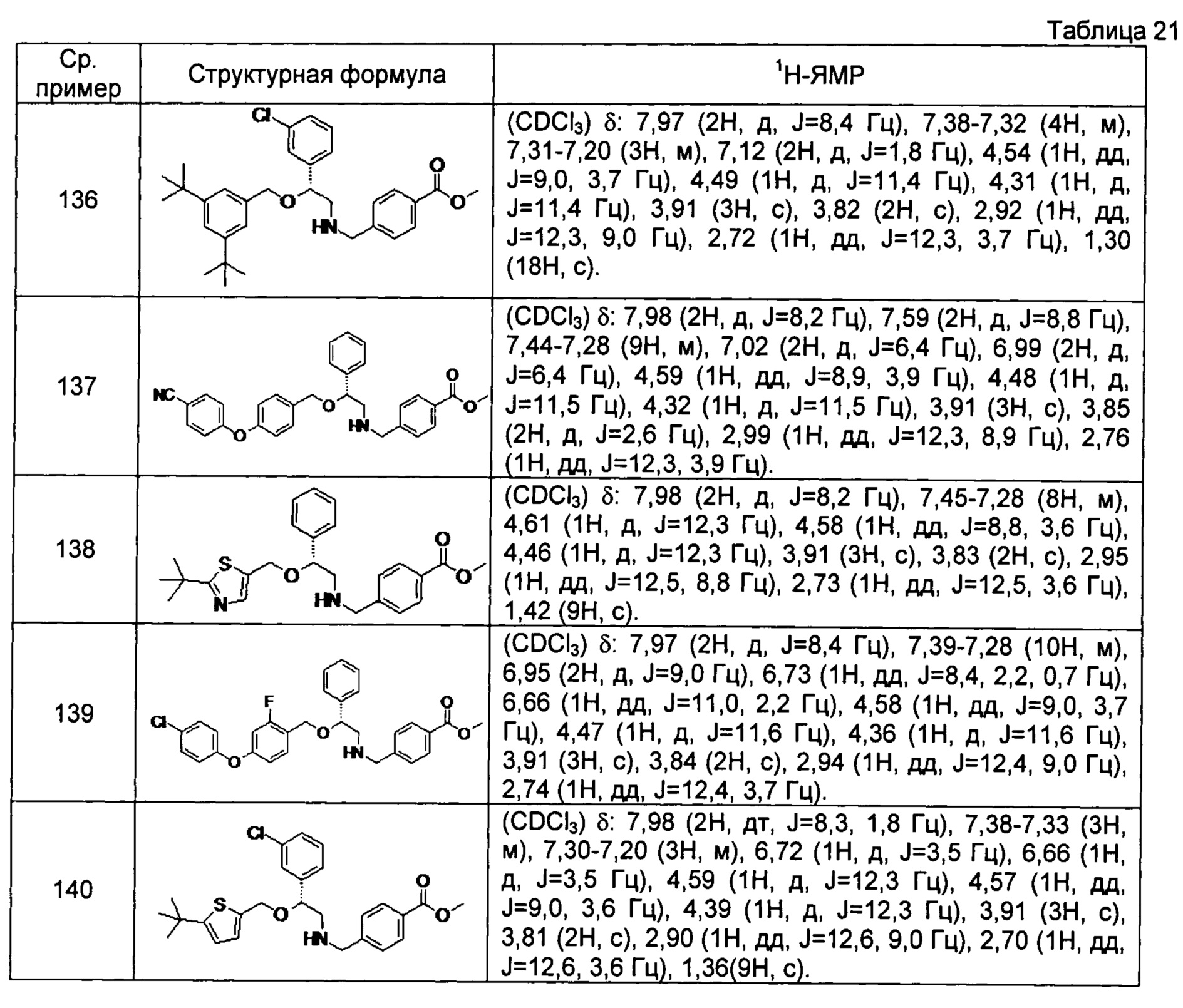
[0150]
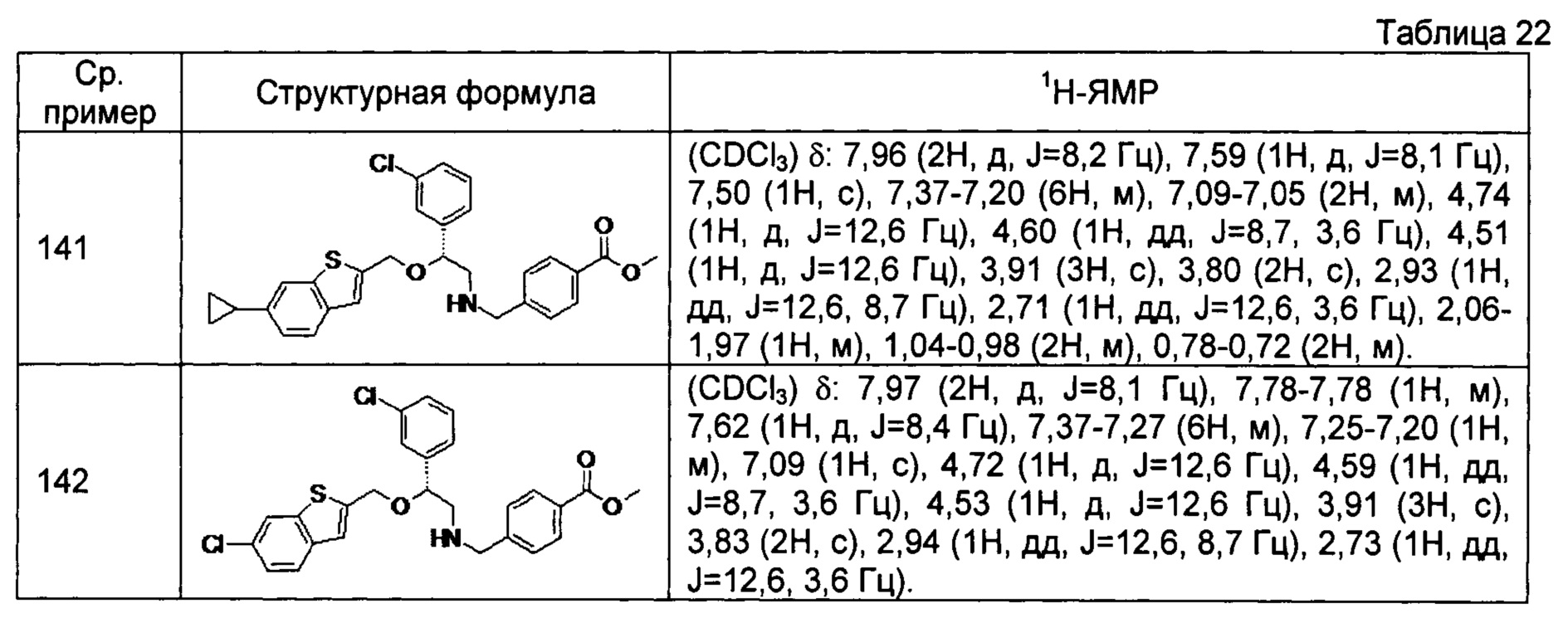
[0151] Соединение сравнительного примера 143
Метил-4-{[N-[2-(4-трет-бутилбензилокси-2-фенилэтил]-N-(4-метоксикарбонилбутил)амино]метил}бензоат
Соединение сравнительного примера 101 (240 мг) растворяют в ацетонитриле (1,0 мл), и добавляют карбонат калия (154 мг), метил-5-бромвалерат (0,12 мл) и иодид натрия (8 мг), и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 23 часов. Реакционный раствор охлаждают до комнатной температуры, и растворитель выпаривают при пониженном давлении. Затем полученный остаток суспендируют в воде, и полученную суспензию экстрагируют этилацетатом. Объединенные органические слои промывают водой и насыщенным солевым раствором, и затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 2 до 20% этилацетат/гексан), получая указанное в заголовке соединение (276 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,91 (2H, д, J=8,2 Гц), 7,38-7,19(11H, м), 4,49 (1H, дд, J=7,1, 4,9 Гц), 4,41 (1H, д, J=11,5 Гц), 4,25 (1H, д, J=11,5 Гц), 3,91(3H, с),3,76 (1H, д, J=14,3 Гц), 3,64(3H, с), 3,62 (1H, д, J=14,3 Гц), 2,88 (1H, дд, J=13,9, 7,1 Гц), 2,67 (1H, дд, J=13,9, 4,9 Гц), 2,53-2,42 (2H, м), 2,18 (2H, т, J=7,2 Гц), 1,57-1,33(4H, м), 1,31(9H, с).
[0152] Соединения сравнительных примеров 144-190, полученные способом, аналогичным способу сравнительного примера 143, с использованием соответствующих соединения сравнительных примеров, представлены в таблицах 23-34.
[0153]
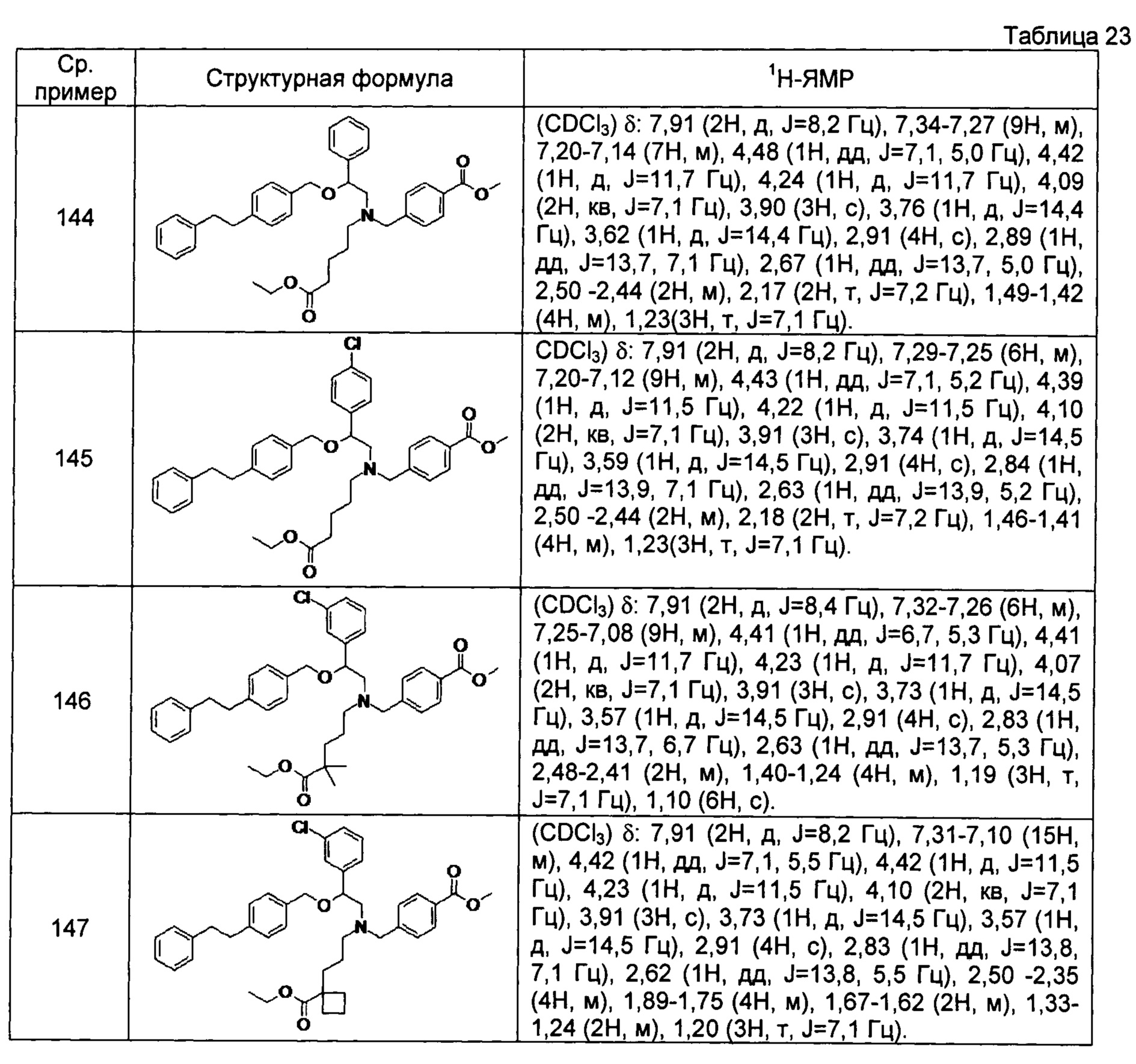
[0154]
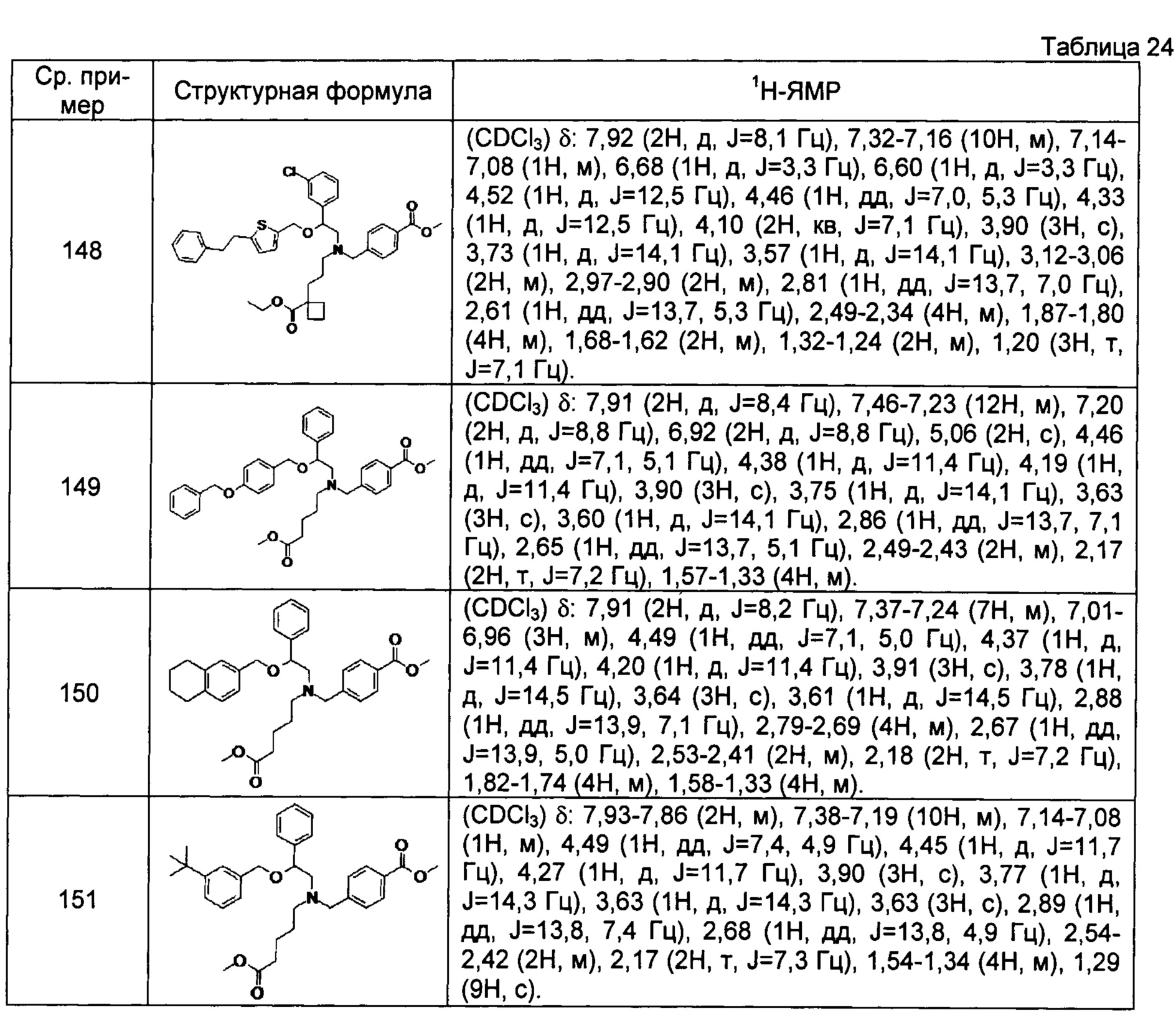
[0155]
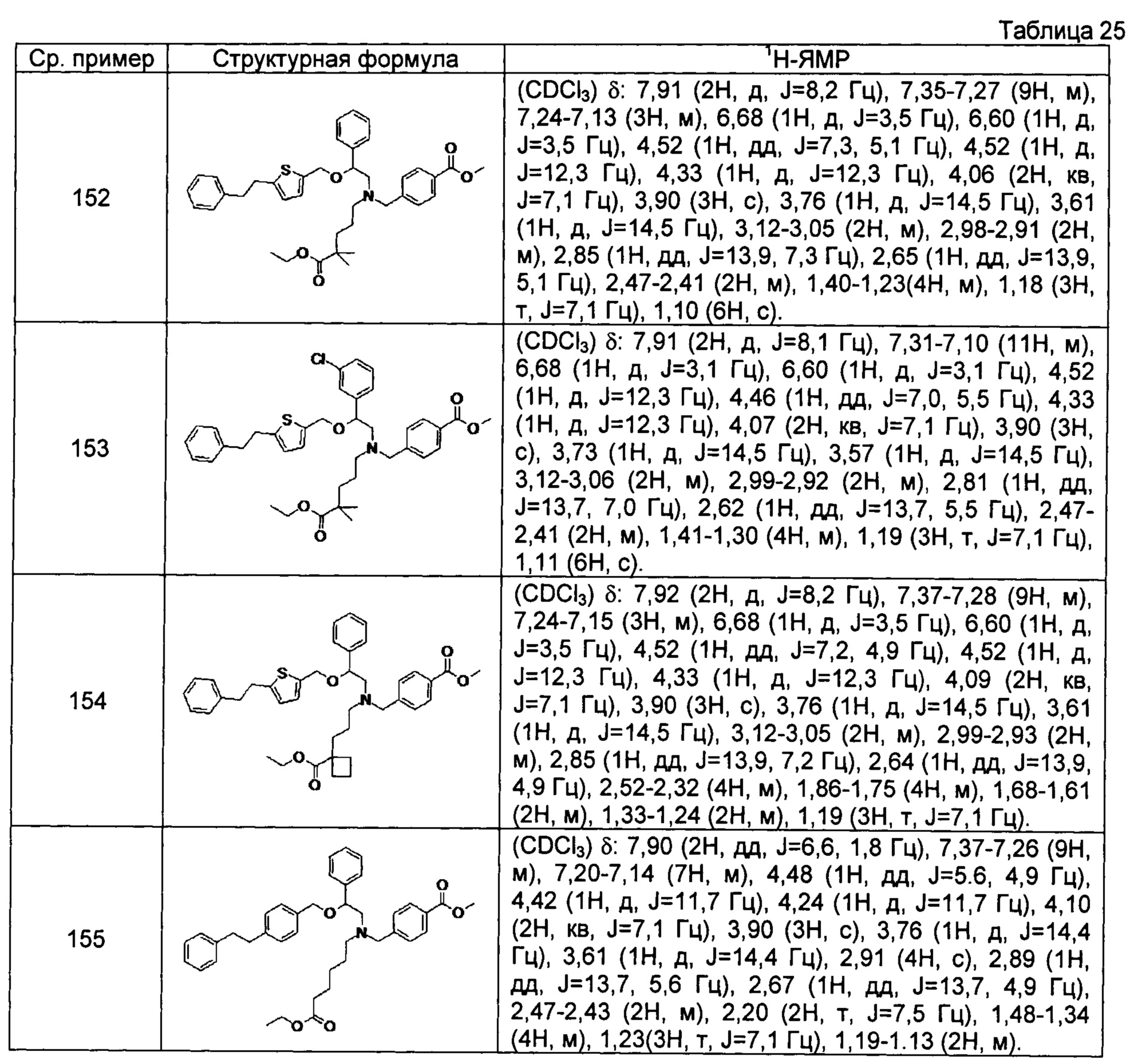
[0156]
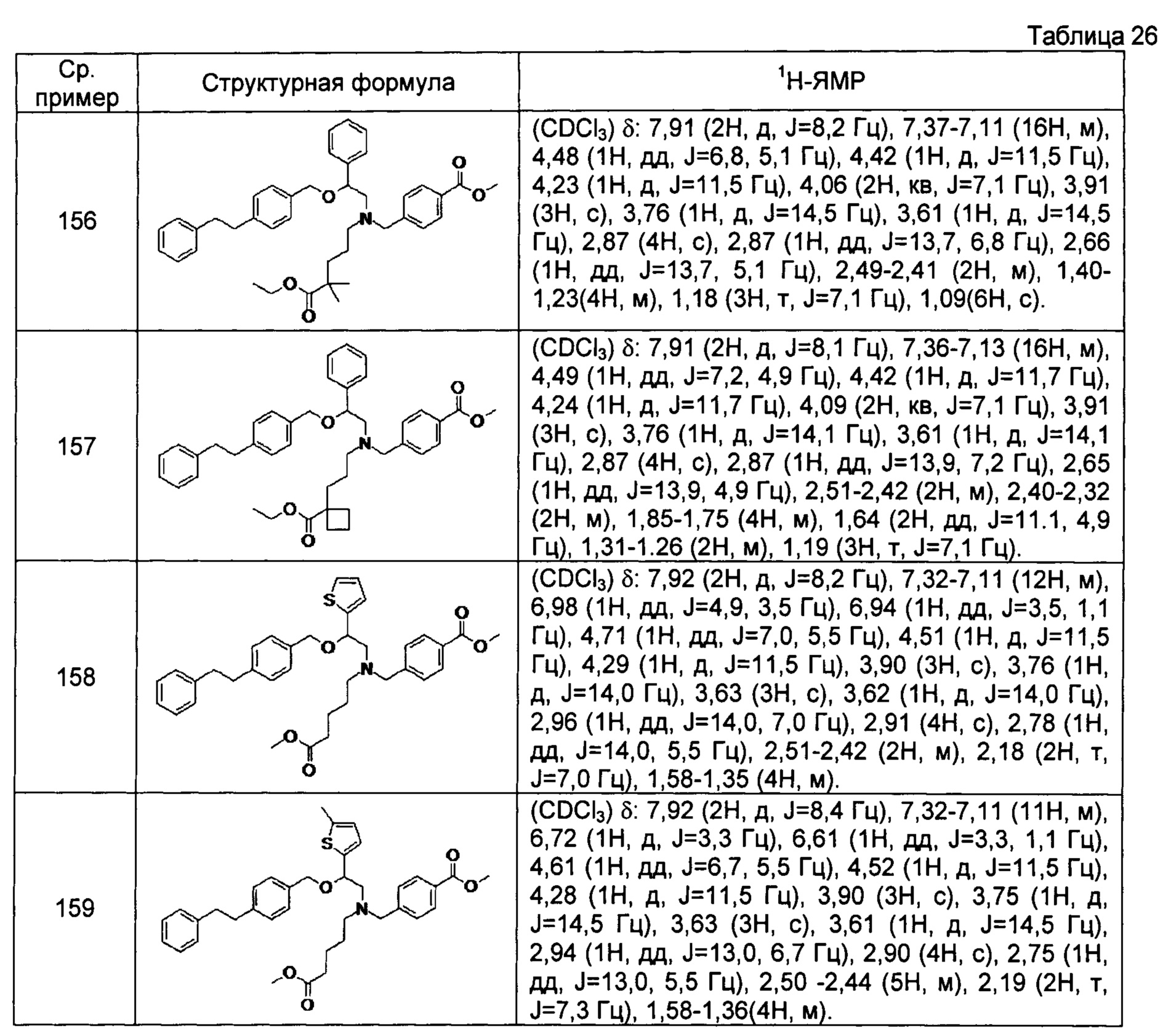
[0157]
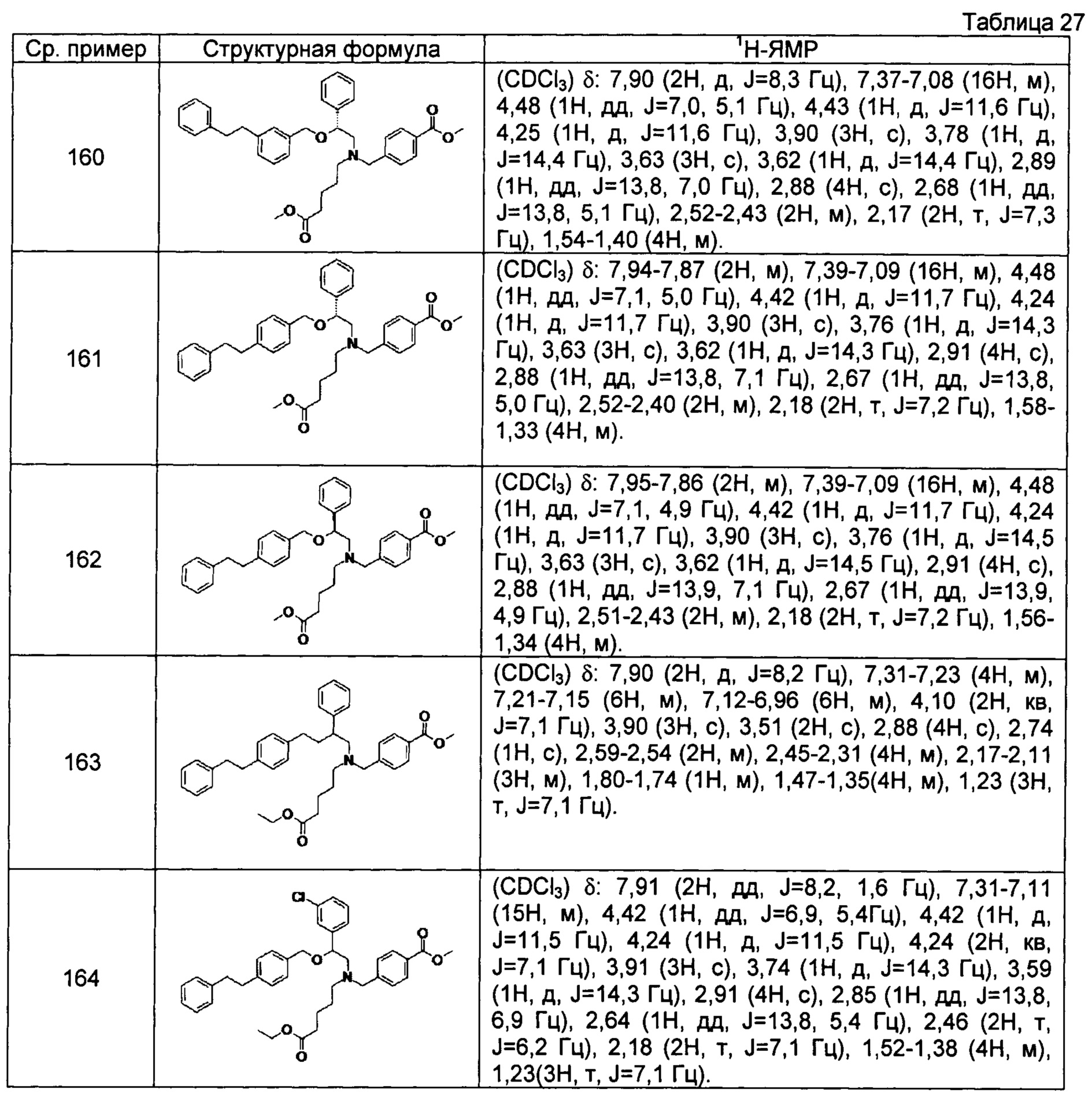
[0158]
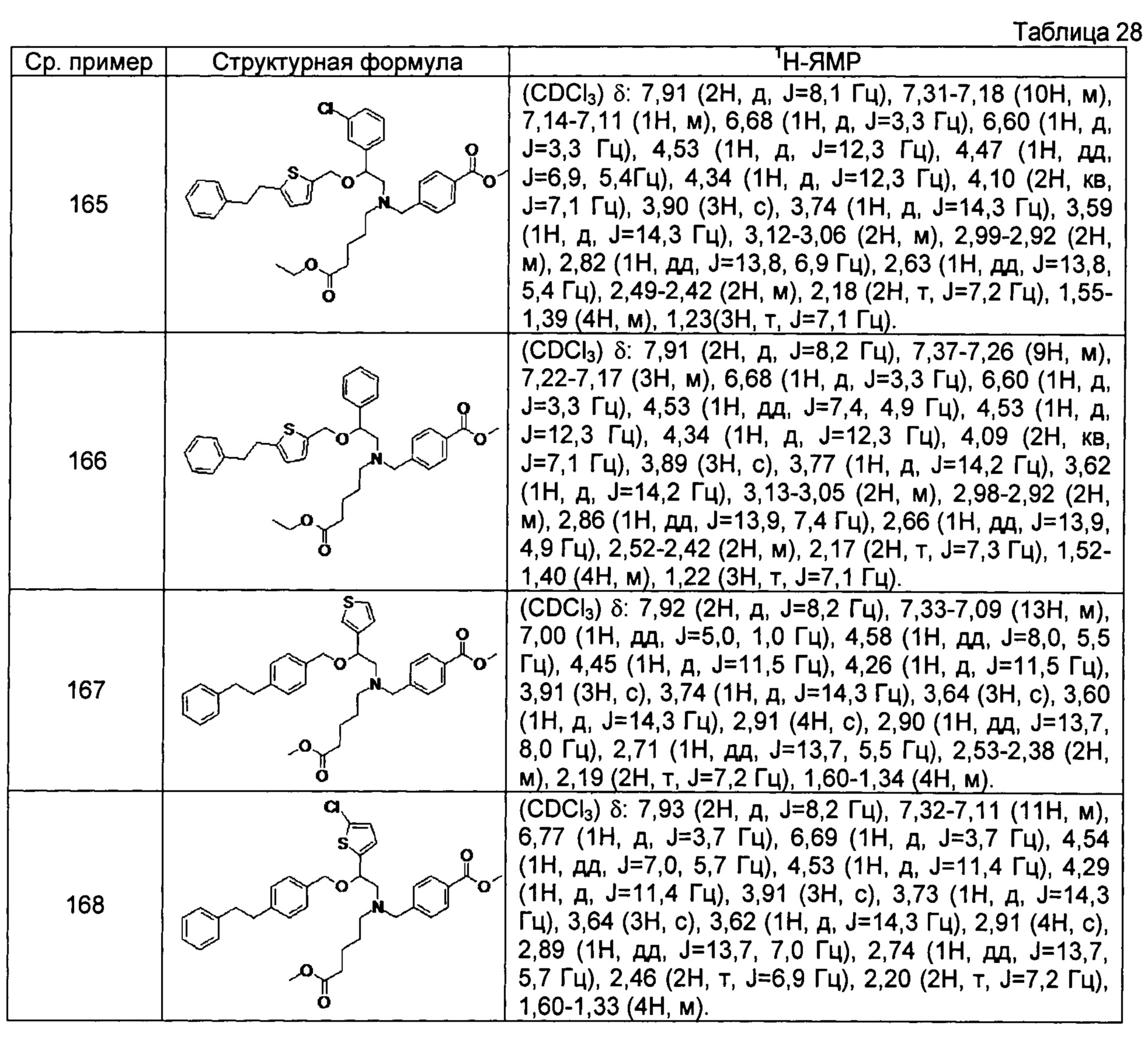
[0159]
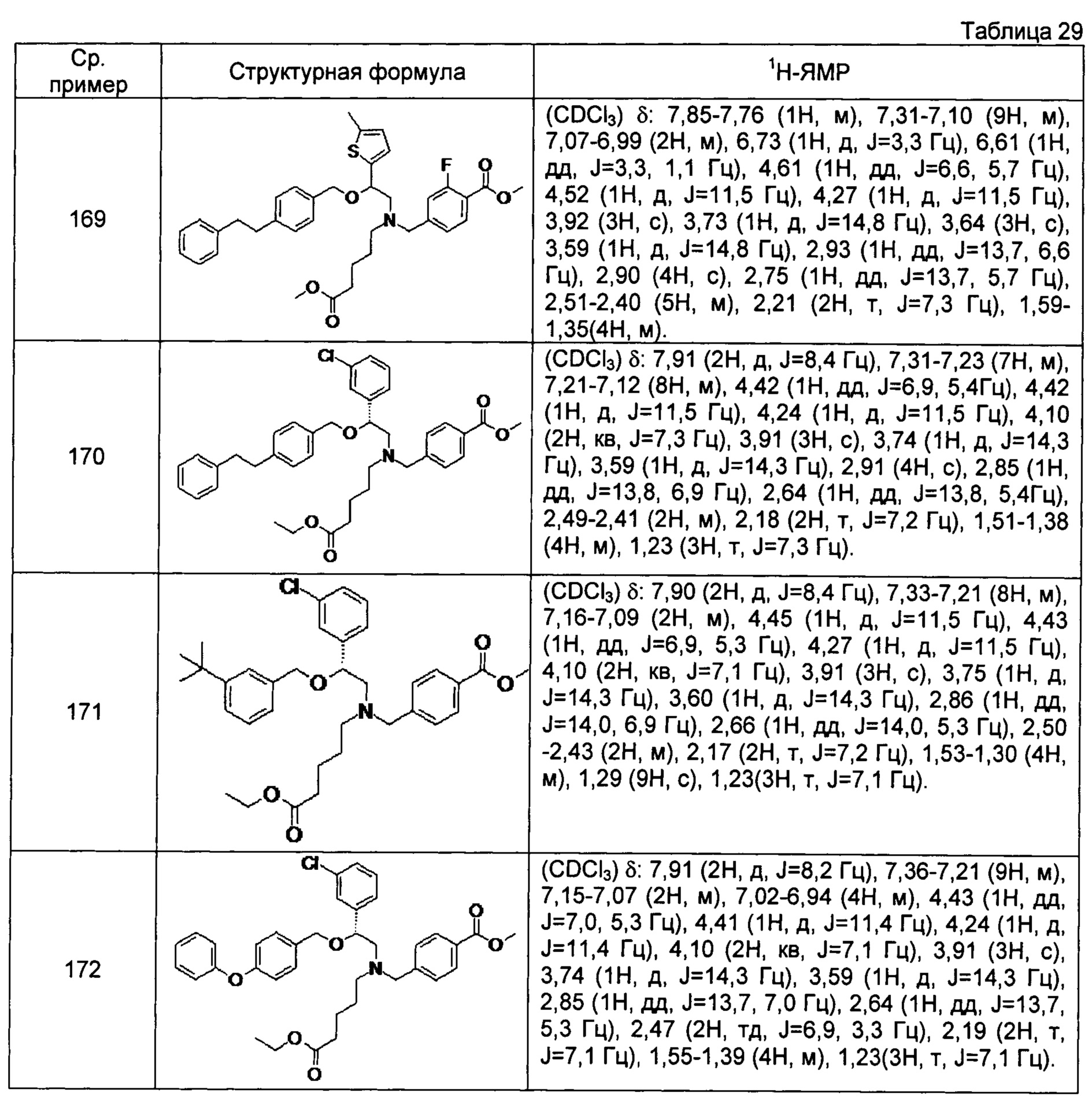
[0160] 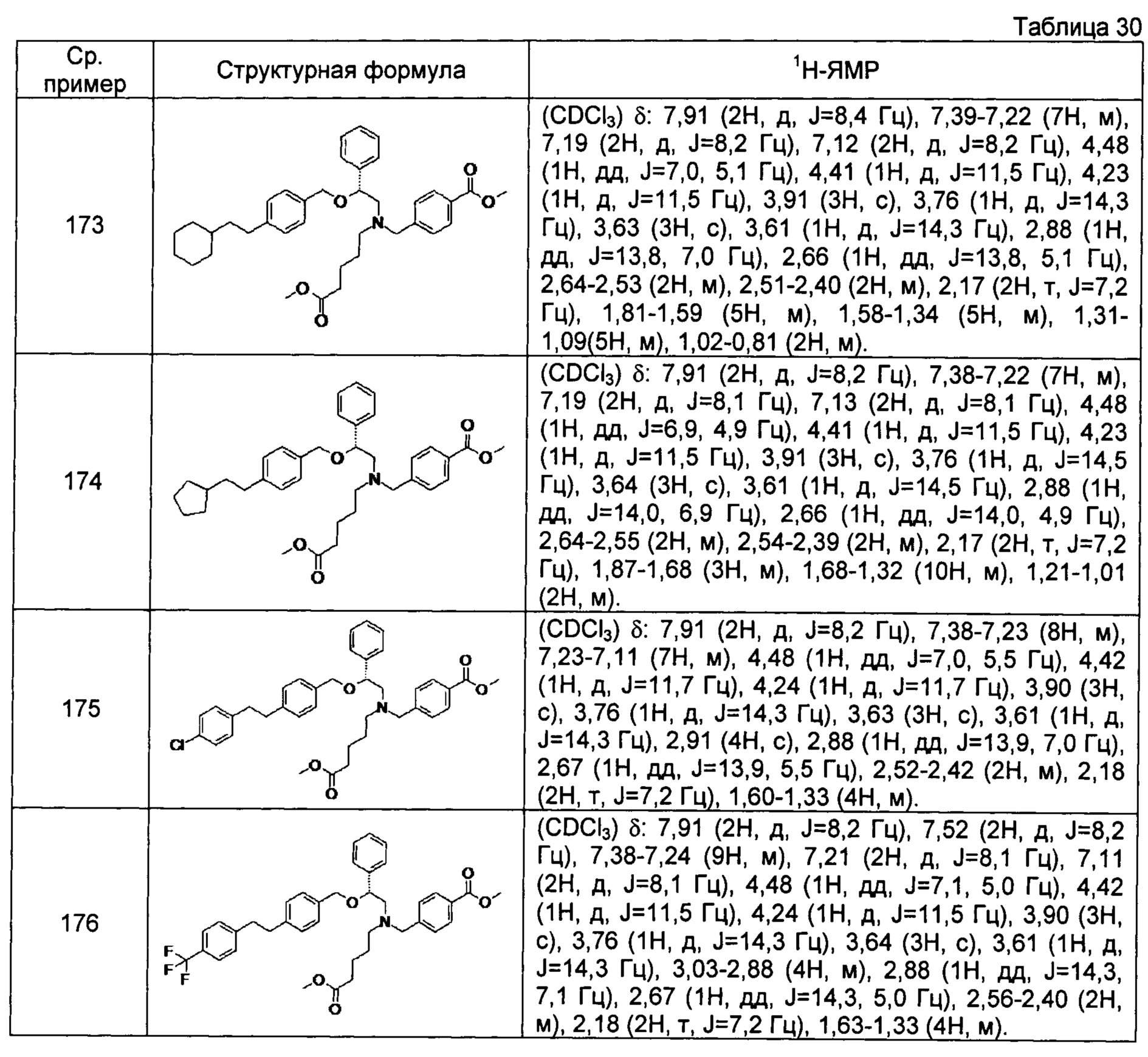
[0161]
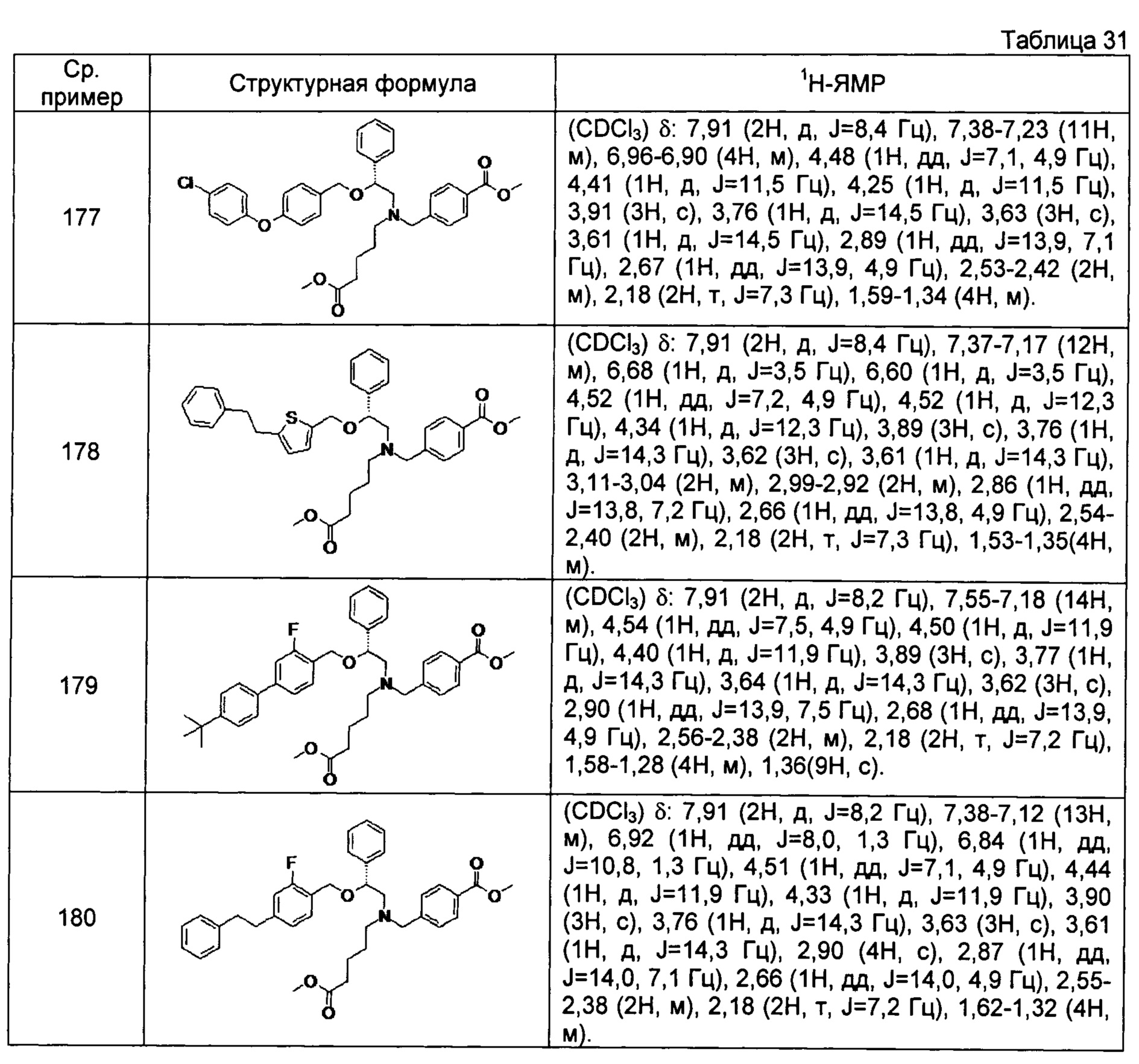
[0162]
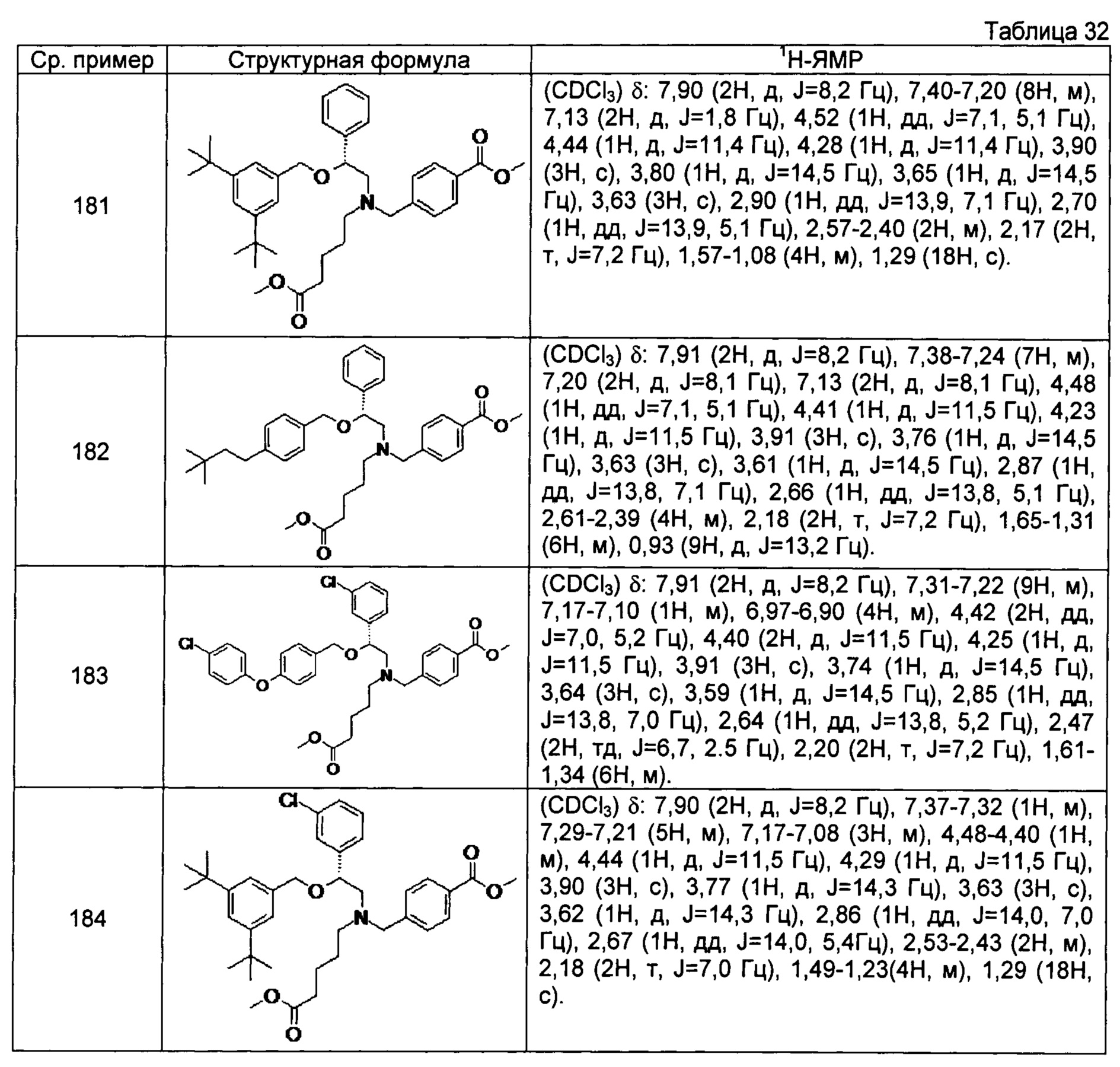
[0163]
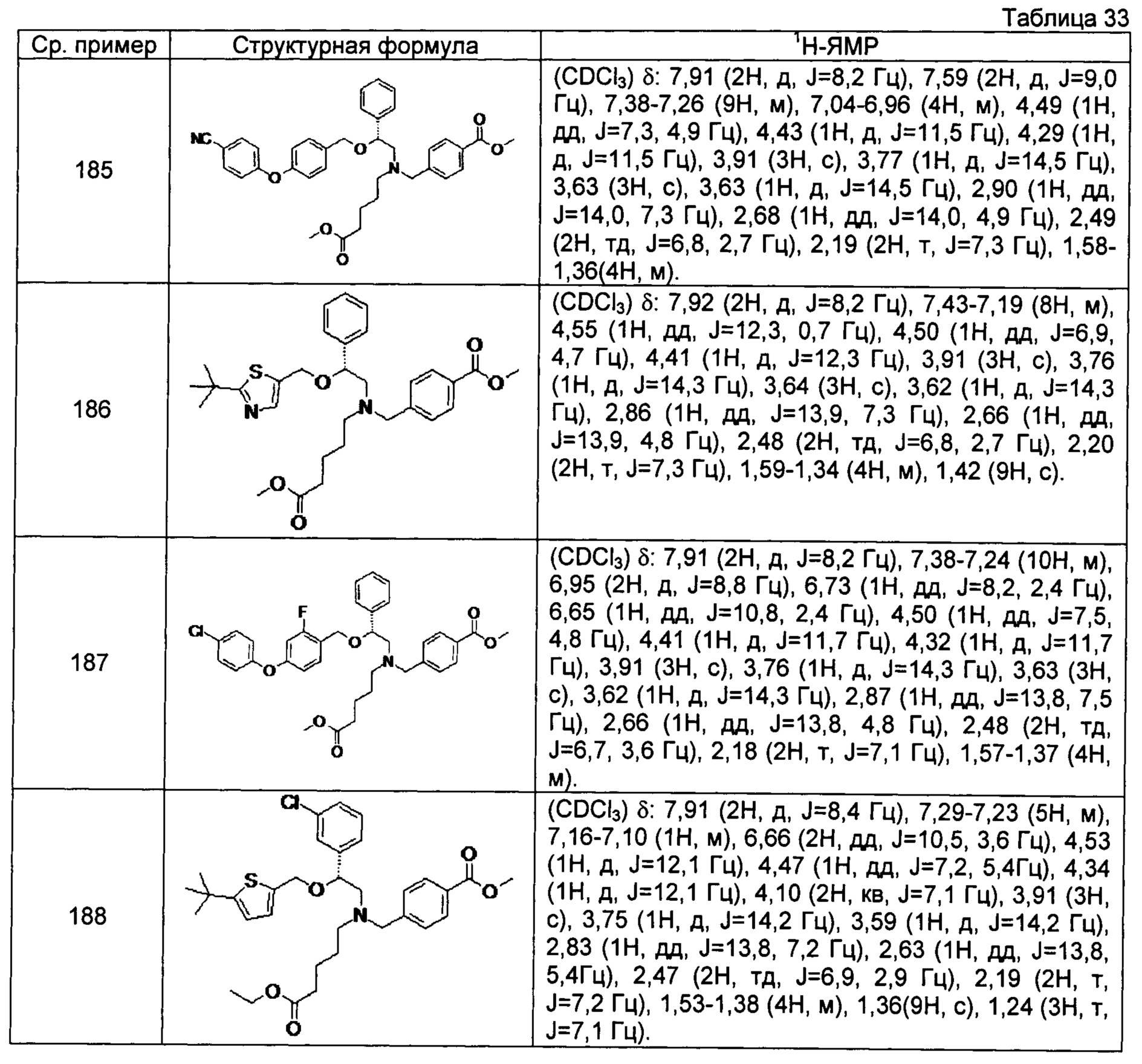
[0164]
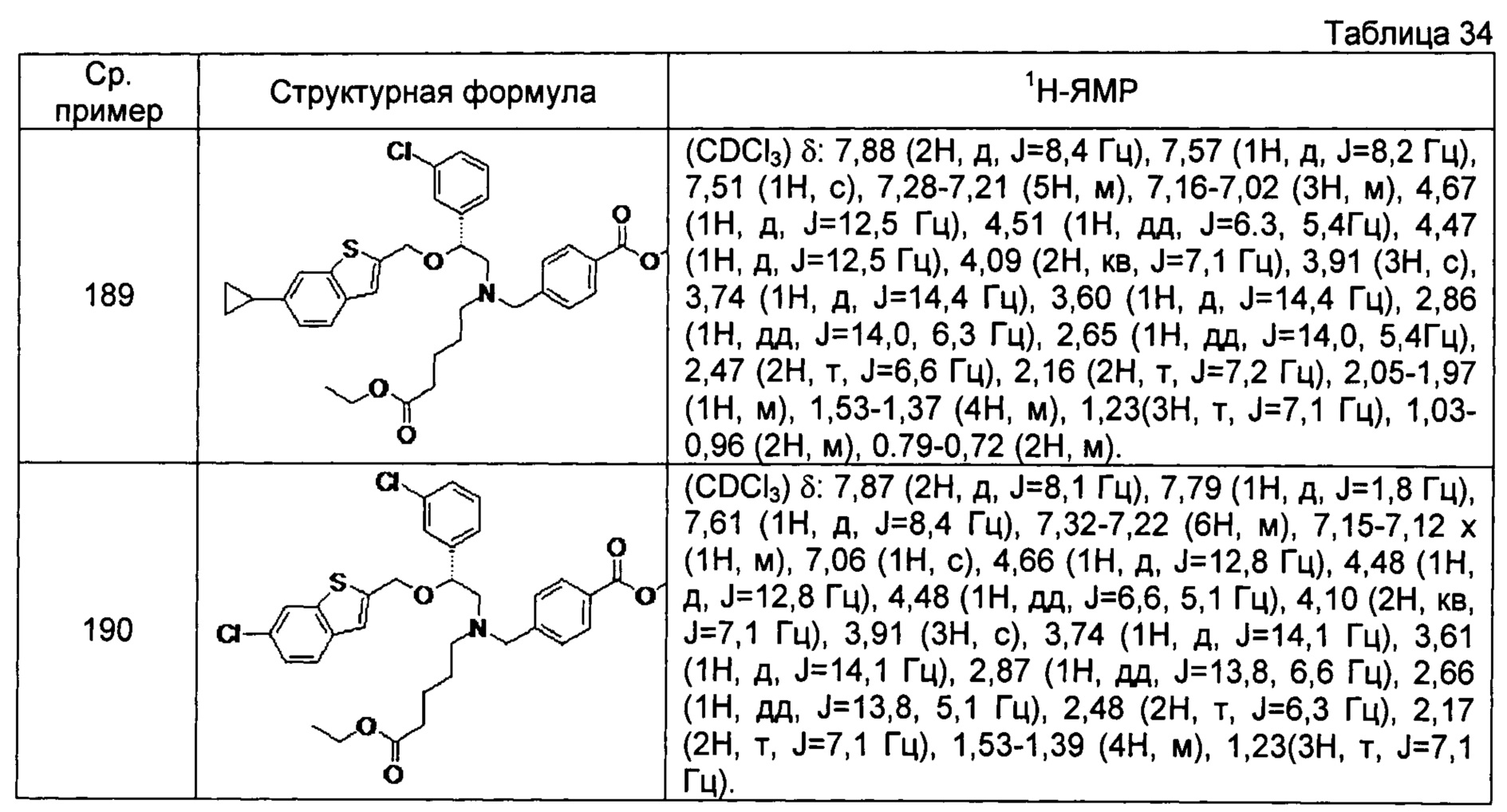
[0165] Соединение сравнительного примера 191
Метил-4-{[N-[(2R)-2-(3-хлорфенил)-2-[5-(4-метилфенилокси)тиофен-2-илметокси]этил]-N-(4- этоксикарбонилбутил)амино]метил}бензоат
Соединение сравнительного примера 84 (37 мг) растворяют в ТГФ (1,0 мл), добавляют три-н-бутилфосфин (25 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 30 минут. Затем добавляют метил терефтальальдегидат (15 мг), и реакционный раствор перемешивают при той же самой температуре в течение 18 часов. Добавляют боргидрид натрия (5 мг) и метанол (374 мкл), и реакционный раствор перемешивают при той же самой температуре в течение 2 часов. Добавляют водный раствор 1 моль/л хлористоводородной кислоты и реакционный раствор перемешивают, затем нейтрализуют насыщенным водным раствором бикарбоната натрия, и экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия, и затем растворитель выпаривают при пониженном давлении, полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 20 до 40% этилацетат/гексан), получая сырой продукт (масло бледно-желтого цвета). Сырой продукт растворяют в ацетонитриле (1,0 мл), и добавляют карбонат калия (12 мг) и метил-5-бромвалерат (11 мкл), и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 20 часов. Реакционный раствор охлаждают до комнатной температуры, гасят водой, экстрагируют этилацетатом, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 10 до 30% этилацетат/гексан), получая указанное в заголовке соединение (24 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,91 (2H, д, J=8,2 Гц), 7,27-7,23(5H, м), 7,14-7,07(3H, м),6,98 (2H, д, J=8,6 Гц), 6,58 (1H, д, J=3,7 Гц), 6,32 (1H, д, J=3,7 Гц), 4,47 (1H, д, J=12,3 Гц), 4,47 (1H, дд, J=6,7,5,3 Гц), 4,29 (1H, д, J=12,3 Гц), 4,10 (2H, кв, J=7,1 Гц), 3,91 (3H, с),3,74 (1H, д, J=14,2 Гц), 3,60 (1H, д, J=14,2 Гц), 2,82 (1H, дд, J=13,9,6,7 Гц), 2,63 (1H, дд, J=13,9,5,3 Гц), 2,46 (2H, тд, J=6,8, 2,9 Гц), 2,32 (3H, с), 2,18 (2H, т, J=7,1 Гц), 1,53-1,34(4H, м), 1,23(3H, т, J=7,1 Гц).
[0166] Соединение сравнительного примера 192
Метил-4-{[N-(4-метоксикарбонилбутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}-2-фторбензоат
Соединение сравнительного примера 86 (309 мг), и метил-2-фтор-4-формилбензоат (164 мг) растворяют в ТГФ (3,0 мл), добавляют уксусную кислоту (126 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 30 минут. Затем добавляют триацетоксиборгидрид натрия (474 мг), и реакционный раствор перемешивают при той же самой температуре в течение 17 часов. Добавляют насыщенный водный раствор бикарбоната натрия и реакционный раствор перемешивают, и затем экстрагируют хлороформом. Объединенные органические слои сушат над безводным сульфатом натрия, затем растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 10 до 60% этилацетат/гексан), получая продукт (156 мг) в виде бесцветного масла. Полученный продукт (150 мг) растворяют в ацетонитриле (2,0 мл), добавляют карбонат калия (83 мг) и метил-5-бромвалерат (67 мкл), и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 2 дней. Реакционный раствор охлаждают до комнатной температуры, гасят водой, и экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 6 до 40% этилацетат/гексан), получая указанное в заголовке соединение (120 мг) в виде бесцветного масла.
1H-ЯМР(CDCl3) δ: 7,83-7,76 (1H, м),7,39-7,24 (7H, м), 7,22-7,12 (7H, м),7,05-6,98 (2H, м), 4,49 (1H, дд, J=7,1,4,9 Гц), 4,42 (1H, д, J=11,5 Гц), 4,23 (1H, д, J=11,5 Гц), 3,92(3H, с), 3,74 (1H, д, J=14,7 Гц), 3,64 (3H, с), 3,59 (1H, д, J=14,7 Гц), 2,91 (4H, с), 2,87 (1H, дд, J=13,5, 7,1 Гц), 2,66 (1H, дд, J=13,5,4,9 Гц), 2,55-2,40 (2H, м), 2,20 (2H, т, J=7,2 Гц), 1,60-1,34(4H, м).
[0167] Соединение сравнительного примера 193
Метил-4-{[N-(4-бензилоксикарбонил-3,3-диметилбутил)-N-[2-[4-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензоат
Указанное в заголовке соединение (303 мг) получают в виде бесцветного масла из соединения сравнительного примера 102 (215 мг) и соединения сравнительного примера 8 (105 мг) способом, аналогичным способу сравнительного примера 101.
1H-ЯМР(CDCl3) δ: 7,90 (2H, д, J=8,4 Гц), 7,37-7,27 (13H, м),7,25-7,15(6H, м),7,12 (2H, д, J=8,2 Гц), 5,05 (2H, с), 4,46 (1H, дд, J=6,0, 4,9 Гц), 4,41 (1H, д, J=11,7 Гц), 4,22 (1H, д, J=11,7 Гц), 3,90 (3H, с), 3,72 (1H, д, J=14,5 Гц), 3,59 (1H, д, J=14,5 Гц), 2,89 (4H, с),2,86 (1H, дд, J=13,7, 6,0 Гц), 2,63 (1H, дд, J=13,7, 4,9 Гц), 2,54-2,48 (2H, м), 2,15 (2H, с), 1,45 (2H, т, J=8,2 Гц), 0,89 (6H, с).
[0168] Соединение сравнительного примера 194
Метил-4-{[N-(4-этоксикарбонилбутил)-N-[2-(3-метилфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензоат
Соединение сравнительного примера 164 (257 мг) растворяют в 1,4-диоксане (4,0 мл), и добавляют метилбороновую кислоту (72 мг), трис(дибензилиденацетон)дипалладий (37 мг), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (38 мг) и карбонат калия (166 мг) в атмосфере аргона, и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 18 часов. Реакционный раствор охлаждают до комнатной температуры, фильтруют через целит, и промывают этилацетатом, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 5 до 50% этилацетат/гексан), получая указанное в заголовке соединение (201 мг) в виде масла светло-желтого цвета.
1H-ЯМР(CDCl3) δ: 7,91 (2H, д, J=8,1 Гц), 7,30-7,25 (5H, м), 7,23-7,06 (10H, м), 4,45 (1H, дд, J=7,5, 4,6 Гц), 4,43 (1H, д, J=11,7 Гц), 4,24 (1H, д, J=11,7 Гц), 4,10 (2H, кв, J=7,1 Гц), 3,90(3H, с), 3,76 (1H, д, J=14,3 Гц), 3,61 (1H, д, J=14,3 Гц), 2,91 (4H, с), 2,87 (1H, дд, J=13,9, 7,5 Гц), 2,65 (1H, дд, J=13,9, 4,6 Гц), 2,50-2,45 (2H, м), 2,34(3H, с), 2,17 (2H, т, J=7,2 Гц), 1,56-1,40 (4H, м), 1,23(3H, т, J=7,1 Гц).
[0169] Соединение сравнительного примера 195
Этил-4-{[N-(4-этоксикарбонилбутил)-N-[2-(4-метилфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензоат
Указанное в заголовке соединение (155 мг) получают в виде масла светло-желтого цвета из соединения сравнительного примера 145 (230 мг) способом, аналогичным способу сравнительного примера 194. 1H-ЯМР(CDCl3) δ: 7,90 (2H, д, J=8,2 Гц), 7,28-7,26 (3H, м), 7,21-7,12 (12H, м),4,45 (1H, дд, J=7,1, 4,9 Гц), 4,41 (1H, д, J=11,5 Гц), 4,22 (1H, д, J=11,5 Гц), 4,09 (2H, кв, J=7,1 Гц), 3,90 (3H, с), 3,76 (1H, д, J=14,5 Гц), 3,61 (1H, д, J=14,5 Гц), 2,90 (4H, с), 2,87 (1H, дд, J=13,6, 7,1 Гц), 2,64 (1H, дд, J=13,6, 4,9 Гц), 2,50-2,45 (2H, м), 2,36(3H, с), 2,17 (2H, т, J=7,1 Гц), 1,48-1,40 (2H, м), 1,23(3H, т, J=7,1 Гц).
[0170] Соединение сравнительного примера 196
Метил-4-{[N-[(2R)-2-(3-цианофенил)-2-[4-(2-фенилэтил)бензилокси]этил]-N-(4- этоксикарбонилбутил)амино]метил}бензоат
Соединение сравнительного примера 170 (200 мг) растворяют в ДМФ (3,0 мл), и добавляют трис(дибензилиденацетон)дипалладий (57 мг), цианид цинка (73 мг) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (37 мг) в атмосфере аргона, и реакционный раствор перемешивают при 130°C при микроволновом облучении в течение 2 часов. Реакционный раствор охлаждают до комнатной температуры, гасят, используя 28% водный раствор аммония, и затем экстрагируют диэтиловым эфиром. Объединенные органические слои промывают насыщенным солевым раствором, затем сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 15 до 50% этилацетат/гексан), получая указанное в заголовке соединение (167 мг) в виде масла светло-желтого цвета.
1H-ЯМР(CDCl3) δ: 7,90 (2H, д, J=8,4 Гц), 7,61-7,53 (2H, м), 7,49-7,39 (2H, м), 7,33-7,26 (2H, м), 7,23- 7,13(9H, м), 4,45 (1H, дд, J=6,7, 5,7 Гц), 4,40 (1H, д, J=11,5 Гц), 4,24 (1H, д, J=11,5 Гц), 4,11 (2H, кв, J=7,1 Гц), 3,91 (3H, с), 3,73 (1H, д, J=14,2 Гц), 3,57 (1H, д, J=14,2 Гц), 2,91(4H, с), 2,84 (1H, дд, J=13,9, 6,7 Гц), 2,63 (1H, дд, J=13,9, 5,7 Гц), 2,48(2H, тд, J=6,8, 3,1 Гц), 2,19 (2H, т, J=7,2 Гц), 1,54-1,38 (4H, м),1,24 (3H, т, J=7,1 Гц).
[0171] Соединения сравнительных примеров 197 и 198, полученные способом, аналогичным способу сравнительного примера 196, с использованием соединений сравнительных примеров 171 и 172 представлены в таблице 35.
[0172]
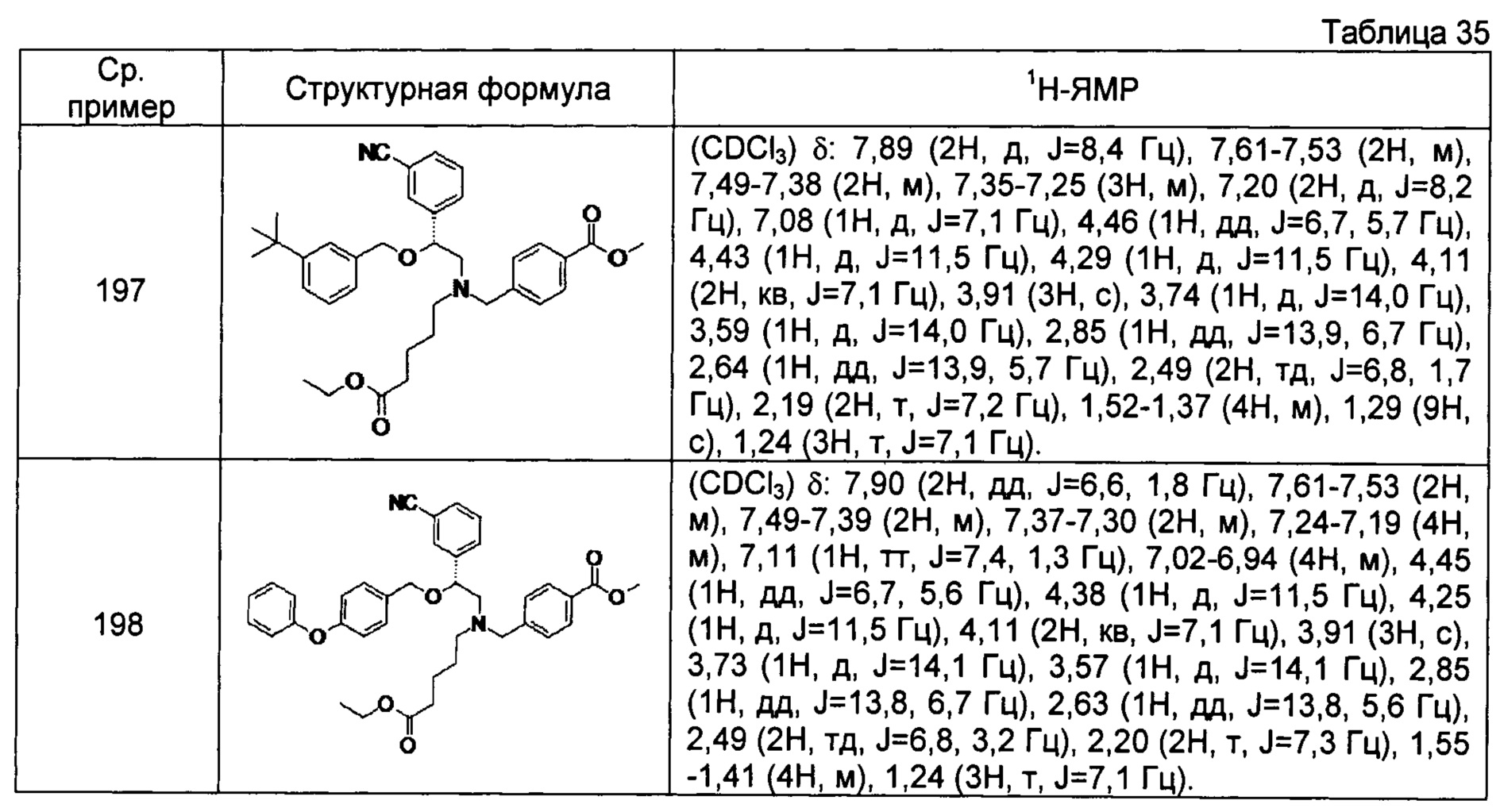
[0173] Пример 1
4-{[N-[2-(4-трет-бутилбензилокси)-2-фенилэтил]-N-(4-карбоксибутил)амино]метил}бензойная кислота
Соединение сравнительного примера 143 (270 мг) растворяют в метаноле (3,0 мл), добавляют 2 моль/л водный раствор гидроксида натрия (0,9 мл), и реакционный раствор перемешивают при 50°C в течение 3 часов. Реакционный раствор охлаждают до комнатной температуры, и растворитель выпаривают при пониженном давлении. pH полученного остатка доводят до 4, используя 2 моль/л хлористоводородную кислоту, и затем экстрагируют смешанным раствором метанола и хлороформа (1:9), и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении, затем полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 2% до 10% метанол/хлороформ), получая указанное в заголовке соединение (234 мг) в виде аморфного вещества белого цвета.
1H-ЯМР(CD3OD) δ: 7,99 (2H, д, J=8,2 Гц), 7,49-7,32 (9H, м),7,25 (2H, д, J=8,2 Гц), 4,69 (1H, дд, J=9,8, 4,9 Гц), 4,45 (1H, д, J=11,4 Гц), 4,23 (1H, д, J=11,4 Гц), 4,15 (2H, с),3.22 (1H, дд, J=13,7, 9,8 Гц), 3,02 (1H, дд, J=13,7, 4,9 Гц), 2,95-2,81 (2H, м), 2,25 (2H, т, J=7,0 Гц), 1,76-1,60 (2H, м), 1,57-1,44 (2H, м), 1,30 (9H, с). ESI-МС найдено: m/z 518(M+H)+
[0174] Соединения примеров 2-56, полученные способом, аналогичным способу примера 1, с использованием соединений соответствующих сравнительных примеров, представлены в таблицах 36-56.
[0175]
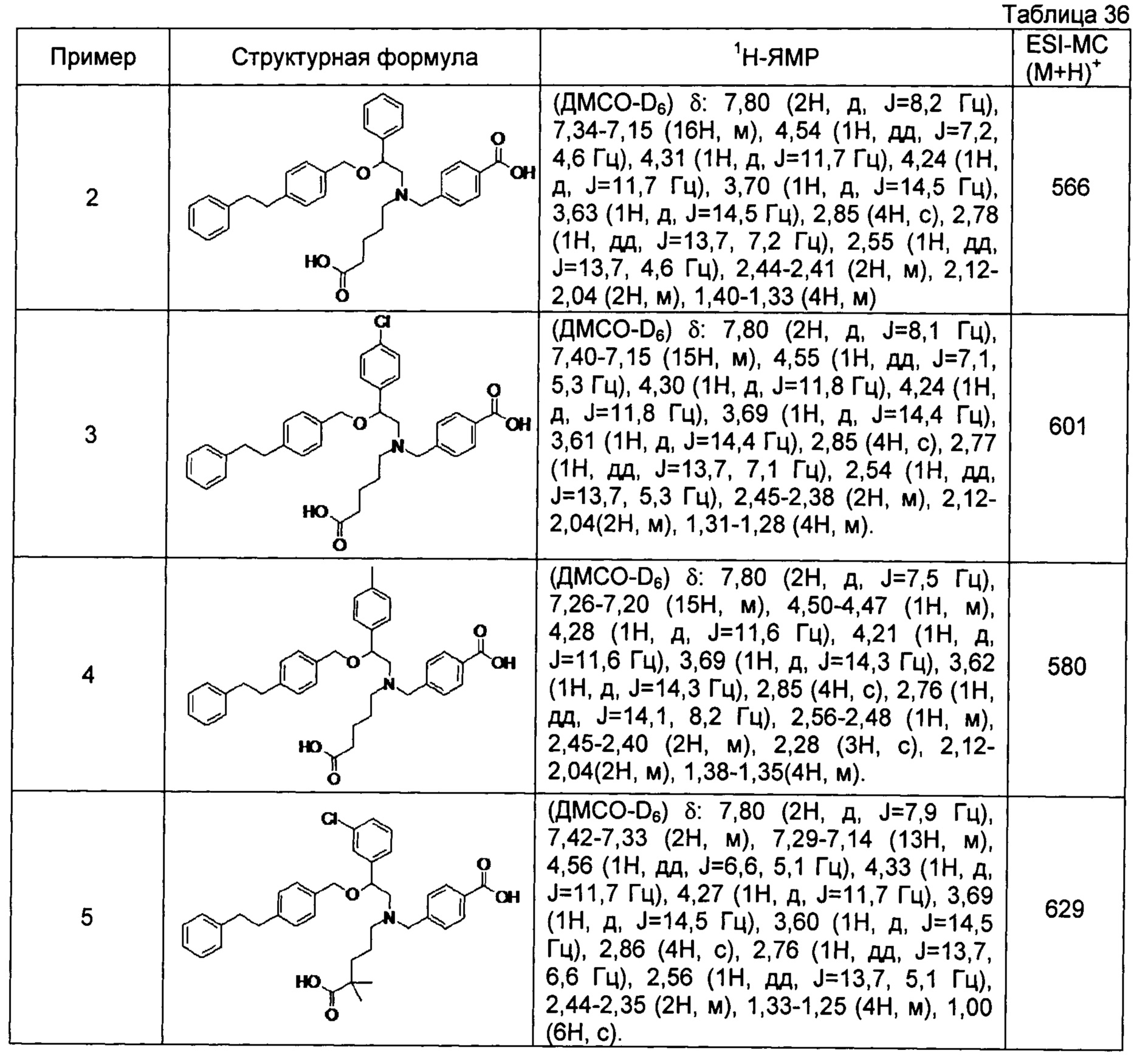
[0176]
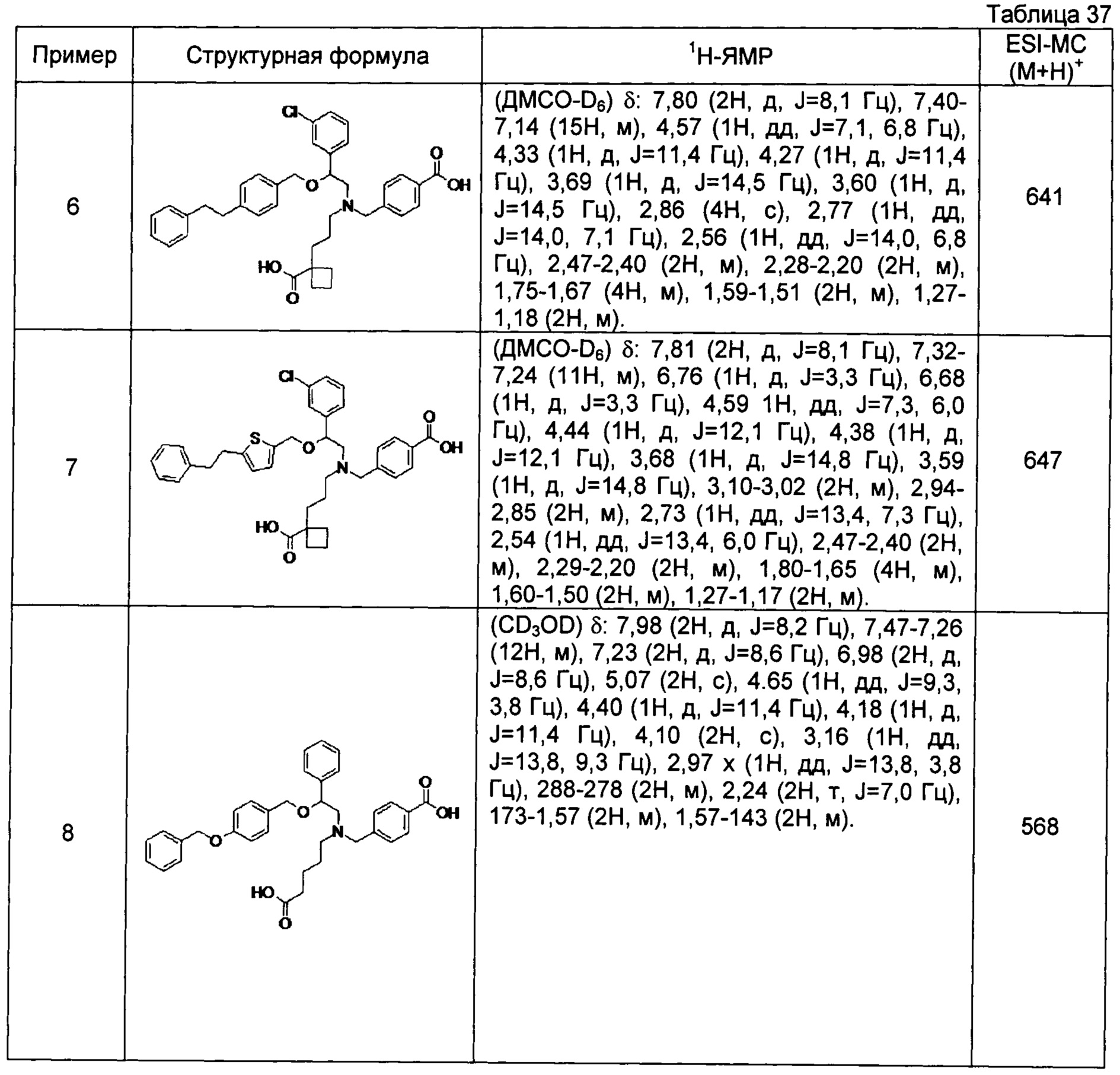
[0177]
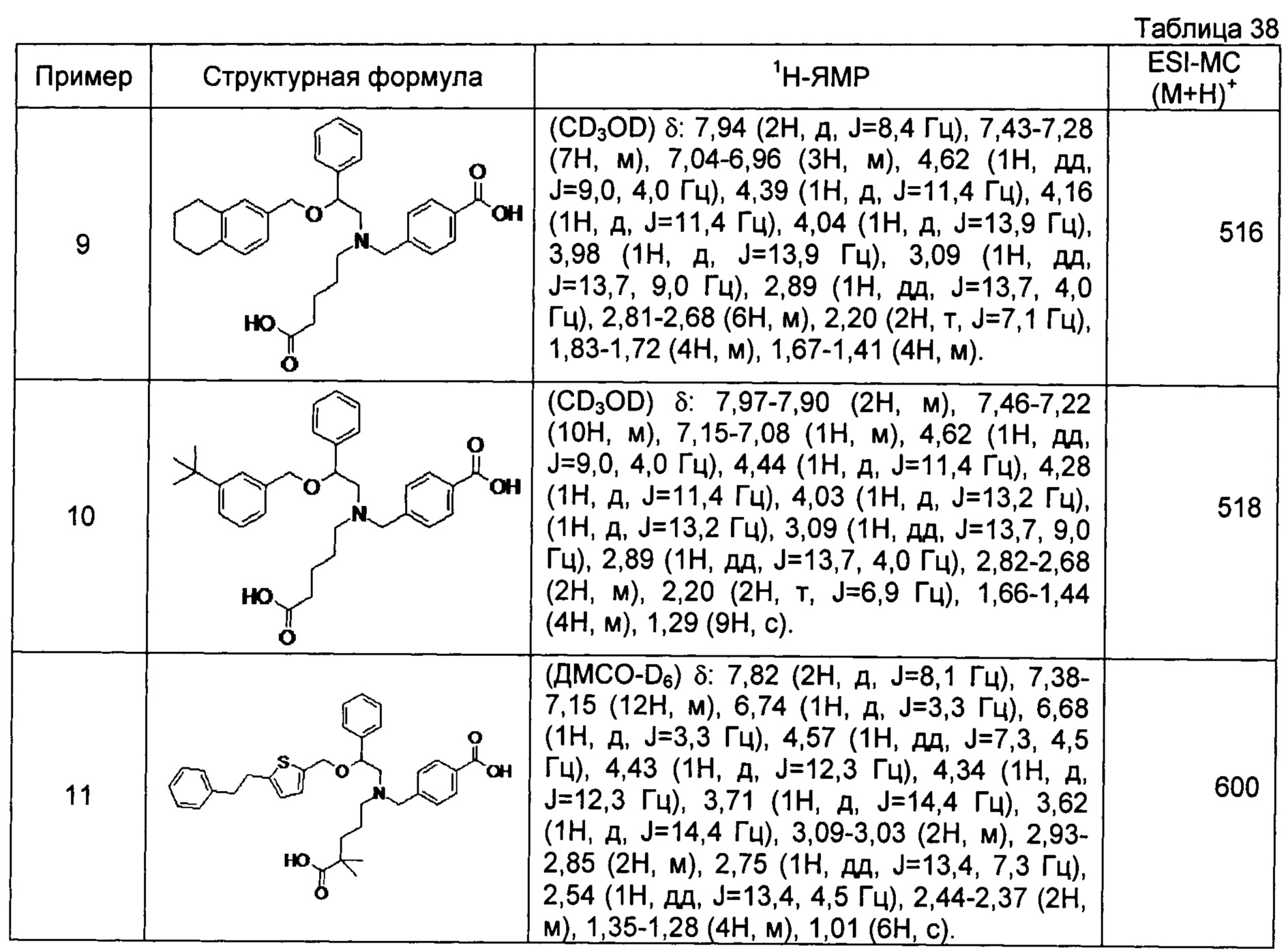
[0178]
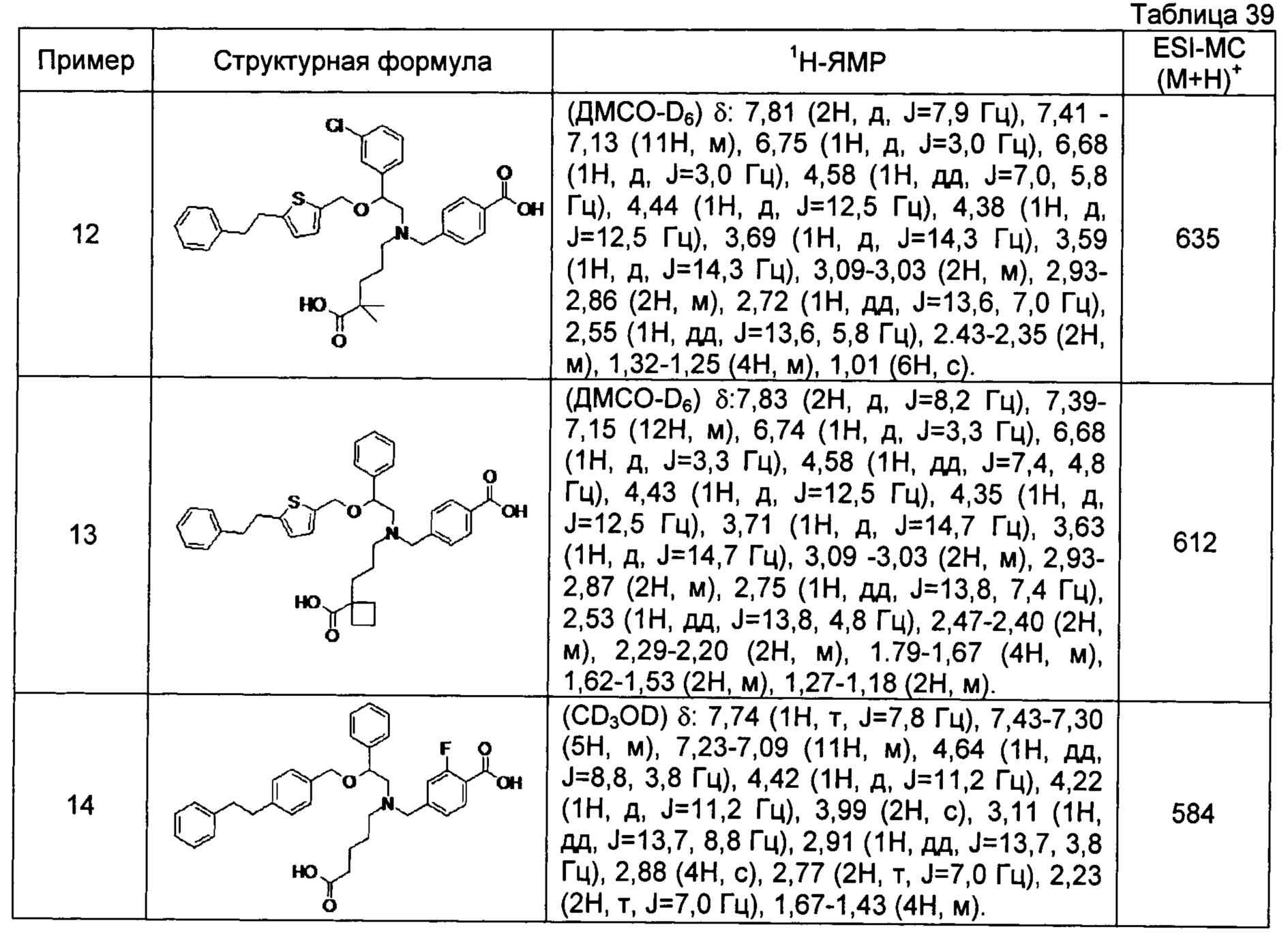 9
9
[0179]
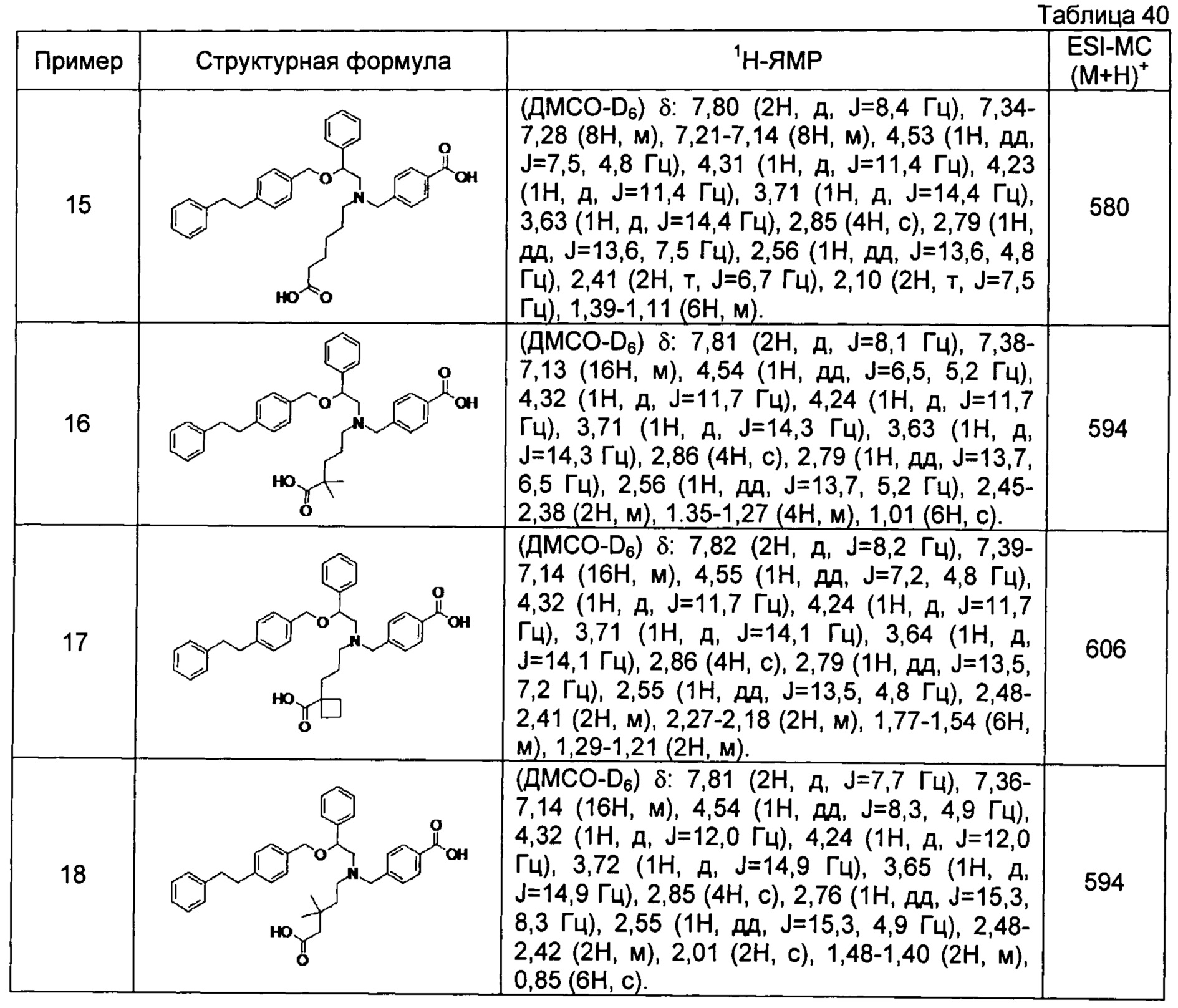
[0180]
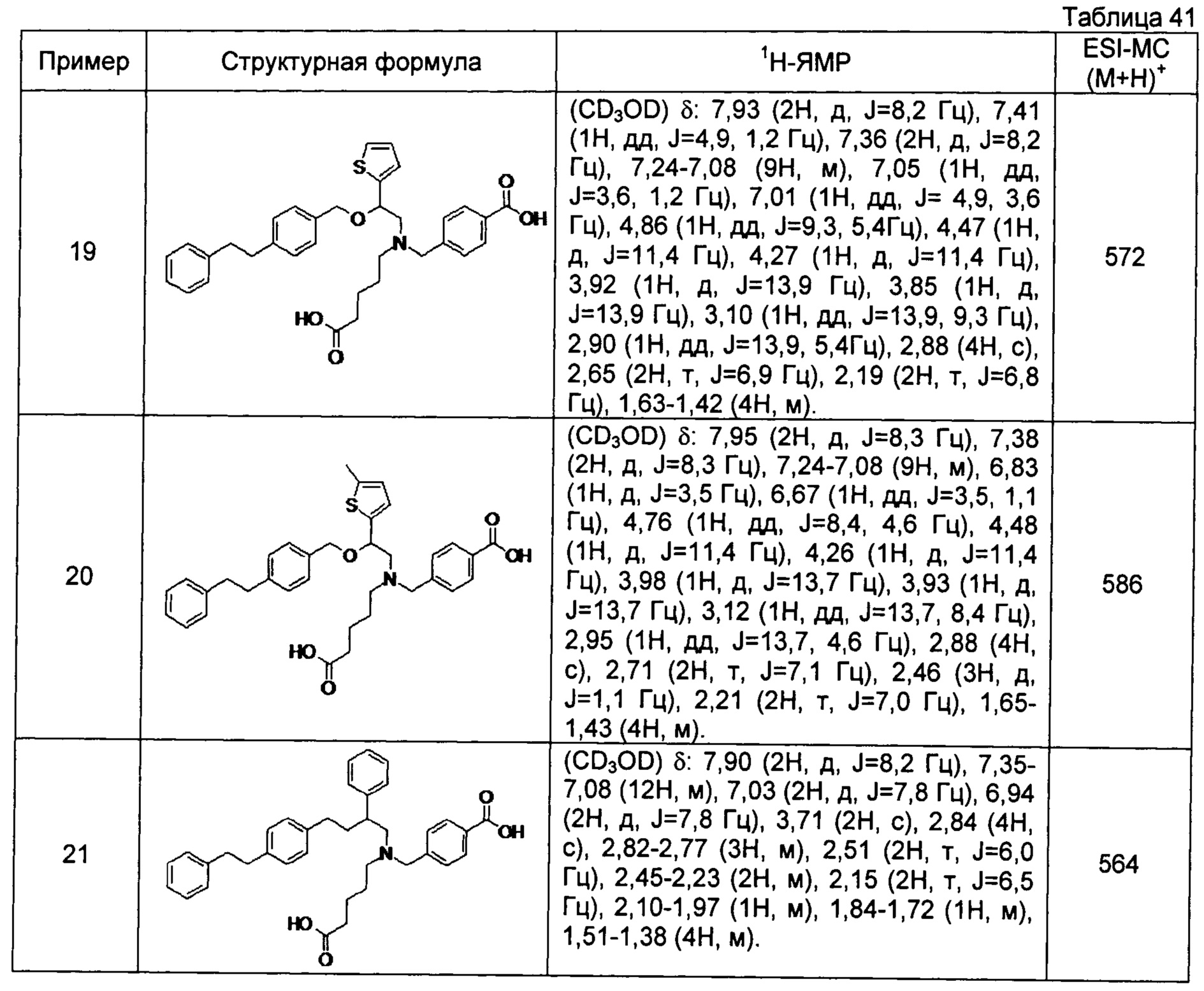
[0181]
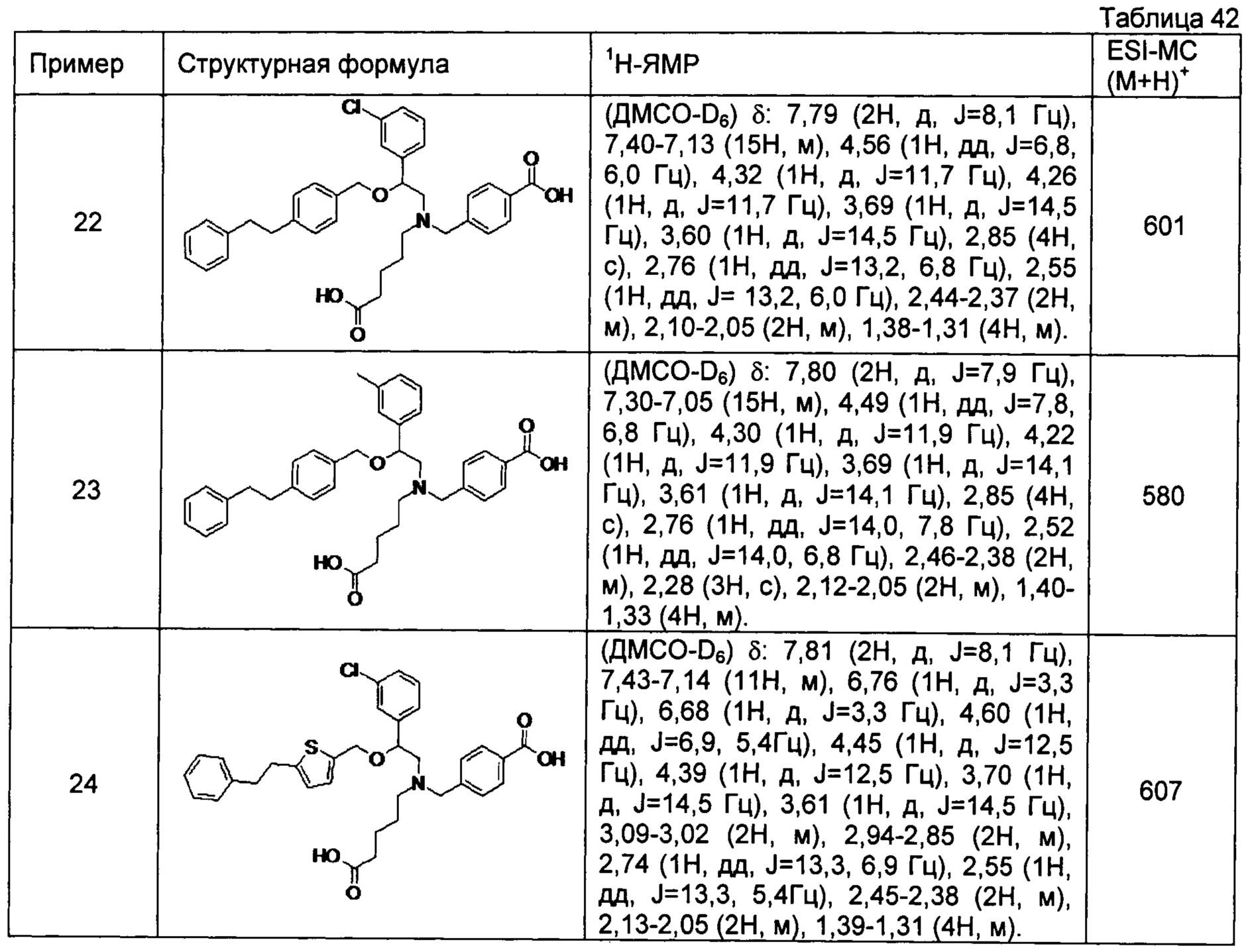 2
2
[0182]
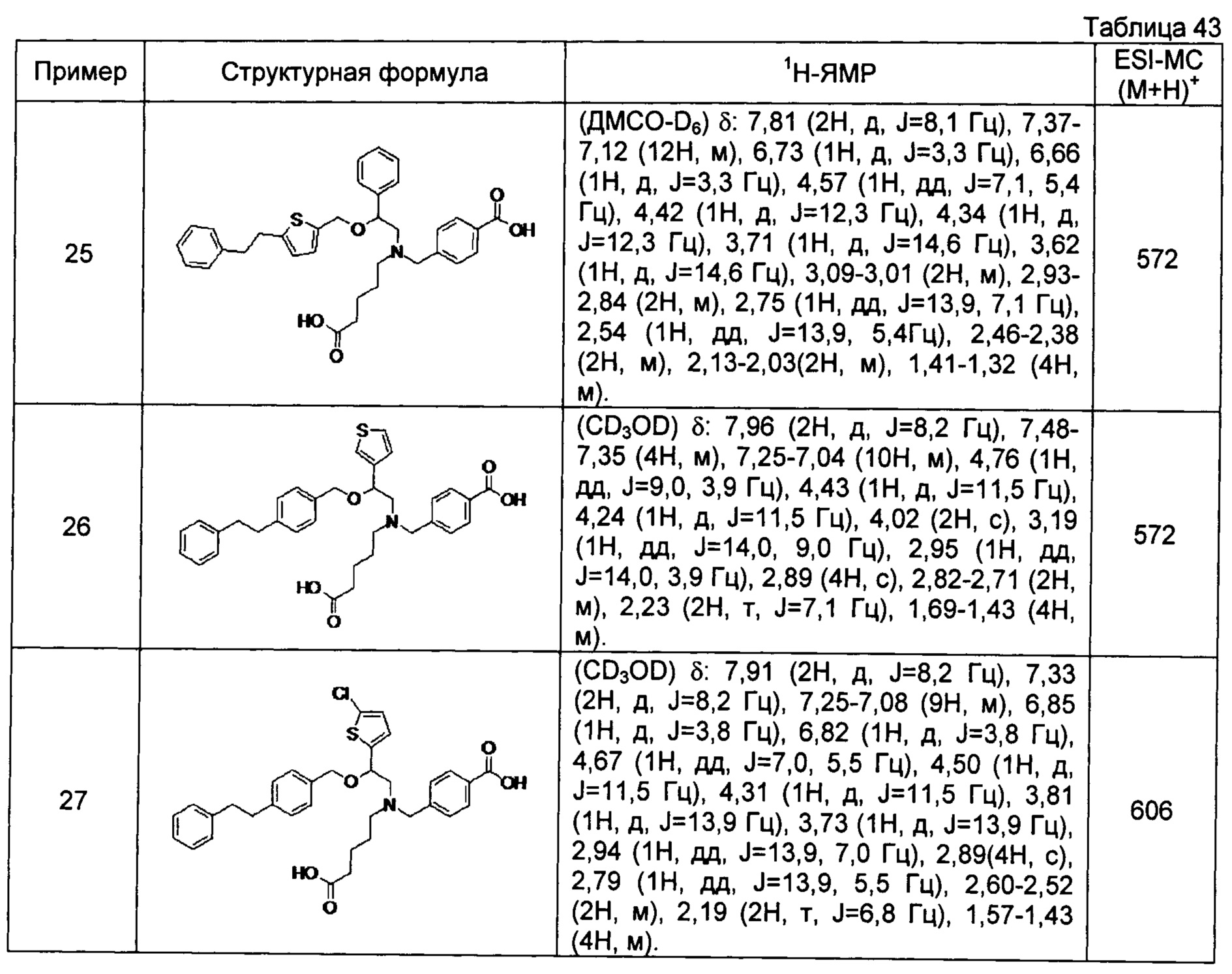 3
3
[0183]
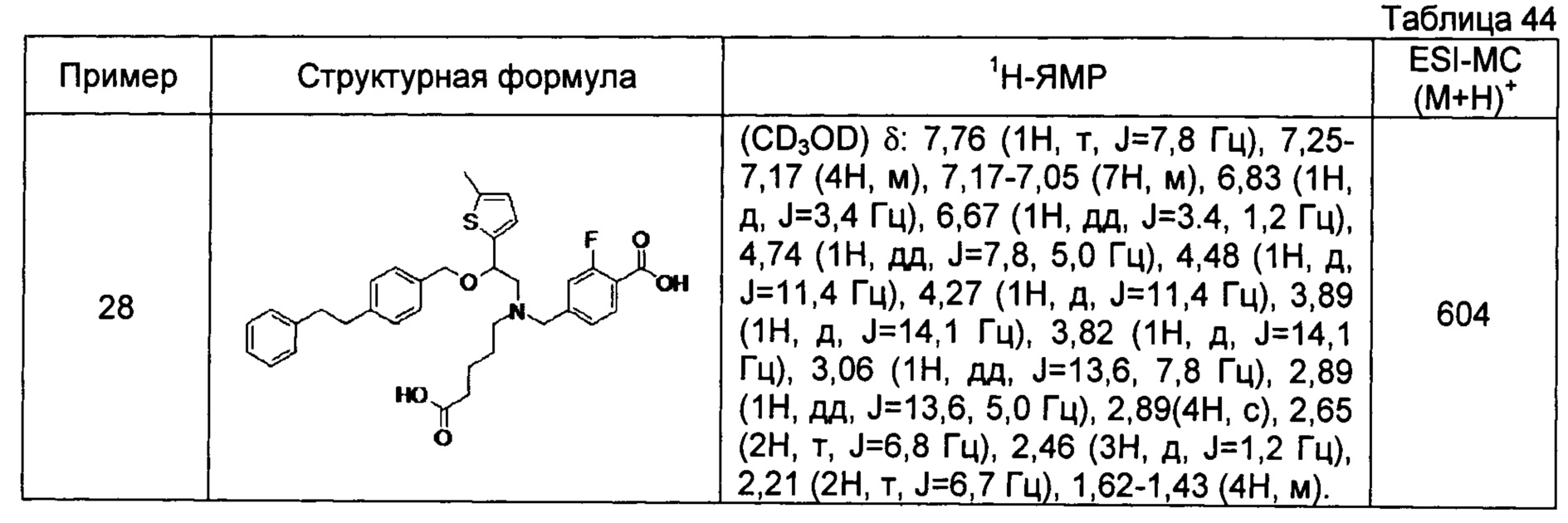
[0184]
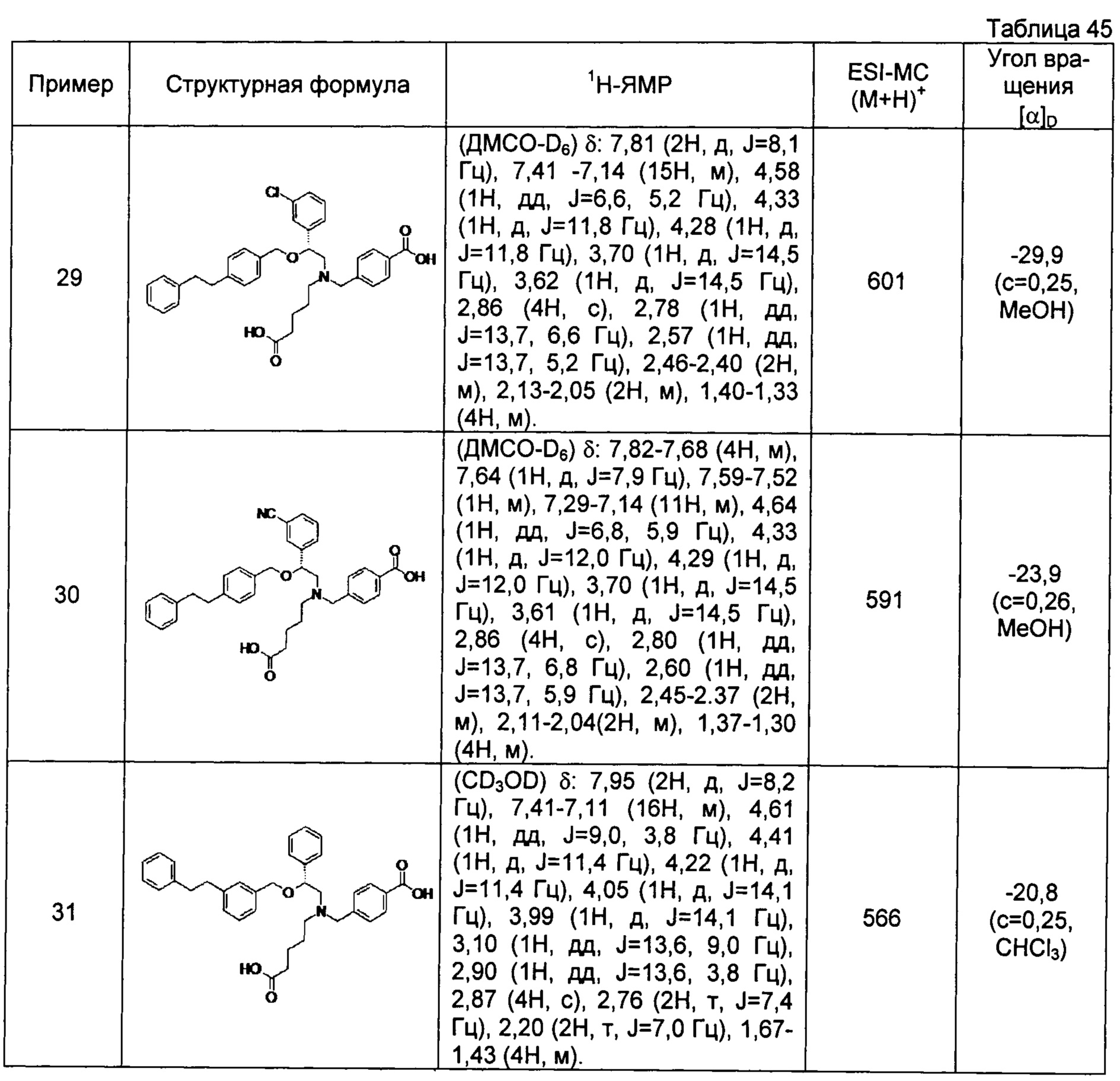 5
5
[0185]
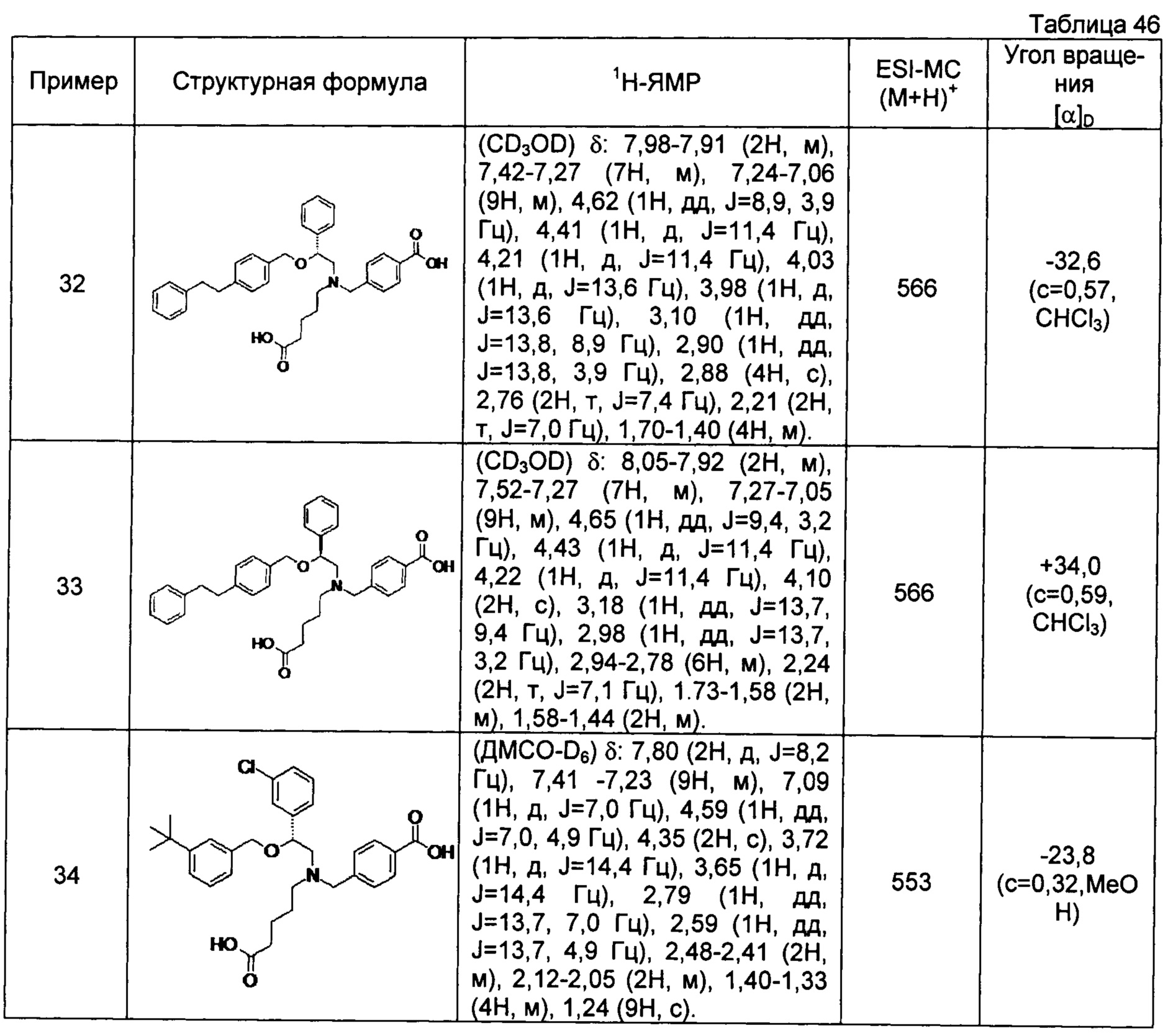
[0186]
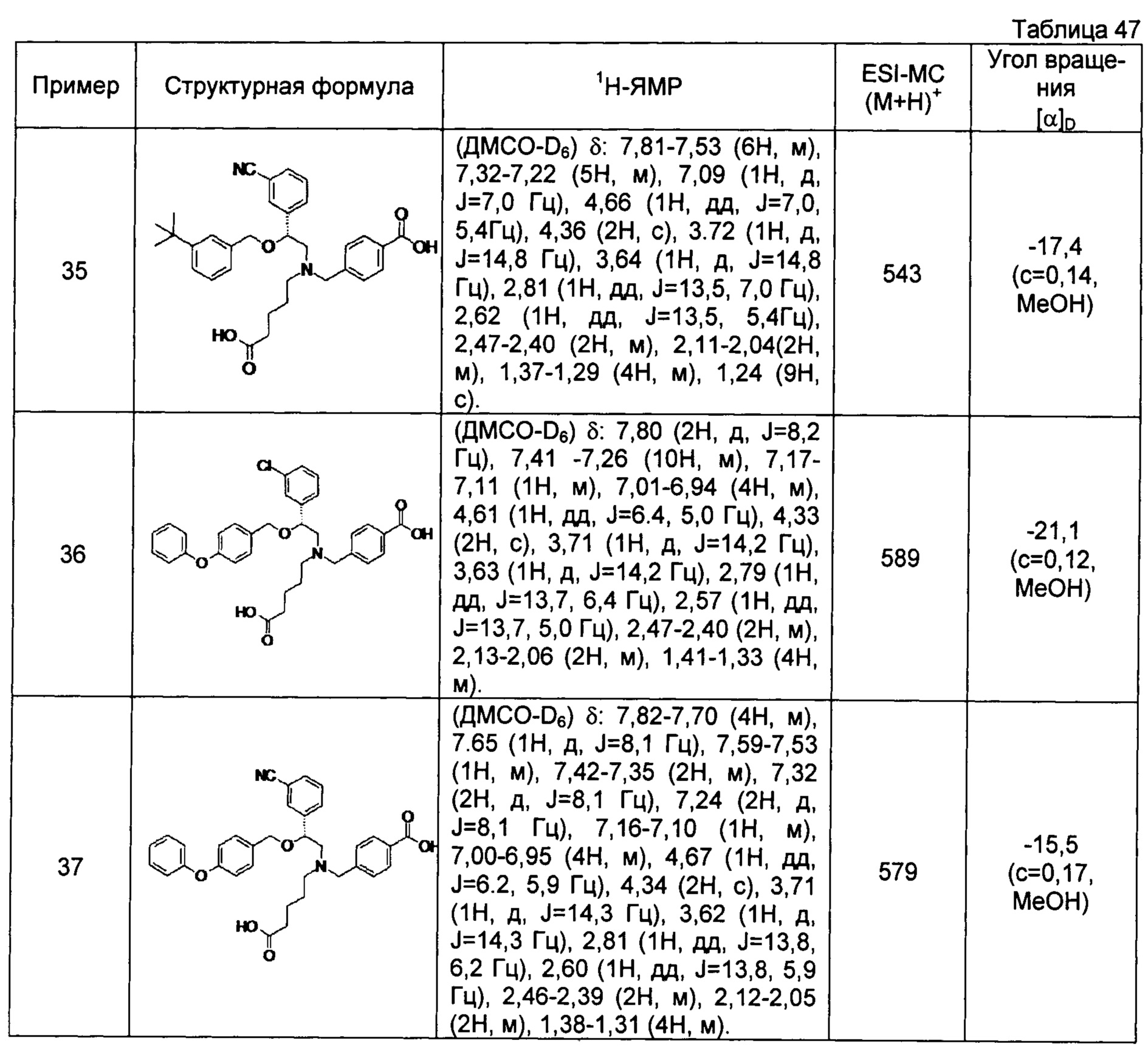
[0187]
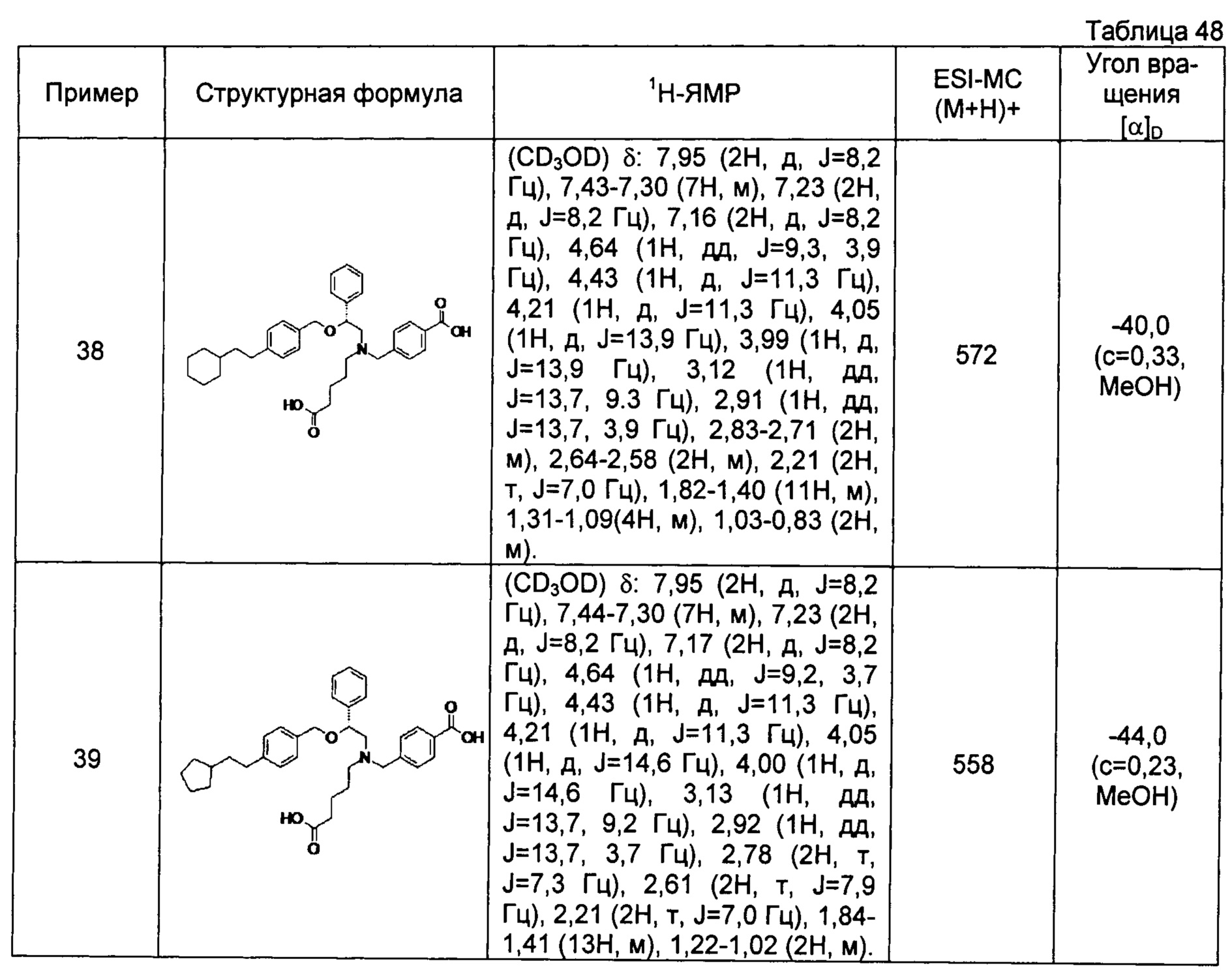
[0188]
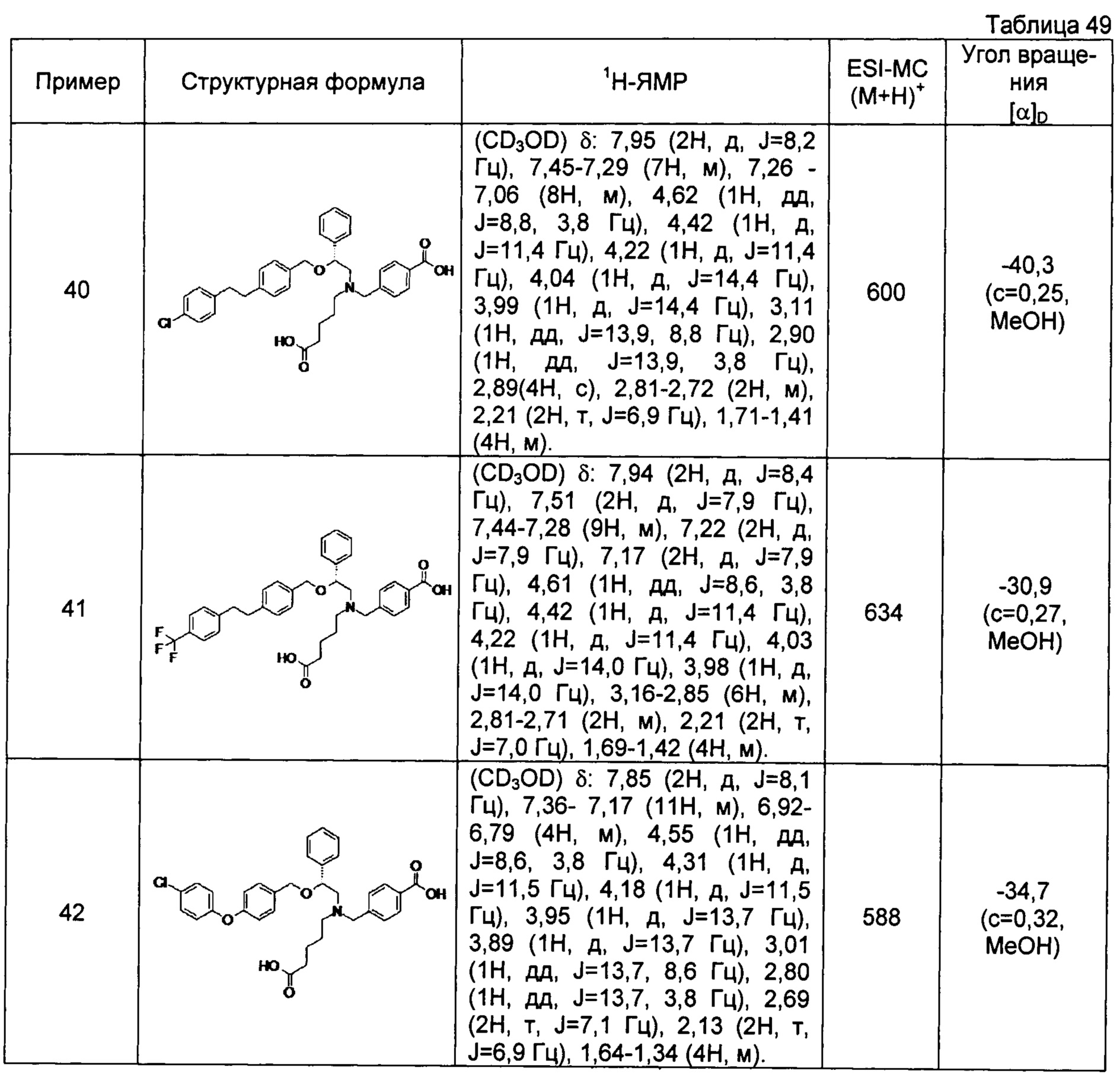
[0189]
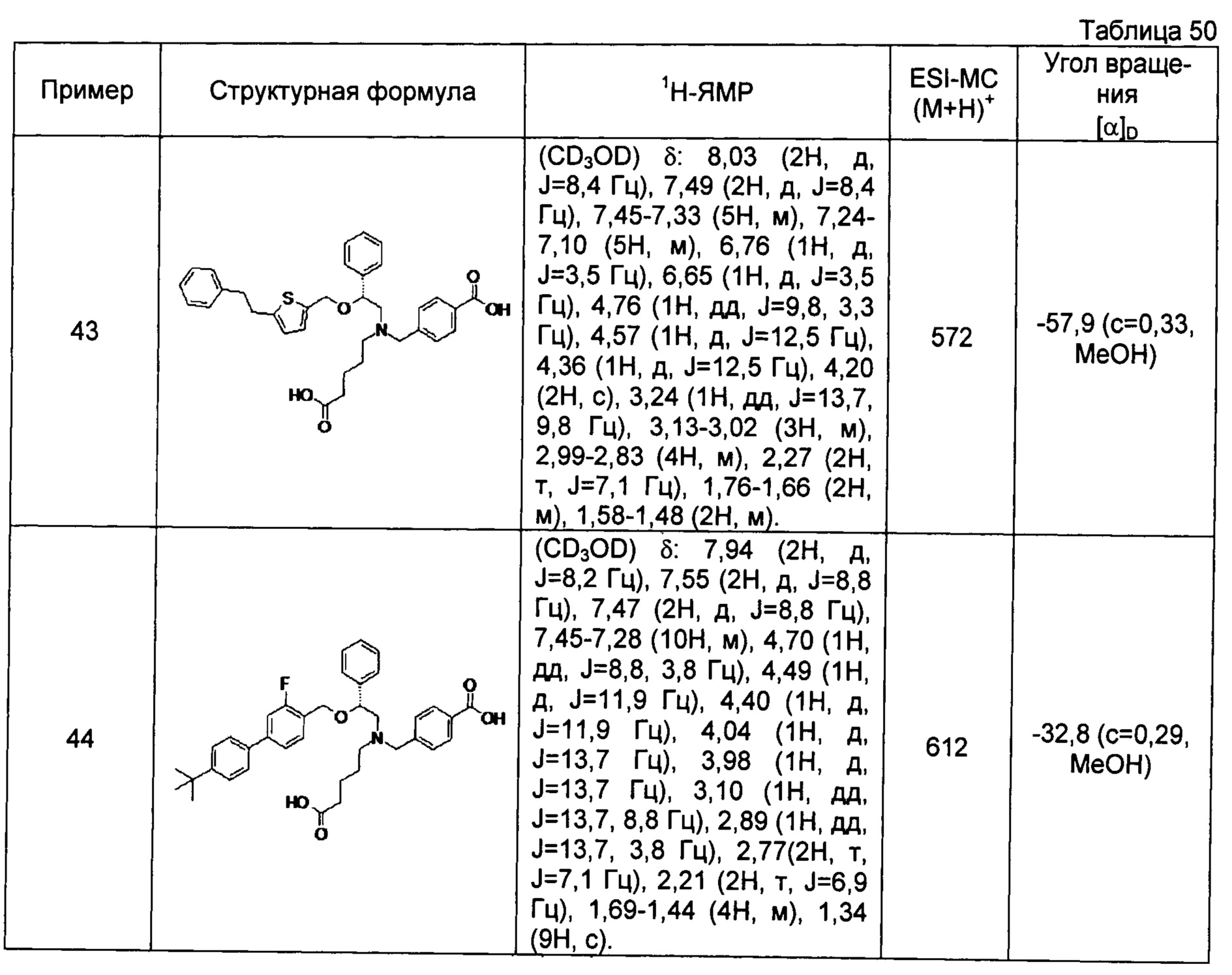
[0190]
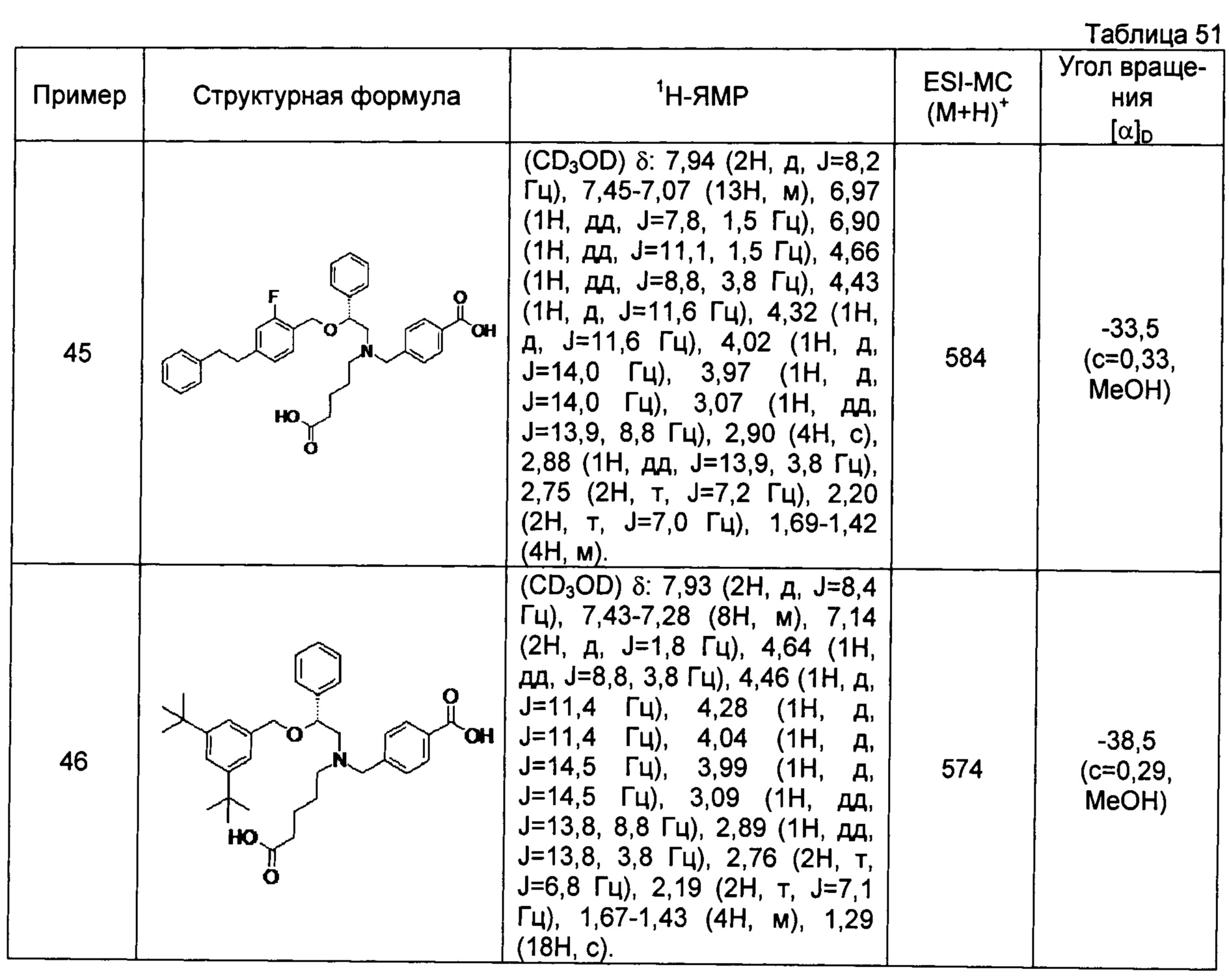
[0191]
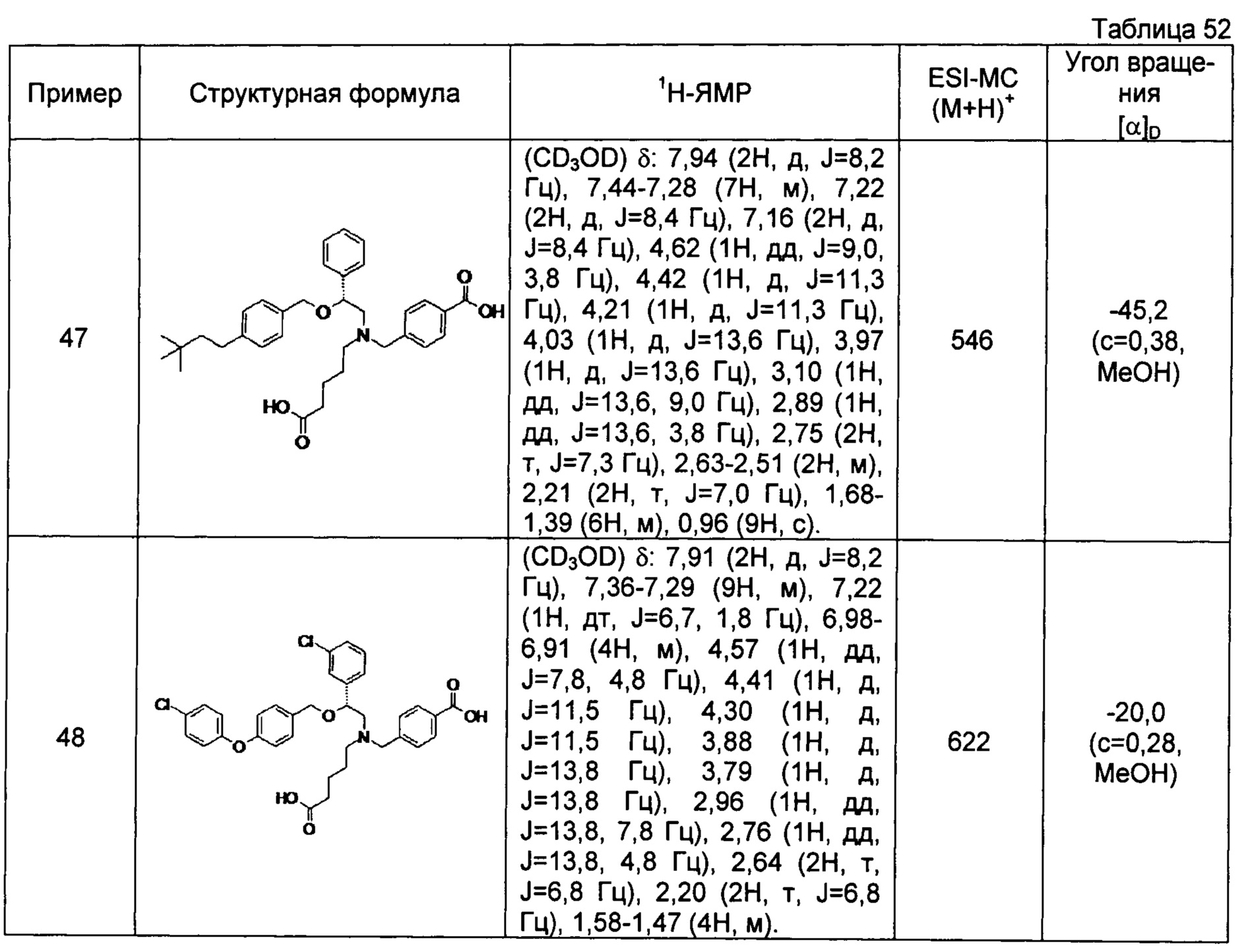
[0192]
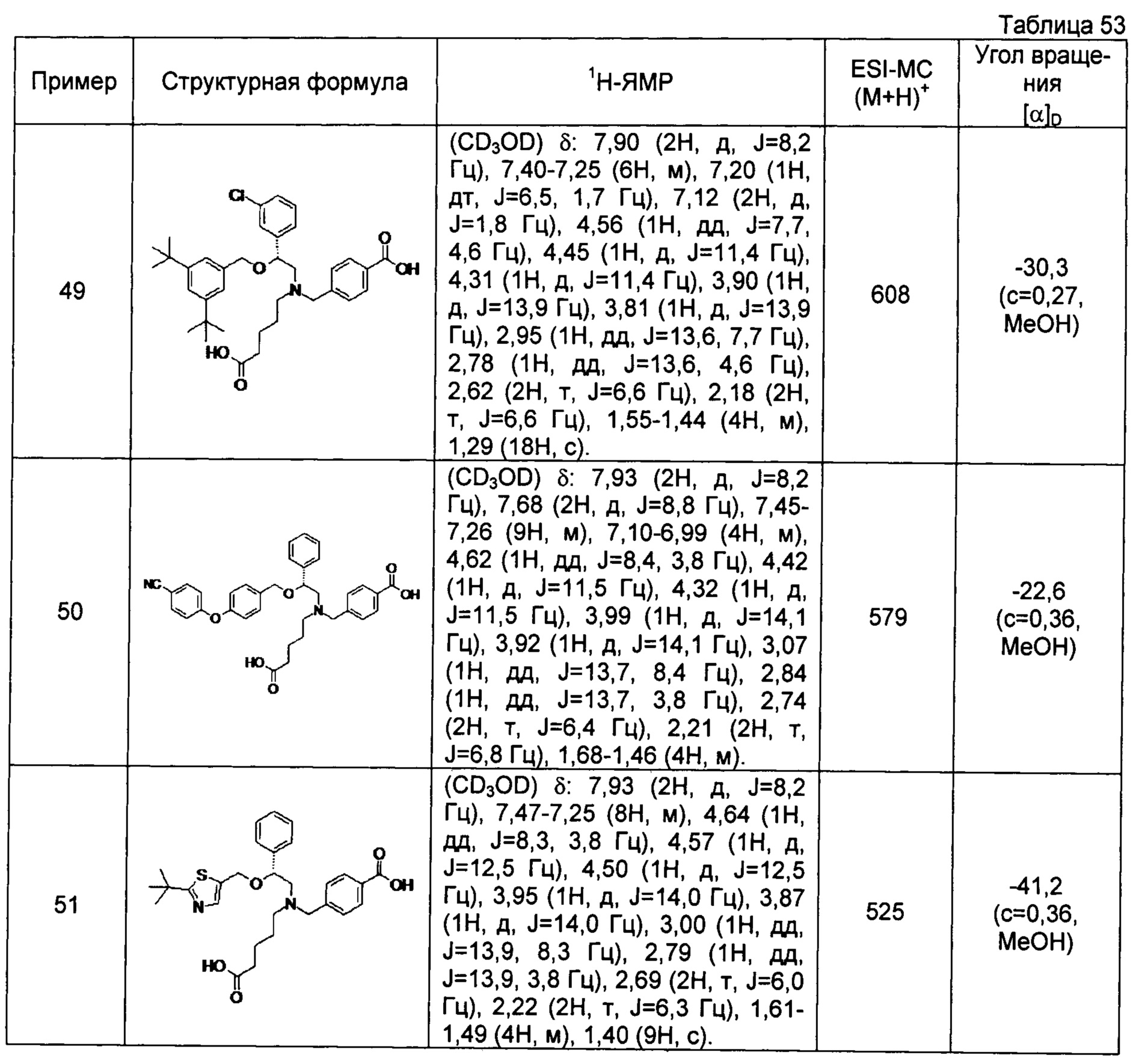
[0193]
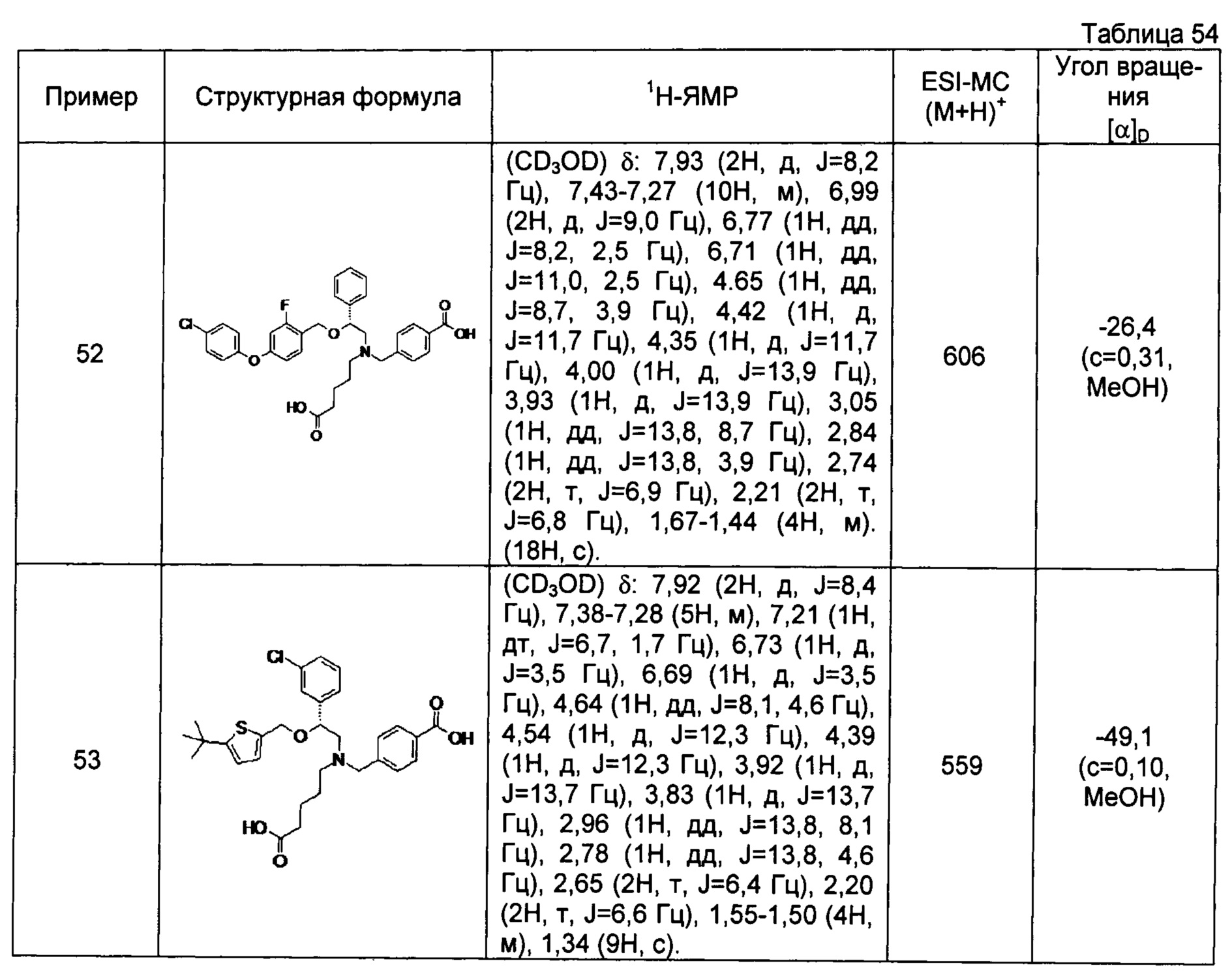
[0194]
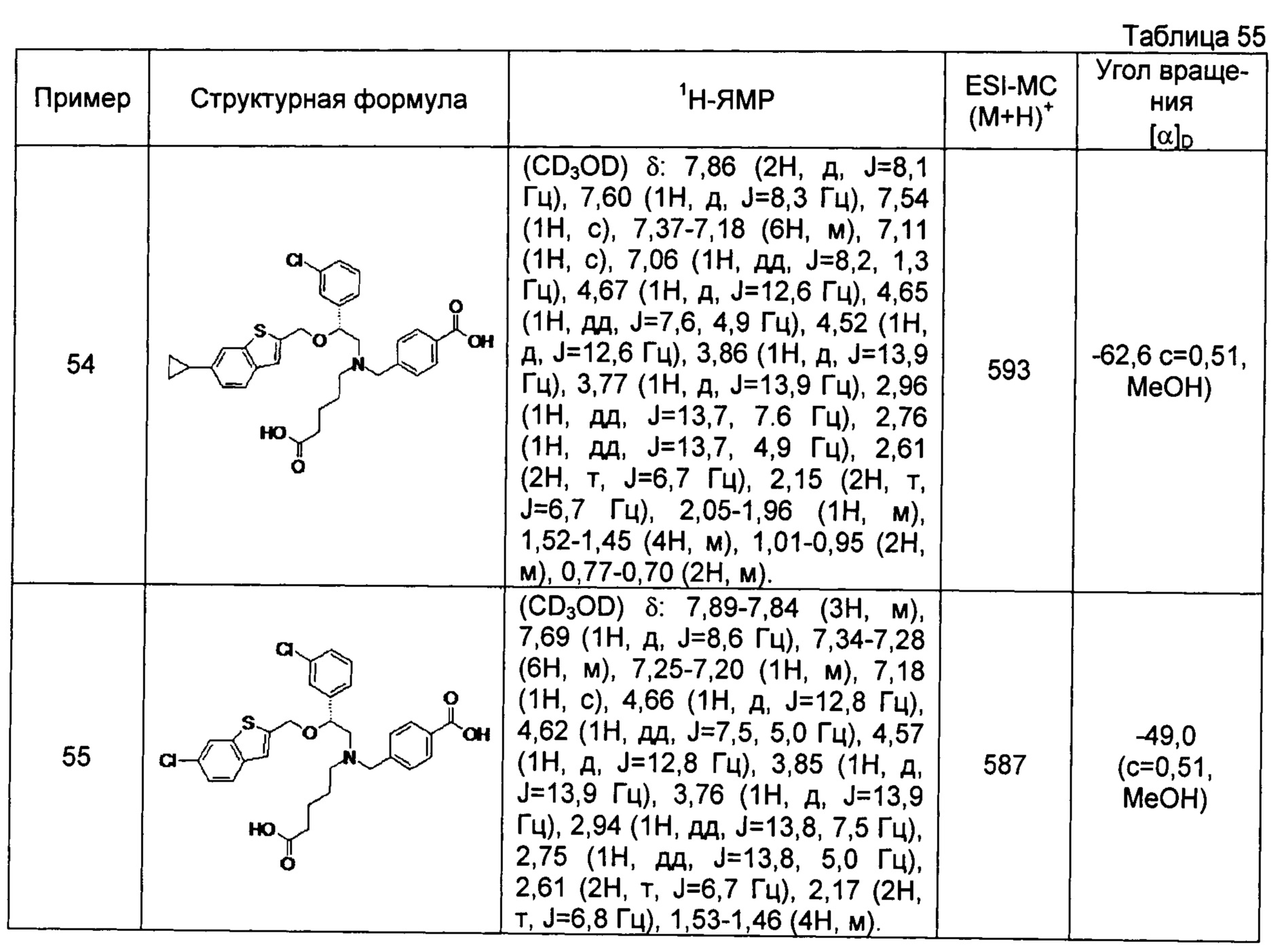
[0195]
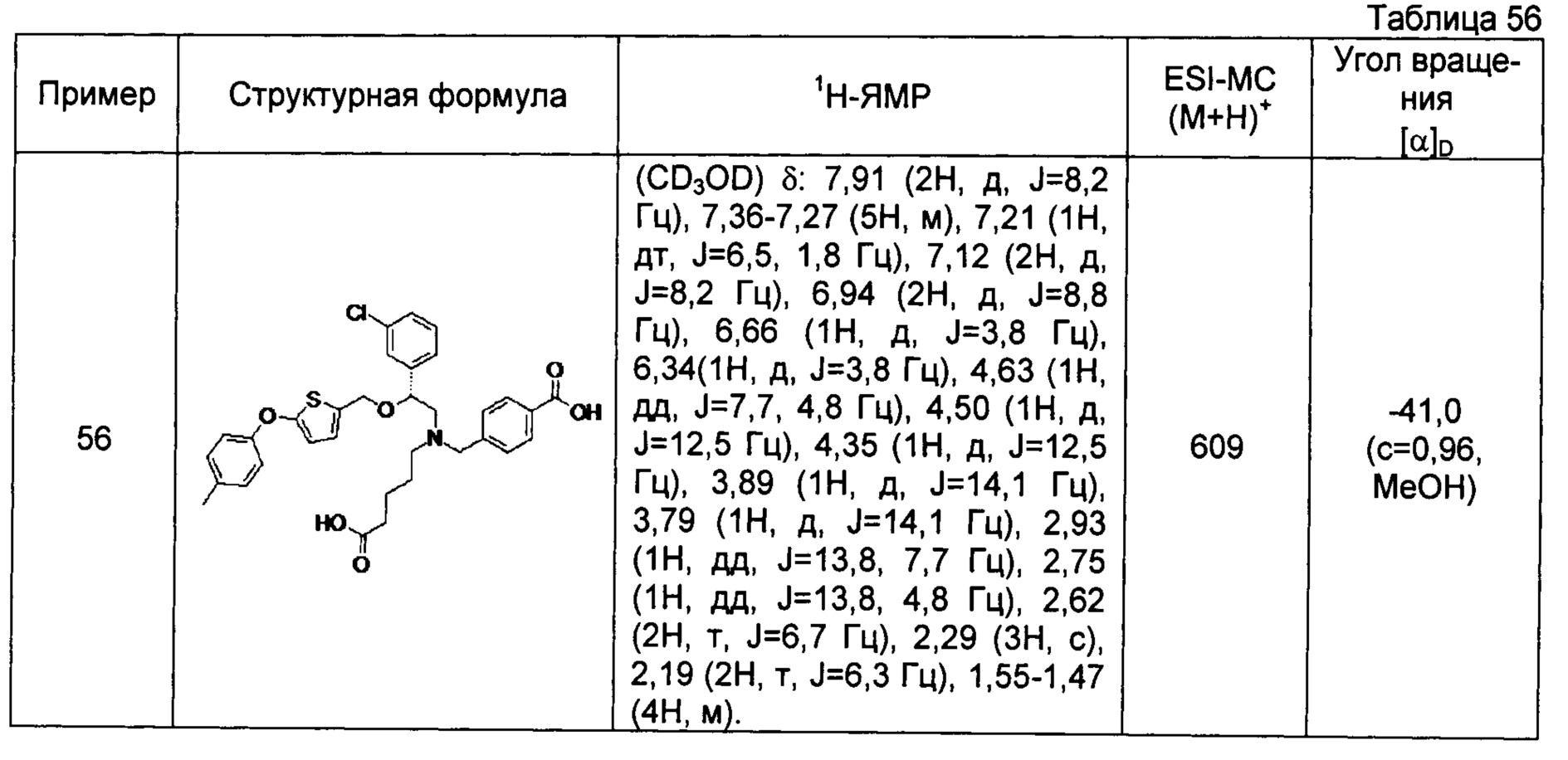
[0196] Пример 57
4-{[N-(4-карбокси-3,3-диметилбутил)-N-[2-(3-хлорфенил)-2-[4-(2-фенилэтил)бензилокси]этил]амино]метил}бензойная кислота
Соединение сравнительного примера 115 (206 мг) растворяют в ТГФ (2,0 мл), добавляют уксусную кислоту (57 мкл), и реакционный раствор перемешивают при комнатной температуре в течение 10 минут. Затем добавляют триацетоксиборгидрид натрия (254 мг), и реакционный раствор перемешивают при той же самой температуре в течение 19 часов. Добавляют насыщенный водный раствор бикарбоната натрия, реакционный раствор перемешивают, и затем экстрагируют этилацетатом. Растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 10 до 40% этилацетат/гексан), получая продукт (292 мг) в виде бесцветного масла. Полученный продукт (285 мг) растворяют в смешанном растворе метанола и ТГФ (3:1, 4,0 мл), добавляют 2,5 моль/л водный раствор гидроксида натрия (0,9 мл), и реакционный раствор перемешивают при 60°C в течение 3 часов. Реакционный раствор охлаждают до комнатной температуры, pH доводят до 4, используя 1 моль/л хлористоводородную кислоту, и затем экстрагируют хлороформом. Растворитель выпаривают при пониженном давлении, полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 5% до 15% метанол/хлороформ), получая указанное в заголовке соединение (199 мг) в виде аморфного вещества белого цвета.
1H-ЯМР (ДМСО-D6) δ: 7,80 (2H, д, J=8,1 Гц), 7,41-7,14(15H, м), 4,55 (1H, дд, J=6,5, 5,3 Гц), 4,34 (1H, д, J=11,7 Гц), 4,27 (1H, д, J=11,7 Гц), 3,70 (1H, д, J=14,5 Гц), 3,63 (1H, д, J=14,5 Гц), 2,85(4H, с), 2,78 (1H, дд, J=13,3,6,5 Гц), 2,56 (1H, дд, J=13,3, 5,3 Гц), 2,48-2,42 (2H, м), 2,01 (2H, с), 1,45-1,38 (2H, м), 0,85 (6H, с). ESI-MS найдено: m/z 629(M+H)+
[0197] Соединения примеров 58 и 59, полученные способом, аналогичным способу примера 57, с использованием соединений соответствующих сравнительных примеров, представлены в таблице 57.
[0198]
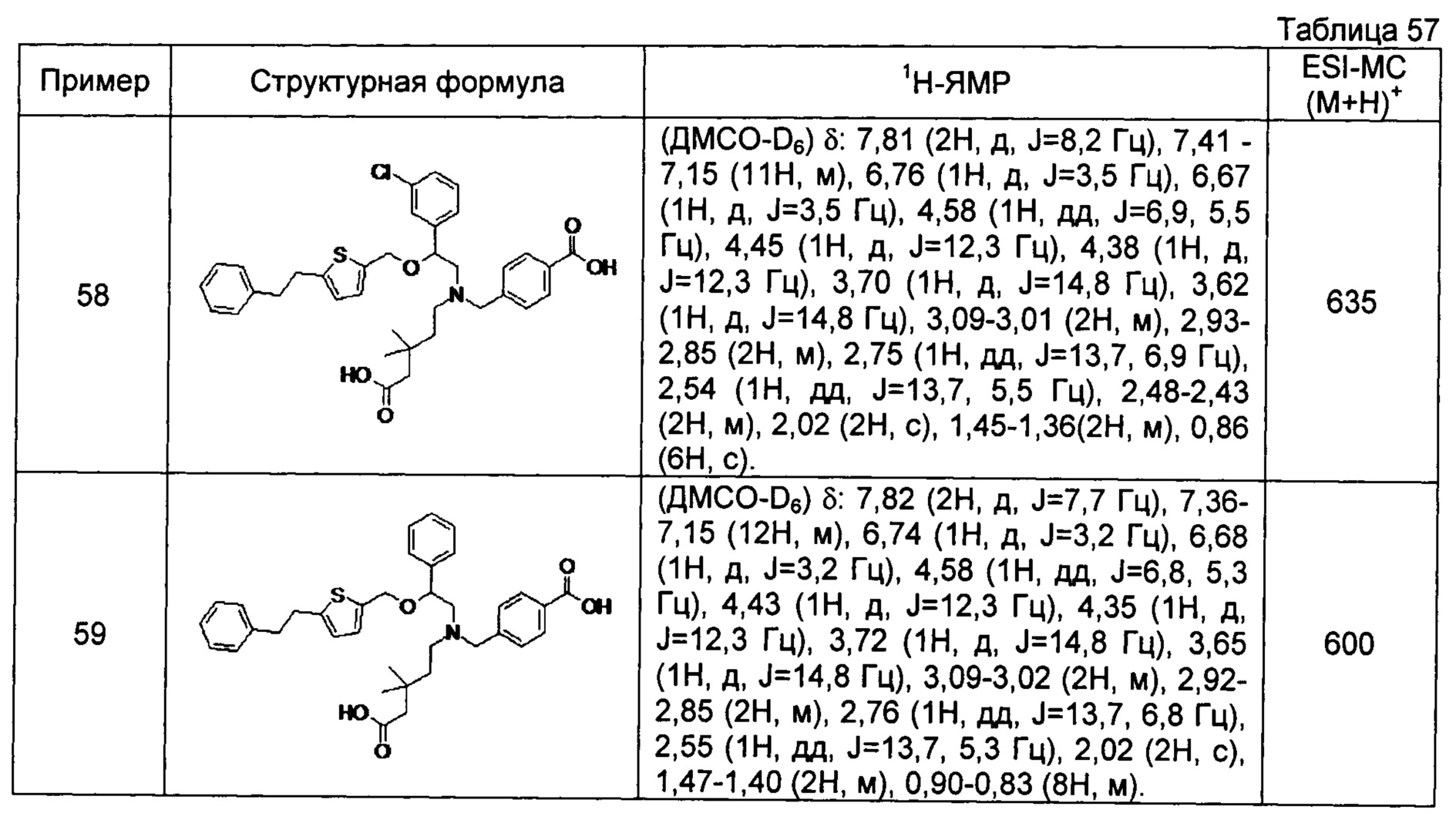
[0199] Пример 60
4-{[N-(4-карбоксибутил)-N-[2-[3-(2-фенилэтил)бензилокси]-2-фенилэтил]амино]метил}бензойная кислота
Соединение сравнительного примера 105 (230 мг) растворяют в ацетонитриле (6,0 мл), и добавляют карбонат калия (199 мг), метил-5-бромвалерат (167 мкл) и иодид натрия (22 мг), и реакционный раствор перемешивают и нагревают при кипении с обратным холодильником в течение 23 часов. Реакционный раствор охлаждают до комнатной температуры, и растворитель выпаривают при пониженном давлении. Затем полученный остаток суспендируют в воде, и суспензию экстрагируют этилацетатом. Объединенные органические слои сушат над безводным сульфатом натрия, и затем растворитель выпаривают при пониженном давлении. Полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 10 до 50% этилацетат/гексан), получая продукт (258 мг) в виде бесцветного масла. Полученный продукт (250 мг) растворяют в смешанном растворе метанола и ТГФ (3:1, 5,0 мл), добавляют 1 моль/л водный раствор гидроксида натрия (2,5 мл), и реакционный раствор перемешивают при комнатной температуре в течение 18 часов. Растворитель выпаривают при пониженном давлении, и pH полученного остатка доводят до 4, используя 1 моль/л хлористоводородную кислоту, и затем экстрагируют смешанным раствором метанола и хлороформа (1:9). Объединенные органические слои сушат над безводным сульфатом натрия, затем растворитель выпаривают при пониженном давлении, и полученный остаток очищают, используя хроматографическую колонку с силикагелем (с 5% до 15% метанол/хлороформ), получая указанное в заголовке соединение (208 мг) в виде аморфного вещества белого цвета.
1H-ЯМР (ДМСО-D6) δ: 7,80 (2H, д, J=8,1 Гц), 7,35-7,08 (16H, м), 4,55 (1H, дд, J=7,1, 5,5 Гц), 4,32 (1H, д, J=11,9 Гц), 4,26 (1H, д, J=11,9 Гц), 3,73 (1H, д, J=14,6 Гц), 3,65 (1H, д, J=14,6 Гц), 2,83(4H, с), 2,80 (1H, дд, J=13,0, 7,1 Гц), 2,57 (1H, дд, J=13,0, 5,5 Гц), 2,46-2,40 (2H, м), 2,10-2,06 (2H, м),1,40-1,34 (4H, м). ESI-MS найдено: m/z 566(M+H)+
[0200] Соединения примеров 61 и 62, полученные способом, аналогичным способу примера 60, с использованием соединений соответствующих сравнительных примеров, представлены в таблицах 58 и 59.
[0201]
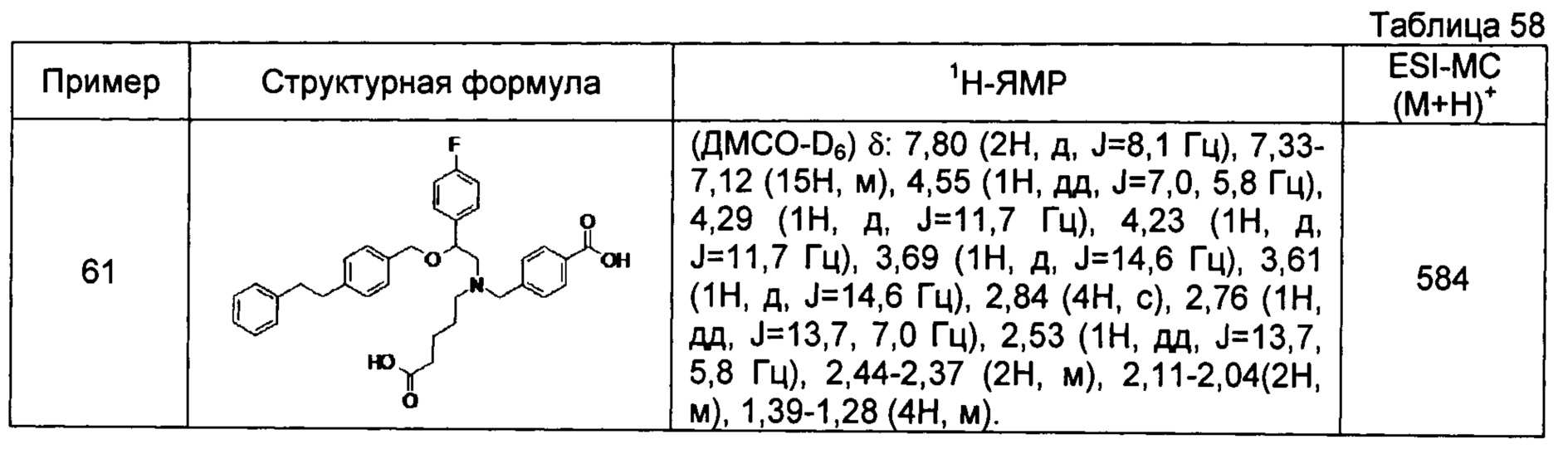
[0202]
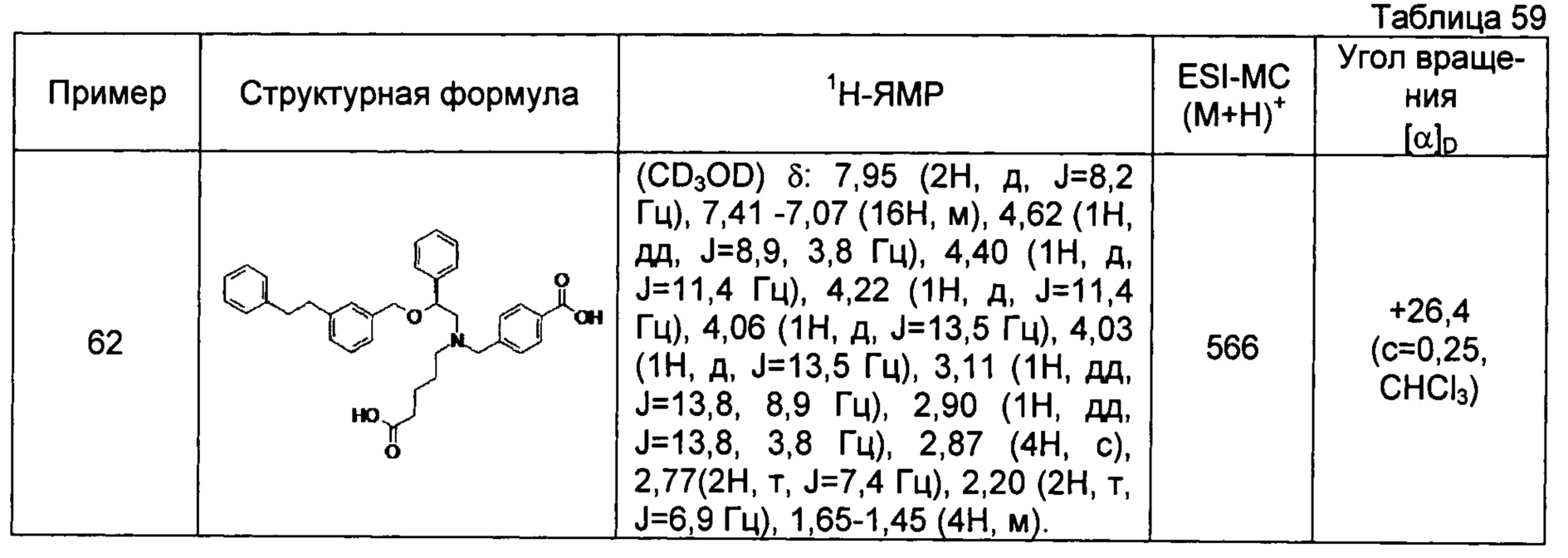
[0203] Соединение настоящего изобретения тестируют в отношении эффекта активации sGC в соответствии с тестовыми примерами, раскрытыми далее.
[0204] [Тестовый пример 1] Максимальный эффект активации sGC
Для этого анализа используют, клетки яичников китайского хомяка (CHO-K1 клетки), стабильно экспрессирующие как α, так и β субъединицы человеческих sGC и мышиные циклические нуклеотидзависимые каналы (CNGA2).
CHO-K1 клетки, стабильно экспрессирующие человеческие sGC и мышиные CNGA2, культивируют при 37°C в F-12 среде, содержащей 10% (об/об) фетальной телячьей сыворотки (FBS), пенициллин (100 Ед/мл), стрептомицин (100 мкг/мл), G418 (250 мкг/мл) и зеоцин (250 мкг/мл). Клетки суспендируют в культуральной среде, высевают в 96-луночный планшет, и затем культивируют при 37°C в течение 24 часов. Клетки промывают аналитическим буфером 1 (140 ммоль/л хлорид натрия, 5 ммоль/л хлорид калия, 0,5 ммоль/л хлорид магния, 0,01 ммоль/л хлорид кальция, 10 ммоль/л глюкозы, 0,4 ммоль/л сульфат магния, 10 ммоль/л 4-(2-гидроксиэтил)пиперазин-1-илэтансульфоновой кислоты и 125 мкмоль/л сульфинпиразона, pH 7,4), и затем добавляют раствор, содержащий Fura2-AM, флуоресцентный индикатор Ca2+, в аналитическом буфере 1 в концентрации 5 мкмоль/л в качестве индикаторного раствора, и культивируют при 37°C в течение 60 минут. Культуральную среду удаляют, и полученные клетки промывают аналитическим буфером 1, затем добавляют раствор, содержащий тестируемое соединение, и культивируют при комнатной температуре в течение 10 минут. Планшет помещают на флуориметр (FlexStation II, Molecular Devices), и концентрацию внутриклеточного кальция определяют как отношение интенсивности флуоресценции, полученной в измерениях с использованием длин волн возбуждения 340 нм и 380 нм и детектирования на длине волны 510 нм.
Растворы тестируемых соединений получают, растворяя каждое тестируемое соединение в ДМСО до концентрации 10 ммоль/л, и затем разбавляя полученный раствор до тестовой концентрации в 10 мкмоль/л аналитическим буфером 2 (140 ммоль/л хлорид натрия, 5 ммоль/л хлорид калия, 0,5 ммоль/л хлорид магния, 1 ммоль/л хлорид кальция, 10 ммоль/л глюкозы, 0,4 ммоль/л сульфат магния, 10 ммоль/л 4-(2-гидроксиэтил)пиперазин-1-илэтансульфоновой кислоты, 125 мкмоль/л сульфинпиразона, 100 мкмоль/л изобутилметилксантина, и 10 мкмоль/л 1H-[1,2,4]-оксадиазол[4,3-a]хиноксалин-1-она (здесь и далее, ODQ), pH 7,4). Оценку в отсутствии ODQ осуществляют аналогичным образом, за исключением того, что ODQ не добавляют в аналитический буфер 2. В качестве контрольного раствора используют ДМСО раствор вместо раствора тестируемого соединения.
Активность тестируемого соединения определяют как повышение степени активности sGC (%) во время добавления раствора тестируемого соединения относительно активности sGC во время добавления контрольного раствора, рассчитывают, деля степень интенсивности флуоресценции во время добавления тестируемого раствора на степень интенсивности флуоресценции контрольного раствора, и вычитая активность sGC во время добавления контрольного раствора (100%).
Результаты анализов представлены в таблице 60.
[0205]
Таблица 60
|
[0206] Если в представленном анализе sGC активируется, внутриклеточная концентрация cGMP возрастает, и соответственно внутриклеточная концентрация Ca2+ возрастает за счет раскрытия CNGA2. Соответственно, sGC активацию можно измерять как изменение концентрации Ca2+ в клетке. ODQ представляет собой специфический окислитель гем-связывания атома железа, и атом железа гема окисляется в присутствии ODQ, и поэтому не происходит гем-зависимой активации sGC. Соответственно, можно оценивать максимальный эффект активации sGC, включая гем-зависимую активацию в отсутствии ODQ, и также возможно оценивать эффект гем-независимой активации sGC в присутствии ODQ. Необходимо отметить, что в любом случае, используя любое тестируемое соединение (включая использование цинациквата в качестве сравнительного примера), активность sGC демонстрирует постоянноое максимальное значение при 10 мкмоль/л или более высокой концентрации в присутствии и отсутствии ODQ. В соответствии с полученными результатами значение активности при концентрации 10 мкмоль/л определяют как возможность максимизации активности sGC (Eмакс) для каждого из тестируемых соединений.
Как представлено в таблице 60, было выяснено, что любое из соединений настоящего изобретения заметно повышает активность sGC в присутствии ODQ, и является гем-независимым, прямым активатором sGC. Кроме того, было выяснено, что соединения настоящего изобретения демонстрируют более высокие значения Eмакс по сравнению с цинацикватом как в присутствии, так и в отсутствии ODQ, и демонстрируют превосходящий эффект активации sGC по сравнению с цинацикватом.
[0207] [Тестовый пример 2] Оценка активности в отношении релаксации кровеносных сосудов
Представительные соединения настоящего изобретения анализируют в отношении активности релаксации кровеносных сосудов в соответствии с раскрытыми далее тестовыми примерами. В анализе у крысы (самца, SD) отбирают кровь из верхней части сердца под анестезией фенобарбиталом (30 мг/кг), и экстрагируют вентральную аорту. Соединительную ткань, окружающую кровеносный сосуд вентральной аорты, извлекают и переносят в охлажденный льдом раствор Кребса-Хензелейта (KH раствор) (118 ммоль/л хлорид натрия, 4,7 ммоль/л хлорид калия, 1,2 ммоль/л сульфат магния, 1,2 ммоль/л дигидрофосфат калия, 25 ммоль/л гидрокарбонат натрия, 2,5 ммоль/л хлорид кальция и 10 ммоль/л глюкоза, pH 7,4). Затем приготавливают образец кольца длиной 2 мм, и фиксируют в 5 мл инкубаторе органов, заполненном раствором KH. KH раствор поддерживают при 37°C, и вентилируют смесью газов 95% O2 и 5% CO2. Образец стабилизируют, используя 1 г давления покоя в течение 1 часа. В течение этого времени KH раствор сменяют дважды. Натяжение образца регистрируют, используя многоканальный рекордер через приемник и усилитель. После стабилизации образца, вызывают сокращение, используя 1 мкмоль/л фенилэприна (Phe), и осуществляют кумулятивное введение каждого из соединений (0,001, 0,01, 0,03, 0,1, 0,3, 1, 3, 10, 30, 100, 1000, 10000 нмоль/л). В случае оценки во время содержания ODQ, 10 мкмоль/л ODQ добавляют за 10 минут до введения Phe, и осуществляют аналогичную оценку.
Величину EC50 рассчитывают, используя четырехпараметрическую логистическую модель и аналитический прибор (Accelrys, Inc.). Необходимо отметить, что раствор тестируемых соединений приготавливают, растворяя соединения в ДМСО для получения растворов с концентрацией каждого из тестируемых соединений в 1000 раз выше, чем финальная концентрация.
Результаты анализа представлены в таблице 61.
[0208]
Таблица 61
|
[0209] Из данных таблицы 61, следует, что любое из соединений настоящего изобретения демонстрирует более низкое значение EC50, нежели цинацикват, и является гем-независимым по сравнению с цинацикватом.
Промышленная применимость
[0210] Производные 4-аминометилбензойной кислоты, их фармацевтически приемлемые соли или их сольваты настоящего изобретения обладают гем-независимым превосходным эффектом активации sGC, и поэтому могут быть использованы в качестве средств для лечения или профилактики различных заболеваний, связанных с растворимой гуанилатциклазой, таких как, например, сердечная недостаточность, гипертония, легочная гипертония или ишемическая болезнь сердца.