Результат интеллектуальной деятельности: СОЧЕТАННЫЕ ПРЕПАРАТЫ НЕОСАКСИТОКСИНА ДЛЯ ПРОЛОНГИРОВАННОЙ МЕСТНОЙ АНЕСТЕЗИИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании U.S.S.N. 61/789054, поданную 15 марта 2013, под заголовком "Combinations of Neosaxitoxin with Bupivacaine and Epinephrine Increase Efficacy of Peripheral Nerve Block and Infiltration Local Anesthesia and Analgesia Without Increasing Toxicity", Charles Berde, описание которой включено в настоящий документ.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в основном, относится к области улучшения блокады нервов и инфильтрационной местной анестезии и анальгезии без увеличения токсичности, в частности, к сочетаниям неосакситоксина с бупивакаином, используемым отдельно или в сочетании с эпинефрином, в конкретных общих дозах и концентрациях.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Существует потребность в средстве, которое не отличается замедленным высвобождением и надежно обеспечивает блокаду нервов хирургического класса в течение 6-12 часов и в течение последующих примерно 48 ч уменьшенную блокаду и облегчение боли без дополнительного лечения. Первый период можно использовать во время операции и сразу после операции; последний период обеспечивает уменьшение обезболивания и позволяет увеличивать использование поврежденной части тела по мере заживления. Единствнный присутствующий на рынке местный анестетик пролонгированного действия Exparel™ обеспечивает непредсказуемое блокаду нервов у человека, пик которой наблюдается через 24 ч после инъекции, а обезболивающий эффект обратно пропорционален дозе. Кроме того, он предполагает использование системы замедленного высвобождения и вызывает локальное повреждение тканей и воспаление.
Подобные явления наблюдаются при применении микрочастиц, содержащих бупивакаин + дексаметазон, которые способны обеспечивать местную анестезию пролонгированного действия, но требуют применения системы замедленного высвобождения и приводят к очень тяжелой травме тканей. Четвертичное производное лидокаина QX-314 может обеспечивать местную анестезию в течение длительного периода (продолжительностью примерно 24 ч), но вызывает очень тяжелую травму местных тканей и системную токсичность.
В случае передозировки или случайного внутрисосудистого введения амино-амидные и амино-эфирные местные анестетики вызывают сердечно-сосудистую токсичность, которая, как известно, не поддается реанимации (Polaner et al. Ped Anes 2011; 21: 737-742; Fisher, et al, Can. J. Anaesth., 1997; 44: 592-598; Butterworth, Reg. Anesth. Pain Med., 2010; 35: 167-76). Сердечно-сосудистая токсичность бупивакаина, по всей вероятности, опосредуется сердечным натриевым каналом Nav1.5, который является относительно устойчивым к связыванию блокаторов участка 1 натриевых каналов и инактивации под действием указанных блокаторов (Clarkson, et al, Anesthesiology, 1985; 62: 396-405).
Фикотоксины неосакситоксин, сакситоксин и гониаулатоксины представляют собой активные соединения, которые продуцируются при бурном развитии вредных водорослей родов Alexandrium sp., Piridinium sp. и Gimnodinium sp., (Lagos, N. Biol. Res., 31: 375-386, 1998)). В течение последних 15 лет было показано, что указанные фикотоксины также могут продуцироваться цианобактериями пресной воды, такими как фотосинтезирующие сине-зеленые водоросли, а также морскими динофлагеллятами.
Идентифицировано только четыре рода цианобактерий, способных продуцировать парализующие фикотоксины, причем цианобактерии разных родов продуцируют смеси фикотоксинов, различающиеся по количеству и типу входящих в их состав фикотоксинов, то есть они продуцируют разные профили парализующих фикотоксинов (Lagos, et al, 1999, TOXICON, 37: 1359-1373 (1999), Pereira, et al, TOXICON, 38: 1689-1702 (2000)).
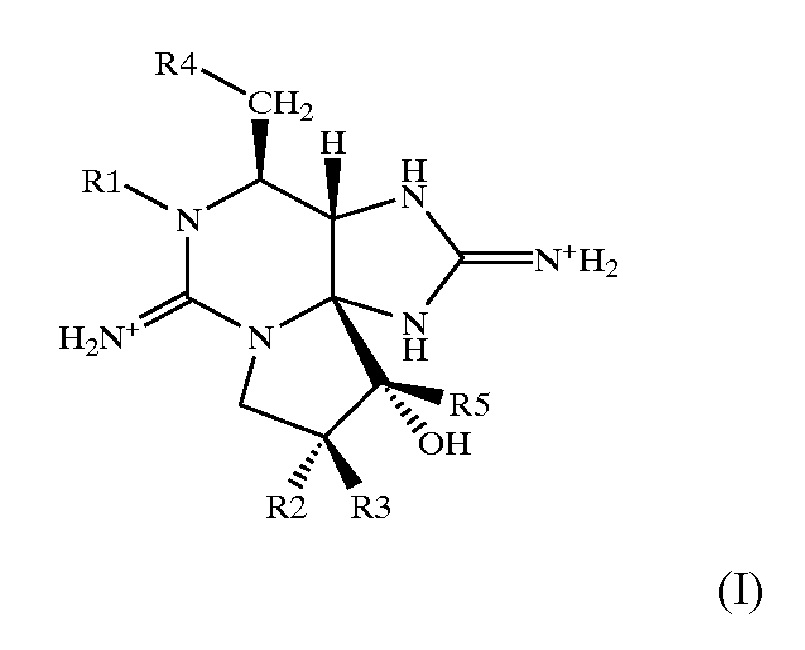
Указанные фикотоксины имеет общую химическую структуру (I), а структура отдельных фикотоксинов определяется заместителями R1-R5 в соответствии с приведенной ниже таблицей:
|
Указанные парализующие фикотоксины действуют как специфические блокаторы потенциал-зависимых натриевых каналов, присутствующих в возбуждаемых клетках (Kao, C. Y., Pharm. Rev., 18: 997-1049 (1966)). Вследствие ингибирования натриевых каналов блокируется передача нервного импульса и предотвращется высвобождение нейромедиаторов на уровне нервно-мышечного соединения, что препятствует мышечному сокращению. Благодаря таким физиологическим эффектам указанные соединения можно использовать в фармакологии в качестве ингибиторов мышечной активности при патологиях, связанных с гиперактивностью мышц, таких как мышечные спазмы и фокальная дистония, путем местного применения в виде инъекций. Кроме того, поскольку блокада нервного импульса на уровне передачи генерируется при применении указанных соединений путем местной инфильтрации, они способны блокировать не только эфферентные, но и афферентные пути нейропередачи, ингибировать сенсорные пути и генерировать обезболивающий эффект при местном введении. Это неожиданный результат, так как оба эффекта наблюдаются одновременно, как описано в патенте США № 4001413.
Как описано в патенте США № 6326020, Kohane, et al, были проводены исследования сочетаний природных блокаторов натриевых каналов участка 1, таких как тетродотоксин (TTX), сакситоксин (STX), декарбамоил сакситоксин и неосакситоксин, с другими средствами, с целью достижения продолжительной блокады и улучшенных характеристик, связанных, например, с безопасностью и специфичностью. В одном варианте осуществления длительность блокады значительно увеличивается в результате объединения токсина с местным анестетиком, вазоконстриктором, глюкокортикоидом и/или адренергическими препаратами, включающими в себя агонисты альфа-рецепторов обоих типов (эпинефрин, фенилэфрин) и агонисты альфа-2 смешанного центрального и периферического действия (клонидин), или другие средства. Длительную блокаду нервов можно достичь путем применения сочетаний токсина с ваниллоидами. Диапазоны дозировок были определены на основании исследований тетродотоксина и сакситоксина. Однако, как известно, чтобы определить эффективные дозы, исследования нужно проводить с каждым токсином, так как дозы, установленные для одного типа токсина, не позволяют предсказать эффективность токсина другого типа. Как показано в нижеследующих примерах, также было обнаружено, что значения безопасности и эффективности доз указанных токсинов, полученные на крысах или овцах, нельзя экстраполировать на человека.
Традиционные местные анестетики вызывают местную нейротоксичность в клинических дозах и высокую сердечно-сосудистую токсичность при передозировке. Хотя общее число случаев является низким, исследования также выявили случаи длительного онемения и парестезии, как осложнение местной и регионарной анестезии амидными анестетиками. Такие явления связаны с гистологическими симптомами химического повреждения нервов (Myers, et al, Anesthesiology, 1986; 64: 29-35; Kalichman, et al, J. Pharm. Exper. Therapeutics, 1989; 250(1): 406-413). По всей вероятности, указанный риск местной нейротоксичности может дополнительно увеличиваться при попытках достичь длительного обезболивания путем введения традиционных местных анестетиков посредством доставки с контролируемым высвобождением (Padera, et al, Anesthesiology, 2008; 108: 921-8; Kohane and Langer, Chem. Sci., 2010; 1: 441-446) или местных периневральных инфузий, особенно, если используются повышенные концентрации или дозы в течение более длительных периодов времени. Блокаторы натриевых каналов участка 1, вводимые интратекально в эквипотентных дозах, вызывают более длительное обезболивание при более низких гистологических показателях нейротоксичности, чем бупивакаин (Sakura, et al, Anesth. Analg, 1995; 81: 338-46). В целом способы достижения пролонгированной местной анестезии с применением блокаторов натриевых каналов участка 1 характеризуются более низким риском повреждения нерва, чем способы, включающие в себя длительное или повторное введение традиционных амино-амидов или амино-сложных эфиров.
Следовательно, задача настоящего изобретения состоит в обеспечении конкретных сочетаний неосакситоксина с бупивакаином и, необязательно, с эпинефрином, обеспечивающих облегчение боли в течение периода от двух до трех дней после единственной инъекции, которые являются как безопасными, так и эффективными для человека.
Другой задачей настоящего изобретения является получение композиции, способной безопасно и эффективно обеспечивать местную анестезию и анальгезию у пациентов детского возраста.
Следующей задачей настоящего изобретения является получение композиции для лечения симптомов, требующих местной анестезии высокого, среднего и низкого уровня.
Кроме того, задачей настоящего изобретения является получение композиции для лечения симптомов, требующих различных скоростей выхода из сенсорной или моторной блокады вследствие местной анестезии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Проводят исследования с целью определения доз неосакситоксина ("NeoSTX") и бупивакаина, используемых по отдельности или в сочетании с эпинефрином, которые способны обеспечить обезболивание, длящееся до двух-трех дней. Исследования, проведенные с использованием чрескожной блокады седалищного нерва у крыс, демонстрируют, что 1) сочетания бупивакаин-NeoSTX не увеличивают системную токсичность по сравнению с NeoSTX, используемым отдельно; 2) сочетания бупивакаин-NeoSTX обеспечивают более надежную и более продолжительную блокаду по сравнению с NeoSTX, используемым отдельно; и 3) тройное сочетание NeoSTX-бупивакаин-эпинефрин обеспечивает более продолжительную местную анестезию, чем двойное сочетание NeoSTX-бупивакаин. Добавление эпинефрина к указанному сочетанию NeoSTX-бупивакаин значительно увеличивает продолжительность полной блокады реакций на механические раздражители.
Исследования, проведенные на крысах и овцах, демонстрируют, что NeoSTX не вызывает кардиотоксичность, даже при внутривенном введении. Однако дозы, эффективные для людей, взрослых или детей, наркотизированных или ненаркотизированных, невозможно определить с помощью исследований на животных вследствие ограничивающих побочных эффектов, определяемых у людей, но не у животных.
Указанные двойные и тройные сочетания характеризуются аддитивными или синергетическими взаимодействиями, приводящими к повышению эффективности, при том, что токсичные эффекты сочетаний меньше аддитивных, что повышает общий уровень безопасности и эффективности. На основании указанных неожиданных результатов, полученных при исследовании эффективности на крысах и людях, выбирают концентрацию бупивакаина 0,2%, значение которой ниже концентраций стандартных коммерческих препаратов бупивакаина 0,25%, 0,5% или 0,75%.
Фазу 1 инициированного исследователями испытания нового препарата (IND) на людях проводят с разрешения FDA и IRB. Исследование демонстрирует, что сочетания NeoSTX-бупивакаин, используемые по отдельности или в сочетании с эпинефрином в разных соотношениях для разных клинических показаний, обеспечивают клинически важное повышение уровней эффективности, продолжительности обезболивания и безопасности при местной анестезии по сравнению со стандартным препаратом бупивакаина.
Результаты демонстрируют:
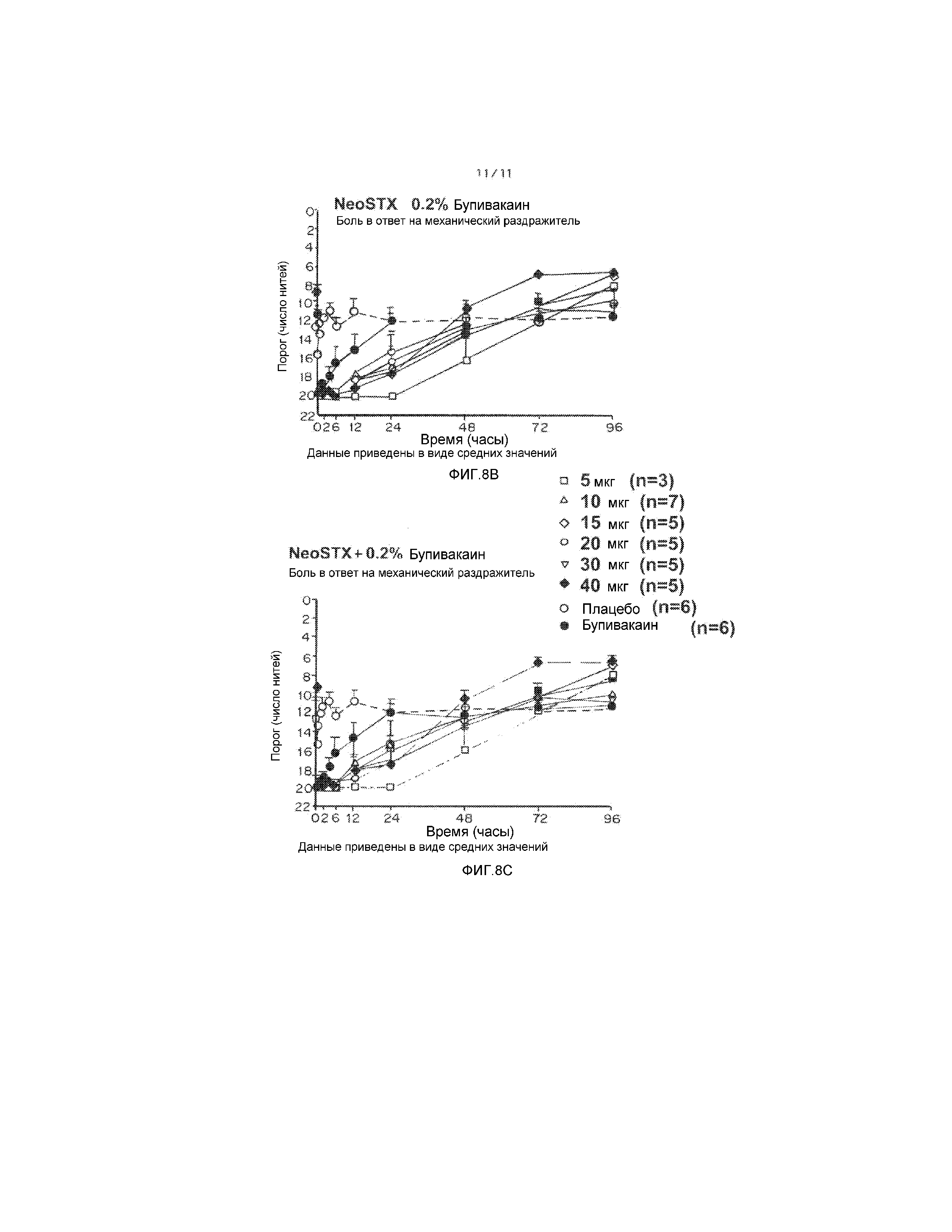
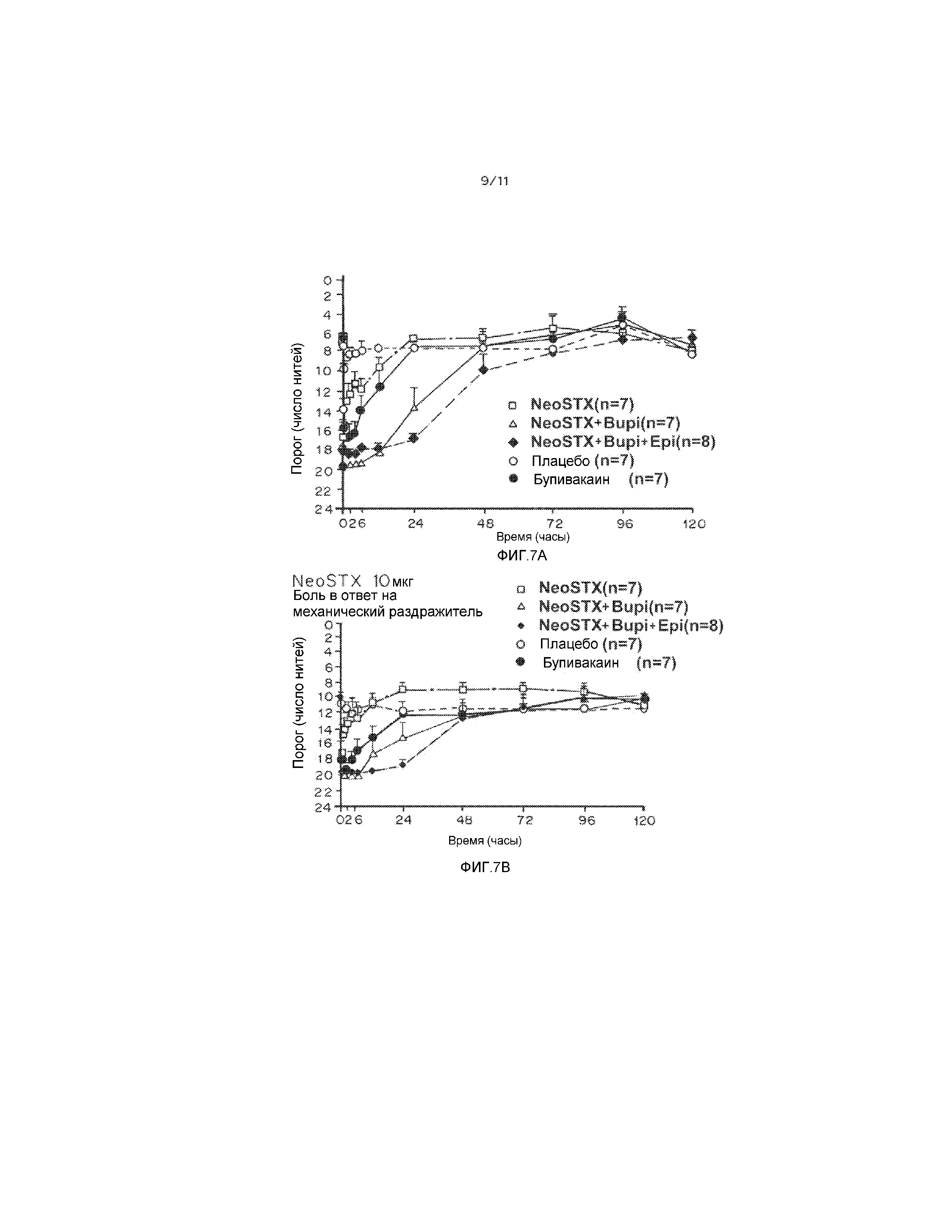
1. Сочетания NeoSTX-бупивакаин 0,2%, даже при использовании NeoSTX в дозах, не превышающих 5-10 мкг (концентрации 0,5-1 мкг/мл), и в отсутствие эпинефрина, увеличивают длительность блокады по сравнению со стандартом бупивакаином примерно в 4 раза (фиг. 7 и 8).
2. Используемый отдельно NeoSTX, растворенный в физиологическом растворе, в допустимых дозах дает неэффективные и непостоянные результаты, так что данные, полученные на людях, решительно поддерживают требование к применению сочетания NeoSTX-бупивакаин (фиг. 7 и 8).
3. Эпинефрин уменьшает системные симптомы, расширяя тем самым границы безопасности, увеличивает продолжительность плотной блокады (подходит для хирургической анестезии) и дополнительно увеличивает длительность обезболивающего действия (например, от 48 до 72 часов) (фиг. 8). Это позволяет вводить препарат в больших объемах, что в последнее время стали очень широко использовать для инфильтрации ран во время хирургических операций на тазобедренных и коленных суставах (обычно вводят более 100 мл) и больших операций на брюшной полости.
4. Побочные эффекты (покалывание, рвота, тошнота) ограничивают переносимую дозу NeoSTX-бупивакаина у ненаркотизированных пациентов до уровня NeoSTX менее 40 мкг, хотя для пациентов, находящихся под общим наркозом, более высокие дозы являются безопасными. Следует отметить, что указанные ограничивающие побочные эффекты наблюдаются при применении сочетаний NeoSTX-физиологических раствор и NeoSTX-бупивакаин, но не NeoSTX-бупивакаин-эпинефрин.
Затем определяют конкретные объемы и концентрации компонентов, которые улучшают безопасность, переносимость и эффективность в конкретных клинических ситуациях. Указанные открытия инициировали исследования по разработке сочетаний лекарственных препаратов в следующих дозировках:
При применении композиций в больших объемах, составляющих 35-120 мл для взрослых людей и 0,5-1,8 мл/кг для детей, активные средства, входящие в состав тройного сочетания, включают в себя бупивакаин в диапазоне концентраций от 0,1% (1 мг/мл) до 0,25% (2,5 мг/мл), обеспечивающем общую системную дозу бупивакаина не более 225 мг у взрослых или 2,5 мг/кг у детей; NeoSTX в диапазоне концентраций от 0,1 мкг/мл до 1 мкг/мл, обеспечивающем общую системную дозу от 3,5 до 100 мкг у взрослых или от 0,05 до 1,5 мкг/кг у детей, и эпинефрин в диапазоне концентраций от 2 мкг/мл (1:500000 в традиционной терминологии) до 10 мкг/мл (1:100000). Данное сочетание обычно используют для инфильтрации трех или четырех слоев большой хирургической раны при полноразмерной открытой лапаротомии, торакоабдоминальном разрезе, или боковом разрезе. Некоторые из таких операций включают в себя: кесарево сечение, открытую гистерэктомию, резекцию пищевода и проксимального отдела желудка, нефрэктомию, или обширные операции брюшной полости по поводу рака, такие как колэктомия. Идеальным применением указанных композиций также является инфильтрация раны при тотальном замещении тазобедренного сустава (артропластика тазобедренного сустава) и полной замене коленного сустава (артропластика коленного сустава).
При применении композиций в средних объемах, составляющих от 15 до 50 мл, активные средства, входящие в состав сочетания, включают в себя бупивакаин в диапазоне концентраций от 0,125% до 0,3% (1,25-3 мг/мл), обеспечивающем системную дозу у взрослых не более 100 мг (не более 2 мг/кг у детей), NeoSTX в диапазоне концентраций от 0,2 до 2 мкг/мл, обеспечивающем системную дозу у взрослых 7- 50 мкг (0,1-1,5 мкг/кг у детей), и эпинефрин в диапазоне концентраций от 0 до 10 мкг/мл (≤1:100000).
Способы применения композиций в умеренных объемах включают в себя как блокаду периферических нервов, так и блокаду сплетений (периневральная инъекция), а также инфильтрацию (введение вдоль слоев хирургической раны). Способы применения указанных композиций включают в себя хирургию плеча, руки или кисти, инфильтрацию или подвздошно-паховую/подвздошно-подчревную блокаду при лечении паховой грыжи, пениальную блокаду при лечении гипоспадии, бедренную блокаду при полной замене коленного сустава или лечении передней крестообразной связки, блокаду межреберных нервов при открытой хирургии груди, или блокаду бедренного и седалищного нервов при ампутации ноги. При хирургии бедра композиции можно использовать для блокады поясничного сплетения и, в более низком объеме, для блокады седалищного нерва. Данную композицию также можно использовать для блокады нервов (бедренного и седалищного, поясничного сплетения и седалищного нерва) при хирургической операции по замене тазобедренного или коленного сустава.
Для некоторых способов применения композиции в средних объемах, особенно в случае блокады периферических нервов и блокады сплетения приоритетом является достижение трех характеристик:
i. анестезия (почти полное отсутствие чувствительности) для операции в течение 3-12 часов,
ii. обезболивание (длительное облегчение боли) после операции в течение не менее 24 часов, при обеспечении безопасности,
iii. восстановление после моторной блокады с обеспечением некоторой способности к движению конечностей в течение временного интервала 24-48 часов.
Для блокады периферических нервов и блокады сплетений с двигательными эффектами на руках и ногах и с учетом требования восстановления от моторной блокады в течение периода 24-48 часов, композиции, содержащие сочетание NeoSTX-бупивакаин в отсутствие эпинефрина, по всей вероятности, являются идеальными, как показано в нижеследующих таблицах.
При применении композиции в малом объеме с длительным временем действия, активные средства, входящие в состав сочетания, включают в себя бупивакаин в концентрации 0,25%-0,5% (2,5-5 мг/мл), где введение 5-15 мл композиции обеспечивает системную дозу бупивакаина у взрослых не более чем 75 мг, NeoSTX в диапазоне концентраций от 0,5 до 5 мкг/мл, где введение 5-15 мл композиции обеспечивает системную дозу у взрослых 5-75 мкг, и эпинефрин в диапазоне концентраций от 2,5 до 10 мкг/мл (1:500000-1:100000). Примером такого применения является блокада поясничного отдела симпатического ствола при комплексном региональном болевом синдроме/рефлекторной симпатической дистрофии, или сосудистой недостаточности ноги, или блокада солнечного сплетения при панкреатите или раке поджелудочной железы.
Желательно, чтобы данный тип блокады длился настолько долго, насколько это возможно, так как при введении композиции в малых объемах с флюороскопическим контролем направления, существует очень небольшая сенсорная или моторная блокада. Следовательно, в данном способе применения все три компонента нужно использовать в относительно высоких концентрациях, чтобы достичь продолжительности симпатической блокады и увеличения местного кровотока в течение по меньшей мере 3-4 дней, а возможно и больше. К другим способам применения, которые могут включать в себя введение композиции в малом объеме с продолжительным периодом действия, относится длительная блокада седалищного нерва, где быстрое восстановление двигательной функции не является проблемой, как в случае ампутации голени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1А-1F показаны дозозависимые ответы у крыс, измеряемые интенсивностью блокады седалищного нерва через 15 минут (максимальный эффект) после введения NeoSTX в солевом растворе и сочетания NeoSTX-бупивакаина. На фиг. 1А-1F приведены графики, демонстрирующие интенсивность блокады у крыс через 15 минут после инъекции в седалищный нерв, как описано в примере 1, которую измеряют путем тестирования с использованием горячей пластины, а также тестирования методами ЕРТ и фон Фрея задней конечности, в которую вводят лекарственный препарат (фиг. 1A-1C), и противоположной задней конечности (фиг. 1D-1F), сравнивая задержку отдергивания конечности (секунды) (1А, 1D); реакцию разгибателей на постуральную нагрузку (г) (1B, 1E) и усилие, прикладываемое для отдергивания конечности (г) (1С, 1F).
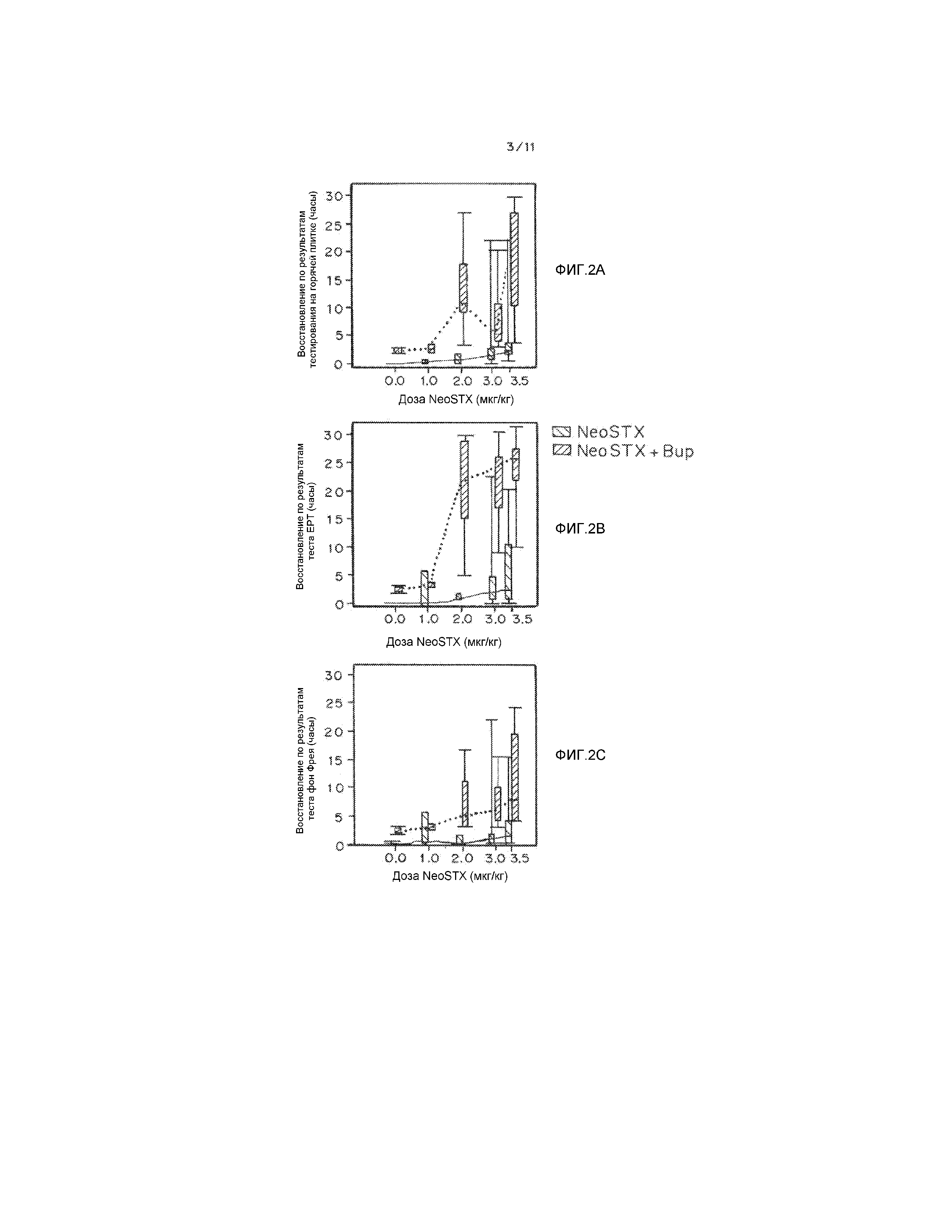
На фиг. 2А-2F показана длительность блокады седалищного нерва крысы под действием NeoSTX в физиологическом растворе и сочетания NeoSTX-бупивакаин. На фиг. 2А-2F приведены графики, демонстрирующие длительность блокады у крыс после инъекции в седалищный нерв, как описано в примере 1, которую измеряют посредством определения восстановления в тестах горячей пластины (часы) (2А, 2D), ЕРТ (часы) (2B, 2E) и фон Фрея (часы) (2С, 2Е), путем тестирования задней конечности (2A-2C), в которую вводят лекарственный препарат, и противоположной задней конечности (2D-2F).
На фиг. 3 показано, что добавление бупивакаина уменьшает системную токсичность NeoSTX (увеличивает LD50). NeoSTX4 и NeoSTX5 представляют собой две разные композиции, полученные на разных промышленных предприятиях с интервалом в один год. На фиг. 3 приведен график, демонстрирующий LD50 (в микрограммах) 2 композиций NeoSTX, Neo 4 (линии на левой стороне графика) и нео 5 (линии на правой стороне графике), в присутствии и в отсутствие бупивакаина, с использованием результатов, полученных на крысах.
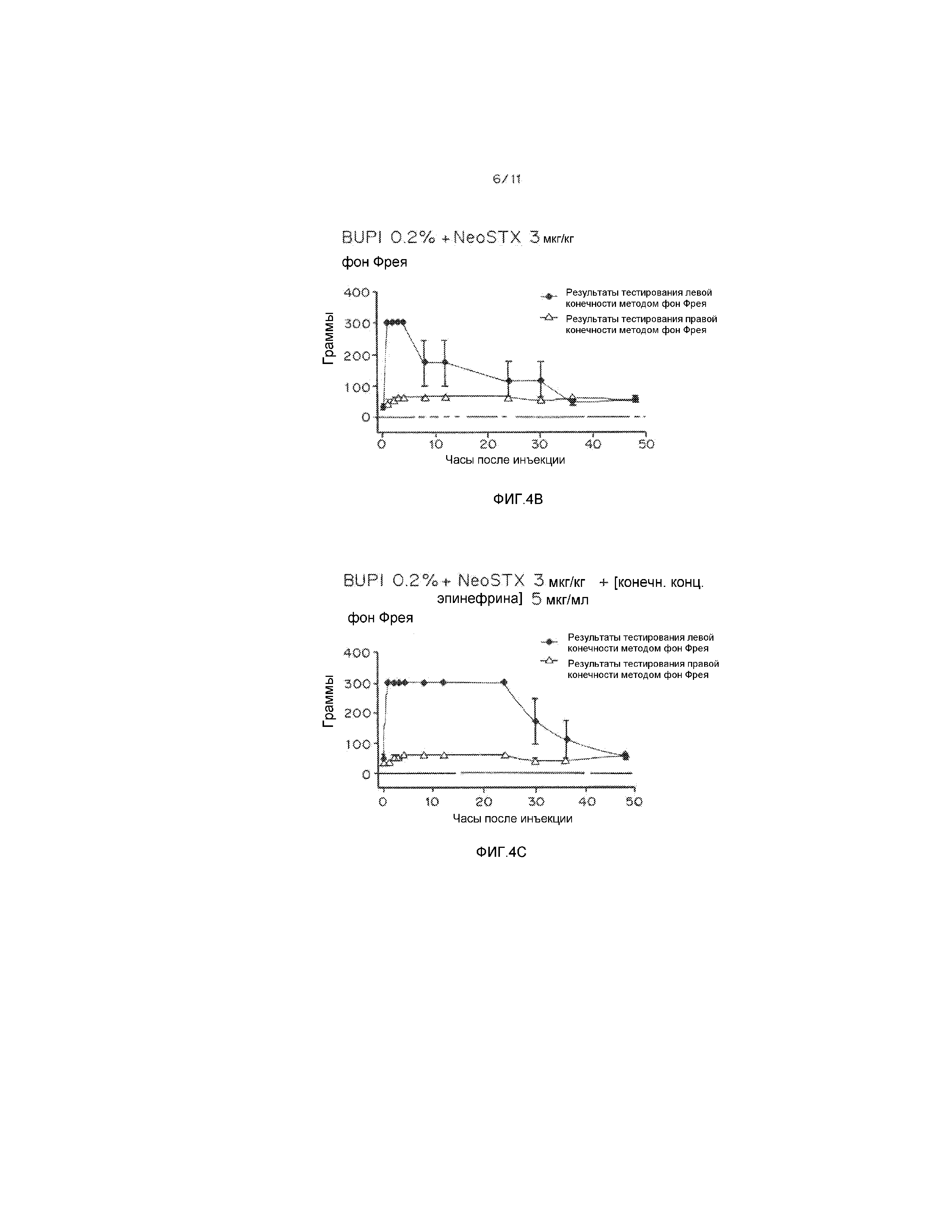
На фиг. 4А-4С, показано, что самую большую длительность блокады обеспечивает сочетание NeoSTX-бупивакаин-эпинефрин, промежуточную - сочетание NeoSTX-бупивакаин и самую короткую - отдельно вводимый бупивакаин. На фиг. 4А-4С приведены графики, демонстрирующие результаты тестирования крыс методом фон Фрея через разные промежутки времени после введения 0,2% бупивакаина (фиг. 4А), смеси 0,2% бупивакаина плюс 3 мкг NeoSTX/кг (фиг. 4В) и смеси 0,2% бупивакаина плюс 3 мкг NeoSTX/кг плюс 5 мкг эпинефрина/кг (фиг. 4С).
На фиг. 5А и 5В показано, что добавление бупивакаина к NeoSTX повышает надежность и продолжительность блокады седалищного нерва у крыс по сравнению с NeoSTX в физиологическом растворе. Добавление эпинефрина к смеси NeoSTX-бупивакаин приводит к дополнительному увеличению длительности блокады. Полученные результаты показывают, что введение NeoSTX в физиологическом растворе приводит к непостоянному и отсроченному началу механической сенсорной блокады, причем блокада полностью восстанавливается через 12 часов, даже если дозу NeoSTX слегка повышают (3,5 мкг/кг) по сравнению с дозой, приведенной на фиг. 5В (3 мкг/кг). На фиг. 5А и 5В приведены результаты теста фон Фрея в виде зависимости механического усилия в граммах от времени в часах для ноги, обработанной 3,5 мкг NeoSTX (треугольники), по сравнению с контролем (кружки) (фиг. 5А), и в сравнении с 0,2% бупивакаином (кружки), смесью, содержащей 0,2% бупивакаина и 3 мкг NeoSTX (квадраты), или смесью, содержащей 0,2% бупивакаина, 3 мкг NeoSTX и 5 мкг/мл эпинефрина (треугольники) (фиг. 5B). Все три препарата приводят к быстрому началу плотной сенсорной блокады. Графики показывают, что добавление NeoSTX в дозе 3 мкг/кг к 0,2% бупивакаину приводит к 4-кратному увеличению продолжительности полной блокады (4 часа и 1 час) и 6-кратному увеличению продолжительности полумаксимальной блокады (12 часов и 2 часа). Результаты показывают, что добавление эпинефрина в дозе 5 мкг/кг к смеси 0,2% бупивакаина + 3 мкг/кг NeoSTX приводит к дополнительному 6-кратному увеличению продолжительности полной блокады (24 часа и 4 часа) и дополнительному 2,5-кратному увеличению продолжительности полумаксимальной блокады (30 часов и 12 часов) по сравнению с результатами, полученными для смеси 0,2% бупивакаина + 3 мкг/кг NeoSTX. По сравнению с используемым в настоящее время стандартом, бупивакаином, введение тройного сочетания бупивакаин-NeoSTX-эпинефрин приводит к 24-кратному увеличению продолжительности полной блокады и к 15-кратному увеличению продолжительности полумаксимальной блокады.
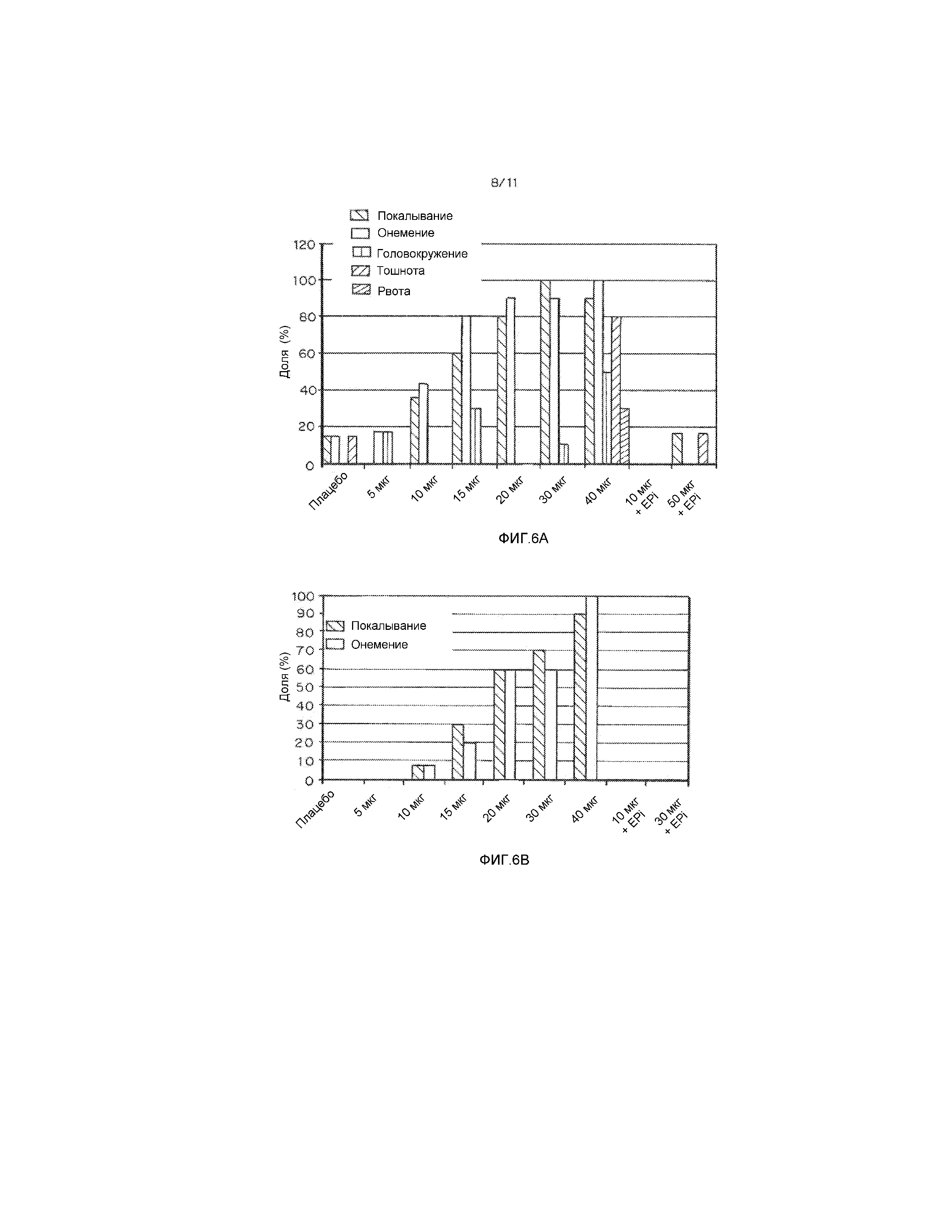
На Фиг. 6А и 6В показаны результаты фазы I клинических испытаний на людях, демонстрирующие, что системные симптомы варьируют в зависимости от дозы NeoSTX и значительно подавляются путем добавления эпинефрина. Добавление эпинефрина к сочетаниям NeoSTX-бупивакаин резко снижает встречаемость и клиническую значимость системных симптомов при дозах NeoSTX 10 мкг и 30 мкг у взрослых людей в испытаниях фазы I. На фиг. 6А приведен график, демонстрирующий процент индифидуумов, имеющих какие-либо из системных симптомов, включающих в себя покалывание, онемение, головокружение, тошноту или рвоту, в любой момент времени после введения 0, 5, 10, 15, 20, 30 или 40 мкг смеси NeoSTX-бупивакаин-эпинефрина. Тошнота наблюдается у 80% субъектов после введения 40 мкг NeoSTX. График показывает, что встречаемость системных симптомов в любой момент времени после введения сочетания NeoSTX-бупивакаин-эпинефрин в дозах, соответствующих 10 мкг или 30 мкг NeoSTX, не повышается по сравнению с плацебо. На фиг. 6В приведен график, демонстрирующий процент индивидуумов, у которых клинически значимые системные симптомы, т.е. соответствующие оценке выше 3 по шкале 0-10, наблюдаются в течение 30 минут или дольше. На фиг. 6В показано, что у индивидуумов, получающих сочетание NeoSTX-бупивакаин-эпинефрин в дозах 10 мкг или 30 мкг, отсутствуют оценки выше нуля.
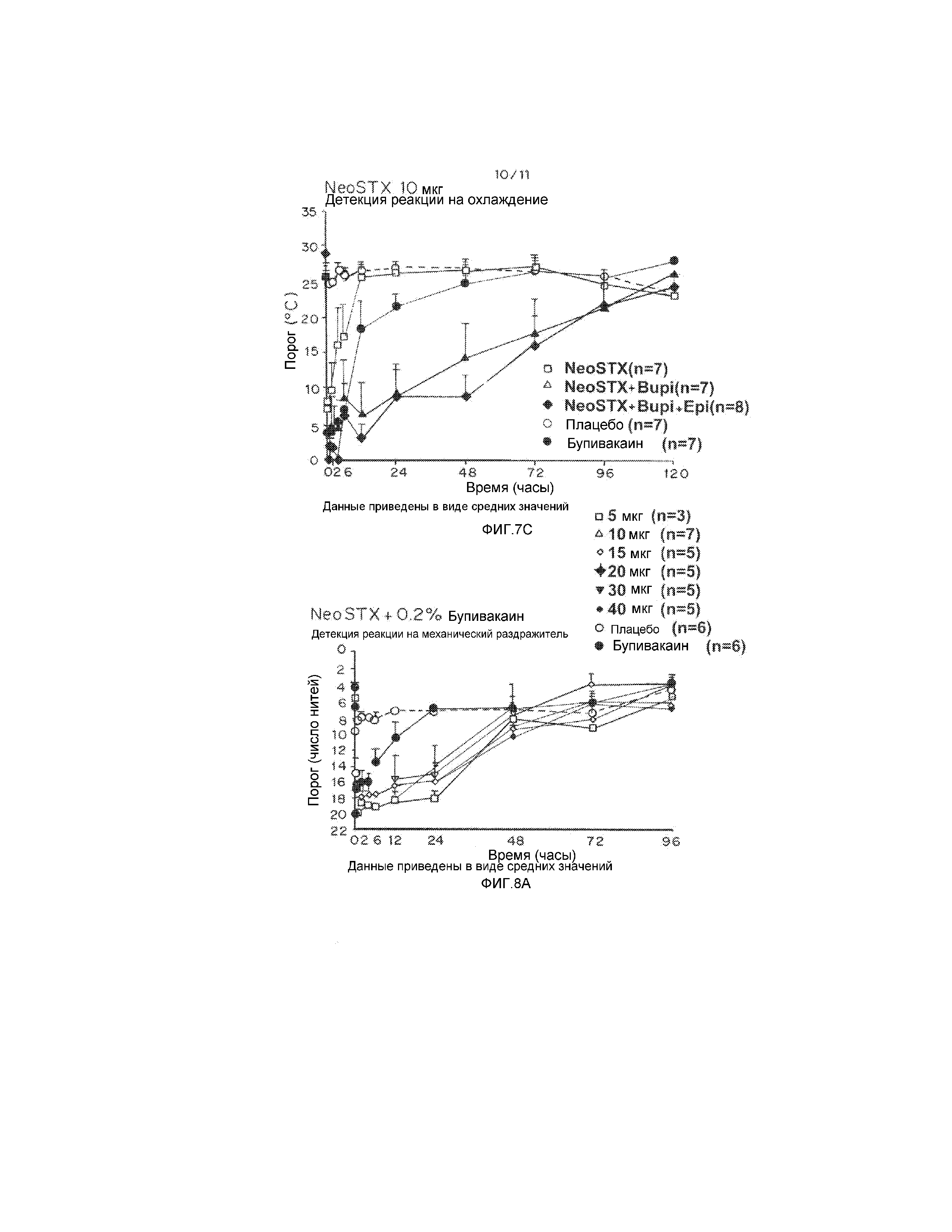
На фиг. 7А и 7В показаны результаты фазы I клинических испытаний на людях, демонстрирующие интенсивность и продолжительность блокады, вызванной сочетаниями NeoSTX-бупивакаин и NeoSTX-бупивакаин-эпинефрин в дозах, соответствующих 10 мкг NeoSTX. На фиг. 7A, B, и С приведены результаты фазы I клинических испытаний на людях, демонстрирующие, что добавление эпинефрина увеличивает интенсивность и продолжительность блокады под действием сочетаний NeoSTX с бупивакаином. На фигурах 7А, 7В и 7С приведены графики, демонстирующие пороговое измерение плотной и частичной блокады под действием NeoSTX, NeoSTX+бупивакаин, NeoSTX+бупивакаин+эпинефрин по сравнению с плацебо и контролями (отличными от NeoSTX) с течением времени в часах, путем определения реакции на механический раздражитель (7А), боль (7В) и охлаждение (7С). Результаты показывают, что бупивакаин в концентрации 0,2% обеспечивает плотную блокаду не более чем на 6 часов, и частичное обезболивание в диапазоне 6-12 часов. Введение 10 мкг NeoSTX в физиологическом растворе приводит к сильно варьирующей и кратковременной блокаде. Введение 10 мкг NeoSTX в 0,2% бупивакаине обеспечивает плотную блокаду в течение примерно 12 часов и разные степени обезболивания в течение 24-72 часов. Сочетание 10 мкг NeoSTX в 0,2% бупивакаине с 5 мкг/мл эпинефрина дает плотную блокаду в течение 24 часов и разные степени обезболивания в течение 48-72 часов.
На фиг. 8А-8С приведены результаты увеличения дозы NeoSTX в сочетаниях NeoSTX-0,2% бупивакаин. На фиг. 8А, В и С показаны результаты фазы I клинических испытаний на людях, демонстрирующие, что сочетания NeoSTX-бупивакаин увеличивают продолжительность блокады по сравнению с бупивакаином, вводимым отдельно, в дозах, не превышающих 5 мкг. На фиг. 8А-C приведены графики, демонстрирующие результаты измерения плотной и частичной блокады, обеспечиваемой бупивакаином, сочетаниями NeoSTX-бупивакаин и NeoSTX-бупивакаин-эпинефрин, используемыми в дозах, соответствующих 10 мкг NeoSTX, путем детекции ответов на механические (фиг. 8А) и термальные (фиг. 8B, 8C) раздражители. Результаты показывают, что сочетания NeoSTX-0,2% бупивакаин, соответствующие всем дозам NeoSTX в диапазоне от 5 мкг до 40 мкг, обеспечивают плотную блокаду по нескольким сенсорным модальностям в течение по меньшей мере 12 часов, обезболивание в течение периодов в диапазоне 24-72 часов и надежное восстановление от плотной механической блокады в течение 48 часов, что отвечает требованиям к лекарственным препаратам, используемым для блокады периферических нервов, отвечающих за двигательную функцию рук и ног.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Улучшение безопасности, связанное со снижением дозы бупивакаина в сочетании с NeoSTX, важно для пациентов всех возрастов, но особенно для детей. Эпидемиологические данные из проспективных реестров показывают, что маленькие дети имеют более высокий риск системных реакций при местной анестезии, чем взрослые. Местные анестетики и региональную анестезию все чаще используют для облегчения боли после операции у новорожденных и детей. Повышенный уровень безопасности, присущий данным сочетаниям, обуславливает их уникальное применение в педиатрии. Оптимальные, предпочтительные и относящиеся к широкому диапазону дозы, объемы и концентрации, используемые для педиатрических пациентов при разных показаниях, определяют с учетом факторов, связанных с физико-химическими свойствами NeoSTX и размерами компартментов организма и объемами распределения, в зависимости от массы тела детей и новорожденных.
Определения:
Обезболивание включает в себя комплекс мер, обеспечивающих отсутствие чувствительности к боли без потери сознания.
Анестезия включает в себя потерю чувствительности (местной без потери сознания; системной с потерей сознания) и, как правило, сознания без утраты жизненно важных функций.
Вазоконстриктор представляет собой средство, суживающее просвет сосудов, особенно в результате вазомоторного действия.
Инфильтрация включает в себя введение в несколько слоев или областей ткани.
Инъекция представляет собой введение в одну точку ткани, или в просвет.
Блокада нерва представляет собой местную анестезию, осуществляемую путем прерывания потока импульсов вдоль нервного ствола.
Минимальная эффективная концентрация ("MEC") представляет собой самую низкую местную концентрацию одного или нескольких лекарственных средств в конкретном участке, достаточную для обеспечения обезболивания.
II. Композиции
А. Блокаторы натриевых каналов участка 1
Блокаторы участка 1 представляют собой семейство молекул, давно известных как мощные и специфические блокаторы потенциалзависимых натриевых каналов. Блокаторы натриевых каналов участка 1 включают в себя тетродотоксин (ТТХ), сакситоксин (STX), декарбамоилсакситоксин, неосакситоксин и гониаутоксины (совместно упоминаемые здесь как "токсины"). Тетродотоксины получают из яичников и яичек нескольких видов рыбы фугу и некоторых видов тритонов Калифорнии. В основе химической структуры тетродотоксинов лежит аминопергидрохинолин. См. Pharmacological Reviews, Vol. 18 No. 2, pp. 997-1049. Тетродотоксин сам по себе является слишком токсичным для применения в качестве анестезирующего средства. Сочетания тетродотоксина с бупивакаином обеспечивают длительную блокаду седалищного нерва у крыс без увеличения системной токсичности по сравнению с используемым отдельно тетродотоксином (Kohane, et al., Anesthesiology, 1998: 119-131). Хотя наиболее широко известный токсин участка 1, тетродотоксин, эффективен в качестве анестезирующего средства, он является дорогим для клинического применения, поскольку его получают из рыбы фугу; если эндосимбиотические бактерии, продуцирующие ТТХ, выращивают ex vivo, продукция ТТХ уменьшается.
Сакситоксин впервые был выделен из маленьких молюсков Аляски, Saxidomus giganteus, где он присутствует в водорослях рода Gonyaulax. Он имеет химическую формулу C10H15N7O3.2HCl. Считается, что токсин содержит пергидропуриновое ядро, в которое включены два гуанидиновых фрагмента. Сакситоксин также является слишком токсичным, чтобы использоваться отдельно в качестве местного анестетика.
Сакситоксин и его производные можно получить в биореакторах из водорослей. Два производных, неосакситоксин (NeoSTX) и декарбамоилсакситоксин, имеют преимущества с точки зрения производственного процесса и активности. В исследовании анализируют блокаду седалищного нерва крыс под действием нескольких членов семейства сакситоксинов, включающих в себя NeoSTX (Kohane, et al, Reg. Anesth. Pain Med., 2000; 25: 52-9). Сакситоксин и два указанных производных в сочетании с бупивакаином или эпинефрином вызывают заметную синергетическую и продолжительную блокаду (блокаду седалищного нерва крыс в течение 1-2 дней in vivo).
Неосакситоксин и декарбамоилсакситоксин потенциально являются более активными и как компоненты композиции могут иметь преимущества по сравнению с сакситоксином. Неосакситоксин (NeoSTX) проходит клинические испытания как местный анестетик пролонгированного действия (Rodriguez-Navarro, et al., Anesthesiology, 2007; 106: 339-45; Rodriguez-Navarro, et al, Neurotox. Res., 2009; 16: 408-15; Rodriguez-Navarro, et al., Reg. Anesth. Pain Med., 2011; 36: 103-9). Исследование подкожной инфильтрации на людях-добровольцах фазы 1 демонстрирует, что NeoSTX эффективно вызывает кожную гипостезию (Rodriguez-Navarro, et al. , Anesthesiology , 2007; 106:339-45), а другое исследование фазы 1 демонстрирует, что сочетание с бупивакаином приводит к более длительному обезболиванию по сравнению с NeoSTX или бупивакаином, используемыми по отдельности (Rodriguez-Navarro, et al, Neurotox. Res., 2009; 16: 408-15).
Предпочтительным источником блокатора натриевого канала участка I является неосакситоксин, производимый Proteus, Chile.
B. Местные анестетики
В данном описании термин "местный анестетик" относится к лекарственному средству, которое обеспечивает местное онемение или обезболивание. Подходящие для применения классы местных анестетиков включают в себя аминоациланилидные соединения, такие как лидокаин, бупивакаин, прилокаин, мепивакаин и родственные им соединения, содержащие разные заместители в циклической системе или азот аминогруппы; аминоалкилбензоатные соединения, такие как прокаин, хлорпрокаин, пропоксикаин, гексилкаин, тетракаин, циклометилкаин, беноксинат, бутакаин, пропаракаин и родственные им соединения; кокаин и родственные ему местные анестетики; аминокарбонатные соединения, такие как диперодон и родственные ему местные анестетики; N-фениламидиновые соединения, такие как фенакаин и родственные ему анестетики; N-аминоалкиламидные соединения, такие как дибукаин и родственные ему местные анестетики; аминокетоновые соединения, такие как фаликаин, диклонин и родственные им соединения; и аминоэфирные соединения, такие как прамоксин, диметизохин, и родственные им соединения. Предпочтительными местными анестетиками являются аминоамиды и сложные аминоэфиры, из которых наиболее предпочтительными является бупивакаин, причем, если нужен местный анестетик с сосудосуживающей активностью, используют левоэнантиомер бупивакаина, тетракаин и ропивакаин, который обладает немного повышенной сенсорной селективностью.
Указанные лекарственные средства обеспечивают обезболивание в среднем в течение периода от шести до десяти часов при введении в разных участках и при разных видах хирургии. При многих типах хирургии желательно, чтобы обезболивание длилось два или три дня. Предпочтительные местные анестетики для применения в сочетании с NeoSTX включают в себя бупивакаин, ропивакаин, тетракаин и левобупивакаин. Бупивакаин является местным анестетиком, характеризующимся высокой продолжительностью и эффективностью действия. Его другие преимущества включают в себя достаточную сенсорную анестезию, а не только частичную моторную блокаду, и широкую доступность.
С. Вазоконстрикторы
Подходящие для применения вазоконстрикторы включают в себя соединения, которые действуют местно, ограничиая поток крови и тем самым удерживая введенные лекарственные средства в участке введения. В результате значительно снижается системная токсичность. Предпочтительные вазоконстрикторы включают в себя соединения, действующие на альфа-адренорецепторы, такие как эпинефрин и фенилэпинефрин.
Другие препараты и красители, такие как бупивакаин и левобупивакаин, оказывают сосудосуживающее действие в качестве побочного эффекта.
D. Вспомогательные вещества и консерванты
Композиции также могут содержать консерванты, средства, регулирующие рН, антиоксиданты и средства, поддерживающие изотоничность.
В предпочтительном варианте осуществления композицию получают путем разведения анестетика в физиологическом растворе или в кислом буферном растворе, необязательно содержащем консервант. Можно использовать носители, обеспечивающие локальное или замедленное высвобождение, но они не являются предпочтительными.
Е. Единичные лекарственные формы
В предпочтительных вариантах осуществления NeoSTX, бупивакаин и, необязательно, эпинефрин предоставляют во флаконах в виде водного раствора. В зависимости от типа композиции, как описано выше и ниже, размеры флаконов могут варьировать от 15 до 40 мл, причем в разных ситуациях для одного пациента можно использовать 1-3 флакона. В другом варианте осуществления NeoSTX, местный анестетик и, необязательно, вазоконстриктор, предоставляют в одном или нескольких флаконах, необязательно в лиофилизированном виде, а перед применением их подвергают регидратации и объединяют. В указанном втором варианте осуществления предпочтительный размер флаконов может варьировать от 5 до 40 мл.
III. Композиции и дозировки
Чтобы определить дозы и объемы, эффективные для лечения людей, нужно провести исследования на животных и на людях. Например, порядок величины активности блокаторов натриевых каналов участка 1, определенный путем физиологических экспериментов in vitro, не позволяет предсказать порядок величины активности этих соединений in vivo (Kohane, et al, Reg. Anesth. Pain Med., 2000; 25: 52-9).
Нижеследующие факторы накладывают ограничения на дозы, объемы и концентрации местных анестетиков.
Разные клинические ситуации предъявляют разные требования к безопасности и эффективности местных анестетиков.
Системная безопасность определяет верхний предел общей дозы (мг или мг/кг) бупивакаина, NeoSTX, или других местных анестетиков. Общие допустимые дозы немного различаются в зависимости от динамики поглощения, кровеносных сосудов и т.д., но в целом каждый местный анестетик имеет максимально допустимую общую дозу. Как описано в данном документе, применение эпинефрина вместе с NeoSTX и бупивакаином повышает эффективность и системную безопасность, позволяя использовать более высокие дозы или большие объемы и повышая продолжительность обезболивания. Тем не менее, в организме существуют некоторые участки, в которых следует избегать присутствия эпинефрина вследствие чрезмерного сужения сосудов. Такие участки включают в себя области вокруг пальцев рук и ног, а также вокруг пениса. Таким образом, для разных применений клинических важно разработать композиции как содержащие, так и не содержащие эпинефрин.
В любом определенном участке организма требуется достаточная локальная концентрация местных анестетиков в ткани, чтобы блокировать афферентную передачу. Самая низкая локальная концентрация одного или нескольких лекарственных средств в конкретном участке, достаточная для обеспечения обезболивания, называется "минимальная эффективная концентрация" или MEC.
Таким образом, в клинических ситуациях, в которых требуется инфильтрация больших объемов тканей, нужно использовать более высокие общие объемы местного анестетика в концентрации, равной или превышающей MEC, чем в клинических ситуациях, в которых требуется инфильтрация меньших объемов ткани. Если MEC одинакова в разных участкках, то большие объемы ткани требуют более высокой общей дозы, чем маленькие объемы ткани.
В фазе 1 клинических испытаний на людях NeoSTX в солевом растворе и сочетаний NeoSTX-бупивакаин неожиданно было обнаружено, что системные симптомы, включающие в себя небольшое покалывание и/или онемение пальцев, губ и языка, встречаются при использовании общих доз NeoSTX, не превышающих 10 мкг. Указанные симптомы являются легкими в диапазоне доз 10-15 мкг, однако при увеличении дозы до 40 мкг их тяжесть увеличивается и появляется кратковременная тошнота. Появление указанных симптомов является неожиданным, поскольку покалывание и тошноту невозможно идентифицировать в исследованиях, проводимых не на людях. Исследования на людях также демонстрируют, что добавление эпинефрина к сочетанию NeoSTX-бупивакаин резко уменьшает встречаемость данных симптомов в диапазоне доз NeoSTX 10-30 мкг (фиг. 6). Следовательно, из полученных ранее результатов невозможно сделать вывод о необходимости добавления эпинефрина для предотвращения покалывания и тошноты в указанных концентрациях. Фаза 1 испытаний на людях также демонстрирует, что эпинефрин резко увеличивает продолжительность блокады под действием NeoSTX+BPV.
В некоторых медицинских учреждениях предпочтитают не вводить большие объемы (то есть превышающие 20 мл) местного анестетика, чтобы предотвратить распространение онемения или слабости в другие участки организма, в которых эти эффекты являются нежелательными или даже опасными. Например, введение в объеме, превышающем 20 мл, для межлестничной блокады плечевого сплетения, которая используется при хирургии плеча, повышает риск перетекания к соседним нервам шеи, иннервирующим гортань, что приводит к хрипоте и риску вдыхания жидкостей в трахею. Подобным образом, применение объемов, превышающих 20 мл, для поясничной симпатической блокады увеличивает риск перетекания к соматическим нервам, что может привести к временной слабости ног вследствие онемения нервов основных мышц ног. В других случаях, если не используются очень большие объемы, некоторые ткани могут быть не охвачены, и в результате можно получить недостаточное обезболивание. Примеры таких случаев приведены ниже.
В клинических испытаниях обнаружены конкретные факторы, касающиеся дозирования, которые невозможно было предсказать на основании известной информации по блокаторам натриевых каналов участка 1. Некоторые из них противоречат существующим в настоящее время представлениям и клинической практике в области местной/региональной анестезии. Указанные факторы также оказывают неожиданное влияние на конкретные композиции, предназначенные для безопасного применения в организме человека.
У крыс детектируемая блокада нерва начинается при введении средства в дозе, превышающей 30 мкΜ в 0,1 мл (Kohane, et al, RAPM, 25 (1): 1-107 (2000)), что соответствует дозе примерно 1 мкг на крысу массой 350 г, и примерно 270 мкг на человека массой 70 кг. Как описано в примере 1 и в дополнительных исследованиях, дозозависимый ответ определяют на крысах путем местной анестезии под действием NeoSTX в физиологическом растворе, сочетания NeoSTX-бупивакаин и сочетания NeoSTX-бупивакаин-эпинефрин (см. фиг. 1, 2, 4 и 5). В исследованиях на крысах и на людях используют одинаковую концентрацию бупивакаина 0,2%. У крыс сочетания NeoSTX-бупивакаин при дозе NeoSTX 2 мкг/кг дают противоречивое или статистически незначимое увеличение длительности блокады по сравнению с бупивакаином, используемым отдельно, а надежное и устойчивое увеличение длительности достигается только при применении NeoSTX в дозах, составляющих по меньшей мере 3 мкг/кг. В указанных исследованиях вводимый объем составляет 0,3 мл. С учетом массы крыс (примерно 250 г) в указанных экспериментах доза NeoSTX 3 мкг/кг соответствуют концентрации NeoSTX во вводимых препаратах 2,5 мкг/мл.
И, наоборот, в фазе 1 испытаний на людях с использованием сочетаний NeoSTX-бупивакаин было обнаружено, что дозы NeoSTX, не превышающие 5 мкг (примерно 0,07 мкг/кг для взрослых людей), дал превосходное, т.е. 4-кратное увеличение длительности блокады по сравнению с бупивакаином, используемым отдельно (фиг. 7). С учетом вводимого объема 10 мл это указывает на то, что NeoSTX в сочетаниях NeoSTX-бупивакаин очень эффективно увеличивает длительность блокады у людей, при использовании NeoSTX в концентрации 5 мкг/10 мл, или 0,5 мкг/мл.
Таким образом, у людей NeoSTX, входящий в состав сочетаний NeoSTX-бупивакаин, вызывает надежное увеличение длительности блокады в дозе, которая после коррекции по массе по меньшей мере в 40 раз ниже, и в концентрации, которая по меньшей мере в 5 раз ниже, чем соответствующие эффективные скорректированные по массе дозы и концентрации NeoSTX, используемые для введения крысам. Схему введения лекарственного средства и, следовательно, конкретные диапазоны концентраций, необходимые для конкретных видов хирургии, невозможно определить на основании предыдущего уровня техники, поскольку животных нельзя опросить по поводу симптомов, свидетельствующих о довольно значительной токсичности. В частности, в исследований NeoSTX на людях было установлено, что системные симптомы, включающие в себя покалывание, онемение губ, пальцев и языка, а также возникающая со временем тошнота, появляются при введении доз, которые после коррекции по массе (15-40 мкг, или примерно 0,2-0,6 мкг/кг), значительно ниже, чем используемые в исследованиях на крысах (2-5 мкг/кг), фиг. 1-5, причем покалывание, онемение и тошнота встречаются как при неизбежной токсичности существующих местных анестетиков, так и при паралитическом отравлении моллюсками.
В заключение:
Результаты предыдущих исследований NeoSTX на крысах или на людях не предсказывали появление указанных симптомов в указанных низких дозах.
Указанные симптомы встречаются при гораздо более низких дозах NeoSTX, чем дозы, вызывающие измеримые физиологические эффекты, такие как слабость или ухудшение респираторных показателей. Данные симптомы ограничивают максимальные дозы NeoSTX-бупивакаина у ненаркотизированных индивидуумов в большей степени, чем у наркотизированных индивидуумов.
Симптомы, вызванные NeoSTX, подразумевают меньший риск, чем подобные симптомы, вызванные чрезмерно высокой дозой бупивакаина. Если бупивакаин вызывает только покалывание, существует вероятность, что у индивидуума в скором времени могут развиться судороги, аритмия или сердечный приступ. В случае NeoSTX этого не происходит.
Эпинефрин резко уменьшает тяжесть указанных симптомов, позволяя переносить высокие дозы NeoSTX в составе таких тройных сочетаний по сравнению с двойными сочетаниями.
Схема введения лекарственного средства и, следовательно, конкретные диапазоны концентраций, предлагаемые для конкретных видов хирургии, отличаются от дозировок местных анестетиков, используемых во всем мире. Системная токсичность редко является ограничивающим фактором при применении традиционных местных анестетиков, поэтому нет необходимости в корректировке концентрации с учетом вводимого объема. Применение NeoSTX и подобных соединений требует иного подхода, включающего в себя изменение состава раствора лекарственного средства.
Разработаны композиции, оптимизированные для клинических ситуаций разных типов.
"Инфильтрационное обезболивание с использованием больших объемов".
Композиция, используемая для введения больших объемов, составляющих 35-120 мл для взрослых людей и 0,5-1,8 мл/кг для детей, содержит в качестве активных агентов в случае тройного сочетания бупивакаин в диапазоне концентраций от 0,1% (1 мг/мл) до 0,25% (2,5 мг/мл), обеспечивающем общую системную дозу бупивакаина не более 225 мг у взрослых или 2,5 мг/кг у детей; NeoSTX в диапазоне концентраций от 0,1 мкг/мл до 1 мкг/мл, обеспечивающем общую системную дозу 3,5-100 мкг у взрослых или 0,05-1,5 мкг/кг у детей, и эпинефрин в диапазоне концентраций от 2 мкг/мл (1:500000 в традиционной терминологии) до 10 мкг/мл (1:100000). Такую композицию обычно используют для инфильтрации трех или четырех слоев большой хирургической раны при полноразмерной открытой лапаротомии, торакоабдоминальном разрезе, или боковом разрезе. Некоторые из таких операций включают в себя: кесарево сечение, открытую гистерэктомию, резекцию пищевода и проксимального отдела желудка, нефрэктомию, или обширные операции брюшной полости по поводу рака, такие как колэктомия. Идеальным применением указанных композиций также является инфильтрация раны при тотальном замещении тазобедренного сустава (артропластика тазобедренного сустава) и полной замене коленного сустава (артропластика коленного сустава). Предпочтительным применением указанной композиции является инфильтрации трех или четырех слоев большой хирургической раны при полноразмерной открытой лапаротомии, торакоабдоминальном разрезе, или боковом разрезе.
|
|
"Средний объем, промежуточная длительность действия"
Такие способы применения включают в себя использование общего объема, составляющего примерно 15-40 мл у взрослых или 0,2-0,6 мл/кг у детей. В указанных способах применения следует использовать сравнительно низкие объемы, чтобы предотвратить перетекание в нежелательные участки. Например, при хирургии плеча обычно используют межлестничную блокаду плечевого сплетения. Для точного размещения иглы используют ультразвуковое наведение, а общий объем ограничивают, чтобы предотвратить перетекание к нежелательным участкам, таким как возвратный гортанный нерв (который контролирует функционирование гортани). Используемая в настоящее время блокада, как правило, длится 10 часов, редко до 15-18 часов. Это часто означает, что блокада продолжается до ночи и в первую ночь после операции пациенты испытывают сильную боль.
В данном режиме желательно, чтобы блокада обеспечивала надежное обезболивание в течение по меньшей мере 24 часов (т.е. чтобы она длилась до окончания первой ночи), и до 48-72 часов, однако плотная моторная блокада и компоненты блокады, отвечающие за чувствительность к легким прикосновениям, должны уменьшаться в течение примерно 24 часов, чтобы у пациента увеличивалась подвижность руки и кисти (при блокаде плечевого сплетения) или ноги (при блокаде бедренного нерва, поясничного сплетения или седалищного нерва) через день после операции.
Композиция, используемая в среднем объеме от 15 до 50 мл, содержит в качестве активных средств бупивакаин в диапазоне концентраций от 0,125% до 0,3% (1,25-3 мг/мл), обеспечивающем системную дозу у взрослых не более 150 мг (не более 2 мг/кг у детей), NeoSTX в диапазоне концентраций от 0,2 до 2 мкг/мл, обеспечивающем системную дозу у взрослых от 7 до 100 мкг (0,1-1,5 мкг/кг у детей), и эпинефрин в диапазоне концентраций от 0 до 10 мкг/мл (≤1:100000).
Предполагаемые способы примненения средних объемов композиций включают в себя как блокаду периферических нервов, так и блокаду сплетений (периневральные инъекции), а также инфильтрацию (введение вдоль слоев хирургической раны). Способы применения таких композиций включают в себя хирургию плеча, кисти или руки, инфильтрацию или подвздошно-паховую/подвздошно-подчревную блокаду при лечении паховой грыжи, пениальную блокаду при лечении гипоспадии, бедренную блокаду при полной замене коленного сустава или лечении передней крестообразной связки, блокаду межреберных нервов при открытой хирургии груди, или блокаду бедренного и седалищного нервов при ампутации ноги или операции на ступне или голеностопном суставе. При хирургии бедра композиции можно использовать для блокады поясничного сплетения и, в более низком объеме, для блокады седалищного нерва. Данную композицию также можно использовать для блокады нервов (бедренного и седалищного, поясничного сплетения и седалищного нерва) при хирургической операции по замене тазобедренного или коленного сустава.
Для некоторых способов применения композиции в средних объемах, особенно в случае блокады периферических нервов и блокады сплетения приоритетом является достижение трех характеристик: анестезия (почти полное отсутствие чувствительности) для операции в течение 3-12 часов, обезболивание (длительное облегчение боли) после операции в течение не менее 24 часов, и обеспечение восстановления после моторной блокады с обеспечением некоторой способности к движению конечностей в течение временного интервала 24-48 часов.
Для блокады периферических нервов и блокады сплетений с двигательными эффектами на руках и ногах и с учетом требования восстановления от моторной блокады в течение периода 24-48 часов, композиции, содержащие сочетание NeoSTX-бупивакаин в отсутствие эпинефрина, по всей вероятности, являются идеальными, как показано в нижеследующих таблицах.
|
|
"Низкий объем, высокая длительность действия"
Данная композиция предназначена для участков, в которых достигается очень длительный эффект, и в которых объемы нужно поддерживать на низком уровне, чтобы избежать перетекания в другие участки. Примером такого применения является блокада поясничного отдела симпатического ствола при комплексном региональном болевом синдроме/рефлекторной симпатической дистрофии, или сосудистой недостаточности ноги, или блокада солнечного сплетения при панкреатите или раке поджелудочной железы.
При блокаде поясничного отдела симпатического ствола проводят инъекцию, чтобы блокировать группу нервов, которые вызывают сужение кровеносных сосудов в ноге. Блокада таких нервов приводит к увеличению притока крови к ноге и уменьшению боли, обусловленной некоторыми заболеваниями. При такой блокаде нервов объем должен быть относительно низким (предпочтительно 8-20 мл), чтобы избежать перетекания к соматическим нервам поясничного сплетения, что может вызвать слабость в ноге. Однако в отличие от среднего объема и промежуточной длительности действия желательно, чтобы данный тип блокады длился так долго, насколько это возможно, поскольку при введении в небольших объемах с использованием флюороскопического контроля существует очень небольшая сенсорная или моторная блокада. Следовательно, в данном способе применения нужно использовать относительно высокие концентрации всех трех компонентов, чтобы достичь длительности симпатической блокады и повышенного местного кровотока в течение по меньшей мере четырех дней.
Композиция, предназначенная для применения в низких объемах, и характеризующаяся длительным действием, содержит в качестве активных ингредиентов бупивакаин в концентрации от 0,25% до 0,5% (2,5-5 мг/мл), где введение 5-15 мл обеспечивает системную дозу бупивакаина у взрослых не более 75 мг, NeoSTX в диапазоне концентраций от 0,5 до 5 мкг/мл, где введение 5-15 мл обеспечивает системную дозу у взрослых 5-75 мкг, и эпинефрин в диапазоне концентраций от 2,5 до 10 мкг/мл (1:500000-1:100000). Примером такого применения является блокада поясничного отдела симпатического ствола при комплексном региональном болевом синдроме/рефлекторной симпатической дистрофии, или сосудистой недостаточности ноги, или блокада солнечного сплетения при панкреатите или раке поджелудочной железы.
Желательно, чтобы данный тип блокады длился так долго, насколько это возможно, поскольку при введении в небольших объемах с использованием флюороскопического контроля существует очень небольшая сенсорная или моторная блокада. Следовательно, в данном способе применения нужно использовать относительно высокие концентрации всех трех компонентов, чтобы достичь симпатической блокады и повышенного местного кровотока в течение по меньшей мере 3-4 дней, а возможно и дольше. Другие способы применения композиций, используемых в низком объеме и обеспечивающих длительное действие, включают в себя блокаду седалищного нерва длительного действия, где быстрое восстановление двигательной функции не является проблемой, как в случае ампутации голени.
|
|
Двойные сочетания лекарственных средств NeoSTX + BPV
Существует потребность в средстве, которое не отличается замедленным высвобождением и надежно обеспечивает блокаду нервов хирургического класса в течение 6-12 часов и в течение последующих примерно 48 ч уменьшенную блокаду и облегчение боли без дополнительного лечения. Первый период можно использовать во время операции и сразу после операции; последний период обеспечивает уменьшение обезболивания и позволяет увеличивать использование поврежденной части тела по мере заживления. Сочетание NeoSTX + BPV может обеспечить такую продолжительность блокады.
Далее настоящее изобретение разъясняется со ссылкой на нижеследующие неограничивающие примеры.
Пример 1: Сочетание неосакситоксина (NeoSTX) с бупивакаином обеспечивает местное обезболивание длительного действия в клинических испытаниях без увеличения токсичности.
Проведенное в последнее время исследование NeoSTX на овцах с использованием подкожной инъекции демонстрирует, что бупивакаин не ухудшает суррогатные значения дыхательной или нервно-мышечной токсичности NeoSTX. У отдельном модели преднамеренное внутривенное вливание NeoSTX приводит к удивительно низкой сердечно-сосудистой токсичности, гораздо ниже, чем в предыдущих исследованиях бупивакаина. В настоящем исследовании дополнительно анализируют дозозависимый ответ на введение NeoSTX и сочетаний NeoSTX-бупивакаин путем определения нейроповеденческих признаков блокады седалищного нерва крыс, а также местной и системной токсичности указанных сочетаний. Эти эксперименты проводят как доклинические исследования для получения Заявки на проведение клинических испытаний нового лекарственного препарата с использованием композиций NeoSTX, изготовленных для клинического применения в плановых клинических испытаниях фазы 1.
Выдвинуты следующие гипотезы: 1) при фиксированных дозах NeoSTX добавление бупивакаина увеличивает интенсивность и продолжительность блокады седалищного нерва крыс; 2) в присутствии или в отсутствие бупивакаина интенсивность и длительность блокады повышается с увеличением дозы NeoSTX; 3) гистологическое действие NeoSTX (в физиологическом растворе или в сочетании с бупивакаином) на седалищный нерв крыс является неопасным в используемом диапазоне доз, и статистически не отличается от действия среды или от необработанных нервов; 4) при моделировании быстрого случайного внутривенного вливания NeoSTX и бупивакаин, введенные раздельно, генерируют респираторные и электрокардиографические показатели с разной зависимостью от времени.
Сочетания, содержащие полные концентрации как NeoSTX, так и бупивакаина, вызывают системную токсичность более быстро (т.е. при более коротком времени инфузии и более низкой накопленной дозе), тогда как сочетания, содержащие половинные концентрации каждого компонента, вызывают токсичность более медленно, то есть при большей накопленной дозе.
Материалы и методы
Методы: NeoSTX, 0,25% бупивакаин, или их сочетание вводят крысам Sprague-Dawley путем инъекции в седалищный нерв. Сенсорно-ноцицептивную функцию оценивают путем тестирования на горячей плитке и с использованием нитей фон Фрея. Моторные и проприоцептивные функции оценивают по реакции разгибателей на постуральную нагрузку. Через семь дней седалищныео нервы выделяют и подвергают гистологическому анализу на токсичность. После инъекции в седалищный нерв также рассчитывают LD50 для NeoSTX и сочетания NeoSTX-бупивакаин. Для моделирования случайного внутривенного введения повышенной дозы анестезированные изофлураном, самостоятельно дышащие крысы получают инфузии либо только NeoSTX, либо только бупивакаина, либо сочетания NeoSTX-бупивакаин, до достижения респираторных и электрокардиографических показателей.
Лекарственные средства
При моделировании инъекции седалищного нерва лекарственные препараты получают в день эксперимента и вводят в фиксированном объеме 0,3 мл. NeoSTX (Proteus SA, Chile) транспортируют и хранят в соответствии с нормами безопасности детской больницы Бостона и Гарвардского Комитета по микробиологической безопасности. Исходный раствор NeoSTX содержит 20 мкг/мл неосакситоксина при рН 4,5.
NeoSTX разводят в 0,9% физиологическом растворе или в растворе гидрохлорида бупивакаина (SENSORCAINE®, APP Pharmaceuticals, Schaumberg, IL). В зависимости от предполагаемой конечной концентрации NeoSTX коммерческие флаконы, каждый из которых содержит бупивакаин в концентрации либо 5 мг/мл (0,5%), либо 2,5 мг/мл (0,25%), используют для получения конечной концентрации бупивакаина 2 мг/мл (0,2%) в конечных препаратах для инъекций. Для модели в.в. инфузии повышенной дозы используют следующие концентрации: 2 мг/мл бупивакаина, 1,88 мкг/мл NeoSTX, в сочетании полная концентрация бупивакаина составляет 2 мг/мл, а NeoSTX - 1,88 мкг/мл, половинная концентрация в сочетании: бупивакаин 1 мг/мл и NeoSTX 0,94 мкг/мл. Скорость инфузии корректируют в соответствии с массой животного, чтобы гарантировать постоянную скорость доставки лекарственного средства, доза которого скорректирована по массе. Так, в виде отдельных препаратов, бупивакаин вводят со скоростью 3,2 мг/кг/мин, а NeoSTX со скоростью 3 мкг/кг/мин. Животным, получающим сочетания, содержащие полные дозы, бупивакаин вводят со скоростью 3,2 мг/кг/мин, а NeoSTX вводят со скоростью 3 мкг/кг/мин, а животным, получающим сочетания, содержащие половинные дозы, бупивакаин вводят со скоростью 1,6 мг/кг/мин, а NeoSTX вводят со скоростью 1,5 мкг/кг/мин), причем все животные получают инфузию с постоянной, скорректированной по массе, скоростью, составляющей 1,6 мл/кг/мин.
Уход за животными
Самцов крыс Sprague-Dawley получают из Charles River Laboratories (Wilmington, MA): молодых взрослых животных массой от 200 до 250 г используют для моделирования инъекции в седалищный нерв, а животных массой 325-400 г используют для моделирования в.в. введения повышенной дозы. Уход за животными и их умерщвление осуществляют в соответствии с протоколами, утвержденными Комитетом по содержанию и использованию лабораторных животных при детской больнице. Разрабатывают порядок процедур, чтобы приучить животных к схеме тестирования и свести к минимуму стресс-индуцированное обезболивание.
Инъекция в седалищный нерв
Крыс быстро анестезируют изофлураном с использованием носового конуса. Иглу вводят заднемедиально в большой вертел, ориентируя ее в переднемедиальном направлении. После контакта с костью вводят 0,3 мл раствора. Левую ногу всегда используют для блокады; правая служит в качестве контроля и для измерения системной токсичности (Kohane, et al, Anesthesiology, 1998: 119-131).
Нейроповеденческое тестирование
Используют батарею нейроповеденческих тестов, полученную путем модификации теста Thalhammer et al., с помощью которой измеряют сенсорно-ноцицептивные и моторно-проприоцептивные нарушения, чтобы оценить длительность и интенсивность блокады после периневральной инъекции в седалищный нерв (Thalhammer, et al, Anesthesiology, 1995; 82: 1013-1025). Исследователям не сообщают дозы и назначение лечения. Чувствительность вначале анализируют с использованием нитей фон Фрея (VF) (Touch-Test Sensory Evaluator, North Coast Medical Inc., CA). После краткого привыкания к клетке из проволочной сетки применяют нити фон Фрея с возрастающим усилием до наблюдения отдергивания лап. Нити применяют только на боковых поверхностях подошвы, достоверно иннервирующихся седалищным нервом. Нити применяют с возрастающим усилием до наблюдения отдергивания, или до достижения максимального усилия 300 г (Yahalom, et al, Anesthesiology, 2011; 114(6): 1325-1335). Усилие в граммах, затраченное разгибателем в ответ на постуральную нагрузку (EPT) для поддержания равновесия, и время отдергивания от набора горячих пластин при 56 градусах Цельсия измеряют по способу, описанному Kohane, et al (Kohane 2000).
Измерение нейроповеденческих параметров проводят до инъекции, чтобы получить фоновые значения, через 15 минут, 1, 2, 3, 4, 6, 8, 10 и 12 часов после инекции в 1ый день и затем каждые 4 ч во второй день до восстановления двигательных функций. В каждый момент времени проводят три измерения усилия EPT и задержки в тесте с использованием горячей плитки, и определяют среднее значение.
Предыдущие исследования блокаторов натриевых каналов участка 1 с использованием данной схемы демонстрируют, что повышенные дозы вызывают временные контралатеральные ухудшения нейроповеденческих параметров, свидетельствующие о системном обезболивании и/или общей слабости (Kohane, et al, Reg. Anesth. Pain Med., 2001; 26(3) 239-45).
В предыдущих исследованиях показано, что введение 0,3 мл бупивакаина в концентрации 2,5 мг/мл приводит к полной блокаде (на основании порогов, определенных далее в данном параграфе) у >98% животных.
В анализах используют допущение, что неполная блокада под действием тестируемых композиций скорее отражает фактический фармакологический эффект используемой дозы, чем техническую неудачу при ведении. В предыдущей работе использовали следующие пороги для определения достижения сенсорной или моторной блокады животных: 7 с для задержки в термальном тесте, 40 г для реакции разгибателя на постуральную нагрузку. 50% восстановление определяют как 7 с и если порог не достигается, продолжительность блокады считают равной нулю. Было обнаружено, что использование указанных порогов может уменьшить степень потенциальной клинической значимости сенсорного и моторного ухудшения. Чтобы улучшить указанные пороги, рассчитывают наибольшие изменения по сравнению с фоновыми значениями в течение 15 минут после инъекции и полученные значения используют в качестве порога для блокады реакции на горячую плитку и EPT (0,8 с и 8 г, соответственно). Порог блокады в тесте фон Фрея составляет 60 г. Восстановление определяют как возвращение к прежним значениям.
Гистологические процедуры
Через семь дней после инъекции в седалищный нерв крыс, получивших повышенную дозу фенобарбитала (150 мг/кг), фиксируют путем траскардиальной перфузии в две стадии: вначале проводят инфузию с использованием 100 мл 0,9% физиологического раствора и затем с использованием 200 мл модифицированного фиксатора Карновского, содержащего 2,5% глутаральдегида и 1,25% параформальдегида в 0,1М фосфатном буфере. Левый и правый седалищные нервы выделяют и хранят в разбавленном фиксаторе при 4°С. Ткань седалищного нерва погружают в пластик с помощью стандартного метода электронной микроскопии с использованием тетроксида осмия, разрезают с получением срезов средней толщины и окрашивают толуидиновым синим. Срезы анализирует квалифицированный невролог (G.C.) с использованием системы баллов Estebe & Myers; анализы во всех группах указанный невролог проводит вслепую (Estebe, Anesthesiology, 2004; 100: 1519-25).
Системная токсичность при периневральной инъекции в седалищный нерв.
Сублетальную системную токсичность оценивают путем измерения сенсорно-ноцицептивных и моторно-проприоцептивных нарушений в правых задних конечностях после инъекций в седалищный нерв левых задних конечностей, как описано в предыдущем разделе "Нейроповеденческое тестирование". При более высоких дозах NeoSTX, используемого отдельно или в сочетании с бупивакаином, у большего числа животных развивается апноэ или затрудненное дыхание. Чтобы свести к минимуму страдания в данном эксперименте с участием неанестезированных животных, любое животное, у которого развивается апноэ или затрудненное дыхание, сразу умерщвляют путем внутрибрюшинного введения фенобарбитала (100 мг/кг), считая это летальным исходом. LD50 рассчитывают по способу, описанному в приведенном ниже разделе Статистические методы.
Системная токсичность при внутривенной инфузии
Чтобы смоделировать случайную в.в. инъекцию, анестезированным изофлураном, самостоятельно дышащим крысам вводят путем инфузии через канюлю в хвостовой вене раствор, содержащий лекарственное средство, до конечной асистолии. 26 крыс случайным образом распределяют на 4 группы: NeoSTX без добавок (n=6); бупивакаин (n=7); сочетание NeoSTX-бупивакаин, содержащее полные концентрации (n=7); и сочетание NeoSTX-бупивакаин, содержащее половинные концентрации (n=6), используя концентрации лекарственных средств и скорости инфузии, описанные в приведенном выше разделе "Лекарственные средства". Животных анестезируют путем вдыхания через носовой конус 3-5% изофлурана в кислороде с поддерживающей дозой 1% изофлурана. Катетер помещают в хвостовую вену, промывают 2 мл 0,9% физиологического раствора и соединяют со шприцевым насосом Medfusion (Smiths Medical, St Paul, MN). Непрерывно регистрируют показатели жизненно важных функций и результаты физиологических анализов, используя оборудование PowerLab и программное обеспечение LabChart (AD Instruments, Sydney, Australia). Фоновые значения измеряют (последующий анализ вне линии) после калибровки и соединения регистрирующего оборудования (ЭКГ, термометр, пульсоксиметр, датчик давления контура Бэйна и плетизмограф хвостовой вены), обеспечения доступа в хвостовую вену и поддерживания крысы на стабильном уровне анестезии путем вдыхания 1% изофлурана в кислороде в течение по меньшей мере 5 минут. Инфузии, как описано в приведенном выше параграфе под названием "Лекарственные средства", инициируют сразу после короткого периода регистрации фоновых значений и продолжают до достижения асистолии. Первичные результаты анализа включают в себя: (1) апноэ (недетектируемые изменения давления в контуре Бэйна), и (2) асистолия. Вторичные результаты включают в себя: брадикардию (частота сердечных сокращений <270), неблагоприятное изменение электрокардиографического сигнала (в том числе любая блокада сердца, широкий комплекс QRS, эктопическое биение предсердий или желудочков или пролонгированный интервал QTc), и уменьшение пульсации хвостовой артерии по данным плетизмографии.
Статистические методы
Результаты всех измерений приводят в виде срединных значений с интерквартильным диапазоном, или в виде среднего значения ± стандартное отклонение от среднего значения. Изменения в нейроповеденческие функциональных тестах оценивают с помощью непараметрической модели Фридмана, где обработку и дозу NeoSTX используют в качестве постоянных факторов, с корректировкой p-значений по Бонферрони для множественных сравнений (Montgomery, D., Design and Analysis of Experiments, 5th Ed. 2001, New York, NY: John Wiley & Sons, Inc.). Сочетания клинически значимых доз 1 или 2 мкг/кг дополнительно исследуют с использованием U-критерия Манна-Уитни. Результаты гистологических анализов нервов обрабатывают с помощью модели Крускала-Уоллиса. Пробит-анализ с использованием принципа максимального правдоподобия применяют для расчета срединной летальной дозы (LD50) для каждого введения лекарственного средства с 95% доверительными интервалами отношения правдоподобия, полученными профильным методом log-правдоподобия с использованием модели в.в. введения повышенных доз, причем время до получения информации о событии определяют с помощью кривых Каплана Мейера. Проводят несколько парных сравнений кривых выживания после введения одного бупивакаина и результаты, соответствующие p-значениям менее 0,017 считают статистически значимыми (Finney, Arch. Toxicol, 1985; 56: 215-218; Faraggi, et al, Statist. Med., 2003; 22: 1977-1988). Статистический анализ проводят с использованием статистического пакета SPSS (версия 19.0, SPSS Inc./IBM, Chicago, IL).
Результаты:
В диапазоне доз добавление бупивакаина к NeoSTX вызывает более интенсивную и более длительную блокаду ноцицептивной и моторно-проприцептивной функции, чем один NeoSTX. См. таблицу 7. Оценки гистологического повреждения в целом являются очень низкими во всех группах, со срединным и IQR-значениями, равными 0 по шкале Эстебе-Майерса. В случае подкожной инъекции добавление бупивакаина к NeoSTX не вызывает увеличения системной токсичности (LD50) по сравнению с введенным оттдельно NeoSTX. При внутривенной инфузии NeoSTX, бупивакаин и их сочетания демонстрируют разную динамику при достижении респираторных и электрокардиографических конечных результатов. См. таблицу 8.
Нейроповеденческие параметры
Интенсивность блокады
На фиг. 1А-1F показана зависимость интенсивности блокады от дозы NeoSTX через 15 минут после введения в присутствии или в отсутствие бупивакаина. Все бупивакаин-содержащие композиции вызывают полную блокаду всех трех поведенческих параметров в указанный момент времени. В отсутствие бупивакаина NeoSTX, вводимый отдельно в дозе, меньшей или равной 3 мкг/кг, вызывает неполную блокаду у большинства животных.
Продолжительность блокады
По сравнению с животными, получающими инъекции NeoSTX в физиологическом растворе, добавление бупивакаина приводит значительному увеличению времени, требующемуся для 100% восстановления от термальной и механической сенсорно-ноцицептивной и моторно-проприоцептивной блокады (p <0,001). Результаты показаны на фиг. 2А-2F. Корректированный по Бонферрони попарный анализ групп, получающих повышенные дозы NeoSTX в присутствии и в отсутствие бупивакаина, демонстрирует, что группа, получающая бупивакаин, характеризуется значительно более продолжительной блокадой при всех дозах более 1 мкг/кг (фиг. 2А).
Срединное значение времени до 100% восстановления после введения только 0,25% бупивакаина составляет 2,2 ч (1,9-2,9) по результатам теста с использованием горячей плитки, 2,2 ч (1,8-2,6) по результатам теста EPT и 1,9 ч (1,7-2,7) по результатам теста VF. Введение 0,25% бупивакаина в сочетании с 1 мкг/кг NeoSTX приводит к значительному увеличению времени до 100% восстановления по результатам теста фон Фрея (2,8 ч, 2,2-3,5, p=0,05) и по результатам теста EPT (3,1 ч, 2,8-3,9, p<0,001), но не увеличивает время до 100% восстановления ноцицептивного поведения по результатам теста с использованием горячей плитки (2,5 ч, 2,0-3,5, p=0,4). Во всех тестов и для всех доз рассчитывают время в часах до 50% восстановления и результаты приводят в таблице 7. Время до 50% восстановления по результатам теста фон Фрея значительно увеличивается у животных после введения 1 мкг/кг NeoSTX в сочетании с бупивакаином по сравнению с бупивакаином, вводимым отдельно (2,5 ч, 1,7-2,9 по сравнению с 1,5 ч, 1,5-2,1, р=0,03), тогда как результаты тестов EPT и горячей плитки не отличаются друг от друга в значительной степени. Однако сочетание 2 мкг/кг NeoSTX с бупивакаином вызывает значительное и существенно более высокое увеличение времени до 100% восстановления по реакции на горячую плитку (10,8 ч, 9,1-17,8, p<0,001), по результатам теста EPT (22 ч, 15-28, p<0,001), и по результатам теста фон Фрея (4,7 ч, 3-11, p<0,001).
|
Системная токсичность
В качестве показателя системного распределения лекарственного средства после инъекции в седалищный нерв измеряют нейроповеденческие параметры на неинъецированной правой конечности. По сравнению с бупивакаином, введенным отдельно, инъекция сочетания NeoSTX с бупивакаином вызывает увеличение интенсивности блокады на 15 минут (р=0,001) по результатам теста EPT, однако результаты теста с использованием горячей плитки или теста фон Фрея не различаются в значительной степени (фиг. 2С, 2Е). В скорректированной по Бонферрони модели, с использованием дозы NeoSTX и присутствия бупивакаина в качестве переменных факторов, сочетание NeoSTX с бупивакаином вызывает блокаду реакции на горячую плитку (2А, 2D) и EPT (2B, 2E) в контралатеральной конечности в значительно большей степени, чем один бупивакаин, в дозах 3 мкг/кг (p=0,011 и p=0,038, соответственно) и 3,5 мкг/кг (p<0,001 и p=0,036, соответственно). При относительно небольшой наблюдаемой блокаде в контралатеральной конечности, ANOVA не выявляет существенных различий по времени, необходимом для 100% восстановления контралатеральной конечности, среди животных, получающих NeoSTX, и животных, получающих сочетание NeoSTX-бупивакаин, если доза NeoSTX составляет менее 3 мкг/кг (фиг. 2E).
Определение LD50
С учетом отсутствия смертности в группе, получающей 3 мкг/кг NeoSTX, дозу повышают до максимального значения 8 мкг/кг. Указанная максимальная доза приводит к 100% смертности в течение 30 минут после введения NeoSTX, как отдельно, так и в сочетании с бупивакаином. У всех животных смерть наступает в результате окончательного апноэ. LD50 рассчитывают при 4,9 мкг/кг (95% CI=4,2-6,9) для одного NeoSTX и при 5,7 мкг/кг (95% CI=4,9-7,9) для сочетания NeoSTX с бупивакаином (фиг. 4). Увеличение дозы NeoSTX на протяжении измеряемого диапазона в значительной мере связано с повышением смертности (Z=5,82, p<0,001), а эффект снижения смертности в результате добавления бупивакаина приближается к уровню значимости (Z=1,86, p=0,06). Здесь можно сделать вывод, что совместное введение бупивакаина скорее уменьшает, а не увеличивает системную токсичность NeoSTX.
|
Гистология нервов
Оценка повреждения нерва по Эстебе-Майерсу свидетельствует об очень благоприятном гистологическом профиле после инъекции в седалищный нерв. При всех условиях обработки срединная оценка повреждения нерва по Эстебе-Майерсу равна 0 (IQR 0 - 0). Нервы с оценкой 3 или 4 отсутствуют. Статистические различия между нервами из экспериментальных групп и контрольными седалищными нервами (из правой конечности), не получающими инъекцию, отсутствуют. Общее число анализируемых нервов включает в себя следующее распределение по группам: среда 19, бупивакаин 0,25% чистый 19, контралатеральной (правая сторона, не получающая инъекцию) 16, NeoSTX 1 мкг/кг в физиологическом растворе 4, NeoSTX 1 мкг/кг в бупивакаине 8, NeoSTX 2 мкг/кг в физиологическом растворе 4, NeoSTX 2 мкг/кг в бупивакаине 7, NeoSTX 3 мкг/кг в физиологическом растворе 19, NeoSTX 3 мкг/кг в бупивакаине 27, NeoSTX 3,5 мкг/кг в физиологическом растворе 12, NeoSTX 3,5 мкг/кг в бупивакаине 13, NeoSTX 4 мкг/кг в физиологическом растворе 1, NeoSTX 4 мкг/кг в бупивакаине 6. Для проверки достоверности оценок гистолога, сделанных вслепую, получают срезы положительных контрольных нервов, взятых от животных с преднамеренным повреждением нерва (модель слабого лигирования), обработанных по той же схеме. Все указанные положительные контрольные нервы получают высокие оценки повреждения, составляющие по шкале Эстебе-Майерса 3 или 4.
Полученные результаты демонстрируют, что сочетание NeoSTX с бупивакаином после подкожной инъекции увеличивает продолжительность и надежность блокады седалищного нерва без повышения нейротоксичности или системной токсичности (пониженные значения LD50).
Исследование показывает, что совместная инъекция в седалищный нерв крыс 0,25% бупивакаина в сочетании с NeoSTX повышает интенсивность и продолжительность ноцицептивной блокады реакции на тепловой раздражитель без увеличения нейротоксичности или смертности. Если бупивакаин добавляют к 3 мкг/кг NeoSTX, его скорректированная по массе доза примерно в 2 раза больше, чем доза, ранее использованная в организме человека, причем процент животных с эффективной блокадой увеличивается от 50 до 100%. В клинически значимых дозах (1 и 2 мкг/кг) сочетание NeoSTX с бупивакаином приводит к значительному увеличению интенсивности и длительности сенсорно ноцицептивной блокады.
На фиг.4А-С, интенсивность и продолжительность сенсорной блокады в группах крыс, получающих либо чистый бупивакаин 0,2% (4А), либо бупивакаин 0,2% в сочетании с NeoSTX 3 мкг/кг (4В), либо бупивакаин 0,2% в сочетании с NeoSTX 3 мкг/кг и эпинефрином 5 мкг/мл (фиг. 4C). Видно, что тройное сочетание вызывает более интенсивную и продолжительную блокаду, чем двойное сочетание. Это позволяет предположить, что тройное сочетание вызывает более интенсивное и продолжительное обезболивание, чем двойное сочетание, что особенно важно при описанных выше клинических применениях в "высоком объеме" и "среднем объеме".
Используют модель для изучения системной токсичности. Модель внутримышечной (периневральной по отношению к седалищному нерву) инъекции используют для имитации системной токсичности во внесосудистом участке, как это происходит во время блокады нервов или инфильтрации при клиническом применении. У данной модели совместное введение бупивакаина и NeoSTX незначительно снижает системную токсичность по сравнению с животными, получающими такую же дозу NeoSTX в физиологическом растворе. В данном случае доза бупивакаина ниже диапазона, который продуцирует кардиотоксичность. Предполагаемая причина смерти включает в себя ослабление дыхательных мышц и некоторое расширение сосудов под действием NeoSTX, тогда как бупивакаин может уменьшить системную токсичность NeoSTX путем сужения сосудов в месте инъекции, тем самым замедляя системное поглощение NeoSTX. Данное предположение основано на известных местных сосудосуживающих эффектах бупивакаина и предыдущих экспериментах по изучению регионального кровотока у крыс после периневральной инъекции в седалищный нерв другого блокатора натриевого канала участка 1, тетродотоксина.
Поскольку совместное введение бупивакаина увеличивает эффективность и продолжительность блокады нервов под действием NeoSTX, немного уменьшая его системную токсичность, сочетание NeoSTX-бупивакаин обеспечивает значительное улучшение терапевтического индекса по сравнению с введенным отдельно NeoSTX. Композиция NeoSTX, разработанная для клинических испытаний, обеспечивает более длительную продолжительность блокады седалищного нерва у крыс, чем бупивакаин. Совместное введение бупивакаина повышает надежность и длительность блокады по сравнению с введенным отдельно NeoSTX.
Пример 2: Фаза I клинических исследований на взрослых людях
Исследователи из Университета Чили, Сантьяго, и небольшой биотехнологической компании Proteus SA, разработали биореакторный процесс для получения NeoSTX, обладающего клинической степенью эффективности, а также превосходными уровнями чистоты, стабильности, стерильности и непирогенности. Ряд доклинических исследований по токсикологии и безопасности на мышах, крысах и овцах проводят в CHB и Toxikon, Inc. С утверждения надзора областного IRB и чилийского института де Salud Publica (ISP), основного регуляторного органа по разрешению лекарственных средств и надзором за их применением в Чили, доктор Родригес-Наварро и др. проводят два испытания фазы 1 на добровольцах (Rodriguez-Navarro, et al., Anesthesiology, 106: 339-345, 2009; Rodriguez-Navarro, et al. Neurotox. Res., 2009; 16: 408-15) и два испытания фазы 2 с использованием NeoSTX в качестве местного анестетика пролонгированного действия для пациентов, перенесших лапароскопическую холецистэктомию (Rodriguez-Navarro, et al, Reg. Anesth. Pain Med., 2011, 36: 103-109; Rodriguez-Navarro - реферат для презентации на конференции ESRA, сентябрь 2010).
В фазе 1 испытаний на добровольцах дозы 10 или 50 мкг вызывают онемение кожи с высокой местной и системной безопасностью. Сочетания NeoSTX либо с бупивакаином, либо с эпинефрином, значительно повышают интенсивность и длительность кожного онемения по сравнению с NeoSTX, введенным отдельно, который, в свою очередь, вызывает более длительное онемение кожи, чем бупивакаин (Rodriguez-Navarro, et al., Neurotox. Res., 2009; 16: 408-15). Добавление эпинефрина уменьшает системную токсичность и приводит к надежному увеличению длительности сенсорной блокады.
В двух двойных слепых испытаниях по доказательству более высокой эффективности фазы 2 с участием пациентов, подвергающихся лапароскопической холецистэктомии под общей анестезией, в которых сравнивают 100 мкг NeoSTX с бупивакаином, используемых для инфильтрации участков введения троакара, NeoSTX обеспечивает более длительное обезболивание, чем бупивакаин, а пациенты указывают общие оценки, свидельствующие о более быстром восстановлении после операции. В настоящее время 181 пациент в Чили получает NeoSTX в клинических испытаниях при отсутствии каких-либо серьезных побочных эффектов.
Проводимые в последнее время испытания на людях демонстрируют эффективность, безопасность и длительное обезболивающее действие NeoSTX, используемого в исследованиях фазы 1 с участием ненаркотизированных добровольцев для инфильтрации кожи в дозе 10 мкг или 50 мкг, и в исследованиях фазы 2 с участием пациентов, подвергающихся лапароскопической холецистэктомии под общей эндотрахеальной анестезией, для инфильтрации слоев раны в дозе 100 мкг.
Данные о наличии слабости или симптомов респираторных или гемодинамических нарушений у активных добровольцев отсутствуют, однако подробные суррогатные измерения субклинических системных эффектов не проводились.
Пациенты, подвергающиеся лапароскопической холецистэктомии и участвующие в испытаниях по двойному слепому сравнению с бупивакаином, получают инъекции под общей эндотрахеальной анестезией с искусственной вентиляцией легких. Следовательно, невозможно оценить непосредственное воздействие на симптомы и дыхательные мышцы. Тем не менее, у всех индивидуумов наблюдается превосходное дыхательное усилие в конце операции и ни один из пациентов не требует отсрочки экстубации (продолжительность операции составляет примерно 1 час), кроме того, никаких признаков слабости или гиповентиляции не было отмечено при длительном наблюдении в палате посленаркозного ухода (PACU).
Однако, даже хотя указанные исследования фазы 2 на хирургических пациентах свидетельствуют о хорошей системной безопасности NeoSTX в дозе 100 мкг у анестезированных индивидуумов с механической вентиляцией легких, необходимо провести дополнительные исследования фазы 1 по повышению дозы, начиная с небольших доз, с использованием более точных суррогатных измерений субклинических системных эффектов, чтобы выбрать дозу, безопасную (характеризующуюся минимальным порогом побочных эффектов) для ненаркотизированных молодых взрослых мужчин.
Материалы и методы
Первой целью данного исследования фазы 1 является оценка системной безопасности неосакситоксина (NeoSTX), водимого путем подкожной инъекции в сочетании с традиционно используемым местным анестетиком, бупивакаином, и эпинефрином. Второй целью данного исследования фазы 1 является определение зависимости от дозы интенсивности и длительности кожной сенсорной блокады (нечувствительность к термальным и механическим раздражителям) под действием NeoSTX в физиологическом растворе по сравнению с NeoSTX в сочетании с бупивакаином и эпинефрином, для оценки местной безопасности и переносимости NeoSTX при введении путем подкожной инъекции, а также для измерения фармакокинетики NeoSTX после подкожной инъекции. Исследование фазы 1 проводят на основании инициированной исследователем FDA IND, чтобы дополнительно определить системную и местную безопасность и дозозависимый ответ для кожной сенсорной блокады под действием NeoSTX, вводимого путем подкожной инфильтрации здоровым молодым мужчинам-добровольцам.
Как указано ниже, покалывание губ, языка и пальцев происходит в дозах, которые с физиологической точки зрения являются очень безопасными. Данная поправка к протоколу отражает предположение, что NeoSTX можно использовать в двух диапазонах доз в последующем исследовании фазы 2: один диапазон обеспечивает минимальные системные симптомы у ненаркотизированных индивидуумов, а второй, включающий в себя несколько повышенные дозы, предназначается для применения у индивидуумов, находящихся под воздействием седативных средств или анестезии в условиях операционной. Данная поправка включает в себя группы индивидуумов, получающих лекарственное средство, в условиях операционной и позволяет индивидуумам получать низкие дозы анксиолизиса с использованием мидазолама, если покалывание воспринимается как интенсивное или очень надоедливое. Следовательно, важно определить безопасность в диапазоне доз, в котором препарат будет использоваться в условиях операционной. Схему с последовательным увеличением дозы используют для групп из 9 индивидуумов на каждой дозировочной стадии. В двойном слепом исследовании каждый индивидуум получает две инъекции одновременно в квадратный участок размером 3 см × 3 см на коже задней поверхности голени (икры), по одному с каждой стороны, по схеме рандомизированной блокады. Каждый индивидуум получает одну инъекцию 0,2% бупивакаина на одной стороне. На другой стороне индивидуум получает один из 2 возможных растворов: (1) физиологический раствор в качестве плацебо, или (2) NeoSTX в сочетании с бупивакаином и эпинефрином. В каждой группе, получающей лекарственное средство, только одна из инъекций включает в себя плацебо.
В исследовании участвуют молодые взрослые мужчины. Подкожную инфильтрацию проводят с использованием иглы 1½ дюйма 25 калибра. Объем 10 мл распределяют так, чтобы вводить подкожно 2 мл на каждой стороне квадрата 3 × 3 см, и 2 мл вводят по диагонали.
Индивидуумы получают NeoSTX в дозе 5, 10, 15, 20, 30 или 40 мкг, бупивакаин в концентрации 0,2% и эпинефрин в концентрации 5 мкг/мл. Эпинефрин обычно добавляют к инъекциям местных анестетиков по двум причинам: (1) для замедления системного поглощения и уменьшения системных концентраций в крови, и тем самым уменьшения риска системной токсичности, и (2) для увеличения длительности местной анестезии.
Применение схемы дозирования в паре индивидуумов, включающей в себя ввдение бупивакаина с одной стороны и с другой стороны либо NeoSTX в физиологическом растворе, либо NeoSTX в бупивакаине, позволяет проводить среди индивидуумов сравнение интенсивности и продолжительности кожного обезболивания растущими дозами NeoSTX, в присутствии или в отсутствие фиксированной концентрации бупивакаина 0,2%, по сравнению с используемым в настоящее время стандартом, 0,2% бупивакаином.
Основной мерой результата данного исследования фазы I является отсутствие или присутствие, частота и степень нежелательных явлений, в соответствии с 21 CFR 312.32, в зависимости от дозы NeoSTX на каждой стадии, вводимого в присутствии или в отсутствие бупивакаина. Указанные нежелательные явления являются мерой системных эффектов, обусловленных NeoSTX.
Данная схема предназначена для определения порога системных эффектов при снижении вероятности нежелательных явлений и серьезных нежелательных явлений.
Нежелательное явление (АЕ) включает в себя любое неблагоприятное медицинское событие, связанное с применением неосакситоксина у людей, независимо от того, считается ли оно связанным с лекарственным средством, или нет, как описано в 21 CFR 312.32.
Интенсивность (степень) каждого AE оценивают по следующей шкале:
Степень 1 (легкая): Ощущения, которые обычно являются преходящими, не требуют специального лечения, и не мешают повседневной деятельности индивидуума.
Степень 2 (умеренная): Ощущения, которые сопровождаются определенным уровнем неудобства или беспокойства субъекта, и могут несколько мешать повседневной деятельности, но, как правило, уменьшаются в результате простых лечебных мероприятий (которые могут включать в себя медикаментозную терапию).
Степень 3 (тяжелая): Ощущения, которые являются неприемлемыми или непереносимыми, препятствуют в значительной степени обычной повседневной деятельности субъекта, и требуют системной медикаментозной терапии или другого лечения.
Степень 4 (угрожающая жизни): Ощущения, которые свидетельствуют индивидууму о непосредственной опасности смерти.
Степень 5 (смерть): Смерть индивидуума
Результаты для NeoSTX в сочетании с бупивакаином и эпинефрином
Завершают полный анализ групп, получающих лекарственное средство в дозе 5 мкг, 10 мкг, 15 мкг, 20 мкг и 30 мкг, а также в группе, получающей 40 мкг (n=10, продолжающие участие). При дозе 40 мкг наблюдается высокий уровень системных эффектов у активных индивидуумов. Как и прежде, указанные эффекты включают в себя системные симптомы (покалывание и онемение, а затем тошнота), но признаки надвигающейся физиологической опасности отсутствуют. У 8 из 10 пациентов также наблюдаются тошнота и рвота в течение короткого периода времени (один час) после инъекции. В настоящее время пациенты оценивают такие признаки как умеренно надоедливые. Нарушения оксигенации и вентиляции, а также нарушения силы вдоха или жизненной емкости легких (силы дыхательных мышц) отсутствуют, кроме того, отсутствуют сила схвата, изменения сердечного ритма и гипотония.
В будущем клиническом применении инфильтрации, вполне вероятно, будут использоваться более высокие объемы инъекции, например 30 мл. Как правило, если операционное поле в три раза больше, для его блокады требуется ввести примерно в три раза больший объем и, следовательно, в три раза большую дозу местного анестетика при использовании его в фиксированной концентрации. Системная безопасность зависит от суммарной дозы, тогда как местная эффективность и длительность действия зависит от местной концентрации лекарственного средства. Результаты исследования демонстрируют, что 30 мкг NeoSTX является безопасной дозой для указанных добровольцев.
При общей дозе 10 мкг во вводимом объеме 10 мл местная концентрация NeoSTX равна ожидаемой концентрации при использовании для инфильтрации раны в объеме 30 мл.
В группе, получающей высокую дозу NeoSTX (30 мкг), максимальная общая доза соответствует дозе, содержащейся во флаконах объемом 30 мл, предназначающихся для будущего инфильтрационного обезболивания.
На фигурах 5А и 5В показана степень сенсорной блокады. На оси Y откладывают пороги детекции механического раздражения, определяемые с использованием нитей фон Фрея. Число фон Фрея находится в логарифмической зависимости от прикладываемого усилия в граммах. Числа >16 соответствуют довольно плотной сенсорной блокаде. Числа в диапазоне 10-14 относятся к частичной блокаде и, возможно, в некоторой степени к послеоперационному обезболиванию. На оси Х откладывают время после инъекции. Планки погрешностей обозначают SD.
На фигуре 6 приведен график, демонстрирующий процент индивидуумов, имеющих системные симптомы: покалывание, онемение, головокружение, тошнота или рвота в любой момент времени после введения сочетания 0, 5, 10, 15, 20, 30 или 40 мкг NeoSTX-бупивакаин-эпинефрин. Тошнота наблюдается у 80% индивидуумов при 40 мкг NeoSTX. Индивидуумы не требовали медицинского вмешательства или дополнительного кислорода. Все значения 02 нас, BP, NIF, VC, сила схвата, ЭКГ являются весьма обнадеживающими. При применении NeoSTX в физиологическом растворе и сочетания NeoSTX-бупивакаин преходящее слабое покалывание губ, языка и пальцев начинается при 10 мкг и увеличивается при повышении дозы до 40 мкг. Преходящая тошнота и рвота наблюдаются при 40 мкг. Симптомы обычно проходят в течение 1 часа. Местные или системные осложнения не наблюдаются.
На фигурах 7А и 7В приведены графики, демонстрирующие пороговые значения плотной и частичной блокады, результаты детекции механических (7А) и холодовых раздражителей (фиг.7В) для NeoSTX, NeoSTX+бупивакаин, NeoSTX+бупивакаин+эпинефрин, по сравнению с плацебо и контролями (в отсутствие NeoSTX), в зависимости от времени в часах.
Сочетание NeoSTX-бупивакаин обеспечивает более продолжительную механическую и термальную блокаду, чем NeoSTX или бупивакаин, введенные по отдельности. Сочетание NeoSTX-бупивакаин обеспечивает надежную анестезию хирургической степени в течение 12 часов и надежное сильное обезболивание в течение >24 часов. На основании восстановления от частичной механической блокады, авторы предполагают, что если указанные средства используют для блокады периферических нервов, моторная блокада будет длиться не более 24 часов, что является желательным. На основании восстановления от частичной механической блокады перед восстановлением от частичной блокады с термальной детекцией (которая коррелирует с болевыми ощущениями), можно прогнозировать длительный период обезболивания в диапазоне 24-48 часов, или даже дольше, с частичным восстановлением сенсорной и моторной функции в течение 24 часов.
Сочетание NeoSTX-бупивакаин-эпинефрин вызывает более длительную механическую и термальную блокаду, чем сочетание NeoSTX-бупивакаин, один NeoSTX или один бупивакаин. Сочетание NeoSTX-бупивакаин обеспечивает надежную анестезию хирургического уровня/очень плотное обезболивание в течение по меньшей мере 24 часов.
На основании продолжительности частичной блокады с термальной детекцией (которая коррелирует с болевыми ощущениями), можно прогнозировать длительный период послеоперационного обезболивания в диапазоне 48-72 часов, или даже дольше.