Результат интеллектуальной деятельности: НЕЙРОПРОТЕКТИВНЫЕ АГЕНТЫ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] По настоящей заявке испрашивается приоритет на основании заявки на патент Китая №201410170263,7, поданной 25 апреля 2014 года, описание которой включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к новому фармацевтическому применению соединения 5α-андростан-3β,5,6β-триола и его аналогов.
УРОВЕНЬ ТЕХНИКИ
[0003] Атмосферное давление и парциальное давление кислорода снижаются по мере того, как увеличивается высота над уровнем моря. Низкий уровень парциального давления кислорода во вдыхаемом воздухе приводит к снижению парциального давления кислорода в артериальной крови, снижению содержания кислорода и недостаточной доставке кислорода к тканям. Данное состояние, которое называется гипобарической гипоксией (ГГ), в основном наблюдается в высотных областях и, таким образом, его также именуют высотной гипоксией.
[0004] Острая Гипобарическая Гипоксия возникает тогда, когда человек достигает области на высоте более 2500 метров над уровнем моря. Если человек не может акклиматизироваться к такому изменению окружающей среды, он или она может последовательно страдать от Высотной Головной Боли (High-Altitude Headache - HAH) и Острой Горной Болезни (Acute Mountain Sickness - AMS). Более того, AMS может также развиться в Высотный Отек Головного Мозга (High-Altitude Cerebral Edema - НАСЕ) и Высотный Отек Легких (High-Altitude Pulmonary Edema - НАРЕ). Большое количество публикаций показало, что клинические признаки, вызываемые высотными болезнями, включают неврологические симптомы, такие как головная боль, логорея, бессонница, нарушение походки, нарушение умственных способностей, сонливость, психическое онемение и атаксия.
[0005] Современная терапия для высотных болезней была в основном направлена на улучшение доставки кислорода и ответов на цитокины или воспалительные реакции. Типичным лекарственным средством для первых из упомянутых средств является ацетазоламид, ингибитор карбоангидразы. Примеры лекарственных средств для последних включают глюкокортикоиды и некоторые антиоксиданты (Wright A, Brearey S, Imray С. High hopes at high altitudes: pharmacotherapy for acute mountain sickness and high-altitude cerebral and pulmonary oedema. Expert Opin Pharmacother 2008 Jan; 9 (1): 119-27). Публикаций относительно применения нейропротективного агента для лечения высотных болезней не было.
[0006] В патенте Китая №ZL 201010224173,3, принадлежащем Университету Сунь Ят-Сэна (Sun Yat-Sen University), был раскрыт недавно обнаруженный нейропротективный агент, 5α-андростан-3β,5,6β-триол, обладающий формулой:

[0007] Авторы настоящего изобретения неожиданно обнаружили, что 5α-андростан-3β,5,6β-триол и его аналоги могли значимо улучшать неврологические оценки у индивидуумов с лечением гипобарической гипоксии и защищать мозг от патологического повреждения, вызываемого гипобарической гипоксией. Данные соединения являются перспективными для применения в профилактике или лечении высотных болезней, вызванных гипобарической гипоксией.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Задача настоящего изобретения состоит в том, чтобы обеспечить применение 3β,5α,6β-тригидроксильного стероидного соединения формулы А или его фармацевтически приемлемой соли для получения фармацевтической композиции для профилактики или лечения высотной болезни, вызванной гипобарической гипоксией:
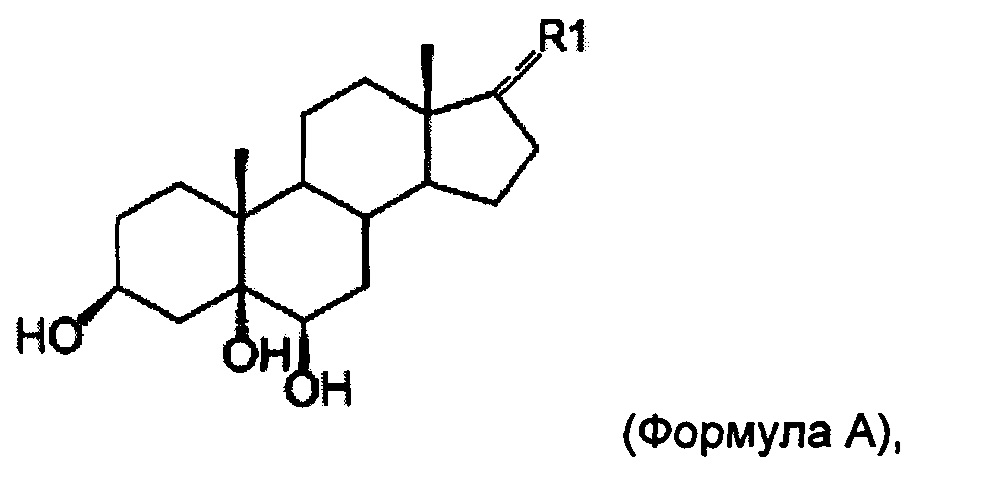
где R1 представляет собой Н или линейный или разветвленный алкил или терминальный алкенил, содержащий от 1 до 5 углеродных атомов.
[0009] В одном варианте реализации R1 представляет собой Н, а соединение представляет собой 5α-андростан-3β,5,6β-триол (в настоящем описании также обозначаемое как YC-6).
[0010] В одном варианте реализации высотная болезнь представляет собой острую высотную болезнь, вызванную высотной острой гипобарической гипоксией.
[0011] В другом варианте реализации высотная болезнь представляет собой высотный отек головного мозга и, в частности, высотный ангионевротический отек головного мозга.
[0012] В другом варианте реализации высотная болезнь представляет собой нейронное повреждение, а именно нейронную дегенерацию, включая нейронные повреждения, вызванные высотной острой гипобарической гипоксией и высотной хронической гипобарической гипоксией.
[0013] В другом варианте реализации фармацевтическая композиция дополнительно содержит дополнительный компонент для профилактики или лечения высотной болезни, вызванной гипобарической гипоксией, такой как ингибиторы карбоангидразы (например, ацетазоламид), глюкокортикоиды или антиоксиданты.
[0014] В настоящем изобретении модель гипобарической гипоксии примата, не относящегося к человеку, показала, что 5α-андростан-3β,5,6β-триол значимо улучшает неврологические оценки в группах лечения гипобарической гипоксии и защищает мозг от патологического повреждения, вызванного гипобарической гипоксией, что указывает на эффекты от профилактики или лечения в отношении высотного отека головного мозга (AMS) и высотного отека легких (НАСЕ).
[0015] Дальнейшие исследования показали, что увеличение содержания воды в головном мозге, вызванное гипобарической гипоксией, эффективно блокируется при помощи 5α-андростан-3β,5,6β-триола. Вазогенный отек мозга и нейрональная вакуольная дегенерация, вызванные гипобарической гипоксией, снижаются при помощи 5α-андростан-3β,5,6β-триола при патологическом анализе с применением электронной микроскопии и окрашивании гематоксилином и эозином (НЕ).
[0016] В другом варианте реализации R1 представляет собой -CH(CH3)(CH2)3CH(CH3)2, и таким образом соединение представляет собой холестан-3β,5α,6β-триол (Соединение I). В патенте Китая №ZL 200810198703,4, принадлежащем Университету Сунь Ят-Сэна (Sun Yat-Sen University), было раскрыто, что Соединение I также являлось нейропротективным. Аналогичным образом, авторы настоящего изобретения обнаружили, что соединение также могло снижать вазогенный отек мозга и нейрональную вакуольную дегенерацию, вызванные гипобарической гипоксией. Соединение I имеет формулу:
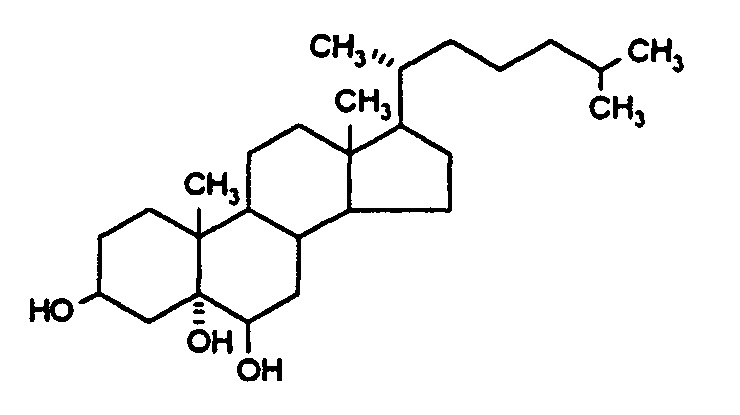
[0017] В патенте Китая ZL 201110061235,8 были раскрыты эффекты нейронной защиты другими соединениями согласно формуле А. Авторами настоящего изобретения также было обнаружено, что указанные соединения являлись эффективными в снижении вазогенного отека мозга, вызванного гипобарической гипоксией, блокаде повышения содержания жидкости в головном мозге и защите от нейрональной вакуольной дегенерации, вызванной гипобарической гипоксией.
[0018] В вариантах реализации, где R1 представляет собой -CHCH2CH3, -CH(CH3)2 или -CH(CH2)3CH3, соединение представляет собой 17-пропилиден-андростан-3β,5α,6β-триол (Соединение II), 17-изопропил-андростан-3β,5α,6β-триол (Соединение III) или 17-бутил-андростан-3β,5α,6β-триол (Соединение IV) соответственно.
[0019] Другая задача настоящего изобретения состоит в том, чтобы обеспечить способ для профилактики или лечения высотной болезни, вызванной гипобарической гипоксией, включающий введение субъекту, нуждающемуся в этом, эффективного количества 3β,5α,6β-тригидроксильного стероидного соединения, обладающего Формулой А, или его фармацевтически приемлемой соли:

где R1 представляет собой Н или линейный или разветвленный ал кил или терминальный алкенил, содержащий от 1 до 5 углеродных атомов.
[0020] В одном варианте реализации R1 представляет собой Н и соединение представляет собой 5α-андростан-3β,5,6β-триол (в настоящем описании также обозначаемое как YC-6). В другом варианте реализации R1 представляет собой -CH(CH3)(CH2)3CH(CH3)2, таким образом, соединение представляет собой холестан-3β,5α,6β-триол (Соединение I). В других вариантах реализации, R1 представляет собой -CHCH2CH3, -СН(CH3)2 или -СН(CH2)3CH3, соединение представляет собой 17-пропилиден-андростан-3β,5α,6β-триол (Соединение II), 17-изопропил-андростан-3β,5α,6β-триол (Соединение III) или 17-бутил-андростан-3β,5α,6β-триол (Соединение IV) соответственно.
[0021] В вариантах реализации изобретения высотная болезнь выбрана из группы, состоящей из острой высотной болезни, высотного отека головного мозга, нейронного повреждения, вызванного острой гипобарической гипоксией, и нейронного повреждения, вызванного хронической гипобарической гипоксией.
[0022] В вариантах реализации изобретения субъект является млекопитающим, например, человеком.
[0023] 5α-андростан-3β,5,6β-триол и его аналоги структурно принадлежат к 3β,5α,6β-тригидроксильным стероидам и являются эффективными для защиты нейронов. Авторы настоящего изобретения обнаружили, что данные соединения были эффективны в профилактике или лечении высотной болезни, вызванной гипобарической гипоксией.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
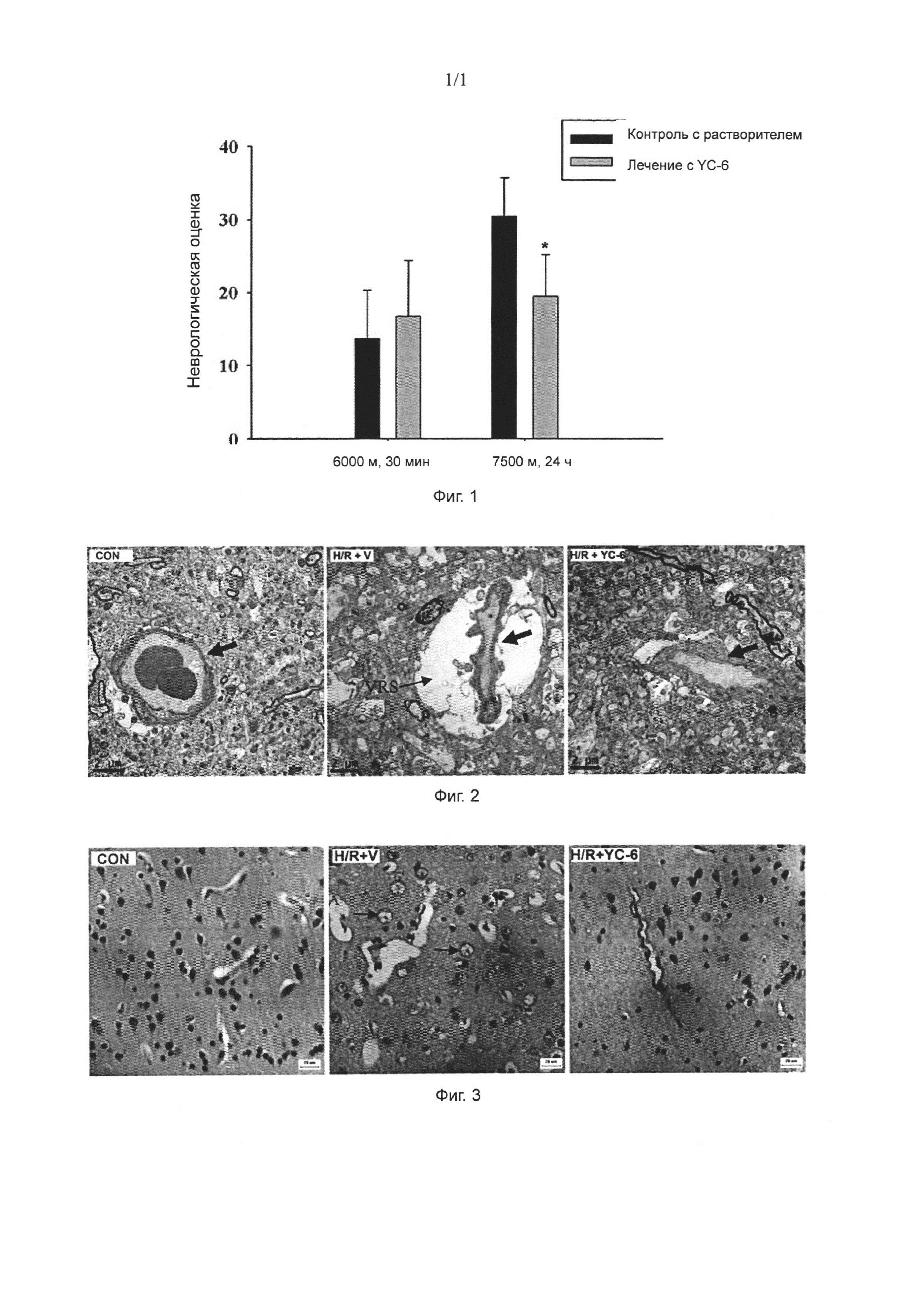
[0024] Фиг. 1: Неврологическую оценку значимо улучшили у макак-крабоедов (Масаса fascicularis) при помощи 5α-андростан-3β,5,6β-триола после воздействия острой гипобарической гипоксии. *P<0,05, группа лечения с 5α-андростан-3β,5,6β-триолом против контроля с растворителем.
[0025] Фиг. 2: Вазогенный отек ткани коры головного мозга у макак-крабоедов, вызванный острой гипобарической гипоксией, снизили при помощи 5α-андростан-3β,5,6β-триола (просвечивающий электронный микроскоп, 3900х). Con: пустой контроль; H/R+V: контроль с растворителем; H/R+YC-6: группа лечения с 5а-андростан-3β,5,6β-триолом. Толстые стрелки указывают на капиллярные сосуды в кортикальной ткани лобной доли, а тонкие стрелки указывают на пространства Вирхова-Робина (ПВР).
[0026] Фиг. 3: Дегенерацию нейронов коры головного мозга у макак-крабоедов, вызванную острой гипобарической гипоксией, снизили при помощи 5α-андростан-3β,5,6β-триола (НЕ окрашивание, 400х). Con: пустой контроль; H/R+V: контроль с растворителем; H/R+YC-6: группа лечения с 5α-андростан-3β,5,6β-триолом. Стрелки указывают на нейроны, которые подверглись дегенерации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0027] Настоящее изобретение будет описано более подробно со ссылкой на конкретные примеры. Следует понимать, что объем настоящего изобретения не будет ограничен данными примерами.
Проверка нового применения 5α-андростан-3β,5,6β-триола
1. Животные
[0028] Использовали 17 здоровых самцов макак-крабоедов, 6 до 6,5 лет массой 6,8-7,5 кг. Использование лабораторных животных одобрено Комитетом по контролю и использованию лабораторных животных и комитетом по этике экспериментальных животных. Схема эксперимента соответствует правилам в отношении защиты животных, благополучия животных и этических принципов. 17 макак-крабоедов были сгруппированы случайным образом на 3 группы (Таблица 1).

2. Принцип работы установки и параметры
[0029] Узел барокамеры низкого давления представляет собой платформу, применяемую для имитации низких температур и низкого давления условий нагорья. С системой можно проводить манипуляции, чтобы имитировать условия низкого давления, которые присущи любой высоте ниже 10000 метров над уровнем моря и любой температуре выше -30°C. Восходящая скорость: 3 м/сек (0 до 6000 м); нисходящая скорость: 2 м/сек (6000 м до 7500 м); постоянная температура: 22°C; средняя скорость потока воздуха: 150 м3/ч.
3. Моделирование острой гипобарической гипоксии у макак-крабоедов и введение лекарственного средства
[0030] (1) Высоту в 7500 метров над уровнем моря имитировали посредством проведения манипуляции с барокамерой низкого давления, чтобы вызвать острую гипоксию у макак-крабоедов.
[0031] Макак-крабоедов, выращенных в виварии для лабораторных животных, помечали и помещали в барокамеру низкого давления. Макак-крабоедов кормили в течение более 1 суток в барокамере для того, чтобы адаптировать их к экспериментальной среде. Давление в барокамере низкого давления регулировали для имитации высоты в 3000, 4500 и 6000 метров над уровнем моря, находясь на каждой высоте в течение 30 мин с последующей имитацией высоты в 7000 метров над уровнем моря в течение 24 часов. Далее животные получали лечение лекарственными препаратами в индивидуальном порядке с заранее определенными дозами. После лечения на 7500 м в течение 48 часов высоту снижали до 6000 м над уровнем моря со скоростью 3 м/сек. Животных подвергали анестезии с кетамином, умерщвляли, вскрывали и отбирали образцы. Образцы фиксировали. Животных, которые были сгруппированы по пустым контролям, выращивали в виварии на высоте в 350 м над уровнем моря до наблюдения и умерщвления.
[0032] (2) Животным в группе лечения с 5α-андростан-3β,5,6β-триолом посредством внутривенной инъекции вводили 10 мл раствора 5α-андростан-3β,5,6β-триола в физиологическом растворе глюкозы в дозировке 10 мг/кг до имитации, после 30 мин на 3000 м и после 30 минут на 4500 метров соответственно. Животные в группе с контролем с растворителем получали 10 мл физиологического раствора глюкозы посредством внутривенной инъекции.
[0033] (3) Животным в группе лечения с 5α-андростан-3β,5,6β-триолом посредством инъекции в скелетную мышцу в 5 различных точках вводили состав 5α-андростан-3β,5,6β-триола с замедленным высвобождением в дозировке 30 мг/кг через 30 мин на 6000 метрах. Моделям с острой высотной гипоксией вводили 10 мл физиологического раствора глюкозы посредством внутривенной инъекции.
[0034] (4) Животным в группе лечения с 5α-андростан-3β,5,6β-триолом посредством внутривенной инъекции вводили инъекцию 10 мл 5α-андростан-3β,5,6β-триола в физиологическом растворе глюкозы в дозировке 10 мг/кг через 24 часа на 7500 м и далее посредством инъекции в скелетную мышцу в 5 различных точках состава 5α-андростан-3β,5,6β-триола с замедленным высвобождением в дозировке 30 мг/кг. Моделям с острой высотной гипоксией вводили 10 мл физиологического раствора глюкозы посредством внутривенной инъекции.
4. Оценочный индекс
4.1 Неврологические оценки
[0035] Животные находились на сымитированной высоте в 7500 метров над уровнем моря в течение 24 часов до снижения до 6000 метров со скоростью 3 м/с. Неврологические оценки определяли и регистрировали согласно описанного способа (Zhu и др., An improved method of neurological score for non-human primates, Chinese Journal of Comparative Medicine, 2011, 21 (9): 58-62). Неврологическую оценку определяли и регистрировали два обученных наблюдателя, которые не были ни осведомлены о группировании, ни вовлечены в процесс введения лекарственного средства. Оценку получали в виде среднего значения.
4.2 Измерение содержания воды в левом полушарии головного мозга
[0036] Содержание воды в головном мозге измеряли согласно описанного способа (Patir Н, Sarada SK, Singh S, Mathew T, Singh В, Bansal A. Quercetin as a prophylactic measure against high altitude cerebral edema. Free Radic Biol Med 2012 Aug 15; 53 (4): 659-68). Животные находились на сымитированной высоте в 7500 метров над уровнем моря в течение 48 часов в барокамере низкого давления, а лаборанты, которые не были ни осведомлены о группировании, ни вовлечены в процесс введения лекарственного средства, усыпляли и умерщвляли животных пустого контроля. Мозги животных быстро извлекали и измеряли массы левых полушарий во влажном состоянии. Далее левые полушария помещали в сушильный шкаф при 60°C и ежедневно измеряли их массу в определенное время до тех пор, пока наблюдались изменения массы. Регистрировали конечные массы. Содержание воды в головном мозге = (масса левого полушария во влажном состоянии - масса левого полушария в сухом состоянии) / масса левого полушария во влажном состоянии × 100%.
4.3 Просвечивающая электронная микроскопия кортикальной ткани лобной доли головного мозга
[0037] Извлекали кортикальную ткань лобной доли головного мозга животных и разрезали, чтобы обеспечить кусочки головного мозга в 1 мм3, которые фиксировали в неподвижной жидкости 2,5% глутаральдегида для подготовки ультратонких срезов. Морфологию нейронов и структуру кровеносных сосудов наблюдали при помощи просвечивающей электронной микроскопии.
4.4 НЕ окрашивание кортикальной ткани лобной доли головного мозга
[0038] Извлекали кортикальную ткань лобной доли головного мозга животных и разрезали, чтобы обеспечить блоки в 1 см3, которые фиксировали в 4% параформальдегиде. Далее производили заливку в парафин, изготовление срезов и окрашивание с гематоксилином и эозином согласно общепринятой процедуре проведения НЕ окрашивания с последующим наблюдением под микроскопом.
4.5 Статистические данные
[0039] Результаты указывали в виде среднего значения ± стандартное отклонение и статистически анализировали при помощи программного обеспечения SigmaPlot. P<0,05 указывает на статистическую значимость.
[0040] Результаты показали, что 5α-андростан-3β,5,6β-триол значимо обеспечивал защиту неврологической функции у макак-крабоедов в условии гипобарической гипоксии. Животные, находившие на сымитированной высоте в 6000 метров над уровнем моря в течение 30 минут в барокамере низкого давления, значимо понижали свою деятельность и активность, а также свои реакции на угрозу и раздражители. После повышения сымитированной высоты до 7500 метров над уровнем моря в течение 24 часов, макаки-крабоеды с контролем с растворителем показывали значимое замедление сознания, значительно пониженную деятельность и активность и дисфункцию в своей двигательной системе и системе чувств с неврологической оценкой 31,6±4,2. В отличие от этого, неврологическая оценка животных в группе лечения с 5α-андростан-3β,5,6β-триолом составляла 20,5±5,7 (Р<0,01), что указывает на то, что их неврологическая функция была эффективно защищена (Фиг. 1)
[0041] Повышенное содержание воды в головном мозге у макак-крабоедов в условиях гипобарической гипоксии было значимо снижено при помощи 5α-андростан-3β,5,6β-триола. Как показало рассчитанное содержание воды в головном мозге, содержание воды в головном мозге у макак-крабоедов в пустом контроле составило 76,155%. В отличие от этого, после лечения на сымитированной высоте в 7500 м над уровнем моря в течение 48 часов в барокамере низкого давления, содержание воды в головном мозге у макак-крабоедов в контроле с растворителем увеличилось до 76,714% (p<0,05). В ситуации, когда 5α-андростан-3β,5,6β-триол вводили до повышения до 7500 м и 5α-андростан-3β,5,6β-триол снова вводили после поддержания на 7500 метрах в течение 24 часов, содержание воды в головном мозге у макак-крабоедов понизилось до 76,283% (p<0,05), что показывает, что введение 5α-андростан-3β,5,6β-триола может ингибировать увеличение содержания воды в головном мозге у макак-крабоедов в условиях острой гипобарической гипоксии (Таблица 2).

[0042] Вазогенный отек, вызванный гипобарической гипоксией, снижали при помощи 5α-андростан-3β,5,6β-триола. В просвечивающем электронном микроскопе наблюдали, что капиллярные сосуды в кортикальной ткани лобной доли головного мозга у макак-крабоедов в контроле с растворителем показали значимо расширенные пространства Вирхова-Робина (ПВР) в своей наружней оболочке по сравнению с пустым контролем, указывая на утечку при остром вазогенном отеке. Тем не менее, ткань головного мозга у макак-крабоедов, получавших лечение с 5α-андростан-3β,5,6β-триолом, продемонстрировала пространства Вирхова-Робина, которые, как правило, были нормальными, что свидетельствует о том, что никакого значимого вазогенного отека не происходило (Фиг. 2).
[0043] Нейрональную вакуольную дегенерацию, вызванную гипобарической гипоксией, снижали при помощи 5α-андростан-3β,5,6β-триола. После НЕ окрашивания наблюдали, что кортикальная ткань лобной доли головного мозга в контроле с растворителем показала значимо разрыхленную структуру с отечной жидкостью, появляющейся вокруг сосуда и сдавливающей просвет сосуда, а также частично показала нейрональную дегенерацию со сморщивающимися сомами и пикнотическими ядрами, что указывало на вакуольную дегенерацию (показано стрелками). Группа лечения с 5α-андростан-3β,5,6β-триолом не показала значимого вазогенного отека и показала снижение нейрональной вакуольной дегенерации, аналогичное с пустым контролем, что свидетельствует об обеспечении защиты нейронов 5α-андростан-3β,5,6β-триолом в условиях гипобарической гипоксии (Фиг. 3).
Фармацевтическая композиция
[0044] В вариантах реализации применяли инъекции и суспензии с замедленным высвобождением 5α-андростан-3β,5,6β-триола. Тем не менее, препараты для профилактики или лечения высотных болезней, вызываемых гипобарической гипоксией, включают, но не ограничиваются ими, инъекции, суспензии с замедленным высвобождением, пероральные капсулы, суппозитории, подкожные имплантаты и прикрепляемые пластыри.
(1) Получение инъекции 5α-андростан-3β,5,6β-триола (YC-6)
[0045] Получение 20% раствора HP-β-CD: к 20,0 г 2-гидроксипропил-β-циклодекстрина (НР-β-CD) добавляли 80 мл физиологического раствора и далее перемешивали до растворения. Физиологический раствор добавляли, чтобы обеспечить 100 мл раствора. Раствор подвергали осветляющей фильтрации при помощи микропористой мембраны 0,22 мкм и далее по отдельности наполняли 15 мл центрифужные пробирки, которые затем герметизировали и хранили при 4°c.
[0046] Получение 2 мг/мл раствора YC-6: к 6,0 г HP-β-CD добавляли 24 мл деионизированной воды и далее перемешивали до растворения. Добавляли 0,060 г YC-6 поверх раствора HP-β-CD, который далее перемешивали до растворения. Добавляли 0,270 г хлорида натрия и далее перемешивали до растворения. Добавляли деионизованную воду, чтобы обеспечить 30 мл раствора. Раствор подвергали осветляющей фильтрации при помощи микропористой мембраны 0,22 мкм и далее по отдельности наполняли 1,5 мл пробирки Эппендорфа, которые затем герметизировали и хранили при 4°C для последующего применения. Дозировка введения при применении для раствора составляет 10 мл/кг, что эквивалентно 20 мг/кг дозировке для лекарственного средства.
(2) Получение суспензий 5α-андростан-3β,5,6β-триола (YC-6) с замедленным высвобождением
[0047] Суспензии с замедленным высвобождением получали при помощи: 12,5 г YC-6, 30 мл глицерина, 50 г HP-β-CD, 0,48 г натрий-карбоксиметилцеллюлозы (Na-КМЦ), к которым добавляли воду для инъекций, чтобы получить 250 мл.
[0048] Получение 0,8% раствора Na-КМЦ: за несколько раз добавляли 0,8 г Na-КМЦ в 90 мл 90°C воды при перемешивании до тех пор, пока ее полностью не добавили и не растворили. Раствор оставляли охлаждаться до комнатной температуры и далее к нему добавляли воду, чтобы обеспечить 100 мл раствора. Затем раствор перемешивали и подвергали центрифугированию при 3000 об/мин в течение 15 мин. Супернатант отделяли для последующего применения.
[0049] Получение 40% раствора HP-β-CD: 80 г HP-β-CD добавляли в примерно 100 мл воды, который далее перемешивали и растворяли. Воду добавляли, чтобы обеспечить 200 мл раствора для последующего применения.
[0050] Примерно 12,5 г YC-6 помещали в контейнер для измельчения. Добавляли 30 мл глицерина и измельчали лабораторной мешалкой, чтобы обеспечить молочно-белый лубрикант в виде пасты. В процессе измельчения постепенно добавляли 125 мл 40% водного раствора HP-β-CD. Для того, чтобы избежать образования слишком большого количества пузырьков, в процессе измельчения добавляли 60 мл 0,8% Na-КМЦ. Реакционную смесь переносили в мерную колбу, которую наполняли водой для инъекций для обеспечения 250 мл раствора с последующим встряхиванием.
Проверка нового применения аналогов 5α-андростан-3β,5,6β-триола
[0051] Вышеуказанные эксперименты для модели макак-крабоедов при острой гипобарической гипоксии повторяли при тех же самых условиях, за исключением того, что YC-6 замещали вышеуказанными соединениями I, II, III и IV. Результаты показали, что, аналогичным образом, неврологическая функция макак-крабоедов, получавших лечение с соединениями II, III и IV, была эффективно защищена с подавлением увеличения содержания воды в головном мозге и без значимого ангионевротического отека. Можно заметить, что аналоги 5α-андростан-3β,5,6β-триола, в частности соединение I и соединение, обладающее формулой А, особенно соединения II, III и IV, являются подходящими для профилактики или лечения высотных болезней, вызванных гипобарической гипоксией.
[0052] Следует понимать, что вышеупомянутые примеры представляют собой лишь предпочтительные варианты реализаций настоящего изобретения, и объем настоящего изобретения не будет ограничиваться данными примерами. Изменения или модификации могут быть проведены специалистом в данной области техники, основанные на раскрытии настоящего изобретения без выхода за пределы объема притязаний.