НОВЫЕ СПОСОБЫ
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет на основании предварительной заявки США 61/644268 от 8 мая 2012, предварительной заявки США 61/651778 от 25 мая 2012, и предварительной заявки США 61/799606 от 15 марта 2013, содержание каждой из которых включено в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к применению селективных ингибиторов аквапорина, например, аквапорина-4 или аквапорина-2, например, некоторых соединений фенилбензамида, для профилактики, лечения и контроля аквапорин-опосредованных состояний, таких как, например, заболевания, сопровождающиеся нарушением водного баланса, например, отек (в частности, отек головного и спинного мозга, например, после травмы или ишемического инсульта, а также отек, связанный с глиомой, менингитом, острой горной болезнью, эпилептическими припадками, инфекциями, с нарушениями обмена веществ, гипоксией, водной интоксикацией, печеночной недостаточностью, печеночной энцефалопатией, диабетическим кетоацидозом, абсцессом, эклампсией, болезнью Крейтцфельдта-Якоба, и с энцефалитом при системной крaсной волчанке, а также отек вследствие воздействия микрогравитации и/или радиационного воздействия, а также отек вследствие инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга, а также отек сетчатки), а также гипонатриемия и задержка избыточной жидкости и заболевания, такие как эпилепсия, ишемия сетчатки и другие заболевания глаз, связанные с нарушениями внутриглазного давления и/или тканевой гидратации, ишемия миокарда, повреждение миокарда при ишемии/реперфузии, инфаркта миокарда, гипоксии миокарда, застойной сердечной недостаточности, сепсис и оптиконевромиелит, а также мигрень, а также к новым тестам для идентификации ингибиторов аквапорина.
Уровень техники изобретения
Аквапорины представляют собой клеточные мембранные белки, которые действуют, как молекулярные водные каналы, которые опосредуют поступление воды в клетки и из клеток. В то время как существует определенная степень пассивной диффузии или осмоса воды через клеточные мембраны, быстрый и селективный транспорт воды внутрь и из клеток задействует аквапорины. Указанные водные каналы селективно проводят молекулы воды внутрь и из клетки, в то же время блокируют прохождение ионов и других растворенных веществ, сохраняя тем самым мембранный потенциал клетки. Аквапорины найдены практически во всех жизненных формах, от бактерий и до растений и животных. В организме человека они обнаружены во всех клетках.
Отек мозга (CE) является одной из основных причин повреждения при инсульте, поскольку он может привести к увеличению внутримозгового давления (ICP), соответствующему уменьшению перфузии головного мозга, и потенциально постоянного или фатального повреждения головного мозга. Отек также способствует поражению ЦНС, например, при таких состояниях как черепно-мозговая травма и травма спинного мозга, глиома, менингит, острая горная болезнь, эпилептические припадки, инфекции, нарушения обмена веществ, гипоксия, водная интоксикация, печеночная недостаточность, печеночная энцефалопатия, диабетический кетоацидоз, абсцесс, эклампсия, болезнь Крейтцфельдта Якоба и энцефалит при системной крaсной волчанке. Пациенты, пережившие период максимального ICP, обычно три дня после инсульта или черепно-мозговой травмы, как правило, выживают. К сожалению, существует немного методов лечения CE, и они имеют ограниченную эффективность.
Гипонатриемия, характеризующаяся сывороточными уровнями натрия ≤135 мм, является наиболее распространенной формой электролитного дисбаланса, причем распространенность в масштабе страны по данным больниц составляет 15-20%. Ассоциированная задержка жидкости является симптомом таких заболеваний как сердечная недостаточность (HF), цирроз печени, нефротическое нарушение и синдром неадекватной секреции антидиуретического гормона (SIADH). Различные диуретики используются для лечения застоя, связанного с HF. Путем ингибирования котранспортера Na/K/Cl в толстой восходящей части петли Генле, петлевые диуретики вызывают натрийурез путем уменьшения реабсорбции Na+ и Cl- из мочи. Альтернативная терапия гипонатриемии заключается в применении антагонистов рецепторов вазопрессина, которые ингибируют реабсорбцию воды за счет ингибирования вазопрессин-индуцированного транспорта AQP2. К сожалению, петлевые диуретики и антагонисты рецепторов вазопрессина оказывают косвенное действие на достижение желаемого физиологического результата. Идеальный препарат блокировал бы реабсорбцию непосредственно, минимизируя, таким образом, возможные побочные эффекты, вызванные предшествующими эффекторами, но в настоящее время такие препараты не известны.
Эпилепсия представляет собой нарушение мозговой деятельности, характеризующееся повторяющимися приступами. Приступы возникают из-за нарушения мозговой активности, приводящего в некоторой степени к временной дисфункции мозга. Приступы могут вызвать неконтролируемую дрожь и потерю сознания, но, чаще всего, человек, испытывающий приступ, перестает двигаться или не осознает, что происходит. Противосудорожные препараты могут быть использованы для лечения эпилепсии, однако, противосудорожные препараты эффективны не у всех людей с эпилепсией.
Ишемия представляет собой состояние, характеризующееся прекращением или недостаточным поступлением крови к тканям. Ишемия сетчатки происходит из-за недостаточного кровоснабжения сетчатки. Васкулярная окклюзия, глаукома и диабетическая ретинопатия связаны с ишемией сетчатки и могут вызывать отек сетчатки и гибель ганглиозных клеток, приводящую к нарушениям зрения и слепоте. AQP4 экспрессируется в клетках Мюллера в сетчатке. В результате относительно неэффективного лечения, ишемия сетчатки остается основной причиной нарушения зрения и слепоты.
Ишемия миокарда представляет собой состояние, вызванное закупоркой или сужением одной или более коронарных артерий, например, может иметь место окклюзия атеросклеротической бляшкой окклюзии или разрыв. Инфаркт миокарда, сердечный приступ происходит, когда ишемия миокарда превышает критический порог и поражает механизмы восстановления клеток миокарда, предназначенных для поддержания нормального рабочего режима и гомеостаза. Инфаркт миокарда остается главной причиной заболеваемости и смертности во всем мире. Соединения, эффективные в лечении ишемии миокарда, повреждения миокарда при ишемии/реперфузии, инфаркта миокарда и застойной сердечной недостаточности являлись бы полезными лекарственными препаратами.
Соединения фенилбензамида известны как лекарственные средства. Фенилбензамиды включают такие соединения как никлозамид (5-хлор-N-(2-хлор-4-нитрофенил)-2-гидроксибензамид), антигельминтный агент, используемый при лечении против ленточных червей, но неизвестно, оказывает ли он какой-либо на аквапорины. Патентная публикация США US2010/0274051 A1 (содержание которой включено в настоящее описание в качестве ссылки) описывает некоторые фенилбензамиды как способные ингибировать NF-κB с помощью селективного ингибирования IKK-β, кроме того патентная заявка США US7626042 (также включенная в данное описание в качестве ссылки) раскрывает O-ацил производные таких соединений, тогда как патентная заявка США US7700655 (также включенная в данное описание в качестве ссылки) описывает некоторые фенилбензамиды, как полезные при лечении аллергических заболеваний. Однако указанные патентные заявки не раскрывают какой-либо информации об отеке мозга или нарушении водного баланса (водный диурез) или аквапоринах.
В статье, опубликованной в 2004 г., группа исследователей предположительно изучала эффективность N-(3,5-бис-трифторметил-фенил)-5-хлор-2-гидрокси-бензамида в блокировании фосфорилирования IκB в крысиной модели ишемии миокарда/реперфузионного повреждения. Onai, Y. et al, "Inhibition of IKB Phosphorylation in Cardiomyocytes Attenuates Myocardial Ischemia/Reperfusion Injury" Cardiovascular Research, 2004, 63, 51-59. Группа сообщала о некоторой активности исследуемого соединения. Однако в дальнейшем влияние указанной активности соединения не смогли подтвердить, и соответственно N-(3,5-бис-трифторметил-фенил)-5-хлор-2-гидрокси-бензамид не исследовали в отношении указанного применения у человека.
До настоящего изобретения не были известны конкретные, проверенные ингибиторы аквапоринов, например, AQP4 или AQP2. Ранее сообщали, что некоторые противоэпилептические или сульфонамидные препараты (например, ацетилсульфаниламид, ацетазоламид, 6-этокси-бензотиазол-2-сульфонамид, топирамат, зонисамид, фенитоин, ламотриджин и суматриптан) возможно являются ингибиторами AQP4, но позже оказалось, что эти сообщения не соответствуют действительности. Yang, et al., Bioorganic & Medicinal Chemistry (2008) 16: 7489-7493. Не описаны прямые ингибиторы AQP2. Поиск терапевтически эффективных ингибиторов аквапоринов затруднен отсутствием эффективных высокопроизводительных скрининговых тестов, а также отсутствием высоко селективных ингибиторов, которые нужны для разработки и валидации тестов и которые служат в качестве положительных контролей или конкурентов в реакции связывания.
Существует потребность в улучшенных подходах к лечению и контролю заболеваний с нарушением водного баланса, таких как отек, например, отек мозга, и с задержкой воды и гипонатриемией, а также заболеваний, таких как эпилепсия, ишемия сетчатки, ишемия миокарда, повреждение ишемии миокарда/реперфузии, инфаркт миокарда, гипоксия миокарда, застойная сердечная недостаточность, сепсис и оптиконевромиелит, а также мигрени.
Краткое описание изобретения
Настоящее изобретение относится к использованию селективных ингибиторов аквапорина, например, аквапорина-4 или аквапорина-2 для профилактики, лечения и контроля аквапорин-опосредованных состояний, например, заболеваний с нарушением водного баланса, таких как отек (особенно отек головного и спинного мозга, например, после травмы или ишемического инсульта, а также отек, связанный с глиомой, менингитом, острой горной болезнью, эпилептическими припадками, инфекцией, нарушениями обмена веществ, водной интоксикацией, печеночной недостаточностью, печеночной энцефалопатией, диабетическим кетоацидозом, абсцессом, эклампсией, болезнью Крейтцфельдта-Якоба и энцефалитом при системной крaсной волчанке, также отек вследствие воздействия микрогравитации и/или радиации, а также отек вследствие инвазивных процедур центральной нервной системы, например, нейрохирургической операции, эндоваскулярного удаления тромба, спинномозговой пункции, реконструкции сосуда при аневризме, или глубокой стимуляции мозга, а также отек сетчатки, а также отек мозга вследствие остановки сердца, например, связанный с развитием метаболического ацидоза (например, лактоацидоза) вследствие гипоксии перед периодом реанимации), а также гипонатриемия и удержание избыточной жидкости, а также заболевания, такие как эпилепсия, ишемия сетчатки и другие заболевания глаз, связанные с нарушениями внутриглазного давления или гидратацией тканей, ишемия миокарда, повреждения ишемии миокарда/реперфузии, инфаркт миокарда, гипоксия миокарда, застойная сердечная недостаточность, сепсис и оптиконевромиелит, а также мигрени.
Кроме того, изобретение относится к применению определенных фенилбензамидов, предназначенных для ингибирования аквапоринов, в частности, AQP4 и AQP2
Настоящее изобретение предусматривает, в частности, способы лечения или контролирования заболевания или состояния, опосредованного аквапорином, например, заболевания или состояния с нарушением водного баланса и других заболеваний, таких как отек головного и спинного мозга, например, отек головного мозга, например, отек мозга вследствие травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекций, нарушений обмена веществ, гипоксии, (включая общую системную гипоксию и гипоксию, связанную с остановкой сердца), водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, диабетического кетоацидоза, абсцесса, эклампсии, болезни Крейтцфельдта-Якоба, энцефалита при системной крaсной волчанке, или инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга, или, например, отек спинного мозга вследствие травмы спинного мозга, например, сдавления спинного мозга; или отек спинного и/или зрительного нерва вследствие воздействия микрогравитации и/или радиации; или
отек сетчатки; или гипонатриемия или задержка избыточной жидкости, например, в результате сердечной недостаточности (HF), цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH); или
эпилепсия, ишемия сетчатки или другие заболеваний глаз, связанные с нарушениями внутриглазного давления и/или гидратацией тканей, ишемия миокарда, повреждение ишемии миокарда/реперфузии, инфаркт миокарда, гипоксия миокарда, застойная сердечная недостаточность, сепсис или оптиконевромиелит или мигрени, где указанные способы включают введение пациенту, который в этом нуждается, эффективного количества ингибитора аквапорина, например, ингибитора AQP2 или AQP4, например фенилбензамида, например, никлозамида или соединения формулы (I), как описано в патентной заявке US 2010/0274051 A1 или US 7700655, например, соединение общей формулы (I), (I-1), (I-2), (I-3) и (I-4), как изложено в ней, например, выбранное из соединения №№ 1-223, как изложено в US 2010/0274051 или соединения №№ 301-555, как изложено в US 7700655, или соединение формулы (I), как описано в патентной заявке США 7626042, например, выбранное из соединения №№ 1-151, как изложено в ней; например, соединение формулы 1a:
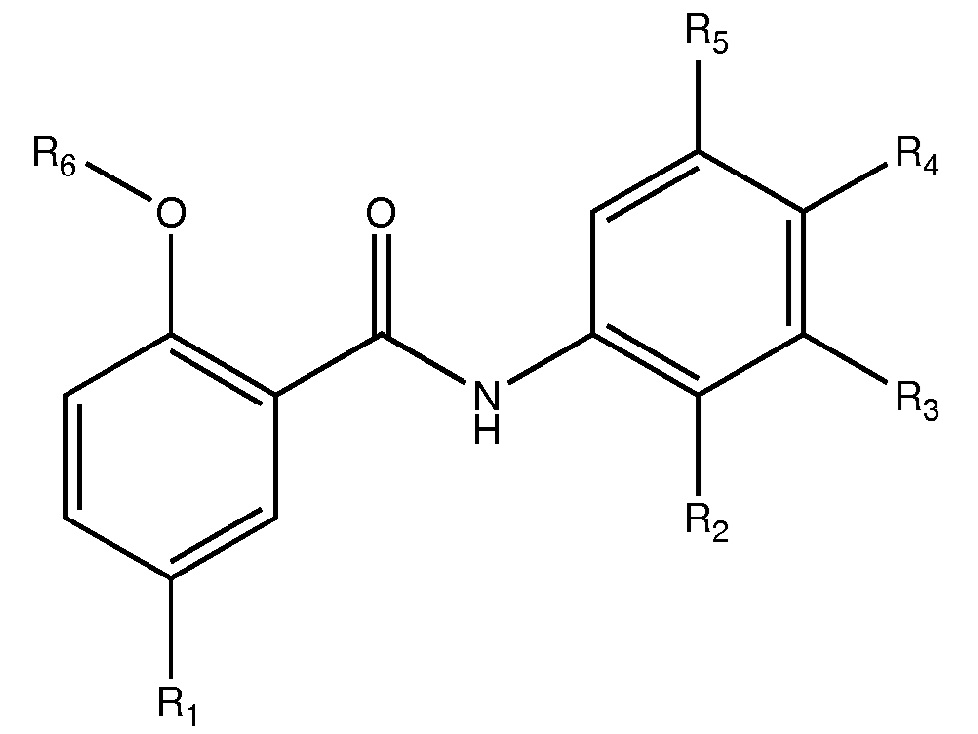
где R1, R2, R3, R4 и R5 выбирают из H, галогена, галогенированного алкила C1-4 (например, трифторметил), и цианогруппы; и R6 выбирают из H и физиологически гидролизуемых и приемлемых ацильных групп, в свободной форме или в форме фармацевтически приемлемой соли.
Кроме того, изобретение предлагает тесты с высокой пропускной способностью для идентификации конкретных аквапоринов, включающие измерение ответа популяции клеток, экспрессирующих аквапорин, в сравнении с контрольной клеточной популяцией, на гипертонический или гипотонический раствор в присутствие или в отсутствие тестируемого соединения.
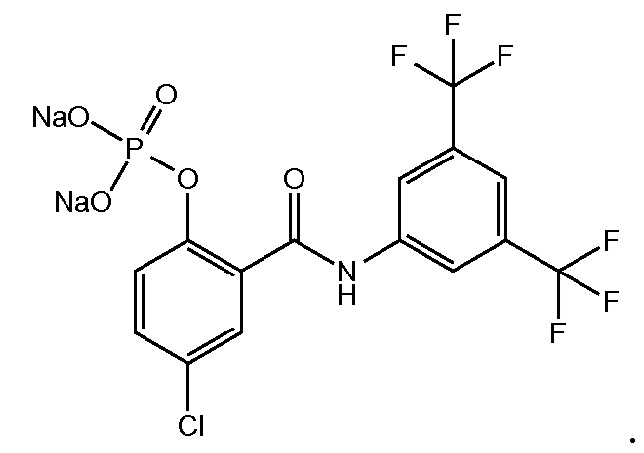
Изобретение также предлагает соединение формулы
Другие области применения настоящего изобретения станут очевидными из подробного описания, представленного ниже. Следует понимать, что подробное описание и конкретные примеры, показывающие предпочтительный вариант осуществления изобретения, предназначены только для иллюстративных целей и не предназначены для ограничения объема изобретения.
Краткое описание чертежей
Настоящее изобретение станет более понятным из подробного описания и прилагаемых чертежей, где:
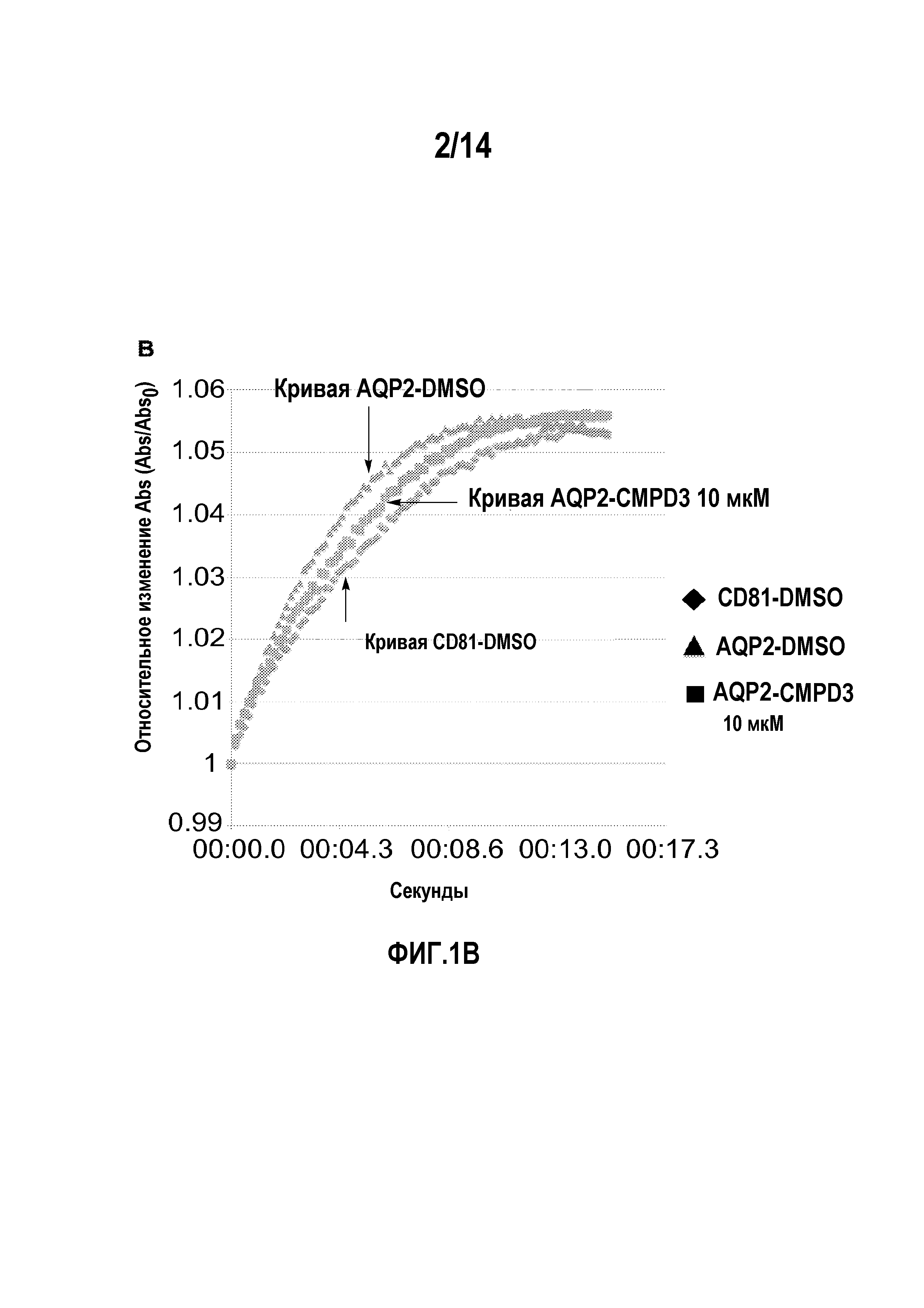
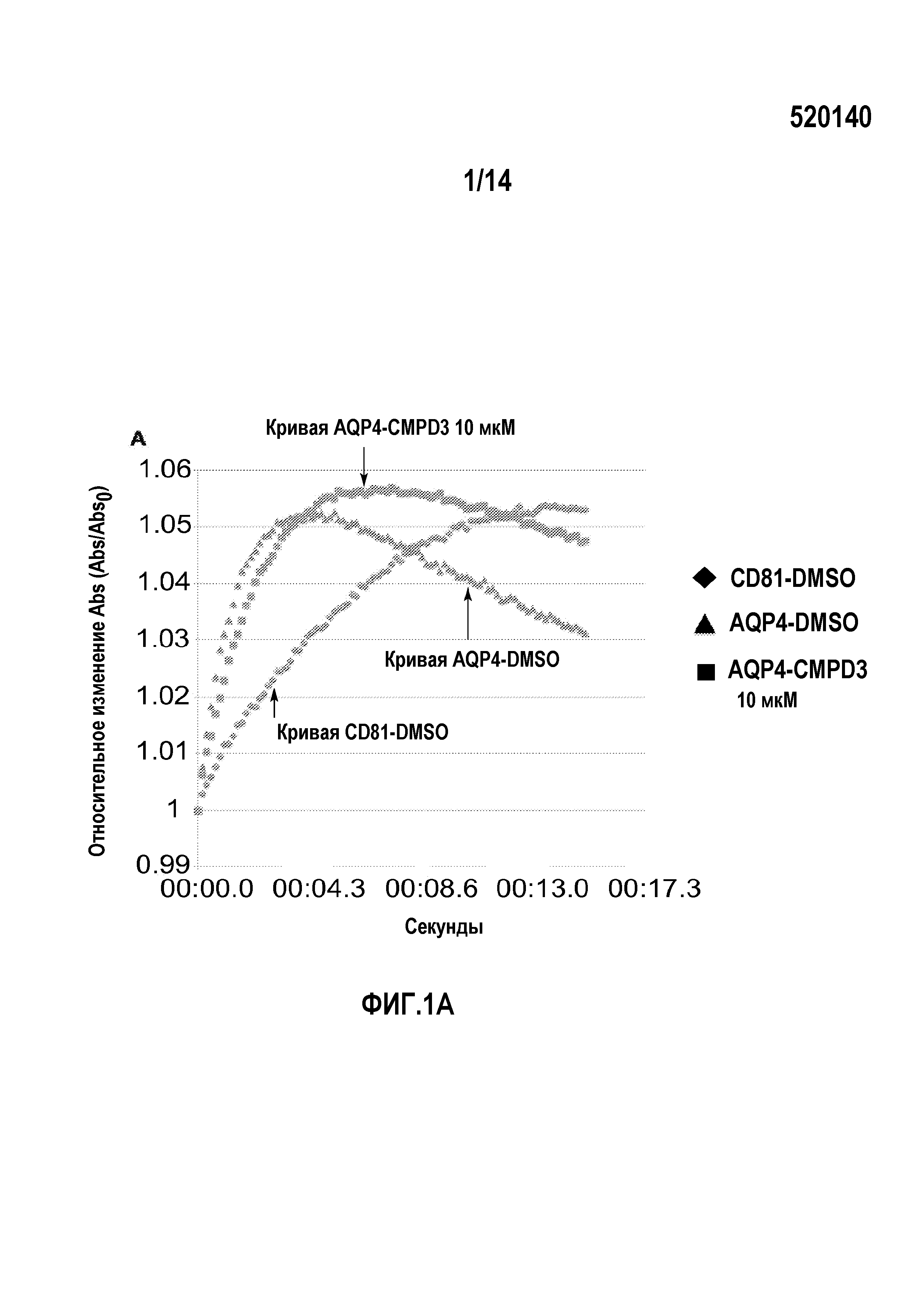
на фигуре 1 представлены результаты тестов изменения клеточного объема, опосредуемого аквапорином-4 (фиг.1A) и аквапорином-2 (фиг.1B), и ингибирующего действия соединения 3 (соединение формулы 1a, в которой R1, R3 и R5, каждый, представляют собой хлор, и R2, R4 и R6 являются H) в отношении указанных аквапоринов.
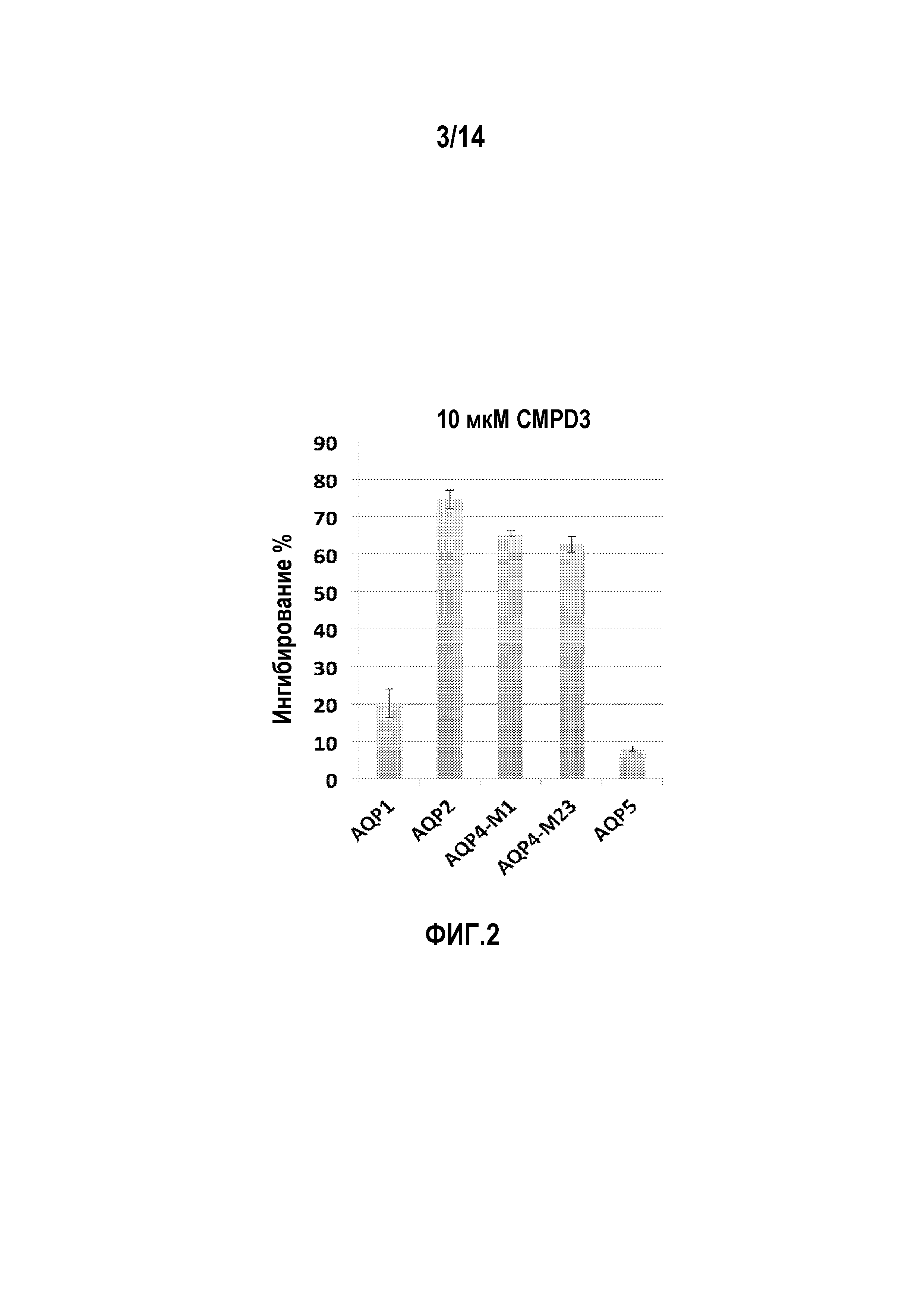
На фигуре 2 изображены результаты проверки специфичности соединения 3 в отношении AQP-1, AQP-2, AQP-4-M1, AQP-4-M23 и AQP-5.
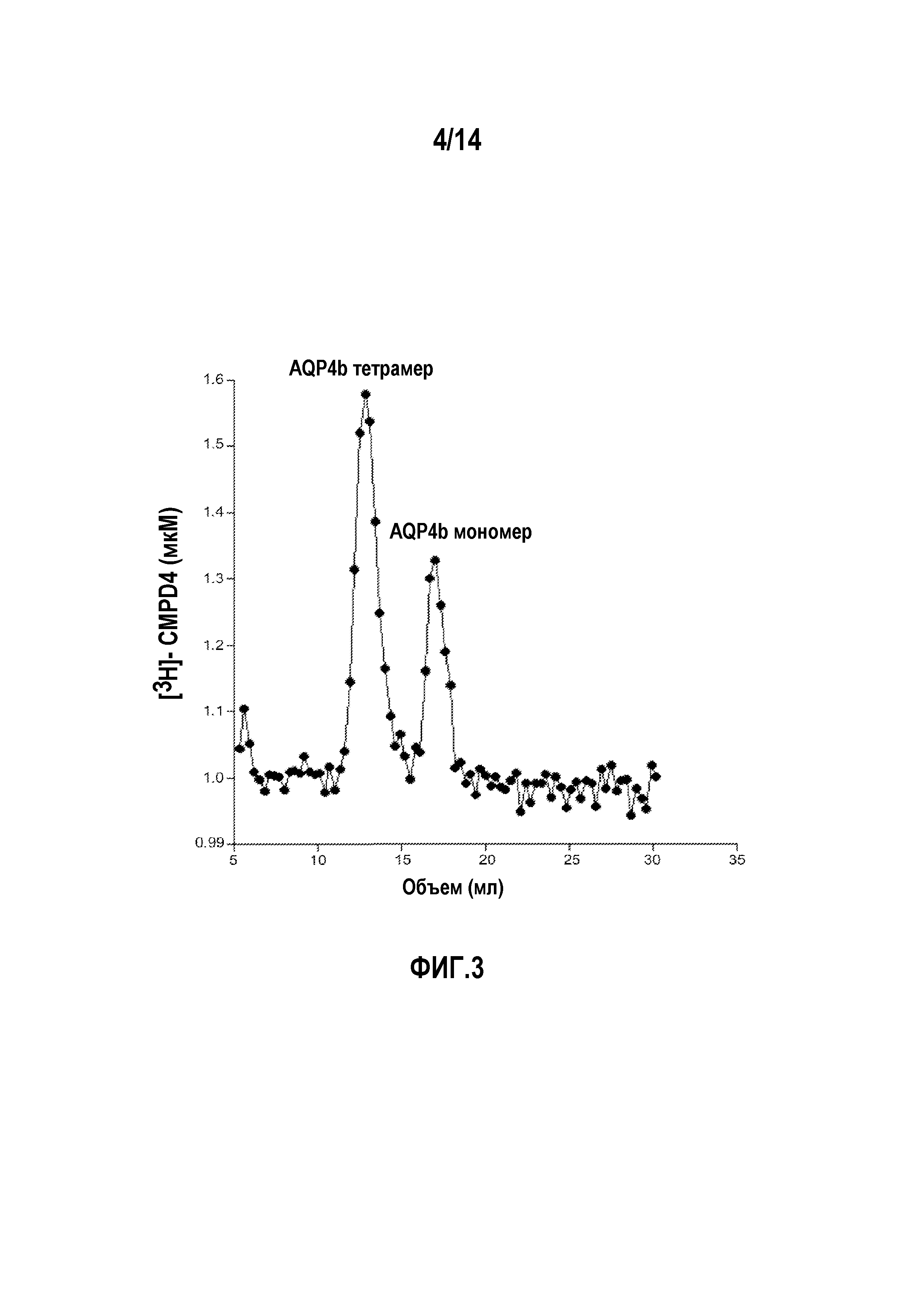
На фигуре 3 изображены результаты исследования по методу Хаммеля-Дрейера связывания [3H]-меченого соединения 4 (соединение формулы 1a, в которой R1, R3 и R5, каждый, представляют собой трифторметил, и R2, R4 и R6 обозначают H) с очищенным AQP4b.
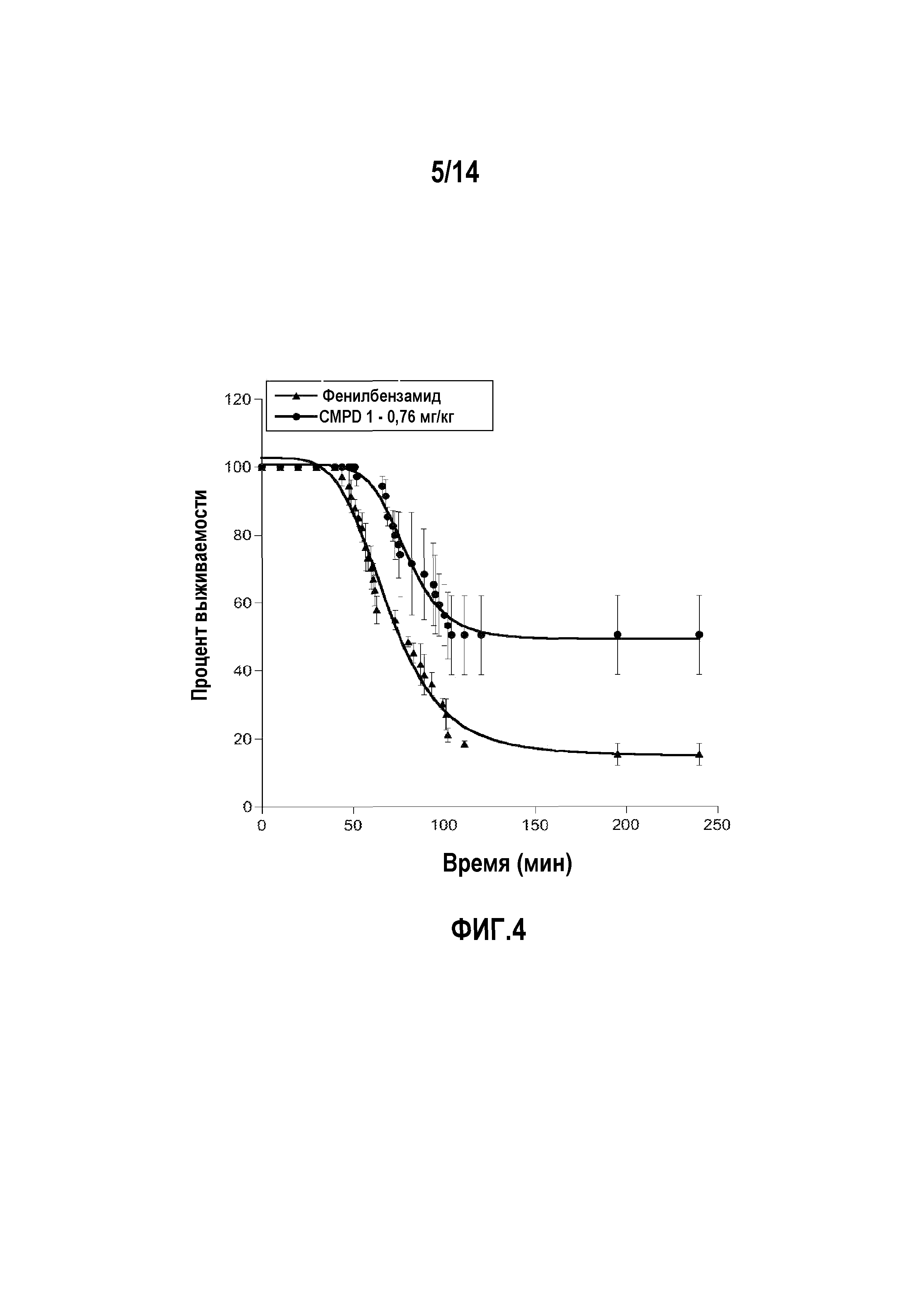
На фигуре 4 изображены кривые выживаемости, выраженной в процентах, полученные в мышиной модели водной токсичности с использованием 0,76 мг/кг соединения 1 (соединение формулы 1a, в которой R1 обозначает хлор, R3 и R5 обозначают трифторметил, и R2, R4 и R6 обозначают H).
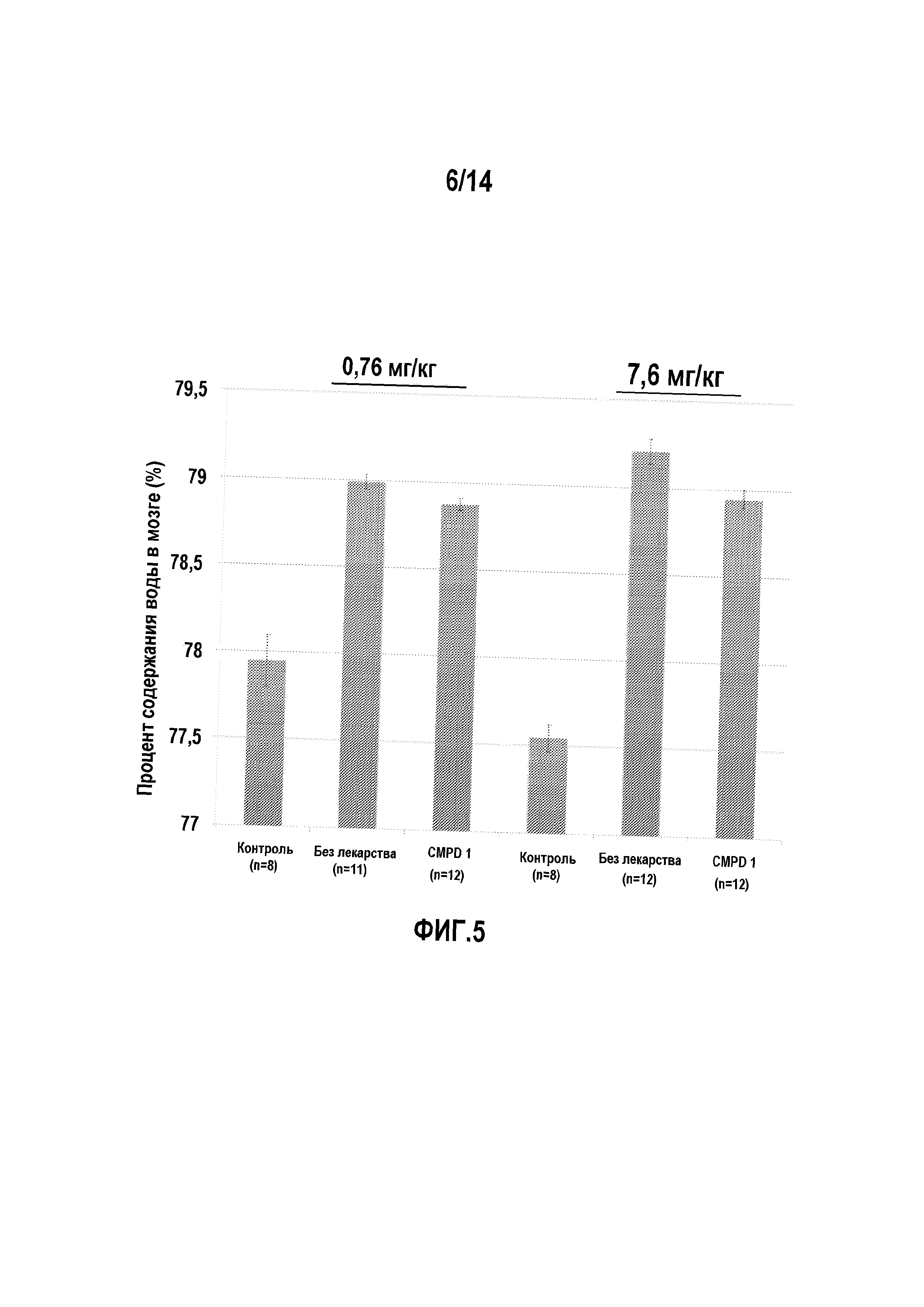
На фигуре 5 изображено ингибирование образования отека мозга в мышиной модели водной токсичности, определяемое по содержанию воды в мозге с использованием соединения 1.
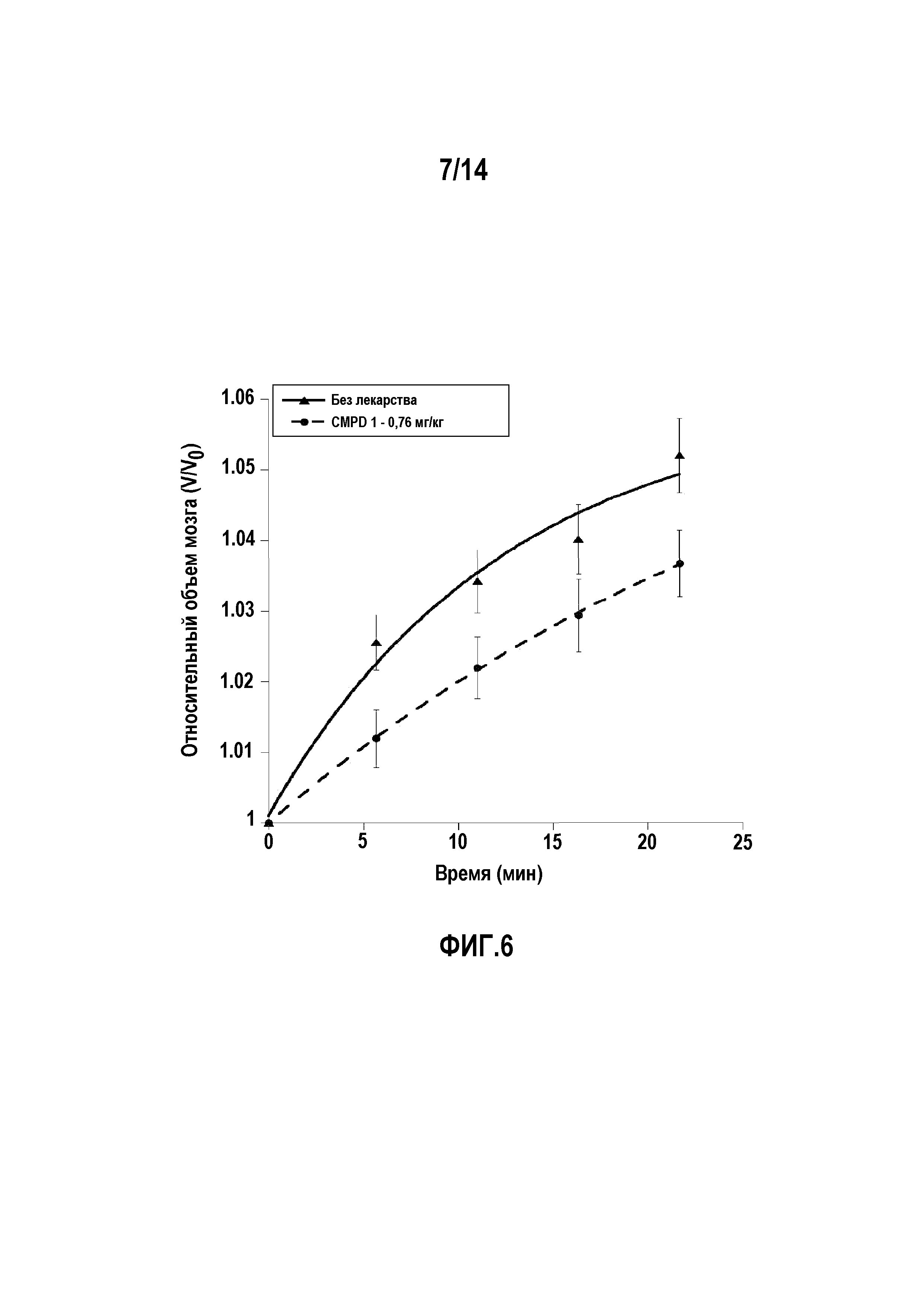
На фигуре 6 изображено ингибирование образования отека мозга с помощью соединения 1 в мышиной модели водной токсичности с применением анализа МРТ для измерения объема мозга с учетом n=14 мышей/группу лечения. Образование отека в зависимости от времени показано в сравнении с группой, не получавшей лекарство, и группой, получавшей соединение 1 в дозе 0,76 мг/кг. Первая временная точка на 5,67 мин соответствует срезу сканирования в средней части мозга во время первого сканирования после введения инъекции. Другие временные точки расположены аналогичным образом. Данные соответствуют экспоненциальному уравнению первого порядка:
V/Vo=Vi+dVmax(1-e(-kt));
где V/Vo = относительный объем мозга, Vi = начальный относительный объем мозга, dVmax = максимальное изменение относительного объема мозга, k = константа скорости первого порядка (мин-1), и t = время в минутах.
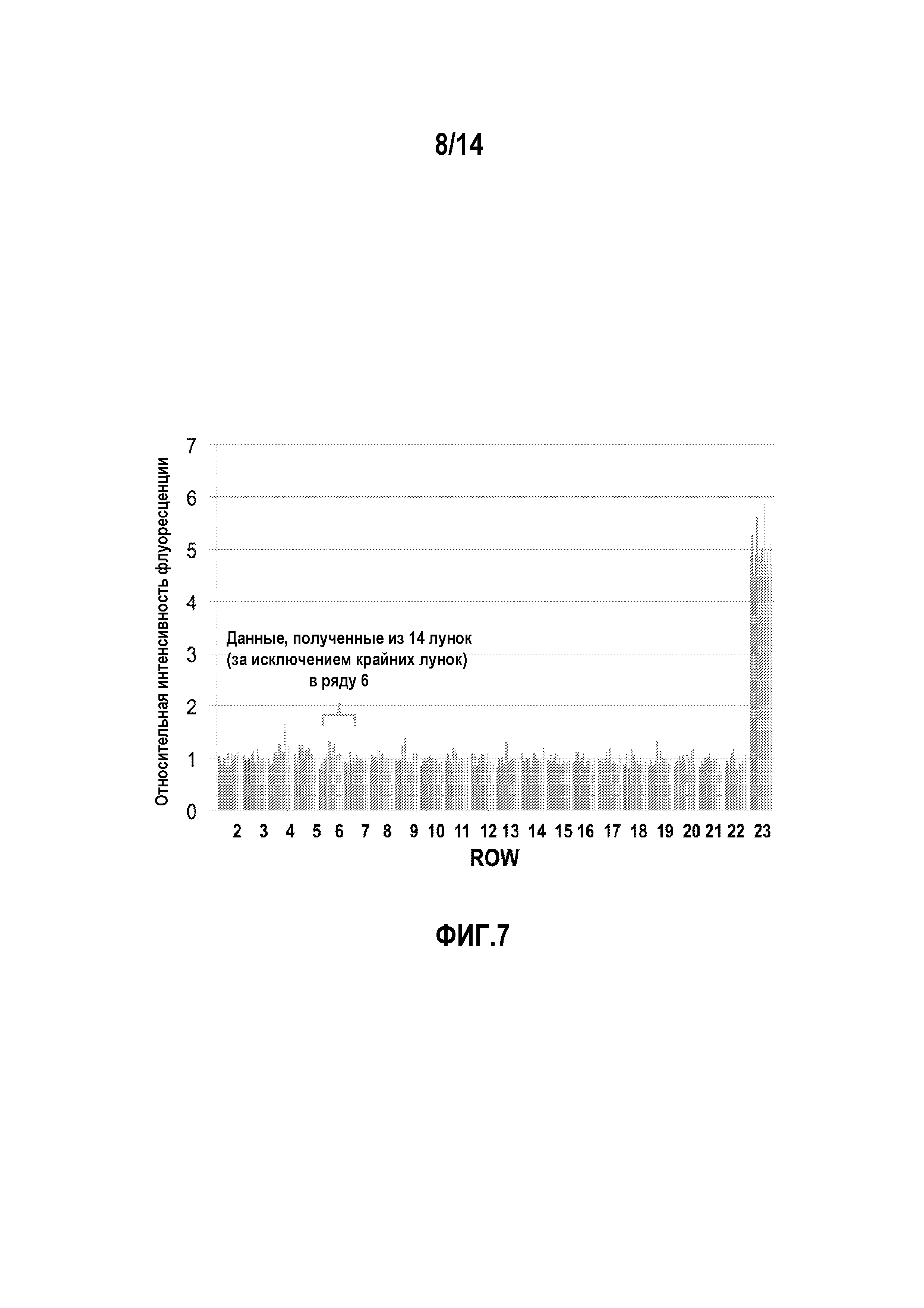
На фигуре 7 изображены результаты одноточечного флуоресцентного исследования с кальцеином, используемого для высокопроизводительного скрининга.
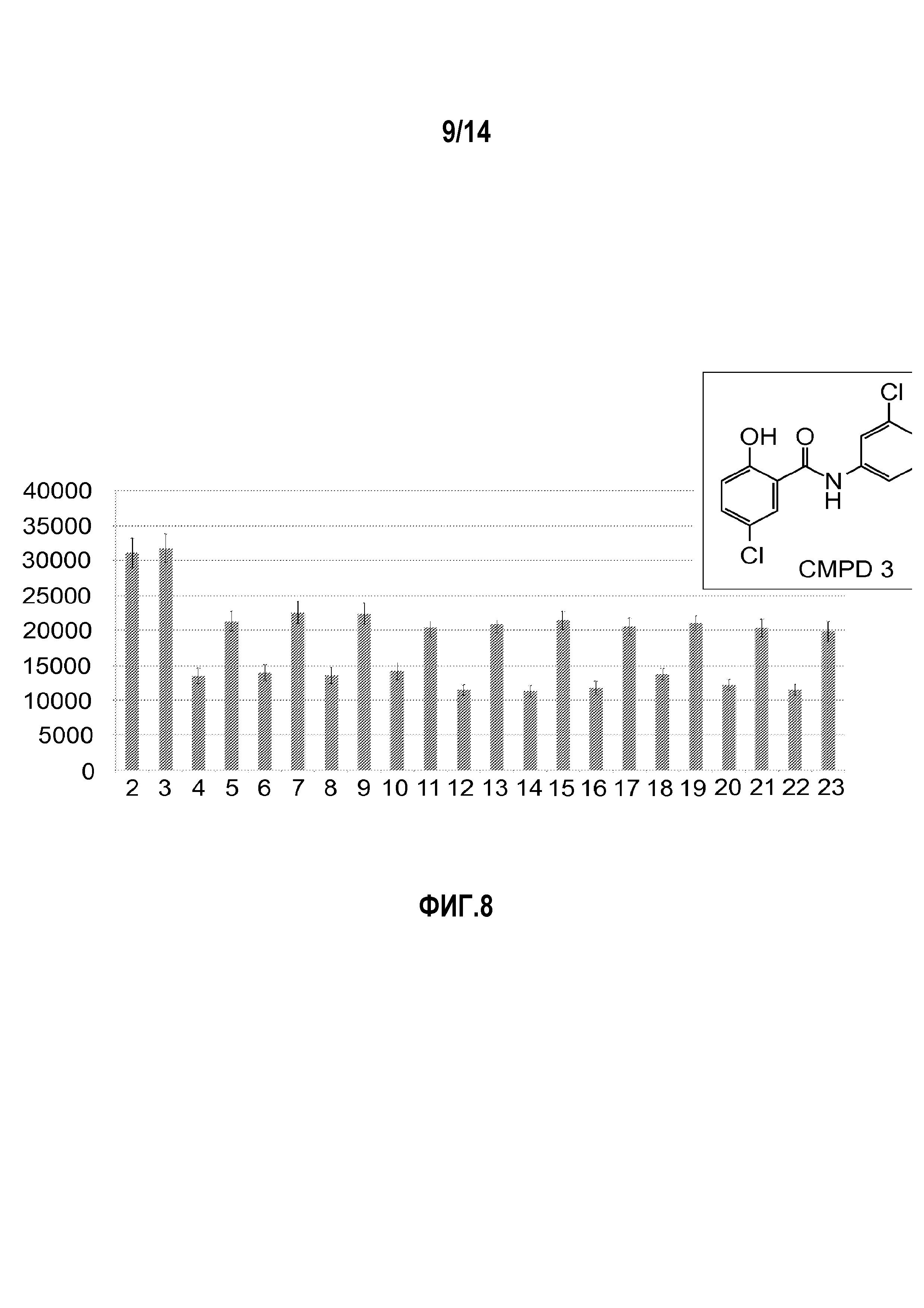
На фигуре 8 изображены результаты проверки соединений, полученные с использованием теста аквапорин-опосредованного разрыва клеток; на вставленной иллюстрации представлена структура соединения 3.
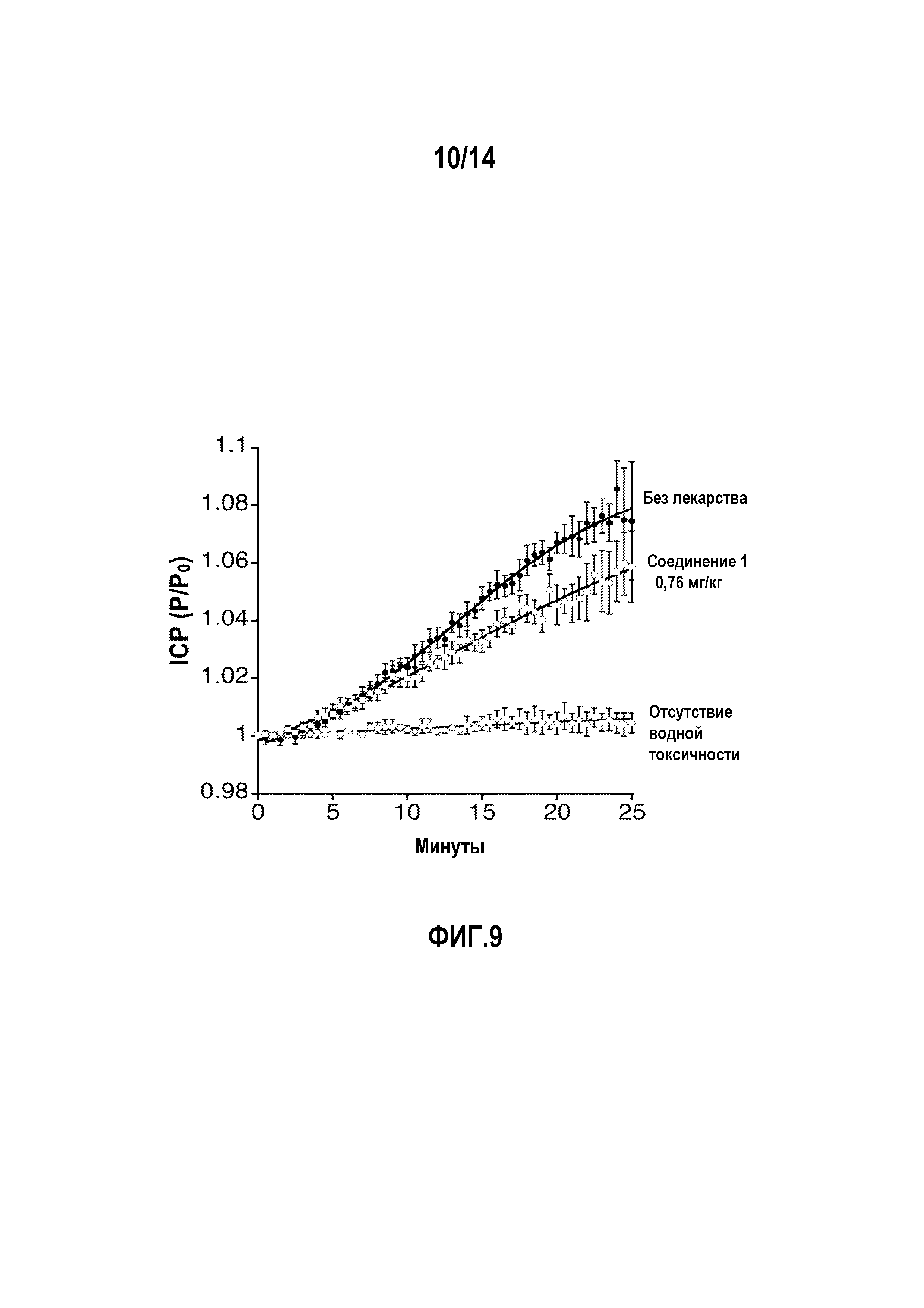
На фигуре 9 показано снижение внутричерепного давления (ICP) в мышиной модели водной токсичности при использовании 0,76 мг/кг соединения 1.
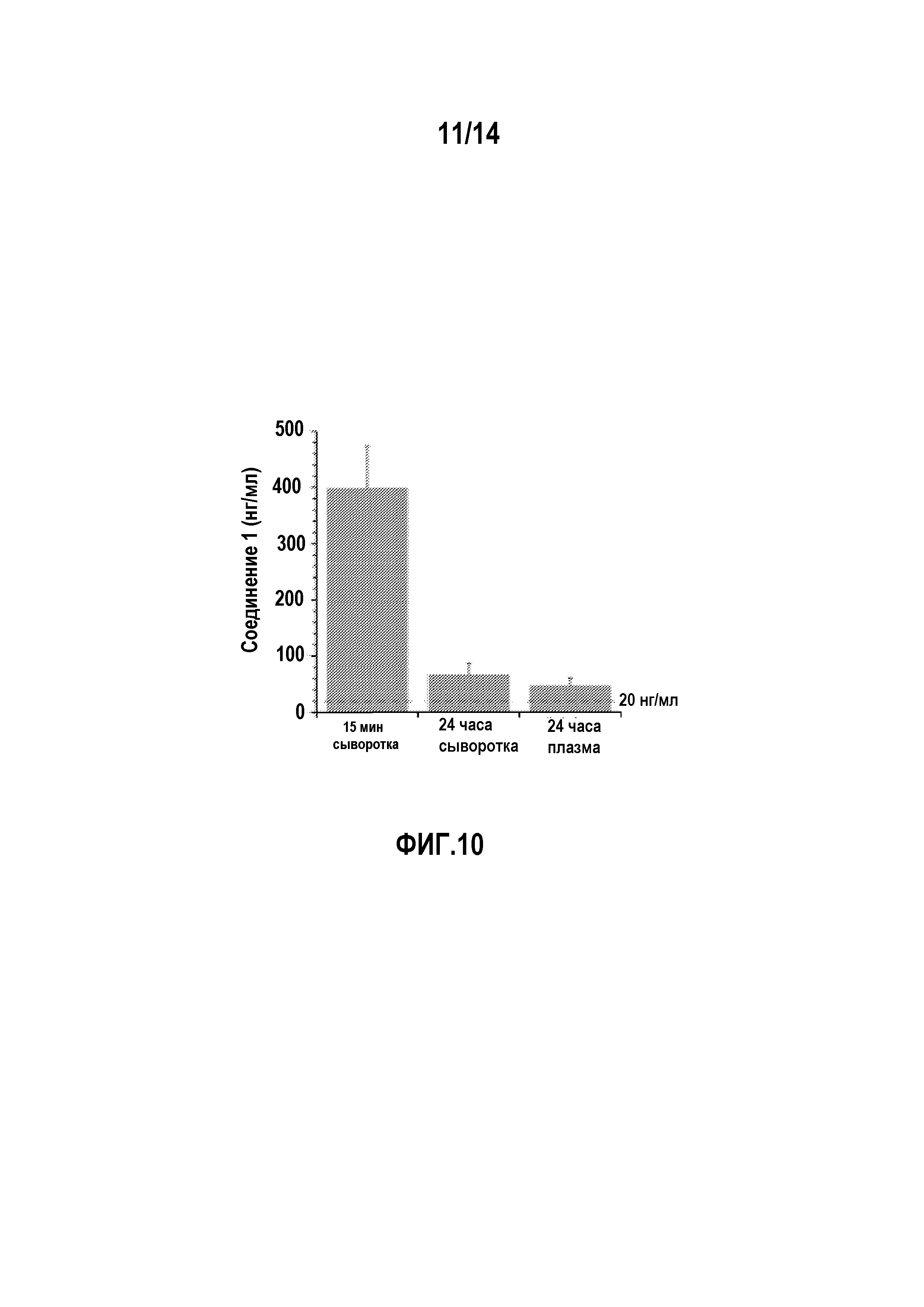
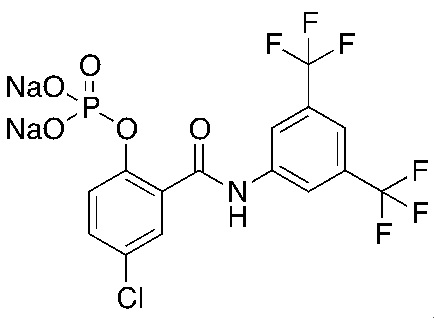
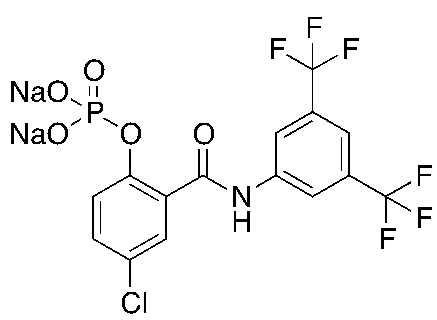
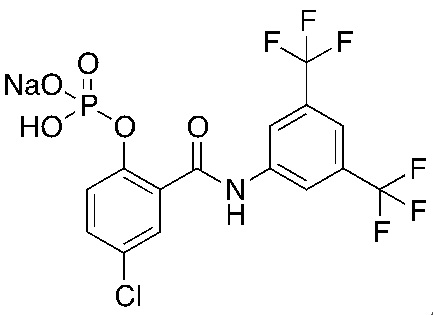
На фигуре 10 изображены уровни в плазме и сыворотке соединения 1, преобразованного из соединения 5 (соединение формулы 1a, где R1 представляет собой хлор, R3 и R5 представляют собой трифторметил, R2 и R4 представляют собой H, и 6 является P(=O)(O)2 в форме динатриевой соли).
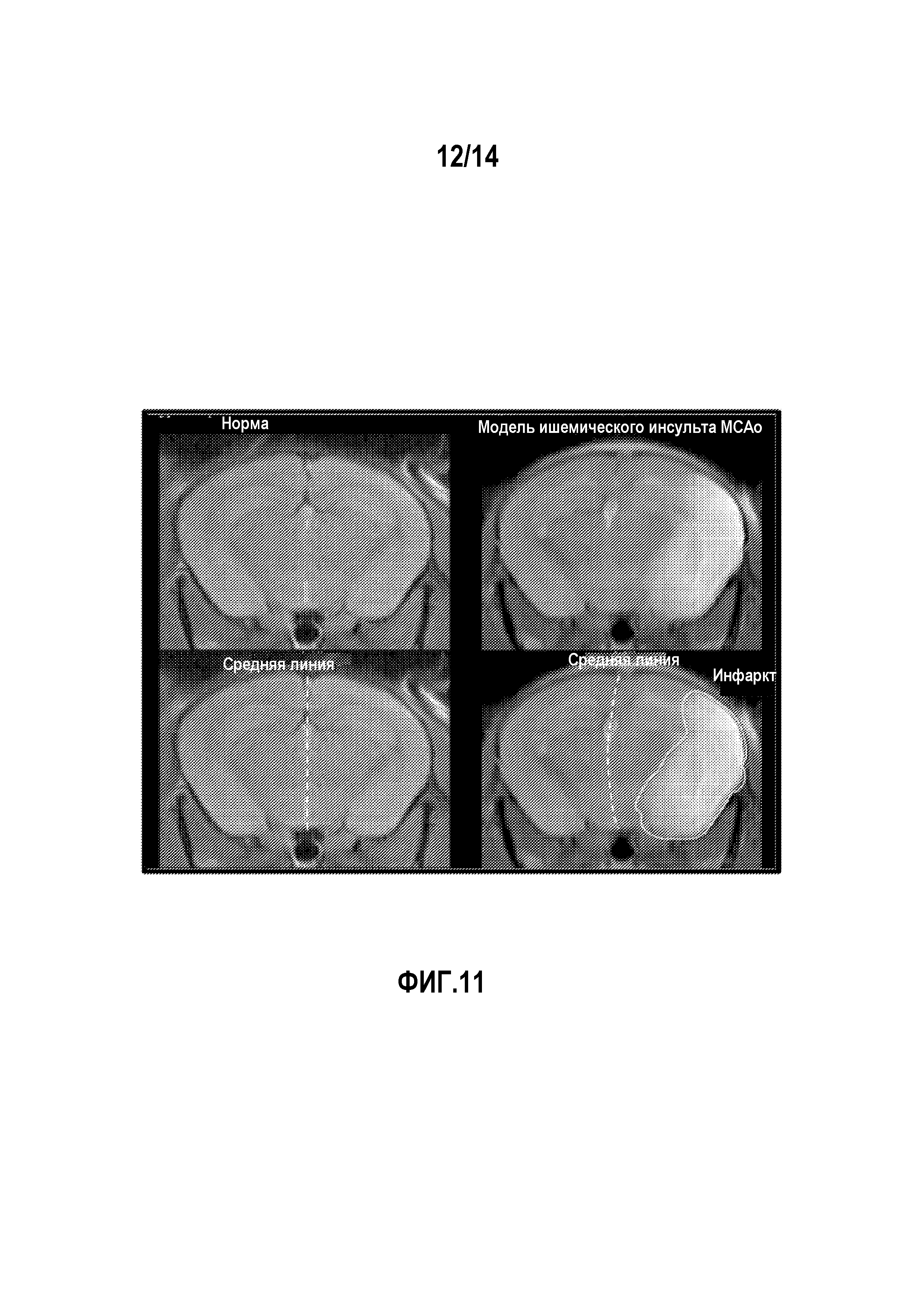
На фигуре 11 изображена модель ишемического инсульта мышей при окклюзии средней мозговой артерии (MCAo).
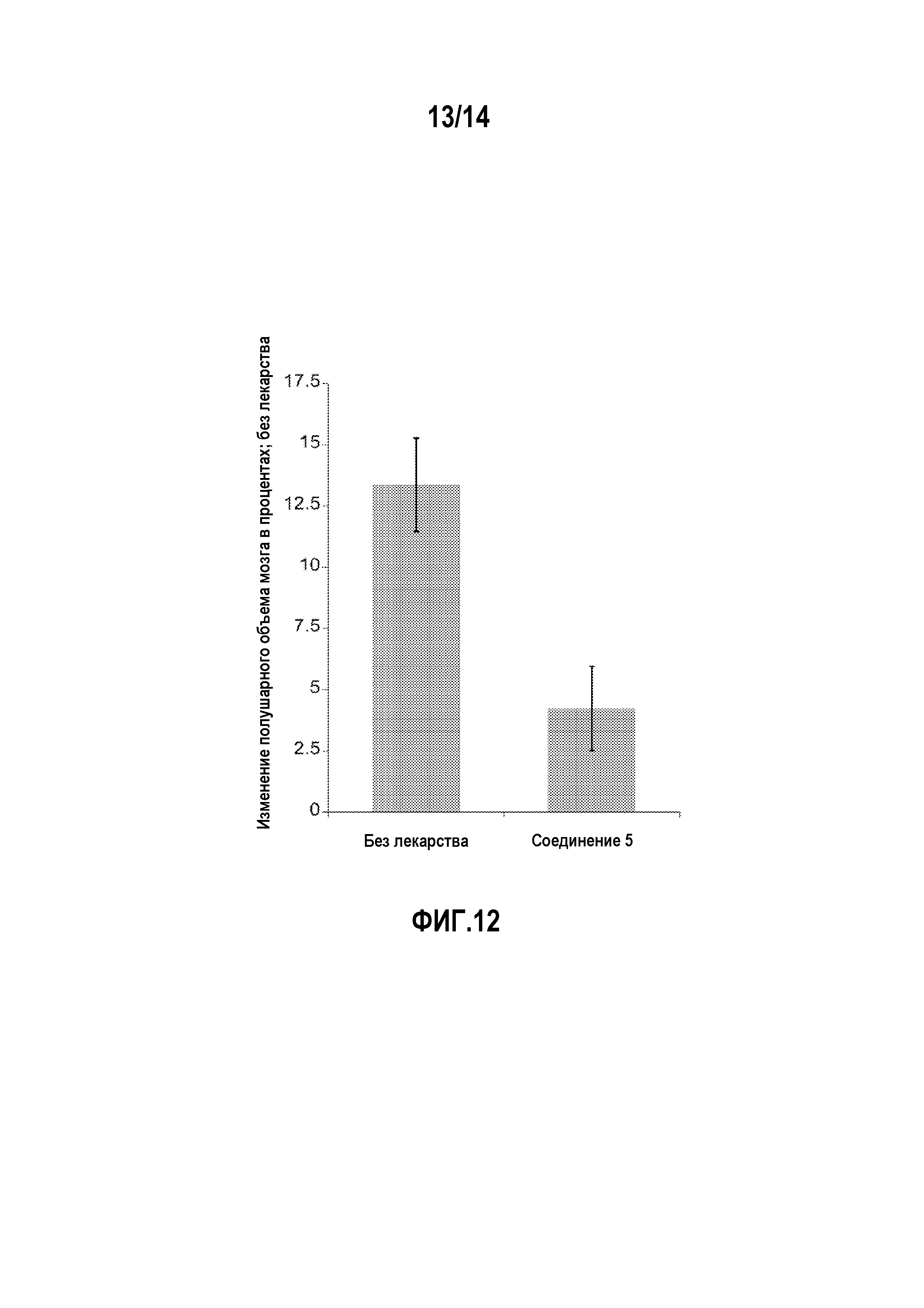
На фигуре 12 изображено относительное изменение полушарного объема мозга в модели окклюзии средней мозговой артерии (MCAo).
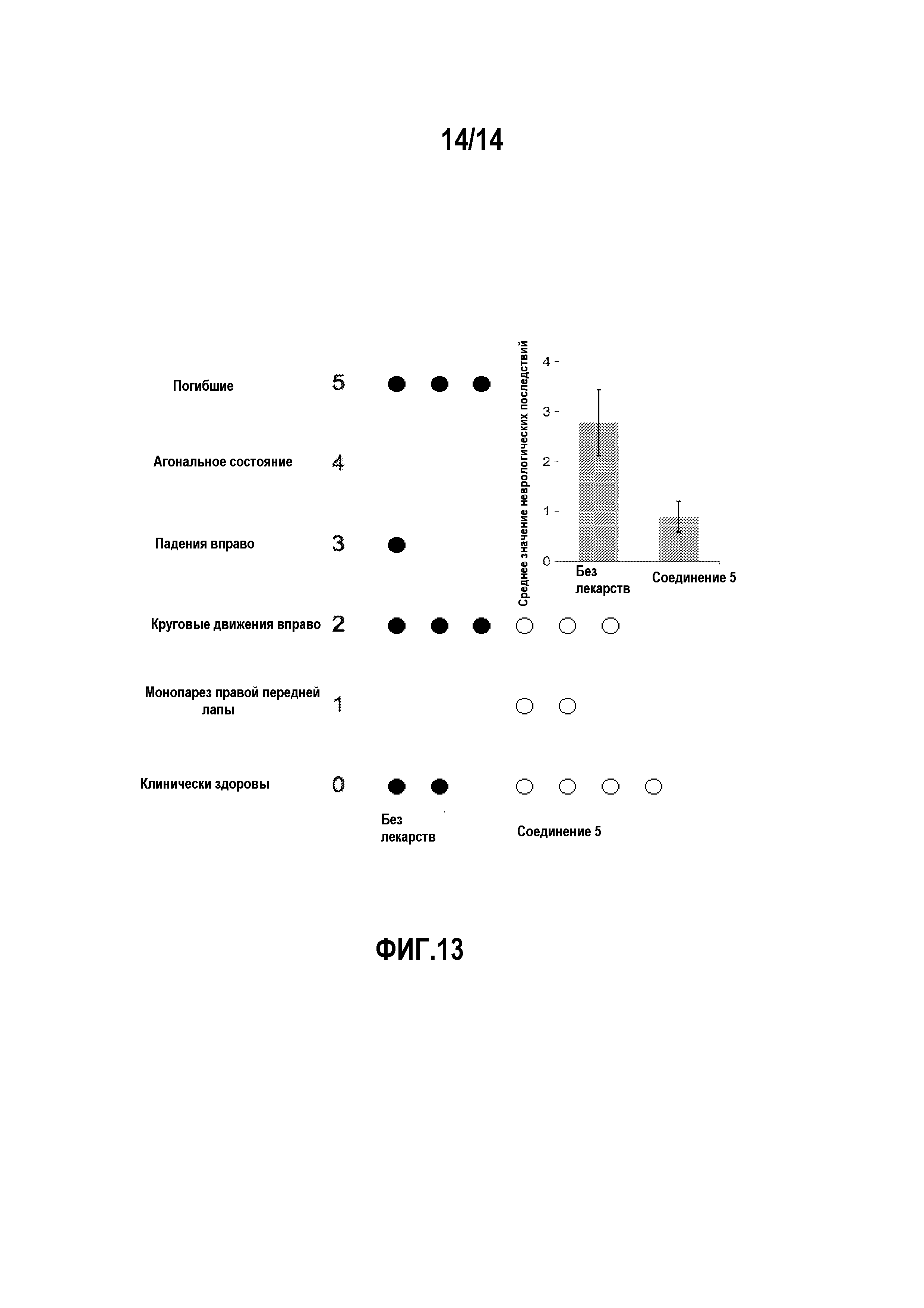
На фигуре 13 изображены неврологические последствия MCAo у мышей, получавших физиологический раствор (без лекарства,•) или соединение 5 (o).
Подробное описание изобретения
Последующее описание предпочтительных вариантов носит лишь иллюстративный характер и никоим образом не предназначено для ограничения изобретения, его назначения или применений.
Экспрессия аквапорина-4 (AQP4) активируется в животных моделях травмы, инсульта и водной интоксикации, а также при злокачественных опухолях головного мозга человека. Показано, что аквапорин-4 (AQP4) играет важнейшую роль в развитии отека головного мозга и спинного мозга. AQP4 обеспечивает основной путь движения воды через ГЭБ и пограничную глиальную мембрану. У AQP4-нокаутных мышей, без гена APQ4, наблюдали улучшенную выживаемость по сравнению с мышами дикого типа в моделях ишемического инсульта, водной токсичности, бактериального менингита и сдавления спинного мозга.
Отек головного мозга (CE) обычно делят на 2 основные категории: вазогенный и цитотоксический. Вазогенный отек мозга может происходить, если нарушение гематоэнцефалического барьера (ГЭБ) позволяет воде и растворенным веществам диффундировать в мозг. Сообщалось, что у AQP4-нулевых мышей наблюдался повышенный отек мозга в модели субарахноидального кровоизлияния, что позволяет предположить, что AQP4 необходим для клиренса воды, собранной в межклеточном пространстве. В отличие от этого, цитотоксический отек мозга может быть инициирован ишемией, которая приводит к уменьшению плазматической осмолярности, в отличие от нарушения ГЭБ. Ишемия может привести к падению уровней АТФ, что, как полагают, замедляет работу насоса Na-K АТФазы, что приводит к поглощению Na+ и Cl- через пути утечек. Конечным результатом может быть нарушение осмотического баланса клеток, поступление H2О внутрь клеток, в большей степени астроцитов, чем нейронов, что приводит к увеличению ICP. Мышиные модели ишемического инсульта, водной токсичности, бактериального менингита и сдавления спинного мозга относятся к этой категории. В указанных моделях у AQP4-нулевых мышей наблюдали сниженный CE, что указывает на AQP4 в качестве основного пути перемещения воды в мозг во время формирования цитотоксического CE. Однако цитотоксический отек и вазогенный отек не являются резко разделенными категориями; повреждение, которое исходно вызывает цитотоксический отек, может сопровождаться в дальнейшем, например, спустя несколько часов или дней, вазогенным отеком. Данный факт позволяет предложить различные виды лечения отека головного мозга в разное время.
Сообщалось, что склонность к эпилептическим приступам связана с относительным объемом клеточного и внеклеточного пространства (ECS). Повышенная возбудимость и повышенная эпилептиформная активность является следствием гипотонического воздействия, которое уменьшает объем ECS, тогда как сниженная эпилептиформная активность является следствием гиперосмолярной среды. Сообщалось, что фуросемид, который блокирует клеточный отек, индуцированный эпилептическим приступом, ингибирует эпилептиформную активность in vitro и in vivo. Сообщалось, что мыши, нокаутные по гену AQP4, обладают более низкой восприимчивостью к судорогам, вызванным конвульсантом пентилентетразолом, и более высоким порогом электрографических судорог при индукции с помощью электрической стимуляции гиппокампа. Также сообщалось, что AQP4-нокаутные мыши характеризовались более продолжительной стимуляцией гиппокампа для индукции судорог, по сравнению с мышами дикого типа.
AQP4 экспрессируется в клетках Мюллера в сетчатке. Исследования включали в себя участие клеток Мюллера в патогенезе повреждения сетчатки после ишемии. Сообщалось, что делеция гена AQP4 у мышей обеспечивала значительное сохранение функции сетчатки и архитектуры после ретинальной ишемии.
Как стало известно, AQP4 обнаружен в сердце млекопитающих. Сообщалось, что экспрессия AQP4 в сердце человека представлена на уровне мРНК и на уровне белка. Вода накапливается в миокарде в результате ишемии, когда ишемическая ткань становится гиперосмолярной и притягивает воду из просвета капилляров. Вода транспортируется в клетки миокарда, например, в кардиомиоциты. При реперфузии нормоосмолярная кровь поступает к гиперосмолярным клеткам, что приводит к дальнейшему развитию клеточного отека, который может вовлекать даже клетки, находящиеся вне зоны риска. Указанное накопление воды приводит к выраженному подавлению сердечной деятельности, и усиливает эффекты недостатка кислорода и запаса питательных веществ. Повреждение ишемии миокарда/реперфузии относится к повреждению, вызванному ишемией с последующей реперфузией в сердце. Сообщалось, что у мышей с нокаутом AQP4 наблюдали сниженный размер инфаркта после ишемии-реперфузии ex vivo и после ишемии in vivo без реперфузии. Пришли к выводу, что генотип с нокаутом AQP4 обеспечивал увеличение устойчивости к ишемическому повреждению.
Оптиконевромиелит (NMO) представляет собой нейрогенное демиелинизирующее заболевание, которое главным образом поражает зрительный нерв и спинной мозг. Особенностью NMO является наличие в сыворотке крови антител, направленных против внеклеточных эпитопов AQP4. Сообщалось, что большинство, если не все пациенты с NMO являются сероположительными в отношении аутоантител к AQP4 (NMO-IgG). Считают, что NMO-IgG, связывающийся с AQP4 в астроцитах, инициирует воспалительный каскад и последующее нейровоспаление и потеря миелина являются причиной неврологических расстройств. Блокирование связывания указанных антител с AQP4 может предотвратить инициацию воспалительного каскада.
В одном варианте осуществления изобретение предлагает способы лечения отека, опосредованного аквапорином, например, AQP4, где отек является следствием гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца. Гипоксия может привести к развитию метаболического ацидоза (например, лактоацидоза), который, в свою очередь, приводит к отеку, и отек затем может уменьшить кровоснабжение, что приводит к гибели клеток и неблагоприятным исходам, особенно в тканях, где отек ограничивается физически, например, внутри черепа или в пределах перикарда. Считают, что указанная гипоксия является причиной того, что, например, у пациентов переживших остановку сердца, может впоследствии развиться отек мозга, а также повреждение сердечной ткани. Блокирование аквапориновых каналов, например, AQP4, например, путем введения соединения, ингибирующего аквапорин, как описано здесь, позволяет ингибировать или контролировать указанный отек, ограничивая тем самым дальнейшее повреждение пораженной ткани.
Аквапорин-2 (AQP2) является основным способом движения воды в собирательных канальцах почек. Блокирование указанного водного канала могло бы снизить реабсорбцию воды без нарушения электролитного баланса или мешая вазопрессина рецептор-опосредованного сигнализации или вмешательства в сигнальный путь опосредованный рецепторами вазопрессина. Доказательство того, что ингибитор AQP2 не вызывает дисбаланса электролитов и на самом деле является эффективным лекарственным средством при гипонатриемии, получено у пациентов с несахарным диабетом, у которых отсутствует функциональный AQP2. У них наблюдается хроническое повышение водного диуреза, но при поддержании нормальной гидратации, не наблюдается других последствий продолжительного отсутствия функции AQP2.
Таким образом, изобретение относится к применению ингибиторов аквапорина для контроля заболеваний или состояний с нарушением водного баланса, включая отек, в особенности отеки головного мозга и спинного мозга, например, после травмы или ишемического инсульта, а также отек, связанный с глиомой, менингитом, острой горной болезнью, приступами эпилепсии, инфекциями, метаболическими нарушениями, гипоксией, водной интоксикацией, печеночной недостаточностью, печеночной энцефалопатией, гипоксией, и диабетическим кетоацидозом, путем ингибирования поступления воды через BBB, и также является полезным для лечения и контроля гипонатриемии и задержки избыточной жидкости, путем ингибирования захвата воды в почках. Изобретение также предлагает применение ингибиторов аквапорина для контроля заболеваний или состояний, включая эпилепсию, ретинальную ишемию и другие заболевания глаз, ассоциированные нарушениями внутриглазного давления и/или гидратации ткани, ишемию миокарда, повреждение ишемии миокарда/реперфузии, инфаркт миокарда, гипоксию миокарда, застойную сердечную недостаточность, сепсис, оптиконевромиелит, и мигрени.
В одном варианте осуществления изобретение предлагает способ (способ 1) лечения или контроля заболевания или состояния, опосредованного аквапорином, включающий введение пациенту, который в этом нуждается, эффективного количества соединения фенилбензамида, например, эффективного количества никлозамида (5-хлор-N-(2-хлор-4-нитрофенил)-2-гидроксибензамид) или соединения формулы I:
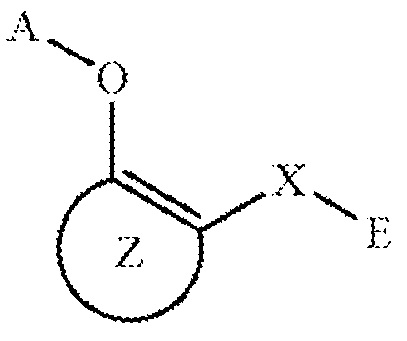
в котором X обозначает соединительную группу, в которой число атомов главной цепи составляет от 2 до 5 (указанная соединительная группа может быть замещенной), A обозначает атом водорода или ацильную группу, которая может быть замещенной, или алкильную группу C1-C6, которая может быть замещенной, или A может связываться с соединительной группой X с образованием циклической структуры, которая может быть замещенной, E обозначает арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещена, кольцо Z обозначает арен, который может содержать один или несколько заместителей в дополнение к группе, представленной формулой -O-A, в которой A имеет такое же значение, как указано выше, и группе, представленной формулой -X-E, где X и E имеют такое же значение, как указано выше, или гетероарен, который может иметь один или больше заместителей в дополнение к группе, представленной формулой -O-A, где A имеет такое же значение, как указано выше и группе, представленной формулой -X-E, где X и E имеют такое же значение, как указано выше; в свободной форме или в форме фармацевтически приемлемой соли, включая формы сольватов или гидратов; например,
1.1. Способ 1, в котором соединение формулы I выбирают из соединений формулы (I), как описано в US 2010/0274051 A1 или US 7700655, например, соединение по общим формулам (I), (I-1), (I-2), (I-3) и (I-4), как указано здесь, например, выбирают из соединений № 1-223, в соответствии с US 2010/0274051 или соединение № 301-555, в соответствии с US 7700655.
1.2. Способ 1.1, в котором соединение формулы I выбирают из свободной формы или форм фармацевтически приемлемых солей:
N-[3,5-бис(трифторметил)фенил]-5-фтор-2-гидроксибензамид,
N-[3,5-бис(трифторметил)фенил]-5-циано-2-гидроксибензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(трифторметил)бензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(1,1,2,2,2-пентафторэтил)бензамид,
N-[3,5-бис(трифторметил)фенил]-5-(2,2-дицианоэтен-1-ил)-2-гидроксибензамид,
N-[3,5-бис(трифторметил)фенил]-5-этинил-2-гидроксибензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(фенилэтинил)бензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-[(триметилсилил)этинил]бензамид,
N-[3,5-бис(трифторметил)фенил]-4-гидроксибифенил-3-карбоксамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(3-тиенил)бензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(1-пирролил)бензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(2-метилтиазол-4-ил)бензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(2-пиридил)бензамид,
N-[3,5-бис(трифторметил)фенил]-5-диметилсульфамоил-2-гидроксибензамид,
N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(пиррол-1-сульфонил)бензамид,
N-[2,5-бис(трифторметил)фенил]-5-хлор-2-гидроксибензамид,
N-(2,5-бис(трифторметил)фенил-5-бром-2-гидроксибензамид,
2-ацетокси-N-[2,5-бис(трифторметил)фенил]-5-хлорбензамид,
2-ацетокси-N-[3,5-бис(трифторметил)фенил]-5-хлорбензамид,
5-хлор-N-[2-фтор-3-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-N-[2-фтор-5-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-N-[2-хлор-5-(трифторметил)фенил]-2-гидроксибензамид,
5-бром-N-[2-хлор-5-(трифторметил)фенил]-2-гидроксибензамид,
2-ацетокси-5-хлор-N-[2-хлор-5-(трифторметил)фенил]бензамид,
5-хлор-N-[3-фтор-5-(трифторметил)фенил]-2-гидроксибензамид,
5-бром-N-[3-бром-5-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-N-[3-фтор-5-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-N-[4-фтор-3-(трифторметил)фенил]-2-гидроксибензамид,
5-бром-N-[4-хлор-3-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-2-гидрокси-N-[2-нитро-5-(трифторметил)фенил]бензамид,
5-бром-N-[4-циано-3-(трифторметил)фенил]-2-гидроксибензамид,
5-хлор-2-гидрокси-N-[2-метил-3-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[2-метил-5-(трифторметил)фенил]бензамид,
2-гидрокси-5-метил-N-[2-метил-5-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[4-метил-3-(трифторметил)фенил]бензамид,
2-гидрокси-5-метил-N-[4-метил-3-(трифторметил)фенил]бензамид,
5-бром-2-гидрокси-N-[2-метокси-5-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[2-метокси-5-трифторметил)фенил]бензамид,
5-бром-2-гидрокси-N-[3-метокси-5-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[4-метокси-3-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[2-метилсульфанил-5-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[2-(1-пирролидино)-5-(трифторметил)фенил]бензамид,
5-хлор-2-гидрокси-N-[2"-морфолино-5-(трифторметил)фенил]бензамид,
5-бром-N-[5-бром-4-(трифторметил)тиазол-2-ил]-2-гидроксибензамид,
5-хлор-N-{5-циано-4-[(1,1-диметил)этил]тиазол-2-ил}-2-гидроксибензамид,
5-бром-N-{5-циано-4-[(1,1-диметил)этил]тиазол-2-ил}-2-гидроксибензамид,
2-(5-бром-2-гидроксибензоил)амино-4(трифторметил)тиазол-5-карбоновой кислоты этиловый эфир.
1.3. Способ 1, в котором A обозначает ацил C1-4 (например, ацетил).
1.4. Способ 1, в котором соединение представляет собой соединение формулы I, как описано в US 7626042, например, по формуле I-1, например, любое из соединений 1-151, как описано в US 7626042.
1.5. Способ 1.4, в котором A обозначает ацил C1-4 (например, ацетил).
1.6. Способ 1, в котором A обозначает остаток аминокислоты.
1.7. Способ 1, в котором A обозначает 5-6-членную неароматическую гетероциклическую кольцевую карбонильную группу, например, 5-6-членную неароматическую гетероциклическую кольцевую карбонильную группу, которая содержит по меньшей мере один атом азота в качестве кольцевых атомов (атомы, формирующие кольцо) в указанном гетероциклическом кольце и в которой карбонильная группа связана с атомом азота, например, где указанное 5-6-членное неароматическое гетероциклическое кольцо выбирают из 1-пирролидинильной группы, пиперидиногруппы, морфолиновой группы, и 1-пиперазинильной группы, и указанное гетероциклическое кольцо может содержать один или более заместителей, например, независимо выбранных из алкильной группы, алкил-окси-карбонильной группы, и карбоксигруппы; например, где A обозначает (морфолин-4-ил)карбонил.
1.8. Способ 1, в котором A обозначает N,N-дизамещенную карбамоильную группу, в которой два заместителя указанной карбамоильной группы могут соединяться друг с другом, и вместе с атомом азота, с которым они связаны, с образованием азотсодержащей гетероциклической группы, которая может быть замещенной.
1.9. Способ 1, в котором A обозначает (морфолин-4-ил)карбонильную группу.
1.10. Способ 1, в котором A обозначает фосфоногруппу, которая может быть замещенной, например, дибензилфосфоногруппа, или не замещенной.
1.11. Способ 1, в котором соединение формулы I представляет собой соединение формулы 1a:
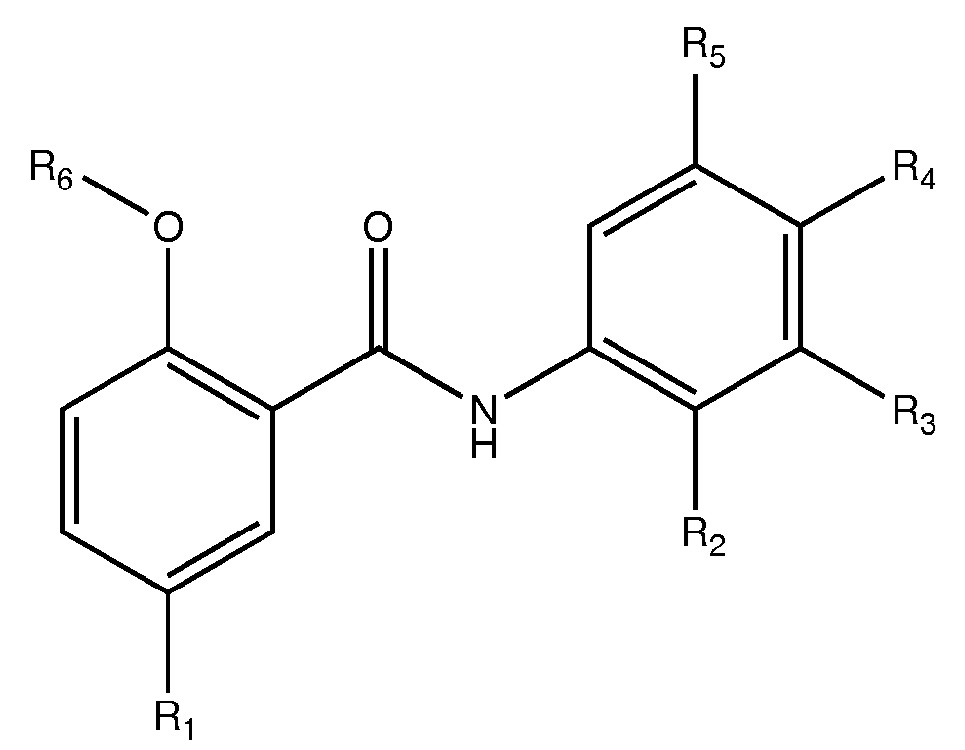
в которой R1, R2, R3, R4 и R5 выбирают из H, галогена, галогенированного алкила C1-4 (например, трифторметил), и цианогруппы; и R6 выбирают из H и физиологически гидролизуемого и приемлемого ацила, например, где R6 представляет собой A, как указано выше в любом из способов 1-1.9;
в форме свободной фармацевтически приемлемой соли.
1.12. Способ 1.11, в котором соединение формулы I представляет собой соединение формулы 1a, в котором R1 выбирают из трифторметила, хлора, фтора и брома; R3 и R5 являются одинаковыми или различными, и выбраны из трифторметила, хлора, фтора и брома; и R2 и R4 оба обозначают H.
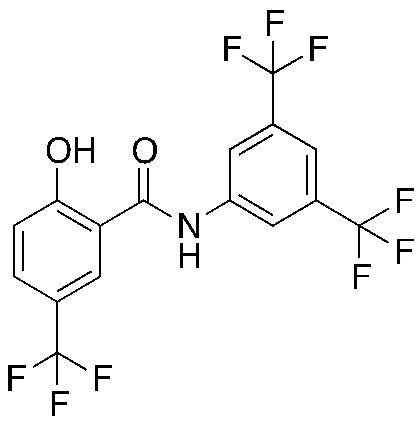
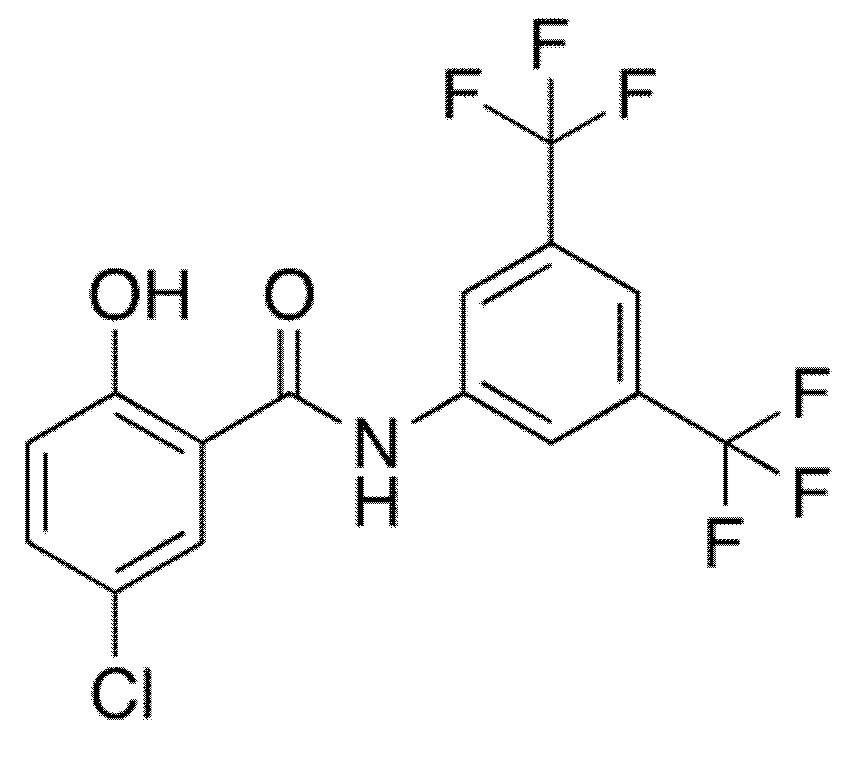
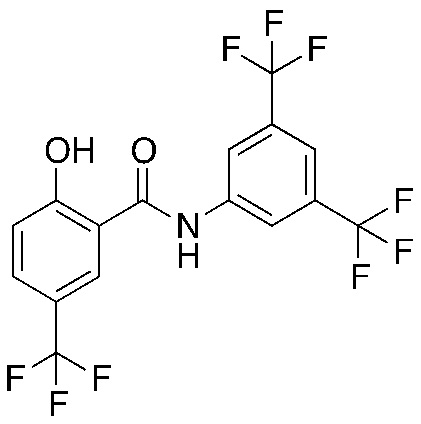
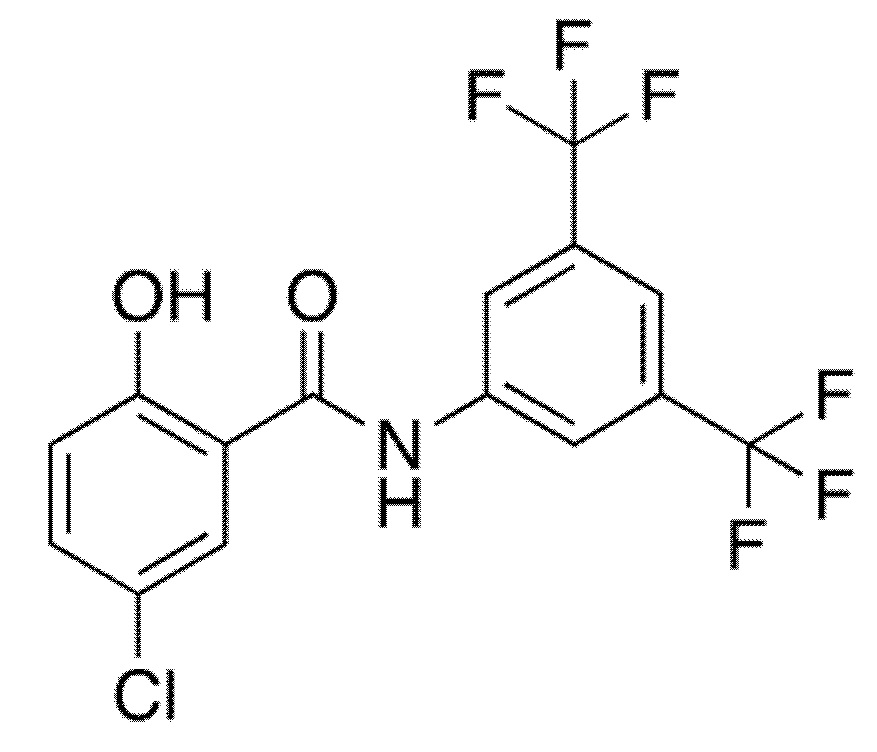
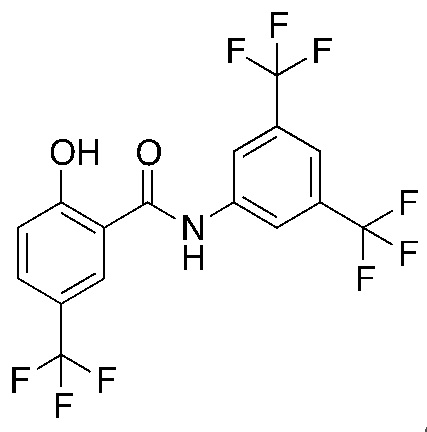
1.13. Способ 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, в котором R1 выбирают из хлора и брома; R3 и R5 оба обозначают трифторметил; и R2 и R4 и R6 обозначают H, например, где соединение формулы 1a выбирают из:

1.14. Способ 1.11 или 1.12, в котором R6 обозначает H.
1.15. Способ 1.11 или 1.12, в котором R6 обозначает ацил.
1.16. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, в котором R1 выбирают из хлора и брома; R3 и R5 оба обозначают трифторметил; и R2 и R4 обозначают H, и R6 обозначает ацетил, например, где соединение формулы 1a выбирают из:
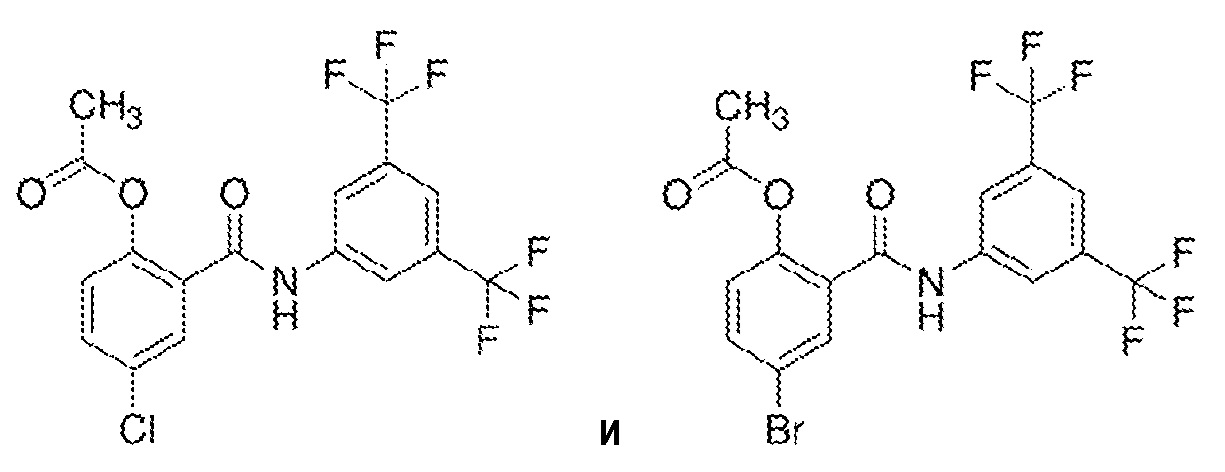
1.17. Способ 1.13, в котором соединение формулы 1a представляет собой соединение 1
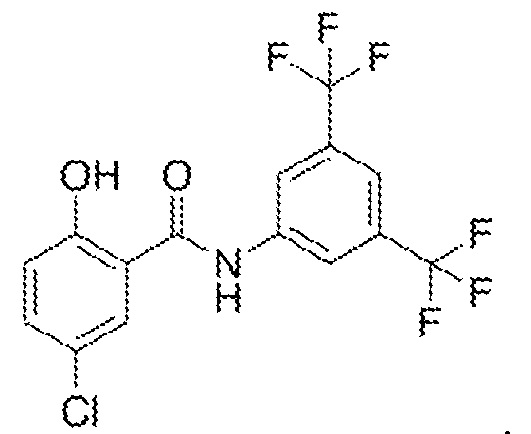
1.18. Способ 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, в котором R1, R3 и R5 каждый обозначают хлор, и R2, R4 и R6 каждый обозначают H (соединение 3).
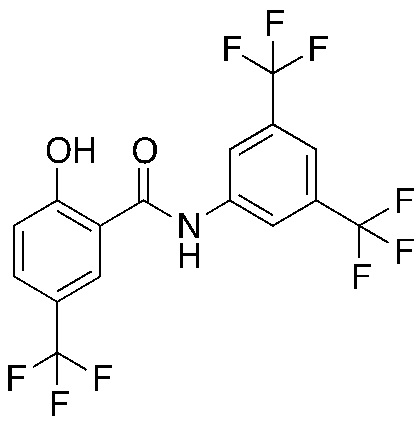
1.19. Способ 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, в котором R1, R3 и R5 каждый обозначают трифторметил, и R2, R4 и R6 каждый обозначают H (соединение 4).
1.20. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы la, и R6 обозначает C1-4 ацил (например, ацетил).
1.21. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, и R6 обозначает остаток аминокислоты.
1.22. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, и R6 обозначает 5-6-членное неароматическое гетероциклическое кольцо-карбонильную группу, например, 5-6-членное неароматическое гетероциклическое кольцо-карбонильную группу, который содержит по меньшей мере один атом азота в качестве атомов, представляющих собой кольцо (атомов, формирующих кольцо), в указанном гетероциклическом кольце и связывается с карбонильной группой у атома азота, например, где указанное 5-6-членное неароматическое гетероциклическое кольцо выбрано из 1-пирролидинильной группы, пиперидиногруппы, морфолиновой группы, и 1-пиперазинильной группы, и указанное гетероциклическое кольцо может содержать один или более заместителей, например, независимо выбранных из алкильной группы, алкил-окси-карбонильной группы, и карбоксигруппы, например, где R6 обозначает (морфолин-4-ил)карбонил.
1.23. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a, и R6 обозначает N,N-ди-замещенную карбамоильную группу, где два заместителя указанной карбамоильной группы могут объединяться друг с другом, вместе с азота с которым они связаны, с образованием азот-содержащей гетероциклической группы, которая может быть замещенной.
1.24. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a и R6 обозначает (морфолин-4-ил)карбонилгруппу.
1.25. Способ 1.11 или 1.12, в котором соединение формулы I представляет собой соединение формулы 1a и R6 обозначает фосфоногруппу, которая может быть замещенной, например, дибензилфосфононогруппой, или незамещенной.
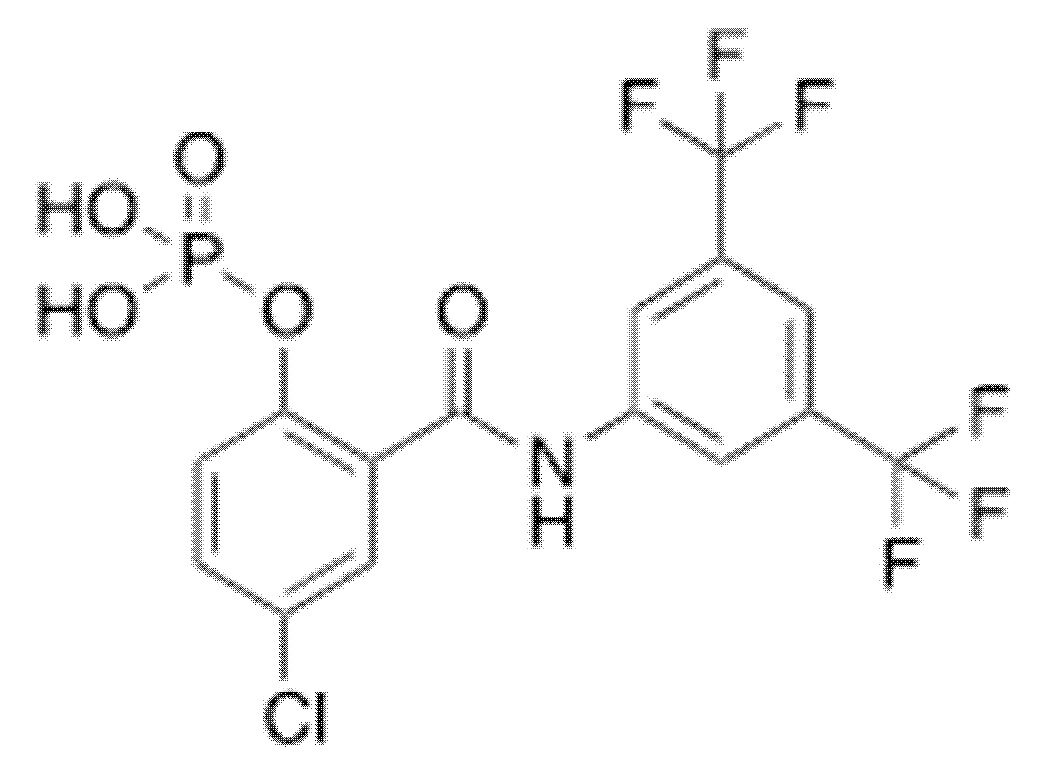
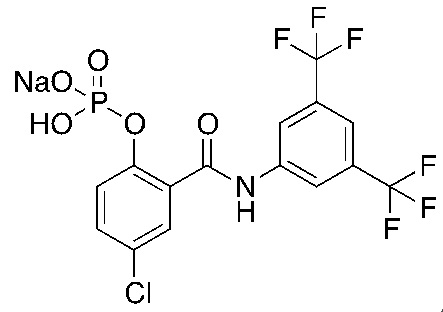
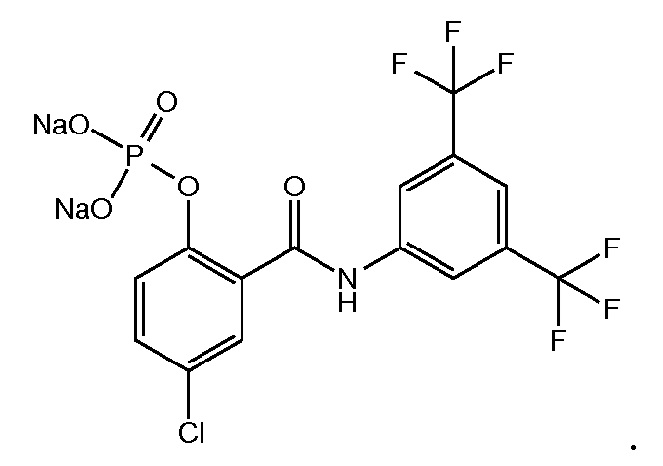
1.26. Способ 1.25, в котором соединение формулы 1a выбирают из:

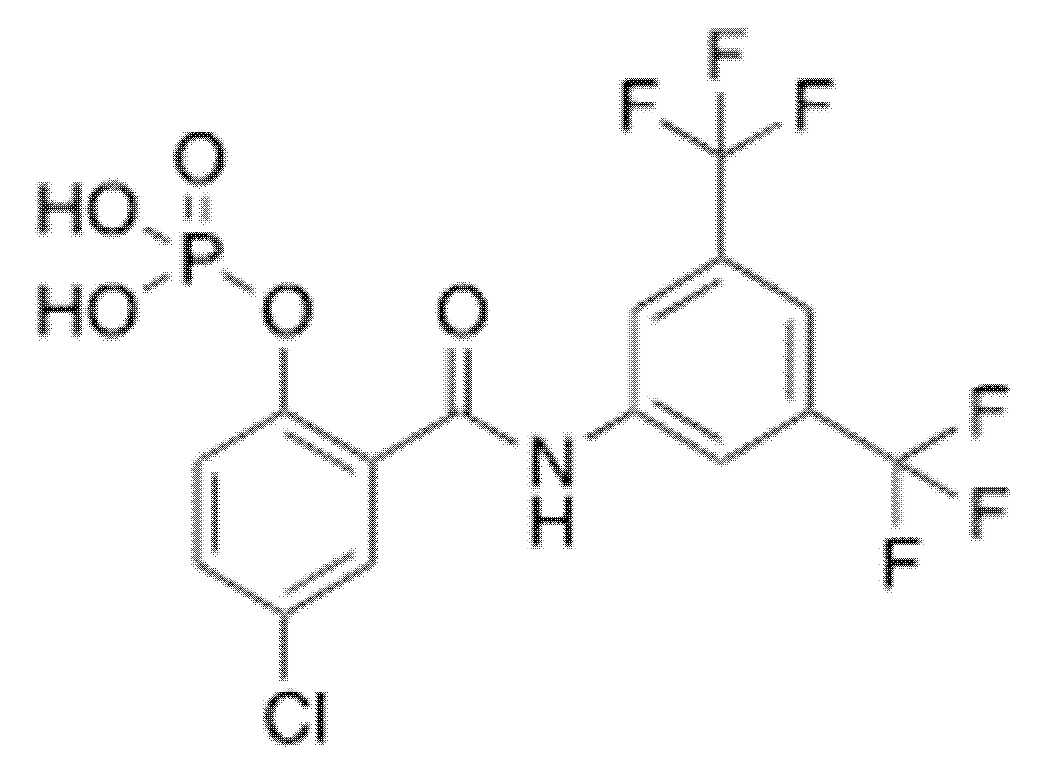
1.27. Способ 1.26, в котором соединение формулы 1a представляет собой соединение 5
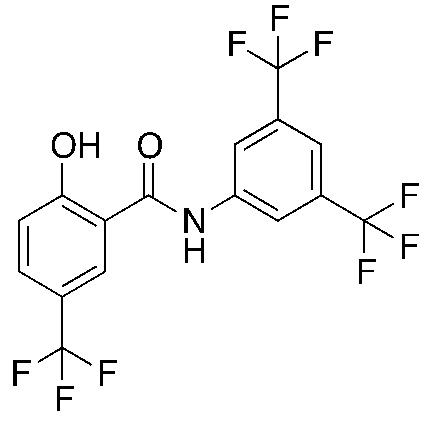
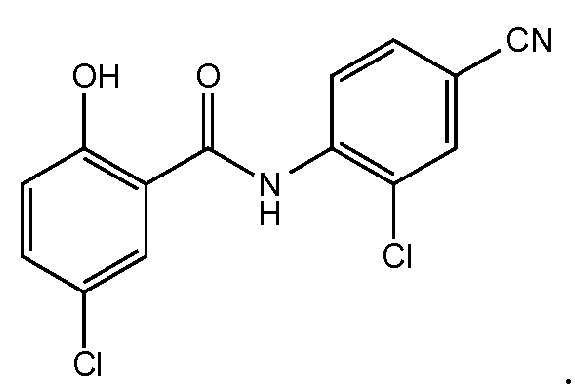
1.28. Способ 1, в котором соединение фенилбензамида представляет собой никлозамид или соединение, представленное ниже
1.29. Любой из способов 1 и далее, в котором аквапорин представляет собой AQP4.
1.30. Любой из способов 1 и далее, в котором состояние, которое лечат или контролируют, представляет собой состояние, выбранное из отека, например, отека головного или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекций, нарушений обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза, или, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
1.31. Способ 1.30, также включающий лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
1.32. Любой из способов 1 и далее, в котором пациент имеет повышенный риск отека головного мозга, например, в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
1.33. Способ 1.30, в котором пациент уже имеет инсульт, травму головы или травму спины.
1.34. Способ 1.33, в котором пациент уже имеет инсульт, травму головы или травму спины в течение 12 часов, например, в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
1.35. Способ 1.30, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
1.36. Любой из способов 1 и далее, в котором пациент уже имеет отек головного мозга.
1.37. Любой из способов 1 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
1.38. Любой из способов 1 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
1.39. Любой из способов 1 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
1.40. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
1.41. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
1.42. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
1.43. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
1.44. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни или водной интоксикации.
1.45. Любой из способов 1-1.32, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии, диабетического кетоацидоза.
1.46. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
1.47. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
1.48. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельда-Якоба.
1.49. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалит при системной крaсной волчанке.
1.50. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек в результате гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца.
1.51. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации и/или радиации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
1.52. Любой из способов 1-1.31, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
1.53. Способ 1.51 или 1.52, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме, или глубокой стимуляции мозга.
1.54. Способ 1.51 или 1.52, в котором пациент уже имеет отек.
1.55. Любой из способов 1 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
1.56. Любой из способов 1-1.45 или 1.50, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
1.57. Любой из способов 1-1.30, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
1.58. Способ 1.57, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
1.59. Любой из способов 1-1.30, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
1.60. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой эпилепсию.
1.61. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные с нарушениями внутриглазного давления и/или гидратации ткани.
1.62. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
1.63. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
1.64. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
1.65. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
1.66. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
1.67. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
1.68. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
1.69. Любой из способов 1-1.28, в котором аквапорин представляет собой AQP2.
1.70. Любой из способов 1-1.28 или 1.69, в котором состояние, которое лечат, представляет собой гипонатриемию или задержку избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH).
1.71. Любой из способов 1-1.28 или 1.69-1.70, также включающий одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
1.72. Любой из способов 1 и далее, в котором никлозамид или соединение формулы I или формулы 1а ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 и/или AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
1.73. Любой из способов 1-1.29, в котором состояние, которое лечат или контролируют, представляет собой оптиконевромиелит.
1.74. Любой из способов 1 и далее, в котором никлозамид или соединение формулы I или формулы 1а вводят перорально.
1.75. Любой из способов 1 и далее, в котором никлозамид или соединение формулы I или формулы 1а вводят парентерально.
1.76. Способ 1.75, в котором никлозамид или соединение формулы I или формулы 1а вводят внутривенно.
1.77. Любой из способов 1 и далее, в котором пациент является человеком.
1.78. Любой из способов 1 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28, наступает достаточно быстро.
Изобретение также предлагает фенилбензамид, например, никлозамид или соединение формулы I или формулы 1а, как описано выше, для применения в лечении или контроле заболевания или состояния, опосредуемого аквапорином, например, в любом из способов 1, 1.1 и далее,
Изобретение также предлагает фенилбензамид, например никлозамид или соединение формулы I или формулы 1а, как описано выше, в получении лекарственного средства для лечения или контроля заболевания или состояния, опосредованного аквапорином, например, для применения в любом из способов 1, 1.1 и далее,
Изобретение также предлагает фармацевтическую композицию, содержащую фенилбензамид, например, никлозамид или соединение формулы I или формулы 1а, как описано выше, в комбинации с фармацевтически приемлемым разбавителем или носителем, для применения в лечении или контроле заболевания или состояния, опосредуемого аквапорином, например, в любом из способов 1, 1.1 и далее,
Фенилбензамиды, например, формулы I или формулы 1a, как описано выше, могут существовать в свободной форме или в форме соли, например, в виде солей присоединения кислоты. В настоящем описании, если в не указано иное, формулировки например, "соединение формулы I или формулы 1a" или "соединения формулы I или формулы 1a" следует понимать, как включающие соединения в любой форме, например, в форме свободного основания или в форме соли присоединения кислоты. Фармацевтически приемлемые соли известны в данной области, и они включают соли, которые физиологически приемлемы в дозируемом количестве и форме, в которой их вводят, например гидрохлориды.
Примеры ацильной группы включают, например, формильную группу, глиоксилоильную группу, тиоформильную группу, карбамоильную группу, тиокарбамоильную группу, сульфамоильную группу, сульфмамоильную группу, карбоксильную группу, сульфогруппу, фосфоногруппу, и группы, представленные следующими формулами
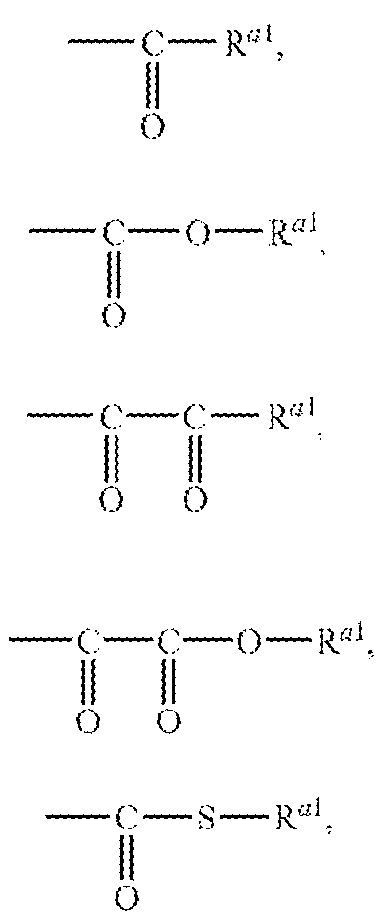
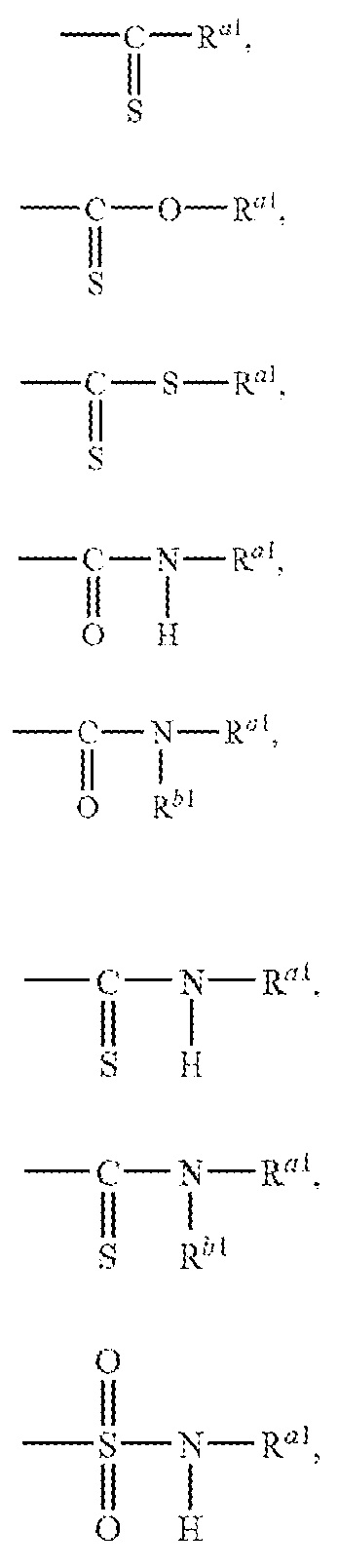

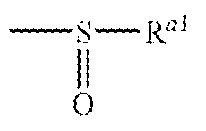
где Ra1 и Rb1 могут быть одинаковыми или различными и обозначают углеводную группу или гетероциклическую группу, или R Ra1 и Rb1 объединяются друг с другом, вместе с атомом азота, с которым они связаны, с образованием циклической аминогруппы. Ацил включает физиологически гидролизуемую и приемлемую ацильную группу. Примеры ацильной группы из числа "ацильной группы, которая может быть замещенной" в данном контексте, например, в отношении "A" включают группы, сходные с ацильной группой в приведенном выше определении. "A" обозначает группу, выбранную из следующей группы заместителей ω:
[группа заместителей ω] углевод-карбонильная группа, которая может быть замещенной, гетероциклическое кольцо-карбонильная группа, которая может быть замещенной, углевод-оксикарбонильная группа, которая может быть замещенной, углевод-сульфонильная группа, которая может быть замещенной, сульфамоильная группа, которая может быть замещенной, сульфогруппа, которая может быть замещенной, фосфоногруппа, которая может быть замещенной, и карбамоильная группа, которая может быть замещенной. Термин "физиологически гидролизуемый и приемлемый ацил" в данном контексте, например, в отношении "A" или "R6" в соединениях формулы I или формулы 1a, обозначает остаток аминокислоты, например, карбоновой кислоты, карбаминовой кислоты или фосфорной кислоты (например, необязательно замещенный карбонил, такой как ацетил или остаток аминокислоты, необязательно замещенный карбамоил, например, (морфолин-4-ил)карбонил, или необязательно замещенный фосфоно например, дибензилфосфоно), связанный с кислородом, например, как изображено в формуле 1 или формуле 1a выше, например, с образованием сложного эфира или фосфоэфира с соединением формулы I или формулы 1a, который способен гидролизоваться за счет указанного кислорода в физиологических условиях с образованием кислоты, которая является физиологически переносимой в дозах, в которых ее вводят вместе с соответствующим гидроксисоединением формулы I или формулы 1a, где A или R6 обозначает H. Как будет понятно, термин охватывает общепринятые фармацевтические формы пролекарств, хотя соединения необязательно должны гидролизоваться, чтобы быть активными. Ацильные соединения можно получить обычным способом, например, путем ацилирования соединения формулы 1 или формулы 1a, где A или R6 обозначает H, с желаемой кислотой или галогенангидридом. Примеры ацилированных соединений и способов их получения предоставлены, например, в US 2010/0274051 A1, US 7700655, и в US 7626042, каждый из которых включен в описание посредством ссылки.
Термин "пациент" включает пациента человека или не человека (т.е. животное). В конкретном варианте осуществления изобретение включает человека и не человека. В другом варианте осуществления изобретение включает не человека. В другом варианте осуществления термин включает человека.
Термин "достаточно быстро" в отношении наступления действия означает, что время после введения соединения и до наступления наблюдаемого ответа составляет 30 минут или меньше, например, 20 минут или меньше, например, или 15 минут или меньше, например, 10 минут или меньше, например, 5 минут или меньше, например, 1 минута или меньше.
Фенилбензамиды, например, по формуле 1 или по формуле 1a, как описано выше, предназначенные для применения в способах изобретения, можно использовать в виде отдельного лекарственного средства, но также можно использовать в комбинации или при совместном введении с другими активными веществами, например, в сочетании с общепринятыми методами лечения в случае отека головного мозга, инсульта, травмы головного мозга, глиомы, менингита, острой горной болезни, инфекции, нарушения обмена веществ, гипоксии, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, диабетического кетоацидоза, абсцесса, эклампсии, болезни Крейтцфельдта-Якоба, энцефалита при системной крaсной волчанке, отеке глазного нерва, гипонатриемии, задержке жидкости, эпилепсии, ретинальной ишемии или других заболеваниях глаз, ассоциированных с нарушениями внутриглазного давления и/или гидратации ткани, ишемии миокарда, повреждения ишемии миокарда/реперфузии, инфаркта миокарда, гипоксии миокарда, застойной сердечной недостаточности, сепсиса или оптиконевромиелита или мигреней.
В другом варианте осуществления изобретение предлагает способ (способ 2) лечения или контроля отека, например, отека головного или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, гипоксии, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза, абсцесса, эклампсии, болезни Крейтцфельдта-Якоба, или энцефалита при системной крaсной волчанке, а также отека в результате воздействия микрогравитации и/или радиации, а также отека в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга или, например, отека сетчатки или, например, отека спинного мозга, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга, включающий введение эффективного количества ингибитора AQP4, например, соединения, связывающегося с AQP4, пациенту, который в этом нуждается, например, где ингибитор AQP4 выбран из фенилбензамидов, например, никлозамида или соединения формулы I или формулы 1а, как описано выше, например, любое из соединений, указанных в способах 1-1.28 выше, например
2.
2.1. Способ 2, также включающий лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
2.2. Способ 2 или 2.1, в котором пациент имеет повышенный риск отека головного мозга, например, в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступа эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии или диабетического кетоацидоза.
2.3. Способ 2, 2.1 или 2.2, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга.
2.4. Любой из способов 2 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга в течение 12 часов, например, в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
2.5. Любой из способов 2 и далее, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
2.6. Любой из способов 2 и далее, в котором пациент уже имеет отек головного мозга.
2.7. Любой из способов 2 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
2.8. Любой из способов 2 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
2.9. Любой из способов 2 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
2.10. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
2.11. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
2.12. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
2.13. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
2.14. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни или водной интоксикации.
2.15. Любой из способов 2-2.2, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
2.16. Способ 2 или 2.1, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
2.17. Способ 2 или 2.1, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
2.18. Способ 2 или 2.1, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельда-Якоба.
2.19. Способ 2 или 2.1, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалита при системной крaсной волчанке.
2.20. Способ 2 или 2.1, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
2.21. Способ 2 или 2.1, отличающийся состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме, или глубокой стимуляции мозга.
2.22. Способ 2.20 или 2.21, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме, или глубокой стимуляции мозга.
2.23. Способ 2.20 или 2.21, в котором пациент уже имеет отек.
2.24. Любой из способов 2 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
2.25. Любой из способов 2-2.15 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
2.26. Способ 2, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
2.27. Способ 2.26, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
2.28. Способ 2, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
2.29. Любой из способов 2 и далее, в котором ингибитор AQP4 ингибирует активность AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
2.30. Любой из способов 2 и далее, в котором продолжительность лечения ингибитором AQP4 составляет меньше 21 дня, например, меньше 2 недель, например, одну неделю или меньше.
2.31. Любой из способов 2 и далее, в котором ингибитор AQP4 вводят перорально.
2.32. Любой из способов 2 и далее, в котором ингибитор AQP4 вводят парентерально.
2.32. Любой из способов 2, в котором ингибитор AQP4 вводят внутривенно.
2.34. Любой из способов 2 и далее, в котором пациент является человеком.
2.35. Любой из способов 2 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28 наступает достаточно быстро.
2.36. Любой из способов 2 и далее, в котором является результатом гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца или другим нарушением кровообращения мозга.
В другом варианте осуществления изобретение предлагает способ (способ 3) лечения или контроля состояния. Выбранного из гипонатриемии и задержки избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH), включающий введение эффективного количества AQP2, например, соединения, связывающегося с AQP2, например, пациенту, который в этом нуждается, например, способ, в котором ингибитор AQP2 выбирают из фенилбензамидов, например, никлозамида или соединения формулы I или формулы 1а, как описано выше, например, любое из соединений, указанных в способах 1-1.28 выше, например
3.
3.1. Способ 3, также включающий одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
3.2. Любой из способов 3 и далее, в котором ингибитор AQP2 ингибирует активность AQP2 по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
3.3. Любой из способов 3 и далее, в котором ингибитор AQP2 вводят перорально.
3.4. Любой из способов 3 и далее, в котором ингибитор AQP2 вводят парентерально.
3.5. Способ 3.4, в котором ингибитор AQP2 вводят внутривенно.
3.6. Любой из способов 3 и далее, в котором пациент является человеком.
3.7. Любой из способов 3 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28 наступает достаточно быстро.
В другом варианте осуществления изобретение предлагает способ (способ 4) лечения или контроля состояния, выбранного из эпилепсии, ретинальной ишемии или других заболеваний глаз, ассоциированных с нарушениями внутриглазного давления и/или гидратации ткани, ишемии миокарда, повреждения ишемии миокарда/реперфузии, инфаркта миокарда, гипоксии миокарда, застойной сердечной недостаточности, сепсиса, оптиконевромиелита, или мигреней, включающий введение эффективного количества ингибитора AQP4, например, соединения, связывающегося с AQP4, пациенту, который в этом нуждается, например, где ингибитор AQP4 выбирают из фенилбензамидов, например, никлозамида или соединения формулы I или формулы 1а, как описано выше, например, любое из соединений, указанных в способах 1-1.28 выше, например
4.
4.1. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные нарушениями внутриглазного давления и/или гидратации ткани.
4.2. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
4.3. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
4.4. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
4.5. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
4.6. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
4.7. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
4.8. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой оптиконевромиелит.
4.9. Способ 4, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
4.10. Любой из способов 4 и далее, в котором ингибитор ингибирует активность AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например ингибирует активность APQ4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
4.11. Любой из способов 4 и далее, в котором ингибитор AQP4 вводят перорально.
4.12. Любой из способов 4 и далее, в котором ингибитор AQP4 вводят парентерально.
4.13. Способ 4.12, в котором ингибитор AQP4 вводят внутривенно.
4.14. Любой из способов 4 и далее, в котором пациент является человеком.
4.15. Любой из способов 4 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28 наступает достаточно быстро.
В другом варианте осуществления изобретение предлагает способ (способ 5) лечения или контроля заболевания или состояния, опосредованного аквапорином, включающий введение пациенту, который в этом нуждается фенилбензамида, например, никлозамида или соединение формулы I или формулы 1а, как описано выше, например, любого из соединений, указанных в способах 1-1.28 выше, в количестве, эффективном для ингибирования аквапорина, например
5.
5.1. Способ 5, в котором аквапорин представляет собой AQP4.
5.2. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой состояние, выбранное из отека, например, отека головного или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекций, нарушений обмена веществ водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза или, например, отека спинного мозга, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
5.3. Способ 5.2 также включающий лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
5.4. Любой из способов 5 и далее, в котором пациент имеет повышенный риск отека головного мозга, например, в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
5.5. Любой из способов 5 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга.
5.6. Любой из способов 5 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга в течение 12 часов, например, в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
5.7. Любой из способов 5 и далее, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
5.8. Любой из способов 5 и далее, в котором пациент уже имеет отек головного мозга.
5.9. Любой из способов 5 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
5.10. Любой из способов 5 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
5.11. Любой из способов 5 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
5.12. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
5.13. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
5.14. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
5.15. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
5.16. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни, или водной интоксикации.
5.17. Любой из способов 5-5.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
5.18. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
5.19. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
5.20. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельда-Якоба.
5.21. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалит при системной крaсной волчанке.
5.22. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек в результате гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца.
5.23. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации и/или радиации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
5.24. Любой из способов 5-5.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
5.25. Способ 5.23 или 5.24, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
5.26. Способ 5.23 или 5.24, в котором пациент уже имеет отек.
5.27. Любой из способов 5 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
5.28. Любой из способов 5-5.17 или 5.22, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
5.29. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
5.30. Способ 5.29, в котором, состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
5.31. Любой из способов 5-5.2, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
5.32. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой эпилепсию.
5.33. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные с нарушениями внутриглазного давления и/или гидратации ткани.
5.34. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
5.35. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
5.36. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
5.37. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
5.38. Способ 5 или 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
5.39. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
5.40. Способ 5 или 5.1, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
5.41. Способ 5, в котором аквапорин представляет собой AQP2.
5.42. Способ 5 или 5.41, в котором состояние, которое лечат, аквапорин представляет гипонатриемию или задержку избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH).
5.43. Способ 5.42, также включающий одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
5.44. Любой из способов 5 и далее, в котором соединение формулы I или формулы 1а ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует APQ2 и/или AQP4 activity по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
5.45. Любой из способов 5 и далее, в котором продолжительность лечения фенилбензамидом составляет менее 21 дня, например, меньше 2 недель, например, одну неделю или меньше.
5.46. Любой из способов 5 и далее, в котором никлозамид или соединение формулы I или формулы 1а вводят перорально.
5.47. Любой из способов 5 и далее, в котором никлозамид или соединение формулы I или формулы 1а вводят парентерально.
5.48. Способ 5.47, в котором никлозамид или соединение формулы I или формулы 1а вводят внутривенно.
5.49. Любой из способов 5 и далее, в котором пациент является человеком.
5.50. Любой из способов 5 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28, наступает достаточно быстро.
В другом варианте осуществления изобретение предлагает способ (способ 6) ингибирования аквапорина, включающий контактирование аквапорина с эффективным количеством фенилбензамида, например, никлозамида или соединения формулы I или формулы 1а, как описано выше, например, любым из соединений, указанных в способе 1-1.28 выше, например
6.
6.1. Способ 6, в котором аквапорин ингибируют in vivo.
6.2. Способ 6, в котором аквапорин ингибируют in vitro.
6.3. Любой из способов 6 и далее, в котором аквапорин представляет собой AQP4.
6.4. Любой из способов 6 и далее, в котором аквапорин представляет собой AQP2.
6.5. Любой из способов 6 и далее, в котором соединение формулы I или формулы 1a ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 и/или AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
6.6. Способ 6.1, в котором никлозамид или соединение формулы I или формулы 1а вводят перорально.
6.7. Способ 6.1, в котором никлозамид или соединение формулы I, или формулы 1а вводят парентерально.
6.8. Способ 6.7, в котором никлозамид или соединение формулы I, или формулы 1а вводят внутривенно.
В другом варианте осуществления изобретение предлагает способ (способ 7) ингибирования аквапорина у пациента, имеющего заболевание или состояние, опосредованное аквапорином, включающий введение эффективного количества фенилбензамида, например, никлозамида или соединения формулы I или формулы 1а, как описано выше, например, любого из соединений, описанных в способах 1-1.28 выше, для ингибирования аквапорина.
7.
7.1. Способ 7, в котором аквапорин представляет собой AQP4.
7.2. Способ по п.7 или 7.1, в котором состояние, которое лечат или контролируют, выбрано отека, например, отека головного мозга или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза или, например, отека спинного мозга, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
7.3. Способ 7.2, также включающий лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
7.4. Любой из способов 7 и далее, в котором пациент имеет повышенный риск отека головного мозга, например, вследствие травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии или диабетического кетоацидоза.
7.5. Любой из способов 7 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга.
7.6. Любой из способов 7 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга в течение 12 часов, например в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
7.7. Любой из способов 7 и далее, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
7.8. Любой из способов 7 и далее, в котором пациент уже имеет отек головного мозга.
7.9. Любой из способов 7 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
7.10. Любой из способов 7 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
7.11. Любой из способов 7 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
7.12. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
7.13. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
7.14. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
7.15. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
7.16. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни или водной интоксикации.
7.17. Любой из способов 7-7.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии или диабетического кетоацидоза.
7.18. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
7.19. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
7.20. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельдта-Якоба.
7.21. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалита при системной крaсной волчанке.
7.22. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек в результате гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца.
7.23. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации и/или радиации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
7.24. Любой из способов 7-7.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
7.25. Способ 7.23 или 7.24, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
7.26. Способ 7.23 или 7.24, в котором пациент уже имеет отек.
7.27. Любой из способов 7 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
7.28. Любой из способов 7-7.17 или 7.22, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
7.29. Любой из способов 7-7.2, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
7.30. Способ 7.29, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
7.31. Любой из способов 7-7.2, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
7.32. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой эпилепсию.
7.33. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные с нарушениями внутриглазного давления и/или гидратации ткани.
7.34. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
7.35. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
7.36. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
7.37. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
7.38. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
7.39. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
7.40. Способ 7 или 7.1, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
7.41. Способ 7, в котором аквапорин представляет собой AQP2.
7.42. Способ 7 или 7.41, в котором состояние, которое лечат, аквапорин представляет гипонатриемию или задержку избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH).
7.43. Способ 7.42, также включающий одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
7.44. Любой из способов 7 и далее, в котором соединение формулы I или формулы 1a ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 и/или AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
7.45. Любой из способов 7 и далее, в котором продолжительность лечения фенилбензамидом составляет меньше 21 дня, например, меньше 2 недель, например, одну неделю или меньше.
7.46. Любой из способов 7 и далее, в котором никлозамид соединение формулы I или формулы 1a вводят перорально.
7.47. Любой из способов 7 и далее, в котором никлозамид или соединение формулы I или формулы 1a вводят парентерально.
7.48. Способ 7.47, в котором никлозамид или соединение формулы I или формулы 1a вводят внутривенно.
7.49. Любой из способов 7 и далее, в котором пациент является человеком.
7.50. Любой из способов 7 и далее, в котором начало действия любого из соединений, указанных в способах 1-1.28, наступает достаточно быстро.
В другом варианте осуществления изобретение предлагает фармацевтическую, композицию, содержащую фенилбензамид, например, никлозамид или соединение формулы I или формулы 1а как описано выше, например, любое из соединений, указанных в способах 1-1.28 выше, для применения (применение 8) с целью ингибирования аквапорина у пациента, имеющего заболевание или состояние, опосредованное аквапорином. Например, для применения в любом из упомянутых выше способов.
8.
8.1. Применение 8, в котором аквапорин представляет собой AQP4.
8.2. Применение 8 или 8.1, отличающееся тем, что состояние, которое лечат или контролируют, выбрано из отека, например, отека головного мозга или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза или, например, отека спинного мозга, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
8.3. Применение 8.2, также включающее лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
8.4. Любое из применений 8 и далее, в котором пациент имеет повышенный риск отека головного мозга, например, в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступа эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
8.5. Любое из применений 8 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга.
8.6. Любое из применений 8 и далее, в котором пациент уже имеет инсульт, травму головы или повреждение спинного мозга в течение 12 часов, например в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
8.7. Любое из применений 8 и далее, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
8.8. Любое из применений 8 и далее, в котором пациент уже имеет отек головного мозга.
8.9. Любое из применений 8 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
8.10. Любое из применений 8 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
8.11. Любое из применений 8 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
8.12. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
8.13. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
8.14. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
8.15. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
8.16. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни или водной интоксикации.
8.17. Любое из применений 8-8.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии или диабетического кетоацидоза.
8.18. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
8.19. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
8.20. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельда-Якоба.
8.21. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалита при системной красной волчанке.
8.22. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек в результате гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца.
8.23. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации и/или радиации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
8.24. Любое из применений 8-8.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
8.25. Применение 8.23 или 8.24, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
8.26. Применение 8.23 или 8.24, в котором пациент уже имеет отек.
8.27. Любое из применений 8 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
8.28. Любое из применений 8-8.17 или 8.22, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
8.29. Любое из применений 8-8.2, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
8.30. Применение 8.29, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
8.31. Любое из применений 8-8.2, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
8.32. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой эпилепсию.
8.33. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные с нарушениями внутриглазного давления и/или гидратации ткани.
8.34. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
8.35. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
8.36. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
8.37. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
8.38. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
8.39. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
8.40. Применение 8 или 8.1, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
8.41. Применение 8, в котором аквапорин представляет собой AQP2.
8.42. Применение 8 или 8.41, в котором состояние, которое лечат, аквапорин представляет гипонатриемию или задержку избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH).
8.43. Применение 8.42, также включающее одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
8.44. Любое из применений 8 и далее, в котором соединение формулы I формулы 1a ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 и/или AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
8.45. Любое из применений 8 и далее, в котором продолжительность лечения фенилбензамидом составляет менее 21 дня, например, менее 2 недель, например, одну неделю или меньше.
8.46. Любое из применений 8 и далее, в котором фармацевтическую композицию вводят перорально.
8.47. Любое из применений 8 и далее, в котором фармацевтическую композицию вводят парентерально.
8.48. Применение 8.47, в котором фармацевтическую композицию вводят внутривенно.
8.49. Любое из применений 8 и далее, в котором пациент является человеком.
8.50. Любое из применений 8 и далее, в котором начало действия фармацевтической композиции наступает достаточно быстро.
В другом варианте осуществления изобретение предлагает применение (применение 9) фенилбензамида, например, никлозамид или соединения формулы I или формулы 1а, как описано выше, например, любого из соединений, указанных в способах 1-1.28 выше, в получении лекарственного средства для лечения или контроля заболевания или состояния, опосредованного аквапорином, где лекарственное средство включает фенилбензамид в количестве, эффективном для ингибирования аквапорина. Например, для применения в любом из указанных ниже способов.
9.
9.1. Применение 9, отличающееся тем, что аквапорин представляет собой AQP4.
9.2. Любое из применения 9 или 9.1, в котором состояние, которое лечат или контролируют, выбрано из отека, например, отека головного или спинного мозга, например, отека головного мозга, например, отека головного мозга в результате травмы головы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступа эпилепсии, инфекции, нарушения обмена веществ, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза или, например, отека спинного мозга, например, отека спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
9.3. Применение 9.2, также включающее лечение, выбранное из одного или более из следующего: оптимальное положение головы и шеи для облегчения венозного оттока, например, поднятие головы на 30°; предотвращение дегидратации; системная гипотензия; поддержание нормотермии или гипотермии; интенсивные меры; осмотерапия, например, применение маннитола или гипертонического раствора NaCl для внутривенного введения; гипервентиляция; терапевтические прессорные препараты для усиления перфузии головного мозга; введение барбитуратов для уменьшения метаболизма мозга (CMО2); гемикраниэктомия; введение аспирина; введение амантадина; внутривенный тромболизис (например, с использованием rtPA); механическое устранение сгустка; ангиопластика; и/или стенты.
9.4. Любое из применения 9 и далее, в котором пациент имеет повышенный риск отека головного мозга, например, вследствие травмы, ишемического инсульта, глиомы, менингита, острой горной болезни, приступов эпилепсии, инфекции, нарушения обмена веществ, гипоксии, водной интоксикации, печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
9.5. Любое из применения 9 и далее, в котором пациент уже имеет инсульт, травму головы, или повреждение спинного мозга.
9.6. Любое из применения 9 и далее, в котором пациент уже имеет инсульт, травму головы, или повреждение спинного мозга в течение 12 часов, например в течение 6 часов, предпочтительно в течение 3 часов после начала лечения.
9.7. Любое из применения 9 и далее, в котором пациент имеет повышенный риск развития инсульта, травмы головы или повреждения спинного мозга, например, в бою или в спортивном соревновании.
9.8. Любое из применения 9 и далее, в котором пациент уже имеет отек головного мозга.
9.9. Любое из применения 9 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта или травматического повреждения головного мозга.
9.10. Любое из применения 9 и далее, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инсульта средней мозговой артерии.
9.11. Любое из применения 9 и далее, отличающееся тем, что состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате закрытой черепно-мозговой травмы.
9.12. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате приступа эпилепсии.
9.13. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инфекции.
9.14. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате нарушения обмена веществ.
9.15. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате глиомы.
9.16. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате менингита, острой горной болезни или водной интоксикации.
9.17. Любое из применений 9-9.4, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате печеночной недостаточности, печеночной энцефалопатии, или диабетического кетоацидоза.
9.18. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате абсцесса.
9.19. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате эклампсии.
9.20. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате болезни Крейтцфельдта-Якоба.
9.21. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате энцефалит при системной крaсной волчанке.
9.22. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек в результате гипоксии, например, генерализованной системной гипоксии, например, гипоксии, вызванной нарушением перфузии крови, например, где отек представляет собой отек головного мозга в результате гипоксии, вызванной остановкой сердца, инсультом, или другим нарушением перфузии крови в мозге, или где отек представляет собой сердечный отек в результате сердечной ишемии или другого нарушения кровообращения сердца.
9.23. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга и/или зрительного нерва в результате воздействия микрогравитации и/или радиации, например, в результате воздействия космического полета или работы с радиоактивными материалами или работы в зонах радиоактивного заражения.
9.24. Любое из применений 9-9.3, в котором состояние, которое лечат или контролируют, представляет собой отек головного мозга в результате инвазивных процедур центральной нервной системы, например, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
9.25. Любое из применений 9.24 или 9.25, в котором пациент имеет повышенный риск отека, например, в результате воздействия микрогравитации и/или радиации, нейрохирургических операций, удаления эндоваскулярного сгустка, спинномозговой пункции, реконструкции сосуда при аневризме или глубокой стимуляции мозга.
9.26. Любое из применений 9.24 или 9.25, в котором пациент уже имеет отек.
9.27. Любое из применений 9 и далее, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
9.28. Любое из применений 9-9.17 или 9.22, в котором отек представляет собой цитотоксический отек головного мозга или исходно является цитотоксическим отеком головного мозга.
9.29. Любое из применений 9-9.2, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга, например, отек спинного мозга в результате травмы спинного мозга, например, сдавления спинного мозга.
9.30. Применение 9.29, в котором состояние, которое лечат или контролируют, представляет собой отек спинного мозга в результате сдавления спинного мозга.
9.31. Любое из применений 9-9.2, в котором состояние, которое лечат или контролируют, представляет собой отек сетчатки.
9.32. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой эпилепсию.
9.33. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой ретинальную ишемию или другие заболевания глаз, ассоциированные с нарушениями внутриглазного давления и/или гидратации.
9.34. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой ишемию миокарда.
9.35. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой повреждение ишемии миокарда/реперфузии.
9.36. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой инфаркт миокарда.
9.37. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой гипоксию миокарда.
9.38. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой застойную сердечную недостаточность.
9.39. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой сепсис.
9.40. Применение 9 или 9.1, в котором состояние, которое лечат или контролируют, представляет собой мигрень.
9.41. Применение 9, в котором аквапорин представляет собой AQP2.
9.42. Применение 9 или 9.41, в котором состояние, которое лечат, представляет собой гипонатриемию или задержку избыточной жидкости, например, в результате сердечной недостаточности (HF), например, застойной сердечной недостаточности, цирроза печени, нефротического нарушения или синдрома неадекватной секреции антидиуретического гормона (SIADH).
9.43. Применение 9.42, также включающее одно или более из ограничений натрия в рационе питания, жидкости и/или алкоголя; и/или введение одного или более диуретиков, антагонистов рецепторов вазопрессина, ингибиторов ангиотензин-превращающего фермента (ACE), ингибиторов альдостерона, блокаторов рецепторов ангиотензина (ARBs), антагонистов бета-адренорецепторов (бета-блокаторов), и/или дигоксина.
9.44. Любое из применений 9 и далее, в котором соединение формулы I формулы 1a ингибирует активность аквапорина, например, активность AQP2 и/или AQP4, по меньшей мере на 50% в концентрациях 10 микромоль или меньше, например, ингибирует активность APQ2 и/или AQP4 по меньшей мере на 50% в концентрациях 10 микромоль или меньше в тесте изменения клеточного объема, опосредованного аквапорином, например, является активным в любом из тестов способа 10 и далее, ниже.
9.45. Любое из применений 9 и далее, в котором продолжительность лечения фенилбензамидом составляет меньше 21 дня, например, меньше 2 недель, например, одну неделю или меньше.
9.46. Любое из применений 9 и далее, в котором лекарственный препарат разработан для перорального введения.
9.47. Любое из применений 9 и далее, в котором лекарственный препарат разработан для парентерального введения.
9.48. Применение 9.47, в котором лекарственный препарат разработан для внутривенного введения.
Доза или способ введения дозы настоящего изобретения не ограничен особенно. Дозы, используемые при осуществлении на практике настоящего изобретения, будут варьировать в зависимости, например, от конкретного заболевания или состояния, которое лечат, от конкретного используемого соединения, способа введения и желаемой терапии. Соединения могут быть введены любым подходящим путем, в том числе перорально, парентерально, трансдермально, или с помощью ингаляции. При инсульте или других тяжелых истощающих заболеваниях или состояниях, например, когда пациент может находиться в бессознательном состоянии или не может глотать, могут быть предпочтительными IV инфузия или IV болюсное введение. Указано, что в целом получены удовлетворительные результаты, например, при лечении заболеваний, как изложено выше, при пероральном введении в дозах порядка приблизительно от 0,01 до 15,0 мг/кг. Для более крупных млекопитающих, например, человека, указанная суточная доза при пероральном введении, соответственно, находится в диапазоне приблизительно от 0,75 до 1000 мг в день, дозу обычно вводят один раз в целях удобства, или в виде отдельных доз 2-3 раза в день, или в форме с замедленным высвобождением. Таким образом, стандартные лекарственные формы для перорального введения могут содержать, например, приблизительно от 0,2 до 75 или 150 мг, например, приблизительно от 0,2 или 2,0 до 50, 75, 100, 125, 150 или 200 мг соединения изобретения, в сочетании с фармацевтически приемлемым разбавителем или носителем. Если лекарственный препарат вводят с помощью инъекции (подкожно, внутримышечно или внутривенно), доза может составлять от 0,25 до 500 мг/день при использовании болюсной инъекции или IV болюсного введения или инфузии.
Фармацевтические композиции, содержащие соединения формулы I или формулы 1а, могут быть получены с использованием обычных разбавителей или наполнителей и методик, известных в данной области медицины. Таким образом, пероральные лекарственные формы могут включать таблетки, капсулы, растворы, суспензии и т.п.
Способы изготовления и включения в составы соединений формулы I или формулы 1а изложены в US 2010/0274051 A1, US 7700655, и в US 7626042, каждый из которых включен в качестве ссылки.
В другом варианте осуществления изобретение предлагает способ, например, способ 10, для идентификации специфических ингибиторов аквапорина, включающий в себя, количественное определение ответа популяции аквапорин-экспрессирующих клеток в сравнении с контрольной клеточной популяции на гипертонический или гипотонический раствор при наличии или отсутствии тестируемого соединения. Например, изобретение обеспечивает, например,
10.
10.1. Способ 10, в котором аквапорин-экспрессирующая клеточная популяция экспрессирует AQP2 или AQP4.
10.2. Любой из способов 10 или 10.1, в котором клетки представляют собой клетки млекопитающих, например, трансгенные клетки CHO.
10.3. Любой из способов 10 и далее, в котором контрольные клетки экспрессируют трансгенный трансмембранный белок, отличающийся от аквапорина, например, CD81.
10.4. Любой из способов 10 и далее, в котором клетки помещают на некоторый период времени в гипотоническую среду с концентрацией, которая вызывает разрыв большинства аквапорин-экспрессирующих клеток при отсутствии тестируемого соединения, но не вызывает разрыва клеток контрольной популяции, например помещают в воду на 3-8 минут.
10.5. Способ 10.4, в котором разрушение клеток измеряют с помощью флуоресцентного сигнала, который продуцируют живые клетки, но не испускают разрушенные клетки, например, превращение ацетоксиметилкальцеина (кальцеин-АМ) во флуоресцентный краситель кальцеин.
10.6. Способ 10.4 или 10.5, в котором клетки помещают в гипотоническую среду, например, в деионизованную воду, на период времени 3-8 минут, и затем возвращают в нормотическую среду (например, ca. 300 мОсм) с последующим измерением доли живых клеток.
10.7. Любой из способов 10 и далее, в котором измерение жизнеспособности представляет собой определение способности клеток превращать ацетоксиметилкальцеин (кальцеин-АМ) во флуоресцентный краситель кальцеин.
10.8. Любой из упомянутых выше способов 10.4 и далее, в котором соединение формулы I как описано выше, например, формулы 1a, используют в качестве положительного контроля, который препятствует разрушению клеток аквапорин-экспрессирующей популяции в гипотонической среде.
10.9. Любой из упомянутых выше способов 10.4-10.8, в котором тестируемое соединение идентифицируют, как обладающее аквапорин-ингибирующей активностью, если популяцию аквапорин-экспрессирующих клеток определяют как жизнеспособную, например, по способности клеток превращать ацетоксиметилкальцеин (кальцеин-АМ) во флуоресцентный краситель кальцеин, после воздействия гипотонической среды в присутствии тестируемого соединения, который предоставляет аквапорин-экспрессирующую клеточную популяцию, нежизнеспособную при отсутствии тестируемого соединения.
10.10. Любой из способов 10 или 10.1-10.3, в котором клетки помещают на некоторый период времени в гипертоническую среду с концентрацией, достаточной чтобы вызвать сморщивание клеток популяции, экспрессирующей аквапорин, в отсутствие тестируемого соединения, например, 3-8 минут приблизительно при 530 мОсм.
10.11. Способ 10.9, в котором сморщивание клеток измеряют с помощью светорассеяния.
10.12. Способ 10.10 и далее, в котором гипертоническая среда представляет собой приблизительно 530 мОсм и нормотическая среда представляет собой приблизительно 300 мОсм.
10.13. Любой из способов 10.10 и далее, в котором соединение формулы I как описано выше, например, формулы 1a, используют в качестве положительного контроля, который предотвращает сморщивание клеток популяции, экспрессирующей аквапорин, в гипертонической среде.
10.14. Любой из упомянутых выше способов 10.10 и далее, в котором тестируемое соединение идентифицируют в виде активности, ингибирующей аквапорин, путем подавления сморщивания клеток популяции, экспрессирующей аквапорин, в гипертонической среде.
10.15. Любой из упомянутых выше способов, в котором тестируемое соединение идентифицируют в виде аквапорин-ингибирующей активности.
10.16. Любой из способов 10 и далее, в котором популяция аквапорин-экспрессирующих клеток экспрессирует AQP2.
10.17. Любой из способов 10 и далее, в котором популяция аквапорин-экспрессирующих клеток экспрессирует AQP4.
10.18. Любой из способов 10 и далее, в котором тестируемое соединение представляет собой фенилбензамид, например, формулы I как описано выше, например, формулы 1a.
В данном контексте, диапазаны используются в качестве сокращения для описания всех без исключения значений, которые входят в диапазон. Любое значение в пределах диапазона может быть выбрано в качестве конца диапазона. Кроме того, все ссылки, приведенные в данном описании, включены сюда путем ссылки во всей полноте. В случае расхождения определения в настоящем раскрытии и в цитируемой ссылке, настоящее раскрытие имеет преимущественную силу.
Если не указано иное, все процентные значения и количества, представленные здесь и в других местах в данном описании, следует понимать как относящиеся к процентам по весу. Указанные количества соответствуют весу активного вещества.
Пример 1
Структурно-функциональная взаимосвязь фенилбензамид-AQP
Структурно-функциональные взаимосвязи (SAR) определяют путем оценки аналогов выбранных соответствий, чтобы направить химические исследования для получения новых молекул, которые тестируют в отношении повышенной эффективности. Для данного итеративного процесса авторы изобретения использовали количественный кинетический анализ - анализ изменения клеточного объема, опосредованного аквапорином - в 96-луночном мультипланшетном ридере. Он позволяет определять изменения светорассеяния монослоя клеток CHO, экспрессирующих желаемый AQP, as они сжимаются под действием гипертонического раствора (300 мОсм → 530 мОсм). На фиг.1 представлены результаты анализа изменения клеточного объема, опосредованного аквапорином, с клетками, экспрессирующими AQP4 (фиг.1A) и клетками, экспрессирующими AQP2 (фиг.1B). Клетки, экспрессирующие аквапорины, сморщиваются быстрее, чем контрольные клетки, за счет усиленного потока воды, указанное сморщивание можно ингибировать с помощью соединения, которое ингибирует аквапорин.
На фиг.1 представлены клетки, экспрессирующие аквапорин, в присутствии DMSO (треугольники) или в присутствии 10 мкМ тестируемого соединения (здесь соединение 3) (квадраты), а также контрольные клетки, экспрессирующие CHO-CD81, в присутствии DMSO (ромбы). Каждая кривая представляет собой среднее из 16 лунок в 96-луночном планшете.
На фиг.1A, когда клетки AQP4b обработанные DMSO, подвергают гипертоническому шоку, происходит быстрое сморщивание клеток, что обеспечивает увеличение светорассеяния (повышение относительного значения абсорбции, Abs/Abs0) с последующим снижением, поскольку клетки отсоединяются от планшета. Клетки линии CHO-AQP4b демонстрируют увеличение в 4,5 раза скорости сморщивания по сравнению с контрольными клетками CHO-CD81 (в соответствии с двухэкспоненциальной моделью). Клетки CHO-AQP4b, обработанные 10 мкМ аналога соединения 3 (квадраты) демонстрируют более низкую скорость сморщивания (55% ингибирование), что видно по характерной “разогнутой” форме кривой светорассеяния. Аналогично на фиг.1B представлены результаты эксперимента, в котором сравнивали клетки CHO-AQP2, обработанные DMSO, или клетки, обработанные 10 мкМ соединения 3.
Аквапорин-2 характеризуется более низкой собственной проницаемостью для воды, чем AQP4, как наблюдали в эксперименте. Клетки линии CHO-AQP2, обработанные DMSO (фиг.1B, треугольники), демонстрируют 1,7-кратное увеличение скорости сморщивания по сравнению с контрольными клетками CHO-CD81 (ромбы), также обработанными DMSO (что соответствует двухэкспоненциальной модели) (фиг.1B). Клетки CHO-AQP2, обработанные 10 мкМ соединения 3 (квадраты), демонстрируют более низкую скорость сморщивания (81% ингибирование), при сравнении относительного изменения Abs (Abs/Abs0) (фиг.1B).
Результаты показывают, что в данном тесте соединение 3 способно существенно ингибировать активность AQP2 и AQP4, например, более чем на 50%, при использовании в концентрациях 10 мкМ.
Пример 2
Специфичность соединений фенилбензамида к аквапорину
Проверяют специфичность соединений в отношении наиболее тесно связанных 3 известных аквапоринов: AQP1, AQP2, AQP5 и обоих сплайс-вариантов AQP4 (A и B). Создают стабильную клеточную линию CHO для каждого из указанных выше аквапоринов и проверяют ингибирование водопроницаемости с применением анализа изменения клеточного объема, опосредованного аквапорином с 10 мкМ соединения 3. Соединение 3 ингибирует AQP2 и 4, и в то же время слабо ингибирует AQP1 и 5 (фиг.2).
Пример 3
Прямые взаимодействия лекарство-мишень между фенилбензамидами и AQP4
Для подтверждения механизма действия, с помощью которого фенилбензамиды непосредственно блокируют AQP4, авторы изобретения выполняют исследования связывания in vitro с использованием очищенного AQP4b и соединения 4, меченного 3H. При использовании методики Гуммеля-Драера, уравновешивают колонку для гель-фильтрации буфером, содержащим детергент, для поддержания растворимости AQP4b, и 1 мкМ [3H]-соединения 4. Разводят AQP4b до концентрации 250 мкМ в указанном буфере для уравновешивания колонки и инкубируют при RT в течение 30 мин. Затем наносят на колонку образец, собирают фракции и определяют наличие [3H]-соединения 4 с помощью жидкостной сцинтилляционной детекции. На фиг.3 представлен профиль элюции [3H]-соединения 4 из гель-фильтрационной колонки с указанными пиками элюции тетрамерными и мономерного AQP4b. Увеличение [3H]-соединения 4, по сравнению с исходным значением 1 мкМ свидетельствует о связывании с каждым из указанных белков. Хотя мономерный AQP4b нельзя легко обнаружить в высокоочищенном AQP4b настоящего изобретения с помощью обычных средств, данный анализ позволяет выявить наличие небольшого, стремящегося к нулю количества мономера. Относительные значения аффинности соединения 4 составляют ~100 мкМ и менее чем 1 мкМ для тетрамера и мономера, соответственно. Данный тест показывает относительно слабое связывание соединения 4 с солюбилизированным AQP4b; тем не менее, он ясно демонстрирует, что указанный фенилбензамид взаимодействует непосредственно с AQP4b.
Пример 4
Фармакологическое подтверждение концепции
Мышиная модель водной токсичности - кривые выживаемости: тестируют in vivo эффективности соединений с использованием мышиной модели водной токсичности, в которой мыши вводят воду в количестве 20% массы ее тела. Manley, G. T. et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke. Nat Med 6, 159-163 (2000); Gullans, S. R. & Verbalis, J. G. Control of brain volume during hyperosmolar and hypoosmolar conditions. Annual Review of Medicine 44, 289-301 (1993). Возникающая в результате этого эуволемическая гипонатриемия быстро приводит к CE, что позволяет использовать данную модель в качестве практической модели для проверки ингибитора аквапорина CNS, AQP4b.
Способность мышей переносить H2О токсичность определяют в трех экспериментах, с участием в каждом из них 10-12 мышей (самцы/самки в возрасте 16-19 недель). Готовят деионизованную воду для инъекции с 0,39 мг/кг фенилбензамида (плацебо) или с 0,76 мг/кг тестируемого соединения. На фиг.4 представлены объединенные результаты указанных экспериментов (n=33 плацебо, n=34 соединение 1). Процент выживаемости в когорте мышей, получавших соединение 1, выше в 3,2 раза и время достижения 50% выживаемости у животных, получавших соединение 1, увеличивается приблизительно на 52 мин.
Мышиная модель водной токсичности - содержания воды в мозге: соединения также тестируют в отношении способности уменьшать CE у мышей, подвергнутых водному шоку путем проверки содержания воды в мозге. Мышам вводят болюсную инъекцию воды, как описано выше, затем умерщвляют через 30 мин. Содержание воды в мозге определяют по отношению веса сырой ткани/сухой ткани, т.е. мозг взвешивают сразу после получения, затем обезвоживают в сушильной камере при 100°C в течение 24 часов и измеряют вес сухой ткани (процентное содержание воды в мозге = 100 × вес сухой ткани/вес сырой ткани). У мышей, которым вводят через 30 минут 0,76 мг/кг и 7,6 мг/кг соединение 1, наблюдают уменьшение CE на 11,2% и 15,9% соответственно (фиг.5).
Мышиная модель водной токсичности - определение объема мозга с помощью магнитно-резонансной томографии (МРТ): МРТ используют для оценки изменений объема мозга в ответ на водный шок, с применением модели водной токсичности. Как описано выше для исследования выживаемости и исследования содержания воды в мозге, мышам вводят IP болюсные инъекции воды или болюсные инъекции воды и тестируемого соединения в дозе 0,76 мг/кг, и осуществляют мониторинг изменений объема мозга, который определяют с помощью МРТ. Показатели объема мозга мышей оценивают с помощью изображений МРТ, полученных с помощью сканнера 9.4T Bruker Biospec MRT в Центре томографических исследований Кейза в Западном резервном университете Кейза. Установлено, что указанный метод томографической диагностики обладает контрастом и разрешением, чтобы с достаточной чувствительностью выявлять изменения общего объема мозга в мышиной модели водной токсичности при отеке головного мозга. Т2-взвешенные изображения сагиттальных срезов с высоким разрешением (разрешение = 0,1 мм × 0,1 мм × 0,7 мм) головы мыши получают перед проведением инъекции воды, через 5,67 мин после инъекции воды и затем через каждые 5,2 минуты до гибели животного в результате водной нагрузки. Каждое томографическое изображение содержит двадцать пять 0,7 мм смежных томографических срезов, из которых 14-15 срезов содержат часть мозга. Площадь поперечного сечения мозга в каждом томографическом срезе измеряют путем выбора вручную изучаемой области с применением ImageJ. Затем рассчитывают значения объема мозга для каждого изображения путем суммирования отдельных площадей поперечного сечения мозга и умножения на толщину среза (0,7 мм).
Лечение 0,76 мг/кг соединения 1 уменьшает скорость развития CE от 0,081 до 0,032 мин-1 (или в 2,5 раза), что соответствует одноэкспоненциальной модели (фиг.6). Также размер CE во время периода наблюдения уменьшается (фиг.6). Кроме того, обнаружили, что плазматические уровни в том же тесте изменяются в диапазоне 0,03-0,06 г, как установили с помощью метода LC-MS/MS (выполнено в Lerner Center, Cleveland Clinic, Cleveland, OH) и они являются достаточными, чтобы показать эффективность в данной модели CE.
Также проводят эксперимент по определению объема мозга с помощью магнитно-резонансной томографии с фенилбензамидом (0,39 мг/кг) и соединением 4 (0,83 мг/кг). Соединение 4 уменьшает скорость развития CE от 0,081 до 0,022 мин-1 (таблица 1). В случае фенилбензамида не наблюдают уменьшения скорости развития CE у мышей (таблица 1).
|
Для группы, которой не вводили лекарство, и группы, получавшей соединение 1, n=14 мышей в каждой группе. Для группы, получавшей фенилбензамид, и группы, получавшей соединение 4, n=12 мышей в каждой группе.
Пример 5
Высокопроизводительный скрининговый тест
При гипотоническом шоке, нетрансфицированные клетки и клетки, экспрессирующие не относящийся к исследованию трансмембранный белок (CD81, в количествах эквивалентных AQP4b) медленно набухают, но остаются интактными. Указанные наблюдения авторы изобретения использовали для создания высокопроизводительного скринингового теста (HTS).
После проведения гипотонического шока в формате 384 луночного планшета, авторы изобретения возвращают осмоляльность к нормальному значению (300 мОсм) путем добавления в каждую лунку 2x концентрированного забуференного фосфатом физиологического раствора, дополненного 2 мкМ нефлуоресцентного ацетоксиметил производного кальцеина (кальцеин-AM). Интактные клетки поглощают кальцеин-AM и превращают его во флуоресцентный краситель кальцеин, что позволяет провести количественную оценку сохранившихся интактных клеток. Разрушенные клетки не превращают предшественник в краситель. Поглощение воды AQP4-экспрессирующими клетками происходит относительно быстро, при этом большинство тестируемых клеток разрушается в течение 4 мин гипотонического шока, тогда как большинство клеток, экспрессирующих CD81, остаются жизнеспособными через 8 мин. Внутриклеточное превращение кальцеина-AM обеспечивает сильный и легко детектируемый при 535 нм сигнал в тесте, предлагаемом авторами изобретения (фиг.7).
Анализ флуоресценции кальцеина с детекцией по “конечной точке”: клетки высевают за 24 часа до проведения анализа для достижения 100% слияния. Культуральную среду заменяют на H2О на 5:30 мин (осмотический шок). Затем осмолярность приводят к нормальному значению путем добавления 2x PBS плюс 2 мкМ кальцеин-AM. Затем клетки инкубируют при 37°C в течение 30 мин и измеряют флуоресценцию с помощью планшетного ридера. Клетки CHO-AQP4 размещают на рядах 1-22, и клетки CHO-CD81 размещают на рядах 23-24 (384-луночный планшет). Следует отметить, что данные, полученные в крайних лунках планшета, не учитывают. Относительную интенсивность флуоресценции рассчитывают, как интенсивность флуоресценции (FI) каждой лунки, деленная на среднее значение FI клеток AQP4, обработанных DMSO (контроль). Критерии успешного проведения исследования: значения коэффициентов вариации (CV) <15%, и Z-факторов >0,5. Статистический анализ показывает, что 5,5 мин осмотического шока обеспечивает оптимальное отношение “сигнал/шум”.
|
Как будет показано, сигнал, полученный в случае клеток CD81 приблизительно в 5 раз выше, чем сигнал, полученный для клеток APQ4, поскольку через 5,5 мин большинство клеток AQP4 разрушается, в то время как большинство клеток CD81 остаются интактными. Поэтому предполагается, что при ингибировании AQP4 можно получить более высокий сигнал, сходный с сигналом клеток CD81.
Указанный тест применяют в экспериментальном скрининге 20 тыс/библиотек MicroSource GenPlus 960 и Maybridge DiversityTM (приблизительно 21000 тестируемых соединений, 10-20 мкМ каждого соединения).
В результате указанного теста идентифицируют a специфические химические соединения, фенилбензамиды, которые представляют собой 3 из лучших 234 совпадений.
Совпадения, полученные в результате HTS, подтверждают с помощью такого же теста с применением различным образом подготовленных планшетов. На фиг.8 показаны результаты подтверждающего теста, используемого при проверке соединения 3. Клетки высевают в 96-луночном мультипланшетном формате, при этом лунки на краях планшета не используют (ряды 1 и 24) и используют весь столбец (n=16) при проверке способности соединения блокировать AQP4-опосредованное разрушение клеток в результате H2О-шока. Клетки CHO, экспрессирующие CD81, высевают в ряды 2-3 в качестве контроля, и клетки CHO, экспрессирующие AQP4, высевают в ряды 4-23. Клетки обрабатывают 0,1% DMSO в 10% FBS, DMEM (четные столбцы) или 10 мкМ соединения 1 (нечетные столбцы) в 0,1% DMSO, 10% FBS, DMEM в течение 30 мин. Клетки подвергают шоку с помощью H2О в течение 5:30 мин, затем осмолярность возвращают к нормальному значению 300 мОсм в присутствии 1 мкМ кальцеина-AM, как описано выше. Клетки инкубируют при 37°C в течение 30 мин и измеряют относительное значение флуоресценции (экстинкция 495/эмиссия 535 нМ) с помощью флуоресцентного мультипланшетного ридера. Данные на фиг.8 представлены в виде среднего значения в относительных единицах флуоресценции (RFU±SEM, n=16).
Пример 6
Модель водной токсичности CE: внутричерепное давление (ICP)
Мониторинг ICP осуществляют с применением сенсора Samba 420, измерительного датчика давления, с блоком управления Samba 202 (Harvard Apparatus, Holliston, MA). Указанная система мониторинга ICP включает в себя элемент 0,42 мм кремниевого датчика, установленного на оптоволокне. Инъекционную иглу калибра 20 вживляют в заднюю мозжечково-мозговую цистерну на глубину ~1 см. Впоследствии иглу используют в качестве проводника для введения сенсора Samba на место вживления, и открытый конец иглы герметично закрывают 100% силиконовым герметиком. Осуществляют считывание исходных значений ICP с последующим введением IP болюсной инъекции воды (20% массы животного) с соединением 1 или без него. Мониторинг ICP осуществляют до гибели животного в результате водной нагрузки.
С поправкой на незначительное повышение ICP, наблюдаемое у животных при мониторинге без введения водной болюсной инъекции (фиг.9, отсутствие водной токсичности), соединение 1 в дозе 0,76 мг/кг снижает относительную скорость увеличения ICP на 36%, от 3,6×10-3 мин-1 до 2,3×10-3 мин-1 (n=6 мышей/группу лечения, среднее значение ± SEM).
Пример 7
Превращение соединения 5 в соединение 1
Измеряют плазматические или сывороточные уровни соединения 1 с помощью LC-MS/MS в Профильном центре масс-спектрометрии II в Исследовательском институте Лернера Фонда клинических исследований Кливленда через 15 мин и 24 часа после введения i.p. нагрузочной дозы 10 мг/кг и поддерживающей дозы 1 мг/мл при 8 мкл/час (вводимой i.p. с помощью осмотического насоса Alzet, Durect Corp., Cupertino, CA) соединения 5 (n=5 мышей/временную точку, среднее значение ± SEM) (фиг.10). После начальной обработки для удаления белков (экстракция 75% раствором ацетонитрила), вносят соединение 3 для проведения улучшенной количественной оценки с применением мониторинга множественных реакций (MRM). Образцы анализируют методом тандемной LC-MS/MS с применением хроматографии с обращенной фазой C18 и масс-анализа с помощью тройного квадрупольного масс-спектрометра. Метод LC позволяет разделить соединение 1 и соединение 3, и последующий анализ MRM обеспечивает достоверную количественную оценку с линейной реакцией в диапазоне 0,004-0,4 нг соединения 1 для его преобладающего дочернего иона. Пунктирная линия на фиг.10 обозначает относительную эффективную плазматическую концентрацию соединения 1, наблюдаемую в мышиной модели водной токсичности. Имплантирование осмотического насоса Alzet (Durect Corp., Cupertino, CA), содержащего соединение 5, в брюшную полость, в сочетании с начальной нагрузочной дозой, являлось достаточным для поддержания концентрации соединения 1 выше предполагаемой эффективной плазматической концентрации 20 нг/мл в течение 24 часов (фиг.10).
Растворимость соединения 1 в воде составляет 3,8 г/мл. Растворимость соединения 5 в воде составляет 1 мг/мл. Первоначальные эксперименты показывают быстрое превращение соединения 5 в соединение 1, когда его добавляют к плазме крови мышей in vitro. Менее 5 мин при 20°C достаточно, чтобы соединение 5 перестало детектироваться. Кроме того, соединение 1 не выявляют в образцах плазмы, полученных у мышей, которым вводили IP соединение 5. Вместе с тем, соединение 1 выявляют в концентрации, указывающей на высокую биодоступность и почти полное превращение соединения 5. В случае соединения 5, можно использовать дозы 10 мг/кг и объемы IP инъекций в физиологическом растворе (0,5 мл для 30 гр мыши), которые обеспечивают сывороточные концентрации соединения 1 свыше 400 нг/мл (фиг.10). Основные параметры PK соединения 5 составляют: скорость абсорбции 0,12 мин-1; скорость выведения 0,017 мин-1.
Пример 8
Животная модель инсульта
Большинство ишемических инсультов (~80%) происходит в области средней мозговой артерии (MCA). Для имитации указанного повреждения у мышей используют модель окклюзии средней мозговой артерии (MCAo) с введением в просвет сосуда моноволокна. Окклюзия достигается путем введения хирургической нити в наружную сонную артерию (ECA) и проведения ее во внутреннюю сонную артерию (ICA) до блокирования кончиком волокна начала MCA. Получаемое в результате прекращение кровотока вызывает последующий инфаркт мозга в бассейне MCA (Longa, E.Z. et al., Reversible Middle Cerebral Artery Occlusion Without Craniectomy in Rats, Stroke, 20, 84-91 (1989)). Указанную методику используют для изучения временной окклюзии, при которой MCA блокировали в течение одного часа. Затем волокно удаляют для проведения реперфузии в течение 24 часов перед получением изображений мозга животных с применением T2-взвешенных изображений в сканнере 9,4T Bruker MRI в Центре томографических исследований Кейза (фиг.11). На фиг.11 представлен отдельный срез T2-взвешенного MR-изображения, на котором изображена ось мозга, показывающая положение коры головного мозга, гиппокампа, таламуса, миндалевидного тела и гипоталамуса у "нормальной" мыши (левые панели) и у мыши, которой проводят MCAo в течение одного часа с последующей реперфузией в течение 24 часов (правые панели). Пунктирные линии показывают среднюю линию мозга, и они показывают значительное смещение в мозге при MCAo в результате отека. Сплошной линией выделена область инфаркта мозга при MCAo.
Выживаемость. Мышам вводят соединение 5 с применением нагрузочной дозы 2 мг/кг i.p. и поддерживающей дозы 1 мг/мл соединения 5 со скоростью 8 мкл/час (вводимой с помощью i.p. осмотического насоса), или физиологический раствор (контрольная группа; n=17) с применением аналогичного подхода. В данной модели авторы изобретения наблюдали 29,4% увеличение общей выживаемости в течение 24 часов, когда животным вводят соединение 5 (X2(1)=4,26; P<0,05).
Отек головного мозга. Мышам вводят физиологический раствор или соединение 5 с помощью нескольких доз 5 мг/кг i.p. каждые три часа (n=8 на группу лечения). Указанный режим введения позволяет поддерживать плазматическую концентрацию соединения 1>10 нг/мл на протяжении исследования. Ипсилатеральный и контралатеральный полушарный объем измеряют на основании T2-взвешенных изображений MR мышей через 24 часа после развития паралича. Относительное изменение объема полушария рассчитывают в виде процентного значения разности между ипсилатеральным объемом мозга (Vi) и контралатеральным объемом мозга (Vc) деленного на контралатеральный объем мозга (относительное изменение полушарного объема мозга = ((Vi-Vc)/Vc)×100%).
У животных контрольной группы наблюдают отек в ипсилатеральном полушарии с относительным изменением ипсилатерального объема мозга 13,4%±1,9%, тогда как у животных, получавших соединение 5, наблюдают изменение 4,2±1,7% (P=0,003, ± SEM, см. фиг.12). Данный результат представляет собой 3,2-кратное уменьшение отека мозга после MCAo.
Неврологический исход. В том же эксперименте, как указано выше, у животных проводят оценку неврологических исходов по простой 5-балльной шкале, описанной Manley, G.T. et al, Aquaporin-4 Deletion in Mice Reduces Brain Edema After Acute Water Intoxication and Ischemic Stroke, Nature Medicine, 6, 159-163 (2000). Улучшение неврологического исхода наблюдают у животных, получавших соединение 5. У животных контрольной группы средняя неврологическая оценка составляет 2,77±0,66, тогда как у животных получавших соединение 5, средняя неврологическая оценка составляет 0,88±0,31 (фиг.13, на вставке, P=0,025, n=9 на группу лечения). У животных, получавших соединение 5, не наблюдали прогрессирования до состояния тяжелого паралича или гибели.
Результаты, полученные в модели инсульта MCAo, в сочетании с результатами, полученными в модели водной токсичности (отек головного мозга) позволяют связать фармакологические свойства соединения 5/соединения 1 с более благоприятными исходами при инсульте.