Результат интеллектуальной деятельности: МОДУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет временной заявки на патент США № 62/011368, поданной 12 июня 2014 года, озаглавленной «Модуляция активности комплемента», временной заявки на патент США № 62/077460, поданной 10 ноября 2014 года, озаглавленной «Модуляция активности комплемента», и временной заявки на патент США № 62/108772, поданной 28 января 2015 года, озаглавленной «Модуляция активности комплемента», причем содержание каждой из них полностью включено в настоящее описание путем ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит список последовательностей, который был подан в электронном виде в формате ASCII и тем самым включен путем ссылки в полном объеме. Указанная копия ASCII, созданная 11 июня 2015 года, названа 20111005PCT_SL.txt и имеет размер 130110 байт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0003] Настоящее изобретение относится к соединениям, в том числе полипептидам, которые являются полезными в качестве ингибиторов и/или антагонистов активности комплемента. Изобретение также относится к способам применения ингибиторов в качестве терапевтических средств.
УРОВЕНЬ ТЕХНИКИ
[0004] Иммунный ответ позвоночных состоит из адаптивных и врожденных компонентов иммунитета. В то время как адаптивный иммунный ответ является избирательным в отношении конкретных патогенов и реагирует медленно, компоненты врожденного иммунного ответа распознают широкий спектр патогенов и быстро реагируют на инфекцию. Одним из таких компонентов врожденного иммунного ответа является система комплемента.
[0005] Система комплемента включает около 20 циркулирующих в крови белков, синтезируемых главным образом печенью. Компоненты этого специфического иммунного ответа впервые были названы «комплементом» из-за наблюдения, что они дополняли гуморальный ответ в уничтожении бактерий. Эти белки остаются в неактивной форме до активации в ответ на инфекцию. Активация происходит по пути протеолитического расщепления, инициируемого распознаванием патогена, и приводящего к разрушению патогена. В системе комплемента известны три таких пути, которые называются классическим путем, лектиновым путем и альтернативным путем. Классический путь активируется, когда молекула IgG или IgM связывается с поверхностью патогена. Лектиновый путь инициируется маннан-связывающим белком лектином, распознающим сахарные остатки бактериальной клеточной стенки. Альтернативный путь остается активным на низком уровне в отсутствие каких-либо конкретных стимулов. Хотя все три пути различаются по своей инициации, они сходятся на расщеплении компонента С3 системы комплемента. C3 расщепляется на два продукта, называемыми C3a и C3b. Из них C3b становится ковалентно связанным с поверхностью патогена, тогда как С3а выступает в качестве диффундирующего сигнала, усиливая воспалению и способствуя привлечению циркулирующих иммунных клеток. Поверхностно-связанный C3b образует комплекс с другими компонентами, инициируя каскад реакций более поздних компонентов системы комплемента. Из-за необходимости прикрепления к поверхности активность комплемента остается локализованной и сводит к минимуму разрушение нецелевых клеток.
[0006] Связанный с патогеном C3b способствует уничтожению патогенных микроорганизмов двумя способами. В одном пути C3b непосредственно распознается фагоцитами и приводит к поглощению патогена. Во втором пути связанный с патогеном C3b инициирует образование мембраноатакующего комплекса (MAC). На первом этапе C3b образует комплекс с другими компонентами комплемента с образованием C5-конвертазного комплекса. В зависимости от начального пути активации комплемента компоненты этого комплекса могут отличаться. С5-конвертаза, образующаяся в результате классического пути комплемента, включает C4B и С2a в дополнение к C3b. При образовании по альтернативному пути С5-конвертаза состоит из двух субъединиц C3b, а также из одного Bb-компонента.
[0007] Компонент комплемента С5 расщепляется любым С5-конвертазным комплексом на С5а и C5b. С5а, так же, как С3а, диффундирует в кровоток и усиливает воспаление, действуя в качестве хемоаттрактанта для воспалительных клеток. C5b остается прикрепленным к поверхности клетки, где он вызывает образование MAC через взаимодействие с C6, C7, C8 и C9. MAC представляет собой гидрофильную пору, которая проходит через мембрану и способствует свободному притоку текучей среды в клетки и из нее, тем самым разрушая ее.
[0008] Важным компонентом всей иммунной активности является способность иммунной системы различать свои и чужие клетки. Патология возникает, когда иммунная система не в состоянии сделать это. В случае системы комплемента клетки позвоночных экспрессируют белки, которые защищают их от активности каскада комплемента. Это гарантирует, что мишени системы комплемента ограничиваются патогенными клетками. Многие связанные с комплементом расстройства и заболевания связаны с аномальным разрушением своих клеток каскадом комплемента. В одном примере, пациенты, страдающие пароксизмальной ночной гемоглобинурией (PNH) не способны синтезировать функциональные версии регуляторных белков комплемента, CD55 и CD59, на гемопоэтических стволовых клетках. Это приводит к комплемент-опосредованному гемолизу и различным последующим осложнениям. Другие расстройства и заболевания, связанные с комплементом, включают, но не ограничиваются ими, аутоиммунные заболевания и расстройства, неврологические заболевания и расстройства, гематологическое заболевания и расстройства, а также инфекционные заболевания и расстройства. Экспериментальные данные свидетельствуют о том, что многие расстройства, связанные с комплементом, ослабляются при ингибировании активности комплемента. Поэтому существует потребность в создании соединений, способных селективно блокировать опосредуемое комплементом разрушение клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к соединениям, включая полипептиды (например, пептидомиметики, циклические полипептиды и циклические пептидомиметики,), низкомолекулярные соединения, антитела, фрагменты антител и аптамеры, а также к способам использования указанных соединений для модуляции комплемента. Согласно настоящему изобретению, полипептиды могут иметь последовательности, указанные в SEQ ID NO: 1-201 или 211. Они могут быть линейными или циклическими и могут содержать циклическую петлю, образованную мостиковым элементом между двумя аминокислотами. Мостиковые элементы могут включать признак, выбранный из группы, состоящей из дисульфидной связи, амидной связи (лактама), тиоэфирной связи, ароматического кольца, ненасыщенной алифатической углеводородной цепи, насыщенной алифатической углеводородной цепи, триазольного кольца или их комбинации. Кроме того, циклическая петля может варьировать по длине и может составлять 1 аминокислоту, 2 аминокислоты, 3 аминокислоты, 4 аминокислоты, 5 аминокислот, 6 аминокислот, 7 аминокислот, 8 аминокислот, 9 аминокислот, 10 аминокислот, 11 аминокислот, 12 аминокислот, 13 аминокислот, 14 аминокислот, 15 аминокислот, 16 аминокислот или большее число аминокислот.
[0010] Мостиковый элемент может включать дисульфид между двумя цистеиновыми остатками или ароматическое кольцо, полученное путем реакции с поли(бромметил)бензолом, и такой поли(бромметил)бензол может быть выбран из группы, состоящей из 1,2-бис(бромметил)бензола, 1,3-бис(бромметил)бензола и 1,4-бис(бромметил)бензола.
[0011] Мостиковый элемент также может включать ароматическое кольцо, полученное путем реакции с соединением, выбранным из группы, состоящей из 2,6-бис(бромметил)пиридина, (Е)-1,4-дибромбут-2-ена и 1,2-бис(бромметил)-4-алкилбензола.
[0012] Мостиковый элемент может также включать амидную связь, полученную путем реакции боковых цепей следующих пар аминокислот: лизина и глутаминовой кислоты, лизина и аспартата, орнитина и глутамата, орнитина и аспартата, гомолизина и глутаминовой кислоты, гомолизина и аспарагиновой кислоты, других комбинаций аминокислот, неприродных аминокислот или не относящихся к аминокислотам групп, которые включают первичный амин и карбоновую кислоту.
[0013] Согласно настоящему изобретению, полипептиды полезны тем, что они могут проявлять C5-ингибиторную активность. В некоторых случаях такая активность может варьировать в диапазоне от половинной максимальной ингибирующей концентрации (IC50), составляющей примерно 50 нМ, до примерно 200 нМ или может составлять менее 50 нМ.
[0014] В некоторых вариантах осуществления настоящее изобретение относится к полипептидам, имеющим триптофан или один или несколько триптофановых аналогов, выбранных из группы, состоящей из 5-фтортриптофана, 5-метил-O-триптофана, 1-метилтриптофана, D-триптофана и 7-азатриптофана, присутствующих в аминокислотной последовательности. Такие соединения включают, среди прочего, соединения из SEQ ID NO: 3, 9, 11, 19, 45, 46, 50 и 59.
[0015] В некоторых вариантах осуществления полипептиды по настоящему изобретению могут связываться с областью на С5, где указанная область является дистальной по отношению к сайту расщепления С5а-C5b. В некоторых случаях, полипептиды по настоящему изобретению могут ингибировать расщепление C5 до продуктов расщепления С5а и C5b.
[0016] В некоторых случаях, полипептиды по настоящему изобретению могут быть частью антитела.
[0017] Полипептиды по настоящему изобретению могут содержаться в композициях. Такие композиции могут включать один или несколько приемлемых носителей или вспомогательных веществ. Такие полипептиды могут быть дополнительно конъюгированы с другим неполипептидным элементм, таким как, например, водорастворимый полимер. Эти полимеры могут быть гидрофильными или гидрофобными. В некоторых вариантах осуществления гидрофильный полимер выбран из группы, состоящей из полиалкиленоксидных гомополимеров, полипропиленгликолей, полиоксиэтилированных многоатомных спиртов и их сополимеров. Он может также включать полиэтиленгликоль (ПЭГ). Композиции могут дополнительно включать полипептиды, конъюгированные с альбумин-связывающим полипептидом, выбранным из группы, состоящей из SEQ ID NO: 202-204. В некоторых случаях композиции могут включать полипептиды, конъюгированные с проникающим в клетку полипептидом, выбранным из группы, состоящей из SEQ ID NO: 205-210. Композиции могут дополнительно включать полипептиды, конъюгированные с липидным элементом. Липидные элементы могут включать, но не ограничиваются ими, жирные кислоты, фосфолипиды и стерины. В некоторых вариантах осуществления липидные элементы могут быть напрямую конъюгированы с полипептидами по изобретению или связаны с конъюгатом полипептида и ПЭГ. Некоторые композиции могут включать фармацевтически приемлемое эксципиент.
[0018] В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования расщепления C5 в клеточной системе, включающему использование композиции по настоящему изобретению, такой как те, что описаны выше. Некоторые такие способы могут снизить уровни С5а. Другие способы могут снизить образование мембраноатакующего комплекса (MAC).
[0019] Некоторые способы по изобретению могут обеспечивать ингибирование расщепления С5 с IC50 от примерно 50 нМ до примерно 200 нМ. В некоторых случаях, способы по настоящему изобретению могут включать ингибирование расщепления C5 с IC50 менее 50 нМ.
[0020] Некоторые способы по настоящему изобретению могут быть применены к клеточным системам, которые выбирают из системы in vitro, системы in vivo и системы ex vivo. Некоторые системы in vivo могут включать в себя пациентов, таких как человек. В некоторых случаях, полипептиды и полипептидные композиции могут быть использованы в лечении или профилактике связанного с комплементом заболевания, расстройства и/или состояния у пациента. Введение пациенту может быть выбрано из группы, состоящей из буккального, интраназального, перорального, внутривенного, внутримышечного, внутрибрюшинного, подкожного, чрескожного и интравитреального. В некоторых случаях, композиции могут быть использованы для лечения пароксизмальной ночной гемоглобинурии и/или атипичного гемолитико-уремического синдрома. В некоторых случаях, композиции по настоящему изобретению могут быть использованы для лечения одного или нескольких из воспалительного заболевания, раны, травмы, аутоиммунного заболевания, сосудистого заболевания, неврологического заболевания, почечного заболевания и глазного заболевания.
[0021] В некоторых вариантах осуществления настоящее изобретение относится к способам ингибирования тромбин-индуцированной активации комплемента в клеточных системах, включающим контактирование таких систем с полипептидами по настоящему изобретению. Дополнительно предложены способы лечения гемолиза у пациентов, включающие введение полипептида, описанного в данном документе. Согласно некоторым таким способам подлежащий лечению гемолиз вызывается тромбин-индуцированной активацией комплемента.
[0022] В некоторых вариантах осуществления предложены наборы для диагностики, прогнозирования, профилактики или лечения заболевания, расстройства и/или состояния у млекопитающего, включая человека. Такие наборы будут содержать один или несколько полипептидов или полипептидных композиций по настоящему изобретению и, необязательно, реагенты и/или инструкции по применению. В таких наборах полипептиды могут содержать детектируемую метку или могут быть способны связываться с детектируемой меткой с образованием детектируемого комплекса. Согласно одному варианту осуществления, метка содержит метку BODIPY-TMR.
ОПИСАНИЕ ФИГУР
[0023] Вышеизложенные и другие цели, признаки и преимущества будут очевидны из нижеследующего описания конкретных вариантов осуществления изобретения, проиллюстрированных на прилагаемых чертежах, на которых аналогичные условные обозначения используются для обозначения одинаковых частей на всех чертежах. Чертежи не обязательно выполнены в масштабе, напротив, особое внимание направлено на иллюстрацию принципов различных вариантов осуществления настоящего изобретения.
[0024] Фигура 1 является диаграммой, отображающей результаты иммуноферментного анализа (ИФА) для обнаружения С5а в супернатанте из анализа гемолиза эритроцитов у человека с увеличением концентрации ингибиторов R3002 (SEQ ID NO: 3) и R3008 (SEQ ID NO: 9). Уровни С5а коррелируют с активностью комплемента и, следовательно, являются показателем способности тестируемых соединений ингибировать активность системы комплемента. Супернатант из анализа гемолиза разводили в соотношении 1:50 и анализировали на содержание С5а. Уровни С5а снижались в образцах супернатантов из анализа гемолиза эритроцитов у человека с увеличением уровня любого анализируемого ингибитора. R3002 (SEQ ID NO: 3) имел IC50 5,4 нМ, тогда как R3008 (SEQ ID NO: 9) имел IC50 54,5 нМ. Используемый в настоящем описании термин «IC50» относится к половинной максимальной ингибирующей концентрации - значению, используемому для указания количества ингибитора, необходимого для снижения данной реакции или процесса наполовину.
[0025] Фигура 2 является диаграммой, отображающей результаты ИФА для обнаружения мембранноатакующего комплекса (MAC) в супернатанте из анализа гемолиза эритроцитов у человека с увеличением концентраций R3008 (SEQ ID NO: 9). Уровни MAC коррелируют с активностью комплемента и, следовательно, являются показателем способности R3008 (SEQ ID NO: 9) ингибировать активность системы комплемента. Супернатант из анализа гемолиза разводили 1:5 и анализировали на содержание MAC. Уровни MAC снижались в образцах супернатантов из анализа гемолиза с увеличением уровня анализируемого ингибитора с IC50 33 нМ.
[0026] Фигура 3 является диаграммой, отображающей данные по конкурентной поляризации флуоресценции (FP) для исследуемых соединений R3003 (SEQ ID NO: 4), R3011 (SEQ ID NO: 31), R3014 (SEQ ID NO: 55), R3023 (SEQ ID NO: 104), R3043 (SEQ ID NO: 50) и R3050 (SEQ ID NO: 23). FP позволяет измерить события связывания в гомогенном растворе. Был проведен анализ конкурентного связывания, где 25 нМ раствор соединения R3076 (SEQ ID NO: 40), которое имеет флуоресцентную метку, смешивали с увеличивающимся количеством исследуемых соединений и измеряли изменения в FP (в милли-поляризационных единицах, mP). Снижение уровня mP коррелирует с успешной конкуренцией за C5 исследуемых соединений. Показано среднее для двух независимых экспериментов, проведенных в трипликатах (+/- стандартное отклонение). Из протестированных соединений R3003 (SEQ ID NO: 4) было самым сильным, тогда как R3023 (SEQ ID NO: 104, контрольный полипептид) не был активным даже при самой высокой тестируемой концентрации.
[0027] На фигуре 4 представлены результаты исследования на яванских макаках. Показаны изменения концентрации R3152 (SEQ ID NO: 153) в плазме крови (кружки) после ведения яванским макакам одной дозы 3 мг/кг внутривенно. Также показаны изменения в гемолитической активности (квадраты) в тех же временных точках.
[0028] На фигуре 5 представлены результаты мониторинга в плазме после внутривенного (IV; квадраты) или подкожного (SC, кружки) введения 2 мг/кг соединения R3152 (SEQ ID NO: 153) самцам крыс линии Sprague-Dawley. Мониторинг включал определение объединенных концентраций в плазме R3152 (SEQ ID NO: 153), а также его деамидированного по С-концу метаболита, R3201 (SEQ ID NO: 211), имеющего равную активность.
[0029] На фигуре 6 показана фармакокинетика соединений по настоящему изобретению у крыс. Слева: самцам крыс Sprague-Dawley (n=3) соединения вводили внутривенно в однократной дозировке 2 мг/кг. Образцы крови собирали в указанные моменты времени, выделяли плазму и анализировали на содержание указанного соединения с помощью ЖХ-МС. Черные кружки: R3176 (SEQ ID NO: 177) (нелипидированное соединение); пустые кружки: R3183 (SEQ ID NO: 184) (С16-липидированное соединение). Справа: самцам крыс Sprague-Dawley (n=3) соединения вводили подкожно в однократной дозировке 15 мг/кг. Образцы крови собирали в указанные моменты времени, выделяли плазму и анализировали на содержание указанного соединения с помощью ЖХ-МС. Черные кружки: R3176 (SEQ ID NO: 177) (нелипидированное соединение); пустые кружки: R3183 (SEQ ID NO: 184) (С16-липидированное соединение).
[0030] Фигура 7 является диаграммой, представляющий действие R3183 (SEQ ID NO: 184) (С16-липидированного соединения) или анти-С5 моноклонального антитела, аналогичного ECULIZUMAB®, на ингибирование гемолиза через тромбин-индуцированный путь комплемента.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0031] Настоящее изобретение относится к открытию новых модулирующих С5 соединений. Такие соединения могут включать в себя, но не ограничиваются ими, полипептиды (например, циклические полипептиды, пептидомиметики и циклические пептидомиметики, низкомолекулярные соединения, антитела, фрагменты антител и аптамеры). В некоторых случаях, модулирующие C5 соединения представляют собой полипептиды, такие как циклические полипептиды, пептидомиметики и циклические пептидомиметики, которые подходят для диагностики и/или лечения заболеваний, при которых желательно ингибирование активации комплемента. В некоторых вариантах осуществления полипептиды по изобретению специфически связываются с компонентом С5 комплемента. в других вариантах осуществления полипептиды по изобретению снижают комплемент-опосредованный межклеточный лизис путем предупреждения расщепления C5 до фрагментов С5а и C5b.
[0032] В настоящем описании «миметик» относится к молекуле, которая проявляет некоторые свойства или признаки другой молекулы. «Пептидомиметик» или «полипептидомиметик» представляют собой миметик, в котором молекула содержит структурные элементы, которые не найдены в природных полипептидах (т.е. полипептидах, состоящих только из 20 протеиногенных аминокислот). В предпочтительном варианте осуществления пептидомиметики способны повторять или имитировать биологическое действие природного пептида. Пептидомиметик может отличаться во многом от природных полипептидов, включая, но не ограничиваясь этим, изменения в структуре основной цепи и наличие аминокислот, которые не встречаются в природе. В некоторых случаях, пептидомиметики могут включать в себя аминокислоты с боковыми цепями, которые не найдены среди известных 20 протеиногенных аминокислот, неполипептидные мостиковые элементы, используемые для осуществления циклизации между концами или внутренними участками молекулы, замещение водородного элемента амидной связи метильными группами (N-метилирование) или другими алкильными группами, замену пептидной связи химической группой или связью, которая устойчива к воздействию химической или ферментативной обработки, N- и С-концевые модификации и конъюгацию с непептидными удлиняющими молекулами (например, полиэтиленгликолем, липидами, углеводами, нуклеозидами, нуклеотидами, нуклеозидными основаниями, различными низкомолекулярными соединениями или фосфатными или сульфатными группами).
[0033] Некоторые полипептиды по изобретению могут быть циклическими. Циклические полипептиды включают любые полипептиды, которые имеют в качестве части своей структуры один или нескольких признаков присутствия цикла, таких как петля, мостиковый элемент и/или внутренняя связь. Используемый в настоящем описании термин «мостиковый элемент» относится к одному или нескольким компонентам мостика, образованного между двумя смежными или несмежными аминокислотами, неприродными аминокислотами или неаминокислотными группами в полипептиде. Мостиковые элементы могут иметь любой размер и состав. В некоторых вариантах осуществления мостиковые элементы могут содержать одну или несколько химических связей между двумя смежными или несмежными аминокислотами, неприродными аминокислотами, неаминокислотными группами или их комбинациями. В некоторых вариантах осуществления такие химические связи могут находиться между одной или несколькими функциональными группами на смежных или несмежных аминокислотах, неприродных аминокислотах, неаминокислотных группах или их комбинациях. Мостиковые элементы могут содержать один или несколько признаков, включающих, но не ограниченных ими, амидную связь (лактам), дисульфидную связь, тиоэфирную связь, ароматическое кольцо, триазольное кольцо и углеводородную цепь. В некоторых вариантах осуществления мостиковые элементы содержат амидную связь между аминногруппой и карбоксигруппой, которые присутствуют в боковой цепи аминокислоты, неприродной аминокислоты или неаминокислотной группы. В некоторых вариантах осуществления амино- или карбокси-группы являются частью неаминокислотной группы или неприродного аминокислотного остатка. В некоторых случаях мостиковые элементы могут содержать связи, образованные между остатками, которые могут включать, но не ограничиваются ими, (S)-2-амино-5-азидовалериановую кислоту (также называемую в данном документе «X02»), (S)-2-аминогепт-6-еновую кислоту (также называемую в данном документе «X30»), (S) -2-аминопент-4-иновую кислоту (также называемую в данном документе «X31») и (S)-2-аминопент-4-еновую кислоту (также называемую в данном документе «X12»). Мостиковые элементы могут быть образованы посредством реакции циклизации с использованием реакции олефинового обмена. В некоторых случаях такие мостиковые элементы могут быть образованы между остатками X12 и X30. В некоторых вариантах осуществления мостиковый элемент содержит дисульфидную связь, образованную между двумя тиолсодержащими остатками. В некоторых вариантах осуществления мостиковый элемент содержит одну или несколько тиоэфирных связей. Такие тиоэфирные связи могут включать в себя присутствующие в цикло-тиоалкильных соединениях. Эти связи образуются в ходе химической реакции циклизации между модифицированными по N-концу хлоруксусной кислотой группами (также называемыми в данном документе «X35») и цистеином. В некоторых случаях мостиковые элементы содержат одно или несколько триазольных колец. Такие триазольные кольца могут включать, но не ограничиваются ими, кольца, образованные в результате реакции циклизации между X02 и X31. В некоторых вариантах осуществления мостиковые элементы содержат небелковые или неполипептидные группы, включающие, но не ограниченные ими, циклические кольца (включая, но не ограничиваясь ими, ароматические кольцевые структуры (например, ксилилы)). Такие мостиковые элементы могут быть введены путем взаимодействия с реагентами, содержащими много реакционно-способных галогенидов, включая, но не ограничиваясь ими, поли(бромметил)бензолы, поли(бромметил)пиридины, поли(бромметил)алкилбензолы и/или (Е)-1,4-дибромбут-2-ен. В некоторых вариантах осуществления мостиковые элементы по настоящему изобретению включают, но не ограничиваются ими, следующие структуры:
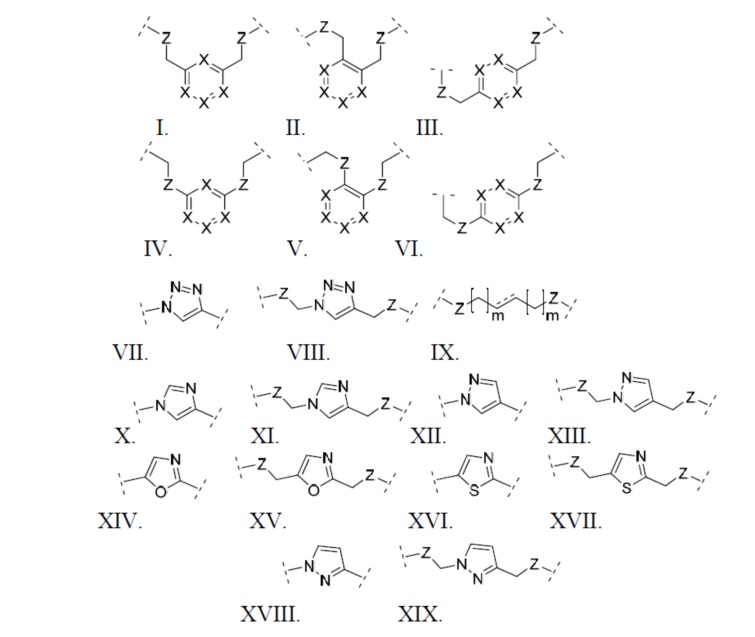
где каждый Х независимо представляет собой Н или СН, так что ни одно кольцо не содержит более 2 атомов азота; каждый Z, независимо, отсутствует или выбран из связи, NR, O, S, CH2, C(O)NR, NRC(O), S(O)vNR и NRS(O)v; каждый m, независимо, выбран из 0, 1, 2 и 3; каждый v, независимо, выбран из 1 и 2; каждый R, независимо, выбран из Н и С1-С6; и каждый мостиковый элемент соединен с полипептидом независимо выбранной связью или С1-С6-спейсером.
[0034] В некоторых вариантах осуществления полипептиды становятся макроциклическими за счет образования ковалентных связей между атомами, присутствующими в линейном полипептиде, и атомами мостикового элемента. Этот мостиковый элемент служит для химического связывания двух реакционноспособных участков на линейном полипептиде таким образом, чтобы получить циклический полипептидный продукт. Варианты осуществления настоящего изобретения включают полипептиды, циклизованные вышеуказанным образом и содержащие мостиковый элемент, содержащий ароматическое 6-членное кольцо. В этих вариантах осуществления атомы линейного полипептида, которые образуют прямые химические связи с мостиковым элементом, могут представлять собой гетероатомы (включая, но не ограничиваясь ими, азот, кислород и серу) или насыщенные или ненасыщенные атомы углерода. В каждом из этих вариантов осуществления атомы боковой цепи полипептида могут быть соединены непосредственно с атомом углерода в ароматическом кольце мостикового элемента. В альтернативных формах атомы полипептидной боковой цепи могут быть связаны к насыщенной -СН2- группой, которая, в свою очередь, напрямую связана с атомом углерода в ароматическом кольце мостикового элемента. В некоторых случаях, ароматическое 6-членное кольцо в мостиковом элементе представляет собой бензол, как в следующих структурах, где Z может быть выбран из NH, S, O и (CH)2:
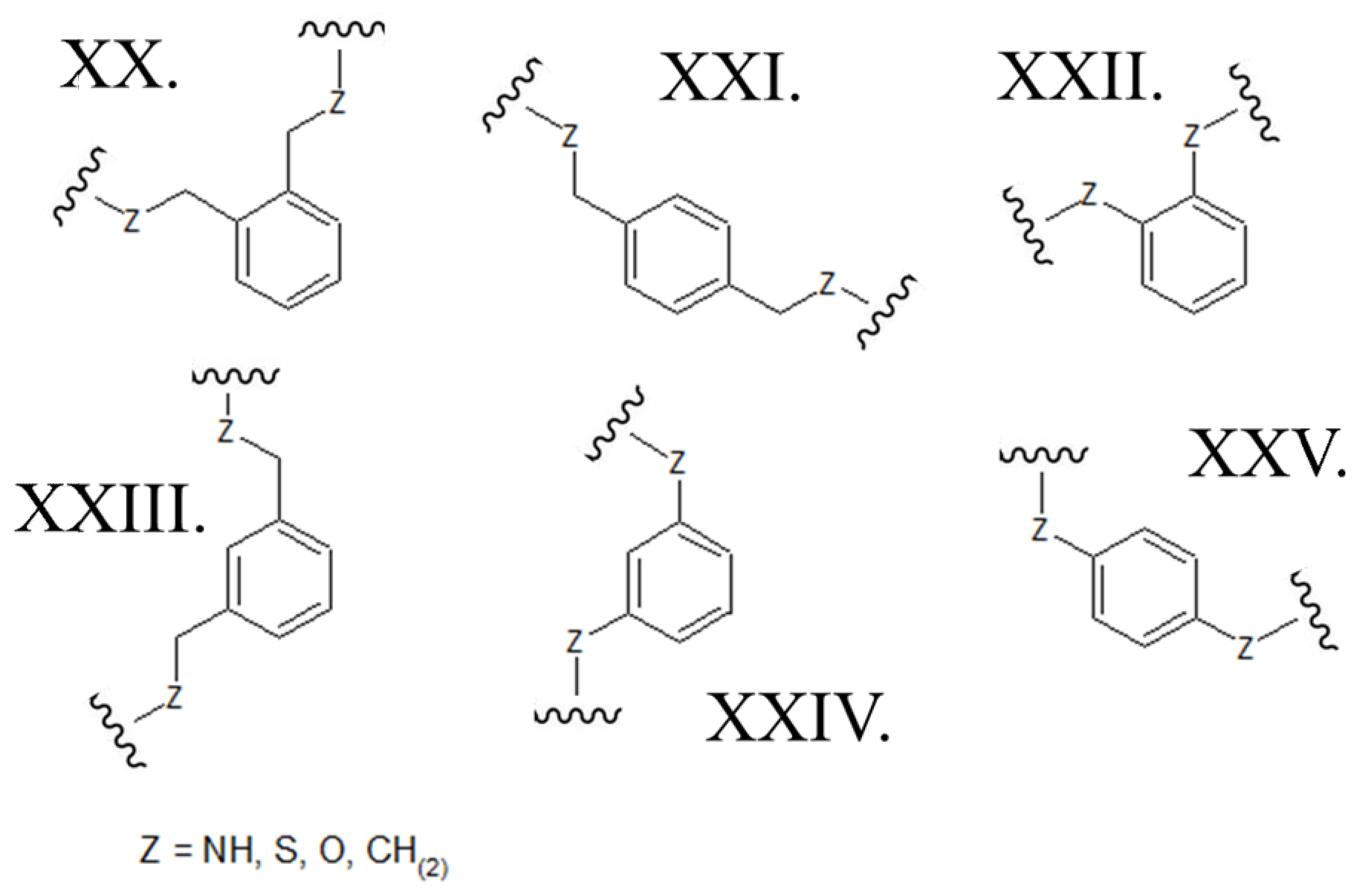
[0035] В альтернативных формах настоящего изобретения, ароматическое 6-членное кольцо, которое содержит мостиковый элемент, представляет собой гетероцикл и содержит один или несколько атомов азота. В этих вариантах осуществления ароматический гетероцикл может представлять собой пиридин, содержащий один атом азота в ароматическом кольце (например, любую из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
[0036] Ароматические гетероциклы могут, в качестве альтернативы, представлять собой пиридазин, содержащий два соседних атома азота в 1,2-ориентации в ароматическом кольце (например, любую из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
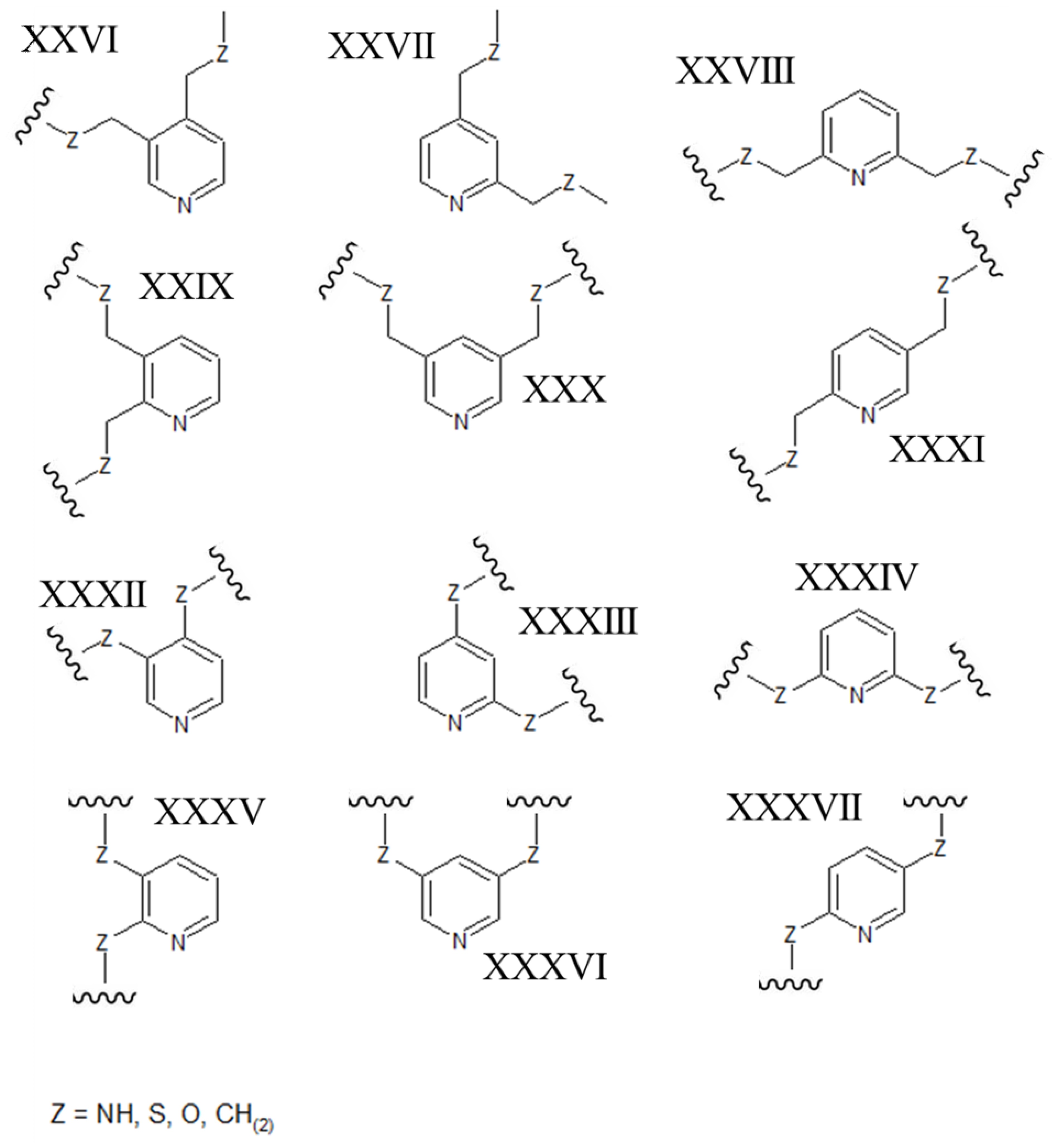
[0037] В других вариантах осуществления ароматический гетероцикл может представлять собой пиримидин, содержащий два атома азота в 1,3-ориентации в ароматическом кольце (например, любую из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
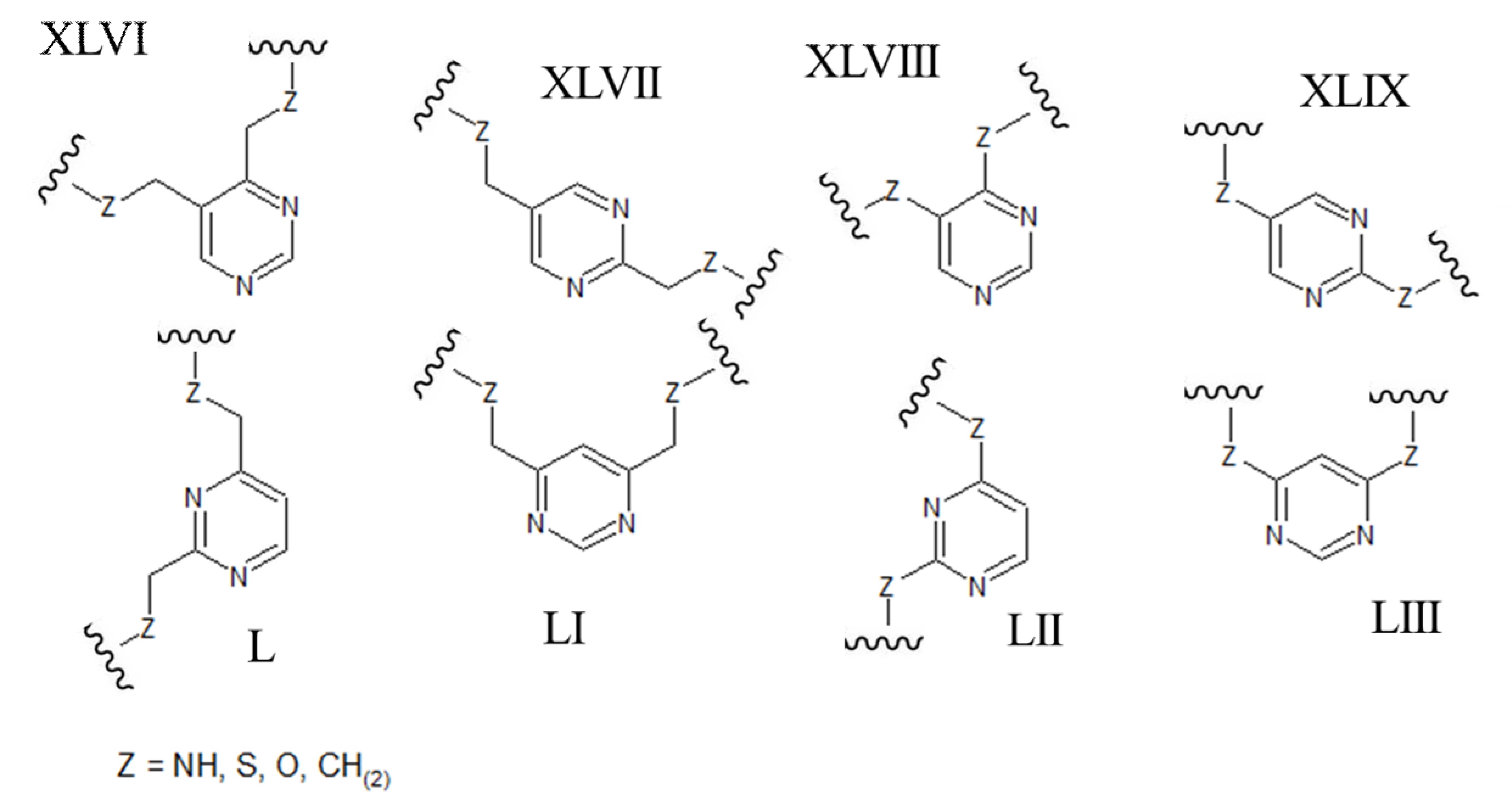
[0038] В качестве альтернативы, ароматический гетероцикл может представлять собой пиразин, содержащий два азота атома в 1,4-ориентации в ароматическом кольце (например, любую из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
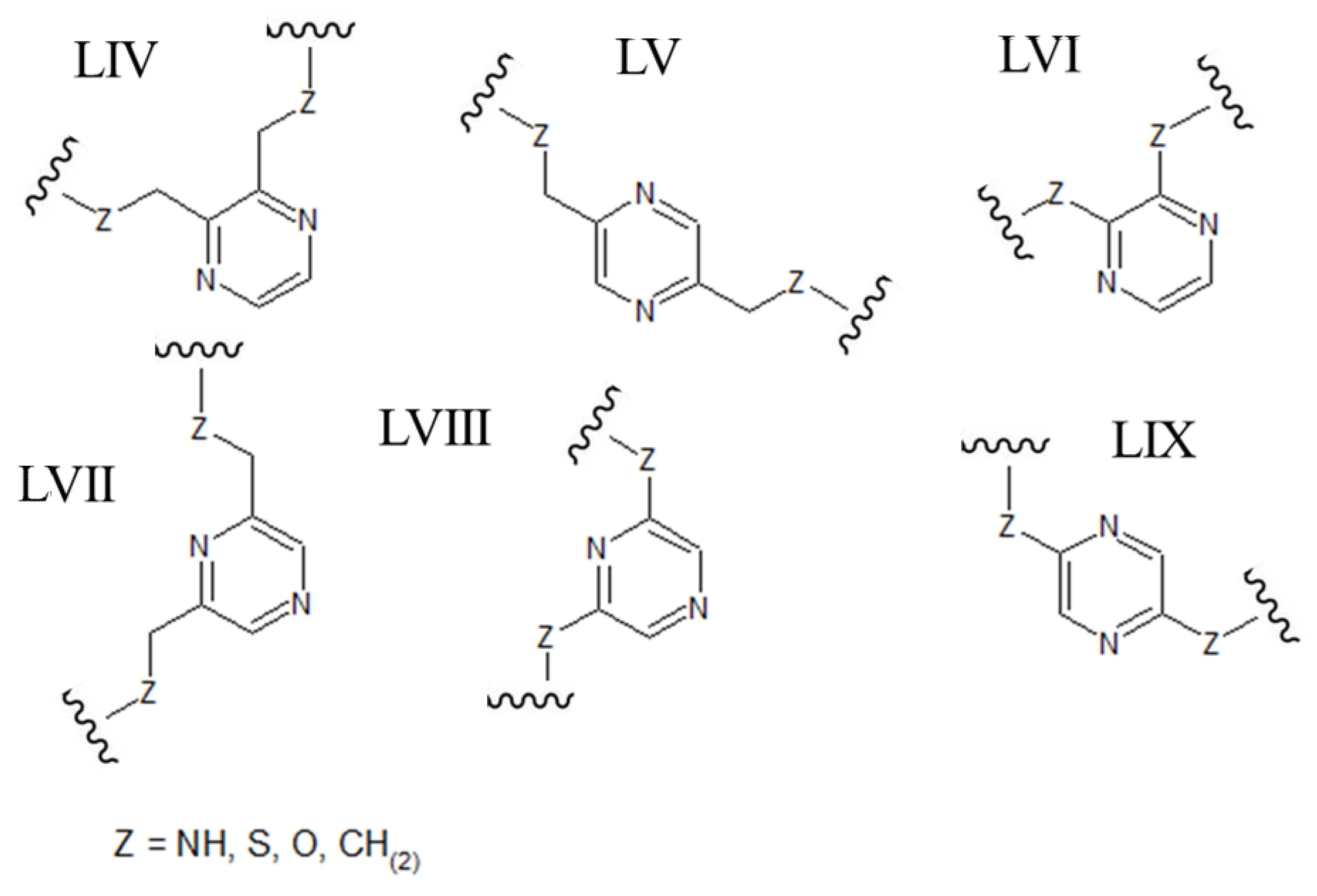
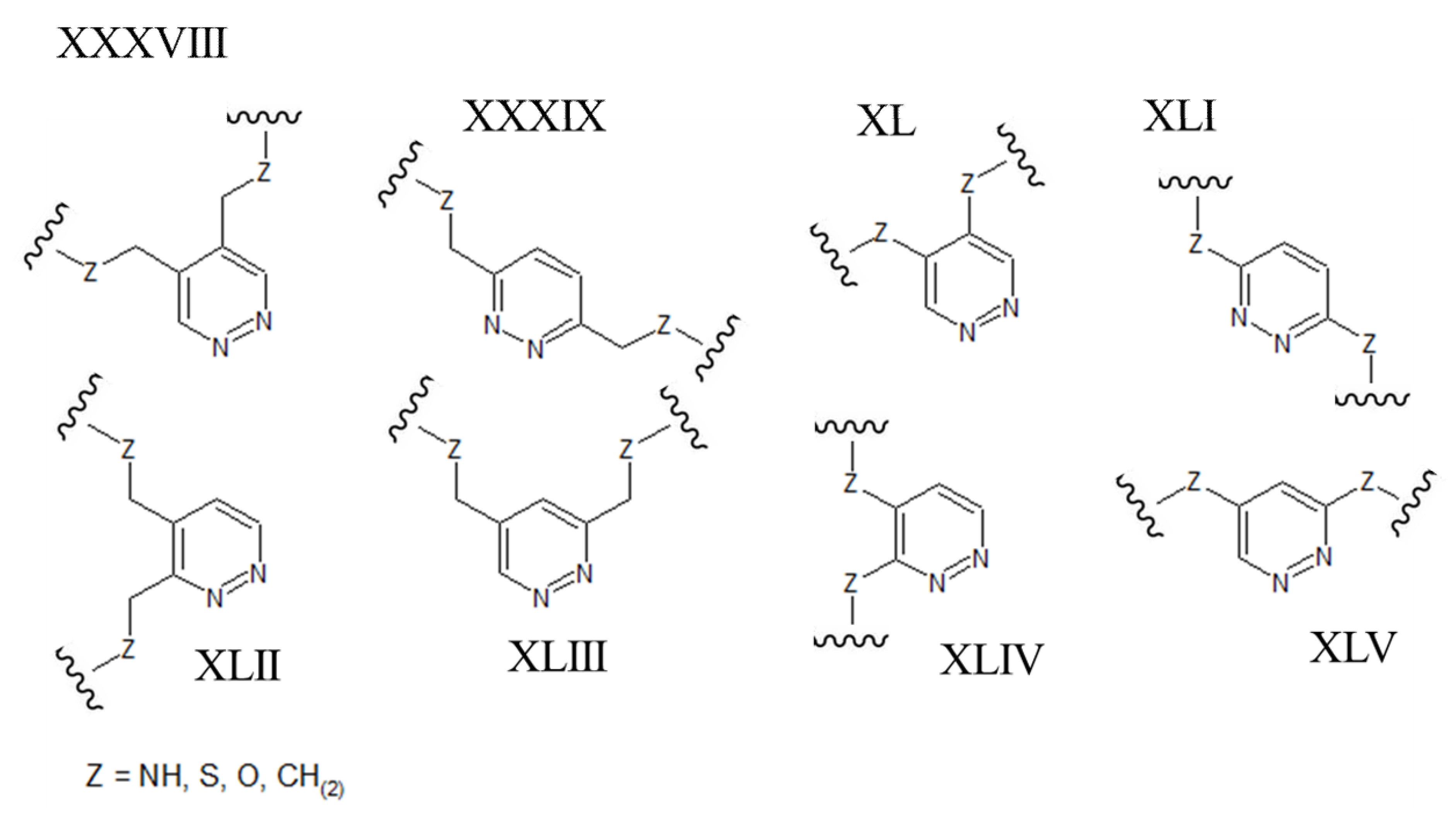
[0039] В альтернативных формах осуществления настоящего изобретения полипептиды становятся макроциклическими в результате образования ковалентных связей между атомами линейного полипептида и атомами мостикового элемента, состоящего из гетероциклического ароматического 5-членного кольца. В этих вариантах осуществления атомы линейного полипептида, которые образуют прямые химические связи с мостиковым элементом, могут представлять собой гетероатомы (включая, но не ограничиваясь ими, азот, кислород и серу) или насыщенные или ненасыщенные атомы углерода. В каждом из этих вариантов осуществления атомы боковой цепи полипептида могут быть присоединены непосредственно к атому углерода или атому азота в ароматическом кольце мостикового элемента. В альтернативных формах атомы боковой цепи полипептида могут быть присоединены к насыщенной -СН2- группе, которая, в свою очередь, непосредственно связана с атомом углерода или атомом азота в ароматическом кольце мостикового элемента. В некоторых случаях гетероциклическое ароматическое 5-членное кольцо в мостиковом элементе является 1,2,3-триазолом. В этих вариантах осуществления ароматическое кольцо может быть замещено в положениях 1 и 4 химически-активными группами линейного полипептида, которые необходимо соединить. В качестве альтернативы, 1,2,3-триазольный каркас может быть замещен в положениях 1 и 4 группами -СН2-, которые напрямую связаны с атомами линейного полипептида, которые необходимо соединить (например, любая из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
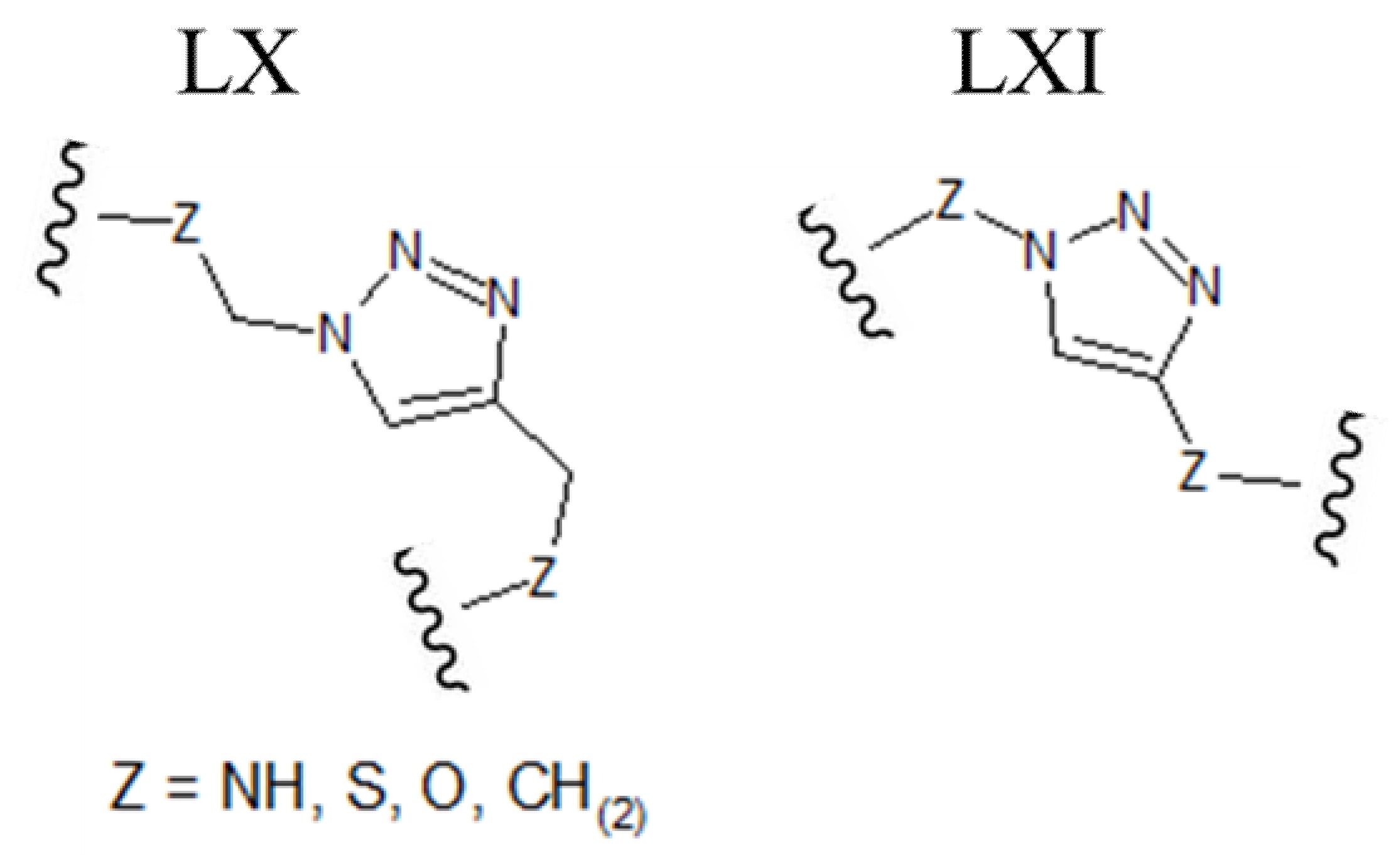
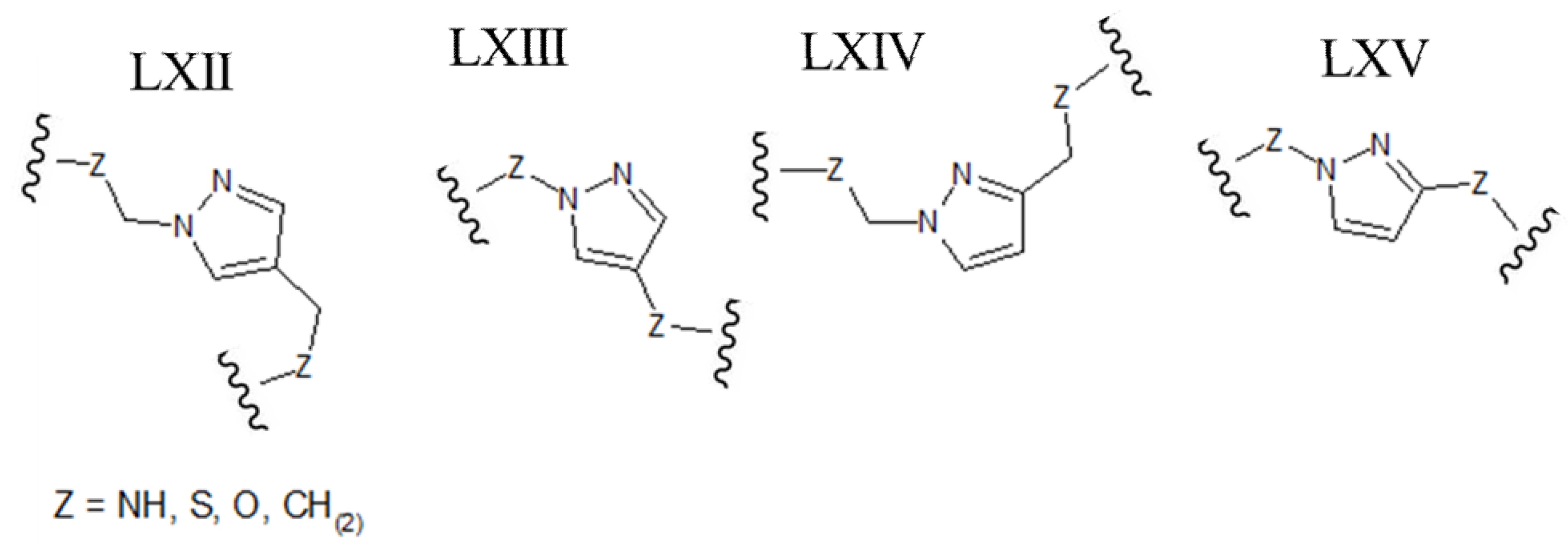
[0040] В других вариантах осуществления гетероциклическое ароматическое 5-членное кольцо, которое содержит мостиковый элемент, представляет собой пиразол. В этих вариантах осуществления ароматическое кольцо может быть замещено либо в положениях 1 и 3, либо в положениях 1 и 4 химически-активными группами линейного полипептида, которые необходимо соединить. В качестве альтернативы, пиразольный каркас может быть замещен либо в положениях 1 и 3, либо в положениях 1 и 4 группами -СН2-, которые напрямую связаны с атомами линейного полипептида, которые необходимо соединить (например, любая из структур, приведенных ниже, где Z может быть выбран из NH, S, O и (CH)2):
[0041] Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, какое обычно понимает средний специалист в данной области, к которой принадлежит настоящее изобретение. Хотя на практике или при тестировании циклических полипептидов и способов, приведенных в изобретении, могут быть использованы способы и материалы, подобные или эквивалентные описанным в настоящем документе, подходящие способы и материалы описаны ниже.
Полипептиды в качестве лекарственных средств
[0042] В силу своих размеров и сложности структуры, полипептиды способны образовывать многочисленные, весьма специфические контакты со своими биологическими мишенями и могут демонстрировать высокий уровень селективности в отношении «правильной» или желаемой мишени по сравнению с близкородственной мишенью в пределах одного семейства. Нецелевые эффекты (известные также как побочные эффекты) часто обуславливают невозможность одобрения регулирующими органами высокоэффективных препаратов из-за безопасности.
[0043] Многочисленные полипептиды (включая, но не ограничиваясь ими, пептидомиметики), были превращены в эффективные лекарственные средства. К ним относятся, без ограничения, инсулин, глюкагон-подобный пептид 1 (GLP-1), соматостатин, вазопрессин, циклоспорин А и т.п. Терапевтический полипептид может быть идентичным природной молекуле (т.е. той, которая циркулирует в организме человека и считается «диким типом» в человеческой популяции). Во многих других случаях этот полипептид не подходит или является неоптимальным для терапевтического применения из-за короткого времени полужизни в кровотоке, что часто обусловлено метаболической нестабильностью в организме. В этих случаях используется модифицированная форма или вариант полипептида (пептидомиметик), что приводит к улучшению фармакокинетических и фармакодинамических характеристик. В другом случае, полипептид, полученный из природного источника, имеет эквивалентный механизм действия и предпочтительный фармацевтический профиль и может быть использован в качестве терапевтического средства. Например, эксенатид, синтетический вариант эксендина-4, имеет биологические свойства, аналогичные свойствам человеческого глюкагон-подобного пептида-1 (GLP-1), но улучшенные фармакокинетические свойства, и был одобрен FDA для лечения сахарного диабета II типа. В другом примере, лососевый кальцитонин (кальцитонин, выделенный из желез ультимобранхиальных желез лосося) напоминает человеческий кальцитонин, но более активен чем кальцитонин человека и может быть использован для лечения постменопаузального остеопороза, гиперкальциемии, болезни Педжета, метастаз в кости и фантомных болей конечностей.
[0044] Полипептиды обычно ограничены непероральными путями введения. Почти во всех случаях полипептиды должны быть доставлены путем инъекции, так как даже очень короткие полипептиды (например, полипептиды с 4-10 аминокислотными остатками) не способны или плохо способны проходить через клеточные мембраны, выстилающие желудочно-кишечный тракт. Для эффективной пероральной доступности препаратов, как правило, необходимо пройти через обе люминальную и базолатеральную мембраны кишечника эпителиальных клеток, чтобы войти в системный кровоток. Плохая проницаемость мембран и отсутствие пероральной биодоступности полипептидов существенно ограничивает их терапевтическое применение.
[0045] Эффективность полипептида в качестве лекарственного средства может зависеть от его протеолитической стабильности. В организме полипептиды могут модифицироваться или разлагаться под действием ферментов, что может ограничивать их эффективность в отношении взаимодействия с заданной мишенью.
[0046] Метаболическая стабильность полипептидов имеет важное значение, поскольку это связано с их общей гибкостью, внутримолекулярными колебаниями, различными внутренними динамическими процессами, а также со многими биологическими функциями. Метаболическая стабильность полипептидов может иметь решающее значение при разработке фармацевтических препаратов, влияя на параметры, такие как, но не ограниченные ими, клиренс, время полужизни и биодоступность лекарственных соединений.
[0047] Поддержание заданного уровня терапевтического полипептида в организме или кровотоке может быть затруднено из-за его выведения. Скорость выведения полипептида из организма может изменяться и должна контролироваться при рассмотрении вопроса введения терапевтических полипептидов.
[0048] В медицине сохраняется острая необходимость в ингибиторах активации комплемента или ингибиторах активности комплемента и препаратах ингибиторов, которые являются высокоактивными и высокоспецифичными.
Поиск пептидомиметиков
[0049] Пептидомиметики могут быть идентифицированы с помощью различных средств. В некоторых случаях природный пептид или последовательность, найденная в природном белке, используются в качестве отправной точки. В этих случаях исходная пептидная последовательность была выбрана, потому что известно, что она физически взаимодействует с желаемой молекулой-мишенью. Природный пептид может быть выбран, потому что он является агонистом или антагонистом для рецептора, ингибирует фермент или модулирует канал. Последовательность, находящаяся в природном белке, может быть выбрана, потому что она содержит домен, участвующий во взаимодействии с другим белком или какой-либо другой молекулой у человека или животного. Во многих случаях структурные данные о взаимодействующих белках можно получить из общедоступных баз данных (например, RCSB Protein Data Bank; H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank Nucleic Acids Research, 28: 235-242), а определенная область белка, которая взаимодействует с мишенью, может быть идентифицирована на основе кристаллографических данных о белковом комплексе. В других случаях могут быть получены полипептиды, соответствующие различным участкам белка, и протестированы на связывание с мишенью, представляющей интерес. После идентификации вводятся химические модификации для повышения его стабильности и силы действия, а полученный в результате пептидомиметик имеет улучшенные фармакокинетические или фармакодинамические параметры.
[0050] В других случаях, полипептид выделяют одним из нескольких способов выделения полипептидных последовательностей из библиотек полипептидов, основанных на их сродстве к конкретным целевым белкам, нуклеиновым кислотам, углеводам, липидам или целым клеткам. Такие способы включают фаговый дисплей, мРНК-дисплей, рибосомный дисплей, ДНК-дисплей, ДНК-кодируемую сборку и двухгибридный скрининг, а также их модификации (см., например, Takashashi, T.T. et al. (2003). Trends in Biochem. Sci. 28(3):159-165; Kay, B.K. et al. (2001). Methods. 24:240-246; He, M and Taussig, M (2002). Briefs in Functional Genomics and Proteomics. 1(2): 204-212; Rothe, A. et al. (2006). The FASEB Journal. 20(10):1599-1610; которые все полностью включены в настоящее описание путем ссылки).
[0051] Полипептиды могут принимать трехмерные структуры, которые способны связываться с другими биологическими молекулами с определенной степенью аффинности и специфичности. Некоторые из них будут связываться с очень высокой аффинностью и специфичностью. Библиотека случайных полипептидных последовательностей будет включать молекулы с широким спектром различных трехмерных структур. Для того, чтобы выделить полипептид с конформацией, которая взаимодействует с определенным белком-мишенью, индивидуальные последовательности из библиотеки могут быть получены и протестированы или скринированы по их сродству к мишени. Однако для очень больших библиотек (>106 членов) скрининг на индивидуальные последовательности по аффинности связывания не представляется возможным. Чтобы преодолеть это ограничение, был разработан ряд методов для отбора новых полипептидов из чрезвычайно больших и сложных смесей за счет их аффинности связывания с мишенью. Поскольку предполагается, что полипептиды с высокой аффинностью связывания встречаются в популяции с очень низкой частотой, эти способы отбора полагаются на поддержание физической связи между полипептидом и генетическим материалом (обычно, нуклеиновой кислотой, такой как ДНК или РНК), кодирующим полипептид, так что отбор полипептида автоматически включает выделение нуклеиновой кислоты, кодирующей его. Нуклеиновая кислота, кодирующая отобранный полипептид, может быть амплифицирована и секвенирована, чтобы выявить последовательность обоих нуклеиновой кислоты и полипептида. В одном подходе фагового дисплея (см. Cwirla, S.E. et al. (1990). Proc. Natl. Acad. Sci. U.S.A. 87:6378-6382; Dower W.J. и Cwirla S.E. патенты США №№ 5427908 и 5580717) каждый случайный член полипептидной библиотеки отображается на поверхности частицы бактериофага как часть слитого белка между полипептидом и одним из белков фаговой оболочки. Частица фага обеспечивает связь между полипептидом и кодирующей ДНК путем их колокализации в пределах одной физической единицы, а кодирующая ДНК может быть впоследствии амплифицирована путем инфицирования бактерий отобранным фагом. В другом подходе рибосомного дисплея (см. Kawasaki, патенты G.H.U.S. №№ 5658754 и 5643768) смесь молекул мессенджерных РНК (мРНК) транслируется in vitro таким образом, который продуцирует для каждой мРНК в смеси стабилизированный комплекс из рибосомы, мРНК и вновь синтезированного полипептида, выступающего из рибосомы. Стабилизация комплекса позволяет ему сохраняться целым, в то время как полипептиды подвергаются скринингу по связыванию с мишенью, представляющей интерес. мРНК, кодирующие отобранные полипептиды, могут быть амплифицированы с помощью полимеразной цепной реакции (ПЦР), а затем охарактеризованы, например, с помощью секвенирования.
[0052] В еще одном подходе мРНК дисплея (см. Szostak J.W. и Roberts R.W., патент США № 6258558, содержание которого включено в настоящее описание путем ссылки в полном объеме) каждая молекула мРНК в библиотеке модифицируется ковалентным добавлением пуромицин-подобного фрагмента на своем 3'-конце. Пуромицин-подобный фрагмент представляет собой аналог акцепторного стебля аминоацил-тРНК, который функционирует в качестве пептидильного акцептора и может быть добавлен к растущей полипептидной цепи путем пептидилтрансферазной активности рибосомы, транслирующей мРНК. Во время трансляции in vitro мРНК и кодируемый полипептид становятся ковалентно связаны через пуромицин-подобный фрагмент, создавая гибрид РНК-пептид. После отбора слитой молекулы путем связывания его полипептидного компонента с мишень, РНК-компонент отобранной слитой молекулы может быть амплифицирован с помощью ПЦР, а затем охарактеризован. Были разработаны несколько других способов для создания физической связи между полипептидом и кодирующей его нуклеиновой кислотой с целью облегчения отбора и амплификации (см. Yanagawa, H., Nemoto, N., Miyamoto, E., and Husimi, Y., патент США № 6361943; Nemoto, H., Miyamoto-Sato, E., Husimi, H., and Yanagawa, H. (1997). FEBS Lett. 414:405-408; Gold, L., Tuerk, C., Pribnow, D., and Smith, J.D., патенты США №№ 5843701 и 6194550; Williams, R.B., патент США № 6962781; Baskerville, S. and Bartel, D.P. (2002). Proc. Natl. Acad. Sci. USA 99:9154-9159; Baskerville, D.S. and Bartel, D.P., патент США № 6716973; Sergeeva, A. et al. (2006). Adv. Drug Deliv. Rev. 58:1622-1654; содержание которых включено в данное описание путем ссылки в полном объеме).
[0053] мРНК-дисплей является особенно полезным способом для создания крупных библиотек полипептидов. Соответственно, в настоящем описании предложены способы отбора полипептида (или мРНК, кодирующей полипептид), который взаимодействует с белком комплемента С5. Библиотека, как правило, содержит по меньшей мере 102 членов, более предпочтительно, по меньшей мере 106 членов и, более предпочтительно, по меньшей мере 109 членов (например, любых мРНК-полипептидных комплексов). В некоторых вариантах осуществления библиотека будет включать по меньшей мере 1012 членов или по меньшей мере 1014 членов. В общем, члены будут отличаться друг от друга, однако ожидается, что будет присутствовать некоторая степень вырожденности в любой библиотеке. Библиотека может существовать в виде одной смеси всех членов или может быть разделена на несколько пулов, содержащихся в отдельных контейнерах или лунках, каждые из которых содержат подмножество библиотеки, или библиотека может представлять собой совокупность контейнеров или лунок на планшете, причем каждый контейнер или лунка содержат только один или несколько членов библиотеки.
[0054] Каждая мРНК в библиотеке, предпочтительно, включает последовательность инициации трансляции, старт-кодон и вариабельную область, кодирующую полипептид (например, белок или короткий пептид), которая генерируется, например, случайной или полу-случайной сборкой нуклеотидов, и меняется от мРНК к мРНК в библиотеке (хотя, возможно, что в библиотеке будет некоторая степень вырожденности). Последовательность инициации трансляции, стартовый кодон и вариабельная область, кодирующая полипептид, могут быть фланкированы известными фиксированными последовательностями, которые могут быть использованы для ПЦР-амплификации мРНК, например, после отбора. Другие фиксированные последовательности, которые могут присутствовать, включают те, что соответствует последовательностям, которые кодируют аминокислоты, которые могут участвовать в химических или ферментативных сшивающих реакциях, так что после трансляции продуцируемый полипептид может быть модифицирован или дериватизирован, либо которые кодируют фиксированное удлинение С-конца, такое как полипептидный тег, который может облегчить очистку слитых пептида и мРНК.
[0055] После создания библиотеки мРНК, дериватизированной пуромицином, библиотека может быть транслирована. Полученные в результате полипептиды (например, представляемые полипептиды) будут связаны с соответствующими им мРНК, как описано в настоящем документе (например, в виде мРНК-полипептидного комплекса).
[0056] В литературе описаны многочисленные системы трансляции in vitro. Наиболее распространенные системы используют лизаты ретикулоцитов кролика, экстракты зародышей пшеницы или экстракты E. coli, которые доступны из целого ряда коммерческих источников в виде наборов (например, от Ambion, Austin, TX; Promega, Madison, WI; Novagen/EMD Chemicals, Gibbstown, NJ; Qiagen, Valencia, CA).
[0057] В отличие от фагового дисплея или других систем, которые основаны на трансляции в клетках, мРНК-дисплей может быть адаптирован к прямому получению библиотек пептидомиметиков путем выполнения трансляции in vitro с неприродными или нестандартными аминокислотами. 20 природных протеиногенных аминокислот были идентифицированы и указываются в настоящем описании однобуквенными или трехбуквенными следующими обозначениями: аспарагиновая кислота (Asp: D), изолейцин (Ile: I), треонин (Thr: Т), лейцин (Leu: L), серин (Ser: S), тирозин (Tyr: Y), глутаминовая кислота (Glu: Е), фенилаланин (Phe: F), пролин (Pro: P), гистидин (His: Н), глицин (Gly: G), лизин (Lys: К), аланин (Ala: А), аргинин (Arg: R), цистеин (Cys, C), триптофан (Trp: Вт), валин (Val: V), глутамин (Gln: Q) метионин (Met: M), аспарагин (Asn: N). Встречающиеся в природе аминокислоты существуют в своей левовращающей (L) стереоизомерной форме. Аминокислоты, упоминаемые в настоящем описании, являются L-стереоизомерами, если не указано иное.
[0058] Неприродные аминокислоты имеют боковые цепи или другие признаки, отсутствующие у 20 встречающихся в природе аминокислот, перечисленных выше, и включают, но не ограничиваются ими: N-метил-аминокислоты, N-алкил-аминокислоты MINO кислоты, альфа,альфа-замещенные аминокислоты, бета-аминокислоты, альфа-гидроксиаминокислоты, D-аминокислоты и другие неприродные аминокислоты, известные в данной области (см., например, Josephson et al., (2005) J. Am. Chem. Soc. 127: 11727-11735; Forster, A.C. et al. (2003) Proc. Natl. Acad. Sci. USA 100: 6353-6357; Subtelny et al., (2008) J. Am. Chem. Soc. 130: 6131-6136; Hartman, M.C.T. et al. (2007) PLoS ONE 2:e972; и Hartman et al., (2006) Proc. Natl. Acad. Sci. USA 103:4356-4361).
[0059] По существу может быть использована любая аминокислота, которая, будучи прикрепленной к соответствующей тРНК, может быть собрана в полимер с помощью природных или мутантных рибосом (см. Sando, S. et al., (2007) J. Am. Chem. Soc. 129:6180-6186; Dedkova, L. et al. (2003) J. Am. Chem. Soc. 125: 6616-6617; Josephson, K., Hartman, M.C.T., and Szostak, J.W. (2005) J. Am. Chem. Soc. 127:11727-11735; Forster, A.C. et al. (2003) Proc. Natl. Acad. Sci. USA 100:6353-6357; Subtelny, A.O., Hartman, M.C.T., and Szostak, J.W. (2008) J. Am. Chem. Soc. 130:6131-6136; и Hartman, M.C.T. et al. (2007) PLoS ONE 2:e972).
[0060] Когда желательно использовать неприродные аминокислоты, может быть предпочтительным использовать очищенную трансляционную систему, в которой отсутствуют эндогенные аминоацилированные тРНК (Shimizu, Y. et al. (2001) Nat. Biotech. 19:751-755; Josephson, K., Hartman, M.C.T., and Szostak, J.W. (2005) J. Am. Chem. Soc. 127: 11727-11735; Forster, A.C. et al. (2003) Proc. Natl. Acad. Sci. USA 100: 6353-6357). Если неприродные аминокислоты используются в трансляционной системе in vitro на основе лизата или экстракта, может быть желательным истощение экстракта по эндогенным тРНК, как было описано ранее (см. Jackson, R.J., Napthine, S., and Brierley, I. (2001) RNA 7:765-773). Коммерчески доступной является система на основе очищенных трансляционных факторов из E. coli (PUREXPRESS™, New England Biolabs, Ipswich, MA). Эти системы особенно полезны в трансляции с неприродными аминокислотами для продукции пептидомиметиков.
[0061] При использовании природных аминокислот с системой трансляции in vitro на основе лизата или экстракта, трансляция зависит от ферментативного переноса аминокислот на тРНК тРНК-синтетазами, которые все являются компонентами экстрактов. В качестве альтернативы, системы трансляции in vitro, в которых используются очищенные факторы трансляции и рибосомы или обедненные по тРНК экстракты, требуют добавления аминоацилированных тРНК. В этих случаях, очищенные или синтезированные in vitro тРНК могут быть связаны с аминокислотами с использованием химических (см. Frankel, A., Millward, S.W., and Roberts, R.W. (2003) Chem. Biol. 10:1043-1050) или ферментативных процедур (Josephson, K., Hartman, M.C.T., and Szostak, J.W. (2005) J. Am. Chem. Soc. 127: 11727-11735; Murakami, H. et al. (2006) Nat. Methods 3:357-359).
[0062] В многочисленных публикациях описано выделение представленных на мРНК полипептидов из трансляционных комплексов, и они пригодны для использования с описанными в настоящем описании способами (Liu, R. et al. (2000). Methods Enzymol. 318:268-293; Baggio, R. et al. (2002). J. Mol. Recognit. 15:126-134; патент США № 6261804). Выделение представленных на мРНК полипептидов может быть облегчено за счет использования различных «тегов», которые включены в полипептид путем трансляции фиксированных последовательностей полипептид-кодирующей последовательности, и которые связываются с конкретными субстратами или молекулами. Многочисленные реагенты для захвата таких тегов являются коммерчески доступными, включая реагенты для захвата His-тега, FLAG-тега, тега из глутатион-S-трансферазы (GST-тега), стрептококкового тега, HSV-тега, T7-тега, S-тега, DsbA-тега, DsbC-тега, Nus-тега, Мус-тега, гемагглютининового тега (HA-тега) или Trx-тега (Novagen, Gibbstown, NJ; Pierce, Rockford, IL). Представленные на мРНК полипептиды также могут быть выделены путем связывания полиА-хвоста на мРНК с поли dT-смолой или с использованием комбинации поли А-хвоста и His-тега.
[0063] После выполнения реакция трансляции in vitro и перед стадией отбора мРНК-участок функционализированной РНК, как правило, обратно транскрибируют, получая гибридную молекулу РНК-ДНК. Это служит для защиты РНК от деградации, а также предупреждает образование вторичной структуры РНК, которая может связываться с мишенью, используемой для отбора, что привело бы к отбору несоответствующих продуктов (например, отбору РНК-аптамеров, а не полипептидных аптамеров).
[0064] После трансляции in vitro и выделения слитых полипептида и мРНК, полипептидный элемент может быть модифицирован путем внутримолекулярной или межмолекулярной сшивки, химической конъюгации, ферментативного расщепления, укорочения или удлинения с использованием дополнительных аминокислотных мономеров. Одним из способов достижения этой цели является включение неприродных аминокислот с реакционно-способными боковыми цепями в полипептиды, которые составляют библиотеку. После трансляции новосинтезированные полипептиды могут взаимодействовать с молекулами, которые специфически взаимодействуют с реакционно-способной боковой цепью включенной аминокислоты. Например, аминокислота с концевой алкиновой боковой цепью может быть включена в полипептидную библиотеку и затем введена в реакцию с азидосахаром с созданием библиотеки представляемых полипептидов с сахарами, присоединенными к алкинильным боковым цепям (Josephson, K., Hartman, M.C.T., and Szostak, J.W. (2005) J. Am. Chem. Soc. 127: 11727-11735). Для такой посттрансляционной конъюгации может быть использовано множество реакционно-способных боковых цепей, включая амины, карбоксильные группы, азиды, концевые алкины, алкены и тиолы.
[0065] Одна особенно полезная модификация основана на сшивке аминокислот с образованием циклических структур. Циклические области в полипептиде содержат жесткий домен, который снижает конформационную гибкость и степень свободы вращения, что приводит к очень высокой аффинности связывания с белками-мишенями. Ряд способов циклизации полипептида доступен специалистам в данной области и включен в настоящее описание путем ссылки. Как правило, для получения циклической молекулы используют химическую реакционную способность отдельных аминокислотных боковых цепей и/или карбокси- или амино-концов полипептида для сшивки двух участков полипептида. В одном способе, тиольную группу остатка цистеина сшивают с другим остатком цистеина с образованием дисульфидной связи. В некоторых вариантах осуществления тиольные группы остатков цистеина реагируют с бромметильными группами молекул поли(бромметил)бензола с образованием стабильных связей (см. Timmerman, P. et al., (2005) ChemBioChem 6:821-824, содержание которой включено в настоящий документ путем ссылки во всей полноте). Молекулы поли(бромметил)бензола по настоящему изобретению могут включать в себя, но не ограничиваются ими, 1,2-бис(бромметил)бензол, 1,3-бис(бромметил)бензол и 1,4-бис(бромметил)бензол. Молекулы бис, трис- и тетракис-(бромметил)бензола, например, может использоваться для создания мостиковых элементов с целью получения полипептидов с одной, двумя или тремя петлями, соответственно. Бромметильные группы молекулы поли(бромметил)бензола могут быть расположены на бензольном кольце на смежных кольцевых атомах углерода (орто- или о-положение), с кольцевым атомом углерода, разделяющим две группы (мета- или м-положение) или на противоположных кольцевых атомах углерода (пара- или п-положение). В некоторых вариантах осуществления м-бис(бромметил)бензол (также называемый в настоящем описании м-дибромксилолом) используется для образования циклических полипептидов. В некоторых вариантах осуществления о-бис(бромметил)бензол (также называемый в настоящем описании о-дибромксилолом) или п-бис(бромметил)бензол (также называемый в настоящем описании п-дибромксилолом) используются для образования циклических полипептидов. В некоторых вариантах осуществления тиольные группы остатков цистеина вступают в реакцию с другими реагентами, содержащими одну или несколько бром-функциональных групп с образованием стабильных связей. Такие реагенты могут включать в себя, но не ограничиваются ими, поли(бромметил)пиридин (включая, но не ограничиваясь этим, 2,6-бис(бромметил)пиридин), поли(бромметил)алкилбензол (включая, но не ограничиваясь этим, 1,2-бис(бромметил)-4-алкилбензол) и/или (Е)-1,4-дибромбут-2-ен).
[0066] В еще одном иллюстративном способе боковую цепь аминогруппы и концевую аминогруппу сшивают с дисукцинимидилглутаратом (см. Millward, S.W. et al., J. Am. Chem. Soc. 127:14142-14143, 2005). В других подходах циклизация осуществляется путем формирования тиоэфирной связи между двумя участками на полипептиде (см. Timmerman, P. et al., (2005) ChemBioChem 6:821-824; включенную в данный документ путем ссылки во всей полноте). Ферментативный способ основан на реакции между (1) цистеином и (2) дегидроаланиновой или дегидробутириновой группой, катализируемой лантибиотикосинтетазой, с образованием тиоэфирной связи (см. Levengood, M.R. and Van der Donk, W.A., Bioorg. and Med. Chem. Lett. 18:3025-3028, 2008). Дегидро-функциональная группа также может быть создана химическим путем за счет окисления содержащих селен боковых цепей аминокислот, включенных во время трансляции (см. Seebeck, F.P. and Szostak, J.W. J. Am. Chem. Soc. 2006).
[0067] Чтобы выделить комплексы, представляющие желаемые полипептиды, может быть проведена стадия селекции партиями с использованием библиотеки слитых мРНК-полипептидов (также указываемой в настоящем описании как библиотека мРНК-дисплея), которая создана с использованием вышеописанных способов, и которая может быть подвергнута (или нет) посттрансляционной модификации (например, циклизации полипептидов, как описано выше).
[0068] Как правило, С5 конъюгируют с твердым субстратом, таким как агароза или синтетические полимерные шарики. Существует множество способов иммобилизации C5 на твердой подложке. В одном особенно предпочтительном способе, С5 конъюгируют с биотином, а стрептавидиновые шарики используются для иммобилизации белка. Шарики, содержащие иммобилизованный С5, смешивают с библиотекой мРНК-дисплея и инкубируют при определенных условиях (например, при определенных температуре, ионной силе, содержании двухвалентных катионов и конкурирующих связывающих молекулах), которые позволяют определенным членам библиотеки связываться с мишенью. В качестве альтернативы, биотинилированный фермент может присутствовать свободным в растворе, и после связывания с соответствующим полипептидом слитые молекулы мРНК и полипептида, связавшиеся с C5, захватываются соответствующим образом модифицированными шариками.
[0069] Условия связывания можно варьировать, для того чтобы поменять жесткость отбора. Например, могут быть добавлены низкие концентрации конкурентного связывающего агента, чтобы гарантировать, что отобранные полипептиды имеют относительно более высокую аффинность. В качестве альтернативы, может быть выбрано очень короткое время инкубации, так чтобы отобрать только полипептиды с высокими значениями kon (скорости ассоциации). Таким образом, условия инкубации играют важную роль в определении свойств отобранных полипептидов. Также может использоваться отрицательная селекция. В этом случае, проводят селекцию, чтобы удалить полипептиды со сродством к подложке, с которой связана мишень (например, Сефарозой), путем взаимодействия библиотеки с субстратными шариками без белка-мишени. Эта стадия может удалить мРНК и кодируемые ими полипептиды, которые не являются специфичными к белку-мишени. Доступны многочисленные ссылки, описывающие, как проводить эксперименты по отбору. (См., например, патент США № 6258558, Smith, G.P. and Petrenko, V.A., (1997) Chem. Rev. 97:391-410; Keefe, A.D. and Szostak, J.W. (2001) Nature 15:715-718; Baggio, R. et al. (2002) J. Mol. Recog. 15:126-134 и Sergeeva, A. et al. (2006) Adv. Drug Deliv. Rev. 58:1622-1654; содержание которых полностью включено в данный документ путем ссылки).
[0070] Ожидается, что частота, с которой связывающие молекулы присутствуют в библиотеке случайных последовательностей, будет очень низкой. Таким образом, на начальной стадии отбора очень немногие полипептиды, отвечающие критериям отбора (и связанные с ними мРНК), должны быть выделены. Как правило, отбор повторяют с мРНК, отобранными в первом раунде отбора. Это осуществляют с использованием ПЦР для амплификации мРНК или соответствующих кДНК, отобранных в первом раунде, с последующей транскрипцией in vitro, чтобы получить новую библиотеку мРНК. Используют ПЦР-праймеры, соответствующие 5'- и 3'-концами мРНК в библиотеке. Как правило, 5'-праймер будет выступать в 5'-направлении от конца мРНК, так что бактериальный промотор, такой как Т7-промотор, будет добавляться к 5'-концу каждой амплифицированной молекулы. После амплификации двухцепочечная ДНК может быть использована в реакции транскрипции in vitro для создания мРНК для последующего цикла отбора.
[0071] Процесс отбора, как правило, включает в себя ряд раундов или циклов, в которых пул выбранных молекул постадийно обогащается по определенному набору последовательностей в конце каждого раунда. Условия отбора могут быть одинаковыми для каждого раунда, или условия могут меняться, например, с целью повышения жесткости отбора в последующих раундах. Ход отбора может контролироваться с использованием изотопно-меченых аминокислот, таких как 35S-метионин. Измеряют количество радиоактивно меченого полипептида, связанного с мишенью в каждом раунде, и постепенное накопление выделенной радиоактивной метки свидетельствует о прогрессирующем обогащении молекулами РНК, кодирующими полипептиды, имеющими сродство с мишенью. После любого раунда, продукты ПЦР могут быть клонированы и секвенированы. Как правило, клонирование и секвенирование выполняется после раунда, в котором заметное (например, >2% относительно фона для шариков, не имеющих иммобилизованного C5) количество радиоактивно меченого полипептида выделяется в связанном с мишенью пуле. Последовательности, которые присутствуют в нескольких выделенных образцах, потенциально кодируют полипептиды, которые специфически связываются с мишенью. В альтернативном варианте может быть выполнено высокопроизводительное секвенирование тысяч клонов после первого или последующих раундов. Последовательности, частота встречаемости которых увеличивается между раундами, например, третьим и четвертым, являются потенциально кодирующими полипептиды, которые специфически связываются с мишенью. Полипептид, кодируемый любой последовательностью, может быть транслирован или синтезирован, и протестирован на сродство связывания с исходным белком-мишенью, используемым в отборе.
[0072] Библиотеки и способы по настоящему изобретению могут быть использованы для оптимизации функции или свойств полипептида. В одном подходе используется мутагенная ПЦР (Keefe, A.D. and Szostak, J.W. (2001). Nature 15:715-718) для введения изменчивости последовательностей в библиотеку после обогащения популяции полипептидами с определенным уровнем аффинности связывания. В качестве альтернативы, единственная последовательность РНК, кодирующая полипептид с определенными свойствами связывания, может быть реплицирована, но с определенным уровнем мутаций, или может быть проведена мутагенная ПЦР, чтобы получить пул мутантных молекул. Ожидается, что после in vitro трансляции полученная смесь молекул мРНК из такого пула будет кодировать полипептиды с улучшенной, аналогичной или сниженной аффинностью по сравнению с исходной последовательностью, и селекция, проведенная на мРНК из такого пула, может, как ожидается, идентифицировать полипептиды с улучшенной аффинностью, если во время селекции используется соответствующий режим жесткости отбора.
[0073] Во втором подходе проводят направленную оптимизацию. Последовательность, кодирующую полипептид с установленным связывающими или функциональными свойствами, подвергают сайт-направленному мутагенезу, в результате чего образуется набор последовательностей, причем каждая последовательность имеет один кодон, замененный, например, кодоном аланина. Количество последовательностей в наборе равно числу аминокислотных остатков, которые должны быть мутированы. После трансляции in vitro полипептидный продукт каждого «аланин-сканирующего» мутанта проверяется на наличие связывающих или функциональных свойств. Участки, в которых аланиновая замена влияет на связывание или функцию полипептида, считаются критическими остатками. Аналогичным образом может быть выполнено N-метил-сканирование, так что каждый остаток заменяют на N-метильные производные, и могут быть идентифицированы позиции в полипептидной цепи, допускающие N-метильные замены.
[0074] В качестве альтернативы, последовательности могут быть объединены, подвергнуты одному или нескольким циклам селекции с высокой жесткостью отбора, и выделен пул последовательностей, представляющих полипептиды с высокой аффинностью связывания. Критические остатки определяют после секвенирования выделенной ДНК как те, которые не могут быть заменены остатком аланина без потери активности. После идентификации критических остатков получают пул молекул мРНК, кодирующих широкий спектр природных (или неприродных) аминокислот в каждой из критических позиций. С полученным пулом проводят один или несколько раундов селекции высокой жесткости (с соответствующей смесью тРНК, несущих природные или неприродные аминокислоты), и последовательности, представляющие полипептиды с высокой аффинностью связывания, выделяют после трансляции in vitro. Таким образом, может быть идентифицирован оптимальный полипептид. Поскольку оптимальная последовательность необязательно может быть идентифицирована путем объединения оптимальных остатков в отдельных участках, полезно проводить тестирование мутаций в нескольких сайтах в комбинации друг с другом.
[0075] Оба аланиновое и N-метильное сканирование могут также выполняться с использованием подходов химического синтеза, таких как твердофазный синтез полипептидов (см., например, Coin, I et al. (2007); Nature Protocols 2(12):3247-56, содержание которой полностью включено в данный документ путем ссылки).
[0076] После идентификации пула, популяции или подмножества полипептидов можно провести их оценку в отношении терапевтического или диагностического применения, включая улучшенные фармакокинетические и/или фармакодинамические свойства.
[0077] В одном варианте осуществления полипептиды оценивают по одной или нескольким из аффинности связывания с мишенью, активности в биохимических или клеточных анализах, устойчивости к действию протеаз, in vitro или in vivo прохождению в клетки, свойствам, относящимся к пригодности для использования в качестве фармацевтического средства, таким как связывание с белками плазмы, метаболизм (в микросомах, гепатоцитах или плазме), ингибирование P-гликопротеина (PGP) и ингибирование цитохрома Р450. Полипептиды по настоящему изобретению могут также тестироваться по пероральной биодоступности, токсичности, ингибированию продукта Ether-a-go-go-связанного гена человека (HERG), времени полужизни в крови, другим фармакокинетическим и фармакодинамическим параметрам и эффективности в животных моделях болезней.
Полипептиды по изобретению
[0078] В соответствии с настоящим изобретением, после идентификации одного полипептида или пула потенциальных полипептидных молекул, они могут пройти через один или несколько раундов оптимизации соотношения структуры и активности (SAR) с использованием стандартных химических методов и методов полипептидного синтеза. Такая оптимизация может включать в себя исключение заряженных полярных боковых цепей (Asp, Glu, Arg, Lys), которые могут препятствовать проникновению в клетки, исключение боковых цепей, которые ускоряют метаболизм пептида (Tyr, Met, Trp, Cys), улучшение растворимости, сокращение ненужного молекулярного веса, исключение вращающихся связей и изменение липофильности.
[0079] В одном варианте осуществления целью настоящего изобретения является создание циклических пептидомиметиков, разработанных, чтобы быть метаболически стабильными, проникающими в клетки и/или перорально доступными.
Аминокислотные варианты
[0080] Используемый в настоящем описании термин «аминокислота» включает остатки природных аминокислот, а также неприродные аминокислоты. Этот термин также включает в себя аминокислоты, несущие обычную аминозащитную группу (например, ацетил или бензилоксикарбонил), а также природные и неприродные аминокислоты, защищенные на карбоксиконце (например, в виде (C1-C6)алкильного, фенильного или бензильного эфира или амида, или в виде альфа-метилбензиламида). Другие подходящие амино- и карбокси-защитные группы известны специалистам в данной области техники (см., например, Greene, T. W.; Wutz, P. G. M., Protecting Groups In Organic Synthesis; second edition, 1991, New York, John Wiley & sons, Inc., и документы, приведенные в них). Полипептиды и/или полипептидные композиции по настоящему изобретению могут также включать модифицированные аминокислоты.
[0081] Неприродные аминокислоты, полезные для оптимизации полипептидов и/или полипептидных композиций по настоящему изобретению, включают, но не ограничиваются ими, 1,2,3,4-тетрагидроизохинолин-1-карбоновую кислоту, 1-амино-2,3-гидро-1H-инден-1-карбоновую кислоту, гомолизин, гомоаргинин, гомосерин, 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, бета-аланин, аминопропионовую кислоту, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 5-аминовалериановую кислоту, 5-аминокапроновую кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, десмозин, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, алло-гидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, алло-изолейцин, N-метилпентилглицин, нафтилаланин, орнитин, пентилглицин, тиопролин, норвалин, трет-бутилглицин, фенилглицин, азатриптофан, 5-азатриптофан, 7-азатриптофан, 4-фторфенилаланин, пеницилламин, саркозин, гомоцистеин, 1-аминоциклопропанкарбоновую кислоту, 1-аминоциклобутанкарбоновую кислоту, 1-аминоциклопентанкарбоновую кислоту, 1-аминоциклогексанкарбоновую кислоту, 4-аминотетрагидро-2H-пиран-4-карбоновую кислоту, (S)-2-амино-3-(1H-тетразол-5-ил)пропионовую кислоту, циклопентилглицин, циклогексилглицин, циклопропилглицин, η-ω-метиларгинин, 4-хлорфенилаланин, 3-хлортирозин, 3-фтортирозин, 5-фтортриптофан, 5-хлортриптофан, цитруллин, 4-хлор-гомофенилаланин, гомофенилаланин, 4-аминометил-фенилаланин, 3-аминометил-фенилаланин, октилглицин, норлейцин, транексамовую кислоту, 2-аминовалериановую кислоту, 2-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминокаприловую кислоту, 2-аминопеларгоновую кислоту, 2-аминокаприновую кислоту, 2-аминоундекановую кислоту, 2-аминолауриновую кислоту, аминовалериановую кислоту и 2-(2-аминоэтокси)уксусную кислоту, пипеколиновую кислоту, 2-карбоксиазетидин, гексафторлейцин, 3-фторвалин, 2-амино-4,4-дифтор-3-метилбутанкарбоновую кислоту, 3-фторизолейцин, 4-фторизолейцин, 5-фторизолейцин, 4-метилфенилглицин, 4-этилфенилглицин, 4-изопропилфенилглицин, (S)-2-амино-5-азидовалериановую кислоту (также называемую в настоящем описании «Х02»), (S)-2-аминогепт-6-еновую кислоту (также называемую в настоящем описании «X30»), (S)-2-аминопент-4-иновую кислоту (также называемую в настоящем описании «X31»), (S)-2-аминопент-4-еновую кислоту (также называемую в настоящем описании «X12»), (S)-2-амино-5-(3-метилгуанидино)валериановую кислоту, (S)-2-амино-3-(4-(аминометил)фенил)пропионовую кислоту, (S)-2-амино-3-(3-(аминометил)фенил)пропионовую кислоту, (S)-2-амино-4-(2-аминобензо[d]оксазол-5-ил)масляную кислоту, (S)-лейцинол, (S)-валинол, (S)-трет-лейцинол, (R)-3-метилбутан-2-амин, (S)-2-метил-1-фенилпропан-1-амин и (S)-N,2-диметил-1-(пиридин-2-ил)пропан-1-амин, (S)-2-амино-3-(оксазол-2-ил)пропионовую кислоту, (S)-2-амино-3-(оксазол-5-ил)пропионовую кислоту, (S)-2-амино-3-(1,3,4-оксадиазол-2-ил)пропионовую кислоту, (S)-2-амино-3-(1,2,4-оксадиазол-3-ил)пропионовую кислоту, (S)-2-амино-3-(5-фтор-1Н-индазол-3-ил)пропионовую кислоту и (S)-2-амино-3-(1H-индазол-3-ил)пропионовую кислоту, (S)-2-амино-3-(оксазол-2-ил)масляную кислоту, (S)-2-амино-3-(оксазол-5-ил)масляную кислоту, (S)-2-амино-3-(1,3,4-оксадиазол-2-ил)масляную кислоту, (S)-2-амино-3-(1,2,4-оксадиазол-3-ил)масляную кислоту, (S)-2-амино-3-(5-фтор-1Н-индазол-3-ил)масляную кислоту и (S)-2-амино-3-(1H-индазол-3-ил)масляную кислоту, 2-(2'-метоксифенил)-2-аминоуксусную кислоту, тетрагидро-3-изохинолинкарбоновую кислоту и их стереоизомеры (включая, но не ограничиваясь ими, D и L-изомеры).
[0082] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов или полипептидных композиций по изобретению, включают, но не ограничиваются ими, фторированные аминокислот, в которых один или несколько связанных с углеродных атомов водорода замещены фтором. Число включенных атомов фтора может находиться в диапазоне от 1 до всех атомов водорода включительно. Примеры таких аминокислот включают, но не ограничиваются ими, 3-фторпролин, 3,3-дифторпролин, 4-фторпролин, 4,4-дифторпролин, 3,4-дифторпролин, 3,3,4,4-тетрафторпролин, 4-фтортриптофан, 5-фтортриптофан, 6-фтортриптофан, 7-фтортриптофан и их стереоизомеры.
[0083] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов или полипептидных композиций по настоящему изобретению, включают, но не ограничиваются теми, которые являются двухзамещенными по α-углероду. К ним относятся аминокислоты, в которых два заместителя на α-углероде являются одинаковыми, например, α-аминоизомасляная кислота и 2-амино-2-этилмасляная кислота, а также те, в которых заместители разные, например, α-метилфенилглицин и α-метилпролин. Кроме того, заместители на α-углероде могут быть объединены, образуя кольцо, например, 1-аминоциклопентанкарбоновая кислота, 1-аминоциклобутанкарбоновая кислота, 1-аминоциклогексанкарбоновая кислота, 3-аминотетрагидрофурин-3-карбоновая кислота, 3-аминотетрагидропиран-3-карбоновая кислота, 4-аминотетрагидропиран-4-карбоновая кислота, 3-аминопирролидин-3-карбоновая кислота, 3-аминопиперидин-3-карбоновая кислота, 4-аминопиперидин-4-карбоновая кислота и их стереоизомеры.
[0084] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов или полипептидных композиций по настоящему изобретению, включают, но не ограничиваются ими, аналоги триптофана, в которых индольная система заменяется другой 9- или 10-членной бициклической системой, содержащей 0, 1, 2, 3 или 4 гетероатома, независимо выбранных из N, О или S. Каждая кольцевая система может быть насыщенной, частично ненасыщенной или полностью ненасыщенной. Кольцевая система может быть замещена 0, 1, 2, 3 или 4 заместителями по любому замещаемому атому. Каждый заместитель независимо выбран из H, F, Cl, Br, CN, COOR, CONRRʹ, оксо-, OR, NRRʹ. Каждый R и Rʹ независимо выбраны из Н, С1-С20-алкила, C1-С20-алкил-O-C1-20-алкила.
[0085] В некоторых вариантах осуществления аналоги триптофана (также указываемые в настоящем описании как «триптофановые аналоги»), которые могут быть использованы при оптимизации полипептидов или полипептидных композиций по изобретению, включают, но не ограничиваются ими, 5-фтортриптофан [(5-F)W], 5-метил-О-триптофан [(5-MeO)W], 1-метилтриптофан [(1-Ме-W) или (1-Me),W], D-триптофан (D-Trp), азатриптофан (включая, но не ограничиваясь ими, 4-азатриптофан, 7-азатриптофан и 5- азатриптофан) 5-хлортриптофан, 4-фтортриптофан, 6-фтортриптофан, 7-фтортриптофан и их стереоизомеры. За исключением случаев, где указано иное, термин «азатриптофан» и его сокращение «azaTrp», используемое в настоящем описании, относятся к 7-азатриптофану.
[0086] Модифицированные аминокислотные остатки, полезные при оптимизации полипептидов и/или полипептидных композиций по настоящему изобретению, включают, но не ограничиваются ими, те, которые химически блокированы, обратимо или необратимо, или химически модифицированы по своей N-концевой аминогруппе или группе боковой цепи, или химически модифицированы по амидному каркасу, например, N-метилированы; стереоизомеры или остатки D (неприродных аминокислотам) и L (природных аминокислот), в которых функциональные группы боковой цепи химически модифицированы в другую функциональную группу. Например, модифицированные аминокислоты включают в себя, без ограничения, метионинсульфоксид; метионинсульфон; бета-метиловый эфир аспарагиновой кислоты, модифицированную аспарагиновую кислоту; N-этилглицин, модифицированный глицин; или аланин-карбоксамид и модифицированный аланин. Неприродные аминокислоты могут быть приобретены у компании Sigma-Aldrich (St. Louis, MO), Bachem (Torrance, CA) или у других поставщиков. Неприродные аминокислоты могут дополнительно включать в себя любые из тех, которые перечислены в таблице 2 патентной публикации США US 2011/0172126, содержание которой полностью включено в настоящее описание путем ссылки.
[0087] В некоторых вариантах осуществления аминокислотные последовательности полипептидов и/или полипептидных композиций по настоящему изобретению могут содержать только природные аминокислоты. Хотя в данной области техники известно, что термины пептиды, полипептиды и/или их фрагменты подразумевают относительный размер, эти термины в контексте настоящего изобретения не следует рассматривать как ограничивающие по размеру различные молекулы на основе полипептидов, приведенные в настоящем описании, и которые охвачены данным изобретением, если не указано иное. В некоторых вариантах осуществления полипептиды могут содержать как встречающиеся в природе и не встречающиеся в природе и/или модифицированные аминокислоты, или могут исключительно состоять из не встречающихся в природе аминокислот.
Полипептидные варианты
[0088] Согласно настоящему изобретению любая молекула на основе аминокислот (природная или неприродная) может быть названа «полипептидом», и этот термин охватывает «пептиды», «пептидомиметики» и «белки». Полипептиды также входят в категорию белков и традиционно считается, что они имеют размер от примерно 4 до примерно 50 аминокислот. Дипептиды, имеющие два аминокислотных остатка, относятся к категории полипептидов, так же как трипептиды (полипептиды, содержащие три аминокислоты). Полипептиды больше примерно 50 аминокислот обычно называют «белками». Последовательности полипептидов могут быть линейными или циклическими. Например, циклический полипептид может быть получен при образовании или может быть результатом образования дисульфидных связей между двумя остатками цистеина в последовательности. Полипептид может быть циклизован через карбоксиконец, аминоконец или через любую другую удобную точку присоединения, такую как, например, сера в цистеине или любой боковой цепи аминокислотного остатка или другая связь, включающая, но не ограниченная этим, малеимидную связь, амидную связь, сложноэфирную связь, простую эфирную связь, тиоэфирную связь, гидразоновую связь или ацетамидную связь. В некоторых вариантах осуществления циклические полипептиды образуются, когда молекула действует в качестве мостикового элемента для соединения двух или большего числа областей полипептида.
[0089] Термин «вариант аминокислотной последовательности» относится к полипептидам с некоторыми отличиями в их аминокислотных последовательностях по сравнению с исходной, эталонной или нативной последовательностью. Варианты аминокислотных последовательностей могут иметь замены, делеции и/или инсерции в определенных положениях в пределах аминокислотной последовательности. Как правило, варианты будут иметь по меньшей мере около 70% гомологии с нативной или исходной последовательностью, и, предпочтительно, они будут по меньшей мере примерно на 80%, более предпочтительно, по меньшей мере примерно на 90% гомологичны нативной или исходной последовательности.
[0090] «Гомология» в отношении аминокислотных последовательностей определяется как процент остатков в аминокислотной последовательности-кандидате, которые идентичны остаткам во второй аминокислотной последовательности после выравнивания последовательностей и введения разрывов, если это необходимо для достижения максимального процента гомологии. Способы и компьютерные программы для выравнивания хорошо известны в данной области техники. Понятно, что гомология зависит от вычисления процента идентичности, но может различаться по величине из-за разрывов и штрафов, учитываемых в вычислениях.
[0091] Под «гомологами» в отношении аминокислотных последовательностей подразумевают соответствующую последовательность из другого биологического вида, имеющую существенную идентичность со второй последовательностью второго вида.
[0092] «Аналоги» означает включение вариантов аминокислотных последовательностей, которые отличаются изменением одной или нескольких аминокислот, например, заменой, добавлением или делецией аминокислотных остатков, которые все еще сохраняют одно или несколько из свойств родительского или исходного полипептида.
[0093] Настоящее изобретение предусматривает несколько типов композиций, которые включают полипептиды, включая варианты и производные. К ним относятся замещенные, инсерционные, делеционные и ковалентные варианты и производные. Термин «производное» используется в качестве синонима термина «вариант» и относится к молекуле, которая была модифицирована или изменена любым образом относительно эталонной или исходной молекулы.
[0094] Таким образом, в настоящее изобретение включены полипептиды, содержащие замены, вставки и/или добавления, делеции и ковалентные модификации. Например, последовательности тегов или аминокислоты, такие как один или несколько лизинов, могут быть добавлены к полипептидным последовательностям по изобретению (например, на N- или С-конце). Последовательности тегов могут быть использованы для очистки или определения местоположения полипептида. Лизины могут быть использованы для увеличения растворимости полипептида или для обеспечения сайт-специфичных модификаций, таких как, но не ограниченных ими, биотинилирование или ПЭГилирование. В некоторых случаях полипептиды могут быть дестиобиотинилированы. Используемый в настоящем описании, полипептид, который является дестиобиотинилированным, может содержать молекулу дестиобиотина (Dtb), конъюгированную с эпсилон-аминогруппой остатка лизина. Такие лизиновые остатки могут являться в некоторых случаях С-концевыми остатками. В качестве альтернативы, аминокислотные остатки, расположенные на карбокси- и амино-концевых участках аминокислотной последовательности полипептида, необязательно, могут быть удалены, что дает укороченные последовательности. Некоторые аминокислоты (например, С-концевые или N-концевые остатки) могут в альтернативном варианте быть удалены в зависимости от предполагаемого использования последовательности, как, например, экспрессии последовательности в виде части более крупной последовательности, которая является растворимой или связанной с твердой подложкой.
[0095] «Замещенные варианты» в отношении полипептидов представляют собой те, в которых по меньшей мере один аминокислотный остаток в нативной или исходной последовательности удален, и на его место вставлена другая аминокислота. Эти замены могут быть одиночными, когда замещена только одна аминокислота в молекуле, или они могут быть множественными, когда две или большее число аминокислот замещены в одной молекуле.
[0096] В настоящем описании термин «консервативная аминокислотная замена» относится к замене аминокислоты, которая обычно присутствует в последовательности, другой аминокислотой, имеющей аналогичные размер, заряд или полярность. Примеры консервативных замен включают замену неполярного (гидрофобного) остатка, такого как изолейцин, валин и лейцин, другим неполярным остатком. Аналогично, примеры консервативных замен включают замену одного полярного (гидрофильного) остатка другим, такую как между аргинином и лизином, между глутамином и аспарагином, и между глицином и серином. Кроме того, замена основного остатка, такого как лизин, аргинин или гистидин, на другой, или замена одного кислотного остатка, такого как аспарагиновая кислота или глутаминовая кислота, на другой кислотный остаток, являются дополнительными примерами консервативных замен. Примеры неконсервативных замен включают замену неполярного (гидрофобного) аминокислотного остатка, такого как изолейцин, валин, лейцин, аланин, метионин, на полярный (гидрофильный) остаток, такой как цистеин, глутамин, глутаминовая кислота или лизин, и/или замену полярного остатка на неполярный остаток.
[0097] «Изостерами» являются две или несколько молекул, которые демонстрируют некоторое сходство биологических свойств в результате содержания одинакового числа общих или валентных электронов в одинаковом расположении, и которые состоят из разных атомов, необязательно, с одинаковым числом атомов. Существует два класса изостер - классические и неклассические. Классические изостеры имеют одинаковое число атомов и/или одинаковое число валентных электронов, тогда как неклассические изостеры представляют собой молекулы, которые дают аналогичный биологический эффект in vivo, но не имеют одинакового числа атомов и/или валентных электронов.
[0098] Согласно настоящему изобретению «изостеры пептидной связи» определяются как изостеры, обладающие свойствами, напоминающими пептидную связь. Изостеры пептидной связи могут быть линейного типа, включая по меньшей мере одну замену пептидной связи, или могут быть циклическими и включают функцию карбоновой кислоты и амина. Такая замена может являться любым фрагментом, который улучшает физико-химические, структурные или функциональные свойства молекулы. Замена пептидной связи может увеличить метаболическую стабильность полипептидов и уменьшить или увеличить гибкость. Изостерами пептидной связи, описанными в настоящем описании, могут быть изостеры моно-, ди-, три-, тетра-, пента-, секста-, септа-, окта-, нона- или дека-пептидной связи, что означает, что по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 пептидных связей могут быть заменены. Неограничивающие примеры линейных изостер дипептидной связи для амидных (пептидных) связей включают тиоамид, сульфаниламид, сульфонат, фосфонамид, фосфонат, фосфотиоат, фосфинат, алкан, 1- или 2-гидроксиэтилен, дигидроксиэтилен, C-C одинарную связь (алкан), C-C двойную связь (алкен), C-C тройную связь (алкин), C-O связь (метиленоксид), O-N или N-O связь, (метиленамино), триазол, гидразид, мочевину, кетон, уретановую связь, (ди)галогеналкен, метиленмеркапто, метиленамино, трифторэтиламино, гидразид, амидоксид и другие, известные специалистам в данной области.
[0099] Изостеры пептидной связи могут также быть циклическими молекулами, которые несут аминогруппу и карбоксигруппу. Неограничивающие примеры циклических изостер пептидной связи с различными размерами колец включают карбациклы, азациклы и оксациклы. Азациклы могут быть основаны на алкалоидном ядре, которое образует изостеру с бициклической структурой. Пример азациклической изостеры включает изостеру на основе триазольного кольца, образуемого в результате катализируемого медью азид-алкинового циклоприсоединения. Циклические изостеры пептидной связи, описанные в настоящем описании, могут быть циклическими изостерами би-, три-, тетра-, пента-, секста-, септа, окта-, нона-, дека-пептидов.
[00100] «Инсерционные варианты» в отношении полипептидов представляют собой варианты с одной или несколькими аминокислотами, вставленными в непосредственной близости с аминокислотой в определенном положении в нативной или исходной последовательности. «В непосредственной близости» с аминокислотой означает соединенное с альфа-карбокси или с альфа-амино функциональной группой аминокислоты.
[00101] «Делеционные варианты» в отношении полипептидов, представляют собой варианты с одной или несколькими аминокислотами, удаленными в нативной или исходной аминокислотной последовательности. Как правило, делеционные варианты будут иметь одну или несколько аминокислот, удаленных в определенной области молекулы.
[00102] «Укороченные варианты» в отношении полипептидов представляют собой варианты с одной или несколькими аминокислотами в нативной или исходной аминокислотной последовательности, удаленными с любого конца полипептида.
[00103] Согласно настоящему изобретению полипептиды могут быть модифицированы путем добавления одной или нескольких соединительных групп. В некоторых вариантах осуществления полипептиды могут быть введены в комбинации с одной или несколькими дополнительными молекулами.
[00104] Используемый в настоящем описании термин «конъюгат» относится к любой молекуле или фрагменту, соединенными с другой молекулой. В настоящем изобретении, конъюгаты могут быть на полипептидной (аминокислотной) основе или нет. Конъюгаты могут содержать липиды, низкомолекулярные соединения, РНК, ДНК, полипептиды, полимеры или их комбинации. Функционально, конъюгаты могут служить в качестве направляющих молекул или могут служить в качестве полезной нагрузки, которая должна быть доставлена в клетку, орган или ткань. Конъюгаты, как правило, представляют собой ковалентные модификации, внесенные в результате реакции целевых аминокислотных остатков или концов полипептида с органическим дериватизирующим агентом, который способен вступать в реакцию с выбранными боковыми цепями или концевыми остатками. Такие модификации известны обычному специалисту в данной области техники и выполняются без излишних экспериментов.
[00105] Процесс конъюгации может включать в себя ПЭГилирование, липидизацию, добавление альбумина, биотинилирование, дестиобиотинилирование, добавление других полипептидных хвостов или пересадку на Fc-домены антител, CDR-области интактных антител или домены антител, полученные любым образом. Конъюгат может включать в себя якорные молекулы («якори»), включающие холестеринолеатную группу, холестеринлауратную группу, α-токоферольную группу, фитольную группу, олеатную группу или ненасыщенную холестеринэфирную группу или липофильное соединение, выбранное из ацетанилидов, анилидов, аминохинолинов, бензгидрильных соединений, бензодиазепинов, бензофуранов, каннабиноидов, циклических полипептидов, дибензазепинов, гликозидов наперстянки, алкалоидов спорыньи, флавоноидов, имидазолов, хинолина, макролидов, нафталинов, опиатов (таких как, но не ограниченных ими, морфины или другие психоактивные вещества), оксазинов, оксазолов, фенилалкиламинов, пиперидинов, полициклических ароматических углеводородов, пирролидинов, пирролидинонов, стильбенов, сульфонилмочевин, сульфонов, триазолов, тропанов и алкалоидов барвинка.
[00106] Используемый в настоящем описании термин «ковалентное производное» в отношении полипептида включает в себя модификацию нативного или исходного полипептида органическим белковым или небелковой дериватизирующим агентом и/или посттрансляционную модификацию. Ковалентные модификации традиционно добавляются путем реакции целевых аминокислотных остатков полипептида с органическим дериватирующим агентом, который способен вступать в реакцию с выбранными боковыми цепями или концевыми остатками, или путем использования механизмов посттрансляционных модификаций, которые функционируют в выбранных рекомбинантных клетках-хозяевах. Полученные ковалентные производные могут быть использованы в программах, направленных на выявление остатков, важных для биологической активности, для иммунологического анализа или для получения антител к белку для иммуноаффинной очистки рекомбинантного белка. Такие модификации известны обычному специалисту в данной области техники и выполняются без излишних экспериментов.
[00107] Некоторые посттрансляционные модификации являются результатом действия рекомбинантных клеток-хозяев на экспрессированный полипептид. Глутаминильный и аспарагинильный остатки можно деамидировать с образованием соответствующих глутамильных и аспартильных остатков. В альтернативном варианте эти остатки можно деамидировать в слабокислых условиях. Любая форма этих остатков может присутствовать в полипептидах, полученных в соответствии с настоящим изобретением.
[00108] Другие посттрансляционные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп тирозинильного, серильного или треонильного остатков, метилирование альфа-аминогрупп лизина, аргинина и боковых цепей гистидина (Creighton, T. E., Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, 1983, pp. 79-86).
[00109] Ковалентные модификации специально включают соединение небелковых полимеров с полипептидами по настоящему изобретению. Небелковые полимеры могут включать гидрофильный синтетический полимер, то есть полимер иначе не встречается в природе. Однако полимеры, которые существуют в природе и продуцируются рекомбинантными или in vitro способами являются полезными, поскольку представляют собой полимеры, которые выделены из природного окружения. Гидрофильные поливинильные полимеры входят в объем настоящего изобретения, например, поливиниловый спирт и поливинилпирролидон. Эти полипептиды могут быть связаны с различными небелковыми полимерами, такими как полиэтиленгликоль, полипропиленгликоль или полиоксиалкилены посредством способа, изложенного в патентах США №№ 4640835, 4496689, 4301144, 4670417, 4791192 или 4179337.
[00110] «Признаки» в отношении полипептидов определяются как компоненты молекулы на основе индивидуальных аминокислотных последовательностей. Признаки полипептида по настоящему изобретению, включают форму поверхности, местные конформационные формы, складки, петли, полупетли, домены, полудомены, сайты, концы или любую их комбинацию.
[00111] При использовании в настоящем описании в отношении полипептидов термин «складка» относится к получающейся конформации аминокислотной последовательности после минимизации энергии. Складка может возникнуть на вторичном или третичном уровне процесса сворачивания полипептида. Примеры складок вторичного уровня включают бета-листы и альфа-спирали. Примеры третичных складок включают домены и области, образованные за счет агрегации или разделения физико-химически отличающихся областей. Области, образованные таким образом, включают в себя гидрофобные и гидрофильные карманы и т.п.
[00112] Используемый в настоящем описании термин «изгиб» в отношении конформации белка означает изгиб, который меняет направление полипептидной цепи и может включать один, два, три или большее число аминокислотных остатков.
[00113] В настоящем описании, когда речь идет о полипептидах, термин «петля» относится к структурному признаку полипептида, который может служить для изменения направления основной цепи полипептида на противоположное. Если петля находится в полипептиде и изменяет только направление основной цепи, она может включать в себя четыре или большее число аминокислотных остатков. Oliva и др. выделили по меньшей мере 5 классов белковых петель (Oliva, B. et al., J Mol Biol. 1997 Mar 7;266(4):814-30; содержание которой полностью включено в настоящее описание путем ссылки). Петли могут быть открытыми или замкнутыми. Замкнутые или «циклические» петли могут образоваться, когда две аминокислоты связаны мостиковым элементом. Циклическая петля включает в себя аминокислоты в полипептиде, находящиеся между мостиковыми аминокислотами. Циклические петли могут включать в себя 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее число аминокислот.
[00114] В настоящем описании, когда речь идет о полипептидах, термин «полупетля» относится к части идентифицированной петли, содержащей по меньшей мере половину числа аминокислот в петле, из которых она образуется. Понятно, что петли могут не всегда содержать четное число аминокислотных остатков. Поэтому в тех случаях, когда петля содержит или идентифицирована, как содержащая нечетное число аминокислот, полупетля из петли с нечетным числом аминокислот будет содержать часть с целым числом аминокислот или часть со следующим после целым числом аминокислот (число аминокислот в петле/2 +/- 0,5 аминокислот). Например, петля, идентифицированная как 7-аминокислотная петля, может давать полупетли из 3 или 4 аминокислот (7/2=3,5 +/- 0,5 может составлять 3 или 4).
[00115] В настоящем описании, когда речь идет о белках, термин «область» относится к зоне или к общей области. В некоторых вариантах осуществления, когда речь идет о белке, область может включать в себя линейную последовательность аминокислот белка или может содержать определенную вторичную или третичную структуру и/или один или несколько признаков, или белковых доменов.
[00116] Используемый в настоящем описании термин «домен», когда речь идет о белках, относится к мотиву полипептида, имеющему одну или несколько идентифицируемых структурных (таких как вторичные или третичные структуры) или функциональных характеристик или свойств (например, связывающую способность, выступающую в качестве участка для белок-белковых взаимодействий).
[00117] Используемый в настоящем описании термин «полудомен», когда речь идет о белках, относится к части идентифицированного домена, содержащей по меньшей мере половину числа аминокислот в домене, из которого он образуется. Понятно, что домены могут не всегда содержать четное число аминокислотных остатков. Поэтому в тех случаях, когда домен содержит или идентифицирован, как содержащий нечетное число аминокислот, полудомен из домена с нечетным числом аминокислот будет содержать часть с целым числом аминокислот или часть со следующим после целым числом аминокислот (число аминокислот в петле/2 +/- 0,5 аминокислот). Например, домен, идентифицированный как 7-аминокислотный домен, может давать полудомены из 3 или 4 аминокислот (7/2=3,5 +/- 0,5 может составлять 3 или 4). Следует также понимать, что в доменах или полудоменах могут быть идентифицированы субдомены, причем эти субдомены обладают не всеми структурными или функциональными свойствами, определенными у доменов или полудоменов, из которых они были получены. Следует также понимать, что аминокислоты, которые составляют любой из типов доменов в данном изобретении, необязательно, должны быть расположены последовательно в основной цепи полипептида (т.е. непоследовательные аминокислоты могут укладываться в структуру, образуя домен, полудомен или субдомен).
[00118] Используемый в настоящем описании в отношении полипептидов термин «сайт», когда речь идет об аминокислотных вариантах, используется параллельно с «аминокислотным остатком» и «боковой цепью аминокислоты». Сайт представляет собой положение в полипептиде, которое можно модифицировать, манипулировать, изменять, дериватизировать или варьировать в молекулах на основе полипептидов по настоящему изобретению.
[00119] В настоящем описании термины «концы» или «конец» в отношении полипептидов относятся к концевой части полипептида. Такая концевая часть не ограничивается только первым или последним сайтом полипептида, а может включать в себя дополнительные аминокислоты в концевых областях. Молекулы на основе полипептидов по настоящему изобретению могут быть охарактеризованы, как имеющие оба N- и С-конца. Полипептиды и/или полипептидные композиции по настоящему изобретению в некоторых случаях состоят из нескольких полипептидных цепей, объединенных дисульфидными связями или нековалентными силами (мультимеры, олигомеры). Такого рода белки будут иметь несколько N- и С-концов. В альтернативном варианте концы полипептидов могут быть модифицированы таким образом, что они начинаются или заканчиваются (в зависимости от обстоятельств) неполипептидной молекулой, как, например, органический конъюгат.
[00120] В одном варианте осуществления полипептиды по настоящему изобретению могут включать в себя концевую область. В настоящем описании термин «концевая область» представляет собой концевую область из аминокислот, которые могут включать цистеин. Концевая область может являться N- и/или С-концевой областью. В некоторых вариантах осуществления концевые области могут быть соединены с родительскими полипептидами с использованием мостикового элемента. Используемый в настоящем описании термин «родительский полипептид» относится к части полипептида, которая не включает в себя концевую область. Концевая область может быть отделена от исходного полипептида 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большим числом остатков. Добавленные остатки могут быть выбраны из, но не ограничены ими, любой природной или искусственной аминокислоты, N-метилированной формы любой природной или искусственной аминокислоты, D-стереоизомера любой природной или искусственной аминокислоты, норвалина, трет-бутилглицина, фенилглицина, азатриптофана, 7-азатриптофана, 4-фторфенилаланина, пеницилламина, саркозина, гомоцистеина, 1-аминоциклопропанкарбоновой кислоты, 1-аминоциклобутанкарбоновой кислоты, 1-аминоциклопентанкарбоновой кислоты, 1-аминоциклогексанкарбоновой кислоты, 4-аминтетрагидро-2H-пиран-4-карбоновой кислоты, аминоизомасляной кислоты, (S)-2-амино-3-(1H-тетразол-5-ил)пропионовой кислоты, циклопентилглицина, циклогексилглицина, циклопропилглицина, η-ω-метиларгинина, 4-хлорофенилаланина, 3-хлортирозина, 3-фтортирозина, 5-фтортриптофана, 5-хлортриптофана, цитруллина, 4-хлор-гомофенилаланина, гомофенилаланина, 4-аминометилфенилаланина, 3-аминометилфенилаланина, октилглицина, норлейцина, транексамовой кислоты, 2-аминовалериановой кислоты, 2-аминокапроновой кислоты, 2-аминогептановой кислоты, 2-аминокаприловой кислоты, 2-аминопеларгоновой кислоты, 2-аминокаприновой кислоты, 2-аминоундекановой кислоты, 2-аминолауриновой кислоты, аминовалериановой кислоты и 2-(2-аминоэтокси)уксусной кислоты, пипеколиновой кислоты, 2-карбоксиазетидина, гексафторлейцина, 3-фторвалина, 2-амино-4,4-дифтор-3-метилбутанкарбоновой кислоты, 3-фторизолейцина, 4-фторизолейцина, 5-фторизолейцина, 4-метилфенилглицина, 4-этилфенилглицина, 4-изопропилфенилглицина, (S)-2-амино-5-(3-метилгуанидино)валериановой кислоты, (S)-2-амино-3-(4-(аминометил)фенил)пропионовой кислоты, (S)-2-амино-3-(3-(аминометил)фенил)пропионовой кислоты, (S)-2-амино-4-(2-аминобензо[d]оксазол-5-ил)масляной кислоты, (S)-лейцинола, (S)-валинола, (S)-трет-лейцинола, (R)-3-метилбутан-2-амина, (S)-2-метил-1-фенилпропан-1-амина и (S)-N,2-диметил-1-(пиридин-2-ил)пропан-1-амина, (S)-2-амино-3-(оксазол-2-ил)пропионовой кислоты, (S)-2-амино-3-(оксазол-5-ил)пропионовой кислоты, (S)-2-амино-3-(1,3,4-оксадиазол-2-ил)пропионовой кислоты, (S)-2-амино-3-(1,2,4-оксадиазол-3-ил)пропионовой кислоты, (S)-2-амино-3-(5-фтор-1Н-индазол-3-ил)пропионовой кислоты и (S)-2-амино-3-(1H-индазол-3-ил)пропионовой кислоты.
[00121] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов по настоящему изобретению, включают, но не ограничиваются ими, фторированные аминокислоты, где один или несколько углеродных атомов водорода замещены атомами фтора. Число включенных атомов фтора может варьировать в диапазоне от 1 до всех включительно атомов водорода. Примеры таких аминокислот включают, но не ограничиваются ими, 3-фторпролин, 3,3-дифторпролин, 4-фторпролин, 4,4-дифторпролин, 3,4-дифторпролин, 3,3,4,4-тетрафторпролин, 4-фтортриптофан, 6-фтортриптофан, 7-фтортриптофан и их стереоизомеры.
[00122] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов по изобретению, включают, но не ограничиваются ими, двузамещенные по α-углероду аминокислоты. К ним относятся аминокислоты, в которых два заместителя на α-углероде являются одинаковыми, например, α-аминоизомасляная кислота и 2-амино-2-этилмасляная кислота, а также те, где заместители отличаются, например, α-метилфенилглицин и α-метилпролин. Кроме того, заместители на α-углероде могут быть соединены, образуя кольцо, например, 1-аминоциклопентанкарбоновую кислоту, 1-аминоциклобутанкарбоновую кислоту, 1-аминоциклогексанкарбоновую кислоту, 3-аминотетрагидрофуран-3-карбоновую кислоту, 3-аминотетрагидропиран-3-карбоновую кислоту, 4-аминотетрагидропиран-4-карбоновую кислоту, 3-аминопирролидин-3-карбоновую кислоту, 3-аминопиперидин-3-карбоновую кислоту, 4-аминопиперидин-4-карбоновую кислоту и их стереоизомеры.
[00123] Дополнительные неприродные аминокислоты, которые полезны при оптимизации полипептидов по настоящему изобретению, включают, но не ограничиваются ими, аналоги триптофана, в которых индольная система заменяется другой 9 или 10-членной бициклической кольцевой системой, содержащей 0, 1, 2, 3 или 4 гетероатомов, независимо выбранных из N, О или S. Каждая кольцевая система может быть насыщенной, частично ненасыщенной или полностью ненасыщенной. Кольцевая система может быть замещена 0, 1, 2, 3 или 4 заместителями по любому замещаемому атому. Каждый заместитель независимо выбран из Н, F, Cl, Br, CN, оксо-группы, COOR, CONRRʹ, OR, NRRʹ. Каждый R и Rʹ независимо выбран из Н, С1-С20-алкила, C1-С20-алкил-O-C1-20-алкила.
[00124] В некоторых вариантах осуществления аналоги триптофана (также указываемые в настоящем описании как «триптофановые аналоги»), которые могут быть использованы при оптимизации полипептидов по настоящему изобретению, включают, но не ограничиваются ими, 5-фтортриптофан [(5-F)W], 5-метил-О-триптофан [(5-MeO)W], 1-метилтриптофан [(1-Ме-W) или (1-Me)W], D-триптофан (D-Trp), 7-азатриптофан (включая, но не ограничиваясь ими, 4-азатриптофан, 7-азатриптофан и 5- азатриптофан) 5-хлортриптофан, 4-фтортриптофан, 6-фтортриптофан, 7-фтортриптофан и их стереоизомеры. За исключением случаев, где указано иное, термин «азатриптофан» и его сокращение «azaTrp», используемые в настоящем описании, относятся к 7-азатриптофану
[00125] В одном варианте осуществления полипептиды по настоящему изобретению могут включать в себя концевую модификацию на N- или С-конце с добавлением 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большего числа остатков и/или цистеинов в концевой области. Добавленные остатки могут быть выбраны из, но не ограничиваются ими, любой природной или искусственной аминокислоты, N-метилированной формы любой природной или искусственной аминокислоты, D-стереоизомера любой аминокислоты, норвалина, трет-бутилглицина, фенилглицина, азатриптофана, 7-азатриптофана, 4-фторфенилаланина, пеницилламина, саркозина, гомоцистеина, 1-аминоциклопропанкарбоновой кислоты, 1- аминоциклобутанкарбоновой кислоты, 1-аминоциклопентанкарбоновой кислоты, 1- аминоциклогексанкарбоновой кислоты, 4-аминтетрагидро-2H-пиран-4-карбоновой кислоты, аминоизомасляной кислоты, (S)-2-амино-3-(1H-тетразол-5-ил)пропионовой кислоты, циклопентилглицина, циклогексилглицина, циклопропилглицина, η-ω-метиларгинина, 4-хлорофенилаланина, 3-хлортирозина, 3-фтортирозина, 5-фтортриптофана, 5-хлортриптофана, цитруллина, 4-хлор-гомофенилаланина, гомофенилаланина, 4-аминометилфенилаланина, 3-аминометилфенилаланина, октилглицина, норлейцина, транексамовой кислоты, 2-аминовалериановой кислоты, 2-аминокапроновой кислоты, 2-аминогептановой кислоты, 2-аминокаприловой кислоты, 2-аминопеларгоновой кислоты, 2-аминокаприновой кислоты, 2-аминоундекановой кислоты, 2-аминолауриновой кислоты, аминовалериановой кислоты и 2-(2-аминоэтокси)уксусной кислоты, пипеколиновой кислоты, 2-карбоксиазетидина, гексафторлейцина, 3-фторвалина, 2-амино-4,4-дифтор-3-метилбутанкарбоновой кислоты, 3-фторизолейцина, 4-фторизолейцина, 5-фторизолейцина, 4-метилфенилглицина, 4-этилфенилглицина, 4-изопропилфенилглицина, (S)-2-амино-5-(3-метилгуанидино)валериановой кислоты, (S)-2-амино-3-(4-(аминометил)фенил)пропионовой кислоты, (S)-2-амино-3-(3-(аминометил)фенил)пропионовой кислоты, (S)-2-амино-4-(2-аминобензо[d]оксазол-5-ил)масляной кислоты, (S)-лейцинола, (S)-валинола, (S)-трет-лейцинола, (R)-3-метилбутан-2-амина, (S)-2-метил-1-фенилпропан-1-амина и (S)-N,2-диметил-1-(пиридин-2-ил)пропан-1-амина, (S)-2-амино-3-(оксазол-2-ил)пропионовой кислоты, (S)-2-амино-3-(оксазол-5-ил)пропионовой кислоты, (S)-2-амино-3-(1,3,4-оксадиазол-2-ил)пропионовой кислоты, (S)-2-амино-3-(1,2,4-оксадиазол-3-ил)пропионовой кислоты, (S)-2-амино-3-(5-фтор-1Н-индазол-3-ил)пропионовой кислоты и (S)-2-амино-3-(1H-индазол-3-ил)пропионовой кислоты.
[00126] Полипептиды по настоящему изобретению могут быть конъюгированы с полипептидом, который увеличивает или уменьшает связывание с белками плазмы, включая, но не ограничиваясь этим, такие, которые описаны в Dennis, M.S. et al., Albumin binding as a general strategy for improving the pharmacokinetics of proteins. J Biol Chem. 2002 Sep 20; 277(38):35035-43; Nguyen, A. et al., The pharmacokinetics of an albumin-binding Fab (AB Fab) can be modulated as a function of affinity for albumin. Protein Eng Des Sel. 2006 Jul; 19(7):291-7 и Langerheim, J.F. et al., Improving the pharmacokinetics/pharmacodynamics of prolactin, GH, and their antagonists by fusion to a synthetic albumin-binding polypeptide. J Endocrinol. 2009 Dec;203(3):375-87. В некоторых вариантах осуществления такие полипептиды связывают сывороточный альбумин (называемые в настоящем документе как «альбумин-связывающие полипептиды»). В некоторых вариантах осуществления, альбумин-связывающие полипептиды подвергают циклизации путем образования дисульфидной связи между остатками цистеина, присутствующими в их полипептидных последовательностях. В некоторых вариантах осуществления альбумин-связывающие полипептиды конъюгируют через их N- или С-концы. В некоторых вариантах осуществления конъюгация с альбумин-связывающим полипептидом изменяет время, в течение которого полипептид по настоящему изобретению остается интактным в пациенте. В предпочтительном варианте осуществления конъюгация с альбумин-связывающим полипептидом увеличивает время, в течение которого полипептид по настоящему изобретению остается в крови пациента. Полипептиды по настоящему изобретению могут быть конъюгированы с полипептидами, которые обладают свойством проникать в клетки (называемые в настоящем документе как «проникающие в клетки полипептиды»), включая, но не ограничиваясь ими, раскрытые в Milletti, F., Cell-penetrating peptides: classes, origin, and current landscape. Drug Discov Today. 2012 Aug;17(15-16):850-60. Дополнительные проникающие в клетки полипептиды известны специалистам в данной области техники. Полипептиды по настоящему изобретению могут быть конъюгированы с любым из полипептидных конъюгатов, описанных, например, в публикациях патентов США US20110172126 или US20030040472, содержание которых полностью включено в данное описание путем ссылки. Полипептиды по настоящему изобретению могут быть конъюгированы с липофильной молекулой, которая увеличивает связывание с белками плазмы, такой как липофильные заместители, описанные, например, в патенте США № 6268343 или публикации патента США № US2013/0053311, содержание которых полностью включено в настоящее описание путем ссылки.
[00127] После того как любые признаки были идентифицированы или определены в качестве желательного компонента полипептида, могут быть выполнены любая из нескольких манипуляций и/или модификаций этих признаков путем перемещения, замены, инвертирования, удаления, рандомизации или дуплицирования. Кроме того, следует понимать, что манипуляции с признаками могут дать такой же результат, что и модификация молекул по изобретению. Например, манипуляция, которая включает удаление домена, может привести к изменению длины молекулы, так же, как и модификация нуклеиновой кислоты, сокращающая кодирующую область относительно полной длины молекулы.
[00128] Модификации и манипуляции можно выполнить с помощью способов, известных в данной области техники, таких как, но не ограниченных этим, сайт-направленный мутагенез. Полученные модифицированные молекулы могут затем быть протестированы на активность с использованием in vitro или in vivo методов анализа, таких как те, которые описаны в настоящем описании, или с использованием любого другого подходящего метода скрининга, известного в данной области техники.
[00129] Согласно настоящему изобретению полипептиды могут включать консенсусную последовательность, которая обнаруживается после ряда экспериментов. Используемая в настоящем описании «консенсусная» последовательность является одной последовательностью, которая представляет собой совокупную популяцию последовательностей, при этом позволяя вариабельность по одному или нескольким сайтам.
[00130] Термин «идентичность», известный в данной области, относится к взаимосвязи между последовательностями двух или нескольких полипептидов, определяемой путем сравнения последовательностей. В данной области идентичность означает также степень близости последовательностей между полипептидами, определяемой по числу совпадений между цепочками из двух или большего числа аминокислотных остатков. Идентичность измеряет процент идентичных совпадений между меньшей из двух или нескольких последовательностей с разрывали в выравнивании (если таковые имеются), вставляемыми конкретной математической моделью или компьютерной программой (то есть «алгоритмом»). Идентичность родственных полипептидов может быть легко вычислена известными способами. Такие способы включают в себя, но не ограничиваются ими, те, которые описаны ранее другими исследователями (Lesk, A. M., ed., Computational Molecular Biology, Oxford University Press, New York, 1988; Smith, D. W., ed., Biocomputing: Informatics and Genome Projects, Academic Press, New York, 1993; Griffin, A. M. et al., ed., Computer Analysis of Sequence Data, Part 1, Humana Press, New Jersey, 1994; von Heinje, G., Sequence Analysis in Molecular Biology, Academic Press, 1987; Gribskov, M. et al., ed., Sequence Analysis Primer, M. Stockton Press, New York, 1991; and Carillo et al., Applied Math, SIAM J, 1988, 48, 1073).
[00131] В некоторых вариантах осуществления вариант полипептида может иметь такую же или аналогичную активность, как эталонный полипептид. В качестве альтернативы, вариант может иметь измененную активность (например, повышенную или сниженную) по сравнению с эталонным полипептидом. В общем, варианты конкретного полипептида по изобретению будут иметь по меньшей мере примерно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, но менее 100%, идентичности по последовательности по сравнению с конкретным эталонным полипептидом, которая определяется с помощью программ выравнивания последовательностей и параметров, описанных в настоящем описании, и известных специалистам в данной области. Такие инструменты для выравнивания включают пакет BLAST (Altschul, S.F. et al., Gapped BLAST and PSI-BLAST: a new generation of protein database search programs, Nucleic Acids Res. 1997, 25:3389-3402). Другие инструменты описаны в настоящем документе, в частности, в определении «идентичности».
[00132] Параметры по умолчанию в алгоритме BLAST включают, например, ожидаемый порог 10, размер слова 28, оценку Совпадение/Несовпадение 1, -2, линейную стоимость разрыва. Может использоваться любой фильтр, а также отбор по видоспецифичным повторам, например, Homo sapiens.
Сокращения, используемые в полипептидах
[00133] В настоящем описании сокращения имеют следующие значения: «Ac» и «NH2» обозначают ацетильный и амидированный концы, соответственно, «Nvl» обозначает норвалин; «Phg» обозначает фенилглицин; «Tbg» обозначает трет-бутилглицин; «Chg» означает циклогексилглицин; «(N-Me)Х» обозначает N-метилированную форму аминокислоты, указываемой однобуквенным или трехбуквенным аминокислотным кодом вместо переменной «X», в письменном виде как N-метил-Х [например, (N-Me)А или (N-Me)Ala обозначает N-метилированную форму аланина или N-метилаланин]; «azaTrp» обозначает азатриптофан; «(4-F)Phe» обозначает 4-фторфенилаланин; «Tyr(ОМе)» обозначает O-метил-тирозин, «Aib» обозначает аминоизомасляную кислоту; «(гомо)F» или «(гомо)Phe» обозначает гомофенилаланин; «(2-ОМе)Phg» обозначает 2-О-метилфенилглицин; «(5-F)W» обозначает 5-фтортриптофан; «D-X» относится к D-стереоизомеру данной аминокислоты «Х» [например, (D-Chg) обозначает D-циклогексилглицин]; «(5-MeO)W» обозначает 5-метил-О-триптофан; «гомоC» обозначает гомоцистеин; «(1-Ме-W)» или «(1-Me)W» обозначает 1-метилтриптофан; «Nle» обозначает норлейцин; «Tiq» обозначает остаток тетрагидроизохинолина; «Asp(Т)» обозначает (S)-2-амино-3-(1H-тетразол-5-ил)пропионовую кислоту; «(3-Cl-Phe)» обозначает 3-хлорфенилаланин; «[(N-Me-4-F)Phe]» или «(N-Me-4-F)Phe» обозначает N-метил-4-фторфенилаланин; «(м-Cl-гомо)Phe» обозначает мета-хлоргомофенилаланин; «(дезамино)С» обозначает 3-тиопропионовую кислоту; «(альфа-метил)D» обозначает альфа-метил-L-аспарагиновую кислоту; «2Nal» обозначает 2-нафтилаланин; «(3-аминометил)Phe» обозначает 3-аминометил-L-фенилаланин; «Cle» обозначает циклолейцин; «Ас-пиран» обозначает 4-амино-тетрагидропиран-4-карбоновую кислоту; «(Lys-С16)» обозначает N-ε-пальмитоиллизин; «(Lys-С12)» обозначает N-ε-лауриллизин; «(Lys-С10)» обозначает N-ε-каприллизин; «(Lys-С8)» обозначает N-ε-каприллизин; «[x-ксилил(y,z)]» обозначает ксилильный мостиковый элемент между двумя тиолсодержащими аминокислотами, где х может обозначать м, п или о, указывающие на использование мета-, пара- или орто-дибромксилолов (соответственно) для создания мостикового элемента, а числовые идентификаторы, y и z, указывают аминокислотные позиции в полипептиде для аминокислот, участвующих в процессе циклизации; «[цикло(y,z)]» обозначает образование связи между двумя аминокислотными остатками, где числовые идентификаторы, y и z, указывают позиции остатков, участвующих в образовании связи; «[цикло-олефинил(y,z)]» обозначает образование связи между двумя аминокислотными остатками с помощью реакции обмена олефинов, где числовые идентификаторы, y и z, указывают позиции остатков, участвующих в образовании связи; «[цикло-тиоалкил(y,z)]» обозначает образование тиоэфирной связи между двумя аминокислотными остатками, где числовые идентификаторы, y и z, указывают позиции остатков, участвующих в образовании связи; «[цикло-триазолил(y,z)]» обозначает образование триазольного кольца между двумя аминокислотными остатками, где числовые идентификаторы, y и z, указывают позиции остатков, участвующих в образовании связи. «В20» обозначает N-ε-(ПЭГ2-γ-глутаминовая кислота-N-α-октодекандионовая кислота)лизин [также известный как (1S,28S)-1-амино-7,16,25,30-тетраоксо-9,12,18,21-тетраокса-6,15,24,29-тетраазагексатетраконтан-1,28,46-трикарбоновая кислота]
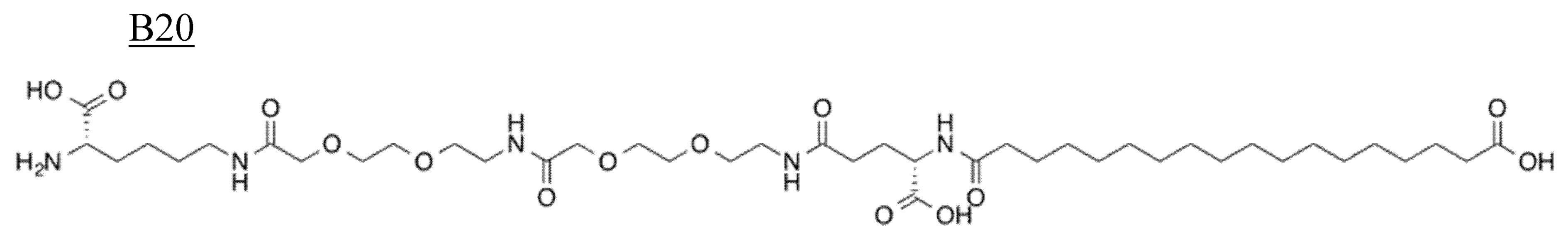
«В28» обозначает N-ε-(ПЭГ24-гаммаглутаминовая кислота-N-α-гексадеканоил)лизин.
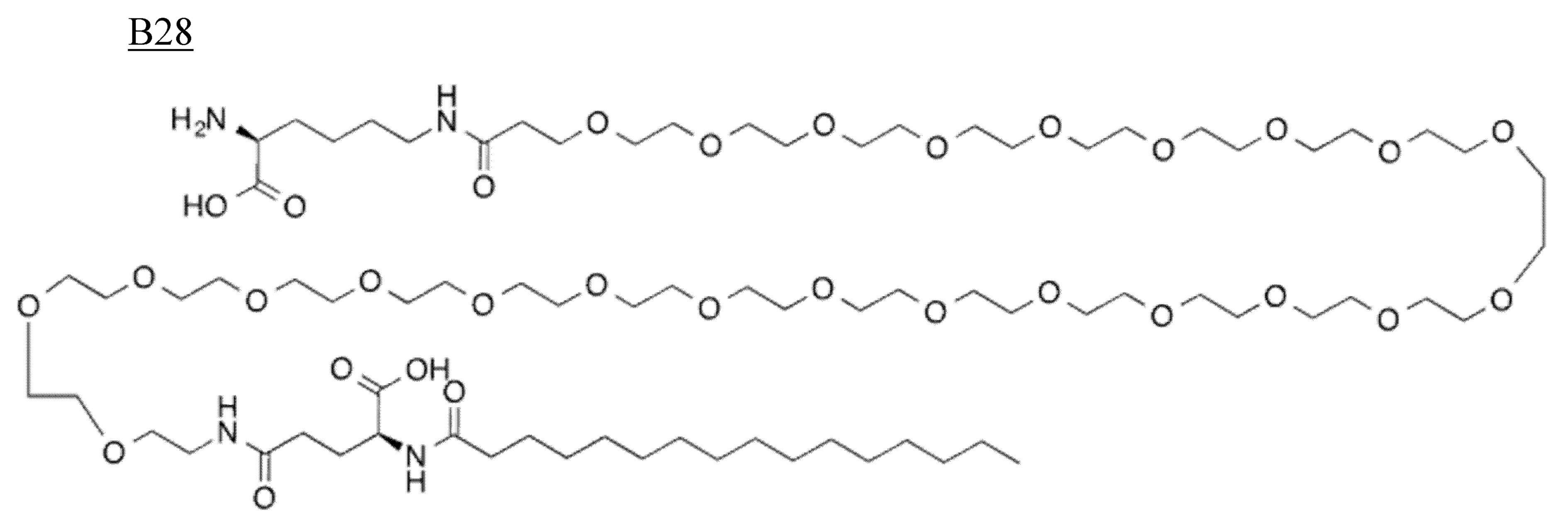
«K14» обозначает N-ε-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)-3-метилбутил-L-лизин. Все остальные символы относятся к стандартному однобуквенному аминокислотному коду.
Антитела
[00134] В некоторых вариантах осуществления соединения и/или композиции по настоящему изобретению могут содержать антитела или их фрагменты. Используемый в настоящем описании термин «антитело» относится в самом широком смысле и специально охватывает различные варианты, включающие, но не ограниченные ими, моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела, образованные по меньшей мере из двух интактных антител), а также фрагменты антител, такие как диантитела, при условии, что они проявляют желаемую биологическую активность. Антитела по настоящему изобретению могут также включать в себя антитела человека или гуманизированные антитела. Антитела представляют собой молекулы, в основном состоящие из аминокислот, но могут также включать в себя одну или несколько модификаций (включая, но не ограничиваясь этим, добавление сахарных молекул, флуоресцентных остатков, химических тегов и т.д.).
[00135] Используемый в настоящем описании термин «фрагмент антитела» относится к любой части интактного антитела. В некоторых вариантах осуществления фрагменты антитела включают антигенсвязывающие области из интактных антител. Примеры фрагментов антител могут включать в себя, но не ограничиваются ими, Fab-, Fabʹ, F(аbʹ)2-, и Fv-фрагменты; диантитела; линейные антитела; молекулы одноцепочечных антител; и полиспецифичные антитела, образуемые из фрагментов антител. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, каждый с одним антигенсвязывающим участком. Также продуцируется остаточный «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(аbʹ)2-фрагмент, который имеет два антигенсвязывающих участка и по-прежнему способен к перекрестному связыванию антигена. Соединения и/или композиции по настоящему изобретению могут содержать один или несколько из этих фрагментов. В контексте настоящего изобретения термин «антитело» может включать в себя вариабельные домены тяжелой и легких цепей, а также в Fc-область.
[00136] Используемый в настоящем описании термин «нативное антитело» относится к обычно гетеротетрамерному гликопротеину около 150000 дальтон, состоящему из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как число дисульфидных связей между тяжелыми цепями варьирует у различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет на одном конце вариабельный домен (VL) и константный домен на другом конце; константный домен легкой цепи расположен вдоль первого константного домена тяжелой цепи, а вариабельный домен легкой цепи расположен вдоль вариабельного домена тяжелой цепи.
[00137] Используемый в настоящем описании термин «вариабельный домен» относится к определенным доменам антител, которые значительно отличаются по последовательности между антителами и используются в связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена.
Используемый в настоящем описании термин «Fv» относится к фрагментам антитела, содержащим полные антигенраспознающие и антигенсвязывающие участки. Эти области состоят из димера вариабельных доменов одной тяжелой цепи и одной легкой цепи в тесной, нековалентной ассоциации.
[00138] Используемый в настоящем описании термин «легкая цепь» относится к компоненту антитела из любого вида позвоночных, отнесенному к одному из двух четко различающихся типов, называемых каппа и лямбда, на основе аминокислотных последовательностей константных доменов.
[00139] В зависимости от аминокислотной последовательности константного домена их тяжелых цепей антитела могут быть отнесены к различным классам. Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2.
[00140] Используемый в настоящем описании термин «одноцепочечный Fv» или «scFv» относится к слитому белку из VH- и VL-доменов антитела, где эти домены соединены вместе в одной полипептидной цепи. В некоторых вариантах осуществления настоящего изобретения полипептидный линкер Fv позволяет scFv формировать желаемую структуру для связывания антигена.
[00141] Используемый в настоящем описании термин «диантитело» относится к небольшому фрагменту антитела с двумя антигенсвязывающими участками. Диантитела содержат вариабельный домен тяжелой цепи VH, соединенный с вариабельным доменом легкой цепи VL в одной полипептидной цепи. При использовании линкера, который является слишком коротким, чтобы позволить образование пар между двумя доменами на одной и той же цепи, домены вынуждены образовывать пары с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. Диантитела более подробно описаны, например, в ЕР 404097; WO 93/11161; и Hollinger и др. (Hollinger et al. (Hollinger, P. et al., ʺDiabodiesʺ:Small bivalent and bispecific antibody fragments. PNAS. 1993. 90:6444-8), содержание которых полностью включено в данное описание путем ссылки.
[00142] Используемый в настоящем описании термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных клеток (клонов), т.е. индивидуальные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов, которые могут возникнуть в процессе получения моноклональных антител, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
[00143] Модификатор «моноклональное» указывает на характер антитела, полученного в основном из гомогенной популяции антител, и не должен быть истолкован, как требующий получения антитела с помощью какого-либо конкретного способа. Моноклональные антитела в настоящем описании включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также включают фрагменты таких антител.
[00144] Используемый в настоящем описании термин «гуманизированное антитело» относится к химерному антителу, содержащему минимальный участок из одного или нескольких источников животных антител (например, мышиных), а его остальная часть получена из одного или нескольких источников иммуноглобулинов человека. По большей части гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в которых остатки из гипервариабельной области антитела-реципиента заменены остатками из гипервариабельной области антител видов животных (донорных антител), таких как мышь, крыса, кролик или примат, кроме человека, имеющей желаемую специфичность, аффинность и/или связывание.
[00145] Используемый в настоящем описании термин «гипервариабельная область» относится к областям в антигенсвязывающем домене антитела, содержащим аминокислотные остатки, отвечающие за связывание антигена. Аминокислоты, присутствующие в гипервариабельных областях, определяют структуру определяющей комплементарность области (CDR). Используемый в настоящем описании термин «CDR» относится к областям антител, содержащим структуру, которая является комплементарной его антигену-мишени или эпитопу.
[00146] В некоторых вариантах осуществления соединения и/или композиции по настоящему изобретению могут представлять собой или содержать миметики антител. Используемый в настоящем описании термин «миметик антитела» относится к любой молекуле, которая имитирует функцию или действие антитела, и которая связывается специфично и с высокой аффинностью с его молекулярными мишенями. В некоторых вариантах осуществления миметики антител могут быть моноантителами, созданными для включения домена фибронектина III типа (Fn3) в качестве белкового каркаса (US 6673901 и US 6348584, содержание которых полностью включено в настоящее описание путем ссылки). В некоторых вариантах осуществления миметики антител могут включать в себя те, которые известны в данной области, включая, но не ограничиваясь ими, молекулы аффиантител, аффилины, аффитины, антикалины, авимеры, Центирины, DARPin™, Fynomer, Adnectin и пептиды из домена Кунитца. В других вариантах осуществления миметики антител могут включать в себя один или несколько непептидных областей.
[00147] Используемый в настоящем описании термин «вариант антитела» относится к биомолекуле, напоминающей антитело по структуре и/или функции, содержащей некоторые различия в своей аминокислотной последовательности, композиции или структуре по сравнению с нативным антителом.
[00148] Получение антител, моноклональных или поликлональных, известно в данной области техники. Методики получения антител хорошо известны в данной области и описаны, например, в Harlow and Lane ʺAntibodies, A Laboratory Manualʺ, Cold Spring Harbor Laboratory Press, 1988 and Harlow and Lane ʺUsing Antibodies: A Laboratory Manualʺ Cold Spring Harbor Laboratory Press, 1999.
[00149] В некоторых вариантах осуществления полипептидные последовательности, приведенные в настоящем описании, могут быть использованы для получения одного или нескольких антител. В некоторых случаях такие полипептидные последовательности могут быть включены в вариабельные домены антител. Такие вариабельные домены могут быть включены в антитела, миметики антител или варианты антител.
Низкомолекулярные соединения
[00150] В некоторых вариантах осуществления соединения по настоящему изобретению могут представлять собой низкомолекулярные соединения. Такие соединения могут иметь размер от примерно 100 до до 2000 дальтон (например, от примерно 100 до примерно 200, до примерно 300, до примерно 400, до примерно 500, до примерно 600, до примерно 700, до примерно 800, примерно 900, до примерно 1000, до примерно 1100, до примерно 1200, до примерно 1300, до примерно 1400, до примерно 1500, до примерно 1600, до примерно 1700, до примерно 1800, до 1900 или до примерно 2000 дальтон). Низкомолекулярные соединения могут быть непептидными или иметь некоторые или множественные характеристики полипептидов и циклических полипептидов, включая амидные связи, циклические структуры и аминокислотоподобные заместители.
Аптамеры
[00151] В некоторых вариантах осуществления соединения по настоящему изобретению могут включать аптамеры (Keefe, A.D., Pai, S. and Ellington, A. (2010). Nat. Rev. Drug Discovery 9:537-550). Используемый в настоящем описании термин «аптамеры» относится к олигонуклеотидным или полипептидным молекулам, которые способны связывать определенные молекулы-мишени. Некоторые аптамеры могут принимать трехмерную конформацию, способную связывать такие молекулы-мишени с высокой аффинностью и специфичностью.
Изотопные варианты
[00152] Полипептиды по настоящему изобретению могут содержать один или несколько атомов, которые являются изотопами. Используемый в настоящем описании термин «изотоп» относится к химическому элементу, который имеет один или несколько дополнительных нейтронов. В одном варианте осуществления полипептиды по настоящему изобретению могут быть дейтерированными. Используемый в настоящем описании термин «дейтерированный» относится к веществу, в котором один или несколько атомов водорода замещены изотопами дейтерия. Изотопы дейтерия являются изотопами водорода. Ядро водорода содержит один протон, тогда как ядра дейтерия содержат оба протон и нейтрон. Соединения и фармацевтические композиции по настоящему изобретению могут быть дейтерированы для того, чтобы изменить физические свойства, такие как стабильность, или чтобы их можно было использовать в диагностике или в экспериментальной работе.
Рецептуры и доставка
[00153] Термин «фармацевтическая композиция» относится к композиции, содержащей по меньшей мере один действующий ингредиент (например, такой как полипептид) в форме и в количестве, которые позволяют действующему ингредиенту быть терапевтически эффективным.
[00154] Полипептидные составы по настоящему изобретению включают составы с контролируемым высвобождением в двенадцатиперстной кишке, составы с контролируемы во времени высвобождением, системы доставки с осмотически контролируемым высвобождением, микроэмульсии, микросферы, липосомы, наночастицы, пластыри, насосы, лекарственные депо и т.п. Специально включенными в настоящее изобретение являются твердые пероральные лекарственные формы, такие как порошки, мягкие желатиновые капсулы, капсулы, пилюли и таблетки.
[00155] Фармацевтические композиции по настоящему изобретению могут быть введены любым путем, который приводит к терапевтически эффективному результату. Они включают, но не ограничиваются ими, энтеральное, гастроэнтеральное, эпидуральное, пероральное, перидуральное, внутрицеребральное (в головной мозг), внутритрахеальное (в дыхательные пути для доставки в легкие), интрацеребровентрикулярное (в желудочки мозга), накожное (нанесение на кожу), внутрикожное (в саму кожу), подкожное (под кожу), назальное (через нос) введение, внутривенную (в вену), внутриартериальную (в артерию), внутримышечную (в мышцу), внутрисердечную (в сердце), внутрикостную (в костный мозг) инфузию, интратекальную (в спинномозговой канал), внутрибрюшинную инфузию или инъекцию в брюшину, интравезикулярную инфузию, интравитреальную (в заднюю камеру глаза), интракавернозную (в основание полового члена) инъекцию, интравагинальное введение, внутриматочное, экстра-амниотическое введение, трансдермальное (диффузия через неповрежденную кожу для системного распределения), трансмукозальное (диффузия через слизистую оболочку) введение, инсуффляцию (вдувание), буккальное, сублингвальное, сублабиарльное введение, клизмы, глазные капли (на конъюнктиву) или ушные капли.
[00156] В некоторых вариантах осуществления полипептиды по настоящему изобретению представлены в виде стерильного водного раствора. В некоторых вариантах осуществления полипептиды по настоящему изобретению представлены в липидном или нелипидном составе. В другом варианте осуществления полипептиды по настоящему изобретению представлены в катионном или некатионном липидном составе. В любом варианте осуществления стерильный водный раствор может содержать дополнительные активные или неактивные компоненты. Неактивные компоненты, также называемые в настоящем описании «вспомогательными веществами», могут включать в себя, но не ограничиваются ими, физиологически совместимые соли, сахара, наполнители, поверхностно-активные вещества или буферы.
[00157] Полипептиды и/или полипептидные композиции по настоящему изобретению могут содержать или могут быть составлены или могут доставляться в сочетании с одним или несколькими агентами-носителями. Используемый в настоящем описании термин «носитель» относится к веществу, которое помогает в доставке или повышает эффективность полипептидов и/или полипептидных композиций по настоящему изобретению. Агент-носитель может представлять собой встречающееся в природе вещество, такое как белок (например, человеческий сывороточный альбумин (HSA), липопротеин низкой плотности (LDL) или глобулин), углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин или гиалоуроновая кислота) или липид. Молекула-носитель также может представлять собой рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическую полиаминокислоту. Примеры полиаминокислот включают поли-L-лизин (PLL), поли-L-аспарагиновую кислоту и поли-L-глутаминовую кислоту, а также полимеры, содержащие D-стереоизомеры этих аминокислот. Другие носители включают поли(L-лактидногликолидный) сополимер, полиэтиленгликоль (ПЭГ), поливиниловый спирт (PVA), поли(2-этилакриловую кислоту) и N-изопропилакриламидные полимеры. Другие полезные молекулы-носители могут быть идентифицированы рутинными способами.
[00158] В некоторых вариантах осуществления соединения по настоящему изобретению могут быть объединены с одним или несколькими фармацевтически приемлемыми вспомогательными веществами с образованием фармацевтической композиции. Используемый в настоящем описании термин «фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые с медицинской точки зрения подходят для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения в соответствии разумным соотношением польза и риска. Выражение «фармацевтически приемлемое эксципиент», используемое в настоящем описании, относится к любому ингредиенту, кроме описанных в настоящем описании соединений по изобретению, (например, к носителю, способному суспендировать или растворять действующее вещество), и по существу не токсичному и не вызывающему воспалительной реакции у пациента. Вспомогательные вещества могут включать в себя, например: антиадгезивы, антиоксиданты, связующие вещества, оболочки, вспомогательные вещества для сжатия, способствующие распадаемости вещества, красители, смягчающие вещества, эмульгаторы, наполнители (разбавители), формирователи пленок или оболочек, ароматизаторы, отдушки, способствующие скольжению вещества (способствующие текучести), смазывающие вещества, консерванты, печатные краски, сорбенты, суспендирующие или диспергирующие агенты, подсластители и кристаллизационную воду. Примеры вспомогательных веществ включают, но не ограничиваются этим: бутилгидрокситолуол (ВНТ), карбонат кальция, фосфат кальция (двухосновный), стеарат кальция, кроскармеллозу, сшитый поливинилпирролидон, лимонную кислоту, кросповидон, цистеин, этилцеллюлозу, желатин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, лактозу, стеарат магния, мальтит, маннит, метионин, метилцеллюлозу, метилпарабен, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, повидон, предварительно желатинизированный крахмал, пропилпарабен, ретинилпальмитат, шеллак, диоксид кремния, карбоксиметилцеллюлозу натрия, цитрат натрия, натрия крахмала гликолят, сорбит, крахмал (кукурузный), стеариновую кислоту, сахарозу, тальк, диоксид титана, витамин А, витамин Е, витамин С и ксилит. В некоторых вариантах осуществления фармацевтические композиции содержат один или несколько действующих полипептидных ингредиентов вместе с этанолом, моно-ди-триглицеридами из кукурузного масла, гидрогенизированным касторовым маслом, DL-токоферолом, пропиленгликолем, желатином, глицерином, красителями, ароматизаторами и подсластителями.
[00159] В других вариантах осуществления, фармацевтические композиции содержат один или несколько действующих полипептидных ингредиентов вместе с агентом доставки, таким, как 4-(2-гидрокси-4-метоксибензамидо)масляная кислота (или любой из агентов доставки, описанных в патенте США № 7744910B2, содержание которого полностью включено в данное описание путем ссылки), фармацевтически приемлемым буфером, способствующим распадаемости веществом, детергентом, гидроксипропилметилцеллюлозой, красителями, ароматизаторами и подсластителями.
[00160] В других вариантах осуществления фармацевтические композиции содержат один или несколько действующих полипептидных ингредиентов вместе с этанолом, соевым фосфатидилхолином, диолатом глицерина, которые вводятся в избытке физиологического раствора, как описано в заявке на патент США 2008/0146490A1, содержание которой полностью включено в настоящее описание путем ссылки.
[00161] Доставка одного или нескольких полипептидов пациенту, нуждающемуся в этом, может быть осуществлена несколькими различными способами. In vivo доставка может быть осуществлена непосредственно путем введения пациенту композиции, содержащей один или несколько полипептидов. В качестве альтернативы, доставка может быть выполнена опосредованно путем введения одного или нескольких векторов, которые кодируют и управляют экспрессией полипептидов.
[00162] Местная доставка позволяет избежать всасывания через кишечник и системного воздействия. Например, полипептиды и/или полипептидные композиции по настоящему изобретению могут быть использоваться для глаз в виде капель или в заднем отделе глаза с помощью прямой инъекции. Они могут быть использоваться в кишечнике для направленного воздействия на фермент. Они могут использоваться местно в дерматологии (например, в виде кремов, мазей, трансдермальных пластырей).
[00163] Полипептиды и/или полипептидные композиции по настоящему изобретению могут содержать или могут быть изготовлены с одним или несколькими агентами слияния. Используемый в настоящем описании термин «агент слияния» относится к агенту, который реагирует на изменения, такие как, например, изменение рН в окружающей среде. При попадании в среду с рН эндосомы агент слияния может вызывать физическое изменение, например, изменение осмотических свойств, что нарушает или увеличивает проницаемость мембраны эндосом. Предпочтительно, чтобы агент слияния изменял заряд, например, становился протонированным при рН ниже физиологического диапазона. Например, агент слияния может протонироваться при рН 4,5-6,5. Агент слиянию может служить для высвобождения полипептида в цитоплазму клетки после поглощения композиции клеткой, например, путем эндоцитоза, тем самым увеличивая концентрацию полипептида в клетке.
[00164] В некоторых вариантах осуществления агенты слияния могут содержать фрагмент, например, аминогруппу, которая при воздействии определенного диапазона рН, претерпевает изменения, например, по заряду, например, протонируется. Изменение заряда агентов слияния может запустить изменения, например, осмотические изменения, в везикулах, например, эндоцитарных везикулах, например, эндосомах. Например, агент слияния при рН среды в эндосоме обеспечивает растворение или осмотические изменения, достаточно существенные, чтобы увеличить пористость (предпочтительно, приводя к разрыву) эндосомальной мембраны.
[00165] Агенты слияния могут представлять собой полимеры, предпочтительно полиаминные цепи, например, полиэтиленимин (PEI). PEI может быть линейным, разветвленным, синтетическим или природным. PEI может представлять собой, например, алкил-замещенный PEI или липидозамещенный PEI.
[00166] В других вариантах осуществления агенты слияния могут представлять собой полигистидин, полиимидазол, полипиридин, полипропиленимин, меллитин или полиацетальные соединения, например, катионные полиацетали. В некоторых вариантах осуществления агенты слияния могут иметь альфа-спиральную структуру. Агенты слияния могут представлять собой разрывающие мембрану вещества, например, меллитин. Другие подходящие агенты слияния могут быть протестированы и определены специалистом в данной области.
[00167] Полипептиды и/или полипептидные композиции по настоящему изобретению могут содержать или могут быть изготовлены с одним или несколькими конденсирующими агентами. Конденсирующие агенты композиций, описанных в настоящем описании, могут взаимодействовать с полипептидами (например, привлекать, удерживать или связываться с ними) и действовать, вызывая (а) конденсацию, например, для уменьшения размера или заряда полипептидов и/или (b) для защиты полипептидов, например, защиты полипептидов от деградации. Конденсирующие агенты могут включать в себя фрагмент, например, заряженный фрагмент, который может взаимодействовать с полипептидами за счет ионных взаимодействий. Конденсирующими агентами, предпочтительно, являются заряженные полимеры, например, поликатионные цепи. Конденсирующими агентами могут быть полилизин (PLL), спермин, спермидин, полиамин, псевдопептид-полиамин, полиамин-пептидомиметик, дендримерный полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичная соль полиамина или альфа-спиральный пептид.
[00168] В некоторых вариантах осуществления полипептиды по настоящему изобретению, могут быть бициклическими полипептидами. Используемый в настоящем описании термин «бициклический полипептид» обозначает полипептид с двумя петлями. В качестве неограничивающего примера бициклические полипептидные ингибиторы C5 могут быть получены в комбинаторных библиотеках. Бициклические полипептиды могут иметь 2, 3, 4, 5, 6 или большее число аминокислот в одной петле.
[00169] В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению могут быть предложены в качестве пролекарственных соединений. Используемый в настоящем описании термин «пролекарственное соединение» относится к соединению, которое представлено в неактивной форме, которая становится активной в какой-то момент времени после введения. В некоторых вариантах осуществления, в которых полипептиды вводят в форме пролекарственного соединения, аминокислоты, критичные для ингибиторной активности полипептида, недоступны для взаимодействия с мишенью из-за обратимой химической связи, например, сложноэфирной связи. После введения такие пролекарственные соединения могут расщепляться по обратимой химической связи, например, с помощью ферментативного или кислотного гидролиза в желудке, крови и/или клетках данной ткани-мишени.
Ингибиторы C5
[00170] Некоторые полипептиды и/или полипептидные композиции по настоящему изобретению ингибируют активацию комплемента на уровне компонента С5 системы комплемента и называются в настоящем документе «ингибиторами C5». Некоторые ингибиторы C5 действуют, предотвращая расщепление C5 до продуктов расщепления, С5а и C5b, такие ингибиторы указываются в настоящем документе как «ингибиторы расщепления С5». В некоторых вариантах осуществления способы по настоящему изобретению могут включать ингибирование расщепления C5 в системе. Используемый в описании термин «система» относится к группе связанных частей, которые совместно функционируют. Такие системы включают в себя те, которые содержат C5, и называются в настоящем описании «C5-системами». C5-системы могут включать, но не ограничиваются ими, растворы, матрицы, клетки, тканей, органы и жидкости организма (включая, но не ограничиваясь этим, кровь). В некоторых случаях C5-системы могут представлять собой клеточные системы. Используемый в настоящем описании термин «клеточная система» относится к системе, которая включает в себя одну или несколько клеток, или один или несколько компонентов или продуктов клетки. В некоторых случаях C5-системы могут включать in vivo системы, in vitro системы и ex vivo системы. In vivo C5-системы могут содержать или могут содержаться в пациенте. Используемый в настоящем описании термин «пациент» относится к любому организму, которому соединение по настоящему изобретению может быть введено, например, в экспериментальных, диагностических, профилактических и/или терапевтических целях. Типичные пациенты включают животных (например млекопитающих, таких как мыши, крысы, кролики, приматы (кроме человека) и человека).
[00171] В некоторых случаях, ингибиторы С5 по настоящему изобретению могут включать в себя любой из полипептидов, перечисленных в таблице 1.
Таблица 1. Соединения по настоящему изобретению
|
[00172] В С5-системах, С5 и другие компоненты системы могут находиться в растворе или может быть зафиксированы, например, в аналитической лунке. C5-системы могут дополнительно содержать другие компоненты комплемента, а в некоторых случаях, могут включать все компоненты, необходимые для формирования мембраноатакующего комплекса (MAC). В некоторых случаях полипептиды и/или полипептидные композиции по настоящему изобретению могут быть использованы для ингибирования расщепления C5 у человека. Такие полипептиды и/или полипептидные композиции могут найти применение при лечении различных связанных с системой комплемента расстройств и/или заболеваний, а также сопровождающих их воспалительных заболеваний. Некоторые ингибиторы C5 известны в данной области техники и описаны в патентах США №№ 7348401 и 6355245, которые полностью включены в данное описание путем ссылки.
[00173] Расщепление C5 дает протеолитические продукты C5а и C5b. Сайт расщепления С5, который при расщеплении дает эти продукты, указывается в настоящем описании как сайт расщепления С5а-C5b. C5b способствует образованию мембраноатакующего комплекса (MAC), тогда как С5а стимулирует иммунную систему и воспалительные реакции. В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению предотвращают расщепление C5 и, следовательно, могут быть полезными при лечении воспалений за счет ингибирования воспалительных реакций, включая, но не ограничиваясь этим, хемотаксис и активацию воспалительных клеток (например, макрофагов, тучных клеток, нейтрофилов и тромбоцитов), пролиферацию эндотелиальных клеток и отек.
[00174] Многие из компонентов системы комплемента, включая, но не ограничиваясь этим, С3, С4, и С5, функционально инертны в нативном состоянии до направленного расщепления на множество активных компонентов. Расщепление C3 или C4 вызывает конформационное изменение, которое экспонирует внутренний тиоэфирный домен. В этом домене внутренняя тиоэфирная связь между боковыми цепями остатков цистеина и глютамина представляет собой химически лабильную связь, которая придает способность С3 и С4 связываться с поверхностью клеток и/или биологическими молекулами. Расщепление C3 и C4 также дает компоненты C5-конвертазы, C3bC4bC2a либо (C3b)2Bb. (Law, S.K., et al. (1997). Protein Science. 6:263-274; van den Elsen, J.M.H., (2002). J. Mol. Biol. 322:1103-1115, содержание которых полностью включено в настоящий документ путем ссылки).
[00175] Мультидоменная структура С5 подобна С3 и С4. С5-конвертаза расщепляет С5 на компоненты С5а и C5b. Расщепление С5 вызывает конформационные изменения, которые экспонируют C5b тиоэфир-подобный домен, участвующий в связывания С5 с С6, с последующим взаимодействием с С7 и С8 с образованием цитолитического MAC. Доменные структуры С5 содержат регуляторные функции, которые имеют решающее значение для действия и дальнейшей активности комплемента. ((Fredslund, F. et al. (2008). Nature. 9:753-760; Hadders, M.A. et al. (2012). Cell Reports. 1:200-207).
[00176] В некоторых вариантах осуществления соединения по настоящему изобретению могут связывать C5 и предупреждать расщепление C5 до продуктов расщепления С5а и C5b.
[00177] В последнее время была предложена новая парадигма активации комплемента, основанная на обнаружении того факта, что тромбин генерирует ранее неидентифицированные продукты C5, которые поддерживают путь терминальной активации комплемента (Krisinger, et al., (2014). Blood. 120(8):1717-1725).
[00178] Тромбин действует в коагуляционном каскаде, втором процессе, происходящем в кровотоке, с помощью которого организмы в ответ на повреждение могут ограничить кровотечение, восстановить целостность сосудов и усилить заживлению. После повреждения сосуда, тканевый фактор попадает в кровоток, запуская каскад протеолитических реакций, что приводит к образованию центрального коагуляционного фермента тромбина, который превращает фибриноген в фибриновый тромб.
[00179] Исторически, путь активации комплемента рассматривался отдельно от коагуляционного каскада; однако взаимодействие этих двух систем заслуживает повторного рассмотрения. В ответ на общие патофизиологические стимулы коагуляция и комплемент координировано активируются с перекрытием в пространстве и во времени для поддержания гомеостаза, а заболевание возникает при неправильной активации врожденного иммунного и коагуляционного ответа, о чем свидетельствуют, например, атеросклероз, инсульт, ишемическая болезнь сердца, диабет, ишемически-реперфузионные повреждения, травма, пароксизмальная ночная гемоглобинурия, возрастная макулярная дегенерация и атипичный гемолитико-уремический синдром. Действительно, было обнаружено, что введение ингибиторов комплемента одновременно лечит воспалительные и тромботические нарушения, связанные с некоторыми из этих заболеваний.
[00180] Как было отмечено выше, система комплемента активируется по трем основным путям, которые все сходятся на протеолитической активации центрального компонента комплемента С3. Послеующее образование С5-конвертаз приводит к расщеплению С5 по 751-му аргинину (R751), высвобождая хемотаксический и анафилатоксический фрагмент С5а и генерируя C5b. C5b является инициирующим фактором сборки C5b-зависимого литического мембраноатакующего комплекса (MAC; также известного как C5b-9), ответственного за уничтожение поврежденных клеток и патогенных микроорганизмов.
[00181] Были идентифицированы несколько молекулярных связей между комплементом и коагуляцией. Самое важное, что было описано в качестве нового пути активации комплемента, было установлено, что тромбин способен непосредственно содействовать активации комплемента путем расщепления C5, предположительно, по R751, тем самым высвобождая C5a в отсутствие С3 (Huber-Lang, et al., 2006. Nature Med. 12(6):682-687). Однако в этих исследованиях не было проведено тщательное сравнение тромбина и C5-конвертазы, а только были проведены ограниченное биохимические анализы; таким образом, физиологическая значимость сигнального пути не была проанализирована.
[00182] С использованием очищенных и плазматических систем была проведена оценка эффектов тромбина и C5-конвертазы на C5 путем измерения высвобождения анафилатоксина С5а и генерации C5b, компонента MAC. Было обнаружено, что, хотя тромбин плохо расщепляет C5 по R751, продуцируя минимальные количества C5a и C5b, он эффективно расщепляет C5 по недавно идентифицированному, высоко консервативному сайту R947, генерируя неописанные ранее промежуточные продукты C5T и C5bT. Индуцированное тканевым фактором свертывание плазмы приводило к протеолизу C5 по тромбин-чувствительному сайту, соответствующему этому новому сайту R947, а не по R751. Объединенная обработка C5 тромбином и C5-конвертазой давала C5a и C5bT, причем последний формировал мембраноатакующий комплекс C5bT-9 со значительно более высокой литической активностью, чем C5b-9. Таким образом была предложена новая парадигма активации комплемента, в которой тромбин является инвариантным и критическим партнером C5-конвертазы в инициировании образования более активного MAC через образование ранее неизвестных продуктов C5, которые генерируются путем объединенного протеолиза двумя ферментами. Эти открытия обеспечивают новое понимание регуляции врожденного иммунитета в контексте активации коагуляции, происходящих при многих заболеваниях. (Krisinger, et al., (2014). Blood. 120(8):1717-1725).
[00183] В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по изобретению могут ингибировать индуцированную тромбином активацию комплемента. Следовательно, такие полипептиды и/или полипептидные композиции могут использоваться для лечения гемолиза в результате индуцированной тромбином активации комплемента.
[00184] С учетом обнаруженных молекулярных связей между путями комплемента и коагуляции, полагают, что комплемент может активироваться с помощью дополнительных компонентов коагуляционных и/или воспалительных каскадов. Например, другие сериновые протеазы с несколько иной субстратной специфичностью могут действовать аналогичным образом. Huber-Lang и др. (2006) показали, что тромбин не только расщеплял С5, но также in vitro генерировал C3a при инкубации с нативным С3 (Huber-Lang, et al., 2006. Nature Med. 12(6):682-687; содержание которой полностью включено в настоящее описание путем ссылки). Аналогично было найдено, что другие компоненты коагуляционного пути, такие как FXa, FXIa и плазмин, расщепляют оба C5 и С3.
[00185] В частности, было обнаружено, что плазмин, FXa, FIXa и FXIa способны расщеплять C5, генерируя C5a и C5b, по механизму, аналогичному тому, который наблюдается при активации тромбином (Amara, et al., (2010). J. Immunol. 185:5628-5636; Amara, et al., (2008) ʺInteraction Between the Coagulation and Complement Systemʺ in Current Topics in Complement II, J.D. Lambris (ed.), pp. 71-79). Были найдено, что продуцируемые анафилатоксины являются биологически активными, что было показано с помощью дозозависимого хемотаксисного ответа нейтрофилов и клеток НМС-1, соответственно. Индуцированная плазмином активность расщепления может дозозависимо блокироваться ингибиторами сериновых протеаз, апротинином и лейпептином. Эти данные свидетельствуют о том, что различные сериновые протеазы, принадлежащие коагуляционной системе, способны активировать каскад комплемента независимо от известных путей. Кроме того, генерируются функциональные С5а и С3а (что было обнаружено с помощью иммуноблоттинга и ELISA), которые оба, как известно, являются важными участниками в воспалительной реакции.
[00186] В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению могут ингибировать активацию C5 плазмином, FXa, FIXa, FXIa и другими протеазами коагуляционного пути.
[00187] Уже давно было известно, что эластаза лейкоцитов человека (HLE), фермент, секретируемый нейтрофилами и макрофагами при воспалительных процессах, также высвобождает из С5 хемотаксисный С5а-подобный фрагмент. Однако этот С5а-подобный фрагмент не идентичен С5а, а HLE не расщепляет пептидные связи в сайте расщепления, по которому С5 обычно расщепляется на С5а и C5b после контакта с конвертазами комплемента. Напротив, было найдено, что расщепление компонента комплемента C5 эластазой HLE генерирует функционально активную C5b-подобную молекулу, которая способна принимать участие в формировании MAC (Vogt, (1999). Immunobiology. 201:470-477).
[00188] В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению могут ингибировать активацию C5 с помощью HLE и других протеаз воспалительного каскада.
[00189] В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению могут быть полезны при лечении заболеваний, расстройств и/или состояний, где расщепление С5 приводит к развитию заболевания, расстройства и/или состояния. Такие заболевания, расстройства и/или состояния могут включать в себя, но не ограничиваются ими, иммунные и аутоиммунные, неврологические, сердечно-сосудистые, легочные и глазные заболевания, расстройства и/или состояния. Иммунные и аутоиммунные заболевания и/или расстройства могут включать в себя, но не ограничиваются ими, острый диссеминированный энцефаломиелит (ADEM), острый некротический геморрагической лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемию, очаговую алопецию, амилоидоз, анкилоизирующий спондилит, острое антителоопосредуемое отторжение органов после трансплантации, анти-GBM/анти-ТВМ нефрит, антифосфолипидный синдром (APS), аутоиммунную ангиоэдему, аутоиммунную апластическую анемию, аутоиммунную дизавтономию, аутоиммунный гепатит, аутоиммунную гиперлипидемию, аутоиммунный иммунодефицит, аутоиммунные заболевания внутреннего уха (AIED), аутоиммунный миокардит, аутоиммунный панкреатит, аутоиммунную ретинопатию, аутоиммунную тромбоцитопеническую пурпуру (ATP), аутоиммунные заболевания щитовидной железы, аутоиммунную крапивницу, аксональные и нейрональные невропатии, бактериальный сепсис и септический шок, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, болезнь Каслмен, целиакию, болезнь Шагаса, синдром хронической усталости, хронические воспалительные демиелинизирующие полинейропатии (CIDP), хронический рецидивирующий мультифокальной остеомиелит (CRMO), синдром Чарга-Стросса, рубцовый пемфигоид/доброкачественный пемфигоид слизистых оболочек, болезнь Крона, синдром Когана, холодовую агглютининовую болезнь, врожденную блокаду сердца, миокардит Коксаки, CREST-синдром, эссенциальную смешанную криоглобулинемию, демиелинизирующие невропатии, герпетиформный дерматит, дерматомиозит, болезнь Девича (оптиконевромиелит), диабет I типа, дискоидную волчанку, синдром Дресслера, эндометриоз, эозинофильный эзофагит, эозинофильный фасциит, узловатую эритему, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгию, фиброзирующий альвеолит, гигантоклеточный артериит (височный артериит), гломерулонефрит, синдром Гудпасчера, гранулематоз с полиангиитом (GPA) см. гранулематоз Вегенера, болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическую анемию (включая атипичный гемолитический уремический синдром и резистентный к плазмотерапии атипичный гемолитико-уремический синдром), пурпуру Шенлейна-Геноха, гестационный герпес, гипогаммаглобулинемию, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA-нефропатию, IgG4-связанное склерозирующее заболевание, иммунорегуляторные липопротеины, миозит с включениями телец, инсулинозависимый диабет (1-го типа), интерстициальный цистит, ювенильный артрит, юношеский диабет, синдром Кавасаки, синдром Ламберта-Итона, васкулопатию крупных сосудов, лейкоцитокластический васкулит, красный плоский лишай, склероатрофический лишай, деревянистый конъюнктивит, IgA-линейную болезнь (LAD), волчанку (SLE), болезнь Лайма болезнь Меньера, микроскопический полиангиит, смешанное заболевание соединительной ткани (MCTD), разъедающую язву роговицы, болезнь Муха-Хаберманн, синдром множественных эндокринных неоплазий, множественный склероз, мультифокальную моторную нейропатию, миозит, миастению, нарколепсию, оптиконевромиелит (болезнь Девича), нейтропению, глазной рубцовой пемфигоид, неврит зрительного нерва, остеоартрит, палиндромный ревматизм, PANDAS (детские аутоиммунные психоневрологические расстройства, связанные с стрептококковой инфекцией), паранеопластическую дегенерацию мозжечка, пароксизмальную ночную гемоглобинурию (PNH), синдром Парри Ромберга, синдром Парсонага-Тернера, парспланит (периферический увеит), пузырчатку, периферическую нейропатию, перивенозный энцефаломиелит, пернициозную анемию, POEMS-синдром, узелковый полиартрит, аутоиммунные полигландулярные синдромы I, II и III типов, полиэндокринопатии, ревматическую полимиалгию, полимиозит, постинфарктный синдром, постперикардиотомический синдром, прогестероновый дерматит, первичный билиарный цирроз печени, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический легочный фиброз, гангренозную пиодермию, истинную эритроцитарную аплазию, синдром Рейно, реактивный артрит, рефлекторную симпатическую дистрофию, синдром Рейтера, рецидивирующий полихондрит, синдром беспокойных ног, ретроперитонеальный фиброз, ревматизм, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермию, вызванный шигатоксин-продуцирующими Escherichia coli гемолитико-уремический синдром (STEC-HUS), синдром Шегрена, васкулопатию мелких сосудов, аутоиммунное бесплодие, синдром мышечной скованности, подострый бактериальный эндокардит (SBE), синдром Сусака, симпатическую офтальмию, артериит Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническую пурпуру (ТТР), синдром Толоза-Ханта, поперечный миелит, аутоиммунное заболевание канальцев, язвенный колит, недифференцированное заболевание соединительной ткани (UCTD), увеит, везикулобуллезный дерматоз, васкулит, Витилиго и гранулематоз Вегенера (также известный как гранулематоз с полиангиитом (GPA)). Неврологические заболевания, расстройства и/или состояния могут включать в себя, но не ограничиваются ими, болезнь Альцгеймера, болезнь Паркинсона, деменцию с телами Леви и рассеянный склероз. Сердечно-сосудистые заболевания, расстройства и/или состояния могут включать в себя, но не ограничиваются ими, атеросклероз, инфаркт миокарда, инсульт, васкулит, травмы и состояния, возникающих после сердечно-сосудистых вмешательств (включая, но не ограничиваясь этим, сердечное шунтирование, пересадку артерий и ангиопластику). Легочные заболевания, расстройства и/или состояния могут включать в себя, но не ограничиваются ими, астму, легочный фиброз, хроническую обструктивную болезнь легких (ХОБЛ) и синдром расстройства дыхания у взрослых. Глазные болезни, расстройства и/или состояния могут включать, но не ограничиваются ими, возрастную макулярную дегенерацию, аллергический и гигантский папиллярный конъюнктивит, болезнь Бехчета, воспаление хориоидеи, осложнения, связанные с интраокулярной хирургией, отторжение роговичного трансплантата, язвы роговицы, цитомегаловирусный ретинит, синдром сухих глаз, эндофтальмит, болезнь Фукса, глаукому, иммунокомплексный васкулит, воспалительный конъюнктивит, ишемическую болезнь сетчатки глаза, кератит, макулярный отек, глазное паразитарное заражение/миграцию, пигментный ретинит, склерит, болезнь Штаргардта, субретинальный фиброз, увеит, витреоретинальное воспаление и болезнь Фогта-Койанаги-Харада.
[00190] Полипептиды и/или полипептидные композиции по настоящему изобретению могут быть особенно полезны при лечении больных с PNH, которые демонстрируют слабый ответ на терапию моноклональными антителами, такую как терапия ECULIZUMAB®, из-за мутаций в гене C5, предотвращающих связывание антитела с С5 (Nishimura, J-I. (2012). 54th ASH Annual Meeting, Abstract 3197).
[00191] Полипептиды и/или полипептидные композиции по настоящему изобретению могут быть полезны при лечении инфекционных заболеваний, расстройств и/или состояний, например, у пациента, имеющего инфекцию. В некоторых предпочтительных вариантах осуществления пациент имеет инфекцию, и существует риск развития сепсиса или септического синдрома. Полипептиды и/или полипептидные композиции по настоящему изобретению особенно полезны при лечении сепсиса.
[00192] Полипептиды и/или полипептидные композиции по настоящему изобретению также могут быть введены для улучшения результатов клинических процедур, при которых желательно ингибирование комплемента. Такие процедуры могут включать в себя, но не ограничиваются ими, шунтирование, трансплантацию, имплантацию, катетеризацию, интубацию и т.п. В некоторых вариантах осуществления полипептиды и/или полипептидные композиции по настоящему изобретению используются для покрытия изделий, материалов и/или биоматериалов, используемых в таких процедурах. В некоторых вариантах осуществления настоящего изобретения внутренняя поверхность трубки может быть покрыта полипептидами и/или полипептидными композициями для предотвращения активации комплемента в жидкости организма, которая проходит через трубку, in vivo или ex vivo, например, при экстракорпоральном шунтировании, например, диализе и шунтировании сердца.
[00193]
Способы применения
Показания к применению
[00194] Изобретение относится, в частности, к применению полипептида (например, пептидомиметиков и циклических полипептидов) и композиций, содержащих по меньшей мере один полипептид, для лечения расстройства, состояния или заболевания. В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы для лечения пациентов, страдающих от пароксизмальной ночной гемоглобинурии (PNH). Пациенты с PNH не способны синтезировать функциональные версии регуляторных белков системы комплемента, CD55 и CD59, на гемопоэтических стволовых клетках. Это приводит к комплемент-опосредованному гемолизу и различным последующим осложнениям. Другие расстройства и заболевания, связанные с комплементом, включают, но не ограничиваются ими, аутоиммунные заболевания и расстройства, неврологические заболевания и расстройства, гемологические заболевания и расстройства, а также инфекционные заболевания и расстройства. Экспериментальные данные свидетельствуют о том, что многие связанные с комплементом расстройства ослабляются при ингибировании активности комплемента.
[00195] Приобретенная мутация в гене биосинтеза фосфатидилинозитол гликанового якоря, класс А (PIG-A), который имеет происхождение из мультипотентных гемопоэтических стволовых клеток, приводит к редкому заболеванию, известному как пароксизмальная ночная гемоглобинурия (PNH) (Pu, J.J. et al., Paroxysmal nocturnal hemoglobinuria from bench to bedside. Clin Transl Sci. 2011 Jun;4(3):219-24). PNH характеризуется нарушениям функций костного мозга, гемолитической анемией и тромбозом. Продукт гена PIG-А необходим для получения гликолипидного якоря, гликозилфосфатидилинозитола (GPI), используемого для прикрепления белков к плазматической мембране. Два регулирующих систему комплемента белка, CD55 и CD59, становятся нефункциональными в отсутствие GPI. Это приводит к комплемент-опосредованному разрушению этих клеток. Полипептиды и/или полипептидные композиции по настоящему изобретению особенно полезны при лечении PNH. Используемые в настоящем описании термины «лечить», «лечение» и т.п. относятся к ослаблению или облегчению патологических процессов. В контексте настоящего изобретения, если они имеют отношение к какому-либо другому состоянию из приведенных в настоящем описании ниже, термины «лечить», «лечение» и т.п. означают уменьшение или смягчение по меньшей мере одного симптома, связанного с таким состоянием, или замедление или обращение развития или ожидаемого развития такого состояния, например, замедление роста злокачественной опухоли или рака или ускорение клиренса инфекционного организма, чтобы облегчить/уменьшить симптомы, вызванные инфекцией, например, гепатита, вызванного инфекцией вирусом гепатита, или уменьшение разрушения красных кровяных клеток (измеряемое снижением необходимости в переливании крови или увеличением уровней гематокрита или гемоглобина) в результате пароксизмальной ночной гемоглобинурии.
[00196] Под термином «снизить» или «уменьшить» в контексте маркера или симптома заболевания подразумевается статистически значимое снижение его уровня. Снижение может составлять, например, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40% или более и, предпочтительно, вплоть до уровня, соответствующего диапазону, нормальному для человека без такого заболевания.
[00197] Под термином «увеличить» или «повысить» в контексте маркера или симптома заболевания подразумевается статистически значимое повышение его уровня. Увеличение может составлять, например, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40% или более и, предпочтительно, вплоть до уровня, соответствующего диапазону, нормальному для человека без такого заболевания.
[00198] Используемые в настоящем описании фразы «терапевтически эффективное количество» и «профилактически эффективное количество» относятся к количеству, которое обеспечивает терапевтический эффект при лечении, профилактике или контроле патологических процессов или выраженного симптома одного или нескольких патологических процессов. Конкретное количество, которое является терапевтически эффективным, может быть легко определено обычным практикующим врачом, и может меняться в зависимости от факторов, известных специалистам в данной области техники, таких как, например, тип патологических процессов, история болезни и возраст пациента, стадии патологических процессов, а также введение других агентов, которые ингибируют патологические процессы.
[00199] Используемый в описании термин «фармацевтическая композиция» включает в себя фармакологически эффективное количество полипептида и фармацевтически приемлемый носитель. Используемые в настоящем описании термины «фармакологически эффективное количество», «терапевтически эффективное количество» или просто «эффективное количество» относятся к такому количеству полипептида, которое эффективно для получения предполагаемого фармакологического, терапевтического или профилактического результата. Например, если данное клиническое лечение считается эффективным, когда присутствует по меньшей мере 10%-е изменение (увеличение или уменьшение) измеряемого параметра, связанного с заболеванием или расстройством, то терапевтически эффективным количеством лекарственного средства, предназначенного для лечения этого заболевания или расстройства, является количество, необходимое для осуществления по меньшей мере 10%-го изменения этого параметра. Например, терапевтически эффективным количеством полипептида может быть количество, которое изменяет связывание мишени с ее природным связывающимся партнером по меньшей мере на 10%.
[00200] Термин «фармацевтически приемлемый носитель» относится к носителю для введения терапевтического агента. Такие носители включают в себя, но не ограничиваются ими, физиологический раствор, буферный физиологический раствор, декстрозу, воду, глицерин, этанол и их комбинации. Термин специально исключает среду для культивирования клеток. Для препаратов, вводимых перорально, их фармацевтически приемлемые носители включают, но не ограничиваются ими, фармацевтически приемлемые наполнители, такие как инертные разбавители, способствующие распадаемости агенты, связующие агенты, смазывающие агенты, подсластители, вкусовые добавки, красители и консерванты. Подходящими инертными разбавителями являются карбонат кальция, фосфат натрия и кальция, и лактоза, тогда как кукурузный крахмал и альгиновая кислота являются подходящими способствующими распадаемости агентами. Связующие вещества могут включать крахмал и желатин, тогда как смазывающим агентом, если он присутствует, как правило, будут стеарат магния, стеариновая кислота или тальк. При желании, таблетки могут быть покрыты таким материалом, как глицерилмоностеарат или глицерилдистеарат, чтобы задержать всасывание в желудочно-кишечном тракте. Агенты, включенные в лекарственные формы, дополнительно описаны в настоящем документе ниже.
[00201] Эффективность лечения или облегчения заболевания может быть оценена, например, путем измерения развития заболевания, ремиссии заболевания, тяжести симптомов, снижения болей, качества жизни, дозы лекарственного соединения, необходимой для сохранения лечебного эффекта, уровня маркера заболевания или любого другого измеряемого параметра, подходящего для данного заболевания, подлежащего лечению или являющегося объектом профилактики. В пределы компетенции специалиста в данной области техники входит способность контролировать эффективность лечения или профилактики путем измерения любого из таких параметров или любой комбинации параметров. В отношении введения полипептида или его фармацевтической композиции, «эффективное против» заболевания или расстройства указывает на то, что введение клинически соответствующим способом обеспечивает положительный эффект у по меньшей мере части пациентов, такой как ослабление симптомов заболевания, излечение, уменьшение тяжести заболевания, уменьшение объема опухоли или числа клеток, продление жизни, улучшение качества жизни, снижение потребности в переливании крови или другой эффект, в целом признанный положительным врачами, знакомыми с лечением конкретного типа заболевания или расстройства.
[00202] Лечение или профилактический эффект проявляются, когда присутствует статистически значимое улучшение по одному или нескольким параметрам состояния заболевания, либо по отсутствию ухудшения или развития симптомов, ожидаемых в ином случае. В качестве примера, положительное изменение по меньшей мере на 10% в измеряемом показателе заболевания и, предпочтительно, по меньшей мере на 20%, 30%, 40%, 50% или более может являться показателем эффективности лечения. Эффективность для данного полипептидного лекарственного средства или препарата этого лекарственного средства также можно оценивать с использованием экспериментальной животной модели для данного заболевания, известной в данной области техники. При использовании экспериментальной животной модели эффективность лечения подтверждается, когда наблюдается статистически значимая модуляция по маркеру или симптому.
[00203] Полипептид и дополнительный терапевтический агент могут быть введены совместно в одной композиции, например, парентерально, или дополнительный терапевтический агент может быть введен как часть отдельной композиции или другим способом, описанным в настоящем документе.
Воспалительные заболевания
[00204] В некоторых вариантах осуществления, соединения и композиции по настоящему изобретению могут быть использованы для лечения пациентов с заболеваниями, расстройствами и/или состояниями, связанными с воспалением. Воспаление может усиливаться в ходе развития протеолитического каскада системы комплемента. Хотя воспаление может оказывать благоприятный эффект, избыточное воспаление может привести к различным патологиям (Markiewski et al. 2007. Am J Pathol. 17: 715-27). Соответственно, соединения и композиции по настоящему изобретению могут быть использованы для уменьшения или устранения воспаления, связанного с активацией комплемента.
Стерильное воспаление
[00205] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения, предупреждения или замедления развития стерильного воспаления. Стерильным воспалением является воспаление, которое происходит в ответ на любые стимулы, кроме инфекции. Стерильное воспаление может быть общим ответом на стресс, такой как геномный стресс, гипоксический стресс, стресс от недостатка питания или стресс эндоплазматического ретикулума, вызванный физическими, химическими или метаболическими вредоносными стимулами. Стерильное воспаление может внести свой вклад в патогенез многих заболеваний, таких как, но не ограниченных ими, вызываемые ишемией повреждения, ревматоидный артрит, острые повреждения легких, вызываемые лекарственными препаратами повреждения печени, воспалительные заболевания кишечника и/или другие заболевания, расстройства или состояния. Механизм стерильного воспаления, а также способы и композиции для лечения, профилактики и/или задержки появления симптомов стерильного воспаления могут включать в себя любые из приведенных Rubartelli и др. в Frontiers in Immunology, 2013, 4:398-99, Rock et al. in Annu Rev Immunol. 2010, 28:321-342 или в патенте США № 8101586, содержание которых полностью включено в данное описание путем ссылки.
Синдром системного воспалительного ответа (SIRS) и сепсис
[00206] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или профилактики синдрома системного воспалительного ответа (SIRS). SIRS представляет собой воспаление, затрагивающее весь организм. Если SIRS вызван инфекцией, то он называется сепсисом. SIRS также может быть вызван неинфекционными событиями, такими как травмы, повреждения, ожоги, ишемия, кровоизлияние и/или другие состояния. Во время сепсиса и SIRS активации комплемента приводит к чрезмерной генерации продуктов активации комплемента, которые могут привести к полиорганной недостаточности (MOF) у пациентов. Соединения и композиции по настоящему изобретению могут быть использованы для контроля и/или баланса активации комплемента для профилактики и лечения SIRS, сепсиса и/или MOF. Способы применения ингибиторов комплемента для лечения SIRS и сепсиса могут включать в себя изложенные Rittirsch и др. в Clin Dev Immunol, 2012, 962927, в публикации патента США № US2013/0053302 или в патенте США № 8329169, содержание которых полностью включено в данное описание путем ссылки.
Острый респираторный дистресс-синдром (ARDS)
[00207] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или предупреждения развития острого респираторного дистресс-синдрома (ARDS). ARDS является широко распространенным воспалением легких и может быть вызван травмой, инфекцией (например, сепсисом), тяжелой пневмонией и/или вдыханием вредных веществ. ARDS, как правило, представляет собой тяжелое, опасное для жизни осложнение. Исследования показывают, что нейтрофилы может внести свой вклад в развитие ARDS, влияя на накопление полиморфных клеток в поврежденных легочных альвеолах и интерстициальной ткани легких. Соответственно, соединения и композиции по настоящему изобретению могут быть введены для уменьшения и/или предотвращения продукции нейтрофилами тканевого фактора в альвеолах. Соединения и композиции по настоящему изобретению, кроме того, могут быть использованы для лечения, профилактики и/или задержки начала ARDS, в некоторых случаях в соответствии с любым из способов, изложенных в международной публикации № WO2009/014633, содержание которой полностью включено в настоящий документ путем ссылки.
Пародонтит
[00208] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения или предупреждения развития пародонтита и/или связанных с ними состояний. Пародонтит представляет собой широко распространенное хроническое воспаление, приводящее к разрушению ткани пародонта, которая является тканью, поддерживающей и окружающей зубы. Состояние также включает в себя потерю альвеолярной костной ткани (кости, которая удерживает зубы). Пародонтит может быть вызван отсутствием гигиены полости рта, приводящим к накоплению бактерий на линии десен, также известному как зубной налет. Определенные состояния здоровья, такие как диабет или недостаточное питание, и/или привычки, такие как курение, могут увеличить риск развития пародонтита. Пародонтит может увеличить риск развития инсульта, инфаркта миокарда, атеросклероза, диабета, остеопороза, преждевременных родов, а также других проблем со здоровьем. Исследования показывают корреляцию между пародонтитом и местной активностью комплемента. Бактерии пародонта могут ингибировать или активировать определенные компоненты каскада комплемента. Соответственно, соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения пародонтита и связанных с ними заболеваний и состояний. Ингибиторы активации комплемента и способы лечения могут включать в себя любые из изложенных Hajishengallis в Biochem Pharmacol. 2010, 15; 80(12): 1 или Lambris в публикации США № US2013/0344082, содержание которых полностью включено в данное описание путем ссылки.
Раны и повреждения
[00209] Соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или усиления заживления различных типов ран и/или повреждений. Используемый в настоящем описании термин «повреждение», как правило, относится к физической травме, но может включать в себя месткие инфекционные или болезненные процессы. Повреждения могут быть охарактеризованы как вред, ущерба или разрушения, вызванные внешними событиями, влияющими на части и/или органы тела. Раны ассоциируются с разрезами, ударами, ожогами и/или другими воздействиями на кожу, которые оставляют кожу разорванной или поврежденной. Раны и травмы часто являются острыми событиями, но при отсутствии должного заживления они могут привести к развитию хронических осложнений и/или воспаления.
Раны и ожоговые раны
[00210] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или для ускорения заживления ран. Здоровая кожа обеспечивает водонепроницаемый, защитный барьер для патогенных микроорганизмов и других воздействий окружащей среды. Кожа также регулирует температуру тела и испарение жидкости. Когда кожа поранена, эти функции нарушаются, что усложняет заживление кожи. Ранение инициирует ряд физиологических процессов, связанных с иммунной системой, которая заживляет и регенерирует ткани. Активация комплемента является одним из этих процессов. При исследовании активации комплемента было выявлено несколько компонентов комплемента, связанных с заживлением ран, что изложено van de Goot и др. в J Burn Care Res 2009, 30:274-280 и Cazander и др. в Clin Dev Immunol, 2012, 2012:534291, содержание которых полностью включено в настоящее описание путем ссылки. В некоторых случаях активация комплемента может быть избыточной, вызывая смерть клеток и повышенное воспаление (что приводит к нарушению заживления ран и хроническим ранам). В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы для уменьшения или устранения такой активации комплемента, чтобы способствовать заживлению ран. Лечение с помощью соединений и композиций по настоящему изобретению может проводиться в соответствии с любым из способов лечения ран, раскрытых в международной публикации № WO2012/174055, содержание которой полностью включено в данное описание путем ссылки.
Травма головы
[00211] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или усиления заживления травмы головы. Травмы головы включают травмы головы, черепа или головного мозга. Примеры травм головы включают, но не ограничиваются ими, сотрясения, ушибы, переломы костей черепа, травматические повреждения головного мозга и/или других повреждения. Травмы головы могут быть легкими или тяжелыми. В некоторых случаях травма головы может привести к долговременным физическим и/или психическим осложнениям или к смерти. Исследования показывают, что травмы головы могут вызвать патологическую внутричерепную активацию комплемента, что может привести к местным воспалительным реакциям, способствующим вторичному повреждению головного мозга за счет развития отека мозга и/или гибели нейронов (Stahel и др. в Brain Research Reviews, 1998, 27: 243-56, содержание которой полностью включено в настоящее описание путем ссылки). Соединения и композиции по настоящему изобретению могут быть использованы для лечения травмы головы и/или для уменьшения или предотвращения связанных вторичных осложнений. Способы использования соединений и композиций по настоящему изобретению для контроля активации каскада комплемента при травме головы могут включать в себя любые из тех, что изложены Holers и др. в патенте США № 8911733, содержание которого полностью включено в настоящее описание путем ссылки.
Повреждение с размозжением тканей
[00212] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или усиления заживления повреждений с размозжением тканей. Повреждения с размозжением тканей представляют собой повреждения, вызванные оказываемыми на тело силой или давлением, вызывающими кровотечение, кровоподтеки, переломы, повреждения нервов, раны и/или другие повреждения тела. Соединения и композиции по настоящему изобретению могут быть использованы для уменьшения активации комплемента после повреждений с размозжением тканей, тем самым способствуя заживлению после повреждений с размозжением тканей (например, путем стимуляции регенерации нервов, способствуя сращиванию переломов, профилактики или лечения воспаления, и/или других связанных с ними осложнений). Соединения и композиции по настоящему изобретению могут быть использованы для ускорения заживления в соответствии с любым из способов, описанных в патенте США № 8703136; международных публикациях №№ WO2012/162215, WO2012/174055 или публикации патента США US2006/0270590, содержание которых полностью включено в настоящее описание путем ссылки.
Аутоиммунные заболевания
[00213] Соединения и композиции по настоящему изобретению могут быть использованы для лечения пациентов с аутоиммунными заболеваниями и/или расстройствами. Иммунная система может быть разделена на врожденную и адаптивную системы, соответствующие неспецифическим немедленным защитным механизмам и более сложным антиген-специфическим системам, соответственно. Система комплемента является частью врожденной иммунной системы, распознающей и устраняющей патогенные микроорганизмы. Кроме того, белки комплемента могут модулировать адаптивный иммунитет, соединяя врожденный и адаптивный ответ. Аутоиммунные заболевания и расстройства представляют собой иммуннологические нарушения, в результате которых мишенью системы становятся свои ткани и вещества. Аутоиммунные заболевания могут затрагивать некоторые ткани или органы организма. Соединения и композиции по настоящему изобретению могут быть использованы для модуляции комплемента при лечении и/или профилактике аутоиммунных заболеваний. В некоторых случаях такие соединения и композиции могут быть использованы в соответствии со способами, представленными в Ballanti et al. Immunol Res (2013) 56:477-491, содержание которой полностью включено в настоящее описание путем ссылки.
Антифосфолипидный синдром (APS) и катастрофический антифосфолипидный синдром (CAPS)
[00214] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предупреждения и/или лечения антифосфолипидного синдрома (APS) путем контроля активации комплемента. APS представляет собой аутоиммунное состояние, вызванное антифосфолипидными антителами, которые вызывают свертывание крови. APS может привести к рецидиву венозного или артериального тромбоза в органах, а также к осложнениям в плацентарном кровотоке, вызывая осложнения беременности, такие как выкидыш, мертворождение, преэклампсия, преждевременные роды и/или другие осложнения. Катастрофический антифосфолипидный синдром (CAPS) является выраженным и острым случаем аналогичного состояния, ведущим к закупорке вен в нескольких органах одновременно. Исследования показывают, что активация комплемента может способствовать связанным с APS осложнениям, включая осложнения при беременности, тромботические осложнения (образование тромбов) и сосудистые осложнения. Соединение и композиции по настоящему изобретению могут быть использованы для лечения связанных с APS состояний путем снижения или прекращения активации комплемента. В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы для лечения APS и/или связанных с APS осложнений в соответствии со способами, изложенными в Salmon et al. Ann Rheum Dis 2002;61(Suppl II):ii46-ii50 и Mackworth-Young in Clin Exp Immunol 2004, 136:393-401, содержание которых полностью включено в настоящее описание путем ссылки.
Холодовая агглютининовая болезнь
[00215] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения холодовой агглютининовой болезни (CAD), также называемый холодовым агглютинопосредованным гемолизом. CAD представляет собой аутоиммунное заболевание, возникающее из-за высокой концентрации IgM-антител, взаимодействующих с эритроцитами при низких температурах тела (Engelhardt et al. Blood, 2002, 100(5):1922-23). CAD может привести к состоянию, такому как анемия, утомляемость, одышка, гемоглобинурия и/или акроцианоз. CAD связан с сильной активацией комплемента, а исследования показали, что CAD можно лечить ингибиторами комплемента. Соответственно, настоящее изобретение относится к способам лечения CAD с использованием соединений и композиций по настоящему изобретению. В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы для лечения CAD в соответствии со способами, изложенными Roth и др. в Blood, 2009, 113:3885-86 или в международной публикации № WO2012/139081, содержание которых полностью включено в настоящее описание путем ссылки.
Сосудистые заболевания
[00216] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения сосудистых заболеваний, влияющих на кровеносные сосуды (например, артерии, вены и капилляры). Такие заболевания могут влиять на циркуляцию крови, кровяное давление, кровоток, функционирование органов и/или другие функции организма.
Тромботические микроангиопатии (ТМА)
[00217] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или профилактики тромботических микроангиопатий (TMA) и связанных с ним заболеваний. Микроангиопатии влияют на мелкие кровеносные сосуды (капилляры) тела, приводя к тому, что стенки капилляров становятся толстыми, слабыми и склонными к кровотечениям и замедлению циркуляции крови. Как правило, ТМА приводит к развитию тромбоза сосудов, повреждению эндотелиальных клеток, тромбоцитопении и гемолизу. Органы, такие как мозг, почки, мышцы, желудочно-кишечный тракт, кожа и легкие, могут быть затронуты. ТМА могут возникнуть в результате медицинских операций и/или состояний, которые включают в себя, но не ограничиваются ими, трансплантацию гемопоэтических стволовых клеток (HSCT), почечные заболевания, диабет и/или другие состояния. ТМА может быть вызвана исходной дисфункцией системы комплемента, как описано Meri м др. в European Journal of Internal Medicine, 2013, 24: 496-502, содержание которой полностью включено в настоящее описание путем ссылки. В общем, к ТМА может привести повышение уровня некоторых компонентов комплемента, приводя к тромбозу. В некоторых случаях это может быть вызвано мутациями в белках комплемента или родственных ферментов. Возникающая в результате дисфункция комплемента может привести к тому, что мишенью комплемента становятся эндотелиальные клетки и тромбоциты, что приводит к усилению тромбоза. В некоторых вариантах осуществления ТМА можно предупредить и/или лечить соединениями и композициями по настоящему изобретению. В некоторых случаях способы лечения TMA соединениями и композициями по настоящему изобретению могут быть осуществлены в соответствии с описанными в публикациях патентов США №№ US2012/0225056 или US2013/0246083, содержание которых полностью включено в настоящее описание путем ссылки.
Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром)
[00218] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения диссеминированного внутрисосудистого свертывания крови (ДВС-синдрома) путем контроля активации комплемента. ДВС-синдром представляет собой патологическое состояние, при котором каскад свертывания крови в крови сильно активизируется и приводит к образованию тромбов, особенно в капиллярах. ДВС-синдром может привести к обструкции кровотока в тканях и, в конечном итоге, может привести к повреждению органов. Кроме того, ДВС-синдром влияет на нормальный процесс свертывания крови, что может привести к тяжелому кровотечению. Соединения и композиции по настоящему изобретению могут быть использованы для лечения, предотвращения или уменьшения тяжести ДВС-синдрома путем модуляции активности комплемента. В некоторых случаях соединения и композиции по данному изобретению могут быть использованы в соответствии с любым из способов лечения ДВС-синдрома, описанных в патенте США № 8652477, содержание которого полностью включено в настоящее описание путем ссылки.
Васкулит
[00219] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения васкулита. В общем, васкулит представляет собой расстройство, связанное с воспалением кровеносных сосудов, включая вены и артерии, характеризующееся атакующими ткани лейкоцитами и вызывающее набухание кровеносных сосудов. Васкулит может быть связан с инфекцией, такой как в пятнистая лихорадка Скалистых гор, или аутоиммунными процессами. Примером ассоциированного с аутоиммунными процессами васкулита является васкулит с аутантителами против цитоплазмы нейтрофилов (ANCA). ANCA-васкулит вызван аномальными антителами, атакующими собственные клетки и ткани организма. ANCA-антитела атакуют цитоплазму некоторых белых кровяных клеток и нейтрофилов, заставляя их атаковать стенки сосудов в некоторых органах и тканях организма. ANCA-васкулит может затрагивать кожу, легкие, глаза и/или почки. Исследования показывают, что при ANCA-васкулите активизируется альтернативный путь комплемента и генетируются определенные компоненты комплемента, которые создают цикл усиления воспаления, что приводит к травме сосудов (Jennette et al. 2013, Semin Nephrol. 33(6): 557-64, содержание которой полностью включено в настоящее описание путем ссылки). В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения ANCA-васкулита путем ингибирования активации комплемента.
Неврологические заболевания
[00220] Соединения и композиции по настоящему изобретению могут быть использованы для профилактики, лечения и/или ослабления симптомов неврологических заболеваний, включающих, но не ограниченных ими, нейродегенеративные заболевания и связанные расстройства. Нейродегенерация обычно относится к потере структуры или функций нейронов, включая гибель нейронов. Эти расстройства можно лечить путем ингибирования действия комплемента на нейрональные клетки с использованием соединений и композиций по настоящему изобретению. Связанные с нейродегенерацией расстройства включают, но не ограничиваются ими, амиотрофный латеральный склероз (ALS), рассеянный склероз (MS), болезнь Паркинсона и болезнь Альцгеймера.
Амиотрофный латеральный склероз (ALS)
[00221] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для профилактики, лечения и/или облегчения симптомов ALS. ALS является смертельным заболеванием двигательных нейронов, характеризующимся дегенерацией нейронов спинного мозга, ствола головного мозга и моторной коры. ALS приводит к потере мышечной силы, ведущей в конечном итоге к дыхательной недостаточности. Дисфункция комплемента может способствовать ALS, и поэтому ALS может быть предотвращен, может отвечать на лечение, и/или его симптомы могут быть ослаблены с помощью терапии с использованием соединений и композиций по настоящему изобретению, мишенью которых является активность комплемента. В некоторых случаях соединения и композиции по настоящему изобретению могут быть использованы для усиления регенерации нервов. В некоторых случаях соединения и композиции по настоящему изобретению могут быть использованы в качестве ингибиторов комплемента в соответствии с любым из способов, изложенных в публикациях патентов США №№ US2014/0234275 или US2010/0143344, содержание которых полностью включено в настоящее описание путем ссылки.
Болезнь Альцгеймера
[00222] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения болезни Альцгеймера путем контроля активности комплемента. Болезнь Альцгеймера является хроническим нейродегенеративным заболеванием, с симптомами, которые могут включать в себя дезориентацию, потерю памяти, перепады настроения, поведенческие проблемы, и в конечном итоге приводить к потере функций организма. Болезнь Альцгеймера, как полагают, вызвана внеклеточными отложениями амилоида в головном мозге, которые связаны с воспалением, связанным белками, такими как белки комплемента (Sjoberg et al. 2009. Trends in Immunology. 30(2): 83-90, содержание которой полностью включено в настоящее описание путем ссылки). В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы в качестве ингибиторов комплемента в соответствии с любым из способов лечения болезни Альцгеймера, изложенных в публикации патента США US2014/0234275, содержание которого полностью включено в настоящее описание путем ссылки.
Заболевания почек
[00223] Соединения и композиции по настоящему изобретению могут быть использованы для лечения некоторых заболеваний, расстройств и/или состояний, связанных с почками, в некоторых случаях, путем ингибирования активности комплемента. Почки представляют собой органы, ответственные за удаление продуктов обмена веществ из кровотока. Почки регулируют кровяное давление, мочевыделительную систему и гомеостатические функции и, следовательно, необходимы для различных функций организма. Почки могут более серьезно пострадать от воспаления (по сравнению с другими органами) из-за уникальных структурных особенностей и контакта с кровью. Почки также производят свои собственные белки комплемента, которые могут активироваться при инфекции, заболеваниях почек и трансплантации почек. В некоторых случаях соединения и композиции по настоящему изобретению могут быть использованы в качестве ингибиторов комплемента при лечении некоторых почечных заболеваний, состояний и/или расстройств в соответствии со способами, изложенными в Quigg, J Immunol 2003; 171:3319-24, содержание которой полностью включено в настоящее описание путем ссылки.
Волчаночный нефрит
[00224] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения волчаночного нефрита путем ингибирования активности комплемента. Волчаночный нефрит представляет собой воспаление почек, вызванное аутоиммунным заболеванием, называющимся системная красная волчанка (SLE). Симптомы волчаночного нефрита включают высокое кровяное давление, пенную мочу, отеки ног, ступней, рук или лица, боли в суставах, боли в мышцах, лихорадку и сыпь. Волчаночный нефрит можно лечить с помощью ингибиторов, которые контролируют активность системы комплемента, включая соединения и композиции по настоящему изобретению. Способы и композиции для профилактики и/или лечения волчаночного нефрита путем ингибирования комплемента могут включать в себя любые из предложенных в публикации патента США № US2013/0345257 или в патенте США № 8377437, содержание которых полностью включено в настоящее описание путем ссылки.
Мембранный гломерулонефрит (MGN)
[00225] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения мембранного гломерулонефрита (MGN) путем ингибирования активации определенных компонентов комплемента. MGN представляет собой нарушение функции почек, которое может привести к воспалению и структурным изменениям. MGN вызывается антителами, связывающимися с растворимым антигеном в капиллярах почечных клубочков (гломерулами). MGN может повлиять на функции почек, такие как фильтрация жидкостей, и может привести к почечной недостаточности. Соединения и композиции по настоящему изобретению могут быть использованы в соответствии со способами предупреждения и/или лечения MGN путем ингибирования комплемента, изоложенными в публикации патента США № US2010/0015139 или в международной патентной публикации № WO2000/021559, содержание которых полностью включено в настоящее описание путем ссылки.
Осложнения после гемодиализа
[00226] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения осложнений, связанных с гемодиализом, путем ингибирования активации комплемента. Гемодиализ является медицинской процедурой, используемой для поддержания функции почек у пациентов с почечной недостаточностью. В гемодиализе, удаление отходов, таких как креатинин, мочевина и свободная вода, из крови осуществляется экстракорпорально. Общим осложнением процедуры гемодиализа является хроническое воспаление, вызванное контактом крови и диализной мембраны. Другим распространенным осложнением является тромбоз, выражащийся в формировании кровяных сгустков, затрудняющих кровообращение. Исследования показали, что эти осложнения связаны с активацией комплемента. Гемодиализ может проводиться в сочетании с терапией ингибитором комплемента, чтобы обеспечить возможность контроля воспалительных реакций и патологий, и/или для профилактики или лечения тромбоза у пациентов, проходящих гемодиализ из-за почечной недостаточности. Способы использования соединений и композиций по настоящему изобретению для лечения осложнений гемодиализа могут быть осуществлены в соответствии с любым из способов, изложенных DeAngelis и др. в Immunobiology, 2012, 217(11): 1097-1105 или в Kourtzelis et al. Blood, 2010, 116(4):631-639, содержание которых полностью включено в настоящее описание путем ссылки.
Глазные заболевания
[00227] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения некоторых глазных заболеваний, расстройств и/или состояний. В здоровом глазу система комплемента активируется на низком уровне и постоянно регулируется мембраносвязанными и растворимыми интраокулярными белками, которые защищают от патогенов. Поэтому активация комплемента играет важную роль в нескольких осложнениях, связанных с глазами, и контроль активации комплемента может использоваться для лечения таких заболеваний. Соединения и композиции по настоящему изобретению могут быть использованы в качестве ингибиторов комплемента при лечении глазных заболеваний в соответствии с любым из способов, изложенных Jha и др. в Mol Immunol. 2007; 44 (16): 3901-3908, или в патенте США № 8753625, содержание которых полностью включено в настоящее описание путем ссылки.
Возрастная макулярная дегенерация (AMD)
[00228] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения возрастной макулярной дегенерации (AMD) путем ингибирования активации комплемента в глазах. AMD представляет собой хроническое заболевание глаз, вызывающее помутнение центрального зрения, слепые пятна в центральном зрении и/или возможную потерю центрального зрения. Центральное зрение влияет на способность читать, управлять транспортным средством и/или распознавать лица. AMD, в общем, подразделяется на два типа - неэкссудативную (сухую) и экссудативную (влажную). Сухая AMD относится к ухудшению состояния желтого пятна, которое представляет собой ткань в центре сетчатки. Влажная AMD относится к поражению кровеносных сосудов под сетчаткой, приводящему к утечке крови и жидкости. В нескольких исследованиях на человеке и животных были выявлены белки комплемента, которые связаны с AMD, и новые терапевтические стратегии включают контроль путей активации комплемента, как описано Jha и др. в Mol Immunol. 2007; 44 (16): 3901-8. Способы по изобретению, включающие использование соединений и композиций по настоящему изобретению для профилактики и/или лечения AMD, могут включать в себя любые из изложенных в публикациях патентов США №№ US2011/0269807 или US2008/0269318, содержание которых полностью включено в настоящее описание путем ссылки.
Заболевания роговицы
[00229] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения заболеваний роговицы путем ингибирования активации комплемента в глазах. Система комплемента играет важную роль в защите роговицы от болезнетворных частиц и/или воспалительных антигенов. Роговицей является внешняя передняя часть глаза, покрывающая и защищающая радужку, зрачок и переднюю камеру, и, поэтому, подвергающаяся воздействию внешних факторов. Заболевания роговицы включают, но не ограничиваются только ими, кератоконус, кератит, глазной герпес и/или другие заболевания. Заболевания роговицы могут вызвать боль, ухудшение зрения, слезотечение, покраснение, чувствительность к свету и/или рубцевание роговицы. Система комплемента имеет решающее значение для защиты роговицы, но активация комплемента может привести к повреждению ткани роговицы после исчезновения инфекции, посколько некоторые компоненты комплемента экспрессируются на высоком уровне. Способы по настоящему изобретению для модулирования активности комплемента при лечении заболеваний роговицы могут включать в себя любые из тех, что изложены Jha и др. в Mol Immunol. 2007; 44 (16): 3901-8, содержание которой полностью включено в настоящее описание путем ссылки.
Аутоиммунный увеит
[00230] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения увеита, который представляет собой воспаление увеального слоя (сосудистой оболочки) глаза. Сосудистая оболочка глазного яблока представляет собой пигментированную область глаза, содержащую хориоид, радужку и цилиарное тело глаза. Увеит вызывает покраснение, ухудшение зрения, боли, спайки и, в конечном итоге, может привести к слепоте. Исследования показали, что продукты активации комплемента присутствуют в глазах пациентов с аутоиммунным увеитом, и комплемент играет важную роль в развитии заболевания. В некоторых случаях соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или профилактики увеита в соответствии с любым из способов, изложенных Jha и др. в Mol Immunol. 2007. 44 (16): 3901-8, содержание которой полностью включено в настоящее описание путем ссылки.
Диабетическая ретинопатия
[00231] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения диабетической ретинопатии, которая представляет собой заболевание, вызванное изменениями в кровеносных сосудах сетчатки у больных сахарным диабетом. Ретинопатия может вызвать набухание кровеносных сосудов и истекание жидкости и/или рост аномальных кровеносных сосудов. Диабетическая ретинопатия влияет на зрение и может в конечном итоге привести к слепоте. Исследования показали, что активация комплемента играет важную роль в развитии диабетической ретинопатии. В некоторых случаях, соединения и композиции по настоящему изобретению могут быть использованы в соответствии с методами лечения диабетической ретинопатии, описанными в Jha et al. Mol Immunol. 2007; 44(16): 3901-8, содержание которой полностью включено в настоящее описание путем ссылки.
Преэклампсия и HELLP-синдром
[00232] В некоторых вариантах осуществления соединения и композиции по настоящему изобретению могут быть использованы для предотвращения и/или лечения преэклампсии и/или HELLP-синдрома (аббревиатура признаков синдрома: 1) гемолиз, 2) повышение активности печеночных ферментов и 3) низкое число тромбоцитов) с помощью терапии ингибиторами комплемента. Преэклампсия является нарушением беременности с симптомами, включающими повышенное кровяное давление, отеки, одышку, нарушение функции почек, нарушение функции печени и/или низкое содержание тромбоцитов в крови. Преэклампсия обычно диагностируется по высокому уровню белка в моче и высокому кровяному давлению. Синдром HELLP представляет собой сочетание гемолиза, повышения активности печеночных ферментов и низкого содержания тромбоцитов. Гемолиз является нарушением, включающим разрушение эритроцитов, что приводит к высвобождению гемоглобина из них. Повышенные печеночные ферменты могут свидетельствовать о вызванной беременностью патологии печени. Низкие уровни тромбоцитов приводят к снижению способности к свертыванию крови, что вызывает опасность чрезмерного кровотечения. HELLP связан с преэклампсией и расстройством печени. Синдром HELLP обычно возникает на поздних стадиях беременности или после родов. Он, как правило, диагностируется по анализу крови, указывающему на наличие трех составляющих, которые он включает. Лечат HELLP путем индукции родов.
[00233] Исследования показывают, что при синдроме HELLP и преэклампсии происходит активация комплемента, и что некоторые компоненты комплемента присутствуют в повышенном количестве при HELLP и преэклампсии. Ингибиторы комплемента могут быть использованы в качестве терапевтических средств для предупреждения и/или лечения этих состояний. Соединения и композиции по настоящему изобретению могут быть использованы в соответствии с методами профилактики и/или лечения HELLP и преэклампсии, изложенными Heager и др. в Obstetrics & Gynecology, 1992, 79(1):19-26 или в международной патентной публикации № WO201/078622, содержание которых полностью включено в настоящее описание путем ссылки.
Дозировки и введение
[00234] Для применения при лечении человека полипептиды могут быть изготовлены в виде фармацевтических композиций. В зависимости от пациента, подлежащего лечению, способа введения и типа требуемого лечения (например, предупреждения, профилактики или терапия) полипептиды изготавливают так, чтобы они соответствовали этими параметрам. Краткое описание таких методов можно найти в Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, (2005); и в Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988-1999, Marcel Dekker, New York, которые включены в настоящее описание путем ссылки.
[00235] Композиции по настоящему изобретению предпочтительно изготавливать в терапевтически эффективном количестве, которое может составлять, например, ежедневное количество от примерно 0,1 мг до примерно 100 мг, от примерно 0,5 мг до примерно 200 мг, от примерно 1 мг до примерно 300 мг, от примерно 5 мг до примерно 500 мг, от примерно 10 мг до примерно 750 мг, от примерно 50 мг до примерно 1000 мг или по меньшей мере 1000 мг. В одном варианте осуществления фармацевтическая композиция включает в себя капсулу, например, в стандартной лекарственной форме.
Стандартные лекарственные формы
[00236] Полипептиды по изобретению могут присутствовать в количествах, в общем, составляющих 0,1-95% по весу от общего веса композиции. Композиция может быть представлена в виде лекарственной формы, подходящей для перорального введения. Таким образом, фармацевтическая композиция может быть представлена в форме, например, твердых капсул (например, твердых желатиновых капсул или твердых гидроксипропилметилцеллюлозных капсул), мягких желатиновых капсул, таблеток, капсуловидных таблеток, таблеток с энтеросолюбильной оболочкой, жевательных таблеток, твердых желатиновых капсул с энтеросолюбильной оболочкой, мягких желатиновых капсул с энтеросолюбильной оболочкой, миникапсул, лекарственных леденцов, облаток, полосок, гелевых капсул, драже, растворов, эмульсий, суспензий, сиропов или аэрозолей.
[00237] Пациентам могут вводиться терапевтическое количество полипептида, такое как 0,01 мг/кг, 1,0 мг/кг или 15 мг/кг. Для введения человеку доза полипептидов по настоящему изобретению, как правило, составляет от 0,01 до 15 мг/кг, более предпочтительно, от 3 до 5 мг/кг. Однако уровни дозировок могут в значительной степени зависеть от природы заболевания, эффективности лекарственного средства, состояния пациента, решения практикующего врача и частоты и способа введения.
[00238] В других вариантах осуществления полипептиды вводят с частотой, например, каждые 4 ч, каждые 6 ч, каждые 12 ч, каждые 18 ч, каждые 24 ч, каждые 36 ч, каждые 72 ч, каждые 84 ч, каждые 96 ч, каждые 5 дней, каждые 7 дней, каждые 10 дней, каждые 14 дней, каждые 3 недели или с большим интервалом. Композиции можно вводить один раз в день, или полипептид можно вводить в виде двух, трех или большего количества дробных доз через определенные промежутки времени в течение дня или путем доставки с использованием состава с контролируемым высвобождением. В этом случае содержание полипептида в каждой дробной дозе должны быть соответственно ниже, чтобы достичь общей дневной дозы. Также может быть создана стандартная лекарственная форма для доставки за несколько дней, например, с использованием обычного состава с пролонгированным высвобождением, который обеспечивает замедленное высвобождение полипептида в течение нескольких дней.
[00239] Составы с пролонгированным высвобождением хорошо известны в данной области и особенно полезны для доставки агентов в определенный участок, так что они могу использоваться с полипептидными композициями по настоящему изобретению. Эффект однократной дозы может быть продолжительным, так что последующие дозы вводят не чаще, чем с 3-, 4- или 5-дневными интервалами, или не чаще чем с 1-, 2-, 3- или 4-недельными интервалами.
[00240] Полипептид можно вводить путем внутривенной инфузии в течение определенного периода времени, например, в течение 5 минут, 10 минут, 15 минут, 20 минут или 25 минут. Введение может повторяться, например, на регулярной основе, например, раз в две недели (то есть каждые две недели) в течение одного месяца, двух месяцев, трех месяцев, четырех месяцев или большего периода времени. После первичной схемы лечения, введение можно осуществлять реже. Например, после введения каждые две недели в течение трех месяцев, введение может повторяться один раз в месяц в течение шести месяцев или года, или большего периода. Введение полипептида или композиции может уменьшить, снизить, увеличить или изменить связывание или любой физиологически вредоносный процесс, например, в клетке, ткани, крови, моче или другом отделяемом пациента по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% или в большей степени.
[00241] Перед введением полной дозы полипептида и/или полипептидной композиции, пациентам можно вводить меньшие дозы, например, 5% от полной дозы, и наблюдать за побочными эффектами, такими как аллергические реакции или реакции на инфузию, или повышенный уровень липидов или повышенное кровяное давление. В другом примере, пациента можно мониторить в отношении нежелательных иммуностимулирующих эффектов, например, увеличения уровня цитокинов (например, TNF-альфа, Il-1, Il-6 или Il-10).
[00242] Генетическая предрасположенность играет определенную роль в развитии некоторых заболеваний или расстройств. Таким образом, пациент, нуждающийся в лечении полипептидом и/или полипептидной композицией, может быть идентифицирован по семейной истории болезни или, например, с помощью скрининга на один или несколько генетических маркеров или вариантов. Медицинский работник, такой как врач или медсестра, либо член семьи, могут изучить семейную историю перед назначением или введением терапевтической композиции по настоящему изобретению.
Наборы
[00243] Любая из композиций, описанных в настоящем описании, может входить в состав набора. В качестве неограничивающего примера, полипептиды могут быть включены в набор для лечения заболевания. Набор может включать в себя флакон стерильного сухого порошка полипептида, стерильный раствор для растворения сухого порошка и шприц для вливания для введения полипептида.
[00244] Когда полипептиды представлены в виде сухого порошка, предполагается, что от 10 мкг до 1000 мг полипептида (по меньшей мере или самое большее) предусмотрены в наборах по изобретению.
[00245] Контейнеры обычно включают по меньшей мере один флакон, пробирку, колбу, бутылку, шприц и/или другие контейнеры, в которые помещают полипептидные составы, предпочтительно, соответствующим образом распределенные. Наборы могут также включать второй контейнер, содержащий стерильный, фармацевтически приемлемый буфер и/или другой разбавитель.
[00246] Набор может включать инструкции по применению компонентов набора, а также по применению любого другого реагента, не входящего в набор. Инструкции могут включать в себя изменения, которые могут быть реализованы.
[00247] В то время как различные варианты осуществления настоящего изобретения были подробно показаны и описаны, специалистам в данной области техники будет понятно, что различные изменения в форме и деталях могут быть осуществлены в изобретении без отступления от сущности и объема настоящего изобретения, которые определяются прилагаемой формулой изобретения.
ЭКВИВАЛЕНТЫ И ОБЪЕМ ИЗОБРЕТЕНИЯ
[00248] Специалистам в данной области техники будет понятно, или они будут в состоянии определить, используя не более чем рутинные эксперименты, многие эквиваленты конкретных вариантов осуществления в соответствии с настоящим изобретением, описанным в настоящем документе. Не предполагается, что объем настоящего изобретения ограничен приведенным выше описанием, а наоборот, соответствует изложенному в прилагаемой формуле изобретения.
[00249] В формуле изобретения, формы единственного числа могут означать один или более чем один, если не указано обратное, или иным образом не очевидно из контекста. Формула изобретения или описание, которые включают в себя союз «или» между одним или несколькими членами группы считаются выполненными, если один, более одного или все члены группы, присутствуют, используются или иным образом имеют отношение к данному продукту или процессу, если не указано обратное или иным образом не очевидно из контекста. Настоящее изобретение включает в себя варианты, в которых один член группы присутствует, используется или иным образом имеет отношение к данному продукту или процессу. Изобретение включает в себя варианты осуществления, в которых более чем один или все члены группы присутствуют, используются или иным образом имеют отношение к данному продукту или процессу.
[00250] Следует также отметить, что термин «содержащий» предполагается открытым и разрешает, но не требует включения дополнительных элементов или этапов. Когда термин «содержащий» используется в настоящем описании, термины «состоящий из» и «или включающий», таким образом, также охвачены и раскрыты.
[00251] Если приводятся диапазоны, то конечные точки включены. Кроме того, следует понимать, что, если не указано обратное, или иным образом не очевидно из контекста и понимания обычного специалиста в данной области техники, значения, которые выражены в виде диапазонов, могут подразумевать любое конкретное значение или меньший диапазон в пределах указанных диапазонов в различных вариантах осуществления настоящего изобретение, до десятой от единицы нижнего предела диапазона, если контекст явно не диктует иное.
[00252] Кроме того, следует понимать, что любой конкретный вариант осуществления настоящего изобретения, который относится к предшествующему уровню техники, может быть явным образом исключен из любого одного или нескольких пунктов формулы изобретения. Поскольку такие варианты считаются известными обычному специалисту в данной области техники, они могут быть исключены, даже если исключение не указано явно в настоящем описании. Любой конкретный вариант осуществления композиции по настоящему изобретению (например, любая нуклеиновая кислота или белок, кодируемый таким образом, любой способ получения, любой способ использования и т.д.) могут быть исключены из любого одного или нескольких пунктов формулы изобретения по любой причине, вне зависимости от того, связано ли это или нет с существованием прототипа.
[00253] Все цитируемые источники, например, ссылки, публикации, базы данных, записи в базах данных и методики в данной области, цитируемые в настоящем документе, включены в данную заявку путем ссылки, даже если это и не указано в цитате. В случае противоречивых утверждений цитируемого источника и данной заявки, утверждение в данной заявке должно превалировать.
[00254] Заголовки разделов и таблиц не предназначены для ограничения изобретения.
ПРИМЕРЫ
Пример 1. Получение биотинилированного C5
[00255] Для препаративного биотинилирования использовали эффективное конечное молярное соотношение 1:4 C5 и биотина. Приготавливали 10 мМ раствор EZ-Link Sulfo-NHS-LC Biotin (Thermo Scientific, Billerica, MA) в соответствии с инструкциями изготовителя. К 1 мг C5 из 1 мг/мл раствора (Complement Tech, Tyler TX) добавляли 2,1 мкл 10 мМ раствора биотина и инкубировали на льду в течение 2 часов. Реакцию останавливали в течение 30 минут при 4°С после добавления 100 мкл 1 М Tris-HCl, рН 7,5. Реакционную смесь диализовали в течение ночи против холодного PBST (фосфатный буферный солевой раствор (PBS)+0,1%-й Tween 80). Биотинилированный С5 разделяли на аликвоты и хранили при -80°С. Биотинилированный С5 характеризовали с помощью электрофореза в ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях, и активность характеризовали с помощью анализа гемолиза эритроцитов. Биотинилированный С5 также проверяли на выделение на стрептавидиновых шариках (Invitrogen, Grand Island, NY). Захват осуществляли с использованием условий, рекомендуемых производителем. Для захвата использовали 4 мкг 100 нМ раствора биотинилированного С5 и 40 мкл суспензии шариков и инкубировали при 4°С в течение 1 часа. Концентрацию захваченного биотинилированного C5 рассчитывали с помощью прогона известного количества C5 на геле NuPAGE 4-12% Bis-Tris (Invitrogen, Grand Island, NY).
Пример 2. Анализ гемолиза у человека для QC биотинилированного C5
[00256] Анализ гемолиза проводили с С5-обедненными сыворотками и биотинилированным C5 и небиотинилированным C5 для сравнения лизисной активности C5 до и после биотинилирования. Антителосенсибилизированные овечьи эритроциты (Complement Technology, Tyler TX) в растворе с концентрацией 5×108 клеток/мл центрифугировали при ускорении 2090g в течение 3 минут и ресуспендировали в буфере GVB++ (Complement Technology, Tyler TX). С5-обедненные сыворотки человека (Complement Technology, Tyler TX) быстро размораживали при 37°С и помещали в лед с водой до разведения в GVB++. Небиотинилированный белок C5 (Complement Technology, Tyler TX) и биотинилированный белок C5 (биотинилированный авторами) быстро размораживали при 37°С и помещали в лед с водой до разведения в GVB++. 100 мкл клеток (при конечной концентрации 2,5×107 клеток/мл) смешивали с С5-обедненными сыворотками человека и 50 мкл биотинилированного или небиотинилированного C5 (в конечной концентрации 10 мкг/мл, 3 мкг/мл или 1 мкг/мл) в 96-луночном микротитровочном планшете, обработанном для культивирования тканей (USA Scientific, Ocala, FL). Планшет инкубировали в течение 1 ч при 37°С. После инкубации планшеты центрифугировали при ускорении 2090g в течение 2 минут перед переносом 100 мкл супернатанта в новый микротитровочный планшет. Оптическую плотность считывали при 412 нм, и сравнивали процент лизирующей активности небиотинилированного и биотинилированного C5.
Пример 3. Отбор полипептидов, связывающих C5
[00257] Ингибиторы C5 были идентифицированы в несколько раундах отбора в мРНК-дисплее. мРНК-дисплей проводили в основном, как было описано (Roberts, R.W., and Szostak, J.W. (1997). Proc. Natl. Acad. Sci. USA 94, 12297-12302; WO2009067191, которые включены в настоящее описание путем ссылки в полном объеме) с модификациями, описанными в настоящем документе. Пулы РНК получали с помощью in vitro транскрипции с использованием ДНК, синтезированной с фиксированным N-концевыми метиониновыми и цистеиновыми кодонами с последующими тремя позициями из смеси фосфорамидитов шестнадцати кодонов с последующими восемью позициями из второй смеси кодонов, также содержащей цистеиновый кодон. Полученная библиотека мРНК имеет фиксированный инициирующий метионин, за которым следует остаток цистеина, а затем три позиции, не имеющие цистеина, а затем восемь позиций, в которых цистеин встречается с частотой 12,5%. При проведении отбора, первый раунд обогащения включал первую стадию, в которой пулы РНК, содержащие 3ʹ-концевой УФ-сшитый олигонуклеотид, содержащий пуромицин, транслировали in vitro с очищенными трансляционными компонентами, перечисленными в таблице 2. Трансляцию проводили в двух вариантах для создания двух уникальных библиотек, основанных на вариации аминокислот. В первом варианте использовали только 20 природных аминокислот, в то время как во втором варианте использовали природные аминокислоты (0,1 мМ гистидин, треонин, пролин, лизин, аспарагин, тирозин, глютаминовую кислоту и цистеин), неприродные аминокислоты (2 мМ трет-глицин (Tbg), 0,8 мМ 7-азатриптофан (сокращение «azaTrp» в данном примере) и 1 мМ норвалин (Nvl), азалейцин и фенил-глицин (Phg)) и N-метил аминокислоты (450 мкМ смесь N-метилированных серина [(N-Me)S], аланина [(N-Me)А], глицина [(N-Me)G] и 4-фтор-N-метилфенилаланина [(N-Me-4-F)Phe]). 35S-меченые остатки цистеина были включены в обоих вариантах, чтобы обеспечить возможность мониторинга обогащения полипептидами за раунд.
Таблица 2. Компоненты трансляции in vitro
|
[00258] тРНК ферментативно сшивали с их соответствующими аминокислотами с использованием тРНК-синтетаз. Четыре N-метилированных тРНК были предварительно сшиты, в то время как все остальные тРНК ферментативно сшивали во время реакции трансляции in vitro. тРНК-синтетазы добавляли в расчете на объем независимо от их концентрации. 0,1 мкл каждой тРНК-синтетазы (за исключением метионин-тРНК-синтетазы, которую добавляли в количестве 0,4 мкл на 25 мкл реакции трансляции) добавляли для in-situ сшивки в ходе трансляции на 25 мкл реакции трансляции. Сшитую мРНК добавляли в конечной концентрации 0,75 мкМ. Реакцию трансляции инкубировали при температуре 37°С в течение 1 часа. После трансляции, слияние транслированных полипептидов и их соответствующих мРНК осуществляли путем добавления большого количества соли в трансляционную смесь и инкубирования при 37°С в течение 1,5 часов. Библиотеку для отбора природных полипептидов получали из восьми отдельных библиотек с фиксированным цистеиновым кодоном в позицих 5-11. Случайные позиции в этих библиотеках, со всеми возможными 20 аминокислотами, генерировали комбинаторно с использованием повторяющихся кодоновых звеньев NNS (N является A, G, C или T, S является G или C) (Devlin, J.J., et. al., (1990). Science 249, 404-406). Трансляцию этих библиотек в природные полипептиды проводили с использованием in vitro трансляционного набора из ретикулоцитов кролика, а не в реконструированной системе, описанной выше.
[00259] Выделение представленных на мРНК полипептидов проводили с использованием аффинного выделения на олиго-dT и Ni-NTA, чтобы выделить слитые молекулы, содержащие как полиА-мРНК, так и His-тегированные полипептиды. Связанные с олиго-dT-шариками полипептиды затем циклизуют с помощью дибромксилола, как описано в литературе (J. Am. Chem. Soc. 127:1 1727 (2005)).
[00260] Затем проводили прямой отбор полипептидов по сродству к мишени. Представленным на мРНК полипептидам позволяли связываться в течение 1 часа при 4°С с биотинилированным C5 в 100 нМ растворе биотинилированного C5 в PBST. РНК, соответствующие аффинно-отобранным полипептидам, подвергали обратной транскрипции и ПЦР-амплификации для создания пула двухцепочечных ДНК. Пул ДНК in vitro транскрибировали для создания мРНК, и полученную мРНК сшивали, как и раньше, на ее 3ʹ-конце с пуромицин-содержащим олигонуклеотидом. Слитые с пуромицином мРНК транслировали in vitro, получая второй раунд библиотеки, которая теперь была обогащена полипептидами, связывающими компонент комплемента C5. Отборочный цикл повторяли в шести раундах. После шестого раунда пул ДНК, представляющий выбранные полипептиды, клонировали и секвенировали, и аминокислотные последовательности потенциальных ингибиторов C5 были определены на основе ДНК-последовательностей. Эти идентифицированные полипептидные последовательности приведены в таблице 3.
[00261] Используемые во всех нижеследующих таблицах, а также в списке последовательностей, сокращения имеют следующие значения: «Ас» и «NH2» обозначают ацетильный и амидированный концы, соответственно; «Nvl» обозначает норвалин; «Phg» обозначает фенилглицин; «Sar» обозначает саркозин; «Tbg» обозначает трет-бутилглицин; «Trt» обозначает тритил или трифенилметил; «Chg» обозначает циклогексилглицин; «(N-Me)Х» обозначает N-метилированную форму аминокислоты, обозначенную буквенной или трехбуквенной аббревиатурой для этой аминокислоты вместо переменной «X», пишующуся как N-метил-Х [например, (N-Me)А и (N-Me)Ala - оба обозначают за N-метилированную форму аланина или N-метил-аланин]; 7-азатриптофан включен, где указывается «azaTrp»; «(4-F)Phe» обозначает 4-фторфенилаланин; «Tyr(OMe)» обозначает O-метил-тирозин; «Aib» обозначает амино-изомасляную кислоту; «(гомо)F» или «(гомо)Phe» обозначает гомофенилаланин; «(2-ОМе)Phg» обозначает 2-О-метилфенилглицин; «пропаргил-Gly» обозначает пропаргил-глицин; «(5-F)W» или «(5-F)Trp» обозначает 5-фтортриптофан; «D-X» относится к D-стереоизомеру данной аминокислоты «Х», где аминокислота может быть указана аббревиатурой с использованием одно- или трехбуквенного кода [например, (D-Chg) обозначает D-циклогексилглицин, а (D-W) обозначает D-триптофан]; «(5-MeO)W» или «(5-MeO)Trp» обозначает 5-метил-О-триптофан; «гомоС» относится к гомоцистеину; «(1-Ме-W)» или «(1-Me)W» или «(1-Me-Trp)» или «(1-Me)Trp» относятся к 1-метилтриптофану; «Nle» обозначает норлейцин; 1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота включена, где указывается «Tiq»; «Asp(T)» обозначает (S)-2-амино-3-(1H-тетразол-5-ил)пропионовую кислоту; «(3-Cl-Phe)» обозначает 3-хлорфенилаланин; «[(N-Me-4-F)Phe]» или «(N-Me-4-F)Phe» относится к N-метил-4-фторфенилаланину; «Boc» представляет собой трет-бутилоксикарбонильную защитную группу; «[x-ксилил(y,z)]» относится к ксилильному мостиковому элементу между двумя цистеинами, где х может обозначать м-, п- или о-, указывая на использование мета-, пара- или орто-дибромксилолов (соответственно), чтобы получить мостиковые группы, а числовые идентификаторы, y и z, указывают аминокислотные позиции в полипептиде для цистеинов, участвующих в процессе циклизации; «[цикло(y,z)]» обозначает образование связи между двумя аминокислотными остатками, где числовые идентификаторы, y и z, указывают позиции остатков, участвующих в образовании связи; «[м-ксилил-бицикло]» указывает на то, что полипептид содержит две циклические петли и что мостиковая группа образуется в результате реакции с мета-дибромксилолом. Все остальные символы относятся к стандартному однобуквенному коду аминокислот. Кроме того, указаны полипептиды, содержащие ПЭГ2000 или тег последовательности, BODIPY-TMR-X.
Таблица 3. Последовательности полипептидов
|
Пример 4. Синтез полипептидов
[00262] Полипептиды синтезировали с использованием стандартных твердофазных Fmoc/tBu-способов. Синтез, как правило, проводили на автоматизированном микроволновом пептидном синтезаторе Liberty (CEM, Matthews NC), с использованием стандартных протоколов с амидной смолой Rink, хотя также можно использовать и другие автоматизированные синтезаторы без микроволновой опиции. Все аминокислоты получены от коммерческих источников, если не указано иное. Соединительный реагент представляет собой 2-(6-хлор-1-Н-бензотриазол-1-ил)-1,1,3,3,-тетраметиламиния гексафторфосфат (HCTU), а основание представляет собой диизопропилэтиламин (DIEA). Полипептиды отщепляют от смолы с использованием 95% TFA, 2,5% TIS и 2,5% воды в течение 3 часов и выделяют осаждением с эфиром. Неочищенные полипептиды очищают с помощью обращенно-фазовой препаративной ВЭЖХ с использованием колонки С18 в смеси ацетонитрил/вода, 0,1% TFA с градиентом 20%-50% в течение 30 мин. Фракции, содержащие чистый полипептид, собирают и лиофилизируют, и все полипептиды анализируют с помощью ЖХ-МС.
Пример 5. Образование дисульфидно-циклизованных полипептидов
[00263] Для получения дисульфидно-циклизованных полипептидов линейный полипептид растворяют в смеси воды и DMSO, и полученный раствор энергично перемешивают на воздухе в течение 12 часов.
Пример 6. Циклизация полипептидов дибромксилолом
[00264] В 100 мл колбу вносят ацетонитрил (12 мл) и воду (24 мл) и дегазируют аргоном в течение приблизительно 5 мин. Затем добавляют линейный полипептид (0,01 ммоль) и 200 мМ бикарбоната аммония (6 мл) с последующим добавлением 0,012 ммоль или 1,3-бис(бромметил)бензола, 1,2-бис(бромметил)бензола, 1,4-бис(бромметил)бензола, 2,6-бис(бромметил)пиридина или (Е)-1,4-дибромбут-2-ена. Реакционную смесь перемешивают в атмосфере аргона при комнатной температуре в течение приблизительно 2 часов и контролируют с помощью ЖХ-МС. После завершения реакции реакционный раствор замораживают и лиофилизируют. ВЭЖХ-очистка неочищенного лиофилизированного продукта с последующей лиофилизацией фракций, содержащих очищенный полипептид, дает конечный циклизованный продукт в виде белого порошка.
Пример 7. Лактамная циклизация полипептидов
[00265] Циклизацию полипептидов с использованием лактамной группы проводили на твердой фазе. Полипептид сначала синтезировали на твердой смоле-носителе Wang стандартным Fmoc-метдом. Fmoc-ASP(аллил)-ОН и Fmoc-LYS(Alloc)-OH были включены в полипептид в указанных позициях, в качестве двух мономеров-предшественников для образования лактамного мостика. После завершения удлинения смолу промывали сухим дихлорметаном (3 раза) и продували сухим газообразным азотом в течение 10 мин. Чтобы удалить аллильную и Alloc-защитные группы, смолу обрабатывали 5-кратным мольным избытком фенилсилана и продували азотом в течение 10 мин. Каталитическое количество тетракис-Pd(0) растворяли в сухом дихлорметане и добавляли к суспензии смолы. Через час смолу последовательно промывали дихлорметаном (3 раза), диметилформамидом (3 раза), тригидратом диэтилдитиокарбаматая натрия (3 раза) диметилформамидом (3 раза) и дихлорметаном (3 раза). Лактамную циклизацию в диметилформамиде (DMF) получали путем обработки смолы, содержащей незащищенный полипептид, PyAOP ((3-гидрокси-3Н-1,2,3-триазол[4,5-b]пиридинато-О)три-1-пирролидинил-гексафторфосфатом фосфора) и диизопропилэтиламином и оставляли для прохождения реакции на ночь. Смолу промывали DMF и обрабатывали свежими PyAOP и диизопропилэтиламином в течение еще 60 минут при 45°C. Смолу выдерживали и промывали диметилформамидом пять раз. Полипептид расщепляли и очищали, как описано в примере 4.
Пример 8. Триазольная циклизация полипептидов
[00266] Циклизацию полипептидов, содержащих азидные и алкиновые группы, проводили на твердой фазе. Содержащую полипептид смолу (0,05 ммоль), обрабатывали дихлорметаном и оставляли набухать в течение 10 мин. Растворитель затем заменяли на DMF (3-5 мл) и через 10 мин добавляли раствор лиганда Cu-ТБТА (125 мкл 20 мМ раствора). Суспензию продували аргоном и затем добавляли аскорбиновую кислоту (5 мкмоль). Раствор перемешивали в течение 2 ч, и удаляли избыток реагентов, смолу промывали раствором ЭДТА в DMF для удаления избытка меди. Полипептид расщепляли и очищали, как описано в примере 4.
Пример 9. Полипептиды по настоящему изобретению
[00267] Были синтезированы полипептиды по настоящему изобретению. К ним относятся соединения, перечисленные в таблице 4.
Таблица 4. Соединения по настоящему изобретению
|
[00268] Полипептиды R3183 (SEQ ID NO: 184) и R3193 (SEQ ID NO: 194) были синтезированы в соответствии с аминокислотными последовательностями R3176 (SEQ ID NO: 177), за исключением замены Nvl-NH2 на Lys. Аминогруппа боковой цепи остатка Lys была модифицирована различными липофильными молекулами, что в результате давало липидированные полипептиды.
Пример 10. Оптимизация и тестирование ингибиторов C5
[00269] Полипептиды, выбранные в соответствии с примером 3 и приведенные в таблице 3, были протестированы на их способность ингибировать опосредованный комплементом лизис клеток. Кроме того, были синтезированы, а также протестированы, различные оптимизированные полипептиды в соответствии со способами примеров 4-8 (см. таблицу 4). Оптимизированные полипептидные последовательности включают последовательности, полученные путем различных усечений, делеций, добавлений и/или замен в соединениях R3002 (SEQ ID NO: 3), R3008 (SEQ ID NO: 9) и R3021 (SEQ ID NO: 11) или путем образования гибридных полипептидов, содержащих комбинации областей, выбранных из любых из этих трех соединений.
Анализ гемолиза у человека (анализ лизиса эритроцитов с использованием полных сывороток человека)
[00270] Полипептиды, перечисленные в таблице 3, а также их оптимизированные производные (см. таблицу 4) оценивали на ингибиторную активность с использованием анализа гемолиза красных клеток крови. Антителосенсибилизированные овечьи эритроциты (Complement Technology, Tyler TX) высевали в количестве 2,5×107 клеток/лунку с полной сывороткой человека (Complement Technology, Tyler TX) и полипептидами с целью определения ингибирующего действия полипептидов на лизис эритроцитов. Клетки центрифугировали в течение 3 мин при ускорении 2090g и ресуспендировали в свежем буфере GVB++ (Complement Technology, Tyler TX). Сыворотки человека (Complement Technology, Tyler TX) быстро размораживали при 37°С и помещали в лед с водой до разведения в GVB++. Десять 6-кратных серийных разведений полипептидов (из 10 мМ исходного раствора в DMSO) выполняли в DMSO, а затем добавляли в буфер. 50 мкл каждого разведения полипептидов объединяли с сывороткой и 100 мкл клеток в отдельных лунках 96-луночного микротитровочного планшета, обработанного для культивирования тканей (USA Scientific, Ocala, FL) и ресуспендировали пипетированием. Образцы инкубировали при 37°С в течение одного часа. После инкубации планшеты центрифугировали при ускорении 2090g в течение 2 минут. 100 мкл супернатанта переносили в новый планшет и оптическую плотность считывали при 412 нм. Данные апроксимировали с использованием логарифмической логистической модели для построения кривой доза-ответ и определения IC50. Используемый в настоящем описании термин «IC50» относится к половинному значению максимальной ингибирующей концентрации, используемому для указания количества ингибитора, необходимого для снижения данного ответа или процесса наполовину. Тестируемые соединения приведены в таблице 5.
Таблица 5. Анализируемые соединения
|
Пример 11. Альтернативный анализ гемолиза у человека с помощью C5-обедненный сывороток
[00271] Полипептиды, приведенные в таблице 6, были протестированы на функциональную активность в анализе гемолиза эритроцитов с использованием C5-обедненных сывороток человека и очищенного C5 человека, а не полных сывороток крови человека. Для оценки активности, антителосенсибилизированные овечьи эритроциты (Complement Technology, Tyler TX) высевали в количестве 2,5×107 клеток/лунку с 1,5%-й С5-обедненной сывороткой человека (Complement Technology, Tyler, TX) и 0,5 нМ очищенным C5 человека (Complement Technology, Tyler, TX). Антителосенсибилизированные овечьи эритроциты центрифугировали в течение 3 мин при ускорении 2090g и ресуспендировали в свежем буфере GVB++ (Complement Technology, Tyler, TX). С5-обедненную сыворотку человека и очищенный С5 человека быстро размораживали при 37°С и затем хранили во льду с водой, соответственно. Исходный раствор полипептида (10 мМ в DMSO) серийно разводили в DMSO, чтобы получить 10 6-кратных разведений, а затем к ним добавляли GVB++. 50 мкл каждого разведения полипептида объединяли с 25 мкл С5-обедненной сыворотки, 25 мкл очищенного человеческого C5 и 100 мкл клеток в отдельных лунках 96-луночного микротитровочного планшета, обработанного для культивирования тканей (USA Scientific, Ocala, FL) и ресуспендировали пипетированием. Образцы инкубировали при 37°С в течение одного часа. После инкубации планшеты центрифугировали при ускорении 2090g в течение 2 минут. 100 мкл супернатанта переносили в новый планшет и оптическую плотность считывали при 412 нм. Данные аппроксимировали с использованием логарифмической логистической модели для построения кривой доза-ответ и определения IC50.
Таблица 6. Анализируемые соединения
|
Пример 12. Иммуноферментный анализ для оценки ингибирования C5
[00272] C5-ингибирующую активность оценивали с помощью иммуноферментного анализа (ИФА). Ингибирование продукции С5а и мембраноатакующего комплекса (MAC) были измерены с помощью ИФА-наборов MicroVue (Quidel Corporation, San Diego, CA).
ИФА на С5а
[00273] Супернатант из анализа гемолиза эритроцитов у человека с соединениями R3002 (SEQ ID NO: 3) и R3008 (SEQ ID NO: 9) разводили в соотношении 1:50 и анализировали с помощью ИФА на С5а (фиг.1). Оба полипептида ингибировали образование С5а. R3002 (SEQ ID NO: 3) имел IC50 5,4 нМ, R3008 (SEQ ID NO: 9) имел IC50 54,5 нМ.
ИФА на мембраноатакующий комплекс (MAC)
[00274] MAC-ИФА проводили на разбавленных супернатантах (1:5) из анализа гемолиза эритроцитов у человека для R3008 (SEQ ID NO: 9) (фиг.2). Было показано, что этот полипептид ингибируют образование МАС с IC50 33 нМ.
Пример 13. Характеристика связывания пептидомиметиков методом флуоресцентной поляризации
[00275] Флуоресцентная поляризация (FP) позволяет измерить события связывания в гомогенном растворе (Banks, P. et al., Impact of a red-shifted dye label for high throughput fluorescence polarization assays of G protein-coupled receptors. J Biomol Screen. 2000 Oct; 5(5):329-34 и Parker, G.J. et al., Development of high throughput screening assays using fluorescence polarization: nuclear receptor-ligand-binding and kinase/phosphatase assays. J Biomol Screen. 2000 Apr;5(2):77-88). Ключевой концепцией FP является то, что степень, с которой флуорофор поляризует свет, обратно пропорциональна его молекулярному вращению (Lea, W.A. et al., Fluorescence polarization assays in small molecule screening. Expert Opin Drug Discov. 2011 Jan;6(1):17-32), и флуорофор, связанный с гораздо большим белком-мишенью, вращается медленнее, чем несвязанный флуорофор, что приводит к увеличению поляризации, которая может быть определена количественно. FP используется все чаще в высокопропускных подходах в качестве способа измерения связывания лиганда с мишенью (Parker, G.J. et al., Development of high throughput screening assays using fluorescence polarization: nuclear receptor-ligand-binding and kinase/phosphatase assays. J Biomol Screen. 2000 Apr; 5(2):77-88), для определения равновесной константы диссоциации (KD) (Prystay, L. et al., Determination of equilibrium dissociation constants in fluorescence polarization. J Biomol Screen. 2001 Jun; 6(3):141-50) и обнаружения потенциальных лекарственных соединений в анализах конкурентного связывания (Tian, W. et al., Development of novel fluorescence polarization-based assay for studying the β-catenin/Tcf4 interaction. J Biomol Screen. 2012 Apr; 17(4):530-4).
Материалы и способы
[00276] FP использовали для скрининга конкурентных полипептидных ингибиторов белка C5. Пробу R3076 (SEQ ID NO: 40) получали инкубированием исходного полипептида R3072 (SEQ ID NO: 20) с BODIPY-TMR-X, SE (Life Technologies, Grand Island, NY) в DMF (Sigma, Сент-Луис, МО) в течение 4 часов. Краситель BODIPY-TMR присоединялся к С-концевому лизину белка, и впоследствии меченую пробу очищали с помощью высокоэффективной жидкостной хроматографии.
[00277] Равновесную константу диссоциации (KD) для связывания R3076 (SEQ ID NO: 40) с белком С5 человека (Complement Technology, Tyler, TX) определяли путем инкубирования 25 нМ раствора R3076 (SEQ ID NO: 40) при увеличении концентрации белка C5. Поляризацию измеряли в динамике, пока связывание не достигало равновесия. KD определяли, используя GraphPad Prism (с использованием «Saturating Binding Curves, One Site - Specific Binding With Hill Slope», в качестве аппроксимирующей кривой для определения KD). Равновесие достигалось через 10 минут, со значениями для KD, наклона кривой и максимального связывания остающимися стабильными в течение 60 минут. Окончательное значение KD 8,07 нМ (стандартное отклонение составляло 0,53) определяли путем усреднения значений KD в интервале от 10 до 60 минут. На основе этой информации, 25 нМ и 50 нМ концентрации R3076 (SEQ ID NO: 40) и белка С5, соответственно, были выбраны для использования в конкурентном анализе. Эти концентрации представляли примерный уровень белка, необходимый для 95%-го связывания пробы с белком C5. R3023 (SEQ ID NO: 104) представляет собой полипептидный вариант R3002 (SEQ ID NO: 3) с перетасованной случайным образом последовательностью и включен во все анализы в качестве отрицательного контроля.
[00278] Белок С5 человека разбавляли до 200 нМ в аналитическом буфере, состоящем из TBS (EMD Millipore, Billerica, MA)+0,005% Triton-X (Sigma, Saint Louis, MO). 10 мкл буфера для анализа добавляли во все лунки черного, несвязывающего, 384-луночного аналитического планшета (Greiner, Monroe, NC), и 10 мкл разбавленного из исходного раствора белка C5 добавляли в экспериментальные и заданные контрольные лунки.
[00279] Пробу R3076 (SEQ ID NO: 40) разводили 1:10 в DMSO (Life Technologies, Grand Island, NY) и 30 мкл этой смеси разбавляли в 3 мл буфера для анализа, получая 100 нМ рабочий раствор. 10 мкл этого рабочего раствора затем добавляли в каждую лунку в аналитический планшет. Аналитический планшет инкубировали при комнатной температуре в защищенном от света месте в течение 20 минут, чтобы обеспечить достижение равновесия связывания.
[00280] Тестируемые объекты, перечисленные в таблице 7, последовательно разводили в DMSO и затем буфере для анализа, получая 10 2-кратных разведений, а затем быстро добавляли в аналитический планшет в трех повторах. Аналитический планшет инкубировали в планшетном ридере Paradigm (Molecular Devices, Sunnyvale, CA) в течение 60 минут при 25°C.
[00281] После инкубации в течение 60 минут планшет считывали с использованием Paradigm FP-протокола (Molecular Devices, Sunnyvale, CA), и исходные значения поляризации импортировали в GraphPad Prism. Ki (с использованием односайтовой модели аппроксимации кривой Ki, концентрации зонда=25 нМ, KD=8,07 нМ, с базовой линией, ограниченной в среднем 0%-м контролем связывания) и IC50 (логарифмическая зависимость ответа на ингибитор, 4-параметрическая аппроксимация кривой) были определены в GraphPad.
Результаты
[00282] Все тестируемые объекты были в состоянии конкурировать с меченой пробой за связывание с белком C5 человека (фиг.3, таблица 7). R3003 (SEQ ID NO: 4) был самым активным полипептидом из протестированных, с величиной Ki 9,54 нМ. Связывание R3023 (SEQ ID NO: 104) не детектировалось даже при самой высокой концентрации тестируемого полипептида.
Таблица 7. Данные по конкурентной поляризации флуоресценции
|
[00283] Данные, представленные в таблице 7, были получены из аппроксимации кривой, выполненной с помощью программного обеспечения GraphPad Prism, как описано выше. Трипликаты величин усредняли для получения точек, представленных в каждом эксперименте. Из протестированных полипептидов первоначально был идентифицирован R3003 (SEQ ID NO: 4) при отборе с помощью мРНК-дисплея. Сродство R3003 (SEQ ID NO: 4) к C5 было подтверждено результатами FP-анализа, показывающего низкие значения Ki, а также IC50. Ингибиторы R3011 (SEQ ID NO: 31) и R3050 (SEQ ID NO: 23) также показывали относительно сильное сродство к C5. Контрольный полипептид, R3023 (SEQ ID NO: 104), не показывал сродства к C5, в то время как ингибиторы R3014 (SEQ ID NO: 55) и R3043 (SEQ ID NO: 50) показывали слабое сродство.
Пример 14. Анализ стабильности соединений в плазме
[00284] Соединения анализировали на стабильность в плазме крови человека при следующих условиях. Плазма человека была получена от Bioreclamation (Westbury, NY) и собрана с гепарином натрия. рН плазмы подводили до рН 7,4. Для тестируемых соединений готовили исходные растворы в DMSO с концентрацией 10 мМ. Аликвоты растворов в DMSO вводили в 1 мл плазмы, которая была предварительно прогрета до 37°С, до конечной концентрации тестируемого соединения 10 мкМ. Пробирки выдерживали в настольном THERMOMIXER® (Eppendorf, Hauppauge, NY) в течение всего срока эксперимента. Аликвоты (100 мкл) отбирали в каждой временной точке и добавляли в лунки 96-луночного планшета, которые были предварительно заполнены 300 мкл ацетонитрильного раствора, содержащего смесь внутренних стандартов (метопролола, пропранолола и варфарина, каждый в концетрации 500 нг/мл). Образцы хранили при 4°С до конца эксперимента. После забора образцов в конечной временной точке, содержимое планшета смешивали и затем центрифугировали со скоростью 3000 об/мин в течение 10 минут. Аликвоты супернатанта удаляли и анализировали с помощью LC-HRAMS. Параметры жидкостной хроматографии приведены в таблице 8, а параметры масс-спектрометрии приведены в таблице 9.
Таблица 8. Параметры жидкостной хроматографии
|
Таблица 9. Параметры масс-спектрометрии
|
[00285] Концентрацию тестируемого соединения R3050 (SEQ ID NO: 23) определяли путем сравнения с ранее определенной калибровочной кривой (таблица 10).
Таблица 10. Профиль стабильности
|
[00286] В этих условиях R3050 (SEQ ID NO: 23), как было показано, является весьма стабильным.
Пример 15. Полипептидные варианты, содержащие аналоги триптофана
[00287] В некоторых вариантах осуществления полипептиды по настоящему изобретению включают в себя 7-азатриптофан. Для того, чтобы определить важность этого остатка в ингибировании C5, проводили замещение аминокислот, где 7-азатриптофан заменяли природным триптофаном, а также различными другими аналогами триптофана, включая 5-фтортриптофан [(5-F)W], 1-метил-триптофан [(1-Me)W], D-триптофан и 5-метил-О-триптофан [(5-MeO)W]. Также были проанализированы аналогичные полипептиды с нетриптофановыми заменами.
[00288] Варианты полипептидов R3002 (SEQ ID NO: 3) и R3008 (SEQ ID NO: 9) были синтезированы и протестированы на их способность ингибировать лизис эритроцитов, как было описано в примере 10 (таблицы 11 и 12). Из протестированных вариантов, все с заменой остатка 7-азатриптофана продемонстрировали пониженную способность ингибировать лизис эритроцитов, на что указывало увеличение средних значений IC50 (половинной максимальной ингибирующей концентрации, значения, используемого для указания количества ингибитора, необходимого для снижения данной реакции или процесса наполовину).
Таблица 11. Варианты полипептида R3002 (SEQ ID NO: 3) по 7-азатриптофану, проанализированые с помощью анализа гемолиза у человека
|
Таблица 12. Варианты полипептида R3008 (SEQ ID NO: 9) по 7-азатриптофану, проанализированые с помощью анализа гемолиза у человека
|
Пример 16. Эффект укорочения полипептида и удаления аминокислот, проанализированный с помощью анализа гемолиза у человека
[00289] Укороченные с С-конца варианты полипептида R3021 (SEQ ID NO 11) были синтезированы и исследованы с помощью анализа гемолиза у человека, описанного в примере 10, на их способность ингибировать С5-зависимый лизис эритроцитов. Средние значения IC50 (половинной максимальной ингибирующей концентрации, значения, используемого для указания количества ингибитора, необходимого для снижения данной реакции или процесса наполовину) для каждого тестируемого полипептида приведены в таблице 13. Укороченные полипептиды продемонстрировали снижение способности (о чем свидетельствует увеличение значений IC50) к подавлению лизиса эритроцитов с вариантами, лишенными триптофана, имеющими наибольшие значения IC50.
[00290] Кроме того, варианты полипептида R3021 (SEQ ID NO: 11) с внутренними делециями аминокислот были синтезированы и исследованы на их способность ингибировать С5-зависимый лизис эритроцитов в соответствии со способом, описанным в примере 10 (см. таблицу 14). Дополнительно, N-концевой метионин в этих вариантах был заменен ацетильной группой. Средние значения IC50 для каждого протестированного полипептида приведены в таблице 14. Интересно, что замена ацетильной группой одного только N-концевого метионина [R3048 (SEQ ID NO: 19)] увеличила способность полипептида ингибировать лизис эритроцитов. Удаление внутреннего остатка D [R3124 (SEQ ID NO: 130)] или внутренних остатков DVY [R3125 (SEQ ID NO: 131), соответствующих остаткам 8, 9 и 10 в R3021 (SEQ ID NO: 11)], привело к снижению способности полипептида ингибировать лизис эритроцитов.
Таблица 13. Укороченные с С-конца варианты полипептида R3021 (SEQ ID NO: 11), проанализированные с помощью анализа гемолиза у человека
|
Таблица 14. Варианты полипептида R3021 (SEQ ID NO: 11) с внутренней делецией аминокислотных остатков, проанализированые с помощью анализа гемолиза у человека
|
Пример 17. Включение альбумин-связывающих полипептидов
[00291] Полипептиды конъюгируют с одним или несколькими полипептидами, которые модулируют связывание с белками плазмы. Эти полипептиды, называемые в настоящем описании «альбумин-связывающими полипептидами», приведены в таблице 15.
Таблица 15. Альбумин-связывающие полипептиды
|
[00292] Альбумин-связывающие полипептиды циклизуют путем образования дисульфидных связей между остатками цистеина. В некоторых вариантах осуществления, альбумин-связывающие полипептиды конъюгированы по их N- или С-концам, таким образом, что имеют несколько различные структуры (например, отсутствие ацетильной группы).
Пример 18. Включение проникающих в клетки полипептидов
[00293] Полипептиды конъюгируют с полипептидом, который способен проникать в клетки. Эти полипептиды приведены в таблице 16 и описаны в Milletti, F., Cell-penetrating polypeptides: classes, origin, and current landscape. Drug Discov Today. 2012 Aug;17(15-16):850-60.
Таблица 16. Проникающие в клетки полипептиды
|
Пример 19. Анализ полипептидных смесей, содержащих стереоизомеры аминокислот
[00294] Полипептиды R3136 (SEQ ID NO: 137) и R3137 (SEQ ID NO: 138) были синтезированы в соответствии с аминокислотными последовательностями R3085 (SEQ ID NO: 90) и R3082 (SEQ ID NO: 116), соответственно, за исключением замены Phg в каждом из них на D-Phg (см. таблицу 17). Композиции, содержащие либо R3136 (SEQ ID NO: 137) и R3085 (SEQ ID NO: 90), либо R3137 (SEQ ID NO: 138) и R3082 (SEQ ID NO: 116), анализировали на их способность ингибировать лизис эритроцитов в анализе гемолиза у человека, описанного в примере 10. Композиция, содержащая R3136 (SEQ ID NO: 137) и R3085 (SEQ ID NO: 90), давала среднюю IC50 (нМ)> 50000, тогда как композиция, содержащая R3137 (SEQ ID NO: 138) и R3082 (SEQ ID NO: 116), давала среднюю IC50 (нМ)> 100000.
Таблица 17. Соединения, используемые в смесях полипептидов с стереоизомерами аминокислот
|
Пример 20. Фармакокинетические исследования на приматах
[00295] Фармакокинетические исследования проводили на приматах (кроме человека) с использованием соединений, перечисленных в таблице 18. В таблице «соед.» относится к соединению, а «Средн.» относится к среднему.
Таблица 18. Соединения, протестированные в исследованиях in vivo
|
[00296] Концентрация в плазме полипептида R3152 (SEQ ID NO: 153) была определена у яванских макаков после однократной внутривенной (IV) дозы. Три самца получили по 3 мг/кг полипептида, и концентрацию полипептида в плазме определяли с помощью ЖХ-МС/МС после осаждения ацетонитрилом и экстракции на планшете Sirocco Protein Precipitation (Waters Corporation, Milford, MA). Фармакокинетические параметры (PK) были рассчитаны из временной кривой (см. фиг.4) объединенных плазменных концентраций R3152 (SEQ ID NO: 153), определенных сразу после введения дозы и до 48 ч после введения дозы. Уровень лекарственного вещества в плазме быстро падал во время начальной фазы распределения (<1 часа), а затем оставался постоянным и обнаруживался в течение 48 часов. R3152 (SEQ ID NO: 153) имел средний конечный период полувыведения 10,9±0,8 ч. Средняя скорость клиренса составляла 0,129±0,0122 л/ч/кг, что составляет приблизительно 5% от кровотока в печени типичной обезьяны (2,6 л/ч/кг). Средний объем распределения составлял 1,49±0,152 л/кг, что приблизительно вдвое превышает общую воду организма для типичной обезьяны (0,7 л/кг). Средняя AUC∞ составляла 23319±2120 ч*нг/мл.
[00297] R3152 (SEQ ID NO: 153) связывается с высоким сродством с белком C5 приматов и блокирует пути комплемента за счет предотвращения образования продуктов С5а и C5b и продукции мультимерного мембраноатакующего комплекса (MAC). Ингибирование опосредованного комплементом формирования MAC в образцах плазмы из вышеуказанного фармакокинетического исследования с использованием принятого ex vivo анализа (см. анализ гемолиза у человека, описанный в примере 10), в котором плазму разводили 1:100 и инкубировали с активированным овечьими эритроцитами (Complement Technology, Tyler, TX). В каждой временной точке гемолитическую активность определяли, как показатель активного сывороточного комплемента (см. фиг.4). В плазме, содержащей >200 нг/мл R3152 (SEQ ID NO: 153), существует явное ингибирование опосредованного комплементом гемолиза, что указывает на блокаду формирования MAC. Экзогенный R3152 (SEQ ID NO: 153), добавляемый к нормальной плазме яванских макаков, имеет IC50=2-20 нг/мл. Гемолитическая активность возвращается к нормальному уровню через 48 часов после введения дозы, после того плазматический уровень R3152 (SEQ ID NO: 153) падает ниже 100 нг/мл.
Пример 21. Фармакокинетические исследования на крысах
[00298] Дозу R3152 (SEQ ID NO: 153) доставляли с помощью внутривенного (IV) или подкожного (SC) введения самцам крыс в количестве 2 и 30 мг/кг, соответственно (фиг.5). После IV-введения R3152 (SEQ ID NO: 153) контролировали с помощью ЖХ-МС/МС после осаждения ацетонитрилом и экстракции на планшете Sirocco Protein Precipitation (Waters Corporation, Milford, MA), как описано выше. Фармакокинетические (PK) параметры вычисляли, исходя из временной кривой комбинированной концентрации в плазме (фиг.5) R3152 (SEQ ID NO: 153) и его равноактивного дезамидированного с С-конца метаболита, R3201 (SEQ ID NO: 211).
[00299] R3152 (SEQ ID NO: 153)/R3201 (SEQ ID NO: 211) показывал фазу быстрого распределения с последующим медленным выведением с t1/2=5,3 ч. Аналогичная скорость выведения наблюдалась после SC введения 30 мг/кг с приблизительно 65%-й биодоступностью дозы, исходя из AUC. Tmax, составляющая 4 часа, и пролонгированное действие лекарственного соединения, наблюдаемое при SC введении, создало возможность более широкого покрытия терапевтической концентрации в плазме. Поскольку R3152 (SEQ ID NO: 153) и R3201 (SEQ ID NO: 211) не связываются с С5 крысы, очень низкая ингибирующая активность наблюдалась в ex vivo анализе гемолиза.
[00300] У липидированных и нелипидированных соединений R3183 (SEQ ID NO: 184) и R3176 (SEQ ID NO: 177), соответственно, оценивали фармакокинетические свойства на самцах крыс Sprague-Dawley после внутривенного или подкожного введения. На фиг.6 показаны результаты. На левой панели фиг.6 показаны результаты для самцов крыс Sprague-Dawley (n=3), которым полипептиды вводили внутривенно одной дозой 2 мг/кг. Образцы крови собирали в указанные моменты времени, выделяли плазму и анализировали на содержание указанного соединения с помощью ЖХ-МС. Черные кружки: R3176 (SEQ ID NO: 177) (нелипидированное соединение); незакрашенные кружки: R3183 (SEQ ID NO: 184) (С16-липидированное соединение). На правой панели фиг.6 показаны результаты для самцов крыс Sprague-Dawley (n=3), которым полипептиды вводили подкожно одной дозой 15 мг/кг. Образцы крови собирали в указанные моменты времени, выделяли плазму и анализировали на содержание указанного соединения с помощью ЖХ-МС. Черные кружки: R3176 (SEQ ID NO: 177) (нелипидированное соединение); незакрашенные кружки: R3183 (SEQ ID NO: 184) (С16-липидированное соединение). Липидирование приводило к увеличению экспозиции соединения, что было оценено путем определения площади под кривой (AUC), которая увеличивалась в 2,1 раза при внутривенном и в 2,7 раза при подкожном введении.
Пример 22. Ингибирование гемолиза в тромбин-индуцированном пути комплемента
[00301] Тромбин может индуцировать активность комплемента при расщеплении C5 до C5T, который будет затем расщеплен до С5а и C5bT. C5bT, как C5b, будет связываться с С6 и остальными терминальными компонентами пути комплемента, С7, С8 и С9, что приводит к формированию мембраноатакующего комплекса (МАС), вызывающего лизис эритроцитов (Krisinger, et al., (2014). Blood. 120(8):1717-1725). Поэтому, R3183 и анти-С5 моноклональное антитело, аналогичное ECULIZUMAB®, были протестированы на их способность ингибировать гемолиз через тромбин-индуцированный путь комплемента.
[00302] Для оценки активности ингибиторов, С5 (Complement Technology, Tyler, TX) добавляли для достижения концентрации 400 нМ, и образец инкубировали с C6 в конечной концентрации 600 нМ (Complement Technology, Tyler, TX) и тромбином при концентрации 50 нМ (Enzyme Research Laborites, South Bend, IN) при температуре 37°С в течение 30 минут, в присутствии R3183 или анти-С5-моноклонального антитела, аналогичного ECULIZUMAB®, или в отсутствие ингибитора. Реакцию останавливали с добавлением гирудина до 150 нМ (Cell Sciences, Canton, MA) в буфере GVB+EDTA (Complement Technology, Tyler, TX) и инкубировали в течение 5 минут при комнатной температуре. Эти разбавленные образцы смешивали с антителосенсибилизированным овечьими эритроцитами (Complement Technology, Tyler, TX) в 96-луночном микротитровочном планшете (USA Scientific, Ocala, FL) и инкубировали при 37°С в течение 5 минут. Затем в лунки добавляли С7 (Complement Technology, Tyler, TX) для достижения концентрации 15 нМ, и планшет возвращали на 37°С на 15 минут. Затем к аналитической смеси добавляли комплекс C8 (10 нМ; Complement Technology, Tyler, TX) и С9 (25 нМ; Complement Technology, Tyler, TX), и образцы инкубировали в течение 30 минут при 37°С. После инкубации планшет центрифугировали при 1000g, 100 мкл супернатанта переносили в новый микротитровочный планшет, и оптическую плотность считывали при 412 нм. Полученные данные представлены на фиг.7. Было обнаружено, что R3183 ингибирует гемолиз через тромбин-индуцированный путь комплемента при концентрациях выше 6 нг/мл, тогда как моноклональные анти-С5 антитела этого не делали.

