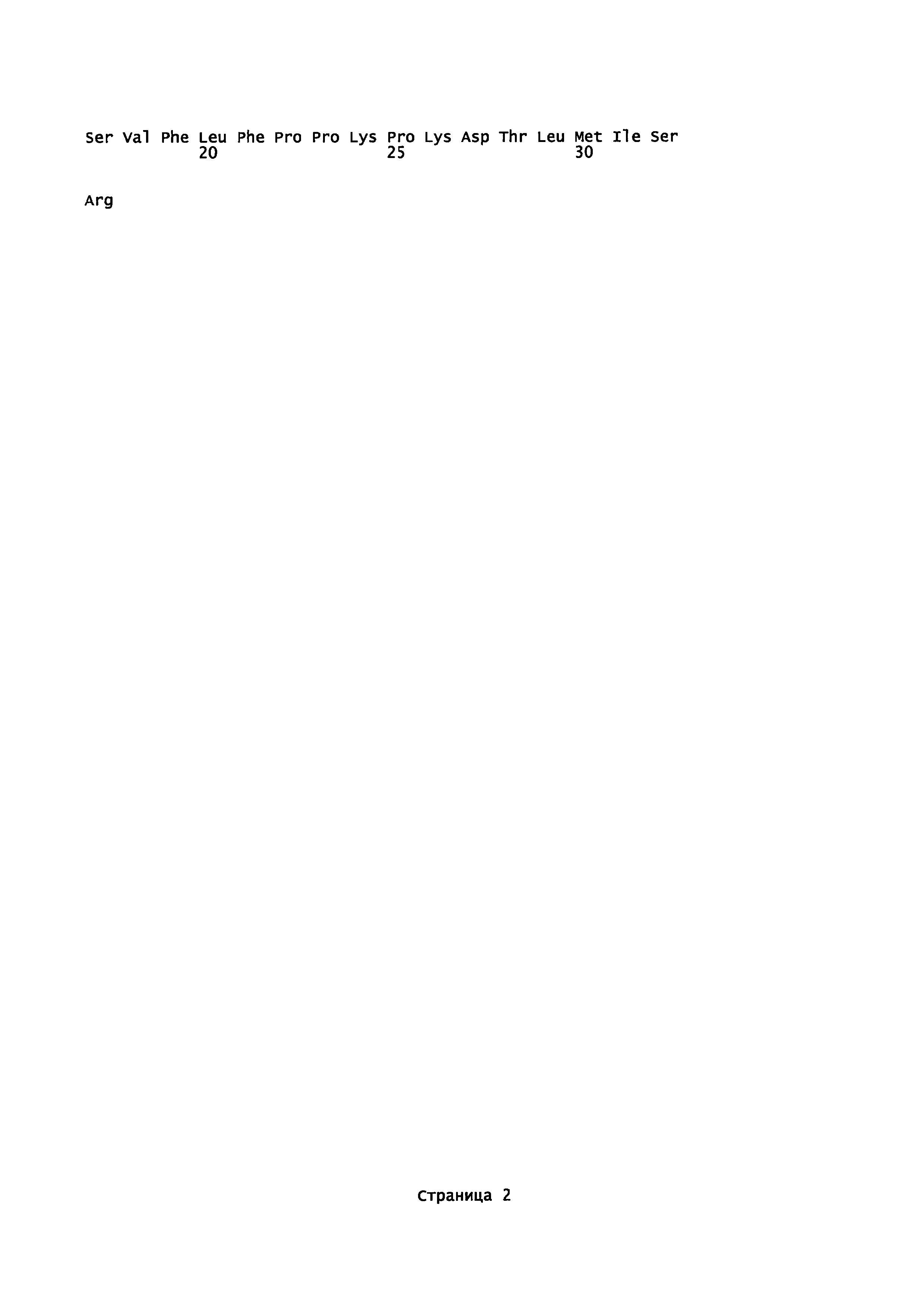КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ АГЕНТАМИ, ОБЛАДАЮЩИЕ УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ, И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники, к которой относится данное изобретение
Данное изобретение относится к конъюгатам антител с лекарственными агентами, содержащим лекарственное вещество, присоединенное с N-концевому аминокислотному остатку тяжелой либо легкой цепи антитела, способу их получения и применению.
Уровень техники
В последние годы изучаются способы диагностирования или лечения различных заболеваний с использованием антител. В частности благодаря специфичности антител к своей мишени разработаны различные терапевтические методы с использованием антител и различные типы лекарственных препаратов, содержащих антитела, например конъюгаты антител с лекарственными агентами (ADC). И постоянно ведутся исследования с целью повысить стабильность антител и конъюгатов антител с лекарственными агентами in vivo и добиться их максимального терапевтического эффекта.
Среди этих методов - применение конъюгатов антител с лекарственными агентами, которые, по сравнению с природными антителами, имеют тот недостаток, что нестабильны in vivo; однако их разрабатывают для того, чтобы преодолеть недостаток природных антител, состоящий в их низкой терапевтической эффективности, путем соединения с лекарственными агентами. Созданы различные конъюгаты антител с лекарственными веществами, обладающими определенным медицинским действием, например цитотоксическим. В частности, сейчас на практике применяется метод, позволяющий вызывать гибель раковых клеток с помощью цитотоксического агента, соединенного с антителом, специфичным к этим раковым клеткам.
Однако такие конъюгаты антител с лекарственными агентами, как правило, обладают низкой стабильностью in vivo по сравнению с природными антителами. Кроме того, при повышении соотношения лекарственный агент : антитела (DAR) с целью усиления терапевтического эффекта приходится решать различные связанные с этим технические проблемы. Во-первых, повышение соотношения лекарственный агент : антитела не должно влиять на способность антител связывать антиген и на функционирование Fc-фрагмента молекулы антитела для специфичной в отношении мишени терапии, не должно снижать стабильность конъюгата лекарственного агента с антителом in vivo (например, время полужизни в кровотоке), но должно усиливать терапевтический эффект. На сегодняшний день задачей в области получения конъюгатов антител с лекарственными агентами является достижение максимально возможного соотношения лекарственный агент : антитело в контексте описанных выше технических проблем. В частности, с учетом того, что уровень экспрессии антигенов поверхности раковых клеток низкий, для обеспечения значительного цитотоксического эффекта в отношении раковых клеток нужно поддерживать максимально возможное соотношение лекарственный агент : антитело (DAR). Однако когда DAR достигает 8, существенная проблема оказывается в том, что время полужизни конъюгата антитела с лекарственным агентом уменьшается из-за влияния гидрофобного лекарственного вещества, конъюгированного с антителом, так что его токсичность возрастает, и эффективность in vivo снижается.
Учитывая сказанное выше, авторы данного изобретения предприняли значительные усилия с целью разработать технологию, которая позволяла бы получать конъюгаты антител с лекарственными агентами, сохраняющие способность связывать антиген, присущую исходному антителу, обладающие значительным противораковым действием и низкой токсичностью, обеспечивая высокую эффективность in vivo. В результате этой работы авторы данного изобретения обнаружили, что если лекарственный агент присоединен к N-концу тяжелой или легкой цепи антитела, то конъюгат антитела с лекарственным агентом обладает высокой стабильностью в крови и значительной противораковой активностью, в то же время проявляя низкую токсичность in vivo, по сравнению с теми конъюгатами антител с лекарственными агентами, о которых сообщалось ранее; таким образом сложилось данное изобретение.
Раскрытие изобретения
Цель данного изобретения - предложить конъюгат антитела с лекарственным агентом, в котором лекарственное вещество присоединено к N-концевому аминокислотному остатку тяжелой или легкой цепи молекулы антитела.
Другая цель данного изобретения - предложить способ получения указанного конъюгата антитела с лекарственным агентом.
Еще одна цель данного изобретения - предложить композицию, содержащую указанный конъюгат антитела с лекарственным агентом.
Еще одна цель данного изобретения - предложить способ лечения рака, включающий введение указанного конъюгата антитела с лекарственным агентом индивиду, у которого подозревается раковое заболевание.
Также цель данного изобретения - предложить способ лечения аутоиммунных заболеваний, включающий введение указанного конъюгата антитела с лекарственным агентом индивиду, у которого подозревается аутоиммунное заболевание.
Также цель данного изобретения - предложить способ скрининга и выявления антител, подходящих для использования при получении указанных конъюгатов антител с лекарственными агентами.
Полезный эффект изобретения
Способ получения конъюгатов антител с лекарственными агентами по данному изобретению позволяет получить конъюгат антитела с лекарственным агентом, обладающий более высокой эффективностью in vivo, стабильностью и меньшей токсичностью.
Краткое описание иллюстраций
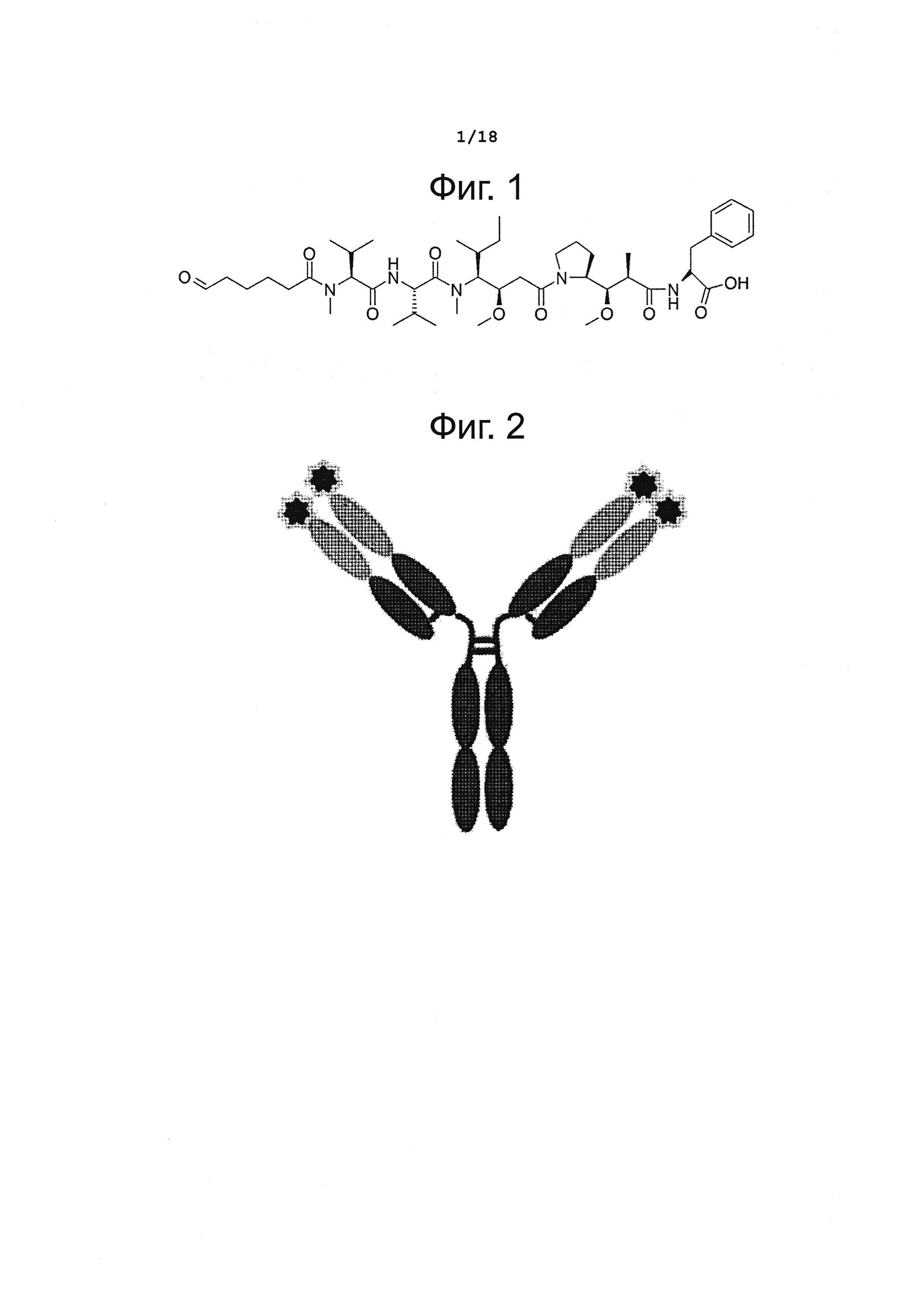
Фигура 1 представляет структурную формулу цитотоксического агента монометилауристатина F (MMAF) с альдегидным линкером на конце молекулы.
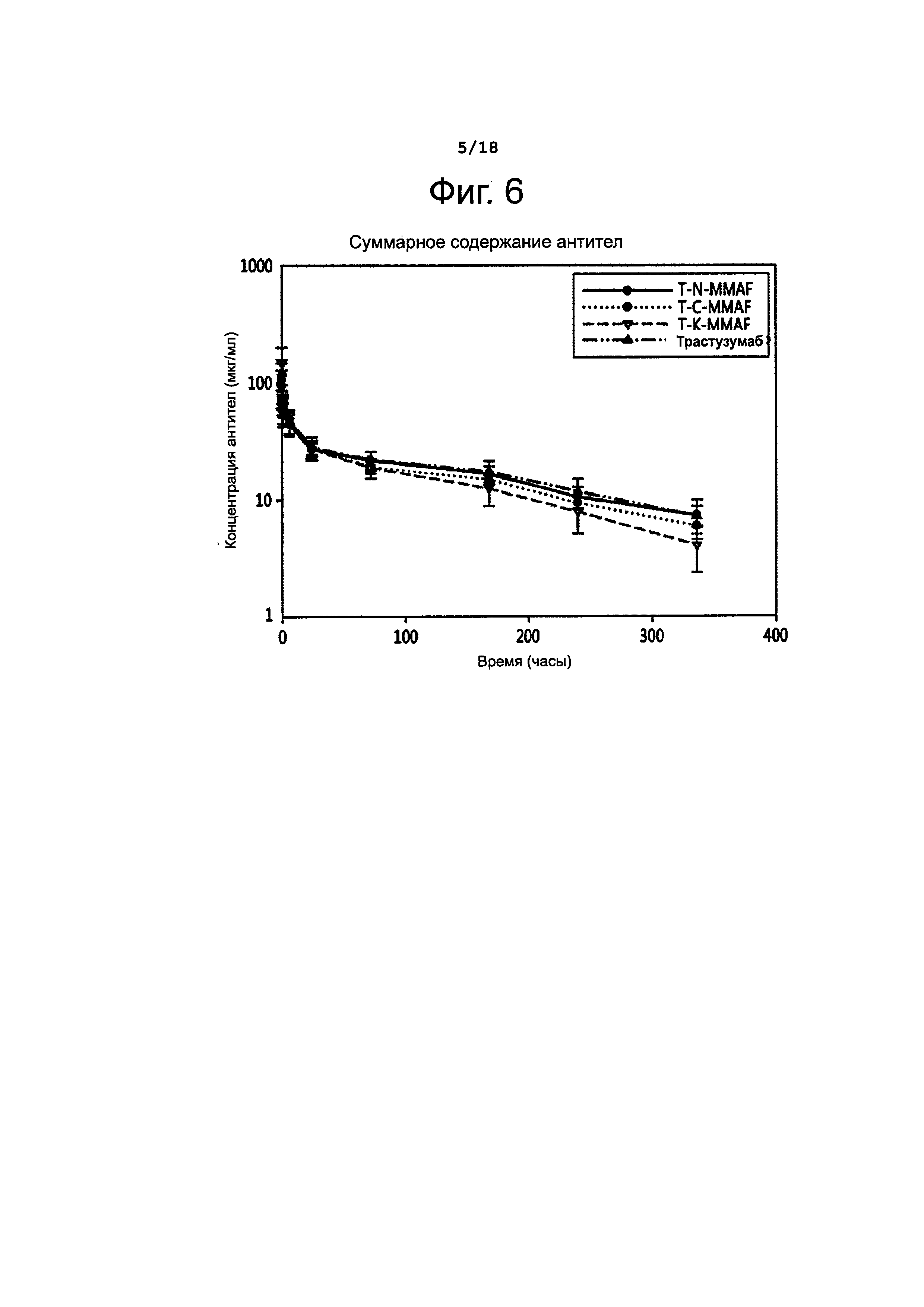
Фигура 2 представляет схематическое изображение структуры конъюгата не модифицированного генетически моноклонального антитела с цитотоксическим агентом, в котором число молекул цитотоксического вещества и сайты их присоединения к молекуле антитела однородны.
Фигура 3 представляет результаты анализа T-N-MMAF путем жидкостной хроматографии с масс-спектрометрией (LC/MS).
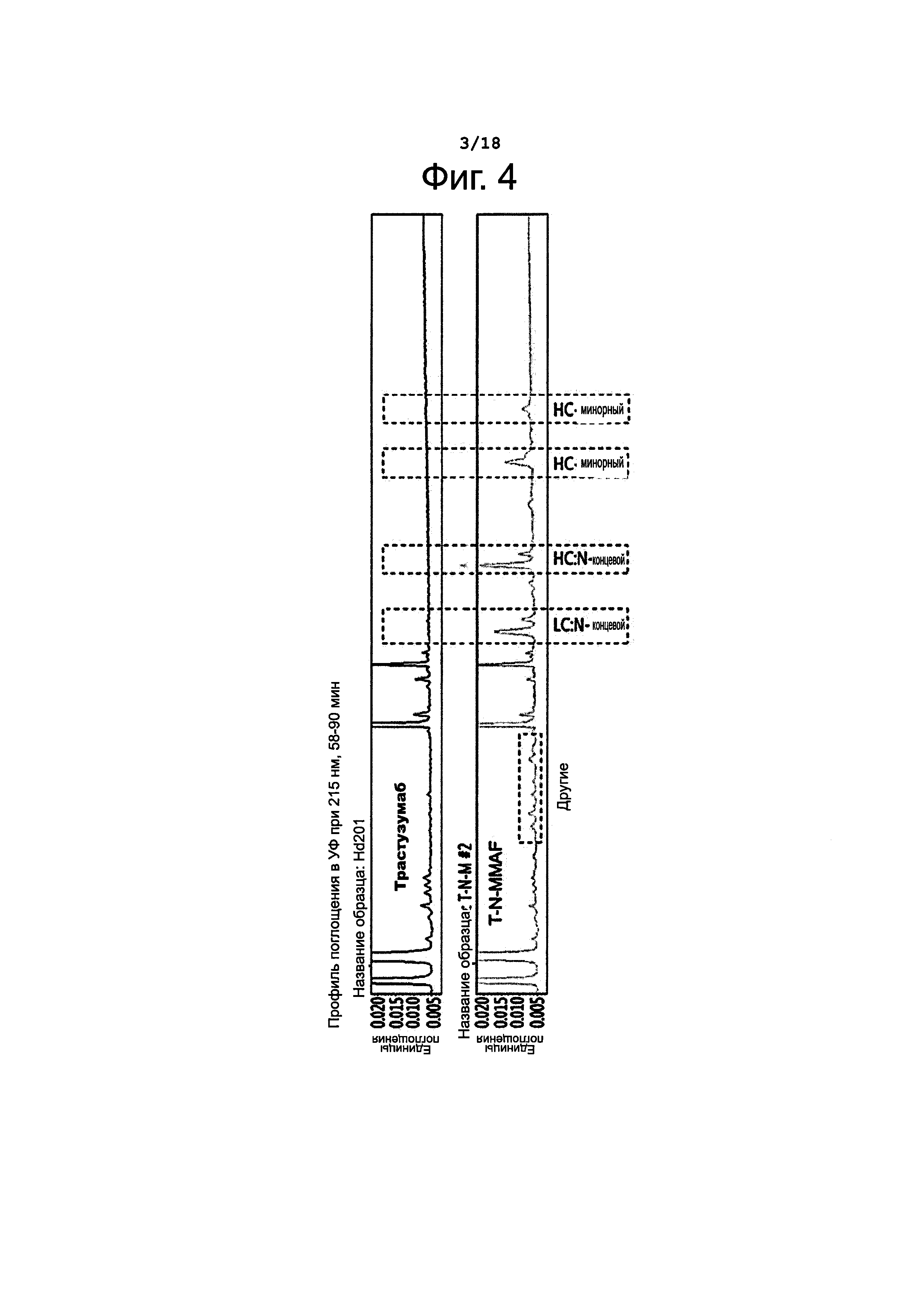
Фигура 4 представляет результаты пептидного картирования, выполненного для определения сайта связывания лекарственного агента в полученном конъюгате трастузумаб-N-MMAF (T-N-MMAF).
Фигура 5 представляет результаты анализа полученного конъюгата T-N-MMAF методом эксклюзионной высокоэффективной жидкостной хроматографии (SEC-HPLC).
Фигура 6 показывает изменение суммарной концентрации антител в крови у крыс во времени.
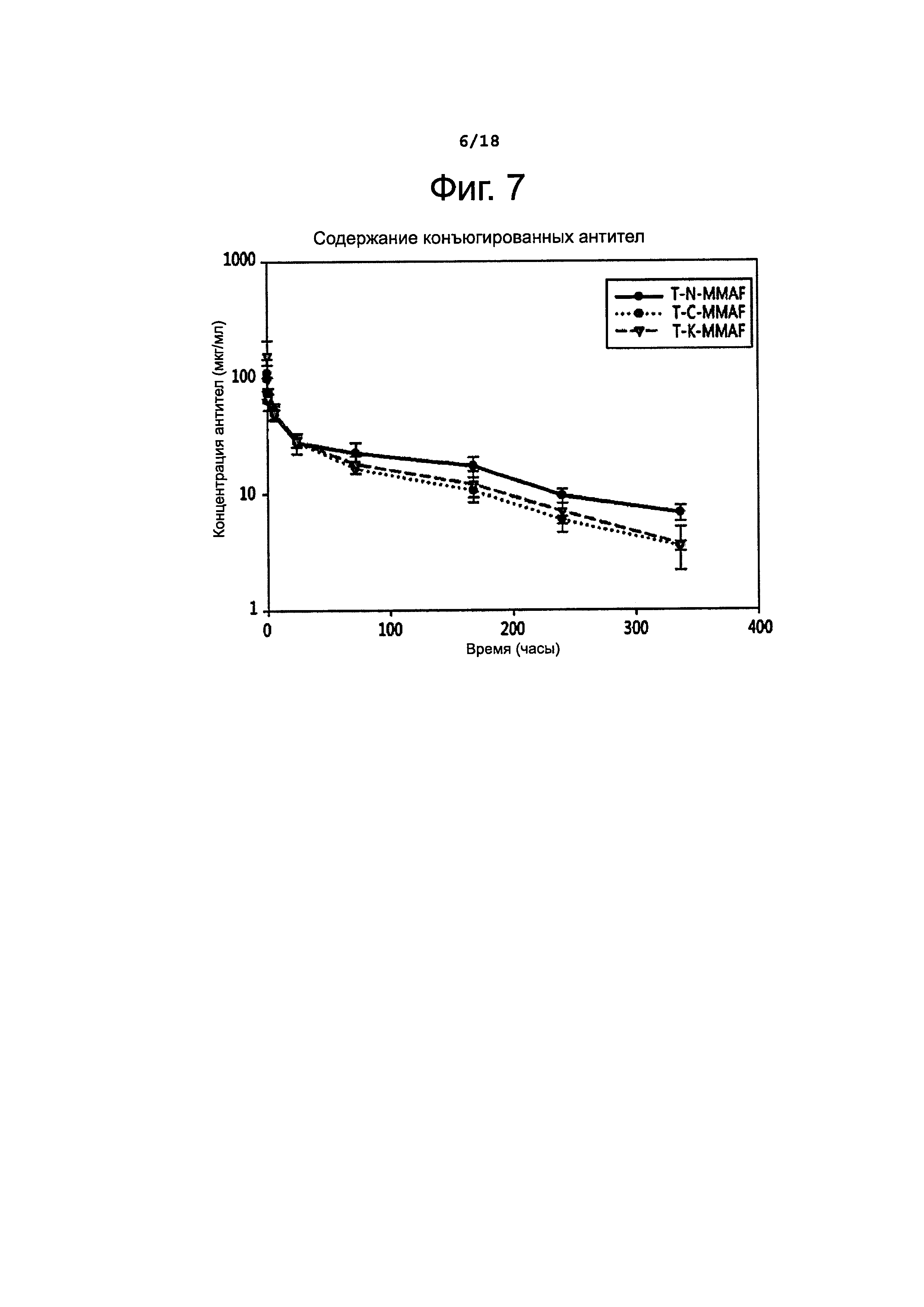
Фигура 7 показывает изменение концентрации конъюгированных антител в крови у крыс во времени.
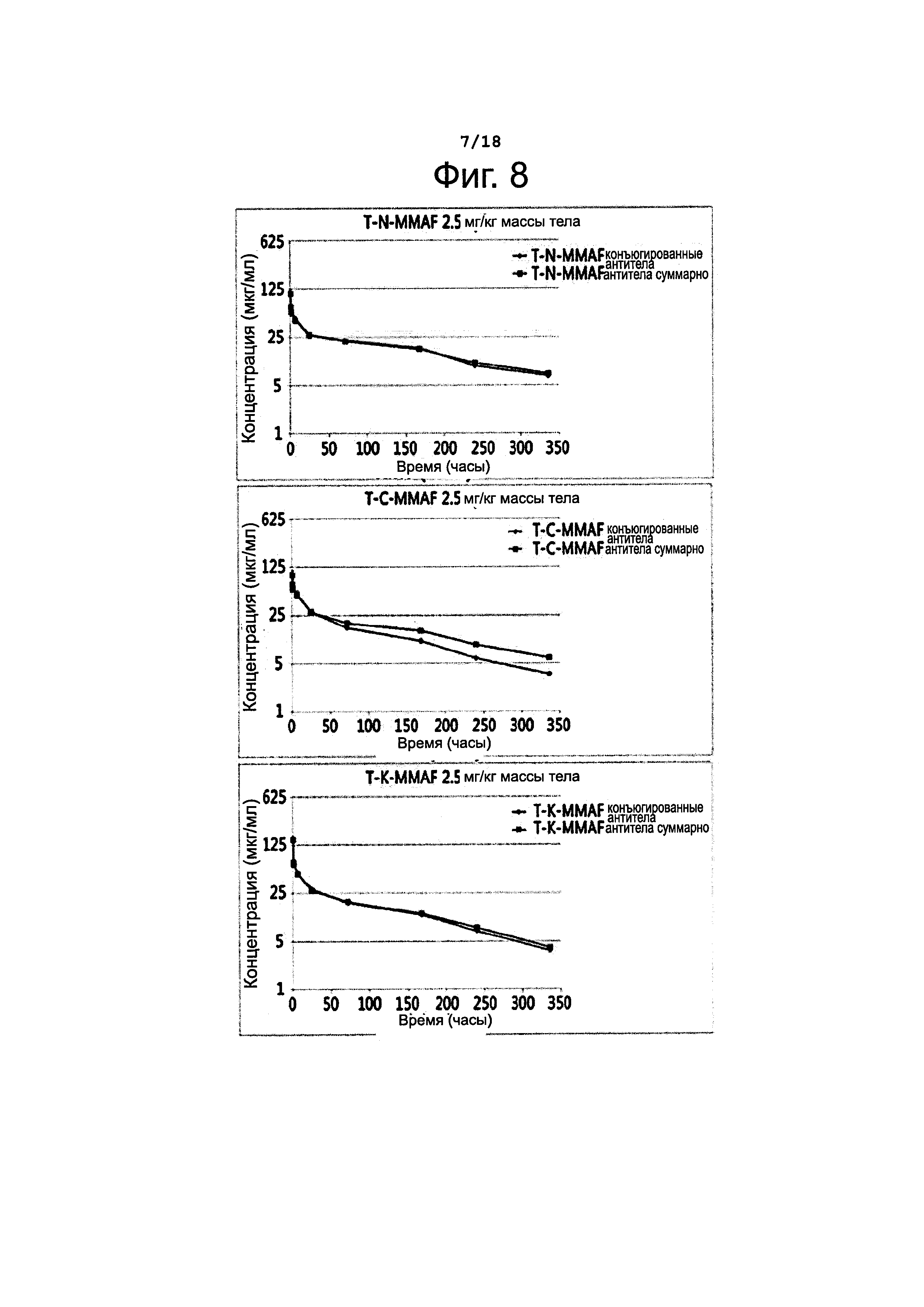
Фигура 8 представляет сравнение разных конъюгатов по фармакокинетической картине (изменение суммарной концентрации антител и концентрации конъюгированных антител во времени).
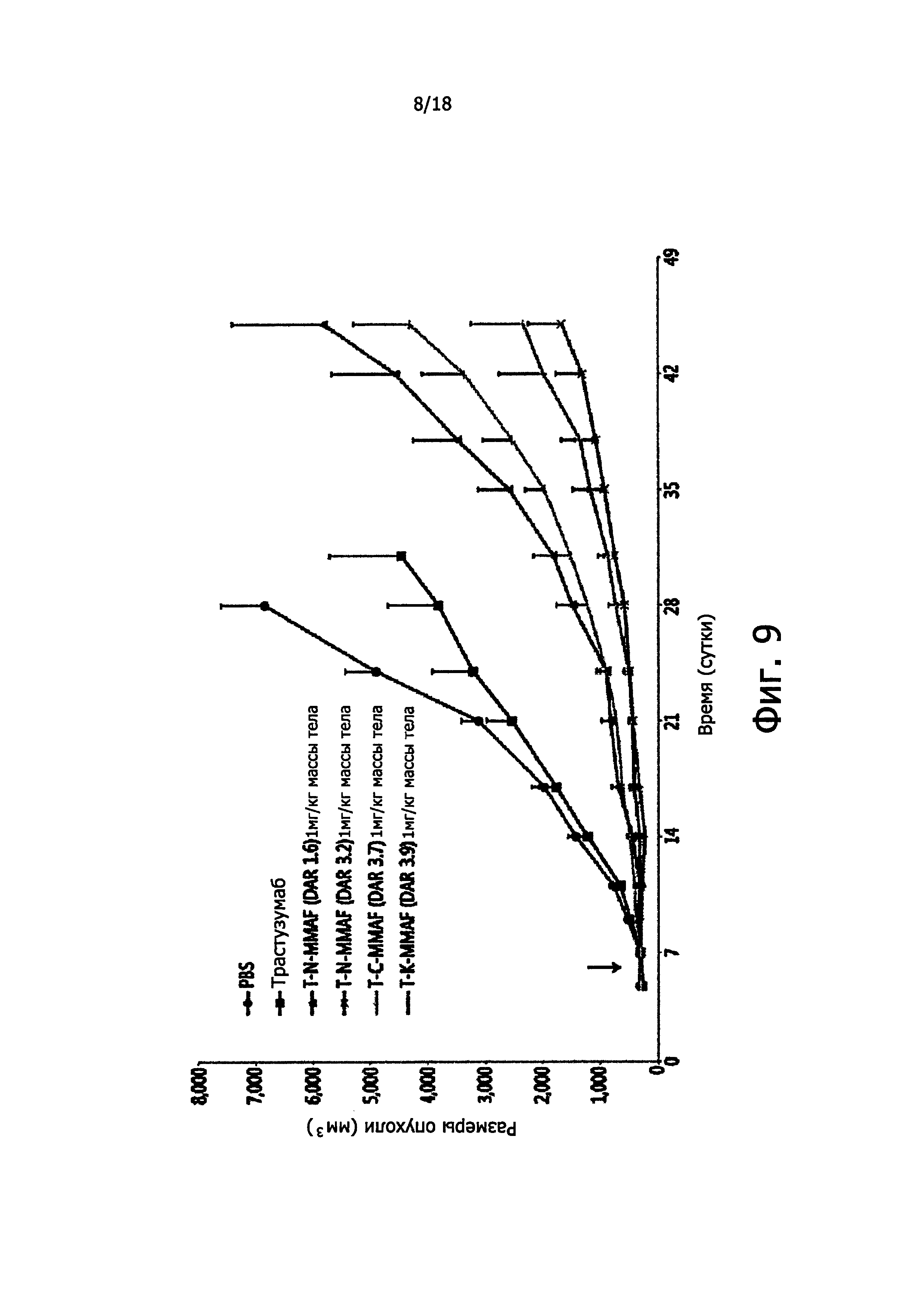
Фигура 9 представляет кривые роста опухолевых ксенографтов, образованных клетками линии НСС1954, у модельных организмов - голых крысах.
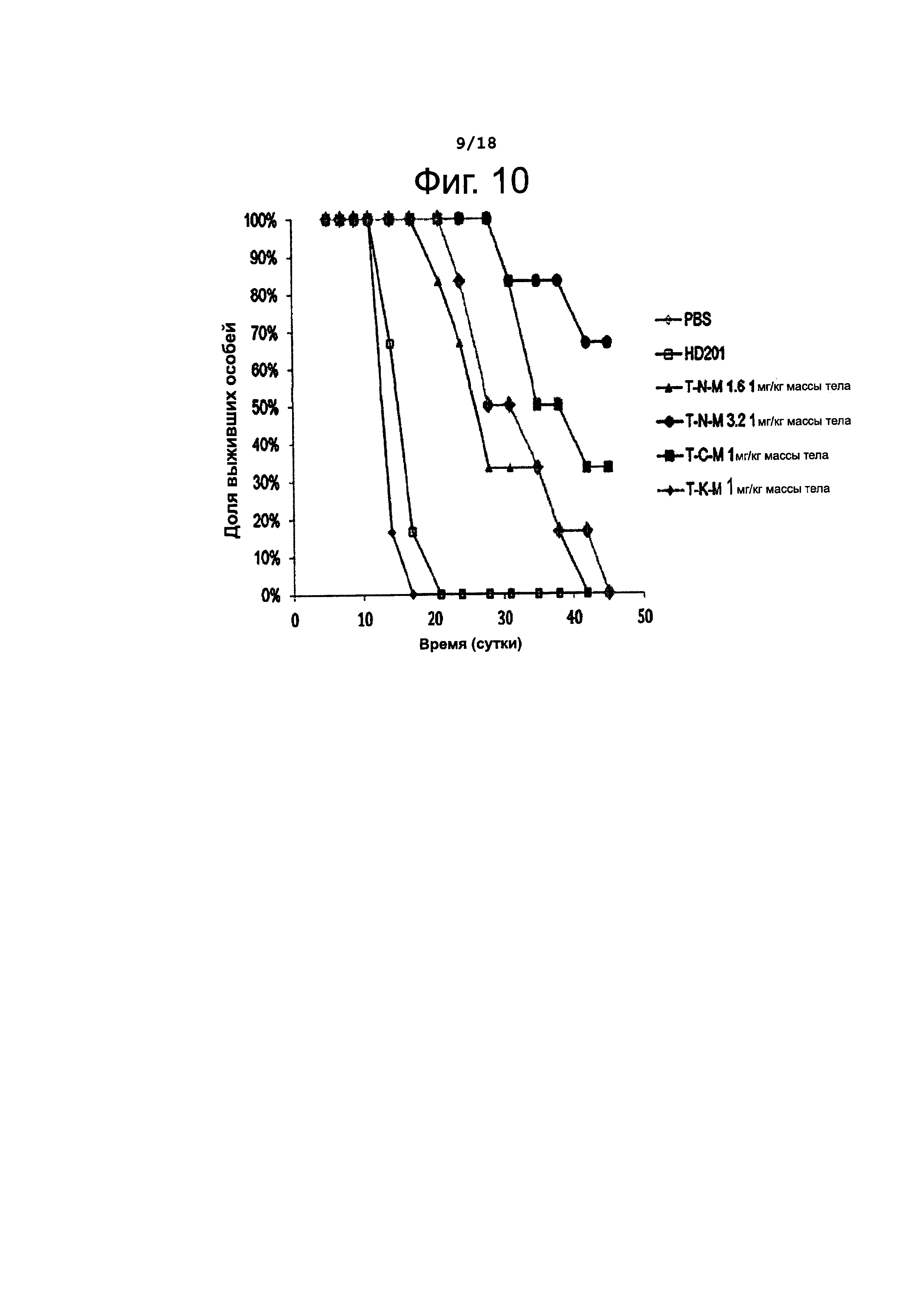
Фигура 10 представляет кривые выживания, полученные в опытах с опухолевыми ксенографтами у голых крыс, проведенных с целью определить конечный объем опухолей.
Фигура 11 представляет кривые изменения абсолютной и относительной массы тела во времени в результате введения различных конъюгатов антител с лекарственными агентами.
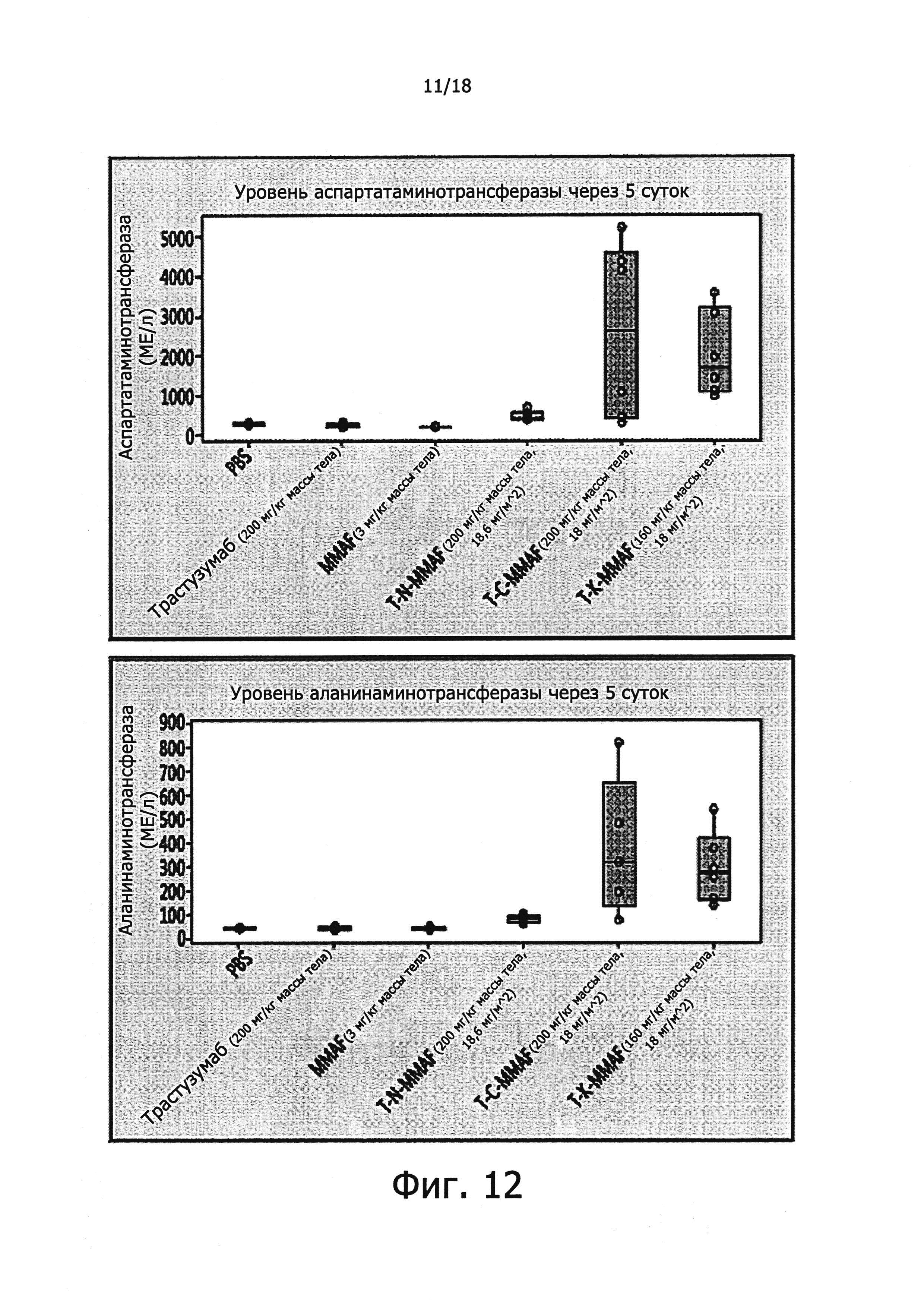
Фигура 12 представляет данные, полученные в опытах, в которых выяснялось, обладают ли взятые конъюгаты антител с лекарственными агентами гепатотоксичностью.
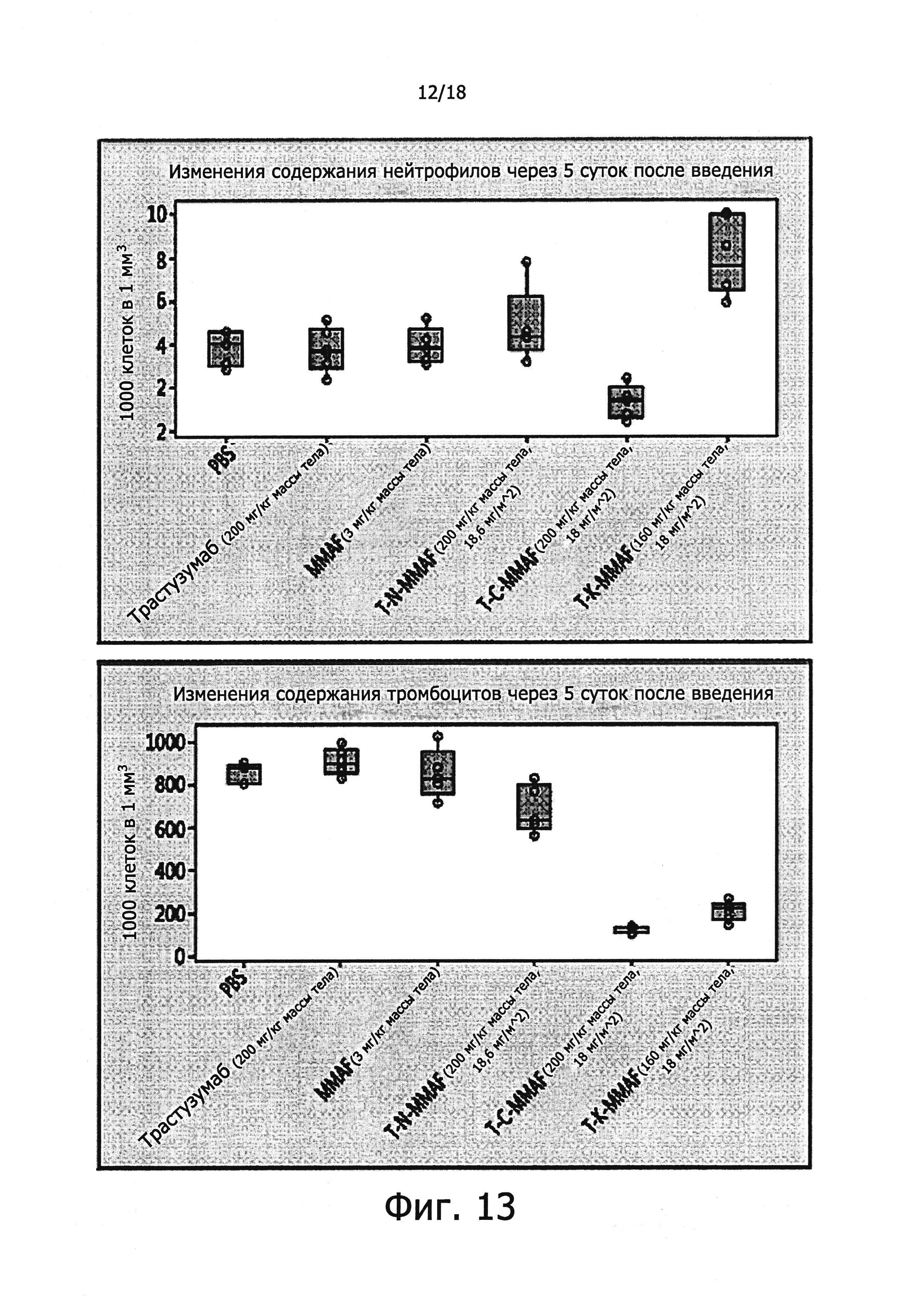
Фигура 13 представляет изменения содержания нейтрофилов и тромбоцитов в результате введения различных конъюгатов антител с лекарственными агентами.
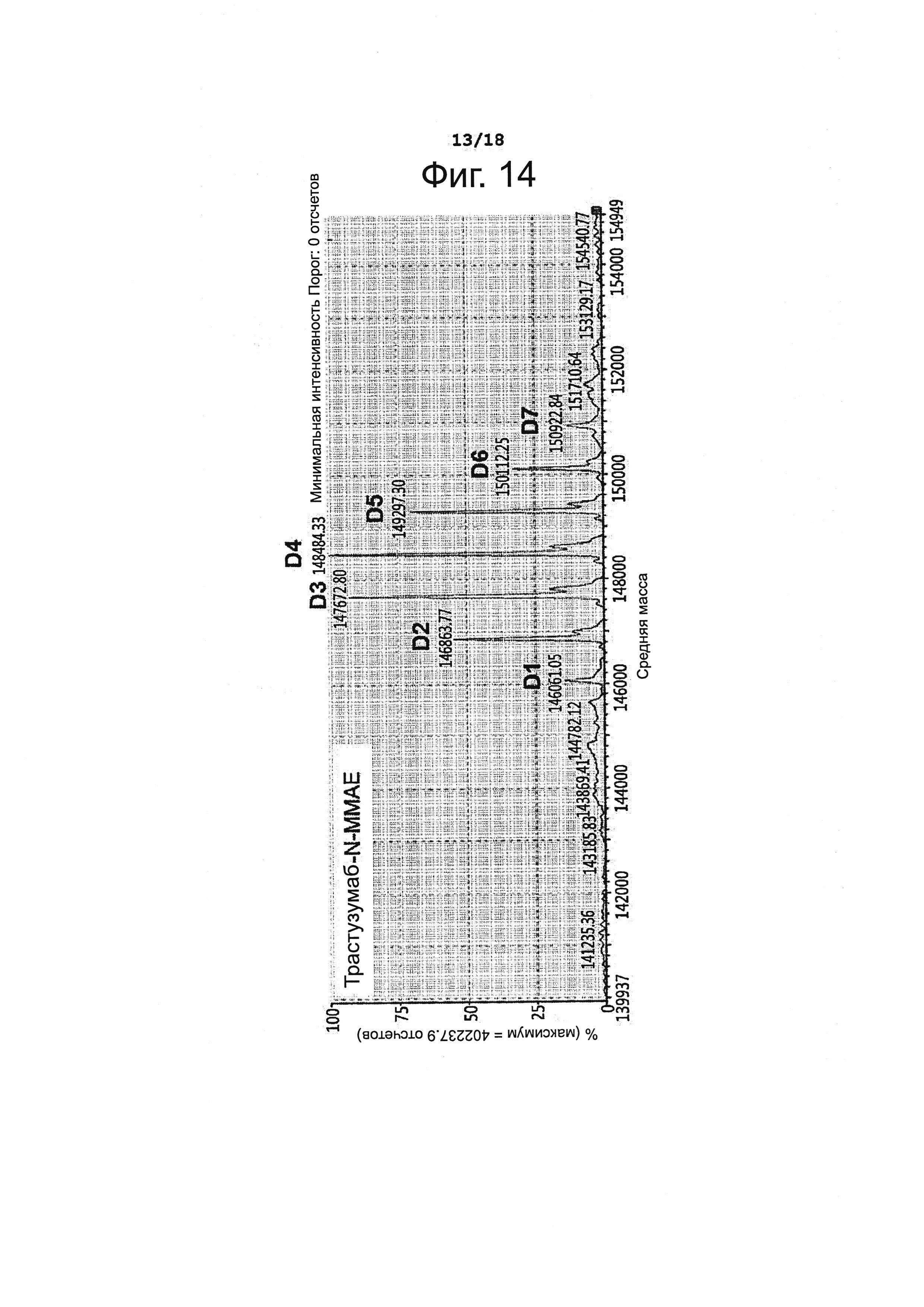
Фигура 14 представляет результаты анализа конъюгата T-N-MMAE методом жидкостной хроматографии с масс-спектрометрией (LC/MS)..
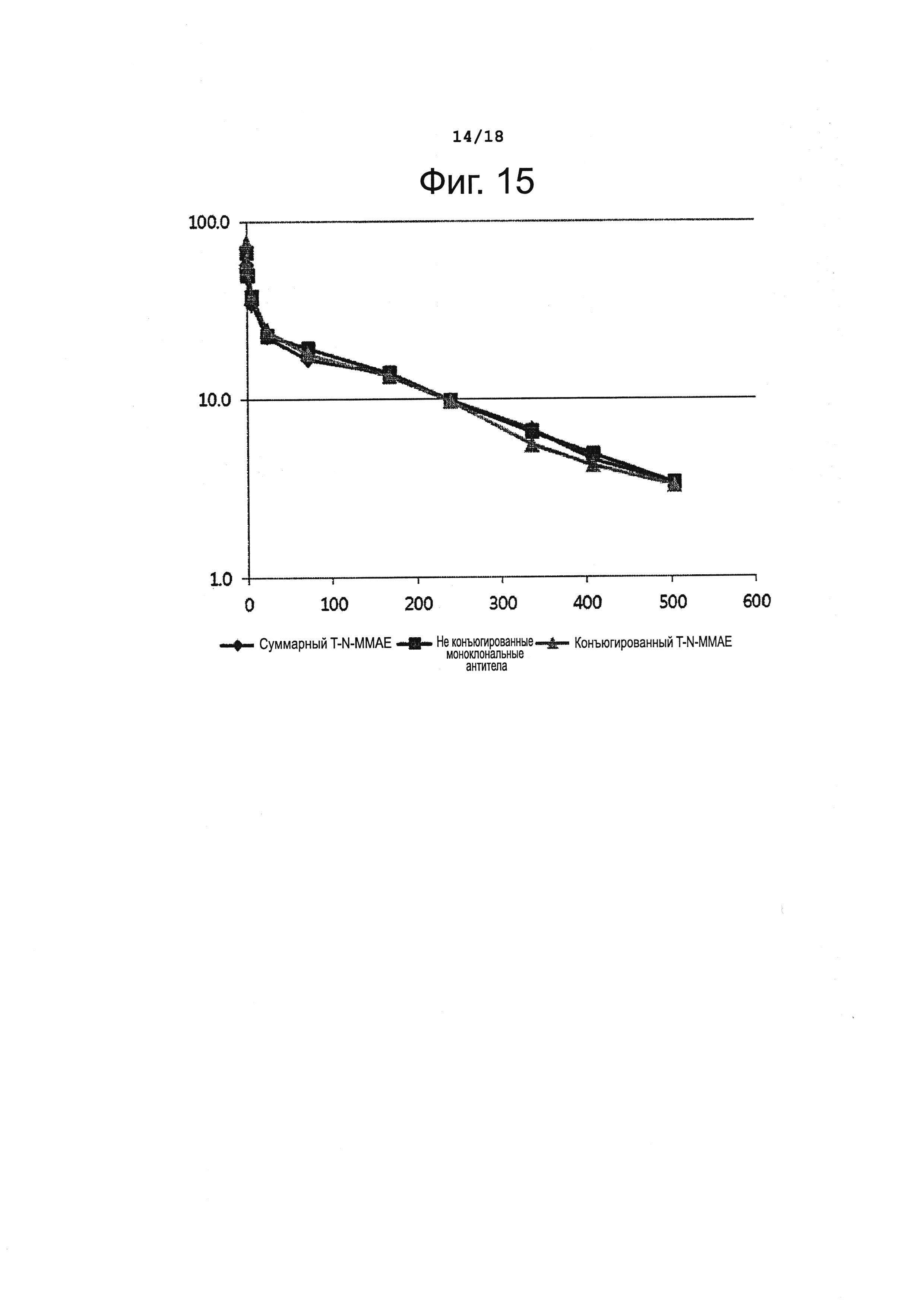
Фигура 15 представляет фармакокинетический профиль T-N-MMAE у крыс.
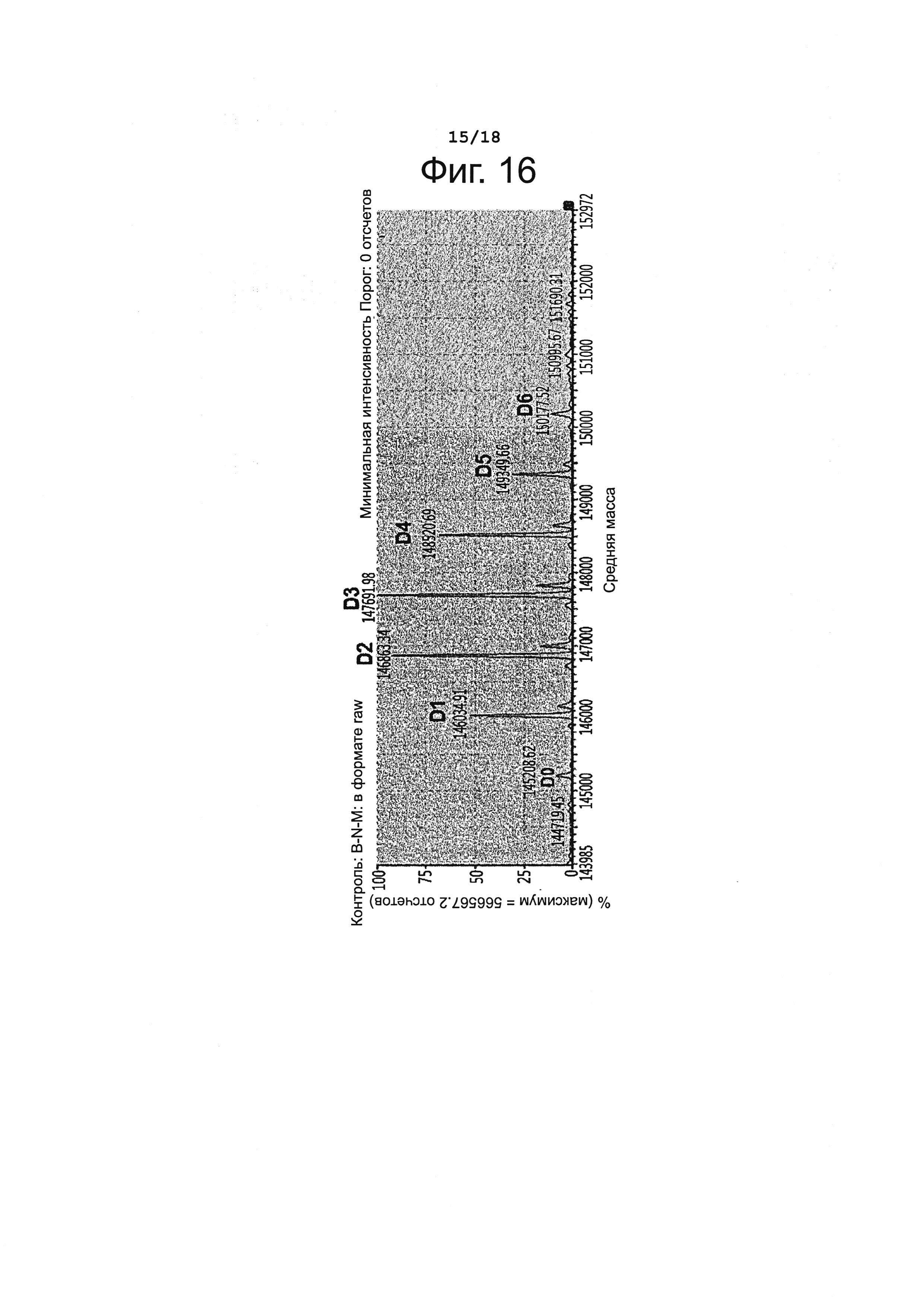
Фигура 16 представляет результаты анализа брентуксимаб-N-MMAF (B-N-MMAF) путем жидкостной хроматографии с масс-спектрометрией (LC/MS).
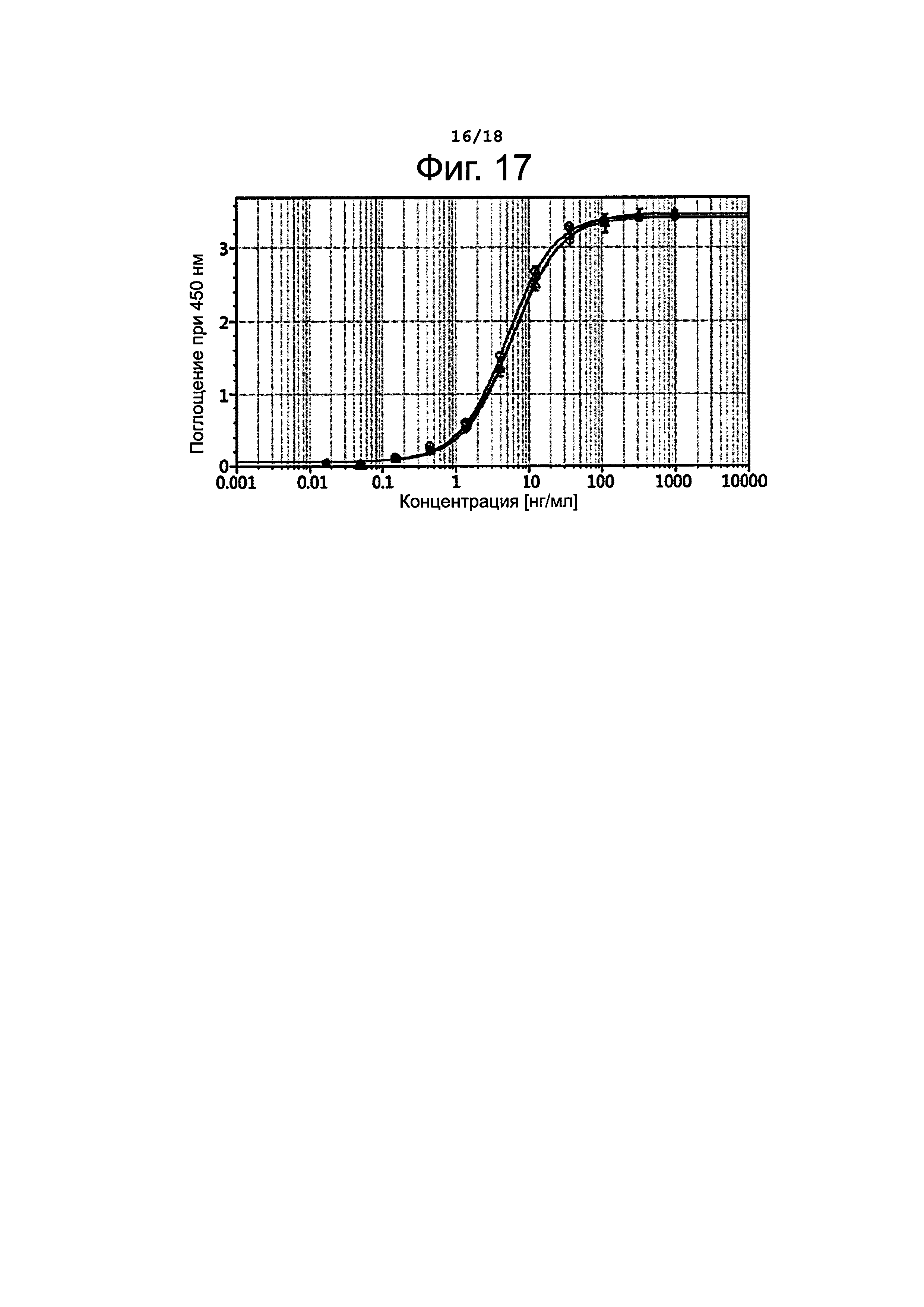
Фигура 17 представляет результаты определения антиген-связывающей активности B-N-MMAF.
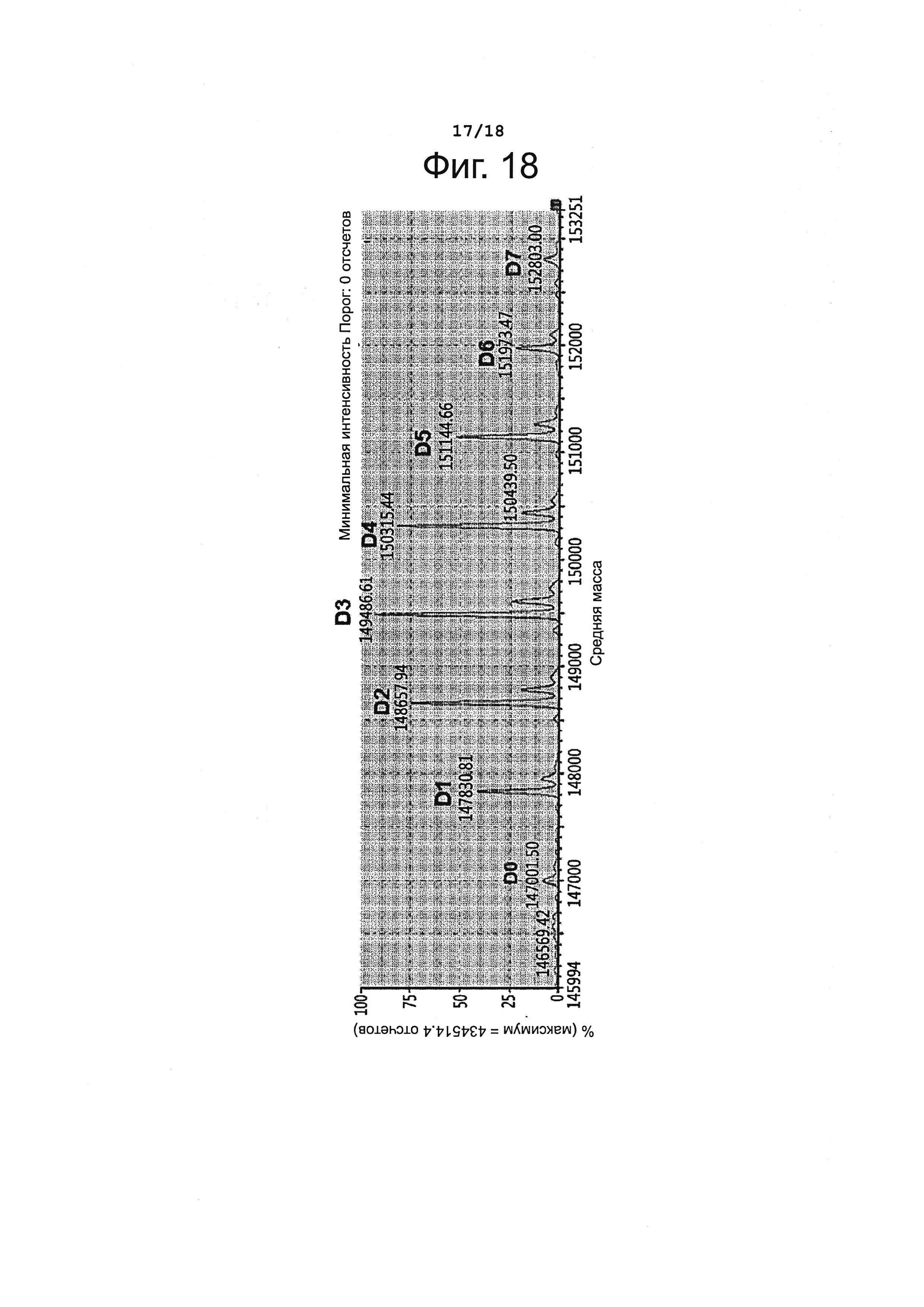
Фигура 18 представляет профиль конъюгации лорвотузумаб-N-MMAF (L-N-MMAF).
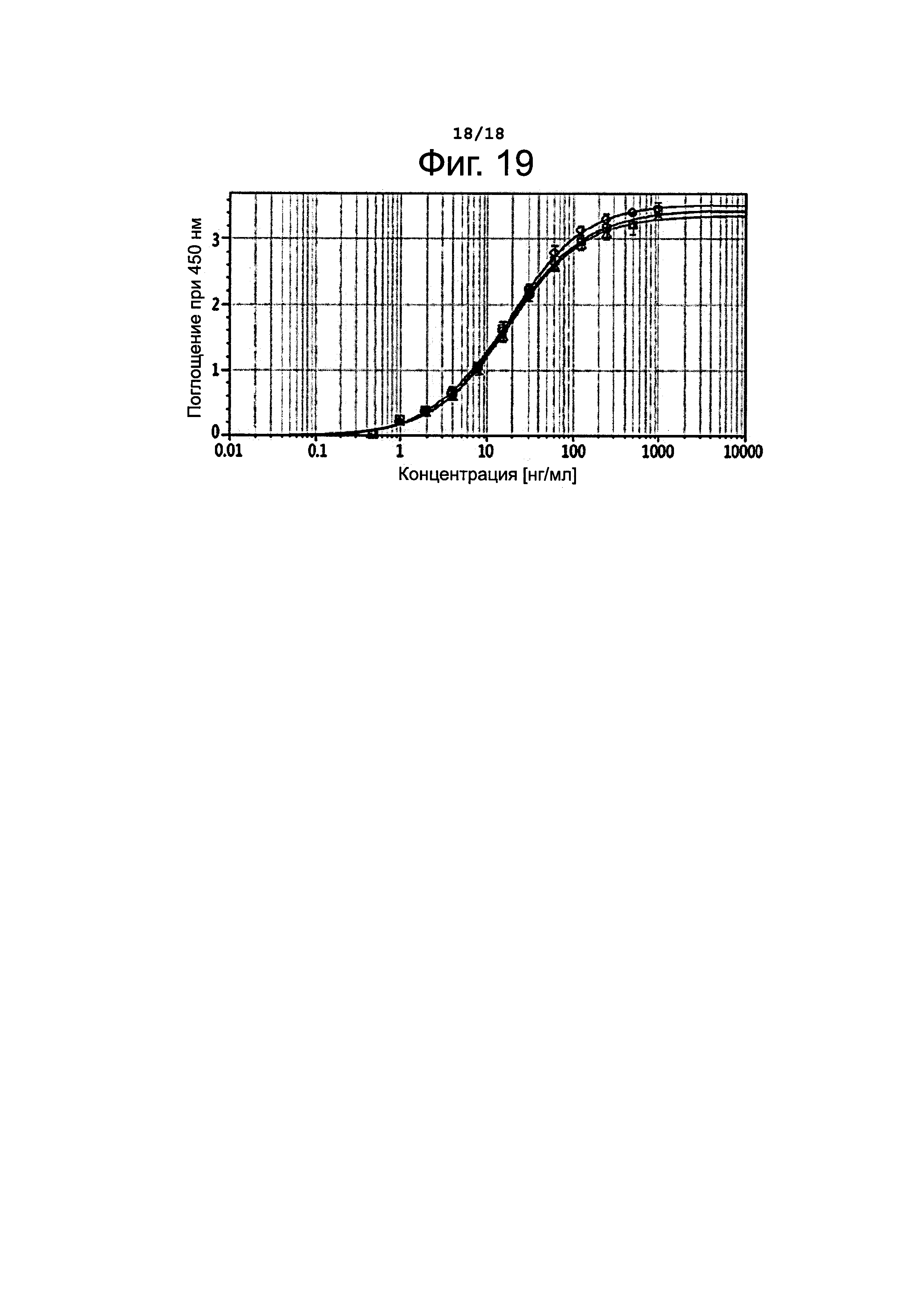
Фигура 19 представляет результаты определения антиген-связывающей активности L-N-MMAF.
Наилучшее техническое выполнение изобретения
В одном из своих аспектов данное изобретение направлено на конъюгат антитела с лекарственным агентом, в котором лекарственное вещество присоединено к N-концевому аминокислотному остатку тяжелой или легкой цепи молекулы антитела.
В настоящем документе термин «конъюгат антитела с лекарственным агентом» (ADC) относится к форме, в которой лекарственное вещество и антитело химически соединены друг с другом без снижения биологической активности антитела и лекарственного агента. В контексте данного изобретения термин «конъюгат антитела с лекарственным агентом» (ADC) относится к форме, в которой лекарственное вещество присоединено к N-концевому аминокислотному остатку тяжелой и/или легкой цепи молекулы антитела, в частности, к форме, в которой лекарственное вещество присоединено к N-концевой аминогруппе тяжелой и/или легкой цепи молекулы антитела. В данном изобретении было обнаружено, что если лекарственное вещество сайт-специфично присоединено к N-концу тяжелой или легкой цепи среди различных областей молекулы антитела, то такой конъюгат лекарственного агента с антителом обладает высокой эффективностью in vivo, превосходной стабильностью и низкой токсичностью по сравнению с теми конъюгатами антител с лекарственными агентами, о которых сообщалось ранее, в том числе ADC, в которых конъюгирование осуществлено через цистеин, ADC, образованных с участием тиоловой группы, и ADC, образованных с участием лизина; это указывает на то, что N-конец тяжелой и/или легкой цепи молекулы антитела является предпочтительным сайтом для конъюгирования антитела с лекарственным агентом с точки зрения эффективности, стабильности и низкой токсичности конъюгата. Конъюгат антитела с лекарственным агентом по данному изобретению схематически изображен на фиг. 2.
В настоящем документе термин «N-конец» относится к амино-концу (N-концу) тяжелой или легкой цепи молекулы антитела, являющемуся местом присоединения лекарственного вещества для целей данного изобретения. Примеры N-конца включают (не ограничиваясь перечисленным здесь) не только аминокислотные остатки в дистальной части N-конца, но также аминокислотные остатки вблизи N-конца. Конкретно, термин «N-конец» относится к первому аминокислотному остатку тяжелой или легкой цепи молекулы антитела, более конкретно - к альфа-аминогруппе первого аминокислотного остатка тяжелой или легкой цепи молекулы антитела (но этим не ограничивается).
Конъюгат антитела с лекарственным агентом по данному изобретению обладает тем преимуществом, что обеспечивает гомогенность за счет специфичного в отношении сайта присоединения лекарственного вещества к молекуле антитела или в отношении числа присоединенных к антителу молекул лекарственного агента. В частности, в результате процедуры оптимизации по данному изобретению в каждой молекуле антитела к N-концевым аминокислотным остаткам может быть присоединено 1-8 молекул лекарственного вещества, что соответствует оптимальному соотношению лекарственное вещество-антитело (DAR).
В настоящем документе термин «гомогенность» относится к такой ситуации, когда соотношение и место соединения молекул двух веществ с образованием конъюгата одинаковы во всех молекулах конъюгата. Однако подразумевается, что этот термин включает не только те случаи, когда соотношение и место соединения молекул двух веществ с образованием конъюгата совершенно одинаковы во всех молекулах конъюгата, но также случаи, когда какие-то конкретные соотношение и сайт конъюгирования преобладают. Когда конъюгат обладает гомогенностью, его молекулы все одинаковы, и тогда можно точно определить зависимость эффективности от дозы и стандартизовать дозу и число введений препарата.
В настоящем документе термин «антитело» означает молекулу белка, который представляет собой иммуноглобулин, иммунологически взаимодействующий с определенным антигеном и служащий рецептором, специфично распознающим этот антиген. Подразумевается, что термин «антитело» охватывает поликлональные антитела, моноклональные антитела, полноразмерные молекулы антител и фрагменты молекул антител, содержащие домены, связывающие антиген. В полноразмерной молекуле антитела имеется две полноразмерных легких цепи и две полноразмерных тяжелых цепи, причем каждая из легких цепей связана с тяжелой цепью дисульфидной связью. Полноразмерные антитела включают IgA, IgD, IgE, IgM и IgG; подтипы IgG включают IgG1, IgG2, IgG3 и IgG4. Термин «фрагмент антитела» относится к фрагменту, обладающему функцией связывания антигена; подразумевается, что этот термин включает Fab, Fab', F(ab')2, scFv и Fv. Фрагмент Fab включает вариабельные области легких и тяжелых цепей, константную область легких цепей и первый константный домен тяжелых цепей (СН1); в Fab один сайт, связывающий антиген. Фрагмент Fab' отличается от Fab тем, что в нем имеется шарнирный участок, содержащий один или более остатков цистеина на С-конце домена СН1 тяжелой цепи. Фрагмент F(ab')2 образуется путем возникновения дисульфидной связи между остатками цистеина шарнирного участка Fab'. Фрагмент Fv - это минимальный антительный фрагмент, в котором имеются только вариабельная область тяжелой цепи и вариабельная область легкой цепи. Фрагмент dsFv имеет такую структуру, что вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны друг с другом дисульфидной связью. Фрагмент scFV, как правило, имеет структуру, в которой вариабельная область тяжелой цепи и вариабельная область легкой цепи объединены в одну полипептидную цепь с помощью пептидного линкера. Эти антительные фрагменты можно получить, используя протеазы (например, фрагменты Fab можно получить путем расщепления полноразмерной молекулы антитела папаином, фрагменты F(ab')2 можно получить путем расщепления полноразмерной молекулы антитела пепсином). Предпочтительно эти антительные фрагменты получают с помощью технологии рекомбинантной ДНК. Эти антительные фрагменты могут быть получены с использованием протеаз (например, расщепление цельного антитела папаином или пепсином позволяет получить Fab или F(ab')2, соответственно), и предпочтительно производятся с помощью технологии рекомбинантной ДНК.
Кроме того, антитела, используемые по данному изобретению, могут быть природными антителами или рекомбинантными антителами. В настоящем документе термин «природное антитело» относится к антителу, не подвергнутому никаким генетическим модификациям. Природным антителам - в отличие от антител, генетически модифицированных in vivo - может быть присущ весьма низкий риск иммуногенности. В настоящем документе термин «рекомбинантное антитело» означает генетически модифицированное антитело, у которого способность связывать антиген или иные желаемые свойства изменены путем модификации на генетическом уровне.
В настоящем документе термин «модификация на генетическом уровне» («генетическая модификация») относится к действиям, приводящим к изменению нужной аминокислотной последовательности, и подразумевается, что он включает модификацию полипептидов, имеющих аминокислотную последовательность, несколько отличную от аминокислотной последовательности нативного полипептида, включающего нужную аминокислотную последовательность. Вариантные аминокислотные последовательности содержат аминокислотную последовательность с заменами, делениями или вставками одного или более аминокислотных остатков в одном или более определенных положениях нативной аминокислотной последовательности.
Антитела, используемые по данному изобретению, могут быть антителами, распознающими антиген клеточной поверхности, который, связавшись с антителом, поглощается (интернализируется) клеткой. Для целей данного изобретения при интернализации антигена клеткой в результате его связывания с антителом лекарственный агент, в частности цитотоксическое вещество, конъюгированное с этим антителом, может проникнуть в клетку благодаря свойствам антитела и таким образом обладает высокой эффективностью (сказанное здесь не имеет ограничительного характера).
Кроме того, антитела, используемые по данному изобретению, могут быть антителами, специфично связывающимися с антигеном поверхности раковых клеток или клеток ткани, пораженной в результате аутоиммунного заболевания.
В настоящем документе термин «антиген поверхности раковых клеток» относится к веществу, которое не образуется в нормальных клетках либо не присутствует на их поверхности, или к веществу, которое присутствует на поверхности исключительно раковых клеток, или к веществу, которое на поверхности раковых клеток присутствует в большем количестве, чем на поверхности нормальных клеток. Когда нужное вещество распознается антителом, оно считается антигеном.
Конкретно, антигеном поверхности раковых клеток, используемым по данному изобретению, может быть любой антиген поверхности раковых клеток, распознаваемый специфично антителами по данному изобретению. Примеры антигенов поверхности раковых клеток включают CD19, CD20, CD30, CD33, CD37, CD22, CD56, CD70, CD74, CD138, Muc-16, мезотелин, HER2, HER3, GPNMB (гликопротеин NMB), IGF-1R, ВСМА (антиген созревания В-клеток), PSMA (мембранный антиген, характерный для предстательной железы), ЕрСАМ (молекулу адгезии эпителиальных клеток) и EGFR (рецептор фактора роста эпидермиса). Более конкретно, антиген поверхности раковых клеток может быть любым выбираемым из группы, состоящей из HER2, CD30, CD56 и GPNMB (перечисленное здесь не имеет ограничительного характера). В одном из примеров по данному изобретению в качестве модельных антител использовались трастузумаб (препарат моноклональных антител против HER2), лорвотузумаб (препарат моноклональных антител против CD56), брентуксимаб (препарат моноклональных антител против CD30) и глембатумумаб (препарат моноклональных антител против GPNMB); эти антитела распознают HER2, CD56, CD30 и GPNMB, соответственно.
В настоящем документе термин «лекарственное вещество/лекарственный агент» означает химическое соединение, обладающее клеткоспецифичной биологической активностью, и подразумевается, что этот термин включает ДНК, РНК, пептиды и подобные вещества. Имеется в виду, что термин «лекарственное вещество/лекарственный агент» включает не только вещества, содержащие реакционноспособную группу, которая может образовать поперечную сшивку с альфа-аминогруппой, но также вещества, в которых имеется линкерная структура, содержащая реакционноспособную группу, образующую поперечную сшивку с альфа-аминогруппой. В этом случае лекарственное вещество может сайт-специфично связываться с N-концевым аминокислотным остатком молекулы антитела посредством линкерной структуры (сказанное здесь не имеет ограничительного характера).
Термин «линкерная структура»/«линкер» относится к химической структуре, содержащей цепочку атомов, позволяющую лекарственному веществу ковалентно связаться с молекулой антитела. Линкерная структура создается такая, чтобы она, будучи соединена с лекарственным веществом, имела на своем конце реакционноспособную группу, которая может образовать связь с молекулой антитела.
Примеры реакционноспособных групп, которые могут образовывать поперечную сшивку с альфа-аминогруппой, включают любые известные в данной области техники реакционноспособные группы, которые могут образовывать поперечную сшивку с N-концевой альфа-аминогруппой тяжелой цепи или легкой цепи молекулы антитела. Примеры таких реакционноспособных групп включают изотиоцианатную, изоцианатную, ацилазидную, N-гидроксисукцинимидэфирную (NHS-эфирную), сульфонилхлоридную, альдегидную, глиоксальную, эпоксидную, оксирановую, карбонатную, арилгалогенидную, имидоэфирную, карбодиимидную, ангидридную и фторфенилэфирную группы. Более предпочтительно, что указанной реакционноспособной группой является (не ограничиваясь перечисленным здесь) альдегидная группа или N-гидроксисукцинимидэфирная группа. Такие реакционноспособные группы могут образовывать связь с аминогруппой путем ацилирования или алкилирования (не ограничиваясь перечисленным здесь).
В частности, конъюгат лекарственного агента с антителом по данному изобретению может быть иммуноконъюгатом, в котором лекарственное вещество, связанное с линкерной структурой, в которой имеется реакционноспособная альдегидная группа, присоединено к N-концевому аминокислотному остатку молекулы антитела специфично в отношении сайта присоединения и числа присоединенных молекул.
Реакционноспособная альдегидная группа эффективна для сайт-специфичного присоединения лекарственного агента к N-концевому аминокислотному остатку (в частности, к альфа-аминогруппе) молекулы антитела, причем неспецифичные реакции при этом сводятся к минимуму. Конечный продукт, образующийся путем восстановительного алкилирования с участием альдегидной связи, гораздо более стабилен, чем в случае присоединения амидной связью. Реакционноспособная альдегидная группа обладает свойством избирательно взаимодействовать с N-концевой аминогруппой при низких pH. Таким образом, конъюгат по данному изобретению обладает гомогенностью в том смысле, что лекарственный агент сайт-специфично присоединен к N-концевой альфа-аминогруппе молекулы антитела. Тем самым данное изобретение позволяет преодолеть существовавшую в данной области техники проблему, состоявшую в том, что в обычных конъюгатах антител с лекарственными агентами невозможно было обеспечить равномерную эффективность и качество лекарственного агента из-за гетерогенности в отношении места его присоединения к молекуле антитела и числа присоединенных молекул лекарственного вещества (сказанное здесь не имеет ограничительного характера).
В одном из примеров по данному изобретению его авторы обнаружили, что если реакция конъюгирования осуществляется при pH 6,0 или ниже, чтобы присоединение цитотоксического вещества происходило сайт-специфично к альфа-аминогруппе молекулы антитела, то можно свести к минимуму присоединение цитотоксического агента к эпсилон-аминогруппе остатков лизина.
Лекарственным агентом, используемым по данному изобретению, может быть любое вещество, способное вызвать активацию или подавление определенных сигнальных путей, включая те, которые участвуют в гибели или размножении клеток, иммунологической активации или иммунологической супрессии. В частности, этим лекарственным агентом может быть цитотоксическое вещество или иммуносупрессор.
В настоящем документе термин «цитотоксический агент»/«цитотоксическое вещество» относится к любому веществу/химическому соединению, способному вызывать гибель клеток или подавлять их размножение. Термин «цитотоксический эффект» относится к явлению подавления или сокращения функций клеток с целью вызвать их разрушение; термин «ингибирующий эффект в отношении клеточной пролиферации»/«подавление размножения клеток» относится к явлению ограничения функций клеточного роста, например роста и размножения клеток.
Примеры цитотоксических веществ, используемых по данному изобретению, включают химиотерапевтические агенты, в том числе ингибиторы образования структуры микротрубочек, ингибиторы мейоза, ингибиторы РНК-полимеразы, ингибиторы топоизомеразы, агенты, интеркалирующие в ДНК, и ингибиторы функций рибосом; белковые токсины, которые могут действовать как ферменты, и радиоактивные изотопы. Примеры цитотоксических веществ, используемых по данному изобретению, включают мейтансиноид, ауристатин, долостатин, тубулизин, калихеамицин, пирролобензодиазепины, доксорубицин, дуокамицин, карбоплатин (параплатин), цисплатин, циклофосфамид, ифосфамид, нидран, [азотистый иприт (мехлорэтамин-HCl)], блеомицин, митомицин С, цитарабин, фторурацил, гемцитабин, триметрексат, метотрексат, этопозид, винбластин, винорелбин, алимта (пеметрексед), алтретамин, прокарбазин, таксол, таксотер, топотекан, иринотекан, трихотецен, СС1065, альфа-аманитин, другие энединовые антибиотики, экзотоксины и растительные токсины. Кроме того, сюда включаются стереоизомеры и производные указанных соединений. Также ауристатин, используемый по данному изобретению, может быть в виде монометилауристатина Е или монометилауристатина F (не ограничиваясь перечисленным здесь).
Термин «иммуносупрессивный агент» относится к любому химическому соединению, вызывающему ослабление иммунного ответа. Этот термин обозначает вещества, которые противодействуют веществам, вызывающим иммунологические реакции, или подавляют активность веществ (цитокинов, например интерлейкинов), участвующих в иммунологических реакциях.
В одном из примеров по данному изобретению в качестве модельных антител использовались трастузумаб, лорвотузумаб, брентуксимаб и глембатумумаб, а в качестве цитотоксических агентов, присоединяемых к N-концу молекулы антитела, использовались монометилауристатин Е (ММАЕ или монометилауристатин F (MMAF) (Примеры 1 и 2). Для присоединения цитотоксического агента к антителу реакцию между трастузумабом и MMAF или ММАЕ проводили при pH 6,0; в результате получали конъюгат лекарственного вещества с антителом. В случае этого конкретного конъюгата лекарственного вещества с антителом было показано, что антиген-связывающая активность антитела и цитотоксическая эффективность лекарственного вещества после конъюгирования сохранялись (Примеры 3 и 5). В частности, у данного конъюгата лекарственного вещества с антителом наблюдались высокая стабильность в человеческой сыворотке крови in vitro по сравнению с другим конъюгатом лекарственного агента с антителом (конъюгат сравнения), в котором имелась связь с участием цистеина или лизина, а также превосходные фармакокинетические свойства в фармакокинетических экспериментах, проведенных на крысах (Пример 6). Кроме того, на животных моделях данный конъюгат лекарственного вещества с антителом обладал значительной противораковой активностью по сравнению с конъюгатом, взятым для сравнения, с цистеином или лизином и притом проявлял низкую токсичность, сходную с наблюдавшейся в контрольной группе, в отношении массы тела, функции печени, показателей крови и проч. (примеры 7 и 8). Результаты, сходные с описанными выше, характеризующие антиген-связывающую активность, цитотоксичность и другие свойства, были получены также при использовании других лекарственных агентов, например, ММАЕ, или других антител, например лорвотузумаба, брентуксимаба и глембатумумаба (Пример 9); это указывало на то, что технология по данному изобретению, при которой лекарственное вещество присоединяется к N-концу тяжелой или легкой цепи молекулы антитела, может стать основой получения конъюгатов антител с лекарственными агентами.
В другом своем аспекте данное изобретение направлено на способ получения конъюгатов антител с лекарственными агентами. При этом конъюгат антитела с лекарственным агентом и его компоненты такие, как описаны выше.
Конкретно, способ получения конъюгата антитела с лекарственным веществом по данному изобретению включает обеспечение взаимодействия антитела с лекарственным веществом, содержащим реакционноспособную группу, которая может образовывать поперечную сшивку с альфа-аминогруппой, тем самым присоединяя лекарственное вещество к N-концевой альфа-аминогруппе тяжелой или легкой цепи антитела.
Способ получения конъюгата антитела с лекарственным веществом по данному изобретению также может включать отделение конъюгата антитела с лекарственным веществом от прочих продуктов реакции, включая молекулы антитела и лекарственного вещества, которые не образовали конъюгата.
Конкретно, в способе получения конъюгата антитела с лекарственным веществом по данному изобретению их конъюгирование друг с другом может проводиться при pH 4,0-6,5, более конкретно 5,5-6,5, еще более конкретно при pH 6,0. Как говорилось выше, преимуществом данного изобретения является то, что специфичное конъюгирование с участием альдегидной группы, имеющейся в лекарственном веществе или в его линкерной структуре, и N-концевой альфа-аминогруппы молекулы антитела может осуществляться при низком pH.
Выделение конъюгата лекарственного вещества с антителом можно осуществлять различными известными в данной области техники методами. Например, можно применять хроматографические методы, включая разделение молекул по размеру путем эксклюзионной хроматографии, но не только такие методы.
В еще одном своем аспекте данное изобретение направлено на композицию, содержащую конъюгат лекарственного агента с антителом.
Такая композиция может быть в виде фармацевтической композиции для лечения раковых или аутоиммунных заболеваний, включающей конъюгат лекарственного вещества с антителом. В том случае антитело в составе конъюгата может быть таким, которое специфично связывается с антигеном поверхности раковых клеток или антигеном поверхности клеток ткани, захваченной аутоиммунным заболеванием. Фармацевтическая композиция по данному изобретению может также содержать фармацевтически приемлемый носитель.
В указанной фармацевтической композиции антитела, лекарственный агент, антиген поверхности раковых клеток или клеток ткани, захваченной аутоиммунным заболеванием, такие, как описано выше.
В настоящем документе термин «рак» включает все виды раковых заболеваний без ограничения, но примеры рака в контексте данного изобретения включают раковые поражения пищевода, желудка, толстой и прямой кишки, полости рта, глотки, гортани, легких, молочной железы, шейки матки, эндометрия, яичника, предстательной железы, яичка, мочевого пузыря, почки, печени, поджелудочной железы, костей, соединительной ткани, кожи, мозга, щитовидной железы, а также лейкозы, болезнь Ходжкина, лимфомы и множественную миелому. Раковое заболевание, подлежащее лечению по данному изобретению, выбирают в зависимости от антигена, специфичного для поверхности раковых клеток.
В настоящем документе термин «аутоиммунное заболевание» относится к любому аутоиммунному заболеванию, при котором может прицельно действовать конъюгат лекарственного агента с антителом. Примеры таких аутоиммунных заболеваний включают ревматоидный артрит, системную склеродермию, системную красную волчанку, атопический дерматит, псориаз, очаговую алопецию, астму, болезнь Крона, болезнь Бехчета, синдром Шегрена, синдром Гийена-Барре, хронический тиреоидит, рассеянный склероз, полимиозит, анкилозирующий спондилит, фиброзит и узелковый полиартрит.
В настоящем документе термин «фармацевтически приемлемый носитель» относится к носителям или разбавителям, которые не нарушают биологическую активность и свойства вводимого вещества и не раздражают организм. В качестве фармацевтически приемлемого носителя в композициях, составленных в виде жидкого раствора, используются стерильные и биологически совместимые носители. Фармацевтически приемлемым носителем по данному изобретению может быть физиологический раствор, стерильная вода, раствор Рингера, забуференный солевой раствор, раствор альбумина для инъекций, раствор декстрозы, раствор мальтодекстрина, глицерин, этиловый спирт или смесь двух или более из указанных здесь субстанций. Кроме того, композиция по данному изобретению может содержать, если это необходимо, другие обычно используемые в фармацевтических композициях дополнительные компоненты, включая антиоксиданты, забуферивающие вещества и бактериостатические агенты.
Носитель для композиций по данному изобретению особо не ограничен, но для перорального введения используются связующие агенты, вещества, улучшающие скольжение, дезинтегрирующие агенты, эмульгирующие агенты, диспергирующие агенты, стабилизирующие агенты, суспендирующие агенты, пигменты, ароматизирующие вещества и другие эксципиенты; для введения путем инъекций композиция по данному изобретению может содержать забуферивающие вещества, консерванты, анальгетики, эмульгирующие агенты, агенты, обеспечивающие нужное осмотическое давление, стабилизирующие агенты и др.; для местного применения композиция по данному изобретению может содержать основу, вещества, улучшающие скольжение, консерванты и другие эксципиенты.
В состав композиции по данному изобретению фармацевтически приемлемый носитель из числа описанных выше может быть включен различными способами. Например, в случае перорального введения композиция по данному изобретению может быть составлена в виде таблеток, пастилок, капсул/облаток, эликсира, суспензии, сиропа и др.; в случае введения путем инъекций композиция по данному изобретению может быть представлена однодозовой ампулой или многодозовой формой. Композиция по данному изобретению может быть составлена также в виде раствора, суспензии, таблеток, драже, капсул, препаратов с замедленным высвобождением и проч.
Вместе с тем примеры носителей, разбавителей или иных эксципиентов, пригодных для составления композиций по данному изобретению, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, стеарат магния и минеральные масла. Кроме того, композиция по данному изобретению может дополнительно включать наполнители, антиагреганты, вещества, улучшающие скольжение, увлажняющие агенты, ароматизаторы и консерванты.
Также фармацевтическая композиция по данному изобретению может включать любой препарат, выбираемый из группы, состоящей из таблеток, драже, порошков, гранул, капсул, суспензий, растворов для внутреннего применения, эмульсий, сиропов, стерилизованных водных растворов, неводных растворителей, суспензий, эмульсий, лиофилизованных агентов и суппозиториев согласно обычно используемым методам.
Также конъюгаты по данному изобретению можно использовать в смеси с различными фармацевтически приемлемыми носителями, например, физиологическим солевым раствором или органическими растворителями. Для повышения стабильности или усиления способности конъюгата всасываться в организме его можно использовать в сочетании с углеводами (например, глюкозой, сахарозой или декстраном), антиоксидантами (например, аскорбиновой кислотой или глутатионом), хелатирующими агентами, белками небольшой молекулярной массы или стабилизирующими агентами.
В еще одном своем аспекте данное изобретение направлено на способ лечения раковых или аутоиммунных заболеваний с использованием конъюгатов лекарственных агентов с антителами или композиций по данному изобретению. При этом можно использовать антитела, которые специфично связываются с антигеном поверхности раковых клеток, а лекарственный агент может быть лекарством для лечения рака. Также используемые антитела могут быть такими, которые специфично связываются с антигеном поверхности клеток ткани, захваченной аутоиммунным заболеванием, а лекарственный агент может быть лекарством для лечения аутоиммунного заболевания. При этом используются антитела и лекарственные агенты, описанные выше.
Способ по данному изобретению может быть способом для лечения ракового или аутоиммунного заболевания, включающим введение фармацевтической композиции по данному изобретению индивиду, нуждающемуся в таком лечении. В способе по данному изобретению используются конъюгаты лекарственных агентов с антителами и носители, описанные выше.
Композиция по данному изобретению может вводиться индивиду в фармацевтически эффективном количестве, заключенном в одной или нескольких дозах. Композиция по данному изобретению может вводиться в организм в жидком виде, в форме порошка, аэрозольного препарата, капсул, таблеток с кишечно-растворимой оболочкой или суппозиториев. Композиция по данному изобретению может вводиться в организм внутрибрюшинно, внутривенно, внутримышечно, подкожно, чрескожно, перорально, местно, интраназально, внутрилегочно или интраректально (перечисленным здесь способы введения не ограничиваются). Однако, поскольку при пероральном введении антитела, будучи белками, подвергаются расщеплению в пищеварительном тракте, активный ингредиент композиции по данному изобретению, предназначенной для перорального введения, должен быть заключен в оболочку или составлен таким образом, чтобы быть защищенным от разрушения в желудке. Также композиция по данному изобретению может вводиться в организм при помощи любого устройства, с помощью которого ее активный ингредиент может быть доставлен к клеткам-мишеням. Также композиция по данному изобретению может вводиться в организм сама по себе или же в сочетании с другими терапевтическими агентами и последовательно или одновременно с обычными терапевтическим агентами.
Композицию, содержащую конъюгат лекарственного агента с антителом по данному изобретению, вводят индивиду в фармацевтически эффективном количестве. В настоящем документе термин «фармацевтически эффективное количество» относится к количеству, достаточному для лечения или предотвращения заболевания с разумным соотношением риска и пользы, приемлемым для лечения или предотвращения заболевания; при этом эффективная дозировка определяется соответственно степени тяжести заболевания, активности лекарственного агента, возрасту, полу, массе тела, состоянию здоровья пациента и его чувствительности к данному лекарственному агенту, времени введения, пути введения и скорости выведения препарата из организма, продолжительности лечения, используемых комбинаций, включающих композицию по данному изобретению, или иных известных факторов и соображений из других областей медицины, включая препараты, принимаемые пациентом одновременно с композицией по данному изобретению.
В другом своем аспекте данное изобретение направлено на способ поиска и выявления антител, пригодных для использования при получении конюъгатов лекарственных агентов с антителами по данному изобретению.
Для создания препаратов конюъгатов лекарственных агентов с антителами по данному изобретению находят, выявляют и отбирают антитела, пригодные для использования при эффективном получении конъюгатов антител с лекарственными веществами путем присоединения лекарственного вещества к N-концу (в частности к альфа-аминогруппе) молекулы антитела.
Примеры
Далее настоящее изобретение описывается подробнее на примерах. Для рядового специалиста в данной области техники будет очевидным, что эти примеры служат лишь иллюстративной цели и что их не следует считать ограничивающими объем настоящего изобретения. Таким образом, действительный объем изобретения определяется прилагаемой формулой изобретения и эквивалентными ее пунктам утверждениями.
Пример 1. Выбор модельных антител
Для того чтобы изучить, будет ли цитотоксический агент, в котором имеется линкерная структура, сайт-специфично конъюгировать с молекулами антител, при получении конъюгатов цитотоксических агентов с антителами, представлявших конъюгаты лекарственных веществ с антителами по данному изобретению, в качестве модельных антител использовались антитела: трастузумаб против HER2, лорвотузумаб против CD56, брентуксимаб против CD30 и глембатумумаб против гликопротеина NMB (GPNMB).
Нуклеотидные последовательности, кодирующие указанные антитела, были встроены в экспрессионные векторы на основании сведений об аминокислотных последовательностях, и из клеток линии СНО были получены соответствующие стабильные клеточные линии. Или же осуществляли временную экспрессию этих антител, их инкубацию и очистку.
Пример 2. Синтез токсического агента
Синтезировали токсическое соединение монометилауристатин F (MMAF), в котором имеется альдегидная линкерная структура на конце молекулы (LegoChem Biosciences или XcessBioscience) (фиг. 1). Кроме того, чтобы изучить, применим ли способ N-концевого конъюгирования по данному изобретению к токсическим агентам, отличным от MMAF, был синтезирован монометилауристатин Е (ММАЕ) (XcessBioscience, США).
Пример 3. Получение конъюгатов цитотоксического агента с моноклональными антителами
3-1. Получение конъюгата лекарственного вещества с моноклональным антителом по данному изобретению
Антитела разводили буферным раствором фосфата калия (100 мМ; pH 5,49) в концентрации около 7,1 мг/мл. Затем MMAF (LegoChem Biosciences, Корея), связанный с линкерной структурой, имеющей реакционноспособную альдегидную группу, растворяли в 50%-ном диметилсульфоксиде (DMSO) в концентрации 2,5 мг/мл. Полученные растворы антител и MMAF смешивали друг с другом так, чтобы достичь следующих условий: конечная концентрация фосфата калия 70 мМ (pH 6,0); концентрация антител 5,0 мг/мл; концентрация DMSO 14%; концентрация MMAF 0,3 мг/мл; молярное соотношение альфа-аминогруппа молекул антител : MMAF около 1:2,3 (или молярное соотношение антитела : MMAF = 1:9). В реакционную смесь прибавляли NaCNBH3 (Sigma, США) до конечной концентрации 20 мМ, и затем давали реакции протекать при температуре 4°С в течение 12 часов при осторожном перемешивании. Чтобы отделить не прореагировавшие антитела и связанный с линкерной структурой MMAF, использовали колонку с Sephadex G-25 (GE Healthcare, США) или колонку с фенильным сорбентом (Resource Phe, GE Healthcare, США). Этим способом получался конъюгат, в котором около трех молекул токсического агента MMAF избирательно присоединено к N-концам молекулы антитела (см. фиг. 2).
3-2. Получение контрольного конъюгата лекарственного вещества с антителом Контрольный конъюгат лекарственного вещества с антителом получали обычным методом путем присоединения с участием цистеина (тиомаб (НС-А114С) + Mal-С6-MMAF), тиоловой группы (Mal-C6-MMAF) или лизина (линкер SMCC, SH-C6-MMAF).
Чтобы получить конъюгат, в котором антитело присоединено с участием тиоловой группы, антитела для восстановления дисульфидных связей обрабатывали трис(2-карбоксиэтил)фосфином (ТСЕР) при pH 8,0; к ним прибавляли Mal-C4-MMAF и давали реакции протекать при температуре 0°С в течение 3 часов. Затем прибавляли тиол к продукту реакции. По окончании реакции проводили обмен растворов с 1X PBS, используя обессоливающую колонку G25 (GE healthcare, США), тем самым завершая реакцию.
Для получения конъюгата, в котором антитело присоединено с участием цистеина, остатки цистеина в очищенных антителах активировали, затем прибавляли Mal-С6-MMAF, и происходило конъюгирование путем, сходным с описанным для получения конъюгата, в котором антитело присоединено с участием тиоловой группы.
Конъюгат, содержащий антитела, присоединенные с участием лизина, получали, как описано в публикации Международного патента № WO 2005037992 (Immunogen). Вначале антитела взаимодействовали с линкером SMCC, и не прореагировавший SMCC удаляли путем буферного обмена. Конъюгат антитело-SMCC взаимодействовал с SH-C4-MMAF (Concortis bioscience, США), содержащим тиоловую группу, и таким образом получался конъюгат антитело-SMCC-MMAF.
Конъюгаты антител с цитотоксическими агентами, полученные путем конъюгирования с участием альфа-аминогруппы по данному изобретению, представлены в таблице 1 ниже.
Для четырех конъюгатов, полученных, как описано выше, определяли соотношение лекарственного агента и антитела (DAR) и сайт конъюгирования. Это исследование проводили путем жидкостной хроматографии с масс-спектрометрией (LC-MS) и пептидного картирования.
Пример 4. Физико-химические и биологические свойства
4-1. Определение молекулярной массы
Молекулярную массу конъюгатов антител с лекарственными агентами (T-N-MMAF) определяли, применяя метод жидкостной хроматографии с масс-спектрометрией (LC-MS). Использовали теоретическое значение молекулярной массы лекарственного вещества (MMAF), равное 824,54 Да, и молекулярную массу трастузумаба, равную 145 кДа. Таким образом, путем масс-спектрометрии можно было одновременно определить конъюгирование лекарственного вещества с антителом и число молекул лекарственного агента, присоединенных к одной молекуле антитела.
Для определения DAR в T-N-MMAF, полученном, как описано в Примере 3, определяли молекулярную массу T-N-MMAF путем LC/MS. Полученный образец обрабатывали пептид-N-гликозидазой F (PNG-азой F) для удаления цепочек Сахаров, и затем проводили разделение, используя колонку ACQUITY UPLC ВЕН 200 SEC, после чего для определения молекулярной массы образец вводили в масс-спектрометрическую систему Waters Synapt G2-S. Полученные результаты представлены на фиг. 3.
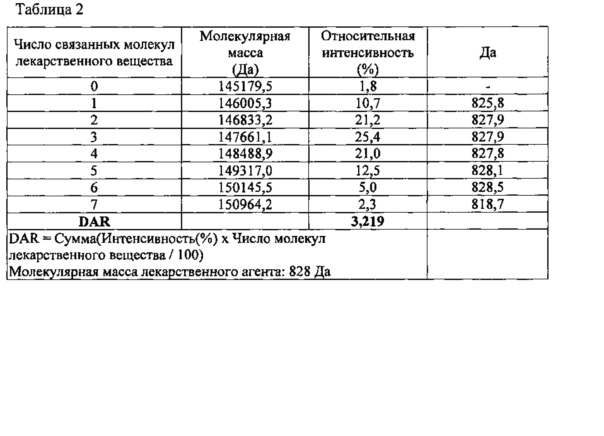
В итоге, как показано на фиг. 3, были выявлены варианты конъюгата от D0, не содержащего молекул лекарственного вещества, до D7, содержащего 7 конъюгированных молекул лекарственного агента на одну молекулу антитела; число конъюгированных молекул лекарственного вещества определяли на основании того, соответствовала ли разница в молекулярных массах между пиками молекулярной массе лекарственного агента или была сходна с ней. Относительная интенсивность для молекул лекарственного агента показана в таблице 2 ниже. DAR рассчитывали как взвешенное среднее по вариантам конъюгата; оно составило 3,2.
4-2. Сайт конъюгирования
Сайт конъюгирования - присоединения лекарственного вещества к молекуле антитела - в полученных конъюгатах T-N_MMAF определяли путем пептидного картирования. Конъюгат лекарственного вещества с антителом T-N-MMAF (характеризующийся DAR=3,2), полученный, как описано в Примере 3, обрабатывали реагентом для быстрого растворения белков Rapigest (Waters) и затем трипсином (Roche) для получения фрагментов. Продукт реакции отделяли с помощью колонки ACQUITY UPLC PST (ВЕН) С18; разделившиеся пики анализировали путем масс-спектрометрии, используя систему Waters Synapt G2-S Q/TOF для определения последовательности продукта реакции. Результаты этого анализа представлены на фиг. 4.
Как видно на фиг. 4, на хроматограмме выявлялись пики, которых не было в случае исходного (не конъюгированного) антитела. Данные, полученные при масс-спектрометрическом анализе, указывают, что были получены следующие фрагменты: N-концевой участок тяжелой цепи, N-концевой участок легкой цепи, часть тяжелой цепи и другие мелкие фрагменты. Соотношение фрагментов представлено в таблице 3, приведенной ниже. Итак, можно видеть, что 75% лекарственного вещества присоединялось к N-концу, 92% лекарственного вещества избирательно присоединялось к N-концу и участку СН2 тяжелой цепи, которые четко определяются.


4-3. Определение чистоты
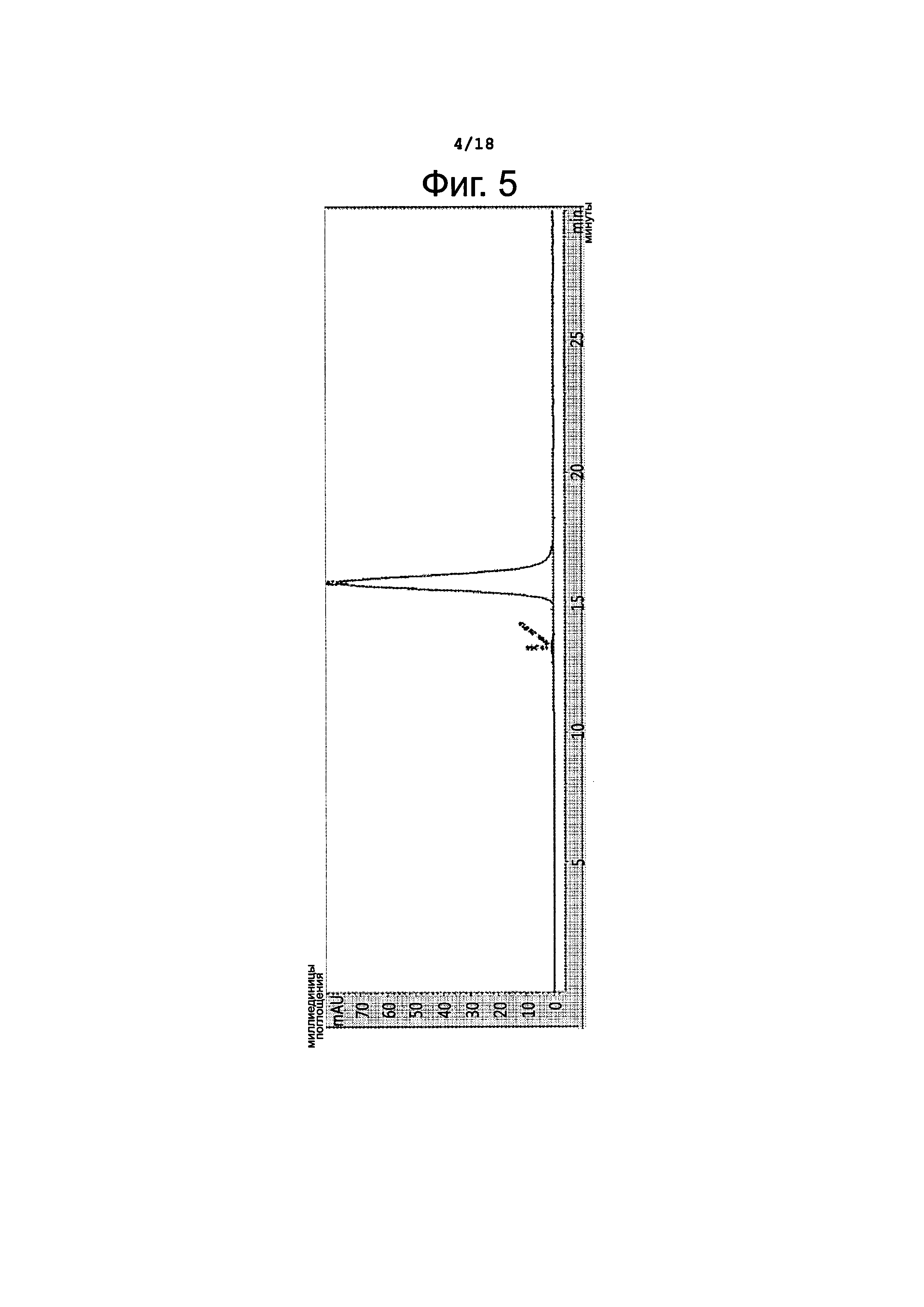
Для определения содержания агрегатов в полученном препарате конъюгата T-N-MMAF проводили анализ чистоты методами эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC) и электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). Для эксклюзионной хроматографии использовали колонку TSK-Gel 3000 SW XL с PBS в качестве мобильной фазы; для гель-электрофореза использовали гель No vex NuPAGE (4-12%). Результаты хроматографического анализа представлены на фиг. 5.
Как видно на фиг. 5, чистота мономера составила 98,8%, что подходит для проверки эффективности; фрагментации или поперечных сшивок выявлено не было.
4-4. Антиген-связывающая активность
Чтобы выяснить, сохраняется ли антиген-связывающая активность антитела после того, как оно образовало конъюгат с лекарственным агентом, определяли антиген-связывающую активность антител в составе конъюгата с лекарственным веществом путем измерения межмолекулярных взаимодействий методом поверхностного плазмонного резонанса на приборе Biacore™. В качестве контроля использовали природные антитела. Определяли связывание антигена (ErbB2) с помощью системы Biacore Т200; каждое антитело иммобилизовали на сенсорном чипе СМ5 (GE healthcare, США) через аминогруппы с помощью соответствующего набора. Равновесную константу диссоциации Kd (М) вычисляли как соотношение скорости связывания (kon) и скорости диссоциации (koff) koff/kon при концентрациях ErbB2 50; 16,67; 5,56; 1,85; 0,62 и 0,21 нМ и скорости потока 30 мкл/мин.

В итоге, как представлено в таблице 4, приведенной выше, было обнаружено, что антиген-связывающая активность антитела (0,1 нМ), сходная с таковой природного антитела, сохранялась и после образования конъюгата с лекарственным агентом независимо от DAR.
Пример 5. Определение цитотоксичности in vitro
Чтобы установить эффективность in vitro полученных конъюгатов антител с лекарственными агентами, определяли их влияние на пролиферацию опухолевых клеток линий ВТ474, НСС1954, SKOV-3, JIMT-1, в которых экспрессируется HER2. Каждую из этих клеточных линий культивировали, и клетки суспендировали в концентрации 1×105 клеток/мл. По 100 мкл такой суспензии вносили в лунки 96-луночного планшета. Клетки инкубировали в течение 3 часов в инкубаторе, затем в каждую лунку добавляли 100 мкл препарата конъюгата антитела с лекарственным агентом, разведенным в той или иной концентрации, и инкубировали в инкубаторе в течение 4 суток. В каждую лунку прибавляли разведение (1:10) раствора для колориметрического анализа (CCK-8, Dojindo), планшет закрывали фольгой и инкубировали в инкубаторе в течение 2-5 часов. После этого в каждой лунке измеряли поглощение при 450 нм с помощью микропланшетного ридера SpectraMax 190 (Molecular Device).
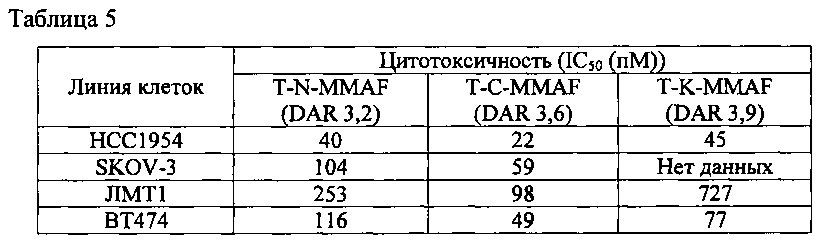
Как видно из приведенной выше таблицы 5, у конъюгата T-N-MMAF цитотоксичность несколько ниже, чем у T-C-MMAF, для всех четырех линий раковых клеток, но существенного снижения цитотоксичности, которое могло бы повлиять на эффективность in vivo, не наблюдалось.
Пример 6. Проверка стабильности
6-1. Стабильность в человеческой сыворотке крови in vitro
Для изучения стабильности конъюгатов антител с лекарственными агентами использовали конъюгат T-N-MMAF, полученный, как описано в Примере 3, и контрольные антитела, включая природное антитело, T-C-MMAF и тиомаб-MMAF, стабильность которых определяли в человеческой сыворотке крови in vitro. Конъюгат антитела с цитотоксическим агентом подвергали буферному обмену с 1×PBS, доводили концентрацию до 3,33 мг/мл и затем смешивали с человеческой сывороткой крови (Sigma, США) в соотношении 1:9 (объем/объем) и оставляли при температуре 37°С на 7 суток. Через 7 суток для удаления прочих белков образец обрабатывали сорбентом MabSelectSure (GE healthcare, USA), чтобы свести к минимуму влияние белков, отличных от конъюгата антитела с цитотоксическим агентом, на результаты анализа путем жидкостной хроматографии с масс-спектрометрией (LC/MS). Результаты определения стабильности взятого конъюгата в человеческой сыворотке крови in vitro методом LC/MS представлены в таблице 6, приведенной ниже.
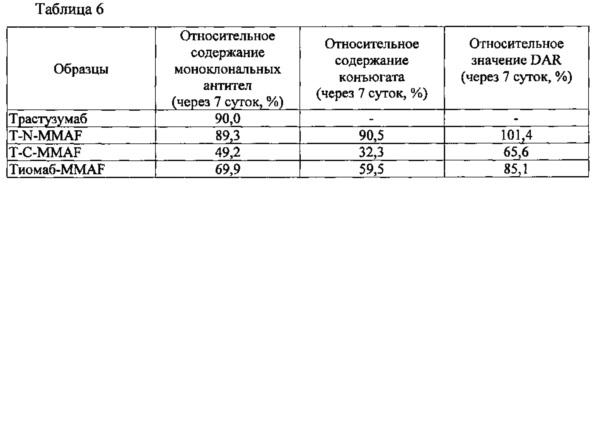
Как можно видеть из таблицы 6, спустя 7 суток изменений содержания и DAR для T-N-MMAF по сравнению с контрольным природным антителом не наблюдалось. Однако в случае взятых для сравнения конъюгатов T-C-MMAF и Тиомаб-MMAF отмечалось снижение общего содержания антител и DAR.
6-2. Фармакокинетические показатели в опытах на крысах
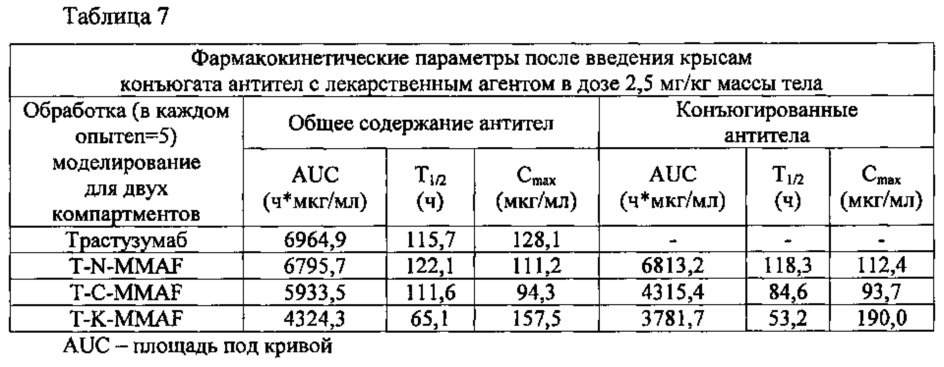
Стабильность конъюгатов антител с лекарственным агентом in vivo изучали в фармакокинетических экспериментах на крысах. Самкам крыс линии Sprague-Dawley вводили внутривенно один из трех конъюгатов (T-K-MMAF, T-C-MMAF и T-N-MMAF) или трастузумаб однократно в дозе 2,5 мг/кг массы тела. Через 0,05; 0,5; 1; 6; 24; 72; 168; 240 и 336 часов после введения указанных веществ у животных брали кровь. Методом твердофазного иммуноферментного анализа (ELISA) определяли общее количество антител, связавшихся с ErbB2 в крови, и количество антител, конъюгированных с лекарственным агентом.
Общее содержание антител определяли следующим образом. Покрывали 96-луночный планшет ErbB2 (R&D systems), затем добавляли образец и инкубировали при температуре 37°С в течение 1 часа. Планшет промывали PBST, чтобы удалить все не иммобилизованные вещества, после чего измеряли поглощение при 450 нм, используя антитела против легких каппа-цепей иммуноглобулина человека, конъюгированные с пероксидазой хрена (HRP), и в качестве субстрата HRP 3,3',5,5'-тетраметилбензидин (ТМВ, Sigma, Т0440); таким образом определялось общее содержание антител в образце.
Антитела в составе конъюгатов определяли способом, сходным с описанным выше. А именно, покрывали 96-луночный планшет антителами против MMAF (Young In Frontier), затем добавляли образец и инкубировали при температуре 37°С в течение 1 часа. Потом для окрашивания прибавляли последовательно биотинилированный ErbB2 (ACROBIOSYSTEMS, USA), стрептавидин-HRP и ТМВ, после чего измеряли поглощение при 450 нм; таким образом определяли концентрацию конъюгированных антител. Результаты этих измерений представлены на фиг. 6 и 8 и в таблице 7, приведенной ниже.
Пример 7. Определение противоракового действия на животных моделях
Для изучения действия трех конъюгатов антител с лекарственными агентами, полученных разными методами, и в зависимости от соотношения лекарственный агент: антитело (DAR), были проведены эксперименты in vivo с использованием в качестве модели голых крыс с ксенотрансплантатами опухоли молочной железы (НСС 1954).
Крысам с трансплантированными раковыми клетками молочной железы НСС 1954 вводили один раз внутривенно какой-либо из четырех взятых для этого исследования конъюгатов антител с лекарственным агентом, а именно T-N-M (DAR около 1,6 и 3,2), Т-С-М (DAR около 3,7) и Т-K-М (DAR около 3,9) в дозе 1 мг/кг массы тела, после чего сравнивали степень подавления роста трансплантированной опухоли в разных группах подопытных животных. Полученные результаты представлены на фиг. 9 и 10.
В итоге, как можно видеть из фиг. 9 и 10, было установлено, что антитела по данному изобретению обладают превосходным противораковым эффектом по сравнению с контрольными антителами и антителами, взятыми для сравнения.
Пример 8. Определение токсичности
Чтобы исследовать, влияют ли изменения стабильности конъюгатов антител с лекарственными агентами в зависимости от метода их получения на токсичность, определяли токсичность однократной дозы в опытах на крысах линии Sprague Dawley (SD). Животным вводили один раз внутривенно какой-либо из трех взятых для этих экспериментов конъюгатов антител с лекарственными агентами в высокой дозе 200 мг/кг массы тела. В контрольных группах животным вводили по отдельности антитела и MMAF в дозе 200 мг/кг массы тела. Массу тела измеряли ежедневно в течение периода начиная от момента введения испытываемой субстанции до окончания эксперимента (день 12). Через 5 суток после введения делали биохимический анализ крови подопытных крыс. Для оценки гепатотоксичности определяли активность аспартатаминотрансферазы (AST) и аланинаминотрансферазы (ALT), для оценки гематотоксичности - содержание нейтрофилов и тромбоцитов.
8-1. Изменение массы
Результаты, полученные при измерении массы, представлены на фиг. 11. Как видно из этой иллюстрации, в группах крыс, получавших T-C-MMAF и T-K-MMAF, наблюдалось отчетливое уменьшение массы по сравнению с другими группами животных, в частности получавших T-N-MMAF. В той группе, где крысам вводили T-C-MMAF, все особи, кроме одной, умерли после 8-го дня.
8-2. Биохимический анализ (гепатотоксичность)
Чтобы выяснить, вызывают ли конъюгаты антител с лекарственными агентами по данному изобретению гепатотоксичностъ, проводили биохимический анализ крови подопытных животных, взятой через 5 суток после введения им испытываемого препарата. Для этого с помощью автоматического биохимического анализатора Au480 (Beckman Coulter, США) измеряли уровни аспартатаминотрансферазы (AST) и аланинаминотрансферазы (ALT), служащие показателем гепатотоксичности. Результаты этих измерений представлены на фиг. 12.
Как видно из фиг. 12, данные для группы крыс, получавших T-N-MMAF по данному изобретению, существенно не отличаются от данных для контрольных групп, включая ту, в которой животным вводили PBS, что свидетельствует о том, что указанный конъюгат не вызывает резкой или значительной гепатотоксичности. А вот в группах, в которых животные получали T-C-MMAF и T-K-MMAF, наблюдалось значительное повышение уровней AST и ALT, что свидетельствовало о вызываемой этими препаратами гепатотоксичности.
8-3. Гематологический анализ (нейтропения и тромбоцитопения)
Поскольку основные клинические признаки токсичности конъюгатов антител с лекарственными агентами, получивших одобрение к применению в последнее время, указывали на гематологические эффекты, был сделан анализ крови подопытных крыс, взятой через 5 суток после введения взятых для этих экспериментов конъюгатов антител с лекарственными агентами; для определения количества клеток крови использовали прибор Hemavet 950 FS (Drew Scientific Inc., USA). Полученные таким образом данные представлены на фиг. 13.
Как видно из фиг. 13, в группе крыс, которым вводили T-N-MMAF, содержание нейтрофилов в крови существенно не отличалось от такового в контрольных группах, включая животных, получавших PBS; это позволяет полагать, что T-N-MMAF не вызывает резкой и значительной гематотоксичности. Напротив, в группе особей, которым вводили T-C-MMAF, наблюдалось значительное снижение числа нейтрофилов, а в группе особей, получавших T-K-MMAF, наблюдалось значительное увеличение числа нейтрофилов, причем сразу после введения указанного препарата антител этот показатель падал, а затем возрастал. Таким образом, можно сделать вывод, что в этих двух группах животных введение препарата вызывало резкую гематотоксичность.
У крыс, получавших T-N-MMAF, количество тромбоцитов было заметно меньше, чем в других группах, включая животных, получавших PBS. Однако в группах животных, которым вводили T-C-MMAF и T-K-MMAF, отмечалось значительное снижение числа тромбоцитов, что указывало на резкую токсичность, вызванную введением препарата.
Пример 9. Изучение базовых функций
Было изучено, применим ли способ получения конъюгатов антител с лекарственными агентами по данному изобретению к различным конъюгатам антител с лекарственными агентами. Для этого способ по данному изобретению использовали применительно к различным лекарственным веществам, различным антителам и антительным формам и исследовали их функции.
9-1. Изучение функций в зависимости от лекарственного агента
Чтобы выяснить, применим ли способ получения конъюгатов антител с лекарственными агентами по данному изобретению к различным лекарственным агентам, осуществили N-концевое конъюгирование различных лекарственных веществ с модельным антителом, в качестве которого взяли трастузумаб. А именно, использовали два лекарственных вещества - MMAF и ММАЕ; результаты, полученные с MMAF, были такие, как описано в Примерах выше. Конъюгаты антитела с лекарственными агентами получали, как описано в Примере 1; определение их DAR, стабильности in vitro и фармакокинетических показателей у крыс осуществляли, как описано в Примерах выше.
9-1-1. Получение T-N-MMAE
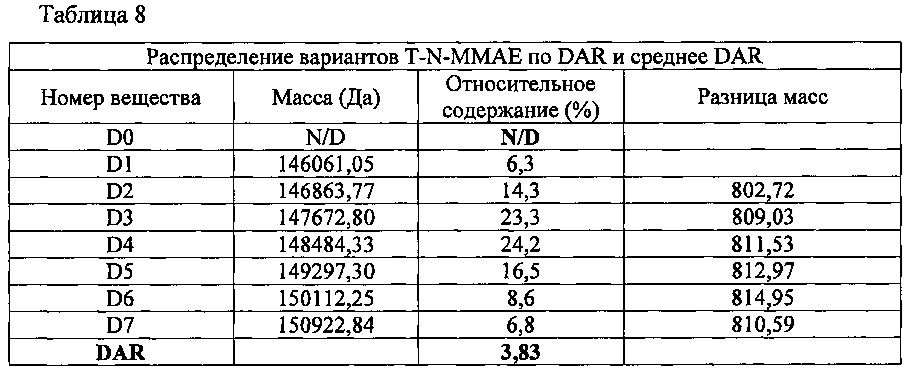
Получали конъюгат ММАЕ (XcessBioscience, США) и антитела. Чтобы установить для этого конъюгата DAR, определяли его молекулярную массу методом жидкостной хроматографии с масс-спектрометрией (LC/MS); полученные результаты представлены на фиг. 14 и в таблице 8, приведенной ниже.
9-1-2. Определение стабильности T-N-MMAE в человеческой сыворотке крови
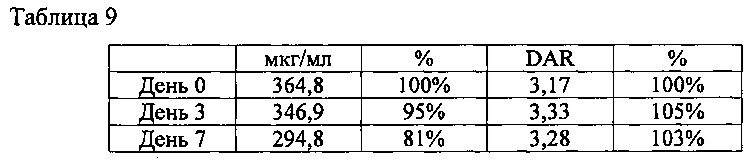
Определяли стабильность конъюгата T-N-MMAE в сыворотке крови, как описано в Примере 6. Концентрацию конъюгата лекарственного агента с антителом в каждом образце определяли по общему содержанию антител методом твердофазного иммуноферментного анализа (ELISA); изменения DAR определяли путем жидкостной хроматографии с масс-спектрометрией (LC/MS).
9-1-3. Фармакокинетические параметры T-N-MMAE у крыс
Чтобы оценить стабильность полученного конъюгата ММАЕ in vivo, были проведены фармакокинетические исследования на крысах линии Sprague Dawley (SD) способом, сходным с описанным в Примере 6. Вкратце проделывали следующее. Самкам крыс SD вводили конъюгат антитела с лекарственным агентом в дозе 2,5 мг/кг массы тела. Через 12 мин, 30 мин, 1 час, 6 часов, 24 часа, 3 суток, 7 суток, 10 суток, 14 суток, 17 суток и 21 суток после введения конъюгата у животных брали кровь и определяли в ней общее содержание белка и концентрацию конюгированных антител описанными выше методами с использованием ELISA.


Как показывают полученные результаты, представленные на фиг. 15 и в таблице 10, приведенной выше, в случае T-N-MMAE изменения суммарной концентрации антител и концентрации конъюгированных антител во времени существенно не отличались от наблюдаемых для исходного антитела; это позволяло полагать, что конъюгат антитела с лекарственным агентом, полученный с использованием ММАЕ, обладает стабильностью, сходной с таковой конъюгата, полученного с использованием MMAF.
9-1-4. Активность T-N-MMAE
Для определения биологической активности полученного конъюгата ММАЕ использовали опухолевые клетки четырех различных линий. Результаты измерений, проведенных способом, сходным с применявшимся в Примере 5, представлены в таблице 11 ниже.
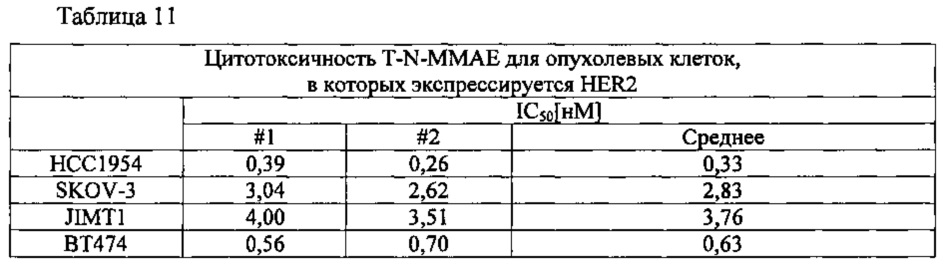
Полученные в результате значения IC50 оказались в диапазоне 0,33-3,76 нМ, что, судя по литературным данным, сходно с активностью (0,47 нМ), наблюдавшейся в случае клеток линии ВТ474 и конъюгата трастузумаб/ММАЕ, образованного с участием тиоловых групп. Это позволяет полагать, что способ избирательного конъюгирования по N-концевой альфа-аминогруппе по данному изобретению применим также к другим лекарственным агентам.
9-2. Исследование функций в зависимости от типа антител
Чтобы выяснить, применим ли способ получения конъюгатов антител с лекарственными агентами по данному изобретению к различным антителам, осуществили N-концевое конъюгирование с тремя различными противораковыми антителами - брентуксимабом, лорвотузумабом и глембатумумабом - и определяли DAR и стабильность in vitro полученных конъюгатов.
9-2-1. Брентуксимаб
9-2-1-1. Получение конъюгата брентуксимаб-N-MMAF
Способом, описанным в Примере 3, получили конъюгат брентуксимаб-N-MMAF (B-N-MMAF), используя брентуксимаб, экспрессируемый клетками линии СНО. С полученным конъюгатом при жидкостной хроматографии с масс-спектрометрией (LC/MS) наблюдалась картина, представленная на фиг. 16 и в таблице 12, приведенной ниже. В полученном конъюгате антитела с лекарственным агентом выявлялись варианты от D0 до D6; рассчитанное значение DAR составило 2,90.
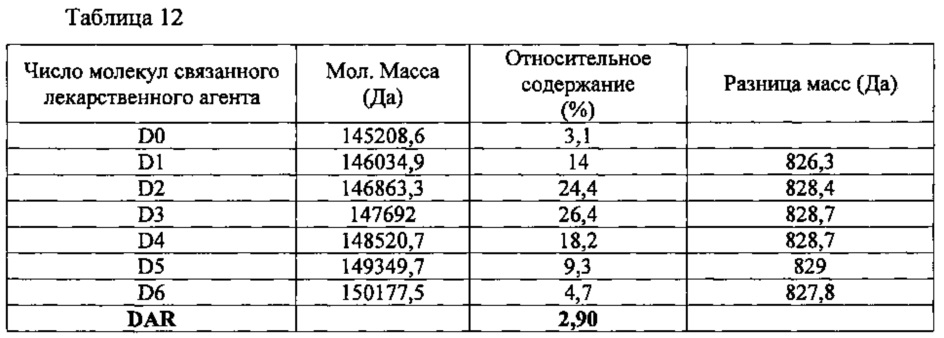
9-2-1-2. Определение связывания лиганда
Чтобы установить, изменяются ли свойства антител в результате конъюгирования, определяли активность связывания антитела с антигеном путем твердофазного иммуноферментного анализа (ELISA). А именно, 96-луночный микропланшет покрывали антигеном CD30 (R&D Systems) в количестве 100 мкг, после чего блокировали. 1%-ным бычьим сывороточным альбумином (BSA) при температуре 37°С в течение 1 часа. После удаления блокирующего раствора на планшет наносили образец и инкубировали при температуре 37°С в течение 1 часа. Планшет промывали пять раз раствором PBST (физиологический раствор, забуференный фосфатом, + 0,05%-ный Tween 20), после чего в лунки добавляли 1000-кратное разведение антител против человеческих иммуноглобулиновых легких каппа-цепей, конъюгированных с пероксидазой хрена (HRP), и инкубировали при температуре 37°С в течение 1 часа. Планшет промывали пять раз PBST, затем прибавляли 3,3',5,5'-тетраметилбензидин (ТМВ, Sigma) и давали развиться окраске в течение 10 минут. Для остановки реакции прибавляли H2SO4 (1 н), после чего измеряли поглощение при 450 нм. Полученные результаты представлены на фиг. 17. На этом графике кривая, обозначенная кружочками (О), соответствует данным для не конъюгированного брентуксимаба; кривая, обозначенная ромбиками (◊), соответствует данным для B-N-MMAF с DAR=2,90; кривая, обозначенная треугольниками (Δ), соответствует данным для B-N-MMAF с DAR=4,22. Как видно из полученных результатов, активность связывания антитела с антигеном не изменяется даже после конъюгирования независимо от величины DAR.
9-2-1-3. Цитотоксичностъ in vitro
Для изучения эффективности in vitro полученного конъюгата антитела с цитотоксическим агентом определяли влияние на пролиферацию клеток линий Karpas-299 и L-540, в которых экспрессируется CD30.
А именно, каждую из указанных клеточных линий культивировали, суспендировали в концентрации 1×105 клеток/мл и по 100 мкл такой суспензии вносили в лунки 96-луночного планшета. Клетки инкубировали в инкубаторе в течение 3 часов. После этого в каждую лунку вносили 100 мкл конъюгата антитела с цитотоксическим агентом, разведенного в той или иной концентрации, и инкубировали в инкубаторе в течение 4 суток. Затем в каждую лунку планшета добавляли реагент CCK-8 (Dojindo) в разведениях 1:10, планшет закрывали фольгой и инкубировали в инкубаторе в течение 2-5 часов. В каждой лунке измеряли поглощение при 450 нм с помощью микропланшетного ридера SpectraMax 190. Полученные результаты представлены в таблице 13, приведенной ниже.

Как видно из полученных данных, в отношении обеих взятых клеточных линий (Karpas-299 и L-540) наблюдалась цитотоксичностъ менее 40 пМ.
9-2-2. Лорвотузумаб. 9-2-2-1. Получение лорвотузумаб-N-MMAF
Лорвотузумаб-N-MMAF (L-N-MMAF) получали, как описано в Примере 3, используя лорвотузумаб - продукт временной экспрессии клетками СНО. Полученный конъюгат антитела с лекарственным агентом давал профиль конъюгации, представленный на фиг. 18 и в таблице 14, приведенной ниже; DAR для этого конъюгата составило 3,33.

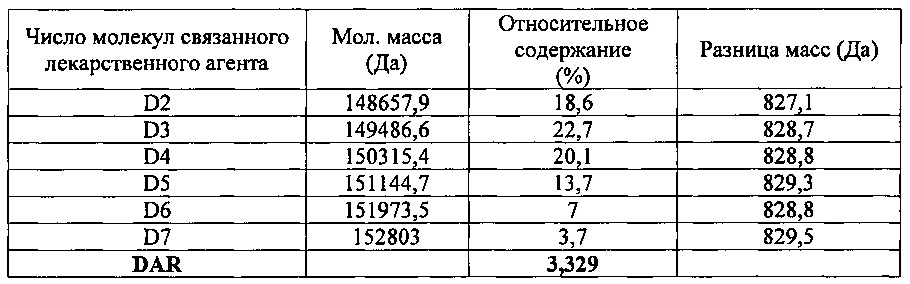
9-2-2-2. Определение связывания лиганда
Чтобы установить, изменяются ли свойства антител в результате конъюгирования, определяли активность связывания антитела с антигеном до и после конъюгирования путем твердофазного иммуноферментного анализа (ELISA). А именно, 96-луночный микропланшет покрывали 100 мкг антигена CD30 (R&D Systems, 2408-NC-050) в концентрации 1 мкг/мл, после чего блокировали 1%-ным бычьим сывороточным альбумином (BSA) при температуре 37°С в течение 1 часа. После удаления блокирующего раствора на планшет наносили изучаемый образец и инкубировали при температуре 37°С в течение 1 часа. Планшет промывали пять раз раствором PBST (физиологический раствор, забуференный фосфатом, + 0,05%-ный Tween 20), после чего в лунки добавляли 1000-кратное разведение антител против человеческих иммуноглобулиновых легких каппа-цепей, конъюгированных с пероксидазой хрена (HRP), и инкубировали при температуре 37°С в течение 1 часа. Планшет промывали пять раз PBST, затем прибавляли 3,3',5,5'-тетраметилбензидин (ТМВ, Sigma) и давали развиться окраске в течение 10 минут. Для остановки реакции прибавляли H2SO4 (1 н), после чего измеряли поглощение при 450 нм. Полученные результаты представлены на фиг. 19. На этом графике кривая, обозначенная кружочками (О), соответствует данным для антитела, не конъюгированного с лекарственным агентом; кривая, обозначенная треугольниками (Δ), соответствует данным для L-N-MMAF с DAR=2,5; кривая, обозначенная ромбиками (◊), соответствует данным для L-N-MMAF с DAR=3,3. Как видно из полученных результатов, активность связывания антитела с антигеном сохранялась независимо от величины DAR.
9-2-2-3. Цитотоксичность in vitro
Для изучения эффективности in vitro полученного конъюгата антитела с цитотоксическим агентом определяли влияние на пролиферацию клеток линии ОРМ-2. А именно, указанную клеточную линию культивировали, суспендировали в концентрации 1×105 клеток/мл и по 100 мкл этой суспензии вносили в лунки 96-луночного планшета. Клетки инкубировали в инкубаторе в течение 3 часов. После этого в каждую лунку вносили 100 мкл конъюгата антитела с цитотоксическим агентом, разведенного в той или иной концентрации, и инкубировали в инкубаторе в течение 4 суток. Затем в каждую лунку планшета добавляли реагент CCK-8 (Dojindo) в разведениях 1:10, планшет закрывали фольгой и инкубировали в инкубаторе в течение 2-5 часов. В каждой лунке измеряли поглощение при 450 нм с помощью микропланшетного ридера SpectraMax 190. Полученные результаты представлены в таблице 15, приведенной ниже.

Как видно из таблицы 15, антитела L-N-MMAF по данному изобретению обладали цитотоксичностью около 42-53 нМ.
9-2-3. Глембатумумаб
9-2-3-1 Цитотоксичностъ in vitro
Для изучения эффективности in vitro полученного конъюгата антитела с цитотоксическим агентом определяли влияние на пролиферацию раковых клеток кожи линии SK-MEL-2. А именно, указанную клеточную линию культивировали, суспендировали в концентрации 1×105 клеток/мл и по 100 мкл этой суспензии вносили в лунки 96-луночного планшета. Клетки инкубировали в инкубаторе в течение 3 часов. После этого в каждую лунку вносили 100 мкл конъюгата антитела с цитотоксическим агентом, разведенного в той или иной концентрации, и инкубировали в инкубаторе в течение 4 суток. Затем в каждую лунку планшета добавляли реагент ССК-8 (Dojindo) в разведениях 1:10, планшет закрывали фольгой и инкубировали в инкубаторе в течение 2-5 часов. В каждой лунке измеряли поглощение при 450 нм с помощью микропланшетного ридера SpectraMax 190. Полученные результаты представлены в таблице 16, приведенной ниже.

Как видно из таблицы 16, конъюгат G-N-MMAF по данному изобретению обладал цитотоксичностью около 3-5 нМ.
Описанные выше результаты свидетельствуют, что новая основа конъюгатов антител с лекарственными агентами, получаемыми путем сайт-специфичного присоединения лекарственного вещества к N-концевому аминокислотному остатку тяжелой или легкой цепи молекулы антитела, не снижает специфичности антител в отношении мишени, причем антитела в то же время обладают высокой стабильностью, а их терапевтический эффект удваивается благодаря конъюгированному лекарственному веществу.
Для специалистов в данной области техники, к которым обращено настоящее изобретение, из предыдущего текста понятно, что это изобретение может быть представлено другими конкретными воплощениями без изменения его технической сущности и существенных признаков. В этой связи следует учесть, что приведенные выше примеры являются во всех отношениях иллюстративными и не носят ограничительного характера. Объем данного изобретения следует считать включающим не подробное описание, а смысловое содержание и объем прилагаемой формулы изобретения, а также все изменения и модифицированные формы, происходящие от равнозначных по смыслу ее пунктов.