АНТАГОНИСТЫ ИЛ-6 И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет по патентной заявке США, серийный №61/723972, поданной 8 ноября 2012 г., и патентной заявке США, серийный №61/831699, поданной 6 июня 2013 г. Полное содержание каждой из указанных выше заявок включено в настоящий документ посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Рассматриваемая заявка содержит Перечень последовательностей, который был подан в электронном виде в формате ASCII и тем самым включен в настоящий документ в полном объеме посредством ссылки. Указанная копия ASCII, создана 19 декабря 2013 г., названа D2046-7044WO_SL.txt и имеет размер 46819 байт.
ОБЛАСТЬ ТЕХНИКИ
Область данного изобретения относится к ИЛ-6. Конкретнее, область техники относится к модуляторам ИЛ-6 и их применению для лечения заболеваний, таких как заболевания глаз.
УРОВЕНЬ ТЕХНИКИ
ИЛ-6 представляет собой плейотропный цитокин с подтвержденной ролью при воспалении, гемопоэзе, ангиогенезе, дифференциации клеток и выживании нейронов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к антителам против ИЛ-6 и их фрагментам и производным таких антител и фрагментов, которые обладают определенными свойствами, включая специфическое связывание с сайтом II ИЛ-6, и способам применения таких антител, фрагментов и производных. Соответственно, настоящее изобретение относится к антителу, его фрагменту или производному, которое может специфически связываться с сайтом II ИЛ-6. В некоторых вариантах реализации изобретения антитело, фрагмент или производное может связываться с ИЛ-6 с KD, равной 240 пМ или меньше. В некоторых вариантах реализации изобретения антитело, фрагмент или производное имеет Tm, равную 70°С или больше. В некоторых вариантах реализации изобретения антитело, фрагмент или производное может связываться с ИЛ-6 с KD, равной 240 пМ или меньше, и имеет Tm, равную 70°С или больше. В некоторых вариантах реализации изобретения антитело или его фрагмент или производное может связываться с по меньшей мере одним из вариантов R24, K27, Y31, D34, S118 или V121 ИЛ-6 человека; в некоторых вариантах реализации изобретения антитело или его фрагмент или производное может связываться с вариантом R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В некоторых вариантах реализации изобретения антитело или его фрагмент или производное связывается с по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5 вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека.
В одном аспекте изобретения в данном документе предложено антитело или его фрагмент (например, его антигенсвязывающий фрагмент), которое может специфически связываться с сайтом II ИЛ-6 человека.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), может связываться с ИЛ-6 с KD, равной 200 пМ или меньше.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), может связываться с ИЛ-6 с KD, равной 200 пМ или меньше, и/или иметь Tm 70°С или больше.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), может связываться с ИЛ-6 с KD, равной 200 пМ или меньше, и/или иметь Tm 80°С или больше.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается с по меньшей мере одним вариантом R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается с по меньшей мере двумя вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается с по меньшей мере тремя вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается с по меньшей мере четырьмя вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается с по меньшей мере пятью вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), связывается вариантами R24, K27, Y31, D34, S118 и V121 ИЛ-6 человека.
В одном аспекте изобретения в данном документе предложено антитело (например, выделенное антитело, например, выделенное моноклональное антитело) или его фрагмент (например, его антигенсвязывающий фрагмент), которое содержит: (а) участок VH CDR1, описанный как SEQ ID NO: 4, VH CDR2, описанный как SEQ ID NO: 5, и VH CDR3, описанный как SEQ ID NO: 6, и, необязательно, (b) VL CDR1, описанный как SEQ ID NO: 7, VL CDR2, описанный как SEQ ID NO: 8, и VL CDR3, описанный как SEQ ID NO: 9, при этом данное антитело или его фрагмент (например, его антигенсвязывающий фрагмент), может специфически связываться с ИЛ-6 человека. В вариантах реализации изобретения антитело или его фрагмент, содержит CDR (определяющие комплементарность участки) тяжелой цепи VH CDR1, VH CDR2 и VH CDR3, которые являются идентичными, соответственно, последовательностям CDR, описанным как SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, или которые в совокупности отличаются от указанных последовательностей CDR не более чем 1, 2,3, 4 или 5 аминокислотами. В вариантах реализации изобретения антитело или его фрагмент содержит CDR легкой цепи VL CDR1, VL CDR2 и VL CDR3, которые являются идентичными, соответственно, последовательностям CDR, описанным как SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9, или которые в совокупности отличаются от указанных последовательностей CDR не более чем 1, 2, 3, 4 или 5 аминокислотами.
В одном аспекте изобретения в данном документе предложено антитело против ИЛ-6 (например, выделенное антитело против ИЛ-6) или его фрагмент (например, его антигенсвязывающий фрагмент), которое может диссоциировать от ИЛ-6 с KD, равной 240 пМ или меньше (например, при определении методом поверхностного плазмонного резонанса). В вариантах реализации изобретения антитело может нейтрализовать активность ИЛ-6 с ИК50, равной 255 пМ или меньше, например, при определении анализом на HEK-Blue™ IL-6 in vitro.
В одном аспекте изобретения в данном документе предложено антитело против ИЛ-6 (например, выделенное антитело против ИЛ-6) или его фрагмент (например, антигенсвязывающий фрагмент), которое может конкурентно ингибировать связывание с ИЛ-6 человека с помощью антитела или его фрагмента (например, антигенсвязывающего фрагмента), включающего SEQ ID NO: 1 и SEQ ID NO: 2, или антитела или его фрагмента (например, антигенсвязывающего фрагмента), включающего SEQ ID NO: 3 и SEQ ID NO: 2.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), обладает KD моновалентного связывания, равной 2 пМ или больше при рН 5,5.
В вариантах реализации изобретения антитело или его фрагмент (например, антигенсвязывающий фрагмент), является антителом IgG2.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), обладает измененным связыванием с FcRn по сравнению с эталонным антителом. В вариантах реализации изобретения связывание с FcRn уменьшено по сравнению с эталонным антителом. В вариантах реализации изобретения Fc-домен антитела или фрагмента, изменен по сравнению с эталонным антителом.
В одном аспекте изобретения в данном документе предложено антитело против ИЛ-6 (антитело, которое способно связываться с ИЛ-6, например, с сайтом II ИЛ-6 человека) или его фрагмент, которое обладает модифицированным Fc-доменом и проявляет уменьшенное связывание с FcRn по сравнению с соответствующим антителом, обладающим Fc-доменом дикого типа.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), содержит мутацию в одном или более положений Н311, I254 и Н436 SEQ ID NO: 23.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), содержит мутацию в двух или более положений Н311, D313, I254 и Н436 SEQ ID NO: 23.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), содержит мутацию в трех или более положений Н311, D313, I254 и Н436 SEQ ID NO: 23.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), содержит мутацию в каждом положении Н311, D313, I254 и Н436 SEQ ID NO: 23.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), содержит одну или более мутаций (например, 1, 2, 3 или 4 мутации), выбранных из группы, состоящей из мутаций Н311А, Н311Е, H311N, D313T, I254A, I254R и Н435А.
В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), является выделенным.
В вариантах реализации изобретения антитело является моноклональным антителом или его фрагментом (например, его антигенсвязывающим фрагментом). В вариантах реализации изобретения антитело является моноклональным антителом человека.
В вариантах реализации изобретения антитело является выделенным моноклональным антителом или его фрагментом (например, его антигенсвязывающим фрагментом).
В вариантах реализации изобретения антитело (например, выделенное моноклональное антитело) включает последовательность SEQ ID NO: 23.
В данном документе также предложено антитело или его фрагмент (например, антигенсвязывающий фрагмент) (например, антитело против ИЛ-6 или его фрагмент, описанное в данном документе) или композиция, содержащая такое антитело или его фрагмент, для применения при лечении ассоциированного с ИЛ-6 заболевания (например, для применения при лечении субъекта, например, субъекта-человека, страдающего ассоциированным с ИЛ-6 заболеванием). В вариантах реализации изобретения указанное заболевание представляет собой заболевание глаз, характеризующееся повышенным уровнем ИЛ-6 в стекловидном теле. В вариантах реализации изобретения указанное заболевание представляет собой диабетический макулярный отек (ДМО), диабетическую ретинопатию, заболевание сухого глаза, возрастную макулярную дегенерацию (ВМД), пролиферативную диабетическую ретинопатию (ПДР), окклюзию вены сетчатки (ОВС), нейромиелит зрительного нерва (НЗН), заболевание, связанное с трансплантатом роговицы, истиранием роговицы или физическим повреждением глаза. В вариантах реализации изобретения указанное заболевание представляет собой ДМО. В вариантах реализации изобретения указанное заболевание представляет собой заболевание сухого глаза. В вариантах реализации изобретения указанное заболевание представляет собой синдром сухого глаза. В вариантах реализации изобретения указанное заболевание представляет собой увеит. В вариантах реализации изобретения указанное заболевание представляет собой ВМД. В вариантах реализации изобретения указанное заболевание представляет собой ПДР. В вариантах реализации изобретения указанное заболевание представляет собой ПДР. В вариантах реализации изобретения указанное заболевание является связанным с трансплантатом роговицы, истиранием роговицы или физическим повреждением глаза. В вариантах реализации изобретения антитело или его фрагмент (например, антигенсвязывающий фрагмент), является подходящим для доставки в стекловидное тело глаза. В вариантах реализации изобретения антитело или его фрагмент (например, антигенсвязывающий фрагмент), доставляют в стекловидное тело глаза.
В данном документе также предложен способ лечения ассоциированного с ИЛ-6 заболевания, данный способ включает введение субъекту антитела против ИЛ-6 или его фрагмента (например, его антигенсвязывающего фрагмента), например, антитело против ИЛ-6 или его фрагмент описанное в данном документе. В вариантах реализации изобретения антитело против ИЛ-6 или его фрагмент (например, его антигенсвязывающий фрагмент), вводится в терапевтически эффективном количестве. В вариантах реализации изобретения заболевание, ассоциированное с ИЛ-6, является заболеванием глаз, характеризующимся повышенным уровнем ИЛ-6 в стекловидном теле. В вариантах реализации изобретения ассоциированное с ИЛ-6 заболевание является диабетическим макулярным отеком (ДМО), диабетической ретинопатией, увеитом, синдромом сухого глаза, заболеванием сухого глаза, увеитом, возрастной макулярной дегенерацией (ВМД), пролиферативной диабетической ретинопатией (ПДР), окклюзией вены сетчатки (ОВС), нейромиелитом зрительного нерва (НЗН), заболеванием, связанным с трансплантатом роговицы, истиранием роговицы или физическим повреждением глаза. В вариантах реализации изобретения антитело или его фрагмент (например, антигенсвязывающий фрагмент), является подходящим для доставки в стекловидное тело глаза. В вариантах реализации изобретения антитело или его фрагмент (например, его антигенсвязывающий фрагмент), доставляют в стекловидное тело глаза субъекта. В вариантах реализации изобретения ассоциированное с ИЛ-6 заболевание является диабетическим макулярным отеком, а антитело или его фрагмент, доставляют в стекловидное тело глаза субъекта.
В другом аспекте изобретения в данном документе предложен вектор, содержащий последовательность, кодирующую антитело против ИЛ-6 или его фрагмент (например, его антигенсвязывающий фрагмент), описанный в данном документе. В вариантах реализации изобретения данный вектор содержит последовательность, кодирующую SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9.
В другом аспекте изобретения в данном документе предложена клетка, которая может экспрессировать последовательность антитела против ИЛ-6 или его фрагмента (например, его антигенсвязывающий фрагмент), описанную в данном документе. В вариантах реализации изобретения клетка может экспрессировать одну или более последовательностей SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9.
В еще одном аспекте изобретение относится к способу уменьшения системных эффектов ингибирования ИЛ-6 в организме субъекта, причем данный способ включает введение субъекту антитела или его фрагмента, которое может ингибировать активность ИЛ-6 и имеет сниженную активность Fc по сравнению с соответствующим антителом или его фрагментом, обладающим Fc-доменом дикого типа. В некоторых случаях способ снижения системных эффектов ингибирования ИЛ-6 в организме субъекта включает введение субъекту антагониста ИЛ-6, который обладает связыванием с FcRn больше чем 1 мкМ, например, при таком низком рН, как рН, равное 5,5.
В данном документе считается, что термин «антитело» является синонимом иммуноглобулина и должен быть понятным как общеизвестный в данной области техники. Термин антитело не ограничен любым конкретным способом получения антител. К примеру, термин антитело включает, помимо прочего, рекомбинантные антитела, моноклональные антитела и поликлональные антитела. В данном документе считается, что антитело является тетрамером и, если не описано иное, каждое состоит из двух идентичных пар полипептидных цепей, и каждая пара имеет одну легкую и одну тяжелую цепь. Амино-конец каждой цепи содержит вариабельный участок из около от 100 до 120 или более аминокислот, которые играют основную роль в распознавании антигенов. Карбокси-концевая часть каждой цепи содержит константный участок, играющий основную роль для обеспечения эффекторной функции антител. Классы легких цепей человека называются легкими цепями каппа и лямбда. Классы тяжелых цепей следующие: мю, дельта, гамма, альфа или эпсилон, и они определяют изотип антитела. Соответственно, существуют такие изотипы антител: IgM, IgD, IgG, IgA и IgE. В пределах легкой и тяжелой цепей вариабельный и константный участки соединены участком «J» из около 12 или более аминокислот, с тяжелой цепью, также включающей участок «D» из около трех или более аминокислот.
Вариабельные участки из каждой пары тяжелой/легкой цепи (VH и VL), соответственно, образуют антигенсвязывающий сайт. Соответственно, интактное IgG-антитело, к примеру, имеет два сайта связывания. Эти два сайта являются одинаковыми за исключением бифункциональных или биспецифических антител.
Вариабельные участки тяжелой и легкой цепи антитела проявляют одинаковую общую структуру относительно консервативных каркасных участков (FR), соединенных с тремя гипервариабельными участками, также называемыми участками, определяющими комплементарность, или CDR. Термин «вариабельный» относится к тому факту, что определенные части вариабельных доменов сильно отличаются среди антител по последовательности и участвуют в связывании и обеспечении специфичности каждого конкретного антитела с его конкретным антигеном. Вариабельность главным образом заключается в CDR, которые разделены более высококонсервативными каркасными участками (FR). Отнесение аминокислот к каждому домену осуществляют согласно определениям последовательностей белков, представляющих иммунологический интерес Кэбота (Национальные институты здоровья, г. Бетесда, штат Мэриленд (1987 и 1991)) или определены в статьях авторов Chothia and Lesk, J. Mol Biol 196: 901-917 (1987); Chothia et al., Nature 342: 878-883 (1989), которые описывают способы, известные в данной области техники.
Термин «дикий тип» может относиться к самой распространенной аллели или виду, обнаруживаемым в популяции, или антителу, полученному от животного, не подвергавшегося манипуляциям, по сравнению с аллелью или полиморфизмом или вариантом или производным, полученным с помощью манипуляции, такой как мутагенез, применение рекомбинантных методов и т.п., для изменения аминокислот антигенсвязывающей молекулы.
Термин «фрагмент антитела» относится к части интактной или полноразмерной цепи или антитела, как правило, связывания мишени или вариабельного участка. Примеры фрагментов антител включают, без ограничения, фрагменты Fab, Fab', F(ab')2 и Fv. «Функциональный фрагмент» или «аналог анти-ИЛ-6 антитела против сайта II» является фрагментом, который может предупреждать или существенно снижать способность ИЛ-6 связываться с рецептором, снижать способность комплекса ИЛ-6/ИЛ-6Р связываться с рецептором gp130 или снижать способность лиганда связываться с gp130 или инициировать передачу сигнала. В данном документе считается, что функциональный фрагмент обычно является синонимом «фрагмента антитела» и касательно антител может относиться к таким фрагментам, как Fv, Fab, F(ab')2 и им подобным, которые могут предупреждать или существенно снижать способность ИЛ-6 связываться с рецептором, снижать способность комплекса ИЛ-6/ИЛ-6Р связываться с gp130 или инициировать передачу сигнала.
«Производное» антитела является полипептидом, который специфически связывается с сайтом II ИЛ-6 и содержит последовательность антитела против сайта II ИЛ-6, например, использует по меньшей мере один CDR антитела, которое может специфически связывать сайт II ИЛ-6 человека.
Термин «конкурентное» означает, что первое антитело или его фрагмент может конкурировать за связывание со вторым антителом или его фрагментом, в результате чего связывание первого антитела со своим эпитопом обнаруживаемо снижается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствии второго антитела. В некоторых случаях данный термин также относится к связыванию второго антитела со своим эпитопом, связывание с которым явно снижается в присутствии первого антитела. Механизм такой конкуренции может реализовываться посредством, например, без ограничения: стерического несоответствия, конформационного изменения, связывания с общим эпитопом.
Термин «процент идентичности последовательностей» в контексте последовательностей нуклеиновых кислот означает результат выравнивания с максимальным соответствием остатков двух последовательностей, которые являются одинаковыми по длине. Длина при сравнении идентичности последовательностей может превышать по меньшей мере около девяти нуклеотидов, например, по меньшей мере около 18 нуклеотидов, по меньшей мере около 24 нуклеотидов, по меньшей мере около 28 нуклеотидов, по меньшей мере около 32 нуклеотидов, по меньшей мере около 36 нуклеотидов или по меньшей мере около 48 или более нуклеотидов. Для определения идентичности нуклеотидных последовательностей могут применять известные в данной области техники алгоритмы. К примеру, полинуклеотидные последовательности могут сравниваться с помощью программ FASTA, Gap или Bestfit (пакет программ Wisconsin Package, версия 10.0, Genetics Computer Group (GCG), г. Мадисон, Висконсин, США). Программа FASTA включает, например, программы FASTA2 и FASTA3, которые обеспечивают проведение выравниваний и определение процента идентичности последовательностей участков с наилучшим перекрыванием между запрашиваемой и исследуемой последовательностями (Pearson, Methods Enzymol 183: 63-98 (1990); Pearson, Methods Mol Biol 132: 185-219 (2000); Pearson, Methods Enzymol 266: 227-258 (1996); Pearson, J. Mol Biol. 276: 71-84 (1998); статьи включены в данный документ посредством ссылок). Обычно для конкретной программы или алгоритма применяют параметры по умолчанию. К примеру, процент идентичности последовательностей между последовательностями нуклеиновых кислот может быть определен с помощью программы FASTA с параметрами по умолчанию (размер слова равен 6, а фактор NOPAM выбран для матрицы замен) или с помощью программы Gap с параметрами по умолчанию, как установлено в пакете GCG версии 6.1, включенном в данный документ посредством ссылки.
Термин «процент идентичности последовательностей» в контексте последовательностей аминокислот означает результат выравнивания с максимальным соответствием остатков двух последовательностей, которые являются одинаковыми по длине. Длина при сравнении идентичности последовательностей может превышать по меньшей мере около пяти аминокислотных остатков, например, по меньшей мере около 20 аминокислотных остатков, по меньшей мере около 30 аминокислотных остатков, по меньшей мере около 50 аминокислотных остатков, по меньшей мере около 100 аминокислотных остатков, по меньшей мере около 150 аминокислотных остатков или по меньшей мере около 200 аминокислотных остатков. Идентичность последовательностей полипептидов обычно определяют с помощью программного обеспечения для анализа последовательностей. Алгоритмы определения процента идентичности последовательностей хорошо известны в данной области техники. К примеру, аминокислотные последовательности могут сравниваться с помощью программ FASTA, Gap или Bestfit (пакет программ Wisconsin Package, версия 10.0, Genetics Computer Group (GCG), г. Мадисон, Висконсин, США). Программное обеспечение для анализа белков сопоставляет последовательности путем определения степени сходства, присвоенной различным заменам, делециям и другим модификациям, включая замены консервативных аминокислот. Например, в пакете GCG содержатся программы, такие как «Gap» и «Bestfit», которые могут применять с параметрами по умолчанию, установленными в программах для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды разных видов организмов, или между белком дикого типа и его аналогом. См., например, пакет GCG версии 6.1 (Университет Висконсина, г. Мэдисон, Висконсин, США). Полипептидные последовательности также могут сравнивать с помощью программы FASTA, применяя параметры по умолчанию или рекомендованные параметры, см. пакет GCG версии 6.1. Программа FASTA (например FASTA2 и FASTA3) обеспечивает проведение выравниваний и определение процента идентичности последовательностей участков с наилучшим перекрыванием между запрашиваемой и исследуемой последовательностями (Pearson, Methods Enzymol 183: 63-98 (1990); Pearson, Methods Mol Biol 132: 185-219 (2000)). Другой алгоритм, который могут применять при сопоставлении последовательности с базой данных, содержащей большое количество последовательностей разных организмов, представляет собой программу BLAST, например, blastp или tblastn, с применением параметров по умолчанию, установленных в этих программах. См., например, статьи Altschul et al., J Mol Biol 215: 403-410 (1990); Altschul et al., Nucleic Acids Res 25: 3389-402 (1997).
Белок или полипептид является «практически чистым», «практически гомогенным» или «практически очищенным», если по меньшей мере около от 60 до 75% образца определяют как один вид полипептида. Полипептид или белок может быть мономерным или мультимерным. Практически чистый полипептид или белок может иметь степень чистоты около 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99%; к примеру, практически чистый полипептид или белок имеет степень чистоты 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99%. Степень чистоты или гомогенности белка может быть оценена любым приемлемым методом, таким как электрофорез образца белка в полиакриламидном геле с последующей визуализацией одной или более полос, связанных с белком или полипептидом (например, при окрашивании геля), эксклюзионной ВЭЖХ, катионообменной ВЭЖХ, капиллярным электрофорезом в восстанавливающих условиях с ДСН, пептидным картированием или гликановым картированием. К примеру, с помощью способов, известных в данной области техники, или других способов очистки можно достичь высокой степени разрешения.
Термин «значительное сходство» в отношении нуклеиновой кислоты или ее фрагмента означает, что при оптимальном выравнивании с соответствующими нуклеотидными инсерциями или делециями с другой нуклеиновой кислотой (или ее комплементарной нитью) существует идентичность нуклеотидной последовательности среди по меньшей мере около 85%, по меньшей мере около 90% и по меньшей мере около 95%, 96%, 97%, 98% или 99% нуклеотидных оснований, к примеру, 85%, 90%, 95%, 96%, 98% или 99% идентичности последовательностей при измерении любым известным алгоритмом для определения идентичности последовательностей, таким как программы FASTA, BLAST или Gap.
Применительно к полипептидам, термин «значительная идентичность» или «значительное сходство» означает, что две аминокислотные последовательности, при оптимальном выравнивании, таком как при применении программ GAP или BESTFIT с применением установленных в этих программах по умолчанию значений гэп-веса, могут обладать по меньшей мере около 70%, 75%, 80%, 90%, 95%, 96%, 97% или 99% идентичности последовательностей; например, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% идентичности последовательностей. В некоторых вариантах реализации изобретения положения остатков, которые не являются идентичными, отличаются из-за замен консервативных аминокислот.
Термин «терапевтически эффективное количество» относится к такому количеству терапевтического агента, которое при введении будет облегчать по меньшей мере один признак или симптом заболевания, требующего лечения, или усиливать или улучшать профилактическое и/или терапевтическое(ие) действие(я) другого вида лечения (например, другого терапевтического агента), применяемого для лечения ассоциированного с ИЛ-6 заболевания. Понятно, что терапевтически эффективное количество могут вводить в виде многократных доз в течение ограниченного периода времени или применять при постоянном лечении.
«Лечить», «проводить лечение» и «лечение» относятся к способу облегчения признаков или симптомов, или заболевания.
В данном документе считается, что термин «заболевание» включает заболевания и нарушения.
Полное описание каждого патентного документа и научной статьи, относящихся к данному документу, и тех патентных документов и научных статей, которые тем самым здесь цитируются, явным образом включено в данный документ во всех отношениях посредством ссылок.
Дополнительные признаки и преимущества данного изобретения более конкретно описаны ниже.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
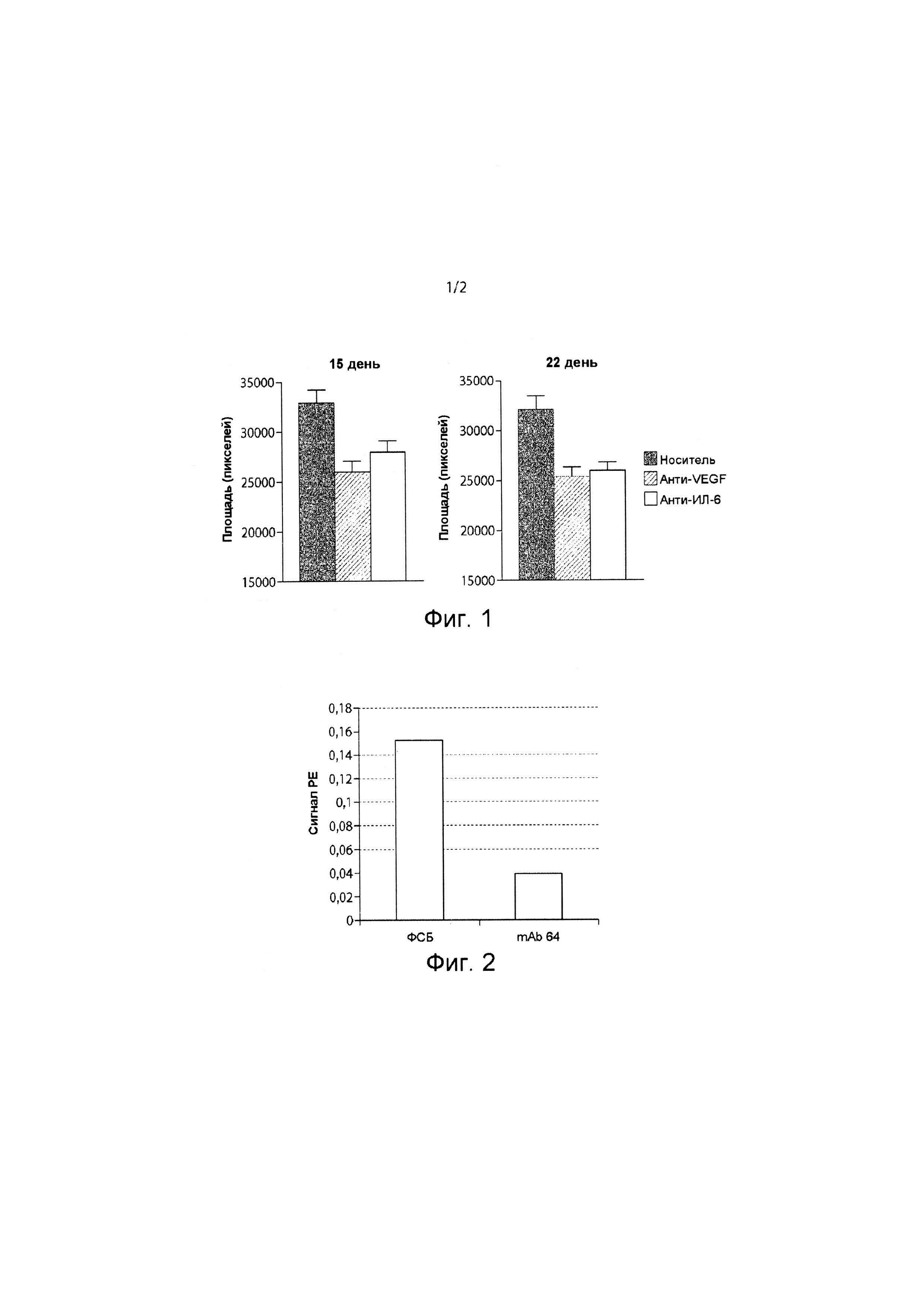
Фиг. 1 представляет собой график, иллюстрирующий результаты эксперимента, в котором анти-ИЛ-6-антитело вводили с помощью инъекции в стекловидное тело (ИСТ) с применением в качестве модели крыс с хориоидальной неоваскуляризацией (ХНВ). Анти-VEGF-антитело вводили в качестве положительного контроля, а отрицательным контролем был только носитель. Результаты применения анти-ИЛ-6 антитела по сравнению с контрольной группой, получавшей носитель, дали такие значения вероятностей: p=0,0054 на 15-й день и p=0,0005 на 22-й день.
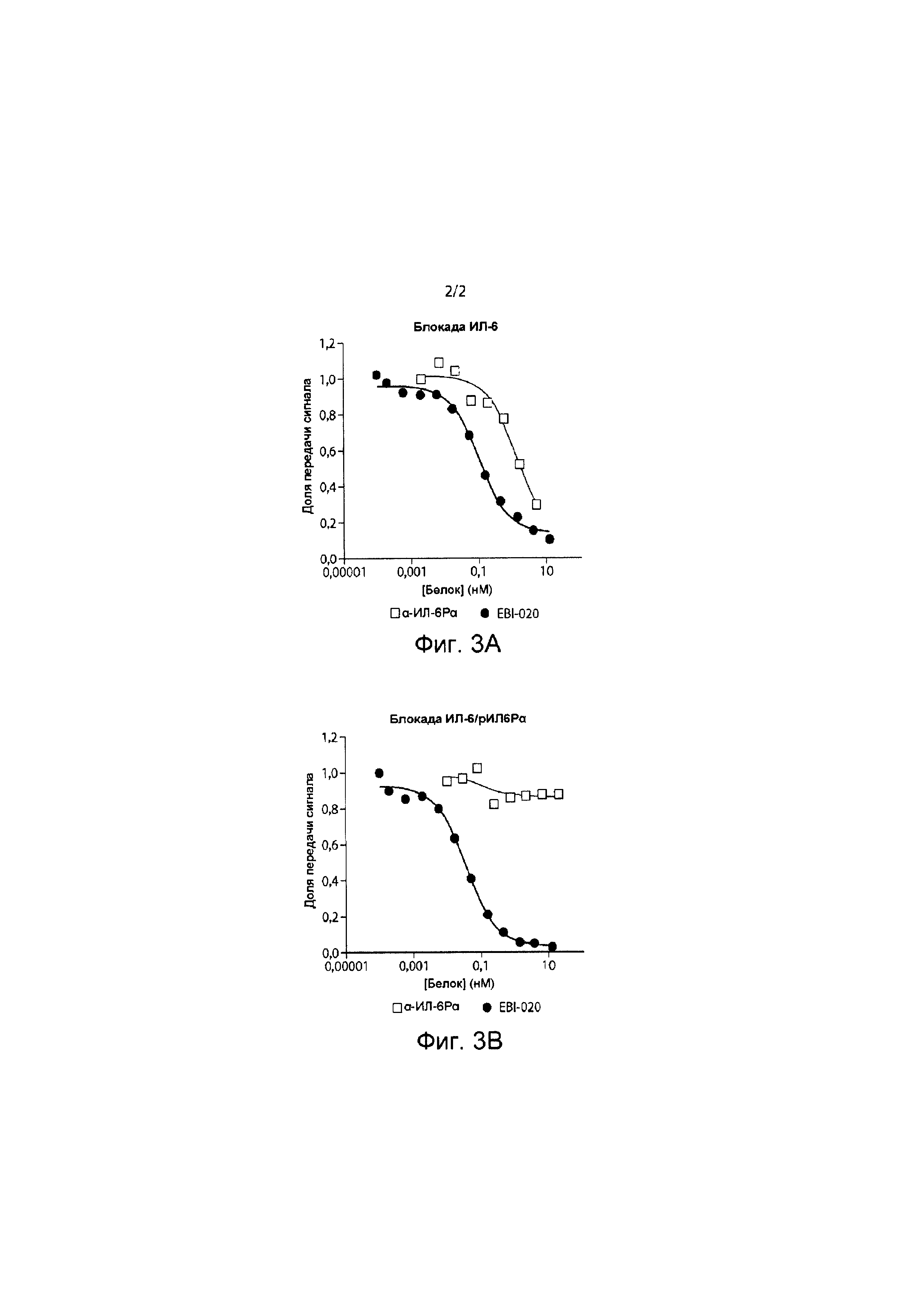
Фиг. 2 представляет собой график, иллюстрирующий результаты экспериментального испытания на способность антитела мыши 64 ингибировать связывание ИЛ-6/ИЛ-6Р с gp130.
Фиг. 3А представляет собой график, иллюстрирующий результаты эксперимента, в котором антитело 020 испытали на способность блокировать передачу сигнала ИЛ-6 в отсутствии избытка растворимого рецептора ИЛ-6Рα. Эксперименты проводили на клетках HEK-Blue-IL-6 с 0,2 нг/мл ИЛ-6 и 2 мкг/мл ИЛ6Рα.
Фиг. 3В представляет собой график, иллюстрирующий результаты эксперимента, в котором антитело 020 испытали на способность блокировать передачу сигнала ИЛ-6 в присутствии избытка растворимого рецептора ИЛ-6Рα. Эксперименты проводили на клетках HEK-Blue-IL-6 с 0,2 нг/мл ИЛ-6 и 2 мкг/мл ИЛ6Рα.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Считается, что ИЛ-6 играет роль в ряде заболеваний, таких как ревматоидный артрит, и было показано, что он значительно гиперэкспрессируется при ряде заболеваний, включая заболевания глаз. ИЛ-6 может действовать как посредством цис-, так и транс-механизмов. Считается, что при цис-механизме свободный ИЛ-6 связывается с мембраносвязанным рецептором ИЛ-6 (ИЛ-6Р, также называемым ИЛ6Рα и CD126), a потом комплекс ИЛ-6/ИЛ-6Р взаимодействует с рецептором gp130 (также называемым CD130, рецептором онкостатина М, ИЛ-6Рбета и трансдуктором сигнала ИЛ-6) для активации сигналинга в клетке, содержащей данный комплекс. При транс-механизме свободный ИЛ-6 связывается с растворимым рецептором ИЛ-6 (рИЛ-6Р). Комплекс ИЛ-6/рИЛ-6Р далее может связываться с рецептором gp130, присутствующим на клеточной мембране. Ключевое отличие между этими механизмами заключается в том, что существует больше типов клеток, экспрессирующих рецептор gp130, чем ИЛ-6Р, экспрессия которого более ограничена. Поэтому при заболеваниях, для которых требуется ингибировать передачу сигнала от ИЛ-6, к примеру для тех, при которых требуется широко подавить передачу сигнала от ИЛ-6, целесообразно ингибировать как цис-, так и транс-сигналинг ИЛ-6. Заявители сконструировали антагонисты ИЛ-6, например, анти-ИЛ-6 антитела, фрагменты и производные, которые могут ингибировать как цис-, так и транс-сигналинг ИЛ-6. Кроме того, заявители сконструировали такие антагонисты ИЛ-6 для достижения усиленного удержания в стекловидном теле и более быстрого системного выведения.
Свойства антагонистов ИЛ-6 (ИЛ-6а)
В общем, антагонист ИЛ-6 (ИЛ-6а), описанный в данном документе, специфически связывается с сайтом II (сайт 2) ИЛ-6 и пригоден для лечения связанного с ИЛ-6 заболевания глаз и некоторых других заболеваний. Связанное с ИЛ-6 заболевание является одним из заболеваний, в котором нежелательный симптом или биологическая активность при заболевании ассоциированы с экспрессией или присутствием ИЛ-6. В некоторых вариантах реализации изобретения ИЛ-6а обладает высокой аффинностью как в отношении свободного, так и связанного ИЛ-6, является относительно стабильным в организме, может ингибировать связывание с рецептором gp130 ИЛ-6, связанного с ИЛ-6Р (называемый в данном документе комплексом ИЛ-6/ИЛ-6Р или ИЛ-6/ИЛ-6Р) и может обладать терапевтическим действием. В общем, ИЛ-6а является антителом или походит от антитела. К примеру, ИЛ-6а является гуманизированным фрагментом Fab с высокой аффинностью, который может специфически связываться с сайтом II ИЛ-6 и потенциально блокирует как цис-, так и транс-сигналинг ИЛ-6. В другом примере ИЛ-6а является полноразмерным антителом, например, антителом IgG1 или IgG2.
В некоторых вариантах реализации изобретения Fab также сконфигурирован как Fc-сконструированная последовательность или является полноразмерным антителом. В некоторых вариантах реализации изобретения Fc-сконструированный ИЛ-6а (например, Fc-сконструированный Fab) обладает повышенным временем удержания в стекловидном теле и/или более быстрым системным выведением по сравнению с подходящим контролем, например, по сравнению с соответствующим антителом, его фрагментом или производным, которые не несут сконструированный фрагмент Fc. Эти и другие свойства ИЛ-6а дополнительно описаны в данном документе.
Заявителями разработаны антагонисты ИЛ-6, которые избирательно связываются с сайтом II ИЛ-6 для обеспечения широкого ингибирования передачи сигнала от ИЛ-6, потому что такие молекулы могут ингибировать связывание gp130 с ИЛ-6, независимо от того связывается ли ИЛ-6 с мембранным рецептором ИЛ-6Р или с рИЛ-6Р. Более того, нацеливание на лиганд (ИЛ-6) в противоположность действию рецептора ИЛ-6 может предотвращать опосредованное рецептором выведение и токсичность из-за механизма АЗКЦ (антителозависимой клеточной цитотоксичности). Из-за того, что ИЛ-6 при заболевании играет как патологическую, так и защитную роль, применение антагониста ИЛ-6 (ИЛ-6а) для лечения заболевания, ассоциированного с повышенным уровнем ИЛ-6, может улучшить некоторые аспекты состояния пациента, но также может вызвать значительные неблагоприятные эффекты, например, системное действие. Эта дуальность механизмов ИЛ-6 (т.е. способность вызывать благоприятные и/или неблагоприятные эффекты) может стать нежелательной при лечении нарушения, ассоциированного с ИЛ-6, с помощью системного ингибитора. Соответственно, композиции и способы, предложенные в данном документе, могут быть пригодными для видов лечения, которые ингибируют по меньшей мере одну активность ИЛ-6, но не оказывают чрезмерного действия на положительные виды активности ИЛ-6, в частности, из-за того, что такие композиции могут быть составлены для местной доставки, например, для местной доставки в глаз. К примеру, в некоторых аспектах изобретения разработали ИЛ-6а такого размера, который подходит для доставки в конкретное место. В некоторых вариантах реализации изобретения ИЛ-6а является полноразмерным антителом. В некоторых вариантах реализации изобретения ИЛ-6а походит от антитела и получается в форме, которая может обеспечить более долгое удержание в стекловидном теле глаза и обладает ограниченным системным выведением. В некоторых вариантах реализации изобретения ИЛ-6а является модифицированным антителом (например, антителом с модифицированным Fc-доменом), который может обеспечить более долгое удержание в стекловидном теле глаза и/или обладает ограниченным системным выведением по сравнению с немодифицированным антителом. В некоторых вариантах реализации изобретения ИЛ-6а является антителом IgG2.
В некоторых аспектах ИЛ-6а представляет собой относительно малую молекулу ИЛ-6а, такую как фрагмент антитела или другое производное антитела, которое является меньше полноразмерного антитела, например, фрагмент Fab, который походит от антитела против ИЛ-6. В некоторых вариантах реализации изобретения ИЛ-6а представлен в форме, которая может проходить из одной части ткани в другую с повышенными параметрами кинетики по сравнению с соответствующим полноразмерным антителом против ИЛ-6. В некоторых вариантах реализации изобретения ИЛ-6а является фрагментом Fab, который сконструировали так, чтобы представлять большую молекулу, которая с большей вероятностью обладает повышенным удержанием в том месте, в которое ее доставили, по сравнению с простым фрагментом Fab, например, ИЛ-6а является димеризованным через Fc-домен. В некоторых вариантах реализации изобретения Fc-домен сконструировали так, чтобы Fc-компонент обладал ослабленным или уменьшенным связыванием с FcRn, которое может привести к увеличенному местному удержанию, например, повышенному удержанию в стекловидном теле и уменьшенному системному аккумулированию по сравнению с таким же объектом для связывания ИЛ-6, который включает дикий тип Fc.
Данные антагонисты ИЛ-6, описанные в данном документе, также обладают достаточно высокой аффинностью к их мишени, ИЛ-6, чтобы быть эффективными для ослабления по меньшей мере одного побочного эффекта ИЛ-6. Данные ингибиторы также являются достаточно стабильными для применения в качестве терапевтических средств.
В общем, параметры фармакокинетики (ФК) для ИЛ-6а, например, ИЛ-6а подходящего для лечения глаза, имеет параметры ФК в месте доставки, например, в стекловидном теле, достаточные для обеспечения терапевтического действия. В неограничивающих примерах такой параметр ФК, как период полувыведения, может составлять по меньшей мере 12 часов, 24 часа, 2 суток, 3 суток, 4 суток, 5 суток, 8 суток, 10 суток, 14 суток, 21 сутки, 28 суток или 30 суток.
Идентификация антагонистов ИЛ-6, связывающихся с сайтом II
В общем, для получения молекулы, которая может связываться с ИЛ-6, могут применять любой способ, известный в данной области техники, к примеру, библиотеки полипептидов или библиотеки молекул могут подвергаться скринингу для определения потенциальных соединений при анализе способности полипептида или соединения связываться с ИЛ-6. Как только такое потенциальное соединение идентифицируют, то с помощью методов, известных в данной области техники, может быть определен сайт связывания данного соединения. К примеру, молекулу могут исследовать на способность связываться с диким типом ИЛ-6 и такое связывание сравнивают со способностью данного соединения связываться с ИЛ-6 с мутацией на сайте I, сайте II или сайте III. В вариантах реализации изобретения ИЛ-6а, описанный в данном документе, сохраняет способность связываться с комплексом ИЛ-6/ИЛ-6Рα и с ИЛ-6 и предотвращает связывание ИЛ-6/ИЛ-6Рα с рецептором gp130. В вариантах реализации изобретения ИЛ-6а, описанный в данном документе, может конкурировать с рецептором gp130 за связывание с комплексом ИЛ-6/ИЛ-6Рα, например, посредством связывания с сайтом II ИЛ-6. Такие виды активности связывания могут анализировать с помощью способов, известных в данной области техники.
Потенциальные ИЛ-6а могут исследовать, к примеру, с применением системы анализа HEK-Blue™ IL-6 (InvivoGen, г. Сан-Диего, США). Клетки HEK-Blue™ IL-6 и клетки HEK293 стабильно трансфецированы с помощью ИЛ-6Р человека и STAT3-индуцибельного репортерного гена SEAP. В присутствии ИЛ-6 активируется STAT3 и секретируется белок SEAP. Содержание SEAP оценивают, например, с помощью анализа QUANTI-Blue™ (InvivoGen, г. Сан-Диего, США). Добавление антагониста ИЛ-6 к клеткам предотвращает секрецию клетками и снижает уровень белка SEAP в результате ингибирования как свободного, так и растворимого рецептора, связанного с ИЛ-6.
Обозначение KD относится к константе равновесия аффинного связывания для конкретного взаимодействия антитело-антиген или взаимодействия фрагмент антитела-антиген. Заявлено, что антитело или его фрагмент специфически связывает антиген, если значение KD меньше чем или равно 250 пМ, например, меньше чем или равно 225 пМ, 220 пМ, 210 пМ, 205 пМ, 150 пМ, 100 пМ, 50 пМ, 20 пМ, 10 пМ или 1 пМ. Значение KD может быть определено с применением способов, известных в данной области техники, например, с помощью метода поверхностного плазмонного резонанса, к примеру, применяя систему BiaCore™.
Обозначение Koff относится к константе скорости диссоциации для конкретного взаимодействия антитело-антиген или взаимодействия комплекса фрагмент антитела-антиген. Значение константы скорости диссоциации может быть определено с помощью метода поверхностного плазмонного резонанса, к примеру, применяя систему BiaCore™. Относительно медленная Koff может сообщать требуемые свойства терапевтическому средству, например, позволяя проводить менее частые введения ингибитора субъекту, нуждающемуся в таком лечении.
Специфичность
Свойство антагонистов ИЛ-6, описанных в данном документе, относится к их специфичности связывания. Как обсуждалось выше, ИЛ-6 может присутствовать в виде свободного ИЛ-6 или в виде ИЛ-6, связанного с растворимым ИЛ-6Рα. Заявители идентифицировали сайт II ИЛ-6 как оптимальную мишень для антагониста ИЛ-6 по сравнению с ингибитором, который связывается с сайтом I ИЛ-6. Ингибитор для сайта I может ингибировать связывание свободного ИЛ-6 с рецептором ИЛ-6Рα. Однако такой ингибитор не может предотвратить проявление активности, инициированной уже существующими комплексами ИЛ-6/ИЛ-6Р, за исключением замещения, ограниченного Koff данного комплекса. Другой альтернативный вариант, в котором ингибитор, связывающийся с ИЛ-6Рα, является менее подходящим, потому что он может иметь ограниченную способность предотвращать проявление активности ИЛ-6, если только он не присутствует в насыщающих концентрациях. Из-за того, что количество рецептора ИЛ-6 обычно несколько выше по сравнению с количеством ИЛ-6, то этот подход может потребовать введения нежелательного большого количества композиции, которая ингибирует активность ИЛ-6 путем связывания с его рецептором. В вариантах реализации изобретения антагонисты ИЛ-6, описанные в данном документе (например, антитела и их фрагменты и производные, описанные в данном документе), могут блокировать активность ИЛ-6 даже когда ИЛ-6 связан с ИЛ-6Р. Соответственно, преимущество ИЛ-6а, описанного в данном документе, является таким, что относительно меньшее количество композиции может понадобиться вводить для достижения терапевтического эффекта по сравнению с ингибитором, нацеленным на рецептор ИЛ-6. Сообщалось, что антитела против рецепторов быстро выводятся путем опосредованного рецепторами механизма выведения, что значительно ограничивает их ФК-параметры, поэтому требуются их большие дозы, более частое дозирование или применение обоих подходов. Дополнительно, как при применении антител против рецепторов, так и против сайта I ИЛ-6 возникает проблема, из-за которой эти антитела значительно повышают концентрацию ИЛ-6 в тканях из-за нарушения нормального опосредованного рецепторами механизма выведения лиганда, в связи с этим субъект подвергается влиянию потенциальных нежелательных уровней ИЛ-6 в ткани. Более того, применение ингибитора, нацеленного на ИЛ-6Рα, может быть необходимым в присутствии ингибитора, связывающегося возле обоих сайтов, для которых обнаружено ингибирование, и сайта, для которого нацеливание нежелательно, например, при системном лечении. Применение ИЛ-6а, который связывает сайт II, это сайт, с которым связывается рецептор gp130, позволяет провести ингибирование через свободный ИЛ-6, а также через ИЛ-6, связанный с ИЛ-6Р, но который еще не активирован механизмом ИЛ-6 посредством gp130. Соответственно, антагонисты ИЛ-6, описанные в данном документе, разработаны для связывания с обеими формами ИЛ-6 (растворимой и связанной с рецептором), антагонисты ИЛ-6 специфически связываются с сайтом II ИЛ-6, который является доступным в обеих формах. Композиции, содержащие ИЛ-6а, описанный в данном документе, могут ингибировать как цис-, так и транс-сигналинг ИЛ-6.
В некоторых случаях соединения и способы, предложенные в данном документе, разработаны для обеспечения эффективной блокады ИЛ-6, достаточной для лечения по меньшей мере одного признака или симптома нарушения, ассоциированного с ИЛ-6, к примеру, ингибировать ангиогенез и/или воспаление.
Соединения, описанные в данном документе, пригодны для лечения заболеваний глаз, которые характеризуются нежелательно высоким уровнем ИЛ-6, например, в стекловидном теле (см. статьи Yuuki et al., J Diabetes Compl 15: 257 (2001); Funatsu et al., Ophthalmology 110: 1690, (2003); Oh et al., Curr Eye Res 35: 1116 (2010); Noma et al., Eye 22: 42 (2008); Kawashima et al., Jpn J Ophthalmol 51: 100 (2007); Kauffman et al., Invest Ophthalmol Vis Sci 35: 900 (1994); Miao et al, Molec Vis 18: 574(2012)).
В общем, ИЛ-6а, описанный в данном документе, является сильным антагонистом сигналинга ИЛ-6. Это достигается, в частности, путем разработки молекул, обладающих высокой аффинностью к ИЛ-6, к примеру, со значением ИК50 меньше чем или равным 100 пМ при анализе HEK-Blue IL-6 с применением 10 пМ ИЛ-6. Высокая аффинность ИЛ-6а может быть определена на основании значения KD ИЛ-6а, к примеру, KD меньше чем или равное 1 нМ, меньше чем или равное 500 пМ, меньше чем или равное 400 пМ, меньше чем или равное 300 пМ, меньше чем или равное 240 пМ или меньше чем или равное 200 пМ.
Для получения биологического препарата ИЛ-6а (например, белка или полипептида, такого как антитело, его фрагмент или производное), который является пригодным для лечения нарушения, ассоциированного с повышенной экспрессией ИЛ-6 или активностью, обычно требуется, чтобы биологический препарат ИЛ-6а получался с высоким выходом. К примеру, подходящий выход составляет больше чем или равен 1 г/л (например, больше чем или равен 2 г/л, больше чем или равен 5 г/л или больше чем или равен 10 г/л).
Для эффективного введения антагониста ИЛ-6 необходимо, чтобы данный ингибитор имел растворимость, сравнимую с концентрацией, в которой он будет вводится. К примеру, в случае ИЛ-6а в виде полноразмерного антитела растворимость составляет больше чем или равна 20 мг/л, больше чем или равна 10 мг/л, больше чем или равна 5 мг/л или больше чем или равна 1 мг/л.
Более того, для успешного лечения данный ингибитор должен обладать высокой стабильностью при температуре тела в места доставки и проявления активности, а также стабильностью при хранении. К примеру, обладать Tm больше чем или равной 60°С (например, больше чем или равной 60°С, больше чем или равной 62,5°С, больше чем или равной 65°С, больше чем или равной 70°С, больше чем или равной 73°С, больше чем или равной 75°С) и Tonset больше чем или равной 45°С, например, больше чем или равной 50°С, больше чем или равной 51°С, больше чем или равной 55°С или больше чем или равной 60°С. Определение Tm и TonSet может проводиться с помощью способов, известных в данной области техники.
Антагонисты, имеющие требуемые свойства, могут быть выбраны из подходящих типов молекул, известных в данной области техники, к примеру, из антител, включая их фрагменты и производные антитела, нацеленного на сайт II ИЛ-6, которое обычно сохраняет или несет достаточные свойства исходного антитела против ИЛ-6 (например, требуемые свойства связывания). Такие антагонисты включают Fab-фрагменты, scFv, Fab-фрагменты, сконструированные так, чтобы включать Fc-компонент, и полноразмерные антитела, сконструированные так, чтобы обладать каркасом, отличным от исходного антитела, нацеленного на сайт II ИЛ-6.
В некоторых аспектах ИЛ-6а, описанный в данном документе, содержит антигенсвязывающий сайт антитела человека, который может конкурировать или перекрестно конкурировать с антителом или его фрагментом, которое может связываться с сайтом II ИЛ-6. К примеру, антитело или его фрагмент может состоять из VH-домен и VL-домена, описанных в данном документе, и VH-, и VL-домен, содержат набор CDR антитела, связывающего ИЛ-6/сайт II, описанного в данном документе.
Для определения домена и/или эпитопа, связывающегося ИЛ-6а, могут применять любой подходящий способ, к примеру, метод мутаций различных сайтов молекулы ИЛ-6. Такие сайты, в которых мутации предотвращают или снижают связывание ИЛ-6а и лиганда ИЛ-6, участвуют в связывании с ИЛ-6а прямо или опосредованно влияют на сайт связывания, например, путем влияния на конформацию ИЛ-6. Могут применяться другие методы, применяемые для определения аминокислот, связываемых ИЛ-6а. К примеру, могут применять сканирование пептидного связывания, такое как PEPS CAN на основе твердофазного иммуноферментного анализа (ELISA). При сканировании пептидного связывания данного типа короткие перекрывающиеся пептиды, которые походят от антигена, систематически подвергают скринингу на связывание с участником связывания. Пептиды могут быть ковалентно связаны с поверхностью подложки для образования матрицы пептидов. Пептиды могут быть представлены в виде линейной конформации или конформации с ограниченной конформационной свободой. Ограниченная конформационная свобода может быть получена с применением пептидов, содержащих концевой остаток цистеина (cys) на каждом конце пептидной последовательности. Остатки cys могут быть ковалентно связаны прямо или опосредованно с поверхностью подложки так, чтобы пептид удерживался в конформации петли. Соответственно, пептид, применяемый в данном способе, может нести остаток cys, добавленный к каждому концу пептидной последовательности, соответствующей фрагменту антигена. Могут также применять пептиды с двойной петлей, в которых остаток cys дополнительно расположен на пептидной последовательности посередине или около середины пептидной последовательности. Остатки cys могут быть ковалентно связаны прямо или опосредованно с поверхностью подложки так, чтобы пептид образовал конформацию двойной петли с одной петлей на каждом конце от центрального остатка cys. Пептиды могут быть получены синтезом, и, поэтому, остатки cys могут быть встроены в требуемые положения, несмотря на встречающуюся в природе последовательность сайта II ИЛ-6. Произвольно, могут проводить скрининг на анализ пептидного связывания как линейные пептиды, так и пептиды с ограниченной конформационной свободой. Сканирование пептидного связывания может включать идентификацию (например, применение ELISA) набора пептидов, в котором связывается участник связывания, при этом пептиды имеют аминокислотные последовательности, соответствующие фрагментам ИЛ-6а (например, пептиды, которые включает около 5, 10 или 15 последовательных остатков ИЛ-6а), и выравнивание данных пептидов для определения остатков области узнавания, связываемой участником связывания, в которой область узнавания содержит остатки общие для перекрывающихся пептидов. В альтернативном варианте или дополнительно метод сканирования пептидного связывания могут применять для идентификации пептидов, с которыми связывается ИЛ-6а с по меньшей мере выбранным соотношением сигнал:шум.
Для определения остатков, связывающихся антителом, и/или подтверждения результатов сканирования пептидного связывания могут применять другие методы, известные в данной области техники, включая к примеру, сайт-направленный мутагенез (например, описанный в данном документе), водород-дейтериевый обмен, масс-спектрометрию, ЯМР и рентгеновскую кристаллографию.
Обычно ИЛ-6а, применяемый как описано в данном документе, является молекулой антитела человека, гуманизированной молекулой антитела или их фрагментом связывания. В большинстве случаев, антитело является моноклональным антителом. Происхождение такого антитела может быть из организма человека, мыши, крысы, верблюдовых животных, кролика, овцы, свиньи или быка, и оно может быть получено в соответствии со способами, известными в данной области техники.
В большинстве случаев ИЛ-6а содержит CDR антитела, которое может специфически связываться с сайтом II ИЛ-6 (например, ИЛ-6 человека). Структура, которая несет CDR или набор CDR данного изобретения, может быть последовательностью тяжелой или легкой цепи антитела или его значительной части, в которой CDR или набор CDR расположен в положении, соответствующему CDR или набору CDR у встречающихся в природе вариабельных доменов антител VH и VL, кодируемых реаранжированными генами иммуноглобулина. Структуры и положения вариабельных доменов иммуноглобулинов могут быть определены со ссылкой на Kabat, et al., 1983 (Национальные институты здоровья) и ее обновления по результатам поиска по слову «Kabat» с помощью любой поисковой системы Интернета.
ИЛ-6а, который представляет собой антитело, обычно содержит VH-домен антитела (например, SEQ ID NO: 1 или SEQ ID NO: 3) и/или VL-домен (например, SEQ ID NO: 2). VH-домен содержит набор CDR (VHCDR) тяжелой цепи, VL-домен содержит набор CDR (VLCDR) легкой цепи. Примеры таких CDR представлены в Примере 3, примеры которых проиллюстрированы как SEQ ID NO: 4-9. Молекула антитела может содержать VH-домен антитела, включающий VHCDR1, VHCDR2 и VHCDR3 и каркас. В альтернативном варианте или к тому же, он может включать VL-домен антитела, включающий VLCDR1, VLCDR2 и VLCDR3 и каркас.
В данном изобретении описаны антагонисты ИЛ-6, содержащие участки VHCDR1 и/или VHCDR2 и/или VHCDR3, такие как описанные в данном документе, и/или участки VLCDR1 и/или VLCDR2 и/или VLCDR3, такие как описанные в данном документе. ИЛ-6а может содержать один или более CDR любого из антител, фрагментов или производных, описанных в данном документе. ИЛ-6а может содержать набор участков VHCDR (например, VHCDR1, VHCDR2 и VHCDR3), и, произвольно, он также может содержать набор VLCDR (например, VLCDR1, VLCDR2 и VLCDR3). CDR могут происходить из одного или более антител, фрагментов или производных, описанных в данном документе. К примеру, VLCDR могут происходить из одного и того же или из разных антител с такими VHCDR.
В большинстве случаев VH-домен образует пары с VL-доменом для получения антигенсвязывающего сайта антитела. К примеру, НС-домен последовательности SEQ ID NO: 1 или SEQ ID NO: 3 образует пары с LC-доменом SEQ ID NO: 2. В некоторых случаях в качестве ИЛ-6а могут применять один VH- или VL-домен.
В некоторых аспектах изобретения ИЛ-6а представляет собой молекулу антитела, ее фрагмент или производное, которая содержит: (i) последовательность VH-домена, которая обладает по меньшей мере 60, 70, 80, 85, 90, 95, 98 или 99% идентичности аминокислотной последовательности с VH-доменом, описанным в данном документе, например, VH-домен последовательности SEQ ID NO: 1 или SEQ ID NO: 3, или (ii) набор VHCDR (например, VHCDR1, VHCDR2 и/или VHCDR3) таких последовательностей (данные последовательности определены в пункте (i)). В вариантах реализации изобретения молекула антитела, ее фрагмент или производное содержит VHCDR1, VHCDR2 и VHCDR3 последовательности SEQ ID NO: 1 или VHCDR1, VHCDR2 и VHCDR3 последовательности SEQ ID NO: 3. В вариантах реализации изобретения молекула антитела, ее фрагмент или производное содержит VHCDR1, VHCDR2 и VHCDR3, которые вместе отличаются от VHCDR1, VHCDR2 и VHCDR3 последовательности SEQ ID NO: 1 не более чем 1, не более чем 2, не более чем 3, не более чем 4 или не более чем 5 аминокислотами. В вариантах реализации изобретения молекула антитела, ее фрагмент или производное содержит VHCDR1, VHCDR2 и VHCDR3, которые вместе отличаются от VHCDR1, VHCDR2 и VHCDR3 последовательности SEQ ID NO: 3 не более чем 1, не более чем 2, не более чем 3, не более чем 4 или не более чем 5 аминокислотами.
Молекула антитела, ее фрагмент или производное может также произвольно содержать: (i) последовательность VL-домена, которая обладает по меньшей мере 60, 70, 80, 85, 90, 95, 98 или 99% идентичности аминокислотной последовательности с VL-доменом, описанным в данном документе, например, VL-домен последовательности SEQ ID NO: 2, или (ii) набор VLCDR (например, VLCDR1, VLCDR2 и/или VLCDR3) таких последовательностей (данные последовательности определены в пункте (i)). В вариантах реализации изобретения молекула антитела, ее фрагмент или производное содержит VLCDR1, VLCDR2 и VLCDR3 последовательности SEQ ID NO: 2. В вариантах реализации изобретения молекула антитела, фрагмент или производное содержит VLCDR1, VLCDR2 и VLCDR3, которые вместе отличаются от VLCDR1, VLCDR2 и VLCDR3 последовательности SEQ ID NO: 3 не более чем 1, не более чем 2, не более чем 3, не более чем 4 или не более чем 5 аминокислотами. Алгоритмы, которые могут применять для расчета процента идентичности двух аминокислотных последовательностей, включают, например, BLAST, FASTA и алгоритм Смита-Уотермана, например, применяемые с параметрами по умолчанию.
ИЛ-6а, описанный в данном документе, может содержать константные участки антитела или их части, например, константные участки антитела человека или их части. К примеру, VL-домен может быть присоединен своим С-терминальным концом к константным доменам легкой цепи антитела, включая цепи СK или CL человека. Аналогичным образом, ИЛ-6а на основе VH-домена может быть присоединен своим С-терминальным концом ко всей или к части (например, СН1-домену) тяжелой цепи иммуноглобулина, происходящего из изотипа антител, например, IgG, IgA, IgE и IgM, и любого из подклассов изотипов, особенно IgG1, IgG2, IgG3 и IgG4.
В некоторых случаях антитело данного изобретения дополнительно модифицировано с помощью способов, известных в данной области техники, для создания последовательности, имеющей специфический аллотип, к примеру, аллотип, который доминирует в популяции, имеющей конкретное географическое происхождение. В некоторых случаях с этой целью модифицируют константный участок тяжелой цепи человека.
ИЛ-6а может быть молекулой антитела, ее фрагментом связывания или вариантом, обладающей одним или большим количеством CDR, к примеру, набором CDR, в пределах каркаса антитела. К примеру, для получения молекулы антитела один или большее количество CDR или набор CDR антитела (например, антитела или его фрагмента, или производного, описанных в данном документе) могут быть внедрены в каркас (например, каркас человека). Каркасные участки могут происходить из генных последовательностей зародышевой линии человека или происходить не из зародышевой линии.
Остатки каркасов VH и/или VL могут модифицироваться, как обсуждается и иллюстрируется в данном документе, например, с применением сайт-направленного мутагенеза.
Изменения аминокислот могут быть произведены в одном или более каркасных участках и/или в одном или более CDR, происходящих из ИЛ-6а в виде антитела, нацеленного на сайт II ИЛ-6 (названное в данном документе «эталонным антителом против ИЛ-6»), применяя способы и параметры, известные в данной области техники. В данный документ также включен результирующий антагонист ИЛ-6, который сохраняет связывание с сайтом II ИЛ-6 (например, сайтом II ИЛ-6 человека) и, в основном, обладает по меньшей мере одинаковым связыванием или повышенной аффинностью по сравнению с эталонным антителом против ИЛ-6. В некоторых случаях для улучшения такого параметра как стабильность, для создания пригодного ИЛ-6а может вводиться изменение, которое приводит к снижению аффинности связывания производного ИЛ-6а по сравнению с эталонным ИЛ-6а (например, эталонным антителом). В некоторых вариантах реализации изобретения, например, в некоторых случаях, в которых эталонный параметр относится к связыванию с FcRn или фармакокинетическому (ФК) параметру, такому как период полувыведения из стекловидного тела или системный период полувыведения (например, из крови, плазмы, сыворотки, лимфы, печени, почек, других тканей или жидкостей организма), эталонное антитело может быть антителом, которое не специфически связывает ИЛ-6.
Изменение аминокислотной последовательности полипептида ИЛ-6а может включать замену одного или более аминокислотного(ых) остатка(ов) не встречающейся в природе или нестандартной аминокислотой, модификацию одного или более аминокислотных остатков на не встречающиеся в природе или с нестандартной формой или вставку одного или более аминокислотных остатков не встречающейся в природе или нестандартной аминокислоты в данную последовательность. Примеры количеств и локализаций изменений в последовательностях данного изобретения описаны в другом месте данного документа. Встречающиеся в природе аминокислоты включают 20 «стандартных» L-аминокислот, обозначаемых по их стандартным однобуквенным кодам как G, А, V, L, I, M, Р, F, W, S, Τ, N, Q, Y, С, K, R, H, D, Е. Нестандартные аминокислоты включают любые другие остатки, которые могут быть включены в полипептидный скелет или быть результатом модификации существующего аминокислотного остатка. Нестандартные аминокислоты могут быть встречающимися в природе и не встречающимися в природе. Несколько встречающихся в природе нестандартных аминокислот, таких как 4-гидроксипролин, 5-гидроксилизин, 3-метилгистидин и N-ацетилсерин, известны в данной области техники. Те аминокислотные остатки, которые являются производными по их N-положению, будут расположены только HaN-конце аминокислотной последовательности. Аминокислота в основном является L-аминокислотой. В некоторых случаях аминокислота является D-аминокислотой. Следовательно, изменение может включать модификацию L-аминокислоты или ее замену D-аминокислотой. Известны также метилированные, ацетилированные и/или фосфорилированные формы аминокислот и в настоящем изобретении аминокислоты могут быть объектом для таких модификаций.
Аминокислотные последовательности доменов антител и участников связывания данного изобретения могут содержать не встречающиеся в природе и нестандартные аминокислоты, обсуждаемые в данном документе. Нестандартные аминокислоты (например, D-аминокислоты) могут быть включены в аминокислотную последовательность с помощью способов, известных в данной области техники, к примеру, при синтезе молекулы или путем пост-синтетической модификации или замещения аминокислоты. В некоторых случаях D-аминокислоту применяют для улучшения ФК ИЛ-6а.
Новые участки VH или VL, несущие CDR-производные последовательности данного изобретения могут быть получены с применением случайного мутагенеза одной или более выбранных последовательностей нуклеиновых кислот VH и/или VL для получения мутаций в пределах целого вариабельного домена. К примеру, могут применять ПЦР пониженной точности (Chao et al., Nature Protocols, 1: 755-768 (2006)). В некоторых вариантах реализации изобретения одна или две аминокислотные замены вводят в пределах целого вариабельного домена или набора CDR. Для создания мутаций могут применять другие способы, известные в данной области техники, к примеру, сайт-направленный мутагенез, в основном, в одном или более CDR.
Одним способом для получения ИЛ-6а в виде антитела является изменение VH-домена таким образом, что изменяются показанные последовательности SEQ ID NO: 1 и SEQ ID NO: 3 путем добавления, удаления, замены и вставки одной или более аминокислот. Измененный VH-домен может комбинироваться с VL-доменом таким образом, что изменяется показанная последовательность SEQ ID NO: 2, которая также может изменяться, как описано в данном документе, и с помощью способов, известных в данной в данной области техники. Такие измененные молекулы испытывают их способность связываться с сайтом II ИЛ-6 и, необязательно, другие требуемые свойства, такие как повышенная аффинность по сравнению с эталонной молекулой. В некоторых случаях, варианты VH- или VL-домена могут иметь 1, 2, 3, 4 или 5 таких изменений (например, 1, 2, 3, 4 или 5 аминокислотных замен).
ИЛ-6а данного изобретения может быть фрагментом антитела, который связывается с сайтом II ИЛ-6 при условии, что этот фрагмент содержит антигенсвязывающий сайт, например, может связываться с сайтом II ИЛ-6. Фрагменты антитела изобретения обычно получают, начиная с эталонной (исходной) молекулы антитела, такой как молекула антитела, содержащая последовательность SEQ ID NO: 1 и SEQ ID NO: 2 или SEQ ID NO: 3 и SEQ ID NO: 2. Фрагменты антитела могут быть получены с помощью способов, известных в данной области техники, таких как методы рекомбинантных ДНК, ферментативное расщепление (к примеру, с помощью пепсина или папаина), химическое расщепление антитела (к примеру, химическим восстановлением дисульфидных мостиков). Фрагменты антитела, которые включают антигенсвязывающий сайт антитела, включают без ограничения такие молекулы, как: Fab, Fab', Fab'-SH, scFv, Fv, dAb, Fd и стабилизированный дисульфидными связями вариабельный участок (dsFv). Могут быть сконструированы различные другие молекулы антител, включающие один или более антигенсвязывающих сайтов, включая, к примеру, F(ab')2, F(ab)3, диатела, триатела, тетартела и минитела. Примеры молекул антител и способы их конструирования и применения описаны в статье Holliger and Hudson, 2005, Nat Biotechnol 23: 1126-1136. Неограничивающие примеры фрагментов связывания представлены: Fab-фрагментом, состоящим из VL, VH, константного домена легкой цепи (CL) и константного домена тяжелой цепи 1 (CH1); Fd-фрагментом, состоящим из VH- и СН1-доменов; Fv-фрагментом, состоящим из VL- и VH-доменом одного антитела; dAb-фрагментом, состоящим из VH- или VL-домена; выделенными участками CDR; F(ab')2-фрагментом, бивалентным фрагментом, содержащим два связанных Fab-фрагмента; одноцепочечной Fv-молекулой (scFv), в которой VH-домен и VL-домен связаны пептидным линкером, который позволяет этим двум доменам ассоциировать с образованием антигенсвязывающего сайта; биспецифическим одноцепочечным Fv-димером (к примеру, описанным в заявке WO 1993/011161) и диателом, которое является мультивалентным или мультиспецифическим фрагментом, сконструированным с помощью гибридизации генов (к примеру, как описано в заявке WO 94/13804). Молекулы Fv, scFv или диател могут быть стабилизированы путем включения дисульфидных мостиков, связывающих VH- и VL-домены. Минитела, содержащие присоединенную к домену СН3 молекулу scFv, также могут применять в качестве ИЛ-6а. Другие фрагменты и производные антитела, которые могут применяться как ИЛ-6а включают: Fab', который отличается от Fab-фрагмента добавлением нескольких аминокислотных остатков на карбоксильном конце СН1-домена тяжелой цепи, включая один или более цистеинов из шарнирного участка антитела, и Fab'-SH, который представляет собой Fab'-фрагмент, в котором остаток(ки) цистеина константного домена несет свободную тиольную группу.
В некоторых случаях ИЛ-6а, который является фрагментом антитела, химически модифицировали для улучшения или придания требуемого свойства, к примеру, ПЭГилирование применяется для увеличения периода полувыведения или инкорпорирования.
dAb (доменное антитело) является малым мономерным антигенсвязывающим фрагментом антитела (вариабельный участок тяжелой или легкой цепи антитела). VH dAb встречаются в природе у верблюдовых (например, верблюдов и лам) и могут быть получены иммунизацией верблюдовых с помощью антигена-мишени, выделением антигенспецифичных В-клеток и прямым клонированием генов dAb из отдельных В-клеток. ИЛ-6а настоящего изобретения может быть антителом dAb, содержащим VH-или VL-домен, в основном, какие указаны в данном документе, или VH- или VL-домен, включающий набор CDR, в основном, какие указаны в данном документе.
Антитела данного изобретения включают биспецифические антитела, в которых два разных вариабельных участка скомбинированы в одной и той же молекуле. ИЛ-6а может быть включен как часть биспецифического антитела, полученного с применением известных в данной области техники способов, к примеру, получены химическим синтезом или с помощью гибридных гибридом. Такая молекула может быть биспецифическим фрагментом антитела описанного выше типа. Неограничивающим примером способа получения биспецифического антитела является технология BiTE™, согласно которой могут применять домены связывания двух антител с разной специфичностью и непосредственно соединенные посредством коротких гибких пептидов. Таким образом, два антитела соединяются одной короткой полипептидной цепью. Диатела и молекулы scFv могут быть сконструированы без Fc-участка с применением только вариабельных доменов, что потенциально снижает эффекты анти-идиопатической реакции. Биспецифические антитела могут быть сконструированы как целый IgG, как биспецифический Fab'2, как Fab'ПЭГ, как диатела или, в ином случае, как биспецифическая молекула scFv. Дополнительно, два биспецифических антитела могут быть соединены с помощью обычных способов, известных в данной области техники, с образованием тетравалентных антител.
Биспецифические диатела, в противоположность биспецифическим целым антителам, являются подходящими, в частности, из-за того, что они могут быть собраны и экспрессированы в клетке Е.coli. Диатела (и многие другие полипептиды, такие как фрагменты антител) с подходящей специфичностью связывания могут быть легко выбраны из библиотек, полученных методом фагового дисплея (WO 1994/13804). Если одна рука диатела сохраняется неизменной, к примеру, с сохранением специфичности направленной против сайта II ИЛ-6, то библиотека может быть создана, где другая рука изменяется и выбирается антитело с подходящей специфичностью.
Биспецифические целые антитела могут быть созданы с помощью альтернативных способов конструирования, описанных в заявках WO 1996/27011, WO 1998/50431 и WO 2006/028936.
В некоторых случаях ИЛ-6а изобретения содержит антигенсвязывающий сайт в пределах неантительной молекулы, к примеру, при включении одного или более CDR, например, набора CDR в остов неантительного белка, как дополнительно обсуждается ниже. В некоторых случаях, CDR включены в неантительный остов. Сайт связывания сайта II ИЛ-6 может быть получен путем упорядочивания CDR на остовах неантительных белков, таких как фибронектин или цитохром В, или путем рандомизаций или мутаций остатков аминокислот петли в пределах белкового остова для придания специфичности связывания с сайтом II ИЛ-6. В данной области техники известны остовы новых сконструированных сайтов связывания. К примеру, белковые остовы для имитаторов антител раскрыты в заявке WO 200034784, которая описывает белки (имитаторы белков), которые включают домен фибронектина III типа, имеющий по меньшей мере одну рандомизированную петлю. Подходящий остов, к которому присоединен один или более CDR, например, набор HCDR, может быть получен из любого представителя домена суперсемейства генов иммуноглобулинов. Остов может быть человеческим или нечеловеческим белком. Преимуществом неантительного белкового остова является то, что он может нести антигенсвязывающий сайт на молекуле остова, которая меньше и/или проще для производства, чем по меньшей мере некоторые молекулы антител. Малый размер участника связывания может придавать полезные физиологические свойства, такие как способность к прохождению в клетку, глубокому проникновению в ткани или достижению мишеней в других структурах, или способность связываться в пределах белковых полостей антигена-мишени. Типовыми являются белки, имеющие стабильный скелет и одну или более вариабельных петель, в которых аминокислотная последовательность петли или петель определенным или случайным образом подверглась мутации с образованием антигенсвязывающего сайта, который связывает антиген-мишень. Такие белки включают домены связывания IgG белка A S.aureus, трансферрин, тетранектин, фибронектин (например, применяя 10-й домен фибронектина III типа), липокалины, а также гамма-кристаллин и другие остовы Affilin™ (Scil Proteins, г. Галле, Германия). Примеры других подходов включают синтетические микротела, на основе циклотидов - малых пептидов, обдающих внутримолекулярными дисульфидными связями, микробелки (например, Versabodies™, Amunix Inc., г. Маунтин-Вью, Калифорния, США) и белки с повторами анкирина (DARPin, например, от компании Molecular Partners AG, Цюрих-Шлирен, Швейцария). Такие белки также включают малые сконструированные белковые домены, такие как, к примеру, иммуно-домены (см., к примеру, патентные публикации США №№2003/082630 и 2003/157561). Иммуно-домены содержат по меньшей мере один определяющий комплементарность участок (CDR) антитела.
ИЛ-6а может содержать дополнительные аминокислоты, например, для придания молекуле другого функционального свойства в дополнение к способности связывать антиген.
В некоторых случаях ИЛ-6а несет детектируемую метку или конъюгирован с токсином или компонентом-мишенью или ферментом (например, посредством пептидильной связи или линкера). К примеру, ИЛ-6а может содержать каталитический сайт (например, домен фермента), а также антигенсвязывающий сайт (например, сайт связывания с сайтом II ИЛ-6), таким образом, чтобы данный антигенсвязывающий сайт связывался с антигеном и, при этом, нацеливал каталитический сайт на ИЛ-6 или комплекс ИЛ-6/ИЛ-6Р. В некоторых случаях каталитический сайт может дополнительно ингибировать биологическую функцию ИЛ-6, например, расщеплением ИЛ-6, ИЛ-6Р или других молекул, которые ассоциированы с комплексом ИЛ-6а/ИЛ-6.
В некоторых аспектах изобретение включает ИЛ-6а в виде антитела, которое модифицировали по сравнению с эталонным антителом для изменения, к примеру, увеличения, уменьшения или удаления функции биологического действия ИЛ-6а. В одном примере изобретения Fc-участок модифицировали или заменили исходный Fc-домен модифицированным Fc-доменом для изменения фармакокинетики модифицированного ИЛ-6а по сравнению с немодифицированным исходным антагонистом. В некоторых вариантах реализации изобретения ИЛ-6а сконструирован так, чтобы содержать каркас IgG2. В других вариантах реализации изобретения ИЛ-6а в составе каркаса IgG1 или IgG2 несет модифицированный Fe, который увеличивает аффинность связывания ИЛ-6а при рН 6,0 и практически не изменяет аффинность связывания при рН 7,0 по сравнению с исходным или другим эталонным ИЛ-6а, или Fc-домен модифицировали и ИЛ-6а обладает увеличенным периодом полувыведения по сравнению с исходным или другим эталонным ИЛ-6а.
В некоторых вариантах реализации изобретения ИЛ-6а в виде антитела модифицировали для увеличения связывания комплемента и комплементзависимой цитотоксичности. В других аспектах изобретения ИЛ-6а в виде антитела модифицировали для повышения способности активировать эффекторные клетки и принимать участие в проявлении антителозависимой цитотоксичности (АЗКЦ) по сравнению с эталонным антителом. В некоторых случаях, антитела, описанные в данном документе, могут быть модифицированы как для усиления их способности активировать эффекторные клетки и принимать участие в проявлении антителозависимой цитотоксичности (АЗКЦ), так и для усиления их способности связывать комплемент и принимать участие в проявлении комплементзависимой цитотоксичности (КЗЦ).
В некоторых вариантах реализации изобретения описанные в данном документе антитела модифицируют для снижения их способности связывать комплемент и принимать участие в проявлении комплементзависимой цитотоксичности (КЗЦ). В других вариантах реализации изобретения антитела модифицируют для снижения их способности активировать эффекторные клетки и принимать участие в проявлении антителозависимой цитотоксичности (АЗКЦ). В еще других вариантах реализации изобретения описанные в данном документе антитела могут быть модифицированы как для снижения их способности активировать эффекторные клетки и принимать участие проявлении в антителозависимой цитотоксичности (АЗКЦ), так и для снижения их способности связывать комплемент и принимать участие в появлении комплементзависимой цитотоксичности (КЗЦ).
Как правило, преимуществом является предотвращение частой доставки дозы ИЛ-6а, к примеру, при доставке препарата выполнением инъекции в глаз. В некоторых вариантах реализации изобретения для обеспечения такого свойства период полувыведения из места доставки, например, стекловидного тела, для описанного в данном документе ИЛ-6а составляет по меньшей мере 4 суток, к примеру, по меньшей мере 7 суток, по меньшей мере 9 суток, по меньшей мере 11 суток или по меньшей мере 14 суток. В некоторых вариантах реализации изобретения среднее значение периода полувыведения ИЛ-6 а составляет по меньшей мере 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 14 суток, 15 суток, 16 суток, 17 суток, 18 суток, 19 суток, 20 суток, 25 суток, 30 суток, 40 суток, 50 суток или 60 суток. Способы увеличения периода полувыведения антитела известны в данной области техники, к примеру, описаны в патенте США №6277375 и международных публикациях №№ WO 1998/23289 и WO 1997/3461. В некоторых вариантах реализации изобретения период полувыведения ИЛ-6а больше в целевом месте доставки, например, в стекловидном теле, чем системный период полувыведения, например, период полувыведения из крови, сыворотки, плазмы, лимфы, печени, почек или других тканей или жидкостей организма.
В другом варианте реализации в изобретении предложен продукт производства, включающий контейнер. Данный контейнер включает композицию, содержащую ИЛ-6а, описанный в данном документе и листок-вкладыш или этикетку, указывающую, что эта композиция может применяться для лечения связанного с ИЛ-6 нарушения. Обычно композиция представляет собой ИЛ-6а в виде композиции, содержащей фармацевтически приемлемое вспомогательное вещество.
В некоторых случаях данное изобретение представляет собой набор, включающий композицию, содержащую ИЛ-6а, описанный в данном документе, и указания по введению композиции субъекту, нуждающемуся в лечении.
В вариантах реализации изобретения, в которых требуется применение ИЛ-6а большого размера, например, для усиления удержания ИЛ-6а в месте доставки или около него, с ИЛ-6а может быть ассоциирован компонент, который увеличивает размер, но не оказывает значительного негативного воздействия на функционирование ИЛ-6а (например, на аффинность связывания ИЛ-6а с ИЛ-6 или комплексом ИЛ-6/ИЛ-6Р). К примеру, Fab может быть сконструирован методами генетической инженерии как экспрессируемые одиночные полипептиды, содержащие Fab- и Fc-компонент.
В вариантах реализации изобретения, в которых требуется применение ИЛ-6а относительно малого размера, могут применять фрагменты ИЛ-6 в виде антитела, к примеру, scFv- или Fab-фрагмент. Антитело IgG имеет размер около 150 кДа, фрагмент Fab - около 50 кДа, а молекула scFv - около 25 кДа. В некоторых вариантах реализации изобретения ИЛ-6а, описанный в данном документе, имеет размер меньше чем около 50 кДа. Такой антагонист может быть размером, к примеру, меньше чем или равным 50 кДа и больше чем 10 кДа, меньше чем или равным 50 кДа и больше чем 20 кДа или меньше чем или равным 50 кДа и больше чем или равным 25 кДа.
В некоторых случаях стабильность антагониста ИЛ-6, например, антитела или другого ингибитора, обладающего дисульфидными связями, улучшают созданием варианта, в котором один или более дисульфидных мостиков являются более стабильными, чем в исходной молекуле.
Другое преимущество некоторых молекул ИЛ-6а, описанных в данном документе, может заключаться в доступности эффективных молекул, обладающих размером, подходящим для способа их доставки, места доставки и механизма действия. К примеру, ИЛ-6а в форме Fab могут использовать для местного применения. Способы конструирования таких молекул описаны в данном документе и известны в данной области техники.
Показания к применению/ассоциированное с ИЛ-6 заболевание
Заболевания, которые можно лечить с помощью ИЛ-6а данного изобретения, включают те заболевания, в которых повышенный уровень ИЛ-6 связан с болезненным состоянием или является предпосылкой такого болезненного состояния. Такие заболевания включают те, в которых ангиогенез или воспаление, вызванные ИЛ-6, способствуют развитию болезненной патологии. Такое состояние включает заболевания, в которых ИЛ-6 повышен по сравнению с нормальными уровнями, например, заболевания, в которых ИЛ-6 повышен в стекловидном теле (такие как, например, диабетический макулярный отек, диабетическая ретинопатия и увеит) или в тканях глаз. Примеры включают некоторые заболевания глаз, включая без ограничения: синдром сухого глаза, увеит, возрастную макулярную дегенерацию (ВМД), пролиферативную диабетическую ретинопатию (ПДР), диабетический макулярный отек (ДМО), окклюзию вены сетчатки (ОВС), нейромиелит зрительного нерва (НЗН). Другие офтальмологические нарушения, которые можно лечить, включают вызванные травмой, такой как введение трансплантанта роговицы, истирание роговицы и другие физические повреждения глаз. Соответственно данное изобретение включает лечение субъекта, страдающего связанным с ИЛ-6 заболеванием с помощью антагониста ИЛ-6а, описанного в данном документе. В некоторых вариантах реализации изобретения лечение субъекта также включает определение того, страдает ли субъект ассоциированным с ИЛ-6 заболеванием и, необязательно, является ли субъект устойчивым к другим не ингибирующим ИЛ-6 видам лечения, как с применением стероидов или анти-VEGF терапевтических средств.
Одной проблемой с применением некоторых терапевтических средств на основе антител является то, что они эффективны в конкретном месте, таком как глаз, к примеру, в стекловидном теле, но проявляют неблагоприятные эффекты, возникающие в результате системного введения. Один раствор должен содержать терапевтические средства, которые могут доставляться местно, в противоположность системному применению, примером средств являются молекулы, описанные в данном документе. Из-за того, что некоторые терапевтические средства, которые доставляются местно, например, в стекловидное тело, в некоторой степени будут оказываться в системном кровотоке, преимущественной является разработка молекулы, которая будет иметь относительно быстрое системное выведение. Заявители сконструировали образец такой молекулы; ИЛ-6а в виде антитела, которое разработано для быстрого системного выведения, например, по сравнению с исходной молекулой или эталонным антителом. Этот результат достигли модификацией связывания данной молекулы с FcRn и снижением FcRn-опосредованной рециркуляции ИЛ-6а. Дополнительным преимуществом такого конструирования, т.е. уменьшения FcRn-рециркуляции, может быть улучшенное удержание в стекловидном теле уменьшением оттока антител из стекловидного тела после введения с помощью ИСТ. Соответственно, в некоторых вариантах реализации изобретения, для ИЛ-6а, имеющего низкое связывание с рецепторами FcRn, можно снизить частоту дозирования.
Диабетический макулярный отек (ДМО) Диабетический макулярный отек (ДМО) включает закупоривание и пропотевание кровяных сосудов сетчатки, вызывающее понижение остроты зрения и потенциально приводящее к слепоте. Стандартные виды лечения ДМО включают местное введение стероидов или анти-VEGF антител. Однако, у многих пациентов проявляется рефрактерность к этим видам терапии. Патогенез диабетического макулярного отека включает компоненты ангиогенеза, воспаления и оксидативного стресса. ИЛ-6 индуцируется гипоксией и гипергликемией и может увеличивать воспаление сосудов, проницаемость сосудов и патологический ангиогенез. ИЛ-6 может непосредственно индуцировать экспрессию VEGF (фактор роста эндотелия сосудов) и может способствовать хориоидальной неоваскуляризации на моделях животных. У пациентов с ДМО уровни ИЛ-6 в глазах положительно коррелируют с макулярным утолщением и тяжестью заболевания. Сообщалось, что уровни ИЛ-6 повышены у пациентов, у которых анти-VEGF терапия не дала результата, тогда как уровни снижались у восприимчивых к анти-VEGF терапии пациентов. Соответственно, введение ИЛ-6а, описанного в данном документе, является пригодным для лечения диабета в комбинации с анти-VEGF терапевтическим средством или, как альтернативный вариант анти-VEGF лечения, включающего применение для пациентов, которые не отвечают на анти-VEGF терапию. Лечение макулярного отека с помощью ИЛ-6а также может повысить безопасность, благодаря устранению необходимости полностью ингибировать какой-либо механизм для подавления данной патологии, таким образом сохраняя требуемые, биологические роли каждого цитокина. Соответственно, местное лечение ИЛ-6а в комбинации с ингибированием VEGF может снизить частоту дозирования и уменьшить неблагоприятные эффекты лечения.
Для ДМО существует положительная корреляция между уровнями ИЛ-6 в стекловидном теле и как тяжестью заболевания, так и рефрактерностью субъектов при лечении VEGF. Соответственно, антагонист ИЛ-6а, описанный в данном документе, может применяться для лечения ДМО у субъектов, которые являются рефрактерными для терапии стероидами, анти-VEGF терапии или обоих видов терапии. В некоторых случаях ИЛ-6а применяют в комбинации с анти-VEGF терапией или терапией стероидами, например, для лечения ДМО.
Антагонисты ИЛ-6а, описанные в данном документе, также могут применять для лечения нарушений, таких как: рак, например, рак простаты, лейкемия, множественная миелома, воспалительные (такое как хронические воспалительные пролиферативные заболевания) и аутоиммунные заболевания, например, ревматоидный артрит, болезнь Кастлемена (гигантская или ангиофолликулярная гиперплазия лимфоузлов, лимфоидная гамартома, ангиофолликулярная гиперплазия лимфоузлов), ювенильный идиопатический артрит (включая полиартикулярный ювенильный идиопатический артрит и системный ювенильный идиопатический артрит), болезнь Стилла (охватывающую ювенильный идиопатический артрит и вспышку болезни Стилла у взрослых), вспышка болезни Стилла у взрослых, амилоидный амилоидоз А, ревматическая полимиалгия, реммитирующий серонегативный симметрический синовит с отеком с возникновением ямки при надавливании, спондилоартриты, болезнь Бехчета (включая лечение глазных проявлений), атеросклероз, псориаз, системная красная волчанка, полимиозит (воспалительная миопатия), рецидивирующий полихондрит, приобретенная гемофилия А, множественный склероз, анемия при воспалении и болезнь Крона.
Антагонисты ИЛ-6 также пригодны для лечения определенных неврологических заболеваний, к примеру, депрессии и болезни Альцгеймера.
Другие заболевания, которые можно лечить с помощью ИЛ-6а, описанных в данном документе, включают без ограничения: системный склероз, артерит Такаясу, гигантоклеточный артерит, реакцию «трансплантат против хозяина», периодический синдром, ассоциированный с рецептором ФНО (TRAPS).
Дозирование
Антитело против ИЛ-6 или его фрагмент могут вводить субъекту (например, пациенту), у которого экспрессируются аномально высокие уровни ИЛ-6. Антитело или его фрагмент могут вводить однократно или вводить много раз. Антитело могут вводить, к примеру, от трех раз ежедневно до одного раза каждые шесть месяцев или дольше. Введение может проводиться по графику, такому как: три раза в ежедневно, дважды в день, один раз в день, один раз каждые два дня, один раз каждые три дня, один раз в неделю, один раз каждые две недели, один раз каждый месяц, один раз каждые два месяца, один раз каждые три месяца и один раз каждые шесть месяцев. Антитело или его фрагмент могут вводиться непрерывно через мининасос или другим способом, таким как имплантируемая капсула с замедленным высвобождением или путем инкапсулирования клетки, продуцирующей данное антитело или его фрагмент. Антитело или его фрагмент могут вводиться посредством мукозального, буккального, интраназального, ингаляционного, внутривенного, подкожного, парентерального, внутриокулярного или внутриопухолевого пути введения. Антитело или его фрагмент могут вводиться один раз, по меньшей мере дважды или в течение по меньшей мере одного периода времени до тех пор, пока состояние не будет вылечено, облегчено или исцелено. Антитело или его фрагмент обычно будут вводиться настолько долго сколько проявляется патологическое состояние. Антитело или его фрагмент обычно будут вводиться как часть фармацевтической композиции, описанной в данном документе. Дозировка антитела, как правило, будет находится в диапазоне от 0,1 до 100 мг/кг, от 0,5 до 50 мг/кг, от 1 до 20 мг/кг и от 1 до 10 мг/кг. Концентрация в сыворотке антитела или его фрагмента может измеряться любым подходящим методом. Одним свойством некоторых соединений, описанных в данном документе, является то, что они требуют относительно нечастого дозирования, к примеру, один раз в неделю, два раза в неделю, три раза в неделю, один раз каждые четыре недели, один раз каждые 8 недель, один раз каждые 12 недель, один раз каждые 16 недель, один раз каждые 32 недели, один раз в месяц, один раз в два месяца, один раз в три месяца или один раз в шесть месяцев. В некоторых случаях данное соединение вводят по мере необходимости, определяемой, к примеру, по состоянию субъекта. Свойством антагонистов ИЛ-6, описанных в данном документе, является то, что они позволяют проводить относительно нечастое дозирование в сочетании с высокой активностью, которая достигается, в частности, по меньшей мере медленной скоростью диссоциации после связывания с ИЛ-6 и способностью данных соединений доставляться в относительно высокой концентрации.
В некоторых случаях ИЛ-6а применяется в качестве монотерапии. В других вариантах реализации изобретения ИЛ-6а вводит совместно с метатрексатом или другим корректирующими заболевание противоревматическим лекарственным средством.
Получение антител
ИЛ-6а в виде антитела или его производное или фрагмент могут получать с применением способов, известных в данной области техники, таких как подход для получения моноклональных антител (например, см. статью Kohler and Milstein (1975) Nature 256: 495). Могут также применяться другие методики для получения моноклональных антител, такие как вирусная или онкогенная трансформация В-лимфоцитов.
Химерные или гуманизированные антитела могут быть получены на основе последовательности мышиных моноклональных антител, полученных известными в данной области техники способами. ДНК, кодирующая тяжелую и легкую цепь иммуноглобулинов, может быть получена из интересующей мышиной гибридомы и сконструирована так, чтобы содержать немышиные (например, человеческие) последовательности иммуноглобулина с применением стандартных методик молекулярной биологии. К примеру, для создания химерного антитела вариабельные участки антитела мыши могут быть связаны с константными участками антитела человека с помощью способов, известных в данной области техники (см., например, патент США №4816567). Для создания гуманизированного антитела мышиные CDR-участки могут быть вставлены в каркас антитела человека с помощью способов, известных в данной области техники (см., например, патент США №5225539 и патенты США №№5530101; 5585089; 5693762 и 6180370).
В вариантах реализации изобретения ИЛ-6а, описанный в данном документе (например, анти-ИЛ-6 антитело или его производное или фрагмент), может специфически связывать ИЛ-6 человека. В вариантах реализации изобретения ИЛ-6а может специфически связываться с сайтом II ИЛ-6 (например, сайтом II ИЛ-6 человека).
В некоторых вариантах реализации изобретения ИЛ-6а в виде антитела является моноклональным антителом человека. Такие антитела могут быть получены с помощью трансгенных или трансхромосомных мышей, содержащих скорее части элементов иммунной системы человека, чем системы мыши. Такие трансгенные или трансхромосомные мыши включают мышей, называемых в данном документе, соответственно, HuMAb Mouse® и KM Mouse®, и в совокупности называемых как «мыши с Ig человека» (например, см. патенты США №№5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429; патент США №5545807; публикации РСТ №№ WO 92/03918, WO 93/12227, WO 94/25585, WO 97/13852, WO 98/24884 и WO 99/45962 и публикацию РСТ № WO 01/14424).
В другом аспекте изобретения анти-ИЛ-6 антитела человека могут быть синтезированы с помощью мыши, которая несет последовательности иммуноглобулинов человека в трансгенах и трансхромосомах, как мышь, которая несет трансген тяжелой цепи человека и трансхромосому легкой цепи человека. Такие мыши подробно описаны в публикации РСТ № WO 02/43478.
Другие трансгенные животные системы, экспрессирующие гены иммуноглобулинов человека, доступны в данной области техники и могут применяться для синтеза ИЛ-6а в виде антител. К примеру, могут применять альтернативные трансгенные системы, называемые Xenomouse™ (Abgenix Inc.), такие мыши описаны, к примеру, в патентах США №№5939598; 6075181; 6114598; 6150584 и 6162963. Более того трансхромосомные животные системы, экспрессирующие гены иммуноглобулинов человека, доступны в данной области техники и могут применяться для синтеза ИЛ-6а в виде антител. К примеру, несущие как трансхромосому тяжелой цепи человека, так и трансхромосому легкой цепи человека мыши описаны в статье Tomizuka et al. (2000, Proc Natl Acad Sci USA 97: 722-727). Моноклональные антитела человека также могут быть получены с использованием мышей SCID, в которые ввели клетки иммунной системы человека так, чтобы после иммунизации могла быть получена продукция антител. Такие мыши описаны, к примеру, в патентах США №№5476996 и 5698767.
Библиотеки фаговых дисплеев
В некоторых случаях ИЛ-6а в виде антитела или его производного или фрагмента получают способом, который включает синтез библиотеки антител человека с помощью фага, скрининг полученной библиотеки с ИЛ-6, например, ИЛ-6 человека или его фрагмента, выделение фага, который связывает ИЛ-6, и получение из фага антитела.
Рекомбинантное антитело-ИЛ-6а человека может также выделяться с помощью скрининга библиотеки рекомбинантных комбинаторных антител. В общем, данная библиотека является библиотекой фагового дисплея scFv, полученная с помощью кДНК VL и VH человека, полученных из мРНК, выделенных из В-клеток. Способы для получения и скрининга таких библиотек известны в данной области техники. Наборы для получения библиотеки фаговых дисплеев коммерчески доступны (например, Pharmacia Recombinant Phage Antibody System, №27-9400-01 по каталогу; и набор для фагового дисплея Stratagene SurfZAP™, №240612 по каталогу). Другие способы и реагенты, которые могут применять для получения и скрининга библиотек дисплеев антител, известных в данной области техники (см., например, патент США №5223409; публикации РСТ №№ WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; статьи Fuchs et al., Bio/Technology 9: 1370-1372 (1991); Hay et al., Hum Antibod Hybridomas 3: 81-85 (1992); Huse et al., Science 246: 1275-1281 (1989); McCafferty et al., Nature 348: 552-554 (1990); Griffiths et al., EMBO J 12: 725-734 (1993); Hawkins et al., J Mol Biol 226: 889-896 (1992); Clackson et al., Nature 352: 624-628 (1991); Gram et al., Proc Natl Acad Sci USA 89: 3576-3580 (1992); Garrad et al., Bio/Technology 9: 1373-1377 (1991); Hoogenboom et al., Nuc Acid Res 19: 4133-4137 (1991); and Barbas et al., Proc Natl Acad Sci USA 88: 7978-7982 (1991), все включены в данный документ посредством ссылок.
Как пример выделения и продукции антител человека против ИЛ-6 с требуемыми характеристиками, сначала применяют антитело человека против ИЛ-6 для выбора последовательностей тяжелой и легкой цепей человека, имеющих сходную активность связывания с ИЛ-6, применяя способы импринтинга эпитопов, описанных в публикации РСТ № WO 93/06213, включенной в данном документе посредством ссылки. Библиотеки антител, применяемые в данном способе, обычно являются библиотеками scFv, полученными и прошедшими скрининг как описано в публикации РСТ № WO 92/01047; статьях McCafferty et al., Nature 348: 552-554 (1990) и Griffiths et al., EMBO J 12: 725-734 (1993), все включены в данный документ посредством ссылок.
Как только выбраны исходные VL- и VH-домены человека, проводят эксперименты по «смешиванию и совпадению», в которых разные части исходных выбранных VL- и VH-сегментов проходят скрининг на определение связывания ИЛ-6 с выбранными предпочтительными комбинациями пар VL/VH. Для выбора требуемых свойств ИЛ-6а, VL- и/или VH-сегменты выбранных пар могут подвергаться случайным мутациям. Это созревание аффинности in vitro может достигаться, к примеру, амплификацией VH- и VL-доменов, применяя праймеры ПЦР, комплементарные CDR одного или обоих выбранных VH- и VL-доменов, такие праймеры содержат случайную смесь четырех нуклеотидных оснований в определенных положениях так, чтобы результирующие продукты ПЦР кодировали VH- и VL-сегменты, в участки VH и/или VL которых были введены случайные мутации. Такие VH- и VL-сегменты со случайными мутациями могут пройти повторный скрининг на связывание с ИЛ-6, например, с сайтом II ИЛ-6.
После скрининга и выделения ИЛ-6а в виде антитела из библиотеки дисплеев рекомбинантных иммуноглобулинов нуклеиновые кислоты, кодирующие выбранное антитело, могут быть восстановлены из пакета дисплея (например, из фагового генома) и субклонированы в других векторах экспрессии с помощью методик рекомбинантных ДНК, известных в данной области техники. С такими антителами могут проводить дополнительные манипуляции для продукции фрагментов антител, таких какие описаны в данном документе.
Фармакокинетика (ФК)
Исследования ФК могут проводить с помощью способов, известных в данной области техники. Одним препятствием для определений, требующих использования животных, например, при исследовании ФК, является то, что ИЛ-6 человека обладает менее чем 50% гомологии с таким белком некоторых животных, обычно используемых в таком испытании. Поэтому, один способ исследования ФК заключается в использовании трансгенных мышей, экспрессирующих ИЛ-6 человека. В некоторых вариантах реализации изобретения для определения ФК применяют приматы кроме человека.
В некоторых вариантах реализации изобретения анти-ИЛ-6-антитело подвергают мутации, что изменяет его ФК, например, из-за изменения чувствительности к рН при связывании с FcRn. Способ получения таких мутаций описан в Примерах. Соответственно, в некоторых вариантах реализации изобретения ИЛ-6а имеет измененную системную ФК по сравнению с исходным ИЛ-6а или эталонной молекулой. В некоторых случаях ФК не изменяется или улучшается при введении в стекловидное тело. В некоторых вариантах реализации изобретения ИЛ-6а обладает такими же или повышенными параметрами ФК (например, повышенным периодом полувыведения) в стекловидном теле и пониженными параметрами системной ФК (например, при анализе циркулирующей жидкости, такой как кровь, плазма, лимфа, сыворотка, в печени, почках и других тканях или других жидкостей организма) по сравнению с исходным ИЛ-6а или эталонной молекулой.
Модели для исследования антагониста ИЛ-6
Антагонисты ИЛ-6 могут тестировать на моделях заболевания ассоциированной с ИЛ-6 доставкой, особенно на эффективность лечения и ограниченное вредное действие при благоприятных свойствах ИЛ-6. К примеру, лечение увеита можно исследовать на экспериментальной модели аутоиммунного увеита у крыс или мышей (Caspi, Invest Ophthalmol Vis Sci 52: 1873; Agarwal et al., 900: 443-69, 2012), применяя иммунизацию межфоторецепторным ретиноидсвязывающим белком (IRBP) с полным адъювантом Фрейнда (ПАФ). Другие модели включают такие известные в данной области техники, как дендритные клетки, индуцирующие увеит, адаптивный перенос культивированных эффекторных Т-клеток, спонтанный EAU (экспериментальный аутоиммунный увеит) у мышей с IRBP TCR Tg, эндотоксин-индуцированный увеит, аутоиммунный увеоретинит (Haruta et al., Invest Ophthalmol Vis Sci 53: 3264 (2011); Yoshimura et al., Rheumatology 48: 347-354 (2009)). Другие модельные системы, которые могут применять для проверки эффектов лечения заболевания ИЛ-6а представлены, к примеру, моделью хороидальной неоваскуляризации (ХНВ) (Izumi-Nagai et al., Am J Pathol 170: 6 (2007); Krzystolik et al, Arch Ophthalmol 120: 338 (2002)) и моделями с диабетом, такими как описанные в статье Kern et al. (Animal Models Of DiabeticComplications Consortium (P01 DK57733), обновленный отчет (сентябрь 2001 - январь 2004)). Модели на животных, пригодные для исследования ИЛ-6а при ревматоидном артрите, известны в данной области техники, например, см. статью Asquith et al. (Eur J Immunol 39: 2040-4 (2009)) and Kollias et al. (Ann Rheum Dis 70: 1357-62 (2011)).
Виды комбинированной терапии
В некоторых вариантах реализации изобретения ИЛ-6а вводят в комбинации со вторым терапевтическим веществом. К примеру, ИЛ-6а вводят в режиме лечения, который включает ингибитор VEGF, такой как ранидизумаб. В некоторых вариантах реализации изобретения ИЛ-6а вводят в режиме лечения, который включает ингибитор ТФР (тромбоцитарного фактора роста), такой как анти-ТФР-антитело или антитело против рецептора ТФР (например, иматиниб).
Доставка антагониста ИЛ-6
Антагонист ИЛ-6 может доставляться местно либо прямым контактом с клеткой или тканью, либо с соседними клетками или тканями, которые должны подвергаться ингибированию ИЛ-6. Неограничивающие примеры таких способов доставки включают инъекцию, инфузию или имплантацию субстанции, содержащей антагонист ИЛ-6.
В некоторых вариантах реализации изобретения композицию ИЛ-6а вводят в офтальмологический состав. Данные способы могут включать введение композиции ИЛ-6а и приемлемый для офтальмологического применения носитель. В некоторых вариантах реализации изобретения офтальмологический состав является жидким, мягким, в виде вставки, в виде пленки, в виде микрочастиц или наночастиц.
В некоторых вариантах реализации изобретения композицию ИЛ-6а готовят в виде состава для местного применения, например, для глаза. Состав для местного применения может представлять собой жидкую или мягкую лекарственную форму, к примеру, состав для местного применения, который включает водный раствор, водную суспензию, мазь или гель. Офтальмологический состав с ИЛ-6а может наноситься местно на переднюю поверхность глаза, под верхнее веко, на нижнее веко и за веко (cul-de-sac). Как правило, офтальмологический состав является стерильным. Офтальмологический состав с ИЛ-6а может содержать одно или более фармацевтических вспомогательных веществ, подходящих для приготовления офтальмологического состава. Примерами таких вспомогательных веществ являются консерванты, буферные агенты, хелатирующие агенты, антиоксиданты и соли для регулирования осмотического давления. Офтальмологические составы, включающие как мази, так и суспензии, обычно обладают вязкостью, которая подходит для выбранного пути введения. В некоторых вариантах реализации изобретения офтальмологический состав имеет вязкость от около 1000 до около 30000 сантипуаз.
В некоторых вариантах реализации изобретения состав является жидким составом, содержащим полимер. Такой полимер могут применять для улучшения биодоступности, повышения вязкости или снижения вытекания из глаза жидкого состава. Подходящие полимеры включают, без ограничения, описанные в статье Wagh et al. (Asian J Pharm, 2: 12-17, 2008). Среди неограничивающих примеров такой полимер представляет собой натрий-гиалуроназа, хитозан, цикл о декстрин, (например, гидроксипропил-β-циклодекстрин, полигалактуроновую кислоту, ксилоглюкан, ксантановую камедь, геллановую камедь, тиомер, полиортоэфир (например, по статье Einmahl, Adv Drag Deliv Rev 53: 45-73, 2001) или полисахарид семян тамаринда (например, по статье Ghelardi et al., Antimicrob Agents Chemother 48: 3396-3401, 2004).
В некоторых вариантах реализации изобретения состав, содержащий композицию ИЛ-6а для офтальмологического введения, может включать один или более сурфактантов, адъювантов, буферных веществ, антиоксидантов, корректирующих тоничность веществ, консервантов (например, ЭДТА, БАК (бензалкония хлорид), натрия хлорит, натрия перборат, поликватериум-1), загустители или модификаторы вязкости (например, карбоксиметилцеллюлоза, гидроксиметилцеллюлоза, поливиниловый спирт, полиэтиленгликоль, гликоль 400, пропиленгликоль-гидроксиметилцеллюлоза, гидроксипропил-гуаровая камедь, гиалуроновая кислота и гидроксипропилцеллюлоза) и тому подобное. Добавки в состав могут включать без ограничения: натрия хлорид, натрия бикарбонат, сорбиновую кислоту, метилпарабен, пропилпарабен, хлоргексидин, касторовое масло и натрия перборат.
В некоторых вариантах реализации изобретения в композиции применяют очищенную или деионизированную воду. рН может регулироваться добавлением любых физиологически и офтальмологически приемлемых корректирующих рН кислот, оснований или буферных веществ для обеспечения диапазона в пределах около 5,0-8,5, например, рН 7,0; рН 7,3; рН 7,4 или рН 7,5. Офтальмологически приемлемые примеры кислот включают: уксусную, борную, лимонную, молочную, фосфорную, хлористоводородную и им подобные, а примеры оснований включают: натрия гидроксид, натрия фосфат, натрия борат, натрия цитрат, натрия ацетат, натрия лактат, трометамин, трисгидроксиметиламинометан и им подобные. Примеры солей и буферных веществ, которые применяют в составе, включают цитрат/декстрозу, натрия бикарбонат, аммония хлорид и смеси вышеупомянутых солей и оснований.
В некоторых вариантах реализации изобретения осмотическое давление офтальмологической композиции может составлять от около 10 миллиосмолярных (мОсм) до около 400 мОсм, к примеру, 200-400 мОсм или 220-370 мОсм. Обычно осмотическое давление может корректироваться с помощью физиологически и офтальмологически приемлемых солей или вспомогательных веществ. В некоторых вариантах реализации изобретения в состав включают натрия хлорид, к примеру, натрия хлорид присутствует в составе в концентрации в диапазоне от 0,01% до 1% по массе или от 0,05% до 0,45% по массе на основании общей массы композиции. В дополнение или вместо натрия хлорида для достижения величин осмоляльности в пределах требуемого диапазона также могут применять эквивалентные количества одной или более солей, состоящих из катионов, таких как калий, аммоний и им подобных, и анионов, таких как хлорид, цитрат, аскорбат, борат, фосфат, бикарбонат, сульфат, тиосульфат, бисульфат, натрия бисульфат, аммония сульфат и им подобных. В некоторых вариантах реализации изобретения для корректирования осмоляльности также применяют сахара, такие как маннит, декстрозу, сорбит, глюкозу и им подобные.
В некоторых вариантах реализации изобретения данные способы включают образование или обеспечение депо для агента, находящегося в контакте с наружной поверхностью глаза. Термин депо относится к агенту, который не удаляется быстро со слезами или другими механизмами очищения глаза. Это позволяет сохранять и поддерживать высокие концентрации агента в жидкости наружной поверхности глаза при одном нанесении препарата. В некоторых вариантах реализации изобретения депо может сохраняться вплоть до восьми часов или дольше. В некоторых вариантах реализации изобретения офтальмологический состав с депо включает без ограничения водные полимерные суспензии, мази и плотные вставки.
В некоторых вариантах реализации изобретения мягкая композиция представляет собой жидкий состав, который повышает вязкость при нанесении на поверхность глаза, в основном благодаря наличию в жидком составе полимера, у которого повышение вязкости происходит при изменении температуры, рН или концентрации электролитов. Полимером может быть, к примеру, целлюлозоацетофталат, полиакриловая кислота, геллановая камедь, гиалуроназа, хитозан, соли альгиновой кислоты (например, натрия альгинат) или блок-сополимер этиленоксида и пропиленоксида (например, Pluronic® компании BASF; полоксамер). В одном из вариантов реализации изобретения полиакриловая кислота является поперечно связанной акриловой кислотой (например, Carbopol®). В некоторых вариантах реализации изобретения мягкая композиция содержит смесь карбопола и блок-сополимера этиленоксида и пропиленоксида; смесь метилцеллюлозы и гидроксиэтилцеллюлозы или смесь полиэтиленгликоля и блок-сополимера этиленоксида и пропиленоксида.
В некоторых вариантах реализации изобретения офтальмологический состав, содержащий ИЛ-6а, является мазью или гелем. В некоторых вариантах реализации изобретения офтальмологический состав является носителем на основе масел. К примеру, состав может содержать минеральное или ланолиновое основание, к которому добавляют композицию ИЛ-6а (к примеру, в количестве от 0,1 до 2%), и вспомогательные вещества. Обычные основы составов могут включать без ограничения минеральное масло, вазелин и их сочетания. В некоторых вариантах реализации изобретения мазь наносят в виде полосы на нижнее веко.
В некоторых случаях офтальмологическая композиция является офтальмологической вставкой. К примеру, офтальмологическая вставка является биологически инертной, мягкой, биоразрушающейся, вязкоэластичной, стабильной к стерилизации после внесения терапевтических агентов, устойчивой к инфекционным агентам из переносимых воздухом бактерий, биоразрушающейся, биосовместимой и/или вязкоэластичной. В некоторых вариантах реализации изобретения вставка содержит офтальмологически приемлемую матрицу, например, полимерную матрицу. Данная матрица, как правило, представляет собой полимер и композицию ИЛ-6а, диспергированную в матрице или связанную с полимерной матрицей. В некоторых вариантах реализации изобретения агент медленно высвобождается из матрицы посредством растворения или гидролиза ковалентной связи. В некоторых вариантах реализации изобретения данный полимер является биоразрушаемым (растворимым) и скорость его растворения может контролировать скорость высвобождения диспергированного в нем агента. В другой форме полимерная матрица является биодеградируемым полимером, который разрушается таким механизмом как гидролиз, вследствие чего высвобождается агент, связанный с полимером или диспергированный в полимере. В дополнительных вариантах реализации изобретения данная матрица и агент могут быть окружены дополнительным полимерным покрытием для дополнительного контроля высвобождения. В некоторых вариантах реализации изобретения вставка содержит биодеградируемый полимер, такой как поликапролактон (ПКЛ), сополимер этилена/винилацетата (ЭВА), полиалкилцианоакрилат, полиуретан, нейлон или сополимер поли(dl-лактид-гликолида) (PLGA) или сополимер любого из этих соединений. В некоторых случаях агент диспергирован в материале матрицы или диспергирован в мономерной композиции, применяемой для создания материала матрицы, перед полимеризацией. В некоторых вариантах реализации изобретения количество терапевтического агента составляет от около 0,1 до около 50% или от около 2 до около 20%. Биодеградируемую или биоразлагаемую матрицу могут применять так, чтобы расходуемую вставку не нужно было удалять из глаза. Поскольку биодеградируемый или биоразлагаемый полимер разрушается или растворяется, то терапевтический агент высвобождается.
В дополнительных вариантах реализации изобретения офтальмологическая вставка содержит полимер, включающий без ограничения, полимеры, описанные в издании Wagh et al., "Polymers used in ocular dosage form and drug delivery systems", Asian J. Pharm., pages 12-17 (January 2008), которое включено в данный документ в полном объеме посредством ссылки. В некоторых вариантах реализации изобретения вставка содержит полимер, выбранный из поливинилпирролидона (ПВП), полимера или сополимера акрилата или метакрилата (например, семейство полимеров Eudragit® от компаний Rohm или Degussa), гидроксиметилцеллюлозы, полиакриловой кислоты, дендримеров полиамидоамина, полидиметилсилоксана, полиэтиленоксида, сополимера поли(лактид-гликолида), поли(2-гидроксиэтилметакрилата), поливинилового спирта или полипропиленфумарата. В некоторых вариантах реализации изобретения вставка содержит материал Gelfoam®. В некоторых вариантах реализации изобретения вставка является конъюгатом полиакриловой кислоты и цистеина, массой 450 кДа.
Вставка может включать сердцевину, которая содержит композицию ИЛ-6а, и внешнюю трубку (например, как описано в публикации патента США №20040009222). В некоторых случаях наружная трубка может быть проницаемой, полупроницаемой или непроницаемой для лекарственного вещества. В некоторых вариантах реализации изобретения сердцевина содержит полимерную матрицу, которая не оказывает значительного влияния на скорость высвобождения композиции ИЛ-6а. В некоторых случаях наружная трубка, полимерная матрица или оба этих элемента являются биоразрушаемыми. В устройствах для доставки лекарственных веществ совместно выделяемый продукт может быть сегментирован. В некоторых вариантах реализации изобретения данное устройство лишено покрытия так, чтобы соответствующие концы являются открытыми, или устройство покрывают, к примеру, слоем проницаемым для композиции ИЛ-6а, полупроницаемым для композиции ИЛ-6а или биоразрушаемым слоем. В некоторых вариантах реализации изобретения композицию ИЛ-6а и по меньшей мере один полимер смешивают в форме порошка.
В некоторых вариантах реализации изобретения офтальмологическая композиция является офтальмологической пленкой. Подходящие полимеры для таких пленок включают, без ограничения, полимеры, описанные в статье Wagh et al. (выше). В некоторых вариантах реализации изобретения пленка представляет собой мягкие контактные линзы, к примеру, линзы, состоящие из сополимеров Ν,Ν-диметилакриламида и метакриловой кислоты, поперечно сшитые этиленгликольдиметакрилатом.
В некоторых вариантах реализации изобретения ИЛ-6а помещают во вставку, которая представляет собой трубчатую форму и может быть сегментирована.
В некоторых вариантах реализации изобретения композиция ИЛ-6а составлена в виде терапевтически эффективного количества, покрытого или диспергированного в полимерной матрице так, чтобы композиция ИЛ-6а представляла собой форму гранул или частиц. В некоторых вариантах реализации изобретения композиция ИЛ-6а высвобождается из состава в виде лекарственного вещества в форме гранул, растворяющееся или распределяющееся в объеме матрицы, диффундирующее через матрицу и высвобождаемое в окружающую физиологическую жидкость. В некоторых вариантах реализации изобретения скорость высвобождения ограничена, главным образом, скоростью растворения композиции ИЛ-6а в виде гранул/частиц, находящихся в матрице; а стадии диффузии через матрицу и дисперсии в окружающую жидкость, в основном, не являются лимитирующими скорость высвобождения. В некоторых вариантах реализации изобретения полимерная матрица не является биоразлагаемой, тогда как в других вариантах реализации изобретения она является биоразлагаемой. Типовые небиоразлагаемые полимерные матрицы могут быть образованы из полиуретана, полисиликона, сополимера полиэтиленвинилацетата (ЭВА), поливинилового спирта и их производных и сополимеров. Типовые биоразлагаемые полимерные матрицы могут быть образованы из полиангидрида, полимолочной кислоты, полигликолевой кислоты, полиалкилцианоакрилата и их производных и сополимеров.
В некоторых случаях композиция ИЛ-6а приготовлена в коллагеновом материале. К примеру, вставка может быть растворимой офтальмологической вставкой с лекарственным веществом (например, полимерной овальной пленкой, которая может вводиться в верхний конъюнктивальный мешок глаза для доставки лекарственного вещества; эллиптической вставкой, такой как OCUSERT® (глазная терапевтическая система с пилокарпином, разработанная компанией Alza Corporation), которая сделана из этиленвинилацетата; вставкой стержневой формы, сделанной из целлюлозы, Lacrisert®; одной из новых офтальмологических систем доставки лекарственных веществ (NODS), сделанной из поливинилового спирта или такими вставками как описаны в статье Fabrizio (Adv Drug Deliv Rev 16: 95-106, 1998). В некоторых случаях вставка содержит коллаген, желатин или полимер, причем данный полимер выбран из поликапролактона (ПКЛ), сополимера этилена/винилацетата (ЭВА), полиалкилцианоакрилата, полиуретана, нейлона или сополимера поли(dl-лактид-гликолида) (PLGA) или сополимера любого из этих соединений. В некоторых случаях вставку имплантируют под верхнее веко. В некоторых случаях вставку имплантируют в задний сегмент глаза, в хороидальное пространство или в склеру. В некоторых вариантах реализации изобретения вставку имплантируют в стекловидное тело или под сетчатку. В некоторых вариантах реализации изобретения вставку инъецируют под сетчатку. Способы введения составов и методики их получения изложены в издании Remington's: The Practice of Science of Pharmacy. 20th edition (Lippincott Williams & Wilkins, 2006), которое включено в данный документ в полном объеме посредством ссылки.
В других вариантах реализации изобретения вставка, содержащая композицию ИЛ-6а, обеспечивает замедленное высвобождение агента в стекловидном теле глаза. В данном документе считается, что термин «замедленное высвобождение» означает, что композиция высвобождает агент длительный период времени в контролированном режиме. В некоторых вариантах реализации изобретения вставка высвобождает агент с такой скоростью, что концентрация водорастворимого агента является меньше, чем концентрация агента в стекловидном теле во время высвобождения. В некоторых вариантах реализации изобретения концентрация водорастворимого агента составляет от около 0,002 мкг/мл до около 0,01 мкг/мл или от около 0,01 мкг/мл до около 0,05 мкг/мл или меньше чем около 0,05 мкг/мл. В некоторых вариантах реализации изобретения агент высвобождается со скоростью от около 1 мкг/сутки до около 50 мкг/сутки или от около 1 мкг/сутки до около 10 мкг/сутки. В некоторых вариантах реализации изобретения вставка дополнительно содержит добавочный терапевтический агент, такой как описано выше, например, фторцинолона ацетонид (такой как выявленный в офтальмологической вставке Retisert®).
В некоторых вариантах реализации изобретения офтальмологическая композиция содержит микросферы или наночастицы. В некоторых вариантах реализации изобретения микросферы содержат желатин. В некоторых вариантах реализации изобретения микросферы инъецируют в задний сегмент глаза, в хороидальное пространство, в склеру, в стекловидное тело или под сетчатку. В некоторых вариантах реализации изобретения микросферы или наночастицы содержат полимер, включая без ограничения полимеры, описанные в статье Wagh et al. (Asian J Pharm 2: 12-17, 2008). В некоторых вариантах реализации изобретения полимером является хитозан, поликарбоновая кислота, такая как полиакриловая кислота, частицы альбумина, сложные эфиры гиалуроновой кислоты, полиитаконовая кислота, полибутилцианоакрилат. поликапролактон, полиизобутилкапролактон, сополимер поли(молочной-гликолевой кислот) или полимолочная кислота. В некоторых вариантах реализации изобретения микросферы или наночастицы содержат твердые липидные частицы.
В некоторых вариантах реализации изобретения композиция ИЛ-6а содержит ионообменную смолу. В некоторых вариантах реализации изобретения ионообменная смола представляет собой неорганический цеолит или синтетическую органическую смолу. В некоторых вариантах реализации изобретения ионообменная смола включает без ограничения, смолы, описанные в издании Wagh et al., см. выше, которое включено в данный документ в полном объеме посредством ссылки. В некоторых вариантах реализации изобретения ионообменная смола представляет собой частично нейтрализованную полиакриловую кислоту.
Композиция ИЛ-6а может быть представлена в виде водной полимерной суспензии. В некоторых вариантах реализации изобретения композиция ИЛ-6а или полимерный суспендирующий агент суспендируют в водной среде (например, обеспечивая свойства, описанные выше). Примеры полимерных суспендирующих агентов включают без ограничения: декстраны, полиэтиленгликоли, поливинилпирролидон, полисахаридные гели, Gelrite®, целлюлозные полимеры, такие как гидроксипропилметилцеллюлоза и содержащие карбокси-группу полимеры, такие как полимеры или сополимеры акриловой кислоты, а также другие полимерные смягчающие средства. В некоторых вариантах реализации изобретения полимерный суспендирующий агент является набухающим в воде, водонерастворимым полимером, особенно перекрестно-сшитый полимер, содержащий карбокси-группы. В некоторых вариантах реализации изобретения полимерный суспендирующий агент составляет по меньшей мере от около 90% до около 99,9% или от около 95% до около 99,9% по массе на основании общей массы присутствующих мономеров из одного или более моноэтилен-ненасыщенных мономеров, содержащих карбокси-группы. В некоторых вариантах реализации изобретения моноэтилен-ненасыщенный мономер, содержащий карбокси-группы, включает акриловую кислоту, метакриловую кислоту, этакриловую кислоту, метилакриловую кислоту (кротоновую кислоту), цис-альфа-метилкротоновую кислоту (ангеликовую кислоту), транс-α-метилкротоновую кислоту (тиглиновую кислоту), α-бутилкротоновую кислоту, альфа-фенилакриловую кислоту, α-бензилакриловую кислоту, α-циклогексилакриловую кислоту, фенилакриловую кислоту (коричную кислоту), кумаровую кислоту (о-гидроксикоричную кислоту) и умбелловую кислоту (п-гидроксикумаровую кислоту). В некоторых вариантах реализации изобретения полимер является перекрестно-сшитым посредством полифункционального перекрестно-сшивающего агента (например, дифункционального перекрестно-сшивающего агента). В некоторых вариантах реализации изобретения перекрестно-сшивающий агент содержится в количестве от около 0,01% до около 5% или от около 0,1% до около 5,0%, или от около 0,2% до около 1% на основании общей массы присутствующих мономеров. В некоторых вариантах реализации изобретения перекрестно-сшивающие агенты являются неполиалкенильными полиэфирными дифункциональными перекрестно-сшивающими мономерами, такими как дивинилгликоль, 2,3-дигидроксигекса-1,5-диен, 2,5-диметил-1,5-гексадиен, дивинилбензол, Ν,Ν-диаллилакриламид, Ν,Ν-диаллилметакриламид; полиалкенильными полиэфирными перекрестно-сшивающими агентами, содержащими две или более алкенильные эфирные группировки на молекулу, например, алкенильные эфирные группировки, содержащие концевые группы Н2С=С, полученные этерификацией многоатомного спирта, содержащего по меньшей мере четыре атома углерода и по меньшей мере три гидроксильные группы, с алкенилгалогенидом, таким как аллилбромид или ему подобным, например, полиаллилсахароза, полиаллилпентаэритрит или им подобные; диолефинные негидрофильные макромерные перекрестно-сшивающие агенты, имеющие молекулярные массы от около 400 до около 8000, такие как нерастворимые диакрилаты и полиакрилаты диолов и полиолов, диизоцианатгидроксиалкилакрилат или метакрилат - продукты реакции изоцианат-концевых преполимеров, получаемых их полиэстердиолов, полиэфирдиолов или полисилоксандиолов с гидроксиалкилметакрилатами, и им подобные.
В некоторых вариантах реализации изобретения перекрестно-сшивающие полимеры получают из моноэтилен-ненасыщенного мономера или мономеров, содержащих карбокси-группы, как целого моноэтилен-ненасыщенного мономера присутствующего вместе с перекрестно-сшивающим агентом или агентами. В некоторых вариантах реализации изобретения данные полимеры являются такими, в которых до около 40%, а, преимущественно, от около 0% до около 20% по массе моноэтилен-ненасыщенного мономера или мономеров, содержащих карбокси-группы, замещено одним или большим количеством моноэтилен-ненасыщенным мономера или мономерами, не содержащими карбокси-группы, а содержащими только физиологически и офтальмологически безопасные заместители, включая сложные эфиры акриловой и метакриловой кислот, такие как метилметакрилат, этилметакрилат, бутилакрилат, 2-этилгексилакрилат, октилметакрилат, 2-гидроксиэтилметакрилат, 3-гидроксипропилакрилат и тому подобные, винилацетат, N-винилпирролидон и тому подобные (например, Mueller et al. - патент США №4548990). В некоторых вариантах реализации изобретения полимеры включают поликарбофил (Noveon АА-1), Carbopol® и DuraSite®. В некоторых вариантах реализации изобретения перекрестно-сшитые полимеры получают полимеризацией суспензии или эмульсии мономеров, применяя традиционные свободнорадикальные катализаторы полимеризации, до получения размера сухих частиц не больше чем около 50 мкм в значении эквивалентного сферического диаметра. В некоторых вариантах реализации изобретения средний размер сухих частиц составляет от около 1 до около 30 мкм или от около 3 до около 20 мкм в значении эквивалентного сферического диаметра. В некоторых вариантах реализации изобретения полимерные частицы получают механическим перемалыванием более крупных полимерных частиц. В дополнительных вариантах реализации изобретения такие полимеры будут обладать молекулярной массой от около 250000 до около 4000000 и от 000000000 до 4000000000. В других вариантах реализации изобретения частицы перекрестно-сшитого полимера являются монодисперсными, что означает, что они имеют такое распределение размеров частиц, которое по меньшей мере для около 80%, около 90% или около 95% частиц попадает в пределы полосы мкм для основного распределения размеров частиц. В дополнительных вариантах реализации изобретения термин частицы монодисперсного размера означает, что существует не более чем около 20%, около 10% или около 5% частиц с размером менее 1 мкм. В некоторых вариантах реализации изобретения водная полимерная суспензия содержит от около 0,05 до около 1%, от около 0,1 до около 0,5% или от около 0,1 до около 0,5% агента и от около 0,1 до около 10%, от около 0,5 до около 6,5%, от около 0,5 до около 2,0%, от около 0,5% до около 1,2%, от около 0,6 до около 0,9% или от около 0,6 до около 0,8% полимерного суспендирующего агента. Несмотря на название в единственном числе, должно быть понятно, что могут применять один или более видов полимерного суспендирующего агента с общим содержанием, попадающим в установленные диапазоны. В одном варианте реализации изобретения количество нерастворимых слабо перекрестно-сшитых полимерных частиц, рН и осмотическое давление могут коррелировать друг с другом и со степенью перекрестной сшивки для получения композиции, имеющей вязкость в диапазоне от около 500 до около 100000 сантипуаз и, предпочтительно, от около 1000 до около 30000 или от около 1000 до около 10000 сантипуаз, при измерении при комнатной температуре (около 25°С), применяя вискозиметр Brookfield Digital LVT, оборудованный ротором номером 25 и малым адаптером для образца 13R, для измерения при 12 об./мин. В некоторых вариантах реализации изобретения вязкость составляет от около 10 до около 400 сантипуаз, от около 10 до около 200 сантипуаз или от около 10 до около 25 сантипуаз.
В некоторых вариантах реализации изобретения водные полимерные суспензии могут быть составлены таким образом, что они сохраняют одинаковую или практически одинаковую вязкость в глазе, которой они обладали перед введение в глаз. В некоторых вариантах реализации изобретения они могут быть составлены таким образом, что происходит повышенное гелеобразование при контакте со слезной жидкостью. Например, когда состав, содержащий DuraSite® или другой подобный полимер типа акриловой кислоты, вводится в глаз при рН меньше чем около 6, 7, то полимер может набухать при контакте со слезной жидкостью, поскольку она обладает более высоким рН (около 7). Это гелеобразование или увеличение гелеобразования может приводить к захватыванию суспендированных частиц, благодаря чему увеличивается время удержания композиции в глазе. В некоторых вариантах реализации изобретения терапевтический агент высвобождается медленно, так как суспендированные частицы растворяются в течение некоторого времени. В некоторых вариантах реализации изобретения этот путь доставки увеличивает комфорт для пациента и увеличивает время контакта агента с тканями глаза, благодаря чему увеличивается степень абсорбции лекарственного вещества и длительность действия состава в глазе. Агенты, содержащиеся в таких системах доставки лекарственных веществ, будут высвобождаться из гелей со скоростями, которые зависят от таких факторов как лекарственные вещества сами по себе и их физическое состояние, степени нагрузки лекарственными веществами и рН системы, а также от любых адъювантов системы доставки, таких как ионообменные смолы, совместимые с поверхностью глаза, которые также могут присутствовать в системах.
В некоторых вариантах реализации изобретения антагонист ИЛ-6 доставляют субъекту с помощью генетической доставки, например, местной генетической доставки. Такую доставку могут осуществлять посредством временной системой экспрессии, стабильной (например, интегрированной) системой экспрессии, такой как лентивирусная система доставки, изготавливаемая компанией Bluebird Bio (г. Кеймбридж, Массачусетс, США) или доставкой клеточной фабрикой, такой как произведенные компанией Neurotech (г. Камберленд, Род-Айленд, США).
Все технические признаки могут быть отдельно скомбинированы со всеми возможными комбинациями таких признаков.
ЭКВИВАЛЕНТЫ ИЗОБРЕТЕНИЯ
Данное изобретение может осуществляться в других специальных формах без отступления от его существа или его существенных характеристик. Следовательно, предшествующие варианты реализации изобретения должны рассматриваться во всех аспектах, скорее, как иллюстративные, чем как ограничивающие описанное в данном документе изобретение.
ПРИМЕРЫ
Следующие неограничивающие примеры дополнительно иллюстрируют варианты реализации изобретений, описанные в данном документе.
Пример 1. Подтверждение местной блокады ИЛ-6 на модели хороидальной неоваскуляризации (ХНВ)
Для определения того, могла ли местная блокада ИЛ-6 быть эффективной для лечения заболевания глаз, например, диабетического макулярного отека (ДМО) или мокнущей ВМД, применяя модельную систему хороидальной неоваскуляризации местно вводили анти-ИЛ-6 антитело. Индуцированная лазерным излучением модель ХНВ (eyecro.com/in-vivo/laser-induced-choroidal-neovascularization-cnv/) воспроизводит многие патологические процессы, лежащие в основе ДМО, включая воспаление и ангиогенез. Исследования выполняли на крысах в организации EyeCRO (г. Оклахома-Сити, Оклахома, США). Шести животным в каждой группе проводили билатеральную лазерную обработку на 0-й день для получения трех очагов поражения на глаз. На 3-й и 10-й дни испытуемой группе путем инъекции в стекловидное тело (ИСТ) вводили 3 мкг поликлонального антитела против ИЛ-6 крысы (R&D Systems AF506; г. Миннеаполис, Миннесота, США), в то время как получавшей носитель контрольной группе и группе положительного контроля вводили, соответственно, ФСБ или поликлональное анти-VEGF-антитело (R&D Systems AF564). Для измерения области поражения на 15-й и 22-й дни выполняли ангиографию in vivo. При обоих исследованиях на 15-й и 22-й дни в группе, лечившейся анти-ИЛ-6, значительно уменьшилась неоваскуляризация по сравнению с контрольной группой, получавшей носитель. Не было статистически значимой разницы между ответом группы, лечившейся анти-ИЛ-6, и ответом группы положительного контроля, получавшей анти-VEGF. На Фиг. 1 показаны результаты такого эксперимента. Полученные данные демонстрируют, что ИЛ-6а, например, анти-ИЛ-6-антитело, введенное ИСТ может снижать неоваскуляризацию на модели крыс с ХНВ до сходных уровней, полученных при действии положительного контроля с анти-VEGF (р=0,0054 на 15-й день и p=0,0005 на 22-й день для сравнения анти-ИЛ-6 и контрольной группы, получавшей носитель).
Эти данные указывают, что местная блокада ИЛ-6 может быть пригодной для лечения заболевания глаза, такого как заболевания, вовлекающие пропотевание сосудов, например, макулярный отек.
Пример 2. Потенциальные антагонисты в виде антител против ИЛ-6
Потенциальные антагонисты в виде антител против ИЛ-6 разрабатывали с помощью процесса, который вначале включал иммунизации. Иммунизации выполняли по указанию авторов изобретения в контрактной исследовательской организации (CRO). Пяти мышам линии BALB/C подкожно инъецировали 80 мкг ИЛ-6 человека (R&D Systems, №206-IL/CF по кат., г. Миннеаполис, Миннесота, США) в ФСБ, содержащем 1 M NaCl с адъювантом Фрейнда. Два бустерных введения выполняли дозами ИЛ-6 80 мкг и 50 мкг. Для образования гибридом собирали клетки селезенки у мышей с высокими титрами антител и гибридизировали их с клетками миеломы P3x763Ag8.653.
Супернатанты гибридом подвергали скринингу на определение связывания ИЛ-6 и проявления антагонизма. Для связывания при проведении анализа ELISA лунки планшетов Costar 9018 покрыли раствором 1 мкг/мл ИЛ-6 человека в ФСБ при 4°С в течение ночи. Лунки блокировали ФСБ, содержащим 2% БСА, промыли и потом инкубировали с 50 мкл супернатанта каждой гибридомы, разбавленного 1:2 ФСБ, содержащим 2% БСА. Через 60 минут лунки три раза промывали с помощью 300 мкл ФСБ, содержащего 0,1% Твин-20. Потом в каждую лунку добавили антитела, меченные пероксидазой хрена (HRP), против антител мышей разбавленные 1:3000 в ФСБ-БСА и планшеты инкубировали в течение 30 минут. Лунки промывали как указано выше, потом добавляли субстрат 3,3',5,5'-тетраметилбензидин (ТМБ) и измеряли сигнал при 450 и 550 нм. Для исследования антагонизма инкубировали репортерные клетки НЕК-Blue™-IL6 (InvivoGen, г. Сан-Диего, Калифорния, США) с возрастающими концентрациями ИЛ-6 человека в присутствии разбавленного 1:10 супернатанта гибридом. Через 20-24 часа 20 мкл супернатанта смешивали с 180 мкл субстрата QuantiBlue™ (InvivoGen) и измеряли оптическую плотность при 655 нм.
На основании результатов исследований связывания и проявления антагонизма заявители выбирали в качестве главного объекта гибридому 64 и субклонировали ее в CRO. Гибридому 64 (синтезировала моноклональные антитела мыши) дополнительно испытывали с помощью твердофазного иммуноферментного анализа (ELISA) на способность ингибировать связывание комплекса ИЛ-6/ИЛ-6Рα с рецептором gp130. Супернатант гибридомы 64 в концентрации 1,5 мкг/мл значительно снижал связывание комплекса ИЛ-6/ИЛ-6Рα с иммобилизованным gp130 при определении методом ELISA (Фиг. 2).
Полученные субклоны повторно подвергали скринингу, вариабельные домены субклона 64.58 амплифицировали методом ПЦР с быстрой амплификацией концов кДНК в 5'-направлении и секвенировали. Последовательности вариабельных доменов мыши (называемые m64) являются следующими:
m64 VH (вариабельный домен тяжелой цепи)

m64 VL (вариабельный домен легкой цепи)

Для создания гуманизированных последовательностей определяющие комплементарность участки (CDR) m64 встраивали в каркас антитела зародышевой линии человека, выбранный по сходству с последовательностью мыши с помощью вычислительного алгоритма. Гуманизированные последовательности (называемые h64) были следующими (измененные по сравнению с последовательностями m64 остатки подчеркнуты) и обладали около 79,5% идентичности (VH) и 84,4% идентичности (VL) с последовательностями мыши:
h64 VH

h64 VL

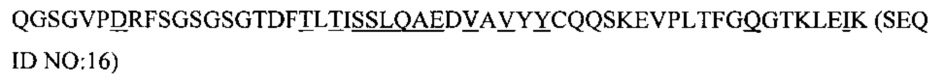
Гуманизированные последовательности синтезировали в компании DNA2.0 (г. Менло-Парк, Калифорния, США), затем клонировали в векторах экспрессии pcDNA3.1, в виде продуктов линейных гибридизаций с константными доменами IgG1 человека. IgG экспрессировали методом временной трансфекции в клетках Freestyle™-293 (Invitrogen, г. Гранд-Айленд, Небраска, США) и очищали с помощью хроматографии на белке А. В обоих исследованиях связывания и проявления антагонизма антитела h64 IgG продемонстрировали существенно уменьшенную активность по сравнению с их предшественником m64. Поэтому для восстановления утерянной аффинности применяли метод дисплея на дрожжевых клетках.
Для выполнения созревания аффинности, разработанного для восстановления или улучшения аффинности гуманизированных h64IgG, последовательности антител h64 повторно клонировали для создания Fab-молекулы в векторах дрожжевых клеток pYC2/CT, в которых FabH-цепь гибридизирована с анти-FITC scFv 4m5.3 антителом через линкер (G4S)3. Потом с помощью ПЦР пониженной точности в соответствии с протоколом Chao et al. (2006, Nature Protocols, 1: 755-768) создавали библиотеку вариантов b.64. Варианты h64 экспрессировали и захватывали поверхностью дрожжевых клеток, меченных FITC-ПЭГ-NHS, с последующим инкубированием с биотинилированным ИЛ-6 человека. Связанный ИЛ-6 детектировали с помощью стрептавидина-АФЦ (аллофикоцианин) и клетки с наибольшим количеством связанного ИЛ-6 по сравнению с количеством отображенных дисплеем Fab выбирали на клеточном сортере BD FACSAria™. Через четыре цикла сортировки выбирали и секвенировали популяцию вариантов с высокой аффинностью. Последовательность клона (называемого h64-1.4), выбранного методом созревания аффинности, является следующей с выделением мутаций жирным шрифтом (например, мутаций, проявившихся по сравнению с последовательностями VH и VL h64), CDR - подчеркнуты. Они представляют вариабельные домены 018 (также как для молекул ИЛ-6а 020 и 029, описанных ниже). Обратите внимание, что полные Fab-фрагменты включают домены СK и IgG1 CH1. В контексте данной заявки, упоминание аминокислотной последовательности «Fab» тяжелой цепи и легкой цепи означает, что последовательность может быть частью функционирующего Fab, состоящего из последовательности легкой цепи и последовательности тяжелой цепи.
h.64-1.4 VH (018VH) (вариабельный домен)
h.64-1.4 VL (018VL) (вариабельный домен)

Вариабельные домены h64-1.4 реклонировали в векторе pcDNA3.1 IgG1 человека и экспрессировали как полноразмерный IgG1 в клетках Freestyle™-HEK293 (Life Technologies). Полученный в результате очищенный IgG был значительно более активным чем оригинальное антитело h64 в обоих исследованиях по определению связывания и проявления клеточного антагонизма. При испытании аффинности с помощью дрожжевой системы аффинность увеличилась с 343 пМ для оригинальной гуманизированной молекулы до 43 пМ. Активность антагониста достигла приблизительно десятикратного увеличения при анализе с помощью клеточной системы HEK-Blue.
Молекула IgG h64-1.4 была преобразована в виде Fab для применения при заболевании глаз и других показаниях. Дополнительно, для дальнейшего улучшения аффинности провели следующий цикл создания библиотеки и отборы с применением дрожжевых клеток. После четырех циклов отбора получили существенное обогащение варианта VH мутацией A79V. Антитела, их варианты и фрагменты, содержащие вариант A79V, называют антителами 019 ИЛ-6а, их вариантами и фрагментами.
Пример 3. Выбор формы
Для исследования подходящих форм антагониста ИЛ-6 на основе антитела, отобранные, как описано выше, антитела против ИЛ-6 испытывали на способность к временной экспрессии, стабильность, свойства агрегации, аффинность связывания и ИК50 с помощью форм Fab, scFv(VH-VL) и scFv(VL-VH) последовательностей 018.
Результаты таких исследований одной из потенциальных молекул ИЛ-6а (последовательностей, содержащих вариабельный участок 018) показаны в Таблице 1.
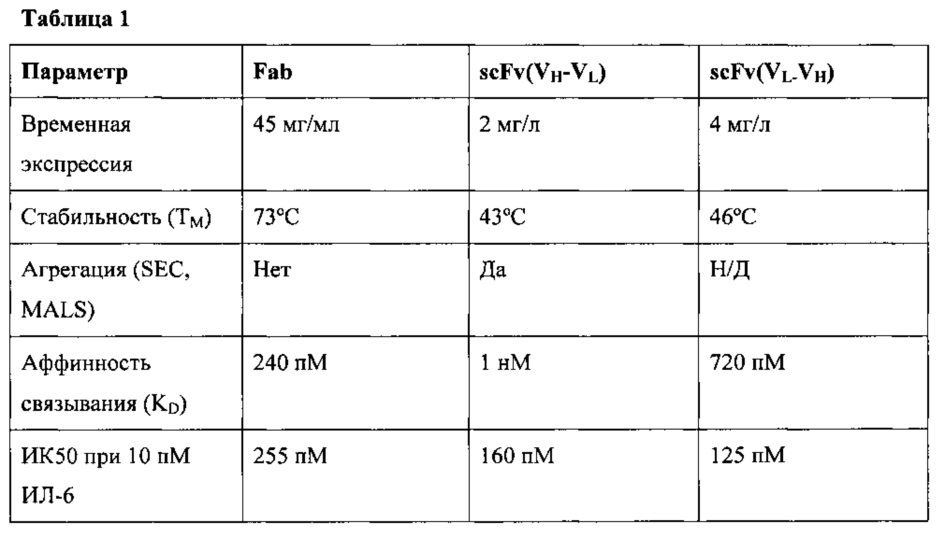
Эти данные демонстрируют способ идентификации ключевых свойств различных форм антагониста ИЛ-6 на основе антитела и иллюстрируют, что антагонисты ИЛ-6, содержащие вариабельные участки 018 в форме 018Fab, обладают наиболее приемлемыми свойствами по главным ключевым категориям, т.е. по экспрессии, стабильности, агрегации и аффинности связывания по сравнению с конфигурацией scFv. Значение ИК50 для молекулы 018Fab попадает в целесообразный диапазон для применения ее в терапевтических целях.
Пример 4. Примеры ИЛ-6а в виде антител, фрагментов и производных
Заявителями с помощью способов, описанных в данном документе, были идентифицированы следующие последовательности. Подчеркнутые последовательности представляют CDR тяжелой и легкой цепей. Другие последовательности могут быть найдены в объеме описания изобретения.
Полипептидная последовательность тяжелой цепи 018 (полноразмерная; fl018HC) на каркасе IgG1

Последовательность нуклеиновой кислоты тяжелой цепи 018 (полноразмерная; fl018HC) на каркасе IgG1


Полипептидная последовательность тяжелой цепи 018 (018FabHC) на каркасе IgG1. CDR подчеркнуты

Полипептидная последовательность полноразмерной легкой цепи 018 (fl018LC). CDR подчеркнуты

Она также представляет собой последовательность легкой цепи антагонистов ИЛ-6 020 и 029
Последовательность нуклеиновой кислоты полноразмерной легкой цепи 018 (018LC) на каркасе IgG1

Тяжелая цепь 019 Fab (019FabHC, такая же последовательность как у 018FabHC за исключением мутации A79V (жирный шрифт/курсив)

019 VH (вариабельный участок/019НС, такая же последовательность как у вариабельного участка 018НС за исключением мутации A79V (жирный шрифт/курсив)

Последовательность легкой цепи антитела 019 (019LC) (полипептидная и нуклеиновой кислоты) является такой как у 018LC

Пример 5. Картирование эпитопа и структуры
Картирование эпитопа
Картирование функционального эпитопа выполняли на выбранных потенциальных антагонистах ИЛ-6. Обнаружено, что потенциальное антитело (мышиное антитело 64) не уменьшило связывание ИЛ-6Рα с ИЛ-6 при определении методом ELISA, указывая на то, что потенциальное антитело не связывается с сайтом I. Проводили дополнительные эксперименты, демонстрирующие как химерное мышиное антитело 64 уменьшает связывание комплекса ИЛ-6/ИЛ-6Рα с рецептором gp130 при определении методом ELISA, указывая на то, что сайт связывания антитела захватывает или сайт II или сайт III ИЛ-6. Обнаружили также, что мышиное антитело 64 не значительно блокирует связывание антитела АН-65 с ИЛ-6 (Immunotech, г. Марсель, Франция), известного связыванием сайта III, указывая на то, что потенциальное антитело связывает сайт II ИЛ-6. Эти данные демонстрируют, что могут быть получены антитела против сайта II, и демонстрируют способ идентификации таких антител.
Для дальнейшего определения эпитопа получили мутации ИЛ-6 с помощью дрожжевых клеток, гибридизированных с последовательностями 4m5.3 (Boder et al., 2000, Proc Natl Acad Sci USA 97, 10701-10705; Chao et al., 2006, Nat Protoc 1, 755-768). Экспрессированные мутации находились в последовательности ИЛ-6 человека со следующими одиночными или двойными мутациями: R24E/D27E, R30E, Y31E, D34R, S118R/V121E, W157E, Q159E/T162P, K171E и R179E. Экспрессированные мутировавшие молекулы ИЛ-6 применяли в исследованиях связывания с молекулой 018 (Fab). Для 018 (Fab) с мутациями R24E/K27E, Y31E, D34Rh S118R/V121R наблюдали уменьшенную аффинность, все мутации расположены на сайте II ИЛ-6. Соответственно, описанное в данном документе изобретение включает антитело, которое связывается с по меньшей мере одной, двумя, тремя, четырьмя, пятью или шестью аминокислотами в положении 24, 27, 31, 34, 118 и 121 ИЛ-6 человека или с эквивалентным сайтом ИЛ-6.
Структурное определение эпитопа сайта II
Следующие расстояния рассчитывали для структурно определенного сайта II. Эти расчеты основаны на гексамерной кристаллической структуре ИЛ-6/ИЛ-6α/gp130, PDB 1Р9М (Boulanger et al., 2003, Science 300: 2101-2104). Спираль 1 ИЛ-6 проходит между сайтом I и сайтом II, что приводит к тому, что некоторые остатки располагаются вблизи сайта II, но содержат боковые цепи, которые направлены на сайт I, например, R30. Аминокислоты D2 и D3 относятся к внеклеточным доменам ИЛ-6Рα.
Определили, что следующие аминокислоты ИЛ-6 располагаются в пределах 5 Å от участка gp130-D2-D3: L19, R24, K27, Q28, R30, Y31, D34, E110, Q111, R113, A114, M117, S118, V121, Q124, F125 и K128.
Определили, что следующие аминокислоты располагаются в пределах 7 Å от участка gp130-D2-D3: L19, Е23, R24, I25, K27, Q28, I29, R30, Y31, D34, K41, Q102, Е109, E110, Q111, A112, R113, A114, V115, Q116, M117, S118, K120, V121, L122, Q124, F125 и K128.
Соответственно, молекула, например, антитело или его фрагмент, которая может связывать одну или более аминокислот ИЛ-6, находящихся в пределах 5 Å или 7 Å от сайта II, может быть ИЛ-6а.
Последовательность ИЛ-6 человека представлена ниже в качестве эталона (почеркнутая последовательность является лидерной последовательностью). Аминокислоты, расположенные в пределах 7 Å от участка gp130-D2-D3, изображены курсивом. Нумерация аминокислот, например, мутаций, введенных в некоторые эпитопы, выполнена без учета данной лидерной последовательности:
ИЛ-6 человека.

Проводили эксперименты для испытания Fab-фрагмента гуманизированного антитела h64-1.4 и демонстрировали, что оно способно блокировать как цис-, так и транс-сигналинг ИЛ-6, что достигается благодаря нацеливанию на сайт II. Активность Fab-фрагмента оставалась неизменной в присутствии растворимого рецептора ИЛ-6 (рИЛ-6Р). Это свойство противоположно анти-ИЛ-6 IgG, который снизил активность в присутствии рИЛ6Р и который блокирует только цис-сигналинг.
Эти эксперименты демонстрируют, что антитело или фрагмент такого антитела, как Fab-фрагмент, который нацелен на сайт II, могут применять для ингибирования как цис-, так и транс-сигналинга ИЛ-6.
Пример 6. Исследования на приматах
Из-за того, что деятельность организма не-приматов может сильно отличаться от деятельности организма приматов, обычно потенциальные антагонисты ИЛ-6 дополнительно оценивают по ФК и другим параметрам с помощью нечеловеческих приматов. ИЛ-6 человека отличается от ИЛ-6 яванского макака и макака-резус по семи сайтам, одно отличие находится на сайте II (аминокислота в положении 28) и является совпадает с сайтом II ИЛ-6 африканской зеленой мартышки. Это приводит к снижению связывания антитела, содержащего последовательности 018, только около в 3-4 раза. Способность связываться с ИЛ-6 приматов кроме человека является полезным свойством антагониста ИЛ-6, облегчая разработку потенциальной молекулы в качестве лекарственного вещества, например, обеспечивая возможность испытания на приматах кроме человека.
Как в случае большинства антител против ИЛ-6, описанные в данном документе анти-ИЛ-6-антитела не дают перекрестную реакцию с ИЛ-6 грызунов, кролика или собаки из-за низкой гомологии последовательностей. Однако в исследованиях аффинности обнаружено, что 018 Fab связывает ИЛ-6 яванского макака и африканской зеленой мартышки приблизительно с аффинностью к ИЛ-6 человека (Таблица 2).

Эти данные дополнительно демонстрируют способность описанных в данном документе ИЛ-6а специфически связываться и демонстрируют возможность разработать молекулу, обладающую свойствами, позволяющими проводить испытания, например, исследования на подходящем животном, связанные с токсикологией и репродуктивным здоровьем.
Пример 7. Увеличение экспрессии ИЛ-6а
Для увеличения экспрессии полипептидов 018 Fab и 019 Fab с помощью способов, известных в данной области техники, создали конструкции путем введения пяти дополнительных аминокислот (DKTHT) в тяжелую цепь СН1/шарнирного участка. Последовательность измененной тяжелой цепи молекулы 018Fab показана ниже как SEQ ID NO: 24. Измененная последовательность 018 в данном документе называется 020, а измененная последовательность 019 называется 021. Молекула 020 (тяжелая цепь 020Fab и легкая цепь 018Fab) обладала лучшей экспрессией по сравнению с исходной Fab, которая состояли из тяжелой 018Fab и легкой 018Fab цепей. Молекула 019 не проявила значимой разности в аффинности по сравнению с молекулой 020. Экспрессию как молекулы 020, так и 019 повысили приблизительно в два раза, и, соответственно, это изменение не повлияло на значения их аффиности.
Тяжелая цепь 020 (Fab с DKTHT на карбоксильном конце)

Антагонизм к ИЛ-6 при применении 020Fab оценивали на репортерных клетках HEK-Blue™ IL-6 (InvivoGen, г. Сан-Диего, Калифорния, США). Клетки инкубировали в смеси 10 пМ ИЛ-6 при варьирующих концентрациях 020 или антитела против ИЛ-6Рα (Cell Sciences, г. Кантон, Массачусетс, США) с или без 50 нМ ИЛ-6Рα. Через 20-24 часа после инкубации 20 мкл супернатанта клеточной культуры смешивали с 180 мкл субстрата QuantiBlue™ (InvivoGen) и инкубировали в течение одного часа; потом измеряли оптическую плотность при 655 нм. На Фиг. 3А и Фиг. 3В проиллюстрированы данные этих экспериментов, демонстрирующие способность молекулы 020 ингибировать активность ИЛ-6 в присутствии или в отсутствии рецепторов ИЛ-6Р.
Пример 8. Антитела IgG2 против ИЛ-6
С помощью способов, известных в данной области техники, молекулу 018 преобразовали введением в изотипный каркас IgG2 человека для снижения связывания с рецептором FcγR и снижения АЗКЦ по сравнению с антителом в форме IgG1. Кроме того, ожидали, что преобразование молекулы 018 в полноразмерную форму, например, IgG2, приведет к уменьшению скорости выведения из стекловидного тела из-за большего размера молекулы.
Конструирование/очистка антител в анти-ИЛ-6 антител IgG2
Для конструирования антител человека в виде IgG2 с применением анти-ИЛ-6 последовательностей, описанных выше, константный домен IgG2 человека получили амплификацией с помощью ПЦР из кДНК с сайтами рестрикции NheI и MluI, соответственно, на N- и С-терминальных концах. Продукт ПЦР очищали, расщепляли с помощью ферментов рестрикции NheI и MluI и потом лигировали с вектором рТТ5, содержащим вариабельный домен анти-ИЛ-6 антитела, т.е. SEQ ID NO: 1 (см. выше). Это привело к получению последовательности полноразмерной тяжелой цепи IgG2. Для получения легкой цепи применяли плазмиды, содержащие полноразмерную легкую цепь, которая содержала последовательность 018.
Для дальнейшего уменьшения связывания с FcRn и, вследствие этого, снижения рециркуляции ИЛ-6а, в тяжелой цепи были созданы точечные мутации. Данные мутации создавали с помощью метода мутагенеза QuikChange® (Agilent Technologies, г. Санта-Клара, Калифорния, США). Плазмиды с тяжелой и легкой цепью совместно трансфецировали с применением полиэтиленимина (ПЭИ) в 100 мл временных культур клеток HEK293-6Е и культивировали так, чтобы позволить прохождение экспрессии в течение около 5 дней. Этот процесс привел к получению антител, содержащих компонент связывания антитела с сайтом II ИЛ-6 и структуру IgG2. Такие структуры, содержащие молекулы 018 CDR, обозначены в данном документе как 018IgG2 или 029. Точечные мутации были созданы по остатку I253.
Молекула IgG2 хорошо экспрессировалась и блокировала ИЛ-6 с немного увеличенной активностью по сравнению с 020Fab при проведении анализов с применением клеток.
Зрелые последовательности 029 (CDR подчеркнуты)
Тяжелая цепь 029

Легкая цепь 029

Изменение связывания с FcRn
ИЛ-6 может обладать некоторыми положительными системными эффектами. Поэтому целесообразным является конструирование ИЛ-6а, который обладает хорошим удержанием в стекловидном теле, но имеет ограниченный системный период полувыведения. Снижение или исключение связывания с FcRn может привести к уменьшению системного аккумулирования любого лекарственного вещества, которое избегает включения в циркуляцию, благодаря чему повышается безопасность ИЛ-6а.
Соответственно, из-за опосредованной FcRn миграции может увеличиться отток антител из глаза. Для ослабления связывания с FcRn молекулу 020 IgG2 была дополнительно модифицировали с помощью создания мутаций в положениях остатков I254, Н311 или Н436 (см. SEQ ID NO: 23), нумерация соответствует статье Martin et al., Molecular Cell, 7:4, 867-877 (2001)). Мутировавшие сайты показаны жирным шрифтом на SEQ ID NO: 23; аминокислота I254 мутировала в А или R, Н311 мутировала в А или Е, Н311 мутировала в N вместе с D313, мутировавшей в Т, и Н436 мутировала в А (нумерация начинается после лидерной последовательности, которая подчеркнута на SEQ ID NO: 23). Антагонисты ИЛ-6, содержащие такие последовательности, названы 018IgG2m.
Тяжелая цепь анти-ИЛ-6 (IgG2) (обычный шрифт: VH; курсив: СН) (без лидерной последовательности) с показанными сайтами мутаций (жирный шрифт)

Тяжелая цепь анти-ИЛ-6 (IgG2) (обычный шрифт: VH; курсив: СН) с лидерной последовательностью (подчеркнута) с показанными сайтами мутаций (жирный шрифт)

Соответственно, некоторые варианты реализации изобретения включают антитело, обладающее последовательностью тяжелой цепи, отображенной в SEQ ID NO: 23 с мутациями I254 (например, А или R), Н311 (мутировавшей в А или Е), Н436 (мутировавшей в А) или D313 (мутировавшей в Т) вместе с Н311, мутировавшей в N.
Следовательно, под SEQ ID NO: 25 предлагается последовательность, которая при мутациях по аминокислотам I133 (например, I133A или I133R), Н190 (например, Н190А или Н190Е), Н315 (например, Н315А) или D192 вместе с H190 (например, D192T с H190N) может применяться в антителе, его фрагменте или производном, для получения полипептида, обладающего уменьшенным Fc-связыванием при низком рН, например, рН 5,5 или лизосомальном рН, и/или полипептида, обладающего уменьшенным системным периодом полувыведения по сравнению с исходной или другой эталонной молекулой, которая не содержит эту последовательность.

Легкая цепь анти-ИЛ-6 (IgG2) (обычный шрифт: VK; курсив: CK)

Пример 9. Стабильность состава
Стабильность Fab-фрагмента анти-ИЛ-6/IgG1 (содержащего домен IgG1CH1) подвергали испытанию путем определения исходной Tm в ФСБ, затем в наборе буферных растворов и вспомогательных веществ с помощью метода дифференциальной сканирующей флуорометрии. Обнаружено, что в цитратном буферном растворе с рН 5,5 Tm повысилась до более чем 80°С. Соответственно, в некоторых вариантах реализации изобретения ИЛ-6а предлагается в цитратном буферном растворе и в некоторых случаях имеет Tm по меньшей мере 80°С.
Способность к агрегации испытывали с применением метода SEC-MALS (эксклюзионная хроматография с детектированием рассеивания лазерного излучения с кратными углами) и не было обнаружено агрегации при концентрации 20 мг/мл в фосфатно-солевом буферном растворе (ФСБ).
Пример 10. Чувствительные к рН антитела с улучшенными параметрами ФК
ИЛ-6 может обладать некоторыми положительными системными эффектами. Поэтому целесообразным является конструирование ИЛ-6а, который обладает хорошим удержанием в стекловидном теле, но имеет ограниченный системный период полувыведения. Снижение или исключение связывания с FcRn может привести к уменьшению системного аккумулирования любого лекарственного вещества, которое избегает включения в циркуляцию, благодаря чему повышается безопасность ИЛ-6а. Соответственно, из-за опосредованной FcRn миграции может увеличиваться отток антител из глаза. Молекулу 020 IgG2 дополнительно модифицировали для ослабления связывания с FcRn путем создания мутаций по остаткам I253, Н310 или Н435 (нумерация соответствует статье Martin et al. (Molecular Cell, 7:4, 867-877 (2001)). Такие антитела, называемые в данном документе как антитела IL-6рН или анти-IL-6pH, дополнительно описаны ниже.
Получение антител IL-6pH
рКа гистидина составляет около 6,0, поэтому гистидины, встроенные в поверхности связывания, могут нарушать связывание вследствие протонирования цепи при низком значении рН. С применениеманти-ИЛ-6-антитела, нацеленного на сайт II ИЛ-6, как описано в данном документе, была создана библиотека, содержащая богатые гистидином варианты CDR молекулы 018, и данную библиотеку подвергали скринингу для определения рН-чувствительного связывания с помощью дисплея дрожжевых клеток. Созданная библиотека была комбинаторной библиотекой с CDR, кодированными вырожденными кодонами, причем каждый остаток представлял собой или остаток дикого типа (т.е. такой как в исходном антителе) или остаток гистидина. Скрининг проводили путем альтернативного сортинга в условиях сильного связывания при физиологическом рН (7,4) и слабого связывания при эндосомальном рН (5,5).
Выбранную с помощью дрожжевых клеток мутировавшую молекулу идентифицировали, как обладающий относительно сильным связыванием при рН 7,4 (Kd моновалентного связывания 407 пМ для мутировавшей молекулы по сравнению с 192 пМ для исходной молекулы) и относительно слабым связыванием при рН 5,5 (Kd моновалентного связывания 2,362 нМ для мутировавшей молекулы по сравнению с 195 пМ для исходной). Это составляет приблизительно 5,8-кратное изменение аффинности при рН 5,5. Эта мутировавшая молекула содержала множественные гистидиновые мутации на CDR1 легкой цепи. Поэтому мутировавшая молекула демонстрировала сходное связывание с исходной молекулой при рН 7,4 и значительную потерю аффинности при рН 5,5. Это наблюдение подтверждали, используя анализы ELISA, FACS и SPR с помощью способов, известных в данной области техники.
Эти данные демонстрируют, что на основе антитела может быть создан ИЛ-6а, обладающий свойствами анти-ИЛ-6-антитела, нацеленного на сайт II ИЛ-6, которое может применяться для ингибирования как цис-, так и транс-активности ИЛ-6, и обладать улучшенными параметрами ФК по сравнению с исходным антителом или другим антителом, имеющим Fc-домен дикого типа, модифицированными, по меньшей мере частично, путем изменения связывания при рН 5,5.
Другие варианты реализации изобретения находятся в пределах объема следующей формулы изобретения.