Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СЛИТОГО БЕЛКА TNFR-FC С ЗАДАННЫМ СОДЕРЖАНИЕМ ПРИМЕСЕЙ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к способу получения смеси слитого белка TNFR-Fc с заданной долей гидрофобного хроматографического пика 3 и к способу коррекции доли гидрофобного хроматографического пика 3. Конкретно, настоящее изобретение относится к (а) способу получения смеси слитого белка TNFR-Fc с использованием среды для хроматографии гидрофобного взаимодействия, содержащей ароматическую функциональную группу, предварительно уравновешенной уравновешивающим буфером, содержащим хлорид натрия или сульфат аммония, и образца, содержащего жидкую смесь слитого белка TNFR-Fc, полученную из клеток млекопитающих, и к способу коррекции доли гидрофобного хроматографического пика 3 посредством хроматографии гидрофобного взаимодействия с использованием уравновешивающего буфера с заранее определенной концентрацией хлорида натрия или сульфата аммония.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Этанерцепт представляет собой биологический модулятор воспаления, действующий как конкурентный ингибитор TNF-α, связывающийся с поверхностным клеточным рецептором TNF-α, ингибируя опосредованные TNF-α иммунные ответы. Этанерцепт является макромолекулой с молекулярной массой 150 кДа и представляет собой гомодимер двух слитых белков, связанных дисульфидной связью, каждый из которых состоит из человеческого растворимого рецептора р75 TNF (фактор некроза опухоли), связанного с Fc-фрагментом человеческого иммуноглобулина G подкласса 1 (Goldenberg, Clinical Therapeutics, 21(1): 75-87, 1999; Moreland et al., Ann. Intern. Med., 130(6): 478-486, 1999).
Типичная форма этого белка была впервые синтезирована Bruce А. Beutler et al. в начале 90-х гг.XX в. в Юго-Западном медицинском центре Техасского университета (University of Texas Southwestern Medical Center) и представлена на рынке компанией Amgen под торговым названием Enbrel® в 2002 г. Этанерцепт является ингибитором TNF-α, используемым для лечения ревматоидного артрита, псориаза и анкилозирующего спондилита и проходящим клинические исследования для лечения васкулита, болезни Альцгеймера и болезни Крона.
Слитый белок TNFR-Fc может быть получен слиянием 235 аминокислот TNFR и 232 аминокислот Fc-области, и при получении методом генетической рекомбинации он существует в форме димера и проявляет биологическую активность. TNFR разделен на 4 домена и трансмембранную область, и из 235 составляющих его аминокислот 22 являются цистеинами, и все эти цистеины образуют дисульфидные связи, формируя трехмерную структуру. Тем не менее, при получении TNFR-Fc из животных клеток, цистеины связываются друг с другом случайным образом и поэтому не образуют дисульфидных связей, идентичных дисульфидным связям нативного белка. TNFR может также быть частично усечен и не способен образовать правильный димер TNFR-Fc. TNFR-Fc с некорректными дисульфидными связями не может проявлять надлежащую биологическую активность из-за значительного снижения способности связываться с TNF-α. Кроме того, при полном или частичном усечении TNFR он также не может проявлять такую биологическую активность.
Поэтому при получении димеров TNFR-Fc с применением технологии рекомбинантных ДНК и методики культивирования животных клеток происходит одновременное образование активных белков, неактивных белков с некорректными дисульфидными связями, агрегатов и усеченных форм, поэтому необходима методика выделения и очистки белков.
Кроме того, согласно патенту США №7294481, где заявителем является Immunex Corporation, разработчик этанерцепта, относящейся к способу получения рекомбинантных белков, было подтверждено, что при хроматографии гидрофобного взаимодействия (HIC) присутствуют три пика, и что эти пики последовательно представлены различными формами этанерцепта с очень низкой биологической активностью, содержащими этанерцепт в форме, усеченной по положениям S186 и D235, слитым белком TNFR-Fc в активной форме и агрегатами, TNFR-Fc со скремблированными (scrambled) дисульфидными связями и так далее. Такой же характер пиков раскрыт также в патенте Кореи №10-1454316, относящемуся к способу получения активной формы слитого белка TNFR-Fc с использованием способа получения рекомбинантного белка. В то же время, хроматография гидрофобного взаимодействия, обычно используемая для выделения слитого белка TNFR-Fc, предназначена только для получения высоко чистой активной формы слитого белка TNFR-Fc путем удаления и минимизации количества примесей, за исключением активных форм слитого белка TNFR-Fc, таких как агрегаты, слитый белок TNFR-Fc со скремблированными дисульфидными связями и усеченные формы слитого белка TNFR-Fc.
В то же время, биоаналог представляет собой вещество, эквивалентное существующим утвержденным продуктам по качеству, безопасности и эффективности, и в частности он может быть использован в качестве биомедицинского продукта только в том случае, если его состав аналогичен оригинальному продукту по ингредиентам и содержанию примесей. Например, этанерцепт (Pfizer) содержит приблизительно от 9% до 18% ингредиента, имеющего низкую биологическую активность, раскрытого в предшествующем уровне техники как компонент пика 3 при хроматографии гидрофобного взаимодействия (далее «пик 3»), который может влиять на фармакологические свойства, а также на активность. Соответственно, при разработке биоаналога необходимо корректировать долю пика 3 до уровня, сходного с уровнем в оригинальном продукте. Несмотря на существование способа очистки образца, содержащего TNFR-Fc, полученный с применением HIC обычным способом получения рекомбинантных белков (патент Кореи №10-1454316), этот способ предназначен только для получения высоко чистого ингредиента пика 2, представляющего собой активную форму TNFR-Fc после удаления примесей. Исследований по коррекции доли пика 3, представляющего собой тип примеси с низкой биологической активностью, до уровня, сходного с уровнем в оригинальном продукте, не было.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Техническая задача
Авторы настоящего изобретения предприняли попытку разработать способ получения слитого белка TNFR-Fc с определенной долей пика 3 посредством ее коррекции при получении слитого белка TNFR-Fc с использованием хроматографии гидрофобного взаимодействия. В результате они подтвердили, что слитый белок TNFR-Fc, доля пика 3 в котором скорректирована до уровня, сходного с общепринятыми оригинальными продуктами, может быть получен предварительным уравновешиванием среды для хроматографии гидрофобного взаимодействия (HIC), содержащей ароматическую функциональную группу, уравновешивающим буфером с заранее определенной концентрацией хлорида натрия, и внесением и элюированием образца, завершив посредством этого настоящее изобретение.
Техническое решение
Задачей настоящего изобретения является обеспечение способа получения смеси слитого белка TNFR-Fc с заданной долей гидрофобного хроматографического пика 3 и к способу коррекции доли гидрофобного хроматографического пика 3.
Полезные эффекты
Согласно настоящему изобретению предложен способ получения смеси слитого белка TNFR-Fc с использованием хроматографии гидрофобного взаимодействия, где заданную долю гидрофобного хроматографического пика 3 обеспечивают, корректируя долю гидрофобного хроматографического пика 3 путем проведения хроматографии гидрофобного взаимодействия посредством уравновешивания уравновешивающим буфером с заранее определенной концентрацией хлорида натрия или сульфата аммония. Соответственно, раскрытый способ может быть применен в качестве инструмента получения биомедицинских продуктов, содержащих рекомбинантные белки, такие как этанерцепт, полученный методикой генетической рекомбинации из культуры животных клеток.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
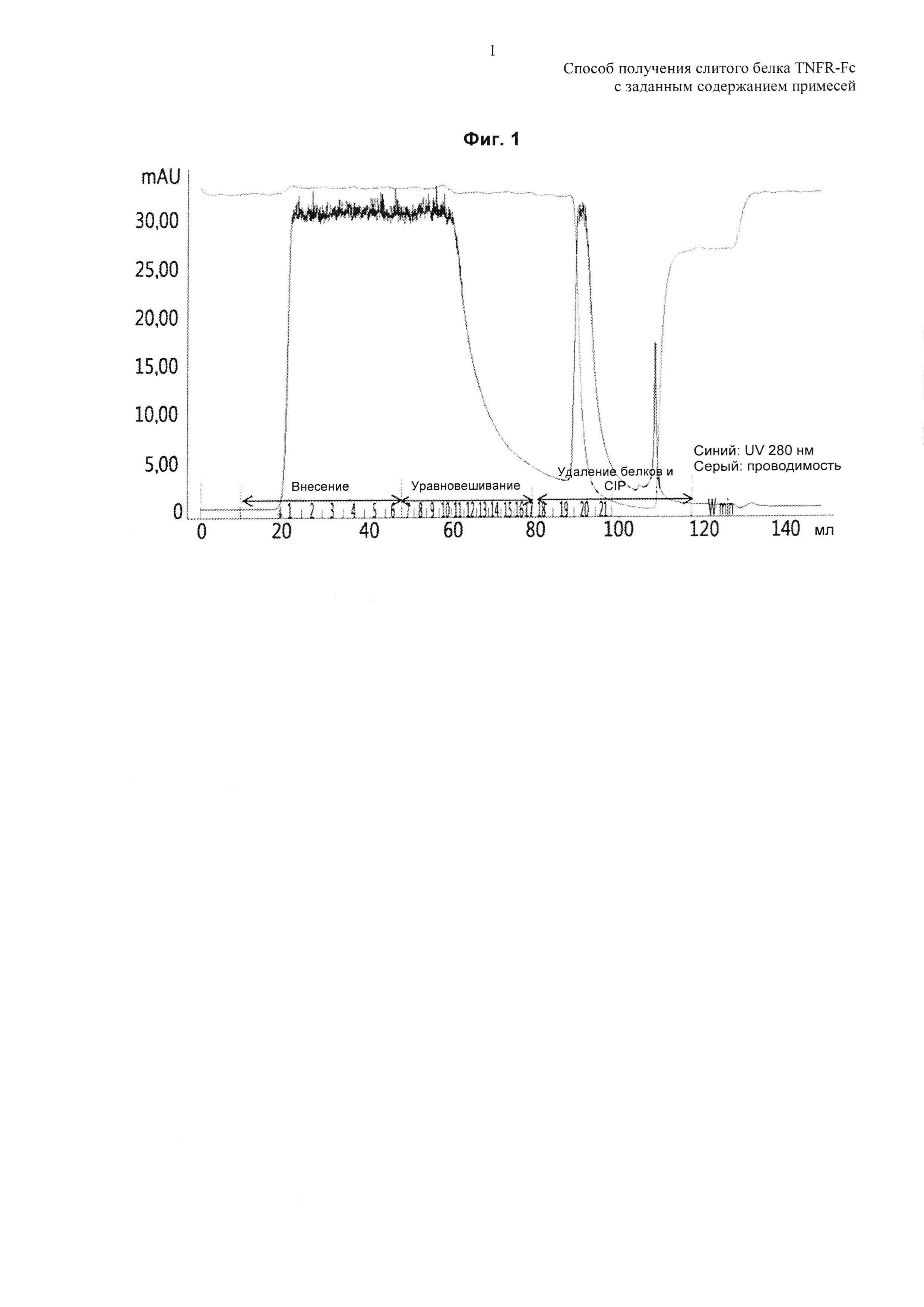
На Фиг. 1 показана хроматограмма, полученная проточной методикой HIC с использованием смолы Phenyl Sepharose High Performance согласно Примеру настоящего изобретения.
ПРЕДПОЧТИТЕЛЬНОЕ ВОПЛОЩЕНИЕ ИЗОБРЕТЕНИЯ
В качестве аспекта настоящего изобретения для решения указанной выше технической проблемы согласно настоящему изобретению предложен способ получения смеси слитого белка TNFR-Fc с заданной долей гидрофобного хроматографического пика 3.
Способ предпочтительно включает: (а) внесение образца, содержащего жидкую смесь слитого белка TNFR-Fc, полученную из клеток млекопитающих, в колонку, заполненную средой для хроматографии гидрофобного взаимодействия (HIC), содержащей ароматическую функциональную группу, предварительно уравновешенной уравновешивающим (EQ) буфером, содержащим хлорид натрия или сульфат аммония; и (б) сбор элюата элюированием белка элюирующим буфером, содержащим хлорид натрия или сульфат аммония в той же концентрации, что и уравновешивающий буфер.
При образовании слитого белка TNFR-Fc клеткой-хозяином, трансформированной вектором экспрессии, содержащим полинуклеотид, кодирующий слитый белок TNFR-Fc, цистеины белка TNFR связываются друг с другом случайным образом, и поэтому они не образуют дисульфидных связей, идентичных дисульфидным связям нативного белка TNFR, или белок TNFR также частично усечен и не способен образовать правильный димер TNFR-Fc, в дополнение к образованию димерной формы слитого белка TNFR-Fc, связывающейся с TNF-α и проявляющей биологическую активность. При гидрофобной хроматографии этим ингредиентам соответствуют отдельные пики, и в проведенных исследованиях их обозначают как пики 1-3, соответственно. Было подтверждено, что эти пики включают усеченную форму белка, активную форму белка и другие агрегаты или ингредиенты с низкой биологической активностью, такие как TNFR-Fc с неправильными дисульфидными связями. Эти слитые белки TNFR-Fc, включая этанерцепт, являются лидерами продаж на фармацевтическом рынке. Тем не менее, в общепринятых продуктах, одобренных для продажи и для клинического применения, доля пика 3 составляет от 9% до 18%, что может влиять на активность и/или фармакологические свойства. В частности, для одобрения биоаналогов, необходимо, чтобы они были эквивалентны существующим одобренным или оригинальным продуктам. Кроме того, различия в содержании примесей, являющиеся результатом препаративных методик, таких как методики выделения и очистки, применяемых для получения биоаналогов, вероятно влияют на эффективность фармацевтических продуктов, и поэтому точная коррекция доли пика 3 при хроматографии гидрофобного взаимодействия крайне важна. Тем не менее, при получении слитых белков TNFR-Fc с применением метода получения рекомбинантных белков доля каждого полученного ингредиента непостоянна и не поддается коррекции. Соответственно, необходим не просто способ удаления ингредиентов с низкой биологической активностью посредством очистки смеси, содержащей различные типы слитых белков TNFR-Fc, но способ коррекции содержания таких ингредиентов до постоянного уровня. Указанный способ по настоящему изобретению может быть применен в качестве инструмента очистки активной формы слитых белков TNFR-Fc, для обеспечения в них заданной доли пика 3 при хроматографии гидрофобного взаимодействия, включая агрегаты, слитые белки TNFR-Fc со скремблированными дисульфидными связями и так далее, при выделении активной формы слитых белков TNFR-Fc из смеси слитых белков TNFR-Fc с применением хроматографии гидрофобного взаимодействия.
С использованием указанного способа, авторы настоящего изобретения впервые обнаружили, что, в то время как хроматография гидрофобного взаимодействия (HIC) традиционно применяется только для удаления примесей, в случае, когда образец, содержащий жидкую смесь слитого белка TNFR-Fc, полученную из клеток млекопитающих, уравновешен солями в различных концентрациях, в частности хлоридом натрия, возможна коррекция доли пика 3 при хроматографии гидрофобного взаимодействия до заданного уровня. Ранее об этом не сообщалось.
При использовании здесь термин «белок TNFR (рецептор фактора некроза опухоли)» обозначает рецепторный белок, связывающийся с TNF-α. Белок TNFR включает белок TNFRI(p55) или белок TNFRII(p75), предпочтительно, но без ограничения, он может представлять собой белок TNFRII. TNFRII может быть использован взаимозаменяемо с TNFRSF1B (представитель 1B суперсемейства рецептора фактора некроза опухоли). Белок TNFRII может представлять собой, без ограничения, белок TNFRII, имеющий 4 домена и трансмембранную область и содержащий 235 аминокислот.Информация о белке TNFRI и белке TNFRII может быть получена из известных баз данных, таких как GenBank Национальных институтов здравоохранения США, и например он может представлять собой, без ограничения, белок с регистрационным номером NP_001056 или Р20333.
Белок TNFR обладает биологической активностью по связыванию с TNF-α, сверхэкспрессия которого в организме человека, как известно, приводит к различным заболеваниям, и поэтому он может быть использован для лечения заболеваний, опосредованных TNF-α, таких как аутоиммунные заболевания. Для этого проводят слияние Fc-области иммуноглобулина с белком TNFR, получая слитый белок с увеличенным периодом полувыведения.
При использовании здесь термин «слитый белок TNFR(рецептор фактора некроза опухоли)-Fс» обозначает продукт, полученный в результате связывания всего белка TNFR или его части с Fc-областью иммуноглобулина под действием ферментов или в результате экспрессии двух полипептидов с получением одного полипептида посредством генетических манипуляций. В слитом белке TNFR-Fc белок TNFR и Fc-область иммуноглобулина могут быть связаны друг с другом непосредственно или, без ограничения, через пептидный линкер. Например, слитые белки TNFR-Fc могут содержать этанерцепт.
Слитый белок TNFR-Fc может быть получен слиянием всего белка TNFR или его части с Fc-областью иммуноглобулина и, например, без ограничения, слиянием аминокислот в положениях 1-235 белка TNFRII с 232 аминокислотами Fc-области иммуноглобулина, включая шарнирную область. Кроме того, кодоны слитого белка TNFR-Fc могут быть оптимизированы для экспрессии в клетках-хозяевах. Например, слитый белок TNFR-Fc может представлять собой, без ограничения, слитый белок TNFR-Fc, кодоны которого оптимизированы для клеток СНО, определенный аминокислотной последовательностью SEQ ID NO:1. Слитый белок TNFR-Fc включает белок, содержащий аминокислотную последовательность SEQ ID NO:1, и все белки, аминокислотные последовательности которых на 70% или более гомологичны, предпочтительно на 80% или более гомологичны, более предпочтительно на 90% или более гомологичны, намного более предпочтительно на 95% или более гомологичны и наиболее предпочтительно на 98% или более гомологичны этой последовательности, при условии, что эти белки обладают существенной активностью по связыванию с TNF-α. Очевидно, что объем настоящего изобретения может включать любой тип белковых вариантов с делецией, модификацией, заменой или добавлением некоторой последовательности, при условии, что гомологичная последовательность представляет собой аминокислотную последовательность, обладающую биологической активностью, по существу идентичной или соответствующей слитому белку TNFR(рецептор фактора некроза опухоли)-Fс. Кроме того, полинуклеотид, кодирующий слитый белок TNFR(рецептор фактора некроза oпyxoли)-Fc, включает нуклеотидную последовательность SEQ ID NO:2, и все нуклеотидные последовательности, на 70% или более гомологичные, предпочтительно на 80% или более гомологичные, более предпочтительно на 90% или более гомологичные, намного более предпочтительно на 95% или более гомологичные и наиболее предпочтительно на 98% или более гомологичные этой последовательности, при условии, что эти нуклеотидные последовательности по существу кодируют белки, обладающие активностью по связыванию с TNF-α. Также очевидно, что объем настоящего изобретения может включать любой тип нуклеотидных последовательностей, кодирующих белковые варианты с делецией, модификацией, заменой или добавлением некоторой последовательности, при условии, что гомологичная последовательность представляет собой нуклеотидную последовательность, которая кодирует аминокислотную последовательность, обладающую биологической активностью, по существу идентичной или соответствующей слитому белку TNFR-Fc. В одном воплощении настоящего изобретения кодоны оптимизированы специально для клеток СНО.
При использовании здесь термин «Fc-область иммуноглобулина (lg)» относится к части иммуноглобулина, содержащей константную область 2 тяжелой цепи (СН2), константную область 3 тяжелой цепи (СН3) и шарнирную область, без вариабельных областей тяжелой и легкой цепей, константной области 1 тяжелой цепи (СН1) и константной области 1 легкой цепи (CL1) иммуноглобулина. Fc-область иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и последовательности ее производных. Аминокислотная последовательность производного представляет собой последовательность, отличающуюся от нативной аминокислотной последовательности делецией, вставкой, неконсервативной или консервативной заменой одного или более чем одного аминокислотного остатка или их комбинациями. Кроме того, Fc-область иммуноглобулина может представлять собой Fc-область, имеющую происхождение от IgG, IgM, IgE, IgA или IgD, или полученную с использованием их комбинаций или гибридов. Предпочтительно, она имеет происхождение от IgG, который, как известно, увеличивает период полувыведения связывающих белков. Более предпочтительно, но без ограничения, она имеет происхождение от IgG1.
В то же время, при использовании здесь термин «комбинация» означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулинов одного и того же происхождения, соединены с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть, возможно получение димера или мультимера из двух или более фрагментов, выбранных из группы, состоящей из Fc-области IgG, Fc-области IgA, Fc-области IgM, Fc-области IgD и Fc-области IgE.
При использовании здесь термин «гибрид» означает, что в одноцепочечной Fc-области иммуноглобулина присутствуют
последовательности, кодирующие две или более Fc-области иммуноглобулина разного происхождения. В настоящем изобретении возможны различные типы гибридов. То есть, доменные гибриды могут состоять из одного-четырех доменов, выбранных из группы, состоящей из СН1, СН2, СН3 и СН4 Fc-области IgG, Fc-области IgM, Fc-области IgA, Fc-области IgE и Fc-области IgD, и могут содержать шарнирную область. С другой стороны, IgG также делят на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение включает их комбинации и гибриды.
Слитый белок TNFR-Fc может быть получен ведением вектора экспрессии, содержащего полинуклеотид, кодирующий слитый белок, в клетки млекопитающих и последующей экспрессией его в этих клетках.
В настоящем изобретении в качестве репрезентативного вектора, содержащего полинуклеотид, кодирующий слитый белок TNFR-Fc, использовали вектор pCUCBin-mSig-TNFcept, и трансформировали им клетки СНО для экспрессии слитого белка TNFR-Fc. Слитые белки TNFR-Fc, полученные указанным выше способом, содержат смесь различных форм слитых белков TNFR-Fc, таких как активный слитый белок TNFR-Fc, усеченные формы слитого белка TNFR-Fc, неактивный слитый белок TNFR-Fc, и/или агрегаты слитого белка TNFR-Fc, и так далее. Таким образом, необходима очистка неактивной формы слитого белка TNFR-Fc, а также его активной формы, чтобы обеспечить их присутствие в заранее определенном соотношении. При использовании способа получения по настоящему изобретению долю пика 3, включая фрагменты, активный слитый белок, очищенные агрегаты и так далее, и таким образом заданную долю пика 3, можно корректировать.
Обычно культуральная жидкость клеток млекопитающих также содержит, помимо заданного белка, различные белки и тому подобное. Для удаления таких белков образец, содержащий смесь слитого белка TNFR-Fc, предпочтительно полученную из клеток млекопитающих, может быть подготовлен посредством частичной очистки аффинной хроматографией и/или анионообменной хроматографией.
В конкретном Примере настоящего изобретения проводили аффинную хроматографию культуральной жидкости трансфицированных клеток СНО и анионообменную хроматографию полученного из нее элюата, и полученный после этого элюат использовали в качестве образца.
В качестве примера, среда, которой заполнена колонка, используемая при хроматографии гидрофобного взаимодействия, может содержать фенильную группу в качестве ароматической функциональной группы. В конкретном Примере настоящего изобретения, без ограничения, используют колонку, заполненную смолой Phenyl Sepgarose High Performance производства GE Healthcare.
В одном воплощении заданная доля гидрофобного хроматографического пика 3 может составлять от 9% до 18%. В качестве конкретного примера, если доля гидрофобного хроматографического пика 3 в смеси слитого белка TNFR-Fc на указанной стадии (а) превышает 20%, доля пика 3 может быть снижена до приблизительно 9%-18% путем использования способа по настоящему изобретению и очисткой.
В одном воплощении указанные уравновешивающий и элюирующий буферы могут содержать от 7 мМ до 15 мМ фосфата натрия. В конкретном Примере настоящего изобретения, без ограничения, используют буфер, содержащий 10 мМ фосфата натрия.
В одном воплощении указанные уравновешивающий и элюирующий буферы могут иметь рН от 6 до 8,5. Буфер, рН которого выходит за пределы указанного диапазона, может приводить к денатурации заданного белка, и, соответственно, его использование в хроматографии гидрофобного взаимодействия рекомбинантного белка может быть затруднительным.
В одном воплощении способ получения по настоящему изобретению характеризуется коррекцией концентрации хлорида натрия в уравновешивающем буфере в соответствии с заданной долей гидрофобного хроматографического пика 3, где при заданной доле гидрофобного хроматографического пика 3 от 2% до 17% для уравновешивания используют уравновешивающий буфер, содержащий хлорид натрия в концентрации от 1 М до 1,4 М. В частности, в случае внесения образца с долей пика 3 21% использование уравновешивающего буфера, содержащего 1,1 М хлорида натрия, позволяет снизить долю пика 3 до 5,3%-17%, использование уравновешивающего буфера, содержащего 1,2 М хлорида натрия, позволяет снизить долю пика 3 до 2,9%-15,7%, использование уравновешивающего буфера, содержащего 1,3 М хлорида натрия, позволяет снизить долю пика 3 до 2,5%-14,8%, и использование уравновешивающего буфера, содержащего 1,4 М хлорида натрия, позволяет снизить долю пика 3 до 2,2%-13,7%.
Кроме того, способ получения по настоящему изобретению характеризуется добавлением сульфата аммония в уравновешивающий буфер в соответствии с заданной долей гидрофобного хроматографического пика 3, где при доле гидрофобного хроматографического пика 3 в образце более 45% для уравновешивания используют уравновешивающий буфер, содержащий сульфат аммония в концентрации от 0,45 М до 0,55 М.
В одном воплощении при избыточной доле гидрофобного хроматографического пика 3, например, более 45%, в культуральной жидкости, полученной способом получения рекомбинантных белков, долю гидрофобного хроматографического пика 3 можно снизить приблизительно до 10% проведением хроматографии гидрофобного взаимодействия с использованием указанного выше уравновешивающего буфера, содержащего хлорид натрия, после снижения доли пика 3 до 20%-30% проведением хроматографии гидрофобного взаимодействия с последующим уравновешиванием уравновешивающим буфером, содержащим сульфат аммония.
Хроматография гидрофобного взаимодействия может быть проведена посредством последовательных процессов, состоящих из внесения, уравновешивания, десорбции белков (stripping) и очистки на месте (cleaning in place, CIP).
Процесс десорбции белков проводят для отделения и элюирования всех белков, оставшихся в колонке, и в этом процессе могут быть использованы буферы, состав которых идентичен уравновешивающему буферу, за исключением хлорида натрия и сульфата аммония.
CIP представляет собой процесс безопасного и рентабельного обслуживания устройств при получении биомедицинских продуктов, позволяющий эффективно удалять примеси из среды для хроматографии и использовать ее повторно. CIP может быть проведена с использованием, без ограничения, 0,5 Н раствора гидроксида натрия. Без ограничения, CIP можно повторять столько раз, сколько необходимо.
В другом аспекте согласно настоящему изобретению предложен способ коррекции доли гидрофобного хроматографического пика 3 в этанерцепте, включающий: предварительное уравновешивание среды для хроматографии гидрофобного взаимодействия уравновешивающим буфером, содержащим хлорид натрия в концентрации от 1,0 М до 1,5 М или сульфат аммония в концентрации от 0,45 М до 0,55 М; и внесение образца, содержащего слитый белок TNFR-Fc, подготовленного таким образом, чтобы концентрация солей в нем была такой же, как в предварительно уравновешенной среде для хроматографии гидрофобного взаимодействия.
В одном воплощении, как указано выше, уравновешивающий буфер имеет рН от 6 до 8,5. Способ по настоящему изобретению с использованием уравновешивающего буфера, содержащего хлорид натрия или сульфат аммония, характеризуется коррекцией доли пика 3 в конечном продукте в сторону снижения по сравнению с вносимым образцом.
В одном воплощении использование уравновешивающего буфера, содержащего хлорид натрия, позволяет снизить долю пика 3 в образце, в котором доля пика 3 превышает 20%, до уровня от 2% до 17%.
В одном воплощении использование уравновешивающего буфера, содержащего сульфат аммония, позволяет снизить долю пика 3 в образце, в котором доля пика 3 превышает 45%, до уровня 18% или менее.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно со ссылкой на Примеры. Тем не менее, эти Примеры приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими Примерами.
Пример 1: Получение этанерцепта и проточная HIC
Для получения этанерцепта клетки СНО трансфицировали вектором pCUCBin-mSig-TNFcept, содержащим ген, кодирующий слитый белок TNFR-Fc, и культивировали, после чего последовательно проводили аффинную хроматографию и анионообменную хроматографию культуральной жидкости клеток СНО, отобранных с использованием МТХ.
Конкретно, аффинную хроматографию проводили следующим образом: колонку ХК26 (GE Healthcare), заполненную MabSelect SuRe™ (GE Healthcare), представляющей собой аффинную смолу, уравновешивали достаточной промывкой буфером, содержащим 20 мМ трис-HCI, рН 8,0, проводили связывание с аффинной смолой посредством промывки подготовленной культуральной жидкостью и затем проводили элюирование элюирующим буфером при рН 3,0-3,4. рН элюата корректировали до рН 7,0-8,0 с использованием 2 М трис.
Анионообменную хроматографию элюата, полученного описанной выше аффинной хроматографией, проводили следующим образом: колонку LRC15 (Pall Life Sciences), заполненную Fractogel EMD TMAE (Merck), представляющим собой анионообменную смолу, уравновешивали достаточной промывкой буфером, содержащим трис при рН 7,5-8,5, проводили связывание с анионообменной смолой посредством промывки элюатом, полученным аффинной хроматографией, и затем проводили элюирование элюирующим буфером с трис, содержащим от 100 мМ до 200 мМ хлорида натрия.
Проточная методика HIC, примененная к элюату, полученному последовательным проведением аффинной хроматографии и анионообменной хроматографии, описана ниже. Полученную в результате долю пика 3 измеряли с применением линейного градиента с буфером А (0,1 М фосфата натрия, рН 6,0, 1,8 М аммония) и буфером В (0,1 М фосфата натрия, рН 6,0).
Экспериментальный пример 1: Коррекция доли пика 3 с использованием хлорида натрия
Для проточной методики НIC готовили EQ-буферы, содержащие от 1,1 М до 1,4 М хлорида натрия в 10 мМ фосфата натрия, и рН EQ-буфера корректировали до 6,3. Кроме того, образцы, вносимые при HIC, были подготовлены таким образом, чтобы концентрация фосфата натрия и хлорида натрия в них была такой же, как в EQ-буфере.
Проточная методика HIC с использованием смолы Phenyl Sepharose High Performance (GE Healthcare) состоит из процессов внесения, уравновешивания, удаления белков и CIP, как показано на Фиг. 1, и в качестве буферов для удаления белков и CIP использовали 10 мМ фосфат натрия с рН 6,3 и 0,5 Н гидроксид натрия, соответственно.
Проводили мониторинг элюата, отбирая 50 mAU или более по поглощению при 280 нм для сбора фракций с использованием 5 объемов колонки (CV) EQ-буфера, и в Таблице 1 показаны результаты, полученные при использовании разных концентраций хлорида натрия.

Как показано в Таблице 1, по мере повышения используемой концентрации хлорида натрия, доля пика 3 демонстрировала тенденцию к снижению, и в результате было подтверждено, что доля пика 3 может быть скорректирована до диапазона от 2,2% до 17,0% в соответствии с используемой концентрацией хлорида натрия.
Экспериментальный пример 2: Коррекция доли пика 3 с использованием
сульфата аммония Для проточной методики HIC с использованием сульфата аммония готовили EQ-буфер, содержащий 0,5 М сульфата натрия в буфере, содержащем 20 мМ трис-HCI при рН 8,0. Кроме того, образцы, вносимые при HIC, были подготовлены таким образом, чтобы они содержали 20 мМ трис-HCI при рН 8,0 и 0,5 М сульфата аммония.
Для проточной методики HIC использовали колонку ХK16 (GE Healthcare), заполненную смолой Phenyl Sepharose High Performance (GE Healthcare) до 5 см. Как в Экспериментальном примере 1, методика состоит из процессов внесения, уравновешивания, десорбции белков и CIP, и в качестве буферов для десорбции белков и CIP использовали 20 мМ трис-HCI при рН 7,0 и 0,5 Н гидроксид натрия, соответственно.
Проводили мониторинг элюата, отбирая 50 mAU или более по поглощению при 280 нм для сбора фракций с использованием 5 объемов колонки (CV) EQ-буфера, и в результате при применении проточной методики HIC с долей пика 3 во внесенном образце 46,1% было подтверждено, что после применения методики доля пика 3 была скорректирована до уровня 12%.