Результат интеллектуальной деятельности: Средство для терапии токсической энцефалопатии, вызванной монооксидом углерода
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к фармакологическим композициям на основе пептидов, обладающим ноотропной и стресспротективной активностью, предназначенным для профилактики и терапии отдаленных последствий поражений центральной нервной системы (ЦНС) при отравлениях монооксидом углерода.
В современных условиях отравления монооксидом углерода (СО) принадлежат к числу заболеваний, занимающих второе-третье место среди причин смертности при острых интоксикациях, что обусловливает большое значение этой проблемы в медицинском и социально-экономическом аспектах. Острые интоксикации монооксидом углерода являются наиболее частой причиной гибели людей на пожарах. Этот яд относится к мажорным компонентам смеси токсичных продуктов термодеструкции. Ежегодно в России, согласно официальной статистике, возникает более 10000 пожаров, на которых погибает около 7 тысяч человек (1).
Монооксид углерода относится к соединениям, обладающим выраженным нейротоксическим действием. Серьезную проблему составляет развитие отдаленных последствий поражения центральной нервной системы после острых тяжелых интоксикаций монооксидом углерода, проявляющихся нарушением в первую очередь когнитивно-мнестических функций. Нарушения памяти, процессов обучения, деменция, тревожность, эмоциональная лабильность, психозы, депрессии, мании, бессонница отмечаются спустя от нескольких дней до нескольких недель после интоксикации монооксидом углерода (2). Это приводит к существенному нарушению качества жизни пострадавших и возможной инвалидизации, которая влечет за собой необходимость проведения дорогостоящих методов их лечения и реабилитации.
Таким образом, решение проблемы предупреждения и лечения токсической энцефалопатии, вызванной монооксидом углерода, в отдаленный период после интоксикации, в частности создание новых высокоэффективных и безопасных средств, обладающих ноотропными и стресспротективными свойствами, является проблемой чрезвычайной медицинской и социальной значимости.
Известен препарат антидота окиси углерода (патент №2038079, A61K 31/315, 1988 г.) (3) для защиты личного состава вооруженных сил и населения от отравления смертельными дозами окиси углерода, выделяемой при пожарах, действии некоторых видов современного оружия и в экстремальных ситуациях в химических, нефтехимических, металлургических и горнодобывающих и других отраслях промышленности. Однако известный препарат направлен только на оказание помощи в острый период интоксикации, но он не предотвращает формирование отдаленных нейротоксических эффектов.
В настоящее время способы и средства лечения отдаленных последствий интоксикации монооксидом углерода не разработаны.
Проведенные научные изыскания указывают на то, что нейротоксические эффекты развиваются вторично, причем чаще механизм их формирования носит комбинированный характер (4, 5). Основными патогенетическими механизмами развития этих эффектов являются гипоксия/ишемия, дефицит образования энергии, эксайтотоксичность, оксидативный стресс и иммунологические реакции.
Среди перспективных препаратов, обладающих нейропротекторным действием, рассматриваются аналоги эндогенных пептидных субстанций - нейропептидов, которые обладают модулирующим действием на функции центральной нервной системы. Нейропептиды влияют на память, двигательную активность, чувствительность и другие функции нервной системы, проявляя эффекты нейромедиаторов и/или нейромодуляторов (6).
Нейротоксическое действие СО может быть также обусловлено увеличением содержания возбуждающих аминокислот в структурах центральной нервной системы. В результате избыточного действия глутамата на NMDA-рецепторы происходит нарушение проницаемости ионных каналов, что приводит к избыточному накоплению внутриклеточного кальция. Накопление кальция внутри клетки способствует запуску каскада реакций с активацией протеолитических ферментов и разрушением клеточных структур. Таким образом, развивающаяся эксайтотоксичность может объяснить отсроченную гибель нейронов после отравления монооксидом углерода (7). Подтверждением этой научной концепции формирования отсроченных эффектов могут быть следующие данные, что при использовании антагонистов NMDA-рецепторов снижается повреждение головного мозга мышей, индуцированное воздействием монооксида углерода.
Механизмы эксайтотоксичности могут инициировать некроз и апоптоз клеток. В экспериментах были обнаружены ультраструктурные изменения клеток коры головного мозга крыс после воздействия монооксида углерода. Эти морфологические изменения, характерные для некроза и апоптоза соответственно, были обнаружены на 3, 7 и 21 сутки после воздействия монооксида углерода. Наиболее выраженные повреждения нейронов обнаружили на 7 сутки после воздействия оксида углерода. Таким образом, некроз и апоптоз играют важную роль в механизмах запуска гибели нейронов после отравления монооксидом углерода (8).
Целью изобретения является создание препарата для терапии токсической энцефалопатии, а именно для профилактики и лечения отдаленных последствий поражений центральной нервной системы (ЦНС) при отравлениях монооксидом углерода.
Для коррекции отдаленных эффектов острого отравления монооксидом углерода предлагается использовать комплексный пептидный препарат, содержащий дельта-сон индуцирующий пептид с последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu (ДСИП), нуклеоспермат натрия, дипептид карнозин и аминокислоту глицин, при массовом соотношении 1:(1-10000):(1-10000):(1-10000). Соотношение компонентов в препарате может варьироваться. Наиболее эффективным является соотношение дельта-сон индуцирующий пептид:нуклеаспермат натрия:карнозин:глицин = 1:100:100:100.
Сущностью данного решения является то, что заявленная композиция состоит из веществ, ранее вместе не применяемых, но обладающих в таком сочетании неожиданным эффектом инициировать механизмы нейропротекции, которые позволяют предотвратить когнитивные нарушения, вызванные мооксидом углерода.
Подобная комбинация компонентов в препарате позволяет получить эффект синергии. Дельта-сон индуцирующий пептид (Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu) обладает широким мультфункциональным действием, относится к классу нейропротекторов с мощным адаптогенным, стресспротективным и антиоксидантным действием (9). ДСИП синтезируется в клетках мозга и активно транспортируется через гематоэнцефалический барьер. Основным механизмом действия ДСИП является предупреждение гибели нейронов (за счет возмещения дефицита пептида в организме), возникающей при различных стрессовых состояниях, токсических воздействиях, старении организма. Модулирующее влияние ДСИП на ЦНС реализуется через классические нейромедиаторные системы: адренергические, серотонин- и ГАМК-ергические.
Известно, что с помощью ДСИП можно стабилизировать нейроны самых древних структур мозга (лимбико-ретикулярной системы). Стабилизируя нейроны подкорковых структур, ДСИП тем самым способствует стабилизации нейро-эндокрино-иммунологического каскада (таким образом, уменьшает проявления как системного стресса, так и психоэмоционального). Кроме того, ДСИП обладает антиоксидантным действием и связано оно с мощным подавлением самой функции образования свободных радикалов в клетках головного мозга. Нейропротекторное действие пептида осуществляется путем предупреждения гипервозбуждения нейронов в процессе нормальных адаптивных реакций, предотвращая их саморазрушение по механизму эксайтотоксичности. Учитывая рассмотренные выше механизмы токсического действия монооксида углерода в развитии отдаленных последствий поражения центральной нервной системы, предполагается, что эффективность ДСИП может быть связана с его установленными механизмами действия.
Одним из ведущих механизмов, лежащим в основе повреждающего действия СО и развития отдаленных эффектов, являются иммунологические изменения, что является основанием для возможного эффективного применения иммуномодуляторов. К таким препаратам, обладающим иммуномодулирующим действием, относится нуклеоспермат натрия (10).
Большинство исследователей отмечает, в различных иммунологических моделях благотворное влияние экзогенных дезоксирибонуклеиновых кислот (ДНК) на клеточные и гуморальные звенья иммунной системы: стимуляция В-лимфоцитов, активация Т-хелперов и клеток моноцитарной-макрофагальной системы. ДНК обладает цитопротекторным действием: стимулирует гемопоэз и нормализует картину периферической крови после лучевой терапии и полихимиотерапии. Несмотря на тот факт, что фармакологическая активность дезоксирибонуклеиновых кислот не подлежит сомнению, но биологическая активность препаратов ДНК в значительной степени определяется как сырьевым источником, так и способом получения препарата. Учитывая вышеизложенное, нами был выбран препарат нуклеоспермат натрия, который представляет собой высокоочищенную стандартизированную смесь натриевых солей полихлоргидратов дериватов ДНК и РНК, получаемую из молок осетровых рыб с использованием оригинальных биотехнологий. Препарат обладает способностью стимулировать гемопоэз, оказывает влияние на процессы пролиферации, миграции и дифференцировки колониеобразующих единиц и действует на всех уровнях кроветворения. Принимает активное участие в клеточном метаболизме, встраиваясь в структуры клетки, особенно в пролиферирующих тканях. Ускоряет гранулоцитопоэз на стадии промиелоцитов и миелоцитов, увеличивает индекс созревания нейтрофилов. Восстанавливает гематологические показатели, сниженные в результате химиотерапии цитостатическими лекарственными средствами. Оказывает иммуномодулирующее действие на клеточном и гуморальном уровнях. Снижает степень иммуносупрессии после полихимиотерапии и лучевой терапии, увеличивая содержание CD4+, повышает их долю в соотношении иммунорегуляторных субпопуляций (CD4+/CD8+), сохраняя высокую пролиферативную активность Т-лимфоцитов, активирует клетки-киллеры, стимулирует антителообразование. Повышает активность супероксиддисмутазы и снижает уровень малонового диальдегида, проявляя умеренную антиоксидантную активность. Активирует противовирусный, противогрибковый и противомикробный иммунитет.
Авторы предлагают использовать сочетание дельта-сон индуцирующего пептида в комплексе с нуклеосперматом натрия и тем самым инициировать механизмы иммунной защиты, которые позволяют повлиять на механизмы апоптотической гибели нейронов. Кроме того, нуклеаспермат натрия оказывает мнемотропный эффект.
Известно, что значительную роль в развитии токсического повреждения ЦНС монооксидом углерода играет оксидантный стресс. Для его коррекции был введен в состав препарата дипептид карнозин.
Карнозин - дипептид, состоящий из двух аминокислот (аланина и гистидина), является природным компонентом ткани человека. В больших концентрациях карнозин обнаружен в тканях мозга, сердца, скелетной мускулатуры, меньше в хрусталике. Карнозин обладает свойствами суперантиоксиданта (способен подавлять свободнорадикальные реакции путем инактивации активных форм кислорода и продуктов перекисного окисления липидов, образующихся в организме), мембранопротектора (оказывает защитные действия на мембранные структуры митохондрий) и нейропротектора (предотвращает гибель нейронов). Карнозин легко усваивается организмом, является природным стимулятором мышечной активности; обладает ярко выраженными антистрессовыми, геропротекторными свойствами, повышает устойчивость организма к тяжелым физическим и психоэмоциональным нагрузкам, оказывает модулирующее влияние на клеточный иммунитет, улучшает микроциркуляцию мозга, препятствует гибели нейронов, восстанавливает сократительную активность сердца при длительном ишемическом состоянии.
Глицин (аминоуксусная кислота) относится к заменимым аминокислотам, входит в состав многих белков и биологически активных соединений, легко усваивается организмом. Глицин обладает выраженным антиоксидантным, антитоксическим и ГАМК-эргическим действием. Глицин является нейромедиатором и регулятором метаболических процессов в тканях мозга человека, нормализует процессы защитного торможения в центральной нервной системе. Глицин проявляет антистрессовые и антитоксические действия, повышает адаптивные и защитные силы организма, снижает психоэмоциональное напряжение, агрессивность, конфликтность, уменьшает вегетососудистые расстройства, повышает умственную работоспособность, концентрацию внимания, способность к обучению, нормализует деятельность иммунной системы, снижает токсическое влияние лекарственных средств.
Таким образом, заявляемое средство для предотвращения отдаленных эффектов при отравлениях монооксидсм углерода обладает ноотропным, иммуномодулирующим, атиоксидантным и стресспротективным эффектом и обеспечивает их мощный синергетический эффект на основные патогенетические механизмы повреждения центральной нервной системы в отдаленные сроки после интоксикации угарным газом. Заявленный препарат улучшает память, способность к восприятию информации, обучаемость в отдаленные сроки после интоксикации угарным газом.
Наиболее эффективен путь введения препарата посредством его введения в носовую полость, что обеспечивает попадание препарата в центральную нервную систему и максимально быструю и эффективную доставку компонентов в ткань мозга. Препарат может применяется также сублингвально или другими способами.
Для подтверждения эффективности предлагаемой комбинации препаратов (дельта-сон индуцирующего пептида, нуклеаспермата натрия, карнозина и глицина) были проведены экспериментальные исследования на лабораторных животных. Моделирование тяжелого отравления оксидом углерода (СО) проводили статическим методом с использованием герметичной затравочной камеры объемом 0,1 м3. Оксид углерода получали химическим способом путем реакции муравьиной и серной кислот при нагревании в аппарате Киппа. Концентрация оксида углерода в затравочной камере составляла 5200±120 ppm, экспозиция 30 мин. Определение концентрации СО проводили при помощи газоанализатора ДАХ-М-03-СО-1500. Оценку состояния функций центральной нервной системы (ЦНС) у лабораторных животных проводили с помощью методик по изучению поведения: выработки условного рефлекса поиска пищи (УРПП) в установке «Восьмилучевой радиальный лабиринт» и выработки условного рефлекса активного избегания (УРАИ) плаванием. С помощью методики выработки УРПП в установке «Восьмилучевой радиальный лабиринт» у животных оценивали пространственную референтную и рабочую память, которая согласно литературным данным имеет общие черты с семантической и эпизодической памятью человека. Животных, находящихся в состоянии частичной пищевой депривации, обучали находить пищу в лучах лабиринта в течение 5 суток и делили на группы. В 1-ю группу вошли интактные животные; во вторую группу (контрольную) - животные, подвергшиеся воздействию СО и получавшие ингаляцию кислорода; в 3-ю группу (опытные) - животные, подвергшиеся воздействию СО и получавшие ингаляцию кислорода и разработанный препарат (в соотношении дельта-сон индуцирующий пептид:нуклеаспермат натрия:карнозин:глицин = 1:100:100:100). Непосредственно перед воздействием оксида углерода проводили контрольное тестирование. После интоксикации крыс повторно тестировали в тех же условиях на 1, 7, 14 и 21 сутки после воздействия СО. В каждом сеансе оценивали число ошибок референтной памяти (заходы в неподкрепленные лучи) и число ошибок рабочей памяти (повторные заходы в подкрепленные лучи в течение одного сеанса). Увеличение ошибок референтной памяти расценивали как нарушение долговременной памяти, увеличение количества ошибок рабочей памяти - как нарушение кратковременной памяти.
Выработку УРАИ плаванием начинали на 7 сутки после воздействия СО. Оценивали время выхода животных из воды на стержень. Для определения степени нарушения обучаемости животных после острого отравления СО сравнивали время активного избегания плаванием между группами в течение периода обучения.
Для профилактики нарушений функций ЦНС после тяжелого отравления СО использовали комбинацию кислорода с разработанным препаратом. Ингаляция 30% кислорода осуществлялась в герметичной камере под обычным давлением в течение 30 мин. Препарат вводили из расчета синтетического аналога ДСИП в дозе 50 мкг/кг. Животным интактной и контрольной групп вводили физиологический раствор. Ингаляция кислородом осуществлялась однократно, непосредственно после извлечения лабораторных животных из затравочной камеры. Препарат вводили интраназально в течение трех суток после интоксикации, первое введение осуществляли через 30 мин после острой интоксикации.
Влияние лечебного использования комбинации кислорода и препарата на память после тяжелой интоксикации СО оценивали по сохранности воспроизведения УРПП у предварительно обученных животных в установке «Восьмилучевой радиальный лабиринт». При контрольном тестировании, через 24 ч после обучения, у всех животных количество ошибок референтной (таблица 1) и рабочей (таблица 2) памяти значимо не различалось.
В таблице 1 приведено число ошибок референтной памяти, оцененных в установке «Восьмилучевой радиальный лабиринт» у предварительно обученных крыс после воздействия оксида углерода в концентрации 5220 ppm (M±m).
В таблице 2 приведено число ошибок рабочей памяти, оцененных в установке «Восьмилучевой радиальный лабиринт» у предварительно обученных крыс после воздействия оксида углерода в концентрации 5220 ppm (M±m).
Влияние лечебного использования комбинации кислорода и препарата на обучаемость отравленных крыс оценивали в методике выработки УРАИ плаванием (таблица 3).
В таблице 3 приведено изменение времени условного рефлекса активного избегания плаванием у животных, обучавшихся с 7-х суток после воздействия оксида углерода в концентрации 5200 ppm, с (М±т).
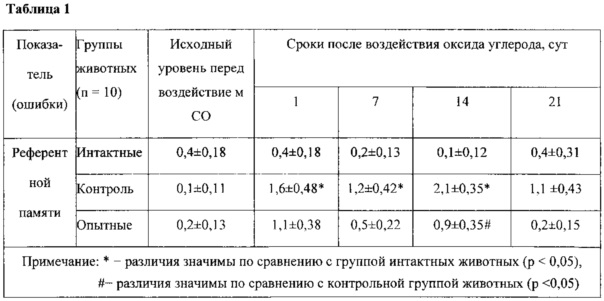
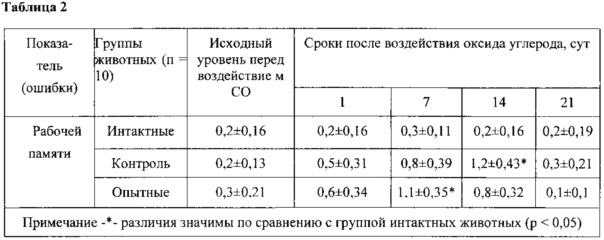
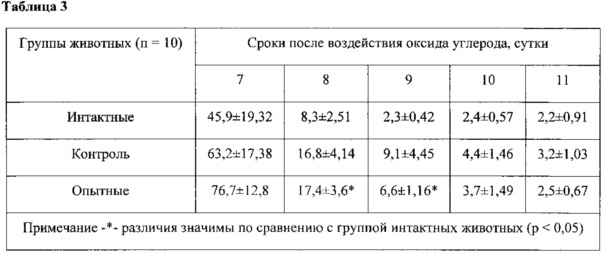
Таким образом, проведенные эксперименты подтверждают, что предлагаемый препарат предотвращал нарушения памяти в отдаленные сроки после интоксикации угарным газом и способствовал улучшению восприятия информации.
Литература
1. Остапенко Ю.Н. Острые отравления в России: тенденции последних лет / Ю.Н. Остапенко, А.В. Ковалев, В.И. Казачков [и др.] // Эфферентная терапия. - 2015. - Т. 21, №5. - С. 48.
2. Софронов Г.А., Черный B.C., Александров М.В. Качество жизни лиц, перенесших острые отравления продуктами горения // Вестн. Рос. Воен.-мед. акад. - 2012. - Т. 2, №38. - С. 6-10.
3. RU, патен №2038079, МПК А61К 31/315, 1988.
4. Suat Z. An assessment of antioxidant status in patient with carbon monoxide poisoning / Z. Suat et al // World J Emerg Med. - 2014. - Vol. 5. - P. 91-95.
5. Wang, W. Effects of hydrogen-rich saline on rats with acute carbon monoxide poisoning / W. Wang, L. Tian, Y. Li [et al] // J Emerg Med. - 2013. - Vol. 44, N 1. - P. 107-115.
6. Шабанов П.Д. Фармакология пептидных препаратов / П.Д. Шабанов // Мед. акад. журн. - 2008. - Т. 8, №4. - С. 3-24.
7. Piantadosi, С.А. Production of hydroxyl radical in the hippocampus after CO hypoxia or hypoxic hypoxia in the rat / C.A. Piantadosi, J. Zhang, I.T. Demchenko // Free Radic. Biol. Med. - 1997. - Vol. 22, N 4. - P. 725-732.
8. Liu, Y. MK801 protects against carbon monoxide induced hearing loss / Y. Liu, L.D. Fechte // Toxicol. Appl. Pharmacol. - 1995. - Vol. 132, N 2. - P. 196-202.
9. RU, патент №2211703, МПК A61K 38/08, A61K 38/19, 2001.
10. RU, патент №2206326, МПК A61P 31/18, A61K 31/711, A61K 31/7105, 2001.

