Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ЦИРРОЗА ПЕЧЕНИ
Вид РИД
Изобретение
Изобретение относится к медицине, направлено на моделирование хронического токсического поражения печени в виде фиброза и цирроза и может быть использовано для изучения токсических поражений печени в доклиническом исследовании гепатозащитных препаратов и при разработке новых способов лечения цирроза печени. В настоящее время в экономически развитых странах заболеваемость циррозом печени составляет около 20-40 больных на 100 тыс. населения, и этот показатель неуклонно растет, от данного заболевания погибают около 350 тыс. человек в год. Чаще цирроз развивается при длительной интоксикации алкоголем (по разным данным, от 40 до 80% случаев). Существующие средства и схемы терапии цирроза печени не всегда оказываются эффективными и характеризуются большим количеством противопоказаний и побочных эффектов. Одна из возможных причин подобного состояния дел - отсутствие адекватных экспериментальных моделей цирроза печени. Роль алкоголя как этиологического фактора в развитии цирроза печени общепризнана.
Известен способ инициации токсического поражения печени путем перорального введения 40% этилового спирта в дозе 14 мл/кг в течение 60 суток [Доркина Е.Г. Гепатопротекторные свойства флавоноидов: автореф. дис. … д-ра биол. наук / Е.Г. Доркина. - Волгоград, 2010. - 45 с.].
Недостатком данного способа является длительность введение 40% этанола - 60 сут и более, а также то, что в результате подобного воздействия обычно развивается только токсический гепатит и/или жировой гепатоз, но никак не фиброз и цирроз. В связи с этим, при моделировании алкоголь-индуцированного экспериментального цирроза печени, согласно данным литературы, возникает необходимость усиливать гепатотоксическое повреждающее действие этанола с помощью других гепатотоксикантов и наоборот [Popper Н. Histogenesis of alcoholic fibrosis and cirrhosis in the baboon / H. Popper, C.S. Lieber // Am. J. Pathol. - 1980. - Vol. 98, №3. - P. 695-716].
Известен способ создания модели токсического гепатита и цирроза печени млекопитающих, согласно которому в качестве гепатотоксиканта внутрижелудочно вводят 50% раствор совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и ежедневно в течение 1 мес вместо воды животным дают для питья 10% раствор этанола (Патент на изобретение RU №2197018, 2003]. Применение в этой модели этанола позволяет добиться развития хронического токсического гепатита, а совтол предназначен для быстрого токсического поражения печени. При сочетании двух компонентов их токсические эффекты суммируются, что в итоге приводит к развитию как токсического гепатита, так и цирроза печени через 4-6 недель после начала введения токсикантов.
Недостатком данного способа моделирования цирроза печени является то, что замена водного питьевого режима алкоголем не является физиологичной, в связи с чем, по данным литературы, около 30% животных отказываются от приема алкоголя [Патент на изобретение RU №2373927, 2007; Филатова Е.В. Влияние социальных условий на формирование предпочтения этанола у крыс / Е.В. Филатова [и др.] // Доклады Академии наук. - 2010. - Т. 430, №4. - С. 35-37].
Известен способ, при котором водный раствор диметилнитрозамина вводят интрагастрально из расчета 50-100 мг/кг массы животного 1 раз в неделю на протяжении 2-3 месяцев, при этом исследование печени обычно проводят через 2 недели после последнего введения. Другим вариантом этого же способа является введение водного раствора диметилнитрозамина интраперитонеально на протяжении 2-3 месяцев каждую неделю три дня подряд с последующим 4-дневным перерывом [Арутюнян И.В. Моделирование цирроза печени на лабораторных животных / И.В. Арутюнян [и др.] // Клиническая и экспериментальная морфология. - 2012. - №2. - С. 45-50].
Недостатком способа является длительность эксперимента.
Известен способ моделирования повреждения печени в эксперименте путем однократного введения крысам N-нитрозодиметиламина внутрибрюшинно в дозах 7 и 15 мг/кг [Томилин Н.В. Экспериментальная оценка генотоксического действия N-нитрозодиметиламина при однократном введении в токсических дозах белым крысам / Н.В. Томилин [и др.] // Актуальные проблемы диагностики, профилактики и лечения профессионально обусловленных заболеваний: Сборник материалов Всероссийской научно-практической конференции, Сочи, 14-15 октября 2013 года. - Сочи, 2013. - С. 423-425].
Однако при действии таких доз N-нитрозодиметиламина при однократном введении фиброз и цирроз печени не развиваются, а эффект повреждения этого органа регистрируется только по цитогенетическим показателям.
При введении диметилнитрозамина в дозах 5,0-7,5 мг/кг в течение 2-3 недель у всех грызунов развивается хронический токсический гепатит, а у значительной части (50-70%) еще и фиброз, но формирования цирроза печени не происходит [Constandinou С. Modelling liver fibrosis in rodents / С. Constandinou, N. Henderson, J.P. Iredale // Methods Mol. Med. - 2005. - Vol. 117. - P. 237-250].
Известен способ моделирования цирроза печени, который представляет собой введение в желудок лабораторного животного два раза в неделю в течение месяца 50%-ного раствора совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и 10%-ного раствора этанола вместо воды для питья [Патент на изобретение RU №2197018, МПК G09B 23/28, 20.01.2003].
Недостатком известного способа является невысокая степень точности воспроизведения поражения печени в эксперименте.
Техническим результатом разработанного изобретения является повышение воспроизводимости и приближение модели экспериментального цирроза к клиническому течению данной патологии печени у человека.
Технический результат достигается тем, что для получения модели цирроза печени в эксперименте включают дозированное введение этанола крысам, причем этанол вводят внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
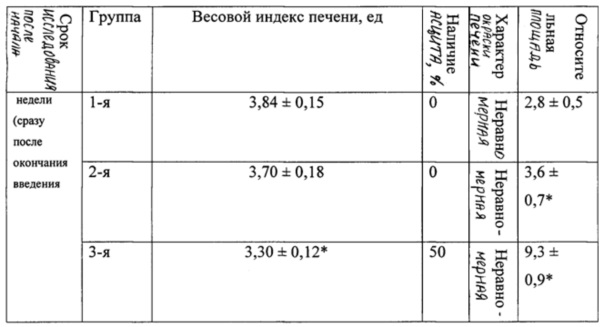
В таблице 1 представлена динамика веса животных в ходе эксперимента.
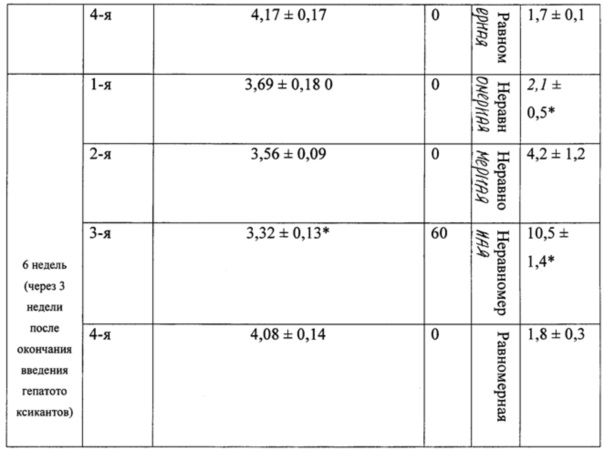
В таблице 2 представлены морфологические показатели у животных при моделировании экспериментального токсического цирроза печени.
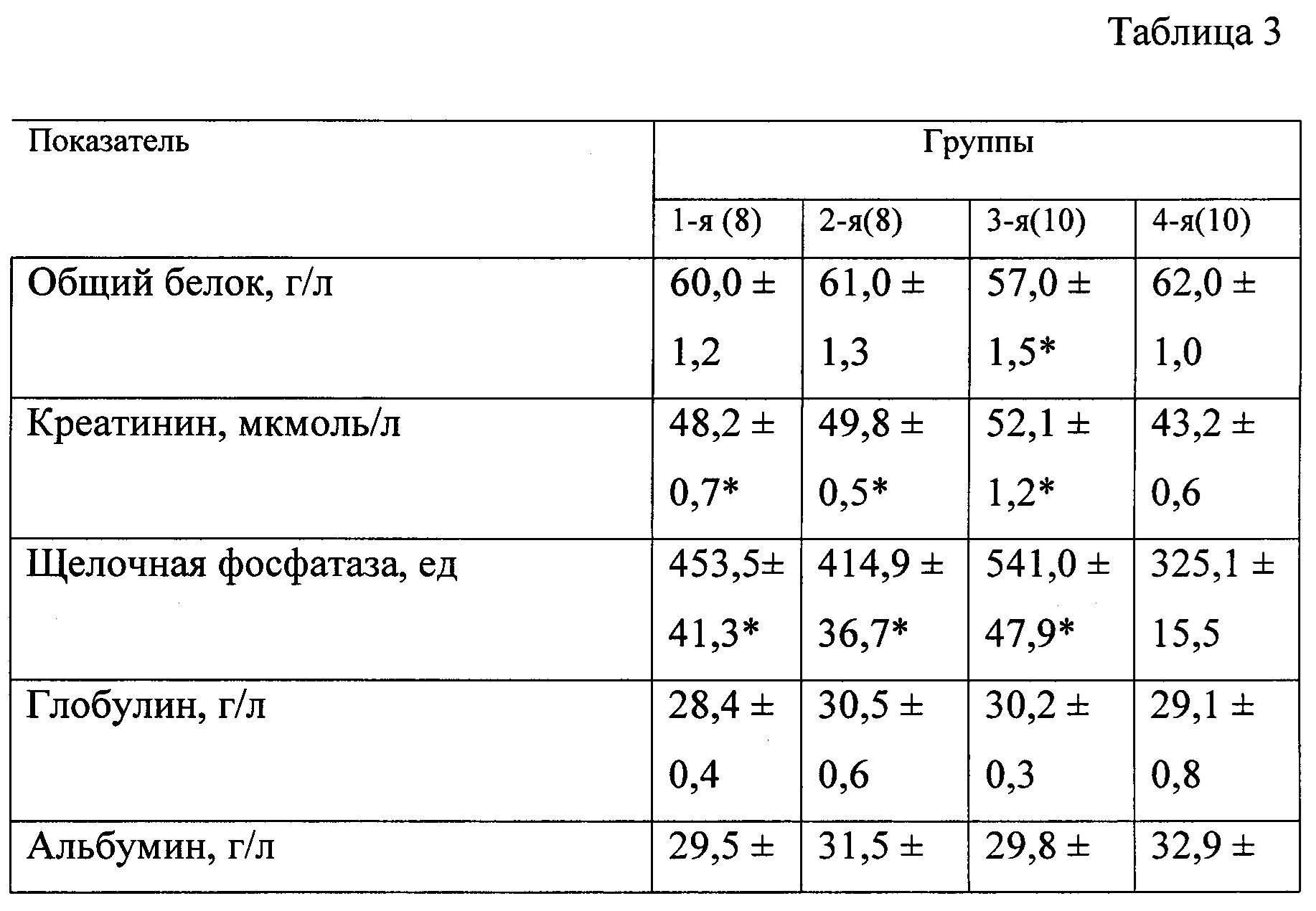
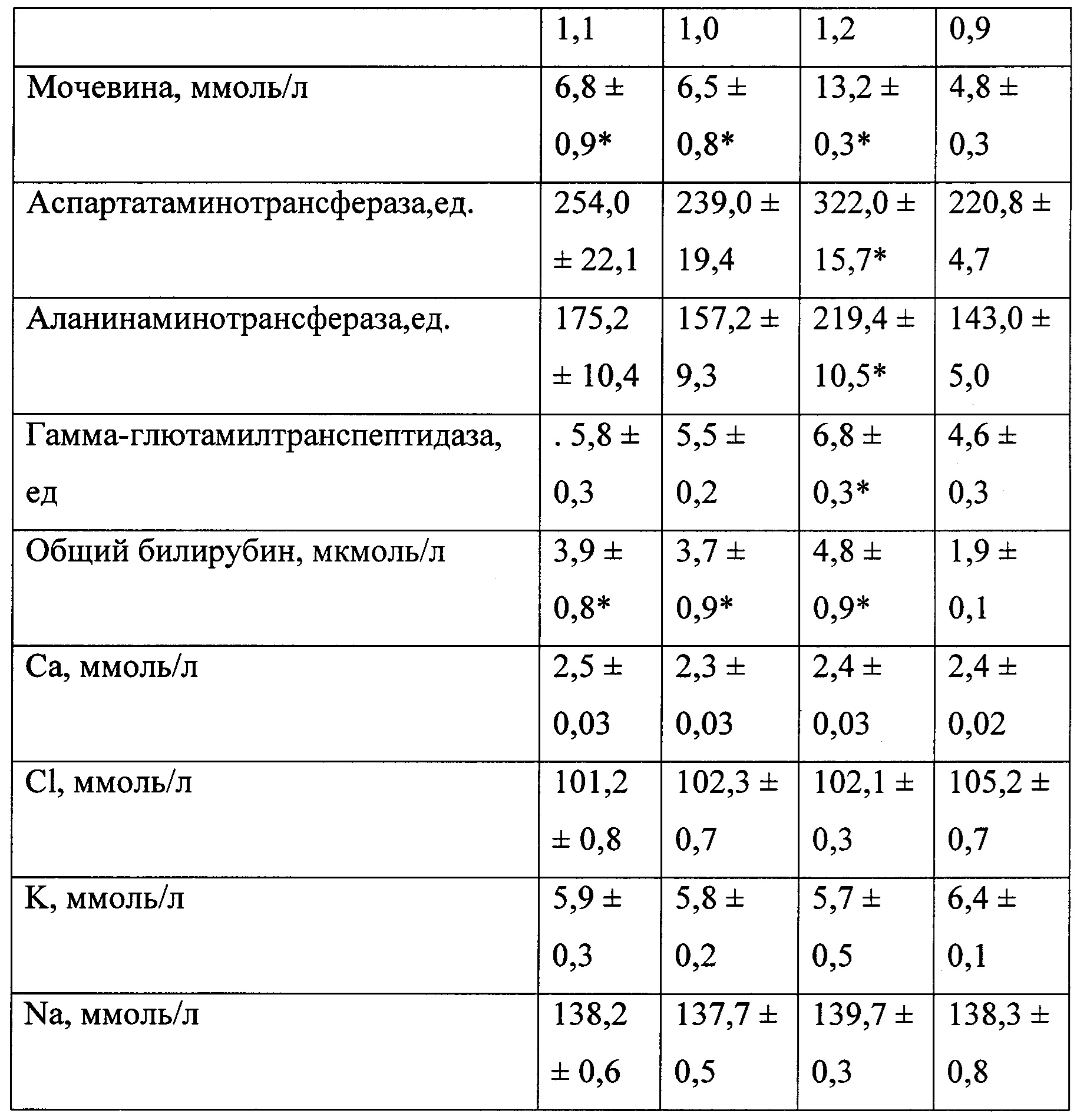
В таблице 3 представлены биохимические показатели у животных при моделировании экспериментального токсического цирроза печени.
Способ осуществляется следующим образом.
Для получения модели цирроза печени экспериментальным животным вводят этанол внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
Для доказательства соответствия заявленного технического решения критериям изобретения был проведен эксперимент на 80 белых беспородных крысах-самцах массой 180-220 г. Животные были разделены на четыре группы:
- 1-я группа (n=20) - внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут;
- 2-я группа (n=20) - внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели в течение 3-х недель;
- 3-я группа (n=20) - внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут и одновременно внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели;
- 4-я группа (n=20) - контрольная группа; животным вводили внутрижелудочно по 0,5 мл физиологического раствора через 1 день и внутрибрюшинно по 0,5 мл физиологического раствора в течение 4-х последовательных суток каждой недели в течение 3-х недель.
Наблюдение за лабораторными животными осуществляли в течение 2-х недель до эксперимента (карантин), в ходе 3-недельного внутрижелудочного и внутрибрюшинного введения гепатотоксикантов, а также в течение 3-х недель после окончания их введения. Оценка клинико-лабораторных и морфологических показателей у лабораторных животных опытных и контрольной групп проводилась до эксперимента, через 3 и 6 недель после начала введения гепатотоксикантов (второе исследование было выполнено для уточнения возможности возобновления процессов спонтанного фиброзобразования после отмены гепатотоксикантов).
Животных содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде. Масса тела животных 1-3-й группы перед началом эксперимента была (147,9±5,2) г, 4-й (контрольной) группы - (148,0±6,3) г. Исходные клинико-лабораторные показатели у животных опытных и контрольной групп также не различались.
Наличие и выраженность токсического повреждения печени оценивали путем визуального наблюдения клинической картины интоксикации, изучения биохимических показателей периферической крови и морфологического исследования препаратов печени.
В качестве биохимических показателей, характеризующих основные функции печени, изучали: общий белок, креатинин, мочевину, глюкозу, билирубин, калий, натрий, хлор, кальций, аланинаминотрансферазу, аспартатаминотрансферазу, гамма-глютамилтранспептидазу и индикатор холестаза - щелочную фосфатазу. Оценку биохимических показателей осуществляли с помощью анализатора «Roche Omni С».
Для подтверждения факта развития экспериментального цирроза печени через 1, 2 и 3 недели после начала эксперимента проводили эвтаназию животных (по 5 особей из каждой группы) и осуществляли забор образцов печени с последующим гистологическим исследованием по стандартным методикам. Срезы печени оценивали с использованием исследовательских микроскопов «Polyvar» и «Leica DMRE», цифрового комплекса видеонаблюдения и программы анализа изображений «Видеотест-4». Морфологическую оценку степени повреждения печени проводили по результатам измерения площади, занимаемой соединительной тканью, в пределах 5-7 печеночных долек на 6 срезах печени, окрашенных по ван Гизону [Руководство по проведению доклинических исследований лекарственных средств / под ред. А.Н. Миронова. - М.: Гриф и К., 2012. - 944 с.]. С помощью компьютерной обработки сканированного изображения среза печени рассчитывали относительную площадь, занимаемую в ткани печени сформировавшимся коллагеном.
Значимость межгрупповых различий средних величин параметрических показателей оценивали с помощью t-критерия Стьюдента. В таблицах данные представлены в виде средней арифметической величины и ошибки средней величины (М±m).
Эксперименты показали (табл. 1), что уже к концу 3-й недели комбинированное воздействие этанола и ДМНА сопровождалось значительным ростом (более чем на 30 г по сравнению с фоновыми значениями) массы тела у животных 3-й группы.
При вскрытии через 3 недели после начала эксперимента у 50% животных 3-й группы отмечали наличие развитого асцита с большим количеством (около 6-8 мл) серозной жидкости в брюшной полости (табл. 2). Весовой коэффициент печени у крыс 3-й группы был статистически значимо меньшим, чем у крыс 4-й (контрольной) группы (р<0,05), влажность печени у животных 3-й группы была понижена.
Повышение воспроизводимости в формировании фиброза и цирроза печени достигается за счет потенцирования N-нитрозодиметиламином гепатотоксического эффекта этанола и наоборот. Кроме того, моделирование токсического фиброза и цирроза печени осуществляется в более короткие сроки, а развивающаяся при этом клинико-лабораторная и морфологическая картина поражения в значительной степени приближена к клиническому течению данной патологии печени у человека.
При использовании нашей модели формирование клинико-лабораторной и морфологической картины цирроза печени с развитием выраженного асцита (до 6-8 мл жидкости в брюшной полости) у 50% лабораторных животных начинается уже через 3 недели после начала сочетанного введения двух гепатотоксикантов - N-нитрозодиметиламина и этанола. У оставшихся 50% лабораторных животных в эти же сроки также формируется фиброз и цирроз печени, но в брюшную полость выпотевает до 1-2 мл жидкости. Таким образом, предлагаемая модель позволяет сократить сроки моделирования цирроза печени по сравнению со стандартной длительностью эксперимента в среднем в два раза (с 6 недель до 3 недель), а также повысить точность воспроизведения клинико-лабораторной и морфологической картины токсического фиброза и цирроза печени.
Комбинированное воздействие гепатотоксикантов способствует формированию у крыс экспериментального цирроза печени уже через 3 недели после начала инъекций, что проявляется в увеличении количества соединительной ткани в печени, цирротическом ее перерождении и развитии асцита. При этом, в первую неделю после начала комбинированного воздействия этанола и N-нитрозодиметиламина в ткани печени отмечается центральный геморрагический некроз, затем происходит формирование септ и волокнистой соединительной ткани (2-я неделя), а спустя 3 недели - мелкоузелкового цирроза. Таким образом, разработанная нами модель позволяет проследить последовательное развитие всех морфологических признаков повреждения вплоть до развития цирроза.