Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pPDGFB, кодирующая полипептид со свойствами фактора роста тромбоцитов-ВВ человека, и рекомбинантный штамм метилотрофных дрожжей Pichia pastoris - продуцент полипептида со свойствами фактора роста тромбоцитов-ВВ человека
Вид РИД
Изобретение
Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в медицинских исследованиях для получения фактора роста тромбоцитов ВВ человека.
Фактор роста тромбоцитов (ФРТ) является основным фактором, способствующим делению и росту клеток фибробластов и гладкой мускулатуры. Несмотря на то, что на сегодняшний день не имеется четкого представления о молекулярных механизмах действия данного регуляторного белка, известно, что ФРТ ведет к повышению уровня биосинтеза специфических белков и обладает митогенным эффектом. Кроме того, при механическом повреждении клеток сосудистого эндотелия, они способны выделять в окружающую среду ФРТ, что приводит к закрытию повреждения в сосудистой стенке и остановке кровотечения. Фактор роста тромбоцитов, даже в концентрации 1÷2 нг/мл, индуцирует направленное перемещение клеток иммунной системы, таких как лейкоциты, гранулоциты, макрофаги, способствуя возникновению защитного иммунного ответа. ФРТ ответственен за активацию клеток соединительной ткани, ответственных за образование рубца и синтез коллагенов. По последним данным установлено, что ФРТ косвенно влияет на образование капилляров и клеток сосудов.
Фактор роста тромбоцитов PDGF-BB является уникальным регуляторным белком, проявляющим высокую биологическую активность в отношении регенерации клеток. Именно по этой причине, к нему проявляется интерес на биофармацевтическом рынке. На сегодняшний день существует единственный препарат рекомбинантного фактора роста тромбоцитов, выпускающегося под торговой маркой «Regranex». Основным показанием к применению данного препарата являются трофические язвы и поражения кожных покровов, возникающие в результате осложнений сахарного диабета. Поэтому существует острая потребность в разработке более эффективной, отечественной технологии получения фактора роста тромбоцитов при помощи методов молекулярного клонирования и гетерологичных систем экспрессии генов.
Использование бактериальной системы экспрессии Е. coli позволяет получить высокие количества фактора роста, однако, сложная пространственная структура белка, с образованием активной димерной формы через экстрамолекулярную дисульфидную связь является причиной агрегации гетерологичного белка и накопления преимущественно в тельцах включения; длительность, трудоемкость и дороговизна методов - характерная черта экспрессии при использовании клеточных линий млекопитающих. Клетки дрожжей, в частности P. pastoris, сочетают в себе преимущества данных систем. Эти низшие эукариоты обладают развитой системой ЭПР для осуществления разнообразных посттрансляционных модификаций протеинов, а также просты и удобны в культивировании. Следует отметить тот факт, что биосинтез рекомбинантного фермента осуществляется в виде зрелого белка, который секретируется в культуральную жидкость.
Аналогом-прототипом получаемого рекомбинантного белка является бекаплермин, являющийся активным компонентом препарата «Regranex». В данном случае, фактор роста тромбоцитов ВВ получают при помощи дрожжевой системы экспрессии на основе S. cerevisiae [патенты US 4766073, опубл. 23.08.1988, C12N 15/67, A61K 38/00, C12N 15/78, A61K 35/16 и US 4845075, опубл. 04.08.1989, A61K 38/00, C07K 14/49, C12N 15/81, A61K 35/16, C12N 15/62, C07K 14/15, C12N 15/18]. На наш взгляд, по системе экспрессии на основе клеток метилотрофных дрожжей P. pastoris, которые способны к производству большего количества белков, по получению фактора роста тромбоцитов в клетках P. pastoris на сегодняшний день имеется 3 работы. В первой был получен фактор роста тромбоцитов А, который не имеет высокой терапевтической актуальности [Н. Li, et al. High level expression, efficient purification and bioactivity assay of recombinant human platelet-derived growth factor AA dimer (PDGF-AA) from methylotrophic yeast Pichia pastoris, 2013]. В данной работе была получена рекомбинантная плазмидная ДНК содержала ген искусственного предшественника PDGF-AA человека, который состоит из последовательности, кодирующей сигнальный пептид α-фактора Saccharomyces сеге-visiae, кДНК гена PDGFA, под контролем индуцибельного промотора АОХ1. Продуцент был получен путем электропорации экспрессионного вектора в штамм GS115 и при последующей «зеоциновой» селекции. Биосинтез рекомбинантного белка осуществляли при культивировании клеток на среде BMMY, содержащей 1% (v/v) метанола. Культивирование проводили в течение 120 часов, целевой продукт секретируется в культуральную жидкость. Анализ уровня экспрессии белка проводили при помощи ПААГ-электрофо-реза в неденатурирующих условиях.
Второй работой является патент «Штамм дрожжей Pichia pastoris 2-2-продуцент тромбоцитоврного фактора роста человека (pdgf-bb) и способ получения тромбоцитоврного фактора роста человека» [RU 2290434, опубл. 27.12.2006, С12Р 21/02, C12N 15/12, C12N 1/19]. Однако в данном патенте описан способ получения ФРТ с дополнительной синтетической последовательностью, способствующей димеризации, и последовательностью, содержащей 6 остатков гистидина. Следовательно, данный белок не является биоаналогом ФРТ. К тому же при конструировании экспрессионного вектора используется промотор глицеральдегид-3-фосфат гидрогеназы, который является недостаточно сильным.
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе [М. Dai et al, Identification and Functional Characterization of Glycosylation of Recombinant Human Platelet-Derived Growth Factor-BB in Pichia pastoris, 2015]. В данной работе была получена рекомбинантная плазмидная ДНК содержала ген искусственного предшественника PDGF-BB человека, который состоит из последовательности, кодирующей сигнальный пептид α-фактора Saccharomyces cerevisiae, кДНК гена PDGFB, под контролем индуцибельного промотора АОХ1. Продуцент был получен путем электропорации экспрессионного вектора в штамм GS115 и при последующей «зеоциновой» селекции. Биосинтез рекомбинантного белка осуществляли при культивировании клеток на среде BMMY, содержащей 0,5% (v/v) метанола. Культивирование проводили в течение 72 часов, целевой продукт секретируется в культуральную жидкость. Анализ уровня экспрессии белка проводили при помощи ПААГ-электрофореза в неденатурирующих условиях. Недостатком способа-прототипа является относительно низкий уровень синтеза и секреции рекомбинантного ФРТ, а также клонирование и экспрессия неоптимизированной нуклеотидной последовательности, что может также существенно негативно повлиять на выход целевого продукта.
Изобретение решает задачу получения полипептида со свойствами фактора роста тромбоцитов ВВ человека путем биосинтеза, а также увеличение выхода секретированного целевого белка в культуральной жидкости.
В настоящем изобретении была поставлена задача получения плазмиды с геном фактора роста тромбоцитов В человека, а также штамма-продуцента фактора роста тромбоцитов ВВ.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pPDGFB, кодирующей синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека, обеспечивающей биосинтез с уровнем порядка 40÷60 мг рекомбинантного белка/л культуры. Высокоэффективный синтез целевого полипептида обеспечивается тем, что целевой ген находится под контролем сильного индуцибельного промотора АОХ1.
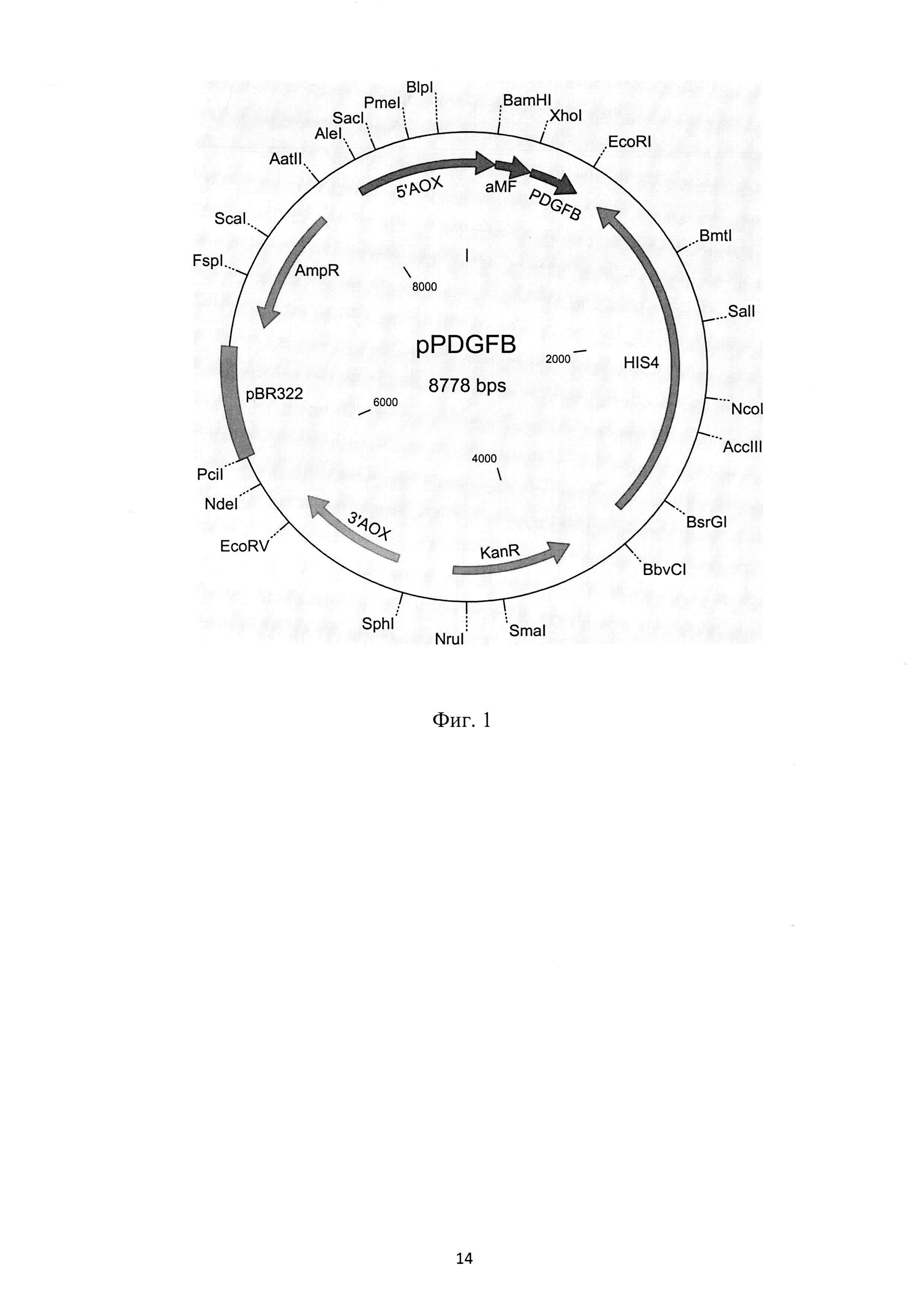
Рекомбинантная плазмидная ДНК pPDGFB, кодирующая полипептид со свойствами фактора роста тромбоцитов-ВВ, характеризуется следующими признаками:
имеет молекулярную массу 6,52 MDa (8,778 т.п.о.);
кодирует аминокислотную последовательность гена фактора роста тромбоцитов-В человека;
состоит из XhoI lEcoRI - фрагмента ДНК плазмиды pPIC9K длиной 9,246 т.п.о., содержащего ген Kan, определяющий устойчивость трансформированных плазмидой pPDGFB клеток к генетицину, ген AmpR β-лактамазы, определяющий устойчивость трансформированных плазмидой pPDGFB клеток к ампициллину, АОХ1-промотор P. pastoris, ген гистидинол дегидрогеназы His4; а также из XhoI /EcoRI фрагмента длиной 342. п.о., включающей и синтетический ген фактора роста тромбоцитов-ВВ человека. Уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: AleI - 8096, Nco I - 2380, PmeI - 8434, XhoI - 438, EcoRI - 780.
Особенностью предложенной плазмидной конструкции является то, что нуклеотидная последовательность фактора роста тромбоцитов-В человека сконструирована с учетом частоты встречаемости кодонов P. pastoris с оптимальным процентным соотношением GC-пар и содержит на N-конце prepro сигнальный пептид α-фактора Saccharomyces cerevisiae.
Для получения штамма-продуцента полипептида со структурой и свойствами фактора роста тромбоцитов-В человека трансформируют клетки Pichia pastoris штамма GS115 (his4, mut+) рекомбинантной плазмидой pPDGFB. Полученный штамм GS115PDGFB характеризуется следующими признаками.
Морфологические признаки. Клетки крупные округлой формы, почкующиеся, 1×4-7 мкм, подвижные.
Культуральные признаки. При росте на плотной среде YPD колонии круглые, гладкие, блестящие, кремовые, край ровный, диаметр колоний 3-6 мм; консистенция пастообразная. Рост в жидкой среде YPD характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-30°С при оптимуме рН 4,0-6,2. В качестве источника азота используют как минеральные соли в виде смеси, так и органические соединения в виде пептона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют глицерин, глюкоза, метанол. В отличие от исходного штамма не является ауксотрофом по гистидину.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы, а также к генетицину (до 500 мкг/мл), обусловленную наличием в плазмиде гена Kan.
Штамм Pichia pastoris GS115PDGFB обеспечивает синтез полипептида со свойствами фактора роста тромбоцитов-ВВ человека в количестве не менее 40 мг целевого белка на литр культуры. Совокупность перечисленных свойств штамма обусловливает большую технологичность процесса получения рекомбинантного фермента.
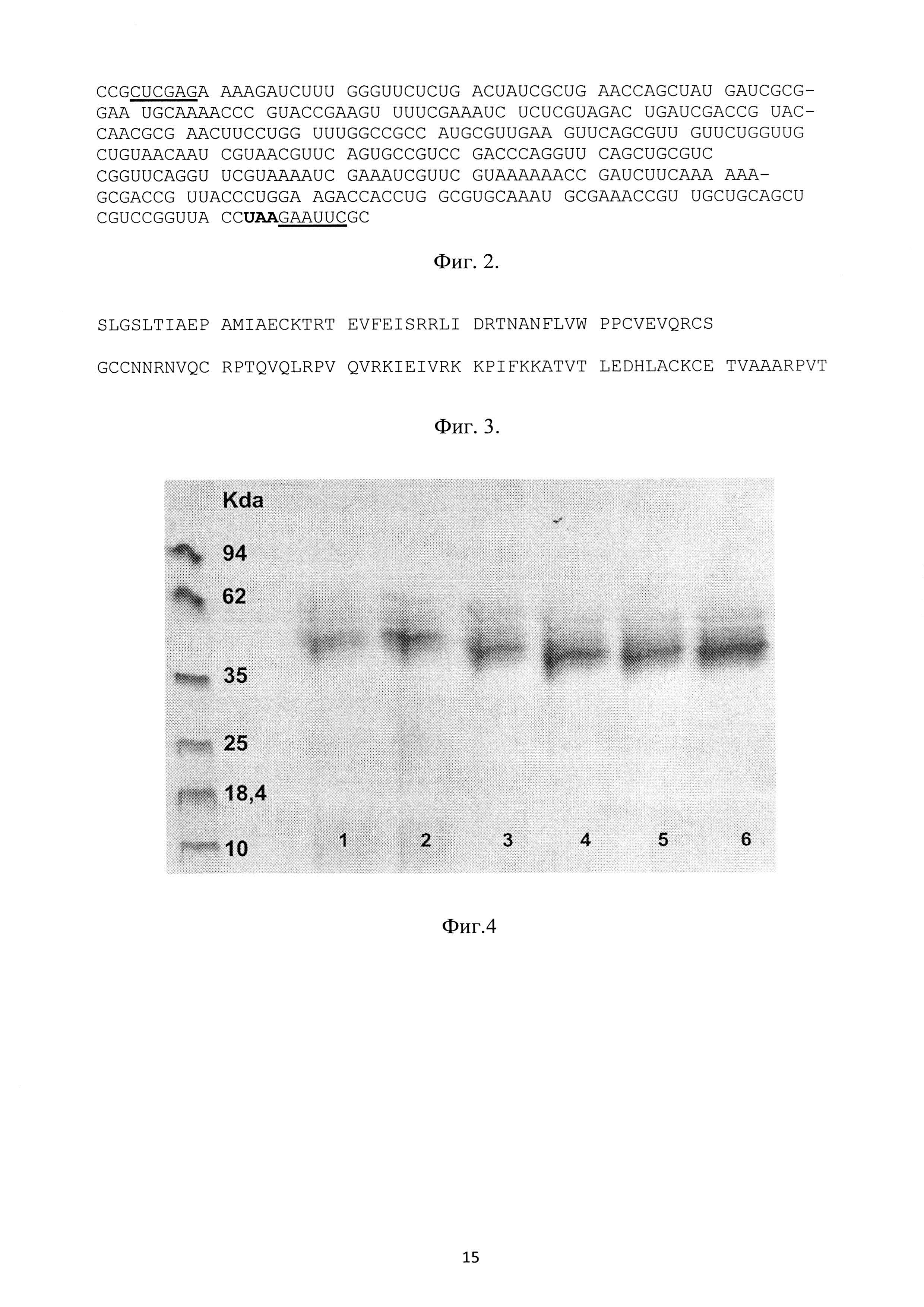
На фиг. 1 представлена физическая карта рекомбинантной плазмиды pPDGFB, где указаны уникальные сайты эндонуклеаз рестрикции, AmpR - ген β-лактамазы, KanR - ген фермента, обуславливающего устойчивость к генетицину, PDGFB- синтетический ген фактора роста тромбоцитов-В человека, aMF - prepro сигнальный пептид α-фактора Saccharomyces cerevisiae, регуляторные последовательности отмечены как 5'АОХ1 и 3'АОХ - фрагменты промотора P. pastoris, HIS4 - регуляторная последовательность и кДНК гистидинолдегидрогеназы; на фиг. 2 - нуклеотидная последовательность синтетического гена искусственного предшественника фактора роста тромбоцитов-В человека. Жирной линией подчеркнут сайт рестриктазы EcoRI, терминирующий кодон выделен жирным шрифтом; на фиг. 3 - аминокислотная последовательность полипептида, кодируемого рекомбинантной плазмидой pPDGFB.; на фиг. 4 - результаты денатурирующего ПААГ-гель электрофореза образцов культуральной жидкости трансформантов при определении уровня экспрессии и штамма-продуцента. Слева расположен маркер молекулярных весов (10; 18,4; 25; 35; 62; 90 КДа), далее трансформанты (номер подписан снизу).
Изобретение иллюстрируется следующими примерами.
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [Sambrook, J., Fritsch, E,F„ and Maniatis, T. Molecular Cloning; A Laboratory Manual, 1989, 2nd ed. Cold Spring Harbor Laboratory Press, New York; Ausubel, F.M., Brent, R., Kingston, R. E., Moore, D.D., Seidman, J.G., Smith, J.A., & Struhl, K. Current Protocols in Molecular Biology, 1997, John Wiley and Sons, New York; Cregg J.M, Higgins D.R. Production of foreign proteins in the yeast Pichia pastoris, 1995, Canadian J. Botany Supp. 73, 5981-5987].
Пример 1. Создание экспрессионного вектора рСРВН В качестве исходного материала служил вектор pPIC9K (Invitrogen, США). С целью накопления плазмиды, проводили трансформацию компетентных клеткок штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F'proAB laclqZ M15 Tn10 (Tetr)] (Stratagene, США), затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Исходя из известной нуклеотидной последовательности плазмиды и гена фермента, были с конструированы олигонуклеотидные последовательности для наработки искусственного гена со свойствами фактора роста тромбоцитов-В человека с необходимыми концевыми сайтами рестрикции. ПЦР-амплификацию проводили в два этапа. В реакцию вносили эквимолярную смесь (5 мкМ каждого) олигонуклеотидных праймеров (всех, кроме крайних), составляющих ген, взаимно перекрывающихся между собой на 15-20 нуклеотидов, 0.2 мкМ раствора dNTP, 1/10 часть реакционного 10х буфера и 1 и термостабильной ДНК-полимеразы PƒuI. Температуру отжига праймеров рассчитывали по стандартной формуле: Tm(°C)=2⋅[NA+NT]+4⋅[NC+NG]-10,
где Nx - количество соответствующих оснований. Реакцию проводили по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 10 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 55°С, 1 минута; синтез ДНК при 74°С, 2,5 минуты. Вторую амплификацию проводили, используя в качестве матрицы, раствор первой реакции и крайние праймеры, обеспечивающие синтез гена с необходимыми сайтами рестриктаз, по следующей схеме: денатурация ДНК при 95°С, 5 минут; затем 30 циклов: денатурация ДНК при 95°С, 1 минута; отжиг праймеров при 55°С, 1 минута; синтез ДНК при 74°С, 2,5 минуты.
Смесь для ПЦР (50 мкл):
5 мкл 10-кратного буфера для РƒuI-полимеразы («Евроген»);
5 мкл реакции 1;
0,5 мкл 100 мкМ праймера PDGF_f;
0,5 мкл 100 мкМ праймера PDGF_r;
1 мкл 10 мМ dNTP каждого вида («Fermentas»);
43 мкл деионизованной воды;
0,5 мкл PƒuI ДНК-полимеразы («Fermentas»).
После амплификации 5 мкл ПЦР смеси анализировали электрофорезом в 1%-ном агарозном геле и выявляли гомогенный фрагмент размером около 1230 пн. Фрагмент выделяли из геля с помощью набора GelElute Plasmid Miniprep Kit (Sigma, США) в соответствии с инструкцией производителя.
200 нг исходной плазмиды и 100 нг фрагмента (гена proPDGF) гидро-лизовали 20 единицами рестриктаз XhoI (New England Biolabs, США) и EcoRI (New England Biolabs, США). Выделенный из агарозного геля XhoI/EcoRI фрагмент клонировали в XhoI/EcoRI вектор pPIC9K - лигировали с помощью Т4 ДНК лигазы (на 20 нг вектора 1,5 нг фрагмента). Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichia coli XL1-Blue, затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Полученные образцы ДНК анализировали совместным гидролизом рестриктазами EcoRI/XhoI, NotI/NcoI, и отбирали «положительные» клоны, содержащие EcoRI/XhoI фрагменты размером 372 и 8406 п.н., AleI/NcoI фрагменты размером 2397 и 6381 п.н, а плазмиды анализировали на наличие мутаций методом секвенирования ДНК (ЦКП центра «Биоинженерия» РАН). В конечном счете, отбирают экспрессионный вектор, который обозначали как pPDGFB.
Пример 2. Создание экспрессионных кассет и отбор трансформантов для синтеза GPCR в клетках метилотрофных дрожжей Pichia Pastoris.
Необходимым условием стабильной экспрессии генов является создание экспрессионной кассеты. Для этого необходимо линеаризовать векторную молекулу по 5'-участку алкогольоксидазного промотора. После электропорации, в результате гомологичной рекомбинации идентичных участков промотора генома дрожжей и линеаризованного вектора, происходит включением интересующего гена в геном Pichia pastoris.
Для электропорации получали 5 мкл раствора ДНК (pPDGFB), предварительно линеаризованной путем гидролитического расщепления рестриктазой PmeI (Fermentas, Литва), с рабочей концентрацией не менее 2 мкг/мкл. 20 мкг плазмиды гидролизовали 100 единицами рестриктазы PmeI в течение 3 часов. К 1 объему реакционной смеси добавляли равный объем фенол-хлороформа (1:1). Перемешивали 30 сек на вортексе. Центрифугировали в течение 3 мин. Отбирали водную фазу и переносили в новую пробирку. Добавляли в пробирку с фенолхлороформом 100 мкл ТЕ-буфера, затем перемешивали 30 сек на вортексе и центрифугируют в течение 3 мин. Отбирали водную фазу при помощи пипетки и объединяли с той частью раствора, которая была отобрана ранее. Добавляли к раствору ДНК 1/10 объема 3М раствора ацетата Na, рН 6.0 и 3 объема этанола. Перемешивают, переворачивая пробирку несколько раз, и оставляют на 10 минут. Затем центрифугировали в течение 15 мин. Супернатант сливали, пробирку с осадком ДНК центрифугировали в течение 2 мин. Супернатант тщательно удаляли и добавляли 1 мл 70%-го этанола. Центрифугировали в течение 2 мин. Супернатант сливали. Снова повторяли центрифугирование в течение 2 мин и отбирали оставшуюся жидкость. Осадок высушивали в течение 5 мин и растворяют в 5 мкл ТЕ-буфера.
Культуру дрожжей штамма GS115 (his 4, mut+) растили на среде YPD в колбах Эйрленмейера на 500 мл до оптической плотности 1-2 единицы. Центрифугируют при 3000 х g в течение 5 минут.Биомассу суспендировали в 1 мМ DTT и 0,1 М HEPES, инкубировали на шейкере, в течение 30 минут. Затем культуру снова центрифугировали. Биомассу промывли холодной деи-онизированной водой 2 раза и суспендируют в 1 мл 1М сорбитола. Полученные клетки разливали по эппендорфам (по 40 мкл в каждый) и хранили при -70°С. Электропорацию проводили на электропораторе 2510 (Eppendorf, Германия) в специальных кюветах с зазором 2 мм. Рабочие характеристики -напряжение: 1500 В; емкость: 25 мкФ; сопротивление: 600 Ом. После электропорации быстро добавляли 1 мл холодного раствора 1М сорбитола и ставили в термостат на 1 час при температуре 30°С.
Для отбора трансформантов проводили на минимальной среде, не содержащей гистидин. После электропорации культуру клеток рассевали на чашки с плотной питательной средой MD agar. Полученные трансформанты переносили на плотный питательный агар YPD, содержащей генетицин в концентрациях 0,01; 0,02; 0,05; 0,1; 0,5 мг/мл. Полученные клоны проверяли с помощью ПЦР-скрининга. Готовили ПЦР-смесь объемом 20 мкл по следующей схеме:
2 мкл 10-кратного буфера для Taq-полимеразы («Евроген»);
0,15 мкл 120 мкМ праймера AOX1_f;
0,15 мкл 150 мкМ праймера YCl_r;
0,4 мкл 10 мМ dNTP каждого вида («Fermentas»);
17 мкл деионизованной воды;
0,2 мкл Taq ДНК-полимеразы («Евроген»).
В каждую пробирку добавляли клетки трансформантов с плотной среды. Тщательно суспендировали и амплифицировали по следующей схеме: 95°, 5' (денатурация), 95°, 30”; 45°, 30”; 74°, 1’30” (амплификация).
«Положительные» клоны отбирали для определения уровня экспрессии рекомбинантного белка.
Пример 3. Культивирование трансформантов и определение уровня экспрессии гена PDGFB.
Трансформанты с чашек переносили на среду YPD (10 мл) и растили при 30°С до оптической плотности 2-4 единицы. Затем культурой клеток инокулировали среду BMGY (25 мл) (разведение в 100 раз) и инкубировали в течение 48 часов при 30°С в колбах объемом 250 мл. Полученную биомассу собирали центрифугированием при 2000×g в течение 5 минут и переносили в среду BMMY (10 мл), содержащей 1% (v/v) метанола. Выращивание проводили в колбах на 100 мл в течение 72 часов, добавляя каждые 24 часа в среду 1% (v/v) метанола. После выращивания культуральную жидкость отделяли от биомассы центрифугированием при 3000×g в течение 5 минут при 4°С. Полученные образцы смешивали с 1/6 объема «Sample Loading Buffer 6×» и анализировали при помощи денатурирующего ПААГ-электрофореза в стандартном режиме. Клон с максимальным уровнем экспрессии обозначили как GS115PDGFBB.