Результат интеллектуальной деятельности: Нитроны стероидов для лечения и предотвращения инсульта или ишемии головного мога, болезни Альцгеймера, болезни Паркинсона и бокового амиотрофического склероза
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к области медицины, в частности к применению нитронов стероидов для лечения и предотвращения инсульта или ишемии головного мозга, болезни Альцгеймера, болезни Паркинсона и бокового амиотрофического склероза.
Предшествующий уровень техники
Известно, что окисление липидов клеточной мембраны является одним из наиболее важных фармакологических событий, происходящих во время инсульта, приводящих к смерти ткани головного мозга и нейронов (Brouns, R.; De Deyn, P. P. The complexity of neurobiological processes in acute ischemic stroke. Clin. Neurol. Neurosurg. 2009, 111, 483-495).
Соответственно, одно из самых активных направлений исследования в области лечения инсультов направлено на поиск новых проникающих агентов с высокой антиоксидантной активностью и сильным нейропротекторным действием, способных блокировать различные типы свободных радикалов кислорода (Reactive oxygen species, ROS),, ответственных за окислительный стресс, вызванный инсультом - серьезная и быстро растущая патология в развитых обществах, для которой не существует эффективного лечения и которая является четвертой по частоте причиной смерти после рака, ишемической болезни сердца и болезни Альцгеймера (Chan, Р.Н. The role of oxygen radicals in brain injury and edema, in Chow CK (ed): Cellular Antioxidant Defense Mechanisms, Volume III. Boca Raton, Florida, CRC Press, Inc, 1988, pp. 89-109). В действительности, мембрана нейрона богата полиненасыщенными жирными кислотами, которые особенно чувствительны к атакам гидроксидных, пероксильных и супероксидных типов ROS в положении, соседствующих с двойными связями, что приводит к созданию высокореактивных аллильных радикалов, способных генерировать новые радикальные цепные реакции, т.е. новые, более сложные радикалы, или взаимодействовать с металлами, такими как железо, с образованием новых, еще более токсичных и вредных радикалов. По этой причине стратегия борьбы с инсультом, основанная на разработке агентов, улавливающих и блокирующих ROS, является областью постоянного интереса и исследования.
В этом контексте органические соединения типа нитронов, учитывая их строение и свойства, сыграли ключевую роль в последние тридцать лет, но, к сожалению, их предполагаемая полезная активность в ряде клинических испытаний, которым подвергался широкий спектр указанных соединений, в дальнейшем не была подтверждена (Floyd, R.Α.; Kорkе, R.D. Choi, С.Η.; Foster, S.В.; Doblas, S.; Towner, R.A. Nitrones as therapeutics. Free Radie. Biol. Med. 2008, 45, 1361-1374).
В этом смысле, (Ζ)-α-фенил-N-трет-бутилнитрон (ФБН), ингибирует окисление липопротеинов (Kalyanaraman, В.; Joseph, J.; Parthasarathy, S. The spin trap, α-phenyl N-tert-butylnitrone, inhibits the oxidative modification of low density lipoprotein FEBS Lett. 1991, 280, 17-20), уменьшает окислительное повреждение в красных кровяных клетках, перекисное окисление липидов из-за фенилгидразинов (Hill, Η.Α.; Thornalley, P.J. The effect of spin traps on phenylhydrazine-induced haemolysis. Biochim. Biophys. Acta 1983, 762, 44-51), и защищает крыс от ишемии и от токсичности МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридина). (Margaill, I.; Plotkine, M.; Lerouet, D. Antioxidant strategies in the treatment of stroke. Free. Radie. Biol. Med. 2005, 39, 429-443).
Нитрон NXY-059 (Kuroda, S.; Tsuchidate, R.; Smith, M.L; Maples, K.R.; Siesjo, B.K. Neuroprotective effects of a novel nitrone, NXY-059, after transient focal cerebral ischaemia in the rat. J. Cereb. Blood Flow Metab. 1999, 19, 778-787) является отличной нейропротекторной ловушкой ROS, но его клинические испытания неоднократно заканчивались неудачно (Macleod, M.R.; van der Worp, H.В.; Sena, E.S.; Howells, D.W.; Dirnagl, U.; Donnan, G.A. Evidence for the efficacy of NXY-059 in experimental focal cerebral ischaemia is confounded by study quality. Stroke 2008, 39, 2824-2829).
Тем не менее, попытки найти оптимальные нитроны не прекращались [(а) Goldstein, S.; P. Lestage, P. Chemical and pharmacological aspects of heteroaryl-nitrones. Curr. Med. Chem. 2000, 7, 1255-1267; (b) Dias, A.G.; Santos, С.Ε.; Cyrino, F.Ζ.; Bouskela, Ε.; Costa, P.R. N-tert-Butyl and N-methyl nitrones derived from aromatic aldehydes inhibit macromolecular permeability increase induced by ischemia/reperfusion in hamsters. Bioorg. Med. Chem. 2009, 17, 3995-3998; (c) Porcal, W.; P.  , P.;
, P.;  M.; Ferreira, Α.; Olea-Azar, С; Cerecetto, Η.; Castro, Α. Heteroarylnitrones as drugs for neurodegenerative diseases: Synthesis, neuroprotective properties, and free radical scavenger properties. J. Med. Chem. 2008, 51, 6150-6159; (d) Kim, S.; Bouajila, J.; Dias, A.G.; Cyrino, F.Z.; Bouskela, E.; Costa, P.R.; Nepveu, F. α-Phenyl-N-tert-butyl nitrone (PBN) derivatives: Synthesis and protective action against microvascular damages induced by ischemia/reperfusion. Bioorg. Med. Chem. 2007, 15, 3572-3578; (e) Balogh, G.T.; Vukics, K.; Konczol, Α.; Kis-Varga, Α.; Gere, Α.; Fischer, J. Nitrone derivatives of trolox as neuroprotective agents. Bioorg. Med. Chem. Lett. 2005, 15, 3012-3015; (f) Becker, D.Α.; Ley, J.J.; Echegoyen, L.; Alvarado, R. Stilbazulenyl nitrone (STAZN): A nitronyl-substituted hydrocarbon with the potency of classical phenolic chain-breaking antioxidants. J. Am. Chem. Soc. 2002, 124, 4678-4684; (g) Dhainaut, Α.; Tizot, Α.; Raimbaud, E.; Lockhart, В.; Lestage, P.; Goldstein, S. Synthesis, structure, and neuroprotective properties of novel imidazolyl nitrones. J. Med. Chem. 2000, 43, 2165-2175].
M.; Ferreira, Α.; Olea-Azar, С; Cerecetto, Η.; Castro, Α. Heteroarylnitrones as drugs for neurodegenerative diseases: Synthesis, neuroprotective properties, and free radical scavenger properties. J. Med. Chem. 2008, 51, 6150-6159; (d) Kim, S.; Bouajila, J.; Dias, A.G.; Cyrino, F.Z.; Bouskela, E.; Costa, P.R.; Nepveu, F. α-Phenyl-N-tert-butyl nitrone (PBN) derivatives: Synthesis and protective action against microvascular damages induced by ischemia/reperfusion. Bioorg. Med. Chem. 2007, 15, 3572-3578; (e) Balogh, G.T.; Vukics, K.; Konczol, Α.; Kis-Varga, Α.; Gere, Α.; Fischer, J. Nitrone derivatives of trolox as neuroprotective agents. Bioorg. Med. Chem. Lett. 2005, 15, 3012-3015; (f) Becker, D.Α.; Ley, J.J.; Echegoyen, L.; Alvarado, R. Stilbazulenyl nitrone (STAZN): A nitronyl-substituted hydrocarbon with the potency of classical phenolic chain-breaking antioxidants. J. Am. Chem. Soc. 2002, 124, 4678-4684; (g) Dhainaut, Α.; Tizot, Α.; Raimbaud, E.; Lockhart, В.; Lestage, P.; Goldstein, S. Synthesis, structure, and neuroprotective properties of novel imidazolyl nitrones. J. Med. Chem. 2000, 43, 2165-2175].
С другой стороны, стероиды представляют собой органические соединения, обладающие доказанной биологической активностью, в том числе способностью выступать в качестве нейропротекторов в воспалительных процессах, затрагивающих центральную нервную систему, переходящих в неврологические заболевания: такие как ишемия головного мозга, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз.
Краткое описание графических материалов
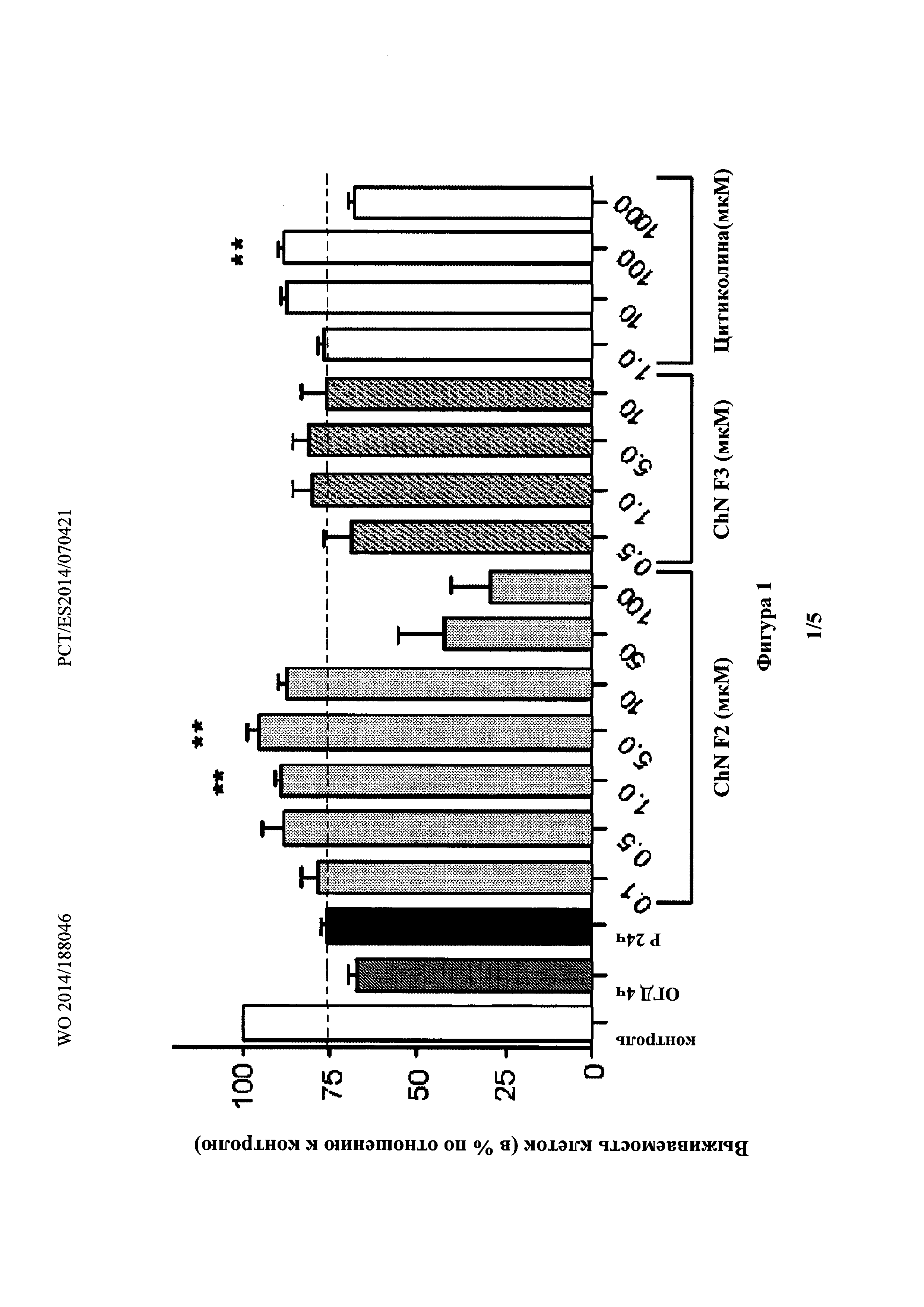
Фиг. 1 показывает, что добавление холестеронитрона F2 при концентрации 1 или 5 мкМ, но не холестеронитрона F3, значительно увеличивало выживаемость нейронов во время реперфузии, и что контрольное значение (89,1% и 95,5%, для холестеронитрона F2, взятого в концентрации 1 или 5 мкм, соответственно; ANOVA, p<0,0001 и p<0,01, критерий Даннета по сравнению с Р24 ч), было практически достигнуто при концентрации 5 мкМ.
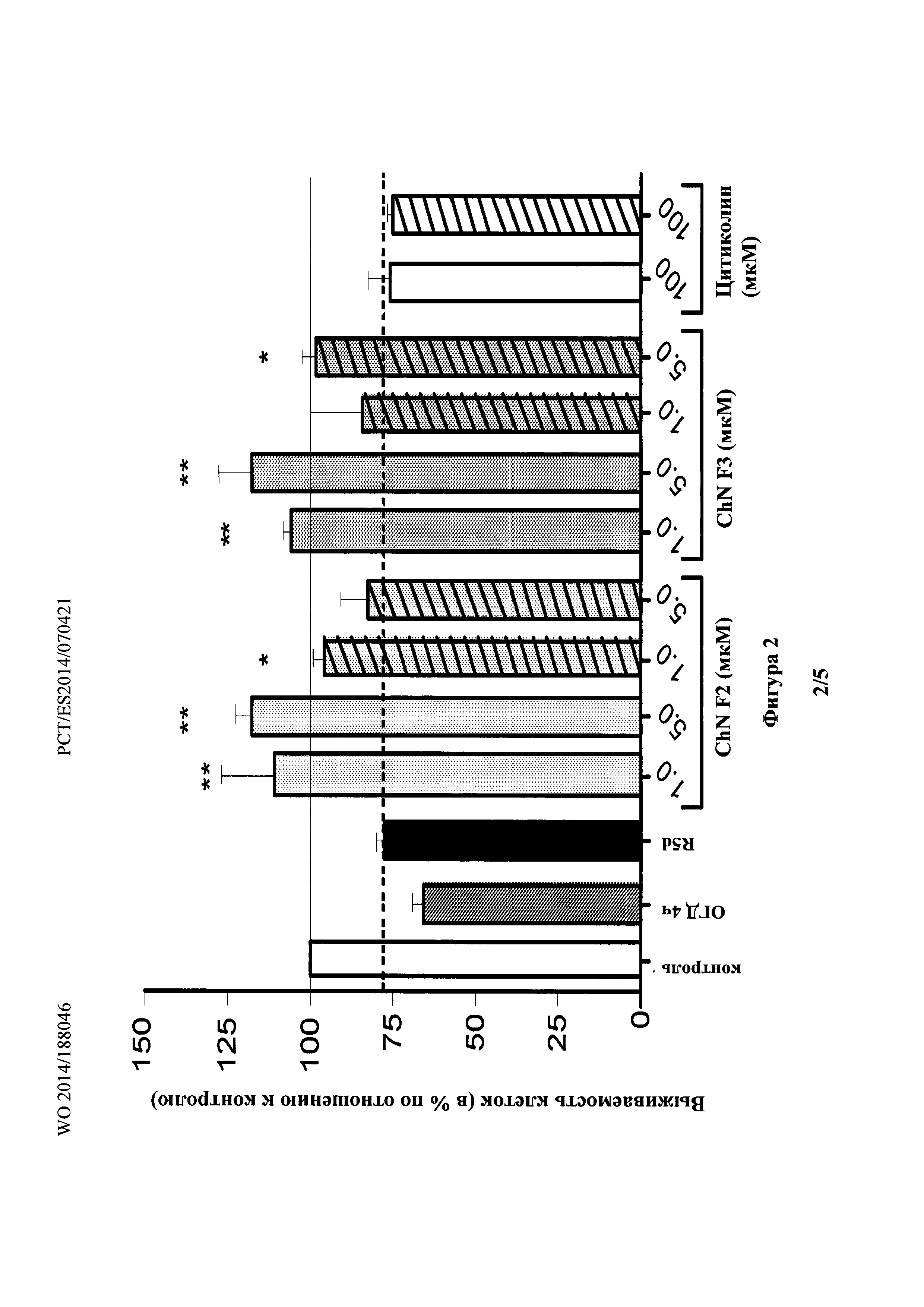
Фиг. 2 показывает, что эксперимент R5d индуцировал более чем заметное снижение выживаемости клеток (77,7%; p<0,0001 по сравнению с 100% клеток в контроле, одновыборочный t-критерий).
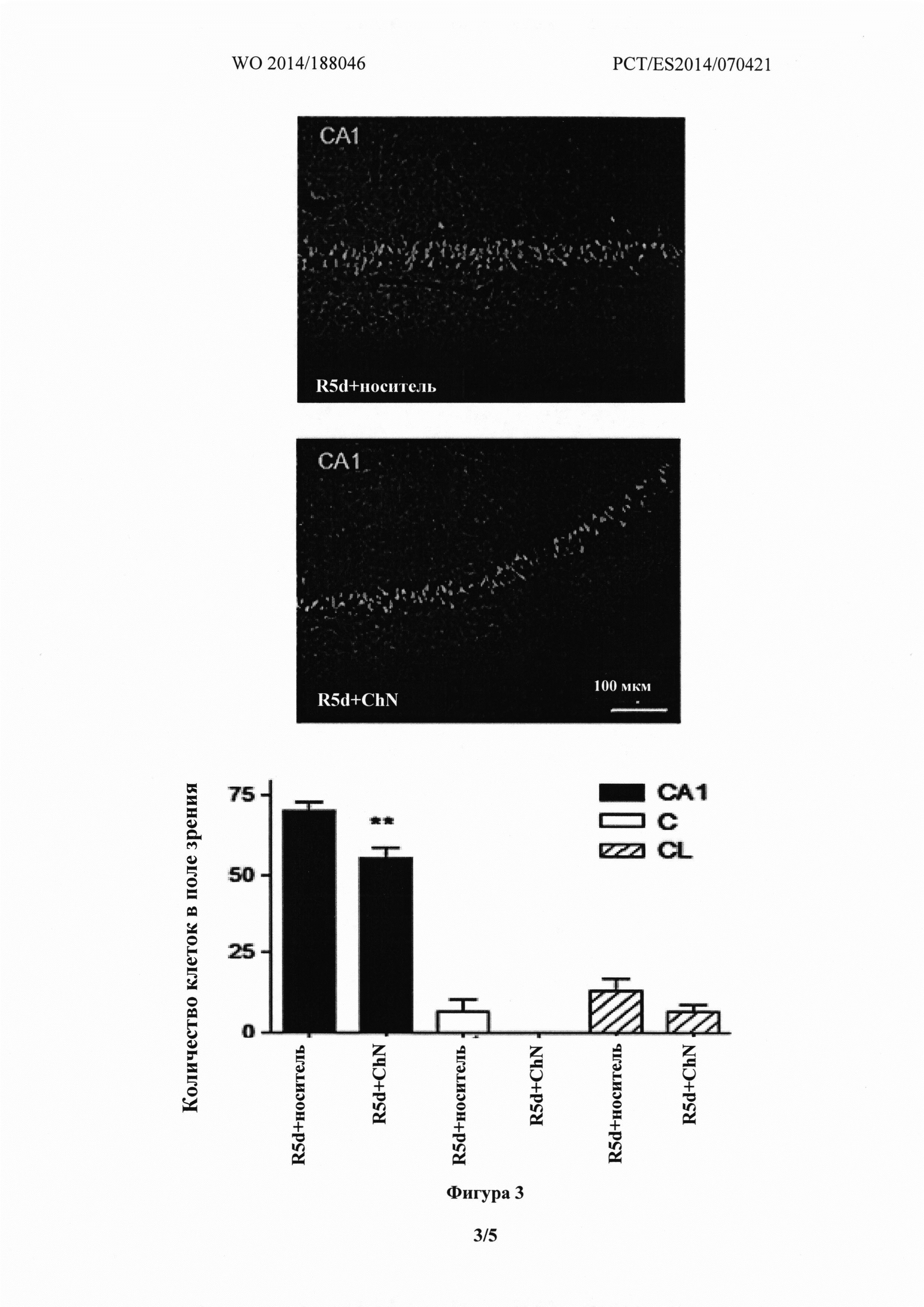
Фиг. 3 показывает, что у животных, получавших холестеронитрон F2, наблюдалось значительное снижение апоптоза в области СА1 (СА1) гиппокампа через пять дней, в эксперименте (R5d) (70,4±2,4 по сравнению с 55,1±3,4 клетками в поле зрения, у животных, получавших солевой раствор и холестеронитрон F2, соответственно, ANOVA, p<0,0001 и p<0.01, критерий Ньюмена-Кейлса).
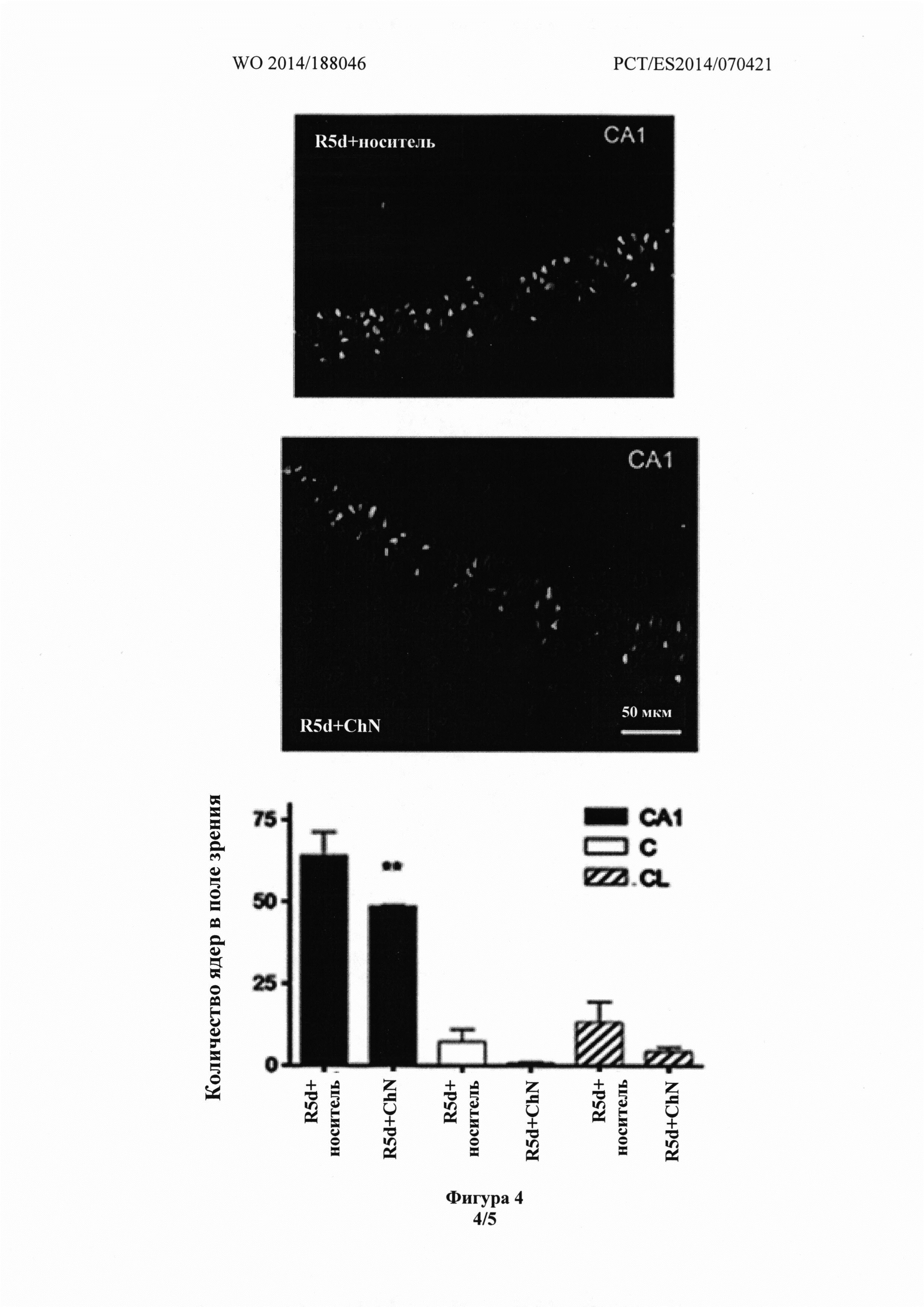
Фиг. 4 показывает, что срезы головного мозга животных, получавших носитель (R5d), демонстрировали более высокий уровень TUNEL-положительных клеток в области СА1 гиппокампа, в церебральном кортексе и латеральном кортексе, по сравнению со срезами головного мозга животных, получавших холестеронитрон.
Таким образом, указанные результаты показали, что у животных, получавших холестеронитрон F2, апоптоз нейронов значительно снижался в области СА1 гиппокампа через 5 дней после реперфузии (R5d) (64.1±7.1 по сравнению с 48.5±0.4 ядрами в поле зрения, у животных, получавших носитель и холестеронитрон, соответственно; ANOVA, p<0.0001 и p<0.01, критерий Ньюмена-Кейлса).
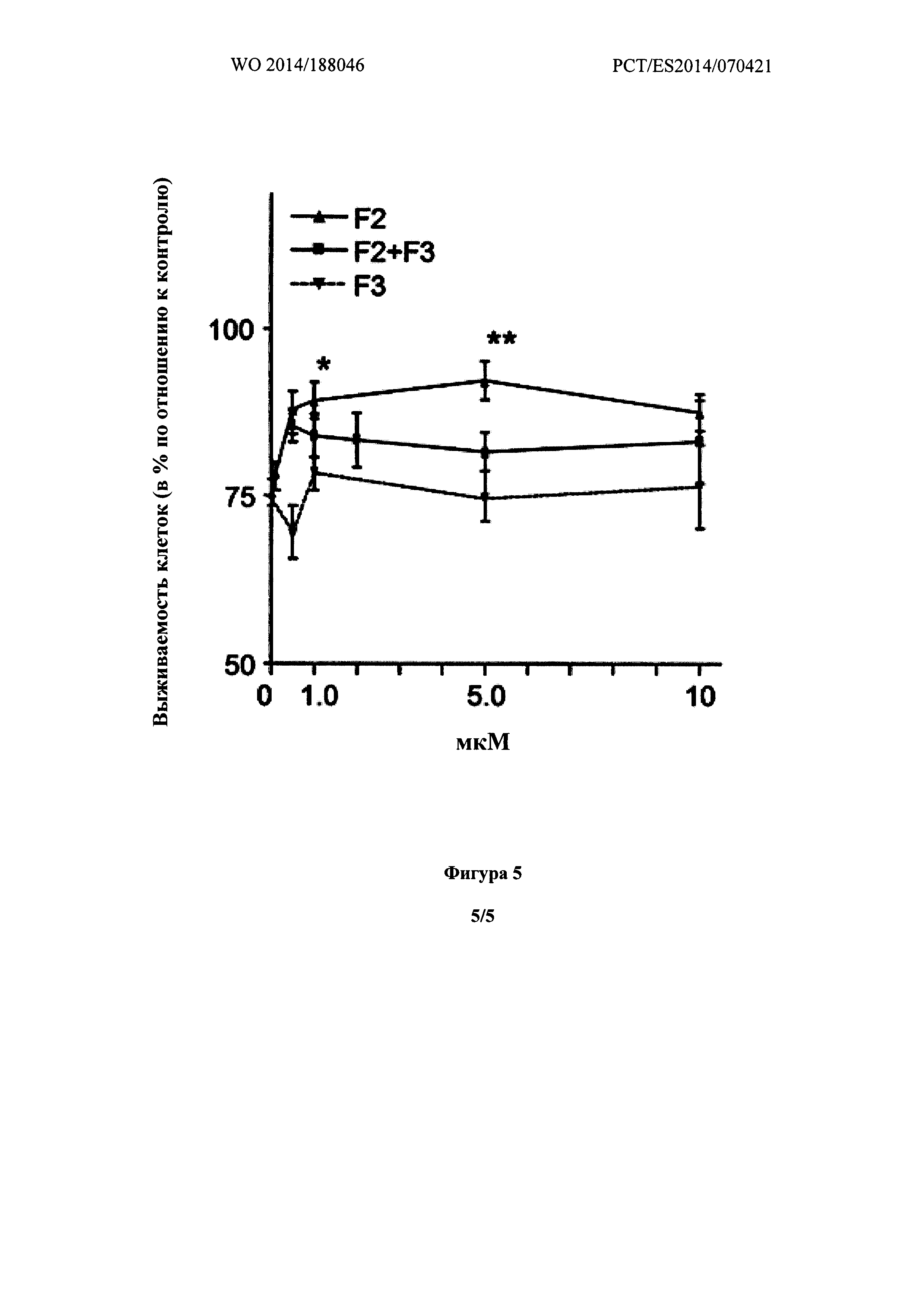
Фиг. 5 показывает выживаемость нейронов в нейрональных культурах, находившихся под действием ОГД (оксоглутарат-дегидрогеназы) и обработанных F2, F3 и смесью F2:F3 (в соотношении 1:1, F2+F3) в указанных концентрациях. F2 и/или F3 были добавлены, в начале периода восстановления. Выживаемость нейронов определяли через 24 часа после восстановления.
Описание изобретения
В контексте недавнего исследования, посвященного синтезу и биологической оценке новых нитронов для лечения инсультов [(a) Abdelouahid, S.; Soriano, Ε.; Revuelta, J.; Valderas, С; Chioua, M.; Garrido, I.;  , В.; Tomassolli, I.; Ismaili, L;
, В.; Tomassolli, I.; Ismaili, L;  , L.; Villarroya, M.;
, L.; Villarroya, M.;  , A.G.; Oset-Gasque M.J.; Marco-Contelles, J. Synthesis, structure, theoretical and experimental in vitro antioxidant/pharmacological properties of α-aryl, N-alkyl nitrones, as potential agents for the treatment of cerebral ischemia. Bioorg. Med. Chem. 2011, 19, 951-960; (b) Chioua, M.; Sucunza, D.; Soriano, E.; Hadjipavlou-Litina, D.;
, A.G.; Oset-Gasque M.J.; Marco-Contelles, J. Synthesis, structure, theoretical and experimental in vitro antioxidant/pharmacological properties of α-aryl, N-alkyl nitrones, as potential agents for the treatment of cerebral ischemia. Bioorg. Med. Chem. 2011, 19, 951-960; (b) Chioua, M.; Sucunza, D.; Soriano, E.; Hadjipavlou-Litina, D.; 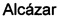 , Α.; Ayuso, I.; Oset-Gasque, M.J.;
, Α.; Ayuso, I.; Oset-Gasque, M.J.;  , M.P.; Monjas, L.;
, M.P.; Monjas, L.;  , M.I.; Marco-Contelles, J.; Samadi, A. α-Aryl-N-alkyl Nitrones, as Potential Agents for Stroke Treatment: Synthesis, Theoretical Calculations, Antioxidant, Anti-inflammatory, Neuroprotective and Brain-Blood Barrier Permeability Properties, J. Med. Chem. 2012, 55, 153-168; (c) Arce, С;
, M.I.; Marco-Contelles, J.; Samadi, A. α-Aryl-N-alkyl Nitrones, as Potential Agents for Stroke Treatment: Synthesis, Theoretical Calculations, Antioxidant, Anti-inflammatory, Neuroprotective and Brain-Blood Barrier Permeability Properties, J. Med. Chem. 2012, 55, 153-168; (c) Arce, С;  , S.; Canales, M.J.; Marco-Contelles, J.; Samadi, Α.; Oset-Gasque, M.J.;
, S.; Canales, M.J.; Marco-Contelles, J.; Samadi, Α.; Oset-Gasque, M.J.;  , M.P. Drugs for stroke: Action of nitrone (Z)-N-(2-bromo-5-hydroxy-4-methoxybenzylidene)-2-methylpropan-2-amine oxide on rat cortical neurons in culture subjected to oxygen-glucose-deprivation. Eur. J. Med. Chem. 2012, 55, 475-479], а также на основании настоящего и предшествующего уровней техники, описанных выше, в лаборатории были разработаны гибридные молекулы, которые совмещают и помещают рядом друг с другом "мотив стероида" и другой "мотив нитрона", что приводит к появлению новых химических структурных единиц, называемых «нитронами стероидов».
, M.P. Drugs for stroke: Action of nitrone (Z)-N-(2-bromo-5-hydroxy-4-methoxybenzylidene)-2-methylpropan-2-amine oxide on rat cortical neurons in culture subjected to oxygen-glucose-deprivation. Eur. J. Med. Chem. 2012, 55, 475-479], а также на основании настоящего и предшествующего уровней техники, описанных выше, в лаборатории были разработаны гибридные молекулы, которые совмещают и помещают рядом друг с другом "мотив стероида" и другой "мотив нитрона", что приводит к появлению новых химических структурных единиц, называемых «нитронами стероидов».
Несмотря на то, что нитроны стероидов были известны в течение многих лет [(a) Weintraub, P.M.; Tiernan, P.L. Steroidal nitrones, J. Org. Chem. 1974, 39, 1061-1065; (b) Joseph, S.P., Dhar, D.N. Reaction of chlorosulfonyl isocyanate with nitrones: An efficient method for the synthesis of cyclic enamides and 2H-pyrroles. Tetrahedron 1988, 44, 5209-5214; (c) Hwu, J.R.; Khoudary, K.P.; Tsay, S.-C. Selectivity of the bulky proton-containing reagent N-methyl-N,O-bis(trimethylsilyl)hydroxylamine in the formation of nitrones, J. Organometallic Chem. 1990, 399, C13-C17; (d) Barton, D. H.R.; Day, M.J.; Hesse, R.H. A new rearrangement of ketonic nitrones: A convenient alternative to the Beckmann rearrangement. J. Chem. Soc; Perkin Trans. 1975, 1764-1767; (e) Barton, D.H. R.; Choi, L.S. L; Lister-James, J.; Hesse, R.H. Preparation and reactions of steroidal cross-conjugated 3-nitrones. J. Chem. Soc; Perkin Trans. 1982, 2599-2606], их фармакологическая активность и возможное применение в определенных методах лечения болезней, неожиданно выяснилось, что они почти не были задействованы и исследованы [(a) Blasig, L.Е.; Mertsch, K.; Haseloff, R.F. Nitronyl nitroxides, a novel group of protective agents against oxidative stress in endothelial cells forming the blood-brain-barrier, Neuropharmacology 2002, 43, 1006-1014; (b) Robinson, A.J.; of Lucca, I.; Drummond, S.; Bosewell, G.A. Steroidal nitrone inhibitors of 5α-reductase, Tetrahedron Lett. 2003, 44, 4801-4804].
Таким образом, настоящая заявка описывает применение нейропротекторных, антиоксидантных нитронов стероидов формулы Ia-c и их геометрических изомеров Е и Z, для которых гематоэнцефалический барьер является высокопроницаемым, в качестве потенциальных агентов и препаратов для лечения инсульта или ишемии головного мозга, болезни Альцгеймера, болезни Паркинсона и бокового амиотрофического склероза, и где,
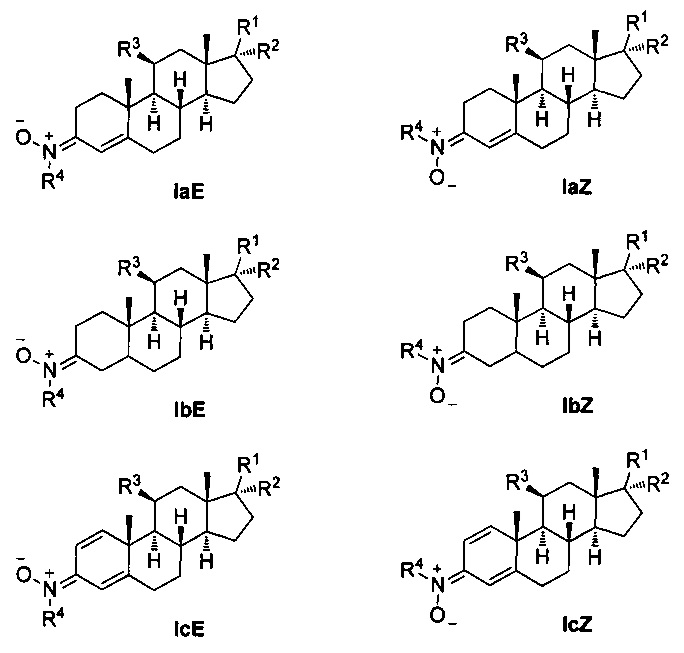
R1 независимо представляет собой замещенный или незамещенный С1-С10 алкильный радикал, α-гидроксикетон, α-метилкетон или гидроксильные группы, галоген, эфир с замещенным или незамещенным С1-С10 алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10 алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами;
R2 представляет собой атом водорода, замещенный или незамещенный С1-С10 алкильный радикал, гидроксил, галоген, эфир с замещенным или незамещенным С1-С10 алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10 алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами, или ацилоксигруппу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10-алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом;
R3 представляет собой атом водорода, или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R4 представляет собой метильную, трет-бутильную или бензильную группу.
Общепринятыми, хотя и не ограничивающие примерами этого семейства соединений являются:
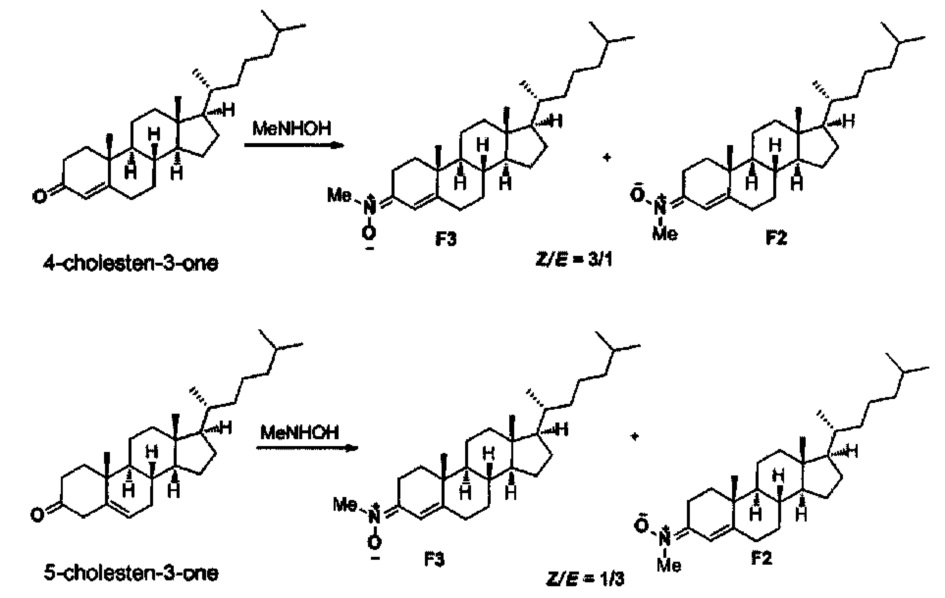
- (E)-N-((8S,9S,10R,13R,14S,17R)-10,13-диметил-17-((R)-6-метилгептан-2-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-1Н-циклопента[а]фенантрен-3(2Н,6Н,10Н)-илиден)метанамин оксид (F2), и
- (Z)-N-((8S,9S,10R,13R,14S,17R)-10,13-диметил-17-((R)-6-метилгептан-2-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-1Н-циклопента[а]фенантрен-3(2Н,6Н,10Н)-илиден)метанамин оксид (F3), полученные из 4-холестен-3-она или 5-холестен-3-она путем реакции с N-метилгидроксиламином, по следующей схеме.
Дополнительно, любое из указанных соединений, упомянутых в качестве примеров по настоящему изобретению, может быть использовано отдельно или в комбинации, в частности, в качестве адъювантной терапии, проводимой совместно, альтернативно или последовательно по отношению к терапии первой линии, подходящей для лечения неврологических заболеваний, таких как ишемия головного мозга, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз. В этом смысле, нитроны стероидов формулы Ia-с, вводимые совместно, альтернативно или последовательно, по отношению к тромболитическому агенту, обеспечивают особенно подходящую терапию для лечения ишемии головного мозга, в частности, острой ишемии головного мозга.
Таким образом, один из аспектов настоящего изобретения относится к композиции, содержащей производное нитрона стероида формулы Ia-с, и его геометрические изомеры Е и Z в двойной связи R4N(O)=C(3),
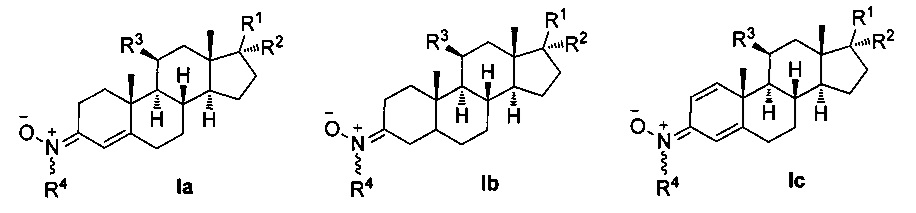
где R1 независимо представляет собой замещенный или незамещенный С1-С10 алкильный радикал, α-гидроксикетон, α-метилкетон, или гидроксильные группы, галоген, эфир с замещенным или незамещенным С1-С10 алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10 алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами;
R2 представляет собой атом водорода, замещенный или незамещенный С1-С10 алкильный радикал, гидроксил, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами, или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10-алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R3 представляет собой атом водорода, или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R4 представляет собой метильную, трет-бутильную- или бензильную группу;
для использования в качестве адъювантной терапии, проводимой совместно, альтернативно или последовательно по отношению к терапии первой линии для лечения неврологических заболеваний, таких как церебральная ишемия, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз. Производное нитрона стероида предпочтительно выбирают из группы, состоящей из холестеронитрона F2 и F3.
Альтернативно, этот аспект настоящего изобретения относится к применению композиции, содержащей описанные выше производные нитронов стероидов, для получения лекарственного препарата для применения в качестве адъювантной терапии, проводимой совместно, альтернативно или последовательно, по отношению к терапии первой линии, подходящей для лечения таких неврологических заболеваний, как ишемия головного мозга, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз. Производное нитрона стероида, предпочтительно, выбирают из группы, включающей холестеронитроны F2 и F3.
Другой аспект настоящего изобретения относится к композиции, содержащей производные нитронов стероидов, описанные выше, предпочтительно производные нитронов стероидов, выбранные из группы, включающей холестеронитроны F2 и F3, для получения лекарственного препарата для применения в качестве адъювантной терапии, проводимой совместно, альтернативно, или последовательно по отношению к терапии первой линии для лечения ишемии головного мозга, где указанная первичная терапия или терапия первой линии включает применение тромболитического агента, предпочтительно, использование тканевого активатора плазминогена (rt-PA). Дополнительно, настоящее изобретение относится к способу определения и оценки, в быстром и возможно автоматизированном режиме, соединений, имеющих высокую нейропротекторную активность и предполагающих возможность эффективной терапии неврологических заболеваний: таких как ишемия головного мозга, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз.
Для выполнения вышеуказанного скрининга лекарства используют производные нитронов стероидов формулы Ia-с и их геометрические изомеры Ε и Ζ в двойной связи R4N(O)=C(3),
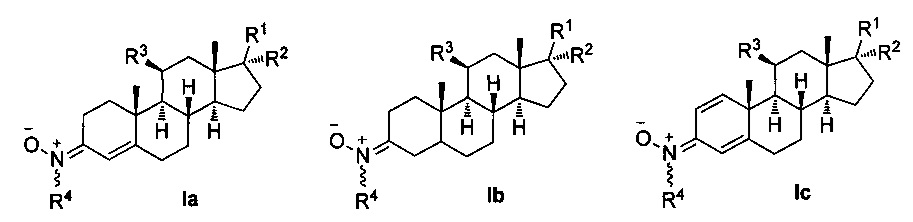
где R1 независимо представляет собой замещенный или незамещенный С1-С10 алкильный радикал, α-гидроксикетон, α-метилкетон, или гидроксильные группы, галоген, эфир с замещенным или незамещенным С1-С10 алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10 алкильным радикалом; третичные амины с двумя замещенными или незамещенными С1-С10 алкильными радикалами;
R2 представляет собой атом водорода, замещенный или незамещенный С1-С10 алкильный радикал, гидроксил, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом, первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами, или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10-алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R3 представляет собой атом водорода, или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом, или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R4 представляет собой метильную, трет-бутильную или бензильную группу.
Для подтверждения нейропротекторной активности указанных нитронов стероидов формулы Ia-c, и обеспечения возможности выбора соединений с наиболее высокой активностью, их нейропротекторную активность определяли с помощью любых in vitro или in vivo моделей или анализов, подходящих для этой цели. Указанные модели или анализы известны специалистам в данной области техники; тем не менее, и, исключительно в качестве примера, возможным анализом для определения нейропротекторной активности нитронов стероидов формулы Ia-с и их возможного применения при лечении неврологических заболеваний, было бы определение выживаемости клеток на первичных нейрональных культурах, культивируемых от 6 до 8 дней, взятых из церебрального кортекса крыс, (Quevedo, С, Salinas, M,  , A. Initiation factor 2B activity is regulated by protein phosphatase 1, which is activated by the mitogen-activated protein kinase-dependent pathway in insulin-like growth factor 1-stimulated neuronal cells. J. Biol. Chem. 2003, 278, 16579-16586), and subjected to oxygen-glucose deprivation (OGD) (Chioua M, Sucunza D, Soriano E, Hadjipavlou-Litina D,
, A. Initiation factor 2B activity is regulated by protein phosphatase 1, which is activated by the mitogen-activated protein kinase-dependent pathway in insulin-like growth factor 1-stimulated neuronal cells. J. Biol. Chem. 2003, 278, 16579-16586), and subjected to oxygen-glucose deprivation (OGD) (Chioua M, Sucunza D, Soriano E, Hadjipavlou-Litina D,  A, Ayuso I, Oset-Gasque MJ,
A, Ayuso I, Oset-Gasque MJ,  MP, Monjas L, Rodriguez-Franco MI, Marco-Contelles J, Samadi A. α-aryl-N-alkyl nitrones, as potential agents for stroke treatment: synthesis, theoretical calculations, antioxidant, anti-inflammatory, neuroprotective, and brain-blood barrier permeability properties. J Med Chem. 2012, 55, 153-168), в соответствии со следующим протоколом:
MP, Monjas L, Rodriguez-Franco MI, Marco-Contelles J, Samadi A. α-aryl-N-alkyl nitrones, as potential agents for stroke treatment: synthesis, theoretical calculations, antioxidant, anti-inflammatory, neuroprotective, and brain-blood barrier permeability properties. J Med Chem. 2012, 55, 153-168), в соответствии со следующим протоколом:
Выживаемость клеток измеряют с использованием 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолий бромида (МТТ-тест). Таким образом, воздействие ОГД на нейрональные культуры в течение 4 ч (ОГД 4 ч) вызывает значительное снижение выживаемости клеток 67.3% (р<0,0001 по сравнению со 100% в контроле, одновыборочный t-критерий), которая частично восстанавливается через 24 часа после реперфузии (Р24 ч, 76,1%; р<0,0022 по сравнению с ОГД 4 ч, t-критерий Стьюдента), но не достигает контрольного значения в 24 ч (р<0,0001 по сравнению с 100% в контролем, одновыборочный t-критерий). В этом смысле, для оценки нейропротекторной активности нитронов стероидов формулы Ia-c, их добавляют в первичную культуру в начале периода реперфузии, используя известный нейропротекторный агент цитиколин в качестве референсного соединения. Выбирают те нитроны стероидов формулы Ia-c, которые имеют более высокую нейропротекторную активность по сравнению с цитиколином.
Дополнительно, а также в качестве примера второй моделью, которая позволяет выбрать нитроны стероидов формулы Ia-c с более высокой нейропротекторной активностью, была бы индукция глобальной ишемии у взрослых крыс в соответствии с методом окклюзии четырех сосудов, [(a)  de la Vega С, Burda J, Nemethova M, Quevedo С,
de la Vega С, Burda J, Nemethova M, Quevedo С,  A,
A,  ME, Salinas M. Possible mechanisms involved in the down-regulation of translation during transient global ischaemia in the rat brain. Biochem J 2001, 357, 819-826; (b)
ME, Salinas M. Possible mechanisms involved in the down-regulation of translation during transient global ischaemia in the rat brain. Biochem J 2001, 357, 819-826; (b)  L, Cid С,
L, Cid С,  A, Burda J, Ayuso I, Salinas M. Regulation proteins of eukaryotic initiation factor 2-alpha subunit (eIF2a) phosphatase, under ischemic reperfusion and tolerance. J Neurochem 2007, 103, 1368-1380; (c) Ayuso MI,
A, Burda J, Ayuso I, Salinas M. Regulation proteins of eukaryotic initiation factor 2-alpha subunit (eIF2a) phosphatase, under ischemic reperfusion and tolerance. J Neurochem 2007, 103, 1368-1380; (c) Ayuso MI,  M,
M, 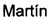 ME, Salinas M,
ME, Salinas M, 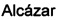 A. New hierarchical phosphorylation pathway of the translational repressor eIF4E-binding protein 1 (4E-BP1) in ischaemia-reperfusion stress. J Biol Chem 2010, 285, 34355-34363].
A. New hierarchical phosphorylation pathway of the translational repressor eIF4E-binding protein 1 (4E-BP1) in ischaemia-reperfusion stress. J Biol Chem 2010, 285, 34355-34363].
Таким образом, проводят каутеризацию двух позвоночных артерий, и через 24 ч индуцируют ишемию путем каротидной окклюзии с помощью небольших зажимов, наложенных на 15 мин; зажимы удаляют и осуществляют реперфузию. Через 5 дней (R5d) животных умерщвляют. Для определения нейропротекторной активности нитронов стероидов формулы Ia-c, животным проводят терапию нитронами стероидов формулы Ia-c с начала периода реперфузии. Протекторный эффект нитронов стероидов по отношению к стресс-индуцированной IR-(lschemia-Reperfusion) гибели нейронов можно наблюдать с помощью окрашивания красителем Fluoro-Jade В (Burda J, Matiasov M, Gottlieb M, Danielisov V, Nemethov M,  L, et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405) и наблюдения с помощью флуоресцентной микроскопии. Эти эксперименты позволяют увидеть, снижает или нет обработка различными нитронами стероидов гибель нейронов, и, следовательно, позволяет выбрать те нитроны, которые имеют более высокую нейропротекторную активность.
L, et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405) и наблюдения с помощью флуоресцентной микроскопии. Эти эксперименты позволяют увидеть, снижает или нет обработка различными нитронами стероидов гибель нейронов, и, следовательно, позволяет выбрать те нитроны, которые имеют более высокую нейропротекторную активность.
Таким образом, дополнительный аспект изобретения относится к способу определения и оценки, в быстром и возможно автоматизированном режиме, соединений, имеющих высокую нейропротекторную активность и предполагающих возможное эффективное лечение неврологических заболеваний, таких как ишемия головного мозга, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз, включающему следующие стадии:
- выбор одного или нескольких производных нитронов стероидов формулы Ia-с, и их геометрических изомеров Е и Z в двойной связи R4N(O)=C(3);
где R1 независимо представляет собой замещенный или незамещенный С1-С10 алкильный радикал, α-гидроксикетон, α-метилкетон или гидроксильные группы, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом; первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами;
R2 представляет собой атом водорода, замещенный или незамещенный С1-С10 алкильный радикал, гидроксил, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом; первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами, или ацилоксигруппу (ОСОХ), где X может быть замещенным или незамещенным С1-С10-алкильным радикалом, фенилом или ароматическим кольцом замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R3 представляет собой атом водорода или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10 алкильным радикалом, фенилом или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R4 представляет собой метильную, трет-бутил или бензильную группу;
- определение нейропротекторной активности указанных нитронов стероидов формулы Ia-с с помощью модели или анализа, обеспечивающего возможность указанного определения; предпочтительно, с помощью любого из способов или анализов, иллюстрирующих настоящее изобретение;
- сравнение указанной нейропротекторной актитвности с референсным соединением или с референсным значением; и
- выбор соединения с наиболее высокой активностью.
Дополнительно, еще один аспект настоящего изобретения относится к способу получения соединений, обладающих высокой нейропротекторной активностью и предполагающих возможное эффективное лечение неврологических заболеваний, таких как церебральная ишемия, болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз, включающему следующие стадии:
- выбор одного или нескольких производных нитронов стероидов формулы Ia-с, и их геометрических изомеров Е и Z в двойной связи R4N(O)=C(3);
где R1 независимо представляет собой замещенный или незамещенный С1-С10 алкильный радикал, α-гидроксикетон, α-метилкетон или гидроксильные группы, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом; первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами;
R2 представляет собой атом водорода, замещенный или незамещенный С1-С10 алкильный радикал, гидроксил, галоген, эфир с замещенным или незамещенным С1-С10-алкильным радикалом; первичный, вторичный амин с замещенным или незамещенным С1-С10-алкильным радикалом; третичный амин с двумя замещенными или незамещенными С1-С10 алкильными радикалами, или ацилоксигруппу (ОСОХ), где X может быть замещенным или незамещенным С1-С10-алкильным радикалом, фенилом или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирными группами с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R3 представляет собой атом водорода или ацилокси группу (ОСОХ), где X может быть замещенным или незамещенным С1-С10-алкильным радикалом, фенилом или ароматическим кольцом, замещенным галогеном, нитро, циано, амино или эфирной группой с замещенным или незамещенным С1-С10 алкильным радикалом, гетероциклическим пирролом, пиридином, индолом, фураном, или тиофенольным кольцом; и
R4 представляет собой метильную, трет-бутил или бензильную группу;
- определение нейропротекторной активности указанных нитронов стероидов формулы Ia-c с помощью модели или анализа, обеспечивающего возможность указанного определения; предпочтительно с помощью любого из способов, или анализов, приведенных в ходе описания настоящего изобретения;
- сравнение указанной нейропротекторной активности с референсным соединением или с референсным значением; и
- выбор соединения с наиболее высокой активностью;
- выделение указанного выбранного соединения, предпочтительно, в по существу чистой форме.
Следующие примеры служат для иллюстрации настоящего изобретения, но ни в коем случае не ограничивают его.
ПРИМЕРЫ
Точки плавления были определены с помощью прибора Коффлера и приводятся без поправок. 1Н и 13С ЯМР-спектры были получены при комнатной температуре на приборах с частотами 300, 400 или 500 МГц, и 75, 100 или 125 МГц, соответственно, с использованием CDCl3 или DMSO-d6 в качестве растворителей и пиков этих дейтерированных растворителей в качестве внутренних референсов (CDCl3: 7,27 (D)), 77,2 (С) м.д.; D2O: 4,60 м.д. и DMSO-d6: 2,49 (D), 40 (С)). Химические сдвиги соединений определяли в соответствии с данными, полученными в стандартных экспериментах ЯМР ((1Н, 13C-DEPT, 1Н, 1H-COSY, gHSQC, gHMBC). Масс-спектрометрические анализы проводили на оборудовании для ГХ/МС (газовой хроматографии/ масс-спектрометрии) с источником ионизации API-ES. Микроанализы проводили в Центре Органической Химии (Высший Совет по Научным Исследованиям, Мадрид). Тонкослойную хроматографию проводили на пластинках с силикагелем F254, для просмотра хроматограмм были использованы ультрафиолетовое излучение или нингидриновая реакция, анизальдегид и фосфорномолибденовая кислота-H2SO4 Все реакции проводили с использованием сухих растворителей. Хроматографические колонки представляли собой 0,06 мм колонки с силикагелем (230 меш).
Пример 1. Общий метод синтеза нитронов.
Раствор кетона (1 ммоль), Na2SO4 (3 ммоль) и триэтиламина (2 ммоль) суспендировали в EtOH и обрабатывали гидрохлоридом гидроксиламина (1,5 ммоль). Смесь перемешивали в течение 30 секунд и облучали в микроволновой печи (250 Вт) при 90°С. Устанавливали окончание реакции (с помощью ТСХ-анализа (тонкослойная хроматография)), растворитель удаляли в вакууме, разбавляли водой, экстрагировали этилацетатом, сушили над Na2SO4, фильтровали и упаривали. Остаток очищали с помощью колоночной хроматографии.
Метод А. В результате проведения общего метода, реакции 4-холестен-3-она (385 мг, 1 ммоль), Na2SO4 (426 мг, 3 ммоль), Εt3Ν (0.30 мл, 2 ммоль), и гидрохлорида N-метилгидроксиламина (126 мг, 1.5 ммоль) в этаноле (10 мл), в течении 3 ч реакции, и после колоночной хроматографии (CH2Cl2/МеОН, от 1% до 2%), получали разделяемую смесь ChN F2 и CHN F3 (396 мг, 96%, в соотношении 1:3).
Метод В. В результате проведения общего метода, реакции 5-холестен-3-она (385 мг, 1 ммоль), Na2SO4 (426 мг, 3 ммоль), Et3N (0.30 мл, 2 ммоль) и гидрохлорида N-метилгидроксиламина (126 мг, 1.5 ммоль) в этаноле (10 мл), в течение 2 ч реакции, и после колоночной хроматографии (CH2Cl2/MeOH, от 1% до 2%), получали разделяемую смесь ChN F2 и CHN F3 (407 мг, 98%, в соотношении 3: 1).
ChN (F2): Белое твердое вещество; Rf (0.21, CH2Cl2/MeOH, 5%); т.пл. 139-141°С; ИК(KBr) v 2939, 2868, 2 849, 1466, 1215 см-1; 1Н-ЯМР (400 МГц, CDCl3) δ 5.97 (д, J=2.0 Гц, 1Н, 4СН), 3.72 (с, 3Н, NCH3), 3.23 (д, J=18.4 Гц, 1Н, 2СН), 2.34 (м, 2Н, 6СН2), 2.21 (м, 1Н, 2СН), 1.99 (м, 2Н, СН2), 1.80 (м, 2Н, СН2), 1,60 (с, 3Н, СН3), 1.36 (м, 10Н, 5СН2), 1.12 (м, 6Н, 6СН2), 1.04 (с, 3Н, 19СН3), 099 (м, 2Н, СН2), 0.91 (д, J=6.4 Гц, 3Н, 21СН3), 0.88 (д, J=1.3 Гц, 3Н, 26СН3), 0.86 (м, 3Н, 27СН3), 0.70 (с, 3Н, 18СН3); 13С-ЯМР (101 МГц, CDCl3) δ 156.8 (3С), 146.4 (5С), 112.9 (4СН), 56.1 (17СН), 55.9 (14СН), 53.5 (9СН), 46.0 (13С), 42.3 (NCH3), 39.6 (С), 39.4 (С), 37.9 (10С), 36.1 (С), 35.77 (С), 35.73 (С), 34.4 (С), 33.4 (С), 32.2 (25СН2), 28.1 (16СН2), 27.9 (2СН2), 24.2 (15СН2), 23.8 (24СН2), 22.7 (26СН3), 22.5 (27СН3), 21.4 (СН2), 21.3 (11СН), 18.6 (19СН3), 17.8 (21СН3), 11.9 (18СН3). МС (ЭИ) м/з: 413 (М, 37%)+, 398 (М-СН3, 27%), 397 (М-О, 70), 137 (C8H11NO, 100%); МС (ESI) м/з: 414.2 (М+Н)+, 436.2 (M+Na)+, 827.8 (2М)+, 849.7 (2М+Na)+, Анал. Вычислено для C28H47NO: С 81.29; Η 11.45; N 3.39. Найдено: С, 80.98; Н, 12.19; Ν, 3.44. ChN (F3): белое твердое вещество: Rf (0.20, CH2Cl2/MeOH, 5%); пл 153-5°С. ИК (KBr) v 2936, 2868, 1629, 1214 см-1; 1Н-ЯМР (400 МГц, CDCl3) δ 6.78 (с, 1Н, 4СН), 3.66 (с, 3Н, NCH3), 2.44 (м, 4Н, 2СН2), 1.88 (м, 4Н, 2СН2), 1.37 (м, 14Н, 7СН2), 1.04 (с, 3Н, 19СН3), 0.98 (м, 2Н, СН2), 0.91 (д, J=6.4 Гц, 3Н, 21СН3), 0.88 (д, J=1.4 Гц, 3Н, 26СН3), 0.85 (д, J=1.4 Гц, 3Н, 27СН3), 0.70 (с, 3Н, 18СН3); 13С-ЯМР (101 МГц, CDCl3) δ 123.7 (3С), 120.3 (5С), 113.7 (4СН), 56.0 (17СН), 55.9 (14СН), 53.5 (9СН), 46.4 (13С), 42.3 (NCH3), 39.6 (С), 39.4 (С), 37.9 (10С), 36.0 (С), 35.72 (С), 35.71 (С), 35.4 (С), 32.9 (С), 32.2 (С), 28.1 (С), 27.9 (С), 24.1 (16СН2), 23,7 (15СН2), 23.6 (24CH2), 22.7 (26CH3), 22.5 (27СН3), 21.3 (11СН2), 18.6 (19СН3), 17.8 (21СН3), 11.9 (18СН3). МС (ЭИ) м/з: 413 (М, 37%)+, 398 (М-СН3, 27%), 397 (М-О, 70), 137 (C8H11NO, 100%); МС (ESI) м/з: 414.2 (М+Н)+, 827.8 (2М)+, 849.7 (2М+Na)+. Анал. Вычислено для C28H47NO: С 81.29; Н, 11.45; N, 3.39. Найдено: С, 81.03; Н, 11.33; N, 3.30,
Фармакологическая оценка нейропротекции при ишемии
Нейропротекторную активность холестеронитронов F2 и F3 определяли в первичных культурах нейронов, культивируемых от 6 до 8 дней, полученных из коры головного мозга крыс (Quevedo, С, Salinas, M,  , A. Initiation factor 2B activity is regulated by protein phosphatase 1, which is activated by the mitogen-activated protein kinase-dependent pathway in insulin-like growth factor 1-stimulated neuronal cells. J. Biol. Chem. 2003, 278, 16579-16586), and subjected to oxygen-glucose deprivation (OGD) (Chioua M, Sucunza D, Soriano E, Hadjipavlou-Litina D,
, A. Initiation factor 2B activity is regulated by protein phosphatase 1, which is activated by the mitogen-activated protein kinase-dependent pathway in insulin-like growth factor 1-stimulated neuronal cells. J. Biol. Chem. 2003, 278, 16579-16586), and subjected to oxygen-glucose deprivation (OGD) (Chioua M, Sucunza D, Soriano E, Hadjipavlou-Litina D,  A, Ayuso I, Oset-Gasque MJ,
A, Ayuso I, Oset-Gasque MJ,  MP, Monjas L,
MP, Monjas L,  MI, Marco-Contelles J, Samadi A. α-aryl-N-alkyl nitrones, as potential agents for stroke treatment: synthesis, theoretical calculations, antioxidant, anti-inflammatory, neuroprotective, and brain-blood barrier permeability properties. J Med Chem. 2012, 55, 153-168), согласно следующему протоколу:
MI, Marco-Contelles J, Samadi A. α-aryl-N-alkyl nitrones, as potential agents for stroke treatment: synthesis, theoretical calculations, antioxidant, anti-inflammatory, neuroprotective, and brain-blood barrier permeability properties. J Med Chem. 2012, 55, 153-168), согласно следующему протоколу:
Выживаемость клеток измеряли с использованием 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолий бромида (МТТ-тест). Таким образом, воздействие ОГД на нейрональную культуру в течение 4 ч (ОГД 4 ч) индуцировало значительное снижение выживаемости клеток 67,3% (р<0,0001 по сравнению с 100% в контроле, одновыборочный t-критерий), которая была частично восстановлена через 24 часа после реперфузии (Р24 ч, 76.1%; p<0.0022 по сравнению с ОГД 4 ч, t-критерий Стьюдента), но не достигала контрольного значения в 24 ч (р<0,0001 по сравнению с 100% в контроле одновыборочный t-критерий) (Фиг. 1).
Холестеронитроны F2 и F3, взятые в диапазонах концентраций от 0,1 до 100 мкМ, и от 0,5 до 10 мкМ соответственно, были добавлены в начале периода реперфузии для оценки их нейропротекторной активности, с использованием хорошо известного нейропроторного агента цитиколина в качестве референсного соединения (Adibhatia, RM, Hatcher, JF, Dempsey, RJ. Citicoline: neuroprotective mechanisms in cerebral ischemia. J. Neurochem. 2002, 80, 12-23).
Цитиколин был протестирован в различных концентрациях, от 1 мкМ до 1 мМ, нейропротективный эффект был обнаружен при концентрациях 10 и 100 мкМ (87,4 и 88,1%, соответственно), эффект при 100 мкМ был значительным по сравнению со значением, полученным при Р24 ч (дисперсионный анализ (ANOVA), р<0,0021 и р<0,01, критерий Даннета].
Добавление холестеронитрона F2 в концентрации 1 или 5 мкм, но не холестеронитрона F3, значительно повышало выживаемость нейронов во время реперфузии, а в концентрации 5 мкМ, контрольное значение почти было достигнуто (89,1 и 95,5%, для холестеронитрона F2 в концентрациях 1 или 5 мкМ, соответственно; ANOVA, р<0,0001 и р<0,01, критерий Даннета по сравнению с Р24 ч) (Фиг. 1).
Нейропротекцию, индуцированную холестеронитроном F2, сравнивали с нейропротекцией, индуцированной цитиколином в концентрации 5 мкМ, в результате F2 продемонстрировал значительно более сильное нейропротекторное действие, чем наблюдалось у цитиколина (Таблица 1).
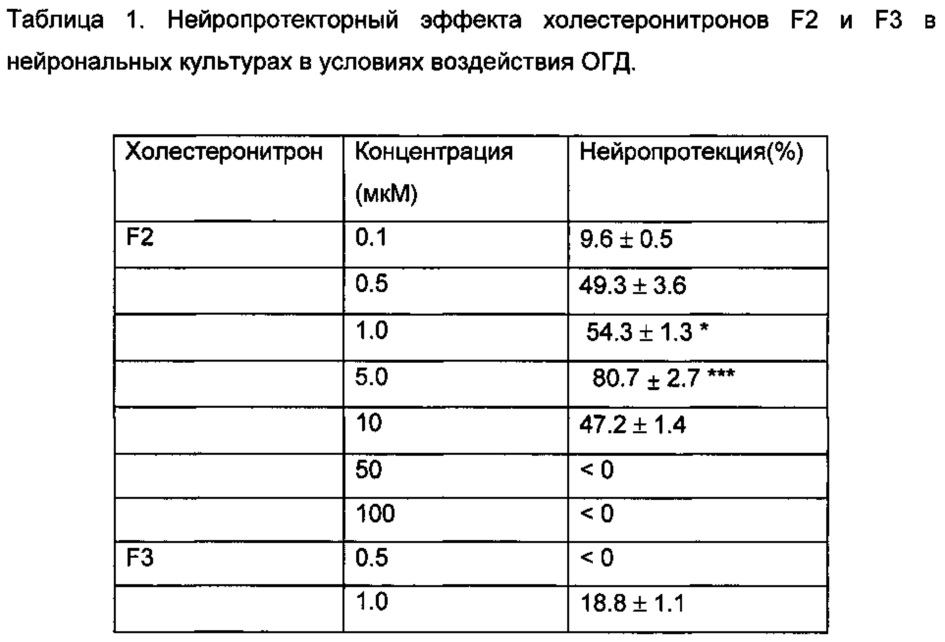

В противоположность этому, холестеронитрон F3 не показывал значительной нейропротекторной активности.
Чтобы оценить нейропротекторную активность холестеронитронов F2 и F3 против ишемического повреждения нейронов в культуре и смоделировать условия долгосрочной реперфузии, культуры подвергали воздействию ОГД в течение 4 часов, и клетки затем подвергали реперфузии в течение 5 дней (R5d).
Холестеронитроны F2 и F3 (в концентрациях 1,0 и 5,0 мкМ) добавляли в начале периода реперфузии и после 48 ч реперфузии, чтобы таким образом оценить их долгосрочную нейропротекторную активность, снова используя референсную молекулу цитиколина, в соответствии с протоколом МТТ-теста (см. выше).
В эксперименте R5d индуцировалось более чем заметное снижение выживаемости клеток (77,7%; р<0,0001 по сравнению с 100% в контроле, одновыборочный t-критерий) (Фиг. 2). Цитиколин, протестированный в концентрации 100 мкМ, не демонстировал какой-либо нейропротекции в R5d эксперименте, и когда его добавляли в начале реперфузии (закрашенные сплошным цветом столбцы), и после 48 ч после реперфузии (столбцы со штриховкой) (76,0 и 74,6%, соответственно; ANOVA, р=0,786).
В противоположность этому, добавление холестеронитрона F2 (или F3) в концентрации 1 и 5 мкМ приводило к значительному увеличению выживаемости нейронов, превышающему контрольную величину, наблюдаемую в 5 дней (110,6 и 118,2%, в концентрации 1 и 5 мкМ для холестеронитрона F2, соответственно; 105,6 и 118,6%, в концентрации 1 и 5 мкМ для холестеронитрона F3 соответственно, ANOVA, р<0,0001 и р<0,01, критерий Даннета) (Фиг. 2, закрашенные сплошным цветом столбцы).
Дополнительно, холестеронитрон F2 (1 мкМ) или холестеронитрон F3 (5 мкМ), добавленные после 48 ч реперфузии (столбцы со штриховкой) значительно увеличивали выживаемость нейронов в эксперименте R5d (95,7 и 97,8%, в концентрациях 1 и 5 мкМ для холестеронитронов F2 и F3 соответственно, ANOVA, p<0,0001 и p<0,05, критерий Даннета при сравнении с R5d) (Фиг. 2, столбцы со штриховкой).
Таким образом, нейропротекция при ишемии с помощью холестеронитронов имела долгосрочную эффективность, которая сохранялась даже через 48 ч после терапии, когда цитиколин больше не оказывал никакого действия. Глобальную ишемию индуцировали у взрослых крыс в соответствии общепринятым способом окклюзии четырех сосудов [(a)  de la Vega С, Burda J, Nemethova M, Quevedo С,
de la Vega С, Burda J, Nemethova M, Quevedo С,  A,
A,  ME, Salinas M. Possible mechanisms involved in the down-regulation of translation during transient global ischaemia in the rat brain. Biochem J 2001, 357, 819-826; (b)
ME, Salinas M. Possible mechanisms involved in the down-regulation of translation during transient global ischaemia in the rat brain. Biochem J 2001, 357, 819-826; (b)  L, Cid С,
L, Cid С,  A, Burda J, Ayuso I, Salinas M. Regulation proteins of eukaryotic initiation factor 2-alpha subunit (eIF2a) phosphatase, under ischemic reperfusion and tolerance. J Neurochem 2007, 103, 1368-1380; (c) Ayuso MI,
A, Burda J, Ayuso I, Salinas M. Regulation proteins of eukaryotic initiation factor 2-alpha subunit (eIF2a) phosphatase, under ischemic reperfusion and tolerance. J Neurochem 2007, 103, 1368-1380; (c) Ayuso MI,  M,
M,  ME, Salinas M,
ME, Salinas M,  A. New hierarchical phosphorylation pathway of the translational repressor eIF4E-binding protein 1 (4E-BP1) in ischemia-reperfusion stress. J Biol Chem 2010, 285, 34355-34363].
A. New hierarchical phosphorylation pathway of the translational repressor eIF4E-binding protein 1 (4E-BP1) in ischemia-reperfusion stress. J Biol Chem 2010, 285, 34355-34363].
Таким образом, осуществляли полную каутеризацию двух позвоночных артерий, и через 24 ч ишемию индуцировали путем каротидной окклюзии с использованием небольших зажимов, наложенных на 15 мин; зажимы удаляли и осуществляли реперфузию. Через 5 дней (R5d), животных умерщвляли. Животных обрабатывали холестеронитроном F2, разбавленным в 10%-ном этаноле в солевом растворе в качестве носителя, вводили внутрибрюшинно в начале периода реперфузии.
Было протестировано десять животных; одно из пяти животных, обработанных носителем, погибло через 2 дня после реперфузии. Все протоколы, используемые в экспериментах с животными, проводили в соответствии с рекомендациями, утвержденными Комитетом по этике больницы Рамона-и-Кахаля (Мадрид) (Ethics Committee of Hospital  y Cajal, Madrid). В модели ишемии головного мозга у крыс путем окклюзии четырех сосудов после краткого периода ишемии наступала отсроченная нейродегенерация в области СА1 гиппокампа [(a) Kirino T. Delayed neuronal death. Neuropathology 2000, 20, S95-S97; (b) Pulsinelli WA, Brierley JB, Plum F. Temporal profile of neuronal damage in a model of transient forebrain ischaemia. Ann Neurol 1982, 11, 491-498; (c) Burda J, Matiasov M, Gottlieb M, Danielisov V, Nemethov M,
y Cajal, Madrid). В модели ишемии головного мозга у крыс путем окклюзии четырех сосудов после краткого периода ишемии наступала отсроченная нейродегенерация в области СА1 гиппокампа [(a) Kirino T. Delayed neuronal death. Neuropathology 2000, 20, S95-S97; (b) Pulsinelli WA, Brierley JB, Plum F. Temporal profile of neuronal damage in a model of transient forebrain ischaemia. Ann Neurol 1982, 11, 491-498; (c) Burda J, Matiasov M, Gottlieb M, Danielisov V, Nemethov M,  L et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405)]. В этой экспериментальной модели, реперфузия с 3 по 7 день после ишемии индуцирует значительную смерть нейронов в области СА1 (Ayuso MI,
L et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405)]. В этой экспериментальной модели, реперфузия с 3 по 7 день после ишемии индуцирует значительную смерть нейронов в области СА1 (Ayuso MI,  Alonso Ε, Cid С, de
Alonso Ε, Cid С, de  MA,
MA,  A. The translational repressor eIF4E-binding protein 2 (4E-BP2) correlates with selective delayed neuronal death after ischemia. J Cereb Blood Flow Metab. At press, doi: 10.1038/jcbfm.2013.60). Селективная нейродегенерация нейронов в области СА1 была очевидной по сравнению с тем, что наблюдалось в церебральном кортексе.
A. The translational repressor eIF4E-binding protein 2 (4E-BP2) correlates with selective delayed neuronal death after ischemia. J Cereb Blood Flow Metab. At press, doi: 10.1038/jcbfm.2013.60). Селективная нейродегенерация нейронов в области СА1 была очевидной по сравнению с тем, что наблюдалось в церебральном кортексе.
Животным вводили холестеронитрон F2 в дозе 0,1 мг/кг с самого начала периода реперфузии, гибель нейронов индуцировалась в 5 дней (R5d). Протекторный эффект холестеронитрона F2 при стресс-индуцированной ИР (ишемия-реперфузия) гибели нейронов наблюдали с помощью окрашивания красителем Fluoro-Jade В (Burda J, Matiasov M, Gottlieb M, Danielisov V, Nemethov M,  L et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405), и флуоресцентной микроскопии.
L et al. Evidence for a role of second pathophysiological stress in prevention of delayed neuronal death in the hippocampal CA1 region. Neurochem Res 2005, 30, 1397-1405), и флуоресцентной микроскопии.
Эти эксперименты показали, что лечение холестеронитроном значительно снижало гибель нейронов в СА1 области гиппокампа. Результаты показали, что у животных, получавших холестеронитрон, значительно снижался апоптоз в области СА1 в (СА1) в 5 дневном эксперименте (R5d) (70,4±2,4 по сравнению с 55,1±3,4 клеток в поле зрения, у животных, получавших физиологический раствор и холестеронитрон F2, соответственно, ANOVA, p<0,0001 и p<0,01, критерий Ньюмена-Кейлса) (Фиг. 3, СА1). Вызванная ишемией гибель нейронов наблюдалась также в церебральном кортексе (С) и в латеральном кортексе (LC), хотя эффект был гораздо более ограниченным, чем в области СА1. Дополнительно, снижение ишемического повреждения нейронов с помощью холестеронитрона F2 можно было наблюдать в церебральном кортексе (6,7±3,5 сравнению с 0±0,1 клеток в поле зрения, у животных, получавших носитель и холестеронитрон, соответственно; p<0.05, t-критерий Стьюдента), и в латеральном кортексе (13,4±3,6 сравнению с 6,3±2,2, у животных, получавших носитель и холестеронитрон, соответственно) (Фиг. 3).
Индукция апоптоза была, в частности, продемонстрирована в области СА1 в эксперименте R5d помощью метода TUNEL (Ayuso MI,  Alonso Ε, Cid С, de
Alonso Ε, Cid С, de  MA,
MA,  A. The translational repressor eIF4E-binding protein 2 (4E-BP2) correlates with selective delayed neuronal death after ischemia. J Cereb Blood Flow Metab. At press, doi: 10.1038/jcbfm.2013.60. На срезах мозга животных, получавших носитель (R5d), виден более высокий уровень TUNEL-положительных клеток в области СА1, церебральном кортексе и латеральном кортексе, чем на срезах мозга животных, получавших холестеронитрон (Фиг. 4).
A. The translational repressor eIF4E-binding protein 2 (4E-BP2) correlates with selective delayed neuronal death after ischemia. J Cereb Blood Flow Metab. At press, doi: 10.1038/jcbfm.2013.60. На срезах мозга животных, получавших носитель (R5d), виден более высокий уровень TUNEL-положительных клеток в области СА1, церебральном кортексе и латеральном кортексе, чем на срезах мозга животных, получавших холестеронитрон (Фиг. 4).
Результаты показали, что у животных, получавших холестеронитрон F2, апоптоз нейронов значительно снижался в области СА1 через 5 дней после реперфузии (R5d) (64,1±7,1 по сравнению с 48,5±0,4 ядер в поле зрения, у животных, получавших носитель и холестеронитрон, соответственно; ANOVA, p<0,0001 и p<0,01, критерий Ньюмена-Кейлса) (Фиг. 4, СА1). В то же время, индуцированное холестеронитроном снижение апоптотической гибели клеток наблюдалось также в церебральном кортексе и латеральном кортексе, в соответствии с результатами, описанными выше (7,2±3,8 и 1±0,5 ядер в поле зрения, для животных, получавших носитель и холестеронитрон, соответственно, в церебральном кортексе; 13,3±6,2 и 4,3±1,4, для животных, получавших носитель и холестеронитрон, соответственно, в латеральном кортексе (Фиг. 4).
Таким образом, можно сделать вывод о том, что фармакологическая терапия животных с ишемией с помощью холестеронитрона F2, применяемого в концентрациях, при которых был доказан его нейропротекторный эффект на нейрональных культурах и на области СА1 гиппокампа, значительно снижала апоптическую гибель нейронов в области ишемии после постишемической реперфузии.