Результат интеллектуальной деятельности: Олигонуклеотидные праймеры и флуоресцентно-меченый зонд, способ и тест-система для выявления генома полевых изолятов вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, к средствам молекулярной диагностики, а именно к выявлению генома полевых изолятов вируса заразного узелкового дерматита крупного рогатого скота (ЗУД КРС).
Каприпоксвирусы из сем. Capripoxviridae (вирус заразного узелкового дерматита крупного рогатого скота, вирус оспы овец и вирус оспы коз) являются возбудителями трансграничных зоонозных болезней крупного и мелкого рогатого скота, которые представляют серьезную угрозу скотоводства не только в Российской Федерации, но и других странах, нанося существенные экономические потери хозяйствам и экономике стран [1, 2].
ЗУД КРС сопровождается лихорадкой, образованием некротизирующихся узелков в коже или бугров, слизистых оболочках органов пищеварения, дыхания, зрения [3]. Главным образом, ЗУД КРС регистрировался в странах Африканского континента, проявляя сезонный характер с максимальным распространением при обилии популяции кровососущих насекомых [4]. Однако беспрецедентное распространение вируса ЗУД КРС на юге РФ в 2015-2016 гг. [5] требует применения высокочувствительных методов диагностики данного заболевания, позволяющих проводить мониторинг и однозначно ставить диагноз в кратчайшие сроки с целью применения мер для предотвращения и борьбы с данным заболеванием.
Известен способ диагностики ЗУД КРС вирусологическим методом, основанном на культивировании возбудителя на чувствительных клеточных культурах, основанного на специфическом проявлении действия вируса на биологических системах [6]. Недостатками данного метода являются: длительность, трудоемкость и необходимость использования биологических моделей.
Известен способ выявления каприпоксвирусов с помощью электронной микроскопии [7]. Недостатком данного метода является невозможность морфологически отличить вирионы вируса ЗУД КРС от ортопоксвирусов и каприпоксвирусов от ортопоксвирусов [7].
Известен способ диагностики через выявление антител к каприпоксвирусам в крови животных методом иммуноферментного анализа, основанного на обнаружении специфического комплекса антиген-антитело с помощью цветной реакции вследствие ферментизации субстрата энзимом, связанным с конъюгатом [7]. Недостатком данного метода является низкая специфичность.
Известен способ выявления генома вируса ЗУД КРС с помощью классической ПЦР на основе поверхностного белка прикрепления [8]. Несмотря на рекомендации МЭБ, данный метод может выявлять ДНК также оспы овец и оспы коз. Более того, существует риск перекрестной контаминации, ввиду необходимости проведения электрофореза для анализа продуктов реакции.
Известен метод для выявления ДНК вируса нодулярного дерматита на основе метода рекомбиназной полимеразной амплификации [9]. Однако данный метод выявляет ДНК не только вируса ЗУД КРС, но и вируса оспы овец и оспы коз.
Наиболее близким к заявляемому методу является тест-система, которая основана на детекции вируса ЗУД, вируса оспы коз и вируса оспы овец путем проведении амплификации фрагментов ДНК с последующим анализом их кривых плавления с высоким разрешением [10]. Недостатком этого способа является высокая зависимость способа к качеству и концентрации ДНК в исследуемой пробе.
Таким образом, технической проблемой является разработка надежного метода с возможностью исследования широкого спектра биологического материала (внутренние органы, нодулы, сыворотка крови, цельная кровь, культура клеток), чувствительного и специфичного для обнаружения генома вируса ЗУД КРС методом полимеразной цепной реакции в режиме реального времени путем конструирования набора, содержащего специфичные олигонуклеотидные праймеры и флуоресцентно-меченый олигонуклеотидный зонд, а также подбора условий для проведения ПЦР с ними, обеспечивающий минимальный риск контаминации в лаборатории и исключающий субъективность при оценке результатов.
Изобретение касается тест-системы, состоящей из олигонуклеотидных праймеров и флуоресцентно-меченного зонда для специфичной экспресс-идентификации генома полевого вируса ЗУД КРС методом полимеразной цепной реакции в режиме реального времени. Представленный метод включает последовательности олигонуклеотидов, специфичные только для полевых изолятов вируса ЗУД КРС и имеющие следующую нуклеотидную последовательность:
LSDf2- 5'- TAGAAAATGGATGTACCACAAATACAG 3',
LSDr33 5' - TTGTTACAACTCAAATCGTTAGGTG-3',
LSD_probe 5' - ACCACCTAATGATAGTGTTTATGATTTACC-3.
В качестве источника флуоресценции на 5' конце зонда применяют краситель FAM, а для тушения флуоресценции на 3' конце - BHQ1. Флуоресценцию измеряют по каналу FAM. Пересечение кривой флуоресценции линии threshold, свидетельствует о наличии в образце генома полевого изолята вируса ЗУД КРС, причем, чем меньше показатель «Ct», тем выше количество генома полевого изолята вируса ЗУД КРС в исследуемом образце. Отсутствие пересечения кривой флуоресценции линии threshold свидетельствует об отсутствии генома полевого изолята вируса ЗУД КРС в исследуемом материале.
Изобретение может быть использовано в ветеринарии, клинической и лабораторной диагностике для выявления ДНК вируса ЗУД КРС в пробах патологического и биоматериала.
Техническим результатом изобретения является: высокоспецифичность в отношении полевых изолятов вируса ЗУД КРС, расширенный спектр биологического материала, пригодного для проведения исследований без возможности получения ложноположительных результатов; возможность использования широко спектра амплификаторов, отвечающих минимальным требованиям для постановки ПЦР; сокращение времени для проведения массовых исследований проб на наличие генома полевого изолята вируса ЗУД КРС, а также расширение арсенала средств диагностики ЗУД КРС.
Сущность изобретения заключается в том, что специфичное выявление ДНК полевого вируса ЗУД КРС проводится в присутствии родственных каприпоксвирусов без какого-либо влияния последних. При помощи указанных праймеров (LSDf2, LSDr33) и зонда (LSD_probe) проводят ПЦР в режиме реального времени, позволяющую выявлять геном полевых изолятов вируса ЗУД КРС. В качестве мишени выбран фрагмент гена наружного капсидного белка EEV с делецией 27 п.н., присутствующей у всех представителей вирусов сем. Capripoxviridae, включая вакцинные штаммы Neethling вируса ЗУД КРС, за исключением полевых вирусов ЗУД КРС. Высокая степень специфичности тест-системы подтверждена сравнением опубликованных в настоящее время последовательностей каприпоксвирусов с аналогичными нуклеотидными последовательностями других каприпоксвирусов (база данных GenBank), а также с помощью лабораторных исследований.
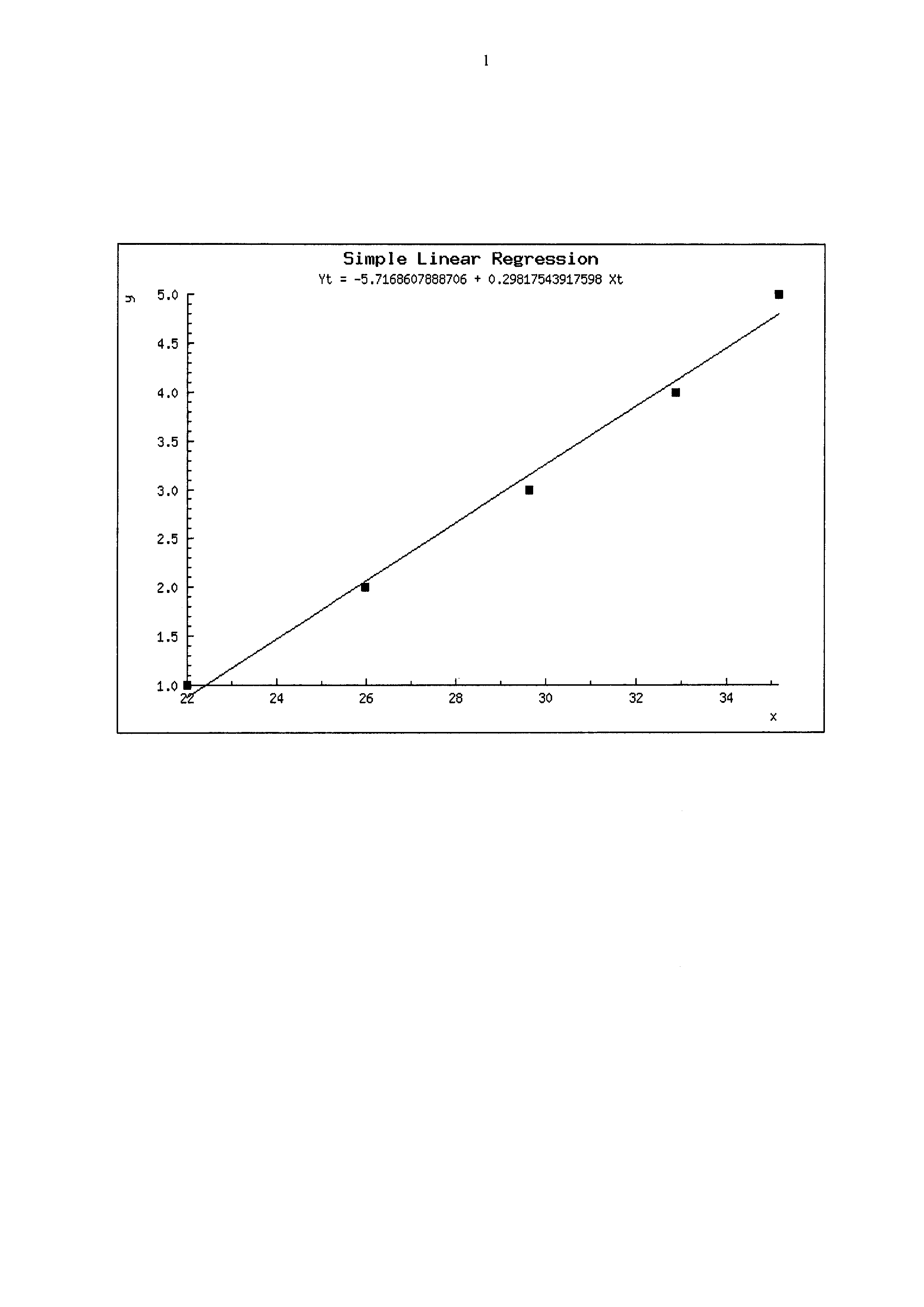
Сущность изобретения пояснена на графическом изображении, на котором представлена линейность результатов ПЦР-РВ при тестировании 10-кратных разведений выделенной ДНК вируса ЗУД КРС (штамм ВНД КРС/ Дагестан / 2015).
Детекция продуктов амплификации осуществляется методом регистрации флуоресценции, генерируемой в результате разрушения гибридизационного зонда, находящегося на 5'-конце флуорофор FAM, а на 3'-конце - гасителя BHQ1. В отсутствии мишени флуорофор и гаситель сближены, и наблюдается лишь незначительная флуоресценция, так как гаситель поглощает испускаемое флуорофором излучение. При накоплении в ходе ПЦР специфических продуктов зонд гибридизируется на ампликон, что ведет к его разрушению за счет 5'-экзонуклеазной активности Taq-полимеразы. В результате флуорофор отделяется от гасителя и его излучение может быть детектировано. Таким образом, увеличение флуоресценции прямо пропорционально количеству синтезированного ПЦР-продукта.
Праймеры и зонд разработаны для амплификации и детекции фрагмента гена EEV вируса НД, в котором у других представителей сем. Capripoxviridae, включая вакцинные штаммы Neethling вируса ЗУД КРС, присутствует делеция 27 п.н. в данном локусе, тогда как у полевых вирусов ЗУД КРС она отсутствует.
Для разработки праймеров из базы данных GenBank были получены полногеномные последовательности каприпоксвирусов. Последовательности выравнивали с помощью программы Bioedit, затем визуально оценивали консервативные участки, на основе которых были получены ряд праймеров. В результате тестирования при различных параметрах была получена оптимальная пара праймеров и зонда, которая используется в тест-системе.
Набор для выявления генома полевых изолятов вируса ЗУД КРС в ПЦР-РВ состоит из следующих компонентов:
№1 готовая ПЦР смесь, объем 550 мкл - 2 пробирки;
№2 фермент Taq-ДНК-полимераза, объем 12,5 мл - 1 пробирка;
№3 положительный контрольный образец, объем 100 мкл - 1 пробирка;
№4 отрицательный контрольный образец, объем 100 мкл - 1 пробирка.
ПЦР-РВ проводится в одну стадию с использованием готовой ПЦР смеси (№1), включающей на одну реакцию буфер 5х для ПЦР-РВ (5 мкл), 25 мМ хлорид магния (3,5 мкл), дезоксирибонуклеотид трифосфаты (0,5 мкл 10 пмолль), олигонуклеотидные праймеры (1 мкл каждого праймера 10 пмоль), зонд (1 мкл 5 пмоль) и фермента Taq-ДНК-полимеразу в программируемом амплификаторе. Перед началом постановки реакции необходимо разморозить все необходимые компоненты реакции, встряхнуть на шейкере, затем центрифугировать несколько секунд на низкоскоростной центрифуге.
Реакционную смесь для проведения ПЦР-РВ готовят в пробирке в расчете на одну реакцию (V=25 мкл) следующим образом:
|
Приготовленную в отдельных 1,5 мл пробирках реакционную ПЦР-смесь переносят в 0,2 мл пробирки по 20 мкл и вносят 5 мкл суммарной ДНК. В соответствующие пробы вносят также выделенные образцы ДНК, отрицательного и положительного контролей. Общий объем смеси - 25 мкл.
Устанавливают пробирки в амплификатор для постановки ПЦР-РВ, отмечают в программе расположение и характеристику проб, выбирают рабочий краситель (FAM), устанавливают в программе температурно-временной профиль реакции.
После первоначальной денатурации при 95°С в течение 10 мин ПЦР в режиме реального времени проводят в следующих условиях: 95°С - 15 с, 60°С - 60 с - 45 циклов.
Результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, что соответствует наличию или отсутствию значения порогового цикла «Ct» в соответствующей графе в таблице результатов реакции, выведенной в результате машинного анализа.
Результат считается достоверным только в случае прохождения положительного (Ct<35) и отрицательного (Ct не определен) контролей амплификации.
Образец считается положительным на наличие ДНК вируса ЗУД КРС, если значение Ct не более 35. Однако в случае, если значение Ct для проб находится в пределах от 30 до 35, необходимо повторить реакцию с целью подтвердить или опровергнуть наличие ДНК вируса в исследуемой пробе.
Образец считается отрицательным на наличие ДНК вируса, если для него значение Ct отсутствует или более 37.
Результаты не подлежат учету (считаются недействительными):
- в случае отсутствия регистрации роста флуоресценции в пробе с положительным контролем, что может свидетельствовать об ошибках, допущенных на этапе постановки ПЦР-РВ;
- в случае регистрации значения Ct в таблице результатов на экране компьютера для отрицательного контрольного образца, что указывает на наличие контаминации.
В любом из этих случаев необходимо повторить анализ всех проб, а при повторном выявлении контаминации отрицательного контроля принять меры по выявлению и ликвидации источника контаминации.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Оценка специфичности тест-системы
Для оценки специфичности тест-системы использовались следующие образцы гетерологичных вирусов, депонированных в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ»: ДНК вируса ЗУД штамма ВНД КРС/Дагестан/2015 (диагностический), ДНК вируса нодулярного дерматита штамма НД КРС Э-95, ДНК вакцинного штамма Neethling, ДНК вируса оспы овец штамма «Афганский», ДНК вируса оспы овец вакцинного штамма «ВНИИЗЖ», ДНК вируса оспы коз штамма «Приморский 2003», ДНК вируса оспы коз штамма «ВНИИЗЖ 2003», ДНК вируса чумы мелких жвачных штамма «ВНИИЗЖ», ДНК вируса везикулярного стоматита штамма «ВНИИЗЖ», ДНК вируса оспы коров штамма «ВНИИЗЖ».
Работу с ДНК проводили в условиях, регламентированных Методическими указаниями МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности [11].
Процедуру выделения ДНК из исследуемого материала проводили с использованием набора реагентов на основе мембранных колонок.
ПЦР в режиме реального времени проводили в реакционной смеси следующего состава (на 1 исследование):
|
ПЦР в режиме реального времени и регистрацию результатов проводили в ПЦР-РВ приборе по программе, описанной выше.
Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линии, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считали положительным в случаи, если кривая накопления флуоресценции для соответствующего образца имела характерную «сигмовидную» форму и пересекала пороговую линию.
При тестировании специфичности тест-системы с использованием ДНК гомологичных и гетерологичных вирусов ложноположительных и ложноотрицательных результатов не выявлено.
Пример 2. Оценка чувствительности тест-системы.
Для оценки чувствительности использовали ДНК штамма ВНД КРС/Дагестан/2015 [12] с титром 5,21. Метод ПЦР-РВ выявлял ДНК вируса ЗУД КРС с чувствительностью 0,21 lg/мл.
Для оценки эффективности амплификации было проведено 3 повторных эксперимента и получены значения Ct, которые использовались для вычисления эффективности. С помощью средних значений Ct была получена линейная регрессия со значением эффективности амплификации (Е) 98,6%. Полученные данные приведены на графическом изображении.
Пример 3. Оценка воспроизводимости тест-системы.
Воспроизводимость определяли с помощью величины стандартного отклонения (SD) для каждой серии разведений, используя полученные значения Ct. Стандартное отклонение SD варьировало от 0,11 до 0,33 на протяжении 5 10-кратных разведений. При этом коэффициент детерминации r2 составил 0,990.
Таким образом, изобретение может быть использовано в ветеринарной практике для выявления генетического материала полевого вируса ЗУД КРС в биологических и культуральных образцах для постановки и уточнения диагноза, для решения научно-исследовательских задач по мониторингу распространения вируса ЗУД КРС среди восприимчивых животных. Использование специфических праймеров и зонда позволяет выявить генетический материал полевого вируса ЗУД КРС в исследуемых образцах методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени (РВ).
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Олигонуклеотидные праймеры и флуоресцентно-меченный зонд, способ и тест-система для выявления генома полевых изолятов вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени».
1. Beard, P.M. Lumpy skin disease: a direct threat to Europe. // Vet Rec., 2016, v. 28, p. 557-558.
2.  M,
M,  M. Epidemiological and Molecular Studies on Lumpy Skin Disease Outbreaks in Turkey during 2014-2015. // Transbound Emerg Dis. 2016 (in Press).
M. Epidemiological and Molecular Studies on Lumpy Skin Disease Outbreaks in Turkey during 2014-2015. // Transbound Emerg Dis. 2016 (in Press).
3. Abutarbush S.M., Ababneh M.M., Al Zoubi I.G., Al Sheyab O.M., Al Zoubi M.G., Alekish M.O., Al Gharabat R.J. Lumpy Skin Disease in Jordan: Disease Emergence, Clinical Signs, Complications and Preliminary-associated Economic Losses. // Transbound Emerg Dis., 2015., v. 62(5), p. 549-554.
4. Tuppurainen ES, Venter EH, Shisler JL, Gari G, Mekonnen GA, Juleff N, Lyons NA, De Clercq K, Upton C, Bowden TR, Babiuk S, Babiuk LA. Capripoxvirus Diseases: Current Status and Opportunities for Control. // Transbound Emerg Dis., 2015., doi: 10.1111/tbed. 12444.
5. Кононов А.В., Кононова С.В., Шумилова И.Н. [и др.] Культурально-биологические свойства возбудителя нодулярного дерматита крупного рогатого скота, выделенного на территории Российской Федерации в 2015 году: научное издание / // Ветеринария сегодня. - 2016. - №3. - С. 8-18.
6. Tuppurainen ES, Venter EH, Coetzer JA. The detection of lumpy skin disease virus in samples of experimentally infected cattle using different diagnostic techniques. BMC Vet Res. 2016. 12: 244.. doi: 10.1186/s12917-016-0875-5
7. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Chapter 2.4.13: Lumpy skin disease. 2017.
8. Ireland DC1, Binepal YS. Improved detection of capripoxvirus in biopsy samples by PCR. J Virol Methods. 1998. V. 74(1). P. 1-7.
9. Shalaby M., El-Deeb A., El-Tholoth M., Hoffmann D., Czerny C, Hufert F., Weidmann M., Abd El Wahed A. Recombinase polymerase amplification assay for rapid detection of lumpy skin disease virus. Onderstepoort J Vet Res. 2005 - 72(2). P. 153-164.
10. Lamien CE, Lelenta M, Goger W, Silber R, Tuppurainen E, Matijevic M, Luckins AG, Diallo A. Real time PCR method for simultaneous detection, quantitation and differentiation of capripoxviruses. J Virol Methods. 2011 V. 171(1). P. 134-140. doi: 10.1016/j.jviromet.2010.10.014.
11. МУ 1.3.2569-09 Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности.
12. Патент РФ №2606254, С12 №7/00, А62K 39/126 G01N 33/569 «Штамм вируса нодулярного дерматита крупного рогатого скота Dermatitis nodularis bovum, рода Capripoxvirus для изготовления биопрепаратов для диагностики и специфической профилактики нодулярного дерматита крупного рогатого скота», 10.01.2017.